Le diméthoate et l’ométhoate dans l’eau potable - Document technique pour consultation publique

Télécharger le rapport complet
(Format PDF, 1.3 mo, 53 pages)
Organisation : Santé Canada
Publiée : 2021-06-18
Document technique pour consultation publique
La période de consultation se termine le 18 août 2021
Objectif de la consultation
Le présent document technique décrit l'évaluation de l'information disponible sur le diméthoate et son métabolite, l'ométhoate, dans le but de mettre à jour les recommandations précédentes sur le diméthoate dans l'eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les répercussions possibles de sa mise en œuvre.
Dans les recommandations existantes sur le diméthoate, élaborées en 1986, la concentration maximale acceptable (CMA) de 0,02 mg/L (20 µg/L) était fondée sur une concentration réduite de cholinestérase dans le sang total chez les humains. Le présent document propose de conserver une CMA de 0,02 mg/L (20 µg/L) pour le diméthoate dans l'eau potable, mais elle est fondée sur l'inhibition de la cholinestérase du cerveau observée dans plusieurs études à doses répétées chez les animaux. Le présent document propose également d'adopter une approche additive pour tenir compte de l'ométhoate dans l'eau potable.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. Veuillez faire parvenir vos commentaires (avec une justification, le cas échéant) à Santé Canada à l'adresse suivante : HC.water-eau.SC@canada.ca
Les commentaires doivent nous parvenir avant le jour mois an. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sera révisé après l'analyse des commentaires reçus et qu'une recommandation finale pour l'eau potable sera établie si nécessaire. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Valeur proposée de la recommandation
Une concentration maximale acceptable (CMA) de 0,02 mg/L (20 μg/L) est proposée pour le diméthoate dans l'eau potable.
Les effets toxicologiques du diméthoate sont attribuables à l'ométhoate, son métabolite analogue de l'oxygène (oxonique). Puisque de l'ométhoate peut se former à la suite de la dégradation environnementale du diméthoate ou durant le traitement d'une eau contenant du diméthoate, une approche additive devrait être adoptée, selon laquelle la somme des concentrations détectées de diméthoate et d'ométhoate (exprimées sous forme d'une valeur équivalente de diméthoate) n'excède pas la CMA du diméthoate.
Sommaire
Le présent document technique, qui a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, s'appuie sur des évaluations du diméthoate (qui comprenaient une évaluation de l'ométhoate) menées par l'Agence de réglementation de la lutte antiparasitaire de Santé Canada et sur des documents à l'appui.
Exposition
Les Canadiens peuvent être exposés au diméthoate par l'alimentation, par l'exposition en milieu de travail et, dans une moindre mesure, par l'eau potable. Le diméthoate est un pesticide organophosphoré à large spectre utilisé pour lutter contre un grand nombre d'insectes et d'acariens dans plusieurs sites agricoles et non agricoles. En 2018 (année la plus récente pour laquelle il existe des données), plus de 25 000 kg de diméthoate (à titre de principe actif) ont été vendus au Canada. Le diméthoate peut être libéré dans l'environnement par dérive de pulvérisation durant l'application. Bien qu'il soit hydrosoluble, il se dégrade rapidement, est non persistant dans l'environnement et, donc, n'est pas susceptible de contaminer l'eau souterraine.
On ne trouve habituellement pas de diméthoate dans les sources d'eau potable au Canada, bien que de faibles concentrations aient été observées dans certaines provinces canadiennes. La concentration maximale détectée se situait bien en dessous de la CMA proposée.
L'ométhoate est un produit de dégradation du diméthoate dans l'environnement. Il est également produit lors du traitement des sources d'eau contenant du diméthoate. Cependant, des données canadiennes limitées de surveillance de l'eau n'ont fait état d'aucun échantillon d'ométhoate dépassant la limite de détection.
Effets sur la santé
Le diméthoate cible principalement le système nerveux par son métabolite, l'ométhoate, qui est plus toxique que le diméthoate. On a aussi constaté que le diméthoate provoquait une hausse des cas de mortalité chez les petits d'animaux.
Considérations relatives à l'analyse et au traitement
L'établissement de recommandations pour la qualité de l'eau potable tient compte de la capacité à mesurer le contaminant et à l'enlever des approvisionnements d'eau potable. Plusieurs méthodes d'analyse existent pour mesurer le diméthoate et l'ométhoate dans l'eau potable à des concentrations bien inférieures à la CMA proposée.
À l'échelon municipal, les techniques de traitement qui permettent de diminuer efficacement les concentrations de diméthoate dans l'eau potable sont notamment l'adsorption sur charbon actif, l'oxydation, la filtration sur membrane et les procédés biologiques. Ces techniques de traitement permettent d'atteindre des concentrations dans l'eau traitée qui se situent bien en deçà de la CMA proposée. Bien qu'on puisse enlever le diméthoate à l'aide d'oxydants couramment utilisés pour la désinfection (p. ex. le chlore), les services d'eau devraient s'assurer de réduire au minimum la formation de sous-produits comme l'ométhoate sans compromettre l'efficacité de la désinfection.
Si l'on souhaite enlever le diméthoate à l'échelle d'un réseau de petite taille ou d'un réseau domestique, par exemple dans les cas où la source d'approvisionnement en eau potable est un puits privé, un dispositif résidentiel de traitement de l'eau potable peut être une solution. Même s'il n'existe pas encore de dispositif de traitement certifié permettant d'enlever le diméthoate de l'eau potable, des techniques comme l'adsorption sur charbon actif et l'osmose inverse devraient être efficaces. Puisque ces techniques n'engendrent pas la formation d'ométhoate, seul l'enlèvement du diméthoate est nécessaire à l'échelle résidentielle. Lorsqu'on utilise un tel dispositif de traitement, il est important d'envoyer des échantillons d'eau prélevée à l'entrée et à la sortie du dispositif à un laboratoire agréé aux fins d'analyse afin d'assurer un enlèvement adéquat du diméthoate.
Application de la recommandation
Remarque : Pour obtenir des conseils précis sur l'application des recommandations pour l'eau potable, il convient de consulter l'autorité appropriée en matière d'eau potable.
La valeur recommandée proposée pour le diméthoate et l'approche additive proposée concernant l'ométhoate visent à offrir une protection contre les effets sur la santé découlant d'une exposition au diméthoate et à l'ométhoate dans l'eau potable toute la vie durant. Tout dépassement de la CMA proposée devrait faire l'objet d'un examen et être suivi des mesures correctives appropriées. En cas de dépassement dans une source d'eau qui n'est pas traitée, une surveillance accrue devrait être mise en place afin de confirmer le dépassement. S'il est confirmé que les concentrations de diméthoate dans la source d'eau dépassent la CMA proposée, un examen devrait être mené pour déterminer le moyen le plus approprié de réduire l'exposition au diméthoate. Les options possibles comprennent l'utilisation d'une autre source d'approvisionnement en eau ou l'installation d'un dispositif de traitement. Si un traitement est déjà en place lorsqu'un dépassement survient, un examen devrait être réalisé pour vérifier le traitement et déterminer si des modifications doivent être apportées pour ramener la concentration dans l'eau traitée en dessous de la CMA proposée. Lorsqu'on utilise des procédés d'oxydation pour dégrader le diméthoate, il faudrait surveiller l'ométhoate pour s'assurer que la somme de leurs concentrations, calculée à l'aide de l'approche additive, se situe sous la CMA.
Table des matières
- 1.0 Considérations liées à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations liées à l'analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations d'ordre international
- 7.0 Justification
- 8.0 Références
- Annexe A: Liste des sigles et acronymes
- Annexe B : Données sur la qualité de l'eau au Canada
1.0 Considérations relatives à l'exposition
1.1 Sources et utilisations
Le diméthoate est un insecticide et acaricide organophosphoré à large spectre utilisé pour lutter contre un grand nombre d'insectes et d'acariens dans plusieurs sites agricoles et non agricoles (Santé Canada, 2011, 2015). Il interrompt la transmission de l'influx nerveux, ce qui inhibe la cholinestérase (ChE) (Santé Canada, 2011). Aucun produit domestique ne contient de diméthoate au Canada, et aucune utilisation résidentielle n'est faite de ce pesticide (Santé Canada, 2011). Plus de 25 000 kg de diméthoate (à titre de principe actif) ont été vendus au Canada en 2018 (année la plus récente pour laquelle il existe des données) (Santé Canada, 2020a).
Le diméthoate peut être libéré dans l'environnement par dérive de pulvérisation et par ruissellement durant l'application dans les champs (Santé Canada, 2015). Il est très soluble dans l'eau et n'est pas susceptible de se volatiliser à partir de sols humides ou d'eaux de surface (Santé Canada, 2011). Il ne s'adsorbe pas aux particules du sol et y est donc extrêmement mobile (OMS, 2004; Santé Canada, 2011, 2015). Malgré cela, il est peu probable que le diméthoate contamine les eaux souterraines, car il se décompose rapidement en ométhoate dans le sol par dégradation microbiologique et hydrolyse (la principale voie d'inactivation du diméthoate dans l'environnement) (OMS, 2004; Santé Canada, 2011, 2015). La phototransformation du diméthoate ne constitue pas une voie importante de transformation dans l'eau et dans le sol (Santé Canada, 2011). Le diméthoate a une demi-vie de 2 à 122 jours dans le sol et de 18 heures à 8 semaines dans l'eau, bien qu'il soit relativement stable à un pH situé entre 2 et 7 (HSDB, 2010; OMS, 2017). Dans l'ensemble, le diméthoate est non persistant dans l'environnement (OMS, 2004; Santé Canada, 2011, 2015).
L'ométhoate est le principal produit de dégradation toxique du diméthoate dans l'environnement (US EPA, 2006a). Il s'agit aussi d'un pesticide organophosphoré qui inhibe la ChE. Cependant, il n'est pas homologué en tant que pesticide au Canada ni aux États-Unis (US EPA, 2004; APVMA, 2011). L'ométhoate présente une mobilité dans le sol élevée à très élevée (AESA, 2006). Comme on a observé des demi-vies de 0,9 à 2,8 jours dans le sol en laboratoire, il est peu probable que l'ométhoate soit persistant (AESA, 2006).
En plus d'être un produit de dégradation présent dans l'environnement, l'ométhoate se forme durant la chloration de l'eau potable, après la conversion de 11 % à 23 % du diméthoate (Marin, 2010). L'ométhoate est aussi un métabolite toxique important du diméthoate chez les mammifères, car sa toxicité est supérieure à celle du produit chimique d'origine (Santé Canada, 2011). Voilà pourquoi la présente évaluation du diméthoate inclut également des renseignements sur l'ométhoate.
1.2 Identité de la substance
Le diméthoate (C5H12NO3PS2), ou phosphorodithioate de S-méthylcarbamoylméthyle et de O,O-diméthyle, est un solide cristallin blanc appartenant au groupe des dithiophosphates (Santé Canada, 2011). Le diméthoate peut contenir de faibles concentrations d'impuretés, comme l'ométhoate et l'isodiméthoate, qui présentent un potentiel d'inhibition de la ChE supérieur à celui du diméthoate (AESA, 2018).
L'ométhoate (C5H12NO4PS), ou phosphorothioate de S-(N-méthylcarbamoylméthyle) et de O,O-diméthyle, est un liquide incolore de synthèse (Lewis et coll., 2016). Il s'agit d'un métabolite analogue de l'oxygène (oxonique) du diméthoate qui joue un rôle important dans les effets toxiques du diméthoate chez les insectes et les mammifères (APVMA, 2010). Certaines propriétés physiques et chimiques du diméthoate et de l'ométhoate sont résumées au tableau 1.
| Propriété | DiméthoateFootnote a | Interprétation | OméthoateFootnote b | Interprétation |
|---|---|---|---|---|
No du CAS |
60-50-1 |
Sans objet |
1113-02-6 |
Sans objet |
Poids moléculaire |
229,4 |
Sans objet |
213,2 |
Sans objet |
Solubilité dans l'eau |
23,3 à un pH de 5 |
Hautement hydrosoluble |
500 à 20 °C |
Hautement hydrosoluble |
Pression de vapeur |
0,25 à 25 °C |
Très faible volatilité; ne devrait pas se volatiliser à partir de sols humides ou de la surface de l'eau |
19,0 à 20 °C |
Modérément volatil |
Constante de la loi d'Henry |
1,42 x 10-6 |
Ne devrait pas se volatiliser à partir de sols humides ou de la surface de l'eau |
4,62 x 10-9 |
Ne devrait pas se volatiliser à partir de sols humides ou de la surface de l'eau |
Coefficient de partage n-octanol-eau |
0,704 |
Bioaccumulation improbable |
-0,9 |
Bioaccumulation improbable |
Constante de dissociation |
2,0 à 20 °C |
S'hydrolyse modérément en milieu acide ou neutre, s'hydrolyse facilement en milieu basique |
Non disponible |
Sans objet |
1.3 Exposition
Une exposition au diméthoate peut survenir principalement par le régime alimentaire, ou en contexte professionnel lors de la manipulation et de l'application de produits contenant du diméthoate (Santé Canada, 2011, 2015). L'eau potable est une source d'exposition mineure au diméthoate (Santé Canada, 2011, 2015). L'exposition à l'ométhoate est possible par le régime alimentaire, si des résidus sont présents dans les aliments, et par la consommation d'eau potable si la substance est présente à la suite de l'oxydation du diméthoate lors du traitement de l'eau et de la dégradation du diméthoate dans l'environnement (Santé Canada, 2011).
Selon l'évaluation des risques globaux associés à l'alimentation et à l'eau potable réalisée par Santé Canada (2015), l'exposition au diméthoate découlant de la consommation d'aliments et d'eau potable n'est pas préoccupante (tableau 2). L'Organisation mondiale de la Santé (OMS) a estimé à 0,001 μg/kg de poids corporel (p.c.) (0,000001 mg/kg p.c.) l'apport quotidien total de diméthoate provenant des aliments, ce qui est considérablement inférieur à la valeur de 0,00011 mg/kg p.c./j estimé par l'ARLA pour la population générale du Canada (Santé Canada, 2015; OMS, 2017).
| Groupe de population (âge) |
Exposition par les alimentsa | Exposition par les aliments et l'eauFootnote a | ||
|---|---|---|---|---|
| mg/kg p.c./j | % AQAFootnote b | mg/kg p.c./j | % AQAb | |
Population générale |
0,00011 |
6 |
0,000147 |
7 |
Tous les nourrissons |
0,000107 |
5 |
0,000230 |
12 |
Enfants de 1 à 2 ans |
0,000262 |
13 |
0,000318 |
16 |
Enfants de 3 à 5 ans |
0,000244 |
12 |
0,000296 |
15 |
Enfants de 6 à 12 ans |
0,000166 |
8 |
0,000202 |
10 |
Hommes de 13 à 19 ans |
0,000105 |
5 |
0,000132 |
7 |
Hommes de 20 à 49 ans |
0,000091 |
5 |
0,000126 |
6 |
Adultes de 50 ans ou plus |
0,000078 |
4 |
0,000115 |
6 |
Femmes de 13 à 49 ans |
0,000088 |
4 |
0,000122 |
6 |
Des données de surveillance de l'eau provenant des provinces et des territoires (approvisionnement municipal et non municipal), de l'ARLA et d'Environnement et Changement climatique Canada (Environnement Canada, 2011) (annexe B) étaient disponibles pour le diméthoate.
Selon les données fournies par les provinces et les territoires ainsi que par la Direction générale de la santé des Premières Nations et des Inuits (DGSPNI) de Services aux Autochtones Canada, les concentrations de diméthoate sont inférieures au seuil de déclaration de la méthode (SDM) ou à la limite de détection de la méthode (LDM) dans la majorité des échantillons prélevés dans divers approvisionnements d'eau au Canada, dont de l'eau de surface et de l'eau souterraine ainsi que de l'eau traitée et distribuée ayant fait l'objet d'une surveillance (Ministère de la Santé de la Colombie-Britannique, 2019; Services aux Autochtones Canada, 2019; Développement durable Manitoba, 2019; Ministère de l'Environnement et de la Lutte contre les changements climatiques du Québec, 2019; Ministère de l'Environnement de la Nouvelle-Écosse, 2019; Ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard, 2019; Agence de la sécurité de l'eau de la Saskatchewan, 2019; Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario, 2020). Le tableau 3 résume les données de surveillance des secteurs de compétence où les échantillons déclarés étaient inférieurs à la LDM. Le tableau 4, quant à lui, résume les données des secteurs de compétence où des détections de diméthoate ont été signalées. La concentration maximale, 2,5 μg/L, a été mesurée dans des échantillons provenant de la Saskatchewan et de l'Ontario. Aucune donnée de surveillance n'était disponible pour le Nouveau-Brunswick, Terre-Neuve-et-Labrador ou le Yukon (Ministère de l'Environnement et des gouvernements locaux du Nouveau-Brunswick, 2019; Ministère des Affaires municipales et de l'Environnement de Terre-Neuve-et-Labrador, 2019; Services de santé environnementale du Yukon, 2019).
| Secteurs de compétence (LDM µg/L) |
Période de surveillance | Approvisionnement municipal/non municipal | Type d'eau (municipale : souterraine/de surface – brute, traitée, distribuée) |
Nombre de détections/ d'échantillons |
|---|---|---|---|---|
Colombie-Britannique |
2013–2018 |
Municipale |
De surface – brute |
0/18 |
DGSPNI, région de l'Ontario |
2014–2018 |
Réseaux publics d'approvisionnement en eau |
Souterraine – brute |
0/13 |
Souterraine – traitée |
0/190 |
|||
Souterraine – distribuée |
0/16 |
|||
De surface – brute |
0/33 |
|||
De surface – traitée |
0/308 |
|||
De surface – distribuée |
0/23 |
|||
Réseaux semi–publics d'approvisionnement en eau |
Souterraine – brute |
0/3 |
||
Souterraine – traitée |
0/16 |
|||
Souterraine – distribuée |
0/68 |
|||
De surface – brute |
0/1 |
|||
De surface – traitée |
0/9 |
|||
De surface – distribuée |
0/2 |
|||
Réseaux privés d'approvisionnement en eau |
Souterraine – traitée |
0/3 |
||
Souterraine – distribuée |
0/50 |
|||
De surface – traitée |
0/5 |
|||
DGSPNI, région de l'Atlantique |
2014–2018 |
Réseaux publics d'approvisionnement en eau |
Souterraine – traitée |
0/4 |
Souterraine – distribuée |
0/4 |
|||
De surface – traitée |
0/1 |
|||
DGSPNI, Québec |
2014–2018 |
– |
Réseau d'approvisionnement en eau potable |
0/4 |
ManitobaFootnote a |
2015–2020 |
Ambiante |
Lac |
0/14 |
Rivière/ruisseau |
0/187 |
|||
Nouvelle–Écosse |
2007–2018 |
Municipale |
Souterraine – brute |
0/71 |
Souterraine – traitée |
0/35 |
|||
De surface – brute |
0/35 |
|||
De surface – traitée |
0/40 |
|||
Distribuée |
0/1 |
|||
| Secteurs de compétence (LDM µg/L) |
Période de surveillance | Type d'eau (municipale : souterraine/de surface - brute, traitée, distribuée et non (municipale) : souterraine) |
Nombre de détections/ d'échantillons | Concentration maximale (µg/L) |
|---|---|---|---|---|
Ontario |
2010-2020 |
Souterraine - brute |
0/194 |
- |
Souterraine - traitée |
2/4 259 |
0,1 |
||
De surface - brute |
0/154 |
- |
||
De surface - traitée |
2/4 192 |
2,5 |
||
Distribuée |
1/60 |
2,5 |
||
Île-du-Prince-Édouard |
2004-2017 |
Souterraine - brute |
0/665 |
- |
Souterraine - brute |
1/614 |
0,1 |
||
Québec |
2012-2018 |
Souterraine - distribuée |
0/291 |
- |
De surface - distribuée |
4/1 040 |
0,4 |
||
Souterraine - bruteFootnote a (municipale) |
0/46 |
- |
||
Souterraine - traitéeFootnote a (municipale) |
0/17 |
- |
||
Souterraine - distribuéeFootnote a (municipale) |
0/5 |
- |
||
Souterraine - bruteFootnote b (municipale) |
0/82 |
- |
||
Souterraine - bruteFootnote b (non |
0/132 |
- |
||
Saskatchewan |
2014-2019 |
Souterraine et de surface - distribuée |
2/32 |
2,5 |
Souterraine et de surface - traitée |
0/4 |
- |
||
Souterraine - brute |
0/16 |
- |
||
Sur la base d'un examen approfondi des données de surveillance disponibles sur l'eau, l'ARLA a déterminé que les concentrations estimées dans l'environnement du diméthoate étaient de 0,03 µg/L et de 0,08 µg/L (95e centile de la concentration moyenne à chaque site étudié, dont la moitié du seuil de détection pour les non-détections) dans l'eau souterraine et l'eau de surface, respectivement (Santé Canada, 2011). Du diméthoate a été détecté dans un seul des 163 échantillons prélevés de 15 réservoirs en tout au Manitoba, en Saskatchewan et en Alberta (de mai 2003 à avril 2004). La limite de détection était de 25,10 ng/L. Les réservoirs ont surtout reçu l'eau ayant ruisselé sur des terres agricoles cultivées durant la fonte des neiges et la pluie. Aucun diméthoate n'a été détecté dans les échantillons d'eau potable traitée (n = 28; prélevés entre juillet 2004 et 2005) prélevés lors de la même étude (Donald et coll., 2007).
Les données canadiennes de surveillance de l'eau sur l'ométhoate se limitaient à celles des rapports du Nova Scotia Groundwater Observation Network (2007–2012, 2015), et faisaient invariablement état de concentrations d'ométhoate inférieures à la limite de détection de 1 µg/L dans des puits d'observation surveillés une fois par année ou aux deux ans dont le nombre pouvait aller jusqu'à 40 (Gouvernement de la Nouvelle-Écosse, 2007–2012, 2015).
En ce qui a trait aux aliments, des résidus de diméthoate et d'ométhoate peuvent être présents dans des denrées d'origine végétale ou animale (Santé Canada, 2015). Dans les végétaux, des résidus liés au diméthoate ont été mesurés à des concentrations plus élevées dans les échantillons de feuille ou de partie extérieure des plantes que dans ceux de graines ou de racine (Santé Canada, 2015). Dans le rapport annuel 2015-2016 de l'Agence canadienne d'inspection des aliments (2019), on a indiqué avoir détecté des résidus de diméthoate et d'ométhoate dans 60 échantillons de fruits et légumes (frais, congelés et transformés) sur 1 801. Parmi ces 60 détections, les concentrations les plus élevées ont été constatées dans les légumes-feuilles (p. ex. laitue frisée, kale, fines herbes). Un seul échantillon excédait la limite maximale de résidus (0,1 ppm); il était constitué de fines herbes (5,77600 ppm) (ACIA, 2019). Dans les denrées d'origine animale (chèvres et poules), les concentrations les plus élevées de résidus de diméthoate (principalement l'acide carboxylique de diméthoate et d'ométhoate) ont été observées dans le foie et les reins, puis dans les œufs et le lait. Les concentrations les plus faibles se trouvaient dans les muscles et la graisse (Santé Canada, 2015).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le diméthoate, sont réglementés par l'ARLA. L'ARLA effectue des évaluations approfondies et des examens cycliques des pesticides, et tient compte de renseignements inédits et exclusifs, d'examens étrangers effectués par d'autres organismes de réglementation comme l'Environmental Protection Agency des États-Unis (US EPA). La présente évaluation des risques pour la santé du diméthoate, y compris l'analyse de l'ométhoate, se fonde principalement sur des évaluations de l'ARLA (Santé Canada, 2011, 2015) et de documents à l'appui. De plus, tous les examens et les publications pertinentes qui sont apparus après la réalisation des évaluations de l'ARLA ont aussi été pris en compte.
2.1 Cinétique
Ni le sexe, la dose ou la voie d'exposition n'ont influé sur l'absorption, la distribution et l'élimination du diméthoate (Santé Canada, 2011). Les métabolites majeurs du diméthoate sont les esters de thiophosphate et phosphoriques (NHMRC, NRMMC, 2011). Bien que l'ométhoate soit un métabolite mineur (1 % à 6 %), il est responsable de l'inhibition de la ChE observée après l'exposition au diméthoate (Santé Canada, 2011; NHMRC, NRMMC, 2011).
Absorption : Le diméthoate et l'ométhoate ont tous deux été rapidement et presque complètement absorbés dans le tractus gastro-intestinal de rats après une administration orale (APVMA, 2010; Santé Canada, 2011). L'absorption cutanée du diméthoate variait de 7 % à 11 % chez les rats (APVMA, 2010). Lors d'une étude in vitro, la peau de rat a absorbé davantage de diméthoate que la peau humaine (Davies, 1999).
Distribution : Le diméthoate se distribue rapidement dans les tissus, en particulier dans le foie, la bile, les reins et les érythrocytes, mais il est peu probable qu'il s'y accumule (APVMA, 2010; Santé Canada, 2011). Chez les rats, la rétention dans les tissus après l'administration de doses uniques radiomarquées par voie orale de 10 ou 100 mg/kg p.c. de diméthoate a été de 0,3 et 7 ppm, respectivement (Santé Canada, 2011).
L'ométhoate est aussi largement distribué dans les tissus (les concentrations les plus élevées ont été observées dans la glande thyroïde). La rétention dans les tissus est minime : moins de 0,05 % des doses administrées demeurait dans les tissus de rats 48 heures après une administration orale (Santé Canada, 2011; NHMRC, NRMMC, 2011).
Métabolisation :Le diméthoate est fortement métabolisé selon des études sur l'exposition par voie orale menées chez le rat (Santé Canada, 2011). L'hydrolyse est la principale voie métabolique empruntée et elle produit de l'acide carboxylique de diméthoate (métabolite majeur; 29 % à 46 %), qui se métabolise par la suite en diméthyldithiophosphate, en acide diméthylthiophosphorique et en acide diméthylphosphorique (Kirkpatrick, 1995; Santé Canada, 2011). La voie oxydative, une voie mineure, est axée sur l'oxydation du diméthoate en ométhoate, son dérivé oxonique (métabolite mineur, 1 % à 6 %), qui se métabolise ensuite de façon limitée (Kirkpatrick, 1995; Santé Canada, 2011; NHMRC, NRMMC, 2011). La perte de dioxyde de carbone par le diméthoate constitue aussi une voie métabolique mineure (Santé Canada, 2011). L'évaluation d'une étude comparative interspécifique in vitro sur le métabolisme conjointement avec des observations in vivo chez l'humain n'a pas permis de déceler de métabolites du diméthoate propres à l'humain (AESA, 2018).
L'ométhoate n'est pas fortement métabolisé (88 % de la substance est éliminée sous une forme non modifiée dans les 8 heures). Les métabolites identifiés sont le N-méthylméthylsulphinylacétamide (métabolite majeur, 13 % à 22 %), l'O-déméthylométhoate (9 %), l'orthophosphate de O,O-diméthyle et le phosphorothioate de O,O-diméthyle (Santé Canada, 2011; NHMRC, NRMMC, 2011).
Élimination : Le diméthoate et ses métabolites sont rapidement éliminés chez le rat. En effet, une proportion de 91 % à 97 % d'une dose donnée est excrétée dans les 5 jours principalement dans l'urine (85 % à 91 %), et des quantités moindres sont éliminées dans les matières fécales (1 % à 2 %), dans l'air expiré (2 % à 3 %) et dans la carcasse (1 % à 2 %) (Kirkpatrick, 1995; APVMA, 2010; Santé Canada, 2011). Les principaux métabolites trouvés dans l'urine (53 % à 87 %) sont l'acide carboxylique, le thiophosphate et les esters phosphoriques de diméthoate. De 1 % à 2 % du diméthoate est excrété tel quel dans l'urine, tandis que l'ométhoate représente 1 % à 6 % des métabolites urinaires (Kirkpatrick, 1995; NHMRC, NRMMC, 2011; Santé Canada, 2011).
L'ométhoate est rapidement éliminé sous une forme inchangée (de 95 % à 98 % sous forme d'ométhoate) surtout dans l'urine, alors qu'une proportion de 2 % à 5 % est excrétée dans les matières fécales (Santé Canada, 2011). Des études sur les animaux ont montré que les profils d'excrétion de l'ométhoate étaient indépendants de la dose ou du sexe, bien qu'une étude ait indiqué que des rats mâles excrétaient davantage d'ométhoate radiomarqué dans les matières fécales à la dose élevée (10 mg/kg p.c.) qu'à la dose faible (0,5 mg/kg p.c.) (Santé Canada, 2011).
2.2 Effets sur la santé
Les bases de données sur la toxicité du diméthoate et de l'ométhoate sont bien caractérisées chez les animaux et couvrent plusieurs effets et divers types d'exposition, mais les données relatives à la toxicité chez l'humain sont limitées (voir US EPA, 2007; APVMA, 2010, 2011; Santé Canada, 2011, 2015 pour des examens plus approfondis). Le diméthoate cible principalement le système nerveux en inhibant l'acétylcholinestérase (AChE), une enzyme qui dégrade des neurotransmetteurs et qui est nécessaire au bon fonctionnement du système nerveux (Santé Canada, 2011). L'AChE est la principale cholinestérase (ChE) de l'organisme et peut être mesurée dans le tissu cérébral, les érythrocytes et le plasma (OMS, 2004; Santé Canada, 2011; AESA, 2018).
2.3 Effets chez les humains
Les évaluations de l'ARLA et les documents à l'appui (US EPA, 2007; Santé Canada, 2011, 2015) n'ont pas abordé les effets du diméthoate ou de l'ométhoate chez les humains. Les données tirées de la littérature se limitaient à des études chez des volontaires, à quelques études de cas et à une étude prospective, lesquels indiquaient qu'une exposition aiguë au diméthoate et à l'ométhoate causait les mêmes signes typiques d'une intoxication aux organophosphates.
La dose sans effet nocif observé (NOAEL) pour l'inhibition de la ChE était de 0,2 mg/kg p.c. par jour chez 9 volontaires hommes et femmes à qui on a donné du diméthoate pendant 39 jours. Cette NOAEL a été confirmée dans sept autres études, dont chacune comptait de 6 à 20 volontaires qui recevaient des doses allant de 0,04 à 1,0 mg/kg p.c. par jour pendant une période allant jusqu'à 57 jours (OMS, 2004).
Des études de cas et des déclarations d'ingestion accidentelle ou délibérée de diméthoate ont été recensées dans la littérature. Dans une étude prospective passant en revue 264 cas d'ingestion délibérée de diméthoate (concentrations plasmatiques de 160,0 à 674,0 µmol/L), l'intoxication aiguë au diméthoate s'est traduite par un choc hypotensif, une fonction respiratoire réduite, l'inhibition de l'AChE (dont un coma) et, dans 61 cas, le décès (Eddleston et coll., 2005). Des signes similaires ont été observés lors d'études de cas individuels d'intoxication au diméthoate et comprenaient une bradycardie (ralentissement du rythme cardiaque), une dépression ou insuffisance respiratoire (difficultés à respirer), une ataxie marquée de la marche (mouvements non coordonnés), des convulsions et un coma (LeBlanc et coll., 1986; De Bleeker et coll., 1992; Fonseka et coll., 2003; Hoffmann et Papendorf, 2006).
Les effets étaient similaires lors d'études de cas portant sur l'ingestion d'ométhoate (Lotti et coll., 1981; Tsatsakis et coll., 1998; Pavlic et coll., 2002). Il est peu probable que l'ométhoate cause une neuropathie différée chez les humains selon des études enzymatiques faisant appel à des prélèvements d'autopsies (Lotti et coll., 1981).
2.4 Effets chez les animaux
L'inhibition de la ChE et la mortalité des petits étaient les principaux effets du diméthoate observés lors d'études sur les animaux, et ces effets étaient concomitants dans certaines études sur la reproduction et le développement (tableau 5). Le diméthoate n'était ni génotoxique, ni cancérogène, ni tératogène. Lors d'études de toxicité aiguë, le diméthoate s'est avéré modérément toxique par voie orale et légèrement toxique par voie cutanée et par inhalation (tableau 6) (Santé Canada, 2011).
Chez les animaux de laboratoire, des études de toxicité par voie orale sur la détermination des doses, de toxicité chronique et de cancérogénicité, de toxicité pour la reproduction sur deux générations et une génération, de neurotoxicité pour le développement (NPD), et d'études comparatives sur la ChE utilisant le diméthoate ont montré des effets sur le système nerveux, en particulier l'inhibition de la ChE dans le cerveau, le plasma et les érythrocytes des animaux traités, tant chez les adultes que les petits (Hellwig et coll., 1986a; Burford et coll., 1990a, 1990b; Brooker et Stubbs, 1991; Brooker et coll., 1992; Myers, 2001a, 2001b; Mellert et coll., 2003; US EPA, 2004, 2006a; APVMA, 2010; Santé Canada, 2011). La ChE du cerveau était généralement l'indicateur le plus sensible de la toxicité, et ce, à des doses similaires ou inférieures à celles causant l'inhibition de la ChE dans les érythrocytes (FIFRA, 2005; US EPA, 2006b; Santé Canada, 2011). L'inhibition de la ChE des érythrocytes a entraîné des changements nocifs dans le tissu nerveux périphérique lors d'études de toxicité aiguë et subaiguë seulement. Lors d'études de plus longue durée, l'inhibition de la ChE des érythrocytes seule n'était pas considérée comme un effet nocif sur le plan toxicologique, en raison des limitations liées au faible taux de resynthèse de la ChE des érythrocytes sur de longues périodes (US EPA, 2006b; Santé Canada, 2011). La ChE du plasma était la moins touchée et était considérée comme un marqueur d'exposition plutôt que comme un effet nocif sur le plan toxicologique (APVMA, 2011; Santé Canada, 2011).
Dans des études de toxicité chronique du diméthoate, des rats étaient légèrement plus sensibles que d'autres espèces à l'inhibition de la ChE selon des NOAEL de 0,05 à 1,3 mg/kg p.c. par jour et des doses minimales avec effet nocif observé (LOAEL) de 0,25 à 3 mg/kg p.c. par jour, comparativement à des LOAEL de 3,75 mg/kg p.c. par jour chez la souris et de 0,73 mg/kg p.c. par jour chez le chien (Hellwig et coll., 1986a; Burford et coll., 1990a, 1990b; US EPA, 2006a; APVMA, 2010; Santé Canada, 2011). Tant les jeunes animaux (y compris les fœtus) que les adultes présentaient une sensibilité semblable aux effets d'inhibition de la ChE par le diméthoate, comme l'ont montré l'étude sur la détermination des doses de l'étude de NPD et l'étude comparative sur la ChE. Lors de l'étude comparative sur la ChE, les adultes et les petits présentaient les mêmes NOAEL (0,5 mg/kg p.c. par jour dans le cas d'une exposition aiguë et 0,1 mg/kg dans le cas d'une exposition répétée) (Myers, 2001c; US EPA, 2004; Santé Canada, 2011). Dans l'ensemble, aucune différence marquée entre les sexes n'est ressortie dans la base de données disponibles sur le diméthoate. La comparaison de données provenant d'études sur le rat de durées différentes révèle que la toxicité s'accroît lorsque les sujets sont exposés à des doses répétées, par rapport aux sujets exposés une seule fois. Toutefois, le recours à des méthodes différentes d'exposition (par gavage ou régime alimentaire) est un facteur de confusion (Santé Canada, 2011).
En plus de l'inhibition de la ChE, une mortalité accrue chez les petits a été observée dans des études de toxicité pour la reproduction sur deux générations et dans l'étude de détermination des doses d'une étude de toxicité pour la reproduction sur une génération ainsi que dans l'étude de détermination des doses de l'étude de NPD. Cependant, cet effet n'a pas été observé dans l'étude de NPD, car la ChE du cerveau n'a pas été mesurée. L'étude de NPD n'a pas évalué les effets comportementaux et neuropathologiques chez les mères et les petits, les petits (mais non les mères) ont présenté des effets aux doses ≥ 0,5 mg/kg p.c. par jour. Une augmentation du nombre de décès chez les petits liée à la dose a été observée dans l'étude de NPD en l'absence de signes évidents de toxicité chez les mères au début de la lactation, chez les petits ayant reçu des doses moyennes et élevées (y compris la perte de toute la portée dans le cas d'une femelle du groupe ayant reçu une dose de 0,5 mg/kg p.c. par jour et dans le cas de trois femelles du groupe ayant reçu une dose de 3,0 mg/kg p.c. par jour). Les rejetons touchés étaient petits, froids au toucher, et présentaient peu de nourriture dans l'estomac. La NOAEL des petits a été établie à 0,1 mg/kg p.c. par jour en fonction de la mortalité accrue des petits et des changements dans l'activité motrice (Myers, 2001b; US EPA, 2004). Une hausse du nombre de décès chez les petits et des pertes de portées complètes ont aussi été observées dans l'étude sur la détermination des doses de l'étude principale de NPD, mais elles se sont produites à 6,0 mg/kg p.c. par jour (Myers, 2001a; APVMA, 2010; Santé Canada, 2011).
L'étude comparative sur la ChE n'a pas révélé d'effets significatifs liés au traitement, peu importe le paramètre de la reproduction ou du développement, notamment le nombre de naissances vivantes, de corps jaunes, d'implantations ou de résorptions complètes, ou les pertes pré-implantation et post-implantation, le poids corporel des fœtus ou le rapport des sexes. Aucun signe clinique ni aucune hausse de la mortalité n'ont été observés chez les rats adultes mâles ou femelles, les fœtus ou les petits, peu importe la dose (Myers, 2001c; US EPA, 2004; Santé Canada, 2011).
Étant donné la hausse des cas de mortalité chez les petits dans l'étude de NPD ainsi qu'une perturbation potentielle du comportement des mères liée à l'inhibition de la ChE, une étude de faible envergure sur l'allaitement croisé a été réalisée pour déterminer l'influence de l'exposition prénatale et postnatale des mères sur la mortalité des petits. Des femelles gravides ont reçu des doses de 0, 3 ou 6 mg/kg p.c. par jour de diméthoate à partir du jour de gestation (JG) 6 jusqu'au jour postnatal (JPN) 11. Au JPN 1, certaines portées de mères témoins ont été échangées avec celles de mères traitées, tel que l'énonce le tableau 5. Les petits n'ont pas été traités directement avec du diméthoate. Les mères traitées (les deux doses) perdaient des poils sur les membres inférieurs, étaient plus agitées et dispersaient leurs petits. Cependant, des tests neurocomportementaux n'ont révélé aucun effet en lien avec le traitement. Le nombre de petits ne présentant aucun lait dans l'estomac a augmenté dans les portées dont prenaient soin les mères traitées (les deux doses). Le nombre de décès a augmenté chez les petits et a été positivement corrélé avec la dose reçue par les mères et la durée du traitement, mais était aussi quelque peu lié à l'agitation des mères et à la dispersion des petits. Par conséquent, l'étude sur l'allaitement croisé n'a pas permis de déterminer si la mortalité des petits était attribuable au manque de soins apportés par les mères ou à l'exposition au diméthoate. L'étude a établi une LOAEL de 3 mg/kg p.c. par jour pour les mères et les petits (Myers, 2004; Santé Canada, 2011).
| Étude (références) |
Méthode | NOAEL (mg/kg p.c. par jour) |
BMDL10 correspondant à l'inhibition de la ChEc cérébrale (mg/kg p.c. par jour) |
Effets (mg/kg p.c. par jour) |
|---|---|---|---|---|
Étude de NPD principale |
|
0,1 (petits) 3,0 (mères, développement) |
Non calculée |
Mères : Petits : Remarque : La ChE n'a pas été mesurée lors de cette étude; voir les données sur la ChE dans l'étude complémentaire comparative sur la ChE |
Étude comparative sur la ChE complémentaire à l'étude de NPD |
|
0,5 (aiguë : petits et adultes) 0,1 (répétée : fœtus, petits, mères et adultes) |
1,3–2 (aiguë : petits et adultes) 0,2–0,7 (répétée : fœtus, petits, mères et adultes) |
Exposition aiguë Mères/adultes Fœtus/petits |
Détermination des doses pour l'étude de NPD |
|
0,2 (mères, petits) 3,0 (développement) |
0,2–0,4 (mères, fœtus, petits) |
Mères : Développement/reproduction : Petits : |
Allaitement croisé |
|
LOAEL de 3 (mères et petits) |
Non calculée |
Mères Petits 6 : hausse de la mortalité, changements hématologiques et de la biochimie du sang, diminution du réflexe de redressement en fonction de la surface au JPN 10, accroissement du gain de poids aux JPN 1 à 11 (traitement postnatal seulement) |
Toxicité chronique et cancérogénicité |
|
0,05 mg/kg p.c./ jour selon l'inhibition de la ChE |
0,22–0,31 |
≥ 0,25 : diminution de la ChE du cerveau et des érythrocytes, augmentation de la fréquence des tumeurs vasculaires (hémangiomes et hémangiosarcomes combinés dans la rate, les ganglions lymphatiques et la peau) ≥ 1,25 : diminution de la ChE du plasma 5 : réduction transitoire du gain de poids chez les mâles; hausse de la mortalité (femelles seulement, vers la fin de l'étude), hausse des cas d'anémie chez les mâles, augmentation du nombre de leucocytes |
Étude de reproduction sur deux générations - rats Sprague-Dawley |
|
0,08/0,09 mâles/femelles (parents) 1,2/1,3 mâles/femelles (reproduction, petits) |
0,3–0,7 |
Parents |
Étude de reproduction sur deux générations - rats Wistar |
|
0,2 (parents) 6,5 (reproduction) 1,0 (petits) |
0,2–0,5 |
Parents |
En plus de la mortalité et des modifications de l'activité motrice chez les petits, le diméthoate a aussi provoqué des effets sur le système reproducteur (réduction des taux de gestation, réduction de la taille des portées, diminution du gain de poids des petits, effets sur la prostate) dans deux études sur la reproduction sur deux générations (Brooker et coll., 1992; Mellert et coll., 2003; US EPA, 2004; APVMA, 2010; Santé Canada, 2011).
Le profil toxicologique connu de l'ométhoate est similaire à celui du diméthoate, mais l'ométhoate était un inhibiteur plus puissant de la ChE dans des études de toxicité subchronique et chronique. On y a fait état d'une NOAEL de 0,04 mg/kg p.c. par jour pour les rats Wistar et de 0,1 mg/kg p.c. par jour pour les souris, ainsi que d'une LOAEL de ≥ 0,125 mg/kg p.c. par jour pour les chiens Beagle (Hoffmann et Schilde, 1984; Schladt, 1995, 2001; Santé Canada, 2011). De plus, la toxicité aiguë de l'ométhoate est beaucoup plus élevée que celle du diméthoate selon la dose létale médiane (DL50) et la concentration létale médiane (CL50) obtenues lors d'études de la toxicité par voie orale, par contact cutané et par inhalation (tableau 6) (Santé Canada, 2011). Tant pour le diméthoate que pour l'ométhoate, les signes cliniques de toxicité aiguë correspondaient à ceux de l'intoxication aiguë aux organophosphates (p. ex. fibrillation musculaire, salivation, larmoiement, incontinence urinaire, diarrhée, détresse respiratoire, prostration, halètement, coma et décès) (Santé Canada, 2011).
| Valeur de toxicité aiguë (unité) | Espèce | Diméthoate | Ométhoate | Référence |
|---|---|---|---|---|
DL50 - orale |
Rat |
310-600 |
22–65 |
OMS, 2004; AESA, 2006; Santé Canada, 2011 |
DL50 - orale |
Souris |
150–160 |
27–36 |
AESA, 2006; APVMA, 2010; Santé Canada, 2011 |
DL50 - orale |
Lapin |
300 |
50 |
Santé Canada, 2011 |
DL50 - cutanée |
Lapin |
>2 000 |
Aucune donnée |
Santé Canada, 2011 |
DL50 - cutanée |
Rat |
> 2 000 |
145–232 |
APVMA, 2010; Santé Canada, 2011 |
CL50 |
Rat |
> 2 |
0,282 |
Santé Canada, 2011 |
L'ométhoate ne s'est pas avéré tératogène dans deux études distinctes faisant appel à des rates Long-Evans FB gravides (de 20 à 24 par dose) et à des rates Wistar gravides (25 par dose), à qui on a donné par gavage 0, 0,3, 1,0 ou 3,0 mg/kg p.c. par jour d'ométhoate aux JG 6 à 15. Cependant, chez les rates Long-Evans, on a observé une réduction du poids des fœtus et une augmentation des cas de résorption dans le groupe ayant reçu une dose élevée en présence de toxicité maternelle. La NOAEL à l'égard des effets sur les mères et le développement était de 1.0 mg/kg p.c. par jour (Bayer, 1975; Holzum, 1990a; Santé Canada, 2011).
Des effets sur le développement (réduction du poids des petits et hausse des pertes postnatales) et la reproduction (baisse du taux d'implantation, augmentation de l'intervalle précoïtal, réduction de la taille des portées et hausse de la vacuolisation de l'épithélium de l'épididyme chez les mâles) ont été observés chez des rats Wistar en présence de toxicité parentale dans une étude de reproduction sur deux générations utilisant de l'ométhoate. La NOAEL était de 0,5 ppm pour les effets sur le développement et de 3 ppm pour les effets sur la reproduction, et la LOAEL pour les effets sur les parents était de 0,5 ppm (Dotti et coll., 1992; Santé Canada, 2011). Des études sur le développement menées sur des lapins ont montré une fréquence accrue de cas d'articulations contractées chez les petits de lapins Himalayan, mais pas chez les lapins New Zealand White. En l'absence de données de témoins historiques sur les lapins Himalayan et sur la relation dose-réponse, il n'est pas certain que l'augmentation était attribuable à l'ométhoate. Parmi les autres effets sur le développement, mentionnons la réduction du poids des fœtus (chez les rats Long-Evans) et une augmentation des cas de résorption (chez les rats Long-Evans et les lapins Himalayan). Toutefois, des effets sur le développement ont été signalés en présence de toxicité maternelle (diminution du gain de poids des mères ou baisse de l'activité de la cholinestérase) (Tesh et coll., 1982; Holzum, 1990b; Santé Canada, 2011).
2.5 Génotoxicité et cancérogénicité
Le diméthoate n'était pas génotoxique lors de plusieurs essais in vitro (test d'Ames, essai de mutation génique sur cellules ovariennes de hamster chinois, essai de mutation du gène de l'hypoxanthine-guanine-phosphoribosyl-transférase [HGPRT], essai de synthèse d'ADN non programmée [UDS]) et in vivo (essai de létalité dominante chez la souris, essai cytogénétique sur moelle osseuse chez le rat, essai UDS) (Santé Canada, 2011). Des résultats positifs ont été obtenus lors d'un essai UDS in vitro, mais à des concentrations cytotoxiques. Un second essai UDS in vitro et un essai UDS in vivo utilisant des rats Wistar mâles ont donné des résultats négatifs (Santé Canada, 2011).
Une étude de 2 ans lors de laquelle on a donné à des rats Wistar 0,5, 4 ou 32 ppm (équivalant à 0,04/0,05, 0,30/0,44, 2,92/3,93 mg/kg p.c. par jour à des mâles et des femelles) de diméthoate dans de l'eau potable a montré une hausse de la fréquence des tumeurs vasculaires chez les mâles seulement, mais les résultats sont considérés comme équivoques compte tenu de l'absence de relation dose-réponse, de la présence de tumeurs chez un sexe seulement, de la significativité statistique négligeable et des fréquences plus faibles que prévu chez les animaux témoins (4 %) par rapport aux données des témoins historiques (16 % et 22 %) (Santé Canada, 2011, 2015).
L'ARLA a conclu qu'il était peu probable que le diméthoate pose un risque de cancer pour l'humain (Santé Canada, 2015). L'Australian Pesticides and Veterinary Medicines Authority (APVMA), un organisme comparable à l'ARLA, n'a pas considéré le diméthoate comme étant génotoxique ou cancérogène (APVMA, 2010).
L'US EPA a classé le diméthoate dans le groupe C, soit « possiblement cancérogène pour les humains », en fonction des tumeurs hémolymphoréticulaires équivoques observées chez des souris B6C3F1 mâles, du faible effet (aucun effet dose-réponse) que constitue l'ensemble des tumeurs présentes dans la rate, les ganglions lymphatiques et la peau chez des rats Wistar mâles, et de l'activité mutagène positive (mutation génétique positive et aberrations chromosomiques structurales, mutation bactérienne et effets clastogènes in vitro et in vivo) associées au diméthoate (US EPA, 1995, 2007). Le Centre international de recherche sur le cancer (CIRC) ne s'est pas penché sur la cancérogénicité du diméthoate.
Concernant l'ométhoate, les essais sur la génotoxicité étaient pour la plupart négatifs, à l'exception de résultats positifs dans un essai de mutation ponctuelle in vivo chez la souris, un essai de mutation génétique à dose très élevée, et dans des essais in vitro de réparation d'ADN et d'échange de chromatides sœurs. Aucun effet n'a été observé lors d'essais in vivo de réparation d'ADN et d'échange de chromatides sœurs (Santé Canada, 2011; NHMRC, NRMMC, 2011).
Aucune cancérogénicité n'était manifeste chez les rats et les souris ayant reçu des doses répétées d'ométhoate (Santé Canada, 2011). L'APVMA n'a pas considéré l'ométhoate comme étant génotoxique ou cancérogène (APVMA, 2011). Ni l'US EPA ni le CIRC n'ont examiné la cancérogénicité de l'ométhoate.
2.6 Mode d'action
Le diméthoate engendre une neurotoxicité lorsqu'on l'active in vivo pour qu'il devienne son métabolite oxonique, l'ométhoate (US EPA, 2004). À l'instar d'autres pesticides organophosphorés, le dérivé oxonique inhibe la ChE par une phosphorylation du site actif de l'enzyme. Cette inhibition mène à une accumulation d'acétylcholine et à la stimulation continue des récepteurs cholinergiques dans l'ensemble des systèmes nerveux central et périphérique, ce qui se traduit par une toxicité cholinergique (US EPA, 2004).
Le mode d'action du diméthoate qui cause la mort des petits d'animaux n'est pas bien compris (US EPA, 2006a).
2.7 Effet principal retenu
La base de données toxicologiques sur le diméthoate est exhaustive et comprend des études sur la toxicité sur le plan du développement prénatal chez le rat et le lapin, deux études sur la toxicité pour la reproduction sur plus d'une génération, une étude sur la NPD, une étude comparative sur la ChE (avec examen des fœtus, des petits, des femelles gravides et des adultes) ainsi qu'une étude spéciale sur l'allaitement croisé (Santé Canada, 2011). À partir de ces études, deux points de départ (PDD) potentiels pour le diméthoate ont été déterminés : l'inhibition de la ChE du cerveau et la mortalité chez les petits (tableau 5).
L'inhibition de la ChE a été systématiquement observée dans une grande variété d'études (chronique ou subchronique par le régime alimentaire, toxicité pour le développement et la reproduction, comparative de la ChE). Les rats semblaient légèrement plus sensibles que d'autres espèces (comme les souris et les chiens) à l'inhibition de la ChE selon les valeurs de la NOAEL/LOAEL. Globalement, aucune différence marquée entre les sexes n'est ressortie dans la base de données disponibles, à l'exception de quelques études chez le rat où les femelles se sont révélées légèrement plus sensibles que les mâles aux effets inhibiteurs du diméthoate. Aucun effet toxique sur les mères n'a été observé dans l'étude sur la NPD, mais une augmentation liée à la dose du nombre de décès chez les petits a été constatée à ≥ 0,5 mg/kg p.c. par jour (LOAEL), et elle était inférieure à la mortalité des petits observée dans l'étude de NPD de détermination des doses (LOAEL = 6 mg/kg p.c. par jour) et dans d'autres études sur la reproduction. La NOAEL pour les petits dans l'étude de NPD principale a été établie par l'US EPA et l'ARLA à 0,1 mg/kg/jour, selon la hausse de la mortalité chez les petits et l'augmentation de l'activité motrice. Dans l'étude complémentaire sur la ChE, la NOAEL à l'égard de l'inhibition de la ChE était de 0,1 mg/kg/jour suivant une administration de doses répétées. Des taux d'inhibition similaires ont été observés chez des adultes et de jeunes animaux, et la NOAEL ne variait pas d'un groupe d'âge à l'autre. À la plus petite dose ayant un effet sur la mortalité des petits, un taux comparable d'inhibition de la ChE du cerveau (de 10 % à 13 %) a été observé entre les sous-populations (femelles gravides, fœtus, petits de 4 jours, petits de 21 jours et rats adultes exposés pendant 11 jours). Une étude par administration du diméthoate par gavage sur l'allaitement croisé chez le rat a montré qu'il survient des cas de mortalité chez les petits par exposition prénatale, postnatale et combinée. Cette étude n'a donc pas permis d'établir si la mortalité des petits était attribuable au manque de soins apportés par les mères (Myers, 2004; US EPA, 2004; Santé Canada, 2011).
Une modélisation de la dose repère (BMD) a été réalisée pour mieux circonscrire le PDD de l'indicateur de toxicité qu'est l'inhibition de la ChE du cerveau, ainsi que la mortalité chez les petits. L'approche de la BMD est une méthode scientifiquement plus évoluée que celle faisant appel à la NOAEL pour la détermination d'un PDD, puisqu'elle utilise toutes les données dose-réponse disponibles d'une ou de plusieurs études données, et qu'elle permet de quantifier les incertitudes associées aux données de courbes dose-réponse. On trouvera des calculs détaillés de la BMD dans un document intitulé Dimethoate: Issues Related to the Hazard and Dose Response Assessment, préparé conjointement par l'US EPA et l'ARLA (US EPA, 2004). L'ensemble de données ayant servi aux analyses des BMD est jugé robuste, en ce que la mise en application de protocoles similaires de plusieurs études a mené à l'obtention de résultats qui se répétaient. En outre, il était possible d'obtenir des courbes dose-réponse robustes à partir d'études portant sur divers modes d'administration et de durées différentes. L'analyse des BMD a été menée à l'aide d'un modèle dose-réponse à courbe exponentielle et d'une limite inférieure de l'intervalle de confiance à 95 % (BMDL). Il a été estimé que pour la mortalité des petits, une hausse de 5 % de la dose repère (BMD5) était le plus petit changement décelable. En ce qui a trait à l'inhibition de la cholinestérase du cerveau, la limite de sensibilité a été établie à la dose BMD10, soit la détection d'une baisse statistiquement significative de l'activité de la ChE (Santé Canada, 2011).
Les valeurs de BMD10 (de 0,20 à 1,0 mg/kg p.c. par jour) et de BMDL10 (de 0,2 à 0,7 mg/kg p.c. par jour) correspondant à l'inhibition de la ChE du cerveau suivant l'administration de doses répétées n'ont révélé aucune différence liée à l'âge. Les estimations de la BMDL10 (de 1,3 à 2,0 mg/kg p.c.) correspondant à l'inhibition de la ChE du cerveau après l'administration de doses uniques de diméthoate étaient aussi comparables pour les petits et les adultes (tableau 5) (US EPA, 2004). L'ARLA a sélectionné une BMDL10 correspondant à l'inhibition de la ChE du cerveau de 0,2 mg/kg p.c. par jour en fonction des valeurs similaires obtenues dans plusieurs études par voie orale et avec doses répétées (c.-à-d. l'exposition pendant 8 jours de rats mâles adultes dans l'étude comparative par gavage sur la cholinestérase, l'exposition de ~ 15 jours de femelles gravides dans l'étude sur la détermination des doses, l'exposition sur 2 ans dans l'étude sur l'exposition chronique par le régime alimentaire, et l'exposition de > 3 mois par le régime alimentaire dans l'étude sur la reproduction portant sur plusieurs générations). Les analyses des BMD correspondant à l'inhibition de la ChE montraient des courbes dose-réponse et des BMD10 similaires pour tous les groupes d'âge exposés pour des durées semblables (Santé Canada, 2011).
En ce qui touche à la toxicité prénatale et postnatale possible, les études de toxicité prénatale pour le développement chez le rat et le lapin ne révèlent pas de plus grande sensibilité des fœtus chez le rat ou le lapin après exposition in utero au diméthoate ou à l'ométhoate. De même, rien dans les études sur la reproduction n'indique une plus grande sensibilité chez les petits que chez les parents. Dans les études avec doses répétées, on observe une augmentation de la mortalité chez les petits, l'étude la plus sensible se révélant être celle sur la NPD du diméthoate, bien qu'aucune association claire ne puisse être établie avec un taux précis d'inhibition de la ChE du cerveau. Une méta-analyse de la mortalité des petits dans la base de données sur le diméthoate a donné une BMDL5 de 0,64 mg/kg p.c. par jour. Les analyses des BMD ont aussi indiqué que le recours à une limite inférieure de l'intervalle de confiance à 95 % de la dose repère (BMDL10) correspondant à l'inhibition de la cholinestérase du cerveau couvrirait la BMDL5 pour la mortalité des petits (Santé Canada, 2011).
L'ARLA et l'US EPA ont conjointement consulté le Scientific Advisory Panel (SAP) du US Federal Insecticide, Fungicide, and Rodenticide Act (FIFRA) concernant leur évaluation du danger posé par le diméthoate et de la dose-réponse ainsi que la modélisation de la BMD (US EPA et Santé Canada, 2004b; Santé Canada, 2011). Le SAP s'est dit d'avis que, même si la cause sous-jacente de la mort des petits ne pouvait être déterminée à partir des données, le choix de l'inhibition de la ChE du cerveau comme effet critique pour l'évaluation du risque conférerait un effet protecteur contre la mortalité chez les petits (FIFRA, 2005; US EPA, 2004; US EPA, 2006b; Santé Canada, 2011).
L'ARLA a ainsi désigné l'inhibition de la ChE du cerveau comme étant l'indicateur le plus sensible de la toxicité du diméthoate et la BMDL10 de 0,2 mg/kg p.c. par jour comme étant le PDD. Cette valeur concorde avec la NOAEL de 0,2 mg/kg p.c. par jour de diméthoate observée dans les études menées avec des volontaires humains dont il a été question à la section 2.3.
3.0 Calcul de la valeur basée sur la santé
Pour calculer l'apport quotidien acceptable (AQA), on a fait appel à une approche fondée sur la BMD plutôt qu'une approche fondée sur la NOAEL/LOAEL, car elle permet une meilleure caractérisation de la dose-réponse. En effet, elle inclut l'ensemble des données expérimentales permettant de déterminer le PDD indépendamment de la dose préétablie. L'évaluation des risques actuelle se fonde sur la BMDL10 correspondant à l'inhibition de la ChE de 0,2 g/kg p.c. par jour, car elle protégeait à la fois de l'inhibition de la ChE et de la mortalité des petits. Un facteur d'incertitude de 100 a été appliqué afin que l'extrapolation interspécifique (facteur de 10) et la variabilité intraspécifique (facteur de 10) soient prises en compte (Santé Canada, 2011).
En utilisant cette BMDL10, on a calculé comme suit l'AQA de diméthoate (Santé Canada, 2011) :
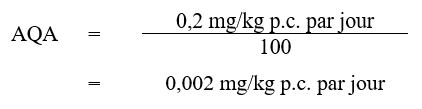
Equation 1 - Équivalent textuel
L'AQA pour diméthoate est de 0,002 mg/kg p.c. par jour. Cette valeur est calculée par divisant la BMDL10 de 0,2 mg/kg p.c. par jour par le facteur d'incertitude de 100.
Où :
- 0,2 mg/kg p.c. par jour est la BMDL10, correspondant à l'inhibition de la cholinestérase;
- 100 est le facteur d'incertitude, choisi pour que soient prises en compte la variation interspécifique (×10) et la variation intraspécifique (×10).
Avec un AQA de 0,002 mg/kg p.c. par jour, on a calculé comme suit la valeur basée sur la santé (VBS) pour le diméthoate dans l'eau potable :
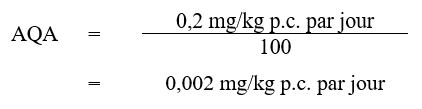
Equation 2 - Équivalent textuel
La VBS pour diméthoate dans l'eau potable est de 0,02 mg/L. Cette valeur est calculée en multipliant l'AQA de diméthoate (0,002 mg/kg p.c. par jour) par le facteur d'attribution de l'eau potable, 0,20, puis par 74 kg, le poids corporel moyen d'un adulte, et en divisant le résultat par 1.53 L/jour, le volume quotidien d'eau consommé par un adulte.
Où :
- 0,002 mg/kg p.c. par jour est l'AQA calculé à l'aide d'une BMDL10 de 0,2 mg/kg p.c. par jour (Santé Canada, 2011);
- 74 kg correspond au poids d'un adulte (Santé Canada, en cours de rédaction);
- 1,53 L par jour correspond au volume quotidien en eau du robinet consommé par un adulte (Santé Canada, en cours de rédaction);
- 0,20 est le facteur d'attribution par défaut pour l'eau potable (Krishnan et Carrier, 2013).
Le présent document propose d'adopter une approche additive pour tenir compte de la présence de l'ométhoate dans l'eau potable. En général, lorsque des résidus chimiques (l'ométhoate) sont combinés et exprimés en équivalents du composé d'origine (le diméthoate), on convertit les résidus en équivalents stœchiométriques en multipliant la concentration de résidus chimiques par le rapport du poids moléculaire (PM) (composé d'origine/résidu). Le poids moléculaire du diméthoate et de l'ométhoate est de 229 g/mol et de 213 g/mol, respectivement. Cela donne un rapport de PM de 219/213 = 1,075. De plus, les données disponibles montrent que l'ométhoate est un inhibiteur de la ChE plus puissant que le diméthoate. Pour tenir compte de cette toxicité accrue, il faut multiplier l'ométhoate (exprimé en équivalent stœchiométrique) détecté dans la source d'approvisionnement en eau ou l'eau potable par un facteur d'ajustement de la toxicité (FAT). L'ARLA a calculé un FAT de 3 pour l'ométhoate en se basant sur les rapports des doses repères du diméthoate et de l'ométhoate calculées à partir des BMD10 pour l'inhibition de la ChE du cerveau chez les rates (Santé Canada, 2011). La valeur résultante en concentration d'ométhoate (exprimée en tant que valeur équivalente pour le diméthoate) est ajoutée à la concentration mesurée de diméthoate. La somme des concentrations détectées de diméthoate et d'ométhoate (l'ométhoate étant exprimé en équivalent du diméthoate) ne devrait pas excéder la CMA de diméthoate.
Voici un exemple de calcul montrant l'utilisation d'un FAT pour convertir l'ométhoate en équivalent du diméthoate ainsi que l'addition de l'ométhoate (comme équivalent du diméthoate) et du diméthoate afin de comparer la valeur résultante à la CMA. Pour le calcul, on suppose une concentration mesurée de 0,5 µg/L d'ométhoate et de 0,3 µg/L de diméthoate dans l'eau potable.
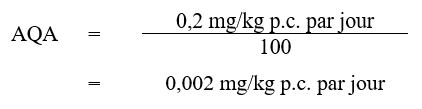
Equation 3 - Équivalent textuel
La valeur équivalente en diméthoate de l'ométhoate est de 1,6125 µg / L. Cette valeur est calculé en multipliant la valeur mesurée de l'ométhoate 0,5 µg / L par le rapport de poids moléculaire de 1,075 par le facteur d'ajustement de la toxicité de 3.
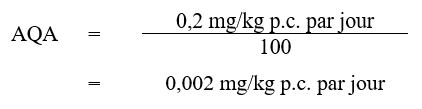
Equation 4 - Équivalent textuel
La somme du diméthoate dans l'exemple est de 1,9125 µg / L arrondie à 1,9 µg / L. Cette valeur est calculé en ajoutant la valeur diméthoate de 0,3 µg / L et la valeur équivalente diméthoate de 1,6125 µg / L. Cette somme de 1,9 µg / L est ensuite comparée à la CMA de 20 µg / L.
Cette somme (1,9 µg/L) est ensuite comparée à la CMA (20 µg/L).
4.0 Considérations relatives à l'analyse et au traitement
Des renseignements sur les considérations liées à l'analyse et au traitement sont facilement accessibles dans le cas du diméthoate, mais sont limités dans le cas de l'ométhoate. Des méthodes normalisées existent pour l'analyse du diméthoate. Cependant, aucune n'existe pour l'ométhoate et, par conséquent, une méthode de recherche pour l'analyse de ce dernier est présentée ici. En matière de traitement, il existe plusieurs études sur diverses techniques d'enlèvement du diméthoate, et seulement une poignée d'études sur l'enlèvement de l'ométhoate par adsorption. Étant donné que l'ométhoate se forme par oxydation du diméthoate, l'approche de traitement globale devrait être d'enlever le diméthoate tout en réduisant au minimum la formation d'ométhoate.
4.1 Méthodes d'analyse utilisées pour déceler le diméthoate et l'ométhoate
Les méthodes normalisées qui existent pour l'analyse du diméthoate dans les sources d'approvisionnement en eau et l'eau potable ainsi que leurs limites de détection de méthode (LDM) respectives sont résumées au tableau 7. Les LDM dépendent de la matrice de l'échantillon, des instruments et des conditions de fonctionnement choisies et varient d'un laboratoire à l'autre. Ces méthodes sont tributaires de diverses interactions que leurs références respectives décrivent.
On a contacté plusieurs laboratoires agréés au Canada pour déterminer les LDM et les seuils minimaux de déclaration (SMD) en vue de l'analyse du diméthoate. Les LDM se situaient dans la plage inférieure de celles indiquées dans le tableau 7. Les SMD, quant à eux, se situaient entre 0,03 et 0,2 μg/L lorsque la méthode EPA 8270 modifiée était utilisée, et étaient de 0,5 μg/L lorsque la méthode EPA 8141 modifiée était utilisée (ALS Environmental, 2019; CARO Analytical Services - laboratoire de Richmond, 2019; Element Materials Technology Canada Inc., 2019; SGS Environmental Services, 2019).
Les LDM et les SDM des données provinciales et territoriales vont de 0,0001 à 10 μg/L (voir la section 1.3).
Il existe d'autres méthodes d'analyse, qui ne sont pas normalisées à l'heure actuelle, pour mesurer le diméthoate dans l'eau. Ces méthodes sont fondées sur la chromatographie liquide à haute performance (CLHP) couplée à la spectrométrie de masse en tandem (Charalampous et coll., 2015). Des méthodes ayant des LDM semblables aux méthodes normalisées susmentionnées ont été signalées et ces méthodes sont adaptées aux laboratoires commerciaux (Haiste-Gulde et Sacher, 2019).
Il n'existe aucune méthode normalisée pour la détection de l'ométhoate. Une méthode conçue par Cheminova A/S pour détecter le diméthoate et l'ométhoate dans l'eau du robinet et de surface (US EPA, 2000a) a été évaluée par l'US EPA. La méthode se fonde sur la chromatographie en phase gazeuse et la spectroscopie de masse et présente une limite de quantification de 0,05 μg/L. Bien que l'US EPA reconnaisse que la méthode pourrait être utile pour l'analyse de l'ométhoate (et du diméthoate), elle ne considère pas qu'il s'agit d'une méthode validée de manière indépendante (US EPA, 2000b). Quelques études présentent des méthodes de détection de l'ométhoate dans l'eau utilisant la CLHP et divers systèmes de détection (Hayama et coll., 2008; Ling et coll., 2011; Zheng et coll., 2016). Une méthode utilisant la CLHP couplée à la spectrométrie de masse en tandem a permis de détecter une concentration de 0,05 μg/L avec des témoins de bonne qualité (Hayama et coll., 2008).
Les services publics d'eau potable devraient discuter des exigences en matière d'échantillonnage avec le laboratoire agréé qui mène l'analyse, afin de s'assurer que les procédures de contrôle de la qualité sont respectées et que les SMD sont assez faibles pour assurer une surveillance précise visant des concentrations inférieures à la CMA. Les facteurs à considérer pour l'analyse du diméthoate dans les échantillons d'eau potable (p. ex. préservation et conservation des échantillons) sont décrits dans les documents de référence présentés au tableau 7. Il est important de noter que la désactivation est critique si un oxydant est présent dans les échantillons afin de prévenir toute dégradation additionnelle du diméthoate ou de l'ométhoate avant l'analyse.
| MéthodeFootnote a (référence) |
Technique | LDM (µg/L) |
|
|---|---|---|---|
Méthodes de l'US EPA |
|||
Méthode 527 |
Chromatographie en phase gazeuse sur colonne capillaire /spectrométrie de masse (CG/SM) |
0,025 |
|
Méthode 8141B |
Chromatographie en phase gazeuse |
0,26 |
|
Méthode 8270D |
Chromatographie en phase gazeuse/spectrométrie de masse (CG/SM) |
20 (limite de quantification estimée) |
|
4.2 Considérations relatives au traitement
Les techniques de traitement qui permettent de réduire efficacement les concentrations de diméthoate dans l'eau potable sont entre autres l'adsorption sur charbon actif, la filtration sur membrane (nanofiltration [NF] et osmose inverse [OI]) et la filtration biologique. Bien que la chloration puisse éliminer complètement la substance (Ormad et coll., 2008; OMS, 2017), de l'ométhoate et d'autres sous-produits se forment durant le processus de dégradation (Caregnato et coll., 2013; Tian et coll., 2014). À l'échelle résidentielle, les dispositifs de traitement certifiés qui s'appuient sur l'OI ou l'adsorption sur charbon actif devraient pouvoir enlever le diméthoate de manière efficace.
4.2.1 Traitement à l'échelle municipale
Le choix d'un bon procédé de traitement pour un approvisionnement en eau donné dépend de nombreux facteurs, dont la source d'eau brute et ses caractéristiques, les conditions de mise en œuvre de la méthode de traitement choisie et les objectifs de traitement du service d'eau. La réalisation de bancs d'essai ou d'essais pilotes est recommandée pour s'assurer que la source d'approvisionnement en eau peut être traitée avec succès et que le plan de procédé est optimal.
Lorsqu'on fait appel à l'oxydation, à un procédé d'oxydation avancée ou à un procédé biologique pour enlever un pesticide de l'eau potable, il faut être conscient du potentiel de formation de sous-produits de dégradation du composé cible (Ikehata et Gamal El-Din, 2006; Beduk et coll., 2012; Li et coll., 2019a). L'ométhoate est un sous-produit de dégradation de l'oxydation du diméthoate qui résulte du traitement (par oxydation), mais très peu de recherches ont été menées sur l'enlèvement de l'ométhoate lui-même de l'eau potable. Par conséquent, l'objectif serait à la fois d'enlever le diméthoate et de choisir une technique de traitement qui réduirait au minimum la formation d'ométhoate et d'autres sous-produits. Avec une telle approche, l'enlèvement subséquent de l'ométhoate et d'autres sous-produits ne devrait pas être nécessaire. De plus, les responsables des services d'eau devraient tenir compte de la possibilité de formation de sous-produits de désinfection selon l'oxydant choisi et la qualité de la source d'eau.
4.2.1.1 Traitement classique
Les procédés classiques de filtration (coagulation chimique, clarification et filtration rapide sur sable) et la désinfection au chlore réduiront les concentrations de diméthoate par oxydation à l'étape de la désinfection (Ormad et coll., 2008). Cependant, l'oxydation pourrait former des sous-produits.
La coagulation et la floculation employées seules sont peu efficaces pour enlever le diméthoate. Ormad et coll. (2008) ont mené une étude à l'échelle de banc d'essai avec de l'eau de rivière présentant une concentration initiale de diméthoate de 1,108 μg/L et un pH de 8,0. Ils ont comparé l'efficacité d'enlèvement de trois doses différentes de coagulant de sulfate d'aluminium (10 mg Al/L, 20 mg Al/L et 40 mg Al/L). Même avec une dose élevée de coagulant, une faible efficacité d'à peine 35 % a été atteinte dans le cas de toutes les doses.
4.2.1.2 Adsorption sur charbon actif
L'adsorption sur charbon actif est un procédé largement utilisé pour réduire les concentrations de micropolluants, dont les pesticides, dans l'eau potable (Haist-Gulde et Happel, 2012; van der Aa et coll., 2012). Le charbon actif peut être appliqué de deux manières : applications d'une solution en suspension de charbon actif en poudre (CAP) ou réacteurs à lit fixe utilisant du charbon actif en grains (CAG) (Chowdhury et coll., 2013).
Les données tirées des essais à l'échelle de banc d'essai visant à déterminer le coefficient d'adsorption des pesticides sont utiles pour prédire si le charbon actif adsorbera un pesticide en particulier (US EPA, 2011). En général, les pesticides ayant une constante d'adsorption (p. ex. coefficient de Freundlich) supérieure à 200 µg/g(L/µg)1/n sont considérés aptes à être éliminés par adsorption sur charbon (Speth et Adams, 1993; Speth et Miltner, 1998; US EPA, 2011). Il faut toutefois noter que la présence de matière organique naturelle (MON) ajoute à la complexité du traitement au charbon actif, parce que cette matière entre directement en compétition avec le diméthoate pour occuper les sites d'adsorption ou encrasse le charbon en obstruant les pores (Chowdhury et coll., 2013). Comme de nombreux facteurs peuvent influer sur la capacité du charbon actif, notamment le caractère ionique du composé et le pH de la solution, des essais appropriés (p. ex. jar tests, essai rapide en colonne à petite échelle) seraient nécessaires pour confirmer l'enlèvement.
Une étude de Brauch et Kühn (1988) souligne que les isothermes d'adsorption de Freundlich de l'atrazine et du diméthoate sont semblables, et que la valeur élevée de l'isotherme de Freundlich indique que le diméthoate devrait être enlevé par le charbon actif.
Charbon actif en poudre
On a constaté que de nombreux pesticides étaient fortement adsorbés sur le charbon actif en poudre (CAP) (Chowdhury et coll., 2013), et l'utilisation de CAP présente l'avantage de fournir du charbon vierge selon les besoins (p. ex. durant la saison d'application du pesticide) (Miltner et coll., 1989). La capacité du CAP d'éliminer les pesticides par adsorption dépend de la dose, des caractéristiques (type, taille des particules), du temps de contact, de la capacité d'adsorption du contaminant et de la compétition avec la MON pour occuper les sites d'adsorption (Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
Deux études à l'échelle de banc d'essai ont été menées pour évaluer l'utilisation du CAP dans l'enlèvement du diméthoate. Elles sont présentées au tableau 8. Dans l'étude menée par Ormad et coll. (2008), on s'est penché sur plusieurs options de traitement et on a constaté que l'enlèvement par CAP était plus efficace que la coagulation/floculation. L'étude menée par Miguel et coll. (2008) a évalué deux CAP différents avec deux types d'eau et a constaté qu'un CAP donnait un meilleur résultat avec l'eau distillée, tandis que l'autre donnait un meilleur résultat avec l'eau naturelle. Cette constatation souligne la nécessité de mener des jar tests pour évaluer le rendement du traitement.
L'enlèvement du diméthoate de l'eau dépend de la matrice d'eau, du type de CAP et du temps de contact. Les taux de réduction observés allaient de 30 % à 60 % (Miguel et coll., 2008; Ormad et coll., 2008).
| Conc. initiale (µg/L) |
Dose de CAP (mg/L) |
Enlèvement | Description du procédé | Référence |
|---|---|---|---|---|
1,108 |
10 |
60 % |
Banc d'essai : |
Ormad et coll. (2008) |
0,5 |
10 |
40 % |
Banc d'essai : |
Miguel et coll. (2008) |
0,5 |
10 (bitumineux) |
30 % |
||
0,5 |
10 (à base de bois) |
35 % |
Banc d'essai : |
|
0,5 |
10 (bitumineux) |
45 % |
||
Charbon actif en grains
L'utilisation de charbon actif en grains (CAG) est une méthode efficace pour traiter les contaminants organiques qui sont souvent présents en concentrations préoccupantes dans les sources d'eau (Chowdhury et coll., 2013). La capacité du CAG d'enlever les pesticides par adsorption dépend des caractéristiques du CAG (type, taille des particules et méthode de réactivation), de la vitesse de filtration, du temps de contact en lit vide (TCLV), de la capacité d'adsorption du contaminant et de la durée du cycle de filtration (Haist-Gulde et Happel, 2012). En outre, étant donné que les adsorbeurs à lit fixe de CAG fonctionnent généralement en continu, le CAG peut devenir encrassé (ou préchargé) de MON et s'avérer partiellement ou complètement inefficace pour enlever le pesticide (Knappe et coll., 1999; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
Une étude pilote a été réalisée pour évaluer l'enlèvement de 33 polluants organiques (dont le diméthoate) à l'aide de CAG (Summers et coll., 2014). Quatre types d'eau différents présentant des pH et des concentrations de carbone organique dissous (COD) différents ont été évalués. Les résultats sont présentés au tableau 9. Les auteurs ont indiqué que le diméthoate avait été modérément adsorbé par le CAG.
| Conc. initiale (ng/L) |
Volumes de lit jusqu'à une pénétration de 10 % | Eau | CAG | TCLV (min) |
Longueur du lit (cm) |
Conditions d'utilisation |
|---|---|---|---|---|---|---|
115 ± 27 |
70 000 |
Type d'eau 1 :
|
|
7 |
58 |
|
> 46 000 |
15 |
125 |
||||
52 000 |
Type d'eau 2 :
|
|
7,5 |
63 |
||
120 000 |
Type d'eau 3 :
|
|
7 |
58 |
||
75 000 |
Type d'eau 4 :
|
|||||
4.2.1.3 Filtration sur membrane
En général, la NF et l'OI sont des procédés efficaces de séparation par membrane sous pression pour enlever les pesticides de l'eau potable. Leur efficacité à enlever les pesticides dépend des caractéristiques de la membrane, des propriétés du pesticide, de la composition de l'eau d'alimentation, des conditions de fonctionnement et de l'encrassement de la membrane (Van der Bruggen et Vandecasteele, 2003; Plakas et Karabelas, 2012).
Comme le principal mécanisme d'enlèvement des pesticides au moyen de membranes de NF et d'OI est l'exclusion par la taille, le seuil de poids moléculaire de la membrane constitue une caractéristique importante. Le poids moléculaire du diméthoate est de 229 Da. La technique de la membrane pourrait être efficace si le seuil de la membrane choisie est approprié. La rétention de petites molécules de pesticide par des membranes avec des pores de grande taille peut être influencée par les interactions physicochimiques entre le pesticide et la surface de la membrane (Plakas et Karabelas, 2012).
Les auteurs de trois études à l'échelle de banc d'essai se sont penchés sur quatre membranes de NF en polyamide différentes (NF90, NF200, NF270 et DK) pour évaluer l'enlèvement de concentrations élevées de diméthoate présent en solution aqueuse (Ahmad et coll., 2008a, 2008b; Tan et coll., 2019). Le procédé de séparation par membrane peut être influencé par la morphologie de la surface de la membrane (liée à la rugosité) et la distribution de la taille des pores (liée à la taille des pores et à la porosité) (Hilal et coll., 2015). Les caractéristiques des membranes ainsi que leurs seuils sont présentés au tableau 10. La première étude à l'échelle de banc d'essai a révélé un taux de rejet plus élevé lorsque la pression de fonctionnement était élevée et que la concentration initiale de diméthoate était faible (Ahmad et coll., 2008a) (tableau 11). La deuxième étude a montré que, pour trois des membranes (NF200, NF270 et DK), une augmentation du pH s'était traduite par une hausse du taux de rejet et une diminution du flux de perméation (Ahmad et coll., 2008a), tandis que la quatrième membrane (NF90) a été relativement peu touchée par la modification du pH.
Dans leur étude à l'échelle de banc d'essai, Tan et coll. (2019) se sont penchés sur l'enlèvement de l'atrazine et du diméthoate dans quatre eaux d'alimentation différentes (déionisée, distillée, du robinet et de rivière; tableau 12). Les résultats d'enlèvement du diméthoate des eaux déionisée et distillée ont été similaires lorsqu'on les a comparés à ceux d'études antérieures réalisées avec de l'eau déionisée. Une hausse du taux d'enlèvement du diméthoate a été observée dans le cas des eaux du robinet et de rivière, et les auteurs ont souligné que cela était peut-être attribuable à la liaison d'autres ions et de la MON avec le diméthoate pour former de plus grandes particules. On a constaté que l'atrazine présentait un meilleur taux d'enlèvement dans tous les cas comparativement au diméthoate, même si ce dernier présentait un plus grand poids moléculaire. Cela pourrait découler du fait que le diméthoate est plus polaire et moins hydrophobe que l'atrazine, ce qui réduit le potentiel de rejet.
Bellona et coll. (2004) présentent un diagramme utilisant les paramètres du pesticide dans l'eau (p. ex. poids moléculaire, log Koe, diamètre moléculaire) et ceux de la membrane (p. ex. seuil, taille des pores) pour déterminer le potentiel d'enlèvement du diméthoate au moyen de la filtration sur membrane. Avant toute mise en œuvre à grande échelle, il est important de mener les essais appropriés dans les conditions opérationnelles proposées avec la membrane et la source d'eau afin d'assurer l'enlèvement adéquat du diméthoate.
| MembraneNote de bas de page a | Seuil (Da) | Rugosité moyenne (nm) | Porosité moyenne (%) | Taille moyenne des pores (nm) |
|---|---|---|---|---|
| NF90 | 90Note de bas de page b Note de bas de page c | 22,7632Note de bas de page d | 17,1Note de bas de page d | 0,55Note de bas de page d |
| NF200 | - | 2,7098Note de bas de page d | 15,5Note de bas de page d | 0,31Note de bas de page d |
| NF270 | 150Note de bas de page c | 3,36Note de bas de page d | 11,7Note de bas de page d | 0,71Note de bas de page d |
| DK | 150-300Note de bas de page b | - | - | 0,55Note de bas de page e |
| Conc. initiale (mg/L) |
Taux de rejet (%)Note de bas de page a Note de bas de page b | Conditions | Description du procédéc | Référence | |||
|---|---|---|---|---|---|---|---|
| NF90 | NF200 | NF270 | DK | ||||
2 |
85 |
55 |
25 |
75 |
P = 6 x 105Pa |
Banc d'essai : |
Ahmad et coll. |
84 |
40 |
22 |
65 |
P =12 x 105Pa |
|||
20 |
85 |
60 |
35 |
80 |
P = 6 x 105Pa |
||
84 |
55 |
34 |
70 |
P =12 x 105Pa |
|||
10 |
80 |
42 |
22 |
41 |
P = 6 x 105Pa |
Ahmad et coll. |
|
82 |
55 |
38 |
40 |
pH = 7 |
|||
80 |
68 |
45 |
50 |
pH = 9 |
|||
10 |
80 |
54 |
40 |
52 |
Déionisée |
Banc d'essai : Examen de l'enlèvement du diméthoate de quatre eaux différentes (tableau 12) |
Tan et coll. |
80 |
55 |
41 |
51 |
Distillée |
|||
85 |
70 |
48 |
58 |
Robinet |
|||
87 |
70 |
50 |
58 |
Rivière |
|||
| Paramètre | Eau distillée (mg/L) | Eau du robinet (mg/L) | Eau de rivière (mg/L) |
|---|---|---|---|
| DCO | Non détecté | Non détecté | 20,3 |
| Al | 0,013 | 0,075 | 0,011 |
| Ba | 12 | 15 | 21 |
| Ca | 0,11 | 2,94 | 1,22 |
| Cl- | 0,4 | 7,6 | 4,5 |
| Cr | 0,006 | 0,015 | 0,020 |
| Cu | 0 | 4 | 3 |
| Mg | 0,01 | 2,24 | 3,20 |
| NO3- | 0,1 | 0,2 | 0,3 |
| SO42- | 1 | 18 | 12 |
| Zn | 0,04 | 0,05 | 0,10 |
| Pb | 0,001 | 0,005 | 0,009 |
4.2.1.4 Oxydation
L'oxydation chimique par le chlore et l'ozone (O3) peut être une méthode de traitement efficace pour enlever le diméthoate de l'eau, en fonction de plusieurs facteurs comme la dose d'oxydant, le temps de contact, la quantité de désinfectant requise, la température et le pH.
Les sous-produits de la dégradation du diméthoate découlant de l'utilisation de chlore sont l'acide phosphorothioïque, le N-méthyl-2-(méthyltio)acétamide et l'ométhoate (Tian et coll., 2014). On a constaté que l'ométhoate représentait de 11 % à 23 % du diméthoate dégradé (voir la section 1.1). L'ométhoate est préoccupant en raison de ses répercussions sur la santé.
Le tableau 13 présente plusieurs études à l'échelle de banc d'essai évaluant divers oxydants. Le chlore s'est avéré extrêmement efficace pour éliminer le pesticide (100 %) dans l'étude réalisée par Ormad et coll. (2008). Les mêmes auteurs ont aussi évalué l'ozone au moyen de deux études à l'échelle de banc d'essai, lors desquelles différentes efficacités d'enlèvement ont été observées (75 % et 25 %). Les rendements variables font ressortir la nécessité de mener des études pilotes.
Une étude à l'échelle de banc d'essai ayant pour but d'examiner la dégradation par l'O3 de 23 pesticides a montré que le diméthoate se dégradait facilement (Meijers et coll., 1995). Dans toutes les conditions, la dégradation du diméthoate a atteint un minimum de 83 % et un maximum de 97 %.
Une autre étude à l'échelle de banc d'essai a été menée pour évaluer la dégradation du diméthoate par le chlore et la formation de sous-produits dans des conditions typiques de traitement de l'eau (Tian et coll., 2014). Les auteurs ont constaté que le bromure et l'acide humique accéléraient la dégradation du diméthoate par le chlore. À l'inverse, la présence d'ammoniac empêchait la dégradation en raison de la formation de monochloramine, qui présente une réactivité inférieure envers le diméthoate.
| Oxydant | Conc. initiale (µg/L) |
Dose initiale d'oxydant (mg/L) ou (g O3/g DOC) |
Taux d'enlèvement | Description du procédé | Référence | |
|---|---|---|---|---|---|---|
Chlore |
1,108 |
18 mg/L (utilisation de NaClO) |
100 % |
Banc d'essai : eau de rivière non traitée; pH = 8,0; vérification de l'enlèvement de 44 pesticides, dont le diméthoate |
Ormad et coll. (2008) |
|
Ozone |
1,108 |
4,3 mg/L |
75 % |
|||
0,5 |
3,0 mg/L |
25 % |
Banc d'essai : eau de rivière; pH = 8,0; conductivité = 750 μS/cm; COD = 3 mg/L; alcalinité = 200 mg CaCO3/L |
Ormad et coll. (2010) |
||
0,9-6,4Note de bas de page a |
0,53 g/g |
83 % |
pH = 7,2; 5 ˚C; C*t10 = 2,0 |
Banc d'essai : eau de rivière; COD = 2,2 mg C/L; Br- = 100 μg/L, HCO3- = 1,6 mM; 23 pesticides |
Meijers et coll. (1995) |
|
0,55 g/g |
85 % |
pH = 7,2; 20 ˚C; C*t10 = 1,0 |
||||
0,95 g/g |
96 % |
pH = 8,3; 20 ˚C; C*t10 = 1,0 |
||||
1,0 g/g |
97 % |
pH = 7,2; 5 ˚C; C*t10 = 7,3 |
||||
1,0 g/g |
97 % |
pH = 7,2; 20 ˚C; C*t10 = 3,3 |
||||
1,0 g/g |
97 % |
pH = 8,3; 20 ˚C; C*t10 = 1,1 |
||||
Enlèvement de l'ométhoate
Ling et coll. (2011) ont mené des expériences en lots avec une solution d'ométhoate de 1,0 mg/L pour évaluer la dégradation par l'O3 seul ainsi que le recours à un catalyseur. Les catalyseurs utilisés lors de l'étude étaient du charbon actif (CA) et du Fe(III) déposé sur du charbon actif (Fe-CA). Les taux d'enlèvement de l'ométhoate dans diverses conditions sont présentés au tableau 14. Le meilleur taux d'enlèvement a été obtenu avec l'ozone et une combinaison Fe-CA à 5 %, et ce taux était beaucoup plus élevé qu'avec l'ozone seul. Les auteurs ont effectué l'expérience avec chacun des catalyseurs, sans O3, afin de déterminer si l'ométhoate était enlevé par adsorption, et les deux catalyseurs ont montré une capacité d'enlèvement médiocre. Par conséquent, d'après les auteurs, l'utilisation d'O3 en présence de Fe-CA menait à la formation de radicaux hydroxyles, lesquels dégradaient l'ométhoate.
Les auteurs d'une étude ultérieure se sont penchés sur la vitesse de réaction de la dégradation de l'ométhoate en présence d'O3 et de radicaux hydroxyle (Qiang et coll., 2013). L'ométhoate s'est dégradé plus lentement en présence d'ozone (0,04 M-1s-1) que de radicaux hydroxyle (5,3 x 108 M-1s-1) à un pH de 7,5 et à une température de 20 ˚C. Les auteurs ont affirmé que la présence du catalyseur, le Fe-CA, avait produit des radicaux hydroxyle en présence d'O3, ce qui avait mené à une meilleure dégradation de l'ométhoate qu'en présence d'ozone seul.
| Oxydant | Conc. Initiale d'ométhoate (mg/L) |
Dose initiale d'oxydant (mg/L) |
Catalyseur (ou oxydant) ajouté |
Taux d'enlèvement | Description du procédé | Référence |
|---|---|---|---|---|---|---|
| Ozone | 1,0 | 1,0 | Aucun | 37,6 % | Étude à l'échelle de banc d'essai = 30 min; pH = 7,5; 20 ± 2 ˚C | Ling et coll., 2011 |
| 20 mg/L de CA | 58,0 % | |||||
| 20 mg/L de Fe-CA à 5 % | 82,4 % | |||||
| Aucun | - | 20 mg/L de CA | 6,5 % | |||
| 20 mg/L de Fe-CA à 5 % | 5,7 % | |||||
4.2.1.5 Traitement biologique
Le traitement biologique nécessite de cibler l'enlèvement de la fraction de la matière organique biodégradable. L'efficacité d'un tel traitement dépend donc de la concentration initiale, des propriétés de la source d'eau, de la communauté microbienne, du temps de contact, des propriétés du sol et de la température (Drewes et coll., 2009; Diem et coll., 2013). Les principaux procédés de traitement biologique de l'eau potable comprennent la filtration sur berge (FB), un procédé de filtration rapide sur milieu granulaire qui ne requiert pas de maintenir une concentration résiduelle de désinfectant comme pour les procédés de filtration à lit, et la filtration lente sur sable.
Filtration sur berge
La filtration sur berge (FB) consiste à placer des puits d'approvisionnement en eau verticaux ou horizontaux près d'une rivière afin d'utiliser la rive et l'aquifère adjacent comme filtre naturel pour éliminer les contaminants. Comme l'eau se déplace vers la nappe souterraine, la concentration des contaminants diminue par adsorption, biodégradation et dilution avec les eaux souterraines (Piet et Zoeteman, 1980; Bize et coll., 1981; Kuehn et Mueller, 2000; Ray et coll., 2002). L'atténuation naturelle par FB est l'une des méthodes les plus élémentaires et les plus abordables de traitement de l'eau (Verstraeten et Heberer, 2002; Sørensen et coll., 2006).
Plusieurs études ont été menées pour évaluer l'efficacité de l'enlèvement de micropolluants organiques (MPO) par FB (Bertelkamp et coll., 2015; Bertelkamp et coll., 2016a, 2006b). Ces études ont fait appel à deux sols oxiques différents et à un sol suboxique/anoxique, dont les propriétés sont présentées au tableau 15.
| Paramètre | Oasen (oxique) | Vitens (oxique) | Vitens (suboxique/anoxique profond) |
|---|---|---|---|
| Porosité | 0,35 | 0,33 | - |
| Capacité d'échange cationique (meq/kg; poids à sec) | 9,19 | 42,13 | 14,07 |
| Argile (v/v%) | 0,50 | 3,72 | 1,71 |
| Limon (v/v%) | 0,52 | 3,58 | 2,50 |
| Sable (v/v%) | 98,98 | 92,69 | 95,79 |
| dmoyen (μm) | 330,62 | 380,38 | 394,84 |
La première étude pilote a été réalisée pour déterminer les effets du type de sol (Bertelkamp et coll., 2015) (tableau 16). De l'eau de rivière additionnée d'un mélange de 20 MPO (dont le diméthoate), chacun à une concentration de 0,5 μg/L, a été utilisée dans deux essais pilotes menés avec des sols différents, soit Oasen et Vitens. Les auteurs ont conclu que la composition de la communauté microbienne semblait principalement déterminée par la phase aqueuse plutôt que par le type de sol, comme en ont fait foi les taux de biodégradation plutôt similaires du diméthoate dans les deux sols (0,42 et 0,37 jour-1). Sur la base des taux de biodégradation, les auteurs ont également estimé un taux d'enlèvement du diméthoate de 99 %. Le temps de séjour requis dans la zone oxique serait d'environ 11,6 jours et 13,1 jours pour les sols Oasen et Vitens, respectivement. Avant d'atteindre les zones anoxiques, l'eau reste dans la zone oxique d'un système de FB seulement pendant les premières heures ou les premiers jours (selon le site). On pourrait donc s'attendre à ce qu'une quantité moindre de diméthoate soit enlevée.
Une étude en colonne a été effectuée pour déterminer les effets sur la vitesse de dégradation dans différentes conditions (Bertelkamp et coll., 2016a). Quatre eaux de rivière d'alimentation présentant des fractions organiques différentes (hydrophile, hydrophobe, transphile et matière organique d'eau de rivière [MOER]) ont été utilisées dans le cadre de cette évaluation. Trois phases différentes ont été étudiées dans le but de simuler des conditions stables, de surcharge de MPO et de surcharge de COD. La première phase, qui tenait lieu de FB dans des conditions stables, présentait une vitesse de biodégradation comparable à celui de l'étude précédente. La deuxième phase, qui comportait des concentrations initiales plus élevées de MPO, s'est traduite par une meilleure vitesse de dégradation du diméthoate. La troisième phase a donné des résultats différents selon l'eau utilisée.
Une étude pilote faisant appel à de l'eau de rivière a été réalisée à l'aide de trois configurations différentes pour évaluer la vitesse de dégradation dans différentes zones de redox (Bertelkamp et coll., 2016b). La première configuration visait à évaluer la dégradation dans la zone oxique; la deuxième, dans la zone suboxique; et la troisième, dans la zone anoxique. En ce qui concerne le diméthoate, la vitesse de dégradation le plus élevée a été obtenue dans la zone oxique.
| Conc. initiale (µg/L) |
Taux de biodégradation (jour-1) |
Configuration de la colonneNote de bas de page a / sol | Description du procédé | Référence | ||
|---|---|---|---|---|---|---|
0,5 |
0,42 |
Pilote A : 2 colonnes en série / Oasen |
Étude pilote; eau de rivière : mélange de 20 MPO – 0,5 μg/L chacun; taux de charge hydraulique = 0,5 L/j |
Bertelkamp et coll. (2015) |
||
0,37 |
Pilote B : 2 colonnes en série / Vitens |
|||||
0,5 |
0,55 (hydrophile) |
Phase 1 (conditions stables) : |
MPO de 0,5 μg/L chacun |
Étude en colonne : eau de rivière; mélange de 20 MPO Taux de charge = 0,2 L/j |
Bertelkamp et coll. (2016a) |
|
2 |
0,60 (hydrophile) |
Phase 2 (surcharge de MPO) : |
MPO de 2 μg/L chacun |
|||
2 |
0,45 (hydrophile) |
Phase 3 (surcharge de COD) : |
MPO de 2 μg/L chacun |
|||
0,5 |
0,39 |
Pilote A (oxique) : 2 colonnes en série / Vitens |
Étude pilote : |
Bertelkamp et coll. (2016b) |
||
0,06 |
Pilote B (suboxique) : 10 colonnes en série (Vitens : les 4 prem. - oxique/les 6 dern. - suboxique/ anoxique) |
|||||
0,11 |
Pilote C (anoxique) : 22 colonnes en série (Vitens : les 4 prem. - oxique/les 18 dern. - suboxique/ anoxique) |
|||||
Filtration biologique modifiée
La filtration biologique modifiée prévoit l'utilisation de filtres granulaires (anthracite/sable ou CAG) sans le besoin de maintenir une concentration résiduelle en désinfectant à la largeur du lit. L'activité biologique dans les filtres peut être influencée par plusieurs facteurs, dont la qualité de l'eau, la température, la dose et le type d'oxydant, ainsi que les procédures de lavage à contre-courant (Huck et coll., 2001).
Une étude à grande échelle examinant deux régimes de traitement différents a été réalisée pour déterminer l'incidence sur l'enlèvement du diméthoate (Yang et coll., 2019). Les régimes de traitement variaient relativement à l'emplacement du filtre à sable par rapport au charbon actif biologique (CAB) (tableau 17). Les concentrations initiales étaient très basses, mais dans les deux régimes de traitement, le diméthoate a été enlevé par le CAB. Une étude à l'échelle de banc d'essai a été réalisée afin d'évaluer le rendement global de filtres biologiques relativement à l'enlèvement de 34 MPO (Zearley et Summers, 2012), dont le diméthoate. La concentration initiale utilisée dans le cadre de l'étude était très faible, or, le diméthoate a été efficacement enlevé, et le meilleur enlèvement a été obtenu avec le TCLV le plus long.
| Conc. initiale (µg/L) |
Enlèvement ou conc. finale | TCLV (min) |
Description du procédé global | Référence |
|---|---|---|---|---|
8,65 ng/L |
6,43 ng/L |
16 |
|
Yang et coll. (2019) |
12,59 ng/L |
5,13 ng/L |
|
||
0,038 |
75 % |
7,9 |
|
Zearley et Summers (2012) |
81 % |
15,8 |
|||
4.2.1.6 Techniques combinées
Une étude à grande échelle examinant deux régimes de traitement différents a montré que les divers procédés avaient enlevé le diméthoate (Yang et coll., 2019). Un régime de traitement comprenait la filtration sur sable avant l'ozonation et le traitement au CAB, tandis que l'autre comportait la filtration sur sable après un traitement au CAB (table 18).
| Conc. initiale (ng/L) |
Conc. finale (ng/L) |
Étape de traitement | Autres données sur les paramètres | Description du procédé global |
|---|---|---|---|---|
35,17 |
30,19 |
Sédimentation |
|
|
9,40 |
Filtration sur sable |
|||
8,65 |
Postozonation |
|||
6,43 |
CABc |
|||
17,08 |
18,17 |
Sédimentation |
|
|
12,59 |
Postozonation |
|||
5,13 |
CAB |
|||
3,47 |
Filtration sur sable |
|||
Ormad et coll. (2008) ont réalisé une étude à l'échelle de banc d'essai pour évaluer la préoxydation par l'ozone et le chlore ainsi que la coagulation et l'adsorption par le CAP tel qu'il est discuté dans les sections précédentes. Dans le cadre de cette étude, ils ont aussi examiné des combinaisons de ces procédés (tableau 19). Dès que le chlore était utilisé, le diméthoate était toujours complètement éliminé. Cependant, il faudrait tenir compte de la formation de sous-produits. La technique la moins efficace pour l'enlèvement du diméthoate a été la coagulation.
| Conc. initiale (µg/L) |
Taux d'enlèvement (%) |
Type de traitement | Description du procédé global |
|---|---|---|---|
| 1,108 | 100 | Chlore | Étude à l'échelle de banc d'essai Eau de rivière : demande en chlore = 18 mg Cl2/L; pH = 8,0 Description des procédés de traitement :
Temps de réaction non fournis |
| 100 | Chlore + coagulation (10 mg Al/L) | ||
| 100 | Chlore + coagulation (20 mg Al/L) | ||
| 75 | Ozone | ||
| 75 | Ozone + coagulation (20 mg Al/L) | ||
| 85 | Ozone + coagulation (40 mg Al/L) | ||
| 60 | CAP | ||
| 75 | Ozone + CAP | ||
| 35 | Coagulation (10 mg Al/L) | ||
| 35 | Coagulation (20 mg Al/L) | ||
| 35 | Coagulation (40 mg Al/L) | ||
| 100 | Chlore + CAP + coagulation (20 mg Al/L) |
||
| 95 | Ozone + CAP + coagulation (20 mg Al/L) |
||
4.2.2 Traitement à l'échelle résidentielle
Dans les cas où l'on souhaite enlever le diméthoate à l'échelle résidentielle, par exemple lorsque l'eau potable provient d'un puits privé, un dispositif résidentiel de traitement peut être employé pour réduire la concentration de diméthoate dans l'eau potable. Avant d'installer un dispositif de traitement, il faudrait faire analyser l'eau pour en établir les caractéristiques chimiques générales et déterminer la concentration de diméthoate dans l'eau non traitée.
Pour vérifier l'efficacité d'un dispositif de traitement, il faudrait régulièrement prélever des échantillons de l'eau à l'entrée et à la sortie du dispositif et de les envoyer à un laboratoire agréé à des fins d'analyses. Les dispositifs peuvent perdre de leur efficacité d'enlèvement avec le temps et l'usure; il est nécessaire de les entretenir et/ou les remplacer. Les consommateurs devraient vérifier la durée de vie des composants de leur dispositif de traitement prévue et recommandée par le fabricant et assurer l'entretien requis. Certains systèmes résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d'une seule résidence, de sorte qu'ils peuvent aussi être utilisés dans des systèmes de petite taille.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) ou de l'American National Standards Institute (ANSI) est certifiée par un organisme de certification agréé. Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la construction des dispositifs de traitement de l'eau potable qui peuvent être vérifiées par un tiers. On s'assure ainsi que les matériaux contenus dans le dispositif ne libèrent pas de contaminants dans l'eau potable (c.-à-d. innocuité des matériaux). De plus, les normes englobent des exigences de performance qui précisent le taux d'élimination qui doit être assuré pour certains contaminants (c.-à-d. déclaration de réduction) qui peuvent être présents dans l'eau. Les organismes de certification (c.-à-d. des tiers), qui doivent être agréés par le Conseil canadien des normes (CCN), garantissent qu'un produit est conforme aux normes en vigueur. Les organismes suivants ont été agréés au Canada :
- Groupe CSA;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- International Association of Plumbing and Mechanical Officials; et
- Truesdail Laboratories, Inc.
On peut obtenir une liste à jour des organismes de certification agréés auprès du CCN.
Les techniques de traitement de l'eau potable susceptibles d'enlever efficacement le diméthoate à l'échelle résidentielle comprennent l'adsorption et l'OI. À l'heure actuelle, le diméthoate n'est pas visé par les exigences de performance des normes NSF/ANSI (p. ex. déclaration de réduction). Toutefois, les consommateurs peuvent utiliser un dispositif de traitement qui est certifié conforme aux normes relatives à l'osmose inverse ou à l'adsorption pour s'assurer que l'innocuité des matériaux a été évaluée.
L'eau traitée par OI peut être corrosive pour l'intérieur des éléments de plomberie. Ces dispositifs devraient donc être installés uniquement au point d'utilisation (PU). De plus, comme il faut de grandes quantités d'eau brute pour obtenir le volume requis d'eau traitée, ces dispositifs ne sont généralement pas pratiques si on les installe au point d'entrée d'eau.
5.0 Stratégies de gestion
Tous les responsables des services d'eau devraient mettre en œuvre une méthode de gestion des risques, comme l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau (CCME, 2004; OMS, 2017). Ces approches exigent une évaluation du système pour caractériser la source d'eau, décrire les barrières qui préviennent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles de fonctionnement ou de gestion sont instaurés (p. ex. mode opératoire normalisé, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est établie et d'autres protocoles de vérification du plan de gestion de la salubrité de l'eau sont adoptés (p. ex. tenue de registres, satisfaction de la clientèle). Les opérateurs doivent aussi recevoir une formation pour assurer en tout temps l'efficacité du plan de gestion de la salubrité de l'eau (Smeets et coll., 2009).
5.1 Surveillance
Le diméthoate peut être présent dans les eaux souterraines et les eaux de surface des régions où il est utilisé, selon le type et l'étendue de son application, les facteurs environnementaux (p. ex. quantité de précipitations, type de sol, milieu hydrogéologique) et le devenir dans l'environnement (p. ex. mobilité, potentiel de lessivage, dégradation) dans les zones à proximité. Les responsables des services d'eau devraient tenir compte de la possibilité que du diméthoate entre dans les sources d'eau (p. ex. approvisionnement en eau brute vers le système d'eau potable) en fonction des caractéristiques propres à chaque site.
Une fois qu'on a déterminé que du diméthoate peut être présent et qu'une surveillance est requise, il faudrait caractériser les sources d'eau de surface et d'eau souterraine afin d'établir la concentration de diméthoate. Cela devrait comprendre la surveillance des sources d'eau de surface pendant les périodes de pointe d'utilisation et de précipitations et/ou la surveillance annuelle des sources d'eau souterraine. Lorsque les données de référence indiquent que la source d'approvisionnement ne contient pas de diméthoate, la surveillance peut être réduite.
Lorsqu'un traitement est nécessaire pour enlever le diméthoate, il faudrait assurer une surveillance opérationnelle pour déterminer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l'eau, de la variation des concentrations dans l'eau brute et du procédé de traitement. Les autorités responsables devraient être conscientes des effets de la MON sur les systèmes au charbon actif, car cette interaction peut avoir une incidence sur les objectifs de qualité de l'eau pour ce qui est de l'enlèvement du diméthoate.
Lorsqu'un traitement est utilisé pour éliminer le diméthoate, il faudrait effectuer une surveillance de conformité (échantillons appariés de la source d'approvisionnement et d'eau traitée afin de confirmer l'efficacité du traitement) au moins tous les ans. Lorsque la surveillance opérationnelle périodique indique un risque de percée du contaminant, comme avec le CAG, la surveillance devrait être exercée au moins chaque trimestre afin qu'on puisse planifier le remplacement du milieu. Lorsqu'on a recours à un procédé de dégradation comme l'oxydation, la surveillance de la formation de sous-produits devrait aussi être envisagée. Plus particulièrement, l'ométhoate devrait aussi être surveillé, puisqu'il s'agit d'un sous-produit du diméthoate qui est préoccupant sur le plan de la santé. Une concentration équivalente de diméthoate devrait être calculée et ajoutée à la concentration de diméthoate mesurée (voir la section 3.0). La somme de ces concentrations ne devrait pas dépasser la CMA du diméthoate.
6.0 Considérations d'ordre international
D'autres organisations nationales et internationales disposent de lignes directrices, de normes et/ou de valeurs recommandées pour le diméthoate et l'ométhoate dans l'eau potable. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées, et des différentes politiques et approches appliquées (p. ex. la BMDL par rapport à la NOEL/NOAEL), notamment en ce qui concerne le choix de l'étude clé ou le recours à des taux de consommation, des poids corporels et des facteurs d'attribution liés à la source différents (tableau 20).
Le National Health and Medical Research Council de l'Australie a fixé une valeur recommandée de 0,007 mg/L pour le diméthoate dans l'eau potable en fonction de l'inhibition de la cholinestérase observée chez les humains, et une valeur de 0,001 mg/L pour l'ométhoate en fonction de l'inhibition de l'AChE constatée dans une étude de 2 ans menée sur des rats. Concernant le diméthoate, l'OMS recommande une valeur de 0,006 mg/L (6 µg/L) qui se fonde sur les effets potentiels du pesticide sur le rendement de la reproduction chez le rat (OMS, 2017). L'US EPA déclare avoir pris la décision de ne pas réglementer le diméthoate dans l'eau potable, car elle a jugé que le pesticide n'était pas présent à des concentrations et à une fréquence préoccupantes pour la santé publique (US EPA, 2016). Ni l'US EPA ni l'OMS ne recommandent de valeur pour l'ométhoate (US EPA, 2006b).
L'Union européenne (UE) n'a pas établi de valeur paramétrique chimique précise pour les pesticides. Elle a plutôt établi une valeur de 0,1 µg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour l'ensemble des pesticides décelés dans l'eau potable. En établissant ces valeurs, l'UE note qu'elle n'a pas tenu compte des données scientifiques sur chaque pesticide, dont les effets sur la santé. Les valeurs reposent plutôt sur une décision politique d'écarter les pesticides de l'eau potable (Union européenne, 2020).
| Organisme (année) |
Valeur (mg/L) |
Effet principal | BMDL10/ NO(A)EL (mg/kg p.c./j) |
FI | AQA (mg/ kg p.c./j) |
P.C. (kg) |
Apport EP (L/j) |
FA (%) |
Commentaires |
|---|---|---|---|---|---|---|---|---|---|
|
0,02 |
Inhibition de la ChE |
0,2 (BMDL10)Note de bas de page a |
100 |
0,002 |
74 |
1,53 |
20 |
|
|
0,006 |
Fonction de reproduction chez les rats |
1,2 (NOAEL) |
500 |
0,002 |
60 |
2 |
10 |
|
|
0,007 |
Inhibition de la ChE dans une étude de 57 jours sur des volontaires humains |
0,2 (NOEL) |
100 |
0,02 |
70 |
2 |
10 |
|
|
0,001 |
Inhibition de la ChE dans une étude de 2 ans sur des rats |
0,04 (NOEL) |
100 |
0,0004 |
70 |
2 |
10 |
|
|
0,1 µg/L |
L'UE a une valeur de 0,1 μg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour l'ensemble des pesticides décelés dans l'eau potable. En établissant ces valeurs, l'UE n'a pas tenu compte des données scientifiques sur chaque pesticide, dont les effets sur la santé. Les valeurs reposent plutôt sur une décision politique d'écarter les pesticides de l'eau potable. |
|||||||
7.0 Justification
Le diméthoate est un pesticide organophosphoré à large spectre homologué au Canada pour lutter contre un grand nombre d'insectes et d'acariens dans plusieurs sites agricoles et non agricoles. Malgré son usage répandu au Canada, les données de surveillance du diméthoate et de l'ométhoate dans les sources d'eau et l'eau potable fournies par les provinces et les territoires indiquent que la détection révèle des concentrations de diméthoate bien inférieurs à la CMA proposée. Le principal effet du diméthoate est l'inhibition de la ChE, bien que la hausse des cas de mortalité chez les petits d'animaux soit également préoccupante. L'activité anticholinestérase du diméthoate est attribuable à son métabolite, l'ométhoate. L'ométhoate est aussi un produit de dégradation majeur du diméthoate dans l'environnement et peut se former lors du traitement de l'eau potable.
Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, propose de maintenir une CMA de 0,02 mg/L (20 µg/L) pour le diméthoate en se fondant sur les considérations suivantes :
- Une VBS de 0,02 mg/L (20 µg/L) en fonction de l'inhibition de la ChE observée dans plusieurs études avec exposition à des doses répétées sur des animaux;
- La CMA proposée protégerait à la fois contre l'inhibition de la ChE et la mortalité chez les petits observées dans plusieurs études avec exposition à des doses répétées sur des animaux;
- L'approche additive proposée pour l'ométhoate confère une protection de la santé dans les cas où celui-ci serait détecté dans les sources d'eau ou dans l'eau traitée;
- Le diméthoate et l'ométhoate peuvent être mesurés avec précision à des concentrations bien inférieures à la CMA proposée;
- Des techniques de traitement de l'eau potable enlèvent le diméthoate pour atteindre des concentrations inférieures à la CMA proposée;
- On peut diminuer la concentration de l'ométhoate en contrôlant ou en réduisant au minimum sa formation.
La CMA proposée pour le diméthoate et l'approche cumulative proposée pour l'ométhoate assurent une protection contre les effets potentiels sur la santé découlant de l'exposition au diméthoate et à l'ométhoate. Dans le cadre de son processus continu de révision des recommandations, Santé Canada continuera de suivre les nouvelles recherches à ce sujet, y compris l'examen des résultats des évaluations de l'ARLA, et recommandera au besoin toute modification jugée nécessaire au présent document technique.
8.0 Références
ACIA (2019). Rapport annuel du Programme national de surveillance des résidus chimiques et Programme de surveillance de la salubrité des aliments 2015-2016. Agence canadienne d'inspection des aliments, Ottawa, Ontario.
Ahmad, A.L., Tan, L.S. et Abd Shukor, S.R. (2008a). The role of pH in nanofiltration of atrazine and dimethoate from aqueous solution. J. Hazard. Mater., 154(1-3): 633-638.
Ahmad, A.L., Tan, L.S. et Abd Shukor, S.R. (2008b). Dimethoate and atrazine retention from aqueous solution by nanofiltration membranes. J. Hazard. Mater., 151(1): 71-77.
ALS Environmental (2019). Communication personnelle avec A. Ganouri-Lumsden. Waterloo, Ont.
APVMA (2010). Human Health Risk Assessment of Dimethoate. Australian Pesticides and Veterinary Medicines Authority, Office of Chemical Safety and Environmental Health, Department of Health and Ageing, Canberra, Australie.
APVMA (2011). Review of the Mammalian Toxicology and Metabolism/Toxicokinetics of Omethoate. Australian Pesticides and Veterinary Medicines Authority, Office of Chemical Safety, Office of Health Protection, Department of Health and Ageing, Canberra, Australie.
Bayer (1975). Evaluation of Omethoate for Embryonic and Teratogenic Effects in rats Following Oral Administration. Bayer AG, rapport no 5235, Wuppertal, Allemagne (citée dans APMA, 2011).
Beduk, F., Aydin, M.E. et Ozcan, S. (2012). Degradation of malathion and parathion by ozonation, photolytic ozonation, and heterogeneous catalytic ozonation processes. Clean - Soil, Air, Water, 40 (2): 179-87.
Bellona, C., Drewes, J.E., Xu, P. et Amy, G. (2004). Factors affecting the rejection of organic solutes during NF/RO treatment - A literature review. Wat. Res., 38 (12): 2795-2809.
Bertelkamp, C., Schoutteten, K., Vanhaecke, L., Vanden Bussche, J., Callewaert, C., Boon, N., Singhal, N., van der Hoek, J.P. et Verliefde, A.R.D. (2015). A laboratory-scale column study comparing organic micropollutant removal and microbial diversity for two soil types. Sci. Total Environ., 536: 632-638.
Bertelkamp, C., van der Hoek, J.P., Schoutteten, K., Hulpiau, L., Vanhaecke, L., Vanden Bussche, J., Cabo, A.J., Callewaert, C., Boon, N., Löwenberg, J., Singhal, N. et Verliefde, A.R.D. (2016a). The effect of feed water dissolved organic carbon concentration and composition on organic micropollutant removal and microbial diversity in soil columns simulating river bank filtration. Chemosphere, 144: 932-939.
Bertelkamp, C., Verliefde, A.R.D., Schoutteten, K., Vanhaecke, L., Vanden Bussche, J., Singhal, N. et van der Hoek, J.P. (2016b). The effect of redox conditions and adaptation time on organic micropollutant removal during river bank filtration: A laboratory-scale column study. Sci. Total Environ., 544: 309-318.
Bize, J., Grenet, B. et Maneglier, H. (1981). Purifying capacity of the alluvial complex bordering a river. Tech. Sci. Munic., 76(7): 393-401.
Brauch, H. et Kühn, W. (1988). Organic micropollutants in the river Rhine and in drinking water treatment. Gwf Wasser Abwasser, 129(3): 189-196.
Brooker, A.J. et Stubbs, A. (1991). Dimethoate: Dietary Range Finding Study in Mature Male and Female Rats and their Juvenile Offspring. Huntingdon Research Center, no doc. DTF : '453-004' réf. : 3-21/vol. 3-, Angleterre (citée dans APVMA, 2010).
Brooker, A.J., Homan, A.B., Parker, C.A., Offer, J.M., Anderson, A. et Dawe, I.S. (1992). The Effect of Dimethoate on Reproductive Function of Two Generations in the Rat. Volume I, II, et III. Huntingdon Research Center, no doc. DTF : '453-003 réf. : 3-22/vol. 3-7 et 3-8 (citée dans APVMA, 2010).
Burford, P., McLean, T.A., Buist, D.P., Gregson, R.L. et Gopinath, C. (1990a). Dimethoate: 12-Month Dietary Study in Beagle Dogs (Final Report - Repeated Daily Dosage for 52 Weeks). Huntingdon Research Center, no doc. DTF : '437-011' réf. : 3-7/vol. 3-4 (citée dans APVMA, 2010).
Burford, P., McLean, T.A., Buist, D.P., Gregson, R.L. et Gopinath, C. (1990b). Observations cliniques individuelles. Supplément au numéro MRID 41939801. Étude alimentaire de 12 mois sur l'exposition au diméthoate menée sur des chiens Beagle (dose quotidienne répétée pendant 52 semaines). Huntingdon Research Center, no doc. DTF : '437-014' réf. : 3-8/vol. 3-4 (citée dans APVMA, 2010).
Caregnato, P., Rosso, J.A., Soler, J.M., Arques, A., Mártire, D.O. Gonzalez, M.C. (2013). Chloride anion effect on the advanced oxidation processes of methidathion and dimethoate: Role of Cl 2- radical. Water Res., 47(1): 351-362.
CARO Analytical Services - laboratoire de Richmond. (2019). Communication personnelle avec K. Fyffe. Richmond, C.-B.
CCME (2004). De la source au robinet : Guide d'application de l'approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba. Accessible au : https://www.ccme.ca/files/Resources/fr_water/fr_source_to_tap/mba_guidance_doc_f.pdf
Charalampous, A.C., Miliadis, G.E. et Koupparis, M.A. (2015). A new multiresidue method for the determination of multiclass pesticides, degradation products and PCBs in water using LC-MS/MS and GC-MS(n) systems. Int. J. Environ. Anal. Chem., 95(13): 1283-1298.
Chowdhury, Z.K., Summers, R.S., Westerhoff, G.P., Leto, B.J., Nowack, K.O. et Corwin, C.J. (2013). Activated carbon: Solutions for improving water quality. Passantino, L. B. (éd.). American Water Works Association. Denver, Colorado.
Davies, D.J. (1999). Dimethoate: In vitro absorption form a 400 g/L EC Formulation through human and rat epidermis. Central Toxicology Laboratory. No doc. DTF : '469-001' (citée dans APVMA, 2011).
De Bleeker, J., Van Den Neucker, K. et Willems, J. (1992). The intermediate syndrome in organophosphate poisoning: Presentation of a case and review of the literature. J. Toxicol. Clin. Toxicol., 30(3): 321-329.
Développement durable Manitoba (2020). Communication personnelle avec K. Philip, Environmental Stewardship Division.
Diem, S., Rudolf Von Rohr, M., Hering, J.G., Kohler, H-E., Schirmer, M. et Von Gunten, U. (2013). NOM degradation during river infiltration: Effects of the climate variables temperature and discharge. Water Res., 47(17): 6585-6595.
Donald, D.B., Cessna, A.J., Sverko, E. et Glozier, N.E. (2007). Pesticides in surface drinking-water supplies of the northern Great Plains. Environ. Health Perspect., 115(8): 1183-1191.
Dotti, A., Biedermann, K., Luetkemeier, H. et Wright, J. (1992). E 6876 (c.n. Omethoate) Two-Generation Reproduction Study in the Rat. Bayer AG, projet no 207326. Étude no T 8029476, Itingen, Suisse (citée dans APVMA, 2011).
Drewes, J.E., Hoppe, C., Oldham, G., McCray, J. et Thompson, K. (2009). Removal of bulk organic matter, organic micropollutants, and nutrients during riverbank filtration. Rapport no 3180. Water Research Foundation, Denver, Colorado.
Eddleston, M., Eyer, P., Worek, F., Senarathna, L., von Myers, L., Juszczak, E., Hittarage, A., Azher, S., Dissanayake, W., Revzi Sheriff, M.H., Dawson, A.H. et Buckley, N.A. (2005). Differences between organophosphorus insecticides in human self poisoning: A prospective cohort study. Lancet, 366(9495): 1452-1459.
EFSA (2006). Conclusion regarding the peer review of the pesticide risk assessment of the active substance dimethoate. Finalisé le 23 juin 2006. EFSA Scientific Report, 84: 1-102.
EFSA (2018). Peer review of the pesticide risk assessment of the active substance dimethoate. EFSA Journal, 16(10): 5454.
Element Materials Technology Canada Inc. (2019). Communication personnelle avec H. Du. Calgary, Alb.
Environnement Canada (2011). Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens. Direction des sciences et de la technologie de l'eau, Environnement Canada, En14-40/2011F-PDF, Ottawa, Ontario.
FIFRA (2005). A Set of Scientific Issues Being Considered by the Environmental Protection Agency regarding: Dimethoate: Issues Related to Hazard and Dose-Response Assessment. FIFRA Scientific Advisory Panel, Compte rendu SAP no 2005-01. Rencontre du 30 novembre et du 1er décembre 2004, Arlington, VA.
Fonseka, M.M.D., Medagoda, K., Tillakaratna, Y., Gunatilake, S.B., de Silva, H.J. (2003). Self-limiting cerebellar ataxia following organophosphate poisoning. Hum. Exp. Toxicol., 22: 107-109.
Gouvernement de la Nouvelle-Écosse (2007). Nova Scotia Groundwater Observation Network. Rapport de 2007. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2008). Nova Scotia Groundwater Observation Network. Rapport de 2008. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2009). Nova Scotia Groundwater Observation Network. Rapport de 2009. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2010). Nova Scotia Groundwater Observation Network. Rapport de 2010. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2011). Nova Scotia Groundwater Observation Network. Rapport de 2011. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2012). Nova Scotia Groundwater Observation Network. Rapport de 2012. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement de la Nouvelle-Écosse (2015). Nova Scotia Groundwater Observation Network. Rapport de 2015. Ministère de l'Environnement de la Nouvelle-Écosse. Accessible au : https://novascotia.ca/nse/groundwater/groundwaternetwork.asp.
Gouvernement du Yukon - Santé et services sociaux (2019). Communication personnelle avec P. Brooks, programme des eaux potables.
Haiste-Gulde, B. et Sacher, F. (2019). Communication personnelle, TZW German Water Centre, Karlsruhe, Allemagne.
Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Rapport no 4022. Water Research Foundation, Denver, Colorado.
Hayama, T., Yoshida, H., Todoroki, K., Nohta, H. et Yamaguchi, M. (2008). Determination of polar organophosphorus pesticides in water samples by hydrophilic interaction liquid chromatography with tandem mass spectrometry. Rapid communications in mass spectrometry. Rapid Commun. Mass Spectrom., 22(14): 2203-2210.
Hellwig, J., Deckhardt, K. et Mirea, D. (1986a). Report on the Study of the Toxicity of Dimethoate in Mice After 78 Week Administration in the Diet. BASF Department of Toxicology, soumissions OCS nos 150 et 415, Allemagne (citée dans APVMA, 2010).
Hellwig, J. et coll. (1986b). Report on the Study of the Toxicity of Dimethoate in Rats After 24 Months administration in the Diet. BASF Department of Toxicology, projet no 70. CO 326/8241, soumissions OCS nos 150 et 415, Allemagne (citée dans APVMA, 2010).
Hilal, N., Al-Zoubi, H., Darwish, N.A. et Mohammad, A.W. (2005). Characterisation of Nanofiltration Membranes using Atomic Force Microscopy. Desalination, 177 (1-3): 187-199.
Hoffmann, K. et Schilde, B. (1984). S 6876 (Omethoate) Chronic Toxicity to Dogs on Oral Administration (Twelve-Month Stomach Tube Study). Bayer AG Institut für Toxikologie, rapport no : 12561 [BA; sub: 239, vol. 6 de 9. CHA; sub: 12564, vol. 3-26 de 39], Wiuppertal, Allemagne (citée dans APVMA, 2011).
Hoffmann, U. et Papendorf, T. (2006). Organophosphate poisonings with parathion and dimethoate. Intensive Care Med., 32: 464-468.
Holzum, B. (1990a). E 6876 (Common Name Omethoate): Study for Embryotoxic Effects on Rats Following Oral Administration. Bayer AG, étude no T 8030636. Rapport no 1922, Wuppertal, Allemagne (citée dans APVMA, 2011).
Holzum, B. (1990b). E 6876 (Common Nam: Omethoate). Study for Embryotoxic Effects on Rabbits Following Oral Administration. Bayer AG, étude no T0032834. Rapport no 19221, Wuppertal, Allemagne (citée dans APVMA, 2011).
HSDB (2010). PubChem database. DIMETHOATE, HSDB #1586. National Center for Biotechnology Information, https://pubchem.ncbi.nlm.nih.gov/source/hsdb/1586.
Huck, P.M., Emelko, M.B., Coffey, B.M., Maurizio, D. et O'Melia, C. (2001). Filter operation effects on pathogen passage. Rapport no 90874. AWWA Research Foundation, Denver, Colorado.
Ikehata, K. et Gamal El-Din, M.G. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and fenton-type advanced oxidation processes: A review. J. Environ. Eng. Sci., 5(2): 81-135.
Kirkpatrick, D. (1995). 14C-Dimethoate: The Biokinetics and Metabolism in the Rat. Huntingdon Life Sciences, Ltd. Période d'étude : de janvier 1993 à décembre 1995, no doc DTF : 651-001, réf. : 3-1/vol. 3-2 (citée dans APVMA, 2010).
Knappe, D.R.U., Snoeyink, V.L., Roche, P., Prados, M.J. et Bourbigot, M-M. (1999). Atrazine removal by preloaded GAC. J. Am. Water Works Assoc., 91(10): 97-109.
Kovács, Z. et Samhaber, W. (2008). Characterization of nanofiltration membranes with uncharged solutes. Membrántechnika, 12(2): 22-36 (citée dans Tan et coll., 2019).
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B, 16(1): 39-51.
Kuehn, W. et Mueller, U. (2000). Riverbank filtration: An overview. J. Am. Water Works Assoc., 92(12): 60-69.
LeBlanc, F.N., Benson, B.E. et Glig, A.D. (1986). A severe organophosphate poisoning requiring the use of an atropine drip. J. Toxicol. Clin. Toxicol., 24(1): 69-76.
Lewis, K.A., Tzillivakis, J., Warner, D. et Green, A. (2016). An international database for pesticide risk assessments and management. Hum. Ecol. Risk. Assess., 22(4): 1050-1064.
Li, W., Zhao, Y., Yan, X., Duan, J., Saint, C.P. et Beecham, S. (2019a). Transformation pathway and toxicity assessment of malathion in aqueous solution during UV photolysis and photocatalysis. Chemosphere, 234: 204-214.
Li, N., Wang, X., Zhang, H., Zhang, Z., Ding, J. et Lu, J. (2019b). Comparing the performance of various nanofiltration membranes in advanced oxidation-nanofiltration treatment of reverse osmosis concentrates. Environ. Sci. Pollut. Res., 26(17): 17472-17481.
Ling, W., Qiang, Z., Shi, Y., Zhang, T. et Dong, B. (2011). Fe(III)-loaded activated carbon as catalyst to improve omethoate degradation by ozone in water. J. Mol. Catal. A Chem., 342-343: 23-29.
Lotti, M., Ferrara, S.D., Caroldi, S. et Sinigaglia, F. (1981). Enzyme studies with human and hen autopsy tissue suggest omethoate does not cause delayed neuropathy in man. Arch. Toxicol., 48: 265-270.
Marin, J. (2010). Determination of the Effect of Chlorination of the Degradation of Dimethoate in Water. Étude non publiée préparée par PTRL West, Inc., no de projet : 1970W (citée dans Santé Canada, 2015).
Meijers, R.T., Oderwald-Muller, E.J., Nuhn, P.A.N.M. et Kruithof, J.C. (1995). Degradation of pesticides by ozonation and advanced oxidation. Ozone Sci. Eng., 17: 673-686.
Mellert, W., Hellwig, J., Gembardt, C., Deckardt, K. et van Ravenzwaay, B. (2003). Dimethoate - Two-Generation Reproduction Toxicity Study in Wistar Rats Administration in the Diet. Durée de l'étude : de novembre 2000 à mai 2002. BASF Aktiengesellshaft, no doc DTF; '453-007' réf. : 3-43/vol. 3-22 à 3-24 (citée dans APVMA, 2010).
Miguel, N., Ormad, M.P., Lanao, M., Mosteo, R. Ovelleiro, J.L. (2008). Influence of the activated carbon nature and the aqueous matrix in the pesticides adsorption. Tecnol. Agua, 28(303): 42-47.
Miltner, R.J., Baker, D.B., Speth, T.F., Fronk, C.A., 1989. Treatment of seasonal pesticides in surface waters. J. Am. Water Works Assoc., 81: 43-52.
Ministère de l'Environnement de la Nouvelle-Écosse (2019). Communication personnelle avec A. Polegato, Sustainability and Applied Science Division.
Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario (2020). Communication personnelle avec S. Deshpande, Direction de l'élaboration des normes.
Ministère de l'Environnement et de la Lutte contre les Changements climatiques du Québec (2019). Communication personnelle avec P. Cantin, Direction de l'eau potable et des eaux souterraines.
Ministère de l'Environnement et des gouvernements locaux du Nouveau-Brunswick (2019). Communication personnelle avec K. Gould.
Ministère de la Santé de la Colombie-Britannique (2019). Communication personnelle avec David Fishwick, gestionnaire, Eau potable.
Ministère des Affaires municipales et Environnement de Terre-Neuve-et-Labrador (2019). Communication personnelle avec H. Khan, Division de la gestion des ressources en eau.
Ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard (2019). Communication personnelle avec G. Somers, Division de l'environnement.
Myers, D.P. (2001a). Dimethoate Dose Finding Study in CD Rats by Oral Gavage Administration Preliminary to Developmental Neurotoxicity Study. Huntingdon Life Sciences, Ltd., projet de laboratoire no CHV/068 (rapport 000129); MRID 45529701, Cambridgeshire, Angleterre. Accessible au : https://archive.epa.gov/scipoly/sap/meetings/web/html/072904_mtg.html.
Myers, D.P. (2001b). Dimethoate. Developmental Neurotoxicity Study in the CD Rat by Oral Gavage Administration. Huntington Life Sciences, Ltd., numéro de rapport de laboratoire CHV/069; 003881, MRID 44529703, Woodley Road, Alconbury, Huntingdon, Cambridgeshire, Angleterre. Accessible au : https://archive.epa.gov/scipoly/sap/meetings/web/html/072904_mtg.html.
Myers, D.P. (2001c). Dimethoate: Effects on Cholinesterase in the CD Rat (Adult and Juvenile) by Oral Gavage Administration. Huntingdon Life Sciences, Ltd., no doc CHV 070/012226. MRID 45529702. Cambridgeshire, Angleterre. Accessible au : https://archive.epa.gov/scipoly/sap/meetings/web/html/072904_mtg.html.
Myers, D.P. (2004). Dimethoate Cross Fostering Study in CD Rats. Huntingdon Life Sciences, Ltd., no de rapport de laboratoire CHV/ 089/033185; MRID 46214501, Cambridgeshire, Angleterre. Accessible au : https://archive.epa.gov/scipoly/sap/meetings/web/html/072904_mtg.html.
NHMRC, NRMMC (2011). Australian Drinking Water Guidelines Paper 6 National Water Quality Management Strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth d'Australie, Canberra.
OMS (2004). Dimethoate in Drinking-Water. Background Document for Development of WHO Guidelines for Drinking-Water Quality. Organisation mondiale de la Santé, WHO/SDE/WSH/03.04/90, Genève.
OMS (2017). Directives de qualité pour l'eau de boisson : 4e édition intégrant le premier additif. Organisation mondiale de la Santé, Genève, Suisse. Accessible au : https://apps.who.int/iris/bitstream/handle/10665/258887/9789242549959-fre.pdf?sequence=1&isAllowed=y
Ormad, M.P., Miguel, N., Claver, A., Matesanz, J.M. Ovelleiro, J.L. (2008). Pesticides removal in the process of drinking water production. Chemosphere, 71(1): 97-106.
Ormad, M.P., Miguel, N., Lanao, M., Mosteo, R. Ovelleiro, J.L. (2010). Effect of application of ozone and ozone combined with hydrogen peroxide and titanium dioxide in the removal of pesticides from water. Ozone Sci.Eng., 32(1): 25-32.
Pavlic, M., Haidekker, A., Grubwieser, P. et Rabl, W. (2002). Fatal intoxication with omethoate. Int. J. Legal Med., 116: 238-241.
Piet, G.J. et Zoeteman, B.C.J. (1980). Organic water quality changes during sand bank and dune filtration of surface waters in the Netherlands. J. Am. Water Works Assoc., 72(7): 400-404.
Plakas, K.V. et Karabelas, A.J. (2012). Removal of pesticides from water by NF and RO membranes - A review. Desalination, 287: 255-265.
Qiang, Z., Ling, W. et Tian, F. (2013). Kinetics and mechanism for omethoate degradation by catalytic ozonation with Fe(III)-loaded activated carbon in water. Chemosphere, 90(6): 1966-1972.
Ray, C., Grischek, T., Schubert, J., Wang, J.Z. et Speth, T.F. (2002). A perspective of riverbank filtration. J. Am. Water Works Assoc., 94(4): 149-160.
Santé Canada (2011). Projet de décision de réévaluation. Diméthoate. Agence de réglementation de la lutte antiparasitaire (ARLA); Santé Canada, PRVD2011-12, Ottawa, Ontario.
Santé Canada (2015). Décision de réévaluation. Diméthoate. Agence de réglementation de la lutte antiparasitaire (ARLA); Santé Canada, RVD2015-04, Ottawa, Ontario.
Santé Canada (2020a). Rapport sur les ventes de produits antiparasitaires en 2018. ARLA, Santé Canada, Ottawa, Ontario.
Santé Canada (2020b). Communication personnelle de la Direction de l'évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Santé Canada (en préparation). Canadian Exposure Factors used in Human Health Risk Assessments. Santé Canada, Ottawa, Ontario.
Saskatchewan Water Security Agency (2019). Communication personnelle avec S. Ferris, Regulatory Division.
Schladt, L. (1995). E6876 (Folimat®) Study for Chronic Toxicity and Carcinogenicity in Wistar Rats Following Two-Year Administration in Drinking Water. Bayer AG Fachbereich Toxikologie, no d'étude Bayer T2030748, Friedrich-Ebert-Strasse, Allemagne (citée dans APVMA, 2011).
Schladt, L. (2001). E 6876 Oncogenicity Study in B6C3F1 Mice (Administration in the Drinking Water Over 24 Months; T1032655). Institute of Toxicology, Bayer AG, no d'étude Bayer T 1032655. No de rapport de laboratoire PH 30972, Friedrich-Ebert-Strasse, Allemagne (citée dans APVMA, 2011).
Services aux Autochtones Canada. (2019). Communication personnelle avec X. Redhead, Direction générale de la santé des Premières nations et des Inuits, Programme sur la qualité de l'eau potable.
SGS Environmental Services (2019). Communication personnelle avec D. Griffin. Lakefield, Ont.
Smeets, P.W.M.H., Medema, G.J. et van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drinking Water Eng. Sci., 2: 1-14.
Sørensen, S.R., Schultz, A., Jacobsen, O.S. et Aamand, J. (2006). Sorption, desorption and mineralization of the herbicides glyphosate and MCPA in samples from two Danish soil and subsurface profiles. Environ. Pollut., 141(1): 184-194.
Speth, T.F. et Adams, J.Q. (1993). GAC and Air Stripping Design Support for the Safe Drinking Water Act, Strategies and Technologies for Meeting SDWA Requirements. Clark, R. et S. Summers, éd., Lewis Publishers, Ann Arbor, MI, p. 47-89.
Speth, T.F. et Miltner, R.J. (1998). Technical note: adsorption capacity of GAC for synthetic organics. AWWA Journal, 90(4): 171.
Summers, R.S., Knappe, D.R.U. et Snoeyink, V.L. (2010). Adsorption of organic compounds by activated carbon, dans : Edzwald, J.K. (éd.), Water Quality and Treatment: A Handbook on Drinking Water, 6e édition. McGraw-Hill.
Summers, R.S., Kennedy, A.M., Knappe, D.R.U., Reinert, A.M., Fotta, M.E., Mastropole, A.J., Corwin, C.J. et Roccaro, J. (2014). Evaluation of Available Scale-Up Approaches for the Design of GAC Contactors. Water Research Foundation.
Tan, L. S., A. L. Ahmad, S. R. A. Shukor, et S. P. Yeap (2019). Impact of solute properties and water matrix on nanofiltration of pesticides. Chem. Eng. Tech., 42 (9): 1780-1787.
Tesh, J.M., Ross, F.W., Wgihtman, T.J. et Wilby, O.K. (1982). S 6876: Effects of Oral Administration upon Pregnancy in the Rabbit. 2. Étude principale. Bayer AG, no rapport LSR 82/BAG023/111, Friedrich-Ebert-Strasse, Allemagne (citée dans APVMA, 2011).
Tian, F., Liu, W., Guo, G., Qiang, Z. Zhang, C. (2014). Kinetics and mechanism of dimethoate chlorination during drinking water treatment. Chemosphere, 103: 181-187.
Tsatsakis, A.M., Manousakis, A., Tzatzarakis, M., Delaki, C. et Agouridakis, P. (1998). Clinical and toxicological data in fenthion and omethoate acute poisoning. J. Environ. Sci. Health B, 33(6): 657-670.
Union européenne (2020). Directive 2020/2184 du Parlement européen et du Conseil du 16 décembre 2020 relative à la qualité des eaux destinées à la consommation humaine (refonte).
US EPA (1995). Dimethoate: Pesticide tolerance. Fed. Regist., 60:128 (mercredi 5 juillet 1995): 34945-34947.
US EPA (1998). Méthode 8270D - Semivolatile organic compounds by gas chromatography/mass spectrometry (GC/MS), révision 4.0.
US EPA (2000a). ECM - Dimethoate & Omethoate in Water. MRID 46276301. Office of Pesticide Programs. Washington, D.C. Accessible au : https://www.epa.gov/pesticide-analytical-methods/ecm-dimethoate-omethoate-water-mrid-46276301.
US EPA (2000b). DER - Dimethoate & Omethoate in Water. MRID 46276301. Office of Pesticide Programs. Washington, D.C. Accessible au : https://www.epa.gov/pesticide-analytical-methods/ecm-dimethoate-omethoate-water-mrid-46276301.
US EPA (2000c). Méthode 8141B - Organophosphorus compounds by gas chromatography, révision 2.0.
US EPA (2002). Dimethoate: 2nd Report of the Hazard Identification Assessment Review Committee. United States Environmental Protection Agency (US EPA), Hazard Identification Assessment Review Committee (HIARC), Health Effects Division, PC Code 035001; TXR NO. 0050600.
US EPA (2004). Dimethoate: Issues Related to the Hazard and Dose Response Assessment. US Environmental Protection Agency, Office of Pesticide Programs for the FIFRA Scientific Advisory Panel, 2 novembre 2004. Docket No. OPP-2004-0320, Washington, D.C.
US EPA (2005). Méthode 527 - Determination of selected pesticides and flame retardants in drinking water by solid phase extraction and capillary column gas chromatography/mass spectrometry (GC/MS), révision 1.0.
US EPA (2006a). Reregistration Eligibility Decision for Dimethoate. Office of Pesticide Programs, United States Environmental Protection Agency, Docket EPA-HQ-OPP-2006-0618, Washington, D.C.
US EPA (2006b). Dimethoate: The Revised Post-SAP HED Chapter of the Reregistration Eligibility Decision Document (RED). United States Environmental Protection Agency (US EPA), Health Effects Division (HED), PC Code: 035001, Case #0088, Washington, D.C.
US EPA (2007). Revised Dimethoate IRED. United States Environmental Protection Agency, Office of Prevention, Pesticides and Toxic Substances, Dimethoate Docket EPA-HGQ-OPP-2005-0084, Washington, D.C.
US EPA (2011). Finalization of Guidance on Incorporation of Water Treatment Effects on Pesticide Removal and Transformation in Drinking Water Exposure Assessments.
US EPA (2016). Announcement of final regulatory determinations for contaminants on the third drinking water contaminant candidate list; EPA-HQ-OW-2012-0155; FRL-9940-64-OW. Fed. Regist., 81:1(lundi 4 janvier 2016): 2015-32760.
van der Aa, L.T.J., Kolpa, R.J., Rietveld, L.C. et van Dijk, J.C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153-163.
Van Der Bruggen, B. et Vandecasteele, C. (2003). Removal of pollutants from surface water and groundwater by nanofiltration: Overview of possible applications in the drinking water industry. Environ. Pollut., 122(3): 435-445.
Verstraeten, I.M. et Heberer, T. (2002). Organic chemical removal issues. Chapter 17 in: Riverbank Filtration: Improving Source-water Quality. Ray, C., Melin, G. et Linsky, R.B. (éd.). Springer, Kluwer Academic Publishers. Pays-Bas. p. 321-330.
Yang, K., Yu, J., Guo, Q., Wang, C., Xia, P., Yang, Y.J. et Yang, M. (2019). Treatment performance comparison between regular O3-BAC and O3-BAC with rear sand filtration: Verification in a full-scale study. Env. Sci. Eur., 31(1).
Zearley, T.L. et Summers, R.S. (2012). Removal of trace organic micropollutants by drinking water biological filters. Environ. Sci. Technol., 46(17): 9412-9419.
Zheng, L., Pi, F., Wang, Y., Xu, H., Zhang, Y. et Sun, X. (2016). Photocatalytic degradation of acephate, omethoate, and methyl parathion by Fe3O4@SiO2@mTiO2 nanomicrospheres. J. Hazard. Mater., 315: 11-22.
Zhu, A., Long, F., Wang, X., Zhu, W. et Ma, J. (2007). The negative rejection of H+ in NF of carbonate solution and its influences on membrane performance. Chemosphere, 67(8): 1558-1565.
Annexe A: Liste des abréviations
- AChE
- acétylcholinestérase
- ANSI
- American National Standards Institute
- APVMA
- Australian Pesticides and Veterinary Medicines Authority
- AQA
- apport quotidien acceptable
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- BMD
- dose repère
- BMDL
- limite inférieure de la dose repère
- CA
- charbon actif
- CAB
- charbon actif biologique
- CAG
- charbon actif en grains
- CAP
- charbon actif en poudre
- CCN
- Conseil canadien des normes
- CCS
- Conseil consultatif scientifique
- CEP
- Comité fédéral-provincial-territorial sur l'eau potable
- ChE
- cholinestérase
- CIRC
- Centre international de recherche sur le cancer
- CL50
- concentration létale médiane
- CLHP
- chromatographie liquide à haute performance
- CMA
- concentration maximale acceptable
- COD
- carbone organique dissous
- DCO
- demande chimique en oxygène
- DGSPNI
- Direction générale de la santé des Premières nations et des Inuits
- DL50
- dose létale moyenne médiane
- EP
- eau potable
- FB
- filtration sur berge
- Fe-CA
- Fe(III) déposé sur du charbon actif
- FI
- facteur d'incertitude
- FIFRA
- Federal Insecticide, Fungicide, and Rodenticide Act
- JG
- jour de gestation
- JPN
- jour postnatal
- LDM
- limite de détection de la méthode
- LOAEL
- dose minimale avec effet nocif observé
- MOER
- matière organique d'eau de rivière
- MON
- matière organique naturelle
- MPO
- micropolluant organique
- NF
- nanofiltration
- NOAEL
- dose sans effet nocif observé
- NOEL
- dose sans effet observé
- NPD
- neurotoxicité sur le plan du développement
- NSF
- NSF International
- OI
- osmose inverse
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- PDD
- point de départ
- SDM
- seuil de déclaration de la méthode
- TCLV
- temps de contact en lit vide
- UDS
- synthèse d'ADN non programmée
- UE
- Union européenne
- US EPA
- United States Environmental Agency
- VBS
- valeur basée sur la santé
Annexe B : Données sur la qualité de l'eau au Canada
| Secteur de compétence (année d'échantillonnage) |
Nb détections/ échantillons | LDM (ng/L) |
Plage (ng/L) |
|
|---|---|---|---|---|
| Min. | Max. | |||
| Eau de surface | ||||
| C.-B. – vallée du bas Fraser et bassin de l'Okanagan (2003–2005) | 15/85 | 0,075 | < 0,075 | 604 |
| C.-B. – vallée du bas Fraser (2003–2005) |
_ | _ | 1,4 | 604 |
| C.-B. – vallée du bas Fraser (2003–2005)Note de bas de page a |
_ | _ | 0,02 | 233 |
| Ont. (2004) |
10/228 | 25,1 | 28,9 | 175 |
| Ont. (2005) |
2/160 | 25,1 | 24,7 | 33 |
| Ont. – 10 lacs isolés (2003–2005) |
31/163 | 0,023 | < 0,023 | 5,87 |
| Qc (2003) |
1/50 | 40 | < 40 | 280 |
| Qc (2004) |
6/69 | 5-40 | < 5 | 90 |
| Qc (2005) |
0/62 | 40 | _ | _ |
| N.-B. (2003–2005) |
4/57 | 40-450 | _ | _ |
| Î.-P.-É. (2003–2005) |
0/82 | 50 | _ | _ |
| N.-É. (2003–2005) |
0/19 | 40 | _ | _ |
| Rivières | ||||
| Alb., Sask., Man. – 8 sites (2003) |
0/13 | 25,1 | _ | _ |
| Eau de réservoirs | ||||
| Alb., Sask., Man. – 15 sites (2003–2004) |
1/30 | 25,10 | 5,98 | 25,1 |
| Eaux de ruissellement | ||||
| C.-B. – vallée du bas Fraser (2003–2005) |
_ | _ | 200 | 3 000 |
| C.-B. – bassin de l'Okanagan (2003–2005) |
_ | _ | 1,2 | 17,5 |
| Eau dans l'atmosphère | ||||
| Ont. – 4 sites (2004–2005) |
0/12 | 0,007 | < 0,007 | _ |