Protozoaires entériques dans l'eau potable : Giardia et Cryptosporidium
Document de consultation publique
Préparé par le Comité fédéral-provincial-territorial sur l'eau potable
La période de consultation se termine le 9 janvier 2017
Table des matières
- Objet de la consultation
- Partie I. Vue d'ensemble et application
- Partie II. Science et considérations techniques
- 4.0 Description
- 5.0 Sources et exposition
- 6.0 Méthodes d'analyse
- 7.0 Techniques de traitement
- 8.0 Effets sur la santé
- 9.0 Évaluation des risques
- 10.0 Justification
- 11.0 Références
- Annexe A : Autres protozoaires entériques d'origine hydrique : Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis
- Annexe B : Certaines éclosions de Giardia et de Cryptosporidium liées à des systèmes d'approvisionnement en eau potable publics, semi-publics et privés au Canada (de 1977 à 2001)
- Annexe C : Liste des abréviations

Télécharger le rapport complet
(Format PDF, 967 Mo, 112 pages)
Sujets connexes
Objet de la consultation
Le Comité fédéral-provincial-territorial sur l'eau potable (CEP) a analysé l'information disponible sur les protozoaires entériques dans le but de mettre à jour la recommandation pour la qualité de l'eau potable. La consultation porte sur la recommandation proposée, la démarche suivie pour l'élaborer et les coûts possibles de sa mise en œuvre, et vise aussi à déterminer la disponibilité d'autres données d'exposition.
Les Recommandations pour la qualité de l'eau potable au Canada relatives aux contaminants microbiologiques sont constamment révisées, compte tenu des progrès scientifiques rapides et de l'importance des risques que la présence de microorganismes dans l'eau potable présente pour la santé. Selon la recommandation actuelle concernant les protozoaires entériques, qui a été révisée pour la dernière fois en 2012, l'objectif de traitement basé sur la santé est à une élimination et (ou) à une inactivation d'au moins 3 log des kystes et des oocystes. Le document actualisé que voici tient compte des nouvelles études scientifiques et offre des renseignements sur les génotypes de Cryptosporidium observés dans les eaux de surface au Canada, ainsi que sur les méthodes de génotypage. Il fournit de l'information nouvelle sur la présence de Giardia et de Cryptosporidium dans les eaux souterraines, les effets des conditions environnementales sur les concentrations de protozoaires dans les sources d'eau et la filtration sur berge comme procédé de traitement. Des valeurs révisées des kystes et des oocystes résultant de l'évaluation quantitative du risque microbien sont présentées, et les modifications des hypothèses du modèle sont analysées. Compte tenu des nouveaux renseignements, il est proposé de confirmer la recommandation de l'objectif de traitement basé sur la santé qui consiste à éliminer ou à inactiver d'au moins 3 log les kystes et les oocystes des protozoaires entériques (Giardia et Cryptosporidium) dans l'eau potable.
Le CEP a demandé que le document soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste, au Secrétariat du CEP, Bureau de la qualité de l'eau et de l'air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, localisateur d'adresse 4903D, Ottawa (Ontario), K1A 0K9. Les commentaires doivent nous parvenir avant le 9 janvier 2017.
Les commentaires reçus à l'occasion de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent fournir une déclaration à cet effet avec leurs commentaires.
Il est à noter que le présent document technique sur les protozoaires entériques dans l'eau potable sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie, s'il y a lieu. Le document doit donc être considéré strictement comme une ébauche à commenter.
Partie I. Vue d'ensemble et application
1.0 Recommandation proposée
Lorsqu'il est un nécessaire d'effectuer un traitement pour les protozoaires entériques, la recommandation proposée pour Giardia et Cryptosporidium dans l'eau potable est un objectif de traitement basé sur la santé correspondant à une élimination et (ou) une inactivation d'au moins 3 log des kystes et des oocystes. Selon la qualité de la source d'eau, une élimination ou inactivation logarithmique plus importante pourrait être nécessaire. Des techniques de traitement et des mesures de protection des bassins versants ou des têtes de puits reconnues pour leur efficacité à réduire le risque de maladies d'origine hydrique doivent être mises en œuvre et maintenues si la source d'eau est susceptible d'être contaminée par des matières fécales ou a déjà causé, par le passé, des éclosions de maladies d'origine hydrique imputées à Giardia ou à Cryptosporidium.
2.0 Sommaire
Les protozoaires constituent un groupe diversifié de microorganismes. Ce sont, pour la plupart, des organismes libres qui peuvent vivre en eau douce et qui ne présentent aucun risque pour la santé humaine. Certains protozoaires entériques sont pathogènes, et ils ont été associés à des éclosions de maladies transmises par l'eau potable. Les protozoaires les plus préoccupants au Canada sont Giardia et Cryptosporidium. Ces organismes peuvent se retrouver dans l'eau à la suite d'une contamination directe ou indirecte par des matières fécales d'humains ou d'animaux. La transmission de Giardia et de Cryptosporidium se fait souvent de personne à personne.
Santé Canada a récemment terminé son examen des risques pour la santé découlant de la présence de protozoaires entériques dans l'eau potable. Le présent document technique examine et évalue les risques reconnus pour la santé de la présence de protozoaires entériques dans l'eau potable. Il comprend une évaluation des nouvelles études et approches, et tient compte des limites des méthodes de détection des protozoaires dans l'eau potable. Partant de cet examen, la recommandation proposée pour les protozoaires dans l'eau potable est un objectif de traitement basé sur la santé correspondant à une réduction d'au moins 3 log des protozoaires entériques.
À sa réunion de l'automne 2015, le Comité fédéral-provincial-territorial sur l'eau potable a examiné ce document technique sur les protozoaires entériques et en a autorisé la diffusion pour consultation publique.
2.1 Effets sur la santé
Les effets sur la santé découlant de l'exposition à Giardia et à Cryptosporidium, comme ceux d'autres organismes pathogènes, dépendent des caractéristiques de l'hôte, du pathogène et de l'environnement. L'état immunitaire de l'hôte, la virulence de la souche, l'infectiosité et la viabilité du kyste ou de l'oocyste, ainsi que le degré d'exposition, sont tous des facteurs déterminants de l'infection et de la maladie. L'infection par Giardia ou Cryptosporidium peut causer des effets aigus et des effets chroniques sur la santé.
En théorie, un seul kyste de Giardia suffirait à causer une infection. Cependant, des études ont montré que la dose infectieuse requise est habituellement supérieure à un kyste et qu'elle dépend de la virulence de la souche en cause. D'ordinaire, Giardia est un microorganisme non invasif, qui cause des infections asymptomatiques. La giardiase symptomatique se manifeste par des nausées, la diarrhée (habituellement soudaine et explosive), l'anorexie, une sensation de gêne dans la partie supérieure de l'intestin, des malaises et parfois une légère fièvre ou des frissons. La phase aiguë de l'infection prend souvent fin de façon spontanée, et les organismes disparaissent généralement des fèces. Certains patients (p. ex. les enfants) souffrent d'accès récurrents de la maladie pendant des mois, voire des années.
Comme c'est le cas pour Giardia et d'autres pathogènes, un seul microorganisme de Cryptosporidium peut causer une infection, bien que des études aient montré qu'il en faut, en général, davantage. Les personnes infectées par Cryptosporidium risquent davantage d'être atteintes d'une maladie symptomatique que celles infectées par Giardia. Les symptômes comprennent une diarrhée aqueuse, des crampes, des nausées, des vomissements (particulièrement chez les enfants), une fièvre légère, une anorexie et une déshydratation. La durée de l'infection dépend de l'état du système immunitaire. Les sujets immunocompétents sont généralement porteurs de l'infection pendant une durée maximale de 30 jours. Chez les personnes immunodéprimées, l'infection peut mettre leur vie en danger et persister pendant toute la période d'immunodépression.
2.2 Exposition
Les kystes de Giardia et les oocystes de Cryptosporidium peuvent survivre dans l'environnement pendant de longues périodes, selon les caractéristiques de l'eau. On a constaté qu'ils pouvaient résister à divers stress environnementaux, notamment la congélation et l'exposition à l'eau de mer. On trouve couramment des kystes et des oocystes dans les eaux de surface au Canada, mais il y en a rarement dans les eaux souterraines. L'afflux soudain et rapide de ces microorganismes dans des sources d'eau pour lesquelles les procédés de traitement sont insuffisants ou inadéquats explique probablement le risque accru d'infection entourant la transmission par l'eau potable.
Giardia et Cryptosporidium sont des causes fréquentes d'éclosions de maladies d'origine hydrique; Giardia est le protozoaire entérique le plus souvent signalé au Canada, en Amérique du Nord et dans le monde entier.
2.3 Analyse et traitement
Une méthode de gestion des risques, comme l'approche à barrières multiples « de la source au robinet », ou le plan de salubrité de l'eau, est la meilleure façon de réduire le nombre de protozoaires entériques et d'autres microorganismes pathogènes dans l'eau potable. Les évaluations des sources d'eau doivent faire partie des évaluations régulières de la vulnérabilité et des enquêtes sanitaires. Elles doivent inclure la surveillance ciblée et régulière de Giardia et de Cryptosporidium. Il est possible de cibler la surveillance des protozoaires dans les sources d'eau en s'aidant des résultats des enquêtes sanitaires sur les sources de contamination fécale, conjugués aux données historiques sur les précipitations, la fonte des neiges et le débit et la turbidité des fleuves et des rivières, afin de repérer les conditions qui entraîneront vraisemblablement des concentrations maximales de kystes et d'oocytes. Il existe une méthode validée pour détecter simultanément ces protozoaires. Lorsqu'il est impossible d'exercer une surveillance régulière de Giardia et de Cryptosporidium (p. ex. dans les approvisionnements d'eau des petites collectivités), des approches telles que celles de la source au robinet ou des plans de gestion de la sécurité sanitaire de l'eau peuvent orienter le choix et la mise en œuvre des mesures de gestion des risques nécessaires.
Une fois établies les caractéristiques de la source d'eau, il est possible de fixer des objectifs de réduction des pathogènes et de mettre en œuvre des procédés efficaces de traitement afin d'atteindre des niveaux sécuritaires dans l'eau potable traitée. En général, tous les approvisionnements d'eau provenant de sources d'eau de surface ou d'eau souterraine sous l'influence directe d'eau de surface (ESSIDES) devrait inclure des processus de filtration (ou une technique équivalente) et de désinfection. Combiner l'élimination mécanique (p. ex. par filtration) et des procédés d'inactivation (p. ex. la désinfection aux rayons ultraviolets [UV]) est la manière la plus efficace de diminuer les protozoaires dans l'eau potable, qui résistent aux désinfectants à base de chlore couramment utilisés.
L'absence de bactéries indicatrices (p. ex. Escherichia coli, coliformes totaux) ne signifie pas nécessairement qu'il y a absence de protozoaires entériques. L'application et le suivi d'une approche à barrières multiples de la source au robinet, conjugués à la surveillance des indicateurs (p. ex. la turbidité, les concentrations résiduelles de chlore, E. coli), peuvent être employés pour vérifier si l'eau a été convenablement traitée et si elle est, par conséquent, d'une qualité microbiologique acceptable.
2.4 Évaluation quantitative du risque microbien
L'évaluation quantitative du risque microbien (ÉQRM) est un processus qui emploie les données sur la qualité des sources d'eau, l'information sur les procédés de traitement et les caractéristiques particulières du pathogène pour estimer la charge de morbidité liée à l'exposition aux microorganismes pathogènes dans une source d'eau potable. Le processus peut servir à la gestion d'un système d'approvisionnement en eau potable dans le cadre d'une approche à barrières multiples de la source au robinet, ou il peut appuyer l'élaboration d'une recommandation sur la qualité de l'eau potable, comme lorsqu'il s'agit de fixer un objectif minimal de traitement basé sur la santé pour les protozoaires entériques.
Dans l'ÉQRM, on sélectionne un protozoaire de référence parmi différents protozoaires entériques qui constituent, en raison de leurs caractéristiques, de bons représentants de tous les protozoaires pathogènes similaires. On présume que si le traitement est efficace contre le protozoaire de référence, il le sera contre tous les protozoaires préoccupants similaires. Cryptosporidium parvum et Giardia lamblia ont été choisis comme protozoaires de référence pour la présente évaluation des risques étant donné leur taux de prévalence élevé, leur grand pouvoir de répandre la maladie, leur résistance à la désinfection au chlore et l'existence d'un modèle dose-réponse pour chacun d'eux.
3.0 Application de la recommandation
Remarque : Des instructions précises pour l'application de la recommandation doivent être obtenues auprès de l'autorité compétente en matière d'eau potable dans le secteur visé.
La mise en œuvre d'une méthode de gestion des risques pour les systèmes d'approvisionnement en eau potable, comme l'approche de la source au robinet ou le plan de salubrité de l'eau, devrait réduire l'exposition à Giardia et à Cryptosporidium. Ces approches prévoient une évaluation de l'ensemble du système d'approvisionnement, depuis la source d'eau jusqu'au consommateur, en passant par les procédés de traitement et le réseau de distribution, afin de repérer les risques et de déterminer les mesures appropriées pour les atténuer.
3.1 Évaluations des sources d'eau
Les évaluations des sources d'eau doivent faire partie des évaluations régulières de la vulnérabilité et des enquêtes sanitaires. Elles doivent repérer les sources éventuelles de contamination fécale d'origine humaine et animale dans le bassin versant ou l'aquifère, de même que les voies potentielles et les événements (risque faible à élevé) qui pourraient permettre aux protozoaires d'atteindre la source et de nuire à la qualité de l'eau. Idéalement, elles devraient aussi comporter la surveillance régulière de la présence de Giardia et de Cryptosporidium afin d'établir des paramètres de référence, puis d'une surveillance ciblée à long terme.
Lorsque la surveillance est possible, on peut décider des fréquences et des lieux d'échantillonnage à l'aide des résultats des enquêtes sanitaires sur la contamination fécale, conjugués aux données historiques sur les précipitations, la fonte des neiges, et la turbidité et le débit des fleuves et des rivières. Les évaluations des sources d'eau doivent envisager le « pire scénario possible » pour la source étudiée. Par exemple, il peut y avoir une brève période où la qualité de la source d'eau est mauvaise après un orage. Cette dégradation à court terme représente parfois le gros du risque dans un système d'approvisionnement en eau potable. Prélever et analyser des échantillons d'eau de la source pour détecter la présence de Giardia et de Cryptosporidium peut fournir des renseignements importants qui permettront de déterminer le degré de traitement nécessaire ainsi que les mesures d'atténuation (gestion des risques) à mettre en œuvre pour ramener la concentration de kystes et d'oocystes à un niveau acceptable.
Il faut évaluer les sources souterraines pour déterminer si l'approvisionnement est exposé à la contamination par des protozoaires pathogènes (c. à d. ESSIDES). Ces évaluations doivent inclure au minimum une étude hydrogéologique, une évaluation de l'intégrité du puits et une enquête sanitaire des caractéristiques physiques de la région et des activités qui y sont menées. Les approvisionnements provenant d'ESSIDES doivent atteindre l'objectif en matière de traitement des protozoaires. Les sources d'eau souterraine qui ont été évaluées comme n'étant pas susceptibles d'être contaminées par des protozoaires pathogènes ne doivent pas contenir de protozoaires, si elles ont été correctement catégorisées. Cependant, toutes les sources souterraines sont vulnérables dans une certaine mesure et doivent faire l'objet de réévaluations périodiques.
3.2 Détermination des procédés de traitement
La plupart des eaux souterraines et des ESSIDES étant susceptibles d'être contaminées par des fèces, des techniques de traitement permettant d'éliminer ou d'inactiver au moins 3 log (99,9 %) de Cryptosporidium et de Giardia doivent être appliquées. Pour de nombreuses sources d'eau de surface, une réduction logarithmique plus importante est nécessaire.
Les réductions logarithmiques s'obtiennent au moyen de procédés d'élimination mécanique, comme la filtration, ou de procédés d'inactivation, comme la désinfection aux rayons ultraviolets. De manière générale, les systèmes approvisionnés par des eaux de surface ou des ESSIDES doivent au moins faire l'objet d'une filtration adéquate (ou d'un autre traitement permettant d'obtenir une réduction logarithmique équivalente) et d'une désinfection. Pour déterminer le type et le degré de traitement indiqués, il faut prendre en compte les fluctuations possibles de la qualité de l'eau, y compris la dégradation de la qualité de l'eau à court terme ainsi que la variabilité de l'efficacité du traitement. Des essais pilotes ou d'autres procédés d'optimisation sont utiles pour déterminer la variabilité du traitement.
Partie II. Science et considérations techniques
4.0 Description
Les protozoaires sont un groupe diversifié de microorganismes eucaryotes généralement unicellulaires. La plupart des protozoaires sont des organismes libres qui peuvent vivre en eau douce et qui ne présentent aucun risque pour la santé humaine. Cependant, certains protozoaires sont pathogènes pour les humains. Les protozoaires entrent dans deux groupes fonctionnels : les parasites entériques et les protozoaires libres. Les cas d'infection humaine causée par des protozoaires libres résultent généralement d'un contact durant la baignade (ou d'un usage domestique de l'eau autre que comme eau de boisson); par conséquent, ce groupe de protozoaires est étudié dans les Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada (Santé Canada, 2012a). En revanche, les protozoaires entériques ont été mis en cause dans plusieurs éclosions de maladies transmises par l'eau potable, qui constitue une voie de transmission importante de ces organismes. Voici, par conséquent, une analyse des protozoaires entériques.
Les protozoaires entériques sont des parasites souvent présents dans l'intestin des humains et d'autres mammifères. Comme les bactéries et les virus entériques, ils peuvent se retrouver dans l'eau à la suite d'une contamination directe ou indirecte par les fèces d'humains ou d'autres animaux. Ces microorganismes sont transmissibles par l'eau potable; ils ont été mis en cause dans plusieurs éclosions de maladies d'origine hydrique en Amérique du Nord et ailleurs dans le monde (Schuster et coll., 2005; Karanis et coll., 2007; Baldursson et Karanis, 2011). La capacité de ce groupe de microorganismes de produire des kystes et des oocystes extrêmement résistants aux stress environnementaux et aux désinfectants à base de chlore couramment utilisés a favorisé leur propagation et a renforcé leur pouvoir pathogène.
Les protozoaires entériques les plus fréquemment mis en cause dans les maladies d'origine hydrique au Canada sont Cryptosporidium et Giardia. Ces protozoaires sont souvent présents dans les eaux de surface : certaines souches sont très pathogènes, survivent longtemps dans l'environnement et sont très résistantes à la désinfection au chlore. C'est la raison pour laquelle ils font l'objet de l'analyse qui suit. Une brève description d'autres protozoaires entériques préoccupants pour la santé humaine (c. à d. Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis) se trouve à l'annexe A. Il est à noter que, par souci de clarté, le nom commun des protozoaires entériques est employé dans ce document. Le nom savant n'est utilisé que lorsqu'il le faut pour présenter avec précision des constats scientifiques.
4.1 Giardia
Giardia est un protozoaire parasite flagellé (embranchement des Metamonada, sous-embranchement des Trichozoa, superclasse des Eopharyngia, classe des Trepomonadea, sous-classe des Diplozoa, ordre des Giardiida, famille des Giardiidae) (Cavalier-Smith, 2003; Plutzer et coll., 2010). Il a été découvert pour la première fois dans des selles humaines en 1681, par Antonie van Leeuwenhoek (Boreham et coll., 1990). Il n'a toutefois été reconnu comme agent pathogène pour l'humain qu'en 1960, après avoir causé des poussées infectieuses dans des collectivités et avoir été dépisté chez des voyageurs (Craun, 1986; Farthing, 1992). La maladie causée par ce parasite est appelée « giardiase ».
4.1.1 Cycle biologique
Giardia vit dans l'intestin grêle des humains et des animaux. Le trophozoïte, soit l'étape de son développement où il se nourrit, se loge surtout dans le duodénum, mais souvent aussi dans le jéjunum et l'iléon de l'intestin grêle. Les trophozoïtes (de 9 à 21 µm de longueur, de 5 à 15 µm de largeur et de 2 à 4 µm d'épaisseur) ont un corps en forme de poire dont l'extrémité antérieure est généralement arrondie; ils présentent deux noyaux, deux minces tiges médianes, quatre paires de flagelles, une paire de corps médians de coloration foncée et un large disque adhésif ventral (cystotome). Les trophozoïtes sont généralement attachés à la surface des villosités intestinales, où ils se nourrissent surtout, pense-t-on, de sécrétions muqueuses. Après s'être détachés, les trophozoïtes binucléés forment des kystes (enkystement), puis s'y divisent, de sorte que quatre noyaux deviennent visibles. Les kystes sont ovoïdes, ont de 8 à 14 µm de longueur sur 7 à 10 µm de largeur), possèdent deux ou quatre noyaux et présentent des restes d'organites visibles. Les kystes stables dans l'environnement sont évacués dans les fèces, souvent en grand nombre. Une description complète du cycle biologique est donnée ailleurs (Adam, 2001; Carranza et Lujan, 2010).
4.1.2 Espèces
La taxonomie du genre Giardia change constamment, à mesure que des données sont recueillies sur de nouveaux génotypes et de nouvelles espèces, sur la phylogénie des souches et sur la spécificité pour l'hôte. La taxonomie actuelle du genre Giardia repose sur la définition des espèces proposée par Filice (1952), qui en a défini trois : G. duodenalis (syn. G. intestinalis, G. lamblia), G. muris et G. agilis selon la forme de leur corps médian, un organite composé de microtubules très facilement observé chez le trophozoïte. D'autres espèces ont, par la suite, été décrites d'après la morphologie des kystes et l'analyse moléculaire. Actuellement, six espèces de Giardia sont reconnues (voir le tableau 1), bien que des travaux récents semblent indiquer que les assemblages A et B de Giardia duodenalis (syn. G. intestinalis, G. lamblia) sont peut-être des espèces distinctes et devraient changer de nom (Prystajecky et coll., 2015). Trois synonymes (G. lamblia, G. intestinalis et G. duodenalis) ont été et continuent d'être utilisés de manière interchangeable dans la littérature à propos des isolats humains de Giardia, bien que l'espèce puisse infecter une grande variété de mammifères. Elle sera appelée « G. lamblia » dans le présent document. La caractérisation moléculaire de cette espèce a montré l'existence d'assemblages génétiquement distincts : les assemblages A et B infectent les humains et d'autres mammifères, tandis que les assemblages C, D, E, F et G, n'ont pas encore été isolés chez des humains et semblent avoir une gamme d'hôtes limitée (et représentent probablement différentes espèces ou divers groupes) (voir le tableau 1) (Adam, 2001; Thompson, 2004; Thompson et Monis, 2004; Xiao et coll., 2004; Smith et coll., 2007; Plutzer et coll., 2010). En raison de la diversité génétique des assemblages A et B, ces groupes ont aussi été caractérisés en sous-assemblages (Cacciò et Ryan, 2008; Plutzer et coll., 2010).
| Espèce (assemblage) | Principaux hôtes |
|---|---|
| G. agilis | Amphibiens |
| G. ardeae | Oiseaux |
G. lamblia, syn. G. intestinalis, syn.G. duodenalis
|
|
| G. microti | Rats musqués, campagnols |
| G. muris | Rongeurs |
| G. psittaci | Oiseaux |
En plus des différences génétiques, les variantes de G. lamblia présentent des variations phénotypiques, entre autres en ce qui concerne la sensibilité aux médicaments et le taux de croissance (Homan et Mank, 2001; Read et coll., 2002). Certains ont utilisé ces différences génétiques pour distinguer l'espèce de Giardia infectieuse pour les humains d'autres espèces ou souches (Amar et coll., 2002; Cacciò et coll., 2002; Read et coll., 2004). L'applicabilité de ce genre de méthode pour l'analyse de Giardia dans l'eau est toutefois limitée (voir la section 6.6). C'est pourquoi, à l'heure actuelle, il faut considérer que tout kyste de Giardia présent dans l'eau peut être infectieux pour les humains.
4.2 Cryptosporidium
Cryptosporidium est un protozoaire parasite (embranchement des Apicomplexa, classe des Sporozoasida, sous-classe des Coccodiasina, ordre des Eucoccidiorida, sous-ordre des Eimeriorina, famille des Cryptosporidiidae). Sa pathogénicité pour les humains a été reconnue pour la première fois en 1976 chez un enfant de trois ans auparavant en bonne santé. Un deuxième cas a été observé deux mois plus tard chez un sujet immunodéprimé par une pharmacothérapie (Meisel et coll., 1976). Par la suite, la maladie est devenue plus courante chez les sujets immunodéprimés présentant des symptômes maintenant connus sous le nom de syndrome d'immunodéficience acquise ou sida (Hunter et Nichols, 2002). La maladie causée par ce parasite est appelée cryptosporidiose.
4.2.1 Cycle biologique
Après que le caractère pathogène pour l'être humain de Cryptosporidium a été établi, plus d'études ont été menées sur le cycle biologique de ce parasite et des recherches ont été effectuées sur les voies de transmission possibles. Le cycle biologique de Cryptosporidium comporte de multiples étapes. Il se déroule chez un seul hôte et comporte six grands stades, sexués et asexués : 1) le dékystement au cours duquel les sporozoïtes sont libérés d'un oocyste enkysté; 2) la schizogonie (syn. mérogonie) au cours de laquelle s'effectue la reproduction asexuée; 3) la gamétogonie au cours de laquelle se forment les gamètes; 4) la fécondation du macrogamétocyte par un microgamète pour former un zygote; 5) la formation des parois de l'oocyste; 6) la sporogonie au cours de laquelle se forme le sporozoïte dans l'oocyste (Current, 1986). Une description complète et un diagramme du cycle biologique figurent ailleurs dans la littérature (Smith et Rose, 1990; Hijjawi et coll., 2004; Fayer et Xiao, 2008). La syzygie, un processus de reproduction sexuée au cours duquel les gamétocytes s'unissent bout à bout ou côte à côte avant la formation des gamètes, a récemment été observée chez deux espèces de Cryptosporidium, soit C. parvum et C. andersoni, ce qui a fourni de nouvelles données sur la biologie (cycle biologique) et la transmission de Cryptosporidium (Hijjawi et coll., 2002; Rosales et coll., 2005).
Étant donné qu'il s'agit d'un organisme pathogène d'origine hydrique, l'étape la plus importante du cycle biologique de Cryptosporidium est celle de l'oocyste rond, à parois épaisses, stable dans l'environnement et d'un diamètre de 4 à 6 µm. Il arrive parfois qu'il y ait une suture externe visible; les noyaux des sporozoïtes peuvent être colorés à l'aide d'un colorant fluorogénique, tel le 4,6-diamidino-2-phénylindole (DAPI). Lorsqu'il est ingéré par les humains, le parasite achève son cycle biologique dans le tractus gastro-intestinal. L'ingestion déclenche le dékystement de l'oocyste et libère quatre sporozoïtes, qui adhèrent aux anthérocytes du tractus gastro-intestinal et les envahissent (Spano et coll., 1998a; Pollok et coll., 2003). La vacuole parasitaire ainsi formée contient un organite nourricier qui est, tout comme le parasite, protégé par une membrane externe. La membrane externe provient de la cellule hôte (intracellulaire). Le sporozoïte se reproduit de façon asexuée (schizogonie) et libère des mérozoïtes qui propagent l'infection aux cellules avoisinantes. La multiplication sexuée (gamétogonie) a ensuite lieu, produisant soit des microgamètes (mâles) ou des macrogamètes (femelles). Des microgamètes sont ensuite libérés pour féconder les macrogamètes et former des zygotes. Un petit nombre (20 %) de zygotes conservent une mince paroi cellulaire; ils sont appelés oocystes à paroi mince. Ces oocystes éclatent après la formation des sporozoïtes, mais avant le passage des fèces, pour entretenir l'infection chez l'hôte. Chez la plupart des zygotes, il se forme une épaisse paroi cellulaire résistante à l'environnement et quatre sporozoïtes, lesquels deviennent des oocystes matures, qui sont évacués dans les fèces.
4.2.2 Espèces
Notre compréhension de la taxonomie du genre Cryptosporidium s'améliore continuellement. Tyzzer (1907) a été le premier à décrire Cryptosporidium; après avoir isolé l'organisme des glandes gastriques de souris, il l'a nommé Cryptosporidium muris. Tyzzer (1912) a découvert un second isolat, qu'il a nommé C. parvum, dans l'intestin de la même espèce de souris. Cette espèce a depuis été renommée C. tyzzeri (Ryan et coll., 2014). À l'heure actuelle, 26 espèces valides de Cryptosporidium sont reconnues (voir le tableau 2) (Ryan et coll., 2014). Les principales espèces de Cryptosporidium incriminées dans la maladie chez l'être humain sont C. hominis et C. parvum. Elles causent plus de 90 % des cas de cryptosporidiose chez l'humain (Bouzid et coll., 2013). La majorité des autres cas chez l'humain sont causés par C. meleagridis et C. cuniculus. Un petit nombre de cas ont été attribués à C. ubiquitum, C. canis, C. felis et C. viatorum. D'autres espèces ont été trouvées dans de rares cas. Ces constatations ont des conséquences importantes pour les collectivités dont la source d'eau peut être contaminée par des matières fécales d'origine animale (voir le tableau 2). L'importance épidémiologique de ces génotypes demeure incertaine, mais les données portent à croire que certains génotypes sont adaptés aux humains et transmis (directement ou indirectement) de personne à personne.
| Espèce (génotype) | Principaux hôtes | Préoccupation pour la santé humaineNote de bas de page a |
|---|---|---|
| C. andersoni | Bovins | +Note de bas de page d |
| C. baileyi | Volaille | -Note de bas de page e |
| C. bovis | Bovins | +Note de bas de page d |
| C. canis | Chiens | ++Note de bas de page c |
| C. cuniculus | Lapins | ++Note de bas de page c |
| C. erinacei | Hérissons et chevaux | +Note de bas de page d |
| C. fayeri | Marsupiaux | +Note de bas de page d |
| C. felis | Chats | ++Note de bas de page c |
| C. fragile | Crapauds | -Note de bas de page e |
| C. galli | Roselins, poulets | -Note de bas de page e |
| C. hominis (génotype H, I ou 1) | Humains, singes | +++Note de bas de page b |
| C. macropodum | Marsupiaux | -Note de bas de page e |
| C. meleagridis | Dindons, humains | ++Note de bas de page c |
| C. molnari | Poissons | -Note de bas de page e |
| C. muris | Rongeurs | +Note de bas de page d |
| C. parvum (génotype C, II ou 2) | Bovins, autres ruminants, humains | +++Note de bas de page b |
| C. ryanae | Bovins | -Note de bas de page e |
| C. scrofarum | Porcs | +Note de bas de page d |
| C. serpentis | Reptiles | -Note de bas de page e |
| C. suis | Porcs | +Note de bas de page d |
| C. tyzzeri | Rongeurs | +Note de bas de page d |
| C. ubiquitum | Ruminants, rongeurs, primates | ++Note de bas de page c |
| C. varanii | Lézards | -Note de bas de page e |
| C. viatorum | Humains | ++Note de bas de page c |
| C. wrairi | Cobayes | -Note de bas de page e |
| C. xiaoi | Moutons, chèvres | -Note de bas de page e |
Outre les 26 espèces de Cryptosporidium qui ont été identifiées, plus d'une quarantaine de génotypes de Cryptosporidium, pour lesquels il n'existe pas de nom de souche, ont aussi été proposés chez divers groupes d'animaux, dont les rongeurs, les marsupiaux, les reptiles, les poissons, les oiseaux sauvages et les primates (Fayer, 2004; Xiao et coll., 2004; Feng et coll., 2007; Smith et coll., 2007; Fayer et coll., 2008; Xiao et Fayer, 2008; Ryan et coll., 2014). La recherche semble indiquer que ces génotypes varient en ce qui concerne leur croissance, leur sensibilité aux médicaments et les manifestations de la maladie (Chalmers et coll., 2002; Xiao et Lal, 2002; Thompson et Monis, 2004; Xiao et coll., 2004)
5.0 Sources et exposition
5.1 Giardia
5.1.1 Sources
Les principales sources de Giardia sont les matières fécales humaines et animales. La giardiase est endémique chez l'humain et plus d'une quarantaine d'espèces d'animaux, les taux de prévalence allant de 1 % à 5 % chez les humains à 10 % à 100 % chez les bovins et à 1 % à 20 % chez les porcs (Olson et coll., 2004; Pond et coll., 2004; Thompson, 2004; Thompson et Monis, 2004). Les kystes de Giardia sont excrétés en grande quantité dans les fèces des personnes et des animaux infectés (symptomatiques et asymptomatiques). Il semble, par exemple, que les bovins infectés excrètent jusqu'à un million (106) de kystes par gramme de fèces (O'Handley et coll., 1999; Ralston et coll., 2003; O'Handley et Olson, 2006). D'autres mammifères, comme le castor, le chien, le chat, le rat musqué et le cheval excrètent aussi dans leurs fèces des espèces de Giardia qui infectent les humains (Davies et Hibler, 1979; Hewlett et coll., 1982; Erlandsen et Bemrick, 1988; Erlandsen et coll., 1988; Traub et coll., 2004, 2005; Eligio-García et coll., 2005). Le parasite Giardia peut aussi être présent dans les fèces d'ours, d'oiseaux et d'autres animaux, mais on ignore si ces souches sont pathogènes pour les humains (voir la section 5.1.3). Les kystes se dispersent facilement dans l'environnement et sont transmissibles par la voie fécale-orale, y compris par de l'eau contaminée par des fèces (directement, ou indirectement par des produits alimentaires), ainsi que par le contact direct avec des humains ou des animaux infectés (Karanis et coll., 2007; Plutzer et coll., 2010).
Il y a fréquemment des kystes de Giardia dans les eaux usées et les eaux de surface, et il y en a parfois dans l'eau potable. Il existe peu de données sur la présence de Giardia dans les sources d'eau souterraine. Le tableau 3 donne un aperçu de certaines études qui ont été effectuées sur la présence de Giardia dans les eaux de surface au Canada. En règle générale, la concentration de Giardia dans les eaux de surface va de 2 à 200 kystes/100 L (0,02 à 2 kystes/L). Des concentrations élevées, de l'ordre de 8 700 kystes/100 L (87 kystes/L), qui étaient associées à un ruissellement printanier exceptionnel, ont été signalées, ce qui montre bien qu'il est important de procéder à un échantillonnage lorsque survient un phénomène particulier (Gammie et coll., 2000). Des études récentes ont aussi examiné les espèces présentes dans les eaux de surface au Canada. Les assemblages A et B de G. lamblia ont été les variantes les plus souvent détectées (Edge et coll., 2013; Prystajecky et coll., 2014). C'est également le cas ailleurs dans le monde (Cacciò et Ryan, 2008; Alexander et coll., 2014; Adamska, 2015).
| Province | Lieu/bassin versant | Fréquence des échantillons positifs | Unité de mesure | Concentration de Giardia (kystes/100 L)Note de bas de page b | Référence |
|---|---|---|---|---|---|
| Enquête nationale | Divers | 245/1 173 | Maximum | 230 | Wallis et coll., 1996 |
| Alberta | Non disponible | 1/1 | Un seul échantillon | 494 | LeChevallier et coll., 1991a |
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 8-193 | Gammie et coll., 2000 |
| Maximum | 2 500Note de bas de page c | ||||
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 98 | EPCOR, 2005 |
| Maximum | 8 700 | ||||
| Colombie-Britannique | District d'irrigation du mont Black | 24/27 | Moyenne géométrique | 60,4 | Ong et coll., 1996 |
| District d'irrigation de Vernon | 68/70 | 26 | |||
| District d'irrigation du mont Black | 24/27 | Fourchette | 4,6-1 880 | ||
| District d'irrigation de Vernon | 68/70 | 2-114 | |||
| Colombie-Britannique | Seymour | 12/49 | MoyenneNote de bas de page d | 3,2 | Metro Vancouver, 2009 |
| Capilano | 24/49 | 6,3 | |||
| Coquitlam | 13/49 | 3,8 | |||
| Seymour | Maximum | 8,0 | |||
| Capilano | 20,0 | ||||
| Coquitlam | 12,0 | ||||
| Colombie-Britannique | Rivière Salmon Ruisseau Coghlan |
38/49 59/65 |
Médiane | 32 107 |
Prystajecky et coll., 2014 |
| Rivière Salmon Ruisseau Coghlan |
Maximum | 730 3 800 |
|||
| Nouvelle-Écosse | Parc Collins East Hants Stewiacke Stellarton Tatamagouche Bridgewater Middle Musquodoboit |
1/26 2/12 3/12 4/12 0/12 0/12 4/25 |
Maximum | 130 10 140 200 <10 <10 1 067 |
Nova Scotia Environment, 2013 |
| Ontario | Rivière Grand | 14/14 | Médiane | 71 | Van Dyke et coll., 2006 |
| Rivière Grand | Maximum | 486 | |||
| Ontario | Bassin versant de la rivière Grand | 101/104 | Médiane Maximum |
80 5 401 |
Van Dyke et coll., 2012 |
| Ontario | Rivière des Outaouais | N/D | Moyenne | 16,8 | Douglas, 2009 |
| Ontario | Lac Ontario, prises d'eau des usines de traitement de l'eau UTE1 UTE2 UTE3 |
17/46 4/35 6/43 |
Maximum | 70 12 18 |
Edge et coll., 2013 |
| Rivière Humber | 32/41 | 540 | |||
| Rivière Credit | 19/35 | 90 | |||
| Québec | Usine de traitement ROS, rivière des Mille-Îles, Montréal | 4/4 | Moyenne géométrique | 1 376 | Payment et Franco, 1993 |
| Usine de traitement STE, rivière des Mille-Îles, Montréal | 8/8 | 336 | |||
| Usine de traitement REP, rivière l'Assomption, Montréal | 4/5 | 7,23 | |||
| Québec | Fleuve Saint-Laurent | N/D | Moyenne géométrique | 200 | Payment et coll., 2000 |
La fourchette caractéristique des concentrations de Giardia dans les eaux de surface canadiennes se trouve à l'extrémité inférieure de la plage décrite dans une étude internationale (Dechesne et Soyeux, 2007). Dechesne et Soyeux (2007) ont découvert que les concentrations de Giardia dans les sources d'eau partout en Amérique du Nord et en Europe variaient de 0,02 à 100 kystes/L, les concentrations les plus élevées ayant été notées aux Pays-Bas. Des données sur la surveillance de la qualité des sources d'eau (de surface et ESSIDES) ont aussi été recueillies pour neuf sources d'eau en Europe (en France, en Allemagne, aux Pays-Bas, en Suède et au Royaume-Uni) et pour une source australienne. Dans l'ensemble, Giardia a fréquemment été détecté à des concentrations relativement faibles qui variaient de 0,01 à 40 kystes/L. Une recherche précédente réalisée par Medema et coll. (2003) a révélé qu'en règle générale, les concentrations de kystes dans les eaux usées brutes et les eaux usées domestiques traitées (c. à d. provenant d'un effluent secondaire) variaient respectivement de 5 000 à 50 000 kystes/L et de 50 à 500 kystes/L.
Il existe peu de données sur la contamination des eaux souterraines par les protozoaires au Canada et ailleurs dans le monde. La recension et l'analyse des pathogènes entériques dans les eaux souterraines aux États-Unis et au Canada (1990-2013), menées par Hynds et coll. (2014), a repéré 102 études sur les eaux souterraines, dont 10 seulement ont porté sur la présence de Giardia, qui a été constatée dans trois de ces dix études. Aucun des sites positifs ne se trouve au Canada. Trois études ont été effectuées au Canada (sur les dix qui ont été repérées). Deux l'ont été à l'Île du-Prince-Édouard et une en Colombie-Britannique. Au total, les études de l'Île-du-Prince-Édouard ont porté sur des échantillons de l'eau de 40 puits de fermes laitières et bovines (Budu-Amoako et coll., 2012a,b). La présence de Giardia n'a été observée dans aucun de ces échantillons. Giardia n'était pas non plus présent dans les échantillons d'eau souterraine de l'étude menée en C. B. (Isaac-Renton et coll., 1999). Des études aux États-Unis et ailleurs ont signalé la présence de kystes dans les eaux souterraines, mais en général à une faible fréquence et à une faible concentration (Hancock et coll., 1998; Moulton-Hancock et coll., 2000; Gaut et coll., 2008; Khaldi et coll., 2011; Gallas-Lindemann et coll., 2013; Sinreich, 2014). Ces études présentent divers types d'approvisionnements en eau souterraine, y compris des cas où l'intégrité des puits et la rapidité de la recharge à partir des sources d'eau de surface ou près de la surface ne sont pas connues précisément. Or, la conception et l'intégrité des puits ont une incidence importante sur la probabilité de détecter des protozoaires entériques (Hynds et coll., 2014).
Des tests visant à détecter la présence de Giardia dans l'eau traitée au Canada sont rarement effectués. Ceux qui ont été faits ont généralement révélé l'absence de kystes ou leur présence en très faibles concentrations (Payment et Franco, 1993; Ong et coll., 1996; Wallis et coll., 1996, 1998; EPCOR, 2005; Douglas, 2009), exception faite de certains cas. En 1997, après un important ruissellement printanier à Edmonton, en Alberta, la présence de 34 kystes/100 L dans l'eau traitée a été notée (Gammie et coll., 2000). Des kystes ont aussi été détectés dans l'eau traitée provenant de sources d'approvisionnement en eau de surface non filtrée (Payment et Franco, 1993; Wallis et coll., 1996).
5.1.2 Survie
Les kystes de Giardia peuvent survivre dans l'eau pendant des semaines, voire des mois (et peut-être plus longtemps), en fonction de certains facteurs, notamment des caractéristiques propres de la souche et de l'eau, comme la température. L'effet de la température sur les taux de survie de Giardia a fait l'objet de nombreuses études. En général, plus la température augmente, plus la période de survie diminue. Par exemple, Bingham et coll. (1979) ont constaté que des kystes de Giardia peuvent survivre jusqu'à 77 jours dans l'eau de robinet à 8 °C, comparativement à 4 jours à une température de 37 °C. DeRegnier et coll. (1989) ont fait état d'un effet semblable dans les eaux fluviales et lacustres. Cet effet de la température explique, en partie, les concentrations maximales de kystes de Giardia signalées durant les mois d'hiver (Isaac-Renton et coll., 1996; Ong et coll., 1996; Van Dyke et coll., 2012). D'autres facteurs, comme l'exposition aux rayons UV (McGuigan et coll., 2006; Heaselgrave et Kilvington, 2011) ou la prédation (Revetta et coll., 2005) peuvent également raccourcir le temps de survie de Giardia.
La viabilité des kystes de Giardia dans l'eau ne semble pas élevée. Les kystes présents dans les eaux de surface sont souvent morts, comme le montre la coloration à l'iodure de propidium (IP) (Wallis et coll., 1995). Les faits observés par LeChevallier et coll. (1991b) portent également à croire que la plupart des kystes présents dans l'eau ne sont pas viables : des 46 kystes isolés qui étaient présents dans l'eau potable, 40 présentaient une morphologie « de type non viable » (c.-à-d. cytoplasme déformé ou rétréci). En Colombie-Britannique, des études plus récentes ayant utilisé la coloration au DAPI et la microscopie à contraste interférentiel différentiel (CID) ont conclu que la vaste majorité des kystes détectés par la surveillance régulière de deux réservoirs d'eau potable n'avaient pas de structure interne, ce qui semble indiquer qu'ils sont âgés ou endommagés et, vraisemblablement, qu'ils ne sont pas viables (Metro Vancouver, 2013). Les études ont fréquemment révélé la présence de kystes vides (« fantômes »), en particulier dans les eaux usées.
5.1.3 Exposition
La transmission de Giardia se fait le plus souvent de personne à personne (Pond et coll., 2004; Thompson, 2004). Les gens contractent l'infection par voie fécale-orale, que ce soit directement (c. à d. par un contact avec les fèces d'une personne contaminée, comme un enfant dans une garderie) ou indirectement (c. à d. par ingestion d'eau potable contaminée ou d'eau utilisée à des fins récréatives et, plus rarement, d'aliments contaminés). Les animaux jouent peut-être aussi un rôle important dans la transmission zoonotique de Giardia, bien qu'on ne sache pas très bien dans quelle mesure. Les bovins sont porteurs de l'espèce de Giardia (assemblage A) infectieuse pour les humains, tout comme les chiens et les chats. Des génotypes de Giardia (assemblage A) ont aussi été détectés chez des animaux sauvages, dont le castor et le cerf (Plutzer et coll., 2010).
Bien qu'il existe certaines preuves de la transmission zoonotique de Giardia, la plupart sont circonstancielles ou limitées par des contrôles inadéquats. Nous ignorons par conséquent à quelle fréquence et dans quelles circonstances la transmission zoonotique survient. Ensemble, ces données semblent indiquer que, la plupart du temps, les animaux ne constituent pas la source initiale d'infection de Giardia pour les humains. Cependant, dans certains cas, il est possible qu'ils amplifient les génotypes zoonotiques présents dans d'autres sources (p. ex. l'eau contaminée). Ainsi, le génotype de Giardia qui infecte les animaux d'élevage (assemblage E) prédomine chez les bovins (Lalancette et coll., 2012); ceux ci sont toutefois susceptibles d'être infectés par les génotypes (zoonotiques) de Giardia qui infectent les humains. D'autres animaux d'élevage, comme les moutons, peuvent aussi être infectés par les génotypes qui infectent les humains. Il se peut que les éleveurs ou les sources d'eau contaminées communiquent les génotypes zoonotiques aux animaux d'élevage, mais il existe aussi des preuves du contraire (Di Giovanni et coll., 2006). Compte tenu de ce que les fèces des animaux d'élevage, comme les veaux, infectés par Giardia contiennent habituellement de 105 à 106 kystes par gramme, ceux-ci pourraient jouer un rôle important dans la transmission de Giardia.
Le rôle que les animaux sauvages jouent dans la transmission zoonotique de Giardia est également obscur. Bien que les animaux sauvages, y compris les castors, puissent être infectés par G. lamblia d'origine humaine (Davies et Hibler, 1979; Hewlett et coll., 1982; Erlandsen et Bemrick, 1988; Erlandsen et coll., 1988; Traub et coll., 2004, 2005; Eligio-García et coll., 2005) et qu'ils aient été associés à des éclosions de giardiase d'origine hydrique (Kirner et coll., 1978; Lopez et coll., 1980; Lippy, 1981; Isaac-Renton et coll., 1993), les données épidémiologiques et moléculaires ne confirment pas la théorie selon laquelle la transmission zoonotique par les animaux sauvages constitue un risque important d'infection pour les humains (Hoque et coll., 2003; Stuart et coll., 2003; Berrilli et coll., 2004; Thompson, 2004; Hunter et Thompson, 2005; Ryan et coll., 2005a). Cependant, ces données semblent indiquer que les animaux sauvages peuvent être porteurs des génotypes de l'espèce de Giardia infectieuse pour les humains, qu'ils contractent par des sources contaminées par les eaux usées. À mesure que la pression démographique et les activités humaines s'intensifient dans les bassins versants, la possibilité que les sources d'eau soient contaminées par des matières fécales augmente, et la possibilité de contamination par les eaux usées doit toujours être envisagée. Erlandsen et Bemrick (1988) ont conclu que les kystes de Giardia présents dans l'eau pouvaient provenir de nombreuses sources et que les études épidémiologiques qui se concentrent sur les castors pouvaient passer à côté d'importantes sources de contamination par les kystes. Il a été établi que certaines éclosions d'origine hydrique étaient imputables à une contamination par des eaux usées (Wallis et coll.1998). Ongerth et coll. (1995) ont montré qu'il existe un lien statistiquement significatif entre l'utilisation de beaucoup d'eau à des fins domestiques et récréatives et la fréquence de la présence de Giardia chez les animaux et dans les eaux de surface. On sait que le castor et le rat musqué peuvent être infectés par l'espèce de Giardia d'origine humaine (Erlandsen et coll.1988) et que ces animaux sont fréquemment exposés à des eaux usées brutes ou partiellement traitées au Canada. L'utilisation des méthodes de génotypage a fourni de nouvelles preuves de l'existence de ce lien. Il est donc probable que les animaux sauvages et d'autres animaux puissent jouer le rôle de réservoirs infectieux de Giardia pour les humains en ingérant de l'eau contaminée par des eaux usées et qu'à leur tour ils accroissent les concentrations de kystes de Giardia dans l'eau. Si des animaux infectés vivent en amont ou à très près des prises d'eau des usines de production d'eau potable, ils pourraient jouer un rôle important dans la transmission de Giardia par voie hydrique. Il est donc important pour prévenir la maladie de gérer les bassins versants afin de limiter leur contamination par des matières fécales humaines et animales.
Comme c'est le cas pour les animaux d'élevage et les animaux sauvages, le rôle que les animaux domestiques jouent dans la transmission zoonotique de Giardia n'est pas connu. Bien que les chiens et les chats soient susceptibles d'être infectés par des génotypes zoonotiques de Giardia, peu d'études ont fourni des preuves directes de transmission entre eux et les humains (Eligio-García et coll., 2005; Shukla et coll., 2006; Thompson et coll., 2008).
5.1.4 Maladies d'origine hydrique
Giardia est le protozoaire entérique le plus souvent signalé en Amérique du Nord et partout dans le monde (Farthing, 1989; Adam, 1991). L'Organisation mondiale de la santé (OMS, 1996) estime l'incidence mondiale de la giardiase à 200 millions de cas par an. Au Canada, un peu plus de 3 800 cas confirmés de giardiase ont été déclarés en 2012. Ce chiffre représente une diminution importante par rapport aux 9 543 cas qui ont été déclarés en 1989. En fait, le nombre total de cas de Giardia a diminué constamment depuis le début des années 1990. Les taux d'incidence ont reculé de la même façon au cours de cette période (passant de 34,98 à 11,12 cas par 100 000 personnes) (ASPC, 2015). La maladie, en particulier les malaises légers, comme les troubles gastro-intestinaux, étant sous-déclarée et sous-diagnostiquée, les taux d'incidence déclarés sont considérés comme une fraction seulement des maladies qui se produisent dans la population. En ce qui concerne Giardia, on estime que le nombre de cas au pays est 40 fois plus élevé à peu près que le nombre signalé à l'échelle nationale (Thomas et coll., 2013). Cependant, bien que Giardia soit le protozoaire entérique le plus souvent déclaré, il n'a tout de même été à l'origine que de 16 % à peu près des cas de maladie causés par les aliments et l'eau en 2013 (ASPC, 2015).
Giardia est une cause fréquente d'éclosions d'origine hydrique au Canada et ailleurs dans le monde (Hrudey et Hrudey, 2004). Entre 1974 et 2001, Giardia a été l'agent étiologique le plus souvent incriminé dans des éclosions liées à l'eau potable au Canada (Schuster et coll., 2005). Giardia était à l'origine de 51 des 138 éclosions pour lesquelles des agents étiologiques ont été identifiés. La majorité (38/51; 75 %) d'entre elles ont été associées à des réseaux publics d'approvisionnement en eau potable; l'annexe B présente certaines de ces éclosions. La contamination des sources d'eau par les eaux d'égout et le traitement inadéquat (p. ex. l'absence de filtration ou la mauvaise filtration, l'utilisation exclusive du chlore) semblent avoir été un facteur important (Schuster et coll., 2005). Depuis 2001, une seule éclosion associée à une source d'eau a été signalée (ASPC, 2009).
Aux États-Unis, des éclosions liées à l'eau potable ont été signalées dans 48 États (Craun, 1979; Lin, 1985; Moore et coll., 1993; Jakubowski, 1994; CDC, 2004; Craun et coll., 2010). Giardia a été l'agent étiologique le souvent reconnu dans les éclosions d'origine hydrique aux États-Unis entre 1971 et 1990, ayant été mis en cause dans 16 % des éclosions (Craun et coll., 2006). Comme au Canada, les taux de maladie imputés à Giardia diminuent aux États-Unis et, en 2012, le taux moyen de giardiase y était de 5,8 par 100 000 personnes (Painter et coll., 2015a). Bien que le taux de giardiase dont il est fait état aux États-Unis soit inférieur à celui du Canada, l'écart s'explique en partie par les différences en matière de surveillance des maladies. Aux États-Unis, la giardiase n'est pas une maladie à déclaration obligatoire dans tous les États, alors qu'elle l'est à l'échelle nationale au Canada. Dans une étude internationale sur les éclosions d'origine hydrique imputables à des protozoaires, G. lamblia était en cause dans 40,6 % des 325 éclosions imputables à toutes les sources d'eau, dont les eaux utilisées à des fins récréatives, qui ont été signalées entre 1954 et 2003 (Karanis et coll., 2007). La plus importante éclosion liée la présence de Giardia dans l'eau potable s'est produite en Norvège, en 2004 (Robertson et coll., 2006). Une révision de cette étude, faisant état de 199 éclosions dues à des protozoaires entre 2004 et 2010, a été publiée en 2011 (Baldursson et Karanis, 2011). Giardia était encore à l'origine de 35,2 % des éclosions, toutes sources d'eau confondues.
5.2 Cryptosporidium
5.2.1 Sources
Les humains et les autres animaux, en particulier les bovins, sont des réservoirs importants de Cryptosporidium. Des cas de cryptosporidiose chez les humains ont été signalés dans plus de 90 pays sur six continents (Fayer et coll., 2000; Dillingham et coll., 2002). Les taux signalés de prévalence de la cryptosporidiose chez les humains varient entre 1 % et 2 %, les taux les plus élevés étant signalés dans les pays en développement (Caprioli et coll., 1989; Zu et coll., 1992; Mølbak et coll., 1993; Nimri et Batchoun, 1994; Dillingham et coll., 2002; Cacciò et Pozio, 2006). Les animaux d'élevage, particulièrement les bovins, sont une source importante de C. parvum (Pond et coll., 2004). Dans une étude réalisée sur les animaux de ferme au Canada, la présence de Cryptosporidium a été détectée dans des échantillons de fèces de bovins (20 %), de moutons (24 %), de porcs (11 %) et de chevaux (17 %) (Olson et coll., 1997). Dans l'ensemble, les taux de prévalence chez les bovins allaient de 1 % à 100 % et de 1 % à 10 % chez les porcs (Pond et coll., 2004). La présence d'oocystes était plus fréquente chez les veaux que chez les animaux adultes; à l'inverse, elle était plus fréquente chez les porcs et les chevaux adultes que chez leurs petits. Les veaux infectés peuvent excréter jusqu'à 107 oocystes par gramme de fèces (Smith et Rose, 1990); ils constituent donc une source importante de Cryptosporidium dans les eaux de surface (voir la section 5.2.2). Les ongulés (animaux à sabots) sauvages et les rongeurs ne sont pas une source importante d'oocystes de Cryptosporidium susceptibles d'infecter les humains (Roach et coll., 1993; Ong et coll., 1996).
Les oocystes se dispersent facilement dans l'environnement et sont transmissibles par la voie fécale-orale. Cryptosporidium se transmet surtout de personne à personne, par l'eau potable contaminée, l'eau utilisée à des fins récréatives, les aliments et le contact avec des animaux, en particulier les animaux d'élevage. Une analyse plus détaillée de la transmission zoonotique figure à la section 5.2.3.
Il y a souvent des oocystes de Cryptosporidium dans les eaux d'égout et les eaux de surface, et il y en a parfois dans l'eau traitée. Il n'existe pas beaucoup de données sur la présence de Cryptosporidium dans les sources d'eau souterraine. Le tableau 4 donne un aperçu de certaines études sur la présence de Cryptosporidium dans les eaux de surface au Canada.
| Province | Lieu/bassin versant | Fréquence des échantillons positifs | Unité de mesure | Concentration de Cryptosporidium (oocystes/100 L)Note de bas de page b | Référence |
|---|---|---|---|---|---|
| Enquête nationale | Divers | 55/1 173 | Maximum (pour la plupart des échantillons) | 0,5 | Wallis et coll., 1996 |
| Alberta | Non disponible | 1/1 | Un seul échantillon | 34 | LeChevallier et coll., 1991a |
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 6-83 | Gammie et coll., 2000 |
| Maximum | 10 300Note de bas de page c | ||||
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 9 | EPCOR, 2005 |
| Maximum | 69 | ||||
| Colombie-Britannique | District d'irrigation du mont Black | 14/27 | Moyenne géométrique | 3,5 | Ong et coll., 1996 |
| District d'irrigation de Vernon | 5/19 | 9,2 | |||
| District d'irrigation du mont Black | 14/27 | Fourchette | 1,7-44,3 | ||
| District d'irrigation de Vernon | 5/19 | 4,8-51,4 | |||
| Colombie-Britannique | Ruisseau Seymour | 0/49 | MoyenneNote de bas de page d | 0,0 | Metro Vancouver, 2009 |
| Capilano | 5/49 | 2,4 | |||
| Coquitlam | 1/49 | 2,0 | |||
| Ruisseau Seymour | Maximum | 0,0 | |||
| Capilano | 4,0 | ||||
| Coquitlam | 2,0 | ||||
| Colombie-Britannique | Rivière Salmon Ruisseau Coghlan |
36/49 36/65 |
Médiane | 11 333 |
Prystajecky et coll., 2014 |
| Rivière Salmon Ruisseau Coghlan |
Maximum | 126 20 600 |
|||
| Nouvelle-Écosse | Parc Collins East Hants Stewiacke Stellarton Tatamagouche Bridgewater Middle Musquodoboit |
1/26 0/12 0/12 0/12 0/12 0/12 0/25 |
Maximum | 130 <10 <10 <10 <10 <10 <10 |
Nova Scotia Environment, 2013 |
| Ontario | Rivière Grand | 33/98 | Moyenne | 6,9 | LeChevallier et coll., 2003 |
| Maximum | 100 | ||||
| Ontario | Rivière Grand | 13/14 | Médiane | 15 | Van Dyke et coll., 2012 |
| Rivière Grand | Maximum | 186 | |||
| Ontario | Bassin versant de la rivière Grand | 92/104 | Médiane Maximum |
12 900 |
Van Dyke et coll., 2012 |
| Ontario | Rivière des Outaouais | N/D /53 | Moyenne | 6,2 | Douglas, 2009 |
| Ontario | Lac Ontario, prises d'eau des usines de traitement de l'eau UTE1 UTE2 UTE3 |
5/46 |
Maximum | 40 |
Edge et coll., 2013 |
| Rivière Humber | 18/41 | 120 | |||
| Rivière Credit | 21/35 | 56 | |||
| Ontario | Rivière Nation Sud (nombreux sites) | 317/674 | Moyenne | 3,3-170 | Ruecker et coll., 2012 |
| Québec | Usine de traitement ROS, rivière des Mille-Îles, Montréal | Moyenne géométrique | 742 | Payment et Franco, 1993 | |
| Usine de traitement STE, rivière des Mille-Îles, Montréal | <2 | ||||
| Usine de traitement REP, rivière l'Assomption, Montréal | <2 | ||||
| Québec | Fleuve Saint-Laurent | Moyenne géométrique | 14 | Payment et coll., 2000 | |
Bien que des concentrations élevées aient été signalées, la concentration de Cryptosporidium dans les eaux de surface au Canada est en général de l'ordre de 1 à 100 oocystes/100 L (0,001 à 1 oocyste/L). Des concentrations élevées, atteignant 10 300 oocystes/100 L (103 oocystes/L), ont été associées à un ruissellement printanier exceptionnel; les concentrations ont atteint 20 600 oocystes/100 L (206 oocystes/L) pendant un programme de surveillance bihebdomadaire de deux ans (Gammie et coll., 2000; Prystajecky et coll., 2014). Ces résultats montrent qu'il est important pour établir les caractéristiques d'une source d'eau d'exercer une surveillance régulière et de procéder aussi à un échantillonnage lorsque survient un événement particulier. L'analyse des données recueillies aux États-Unis a montré que la densité médiane des oocystes allait de 0,005/L à 0,5/L (Ongerth, 2013a).
Des études récentes ont également examiné les espèces de Cryptosporidium présentes dans les sources d'eau. Deux études dans les bassins versants de l'Ontario ont fait état de la fréquence - qui s'établit à moins de 2 % des échantillons - à laquelle C. parvum et C. hominis, les espèces les plus souvent à l'origine des incidences chez l'être humain, sont détectés. (Ruecker et coll., 2012; Edge et coll., 2013). Par contre, une étude effectuée en Colombie-Britannique dans un bassin versant mixte, à la fois rural et urbain, a fait état d'un taux de détection de types pouvant infecter les humains avoisinant 30 % (Prystajecky et coll., 2014). Selon d'autres études menées au Canada, les génotypes qui infectent les humains se situent quelque part entre ces deux niveaux (Pintar et coll., 2012; Van Dyke et coll., 2012). Ces observations ne sont pas uniques. Dans un projet de recherche récent qui a établi le génotype de 220 lames dont la technique d'immunofluorescence avait auparavant confirmé qu'elles étaient positives, 10 % de ces lames renfermaient des génotypes humains (Di Giovanni et coll., 2014).
Une étude internationale des données sur la qualité des sources d'eau (eaux de surface et ESSIDES) a révélé que les concentrations de Cryptosporidium dans les sources d'eau partout en Amérique du Nord et en Europe variaient entre 0,006 et 250 oocystes/L (Dechesne et Soyeux, 2007). Bien que cette fourchette soit étendue, l'examen attentif de neuf sites européens et un site australien permet de constater que, dans l'ensemble, Cryptosporidium a fréquemment été détecté à des concentrations relativement faibles, allant de 0,05 à 4,6 oocystes/L. Dans une étude antérieure des effluents d'eaux usées, Medema et coll. (2003) ont fait état de concentrations d'oocystes dans les eaux usées brutes et les eaux usées domestiques traitées (c. à d. l'effluent secondaire) allant respectivement de 1 000 à 10 000 oocystes/L et de 10 à 1 000 oocystes/L.
Peu de choses sont connues sur la présence de Cryptosporidium dans les eaux souterraines au Canada. Hynds et coll. (2014) ont recensé les études sur les eaux souterraines effectuées au Canada et aux États-Unis entre 1990 et 2013. Les chercheurs ayant mené neuf études ont voulu déterminer si Cryptosporidium était présent dans les eaux souterraines; seulement trois des neuf études ont été menées au Canada. Deux ont été effectuées à l'Île-du-Prince-Édouard (Budu-Amoako et coll., 2012a, 2012b) et une en C. B. (Isaac-Renton et coll., 1999). L'étude réalisée en C. B. n'a pas découvert de Cryptosporidium dans le puits d'eaux souterraines dans la collectivité pendant la période visée. Au cours des études à l'Î. P. É., 40 échantillons d'eau de puits prélevés dans des fermes laitières et bovines ont été analysés; quatre d'entre eux renfermaient des Cryptosporidium dont la densité de concentration était de 0,1 à 7,2/L dans des échantillons de 100 L. Pour confirmer ces observations, les chercheurs ont analysé de nouveau l'eau des puits positifs et y ont découvert des indicateurs bactériens et Cryptosporidium. Des études aux États-Unis et ailleurs ont également fait état de la présence en général occasionnelle d'oocystes dans les eaux souterraines, quoiqu'à des fréquences d'habitude faibles (Hancock et coll., 1998; Moulton-Hancock et coll., 2000; Gaut et coll., 2008; Khaldi et coll., 2011; Füchslin et coll., 2012; Gallas-Lindemann et coll., 2013; Sinreich, 2014). Ces études représentent divers types d'approvisionnement en eau souterraine, dont des approvisionnements pour lesquels l'intégrité des puits et la rapidité de la recharge à partir des eaux de surface ou des eaux près de la surface n'étaient pas précisément connues. Or, la conception et l'intégrité des puits ont une incidence importante sur la probabilité de détection de protozoaires entériques (Hynds et coll., 2014).
La présence de Cryptosporidium dans l'eau traitée au Canada a rarement été évaluée. Les analyses réalisées ont généralement révélé l'absence d'oocystes ou leur présence en très faibles concentrations (Payment et Franco, 1993; Ong et coll., 1996; Wallis et coll., 1996, 1998; EPCOR, 2005; Douglas, 2009), exception faite de certains cas (Gammie et coll., 2000). Des oocystes ont aussi été détectés dans l'eau traitée provenant de sources d'approvisionnement en eau de surface non filtrée (Wallis et coll., 1996) et après la survenue d'événements de contamination graves. Par exemple, en 1997, après qu'un important ruissellement printanier s'est produit à Edmonton, en Alberta, la présence de 80 oocystes/100 L a été observée dans l'eau traitée (Gammie et coll., 2000). Les eaux traitées font l'objet d'une large surveillance dans d'autres pays. La surveillance quotidienne de l'eau prête au débit effectuée au Royaume-Uni (entre 1999 et 2008) a montré que la fréquence des échantillons positifs pouvait atteindre 8 %, mais que, grâce aux améliorations apportées aux systèmes d'approvisionnement en eau potable, ce taux dégringole à 1 % environ (Rochelle et coll., 2012). La méthode employée pour la surveillance quotidienne n'a pas livré d'information sur la viabilité ou l'infectiosité des oocystes. Le génotypage d'un sous-ensemble d'échantillons positifs a toutefois été effectué, et il s'est avéré que les espèces de Cryptosporidium les plus souvent détectées étaient C. ubiquitum (12,5 %), C. parvum (4,2 %) et C. andersonni (4,0 %) (Nichols et coll., 2010).
5.2.2 Survie
Il a été établi qu'en laboratoire les oocystes de Cryptosporidium survivent dans l'eau froide (4 °C) pendant une période pouvant atteindre 18 mois (AWWA, 1988). Dans de l'eau tiède (15 °C), Cryptosporidium parvum peut rester viable et infectieux pendant sept mois (Jenkins et coll., 2003). En règle générale, le temps de survie des oocystes diminue à mesure que la température augmente (Pokorny et coll., 2002; King et coll., 2005; Li et coll., 2010). Robertson et coll. (1992) ont mentionné que les oocystes de C. parvum peuvent résister à divers stress environnementaux, y compris la congélation (viabilité fortement réduite) et l'exposition à l'eau de mer; les oocystes de Cryptosporidium courent toutefois un risque de dessiccation. Une étude en laboratoire de la dessiccation a montré qu'après moins de deux heures, 3 % seulement des oocystes étaient encore viables et qu'en six heures, tous étaient morts (Robertson et coll., 1992).
Bien qu'on suppose fréquemment que la plupart des oocystes se trouvant dans l'eau sont viables, Smith et coll. (1993) ont constaté que la viabilité des oocystes dans les eaux de surface est souvent très faible. Une étude de LeChevallier et coll. (2003) a révélé que 37 % des oocystes détectés dans les eaux naturelles étaient infectieux. De plus, une étude réalisée par Swaffer et coll. (2014) a signalé que 3 % seulement des Cryptosporidium détectés étaient infectieux. En fait, la recherche a montré que, même parmi les oocystes récemment excrétés, de 5 % à 22 % seulement étaient infectieux (Rochelle et coll., 2001, 2012; Sifuentes et Di Giovanni, 2007). Bien que le degré d'infectiosité dont il a été fait état jusqu'à maintenant soit faible et dépende de la méthode employée, les progrès récents de la méthodologie de la culture des cellules employée pour déterminer l'infectiosité de Cryptosporidium ont donné lieu à des augmentations importantes du nombre d'oocystes infectieux (de 43 % à 74 % d'oocytes infectieux) (King et coll., 2011; Rochelle et coll., 2015).
Il a également été fait état de la faible viabilité des oocystes dans les eaux filtrées. Selon une enquête réalisée par LeChevallier et coll. (1991b), dans les eaux filtrées, 21 oocystes sur 23 ont une morphologie « de type non viable » (c. à d. absence de sporozoïtes et déformation ou rétrécissement du cytoplasme). Dans une étude plus récente portant sur 14 usines de production d'eau potable, aucun oocyste infectieux n'a été découvert dans les quelque 350 000 L d'eau potable traitée qui a été filtrée (Rochelle et coll., 2012).
5.2.3 Exposition
Le contact direct avec des animaux d'élevage et le contact indirect avec des eaux contaminées par des fèces sont des voies importantes de transmission de Cryptosporidium (Fayer et coll., 2000; Robertson et coll., 2002; Stantic-Pavlinic et coll., 2003; Roy et coll., 2004; Hunter et Thompson, 2005). Les bovins sont une source importante de C. parvum dans les eaux de surface. Par exemple, un examen hebdomadaire d'échantillons d'eau d'un ruisseau, qui ont été prélevés durant une période de 10 mois en amont et en aval d'une exploitation bovine en Colombie-Britannique, a révélé que les concentrations d'oocystes étaient nettement plus élevées en aval du ruisseau (moyenne géométrique de 13,3 oocystes/100 l, fourchette de 1,4 à 300 oocystes/100 L) qu'en amont (moyenne géométrique de 5,6/100 L, fourchette de 0,5 à 34,4 oocystes/100 L) (Ong et coll.1996). Un pic important des concentrations d'oocystes a été observé dans les échantillons prélevés en aval du ruisseau après la mise bas à la fin de février. Durant une éclosion confirmée de cryptosporidiose d'origine hydrique survenue en Colombie-Britannique, des oocystes ont été détectés dans 70 % des échantillons de fèces de bovins prélevés dans le bassin versant, près de la prise d'eau du réservoir (Ong et coll.1997). Les humains peuvent aussi être une source importante de Cryptosporidium dans les eaux de surface. Une étude menée en Australie a montré que les eaux de surface dans lesquelles des activités récréatives ont lieu comptaient beaucoup plus de Cryptosporidium que celles où il n'y a pas d'activités récréatives (Loganthan et coll., 2012).
La sauvagine peut également être une source de Cryptosporidium. Graczyk et coll. (1998) ont montré que les oocystes de Cryptosporidium restent infectieux pour les souris après avoir utilisé le canard comme premier hôte. Cependant, un examen histologique des appareils respiratoire et digestif des oiseaux, qui a été réalisé sept jours après l'inoculation, a montré que les protozoaires étaient incapables d'infecter les oiseaux. Dans une étude antérieure (Graczyk et coll., 1996), les auteurs ont constaté que les fèces de Bernaches du Canada migratrices recueillies à sept des neuf sites étudiés dans la baie de Chesapeake contenaient des oocystes de Cryptosporidium. Les oocystes de trois de ces sites se sont révélés infectieux pour les souris. D'après ces études et d'autres (Graczyk et coll., 2008; Quah et coll., 2011), il semble que la sauvagine transporte des oocytes de Cryptosporidium infectieux de son habitat vers d'autres endroits, y compris les sources d'approvisionnement en eau potable.
5.2.4 Maladies d'origine hydrique
Cryptosporidium est un des pathogènes entériques les plus souvent signalés en Amérique du Nord et partout dans le monde. La cryptosporidiose est devenue une maladie à déclaration obligatoire au Canada en 2000. Entre 2000 et 2012, à l'exception de 2001, le nombre de cas déclarés a été relativement constant, oscillant entre 588 cas (en 2002) et 875 cas (en 2007) (ASPC, 2015). Par suite d'une éclosion d'origine hydrique à North Battleford (en Saskatchewan), le nombre de cas signalés en 2001 s'est établi à plus de deux fois le nombre de 2007 (1 763). Pour la population canadienne, cela correspond à un taux d'incidence de 1,82 à 2,69 cas par 100 000 personnes par an, à l'exception de 2001, année où le taux d'incidence a été de 7,46 cas par 100 000 personnes (ASPC, 2015). Comme pour Giardia, la maladie causée par Cryptosporidium est à la fois sous-déclarée et sous-diagnostiquée. Thomas et coll. (2013) ont estimé que le nombre de cas au pays est 48 fois plus grand à peu près que le nombre déclaré à l'échelle nationale; l'ASPC (2015) indique cependant que la cryptosporidiose ne représentait qu'environ 4 % des cas de maladie causés par l'eau et les aliments en 2013.
Cryptosporidium parvum et C. hominis sont les principales espèces auxquelles la cryptosporidiose est imputable chez les humains, bien que C. hominis semble être plus répandu en Amérique du Nord et du Sud, en Australie et en Afrique, et C. parvum cause davantage d'infections en Europe (McLauchlin et coll., 2000; Guyot et coll., 2001; Lowery et coll., 2001b; Yagita et coll., 2001; Ryan et coll., 2003; Learmonth et coll., 2004). Des éclosions de cryptosporidiose d'origine hydrique ont été déclarées dans de nombreux pays, dont le Canada (Fayer, 2004; Joachim, 2004; Smith et coll., 2006). Entre 1974 et 2001, Cryptosporidium a été le troisième agent étiologique le plus souvent incriminé dans les éclosions de maladies infectieuses liées à l'eau potable au Canada; Cryptosporidium a été mis en cause dans 12 des 138 éclosions pour lesquelles des agents étiologiques ont été identifiés (Schuster et coll., 2005). La majorité (11/12, soit 92 %) de ces éclosions ont été associées à des systèmes publics d'approvisionnement en eau potable; certaines de ces éclosions sont présentées à l'annexe B. La contamination des sources d'eau par des eaux d'égout et le traitement inadéquat (p. ex. pas de filtration ou mauvaise filtration, utilisation exclusive du chlore) semblent être les principaux facteurs qui expliquent ces éclosions (Schuster et coll., 2005). Aucune éclosion n'a été signalée depuis 2001.
Aux États-Unis, dix éclosions ont été imputées à la présence de Cryptosporidium dans l'eau potable entre 1984 et 2000; 421 000 cas de cryptosporidiose ont été déclarés, la plupart (403 000) étaient rattachés à l'éclosion survenue à Milwaukee en 1993 (U.S. EPA, 2006a). En 2001 et en 2002, les Centers for Disease Control and Prevention (CDC) ont fait état de 17 éclosions de maladies liées à l'eau potable, dont une seulement était imputable à Cryptosporidium (CDC, 2004). Cryptosporidium, qui a causé 7 % des éclosions, a été le deuxième agent infectieux le plus souvent associé aux éclosions d'origine hydrique aux États-Unis entre 1991 et 2002 (Craun et coll., 2006). Le taux d'incidence de Cryptosporidium a été de 2,6 à 3 cas par 100 000 personnes en 2012 2013 aux États-Unis (toutes les sources, y compris l'eau potable) (Painter et coll., 2015b). Ce taux d'incidence est similaire à celui du Canada.
Dix-neuf éclosions ont été déclarées au Royaume-Uni (Craun et coll., 1998). Dans une étude sur les éclosions d'origine hydrique causées par des protozoaires partout dans le monde, Cryptosporidium était en cause dans 50,6 % des 325 éclosions signalées entre 1954 et 2002 (Karanis et coll., 2007). Les taux d'atteinte étaient généralement élevés, allant de 26 % à 40 %, et plusieurs milliers de personnes ont été touchées. Une mise à jour de cette étude faisant état de 199 éclosions attribuables à des protozoaires entre 2004 et 2010 a été publiée en 2011 (Baldursson et Karanis, 2011). La plupart (60,3 %) des éclosions dont l'agent infectieux a été identifié étaient encore imputables à Cryptosporidium. De plus, plusieurs éclosions avaient été associées à des piscines, à des piscines à vagues et à des lacs.
5.3 Effet des conditions environnementales
Les concentrations de Giardia et de Cryptosporidium dans un bassin versant sont influencées par de nombreuses conditions et de nombreux processus environnementaux, qui varient entre les bassins versants et dont les caractéristiques bien souvent sont mal connues. Cependant, certaines constatations semblent applicables à diverses sources d'eau. Lal et coll. (2013) fournissent une bonne analyse des changements environnementaux - dont les habitudes d'utilisation des terres, le climat et les déterminants sociaux et démographiques - qui peuvent, à l'échelle mondiale, avoir une incidence sur la transmission de la giardiase et de la cryptosporidiose.
De nombreuses études ont conclu que les précipitations ont une grande incidence sur la qualité microbiologique des sources d'eau, bien que les conditions exactes qui entraînent un accroissement de la charge des pathogènes varient. Une étude des éclosions de maladies liées à l'eau potable ayant utilisé les données historiques sur les éclosions (pathogènes bactériens, viraux et protozoaires) et les précipitations a été menée en Angleterre. Les auteurs ont conclu que le risque d'éclosion était lié à deux situations : de faibles niveaux de précipitations au cours des trois semaines antérieures et des précipitations excessives au cours de la semaine précédant l'éclosion (Nichols et coll., 2009). En Belgique, une étude a montré que les plus fortes concentrations de Giardia coïncidaient avec des précipitations et la fonte des neiges (Burnet et coll., 2014). La même étude a également observé que la concentration de kystes peut fluctuer, passant d'un niveau inférieur au seuil de détection à des concentrations maximales en trois jours, de sorte qu'il est important de comprendre ce qui précisément, pour un site, donne lieu à une hausse des concentrations dans les eaux de surface. Dans l'étude de Burnet et coll. (2014), des précipitations successives se sont produites au cours des trois jours entre les collectes des échantillons, augmentant le débit pluvial et transportant les eaux de ruissellement contaminées d'emplacements se trouvant en amont. Une méta-analyse examinant les effets des phénomènes météorologiques sur Giardia et Cryptosporidium dans les eaux douces de surface à l'échelle mondiale a récemment été publiée. Les chercheurs ont conclu à un lien entre les phénomènes météorologiques violents et la probabilité de détection de ces organismes (Young et coll., 2015). Dans la même analyse, on a tenté de trouver un substitut facile à surveiller qui pourrait être utilisé pour Giardia et Cryptosporidium, mais on n'a pu établir de corrélation entre d'autres variables météorologiques, comme la température, la turbidité ou le débit de l'eau.
Les modifications subies par le climat canadien jouent peut-être aussi un rôle dans la variation des concentrations de Giardia et de Cryptosporidium. Outre leurs effets possibles sur les précipitations et les crues, lesquelles influent sur la présence de Giardia et de Cryptosporidium, les changements climatiques pourraient avoir, selon des chercheurs qui étudient le lac Ontario, des incidences sur les thermoclines estivales du lac. Selon l'hypothèse qui a été formulée, l'eau des rivières qui alimentent le lac pourrait donc être poussée à une plus grande profondeur, plus près des prises d'eau des usines de production d'eau potable (Edge et coll., 2013). Pendant cette étude, c'est l'eau des rivières qui se déversent dans le lac qui renfermait le plus grand nombre de pathogènes fécaux et qui, par conséquent, pouvait entraîner une plus grande charge en pathogènes aux prises d'eau des usines de potabilisation.
5.4 Relation avec les organismes indicateurs
Les organismes indicateurs qui, selon l'approche à barrières multiples de la source au robinet, font régulièrement l'objet au Canada d'une surveillance visant à vérifier la qualité de l'eau potable sont E. coli et les coliformes totaux. La présence d'E. coli dans l'eau indique que celle ci est contaminée par des matières fécales et qu'elle présente donc un risque élevé pour la santé, peu importe si des organismes pathogènes particuliers, comme les protozoaires entériques, sont observés. Cependant, l'absence d'E. coli ne marque pas nécessairement l'absence de protozoaires entériques. Les coliformes totaux ne sont pas propres aux matières fécales et ne peuvent donc pas être utilisés pour révéler une contamination fécale (ni la présence possible de pathogènes entériques). Les coliformes totaux révèlent plutôt des problèmes généraux de qualité de l'eau. Les documents techniques des recommandations les concernant (Santé Canada, 2012b, 2012c) renferment plus de renseignements sur le rôle d'E. coli et des coliformes totaux dans la gestion de la qualité de l'eau.
5.4.1 Sources d'eau de surface
Dans plusieurs études, on a examiné le lien entre les microorganismes indicateurs et la présence ou l'absence de protozoaires entériques dans des sources d'eau de surface. En général, les études ont révélé peu de corrélation (Medema et coll., 1997; Atherholt et coll., 1998; Payment et coll.; Van Dyke et coll., 2012), sinon aucune (Rose et coll., 1988, 1991; Chauret et coll., 1995; Stevens et coll., 2001; Hörman et coll., 2004; Dorner et coll., 2007; Sunderland et coll., 2007; Edge et coll., 2013; NSE, 2013; Prystajecky et coll., 2014), entre les protozoaires et les indicateurs fécaux, dont E. coli. Lorsqu'une corrélation a été établie, elle a été observée avec Giardia, et le microorganisme indicateur était présent à des concentrations très élevées. Un examen des données publiées pendant 40 ans sur les corrélations entre les indicateurs et les pathogènes a conclu à l'absence probable de corrélation entre Cryptosporidium (rapport de cotes 0,41, intervalle de confiance de 95 % 0,25-0,69) et Giardia (rapport de cotes 0,65, intervalle de confiance de 95 % 0,36-1,15) et les microorganismes indicateurs fécaux (Wu et coll., 2011). Cette absence générale de corrélation est vraisemblablement attribuable à divers facteurs, entre autres les différents taux de survie dans l'environnement, le lieu échantillonné et les différences méthodologiques de l'analyse de l'eau (Payment et Pintar, 2006). Les caractéristiques des bassins versants, notamment les sources et les degrés de contamination fécale, ainsi que des facteurs géochimiques peuvent influer sur la corrélation entre les indicateurs fécaux et les protozoaires, ce qui explique les différences propres à chaque site (Chauret et coll., 1995). Lalancette et coll. (2014) ont examiné les données relatives à E. coli et à Cryptosporidium de plusieurs études afin de déterminer, à l'aide du règlement sur le traitement amélioré à long terme des eaux de surface 2 (Long-Term 2 Enhanced Surface Water Treatment Rule) visant les petits systèmes de l'Agence des États-Unis pour la protection de l'environnement (U.S. EPA, 2006a), qui est basé sur les concentrations d'E. coli, si ces systèmes d'approvisionnement en eau devraient être classés parmi ceux qui doivent subir un traitement supplémentaire pour Cryptosporidium. Les auteurs ont conclu qu'E. coli était utile pour prévoir le risque que présente Cryptosporidium lorsque les points de déversement des égouts se trouvent à proximité étroite du bassin versant, mais que, s'ils sont plus éloignés, ou si des zones agricoles ou forestières sont la principale source de matières fécales dans les eaux, les concentrations d'E. coli sous-estiment le risque entourant Cryptosporidium (Lalancette et coll., 2014). Cette étude suppose que tous les Cryptosporidium détectés peuvent avoir des effets néfastes sur la santé humaine. Bien que ce ne soit peut-être pas le cas, l'hypothèse est appliquée, à l'heure actuelle, dans la plupart des évaluations des risques entourant Cryptosporidium.
Ces observations ont soulevé des questions importantes concernant le bien-fondé d'utiliser E. coli comme indicateur de la contamination des eaux de surface par les protozoaires et ont mis en évidence la nécessité d'exercer une surveillance régulière des protozoaires dans les eaux de surface afin de mieux comprendre le risque pour la santé publique.
5.4.2 Sources d'eau souterraine
Quelques études seulement ont signalé la présence de protozoaires entériques, plus précisément Cryptosporidium, dans les eaux souterraines (voir la section 5.2.1). Dans le contexte de la surveillance des protozoaires, ces études ont également porté sur la présence de divers microorganismes indicateurs fécaux. D'après l'analyse de Hynds et coll. (2014), les entérocoques sont le seul indicateur fécal pour lequel il existe une corrélation positive avec la présence de protozoaires entériques. Les auteurs ont tout de même conclu que les organismes indicateurs fécaux constituaient un moyen peu efficace pour déterminer la présence de protozoaires. À la recherche d'une méthode de rechange à la surveillance directe des protozoaires, les auteurs d'une étude récente menée au Nouveau-Mexique ont examiné le lien entre la présence d'indicateurs bactériens dans le puits de propriétaires fonciers et la réaction de leur immunoglobuline G (IgG) à Cryptosporidium (Tollestrup et coll., 2014). Comme dans le cas des études analysées par Hynds et coll. (2014), aucun lien n'a été découvert avec la présence d'indicateurs dans les puits, mais la réponse IgG a été reliée à la présence d'une fosse septique sur les lieux. Les limites de cette étude viennent de ce que l'eau des puits a été analysée une seule fois et qu'il est donc possible que la contamination soit passée inaperçue (Tollestrup et coll., 2014).
Dans l'ensemble, selon les études qui ont été effectuées, la présence ou l'absence de microorganismes indicateurs fécaux dans une source d'eau souterraine ne permet pas de prévoir avec exactitude la contamination par des protozoaires entériques.
5.4.3 Eau potable traitée
En règle générale, la surveillance des microorganismes indicateurs dans l'eau potable traitée a pour but de vérifier l'efficacité du traitement. Il n'y a pas de corrélation entre les microorganismes indicateurs fécaux couramment utilisés (p. ex. E. coli, coliformes totaux, entérocoques) et la présence de Giardia ou de Cryptosporidium dans les sources d'eau, de sorte qu'ils ne peuvent pas servir à indiquer la présence de ces protozoaires dans l'eau potable traitée. Les microorganismes indicateurs fécaux ne peuvent pas non plus être utilisés pour déterminer l'efficacité du traitement contre les protozoaires entériques. Les protozoaires entériques ont des taux d'élimination par des procédés mécaniques différents et sont plus résistants à de nombreux désinfectants couramment employés dans l'industrie de l'eau potable. À titre de preuve, des kystes de Giardia et des oocystes de Cryptosporidium ont été détectés dans l'eau potable traitée et filtrée qui satisfaisait aux normes réglementaires et ont été reliés à des éclosions de maladies d'origine hydrique (LeChevallier et coll., 1991b; Craun et coll., 1997; Marshall et coll., 1997; Rose et coll., 1997; Nwachuku et coll., 2002; Aboytes et coll., 2004).
Par conséquent, pour limiter les risques que représentent les protozoaires entériques, une approche à barrières multiples de la source au robinet est nécessaire. Quand chacun des procédés de traitement du système fonctionne correctement, E. coli et les coliformes totaux sont susceptibles de constituer un élément important du processus de vérification. Ces indicateurs bactériologiques, lorsqu'ils sont utilisés parallèlement aux renseignements sur l'efficacité du traitement (voir la section 7), confirment que l'eau a été convenablement traitée et qu'elle est, par conséquent, d'une qualité microbiologique acceptable.
6.0 Méthodes d'analyse
La méthode la plus reconnue et la plus utilisée pour détecter la présence de Cryptosporidium et de Giardia dans l'eau est la méthode 1623/1623.1 de l'U.S. EPA, parce qu'elle permet de détecter ces protozoaires simultanément et elle a été validée pour l'analyse des eaux de surface (U.S. EPA, 2005, 2006a). D'autres méthodes normalisées ont été publiées (ISO, 2006; APHA et coll., 2012). Il est important de remarquer que la méthode 1623/1623.1 ne donne pas de renseignements sur la viabilité ou l'infectiosité des organismes. Il existe d'autres méthodes permettant de détecter la présence de Cryptosporidium et de Giardia dans l'eau, mais la plupart présentent des taux de récupération plus faibles et des variations plus prononcées que ceux de la méthode 1623 de l'U.S. EPA (Quintero-Betancourt et coll., 2002). La plupart des méthodes employées pour la détection de Giardia et de Cryptosporidium dans l'eau, y compris la méthode 1623/1623.1 de l'U.S. EPA, comprennent quatre étapes : 1) le prélèvement de l'échantillon; 2) la filtration de l'échantillon et l'élution; 3) la concentration et la séparation (purification) de l'échantillon; 4) l'identification des kystes et des oocytes. Ces étapes sont décrites dans les sections suivantes, qui traitent également de certaines méthodes de détection nouvelles, comme aussi des méthodes pour évaluer la viabilité et l'infectiosité des kystes et des oocytes et pour déterminer s'il s'agit d'espèces qui infectent les humains.
6.1 Prélèvement de l'échantillon
Les échantillons d'eau peuvent être prélevés en vrac ou filtrés sur le terrain, puis placés sur de la glace pour être envoyés à un laboratoire afin d'y être traités le plus rapidement possible (idéalement dans les 24 heures). Le volume d'eau recueilli dépend de la quantité prévue de kystes et d'oocystes dans l'eau (c.-à-d. propre à un site); plus la densité prévue des kystes ou des oocystes est faible, plus le volume des échantillons doit être grand. Dans la plupart des cas, entre 10 l et 1 000 l d'eau sont prélevés. Lorsqu'il s'agit d'analyser l'eau brute, les échantillons sont le plus souvent prélevés en profondeur et à proximité de la prise d'eau potable afin que l'échantillon obtenu soit représentatif de la source d'eau.
6.2 Filtration de l'échantillon et élution
Au Canada, les kystes et les oocystes sont généralement présents en petit nombre dans l'eau contaminée par des matières fécales. Par conséquent, il est nécessaire de filtrer les échantillons d'eau en vrac pour concentrer les pathogènes jusqu'à ce qu'ils atteignent un volume où ils deviennent détectables. L'eau traverse généralement un filtre à l'aide d'une pompe. Le filtre permet de retenir les kystes et les oocystes ainsi que les particules étrangères. La filtration peut être réalisée à l'aide de divers types de filtres, notamment de filtres en bobine, de filtres à membrane, de filtres à fibres creuses et de filtres de mousse comprimée. Ces filtres varient selon le volume d'eau qu'ils peuvent traiter, leur vitesse de filtration, leur utilité pratique, leur compatibilité avec les étapes de traitement subséquentes, leur coût et leur capacité de rétention. Ces différences expliquent les grands écarts entre les taux de récupération mentionnés dans la littérature (Sartory et coll., 1998; DiGiorgio et coll., 2002; Quintero-Betancourt et coll., 2003; Ferguson et coll., 2004). Certains filtres ont été validés par la méthode 1623/1623.1 de l'U.S. EPA (U.S. EPA, 2005a, 2012). Une fois la filtration terminée, on ajoute des solutions d'élution pour libérer les kystes et les oocystes retenus par le filtre afin d'obtenir un éluat.
6.3 Concentration et séparation de l'échantillon
La centrifugation associée à la séparation immunomagnétique (SIM) est la méthode la plus souvent utilisée pour la concentration et la séparation des échantillons. Premièrement, pour concentrer l'échantillon, l'éluat est centrifugé, ce qui entraîne la formation d'un culot. Ce culot est remis en suspension dans une petite quantité de solution tampon pour produire un concentré. La SIM est utilisée pour séparer les kystes et les oocytes des autres contaminants de l'échantillon. Le concentré est mélangé à des anticorps monoclonaux anti-Cryptosporidium et anti-Giardia reliés à des particules magnétiques, aussi appelées billes immunomagnétiques. Celles ci se lient de manière sélective aux kystes et aux oocystes. Un champ magnétique qui sépare les complexes billes-kystes et billes-oocystes des particules étrangères est ensuite appliqué. Ces particules sont retirées, les complexes billes-kystes et billes-oocystes sont dissociés et les billes sont extraites et on obtient une suspension concentrée de kystes et d'oocystes. Plusieurs études ont évalué la capacité de récupération de la SIM employée seule. Selon Fricker et Clancy (1998), il est possible de récupérer à plus de 90 % les kystes et les oocytes ajoutés à des eaux dont la turbidité est faible. Par comparaison, le taux moyen de récupération des kystes et des oocystes présents dans des eaux turbides varient, respectivement, de 55,9 % à 83,1 %, et de 61,1 % à 89,6 % (McCuin et coll., 2001). D'autres auteurs ont fait état de taux de récupération semblables (Moss et Arrowood, 2001; Rimhanen-Finne et coll., 2001, 2002; Sturbaum et coll., 2002; Ward et coll., 2002; Chesnot et Schwartzbrod, 2004; Greinert et coll., 2004; Hu et coll., 2004; Ochiai et coll., 2005; Ryan et coll., 2005b). Les changements du pH (par rapport au pH optimal de 7) peuvent nuire à la SIM (Kuhn et coll., 2002). Bien que la SIM aide à réduire le nombre de faux positifs en diminuant la quantité de débris sur les lames préparées pour analyse microbiologique, elle est relativement coûteuse. C'est toutefois la seule méthode de séparation des échantillons qui fasse partie de la méthode 1623/1623.1 de l'U.S. EPA.
6.4 Identification des kystes et des oocytes
Une fois que les échantillons ont été concentrés et que les kystes et les oocystes ont été séparés des matières étrangères, il est possible d'avoir recours à un certain nombre de techniques de détection. La méthode plus souvent utilisée est l'épreuve d'immunofluorescence (IFA). D'autres méthodes de détection, comme la cytométrie en flux et diverses techniques moléculaires, sont de plus en plus utilisées dans le milieu de la recherche, mais ne font pas encore partie de méthodes normalisées.
6.4.1 Épreuve d'immunofluorescence
Après la concentration et la séparation de l'échantillon, une partie de la suspension de kystes et d'oocystes est transférée sur une lame pour coloration et examen. Pour colorer les échantillons, des anticorps marqués par fluorescence et dirigés contre des antigènes spécifiques présents à la surface des kystes et des oocystes sont appliqués sur la lame en vue d'être incubés. Un microscope à immunofluorescence directe est ensuite utilisé pour trouver les corps fluorescents qui pourraient être des kystes ou des oocystes. Ce procédé, appelé IFA, requiert du matériel spécialisé et une solide expertise. Il peut être hautement sensible. Cependant, parce que la taille et les caractéristiques de coloration de certaines algues naturellement fluorescentes ressemblent beaucoup à celles des kystes et des oocytes, l'identification définitive de ceux-ci exige une autre coloration - au DAPI - et un autre examen au microscope. Le DAPI se liant à l'acide désoxyribonucléique (ADN), il met en évidence les noyaux des kystes et des oocystes et facilite leur identification. On se sert aussi du microscope à CID pour examiner les caractéristiques des structures morphologiques internes et externes des kystes et des oocytes présumés afin de découvrir les structures atypiques. Le DAPI et le CID font partie de méthodes normalisées d'identification des kystes et des oocytes (ISO, 2006; APHA et coll., 2012; U.S. EPA, 2012).
6.4.2 Cytométrie en flux
La cytométrie en flux est une autre technique qui peut être utilisée pour détecter les kystes et les oocystes après l'étape de la concentration. Grâce à la cytométrie en flux, il est possible de trier, de dénombrer et d'examiner les particules microscopiques en suspension dans un liquide en fonction de la diffusion de la lumière. Le tri de cellules marquées par fluorescence (fluorescently activated cell sorting, ou FACS) est une technique de cytométrie en flux qui sert à dénombrer et à séparer les kystes de Giardia et les oocystes de Cryptosporidium des autres particules de fond. Des anticorps immunofluorescents sont généralement introduits dans la suspension de kystes et d'oocystes, puis celle-ci traverse le faisceau lumineux du cytomètre de flux. Lorsque les particules traversent le faisceau lumineux, leur fluorescence est mesurée, et elles sont alors triées et versées dans deux tubes ou plus.
La technique FACS s'est révélée très sensible et très spécifique (Vesey et coll., 1997; Bennett et coll., 1999; Reynolds et coll., 1999; Delaunay et coll., 2000; Lindquist et coll., 2001; Kato et Bowman, 2002; Lepesteur et coll., 2003; Hsu et coll., 2005; Keserue et coll., 2011). Elle a l'avantage d'être rapide et de permettre un criblage à haut débit. Cependant, les cytomètres en flux sont dispendieux, et leur fonctionnement requiert une formation poussée de l'utilisateur. De plus, comme c'est le cas de la technique d'immunofluorescence, les résultats de la technique FACS peuvent être influencés de façon négative par la présence d'algues naturellement fluorescentes et la réactivité croisée des anticorps avec d'autres organismes et particules. Pour de nombreuses méthodes FACS, il faut aussi procéder à un examen au microscope pour confirmer la présence de kystes et d'oocystes; cette étape ne sera peut-être toutefois pas nécessaire pour certaines méthodes en cours d'élaboration (Ferrari et Veal, 2003; Keserue et coll., 2011). Bien que la technique FACS semble prometteuse, elle est toujours en phase de développement et n'est pas utilisée pour les analyses régulières.
6.4.3 Méthodes moléculaires
Plusieurs méthodes moléculaires sont aussi utilisées pour détecter les kystes de Giardia et les oocystes de Cryptosporidium. Une brève description de certaines est présentée ci après. Il importe de remarquer que les méthodes moléculaires ne font pas encore partie de méthodes normalisées de détection de la présence de Cryptosporidium et de Giardia dans l'eau.
6.4.3.1 Réaction en chaîne de la polymérase
La réaction en chaîne de la polymérase (polymerase chain reaction ou PCR) est la méthode moléculaire la plus souvent utilisée pour détecter les kystes et les oocystes. Elle consiste à lyser les kystes et les oocystes afin de libérer leur ADN, puis à introduire des amorces ciblant des régions codantes précises (p. ex. acide ribonucléique ribosomique [ARNr] 18S) de Giardia ou de Cryptosporidium et à amplifier ces régions. Les régions codantes ciblées peuvent être spécifiques à un genre (p. ex. acide ribonucléique ribosomique [ARNr] 18S) ou spécifiques à une espèce ou à un nombre limité d'espèces (p. ex. hsp70, gp60). L'électrophorèse en gel d'agarose, la coloration au bromure d'éthidium et l'examen visuel à la lumière ultraviolette servent à déterminer l'existence d'un signal PRC positif. La technique PCR peut être très sensible (c. à d du niveau d'un seul kyste ou oocyte par éprouvette de réaction) et très spécifique (Deng et coll., 1997, 2000; Bukhari et coll., 1998; Di Giovanni et coll., 1999; Kostrzynska et coll., 1999; Rochelle et coll., 1999; Hallier-Soulier et Guillot, 2000; Hsu et Huang, 2001; McCuin et coll., 2001; Moss et Arrowood, 2001; Rimhanen-Finne et coll., 2001, 2002; Sturbaum et coll., 2002; Ward et coll., 2002), et elle est aussi susceptible d'être automatisée.
La méthode classique de réaction en chaîne de la polymérase décrite ci dessus renseigne sur la présence ou l'absence de l'ADN ciblé dans l'échantillon analysé. Elle peut toutefois être combinée à d'autres techniques, comme le polymorphisme de taille des fragments de restriction (PTFR) ou le séquençage de l'ADN, pour différencier les génotypes et les espèces de Giardia et de Cryptosporidium (Morgan et coll., 1997; Widmer, 1998; Lowery et coll., 2000, 2001a,b; Xiao et coll., 2001; Ruecker et coll., 2012; Prystajecky et coll., 2014), ou de techniques telles que la culture cellulaire (Jenkins et coll., 2003; Keegan et coll., 2003; LeChevallier et coll., 2003), pour déterminer la viabilité et l'infectiosité des kystes et des oocystes (voir la section 6.6).
Des variations de la méthode classique ont été élaborées et sont utilisées pour la détection des pathogènes, la plus fréquemment utilisée étant la PCR quantitative (QPCR, aussi appelée PRC en temps réel). La QPCR est une technique de PCR modifiée utilisant des sondes oligonucléotidiques et des colorants qui rendent l'organisme fluorescent lorsqu'ils sont liés à un ADN à double brin. La région cible dans les kystes ou les oocystes étant amplifiée, la fluorescence est mesurée en temps réel, ce qui permet de quantifier les produits de la PCR. Cette méthode comporte plusieurs avantages par rapport à la PCR classique, dont l'élimination de l'analyse postérieure à la PCR, une plus grande capacité de criblage, la diminution de la probabilité de contamination (c. à d. système de tubes fermés), et la capacité de quantifier les kystes et les oocystes à l'aide d'une courbe d'étalonnage (MacDonald et coll., 2002; Fontaine et Guillot, 2003; Bertrand et coll., 2004), bien qu'en pratique, la quantification des oocystes ne soit pas toujours possible. La recherche a montré que la QPCR ne pouvait faire la distinction entre les signaux pour 1, 2, 5 et 10 oocystes (Staggs et coll., 2013). En règle générale, la densité des oocystes doit augmenter de dix fois pour que les différences de concentration soient détectables (Di Giovanni et LeChevallier, 2005; Staggs et coll., 2013). L'utilisation de la QPCR a d'autres avantages uniques, dont sa capacité de différencier les espèces de Giardia et de Cryptosporidium (par l'analyse de la courbe de fusion) (Limor et coll., 2002; Ramirez et Sreevatsan, 2006) et la détection simultanée de différents microorganismes (c. à d. le multiplexage) (Guy et coll., 2003). Cette technique comporte plusieurs avantages par rapport à la PCR classique et à l'IFA, et elle s'est révélée utile pour l'identification et le dénombrement des kystes et des oocystes.
La PCR numérique à bouclettes est une nouvelle technique qui offre certains des avantages qu'offre la QPCR (p. ex. résultats en temps réel, multiplexage) et surmonte certains de ses inconvénients, comme la nécessité de générer une courbe d'étalonnage pour la quantification (Gutiérrez-Aguirre et coll., 2015; Cao et coll., 2015). Cette technique est utilisée dans un cadre clinique, mais elle n'est que depuis peu appliquée à des échantillons environnementaux. Comme la QPCR, elle exige un analyseur relativement coûteux. La transcription inverse-PCR (RT PCR, ou RT qPCR) cible l'ARN plutôt que l'ADN et peut être utilisée pour différencier les kystes et les oocystes viables et non viables. D'autres renseignements sont fournis à ce sujet à la section 6.6.3.
Bien que les méthodes de PCR aient de nombreux avantages, elles ont aussi plusieurs inconvénients. L'inhibition de la PCR par les cations divalents ainsi que les acides humiques et fulviques constitue un problème important (Sluter et coll.1997). Afin d'éliminer ces inhibiteurs, les échantillons doivent passer par plusieurs étapes de purification. En plus de l'inhibition de la PCR, la lyse inefficace des kystes et des oocystes est souvent problématique. Malgré ces problèmes, on a mis au point de nombreuses épreuves PCR pour détecter les kystes et les oocystes d'origine hydrique (Stinear et coll., 1996; Kaucner et Stinear, 1998; Griffin et coll., 1999; Lowery et coll., 2000; Gobet et Toze, 2001; Karasudani et coll., 2001; Ong et coll., 2002; Sturbaum et coll., 2002; Ward et coll., 2002).
6.4.3.2 Autres méthodes moléculaires
Parmi les autres méthodes moléculaires qui sont employées pour la détection des kystes et des oocystes, il y a l'hybridation in situ en fluorescence (fluorescence in situ hybridization ou FISH), les microréseaux et l'amplification isotherme induite par boucle. Ces méthodes ne sont pas régulièrement utilisées, mais elles l'ont été avec plus ou moins de succès dans des laboratoires de recherche. D'autres travaux seraient nécessaires pour les valider et les normaliser afin qu'elles soient utilisées en dehors de ces laboratoires.
6.5 Taux de récupération
Une partie intégrante du processus de détection de Giardia et de Cryptosporidium consiste à déterminer les taux de récupération. Comme cela a été dit précédemment, les procédés de concentration et de séparation peuvent entraîner des pertes importantes de kystes et d'oocystes. De plus, les caractéristiques de l'eau (p. ex. la présence d'algues et de solides en suspension) peuvent avoir une incidence importante sur le taux de récupération. Jaidi et coll. (2009) ont fait état d'un taux de récupération moyen de Cryptosporidium de 40 % et d'un taux moyen de récupération moyen de Giardia de 69 % par la méthode 1623 de l'U.S. EPA, mais ce taux varie selon les études (U.S. EPA, 2001; Quintero-Betancourt et coll., 2003). La concentration des kystes et des oocystes dans un échantillon d'eau est donc presque toujours plus élevée que la densité mesurée. Ongerth (2013b) a montré que corriger du taux de récupération les mesures de la densité des kystes et des oocystes multiplie par 2 à 10 fois leur concentration, selon le taux de récupération. Il a de plus été montré que la méthode utilisée pour intégrer les données de la récupération fausse l'estimation de la concentration (Schmidt et coll., 2013). Il faut par conséquent inclure le taux de récupération pour obtenir de meilleures estimations de la concentration des kystes et des oocystes et consigner la méthode utilisée pour ce faire.
Le taux de récupération est généralement mesuré par l'ajout (c. à d. l'ensemencement) d'un nombre connu de kystes et d'oocystes dans un échantillon d'eau avant que celui-ci ne soit analysé. Idéalement, le taux de récupération devrait être déterminé pour chaque échantillon; cependant, étant donné les coûts élevés afférents, on recueille habituellement des données sur l'efficacité de récupération pour un sous-ensemble d'échantillons. Cette méthode pourrait devenir plus rentable et être utilisée de manière plus systématique grâce à l'introduction de préparations commerciales contenant un nombre confirmé de kystes et d'oocystes. Plusieurs études ont aussi évalué le taux de récupération obtenu par la méthode 1623 de l'U.S. EPA à l'aide de différents types de filtres (McCuin et Clancy, 2003; Ferguson et coll., 2004; Hu et coll., 2004; Wohlsen et coll., 2004; Karim et coll., 2010). Les taux de récupération variaient beaucoup et étaient corrélés avec les variations de la qualité de l'eau brute, ce qui montre bien l'importance d'un contrôle interne avec chacun des échantillons d'eau.
6.6 Évaluation de la viabilité et de l'infectiosité
Un gros inconvénient des méthodes couramment employées à l'heure actuelle pour détecter la présence de Giardia et de Cryptosporidium est qu'elles offrent très peu d'informations sur la viabilité des kystes et des oocystes, ou sur leur infectiosité pour l'être humain, ce qui est essentiel pour déterminer leur importance pour la santé publique.
Il est possible d'évaluer la viabilité des kystes et des oocystes à l'aide de méthodes in vitro comme le dékystement, l'inclusion/exclusion de colorants fluorogéniques (c. à d. la coloration), RT PCR et FISH. Bien que ces méthodes puissent donner des renseignements sur la viabilité, elles ne disent pas si ces kystes et oocystes appartiennent à des espèces ou à des types pouvant infecter les humains.
Pour évaluer l'infectiosité, il est possible d'employer des méthodes comme le polymorphisme de taille des fragments de restriction (PTFR) ou le séquençage de l'ADN, qui permettent de déterminer si les échantillons renferment des génotypes pouvant être infectieux pour l'humain. Ces méthodes ne renseignent toutefois pas sur la viabilité des microorganismes.
La culture cellulaire, par contre, est une méthode in vitro qui peut évaluer à la fois la viabilité et l'infectiosité. Les épreuves d'infectiosité sur les animaux sont des méthodes in vivo qui évaluent aussi la viabilité et l'infectiosité. Malheureusement, la culture cellulaire et les épreuves d'infectiosité sur les animaux sont coûteuses parce qu'il faut avoir du personnel qualifié et conserver des lignées cellulaires et des animaux; elles ne sont par conséquent pas en général appliquées à l'évaluation régulière des kystes et des oocystes.
Les méthodes existant actuellement pour l'évaluation de la viabilité ou de l'infectiosité sont présentées brièvement dans les sections qui suivent.
6.6.1 Dékystement
On peut estimer la viabilité (mais non l'infectiosité) des kystes et des oocystes en les soumettant à des conditions semblables à celles qui existent dans l'intestin afin de stimuler le dékystement (c. à d. la libération des trophozoïtes et des sporozoïtes). Les divers facteurs et les conditions de dékystement varient considérablement et peuvent être à l'origine d'observations divergentes. Si les kystes et les oocystes parviennent à la phase de dékystement, ils sont considérés comme viables. Il est possible de dékyster Giardia en utilisant de l'acide et des enzymes telles que la trypsine, puis de cultiver ce protozoaire dans un milieu TYI-S-33 (Diamond et coll.1978; Rice et Schaefer 1981), mais le taux de dékystement est souvent faible. Il est aussi possible de dékyster des oocystes de Cryptosporidium parvum (Black et coll., 1996; Hijjawi, 2010); il a toutefois été établi que les méthodes de dékystement sont des indicateurs relativement médiocres de la viabilité des oocystes de Cryptosporidium. Neumann et coll. (2000b) ont constaté que des oocystes non dékystés, ayant été récupérés après l'application de méthodes de dékystement d'usage courant, demeuraient infectieux pour les souris nouveau-nées.
6.6.2 Colorants fluorogéniques
Diverses méthodes de coloration, fondées sur l'inclusion ou l'exclusion de deux colorants : le DAPI et l'iodure de propidium (IP), ont été mises au point pour évaluer la viabilité des kystes et des oocystes (Robertson et coll., 1998; Freire-Santos et coll., 2000; Neumann et coll., 2000b; Gold et coll., 2001; Iturriaga et coll., 2001). Les kystes et les oocystes peuvent être répartis en trois catégories : 1) viables (inclusion du DAPI, exclusion de l'IP); 2) non viables (inclusion du DAPI et de l'IP); et 3) quiescents ou dormants (exclusion du DAPI et de l'IP, mais pouvant être viables). En général, une bonne corrélation est observée entre le DAPI et l'IP et le dékystement in vitro (Campbell et coll.1992). Neumann et coll. (2000a) ont montré l'existence d'une forte corrélation entre l'intensité de la coloration par le DAPI et l'IP et l'infectiosité pour les animaux d'oocystes de C. parvum fraîchement isolés. Ces colorants, conjugués à des anticorps marqués par fluorescence (utilisés pour le tri de cellules par fluorescence), ont aussi été utilisés avec succès pour déterminer la viabilité et l'infectiosité des kystes et des oocystes dans des échantillons d'eau, parce que leurs spectres fluorescents ne chevauchent pas celui des anticorps (Belosevic et coll., 1997; Bukhari et coll., 2000; Neumann et coll., 2000b). En dépit de ces corrélations directes, l'inclusion et l'exclusion de colorants, comme les méthodes de dékystement, surestiment la viabilité et l'infectiosité des kystes et des oocystes (Black et coll., 1996; Jenkins et coll., 1997).
6.6.3 Réaction en chaîne de la polymérase après transcription inverse
La RT PCR peut également être appliquée à la détection directe de kystes et d'oocystes viables dans des concentrés d'eau (Kaucner et Stinear, 1998). La RT PCR amplifie une molécule cible, soit l'acide ribonucléique messager (ARNm). Puisque seuls les organismes viables produisent de l'ARNm, cette méthode expérimentale peut se révéler utile pour évaluer la viabilité des kystes et des oocystes. Par exemple, lorsqu'on compare la RT PCR à la technique d'immunofluorescence par le DAPI/IP, la fréquence de détection des kystes viables de Giardia, qui se situe à 24 % avec la technique d'immunofluorescence, passe à 69 % avec la RT-PCR. Cette dernière technique a l'avantage de pouvoir être combinée à la méthode SIM, ce qui permet de détecter les kystes et les oocystes et de déterminer simultanément leur viabilité (Hallier-Soulier et Guillot, 2000, 2003). Cette méthode peut, en outre, être quantitative, bien que la quantification puisse être difficile parce que le nombre de copies de l'ARN messager peut varier. Comme les autres méthodes fondées sur la PCR, la RT-PCR est très sensible aux inhibiteurs environnementaux et est inefficace pour l'extraction des acides nucléiques des kystes et des oocystes.
6.6.4 Hybridation in situ en fluorescence
L'hybridation in situ en fluorescence (fluorescence in situ hybridization ou FISH) s'est révélée en partie efficace pour différencier les kystes et les oocystes vivants de ceux qui étaient morts (Davies et coll., 2005; Lemos et coll., 2005; Taguchi et coll., 2006); cependant, les résultats faussement positifs sont fréquents (Smith et coll., 2004). Puisque l'ARNr 18S est abondant dans les kystes et les oocystes viables, mais que sa présence est moins fréquente dans les kystes et les oocystes non viables, il est utile pour l'évaluation de la viabilité. Comme la méthode de coloration par le DAPI et l'IP, la technique FISH ne peut évaluer l'infectiosité des kystes et des oocystes.
6.6.5 Méthodes de génotypage
Les méthodes de génotypage, comme l'analyse du polymorphisme de taille des fragments de restriction et le séquençage de l'ADN, ont beaucoup été utilisées au cours des dernières années pour déterminer quelles espèces de Giardia et de Cryptosporidium sont présentes dans les échantillons d'eau positifs et savoir s'il s'agit de génotypes infectieux pour les humains. Les méthodes de génotypage peuvent être appliquées directement aux lames d'une IFA. L'ADN des puits positifs est extrait et la QPCR nichée est utilisée pour amplifier une cible d'ADN donnée, ce qui permet d'identifier le microorganisme jusqu'au niveau de l'espèce (et parfois, de la souche). Plusieurs cibles d'ADN ont été utilisées pour l'amplification. D'habitude, la petite sous-unité de l'ARNr est utilisée pour les méthodes de génotypage parce qu'il y en a de multiples copies et qu'elle fournit des segments uniques et conservés qui peuvent être utilisés pour les outils d'identification. D'autres cibles ont cependant aussi été utilisées. Pour Giardia, le génotypage a été effectué à l'aide du gène 5.8S et les deux régions de l'espaceur transcrit interne voisines (Cacciò et coll., 2010) et le gêne β Giardin (Cacciò et coll., 2002). Pour Cryptosporidium, le gène RNAr 18S est souvent la cible pour l'identification de l'espèce (Ryan et coll., 2003; Loganthan et coll., 2012), mais d'autres gènes, comme hsp70, sont utilisés pour déterminer la souche. Le produit de la PCR est utilisé pour l'analyse du PTFR ou le séquençage de l'ADN afin de déterminer quels génotypes sont présents (Ruecker et coll., 2012; Xiao et coll., 2013). Les deux méthodes sont parfois utilisées, surtout s'il y a de nombreuses espèces dans le même échantillon (Ruecker et coll., 2012). Si l'amplification de l'ADN est effectuée au moyen de la QPCR, une analyse de la courbe de fusion qui aidera à identifier les espèces peut aussi être utilisée.
Il faut examiner davantage la possibilité d'avoir recours aux méthodes de génotypage pendant l'analyse régulière des kystes et des oocystes. Une grande étude multilaboratoire visant à déterminer si le génotypage peut être appliqué avec succès à des échantillons réglementaires déjà prélevés par des laboratoires en dehors d'un cadre de recherche a récemment été effectuée aux États-Unis. Les chercheurs ont constaté qu'avec de la formation, mais sans expérience antérieure du génotypage, les laboratoires parvenaient à génotyper correctement 65 % des lames, dont beaucoup contenaient un faible nombre d'oocystes (Di Giovanni et coll., 2014). Ce qui semble indiquer qu'après d'autres recherches et après validation, il serait possible d'inclure le génotypage dans une méthode normalisée.
6.6.6 Épreuves d'infectiosité sur les animaux
La méthode la plus directe pour évaluer la viabilité et l'infectiosité des kystes et des oocystes consiste à inoculer un animal susceptible et à surveiller l'élimination des kystes et des oocystes et tout autre signe histologique d'évolution de la maladie. On utilise Giardia et Cryptosporidium pour infecter des animaux de laboratoire tels que des gerbilles (pour Giardia) (Belosevic et coll., 1983) et des souris CD-1 nouveau-nées (pour Cryptosporidium) (Finch et coll., 1993). Cette méthode s'est révélée en partie efficace (Delaunay et coll., 2000; Korich et coll., 2000; Matsue et coll., 2001; Noordeen et coll., 2002; Okhuysen et coll., 2002; Rochelle et coll., 2002), mais elle n'est pas pratique, puisqu'elle est coûteuse à réaliser et que la plupart des laboratoires d'analyse ne disposent pas de colonies d'animaux. Cette méthode n'est pas non plus assez sensible pour la surveillance environnementale (c. à d. dose infectieuse médiane [DI50] élevée). Ces épreuves sont généralement réservées à la recherche, par exemple pour évaluer l'efficacité d'un procédé de désinfection, plutôt que d'être utilisées pour l'évaluation régulière de la viabilité et de l'infectiosité des kystes et des oocystes.
6.6.7 Épreuves d'infectiosité en culture cellulaire
Contrairement à Giardia, Cryptosporidium est un parasite intracellulaire qui se multiplie dans des cellules hôtes. Les oocystes ne peuvent donc pas normalement être cultivés dans un milieu exempt de cellules (Hijjawi, 2010). Les épreuves in vitro en culture cellulaire qui visent à évaluer l'infectiosité de Cryptosporidium consistent à exposer des kystes et des oocystes à des stimulus de dékystement, puis à les inoculer dans une lignée cellulaire de mammifère en culture, telles les cellules humaines d'adénocarcinome iléo-cæcal (HCT 8), afin de confirmer la croissance et le développement du parasite. Les oocystes sont habituellement inoculés dans des monocouches de cellules HCT 8. Après une incubation de 24 à 72 heures, on examine la monocouche de cellules au moyen de la technique d'immunofluorescence indirecte (Slifko et coll., 1997) ou de la PCR (Rochelle et coll., 1997) pour vérifier la présence de Cryptosporidium en phase de reproduction; Di Giovanni et coll., 1999). Une épreuve normalisée d'infectiosité en culture cellulaire a récemment été publiée (APHA et coll., 2012).
Cette méthode a été employée pour estimer l'infectiosité des oocystes dans l'eau (Di Giovanni et coll., 1999; Hijjawi et coll., 2001; Weir et coll., 2001; Rochelle et coll., 2002; Johnson et coll., 2005; Schets et coll., 2005; Coulliette et coll., 2006) et elle a donné des résultats semblables à ceux du modèle d'infectiosité pour les souris (Hijjawi et coll., 2001; Rochelle et coll., 2002; Slifko et coll., 2002). Dans d'autres études de comparaison, les épreuves en culture cellulaire, la méthode de dékystement et la méthode de coloration par le DAPI et l'IP ont fourni des pourcentages moyens de viabilité semblables (Slifko et coll., 1997).
Les épreuves en culture cellulaire offrent plusieurs avantages, y compris une grande sensibilité (c. à d. la détection d'un seul oocyste viable), l'applicabilité à l'analyse d'échantillons d'eau brute et traitée, la facilité d'exécution et la production rapide de résultats. Cette méthode permet de plus de conserver in vitro des oocystes de C. parvum et de C. hominis pendant 25 jours, ce qui facilite les études de viabilité et d'immunothérapie (Hijjawi, 2010). De plus, il est possible de combiner la culture cellulaire à d'autres méthodes, y compris la PCR, pour évaluer la viabilité et l'infectiosité avec plus de précision. La PCR à culture cellulaire intégrée (cell culture PCR, ou CC-PCR) s'est révélée utile pour évaluer la contamination des bassins versants et estimer les risques (Joachim et coll., 2003; LeChevallier et coll., 2003; Masago et coll., 2004). Associer la culture cellulaire à l'IFA (CC IFA) peut avoir sur la CC PCR et la CC RT PCR l'avantage de donner lieu à moins de faux positifs (Johnson et coll., 2012). Bien que les épreuves d'infectiosité en culture cellulaire offrent plusieurs avantages, elles présentent également certains inconvénients, notamment la nécessité de maintenir une lignée cellulaire et la faible reproductibilité entre des échantillons semblables pour procéder à des évaluations quantitatives. De plus, on ignore à l'heure actuelle si toutes les espèces de Cryptosporidium peuvent être détectées à l'aide des méthodes de culture cellulaire existant actuellement; il est toutefois prouvé que ces méthodes peuvent détecter les principaux génotypes qui infectent les humains, soit C. parvum, C. hominis at C. meleagridis (Rochelle et coll., 2012).
7.0 Techniques de traitement
Le principal objectif du traitement est de réduire le nombre d'organismes causant des maladies et les facteurs de risque connexes pour les ramener à un niveau acceptable ou sécuritaire. Il est possible d'y parvenir grâce à un ou à plusieurs procédés de traitement qui les éliminent mécaniquement ou les rendent inactifs. Pour assurer l'élimination ou l'inactivation optimale des pathogènes microbiens, il faut comprendre l'importance relative de chacun des procédés. Certains systèmes d'approvisionnement en eau utilisent plusieurs procédés redondants, de sorte que le traitement reste adéquat même si l'un des procédés ne remplit pas pleinement sa fonction. Dans les autres réseaux, tous les procédés en place doivent bien fonctionner pour que le degré de traitement requis soit obtenu. Par exemple, Cryptosporidium est extrêmement résistant aux désinfectants à base de chlore couramment utilisés (Korich et coll., 1990; U.S. EPA, 1991, Finch et coll., 1994, 1997). Dans de nombreux systèmes de traitement de l'eau, l'élimination des oocystes ne repose par conséquent que sur des procédés d'enlèvement mécaniques classiques (c. à d. la filtration). Pour ces systèmes, l'échec du procédé de filtration, ou des procédés préalables au traitement qui sont nécessaires (c. à d. la coagulation et la floculation pour la filtration avec procédé chimique), pourrait entraîner l'éclosion d'une maladie d'origine hydrique.
L'approche à barrières multiples, y compris la protection des bassins versants ou des têtes de puits, est une méthode universellement acceptée de réduction des protozoaires entériques et des autres pathogènes d'origine hydrique dans l'eau potable (O'Connor, 2002; CCME, 2004). Il faut aussi que les opérateurs aient reçu de la formation pour assurer en tout temps le bon fonctionnement des procédés de traitement (Smeets et coll., 2009).
7.1 Traitement à l'échelle municipale
Associer les technologies d'élimination mécanique et d'inactivation est la manière la plus efficace de réduire les kystes et les oocystes dans l'eau potable. Il est essentiel d'atteindre les cibles en matière d'élimination mécanique et d'inactivation avant que l'eau ne parvienne au premier consommateur du réseau de distribution. Les procédés d'élimination mécanique, comme la technologie de filtration, se voient attribuer un crédit d'« élimination logarithmique » pour la réduction des niveaux de kystes et d'oocystes lorsqu'ils atteignent certaines limites de turbidité de l'eau à la sortie des filtres, comme l'explique la section 7.1.2. Les procédés de désinfection primaire font partie des procédés d'inactivation. Les crédits d'« inactivation logarithmique » sont calculés à l'aide des concepts de la désinfection présentés à la section 7.1.3. Les crédits d'« élimination logarithmique » et d'« inactivation logarithmique » sont additionnés et leur somme équivaut à la « réduction logarithmique » globale des kystes et des oocystes pour le procédé de traitement évalué. La désinfection secondaire sert à maintenir un résidu de désinfectant dans le réseau de distribution pour le protéger contre la revivification microbienne et servir de sentinelle pour les changements de la qualité de l'eau. Aucun crédit d'inactivation logarithmique n'est accordé pour les procédés de désinfection secondaire.
7.1.1 Degré de traitement nécessaire
Pour déterminer le degré de traitement nécessaire, il faut établir adéquatement les caractéristiques des sources d'eau. La caractérisation des sources d'eau inclut en général un certain nombre d'étapes, dont la délimitation des limites de la zone où se trouve la source d'eau, le repérage de ce qui menace la source d'eau et les risques qu'elle court, ainsi que la mesure de sa qualité microbiologique, physique, chimique et radiologique (OMS, 2011, 2012). Il est important aussi de surveiller les changements saisonniers pour que les services publics de distribution de l'eau produisent constamment de l'eau traitée de haute qualité pour l'éventail complet des conditions de l'eau brute (Valade et coll., 2009; Huck et Sozański, 2011).
Pour les sources d'eau de surface, on doit idéalement déterminer le degré de traitement nécessaire en mesurant les concentrations de Giardia et de Cryptosporidium dans des conditions normales et après le ruissellement de printemps ou les événements pluviaux-hydrologiques. Les résultats de l'échantillonnage doivent tenir compte du taux de récupération pour la méthode d'analyse et de la viabilité des pathogènes afin d'obtenir l'évaluation la plus précise de la présence de pathogènes infectieux dans les sources d'eau (Emelko et coll., 2008, 2010a; Schmidt and Emelko, 2010; Schmidt et coll., 2010, 2013). Lorsqu'il n'est pas possible d'échantillonner et d'analyser la source d'eau pour détecter Giardia et Cryptosporidium (p. ex. l'approvisionnement en eau des petites collectivités), la caractérisation des sources d'eau - y compris les paramètres de la qualité de l'eau qui peuvent renseigner sur le risque ou le niveau de contamination fécale - peut être employée pour établir le degré de traitement nécessaire. De plus amples renseignements sur la caractérisation des risques dans les petits systèmes sont donnés ailleurs (OMS, 2012). Il est possible d'avoir recours à des facteurs de sécurité ou à des traitements supplémentaires pour assurer la salubrité microbiologique de l'eau potable, en particulier si la qualité de la source d'eau est hautement variable.
Il faut évaluer les sources d'eau souterraine pour déterminer si l'approvisionnement peut être contaminé par des protozoaires pathogènes (c. à d. les ESSIDES). Les approvisionnements provenant de sources d'ESSIDES doivent être conformes aux objectifs de traitement pour les protozoaires, alors que les sources qui, selon l'évaluation, ne sont pas susceptibles d'être contaminées par des protozoaires pathogènes devraient être conformes aux conseils du document technique de la recommandation pour les virus entériques (Santé Canada, 2011a).
Comme la plupart des eaux de surface et des ESSIDES sont susceptibles d'être contaminées par des fèces, des techniques de traitement permettant d'éliminer ou d'inactiver au moins 3 log (99,9 %) de Cryptosporidium et de Giardia doivent être appliquées. Grâce à ce niveau de traitement, une concentration de 21 kystes/100 L d'eau peut être réduite à 2,1 × 10-2kystes/100 L, ce qui satisfait à l'objectif basé sur la santé de 10-6 années de vie corrigées de l'incapacité (AVCI)/personne par an, comme l'explique la section 9.0. De même, une concentration de 13 oocystes/100 L de l'eau d'une source d'eau peut être réduite à 1,3 × 10-2oocystes/100 L. Comme les concentrations de kystes et d'oocystes sont plus élevées dans de nombreuses eaux de surface au Canada (voir les sections 5.1.1 et 5.2.1), il peut être nécessaire pour atteindre les objectifs du traitement d'effectuer une élimination ou une inactivation supplémentaire.
Le procédé de traitement le plus approprié est déterminé à la suite d'une évaluation du site et d'un essai pilote ou d'une analyse convenable. Les situations météorologiques plus instables se rattachant aux changements climatiques rendront encore plus important le choix d'un procédé adéquat (Huck et Coffey, 2004).
7.1.2 Élimination mécanique
Les kystes et les oocystes peuvent être éliminés mécaniquement par diverses technologies, dont la filtration avec produits chimiques, la filtration lente sur sable, la filtration à diatomées et la filtration sur membrane ou une autre technique de filtration approuvée. La filtration sur berge est une méthode de filtration passive d'élimination des microorganismes dont l'autorité compétente en matière d'eau potable pourrait peut-être aussi envisager l'utilisation. En ce qui concerne la filtration avec produits chimiques, la filtration lente sur sable et la filtration à diatomées, il existe suffisamment d'études pilotes ou à échelle réelle qui emploient les kystes et les oocystes pour documenter les éliminations logarithmiques. En ce qui a trait à la filtration sur membrane, les études publiées font état des éliminations logarithmiques soit en utilisant le microorganisme cible ou un substitut approprié (U.S. EPA, 2005b). Pour la filtration sur berge, les éliminations logarithmiques peuvent être calculées à l'aide de Cryptosporidium ou d'un substitut de Cryptosporidium, et des paramètres hydrologiques et de la qualité de l'eau connexes (U.S. EPA, 2010). Les kystes et les oocystes étant rarement détectés dans les approvisionnements d'eau souterraine, les études publiées font état des éliminations logarithmiques à l'aide de substituts. Il n'existe toutefois pas de substitut ou de microorganisme indicateur, de série de microorganismes ou de paramètre physique (p. ex. la turbidité) universellement accepté qui pourrait servir à l'évaluation du devenir et du transport des contaminants microbiens dans les milieux souterrains (Schijven et coll., 2002; Pedley et coll., 2006; Emelko et coll., 2010b; Tufenkji et Emelko, 2011). L'U.S. EPA (2010) recommande de surveiller au moins trois ou quatre microorganismes substituts au moyen d'échantillons appariés d'eaux de surface et d'eaux souterraines pour calculer le taux d'élimination logarithmique et énumère les substituts éventuels suivants : les spores aérobies (p. ex. Bacillus subtilus), les spores anaérobies (p. ex. Clostridium perfringens), les coliformes totaux, E. coli, les entérocoques, les bactériophages, les coliphages, les diatomées, la turbidité, la numération des particules et l'analyse des particules microscopiques.
7.1.2.1 Filtration avec procédé chimique
L'objectif de la coagulation est de déstabiliser (c. à d. de neutraliser leur charge) les particules colloïdales (y compris les organismes pathogènes) afin qu'elles s'agglomèrent bien pendant la floculation et soient par la suite enlevées par clarification (sédimentation ou flottation à l'air dissous). Les appareils à contact de boues, y compris les procédés de floculation lestée de sable, combinent la coagulation, la floculation et la clarification en un seul procédé. La filtration sur milieu granulaire peaufine le travail en enlevant les autres petites particules colloïdales qui n'ont pas été éliminées pendant la clarification. Pour que la filtration soit efficace, les particules colloïdales doivent être déstabilisées pendant la coagulation; c'est pour cette raison que la filtration sur milieu granulaire est reconnue comme un procédé de traitement physico-chimique et est couramment appelée filtration avec procédé chimique. Les usines de filtration directe n'ont pas d'étape de clarification et les usines de filtration en ligne n'ont ni floculation ni clarification (AWWA, 2011a; MWH, 2012).
Énormément de recherches visant à établir le taux d'élimination logarithmique des kystes et des oocystes obtenu par la filtration avec procédé chimique ont été effectuées. Les taux d'élimination logarithmique moyens mentionnés dans les études à échelle réelle vont de >1,54 à >5,2 (médiane des moyennes = >3,02) pour Giardia et de >1,2 à >4,6 (médiane des moyennes = >2,34) pour Cryptosporidium (LeChevallier et coll., 1991c; LeChevallier et Norton, 1992; Payment et Franco, 1993; Nieminski et Ongerth, 1995; States et coll., 1997; Gammie et coll., 2000). Parce que les kystes et les oocystes sont rarement détectés dans l'eau traitée, l'efficacité du traitement dépend en bonne partie de leur concentration dans la source d'eau. Les limites de la détection analytique et les taux de récupération influencent aussi le calcul de l'élimination logarithmique. De nombreuses études pilotes de provocation dans lesquelles des microorganismes ont été ajoutés à de l'eau brute en concentrations suffisantes pour qu'ils soient détectés dans l'eau traitée ont été effectuées. Le tableau 5 résume les résultats des études pilotes publiées pour Giardia (intervalle = 1,0 à 5,5; médiane des moyennes = 3,4) et Cryptosporidium (intervalle = 0,73 à >6,6; médiane des moyennes = 3,4). Bien que la plupart des études pilotes aient évalué l'élimination de Cryptosporidium, Giardia devrait être éliminé concurremment à échelle réelle. Cependant, les concentrations de Giardia étant plus élevées dans les eaux de source que celles de Cryptosporidium, la cible du traitement contre les protozoaires est peut-être fixée par Giardia (Tfaily et coll., 2015).
Les problèmes analytiques rattachés aux limites de la détection et aux taux de récupération, ainsi que la façon de traiter les microorganismes non détectés, ont aussi une incidence sur le calcul de l'élimination logarithmique à échelle pilote (Emelko et coll., 2005; Zhou et coll., 2015). Les facteurs expérimentaux qui influencent les résultats sont la concentration de kystes et d'oocystes, et l'endroit où ils sont ensemencés (Hendricks et coll., 2005; Assavasilavasukul et coll.2008a, 2008b; Campbell et coll.2014). Par exemple, les taux d'élimination logarithmique minimums dont Assavasilavasukul et coll. (2008a, 2008b) ont fait état ont été attribués à la faible concentration utilisée pour l'ensemencement. Sur le plan opérationnel, la chimie de la coagulation est considérée comme la variable la plus importante (Ongerth et coll., 1989; Ongerth et Pecoraro, 1995; Patania et coll., 1995; Edzwald et Kelley, 1998; Coffey et coll., 1999; Emelko et coll., 1999; Dugan et coll., 2001; Harrington et coll., 2001; Huck et coll., 2001, 2002; Dai et Hozalski, 2002; Lytle et coll., 2002; Emelko, 2003; Betancourt et Rose, 2004; Hendricks et coll., 2005; O'Melia, 2006; Hijnen et Medema, 2007a; Brown et Emelko, 2009). Patania et coll. (1995) et Hendricks et coll. (2005) ont fait état de taux d'élimination logarithmique sans prétraitement chimique de l'ordre de 0,0 à 0,84 et de 0,0 à 1,10, respectivement, pour Giardia et Cryptosporidium; Huck et coll. (2001) ont fait état de taux d'élimination logarithmique des oocystes de 0 à 0,86 sans prétraitement. Plusieurs études ont signalé que l'élimination des oocystes par filtration peut beaucoup se dégrader lorsque les conditions de la coagulation ne sont pas optimales (p. ex. l'efficacité du traitement a diminué de 2,0 à 3,4 log par comparaison aux conditions optimales) (Ongerth et Pecoraro, 1995; Patania et coll., 1995; Dugan et coll., 2001; Huck et coll., 2001).
| Étude | Élimination logarithmique Giardia |
Élimination logarithmique Cryptosporidium | ||||
|---|---|---|---|---|---|---|
| Min. | Max. | Moyenne | Min. | Max. | Moyenne | |
| Nieminski et Ongerth, 1995 (usine 1) | 2,20 | 3,90 | 3,40 | 1,94 | 3,98 | 2,98 |
| Nieminski et Ongerth, 1995 (usine 2) | 2,90 | 4,00 | 3,30 | 1,31 | 3,78 | 2,97 |
| Ongerth et Pecoraro, 1995 | 2,82 | 3,70 | 3,33 | 2,52 | 3,40 | 2,90 |
| Patania et coll., 1995 | 3,4 | 5,1 | 4,2 | 2,7 | 5,9 | 4,2 |
| Edzwald et Kelley, 1998 | Non analysé | 4,2 | 5 | Note de bas de page * | ||
| Swertfeger et coll., 1999 | 2,5 | 4,7 | 3,7 | 1,6 | 4,2 | 3,1 |
| Edzwald et coll., 2000 | 4,3Note de bas de page 1 | 5,5Note de bas de page 1 | Note de bas de page * | 5,3Note de bas de page 1 | 5,5Note de bas de page 1 | Note de bas de page * |
| Dugan et coll., 2001 | Non analysé | 4,5 | 5,4 | >5,0 | ||
| Huck et coll., 2001, 2002 (usine 1) | Non analysé | 4,7 | 5,8 | 5,5 | ||
| Huck et coll., 2001, 2002 (usine 2) | 2,9 | 4,9 | 4,4 | 2,0 | 5,0 | 3,0 |
| States et coll., 2002 | Non analysé | 2,3 | >6,6 | >5,8 | ||
| Emelko et coll., 2003a | Non analysé | 4,7 | 5,8 | 5,6 | ||
| Emelko, 2003 | Non analysé | 4,7 | 5,7 | 5,1 | ||
| Emelko et Huck, 2004 | Non analysé | 4,2 | 5,7 | Note de bas de page * | ||
| Hendricks et coll., 2005 (usine 1) | 3Note de bas de page 1 | 3,5Note de bas de page 1 | 3,2 | 3Note de bas de page 1 | 3,6Note de bas de page 1 | 3,4 |
| Hendricks et coll., 2005 (usine 2) | 2,9Note de bas de page 1 | 3,9Note de bas de page 1 | 3,24 | 2,5Note de bas de page 1 | 4,2Note de bas de page 1 | 3,38 |
| Assavasilavasukul et coll., 2008a, 2008b | 1,0 | 5,4 | Note de bas de page * | 0,73 | 5,2 | Note de bas de page * |
| Brown et Emelko, 2009 | Non analysé | 3,8Note de bas de page 1 | 4,7Note de bas de page 1 | Note de bas de page * | ||
Les milieux utilisés (sable, anthracite et sable, charbon actif en grains [CAG] et sable) ont été considérés comme également efficaces (Hall et coll., 1995; Patania et coll., 1995; Swertfeger et coll., 1999; Dugan et coll., 2001; Hendricks et coll., 2005) bien que, selon Hijnen et coll. (2010), les filtres au CAG extrafins non chargés suppriment 2,7 log des C. parvum contre 1,2 log pour les filtres au CAG chargés; le taux moyen d'élimination de G. lamblia a été de 2,1 log pour les filtres au CAG non chargés et chargés. Le taux de filtration n'avait pas d'influence significative sur les résultats (Patania et coll., 1995; Edzwald et Kelley, 1998; Harrington et coll., 2001; Huck et coll., 2001).
D'après Patania et coll. (1995) et Hendricks et coll. (2005), la filtration classique est plus efficace que la filtration directe et en ligne. Plusieurs études pilotes et de référence ont montré que, pour les sources d'eau qui renferment des algues, sont naturellement colorées ou contiennent de la matière organique naturelle (MON), la flottaison à l'air dissous peut éliminer de 2 à 3 log de Giardia et de Cryptosporidium, comparativement à 1 à 2 log pour la sédimentation. Dans ces types de sources, des floculats de faible densité ont tendance à se former et ils se prêtent mieux à la flottaison qu'à la sédimentation (Plummer et coll., 1995; Edzwald et Kelley, 1998; Edzwald et coll., 1999; Edzwald et coll., 2000; Harrington et coll., 2001; Edzwald et coll., 2003; Edzwald, 2010; Gregory et Edzwald, 2011).
D'après de nombreuses études, l'eau à la sortie du filtre doit renfermer au plus 0,1 UTN pour maximiser la réduction des kystes et des oocystes (Logsdon et coll., 1981; Logsdon et coll., 1985; Nieminski et Ongerth, 1995; Patania et coll., 1995; Harrington et coll., 2001; Huck et coll., 2001; Emelko et coll., 2003a; Emelko et coll., 2005; Hendricks et coll., 2005; Campbell et coll., 2014). Cependant, une turbidité inférieure à 0,1 UTN ne signifie pas qu'il n'y a pas de kystes et d'oocystes dans l'eau traitée (Gammie et coll., 2000; Aboytes et coll., 2004).
Les périodes de maturation et de fin de vie du filtre sont également des périodes vulnérables (Logsdon et coll., 1981; Logsdon et coll., 1985; Ongerth et coll., 1989; Patania et coll., 1995; Huck et coll., 2001; Amburgey et coll., 2003; Emelko et coll., 2003a; Emelko et Huck, 2004; Amburgey et coll., 2005; Soucie et Sheen, 2007). Les filtres doivent par conséquent être soigneusement surveillés et lavés à contre-courant afin qu'il n'y ait pendant leur cycle de vie aucune période au cours de laquelle l'élimination est insuffisante. La technique de l'eau filtrée envoyée à l'égout et la prolongation de la phase de subfluidisation terminale du lavage sont des solutions pour réduire le risque pendant la période de maturation (Amburgey et coll., 2003, 2005; Soucie et Sheen, 2007). Il est recommandé de ne pas faire circuler de nouveau dans l'usine de traitement l'eau du lavage à contre-courant des filtres sans d'abord lui faire subir un traitement supplémentaire (Di Giovanni et coll., 1999; Cornwell et MacPhee, 2001).
En bref, les usines de filtration avec procédé chimique bien gérées qui sont optimisées pour l'enlèvement des particules et de la MON devraient pouvoir éliminer 3 log de kystes et d'oocystes (Hall et coll., 1995; Patania et coll., 1995; Huck et coll., 2002; Betancourt et Rose, 2004; Emelko et coll., 2005; Hijnen et Medema, 2007a). Pour que ce soit le cas, il est essentiel que les étapes de coagulation et de floculation qui précèdent soient optimisées. Des essais de floculation doivent être effectués pour optimiser le procédé de prétraitement (Hall et coll., 1995; U.S. EPA, 2004; AWWA, 2011b). Surveiller la charge de particules nettes de la surface après la coagulation peut être utile aussi lorsque la qualité de la source d'eau varie beaucoup (Conio et coll., 2002; Newcombe et Dixon, 2006; AWWA, 2011b; Kundert, 2014; McVicar et coll., 2015; Sharp, 2015).
Outre la turbidité de l'eau à la sortie des filtres, d'autres paramètres, comme la concentration d'ions métalliques dissous du coagulant dans l'eau filtrée et la stabilité de la turbidité de l'eau clarifiée sont des indicateurs des problèmes entourant le traitement et du risque accru que des kystes et des oocystes soient présents dans l'eau (Hall et coll., 1995; Hiltz, 2015). Le comptage des particules a aussi été considéré comme une mesure précise de l'efficacité du traitement, en particulier lorsque la turbidité de l'eau à la sortie des filtres est de 0,1 UTN ou moins (Jacangelo et coll., 1991; Coffey et coll., 1999; Emelko et coll., 1999; Huck et coll., 2001; Huck et coll., 2002).
7.1.2.2 Filtration lente sur sable et filtration à diatomées
Au cours de la filtration lente sur sable, de l'eau non traitée traverse en général lentement un lit de sable poreux submergé. Une croissance biologique se produit pendant l'opération dans le lit de sable et le substrat de gravier. Des bactéries et d'autres matières provenant de la source d'eau s'accumulent de plus à la surface pour former un « film biologique ». La croissance biologique dans le filtre et le film biologique contribue à l'efficacité de la filtration lente sur sable. Selon la qualité de la source d'eau, des semaines ou des mois peuvent être nécessaires pour que cette croissance biologique se produise. Il est recommandé de procéder à un essai pour vérifier que la filtration lente sur sable parviendra à traiter une source d'eau (Bellamy et coll., 1985a, 1985b; Logsdon et coll., 2002).
De nombreuses études de provocation pilotes visant à établir le taux d'élimination logarithmique des kystes et des oocystes obtenu par la filtration lente sur sable ont été effectuées. Bellamy et coll. (1985a) ont fait état d'un taux d'élimination logarithmique de 2,07 pour Giardia à l'aide d'un nouveau filtre sur sable qui n'avait pas de population microbiologique mature. Lorsque la population microbiologique du lit de sable et du substrat de gravier est devenue mature, le taux d'élimination logarithmique est passé de 3,72 à 4,22. Pyper (1985) a fait état d'un taux d'élimination logarithmique de 3,70 log pour Giardia par temps chaud; le taux d'élimination logarithmique se situait cependant entre 2,19 et 3,05 lorsque la température était inférieure à 7 ºC. Les taux d'élimination logarithmique ont diminué encore davantage, à 1,20, par temps froid (0,5 ºC), lorsque des eaux d'égout ont été ajoutées pour simuler un bris des canalisations ou un autre événement entraînant la contamination par Giardia. Schuler et coll. (1991) ont fait état d'un taux d'élimination logarithmique de Giardia de 2,77 pour un nouveau filtre pendant l'hiver et de >4 log par temps chaud, le filtre étant parvenu à maturité; le taux d'élimination logarithmique de Cryptosporidium a été de ≥4 log pour la durée de l'étude (mars 1988 à janvier 1989). Timms et coll. (1995) ont fait état d'un taux d'élimination logarithmique de Cryptosporidium de 4,52 avec un lit de 50 cm de profondeur et n'ont observé aucun effet négatif lorsque la vitesse de la filtration est passée de 0,3 m/h à 0,4 m/h. DeLoyde et coll. (2006) ont signalé des taux d'élimination logarithmique moyens des oocystes de 2,8 à >4,3 et de 2,5 à 3,3, respectivement, lorsque les vitesses étaient de 0,4 m/h et de 0,8 m/h. Les taux d'élimination moyens pour Giardia allaient de >3,6 à 0,4 m/h à >4,2 à 0,8 m/h. Selon Dullemont et coll. (2006), avec un filtre mature, à une vitesse de 0,3 m/h et à température variant entre 8,2 ºC et 18,8 ºC, le taux d'élimination logarithmique de Cryptosporidium était en moyenne de 5,3, un résultat que Hijnen et coll. (2007), utilisant une approche par bilan massique qui tenait compte du nombre de microorganismes traités, de microorganismes trouvés dans le filtra et de microorganismes dans le lit de filtration, ont ajusté ce résultat à 4,7. Il a été dit de cette approche qu'elle représentait mieux les résultats non détectés qui faisaient partie des résultats nuls dans l'étude antérieure. Hijnen et Medema (2007b) ont procédé à une recension de la littérature sur la capacité d'élimination des microbes de la filtration lente sur sable et ont conclu qu'il est possible d'atteindre des taux d'élimination logarithmique de 4,9 et de 4,8, respectivement, pour Giardia et Cryptosporidium. Fogel et coll. (1993) ont fait état de résultats à échelle réelle bien plus faibles à basse température (0,5 ºC), soit 1,2 log pour Giardia et 0,3 log pour Cryptosporidium. Les auteurs ont noté que le sable utilisé avait un quotient d'uniformité de 3,5 plutôt que la spécification initiale (entre 1,8 et 2,2). La basse température peut aussi avoir eu un effet sur l'efficacité, puisque, selon Schijven et coll. (2013), l'élimination des microorganismes par la filtration lente sur sable est très sensible aux changements de température et à l'âge du film biologique.
En bref, lorsque les dispositifs de filtration lente sur sable sont correctement conçus, construits, exploités et entretenus, ils parviennent à enlever les kystes et les oocystes des sources d'eau contaminée dans un large éventail de conditions d'utilisation. En raison de l'action biologique essentielle de la filtration lente sur sable, il est important de laisser un filtre devenir mature pendant un certain temps après l'avoir gratté et nettoyé (Collins et coll., 1991; Edzwald et coll., 1998; Heller et Ladeira Alves de Brito, 2006). D'autres précautions peuvent aussi être nécessaires pour atténuer les incidences des basses températures (Schijven et coll., 2013).
La filtration à diatomées est effectuée par un filtre sous pression employant un milieu fait de diatomées. La couche de support est d'abord recouverte d'un filtre de diatomées (c. à d. d'un gâteau de boues) et de l'eau brute combinée à un nourrissement est pompée à travers le milieu. Les facteurs qui déterminent l'efficacité sont le grade des diatomées, le taux et l'épaisseur de la précouche, le taux de nourrissement, la vitesse de filtration et les caractéristiques des particules, comme la taille, la forme, la concentration et la charge de surface, de sorte qu'il s'agit d'un procédé complexe, difficile à appliquer (Logsdon et coll., 1981; Langé et coll., 1986; Ongerth et Hutton, 1997). D'après Logsdon et coll. (1981), le taux d'élimination logarithmique de Giardia allait de 2,19 à 4,15, alors que pour Pyper (1985), il se situait à 3,52. Langé et coll. (1986) ont fait état de l'élimination complète de Giardia dans 30 des 31 essais pilotes et d'une élimination logarithmique de 3,12 dans le cas du seul résultat pour lequel les concentrations étaient détectables. Schuler et Ghosh (1990) et Schuler et coll. (1991) ont fait état de l'élimination complète de Giardia lorsque la filtration à diatomées fonctionne correctement; l'élimination de Cryptosporidium était excellente aussi (>3 log), mais l'élimination était rarement complète (dose d'alimentation = 1 200 à 3 000 oocystes/L) sauf lorsque de l'alun était utilisé avec les grades les plus fins de diatomées. Ongerth et Hutton (1997, 2001) ont fait état d'une élimination logarithmique >6 pour Cryptosporidium. La filtration à diatomées est une technologie acceptée, mais elle exige plus de travail, plus d'énergie et plus de matières que la filtration lente par sable et elle est moins facile à appliquer lorsque la qualité de l'eau varie beaucoup (Pyper, 1985).
7.1.2.3 Filtration sur membrane
Quatre types de membranes sous pression sont utilisés à l'heure actuelle pour le traitement de l'eau potable : la microfiltration (MF), l'ultrafiltration (UF), la nanofiltration (NF) et l'osmose inverse (OI). Les membranes sont en général classées selon le type de substances qu'elles enlèvent, la pression d'opération et le diamètre des pores ou le seuil de rétention des molécules. Les membranes pour la MF et l'UF sont des membranes à faible pression qui sont utilisées pour l'enlèvement des particules et des organismes pathogènes. Le principal mécanisme d'élimination est la coloration ou l'exclusion basée sur la taille. Les membranes utilisées pour la NF et l'OI sont des membranes à forte pression qui servent à l'enlèvement des matières organiques (p. ex. la MON dissoute) et inorganiques (p. ex. le sodium, le chlorure, le calcium et le magnésium). Les différences de solubilité ou de diffusivité sont le principal mécanisme d'élimination. Les grandes catégories de membranes, leurs dimensions et les substances qui sont enlevées sont analysées dans Kawamura (2000), AWWA (2005, 2011a) et MWH (2012).
Les membranes sont en général constituées de polymères; cependant, les membranes de céramique ont une application limitée (AWWA, 2005; Kommineni et coll., 2010; Huck et Sozański, 2011; MWH, 2012). Bien que les membranes de la NF et de l'OI puissent éliminer les kystes et les oocystes, elles ne sont en général pas conçues pour que l'élimination soit vérifiable (ANSI/AWWA, 2010). Kruithof et coll. (2001) ont toutefois dit avoir utilisé la conductivité et le sulfate pour surveiller l'intégrité de membranes de l'OI. Les membranes de la MF et de l'UF, qui sont conçues de telle manière que l'élimination est vérifiable, sont très couramment utilisées pour l'élimination microbienne.
Jacangelo et coll. (1991) ont fait état de taux d'élimination logarithmique de G. muris à 4,0 à 5,1 à échelle pilote pour quatre sources d'eau de qualité variable au moyen de membranes d'UF (seuil de rétention de molécules = 100 kilodaltons). Les auteurs ont noté que l'intégrité de la membrane était essentielle pour l'efficacité du procédé, puisque G. muris a été détecté dans le filtrat lorsque les membranes étaient détériorées (p. ex. fibres brisées). Jacangelo et coll. (1997) ont évalué l'élimination de G. muris et de C. parvum à échelle pilote pour trois sources d'eau de qualité variable au moyen de membranes de MF (diamètre des pores = 0,1 µm et 0,2 µm) et des membranes d'UF (seuil de rétention des molécules = 100, 300 et 500 kilodaltons). Les membranes de MF et d'UF ont toutes les deux éliminé G. muris et C. parvum jusqu'au seuil de détection, pourvu que la membrane ait été intacte. Les taux d'élimination logarithmique dont il est fait état - 6 à 7 pour G. muris et C. parvum - sont par conséquent fonction de la concentration des kystes et des oocystes ensemencés. Trimboli et coll. (2001) ont effectué un test de provocation à échelle réelle à l'aide de spores de bacilles dans une usine de MF d'une capacité de 36 millions de litres par jour. Selon les auteurs, les spores des bacilles ont été complètement rejetées et l'élimination logarithmique a été supérieure à 5,9. Mi et coll. (2005) ont effectué des tests de provocation à échelle réelle à l'aide de spores de bacilles dans deux usines utilisant la filtration sur membrane (une MF et une UF) dont l'intégrité était fragilisée. Dans l'usine de MF, cinq tests à échelle réelle ont été réalisés sur une des six grilles des membranes de MF. Le test a consisté à couper 0, 1, 3, 6 et 8 fibres, ce qui représente des ruptures de l'intégrité de 0 % à 0,0025 %. Les taux d'élimination logarithmique ont été de >6,4, 6,0, 5,3, 4,8 et 4,6, respectivement, pour 0, 1, 3, 6 et 8 fibres coupées. Dans l'usine d'UF, trois tests à échelle réelle ont été effectués sur une des 11 grilles des membranes d'UF. Le test a consisté à couper 0, 1 et 3 fibres, ce qui représentait des ruptures de l'intégrité de 0 % à 0,0009 %. Les taux d'élimination logarithmique ont été de >5,1, 4,8 et 4,5, respectivement, pour 0, 1 et 3 fibres coupées. D'autres résumés des études sur l'élimination des pathogènes se trouvent dans U.S. EPA (2001).
Le recours à des membranes à faible pression est un procédé bien établi de traitement de l'eau potable et on considère en règle générale que des membranes intactes peuvent réduire de plus de 3 log les concentrations de Giardia et de Cryptosporidium. Les ruptures de l'intégrité, cependant, peuvent réduire la capacité d'élimination d'une membrane. Il est donc essentiel de procéder régulièrement à un examen pour en vérifier l'intégrité. Guo et coll. (2010) présentent un examen complet des méthodes de surveillance de l'intégrité pour les membranes à faible pression. Bien qu'il existe de nombreuses méthodes, la vérification du taux de décroissement de pression et le test de diffusion d'écoulement d'air sont très fréquemment utilisés pour évaluer l'intégrité des membranes. Dans les deux cas, il s'agit de pressuriser un côté de la membrane et de mesurer l'écoulement de l'air par les défauts dans des conditions définies (Johnson, 1998). Si le taux de décroissement de la pression dépasse la limite fixée sur les lieux pour le système, il faut procéder à des essais diagnostics et à des réparations. Les résultats du test d'intégrité doivent aussi être convertis en une valeur d'élimination logarithmique équivalente à l'aide des méthodes décrites dans U.S. EPA (2005b) ou dans ASTM (2010). La plupart des systèmes de MF et d'UF qui existent dans le commerce peuvent vérifier le taux de décroissement de pression et calculer cette valeur.
Il convient de noter que toutes les membranes se salissent lorsqu'elles sont utilisées et que, par conséquent, le flux (débit par unité de surface) pour une différence de pression donnée peut diminuer considérablement (AWWA, 2005; MWH, 2012). Il est nécessaire pour enlever les salissures accumulées de procéder au lavage à contre-courant régulier et au nettoyage chimique périodique, réalisé à l'aide de produits spécialement formulés pour venir à bout de l'encrassement, des membranes. Lorsqu'il n'est plus possible de ramener le flux aux conditions de base, les membranes doivent être remplacées (Alspach et coll., 2014). L'importance de l'encrassement dépend d'un certain nombre de facteurs, dont le type de membrane et la répartition du diamètre des pores, la matière dont elle est faite, la quantité de substances salissantes et leur nature, le prétraitement appliqué, le régime de nettoyage utilisé pour entretenir la membrane et les conditions de fonctionnement, en particulier le flux (Huck et Sozański, 2011). Les interactions colloïdales et la présence de MON dissoute, en particulier les biopolymères, sont des causes importantes d'encrassement et de diminution de la productivité (Peldszus et coll. 2011). Par conséquent, un pré-traitement pourrait être requis (Siembida-Lösch et coll., 2014).
7.1.2.4 Filtration sur berge
La filtration sur berge (FB) consiste à installer des puits d'approvisionnement en eau verticaux ou horizontaux près d'une rivière afin d'utiliser les berges et l'aquifère adjacent comme filtre naturel pour éliminer les particules et les organismes pathogènes, les micropolluants et les autres composés organiques et inorganiques, y compris les composés biodégradables, comme la MON et l'ammoniac (Piet et Zoeteman, 1980; Bize et coll., 1981; Kuehn et Mueller, 2000; Ray et coll., 2002a, 2002b; Gollnitz et coll., 2004; Emelko et coll., 2010b; U.S. EPA, 2010). À mesure que l'eau descend vers la surface de la nappe phréatique, les concentrations de contaminant diminuent par suite de la filtration physique, des réactions géochimiques, de la biodégradation, de la prédation et de la dilution dans les eaux souterraines (Kuehn et Mueller, 2000; Ray et coll., 2002a; Gollnitz et coll., 2003; Weiss et coll., 2003; Partinoudi et Collins, 2007; Hubbs, 2010; Tufenkji et Emelko, 2011). Ray et coll. (2002a) affirment que les usines FB correctement conçues et exploitées peuvent assurer l'élimination de 4 log des Cryptosporidium.
Le procédé de FB est complexe et dépend d'un certain nombre de facteurs qui peuvent varier selon les sites. Les facteurs propres au site sont les caractéristiques, la composition et l'épaisseur des matières de l'aquifère (p. ex. la répartition de la granulométrie, les caractéristiques de la surface des grains et la teneur en oxydes métalliques), la qualité de l'eau de la rivière (p. ex. le nombre et la taille des particules et des microorganismes, la concentration de la MON, l'ammoniac, les éléments nutritifs et les autres polluants), les sédiments du lit de la rivière, la distance et la vélocité de la filtration, la température, le pH, la force ionique, la charge de surface des microbes et sédiments, la concentration en oxygène et les effets de dilution des eaux souterraines (Sontheimer, 1980; McDowell-Boyer et coll., 1986; Johnson et Logan, 1996; Gollnitz et coll., 1997; Brush et coll., 1998, 1999; Walker et coll., 1998; Harter et Wagner, 2000; Kuehn et Mueller, 2000; Shaw et coll., 2000; Tufenkji et coll., 2002; Ray et coll., 2002a; Wang et coll., 2002; Tufenkji et coll., 2004, 2006; Gollnitz et coll., 2005; Hijnen et coll., 2005; Tufenkji et Elimelech, 2005; Partinoudi et Collins, 2007; Abudalo et coll., 2010; Faulkner et coll., 2010; Harvey et coll., 2010; Kim et coll., 2010).
Schijven et coll. (2002) ont fait état de taux d'élimination logarithmique pour divers microorganismes à trois sites de FB aux Pays-Bas et ont conclu que, dans des conditions relativement homogènes et dans un état stable, dans un aquifère sableux saturé, il est possible de supprimer 8 log des virus sur une distance de 30 mètres en 25 jours à peu près et que des taux d'élimination logarithmique plus élevés peuvent être obtenus pour les bactéries, les protozoaires et les algues dans les mêmes conditions. Les auteurs ont fait remarquer que la présence de Cryptosporidium a déjà été constatée dans des puits dont l'eau était filtrée par FB (Hancock et coll., 1998; Moulton-Hancock et coll., 2000) et que la santé publique pourrait être en danger, mais qu'il n'y a pas suffisamment de données pour déterminer le risque. Wang et coll. (2002) ont procédé à une étude de démonstration d'une durée de deux ans d'un puits à drains rayonnants horizontal de 20 millions de gallons par jour (80 ML/j) qui tire son eau d'un aquifère glacial et confiné avec du sable et du gravier moyens, grossiers et très grossiers renfermant peu de fer et de manganèse. Ils ont estimé que le taux global de filtration se situait entre 0,15 et 0,37 m/j. Par suite du petit nombre de Giardia et de Cryptosporidium détectés dans l'eau de la rivière et de ce puits, il a été impossible de calculer les taux d'élimination logarithmique de ces microorganismes. Le taux d'élimination du procédé FB a donc été calculé à l'aide de substituts du transport des pathogènes. Les taux moyens ont été de >7,1, >6,7 et >3,9, respectivement, pour les algues (analyse de particules microscopiques), les diatomées et les spores aérobies. Les auteurs ont mentionné que la turbidité était constamment réduite à moins de 1,0 UTN. Gollnitz et coll. (2003, 2004) ont effectué une étude à échelle réelle d'une durée de 20 mois sur des installations de FB tirant leur eau d'un aquifère de gravier et de sable alluviaux. Ils ont estimé que le taux d'infiltration était inférieur à 0,07 m/h (1,7 m/j) la plupart du temps, sauf pendant sept épisodes de montée des eaux au cours desquels il a atteint 0,15 m/h (3,6 m/j). Comme ni Giardia ni Cryptosporidium n'ont été détectés dans les puits producteurs ou de l'écoulement de l'eau, il a été impossible de calculer leurs taux d'élimination logarithmique. Ces taux ont été calculés à l'aide de substituts; ils variaient entre 4,8 et 6,2 pour les algues et 5,0 et 4,9 pour les spores aérobies. Selon les auteurs, les salissures n'ont pas nui au procédé de FB pendant les épisodes de montée des eaux et la turbidité a constamment été ramenée à moins de 1,0 UTN. Gupta et coll. (2009) et Abbaszadegan et coll. (2011) ont également mentionné que les salissures n'avaient pas influencé l'élimination de C. parvum dans des expériences pilotes sur la FB.
Weiss et coll. (2003) ont mené une étude à échelle réelle d'une durée de deux ans sur trois sites de FB aux États-Unis. Comme pour les autres études, il n'y avait pas suffisamment de données pour calculer les taux d'élimination logarithmique de Giardia et de Cryptosporidium, et des substituts ont été utilisés. Les taux d'élimination logarithmique de Clostridium et des bactériophages étaient respectivement de >3,2 à >3,4 et de >1,9 à >3,3. Gollnitz et coll. (2005) ont mené une étude à échelle réelle de 24 mois sur un aquifère de sable et de gravier dont la conductivité hydraulique était de 76,3 m/j à 244 m/j et les distances que l'eau devait parcourir de 6,1 m approximativement à plus de 304,8 m. Comme pour les autres études sur la FB, les données insuffisantes ne permettaient pas de calculer les taux d'élimination logarithmique de Giardia et de Cryptosporidium, et des substituts ont été utilisés. Les taux d'élimination logarithmique variaient entre 3,70 et 5,50 pour les algues, 6,70 à 7,50 pour les diatomées et 1,50 à 2,10 pour les spores aérobies; les taux d'élimination logarithmique des coliformes totaux, d'E. coli et des entérocoques étaient de l'ordre de 2 log. Les auteurs ont indiqué que la turbidité était constamment réduite à moins de 0,3 UTN. Partinoudi et Collins (2007) ont surveillé quatre sites de FB à diverses fréquences pendant 8 à 20 mois. Les distances de la rivière variaient entre 19,5 m à 55 m pour les trois sites utilisant des puits verticaux et elles étaient de 12,2 m pour le site utilisant des collecteurs horizontaux (caisson). Les temps de déplacement de l'eau dans le sol ont été estimés à 0,75 à 5,5 jours pour les puits verticaux et à 1,0 jour pour le caisson. Les taux d'élimination logarithmique variaient entre ≥2,01 à ≥4,54 pour les spores aérobies, de ≥2,72 à ≥3,61 pour les coliformes totaux et de ≥1,00 à ≥1,74 pour E. coli. Les auteurs ont fait remarquer que les taux d'élimination logarithmique étaient faibles parce que les concentrations de microorganismes dans les sources d'eau l'étaient aussi et qu'ils n'ont pas été détectés dans les eaux souterraines.
En résumé, beaucoup de recherches visant à expliquer le rôle des divers facteurs physiques, chimiques et biologiques sur le transport et l'élimination des microbes dans les milieux naturels souterrains ont été effectuées; il est toutefois difficile de prédire et de quantifier ces taux d'élimination (Emelko et coll., Tufenkji, 2007). À supposer que la trajectoire de l'écoulement et le temps de transport soient suffisamment longs, la FB peut assez améliorer la qualité microbienne de l'eau pour que la santé publique soit protégée (Schijven et coll., 2002). L'élimination et la réduction des microbes doivent être évaluées site par site, compte tenu du nombre de facteurs qui influencent le procédé de FB. Les aquifères regroupés, le substratum rocheux fissuré et les aquifères de calcaire karstique et de gravier ne sont en général pas accessibles aux crédits de FB (Berger, 2002; Wang et coll., 2002; U.S. EPA, 2010; Nova Scotia Environment, 2012).
7.1.2.5 Crédits d'élimination mécanique logarithmique selon les procédés de traitement
Les usines de traitement de l'eau potable qui respectent les limites de turbidité établies dans le document technique de la recommandation sur la turbidité (Santé Canada, 2012d) peuvent appliquer les crédits d'élimination moyens de Giardia et de Cryptosporidium qui sont présentés au tableau 6. Ou encore, ces crédits peuvent être établis en fonction de l'efficacité observée ou d'études pilotes. En ce qui concerne la FB, il faudrait consulter la compétence responsable pour connaître les exigences propres au site.
Les crédits d'élimination mécanique logarithmique peuvent être combinés aux crédits de désinfection (voir la section 7.1.3) afin de répondre aux objectifs de traitement globaux. À titre d'exemple, si une élimination globale de 5 log (99,999 %) de Cryptosporidium est nécessaire dans un système de traitement donné et que la filtration classique assure une élimination de 3 log, la réduction restante de 2 log doit être obtenue à l'aide d'un autre procédé, comme la désinfection primaire.
| Procédé de traitement | Crédit d'élimination de Cryptosporidium | Crédit d'élimination de Giardia |
|---|---|---|
| Filtration classiqueNote de bas de page a | 3 logNote de bas de page b | 3 logNote de bas de page b |
| Filtration directeNote de bas de page a | 2,5 logNote de bas de page b | 2,5 logNote de bas de page b |
| Filtration lente sur sableNote de bas de page a | 3 logNote de bas de page b | 3 logNote de bas de page b |
| Filtration sur diatoméesNote de bas de page a | 3 logNote de bas de page b | 3 logNote de bas de page b |
| Microfiltration et ultrafiltrationNote de bas de page a | Démonstration et test de provocationNote de bas de page b,Note de bas de page c | Démonstration et test de provocationNote de bas de page b,Note de bas de page c |
| Nanofiltration et osmose inverseNote de bas de page a | Démonstration et test de provocationNote de bas de page b,Note de bas de page c | Démonstration et test de provocationNote de bas de page b,Note de bas de page c |
| Filtration sur berge | Propre au siteNote de bas de page d | Propre au siteNote de bas de page d |
7.1.3 Inactivation
La désinfection primaire devrait fournir les crédits de réduction logarithmique qui sont encore nécessaires pour atteindre les objectifs du traitement. La désinfection primaire est en général effectuée après les traitements qui retirent les particules et la MON. Cette stratégie contribue à assurer l'inactivation efficace des organismes pathogènes et réduit au minimum la formation de sous-produits de désinfection (SPD). Il est important de remarquer que, dans la description de la désinfection microbienne de l'eau potable, le terme « inactivation » indique que le pathogène n'est pas infectieux et ne peut se répliquer dans un hôte convenable, mais qu'il peut encore être présent.
Cinq désinfectants sont souvent utilisés pour le traitement de l'eau potable : le chlore libre, la monochloramine, l'ozone, le dioxyde de chlore et la lumière UV. À l'exception de la lumière UV, qui utilise la radiation électromagnétique, ce sont tous des agents oxydants. Les désinfectants chimiques rendent les microorganismes inactifs en détruisant ou en endommageant la structure de leurs cellules, leur métabolisme, leur biosynthèse et leur croissance, alors que la lumière UV endommage l'acide nucléique des pathogènes, ce qui empêche leur réplication et les rend par conséquent incapables d'accomplir des cycles infectieux.
Le chlore libre est le produit chimique le plus souvent utilisé pour la désinfection primaire, parce qu'il est facile de s'en procurer, qu'il est relativement peu coûteux et qu'il fournit un résidu qui peut aussi être utilisé pour la désinfection secondaire afin de maintenir la qualité de l'eau dans le réseau de distribution. Les concentrations ou les temps de contact doivent cependant être relativement élevés pour que le chlore libre rende Giardia inactif et il ne peut inactiver Cryptosporidium aux doses et aux temps de contact en général utilisés pour le traitement de l'eau (Korich et coll., 1990). Les systèmes de traitement qui utilisent le chlore libre pour la désinfection primaire doivent donc éliminer ou inactiver Cryptosporidium à l'aide d'un procédé de traitement supplémentaire (p. ex. la filtration ou un autre désinfectant, comme l'ozone ou la lumière UV). L'utilisation de la monochloramine est en général limitée à la désinfection secondaire (c. à d. l'entretien résiduel) parce que son pouvoir oxydant est faible. L'ozone et le dioxyde de chlore sont des désinfectants efficaces contre Giardia et Cryptosporidium, mais ils sont d'habitude plus coûteux et plus difficiles à appliquer, en particulier pour les petits systèmes. L'ozone se dégradant rapidement après avoir été appliqué, il ne fournit pas de résidu et ne peut être utilisé pour la désinfection secondaire. Le dioxyde de chlore n'est pas recommandé non plus pour la désinfection secondaire parce qu'il se dégrade relativement vite (Santé Canada, 2008). Clancy et coll. (1998, 2002) ont montré que la désinfection à la lumière UV est hautement efficace pour ce qui est d'inactiver Giardia et de nombreuses souches de Cryptosporidium parvum. Johnson et coll. (2005) ont confirmé que Cryptosporidium hominis ne résiste pas non plus à la désinfection par les rayons UV.
7.1.3.1 Désinfection chimique
Il est possible de prédire l'efficacité des désinfectants chimiques d'après la concentration résiduelle d'un désinfectant en particulier et les facteurs qui influencent son efficacité, surtout la température, le pH, le temps de contact et le degré de désinfection requis (AWWA, 1991). Cette relation est communément appelée « concept CT », où CT représente le produit de « C » (concentration résiduelle d'un désinfectant, en mg/L) par « T » (temps de contact avec le désinfectant, en minutes) pour un microorganisme particulier dans des conditions définies (p. ex. la température et le pH). Pour tenir compte de la dégradation du désinfectant, on détermine habituellement la concentration résiduelle à la sortie de la zone de contact plutôt que d'utiliser la dose appliquée ou la concentration initiale. Une valeur T10 qui correspond à la durée de rétention de l'eau pendant laquelle le temps de contact requis est atteint ou dépassé pour 90 % de l'eau est employée le plus souvent pour le calcul du temps de contact. On peut estimer cette valeur T10 en multipliant la durée de rétention (c. à d. le volume du réservoir divisé par le débit) par le facteur de déflexion de la chambre de contact. L'U.S. EPA (1991) fournit les facteurs de déflexion pour des exemples de chambres de contact. Un essai de traçage hydraulique peut aussi être effectué pour déterminer le temps de contact réel dans les conditions d'écoulement de l'usine. La valeur T dépend de la construction hydraulique de l'usine de traitement d'eau. Améliorer les caractéristiques hydrauliques (c. à d. augmenter le facteur de déflexion) est plus efficace qu'accroître la dose de désinfectant pour respecter les exigences relatives à CT et peut se faire par des modifications physiques, tel l'ajout de déflecteurs dans la chambre ou le bassin de contact.
Il est important de tenir compte des caractéristiques hydrauliques de la chambre de contact lorsqu'une ÉQRM est effectuée pour un site en particulier. Il existe trois stratégies pour évaluer le risque : l'exposition réglementaire à la désinfection (CT10), l'exposition médiane à la désinfection (CT50) et les réacteurs à fonctionnement continu reliés en série (N CSTR, N étant le nombre de réacteurs à fonctionnement continu [continuous stirred tank reactors] en série). L'approche N CSTR permet d'obtenir des estimations des risques plus fiables que celles d'autres approches, en particulier pour l'ozone (Smeets et coll., 2006; Tfaily et coll., 2015).
Un manuel de l'U.S. EPA (1991) présente des tableaux pour l'inactivation de Giardia et de Cryptosporidium. Certaines valeurs CT sont présentées au tableau 7 pour une inactivation de Giardia et de Cryptosporidium de 2 log (99 %) réalisée à l'aide du chlore, de la monochloramine, du dioxyde de chlore et d'ozone. Les valeurs CT confirment que le pouvoir oxydant de la monochloramine est limité, puisqu'il faut des concentrations ou des temps de contact beaucoup plus élevés pour atteindre le même degré d'inactivation de Giardia. Elle n'est donc pas recommandée comme désinfectant primaire contre les protozoaires. Les valeurs CT montrent aussi que Cryptosporidium est beaucoup plus résistant que Giardia aux désinfectants chimiques, particulièrement par temps froid (Oppenheimer et coll., 2000). En règle générale, pour Giardia et pour Cryptosporidium, le CT doit doubler ou tripler pour chaque baisse de la température de 10 °C (Hoff, 1986; U.S. EPA, 1991). Lorsque la température de l'eau avoisine 0 °C, comme c'est souvent le cas en hiver au Canada, l'efficacité de la désinfection est réduite, et il faut augmenter la concentration de désinfectant ou le temps de contact pour obtenir le même degré d'inactivation. L'efficacité de certains désinfectants varie également selon le pH. L'utilisation du chlore libre, qui fait passer le pH de 6 à 9, réduit de trois fois le taux d'inactivation de Giardia (U.S. EPA, 1991). Par contre, il a été établi que le pH a peu d'effets lorsque du dioxyde de chlore ou de l'ozone sont utilisés (U.S. EPA, 2006a).
| Temp. (°C) |
Valeurs CT | |||||||
|---|---|---|---|---|---|---|---|---|
| Chlore libre [pH 7,5, concentration résiduelle 1 mg/l] |
Monochloramine [pH 6-9] |
Dioxyde de chlore | Ozone | |||||
| GiardiaNote de bas de page a | Crypto-sporidium | GiardiaNote de bas de page a | Crypto-sporidium | GiardiaNote de bas de page a | Crypto-sporidiumb | GiardiaNote de bas de page a | Crypto-sporidiumNote de bas de page b | |
| 5 | 99 | Non effectué | 1 470 | Non effectué | 17 | 858 | 1,3 | 32 |
| 25 | 25 | 7 200Note de bas de page c | 500 | 7 200Note de bas de page c | 7,3 | 150 | 0,32 | 4,9 |
La réduction de la turbidité est un préalable important pour l'inactivation de Giardia, de Cryptosporidium et d'autres microorganismes, puisque les particules peuvent nuire à la désinfection chimique. De plus, la turbidité neutralise l'action des désinfectants et réduit l'efficacité de la désinfection chimique. Selon LeChevallier et coll. (1981), le pouvoir désinfectant du chlore libre diminue de huit fois lorsque la turbidité passe de 1 à 10 UTN. L'effet de la turbidité sur l'efficacité du traitement est étudié plus en détail dans le document technique de la recommandation sur la turbidité (Santé Canada, 2012d).
Il est important de tenir compte des conditions de fonctionnement, comme la température, le pH et la turbidité, lorsqu'on choisit un désinfectant chimique, puisqu'elles peuvent avoir une influence considérable sur l'inactivation des pathogènes; la température et le pH peuvent aussi influencer la formation de sous-produits chimiques de la désinfection.
La désinfection chimique peut entraîner la formation de sous-produits, dont certains présentent un risque pour la santé. Le chlore, le désinfectant le plus couramment utilisé, réagit avec la MON pour former des trihalométhanes et des acides haloacétiques, ainsi que d'autres composés organiques halogénés (Rook, 1976; Krasner et coll., 2006). Les systèmes qui utilisent la monochloramine et, dans une moindre mesure, ceux qui utilisent le chlore libre peuvent aussi former de la diméthylnitrosamine. Du bromate peut se former dans le cas des systèmes qui utilisent des solutions d'hypochlorite produites sur les lieux ou achetées dans le commerce (Santé Canada, 2016). L'utilisation d'ozone et de dioxyde de chlore peut aussi entraîner la formation de sous-produits inorganiques, comme le bromate (dans le cas de l'ozone) et le chlorite/chlorate (dans le cas du dioxyde de chlore). Il faut tenir compte de l'effet éventuel des SPD lorsqu'un désinfectant chimique est choisi, mais il est essentiel que les tentatives de réduction de la formation de sous-produits ne nuisent pas à l'efficacité de la désinfection. Les documents techniques appropriés renferment plus de renseignements à ce sujet (Santé Canada, 2006, 2008a, 2008b, 2011b, 2016).
7.1.3.2 Désinfection par les rayons ultraviolets
Pour la désinfection par les rayons UV, le produit de la multiplication de l'intensité lumineuse « I » (mesurée en mW/cm2 ou W/m2) et du temps « T » (mesuré en secondes) est la dose calculée (fluence) en mJ/cm2 pour un microorganisme donné. Cette relation est appelée concept IT. Des études ont montré que des doses de rayons UV relativement faibles peuvent permettre une inactivation importante des protozoaires (Clancy et coll., 1998; Bukhari et coll., 1999; Craik et coll., 2000, 2001; Belosevic et coll., 2001; Drescher et coll., 2001; Linden et coll., 2001, 2002; Shin et coll., 2001; Campbell et Wallis, 2002; Mofidi et coll., 2002; Rochelle et coll., 2002). En se fondant sur ces études et sur d'autres, l'U.S. EPA (2006a) a établi les doses de rayons UV - présentés au tableau 8 - nécessaires pour l'inactivation de Giardia lamblia et de Cryptosporidium. En ce qui concerne les systèmes d'approvisionnement en eau au Canada, une dose de rayons UV de 40 mJ/cm2 est en général utilisée (Ontario Ministry of Environment, 2006; Nova Scotia Environment, 2012), de sorte que l'inactivation des protozoaires devrait être efficace. La température et le pH de l'eau traitée n'ont pas d'influence sur la dose de rayons UV (Hijnen et coll., 2006; Wright et coll., 2012), bien qu'il s'agisse de paramètres importants qui ont une incidence sur d'autres procédés de traitement (MWH, 2012).
La désinfection par les rayons UV s'effectue à l'aide de lampes à basse pression (BP) qui émettent des rayons UV essentiellement sur une seule longueur d'ondes (~254 nm) (monochromatiques), ou de lampes à pression moyenne (PM), qui émettent des rayons sur un spectre plus large (polychromatiques). Plusieurs chercheurs ont confirmé qu'il n'y a pas à craindre que les dommages causés par les rayons UV soient réparés lorsque Cryptosporidium parvum est irradié par des lampes à BP ou à PM, même à une très faible dose (1 à 3 mJ/cm2) (Shin et coll., 2001; Oguma et coll., 2001; Zimmer et coll., 2003; Rochelle et coll., 2004). Pour Giardia lamblia, les chercheurs signalent que l'infectiosité n'est pas restaurée après que le microorganisme ait été exposé à des doses de rayons UV de lampes à BP de 16 mJ/cm2 et de 40 mJ/cm2, que l'activité réparatrice est importante lorsqu'il est exposé à une faible dose de rayons UV de lampes à BP de 1 mJ/cm2 et qu'il ne semble pas que les dommages soient réparés lorsqu'il est exposé à la même dose de rayons UV de lampes à PM (Shin et coll., 2010; Shin et Linden, 2015). De plus, Li et coll. (2008) ont signalé que les trophozoïtes de Giardia lamblia peuvent survivre et éventuellement être réactivités après une exposition à des doses de rayons UV BP atteignant 10 mJ/cm2. À des doses de rayons UV de lampes à BP de 20 mJ/cm2 et 40 mJ/cm2, la preuve de la survie ou de la réactivation était ambiguë et n'était pas statistiquement concluante. Bien que cette étude ait été menée sur des trophozoïtes plutôt que sur des kystes, cela signifie qu'une dose minimale est nécessaire pour empêcher la réparation par les kystes de Giardia lamblia des dommages induits par les rayons UV.
L'administration de la dose de rayons UV dépend d'un certain nombre de facteurs, dont le profil hydraulique du réacteur, la vitesse de filtration, le facteur de transmission des ultraviolets de l'eau, l'intensité des rayons UV, la puissance lumineuse des lampes, l'endroit où les lampes sont placées, l'âge des lampes, les salissures et la cinétique de l'inactivation des microbes (U.S. EPA, 2006c; Bolton et Cotton, 2008). Des tests de validation visant à déterminer les conditions de fonctionnement dans lesquelles le réacteur produira la dose de rayons UV doivent être effectués. Il faut constamment surveiller le réacteur pour vérifier qu'il reste dans les limites des conditions validées et qu'il administre la dose requise. Il faut aussi tenir compte des questions opérationnelles afin que l'efficacité du réacteur ne soit pas compromise (p. ex. mise en marche, panne, encrassement et nettoyage des lampes, entretien des capteurs UV) (U.S. EPA, 2006c).
| Inactivation logarithmique | Dose de rayons UV (mJ/cm2) nécessaire pour l'inactivation | |
|---|---|---|
| Cryptosporidium | Giardia lamblia | |
| 0,5 | 1,6 | 1,5 |
| 1 | 2,5 | 2,1 |
| 1,5 | 3,9 | 3,0 |
| 2 | 5,8 | 5,2 |
| 2,5 | 8,5 | 7,7 |
| 3 | 12 | 11 |
| 3,5 | 15 | 15 |
| 4 | 22 | 22 |
La désinfection par les rayons UV est en général utilisée après les procédés d'enlèvement des particules, comme la filtration, pour empêcher que les particules en suspension ne protègent les organismes pathogènes. Plusieurs études ont examiné l'effet des particules sur l'efficacité de la désinfection par les rayons UV et la plupart ont conclu que la réaction des microorganismes à la dose de rayons UV n'était pas influencée par les variations de turbidité de moins de 10 UTN (Christensen et Linden, 2002; Oppenheimer et coll., 2002; Batch et coll., 2004; Mamane-Gravetz et Linden, 2004; Passantino et coll., 2004; Amoah et coll., 2005). Par contre, Mahmud et coll. (2006) ont fait état de taux d'inactivation plus faibles lorsque la coagulation était sous-optimale (turbidité entre 1 et 2 UTN), un phénomène qui a été attribué à l'agrégation ou à l'agglutination des particules, qui a protégé les kystes et les oocystes. De plus, Templeton et coll. (2007) ont constaté que l'inactivation des bactériophages était moins importante pendant les périodes de maturation du filtre et de fin de vie du filtre, au cours desquelles la turbidité était supérieure à 0,3 UTN. Templeton et coll. (2005) ont constaté que les particules organiques qui absorbent les rayons UV (c. à d. les substances humifères) protégeaient contre la lumière UV les bactériophages liés aux particules, alors que les particules inorganiques de kaolinton ne le faisaient pas; Templeton et coll. (2005) ont par conséquent conclu que les caractéristiques des particules étaient plus pertinentes que le degré de turbidité. Pour les approvisionnements d'eau souterraine dont la teneur en fer est élevée, Templeton et coll. (2006) ont constaté que le précipité d'oxyde de fer dans les échantillons d'eau souterraine oxydés par l'air pouvait interférer avec la désinfection par les UV. Le degré de protection des kystes et des oocystes contre la lumière UV dépend très probablement du type de particules (p. ex. la taille, la structure, la composition chimique), du nombre de grosses particules (p. ex. 25 µm), du degré d'agrégation des kystes et des oocystes avec la matière particulaire et du niveau d'inactivation désiré (Caron et coll., 2007; Hargy et Landry, 2007; Templeton et coll., 2008; Kollu et Örmeci, 2012). Les services publics devraient par conséquent s'efforcer de maintenir des conditions de filtration optimales en amont de la désinfection par les UV (Templeton et coll., 2007).
On s'attendrait à ce que la lumière UV cause la formation de peu de SPD (Hijnen et coll., 2006; Bolton et Cotton, 2008). Wang et coll. (2015) ont toutefois fait état de la formation de chlorate et de bromate pour les procédés d'oxydation avancée utilisant les rayons UV et le chlore (UV >1 000 mJ/cm2; chlore libre = 5 à 10 mg/L), et les rayons UV et le peroxyde d'hydrogène (données non présentées). Selon la littérature, des nitrites se forment aussi à partir des nitrates; Sharpless et Linden (2001) ont cependant fait état de la formation de moins de 0,1 mg/L d'azote sous forme de nitrite à partir d'une concentration d'azote des nitrates de 10 mg/L lorsque la dose de rayons UV utilisée atteignait 400 mJ/cm2. Les auteurs ont conclu que la formation de nitrite est peu susceptible de représenter un risque pour la santé pendant la désinfection aux rayons UV à l'aide de lampes à PM. Comme pour les désinfectants chimiques, il faut tenir compte de l'incidence éventuelle des SPD lorsque les rayons UV sont utilisés. Il est essentiel, cependant, que les tentatives de réduction de la formation de SPD ne nuisent pas à l'efficacité de la désinfection. Plus de renseignements à ce sujet se trouvent dans les documents techniques de la recommandation sur le chlore et le chlorate et sur le bromate (Santé Canada, 2008a, 2016).
7.1.3.3 Utilisation de plusieurs désinfectants
Une stratégie faisant appel à au moins deux étapes de désinfection primaire (c. à d. la combinaison séquentielle de désinfectants) parvient à inactiver les protozoaires, ainsi que d'autres microorganismes, présents dans l'eau potable. Il est possible, par exemple, d'utiliser la lumière UV et le chlore libre de façon complémentaire afin d'inactiver les protozoaires, les virus et les bactéries. Puisque la lumière UV est très efficace pour ce qui est d'inactiver les protozoaires (mais qu'elle l'est moins contre les virus) et que le chlore est très efficace lorsqu'il s'agit d'inactiver les bactéries et les virus (mais qu'il l'est moins contre les protozoaires), la stratégie d'utilisation de plusieurs désinfectants permet de se servir de doses de chlore plus faibles. Cette stratégie réduit donc la formation de SPD. Certaines usines de traitement utilisent de l'ozone pour éliminer les composés auxquels le goût et l'odeur de l'eau sont dus, puis procèdent à une désinfection au chlore. Dans les cas de ce genre, on pourrait considérer que l'ozone et le chlore remplissent l'exigence de désinfection globale, selon des facteurs tels que la conception hydraulique du contacteur d'ozone et la présence d'ozone résiduel au point de contact ou à la sortie d'eau du contacteur.
7.1.4 Réseau de distribution
Un réseau de distribution bien entretenu est une composante essentielle de l'approche à barrières multiples; il est essentiel en effet de l'entretenir pour qu'il fournisse de l'eau potable saine (Fisher et coll., 2000). Howe et coll. (2002) ont indiqué qu'il était encore possible de détecter des oocystes à de faibles concentrations 19 jours après qu'une éclosion de cryptosporidiose a entraîné le remplacement d'une source contaminée par une source non contaminée. Ils ont supposé que la lente diminution des concentrations d'oocystes après le changement de la source d'eau était due à la libération d'oocystes présents dans le biofilm à la surface des conduites du réseau de distribution. Aucun autre cas d'infection qui aurait été causé par cette exposition n'a toutefois été signalé. Warnecke (2006) a confirmé que les conduites du réseau de distribution peuvent accumuler et libérer des oocystes pendant une longue période. Puisque les oocystes peuvent se fixer aux biofilms des conduites, s'accumuler dans le réseau de distribution et par la suite se détacher, des mesures de protection des sources d'approvisionnement en eau, l'optimisation du traitement, le maintien de l'intégrité physique et hydraulique du réseau de distribution et la réduction du nombre de phénomènes de pression négative ou de basse pression sont essentiels pour limiter l'entrée des kystes et des oocystes dans le réseau de distribution (Karim et coll., 2003; Friedman et coll., 2004; Fleming et coll., 2006; Angles et coll., 2007).
La qualité de l'eau du réseau de distribution doit être régulièrement surveillée (p. ex. les indicateurs microbiens, le chlore résiduel, la turbidité, le pH), des programmes de fonctionnement et d'entretien doivent être en place (p. ex. nettoyage de la conduite principale, prévention des retours d'eau polluée, gestion des biens) et une hygiène rigoureuse doit être pratiquée pendant les réparations de la conduite principale afin que l'eau potable soit acheminée jusqu'au consommateur sans perdre beaucoup de sa qualité (Kirmeyer et coll., 2001, 2014).
7.2 Traitement à l'échelle résidentielle
Le traitement de l'eau potable dans les installations municipales vise à réduire la présence d'organismes pathogènes ainsi que les risques pour la santé qui s'y rapportent et à les ramener à un niveau acceptable ou sécuritaire. Par conséquent, l'emploi d'appareils dans les habitations pour traiter l'eau déjà traitée par les installations municipales n'est habituellement pas nécessaire; il s'agit essentiellement d'un choix individuel. Dans les cas où un ménage ou un réseau semi-public tire son eau potable d'un approvisionnement privé, il faut établir quelle est la qualité microbiologique de la source et évaluer à quel point elle pourrait être contaminée. L'eau de surface n'est pas recommandée pour l'approvisionnement privé ou semi-public en eau, à moins qu'elle ne soit correctement filtrée et désinfectée, et que la qualité de l'eau soit surveillée. L'eau des puits peut aussi être contaminée et peut devoir être traitée.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) et de l'American National Standards Institute (ANSI) est attestée par un organisme de certification acrédité. Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification garantissent qu'un produit ou service est conforme aux normes en vigueur. Au Canada, le Conseil canadien des normes (CCN) a accrédité un certain nombre d'organismes qu'il autorise à certifier les dispositifs de traitement de l'eau potable qui satisfont aux normes susmentionnées de NSF et de l'ANSI :
- Canadian Standards Association International
- NSF International (anglais seulement);
- Water Quality Association (anglais seulement);
- Underwriters Laboratories Inc. (anglais seulement);
- Bureau de normalisation du Québec
- International Association of Plumbing and Mechanical Officials.
Une liste à jour des organismes de certification peut être obtenue auprès du CCN.
Les responsables d'approvisionnements privés et semi-publics qui utilisent la filtration peuvent consulter plusieurs normes NSF/ANSI sur l'élimination des protozoaires entériques, entre autres la norme NSF/ANSI 53 (Drinking Water Treatment Units - Health Effects), la norme NSF/ANSI 58 (Reverse Osmosis Drinking Water Treatment Systems) et la norme NSF/ANSI 62 (Drinking Water Distillation Systems). Ces normes exigent une réduction d'au moins 3 log pour que l'allégation de réduction des kystes soit certifiée. Les systèmes d'osmose inverse (OI) et de distillation certifiés selon ces normes ne sont censés être installés qu'au point d'utilisation, parce que l'eau traitée par ces systèmes peut être corrosive pour les composantes internes de la plomberie. Ces systèmes exigent aussi de grandes quantités d'influent pour que le volume d'eau potable requis soit obtenu et ne sont en général pas pratiques pour l'installation au point d'entrée. Pour la norme NSF/ANSI 53, les unités certifiées vont de petits filtres au point d'utilisation (c. à d. 0,42 gpm) à de grands systèmes au point d'entrée (c. à d. 15 gpm).
Les systèmes qui exigent une plus grande capacité (de 30 à 800 gpm) peuvent utiliser des filtres à cartouche à qui une tierce partie a fait subir un test de provocation pour l'élimination de Cryptosporidium et qui sont certifiés selon la norme NSF/ANSI 61 pour le contact avec l'eau potable. Les filtres à cartouche sont acceptés comme technologie de rechange conforme à l'exigence en matière de filtration des règlements sur le traitement des eaux de surface aux États-Unis (U.S. EPA, 1991, 2006a). Les filtres à cartouche sont des filtres jetables qu'on utilise jusqu'à ce que la pression différentielle maximale nominale soit atteinte (en général, 30 psi) puis qu'on remplace. Il n'y a donc pas de tests d'intégrité directs. L'utilisation de ces filtres est d'habitude approuvée par chacune des compétences (GLUMRB, 2012).
Les systèmes semi-publics et privés qui ont recours à la désinfection utilisent généralement le chlore ou la lumière UV en raison de leur disponibilité et de leur facilité d'utilisation relative. Il est important de remarquer que l'inactivation de Giardia au moyen de chlore libre requiert des concentrations ou des temps de contact relativement élevés et que la chloration n'inactive pas Cryptosporidium. Les appareils de traitement qui satisfont à la norme NSF/ANSI 55 pour les systèmes de désinfection par les rayons ultraviolets (catégorie A) rendent inactifs les microorganismes, dont les bactéries, les virus et les kystes et oocystes, de l'eau contaminée; ils ne sont pas conçus pour le traitement des eaux usées ou des eaux contaminées par les eaux usées brutes et ils doivent être installés dans de l'eau claire à l'œil nu. Les systèmes de catégorie B ne sont pas conçus pour la désinfection de l'eau microbiologiquement insalubre. Ils ne sont certifiés que pour le traitement bactéricide supplémentaire d'approvisionnements publics en eau potable désinfectée ou d'autres approvisionnements en eau qui ont été analysés et sont considérés comme acceptables pour la consommation humaine par la compétence responsable. Les systèmes de catégorie B ne réduisent que les microorganismes non pathogènes naturellement présents dans l'eau. Lorsqu'un traitement aux rayons UV est appliqué à des systèmes d'approvisionnement en eau de dureté moyenne ou élevée, comme c'est le cas des eaux souterraines, le colmatage et l'encrassement de la surface de la lampe UV constituent un problème courant pour lequel un prétraitement peut être nécessaire.
Les approvisionnements privés et semi-privés qui, entre autres désinfectants, utilisent le chlore (voir la section 7.1.3.3) doivent utiliser des solutions d'hypochlorite qui satisfont à la norme NSF/ANSI 60 (Drinking Water Treatment Chimical - Health Effects) et suivre les recommandations relatives à la manutention et à l'entreposage de l'hypochlorite qui sont présentées dans le document technique sur le bromate (Santé Canada, 2016).
Un laboratoire accrédité doit analyser à intervalles réguliers l'eau à son entrée et à sa sortie du dispositif de traitement pour vérifier l'efficacité de celui-ci. La capacité d'élimination des dispositifs de traitement diminue avec le temps et l'utilisation, et il faut les entretenir ou les remplacer. Les consommateurs doivent vérifier la longévité prévue des composantes de leur dispositif de traitement selon les recommandations du fabricant, et établir un calendrier d'entretien clair. Les dispositifs de traitement doivent être inspectés et entretenus selon le calendrier d'entretien et les recommandations du fabricant.
8.0 Effets sur la santé
Les effets de l'exposition à Giardia et à Cryptosporidium sur la santé, comme ceux attribuables à d'autres organismes pathogènes, dépendent des caractéristiques de l'hôte, du pathogène et de l'environnement. L'état immunitaire de l'hôte, l'infectiosité des kystes et des oocystes et le degré d'exposition (c.-à-d. le nombre de kystes et d'oocystes ingérés) sont tous des facteurs déterminants de l'infection et de la maladie. L'infection par Giardia ou Cryptosporidium peut causer à la fois des effets aigus et des effets chroniques sur la santé, lesquels sont décrits dans les sections suivantes.
8.1 Giardia
8.1.1 Infection
En théorie, un seul kyste de Giardia suffit, à tout le moins dans certaines circonstances, à causer une infection. Cependant, des études ont montré que la DI50 (la dose requise pour infecter 50 % des sujets participant au test) est habituellement supérieure à un seul kyste et dépend de la virulence de la souche en cause. Des essais d'alimentation réalisés auprès de sujets adultes volontaires portent à croire que la DI50 de Giardia est d'environ 50 kystes (Hibler et coll., 1987), bien que certaines personnes puissent contracter une infection à une dose beaucoup plus faible (Rendtorff, 1978; Stachan et Kunstýr, 1983). Il est possible d'extrapoler la DI50 de Giardia chez les humains à partir des courbes de la relation dose-réponse. Cette façon de procéder permet de déterminer que la DI50 de Giardia chez les humains est d'environ 35 kystes (Rose et Gerba, 1991), un résultat comparable à celui qui est indiqué ci-dessus. Il faut souvent moins de kystes pour que les souches de Giardia qui se sont bien adaptées à leurs hôtes (p. ex. par des passages successifs) infectent ces hôtes (Hibler et coll., 1987). Par exemple, dans le cadre d'une étude menée sur des sujets volontaires, Rendtorff (1978) a montré que, lorsque des kystes de Giardia d'origine humaine sont utilisés, la DI50 est de 19 kystes.
La période de prépatence (qui s'écoule entre l'ingestion des kystes et l'excrétion de nouveaux kystes) est de 6 à 16 jours pour la giardiase (Rendtorff, 1978; Stachan et Kunstýr, 1983; Nash et coll., 1987), bien que cette période puisse varier selon la souche. Des recherches menées sur des modèles animaux ont montré que, avec les plus petites doses, les périodes de prépatence sont plus longues, mais que la quantité résultante de parasites ne change pas (Belosevic et Faubert, 1983).
8.1.2 Pathogenèse et réponse immunitaire
Les mécanismes précis par lesquels Giardia cause la giardiase ne sont pas bien compris, et aucun facteur de virulence particulier n'a été identifié. Certains affirment que Giardia cause une irritation mécanique ou une lésion de la muqueuse en s'attachant à la bordure en brosse du tractus intestinal. D'autres ont avancé que la diarrhée est causée par l'attachement des kystes de Giardia à l'épithélium intestinal, qui entraîne une repopulation dans cette région d'anthérocytes relativement immatures dont la capacité d'absorption est réduite.
La relation hôte-parasite est complexe et il a été établi que l'expression des antigènes varie chez Giardia (Nash, 1994), de sorte qu'il est peu probable que l'immunité soit permanente et universelle. La réponse immunitaire humorale se traduit par une augmentation des taux d'anticorps circulants (immunoglobuline G [IgG] et immunoglobuline M [IgM]) et la sécrétion d'anticorps (immunoglobuline A [IgA]) dans le lait, dans la salive et peut-être dans le mucus intestinal. Ces anticorps combattent peut-être la maladie (Heyworth, 1988), mais la durabilité de cette immunité n'a pas été prouvée. On sait très peu de choses sur l'immunité cellulaire, mais une destruction spontanée de trophozoïtes par les monocytes du sang périphérique humain a été décrite (denHollander et coll., 1988).
8.1.3 Symptômes et traitement
D'ordinaire, Giardia est un microorganisme non invasif qui cause des infections asymptomatiques. Selon des données recueillies aux États-Unis, 40 % des personnes infectées par Giardia contractent une maladie symptomatique (Macler et Regli, 1993). La giardiase symptomatique peut se manifester par des nausées, une anorexie, une sensation de gêne dans la partie supérieure de l'intestin, des malaises et parfois une légère fièvre ou des frissons. L'apparition de la diarrhée est généralement soudaine et explosive, avec des selles aqueuses et nauséabondes (Wolfe, 1984). La phase aiguë de l'infection prend souvent fin de façon spontanée; les organismes disparaissent généralement des fèces. L'assemblage A a été associé à une diarrhée légère et intermittente, tandis que l'assemblage B a été lié à une diarrhée grave, aiguë ou persistante (Homan et Mank, 2001; Read et coll., 2002). L'infection par Giardia peut aussi mener à une déficience en lactase (c. à d. une intolérance au lactose) et au syndrome de malabsorption; des recherches récentes donnent à penser qu'elle pourrait de plus mener au syndrome du côlon irritable ou au syndrome de fatigue chronique chez certaines personnes (Cotton et coll., 2011; Wensaas et coll., 2012; Hanvik et coll., 2014). Certains patients deviennent des porteurs asymptomatiques de kystes pendant un certain temps et ne présentent plus de signes cliniques. D'autres, particulièrement les enfants, souffrent d'accès récurrents de la maladie qui peuvent persister pendant des mois, voire des années (Lengerich et coll., 1994). Selon les estimations, 4 600 personnes sont hospitalisées chaque année aux États-Unis en raison d'une giardiase grave, un taux similaire à celui de la shigellose (Lengerich et coll., 1994). La durée médiane des séjours à l'hôpital est de quatre jours.
La giardiase peut être traitée par plusieurs médicaments, comme le métronidazole, la quinacrine, la furazolidone, le tinidazole, l'ornidazole, le nitazoxanide et le nimorazole. Olson et coll. (1994) ont montré qu'il est possible de mettre au point un vaccin, mais que les infections et les symptômes ne seraient qu'atténués et que l'infection ne peut être prévenue pour le moment.
8.2 Cryptosporidium
8.2.1 Infection
Des essais d'alimentation réalisés sur des sujets volontaires immunocompétents ont fourni des données sur la relation dose-réponse. Comme c'est le cas pour Giardia et d'autres pathogènes, un seul microorganisme peut causer une infection, mais des études ont montré qu'il en faut en général plus d'un (DuPont et coll., 1995; Okhuysen et coll., 1998, 2002; Chappell et coll., 1999, 2006). Des études portent à croire que la DI50 de Cryptosporidium se situe entre 9 et 2 066 oocystes (DuPont et coll., 1995; Okhuysen et coll., 1998, 1999, 2002; Chappell et coll., 1999, 2006; Messner et coll., 2001), ce qui signifie que les isolats de Cryptosporidium peuvent différer considérablement quant à leur pouvoir infectant et à leur capacité de causer une cryptosporidiose symptomatique. Ainsi, l'isolat TAMU de C. parvum (isolé à l'origine chez un poulain) avait une DI50 de 9 oocystes et un taux d'atteinte morbide de 86 %, alors que l'isolat UCP de C. parvum (isolé chez un veau) avait une DI50 de 1 042 oocystes et un taux d'atteinte morbide de 59 % (Okhuysen et coll., 1999). Par contre, les isolats Iowa et Moredun de C. parvum avaient, respectivement, une DI50 de 132 et d'environ 300 oocystes, tandis que leurs taux d'atteinte morbide étaient semblables (c. à d. 55 % à 65 %) (DuPont et coll., 1995; Okhuysen et coll., 2002). D'après une méta-analyse de ces études d'alimentation, la DI50 des isolats TAMU, UCP et Iowa a été estimée, respectivement, à 12,1, à 2 066 et à 132 oocystes (Messner et coll., 2001). L'origine génétique de ces différences n'est pas connue, bien que plusieurs facteurs de virulence aient été découverts (Okhuysen et Chappell, 2002). Dans une autre méta-analyse de données d'études ayant été menées sur des sujets humains et ayant porté sur des isolats TAMU, UCP et Iowa, la probabilité d'infection à la suite de l'ingestion d'un seul oocyste infectieux se situait, selon les estimations, entre 4 % et 16 % (U.S. EPA, 2006a). Cette estimation est confirmée par des données sur des éclosions, y compris des observations faites durant l'éclosion survenue à Milwaukee, en 1993 (Gupta et Haas, 2004).
La période de prépatence est de 4 à 9 jours pour la cryptosporidiose (Ma et coll., 1985; DuPont et coll., 1995; Okhuysen et coll., 1999, 2002), mais la période peut varier selon l'isolat.
8.2.2 Pathogenèse et réponse immunitaire
Les infections de Cryptosporidium spp. dans l'intestin humain causent au moins des lésions transitoires à la muqueuse, notamment une atrophie villositaire et un allongement de la crypte (Tzipori, 1983), mais les mécanismes moléculaires par lesquels Cryptosporidium cause ces lésions ne sont pas connus. On croit que plusieurs molécules, notamment les glycoprotéines, les leptines et d'autres complexes protéiques, les antigènes et les ligands, exercent une influence sur la mobilité des oocystes, leur attachement aux cellules hôtes et l'invasion de celles ci (Okhuysen et Chappell, 2002; Tzipori et Ward, 2002). La plupart des données pathologiques disponibles ont été obtenues chez des patients atteints du sida, et l'évaluation des lésions imputables à Cryptosporidium a été compliquée par la présence d'autres pathogènes opportunistes.
Le principal mécanisme de défense de l'hôte semble être l'immunité cellulaire (McDonald et coll., 2000; Lean et coll., 2002; Riggs, 2002), bien qu'on sache que l'immunité humorale joue également un rôle (Riggs, 2002; Okhuysen et coll., 2004; Priest et coll., 2006). Des études de modèles animaux ont démontré l'importance des lymphocytes T auxiliaires (CD4+), de l'interféron gamma (IFN-γ) et de l'interleukine 12 (IL 12) dans le traitement de la cryptosporidiose (Riggs, 2002). Il est établi aussi que la réaction des anticorps contre certaines glycoprotéines joue un rôle dans l'attachement du parasite Cryptosporidium (Riggs, 2002).
On ne sait pas avec certitude si une exposition à Cryptosporidium offre une protection contre la maladie ou les infections subséquentes. Okhuysen et coll. (1998) ont indiqué qu'une première exposition à Cryptosporidium ne protège pas contre les accès futurs de cryptosporidiose. Bien que les taux de diarrhée aient été similaires après chaque exposition, la diarrhée était moins grave après une nouvelle exposition. Selon Chappell et coll. (1999), les sujets volontaires qui étaient porteurs d'anticorps préexistants contre C. parvum (ce qui donne à penser qu'ils avaient déjà été infectés) présentaient une plus grande résistance à l'infection, comme l'a montré une augmentation importante de la DI50, que ceux qui n'étaient pas porteurs de ces anticorps. Cependant, contrairement aux observations précédentes (Okhuysen et coll., 1998), la diarrhée était plus grave (la gravité étant définie par le nombre d'épisodes et la durée de la maladie) chez les sujets dont les chercheurs présumaient qu'ils avaient déjà été infectés que chez les autres.
8.2.3 Symptômes et traitement
Les personnes infectées par Cryptosporidium risquent davantage d'être atteintes d'une maladie symptomatique que celles qui sont infectées par Giardia (Macler et Regli, 1993; Okhuysen et coll., 1999). Le symptôme le plus fréquemment associé à la cryptosporidiose est la diarrhée, qui est caractérisée par des selles très aqueuses et non sanguinolentes. Le volume de diarrhée peut être très important. Chez des hôtes immunocompétents, un volume de 3 L/j est courant. Il a été fait état d'un volume atteignant 17 L/j chez des patients immunodéprimés (Navin et Juranek, 1984). Ce symptôme peut s'accompagner de crampes, de nausées, de vomissements (particulièrement chez les enfants), d'une légère fièvre (moins de 39 °C), d'une anorexie et d'une déshydratation. Des cas de cryptosporidiose touchant d'autres organes que l'intestin (c. à d. les poumons, l'oreille moyenne, le pancréas, etc.) et des décès, surtout chez les personnes atteintes du sida, ont été signalés, mais sont considérés comme rares (Farthing, 2000; Mercado et coll., 2007).
La durée de l'infection dépend de l'état du système immunitaire (Juranek, 1995) et peut être répartie en trois catégories : 1) les personnes immunocompétentes, qui se débarrassent de l'infection en 7 à 14 jours; 2) les personnes atteintes du sida ou dont le système immunitaire est fortement affaibli (p. ex. les personnes présentant une numération de cellules CD4 <180 cellules/mm3) et qui, dans la plupart des cas signalés, ne se débarrassent jamais complètement de l'infection (qui peut se transformer en infection caractérisée par de longues périodes de rémission suivies de symptômes légers); 3) les personnes immunodéprimées par suite de la chimiothérapie, d'une dépression ou d'une maladie de courte durée (p. ex. la varicelle) ou de la malnutrition. Dans les cas où l'immunodépression n'est pas liée au sida, l'infection disparaît généralement (aucune excrétion d'oocystes et disparition des symptômes) dans les 10 à 15 jours suivant l'apparition des symptômes. Des cas où l'infection a persisté pendant 30 jours chez des enfants ont toutefois été signalés. La sensibilité du diagnostic de la cryptosporidiose par l'examen des selles est faible, si faible que des personnes qui excrètent des oocystes peuvent être prématurément classées parmi les cas négatifs. L'utilisation d'outils de diagnostic plus sensibles et plus rapides, tels les tests immunochromatographiques sur membrane, permettra de réduire le nombre de résultats faussement négatifs (Cacciò et Pozio, 2006). Les sujets immunocompétents sont généralement porteurs de l'infection pendant au plus 30 jours. À l'exception des personnes atteintes du sida, les sujets peuvent continuer à éliminer des oocystes pendant 24 jours. Durant une éclosion survenue dans une garderie, des enfants ont éliminé des oocystes durant cinq semaines (Stehr-Green et coll., 1987). On pense que le taux déclaré d'infection asymptomatique est faible, mais un rapport sur une éclosion survenue dans une garderie à Philadelphie, en Pennsylvanie, a conclu que jusqu'à 11 % des enfants n'avaient présenté aucun symptôme (Alpert et coll.1986). Ungar (1994) a examiné trois études différentes menées dans des garderies où le taux d'infection asymptomatique variait entre 67 % à 100 %. L'hypothèse selon laquelle un grand nombre de ces cas asymptomatiques étaient des cas bénins qui avaient été incorrectement diagnostiqués a été formulée (Navin et Juranek, 1984).
Le nitazoxanide est le seul médicament homologué pour le traitement de la cryptosporidiose chez les enfants et les adultes (Fox et Saravolatz, 2005), bien que plus de 200 médicaments aient été mis à l'essai in vitro et in vivo (Tzipori, 1983; O'Donoghue, 1995; Armson et coll., 2003; Cacciò et Pozio, 2006). Ce qui peut s'expliquer, en partie, par le fait que la plupart des inhibiteurs ciblent les voies biochimiques dans l'apicoplaste (organite dérivé du plaste) (Wiesner et Seeber, 2005), une structure absente chez C. parvum (Abrahamsen et coll., 2004) et C. hominis (Xu et coll., 2004). La recherche pharmaceutique doit par conséquent trouver de nouvelles cibles, dont des composés qui ciblent le métabolisme énergétique et la synthèse des lipides. Il est très coûteux de trouver de nouvelles cibles, si bien que d'autres travaux examinent si des médicaments actuellement homologués sur le marché ont des propriétés anti-cryptosporidiennes (Ryan et Hijjawi, 2015).
La séquence complète du génome de plusieurs espèces de Cryptosporidium est disponible (Ryan et Hijjawi, 2015); ces séquences sont utilisées en ce moment pour établir quels sont les déterminants de la virulence et les mécanismes de la pathogenèse, une connaissance qui facilitera la mise au point d'antimicrobiens (Umejiego et coll., 2004), de vaccins (Wyatt et coll., 2005; Boulter-Bitzer et coll., 2007) et d'immunothérapies (Crabb, 1998; Enriquez et Riggs, 1998; Schaefer et coll., 2000; Takashima et coll., 2003) contre Cryptosporidium.
9.0 Évaluation des risques
L'évaluation quantitative du risque microbien (ÉQRM) est un procédé qui utilise de la modélisation mathématique, des données sur la qualité de l'eau à la source, de l'information sur les barrières de traitement et les caractéristiques du pathogène pour estimer la charge de morbidité qui se rattacherait à la source d'eau potable décrite. L'ÉQRM peut être utilisée de deux façons, soit pour la gestion d'un système d'approvisionnement en eau potable dans le cadre d'une approche à barrières multiples ou, comme c'est le cas pour le présent document, pour appuyer l'élaboration de recommandations sur la qualité de l'eau potable.
D'autres renseignements et recommandations sur l'utilisation de l'ÉQRM dans le cadre d'une approche à barrières multiples sont publiés ailleurs (Santé Canada, en cours d'élaboration). Le présent document technique n'aborde que l'utilisation de l'ÉQRM pour l'élaboration d'une recommandation sur la qualité de l'eau potable pour les protozoaires entériques.
9.1 Objectifs basés sur la santé
Les objectifs basés sur la santé sont les buts que l'on doit atteindre pour garantir la salubrité de l'eau potable. Au Canada, on tente souvent de réduire les dangers microbiologiques en cherchant à réaliser deux types d'objectifs : les objectifs de qualité de l'eau et les objectifs de traitement basés sur la santé. La recommandation bactériologique concernant E. coli constitue un exemple d'objectif de qualité de l'eau; elle établit une concentration maximale acceptable pour ce microorganisme dans l'eau potable (Santé Canada, 2012b). Les objectifs de traitement basés sur la santé précisent à quelle réduction des pathogènes il faut parvenir à l'aide de mesures comme les procédés de traitement (voir la section 7.0). Les objectifs de traitement aident à choisir les procédés de traitement et devraient être définis en fonction de la qualité des sources d'approvisionnement en eau. En raison du large éventail de microorganismes pathogènes, il est difficile d'évaluer tous les risques entourant chacun d'eux; les objectifs de traitement sont donc généralement définis en fonction des catégories de microorganismes (p. ex. bactéries, virus, protozoaires) plutôt que d'organismes pathogènes en particulier. Pour Giardia et Cryptosporidium, l'objectif de traitement basé sur la santé est le suivant : élimination ou inactivation d'au moins 3 log des kystes et des oocystes. Dans le cas des eaux de surface, il faudrait parvenir à une élimination ou à une inactivation logarithmique plus grande pour que le niveau de risque demeure acceptable.
9.2 Niveau de risque de référence
Le niveau de risque de référence est la charge de morbidité rattachée à l'eau potable qui est estimée tolérable ou acceptable. Cette valeur sert à fixer les objectifs de traitement basés sur la santé.
Les niveaux de risque sont exprimés de plusieurs façons. Les Directives de qualité pour l'eau de boisson de l'OMS (OMS, 2011) utilisent les années de vie corrigées de l'incapacité (AVCI) comme unité de mesure du risque. Les AVCI permettent d'obtenir une valeur tenant compte du risque de maladie ou de blessure et de la répercussion des effets connexes sur la santé (Murray et Lopez, 1996a; Havelaar et Melse, 2003). Les directives de l'OMS (2011) adoptent 10-6 AVCI/personne par an comme niveau de risque de référence. Le document National Guidelines for Water Recycling (NRMMC-EPHC, 2006), de l'Australie, mentionne la même valeur. Par contre, d'autres organismes établissent des niveaux de risque microbien acceptables en s'appuyant sur le risque d'infection, sans tenir compte de la probabilité ou de la gravité des effets connexes sur la santé. Par exemple, l'U.S. EPA et les Pays-Bas utilisent un objectif en matière de santé correspondant à un risque d'infection annuel de moins de 1/10 000 personnes (10-4) (Regli et coll., 1991; VROM, 2005).
L'évaluation des risques effectuée dans le présent document technique estime la charge de morbidité à l'aide des AVCI. L'utilisation de ces mesures offre plusieurs avantages. En effet, elles prennent en compte à la fois le nombre d'années perdues par suite d'un décès prématuré et le nombre d'années vécues avec une incapacité (par comparaison à l'individu moyen en bonne santé dans la région) et permettent de déterminer les effets sur la santé d'un seul type de pathogène. L'utilisation des AVCI permet aussi de comparer les effets sur la santé de divers pathogènes et, peut-être, de différents dangers microbiologiques et de certains dangers chimiques. Bien qu'aucune unité de mesure commune de la santé n'ait été acceptée à l'échelle internationale, les AVCI sont utilisées par de nombreux groupes, et l'on dispose de données publiées et évaluées par des pairs. Dans la présente évaluation des risques, le niveau de référence de l'OMS (2004), soit 10−6 AVCI/personne par an, est retenu comme niveau de risque acceptable.
9.3 Évaluation quantitative du risque microbien
Le but de ce document est d'appuyer l'élaboration d'un objectif de traitement basé sur la santé pour les protozoaires entériques dans l'eau potable. L'ÉQRM est un outil important pour établir de tels objectifs. L'ÉQRM suit une stratégie courante en évaluation du risque qui comporte quatre volets : l'identification des dangers, l'évaluation de l'exposition, l'évaluation de la relation dose-réponse et la caractérisation des risques. Dans ce cas-ci, le risque est déjà caractérisé par un niveau de référence de 1 × 10-6 AVCI/personne par année. Cette évaluation de risque examine la performance de traitement nécessaire pour diminuer la concentration de protozoaires entériques dans l'eau à la source à un niveau qui permet d'atteindre le résultat sur la santé, en fonction d'une qualité estimée de la source d'eau, des conditions d'exposition établies et de l'information dose-réponse particulière.
9.3.1 Identification des dangers
Au Canada, les protozoaires entériques les plus préoccupants pour la santé humaine dans les sources d'eau potable sont Giardia et Cryptosporidium. D'autres protozoaires entériques, comme Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis, peuvent aussi être présents dans l'eau, mais ce ne sont pas les protozoaires entériques les plus préoccupants (voir l'annexe A). Bien que tous les protozoaires entériques qui peuvent nuire à la santé humaine soient connus, les évaluations des risques tiennent rarement compte de chacun d'eux. Elles ne portent que sur des protozoaires entériques précis qui, en raison de leurs caractéristiques, sont représentatifs de tous les protozoaires pathogènes similaires. On présume que si le traitement est efficace contre le protozoaire de référence, il le sera contre tous les protozoaires préoccupants similaires. Idéalement, le protozoaire de référence est celui du pire scénario : il présente à la fois une grande fréquence, une concentration élevée et une longue période de survie dans la source d'eau, il est mal éliminé ou inactivé au cours du traitement et il possède un pouvoir pathogène élevé pour tous les groupes d'âge. Giardia et Cryptosporidium ont été choisis comme protozoaires de référence pour la présente évaluation des risques. Ces organismes peuvent provoquer des maladies graves chez les sujets immunocompétents et les sujets immunodéprimés. La cryptosporidiose est une maladie plus grave, car elle peut être mortelle, particulièrement pour les sujets immunodéprimés, et peut causer des lésions extra-intestinales (p. ex. aux poumons, au pancréas). Cependant, ces deux organismes ont des taux de prévalence élevés, peuvent causer des maladies largement répandues, résistent à la désinfection au chlore et des modèles dose-réponse sont publiés pour eux. On présume que, si la charge de morbidité de Giardia et de Cryptosporidium est ramenée à un niveau tolérable, le risque que représentent les autres protozoaires entériques le sera aussi.
9.3.2 Évaluation de l'exposition
L'exposition est déterminée être la dose de pathogènes ingérée par un consommateur par jour. La consommation d'eau potable est la principale voie d'exposition qui ait été prise en compte dans la présente évaluation de risques. Pour évaluer l'exposition, il faut connaître ou estimer la concentration de Giardia ou de Cryptosporidium dans l'eau potable ainsi que le volume d'eau ingéré.
9.3.2.1 Estimation des concentrations dans les sources d'eau
Le processus d'ÉQRM a été utilisé en sens inverse afin de guider l'élaboration d'objectifs de traitement basés sur la santé. On a utilisé le processus d'ÉQRM pour répondre à la question suivante : Quelles sont les concentrations de Giardia et de Cryptosporidium dans la source d'eau qui seraient associées à un niveau de risque de référence de 1 × 10-6 AVCI/personne par année, à un volume moyen d'eau ingérée (voir la section 9.3.2.3) et aux réductions du traitement d'un système d'eau potable (voir la section 9.3.2.2)? Les résultats obtenus seraient estimés représenter les concentrations moyennes de ces protozoaires entériques dans l'eau à la source. On prend pour acquis que les concentrations sont corrigées en fonction des taux de récupération de la méthode et que tous les protozoaires entériques décelés sont capables d'infecter des êtres humains.
Il a été démontré que des concentrations moyennes sont appropriées pour quantifier des objectifs de traitement pour l'exposition par l'eau potable (Petterson et coll., 2015). Lorsque l'on détermine les concentrations moyennes de l'eau à la source, il faut se demander si la présence des protozoaires est continue ou intermittente, s'il existe des fluctuations saisonnières régulières et quelle est l'incidence des phénomènes rares, comme les sécheresses ou les inondations, sur les concentrations. Les pics à court terme des concentrations de Giardia ou de Cryptosporidium peuvent augmenter considérablement les risques de maladie et même occasionner des éclosions de maladies d'origine hydrique. Les programmes de surveillance doivent donc tenir compte de ces facteurs pour saisir la variabilité qui se produit dans la source d'eau (Dechesne et Soyeux, 2007). Selon le projet MICRORISK, il faut procéder à un échantillonnage mensuel pendant un an pour établir les niveaux de référence, puis caractériser au moins deux phénomènes complets afin de comprendre les conditions des pics (Dechesne et Soyeux, 2007). Aux États-Unis, l'U.S. EPA exige aussi que Cryptosporidium soit échantillonné chaque mois, mais pour une période de deux ans (ou que des échantillonnages plus fréquents soient effectués pendant un an), afin d'établir les besoins en traitement d'un système d'approvisionnement en eau potable (U.S. EPA, 2006a). Outre la surveillance, l'analyse d'incertitude doit aussi être utilisée pour l'évaluation des concentrations estimées dans les sources d'eau (Petterson et coll., 2015). D'autres renseignements sur comment surveiller ou estimer les concentrations de pathogènes dans l'eau à la source se trouvent dans Santé Canada (en cours d'élaboration).
Les autres facteurs qui doivent être pris en compte au moment de déterminer les concentrations dans les sources d'eau sont le taux de récupération des méthodes de détection de Giardia et de Cryptosporidium, qui est bien inférieur à 100 %, et le danger que les kystes et les oocystes découverts représentent peut-être pour la santé humaine.
9.3.2.2 Diminutions par le traitement
Dans cette évaluation, on a examiné plusieurs combinaisons de réduction logarithmique obtenues par différent procédés de traitement à plusieurs concentrations de Giardia et de Cryptosporidium dans l'eau à la source et on les a comparées à un effet de risque défini. Il est important de noter que de nombreux facteurs peuvent affecter le traitement (voir la section 7.0). On présume que tout kyste de Giardia ou oocyste de Cryptosporidium qui n'a pas été éliminé ou inactivé pendant le traitement est encore capable de causer une infection et une maladie.
9.3.2.3 Volume d'eau ingérée
En ce qui concerne le volume d'eau consommée, il est important de ne considérer que l'eau du robinet non bouillie, puisque l'ébullition entraîne l'inactivation des pathogènes et que, si l'eau bouillie est prise en compte, l'exposition est surestimée. (Gale, 1996; Payment et coll., 1997; OMS, 2008). Au Canada, chacun consomme en moyenne environ 1 L d'eau du robinet non bouillie par jour (Statistique Canada, 2004; Statistique Canada, 2008). Dans la présente évaluation des risques, une consommation moyenne de 1 L d'eau par personne par jour est par conséquent utilisée pour estimer les risques entourant l'exposition aux organismes pathogènes. Cette estimation est comparable aux habitudes de consommation observées dans d'autres pays développés (Westrell et coll., 2006; Mons et coll., 2007). Dans ses Directives de qualité pour l'eau de boisson, l'OMS recommande également d'utiliser une valeur de 1 L d'eau du robinet non bouillie (OMS, 2008). La concentration des microorganismes dans l'eau potable traitée et le volume d'eau ingérée peuvent être utilisés pour déterminer l'exposition, c. à d. la dose de kystes et d'oocystes que chaque personne consomme chaque jour.
9.3.3 Évaluation de la relation dose-réponse
L'évaluation de la relation dose-réponse utilise des modèles dose-réponse pour estimer la probabilité d'infection (Pinfection) et le risque de maladie après exposition aux kystes et aux oocystes. Comme on le fait dans la présente évaluation, on peut aussi utiliser cette relation dose-réponsepour estimer la concentration de Giardia ou de Cryptosporidium associée à un niveau de risque précis dans des conditions définies. Le modèle exponentiel permet d'expliquer plus clairement les données de la relation dose-réponse pour Giardia et Cryptosporidium (Haas et coll., 1999) :
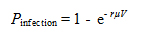
Image 1 - Équivalent textuel
La probabilité d’infection à une certaine dose estimative par jour est calculée en soustrayant de 1 le résultat de ce qui suit : le logarithme de base naturel (e), à la puissance de la valeur négative du produit de la fraction d`organismes ingérés qui survivent pour provoquer l`infection (r), le nombre d`organismes par litre dans le volume consommé (µ) et le volume unique de liquide consommé (V).
Le modèle exponentiel fournit une description mathématique de la distribution des probabilités individuelles de survie et d'infection pour tous les microorganismes, V étant le volume unique de liquide consommé, µ, le nombre d'organismes par litre dans le volume consommé et r, la fraction des organismes ingérés qui survivent pour provoquer l'infection. Dans la présente évaluation, pour Giardia, r = 0,0199 (Rose et Gerba, 1991), alors que pour Cryptosporidium, r = 0,018 (Messner et coll., 2001). Le paramètre r est tiré d'études de la relation dose-réponse menées auprès de sujets en bonne santé; il se peut donc qu'il ne représente pas de façon adéquate les effets sur des sous-groupes sensibles, comme les personnes immunodéprimées, les jeunes enfants et les personnes âgées. Bien que le modèle exponentiel ait été choisi pour la présente évaluation des risques, le modèle dose-réponse bêta Poisson est utilisé aussi (Petterson et coll., 2006; Schijven et coll., 2011).
La dose quotidienne de microorganismes d'une personne est estimée au moyen des informations provenant de l'évaluation de l'exposition (voir la section 9.3.2). La probabilité annuelle d'infection d'une personne est estimée à l'aide de l'équation (2), ci après. Pour la présente évaluation des risques, on présume qu'il n'y a aucune propagation secondaire de l'infection.
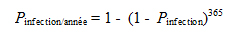
Image 2 - Équivalent textuel
La probabilité d’infection par année est calculée en soustrayant de 1 le résultat de ce qui suit : 1, moins la probabilité d’infection (de l’équation 1), élevé à la puissance 365.
Ce ne sont pas toutes les personnes infectées qui contracteront une maladie clinique. Le risque de maladie par an pour une personne est estimé au moyen de l'équation (3) :
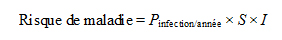
Image 3 - Équivalent textuel
Le risque de maladie est calculé en multipliant la probabilité d’infection par année (de l’équation 2) par la proportion de la population susceptible à l’infection (S) (0,70 pour Cryptosporidium et 0,4 for Giardia) et par la proportion de personnes présentant des symptômes de la maladie après avoir été infectées (I) (1 pour Cryptosporidium et Giardia).
où :
Pinfection/année = la probabilité d'infection obtenue par le modèle exponentiel;
S = la proportion de la population susceptible de contracter l'infection;
I = la proportion des personnes qui présentent une maladie symptomatique après l'infection.
L'évaluation des risques est fondée sur des valeurs I de 0,4 et de 0,7, respectivement, pour Giardia (Nash et coll., 1987) et Cryptosporidium (Okhuysen et coll., 1998). La valeur S est présumée égale à 1.
L'évaluation utilise les AVCI comme unité de mesure commune du risque pour convertir le risque annuel de maladie pour une personne en charge de morbidité par personne. Le principal avantage cité de l'AVCI comme unité de mesure de la santé publique est son caractère global, qui combine les années de vie perdues (AVP) aux années de vie avec une incapacité (AVI) pour calculer la charge de morbidité. Le calcul des AVCI s'effectue comme suit :
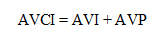
Image 4 - Équivalent textuel
Le coefficient de pondération correspondant à la gravité de l’infection à Cryptosporidium et Giardia en années de vie corrigées de l’incapacité par cas est calculé en multipliant le nombre d’années vécues avec une incapacité par le nombre d’années de vie perdues. Le nombre d’années vécues avec une incapacité correspond à la somme de la fraction de l’effet multiplié par la durée et par le coefficient de pondération correspondant à la gravité pour chacun des effets sur la santé contribuant à la morbidité. Le nombre d’années de vie perdues est calculé en soustrayant l’âge au moment du décès de l’espérance de vie, puis en multipliant le résultat par le coefficient de pondération correspondant à la gravité.
où :
AVI = la somme de [(fraction de l'effet) × (durée) × (poids de la gravité)] pour chaque effet sur la santé jouant un rôle dans la morbidité
AVP = l'[(espérance de vie) − (âge au moment du décès)] × poids de la gravité.
Pour Giardia et Cryptosporidium, la gravité des effets sur la santé varie, allant de la diarrhée légère, à la diarrhée grave et même au décès. Il est important de remarquer que, puisqu'aucune donnée sur la mortalité causée par Giardia n'a été publiée, on présume, dans la présente évaluation des risques, que le risque de décès lié à Giardia est le même que celui qui est imputé à Cryptosporidium. La charge de morbidité que représente la gastro-entérite survenant à la suite d'une infection par Giardia et Cryptosporidium dans l'eau potable est de 1,67 AVCI/1 000 cas (1,67 × 10−3 AVCI/cas) (tableau 9).
| Catégorie | Effet sur la santé | Proportion de la population touchéeNote de bas de page a | Durée de la maladieNote de bas de page b | Poids de la gravitéNote de bas de page c | AVCI/cas |
|---|---|---|---|---|---|
| Morbidité (AVI) | Diarrhée légère | 0,99999 | 0,01918 an (7 jours) | 0,067 | 1,29 × 10−3 |
| Mortalité (AVP) | Décès | 0,00001 | Espérance de vieNote de bas de page d; âge au décèsNote de bas de page e | 1 | 3,90 × 10−4 |
| Charge de morbidité | 1,67 × 10−3 | ||||
Au moyen de cette charge de morbidité (AVCI/cas) et du risque annuel de maladie pour une personne, la charge de morbidité en AVCI/personne par an peut être estimée comme suit :

Image 5 - Équivalent textuel
La charge de morbidité en années de vie corrigées de l’incapacité par personne par année est calculé en multipliant le risque de maladie (de l’équation 3) par le coefficient de pondération correspondant à la gravité en années de vie corrigées de l’incapacité par cas (1,67 x 10-3).
où :
Risque de maladie = valeur calculée au moyen de l'équation (3);
Charge de morbidité (AVCI/cas) = 1,67 × 10−3.
Comme indiqué pécédemment, puisque la charge de morbidité est établie au même niveau que le niveau de risque de référence, les calculs d'AVCI sont utilisées pour convertir le niveau de risque de référence en valeurs pour les modèles dose-réponse pour Giardia et Cryptosporidium.
9.3.4 Caractérisation des risques
Dans cette évaluation de risques, l'étape de caractérisation des risques est utilisée pour déterminer un objectif de traitement basé sur la santé minimal to atteindre le niveau de risque de référence.
Comme l'illustrent les figures 1 et 2, à mesure que la concentration de kystes et d'oocystes augmente dans la source d'eau, la réduction logarithmique doit être plus importante pour que le traitement continue d'atteindre le niveau de risque de référence. Par exemple, lorsque la concentration de Giardia est de 21 kystes/100 L et que l'usine de traitement parvient constamment à une réduction d'au moins 3 log, la charge de morbidité au sein de la population répond au niveau de référence de 10-6 AVCI/personne par an (moins de 1 cas/1 000 personnes par an). De même, pour Cryptosporidium, une concentration de 13 oocystes/100 L d'eau exige que l'usine de traitement parvienne constamment à réduire la concentration d'oocystes de 3 log afin d'atteindre le niveau de risque de référence. Ces concentrations de kystes et d'oocystes entrent dans la fourchette des concentrations des kystes et des oocystes qui se trouvent en général dans les sources d'eau au Canada (voir la section 5.0). À titre de comparaison, il faut une réduction approximative de 5 log pour que la charge de morbidité soit acceptable, si la concentration est de 2 500 kystes/100 L ou de 900 oocystes/100 L. Bien que la plupart des sources d'eau de surface au Canada n'aient pas de concentrations moyennes exigeant une réduction de 5 log, certaines ont des concentrations maximales à ce niveau (voir la section 5.0). Quoique, dans la plupart des cas, les niveaux maximums ne soient pas maintenus pendant longtemps, il est tout de même important que les fournisseurs d'eau potable tiennent compte de ces phénomènes dans leur évaluation d'un site afin de comprendre pleinement les risques éventuels pour leur eau potable (Santé Canada, en cours d'élaboration).
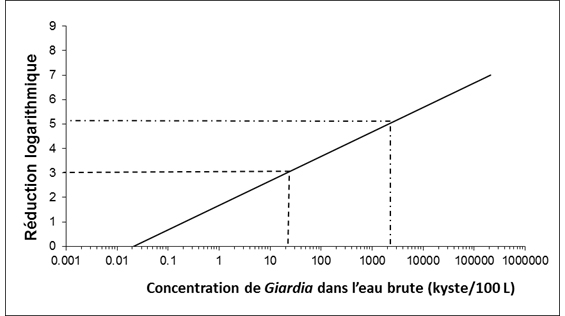
Figure 1 - Équivalent textuel
Le degré de traitement requis pour atteindre un niveau de risque acceptable selon une consommation de 1 litre, pour des concentrations de Giardia allant de 21 kystes pour 100 litres à 2500 kystes pour 100 litres d’eau brute, est présenté sous forme de graphique. L’axe des x correspond aux concentrations de kystes pour 100 litres d’eau brute, selon une échelle logarithmique. L’axe des y correspond à l’élimination logarithmique, selon une échelle linéaire. La relation entre les valeurs de l’axe des x et celles de l’axe des y, pour un niveau de risque de 10-6 AVCI par personne par année, forme une diagonale. Sur le graphique, deux exemples de degrés de traitement sont illustrés en ligne pointillée. Dans le premier, la ligne pointillée horizontale part de l’axe des y à une valeur d’élimination d’environ 3 log, puis croise la diagonale à une valeur d’environ 21 kystes pour 100 litres d’eau brute. Dans le deuxième, la ligne pointillée horizontale part de l’axe des y à une valeur d’élimination d’environ 5 log, puis croise la diagonale à une valeur d’environ 2500 kystes pour 100 litres d’eau brute.
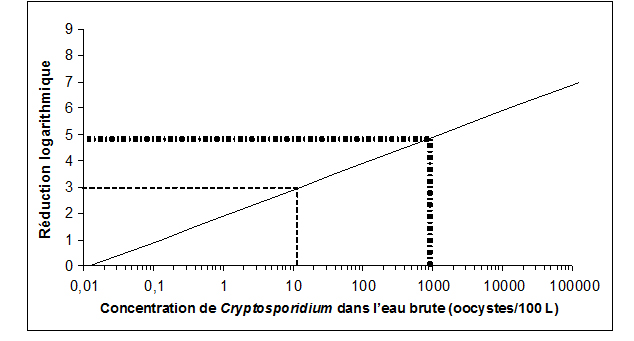
Figure 2 - Équivalent textuel
Le degré de traitement requis pour atteindre un niveau de risque acceptable selon une consommation de 1 litre, pour des concentrations de Cryptosporidium allant de 13 kystes pour 100 litres à 900 kystes pour 100 litres d’eau brute, est présenté sous forme de graphique. L’axe des x correspond aux concentrations de kystes pour 100 litres d’eau brute, selon une échelle logarithmique. L’axe des y correspond à l’élimination logarithmique, selon une échelle linéaire. La relation entre les valeurs de l’axe des x et celles de l’axe des y, pour un niveau de risque de 10-6 AVCI par personne par année, forme une diagonale. Sur le graphique, deux exemples de degrés de traitement sont illustrés en ligne pointillée. Dans le premier, la ligne pointillée horizontale part de l’axe des y à une valeur d’élimination d’environ 3 log, puis croise la diagonale à une valeur d’environ 13 kystes pour 100 litres d’eau brute. Dans le deuxième, la ligne pointillée horizontale part de l’axe des y à une valeur d’élimination d’environ 5 log, puis croise la diagonale à une valeur d’environ 900 kystes pour 100 litres d’eau brute.
Selon les données dont nous disposons sur les protozoaires entériques dans les sources d'eau de surface au Canada, un objectif de traitement basé sur la santé correspondant à une réduction de 3 log de Giardia et de Cryptosporidium est une exigence minimale. Il peut toutefois être nécessaire de parvenir à un plus fort taux d'élimination ou d'inactivation pour atteindre les objectifs du traitement. Il faut évaluer le site pour déterminer quel taux de réduction des kystes et des oocystes doit être obtenu pour une source d'eau donnée. Surveiller les sources d'eau pour y détecter la présence de Giardia et de Cryptosporidium permettra d'obtenir la meilleure évaluation du site qui soit. Cependant, s'il est impossible d'effectuer des mesures, les informations tirées d'enquêtes sanitaires et d'évaluations de la vulnérabilité, de même que les renseignements sur d'autres paramètres de la qualité de l'eau, peuvent servir à estimer le risque et le degré de contamination fécale des sources d'eau. Ces renseignements peuvent ensuite aider à déterminer si les protozoaires entériques présents dans l'eau exigent plus que le traitement minimal.
Il est important aussi de comprendre à quelles réductions logarithmiques l'usine de traitement peut parvenir lorsqu'elle fonctionne dans des conditions optimales, ainsi que l'incidence des perturbations du traitement à court et à long terme sur les réductions logarithmiques. Comprendre les variations de la qualité des sources d'approvisionnement en eau et de l'eau à l'usine de traitement, et planifier en conséquence, crée un système plus robuste pouvant comporter des marges de sécurité. Il est important aussi de tenir compte de l'incertitude relative à l'ÉQRM afin que le traitement en place produise une eau de qualité acceptable. Une analyse de la sensibilité effectuée au moyen d'un modèle peut aussi aider à déterminer les points de contrôle critiques et leurs limites. D'autres renseignements sur les évaluations des sites et l'utilisation de l'ÉQRM comme outil dans une approche à barrières multiples sont donnés ailleurs (Santé Canada, en cours d'élaboration).
9.4 Considérations internationales
Les organismes internationaux et les gouvernements d'autres pays à tous les échelons utilisent de plus en plus les ÉQRM pour prendre des décisions éclairées sur les risques sanitaires que représentent les microorganismes pathogènes de l'eau potable. L'OMS, la Commission européenne, les Pays-Bas, l'Australie et les États-Unis ont tous réalisé des progrès importants en ce qui concerne la validation et les méthodes d'ÉQRM (Staatscourant, 2001; Medema et coll., 2006; NRMMC-EPHC, 2006; U.S. EPA, 2006a,b; OMS, 2008). Ces organismes et gouvernements ont adopté des approches qui utilisent l'ÉQRM pour établir les objectifs sanitaires (c. à d. les niveaux de risque de référence ou les niveaux de maladie) et pour éclairer la gestion des risques (p. ex. le plan de salubrité de l'eau, tel que décrit dans OMS, 2011). Des lignes directrices sur l'ÉQRM de l'eau potable ont été publiées par le projet MICRORISK de la Commission européenne (Medema et coll., 2006) et l'U.S. EPA (2014).
Les Pays-Bas et, aux États-Unis, l'U.S. EPA ont adopté des approches réglementaires fondées sur les ÉQRM. Aux Pays-Bas, les fournisseurs d'eau doivent, conformément à l'approche employée par l'OMS, réaliser une ÉQRM particulière au site pour tous les systèmes d'approvisionnement en eau de surface afin de déterminer si ceux-ci satisfont à un niveau de risque précisé. Les autorités hollandaises peuvent aussi exiger une ÉQRM dans le cas des approvisionnements en eau souterraine vulnérables. Aux États-Unis, l'U.S. EPA, quant à elle, a récemment effectué une évaluation des risques pour la santé imputables aux pathogènes d'origine hydrique au moyen d'ÉQRM et s'est servie des renseignements obtenus pour établir des exigences nationales en matière d'efficacité du traitement (U.S. EPA, 2006a,b). En général, pour les systèmes d'approvisionnement en eau potable, une élimination ou une inactivation de Giardia de l'ordre de 3 log doit être obtenue (U.S. EPA, 1989). Pour réduire les risques liés à Cryptosporidium, il faut surveiller les sources d'eau des systèmes d'approvisionnement en eau potable, calculer la concentration moyenne de Cryptosporidium et utiliser les résultats pour déterminer si la source est susceptible d'être contaminée et si elle requiert un traitement supplémentaire. Les systèmes d'approvisionnement en eau sont classés dans des catégories de risque établies en fonction de la présence ou de l'absence d'un système de filtration; ces catégories donnent également des renseignements sur les exigences supplémentaires en matière d'élimination ou d'inactivation de Cryptosporidium spp. (U.S. EPA, 2006a).
Santé Canada et le Comité fédéral-provincial-territorial sur l'eau potable ont adopté la même approche que l'OMS (2011), en fournissant des objectifs d'efficacité fondés sur les ÉQRM comme exigences minimales. L'ÉQRM particulière à un site est recommandée également comme outil qui peut être utilisé dans le cadre d'une approche à barrières multiples de la source au robinet. L'ÉQRM effectuée pour un site en particulier offre plusieurs avantages, notamment 1) la capacité de comparer les risques entourant des groupes de pathogènes représentatifs (p. ex. virus, protozoaires, bactéries) dans une évaluation globale; 2) la transparence des hypothèses; 3) la prise en compte de la variabilité et de l'incertitude liées aux estimations; 4) l'élimination des facteurs de sécurité cachés (qui peuvent être appliqués consciemment par des organismes de réglementation à la fin du processus, s'ils le désirent); 5) l'établissement des points de contrôle critiques et des limites propres au site au moyen d'analyses de la sensibilité et 6) une bonne connaissance des effets de la gestion d'un système sur un paramètre de santé publique. D'autres renseignements sur l'utilisation de l'ÉQRM pour l'évaluation d'un site en particulier se trouvent dans Santé Canada (en cours d'élaboration).
10.0 Justification
On sait que Giardia lamblia et de nombreuses espèces et de nombreux génotypes de Cryptosporidium infectent les humains. Ces pathogènes sont excrétés dans les matières fécales des personnes et des animaux infectés et peuvent être présents dans les sources d'eau. Leur présence dans les sources d'eau varie au fil du temps et peut être considérablement influencée par des températures extrêmes ou par des déversements ou des événements perturbateurs (c. à d. augmentation du nombre de kystes et d'oocystes associée à ces événements). La meilleure façon de prévenir la présence de Cryptosporidium et de Giardia en concentrations dangereuses dans l'eau potable consiste à appliquer l'approche à barrières multiples. Cette approche englobe la protection des sources d'eau et le traitement adéquat, assurés grâce au contrôle approprié des procédés, dont l'application est suivie par la vérification de l'absence de microorganismes indicateurs fécaux dans l'eau prête au débit. Fixer des objectifs de traitement basés sur la santé permet d'assurer la protection de la santé publique. Or, pour fixer ces objectifs, il faut établir le niveau de risque acceptable. Le Comité fédéral-provincial-territorial sur l'eau potable a retenu le niveau de référence utilisé par l'OMS, soit 10-6 AVCI/personne par an. Il s'agit d'une décision de gestion des risques qui offre un équilibre entre, d'une part, la charge de morbidité estimée pour Cryptosporidium et Giardia et, d'autre part, le manque d'informations sur la prévalence de ces organismes pathogènes dans les sources d'eau, les limites en matière de surveillance des maladies et les variations de l'efficacité des différentes techniques de traitement de l'eau.
Au Canada, bon nombre de sources d'eau de surface présentent des concentrations de Cryptosporidium et de Giardia variant de 1 à 200 kystes et oocystes par 100 L d'eau. L'approche fondée sur les ÉQRM utilisée dans le présent document montre que, si une source d'eau présente une concentration de kystes et d'oocystes correspondant aux valeurs minimales de cette fourchette de concentrations - p. ex. 21 kystes de Giardia/100 L et 13 oocystes de Cryptosporidium/100 L -, l'usine de traitement doit constamment réduire d'au moins 3 log la concentration des kystes et des oocystes afin de respecter le niveau de référence. Par conséquent, si l'eau doit être traitée par suite de la présence de protozoaires entériques, l'élimination ou l'inactivation d'au moins 3 log de Giardia et de Cryptosporidium a été établie comme objectif de traitement basé sur la santé. Certaines eaux de surface au Canada peuvent nécessiter une réduction supérieure à l'objectif de traitement minimal pour respecter le niveau de risque. Il faut évaluer les sources d'eau souterraine pour déterminer si l'approvisionnement peut être contaminé par des protozoaires pathogènes (c. à d. ESSIDES). Les approvisionnements qui proviennent des ESSIDES doivent respecter les objectifs du traitement établis pour les protozoaires. Dans toute la mesure du possible, il faut protéger les bassins versants ou les aquifères qui servent de sources d'eau potable contre toute contamination par les matières fécales.
11.0 Références
Abbaszadegan, M., Rauch-Williams, T., Johnson, W.P. et Hubbs, S.A. (2011). Methods to Assess GWUDI and Bank Filtration Performance. Water Research Foundation, Denver, Colorado.
Aboytes, A., Di Giovanni, G.D., Abrams, F.A., Rheinecker, C., McElroy, W., Shaw, N. et LeChevallier, M.W. (2004). Detection of infectious Cryptosporidium in filtered drinking water. J. Am. Water Works Assoc., 96:88-98.
Abrahamsen, M.S., Templeton, T.J., Enomoto, S., Abrahante, J.E., Zhu, G., Lancto, C.A., Deng, M., Liu, C., Widmer, G., Tzipori, S., Buck, G.A., Xu, P., Bankier, A.T., Dear, P.H., Konfortov, B.A., Spriggs, H.F., Iyer, L., Anantharaman, V., Aravind, L. et Kapur, V. (2004). Complete genome sequence of the apicomplexan, Cryptosporidium parvum. Science, 304(5669):441-445.
Abudalo, R.A., Ryan, J.N., Harvey, R.W., Metge, D.W. et Landkamer, L. (2010). Influence of organic matter on the transport of Cryptosporidium parvum oocysts in a ferric oxyhydroxide-coated quartz sand saturated porous medium. Water Res., 44(4): 1104-1113.
Adam, R.D. (1991). The biology of Giardia spp. Microbiol. Rev., 55:706-732.
Adam, R.D. (2001). Biology of Giardia lamblia. Clin. Microbiol. Rev. 14(3):447-475.
Adamska, M. (2015). Molecular characterization of Cryptosporidium and Giardia occurring in natural water bodies in Poland. Parasitol. Res. 114:687-692.
Alexander, C., Jones, B., Inverarity, D. et Pollock, K.G.J. (2014). Genotyping of Giardia isolates in Scotland: a descriptive epidemiological study. Epidemiol. Infect., 142:1636-1639.
Alpert, G.L., Bell, M., Kirkpatrick, C.E., Budinick, L.D., Campos, J.M., Friedman, H.M. et Plotkin, S.A. (1986). Outbreak of cryptosporidiosis in a day care center. Pediatrics, 77:152-157.
Alspach, B., Delphos, P., Pressman, J., Beaty, J., Cooke, T., Voutchkov, N., Schaefer, J., Noack, R., Marascia, F. et Konstanski, D. (2014). Metrics and methods for MF/UF system optimization. Dans : Proceedings of the Membrane Technology Conference. American Water Works Association, Denver, Colorado.
Amar, C.F., Dear, P.H., Pedraza-Díaz, S., Looker, N., Linnane, E. et McLauchlin, J. (2002). Sensitive PCR-restriction fragment length polymorphism assay for detection and genotyping of Giardia duodenalis in human feces. J. Clin. Microbiol., 40(2):446-452.
Amburgey, J.E., Amirtharajah, A., Brouckaert, B.M. et Spivey, N.C. (2003). An enhanced backwashing technique for improved filter ripeninG. J. Am. Water Works Assoc., 95(12):81-94.
Amburgey, J.E., Amirtharajah, A., York, M.T., Brouckaert, B.M., Spivey, N.C. et Arrowood, M.J. (2005). Comparison of conventional and biological filter performance for Cryptosporidium and microsphere removal. J. Am. Water Works Assoc., 97(12):77-91.
Amoah, K., Craik, S., Smith, D.W. et Belosevic, M. (2005). Inactivation of Cryptosporidium oocysts and Giardia cysts by ultraviolet light in the presence of natural particulate matter. J. Water Supply Res. Technol. AQUA., 54(3):165-178.
Angles, M.L., Chandy, J.P., Cox, P.T., Fisher, I.H. et Warnecke, M.R. (2007). Implications of biofilm-associated Cryptosporidium oocysts for the water industry. Trends Parasitol., 23(8):352-356.
ANSI/AWWA (2010). ANSI/AWWA B110-09 - Membrane systems. American Water Works Association, Denver, Colorado.
APHA/AWWA/WEF (2012). Infectivity of Cryptosporidium in cell culture. Dans : Standard Methods for the Examination of Water and Wastewater 22nd Edition. American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC. 9711D.
Aramini, J.J., Stephen, C., Dubey, J.P., Engelstoft, C., Schwantje, H. et Ribble, C.S. (1999). Potential contamination of drinking water with Toxoplasma gondii oocysts. Epidemiol. Infect., 122(2):305-315.
Armson, A., Thompson, R.C. et Reynoldson, J.A. (2003). A review of chemotherapeutic approaches to the treatment of cryptosporidiosis. Expert Rev. Anti Infect. Ther., 1(2):297-305.
ASPC (2009). Rapport annuel 2007 de C-Enternet. Programme national intégré de surveillance des maladies entériques, Agence de la santé publique du Canada.
ASPC (2015). Maladies à déclaration obligatoire en direct. Agence de la santé publique du Canada. Disponible à : http://maladies.canada.ca/declaration-obligatoire/
Assavasilavasukul, P., Harrington, G.W., Lau., B.L.T., Hoffman, R.M. et Borchardt, M.A. (2008a). Effect of pathogen load on pathogen removal by conventional treatment. American Water Works Association Research Foundation and American Water Works Association. Denver, Colorado.
Assavasilavasukul, P., Lau, B. L. T., Harrington, G.W., Hoffman, R.M. et Borchardt, M.A. (2008b). Effect of pathogen concentrations on removal of Cryptosporidium and Giardia by conventional drinking water treatment. Water Res., 42(10-11):2678-2690.
ASTM (2010). Standard practice for integrity testing of water filtration membrane systems. Designation: D6908‑06 (Reapproved 2010). ASTM International, West Conshohocken, Pennsylvanie.
Atherholt, T.B., LeChevallier, M.W., Norton, W.D. et Rosen, J.S. (1998). Effect of rainfall on Giardia and Cryptosporidium. J. Am. Water Works Assoc., 90:66-80.
AWWA (1988). Roundtable: Cryptosporidium. American Water Works Association. J. Am. Water Works Assoc., 80:14-28.
AWWA (1991). Guidance manual for compliance with the filtration and disinfection requirements for public water systems using surface water sources. American Water Works Association, Denver, Colorado.
AWWA (2005). Microfiltration and ultrafiltration membranes for drinking water: Manual of Water Supply Practices - M53. 1st edition. American Water Works Association, Denver, Colorado.
AWWA (2011a). Water quality and treatment: a handbook of community water supplies. 6th edition. J.K. Edzwald (ed.). McGraw-Hill, New York, New York.
AWWA (2011b). Operational control of coagulation and filtration processes: Manual of Water Supply Practices - M37. 3rd edition. American Water Works Association, Denver, Colorado.
Baldursson, S. et Karanis, P. (2011). Waterborne transmission of protozoan parasites: review of worldwide outbreaks - An update 2004-2010. Water Res. 45:6603-6614.
Batch, L.F., Schulz, C.R. et Linden, K.G. (2004). Evaluating water quality effect on UV disinfection of MS2 coliphage. J. Am. Water Works Assoc., 96(7):75-87.
BCCDC (1996). Outbreak of cryptosporidiosis associated with municipal drinking water: Cranbrook, British Columbia, June. British Columbia Centre for Disease Control. B.C. Health Dis. Surveill., 5(10):93-103.
Bellamy, W.D., Silverman, G.P., Hendricks, D.W. et Logsdon, G.S. (1985a). Removing Giardia cysts with slow sand filtration. J. Am. Water Works Assoc., 77(2):52-60.
Bellamy, W.D., Hendricks, D.W. et Logsdon, G.S. (1985b). Slow Sand Filtration: Influences of selected process variables. J. Am. Water Works Assoc., 77(12):62-66.
Belosevic, M. et Faubert, G.M. (1983). Giardia muris: correlation between oral dosage, course of infection, and trophozoite distribution in the mouse small intestine. Exp. Parasitol., 56:352-365.
Belosevic, M., Faubert, G.M., Guy, R., MacLean, J.D., Law, C. et Croll, N.A. (1983). Giardia lamblia infections in Mongolian gerbils: an animal model. J. Infect. Dis., 147:222-226.
Belosevic, M., Guy, R.A., Taghi-Kilani, R., Neumann, N.F., Gyurek, L.L., Liyanage, L.R., Millard, P.J. et Finch, G.R. (1997). Nucleic acid stains as indicators of Cryptosporidium parvum oocyst viability. Int. J. Parasitol., 27(7):787-798.
Belosevic, M., Craik, S.A., Stafford, J.L., Neumann, N.F., Kruithof, J. et Smith, D.W. (2001). Studies on the resistance/reactivation of Giardia muris cysts and Cryptosporidium parvum oocysts exposed to medium-pressure ultraviolet radiation. FEMS Microbiol. Lett., 204(1):197-203.
Bennett, J.W., Gauci, M.R., Le Moenic, S., Schaefer, F.W. III, and Lindquist, H.D. (1999). A comparison of enumeration techniques for Cryptosporidium parvum oocysts. J. Parasitol., 85(6):1165-1168.
Berger, P. (2002). Removal of Cryptosporidium using bank filtration. Dans : Riverbank filtration: Understanding contaminant biogeochemistry and pathogen removal. C. Ray (ed.). Kluwer Academic Publishers, Dordrecht, The Netherlands. p. 85-121.
Berrilli, F., Di Cave, D., De Liberato, C., Franco, A., Scaramozzino, P. et Orecchia, P. (2004). Genotype characterisation of Giardia duodenalis isolates from domestic and farm animals by SSU-rRNA gene sequencinG. Vet. Parasitol., 122(3):193-199.
Bertrand, I., Gantzer, C., Chesnot, T. et Schwartzbrod, J. (2004). Improved specificity for Giardia lamblia cyst quantification in wastewater by development of a real-time PCR method. J. Microbiol. Meth., 57(1):41-53.
Betancourt, W.Q. et Rose, J.B. (2004). Drinking water treatment processes for removal of Cryptosporidium and Giardia. Vet. Parasitol., 126(1-2):219-234.
Bingham, A.K., Jarroll, E.L., Jr. et Meyer, E.A. (1979). Giardia sp.: physical factors of excystation in vitro, and excystation vs. eosin exclusion as determinants of viability. Exp. Parasitol., 47:284-291.
Bize, J., Grenet, B. et Maneglier, H. (1981). Le pouvoir épurateur du complexe alluvial en bordure de rivière. Techniq. Sci. Municip. L'eau, July:393-401.
Black, E.K., Finch, G.R., Taghi-Kilani, R. et Belosevic, M. (1996). Comparison of assays for Cryptosporidium parvum oocysts viability after chemical disinfection. FEMS Microbiol. Lett., 135:187-189.
Boreham, P.F., Upcroft, J.A. et Upcroft, P. (1990). Changing approaches to the study of Giardia epidemiology: 1681-2000. Int. J. Parasitol., 20(4):479-487.
Boulter-Bitzer, J.I., Lee, H. et Trevors, J.T. (2007). Molecular targets for detection and immunotherapy in Cryptosporidium parvum. Biotechnol. Adv., 25(1):13-44.
Bolton, J.R. et Cotton, C.A. (2008). The ultraviolet disinfection handbook. American Water Works Association, Denver, Colorado.
Bouzid, M., Hunter, P.R., Chalmers, R.M. et Tyler, K.M. (2013). Cryptosporidium pathogenicity and virulence. Clin. Microbiol. Rev., 26(1):115-134.
Bowie, W.R., King, A.S., Werker, D.H., Isaac-Renton, J.L., Bell, A., Eng, S.B. et Marion, S.A. (1997). Outbreak of toxoplasmosis associated with municipal drinking water. The B.C. Toxoplasma Investigation Team. Lancet, 350(9072):173-177.
Brown, T.J. et Emelko, M.B. (2009). Chitosan and metal salt coagulant impacts on Cryptosporidium and microsphere removal by filtration. Water Res., 43(2):331-338.
Brush, C.F., Walker, M.F. Anguish, L.J. et Ghiorse, W.C. (1998). Influence of pretreatment and experimental conditions on electrophoretic mobility and hydrophobicity of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 64(11):4439-4445.
Brush, C.F., Ghiorse, W.C., Anguish, L.J. Parlange, J-Y. et Grimes, H.G. (1999). Transport of Cryptosporidium parvum oocysts through saturated columns. J. Environ. Qual., 28(3):809-815.
Budu-Amoako, E., Greenwood, S.J., Dixon, B.R., Barkema, H.W. et McClure, J.T. (2012a). Giardia and Cryptosporidium on dairy farms and the role these farms may play in contaminating water sources in Prince Edward Island, Canada. J. Vet. Intern. Med., 26:668-673.
Budu-Amoako, E., Greenwood, S.J., Dixon, B.R., Barkema, H.W. et McClure, J.T. (2012b). Occurrence of Cryptosporidium and Giardia on beef farms and water sources within the vicinity of the farms on Prince Edward Island, Canada. Vet. Parasitol. 184:1-9.
Bukhari, Z., McCuin, R.M., Fricker, C.R. et Clancy, J.L. (1998). Immunomagnetic separation of Cryptosporidium parvum from source water samples of various turbidities. Appl. Environ. Microbiol., 64(11):4495-4499.
Bukhari, Z., Hargy, T.M., Bolton, J.R., Dussert, B. et Clancy, J.L. (1999). Medium-pressure UV for oocyst inactivation. J. Am. Water Works Assoc., 91(3):86-94.
Bukhari, Z., Marshall, M.M., Korich, D.G., Fricker, C.R., Smith, H.V., Rosen, J. et Clancy, J.L. (2000). Comparison of Cryptosporidium parvum viability and infectivity assays following ozone treatment of oocysts. Appl. Environ. Microbiol., 66(7):2972-2980.
Burnet, J.B, Penny, C., Ogorzaly, L. et Cauchie, H.M. (2014). Spatial and temporal distribution of Cryptosporidium and Giardia in a drinking water resource: implications for monitoring and risk assessment. Sci. Total Environ., 472:1023-1036.
Cacciò, S.M., Beck, R., Almeida, A., Bajer, A. et Pozio, E. (2010). Identification of Giardia species and Giardia duodenalis assemblages by sequence analysis or the 5.8S rDNA gene and internal transcribed spacers. Parasitology, 137:919-925.
Cacciò, S.M. et Pozio, E. (2006). Advances in the epidemiology, diagnosis and treatment of cryptosporidiosis. Expert Rev. Anti Infect. Ther., 4(3):429-443.
Cacciò, S.M. et Ryan, U. (2008). Molecular epidemiology of giardiasis. Mol. Biochem. Parasitol., 160:75-80.
Cacciò, S.M., De Giacomo, M. et Pozio, E. (2002). Sequence analysis of the beta-giardin gene and development of a polymerase chain reaction-restriction fragment length polymorphism assay to genotype Giardia duodenalis cysts from human faecal samples. Int. J. Parasitol., 32(8):1023-1030.
Campbell, A.T. et Wallis, P. (2002). The effect of UV irradiation on human-derived Giardia lamblia cysts. Water Res., 36(4):963-969.
Campbell, A.T., Robertson, L.J. et Smith, H.V. (1992). Viability of Cryptosporidium parvum oocysts: correlation of in vitro excystation with inclusion or exclusion of fluorogenic vital dyes. Appl. Environ. Microbiol., 58:3488-3493.
Campbell, A., Douglas, I., Emelko, M.B., McLellan, N. et Banihashemi, A. (2014). Evaluating pathogen logs performance through pilot-plant challenge studies. Canadian National Conference on Drinking Water, Ottawa, Ontario.
Cao, Y., Raith, M.R. et Griffith, J.F. (2015). Droplet digital PCR for simultaneous quantification of general and human-associated fecal indicators for water quality assessment. Water Res., 70:337-349.
Caprioli, A., Gentile, G., Baldassari, L., Bisicchia, R., Romoli, E. et Donelli, G. (1989). Cryptosporidium as a common cause of childhood diarrhoea in Italy. Epidemiol. Infect., 102:537-540.
Caron, E., Chevrefils Jr., G., Barbeau, B., Payment, P. et Prévost, M. (2007). Impact of microparticles on UV disinfection of indigenous aerobic spores. Water Res. 41(19):4546-4556.
Carranza, P.G. et Lujan, H.D. (2010). New insights regarding the biology of Giardia lamblia. Microbes Infect., 12:71-80.
Cavalier-Smith, T. (2003). Protist phylogeny and the high-level classification of protozoa. Europ. J. Protistol. 39: 338-348.
CCME (2004). De la source au robinet : Guide d'application de l'approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l'Environnement. Winnipeg, Manitoba. Disponible à : www.ccme.ca/files/Resources/fr_water/fr_source_to_tap/mba_guidance_doc_f.pdf
CDC (2004). Surveillance for waterborne-disease outbreaks associated with drinking water -- United States, 2001-2002. United States Centers for Disease Control and Prevention MMWR Morb. Mortal. Wkly. Rep., 53(SS08):23-45. Disponible à :www.cdc.gov/mmwr/preview/mmwrhtml/ss5308a4.htm
Chalmers, R.M., Elwin, K., Reilly, W.J., Irvine, H., Thomas, A.L. et Hunter, P.R. (2002). Cryptosporidium in farmed animals: the detection of a novel isolate in sheep. Int. J. Parasitol., 32:21-26.
Chappell, C.L., Okhuysen, P.C., Sterling, C.R., Wang, C., Jakubowski, W. et DuPont, H.L. (1999). Infectivity of Cryptosporidium parvum in healthy adults with pre-existing anti-C. parvum serum immunoglobulin G. Am. J. Trop. Med. Hyg., 60(1):157-164.
Chappell, C.L., Okhuysen, P.C., Langer-Curry, R., Widmer, G., Akiyoshi, D.E., Tanriverdi, S. et Tzipori, S. (2006). Cryptosporidium hominis: experimental challenge of healthy adults. Am. J. Trop. Med. Hyg., 75(5):851-857.
Chauret, C., Armstrong, N., Fisher, J., Sharma, R., Springthorpe, S. et Sattar, S. (1995). Correlating Cryptosporidium and Giardia with microbial indicators. J. Am. Water Works Assoc., 87(11):76-84.
Chesnot, T. et Schwartzbrod, J. (2004). Quantitative and qualitative comparison of density-based purification methods for detection of Cryptosporidium oocysts in turbid environmental matrices. J. Microbiol. Methods, 58(3):375-386.
Christensen, J. et Linden, K. (2002). New findings regarding the impacts of suspended particles on UV disinfection of drinking water. Dans : Proceedings of the Annual Conference of the American Water Works Association, New Orleans, LA, June 16-20. American Water Works Association, Denver, Colorado.
Clancy, J.L., Hargy, T.M., Marshall, M.M. et Dyksen, J.E. (1998). UV light inactivation of Cryptosporidium oocysts. J. Am. Water Works Assoc., 90(9):92-102.
Clancy, J. L., Hargy, T. M., Battigelli, D. A., Marshall, M. M., Korich, D. G. et Nicholson, W. L. (2002). Susceptibility of Multiple Strains of C. Parvum to UV Light. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Coffey, B. M., Huck, P. M., Maurizio, D. D., Emelko, M. B., Douglas, I. P. et Van Den Oever, J. (1999). The effect of optimizing coagulation on the removal of Cryptosporidium parvum and Bacillus subtilis. Dans : Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
Collins, M.R., Eighmy, T.T. et Malley, Jr., J.P. (1991). Evaluating Modifications to slow sand filters. J. Am. Water Works Assoc., 83(9):62-70.
Conio, O., Chioetto, M. et Hargesheimer, E. (2002). Organic monitors. Dans : Online Monitoring for Drinking Water Utilities. E. Hargesheimer, O. Conio and J. Papovicova (eds.). Awwa Research Foundation, Denver, Colorado. p. 163-202.
Cornwell, D.A. et MacPhee, M.J. (2001). Effects of spent filter backwash recycle on Cryptosporidium removal. J. Am. Water Works Assoc., 93(4):153-162.
Cotton, J.A., Beatty, J.K. et Buret, A.G. (2011). Host parasite interactions and pathophysiology in Giardia infections. Int. J. Parasitol., 41(9):925-933.
Coulliette, A.D., Huffman, D.E., Slifko, T.R. et Rose, J.B. (2006). Cryptosporidium parvum: treatment effects and the rate of decline in oocyst infectivity. J. Parasitol., 92(1):58-62.
Crabb, J.H. (1998). Antibody-based immunotherapy of cryptosporidiosis. Adv. Parasitol., 40:121-149.
Craik, S.A., Finch, G.R., Bolton, J.R. et Belosevic, M. (2000). Inactivation of Giardia muris cysts using medium-pressure radiation in filtered drinking water. Water Res., 34(18):4325-4332.
Craik, S.A., Weldon, D., Finch, G.R., Bolton, J.R. et Belosevic, M. (2001). Inactivation of Cryptosporidium parvum oocysts using medium- and low-pressure ultraviolet radiation. Water Res., 35(6):1387-1398.
Craun, G.F. (1979). Waterborne outbreaks of giardiasis. Dans : Waterborne transmission of giardiasis. W. Jakubowski and J.C. Hoff (eds.). U.S. Environmental Protection Agency, Cincinnati, Ohio. p. 127-149 (U.S. EPA 600/9-79-001).
Craun, G.F. (1986). Waterborne giardiasis in the United States 1965-1984. Lancet, 328 (8505):513-514.
Craun, G.F., Berger, P.S. et Calderon, R.L. (1997). Coliform bacteria and waterborne disease outbreaks. J. Am. Water Works Assoc., 89(3):96-104.
Craun, G.F., Hubbs, S.A., Frost, F., Calderon, R.L. et Via, S.H. (1998). Waterborne outbreaks of cryptosporidiosis. J. Am. Water Works Assoc., 90:81-91.
Craun, G.F., Brunkard, J.M., Yoder, J.S., Roberts, V.A., Carpenter, J., Wade, T., Calderon, R.L., Roberts, J.M., Beach, M.J. et Roy, S.L. (2010). Causes of outbreaks associated with drinking water in the United States from 1971 to 2006. Clin. Microbiol. Rev., 23(3):507-528.
Craun, M.F., Craun, G.F., Calderon, R.L. et Beach, M.J. (2006). Waterborne outbreaks reported in the United States. J. Water Health, 4(Suppl. 2):19-30.
Current, W. (1986). Cryptosporidiosis. J. Am. Vet. Med. Assoc., 187:1334-1338.
Dai, X. et Hozalski, R.M. (2002). Effect of NOM and biofilm on the removal of Cryptosporidium parvum oocysts in rapid filters. Water Res., 36(14):3523-3532.
Davies, C.M., Altavilla, N., Krogh, M., Ferguson, C.M., Deere, D.A. et Ashbolt, N.J. (2005). Environmental inactivation of Cryptosporidium oocysts in catchment soils. J. Appl. Microbiol., 98(2):308-317.
Davies, R.B. et Hibler, C.P. (1979). Animal reservoirs and cross-species transmission of Giardia. Dans : Waterborne transmission of giardiasis. W. Jakubowski et J.C. Hoff (éditeurs). U.S. Environmental Protection Agency, Cincinnati, Ohio. p. 104-126 (EPA 600/9-79-001).
Dechesne, M. et Soyeux, E. (2007). Assessment of source water pathogen contamination. J. Water Health, 5(Suppl. 1):39-50.
Delaunay, A., Gargala, G., Li, X., Favennec, L. et Ballet, J.J. (2000). Quantitative flow cytometric evaluation of maximal Cryptosporidium parvum oocyst infectivity in a neonate mouse model. Appl. Environ. Microbiol., 66(10):4315-4317.
DeLoyde, J.L., Anderson, W.B., Cleary, S.A., Ndiongue, S., LeCraw, R.A., Galan, M. et Huck, P.M. (2006). Removal of Cryptosporidium oocysts and Giardia cysts by pilot-scale multi-stage slow sand filtration. Dans : Recent progress in slow sand and alternative biofiltration processes. Gimbel, R., Graham, N.J.D. et Collins, M.R. (eds.). IWA Publishing, Cornwall, United Kingdom.
Deng, M.Q., Cliver, D.O. et Mariam, T.W. (1997). Immunomagnetic capture PCR to detect viable Cryptosporidium parvum oocysts from environmental samples. Appl. Environ. Microbiol., 63(8):3134-3138.
Deng, M.Q., Lam, K.M. et Cliver, D.O. (2000). Immunomagnetic separation of Cryptosporidium parvum oocysts using MACS MicroBeads and high gradient separation columns. J. Microbiol. Methods, 40(1):11-17.
denHollander, N., Riley, D. et Befus, D. (1988). Immunology of giardiasis. Parasitol. Today, 4:124-131.
deRegnier, D.P., Cole, L., Schupp, D.G. et Erlandsen, S.L. (1989). Viability of Giardia cysts suspended in lake, river, and tap water. Appl. Environ. Microbiol., 55:1223-1229.
Diamond, L.P., Harlow, D.R. et Cunnick, C.C. (1978). A new medium for the axenic cultivation of Entamoeba histolytica and other Entamoeba. Trans. R. SoC. Trop. Med. Hyg., 72:431-432.
DiGiorgio, C.L., Gonzalez, D.A. et Huitt, C.C. (2002). Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol., 68(12):5952-5955.
Di Giovanni, G.D., Hashemi, F.H., Shaw, N.J., Abrams, F.A., LeChevallier, M.W. et Abbaszadegan, M. (1999). Detection of infectious Cryptosporidium parvum oocysts in surface and filter backwash water samples by immunomagnetic separation and integrated cell culture-PCR. Appl. Environ. Microbiol., 65(8):3427-3432.
Di Giovanni, G.D. et LeChevallier, M.W. (2005) Quantitative-PCR assessment of Cryptosporidium parvum cell culture infection. Appl. Environ. Microbiol., 71(3):1495-1500.
Di Giovanni, G.D., Betancourt, W.Q., Hernandez, J., Assadian, N.W., Margez, J.P.F. et Lopez, E.J. (2006). Investigation of potential zooantroponotic transmission of cryptosporidiosis and giardiasis through agricultural use of reclaimed wastewater. Int. J. Environ. Health. Res. 16(6):405-418.
Di Giovanni, G.D. Hoffman, R.M. et Sturbaum, G.D. (2014) Cryptosporidium genotyping workshop and round robin. Water Research Foundation, Denver, Colorado.
Dillingham, R.A., Lima, A.A. et Guerrant, R.L. (2002). Cryptosporidiosis: Epidemiology and impact. Microbes Infect., 4(10):1059-1066.
Dorner, S.M., Anderson, W.B., Gaulin, T., Candon, H.L., Slawson, R.M., Payment, P. et Huck, P.M. (2007). Pathogen and indicator variability in a heavily impacted watershed. J. Water Health, 5(2):241-257.
Douglas, I. (2009). Using quantitative microbial risk assessment (QMRA) to optimize drinking water treatment. Dans : Proceedings of the AWWA water quality technology conference & exposition, Seattle, WA, November 16-18, 2009. American Water Works Association, Denver, Colorado.
Drescher, A.C., Greene, D.M. et Gadgil, A.J. (2001). Cryptosporidium inactivation by low-pressure UV in a water disinfection device. J. Environ. Health, 64(3):31-35.
Dubey, J.P. (1998). Toxoplasma gondii oocyst survival under defined temperatures. J. Parasitol., 84(4):862-865.
Dugan, N.R., Fox, K.R., Owens, J.H. et Miltner, R.J. (2001). Controlling Cryptosporidium Oocysts using Conventional Treatment. J. Am. Water Works Assoc., 93(12):64-76.
Dullemont, Y.J., Schijven, J.F., Hijnen, W.A.M., Colin, M., Magic-Knezev, A. et Oorthuizen, W.A. (2006). Removal of microorganisms by slow sand filtration. Dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham and M.R. Collins (eds.). IWA Publishing, London, United Kingdom. p. 12-20.
DuPont, H.L., Chappell, C.L., Sterling, C.R., Okhuysen, P.C., Rose, J.B. et Jakubowski, W. (1995). The infectivity of Cryptosporidium parvum in healthy volunteers. N. Engl. J. Med., 332:855-859.
Eberhard, M.L., Ortega, Y.R., Hanes, D.E., Nace, E.K., Do, R.Q., Robl, M.G., Won, K.Y., Gavidia, C., Sass, N.L., Mansfield, K., Gozalo, A., Griffiths, J., Gilman, R., Sterling, C.R. et Arrowood, M.J. (2000). Attempts to establish experimental Cyclospora cayetanensis infection in laboratory animals. J. Parasitol., 86(3):577-582.
Edge, T.A., Khan, I.U.H., Bouchard, R., Guo, J., Hill, S., Locas, A., Moore, L., Neumann, N., Nowak, E., Payment, P., Yang, R., Yerubandi, R. et Watson, S. (2013). Occurrence of waterborne pathogens and Escherichia coli at offshore drinking water intakes in Lake Ontario. Appl. Environ. Microbiol., 79(19):5799-5813.
Edzwald, J.K. et Kelley, M.B. (1998). Control of Cryptosporidium: From reservoirs to clarifiers to filters. Water Sci. Technol., 37(2):1-8.
Edzwald, J.K., Bottero, J.Y., Ives, K.J. et Klute, R. (1998). Particle alteration and particle production processes. Dans : Treatment process selection for particle removal. J.B. McEwen (ed.). AWWA Research Foundation and International Water Supply Association, Denver, Colorado. p. 73-122.
Edzwald, J.K., Tobiason, J.E., Parento, L.M., Kelley, M.B., Kaminski, G.S., Dunn, H.J. et Gallant, P.B. (1999). Clarification and filtration performance for removal of Giardia and Cryptosporidium. Dans : Proceedings of the AWWA water quality technology conference. American Water Works Association, Denver, Colorado.
Edzwald, J.K., Tobiason, J.E., Parento, L.M., Kelley, M.B., Kaminski, G.S., Dunn, H.J. et Gallant, P.B. (2000). Giardia and Cryptosporidium removals by clarification and filtration under challenge conditions. J. Am. Water Works Assoc., 92(12):70-84.
Edzwald, J.K., Tobiason, J.E., Udden, C.T., Kaminski, G.S., Dunn, H.J., Gallant, P.B. et Kelley, M.B. (2003). Evaluation of the effect of recycle of waste filter backwash water on plant removals of Cryptosporidium. J. Water Supply Res. Technol. AQUA, 52(4):243-258.
Edzwald, J.K. (2010). Dissolved air flotation and me. Water Res., 44(7):2077-2106.
Eligio-García, L., Cortes-Campos, A. et Jiménez-Cardoso, E. (2005). Genotype of Giardia intestinalis isolates from children and dogs and its relationship to host origin. Parasitol. Res., 97(1):1-6.
Emelko, M.B. (2003). Removal of viable and inactivated Cryptosporidium by dual- and tri-media filtration. Water Res., 37(12):2998-3008.
Emelko, M.B., Huck, P.M. et Slawson, R.M. (1999). Design and operational strategies for optimizing Cryptosporidium removal by filters. Dans : Proceedings of the AWWA water quality technology conference. American Water Works Association, Denver, Colorado.
Emelko, M.B., Huck, P.M. et Douglas, I.P. (2003a). Cryptosporidium and microsphere removal during late-in-cycle filtration. J. Am. Water Works Assoc., 95(5):173-182.
Emelko, M.B., Watling, M.T. et Coté, M.M. (2003b). Laboratory and field strategies for assessing pathogen removal by riverbank filtration. Dans : Second international riverbank filtration conference program and abstracts. National Water Research Institute, Fountain Valley, CA.
Emelko, M.B. et Huck, P.M. (2004). Microspheres as surrogates for Cryptosporidium filtration. J. Am. Water Works Assoc., 96(3): 94-105.
Emelko, M.B., Huck, P.M. et Coffey, B.M. (2005). A review of Cryptosporidium removal by granular media filtration. J. Am. Water Works Assoc., 95(12):101-115.
Emelko, M.B., Schmidt,. P.J. et Roberson, J.A. (2008). Quantification of uncertainty in microbial data: reporting and regulatory implications. J. Am. Water Works Assoc., 100(3):94-104.
Emelko, M.B., Schmidt, P.J. et Reilly P.M. (2010a). Particle and microorganism enumeration data: Enabling quantitative rigor and judicious interpretation. Environ. Sci. Technol., 44(5):1720-1727.
Emelko, M.B., Tufenkji, N., Stone, M., Rudolph, D. et Marsalek, J. (2010b). Mitigation of urban stormwater and polluted river water impacts on water quality with riverbank filtration. Dans : Effects of urbanization on groundwater: An engineering case-based approach for sustainable development. N-B. Chang (ed.). ASCE Publications, Reston, VA. p. 165-198.
Enriquez, F.J. et Riggs, M.W. (1998). Role of immunoglobulin A monoclonal antibodies against P23 in controlling murine Cryptosporidium parvum infection. Infect. Immunol., 66(9):4469-4473.
EPCOR. (2005). Edmonton water performance report. EPCOR Water Services Inc., Edmonton, Alberta. Disponible à :www.epcor.ca
Erlandsen, S.L. et Bemrick, W.J. (1988). Waterborne giardiasis: sources of Giardia cysts and evidence pertaining to their implication in human infection. Dans : Advances in Giardia research. P.M. Wallis and B.R. Hammond (eds.). University of Calgary Press, Calgary, Alberta. p. 227-236.
Erlandsen, S.L., Sherlock, L.A., Januschka, M., Schupp, D.G., Schaefer, F.W., III, Jakubowski, W. et Bemrick, W.J. (1988). Cross-species transmission of Giardia spp.: inoculation of beavers and muskrats with cysts of human, beaver, mouse and muskrat origin. Appl. Environ. Microbiol., 54:2777-2785.
Eroglu, F. et Koltas, I.S. (2010). Evaluation of the transmission mode of B. hominis by using PCR method. Parasitol. Res., 107:841-845.
Farthing, M.J.G. (1989). Giardiasis as a disease. Dans : Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, United Kingdom. p. 15-37.
Farthing, M.J.G. (1992). Giardia comes of age: progress in epidemiology, immunology and chemotherapy. J. Antimicrob. Chemother., 30(5):563-566.
Farthing, M.J. (2000). Clinical aspects of human cryptosporidiosis. Contrib. Microbiol., 6:50-74.
Faulkner, B.R., Olivas, Y., Ware, M.W., Roberts, M.G., Groves, J.F., Bates, K.S. et McCarty, S.L. (2010). Removal efficiencies and attachment coefficients for Cryptosporidium in sandy alluvial riverbank sediment. Water Res., 44(9): 2725-2734.
Fayer, R. (2004). Cryptosporidium: a water-borne zoonotic parasite. Vet. Parasitol., 126(1-2):37.
Fayer, R. et Xiao, L. (2008). Cryptosporidium and cryptosporidiosis. 2nd edition. CRC Press, Boca Raton, Florida.
Fayer, R., Morgan, U. et Upton, S.J. (2000). Epidemiology of Cryptosporidium: transmission, detection and identification. Int. J. Parasitol., 30(12-13):1305-1322.
Fayer, R., Santín, M. et Trout, J.M. (2008). Cryptosporidium ryanae n. sp. (Apicomplexa: Cryptosporidiidae) in cattle (Bos taurus). Vet. Parasitol., 156(3-4):191-198.
Feng, Y., Alderisio, K.A., Yang, W., Blancero, L.A., Kuhne, W.G., Nadareski, C.A., Reid, M. et Xiao, L. (2007). Cryptosporidium genotypes in wildlife from a New York watershed. Appl. Environ. Microbiol., 73(20):6475-6483.
Ferguson, C., Kaucner, C., Krogh, M., Deere, D. et Warnecke, M. (2004). Comparison of methods for the concentration of Cryptosporidium oocysts and Giardia cysts from raw waters. Can. J. Microbiol., 50(9):675-682.
Ferrari, B.C. et Veal, D. (2003) Analysis-only detection of Giardia by combining immunomagnetic separation and two-color flow cytometry. Cytometry, 51(2):133-5.
Filice, F.P. (1952). Studies on the cytology and life history of a Giardia from a laboratory rat. Univ. Calif. Publ. Zool., 57:53-146.
Finch, G.R., Daniels, C.W., Black, E.K., Schaefer, F.W., III et Belosevic, M. (1993). Dose response of Cryptosporidium parvum in outbred neonatal CD-1 mice. Appl. Environ. Microbiol., 59:3661-3665.
Finch, G.R., Black, E.K., Gyürék, L.L. et Belosevic, M. (1994). Ozone disinfection of Giardia and Cryptosporidium. American Water Works Association Research Foundation and American Water Works Association, Denver, Colorado.
Finch, G.R., Gyürék, L., Liyanage, L.R.J. et Belosevic, M. (1997). Effect of various disinfection methods on the inactivation of Cryptosporidium. American Water Works Association Research Foundation, Denver, Colorado. 66 p.
Fisher, I., Angles, M., Chandy, J., Cox, P., Warnecke, M., Kasti, G. et Jegatheesan, V. (2000). Biofilms - A sticky situation for drinking water? Water, 27(2):33-37.
Fleming, K.K., Dugandzic, J.P., LeChevallier, M.W. et Gullick, R.W. (2006). Susceptibility of distribution systems to negative pressure transients. Awwa Research Foundation and American Water Works Association, Denver, Colorado and IWA Publishing.
Fogel, D., Isaac-Renton, J., Guasparini, R., Moorehead, W. et Ongerth, J. (1993). Removing Giardia and Cryptosporidium by slow sand filtration. J. Am. Water Works Assoc., 85(11):77-84.
Fontaine, M. et Guillot, E. (2003). An immunomagnetic separation-real-time PCR method for quantification of Cryptosporidium parvum in water samples. J. Microbiol. Methods, 54(1):29-36.
Fox, L.M. et Saravolatz, L.D. (2005). Nitazoxanide: a new thiazolide antiparasitic agent. Clin. Infect. Dis., 40(8):1173-1180.
Freire-Santos, F., Oteiza-Lopez, A.M., Vergara-Castiblanco, C.A. et Ares-Mazas, E. (2000). Study of the combined influence of environmental factors on viability of Cryptosporidium parvum oocysts in water evaluated by fluorogenic vital dyes and excystation techniques. Vet. Parasitol., 89(4):253-259.
Fricker, C. et Clancy, J. (1998). Crypto's protocol prospects. Water Qual. Int., May/June:11-15.
Friedman, M., Radder, L, Harrison, S., Howie, D., Britton, M., Boyd, G., Wang, H., Gullick, R., LeChevallier, M., Wood, D. et Funk, J. (2004). Verification and Control of pressure transients and intrusion in distribution systems. Awwa Research Foundation, Denver, Colorado.
Füchslin, H.P., Kötzsch, S. et Egli, T. (2012) Cryptosporidium spp. in drinking water: samples from rural sites in Switzerland. Swiss Med. Wkly., 142:w13683.
Gale, P. (1996). Developments in microbiological risk assessment models for drinking water--a short review. J. Appl. Bacteriol., 81:403-410.
Gallas-Lindemann, C., Sotiriadou, I., Plutzer, J. et Karanis, P. (2013). Prevalence and distribution of Cryptosporidium and Giardia in wastewater and the surface, drinking and groundwaters in the Lower Rhine, Germany. Epidemiol. Infect., 141:9-21.
Gammie, L., Goatcher, L. et Fok, N. (2000). A Giardia/Cryptosporidium near miss? Dans : Proceedings of the 8th National Conference on Drinking Water, Quebec City, Quebec, October 28-30, 1998. Canadian Water and Wastewater Association, Ottawa, Ontario.
Gaut, S., Robertson, L., Gjerde, B., Dagestad, A. et Brattli, B. (2008). Occurrence of Cryptosporidium oocysts and Giardia cysts in Norwegian groundwater wells in bedrock. J. Water Health, 6(3):383-388.
Gillin, F.D. et Diamond, L.S. (1980). Entamoeba histolytica and Entamoeba invadens: effects of temperature and oxygen tension on growth and survival. Exp. Parasitol., 49(3):328-338.
GLUMRB. (2012). Recommended standards for water works. Health Education Services, Great Lakes - Upper Mississippi River Board of State and Provincial Public Health and Environmental Managers, Albany, New York.
Gobet, P. et Toze, S. (2001). Relevance of Cryptosporidium parvum hsp70 mRNA amplification as a tool to discriminate between viable and dead oocysts. J. Parasitol., 87(1):226-229.
Gold, D., Stein, B. et Tzipori, S. (2001). The utilization of sodium taurocholate in excystation of Cryptosporidium parvum and infection of tissue culture. J. Parasitol., 87(5):997-1000.
Gollnitz, W.D., Clancy, J.L. et Garner, S.C. (1997). Reduction of microscopic particulates by aquifers. J. Am. Water Works Assoc., 89(11):84-93.
Gollnitz, W.D., Clancy, J.L., Whitteberry, B.L. et Vogt, J.A. (2003). RBF as a Microbial Treatment Process. J. Am. Water Works Assoc., 95(12):56-66.
Gollnitz, W.D., Whitteberry, B.L. et Vogt, J.A. (2004). Riverbank filtration: Induced Infiltration and Groundwater Quality. J. Am. Water Works Assoc., 96(12):98-110.
Gollnitz, W.D., Clancy, J.L., McEven, J.B. et Garner, S.C. (2005). Riverbank filtration for IESWTR compliance. J. Am. Water Works Assoc., 97(12):64-76.
Graczyk, T.K., Cranfield, M.R., Fayer, R. et Anderson, M.S. (1996). Viability and infectivity of Cryptosporidium parvum oocysts are retained upon intestinal passage through a refractory avian host. Appl. Environ. Microbiol., 62:3234-3237.
Graczyk, T.K., Fayer, R., Trout, J.M., Lewis, E.J., Farley, C.A., Sulaiman, I. et Lal, A.A. (1998). Giardia sp. cysts and infectious Cryptosporidium parvum oocysts in the feces of migratory Canada geese (Branta canadensis). Appl. Environ. Microbiol., 64:2736-2738.
Graczyk, T.K., Majewska, A.C. et Schwab, K.J. (2008). The role of birds in dissemination of human waterborne enteropathogens. Trends Parasitol., 24(2):55-59.
Gregory, R. et Edzwald, J.K. (2011). Sedimentation and flotation. Dans : Water Quality and Treatment. J.K. Edzwald (ed.). McGraw Hill, New York. p. 9.1-9.98 (Chapter 9).
Greinert, J., Furtado, D., Smith, J., Monte Barardi, C. et Simões, C. (2004). Detection of Cryptosporidium oocysts and Giardia cysts in swimming pool filter backwash water concentrates by flocculation and immunomagnetic separation. Int. J. Environ. Health Res.,14(6):395-404.
Griffin, D.W., Gibson, C.J. III, Lipp, E.K., Riley, K., Paul, J.H. III et Rose, J.B. (1999). Detection of viral pathogens by reverse transcriptase PCR and of microbial indicators by standard methods in the canals of the Florida Keys. Appl. Environ. Microbiol., 65(9):4118-4125.
Guo, H., Wyart, Y., Perot, J., Nauleau, F. et Moulin, P. (2010). Low-pressure membrane integrity tests for drinking water treatment: A review. Water Res., 44(1):41-57.
Gupta, M. et Haas, C.N. (2004). The Milwaukee Cryptosporidium outbreak: assessment of incubation time and daily attack rate. J. Water Health, 2(2):59-69.
Gupta, V., Johnson, W.P., Shafieian, P., Ryu, H., Alum, A., Abbaszadegan, M., Hubbs, S.A. et Rauch-Williams, T. (2009). Riverbank filtration: Comparison of pilot scale transport with theory. Environ. Sci. Technol., 43(3):669-676.
Gutiérrez-Aguirre, I., Rački, N., Dreo, T., Ravnikar, M. (2015). Droplet digital PCR for absolute quantification of pathogens. Christophe Lacomme (ed.) Plant Pathology: Techniques and Protocols, Methods in Molecular Biology. Vol 1302. Springer Science Business Media, New York.
Guy, R.A., Payment, P., Krull, U.J. et Horgen, P.A. (2003). Real-time PCR for quantification of Giardia and Cryptosporidium in environmental water samples and sewage. Appl. Environ. Microbiol., 69(9):5178-5185.
Guyot, K., Follet-Dumoulin, A., Lelievre, E., Sarfati, C., Rabodonirina, M., Nevez, G., Cailliez, J.C., Camus, D. et Dei-Cas, E. (2001). Molecular characterization of Cryptosporidium isolates obtained from humans in France. J. Clin. Microbiol., 39:3472-3480.
Haas, C.N., Rose, J.B. et Gerba, C.P. (1999). Quantitative microbial risk assessment. John Wiley, New York, New York.
Hall, T., Pressdee, J., Gregory, R. et Murray, K. (1995). Cryptosporidium removal during water treatment using dissolved air flotation. Water Sci. Technol., 31(3-4):125-135.
Hallier-Soulier, S. et Guillot, E. (2000). Detection of cryptosporidia and Cryptosporidium parvum oocysts in environmental water samples by immunomagnetic separation-polymerase chain reaction. J. Appl. Microbiol., 89(1):5-10.
Hallier-Soulier, S. et Guillot, E. (2003). An immunomagnetic separation-reverse transcription polymerase chain reaction (IMS-RT-PCR) test for sensitive and rapid detection of viable waterborne Cryptosporidium parvum. Environ. Microbiol., 5(7):592-598.
Hancock, C.M., Rose, J.B. et Callahan, M. (1998). Prevalence of Cryptosporidium and Giardia in US groundwaters. J. Am. Water Works Assoc., 90(3):58-61.
Hargy, T. et Landry, L. (2007). An Evaluation of the effects of Coquitlam source water turbidity on ozone and UV disinfection. Dans : Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
Harrington, G.W., Chen, H-W., Harris, A.J., Xagoraraki, I., Battigelli, D.A. et Standridge, J.H. (2001). Removal of emerging waterborne pathogens. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Harter, T. et Wagner, S. (2000). Colloid transport and filtration of Cryptosporidium parvum in sandy soils and aquifer sediments. Environ. Sci. Technol., 34(1):62-70.
Harvey, R.W., Metge, D.W., Barber, L.B. et Aiken, G.R. (2010). Effects of altered groundwater chemistry upon the pH-dependency and magnitude of bacterial attachment during transport within an organically contaminated sandy aquifer. Water Res., 44(4):1062-1071.
Havelaar, A. et Melse, J.M. (2003). Quantifying public health risk in the WHO Guidelines for drinking-water quality: a burden of disease approach. Rijkinstituut voor Volskgezondheid en Milieu, Bilthoven, Netherlands (RIVM Report 734301022).
Heaselgrave, W. et Kilvington, S. (2011). The efficacy of simulated solar disinfection (SODIS) against Ascaris, Giardia, Acanthamoeba, Naeglaria, Entamoeba, and Cryptosporidium. Acta Trop., 119(2-3):138-143.
Heller, L. et Ladeira Alves de Brito, L. (2006). The retention of Cryptosporidium sp. oocysts at varying depths in slow sand filters: A pilot study. J. Water Supply Res. Technol. AQUA, 55(3):193-206.
Hendricks, D.W., Clunie, W.F., Sturbaum, G.D., Klein, D.A., Champlin, T.L., Kugrens, P., Hirsh, J., McCourt, B., Nordby, G.R., Sobsey, M.D., Hunt, J. et Allen, M.J. (2005). Filtration removals of microorganisms and particles. J. Environ. Eng., 131(12):1621-1632.
Hewlett, E.L., Andrews, J.S., Ruffier, J. et Schaefer, F.W., III. (1982). Experimental infection of mongrel dogs with Giardia lamblia cysts and cultured trophozoites. J. Infect. Dis., 145:89-93.
Heyworth, M.F. (1988). Immunology of Giardia infections. Dans : Advances in Giardia research. P.M. Wallis and B.R. Hammond (eds.). University of Calgary Press, Calgary, Alberta. p. 45-48.
Hibler, C.P., Hancock, C.M., Perger, L.M., Wegrzyn, J.G. et Swabby, K.D. (1987). Inactivation of Giardia cysts with chlorine at 0.5 to 5.0°C. American Water Works Association, Denver, Colorado. 39 p. (Technical Research Series).
Hijjawi, N.S., Meloni, B.P., Morgan, U.M. et Thompson, R.C. (2001). Complete development and long-term maintenance of Cryptosporidium parvum human and cattle genotypes in cell culture. Int. J. Parasitol., 31(10):1048-1055.
Hijjawi, N.S., Meloni, B.P., Ryan, U.M., Olson, M.E. et Thompson, R.C. (2002). Successful in vitro cultivation of Cryptosporidium andersoni: evidence for the existence of novel extracellular stages in the life cycle and implications for the classification of Cryptosporidium. Int. J. Parasitol., 32(14):1719-1726.
Hijjawi, N.S., Meloni, B.P., Ng'anzo, M., Ryan, U.M., Olson, M.E., Cox, P.T., Monis, P.T. et Thompson, R.C. (2004). Complete development of Cryptosporidium parvum in host cell-free culture. Int. J. Parasitol., 34(7):769-777.
Hijjawi, N. (2010). Cryptosporidium: New developments in cell culture. Exp. Parasitol., 124:54-60.
Hijnen, W.A.M. et Medema, G. (2007a). Microbial elimination capacity of conventional water treatment for viruses, bacteria and protozoan (oo)cysts. Dans : Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
Hijnen, W.A.M. et Medema, G. (2007b). Elimination of micro-organisms by drinking water treatment process: A review. Kiwa Water Research, Nieuwegein, The Netherlands.
Hijnen, W.A.M., Brouwer-Hanzens, A., Charles, K.J. et Medema, G.J. (2005). Transport of MS2 Phage, Escherichia coli, Clostridium perfringens, Cryptosporidium parvum, and Giardia intestinalis in a gravel and sandy soil. Environ. Sci. Technol., 39(20):7860-7868.
Hijnen, W.A.M., Beerendonk, E.F. et Medema, G.J. (2006). Inactivation credit of UV radiation for viruses, bacteria and protozoan (oo)cysts in water: A review. Water Res. 40(1):3-22.
Hijnen, W.A.M., Dullemont, Y.J., Schijven, J.F., Brouwer-Hanzens, A.J., Rosielle, M. et Medema, G. (2007). Removal and fate of Cryptosporidium parvum, Clostridium perfringens and small-sized centric diatoms (Stephanodiscus hantzschii) in slow sand filters. Water Res., 41(10):2151-2162.
Hijnen, W.A.M., Suylen, G.M.H., Bahlman, J.A., Brouwer-Hanzens, A. et Medema, G.J. (2010). GAC adsorption filters as barriers for viruses, bacteria and protozoan (oo)cysts in water treatment. Water Res., 44(4): 1224-1234.
Hiltz, T. (2015). Communication personnelle. Town of Bridgewater, Nova Scotia.
Hoff, J.C. (1986). Inactivation of microbial agents by chemical disinfectants. U.S. Environmental Protection Agency, Cincinnati, OH (Report No. EPA/600/S286/067).
Homan, W.L. et Mank, T.G. (2001). Human giardiasis: genotype linked differences in clinical symptomatology. Int. J. Parasitol., 31(8):822-826.
Hoque, M.E., Hope, V.T., Scragg, R. et Kjellstrom, T. (2003). Children at risk of giardiasis in Auckland: a case-control analysis. Epidemiol. Infect., 131(1):655-662.
Hörman, A., Rimhanen-Finne, R., Maunula, L., von Bonsdorff, C., Torvela, N., Heikinheimo, A. et Hänninen, M. (2004). Campylobacter spp., Giardia spp., Cryptosporidium spp., noroviruses, and indicator organisms in surface water in southwestern Finland, 2000-2001. Appl. Environ. Microbiol., 70(1):87-95.
Howe, A.D., Forster, S., Morton, S., Marshall, R., Osborn, K.S., Wright, P. et Hunter, P.R. (2002). Cryptosporidium oocysts in a water supply associated with a cryptosporidiosis outbreak. EmerG. Infect. Dis., 8(6): 619-624.
Hrudey, S.E. et Hrudey, E.L. (2004). Safe drinking water: lessons from recent outbreaks in affluent nations. IWA Publishing, London, United Kingdom. 486 p.
Hsu, B.M. et Huang, C. (2001). Performances of the immunomagnetic separation method for Cryptosporidium in water under various operation conditions. Biotechnol. Prog., 17(6):1114-1118.
Hsu, B.M., Wu, N.M., Jang, H.D., Shih, F.C., Wan, M.T. et Kung, C.M. (2005). Using the flow cytometry to quantify the Giardia cysts and Cryptosporidium oocysts in water samples. Environ. Monit. Assess., 104(1-3):155-162.
Hu, J., Feng, Y., Ong, S.L., Ng, W.J., Song, L., Tan, X. et Chu, X. (2004). Improvement of recoveries for the determination of protozoa Cryptosporidium and Giardia in water using Method 1623. J. Microbiol. Methods, 58(3):321-325.
Hubbs, S.A. (2010). Laboratory-simulated RBF particle removal processes. J. Am. Water Works Assoc., 102(12): 57-66.
Huck, P.M., Emelko, M.B., Coffey, B.M., Maurizio, D. et O'Melia, C. (2001). Filter operation effects on pathogen passage. American Water Works Association Research Foundation, Denver, Colorado (Report No. 90874).
Huck, P.M., Coffey, B.M., Emelko, M.B., Maurizio, D.D., Slawson, R.M., Anderson, W.B., Van Den Oever, J., Douglas, I.P. et O'Melia, C.R. (2002). Effects of filter operation on Cryptosporidium removal. J. Am. Water Works Assoc., 94(6):97-111.
Huck, P.M. et Coffey, B.M. (2004). The importance of robustness in drinking-water systems. J. Toxicol. Environ. Health A, 67(20-22):1581-1590.
Huck, P. et Sozański, M. (2011). 3.16 - Chemical basis for water technology. Dans : Treatise on water science. P. Wilderer (ed.). Oxford: Elsevier. p. 429-469.
Hunter, P.R. et Nichols, G. (2002). Epidemiology and clinical features of Cryptosporidium infection in immunocompromised patients. Clin. Microbiol. Rev., 15(1):145-154.
Hunter, P.R. et Thompson, R.C. (2005). The zoonotic transmission of Giardia and Cryptosporidium. Int. J. Parasitol., 35(11-12):1181-1190.
Hynds, P.D., Thomas, M.K. et Pintar, K.D.M. (2014). Contamination of groundwater systems in the US and Canada by enteric pathogens, 1990-2013: a review and pooled-analysis. PLOSOne, 9(5): e93301.
Isaac-Renton, J.L., Cordeiro, C., Sarafis, K. et Shahriari, H. (1993). Characterization of Giardia duodenalis isolates from a waterborne outbreak. J. Infect. Dis., 167:431-440.
Isaac-Renton, J.L., Lewis, L.F., Ong, C.S. et Nulsen, M.F. (1994). A second community outbreak of waterborne giardiasis in Canada and serological investigation of patients. Trans. R. SoC. Trop. Med. Hyg., 88(4):395-399.
Isaac-Renton, J., Moorehead, W. et Ross, A. (1996). Longitudinal studies of Giardia contamination in two community drinking water supplies: cyst levels, parasite viability and health impact. Appl. Environ. Microbiol., 62:47-54.
Isaac-Renton, J., Bowie, W.R., King, A., Irwin, G.S., Ong, C.S., Fung, C.P., Shokeir, M.O. et Dubey, J.P. (1998). Detection of Toxoplasma gondii oocysts in drinking water. Appl. Environ. Microbiol., 64(6):2278-2280.
Isaac-Renton, J., Blatherwick, J., Bowie, W.R., Fyfe, M., Khan, M., Li, A., King, A., McLean, M., Medd, L., Moorehead, W., Ong, C.S. et Robertson, W. (1999). Epidemic and endemic seroprevalence of antibodies to Cryptosporidium and Giardia in residents of three communities with different drinking water supplies. Am. J. Trop. Med. Hyg., 60(4):578-583.
ISO (2006). ISO 15553:2006 Water Quality - Isolation and identification of Cryptosporidium oocysts and Giardia cysts from water. Organisation internationale de normalisation.
Iturriaga, R., Zhang, S., Sonek, G.J. et Stibbs, H. (2001). Detection of respiratory enzyme activity in Giardia cysts and Cryptosporidium oocysts using redox dyes and immunofluorescence techniques. J. Microbiol. Methods, 46(1):19-28.
Jacangelo, J.G., Laîné, J-M., Carns, K.E., Cummings, E.W. et Mallevialle, J. (1991). Low-pressure membrane filtration for removing Giardia and microbial indicators. J. Am. Water Works Assoc., 83(9):97-106.
Jacangelo, J.G., Adham, S. et Laîné, J-M. (1997). Membrane filtration for microbial removal. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Jaidi, K., Barbeau, B., Carrière, A., Desjardins, R. et Prévost, M. (2009). Including operational data in QMRA model: development and impact of model inputs. J. Water Health, 7(1):77-95.
Jakubowski, W. (1994). Communication personnelle. U.S. Environmental Protection Agency, Cincinnati, Ohio.
Jenkins, M.B., Anguish, L.J., Bowman, D.D., Walker, M.J. et Ghiorse, W.C. (1997). Assessment of a dye permeability assay for determination of inactivation rates of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 63:3844-3850.
Jenkins, M., Trout, J.M., Higgins, J., Dorsch, M., Veal, D. et Fayer, R. (2003). Comparison of tests for viable and infectious Cryptosporidium parvum oocysts. Parasitol. Res., 89:1-5.
Joachim, A. (2004). Human cryptosporidiosis: an update with special emphasis on the situation in Europe. J. Vet. Med. B Infect. Dis. Vet. Public Health, 51(6):251-259.
Joachim, A., Eckert, E., Petry, F., Bialek, R. et Daugschies, A. (2003). Comparison of viability assays for Cryptosporidium parvum oocysts after disinfection. Vet. Parasitol., 111(1):47-57.
Johnson, A.M., Linden, K., Ciociola, K.M., De Leon, R., Widmer, G. et Rochelle, P.A. (2005). UV inactivation of Cryptosporidium hominis as measured in cell culture. Appl. Environ. Microbiol., 71(5):2800-2802.
Johnson, A.M., Di Giovanni, G.D. et Rochelle, P.A. (2012). Comparison of assays for sensitive and reproducible detection of cell culture-infectious Cryptosporidium parvum and Cryptosporidium hominis in drinking water. Appl. Environ. Microbiol., 78(1):156-162.
Johnson, W.P. et Logan, B.E. (1996). Enhanced Transport of bacteria in porous media by sediment-phase and aqueous-phase natural organic matter. Water Res., 30(4):923-931.
Johnson, W.T. (1998). Predicting Log removal performance of membrane systems using in-situ integrity testinG. Filtr. Sep., 35(1):26-29.
Juranek, D.D. (1995). Cryptosporidiosis: sources of infection and guidelines for prevention. Clin. Infect. Dis., 21(Suppl.):S57-S61.
Karanis, P., Kourenti, C. et Smith, H. (2007). Waterborne transmission of protozoan parasites: a worldwide review of outbreaks and lessons learnt. J. Water Health, 5(1):1-38.
Karasudani, T., Aoki, S., Takeuchi, J., Okuyama, M., Oseto, M., Matsuura, S., Asai, T. et Inouye, H. (2001). Sensitive detection of Cryptosporidium oocysts in environmental water samples by reverse transcription-PCR. Jpn. J. Infect. Dis., 54(3):122-124.
Karim, M.R., Abbaszadegan, M. et LeChevallier, M. (2003). Potential for pathogen intrusion during pressure transients. J. Am. Water Works Assoc., 95(5):134-146.
Karim, H., Sylvain, S., Laurence, L., Lucien, H. et Henry-Michel, C. (2010). Comparison of three methods to concentration Giardia cysts and Cryptosporidium oocysts from surface and drinking waters. Water Sci. Technol., 62(1):196-201.
Kato, S. et Bowman, D.D. (2002). Using flow cytometry to determine the viability of Cryptosporidium parvum oocysts extracted from spiked environmental samples in chambers. Parasitol. Res., 88(4):326-331.
Kaucner, C. et Stinear, T. (1998). Sensitive and rapid detection of viable Giardia cysts and Cryptosporidium parvum oocysts in large-volume water samples with wound fiberglass cartridge filters and reverse transcription-PCR. Appl. Environ. Microbiol., 64(5):1743-1749.
Kawamura, S. (2000). Integrated design and operation of water treatment facilities. 2nd edition. John Wiley & Sons, New York, New York.
Keegan, A.R., Fanok, S., Monis, P.T. et Saint, C.P. (2003). Cell culture-Taqman PCR assay for evaluation of Cryptosporidium parvum disinfection. Appl. Environ. Microbiol., 69(5):2505-2511.
Keserue, H.A., Füchslin, H.P. et Egli, T. (2011). Rapid detection and enumeration of Giardia lamblia cysts in water samples by immunomagnetic separation and flow cytometric analysis. Appl. Environ. Microbiol. 77(15): 5420-5427.
Khaldi, S., Ratajczak, M., Gargala, G., Fournier, M., Berthe, T., Favennec, L. et Dupont, J.P. (2011). Intensive exploitation of a karst aquifer leads to Cryptosporidium water supply contamination. Water Res., 45:2906-2914.
Kim, H.N., Walker, S.L. et Bradford, S.A. (2010). Coupled factors influencing the transport and retention of Cryptosporidium parvum oocysts in saturated porous media. Water Res., 44(4):1213-1223.
Kirner, J.C., Littler, J.D. et Angelo, L.A. (1978). A waterborne outbreak of giardiasis in Camas, Washington. J. Am. Water Works Assoc., 70:35-40.
King, B.J., Keegan, A.R., Monis, P.T. et Saint, C.P. (2005). Environmental temperature controls Cryptosporidium oocyst metabolic rate and associated retention of infectivity. Appl. Environ. Microbiol., 71(7):3848-3857.
King, B.J., Keegan, A.R., Robinson, B.S. et Monis, P.T. (2011). Cryptosporidium cell culture infectivity assay design. Parasitology, 138(6):671-681.
Kirmeyer, G.J., Friedman, M., Martel, K., Howie, D., LeChevallier, M., Abbaszadegan, M., Karim, M., Funk J. et Harbour, J. (2001). Pathogen intrusion into the distribution system. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Kirmeyer, G.J., Thomure, T.M., Rahman, R., Marie, J.L, LeChevallier, M.W., Yang, J., Hughes, D.M. et Schneider, O. (2014). Effective microbial control strategies for main breaks and depressurization. Water Research Foundation, Denver, Colorado.
Kollu, K. et Örmeci, B. (2012). Effect of particles and bioflocculation on ultraviolet disinfection of Escherichia coli. Water Res., 46(3):750-760.
Kommineni, S.N., Bryck, J., Stringer, C., Stevens, C, Meyers, N., Karnik, B., Hoffman, R. et Sullivan, L. (2010). Evaluation of an emerging water treatment technology: ceramic membranes. Water Sci. Technol. Water Supply, 10(5):765-770.
Korich, D.G., Mead, J.R., Madore, M.S., Sinclair, N.A. et Sterling, C.R. (1990). Effects of ozone, chlorine dioxide, chlorine, and monochloramine on Cryptosporidium parvum oocyst viability. Appl. Environ. Microbiol., 56(5):1423-1428.
Korich, D.G., Marshall, M.M., Smith, H.V., O'Grady, J., Bukhari, Z., Fricker, C.R., Rosen, J.P. et Clancy, J.L. (2000). Inter-laboratory comparison of the CD-1 neonatal mouse logistic dose-response model for Cryptosporidium parvum oocysts. J. Eukaryot. Microbiol., 47(3):294-298.
Kostrzynska, M., Sankey, M., Haack, E., Power, C., Aldom, J.E., Chagla, A.H., Unger, S., Palmateer, G., Lee, H., Trevors, J.T. et De Grandis, S.A. (1999). Three sample preparation protocols for polymerase chain reaction based detection of Cryptosporidium parvum in environmental samples. J. Microbiol. Methods, 35(1):65-71.
Krasner, S.W., Weinberg, H.S., Richardson, S.D., Salvador, J.P., Chinne, R., Sclimenti, M.J., Onstad, G.D. et Thruston, A.D. (2006). Occurrence of a new generation of disinfection byproducts. Environ. Sci. Technol., 40:7175-7185.
Kruithof, J.C., Kamp, P.C., Folmer, H.C., Nederlof, M.M. et van Hoof, S.C.J.M. (2001). Development of a membrane integrity monitoring strategy for the UF/RO Heemskerk drinking water treatment plant. Water Sci. Technol. Water Supply, 1(5-6):261-271.
Kucik, C.J., Martin, G.L. et Sortor, B.V. (2004). Common intestinal parasites. Am. Fam. Physician, 69(5):1161-1168.
Kuehn, W. et Mueller, U. (2000). Riverbank filtration: An overview. J. Am. Water Works Assoc., 92(12):60-69.
Kuhn, R.C., Rock, C.M. et Oshima, K.H. (2002). Effects of pH and magnetic material on immunomagnetic separation of Cryptosporidium oocysts from concentrated water samples. Appl. Environ. Microbiol., 68(4):2066-2070.
Kundert, K. (2014). Alberta Flood 2013 - City of Calgary water treatment system resiliency. Canadian National Conference on Drinking Water, Ottawa, Ontario.
Lal, A., Baker, M.G., Hales, S. et French, N.P. (2013). Potential effects of global environmental changes on cryptosporidiosis and giardiasis transmission. Trends Parasitol., 29(2):83-90.
Lalancette, C., Généreux, M., Mailly, J., Servais, P., Côté, C., Michaud, A., Di Giovanni, G.D. et Prévost, M. (2012). Total and infectious Cryptosporidium oocyst and total Giardia cyst concentrations from distinct agricultural and urban contamination sources in eastern Canada. J. Water Health, 10(1):147-160.
Lalancette, C., Papineau, I., Payment, P., Dorner, S., Servais, P., Barbeau, B., Di Giovanni, G.D. et Prévost, M. (2014). Changes in Escherichia coli to Cryptosporidium ratios for various fecal pollution sources and drinking water intakes. Water Res., 55:150-161.
Langé, K.P., Bellamy, W.D., Hendricks, D.W. et Logsdon, G.S. (1986). Diatomaceous earth filtration of Giardia cysts and other substances. J. Am. Water Works Assoc., 78(1):76-84.
Lean, I.S., McDonald, V. et Pollok, R.C. (2002). The role of cytokines in the pathogenesis of Cryptosporidium infection. Curr. Opin. Infect. Dis., 15(3):229-234.
Learmonth, J.J., Ionas, G., Ebbett, K.A. et Kwan, E.S. (2004). Genetic characterization and transmission cycles of Cryptosporidium species isolated from humans in New Zealand. Appl. Environ. Microbiol., 70:3973-3978.
LeChevallier, M.W., Evans, T.M. et Seidler, R.J. (1981). Effect of turbidity on chlorination efficiency and bacterial persistence in drinking water. Appl. Environ. Microbiol., 42:159-167.
LeChevallier, M.W., Norton, W.D. et Lee, R.G. (1991a). Occurrence of Giardia and Cryptosporidium spp. in surface water supplies. Appl. Environ. Microbiol., 57:2610-2616.
LeChevallier, M.W., Norton, W.D. et Lee, R.G. (1991b). Occurrence of Giardia and Cryptosporidium spp. in filtered drinking water supplies. Appl. Environ. Microbiol., 57:2617-2621.
LeChevallier, M.W., Norton, W.D., Lee, R.G. et Rose, J.B. (1991c). Giardia and Cryptosporidium in water supplies. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
LeChevallier, M.W. et Norton, W.D. (1992). Examining relationships between particle counts and Giardia, Cryptosporidium, and turbidity. J. Am. Water Works Assoc., 84(12):54-60.
LeChevallier, M.W., Di Giovanni, G.D., Clancy, J.L., Bukhari, Z., Bukhari, S., Rosen, J.S., Sobrinho, J. et Frey, M.M. (2003). Comparison of Method 1623 and cell culture-PCR for detection of Cryptosporidium spp. in source waters. Appl. Environ. Microbiol., 69(2):971-979.
Leelayoova, S., Rangsin, R., Taamasri, P., Naaglor, T., Thathaisong, U. et Mungthin, M. (2004). Evidence of waterborne transmission of Blastocystis hominis. Am. J. Trop. Med. Hyg., 70(6):658-662.
Lemos, V., Graczyk, T.K., Alves, M., Lobo, M.L., Sousa, M.C., Antunes, F. et Matos, O. (2005). Identification and determination of the viability of Giardia lamblia cysts and Cryptosporidium parvum and Cryptosporidium hominis oocysts in human fecal and water supply samples by fluorescent in situ hybridization (FISH) and monoclonal antibodies. Parasitol. Res., 98(1):48-53.
Lengerich, E.J., Addiss, D.G. et Juranek, D.D. (1994). Severe giardiasis in the United States. Clin. Infect. Dis., 18:760-763.
Lepesteur, M., Blasdall, S. et Ashbolt, N.J. (2003). Particle dispersion for further Cryptosporidium and Giardia detection by flow cytometry. Lett. Appl. Microbiol., 37(3):218-229.
Li, D., Craik, S.A., Smith, D.W. et Belosevic, M. (2008). Survival of Giardia lamblia trophozoites after exposure to UV light. FEMS Microbiol Lett., 278(1):56-61.
Li, X., Atwill, E.R., Dunbar, L.A. et Tate, K.W. (2010). Effect of daily temperature fluctuation during the cool season on the infectivity of Cryptosporidium parvum. Appl. Environ. Microbiol., 76(4):989-993.
Limor, J.R., Lal, A.A. et Xiao, L. (2002). Detection and differentiation of Cryptosporidium parasites that are pathogenic for humans by real-time PCR. J. Clin. Microbiol., 40(7):2335-2338.
Lin, S.D. (1985). Giardia lamblia and water supply. J. Am. Water Works Assoc., 77:40-47.
Linden, K.G., Shin, G. et Sobsey, M.D. (2001). Comparative effectiveness of UV wavelengths for the inactivation of Cryptosporidium parvum oocysts in water. Water Sci. Technol., 43(12):171-174.
Linden, K.G., Shin, G.A., Faubert, G., Cairns, W. et Sobsey, M.D. (2002). UV disinfection of Giardia lamblia cysts in water. Environ. Sci. Technol., 36(11):2519-2522.
Lindquist, H.D., Ware, M., Stetler, R.E., Wymer, L. et Schaefer, F.W., III. (2001). A comparison of four fluorescent antibody-based methods for purifying, detecting, and confirming Cryptosporidium parvum in surface waters. J. Parasitol., 87(5):1124-1131.
Lippy, E.C. (1981). Waterborne disease: occurrence is on the upswing. J. Am. Water Works Assoc., 73:57-62.
Loganthan, S., Yang, R., Bath, A., Gordon, C. et Ryan, U. (2012). Prevalence of Cryptosporidium species in recreational versus non-recreational water sources. Exp. Parasitol., 131:399-403.
Logsdon, G.S., Symons, J.M., Hoye Jr., R.L. et Arozarena, M.M. (1981). Alternative filtration methods for removal of Giardia cysts and cyst models. J. Am. Water Works Assoc., 73(2):111-118.
Logsdon, G.S., Thurman, V.C., Frindt, E.S. et Stoecker, J.G. (1985). Evaluating sedimentation and various filter media for removal of Giardia cysts. J. Am. Water Works Assoc., 77(2):61-66.
Logsdon, G.S., Kohne, R., Abel, S. et LaBonde, S. (2002). Slow sand filtration for small water systems. J. Environ. EnG. Sci., 1(5):339-348.
Lopez, C.E., Dykes, A.C., Juranek, D.D., Sinclair, S.P., Conn, J.M., Christie, R.W., Lippy, E.C., Schultz, M.G. et Mires, M.H. (1980). Waterborne giardiasis: a community-wide outbreak of disease and a high rate of asymptomatic infection. Am. J. Epidemiol., 112:495-507.
Lowery, C.J., Moore, J.E., Millar, B.C., Burke, D.P., McCorry, K.A., Crothers, E. et Dooley, J.S. (2000). Detection and speciation of Cryptosporidium spp. in environmental water samples by immunomagnetic separation, PCR and endonuclease restriction. J. Med. Microbiol., 49(9):779-785.
Lowery, C.J., Nugent, P., Moore, J.E., Millar, B.C., Xiru, X. et Dooley, J.S. (2001a). PCR-IMS detection and molecular typing of Cryptosporidium parvum recovered from a recreational river source and an associated mussel (Mytilus edulis) bed in Northern Ireland. Epidemiol. Infect., 127(3):545-553.
Lowery, C.J., Moore, J.E., Millar, B.C., McCorry, K.A., Xu, J., Rooney, P.J. et Dooley, J.S. (2001b). Occurrence and molecular genotyping of Cryptosporidium spp. in surface waters in Northern Ireland. J. Appl. Microbiol., 91(5):774-779.
Lytle, D.A., Johnson, C.H. et Rice, E.W. (2002). A systematic comparison of the electrokinetic properties of environmentally important microorganisms in water. Colloids Surf. B. Biointerfaces, 24(2):91-101.
Ma, P., Kaufman, D.L., Helmick, C.G., D'Souza, A.J. et Navin, T.R. (1985). Cryptosporidiosis in tourists returning from the Caribbean. N. Engl. J. Med., 312:647-648.
MacDonald, L.M., Sargent, K., Armson, A., Thompson, R.C. et Reynoldson, J.A. (2002). The development of a real-time quantitative-PCR method for characterisation of a Cryptosporidium parvum in vitro culturing system and assessment of drug efficacy. Mol. Biochem. Parasitol., 121(2):279-282.
Macler, B.A. et Regli, S. (1993). Use of microbial risk assessment in setting US drinking water standards. Int. J. Food Microbiol., 18(4):245-256.
Mahmud, F., Craik, S.A. et Belosevic, M. (2006). The effect of upstream treatment processes on the UV inactivation of Cryptosporidium parvum. Dans : Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
Mamane-Gravetz, H. et Linden, K.G. (2004). Impact of particle aggregated microbes on UV disinfection. Presented at the AWWA Water Quality Technology Conference, San Antonio, Texas, November 14-18. American Water Works Association, Denver, Colorado.
Marshall, M.M., Naumovitz, D., Ortega, Y. et Sterling, C.R. (1997). Waterborne protozoan pathogens. Clin. Microbiol. Rev., 10(1):67-85.
Masago, Y., Oguma, K., Katayama, H., Hirata, T. et Ohgaki, S. (2004). Cryptosporidium monitoring system at a water treatment plant, based on waterborne risk assessment. Water Sci. Technol., 50(1):293-299.
Matsue, T., Fujino, T., Kajima, J. et Tsuji, M. (2001). Infectivity and oocyst excretion patterns of Cryptosporidium muris in slightly infected mice. J. Vet. Med. Sci., 63(3):319-320.
McCuin, R.M. et Clancy, J.L. (2003). Modifications to United States Environmental Protection Agency methods 1622 and 1623 for detection of Cryptosporidium oocysts and Giardia cysts in water. Appl. Environ. Microbiol., 69(1):267-274.
McCuin, R.M., Bukhari, Z., Sobrinho, J. et Clancy, J.L. (2001). Recovery of Cryptosporidium oocysts and Giardia cysts from source water concentrates using immunomagnetic separation. J. Microbiol. Methods, 45(2):69-76.
McDonald, V., Smith, R., Robinson, H. et Bancroft, G. (2000). Host immune responses against Cryptosporidium. Contrib. Microbiol., 6:75-91.
McDowell-Boyer, L.M., Hunt, J.R. et Sitar, N. (1986). Particle transport through porous media. Water Resour. Res., 22(13):1901-1921 .
McGuigan, K.G., Méndez-Hermida, F., Castro-Hermida, J.A., Ares-Mazás, E., Kehoe, S.C., Boyle, M., Sichel, C., Fernández-Ibáñez, P., Meyer, B.P., Ramalingham, S. et Meyer, E.A. (2006). Batch solar disinfection inactivates oocysts or Cryptosporidium parvum and cysts of Giardia muris in drinking water. J. Appl. Microbiol., 101(2):453-463.
McLauchlin, J., Amar, C., Pedraza-Diaz, S. et Nichols, G.L. (2000). Molecular epidemiological analysis of Cryptosporidium spp. in the United Kingdom: results of genotyping Cryptosporidium spp. in 1,705 fecal samples from humans and 105 fecal samples from livestock animals. J. Clin. Microbiol., 38(11):3984-3990.
McVicar, M., Bickerton, B., Chaulk, M. et Walsh, M. (2015). UV254 and streaming current monitors can improve coagulation control in challenging conditions. Opflow, 41(7):26-28.
Medema, G.J., Bahar, M. et Schets, F.M. (1997). Survival of Cryptosporidium parvum, Escherichia coli, faecal enterococci and Clostridium perfringens in river water: influence of temperature and autochthonous microorganisms. Water Sci. Technol., 35(11-12):249-252.
Medema, G.J., Shaw, S., Waite, M., Snozzi, M., Morreau, A. et Grabow, W. (2003). Catchment characterisation and source water quality. Dans : Assessing microbial safety of drinking water: improving approaches and methods. A. Dufour, M. Snozzi, W. Koster, J. Bartram, E. Ronchi and L. Fewtrell (eds.). World Health Organization, Geneva, Switzerland. p. 111-158.
Medema, G., Loret, J.-F., Stenström, T.-A. et Ashbolt, N. (eds.). (2006). Quantitative microbial risk assessment in the water safety plan. April 2006. European Union MicroRisk Project. Report for the European Commission under the Fifth Framework Programme, Theme 4: Energy, environment and sustainable development.
Meisel, J.L., Perera, D.R., Meligro, C. et Robin, C.E. (1976). Overwhelming watery diarrhoea associated with a Cryptosporidium in an immunosuppressed patient. Gastroenterology, 70:1156-1160.
Mercado, R., Buck, G.A., Manque, P.A. et Ozaki, L.S. (2007). Cryptosporidium hominis infection of the human respiratory tract. EmerG. Infect. Dis., 13(3):462-464.
Messner, M.J., Chappell, C.L. et Okhuysen, P.C. (2001). Risk assessment for Cryptosporidium: a hierarchical Bayesian analysis of human dose response data. Water Res., 35:3934-3940.
Metro Vancouver (2009). The Greater Vancouver Water District quality control annual report 2009, Volume 1.
Metro Vancouver (2013). Greater Vancouver water district 2013 quality control annual report, Volume 1. Disponible à : www.metrovancouver.org/services/water/WaterPublications/2013_Water_Quality_Annual_Report_Volume1.pdf
Mi, B., Mariñas, B.J., Curl, J., Sethi, S., Crozes, G. et Hugaboom, D. (2005). Microbial passage in low pressure membrane elements with compromised integrity. Environ. Sci. Technol., 39(11):4270-4279.
Mofidi, A.A., Meyer, E.A., Wallis, P.M., Chou, C.I., Meyer, B.P., Ramalingam, S. et Coffey, B.M. (2002). The effect of UV light on the inactivation of Giardia lamblia and Giardia muris cysts as determined by animal infectivity assay (P-2951-01). Water Res., 36(8):2098-2108.
Mølbak, K., Højlyng, N., Gottschau, A., Sá, J.C.C., Ingholt, L., da Silva, A.P.J. et Aaby, P. (1993). Cryptosporidiosisin infancy and childhood mortality in Guinea Bissau, West Africa. Br. Med. J., 307:417-420.
Mons, M.N., van der Wielen, J.M.L., Blokker, E.J.M., Sinclair, M.I., Hulshof, K.F.A.M., Dangendorf, F., Hunter, P.R. et Medema, G.J. (2007). Estimation of the consumption of cold tap water for microbiological risk assessment: an overview of studies and statistical analysis of data. J. Water Health, 5(Suppl. 1):151-170.
Moore, A.C., Herwaldt, B.L., Craun, G.F., Calderon, R.L., Highsmith, A.K. et Juranek, D.D. (1993). Surveillance for waterborne disease outbreaks -- United States, 1991-1992. MMWR Morb. Mortal. Wkly. Rep., 42:1-35.
Moorehead, W., Guasparini, R., Donovan, C., Mathias, R., Cottle, R. et Baytalan, G. (1990). Giardiasis outbreak from a chlorinated community water supply. Can. J. Public Health, 81:358-362.
Morgan, U.M., Constantine, C.C., Forbes, D.A. et Thompson, R.C. (1997). Differentiation between human and animal isolates of Cryptosporidium parvum using rDNA sequencing and direct PCR analysis. J. Parasitol., 83(5):825-830.
Moss, D.M. et Arrowood, M.J. (2001). Quantification of Cryptosporidium parvum oocysts in mouse fecal specimens using immunomagnetic particles and two-color flow cytometry. J. Parasitol., 87(2):406-412.
Moulton-Hancock, C., Rose, J.B., Vasconcelos, G.J., Harris, S.I. et Sturbaum, G.D. (2000). Giardia and Cryptosporidium occurrence in groundwater. J. Am. Water Works Assoc., 92(9):117-123.
Murray, C.J.L. et Lopez, A.D. (eds.) (1996a). The global burden of disease: a comprehensive assessment of mortality and disability from disease, injury and risk factors in 1990 and projected to 2020. Harvard University Press, Cambridge, MA (Global Burden of Disease and Injury Series, Vol. 1).
Murray, C. et Lopez, A. (1996b). Global health statistics. Harvard School of Public Health, Cambridge, MA (Global Burden of Disease and Injury Series, Vol. 2).
MWH (2012). Water treatment principles and design. 3rd edition. John Wiley & Sons, New York, New York.
Nash, T.E. (1994). Immunology: the role of the parasite. Dans : Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, UK. p. 139-154.
Nash, T.E., Herrington, D.A., Losonsky, G.A. et Levine, M.M. (1987). Experimental human infections with Giardia lamblia. J. Infect. Dis., 156:974-984.
Navin, T.R. et Juranek, D.D. (1984). Cryptosporidiosis: clinical, epidemiologic and parasitological review. Rev. Infect. Dis., 6:313-327.
Neumann, N.F., Gyurek, L.L., Finch, G.R. et Belosevic, M. (2000a). Intact Cryptosporidium parvum oocysts isolated after in vitro excystation are infectious to neonatal mice. FEMS Microbiol. Lett., 183:331-336.
Neumann, N.F., Gyurek, L.L., Gammie, L., Finch, G.R. et Belosevic, M. (2000b). Comparison of animal infectivity and nucleic acid staining for assessment of Cryptosporidium parvum viability in water. Appl. Environ. Microbiol., 66(1):406-412.
Newcombe, G. et Dixon, D. (2006). Introduction. Dans : Interface science in drinking water treatment - theory and applications. G. Newcombe and D. Dixon (éditeurs). Academic Press, Londres, Royaume Uni. p. 1-4.
Nichols, G., Lane, C., Asgari, N., Verlander, N.Q. et Charlett, A. (2009). Rainfall and outbreaks of drinking water related disease in England and Wales. J. Water Health, 7(1):1-8.
Nichols, R.A.B., Connelly, L., Sullivan, C.B. et Smith, H.V. (2010). Identification of Cryptosporidium species and genotypes in Scottish raw and drinking waters during a one-year monitoring period. Appl. Environ. Microbiol., 76(17):5977-5986.
Nieminski, E.C. et Ongerth, J.E. (1995). Removing Giardia and Cryptosporidium by conventional treatment and direct filtration. J. Am. Water Works Assoc., 87(9):96-106.
Nime, F.A., Burek, J.D., Page, D.L., Holscher, M.A. et Yardley, J.H. (1976). Acute enterocolitis in a human being infected with the protozoan Cryptosporidium. Gastroenterology, 70(4):592-598.
Nimri, L.F. et Batchoun, R. (1994). Prevalence of Cryptosporidium species in elementary school children. J. Clin. Microbiol., 32:1040-1042.
Noordeen, F., Horadagoda, N.U., Faizal, A.C., Rajapakse, R.P., Razak, M.A. et Arulkanthan, A. (2002). Infectivity of Cryptosporidium parvum isolated from asymptomatic adult goats to mice and goat kids. Vet. Parasitol., 103(3):217-225.
Nova Scotia Environment (2012). Nova Scotia treatment standards for municipal drinking water systems. Disponible à :www.novascotia.ca/nse/water/docs/Treatment_Standards_for_Municipal_Drinking_Water_Systems.pdf.
Nova Scotia Environment (2013). Assessing protozoan risks for surface drinking water supplies in Nova Scotia. Prepared by: Centre for Water Resources Studies, Dalhousie University, Nova Scotia.
NRMMC-EPHC (2006). Australian guidelines for water recycling: managing health and environmental risks (Phase 1). Natural Resource Management Ministerial Council, Environment Protection and Heritage Council, Australian Health Ministers Conference, Adelaide, Australia.
Nwachuku, N., Craun, G.F. et Calderon, R.L. (2002). How effective is the TCR in assessing outbreak vulnerability? J. Am. Water Works Assoc., 94(9):88-96.
Ochiai, Y., Takada, C. et Hosaka, M. (2005). Detection and discrimination of Cryptosporidium parvum and C. hominis in water samples by immunomagnetic separation-PCR. Appl. Environ. Microbiol., 71(2):898-903.
O'Connor, D.R. (2002). Part two report on the Walkerton inquiry: A strategy for safe drinking water. Ontario Ministry of the Attorney General (ISBN 0-7794-25600X).
O'Donoghue, P.J. (1995). Cryptosporidium and cryptosporidiosis in man and animals. Int. J. Parasitol., 25:139-195.
Oguma, K., Katayama, H., Mitani, H., Morita, S., Hirata, T. et Ohgaki, S. (2001). Determination of pyrimidine dimers in Escherichia coli and Cryptosporidium parvum during UV light inactivation, photoreactivation and dark repair. Appl. Environ. Microbiol., 67(10):4630-7.
O'Handley, R.M. et Olson, M.E. (2006). Giardiasis and cryptosporidiosis in ruminants. Vet. Clin. North Am. Food Anim. Pract., 22(3):623-643.
O'Handley, R.M., Cockwill, C., McAllister, T.A., Jelinski, M., Morck, D.W. et Olson, M.E. (1999). Duration of naturally acquired giardiasis and cryptosporidiosis in dairy calves and their association with diarrhea. J. Am. Vet. Med. Assoc., 214(3):391-396.
Okhuysen, P.C. et Chappell, C.L. (2002). Cryptosporidium virulence determinants--are we there yet? Int. J. Parasitol., 32:517-525.
Okhuysen, P.C., Chappell, C.L., Serling, C.R., Jakubowski, W. et DuPont, H.L. (1998). Susceptibility and serologic response of healthy adults to reinfection with Cryptosporidium parvum. Infect. Immunol., 66:441-443.
Okhuysen, P.C., Chappell, C.L., Crabb, J.H., Sterling, C.R. et DuPont, H.L. (1999). Virulence of three distinct Cryptosporidium parvum isolates for healthy adults. J. Infect. Dis., 180:1275-1281.
Okhuysen, P.C., Rich, S.M., Chappell, C.L., Grimes, K.A., Widmer, G., Feng, X. et Tzipori, S. (2002). Infectivity of a Cryptosporidium parvum isolate of cervine origin for healthy adults and interferon-gamma knockout mice. J. Infect. Dis., 185(9):1320-1325.
Okhuysen, P.C., Rogers, G.A., Crisanti, A., Spano, F., Huang, D.B., Chappell, C.L. et Tzipori, S. (2004). Antibody response of healthy adults to recombinant thrombospondin-related adhesive protein of Cryptosporidium 1 after experimental exposure to Cryptosporidium oocysts. Clin. Diagn. Lab. Immunol., 11(2):235-238.
Olson, M.E., Morck, D.W. et Ceri, H. (1994). Vaccination against Giardia in domestic kittens. Dans : Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, UK. p. 366-367.
Olson, M.E., Thorlakson, C.L., Deselliers, L., Worck, D.W. et McAllister, T.A. (1997). Giardia and Cryptosporidium in Canadian farm animals. Vet. Parasitol., 68:375-381.
Olson, M.E., O'Handley, R.M., Ralston, B.J., McAllister, T.A. et Thompson, R.C. (2004). Update on Cryptosporidium and Giardia infections in cattle. Trends Parasitol., 20(4):185-191.
O'Melia, C.R. (2006). Fundamentals of particle stability. Dans : Interface science in drinking water treatment - theory and applications. G. Newcombe and D. Dixon (eds.). Academic Press, London, United Kingdom. p. 317-362.
OMS (1996). The world health report 1996 - Fighting disease, fostering development. Bruxelles, Belgique. Organisation mondiale de la Santé. Disponible à :www.who.int/whr/1996/en/
OMS (2011). Guidelines for drinking-water quality. 4ème édition. Organisation mondiale de la Santé. Genève, Suisse. Disponible à :www.who.int/water_sanitation_health/publications/2011/dwq_guidelines/en/
OMS (2012). Water safety planning for small community water supplies. Organisation mondiale de la Santé. Genève, Suisse. Disponible à :www.who.int/water_sanitation_health/publications/2012/water_supplies/en/ .
Ong, C., Moorehead, W., Ross, A. et Isaac-Renton, J. (1996). Studies of Giardia spp. and Cryptosporidium spp. in two adjacent watersheds. Appl. Environ. Microbiol., 62:2798-2805.
Ong, C.S.L., Pearce, M., Eisler, D., Goh, S.H., King, A.S., Bowie, W.R., Isaac-Renton, J.L. et Beard, C.B. (1997). An outbreak of cryptosporidiosis in southeastern British Columbia, Canada. Dans : Proceedings of the 1997 international symposium on waterborne Cryptosporidium, March 2-5, 1997, Newport Beach, CA. C.R. Fricker and J.L. Clancy (eds.). American Water Works Association, Denver, Colorado.
Ong, C.S., Eisler, D.L., Goh, S.H., Tomblin, J., Awad-El-Kariem, F.M., Beard, C.B., Xiao, L., Sulaiman, I., Lal, A., Fyfe, M., King, A., Bowie, W.R. et Isaac-Renton, J.L. (1999). Molecular epidemiology of cryptosporidiosis outbreaks and transmission in British Columbia, Canada. Am. J. Trop. Med. Hyg., 61(1):63-69.
Ong, C.S., Eisler, D.L., Alikhani, A., Fung, V.W., Tomblin, J., Bowie, W.R. et Isaac-Renton, J.L. (2002). Novel Cryptosporidium genotypes in sporadic cryptosporidiosis cases: first report of human infections with a cervine genotype. EmerG. Infect. Dis., 8(3):263-268.
Ongerth, J.E., Riggs, J. et Crook, J. (1989). A study of water treatment practices for the removal of Giardia lamblia cysts. American Water Works Association Research Foundation and American Water Works Association, Denver, Colorado.
Ongerth, J.E. (2013a). LT2 Cryptosporidium data: what do they tell us about Cryptosporidium in surface water in the United States? Environmental Science and Technology, 47:4029-4038.
Ongerth, J.E. (2013b). The concentration of Cryptosporidium and Giardia in water - the role and importance of recovery efficiency. Water Res., 47:2479-2488.
Ongerth, J.E. et Hutton, P.E. (1997). DE filtration to remove Cryptosporidium. J. Am. Water Works Assoc., 89(12):39-46.
Ongerth, J.E. et Hutton, P.E. (2001). Testing of diatomaceous earth filtration for removal of Cryptosporidium oocysts. J. Am. Water Works Assoc., 93(12):54-63.
Ongerth, J.E. et Pecoraro, J.P. (1995). Removing Cryptosporidium using multimedia filters. J. Am. Water Works Assoc., 87(12):83-89.
Ongerth, J.E., Hunter, G.D. et DeWalle, F.B. (1995). Watershed use and Giardia cyst presence. Water Res., 29:1295-1299.
Ontario Ministry of Environment (2006). Procedure for disinfection of drinking water in Ontario. PIBS 4448e01. Disponible à :https://dr6j45jk9xcmk.cloudfront.net/documents/1182/99-disinfection-of-drinking-water-en.pdf
Oppenheimer, J.A., Aleta, E.M., Trussell, R.R., Jacangelo, J.G., and Najm, I. (2000). Evaluation of Cryptosporidium inactivation in natural waters. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Oppenheimer, J., Gillogly, T., Stolarik, G. et Ward, R. (2002). Comparing the efficiency of low and medium pressure UV light for inactivating Giardia muris and Cryptosporidium parvum in waters with low and high levels of turbidity. Dans : Proceedings of the Annual Conference and Exhibition of the American Water Works Association, New Orleans, LA, June 16-20. American Water Works Association, Denver, Colorado.
Painter, J.E., Gargano, J.W., Collier, S.A. et Yoder, J.S. (2015a). Giardiasis surveillance - United States, 2011-2012. MMWR Surveill. Summ., 64(3):15-25.
Painter, J.E., Hlavsa, M.C., Collier, S.A., Xiao, L. et Yoder, J.S. (2015b). Cryptosporidiosis surveillance - United States, 2011-2012. MMWR Surveill. Summ., 64(3):1-13.
Partinoudi, V. et Collins, M.R. (2007). Assessing RBF reduction/removal mechanisms for microbial and organic DBP precursors. J. Am. Water Works Assoc., 99(12):61-71.
Passantino, L., Malley, J., Knudson, M., Ward, R. et Kim, J. (2004). Effect of low turbidity and algae on UV disinfection performance. J. Am. Water Works Assoc., 96:128-137.
Patania, N.L, Jacangelo, J.G., Cummings, L., Wilczak, A., Riley, K. et Oppenheimer, J. (1995). Optimization of filtration for cyst removal. American Water Works Association Research Foundation and American Water Works Association. Denver, Colorado.
Payment, P. et Franco, E. (1993). Clostridium perfringens and somatic coliphages as indicators of the efficiency of drinking water treatment for viruses and protozoan cysts. Appl. Environ. Microbiol., 59:2418-2424.
Payment, P. et Pintar, K. (2006). Waterborne pathogens: a critical assessment of methods, results and data analysis. Rev. Sci. Eau, 19(3):233-245.
Payment, P., Siemiatycki, J., Richardson, L., Renaud, G., Franco, E. et Prévost, M. (1997). A prospective epidemiological study of gastrointestinal health effects due to the consumption of drinking water. Int. J. Environ. Health Res., 7:5-31.
Payment, P., Berte, A., Prévost, M., Ménard, B. et Barbeau, B. (2000). Occurrence of pathogenic microorganisms in the Saint Lawrence River (Canada) and comparison of health risks for populations using it as their source of drinking water. Can. J. Microbiol., 46(6):565-576.
Pedley, S., Yates, M., Schijven, J F., West, J., Howard, G. et Barrett, M. (2006). Pathogens: Health relevance, transport and attenuation. Dans : Protecting Groundwater for Health: Managing the Quality of Drinking-water Sources. O. Schmoll, G. Howard, J. Chilton. et I. Chorus (éditeurs). IWA Publishing, Londres, Royaume Uni. p. 49-80.
Pett, B., Smith, F. et Stendahl, D. (1993). Cryptosporidiosis outbreak from an operations point of view. Kitchener-Waterloo, Ontario, Spring 1993. Dans : Proceedings of the AWWA Water Quality Technology Conference, Miami, FL. American Water Works Association, Denver, Colorado. p. 1739-1766.
Petterson, S., Signor, R., Ashbolt, N. et Roser, D. (2006). QMRA methodology. Dans : MicroRisk - Microbiological risk assessment: a scientific basis for managing drinking water safety from source to tap. Avril.
Petterson, S., Roser, D. et Deere, D. (2015). Characterizing the concentration of Cryptosporidium in Australian surface waters for setting health-based targets for drinking water treatment. J. Water Health, 13(3):879-896.
Piet, G.J. et Zoeteman, B.C.J. (1980). Organic water quality changes during sand bank and dune filtration of surface waters in the Netherlands. J. Am. Water Works Assoc., 72(7):400-404.
Pintar, K.D.M., Fazil, A., Pollari, F., Waltner-Toews, D., Charron, D.F., McEwen, S.A. et Walton, T. (2012). Considering the risk of infection by Cryptosporidium via consumption of municipally treated drinking water from a surface water source in a southwestern Ontario community. Risk Anal., 32(7):1122-1138.
Plummer, J.D., Edzwald, J.K. et Kelley, M.B. (1995). Removing Cryptosporidium by dissolved air flotation. J. Am. Water Works Assoc., 87(9):85-95.
Plutzer, J., Törökné, A. et Karanis, P. (2010). Combination of ARAD microfiber filtration and LAMP methodology for simple, rapid and cost-effective detection of human pathogenic Giardi duodenalis and Cryptosporidium spp. in drinking water. Lett. Appl. Microbiol.. 50:82-88.
Pokorny, N.J., Weir, S.C., Carreno, R.A., Trevors, J.T. et Lee, H. (2002). Influence of temperature on Cryptosporidium parvum oocyst infectivity in river water samples as detected by tissue culture assay. J. Parasitol., 88(3):641-643.
Pollok, R.C., McDonald, V., Kelly, P. et Farthing, M.J. (2003). The role of Cryptosporidium parvum-derived phospholipase in intestinal epithelial cell invasion. Parasitol. Res., 90(3):181-186.
Pond, K., Rueedi, J. et Pedley, S. (2004). MicroRisk literature review--Pathogens in drinking water sources. Centre for Public and Environmental Health, University of Surrey, Guildford, Surrey, Royaume Uni. Disponible à : www.microrisk.com/uploads/pathogens_in_drinking_water_sources.pdf
Priest, J.W., Bern, C., Xiao, L., Roberts, J.M., Kwon, J.P., Lescano, A.G., Checkley, W., Cabrera, L., Moss, D.M., Arrowood, M.J., Sterling, C.R., Gilman, R.H. et Lammie, P.J. (2006). Longitudinal analysis of Cryptosporidium species-specific immunoglobulin G antibody responses in Peruvian children. Clin. Vaccine Immunol., 13(1):123-131.
Prystajecky, N., Huck, P.M., Schreier, H. et Isaac-Renton, J.L. (2014). Assessment of Giardia and Cryptosporidium spp. as a microbial source tracking tool for surface water: application in a mixed-use watershed. Appl. Environ. Microbiol. 80(8):2328-2336.
Prystajecky, N., Tsui, C.K.M., Haiao, W.W.L., Uyaguari-Diaz, M.L., Ho, J., Tang, P. et Isaac-Renton, J. (2015). Giardia spp. are commonly found in mixed assemblages in surface water, as revealed by molecular and whole-genome characterization. Appl. Environ. Microbiol.. 81(14):4827-4834.
Pyper, G.R. (1985). Slow sand filter and package treatment plant evaluation: Operating costs and removal of bacteria, Giardia, and trihalomethanes. U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA/600/S2‑85/052).
Quah, J.X., Ambu, S., Lim, Y.A., Mahdy, M.A. et Mak, J.W. (2011). Molecular identification of Cryptosporidium parvum from avian hosts. Parasitology, 138(5):573-577.
Quintero-Betancourt, W., Peele, E.R. et Rose, J.B. (2002). Cryptosporidium parvum and Cyclospora cayetanensis: a review of laboratory methods for detection of these waterborne parasites. J. Microbiol. Methods, 49(3):209-224.
Quintero-Betancourt, W., Gennaccaro, A.L., Scott, T.M. et Rose, J.B. (2003). Assessment of methods for detection of infectious Cryptosporidium oocysts and Giardia cysts in reclaimed effluents. Appl. Environ. Microbiol., 69(9):5380-5388.
Rajah, S.H., Suresh, K.G., Vellayan, S., Mak, J.W., Khairul, A.A., Init, I., Vennila, G.D., Saminathan, R. et Ramakrishnan, K. (1999). Blastocystis in animal handlers. Parasitol. Res., 85:1032-1033.
Ralston, B.J., McAllister, T.A. et Olson, M.E. (2003). Prevalence and infection pattern of naturally acquired giardiasis and cryptosporidiosis in range beef calves and their dams. Vet. Parasitol., 14(2):113-122.
Ramirez, N.E. et Sreevatsan, S. (2006). Development of a sensitive detection system for Cryptosporidium in environmental samples. Vet. Parasitol., 136(3-4):201-213.
Ray, C., Schubert, J., Linsky, R.B. et Melin, G. (2002a). Introduction. Dans : Riverbank filtration: Improving source-water quality. C. Ray, G. Melin and R.B. Linsky (eds.). Kluwer Academic Publishers, Dordrecht, The Netherlands. p. 1-15.
Ray, C., Grischek, T., Schubert, J., Wang, J.Z. et Speth, T.F. (2002b). A perspective of riverbank filtration. J. Am. Water Works Assoc., 94(4):149-160.
Read, C., Walters, J., Robertson, I.D. et Thompson, R.C. (2002). Correlation between genotype of Giardia duodenalis and diarrhoea. Int. J. Parasitol., 32(2):229-231.
Read, C.M., Monis, P.T. et Thompson, R.C. (2004). Discrimination of all genotypes of Giardia duodenalis at the glutamate dehydrogenase locus using PCR-RFLP. Infect. Genet. Evol., 4(2):125-130.
Regli, S., Rose, J.B., Haas, C.N. et Gerba, C.P. (1991). Modeling the risk from Giardia and viruses in drinking water. J. Am. Water Works Assoc., 83(11):76-84.
Rendtorff, R.C. (1978). The experimental transmission of Giardia lamblia among volunteer subjects. Dans : Waterborne transmission of giardiasis. W. Jakubowski and J.C. Hoff (eds.). U.S. Environmental Protection Agency, Cincinnati, Ohio. p. 64-81 (EPA 600/9-79-001).
Revetta, R.P., Rodgers, M.R. et Kinkle, B.K. (2005). Isolation and identification of freshwater bacteria antagonistic to Giardia intestinalis cysts. J. Water Health, 3(1):83-88.
Reynolds, D.T., Slade, R.B., Sykes, N.J., Jonas, A. et Fricker, C.R. (1999). Detection of Cryptosporidium oocysts in water: techniques for generating precise recovery data. J. Appl. Microbiol., 87(6):804-813.
Rice, E.W. et Schaefer, F.W., III. (1981). Improved in vitro excystation procedure for Giardia lamblia cysts. J. Clin. Microbiol., 14:709-710.
Riggs, M.W. (2002). Recent advances in cryptosporidiosis: the immune response. Microbes Infect., 4(10):1067-1080.
Rimhanen-Finne, R., Ronkainen, P. et Hanninen, M.L. (2001). Simultaneous detection of Cryptosporidium parvum and Giardia in sewage sludge by IC-PCR. J. Appl. Microbiol., 91(6):1030-1035.
Rimhanen-Finne, R., Horman, A., Ronkainen, P. et Hanninen, M.L. (2002). An IC-PCR method for detection of Cryptosporidium and Giardia in natural surface waters in Finland. J. Microbiol. Methods, 50(3):299-303.
Roach, P.D., Olson, M.E., Whitley, G. et Wallis, P.M. (1993). Waterborne Giardia cysts and Cryptosporidium oocysts in the Yukon, Canada. Appl. Environ. Microbiol., 59:67-73.
Robertson, B., Sinclair, M.I., Forbes, A.B., Veitch, M., Kirk, M., Cunliffe, D., Willis, J. et Fairley, C.K. (2002). Case-control studies of sporadic cryptosporidiosis in Melbourne and Adelaide, Australia. Epidemiol. Infect., 128(3):419-431.
Robertson, L.J., Campbell, A.T. et Smith, H.V. (1992). Survival of Cryptosporidium parvum oocysts under various environmental pressures. Appl. Environ. Microbiol., 58:3494-3500.
Robertson, L.J., Campbell, A.T. et Smith, H.V. (1998). Viability of Cryptosporidium parvum oocysts: assessment by the dye permeability assay. Appl. Environ. Microbiol., 64(9):3544-3545.
Robertson, L.J., Hermansen, L., Gjerde, B.K., Strand, E., Alvsvåg, J.O. et Langeland, N. (2006). Application of genotyping during an extensive outbreak of waterborne giardiasis in Bergen, Norway, during autumn and winter 2004. Appl. Environ. Microbiol., 72(3):2212-2217.
Rochelle, P.A., Ferguson, D.M., Handojo, T.J., De Leon, R., Stewart, M.H. et Wolfe, R.L. (1997). An assay combining cell culture with reverse transcriptase PCR to detect and determine the infectivity of waterborne Cryptosporidium parvum. Appl. Environ. Microbiol., 63:2029-2037.
Rochelle, P.A., De Leon, R., Johnson, A., Stewart, M.H. et Wolfe, R.L. (1999). Evaluation of immunomagnetic separation for recovery of infectious Cryptosporidium parvum oocysts from environmental samples. Appl. Environ. Microbiol., 65(2):841-845.
Rochelle, P.A., Ferguson, D.M., Johnson, A.M. et De Leon, R. (2001). Quantitation of Cryptosporidium parvum infection in cell culture using a colorimetric in situ hybridization assay. J. Eukaryot. Microbiol., 48(5):565-574.
Rochelle, P.A., Marshall, M.M., Mead, J.R., Johnson, A.M., Korich, D.G., Rosen, J.S. et De Leon, R. (2002). Comparison of in vitro cell culture and a mouse assay for measuring infectivity of Cryptosporidium parvum. Appl. Environ. Microbiol., 68(8):3809-3817.
Rochelle, P.A., Modifi, A.A., Marshall, M.M., Upton, S.J., Montelone, B., Woods, K. et Di Giovanni, G.(2004). An investigation of UV disinfection and repair in Cryptosporidium parvum. AWWA Research Foundation, Denver, Colorado.
Rochelle, P.A., Johnson, A.M., De Leon, R. et Di Giovanni, G.D. (2012). Assessing the risk of infectious Cryptosporidium in drinking water. J. Am. Water Works Assoc., 104:E325-E336.
Rochelle, P.S., Johnson, A.M. et Di Giovanni, G.D., (2015). Still optimizing a cell culture infectivity assay for Cryptosporidium. Dans : American Water Works Association International Symposium on Waterborne Pathogens Conference Proceedings, Savannah, Georgia.
Rook, J.J. (1976). Haloforms in drinking water. J. Am. Water Works Assoc., 68(3):168-172.
Rosales, M.J., Cordón, G.P., Moreno, M.S. et Sánchez, C.M. (2005). Extracellular like-gregarine stages of Cryptosporidium parvum. Acta Trop., 95(1):74-78.
Rose, J.B. et Gerba, C.P. (1991). Use of risk assessment for development of microbial standards. Water Sci. Technol., 24:29-34.
Rose, J.B., Darbin, H. et Gerba, C.P. (1988). Correlations of the protozoa, Cryptosporidium and Giardia, with water quality variables in a watershed. Water Sci. Technol., 20(11/12):271-276.
Rose, J.B, Gerba, C.P. et Jakubowski, W. (1991). Survey of potable water supplies for Cryptosporidium and Giardia. Environ. Sci. Technol., 25(8):1393-1400.
Rose, J.B., Lisle, J.T. et LeChevallier, M. (1997). Waterborne cryptosporidiosis: incidence, outbreaks and treatment strategies. Dans : Cryptosporidium and cryptosporidiosis. R. Fayer (ed.). CRC Press, Boca Raton, Florida. p. 93-109.
Roy, S.L., DeLong, S.M., Stenzel, S.A., Shiferaw, B., Roberts, J.M., Khalakdina, A., Marcus, R., Segler, S.D., Shah, D.D., Thomas, S., Vugia, D.J., Zansky, S.M., Dietz, V. et Bea, M.J. (2004). Risk factors for sporadic cryptosporidiosis among immunocompetent persons in the United States from 1999 to 2001. J. Clin. Microbiol., 42(7):2944-2951.
Ruecker, N.J., Matsune, J.C., Wilkes, G., Lapen, D.R., Topp, E., Edge, T.A., Sensen, C.W., Xiao, L. et Neumann, N.F. (2012). Molecular and phylogenetic approaches for assessing sources of Cryptosporidium contamination in water. Water Res., 46:5135-5150.
Ryan, U., Xiao, L., Read, C., Zhou, L., Lal, A.A. et Pavlasek, I. (2003). Identification of novel Cryptosporidium genotypes from the Czech RepubliC. Appl. Environ. Microbiol., 69:4302-4307.
Ryan, U.M., Bath, C., Robertson, I., Read, C., Elliot, A., McInnes, L., Traub, R. et Besier, B. (2005a). Sheep may not be an important zoonotic reservoir for Cryptosporidium and Giardia parasites. Appl. Environ. Microbiol., 71(9):4992-4997.
Ryan, U., Read, C., Hawkins, P., Warnecke, M., Swanson, P., Griffith, M., Deere, D., Cunningham, M. et Cox, P. (2005b). Genotypes of Cryptosporidium from Sydney water catchment areas. J. Appl. Microbiol., 98(5):1221-1229.
Ryan, U., Fayer, R. et Xiao, L. (2014). Cryptosporidium species in humans and animals: current understanding and research needs. Parasitology. 141:1667-1685.
Ryan, U. et Hijjawi, N. (2015). New developments in Cryptosporidium research. Int. J. Parasitol., 45:367-373.
Santé Canada. (2006). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Les trihalométhanes. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-trihalomethanes-eau/index-fra.php
Santé Canada (2008a). Recommandations pour la qualité de l'eau potable au Canada : document technique - Le chlorite et le chlorate. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-chlorite-chlorate-eau/index-fra.php
Santé Canada (2008b). Recommandations pour la qualité de l'eau potable au Canada : document technique - Les acides haloacétiques. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-haloacetic-haloacetique-eau/index-fra.php
Santé Canada (2011a). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Les virus entériques. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-enteric-virus-enterique-eau/index-fra.php
Santé Canada (2011b). Recommandations pour la qualité de l'eau potable au Canada : Document technique - N-nitrosodiméthylamine (NDMA). Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-nitrosodimethylamine-eau/index-fra.php
Santé Canada (2012a). Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada - Troisième édition. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-recreational-recreative-eau/index-fra.php
Santé Canada (2012b). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Escherichia coli. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-ecoli-eau/index-fra.php
Santé Canada (2012c). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Les coliformes totaux. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-coliforms-coliformes-eau/index-fra.php
Santé Canada (2012d). Recommandations pour la qualité de l'eau potable au Canada : Document technique - La turbidité. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-turbidity-turbidite-eau/index-fra.php
Santé Canada (2016). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Le bromate. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : www.hc-sc.gc.ca/ewh-semt/pubs/water-eau/index-fra.php
Sartory, D.P., Parton, A., Parton, A.C., Roberts, J. et Bergmann, K. (1998). Recovery of Cryptosporidium oocysts from small and large volume water samples using a compressed foam filter system. Lett. Appl. Microbiol., 27(6):318-322.
Schaefer, D.A., Auerbach-Dixon, B.A. et Riggs, M.W. (2000). Characterization and formulation of multiple epitope-specific neutralizing monoclonal antibodies for passive immunization against cryptosporidiosis. Infect. Immunol., 68(5):2608-2616.
Schets, F.M., Engels, G.B., During, M. et de Roda Husman, A.M. (2005). Detection of infectious Cryptosporidium oocysts by cell culture immunofluorescence assay: applicability to environmental samples. Appl. Environ. Microbiol., 71(11):6793-6798.
Schijven, J., Berger, P. et Miettinen, I. (2002). Removal of pathogens, surrogates, indicators, and toxins using riverbank filtration. Dans : Riverbank filtration: improving source-water quality. C. Ray, G. Melin and R.B. Linsky (éditeurs). Kluwer Academic Publishers, Dordrecht, Pays-Bas. p. 73-116.
Schijven, J.F., Teunis, P.F.M., Rutjes, S.A., Bouwknegt, M., and de Roda Husman, A.M. (2011). QMRAspot: a tool for quantitative microbial risk assessment from surface water to potable water. Water Res., 45:5564-5576.
Schijven, J.F., van den Berg, H.H.J.L., Colin, M., Dullemont, Y., Hijnen, W.A.M., Magic-Knezev, A., Oorthuizen, W.A. et Wubbels, G. (2013). A mathematical model for removal of human pathogenic viruses and bacteria by slow sand filtration under variable operational conditions. Water Res., 47(7):2592-2602.
Schmidt, P.J. et Emelko, M.B. (2010). QMRA and decision-making: Are we handling measurement errors associated with pathogen concentration data correctly? Water Res.,45(2):461-472.
Schmidt, P.J., Reilly, P.M. et Emelko, M.B. (2010) Quantification of analytical recovery in particle and microorganism enumeration methods. Environ. Sci. Technol., 44(5):1705-1712.
Schmidt, P.J., Emelko, M.B. et Thompson, M.E. (2013). Analytical recovery of protozoan enumeration methods: Have drinking water QMRA models corrected or created bias. Water Res., 47:2399-2408.
Schuler, P.F. et Ghosh, M.M. (1990). Diatomaceous earth filtration of cysts and other particulates using chemical additives. J. Am. Water Works Assoc., 82(12):67-75.
Schuler, P.F., Ghosh, M.M. et Gopalan, P. (1991). Slow sand and diatomaceous earth filtration of cysts and other particulates. Water Res., 25(8):995-1005.
Schuster, C.J., Ellis, A.G., Robertson, W.J., Charron, D.F., Aramini, J.J., Marshall, B.J. et Medeiros, D.T. (2005). Infectious disease outbreaks related to drinking water in Canada, 1974-2001. Can. J. Public Health, 96(4):254-258.
Sharp, E. (2015). Using online zeta potential measurements for coagulation control: A first for the UK Water Industry. International water association specialist conference on natural organic matter in drinking water, Malmo, Suède.
Sharpless, C.M. et Linden, K.G. (2001). UV photolysis of nitrate: Effects of natural organic matter and dissolved inorganic carbon and implication for UV water disinfection. Environ. Sci. Technol., 35(14): 2949-2955.
Shaw, K, Walker, S. et Koopman, B. (2000). Improving filtration of Cryptosporidium. J. Am. Water Works Assoc., 92(11):103-111.
Shin, G., Linden, K.G., Arrowood, M.J. et Sobsey, M.D. (2001). Low-pressure UV inactivation and DNA repair potential of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 67(7):3029-3032.
Shin, G., Linden, K.G. et Faubert, G. (2010). Reactivation of Giardia lamblia cysts after exposure to polychromatic UV light. Lett. Appl. Microbiol., 51(4):395-9.
Shin, G. et Linden, K.G. (2015). Reactivation of Giardia lamblia cysts after exposure to low-pressure UV irradiation. Can. J. Microbiol., 61(7):513-516.
Shukla, R., Giraldo, P., Kraliz, A., Finnigan, M. et Sanchez, A.L. (2006). Cryptosporidium spp. and other zoonotic enteric parasites in a sample of domestic dogs and cats in the Niagara region of Ontario. Can. Vet. J., 47(12):1179-1184.
Sifuentes, L.Y. et Di Giovanni, G.D. (2007). Aged HCT-8 cell monolayers support Cryptosporidium parvum infection. Appl. Environ. Microbiol., 73(23):7548-7551.
Sinreich, M., Pronk, M. et Kozel, R. (2014). Microbiological monitoring and classification of karst sprints. Environ. Earth Sci., 71:563-572.
Slifko, T.R., Friedman, D., Rose, J.B. et Jakubowski, W. (1997). An in vitro method for detecting infectious Cryptosporidium oocysts with cell culture. Appl. Environ. Microbiol., 63:3669-3675.
Slifko, T.R., Huffman, D.E., Dussert, B., Owens, J.H., Jakubowski, W., Haas, C.N. et Rose, J.B. (2002). Comparison of tissue culture and animal models for assessment of Cryptosporidium parvum infection. Exp. Parasitol., 101(2-3):97-106.
Sluter, S.D., Tzipori, S. et Widmer, G. (1997). Parameters affecting polymerase chain reaction detection of waterborne Cryptosporidium parvum oocysts. Appl. Microbiol. Biotechnol., 48(3):325-330.
Smeets, P.W.M.H., van der Helm, A.W.C., Dullemont, Y.J., Rietveld, L.C., van Dijk, J.C. et Medema, G.J. (2006). Inactivation of Escherichia coli by ozone under bench-scale plug flow and full-scale hydraulic conditions. Water Res., 40(17):3239-3248.
Smeets, P.W.M.H., Medema, G.J. et Van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2(1):1-14.
Smith, A., Reacher, M., Smerdon, W., Adak, G.K., Nichols, G. et Chalmers, R.M. (2006). Outbreaks of waterborne infectious intestinal disease in England and Wales, 1992-2003. Epidemiol. Infect., 134(6):1141-1149.
Smith, H.V. et Rose, J.B. (1990). Waterborne cryptosporidiosis. Parasitol. Today, 6:8-12.
Smith, H.V., Parker, J.F.W., Bukhari, Z., Campbell, D.M., Benton, C., Booth, N. et McCreadie, A. (1993). Significance of small numbers of Cryptosporidium sp. oocysts in water. Lancet, 342(8866):312-313.
Smith, H.V., Cacciò, S.M., Cook, N., Nichols, R.A. et Tait, A. (2007). Cryptosporidium and Giardia as foodborne zoonoses. Vet. Parasitol., 149(1-2):29-40.
Smith, J.J., Gunasekera, T.S., Barardi, C.R., Veal, D. et Vesey, G. (2004). Determination of Cryptosporidium parvum oocyst viability by fluorescence in situ hybridization using a ribosomal RNA-directed probe. J. Appl. Microbiol., 96(2):409-417.
Soave, R. (1996). Cyclospora: an overview. Clin. Infect. Dis., 23(3):429-435.
Sontheimer, H. (1980). Experience with Riverbank Filtration Along the Rhine River. J. Am. Water Works Assoc., 72(7):366-390.
Soucie, W.J. et Sheen, B.J. (2007). Filter-to-waste optimization. J. Am. Water Works Assoc., 99(5):148-157.
Spano, F., Putignani, L., Naitza, S., Puri, C., Wright, S. et Crisanti, A. (1998). Molecular cloning and expression analysis of a Cryptosporidium parvum gene encoding a new member of the thrombospondin family. Mol. Biochem. Parasitol., 92(1):147-162.
Staatscourant. (2001). Dutch Drinking Water Decree. Dutch Government Gazette, January 9, 2001.
Stachan, R. et Kunstýr, I. (1983). Minimal infectious doses and prepatent periods in Giardia muris, Spironucleus muris and Trichomonas muris. Zentralbl. Bakteriol. HyG. A, 256:249-256.
Staggs, S.E., Beckman, E.M., Keely, S.P., Mackwan, R., Ware, M.W., Moyer, A.P., Ferretti, J.A., Sayed, A., Xiao, L. et Villegas, E.N. (2013). The applicability of TaqMan-based quantitative real-time PCR assays for detecting and enumerating Cryptosporidium spp. oocysts in the environment. PLOSOne, 8(6):e66562.
Stantic-Pavlinic, M., Xiao, L., Glaberman, S., Lal, A.A., Orazen, T., Rataj-Verglez, A., Logar, J. et Berce, I. (2003). Cryptosporidiosis associated with animal contacts. Wien. Klin. Wochenschr., 115(34):125-127.
States, S., Stadterman, K., Ammon, L., Vogel, P. Baldizar, J., Wright, D., Conley, L. et Sykor, J. (1997). Protozoa in river water: sources, occurrence and treatment. J. Am. Water Works Assoc., 89(9):74-83.
States, S., Tomko, R., Scheuring, M. et Casson, L. (2002). Enhanced coagulation and removal of Cryptosporidium. J. Am. Water Works Assoc., 94(11):67-77.
Statistique Canada (2004). Enquête sur la santé dans les collectivités canadiennes, Nutrition, volet général sur la santé.
Statistique Canada (2008). Guide de l'utilisateur : Enquête sur la santé dans les collectivités canadiennes, Nutrition, volet général sur la santé.
Statistique Canada (2012). Tables de mortalité, Canada, provinces et territoires, 2007 à 2009. Ministre de l'industrie (ISBN 978‑1-100-99991-3). Disponible à : http://www.statcan.gc.ca/pub/84-537-x/84-537-x2013003-fra.pdf
Stehr-Green, J.K., McCaig, L., Remsen, H.M., Rains, C.S., Fox, M. et Juranek, D.D. (1987). Shedding of oocysts in immunocompetent individuals infected with Cryptosporidium. Am. J. Trop. Med. Hyg., 36:338-342.
Stenzel, D.J. et Boreham, P.F.L. (1996). Blastocystis hominis revisited. Clin. Microbiol. Rev.. 9(4):563-584.
Stevens, M.N., Ashbolt, N.J. et Cunliffe, D. (2001). Microbial indicators of drinking water quality--A NHMRC discussion paper. National Health and Medical Research Council, Canberra, Australia.
Stinear, T., Matusan, A., Hines, K. et Sandery, M. (1996). Detection of a single viable Cryptosporidium parvum oocyst in environmental water concentrates by reverse transcription-PCR. Appl. Environ. Microbiol., 62(9):3385-3390.
Stirling, R., Aramini, J., Ellis, A., Lim, G., Meyers, R., Fleury, M. et Werker, D. (2001). Waterborne cryptosporidiosis outbreak, North Battleford, Saskatchewan, spring 2001. Can. Commun. Dis. Rep., 27(22):185-192.
Stuart, J.M., Orr, H.J., Warburton, F.G., Jeyakanth, S., Pugh, C., Morris, I., Sarangi, J. et Nichols, G. (2003). Risk factors for sporadic giardiasis: a case-control study in southwestern England. EmerG. Infect. Dis., 9(2):229-233.
Sturbaum, G.D., Klonicki, P.T., Marshall, M.M., Jost, B.H., Clay, B.L. et Sterling, C.R. (2002). Immunomagnetic separation (IMS)-fluorescent antibody detection and IMS-PCR detection of seeded Cryptosporidium parvum oocysts in natural waters and their limitations. Appl. Environ. Microbiol., 68(6):2991-2996.
Sullivan, L.P., Bryck, J., Jackson, J. Zach, A. et Jones, C. (2014). An evaluation of the impacts of membrane filtration under the influence of TOC, MIB and geosmin. Dans : Proceedings of the Membrane Technology Conference. American Water Works Association, Denver, Colorado.
Sunderland, D., Graczyk, T.K., Tamang, L. et Breysse, P.N. (2007). Impact of bathers on levels of Cryptosporidium parvum oocysts and Giardia lamblia cysts in recreational beach waters. Water Res., 41:3483- 3489.
Swaffer, B.A., Vial, H.M., King, B.J., Daly, R., Frizenschaf, J. et Monis, P.T. (2014). Investigating source water Cryptosporidium concentration, species and infectivity rates during rainfall-runoff in a multi-use catchment. Water Res., 67:310-320.
Swertfeger, J., Metz, D.H., DeMarco, J., Braghetta, A. et Jacangelo, J.G. (1999). Effect of filter media on cyst and oocyst removal. J. Am. Water Works Assoc., 91(9):90-100.
Taguchi, T., Shinozaki, Y., Takeyama, H., Haraguchi, S., Yoshino, M., Kaneko, M., Ishimori, Y. et Matsunaga, T. (2006). Direct counting of Cryptosporidium parvum oocysts using fluorescence in situ hybridization on a membrane filter. J. Microbiol. Methods, 67(2):373-380.
Takashima, Y., Xuan, X., Kimata, I., Iseki, M., Kodama, Y., Nagane, N., Nagasawa, H., Matsumoto, Y., Mikami, T. et Otsuka, H. (2003). Recombinant bovine herpesvirus-1 expressing p23 protein of Cryptosporidium parvum induces neutralizing antibodies in rabbits. J. Parasitol., 89(2):276-282.
Templeton, M.R., Andrews, R.C. et Hofmann, R. (2005). Inactivation of particle-associated viral surrogates by ultraviolet light. Water Res., 39(15):3487-3500.
Templeton, M.R., Andrews, R.C. et Hofmann, R. (2006). Impact of iron particles in groundwater on the UV inactivation of bacteriophages MS2 and T4. J. Appl. Microbiol., 101(3):732-741.
Templeton, M.R., Andrews, R.C. et Hofmann, R. (2007). Removal of particle-associated bacteriophages by dual-media filtration at different filter cycle stages and impacts on subsequent UV disinfection. Water Res., 41(11):2393-2406.
Templeton, M.R., Andrews, R.C. et Hofmann, R. (2008). Particle-associated viruses in water: impacts on disinfection processes. Critical Reviews in Environmental Science and Technology, 38(3):137-164.
Tfaily, R., Papineau, I., Andrews, R.C. et Barbeau, B. (2015). Application of quantitative microbial risk assessment at 17 Canadian water treatment facilities. J. Am. Water Works Assoc., 107(10):E497-E508.
Thomas, M.K., Murray, R., Flockhart, L., Pintar, K., Pollari, F., Fazil, A., Nesbitt, A. et Marshall, B. (2013). Estimates of the burden of foodborne illness in Canada for 30 specified pathogens and unspecified agents, circa 2006. Foodborne PathoG. Dis., 10(7):639-648.
Thompson, R.C. (2004). The zoonotic significance and molecular epidemiology of Giardia and giardiasis. Vet. Parasitol., 126(1-2):15-35.
Thompson, R.C. et Monis, P.T. (2004). Variation in Giardia: implications for taxonomy and epidemiology. Adv. Parasitol., 58:69-137.
Thompson, R.C., Palmer, C.S. et O'Handley, R. (2008). The public health and clinical significance of Giardia and Cryptosporidium in domestic animals. Vet. J., 177(1):18-25.
Timms, S., Slade, J.S. et Fricker, C.R. (1995). Removal of Cryptosporidium by slow sand filtration. Water Sci. Technol., 31(5-6):81-84.
Tollestrup, K., Frost, F.J., Kunde, T.R., Yates, M.V. et Jackson, S. (2014) Cryptosporidium infection, onsite wastewater systems and private wells in the arid southwest. J. Water Health, 12(1):161-172.
Traub, R.J., Monis, P.T., Robertson, I., Irwin, P., Mencke, N. et Thompson, R.C. (2004). Epidemiological and molecular evidence supports the zoonotic transmission of Giardia among humans and dogs living in the same community. Parasitology, 128(Pt. 3):253-262.
Traub, R.J., Robertson, I.D., Irwin, P.J., Mencke, N. et Thompson, R.C. (2005). Canine gastrointestinal parasitic zoonoses in India. Trends Parasitol., 21(1):42-48.
Trimboli, P., Lozier, J. et Johnson, W. (2001). Demonstrating the integrity of a large scale microfiltration plant using a Bacillus spore challenge test. Water Sci. Technol. Water Supply, 1(5-6):1-12.
Tufenkji, N., Ryan, J.N. et Elimelech, M. (2002). The promise of bank filtration. Environ. Sci. Technol., 36(21):422A-428A.
Tufenkji, N., Miller, G.F., Ryan, J.N., Harvey, R.W. et Elimelech, M. (2004). Transport of Cryptosporidium oocysts in porous media: role of straining and physiochemical filtration. Environ. Sci. Technol., 38(22): 5932-5938.
Tufenkji, N. et Elimelech, M. (2005). Spatial distribution of Cryptosporidium oocysts in porous media: Evidence for dual mode deposition. Environ. Sci. Technol., 39(10):3620-3629.
Tufenkji, N., Dixon, D.R., Considine, R. et Drummond, C.J. (2006). Multi-scale Cryptosporidium/sand interactions in water treatment. Water Res., 40(18):3315-3331.
Tufenkji, N. (2007). Modeling microbial transport in porous media: Traditional approaches and recent developments. Adv. Water Resour., 30(6-7):31455-31469.
Tufenkji, N. et Emelko, M.B. (2011). Fate and transport of microbial contaminants. Dans : Encyclopedia of Environmental Health. J.O. Nriagu (ed.). Elsevier B.V. p. 715-726.
Tyzzer, E.E. (1907). A sporozoan found in the peptic glands of the common mouse. ProC. SoC. Exp. Biol. Med., 5:12-13.
Tyzzer, E.E. (1912). Cryptosporidium parvum (sp. nov.): a coccidian found in the small intestine of the common mouse. Arch. Protistenk., 26:394-418.
Tzipori, S. (1983). Cryptosporidiosis in animals and humans. Microbiol. Rev., 47:84-96.
Tzipori, S. et Ward, H. (2002). Cryptosporidiosis: biology, pathogenesis and disease. Microbes Infect., 4(10):1047-1058.
Umejiego, N.N., Li, C., Riera, T., Hedstrom, L. et Striepen, B. (2004). Cryptosporidium parvum IMP dehydrogenase: identification of functional, structural, and dynamic properties that can be exploited for drug design. J. Biol. Chem., 279(39):40320-40327.
Ungar, B.L.P. (1994). Cryptosporidium and cryptosporidiosis. Dans : Textbook of AIDS medicine. S. Broder, D. Bolognesi and T.C. Merigan, Jr. (eds.). Williams and Wilkins, Baltimore, Maryland. Chapter 21.
U.S. EPA (1989). Part V, Environmental Protection Agency, 40 CFR Parts 141 and 142. National Primary Drinking Water Regulations: Filtration; disinfection; turbidity; Giardia lamblia; viruses; Legionella, and heterotrophic bacteria; Final rule. Fed. Regist., 54:27485-27541.
U.S. EPA (1991). Guidance manual for compliance with filtration and disinfection requirements for public water systems using surface water sources. U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2001). Low-pressure membrane filtration for pathogen removal: Application, implementation and regulatory issues. U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA 815-C-01-001).
U.S. EPA (2004). Long Term 1 Enhanced Surface Water Treatment Rule - Turbidity provisions technical guidance manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC. (EPA 816-R-04-007).
U.S. EPA (2005a). Method 1623: Cryptosporidium and Giardia in water by filtration/IMS/FA. Office of Water, Office of Science and Technology, Engineering and Analysis Division, U.S. Environmental Protection Agency, Washington, DC (EPA 821-R-01-025).
U.S. EPA (2005b). Membrane filtration guidance manual. U.S. Environmental Protection Agency, Cincinnati, OH.
U.S. EPA (2006a). National Primary Drinking Water Regulations: Long Term 2 Enhanced Surface Water Treatment; final rule. Fed. Regist., 71(3):678-671; 782-783.
U.S. EPA (2006b). 40 CFR Parts 9, 141 and 142. National Primary Drinking Water Regulations: Ground Water Rule. Final rule. Fed. Regist., 71.
U.S. EPA (2006c). Ultraviolet disinfection guidance manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC (EPA 815-R-06-007).
U.S. EPA (2010). Long Term 2 Enhanced Surface Water Treatment Rule Toolbox Guidance Manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC. (EPA 815-R-09-016).
U.S. EPA (2012). Method 1623.1: Cryptosporidium and Giardia in water by filtration/IMS/FA. Office of Water, Office of Science and Technology, Engineering and Analysis Division, U.S. Environmental Protection Agency, Washington, DC (EPA 821-R-01-025).
U.S. EPA (2014). Microbiological risk assessment (MRA) tools, methods, and approaches for water media. Office of Water, Office of Science and Technology. U.S. Environmental Protection Agency, Washington, DC. (EPA‑820‑R‑14‑009).
Valade, M.T., Becker, W.C.and Edzwald, J.K. (2009). Treatment selection guidelines for particle and NOM removal. J. Water Supply Res. Technol. AQUA, 58(6):424-432.
Van Dyke, M.I., Morton, V., Anderson, W.B., Isaac-Renton, J.L. et Huck, P. (2006). The occurrence of selected bacterial and protozoan pathogens in the Grand River watershed. Dans : Proceedings of the 12th National Conference on Drinking Water, Saint John, New Brunswick, April 1-4, 2006. Association canadienne des eaux potables et usées, Ottawa, Ontario.
Van Dyke, M.I., Ong, C.S.L., Prystajecky, N.A., Isaac-Renton, J.L. et Huck, P.M. (2012). Identifying host sources, human health risk and indicators of Cryptosporidium and Giardia in a Canadian watershed influenced by urban and rural activities. J. Water. Health., 10(2):311-323.
Vesey, G., Griffiths, K.R., Gauci, M.R., Deere, D., Williams, K.L. et Veal, D.A. (1997). Simple and rapid measurement of Cryptosporidium excystation using flow cytometry. Int. J. Parasitol., 27(11):1353-1359.
VROM. (2005). Inspectorate guideline. Assessment of the microbial safety of drinking water. VROM Inspectorate, the Netherlands,
Walker, M.J., Montemagno, C.D. et Jenkins, M.B. (1998). Source water assessment and nonpoint sources of acutely toxic contaminants: A review of research related to survival and transport of Cryptosporidium parvum. Water Resour. Res., 34(12):3383-3392.
Wallis, P.M., Isaac-Renton, J.L., Erlandsen, S.L. et Olson, M.E. (1995). Risk assessment for waterborne giardiasis and cryptosporidiosis in Canada. Unpublished report to Health Canada.
Wallis, P.M., Erlandsen, S.L., Isaac-Renton, J.L., Olson, M.E., Robertson, W.J. et van Keulen, H. (1996). Prevalence of Giardia cysts and Cryptosporidium oocysts and characterization of Giardia spp. isolated from drinking water in Canada. Appl. Environ. Microbiol., 62(8):2789-2797.
Wallis, P.M., Primrose, B. et Robertson, W.J. (1998). Outbreak of waterborne giardiasis caused by sewage contamination of drinking water. Environ. Health Rev., 42(2):44-51.
Wang, D., Bolton, J.R., Andrews, S.A. et Hofmann, R. (2015). Formation of disinfection by-products in the ultraviolet/chlorine advanced oxidation process. Sci. Total Environ., 518-519:49-57.
Wang, J.Z., Hubbs, S.A. et Song, R. (2002). Evaluation of Riverbank Filtration as a Drinking Water Treatment Process. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Ward, P.I., Deplazes, P., Regli, W., Rinder, H. et Mathis, A. (2002). Detection of eight Cryptosporidium genotypes in surface and waste waters in Europe. Parasitology, 124(Pt. 4):359-368.
Warnecke, M. (2006). Cryptosporidium Oocyst Interactions with Drinking Water Pipe Biofilms. Cooperative Research Centre for Water Quality and Treatment, Salisbury, AU.
Weir, S.C., Pokorny, N.J., Carreno, R.A., Trevors, J.T. et Lee, H. (2001). Improving the rate of infectivity of Cryptosporidium parvum oocysts in cell culture using centrifugation. J. Parasitol., 87(6):1502-1504.
Weiss, W.J., Bouwer, E.J., Ball, W.P., O'Melia, C.R., LeChevallier, M.W., Arora, H. et Speth, T.F. (2003). Riverbank Filtration - Fate of DBP Precursors and Selected Microorganisms. J. Am. Water Works Assoc., 95(10):68-81.
Welker, R., Porter, R., Pett, W.B., Provart, M.R. et Schwartz, K.T. (1994). Cryptosporidiosis outbreak in Kitchener-Waterloo: identification, assessment and future prevention. Dans : Proceedings of the Sixth National Conference on Drinking Water, Victoria, BC, October 16-18, 1994. W. Robertson, T. Kauri and S. Irwin (eds.). American Water Works Association, Denver, Colorado.
Wensaas, K.A., Langeland, N., Hanevik, K., Mørch, K., Eide, G.E. et Rortveit, G. (2012). Irritable bowel syndrome and chronic fatigue 3 years after acute giardiasis: historic cohort study. Gut., 61:214-219.
Westrell, T., Andersson, Y. et Stenström, T.A. (2006). Drinking water consumption patterns in Sweden. J. Water Health, 4(4):511-522.
Widmer, G. (1998). Genetic heterogeneity and PCR detection of Cryptosporidium parvum. Adv. Parasitol., 40:223-239.
Wiesner, J. et Seeber, F. (2005). The plastid-derived organelle of protozoan human parasites as a target of established and emerging drugs. Expert Opin. Ther. Targets, 9:23-44.
Wohlsen, T., Bates, J., Gray, B. et Katouli, M. (2004). Evaluation of five membrane filtration methods for recovery of Cryptosporidium and Giardia isolates from water samples. Appl. Environ. Microbiol., 70(4):2318-2322.
Wolfe, M.S. (1984). Symptomatology, diagnosis and treatment. Dans : Giardia and giardiasis: biology, pathogenesis and epidemiology. S.L. Erlandsen and E.A. Meyer (eds.). Plenum Press, New York, New York. p. 147-161.
Wright, H., Gaithuma, D., Heath, M., Schulz, C. Bogan, T., Cabaj, A. et Schmalweiser, A. (2012). UV Disinfection Knowledge Base. Water Research Foundation, Denver, Colorado.
Wu, J., Long, S.C., Das, D. et Dorner, S.M. (2011). Are microbial indicators and pathogens correlated? A statistical analysis of 40 years of research. J. Water Health, 9(2):265-278.
Wyatt, C.R., Lindahl, S., Austin, K., Kapil, S. et Branch, J. (2005). Response of T lymphocytes from previously infected calves to recombinant Cryptosporidium parvum P23 vaccine antigen. J. Parasitol., 91(5):1239-1242.
Xiao, G., Qiu, Z., Qi, J., Chen, J., Liu, F., Liu, W., Lou, J. et Shu, W. (2013). Occurrence and potential health risk of Cryptosporidium and Giardia in the Three Gorges reservoir, China. Water Res., 47:2431-2445.
Xiao, L. et Fayer, R. (2008). Molecular characterisation of species and genotypes of Cryptosporidium and Giardia and assessment of zoonotic transmission. Int. J. Parasitol., 38(11):1239-1255.
Xiao, L. et Lal, A. (2002). Molecular detection and differentiation of Cryptosporidium oocysts in water: the challenge and promise. Dans : Proceedings of the AWWA Water Quality Technology Conference, Seattle, Washington. American Water Works Association, Denver, Colorado.
Xiao, L., Bern, C., Limor, J., Sulaiman, I., Roberts, J., Checkley, W., Cabrera, L., Gilman, R.H. et Lal, A.A. (2001). Identification of 5 types of Cryptosporidium parasites in children in Lima, Peru. J. Infect. Dis., 183(3):492-497.
Xiao, L., Fayer, R., Ryan, U. et Upton, S.J. (2004). Cryptosporidium taxonomy: recent advances and implications for public health. Clin. Microbiol. Rev., 17(1):72-97.
Xu, P., Widmer, G., Wang, Y., Ozaki, L.S., Alves, J.M., Serrano, M.G., Puiu, D., Manque, P., Akiyoshi, D., Mackey, A.J., Pearson, W.R., Dear, P.H., Bankier, A.T., Peterson, D.L., Abrahamsen, M.S., Kapur, V., Tzipori, S. et Buck, G.A. (2004). The genome of Cryptosporidium hominis. Nature, 431(7012):1107-1112.
Yagita, K., Izumiyama, S., Tachibana, H., Masuda, G., Iseki, M., Furuya, K., Kameoka, Y., Kuroki, T., Itagaki, T. et Endo, T. (2001). Molecular characterization of Cryptosporidium isolates obtained from human and bovine infections in Japan. Parasitol. Res., 87:950-955.
Young, I., Smith, B.A. et Fazil, A. (2015). A systematic review and meta-analysis of the effects of extreme weather events and other weather-related variables on Cryptosporidium and Giardia in fresh surface waters. J. Water Health, 13(1):1-17.
Zhou, Y., Hamouda, M.A., Douglas, I.P., Anderson, W.B. et Huck, P.M. (2015). Accounting for Reported Variability in Cryptosporidium Removal. Ontario Water Works Association, Annual Conference, Toronto, Ontario.
Zimmer, J.L, Slawson, R.M. et Huck, P.M. (2003). Inactivation and potential repair of Cryptosporidium parvum following low- and medium-pressure ultraviolet irradiation. Water Res. 37(14):3517-3523.
Zu, S.-X., Zhu, S.-Y. et Li, J.-F. (1992). Human cryptosporidiosis in China. Trans. R. SoC. Trop. Med. Hyg., 86:639-640.
Annexe A : Autres protozoaires entériques d’origine hydrique : Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis
Toxoplasma gondii est un parasite intracellulaire obligatoire qui infecte presque tous les animaux à sang chaud et les humains. Il se transmet généralement par ingestion de kystes tissulaires à la suite de la consommation de viande infectée crue ou insuffisamment cuite, par ingestion d’oocystes sporulés à la suite de la consommation d’eau ou d’aliments contaminés ou à la suite de la manipulation de sol contaminé ou de fèces d’un chat infecté. Les oocystes sont extrêmement résistants aux conditions environnementales, y compris la sécheresse, et semblent demeurer infectieux pendant plusieurs mois (à des températures de -5 °C) (Dubey, 1998). Même si cet organisme cause généralement des symptômes bénins ressemblant à ceux de la grippe, il peut mettre en danger la vie des sujets immunodéprimés et des femmes enceintes. L’infection peut causer une déficience mentale, une perte de la vision, une déficience auditive et la mortalité chez les enfants atteints d’une infection congénitale. Nous ne savons pas grand-chose de la distribution de cet organisme dans les sources d’eau, mais, selon des chercheurs, les oocystes survivent jusqu’à 17 mois dans l’eau du robinet. Six éclosions de toxoplasmose humaine liées à l’ingestion d’eau ou de sol contaminé, dont une en Colombie-Britannique en 1995, ont été signalées (Karanis et coll., 2007). Cent dix cas aigus ont été recensés pendant cette éclosion, dont 42 femmes enceintes et 11 nouveau-nés; cette éclosion a été imputée à la contamination d’un réservoir d’eau par les fèces de chats domestiques et sauvages (Isaac-Renton et coll.1998; Aramini et coll.1999). Les renseignements disponibles sur l’efficacité des procédés de traitement de l’eau visant à éliminer ou à inactiver T. gondii sont limités. Cependant, vu la taille de cet organisme, les procédés classiques de coagulation/sédimentation et de filtration devraient l’éliminer facilement. Les procédés de traitement de l’eau utilisés pour éliminer ou inactiver Giardia et Cryptosporidium devraient en fait être efficaces contre cet organisme.
Cyclospora cayetanensis est un parasite intracellulaire obligatoire de la classe des coccidies, qui a pour seul hôte naturel l’humain (Eberhard et coll., 2000). Des cas de cyclosporiase ont été signalés partout dans le monde, mais cette maladie semble endémique dans l’ensemble des pays tropicaux (Soave, 1996). Toute la lumière n’a pas encore été faite sur les voies de transmission de ce parasite, bien que la transmission de personne à personne soit improbable (c.‑à‑d. que les oocystes non sporulés sont éliminés dans les fèces et nécessitent une période de maturation). La transmission se fait probablement par de l’eau ou des aliments contaminés par des matières fécales humaines. Bien que Cyclospora cayetanensis ait été détecté dans des échantillons prélevés dans l’environnement, entre autres dans l’eau et les eaux usées, la détection de ce parasite demeure un défi. Peu d’études ont été menées sur la fréquence de la présence de ce parasite, en raison du manque de méthodes sensibles, notamment des méthodes visant à évaluer sa viabilité et son infectiosité. L’infection par Cyclospora cayetanensis provoque des symptômes qui sont semblables à ceux causés par Cryptosporidium (p. ex. nausées, anorexie, diarrhée). La maladie est habituellement spontanément résolutive, mais des effets à long terme sur la santé, y compris sur le système oculo-urétrosynovial, ont été signalés. Les données épidémiologiques portent fortement à croire que C. cayetanensis peut se transmettre par l’eau. En effet, la première éclosion de cyclosporiase ayant été associée à l’eau potable est survenue en 1990 chez le personnel d’un hôpital de Chicago, en Illinois (Karanis et coll., 2007). Elle a été imputée à un système d’approvisionnement en eau chlorée, ce qui indiquerait que C. cayetanensis est résistant au chlore utilisé dans les systèmes de traitement de l’eau. Bien que l’efficacité des procédés de traitement de l’eau potable visant à éliminer ou à inactiver C. cayetenensis n’ait pas été évaluée, les procédés classiques de coagulation et de filtration devraient être au moins aussi efficaces que pour Cryptosporidium, étant donné que les oocystes de C. cayetanenis sont plus gros que ceux de Cryptosporidium.
Entamoeba histolytica est un parasite obligatoire qui infecte les humains et les primates. Les humains sont les seuls réservoirs importants, car ils éliminent les trophozoïtes ou les kystes dans leurs fèces. Entamoeba histolytica peut se transmettre à la suite de l’ingestion d’eau ou d’aliments contaminés par des matières fécales, mais on croit que le contact de personne à personne constitue la principale voie de transmission. La plupart des infections sont asymptomatiques, mais certaines peuvent causer une grave maladie (c.‑à‑d. l’amibiase). Dans les cas d’infection symptomatique, la diarrhée, la fièvre et les douleurs abdominales sont fréquentes. Des effets plus graves sur la santé, notamment la colite chronique, des abcès du foie et la mort ont été signalés (Kucik et coll., 2004). Les kystes d’Entamoeba histolytica sont résistants à la dégradation environnementale; leur survie dépend toutefois principalement de la température. Les kystes meurent rapidement lorsqu’ils sont exposés à une faible chaleur ou congelés (Gillin et Diamond, 1980). Bien qu’aucune éclosion d’amibiase d’origine hydrique n’ait été signalée au Canada, il a été fait état d’éclosions aux États-Unis et ailleurs dans le monde (Karanis et coll., 2007). Ces éclosions sont survenues lorsque l’eau chlorée a été contaminée par les eaux usées. On dispose de données limitées sur l’efficacité des procédés de traitement de l’eau visant à éliminer ou à inactiver Entamoeba histolytica. Cependant, vu la grosseur des kystes de ce parasite, les procédés classiques de coagulation/sédimentation et de filtration devraient l’éliminer facilement. Les procédés de traitement de l’eau utilisés pour éliminer ou inactiver Giardia et Cryptosporidium devraient en fait être efficaces contre cet organisme.
Blastocystis hominisest un protozoaire unicellulaire qui provoque la diarrhée, la nausée, des douleurs abdominales, des vomissements et des ballonnements. Bien que B. hominis ait été identifié au début des années1900, son épidémiologie alimente encore beaucoup la controverse. Ce microorganisme, dont le taux de prévalence est de 1,5 % à 10 % dans les pays industrialisés et de 50 % à 60 % dans les pays en développement, est l’un des parasites intestinaux les plus fréquents chez l’être humain (Stenzel et Boreham, 1996). Cependant, un fort pourcentage des infections aboutissent à l’hébergement asymptomatique du microorganisme, d’où les controverses entourant sa pathogénicité. Les animaux semblent être un réservoir important de Blastocystis. Des études ont montré que le risque d’infection est plus grand pour les gens en contact étroit avec des animaux que pour les autres (Rajah et coll., 1999; Eroglu et Koltas, 2010). Comme pour les autres pathogènes entériques d’origine hydrique, le cycle biologique de Blastocystis renferme une forme kystique, à laquelle sa transmission par la voie fécale-orale est imputable. Les kystes de Blastocystis ont de 3 μm à 5 μm et leur résistance au niveau de chlore utilisé pour le traitement de l’eau potable a été signalée (Leelayoova et coll., 2004). Comme la taille de ces kystes est très semblable à celle des oocystes de Cryptosporidium, les procédés de filtration de l’eau potable devraient les éliminer de la même manière.
Annexe B : CertainesNote de bas de page a éclosions de Giardia et de Cryptosporidium liées à des systèmes d’approvisionnement en eau potable publics, semi-publics et privés au Canada (de 1977 à 2001)
| Date | Lieu | Agent étiologique | Portée de l'éclosion | Causes premières | Références |
|---|---|---|---|---|---|
| 20 mars – 26 avril 2001 | North Battleford (Sask.) | Cryptosporidium | 25 cas confirmés en laboratoire; selon les estimations, entre 5 800 et 7 100 personnes auraient été touchées |
|
Stirling et coll., 2001 |
| 2 juin – 12 juillet 1996 | Cranbrook (C.-B.) | Cryptosporidium | 29 cas confirmés en laboratoire; 107 cas cliniques; nombre de cas estimé à 2 000 |
|
BCCDC, 1996; Ong et coll., 1997, 1999 |
| Février – mai 1994 | Temagami (Ont.) | Giardia | 26 cas confirmés en laboratoire; entre 160 et 330 cas cliniques |
|
Wallis et coll., 1998 |
| Février – mai 1993 | Kitchener-Waterloo (Ont.) | Cryptosporidium | 143 cas confirmés en laboratoire | * Remarque : Aucune donnée épidémiologique déclarée n'établit de lien avec l'eau potable
|
Pett et coll., 1993; Welker et coll., 1994 |
| Janvier – avril 1990 | Creston et Erikson (C.-B.) | Giardia | 124 cas confirmés en laboratoire |
|
Isaac-Renton et coll., 1993, 1994 |
| Juin – août, nov. 1986 | Penticton (C.-B) | Giardia | 362 cas confirmés en laboratoire; nombre de cas estimé à 3 100 |
|
Moorehead et coll., 1990 |
| Nov. – déc. 1985 | Creston (C.-B.) | Giardia | 83 cas confirmés en laboratoire |
|
Isaac-Renton et coll., 1993 |