Processus d'évaluation partagée entre Santé Canada et la FSANZ : Information pour les demandeurs
Contenu
- Introduction
- Le processus d'évaluation partagée
- Les avantages du processus d'évaluation partagée
- Les produits adaptés pour le processus d'évaluation partagée
- Comment fonctionne le processus d'évaluation partagée
- Comment soumettre un produit au processus d'évaluation partagée
- Autres considérations
Introduction
Santé Canada (SC) et la Food Standards Australia New Zealand (FSANZ) ont mis en place un accord de collaboration concernant l'évaluation des aliments génétiquement modifiés avant leur mise en marché : le processus d'évaluation partagée SC-FSANZ.
Les informations suivantes sont destinées aux demandeurs intéressés à soumettre un produit à évaluer et à autoriser pour une utilisation alimentaire au Canada, en Australie et en Nouvelle-Zélande, dans le cadre de la procédure d'évaluation partagée entre Santé Canada et la FSANZ.
Le processus d'évaluation partagée
Le processus d'évaluation partagée est un accord de collaboration entre Santé Canada et la FSANZ en vertu duquel une demande d'évaluation préalable à la mise en marché d'un produit génétiquement modifié destiné à l'alimentation (c'est-à-dire un aliment génétiquement modifiéNote de bas de page 1) peut être soumise aux deux agences, mais une seule évaluation de l'innocuité des aliments est préparée (soit par Santé Canada, soit par la FSANZ). L'évaluation est ensuite transmise à l'autre agence pour révision et fournir un avis sur l'innocuité alimentaire, afin de s'assurer que l'évaluation répond aux exigences des deux agences.
L'évaluation commune est ensuite utilisée par Santé Canada et la FSANZ pour leur propre décision réglementaire distincte et indépendante concernant l'aliment génétiquement modifié en question.
Le processus d'évaluation partagée a été mis au point après plus de dix ans de collaboration, en s'appuyant sur un long historique de partage d'informations entre les deux agences et sur une collaboration internationale plus large concernant les aliments génétiquement modifiés. Des informations supplémentaires sur l'élaboration du processus d'évaluation partagée (et son initiative) sont disponibles dans le document de consensus de l'Organisation de coopération et de développement économiques (OCDE) : Considerations for Collaborative Work on the Safety Assessments of Foods and Feeds Derived from rDNA Plants ENV/CBC/MONO(2023)37.
Avant de mettre en œuvre le processus d'évaluation partagée, Santé Canada et la FSANZ ont mené deux projets pilotes pour tester le processus avec comme évaluateur principal d'un aliment génétiquement modifié, soit Santé Canada, soit la FSANZ. Pour en savoir plus sur ces projets pilotes, consultez le site.
Les avantages du processus d'évaluation partagée
Au cours des deux évaluations pilotes, plusieurs avantages du processus d'évaluation partagée ont été identifiés, notamment
- Gain de temps et de ressources pour les agences réglementaires
- Amélioration de l'alignement et de l'efficacité du processus d'autorisation pour le Canada et l'Australie/Nouvelle-Zélande
- Des délais d'autorisation plus courts et/ou des économies financières pour le demandeur
Les produits adaptés pour le processus d'évaluation partagée
Le champ d'application actuel du processus d'évaluation partagée est limité aux aliments dérivés de plantes génétiquement modifiées (GM) qui doivent faire l'objet d'une évaluation préalable à la mise en marché en vertu des cadres réglementaires des deux agences.
En outre, les demandes doivent répondre aux critères suivants :
- L'évaluation et l'autorisation préalable à la mise en marché effectuées par les deux agences sont sollicitées par le demandeur dans les mêmes délais ou dans un délai similaire.
- Pour les demandes qui font référence à des informations fournies dans une demande antérieure concernant un autre aliment génétiquement modifié, les demandeurs doivent s'assurer que l'aliment génétiquement modifié a été évalué précédemment par les deux agences, de sorte que chaque agence ait accès aux mêmes informations.
- Les demandeurs fournissent des informations identiques dans leur demande à chaque agence. Le format de la demande peut être spécifique aux exigences de chaque agence.
- Les demandeurs acceptent le partage et la discussion entre agences d'informations spécifiques à la demande, y compris d'informations confidentielles, dans le seul but de réaliser l'évaluation partagée.
Comment fonctionne le processus d'évaluation partagée
Dans le cadre du processus d'évaluation partagée, une agence agit en tant qu'évaluateur principal, tandis que l'autre agence agit en tant qu'évaluateur secondaire. Pour chaque aliment génétiquement modifié soumis à une évaluation partagée, Santé Canada et la FSANZ détermineront le rôle de chaque agence. Dans la mesure du possible, la charge de travail sera répartie équitablement entre les deux agences.
Le processus d'évaluation partagée est décrit dans la figure 1 et comprend les étapes suivantes :
- Les deux agences reçoivent une demande pour l'aliment génétiquement modifié qui contient les mêmes informations. Voir la figure 1 pour l'échéancier de soumission.
- La demande sera soumise aux procédures d'admission standard de chaque agence. Si des informations supplémentaires sont nécessaires avant que la demande ne soit acceptée pour évaluation, l'évaluateur principal obtiendra ces informations auprès du demandeur et les communiquera à l'évaluateur secondaire.
- Lorsqu'une demande est acceptée pour évaluation, l'évaluateur principal procède à l'évaluation initiale de l'aliment génétiquement modifié. En fonction de la complexité de la demande, cette étape prendra de 2 à 4 mois. Au cours de cette période, si des lacunes dans la demande sont identifiées, l'évaluateur principal interagira avec le demandeur afin d'obtenir les informations nécessaires à l'évaluation. Toute information supplémentaire fournie à l'évaluateur principal sur demande doit également être fournie à l'évaluateur secondaire afin de garantir que le contenu de la demande est identique pour chaque agence.
- Une fois l'évaluation terminée, l'évaluateur principal la transmet à l'évaluateur secondaire pour qu'il l'examine. Les évaluateurs primaire et secondaire discutent ensuite de l'évaluation initiale afin de permettre à l'évaluateur secondaire de demander des clarifications à l'évaluateur primaire et de souligner tout aspect supplémentaire qui devrait être inclus dans l'évaluation. À la suite du retour d'information de l'évaluateur secondaire, l'évaluateur principal apportera les révisions nécessaires et fournira une version finale à l'évaluateur secondaire. Le processus de révision devrait durer environ 3 à 4 semaines au total.
- Une fois la version finale de l'évaluation approuvée, chaque agence procédera à ses propres processus de post-évaluation, ce qui aboutira à des décisions réglementaires distinctes concernant l'aliment génétiquement modifié en question. Au cours de ces procédures, Santé Canada et la FSANZ se tiendront mutuellement informés de leurs progrès respectifs et de l'échéancier d'autorisation prévu. Les autorisations de chaque agence restent indépendantes l'une de l'autre.
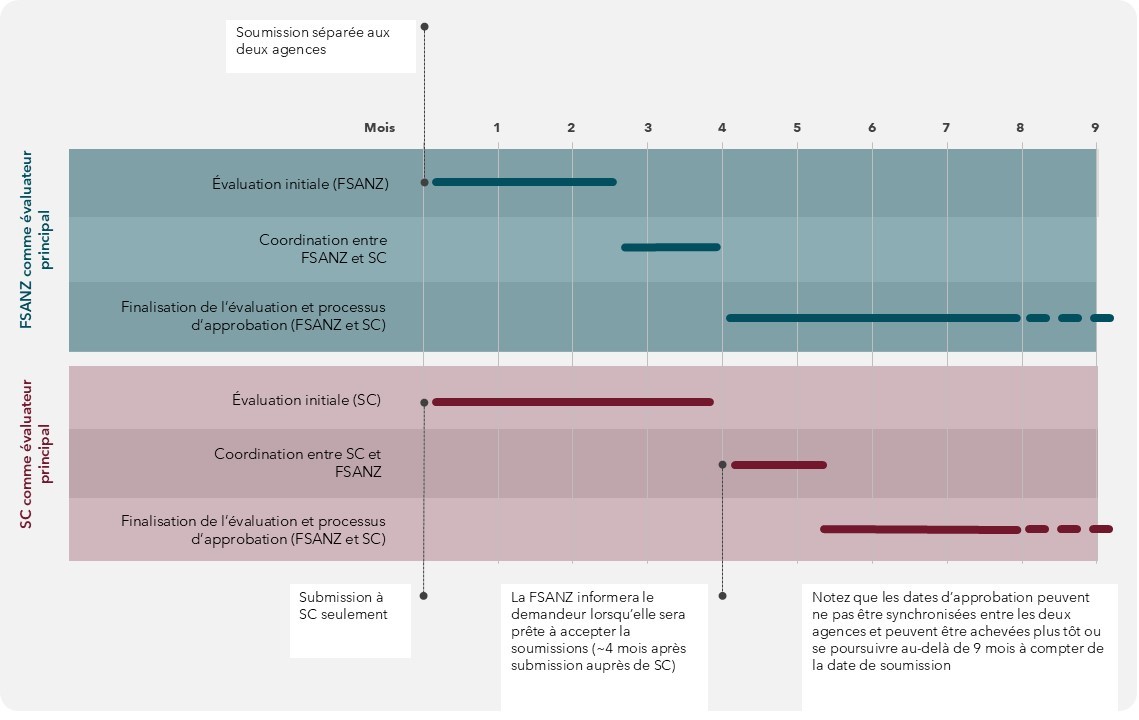
Figure 1 : Texte descriptif
L’échéancier de soumission d'une demande dans le cadre du processus d'évaluation partagée et l'évaluation de la variété génétiquement modifiée dépendent de l'agence qui agit en tant qu'évaluateur principal : la FSANZ ou Santé Canada. Les étapes du processus d'évaluation partagée sont énumérées verticalement dans l'ordre, du début à la fin du processus. La durée que chaque étape prendra est indiquée dans la grille horizontale qui s’étend sur neuf mois. L’échéancier de chaque étape est indiqué dans une grille bleue avec des lignes bleues lorsque la FSANZ est l'évaluateur principal, tandis que l’échéancier de chaque étape est indiqué dans une grille rouge avec des lignes rouges lorsque Santé Canada est l'évaluateur principal.
Comment soumettre un produit au processus d'évaluation partagée
Pour soumettre un produit au processus d'évaluation partagée, les demandeurs doivent suivre les étapes suivantes :
- Le demandeur informe les deux agences de son intention de soumettre son aliment génétiquement modifié à une évaluation partagée entre les deux agences. Il peut le faire en envoyant un courriel à chaque agence ou lors d'une consultation préalable à la soumission. Il est important que le demandeur explique en quoi son produit est adapté à la procédure d'évaluation partagée, ainsi que l'échéancier prévu pour la demande.
- Sur la base des informations ci-dessus, Santé Canada et la FSANZ détermineront, en fonction des capacités actuelles, qui sera l'évaluateur principal et l'évaluateur secondaire pour l'évaluation partagée. Le demandeur sera informé de cette décision, ainsi que de l'échéancier prévisionnel de l'évaluation partagée, y compris de la date à laquelle il doit soumettre sa demande à chaque agence.
- Si le demandeur accepte les termes de l'évaluation partagée, une demande d'autorisation pour son aliment génétiquement modifié peut être introduite par les voies habituelles de chaque agence, aux dates convenues. Les procédures de soumission des demandes pour la FSANZ et Santé Canada sont disponibles sur leurs sites web respectifs.
Autres considérations
Avec la mise en œuvre du processus d'évaluation partagée, Santé Canada et la FSANZ restent liés à toutes les autres exigences réglementaires, légales et/ou politiques associées à leurs cadres réglementaires respectifs.
Par exemple, Santé Canada et l'Agence canadienne d'inspection des aliments (ACIA) appliquent une politique de "coordination des approbations" en ce qui concerne l'autorisation d'une plante génétiquement modifiée pour l'alimentation humaine et animale, ou pour une dissémination non confinée dans l'environnement au Canada. Si l'évaluation partagée d'une plante génétiquement modifiée peut raccourcir le délai d'évaluation par Santé Canada, l'autorisation de cette plante génétiquement modifiée à des fins alimentaires demeure conditionnelle à l'achèvement de toute évaluation préalable à la mise en marché réalisée par l'ACIA pour cette même plante génétiquement modifiée.
Notes de bas de page
- Note de bas de page 1
-
Défini conformément à la norme 1.5.2 du code des normes alimentaires de l'Australie et de la Nouvelle-Zélande et à la partie B, titre 28 du Règlement sur les aliments et drogues du Canada.