Rapport « Ce que nous avons entendu » – Consultation auprès des intervenants sur l’attribution de noms aux médicaments biologiques

Télécharger le format de rechange
(Format PDF, 237 Ko, 9 pages)
Organisation : Santé Canada
Type : Rapport
Date publiée : 2019-02-14
Introduction
Du 18 janvier au 9 février 2018, Santé Canada et l’Institut pour la sécurité des médicaments aux patients du Canada (ISMP) ont mené une consultation en ligne sur l’attribution de noms aux médicaments biologiques. Avec l’arrivée des médicaments biosimilaires sur le marché canadien, le nombre de médicaments biologiques partageant un nom générique (commun) augmente. Les objectifs de la consultation étaient (1) de solliciter les points de vue d’intervenants sur la question de savoir si l’approche actuelle de Santé Canada à l’égard de l’attribution de noms aux médicaments biologiques est adéquate ou, si ce n’est pas le cas, quelle option de rechange proposée serait la plus appropriée pour faire la distinction entre les médicaments biologiques partageant le même nom générique, et (2) de mieux comprendre les répercussions de la mise en œuvre de chaque option proposée sur les intervenants externes.
Le public cible de la consultation comprenait les fournisseurs de soins de santé, les consommateurs, les fabricants de médicaments et leurs associations représentatives. De plus, on a sollicité les commentaires de fournisseurs de technologies de l’information et d’assureurs.
Trois options ont été proposées pour l’attribution de noms aux médicaments biologiques (y compris les médicaments biosimilaires) :
- Option 1 – Conserver l’approche actuelle d’identification et de détermination du nom des médicaments au Canada [statu quo]
- Les médicaments biosimilaires, les médicaments biologiques de référence et les médicaments biologiques innovateurs qui partagent le même nom générique peuvent être distingués par leur nom de marque unique ou leur numéro d’identification de médicament (DIN), mais dans certains contextes, seul le nom générique est utilisé.
- Option 2 – Utiliser le nom de marque avec le nom générique pour distinguer les médicaments biologiques
- Les noms de marque et les noms génériques seraient utilisés, de sorte que les médicaments biosimilaires, les médicaments biologiques de référence et les médicaments biologiques innovateurs qui partagent le même nom générique se distingueraient par leur nom de marque unique. Des lignes directrices seraient fournies sur l’importance d’utiliser à la fois le nom de marque et le nom générique tout au long du processus d’utilisation des médicaments et dans la déclaration des effets indésirables.
- Option 3 – Ajouter un suffixe de quatre lettres au nom générique
- Tous les médicaments biologiques, y compris les médicaments biosimilaires, les médicaments biologiques de référence et les médicaments biologiques innovateurs, recevraient un suffixe unique et sans signification de quatre lettres qui sera ajouté au nom générique. Les produits qui partagent le même nom générique se distingueraient par le suffixe. Des lignes directrices seraient élaborées pour s’aligner le plus possible sur la convention d’attribution de noms fondée sur un suffixe de la Food and Drug Administration (FDA) des États-Unis.
Pour les trois options, tous les médicaments biologiques, y compris les médicaments biosimilaires, continueront d’avoir un DIN unique.
Les commentaires des répondants étaient vastes et diversifiés. Le présent rapport résume les principaux messages, perceptions et suggestions formulés par les participants à la consultation.
Qui a fourni de la rétroaction?
Au total, 362 réponses ont été reçues. 79 % des répondants étaient des fournisseurs de soins de santé; les pharmaciens et les organisations liées aux pharmacies représentant 62 % des répondants. Il y a également eu des réponses de fabricants de produits pharmaceutiques, d’assureurs, de fournisseurs de technologies de l’information, de consommateurs et d’organisations représentant les consommateurs, ainsi que d’autres organisations, comme des groupes de défense et d’éducation.
La répartition des réponses par groupes d’intervenants est présentée à la figure 1 ci-dessous.
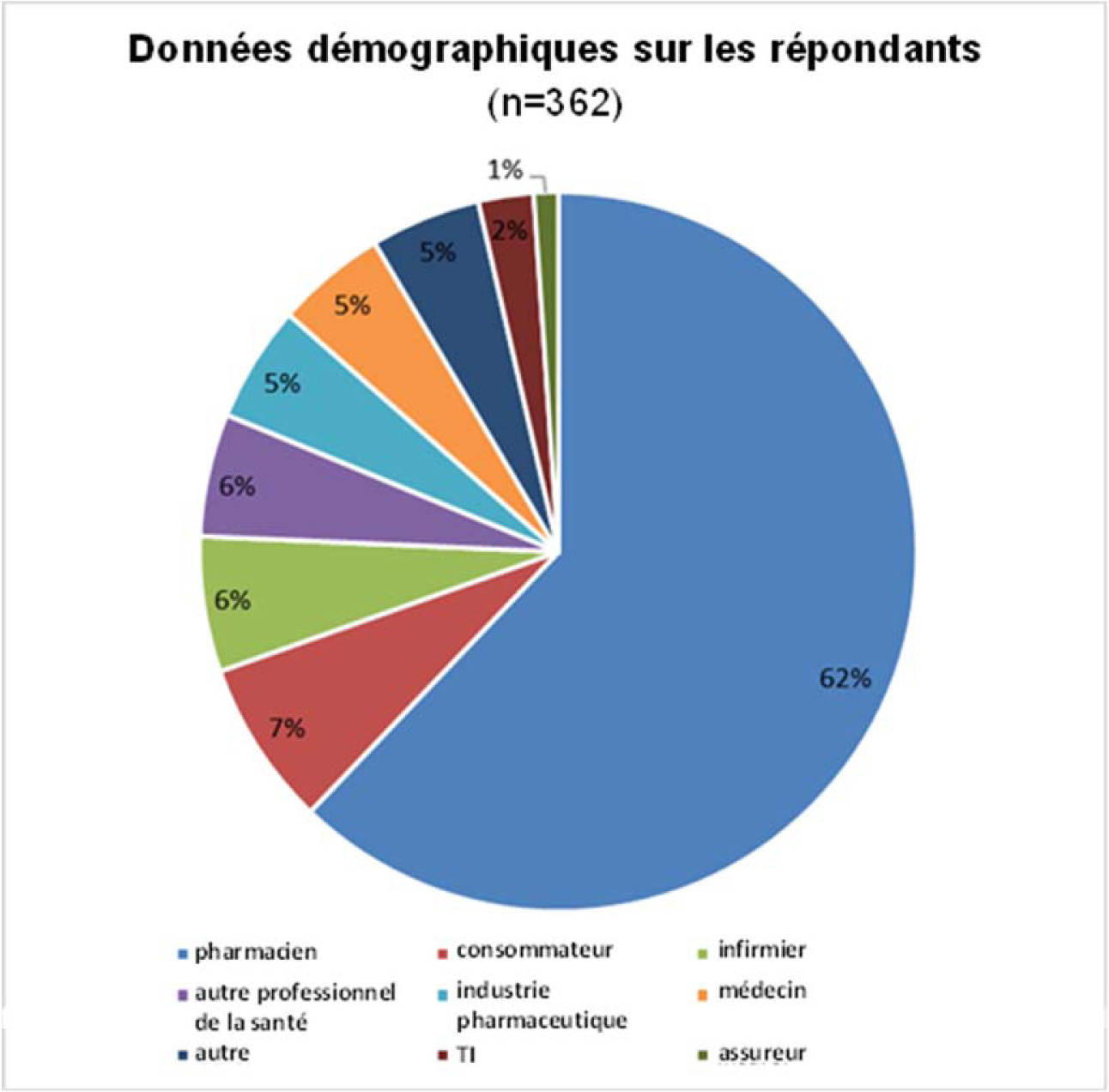
- Figure 1 - note *
Nota : les chiffres ci-dessous reflètent les soumissions uniques de réponses de chaque intervenant auto-identifié; des soumissions ont été reçues de la part d’intervenants individuels et d’associations ou d’organisations.
Équivalent textuel – Figure 1
| Données démographiques sur les répondants (n=362) |
Pourcentage (%) |
|---|---|
| pharmacien | 62 % |
| consommateur | 7 % |
| infirmier | 6 % |
| autre professionnel de la santé | 6 % |
| industrie pharmaceutique | 5 % |
| médécin | 5 % |
| autre | 5 % |
| TI | 2 % |
| assureur | 1 % |
Qu’ont dit les intervenants?
On a demandé aux répondants d’évaluer chacune des trois options proposées comme étant préférables, acceptables ou non acceptables, et de formuler des commentaires à l’appui de leurs points de vue. On a également demandé aux répondants si les options sont compatibles dans leur pratique ou leur milieu actuel et, si ce n’est pas le cas, de déterminer les changements nécessaires pour mettre en œuvre chaque option.
Par la suite, on a posé aux répondants deux questions supplémentaires :
- (1) Si un suffixe devait être ajouté aux noms génériques, les médicaments biosimilaires, les médicaments biologiques et les médicaments biologiques innovateurs préalablement autorisés devraient-ils être renommés pour se conformer à la nouvelle nomenclature?
- (2) Devrait-on tenir compte d’autres options ou facteurs lors de l’élaboration d’une politique d’attribution de noms pour distinguer les médicaments biologiques qui partagent le même nom générique?
| Option | Préférable | Acceptable | Total préférable + acceptable |
Non acceptable |
|---|---|---|---|---|
| 1. Statu quo | 9 % | 21 % | 30 % | 70 % |
| 2. Marque + noms génériques | 48 % | 27 % | 75 % | 25 % |
| 3. Suffixe | 34 % | 17 % | 51 % | 49 % |
Un résumé des commentaires fréquemment entendus des répondants est fourni pour chaque option et les deux questions supplémentaires.
Option 1 : Conserver l’approche actuelle d’identification et de détermination du nom des médicaments au Canada [statu quo]
En général, les répondants étaient favorables au changement par rapport au statu quo. 70 % des répondants ont indiqué que l’approche actuelle d’identification et de détermination du nom des médicaments au Canada n’était pas acceptable. Cependant, certains fabricants de produits pharmaceutiques et associations de l’industrie ont préféré cette option d’attribution de noms.
- Résumé des commentaires des intervenants sur l’option 1 :
- De nombreux répondants ont formulé des commentaires sur le risque de choisir le mauvais médicament biologique lorsque seul le nom générique de celui-ci est utilisé, ce qui pourrait faire en sorte que les patients reçoivent un médicament pour une indication qui n’était pas autorisée, entraîner une déclaration imprécise des effets indésirables du médicament, et entraîner des conséquences financières pour les patients dépendant du remboursement d’un produit précis.
- Le statu quo ne correspond pas aux progrès réalisés dans d’autres administrations pour améliorer la surveillance des effets indésirables.
- Les patients peuvent avoir de la difficulté à savoir si leur produit a été changé.
- On craint que l’utilisation de seulement le nom générique puisse encourager les fournisseurs de soins de santé ou les patients à croire à tort que les médicaments biologiques sont interchangeables.
Option 2 : Utilisation du nom de marque avec le nom générique pour distinguer les médicaments biologiques
Il s’agissait de l’option d’attribution de noms la plus favorisée et la mieux classée, 75 % des répondants l’ayant jugée préférable ou acceptable. 75 % des répondants ont indiqué que cette option d’attribution de noms est compatible avec leur pratique ou environnement actuel.
Dans l’ensemble, les régimes publics d’assurance-médicaments, la majorité des pharmaciens, des médecins, des infirmiers, des fournisseurs de technologies de l’information, des consommateurs/patients et certaines sociétés pharmaceutiques ont jugé cette option préférable ou acceptable.
- Résumé des commentaires des intervenants sur l’option 2 :
- Les répondants qui préconisaient cette option ont indiqué que cela permettrait d’identifier clairement les produits pour la prescription, la distribution et le suivi des effets indésirables et de réduire la probabilité de confusion et d’erreurs pour les fournisseurs de soins de santé et les patients. D’autres répondants ont indiqué que les noms génériques partagés entre les médicaments pourraient mener à la présomption d’interchangeabilité ou à des erreurs de choix de produits.
- De nombreux répondants ont indiqué que l’option 2 est intuitive puisque les noms de marque sont déjà utilisés et sont plus mémorables que l’approche de suffixe proposée.
- De nombreux professionnels de la santé et fournisseurs de technologies de l’information ont fait remarquer que l’option 2 pourrait facilement être mise en œuvre, bien que d’autres répondants aient fait remarquer que des changements aux systèmes d’information dans certains contextes seraient nécessaires pour tenir compte des deux noms.
- Certains répondants ont indiqué que l’utilisation du nom de marque pour différencier les produits est déjà l’approche standard dans certains milieux de pratique; d’autres répondants ont fait remarquer qu’il faudrait modifier l’éducation et les pratiques, car les noms de marque ne sont pas couramment utilisés ou encouragés pour prescrire ou distribuer des médicaments.
Option 3 – Ajouter un suffixe de quatre lettres au nom générique :
Il s’agissait de la deuxième option d’attribution de noms la mieux classée, 51 % des répondants l’ayant jugée préférable ou acceptable. 61% des répondants ont indiqué que cette option d’attribution de noms est compatible avec leur pratique ou environnement actuel.
Cette option a été privilégiée par les organisations représentant les consommateurs/patients, les assureurs privés, les groupes d’éducation et de défense, ainsi que certaines sociétés pharmaceutiques. Une minorité de pharmaciens, de médecins, d’infirmiers, de patients et de fournisseurs de technologies de l’information préféraient cette approche. Environ la moitié des répondants qui préféraient l’option 3 ont également jugé l’option 2 comme acceptable.
Bien que des suffixes vides de sens aient été proposés conformément à l’approche de la FDA des États-Unis, bon nombre des répondants qui préféraient l’option 3 ont indiqué qu’ils préféreraient des suffixes significatifs pour la facilité à mémoriser et pour éviter la confusion.
- Résumé des commentaires des intervenants sur l’option 3 :
- Les répondants qui préconisaient cette approche ont indiqué que l’option 3 identifierait les produits pour la prescription, la distribution et le suivi des effets indésirables et réduirait la probabilité d’erreurs pour les prescripteurs, les pharmaciens et les patients. D’autres répondants ont indiqué que les suffixes seraient complexes et inutiles et que le manque de signification rendrait les suffixes difficiles à retenir et entraînerait de la confusion et des erreurs de médication.
- Les répondants préférant l’option 3 ont fait remarquer que les noms génériques qui sont différentiés par un suffixe identifieraient clairement les produits qui ne sont pas identiques ou interchangeables. D’autres répondants ont indiqué que le suffixe pourrait être plus déroutant qu’utile puisque des médicaments avec différents suffixes peuvent avoir les mêmes indications et les cliniciens et les patients pourraient penser que différents suffixes indiquent des différences cliniquement significatives entre un médicament biosimilaire et son produit de référence.
- De nombreux répondants ont indiqué que les suffixes ne sont pas intuitifs; leur complexité et leur manque de sens peuvent mener à leur omission par les prescripteurs et, par conséquent, les distributeurs devraient faire un suivi pour savoir quel produit est visé.
- Les répondants qui préconisaient l’option 3 ont souligné sa cohérence avec l’approche de la FDA des États-Unis; d’autres répondants ont indiqué que les suffixes seraient incompatibles avec les approches de l’Agence européenne des médicaments et de la Therapeutic Goods Administration de l’Australie en matière d’attribution de noms aux médicaments.
- Certains répondants ont fait remarquer que l’option 3 pourrait être facilement mise en œuvre puisque la pratique actuelle d’utiliser le nom générique dans les systèmes d’information ne nécessiterait pas de changement. D’autres répondants ont indiqué que l’éducation et des changements en matière de pratique seraient nécessaires et que l’option 3 serait difficile à mettre en œuvre en raison du besoin de mettre à jour les bases de données et de reconfigurer les logiciels et l’étiquetage.
Changement de nom de médicaments biologiques préalablement autorisés :
On a demandé aux répondants de donner leur avis sur la question de savoir si les médicaments biologiques préalablement autorisés devraient être renommés si une nomenclature fondée sur un suffixe était adoptée. Plus de 80 % des répondants ont indiqué que les médicaments biologiques préalablement autorisés et innovateurs devraient être renommés si des suffixes devaient être ajoutés à des noms génériques. Les répondants qui préféraient un suffixe et les répondants qui préféraient les options 1 ou 2 appuyaient fortement le changement de nom si les suffixes étaient adoptés. De nombreux répondants ont souligné la nécessité d’une convention d’attribution de noms uniforme et normalisée pour tous les médicaments biologiques afin d’éviter la confusion, les erreurs de médication et la compromission de la sécurité des patients.
- Résumé des commentaires des intervenants sur le changement de nom :
- De nombreux changements seraient nécessaires pour mettre en œuvre le changement de nom des médicaments biologiques préalablement autorisés, y compris les mises à jour des logiciels pour l’information sur les médicaments et les outils d’aide à la décision, la saisie des commandes, les pompes électroniques, le contrôle des stocks, les bases de données de tiers payeurs, les modifications des étiquettes de produits, etc. Les chaînes d’approvisionnement et la gestion des stocks seraient également touchées.
- De nombreux répondants ont souligné les répercussions financières du changement de nom en raison du temps et de la main-d’œuvre nécessaires pour mettre en œuvre les changements nécessaires et les défis liés à la mise en œuvre de cette approche dans certains systèmes électroniques.
- Demandes de mise en œuvre échelonnée sur une période de transition pluriannuelle.
- Certains répondants ont dit craindre que les fabricants de médicaments biologiques préalablement autorisés puissent utiliser l’absence d’un suffixe pour obtenir un avantage commercial si ces produits ne sont pas renommés.
Autres options ou facteurs à prendre en considération :
On a demandé aux répondants de suggérer d’autres options ou facteurs dont il faudrait tenir compte au moment d’élaborer une politique d’attribution de noms.
- Résumé des suggestions des intervenants :
Veuillez noter que le résumé ne contient que des suggestions qui ne figurent pas ailleurs dans le rapport.
- Approche globale d’attribution de noms :
- Attendre une recommandation de l’Organisation mondiale de la Santé pour une cohérence internationale
- Autres options d’attribution de noms :
- Suffixe avec une version abrégée du nom du fabricant
- Attribuer des suffixes numériques de façon séquentielle selon l’entrée sur le marché
- Incorporer des lettres au hasard dans le nom générique pour éviter la troncature du nom
- Suggestions pour la pharmacovigilance :
- Besoin de plus d’éducation pour la déclaration des effets indésirables
- Besoin de renseignements complémentaires sur le médicament (p. ex., nom de marque, DIN, numéro de lot et date d’expiration) pour l’identification du médicament dans les déclarations d’effets indésirables
- Si une modification de la convention d’attribution de noms est apportée, il devrait y avoir une analyse après la mise en œuvre pour évaluer l’incidence sur l’attribution correcte des effets indésirables
Conclusion
Nous tenons à remercier tous les répondants d’avoir rempli le questionnaire. Santé Canada a examiné et pris en considération tous les commentaires pour éclairer l’élaboration d’une convention d’attribution de noms aux médicaments biologiques.
Nos coordonnées
Bureau de la politique et de la collaboration internationale
Direction des produits biologiques et des thérapies génétiques
Direction générale des produits de santé et des aliments
Santé Canada
Édifice nº 6, 100, promenade Eglantine
Pré Tunney
Ottawa (Ontario) K1A 0K9
Indice de l’adresse : 0601B
Courriel : hc.bgtd.opic-bpci.dpbtg.sc@canada.ca