Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion

Télécharger le format de rechange
(Format PDF, 1 314 ko, 169 pages)
- Organisation : Santé Canada
- Date de publication : Février 2025
Renseignements généraux sur les documents de conseils
Il existe deux cas dans lesquels Santé Canada peut décider d'élaborer un document de conseils en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable. Le premier cas est pour fournir des conseils sur les activités ou les mesures de gestion liées à des questions précises qui concernent l'eau potable (par exemple, avis d'ébullition de l'eau, contrôle de la corrosion), auquel cas le document ne fournirait que des renseignements scientifiques restreints ou une évaluation sommaire des risques pour la santé.
Le deuxième cas est pour fournir des renseignements sur l'évaluation des risques lorsqu'une recommandation n'est pas jugée nécessaire. Des recommandations sont formulées dans le cadre des Recommandations pour la qualité de l'eau potable au Canada expressément pour les contaminants qui satisfont à tous les critères suivants :
- l'exposition au contaminant pourrait mener à des effets nocifs pour la santé;
- le contaminant est fréquemment détecté dans un grand nombre de sources d'eau potable au Canada ou on pourrait s'attendre à ce qu'il le soit;
- la concentration à laquelle il est détecté ou à laquelle on pourrait s'attendre à le détecter est susceptible d'avoir des effets sur la santé.
Si un contaminant d'intérêt ne satisfait pas à tous ces critères, Santé Canada peut décider de ne pas établir de recommandation chiffrée ou rédiger de document technique. Dans ce cas, un document de conseils peut être rédigé.
Les documents de conseils passent par un processus semblable à celui des documents techniques de recommandation, y compris des consultations publiques affichées dans le site Web de Santé Canada. Ils sont proposés à titre d'information pour les autorités responsables de l'eau potable et, dans certains cas, pour fournir des conseils en cas de déversement ou d'autres situations d'urgence.
La partie A du présent document fournit des conseils sur l'échantillonnage aux fins du contrôle de la corrosion du plomb dans les réseaux de distribution, conformément aux définitions établies dans le document. La partie B présente les informations scientifiques et techniques sur lesquelles se fondent les conseils donnés, avec les citations correspondantes. La partie C présente les abréviations ainsi que les références, et la partie D offre certains outils requis pour élaborer des programmes et des activités particuliers en matière de contrôle de la corrosion, ainsi que les renseignements nécessaires à cette fin. La partie E comprend un cadre en fonction duquel peut être structuré un programme de contrôle de la corrosion résidentielle, tandis que la partie F fournit un protocole de surveillance alternatif (en deux volets) pour les immeubles non résidentiels et résidentiels. La partie G comprend une liste de ressources sur des sujets tels que la planification du contrôle de la corrosion, les considérations opérationnelles et la mise en œuvre.
Sommaire
La corrosion constitue un problème courant dans les réseaux de distribution d'eau potable et les systèmes de plomberie au Canada. Bien qu'il n'y ait pas d'effets directs sur la santé liés à la corrosion présente dans les réseaux de distribution et les systèmes de plomberie, celle-ci peut entraîner la libération du plomb et d'autres contaminants préoccupants pour la santé des personnes vivant au Canada. Le présent document est axé sur le plomb en tant que principal contaminant préoccupant pour la santé. Les résultats de la surveillance du plomb sont utilisés comme élément déclencheur pour lancer des programmes de contrôle de la corrosion visant un contrôle ou une réduction du relargage de plomb.
La corrosion est la détérioration d'un matériau, habituellement un métal, due à une réaction de avec son environnement. Dans les réseaux de distribution d'eau potable, les matériaux susceptibles d'être affectés par la corrosion -et donc de relarguer des quantités accrues de contaminants comme le plomb- comprennent les tuyaux et les raccords métalliques. Le contrôle de la corrosion peut réduire efficacement les concentrations de plomb au point de consommation. Toutefois, lorsque l'eau est distribuée par une entrée de service en plomb, le traitement à lui seul peut ne pas être suffisant pour réduire le plomb à des concentrations inférieures à la concentration maximale acceptable (CMA) de 0,005 mg/L (5 µg/L), pour le plomb total établie dans les Recommandations pour la qualité de l'eau potable au Canada. Par conséquent, l'enlèvement de la totalité de l'entrée de service en plomb est considéré comme la solution la plus efficace et la plus permanente. Toutefois, les éléments de plomberie peuvent aussi contribuer à des concentrations élevées de plomb, même après l'enlèvement des entrées de service en plomb.
Dans le présent document, la « corrosion » fait référence à la corrosion interne du réseau de distribution et non la corrosion externe des infrastructures. De plus, le terme « contrôle de la corrosion » désigne l'action de contrôler ou d'atténuer la libération de métaux, principalement le plomb, résultant de la corrosion des matériaux dans les réseaux de distribution d'eau potable. Des informations sur les éléments d'un programme de contrôle de la corrosion sont fournies. Les ressources connexes sont énumérées à la partie G. Certains aspects du contrôle de la corrosion, comme les détails concernant l'élaboration d'un plan de contrôle de la corrosion, l'enlèvement des entrées de service en plomb et la corrosion influencée par les microorganismes, ne sont pas abordés en détail dans le présent document.
Bien qu'il n'y ait pas de méthode simple et fiable permettant de mesurer la corrosion proprement dite, il est possible de déterminer la concentration de plomb au robinet du consommateur et de s'en servir comme indice de corrosion, en combinaison avec d'autres approches ou outils, comme les montages de tuyaux en boucle et la surveillance de la qualité de l'eau. Les programmes de contrôle de la corrosion varient selon l'autorité responsable. Ces programmes peuvent aller de programmes exhaustifs à l'échelle du réseau mis en œuvre par le responsable du système de distribution d'eau potable à des programmes locaux mis en œuvre par un propriétaire d'immeuble qui sont responsables de la santé et sécurité des occupants d'immeubles résidentiels et non-résidentiels.
Le présent document de conseils, rédigé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, évalue toutes les données disponibles sur le contrôle de la corrosion dans le contexte de la qualité et de la salubrité de l'eau potable.
Évaluation
L'objectif du présent document est de fournir aux autorités responsables, par exemple aux municipalités, des conseils pour évaluer la corrosion et sur les éléments déclencheurs de la mise en œuvre d'un plan de contrôle de la corrosion dans les réseaux de distribution en milieu résidentiel. Il fournit également des protocoles d'échantillonnage et des mesures correctives pour les immeubles à logements multiples, les écoles, les garderies et les services de garde ainsi que les immeubles à bureaux. Ils sont destinés aux autorités (conseils scolaires, propriétaires d'immeubles ou employeurs) qui sont responsables de la santé et de la sécurité des personnes occupant ces bâtiments. L'objectif de ces conseils est de réduire au minimum l'exposition au plomb au robinet. En général, l'eau potable relève de la compétence provinciale, et la station de traitement ainsi que le réseau de distribution jusqu'aux limites des propriétés privées, relèvent de la responsabilité d'un système de distribution d'eau potable public, privé ou municipal. La responsabilité de la mise en œuvre des plans de contrôle de la corrosion et des activités connexes peut varier au sein des secteurs de compétence et/ou au niveau municipal. Elle peut également inclure la nécessité de collaborer avec les responsables de la santé publique.
Le présent document souligne sommairement les étapes à suivre pour réduire l'exposition au plomb dans l'eau potable, lesquelles peuvent aussi permettre de réduire l'exposition des consommateurs à d'autres contaminants liés à la corrosion, comme le cuivre. Il aborde brièvement les inquiétudes soulevées par d'autres contaminants dont les concentrations peuvent être affectés par la corrosion, comme le fer, afin de s'assurer qu'une approche holistique du contrôle de la corrosion est prise en compte.
Ce document vise à compléter les renseignements fournis dans les Recommandations pour la qualité de l'eau potable au Canada – Le plomb. La recommandation pour le plomb dans l'eau potable fournit de l'information détaillée sur l'application de la recommandation, les sources de plomb dans l'eau potable, l'exposition, les effets sur la santé et les considérations relatives au traitement et aux réseaux de distribution (y compris les entrées de service en plomb). La recommandation concernant le plomb dans l'eau potable devrait être lue conjointement avec le présent document de conseils, afin de s'assurer de bien comprendre le lien entre la surveillance de l'exposition de la communauté au plomb total et la nécessité de minimiser l'exposition au plomb en identifiant les sources de plomb et en utilisant des stratégies d'atténuation telles que, mais sans s'y limiter, l'enlèvement des entrées de service en plomb et les programmes de contrôle de la corrosion.
Table des matières
- Partie A. Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion
- A.1 Objectif et portée
- A.2 Introduction et contexte
- A.3 Protocoles et programmes de surveillance pour le contrôle de la corrosion
- A.3.1 Considérations relatives à l'échantillonnage
- A.3.2 Protocoles de surveillance en deux volets pour les habitations résidentielles
- A.3.3 Échantillonnage de suivi (démonstration de l'optimisation du TCC et de l'efficacité des interventions)
- A.3.4 Fréquence de l'échantillonnage pour la surveillance des immeubles résidentiels
- A.3.5 Nombre et choix des sites pour la surveillance des résidences
- A.3.6 Protocole de surveillance pour les immeubles non résidentiels et résidentiels à logements multiples (en deux volets)
- A.3.7 Considérations pour les petits systèmes
- A.4 Diagrammes décisionnels des protocoles d'échantillonnage du plomb
- Partie B. Renseignements à l'appui
- B.1 Principes de la corrosion dans les réseaux de distribution d'eau potable
- B.2 Défis en matière de mesure de la corrosion
- B.3 Méthodes de mesure de la corrosion
- B.4 Mesures de traitement et de contrôle ayant trait au plomb, au cuivre et au fer
- B.4.1 Mesures d'intervention ciblant les réseaux de distribution d'eau potable
- B.4.1.1 Remplacement des entrées de service en plomb
- B.4.1.2 Mesures d'intervention visant la corrosion galvanique
- B.4.1.3 Mesures d'intervention visant la corrosion du cuivre
- B.4.1.4 Utilisation de produits certifiés
- B.4.1.5 Stratégie d'intervention pour les réseaux de distribution
- B.4.1.6 Atténuation des répercussions découlant des traitements
- B.4.2 Ajustement du pH et de l'alcalinité
- B.4.3 Inhibiteurs de corrosion
- B.4.4 Purge et entretien
- B.4.5 Filtres pour le traitement de l'eau potable
- B.4.6 Méthodes de réhabilitation des entrées de service en plomb
- B.4.1 Mesures d'intervention ciblant les réseaux de distribution d'eau potable
- B.5 Justification des programmes de surveillance visant à évaluer la corrosion
- B.5.1 Programmes de surveillance résidentielle
- B.5.2 Détermination des protocoles d'échantillonnage pour un programme de surveillance résidentielle
- B.5.2.1 Échantillonnage RDT pour le volet 1 (option 1)
- B.5.2.2 Échantillonnage 30MS pour le volet 1 (option 2)
- B.5.2.3 Échantillonnage 30MS pour le volet 2 (options 1 et 2)
- B.5.2.4 Échantillonnage après 6 h de stagnation pour le volet 2 (options 1 et 2)
- B.5.2.5 Considérations relatives au volet 2
- B.5.2.6 Limites
- B.5.3 Détermination des protocoles d'échantillonnage pour les immeubles non résidentiels et résidentiels à logements multiples
- Partie C. Références et abréviations
- Partie D. Tableaux
- D.1 Principaux facteurs influant sur la corrosion et le relargage du plomb, du cuivre, du fer et du ciment
- D.2 Paramètres de qualité de l'eau dont la surveillance est suggéréeNote de bas de page a
- D.3 Conditions favorisant le relargage du plomb dans les réseaux de distribution d'eau potable et les systèmes de plomberie et indicateurs correspondants
- Partie E. Cadre d'un programme de contrôle de la corrosion dans des sites résidentiels
- Partie F. Protocole de surveillance alternatif pour les immeubles non résidentiels et résidentiels (stagnation en deux volets)
- Partie G. Ressources additionnelles sur des sujets liés au contrôle de la corrosion
- Partie H. Considérations internationales
Partie A. Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion
A.1 Objectif et portée
Le présent document de conseils fournit des connaissances, des outils et des approches grâce auxquels les autorités responsables, notamment les fournisseurs d'eau potable et les municipalités, pourront évaluer la corrosion et y remédier.
Ce document de conseil établit des protocoles d'échantillonnage permettant d'évaluer et d'identifier les mesures correctives à prendre pour réduire les concentrations de plomb dans l'eau du robinet. Le document porte sur un métal en particulier – le plomb –, car il s'agit du contaminant le plus préoccupant pour la santé lorsqu'il est question de la corrosion. Il est important de réduire le plus possible l'exposition au plomb puisqu'il est néfaste pour la santé même à de faibles concentrations. La démarche de surveillance qui est décrite dans la recommandation pour le plomb dans l'eau potable vise à évaluer l'exposition au plomb total dans une collectivité. En revanche, la démarche de surveillance qui est décrite dans le présent document de conseils vise à identifier les sources de plomb dans le réseau de distribution, y compris dans les systèmes de plomberie des bâtiments (résidentiels et commerciaux), et à évaluer l'efficacité d'approches d'atténuation comme, sans toutefois s'y limiter, l'enlèvement des entrées de service en plomb ou les programmes de contrôle de la corrosion. Ces objectifs sont complémentaires, et la recommandation pour le plomb dans l'eau potable devrait être lue en parallèle avec le présent document de conseils.
Dans le présent document, on entend par « contrôle de la corrosion » l'ensemble des mesures prises pour contrôler ou réduire le relargage de métaux, spécifiquement le plomb, dû à la corrosion des matériaux présents dans les réseaux de distribution d'eau potable. Des renseignements sur les grandes composantes d'un programme de contrôle de la corrosion sont fournis; toutefois, les aspects particuliers de l'exécution d'un plan de contrôle de la corrosion ou de l'enlèvement des entrées de service en plomb sont propres au site et ne sont pas abordés ici.
Le présent document ne traite que brièvement de la corrosion influencée par les microorganismes et ne fournit pas d'information détaillée sur le sujet.
A.2 Introduction et contexte
La corrosion constitue un problème courant des réseaux de distribution d'eau potable et des systèmes de plomberie au Canada. La corrosion est la détérioration d'un matériau, habituellement un métal, due à une réaction de celui-ci avec son environnement. Dans les réseaux de distribution d'eau potable, les tuyaux (comme les entrées de service en plomb) et les raccords métalliques font partie des matériaux qui peuvent être sujets à la corrosion interne et qui peuvent relarguer des concentrations croissantes de contaminants. La corrosion tend à provoquer une augmentation de la concentration de nombreux métaux (par exemple, des sous-produits de la corrosion) dans l'eau du robinet des consommateurs. Les dépôts de corrosion dans les tuyaux constituent également un réservoir important d'une grande variété de contaminants, dont certains sont préoccupants pour la santé. Le présent document se veut complémentaire à la recommandation pour le plomb dans l'eau potable et utilise les méthodes d'échantillonnage décrites dans cette recommandation. Les protocoles d'échantillonnage comportent trois objectifs en aidant à : estimer l'exposition au plomb d'une population; cerner les problèmes de relargage de plomb; et déterminer l'efficacité des mesures prises vis-à-vis de la corrosion.
On utilise aussi couramment le terme « corrosion » pour désigner les réactions de dissolution et de carbonatation (la précipitation du CaCO3) des matériaux à base de ciment. Ces réactions entraînent souvent une augmentation du pH, ce qui peut nuire à la désinfection et à la qualité esthétique de l'eau et réduire l'efficacité des produits chimiques utilisés pour le contrôle de la corrosion. Dans certains cas, l'attaque chimique subie par les tuyaux au contact de l'eau peut diminuer l'intégrité structurelle des tuyaux et provoquer leur défaillance ultérieure.
La corrosion des réseaux de distribution d'eau potable peut être causée par plusieurs facteurs, dont le type de matériau utilisé, l'âge des conduites et des raccords, la durée de stagnation de l'eau et la qualité de l'eau dans le réseau, y compris son pH. Les propriétés ayant le plus d'importance en ce qui concerne la corrosion des matériaux et la libération de contaminants dans les réseaux de distribution sont le pH et l'alcalinité. La température, la teneur en calcium, le chlore libre résiduel, les chloramines, le chlorures, le sulfate, le carbone inorganique dissous (CID), la dureté, le fer (Fe), le manganèse (Mn), l'aluminium (Al), l'oxygène dissous (OD) et la matière organique naturelle (MON) constituent d'autres paramètres qui influent sur la corrosion (voir le tableau D.1). Ces paramètres devraient faire l'objet d'une surveillance et/ou de mesures correctives afin que la qualité de l'eau soit optimisée en vue du contrôle efficace de la corrosion (voir le tableau D.2). À titre d'exemple, l'enlèvement de la MON, du manganèse et du fer faciliterait l'ajustement du pH et limiterait les interférences avec le traitement de contrôle de la corrosion. Les modifications du procédé de traitement de l'eau potable et les altérations de la qualité de l'eau (y compris en cas de mélange) peuvent avoir un impact sur la corrosion dans le réseau de distribution et les systèmes de plomberie résidentiels. De l'information détaillée sur l'échantillonnage des paramètres de qualité de l'eau peut être trouvée ailleurs (WRF, 2023).
Dans le présent document, on entend par « contrôle de la corrosion » l'ensemble des mesures prises pour contrôler ou réduire la libération de métaux, spécifiquement le plomb, dû à la corrosion des matériaux présents dans les réseaux de distribution d'eau potable. Bien qu'il n'y ait pas de méthode simple et fiable permettant de mesurer la corrosion proprement dite, il est possible de déterminer la concentration de plomb au robinet du consommateur et de s'en servir comme indice de corrosion. La surveillance des concentrations de plomb au robinet peut permettre de déterminer les sources du plomb et aider à choisir des stratégies efficaces de contrôle de la corrosion pour réduire ces concentrations.
Il n'existe aucun effet sur la santé directement lié à la corrosion dans les réseaux de distribution d'eau potable. Toutefois, la corrosion peut entraîner la libération de contaminants à des concentrations qui seraient préoccupantes pour la santé des personnes vivant au Canada. Le principal contaminant d'intérêt est le plomb, que l'on utilise comme élément déclencheur pour la mise en œuvre de programmes de contrôle de la corrosion et des mesures d'intervention connexes. La concentration maximale acceptable (CMA) actuelle pour le plomb (total) dans l'eau potable, établie sur la base d'effets sur la santé chez les enfants, est fixée à 0,005 mg/L. Le contrôle de la corrosion est une méthode de traitement efficace pour minimiser les concentrations de plomb au point de consommation. Toutefois, si l'eau est distribuée par une entrée de service en plomb, le contrôle de la corrosion à lui seul ne suffira peut-être pas à diminuer le plomb à des concentrations inférieures à la CMA. Par conséquent, l'enlèvement complet de l'entrée de service en plomb représente la solution jugée la plus efficace et la plus permanente. Le remplacement partiel des entrées de service en plomb n'est pas recommandé de façon générale. Il conviendrait aussi de remplacer toute portion de l'entrée de service qui contient du fer galvanisé.
Parmi les autres contaminants pouvant être relargués dans les réseaux de distribution d'eau potable sous l'effet de la corrosion, on retrouve le cuivre et le fer. La valeur de la recommandation pour le cuivre dans l'eau potable est de 2,0 mg/L (cuivre total). La valeur de la recommandation pour le fer (total) dans l'eau potable est de ≤ 0,1 mg/L et constitue un objectif esthétique. Les conseils fournis dans le présent document sur le contrôle de la corrosion visent à compléter les renseignements fournis sur l'échantillonnage et les mesures d'intervention dans les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Le plomb. La biocorrosion est brièvement abordée, mais les informations détaillées sujet dépassent le cadre du présent document. Néanmoins, le maintien de la stabilité biologique de l'eau est une part importante d'un bon contrôle de la corrosion (voir la section B.4.1.5).
Bien que les protocoles décrits dans le présent document représentent la meilleure approche pour évaluer les problèmes de corrosion dans les réseaux de distribution d'eau potable, d'après les données de surveillance et les données scientifiques disponibles, ils peuvent être peu pratiques ou irréalisables dans certains réseaux. Dans de tels cas, une version modifiée ou à échelle réduite de cette approche peut contribuer à une amélioration de la protection de la santé et de la qualité de l'eau (voir la section A.3.7).
Dans le présent document, le terme « réseau de distribution » est utilisé dans un sens large, comprenant le réseau de conduites des services publics, ainsi que les tuyaux, raccords et autres équipements adjacents ou à l'intérieur d'un immeuble ou d'un logement et servant à l'alimentation en eau. Cette définition ne suppose aucun changement quant à la responsabilité établie par un secteur de compétence ou une municipalité à l'égard de toute partie d'une entrée de service ou du système de plomberie se situant sur une propriété privée.
Messages clés
- La détermination des concentrations de plomb au robinet est essentielle à l'évaluation de l'exposition
- L'enlèvement complet des entrées de service en plomb est la solution de réduction du plomb la plus efficace et la plus permanente
- Le contrôle du pH et de l'alcalinité fait partie intégrante d'un contrôle efficace de la corrosion
- Un épisode de coloration de l'eau devrait déclencher un échantillonnage du plomb et d'autres métaux
- Un contrôle efficace de la corrosion exige une qualité d'eau stable dans le réseau de distribution et de bonnes pratiques d'entretien
A.3 Protocoles et programmes de surveillance pour le contrôle de la corrosion
Tout réseau de distribution d'eau potable, quelle que soit sa taille, peut être sujet à la corrosion. Il est donc important pour les autorités responsables de mettre en place un programme de surveillance afin d'évaluer si un réseau est sujet à de la corrosion, et à quel degré, et de prendre des mesures correctives appropriées. Comme il est indiqué à la section A.1, le contrôle de la corrosion correspond aux mesures prises pour contrôler ou réduire la libération du plomb (principalement). Ainsi, un programme de contrôle de la corrosion pour un réseau de distribution d'eau potable devrait être fondé sur les concentrations de contaminants spécifiques détectées au robinet du consommateur. Bien que la corrosion entraîne la libération de divers contaminants, le contrôle de la corrosion devrait avoir pour cible principale le plomb, puisqu'il s'agit du contaminant qui risque le plus d'entraîner des effets nocifs pour la santé aux concentrations habituellement mesurées dans les résidences et les réseaux de distribution. La qualité de l'eau du réseau de distribution est un facteur important du contrôle de la corrosion. Le maintien de la qualité de l'eau comprend la surveillance microbiologique et chimique, en plus des processus physiques/hydrauliques. Cela garantira une approche globale du contrôle de la corrosion (voir la section B.4.1).
La figure E.1 présente un cadre qui porte sur les activités et les étapes à entreprendre dans le cadre d'une approche holistique du contrôle de la corrosion et des traitements de contrôle de la corrosion (en l'occurrence, l'utilisation de produits chimiques). Ce cadre décrit l'interconnexion entre les différents éléments d'un Plan de contrôle de la corrosion dans un système (PCCS) se trouvant à la liste 1 et ceux des protocoles de surveillance décrits par la suite. Bien que la liste 1 illustre certains des éléments à inclure dans le PCCS relativement au plomb, une description complète dépasse le cadre du présent document. Le tableau G.1 contient des ressources qui faciliteront l'élaboration du PCCS, et certains renseignements sur le PCCS se trouvent à la partie B du document (par exemple, B.3 et B.4).
Liste 1. Exemple d'éléments à inclure dans un PCCS
Plan de contrôle de la corrosion dans un système (PCCS) – plomb (Pb)
- Évaluation des risques associés au plomb
- types et emplacement des sources de plomb
- données démographiques du système/population à risque
- inventaire des entrées de service en plomb (ESP) et échéancier de l'inventaire initial et de la mise à jour
- échantillonnage du plomb et surveillance des paramètres de qualité de l'eau
- perturbations potentielles (travaux routiers ou réparations/améliorations du réseau de distribution [RD], prévus ou urgents, etc.)
- types et emplacement des sources de plomb
- Mesures d'intervention
- plan de remplacement complet des ESP
- notification avant la réalisation des réparations
- mise en place d'un filtre au point d'utilisation ou utilisation d'eau en bouteille après les perturbations
- purge (mesure temporaire) après les perturbations
- construction, réparation du réseau de distribution/site
- remplacement partiel des ESP
- traitement de contrôle de la corrosion (TCC)
- Évaluation des contraintes liées à l'optimisation des concentrations de plomb
- Études d'optimisation des installations de traitement en vue d'une conformité simultanée
- Cibles de qualité de l'eau dans les installations de traitement (plages opérationnelles définies)
- Définition de plages et de limites pour les objectifs importants en matière de qualité de l'eau dans les RD (désinfectant et inhibiteur résiduels, pH, etc.)
- Caractérisation du RD et fonctionnement par rapport au relargage de Pb (ou de cuivre [Cu])
- Réduction des sédiments, des dépôts, des biofilms et des épisodes d'eau colorée (c'est-à-dire nettoyage) avant la mise en œuvre du TCC ou l'optimisation
- Réparation et remise en service des entrées comme mesure supplémentaire visant le Pb dans le cadre du TCC
- Établissement d'une stratégie d'éducation du public et de communication
Un programme de contrôle de la corrosion efficace comprend certains ou l'ensemble des éléments suivants :
- Mesure des paramètres de qualité de l'eau liés à la corrosion, en particulier le pH et l'alcalinité, dans le réseau de distribution plusieurs fois par année pour :
- évaluer les changements de qualité de l'eau dans le système
- établir la nécessité d'un contrôle de la corrosion
- Montages de tuyaux de plomb en boucle pour l'échantillonnage dans l'infrastructure appartenant à l'installation de traitement pour :
- évaluer les répercussions du traitement à grande échelle
- évaluer les changements liés au contrôle de la corrosion
- Échantillonnage au robinet dans des conditions contrôlées et uniformes (y compris, s'il y a lieu, les données issues de l'échantillonnage pour la conformité du plomb)
- Études théoriques
- Montages de tuyaux en boucle/pilotes
A.3.1 Considérations relatives à l'échantillonnage
Protocoles de contrôle de la corrosion
La présence de métaux dans l'eau potable est en grande partie liée à la corrosion des réseaux de distribution et de la plomberie, la mesure du contaminant au robinet constitue le meilleur outil pour évaluer la corrosion et établir l'exposition de la population. Ainsi, l'une des premières étapes de la mise en œuvre d'un programme de contrôle de la corrosion consiste à surveiller les concentrations de plomb au robinet du consommateur et à caractériser la qualité de l'eau. Cette surveillance fournira aux autorités responsables des renseignements sur la corrosivité de l'eau en ce qui a trait au plomb. Un programme de surveillance fournit les renseignements nécessaires pour déterminer les mesures correctives à prendre si les concentrations totales de plomb détectées dans le réseau dépassent la CMA (0,005 mg/L), ainsi que des renseignements sur le niveau de surveillance à mettre en œuvre par la suite. La surveillance de certains paramètres de qualité de l'eau, dont le pH et l'alcalinité, est essentielle pour évaluer les problèmes de corrosion et établir l'efficacité d'un programme de contrôle de la corrosion (voir le tableau D.1.2). D'autres outils, comme les montages de tuyaux en boucle, peuvent faciliter l'évaluation du contrôle de la corrosion. À terme, il faudra mesurer la teneur en plomb dans l'eau du robinet pour vérifier l'efficacité des mesures de contrôle de la corrosion et limiter l'exposition de la population.
Les protocoles d'échantillonnage varieront selon l'objectif (le but) visé (voir le tableau 1). Parmi les différents protocoles d'échantillonnage qui peuvent servir à la surveillance du plomb au robinet, il est important de choisir un protocole approprié en fonction de l'objectif et du type d'habitation. Une justification et des renseignements complémentaires sur les protocoles de surveillance, y compris leurs avantages et leurs limites, se trouvent à la partie B.5 de ce document. Une liste de ressources sur des sujets comme la planification du contrôle de la corrosion, les considérations opérationnelles et la mise en œuvre se trouve à la partie G, avec les références correspondantes. Les provinces et les territoires peuvent avoir établi des protocoles et des approches réglementaires. Les responsables de systèmes de distribution d'eau potable devraient consulter l'autorité dont ils relèvent en matière d'eau potable pour déterminer les exigences qui régissent la surveillance de la qualité de l'eau et obtenir des réponses aux questions touchant le protocole choisi.
| But | Type d'échantillon | Protocole |
|---|---|---|
Conformité à la réglementation relative au plomb et/ou Efficacité du contrôle de la corrosion |
Premier jet (U.S. EPA) voir la partie H : Considérations internationales |
|
| Aléatoire (RDT) (R.-U./UE) *Random Day Time |
|
|
| 30MS* (Ontario) *minutes de stagnation |
|
|
| 30MS* (Québec) *minutes de stagnation |
|
|
Détermination des sources de plomb (conduites/entrée de service en plomb) et/ou Détermination du type de plomb |
SéquentielNote de bas de tableau 1 - a – classique |
|
| SéquentielNote de bas de tableau 1 - a (Québec) |
|
|
| Séquentiel, stimulant la libération de particules | Échantillonnage séquentiel classique à débit croissant (faible, moyen et élevé) | |
| Après purge complète | 5 minutes de purge; prélèvement de 1 L et comparaison au seuil validé, propre à la collectivité, indiquant la présence d'une ESP | |
| 3Ts for schools and childcare facilities: revised manual, U.S. EPA |
|
|
RDT, random daytime (échantillonnage aléatoire); 30MS, 30 minutes de stagnation |
||
Les protocoles d'échantillonnage présentés dans ce document permettent de déterminer si l'eau distribuée est corrosive pour les matériaux présents dans le réseau de distribution et dans les systèmes de plomberie résidentiels, et de déterminer si les mesures de contrôle de la corrosion sont efficaces.
Si, dans le cadre d'un programme de contrôle de la corrosion, la surveillance et les autres prélèvements prévus à la section A.3 montrent que les concentrations de plomb dépassent la CMA, soit 0,005 mg/L (plomb total), une ou plusieurs des mesures correctives suggérées devraient être prises. Il faut établir l'efficacité de ces mesures par la suite, en poursuivant la surveillance. Ceci est important pour s'assurer que le programme de contrôle de la corrosion est optimisé de manière à réduire le plus possible les concentrations de plomb, ainsi que l'exposition au plomb et à d'autres contaminants connexes.
Types d'immeubles
Lors de la surveillance des concentrations de plomb dans le cadre d'un programme de contrôle de la corrosion, il faut tenir compte de deux contextes différents :
- les habitations résidentielles (comptant jusqu'à six logements)Note de bas de page 1;
- les immeubles non résidentiels et les immeubles résidentiels, notamment les écoles, les immeubles à logements multiples et les grands immeubles commerciaux.
Dans un contexte résidentiel, c'est-à-dire les habitations résidentielles, comme les maisons unifamiliales et les immeubles résidentiels (comptant jusqu'à six logements), on cherchera à déterminer les concentrations de plomb dans l'ensemble du réseau et à identifier les sources de plomb dans le réseau de distribution et dans les systèmes de plomberie résidentiels. Les programmes de surveillance résidentiels ont généralement pour but d'identifier les problèmes de corrosion, d'établir la cause du problème et, au besoin, de déterminer les meilleures mesures correctives. Une surveillance ultérieure doit être effectuée pour évaluer l'efficacité du programme de contrôle de la corrosion à l'échelle du réseau et pour déterminer si le contrôle de la corrosion a été optimisé.
En raison de la nature complexe des immeubles, les activités de surveillance dans les écoles, les immeubles à logements multiples (comptant plus de six logements) et les grands immeubles commerciaux seront principalement axées sur les sources de plomb dans le système de plomberie des immeubles. L'objectif d'un programme de surveillance dans les immeubles non résidentiels et les immeubles résidentiels est de localiser les problèmes particuliers de relargage de plomb et de déterminer les endroits où il convient d'intervenir, ainsi que les mesures correctives à prendre. Étant donné que les protocoles d'échantillonnage ont des objectifs différents selon qu'ils s'appliquent aux habitations résidentielles, aux immeubles non résidentiels ou aux immeubles résidentiels, le nombre d'échantillons à prélever, la fréquence d'échantillonnage et les mesures correctives à prendre seront également différents.
Traitements de contrôle de la corrosion
La mise en œuvre de traitements de contrôle de la corrosion a pour objectif de réduire le plus possible la libération de contaminants par les matériaux des réseaux de distribution, afin de protéger la santé des consommateurs. Parmi les autres avantages de ces traitements, on retrouve le prolongement de la durée de vie des conduites, ainsi qu'une réduction des fuites et du nombre de réparations et de remplacements de conduites à effectuer. On s'attend généralement à ce que les coûts de mise en œuvre des traitements de contrôle de la corrosion protègent la santé humaine et prolongent la durée de vie du réseau de distribution.
Les responsables de systèmes de distribution d'eau potable doivent veiller à ce que les modifications apportées aux processus de traitement de l'eau et à ce que les changements de source d'approvisionnement ne rendent pas l'eau plus corrosive envers le plomb. Tout changement apporté au traitement (y compris l'optimisation du contrôle de la corrosion) ou à la source d'approvisionnement devrait déclencher la surveillance du plomb et des autres métaux sensibles aux changements de qualité de l'eau (voir le tableau D.1.2). Il est essentiel de gérer la qualité de l'eau par un contrôle des sources d'approvisionnement (par exemple, le mélange de deux sources d'eau) et des autres contaminants (comme le fer ou le manganèse) pour que le traitement de contrôle de la corrosion soit efficace. Bien qu'il soit reconnu que la responsabilité des systèmes de traitement n'inclut pas, en général, les systèmes de plomberie résidentiels, la plupart des CMA établies dans les Recommandations pour la qualité de l'eau potable au Canada sont conçues de manière à s'appliquer au robinet du consommateur. En tant que tels, les programmes de contrôle de la corrosion doivent permettre de s'assurer que l'eau distribuée n'est pas corrosive pour les composants du réseau de distribution et du système de plomberie.
Pour les besoins du présent document, l'expression « réseau de distribution » comprend la conduite d'amenée qui relie la conduite principale à l'habitation ou à l'immeuble et à son système de plomberie. Bien que l'autorité en matière d'eau potable n'ait le contrôle du réseau de distribution que jusqu'à la limite de la propriété privée, il est important de tenir compte des effets de la corrosion après cette limite. Cela exige une bonne communication et une collaboration avec les propriétaires et les gestionnaires des immeubles. Les programmes de contrôle de la corrosion peuvent varier selon l'autorité responsable. Il peut aussi bien s'agir de programmes exhaustifs, mis en œuvre à l'échelle d'un réseau par le responsable de système de distribution d'eau potable, que de programmes locaux mis en œuvre par un propriétaire d'immeuble pour assurer un environnement sain et sûr aux occupants d'immeubles résidentiels et non résidentiels.
Échantillonnage au robinet
Puisque les concentrations de plomb au robinet du consommateur peuvent être considérablement plus élevées qu'à l'installation de traitement ou que dans les conduites principales, les stratégies visant à réduire l'exposition au plomb devraient être axées sur le contrôle de la corrosion dans les réseaux de distribution et sur l'enlèvement des composants contenant du plomb, comme les entrées de service en plomb. Bien qu'il soit reconnu que la responsabilité des systèmes de traitement n'englobe pas, en général, les systèmes de plomberie résidentiels, les consommateurs s'attendent à ce que l'eau provenant de leur robinet soit salubre. Pour certaines des CMA, la salubrité ne peut être vérifié qu'en surveillant l'eau potable au robinet du consommateur. L'échantillonnage à des fins de conformité se fait par la collecte d'échantillons représentatifs de la population desservie dans une zone (secteur) d'approvisionnement définie (échantillonnage par secteur). Un secteur d'approvisionnement correspond à un secteur géographique où la qualité de l'eau potable est à peu près uniforme. Il faut échantillonner toutes les secteurs, de manière à évaluer l'ensemble du réseau de distribution et à recenser toutes les secteurs à problèmes.
Inventaire des entrées de service en plomb
Un inventaire des entrées de service en plomb est un outil important pour le choix des sites de vérification de la conformité et des sites sentinelles lors de la mise en œuvre de mesures de contrôle de la corrosion. Un tel inventaire sera essentiel pour la gestion des entrées de service en plomb, pour la planification de leur enlèvement et pour la réalisation des travaux nécessaires. Les sites sentinelles correspondent aux sites où il est le plus probable de retrouver des concentrations élevées de plomb. Ils sont utilisés pour refléter les problèmes potentiels de relargage de plomb ou pour évaluer l'efficacité des programmes de contrôle de la corrosion. Pour évaluer l'efficacité du contrôle de la corrosion, une analyse comparative des différents secteurs devrait être réalisée avec comme point de référence les échantillons prélevés dans une propriété particulière (site sentinelle).
Les sites sentinelles sont désignés à partir d'un bassin de résidents souhaitant participer à la surveillance continue du plomb. La désignation à titre de site sentinelle ne devrait pas influencer le calendrier de réalisation des mesures d'intervention, comme le remplacement des entrées de service en plomb. Puisque la participation à la surveillance est volontaire, il conviendrait de recenser les sites potentiels dans une base de données et d'y recourir si certains sites ne peuvent plus être utilisés (par exemple, si l'entrée de service en plomb est remplacée) ou si un résident décide de se retirer du programme de surveillance.
Les sites sentinelles devraient être concentrés dans les endroits où la présence de risques élevés est confirmée (par exemple, entrées de service en plomb ou cols-de-cygne en plomb), et ils devraient comprendre les secteurs alimentés par de l'eau potentiellement corrosive (par exemple, cul-de-sac dans les réseaux chloraminés) et les réseaux consécutifs (c'est-à-dire les réseaux de distribution publics dont l'approvisionnement se fait à partir d'un autre réseau public). Il peut être utile de recourir à un cadre fondé sur l'échantillonnage (par exemple, échantillonnage séquentiel ou avec purge) pour déterminer si des entrées de service en plomb sont présentes et dresser un inventaire des entrées de service en plomb. Des ressources sont répertoriées dans le tableau G.1.
Mesures correctives
Lorsque les concentrations dépassent la CMA, il faut mener une enquête puis, s'il y a lieu, prendre des mesures correctives. Ces mesures comprennent, sans toutefois s'y limiter, le rééchantillonnage, l'enlèvement des entrées de service en plomb et des autres sources de plomb, l'éducation du public, l'installation de filtres temporaires aux points d'utilisation et/ou des traitements de contrôle de la corrosion. Bien que le contrôle de la corrosion soit une méthode de traitement efficace pour minimiser les concentrations de plomb aux points de consommation, ce traitement à lui seul sera peut-être insuffisant si l'eau est distribuée par des entrées de service en plomb. Pour cette raison, l'enlèvement complet des entrées de service en plomb est la solution jugée la plus efficace et la plus permanente.
Les mesures correctives pourraient également comprendre l'entretien des réseaux de distribution, comme l'élimination du fer, du manganèse et de l'aluminium, car ces métaux nuisent au traitement de contrôle de la corrosion et peuvent aussi favoriser le relargage du plomb. Le fait de purger le robinet d'eau froide ne s'est pas avéré suffisamment efficace pour réduire de façon systématique l'exposition au plomb dans les écoles, les immeubles à logements multiples et les grands immeubles (commerciaux). Les mesures correctives devraient être fondées sur une évaluation de la cause du dépassement au moyen de protocoles adéquats.
A.3.2 Protocoles de surveillance en deux volets pour les habitations résidentielles
L'échantillonnage dans les sites résidentiels (jusqu'à six logements) est une approche en deux volets qui vise à évaluer la corrosion de divers matériaux contenant du plomb dans les réseaux de distribution résidentiels. Le protocole comprend deux options : l'option 1, un échantillonnage aléatoire réalisé de jour (RDT); et l'option 2, un échantillonnage réalisé après 30 minutes de stagnation (30MS).
A.3.2.1 Premier volet d'échantillonnage
Il est important que le protocole retenu soit appliqué uniformément au cours des échantillonnages subséquents pour que les résultats puissent être comparés. Pour les deux options, le premier volet (volet 1) d'échantillonnage donne une indication des concentrations de plomb dans l'ensemble du réseau et de la nécessité de prendre des mesures pour contrôler la corrosion et réduire l'exposition au plomb. Un sous-ensemble de sites sentinelles est inclus dans le volet 1, afin qu'il soit possible de caractériser les zones/secteurs les plus préoccupants et d'évaluer l'efficacité des mesures prévues de contrôle de la corrosion. Une fois le programme de contrôle de la corrosion mis en place, le volet 1 d'échantillonnage fournit aussi les données requises pour évaluer si les mesures correctives ont permis de réduire la corrosion des divers matériaux contenant du plomb dans l'ensemble du réseau. Le SG est une concentration de plomb au 90e centile de 0,005 mg/L ou moins. Par conséquent, lorsque la concentration (totale) de plomb est supérieure à 0,005 mg/L dans plus de 10 % des sitesNote de bas de page 2, des mesures correctives et un échantillonnage de suivi sont déclenchés. Il y aurait lieu de procéder à un échantillonnage du volet 2 chaque fois que la concentration de plomb mesurée dans un échantillon dépasse 0,005 mg/L.
A.3.2.2 Volet 1, option 1, protocole d'échantillonnage aléatoire (RDT)
L'échantillonnage aléatoire (RDT) permet de mesurer l'exposition typique d'une population, y compris son exposition potentielle au plomb particulaire. Ce type d'échantillonnage permet d'identifier les endroits où il faut réduire les concentrations de plomb en priorité et d'évaluer la conformité dans l'ensemble du réseau.
On prélève un échantillon de premier jet de 1 L au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille), de façon aléatoire durant la journée, dans chaque résidence. Les échantillons doivent être prélevés sans purge préalable ni période de stagnation, afin de mieux refléter l'utilisation typique du consommateur.
A.3.2.3 Volet 1, option 2, Protocole d'échantillonnage 30MS
Ce protocole d'échantillonnage a pour but de mesurer la concentration de plomb dans l'eau qui a été en contact pendant une brève période transitoire (30 minutes) avec l'entrée de service en plomb et les éléments de plomberie interne comme les soudures au plomb ou les raccords en laiton. On prélève deux échantillons de 1 L au robinet d'eau froide du consommateur sans retirer l'aérateur ou la grille, après avoir purgé la plomberie pendant 5 minutes, puis avoir laissé l'eau stagner pendant 30 minutes. Chaque échantillon de 1 L est analysé individuellement. Le plus haut résultat obtenu servira à déterminer si les concentrations de plomb (plomb total) dépassent 0,005 mg/L dans plus de 10 % des sites. Ainsi, la concentration de plomb correspondant au pire scénario est systématiquement prise en compte. Il s'agit d'une divergence par rapport à la recommandation pour le plomb dans l'eau potable, où l'on utilise la moyenne de deux échantillons de 1 L prélevés après 30 minutes de stagnation afin de refléter l'exposition réelle (Santé Canada, 2019). Puisqu'une purge précède l'échantillonnage dans le protocole 30MS, il ne permettra vraisemblablement pas de capter d'éventuelles particules de plomb libérées. L'analyse d'autres métaux présents dans les échantillons (par exemple cuivre, cadmium, fer, manganèse) peut faciliter l'identification de la source de plomb (par exemple du laiton ou de l'acier galvanisé). Elle peut aussi montrer que certains éléments interférents nuisent au traitement de contrôle de la corrosion et doivent être éliminés. On peut penser, par exemple, au CaCO3, qui interfère avec les orthophosphates.
A.3.2.4 Deuxième volet d'échantillonnage
Le protocole d'échantillonnage séquentiel pour le deuxième volet (volet 2) est un outil qui peut aider à trouver les sources de plomb. Il permet d'obtenir un profil des contributions de plomb du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et de l'entrée de service en plomb. Si l'échantillonnage réalisé dans le cadre du volet 1 révèle la présence, dans plus de 10 % des sites, d'une concentration de plomb (plomb total) supérieure à 0,005 mg/L, des mesures correctives et un échantillonnage de suivi s'imposent. Toutefois, si le SG est respecté, tout site où est prélevé un échantillon dépassant 0,005 mg/L devrait faire l'objet de prélèvements selon le protocole du volet 2, afin d'établir si le problème se situe au niveau de la résidence ou du secteur.
Le protocole d'échantillonnage du volet 2 s'applique aux options 1 et 2 du volet 1 (échantillonnage RDT et 30MS). L'échantillonnage du volet 2 se déroule dans un nombre réduit de sites dérivant du volet 1. Il permet d'obtenir des renseignements détaillés sur la contribution des différents matériaux contenant du plomb présents dans le réseau de distribution à la concentration totale de plomb. C'est ce qu'on appelle le profil des concentrations de plomb. Avec ces renseignements, les autorités responsables peuvent déterminer les sources probables de plomb et les éléments contribuant le plus à cette contamination, de façon à pouvoir choisir des mesures correctives adéquates et optimiser le contrôle de la corrosion.
Dans certains cas, l'autorité responsable peut juger souhaitable de prélever les échantillons pour les deux volets à l'occasion d'une même visite dans un site. Cette étape élimine le besoin de retourner dans une résidence si le SG n'est pas atteint dans le cadre du volet 1, mais elle pourrait être irréalisable dans certaines situations, comme l'échantillonnage avec 6 h de stagnation.
L'échantillonnage séquentiel du volet 2 est effectué dans 10 % des sites échantillonnés dans le cadre du volet 1, et plus précisément dans les sites où l'on a observé les concentrations les plus élevées de plomb. Dans le cas d'un réseau de petite taille (desservant 100 personnes ou moins), il faut prélever des échantillons dans au moins deux sites afin d'obtenir des données suffisantes pour dresser le profil des concentrations de plomb de l'eau de ce réseau. Le choix de la période de stagnation dépend de considérations d'ordre pratique et vise à générer des concentrations accrues de plomb afin de faciliter l'évaluation tout changements.
Dans le cadre du volet 2, les échantillons sont prélevés après une période définie de stagnation de l'eau, selon l'un ou l'autre des protocoles suivants :
- 30 minutes (30MS) : Ce protocole d'échantillonnage séquentiel permet de mesurer la concentration de plomb dans l'eau qui a été en contact pendant une brève période transitoire (30 minutes) avec l'entrée de service en plomb et les éléments de plomberie interne (comme les soudures au plomb ou les raccords en laiton). Une purge de 5 minutes, suivie d'une période de stagnation de 30 minutes, est effectuée au robinet d'eau froide potable du consommateur. On prélève ensuite (au moins) quatre échantillons consécutifs de 1 L à ce robinet, sans retirer l'aérateur ou la grille. On analyse individuellement chaque échantillon de 1 L afin d'obtenir un profil des contributions du robinet, de la plomberie et d'une portion ou de l'ensemble de l'entrée de service en plomb à la concentration totale en plomb. Les responsables de systèmes de distribution d'eau potable peuvent choisir de prélever les quatre échantillons de 1 L lors des visites effectuées pour le volet 1 et procéder aux analyses du volet 2 pour les trois échantillons restants, seulement si nécessaire, pour le 10 % des résidences où les concentrations de plomb sont les plus élevées.
- 6 heures (au minimum) : Ce protocole d'échantillonnage séquentiel, qui comprend une période de stagnation plus longue que dans le protocole 30MS, permet de mesurer la concentration de plomb dans l'eau soumise à un contact prolongé avec l'entrée de service en plomb et les éléments de plomberie interne (comme les soudures au plomb ou les raccords en laiton). Les concentrations de plomb se rapprochent de leur valeur maximale après 5 heures de stagnation, ce qui facilite l'évaluation des changements. On prélève (au moins) quatre échantillons consécutifs de 1 L au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille) après une période de stagnation de 6 heures ou plus. On analyse individuellement chaque échantillon de 1 L afin d'obtenir un profil de la contribution du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et de l'entrée de service en plomb. Il n'est cependant pas pratique de prélever les échantillons de 1 L au cours des visites du volet 1 si un protocole d'échantillonnage séquentiel de 6 heures (au minimum) est planifié.
Remarque : Dans certaines circonstances, il peut être avantageux de prélever de plus petits volumes cumulatifs pour chaque échantillon de 1 L afin de trouver la source de plomb avec plus de précision. Étant donné qu'il est possible que quatre échantillons consécutifs de 1 L ne permettent pas de déterminer la contribution de l'entrée de service en plomb dans les plus grands systèmes de plomberie, le prélèvement d'échantillons supplémentaires de 1 L peut s'avérer utile.
Malgré l'atteinte du SG, quand la concentration totale de plomb dépasse 0,005 mg/L dans un échantillon, les responsables des systèmes de distribution d'eau potable devraient aviser les consommateurs occupant les habitations touchées et leur fournir des renseignements sur les moyens de réduire leur exposition au plomb. Des exemples sont indiqués au point no 1 dans la liste 2. On recommande que les responsables de systèmes de distribution d'eau potable effectuent des prélèvements de suivi sur ces sites afin d'évaluer l'efficacité des mesures correctives prises par les consommateurs. Lorsque la concentration (totale) de plomb est supérieure à 0,005 mg/L (SG) dans plus de 10 % des sitesNote de bas de page 2, il est recommandé que les responsables de systèmes de distribution d'eau potable prennent les mesures indiquées à la liste 2.
Résultats de l'échantillonnage séquentiel
Les résultats de l'échantillonnage séquentiel réalisé selon l'une ou l'autre des méthodes (30 minutes ou au minimum 6 heures de stagnation) permettront de déterminer quelles mesures d'intervention, parmi celles énoncées dans la liste 2, les responsables de systèmes de distribution d'eau potable peuvent mettre en œuvre ou recommander au consommateur.
Liste 2. Mesures que devraient prendre les responsables de systèmes de distribution d'eau potable lorsque la concentration totale de plomb dépasse 0,005 mg/L dans plus de 10 % des sites
- Communiquer les résultats des analyses aux consommateurs et les informer des mesures correctives qu'ils peuvent prendre pour réduire leur exposition au plomb, et en particulier l'exposition des enfants et des nourrissons alimentés au lait maternisé. Les consommateurs peuvent prendre les mesures correctives suivantes, seules ou en combinaison :
- purger les conduites en laissant couler l'eau après une période de stagnation prolongée;
- utiliser des dispositifs de traitement de l'eau potable certifiés conformes à la norme NSF/ANSI 53 pour l'enlèvement du plomb jusqu'à ce que les sources de plomb soient remplacées;
- remplacer leur portion de l'entrée de service en plomb (idéalement en coordination avec le remplacement de la portion appartenant à la municipalité);
- replacer les tuyaux en fer galvanisé et les tuyaux en fer galvanisé à revêtement de plomb;
- remplacer les dispositifs en ligne ou les raccords en laiton;
- remplacer les tuyaux en cuivre qui ont des soudures au plomb.
- Lancer un programme d'éducation du public afin d'encourager les consommateurs à purger leurs conduites après une période de stagnation, pendant que des mesures correctives appropriées sont évaluées ou prises. Cette purge devrait être réalisée de manière à éliminer toute l'eau stagnante ayant été en contact avec du plomb présent dans les robinets, les raccords et les soudures connexes, ainsi que l'entrée de service en plomb.
- Envisager de fournir des filtres certifiés conformes aux normes NSF/ANSI 53 et 42 pour l'enlèvement du plomb dans l'eau potable ou recommander l'utilisation de tels filtres (voir la section sur le choix d'un filtre pour le plomb dans le tableau G.1).
- Faire d'autres prélèvements (comme indiqué dans le protocole d'échantillonnage du volet 2) dans 10 % des sites échantillonnés lors du volet 1 pour lesquels on a observé les concentrations de plomb les plus élevées (plus de 0,005 mg/L).
- Mettre en œuvre des mesures correctives afin de contrôler la corrosion dans l'ensemble du réseau. L'analyse des échantillons individuels de 1 L fournira des données sur la source du plomb dans le réseau. Toutefois, si la source du plomb ne peut être identifiée au moyen du profil des concentrations de plomb dans les quatre échantillons de 1 L, d'autres études peuvent s'avérer nécessaires. Selon la source du plomb et le nombre de résidences touchées, les mesures correctives suivantes peuvent être prises, individuellement ou en combinaison :
- remplacer les entrées de service en plomb (ainsi que les raccords en queue de cochon et les cols-de-cygne, le cas échéant);
- replacer les tuyaux en fer galvanisé et les tuyaux en fer galvanisé à revêtement de plomb;
- ajuster le pH et l'alcalinité;
- ajuster le pH (au besoin) et ajouter des inhibiteurs de corrosion;
- remplacer les dispositifs en ligne ou les raccords en laiton.
- Encourager les propriétaires à éliminer périodiquement les débris retenus dans les grilles ou les aérateurs des robinets d'eau. Si une quantité substantielle de débris est enlevée de la grille ou de l'aérateur, les autorités peuvent juger souhaitable de procéder à une nouvelle analyse de l'eau de ces robinets en suivant le même protocole. Si les résultats de ces nouveaux tests indiquent des concentrations totales de plomb inférieures à 0,005 mg/L, les responsables de systèmes de distribution d'eau potable devraient chercher à savoir si le plomb particulaire contribue de manière importante aux concentrations élevées observées et si un nettoyage régulier de l'aérateur ou de la grille constitue une mesure corrective appropriée.
A.3.3 Échantillonnage de suivi (démonstration de l'optimisation du TCC et de l'efficacité des interventions)
Au fil du temps, les données de surveillance issues des échantillonnages de suivi peuvent être utilisées par les responsables de systèmes de distribution d'eau potable pour évaluer l'efficacité du contrôle de la corrosion et optimiser leurs programmes. La comparaison des concentrations de plomb les plus élevées dans les sites sentinelles et le réseau avant et après la mise en place du programme de contrôle de la corrosion constitue la meilleure approche pour quantifier avec précision les effets du traitement de contrôle de la corrosion et démontrer que le traitement a été optimisé. La fréquence et la durée de l'échantillonnage de suivi dépendront du type de mesures de contrôle de la corrosion retenues. On trouvera à la section A.3.4 des conseils généraux sur la fréquence et la durée de la surveillance pour différentes mesures correctives. L'échantillonnage de suivi devrait être effectué jusqu'à ce que les résultats d'au moins deux séries consécutives de prélèvements montrent que l'objectif est atteint. Selon la source de plomb la plus importante dans un réseau, les responsables de l'approvisionnement en eau potable peuvent devoir compléter l'échantillonnage du volet 1 par un deuxième volet d'échantillonnage afin d'évaluer si le contrôle de la corrosion est optimisé.
Une fois qu'on aura déterminé que le contrôle de la corrosion est optimisé, la surveillance annuelle pourra reprendre.
A.3.4 Fréquence de l'échantillonnage pour la surveillance des immeubles résidentiels
Pour des raisons de conformité, les concentrations de plomb au robinet doivent faire l'objet d'une surveillance au moins une fois par an (dans chaque site du programme d'échantillonnage), afin qu'il soit possible de déterminer si le réseau de distribution d'eau potable présente un problème de corrosion. Au début de la mise en œuvre d'un programme de contrôle de la corrosion, la surveillance doit se faire plus souvent qu'une fois par an, en fonction des mesures de contrôle retenues. Cette fréquence de surveillance accrue doit être maintenue jusqu'à ce que les mesures de contrôle aient été optimisées. Étant donné que la corrosion du plomb et les concentrations de plomb varient facilement suite à des modifications mineures de la qualité de l'eau distribuée, un échantillonnage annuel devrait être réalisé même une fois le programme de contrôle de la corrosion optimisé. Il est recommandé d'augmenter la fréquence de la surveillance (aux sites sentinelles et aux sites d'échantillonnage) lorsque des modifications touchant la qualité de l'eau (par exemple nitrification), les processus de traitement (par exemple changement de désinfectant, d'oxydant ou coagulant) ou dans la source d'eau risquent d'altérer des paramètres de la qualité de l'eau qui ont une incidence sur la corrosion (comme le pH et l'alcalinité). Dans certaines circonstances, un échantillonnage supplémentaire peut être requis lorsqu'on procède à des modifications localisées du réseau de distribution et/ou de la plomberie.
Lorsqu'on utilise des ajustements du pH et de l'alcalinité ou des ajustements du pH et des inhibiteurs de corrosion pour contrôler la corrosion à l'échelle du réseau, il faut surveiller la qualité de l'eau au moins une fois par semaine au point d'entrée du réseau de distribution et une fois par mois dans le réseau de distribution, y compris au robinet. La mise en œuvre d'un programme de contrôle de la corrosion doit être effectuée de manière à tenir compte des conditions qui sont représentatives des variations de la qualité de l'eau (par exemple température, pH, alcalinité). Si le contrôle de la corrosion est effectué sur une période de moins d'un an, il faut démontrer que les variations saisonnières de certains paramètres (par exemple température, couleur, pH, alcalinité) ont été prises en compte dans l'analyse de l'efficacité des mesures de contrôle de la corrosion. Il faut envisager d'effectuer une surveillance en ligne et en temps réel de tous les paramètres de contrôle de procédés pour être en mesure de détecter les éventuelles variations de la qualité de l'eau.
Les paramètres de qualité de l'eau comme le pH, l'alcalinité, la concentration de plomb et d'inhibiteur de corrosion résiduel (s'il y a lieu) doivent être surveillés pendant au moins 6 mois en cas d'ajustements du pH et de l'alcalinité. Puisque le contrôle de la corrosion au moyen d'inhibiteurs de corrosion, comme les orthophosphates, exige plus de temps, la surveillance des paramètres de qualité de l'eau devrait être maintenue pendant au moins 18 mois après leur introduction. Selon les meilleures pratiques, il faut continuer à surveiller les paramètres qui influent sur le contrôle de la corrosion et ceux qui mesurent l'efficacité du contrôle de la corrosion. Pendant l'étape de mise en œuvre, il faut également surveiller les concentrations de cuivre, de fer et de de désinfectant résiduel, ainsi que les indicateurs microbiologiques (dont l'acide nucléique adénosine triphosphate) dans le réseau de distribution. On trouvera ailleurs dans la documentation de l'information détaillée sur l'échantillonnage associé à la surveillance des paramètres de qualité de l'eau (WRF, 2023).
En règle générale, les responsables de systèmes de distribution d'eau potable devraient viser le remplacement de l'entrée de service en plomb en entier afin de réduire au minimum l'exposition du consommateur au plomb. Toutefois, dans les faits, les mesures d'intervention peuvent inclure un remplacement total ou partiel des entrées de service en plomb, en fonction d'un certain nombre de facteurs. Lorsque les entrées de service en plomb sont remplacées, il faut encourager le consommateur à faire couler l'eau froide pendant une longue période et effectuer un échantillonnage une ou deux fois par semaine jusqu'à ce que les concentrations de plomb se stabilisent. Il est particulièrement important de le faire lorsqu'on ne peut procéder qu'à un remplacement partiel des entrées de service en plomb. Une fois qu'on aura déterminé que le contrôle de la corrosion est optimisé, la surveillance annuelle pourra reprendre.
L'échantillonnage annuel de routine (conformité) devrait être réalisé tous les ans à la même période, étant donné que le relargage du plomb, ainsi que la libération d'autres contaminants, dans le réseau de distribution est influencé par les changements de température et les variations saisonnières. Dans l'ensemble du Canada, la saison la plus chaude, de mai à octobre, est recommandée comme période d'échantillonnage pour des raisons pratiques et parce qu'on s'attend à ce que les concentrations de plomb soient plus élevées au cours de ces mois.
A.3.5 Nombre et choix des sites pour la surveillance des résidences
Le nombre de résidences à surveiller est déterminé en fonction de la taille du réseau de distribution d'eau potable, tel qu'indiqué dans le tableau 2. Le nombre suggéré de sites de surveillance est le nombre minimal de sites requis pour pouvoir caractériser le profil des concentrations de plomb dans un réseau. Il faut prélever un minimum de 20 échantillons par an dans un secteur d'approvisionnement en eau donnée (secteur géographique où la qualité de l'eau potable est à peu près uniforme), quelle que soit la méthode d'échantillonnage. Par souci d'efficience, on peut inclure dans un même secteur d'approvisionnement différents réseaux de distribution dont la qualité de l'eau est similaire, si cela permet d'obtenir un nombre suffisant d'échantillons. En général, il faut de 20 à 60 échantillons (par an) par secteur d'approvisionnement en eau afin que l'efficacité du contrôle de la corrosion puisse être évaluée avec une robustesse statistique suffisante. La surveillance devrait se poursuivre dans un nombre réduit de sites de surveillance du contrôle de la corrosion (voir le tableau 2) une fois le programme de contrôle de la corrosion optimisé. La caractérisation des taux de plomb dans un très petit réseau (desservant, par exemple, une population de 500 personnes ou moins) pourrait exiger le regroupement d'un nombre inférieur d'échantillons pendant une période prolongée.
Dans le cas de l'échantillonnage de routine (conformité) de petits systèmes de distribution en eau, il peut être approprié de prélever un nombre inférieur d'échantillons, selon les circonstances locales. Cette fréquence peut être réduite s'il ne survient aucun problème pendant la période définie par l'autorité responsable.
L'échantillonnage RDT peut être utilisé dans l'ensemble du réseau, alors que l'échantillonnage 30MS est normalement utilisé dans les sites sentinelles. En raison du caractère aléatoire de l'échantillonnage RDT, il faut prélever de 2 à 5 fois plus d'échantillons que dans le cas de l'échantillonnage 30MS pour que la robustesse statistique soit suffisante. Alors que l'échantillonnage RDT est relativement peu coûteux, plus pratique à mettre en application et généralement mieux accepté par le consommateur que l'échantillonnage 30MS, cette dernière méthode d'échantillonnage peut également être utilisée pour déterminer la cause des dépassements et pour identifier les mesures d'intervention appropriées.
Les résidences à haut risque, comme celles dont l'entrée de service est en plomb, devraient être retenues comme sites sentinelles afin de refléter les problèmes potentiels de plomb dans la collectivité et de réduire adéquatement l'exposition au plomb de la population. Les sites sentinelles peuvent aussi servir à évaluer l'efficacité du contrôle de la corrosion. De façon générale, on recommande un minimum de 6 sites sentinelles et un échantillonnage périodique pour évaluer le contrôle de la corrosion. Un inventaire des entrées de service en plomb permettra d'identifier les secteurs d'approvisionnement en eau ou les résidences les plus susceptibles de présenter des concentrations élevées de plomb, et il aidera à trouver de nouveaux sites sentinelles si un site existant ne peut plus être utilisé. Le fait de cibler ces secteurs d'approvisionnement en particulier fournira une meilleure évaluation du contrôle de la corrosion. Les sites de surveillance doivent être choisis en fonction du protocole d'échantillonnage retenu.
Les programmes de surveillance associés à l'échantillonnage aléatoire sont effectués dans des secteurs d'approvisionnement en eau définies, dont la taille peut varier, mais qui ne doivent idéalement pas dépasser 100 000 habitants. Il est possible d'augmenter la taille de l'échantillon soit en prélevant davantage d'échantillons soit en regroupant les données recueillies sur plusieurs années. Dans ces cas, l'échantillonnage des propriétés à l'aide d'autres approches (comme des sites sentinelles) fournira une estimation plus fiable de l'exposition du public ainsi que de l'efficacité et de l'optimisation des mesures de contrôle de la corrosion. Il peut également être utile de connaître l'utilisation qui est faite de l'eau dans les sites d'échantillonnage (faibles volumes, longues périodes sans utilisation, etc.) pour déterminer les répercussions possibles sur les concentrations de plomb et l'efficacité du traitement de contrôle de la corrosion.
Quel que soit le protocole utilisé, tous les échantillons devraient être prélevés dans des bouteilles d'échantillonnage à grande ouverture sans retirer l'aérateur du robinet. La conservation (acidification) de l'échantillon peut être réalisée au laboratoire dans des conditions définies. Les échantillons doivent être acidifiés avec une solution d'acide nitrique à 2 % (par volume), et un délai d'attente d'au moins 16 heures est ensuite requis avant de procéder à l'analyse. Chaque échantillon doit être bien mélangé avant l'analyse à l'aide d'une méthode appropriée. L'ajout d'acide nitrique à 2 % doit être réalisé par des membres du personnel qualifiés, qui prendront les précautions nécessaires. À cette fin, si l'échantillonnage est effectué par les propriétaires des résidences, l'échantillon sera acidifié et mis en attente à son arrivée au laboratoire seulement. La conservation des échantillons est abordée plus en détail dans la recommandation pour le plomb dans l'eau potable (Santé Canada, 2019a).
| Taille de la zone/secteur d'approvisionnement (nombre de personnes desservies) |
Nombre de sites par zone/secteur d'approvisionnementNote de bas de tableau 2 - a (surveillance annuelle) |
Nombre minimal de sites de surveillance par zone/secteur d'approvisionnementNote de bas de tableau 2 - b (surveillance du contrôle de la corrosion) |
|---|---|---|
| 100 001 à 500 000 | 4 à 12 | 20 |
| 50 001 à 100 000 | 3 à 4 | 20 |
| 5 001 à 50 000 | 2 à 4 | 20 |
| 501 à 5 000 | 1 | 20 |
| < 100 à 500 | 1 | < 20 |
D'autres études peuvent s'avérer nécessaires pour identifier la source de plomb dans certains cas. Ces études supplémentaires, faites au moyen d'un échantillonnage séquentiel, pourraient consister en la collecte de plusieurs échantillons séquentiels de 1 L (ou de plus petits volumes cumulatifs, par exemple 8 x 125 mL, 4 x 250 mL, 2 x 500 mL, selon la configuration de la plomberie) afin qu'il soit possible de déterminer le profil des concentrations de plomb dans une résidence avec plus de précision. De façon générale, le diamètre interne du tuyau et le volume d'eau prélevé permettent de calculer la longueur de tuyau correspondant à chaque volume. La longueur calculée peut ensuite servir à déterminer l'emplacement des raccords d'où semble provenir le plomb aux endroits correspondants du système de plomberie. Il est important que les autorités responsables dressent un inventaire des sites de surveillance où il est probable que des matériaux contenant du plomb soient présents. Les registres historiques, comme les codes de la plomberie, les permis de construction et les registres de compteurs, peuvent fournir aux autorités des renseignements utiles sur les matériaux utilisés à certaines époques ou dans certains secteurs du réseau de distribution. Ceci peut être utile pour identifier les sites potentiels de surveillance. Les registres historiques peuvent être limités ou incorrects. Les responsables de systèmes de distribution d'eau potable pourraient donc devoir évaluer les résultats de l'échantillonnage pour déterminer si des sites supplémentaires de surveillance sont nécessaires et s'assurer que le réseau a été correctement évalué. Il peut être utile de recourir à un cadre fondé sur l'échantillonnage pour déterminer si des entrées de service en plomb sont présentes, dresser un inventaire des entrées de service et définir les secteurs d'approvisionnement qui feront l'objet d'un échantillonnage ciblé. Lorsque les concentrations de contaminants sont hautement variables, comme dans le cas du plomb, il est impossible de concevoir un protocole de surveillance sélectif qui reflète avec certitude les concentrations dans l'ensemble du réseau.
Si, à un moment quelconque, un réseau ne satisfait pas à l'objectif décrit à la section A.3.1 dans le cadre d'un programme de surveillance annuelle réduite, les mesures correctives doivent être réévaluées et des mesures appropriées doivent être prises. Un échantillonnage ultérieur doit être réalisé sur un certain nombre de sites inclus dans la surveillance annuelle jusqu'à ce qu'au moins deux périodes d'échantillonnage consécutives montrent que le programme de contrôle de la corrosion a été efficace.
A.3.6 Protocole de surveillance pour les immeubles non résidentiels et résidentiels à logements multiples (en deux volets)
Les objectifs des protocoles d'échantillonnage et le SG pour les immeubles non résidentiels comme les écoles, les garderies et les services de garde ainsi que les immeubles résidentiels à logements multiples (de plus de six logements) et les grands immeubles consistent à localiser les problèmes particuliers de relargage de plomb dans les immeubles, à déterminer les endroits où il faut intervenir et à déterminer quelles mesures il convient de prendre. L'objectif est de réduire le plus possible les concentrations de plomb aux sorties d'eau froide (à savoir les raccords et appareils comme les robinets et les fontaines) utilisées pour la boisson et la cuisine et de protéger ainsi la santé des occupants contre une exposition au plomb. Les protocoles d'échantillonnage visent l'obtention d'une meilleure compréhension des concentrations de plomb observées aux diverses sorties d'eau des immeubles. Les concentrations aux sorties d'eau varieront selon les sources de plomb dans la plomberie et les modes d'utilisation de l'eau dans le bâtiment.
Un plan d'échantillonnage devrait tenir compte du type d'immeuble échantillonné et cibler des sites prioritaires pour chaque prélèvement (c'est-à-dire pour chaque cycle d'échantillonnage que prévoit le plan). On recommande de dresser un profil de la plomberie de l'immeuble afin de déterminer les sources potentielles de plomb et les zones de stagnation et d'évaluer le potentiel de contamination par le plomb de chaque fontaine et de chaque robinet d'eau froide utilisé pour la boisson ou la cuisine.
Les périodes de stagnation dépendront de facteurs tels que la fréquence d'utilisation d'un robinet, la distribution ou non d'eau en bouteille, de combien d'heures par jour et le nombre de jours par semaine que le bâtiment est occupé et le nombre d'occupants. La détermination de la source du problème dans un immeuble spécifique est un outil critique pour évaluer les mesures à prendre afin de réduire l'exposition au plomb. Les endroits posant des problèmes particuliers sont déterminés par la mesure des concentrations de plomb aux fontaines et aux robinets d'eau froide. Lorsque des concentrations élevées de plomb sont détectées dans une sortie d'eau, elles peuvent provenir de matériaux contenant du plomb présents au niveau de la sortie d'eau elle-même (par exemple robinet, fontaine à jet vertical ou refroidisseur d'eau), de la plomberie en amont de la sortie d'eau ou de l'eau entrant dans l'immeuble. On suit une approche à deux volets pour identifier la source de cette concentration élevée de plomb.
Le présent protocole pour les immeubles non résidentiels et les immeubles résidentiels à logements multiples est destiné aux autorités responsables, comme les propriétaires ou les gestionnaires d'immeubles et les conseils scolaires, dans le cadre de la gestion globale de la santé et de la sécurité des occupants dans les écoles, les garderies et les services de garde et d'autres immeubles non résidentiels. Ce protocole peut également être suivi par les responsables de systèmes de distribution d'eau potable qui voudraient inclure des immeubles non résidentiels ou résidentiels, comme des écoles et des immeubles à logements multiples, dans leurs programmes de surveillance et de contrôle de la corrosion. L'ampleur de l'échantillonnage réalisé dans un immeuble par une autorité responsable peut varier selon le but de l'échantillonnage et de l'autorité procédant à ce dernier.
L'échantillonnage avec une période de stagnation déterminée est difficile à mettre en œuvre, en particulier dans les habitations à logements multiples et les grands immeubles (commerciaux). L'échantillonnage dans les grands immeubles représente un défi particulier raison de la complexité des profils d'utilisation, la variabilité de l'âge de la plomberie, les différences de configuration de la plomberie d'une pièce à l'autre et l'absence d'un inventaire détaillé des produits de plomberie installés dans les immeubles. Il peut être très difficile d'assurer la stagnation de l'eau dans les grands immeubles. Ainsi, un protocole d'échantillonnage aléatoire (RDT) est recommandé dans un tel contexte et permettra également de capturer les expositions typiques, y compris une éventuelle exposition au plomb particulaire. On prélève les échantillons de préférence dans des bouteilles à grande ouverture, à un débit moyen à élevé (> 5 L/min), sans retirer l'aérateur ou la grille. Une alternative au protocole de stagnation, pour les immeubles non résidentiels, inspirée du programme de surveillance exposée dans le document de conseils 3Ts de l'U.S. EPA, est présentée à la partie F.
A.3.6.1 Protocole d'échantillonnage pour le volet 1
Le but du protocole d'échantillonnage pour le volet 1 est d'identifier les sorties d'eau potable froide où la concentration de plomb est élevée au moyen d'un échantillonnage aléatoire. Ce protocole d'échantillonnage permet de mesurer l'exposition typique, y compris l'exposition potentielle aux particules de plomb. Il permet d'identifier les endroits prioritaires où il faut réduire les concentrations de plomb et l'exposition au plomb.
La collecte d'un plus petit volume d'échantillon aide à préciser si la source du plomb provient de la sortie d'eau elle-même et à proposer des mesures correctives appropriées. L'échantillonnage pour le volet 1 doit être réalisé aux sorties d'eau potable froide identifiées dans le plan d'échantillonnage établi pour les immeubles non résidentiels ou résidentiels à logements multiples. Un échantillon représentatif de l'eau arrivant dans l'immeuble (échantillon de la conduite d'eau principale) devrait être prélevé lors de chaque échantillonnage de surveillance. Les échantillons d'eau qui sont représentatifs de l'eau qui circule dans la conduite principale devraient être prélevés à un robinet d'eau potable situé à proximité de l'entrée de service, en observant une période de purge d'environ 5 minutes (une purge plus longue peut être nécessaire). Tous les autres échantillons dans l'immeuble devraient être prélevés en suivant le protocole décrit ci-après.
On prélève un échantillon d'un volume total de 250 mL aux sorties d'eau potable froide identifiées dans le plan d'échantillonnage (sans retirer l'aérateur ou la grille qui peut être présent) de façon aléatoire durant la journée, à chaque site d'échantillonnage. Les échantillons doivent être prélevés sans purge préalable ni période de stagnation, afin de mieux refléter l'utilisation typique du consommateur. Il est recommandé de recueillir les échantillons en plus petits volumes (2 x 125 mL) pour aider à déterminer, avec une plus grande confiance, la source de plomb. Il s'agit d'une forme d'échantillonnage séquentiel qui facilite la phase d'enquête si l'analyse des échantillons révèle la présence de plomb. Les petits échantillons sont représentatifs de l'eau des raccords (fontaine ou robinet) et d'une plus petite section du système de plomberie; ils fournissent donc une meilleure indication de la source de plomb associée à une sortie d'eau. Il peut être utile de procéder à la collecte d'échantillons pour le volet 2 à cette étape, ce qui évitera de devoir retourner sur les lieux pour prélever d'autres échantillons afin d'identifier la source de plomb.
L'utilisation de bouteilles à large goulot permet à l'échantillonneur de remplir la bouteille à un débit usuel moyen à élevé, ce qui donne un résultat plus représentatif. Les bouteilles d'échantillonnage dont le goulot est plus petit seront difficiles à remplir à un débit usuel et fourniront des résultats inexacts pour le calcul de l'exposition potentielle et pour les besoins des enquêtes ou des mesures correctives. Lorsque deux volumes de 125 mL sont prélevés, la concentration de plomb correspond à la moyenne des résultats des deux échantillons.
Lorsque la concentration (totale) de plomb est inférieure à 0,005 mg/L, l'endroit surveillé concerné devrait demeurer dans le bassin d'échantillonnage.
Si la concentration (totale) de plomb est supérieure à la CMA de 0,005 mg/L à l'un des endroits surveillés, il est recommandé de prendre les mesures suivantes :
- Informer et éduquer les occupants de l'immeuble (par exemple les professeurs, le personnel des garderies et services de garde et les élèves) et les autres parties intéressées (comme les parents ou les comités de santé et de sécurité au travail) des résultats de l'échantillonnage et des mesures provisoires qui ont été prises, ainsi que des plans pour un échantillonnage supplémentaire.
- Faire des prélèvements supplémentaires aux robinets où la concentration (totale) de plomb est supérieure à 0,005 mg/L afin de déterminer la source du plomb, tel qu'indiqué dans le protocole du volet 2. Remplacer les composantes identifiées (sources de plomb).
- Mettre immédiatement en œuvre des mesures correctives provisoires pour réduire l'exposition des occupants au plomb dans l'eau. Les mesures suivantes peuvent être prises, individuellement ou en combinaison :
- mettre hors service la sortie d'eau potable;
- éliminer les débris de l'aérateur ou de la grille de la sortie d'eau potable;
- purger la plomberie après une période de stagnation;
- installer des dispositifs de traitement de l'eau potable qui sont certifiés pour l'enlèvement du plomb jusqu'à ce que les sources de plomb puissent être remplacées;
- fournir une autre source d'alimentation en eau.
- Lorsqu'une quantité importante de débris a été éliminée de l'aérateur ou de la grille de certaines sorties d'eau potable, les autorités peuvent juger souhaitable de procéder à une nouvelle analyse de l'eau de ces robinets en suivant le même protocole. Si les résultats des nouveaux tests indiquent des concentrations de plomb inférieures à 0,005 mg/L (plomb total), les autorités devraient chercher à savoir si le plomb particulaire contribue de manière importante aux concentrations élevées observées et si un nettoyage régulier de l'aérateur ou de la grille devrait être fait dans le cadre d'un programme d'entretien ou d'un programme de purge rigoureuse du robinet d'eau froide.
A.3.6.2 Protocole d'échantillonnage pour le volet 2
L'échantillonnage pour le volet 2 est réalisé en combinaison avec les résultats obtenus au volet 1 afin de déterminer la source du plomb dans la plomberie interne de l'immeuble. L'échantillonnage séquentiel aidera à déterminer la concentration de plomb dans l'eau qui a stagné dans la plomberie en amont de la sortie d'eau. Ce protocole d'échantillonnage a pour but de mesurer la concentration de plomb dans l'eau qui a été en contact pendant une brève période (30 minutes) avec la plomberie interne (soudure au plomb, raccords en laiton, etc.). Il s'agit d'une forme d'échantillonnage séquentiel qui facilite la phase d'enquête si l'analyse des échantillons révèle la présence de plomb. Ces petits échantillons sont représentatifs de l'eau en contact avec les raccords (fontaine ou robinet) et une plus petite section du système de plomberie et permettent donc de repérer plus efficacement la source de plomb associée à une sortie d'eau.
Après avoir effectué une purge complète pendant 5 minutes puis avoir laissé l'eau stagner 30 minutes, on prélève un minimum de deux échantillons consécutifs de 125 mL aux sorties d'eau potable froide pour lesquelles la concentration de plomb avait dépassé le seuil de 0,005 mg/L (Pb total) au volet 1 (sans que l'aérateur ou la grille ait été retiré). On analyse individuellement chaque échantillon de 125 mL afin de déterminer la contribution du robinet et de la plomberie à la concentration de plomb. Les responsables de systèmes de distribution d'eau potable peuvent choisir de prélever un plus grand nombre d'échantillons de volumes variables pendant la visite du site afin d'être en mesure de mieux caractériser les sources de plomb.
Lorsque la concentration de plomb dans l'un de ces seconds échantillons dépasse le seuil de 0,005 mg/L (Pb total), il convient de prendre immédiatement l'une ou l'autre des mesures correctives suivantes, ou une combinaison de celles-ci, jusqu'à ce qu'une solution permanente puisse être mise en œuvre :
- purger la sortie d'eau avant l'arrivée des occupants (pendant au moins 5 minutes afin d'obtenir de l'eau froide de la conduite principale; une purge plus longue peut être nécessaire);
- mettre les sorties d'eau hors service;
- utiliser des dispositifs de traitement de l'eau potable qui sont certifiés pour l'enlèvement du plomb jusqu'à ce que les sources de plomb puissent être remplacées;
- fournir une autre source d'alimentation en eau.
De plus, selon les résultats de l'échantillonnage effectué pour le volet 1 et le volet 2, il conviendra de prendre une ou plusieurs des mesures suivantes de contrôle de la corrosion :
- Informer et éduquer les occupants de l'immeuble (par exemple les professeurs, le personnel des services de garde et les élèves) et les autres parties intéressées (comme les parents ou les comités de santé et de sécurité au travail) des résultats de l'échantillonnage et des mesures correctives qui seront prises provisoirement et à long terme.
- Comparer les résultats obtenus lors du volet 1 et du volet 2 afin de déterminer si la source de la contamination au plomb est un raccord, un appareil de plomberie ou la plomberie interne elle-même. Si les résultats des deux volets indiquent une contamination au plomb, faire des prélèvements supplémentaires dans la plomberie interne de l'immeuble afin de déterminer de façon plus précise les sources du plomb.
- Purger les sorties d'eau.
- Installer des dispositifs de traitement de l'eau potable qui sont certifiés pour l'enlèvement du plomb jusqu'à ce que les sources de plomb puissent être remplacées.
- Remplacer les robinets, les fontaines ou les conduites.
- Mettre les sorties d'eau hors service.
- Remplacer les raccords en laiton ou les dispositifs en ligne.
- Travailler en collaboration avec le fournisseur d'eau pour s'assurer que l'eau distribuée dans l'immeuble n'est pas corrosive.
- Fournir une autre source d'alimentation en eau.
A.3.6.3 Sélection des sites de surveillance et fréquence de la surveillance
Le nombre de sites de prélèvement dans un immeuble peut varier selon le but de l'échantillonnage, l'autorité responsable procédant aux prélèvements et le type d'occupation de l'immeuble. Lorsque des écoles, des garderies, des services de garde ou d'autres immeubles non résidentiels ou résidentiels à logements multiples relèvent des responsables de systèmes de distribution d'eau potable, la priorité pour l'échantillonnage devrait accordée aux écoles, aux garderies et aux services de garde.
Les autorités responsables de l'entretien et de la surveillance de la qualité de l'eau dans des immeubles non résidentiels devront faire un échantillonnage plus poussé aux sorties d'eau individuelles, en se basant sur le plan d'échantillonnage élaboré pour ces immeubles. Le plan d'échantillonnage doit donner la priorité aux fontaines à eau et aux robinets d'eau froide utilisés pour la boisson et la cuisine en se fondant sur les renseignements obtenus dans le profil de plomberie, y compris dans les zones comprenant des soudures au plomb ou des raccords en laiton contenant du plomb, les zones de stagnation, les zones dotées de tuyaux ou de composants en fer galvanisé et les zones qui desservent des populations à haut risque, comme les bébés (en particulier s'ils sont alimentés au lait maternisé), les enfants et les personnes enceintes.
Les responsables de systèmes de distribution d'eau potable, les propriétaires d'immeubles et les autres autorités responsables (par exemple conseils scolaires) devraient travailler en collaboration afin de s'assurer que les programmes d'échantillonnage sont conçus de manière à protéger la santé des occupants, y compris des populations à haut risque comme les jeunes enfants et les personnes enceintes. De grandes variations sont à prévoir dans les concentrations de plomb mesurées d'un robinet à l'autre dans un immeuble. Par conséquent, les programmes d'échantillonnage doivent être conçus et mis en œuvre avec soin de manière à identifier correctement les sorties d'eau susceptibles de présenter des concentrations élevées de plomb.
Après avoir identifié les sorties d'eau présentant des concentrations élevées de plomb, il faut mettre en œuvre des mesures correctives. Selon le type de mesure corrective retenue (remplacement des robinets, purge de routine, etc.), d'autres prélèvements doivent être effectués pour s'assurer que les concentrations de plomb ont effectivement été réduites. Lorsque des programmes de purge de routine sont mis en œuvre comme mesure corrective, des prélèvements supplémentaires devraient servir à vérifier que la purge est efficace pour réduire les concentrations de plomb pendant toute la période d'occupation de l'immeuble durant la journée. De même, lorsque des robinets sont remplacés, il convient de faire des prélèvements pendant une période allant jusqu'à 3 mois après le remplacement afin de s'assurer que les concentrations de plomb ont été adéquatement réduites.
Après la mise en place des mesures correctives appropriées, des échantillonnages ultérieurs devraient être faits sur les sites utilisés pour la surveillance initiale, jusqu'à ce qu'au moins deux échantillonnages consécutifs indiquent que le programme de contrôle de la corrosion est efficace. Une fois que l'échantillonnage a été effectué dans tous les sites identifiés dans le plan d'échantillonnage d'un immeuble non résidentiel et qu'un programme de contrôle de la corrosion a été mis en œuvre efficacement, seuls les sites prioritaires (à haut risque) devront faire l'objet d'une surveillance annuelle. On devrait aussi procéder à une surveillance supplémentaire en cas de modifications locales du réseau de distribution, comme une modification des conduites, des robinets ou des raccords à la suite de réparations ou de nouvelles constructions, ainsi qu'en cas de modification des modes d'utilisation de l'eau.
On recommande également de faire des prélèvements à un robinet proche du point d'entrée de l'eau dans l'immeuble lors de chaque série d'échantillonnage, afin de déterminer la contribution de l'entrée de service et du réseau de distribution d'eau potable (conduite principale) à la concentration de plomb dans l'eau de l'immeuble. Idéalement, les échantillons devraient être prélevés après un temps de purge suffisant pour qu'ils soient représentatifs de l'eau provenant de l'entrée de service et de la conduite principale. Le volume d'eau à purger dépendra des caractéristiques de la plomberie de l'immeuble, notamment la distance entre l'entrée de service et la conduite principale, le diamètre des tuyaux et le débit de purge.
a) Écoles, garderies et services de garde en milieu familal
Le plan d'échantillonnage pour les écoles publiques, les écoles privée, les garderies et les services de garde doit prendre en compte le fait que les types d'occupants de ces immeubles sont parmi les plus vulnérables aux effets néfastes du plomb sur la santé. Les plans d'échantillonnage de ces installations doivent donc accorder la priorité à toutes les fontaines et tous les robinets d'eau potable froide utilisés pour la boisson ou la cuisine plutôt qu'aux sorties d'eau moins souvent utilisées. Les concentrations totales de plomb devraient être mesurées au moins une fois l'an. Il est recommandé de procéder à l'échantillonnage en juin ou en octobre dans le cas des écoles. Dans le cas des autres immeubles, il est recommandé de procéder à l'échantillonnage entre juin et octobre lorsque les immeubles sont entièrement occupés et fonctionnels. Les autorités responsables peuvent choisir de réduire la fréquence d'échantillonnage lorsqu'elles jugent que les problèmes de plomb ont été identifiés et résolus.
On pourrait procéder pendant l'année à un échantillonnage d'autres sites, comme les robinets situés dans les classes qui ne sont utilisés qu'occasionnellement pour la boisson, ou ceux dans les salles pour premiers soins qui ne sont pas identifiés comme prioritaires. L'objectif est que tous les sites identifiés dans le plan d'échantillonnage fassent l'objet d'une analyse sur une période d'un an.
b) Autres immeubles non résidentiels ou résidentiels à logements multiples
Dans les immeubles autres que les écoles, les garderies et les services de garde, les plans d'échantillonnage devraient également cibler les fontaines et les sorties d'eau froide utilisées pour la boisson ou la cuisine. Tout site identifié comme prioritaire dans le plan d'échantillonnage doit être échantillonné en premier. Les autres sites du plan devraient être soumis à un échantillonnage au cours de l'année. L'objectif est que tous les sites identifiés dans le plan d'échantillonnage fassent l'objet d'une analyse, idéalement sur une période d'un an.
Dans les immeubles à logements multiples (de plus de six logements) ou les grands immeubles (commerciaux), il est recommandé de surveiller les concentrations totales de plomb en échantillonnant dans un délai précis chaque fontaine et une proportion des robinets d'eau froide utilisés pour la boisson ou la cuisine. Dans le cas de l'échantillonnage des immeubles résidentiels à logements multiples, la priorité devrait être accordée aux sites où l'on sait ou soupçonne que les entrées de service sont faites en plomb, en partie ou en totalité.
A.3.7 Considérations pour les petits systèmes
Bien que les mesures décrites dans le présent document représentent la meilleure approche pour traiter des problèmes de corrosion dans les réseaux de distribution d'eau potable, elles peuvent être peu pratiques ou irréalisables dans certains petits systèmes. Dans de tels cas, une approche différente pourrait être nécessaire pour améliorer la protection de la santé et la qualité de l'eau. Par exemple, dans le cas des petits systèmes, il pourrait être plus raisonnable de remplacer le matériel, car la mise en œuvre d'un TCC exige que l'on mène des études et que l'on surveille la qualité de l'eau ainsi que les concentrations de plomb. Ces types d'activités peuvent nécessiter des ressources trop importantes et complexes pour les capacités ou le budget d'un petit système. Les études et les essais avec tuyaux en boucle et coupons qu'il faudrait mener à l'égard du TCC pourraient exiger un engagement de longue durée. L'affectation de ressources similaires sur une plus courte période pourrait donner des résultats tout aussi efficaces si l'on éliminait les sources de plomb, comme les entrées de service en plomb.
Les développements dans les protocoles d'essais par immersion (coupons) offrent des alternatives possibles pour évaluer les mécanismes de corrosion, ainsi que pour la déterminer et sélectionner des options de TCC. Ces protocoles, décrits à la section B.3.2, représentent une stratégie peu coûteuse et peu complexe, nécessitent moins de ressources et conviennent aux systèmes de petite et de moyenne taille.
Les opérateurs disposent d'un certain nombre d'options pour mettre en œuvre un TCC qui réduirait la complexité opérationnelle et diminuerait certaines difficultés liées à la manipulation de produits chimiques et aux conditions de travail, en comparaison avec d'autres méthodes. Par exemple, le recours combiné à l'aération et à des contacteurs au calcaire peut donner le même résultat que l'utilisation du silicate de sodium, sans qu'il faille respecter des protocoles de santé et de sécurité au travail aussi exigeants que ceux qui s'appliquent au silicate de sodium. L'utilisation d'un logiciel comme WaterPro peut également simplifier le TCC dans les systèmes pour lesquels les exigences en matière de qualité de l'eau sont relativement simples. L'on trouvera ci-dessous une liste de difficultés, de points essentiels à vérifier et de stratégies concernant les TCC dans les petits systèmes.
A.3.7.1 Défis
Les défis pour les petits systèmes sont notamment les ressources moindres dont ils disposent pour régler les problèmes de corrosion et le besoin de faire appel à un consultant externe. La taille de la station de traitement existante peut aussi limiter les options possibles. La disponibilité des opérateurs et les exigences particulières en matière d'accréditation ou de formation avancée peuvent être à l'origine de contraintes opérationnelles. En voici quelques exemples :
- Des exigences de santé et de sécurité que ne peuvent pas être rencontrées pour certains produits chimiques, ce qui signifie qu'ils ne peuvent pas être utilisés pour des raisons de santé;
- Des ajustements de la qualité de l'eau ne peuvent être mis en œuvre en raison de leur complexité;
- La capacité d'échantillonnage n'est pas suffisante par rapport au nombre d'échantillons à prélever, y compris pour la recherche des entrées de service en plomb.
A.3.7.2 Renseignements essentiels
Les données sur la qualité de l'eau peuvent fournir des renseignements sur les problèmes possibles et aider à définir les meilleures stratégies de réduction des concentrations de plomb. La surveillance des paramètres de qualité de l'eau (voir le tableau D.1.2) est essentielle au maintien d'une qualité d'eau stable et au contrôle efficace de la corrosion. Les paramètres à surveiller devraient inclure, au minimum, ceux-ci
- pH (Le pH devrait être mesuré sur le terrain par souci d'exactitude)
- alcalinité
- cations (par exemple calcium et magnésium)
- anions (par exemple chlorure et sulfate)
- Fe
- Mn
- chlore résiduel
- réseau de distribution
Des tests simplifiés de croissance du biofilm sur coupons d'acier doux peuvent fournir des renseignements utiles sur la biostabilité du réseau de distribution. On trouvera de plus amples renseignements à ce sujet dans le document Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution, publié par Santé Canada.
Il est important de connaître les matériaux présents dans un réseau et d'être en mesure de répondre à des questions telles que :
- Y a-t-il des entrées de service, des cols-de-cygne ou des raccords en queue de cochon en plomb?
- Y a-t-il des tuyaux galvanisés ou des tuyaux galvanisés à revêtement de plomb?
- S'agit-il d'une maison ou d'un immeuble récent (de moins de 10 ans) avec des tuyaux en cuivre?
- Y a-t-il des connexions galvaniques ou d'autres matériaux préoccupants?
A.3.7.3 Stratégies
L'enlèvement du manganèse et du fer contribue au contrôle de la corrosion et peut :
- faciliter l'ajustement du pH
- réduire l'accumulation et la libération de métaux dans les réseaux de distribution et la plomberie
- réduire la quantité d'oxydants/de désinfectant nécessaire
- réduire l'interférence avec le TCC
Le ratio massique chlorure/sulfate (RMCS) peut révéler un risque de corrosion galvanique. Cela nécessite de connaître à la fois les concentrations des anions chlorure et sulfate. Des renseignements sur le RMCS se trouvent à la section B.2.2.9.
La détection des entrées de service en plomb peut être faite en utilisant des méthodes d'échantillonnage avec purge préalable qui peuvent être instructives et économiques. Même si l'échantillonnage séquentiel est idéal, un protocole d'échantillonnage après purge, qui a été validé, n'en demeure pas moins un outil utile. Toutefois, il faudra procéder à une étude afin d'établir un seuil de dépistage du plomb sur un échantillon prélevé après une purge (voir les ressources à la partie G).
L'établissement d'un traitement optimal de contrôle de la corrosion (TOCC) peut se faire à peu de frais, rapidement et avec des ressources limitées en utilisant des essais d'immersion (coupons) décrits à la section B.3.2. Les stratégies de contrôle de la corrosion peuvent inclure l'utilisation de contacteurs au calcaire pour élever le pH, la teneur en calcium, l'alcalinité et la teneur en CID de l'eau. Un système d'aération peut ajuster le pH sans ajout de produit chimique et réduire le CID en excès par l'élimination du dioxyde de carbone en sursaturation. Le dioxyde de carbone peut diminuer le pH lorsqu'il est ajouté à l'eau. Cependant, il augmente l'alcalinité. Des informations supplémentaires sur ces options, y compris les contraintes et les conditions de qualité de l'eau, sont disponibles dans le document AWWA Internal Corrosion Control in Water Distribution Systems: Manual of Water Supply Practices – M58, qui figure parmi les ressources indiquées dans le tableau G.1.
A.4 Diagrammes décisionnels des protocoles d'échantillonnage du plomb
La section suivante comprend des diagrammes décisionnels qui décrivent les protocoles d'échantillonnage du plomb dans les habitations résidentielles, de même que pour les immeubles non résidentiels et résidentiels à logements multiples. Il convient d'aviser les consommateurs si la concentration dépasse 0,005 mg/L dans un échantillon.
A.4.1 Figure – Surveillance des habitations résidentielles (en deux volets)

Figure A.4.1 - Équivalent textuel
Le diagramme décisionnel comporte des étapes et des points de décision avec des questions de type oui ou non pour les deux options de surveillance des habitations résidentielles, soit la surveillance RTD ou la surveillance 30MS (deux volets). Les deux volets fournissent des informations sur l'échantillonnage de conformité pour l'objectif de secteur/réseau. Le volet 2 fournit des informations sur l'échantillonnage d'investigation dans les résidences. L'information suivante est présentée dans un encadré : l'objectif de réseau (SG) est que le 90e centile de la concentration de plomb soit égal à ou inférieure à 0,005 mg/L, ce qui signifie que la concentration de plomb est supérieure à 0,005 mg/L dans moins de 10 % des sites.
Volet 1 : RDT (1L) ou 30MS (le résultat le plus élevé de 2x1L est retenu), surveillance des zones, objectif du réseau/secteur
L'évaluation du réseau de distribution entier est menée simultanément avec l'évaluation des sites à haut risque (sentinelles).
Question : Est-ce que le SG est atteint?
- Si votre réponse est "Oui"
- Pour les échantillons individuels dont la concentration de plomb est supérieure à 0,005 mg/L
- Informez les résidents
- Passez au volet 2 : Échantillonnage séquentiel avec stagnation de 30 minutes ou de 6 heures (Quatre échantillons consécutifs ou plus de 1 L) Investigation dans les résidences.
- Pour les échantillons individuels dont la concentration de plomb est supérieure à 0,005 mg/L
Question : Est-ce qu'il s'agit-il d'un problème de secteur (par exemple, la qualité de l'eau locale)?
- Si votre réponse est "Oui"
- Mettez en œuvre des mesures correctives et effectuez un échantillonnage supplémentaire
- Menez des actions d'éducation et de sensibilisation du public.
- Retournez les sites dans le bassin d'échantillonnage pour la prochaine campagne d'échantillonnage du volet 1
- Si votre réponse est "Non", entreprendre :
- Des mesures d'intervention individuelles (remplacer sources de plomb, point d'utilisation, purge, etc.)
- La communication avec les résidents ainsi que l'éducation des résidents
- Si votre réponse est "Non" pour la question est-ce que le SG est atteint?
- Mettez en œuvre des mesures correctives et effectuez un échantillonnage supplémentaire
- Menez des actions d'éducation et de sensibilisation du public
- Retournez les sites dans le bassin d'échantillonnage pour la prochaine campagne d'échantillonnage du volet 1
A.4.2 Figure – Protocole de surveillance pour les immeubles non résidentiels et résidentiels à logements multiples (en deux volets)
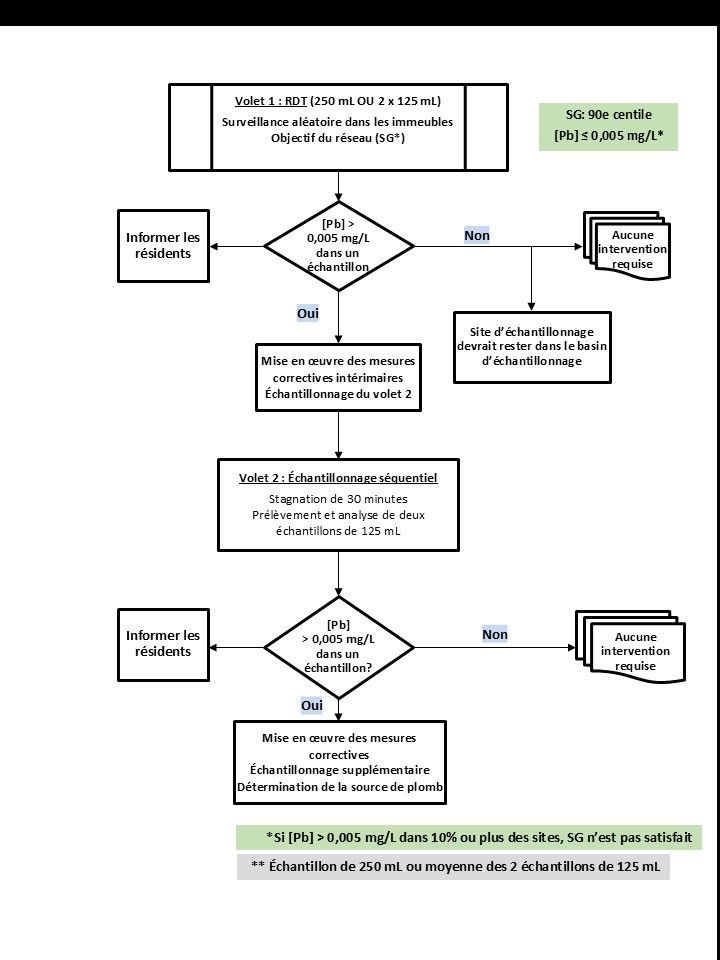
Figure A.4.2 - Équivalent textuel
Le diagramme décisionnel comporte des étapes et des points de décision avec des questions de type oui ou non pour la surveillance des immeubles non résidentiels/résidentiels à logements multiples (en deux volets). L'information suivante est présentée dans un encadré : l'objectif de réseau (SG) est que le 90e centile de la concentration de plomb soit égal à ou inférieure à 0,005 mg/L, ce qui signifie que la concentration de plomb est supérieure à 0,005 mg/L dans moins de 10 % des sites.
Volet 1 : RDT (250 mL OU 2 x 125 mL). Surveillance aléatoire dans les immeubles, objectif de réseau (SG)
Question : La concentration de plomb est-elle supérieure à 0.005 mg/L dans un échantillon? Informez les résidents du résultat.
- Si votre réponse est "Oui"
- Mettez en œuvre des mesures correctives intérimaires
- Effectuez un échantillonnage du volet 2
- Si votre réponse est "Non"
- Aucune intervention requise
- Site d'échantillonnage devrait rester dans le bassin d'échantillonnage
Volet 2 : Échantillonnage séquentiel, 30 MS. Prélevez et analysez deux échantillons de 125 mL
Question : La concentration de plomb est-elle supérieure à 0.005 mg/L dans un des échantillons ? Informez les résidents du résultat.
- Si votre réponse est "Oui"
- Mettez en œuvre des mesures correctives et effectuez un échantillonnage supplémentaire
- Déterminez la source du plomb
- Si votre réponse est "Non"
- Aucune intervention requise
Partie B. Renseignements à l'appui
B.1 Principes de la corrosion dans les réseaux de distribution d'eau potable
L'exposition aux contaminants dû à la corrosion interne des systèmes d'approvisionnement en eau potable peut être dû à la corrosion des matériaux dans les réseaux de distribution d'eau potable ou de la plomberie.
Il est possible d'évaluer adéquatement l'efficacité des mesures destinées à contrôler la corrosion et le relargage de contaminants dans un réseau donné en mesurant les concentrations des contaminants dans l'eau du robinet au fil du temps et en établissant une corrélation entre ces concentrations et les activités de contrôle.
Le présent document porte principalement sur la corrosion des matériaux métalliques. L'emphase est sur le relargage de plomb, mais les matériaux à base de cuivre et de fer (y compris les matériaux galvanisés) sont également mentionnés. Le relargage à partir des conduites en ciment n'est abordé que brièvement. Le document traite aussi brièvement de la corrosion influencée par les microorganismes et ne fournit pas d'information détaillée sur le sujet.
La corrosion des matériaux métalliques est électrochimique par nature; elle se définit comme la destruction d'un métal par le biais de réactions de transfert d'électrons (Snoeyink et Wagner, 1996). Ce type de corrosion se produit uniquement en présence des quatre composantes typiques d'une cellule électrochimique, c'est-à-dire : 1) une anode, 2) une cathode; 3) une connexion entre l'anode et la cathode permettant le transfert des électrons et 4) une solution électrolytique qui conduira les ions entre l'anode et la cathode. Dans le cas de la corrosion interne des réseaux de distribution d'eau potable, l'anode et la cathode sont des sites à la surface du métal qui présentent un potentiel électrochimique différent; la connexion électrique est assurée par le métal, et l'eau sert d'électrolyte.
La réaction principale de la corrosion est l'oxydation ou la dissolution anodique du métal pour produire des ions métalliques et des électrons :
M → Mn+ + ne−
où :
- M est le métal
- e est un électron
- n est la valence et le nombre correspondant d'électrons
Pour que cette réaction anodique se poursuive, il faut une seconde réaction utilisant les électrons produits. Les accepteurs d'électrons les plus communs dans l'eau potable sont l'oxygène dissous et les espèces chlorées en solution aqueuse.
Les ions issus de la réaction anodique peuvent être libérés dans l'eau potable en tant que produits de corrosion, ou réagir avec les substances présentes dans l'eau pour former à la surface de la conduite une incrustation dont la nature peut varier de très soluble et friable à adhérente et protectrice. Les incrustations protectrices se forment habituellement lorsque le cation métallique se combine avec un hydroxyde, un oxyde, un carbonate, un phosphate ou un silicate pour former un précipité.
La concentration d'un métal donné dans l'eau potable dépend du taux de corrosion et des propriétés de dissolution et de précipitation des incrustations formées. Au départ, lorsque le métal est nu, le taux de corrosion dépasse de loin le taux de dissolution. À mesure que les produits de corrosion s'accumulent à la surface, le taux de corrosion diminue et se rapproche graduellement du taux de dissolution (Snoeyink et Wagner, 1996).
B.1.1 Principaux contaminants découlant de la corrosion dans les réseaux de distribution d'eau potable
Les matériaux présents dans le réseau de distribution déterminent la nature des contaminants qui aboutiront le plus vraisemblablement dans l'eau du robinet. Les contaminants les plus inquiétants qui peuvent être relargués du fait de la corrosion des matériaux dans les réseaux de distribution d'eau potable sont l'antimoine, le cadmium, le cuivre, le fer, le plomb et le zinc. Il est important de déterminer si ces contaminants sont présents à des concentrations supérieures à celles jugées sécuritaires pour la consommation humaine. Les épisodes d'eau colorée (eau rouge) peuvent vraisemblablement être accompagnés de la libération de contaminants accumulés, y compris de plomb. L'eau colorée ne doit pas être considérée comme propre à la consommation ou comme un simple problème d'ordre esthétique. Au contraire, la présence d'une eau colorée devrait déclencher un processus d'échantillonnage pour détecter la présence de métaux et, possiblement, une opération d'entretien supplémentaire du réseau de distribution (Friedman et coll., 2016).
B.1.2 Sources des contaminants dans les réseaux de distribution
Au Canada, le plomb a été largement utilisé dans les conduites jusqu'en 1975. En raison de la durabilité de ces conduites, elles sont encore souvent présentes aujourd'hui. Les tuyauteries en cuivre avec soudures plomb-étain (d'utilisation courante jusqu'en 1989) et les robinets et raccords en laiton sont prédominants dans les systèmes de plomberie résidentiels (Churchill et coll., 2000).
Historiquement, on a utilisé des tuyaux en fonte et en fonte ductile comme conduites principales au Canada. Le revêtement des tuyaux en fonte ductile et des conduites en fonte avec du mortier de ciment pour les protéger contre la corrosion demeure une pratique courante (AWWA, 2017a). L'acier galvanisé était couramment utilisé dans la fabrication des tuyaux de plomberie et des composants des puits pour les systèmes de plomberie jusqu'en 1980 (NRCC, 2015). Les matériaux à base de ciment, y compris les matériaux en amiante-ciment (A/C), sont également couramment utilisés pour la fabrication des tuyaux de grand diamètre. Dans les nouvelles installations, les tuyaux en polychlorure de vinyle (PVC) remplacent souvent les tuyaux en cuivre et les entrées de service et tuyaux de distribution en plomb.
B.1.2.1 Tuyaux et soudures en plomb
Pendant de nombreuses années, le plomb a été une composante courante des réseaux de distribution d'eau. Le plomb peut être présent, et être relarguée dans l'eau potable, dans les vieilles conduites principales, les entrées de service, la pâte à joints et les soudures, les raccords en laiton et en bronze, ainsi que dans les cols-de-cygne/raccords en queue de cochon et les éléments de soupape ou les joints d'étanchéité utilisés dans les usines de traitement ou les conduites principales.
Les entrées de service en plomb demeurent une source très élevée de plomb sur de nombreuses années et elles sont responsables de 50 % à 75 % du plomb total au robinet après des périodes de stagnation prolongées (Sandvig et coll., 2008). Lytle et coll. (2019) ont prélevé des échantillons séquentiels à Flint, MI, pendant quatre séries d'échantillonnage entre janvier et novembre 2016 dans le but d'identifier les sources de plomb dans l'eau potable des résidences. Dans le cadre de cette étude, les concentrations de plomb dans l'eau potable ont été déterminées avant et après l'enlèvement complet des entrées de service en plomb à cinq emplacements. Les auteurs ont établi que l'enlèvement complet des entrées de service en plomb avait réduit de 86 % en moyenne la masse totale de plomb dans l'eau potable, confirmant que les entrées de service en plomb constituaient la principale source de plomb des résidences.
Les entrées de service en plomb libèrent du plomb sous forme dissoute et particulaire dans diverses conditions (Santé Canada, 2019a). Un certain nombre d'études ont révélé qu'il y avait relargage de fer après le remplacement total ou partiel des entrées de service en plomb. Ces études ont permis d'établir une corrélation entre le plomb particulaire au robinet et des métaux comme le fer, le zinc, l'étain et le cuivre (Deshommes et coll., 2010a; McFadden et coll., 2011; Camara et coll., 2013). Des renseignements plus détaillés sur le relargage de plomb par les entrées de service en plomb se trouvent ailleurs dans la documentation (Santé Canada, 2019a).
La réglementation et/ou les politiques relatives à la plomberie se fondent sur le Code national de la plomberie – Canada (CNP) dans l'ensemble des provinces, des territoires et des terres relevant de la compétence fédérale. Le CNP a accepté jusqu'en 1975 l'utilisation du plomb dans la fabrication des tuyaux (entrées de service) (CNRC, 2015).
La version de 1990 du CNP interdit officiellement l'utilisation des soudures à base de plomb pour réaliser ou réparer des systèmes de plomberie servant à distribuer de l'eau potable (CNRC, 2015). Les produits de rechange les plus communément utilisés sont les soudures étain-antimoine, étain-cuivre et étain-argent. Selon le CNP, les composants (à savoir les raccords) utilisés dans les applications servant à l'eau potable doivent être conformes aux normes pertinentes qui s'appliquent aux raccords de plomberie (CNRC, 2015). Ces normes, soit la norme ASME A112.18.1/CSA B125.1 et la norme CSA B125.3 (CSA, 2018a, 2018b), limitent la teneur en plomb des soudures à 0,2 % et exigent la conformité aux normes NSF/ANSI/CAN 61 et NSF/ANSI/CAN 372 (NSF International, 2022a, 2022b).
Les appareils tels que les refroidisseurs d'eau et les fontaines à jet vertical couramment utilisés dans les écoles et les autres immeubles non résidentiels peuvent contenir du plomb. Certains composants des refroidisseurs d'eau, comme les joints soudés ou le revêtement du réservoir, peuvent contenir des alliages à base de plomb (U.S. EPA, 2006b). Certains de ces appareils sont encore utilisés au Canada et peuvent être à l'origine de concentrations élevées de plomb dans l'eau potable (McIlwain et coll., 2015).
B.1.2.2 Tuyaux en cuivre et raccords et appareils en laiton
Le cuivre est utilisé dans les tuyaux et les alliages des systèmes de plomberie résidentiels. Les alliages en cuivre utilisés dans les réseaux de distribution d'eau potable sont le laiton (pour les raccords) et le bronze (pour les robinets). Le laiton est essentiellement composé de cuivre et de zinc, auxquels s'ajoutent d'autres composants mineurs comme le plomb. Les raccords en laiton sont aussi souvent enduits d'un mélange de chrome et de nickel. Le bronze (appelé également laiton rouge) est un alliage de cuivre, d'étain et de zinc, avec ou sans plomb. Auparavant, le laiton contenait normalement entre 2 % et 8 % de plomb, mais il en contient généralement moins de 4 % (NSF International, 2022a). Une stratégie importante pour réduire l'exposition au plomb est de prévenir le relargage en exigeant que ces matériaux soient conformes aux normes sanitaires et aux normes relatives à la plomberie. Plusieurs études ont démontré que l'utilisation de composants comme des robinets et d'autres raccords à faible teneur en plomb peut entraîner une réduction de la concentration de plomb au robinet (Santé Canada, 2019a; Pieper et coll., 2016). La norme NSF/ANSI/CAN 61 (Composants du système d'eau potable – Effets sur la santé) limite le relargage du plomb dans l'eau potable. Pour être conformes à la norme NSF/ANSI/CAN 372 (Composants du système d'eau potable – Teneur en plomb) (NSF International, 2022a, 2022b), les composants, comme les matériaux et les raccords de plomberie, doivent avoir une teneur moyenne pondérée en plomb ne dépassant pas 0,25 %.
Selon Pieper et coll. (2015), la corrosion peut être un problème important pour les propriétaires de puits, et les composants en laiton sont la source la plus probable de plomb. Une autre étude a révélé que le relargage de plomb à partir du laiton C36000 augmentait lorsque le pH et l'alcalinité diminuaient (Pieper et coll., 2016). On trouvera des renseignements plus détaillés sur le relargage de plomb à partir des composants en laiton ailleurs dans la documentation (Santé Canada, 2019a).
B.1.2.3 Tuyaux de fer
Les matériaux suivants constituent les principales sources de fer dans les réseaux de distribution d'eau potable : fonte, fonte ductile, fer et acier galvanisés. Le fer peut être libéré directement, à partir des matériaux à base de fer, ou indirectement, par les sous-produits de la corrosion du fer, ou tubercules de rouille, qui se forment pendant le processus de corrosion, ce qui cause les épisodes d'eau colorée (eau rouge). Comme on trouve souvent de la fonte et de la fonte ductile dans les réseaux canadiens de distribution d'eau potable, il n'est pas surprenant de constater que l'eau rouge soit le problème de corrosion le plus souvent signalé par les consommateurs. Lorsque la concentration de fer dépasse l'objectif esthétique, elle peut tacher la lessive et les appareils de plomberie, conférer un goût désagréable aux boissons et donner à l'eau une couleur qui va du jaune au rouge brunâtre.
Dans les réseaux de distribution, les contaminants peuvent s'accumuler sur ou dans les produits de corrosion du fer et du plomb et sur ou dans les dépôts d'incrustations (Lytle et coll., 2004; Schock, 2005; Schock et coll., 2008a, 2014; Friedman et coll., 2010). Ces incrustations peuvent ensuite se déloger et être relarguées dans l'eau des réseaux de distribution avec des contaminants accumulés, comme le plomb et l'arsenic (Schock, 2005; U.S. EPA, 2006; Lytle et coll., 2014). Le relargage de fer a également été corrélé à la présence de plomb particulaire au robinet (Deshommes et coll., 2010a; McFadden et coll., 2011; Camara et coll., 2013, Schock et coll., 2014; Trueman et Gagnon, 2016; Trueman et coll., 2017; Deshommes et coll., 2017, 2018).
B.1.2.4 Tuyaux galvanisé
Les tuyaux galvanisés libèrent du zinc puisqu'ils sont fabriqués par trempage de tuyaux d'acier dans un bain de zinc en fusion. Ils peuvent aussi libérer du cadmium et du plomb, présents sous forme d'impuretés (Leroy et coll., 1996).
Jusqu'en 1980, le CNP a accepté l'utilisation d'acier galvanisé dans la fabrication des tuyaux destinés aux systèmes de plomberie (CNRC, 2005). Le plomb et le cadmium sont corrélés au zinc lorsque le relargage de plomb est dû à des tuyaux en acier galvanisé (Clark et coll., 2015). Ainsi, la présence de cadmium peut indiquer que le plomb proviendrait de tuyaux en acier galvanisé. Dans une étude, on a exposé du laiton et de l'acier galvanisé à de l'eau plus agressive que les eaux souterraines. L'étude a permis de constater que l'acier galvanisé peut libérer des concentrations importantes de plomb en raison de la sorption du plomb sur la plomberie. Les auteurs ont conclu que l'acier galvanisé demeurerait un problème pour les systèmes sans contrôle de la corrosion et qu'il est important que les propriétaires de puits privés fassent faire une analyse du plomb (Pieper et coll., 2016). On trouvera des renseignements plus détaillés sur le relargage de plomb et de cadmium à partir des tuyaux galvanisés ailleurs dans la documentation (Santé Canada, 2019a, 2020a).
Les tuyaux en fer galvanisé et les tuyaux en fer galvanisé à revêtement de plomb peuvent aussi contribuer de façon significative au relargage de plomb dans l'eau potable. Les tuyaux à revêtement de plomb peuvent être classés à tort comme des tuyaux en fer galvanisé en utilisant les méthodes courantes d'identification des matériaux. Toutefois, si le revêtement de plomb est intact, ces tuyaux se comporteront comme ceux en plomb, et ils relargueront du plomb de la même façon qu'une entrée de service en plomb s'ils sont soumis aux mêmes conditions. Le relargage de plomb provenant des tuyaux en fer galvanisé peut découler de perturbations chimiques (par exemple des variations du pH ou de l'alcalinité) ou de perturbations physiques (comme l'enlèvement d'une entrée de service en plomb, un coup de bélier ou une inversion du sens d'écoulement) (Edwards et coll., 2023). Ces facteurs montrent l'importance de procéder à des analyses de plomb en présence de tuyaux que l'on soupçonne d'être faits d'acier galvanisé et pendant les épisodes d'eau colorée (rouge).
B.1.2.5 Tuyaux en ciment
Les matériaux à base de ciment utilisés pour la distribution de l'eau potable comprennent les tuyaux en béton armé, les revêtements en mortier de ciment et les tuyaux en A/C. Outre les agrégats (sable, gravier ou amiante) qui forment la structure de base du ciment, le liant, qui assure la cohésion du matériau et lui confère ses propriétés mécaniques, est constitué principalement de silicates de calcium et d'aluminates de calcium utilisés en diverses proportions (Leroy et coll., 1996). La dégradation des matériaux à base de ciment entraîne une dégradation importante de la qualité de l'eau, en particulier dans les longues conduites ou les zones à faible débit et dans le cas des eaux faiblement à moyennement tamponnées. Cette dégradation peut libérer de l'hydroxyde de calcium dans l'eau distribuée, ce qui risque d'augmenter le pH et l'alcalinité. La dégradation peut également entraîner la précipitation d'une variété de minéraux, ce qui rend l'eau trouble ou turbide et lui donne un mauvais goût. Dans des cas extrêmes, l'eau agressive peut réduire la résistance des tuyaux et provoquer une perte de charge accrue (Schock et Lytle, 2011).
La dégradation des matériaux à base de ciment peut également libérer de l'aluminium et de l'amiante dans l'eau potable. Un relargage d'aluminium a été observé dans un délai aussi court que 3 heures après l'application d'un revêtement en mortier de ciment dans divers tuyaux (acier, fonte ductile) (Santé Canada, 2021). On signale des cas où des revêtements en mortier de ciment nouvellement réalisés in situ auraient causé des problèmes de qualité de l'eau dans des conditions de débit d'eau faible ou des culs-de-sac, lorsque l'alcalinité est faible (Douglas et Merrill, 1991).
B.1.2.6 Tuyaux en plastique
Les tuyaux en PVC, en polyéthylène ou en PVC chloré utilisés dans les réseaux de distribution peuvent libérer des contaminants dans l'eau distribuée. On utilise des stabilisants pour protéger le PVC contre la décomposition lorsqu'il est exposé à une chaleur extrême pendant la production. Au Canada, les composés d'organoétain sont les stabilisants les plus couramment employés dans la production de tuyaux en PVC utilisés pour la distribution d'eau potable, et un relargage de ces composés dans l'eau potable est possible. On trouvera des renseignements plus détaillés sur le relargage de contaminants à partir des tuyaux en PVC ailleurs dans la documentation (Santé Canada, 2013). Les raccords conçus pour les tuyaux en PVC peuvent être faits de laiton, qui constituent une source potentielle de plomb en cas d'utilisation de tuyaux en PVC. Selon le CNP, tous les tuyaux en plastique doivent être conformes à la série de normes CSA B137 sur les tuyaux en plastique, ces normes exigeant que les tuyaux et leurs raccords soient conformes aux exigences de la norme NSF/ANSI/CAN 61 (NSF International, 2022a) concernant le relargage des contaminants, entre autres les organoétains.
B.2 Défis en matière de mesure de la corrosion
Il n'existe pas de méthode ou d'indice universel fiable pour mesurer la corrosivité de l'eau et évaluer ainsi le degré d'exposition des populations aux contaminants relargués dans les réseaux de distribution. Comme la corrosion des matériaux des réseaux de distribution et des systèmes de plomberie constitue une source importante de métaux dans l'eau potable, la mesure des contaminants dans l'eau du robinet constitue le meilleur moyen d'évaluer la corrosion et l'exposition de la population.
B.2.1 Concentrations de contaminants dans l'eau du robinet
La documentation scientifique indique que le plomb, le cuivre et le fer sont les contaminants dont les concentrations risquent le plus de dépasser les valeurs recommandées à cause de la corrosion des matériaux des réseaux de distribution d'eau potable. Les Recommandations pour la qualité de l'eau potable au Canada comprennent des CMA établies pour le plomb (Santé Canada, 2019a) et le cuivre (Santé Canada, 2019b), de même qu'un objectif d'ordre esthétique pour le fer (Santé Canada, 2024). La CMA pour le plomb total est fondée sur les effets du plomb sur la santé de la population la plus sensible (les enfants). Puisqu'il n'est pas possible d'établir un seuil sous lequel le plomb ne serait plus associé à des effets néfastes sur la santé, les concentrations de plomb devraient être maintenues au niveau le plus bas qu'il soit raisonnablement possible d'atteindre (Santé Canada, 2019a). La recommandation pour le cuivre est fondée sur les bébés nourris au biberon (Santé Canada, 2019b) et la recommandation pour le fer est fondée sur un objectif esthétique (Santé Canada, 2024). Le cuivre et le fer sont considérés comme des éléments essentiels pour la santé des humains, en quantités inférieures aux niveaux préoccupants. Étant donné ce qui précède et la recommandation de viser le plus bas niveau de plomb qu'il soit raisonnablement possible d'atteindre pour réduire la possibilité d'effets néfastes sur la santé, la concentration de plomb au robinet a été retenue comme déclencheur des programmes de contrôle de la corrosion.
Une étude a été réalisée afin d'évaluer les concentrations de cadmium, de calcium, de chrome, de cobalt, de cuivre, de plomb, de magnésium, de nickel et de zinc dans l'eau potable distribuée au Canada (Méranger et coll., 1981). En s'appuyant sur des échantillons représentatifs prélevés d'un robinet qui a coulé pendant 5 minutes au débit maximal, l'étude a conclu que seules les concentrations de cuivre augmentaient de façon importante dans l'eau potable du robinet, comparativement à l'eau brute.
Par ailleurs, diverses autres études ont montré que les concentrations de métaux-traces mesurées dans des échantillons d'eau du robinet prélevés après une période de stagnation pouvaient atteindre des valeurs supérieures à celles recommandées (Wong et Berrang, 1976; Lyon et Lenihan, 1977; Nielsen, 1983; Samuels et Méranger, 1984; Birden et coll., 1985; Neff et coll., 1987; Schock et Neff, 1988; Gardels et Sorg, 1989; Schock, 1990a; Singh et Mavinic, 1991; Lytle et coll., 1993; Viraraghavan et coll., 1996).
Un certain nombre de contaminants peuvent s'accumuler dans les réseaux de distribution d'eau et être relargués dans ces réseaux. Les incrustations qui se sont formées dans les tuyaux des réseaux de distribution et ont atteint un équilibre dynamique peuvent ensuite libérer des contaminants tels que l'aluminium, l'arsenic, d'autres métaux-traces et des radionucléides (Valentine et Stearns, 1994; Reiber et Dostal, 2000; Lytle et coll., 2004; Schock, 2005; Copeland et coll., 2007; Morris et Lytle, 2007; Schock et coll., 2008a; Friedman et coll., 2010; Wasserstrom et coll., 2017). Les effets des changements apportés aux processus de traitement, en particulier ceux qui ont une incidence sur les paramètres de la qualité de l'eau, comme le pH, l'alcalinité et le potentiel d'oxydoréduction (POR), le mélange et le changement de la source d'approvisionnement en eau, doivent être surveillés de près dans l'eau distribuée (Schock, 2005).
B.2.1.1 Entrées de service en plomb
Les entrées de service en plomb demeurent une source élevée de plomb sur de nombreuses années et elles sont responsables de 50 % à 86 % du plomb total au robinet après des périodes de stagnation prolongées (Sandvig et coll., 2008; Lytle et coll., 2019). La majeure partie du plomb libéré dans des conditions stagnantes est du plomb dissous, mais le débit de l'eau peut accroître la libération du plomb dissous et du plomb particulaire qui se trouvent dans les incrustations des tuyaux par un phénomène de transfert de masse et par le délogement physique de ces incrustations. La contribution relative du plomb sous les formes dissoute et particulaire n'est pas bien comprise et varie probablement selon la chimie de l'eau, la configuration de la plomberie, la durée de stagnation, le régime d'écoulement, l'âge des matériaux de plomberie contenant le plomb et les habitudes d'utilisation. Pour cette raison, l'échantillonnage devrait se faire à un débit moyen à élevé, comme indiqué à la section A2.6. La présence de plomb particulaire dans l'eau potable est sporadique, imprévisible et souvent associée à des perturbations mécaniques du réseau; on a découvert qu'elle était aussi causée par la corrosion galvanique (Santé Canada, 2019a) et qu'elle se poursuivait, voire s'aggravait, pendant de longues périodes (St. Clair et coll., 2015).
Le remplacement d'une entrée de service en plomb peut perturber ou déloger les incrustations de plomb existantes ou les sédiments contenant du plomb et entraîner une augmentation importante des concentrations de plomb au robinet. Cette augmentation peut durer trois mois ou plus après le remplacement de l'entrée de service en plomb (Santé Canada, 2019a). Del Toral et coll. (2013) ont constaté que les perturbations de l'entrée de service en plomb augmentaient les concentrations de plomb dans l'eau. Ces perturbations englobaient notamment l'installation ou le remplacement de compteurs, l'installation de compteurs automatisés, les fuites d'entrées de service ou la réparation de robinets d'arrêt de la conduite externe, ainsi que d'importants travaux d'excavation dans la rue à proximité de la résidence.
Le plomb était fortement corrélé au fer en raison de l'adsorption du plomb dissous sur les dépôts de fer dans l'entrée de service en plomb et dans la plomberie du bâtiment(Santé Canada, 2019a; Trueman et Gagnon, 2016; Deshommes et coll., 2017; Pieper et coll., 2017; Trueman et coll., 2017; Pieper et coll., 2018; Bae et coll., 2020). La libération persistante du plomb après le remplacement complet des entrées de service en plomb pourrait être attribuable à l'adsorption du plomb sur des incrustations résultant de la corrosion du fer provenant de vieilles installations de plomberie en fer galvanisé (McFadden et coll., 2011, Edwards et coll., 2023). Le relargage de quantités importantes de plomb particulaire pendant quatre ans après le remplacement complet des entrées de service en plomb était lié à l'accumulation de manganèse et de fer sur les parois des tuyaux de la plomberie du bâtiment, qui agissait comme un puits pour le plomb. L'accumulation de manganèse sur les tuyaux en plomb peut empêcher la formation d'incrustations plus stables dues à la corrosion du Pb(IV), ce qui augmente le risque de relargage de plomb par des incrustations qui peuvent se dissoudre aisément (Schock et coll., 2014).
Les revêtements de manganèse et de fer sont fréquents sur les tuyaux en plomb et les autres types de tuyaux; ils peuvent prolonger le temps nécessaire à la formation de films passivants avec des inhibiteurs de corrosion. Ils ont également tendance à augmenter la probabilité de pics sporadiques de la concentration de plomb qui seraient dus au relargage de particules. L'accumulation de manganèse dans les conduites de distribution d'eau et les réservoirs est une situation probablement beaucoup plus courante que ce qui a été signalé (Schock et Lytle, 2011).
Des concentrations élevées de plomb ont été observées après le remplacement complet et partiel des entrées de service en plomb et ont été associées au relargage de fer dans l'eau fournie par une conduite principale faite en fer sans revêtement (Camara et coll., 2013; Trueman et coll., 2017; Deshommes et coll., 2017; 2018). Le plomb peut s'accumuler dans la tuyauterie en fer galvanisé ou les dépôts de fer formés dans la plomberie des bâtiments par adsorption et être relargué même après l'élimination de la source primaire de plomb (McFadden et coll., 2011; Schock et coll., 2014).
B.2.1.2 Soudures au plomb
Une étude sur le relargage du cuivre, du fer, du plomb et du zinc dans la plomberie de cuivre avec des soudures au plomb a été menée dans le district régional du Grand Vancouver (Singh et Mavinic, 1991). On a pu observer que, dans le cas d'une eau généralement corrosive (pH : 5,5-6,3; alcalinité : 0,6-3,7 mg/L de CaCO3), le premier litre d'eau prélevé au robinet après une période de stagnation de 8 heures dépassait les valeurs fixées par les Recommandations pour la qualité de l'eau potable au Canada concernant le plomb et le cuivre dans 43 % (plomb) et 62 % (cuivre) des échantillons prélevés dans les tours d'habitation, et dans 47 % (plomb) et 73 % (cuivre) des échantillons prélevés dans les maisons unifamiliales. Les échantillons prélevés dans les tours d'habitation après une période de purge prolongée de l'eau du robinet présentaient toujours des concentrations trop élevées dans 6 % des cas pour le plomb et dans 9 % des cas pour le cuivre. En ce qui concerne les maisons unifamiliales, il a été possible dans tous les cas de ramener les teneurs en plomb et en cuivre de l'eau du robinet à une concentration inférieure aux valeurs des recommandations en faisant couler l'eau froide pendant 5 minutes.
Subramanian et coll. (1995) ont étudié le relargage de l'antimoine, de l'argent, du cadmium, du cuivre, de l'étain, du plomb et du zinc à partir de tuyaux de cuivre neufs à soudures sans plomb exposés à différente qualités d'eau (pH de 7,5 à 8,4; alcalinité de 40 à 150 mg/L de CaCO3) durant 28 jours afin d'évaluer le relargage après des périodes de stagnation allant de 1 heure à 672 heures. Les concentrations de plomb avaient dépassé 5 µg/L après aussi peu que 1 heure, pour toutes les qualités d'eau, et ont en général accrues au fil du temps. Les chercheurs ont conclu que les soudures plomb-étain 50 :50 utilisées dans les tuyaux de cuivre avaient entraîné un relargage croissant de plomb dans l'eau potable des échantillons pendant jusqu'à 28 jours.
Les soudures au plomb peuvent aussi être une source plomb particulaire, qui sont ensuite piégées dans l'aérateur du robinet. Ces particules peuvent faire augmenter considérablement les concentrations de plomb dans l'eau du robinet. Des informations plus détaillées sur le relargage de plomb particulaire peuvent être trouvées ailleurs (Santé Canada, 2019a).
B.2.1.3 Robinets et composants en laiton
Samuels et Méranger (1984) ont étudié le relargage des métaux-traces à partir des robinets de cuisine en contact avec l'eau de la Ville d'Ottawa (pH de 6,3 à 8,1). L'eau a été prélevée après une période de stagnation de 24 heures à partir de robinets neufs non rincés. En règle générale, les concentrations de cadmium, de chrome, de cuivre et de zinc relargués ne dépassaient pas les valeurs fixées à l'époque par les Recommandations pour la qualité de l'eau potable au Canada. Toutefois, les concentrations de plomb relarguées à partir des robinets contenant des joints en cuivre soudés au plomb étaient très supérieures à la valeur recommandée.
Une étude similaire de Schock et Neff (1988) a révélé que les robinets neufs en laiton chromé pouvaient libérer dans l'eau potable des quantités importantes de cuivre, de plomb et de zinc, notamment après une période de stagnation. Les chercheurs ont également conclu que les robinets et les raccords en laiton des plomberies résidentielles constituaient une source continue de plomb, même lorsque les tuyaux de cuivre étaient raccordés avec de la soudure et du flux sans plomb. Maas et coll. (1994) ont procédé à une analyse statistique des échantillons d'eau prélevés dans des immeubles non résidentiels après une période de stagnation nocturne à partir de plus de 12 000 fontaines, fontaines à jet vertical, refroidisseurs, robinets et machines à glaçons. L'analyse a révélé que plus de 17 % des échantillons avaient des concentrations de plomb supérieures à 15 µg/L. Plus particulièrement, plus de 25 % des échantillons d'eau potable provenant des fontaines à jet vertical, des refroidisseurs et des robinets avaient des concentrations de plomb supérieures à 15 µg/L. D'autres études ont révélé qu'entre 5 % et 21 % des fontaines ou des robinets d'eau potable présentaient des concentrations de plomb supérieures à 20 µg/L après une période de stagnation de plus de 8 heures (Gnaedinger, 1993; Bryant, 2004; Sathyanarayana et coll., 2006; Boyd et coll., 2008a).
Des études réalisées à Copenhague (Danemark) ont décelé un relargage de nickel à partir du laiton nickelé et chromé après une période de stagnation de l'eau (Anderson, 1983). Les concentrations de nickel mesurées dans les premiers 250 mL variaient de 8 à 115 µg/L, et n'étaient plus que de 9 à 19 µg/L après une purge de 5 minutes. D'autres études ont révélé la présence de concentrations élevées de nickel (jusqu'à 8 700 µg/L dans un cas) dans l'eau provenant d'installations nouvelles nickelées, en laiton nickelé et chromé ou en bronze industriel contenant du nickel au bout d'une période de stagnation de 12 heures (Nielsen et Andersen, 2001). Selon Kimbrough (2001), le laiton constitue une source possible de nickel dans l'eau du robinet. On a trouvé du nickel dans le premier litre d'eau prélevé après une période de stagnation (concentrations moyennes variant entre 4,5 et 9,2 µg/L, et concentrations maximales variant entre 48 et 102 µg/L). Les résultats ont aussi montré que le nickel se trouvait presque entièrement dans les 100 premiers millilitres prélevés.
B.2.1.4 Tuyaux de fer
Lorsque des tuyaux de fer, y compris des tuyaux en fer galvanisé, sont exposés à de l'eau aérée ou chlorée, le fer métallique est oxydé et des produits de corrosion du fer se forment (par exemple, des tubercules). Bien que l'oxydant dominant dans la plupart des sources d'approvisionnement en eau soit l'oxygène dissous, le chlore accélère lui aussi la corrosion; toutefois, les concentrations de chlore sont généralement inférieures à celles de l'oxygène dissous. Le taux de corrosion du fer dépend de la concentration d'oxygène dissous et du taux de transport vers la surface du métal. Les ions ferreux produits par la réaction d'oxydation peuvent se dissoudre dans l'eau ou se déposer sur la surface de fer corrodée, sous la forme d'incrustations. En prenant de l'ampleur, ces incrustations diminuent le taux de corrosion du fer, mais la dissolution des sous-produits de la corrosion contribue au relargage de fer dans l'eau. L'ampleur de ce processus dépend de la qualité de l'eau et des conditions hydrauliques (Benjamin et coll., 1996; McNeill et Edwards, 2001; Edwards et coll., 2023). Le débit d'eau dans le tuyau, la température, ainsi que l'épaisseur et la porosité des incrustations accumulées à la surface du métal affectent tous le transport de l'oxygène. Les paramètres de qualité de l'eau, comme l'alcalinité, le pH et la concentration d'ions inorganiques, ont un effet minime sur le taux de corrosion; toutefois, ils peuvent avoir une incidence sur la formation d'incrustations de corrosion puis, à un stade ultérieur, sur le taux de corrosion (Benjamin et coll., 1996).
Selon de nombreux travaux de recherche, les incrustations constituées de fer peuvent servir de puits ou de source persistante de plomb dans l'eau potable (Friedman et coll., 2010; Schock et coll., 2014). Plus particulièrement, une corrélation a été observée entre les concentrations de fer au robinet et le plomb. Des concentrations élevées de plomb ont été observées après le remplacement complet et partiel des entrées de service en plomb et ont été associées au relargage de fer dans l'eau fournie par une conduite principale faite en fer sans revêtement (Camara et coll., 2013; Trueman et Gagnon, 2016; Deshommes et coll., 2017; Pieper et coll., 2017, 2018; Trueman et coll., 2017; Santé Canada, 2019a). Le plomb peut s'accumuler dans la tuyauterie en fer galvanisé ou les dépôts de fer formés dans la plomberie des bâtiments par adsorption et être relargué même après l'élimination de la source primaire de plomb (McFadden et coll., 2011; Schock et coll., 2014; Edwards et coll., 2023).
Les hydroxydes de fer peuvent également provoquer l'adsorption et la concentration d'autres contaminants, comme le manganèse, l'arsenic et l'aluminium. La chloration de l'eau dans un réseau de distribution d'eau souterraine aux États-Unis a provoqué une hausse marquée des concentrations d'arsenic au robinet. La chloration a induit la formation d'hydroxyde ferrique solide, ce qui a provoqué la sorption et la concentration de l'arsenic qui se trouvait dans les eaux souterraines pourtant à des concentrations inférieures à 10 µg/L. La chloration a également entraîné la libération d'oxydes de cuivre, qui ont eux aussi provoqué la sorption et la concentration de l'arsenic. Les concentrations d'arsenic mesurées dans l'eau ont atteint jusqu'à 5 mg/L (Reiber et Dostal, 2000). Triantafyllidou et coll. (2019) ont signalé des concentrations moyennes d'arsenic au robinet allant de 0,5 à 51 μg/L dans des réseaux où les concentrations élevées étaient attribuées en partie à une désorption à partir d'oxydes de fer, à la dissolution d'oxydes de fer ou à une remise en suspension avec des oxydes de fer. Du manganèse, du cadmium, du chrome, du baryum, du radium, du thorium, de l'uranium ainsi que du fer ont été détectés dans les solides évacués lors de la purge de bornes d'incendie. Le manganèse s'accumule dans les dépôts qui se forment dans les tuyaux de distribution et qui peuvent se détacher; dans les tuyaux de fer, le manganèse est associé aux tubercules (Santé Canada, 2019d). Le manganèse s'accumule moins dans les incrustations qui se forment sur la surface des tuyaux de fer que dans les tuyaux de PVC (Imran et coll., 2005; Friedman et coll., 2016). L'aluminium peut s'accumuler sur les tuyaux de fer et être libéré avec d'autres contaminants lorsque la qualité de l'eau change. Des perturbations physiques ou hydrauliques peuvent également provoquer le détachement des dépôts d'aluminium (Santé Canada, 2020b).
De plus, les dépôts peuvent se déloger ultérieurement si la qualité de l'eau distribuée est modifiée (Reiber et Dostal, 2000; Lytle et coll., 2004) ou si les conditions hydrauliques sont modifiées. Les changements dans l'approvisionnement en eau peuvent également causer des épisodes d'eau rouge et une augmentation concomitante des concentrations de contaminants inorganiques (Friedman et coll., 2016).
Les produits de la corrosion du fer dans le réseau de distribution favorisent la croissance microbienne, et les incrustations de corrosion constituent un habitat favorable pour les microorganismes, tout comme les produits de corrosion en suspension. La corrosion libère du fer ferreux, qui est oxydé par le chlore en fer ferrique, ce qui provoque l'épuisement de désinfectant résiduel et favorise la croissance microbienne. Des microorganismes réducteurs de sulfate ou de nitrates, des microorganismes oxydant les nitrites, l'ammoniac ou le soufre, ainsi que d'autres microorganismes hétérotrophes non identifiés ont été détectés dans les tubercules de rouille ferreux (Tuovinen et coll., 1980). Un certain nombre d'espèces de coliformes ont été détectées dans les tubercules de fer (Emde et coll., 1992; LeChevallier et coll., 1988). Les tubercules peuvent aussi abriter des espèces pathogènes opportunistes comme Legionella (NASEM, 2020; Santé Canada, 2022). Le fer corrodé fournit un milieu propice à la croissance bactérienne, protégeant ainsi les bactéries du biofilm contre l'inactivation par le chlore libre. Même un faible taux de corrosion (par exemple 1 mm/an) permet aux tuyaux de fer de soutenir une plus grande biomasse bactérienne que les tuyaux non corrodés. Un taux de corrosion élevé réduit par ailleurs la capacité de désinfection des monochloramines (LeChevallier et coll., 1993).
B.2.1.5 Tuyaux en ciment
Des concentrations élevées d'aluminium ont été détectées dans l'eau potable de Willemstad, à Curaçao (Antilles néerlandaises), après l'installation de 2,2 km de nouveaux tuyaux de fonte ductile à revêtement de ciment ayant une teneur en aluminium élevée (18,7 % d'oxyde d'aluminium) (Berend et Trouwborst, 1999). Les concentrations d'aluminium dans l'eau distribuée sont passées de 5 à 690 µg/L dans les deux mois qui ont suivi cette installation, et elles étaient toujours supérieures à 100 µg/L deux ans plus tard. Ces concentrations anormalement élevées ont été attribuées à la faible dureté de l'eau (15 à 20 mg/L de CaCO3), à sa faible alcalinité (18 à 32 mg/L de CaCO3), à son pH élevé (8,5 à 9,5), au temps de contact prolongé (2,3 jours) de l'eau distribuée et à l'utilisation de polyphosphates en guise d'inhibiteurs de corrosion.
Une série d'essais effectués sur le terrain dans diverses régions du Royaume-Uni où l'eau présentait des caractéristiques différentes (Conroy, 1991) a permis d'observer un relargage d'aluminium à partir de tuyaux à revêtement de ciment Portland appliqué in situ. On a mesuré des concentrations d'aluminium supérieures à la concentration de 0,2 mg/L prévue par la norme de la Communauté européenne (CE) après l'installation de tuyaux dans un secteur où l'eau présentait une très faible alcalinité (environ 10 mg/L de CaCO3) et un pH élevé (> 9,5), avec un temps de contact de 6 heures; les concentrations d'aluminium sont passées sous le seuil de 0,2 mg/L après deux mois d'utilisation. Par ailleurs, dans les secteurs où l'eau était légèrement plus alcaline (environ 50 mg/L de CaCO3), les concentrations d'aluminium ne dépassaient pas la valeur prévue par la norme de la CE. La valeur de la recommandation canadienne pour l'aluminium dans l'eau potable est une CMA de 2,9 mg/L, et cette valeur est fondée sur des effets neurologiques (Santé Canada, 2020b).
On a observé la libération de fibres d'amiante dans l'eau distribuée par des tuyaux en A/C (Leroy et coll., 1996; OMS, 2021). Le relargage de fibres d'amiante dans les tuyaux en A/C est lié aux caractéristiques de la source d'approvisionnement d'eau, notamment le pH, la dureté (calcique et carbonatée) et la présence de composants comme la silice, le fer, le manganèse et le zinc (Buelow et coll., 1980; Schock et Buelow, 1981). L'ajout d'un revêtement sur la paroi intérieure des tuyaux de distribution peut prévenir ce phénomène. Une étude a montré que la défaillance des tuyaux en A/C était associée à un faible pH, à une faible alcalinité, à l'âge et à la présence d'un revêtement interne à base de goudron de houille, de bitume ou de résine époxy (Mordak et Wheeler, 1988). Il n'y a pas de CMA pour l'amiante dans l'eau potable (Santé Canada, 1989), en l'absence d'un ensemble cohérent de données convaincantes indiquant que l'ingestion d'amiante est dangereuse. En 2021, l'Organisation mondiale de la Santé a conclu que, globalement, les données probantes n'indiquaient pas l'existence d'un risque accru de cancer après l'ingestion d'amiante dans l'eau potable. L'organisme n'a pas jugé nécessaire ou pertinent d'établir une valeur guide pour les fibres d'amiante dans l'eau potable (OMS, 2022a).
B.2.2 Facteurs influant sur les concentrations de contaminants dans l'eau du robinet
De nombreux facteurs contribuent à la corrosion et au relargage de contaminants dans les réseaux de distribution d'eau potable, mais les principaux sont le type de matériau utilisé, l'âge de la plomberie, la période de stagnation de l'eau et la qualité de l'eau dans le réseau. Les concentrations de toutes les matières corrosives ou solubles présentes dans le réseau de distribution dépendront à divers degrés de certains ou de l'ensemble des facteurs.
La corrosion influencée par les microorganismes est le résultat d'une réaction entre le matériau des tuyaux et les organismes qui s'y trouvent, leurs sous-produits métaboliques, ou les deux (Schock et Lytle, 2011). L'activité microbienne peut influencer le pH, la solubilité des métaux et le potentiel d'oxydoréduction dans le microenvironnement. Des renseignements plus détaillés sur ce type de corrosion se trouvent dans d'autres documents de référence (AWWA, 2017a; Santé Canada, 2019b).
Les facteurs qui influent sur la corrosion et le relargage du plomb, du cuivre, du fer (y compris du fer galvanisé) et du ciment sont examinés ci-après, puisque ces matériaux sont ceux qui risquent le plus de produire des contaminants en concentrations supérieures aux Recommandations pour la qualité de l'eau potable au Canada, de poser des risques pour la santé publique et d'être à l'origine de plaintes des consommateurs.
B.2.2.1 Âge de la plomberie
Les concentrations de plomb mesurées au robinet en provenance des soudures au plomb et des raccords en laiton diminuent avec le temps (Sharrett et coll., 1982; Birden et coll., 1985; Boffardi, 1988, 1990; Schock et Neff, 1988; Neuman, 1995). Les chercheurs ont conclu que les concentrations de plomb les plus élevées s'observent au cours de la première année qui suit l'installation de la plomberie et qu'elles diminuent ensuite pour marquer un palier au bout d'un certain nombre d'années (Sharrett et coll., 1982; Boffardi, 1988). Toutefois, contrairement aux joints soudés au plomb et aux raccords en laiton, les tuyaux en plomb demeurent une source constante et importante de plomb même après plusieurs années d'utilisation (Britton et Richards, 1981; Schock et coll., 1996). L'analyse d'échantillons d'eau du robinet prélevés dans le cadre d'une étude sur le terrain (Maas et coll., 1991) a montré que les habitations de tous âges présentaient des risques importants de contamination par le plomb.
L'âge des matériaux, des raccords et des dispositifs de plomberie est particulièrement important en ce qui concerne le cuivre et le laiton (Schock et Lytle, 2011). La libération du cuivre dans l'eau potable dépend en grande partie du type d'incrustations formées par la corrosion dans le système de plomberie. On peut supposer qu'à un âge donné, un sous-produit de la corrosion déterminera les concentrations de cuivre libérées dans l'eau potable. Une diminution de la solubilité est observée dans l'ordre suivant et dépend de la nature des incrustations prédominantes : hydroxyde cuivreux [Cu(OH)2] > brochantite [Cu4(SO4)(OH)6] >> phosphate cuivrique [Cu3(PO4)2] > ténorite [CuO] et malachite [Cu2(OH)2CO3] (Schock et coll., 1995). Les concentrations de cuivre continuent de diminuer avec l'âge des matériaux de plomberie même après 10 ou 20 ans d'utilisation, lorsque les incrustations de ténorite ou de malachite tendent à prédominer (Sharrett et coll., 1982; Neuman, 1995; Edwards et McNeill, 2002). Dans certains cas (par exemple une alcalinité de 300 mg/L de CaCO3 3 dans un tuyau âgé), les sulfates et les phosphates peuvent d'abord réduire les concentrations de cuivre en formant de la brochantite et du phosphate cuivrique, mais ils risquent à plus long terme d'empêcher la formation d'incrustations de ténorite et de malachite plus stables (Edwards et coll., 2002).
L'âge des tuyaux en fer influe sur leur corrosion. En règle générale, la concentration de fer dans l'eau et le taux de corrosion augmentent avec le temps à partir de la première exposition à l'eau, et diminuent ensuite graduellement à mesure que les incrustations s'accumulent (McNeill et Edwards, 2001). Toutefois, la plupart des problèmes d'eau rouge actuels sont causés par de vieux tuyaux en fonte sans revêtement, à la surface recouverte de très nombreux tubercules, qui sont sujet à une stagnation de l'eau dans les culs-de-sac. Sarin et coll. (2003) ont récupéré des tuyaux en fonte sans revêtement vieux de 90 à 100 ans dans des réseaux de distribution et ont constaté que l'accumulation d'incrustations dans ces tuyaux était telle qu'elle réduisait le diamètre interne des tuyaux dans une proportion qui pouvait atteindre 76 %. Les tuyaux dans cet état sont sujets à l'abrasion et présentent de grandes surfaces de contact qui favorisent la libération du fer.
Un matériau à base de ciment nouvellement installé libère généralement de l'hydroxyde de calcium qui contribue à augmenter le pH, l'alcalinité et la teneur en calcium de l'eau (Holtschulte et Schock, 1985; Douglas et Merrill, 1991; Conroy et coll., 1994; Douglas et coll., 1996; Leroy et coll., 1996).
Les expériences de Douglas et Merrill (1991) ont montré qu'après 1, 6 et 12 années d'exposition à un débit peu élevé d'eau faiblement alcaline, le relargage d'hydroxyde de calcium à partir du revêtement de mortier de ciment persistait, mais diminuait toutefois de façon importante dans les tuyaux de 6 et de 12 ans comparativement aux tuyaux d'un an. Le relargage d'hydroxyde de calcium diminue naturellement avec l'épuisement du calcium de la surface des tuyaux, et les dépôts formés au fil du temps protègent le mortier contre un relargage supplémentaire.
B.2.2.2 Temps de stagnation, âge de l'eau et débit
Plomb
Les concentrations de plomb et de cuivre mesurées dans l'eau potable provenant de diverses sources de plomb, notamment les entrées de service en plomb, les soudures au plomb et les raccords en laiton, peuvent augmenter de façon importante après quelques heures de stagnation de l'eau dans les réseaux de distribution. De nombreux facteurs, comme la qualité de l'eau et l'âge, la composition, le diamètre et la longueur des tuyaux de plomb, ont des répercussions sur la forme des courbes de stagnation et sur le temps requis pour atteindre un état d'équilibre (Lytle et Schock, 2000).
À l'examen des courbes de stagnation établies par divers auteurs, Schock et coll. (1996) ont conclu que les concentrations de plomb augmentaient de façon exponentielle lorsqu'il y avait stagnation, mais qu'elles atteignaient une valeur d'équilibre assez constante au bout d'une nuit de stagnation. Lytle et Schock (2000) ont montré que les concentrations de plomb augmentaient rapidement avec la stagnation de l'eau, et que les 20 à 24 premières heures constituaient une période critique pour les tuyaux de plomb et les raccords en laiton. Ils ont constaté que l'augmentation de la concentration de plomb était plus rapide au cours des 10 premières heures, atteignant environ 50 % à 70 % de la valeur maximale observée. La concentration du plomb continuait ensuite d'augmenter légèrement, même jusqu'à une période de 90 heures de stagnation.
Kuch et Wagner (1983) ont représenté graphiquement les concentrations de plomb par rapport à la durée de stagnation pour deux qualités d'eau et deux diamètres de tuyaux en plomb. Les concentrations de plomb dans un tuyau de 1/2 po (1,3 cm), dont l'eau présentait un pH de 6,8 et une alcalinité de 10 mg/L CaCO3, étaient sensiblement plus élevées que celles mesurées dans un tuyau de 3/8 po (0,95 cm), dont l'eau présentait un pH de 7,2 et une alcalinité de 213 mg/L CaCO3. D'autres données produites par Kuch et Wagner (1983) indiquent que les concentrations de plomb atteignent un niveau presque maximal ou d'équilibre après une période de stagnation de plus de 300 minutes (5 heures) dans un tuyau de 1/2 po (entrée de service en plomb de 1,3 cm) et de plus de 400 minutes (6,7 heures) dans un tuyau de 3/8 po (1,0 cm). Le diamètre des tuyaux ou des entrées de service en plomb au Canada varie de 1/2 po (1,3 cm) à 3/4 po (1,9 cm), mais se situe le plus souvent entre 5/8 po (1,6 cm) et 3/4 po (1,9 cm). On a démontré que les concentrations de plomb sont très sensibles à la durée de stagnation durant les trois premières heures du temps de repos de l'eau dans des tuyaux dont le diamètre se situe entre 1/2 po (1,3 cm) et 3/4 po (1,9 cm). Selon les caractéristiques de la qualité de l'eau et le diamètre des tuyaux, des différences dans la durée de stagnation aussi peu importantes que 30 ou 60 minutes ont permis d'observer des écarts dans les concentrations de plomb allant de 10 % à 30 % (Kuch et Wagner, 1983; Schock, 1990a). Les tuyaux de plomb et les tuyaux de cuivre longs et de faible diamètre produisent respectivement les plus fortes concentrations de plomb et de cuivre sous l'effet de la stagnation (Kuch et Wagner, 1983; Ferguson et coll., 1996).
Le plomb est également libéré à partir des joints soudés et des raccords en laiton pendant les périodes de stagnation (Birden et coll., 1985; Neff et coll., 1987; Schock et Neff, 1988). Wong et Berrang (1976) ont conclu que les concentrations de plomb de l'eau prélevée dans un système de plomberie résidentiel installé depuis un an et constitué de tuyaux de cuivre avec soudures étain-plomb pouvaient dépasser 0,05 mg/L après une période de stagnation de 4 à 20 heures, et que l'eau en contact avec des tuyaux de plomb pouvait dépasser cette valeur en 10 à 100 minutes. Dans une étude sur les effets de la durée de stagnation sur la libération de plomb à partir de coupons en laiton, Schock et coll. (1995) ont observé que les concentrations de plomb issues de coupons en laiton contenant 6 % de plomb ont augmenté lentement pendant la première heure. Après 6 heures de stagnation, la concentration de plomb était supérieure à 0,04 mg/L, et la concentration maximale, soit 0,08 mg/L, a été atteinte après 15 heures de stagnation. Les auteurs de l'étude ont observé que la quantité de plomb libérée des raccords en laiton variait selon la composition de l'alliage et la durée de stagnation.
On sait que la période de stagnation, le régime d'écoulement et la chimie de l'eau influent sur la libération du plomb particulaire provenant des incrustations formées dans les entrées de service en plomb. On a observé que la teneur en plomb particulaire augmentait dans des conditions d'eau en mouvement et d'eau stagnante, de même que dans des conditions de faible débit, en présence d'orthophosphate, avec une période de stagnation croissante et à un pH élevé dans des conditions d'eau en mouvement. Fait particulièrement intéressant, ces études ont invariablement montré que les débits modérés à élevés (> 5 L/minute) typiques d'un écoulement turbulent ou de perturbations d'écoulement peuvent accroître la mobilisation du plomb et entraîner des contributions importantes du plomb particulaire à la concentration totale de plomb (Santé Canada, 2019a).
Cuivre
Le cuivre affiche un comportement plus complexe que le plomb en eau stagnante. Les concentrations de cet élément augmentent au début de la stagnation, mais elles peuvent ensuite diminuer ou continuer d'augmenter selon les teneurs de l'eau en oxydant. Lytle et Schock (2000) ont montré que les concentrations de cuivre augmentent rapidement avec la stagnation de l'eau dans les tuyaux, mais qu'elles retombent rapidement dès que la concentration d'oxygène dissous passe sous le seuil de 1 mg/L. Ce comportement est également démontré dans une étude sur les effets de la stagnation et de la température sur la qualité de l'eau dans les réseaux de distribution (Zlatanovic et coll., 2017). Les auteurs ont constaté que les concentrations de cuivre augmentaient avec le temps de stagnation en hiver et en été. Des échantillons prélevés au robinet ont permis de constater que les concentrations de cuivre culminaient à 1 370 mg/L après 48 heures de stagnation en hiver et à 1 140 mg/L après 24 heures de stagnation en été. Les concentrations de cuivre ont diminué après le pic dans les deux saisons (données sur le pH et l'alcalinité non fournies). Sorg et coll. (1999) ont également observé que lorsque l'eau est adoucie, les concentrations de cuivre augmentent jusqu'à atteindre des valeurs maximales de 4,4 et de 6,8 mg/L après environ 20 à 25 heures de stagnation, et qu'elles retombent ensuite à 0,5 mg/L après 72 à 92 heures. Les concentrations maximales correspondent au moment où la teneur en oxygène dissous est réduite à 1 mg/L ou moins. Dans l'eau non adoucie, la concentration maximale est atteinte en moins de 8 heures, puisque la concentration d'oxygène dissous diminue plus rapidement dans les montages de tuyaux en boucle exposés à ces conditions. Les vitesses d'écoulement élevées peuvent parfois être associées à la corrosion par érosion ou au retrait mécanique de l'incrustation protectrice dans les tuyaux en cuivre. Une vitesse d'écoulement élevée, combinée à des propriétés corrosives de l'eau, peut rapidement altérer les matériaux des tuyaux (Santé Canada, 2019b).
Fer
La plupart des épisodes d'eau rouge sont causés par de vieux tuyaux en fonte sans revêtement, à la surface recouverte de très nombreux tubercules, qui présentent une stagnation de l'eau dans les culs-de-sac. On a indiqué que les périodes cycliques d'écoulement et de stagnation de l'eau constituaient la principale cause des problèmes d'eau rouge découlant de la corrosion du fer dans les réseaux de distribution (Benjamin et coll., 1996). On a également montré que la concentration du fer augmentait pendant les périodes plus longues de stagnation qui caractérisent les culs-de-sac (Beckett et coll., 1998; Sarin et coll., 2000). Le fer peut également se corroder dans un réseau de distribution d'eau lorsque la concentration d'oxygène dissous est limitée (eau stagnante). Pendant la stagnation, la concentration d'oxygène dissous est réduite près de la surface du métal, et les oxydes ferriques présents dans les incrustations de corrosion peuvent agir comme oxydant. Le fer ferrique sert ainsi d'oxydant, ce qui entraîne la production de fer ferreux. Le fer ferreux peut se précipiter ou se diffuser dans l'eau distribuée et être ensuite oxydé en fer ferrique (insoluble) par l'oxygène dissous, conférant ainsi à l'eau une coloration rouge (Benjamin et coll., 1996; Sarin et coll., 2004 a, b). Il peut y avoir des plaintes au sujet d'épisodes d'eau rouge lorsque des périodes d'écoulement et de stagnation de l'eau se succèdent de façon cyclique (Benjamin, 1996).
Ciment
On a établi une corrélation entre la période de contact de l'eau distribuée avec les matériaux en ciment et la détérioration de la qualité de l'eau, qui augmente avec un contact prolongé (Holtschulte et Schock, 1985; Conroy, 1991; Douglas et Merrill, 1991; Conroy et coll., 1994; Douglas et coll., 1996; Berend et Trouwborst, 1999). À l'issue d'une étude effectuée aux États-Unis sur 33 réseaux de distribution dotés de nouveaux tuyaux à revêtement de mortier de ciment in situ et qui transportaient de l'eau de faible alcalinité, Douglas et Merrill (1991) ont conclu que la dégradation de la qualité de l'eau était plus évidente dans les culs-de-sac ou dans les sections à débit faible ou intermittent. De la même manière, Conroy (1991) et Conroy et coll. (1994) ont constaté que plus l'eau restait en contact avec le revêtement en mortier, plus les hydroxydes relargués s'accumulaient et, par conséquent, plus le pH était élevé.
B.2.2.3 pH
L'effet du pH sur la solubilité des sous-produits de la corrosion est souvent un facteur clé permettant de comprendre la concentration des métaux dans l'eau du robinet. Il est important de souligner à cet égard que la solubilité des sous-produits de la corrosion formés dans les réseaux de distribution diminue habituellement lorsque le pH de l'eau augmente. Toutefois, ces effets ne sont pas universels, car certains métaux (et/ou certaines espèces de métaux) sont relargués lorsque le pH diminue (par exemple le plomb, le cuivre et le manganèse) mais ils peuvent aussi être libérés à la suite d'une augmentation du pH (par exemple l'arsenic, le cuivre et le chrome) (Kim et coll., 2011; Wahman et coll., 2021). La libération de métaux à partir des matériaux utilisés dans les réseaux de distribution et la plomberie des bâtiments est influencée non seulement par le pH, mais aussi par l'alcalinité et la concentration de CID de l'eau, puisque ces derniers influent sur la formation d'incrustations à la surface des matériaux. La présence d'incrustations sur la surface interne des tuyaux aide à prévenir la libération de plomb ou de cuivre dans l'eau (Schock et Lytle, 2011).
Plomb
La passivation du plomb résulte généralement de la formation d'une couche de surface composée de particules d'hydroxycarbonate ou d'orthophosphate de Pb(II). La solubilité des principaux sous-produits bivalents de la corrosion du plomb (cérusite [PbCO3, hydrocérusite [Pb3(CO3)2(OH)2] et hydroxyde de plomb [Pb(OH)2]) a un effet déterminant sur les concentrations de plomb dans l'eau du robinet (Schock, 1980, 1990b; Sheiham et Jackson, 1981; De Mora et Harrison, 1984; Boffardi, 1988, 1990; U.S. EPA, 1992; Leroy, 1993; Peters et coll., 1999).
Pour des raisons ayant trait à la thermodynamique, la solubilité des sous-produits de la corrosion du plomb dans les réseaux de distribution diminue à mesure que le pH augmente (Britton et Richards, 1981; Schock et Gardels, 1983; De Mora et Harrison, 1984; Boffardi, 1988; Schock, 1989; U.S. EPA, 1992; Singley, 1994; Schock et coll., 1996). Les modèles de solubilité montrent que les concentrations de plomb sont au plus bas lorsque le pH se situe autour de 9,8. Toutefois, ces relations avec le pH de l'eau risquent de ne pas être valides dans le cas du dioxyde de plomb tétravalent insoluble solide (PbO2), découvert dans les dépôts de tuyaux en plomb de plusieurs réseaux de distribution où le potentiel d'oxydoréduction est élevé (conditions hautement oxydantes) (Schock et coll., 1996, 2001; Schock et Lytle, 2011). Selon le pH et l'alcalinité de l'eau, les incrustations des tuyaux peuvent comprendre de l'hydrocérusite (faible pH, faible alcalinité), de la cérusite et du massicot (PbO) (alcalinité élevée) (McNeill et Edwards, 2004).
Du dioxyde de plomb a aussi été trouvé dans des eaux à pH faible, et souvent dans des eaux à forte alcalinité (Schock et coll., 2001, 2005b). Selon une compilation de données thermodynamiques, la relation observée entre le pH et le PbO2 2 pourrait être l'inverse de celle observée avec les solides du plomb bivalent (par exemple, cérusite, hydrocérusite) (Schock et coll., 2001; Schock et Giani, 2004). Lytle et Schock (2005) ont démontré que le PbO2 se formait facilement à un pH de 6 à 6,5 dans de l'eau contenant de chlore libre résiduel persistant, en quelques semaines à quelques mois.
Le relargage de plomb à partir des soudures au plomb est principalement contrôlé par la corrosion galvanique, et l'augmentation du pH est associée à une diminution de la corrosion des soudures au plomb (Oliphant, 1983a; Schock et Lytle, 2011).
On a constaté, par expérience dans les municipalités, que les concentrations les plus faibles de plomb dans l'eau du robinet étaient associées à un pH supérieur à 8 (Karalekas et coll., 1983; Lee et coll., 1989; Dodrill et Edwards, 1995; Douglas et coll., 2004). En se fondant sur des études à l'échelle de banc d'essai et des essais pilotes, ainsi que sur l'analyse d'un certain nombre de critères, la Ville d'Ottawa a choisi d'utiliser de l'hydroxyde de sodium et du dioxyde de carbone pour maintenir un pH de 9,2 et une alcalinité minimale cible de 35 mg/L de CaCO3 afin de contrôler la corrosion. Pendant la phase initiale du passage à l'hydroxyde de sodium, le pH a été maintenu à 8,5. Toutefois, en mesurant la concentration de plomb, on a découvert un secteur de la ville où la teneur en plomb dans l'eau du robinet était élevée (de 10 à 15 µg/L dans les échantillons prélevés durant l'écoulement). Le problème a été attribué à un phénomène de nitrification dans le réseau de distribution, qui a réduit le pH de 8,5 à 7,8-8,2, et a entraîné le relargage du plomb à partir des entrées de service en plomb. On a augmenté le pH de l'eau à 9,2, et cette hausse a presque immédiatement réduit les concentrations de plomb à 6 à 8 µg/L dans les échantillons prélevés après une période de purge. Une surveillance continue a montré que, après l'augmentation du pH, les concentrations de plomb dans l'eau du robinet étaient systématiquement inférieures à la norme de 10 µg/L (soit 1,3 à 6,8 µg/L) (Douglas et coll., 2007).
L'étude de données sur le traitement provenant de 365 systèmes d'approvisionnement en eau potable a révélé que les teneurs moyennes en plomb de l'eau du robinet au 90e centile dépendaient à la fois du pH et de l'alcalinité de l'eau (Dodrill et Edwards, 1995). Dans la catégorie du niveau le plus bas de pH (pH < 7,4) et d'alcalinité (< 30 mg/L de CaCO3), la probabilité pour les systèmes d'approvisionnement en eau potable de dépasser le niveau d'intervention prescrit par la Lead and Copper Rule (LCR) de l'U.S. EPA pour le plomb, soit 0,015 mg/L, s'établissait à 80 %. Dans cette catégorie de faible alcalinité, seul un pH supérieur à 8,4 semblait capable de réduire les concentrations de plomb dans l'eau du robinet. Toutefois, lorsqu'on combine une alcalinité supérieure à 30 mg/L de CaCO3 et un pH supérieur à 7,4, l'eau distribuée peut dans certains cas satisfaire au niveau d'intervention relatif au plomb.
Une enquête a été menée sur 94 systèmes d'approvisionnement en eau potable, dans le cadre de laquelle on a échantillonné 1 484 sites comportant des entrées de service en plomb et des entrées de service sans plomb après une période de stagnation d'au moins 6 heures pendant la nuit, afin d'évaluer les facteurs qui influent sur les concentrations de plomb au robinet du consommateur (Lee et coll., 1989). Les chercheurs ont démontré que le maintien d'un pH d'au moins 8,0 permettait de contrôler efficacement les concentrations de plomb (< 10 µg/L) dans le premier litre d'eau recueilli au robinet.
Une étude de 5 ans a été menée pour réduire les concentrations de plomb dans le réseau de distribution d'eau potable de la région métropolitaine de Boston, au Massachusetts (Karalekas et coll., 1983). Les chercheurs ont surveillé les concentrations de plomb dans l'eau du robinet, dans les entrées de service en plomb et dans le réseau de distribution connexe de quatorze ménages. Les concentrations moyennes ont été calculées en combinant des échantillons prélevés au robinet 1) après une nuit de stagnation; 2) après avoir laissé couler l'eau jusqu'à ce qu'elle devienne froide; 3) après une purge du réseau pendant trois minutes supplémentaires. Même si l'alcalinité est toujours restée très faible (12 mg/L de CaCO3), l'élévation du pH de 6,7 à 8,5 a réduit les concentrations moyennes de plomb de 0,128 à 0,035 mg/L.
Cuivre
Même si l'ion hydrogène ne joue pas un rôle de réduction direct sur les surfaces de cuivre, le pH peut influer sur la corrosion du cuivre en modifiant le potentiel d'équilibre de la demi-réaction de réduction de l'oxygène, ainsi que l'espèce de cuivre en solution (Reiber, 1989). La libération de cuivre dépend en grande partie du pH. Lorsque le cuivre se corrode, il est oxydé en espèces de cuivre Cu(I) (cuivreux) et Cu(II) (cuivrique) qui peuvent former des incrustations protectrices à base de carbonate de cuivre (passivation) à la surface des matériaux de plomberie en cuivre, en fonction du pH et des concentrations de CID et d'agents oxydants dans l'eau (Atlas et coll., 1982; Pisigan et Singley, 1987; Schock et coll., 1995; Ferguson et coll., 1996). La corrosion du cuivre augmente rapidement lorsque le pH est inférieur à 6, et les taux de corrosion uniformes peuvent être élevés lorsque le pH est faible (inférieur à 7, environ), ce qui provoque un amincissement du métal. À des valeurs de pH plus élevées (supérieures à 8, environ), les problèmes de corrosion du cuivre se manifestent presque toujours par des piqûres de corrosion ou par une corrosion inégale (Edwards et coll., 1994a; Ferguson et coll., 1996). Edwards et coll. (1994b) ont observé que, dans le cas de surfaces de cuivre neuves exposées à des solutions simples contenant du bicarbonate, du chlorure, du nitrate, du perchlorate ou du sulfate, l'augmentation du pH de 5,5 à 7,0 réduisait environ de moitié le taux de corrosion, mais que des hausses additionnelles du pH n'entraînaient que des changements mineurs.
Pour prévoir les concentrations de cuivre dans l'eau potable, on s'appuie sur la solubilité et les propriétés physiques de l'oxyde et de l'hydroxyde cuivriques ainsi que des carbonates solides dont sont constituées les incrustations dans la plupart des réseaux de distribution d'eau faits de cuivre (Schock et coll., 1995). Le modèle à l'hydroxyde cuivrique de Schock et coll. (1995) montre clairement qu'une augmentation du pH entraîne une réduction de la solubilité du cuivre. Lorsque le pH atteint une valeur supérieure à environ 9,5, le modèle prédit une augmentation de la solubilité de l'hydroxyde cuivrique causée par les complexes de carbonates et d'hydroxydes. L'examen des données sur les concentrations de cuivre dans l'eau potable communiquées par 361 systèmes d'approvisionnement en eau potable révèle que les valeurs moyennes du 90e centile sont plus élevées dans l'eau dont le pH est inférieur à 7,4, et qu'aucun des services dont l'eau présentait un pH supérieur à 7,8 n'a dépassé le niveau d'intervention de 1,3 mg de cuivre par litre d'eau prescrit par l'U.S. EPA (Dodrill et Edwards, 1995). On a toutefois signalé que les problèmes liés à la solubilité du cuivre persistaient jusqu'à un pH d'environ 7,9 lorsqu'on utilise de l'eau souterraine froide, très alcaline et riche en sulfates (Edwards et coll., 1994a).
En général, la solubilité du cuivre augmente (c'est-à-dire que la concentration du cuivre augmente) à mesure que la concentration de CID augmente et que le pH diminue (Ferguson et coll., 1996; Schock et coll., 1995). Il est possible de contrôler les concentrations de cuivre aux faibles pH. Toutefois, les eaux souterraines qui sont très alcalines et qui ont une forte concentration de CID entraînent généralement des problèmes de corrosion du cuivre, et il peut être impossible d'ajuster le pH en raison du potentiel de précipitation du CaCO3.
Fer
La libération de fer à partir des matériaux à base de fer utilisés dans les réseaux de distribution d'eau potable, comme la fonte, l'acier et la fonte ductile, a été modélisée à partir de la formation d'incrustations protectrices composées de solides ferreux (FeCO3). À l'intérieur de la plage de pH de 7 à 9, le taux de corrosion et le degré de formation de tubercules dans les réseaux de distribution en fer augmentent généralement avec la valeur du pH (Larson et Skold, 1958; Stumm, 1960; Hatch, 1969; Pisigan et Singley, 1987). Toutefois, la solubilité des sous-produits de la corrosion du fer et, donc, la concentration de fer diminuent à mesure que le pH augmente (Karalekas et coll., 1983; Kashinkunti et coll., 1999; Broo et coll., 2001; Sarin et coll., 2003). Dans une étude pilote sur un montage de tuyaux en boucle fabriqué à l'aide de tuyaux en fonte sans revêtement vieux de 90 à 100 ans récupérés d'un réseau de distribution d'eau de Boston, les concentrations de fer ont diminué de façon constante lorsqu'on a augmenté le pH de 7,6 à 9,5 (Sarin et coll., 2003). De même, on a constaté une nette tendance à la baisse des concentrations de fer mesurées sur deux ans dans un réseau de distribution où le pH de l'eau avait augmenté de 6,7 à 8,5 (Karalekas et coll., 1983). Le taux d'oxydation du fer ferreux augmente avec le pH et, en général, tant la solubilité que les taux de dissolution des oxydes de fer – et des autres composés du fer – diminuent à mesure que le pH augmente (Schwertmann, 1991; Sarin et coll., 2003; Duckworth et Martin, 2004). Le pH de l'eau traitée a été abaissé de 10,3 à 9,7, ce qui a permis de réduire le relargage de plomb soluble. Cependant, les concentrations de fer ont augmenté à un pH de 9,7, et il y avait une corrélation avec une augmentation du relargage de plomb particulaire (Masters et Edwards, 2015).
Les eaux dont le pouvoir tampon est élevé atténuent les changements de pH. Un pH relativement stable favorise la formation de solides à base de fer, ce qui a un effet protecteur et diminue le relargage de fer. Le maintien d'un pH stable peut être important pour empêcher la désorption des contaminants inorganiques associés aux oxydes de fer.
Ciment
L'eau acide, faiblement alcaline et à faible teneur en calcium est particulièrement corrosive pour les matériaux en ciment. Les problèmes de qualité de l'eau qui peuvent se présenter sont liés à la chimie du ciment. La chaux du ciment libère dans l'eau potable des ions calcium et hydroxyles qui peuvent entraîner une hausse importante du pH, selon le pouvoir tampon de l'eau (Leroy et coll., 1996). Des essais à l'échelle pilote ont été réalisés pour simuler des conditions de faible débit dans des tuyaux récemment revêtus de mortier de ciment distribuant une eau de faible alcalinité (Douglas et coll., 1996). Dans une eau dont le pH initial était de 7,2, l'alcalinité était de 14 mg/L (CaCO3) et la teneur en calcium était de 13 mg/L (CaCO3), le pH mesuré pouvait être aussi élevé que 12,5. De même, dans une eau dont le pH initial était de 7,8, l'alcalinité était de 71 mg/L (CaCO3) et la teneur en calcium était de 39 mg/L (CaCO3), le pH mesuré pouvait être aussi élevé que 12. Les augmentations les plus importantes du pH ont été observées pendant la première semaine de l'expérience, et le pH a ensuite diminué lentement avec le vieillissement du revêtement. Dans une série d'essais sur le terrain et de montages à l'échelle de banc d'essai visant à déterminer l'incidence du revêtement de mortier de ciment in situ sur la qualité de l'eau, Conroy et coll. (1994) ont observé que, dans des conditions de faible débit et de faible alcalinité de l'eau (environ 10 mg/L de CaCO3), le pH pouvait rester supérieur à 9,5 plus de deux ans après la pose du revêtement. Les tuyaux en A/C sont particulièrement sensibles aux eaux à faible pH (inférieur à 7,5-8,0) ayant une forte alcalinité calcique et des concentrations élevées de silicate (Schock et Lytle, 2011).
Des expériences réalisées sur le terrain dans des régions du Royaume-Uni ayant diverses qualités d'eau ont permis de conclure qu'un pH élevé de l'eau dans les tuyaux en ciment pouvait rendre le plomb soluble. On a observé une hausse importante des concentrations de plomb avec l'augmentation du pH, lorsque celui-ci était supérieur à 10,5. Les concentrations de plomb variaient d'un peu moins de 100 µg/L à un pH de 11 à plus de 1 000 µg/L à un pH supérieur à 12 (Conroy, 1991). Ce résultat nous incite à nous interroger sur l'exactitude des modèles de solubilité dans des conditions de pH élevé et sur le niveau à partir duquel un ajustement du pH risque de devenir préjudiciable. Les valeurs de pH élevées provoquées par le relargage du ciment risquent aussi de favoriser le relargage d'aluminium à partir des matériaux en ciment, puisque le pH élevé risque d'augmenter la solubilité de l'aluminium (Berend et Trouwborst, 1999). L'aluminium peut perturber la passivation associée aux orthophosphates utilisés pour le contrôle de la corrosion en empêchant la formation d'incrustations protectrices (AWWA, 2017a; Wasserstrom et coll., 2017).
Zinc
Les revêtements de zinc sur l'acier galvanisé se corrodent de façon semblable au fer, mais les réactions de corrosion sont habituellement plus lentes. La corrosion des tuyaux galvanisés peut provoquer le relargage de métaux à l'état de traces, comme le cadmium et le plomb, dans les réseaux de distribution d'eau potable. Si les tuyaux sont neufs, la corrosion dépend fortement du pH. Pisigan et Singley (1987) ont trouvé qu'à un pH inférieur à 7,5, la présence du zinc augmente dans l'eau potable (concentration de CID de 50 mg de carbone par litre [C/L]). À des pH de 7,5 à 10,4, l'hydrozincite, le sous-produit de corrosion le plus stable, prédomine. Les eaux dont le pH est supérieur à 10,4 peuvent être agressives pour le zinc et vont souvent éliminer les revêtements galvanisés (les hydroxydes de zinc dominent).
B.2.2.4 Alcalinité
L'alcalinité sert à contrôler l'intensité du pouvoir tampon dans la plupart des réseaux de distribution d'eau. Il convient donc de maintenir une valeur minimale d'alcalinité pour stabiliser le pH afin de contrôler la corrosion du plomb, du cuivre et du fer et d'assurer la stabilité des revêtements et des tuyaux à base de ciment.
Plomb
Selon les modèles thermodynamiques, la solubilité minimale du plomb s'observe à un pH relativement élevé (9,8) et à une alcalinité faible (30 à 50 mg/L de CaCO3) (Schock, 1980, 1989; Schock et Gardels, 1983; U.S. EPA, 1992; Leroy, 1993; Schock et coll., 1996). Ces modèles montrent que le niveau à partir duquel l'alcalinité influe sur la solubilité du plomb dépend de la forme de carbonate de plomb présente à la surface du tuyau. Ces modèles s'appliquent à des incrustations uniformes de minéraux de plomb, mais pas à des phases minérales de dépôts mixtes, et ils ne sont pas de bons prédicteurs des incrustations formées dans les entrées de service en plomb utilisées pour transporter de l'eau potable dans des conditions réelles (Tully et coll., 2019). Lorsque la cérusite est stable, une augmentation de l'alcalinité réduit la solubilité du plomb; lorsque l'hydrocérusite est stable, une augmentation de l'alcalinité augmente la solubilité du plomb (Sheiham et Jackson, 1981; Boffardi, 1988, 1990). La cérusite est moins stable aux valeurs du pH auxquelles l'hydrocérusite est stable et peut se former. L'hydrocérusite est au final convertie en cérusite, substance que l'on trouve dans beaucoup de dépôts qui se forment dans les tuyaux de plomb. On a observé une libération élevée du plomb dans des tuyaux où la cérusite était censée être stable compte tenu des conditions de pH et d'alcalinité. Toutefois, lorsque ces conditions sont ajustées pour permettre la stabilité thermodynamique de l'hydrocérusite, la libération du plomb devient moins élevée que dans tous les endroits où la cérusite est stable (Schock, 1990a).
Des expériences en laboratoire ont également révélé qu'à un pH variant de 7 à 9,5, l'alcalinité optimale pour le contrôle de la corrosion du plomb se situait entre 30 et 45 mg/L de CaCO3, et que des ajustements visant à augmenter l'alcalinité au-delà de cette plage de valeurs ne procurait que peu d'avantages supplémentaires (Schock, 1980; Sheiham et Jackson, 1981; Schock et Gardels, 1983; Edwards et McNeill, 2002) et pouvaient même être nuisibles dans certains cas (Sheiham et Jackson, 1981).
Schock et coll. (1996) ont fait état de l'existence de quantités importantes de dioxyde de plomb tétravalent insoluble dans les dépôts de tuyaux de plomb de plusieurs réseaux de distribution d'eau. Toutefois, on ignore s'il existe un rapport entre l'alcalinité de l'eau et la solubilité du dioxyde de plomb, puisqu'on n'a signalé la présence d'aucun complexe ni d'aucun carbonate solide. L'existence de quantités importantes de dioxyde de plomb insoluble dans les dépôts des tuyaux en plomb pourrait expliquer la variabilité de la libération du plomb dans l'eau des entrées de service en plomb et le rapport médiocre entre la concentration totale de plomb et l'alcalinité (Lytle et Schock, 2005). L'alcalinité ne devrait pas influer sur la libération du plomb à partir des soudures au plomb, puisque cette libération dépend surtout de la corrosion galvanique des soudures, par opposition à la solubilité des sous-produits de la corrosion qui sont formés (Oliphant, 1983b). Toutefois, Dudi et Edwards (2004) ont avancé que l'alcalinité pourrait jouer un rôle dans le relargage du plomb à partir des connexions galvaniques entre les éléments de plomberie contenant du plomb et ceux contenant du cuivre. Aucun lien net n'a encore été établi, d'après l'expérience des installations de traitement, entre l'alcalinité de l'eau et la solubilité du plomb. Des données recueillies dans 47 municipalités des États-Unis ont indiqué que les cibles les plus prometteuses en matière de chimie de l'eau pour le contrôle de la corrosion du plomb étaient un pH variant entre 8 et 10, et une alcalinité de 30 à 150 mg/L de CaCO3 (Schock et coll., 1996). Une étude ultérieure réalisée aux États-Unis auprès de 94 sociétés et districts d'approvisionnement en eau n'a révélé aucun lien entre la solubilité du plomb et l'alcalinité (Lee et coll., 1989). Une étude menée auprès de 365 systèmes d'approvisionnement en eau potable visés par la LCR de l'U.S. EPA a permis de constater que la libération du plomb était beaucoup moins élevée lorsque l'alcalinité était maintenue entre 30 et 74 mg/L de CaCO3 que lorsqu'elle était inférieure à 30 mg/L de CaCO3. On a également relevé des teneurs en plomb inférieures dans les réseaux des services dont l'eau présentait une alcalinité située entre 74 et 174 mg/L, ou supérieure à 174 mg/L, lorsque le pH était de 8,4 ou moins (Dodrill et Edwards, 1995).
Cuivre
Des expériences effectuées en laboratoire et dans les installations de traitement ont démontré que le relargage du cuivre est plus important lorsque l'alcalinité est élevée (Edwards et coll., 1994b, 1996; Schock et coll., 1995; Ferguson et coll., 1996; Broo et coll., 1998) et que cette hausse est vraisemblablement due à la formation de complexes de bicarbonates et de carbonates de cuivre solubles (Schock et coll., 1995; Edwards et coll., 1996). L'examen des données recueillies auprès de 361 systèmes de traitement a également montré que les effets de l'alcalinité évoluaient d'une manière à peu près linéaire et qu'ils étaient plus importants à un pH peu élevé : la combinaison d'un pH faible (< 7,8) et d'une alcalinité élevée (> 74 mg/L de CaCO3) a donné les concentrations de cuivre les plus élevées du 90e centile (Edwards et coll., 1999). Toutefois, une faible alcalinité (< 25 mg/L de CaCO3) peut elle aussi causer des problèmes selon le pH (Schock et coll., 1995). Dans le cas d'eaux fortement alcalines, la seule solution pratique pour réduire la solubilité du cuivre consiste à adoucir l'eau à la chaux, à éliminer le bicarbonate ou à ajouter des quantités relativement élevées d'orthophosphate (U.S. EPA, 2003).
Des concentrations de cuivre peu élevées peuvent cependant être observées avec une alcalinité élevée lorsque les conditions favorisent la formation de malachite et de ténorite moins solubles (Schock et coll., 1995). Une expérience réalisée en laboratoire par Edwards et coll. (2002) a permis d'observer que, dans le cas des tuyaux relativement neufs, à un pH de 7,2, il y avait un rapport pratiquement linéaire entre la concentration maximale du cuivre libéré et l'alcalinité. Toutefois, à mesure que les tuyaux vieillissaient, la concentration de cuivre libéré dans l'eau était moins élevée à une alcalinité de 300 mg/L de CaCO3, favorisant la formation de malachite, qu'à une alcalinité de 15 et 45 mg/L de CaCO3, qui favorisait plutôt la formation d'hydroxyde cuivrique relativement soluble.
Fer
On a attribué des taux de corrosion du fer plus faibles (Stumm, 1960; Pisigan et Singley, 1987; Hedberg et Johansson, 1987; Kashinkunti et coll., 1999) et des concentrations de fer plus faibles (Horsley et coll., 1998; Sarin et coll., 2003) à l'alcalinité élevée de l'eau dans les réseaux de distribution.
Des études utilisant un montage de tuyaux en boucle fabriqué à l'aide de tuyaux en fonte sans revêtement vieux de 90 à 100 ans récupérés d'un réseau de distribution d'eau de Boston ont démontré qu'une réduction de l'alcalinité de 30-35 mg/L à 10-15 mg/L de CaCO3 à un pH constant provoquait une augmentation immédiate de 50 % à 250 % de la libération du fer dans l'eau. En augmentant l'alcalinité de l'eau de 30-35 mg/L à 58-60 mg/L de CaCO3 et en la ramenant ensuite à 30-35 mg/L, a aussi démontré que l'augmentation de l'alcalinité réduisait la libération de fer, mais que le changement n'était pas aussi important que les changements observés dans la plage inférieure des valeurs de l'alcalinité (Sarin et coll., 2003). Une analyse des paramètres de la qualité de l'eau traitée (pH, alcalinité, dureté, température et teneurs en chlorures et en sulfates) et des plaintes de consommateurs ayant trait à des épisodes d'eau rouge pour la période allant de 1989 à 1998 a été réalisée. La plupart des épisodes d'eau rouge étaient liés à l'utilisation de tuyaux en fonte sans revêtement âgés de 50 à 70 ans. Pendant cette période, le pH annuel moyen de l'eau distribuée a varié entre 9,1 et 9,7; son alcalinité a varié de 47 à 76 mg/L de CaCO3, et sa dureté totale a varié de 118 à 158 mg/L de CaCO3. Les auteurs ont conclu que la relation la plus forte était entre l'alcalinité de l'eau et sa coloration rouge, et que le maintien de l'alcalinité de l'eau traitée à un niveau supérieur à 60 mg/L de CaCO3 permettait de réduire de façon importante le nombre de plaintes des consommateurs (Horsley et coll., 1998).
La nature de la couche de passivation formé sur le tuyau d'acier galvanisé change en fonction de divers facteurs. Les eaux dont la concentration de CID est modérée et dont le pouvoir tampon est élevé semblent produire de bonnes couches de passivation (Crittenden et coll., 2012).
Ciment
L'alcalinité est un des principaux paramètres influant sur la détérioration de la qualité de l'eau due aux matériaux à base de ciment. Lorsque de l'eau faiblement tamponnée entre en contact avec du ciment, les substances alcalines solubles du ciment passent rapidement dans l'eau potable. Conroy et coll. (1994) ont observé que l'alcalinité jouait un rôle important dans la détérioration de la qualité de l'eau prélevée dans les culs-de-sac de conduites principales à revêtement de mortier in situ où le débit d'eau est faible. Lorsque l'alcalinité se maintenait aux alentours de 10 mg/L de CaCO3, les valeurs du pH restaient au-dessus de 9,5 pendant une période pouvant aller jusqu'à deux ans, et les concentrations d'aluminium demeuraient supérieures à 0,2 mg/L pendant un mois ou deux après l'installation du revêtement. Par contre, lorsque l'alcalinité atteignait environ 35 mg/L de CaCO3, les problèmes de qualité de l'eau se limitaient à une hausse du pH à un niveau supérieur à 9,5 pendant un mois ou deux après l'installation du revêtement. Lorsque l'alcalinité eétait supérieure à 55 mg/L de CaCO3, on ne relèvait aucun problème de qualité de l'eau.
B.2.2.5 Température et variations saisonnières
Il n'existe pas de relation simple entre la température et les processus de corrosion, puisque la température influe sur plusieurs paramètres de la qualité de l'eau, comme la solubilité de l'oxygène dissous, la viscosité, les taux de diffusion, les coefficients d'activité, l'enthalpie des réactions, la solubilité des composés, les taux d'oxydation et l'activité biologique (McNeill et Edwards, 2002).
Ces paramètres influent à leur tour sur le taux de corrosion, les propriétés des incrustations formées et le relargage des substances dans les réseaux de distribution. On s'attend à ce que le taux de corrosion du plomb et du fer augmente en fonction de la température. L'eau chaude est souvent plus corrosive que l'eau froide (Schock et Lytle, 2011). Ainsi, il y a un effet plus direct sur la solubilité du plomb au robinet lorsque la température est élevée. La solubilité de plusieurs sous-produits de la corrosion diminue à mesure que la température augmente (Schock, 1990a; Edwards et coll., 1996; McNeill et Edwards, 2001, 2002).
On a établi une corrélation entre les variations saisonnières (été-hiver) de la température et les concentrations de plomb dans l'eau, ces dernières étant plus élevées en été (Britton et Richards, 1981; Karalekas et coll., 1983; Colling et coll., 1987, 1992; Douglas et coll., 2004; Deshommes et coll., 2013; Ngueta et coll., 2014). Douglas et coll. (2004) ont fait état d'une importante variation saisonnière des concentrations de plomb, les valeurs les plus élevées s'observant de mai à novembre. Dans une étude sur l'exposition au plomb à partir de l'eau potable, Jarvis et coll. (2018) ont observé que les concentrations de plomb étaient considérablement plus élevées en été qu'en hiver, à la fois dans les propriétés qui avaient une entrée de service en plomb et dans celles qui n'en avaient pas, et avec ou sans ajout d'orthophosphate. Dans presque tous les cas, la concentration moyenne de plomb dans l'eau pour chaque participant était plus élevée en été qu'en hiver. Masters et coll. (2016) ont également constaté que les concentrations de plomb dissous étaient trois fois plus élevées en été qu'en hiver dans 50 % des foyers échantillonnés. En général, dans les réseaux de distribution et les entrées de service, les fluctuations de température sont limitées à de courtes périodes, de sorte que tout effet serait faussé par d'autres facteurs. Les changements saisonniers de température s'accompagnent souvent de changements importants d'autres paramètres (comme la MON) (Masters et coll., 2016). Trueman et coll. (2022) ont étudié le rôle de l'aluminium dans le relargage saisonnier du plomb. Les auteurs ont modélisé l'effet de la précipitation de la variscite (AlPO4·2H2O) sur la solubilité du plomb, ainsi que les effets de l'aluminium, de la température et de la concentration d'orthophosphates sur le relargage de plomb à partir de coupons de plomb neufs. Durant la coagulation, les concentrations d'aluminium dans l'eau sont sujettes à des variations saisonnières. La solubilité de la variscite diminue lorsque la coagulation se produit en dessous du pH de solubilité minimale, ce qui engendre de concentrations élevées d'aluminium résiduel en hiver. La précipitation de la variscite a augmenté la solubilité prévue du plomb en diminuant la disponibilité des orthophosphates. L'augmentation de la concentration d'aluminium de 20 à 500 μg/L, a augmenté le relargage de plomb des coupons de 41 %. Les auteurs ont observé une efficacité moindre des orthophosphates, un effet qu'ils ont attribué à une baisse de la concentration en phosphore soluble liée à l'augmentation de l'aluminium. Cela s'est accompagné d'une hausse des concentrations de plomb particulaire et de phosphore. Ces phénomènes pourraient être à l'origine d'une variation saisonnière du relargage de plomb dans l'eau potable traitée aux orthophosphates. Toutefois, les concentrations de cuivre se sont révélées être de 2,5 à 15 fois supérieures pendant l'hiver, en comparaison de l'été, dans cinq des huit résidences échantillonnées (Masters et coll., 2016).
Dans une étude portant sur le relargage de cuivre dans des tours d'habitation et des maisons unifamiliales, Singh et Mavinic (1991) ont observé que les concentrations de cuivre mesurées au robinet d'eau froide n'atteignaient généralement que le tiers de celles mesurées au robinet d'eau chaude. Un essai de laboratoire a comparé le relargage du cuivre d'une eau douce de faible alcalinité à des températures de 4 °C, 20 °C, 24 °C et 60 °C. L'eau à 60 °C contenait plus de cuivre, mais la différence observée entre 4 °C et 24 °C était minime (Boulay et Edwards, 2001). Toutefois, il a été démontré que la solubilité de l'hydroxyde de cuivre diminuait à avec une augmentation de la température (Edwards et coll., 1996; Hidmi et Edwards, 1999). Une étude réalisée auprès de 365 systèmes d'approvisionnement en eau potable n'a révélé aucune tendance significative entre la température et les concentrations mesurées de plomb et de cuivre (Dodrill et Edwards, 1995).
Horsley et coll. (1998) ont analysé le nombre de plaintes relatives à des épisodes d'eau rouge en fonction de la température de l'eau. Ils n'ont observé aucune corrélation directe entre la température et le nombre de plaintes enregistrées, mais ils ont constaté que ce nombre était plus élevé en été. Par ailleurs, une corrélation très étroite a été relevée entre les taux de corrosion mesurés dans des réacteurs annulaires faits de tuyaux de fonte neufs et les variations saisonnières de la température (Volk et coll., 2000). Les taux de corrosion mesurés au début de l'étude (mars) s'établissaient à environ 2,5 millièmes de pouce par an (0,064 mm par an) à une température inférieure à 13 °C. Ils ont commencé à augmenter en mai et ont enregistré leurs valeurs les plus élevées de juillet à septembre (5 à 7 millièmes de pouce par an [0,13 à 0,18 mm par an] et > 20 °C).
Aucune information n'a été trouvée dans la littérature scientifique sur la relation entre la température et la dégradation des tuyaux en ciment.
B.2.2.6 Calcium
On croyait par le passé que le calcium entravait la corrosion des métaux en formant à leur surface une couche de carbonate de calcium (également appelé passivation). Il est rare qu'une couche substantielle de carbonate de calcium se forme sur le plomb, et la capacité de cette couche à inhiber la corrosion du plomb n'a pas été établie. En outre, aucune étude publiée n'a réussi à démontrer, en utilisant des techniques d'analyse propres au composé, la formation d'une couche protectrice de carbonate de calcium dans les tuyaux de plomb, de cuivre ou de fer (Stumm, 1960; Nielsen, 1983; Lee et coll., 1989; Schock, 1989, 1990b; Leroy, 1993; Dodrill et Edwards, 1995; Lyons et coll., 1995; Neuman, 1995; Reda et Alhajji, 1996; Rezania et Anderl, 1997; Sorg et coll., 1999; Schock et Lytle, 2011). Leroy (1993) a démontré que, dans certains cas, le calcium pouvait augmenter légèrement la solubilité du plomb. Enfin, des études réalisées auprès de sociétés et de districts d'approvisionnement en eau aux États-Unis n'ont laissé constater aucun lien entre les concentrations de plomb ou de cuivre et les concentrations de calcium (Lee et coll., 1989; Dodrill et Edwards, 1995).
S'agissant du fer, de nombreux auteurs ont fait état de l'importance du calcium dans diverses situations, y compris la formation d'incrustations de carbonate de calcium ou de mélanges solides de carbonate de fer et de carbonate de calcium, et la formation d'une couche de passivation sur les sites cathodiques (Larson et Skold, 1958; Stumm, 1960; Merill et Sanks, 1978; Benjamin et coll., 1996; Schock et Fox, 2001). Toutefois, le carbonate de calcium ne forme pas en soi d'incrustations protectrices sur les matériaux en fer (Benjamin et coll., 1996).
Le calcium constitue le principal composé chimique des matériaux en ciment. Les types primaires de ciment utilisés pour la distribution d'eau potable renferment de 38 % à 65 % d'oxyde de calcium (Leroy et coll., 1996). Tant que l'état d'équilibre n'est pas atteint entre la teneur en calcium du ciment et celle de l'eau distribuée, on présume qu'il y aura relargage du ciment dans l'eau, ou précipitation du calcium de l'eau dans les pores du ciment, selon le potentiel de précipitation du carbonate de calcium présent dans l'eau.
B.2.2.7 Chlore libre résiduel
L'acide hypochloreux est un agent oxydant fort utilisé pour la désinfection de l'eau potable; il s'agit de la forme prédominante de chlore libre lorsque le pH est inférieur à 7,5. Les espèces de chlore libre (c'est-à-dire, acide hypochloreux et ion hypochlorite) peuvent également servir d'oxydants primaires du plomb et donc en augmenter la corrosion (Boffardi, 1988, 1990; Schock et coll., 1996; Lin et coll., 1997). Le chlore gazeux peut abaisser le pH de l'eau en réagissant avec l'eau pour former de l'acide hypochloreux, des ions hydrogène et des ions chlorure. Dans les eaux faiblement tamponnées, le chlore peut augmenter la corrosivité en réduisant le pH et, en général, en augmentant le taux de corrosion et le POR (Schock et Lytle, 2011). Une étude des effets du chlore sur la corrosion réalisée à l'échelle pilote sur des tuyaux en boucle a démontré que l'ajout de chlore libre (0,2 mg/L) n'augmentait pas les concentrations de plomb (Cantor et coll., 2003). Une étude réalisée auprès de 94 sociétés et districts d'approvisionnement en eau aux États-Unis n'a pas non plus décelé de lien entre les concentrations de plomb et les concentrations résiduelles de chlore libre (entre 0 et 0,5 mg/L) (Lee et coll., 1989).
La présence de dépôts importants de dioxyde de plomb dans les incrustations de corrosion a été signalée pour la première fois par Schock et coll. (1996), dans les tuyaux de différents réseaux de distribution d'eau potable. Les chercheurs ont proposé des théories concernant les conditions chimiques qui favoriseraient les dépôts de plomb tétravalent (dioxyde de plomb – PbO2) ainsi que les modifications des conditions de traitement (notamment la désinfection) qui pourraient rendre les incrustations de PbO2 plus vulnérables à une déstabilisation. Schock et coll. (2001) ont trouvé, dans des tuyaux en plomb, des dépôts dont la phase solide protectrice principale était constituée de dioxyde de plomb. À la suite de ces résultats, ils ont également examiné diverses caractéristiques de la chimie de la solubilité théorique du dioxyde de plomb, notamment son association avec un chlore libre résiduel élevé et une faible demande en oxydants. Les diagrammes de Pourbaix indiquent que ces incrustations de PbO2 se forment en présence d'un POR élevé (Eh supérieur à 1) dans les plages de pH typiques des systèmes d'approvisionnement en eau (Schock et Lytle, 2011). Les faibles concentrations de plomb observées dans la majeure partie de ce réseau de distribution se sont avérées être le résultat de couches de passivation en PbO2 presque pur (Schock et coll., 2001). Les concentrations élevées de plomb mesurées à Washington (DC) ont été liées à un changement de désinfectant secondaire (remplacement du chlore par la chloramination) et à des travaux réalisés antérieurement en lien avec la formation de PbO2 (Schock et coll., 2001; Renner, 2004). Les résultats de l'analyse des solides présents dans les incrustations des tuyaux à Washington (DC) ont confirmé que la dégradation du PbO2 se fait par dissolution réductrice (Schock et coll., 2001). De nombreuses études ont exploré divers aspects de la cinétique de la formation et de la dégradation du PbO2 (Lytle et Schock, 2005; Switzer et coll., 2006; Lin et Valentine, 2008a,b; Liu et coll., 2008; DeSantis et coll., 2020). D'autres études ont montré que la réaction est réversible en l'espace de quelques semaines seulement (Giani et coll., 2005; Lytle et Schock, 2005). Edwards et Dudi (2004) et Lytle et Schock (2005) ont confirmé que les dépôts de dioxyde de plomb pouvaient se former facilement et être par la suite déstabilisés en quelques semaines ou en quelques mois dans des conditions réalistes de pH, de POR et d'alcalinité du réseau de distribution.
Lorsqu'on ajoute de l'acide hypochloreux dans un approvisionnement en eau, il devient l'oxydant dominant des surfaces en cuivre (Atlas et coll., 1982; Reiber, 1987, 1989; Hong et Macauley, 1998). On a démontré que la présence de chlore libre résiduel favorisait la corrosion du cuivre à un pH moins élevé (Atlas et coll., 1982; Reiber, 1989). Par contre, le chlore libre résiduel réduisait le taux de corrosion du cuivre à un pH de 9,3 (Edwards et Ferguson, 1993; Edwards et coll., 1999). Toutefois, Schock et coll. (1995) ont conclu que le chlore libre affecte le produit de solubilité du cuivre en stabilisant les phases solides du Cu(II), ce qui a pour effet d'augmenter la libération de cuivre. Les auteurs n'ont observé aucun effet direct du chlore libre sur la solubilité du cuivre(II), si ce n'est le changement de valence et son effet indirect sur le potentiel de solubilité du cuivre.
Lors de l'exposition au désinfectant pendant le traitement et la distribution de l'eau, le Fe(II) est oxydé en Fe(III), un état d'oxydation relativement insoluble qui est responsable de la coloration de l'eau. Quelques auteurs ont fait état d'une augmentation du taux de corrosion du fer en présence de chlore libre (Pisigan et Singley, 1987; Cantor et coll., 2003). Toutefois, la consommation rapide du chlore libre résiduel par les sous-produits de la corrosion du fer est plus inquiétante (Frateur et coll., 1999). En revanche, lorsque la corrosion du fer subit l'effet de microorganismes, la présence d'une concentration plus élevée de chlore libre résiduel peut en fait réduire les problèmes de corrosion (LeChevallier et coll., 1993). Aucune information établissant une corrélation entre les concentrations de fer et la présence de chlore libre résiduel n'a été trouvée dans la littérature scientifique.
La documentation scientifique consultée n'établit par ailleurs aucune corrélation entre la présence de chlore libre résiduel et la dégradation des tuyaux en ciment.
B.2.2.8 Chloramines
Des rapports ont fait état de l'incidence des chloramines sur les concentrations de plomb dans les réseaux de distribution d'eau potable. À Washington (DC), les chloramines ont été substituées au chlore pour la désinfection secondaire. Par la suite, on a détecté dans plus de 1 000 foyers de Washington (DC) des concentrations de plomb supérieures au niveau d'intervention de 0,015 mg/L prescrit par l'U.S. EPA, et mesuré dans plus de 157 foyers des concentrations de plomb supérieures à 300 µg/L dans l'eau du robinet (Renner, 2004; U.S. EPA, 2007). Le chlore est un oxydant puissant, et les incrustations d'oxyde de plomb qui s'étaient formées dans les tuyaux au fil des années étaient parvenues à un état d'équilibre dynamique dans le réseau de distribution. Le passage du chlore aux chloramines a réduit le potentiel d'oxydation de l'eau distribuée et a déstabilisé les incrustations d'oxyde de plomb, augmentant ainsi le relargage du plomb (Schock et Giani, 2004; Lytle et Schock, 2005; DeSantis et coll., 2020). Les travaux de Edwards et Dudi (2004) ont également montré que les chloramines ne formaient pas de solides de faible solubilité sur les surfaces de plomb. Le POR de l'eau traitée par chloramination favorise la formation de solides du plomb bivalent, plus solubles. Une étude de Treweek et coll. (1985) indique également que, dans certaines conditions, l'eau chloraminée a un pouvoir de solubilisation plus grand que l'eau chlorée, même si la corrosion apparente du plomb est plus lente.
La littérature scientifique renseigne peu sur les effets des chloramines sur le cuivre ou sur le fer. Certains auteurs indiquent que les chloramines sont moins corrosives pour le fer que le chlore libre (Treweek et coll., 1985; Cantor et coll., 2003). Hoyt et coll. (1979) font par ailleurs état d'une hausse des plaintes concernant des épisodes d'eau rouge à la suite du remplacement des chloramines par du chlore libre résiduel pour le traitement de l'eau.
Aucune information n'a été trouvée dans la littérature scientifique examinée sur l'existence d'un lien possible entre l'utilisation des chloramines et la dégradation des tuyaux en ciment.
B.2.2.9 Chlorure et sulfate
Des études ont montré que les effets du chlorure sur la corrosion du plomb dans les réseaux de distribution d'eau potable étaient négligeables (Schock, 1990b). Le chlorure ne devrait pas avoir d'effet appréciable sur la solubilité du plomb (Schock et coll., 1996). Toutefois, Oliphant (1993) a constaté que cette substance augmentait la corrosion galvanique des soudures à base de plomb dans les systèmes de plomberie en cuivre.
Le chlorure a toujours été considéré comme étant corrosif pour le cuivre (Edwards et coll., 1994b). Toutefois, des chercheurs ont démontré que des concentrations élevées de chlorure (71 mg/L) réduisaient en fait le taux de corrosion du cuivre à un pH de 7 à 8 (Edwards et coll., 1994a,b, 1996; Broo et coll., 1997, 1999). Edwards et McNeill (2002) avancent que cette dichotomie peut s'expliquer si on prend en compte les effets à long terme au lieu des effets à court terme. Le chlorure augmenterait le taux de corrosion du cuivre à court terme. Au fil du temps, les sous-produits de cette corrosion en viendraient à protéger efficacement la surface de cuivre.
Des études ont démontré que les effets du sulfate sur la corrosion du plomb dans l'eau potable sont généralement négligeables (Boffardi, 1988; Schock, 1990b; Schock et coll., 1996). Le sulfate réduirait en fait la corrosion galvanique des soudures à base de plomb (Oliphant, 1993). En effet, il modifie la forme physique du produit normal de la corrosion, qui se transforme en plaques cristallines plus protectrices.
Le sulfate est un puissant catalyseur de la corrosion qui participe à la piqûration du cuivre (Schock, 1990b; Edwards et coll., 1994b; Ferguson et coll., 1996; Berghult et coll., 1999). On a montré qu'il réduisait les concentrations de cuivre dans les matériaux de cuivre neufs. Lorsque ces matériaux vieillissent, des concentrations élevées de sulfate font augmenter les concentrations de cuivre dans l'eau (Edwards et coll., 2002). Les auteurs ont conclu que ce phénomène était dû à la propriété du sulfate de prévenir la formation d'incrustations de malachite et de ténorite, plus stables et moins solubles. Schock et coll. (1995) signalent que les complexes de sulfate aqueux n'auront vraisemblablement pas d'effet notable sur la solubilité du cuivre dans l'eau potable.
Une étude des concentrations de plomb signalées par 365 systèmes d'approvisionnement en eau potable a révélé que des RMCS plus élevés entraînaient des valeurs plus élevées des concentrations de plomb dans l'eau du robinet au 90e centile. Cette étude a montré que 100 % des systèmes d'approvisionnement en eau potable qui fournissent une eau potable dont le RMCS est inférieur à 0,58 satisfont au niveau d'intervention de 0,015 mg/L prescrit par l'U.S. EPA pour le plomb. Toutefois, seuls 36 % des systèmes d'approvisionnement en eau potable fournissant une eau dont le RMCS est supérieur à 0,58 satisfont à ce critère (Edwards et coll., 1999). Dudi et Edwards (2004) ont également démontré d'une manière concluante que des RMCS plus élevés augmentent le relargage du plomb à partir du laiton à cause des connexions galvaniques. Des études ont permis de déterminer que les concentrations élevées de plomb dans l'eau potable de Durham, en Caroline du Nord, étaient dues à un changement de coagulant (remplacement du sulfate d'aluminium par du chlorure ferrique), ce qui avait entraîné une augmentation du RMCS et provoqué le relargage de plomb à partir de la plomberie (Renner, 2006; Edwards et Triantafyllidou, 2007).
Il s'est avéré impossible d'établir un rapport clair entre les teneurs en chlorure ou en sulfate et la corrosion du fer. Larson et Skold (1958) ont démontré que le ratio entre la somme du chlorure et du sulfate et le bicarbonate (que l'on a par la suite appelé l'indice de Larson) jouait un rôle important, un ratio élevé indiquant une eau plus corrosive. Des chercheurs ont signalé que le chlorure (Hedberg et Johansson, 1987; Velveva, 1998) et le sulfate (Velveva, 1998) favorisaient la corrosion du fer. L'exposition en laboratoire de sections de tuyaux de fonte de 90 ans à de l'eau contenant 100 mg de chlorure par litre a provoqué une augmentation immédiate des concentrations de fer dans l'eau (de 1,8 à 2,5 mg/L). Par contre, on a constaté que le sulfate inhibait la dissolution des oxydes de fer et réduisait ainsi les concentrations de fer dans l'eau (Bondietti et coll., 1993). Les résultats d'autres études ont montré que la présence de sulfate ou de chlorure favorisait la formation d'incrustations protectrices (Feigenbaum et coll., 1978; Lytle et coll., 2003). Dans une autre étude, ni le sulfate ni le chlorure ne semblaient avoir d'effet sur la corrosion du fer (Van Der Merwe, 1988).
Lytle et coll. (2020) ont évalué les effets du chlorure, du sulfate et de la concentration de CID sur la libération du fer dans une section d'un tuyau en fonte de 90 ans dans une eau à pH 8,0 dans des conditions de stagnation. Les résultats ont révélé que l'ajout de 150 mg/L de sulfate dans l'eau a provoqué une augmentation de la concentration moyenne de fer total, qui est passée de 0,54-0,79 mg/L à 1,13-2,68 mg/L, dans de l'eau avec 10 mg C/L de CID. Des résultats similaires ont été observés lorsque le chlorure était ajouté seul et lorsque le sulfate et le chlorure étaient ajoutés ensemble. En revanche, les concentrations moyennes de fer total ont été réduites de 53 % à 80 % dans les eaux présentant des concentrations de CID plus élevées (50 mg C/L).
Des concentrations élevées de sulfate peuvent dans certains cas provoquer une dégradation rapide des matériaux à base de ciment. Il est possible que le sulfate réagisse avec les aluminates de calcium présents dans le ciment hydraté, produisant ainsi des sulfoaluminates de calcium fortement hydratés, ce qui peut provoquer l'apparition de fissures et réduire la résistance mécanique des matériaux. Cet effet du sulfate pourrait être atténué en présence de concentrations élevées de chlorure (Leroy et coll., 1996).
B.2.2.10 Matière organique naturelle (MON)
La MON peut affecter la corrosion de diverses façons. Certaines matières organiques peuvent recouvrir les tuyaux et réduire la corrosion, tandis que d'autres matières organiques peuvent favoriser la corrosion. Il est généralement recommandé d'éliminer la MON pour réduire au minimum les concentrations de plomb et de cuivre et pour favoriser un contrôle efficace de la corrosion, en plus de prévenir la formation de sous-produits de désinfection. Des renseignements détaillés sur la MON se trouvent ailleurs dans la documentation (Santé Canada, 2020c).
La MON peut avoir différents effets sur la surface des métaux avec certains types formeant une couche protectrice et réduisant la corrosion sur de longues périodes (Schock et Lytle, 2011). D'autres types réagissent avec les produits de corrosion pour augmenter la corrosion du plomb (Korshin et coll., 1996, 1999, 2000, 2005; Dryer et Korshin, 2007; Liu et coll., 2009; Masters et Lin, 2009; Zhou et coll., 2015; Masters et coll., 2016). Au Royaume-Uni, la MON est l'une des principales difficultés liées au contrôle de la dissolution du plomb à l'aide d'orthophosphates (Colling et coll., 1987; Hayes et coll., 2008). La MON peut former des complexes avec des ions calcium et les empêcher de former une couche protectrice de CaCO3 enempêchant la nucléation, le développement des cristaux, la vitesse de précipitation, la solubilité ou la structure cristalline du CaCO3 (Schock et Lytle, 2011). Lors de simulations du remplacement partiel d'entrées de service en plomb, Zhou et coll. (2015) ont observé qu'une augmentation de la MON entraînait une augmentation importante du relargage de plomb. Dans des études à l'échelle de banc d'essai, Trueman et coll. (2017) ont observé un relargage accru de plomb à partir de coupons en raison d'une corrosion uniforme et d'une corrosion galvanique en présence d'acide humique. L'ajout d'orthophosphate a permis de réduire le relargage de plomb, mais les substances humiques ont eu une incidence sur l'efficacité de cette mesure. Zhao et coll. (2018) ont constaté que la MON retardait l'agrégation des particules de phosphate de plomb après la déstabilisation du PbO2.
Des études portant sur la piqûration de la plomberie de cuivre ont indiqué que certaines MON pourraient prévenir ce type de corrosion (Campbell, 1954 a, b, 1971; Campbell et Turner, 1983; Edwards et coll., 1994a; Korshin et coll., 1996; Edwards et Sprague, 2001). Toutefois, la MON contient des groupes complexants puissants et elle peut augmenter la solubilité des produits de la corrosion du cuivre (Korshin et coll., 1996; Rehring et Edwards, 1996; Broo et coll., 1998, 1999; Berghult et coll., 1999, 2001; Edwards et coll., 1999; Boulay et Edwards, 2001; Edwards et Sprague, 2001). Néanmoins, on n'a pas démontré de façon concluante l'importance de la MON dans la solubilité du cuivre par rapport à celle des ligands concurrents (Schock et coll., 1995; Ferguson et coll., 1996). Un relargage de cuivre peut donner à l'eau une coloration bleue, qui peut être causée par la présence de cuivre particulaire. Une eau bleue et des concentrations de cuivre dépassant 6 mg/L ont été observées dans un nouveau système de plomberie en cuivre. L'enlèvement de la MON a augmenté la concentration d'oxygène dissous et, par conséquent, la formation d'incrustations. Les auteurs ont avancé qu'en l'absence de MON, le taux de corrosion diminue, ce qui accélère le processus de vieillissement naturel (Arnold et coll., 2012). On trouvera des renseignements plus détaillés sur la MON, le plomb et le cuivre ailleurs dans la documentation (Santé Canada, 2019a,b, 2020c).
Plusieurs auteurs ont démontré que la MON diminuait le taux de corrosion du fer dans les tuyaux d'acier galvanisé et de fonte (Larson, 1966; Sontheimer et coll., 1981; Broo et coll., 1999). Des expériences réalisées par Broo et coll. (2001) ont révélé que la MON favorisait la corrosion à un pH faible, mais la réduisait à un pH élevé. Cet effet opposé a été attribué aux différents complexes qui se forment à la surface sous différentes conditions de pH. On a également constaté que la MON stimulait la formation d'incrustations protectrices dans les tuyaux en fer en réduisant les colloïdes ferriques en fer ferreux soluble (Campbell et Turner, 1983). Toutefois, la MON peut complexer les ions métalliques (Benjamin et coll., 1996), ce qui pourrait conduire à une augmentation des concentrations de fer dans l'eau. Peng et coll. (2013) ont observé que la libération de fer augmentait en présence de MON et d'autres matières inorganiques.
Dans certains cas, la MON peut servir de nourriture aux organismes qui se développent dans le réseau de distribution ou à la surface des tuyaux. Ainsi, le taux de corrosion peut augmenter lorsque ces organismes attaquent la surface.
La documentation scientifique examinée contenait peu d'information sur le lien entre la MON et la dégradation des tuyaux en ciment.
B.3 Méthodes de mesure de la corrosion
Comme nous l'avons indiqué plus haut, il n'existe pas de méthode de mesure simple et directe de la corrosion interne des réseaux de distribution d'eau potable. Diverses méthodes ont été proposées pour évaluer indirectement corrosion interne des réseaux de distribution d'eau potable. Bien que l'indice de Langelier ait servi par le passé à déterminer la corrosivité de l'eau distribuée pour les métaux, l'inefficacité de cette méthode a depuis été démontrée et elle n'est plus employée à cette fin. Des méthodes fondées sur l'utilisation de coupons et les bancs d'essai de tuyaux ont été mises au point pour comparer diverses méthodes de contrôle de la corrosion. En raison des préoccupations que suscitent les effets du relargage de métaux dans les réseaux de distribution sur la santé des consommateurs, mesurer la concentration des métaux dans l'eau du robinet est maintenant considérée comme la méthode la plus appropriée pour évaluer l'exposition de la population aux métaux et surveiller les résultats du contrôle de la corrosion.
B.3.1 Indices de corrosion
Les indices de corrosion ne devraient pas être utilisés pour évaluer l'efficacité des programmes de contrôle de la corrosion puisqu'ils ne donnent qu'un aperçu de la tendance du carbonate de calcium à se dissoudre ou à précipiter. Par le passé, ces indices ont servi à évaluer la corrosivité de l'eau distribuée pour les métaux et à contrôler la corrosion. Ils étaient fondés sur l'hypothèse selon laquelle la formation d'une mince couche de carbonate de calcium à la surface d'un tuyau métallique protégeait contre la corrosion. Un certain nombre de ratios semi-empiriques et empiriques comme l'indice de Langelier, l'indice de Ryzner, l'indice d'agressivité, l'excès momentané et le potentiel de précipitation du carbonate de calcium (CCPP) ont été élaborés pour évaluer l'équilibre carbonate-bicarbonate de calcium. Toutefois, un dépôt de carbonate de calcium ne forme pas une couche protectrice adhérent à la surface du métal. La détermination du CCPP permet de comprendre la quantité de carbonate de calcium qui pourrait précipiter dans un réseau de distribution et aidera les responsables de systèmes de distribution d'eau à éviter une précipitation excessive à un pH, une alcalinité ou une nouvellement ciblées (AWWA, 2017a).
D'importantes preuves empiriques viennent contredire l'existence présumée d'un lien entre la corrosion et l'indice de Langelier, de sorte qu'il ne faudrait pas utiliser les indices de corrosion à des fins de contrôle de la corrosion (Benjamin et coll., 1996). Les travaux d'Edwards et coll. (1996) ont démontré que, dans certaines conditions, l'utilisation des indices de corrosion pouvait conduire à la prise de mesures susceptibles d'augmenter la libération de sous-produits de la corrosion.
B.3.2 Coupons et bancs d'essai de tuyaux
La sélection des matériaux les plus appropriés aux conditions étudiées est essentielle pour obtenir une approximation raisonnablement fiable des conditions réelles dans le réseau modélisé. L'utilisation de matériaux de plomberie neufs dans les simulateurs (par exemple, bancs d'essai de tuyaux) doit convenir à l'étude du problème de corrosion en question. Ainsi, le recours à des tuyaux neufs en cuivre sera approprié si le réseau à l'étude approvisionne des bâtiments neufs qui utilisent ce type de tuyaux. Les robinets en laiton au plomb conviennent lorsque leur utilisation est autorisée par la réglementation en vigueur et qu'ils sont disponibles sur le marché. Par contre, l'utilisation de tuyaux en plomb neufs ne convient pas lorsqu'il s'agit de reproduire les conditions d'un réseau comportant de vieilles entrées de service en plomb ou de vieux raccords en cols-de-cygne/queue de cochon en plomb, dont l'intérieur est recouvert d'incrustations bien développées contenant ou non du plomb. En fait, si l'on tente de prédire la réaction de ces matériaux à divers changements de traitements ou de la qualité de l'eau en procédant à une simulation sur des matériaux inappropriés, les conclusions obtenues pourraient être erronées.
Les coupons et les bancs d'essai de tuyaux constituent des outils utiles pour comparer les diverses techniques de contrôle de la corrosion avant de mettre en place des programmes de contrôle de la corrosion à l'échelle du réseau. Ils permettent de simuler efficacement les conditions des réseaux de distribution sans modifier l'intégrité de ceux-ci à la grande échelle. Les études à l'échelle de banc d'essai de tuyaux peuvent être utiles dans le cadre d'une stratégie globale d'optimisation du contrôle de la corrosion, en tenant compte de la qualité de l'eau, de la formation d'incrustations et de la surveillance du traitement de la corrosion. L'efficacité de cette approche intégrée a été démontrée dans plusieurs réseaux de distribution d'eau (Cantor, 2008). Un montage de tuyaux en boucle à faible coût décrit par Lytle et coll. (2012) pourrait servir d'instrument d'évaluation aux responsables de systèmes de distribution d'eau potable. Toutefois, même lorsqu'on a recours à de longues périodes de conditionnement des matériaux dans l'eau des réseaux à l'étude, les coupons testés sur le terrain ou en laboratoire et les bancs d'essai de tuyaux ne fournissent pas une évaluation exacte de la corrosion qui peut survenir à plus grande échelle dans les réseaux de distribution. Ces essais ne reflètent pas d'une manière fiable l'exposition des populations aux contaminants présents dans les réseaux de distribution, vu le nombre considérable de facteurs pouvant influer sur la concentration des contaminants dans l'eau du robinet.
On utilise habituellement des coupons insérés dans les réseaux de distribution pour déterminer le taux de corrosion correspondant à un métal particulier. Ces coupons fournissent une bonne estimation du taux de corrosion ainsi que des informations visuelles sur la morphologie des incrustations. Il n'existe actuellement aucune norme universelle régissant la géométrie des coupons, les matériaux les composant ou les protocoles d'exposition dans les réseaux de distribution d'eau potable (Reiber et coll., 1996; AWWA, 2017a). Les coupons utilisés doivent être représentatifs des matériaux dont sont faits les tuyaux à l'étude. On suppose que la perte de métal se produit uniformément sur toute la surface de test du coupon, bien que ce ne soit pas forcément exact. Dans le cas des métaux dont la corrosion est généralement uniforme (entre autres le cuivre, les alliages de cuivre et les soudures plomb/étain, etc.), il est acceptable de supposer une perte uniforme de métal et de s'en servir dans le calcul d'une durée de vie approximative. En revanche, ce type d'analyse pourrait ne pas être approprié pour la piqûration ou d'autres formes localisées de corrosion (AWWA, 2017a). Les coupons sont généralement insérés dans le réseau de distribution pour une période donnée, et le taux de corrosion est déterminé par une mesure de la perte de masse par unité de surface. La durée du test doit permettre la formation d'incrustations de corrosion, et peut donc varier de 3 à 24 mois selon le type de métal testé (Reiber et coll., 1996).
La piètre reproductibilité des résultats (haut degré de variation entre les mesures effectuées sur différents coupons) constitue le principal inconvénient de la méthode. Ce manque de précision est dû à la fois à la séquence complexe des procédures de manipulation, de préparation et de restauration de la surface, qui comporte un risque d'erreurs induites par l'analyse, et au haut degré de variabilité qui caractérise les propriétés métallurgiques ou les conditions chimiques de la surface du coupon pendant la période d'exposition (Reiber et coll., 1996).
Les essais d'immersion s'apparentent aux essais sur coupons. Ils consistent à soumettre des échantillons représentatifs d'un métal à des eaux d'essai spécifiques. Les concentrations de plomb et de cuivre relargués au fil du temps sont mesurées. Les échantillons de métal sont maintenus dans des conditions de stagnation, et l'eau à laquelle ils sont exposés est changée à fréquence fixe. Les essais d'immersion peuvent être réalisés en bécher (jar test) ou à l'aide de sections de tuyaux (U.S. EPA, 1993). Les essais d'immersion permettent d'étudier les mécanismes de corrosion, de déterminer le TOCC et d'évaluer diverses alternatives de traitements de contrôle de la corrosion afin de restreindre les conditions d'essai à utiliser dans les essais subséquents sur des montages de tuyaux en boucle (Cornwell et Wagner, 2019; Kirmeyer et coll., 2004; U.S. EPA, 1993). Les résultats obtenus fournissent une indication relative de la libération de métaux dans chacune des eaux testées par rapport à une condition témoin.
Arnold et coll. (2021) ont décrit un protocole d'essai d'immersion standardisé conçu pour étudier les mécanismes de corrosion, déterminer le TOCC et évaluer les impacts de changer la source d'eau ou le traitement. Les auteurs ont constaté qu'il s'agissait d'une approche peu coûteuse et peu complexe, exigeant moins de ressources que les études pilotes de tuyaux en boucle et convenant aux systèmes de petite ou de moyenne taille. Masters et coll. (2022) ont utilisé ce protocole d'essai d'immersion pour comparer les résultats relatifs au plomb à ceux d'une étude sur montage pilote, afin d'établir si les deux méthodes produiraient des recommandations similaires pour l'optimisation du TCC. Les auteurs ont montré que dans les deux méthodes d'essai, les concentrations de plomb étaient réduites en fonction de l'ajustement du pH (pH 8,8) et de l'ajout d'orthophosphate (1-3 mg/L de PO4) avec des conditions similaires de qualité de l'eau. Tant l'étude sur coupon que celle sur montage de tuyaux ont surestimé le relargage de plomb dans le réseau de distribution, avaient une forte variabilité et indiquaient que les orthophosphates étaient plus efficaces que le pH pour réduire les concentrations de plomb dans l'un des deux réseaux examinés. Les auteurs ont conclu que l'utilisation de coupons était une option durable, relativement rapide (quelques mois au lieu de plusieurs années) et économique pour évaluer le TCC, malgré certains inconvénients comme l'impossibilité de tenir compte des variations saisonnières.
Les stations de surveillance de Process Research Solutions sont une variante des essais d'immersion dans laquelle des plaques métalliques sont exposées à l'eau dans une chambre d'essai. Les plaques ne fonctionnent pas comme des coupons. Plutôt, les métaux libérés des plaques, habituellement du plomb et du cuivre, sont recueillis dans l'eau stagnante prélevée à proximité des plaques métalliques. Les plaques sont retirées, et les couches et la composition des débris de corrosion sont étudiées, de la même façon que pour les tuyaux extraits d'un réseau de distribution (AWWA, 2017a).
Les bancs d'essai de tuyaux sont plus complexes que les coupons et peuvent être conçus de manière à reproduire diverses conditions de qualité de l'eau. Des expériences en laboratoire avec des bancs d'essais de tuyaux peuvent également servir à évaluer la corrosion des métaux. En plus de servir à mesurer la perte de masse par unité de surface, les techniques électrochimiques peuvent être utilisées pour déterminer le taux de corrosion. De plus, les bancs d'essai de tuyaux peuvent simuler un réseau de distribution et/ou un système de plomberie et permettre ainsi de mesurer le relargage des contaminants en fonction de la stratégie de contrôle de la corrosion utilisée. Ces montages, qui peuvent être faits de matériaux neufs ou de sections de tuyaux usagés, sont conditionnés pour permettre la formation d'incrustations de corrosion ou de couches de passivation qui influeront à la fois sur le taux de corrosion et sur la libération du métal sous-jacent. La période de conditionnement peut durer de 4 semaines à 17,25 mois, mais la durée médiane est de 6 mois (Eisnor et Gagnon, 2003; Centre for Water Resources Studies, 2023; WRF, 2023). La période d'essai allait de 7 mois à 3,5 ans, et la durée médiane était de 12 mois (WRF, 2023).
Comme dans le cas des tests sur coupons, il n'existe actuellement aucune norme universelle régissant l'utilisation des bancs d'essai de tuyaux pour évaluer la corrosion dans les réseaux de distribution d'eau potable. Cependant, diverses publications peuvent renseigner les chercheurs sur les concepts et les facteurs opérationnels à prendre en compte lorsqu'ils entreprennent ce type d'études (AwwaRF, 1990, 1994; Eisnor et Gagnon, 2003; Centre for Water Resources Studies, 2023; WRF, 2023). Un document de conseils bien conçu a été élaboré, rendant compte de la vaste expérience acquise, pour fournir les connaissances manquantes concernant la conception et l'opération des montages de tuyaux en boucle, ainsi que l'interprétation des données obtenues. Les sujets abordés comprennent les meilleures pratiques pour la conception et l'opération des montages de tuyaux en boucle, des outils pour la gestion et l'analyse statistique des données et des études de cas. Il fournit une évaluation des études de tuyaux en boucle ainsi que des informations sur la variabilité de la façon dont ces dispositifs sont conçus et opérés (Centre for Water Resources Studies, 2023). Trueman et coll. (2023) ont estimé l'effet de modifications de la dose d'orthophosphate et du processus de coagulation sur le relargage de plomb au moyen d'ESP récupérées et intégrées à des montages de tuyaux sentinelles répartis dans un réseau de distribution. Des échantillonnages ont aussi été effectués dans des sites sentinelles, et toutes les données ont été analysées à l'aide du modèle additif généralisé. Les auteurs ont constaté que les résultats des sites sentinelles correspondaient à ceux des montages de tuyaux sentinelles. Ils ont conclu que ce type de montage pourrait être une alternative durable à l'échantillonnage des conduites dans l'évaluation du contrôle de la corrosion. Leurs travaux fournissent un cadre pour évaluer le contrôle de la corrosion en intégrant de l'information provenant de plusieurs sources. Un autre document de conseils a été élaboré pour la réalisation d'une étude sur banc d'essai de tuyaux « adaptée aux besoins » dans les réseaux. Il y est question des facteurs et des caractéristiques propres aux systèmes qui pourraient influencer la stratégie globale d'essai, notamment la conception du dispositif d'essai, les procédures opérationnelles, les méthodes d'analyse des données et les aspects financiers. Des ressources supplémentaires ont aussi été élaborées pour faciliter l'élaboration d'une étude à l'échelle de banc d'essai de tuyaux, entre autres les résultats d'études du TCC sur bancs d'essai de tuyaux, des fiches d'information, des schémas, des listes de vérification des pièces et des procédures, des vidéos didactiques sur la collecte des tuyaux et l'utilisation des bancs d'essai, un guide de programme sur l'analyse statistique et un outil d'estimation des coûts (WRF, 2023).
B.3.3 Surveillance au robinet
L'exposition des consommateurs à des contaminants provenant de la corrosion interne des réseaux d'eau potable peut provenir de la corrosion du réseau de distribution aussi bien que de la plomberie. La mesure des contaminants au robinet, et en particulier du plomb, demeure le meilleur moyen de déterminer l'exposition de la population. L'échantillonnage du plomb au robinet est requis pour vérifier l'efficacité des mesures de contrôle de la corrosion et de s'assurer de réduire l'exposition de la population au plomb (Santé Canada, 2019a). On peut également adéquatement évaluer l'efficacité du programme de contrôle de la corrosion en mesurant les concentrations du contaminant étudié dans l'eau du robinet au fil du temps et en établissant une corrélation entre ces concentrations et les activités de contrôle de la corrosion. Le Royaume-Uni a documenté l'efficacité d'un programme d'échantillonnage RDT effectué à l'échelle du réseau pour la surveillance de la conformité et pour évaluer la performance et l'optimisation du contrôle de la corrosion (Cardew, 2000, 2003, 2009; Hayes et Croft, 2012; Hayes et coll., 2014).
B.4 Mesures de traitement et de contrôle ayant trait au plomb, au cuivre et au fer
Dans le cadre du présent document, les concentrations de plomb dans l'eau du robinet constituent la mesure privilégiée pour la mise en place ou l'optimisation d'un programme de contrôle de la corrosion. Des mesures de contrôle visant le cuivre et le fer sont cependant examinées dans ce qui suit, puisque que la corrosion et les concentrations de ces métaux dépendent étroitement des méthodes de contrôle de la corrosion choisies.
La corrosion des réseaux d'eau potable et la libération de contaminants dans l'eau distribuée dépendent à la fois des matériaux exposés à la corrosion et de l'eau qui entre en contact avec ces derniers. La durée du contact de l'eau avec les matériaux a une incidence considérable sur les concentrations de métaux dans l'eau potable. Par conséquent, le fait de purger les matériaux de plomberie après une période de stagnation et avant de consommer de l'eau aide à réduire l'exposition au plomb. On peut également réduire l'exposition des consommateurs aux métaux lourds en utilisant, comme mesure provisoire, des dispositifs de traitement de l'eau potable certifiés.
On peut également réduire la corrosivité de l'eau potable en ajustant son pH et/ou son alcalinité ou en y ajoutant des inhibiteurs de corrosion. Les ajustements du pH et/ou de l'alcalinité ou l'utilisation d'inhibiteurs de corrosion pour contrôler les concentrations de plomb, de cuivre ou de fer dans l'eau potable doivent être effectués avec prudence. Des études pilotes devraient être effectuées pour déterminer l'efficacité de la méthode de contrôle de la corrosion retenue, compte tenu des conditions particulières prévalant dans le réseau de distribution. Même si une méthode permet de réduire efficacement les concentrations de plomb, de cuivre ou de fer lors d'essais pilotes, elle peut ne pas être efficace en conditions réelles, dans le réseau de distribution.
Une surveillance rigoureuse à grande échelle doit donc également être effectuée avant, pendant et après l'introduction ou l'optimisation d'un programme de contrôle de la corrosion d'un système. Les changements apportés au traitement, y compris les changements qui touchent le TCC tels que le passage d'un ajustement de pH/alcalinité à l'ajout d'orthophosphates, devraient aussi faire l'objet d'une surveillance rigoureuse. La surveillance des paramètres de qualité de l'eau (voir le tableau D.1.2) est essentielle au maintien d'une qualité d'eau stable et au contrôle efficace de la corrosion. On veillera ainsi à ce que le pH ne varie pas de plus de 0,2 unité de pH dans le réseau de distribution (Santé Canada, 2015). Des exemples de fréquences d'échantillonnage et d'emplacements pour la surveillance de ces paramètres se trouvent ailleurs dans la documentation (WRF, 2023).
Le recours à certains procédés de traitement, comme les coagulants ou les oxydants, peut modifier la qualité de l'eau et entraîner une augmentation de la concentration de plomb. Des informations supplémentaires sur les impacts du traitement et des changements peuvent être trouvées ailleurs (AWWA, 2017a).
B.4.1 Mesures d'intervention ciblant les réseaux de distribution d'eau potable
Un choix judicieux des matériaux (contenant peu de plomb, comme les soudures sans plomb ou les raccords et éléments de plomberie en ligne à faible teneur en plomb) constitue un des moyens de réduire l'exposition de la population aux contaminants inquiétants. Par exemple, l'utilisation de soudures sans plomb et de raccords en laiton à faible teneur en plomb réduit la concentration de plomb dans l'eau potable causée par la corrosion des soudures.
B.4.1.1 Remplacement des entrées de service en plomb
Le remplacement complet des entrées de service en plomb (la portion appartenant à la municipalité et celle appartenant au propriétaire de la résidence) est le moyen le plus efficace et le plus permanent de réduire considérablement les concentrations de plomb dans l'eau du robinet du consommateur. Lytle et coll. (2019) ont constaté que les entrées de service en plomb, lorsqu'elles étaient présentes, étaient la plus grande source de plomb. Ils ont aussi observé que la masse totale de plomb dans l'eau avait été réduite de 86 % en moyenne (plage de 80 à 94 %) après l'enlèvement des entrées de service en plomb. Ces valeurs étaient supérieures à celles rapportées par Sandvig et coll. (2008), qui ont montré que les entrées de service en plomb généraient de 50 % à 75 % de la masse totale de plomb mesurée au robinet. Ces études montrent l'avantage significatif que procure l'enlèvement complet des entrées de service en plomb.
Il est important que les responsables de systèmes de distribution d'eau potable encouragent fortement les propriétaires à remplacer leur portion de l'entrée de service en plomb lorsque la municipalité remplace la portion publique. Cela garantit un remplacement complet de l'entrée de service en plomb et minimise l'exposition du consommateur au plomb. Le remplacement partiel de ces conduites (en remplaçant soit seulement la portion de la municipalité ou seulement celle du consommateur) peut réduire les concentrations de plomb, mais cette réduction n'est pas proportionnelle si on la compare à la réduction observée après un remplacement complet (Santé Canada, 2019a). Le remplacement partiel des entrées de service en plomb n'est pas recommandé.
Le remplacement (complet ou partiel) d'une entrée de service en plomb peut perturber ou déloger les incrustations de plomb existantes ou les sédiments contenant du plomb et entraîner une augmentation importante des concentrations de plomb au robinet. Cette augmentation peut durer trois mois ou plus après le remplacement de l'entrée de service en plomb (Trueman et Gagnon, 2016; Deshommes et coll., 2017; Pieper et coll., 2017; Trueman et coll., 2017; Pieper et coll., 2018; Doré et coll., 2019; Santé Canada, 2019a). Doré et coll. (2019) ont constaté que le traitement optimal de contrôle de la corrosion varie selon que le remplacement de l'entrée de service en plomb est complet ou partiel, et les effets à court terme sur le relargage de plomb peuvent être atténués par la mise en place d'un TCC avant le remplacement de l'entrée de service en plomb. De façon générale, dans le cas d'un remplacement complet, le meilleur traitement contre la corrosion s'est avéré être l'ajout d'orthophosphate, tandis que dans le cas d'un remplacement partiel, c'est la diminution du RMCS qui a donné les meilleurs résultats dans une eau présentant certaines caractéristiques précises.
Lorsqu'on entreprend le remplacement d'une entrée de service en plomb, il faut procéder à une purge après le remplacement, puis nettoyer les débris des grilles ou des aérateurs des sorties d'eau (AWWA, 2017a; Santé Canada, 2019a). Le consommateur doit être encouragé à faire une purge initiale complète, etd'autres mesures d'atténuation, comme la filtration au point d'utilisation, l'éducation du public, une courte purge quotidienne supplémentaire et la réalisation d'analyses un mois après le remplacement, devraient être prises (AWWA, 2017a). Les analyses devraient débuter au moins un mois après un remplacement complet et 72 heures après un remplacement partiel. La qualité de l'eau au robinet du consommateur devrait être surveillée à la suite d'un remplacement complet ou partiel, et ce, pendant plusieurs mois après le remplacement, jusqu'à ce que les concentrations de plomb se stabilisent. Une série de procédures et de meilleures pratiques concernant le remplacement complet ou partiel des entrées de service en plomb (notamment en ce qui concerne les outils à utiliser, les purges à réaliser, les renseignements à fournir aux clients et les vérifications à entreprendre) se trouvent dans la norme C-810-17 de l'AWWA (AWWA, 2017b).
La remise au consommateur d'un filtre certifié pour l'enlèvement du plomb au point d'utilisation et d'instructions sur l'utilisation du filtre pour une période de trois à six mois après le remplacement d'une entrée de service en plomb est une autre option, avec un échantillonnage à la fin de la période prescrite pour confirmer la réduction des concentrations de plomb à la suite du remplacement. Cet échantillonnage aidera par ailleurs à déterminer si le plomb mesuré au robinet provient de la plomberie du bâtiment. L'utilisation de filtres pour l'eau potable certifiés est une option temporaire efficace pour réduire l'exposition au plomb après l'enlèvement d'une entrée de service en plomb (Santé Canada, 2019a). Les filtres doivent être remplacés régulièrement et faire l'objet d'un entretien continu. Les consommateurs doivent être informés de l'importance de procéder à un nettoyage régulier des aérateurs de sorties d'eau pour s'assurer que les particules de plomb sont enlevées dans le cadre de l'entretien continu (Santé Canada, 2019a; 2023a). Des conseils ont été publiées sur le nettoyage des aérateurs et le choix d'un filtre approprié pour l'enlèvement du plomb (Santé Canada, 2023a,b).
B.4.1.2 Mesures d'intervention visant la corrosion galvanique
Un remplacement partiel peut également provoquer une corrosion galvanique à l'endroit où la nouvelle tuyauterie en cuivre est rattachée à la tuyauterie en plomb. Lors du raccordement de deux métaux dissemblables, raccord diélectrique devrait être utilisé pour éviter la corrosion galvanique (Wang et coll., 2012; Clark et coll., 2014; AWWA, 2017b). De la même manière, on suppose que le branchement d'une conduite en PVC à l'entrée de service en plomb lors d'un remplacement partiel empêcherait également la corrosion galvanique. La consignation de tous les travaux de remplacement des entrées de service en plomb est une étape importante permettant aux responsables de systèmes de traitement d'avoir des dossiers complets sur les programmes de remplacement des entrées de service en plomb et sur l'évolution des travaux (AWWA, 2017b).
B.4.1.3 Mesures d'intervention visant la corrosion du cuivre
Étant donné la variation des conditions relatives à la qualité de l'eau, microbiologiques et à l'écoulement qui peuvent causer une corrosion par piqûres, les responsables de systèmes de distribution d'eau potable devraient envisager l'utilisation d'outils comme ceux figurant dans l'étude de Sarver et coll. (2011). Ces outils aident les responsables de systèmes de distribution d'eau potable à adopter d'importants changements de qualité de l'eau, notamment le retrait de la MON, des phosphates et du silicate, de même que le traitement des eaux contenant du chlorure ou présentant un pH élevé ou une faible alcalinité, afin d'éviter ou d'atténuer la corrosion du cuivre par piqûres. Un montage de tuyaux en boucle à faible coût décrit par Lytle et coll. (2012) pourrait servir d'instrument d'évaluation aux responsables de systèmes de distribution d'eau potable. Une eau à forte alcalinité et à faible concentration de chlorure est associée à une diminution de la dézincification (Sarver et coll., 2011). Lytle et Schock (1996) ont découvert que l'orthophosphate ne présentait pas d'avantages clairs à un pH de 7 et de 8,5, mais ils ont suggéré que l'orthophosphate pourrait être plus efficace pour prévenir le relargage du cuivre provenant du laiton. De l'information relative au cuivre, notamment au sujet des mesures de surveillance et d'atténuation, se trouve dans les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Le cuivre (Santé Canada, 2019b).
B.4.1.4 Utilisation de produits certifiés
Santé Canada recommande aux consommateurs et aux responsables de systèmes de distribution d'eau potable d'utiliser des produits certifiés conformes aux normes applicables de NSF et de l'ANSI en matière de santé et de teneur en plomb (NSF International, 2022a,b) (voir la section B.1.2.1). Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec l'eau.
B.4.1.5 Stratégie d'intervention pour les réseaux de distribution
Des épisodes d'eau colorée (par exemple eau rouge, grise, noire ou bleue) seront probablement accompagnés par le relargage de contaminants accumulés, notamment de plomb, parce que le plomb dissous est adsorbé sur les dépôts de fer dans les entrées de service en plomb. Par conséquent, des épisodes d'eau colorée devraient déclencher des mesures d'entretien du réseau de distribution, comme le rinçage unidirectionnel systématique du réseau de distribution, pour s'assurer que toutes les particules sont éliminées avant que l'eau ne parvienne au consommateur (Vreeburg, 2010; Friedman et coll., 2016). Friedman et coll. (2010) ont recensé plusieurs conditions essentielles de la qualité de l'eau qui devraient être contrôlées afin de maintenir la stabilité de l'eau et ne pas remobiliser les dépôts de matières inorganiques, notamment le pH, le POR et les mesures de contrôle de la corrosion, ainsi que d'éviter à la fois le mélange non contrôlé des eaux de surface avec les eaux souterraines et de l'eau chlorée avec de l'eau chloraminée. Les responsables de systèmes de distribution d'eau potable peuvent déterminer les paramètres de base d'une eau de qualité de façon à fixer des limites à l'extérieur desquelles il y aurait un événement de relargage (Friedman et coll., 2016). Par ailleurs, des stratégies visant à réduire au minimum les perturbations physiques et hydrauliques devraient être élaborées.
Les autres mesures qui contribuent à maintenir des conditions stables dans le réseau de distribution comprennent le nettoyage des conduites (par exemple, rinçage unidirectionnel, ramonage des conduites), le remplacement des conduites et le traitement approprié pour minimiser la charge des puits de contaminants (par exemple fer, manganèse) dont peut découler une co-accumulation de contaminants inorganiques tels que l'arsenic et le plomb (Friedman et coll., 2010; Cantor, 2017; Hill et Lemieux, 2022a,b). Le nettoyage des conduites principales peut aussi atténuer d'autres répercussions des dépôts antérieurs sur la qualité de l'eau et sur les infrastructures. D'autres sources décrivent les meilleures pratiques d'intervention dans les réseaux de distribution, notamment la purge et le nettoyage (AWWA, 2017a,b).
Dans les réseaux utilisant des orthophosphates pour contrôler la corrosion, on devrait appliquer l'inhibiteur à tous les points d'entrée du réseau, et une concentration résiduelle devrait être maintenue dans tout le réseau de distribution pour favoriser la stabilité des incrustations contenant des phosphates (Friedman et coll. 2010).
La biostabilité du réseau de distribution est une autre condition importante à surveiller pour minimiser l'accumulation et le relargage de contaminants, en particulier ceux qui découlent de l'activité microbienne. Il est possible de maintenir la biostabilité en réduisant au minimum la présence d'éléments nutritifs dans l'eau (par exemple carbone organique, ammoniac, nitrate/nitrite, phosphore total), en surveillant la durée de séjour de l'eau dans le réseau et en maintenant une concentration suffisante de désinfectant résiduel (Cantor, 2017; Santé Canada, 2022).
B.4.1.6 Atténuation des répercussions découlant des traitements
Certaines techniques de traitement peuvent augmenter les concentrations de plomb dans l'eau potable en changeant les caractéristiques de l'eau qui affectent le relargage de plomb. Dans le processus d'échange d'anions utilisé pour l'enlèvement de contaminants comme l'uranium, la résine échangeuse d'ions récemment régénérée enlève les ions bicarbonate, ce qui diminue le pH et l'alcalinité totale pendant les 100 premiers volumes de lit (VL) d'un cycle. Il peut être nécessaire d'augmenter le pH de l'eau traitée au début d'un cycle (100 à 400 VL) afin d'éviter la corrosion (Clifford, 1999; Wang et coll., 2010; Clifford et coll., 2011). Similairement, la régénération fréquente d'une résine échangeuse d'ions peut aussi avoir un impact sur la corrosion. Dans une étude de cas réalisée dans l'État du Maine, une régénération fréquente de la résine échangeuse d'ions a été mise en place afin de diminuer les concentrations d'uranium dans les eaux résiduaires. Cela a entraîné une diminution importante et continue du pH suivie d'une libération de cuivre et de plomb dans l'eau potable (Lowry, 2009, 2010).
Puisque l'osmose inverse enlève continuellement et complètement l'alcalinité de l'eau, elle entraînera sans cesse une diminution du pH de l'eau traitée et augmentera sa corrosivité. Par conséquent, le pH de l'eau produite doit être ajusté pour éviter les problèmes de corrosion, comme la libération de plomb et de cuivre, dans le réseau de distribution (Schock et Lytle, 2011; U.S. EPA, 2023).
Il a été aussi démontré que la corrosion galvanique des soudures résultant d'un changement de désinfectant ou de coagulant est un facteur important qui entraîne des concentrations élevées de plomb (Edwards et Dudi, 2004; Edwards et Triantafyllidou, 2007; Nguyen et coll., 2010). Des modifications du RMCS résultant d'un changement de coagulant ont mené au relargage de plomb issu du laiton en raison de la corrosion galvanique (Edwards et Triantafyllidou, 2007; Nguyen et coll., 2010; Triantafyllidou et Edwards, 2010; Cartier et coll., 2012a, 2013). Des informations supplémentaires sur les répercussions des changements relatifs au traitement peuvent être trouvées ailleurs (U.S. EPA, 2016; Santé Canada, 2019a).
B.4.2 Ajustement du pH et de l'alcalinité
L'ajustement du pH à l'usine de traitement de l'eau est la méthode la plus communément employée pour réduire la corrosion et le relargage des contaminants dans les réseaux de distribution d'eau potable. L'augmentation du pH demeure l'une des méthodes les plus efficaces pour réduire la corrosion du plomb et du cuivre et limiter les concentrations de plomb, de cuivre et de fer dans l'eau potable. L'expérience a montré que le pH optimal pour le contrôle du plomb et du cuivre se situe entre 7,0 et 9,5. Les valeurs les plus élevées de cette plage seraient également bénéfiques pour réduire les concentrations de fer, mais elles pourraient également favoriser la corrosion de ce métal et la formation de tubercules. Même si on a eu tendance par le passé à recommander d'augmenter l'alcalinité de l'eau pour contrôler la corrosion, il n'est pas certain que cette méthode soit la meilleure pour réduire les concentrations de plomb et de cuivre dans l'eau potable. La documentation scientifique indique que l'alcalinité optimale pour limiter le relargage du plomb et du cuivre se situe entre 30 et 75 mg/L de CaCO3. Une alcalinité plus élevée (> 60 mg/L de CaCO3) est également préférable pour réduire la corrosion et le relargage du fer et limiter les problèmes d'eau rouge. De plus, l'alcalinité sert à réguler l'intensité du pouvoir tampon de la plupart des réseaux de distribution d'eau. Il est donc nécessaire de maintenir une alcalinité suffisante pour assurer la stabilité du pH dans l'ensemble du réseau de distribution afin de contrôler la corrosion du plomb, du cuivre et du fer et stabiliser les revêtements et tuyaux à base de ciment.
B.4.3 Inhibiteurs de corrosion
Les composés à base de phosphate ou de silicate sont généralement utilisés comme inhibiteurs de corrosion dans le traitement de l'eau potable. Les composés les plus communément utilisés sont des orthophosphates, des polyphosphates (généralement, des polyphosphates mélangés) et le silicate de sodium, tous disponibles avec ou sans zinc. Toutefois, des études ont montré que les polyphosphates et les composés à base de silicate ne sont pas des inhibiteurs efficaces du plomb.
L'utilisation réussie des inhibiteurs de corrosion est un processus par essais successifs et dépend à la fois de la qualité de l'eau et des conditions qui caractérisent le réseau de distribution. L'efficacité des inhibiteurs de corrosion dépend aussi largement du maintien d'une concentration résiduelle de ces produits à travers le réseau de distribution, ainsi que du pH et de l'alcalinité de l'eau.
La mesure de la concentration d'inhibiteurs présents dans le réseau de distribution fait partie des bonnes pratiques de contrôle de la corrosion. D'une manière générale, il est impossible d'établir une corrélation directe entre la concentration d'inhibiteur résiduel présente dans le réseau de distribution et les concentrations de plomb, de cuivre ou de fer dans l'eau du robinet.
Santé Canada recommande aux responsables de systèmes de distribution d'eau potable et aux consommateurs d'utiliser des additifs, tels que les inhibiteurs de corrosion, certifiés comme étant conformes à la norme de santé NSF/ANSI appropriée ou à une norme équivalente. Les inhibiteurs de corrosion à base de phosphate et de silicate sont inclus dans la norme NSF/ANSI/CAN 60 intitulée Produits chimiques de traitement de l'eau potable – Effets sur la santé (NSF International, 2021c). Ces normes ont été conçues pour préserver la qualité de l'eau potable en assurant que les additifs respectent les exigences minimales quant à leurs effets sur la santé et leur innocuité dans l'eau potable.
Le chlorure stanneux a été utilisé comme inhibiteur de corrosion, mais il existe très peu de données expérimentales sur cet inhibiteur. Sous certaines conditions, cet inhibiteur réagit avec le métal à la surface du tuyau ou avec les sous-produits de la corrosion déjà présents pour former un dépôt moins soluble sur la paroi interne des tuyaux. Puisque les dépôts sont moins solubles, la concentration des métaux dans l'eau du robinet est diminuée. Le chlorure stanneux peut stabiliser le pH dans le réseau de distribution en inhibant la croissance du biofilm, ce qui contribue à réduire les concentrations de plomb. Plusieurs études ont été menées sur le chlorure stanneux, mais elles n'ont pas réussi à démontrer que l'utilisation de cette substance était un traitement viable de contrôle de la corrosion dans les conditions étudiées. Le chlorure stanneux ne s'est pas révélé efficace pour contrôler la corrosion du cuivre dans un système d'eau souterraine où les concentrations de CID et la dureté de l'eau étaient élevées (AWWA, 2017a).
B.4.3.1 Inhibiteurs à base de phosphate
Orthophosphates
L'orthophosphate et l'orthophosphate de zinc sont les inhibiteurs dont on signale le plus souvent l'efficacité dans la documentation scientifique pour la réduction des concentrations de plomb et de cuivre dans l'eau potable (Santé Canada, 2019a,b; Cantor et coll., 2017).
Des essais sur le terrain et en laboratoire ont montré que les orthophosphates réduisent considérablement la solubilité du plomb par la formation de Pb(II). L'orthophosphate réagit avec le métal du tuyau lui-même (notamment avec le plomb, le fer et l'acier galvanisé) dans des plages de pH et de doses restreintes. L'efficacité de l'orthophosphate dépend d'un contrôle adéquat du pH et de la concentration de CID, de l'ajout d'une quantité suffisante d'orthophosphate, et de la présence de concentrations résiduelles d'orthophosphate suffisamment élevées dans le réseau de distribution et la plomberie du bâtiment. En raison de la solubilité, des doses beaucoup plus élevées d'orthophosphate sont nécessaires dans les eaux à forte teneur en carbonate (Schock et Lytle, 2011).
Au Royaume-Uni, les doses d'orthophosphate qui se sont avérées très efficaces pour contrôler la solubilité du plomb sont généralement de 2 à 4 fois supérieures aux doses couramment utilisées aux États-Unis (Hayes et coll., 2008; Cardew, 2009). Cardew (2009) a fait état du succès à long terme de l'utilisation de doses élevées d'orthophosphate pour atténuer à la fois la libération de plomb particulaire et la solubilité du plomb dans les eaux difficiles.
Dans les réseaux de distribution dont l'eau présente de faibles concentrations de CID, il s'est avéré difficile de bien contrôler le relargage de plomb en utilisant du phosphate à un pH supérieur à 8. Ce phénomène a également été observé dans des expériences en laboratoire menées avec de l'eau présentant de faibles concentrations de CID et environ 1 mg PO4/L d'orthophosphate (Schock, 1989; Schock et coll., 1996, 2008b). Le taux de formation des couches de passivation d'orthophosphate de plomb semble être plus lent que le taux de formation des couches de carbonate ou d'hydroxycarbonate. Il faut prévoir un temps considérable pour que les réactions aient lieu. Selon certaines études, plusieurs mois voire plusieurs années sont nécessaires pour ramener le taux de relargage de plomb à des concentrations essentiellement constantes (Lyons et coll., 1995; Cook, 1997). Le taux et le degré de réduction semblent être proportionnels à la dose d'orthophosphate utilisée.
Les modèles de solubilité du plomb et du cuivre indiquent que le pH optimal pour la formation d'une couche d'orthophosphate se situe entre 6,5 et 7,5 sur les surfaces de cuivre (Schock et coll., 1995) et entre 7 et 8 sur les surfaces de plomb (Schock, 1989). Une étude portant sur 365 systèmes d'approvisionnement en eau potable visés par la LCR de l'U.S. EPA a également révélé que les systèmes utilisant l'orthophosphate avaient des concentrations de cuivre significativement réduites seulement lorsque le pH était inférieur à 7,8, et des concentrations réduites de plomb seulement lorsque le pH était inférieur à 7,4 et que l'alcalinité était inférieure à 74 mg/L de CaCO3 (Dodrill et Edwards, 1995). Il a été signalé que l'orthophosphate peut toujours réduire le plomb dans la plage de pH de 7,0 à 8,0 (AWWA, 2017a).
Schock et Fox (2001) ont obtenu une réduction concluante de la corrosion du cuivre dans de l'eau très alcaline en utilisant de l'orthophosphate dans des conditions où les ajustements du pH et de l'alcalinité ne donnaient pas de bons résultats. Les teneurs résiduelles typiques d'orthophosphate varient entre 0,5 et 3,0 mg/L (équivalent d'acide phosphorique) (Vik et coll., 1996).
Plusieurs auteurs ont signalé que l'orthophosphate réduisait les concentrations de fer (Benjamin et coll., 1996; Lytle et Snoeyink, 2002; Sarin et coll., 2003), les taux de corrosion du fer (Benjamin et coll., 1996; Cordonnier, 1997) et la fréquence des épisodes d'eau rouge (Shull, 1980; Cordonnier, 1997). Reiber (2006) a constaté que l'orthophosphate était efficace pour durcir les incrustations de fer existantes à un pH de 7,4 à 7,8, réduisant ainsi la fréquence des épisodes d'eau rouge. Lytle et coll. (2003) ont observé que le fer total libéré demeurait faible après l'arrêt de l'ajout d'orthophosphate, en raison de la formation de solides fer-phosphore dans les incrustations, ce qui réduisait la solubilité du fer ferreux et/ou diminuait la perméabilité des incrustations.
Les inhibiteurs à base de phosphate, en particulier les orthophosphates, peuvent également réduire les populations de bactéries hétérotrophes évaluées par numération sur plaque ainsi que le nombre de coliformes dans les réseaux de distribution en fonte en contrôlant la corrosion. Dans le cadre d'une étude de 18 mois réalisée sur 31 réseaux de distribution d'eau en Amérique du Nord, les réseaux de distribution utilisant des inhibiteurs à base de phosphate contenaient moins de coliformes que ceux qui n'utilisaient aucune méthode de contrôle de la corrosion (LeChevallier et coll., 1996). De même, l'ajout d'orthophosphate à raison de 1 mg PO4/L dans un réacteur de fonte très corrodé a immédiatement réduit la libération d'oxyde de fer et le nombre de bactéries présentes dans l'eau (Appenzeller et coll., 2001).
Les formulations d'orthophosphate contenant du zinc peuvent diminuer le taux de dézincification du laiton et provoquer le dépôt d'une couche protectrice de zinc (probablement du silicate de zinc ou du carbonate de zinc basique) à la surface des tuyaux en ciment ou en A/C, dans des conditions chimiques appropriées. Les travaux de recherche ont généralement montré que le zinc n'est pas nécessaire dans la formulation utilisée pour contrôler la corrosion dans les tuyaux en plomb (Schock et Lytle, 2011).
Polyphosphates et mélanges de phosphates
Le recours à des polyphosphates pour le contrôle du plomb n'est généralement pas recommandé. Même si les polyphosphates peuvent être considérés comme des inhibiteurs de corrosion, ils servent principalement à la séquestration et à l'atténuation des épisodes d'eau colorée liés à la présence de manganèse et de fer dans la source d'eau. La séquestration peut réduire efficacement la coloration de l'eau due à la présence de métaux, elle ne les élimine pas. Ainsi, l'on serait exposé aux métaux séquestrés si l'on consommait l'eau.
Même si certaines études ont indiqué leur utilité (Boffardi, 1988, 1990, 1993; Lee et coll., 1989; Hulsmann, 1990; Boffardi et Sherbondy, 1991), les polyphosphates se sont révélés inefficaces pour réduire les concentrations de plomb et pouvaient même, dans certains cas, aggraver le problème de plomb (Holm et coll., 1989; Schock, 1989; Holm et Schock, 1991; Maas et coll., 1991; Boireau et coll., 1997; Cantor et coll., 2000; Edwards et McNeill, 2002). McNeill et Edwards (2002) ont montré que les polyphosphates pouvaient conduire à une augmentation significative de la concentration de plomb dans des tuyaux âgés de trois ans après des périodes de stagnation de 8 heures et de 72 heures. Des augmentations des concentrations de plomb atteignant jusqu'à 591 % ont été constatées comparativement aux concentrations mesurées dans les mêmes conditions sans inhibiteur.
L'ajout d'orthophosphate au moyen de mélanges de phosphates est compliqué par la formulation chimique particulière (exclusive) du produit et par la capacité du composant polyphosphate à former des complexes ou à séquestrer des substances. Bien que la plupart des études montrent un certain avantage à ce que le rapport orthophosphate/polyphosphate soit élevé, il n'y a pas toujours un avantage si le composant polyphosphate est un agent complexant fort et stable contre une réversion. Les caractéristiques chimiques générales de l'eau, notamment les concentrations de fer, de calcium et de magnésium, jouent également un rôle important dans l'efficacité des mélanges de phosphates.
Cantor et coll. (2000) indiquent que l'utilisation de polyphosphates augmentait la concentration de cuivre dans l'eau du robinet. Dans une étude réalisée sur banc d'essai de tuyaux de cuivre, Edwards et coll.(2002) ont démontré que, bien que les polyphosphates réduisent généralement les concentrations de cuivre soluble, les concentrations de cuivre ont augmenté de façon significative à un pH de 7,2 et à une alcalinité de 300 mg/L de CaCO3, car les polyphosphates nuisent à la formation d'incrustations de malachite, plus stables.
Les polyphosphates ont été fréquemment utilisés pour contrer la formation de tubercules et restaurer l'efficacité hydraulique des conduites principales. Les polyphosphates peuvent parfois modifier le type de corrosion. passant d'une corrosion par piqûres ou par cellules de concentration à un type de corrosion plus uniforme, ce qui réduit les fuites et les plaintes liées à l'esthétique. Les parois des tuyaux sont généralement suffisamment épaisses pour que l'augmentation du taux de dissolution ne soit pas significative sur le plan pratique (Schock and Lytle, 2011). Plusieurs auteurs ont indiqué que l'utilisation de polyphosphates pouvait prévenir la corrosion du fer et contrôler les concentrations de fer dans l'eau (McCauley, 1960; Williams, 1990; Facey et Smith, 1995; Cordonnier, 1997; Maddison et Gagnon, 1999). Toutefois, le polyphosphate n'agit pas comme un inhibiteur de corrosion, mais plutôt comme un agent qui séquestre le fer et entraîne une diminution de l'observation visuelle de l'eau rouge (Lytle et Snoeyink, 2002). Selon McNeill et Edwards (2001), un tel effet a conduit de nombreux chercheurs à conclure à une réduction des sous-produits du fer alors qu'en fait, les concentrations de fer et les taux de corrosion du fer pourraient avoir augmenté.
Certains systèmes contenant naturellement du fer dans leur source d'eau appliquent des polyphosphates pour séquestrer le fer avant la chloration. Cependant, l'efficacité de l'agent séquestrant diminue avec le temps. Ces réactions libèrent des ions de fer dans l'eau, où ils s'oxydent, précipitent et s'accumulent dans le réseau de distribution; ils peuvent ainsi être libérés à nouveau. Étant donné la propension des métaux comme le plomb et le manganèse à s'adsorber sur le fer, la consommation de l'eau entraînera une exposition à ces métaux et à d'autres métaux préoccupants pour la santé (Friedman et coll., 2010).
B.4.3.2 Composés à base de silicate
Comme indiqué précédemment, les composés à base de silicate ont généralement été utilisés comme inhibiteurs. Cependant, le silicate de sodium est un composé basique, et il est toujours associée à une augmentation du pH. Il a été démontré que le pH est le principal mécanisme de réduction des concentrations de plomb (Li et coll., 2021a,b). Or, il a aussi été établi que les silicates entraînaient une hausse des concentrations de plomb en dispersant le plomb colloïdal (Li et coll., 2021a,b; 2022).
Selon une revue de la littérature effectuée par Li et coll. (2021c), l'utilisation de silicate engendre un relargage accru de plomb (de 0,5 à 21,5 fois plus élevé) que dans un réseau équivalent exposé au même pH, sans silicate de sodium. D'autres conclusions comprenaient la tendance à la formation de colloïdes dans les réseaux traités au silicate, ce qui accroît la mobilité du plomb. Le traitement au silicate s'est dans l'ensemble révélé inférieur au traitement à l'orthophosphate pour réduire les concentrations de plomb : le silicate de sodium entraînant le relargage de plomb de 1,0 à 65 fois plus important que le relargage observé dans un réseau équivalent traité à l'orthophosphate. L'effet positif du silicate de sodium sur le pH semble être le principal facteur limitant le relargage de plomb. Gao et coll. (2022) ont étudié des coupons de plomb corrodés en présence ou non de chlore et ont comparé les effets de l'ajout d'orthophosphate et de silicate sur ces échantillons. Les auteurs n'ont pas détecté de silicate de plomb dans les incrustations. Les résultats montrent que l'orthophosphate a procuré un meilleur contrôle de la corrosion que le silicate, lequel a favorisé la dégradation de la couche d'incrustations de plomb.
Une étude de Schock et coll. (2005a) dans un système de traitement de taille moyenne portait sur un problème de fer dans la source d'approvisionnement en eau et sur un problème de relargage de plomb et de cuivre dans le système de plomberie de quatre puits. Les problèmes ont été résolus simultanément par l'ajout de silicate de sodium au lieu du polyphosphate et par une hausse du pH dans les trois puits qui présentaient des concentrations élevées de fer et de manganèse et qui approvisionnaient des habitations équipées d'entrées de service en plomb. Dans ces trois puits, une dose initiale de silicate de 25 à 30 mg/L a causé l'augmentation du pH, qui est passé de 6,3 à 7,5, et a entraîné une réduction immédiate de 55 % et de 87 % des concentrations de plomb et de cuivre, respectivement. L'augmentation de la dose de silicate à 45-55 mg/L a fait monter le pH à 7,5 et a entraîné une nouvelle réduction des concentrations de plomb et de cuivre (qui ont atteint 0,002 mg/L et 0,27 mg/L, respectivement). La qualité de l'eau traitée sur le plan de la couleur et de la teneur en fer était égale ou supérieure à celle mesurée avant le traitement. Un quatrième puits n'avait besoin que d'une chloration et d'un ajustement du pH à l'aide d'hydroxyde de sodium. Selon la littérature scientifique, l'utilisation du silicate de sodium ne réduit pas à elle seule de manière concluante les concentrations de plomb et de cuivre.
Lintereur et coll. (2011) ont comparé trois doses de silicate de sodium (3 mg/L, 6 mg/L et 12 mg/L) et ont constaté que le silicate de sodium entraînait une réduction de la libération de cuivre par rapport aux témoins (aucun traitement et augmentation du pH). La réduction semblait dépendre de la dose : les libérations de cuivre les plus faibles ont été observées avec les doses de silicate de sodium les plus élevées. L'analyse des incrustations a révélé la présence d'incrustations de silicate-cuivre, ce qui indique que des incrustations de silicate peuvent être en partie responsables de l'action inhibitrice. Woszczynski et coll. (2015) ont constaté que les silicates de sodium (18 mg Si/L, pH 7,3 et pH 6,3) ne permettaient pas de contrôler les concentrations de cuivre, comparativement au phosphate (0,8 mg PO4/L, pH 7,3). Les auteurs ont constaté que le pH avait une incidence sur l'efficacité des silicates et que les conditions de qualité de l'eau pouvaient également avoir une incidence.
Entre 1920 et 1960, plusieurs auteurs ont indiqué que l'utilisation de silicate de sodium permettait de réduire les épisodes de coloration rouge de l'eau (Tresh, 1922; Texter, 1923; Stericker, 1938, 1945; Loschiavo, 1948; Lehrman et Shuldener, 1951; Shuldener et Sussman, 1960). Toutefois, selon une étude réalisée sur le terrain dans un réseau de distribution canadien, l'utilisation de silicate de sodium (4 à 8 mg/L; pH de 7,5 à 8,8) pour réduire les concentrations de fer dans de vieux tuyaux de fonte ou de fonte ductile n'a eu aucun effet bénéfique. Une inspection visuelle a été faite au moyen d'une caméra insérée dans un tuyau de fonte immédiatement après l'élimination mécanique des tubercules et avant l'injection de silicate de sodium. Après 5 mois de traitement au silicate de sodium, il a été établi que ces faibles concentrations ne permettaient pas de réduire la présence de tubercules ni d'en prévenir la formation (Bénard, 1998). Très peu d'études ont prouvé l'efficacité du silicate de sodium dans l'inhibition de la corrosion ou ont réussi à en élucider le véritable mode d'action. Li et coll. (2019) ont réalisé une expérience à l'échelle de banc d'essai pour évaluer l'effet du silicate de sodium sur la couleur et la turbidité selon le pH.
Les expériences qui ont porté sur les effets de concentrations élevées de silice à différentes valeurs de pH ont révélé qu'à un pH de 8, cette substance pouvait jouer un rôle dans le processus de stabilisation de la matrice de ciment des tuyaux, en intervenant dans la formation de couches protectrices de fer ferrique qui ralentissent le relargage du calcium (Holtschulte et Schock, 1985). Li et coll. (2021) ont constaté qu'en comparaison avec des orthophosphates (avec zinc et sans zinc) à une concentration de 0,3 mg/L de phosphate, l'utilisation de 20 mg/L de silicate de sodium ne permettait pas de contrôler la corrosion du plomb dans des entrées de service partiellement ou entièrement en plomb, dans une eau de faible alcalinité à un pH constant de 7,4. Une dose de 48 mg/L de silicate de sodium s'est avérée disperser les incrustations de corrosion dans les sections en fonte des tuyaux et dans les entrées de service en plomb, ce qui a considérablement accru le relargage de plomb et de fer. Les auteurs ont conclu que l'inhibition de la corrosion due à des interactions directes entre le plomb et le silicate était peu probable. Aghasadeghi et coll. (2021) ont comparé les silicates de sodium, les orthophosphates et l'ajustement du pH dans des conditions de pH identiques avec une eau dont l'alcalinité était de 79 mg/L de CaCO3. Les auteurs ont constaté que le traitement à raison de 20 mg/L de silicate de sodium était moins efficace pour réduire le relargage de plomb que l'ajustement du pH (à 7,9), et que l'augmentation de la dose de silicate à 25 mg/L provoquait en fait un relargage accru de plomb et une déstabilisation des incrustations de corrosion. Les auteurs ont conclu que les silicates n'offraient aucun avantage autre que l'augmentation du pH pour réduire le relargage de plomb à partir des ESP.
B.4.4 Purge et entretien
Comme les concentrations des métaux-traces augmentent avec la stagnation de l'eau, la purge de la plomberie peut réduire de façon importante les concentrations de plomb et de cuivre dans l'eau potable. Cette pratique peut être assimilée à une mesure de contrôle de l'exposition, bien qu'il s'agisse d'une mesure temporaire. Gardels et Sorg (1989) ont démontré que de 60 % à 75 % du plomb relargué des robinets de cuisine se trouvaient dans les 125 premiers millilitres recueillis au robinet. Ils ont en outre conclu qu'en laissant couler de 200 à 250 mL d'eau, on évacuait 95 % ou plus du plomb relargué dans l'eau (en supposant l'absence d'autres sources de plomb en amont du robinet). Dans des études canadiennes au cours desquelles les robinets d'eau froide de résidences étaient purgés pendant 5 minutes, aucune des concentrations mesurées des métaux-traces ne dépassait les recommandations correspondantes pour la qualité de l'eau potable alors en vigueur (Méranger et coll., 1981; Singh et Mavinic, 1991). Toutefois, la purge des robinets d'eau froide dans les immeubles, en particulier dans les grands bâtiments ou établissements, risque de ne pas suffire pour abaisser les teneurs de l'eau en plomb et en cuivre sous les seuils prescrits (Singh et Mavinic, 1991; Murphy, 1993; Deshommes et coll., 2012; McIlwain et coll., 2016; Miller-Schulze et coll., 2019).
Murphy (1993) a démontré que la concentration médiane de plomb contenue dans des échantillons prélevés aux fontaines et aux robinets d'eau potable dans des écoles avait augmenté sensiblement à l'heure du dîner après une purge de 10 minutes le matin. Les auteurs en ont conclu à la nécessité de procéder à des purges périodiques durant la journée afin de réduire les concentrations de plomb. Les purges sont considérées comme une approche qui permet de réduire les concentrations de plomb à court terme (Deshommes et coll., 2012; McIlwain et coll., 2016; Doré et coll., 2018; Katner et coll., 2018; Miller-Schulze et coll., 2019). Doré et coll. (2018) ont observé qu'une purge partielle (30 secondes) et une purge complète (5 minutes) permettaient de réduire les concentrations de plomb de 88 % et de 92 %, respectivement. Cependant, après seulement 30 minutes de stagnation, les concentrations médianes de plomb avaient augmenté et représentaient plus de 45 % des concentrations observées après une stagnation prolongée (> 8 heures). Les auteurs ont recommandé de purger les robinets en laissant couler les 250 premiers millilitres d'eau stagnante avant la consommation, même après une courte période de stagnation. D'après les auteurs, il faudrait de 2 à 20 secondes pour purger ce volume d'eau avec la plupart des fontaines.
Lorsque le plomb relargué dans l'eau provient des entrées de service en plomb, il ne suffit pas de laisser couler l'eau jusqu'à ce qu'elle devienne froide, puisque c'est généralement à ce point que l'eau qui reposait dans l'entrée de service atteint le robinet. L'échantillonnage séquentiel de plusieurs litres peut aider à déterminer si la purge suffira à elle seule à réduire les concentrations de plomb, ainsi que la durée de purge requise. À Washington (DC), les concentrations de plomb atteignaient parfois leur maximum dans des échantillons prélevés après une purge d'une minute. En effet, des concentrations de plomb aussi élevées que 48 mg/L ont été observées après une purge. Dans certains cas, les concentrations de plomb étaient encore élevées après 10 minutes de purge (Edwards et Dudi, 2004).
Le remplacement (complet ou partiel) des entrées de service en plomb et les travaux de construction (Sandvig et coll., 2008; Cartier et coll., 2013; Del Toral et coll., 2013) peuvent perturber ou déloger les incrustations de plomb existantes ou des sédiments contenant du plomb, ce qui entraîne une augmentation importante des concentrations de plomb au robinet. Il faudrait encourager le consommateur à effectuer une purge initiale complète, et les responsables de systèmes de distribution d'eau potable devraient suivre les meilleures pratiques en matière de purge (AWWA, 2017b). Dans certains cas, la purge peut s'avérer insuffisante pour réduire les concentrations de plomb dans l'eau du robinet. Par conséquent, les responsables de systèmes de distribution d'eau potable devraient procéder à une surveillance appropriée pour s'assurer que la purge constitue une mesure adéquate avant de la recommander aux consommateurs. Les responsables de systèmes de distribution d'eau potable devraient également veiller à ce que des purges adéquates soient effectuées et communiquer les limites pratiques de ces purges (Katner et coll., 2018).
Des activités d'entretien, comme un nettoyage régulier des aérateurs ou des grilles des robinets pour en déloger les débris, peuvent également jouer un rôle important dans la réduction des concentrations de plomb dans l'eau du robinet. Parmi les débris des aérateurs ou des grilles, on trouve parfois des particules de plomb, qui peuvent être abrasées et franchir les grilles pendant les périodes de consommation d'eau. Ceci peut entraîner une augmentation notable, de façon variable et sporadique, du plomb particulaire dans l'eau du robinet. Il est important de veiller à ce que l'échantillonnage soit réalisé avec l'aérateur ou la grille en place afin de détecter toute contribution possible du plomb particulaire. Les meilleures pratiques prévoient aussi que l'on procède régulièrement à la purge des réseaux de distribution de grande envergure, et notamment des culs-de-sac, pour évacuer les sous-produits de la corrosion qui se détachent des parois et les microorganismes qu'ils pourraient contenir.
B.4.5 Filtres pour le traitement de l'eau potable
Il est possible de réduire provisoirement l'exposition au plomb en utilisant des dispositifs de traitement de l'eau potable. Il importe cependant de signaler que, dans les situations où le remplacement d'entrées de service peut entraîner des concentrations élevées de plomb, la capacité des dispositifs de traitement est susceptible de diminuer, et il faut parfois remplacer ces dispositifs plus fréquemment. Comme l'exposition au plomb par l'eau potable ne devient inquiétante qu'en cas d'ingestion du contaminant, on juge que l'installation aux robinets de dispositifs de traitement certifiés pour l'enlèvement du plomb, selon la norme NSF/ANSI 53 (NSF International, 2022c), constitue le meilleur moyen de réduire les concentrations à des niveaux sûrs immédiatement avant la consommation. Des études ont démontré que l'installation de dispositifs de filtration au point d'utilisation peut constituer une mesure provisoire efficace pour réduire l'exposition au plomb soluble et au plomb particulaire (Deshommes et coll., 2010b, 2012; Bosscher et coll., 2019; CDM Smith, 2019; Pan et coll., 2020; Purchase et coll., 2020; Doré et coll., 2021). Deshommes et coll. (2012) ont montré que l'installation de dispositifs de filtration au point d'utilisation dans un complexe pénitentiaire fédéral a considérablement diminué les concentrations de plomb dissous et de plomb particulaire, même lorsque la fraction particulaire était deux fois plus importante que la fraction soluble. Certains dispositifs de filtration au point d'utilisation enlevaient le plomb pendant une période pouvant aller jusqu'à 6 mois sans qu'il soit nécessaire de remplacer la matière filtrante (Mulhern et Macdonald Gibson, 2020).
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l'eau potable, mais conseille vivement aux consommateurs de n'acheter que des dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de NSF International (NSF) et de l'American National Standards Institute (ANSI). Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification accrédités par le Conseil canadien des normes testent les dispositifs de traitement destinés à réduire les concentrations de plomb (et d'autres contaminants) et certifient qu'ils sont conformes aux normes NSF/ANSI pertinentes. Au Canada, le Conseil canadien des normes (www.scc.ca/fr) a accrédité les organismes suivants, qu'il autorise ainsi à homologuer les dispositifs de traitement de l'eau potable qui satisfont aux normes NSF/ANSI susmentionnées :
- CSA International (www.csa-international.org)
- NSF International (www.nsf.org) (en anglais seulement)
- Water Quality Association (www.wqa.org) (en anglais seulement)
- Underwriters Laboratories Inc. (canada.ul.com/fr/)
- Quality Auditing Institute (qai.org/fr/accueil/)
- International Association of Plumbing and Mechanical Officials (www.iapmo.org) (en anglais seulement)
- ALS-Truesdail Laboratories Inc. (www.truesdail.com) (en anglais seulement)
L'adsorption (c'est-à-dire charbon en bloc/résine), l'osmose inverse et la distillation sont des technologies de traitement efficaces à l'échelle résidentielle pour éliminer le plomb au robinet. Il existe à l'heure actuelle des dispositifs résidentiels certifiés pour la réduction du plomb (dissous et particulaire) dans l'eau potable par un traitement d'adsorption et d'osmose inverse. Par contre, il n'y a aucun système de distillation certifié.
Pour qu'un dispositif de traitement de l'eau potable soit certifié pour l'enlèvement du plomb, il doit être en mesure de réduire une concentration de plomb de 150 µg/L (particulaire et dissous) dans l'influent à une concentration finale maximale (effluent) de moins de 5 µg/L (NSF International, 2022c,d,e).
B.4.6 Méthodes de réhabilitation des entrées de service en plomb
Généralement, les revêtements, enduits et peintures sont appliqués mécaniquement lors de la fabrication des tuyaux ou sur le terrain avant l'installation. Certains revêtements peuvent être appliqués après la mise en service des tuyaux. Les revêtements les plus courants sont la peinture époxy, le mortier de ciment et le polyéthylène, et ils sont habituellement utilisés dans les tuyaux de grand diamètre. La réalisation in situ de revêtements en mortier sur des tuyaux de fonte peut réduire considérablement la survenue d'épisodes d'eau colorée (AWWA, 2017b). L'utilisation de revêtements doit faire l'objet d'une surveillance attentive, car ils peuvent être à l'origine de plusieurs problèmes relatifs à la qualité de l'eau (Schock et Lytle, 2011). Les revêtements devraient répondre aux exigences de la norme NSF/ANSI/CAN 61 et des normes pertinentes de l'AWWA.
On a mis au point des produits de revêtement pouvant être appliqués in situ sur les entrées de service en plomb. Ces produits sont constitués de tubes affaissés insérés dans des tuyaux de petit diamètre, qui prennent de l'expansion sous l'effet de la chaleur et de la pression et rendent la surface intérieure des tuyaux étanche à l'eau. De même, on a envisagé d'utiliser des revêtements époxydiques pour les entrées de service en plomb. Peu d'articles scientifiques ont été publiés sur l'utilisation de ces revêtements, mais s'ils sont efficaces, ils pourraient contribuer à réduire les perturbations et les temps d'arrêt (UK WIR, 2012). Cependant, on dispose de peu de données pour étayer leur durabilité à long terme et leur efficacité dans des tuyaux très déformés ou endommagés ou dans des raccords en ligne (par exemple, vannes, raccords en T) (UK WIR, 1997; Tarbet et coll., 1999; Randtke et coll., 2017). Il convient donc d'être prudent au moment d'envisager de tels revêtements, car tout problème risque d'exposer involontairement le consommateur à du plomb.
B.5 Justification des programmes de surveillance visant à évaluer la corrosion
Les protocoles d'échantillonnage et les objectifs liés aux protocoles de surveillance ci-dessous tiennent compte de la variabilité des concentrations de plomb mesurées au robinet, qui dépendent de la période de stagnation, de l'âge et de la source du plomb, ainsi que d'autres facteurs. La surveillance du plomb au robinet peut se faire au moyen de différents protocoles d'échantillonnage, mais le protocole choisi doit tenir compte de l'objectif souhaité. Ces protocoles peuvent servir à repérer les sources de plomb, à contrôler efficacement la corrosion ou à estimer l'exposition au plomb. Ils varieront selon divers facteurs, comme la durée de stagnation souhaitée, le volume à prélever, les sites d'échantillonnage choisis et la fréquence d'échantillonnage (Schock, 1990a; van den Hoven et Slaats, 2006; Schock et Lemieux, 2010). Le choix de la période de stagnation dépend de considérations d'ordre pratique et vise à générer des concentrations accrues de plomb pour faciliter l'évaluation de tout changements (Jackson et Ellis, 2003).
B.5.1 Programmes de surveillance résidentielle
Des programmes de surveillance résidentielle mis en œuvre dans le passé aux États-Unis et en Europe ont permis de démontrer que les concentrations de plomb au robinet varient de façon importante dans un système et dans un même site d'échantillonnage (Karalekas et coll., 1978; Bailey et Russell, 1981; AwwaRF, 1990; Schock, 1990a,b; U.S. EPA, 1991). La concentration de plomb dans l'eau du robinet dépend d'un éventail de facteurs physiques et chimiques, notamment la qualité de l'eau (le pH, l'alcalinité, la température, le chlore résiduel, etc.), la durée de stagnation ainsi que l'âge, le type, la taille et l'étendue des matériaux à base de plomb. Le mode d'utilisation de l'eau et le volume prélevé sont également des facteurs ayant une importante influence sur la concentration de plomb au robinet (Deshommes et coll., 2016a; Doré et coll., 2018; Riblet et coll., 2019).
Sur le plan statistique, plus le degré de variation est important, plus le nombre de sites d'échantillonnage doit être grand pour que les résultats soient représentatifs du réseau de distribution. Lorsqu'on effectue un échantillonnage dans le but d'évaluer l'efficacité de modifications apportées à une méthode de traitement de la corrosion, il est important de réduire le degré de variabilité des concentrations de plomb mesurées dans l'eau du robinet (AwwaRF, 1990). Pour obtenir des résultats représentatifs et reproductibles, il est donc essentiel d'intégrer à tout programme de surveillance des mesures destinées à contrôler les facteurs qui causent la variation (Schock, 1990a; AwwaRF, 2004; Commission européenne, 1999).
En ce qui concerne les programmes de surveillance résidentielle, il faut veiller à ce que les échantillons soient prélevés à partir du robinet de la cuisine, en gardant l'aérateur ou la grille en place, et en respectant un débit correspondant à celui normalement utilisé (environ de 4 à 5 L/minute) par les consommateurs (van den Hoven et Slaats, 2006). Ces précautions contribuent à garantir que les échantillons prélevés sont représentatifs des concentrations de plomb habituelles dans l'eau du robinet.
Baron (2001) a constaté qu'à l'échelle des zones/secteurs (la taille de la population d'une zone allant de 11 000 à 500 000 personnes), l'échantillonnage RDT et l'échantillonnage 30MS donnaient des résultats très similaires lorsque le nombre de ménages était suffisant. L'auteur a aussi établi que la sélection aléatoire des propriétés semblait être une bonne solution pour évaluer la situation dans une zone et pour pouvoir déterminer et prioriser les types de mesures à mettre en place.
Un certain nombre d'études ont montré que l'échantillonnage RDT était représentatif et permettait de détecter une grande proportion des sites ayant des problèmes de plomb. De plus, l'échantillonnage RDT était relativement peu coûteux, pratique à mettre en œuvre et acceptable du point de vue du consommateur. Toutefois, l'échantillonnage RDT s'est avéré moins reproductible (plus variable) que l'échantillonnage 30MS et était généralement associé à une surestimation de l'exposition au plomb (Union européenne, 1999; Jackson, 2000; Cardew, 2003; van den Hoven et Slaats, 2006). L'échantillonnage 30MS s'est avéré davantage reproductible et tout aussi représentatif.
L'approche d'échantillonnage résidentiel, intègre l'utilisation de la CMA pour le plomb afin d'orienter les mesures devant être prises par le consommateur et réduisant ainsi les risques pour les personnes vulnérables (c'est-à-dire les nourrissons, les enfants et les personnes enceintes). Cette approche est complémentaire au protocole décrit dans la recommandation pour le plomb dans l'eau potable (Santé Canada, 2019a). Elle est facile à mettre en œuvre, elle est informative et elle constitue une solution alternative éprouvée qui peut également être utilisée dans les grands immeubles et les habitations à logements multiples (Cardew, 2003). S'il est permis de le faire, la surveillance dans le cadre de cette approche peut porter sur des échantillons prélevés par le consommateur ou la municipalité, en combinaison avec les mesures de contrôle de la qualité.
Si un problème est lié à un échantillon prélevé à partir d'un robinet dans un domicile ou dans un autre type d'immeuble non public, il n'est pas nécessaire de prélever d'autres échantillons. Il faut alors mener une enquête approfondie pour déterminer si le plomb est présent dans la tuyauterie appartenant au propriétaire.
Ce protocole d'échantillonnage permettra aux responsables de systèmes de distribution d'eau potable d'obtenir l'information sur la qualité de l'eau, nécessaire pour protéger les populations les plus sensibles contre les concentrations dangereuses de plomb, en déterminant si les consommateurs doivent être informés de la nécessité de purger leur réseau d'eau potable après des périodes de stagnation. Les échantillons prélevés servent également, sur le plan opérationnel, à déterminer si l'eau distribuée a tendance ou non à être corrosive pour le plomb et, dans l'affirmative, à établir les prochaines étapes à entreprendre pour mettre en œuvre un programme de contrôle de la corrosion.
Les variations de la qualité de l'eau ont une incidence sur la variabilité des concentrations de plomb, car certains effets sont de nature saisonnière (par exemple la température, l'alcalinité, la matière organique). D'autres facteurs contribuent également à la variabilité des concentrations de plomb, notamment le type de logement, le mode d'utilisation de l'eau et le comportement du consommateur, comme l'ouverture complète des robinets, ainsi que le protocole d'échantillonnage utilisé pour vérifier la conformité (Cardew, 2003).
Il est important de concevoir un programme d'échantillonnage qui tient compte des effets saisonniers, afin que les programmes de contrôle de la corrosion tiennent compte de la variabilité qui en découle (Cardew, 2000, 2003). L'échantillonnage devrait être effectué au robinet d'eau froide de la cuisine ou d'un autre endroit approprié où l'eau est utilisée pour la boisson ou la cuisine. Quel que soit le protocole utilisé, tous les échantillons devraient être prélevés dans des bouteilles d'échantillonnage à large goulot sans retirer l'aérateur.
B.5.2 Détermination des protocoles d'échantillonnage pour un programme de surveillance résidentielle
Les protocoles d'échantillonnage RDT et 30MS peuvent tous deux être utilisés dans les sites résidentiels, car ils permettent d'identifier les endroits prioritaires où réduire les concentrations de plomb et évaluer la conformité. Bien que les protocoles RDT et 30MS conviennent à l'évaluation de l'efficacité des stratégies de contrôle de la corrosion, l'échantillonnage RDT peut être utilisé dans l'ensemble du réseau alors que l'échantillonnage 30MS est normalement utilisé dans les sites sentinelles (Hayes, 2010). En raison du caractère aléatoire de l'échantillonnage RDT, il se pourrait que l'on doive prélever plus d'échantillons que dans le cas de l'échantillonnage 30MS pour que la robustesse statistique soit suffisante. Jackson (2000) a déterminé qu'un protocole d'échantillonnage RDT nécessiterait de 3 à 5 fois plus d'échantillons pour fournir des informations équivalentes s'il était utilisé comme alternative au protocole avec stagnation. Cependant, la méthode d'échantillonnage (et d'autres facteurs) peuvent contribuer à la variabilité des concentrations de plomb. Les fluctuations de la qualité de l'eau et leur incidence sur la variabilité globale des concentrations de plomb ont été évaluées au moyen d'une simulation de Monte Carlo (Cardew, 2003). Cette étude a déterminé que le coefficient de variation (CV) associé aux protocoles 30MS et RDT dans différentes conditions d'échantillonnage et de qualité de l'eau augmentait en raison des fluctuations de la qualité de l'eau. Les fluctuations de la qualité de l'eau entraînent une augmentation considérable du nombre d'échantillons nécessaires pour le protocole 30MS, de sorte que, selon Cardew (2003), le nombre d'échantillons requis n'est que légèrement supérieur (deux fois plus élevé) dans le protocole RDT par rapport au protocole 30MS.
Alors que l'échantillonnage RDT est relativement peu coûteux, plus pratique à mettre en oeuvre et généralement mieux accepté par le consommateur que l'échantillonnage 30MS, cette dernière méthode d'échantillonnage peut toutefois être utilisée pour déterminer la cause des dépassements et pour identifier des mesures d'atténuation appropriées. Une approche en deux volets constitue une méthode efficace pour évaluer la corrosion dans l'ensemble d'un réseau de distribution et pour déterminer les concentrations de plomb potentiellement élevées. Elle est également efficace pour fournir les informations appropriées pour sélectionner les meilleures mesures correctives et pour évaluer l'efficacité du contrôle de la corrosion dans les réseaux résidentiels au Canada.
Le SG pour les deux options du volet 1 vise à déclencher des mesures correctives, notamment le prélèvement d'échantillons supplémentaires selon le protocole du volet 2. Malgré l'atteinte du SG, quand la concentration totale de plomb dépasse 0,005 mg/L dans un échantillon, les responsables de systèmes de distribution d'eau potable devraient aviser les consommateurs occupant les habitations touchées et leur fournir des renseignements sur les moyens de réduire leur exposition au plomb. Ces mesures peuvent comprendre la purge d'un volume approprié d'eau avant d'en consommer après une période de stagnation, la vérification des grilles et des aérateurs afin de déterminer s'il s'y trouve des débris pouvant contenir du plomb, comme des soudures au plomb, et le remplacement de la portion des entrées de service en plomb qui appartient aux consommateurs. On recommande également aux responsables de systèmes de distribution d'eau potable d'effectuer un échantillonnage de suivi dans ces sites afin d'évaluer l'efficacité des mesures correctives prises par les consommateurs. Dans certains cas, l'autorité responsable peut juger souhaitable de prélever les échantillons pour les deux volets à l'occasion d'une même visite. Elle élimine ainsi le besoin de retourner dans une résidence si les concentrations mesurées dépassent le SG pour le volet 1. Les analyses à faire dans le cadre du volet 2 se limiteront aux échantillons appropriés, d'après les résultats du volet 1.
B.5.2.1 Échantillonnage RDT pour le volet 1 (option 1)
L'option 1 (RDT + stagnation) du programme de surveillance résidentielle (protocole d'échantillonnage en deux volets) a pour objectifs d'identifier les systèmes présentant un problème de corrosion du plomb provenant de divers matériaux et d'établir la cause du problème; d'estimer le risque d'une exposition des consommateurs à des concentrations élevées de plomb; et d'évaluer la qualité et l'efficacité des programmes de contrôle de la corrosion.
Un échantillon de 1 L est recueilli à n'importe quel moment de la journée d'un robinet d'eau potable de chacune des résidences. Les échantillons doivent être prélevés directement au robinet du consommateur sans purge préalable; aucune période de stagnation n'est prescrite afin de mieux représenter l'utilisation des consommateurs (sans retirer l'aérateur ou la grille). Largement utilisé pour évaluer les concentrations de plomb à l'échelle d'un réseau, le protocole d'échantillonnage du volet 1 s'est révélé être une méthode efficace pour identifier les réseaux munis ou non d'entrées de service en plomb qui nécessitent un contrôle de la corrosion.
Au Royaume-Uni, on a documenté l'efficacité d'un programme d'échantillonnage RDT effectué à l'échelle du réseau pour surveiller la conformité et pour évaluer la performance et l'optimisation du contrôle de la corrosion (Jackson, 2000; Santé Canada, 2019a). L'échantillonnage à des fins de conformité se fait par la collecte d'un certain nombre d'échantillons, selon une fréquence donnée, en fonction de la population desservie dans un secteur d'approvisionnement définie (zone). Cette fréquence peut être réduite s'il ne survient aucun problème pendant la période définie. Toutefois, un échantillonnage accru peut être nécessaire lorsqu'un problème de plomb est important. Une telle situation s'est produite dans le nord-ouest de l'Angleterre, où il fallait prélever 50 échantillons par année dans chaque secteur d'approvisionnement en eau (Cardew, 2003). Cardew (2009) a analysé les répercussions de la taille d'échantillon et du nombre de sites ayant des entrées de service en plomb. Selon le chercheur, de manière générale, 25 échantillons avaient été prélevés par secteur desservant moins de 50 000 personnes à des fins de vérification de la conformité. L'auteur était aussi en mesure de distinguer les résidences n'ayant pas de problème de plomb lié à leur entrée de service des résidences qui étaient touchées par un problème de plomb (soluble ou particulaire) en évaluant les données de conformité recueillies sur une période de six ans dans trois secteurs d'approvisionnement en eau.
Le Royaume-Uni a réduit le nombre d'échantillons à prélever par année pour chaque secteur d'approvisionnement en eau (voir le tableau 2) (Cardew, 2003; DWI, 2010). Cependant, étant donné la réduction de la signification statistique des résultats, l'utilisation des données de conformité pour prioriser des interventions peut nécessiter une taille d'échantillon accrue lorsque le nombre de sites ayant une entrée de service en plomb diminue dans une précise. Il est possible d'augmenter la taille de l'échantillon soit en prélevant davantage d'échantillons, soit en regroupant les données recueillies sur plusieurs années. Dans ces cas, l'utilisation d'approches complémentaires (par exemple des sites sentinelles pour les entrées de service en plomb) fournira une estimation plus fiable de l'exposition du public ainsi que de l'efficacité du contrôle de la corrosion (Cardew, 2003). Selon Baron (2001), il faudrait de 20 à 60 échantillons pour obtenir une évaluation exacte et statistiquement valide de la conformité du plomb dans une zone d'approvisionnement (population > 500; Commission européenne, 1999). Dans une zone d'approvisionnement dont l'eau présente des caractéristiques de qualité similaires, le nombre minimal d'échantillons est de 20. Il convient d'augmenter le nombre d'échantillons lorsque le degré de conformité est élevé (c'est-à-dire 90 %), pour s'assurer que la zone est bien caractérisée.
Cardew (2003) a constaté que l'efficacité du TCC pouvait être évaluée à l'aide des données de conformité obtenues par échantillonnage RDT. Le chercheur a par ailleurs établi que l'optimisation pourrait être modélisée pour permettre l'évaluation du point de décroissance en ce qui concerne l'effet des concentrations de phosphate sur les taux de plomb, et il a entrepris de comparer les protocoles d'échantillonnage RDT et 30MS dans des conditions précises.
B.5.2.2 Échantillonnage 30MS pour le volet 1 (option 2)
Cette méthode d'échantillonnage du volet 1 peut être utilisée afin d'accroître les chances de déceler correctement les problèmes de contamination par le plomb à l'échelle d'un réseau de distribution, notamment la présence de concentrations élevées de plomb attribuables au contact de l'eau avec divers matériaux contenant du plomb durant une période de stagnation de 30 minutes. Les études mentionnées au point B.5.2 ont conclu que le protocole d'échantillonnage 30MS est à la fois reproductible et représentatif des expositions typiques, et il est également représentatif du temps moyen de stagnation entre deux utilisations dans un contexte résidentiel (Bailey et coll., 1986; van den Hoven et Slaats, 2006; Riblet et coll., 2019). Il a été déterminé que l'on pouvait prendre la concentration moyenne de plomb de deux échantillons de 1 L prélevés selon le protocole 30MS pour refléter l'exposition typique. La reproductibilité de l'échantillonnage 30MS en fait un bon outil pour surveiller les changements dans la teneur en plomb au fil du temps et pour évaluer l'efficacité d'un traitement correctif aux sites sentinelles (Jackson, 2000). Cependant, ce protocole d'échantillonnage s'avère plus coûteux, plus difficile à mettre en application et moins acceptable pour les consommateurs que l'échantillonnage RDT. Par contre, le protocole d'échantillonnage 30MS est considéré comme étant moins variable et plus reproductible que le protocole RDT en raison du temps de stagnation fixe (Union européenne, 1999; Jackson, 2000; Cardew, 2003).
On sait qu'une purge effectuée avant une période de stagnation permet d'éliminer les particules accumulées (van den Hoven et Slaats, 2006; Deshommes et coll., 2010a, 2012). Toutefois, l'écoulement turbulent observé à des débits élevés est associé à la présence de plomb particulaire (Cartier et coll., 2012b; Clark et coll., 2014). À la lumière de ces observations, l'échantillonnage devrait être réalisé à un débit moyen à élevé (> 5 L/minute) afin qu'il soit possible de capter la libération de plomb particulaire pour le protocole d'échantillonnage 30MS auquel on a habituellement recours dans les sites sentinelles. Le protocole d'échantillonnage 30MS peut également être utilisé pour déterminer la cause des dépassements et pour identifier les mesures d'intervention appropriées.
Ce protocole d'échantillonnage fournira aux responsables de systèmes de distribution d'eau potable les informations nécessaires pour protéger les populations les plus sensibles contre les concentrations dangereuses de plomb en déterminant si les consommateurs doivent être informées de la nécessité de purger leur réseau d'eau potable après des périodes de stagnation. Les échantillons prélevés servent également, sur le plan opérationnel, à déterminer si l'eau distribuée a tendance ou non à être corrosive pour le plomb et, dans l'affirmative, à établir les prochaines étapes à entreprendre pour mettre en œuvre un programme de contrôle de la corrosion. Le choix de ce protocole en tant que méthode de alternative pour la surveillance résidentielle s'appuie sur une adaptation d'un protocole d'échantillonnage utilisé par diverses études européennes dans le but d'estimer l'exposition hebdomadaire moyenne du consommateur au plomb par l'eau du robinet (Baron, 1997, 2001; Commission européenne, 1999).
Riblet et coll. (2019) ont constaté que dans les résidences n'ayant pas d'entrée de service en plomb, le deuxième litre des échantillons prélevés selon la méthode 30MS affichait des concentrations de plomb inférieures aux résultats obtenus pour le premier litre avec la méthode 30MS, avec la méthode RDT et après 6 heures de stagnation. Les auteurs ont observé que dans les résidences dotées d'une entrée de service en plomb, le plomb présent dans le premier litre provenait de la plomberie du bâtiment, tandis que le deuxième litre renfermait davantage de plomb et que ce plomb provenait de l'entrée de service en plomb. Ces observations rejoignent celles d'études antérieures (Cartier et coll., 2011; Hayes et coll., 2014). Chaque échantillon de 1 L est analysé individuellement dans le programme d'échantillonnage 30MS du volet 1. Pour la détermination des interventions prioritaires de réduction des concentrations de plomb, le calcul du 90e centile se fait à l'aide du résultat d'échantillon le plus élevé.
Bien qu'il ait servi dans ces études à estimer l'exposition hebdomadaire moyenne, ce protocole est aussi utile pour obtenir de l'information sur la corrosivité de l'eau pour les tuyaux en plomb et les autres sources de plomb (comme les raccords). Il peut donc être utilisé afin d'identifier les sites résidentiels équipés d'une entrée de service en plomb qui pourraient présenter des concentrations élevées de plomb. Lorsqu'il est associé au prélèvement d'échantillons séquentiels, le protocole d'échantillonnage 30MS peut être utilisé à des fins d'investigation dans des résidences (Cartier et coll., 2011). Comme nous l'expliquons en détail ci-dessous, le protocole a été adapté afin de pouvoir également être utilisé comme outil pour déterminer la cause de la corrosion.
B.5.2.3 Échantillonnage 30MS pour le volet 2 (options 1 et 2)
L'échantillonnage du volet 2 est nécessaire uniquement si le volet 1 révèle la présence, dans plus de 10 % des sites (90e centile), de concentrations de plomb supérieures à 0,005 mg/L (SG). Les prélèvements sont effectués dans 10 % des sites échantillonnés dans le cadre du volet 1, plus précisément dans les sites où l'on a observé les concentrations les plus élevées. Dans le cas d'un réseau de petite taille (desservant 500 personnes ou moins), il faut prélever des échantillons dans au moins deux sites afin d'obtenir des données suffisantes pour dresser le profil des concentrations de plomb de l'eau de ce réseau. Ce protocole vise à mesurer la concentration de plomb de l'eau qui a été en contact avec l'entrée de service en plomb et la plomberie interne (par exemple les soudures au plomb, les raccords en laiton au plomb) durant une courte période transitoire (30 minutes). Ainsi, il permet d'établir le profil des contributions du robinet, de la plomberie intérieure de la résidence et, dans de nombreux cas, d'une portion ou de l'ensemble de l'entrée de service en plomb.
Après une purge complète de 5 minutes et une période de stagnation de 30 minutes, on prélève quatre échantillons (ou plus) consécutifs de 1 L au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille). Chaque échantillons de 1 L prélevés consécutivement est ensuite analysé séparément afin d'obtenir un profil des contributions du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et de l'entrée de service en plomb.
B.5.2.4 Échantillonnage après 6 h de stagnation pour le volet 2 (options 1 et 2)
L'échantillonnage du volet 2 est nécessaire uniquement si le volet 1 révèle la présence, dans plus de 10 % des sites (90e centile), de concentrations de plomb supérieures à 0,005 mg/L (SG). Les prélèvements sont effectués dans 10 % des sites échantillonnés dans le cadre du volet 1, plus précisément dans les sites où l'on a observé les concentrations les plus élevées. Dans le cas d'un réseau de petite taille (desservant 500 personnes ou moins), il faut prélever des échantillons dans au moins deux sites afin d'obtenir des données suffisantes pour dresser le profil des concentrations de plomb de l'eau de ce réseau.
On prélève quatre échantillons (ou plus) consécutifs de 1 L au robinet d'eau froide du consommateur (sans retirer l'aérateur ou la grille) après une période de stagnation d'au moins 6 h. Chaque échantillon de 1 L est ensuite analysé séparément afin d'obtenir un profil des contributions du robinet, de la plomberie (plomb présent dans les soudures, les raccords en laiton ou en bronze, les compteurs d'eau en laiton, etc.) et d'une portion ou de l'ensemble de l'entrée de service en plomb.
L'échantillonnage du volet 2 a pour objectif de fournir des renseignements sur la source de la contamination au plomb et sur les concentrations de plomb potentiellement les plus élevées, afin d'aider les responsables de systèmes de distribution d'eau potable à déterminer les meilleures mesures correctives à prendre. Il permet également d'obtenir les meilleures informations pour évaluer l'efficacité et l'optimisation du programme de contrôle de la corrosion.
B.5.2.5 Considérations relatives au volet 2
Pour obtenir des renseignements sur les concentrations potentiellement les plus élevées, il est important de réaliser l'échantillonnage après une période de stagnation. Le protocole d'échantillonnage du volet 2 vise notamment à prélever des échantillons de l'eau qui a reposé non seulement dans la plomberie du bâtiment, mais également dans une portion ou dans l'ensemble de l'entrée de service en plomb, s'il y a présence d'une telle conduite. Les concentrations de plomb dans l'eau ayant reposé dans des tuyaux de plomb augmentent de façon considérable avec le temps, durant une période pouvant aller jusqu'à 8 heures, comme pour les autres matériaux à base de plomb (soudures au plomb et raccords en laiton).
Plusieurs facteurs influent sur la pente des courbes de stagnation de l'eau potable dans un tuyau de plomb. Généralement, la concentration de plomb augmente rapidement durant les 300 premières minutes. La pente de la courbe de stagnation pour un tuyau de plomb est habituellement très abrupte pour les périodes de stagnation inférieures à 6 heures. Par conséquent, de petites différences dans la durée de stagnation de l'eau peuvent entraîner des variations importantes dans les concentrations de plomb mesurées (Kuch et Wagner, 1983; AwwaRF, 1990, 2004; Schock, 1990a).
Le volume d'eau qui a été en contact avec l'entrée de service en plomb après une période de stagnation constitue un autre facteur important qui influe sur les concentrations de plomb au robinet. Des études établissant les profils des concentrations de plomb de réseaux de distribution au Canada et aux États-Unis ont indiqué que parmi les échantillons prélevés au robinet de résidences équipées d'une entrée de service en plomb, ce sont les échantillons d'eau ayant reposé dans une telle conduite qui présentent la concentration de plomb la plus élevée (Campbell et Douglas, 2007; Huggins, 2007; Kwan, 2007; U.S. EPA, 2007; Craik et coll., 2008). Selon les résultats de ces études, lorsque l'eau a reposé dans une entrée de service en plomb durant 6 heures, la concentration maximale de plomb peut être mesurée dans les échantillons se situant entre le quatrième et le douzième litre du volume d'eau recueilli. Dans de nombreuses études, on a souvent mesuré des concentrations de plomb très élevées dans le quatrième, le cinquième ou le sixième litre du volume d'échantillon (Campbell et Douglas, 2007; Douglas et coll., 2007; Sandvig, 2007; Craik et coll., 2008; Deshommes et coll., 2016b). L'établissement de profils complets des concentrations de plomb dans l'eau de résidences de Washington (DC) équipées d'une entrée de service en plomb, effectué après le remplacement de l'ancienne méthode de traitement par un traitement aux chloramines, a montré que la quantité moyenne de plomb libéré dans l'eau (concentration ajustée au volume réel) attribuée à l'entrée de service était de 470 µg (73 µg/L), comparativement à 26 µg (26 µg/L) dans le premier litre d'échantillon et à 72 µg (31 µg/L) dans les échantillons provenant des autres éléments de tuyauterie des résidences et des composantes en amont de l'entrée de service en plomb (U.S. EPA, 2007).
Déterminer la possibilité de concentrations élevées de plomb dans l'eau ayant reposé dans une entrée de service en plomb constitue donc un élément essentiel de tout protocole d'échantillonnage servant à évaluer la corrosion interne des réseaux de distribution résidentiels et l'optimisation consécutive du contrôle de la corrosion. Une comparaison des échantillons présentant les concentrations de plomb les plus élevées avant et après la mise en œuvre de mesures de contrôle de la corrosion permettra aux responsables de systèmes de distribution d'eau potable d'obtenir les données nécessaires pour déterminer si la méthode de traitement utilisée a été optimisée. Cette comparaison aidera en dernier lieu à démontrer que les concentrations les plus élevées ont été réduites le plus possible. On estime que, dans le cas des systèmes de distribution d'eau potable canadiens, le prélèvement d'au moins quatre échantillons de 1 L après une période de stagnation de 6 heures accroîtra les chances de détection des concentrations de plomb les plus élevées. Étant donné que le volume d'échantillon requis pour recueillir de l'eau ayant reposé dans l'entrée de service en plomb dépendra de la configuration propre à la plomberie de chaque site, les responsables de systèmes de distribution d'eau potable devraient effectuer une caractérisation générale des différents types de sites à haut risque dans le but de déterminer si le prélèvement de quatre échantillons de 1 L sera suffisant.
Le prélèvement de quatre échantillons de 1 L à analyser séparément permettra d'établir le profil des contributions du robinet, de la plomberie intérieure de la résidence et, dans de nombreux cas, d'une portion ou de l'ensemble de l'entrée de service en plomb, aux concentrations de plomb. Des études antérieures ont montré que 95 % du plomb provenant du robinet est évacué avec les premiers 200 à 250 mL d'eau. En outre, le plomb provenant des soudures au plomb se trouve généralement dans les deux premiers litres d'eau évacués des tuyaux de plomberie. Le prélèvement de quatre échantillons de 1 L à analyser séparément permettra donc aux fournisseurs d'eau d'obtenir des renseignements à la fois sur les concentrations de plomb au robinet potentiellement les plus élevées et sur la source de la contamination par le plomb. Ces renseignements pourront ensuite servir à déterminer les meilleures mesures correctives à prendre pour le réseau et fourniront des données qui faciliteront l'évaluation visant à déterminer si le contrôle de la corrosion a été optimisé.
B.5.2.6 Limites
En général, un programme de surveillance résidentielle a pour buts d'identifier les systèmes dans lesquels il se produit une corrosion du plomb provenant de divers matériaux et de déterminer la cause du problème; d'estimer la possibilité d'une exposition des consommateurs à des concentrations élevées de plomb; et d'évaluer la qualité et l'efficacité des programmes de contrôle de la corrosion. Destinée aux résidences équipées d'une entrée de service en plomb, la deuxième option du programme de surveillance résidentielle n'a pas été évaluée en fonction de ces objectifs. Elle est plutôt destinée à déceler les concentrations élevées de plomb dans l'eau des résidences équipées d'une entrée de service en plomb. Il est également important de signaler que ce protocole n'a fait l'objet d'aucune évaluation visant à déterminer s'il est efficace pour déceler la corrosion d'autres matériaux utilisés en plomberie, et qu'il ne permet pas de mesurer les concentrations potentiellement plus élevées qui pourraient être présentes dans l'eau ayant reposé durant une période prolongée dans les entrées de service en plomb et les systèmes de plomberie des résidences.
Selon une étude de Kuch et Wagner (1983), les concentrations de plomb atteignent une valeur d'équilibre assez constante après 5 à 7 heures de stagnation, selon le diamètre des tuyaux (correspondant à 1/2 po et à 3/8 po [1,3 cm et 1,0 cm]). De plus, la concentration de plomb augmente de façon exponentielle durant les 300 premières minutes de stagnation dans un tuyau en plomb. On a également constaté que la contribution à la concentration de plomb des autres matériaux, comme les raccords en laiton au plomb et les soudures à base de plomb, augmente de façon considérable après 4 à 20 heures de stagnation. Un petit nombre d'études avancent que, pour des volumes d'échantillon équivalents prélevés à un même robinet, les concentrations de plomb mesurées après une période de stagnation de 30 minutes sont beaucoup moins importantes que celles mesurées après une période de stagnation de 6 heures (AwwaRF, 1990; Douglas et coll., 2007; Craik et coll., 2008). Il semble donc y avoir un risque notable de sous-estimer la concentration maximale de plomb au robinet lorsqu'on utilise une période de stagnation de 30 minutes.
B.5.3 Détermination des protocoles d'échantillonnage pour les immeubles non résidentiels et résidentiels à logements multiples
Les buts des protocoles d'échantillonnage et le SG pour les sites non résidentiels, les sites résidentiels à logements multiples (plus de six logements) et les grands immeubles, comme les services de garde, les écoles, les immeubles résidentiels et les immeubles à bureaux, consistent à localiser les problèmes particuliers de relargage de plomb dans les immeubles, à déterminer les endroits où il faut intervenir et à déterminer quelles mesures il convient de prendre. De cette façon, on réduira le plus possible les concentrations de plomb aux sorties d'eau froide (à savoir les raccords et appareils comme les robinets et les fontaines) utilisées pour la boisson et la cuisine et on protégera la santé des occupants contre une exposition au plomb. Les protocoles d'échantillonnage visent l'obtention d'une meilleure compréhension de la façon dont varient les concentrations de plomb observées aux diverses sorties d'eau des immeubles. Les concentrations aux sorties d'eau varieront selon les sources de plomb dans la plomberie et les modes d'utilisation de l'eau dans l'immeuble.
La teneur en plomb de l'eau potable acheminée aux immeubles non résidentiels par un réseau de distribution est généralement faible. On recommande de prélever, lors de chaque visite de surveillance, des échantillons à une sortie d'eau située près du point d'entrée de l'eau dans le bâtiment non résidentiel ou résidentiel à logements multiples. Ces échantillons permettront de déterminer la concentration de plomb attribuable à l'entrée de service ou au réseau de distribution (conduite principale). Idéalement, les échantillons devraient être prélevés après un temps de purge suffisant pour qu'ils soient représentatifs de l'eau provenant de l'entrée de service et de la conduite principale. Le volume d'eau à purger dépendra des caractéristiques de la plomberie du bâtiment (à savoir la distance entre l'entrée de service et la conduite principale).
En règle générale, le diamètre des entrées de service en plomb dépasse rarement 2 pouces (5 cm). Néanmoins, des entrées de service en plomb d'un diamètre aussi grand que 3 pouces (7,6 cm) ont été signalées (LSLR Collaborative, 2023). Dans certains cas (par exemple lorsque le bâtiment est équipé d'une entrée de service en plomb) il peut être difficile d'obtenir un échantillon représentatif de l'eau arrivant de la conduite principale en raison de l'apport de plomb provenant de l'entrée de service. Dans une telle situation, un emplacement alternatif pour effectuer l'échantillonnage pourrait devoir être sélectionné.
Les protocoles d'échantillonnage sont fondés sur une compréhension des variations des les concentrations de plomb aux sorties d'eau des immeubles non résidentiels, variations qui dépendent des sources de plomb dans la plomberie ainsi que des modes d'utilisation de l'eau (Deshommes et coll., 2012; McIlwain et coll., 2016; Katner et coll., 2018; Miller-Schulze et coll., 2019). Dans le cas de l'échantillonnage des immeubles à logements multiples, la priorité doit être accordée aux sites où l'on sait ou soupçonne que les entrées de service sont faites en plomb, en partie ou en totalité. Un protocole d'échantillonnage RDT est recommandé dans ces sites, car il permet de mesurer l'exposition typique, y compris l'exposition potentielle aux particules de plomb.
L'échantillonnage RDT devrait être effectué, sans période de stagnation ni purge préalable, aux fontaines ou aux robinets d'eau froide où l'eau est utilisée pour la boisson ou la cuisine. On prélèvera deux échantillons de 125 mL, de préférence dans des bouteilles à large goulot, à un débit moyen à élevé, sans retirer l'aérateur. La concentration de plomb correspondra à la moyenne des résultats des deux échantillons.
Le plan d'échantillonnage pour les écoles et les services de garde doit prendre en compte le fait que bon nombre d'occupants de ces immeubles sont les plus vulnérables aux effets néfastes du plomb sur la santé. Les plans d'échantillonnage de ces installations doivent donc accorder la priorité à toutes les fontaines et tous les robinets d'eau potable froide utilisés pour la boisson ou la cuisine plutôt qu'aux sorties d'eau moins souvent utilisées. Dans les autres types d'immeubles, les plans d'échantillonnage devraient également cibler les fontaines et les sorties d'eau froide utilisées pour la boisson ou la cuisine.
Lorsqu'on prélève des échantillons aux robinets d'une cuisine d'un immeuble non résidentiel, il faut laisser les aérateurs et les grilles en place, et le débit de l'eau doit correspondre à celui normalement utilisé (environ 4 à 5 L/min). Toutefois, dans le cas des autres sorties d'eau, comme les fontaines, le débit est habituellement moins grand et doit par conséquent être également moins grand durant l'échantillonnage. Ces précautions contribuent à garantir que chaque échantillon est représentatif de la qualité moyenne de l'eau provenant de la fontaine ou du robinet où il a été prélevé.
Dans certains cas, les autorités responsables peuvent juger souhaitable de prélever les échantillons pour les volets 1 et 2 en même temps, afin de ne pas avoir à retourner sur un site. Il faut cependant savoir que le niveau de confiance dans les résultats de l'analyse de certains échantillons sera moindre, puisque le fait de purger une sortie d'eau peut influer sur les échantillons prélevés après la purge à d'autres sorties situées à proximité.
B.5.3.1 Échantillonnage pour le volet 1
On prélève un échantillon de 250 mL, de façon aléatoire durant la journée, aux sorties d'eau potable froide de chacun des emplacements désignés dans le plan d'échantillonnage. Les échantillons doivent être prélevés sans purge préalable ni période de stagnation, afin de mieux refléter l'utilisation typique du consommateur. Pour que les échantillons recueillis soient représentatifs, l'aérateur ou la grille de la sortie d'eau ne doivent pas être retirés avant le prélèvement. Si la concentration (totale) de plomb est supérieure à 0,005 mg/L (CMA) à l'un des endroits surveillés, des mesures correctives doivent être prises.
Tout comme dans le cadre d'un programme de surveillance résidentielle, chacun des éléments d'un protocole d'échantillonnage en milieu non résidentiel et dans les immeubles résidentiels à logements multiples, comme la période de stagnation, le volume d'eau prélevé et le SG, a une incidence importante sur l'utilité des données recueillies. Étant donné que les objectifs du prélèvement d'échantillons dans des immeubles non résidentiels et résidentiels à logements multiples sont distincts de ceux du prélèvement d'échantillons dans un cadre résidentiel typique, les volumes d'eau prélevés sont également différents.
Les protocoles d'échantillonnage des volets 1 et 2 dans les milieux non résidentiels et les milieux résidentiels à logements multiples sont établis en fonction du prélèvement d'un volume d'échantillon de 250 mL. Des études ont démontré que lors de l'évaluation de la quantité de plomb relarguée à partir de sorties d'eau comme les robinets de cuisine, plus de 95 % du plomb présent peut être mesuré dans les premiers 200 à 250 mL d'eau provenant d'un robinet (Gardels et Sorg, 1989). On a également constaté que les concentrations de plomb dans les immeubles non résidentiels diminuent généralement de façon importante après une purge de 30 secondes. Cette diminution laisse supposer que les fontaines et les robinets d'un immeuble non résidentiel, de même que les éléments de plomberie qui y sont raccordés, peuvent contribuer de façon importante aux concentrations élevées de plomb observées (Bryant, 2004; Boyd et coll., 2008a,b; Pieper et coll., 2015, Doré et coll., 2018).
Le prélèvement d'un volume plus important d'eau, un litre par exemple, toucherait ainsi une portion plus grande des éléments de plomberie en amont des sorties d'eau. Ces éléments de plomberie peuvent comprendre des vannes, des raccords en T et des joints soudés pouvant contribuer à la concentration de plomb de l'échantillon de 1 L. Il ne serait cependant pas possible de déterminer le matériau responsable de la libération du plomb. En outre, on suppose que le prélèvement d'une telle quantité d'eau à partir d'une fontaine d'eau potable pourrait diluer la concentration initialement mesurée à la sortie d'eau. Cette situation n'est pas souhaitable, car l'eau prélevée des sections de la plomberie situées plus loin de la sortie d'eau présente généralement des concentrations moins élevées (U.S. EPA, 2004). On considère donc qu'il est important lors de la prise d'échantillons dans un immeuble non résidentiel de prélever des volumes d'eau moins grands (250 mL) que ceux normalement utilisés pour évaluer la corrosion interne des réseaux résidentiels (un litre ou plus). On préconise ainsi, pour l'échantillonnage dans les immeubles non résidentiels, un volume d'échantillon de 250 mL, puisqu'un tel volume correspond à l'eau provenant à la fois de l'appareil de plomberie (la fontaine ou le robinet) et d'une section plus courte de la plomberie, et qu'il permet par conséquent d'identifier avec une plus grande efficacité la source du plomb présent à la sortie d'eau (U.S. EPA, 1994, 2006).
Comme mentionné à la section B.2.2.2, Temps de stagnation, âge de l'eau et débit, des études cherchant à déterminer les sources du plomb dans l'eau du robinet ont montré que les soudures au plomb et les raccords en laiton contribuent de façon notable aux concentrations élevées de plomb mesurées après une période de stagnation (Lee et coll., 1989; Singh et Mavinic, 1991; AwwaRF, 2004; U.S. EPA, 2007). Ces études indiquent que, selon l'âge et le type des matériaux, les concentrations de plomb augmentent de façon importante après des périodes de stagnation de 4 à 20 heures (Lytle et Schock, 2000). Le mode d'utilisation de l'eau dans un immeuble constitue donc un facteur important dans la détermination des concentrations de plomb au robinet. Étant donné que l'utilisation de l'eau est généralement intermittente dans les bâtiments non résidentiels, comme les services de garde, les écoles et les immeubles à bureaux, il est important d'effectuer un prélèvement d'échantillons après une période de stagnation pour le volet 2.
Lorsqu'on observe des concentrations supérieures au SG de 0,005 mg/L, des mesures correctives provisoires doivent être prises afin de protéger la santé des populations qui sont sensibles dans des conditions d'exposition comme celles qu'on retrouve dans les immeubles non résidentiels. Les occupants du bâtiment ainsi que toute autre partie intéressée, comme les parents, devraient être informés des résultats des échantillonnages effectués dans ce bâtiment.
B.5.3.2 Échantillonnage pour le volet 2
Afin de faciliter l'identification de la source du plomb aux sorties d'eau qui présentent des concentrations de plomb supérieures à 0,005 mg/L pour le volet 1, on prélève des échantillons de suivi de l'eau qui a reposé dans la plomberie en amont et non de l'eau présente dans la sortie d'eau elle-même. L'échantillonnage pour le volet 2 permet, en combinaison avec les résultats obtenus au volet 1, de déterminer la source du plomb dans la plomberie interne de l'immeuble. L'échantillonnage séquentiel (au moins 2 échantillons de 125 mL chacun) aidera à déterminer la concentration de plomb dans l'eau qui a stagné dans la plomberie en amont de la sortie d'eau. Ce protocole d'échantillonnage a pour but de mesurer la concentration de plomb dans l'eau qui a été en contact pendant une brève période (30 minutes) avec la plomberie interne (soudure au plomb, raccords en laiton, etc.). Il s'agit d'une forme d'échantillonnage séquentiel qui facilite la phase d'enquête si l'analyse des échantillons révèle la présence de plomb. Ces petits échantillons sont représentatifs de l'eau des raccords (fontaine ou robinet) et d'une plus petite section du système de plomberie et permettent aussi de repérer plus efficacement la source de plomb associée à une sortie d'eau. Si la concentration de plomb du premier échantillon de 125 mL du volet 2 est supérieure à 0,005 mg/L, on pourra conclure que le plomb provient vraisemblablement de la fontaine d'eau, du robinet d'eau potable froide ou de la plomberie à proximité. Si des concentrations de plomb supérieures à 0,005 mg/L sont mesurées dans le deuxième échantillon de 125 mL prélevé dans le cadre du volet 2, les sources du plomb peuvent inclure la plomberie qui se trouve derrière le mur ou la sortie d'eau et la plomberie de l'immeuble combinées. Lorsque les concentrations de plomb dépassent 0,005 mg/L dans les échantillons prélevés dans le cadre du volet 2, il faut prendre des mesures correctives immédiates, déterminer les sources du plomb et mettre en œuvre des mesures visant à remédier au problème.
Les résultats de l'échantillonnage effectué dans le cadre des volets 1 et 2 doivent être interprétés en fonction du profil de la plomberie, de manière à ce qu'il soit possible de déterminer les sources du plomb et de prendre les mesures correctives provisoires et à long terme qui s'imposent.
Partie C. Références et abréviations
C.1 Références
- Aghasadeghi, K., Peldszus, S., Trueman, B.F., Mishrra, A., Cooke, M.G., Slawson, R.M., Giammar, D.E., Gagnon, G.A. et Huck, P.M. (2021). Pilot-scale comparison of sodium silicates, orthophosphate and pH adjustment to reduce lead release from lead service lines. Water Res., 195:116955. Disponible à : DOI: 10.1016/j.watres.2021.116955.
- Anderson, K.E. (1983). Nickel in tap water. Contact Dermatitis, 9: 140–143.
- Appenzeller, B.M.R., Batté, M., Mathieu, L., Block, J.C., Lahoussine, V., Cavard, J. et Gatel, D. (2001) Effect of adding phosphate to drinking water on bacterial growth in slightly and highly corroded pipes. Water Res., 35(4): 1100–1105.
- Arnold, R.B., Griffin, A. et Edwards, M. (2012). Controlling copper corrosion in new construction by organic matter removal. J. Am. Water Works Assoc., 104(5): E310–E317.
- Arnold, R. B., Rhoades, J., Criswell, M., Ingels, T. et Becker, W. (2021). Colorado's bench-scale Lead and copper corrosion testing protocol. J. AWWA, 113, 30–40. https://doi.org/10.1002/awwa.1725
- Atlas, D., Coombs, J. et Zajcek, O.T. (1982). The corrosion of copper by chlorinated drinking waters. Water Res., 16: 693–698.
- AWWA (2017a). Internal corrosion control in water distribution systems: Manual of water supply practices M58. Second edition. American Water Works Association, Denver, CO.
- AWWA (2017b). Water Quality in Distribution Systems: Manual of Water Supply Practices, M68. First edition. American Water Works Association, Denver, CO.
- AWWA (2017c). Standard ANSI/AWWA C810-17: Replacement and flushing of lead service lines. American Water Works Association, Denver, CO.
- AwwaRF (1990). Lead control strategies. AWWA Research Foundation and American Water Works Association, Denver, CO.
- AwwaRF (1994). Development of a pipe loop protocol for lead control. AWWA Research Foundation, Denver, CO.
- AwwaRF (2004). Post optimization lead copper control monitoring strategies. AWWA Research Foundation, Denver, CO (Report 90996F).
- Bae, Y., Pasteris, J.D. et Giammar, D.E. (2020). Impact of iron-rich scale in service lines on lead release to water. AWWA Water Sci. 2(4). Disponible à : DOI: 10.1002/aws2.1188
- Bailey, R.J. et Russell, P.F. (1981). Predicting drinking water lead levels. Sci. Technol. Lett., 2: 57–66.
- Bailey, R.J., Holmes, D., Jolly, P.K. et Lacey, R.F. (1986). Lead concentration and stagnation time in water drawn through lead domestic pipes. Water Research Centre, Medmenham, UK. (Environment Report TR 243).
- Baron, J. (1997). La mesure du plomb au robinet de l'usager. Étude des méthodes d'échantillonnage. Tech. Sci. Meth. Gen. Urbain Gen. Rural, 92(5): 47–54.
- Baron, J. (2001). Monitoring strategy for lead in drinking water at consumer's tap: field experiments in France. Water Sci. Technol. Water Supply, 1(4): 193–200.
- Beckett, M.A., Snoeyink, V.L. et Jim, K. (1998). A pipe loop system for evaluating iron uptake in distribution systems. Dans : Proceedings of the 1998 AWWA Water Quality Technology Conference, San Diego, CA. American Water Works Association, Denver, CO.
- Bénard, I. (1998). Évaluation de l'effet du silicate comme inhibiteur de corrosion dans un réseau de distribution de l'eau potable. École Polytechnique de Montréal, Montréal, QC (mémoire de maîtrise).
- Benjamin, M.M., Sontheimer, H. et Leroy, P. (1996). Corrosion of iron and steel. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. p. 46.
- Berend, K. et Trouwborst, T. (1999). Cement-mortar pipes as a source of aluminum. J. Am. Water Works Assoc., 91(7): 91–100.
- Berghult, B., Hedberg, T. et Broo, A.E. (1999). Drinking water distribution: corrosion control in Swedish municipalities. J. Water Supply Res. Technol. – Aqua, 48(2): 44–52.
- Berghult, B., Broo, A.E. et Hedberg, T. (2001). Corrosion control measures in Sweden and the effect of succession order. Water Sci. Technol. Water Supply, 1(3): 47–58.
- Birden, H.H., Calabrese, E.J. et Stoddard, A. (1985). Lead dissolution from soldered joints. J. Am. Water Works Assoc., 77(11): 66–70.
- Boffardi, B.P. (1988). Lead in drinking water—causes and cures. Public Works, 119(11): 67–70.
- Boffardi, B.P. (1990). Minimization of lead corrosion in drinking water. Mater. Perform., 29(8): 45–49.
- Boffardi, B.P. (1993). The chemistry of polyphosphate. Mater. Perform., 8: 50–53.
- Boffardi, B.P. et Sherbondy, A.M. (1991). Control of lead corrosion by chemical treatment. Corrosion, 47(12) : 966–975.
- Boireau, A., Benezet-Toulze, M., Randon, G. et Cavard, J. (1997). Limitation de la solubilisation du plomb par ajout de produit filmogène. Transposition d'une étude sur pilote à un réseau réel. Tech. Sci. Meth. Gen. Urbain Gen. Rural, 92(5): 63–72.
- Bondietti, G., Sinniger, J. et Stumm, W. (1993). The reactivity of Fe(III) (hydr)oxides: effects of ligands in inhibiting the dissolution. Colloids Surf. A Physicochem. Eng. Asp., 79(2–3): 157.
- Bosscher, V., Lytle, D.A., Schock, M.R., Porter, A. et Del Toral, M. (2019). POU water filters effectively reduce lead in drinking water: a demonstration field study in Flint, Michigan. J Environ. Sci. Health A, 54:5, 484–493. Disponible à : DOI:10.1080/10934529.2019.1611141
- Boulay, N. et Edwards, M. (2001). Role of temperature, chlorine, and organic matter in copper corrosion by- product release in soft water. Water Res., 35(3): 683–690.
- Boyd, G.R., Pierson, G.L., Kirmeyer, G.J., Britton, M.D. et English, R.J. (2007). Lead release from end-use plumbing components in Seattle public schools. Dans : Proceedings of the 2007 AWWA Research Symposium – Distribution Systems: The Next Frontier, March 2–3, 2007, Reno, NV. American Water Works Association, Denver, CO.
- Boyd, G.R., Pierson, G.L., Kirmeyer, G.J. et English, R.J. (2008a). Lead variability testing in Seattle public schools. J. Am. Water Works Assoc., 100(2): 53–64.
- Boyd, G.R., Pierson, G.L., Kirmeyer, G.J., Britton, M.D. et English, R.J. (2008b). Lead release from new end-use plumbing components in Seattle public schools. J. Am. Water Works Assoc., 100(3): 105–114.
- Britton, A. et Richards, W.N. (1981). Factors influencing plumbosolvency in Scotland. J. Inst. Water Eng. Sci., 35(4): 349–364.
- Broo, A.E., Berghult, B. et Hedberg, T. (1997). Copper corrosion in drinking water distribution systems – The influence of water quality. Corros. Sci., 39(6): 1119–1132.
- Broo, A.E., Berghult, B. et Hedberg, T. (1998). Copper corrosion in water distribution systems – The influence of natural organic matter (NOM) on the solubility of copper corrosion products. Corros. Sci., 40(9): 1479–1489.
- Broo, A.E., Berghult, B. et Hedberg, T. (1999). Drinking water distribution – The effect of natural organic matter (NOM) on the corrosion of iron and copper. Water Sci. Technol., 40(9): 17–24.
- Broo, A.E., Berghult, B. et Hedberg, T. (2001). Drinking water distribution – Improvements of the surface complexation model for iron corrosion. Water Sci. Technol. Water Supply, 1(3): 11–18.
- Bryant, S.D. (2004). Lead contaminated drinking waters in the public schools of Philadelphia. J. Toxicol., 42(3): 287–294.
- Buelow R.W., Millette J.R., McFarren E.F. et Symons J.M. (1980). The behaviour of asbestos/cement pipe under various water quality conditions: a progress report. J. Am. Water Works Assoc. 72: 91–102.
- Camara, E., Montreuil, K.R., Knowles, A.K. et Gagnon, G.A. (2013). Role of the water main in lead service line replacement: a utility case study. J. Am. Water Works Assoc., 105(8): E423–E431.
- Campbell, A. et Douglas, I. (2007). Corrosion control in Ottawa. Dans : Proceedings of the Ontario Water Works Association Distribution System Workshop, Toronto, ON. Ontario Water Works Association, Markham, ON.
- Campbell, H.S. (1954a). The influence of the composition of supply waters, especially of traces of natural inhibitor on pitting corrosion of copper water pipes. Proc. Soc. Water Treat. Exam., 3: 100–117.
- Campbell, H.S. (1954b). A natural inhibitor of pitting corrosion of copper in tap waters. J. Appl. Chem., 4: 633–647.
- Campbell, H.S. et Turner, M.E.D. (1983). The influence of trace organics on scale formation and corrosion. J. Inst. Water Eng. Sci., 37(1): 55–72.
- Cantor, A.F. (2018). Water Distribution System Monitoring: A Practical Approach for Evaluating Drinking Water Quality. Second edition. Boca Raton, FL: CRC Press.
- Cantor, A.F., Denig-Chakroff, D., Vela, R.R., Oleinik, M.G. et Lynch, D.L. (2000). Use of polyphosphate in corrosion control. J. Am. Water Works Assoc., 92(2): 95–102.
- Cantor, A.F., Park, J.K. et Vaiyavatjamai, P. (2003). Effect of chlorine on corrosion. J. Am. Water Works Assoc., 95(5): 112–123.
- Cantor, A.F. (2017). Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality. Water Research Foundation and Water Environment and Reuse Foundation, Denver, Colorado. Report #4586.
- Cardew, P. (2000). Simulation of lead compliance data. Water Res., 34(8): 2241–2252.
- Cardew, P. (2003). A method for assessing the effect of water quality changes on plumbosolvency using random daytime sampling. Water Res., 37(12): 2821–2823. Disponible à : https://doi.org/10.1016/S0043-1354(03)00120-9
- Cardew, P.T. (2009). Measuring the benefit of orthophosphate treatment on lead in drinking water. J. Water Health, 7(1): 123–131.
- Cartier, C., Laroche, L., Deshommes, E., Nour, S., Richard, G., Edwards, M. et Prévost, M. (2011). Investigating dissolved lead at the tap using various sampling protocols. J. Am. Water Works Assoc., 103(3): 53–67.
- Cartier, C., Nour, S., Richer, B., Deshommes, E. et Prévost, M. (2012a). Impact of water treatment on the contribution of faucets to dissolved and particulate lead release at the tap. Water Res., 46(16): 5205–5216.
- Cartier, C., Arnold, R., Triantafyllidou, S., Prévost, M. et Edwards, M. (2012b). Effect of flow rate and lead/copper pipe sequence on lead release from service lines. Water Res., 46(13): 4142–4152.
- Cartier, C., Doré, E., Laroche, L., Nour, S., Edwards, M. et Prévost, M. (2013). Impact of treatment on Pb release from full and partially replaced lead service lines (LSLs). Water Res., 47(2): 661–671.
- CDM Smith. (2019). City of Newark Point-of-Use Filter Study (August–September 2019). Filter Results Report – Final. Newark, NJ.
- Centre for Water Resources Studies (2023). Guidance for using pipe loops to inform corrosion control treatment decisions, Dalhousie University. Rapport présenté à Santé Canada. Disponible sur demande à : water-eau@hc-sc.gc.ca.
- Churchill, D.M., Mavinic, D.S., Neden, D.G. et MacQuarrie, D.M. (2000). The effect of zinc orthophosphate and pH–alkalinity adjustment on metal levels leached into drinking water. Can. J. Civil Eng., 27(6): 33–43.
- Clark, B., Masters, S. et Edward, M. (2014). Profile sampling to characterize particulate lead risks in potable water. Environ. Sci. Technol., 48(12): 6836–6843. Disponible à : DOI: 10.1021/es501342j
- Clark, B.N., Masters, S.V. et Edwards, M.A. (2015). Lead release to drinking water from galvanized steel pipe coatings. Environ. Eng. Sci., 32(8): 713–721.
- Clifford, D.A (1999). Ion exchange and inorganic adsorption. Chapter 9 dans : Letterman, R.D. (ed.), Water quality and treatment: a handbook of community water supplies.5th edition. American Water Works Association, Denver, CO; McGraw-Hill, New York, New York.
- Clifford, D., Sorg, T. et Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Chapter 12 dans : Water quality and treatment: A handbook of drinking water. 6th edition. Edzwald, J.K. (ed.). American Water Works Association, Denver, Colorado.
- Colling, J.H., Whincup, P.A.E. et Hayes, C.R. (1987). The measurement of plumbosolvency propensity to guide the control of lead in tapwaters. J. Inst. Water Environ. Manage., 1(3): 263–269.
- Colling, J.H., Croll, B.T., Whincup, P.A.E. et Harward, C. (1992). Plumbosolvency effects and control in hard waters. J. Inst. Water Environ. Manage., 6(6): 259–269.
- Commission européenne (1999). Developing a new protocol for the monitoring of lead in drinking water. Directorate General for Science, Research and Development, European Commission, Brussels (Report No. REPORT EUR 19087 EN).
- Commission européenne (2015). Directive (UE) 2015/1787 de la Commission du 6 octobre 2015 modifiant les annexes II et III de la directive 98/83/CE du Conseil relative à la qualité des eaux destinées à la consommation humaine. Annexe II, partie D. Disponible à : https://eur-lex.europa.eu/search.html?lang=en&text=2015%2F1787&qid=1701753141345&type=quick&scope=EURLEX&locale=fr.
- Conroy, P.J. (1991). Deterioration of water quality in distribution systems – the effects of water quality arising from in situ cement lining (APP 9770). Water Research Centre, Swindon, Wiltshire, UK. (Report No. DoE 2435-SW (P)).
- Conroy, P.J., Kings, K., Olliffe, T., Kennedy, G. et Blois, S. (1994). Durability and environmental impact of cement mortar linings. Water Research Centre, Swindon, Wiltshire, UK. (Report No. FR 0473).
- Copeland, R.C., D.A. Lytle et D.D. Dionysiou (2007) Desorption of Arsenic from Drinking water Distribution System Solids, Environmental Monitoring and Assessment, 127: 523–535.
- Cordonnier, J. (1997). Protection des réseaux de distribution par les inhibiteurs de corrosion. Choix et optimisation. Tech. Sci. Meth. Gen. Urbain Gen. Rural, 5: 75–82.
- Cornwell, D. A. et Wagner, J. R. (2019). Coupon procedures for evaluating Lead and copper solubility. Journal AWWA, 111, 12–24. https://doi.org/10.1002/awwa.1377
- Craik, S., Gammie, L., Gao, M., Melnychuk, P. et Bruineman, C. (2008). Lead at customer's taps: results of the 2007 sampling program. Final report by EPCOR Water Services (Quality Assurance), Edmonton, AB.
- Crittenden, J.C., Trussell, R.R., Hand, D.W., Howe, K.J. et Tchobanoglous, G. (2012). Water Treatment: Principles and Design, 3rd edition. John Wiley & Sons, Hoboken, NJ.
- CSA (2018a). American Society of Mechanical Engineers/Canadian Standards Association ASME A112.18.1-2018/CSA B125.1-18 – Plumbing supply fittings. CSA Group, Mississauga, ON.
- CSA (2018b). Canadian Standards Association CSA B125.3-18 – Plumbing supply fittings. CSA Group, Mississauga, ON.
- Del Toral, M.A., Porter, A. et Schock, M.R. (2013). Detection and evaluation of elevated lead release from service lines: a field study. Environ. Sci. Technol., 47(16): 9300–9307.
- De Mora, S.J. et Harrison, R.M. (1984). Lead in tap water: contamination and chemistry. Chem. Br., 20(10):900–904.
- DeSantis, M.K., Schock, M.R., Tully, J. et Bennett-Stamper, C. (2020). Orthophosphate interactions with destabilized PbO2 scales. Environ. Sci. Technol., 54 (22), 14302–14311. DOI: 10.1021/acs.est.0c03027
- Deshommes, E., Laroche, L., Nour, S., Cartier, C. et Prévost, M. (2010a). Source and occurrence of particulate lead in tap water. Water Res., 44(12): 3734–3744.
- Deshommes, E., Zhang, Y., Gendron, K., Sauvé, S., Edwards, M., Nour, S. et Prévost, M. (2010b). Lead Removal from Tap Water Using POU Devices. J. Am. Water Works Assoc. 2010, 102 (10), 91–105.
- Deshommes, E., Nour, S., Richer, B., Cartier, C. et Prévost, M. (2012). POU devices in large buildings: lead removal and water quality. J. Am. Water Works Assoc., 104(4): E282–E297.
- Deshommes, E., Andrews, R., Gagnon, G., McCluskey, T., McIlwain, Doré, E., Nour, S. et Prévost, M. (2016). Evaluation of exposure to lead from drinking water in large buildings. Water Res., 99: 46–55.
- Deshommes, E., Bannier, A., Laroche, L., Nour, S. et Prévost, M. (2016b). Monitoring‐based framework to detect and manage lead water service lines. Journal‐American Water Works Association, 108(11), E555-E570.
- Deshommes, E., Laroche, L., Deveau, D., Nour, S. et Prévost, M. (2017). Short-and long-term lead release after partial lead service line replacements in a metropolitan water distribution system. Environ. Sci. Technol., 51(17), 9507–9515.
- Deshommes, E., Trueman, B., Douglas, I., Huggins, D., Laroche, L., Swertfeger, J., Spielmacher, A., Gagnon, G. A. et Prévost, M. (2018). Lead Levels at the Tap and Consumer Exposure from Legacy and Recent Lead Service Line Replacements in Six Utilities. Environ. Sci. Technol., 52(16), 9451–9459.
- Dodrill, D.M. et Edwards, M. (1995). Corrosion control on the basis of utility experience. J. Am. Water Works Assoc., 87(7): 74–85.
- Doré, E., Deshommes, E., Andrews, R.C., Nour, S. et Prévost, M. (2018). Sampling in schools and large institutional buildings: Implications for regulations, exposure and management of lead and copper. Water Res., 140 (2018) 110—122.
- Doré, E., Deshommes, E., Laroche, L., Nour, S. et Prévost, M. (2019). Study of the long-term impacts of treatments on lead release from full and partially replaced harvested lead service lines. Water Res. 149: 566e577.
- Doré, E., Formal, C., Muhlen, C., Williams, D., Harmon, S., Pham, M., Triantafyllidou, S. et Lytle, D. A. (2021). Effectiveness of point-of-use and pitcher filters at removing lead phosphate nanoparticles from drinking water. Water Res., 201, 117285.
- Douglas, B.D. et Merrill, D.T. (1991). Control of water quality deterioration caused by corrosion of cement-mortar pipe linings. AWWA Research Foundation, American Water Works Association, Denver, CO.
- Douglas, B.D., Merrill, D.T. et Caitlin, J.O. (1996). Water quality deterioration from corrosion of cement-mortar linings. J. Am. Water Works Assoc., 88(7): 99–107.
- Douglas, I., Guthmann, J., Muylwyk, Q. et Snoeyink, V. (2004). Corrosion control in the City of Ottawa – Comparison of alternatives and case study for lead reduction in drinking water. Dans : W. Robertson and T. Brooks (eds.), 11th Canadian National Drinking Water Conference and 2nd Policy Forum, April 3–6, Calgary, AB. Canadian Water and Wastewater Association, Ottawa, ON.
- Douglas, I., Lemieux, F. et Weir, D. (2007). Testing the waters: putting Canada's new corrosion control guideline into practice. Dans : Proceedings of the 2007 AWWA Research Symposium—Distribution Systems: The Next Frontier, March 2–3, 2007, Reno, NV. American Water Works Association, Denver, CO.
- Duckworth, O.W. et Martin, S.T. (2004). Role of molecular oxygen in the dissolution of siderite and rhodochrosite. Geochim. Cosmochim. Acta, 68(3) : 607-621.
- Dudi, A. et Edwards, M. (2004). Galvanic corrosion of lead bearing plumbing devices. Dans : Reconsidering lead corrosion in drinking water: Product testing, direct chloramine attack and galvanic corrosion. Faculty of the Virginia Polytechnic Institute and State University, Blacksburg, VA. pp. 69–105 (A. Dudi Master's Thesis).
- Edwards, M. et Dudi, A. (2004). Role of chlorine and chloramine in corrosion of lead-bearing plumbing materials. J. Am. Water Works Assoc., 96(10): 69–81.
- Edwards, M. et Ferguson, J.F. (1993). Accelerated testing of copper corrosion. J. Am. Water Works Assoc., 85(10): 105–113.
- Edwards, M. et McNeill, L.S. (2002). Effect of phosphate inhibitors on lead release from pipes. J. Am. Water Works Assoc., 94(1): 79–90.
- Edwards, M. et Sprague, N. (2001). Organic matter and copper corrosion by-product release: a mechanistic study. Corros. Sci., 43(1): 1–18.
- Edwards, M. et Triantafyllidou, S. (2007). Chloride-to-sulfate mass ratio and lead leaching to water. J. Am. Water Works Assoc., 99(7): 96–109.
- Edwards, M., Ferguson, J.F. et Reiber, S.H. (1994a). The pitting corrosion of copper. J. Am. Water Works Assoc., 86(7): 74–90.
- Edwards, M., Meyer, T.E. et Rehring, J.P. (1994b). Effect of selected anions on copper corrosion rates. J. Am. Water Works Assoc., 86(12): 73–81.
- Edwards, M., Schock, M.R. et Meyer, T.E. (1996). Alkalinity, pH, and copper corrosion by-product release. J. Am. Water Works Assoc., 88(3): 81–94.
- Edwards, M., Jacobs, S. et Dodrill, D.M. (1999). Desktop guidance for mitigating Pb and Cu corrosion by-products. J. Am. Water Works Assoc., 91(5): 66–77.
- Edwards, M., Hidmi, L. et Gladwell, D. (2002). Phosphate inhibition of soluble copper corrosion by-product release. Corros. Sci., 44(5): 1057–1071.
- Edwards, M., Arnold, R., Rosenfeldt, B., Masters, S.V., Parks, J. et Tang, M. (2023). Utility considerations in developing a galvanized iron water pipe management plan. AWWA Water Science, 5 (4): e1350. https://doi.org/10.1002/aws2.1350
- Eisnor, J.D. et Gagnon, G.A. (2003). A framework for the implementation and design of pilot-scale distribution systems. J. Water Supply Res. Technol. – Aqua, 57(7): 501–520.
- Emde, K.M.E., Smith, D.W. and Facey, R.M. (1992) Initial investigation of microbially influenced corrosion (MIC) in a low temperature water distribution system. Water Res., 26(2): 169–175.
- Facey, R.M. et Smith, D.W. (1995). Soft, low-temperature water-distribution corrosion: Yellowknife, NWT. J. Cold Reg. Eng., 9(1): 23–40.
- Feigenbaum, C., Gal-Or, L. et Yahalom, J. (1978). Scale protection criteria in natural waters. Corrosion, 34(4): 133.
- Ferguson, J.F., Franqué, O.V. et Schock, M.R. (1996). Corrosion of copper in potable water systems. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 231–268.
- Frateur, I., Deslouis, C., Kiene, L., Levi, Y. et Tribollet, B. (1999). Free chlorine consumption induced by cast iron corrosion in drinking water distribution systems. Water Res., 33(8): 1781–1790.
- Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L. et Korshin, G.V. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation, Denver, CO (Project No. 3118).
- Friedman, M., Hill, A., Booth, S., Hallett, M., McNeill, L., McLean, J., Sorensen, D., Hammer, T., De Haan, M., MacArthur, K. et Mitchell, K. (2016). Metals accumulation and release within the distribution system: Evaluation and mitigation. Water Research Foundation, Denver, CO.
- Gao, Y., Trueman, B. F. et Gagnon, G. A. (2022). Early phase effects of silicate and orthophosphate on lead (Pb) corrosion scale development and Pb release. Journal of Environmental Management, 321, 115947.
- Gardels, M.C. et Sorg, T.J. (1989). A laboratory study of the leaching of lead from water faucets. J. Am. Water Works Assoc., 81(7): 101–113.
- Giani, R., Donnelly, M. et Ngantcha, T. (2005). The Effects of Changing Between Chloramine and Chlorine Disinfectants on Lead Leaching. Proc. AwwA Water Quality Technology Conference, Ville de Québec, Canada.
- Gnaedinger, R.H. (1993). Lead in school drinking water. J. Environ. Health, 55(6): 15–18.
- Gregory, R. (1990). Galvanic corrosion of lead solder in copper pipework. J. Inst. Water Environ. Manage., 4(2): 112–118.
- Hatch, G.B. (1969). Polyphosphate inhibitors in potable water. Mater. Prot., 8(11): 31–35.
- Hayes, C.R., (2010). Best Practice Guide on the Control of Lead in Drinking Water. IWA Publishing, London, UK.
- Hayes, C.R. et Croft, T.N. (2012). An investigation into the representativeness of random daytime sampling for lead in drinking water, using computational modelling. J. Water Supply Res. Technol. – Aqua, 61(3): 142-152.
- Hayes, C.R., Incledion, S. et Balch, M. (2008). Experience in Wales (UK) of the optimization of ortho-phosphate dosing for controlling lead in drinking water. J. Water Health, 6(2): 177–185.
- Hayes, C.R., Croft, T.N., Phillips, E., Craik, S. et Schock, M. (2014). Optimisation of plumbosolvency control using computation modelling techniques: a demonstration project for the Government of Alberta, working with the City of Calgary and EPCOR (Edmonton). WQM Associates, Pembrokeshire, Royaume-Uni.
- Hedberg, T. et Johansson, E. (1987). Protection of pipes against corrosion. Water Supply, 5(3/4): SS20-1–SS20-7.
- Hidmi, L. et Edwards, M. (1999). Role of temperature and pH in Cu(OH)2 solubility. Environ. Sci. Technol., 33(15): 2607–2610.
- Hill, A.S et Lemieux, F.(2022a). Main Cleaning Strategies Remove Legacy Manganese. Opflow 48(5): 16-22. American Water Works Association. Denver, CO. DOI: 10.1002/opfl.1687
- Hill, A.S et Lemieux, F.(2022b). Beware of Legacy Manganese Issues in Distribution Systems. Opflow 48(1): 16-21. American Water Works Association. Denver, CO. https://doi.org/10.1002/opfl.1633
- Holm, T.R. et Schock, M.R. (1991). Potential effects of polyphosphate products on lead solubility in plumbing systems. J. Am. Water Works Assoc., 83(7): 76–82.
- Holm, T.R., Smothers, S.H., Xiaofeng, Z. et Schock, M.R. (1989). Polyphosphate water-treatment products: their effects on the chemistry and solubility of lead in potable water systems. Dans : Proceedings of the 1989 AWWA Water Quality Technology Conference, Philadelphia, PA. American Water Works Association, Denver, CO.
- Holtschulte, H. et Schock, M.R. (1985). Asbestos–cement and cement-mortar-lined pipes. Dans : Internal Corrosion of Water Distribution Systems. American Water Works Association Research Foundation and DVGW Engler Bunte Institute, Denver, CO. pp. 417–512.
- Hong, P.K.A. et Macauley, Y. (1998). Corrosion and leaching of copper tubing exposed to chlorinated drinking water. Water Air Soil Pollut., 108(3–4): 457–471.
- Horsley, M.B., Northup, B.W., O'Brien, W.J. et Harms, L.L. (1998). Minimizing iron corrosion in lime softened water. Dans : Proceedings of the 1998 AWWA Water Quality Technology Conference, San Diego, CA. American Water Works Association, Denver, CO.
- Hoyt, B.P., Kirmeyer, G.J. et Courchene, J.E. (1979). Evaluating home plumbing corrosion problems. J. Am. Water Works Assoc., 71(12): 720.
- Huggins, D. (2007). City of London lead testing and remediation programs. Dans : Proceedings of the Ontario Water Works Association Distribution System Workshop, Toronto, ON. Ontario Water Works Association, Markham, ON.
- Hulsmann, A.D. (1990). Particulate lead in water supplies. J. Inst. Water Environ. Manage., 4: 19–25.
- Imran, S. A., Dietz, J. D., Mutoti, G., Taylor, J. S., Randall, A. A. et Cooper, C.D. (2005). Red water release in drinking water distribution systems. J. Am. Water Works Assoc., 97(9), 93–100.
- Jackson, P. (2000). Monitoring the performance of corrective treatment methods. WRc-NSF Ltd., Oakdale, Gwent, UK.
- Jackson, P.J. et Ellis, J.C. (2003). Demonstration of optimisation of plumbosolvency treatment and control measures. Drinking Water Inspectorate, Buckinghamshire, UK. Report No. DWI 6173
- Karalekas, P.C., Ryan, C.R., Larson, C.D. et Taylor, F.B. (1978). Alternative methods for controlling the corrosion of lead pipes. J. N. Engl. Water Works Assoc., 92(2): 159–178.
- Karalekas, P.C., Ryan, C.R. et Taylor, F.B. (1983). Control of lead, copper, and iron pipe corrosion in Boston. J. Am. Water Works Assoc., 75(2): 92–95.
- Kashinkunti, R.D., Metz, D.H., Hartman, D.J. et DeMarco, J. (1999). How to reduce lead corrosion without increasing iron release in the distribution system. Dans : Proceedings of the 1999 AWWA Water Quality Technology Conference, Tampa Bay, FL. American Water Works Association, Denver, CO.
- Katner, A, Pieper, K., Brown, K., Lin H., Parks, J., Wang., X., Hu, C-H, Masters, S., Mielke, H. et Edwards, M.E. (2018). Effectiveness of Prevailing Flush Guidelines to Prevent Exposure to Lead in Tap Water. Int. J. Environ. Res. Public Health, (15): 1537; DOI:10.3390/ijerph15071537
- Kim, E. J., Herrera, J. E., Huggins, D., Braam, J. et Koshowski, S. (2011). Effect of pH on the concentrations of lead and trace contaminants in drinking water: a combined batch, pipe loop and sentinel home study. Water research, 45(9), 2763-2774.
- Kimbrough, D.E. (2001). Brass corrosion and the LCR monitoring program. J. Am. Water Works Assoc., 93(2): 81–91.
- Korshin, G.V., Pery, S.A.L. et Ferguson, J.F. (1996). Influence of NOM on copper corrosion. J. Am. Water Works Assoc., 88(7): 36–47.
- Korshin, G.V., Ferguson, J.F., Lancaster, A.N. et Wu, H. (1999). Corrosion and metal release for lead-containing materials: influence of NOM. Water Research Foundation, Denver, CO. (AWWA Research Foundation Project No. 90759. No. 4349).
- Korshin, G.V., J.F. Ferguson, et A.N. Lancaster (2000). Influence of Natural Organic Matter on the Corrosion of Leaded Brass in Potable Water, Corros. Sci., 42: 53–66.
- Korshin, G.V., Ferguson, J.F. et Lancaster, A.N. (2005). Influence of natural organic matter on the morphology of corroding lead surfaces and behavior of lead-containing particles. Water Res., 39(5): 811–818.
- Kuch, A. et Wagner, I. (1983). A mass transfer model to describe lead concentrations in drinking water. Water Supply, 17(10): 1330–1307.
- Kwan, P. (2007). Lead in water: release before and after a lead service line replacement. Dans : Proceedings of the Ontario Water Works Association Distribution System Workshop, Toronto, ON. Ontario Water Works Association, Markham, ON.
- Larson, T.E. (1966). Chemical corrosion control. J. Am. Water Works Assoc., 49(12): 1581.
- Larson, T.E. et Skold, R.V. (1958). Current research on corrosion and tuberculation of cast iron. J. Am. Water Works Assoc., 50(11): 1429–1432.
- LeChevallier, M.W., Cawthon, C.D. et Lee, R.G. (1988) Inactivation of biofilm bacteria. Appl. Environ. Microbiol., 54: 2492–2499.
- LeChevallier, M.W., Lowry, C.D., Lee, R.G. et Gibbon, D.L. (1993). Examining the relationship between iron corrosion and the disinfection of biofilm bacteria. J. Am. Water Works Assoc., 87(7): 111–123.
- LeChevallier, M.W., Welch, N.J. et Smith, D.B. (1996). Full-scale studies of factors related to coliform regrowth in drinking water. Appl. Environ. Microbiol., 62(7): 2201–2211.
- Lee, R.G., Becker, W.C. et Collins, D.W. (1989). Lead at the tap: sources and control. J. Am. Water Works Assoc., 81(7): 52–62.
- Lehrman, L. et Shuldener, H.L. (1951). The role of sodium silicate in inhibiting corrosion by film formation on water piping. J. Am. Water Works Assoc., 43(3): 175–188.
- Leroy, P. (1993). Lead in drinking water—Origins; solubility; treatment. J. Water Supply Res. Technol. – Aqua, 42(4): 223–238.
- Leroy, P., Schock, M.R., Wagner, I. et Holtschulte, H. (1996). Cement-based materials. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 313–388.
- Li, B., Trueman, B. F., Rahman, M. S., Gao, Y., Park, Y. et Gagnon, G. A. (2019). Understanding the impacts of sodium silicate on water quality and iron oxide particles. Environ. Sci.: Water Res. Technol., 5(8), 1360-1370.
- Li, B., Trueman, B. F., Munoz, S., Locsin, J. A. et Gagnon, G. A. (2021a). Impact of sodium silicate on lead release and colloid size distributions in drinking water. Water Research, 190, 116709.
- Li, B., Trueman, B. F., Rahman, M. S. et Gagnon, G. A. (2021b). Controlling lead release due to uniform and galvanic corrosion—an evaluation of silicate-based inhibitors. Journal of Hazardous Materials, 407, 124707.
- Li, B., Trueman, B.F., Doré, E. et Gagnon, G.A. (2021c). Effectiveness of sodium silicates for lead corrosion control: A critical review of current data. Environmental Science & Technology Letters, 8 (11), 932-939. Disponible à : DOI: 10.1021/acs.estlett.1c00671
- Lin, Y.-P. et Valentine, R.L. (2008a). The release of lead from the reduction of lead oxide (PbO2) by natural organic matter. Environ. Sci. Technol., 42(3): 760–765.
- Lin, Y.-P, et Valentine, R.L. (2008b). Release of Pb(II) from Monochloramine-Mediated Reduction of Lead Oxide (PbO2). Environ. Sci. Technol., 42 (24): 9137–9143.
- Lin, N.-H., Torrents, A., Davis, A.P. et Zeinali, M. (1997). Lead corrosion control from lead, copper–lead solder, and brass coupons in drinking water employing free and combined chlorine. J. Environ. Sci. Health A, 32(4): 865–884.
- Lintereur P.A., Duranceau S.J. et Taylor J.S. (2011). Sodium silicate impacts on copper release in a potable water comprised of ground, surface and desalted sea water supplies. Desalin. Water Treat. 30, 348-360 DOI: 10.5004/dwt.2011.2255
- Loschiavo, G.P. (1948). Experiences in conditioning corrosive army water supplies in New England. Corrosion, 4(1): 1–14.
- Lowry, J., (2009). Lakhurst Acres, ME: Compliance issues engineering problems and solutions. U.S. EPA Sixth annual drinking water workshop: Small drinking water system challenges and solutions. August 4-6, 2009. Cincinatti, Ohio.
- Lowry, J., (2010). Corrosion control with air stripping. American Water Work Association. Inorganic Contaminants Workshop, Denver, Colorado.
- LSLR Collaborative (2023). Lead service line collaborative (site Web). Disponible à : https://www.lslr-collaborative.org/preparing-an-inventory.html
- Lyon, T.D.B. et Lenihan, M.A. (1977). Corrosion in solder jointed copper tubes resulting in lead contamination of drinking water. Br. Corros. J., 12(1): 41–45.
- Lyons, J.J., Pontes, J. et Karalekas, P.C. (1995). Optimizing corrosion for lead and copper using phosphoric acid and sodium hydroxide. Dans : Proceedings of the 1995 AWWA Water Quality Technology Conference, New Orleans, LA. American Water Works Association, Denver, CO.
- Lytle, D.A. et Schock, M.R. (2000). Impact of stagnation time on metal dissolution from plumbing materials in drinking water. J. Water Supply Res. Technol. – Aqua, 49(5): 243–257.
- Lytle, D.A. et Schock, M.R. (2005). Formation of Pb(IV) oxides in chlorinated water. J. Am. Water Works Assoc., 97(11): 102–114.
- Lytle, D.A. et Snoeyink, V.L. (2002). Effect of ortho- and polyphosphate on the properties of iron particles and suspensions. J. Am. Water Works Assoc., 94(10): 87–99.
- Lytle, D.A., Schock, M.R., Dues, N.R. et Clark, P.J. (1993). Investigating the preferential dissolution of lead from solder particulates. J. Am. Water Works Assoc., 85(7): 104–110.
- Lytle, D.A., Sarin, P. et Snoeyink, V.L. (2003). The effect of chloride and orthophosphate on the release of iron from a drinking water distribution system cast iron pipe. Dans : Proceedings of the 2003 AWWA Water Quality Technology Conference, Philadelphia, PA. American Water Works Association, Denver, CO.
- Lytle, D.A., Sorg, T.J. et Frietch, C. (2004). Accumulation of arsenic in drinking water distribution systems. Environ. Sci. Technol., 38(20): 5365–5372.
- Lytle, D.A., Williams, D. et White, C. (2012). A simple approach to assessing copper pitting corrosion tendencies and developing control strategies. J. Water Supply Res. T. – Aqua, 63(3): 164–175.
- Lytle, D. A., Sorg, T., Wang, L. et Chen, A. (2014). The accumulation of radioactive contaminants in drinking water distribution systems. Water Res., 50, 396–407.
- Lytle, D. A., Schock, M. R., Wait, K., Cahalan, K., Bosscher, V., Porter, A. et Del Toral, M. (2019). Sequential drinking water sampling as a tool for evaluating lead in Flint, Michigan. Water research, 157, 40-54.
- Lytle, D.A., Tang, M., Francis, A.T., O'Donnell, A.J. et Newton, J.L. (2020). The effect of chloride, sulfate and dissolved inorganic carbon on iron release from cast iron. Water Res. 183:116037
- Maas, R.P., Patch, S.C., Kucken, D.J. et Peek, B.T. (1991). A multi-state study of the effectiveness of various corrosion inhibitors in reducing residential lead levels. Dans : Proceedings of the 1991 AWWA Annual Conference, Philadelphia, PA. American Water Works Association, Denver, CO.
- Maas, R.P., Patch, S.C. et Gagnon, A.M. (1994). The dynamics of lead in drinking water in US workplaces and schools. J. Am. Ind. Hyg. Assoc., 55: 829–832.
- Maddison, L.A. et Gagnon, G.A. (1999). Evaluating corrosion control strategies for a pilot scale distribution system. Dans : Proceedings of the 1999 AWWA Water Quality Technology Conference, Tampa Bay, FL. American Water Works Association, Denver, CO.
- Masters, S. et Edwards, M. (2015). Increased Lead in Water Associated with Iron Corrosion. Environ. Eng. Sci., Vol. 32 (5): 150127063128008. Disponible à : DOI: 10.1089/ees.2014.0400
- Masters, S., Welter, G.J. et Edwards, M. (2016). Seasonal variations in lead release to potable water. Environ. Sci. Technol., 50(10): 5269–5277.
- Masters, S. V., Poncelet-Johnson, N., Walsh, R., Seidel, C. J. et Corwin, C. J. (2022). Comparison of coupon and pipe rack studies for selecting corrosion control treatment. AWWA Water Science, 4(4), e1293. https://doi.org/10.1002/aws2.1293
- McCauley, R.F. (1960). Use of polyphosphate for developing protective calcite. J. Am. Water Works Assoc., 52(6): 721.
- McFadden, M., Giani, R., Kwan, P. et Reiber, S.H. (2011). Contributions to drinking water lead from galvanized iron corrosion scales. J. Am. Water Works Assoc., 103:4:76.
- McIlwain, B., Park, Y. et Gagnon, G.A. (2015). Fountain autopsy to determine lead occurrence in drinking water. J. Environ. Eng., 142(3):04015083. Disponible à : DOI: 10.1061/(ASCE)EE.1943-7870.0001047
- McNeill, L.S. et Edwards, M. (2001). Iron pipe corrosion in distribution systems. J. Am. Water Works Assoc., 93(7): 88–100.
- McNeill, L.S. et Edwards, M. (2002). Phosphate inhibitor use at US utilities. J. Am. Water Works Assoc., 94(7): 57–63.
- McNeill, L.S. et Edwards, M. (2004). Importance of Pb and Cu particulate species for corrosion control. J. Environ. Eng., 130(2): 136-144.
- Méranger, J.C., Subramanian, K.S. et Chalifoux, C. (1981). Survey for cadmium, cobalt, chromium, copper, nickel, lead, zinc, calcium, and magnesium in Canadian drinking water supplies. J. Assoc. Off. Anal. Chem., 64(1): 44–53.
- Merill, D.T. et Sanks, R.L. (1978). Corrosion control by deposition of CaCO3 films. Part 3. A practical approach for plant operators. J. Am. Water Works Assoc., 70(1): 12.
- Miller-Schulze, J., Ishikawa, C. et Foran, J. (2019). Assessing lead-contaminated drinking water in a large academic institution: a case study. J. Water Health. 17 (5): 728–736. Disponible à : DOI: 10.2166/wh.2019.025.
- Mordak J. et Wheeler J. (1988). Deterioration of asbestos cement water mains (MSP 9731 SLD): final report to the Department of the Environment. Swindon, United Kingdom: Water Research Council (https://cdn.dwi.gov.uk/wp-content/uploads/2020/10/27105803/dwi0131.pdf)
- Mulhern, R. et Macdonald Gibson, J. (2020). Under-sink activated carbon water filters effectively remove lead from private well water for over six months.Water 12(12):3584. Disponible à : DOI: 10.3390/w12123584
- Murphy, E.A. (1993). Effectiveness of flushing on reducing lead and copper levels in school drinking water. Environ. Health Perspect., 101(3): 240–241.
- National Academies of Sciences, Engineering, and Medicine (NASEM) (2020). Management of Legionella in Water Systems. Washington, DC: The National Academies Press. https://doi.org/10.17226/25474.
- Neff, C.H., Schock, M.R. et Marden, J. (1987). Relationships between water quality and corrosion of plumbing materials in buildings. Vol. 1. Galvanized steel and copper plumbing systems. U.S. Environmental Protection Agency, Washington, DC (Report No. EPA/600/2-87/036A).
- Neuman, W.E. (1995). AWWC experience with zinc orthophosphate treatment. J. N. Engl. Water Works Assoc., 109: 57–60.
- Ngueta, G., Prévost, M., Deshommes, E., Abdous, B., Gauvin, D. et Levallois, P. (2014). Exposure of young children to household water lead in the Montreal area (Canada): the potential influence of winter-to-summer changes in water lead levels on children's blood lead concentration. Environ. Int., 73 : 57–65.
- Nguyen, C., Edwards, M., Stone, K., Clark, B., Gagnon, G. et Knowles, A. (2010). Impact of chloride:sulfate mass ratio (CSMR) changes on lead leaching in potable water. Water Research Foundation and U.S. Environmental Protection Agency, Denver, Colorado.
- Nielsen, K. (1983). Control of metal contaminants in drinking water in Denmark. J. Water Supply Res. Technol. – Aqua, 32(4): 173–182.
- Nielsen, K. et Andersen, A. (2001). Metal release from domestic water installations. Dans : Proceedings of the 6th International CEOCOR Congress, Giardini/Naxos, Italy. European Committee for the Study of Corrosion and Protection of Pipes, Brussels.
- NRCC (2015). National Plumbing Code. National Research Council of Canada, Ottawa, ON.
- NSF International (2021). NSF/ANSI/CAN Standard 60 (. Ann Arbor, MI.
- NSF International (2022a). NSF/ANSI/CAN Standard 61: Composants du système d'eau potable – Effets sur la santé. Ann Arbor, MI.
- NSF International (2022b). NSF/ANSI/CAN Standard 372: Composants du système d'eau potable —Teneur en plomb. Ann Arbor, MI
- NSF International (2022c). NSF/ANSI Standard 53: Drinking water treatments units—Health effects. NSF International, Ann Arbor, MI.
- NSF International (2022d). NSF/ANSI 58: Reverse osmosis drinking water treatment systems. NSF International, Ann Arbor, MI.
- NSF International (2022e). NSF/ANSI Standard 62: Drinking water distillation system. NSF International, Ann Arbor, MI.
- Oliphant, R.J. (1983a). Summary report on the contamination of potable water by lead from soldered joints. Wrc Engineering, Swindon, Wiltshire, UK. (Report No. ER 125E).
- Oliphant, R.J. (1983b). Lead contamination of potable water arising from soldered joints. Water Supply, 1(2/3): SS 18-5–SS 18-9.
- Oliphant, R.J. (1993). Changing perception of the significance of potential sources of lead contamination in domestic water systems. Water Supply, 11(3/4): 339–412.
- Organisation mondiale de la Santé (OMS). (2022a). Guidelines for drinking-water quality: Fourth edition incorporating the first and second addenda. Disponible à : https://www.who.int/publications/i/item/9789240045064
- Organisation mondiale de la Santé (OMS). (2022b). Plomb dans l'eau de boisson: Risques pour la santé, surveillance et mesures correctives –Note technique. Disponible à : https://www.who.int/fr/publications/i/item/9789240020863
- Pan, W., Johnson, E.R. et Giammar, D.E. (2020). Accumulation on and Extraction of Lead from Point-of-Use Filters for Evaluating Lead Exposure from Drinking Water. Environ. Sci. Water Res. Technol., 6, 2734.
- Peng, C.Y., Ferguson, J.F. et Korshin, G.V. (2013). Effects of chloride, sulfate and natural organic matter (NOM) on the accumulation and release of trace-level inorganic contaminants from corroding iron. Water Res., 47(14), 5257–5269.
- Peters, N.J., Davidson, C.M., Britton, A. et Robertson, S.J. (1999). The nature of corrosion products in lead pipes used to supply drinking water to the City of Glasgow, Scotland, UK. Fresen. J. Anal. Chem., 363(5/6): 562–565.
- Pieper, K.J., Krometis, L.A., Gallagher, D.L., Benham, B.L et Edwards, M. (2015). Incidence of waterborne lead in private drinking water systems in Virginia. J. Water Health, 13(3): 897–908.
- Pieper, K.J., Krometis, L.A. et Edwards, M. (2016). Quantifying Lead-Leaching Potential from Plumbing Exposed to Aggressive Waters. J. Amer. Water W Assoc. 108:9m. pp. E458–E466.
- Pieper, K.J., Tang, M. et Edwards, M.A. (2017). Flint water crisis caused by interrupted corrosion control: Investigating "ground zero" home. Enviro. Sci. Technol., 51(4), 2007–2014.
- Pieper, K.J., Martin, R., Tang, M., Walters, L., Parks, J., Roy, S., Devine, C. et Edwards, M.A. (2018). Evaluating water lead levels during the Flint water crisis. Enviro. Sci. and Technol., 52(15), 8124–8132.
- Pinney, K., Craik, S., Gamal El-Din, M., Kindzierski, W., Gammie, L., Emde, K. et Westergard, J. (2007). Opportunities for improving drinking water quality in large buildings. Dans : Proceedings of the Western Canada Water and Wastewater Association Annual Conference, Edmonton, AB. Western Canada Water and Wastewater Association, Calgary, AB.
- Pisigan, R.A. et Singley, J.E. (1987). Influence of buffer capacity, chlorine residual, and flow rate on corrosion of mild steel and copper. J. Am. Water Works Assoc., 79(2): 62–70.
- Purchase, J.M., Rouillier, R., Kelsey J. Pieper, K.J. et Edwards, M. (2020). Understanding Failure Modes of NSF/ANSI 53 Lead-Certified Point-of-Use Pitcher and Faucet Filters. Disponible à : https://dx.doi.org/10.1021/acs.estlett.0c00709
- Randtke, S.J., Peltier, E.F., Adams, C.D., Lane, R.F., Breault, Z.A., Carter, R. E. Jr. et Roberson, J.A. (2017). Evaluation of Lead Service line lining and coating technologies. Water Research Foundation, Denver, Colorado. Project No. 4351.
- Reda, M.R. et Alhajji, J.N. (1996). Role of solution chemistry on corrosion of copper in tap water: effect of sulfate ion concentration on uniform and localized attack. Corrosion, 52(2): 232–239.
- Rehring, J.P. et Edwards, M. (1996). Copper corrosion in potable water systems: impacts of natural organic matter and water treatment processes. Corrosion, 52(4): 301–317.
- Reiber, S.H. (1987). Corrosion monitoring and control in the Pacific Northwest. J. Am. Water Works Assoc., 71(2): 71–74.
- Reiber, S.H. (1989). Copper plumbing surfaces: an electrochemical study. J. Am. Water Works Assoc., 87(7): 114.
- Reiber, S.H. et Dostal, G. (2000). Well water disinfection sparks surprises. Opflow, 26(3): 1, 4–6, 14.
- Reiber, S.H., Ryder, R.A. et Wagner, I. (1996). Corrosion assessment technologies. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 445–486.
- Renner, R. (2004). Leading to lead. Sci. Am., 291(1): 22, 24.
- Renner, R. (2006). Lead in water linked to coagulant. Environ. Sci. Technol., 40(17): 5164–5165.
- Rezania, L.W. et Anderl, W.H. (1995). Copper corrosion and iron removal plants. The Minnesota experience. Dans : Proceedings of the 1995 AWWA Water Quality Technology Conference, New Orleans, LA. American Water Works Association, Denver, CO.
- Rezania, L.W. et Anderl, W.H. (1997). Corrosion control for high DIC groundwater phosphate or bust. Dans : Proceedings of the 1997 AWWA Annual Conference, Atlanta, GA. American Water Works Association, Denver, CO.
- Samuels, E.R. et Méranger, J.C. (1984). Preliminary studies on the leaching of some trace metals from kitchen faucets. Water Res., 18(1): 75–80.
- Sandvig, A. (2007). Field evaluation of the impact of faucet replacement on lead levels measured at the tap. Dans : Proceedings of the 2007 AWWA Research Symposium – Distribution Systems: The Next Frontier, March 2–3, 2007, Reno, NV. American Water Works Association, Denver, CO.
- Sandvig, A., Kwan, P., Kirmeyer, G., Maynard, B., Mast, D., Trussell, R.R., Trussell, S., Cantor, A. et Prescott, A. (2008). Contribution of service line and plumbing fixtures to lead and copper rule compliance issues. Water Research Foundation, Denver, Colorado (Awwa Research Foundation Project No. 90721).
- Santé Canada (1989). Recommandations pour la qualité de l'eau potable au Canada : document technique – l'amiante. Bureau des dangers des produits chimiques, Direction de l'hygiène du milieu, Santé Canada, Ottawa (Ontario).
- Santé Canada (2013). Recommandations pour la qualité de l'eau potable au Canada : document technique – le chlorure de vinyle. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2019a). Recommandations pour la qualité de l'eau potable au Canada : document technique – le plomb. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2019b). Recommandations pour la qualité de l'eau potable au Canada – Document technique : Le cuivre. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2019c). Assessment of the Impacts of Iron in Drinking Water Distribution Systems. Préparé par Armview Engineering Limited pour le Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible sur demande.
- Santé Canada (2019d). Recommandations pour la qualité de l'eau potable au Canada : document technique – le manganèse. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2020a). Recommandations pour la qualité de l'eau potable au Canada : document technique : cadmium. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2020b). Recommandations pour la qualité de l'eau potable au Canada : document technique – aluminium. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2020c). Document de conseils sur la matière organique naturelle dans l'eau potable. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2022). Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2023a). Infographie : Nettoyage des aérateurs de robinets. Santé Canada, Direction générale de la santé environnementale et de la sécurité des consommateurs. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/infographie-nettoyage-aerateurs-robinets.html
- Santé Canada (2023b). Infographie : Se procurer un filtre à eau potable certifié pour le plomb. Santé Canada, Direction générale de la santé environnementale et de la sécurité des consommateurs. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/infographie-procurer-filtre-eau-potable.html
- Santé Canada (2024). Recommandations pour la qualité de l'eau potable au Canada : Document technique –Fer. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-fer.html
- Sarin, P., Bebee, J., Becket, M.A., Jim, K.K., Lytle, D.A., Clement, J.A., Kriven, W.M. et Snoeyink, V.L. (2000). Mechanism of release of iron from corroded iron/steel pipes in water distribution systems. Dans : Proceedings of the 2000 AWWA Annual Conference, Denver, CO. American Water Works Association, Denver, CO.
- Sarin, P., Clement, J.A., Snoeyink, V.L. et Kriven, W.M. (2003). Iron release from corroded, unlined cast-iron pipe. J. Am. Water Works Assoc., 95(11): 85–96.
- Sarin, P., Snoeyink, V.L., Lytle, D.A. et Kriven, W.M. (2004). Iron Corrosion Scales: Model for Scale Growth, Iron Release, and Colored Water Formation. J. Environ. Eng, 130:4:364.
- Sarin, P., V.L. Snoeyink, J. Bebee, K.K. Jim, M.A. Beckett, W.M. Kriven et J.A. Clement (2004) Iron Release from Corroded Iron Pipes in Drinking water Distribution Systems: Effect of Dissolved Oxygen, Water Research, 38(5): 1259–1269.
- Sathyanarayana, S., Beaudet, N., Omri, K. et Karr, K. (2006). Predicting children's blood lead levels from exposure to school drinking water in Seattle, WA. Ambul. Pediatr., 6(5): 288–292.
- Sarver, E., Zhang, Y. et Edwards, M. (2011). Copper pitting and brass dezincification: chemical and physical effects. Water Research Foundation, Denver, CO.
- Schock, M.R. (1980). Response of lead solubility to dissolved carbonate in drinking water. J. Am. Water Works Assoc., 72(12): 695–704.
- Schock, M.R. (1989). Understanding corrosion control strategies for lead. J. Am. Water Works Assoc., 81(7): 88–100.
- Schock, M.R. (1990a). Causes of temporal variability of lead in domestic plumbing systems. Environ. Monit. Assess., 15(1): 59–82.
- Schock, M.R. (1990b). Internal corrosion and deposition control. Dans : AWWA water quality and treatment: a handbook of community water supplies. McGraw-Hill, Inc., New York, NY (for the American Water Works Association).
- Schock, M.R. (2005). Distribution systems as reservoirs and reactors for inorganic contaminants. Dans : Distribution system water quality challenges in the 21st century: a strategic guide. American Water Works Association, Denver, CO.
- Schock M.R. et Buelow R.W. (1981). The behavior of asbestos/cement pipe under various water quality conditions: Part 2. Theoretical considerations. J Am Water Works Assoc. 73:636–51.
- Schock, M.R. et Fox, J.C. (2001). Solving copper corrosion problems while maintaining lead control in a high alkalinity water using orthophosphate. Dans : Proceedings of the 2001 AWWA Annual Conference, Washington, DC. American Water Works Association, Denver, CO.
- Schock, M.R. et Gardels, M.C. (1983). Plumbosolvency reduction by high pH et low carbonate–solubility relationships. J. Am. Water Works Assoc., 75(2): 87–91.
- Schock, M.R. et Giani, R. (2004). Oxidant/disinfectant chemistry and impacts on lead corrosion. Dans : Proceedings of the 2004 AWWA Water Quality Technology Conference, San Antonio, TX. American Water Works Association, Denver, CO.
- Schock, M.R. et Lemieux, F.G. (2010). Challenges in addressing variability of lead in domestic plumbing. Water Sci. Technol. Water Supply, 10(5), 793–799.
- Schock, M. et Lytle, D. (2011). Chapter 20: Internal corrosion and deposition control. Dans : J.K. Edzwald (ed.), Water Quality and Treatment: A Handbook on Drinking Water. 6th edition. McGraw Hill and American Water Works Association, Denver, CO.
- Schock, M.R. et Neff, C.H. (1988). Trace metal contamination from brass fittings. J. Am. Water Works Assoc., 80(11): 47–56.
- Schock, M.R., Lytle, D.A. et Clement, J.A. (1995). Effect of pH, DIC, orthophosphate, and sulfate on drinking water cuprosolvency. U.S. Environmental Protection Agency, Cincinnati, OH (Report No. EPA/600/R-95/085).
- Schock, M.R., Wagner, I. et Oliphant, R.J. (1996). Corrosion and solubility of lead in drinking water. Dans : Internal corrosion of water distribution systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 131–230.
- Schock, M.R., Harmon, S.M., Swertfeger, J. et Lohmann, R. (2001). Tetravalent lead: a hitherto unrecognized control of tap water lead contamination. Dans : Proceedings of the 2001 AWWA Water Quality Technology Conference, Nashville, TN. American Water Works Association, Denver, CO.
- Schock, M.R., Lytle, D.A., Sandvig, A.M., Clement, J.A. et Harmon, S.M. (2005a). Replacing polyphosphate with silicate to solve lead, copper, and source water iron problems. J. Am. Water Works Assoc., 97(11): 84–93.
- Schock, M.R., Scheckel, K., DeSantis, M. et Gerke, T. (2005b). Mode of occurrence, treatment, and monitoring significance of tetravalent lead. Dans : Proceedings of the 2005 AWWA Water Quality Technology Conference, Québec, QC. American Water Works Association, Denver, CO.
- Schock, M.R., Hyland, R.N. et Welch, M.M. (2008a). Occurrence of contaminant accumulation in lead pipe scales from domestic drinking-water distribution systems. Environ. Sci. Technol., 42(12): 4285–4291.
- Schock, M.R., DeSantis, M.K., Metz, D.H., Welch, M.M. Hyland, R.N and. Nadagouda, M.N (2008b). Revisiting the pH Effect on the Orthophosphate Control of Plumbosolvency. Proc. AWWA Annual Conference, Atlanta, GA.
- Schock, M.R., Cantor, A., Triantafyllidou, S., DeSantis, M.K. et Scheckel, K.G. (2014). Importance of pipe deposits to Lead and Copper Rule compliance. J. Am. Water Works Assoc., 106(7): E336–E349.
- Seattle Public Schools (2005). Seattle Public Schools water quality remediation plan: results of special lead sampling at Decatur (AE II) School. Disponible à : www.seattleschools.org/area/ehs/drinkingwater/HDR/AttachmentE.pdf
- Sharrett, A.R., Carter, A.P., Orheim, R.M. et Feinleib, M. (1982). Daily intake of lead, cadmium, copper, and zinc from drinking water: the Seattle study of trace metal exposure. Environ. Res., 28: 456–475.
- Sheiham, I. et Jackson, P.J. (1981). The scientific basis for control of lead in drinking water by water treatment. J. Inst. Water Eng. Sci., 35(6): 491–515.
- Shuldener, H.L. et Sussman, S. (1960). Silicate as a corrosion inhibitor in water systems. Corrosion, 16: 354–358.
- Shull, K.E. (1980). An experimental approach to corrosion control. J. Am. Water Works Assoc., 72(5): 280–285.
- Schwertmann, U. (1991). Solubility and dissolution of iron oxides. Plant and Soil 130: 1-25.
- Singh, I. et Mavinic, D.S. (1991). Significance of building and plumbing specifics on trace metal concentrations in drinking water. Can. J. Civil Eng., 18(6): 893–903.
- Singley, J.E. (1994). Electrochemical nature of lead contamination. J. Am. Water Works Assoc., 86(7): 91–96.
- Snoeyink, V.L. et Wagner, I. (1996). Principles of corrosion of water distribution systems. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 1–28.
- Sontheimer, H., Kolle, W. et Snoeyink, V.L. (1981). The siderite model of the formation of corrosion-resistant scales. J. Am. Water Works Assoc., 71(11): 572–579.
- Sorg, T.J., Schock, M.R. et Lytle, D.A. (1999). Ion exchange softening: effects on metal concentrations. J. Am. Water Works Assoc., 91(8): 85–97.
- St. Clair, J. Cartier, C., Triantafyllidou, S., Clark, B. et Edwards, M. (2015). Long-Term Behavior of Simulated Partial Lead Service Line Replacements. Environ Eng Sci. 2016 Jan 1; 33(1): 53–64. Disponible à : DOI: 10.1089/ees.2015.0337
- Stericker, W. (1938). Sodium silicates in water to prevent corrosion. Ind. Eng. Chem., 30(3): 348–351.
- Stericker, W. (1945). Protection of small water systems from corrosion. Ind. Eng. Chem., 37(8): 716–720.
- Stumm, W. (1960). Investigation on the corrosive behavior of waters. J. Sanit. Eng. Div. Proc. Am. Soc. Civil Eng., 86: 27–45.
- Subramanian, K.S., Sastri, V.S., Elboujdaini M., Connor, J.W. et Davey, A.B.C. (1995). Water contamination: Impact of tin-lead solder. Water Res., 29 (8): 1827-1836, DOI: https://doi.org/10.1016/0043-1354(95)00005-6.
- Switzer, J.A., Rajasekharan, V.V., Boonsalee, S., Kulp, E.A. et Bohannan, E.M.W. (2006). Evidence that monochloramine disinfectant could lead to elevated Pb levels in drinking water. Environ. Sci. Technol., 40(10): 3384–3387.
- Tarbet, N.K., Hegarty, B. et Jackson, P.J. (1999). Feasibility of using lining or coating techniques for reducing exposure to lead from water supply pipes. WRc, Swindon, UK. (DETR/DWI 4712)
- Texter, C.R. (1923). The prevention of corrosion in hot water supply systems and boiler economizer tubes. J. Am. Water Works Assoc., 10(9): 764–772.
- Tresh, J.C. (1922). The action of natural waters on lead. Analyst, 47(560): 459–468, 500–505.
- Treweek, G.P., Glicker, G., Chow, B. et Spinker, M. (1985). Pilot-plant simulation of corrosion in domestic pipe materials. J. Am. Water Works Assoc., 77(10): 74–82.
- Triantafyllidou, S. et Edwards, M. (2010). Contribution of galvanic corrosion to lead in water after partial lead service line replacements. Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 4088b).
- Triantafyllidou, S., Lytle, D.A., Chen, A.S.C., Wang, L., Muhlen, C. et Sorg, T.J. (2019). Patterns of arsenic release in drinking water distribution systems. AWWA Water Science, 1(4): e1149.
- Trueman, B. F., Bleasdale-Pollowy, A., Locsin, J. A., Bennett, J. L., Krkošek, W.H. et Gagnon, G. A. (2022). Seasonal Lead Release into Drinking Water and the Effect of Aluminum. ACS ES&T Water: 2(5), 710-720. DOI: 10.1021/acsestwater.1c00320
- Trueman, B.F. et Gagnon, G.A. (2016). A new analytical approach to understanding nanoscale lead-iron interactions in drinking water distribution systems. J. Hazard. Mater. 311: 151–157.
- Trueman, B.F., Locsin, J. A., Krkošek, W.H. et Gagnon, G.A. (2023). Evaluating sentinel pipe racks for monitoring lead release and optimizing corrosion control. Environ. Sci. Technol., 3(11), 3526–3533. https://doi.org/10.1021/acsestwater.3c00273.
- Trueman, B.F., Sweet, G.A., Harding, M.D., Estabrook, H., Bishop, D.P. et Gagnon, G.A. (2017). Galvanic corrosion of lead by iron (oxyhydr) oxides: potential impacts on drinking water quality. Environ. Sci. Technol., 51(12), 6812–6820.
- Tuovinen, O.H., Button, K.S., Vuorinen, A., Carlson, L., Mair, D.M. and Yut, L.A. (1980) Bacterial, chemical, and mineralogical characteristics of tubercles in distribution pipelines. J. Am. Water Works Assoc., 71(11): 626–635.
- Tully, J., DeSantis, M.K. et Schock, M.R. (2019). Water quality-pipe deposit relationships in Midwestern lead pipes. AWWA Water Sci. 2019 Mar 4; 1(2). Disponible à : https://doi.org/10.1002/aws2.1127
- U.K. WIR (1997). Approaches for Controlling Plumbosolvency. UK Water Industry Research Limited, London, UK. Report Ref. No. 97/DW/04/4.
- U.K. WIR (2012). Alternatives to Phosphate for Plumbosolvency Control. Water Industry Research Limited, London, UK. Report Ref. No. 12/DW/04/12. Disponible à : https://ukwir.org/reports/12-DW-04-12/66733/Alternatives-to-Phosphate-for-Plumbosolvency-Control
- U.S. EPA (1991). 40 CFR Parts 141 et 142, Maximum Contaminant Level Goals and National Primary Drinking Water Regulations for Lead and Copper; Final Rule. U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (1992). Lead and Copper Rule guidance manual. U.S. Environmental Protection Agency, Washington, DC (Report No. EPA/811/B-92/002).
- U.S. EPA (1993). Seminar Publication: Control of Lead and Copper in Drinking Water. EPA/625/R-93/001. U.S. Environmental Protection Agency, Washington, DC.
- U..S EPA (1994). Lead in drinking water in schools and non-residential buildings. Office of Water, U.S. Environmental Protection Agency, Washington, DC (Report No. EPA 812-B-94-002).
- U.S. EPA (2003). Revised guidance manual for selecting lead and copper control strategies. U.S. Environmental Protection Agency, Washington, DC (Report No. EPA-816-R-03-001).
- U.S. EPA (2004). Controlling lead in drinking water for schools and day care facilities: a summary of state programs. Office of Water, U.S. Environmental Protection Agency, Washington, DC (Report No. EPA-810-R-04- 001). Disponible à : www.epa.gov/ogwdw000/lcrmr/pdfs/report_lcmr_schoolssummary.pdf
- U.S. EPA (2006). 3Ts for Reducing Lead in Drinking Water in Schools: Revised Technical Guidance. US Environmental Protection Agency, Washington, DC.
- U.S. EPA (2007). Elevated Lead in D.C. Drinking Water – A Study of Potential Causative Events, Final Summary Report. Office of Water, U.S. Environmental Protection Agency, Washington, DC (Report No. EPA 812-B-94-002).
- U.S. EPA (2016). Optimal Corrosion Control Treatment Evaluation Technical Recommendations for Primacy Agencies and Public Water Systems. U.S. Environmental Protection Agency, Office of Water. Washington, DC. (Report No. EPA 816-B-16-003). Disponible à : https://www.epa.gov/sites/default/files/2019-07/documents/occtmarch2016updated.pdf
- U.S. EPA (2018). 3Ts for Reducing Lead in Drinking Water in Schools and Childcare Facilities: Revised Manual. U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (2023). Work breakdown structure-based cost model for reverse osmosis/nanofiltration drinking water treatment. United States Environmental Protection Agency, Office of Water, Washington, DC.
- Valentine, R.L. et Lin, Y-P. (2009). The role of free chlorine, chloramines, and NOM on the release of lead into drinking water. Report number 91243. Water Research Foundation, Denver, CO.
- Valentine, R.L. et S.w. Stearns (1994) Radon Release from water Distribution System Deposits,
- Environmental Science and Technology, 28(3): 534–537.
- van den Hoven, T. et Slaats, N. (2006). Lead monitoring. Dans : P. Quevauviller and K.C. Thompson (eds.), Analytical Methods for Drinking Water: Advances in Sampling and Analysis. John Wiley & Sons, Ltd., New York, NY.
- Van Der Merwe, S.W. (1988). The effect of water quality variables on the corrosion behavior of water coagulated with a cationic polyelectrolyte and with lime/activated silica. Water Supply, 6(4): SS2.
- Veleva, L. (1998). The corrosion performance of steel and reinforced concrete in a tropical humid climate. A review. Corros. Rev., 16(3): 235.
- Vik, E.A., Ryder, R.A., Wagner, I. et Ferguson, J.F. (1996). Mitigation of corrosion effects. Dans : Internal Corrosion of Water Distribution Systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, CO. pp. 389–444.
- Viraraghavan, T., Subramanian, K.S. et Rao, B.V. (1996). Drinking water at the tap: impact of plumbing materials on water quality. J. Environ. Sci. Health A, 31(8): 2005–2016.
- Volk, C., Dundore, E., Schiermann, J. et LeChevallier, M.W. (2000). Practical evaluation of iron corrosion control in a drinking water distribution system. Water Res., 34(6): 1967–1974.
- Vreeburg, J. (2010). Discolouration in drinking water systems: the role of particles clarified. IWA Publishing, London, UK.
- Wahman, D.G., Pinelli, M.D., Schock, M.R. et Lytle, D.A. (2021) Theoretical equilibrium lead(II) solubility revisited: Open source code and practical relationships. AWWA Water Sci., 3(5): e1250
- Wang, L., Chen, A.S.C. et Wang, A. (2010). Arsenic removal from drinking water by ion exchange. U.S. EPA demonstration project at Fruitland, ID. Final performance evaluation report. Cincinnati, Ohio. EPA/600/R-10/152.
- Wang, Y., Jing, H., Mehta, V., Welter, G.J. et Giammar, D.E. (2012). Impact of galvanic corrosion on lead release from aged lead service lines. Water Res., 46: 5049–5060.
- Wasserstrom, L., Miller, S. et Schock, M.R. (2017). Scale formation under blended phosphate treated for a utility with lead pipes. J. Am. Water Works Assoc. 109 (11): E464–478.
- Water Research Foundation (WRF). (2016). Evaluation of Lead Service Line Lining and Coating Technologies (Project No. 4351). Water Research Foundation. Denver, CO. Disponible à : https://www.waterrf.org/research/projects/evaluation-lead-service-line-lining-and-coating-technologies
- Water Research Foundation (WRF). (2023). Guidance for using pipe rigs to inform lead and copper corrosion control treatment decisions (Project No. 5081). Water Research Foundation and Copper Development Association. Denver, CO. Disponible à : https://www.waterrf.org/research/projects/guidance-using-pipe-rigs-inform-lead-and-copper-corrosion-control-treatment
- Williams, S.M. (1990). The use of sodium silicate and sodium polyphosphate to control water problems. Water Supply, 8: 195.
- Wong, C.S. et Berrang, P. (1976). Contamination of tap water by lead pipe and solder. Bull. Environ. Contam. Toxicol., 15(5): 530–534.
- Woszczynski, M., Bergese, J., Payne, S.J. et Gagnon, G.A. (2015). Comparison of sodium silicate and phosphate for controlling lead release from copper pipe rigs. Canadian Journal of Civil Engineering, 42: 953–959.
- Zhao, J., Giammar, D.E., Pasteris, J.D., Dai, C., Bae, Y, et Hu, Y. (2018). Formation and aggregation of lead phosphate particles: implications for lead immobilization in water supply systems. Environ. Sci. Technol., 52(21):12612-12623. DOI: 10.1021/acs.est.8b02788
- Zhou, E., Payne, S.J.O., Hofmann, R. et Andrews, R.C. (2015). Factors affecting lead release in sodium silicate-treated partial lead service line replacements. J. Environ. Sci. Health Part A Toxic Hazard. Subst. Environ. Eng., 50(9): 922-930.
- Zlatanovic, L., van der Hoek, J.P. et Vreeburg, J.H.G. (2017). An experimental study on the influence of water stagnation and temperature change on water quality in a full-scale domestic drinking water system. Water Res., 123: 761–772.
C.2 Abbreviations
- 30MS
- période de stagnation de 30 minutes
- A/C
- amiante-ciment
- ANSI
- American National Standards Institute
- ASME
- American Society of Mechanical Engineers
- ASTM
- American Society for Testing and Materials
- CCPP
- potentiel de précipitation du carbonate de calcium
- CMA
- concentration maximale acceptable
- CNP
- Code national de la plomberie – Canada
- CSA
- Groupe CSA
- CV
- coefficient de variation
- EPA
- Environmental Protection Agency des États-Unis
- ESP
- entrée de service en plomb
- MON
- matière organique naturelle
- NSF
- NSF International
- OD
- oxygène dissous
- PCCS
- Plan de contrôle de la corrosion dans un système
- POR
- potentiel d'oxydoréduction
- PVC
- polychlorure de vinyle
- RMCS
- ratio massique chlorure/sulfate
- RD
- réseau de distribution
- RDT
- échantillonnage aléatoire
- R.-U.
- Royaume-Uni
- SG
- objectif du réseau ou du secteur
- TCC
- traitement de contrôle de la corrosion
- TOCC
- traitement optimal de contrôle de la corrosion
- UE
- Union européenne
- VL
- volume de lit
Part D. Tableaux
| Facteurs | Principaux effets |
|---|---|
| Âge des tuyaux | Le relargage du plomb, du cuivre, du fer et du ciment diminue habituellement avec l'âge des éléments des réseaux de distribution. Cependant, les tuyaux de fer dont la paroi intérieure est recouverte de nombreux tubercules causent souvent des épisodes d'eau rouge et sont associés à des concentrations accrues de plomb au robinet. |
| Période de stagnation | Les concentrations de plomb et de fer dans l'eau du robinet augmentent rapidement en fonction de la période de stagnation de l'eau dans le système de plomberie, mais elles atteignent un niveau assez stable après 8 heures ou plus. Les concentrations de cuivre augmentent rapidement au début de la période de stagnation, mais elles peuvent ensuite diminuer ou continuer d'augmenter selon les taux d'oxydant. Un temps de résidence prolongé dans les tuyaux peut aussi accélérer la détérioration de la qualité de l'eau due aux matériaux à base de ciment. |
| pH | Les concentrations de plomb, de cuivre et de fer dans l'eau du robinet diminuent habituellement à mesure que le pH de l'eau augmente. Un pH plus élevé favorise la corrosion du fer et la formation de tubercules. Un pH bas favorise le relargage à partir du ciment, ce qui provoque en retour une augmentation du pH de l'eau. |
| Alcalinité | Les concentrations de plomb et de cuivre dans l'eau du robinet augmentent généralement lorsque l'alcalinité est faible. Les concentrations de cuivre peuvent également augmenter lorsque l'alcalinité est très forte. Une faible alcalinité favorise le relargage du fer, ainsi que le relargage à partir du ciment qui, en retour, provoque une augmentation de l'alcalinité de l'eau. |
| Température | Il n'existe pas de rapport simple entre les concentrations de plomb, de cuivre et de fer dans l'eau du robinet et la température. On s'attend à ce que le taux de corrosion du plomb et du fer augmente en fonction de la température. L'eau chaude est souvent plus corrosive que l'eau froide. |
| Calcium | La teneur en calcium n'a pas d'incidence significative sur les concentrations de plomb, de cuivre et de fer dans l'eau du robinet. Les faibles concentrations de calcium dans l'eau potable favorisent le relargage à partir du ciment. Ce relargage provoque en retour une augmentation de la concentration du calcium dans l'eau potable. |
| Chlore libre | La présence de chlore dans l'eau peut entraîner la formation d'incrustations stables de plomb IV. Le chlore libre peut accélérer la corrosion du cuivre à un faible pH et la réduire à un pH élevé. Le chlore libre peut par ailleurs accélérer la corrosion du plomb et du fer. |
| Chloramines | Les chloramines peuvent dissoudre les incrustations formées dans les tuyaux acheminant de l'eau chlorée et conduire à l'instabilité des incrustations de plomb. Peu d'informations sont disponibles sur les effets des chloramines sur le cuivre et le fer. |
| Chlorure et sulfate | Le chlorure à lui seul n'influe pas d'une manière concluante sur les concentrations de plomb dans l'eau du robinet. Il peut, jusqu'à des concentrations relativement élevées, réduire le taux de corrosion du cuivre, mais risque de provoquer une corrosion par piqûres du cuivre à de fortes concentrations. Le sulfate ne semble pas avoir une incidence importante sur les concentrations de plomb et de cuivre dans l'eau du robinet. Il peut toutefois provoquer une corrosion par piqûres du cuivre. Un RMCS supérieur à 0,58 peut entraîner des concentrations plus élevées de plomb dans l'eau du robinet. Des concentrations élevées de sulfate pourraient provoquer la formation de fissures dans les tuyaux en ciment. |
| Matière organique naturelle (MON) | La MON a des effets variés sur la qualité de l'eau, notamment sur les concentrations de métaux, comme la hausse des concentrations de plomb. La MON pourrait diminuer la corrosion par piqûres du cuivre et la corrosion du fer. Elle pourrait augmenter la solubilité du plomb, du cuivre et du fer. |
| Paramètres de base de qualité de l'eau | Paramètres supplémentaires |
|---|---|
|
|
Adapted from AWWA, 2017a |
|
D.3 Conditions favorisant le relargage du plomb dans les réseaux de distribution d'eau potable et les systèmes de plomberie et indicateurs correspondants
| Condition | Commentaire |
|---|---|
| Lorsque le pH est inférieur à 7,0 ou supérieur à 9,5 | Le pH de l'eau est contrôlé dans les usines de traitement, mais il peut varier dans les réseaux de distribution. On a constaté l'existence d'une corrélation très étroite entre un pH faible et des concentrations élevées de plomb dans l'eau du robinet. Un pH supérieur à 9,5 peut conduire à une plus grande solubilité du plomb. Le pH devrait être maintenu à l'intérieur d'un intervalle de ± 0,2 unité pour préserver la stabilité de l'eau dans le réseau de distribution. |
| Lorsque l'alcalinité est inférieure à 30 mg/L | Même si l'alcalinité est contrôlée à l'usine de traitement, elle peut varier dans les réseaux de distribution. On a établi une corrélation entre la faible alcalinité de l'eau et des concentrations élevées de plomb dans l'eau du robinet. En outre, une eau de faible alcalinité a un faible pouvoir tampon et peut mettre en jeu la stabilité du pH. |
| Modification de la méthode de traitement | Toute modification apportée à la méthode de traitement de l'eau qui risque d'avoir des conséquences chimiques, biologiques et physiques sur l'eau distribuée devrait faire l'objet d'un suivi rigoureux dans le réseau de distribution. La corrosion et les concentrations de plomb dans l'eau sont facilement influencées par de petits changements de la qualité de l'eau distribuée. Les concentrations de plomb dans l'eau du robinet et dans le réseau de distribution devraient faire l'objet d'un suivi rigoureux lors d'une modification de la méthode de traitement, en particulier si on change de coagulant ou de désinfectant. |
| Remplacement du chlore par des chloramines | La modification du traitement au désinfectant résiduel aura une incidence sur le potentiel électrochimique et le pH de l'eau. Ces effets pourraient à leur tour déstabiliser les sous-produits de la corrosion présents dans le réseau de distribution et la plomberie. Les concentrations de plomb dans l'eau du robinet et dans le réseau de distribution devraient faire l'objet d'un suivi rigoureux lors d'une modification de la méthode de traitement, en particulier si on change de coagulant ou de désinfectant. |
| Condition | Commentaire |
|---|---|
| Raccords ou éléments de plomberie en ligne à base de plomb | Le plomb contenu dans les cols-de-cygne, les éléments de soupapes ou les joints d'étanchéité utilisés dans les usines de traitement ou les conduites principales peut être libéré dans l'eau. |
| Vieux tuyaux de fonte sans revêtement | Les vieux tuyaux de fonte sans revêtement sont très corrodés. Les tubercules réduisent le diamètre intérieur et favorisent la prolifération des microorganismes. Le ratio élevé de la surface exposée pour une longueur de tuyau donnée, le temps de résidence prolongé et l'activité microbiologique plus intense risquent de modifier le pH, l'alcalinité et l'équilibre chimique de l'eau. Ces tuyaux peuvent également être connectés à des entrées de service en plomb. Le fer adsorbe le plomb et d'autres métaux et peut en augmenter la concentration au robinet. |
| Culs-de-sac | Les culs-de-sac allongent la période de stagnation de l'eau et le temps de contact de l'eau avec les contaminants et favorisent donc l'activité microbiologique et chimique. |
| Activité microbiologique | Les films biologiques se développent dans les réseaux de distribution et la plomberie. Les microorganismes qu'ils contiennent influent sur l'équilibre biochimique de l'eau et, par conséquent, sur la corrosion. |
| Nitrification | La nitrification pourrait jouer un rôle en abaissant le pH de l'eau et en favorisant la dissolution du plomb, en particulier lorsqu'on utilise la chloramine comme désinfectant secondaire. La température influence également la nitrification. |
| Modification du débit | Un changement soudain du débit dans les tuyaux risque d'entraîner le détachement des sous-produits solides de la corrosion adhérant à la paroi interne de ces tuyaux. |
| Entrées de service en plomb | Le relargage du plomb à partir des entrées de service se poursuit même plusieurs années après leur installation. Il existe une corrélation étroite entre la période de stagnation et la libération du plomb à partir de ces conduites. Un remplacement partiel des entrées de service risque d'entraîner une augmentation temporaire des concentrations de plomb due aux limailles ou aux perturbations mécaniques ou hydrauliques qui entraînent le détachement des sous-produits accumulés de la corrosion. |
| Nitrification | La nitrification peut influer sur le relargage de plomb par l'entremise d'une baisse du pH de l'eau, ce qui peut favoriser le relargage de plomb. Cette préoccupation concerne en particulier les eaux douces. |
| Condition | Commentaire |
|---|---|
| Entrées de service en plomb (y compris les cols-de-cygne et les raccords en queue de cochon) | Le relargage du plomb à partir des entrées de service se poursuit même plusieurs années après leur installation. Il existe une corrélation étroite entre la période de stagnation et la libération du plomb à partir de ces conduites. Un remplacement partiel des entrées de service risque d'entraîner une augmentation temporaire des concentrations de plomb due aux limailles ou aux perturbations mécaniques ou hydrauliques qui entraînent le détachement des sous-produits accumulés de la corrosion. |
| Raccords et éléments de plomberie en laiton | Les raccords et les éléments de plomberie en laiton au plomb, y compris les compteurs d'eau résidentiels, peuvent contenir du plomb susceptible d'être relargué dans l'eau. Le laiton utilisé dans les éléments de plomberie fabriqués il y a un certain temps peut contenir jusqu'à 8 % de plomb et être une source de plomb pendant une certaine période. Les compteurs d'eau sont installés dans les résidences, mais c'est d'ordinaire la municipalité qui en est responsable. Selon le CNP (2014), leur teneur moyenne pondérée en plomb ne doit pas dépasser 0,25 %. |
| Soudure au plomb | Les systèmes de plomberie installés avant 1990 sont soudés au plomb. Ces soudures constituent une source de plomb dans l'eau du robinet. |
| Période de stagnation | Il existe une corrélation étroite entre la période de stagnation de l'eau et la libération du plomb. La concentration de plomb atteint sa valeur maximale après 8 heures. |
| Condition | Commentaire |
|---|---|
| Plaintes des consommateurs | Les plaintes des consommateurs constituent une source utile d'informations pour déterminer les endroits susceptibles d'être contaminés par le plomb. Elles peuvent découler directement des préoccupations relatives à la concentration de plomb dans l'eau ou être liées à des considérations esthétiques ayant un lien indirect avec la concentration de plomb. |
| Couleur, turbidité ou débris | La couleur, la turbidité ou la présence de débris dans l'eau du robinet peuvent nous renseigner sur la corrosion du réseau de distribution. Ces phénomènes sont la plupart du temps liés à la présence de fer dans l'eau, mais il peut également y avoir adsorption de plomb et d'autres métaux. |
| Concentrations de plomb | La mesure de la concentration de plomb demeure la seule méthode vraiment fiable d'évaluer l'exposition de la population au plomb dans l'eau potable. |
| Modes d'utilisation de l'eau | Les modes d'utilisation peuvent influencer le relargage de plomb. Par exemple, l'utilisation de débits d'eau élevés ou faibles pour remplir un verre, la durée de stagnation de l'eau entre les utilisations ou le fait de laisser l'eau couler avant de la consommer feraient varier les concentrations de plomb dans l'eau potable. |
Partie E. Cadre d'un programme de contrôle de la corrosion dans des sites résidentiels
E.1 Figure - Diagramme décisionnel d'un programme de contrôle de la corrosion dans des sites résidentiels
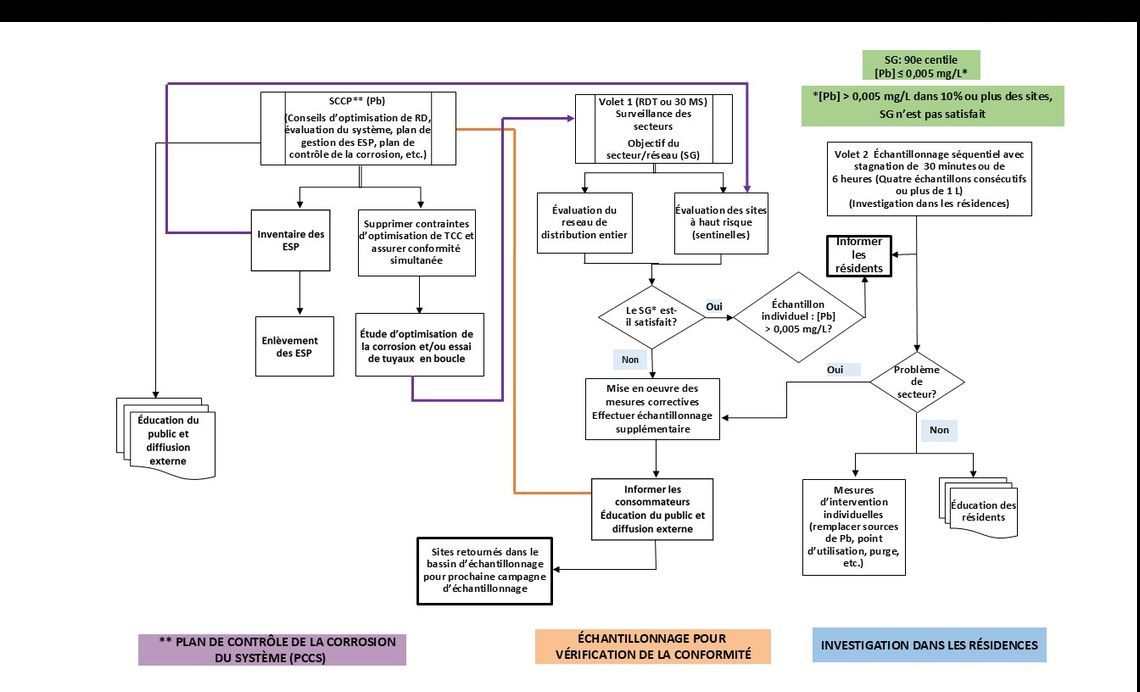
Figure E.1 - Équivalent textuel
Ceci est un diagramme décisionnel décrivant le cadre d'un programme de contrôle de la corrosion résidentiel. Le cadre décrit les activités et les étapes à entreprendre pour obtenir une approche holistique du contrôle de la corrosion et de son traitement. Il décrit l'interconnexion entre les divers éléments du plan de contrôle de la corrosion du système, comme les conseils pour l'optimisation du contrôle de la corrosion dans le système de distribution, suivis de l'inventaire des entrées de service en plomb et de le remplacement ultérieure de ces entrées. Il comprend également, en parallèle, la suppression des contraintes à un contrôle de la corrosion optimal et la conformité simultanée suivie d'une étude d'optimisation de la corrosion et/ou d'études sur des montages de tuyaux en boucle, qui informent ensuite les protocoles de surveillance zonale des habitations résidentielles. L'inventaire des entrées de service en plomb permet de sélectionner et d'évaluer les sites sentinelles, qui sont utilisés dans les deux options des protocoles pour les habitations résidentielles (RDT et 30 MS). Le protocole fournit des informations sur l'échantillonnage de conformité pour l'objectif de secteur/réseau ainsi que des informations sur l'échantillonnage d'investigation dans les résidences. L'information suivante est présentée dans un encadré : l'objectif de réseau (SG) est que le 90e centile de la concentration de plomb soit égal à ou inférieure à 0,005 mg/L, ce qui signifie que la concentration de plomb est supérieure à 0,005 mg/L dans moins de 10 % des sites.
Partie F. Protocole de surveillance alternatif pour les immeubles non résidentiels et résidentiels (stagnation en deux volets)
F.1 Protocole d'échantillonnage alternatif
Les buts de ce protocole d'échantillonnage alternatif et le SG concernant les immeubles non résidentiels et résidentiels, comme les les écoles, les garderies, les services de garde et les grands immeubles, visent à localiser les problèmes particuliers de relargage de plomb dans les immeubles et à déterminer les endroits où il faut intervenir ainsi que les mesures correctives à prendre. Le but est de minimiser les concentrations de plomb aux sorties d'eau froide (raccords et appareils comme les robinets et les fontaines) utilisées pour la boisson et la cuisine et de protéger ainsi la santé des occupants contre une exposition au plomb. Les protocoles d'échantillonnage et le SG se fondent sur les variations observées dans les concentrations de plomb aux sorties d'eau des immeubles non résidentiels, variations qui dépendent des sources de plomb dans la plomberie ainsi que des modes d'utilisation de l'eau.
Les périodes de stagnation dépendront de facteurs tels que la fréquence d'utilisation d'un robinet, la distribution ou non d'eau en bouteille, la durée d'occupation de l'immeuble (24 heures ou 8 heures par jour) et le nombre d'occupants. La détermination de la source du problème dans un immeuble spécifique est critique pour évaluer les mesures à prendre afin de réduire l'exposition au plomb. Les endroits posant des problèmes particuliers sont déterminés par la mesure des concentrations de plomb aux fontaines et aux robinets d'eau froide. Lorsque des concentrations élevées de plomb sont détectées dans une sortie d'eau, elles peuvent provenir de matériaux contenant du plomb présent dans la sortie d'eau elle-même (par exemple, robinet, fontaine à jet vertical, refroidisseur d'eau), de la plomberie en amont de la sortie d'eau ou de l'eau entrant dans l'immeuble. On suit une approche à deux volets pour identifier la source de cette concentration élevée de plomb.
Étant donné qu'il est possible de trouver dans un immeuble des concentrations élevées de plomb dans l'eau potable dues à un relargage par des matériaux du système de plomberie (raccords et appareils de plomberie, entre autres), le présent protocole devrait être suivi par les autorités responsables, comme les propriétaires ou les gestionnaires d'immeubles, les conseils scolaires et les employeurs, dans le cadre de la gestion globale de la santé et de la sécurité des occupants. Ce protocole peut également être suivi par les responsables de systèmes de distribution d'eau potable qui voudraient inclure des immeubles non résidentiels ou résidentiels, comme des écoles et des immeubles à logements multiples, dans leurs programmes de surveillance et de contrôle de la corrosion. L'ampleur de l'échantillonnage réalisé dans un immeuble peut varier selon le but de l'échantillonnage et de l'autorité procédant à ce dernier.
Dans certains cas, les autorités responsables peuvent juger souhaitable de prélever les échantillons pour les volets 1 et 2 en même temps afin de ne pas avoir à retourner sur un site. Il faut cependant savoir que le niveau de confiance dans les résultats de l'analyse de certains échantillons sera moindre, puisque le fait de purger une sortie d'eau peut influer sur les échantillons prélevés après la purge à d'autres sorties situées à proximité.
F.1.1 Protocole d'échantillonnage pour le volet 1
but du protocole d'échantillonnage pour le volet 1 est d'identifier les sorties d'eau potable froide où la concentration de plomb est élevée après une période de stagnation. La collecte d'un plus petit volume d'échantillon aide à préciser si la source du plomb provient de la sortie d'eau elle-même et à proposer des mesures correctives appropriées. L'échantillonnage pour le volet 1 doit être réalisé aux endroits identifiés dans le plan d'échantillonnage établi pour les immeubles non résidentiels ou résidentiels. De plus, un échantillon représentatif de l'eau arrivant dans l'immeuble (échantillon de la conduite principale) devrait être prélevé lors de chaque échantillonnage de surveillance. Les échantillons d'eau de la conduite principale devraient être prélevés à un robinet d'eau potable situé à proximité de l'entrée de service, en observant une période de purge d'environ 5 minutes (une purge plus longue peut être nécessaire pour s'assurer que l'échantillon est représentatif de l'eau qui circule dans la conduite principale). Tous les autres échantillons dans l'immeuble devraient être prélevés en suivant le protocole décrit ci-après.
On prélève un échantillon de premier jet de 250 mL aux endroits désignés dans le plan d'échantillonnage, après stagnation de l'eau pendant au moins 8 heures, mais généralement pas plus de 24 heures. Pour que les échantillons recueillis soient représentatifs, l'aérateur ou la grille de la sortie d'eau ne doivent pas être retirés avant le prélèvement. Il est recommandé de séparer les échantillons en plus petits volumes (par exemple 2 × 125 mL). Il s'agit d'une forme d'échantillonnage séquentiel qui facilite la phase d'enquête si l'analyse des échantillons révèle la présence de plomb. Ces plus petits échantillons sont représentatifs de l'eau des raccords (fontaine ou robinet) et d'une plus petite section du système de plomberie et permettent de repérer plus efficacement la source de plomb associée à une sortie d'eau. La collecte d'échantillons pour le volet 2 au même moment que les échantillons du volet 1 permet d'éviter de devoir retourner sur les lieux pour prélever d'autres échantillons afin d'identifier la source de plomb.
L'utilisation de bouteilles à large goulot permet à l'échantillonneur de remplir la bouteille à un débit usuel moyen à élevé, ce qui donne un résultat plus précis. Les bouteilles d'échantillonnage dont le goulot est plus petit seront difficiles à remplir à un débit usuel et fourniront des résultats inexacts pour le calcul de l'exposition potentielle et pour les besoins des enquêtes et des mesures correctives.
Si la concentration de plomb est supérieure à 0,005 mg/L (objectif du réseau) à l'un des endroits surveillés, il est recommandé de prendre les mesures suivantes :
- Informer les occupants (par exemple, professeurs, personnel des services de garde, élèves, etc.) de l'immeuble et les autres parties intéressées (par exemple, parents, comités de santé et de sécurité au travail, etc.) des résultats de l'échantillonnage et des mesures provisoires qui ont été prises, ainsi que des plans pour un échantillonnage supplémentaire.
- Faire des prélèvements supplémentaires aux robinets où la concentration de plomb est supérieure à 0,005 mg/L afin de déterminer la source du plomb, comme indiqué dans le protocole du volet 2.
- Mettre immédiatement en œuvre des mesures correctives provisoires pour réduire l'exposition des occupants au plomb dans l'eau du premier jet. Les mesures suivantes peuvent être prises, individuellement ou en combinaison :
- éliminer les débris de l'aérateur ou de la grille de la sortie d'eau potable;
- purger la plomberie après une période de stagnation;
- mettre hors service la sortie d'eau potable;
- utiliser un dispositif de traitement de l'eau potable certifié;
- fournir une autre source d'alimentation en eau.
- Lorsqu'une quantité importante de débris a été éliminée de l'aérateur ou de la grille, les autorités peuvent juger souhaitable de procéder à une nouvelle analyse de l'eau de ces robinets en suivant le même protocole. Si les résultats des nouveaux tests indiquent des concentrations de plomb inférieures à 0,005 mg/L, les autorités devraient chercher à savoir si le plomb particulaire contribue de manière importante aux niveaux élevés observés et si un nettoyage régulier de l'aérateur ou de la grille devrait être fait dans le cadre du programme d'entretien ou de purge.
F.1.2 Protocole d'échantillonnage pour le volet 2
L'échantillonnage pour le volet 2 permet, en combinaison avec les résultats obtenus au volet 1, de déterminer la source du plomb dans la plomberie interne de l'immeuble. L'échantillonnage après une courte période de purge (30 secondes) permettra de déterminer la concentration de plomb dans l'eau qui a stagné dans la plomberie en amont de la sortie d'eau.
On prélève un deuxième échantillon de 250 mL aux fontaines et robinets d'eau froide qui présentaient une concentration en plomb supérieure à 0,005 mg/L lors du volet 1, après que l'eau ait stagné au moins 8 heures (mais généralement pas plus de 24 heures) et après une purge de 30 secondes. Il est recommandé de séparer les échantillons en plus petits volumes (par exemple 2 × 125 mL). Il s'agit d'une forme d'échantillonnage séquentiel qui facilite la phase d'enquête si l'analyse des échantillons révèle la présence de plomb. Ces petits échantillons sont représentatifs de l'eau des raccords (fontaine ou robinet) et d'une plus petite section du système de plomberie et permettent aussi de repérer plus efficacement la source de plomb associée à une sortie d'eau.
Lorsque la concentration de plomb dans l'un de ces seconds échantillons dépasse la CMA de 0,005 mg/L, des mesures correctives devraient être prises immédiatement. Ces mesures correctives peuvent comprendre des mesures provisoires, comme une purge de routine de la sortie d'eau avant l'arrivée des occupants pendant au minimum 5 minutes afin d'obtenir de l'eau provenant de la conduite principale, la mise hors service de la sortie d'eau, l'utilisation de dispositifs de traitement de l'eau potable certifiés ou fournir une autre source d'alimentation en eau. Ces mesures provisoires resteront en vigueur jusqu'à ce qu'une solution permanente soit trouvée. De plus, selon les résultats de l'échantillonnage effectué pour le volet 1 et le volet 2, il conviendra de prendre une ou plusieurs des mesures suivantes de contrôle de la corrosion :
- Informer et éduquer les occupants (par exemple, professeurs, personnel des services de garde, élèves, etc.) de l'immeuble et les autres parties intéressées (par exemple, parents, comités de santé et de sécurité au travail, etc.) des résultats de l'échantillonnage et des mesures provisoires qui ont été prises, ainsi que des plans pour un échantillonnage supplémentaire.
- Comparer les résultats obtenus lors du volet 1 et du volet 2 afin de déterminer si la source de la contamination au plomb est un raccord, un appareil de plomberie ou la plomberie interne elle-même. Si les résultats des deux volets indiquent une contamination au plomb, faire des prélèvements supplémentaires dans la plomberie interne de l'immeuble afin de déterminer de façon plus précise les sources du plomb.
- Autres mesures à prendre en compte :
- Purger les sorties d'eau;
- Installer des dispositifs de traitement de l'eau potable certifiés;
- Remplacer les robinets, les fontaines ou les conduites;
- Mettre les sorties d'eau hors service;
- Remplacer les raccords en laiton ou les dispositifs en ligne;
- Travailler en collaboration avec le fournisseur d'eau pour s'assurer que l'eau distribuée dans l'immeuble n'est pas corrosive;
- Fournir une autre source d'alimentation en eau.
F.2 Justification du protocole d'échantillonnage alternatif après une période de stagnation
Tout comme dans le cadre d'un programme de surveillance résidentielle, chacun des éléments d'un protocole d'échantillonnage en milieu non résidentiel, comme la période de stagnation, le volume d'eau prélevé et le SG, a une incidence importante sur l'utilité des données recueillies. Étant donné que les objectifs du prélèvement d'échantillons dans des immeubles non résidentiels sont distincts de ceux du prélèvement d'échantillons dans un cadre résidentiel, les volumes d'eau prélevés sont également différents.
Les protocoles d'échantillonnage en milieu non résidentiel des volets 1 et 2 prescrivent le prélèvement d'un volume d'échantillon de 250 mL. Lors de l'évaluation de la quantité de plomb relarguée à partir de sorties d'eau comme les robinets de cuisine, plus de 95 % du plomb présent peut être mesuré dans les premiers 200 à 250 mL d'eau provenant d'un robinet (Gardels et Sorg, 1989). On a constaté que les concentrations de plomb dans les immeubles non résidentiels et les grands immeubles résidentiels diminuent généralement de façon importante après une purge de 30 secondes. Cette diminution laisse supposer que les fontaines ou les robinets, de même que les éléments de plomberie qui y sont raccordés, peuvent contribuer de façon importante aux concentrations élevées de plomb observées aux sorties d'eau dans les immeubles non résidentiels et les immeubles institutionnels (Bryant, 2004; Boyd et coll., 2008a,b; McIlwain et coll., 2016; Doré et coll., 2018; Katner et coll., 2018; Miller-Schulze et coll., 2019).
Le prélèvement d'un volume plus important d'eau, un litre par exemple, rend compte d'une portion plus grande des éléments de plomberie en amont des sorties d'eau. Ces éléments de plomberie peuvent comprendre des vannes, des raccords en T et des joints soudés pouvant contribuer à la concentration de plomb de l'échantillon de 1 L. Il ne serait cependant pas possible de déterminer le matériau responsable de la libération du plomb. En outre, on suppose que le prélèvement d'une telle quantité d'eau à partir d'une fontaine d'eau potable pourrait diluer la concentration initialement mesurée à la sortie d'eau. Cette situation n'est pas souhaitable, car l'eau prélevée des sections de la plomberie situées plus loin de la sortie d'eau présente généralement des concentrations moins élevées (U.S. EPA, 2004). On considère donc qu'il est important, lors de la prise d'échantillons dans des immeubles non résidentiels, de prélever des volumes d'eau moins grands (250 mL) que ceux normalement utilisés pour évaluer la corrosion interne des réseaux (1 L ou plus) dans les habitations résidentielles de six logements ou moins. On préconise ainsi, pour l'échantillonnage dans les immeubles non résidentiels, un volume d'échantillon de 250 mL, puisqu'un tel volume correspond à l'eau provenant à la fois de l'appareil de plomberie (la fontaine ou le robinet) et d'une section plus courte de la plomberie, et qu'il permet par conséquent d'identifier avec une plus grande efficacité la source du plomb présent à la sortie d'eau, et plus particulièrement si ce volume est décomposé en plus petits volumes (par exemple 2 × 125 mL) de manière à fournir un profil de la plomberie (U.S. EPA, 1994, 2006). Si des volumes d'eau supplémentaires sont prélevés après la prise du premier échantillon de 250 mL (des volumes de 250 à 1 000 mL, par exemple), l'analyse de cette quantité plus importante d'eau risque, si le calcul est effectué en fonction d'un échantillon de 1 L, d'indiquer une concentration moindre. Ceci s'explique par le fait que les volumes prélevés consécutivement au premier échantillon de 250 mL seront susceptibles de contenir des concentrations de plomb inférieures à celui-ci et, par conséquent, d'avoir un effet de dilution (U.S. EPA, 2004). Toutefois, des études ont également montré une augmentation de la concentration de plomb en fonction du volume (McIlwain et coll., 2016; Miller-Schulze et coll., 2019).
Des études portant sur les sources du plomb dans l'eau du robinet ont montré que les soudures au plomb et les raccords en laiton contribuent de façon notable aux concentrations élevées de plomb mesurées après une période de stagnation (Lee et coll., 1989; Singh et Mavinic, 1991; AwwaRF, 2004; U.S. EPA, 2007). Ces études indiquent que, selon l'âge et le type des matériaux, les concentrations de plomb augmentent de façon importante après des périodes de stagnation de 4 à 20 heures (Lytle et Schock, 2000). Le mode d'utilisation de l'eau dans un immeuble constitue donc un facteur important dans la détermination des concentrations de plomb au robinet. Une période de stagnation permettra de tenir compte de l'utilisation généralement intermittente de l'eau dans les immeubles, comme les services de garde, les écoles, les immeubles résidentiels et les immeubles à bureaux. La période de stagnation la plus prudente avant la prise d'échantillons se situe entre 8 et 18 heures, puisqu'il s'agit de la période la plus susceptible de permettre la mesure des concentrations maximales de plomb dans l'eau. Les échantillons devraient être prélevés au premier jet à la suite d'une période de stagnation de 8 heures au moins, et de 24 heures au plus, pour qu'ils soient représentatifs des périodes les plus longues durant lesquelles, au cours de la plupart des jours de la semaine, les robinets et les fontaines d'un immeuble non résidentiel ne sont pas utilisés pour boire.
F.2.1 Protocole d'échantillonnage pour le volet 1
Le protocole d'échantillonnage du volet 1 a été utilisé dans des immeubles non résidentiels et des immeubles résidentiels pour localiser les problèmes particuliers de relargage de plomb, pour déterminer les méthodes d'intervention requises et pour démontrer l'efficacité de mesures correctives. Il existe de nombreuses études publiées sur la mise en œuvre de programmes complets d'échantillonnage visant à mesurer les concentrations de plomb au robinet dans des écoles et d'autres immeubles non résidentiels et résidentiels. Ces études démontrent que le prélèvement d'échantillons de 250 mL après une période de stagnation d'au moins 8 heures, mais généralement pas plus de 24 heures, constitue un moyen efficace pour identifier les sorties d'eau qui présentent des concentrations élevées de plomb (Gnaedinger, 1993; Murphy, 1993; Maas et coll., 1994; Bryant, 2004; Boyd et coll., 2008a,b). Les auteurs de nombreuses études sont arrivés à déterminer au moyen de cette méthode d'échantillonnage la source du plomb dans les écoles et à élaborer des plans d'intervention (Boyd et coll., 2008a,b; Deshommes et coll., 2016; Doré et coll., 2018).
F.2.2 Protocole d'échantillonnage pour le volet 2
Afin de faciliter l'identification de la source du plomb aux sorties d'eau qui présentent des concentrations de plomb supérieures au SG pour le volet 1, on prélève des échantillons de suivi de l'eau qui a reposé dans la plomberie en amont, et non de l'eau présente dans la sortie d'eau elle-même. Les résultats peuvent ensuite être comparés afin d'évaluer les sources des concentrations élevées de plomb et de déterminer les mesures correctives qui s'imposent. Dans le but d'effectuer une comparaison des résultats, un deuxième échantillon de 250 mL est prélevé après une période de stagnation équivalente. L'eau qui a reposé dans la plomberie en amont d'une sortie d'eau peut être recueillie en prenant un échantillon de 250 mL après une période de stagnation minimale de 8 heures, mais ne dépassant généralement pas 24 heures, suivie d'une purge de 30 secondes. L'eau provenant des fontaines et des robinets d'eau froide est recueillie après une purge de 30 secondes. Une telle purge devrait normalement éliminer l'eau présente dans la sortie d'eau. Si la concentration de plomb du deuxième échantillon de 250 mL est inférieure à 0,005 mg/L (SG), on pourra conclure que le plomb provient de la fontaine d'eau, du robinet d'eau froide ou de la plomberie à proximité. Si des concentrations de plomb supérieures à la CMA de 0,005 mg/L sont mesurées dans les échantillons prélevés dans le cadre du volet 2, les sources du plomb peuvent inclure la plomberie qui se trouve derrière le mur, la sortie d'eau et la plomberie de l'immeuble combinées, ou l'entrée de service.
Les résultats de l'échantillonnage effectué dans le cadre des volets 1 et 2 doivent être interprétés en fonction du profil de la plomberie, de manière à ce qu'il soit possible de déterminer les sources du plomb et de prendre les mesures correctives provisoires et à long terme qui s'imposent. Une autre source de référence (U.S. EPA, 2018) contient de l'information sur un type différent d'échantillonnage permettant d'établir la source du plomb dans différentes configurations de plomberie, ainsi que des renseignements détaillés sur la façon d'interpréter les résultats de l'échantillonnage réalisé dans le cadre des volets 1 et 2.
Part G. Ressources additionnelles sur des sujets liés au contrôle de la corrosion
L'on trouvera des conseils supplémentaires sur les plans de contrôle de la corrosion, la détection et l'enlèvement des entrées de service en plomb, la gestion des tuyaux en fer galvanisé et les communications aux clients, de même qu'une série d'autres sujets, dans les références et les liens [pour la plupart en anglais] présentés ci-après.
| Titre du document | Sujets abordés | Référence |
|---|---|---|
| Renseignements généraux sur la corrosion et les stratégies de contrôle de la corrosion | ||
| Internal Corrosion Control in Water Distribution Systems: Manual of Water Supply Practices, M58 | Principes fondamentaux de la corrosion, du relargage et de la libération des métaux, surveillance de la qualité de l'eau, techniques de contrôle de la corrosion, outils de surveillance de l'efficacité du contrôle de la corrosion | AWWA, 2017a |
| Water Quality in Distribution Systems: Manual of Water Supply Practices, M68 | Information sur le contrôle de la corrosion et la qualité de l'eau | AWWA, 2017b |
| Lead control strategies | Sources de plomb, stratégies de surveillance, stratégies de traitement | AwwaRF, 1990 |
| Post optimization lead and copper control monitoring strategies | Changement relatif au traitement ou à la source d'eau, échantillonnage dans les résidences, surveillance en ligne | AwwaRF, 2004 |
| Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality | Ajustement du pH et de l'alcalinité, ajout de phosphate et optimisation, surveillance de la qualité de l'eau | Cantor, A.F. (2017). (Water Research Foundation Project #4586) Ch. 13 |
| Evaluating key factors that affect the accumulation and release of lead from galvanized pipes | Relargage de plomb des tuyaux galvanisés, cadre d'un plan de gestion et de remplacement, information sur le contrôle de la corrosion, sensibilisation du public, études à l'échelle de banc d'essai | Edwards et coll., 2022 |
| Ontario Guidance Document for Preparing Corrosion Control Plans (2009) | Préparation d'un plan de contrôle de la corrosion, évaluation de l'efficacité des mesures de traitement, etc. Quelques renseignements concernant les petits systèmes. | MOE, 2009 |
| Guide de conception des installations de production d'eau potable | Conception des installations de traitement de l'eau potable | MELCC, 2021a |
| Guide d'évaluation et d'intervention relatif au suivi du plomb et du cuivre dans l'eau potable | Réglementation et protocoles concernant le plomb dans l'eau potable; renseignements généraux; modèles | MELCC, 2021b |
| Optimal Corrosion Control Treatment Evaluation Technical Recommendations for Primacy Agencies and Public Water Systems | Sources de plomb et de cuivre, facteurs liés à la qualité de l'eau qui influent sur le relargage de plomb et de cuivre, options de traitement de contrôle de la corrosion, surveillance du traitement de contrôle de la corrosion, incidence de modifications apportées au traitement et aux caractéristiques de la source d'eau | U.S. EPA, 2016 |
| Inventaire ou détection des entrées de service en plomb | ||
| Rapid and simple lead service line detection screening protocol using water sampling | Échantillonnage de l'eau en vue de la détection des entrées de service en plomb | Schock et coll., 2021 |
| Lead service line identification: A review of strategies and approaches | Examen des méthodes de détection des entrées de service en plomb | Hensley et coll., 2021 |
| Standard ANSI/AWWA C810-17: Replacement and flushing of lead service lines | Information sur la procédure de remplacement des entrées de service en plomb et la purge à la suite du remplacement | AWWA, 2017c |
| Remplacement des entrées de service en plomb | ||
| Strategies to obtain customer acceptance of complete lead service line replacement | Stratégies pour faire accepter aux clients le remplacement complet des entrées de service en plomb | AWWA, 2005 |
| Standard ANSI/AWWA C810-17: Replacement and flushing of lead service lines | Information sur la procédure de remplacement des entrées de service en plomb et la purge à la suite du remplacement | AWWA, 2017b |
| Lead Service Line Replacement Collaborative | Ressource téléchargeable sur plusieurs sujets en lien avec le remplacement des entrées de service en plomb et l'inventaire des entrées de service en plomb, entre autres | LSLR Collaborative, 2021 |
| Full Lead Service Line Replacement Guidance (Project No. 4713) | Renseignements généraux sur les sources de plomb, la purge à haut débit, le remplacement des entrées de service en plomb et le contrôle de la solubilité du cuivre. Études de cas et sur le terrain; boîte à outils pour les remplacements complets d'entrées de service en plomb | Water Research Foundation, 2021 |
| Méthodes de réhabilitation des entrées de service en plomb | ||
| Evaluation of Lead Service Line Lining and Coating Technologies | Renseignements sur les revêtements des entrées de service en plomb; avantages, désavantages et relargage d'autres substances chimiques, études de cas | Randtke et coll., 2017 (Water Research Foundation Project #4351) |
| Montages de tuyaux en boucle/bancs d'essai | ||
| Development of a pipe loop protocol for lead control | Construction et utilisation des montages de tuyaux en boucle, recommandations pour l'évaluation statistique, études antérieures sur des tuyaux en boucle | AwwaRF, 1994 |
| Guidance for using pipe loops to inform lead and copper corrosion control treatment decisions (Project No. 5081) | Considérations et limites associées aux études de bancs d'essai de tuyaux, facteurs ayant une influence, conception des bancs d'essai de tuyaux, fonctionnement, analyse des données, coûts | Water Research Foundation, 2023 |
| Report to Health Canada on guidance for using pipe loops to inform corrosion control treatment decisions | Analyse de montages antérieurs de tuyaux en boucle et cadre pour la formulation de conseils (études de cas), pratiques exemplaires et conception, analyse statistique des données obtenues au moyen de tuyaux en boucle, modélisation de la solubilité du plomb | Centre for Water Resources Studies, 2023 |
| Écoles, garderies ou services de garde et grands immeubles y compris les immeubles commerciaux | ||
| 3Ts for Reducing Lead in Drinking Water in Schools and Child Care Facilities A Training, Testing, and Taking Action Approach Revised Manual | Information sur les sources de plomb, l'élaboration d'un plan d'échantillonnage, l'échantillonnage et l'interprétation des résultats et les stratégies d'intervention | U.S. EPA, 2018 |
| Procédure visant à mesurer les concentrations de plomb dans l'eau potable des écoles du Québec | Échantillonnage du plomb dans les écoles | MEES 2020 |
| Gestion du plomb dans l'eau potable : un guide pour les propriétaires d'un grand bâtiment | Échantillonnage du plomb dans les grands bâtiments | MELCC, 2021c |
| Lead Service Line Replacement Collaborative Website | Ressource en ligne concernant les écoles et les services de garde | LSLR Collaborative, 2023 |
| Choix d'un filtre pour le plomb et nettoyage des aérateurs | ||
| Infographie : Nettoyage des aérateurs de robinets | Marche à suivre pour nettoyer les aérateurs et éliminer les particules de plomb et les autres particules | Santé Canada, 2023a |
| Infographie : Se procurer un filtre à eau potable | Instructions pour la recherche d'un filtre certifié pour l'enlèvement du plomb | Santé Canada, 2023b |
| Sensibilisation et communications | ||
| Lead Service Line Replacement Collaborative Website | Ressources en ligne | LSLR Collaborative, 2023 |
Listes des références du tableau G.1
- AWWA (2005). Strategies to Obtain Customer Acceptance of Complete Lead Service Line Replacement. American Water Works Association, Denver, CO. Disponible à : https://www.awwa.org/Portals/0/AWWA/Government/StrategiesforLSLs.pdf?ver=2013-03-29-132027-193
- AWWA (2017a). Internal Corrosion Control in Water Distribution Systems: Manual of Water Supply Practices, M58. Second edition. American Water Works Association, Denver, CO.
- AWWA (2017b). Water Quality in Distribution Systems: Manual of Water Supply Practices, M68. First edition. American Water Works Association, Denver, CO.
- AWWA (2017c). Standard ANSI/AWWA C810-17: Replacement and flushing of lead service lines. American Water Works Association, Denver, CO.
- AwwaRF (1990). Lead control strategies. AWWA Research Foundation and American Water Works Association, Denver, CO.
- AwwaRF (1994). Development of a pipe loop protocol for lead control. AWWA Research Foundation, Denver, CO.
- AwwaRF (2004). Post optimization lead and copper control monitoring strategies. AWWA Research Foundation, Denver, CO (Report 90996F).
- Cantor, A.F. (2017). Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality. Water Research Foundation and Water Environment and Reuse Foundation, Denver, Colorado. Report #4586.
- Centre for Water Resources Studies (2023). Guidance for using pipe loops to inform corrosion control treatment decisions, Dalhousie University. Rapport présenté à Santé Canada. Disponible sur demande à : water-eau@hc-sc.gc.ca.
- Edwards, M., Mohsin, H., Parks, J. Masters, S.V., Arnold, R. et Rosenfeldt, B. (2022). Evaluating key factors that affect the accumulation and release of lead from galvanized pipes. Water Research Foundation, Denver, Colorado (Water Research Foundation Project No.4910).
- Hensley, Bosscher, V., Triantafyllidou, S. et Lytle, D.A. (2021). Lead service line identification: A review of strategies and approaches. AWWA Wat sci. Vol 3 (3) : e1226. doi.org/10.1002/aws2.1226
- Lead Service Line Replacement Collaborative (2023). Site Web offrant une variété de ressources téléchargeables sur de nombreux sujets. https://www.lslr-collaborative.org/
- Ministère de l'Éducation et de l'Enseignement supérieur (MEES) (2020). Procédure visant à mesurer les concentrations de plomb dans l'eau potable des écoles du Québec. Direction de l'expertise et du développement des infrastructures scolaires, Direction générale des infrastructures. Québec, QC. Disponible à : https://www.education.gouv.qc.ca/fileadmin/site_web/documents/education/reseau/boite-outils/Procedure-concentrations-plomb.pdf
- Ministère de l'Environnement et de la Lutte contre les changements climatiques (MELCC) (2021a). Guide de conception des installations de production d'eau potable. Volumes 1 et 2. Disponible à : https://www.environnement.gouv.qc.ca/eau/potable/guide/index.htm
- Ministère de l'Environnement et de la Lutte contre les changements climatiques (MELCC) (2021b). Guide d'évaluation et d'intervention relatif au suivi du plomb et du cuivre dans l'eau potable. Québec, QC. Ministère de l'Environnement et de la Lutte contre les changements climatiques. Disponible à : https://www.environnement.gouv.qc.ca/eau/potable/plomb/guide-evaluation-intervention.htm
- Ministère de l'Environnement et de la Lutte contre les changements climatiques (MELCC) (2021c). Gestion du plomb dans l'eau potable : un guide pour les propriétaires d'un grand bâtiment. Québec, QC. Ministère de l'Environnement et de la Lutte contre les changements climatiques. Disponible à : https://www.environnement.gouv.qc.ca/eau/potable/plomb/guide-evaluation-intervention.htm
- OME (2009). Guidance document for preparing corrosion control plans for drinking water systems. Ontario Ministry of the Environment. Disponible à : https://ia803403.us.archive.org/35/items/guidancedocument00snsn21738/guidancedocument00snsn21738.pdf
- Santé Canada (2023a). Infographie : Nettoyage des aérateurs de robinets. Santé Canada, Direction générale de la santé environnementale et de la sécurité des consommateurs. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/infographie-nettoyage-aerateurs-robinets.html
- Santé Canada (2023b). Infographie : Se procurer un filtre à eau potable certifié pour le plomb. Santé Canada, Direction générale de la santé environnementale et de la sécurité des consommateurs. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/infographie-procurer-filtre-eau-potable.html
- Schock, M. R., Lytle, D.A., James, R. R., Lal, V. et Tang, M. (2021). Rapid and simple lead service line detection screening protocol using water sampling. AWWA Water Science, e1255. https://doi.org/10.1002/aws2.1255
- U.S. EPA (2016). Optimal Corrosion Control Treatment Evaluation Technical Recommendations for Primacy Agencies and Public Water Systems. U.S. Environmental Protection Agency, Office of Water. Washington, DC. (Report No. EPA 816-B-16-003). Disponible à : https://www.epa.gov/sites/default/files/2019-07/documents/occtmarch2016updated.pdf
- U.S. EPA (2018). 3Ts for Reducing Lead in Drinking Water in Schools and Child Care Facilities A Training, Testing, and Taking Action Approach Revised Manual. U.S. Environmental Protection Agency, Office of Water. Washington, DC. (Report No. EPA 815-B-18-007). Disponible à : https://www.epa.gov/system/files/documents/2021-07/epa-3ts-guidance-document-english.pdf
- U.S. EPA (2022). Guidance for Developing and Maintaining a Service Line Inventory. U.S. Environmental Protection Agency, Office of Water. Washington, DC. (Report No. EPA 816-B-22-001). Disponible à : https://www.epa.gov/system/files/documents/2022-08/Inventory%20Guidance_August%202022_508%20compliant.pdf
- Water Research Foundation (2021). Full lead service line replacement guidance (Project No. 4713). Water Research Foundation. Denver, CO. Disponible à : https://www.waterrf.org/system/files/resource/2022-09/DRPT-4713.pdf
- Water Research Foundation (2023). Guidance for using pipe rigs to inform lead and copper corrosion Control treatment decisions (Project No. 5081). Water Research Foundation and Copper Development Association. Denver, CO. Disponible à : https://www.waterrf.org/research/projects/guidance-using-pipe-rigs-inform-lead-and-copper-corrosion-control-treatment
Partie H. Considérations internationales
Bien que diverses organisations nationales et internationales aient établi des valeurs en ce qui concerne la présence de plomb dans l'eau potable, peu d'entre elles ont émis des recommandations ou adopté des règlements sur le contrôle de la corrosion dans l'eau potable.
L'U.S. EPA a révisé son seuil d'intervention pour le plomb à 0,010 mg/L (10 µg/L) dans sa version finale de la Lead and Copper Rule Revisions (LCRR), publiée en novembre 2023 et basée sur le 90e centile des échantillons prélevés. Les systèmes de distribution d'eau potable qui dépassent le seuil d'intervention sont tenus de remplacer les entrées de service en plomb à un taux annuel moyen d'au moins 10 %, sur une période mobile de trois ans, et lancer (ou ré-optimiser) le TCC. En outre, systèmes de distribution d'eau potable réglementés devaient compléter les inventaires initiaux de leurs entrées de service en plomb avant octobre 2024.
L'U.S. EPA a promulgué le 8 octobre 2024 la règle finale relative aux améliorations du LCR (LCRI). Cette règle exige que la grande majorité des systèmes de distribution d'eau potable remplacent les entrées de service en plomb dans un délai de 10 ans et mettent régulièrement à jour leurs inventaires. Pour les sites ayant des entrées de service en plomb, les systèmes de distribution d'eau potable sont tenus de prélever et d'analyser le premier et le cinquième litre d'eau et de retenir la valeur la plus élevée de ces deux échantillons pour établir la conformité règlementaire. Les systèmes de distribution d'eau potable qui dépassent à plusieurs reprises le seuil d'intervention pour le plomb sont tenus de continuer à ajuster le traitement, de mener des actions de sensibilisation supplémentaires auprès des communautés et de fournir des filtres certifiés pour réduire la teneur en plomb à tous les consommateurs.
La LCRI finale prévoit des communications plus fréquentes et plus proactives sur les entrées de service en plomb et les plans de remplacement.
L'Organisation mondiale de la Santé a publié une note technique donnant des conseils sur la gestion de la contamination par le plomb dans les systèmes d'approvisionnement en eau potable. Ce document comprend des renseignements sur l'échantillonnage à des fins de conformité et d'enquête ainsi que sur les mesures correctives provisoires et à long terme à entreprendre (OMS, 2022b).
L'Union européenne et le National Health and Medical Research Council de l'Australie n'ont pas établi de recommandations sur le contrôle de la corrosion.
Notes de bas de page
- Note de bas de page 1
-
Une habitation résidentielle convertie en garderie serait considérée comme une habitation résidentielle aux fins de l'échantillonnage.
- Note de bas de page 2
-
D'après le 90e centile des concentrations les plus élevées de plomb dans les échantillons prélevés au robinet pendant la période de surveillance.