Page 4 : Document de conseils sur l'hydrate de chloral dans l'eau potable
L'hydrate de chloral (2,2,2-trichloro-1,1-éthanediol) a un poids moléculaire relatif de 165,4. D'apparence cristalline, il a une odeur aromatique légèrement âcre et un goût légèrement amer (Reynolds et Prasad, 1982; Budavari, 1996). Il est synthétisé par chloration de l'éthanol (Reynolds et Prasad, 1982; Budavari, 1996; Verschueren, 2001).
Son point de fusion est de 57 °C, son point d'ébullition, de 96 °C (Hansch et coll., 1995), et sa masse volumique, de 1,91 g/cm³ à 20 °C. Comme son coefficient de partage octanol-eau (log Koe) est de 0,99, la bioconcentration n'est pas un facteur important. À 25 °C, l'hydrate de chloral a une pression de vapeur de 2 kPa (Reynolds et Prasad, 1982; Hansch et coll., 1995) et une solubilité dans l'eau de 9,3 × 106 mg/L (McEvoy, 1999). Il se volatilise lentement à l'air ambiant et se décompose sous l'effet de la lumière (McEvoy, 1999).
L'hydrate de chloral sert de sédatif et d'hypnotique en médecine humaine et vétérinaire. Il entre aussi dans la fabrication du DDT (Budavari, 1996) et de l'acide dichloroacétique (DCA) (Kirk-Othmer, 1991); il sert d'intermédiaire dans la production des insecticides méthoxychlore, naled, trichlorfon et dichlorvos, de l'herbicide acide trichloroacétique (TCA) et des hypnotiques chloralbétaïne, chloralose et trichlorfos sodium (CIRC, 1995). L'hydrate de chloral peut être formé comme sous-produit de la chloration d'une eau qui contient des précurseurs organiques comme des acides fulviques ou humiques. De l'hydrate de chloral peut aussi être rejeté dans l'environnement par des usines de traitement des eaux usées, ainsi que lors de la fabrication d'hydrate de chloral de qualité pharmaceutique et de la fabrication d'insecticides et d'herbicides où l'hydrate de chloral est utilisé comme intermédiaire (U.S. EPA, 2000).
La bactérie méthanotrophe Methylosinus trichosporium peut transformer l'hydrate de chloral en trichloroéthanol (TCOH) et en TCA. En conditions abiotiques (pH 9,0 et 60 °C), l'hydrate de chloral se transforme en chloroforme après 2,3 minutes. L'acide formique est un autre produit de décomposition de l'hydrate de chloral (Newman et Wackett, 1991).
Aucune donnée n'est disponible sur l'exposition humaine à l'hydrate de chloral dans l'air. L'exposition par inhalation d'hydrate de chloral en solution aqueuse est négligeable en raison de sa forte solubilité dans l'eau et de sa faible volatilité (U.S. EPA, 2000).
Selon des relevés effectués au Canada en 1995 et en 1997, la concentration moyenne d'hydrate de chloral dans l'eau potable variait de 1,2 à 3,8 µg/L l'hiver et de 3,6 à 8,4 µg/L l'été, et a atteint un sommet de 22,5 µg/L l'hiver lors d'un échantillonnage de 53 sites (Santé Canada, 1995; Edsall et Charlton, 1997; Williams et coll., 1997). Bien qu'on observe des concentrations légèrement plus élevées dans de petites usines de traitement dont les capacités d'élimination des matières organiques avant la chloration sont limitées, ces concentrations restent bien inférieures à tout niveau préoccupant.
Aux États-Unis, les concentrations médianes d'hydrate de chloral dans l'eau traitée variaient de 1,7 à 2,5 µg/L, et les concentrations maximales, de 22 à 46 µg/L (Krasner et coll., 1989; U.S. EPA, 1992). La concentration d'hydrate de chloral était plus élevée dans les réseaux distribuant de l'eau de surface (médiane de 4,0 µg/L) que dans l'eau souterraine (médiane de 0,5 µg/L) et était généralement plus forte que dans l'eau prête au débit (médiane de 2,4 µg/L), ce qui semble indiquer que les concentrations d'hydrate de chloral augmentent à travers le réseau de distribution.
Aucune donnée n'est disponible sur l'exposition humaine à l'hydrate de chloral par le biais des aliments (CIRC, 1995).
Pour les adultes, la dose hypnotique habituelle d'hydrate de chloral est de 0,5-1 g, tandis que la dose sédative courante est de 250 mg 3 fois par jour. Pour atténuer les symptômes de sevrage alcoolique, la dose usuelle est de 0,5-1 g, répétée aux 6 heures au besoin. En général, les doses uniques ou les doses quotidiennes ne doivent pas dépasser 2 g pour un adulte. Chez les enfants, la dose hypnotique est de 50 mg/kg p.c, ou 1,5 g/m³ (dose maximale de 1 g), et la dose sédative, de 8 mg/kg p.c., ou 250 mg/m³ 3 fois par jour (dose maximale de 500 mg 3 fois par jour). Comme prémédication avant l'électroencéphalographie, on peut administrer une dose d'hydrate de chloral de 2 à 25 mg/kg p.c. aux enfants (McEvoy, 1999).
L'hydrate de chloral est très soluble dans l'eau, son coefficient de partage octanol-eau (Kow) est inférieur à 10, et il est présent dans l'eau potable comme SPD. Il n'existe aucune donnée sur les concentrations d'hydrate de chloral dans l'air, le sol ou la nourriture, mais rien n'indique qu'elles seraient importantes. Ces caractéristiques laissent croire que l'eau potable constituerait la principale voie d'exposition de la population générale à l'hydrate de chloral; c'est pourquoi un facteur d'allocation de 80 % est appliqué dans l'évaluation des risques. L'exposition professionnelle peut se produire durant la fabrication d'hydrate de chloral (CIRC, 1995), et une exposition par des produits pharmaceutiques est aussi possible.
L'hydrate de chloral est utilisé comme agent thérapeutique sédatif ou hypnotique depuis plus d'un siècle chez les enfants, les adultes et les animaux (Henderson et coll., 1997). Il manque de données pour établir la dose sans effet nocif observé (NOAEL) chez l'humain. La plus faible dose avec effet nocif observé (LOAEL) est de 10,7 mg/kg p.c. par jour (pour un adulte de 70 kg), selon la dose recommandée comme sédatif chez l'adulte, soit 250 mg 3 fois par jour.
L'administration orale de fortes doses d'hydrate de chloral cause de l'irritation gastrique accompagnée le plus souvent de nausées, de vomissements et de diarrhée. La leucopénie, l'éosinophilie et, plus rarement, la cétonurie sont au nombre des autres effets nocifs possibles (McEvoy, 1999).
Ellenhorn et coll. (1997) ont estimé à 10 mg/100 mL et à 25 mg/100 mL, respectivement, la concentration toxique et la concentration létale d'hydrate de chloral dans le sang.
Bien qu'on ait estimé à 10 g la dose létale chez l'adulte, un cas d'ingestion mortelle de 4 g a été signalé, alors que certains patients ont survécu à l'ingestion de fortes doses allant jusqu'à 30 g (McEvoy, 1999). Dans un cas, l'ingestion de 20 g a entraîné chez un patient, tombé ultérieurement dans le coma, une perforation de l'estomac diagnostiquée 4 jours après l'ingestion. Dans un autre cas, une dose de 18 g a provoqué une hémorragie gastro-intestinale, puis une sténose de l'oesophage. Le foie (ictère, hypertransaminasémie) et les reins (albuminurie) peuvent être atteints plusieurs jours après l'ingestion, mais rarement de façon grave ou prolongée (Abbas et coll., 1996).
Dans une étude sur 1 618 patients qui avaient reçu diverses doses d'hydrate de chloral, Shapiro et coll. (1969) ont fait état d'un large éventail d'effets nocifs sans indiquer clairement si les patients présentaient ces effets cliniques avant ou après l'exposition à l'hydrate de chloral. La cirrhose hépatique a été le plus souvent diagnostiquée (15 %), suivie d'une maladie respiratoire chronique obstructive (7 %), du cancer du sein (7 %) et de l'insuffisance cardiaque congestive (7 %), mais une relation causale n'a pu être établie. Les autres réactions à l'hydrate de chloral, symptômes gastro-intestinaux (10 patients), dépression du système nerveux central (20 patients), éruption cutanée (5 patients), allongement du temps de prothrombine (1 patient), aggravation d'une encéphalopathie hépatique (1 patient) et bradycardie (1 patient), ont disparu peu après la fin de l'administration du produit (Shapiro et coll., 1969). Une autre étude de dossiers médicaux a montré que l'effet prédominant de l'exposition à l'hydrate de chloral de 5 435 patients a été la dépression du système nerveux central (Greenberg et coll., 1991).
Aucune étude de longue durée n'a été publiée sur l'exposition humaine à l'hydrate de chloral.
Chez les souris, la DL50 d'hydrate de chloral a été établie à 1 265 mg/kg p.c. pour les femelles et à 1 442 mg/kg p.c. pour les mâles. Les rats étaient plus sensibles à l'hydrate de chloral : la DL50 s'est chiffrée à 285 mg/kg p.c. pour les nouveau-nés et à 479 mg/kg p.c. pour les adultes (Sanders et coll., 1982).
Des souris exposées par inhalation à 603 mg/m³ d'hydrate de chloral pendant 6 heures ont présenté plusieurs changements au niveau des poumons, notamment une vacuolisation des cellules de Clara, une nécrose alvéolaire, une desquamation de l'épithélium et un oedème alvéolaire (Odum et coll., 1992).
Le foie est le principal organe cible de l'exposition de courte durée à l'hydrate de chloral. Dans une étude de 7 jours sur 28 rats Sprague-Dawley mâles exposés à 5, 43 ou 375 mg/kg p.c. d'hydrate de chloral par jour dans l'eau potable, aucune NOAEL n'a pu être établie, car leur foie n'a présenté aucune modification histopathologique. Par contre, d'autres changements observés dans le foie (p. ex. hausse de la concentration de la palmitoyl coenzyme A (CoA) oxydase [enzyme des peroxysomes hépatiques], suppression de l'activité de l'aldéhyde déshydrogénase [ALDH] hépatique et baisse des concentrations hépatiques de cholestérol et de triglycérides) portent à croire que le foie est l'organe cible de l'exposition à l'hydrate de chloral (Poon et coll., 2000). Ces chercheurs ont aussi mené une étude de 13 semaines dans laquelle ils ont exposé des rats Sprague-Dawley (10 rats par sexe et par dose) à 0, 0,2, 2, 20 ou 200 mg/L d'hydrate de chloral dans l'eau potable (ce qui correspond à des doses de 0, 0,02, 0,19, 1,9 et 19,8 mg/kg p.c. par jour pour les mâles et de 0, 0,03, 0,24, 2,6 et 23,6 mg/kg p.c. par jour pour les femelles). D'après la baisse de l'activité de l'ALDH observée à la plus forte dose chez les deux sexes, la hausse de la concentration d'aniline hydroxylase enregistrée aux plus fortes doses chez les deux sexes et la vacuolisation minimale de la gaine de myéline relevée à la plus forte dose chez les mâles, la dose sans effet observé (NOEL) a été établie à 1,9 mg/kg p.c. par jour pour les mâles et à 2,6 mg/kg p.c. par jour pour les femelles. La LOAEL pour les mâles était de 19,8 mg/kg p.c. par jour, d'après la légère vacuolisation de la gaine de myéline (Poon et coll., 2002). (Selon les auteurs, le tissu nerveux est particulièrement susceptible à une mauvaise fixation, la vacuolisation en constituant un des artefacts histologiques les plus courants.)
Sanders et coll. (1982) ont exposé des souris CD-1 (48 par sexe pour le groupe témoin; 32 par sexe pour chaque groupe de traitement) à 70 ou à 700 mg/L d'hydrate de chloral dans l'eau potable pendant 90 jours (ce qui correspond à des doses de 16 et de 160 mg/kg p.c. par jour pour les mâles et de 18 et de 173 mg/kg p.c. par jour pour les femelles). En se fondant sur les changements observés dans le foie des mâles, notamment la hausse du poids du foie, l'hépatomégalie et la prolifération de microsomes, ils ont calculé une LOAEL de 160 mg/kg p.c. par jour et une NOAEL de 16 mg/kg p.c. par jour. Dans une étude semblable, Kauffmann et coll. (1982) en sont arrivés à une NOAEL de 16 mg/kg p.c. par jour pour la baisse de l'immunité humorale (estimée selon les titres hémagglutinants et le nombre de cellules spléniques formant des anticorps contre des érythrocytes du mouton), ainsi qu'à une LOAEL de 160 mg/kg p.c. par jour.
Daniel et coll. (1992b) ont confirmé que le foie était l'organe cible dans une étude d'exposition de rats Sprague-Dawley (10 par sexe et par dose) à 300, 600, 1 200 ou 2 400 mg/L d'hydrate de chloral dans l'eau potable pendant 90 jours (ce qui correspond à 24, 48, 96 et 168 mg/kg p.c. par jour pour les mâles et à 33, 72, 132 et 288 mg/kg p.c. par jour pour les femelles). D'après les effets hépatotoxiques (foyers de nécrose hépatocellulaire chez les mâles) et les modifications touchant des enzymes sériques (observées chez les deux sexes, mais non liées à la dose et pas importantes sur le plan toxicologique), les auteurs ont calculé une LOAEL de 96 mg/kg p.c. par jour et une NOAEL de 48 mg/kg p.c. par jour.
Plusieurs études sur l'exposition de longue durée et la cancérogénicité ont confirmé que le foie est le principal organe cible de la toxicité de l'hydrate de chloral.
Rijhsinghani et coll. (1986) ont exposé des souris mâles C57BL × C3HF1 de 15 jours à une seule dose de 5 mg/kg p.c. ou de 10 mg/kg p.c. d'hydrate de chloral dans de l'eau distillée, et ont donné de l'eau distillée seulement à un groupe témoin. Pour étudier les effets à long terme, les chercheurs ont sacrifié des souris à intervalle régulier, ainsi que les souris qui sont devenues moribondes, jusqu'à la fin de la période de 92 semaines. Ils ont mis en évidence une hausse significative (P < 0,05) de l'incidence de tumeurs seulement chez les souris exposées à la dose de 10 mg/kg p.c. Ces souris ont présenté une hausse du poids relatif du foie, mais pas celles exposées à la dose de 5 mg/kg p.c. L'incidence de nodules hépatiques par rapport au groupe témoin a augmenté seulement chez les souris exposées à la dose de 10 mg/kg p.c. d'hydrate de chloral. Les lésions nodulaires du foie ont consisté en des foyers hyperplasiques de cellules claires ou acidophiles, en des adénomes hépatocellulaires ou en des carcinomes trabéculaires contenant des hépatocytes éosinophiles (Rijhsinghani et coll., 1986). Il faut souligner que cette étude date de 20 ans et que son protocole n'était pas conforme aux lignes directrices de l'Organisation de coopération et de développement économiques (OCDE) concernant l'utilisation des deux sexes, le nombre d'animaux testés et le nombre de doses pour une étude de cancérogénicité. On croit que la hausse de l'incidence de tumeurs hépatiques observée dans cette étude était attribuable à la variation normale chez les souris plutôt qu'au traitement par l'hydrate de chloral (NTP, 2002b).
George et coll. (2000) ont réalisé une importante étude dans laquelle ils ont exposé durant 104 semaines des souris B6C3F1 mâles (72 par dose) à 0, 120, 580 ou 1 280 mg/L d'hydrate de chloral dans l'eau potable (ce qui correspond à des doses de 0, 13,5, 65 et 146,6 mg/kg p.c. par jour). La prévalence de carcinomes hépatocellulaires était plus élevée chez les souris exposées à la plus forte dose (84,4 %) que dans le groupe témoin (54,8 %) et les groupes ayant reçu les doses faible (54,3 %) et moyenne (59,0 %). La prévalence d'adénomes hépatiques a augmenté significativement chez tous les groupes exposés à l'hydrate de chloral : elle a été de 43,5 %, de 51,3 % et de 50,0 % respectivement pour les souris exposées aux doses faible, moyenne et forte, et de 21,4 % pour le groupe témoin. Les activités sériques de la lactodéshydrogénase (LDH), de l'alanine aminotransférase (ALT), de l'aspartate aminotransférase (AST) et de la sorbitol déshydrogénase (SDH) ainsi que les concentrations totales d'antioxydants ont corroboré le degré minime d'atteinte hépatocellulaire observé au microscope. En effet, aucun de ces paramètres ne différait chez les groupes traités et le groupe témoin au bout de 52 et de 78 semaines d'exposition. L'activité de la palmitoyl CoA oxydase dans les homogénats de foie n'était pas significativement plus élevée chez les souris exposées que chez les souris témoins, ce qui indique que l'hydrate de chloral n'a pas provoqué une prolifération de peroxysomes. Comme une hausse de la prévalence des néoplasies hépatiques s'est produite à la plus faible dose (13,5 mg/kg p.c. par jour), une NOAEL n'a pu être déterminée, mais on peut établir la LOAEL à 13,5 mg/kg p.c. par jour. Les résultats relatifs aux tumeurs combinées ont été significativement plus élevées pour la prévalence dans les groupes exposés aux doses moyenne et forte et pour la multiplicité dans tous les groupes exposés. Dans cette étude, l'incidence d'adénomes hépatocellulaires a augmenté à toutes les doses, mais l'incidence de carcinomes hépatocellulaires n'a crû qu'à la plus forte dose (George et coll., 2000). Le Programme international sur la sécurité des substances chimiques (PISSC, 2000) a évalué cette étude et a établi une NOAEL de 146,6 mg/kg p.c. par jour pour les effets non cancérogènes sur la souris, utilisant comme justification de la NOAEL la prévalence des lésions prolifératives dans le groupe témoin. On a également noté l'absence de hausse de la prévalence de néoplasies ailleurs que dans le foie. Les souris mâles ont présenté une hausse des lésions prolifératives (hyperplasie, adénomes, carcinomes ainsi qu'adénomes et carcinomes combinés) dans le foie à toutes les doses d'exposition.
Dans un autre volet de l'étude (George et coll., 2000), des rats F344 mâles (78 par dose) ont reçu durant 104 semaines 0, 120, 580 ou 2 510 mg/L d'hydrate de chloral dans l'eau potable (ce qui correspond à des doses de 0, 7,4, 37,4 et 162,6 mg/kg p.c. par jour). Après 52 et 78 semaines d'exposition, aucun des paramètres mesurés ne différait entre les rats exposés et le groupe témoin, et la NOAEL a donc été fixée à la plus forte dose pour cette étude (George et coll., 2000). Toutefois, l'EPA (2000) a conclu que la dose maximale tolérée n'a pas été atteinte dans l'étude, et nous sommes d'accord avec cette conclusion.
Deux études du National Toxicology Program (NTP, 2002a et 2002b) ne fournissent que de faibles preuves de la cancérogénicité de l'hydrate de chloral chez les souris B6C3F1 mâles et femelles. Dans la première étude (NTP, 2002a), cinq groupes de souris B6C3F1 ont reçu par gavage de l'hydrate de chloral dans de l'eau distillée durant 5 semaines, selon un régime posologique compliqué. Des doses allant jusqu'à 100 mg/kg p.c. par jour d'hydrate de chloral ont été administrées 5 jours par semaine (71,4 mg/kg p.c. pour la même exposition étalée sur 7 jours par semaine). Dans le premier groupe, l'incidence d'adénomes du lobe antérieur de l'hypophyse présentait une tendance positive en fonction de la dose, et l'incidence à la plus forte dose était significativement plus élevée que dans le groupe témoin; chez des souris femelles qui avaient reçu 71,4 mg/kg p.c. par jour durant au plus 24 mois, l'incidence d'adénomes présentait aussi une tendance positive en fonction du temps, et la gravité de l'hyperplasie du lobe antérieur a augmenté significativement. Les auteurs ont conclu, d'après les hausses de l'incidence d'adénomes du lobe antérieur de l'hypophyse, que les preuves de l'activité cancérogène de l'hydrate de chloral chez des souris femelles exposées continuellement pendant 2 ans étaient équivoques. Ils n'ont observé aucune hausse de l'incidence de tumeurs chez des souris B6C3F1 femelles qui avaient reçu une seule dose d'hydrate de chloral à l'âge de 15 ou de 28 jours, ni chez des souris B6C3F1 mâles qui avaient reçu une seule dose d'hydrate de chloral à l'âge de 15 jours. Aucune cancérogénicité hépatique n'a été relevée, peu importe la dose. La NOAEL pour les effets néoplasiques a été établie à 71,4 mg/kg p.c. par jour (NTP, 2002a).
Haseman et coll. (1998) ont fait état d'importants écarts entre le groupe expérimental et les témoins historiques dans l'étude NTP (2000a) de même que dans l'incidence d'adénomes du lobe antérieur de l'hypophyse et de tumeurs, adénomes et carcinomes hépatocellulaires selon la dose. Par exemple, l'incidence d'adénomes (12 % à 71,4 mg/kg p.c. par jour) a dépassé l'incidence chez les témoins historiques (incidence historique dans les groupes témoins des études du National Center for Toxicological Research [NCTR] : incidence de 4,9 %, intervalle de 0 à 6 %). L'incidence d'adénomes et de carcinomes du lobe antérieur de l'hypophyse se chiffrait à 14,8 % pour les témoins historiques (Haseman et coll., 1998), ce qui est plus élevé que l'incidence de 12 % observée à la plus forte dose dans les deux premiers groupes testés. Ce type d'adénome n'a pas été observé dans d'autres études. Dans les deux cas (adénome et hyperplasie de l'hypophyse), on ne peut déduire d'effet lié à la dose. L'incidence de lymphomes malins observée aux doses faible et forte (33 % à 10 mg/kg p.c.) (dans le troisième groupe) est plus élevé que celle dans les deux groupes témoins des études du NCTR (24,6 %) et de Haseman et coll. (1998) (20,9 %). La durée du traitement n'a eu aucun effet sur les incidences de lymphomes malins, lesquelles étaient dans la plage des incidences chez les témoins historiques, ce qui permet de conclure que les incidences observées dans les premier et troisième groupes testés étaient attribuables à la variation normale chez les souris B6C3F1 femelles. L'incidence d'adénomes bronchiolaires/alvéolaires a été significativement plus élevée (18 %) dans le deuxième groupe après 12 mois, mais aucune différence significative n'a été relevée au bout de ans, ce qui porte à croire que l'incidence n'était peut-être pas attribuable à l'hydrate de chloral. L'incidence observée dans cette étude se situe dans la plage des valeurs historiques (5,9 %; intervalle de 0 à 24 %) pour les souris B6C3F1 femelles témoins nourries au NIH-07 (un mélange alimentaire à base de céréale à formule libre qui constitue la norme du NTP pour les études de toxicité chimique et de cancérogénicité) (Haseman et coll., 1998), mais elle est plus élevée que celle recensée chez des souris B6C3F1 femelles dans l'autre étude du NCTR, soit 3,8% (intervalle de 2 à 6 %). Ce type de lésion n'a été décelée dans aucune autre étude sur l'hydrate de chloral. Dans l'étude du NTP (2002a), l'incidence de tumeurs hépatocellulaires chez les femelles des troisième et quatrième groupes était assez faible, de 1 % à 13 % à des doses allant jusqu'à 50 mg/kg p.c., tandis que chez les mâles (dans le cinquième groupe), l'incidence de tumeurs hépatocellulaires était plutôt élevée, même dans le groupe témoin (50 %). Aucune tumeur chez la souris n'a pu être attribuée à l'exposition à l'hydrate de chloral.
Dans la deuxième étude du NTP (NTP, 2002b), 120 souris B6C3F1 mâles ont reçu pendant 2 ans 0, 25, 50 ou 100 mg/kg par jour d'hydrate de chloral dans leur nourriture 5 jours par semaine (soit 0, 17,9, 35,7 ou 71,4 mg/kg p.c. par jour pour la même exposition étalée sur 7 jours par semaine). Les souris mâles ont été séparées en deux groupes de 60 : un qui était nourri ad libitum, et l'autre à qui l'on a donné quotidiennement une quantité mesurée de nourriture (gavage). On a évalué dans chaque groupe de dose et par diète 12 souris après 15 mois, et les 48 autres après 2 ans. Des changements histopathologiques n'ont été observés que dans le foie. Dans le groupe nourri ad libitum, l'incidence d'adénomes ou de carcinomes hépatocellulaires a été significativement plus élevée seulement chez les souris exposées à 17,9 mg/kg p.c. par jour. Parmi les souris soumises à un régime alimentaire contrôlé, l'incidence de carcinomes hépatocellulaires n'a été significativement différente qu'à la dose de 71,4 mg/kg p.c. par jour. La NOAEL pour les effets non néoplasiques est de 71,4 mg/kg p.c. par jour (NTP, 2002b). L'incidence d'adénomes et de carcinomes hépatocellulaires pour le groupe nourri ad libitum s'élevait à 33 %, 52 %, 48 % et 46 %, respectivement, aux doses de 0, 17,9, 35,7 et 71,4 mg/kg p.c. par jour, alors qu'elle était de 42 % pour les témoins historiques. Chez les souris au régime alimentaire contrôlé, l'incidence combinée d'adénomes et de carcinomes à toutes les doses a été inférieure au taux de 42,2 % pour les témoins historiques de la même souche, soit de 23 %, 23 %, 29 % et 38 %, respectivement, aux doses de 0, 17,9, 35,7 et 71,4 mg/kg p.c. par jour. Aucune souris femelle n'a été exposée dans cette étude.
Dans une étude de Daniel et coll. (1992a), 40 souris B6C3F1 mâles ont reçu 1 g/L d'hydrate de chloral (166 mg/kg p.c. par jour) dans l'eau potable durant 104 semaines. Seuls de légers changements histopathologiques ont été observés et ce, uniquement dans le foie. Parmi les souris sacrifiées après 60 semaines, 2 souris exposées à l'hydrate de chloral étaient porteuses d'un carcinome hépatocellulaire, mais aucune des souris témoins. À la fin de l'étude, 11 des 24 souris exposées ayant survécu ont présenté un carcinome hépatocellulaire, tandis que 7 d'entre elles étaient porteuses d'un adénome hépatocellulaire. Parmi les 20 souris témoins survivantes examinées, 2 avaient un carcinome, et 1, un adénome. L'incidence des adénomes et celle des carcinomes étaient significativement plus élevées chez les souris exposées que dans le groupe témoin, et la hausse de l'incidence combinée des adénomes et des carcinomes était très significative (Daniel et coll., 1992a). L'incidence de tumeurs hépatocellulaires chez les témoins dans cette étude (15%) était faible par rapport au taux de 42,2 % chez les témoins historiques (Haseman et al., 1998). L'étude a toutefois montré que le foie est l'organe cible de l'exposition à l'hydrate de chloral et a mis en évidence des cas de nécrose hépatocellulaire et de tumeurs (carcinomes et adénomes). L'étude ne respecte cependant pas les normes de l'OCDE, car elle n'a porté que sur une seule dose. La différence dans les incidences d'adénomes et de carcinomes hépatocellulaires entre l'étude du NTP (2002a) et celle de Daniel et coll. (1992a) pourrait être attribuable à la plus forte dose employée dans cette dernière étude.
Un essai d'exposition chronique a été réalisée sur des rats Sprague-Dawley (50 par sexe et par groupe) qui ont reçu des doses d'hydrate de chloral de 0, 15, 45 ou 135 mg/kg p.c. par jour dans l'eau potable durant 124 semaines pour les mâles et 128 semaines pour les femelles. L'incidence de tumeurs n'a augmenté dans aucun des organes. Une hausse de l'incidence de l'hypertrophie hépatocellulaire (hypertrophie diffuse des cellules hépatiques présentant un cytoplasme légèrement éosinophile) a été observée à la plus forte dose (28 %) par rapport au groupe témoin (11 %). Cette hausse n'a été constatée que chez les rats mâles, et sa gravité a été jugée minime à légère. Le type, l'incidence et la répartition par organe des lésions néoplasiques ne différaient pas chez les rats exposés à l'hydrate de chloral et les rats témoins, les lésions ont été considérées comme des événements aléatoires. Aucun changement n'a été observé dans le poids du corps ou des organes. La hausse de l'incidence d'hypertrophie hépatocellulaire a permis d'établir une NOAEL de 45 mg/kg p.c. par jour et une LOAEL de 135 mg/kg p.c. par jour (Leuschner et Beuschner, 1998). L'EPA (2000) a conclu que la dose maximale tolérée n'a pas été atteinte dans l'étude, et nous sommes d'accord avec cette conclusion.
Les données sur la génotoxicité de l'hydrate de chloral sont équivoques. Moore et Harrington-Brock (2000) ont constaté une certaine activité génotoxique de l'hydrate de chloral et de ses métabolites, mais seulement à de très fortes doses, ce qui indique que l'hydrate de chloral est faiblement génotoxique.
Des résultats positifs ont été obtenus in vitro pour des essais de mutation ponctuelle sur les souches TA198 and TA100 de Salmonella typhimurium (Waskell, 1978; Bruce et Heddle, 1979; Bignami et coll., 1980; NTP, 2002a), pour les échanges de chromatides soeurs (Bruce et Heddle, 1979; NTP, 2002a), pour des cassures de brins d'ADN dans des lymphocytes humains (Gu et coll., 1981), pour des aberrations chromosomiques dans des cellules d'ovaire de hamster chinois avec et sans S9 (Bruce et Heddle, 1979; NTP, 2002a), pour l'aneuploïdie et la clastogénicité dans plusieurs systèmes expérimentaux de cellules de mammifères (Natarajan et coll., 1993; Harrington-Brock et coll., 1998) et pour l'aneuploïdie dans divers champignons sans activation métabolique (U.S. EPA, 2000). L'hydrate de chloral a provoqué une aneuploïdie in vitro dans des fibroblastes embryonnaires de hamster chinois sans système métabolique exogène à une dose de 250 µg/mL (Harrington-Brock et coll., 1998), dans deux lignées de cellules pulmonaires de hamster chinois à des doses de 250 µg/mL et de 50 µg/mL (Warr et coll., 1993) et dans des lymphocytes du sang périphérique humain sans système métabolique exogène à une dose de 50 µg/mL (Sbrana et coll., 1993).
Allen et coll. (1994) ont observé des hausses du nombre de micronoyaux dans des spermatides de souris lorsqu'ils ont exposé des spermatogonies souches à 41, 83 ou 165 mg/kg p.c. d'hydrate de chloral. Une dose de 5 500 mg/kg p.c. d'hydrate de chloral a provoqué une légère hausse de la fréquence des mutations récessives létales liées au sexe dans des cellules germinales de Drosophila melanogaster mâles (Yoon et coll., 1985).
Des résultats négatifs ont été obtenus pour la souche TA1535 de Salmonella typhimurium dans des essais de mutation ponctuelle, pour l'enjambement mitotique chez Aspergillus nidulans sans activation métabolique, pour une mutation inverse chez Saccharomyces cerevisiae, pour des liaisons transversales entre l'ADN et des protéines dans des noyaux de cellules hépatiques de rats, pour des cassures simple brin de l'ADN dans des cultures primaires d'hépatocytes de rongeur et dans des cellules CCRF-CEM, une lignée de cellules de leucémie lymphoblastique humaine (Chang et coll., 1992), pour la réparation de l'ADN chez Escherichia coli (U.S. EPA, 2000) et pour l'induction de micronoyaux et l'aneuploïdie dans des cellules de lymphome de souris (Natarajan et coll., 1993; Harrington-Brock et coll., 1998). L'exposition à l'hydrate de chloral a aussi donné des résultats négatifs dans des essais sur des ovocytes de souris ICR en métaphase II (Mailhes et coll., 1993).
In vivo, l'hydrate de chloral a donné des résultats positifs dans le test du micronoyau de la moelle osseuse de souris (U.S. EPA, 2000; NTP, 2002b). L'exposition in vivo de souris à l'hydrate de chloral a augmenté la fréquence d'aberrations chromosomiques dans la moelle osseuse, les spermatogonies et les spermatocytes primaires et secondaires, mais pas dans les ovocytes (U.S. EPA, 2000).
Les effets nocifs de l'hydrate de chloral sur la reproduction, l'embryon et le foetus, ainsi que ses effets tératogènes, ont été étudiés chez plusieurs espèces. Ces effets ont consisté notamment en une toxicité pour le développement neurologique, en une réduction de la motilité des spermatozoïdes et en une incidence accrue de malformations cardiaques.
Des souris CD-1 mâles et femelles (quatre par cage; nombre total non précisé) ont été exposées à 60 ou à 600 mg/L d'hydrate de chloral dans l'eau potable (équivalents à 21,3 et à 204,8 mg/kg p.c. par jour). Tous les animaux ont été exposés pendant 3 semaines avant l'accouplement, et les femelles l'ont été également durant la gestation et jusqu'au sevrage des petits à l'âge de 21 jours. Dans des essais de rétention d'une heure et de 24 heures, la dose de 204,8 mg/kg p.c. par jour a nui à la rétention de l'apprentissage par évitement passif chez des petits de 23 jours. Dans cette étude, on a établi une NOAEL de 21,3 mg/kg p.c. par jour en ce qui a trait à la toxicité pour le développement neurologique. Quant aux effets sur le reproduction et le développement, la NOAEL était de 204,8 mg/kg p.c. par jour (Kallman et coll., 1984).
Pour évaluer les effets de l'hydrate de chloral sur la morphologie et la motilité des spermatozoïdes, on a administré à des rats F344 mâles (deux par cage; nombre total non précisé) de l'hydrate de chloral dans l'eau potable à des concentrations de 0, 780 ou 2 700 mg/L (ce qui correspond à des doses de 0, 55 et 188 mg/kg p.c. par jour) pendant 52 semaines. On a observé une réduction de la motilité des spermatozoïdes chez les rats exposés à 188 mg/kg p.c. par jour (58 %) par rapport aux rats témoins (68 %). Cette dose a également modifié la distribution de fréquences des vitesses moyennes de déplacement en ligne droite des spermatozoïdes. Pour les effets sur la motilité des spermatozoïdes, la NOAEL se chiffrait à 55 mg/kg p.c. par jour, et la LOAEL, à 188 mg/kg p.c. par jour (Klinefelter et coll., 1995).
Saillenfait et coll. (1995) ont étudié l'embryotoxicité in vitro sur des embryons de rats Sprague-Dawley au dixième jour de gestation après les avoir exposés à des concentrations de 0,5 à 2,5 mmol/L (83-414 mg/L) pendant 46 heures. Tous les embryons sont morts à la plus forte dose, mais aucune mortalité n'a été observée aux autres doses. L'hydrate de chloral a causé des baisses de la croissance et de la différentiation et des hausses de l'incidence d'anomalies morphologiques qui variaient en fonction de la concentration. À 1,0 mmol/L, la longueur vertex-coccyx, le nombre de somites (segments embryonnaires) et la teneur en protéines ou en ADN des embryons ont diminué. À 1,0, 1,5 et 2,0 mmol/L, respectivement, 18 %, 68 % et 100 % des embryons ont présenté des malformations. Les malformations de l'encéphale, des yeux et des oreilles étaient les effets sur le développement les plus fréquents. À 2,0 mmol/L, le tronc et les systèmes visuel et auditif ont également présenté des anomalies, et, aux plus fortes concentrations, il y a eu de graves altérations de la région craniofaciale. On a aussi observé une hypoplasie du prosencéphale. L'hydrate de chloral a causé la dilatation du péricarde chez 45 % des embryons à une dose de 2 mmol/L. La létalité de l'hydrate de chloral pour les embryons a augmenté par paliers avec la concentration. Selon cette étude in vitro, l'hydrate de chloral est plus toxique que le TCA et le DCA, et la NOAEL est de 0,5 mmol/L (83 mg/L) pour l'embryotoxicité (Saillenfait et coll., 1995). Comme il s'agit d'une étude in vitro, on ne peut en comparer les résultats avec ceux d'une étude in vivo, ni les extrapoler au risque pour la santé humaine. Cette étude est inhabituelle parce que, dans la plupart des études sur la reproduction, l'exposition englobe la période d'organogenèse (jours 5 à 12) ou toute la période de gestation.
Johnson et coll. (1998) ont exposé des rates Sprague-Dawley gravides à 1,232 mg/mL d'hydrate de chloral dans l'eau potable (exposition moyenne de 151 mg/kg p.c. par jour) du jour 1 au jour 22 de gestation. Ils n'ont observé aucune toxicité maternelle, aucun changement du nombre de foetus vivants ou morts, du poids du placenta ou du foetus, et de la longueur vertex-coccyx, ni de hausse de l'incidence de changements morphologiques. Ils ont relevé des malformations cardiaques (non significatives), comme des communications interauriculaires (2), des anomalies de la valvule mitrale (2), des communications interventriculaires (3) et des anomalies de la valvule pulmonaire (1), alors que le groupe témoin a présenté 15 types de malformations cardiaques. Chez le groupe exposé à l'hydrate de chloral, l'incidence d'anomalies cardiaques s'élevait à 3,23 %, contre 2,15 % pour le groupe témoin (différence significative). D'après la toxicité pour le développement, les auteurs de l'étude ont calculé une LOAEL de 151 mg/kg p.c. d'hydrate de chloral par jour, mais n'ont pas trouvé de NOAEL (Johnson et coll., 1998).
Dans leur étude de toxicité subchronique décrite ci-dessus, Poon et coll. (2002) présumaient que les effets biologiques observés étaient attribuables au TCA, un agent connu de prolifération des peroxysomes. La baisse des triglycérides pourrait aussi être un effet du TCA. La présence de TCA dans le sérum et la hausse de la catalase hépatique cadrent bien avec un effet de l'hydrate de chloral sur la prolifération des peroxysomes. Toutefois, ce phénomène est peu pertinent chez l'humain, parce que les primates sont moins susceptibles que les souris et les rats à la prolifération des peroxysomes. Par contre, l'hypotriglycéridémie hépatique est une variable importante chez l'humain parce les agents de prolifération ont un effet hypolipémiant autant sur les animaux de laboratoire que chez l'humain.
Dans une étude in vitro sur des microsomes hépatiques de souris B6C3F1 mâles, on a constaté que l'hydrate de chloral a produit des intermédiaires radicaux libres qui ont entraîné la peroxydation de lipides endogènes, formant ainsi du malondialdéhyde, du formaldéhyde, de l'acétaldéhyde, de l'acétone et du propionaldéhyde, qui sont des substances tumorigènes connues. Le TCA et le TCOH ont également provoqué la peroxydation de lipides, mais le TCA a eu un plus grand effet que le TCOH, ce qui porte à croire que la formation de TCA est la principale voie qui mène à la peroxydation de lipides. Le cytochrome P-450 (peut-être l'isoenzyme CYP2E1) a été l'enzyme responsable de l'activation du métabolisme de l'hydrate de chloral et de ses métabolites pour former du TCA et du TCOH, ce qui a entraîné la peroxydation de lipides tumorigènes (Ni et coll., 1996).
Chez l'humain, l'hydrate de chloral est rapidement absorbé, puis il est soit oxydé en TCA (8 %), soit réduit en TCOH (92 %), surtout par le foie, mais aussi par le rein. Le TCOH peut se combiner avec l'acide glucuronique pour former du glucuronide de trichloroéthanol (TCOG), un métabolite inactif (Ogino et coll., 1990; McEvoy, 1999). Du TCA se forme aussi durant la circulation entérohépatique du TCOH, de sorte que 35 % de la dose initiale d'hydrate de chloral est transformée en TCA (Allen et Fisher, 1993). Les érythrocytes métabolisent également l'hydrate de chloral en TCOH, surtout par l'action de l'alcool déshydrogénase.
On a administré à des sujets volontaires mâles en santé (n = 18) une seule dose de 250 mg d'hydrate de chloral dans de l'eau potable, puis on a mesuré les concentrations d'hydrate de chloral, de TCOH et de TCA dans le plasma. De l'hydrate de chloral n'a été détecté que dans certains des échantillons de plasma, de 8 à 60 minutes après son administration. Les auteurs de l'étude ne donnent aucune concentration, mais précisent que la limite de détection était de 0,1 mg/L. Les concentrations maximales de TCOH et de TCA dans le plasma, soit 3 mg/L et 8 mg/L, ont été observées 0,67 et 32 heures, respectivement, après l'administration. La demi-vie terminale variait de 9,3 à 10,2 heures pour le TCOH et de 89 à 94 heures pour le TCA (Zimmermann et coll., 1998).
Quant aux doses thérapeutiques d'hydrate de chloral chez l'humain, la demi-vie dans le plasma est de 4-5 minutes pour l'hydrate de chloral, de 8-12 heures pour le TCOH, et de 67 heures pour le TCA (Ellenhorn et Barceloux, 1988).
Henderson et coll. (1997) ont mesuré les concentrations de TCA, de DCA et de TCOH chez des nourrissons et des enfants à qui l'on avait administré de l'hydrate de chloral comme sédatif et ont montré que la demi-vie du TCA est très longue. Ketcha et coll. (1996) ont constaté que le TCA peut se transformer en DCA dans les échantillons de sang prélevés pour l'analyse si l'on ne stabilise pas les échantillons, ce qui fait craindre que les concentrations de DCA qui ont été mesurées chez les humains seraient peut-être trop élevés.
L'hydrate de chloral et le TCOH ne s'accumulent pas dans le corps humain (Gilman et al., 1985). Comme le métabolisme hépatique des nourrissons est immature, particulièrement la voie de la glucuronidation, et que leur filtration glomérulaire est réduite, la demi-vie du TCOH est plus longue chez eux que chez les adultes. Par contre, chez les enfants qui commencent à marcher, la demi-vie du TCOH est semblable à celle chez les adultes, ce qui indique que le métabolisme du foie a atteint sa maturité chez ces enfants (PISSC, 2000).
Les rats et les souris métabolisent rapidement l'hydrate de chloral, principalement en TCOH et en TCA, la concentration de ce dernier métabolite étant plus élevée chez les souris que chez les rats. Beland (1999) a montré in vitro que le métabolisme de l'hydrate de chloral, du TCA et du TCOH produit des intermédiaires radicaux libres qui causent la peroxydation des lipides et la formation de malondialdéhyde. Comme chez les humains, l'hydrate de chloral disparaît rapidement du sang des souris et se métabolise en TCOH, TCOG, TCA et DCA (Abbas et coll., 1996). Les demi-vies du TCOH et du TCOG semblent significativement plus longues chez les rats que chez les souris (Beland et coll., 1998). Lipscomb et coll. (1996) ont trouvé que le TCOH était le principal métabolite in vivo de l'hydrate de chloral dans le sang et le foie de rats Fischer 344, de souris B6C3F1 et des humains.
L'hydrate de chloral est un important métabolite du trichloroéthylène (TCE) et un intermédiaire dans la formation de TCA. À partir des résultats d'un certain nombre d'études, un modèle pharmacocinétique à base physiologique (MPBP) a été mis au point pour le TCE. Ce modèle, qui tient compte de la recirculation entérohépatique des métabolites du TCE, donne de bonnes prévisions quantitatives de l'absorption, de la distribution et de l'élimination du TCE, du TCOH, du TCOG, et du TCA. Le modèle montre clairement que la formation de TCA est retardée après la recirculation entérohépatique, ce qui explique la demi-vie plus longue du TCA observée dans les études chez l'animal (Stenner et coll., 1998). Ce phénomène est corroboré par les résultats de Merdink et coll. (1999), qui ont observé qu'une partie du TCOH est retransformée en hydrate de chloral, lequel est ensuite oxydé pour former du TCA.
La plupart de l'hydrate de chloral est excrété dans l'urine sous forme de TCOG, et le reste sous forme de TCOH et de TCA (Butler, 1948; Marshall et Owens, 1954; Allen et Fisher, 1993), mais l'hydrate de chloral n'est pas excrété tel quel (McEvoy, 1999).
Aucune étude épidémiologique et de cancérogénicité chez l'humain n'a associé l'hydrate de chloral et le cancer, bien qu'on se serve de l'hydrate de chloral depuis de nombreuses décennies comme sédatif ou hypnotique chez des adultes et des enfants, notamment pour des interventions dentaires. L'EPA (2000) a calculé une dose orale aiguë de référence de 0,1 mg/kg p.c. par jour fondée sur la dose pharmacologique active (250 mg, équivalent à 10,7 mg/kg p.c. par jour) chez l'humain. Cette dose est censée protéger contre tout effet non cancérogène sur la santé découlant d'une exposition chronique. Toutefois, l'hydrate de chloral a eu un effet cancérogène dans deux essais biologiques d'exposition de souris mâles à long terme dans l'eau potable et dans une étude longitudinale sur des souris mâles exposées à une seule dose orale. En outre, l'hydrate de chloral s'est révélé faiblement mutagène et clastogène, ce qui porte à croire que la génotoxicité pourrait jouer un rôle dans la toxicité de l'hydrate de chloral, mais à des concentrations supérieures à celles qu'on devrait trouver dans l'environnement. On estime que la dose pharmacologique de 10,7 mg/kg p.c. par jour ne convient pas au calcul d'une valeur basée sur la santé pour l'hydrate de chloral dans l'eau potable.
En 1995, le Centre international de recherche sur le cancer a classé l'hydrate de chloral dans le groupe 3 (inclassable quant à sa cancérogénicité pour l'humain) en raison de l'insuffisance de données chez l'humain et l'animal (CIRC, 1995). L'EPA (2000) a classé l'hydrate de chloral comme une substance cancérogène possible chez l'humain en concluant que son interaction avec des enzymes et des protéines cellulaires, plutôt qu'une interaction directe avec l'ADN, constitue le mode d'action le plus probable menant à la formation de tumeurs chez les souris. Santé Canada (1994) classe l'hydrate de chloral dans le groupe III.B (susceptible d'être cancérogène pour l'être humain; données insuffisantes chez l'humain et l'animal). Les indications de la génotoxicité de l'hydrate de chloral sont équivoques.
Pour les substances « susceptibles d'être cancérogènes pour l'être humain », on calcule une valeur basée sur la santé à partir de la dose journalière admissible (DJA) obtenue en divisant la plus faible NOAEL ou LOAEL par des facteurs d'incertitude appropriés.
Deux études du NTP (2002a, 2002b) ne fournissent que de faibles preuves de cancérogénicité chez les souris B6C3F1 des deux sexes. Toutefois, comme il y a eu d'importants écarts dans les incidences d'adénomes du lobe antérieur de l'hypophyse et de tumeurs et adénomes/carcinomes hépatocellulaires entre les témoins expérimentaux et historiques et les groupes traités (Haseman et coll., 1998), ces études ne peuvent servir à calculer une valeur recommandée. Par contre, dans les deux études, des tumeurs hépatocellulaires se sont formées à des concentrations semblables à celles observées dans l'étude retenue pour l'évaluation du risque (George et coll., 2000), indiquant que ces concentrations causeraient des lésions prolifératives.
Le paramètre pour l'histopathologie non cancéreuse du foie calculé par George et coll. (2000) a été choisi pour l'évaluation du risque. Dans une étude longitudinale, des souris B6C3F1 mâles ont été exposées à 0, 120, 580 ou 1 280 mg/L d'hydrate de chloral (soit des doses de 0, 13,5, 65 et 146,6 mg/kg p.c. par jour). La prévalence de carcinomes hépatocellulaires était plus élevée (84,4 %) dans le groupe exposé à la forte dose que dans le groupe témoin (54,8 %) et les groupes ayant reçu une dose faible (54,3 %) et moyenne (59,0 %). La prévalence d'adénomes du foie a été plus élevée à toutes les doses d'hydrate de chloral (faible - 43,5 %; moyenne - 51,3 %; forte - 50,0 %) que chez les souris témoins (21,4 %). Dans cette étude, on a administré l'hydrate de chloral dans l'eau potable, plutôt que par gavage 5 jours par semaine comme dans les études du NTP (2002a, 2002b), ce qui justifie l'utilisation de l'étude de George et coll. (2000) pour l'évaluation du risque.
Bien que le PISSC (2000) ait établi une NOAEL de 1 280 mg/L (146,6 mg/kg p.c. par jour) pour les effets non cancéreux (d'après l'absence de nécrose hépatocellulaire à toutes les expositions et des changements minimes dans les concentrations d'enzymes sériques), dans l'étude de George et coll. (2000), l'hydrate de chloral a provoqué une hausse de l'incidence de lésions prolifératives (hyperplasie, adénome, carcinome et ces deux derniers combinés) à toutes les doses d'exposition, à l'exception des carcinomes pour les deux doses les plus faibles. Les groupes témoins ont aussi présenté des lésions prolifératives, mais à des taux plus faibles pour l'hyperplasie et les adénomes hépatocellulaires. Des hausses significatives de l'incidence des lésions prolifératives ont été observées à des doses de 120 mg/L (13,5 mg/kg p.c. par jour) et plus. Cette hausse constitue un effet important. Puisque ces lésions ont été observées à toutes les doses, on n'a pas pu calculer de NOAEL, et on a donc établi une LOAEL de 120 mg/L (13,5 mg/kg p.c. par jour) pour calculer la DJA. On a ajouté un facteur d'incertitude supplémentaire de 3 pour tenir compte des limitations de la base de données en ce qui concerne les preuves de cancérogénicité chez l'animal.
La DJA est calculée comme suit :
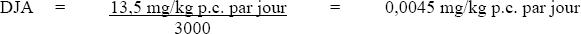
Figure 1 - Description textuel
où
- 13,5 mg/kg p.c. par jour est la LOAEL pour la hausse de l'incidence de modifications histopathologiques du foie chez des souris B6C3F1;
- 3 000 est le facteur d'incertitude (×10 pour la variabilité interspécifique; ×10 pour la variabilité intraspécifique; ×10 pour tenir compte de l'utilisation d'une LOAEL plutôt que d'une NOAEL; ×3 pour tenir compte des limitations de la base de données en ce qui concerne les preuves de cancérogénicité).
On calcule comme suit, à partir de cette DJA, une concentration d'hydrate de chloral dans l'eau potable basée sur la santé :
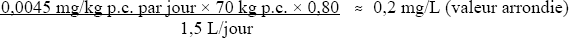
Figure 2 - Description textuel
où
- 0,0045 mg/kg p.c. par jour est la DJA, telle que calculée plus haut;
- 70 kg est le poids corporel moyen d'un adulte;
- 0,80 est la proportion de la dose journalière attribuée à l'eau potable, car l'eau potable traitée au chlore est la principale source d'exposition de la population générale à l'hydrate de chloral (section 5);
- 1,5 L/jour est la consommation quotidienne moyenne d'eau potable pour un adulte.
L'Environmental Protection Agency (EPA) des États-Unis reconnaît et approuve une méthode d'extraction au solvant éther de méthyle et de tert-butyle (méthode 551.1 de l'EPA) pour le dosage de l'hydrate de chloral dans l'eau potable (U.S. EPA, 1995). L'hydrate de chloral est analysé par chromatographie en phase gazeuse et détection par capture d'électron et la limite de détection de la méthode est de 0,005 µg/L. Le protocole d'échantillonnage nécessite l'ajustement du pH (pH de 4,8) sur le terrain et l'utilisation d'un tampon phosphate ainsi que l'ajout de sulfite de sodium pour absorber le chlore résiduel.
La méthode 5710 D décrite dans la 21e édition de Standard Methods for the Examination of Water and Wastewater sert également à doser l'hydrate de chloral; elle prévoit que ce dernier peut être dosé avec les trihalométhanes (THM) en utilisant une solution de sulfite de sodium pour arrêter la réaction. L'hydrate de chloral est ensuite dosé par extraction liquide-liquide, chromatographie en phase gazeuse sur colonne capillaire et détection par capture d'électron (APHA et coll., 2005).
Bien que la formation d'hydrate de chloral dans l'eau dépende surtout de la quantité des composés organiques présents dans l'eau et de leur temps de contact avec le chlore, il est important de reconnaître que la chloration et d'autres procédés de désinfection ont pratiquement éliminé les maladies microbiennes d'origine hydrique. Comme pour les trihalométhanes et les autres SPD chlorés, il importe de caractériser l'approvisionnement en eau pour optimiser le traitement de façon à éliminer les précurseurs et ainsi de réduire les concentrations d'hydrate de chloral dans l'eau.
L'EPA suggère de limiter les concentrations d'hydrate de chloral dans l'eau potable en améliorant la coagulation et l'adoucissement de façon à éliminer les précurseurs des SPD (carbone organique total). Pour réduire la production d'hydrate de chloral, l'EPA propose également de déplacer le point de désinfection afin de réduire la réaction entre le chlore et les précurseurs des SPD et de recourir à des chloramines plutôt qu'au chlore pour la désinfection résiduelle (U.S. EPA, 1998a). La limitation des concentrations totales de THM et d'acides haloacétiques et l'utilisation de meilleures méthodes de coagulation ou d'adoucissement pour l'élimination des précurseurs de SPD permettra de limiter la formation d'hydrate de chloral et d'autres sous-produits de la chloration (U.S. EPA, 1998b).
Voici les trois façons de limiter les concentrations d'hydrate de chloral dans l'eau potable traitée à l'échelle municipale :
- élimination des précurseurs d'hydrate de chloral avant la désinfection;
- recours à d'autres produits et stratégies de désinfection;
- élimination de l'hydrate de chloral après sa formation.
L'industrie du traitement de l'eau met actuellement l'accent sur des stratégies d'élimination des précurseurs de SPD avant la désinfection et le recours à d'autres produits et stratégies de désinfection.
L'élimination des précurseurs organiques est la meilleure façon de réduire les concentrations de tous les SPD, y compris l'hydrate de chloral, dans l'eau traitée (Reid Crowther & Partners Ltd., 2000). Ces précurseurs comprennent des composés organiques synthétiques ou de la matière organique naturelle qui peuvent réagir avec les désinfectants pour former de l'hydrate de chloral. Les techniques classiques de traitement de l'eau à l'échelle municipale peuvent réduire la quantité de précurseurs, mais elles ne peuvent éliminer efficacement l'hydrate de chloral une fois qu'il est formé. Des systèmes de filtration au charbon actif granulé, de filtration sur membrane et de biofiltration à l'ozone peuvent aussi éliminer la matière organique de l'eau. Selon l'EPA, les techniques d'élimination des précurseurs, comme le charbon activé granulé (CAG) et la filtration sur membrane, sont les meilleures techniques disponibles (BAT) pour limiter la formation de sous-produits de désinfection (U.S. EPA, 2005). Toutefois, les procédés de filtration sur membrane produisent des résidus concentrés dont l'élimination peut coûter cher (Xie, 2004). Des combinaisons optimisées de désinfectants peuvent aider à limiter la formation d'hydrate de chloral.
On peut utiliser du permanganate de potassium pour oxyder les précurseurs organiques à l'entrée de l'usine de traitement afin de réduire au minimum la formation de SPD à l'étape de désinfection (U.S. EPA, 1999a). L'utilisation de l'ozone pour oxyder les précurseurs est actuellement à l'étude; les premiers travaux ont montré que les effets du traitement à l'ozone dépendent des caractéristiques du traitement et de la qualité de l'eau brute et sont donc imprévisibles. La dose d'ozone, le pH, l'alcalinité et la nature des matières organiques dans l'eau sont les principales variables qui semblent déterminer l'effet de l'ozone. On a montré que l'ozone réduit efficacement les concentrations de précurseurs à de faibles pH, mais, à des pH supérieurs à 7,5, l'ozone peut en fait accroître la production de précurseurs de SPD chlorés (U.S. EPA, 1999a).
D'autres désinfectants, comme les chloramines (désinfection secondaire seulement), l'ozone (désinfection primaire seulement) et le dioxyde de chlore (désinfection primaire seulement), sont de plus en plus utilisés, mais chacun de ces désinfectants entraîne la formation de sa propre série de SPD. Selon Reid Crowther & Partners Ltd. (2000), la préozonation est possible pour les eaux de surface dont la turbidité est inférieure à 10 unités de turbidité néphélémétrique et la concentration de bromure, inférieure à 0,01 mg/L (pour limiter le plus possible la formation de bromate). Les ultraviolets (UV) sont aussi utilisés comme désinfectant. Vu que la désinfection aux UV dépend de la transmission de la lumière jusqu'aux microbes, il faut concevoir le système en tenant compte des caractéristiques de l'eau qui influent sur la transmission des UV. La désinfection à l'ozone ou aux UV ne laissant aucun résidu de désinfectant, ces traitements doivent être utilisés de concert avec un désinfectant secondaire qui restera en partie dans le réseau de distribution.
On recommande que tout changement apporté au procédé de traitement, notamment le remplacement du désinfectant, s'accompagne d'une surveillance étroite des concentrations de plomb dans l'eau distribuée. On a constaté qu'un changement de désinfectant influait sur les concentrations de plomb au robinet; à Washington, D.C., le passage du chlore aux chloramines a contribué à accroître grandement les concentrations de plomb dans l'eau potable distribuée. Lorsque le chlore, un puissant oxydant, est employé comme désinfectant, les incrustations de dioxyde de plomb formées dans les tuyaux du réseau de distribution atteignent un équilibre dynamique dans le réseau. À Washington, D.C., le remplacement du chlore par les chloramines a réduit le potentiel d'oxydo-réduction de l'eau distribuée et déstabilisé les incrustations de dioxyde de plomb, ce qui a augmenté la lixiviation du plomb (Schock et Giani, 2004). Des expériences subséquentes en laboratoire effectuées par Edwards et Dudi (2004) et Lytle et Schock (2005) ont confirmé que des dépôts de dioxyde de plomb pourraient se former facilement puis être déstabilisés en quelques semaines ou mois dans les conditions réalistes de pH, de potentiel d'oxydo-réduction et d'alcalinité d'un réseau de distribution.
Comme le traitement municipal de l'eau potable consiste à réduire les concentrations de contaminants à des niveaux égaux ou inférieurs aux valeurs recommandées, le recours à un dispositif de traitement à l'échelle résidentielle pour traiter l'eau municipale n'est généralement pas nécessaire, mais relève plutôt d'un choix individuel. Dans les cas où le traitement municipal produit de faibles concentrations d'hydrate de chloral dans l'eau potable, certaines techniques de traitement à l'échelle résidentielle au point d'entrée ou au point d'utilisation peuvent éliminer l'hydrate de chloral de l'eau. Citons entre autres les systèmes à osmose inverse et d'adsorption, comme le charbon activé, mais aucune technique n'est actuellement certifiée expressément pour l'élimination d'hydrate de chloral.
NSF International (NSF) a établi plusieurs normes concernant les dispositifs résidentiels de traitement de l'eau visant à réduire les concentrations de divers types de contaminants dans l'eau potable, mais aucune pour l'hydrate de chloral. Des recherches sont en cours dans les secteurs public et privé pour vérifier et adopter des méthodes efficaces de réduction de la concentration d'hydrate de chloral dans l'eau potable.
Comme les produits perdent de leur efficacité avec l'usage, il faut les entretenir ou les remplacer après un certain temps. Les consommateurs doivent vérifier la longévité prévue du matériel d'adsorption dans leur dispositif de traitement selon les recommandations du fabricant et en faire l'entretien en conséquence.
Santé Canada a étudié l'efficacité d'un certain nombre de dispositifs de traitement de l'eau au point d'entrée comme moyen d'éliminer l'hydrate de chloral. On a réussi à réduire la concentration d'hydrate de chloral d'environ 98 % en faisant bouillir l'eau pendant 2 à 5 minutes dans un chaudron ou une bouilloire. L'efficience des filtres (filtres à pression ou à gravité utilisant le charbon actif granulé) dépendait de la marque et de l'âge des filtres (nouveaux filtres, baisse de 28 à >99 %). Le vieillissement du filtre, même sur une courte période, a réduit significativement sa capacité d'éliminer l'hydrate de chloral (Benoit et coll., 2000; LeBel et coll., 2002).
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l'eau potable, mais conseille vivement aux consommateurs de n'utiliser que les dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées du NSF International (NSF) et de l'American National Standards Institute (ANSI). Ces normes visent à protéger l'eau potable en aidant à garantir l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec l'eau potable. Les organismes de certification garantissent qu'un produit ou service est conforme aux normes en vigueur et doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, le CCN a accrédité un certain nombre d'organismes qu'il autorise ainsi à certifier les dispositifs de traitement de l'eau potable qui satisfont aux normes susmentionnées du NSF et de l'ANSI :
Certains hyperliens donnent accès à des sites d'organismes qui ne sont pas assujettis à la Loi sur les langues officielles. L'information qui s'y trouve est donc dans la langue du site.
- Abbas, R.R., Seckel, C.S., Kidney, J.K. et Fisher, J.W. (1996) Pharmacokinetic analysis of chloral hydrate and its metabolism in B6C3F1 mice. Drug Metab. Dispos., 24(12) : 1340-1346.
- Allen, B.C. et Fisher, J.W. (1993) Pharmacokinetic modeling of trichloroethylene and trichloroacetic acid in humans. Risk Anal., 13 : 71-86.
- Allen, J.W., Collins, B.W. et Evansky, P.A. (1994) Spermatid micronucleus analyses of trichloroethylene and chloral hydrate effects in mice. Mutat. Res., 323(1-2) : 81-88.
- APHA (American Public Health Association), AWWA (American Water Works Association) et WEF (Water Environment Federation) (2005) Standards methods for the examination of water and wastewater. 21e éd. Washington, DC. p. 5.70.
- Beland, F.A. (1999) NTP technical report on the toxicity and metabolism studies of chloral hydrate (CAS No. 302-17-0) administered by gavage to F344/N rats and B6C3F1 mice. Toxicity Report Series No. 59, National Toxicology Program, National Institutes of Health, Research Triangle Park, NC. p. 1-136.
- Beland, F.A., Schmitt, T.C., Fullerton, N.F. et Young, J.F. (1998) Metabolism of chloral hydrate in mice and rats after single and multiple doses. J. Toxicol. Environ. Health, 54 : 209-226.
- Benoit, F.M., LeBel, G.L. et Jay, B. (2000) Evaluation of remedial actions to reduce the levels of chlorinated disinfection by-products in drinking water at the point of use. Proceedings of the 9th National Conference on Drinking Water, Regina (Saskatchewan), 16-18 mai 2000.
- Bignami, M., Conti, G., Conti, L., Crebelli, R., Misuraca, F., Puglia, A.M., Randazzo, R., Sciandrello, G. et Carere, A. (1980) Mutagenicity of halogenated aliphatic hydrocarbons in Salmonella typhimurium, Streptomyces coelicolor and Aspergillus nidulans. Chem. Biol. Interact., 30 : 9-23.
- Bruce, W.R. et Heddle, J.A. (1979) The mutagenic activity of 61 agents as determined by the micronucleus, Salmonella, and sperm abnormality assays. Can. J. Gen. Cytol., 21 : 319-334.
- Budavari, S. (1996) The Merck index. An encyclopedia of chemicals, drugs, and biologicals. 12e éd. Merck and Co. Inc., Whitehouse Station, NJ.
- Butler, T.C. (1948) The metabolic fate of chloral hydrate. J. Pharmacol. Exp. Ther., 92 : 49-58.
- Chang, L.W., Daniel, F.B. et DeAngelo, A.B. (1992) Analysis of DNA strand breaks induced in rodent liver in vivo, hepatocytes in primary culture, and a human cell line by chlorinated acetic acid and chlorinated acetaldehydes. Environ. Mol. Mutagen., 20(4) : 277-288.
- CIRC (Centre International de Recherche sur le Cancer) (1995) Chloral and chloral hydrate. IARC Monogr. Eval. Carcinogen. Risks Hum., 63: 245-269.
- Daniel, F.B., DeAngelo, A.B., Stober, J.A., Olson, G.R. et Page, N.P. (1992a) Hepatocarcinogenicity of chloral hydrate, 2-chloroacetaldehyde, and dichloroacetic acid in the male B6C3F1 mouse. Fundam. Appl. Toxicol., 19(2) : 159-168.
- Daniel, F.B., Robinson, M., Stober, J.A., Page, N.P. et Olson, G.R. (1992b) Ninety-day toxicity study of chloral hydrate in the Sprague-Dawley rat. Drug Chem. Toxicol., 15 : 217-232.
- Edsall, T.A. et Charlton, M.N. (1997) Nearshore waters of the Great Lakes. State of the Lakes Ecosystem Conference 1996. EPA 905-R-97-015A ( No catalogue En40-11/35-1-1-1997E).
- Ellenhorn, M.J. et Barceloux, D.G. (1988) Medical toxicology. Diagnosis and treatment of human poisoning. Elsevier Science Publishing Co., Inc., New York, NY.
- Ellenhorn, M.J., Schonwald, S., Ordog, G. et Wasserberger, J. (1997) Ellenhorn's medical toxicology: Diagnosis and treatment of human poisoning. 2e éd. Williams and Wilkins, Baltimore, MD.
- George, M., Moore, T., Kilburn, S., Olson, G.R. et DeAngelo, A.B. (2000) Carcinogenicity of chloral hydrate administered in drinking water to the male F344/N rat and male B6C3F1 mouse. Toxicol. Pathol., 28 : 610-618.
- Gilman, A.G., Goodman, L.S. et Gilman, A. (1985) Chloral hydrate. Dans : Goodman et Gilman, The pharmacological basis of therapeutics. Macmillan, New York, NY. p. 352, 370.
- Greenberg, S.B., Faerber, E.N. et Aspinall, C.L. (1991) High-dose chloral hydrate sedation for children undergoing CT. J. Comput. Assist. Tomogr., 15 : 467-469.
- Gu, Z.W., Sele, B., Jalbert, P., Vincent, M., Vincent, F., Marka, C., Chmara, D. et Faure, J. (1981) Effets du trichloroéthylène et de ses métabolites sur le taux d'échanges de chromatides-soeurs. Toxicol. Eur. Res., 3(2) : 63-67.
- Hansch, C., Leo, A. et Hoekman, D. (1995) Exploring QSAR - Hydrophobic, electronic, and steric constants. American Chemical Society, Washington, DC.
- Harrington-Brock, K., Doerr, C.L. et Moore, M.M. (1998) Mutagenicity of three disinfection by-products: di- and trichloroacetic acid and chloral hydrate in L5178Y/TK +/-(-)3.7.2C mouse lymphoma cells. Mutat. Res., 413(3) : 265-276.
- Haseman, J.K., Hailey, J.R. et Harris, R.W. (1998) Spontaneous neoplasm incidences in Fischer 344 rats and B6C3F1 mice in two-year carcinogenicity studies: A National Toxicology Program update. Toxicol. Pathol., 26(3) : 428-441.
- Henderson, G.N., Yan, Z., James, M.O., Davydova, N. et Stacpoole, P.W. (1997) Kinetics and metabolism of chloral hydrate in children: identification of dichloroacetate as a metabolite. Biochem. Biophys. Res. Commun., 235 : 695-698.
- Johnson, P.D., Dawson, B.V. et Goldberg, S.J. (1998) Cardiac teratogenicity of trichloroethylene metabolites. J. Am. Coll. Cardiol., 32 : 540-545.
- Kallman, M.J., Kaempf, G.L. et Balster, R.L. (1984) Behavioral toxicity of chloral in mice: an approach to evaluation. Neurobehav. Toxicol. Teratol., 6 : 137-146.
- Kauffmann, B.M., White, K.L., Sanders, V.M., Douglas, K.A., Sain, L.E., Borzelleca, J.F. et Munson, A.E. (1982) Humoral and cell-mediated status in mice exposed to chloral hydrate. Environ. Health Perspect., 44 : 147-151.
- Ketcha, M.M., Stevens, D.K., Warren, D.A., Bishop, C.T. et Brashear, W.T. (1996) Conversion of trichloroacetic acid to dichloroacetic acid in biological samples. J. Anal. Toxicol., 20 : 236-241.
- Kirk-Othmer (1991) Kirk-Othmer encyclopedia of chemical technology. 4e éd. Wiley Interscience, New York, NY.
- Klinefelter, G.R., Suarez, J.D., Roberts, N.L. et DeAngelo, A.B. (1995) Preliminary screening for the potential of drinking water disinfection by-products to alter male reproduction. Reprod. Toxicol., 9 : 571-578.
- Krasner, S.W., McGuire, M.J., Jacangelo, J.G., Patania, N.L., Reagan, K.M. et Aieta, E.M. (1989) The occurrence of disinfection by-products in US drinking water. J. Am. Water Works Assoc., 81(8) : 41-52.
- LeBel, G.L., Jay, B. et Benoit, F.M. (2002) Evaluation of filtration devices to reduce levels of chlorinated disinfection by-products (CDBPs) in drinking water at the point of use. Proceedings of the 10th National Conference on Drinking Water, Halifax (Nouvelle-Écosse), 27-30 avril 2002.
- Leuschner, J. et Beuscher, N. (1998) Studies on the mutagenic and carcinogenic potential of chloral hydrate. Arzneimittel-Forschung, 48 : 961-968.
- Lipscomb, J.C., Mahle, D.A., Brashear, W.T. et Garrett, C.M. (1996) A species comparison of chloral hydrate metabolism in blood and liver. Biochem. Biophys. Res. Commun., 227 : 340-350.
- Mailhes, J.B., Aardena, M.J. et Marchetti, F. (1993) Investigation of aneuploidy induction in mouse oocytes following exposure to vintablastine-sulfate, pyrimethamine, diethylstibestrol diphosphate, or chloral hydrate. Environ. Mol. Mutagen., 22 : 107-114.
- Marshall, E.K. et Owens, A.H. (1954) Absorption, excretion and metabolic fate of chloral hydrate and trichloroethanol. Bull. Johns Hopskins Hosp., 95 : 1-18.
- McEvoy, G.K. (1999) American Hospital Formulary Service Drug Information 99. American Society of Health-SystemPharmacists, Inc., Bethesda, MD.
- Merdink, J.L., Stenner, R.D., Stevens, D.K., Parker, J.C. et Bull, R.J. (1999) Effect of enterohepatic circulation on the phamacokinetics of chloral hydrate and its metabolites in F344 rats. J. Toxicol. Environ. Health, 57 : 357-368.
- Moore, M.M. et Harrington-Brock, K. (2000) Mutagenicity of trichloroethylene and its metabolites: implications for the risk assessment of trichloroethylene. Environ. Health Perspect., 108 : 215-223.
- Natarajan, A.T., Duivenvooden, W.C., Meijers, M. et Zwanenburg, T.S. (1993) Induction of mitotic aneuploidy using Chinese hamster primary embryonic cells: Test results of 10 chemicals. Mutat. Res., 287(1) : 47-56.
- Newman, L.M. et Wackett, L.P. (1991) Fate of 2,2,2-trichloroacetaldehyde (chloral hydrate) produced during trichloroethylene oxidation by methanotrophs. Appl. Environ. Microbiol., 57 : 2399-2402.
- Ni, Y.C., Wong, T.Y., Lloyd, R.V., Heinze, T.M., Shelton, S., Casciano, D., Kadlubar, F.F. et Fu, P.P. (1996) Mouse liver microsomal metabolism of chloral hydrate, trichloroacetic acid, and trichloroethanol leading to induction of lipid peroxidation via a free radical mechanism. Drug Metab. Dispos., 24(1) : 81-90.
- NTP (National Toxicology Program) (2002a) Toxicology and carcinogenesis studies of chloral hydrate in B6C3F1 mice (gavage studies). NTP Technical Report Series 502, National Institutes of Health, Research Triangle Park, NC. 197 p.
- NTP (National Toxicology Program) (2002b) Toxicology and carcinogenesis studies of chloral hydrate (ad libitum and dietary controlled) in male B6C3F1 mice (gavage study). NTP Technical Report Series 503, National Institutes of Health, Research Triangle Park, NC. 218 p.
- Odum, J., Foster, J.-R. et Green, T. (1992) A mechanism for the development of Clara cell lesions in the mouse lung after exposure to trichloroethylene. Chem.-Biol. Interact., 83(2) : 135-153.
- Ogino, K., Hobara, T., Kobayashi, H. et Iwamoto, S. (1990) Gastric mucosal injury by chloral hydrate. Toxicol. Lett., 52(2) : 129-133.
- PISC (Programme international sur la sécurité des substances chimiques) (2000) Chloral hydrate. Concise International Chemical Assessment Document No. 25, Organisation mondiale de la santé, Genève.
- Poon, R., Nadeau, B. et Chu, I. (2000) Biochemical effects of chloral hydrate on male rats following 7-day drinking water exposure. J. Appl. Toxicol., 20 : 455-461.
- Poon, R., Nakai, J., Yagminas, A., Benoit, F., Moir, D., Chu, I. et Valli, V.E. (2002) Subchronic toxicity of chloral hydrate on rats - a drinking water study. J. Appl. Toxicol., 22 : 227-236.
- Reid Crowther & Partners Ltd. (2000) Canadian water treatment study: water treatment and disinfection byproducts. Edmonton (Alberta). Septembre.
- Reynolds, J.E.F. et Prasad, A.B. (1982) Martindale - The extra pharmacopia. 28e éd. The Pharmaceutical Press, Londres.
- Rijhsinghani, K.S., Abrahams, C., Swerdlow, M.A., Rao, K.V.N. et Ghose, T. (1986) Induction of neoplastic lesions in the livers of C57BL × C3HF1 mice by chloral hydrate. Cancer Detect. Prev., 9(3-4) : 279-288.
- Saillenfait, A.M., Langonne, I. et Sabate, J.P. (1995) Developmental toxicity of trichloroethylene, tetrachloroethylene and four of their metabolites in rat whole embryo cultures. Arch. Toxicol., 70 : 71-78.
- Sanders, V.M., Kauffman, B.M., White, K.L., Douglas, K.A., Barnes, D.W., Sain, L.E., Bradshaw, T.J., Borzelleca, J.F. et Munson, A.E. (1982) Toxicology of chloral hydrate in the mouse. Environ. Health Perspect., 44 : 137-146.
- Santé Canada (1994) Loi canadienne sur la protection de l'environnement. L'évaluation du risque sur la santé humaine des substances d'intérêt prioritaire. No En40-215/41F au catalogue, ministre des Approvisionnements et Services Canada, Ottawa (Ontario).
- Santé Canada (1995) Étude nationale sur les sous-produits de désinfection chlorés dans l'eau potable au Canada. Rapport no 95-DHM-197. Direction de l'hygiène du milieu, Santé Canada, Ottawa (Ontario).
- Sbrana, I., Di Sibio, A., Lomi, A. et Scarcelli, V. (1993) C-mitosis and numerical chromosome aberration analyses in human lymphocytes: 10 known or suspected spindle poisons. Mutat. Res., 287(1) : 57-70.
- Shapiro, S., Stone, D., Lewis, G.P. et Jick, H. (1969) Clinical effects of hypnotics. II. An epidemiological study. J. Am. Med. Assoc., 209 : 2016-2020.
- Stenner, R.D., Merdink, J.L., Fisher, J.W. et Bull, R.J. (1998) Physiologically-based pharmacokinetic model for trichloroethylene considering enterohepatic recirculation of major metabolites. Risk Anal., 18(3) : 261-269.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1990) Draft Method 551. Determination of chlorination disinfection by-products and chlorinated solvents in drinking water by liquid-liquid extraction and gas chromatography with electron capture detection. Environmental Monitoring and Support Laboratory, Cincinnati, OH.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1992) Technical Support Division Disinfection By-Products Field Study Database. Technical Support Division, Office of Ground Water and Drinking Water, Cincinnati, OH.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1995) Methods for the determination of organic compounds in drinking water - Supplement III. EPA-600/R-95/131.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1998a) National Primary Drinking Water Regulations; disinfectants and disinfection byproducts: Notice of data availability. 40 CFR Parts 141 and 142. Fed. Regist., 63(145) : 15674-15692.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1998b) National Primary Drinking Water Regulations: disinfectants and disinfection byproducts. 40 CFR Parts 9, 141, and 142. Fed. Regist., 63 : 6904.
- U.S. EPA (Environmental Protection Agency des États-Unis) (1999) EPA guidance manual - Alternative disinfectants and oxidants. EPA-815-R-99-014. Washington, DC, avril.
- U.S. EPA (Environmental Protection Agency des États-Unis) (2000) Toxicological review of chloral hydrate. In support of summary information on the Integrated Risk Information System (IRIS). EPA/635/R-00/006.
- Verschueren, K. (2001) Handbook of environmental data on organic chemicals. 3e éd. Van Nostrand Reinhold Co., New York, NY.
- Warr, T.J., Parry, E.M. et Parry, J.M. (1993) A comparison of two in vivo mammalian cell cytogenetic assays for the detection of mitotic aneuploidy using 10 known or suspect aneugens. Mutat. Res., 287(1) : 29-46.
- Waskell, L. (1978) A study of the mutagenicity of anesthetics and their metabolites. Mutat. Res., 57(2) : 141-153.
- Williams, D.T., LeBel, G.L. et Benoit, F.M. (1997) Disinfection by-products in Canadian drinking water. Chemosphere, 34 : 299-316.
- Xie, Y.F. (2004) Disinfection byproducts in drinking water: Formation, analysis, and control. Lewis Publishers, CRC Press, Boca Raton, FL.
- Yoon, J.S., Mason, J.M., Valencia, R., Woodruff, R.C. et Zimmering, S. (1985) Chemical mutagenesis testing in Drosophila. IV. Results of 45 coded compounds tested for the National Toxicology Program. Environ. Mutagen., 7 : 349-367.
- Zimmermann, T., Wehling, M. et Schulz, H.U. (1998) [Pharmacocinétique et biodisponibilité relative de l'hydrate de chloral et de ses métabolites.] Arzneimittelforschung, 48 : 5-12 (en allemand).
- ADN
- acide désoxyribonucléique
- ALDH
- aldéhyde déshydrogénase
- ALT
- alanine aminotransférase
- ANSI
- American National Standards Institute
- AST
- aspartate aminotransférase
- CCN
- Conseil canadien des normes
- CoA
- coenzyme A
- DCA
- acide dichloroacétique
- DDT
- dichlorodiphényltrichloroéthane
- DJA
- dose journalière admissible
- DL 50
- dose létale médiane
- EPA
- Environmental Protection Agency des États-Unis
- HAA
- acide haloacétique
- K ow
- coefficient de partage octanol-eau
- LDH
- lactate déshydrogénase
- LOAEL
- la plus faible dose avec effet nocif observé ( lowest-observed-adverse-effect level) MPBP modèle pharmacocinétique à base physiologique
- MTBE
- éther de méthyle et de tert-butyle
- NCTR
- National Center for Toxicological Research
- NOAEL
- dose sans effet nocif observé ( no-observed-adverse-effect level) NOEL dose sans effet observé ( no-observed-effect level)
- NSF
- NSF International
- NTP
- National Toxicology Program (États-Unis)
- OCDE
- Organisation de coopération et de développement économiques
- OMS
- Organisation mondiale de la santé
- p.c.
- poids corporel
- S9
- activation métabolique (9000 x g de surnageant)
- SDH
- sorbitol déshydrogénase
- SPD
- sous-produit de désinfection
- TCA
- acide trichloroacétique
- TCE
- trichloroéthylène
- TCOG
- glucuronide de trichloroéthanol
- TCOH
- trichloroéthanol
- THM
- trihalométhane
- UV
- rayons ultraviolets