Pollution atmosphérique liée à la circulation automobile : asthme, allergies et fonction pulmonaire
Remerciements
Cette évaluation du risque a été examinée par les experts scientifiques externes suivants :
- Elaine Fuertes, M. Sc., Ph. D. (Imperial College London)
- Dre Zhiwei Gao, M. Sc., M.D., Ph. D. (Memorial University of Newfoundland)
Table des matières
- Remerciements
- Liste des tableaux
- Liste des figures
- Liste des abréviations
- Résumé
- Chapitre 1. Introduction
- Chapitre 2. Méthode
- Chapitre 3. Revue globale
- Chapitre 4. Caractérisation du risque et évaluation de la causalité
- Conclusion
- Principales incertitudes et lacunes
- Références
- Annexes
- Annexe A. Stratégie de recherche plus précise pour la mise à jour de la documentation
- Annexe B. Tableau d'évaluation de la qualité des études utilisant l'outil d'évaluation AMSTAR 2 adapté aux études d'épidémiologie environnementale
- Annexe C. Liste des études citées dans les revues incluses dans cette évaluation
- Annexe D. Tableau récapitulatif des principales revues incluses dans la revue globale
Liste des tableaux
- Tableau 1.1 Résumé des résultats sur la santé et classification des liens de causalité tirés de la revue menée par le HEI (Panel HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010)
- Tableau 2.1 Domaines critiques de l'outil d'évaluation AMSTAR 2 adapté aux études épidémiologiques environnementales
- Tableau 2.2 Méthode du poids de la preuve aux fins de détermination de la causalité (d'après l'EPA des É.-U., 2015)
- Tableau 3.1 Méta-analyses à effets aléatoires entre les polluants de la PACA et l'apparition de l'asthme chez les enfants entre la naissance et l'âge de 18 ans, comme signalé dans Khreis et al. (2017)
- Tableau 3.2 Méta-analyses à effets aléatoires entre les polluants de la PACA et l'incidence d'asthme et la prévalence de respiration sifflante chez les enfants et les adolescents, comme signalé dans Heinrich et al. (2016)
- Tableau 4.1 Estimations regroupées des résultats en matière d'allergies chez les enfants signalés par Heinrich et al. (2016) et Bowatte et al. (2015)
Liste des figures
- Figure 2.1 Processus de sélection des études pour les besoins de la revue de la portée et de la revue globale
- Figure 4.1 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 10 µg/m 3 de NO2; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité
- Figure 4.2 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 1 µg/m 3 de PM2,5; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité
- Figure 4.3 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence d'asthme pendant l'enfance, standardisée selon un palier de 0,5 × 10− 5/m de CN; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité
- Figure 4.4 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 2 µg/m 3 de PM10; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité
Liste des abréviations
- AMSTAR 2
- Outil d'évaluation de la qualité des revues systématiques (A Measurement Tool of Assess Systematic Reviews)
- AVAI
- année de vie ajustée en fonction de l'incapacité
- BAMSE
- Cohorte BAMSE (Barn Allergi Miljö Stockholm Epidemiologi)
- CCAAPS
- Étude CCAAPS (Cincinnati Childhood Allergy and Air Pollution Study)
- CCCEH
- Columbia Center for Children's Environmental Health
- CN
- carbone noir
- CO
- monoxyde de carbone
- COPSAC
- Étude COPSAC (Copenhagen Prospective Study on Asthma in Childhood)
- CVF
- capacité vitale forcée
- DEM25-75
- débit expiratoire maximal entre 25 % et 75 % de la capacité vitale forcée
- DEMM
- débit expiratoire maximal médian
- DEP
- débit expiratoire de pointe
- DRO
- dérivés réactifs de l'oxygène
- ECHRS
- Enquête ECHRS (European Community Respiratory Health Survey)
- EPA des É.-U.
- Environmental Protection Agency des États-Unis
- ESCAPE
- Étude européenne de cohortes sur les effets de la pollution atmosphérique
- RS-MA
- revue systématique–méta-analyse
- FLEHS
- Enquête FLEHS (Flemish Environment and Health Survey)
- GBD
- Étude sur la charge mondiale de morbidité
- GED
- gaz d'échappement des moteurs diesel
- GEE
- gaz d'échappement des moteurs à essence
- GINI
- Cohorte GINI (German Infant Nutrition Intervention Programme)
- GSTP1
- glutathion S-transférase P1
- HAP
- hydrocarbure aromatique polycyclique
- HEI
- Institut de recherche sur les effets sur la santé (Health Effects Institute)
- HVR
- hyperréactivité des voies respiratoires
- IC
- intervalle de confiance
- IgE
- Immunoglobuline E
- ISA
- Évaluation scientifique intégrée (Integrated Science Assessment)
- LISA
- Cohorte LISA (Lifestyle Related Factors on the Human Immune System and Development of Allergies in Children)
- MPOC
- maladie pulmonaire obstructive chronique
- NO
- oxyde d'azote
- NO2
- dioxyde d'azote
- NOx
- oxydes d'azote
- O3
- ozone
- PACA
- pollution atmosphérique liée à la circulation automobile
- PCAA
- particules concentrées dans l'air ambiant
- PGED
- particules dans le gaz d'échappement des moteurs diesel
- PGEE
- particules dans le gaz d'échappement d'essence
- PIAMA
- Étude PIAMA (Prevention and Incidence of Asthma and Mite Allergy)
- PM
- matières particulaires
- PM10
- particules d'un diamètre inférieur à 10 micromètres
- PM2,5
- particules d'un diamètre inférieur à 2,5 micromètres
- PUF
- particule ultrafine
- RA
- résistance des voies aériennes
- RB
- risque de biais
- RC
- rapport de cotes
- RUT
- régression de l'utilisation des terres
- SIG
- système d'information géographique
- SO2
- dioxyde de soufre
- sRAW
- résistance spécifique des voies aériennes
- SSE
- statut socioéconomique
- STROBE
- Outil STROBE (Strengthening the Reporting of Observational Studies in Epidemiology )
- TNF
- facteur de nécrose tumorale
- VEMS
- volume expiratoire maximal par seconde
Résumé
La circulation automobile, une source majeure de polluants atmosphériques, est un problème mondial. Dans les régions urbaines du monde, y compris au Canada, les effets de la circulation automobile sont particulièrement préoccupants. Le mélange de gaz d'échappement des véhicules, de polluants atmosphériques secondaires formés dans l'atmosphère, d'émissions de gaz d'évaporation des véhicules et d'émissions non causées par la combustion (p. ex. poussière de route et usure des pneus) est appelé la pollution atmosphérique liée à la circulation automobile (PACA). Les principaux dérivés entrant dans la composition de la PACA comprennent le dioxyde d'azote (NO2), les particules d'un diamètre inférieur à 2,5 micromètres (PM2,5) et inférieur à 10 micromètres (PM10) et le carbone noir (CN). Parmi ces derniers, la présence de NO2 est considérée comme la mesure la plus directe de la PACA, car il a été signalé que les sources de circulation automobile locale sont responsables de jusqu'à 80 % du NO2 présent dans l'air ambiant.
L'objectif de cette évaluation du risque est de mesurer le lien entre l'asthme, les allergies et la fonction pulmonaire et l'exposition à la PACA afin de documenter et d'appuyer des programmes ou des politiques destinés à réduire l'exposition à la PACA et les impacts sanitaires connexes au Canada. La PACA constitue la meilleure représentation du mélange réel de polluants auquel de nombreux Canadiens sont exposés chaque jour. On estime que 10 millions de personnes (près d'un tiers de la population totale) vivent dans un rayon de 500 m d'une autoroute ou de 100 m d'une route urbaine majeure au Canada. De plus, les Canadiens vivant en milieu urbain passent en moyenne une heure ou plus chaque jour dans des microenvironnements influencés par une circulation automobile modérée à intense, y compris en se déplaçant dans un véhicule ou en utilisant un mode de transport actif.
Une approche de revue globale a été adoptée pour rechercher, organiser et évaluer systématiquement les données probantes épidémiologiques existantes issues de multiples revues systématiques ou d'autres revues sélectionnées, y compris des revues incluant une synthèse quantitative, sur les effets de l'exposition à la PACA sur l'asthme, les allergies et la fonction pulmonaire. Dans le cadre de la présente évaluation du risque, 17 publications ont été examinées et évaluées. La synthèse des données probantes incluait également des preuves mécanistes recueillies à partir d'une revue des documents d'évaluation existants pour les composants de la PACA. La revue globale et la revue des preuves expérimentales ont été réalisées conjointement afin de soutenir l'adoption d'une méthode du poids de la preuve visant à définir le rôle causal de l'exposition à la PACA en ce qui concerne l'asthme, les allergies et la fonction pulmonaire.
La méthode du poids de la preuve permet de conclure que les données probantes appuient la présence d'un lien de causalité entre l'exposition à la PACA et l'incidence et la prévalence de l'asthme chez les enfants. En outre, le poids de la preuve indique que les données concernant la relation entre l'exposition à la PACA et la prévalence de l'asthme chez les adultes évoquent un lien de causalité, mais qu'elles sont insuffisantes pour inférer un tel lien de causalité. Cependant, les données probantes ne permettent pas d'inférer un lien de causalité entre l'exposition à la PACA et l'incidence de l'asthme chez les adultes. Le poids de la preuve indique également que les données concernant le lien entre l'exposition à la PACA et la sensibilisation et les réactions allergiques évoquent un lien de causalité, mais qu'elles sont insuffisantes pour inférer un tel lien de causalité. Le poids de la preuve révèle aussi qu'il existerait un lien de causalité entre l'exposition à la PACA et la fonction pulmonaire.
Chapitre 1. Introduction
1.1 Contexte
La pollution atmosphérique représente un enjeu de santé à l'échelle mondiale. En 2017, l'Étude sur la charge mondiale de morbidité (GBD) a estimé que plus de 4,9 millions de décès et 147 millions d'années de vie ajustées en fonction de l'incapacité (AVAI) étaient attribuables à la pollution atmosphérique (GBD Risk Factor Collaborators 2018) dans le monde. De surcroît, sur les 84 facteurs de risque pris en considération dans le cadre de la GBD, la présence de matières particulaires (PM) dans l'air ambiant était le seul facteur de risque environnemental à figurer parmi les 10 plus importants. À l'aide d'une méthodologie semblable à celle de la GBD, Santé Canada a estimé à 14 600 le nombre annuel de décès prématurés au pays qui sont liés à la pollution atmosphérique sous forme de particules d'un diamètre inférieur à 2,5 micromètres (PM2,5), de dioxyde d'azote (NO2) et d'ozone (O3) (Santé Canada, 2019).
Partout dans le monde, la circulation automobile est une source majeure de polluants atmosphériques, surtout dans les zones urbaines. Le mélange de gaz d'échappement des véhicules, de polluants atmosphériques secondaires formés dans l'atmosphère, d'émissions de gaz d'évaporation des véhicules et d'émissions non causées par la combustion (p. ex. poussière de route et usure des pneus) est appelé « pollution atmosphérique liée à la circulation automobile » ou PACA. L'étude de l'exposition à la PACA est d'autant plus difficile du fait de sa grande variabilité spatiale et temporelle, qui s'ajoute à sa nature omniprésente et à sa prédominance dans les zones urbaines (Khreis et Nieuwenhuijsen, 2017). La plupart des publications concernant la PACA traitent principalement du NO2, des PM2,5, des particules d'un diamètre inférieur à 10 micromètres (PM10) et du carbone noir (CN) comme composants polluants importants de la PACA. La présence de dioxyde d'azote est considérée comme la mesure la plus directe de la PACA, car il a été signalé que les sources de circulation automobile locale sont responsables de jusqu'à 80 % du NO2 présent dans l'air ambiant, alors qu'un pourcentage beaucoup plus faible, soit entre 9 % et 66 % et entre 9 % et 53 %, des PM2,5 et PM10, respectivement, dans l'air ambiant serait attribuable à la circulation automobile (examiné dans Khreis et Nieuwenhuijsen, 2017). Le CN est considéré comme un marqueur pour la circulation de véhicules au diesel (Richmond-Bryant et al., 2009). En 2010, l'Institut de recherche sur les effets sur la santé (HEI) a publié une revue critique de la littérature traitant des émissions de PACA, de l'exposition à cette dernière et de ses effets sur la santé (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010). En ce qui a trait aux effets sur la santé, la littérature épidémiologique a été évaluée dans le but de conclure à des liens de causalité entre l'exposition à la PACA et des résultats sur la santé. Pour les besoins de cette évaluation, les ouvrages scientifiques toxicologiques ont été examinés en vue de définir tout mécanisme et de comprendre le rôle des émissions liées à la circulation automobile dans les effets observés dans le cadre d'études épidémiologiques. La revue menée par le HEI a permis de classifier les liens de causalité entre l'exposition à la PACA et certains résultats sur la santé (tableau 1.1). Depuis la publication de la revue menée par le HEI, la PACA est demeurée un domaine de recherche actif d'intérêt en santé environnementale. À cette fin, Santé Canada publiera plusieurs rapports caractérisant et évaluant l'exposition à la PACA, les effets sur la santé de l'exposition à la PACA et les impacts sanitaires connexes au Canada. Le présent rapport porte sur certains effets sur la santé associés à l'exposition à la PACA.
| Résultat sur la santé | Classification du lien de causalité |
|---|---|
| Mortalité et morbidité | |
| Mortalité de toutes causes et mortalité cardiovasculaire | Évocateur, mais insuffisant |
| Morbidité cardiovasculaire | Évocateur, mais insuffisant |
| Asthme et appareil respiratoire (enfants) | |
| Incidence et prévalence de l'asthme | Suffisant ou évocateur, mais insuffisant |
| Exacerbations des symptômes avec asthme | Suffisant |
| Exacerbations des symptômes sans asthme | Inadéquat et insuffisant |
| Utilisation des services de santé | Inadéquat et insuffisant |
| Asthme et appareil respiratoire (adultes) | |
| Apparition de l'asthme à l'âge adulte | Inadéquat et insuffisant |
| Symptômes respiratoires | Évocateur, mais insuffisant |
| Appareil respiratoire | |
| Fonction pulmonaire (tout âge) | Évocateur, mais insuffisant |
| Maladie pulmonaire obstructive chronique | Inadéquat et insuffisant |
| Allergies | Inadéquat et insuffisant |
| Autres résultats sur la santé | |
| Résultats liés aux naissances | Inadéquat et insuffisant |
| Cancer (non lié à l'exposition professionnelle aux GED) | Inadéquat et insuffisant |
|
|
Santé Canada a mené une évaluation des risques pour la santé humaine des gaz d'échappement des moteurs diesel (GED) (Santé Canada, 2016a) et des gaz d'échappement des moteurs à essence (GEE) (Santé Canada, 2017). Ces évaluations des risques ont permis de définir des répercussions considérables sur la santé de la population canadienne associées à la contribution graduelle aux concentrations de principaux contaminants atmosphériques dans l'air ambiant attribuable aux émissions de véhicules diesel et à essence sur route. D'ailleurs, Santé Canada a évalué le poids de la preuve concernant le rôle causal des mélanges de GED et de GEE dans l'apparition d'effets néfastes sur la santé. L'évaluation des GED comptait parmi ses conclusions finales que les GED causent des troubles respiratoires aigus, ainsi que le cancer du poumon, et qu'il est probable qu'ils soient à l'origine de troubles respiratoires chroniques, de troubles immunologiques et de troubles cardiovasculaires aigus. L'évaluation des GEE, quant à elle, a permis de déterminer que les données probantes évoquaient un lien de causalité unissant l'exposition au mélange de GEE à des troubles respiratoires, mais étaient insuffisantes pour conclure à un lien de causalité avec des troubles immunologiques ou d'autres troubles de santé.
La revue des effets des GED et des GEE sur la santé à partir d'études à méthodologie épidémiologique a été limitée par le fait que les populations sont généralement exposées aussi bien aux GED qu'aux GEE, et qu'aucun marqueur de substitution unique n'a été défini, ce qui complique l'évaluation de l'exposition. Cependant, des recherches épidémiologiques approfondies ont été menées pour comprendre les effets sur la santé de toutes les émissions de véhicules routiers (c.-à-d. de la PACA), ce qui constitue la meilleure représentation du mélange réel de polluants auquel les Canadiens sont exposés chaque jour. On estime que 10 millions de personnes (près d'un tiers de la population totale) vivent dans un rayon de 500 m d'une autoroute ou de 100 m d'une route urbaine majeure (Brauer et al., 2013). De plus, on estime que les Canadiens vivant en milieu urbain passent chaque jour 4 % à 7 % de leur temps dans des microenvironnements influencés par une circulation automobile modérée à intense, y compris en se déplaçant dans un véhicule ou en utilisant un mode de transport actif (Matz et al., 2018).
En se fondant sur les évaluations des risques pour la santé humaine propres au type de carburant (GED et GEE), cette évaluation des risques se penche sur le lien entre l'exposition à la PACA et l'asthme, les allergies et la fonction pulmonaire. Ces effets sanitaires précis ont fait l'objet d'évaluations et de rapports dans les ouvrages scientifiques, en association avec l'exposition à la pollution atmosphérique, y compris à la PACA ou à ses composants. L'asthme constitue un diagnostic général désignant plusieurs maladies des voies respiratoires qui se manifestent par des symptômes de respiration sifflante, d'essoufflement, de toux et de serrement de poitrine et qui sont associés à des obstructions ventilatoires (examiné dans Kuruvilla et al., 2019). Les deux principaux phénotypes de l'asthme sont l'asthme allergique (ou extrinsèque) et l'asthme non allergique (ou intrinsèque). L'asthme allergique se manifeste le plus souvent de façon précoce pendant l'enfance ou chez les jeunes adultes, alors que l'asthme non allergique prédomine au sein des groupes plus âgés. L'asthme allergique précoce peut être léger à grave et se distingue par des concentrations sériques élevées d'immunoglobulines E (IgE) spécifiques. Les IgE sériques sont utilisées comme marqueur allergique, car des IgE spécifiques sont développées en réaction à l'exposition aux allergènes. Ce processus de développement d'IgE spécifiques aux allergènes est appelé « sensibilisation allergique ». Après la sensibilisation, l'exposition à un allergène provoque une réaction allergique. Cette réaction d'hypersensibilité, médiée par l'activation de mastocytes et de basophiles par des IgE spécifiques aux allergènes, déclenche une cascade de réponses cellulaires qui se manifeste sous forme de réponse allergique (examiné dans Kuruvilla et al., 2019, et Reber et al., 2017). La progression des affections allergiques au cours de la petite enfance et de l'enfance est appelée « marche atopique » (examiné dans Hill et Spergel, 2018). Ces affections, commençant par la dermatite atopique et évoluant vers l'allergie alimentaire, l'asthme et la rhinite allergique, ont des facteurs de prédisposition génétiques et environnementaux communs. Notamment, l'apparition d'une des affections allergiques augmente le risque d'apparition des autres. Cette évaluation des risques traite également de la fonction pulmonaire, car les mesures de la fonction pulmonaire sont des indicateurs clés de la santé respiratoire et sont utilisées en contexte clinique aux fins de diagnostic et de surveillance des maladies respiratoires, y compris de l'asthme (examiné dans Liang et al., 2012).
1.2 Approche et objectifs
Pour les besoins de cette évaluation des risques, une approche de revue globale a été adoptée. Une revue globale comprend la recherche, l'organisation et l'évaluation systématiques des preuves existantes provenant de multiples revues systématiques,Note de bas de page 1 avec ou sans méta-analysesNote de bas de page 2 (Aromataris et al., 2015). L'élément le plus caractéristique des revues globales est que ce type de synthèse des données probantes n'inclut que des données de la plus haute qualité. Plus précisément, dans le cadre des revues globales, les unités à l'échelle desquelles s'effectue la revue analytique sont des revues systématiques publiées avec ou sans méta-analyse. Cette approche permet une revue rapide de l'ensemble des données probantes existantes et d'en relever les points cohérents ou contradictoires. Une revue globale est idéale pour déterminer si des revues systématiques répondant à des questions semblables font des observations semblables et tirent des conclusions généralement semblables de façon indépendante. Il est important de noter que l'objectif d'une revue globale n'est pas de répéter le processus de définition, d'évaluation et de synthèse des études primaires incluses dans les revues systématiques, avec ou sans méta-analyses, dont il est composé. L'objectif est plutôt de fournir un résumé des synthèses de recherche existantes et d'en tirer une interprétation globale d'un sujet vaste.
Pour les besoins de cette évaluation des risques fondée sur une revue globale, les revues systématiques, les revues systématiques–méta-analyses (RS-MA) et d'autres revues sélectionnées (c.-à-d. analyse détaillée de la littérature) ont été incluses. Bien que ces autres revues sélectionnées n'aient pas été effectuées à titre de revues systématiques, elles ont fourni une bonne vue d'ensemble des résultats de recherche visant à permettre de déterminer l'existence d'un lien de causalité entre l'exposition et les effets sur la santé et ont donc été considérées comme informatives dans le cadre de cette évaluation des risques.
L'objectif de cette évaluation des risques est d'utiliser une approche de revue globale pour évaluer les liens entre l'exposition à la PACA et l'asthme, les allergies et la fonction pulmonaire, en se fondant sur des revues de la littérature épidémiologique. À partir de cette évaluation, une méthode du poids de la preuve a été adoptée pour déterminer le rôle causal de la PACA dans le développement des effets sanitaires de l'asthme, d'allergies et de troubles pulmonaires. De surcroît, des preuves mécanistes recueillies à partir d'une revue des documents existants d'évaluation des risques pour les composants de la PACA ont été également prises en compte afin d'évaluer la plausibilité biologique des liens définis dans le cadre de la revue globale et d'appuyer la détermination de la causalité.
Chapitre 2. Méthode
La méthodologie adoptée pour cette évaluation des risques est décrite en détail dans ce chapitre. La section 2.1 décrit le processus de la revue de la portée utilisé pour identifier la littérature épidémiologique pertinente relative à l'exposition à la PACA. La section 2.2 détaille le processus utilisé pour évaluer la qualité des articles de revue. La section 2.3 décrit comment les preuves expérimentales liées à la PACA et les effets sanitaires d'intérêt ont été utilisées pour évaluer la plausibilité biologique et identifie les sources de ces preuves. Enfin, la section 2.4 présente les critères utilisés pour déterminer le niveau de causalité par la méthode du poids de la preuve.
2.1 Revue de la portée
Comme première étape, une revue de la portéeNote de bas de page 3 de la littérature épidémiologique traitant des effets de la PACA sur la santé humaine a été menée (Matz et al., 2019). La principale question de recherche pour cette revue de la portée était la suivante : Quels sont les ouvrages scientifiques existants traitant du lien entre l'exposition à la PACA et les effets indésirables sur la santé humaine (y compris les effets touchant divers systèmes : respiratoire, cardiovasculaire, immunologique, reproducteur [développement] et nerveux, ainsi que d'autres effets sur la santé, comme le cancer et la mortalité)? La revue de la portée comprenait des articles de recherches épidémiologiques primaires et certains types de revues (décrits ci-dessous), qui ont été publiés dans des revues évaluées par des pairs et qui répondaient aux objectifs de la revue de la portée. Les conceptions d'étude observationnelles incluses étaient les études cas/témoins, de cohorte, transversales, de panel, écologiques, de séries chronologiques et croisées. Des études expérimentales ont été incluses uniquement si des sujets humains y avaient participé (c.-à-d. des études d'exposition contrôlée chez l'humain). Les types de revues inclus dans la revue de la portée étaient des revues systématiques, des méta-analyses, des revues de la portée et d'autres revues sélectionnées, qui comprenaient une évaluation du lien de causalité. En ce qui a trait aux mesures de l'exposition à la PACA et à la circulation automobile, les critères d'inclusion ont été définis d'après la revue critique de la PACA par le panel du HEI sur les effets de la pollution atmosphérique liée à la circulation automobile (HEI Panel on the Health Effects of Traffic-Related Air Pollution) (2010). Ces critères ont permis aux examinateurs d'extraire les études centrées sur la PACA ou la circulation automobile d'un large éventail d'études sur la pollution atmosphérique en général. Les mesures d'exposition satisfaisant aux critères d'inclusion comprenaient les suivantes : distance par rapport aux routes; mesures de la densité de la circulation automobile; modélisation (p. ex. régression de l'utilisation des terres [RUT] et dispersion) visant à estimer l'exposition à la circulation automobile spécifiquement; répartition des sources selon la circulation automobile; professions caractérisées par l'exposition à la circulation automobile (p. ex. chauffeurs de taxi et camionneurs); sujets dans des emplacements caractérisés par le degré d'exposition à la circulation automobile (p. ex. comparaison entre des emplacements à faible ou à forte exposition) et surveillance des polluants liés à la PACA (p. ex. NO2 et CN) lorsque les mesures pouvaient raisonnablement être reliées aux sources de circulation automobile (p. ex. surveillance de routes en particulier).
Les recherches documentaires ont été menées par un bibliothécaire de Santé Canada dans deux bases de données, Ovid Embase et Ovid MEDLINE, et ont couvert la période allant du 1er janvier 2000 au 4 avril 2018. La stratégie de recherche et les critères d'inclusion pour la recherche sont décrits plus en détail dans Matz et al. (2019). Les références extraites de la recherche documentaire ont été examinées de façon indépendante par deux évaluateurs pour déterminer leur admissibilité, d'abord selon le titre et le résumé, puis le texte complet. Les désaccords ont été résolus au moyen d'une approche consensuelle. Pour établir des liens entre les données probantes, l'extraction des données incluait les paramètres de conception de l'étude et les résultats sur la santé humaine. Des tableaux récapitulatifs descriptifs ont été créés pour offrir un résumé général du nombre et des types d'articles évaluant les différents types d'effets sur la santé et une tabulation recoupée en fonction des paramètres de conception de l'étude. Le processus de revue a été géré entièrement à l'aide de DistillerSR (Evidence Partners, Ottawa, Ontario).
La revue de la portée a permis de déterminer qu'il convenait d'évaluer le lien entre l'exposition à la PACA et l'asthme au moyen d'une revue globale. Plus précisément, dans le cas de l'asthme, quatre RS-MA, sept revues systématiques et deux autres revues sélectionnées incluant une évaluation du lien de causalité ont été extraits. Les allergies et la fonction pulmonaire ont également été incluses dans l'évaluation fondée sur la revue globale, en raison de la nature des effets sur la santé associés à l'asthme, et la revue de la portée a permis d'extraire un ensemble d'ouvrages scientifiques existants pour les besoins de cette approche. À ce sujet, une RS-MA et deux revues systématiques concernant l'asthme, ainsi qu'une RS-MA et quatre revues systématiques concernant la fonction pulmonaire, ont été extraites dans le cadre de la revue de la portée. Pour les besoins de cette évaluation, le 30 octobre 2018, une mise à jour de la documentation a été réalisée au moyen d'une stratégie de recherche plus précise, qui restreignait la portée des études à l'asthme, aux allergies et à la fonction pulmonaire; cette stratégie de recherche plus précise figure à l'annexe A. Aucun nouvel article de revue répondant aux critères d'inclusion n'a été extrait par suite de la mise à jour de la documentation.
La figure 2.1 illustre le processus de sélection des études.
Figure 2.1 Processus de sélection des études pour les besoins de la revue de la portée et de la revue globale
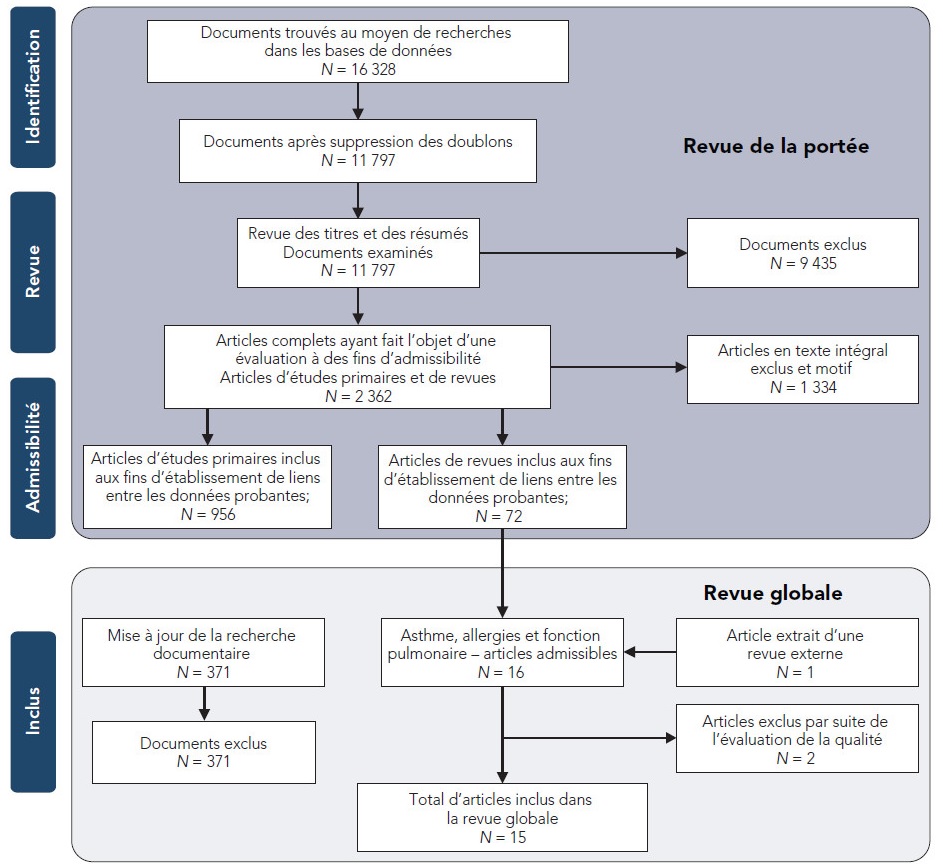
Équivalent textuel
La figure 2.1 illustre le processus de sélection des études selon les différentes phases d'une revue systématique et indique le nombre de documents identifiés, inclus et exclus ainsi que les raisons des exclusions. Pour la revue de la portée, 16 328 documents ont été trouvés au moyen de recherches dans les bases de données et 11 797 documents ont été retenus après la suppression des doublons. Parmi ces 11 797 documents, 9 435 documents ont été exclus à la suite de la revue des titres et des résumés, laissant 2 362 articles d'études primaires et de revues pour une évaluation du texte intégral à des fins d'admissibilité. À la suite de l'exclusion justifiée de 1 334 articles, 956 articles d'études primaires et 72 articles de revues ont été inclus aux fins d'établissement de liens entre les données probantes. Pour la revue globale, 16 articles de revues étaient admissibles pour l'évaluation de l'asthme, des allergies et de la fonction pulmonaire. Par ailleurs, un article additionnel a été extrait d'une revue externe. La revue globale a finalement porté sur 15 articles de revues après l'exclusion de 2 articles résultant de l'évaluation de la qualité. Tous les 371 documents identifiés lors de la mise à jour de la recherche documentaire ont été exclus.
2.2 Évaluation de la qualité de la revue
La qualité méthodologique de chacune des RS-MA, des revues systématiques et des autres revues sélectionnées extraites pendant la revue de la portée a été évaluée à l'aide de la version révisée de l'outil d'évaluation de la qualité des revues systématiques (AMSTAR 2) (Shea et al., 2017). Cet outil d'évaluation critique des revues systématiques a été mis au point pour permettre l'évaluation des revues systématiques des études avec et sans répartition aléatoire portant sur les interventions en soins de santé. Bien que l'outil compte 16 domaines pour l'évaluation des revues, il n'est pas conçu pour produire une note globale. On recommande aux utilisateurs de l'outil de définir les domaines critiques pour déterminer la validité d'une revue et le degré de certitude qu'ils peuvent en tirer. Le recours à une approche globale pour l'attribution d'une note est susceptible de masquer les lacunes et les faiblesses des domaines critiques.
Dans le cadre de cette évaluation des risques fondée sur la revue globale, l'outil AMSTAR 2 a été évalué afin de définir les domaines critiques les plus pertinents et applicables dans le cadre des études d'épidémiologie environnementale. Au total, huit domaines critiques ont été définis (voir le tableau 2.1) : cinq domaines s'appliquent à toutes les évaluations et trois autres s'appliquent uniquement aux synthèses quantitatives. Chacune des revues a été évaluée au regard des domaines critiques, et l'attribution de notes associées aux domaines critiques a été considérée comme un moyen raisonnable de déterminer la qualité de la revue. Chaque point a reçu une note de 1 si le critère précis avait été respecté, une note partielle de 0,5 si tous les aspects du critère n'avaient pas été respectés, ou une note de 0 si le critère n'avait pas été respecté, s'il y avait une incertitude ou si le critère n'était pas applicable. Ainsi, plus la note est élevée, moins la revue présente de lacunes ou de faiblesses critiques ayant une incidence sur sa validité et le degré de certitude qu'on peut en tirer. L'attribution de notes a servi à distinguer les revues dont les notes étaient faibles (c.-à-d. dont les faiblesses et les failles critiques associées aux domaines critiques ont entraîné un faible degré de certitude et une faible validité); ces revues de qualité inférieure ont ensuite été exclues de celles prises en considération pour la revue globale. La revue globale implique une évaluation complète de toutes les revues incluses. Étant donné que trois des huit questions ne s'appliquaient qu'aux méta-analyses, les RS-MA ont été évaluées en fonction d'une note maximale de huit, alors que les revues systématiques sans méta-analyse et les autres revues sélectionnées ont été évaluées selon une note maximale de cinq. Les revues incluses ont été évaluées indépendamment par deux évaluateurs ; les désaccords ont été résolus au moyen d'une approche consensuelle. La qualité des revues a été définie comme inférieure, moyenne ou supérieure, selon la note attribuée dans le cadre de l'évaluation des domaines critiques (voir l'annexe B pour de plus amples renseignements).
Tableau 2.1 Domaines critiques de l'outil d'évaluation AMSTAR 2 adapté aux études épidémiologiques environnementales
Domaines critiques d'AMSTAR 2 les plus pertinents pour les études épidémiologiques environnementales
- Les auteurs de la revue ont-ils utilisé une stratégie de recherche documentaire exhaustive?
- Les auteurs de la revue ont-ils fourni une description adéquatement détaillée des études incluses?
- Les auteurs ont-ils eu recours à une technique satisfaisante pour évaluer la qualité de l'étude ou évaluer le risque de biais (RB) des études individuelles incluses dans la revue?
- Les auteurs de la revue ont-ils tenu compte de la qualité de l'étude ou du RB des études individuelles lors de l'interprétation ou de la description des résultats de la revue?
- Les auteurs de la revue ont-ils fourni une explication satisfaisante et une description de toute hétérogénéité observée dans les résultats de la revue, le cas échéant?
- Si une méta-analyse a été réalisée, les auteurs ont-ils utilisé les méthodes appropriées pour le regroupement statistique des résultats?
- Si une méta-analyse a été réalisée, les auteurs de la revue ont-ils évalué l'incidence potentielle de la qualité de l'étude ou du RB des études individuelles sur les résultats de la méta-analyse ou de la synthèse des données probantes?
- S'ils ont effectué une synthèse quantitative, les auteurs de la revue se sont-ils suffisamment interrogés concernant tout biais de publication (biais d'étude de petite envergure) et ont-ils discuté de son incidence probable sur les résultats de la revue?
2.3 Preuves expérimentales
Afin d'évaluer les preuves expérimentales et d'évaluer la plausibilité biologique des liens définis dans le cadre de la revue globale, une revue des évaluations a été effectuée par des organismes reconnus internationalement, y compris Santé Canada, l'HEI et l'Environmental Protection Agency des États-Unis (EPA des É.-U.). Les sections expérimentales des évaluations, qui consistent en une revue des études d'exposition contrôlée chez l'humain, des études expérimentales sur les animaux et des études in vitro, ont été examinées pour en analyser les liens entre l'exposition à la PACA et l'asthme, les allergies et la fonction pulmonaire. En raison de la nature des conceptions des études en question (p. ex. durées et concentrations précises pour l'exposition), ces études expérimentales se sont penchées sur des expositions à des composants précis de la PACA (c.-à-d. NO2 et PM) et à des mélanges connus pour contribuer à la PACA (c.-à-d. GED et GEE). Bien que bon nombre de ces études portaient sur des périodes d'exposition à court terme, les réactions biologiques observées sont informatives, car elles fournissent des renseignements mécanistes sur les voies d'activation possibles pouvant entraîner les effets observés dans les études épidémiologiques à long terme. Plus précisément, les évaluations des risques pour la santé humaine menées par Santé Canada sur les GED (2016a), les GEE (2017), le NO2 (2016b) et les PM (2013) ont été passées en revue. Comme la présente évaluation, la revue critique de la PACA menée par l'HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010) portait également sur certains composants et mélanges de PACA et a été incluse dans cette revue. Les évaluations scientifiques intégrées (ISA) menées par l'EPA des É.-U. sur le NO2 (2016) et les PM (2009) ont été examinées; l'évaluation des PM s'est également penchée sur des études concernant les GED comme source de PM.
2.4 Détermination de la causalité
En combinaison avec l'évaluation de la qualité des articles de revue, les synthèses quantitatives des RS-MA ont été considérées comme fournissant les preuves de meilleure qualité, alors que les synthèses qualitatives tirées des revues systématiques et autres revues sélectionnées ont fourni un appui quant aux ouvrages scientifiques existants pour déterminer la causalité. Les preuves expérimentales ont été utilisées pour appuyer les liens observés dans la littérature épidémiologique ainsi que la détermination de la causalité.
La méthode du poids de la preuve utilisée dans cette évaluation en vue de déterminer le rôle causal des polluants atmosphériques quant à l'apparition d'effets précis sur la santé prend en compte les critères d'inférence causale définis par Bradford Hill (1965). Ces critères, largement utilisés dans la revue de la littérature épidémiologique et considérés de façon collective dans l'évaluation par méthode du poids de la preuve, sont les suivants :
- Plausibilité biologique : un mécanisme plausible peut être défini entre l'exposition et l'effet;
- Temporalité : l'exposition précède le résultat en matière de santé;
- Stabilité du lien : le lien est relevé par différents chercheurs, pour différentes conceptions d'étude, dans différentes populations, etc.;
- Cohérence : les résultats d'études toxicologiques et épidémiologiques et d'études d'exposition contrôlée chez l'humain de divers types appuient les effets observés et les modes d'action possibles;
- Gradient biologique : il existe des preuves d'un lien exposition-réaction;
- Force du lien : plus l'estimation du risque est grande, moins il est probable que la relation soit due à un facteur de confusion résiduel non contrôlé;
- Robustesse des liens : les liens sont robustes relativement aux spécifications des modèles et aux corrections pour tenir compte de possibles facteurs de confusion, comme les conditions météorologiques, les tendances temporelles et les copolluants.
Ces critères servent à fournir des renseignements pour conclure si le lien unissant l'exposition à la PACA à un effet sur la santé est un lien de causalité, probablement un lien de causalité, évocateur d'un lien de causalité, inadéquat pour conclure à un lien de causalité ou un lien de causalité peu probable. Les définitions de chacune de ces déterminations de causalité, d'après l'EPA des É.-U. (2015), figurent dans le tableau 2.2. Santé Canada a déjà utilisé ce cadre de causalité dans les évaluations des risques des GED (2016a), du NO2 (2016b) et des GEE (2017), largement fondées sur des évaluations d'ouvrages scientifiques d'études primaires. Pour les besoins de cette évaluation fondée sur la revue globale, le cadre de causalité a été utilisé tout en reconnaissant que chaque publication de revue (c.-à-d. les unités d'analyse à l'échelle desquelles s'effectue une revue globale) représentait une synthèse de plusieurs études primaires.
| Lien | Description |
|---|---|
| Lien de causalité | Les données probantes sont suffisantes pour conclure qu'il existe un lien de causalité avec des expositions pertinentes aux polluants (p. ex. doses ou expositions se comparant aux concentrations observées récemment, généralement à un ou deux ordres de grandeur près). Autrement dit, il a été constaté que le polluant entraîne des effets sur la santé dans des études où le hasard, le biais et les facteurs de confusion ont pu être exclus avec une certitude raisonnable. Par exemple : (1) des études d'exposition contrôlée chez l'humain qui montrent des effets constants ou (2) des études observationnelles qui ne peuvent s'expliquer autrement de façon plausible ou qui sont appuyées par d'autres éléments de preuve (p. ex. des études sur des animaux ou des données sur le mode d'action). En général, la détermination est fondée sur plusieurs études de qualité supérieure menées par plusieurs groupes de recherche. |
| Lien de causalité probable | Les données probantes sont suffisantes pour conclure qu'il existe probablement un lien de causalité avec des expositions pertinentes aux polluants. Autrement dit, il a été constaté que le polluant entraîne des effets sur la santé dans des études où le hasard, des facteurs de confusion et d'autres biais peuvent être exclus, mais des incertitudes persistent quant à l'ensemble de la preuve. Par exemple : (1) des études observationnelles montrent un lien, mais les expositions à des copolluants sont difficiles à étudier ou les autres éléments de preuve (exposition contrôlée chez l'humain, études sur des animaux ou données sur le mode d'action) sont limités ou incohérents, ou (2) les résultats de plusieurs études toxicologiques réalisées sur des animaux par des laboratoires différents montrent des effets, mais les données humaines sont limitées ou inexistantes. De façon générale, la détermination est fondée sur plusieurs études de qualité supérieure. |
| Données évocatrices, mais insuffisantes, pour conclure à un lien de causalité | Les données évoquent un lien de causalité avec des expositions pertinentes aux polluants, mais ce lien demeure limité parce qu'il n'est pas possible d'écarter l'effet du hasard, des facteurs de confusion et d'autres biais. Par exemple : (1) si l'ensemble des données probantes est relativement petit, au moins une étude épidémiologique de qualité supérieure montre un lien avec un effet sur la santé ou au moins une étude toxicologique de qualité supérieure révèle des effets pertinents pour les humains chez des espèces animales, ou (2) si l'ensemble des données probantes est relativement grand, les résultats d'études de qualité variable sont généralement probants, mais pas entièrement cohérents, et il peut y avoir cohérence entre les éléments de preuve (p. ex. études sur des animaux ou renseignements sur le mode d'action) à l'appui de la détermination. |
| Données insuffisantes pour conclure à un lien de causalité | Les données ne permettent pas de déterminer s'il existe un lien de causalité avec des expositions pertinentes aux polluants. Le nombre, la qualité, la cohérence ou la puissance statistique des études disponibles ne permettent pas de tirer une conclusion quant à la présence ou à l'absence d'un effet. |
| Lien de causalité peu probable | Les données indiquent qu'il n'existe pas de lien de causalité avec des expositions pertinentes aux polluants. Plusieurs études de qualité couvrant la gamme complète des degrés d'exposition connus auxquels sont soumis les êtres humains et examinant des populations à risque à différentes étapes du cycle de la vie montrent toutes qu'il n'y a pas d'effet, quel que soit le degré d'exposition. |
Chapitre 3. Revue globale
3.1 Caractéristiques des revues incluses
Le processus de revue de la portée a extrait 16 revues pertinentes. Une revue supplémentaire (Heinrich et al., 2016) a été extraite pendant le processus de revue externe; cette revue provenait d'une publication non indexée dans les bases de données utilisées pour la recherche documentaire de la revue de la portée. Parmi ces 17 revues, seulement 15 ont été incluses dans la revue globale par suite de l'évaluation de la qualité à l'aide de l'outil AMSTAR 2 adapté (décrit à la section 2.2). Deux revues (Choudhary et Tarlo, 2014; Pollock et al., 2017) ont été exclues parce qu'elles ont été catégorisées comme inacceptables pour l'inclusion dans l'évaluation des risques, en raison d'une qualité inférieure (c.-à-d. faible validité et faible certitude pouvant être retirées des résultats de la revue) par suite de l'évaluation des domaines critiques. Seulement deux revues (Heinrich et al., 2016; Khreis et al., 2017) ont été jugées de qualité supérieure et les autres (Boothe et Shendell, 2008; Götschi et al., 2008; Salam et al., 2008; Bråbäck et Forsberg, 2009; Heinrich, 2011; Koppen et al., 2011; Gasana et al., 2012; Jacquemin et al., 2012; Favarato et al., 2014; Barone-Adesi et al., 2015; Bowatte et al., 2015; Khreis et Nieuwenhuijsen, 2017; Schultz et al., 2017) ont été jugées de qualité moyenne. La plupart des revues n'ont pas pris en compte le RB des études individuelles qu'ils incluaient. Toutes les études de qualité supérieure ou moyenne ont été incluses dans l'évaluation pour la revue globale. De plus amples renseignements ainsi que les notes individuelles figurent dans le tableau d'évaluation de la qualité des études, à l'annexe B.
En ce qui concerne la méthodologie générale, sept des études étaient des revues systématiques et six étaient des revues systématiques incluant des méta-analyses. Deux revues supplémentaires ont été incluses, car chacune a effectué une revue exhaustive des ouvrages scientifiques pour appuyer la détermination de la causalité; ces revues supplémentaires sont appelées « autres revues sélectionnées » dans cette évaluation. Dans l'ensemble, les revues utilisées ont été publiées entre 2008 et 2017 et incluaient 157 études primaires uniques publiées entre 1989 et 2016. Parmi ces études primaires, 109 traitaient de l'asthme et incluaient des études de cohorte ou des études cas/témoins nichées dans une cohorte (62 études), des études transversales ou des études cas/témoins nichées dans une étude transversale (34 études), des études cas/témoins ou cas/cohorte (huit études) et des analyses regroupées de cohortes (quatre études). Le type d'étude n'a pas été précisé pour une étude. Parmi les 157 études primaires, 22 ont examiné l'allergie comme effet sur la santé : 18 étaient des études de cohorte par conception, trois étaient des analyses regroupées d'études de cohorte et une était une étude cas/cohorte. En revanche, 32 des 52 études primaires ayant examiné la fonction pulmonaire comme effet sur la santé ont utilisé une conception d'étude transversale ou ont signalé des liens transversaux; les 20 études restantes avaient une conception de cohortes.
L'ampleur du chevauchement entre les revues, en ce qui concerne les études primaires ayant examiné les effets sur la santé pris en compte dans cette synthèse, a également été déterminée afin d'évaluer l'étendue des ouvrages scientifiques d'études primaires et est illustrée à l'annexe C. Le chevauchement partiel et la grande variabilité observée quant aux études primaires citées incluses dans les revues peuvent être attribués à l'objectif précis de chaque revue, à ses critères d'inclusion et d'exclusion et à sa date de publication. La nature interreliée de ces effets sur la santé, à savoir, l'asthme et les allergies et l'asthme et la fonction pulmonaire, a également fait en sorte que certaines revues et certaines cohortes décrites dans les revues évaluent plus d'un de ces effets sur la santé. Les revues sur lesquelles se penche cette synthèse n'étaient également pas cohérentes dans leur description des études primaires; certaines revues désignent les études par le nom de la cohorte, alors que d'autres les désignent seulement par l'emplacement de cohorte ou par l'auteur de l'étude primaire. Sept études primaires (Brauer et al., 2002, 2007; Gehring et al., 2002, 2010; Morgenstern et al., 2007, 2008; Oftedal et al., 2009), étaient les plus citées (chacune sept à neuf fois) parmi les 15 revues systématiques ou autres revues sélectionnées. Un tableau récapitulatif de ces 15 articles de revue figure à l'annexe D.
3.2 Asthme
Quatre RS-MA (Gasana et al., 2012; Favarato et al., 2014; Bowatte et al., 2015; Khreis et al., 2017) évaluant le lien entre l'exposition à la PACA et l'asthme ont été extraites pendant la revue de la portée et une RS-MA (Heinrich et al. 2016) a été extrait pendant le processus de revue externe. Cinq revues systématiques (Salam et al., 2008; Bråbäck et Forsberg, 2009; Koppen et al., 2011; Jacquemin et al., 2012; Khreis et Nieuwenhuijsen, 2017) et deux autres revues sélectionnées (Boothe et Shendell, 2008; Heinrich, 2011) ont également été extraites pendant le processus de revue de la portée concernant le lien potentiel entre l'exposition à la PACA et l'asthme. La plupart de ces revues portaient principalement sur les enfants.
3.2.1 RS-MA
Khreis et al. (2017) est la revue la plus récente parmi les RS-MA extraites lors de la revue de la portée. Les auteurs ont mené une RS-MA d'études épidémiologiques observationnelles portant sur le lien entre les expositions à la PACA et l'apparition subséquente de l'asthme chez les enfants, de la naissance à l'âge de 18 ans. Contrairement aux analyses précédentes qui incluaient également la respiration sifflante pendant l'enfance, Khreis et al. (2017) traitent principalement de l'exposition à la PACA précédant uniquement l'apparition de l'asthme (p. ex. l'asthme devait être explicitement précisé et la respiration sifflante pendant l'enfance n'était pas incluse). Quarante et une études primaires de diverses conceptions, soit 28 études de cohorte (21 études de cohorte de naissance), trois études fondées sur les données regroupées de cohortes de naissance, six études cas/témoins et quatre études transversales, ont été incluses dans la synthèse qualitative, alors que 21 études primaires ont été incluses dans les différentes analyses quantitatives. La qualité des études a été évaluée à l'aide des listes de vérification du Programme de compétences d'évaluation critique (Critical Appraisal Skills Program) et chaque étude primaire a été considérée comme étant de bonne qualité et valide aux fins d'inclusion dans la revue. Les études primaires ont été menées en Europe (17 études), en Amérique du Nord (11 études) et en Asie (10 études); trois études ont signalé des analyses regroupées provenant de multiples cohortes regroupées menées principalement en Europe. Il convient de souligner que 17 études primaires se sont appuyées exclusivement sur le signalement par les sujets eux-mêmes ou les parents de l'asthme diagnostiqué par un médecin et que 21 études primaires ont utilisé des définitions plus restreintes (p. ex. combinaison du diagnostic d'un médecin et de symptômes ou d'ordonnances ou d'utilisations récentes de médicaments antiasthmatiques, ou encore, de symptômes et d'une hyperréactivité bronchique ou d'un résultat positif au test de provocation à la méthacholine). D'autres définitions de l'asthme comprenaient les suivantes : diagnostic d'un pédiatre; combinaison de symptômes récurrents et de réaction aux β-agonistes, aux anti-inflammatoires ou aux deux; utilisation de codes de maladies dans les dossiers de réclamation ou de facturation de soins primaires et de congés hospitaliers; utilisation de données du registre sur la distribution de médicaments antiasthmatiques. Bien que de nombreuses techniques d'évaluation de l'exposition (p. ex. marqueurs de substitution de la PACA, stations de surveillance fixes, modèles de RUT, modèles de dispersion et surveillance individuelle au domicile) aient été utilisées dans les études primaires, la plupart des études (22) utilisaient des modèles de RUT. À l'exception de cinq études primaires ayant utilisé des mesures des stations fixes près des écoles ou des pouponnières pour attribuer l'exposition, l'exposition à la PACA a été attribuée selon l'adresse résidentielle. Huit études primaires se sont également penchées sur la mobilité des enfants et les expositions à la PACA attribuées pondérées dans le temps à d'autres endroits (p. ex. garderies et écoles). Bien que la répartition des expositions liées à la circulation automobile pour chacun des polluants mesurés ait été précisée pour les études individuelles, il n'y avait aucune cohérence en matière de signalement entre les études, et aucun intervalle ni aucune description d'ensemble n'ont été fournis dans Khreis et al. (2017). En ce qui concerne les facteurs de confusion potentiels (p. ex. tabagisme, statut socioéconomique [SSE] et facteurs héréditaires), les résultats des modèles ajustés pour le plus grand nombre de covariables ont été choisis pour l'analyse quantitative, le cas échéant. Seules les études primaires ayant évalué ou modélisé plus particulièrement l'exposition aux polluants de la PACA ont été incluses dans l'analyse quantitative; les estimations des risques des études incluses ont été standardisées selon des paliers d'augmentation de 0,5 × 10−5/m pour le CN, de 4 µg/m3 pour le NO2, de 30 µg/m3 pour les oxydes d'azote (NOx), de 1 µg/m3 pour les PM2,5 et de 2 µg/m3 pour les PM10.
La méta-analyse à effets aléatoires a révélé un lien positif et essentiellement significatif entre chaque polluant et l'apparition de l'asthme, sans égard à l'âge d'apparition. Pour chaque polluant, le rapport de cotes (RC) regroupé, l'intervalle de confiance (IC) à 95 %, le pourcentage de variation entre les études attribuée à l'hétérogénéité (I2), et la valeur p pour le test du χ2 de l'hétérogénéité figurent dans le tableau 3.1. Des RC regroupés significatifs (intervalle de 1,03-1,08) ont été signalés pour le CN, le NO2, les PM2,5 et les PM10, malgré une grande hétérogénéité pour le NO2. Les RC regroupés pour les NOx étaient élevés (RC : 1,48), mais non significatifs, et il a été révélé que les études présentaient une grande hétérogénéité. Les résultats de la méta-analyse à effets fixes étaient comparables à ceux de la méta-analyse à effets aléatoires pour le CN, le NO2, les PM2,5 et les PM10, mais ont relevé une augmentation significative sur le plan statistique des risques pour les NOx. Étant donné la grande hétérogénéité pour le NO2 et les NOx, le modèle à effets aléatoires a été considéré comme plus approprié pour la synthèse quantitative.
| Polluant (palier d'augmentation standardisé) | Nombre d'études primaires incluses dans la méta-analyse | RC regroupé (IC à 95 %) | Hétérogénéité (I2) | Valeur p | |
|---|---|---|---|---|---|
| Nombre total | Liens positifsTableau 3.1 Note de bas de page a | ||||
| CN (0,5 × 10−5/m) |
8 | 7 (1) | 1.08 (1,03–1,14) |
0 % | 0,87 |
| NO2 (4 µg/m3) |
20 | 16 (9) | 1,05 (1,02–1,07) |
65 % | 0,0001 |
| NOx (30 µg/m3) |
7 | 5 (3) | 1,48 (0,89–2,45) |
87 % | 0,00001 |
| PM2,5 (1 µg/m3) |
10 | 8 (2) | 1.03 (1,01–1,05) |
28 % | 0,18 |
| PM10 (2 µg/m3) |
12 | 10 (1) | 1,05 (1,02–1,08) |
29 % | 0,16 |
| |||||
Lorsque l'âge à l'apparition était pris en compte (c.-à-d., ≤ 6 ans [âge préscolaire] et > 6 ans [âge scolaire]), les estimations du risque étaient généralement plus élevées dans le groupe d'âge le plus jeune, à l'exception de celles pour les NOx et tous les liens sont demeurés positifs, mais beaucoup n'étaient plus significatifs. Cette perte de signification est probablement attribuable à la réduction de la puissance de l'analyse statistique. Les liens étant demeurés significatifs comprennent celui unissant l'apparition de l'asthme chez les enfants d'âge préscolaire et au CN, au NO2 et aux PM10, avec des RC de 1,17 (IC à 95 % : 1,01-1,36; I2 = 45 %, p = 0,12), 1,08 (IC à 95 % : 1,04-1,12; I2 = 26 %, p = 0,23) et 1,09 (IC à 95 % : 1,04-1,15; I2 = 12 %, p = 0,34), respectivement; et celui unissant l'apparition de l'asthme chez les enfants d'âge scolaire aux PM2,5, avec un RC de 1,04 (IC à 95 % : 1,02-1,07; I2 = 3 %; p = 0,41). Dans les analyses générales et propres à l'âge, les estimations liées au CN présentaient la plus faible hétérogénéité, celles liées aux PM2,5 et aux PM10 présentaient une certaine hétérogénéité et celles liées aux NO2 et aux NOx présentaient la plus grande hétérogénéité. Les auteurs attribuent les plus hauts degrés d'hétérogénéité révélés dans l'analyse du NO2, malgré le nombre plus élevé d'études primaires (20), au fait que le NO2 est un marqueur de substitution d'un autre polluant ou d'un autre mélange responsable des effets observés, comme le CN et les PM2,5, car ceux-ci présentaient une plus faible hétérogénéité.
Les auteurs ont également effectué des analyses de sensibilité dans le cadre desquelles ils ont exclu les études dont la contribution était la plus importante, les études cas/témoins, les études transversales ou les études ayant des caractéristiques particulières (c.-à-d. cohorte de naissances à haut risque). Les estimations des risques regroupées des méta-analyses à effets aléatoires se sont généralement avérées robustes à l'égard de ces analyses de sensibilité. Plus particulièrement, les RC pour le CN et le NO2 sont demeurés positifs et statistiquement significatifs dans les analyses de sensibilité de tous les groupes d'âge et du groupe d'âge le plus jeune. Il convient de souligner qu'aucune des estimations des risques regroupées n'incluait d'étude transversale pour le CN, les NOx et les PM2,5 et qu'aucune étude cas/témoins n'a été incluse dans l'estimation des risques regroupée pour l'ensemble des NOx dans tous les groupes d'âge ni pour les NOx ni le CN chez les enfants d'âge scolaire. Les estimations des risques regroupées d'ensemble sont demeurées largement inchangées lorsque les études cas/témoins ou les études transversales ont été exclues des analyses, à l'exception du CN, pour lequel l'estimation des risques regroupée est grimpée à 1,12 (1,01-1,24) après l'exclusion des études cas/témoins, et des PM10, pour lesquels les liens positifs ont atteint le seuil de signification statistique après l'exclusion des études cas/témoins ou des études transversales (RC regroupés : 1,03 [1,00-1,06] et 1,05 [1,00-1,10], respectivement). Pour les enfants d'âge préscolaire, les estimations des risques regroupées pour le CN, le NO2 et les PM2,5 ont augmenté (RC regroupés de 1,27 [1,05-1,54], 1,10 [1,06-1,213] et 1,09 [1,02-1,17], respectivement), devenant statistiquement significatives pour les PM2,5, alors que l'estimation des risques regroupée pour les PM10 a diminué, mais est demeurée statistiquement significative (RC regroupé : 1,07 [1,01-1,12]) après l'exclusion des études cas/témoins. Pour les enfants d'âge scolaire, les estimations des risques regroupées pour le NO2, les PM2,5 et les PM10 sont demeurées en grande partie inchangées après l'exclusion des études de cas ou des études transversales.
Khreis et al. (2017) ont signalé que, généralement, les résultats de méta-analyse pour le NO2 comptaient le plus grand nombre d'études, présentaient la plus forte hétérogénéité et un effet d'envergure relativement faible, alors que les RC des méta-analyses pour les PM2,5 étaient également de relativement faible envergure, mais présentaient une plus faible hétérogénéité. En revanche, les résultats de méta-analyse pour le CN et les PM10 ont présenté des effets de plus grande envergure et une hétérogénéité minimale. Les méta-analyses pour les NOx comptaient le plus faible nombre d'études incluses et, bien que l'estimation des risques regroupée ait été élevée, elle n'était pas statistiquement significative.
De plus, Khreis et al. (2017) ont examiné les effets des expositions à la PACA et l'apparition subséquente de l'asthme selon le sexe et le phénotype de l'asthme (c.-à-d. allergique et non allergique). Bien que sept des 11 études primaires aient révélé des différences propres au sexe, les effets observés étaient incohérents. Dans les cinq études primaires ayant défini les phénotypes de l'asthme comme allergique ou non allergique, seul le phénotype non allergique présentait des liens positifs ou une augmentation des RC ou des RC plus élevés que l'asthme allergique, et ces résultats ont été observés pour tous les polluants étudiés (c.-à-d. CN, NO2, NOx, PM2,5, PM10 et PM grossières).
Dans l'ensemble, cette RS-MA a démontré l'existence d'un lien significatif entre l'exposition à la PACA et l'apparition subséquente de l'asthme pendant l'enfance. Les graphiques en entonnoir des méta-analyses étaient symétriques pour tous les polluants, à l'exception des NOx, indiquant ainsi une faible probabilité de biais de publication, sauf pour l'analyse des NOx. Compte tenu du plus faible nombre d'études existantes sur les polluants autres que le NO2, le pouvoir de détection d'hétérogénéité et de liens est probablement limité. En outre, Khreis et al. (2017) ont relevé une variabilité dans les définitions de l'asthme pouvant potentiellement entraîner un biais de sélection (21 études), ainsi qu'une variabilité quant aux méthodes d'évaluation de l'exposition à la PACA et à la correction des facteurs de confusion. La plupart des études (17) se sont également appuyées exclusivement sur les réponses à des questionnaires reposant sur l'autodéclaration ou la déclaration de parents d'un diagnostic d'asthme posé par un médecin, ce qui pourrait donner lieu à un biais de rappel. Malgré ces limites, les auteurs ont indiqué qu'il y avait suffisamment de preuves pour appuyer un lien entre l'exposition à la PACA et l'apparition d'asthme pendant l'enfance, d'après le degré élevé de cohérence des résultats et des conclusions des études individuelles, des résultats de la méta-analyse et de l'appui considérable des ouvrages scientifiques existants. Cependant, les auteurs n'ont tiré aucune conclusion quant aux effets de l'âge d'apparition, du sexe ou du phénotype d'asthme concernant ce lien.
Heinrich et al. (2016) se sont appuyés sur une ancienne RS-MA de cohortes de naissances de Bowatte et al. (2015) (décrite ci-dessous) afin d'examiner le lien entre l'exposition à la PACA au début d'enfance et l'apparition subséquente d'asthme et les résultats sur la santé liés aux allergies à l'enfance et à l'adolescence. Plus précisément, la revue comprenait des études primaires n'ayant pas été extraites par Bowatte et al. (2015), en raison de la prolongation de la recherche documentaire identique de presque deux ans et de l'inclusion d'estimations des risques d'analyses regroupées. Vingt-huit études primaires représentant 15 cohortes de naissance (c.-à-d. huit cohortes d'Europe, six d'Amérique du Nord et une de Taïwan) ont satisfait aux critères d'inclusion. La qualité des études a été évaluée à l'aide de l'échelle Newcastle-Ottawa pour les études de cohorte, et chaque étude primaire a été considérée comme étant de bonne qualité et valide aux fins d'inclusion dans la revue. Les cohortes étaient toutes basées sur la population, à l'exception de celles qui comprenaient seulement des enfants dont les parents avaient des antécédents de maladies allergiques. Les résultats d'incidence d'asthme et de prévalence de symptômes de respiration sifflante ont été déterminés principalement par les diagnostics de médecins signalés par les parents et les questions sur l'asthme ne portaient généralement que sur l'année précédant le suivi. Pour la respiration sifflante, à l'exception d'une cohorte, seules les données sur les symptômes étant apparus au cours des 12 mois précédents ont été utilisées. Pour l'asthme, la période de suivi de la plupart des études primaires était d'environ 10 ans; le suivi le plus long était de 14 à 16 ans dans quatre cohortes qui ont suivi les enfants jusqu'à l'adolescence. La période de suivi pour la respiration sifflante était généralement plus courte. La plupart des études de cohorte de naissance ont utilisé des modèles de RUT pour déterminer l'exposition à long terme aux polluants de la PACA (c.-à-d. NO2 et PM2,5) à l'adresse du domicile des participants. Bien qu'il n'y ait pas eu non plus de cohérence dans le signalement de l'exposition (p. ex. intervalle général, moyenne, 5e au 95e percentile et intervalle interquartile) dans le cadre des études individuelles, Heinrich et al. (2016) ont observé une variabilité importante des concentrations moyennes de pollution dans l'air ambiant dans l'ensemble des cohortes et ont indiqué qu'en moyenne, la vaste majorité des sujets étaient exposés à des concentrations de PACA en deçà des lignes directrices actuelles de l'Organisation mondiale de la Santé (c.-à-d. expositions annuelles moyennes de 10 µg/m3 pour les PM2,5 et de 40 µg/m3 pour le NO2). Les estimations d'effets fournies ci-dessous concernent des paliers de 10 µg/m3 pour le NO2 et de 2 µg/m3 pour les PM2,5.
Les méta-analyses à effets aléatoires entre les polluants de la PACA et les résultats d'incidence d'asthme et de prévalence de respiration sifflante chez les enfants et les adolescents figurent dans le tableau 3.2. En ce qui a trait à l'incidence d'asthme, des RC regroupés au seuil de signification statistiqueNote de bas de page 4 ont été signalés autant pour le NO2 que pour les PM2,5 (RC de 1,08 et de 1,11, respectivement), malgré qu'une hétérogénéité modérée à élevée ait été relevée pour les deux polluants (valeur p non fournie). De même, pour le résultat de prévalence de symptômes de respiration sifflante, les méta-analyses à effets aléatoires ont révélé l'existence de liens positifs au seuil de signification statistique pour le NO2 et les PM2,5, avec des RC regroupés de 1,08 et 1,13, respectivement. Aucune hétérogénéité (valeur p non fournie) n'a été observée pour l'un ou l'autre des polluants.
| Résultat en matière de santé | Polluant (palier d'augmentation standardisé) | Nombre d'études primaires incluses dans la méta-analyse | RC regroupé (IC à 95 %) | Hétérogénéité (I2)Tableau 3.2 Note de bas de page b | |
|---|---|---|---|---|---|
| Nombre total | Liens positifsTableau 3.2 Note de bas de page a | ||||
| Incidence d'asthme | NO2 (10 µg/m3) |
10 | 6 (3) | 1,08 (0,96–1,20) |
55 % |
| Incidence d'asthme | PM2,5 (2 µg/m3) |
7 | 5 (1) | 1,11 (0,97–1,26) |
58 % |
| Prévalence de respiration sifflante | NO2 (10 µg/m3) |
9 | 7 (0) | 1,08 (0,98–1,18) |
0 % |
| Prévalence de respiration sifflante | PM2,5 (2 µg/m3) |
4 | 4 (0) | 1,13 (1,00–1,28) |
0 % |
|
|||||
Il a été signalé que les résultats des méta-analyses à effets fixes étaient très semblables à ceux des méta-analyses à effets aléatoires, mais ils n'ont pas été fournis par Heinrich et al. (2016). Dans les analyses de sensibilité, desquelles la cohorte à haut risque a été exclue, les estimations d'effets pour l'incidence d'asthme sont demeurées positives, mais elles ont été atténuées pour les NO2 et les PM2,5 (1,06 [IC à 95 % : 0,95-1,19] et 1,03 [IC à 95 % : 0,97-1,10], respectivement). Bien que des résultats similaires aient été obtenus pour la prévalence de symptômes de respiration sifflante et les PM2,5 (1,09 [IC à 95 % : 0,99-1,20]), les estimations d'effets pour la prévalence de symptômes de respiration sifflante sont demeurées inchangées pour le NO2 lorsque la cohorte à haut risque et la cohorte de jeunes enfants ont été exclues.
Dans l'ensemble, cette RS-MA a révélé des liens positifs au seuil de signification statistique entre les polluants clés de la PACA et l'incidence d'asthme chez les enfants ainsi que chez les adolescents et la prévalence de symptômes de respiration sifflante chez les enfants. De plus, Heinrich et al. (2016) ont conclu qu'il n'y avait pas suffisamment de preuves épidémiologiques pour appuyer l'existence d'un lien de causalité entre la PACA et l'asthme. Les facteurs de confusion potentiels n'ont pas été abordés dans cette RS-MA, mais les auteurs ont souligné que les facteurs de confusion non mesurés (p. ex. SSE, fumée secondaire et prédisposition allergique), en plus d'autres facteurs (p. ex. variabilité des critères cliniques pour le diagnostic d'asthme, changements dans les procédures diagnostiques au fil du temps et mélange urbain/rural dans les cohortes), pouvaient aider à expliquer l'hétérogénéité modérée à élevée observée dans les méta-analyses. De plus, Heinrich et al. (2016) ont signalé que les résultats de quelques études, qui comprenaient une perte de plus de 40 % de la cohorte initiale inscrite lors de longues périodes de suivi, pourraient être biaisés en raison de la nature non aléatoire de cette perte.
Bowatte et al. (2015) ont mené une RS-MA de cohortes de naissances examinant le lien entre l'exposition à la PACA au début de l'enfance et l'apparition subséquente d'asthme, d'allergies et de sensibilisation allergique. Dix-neuf études primaires représentant 11 cohortes de naissance ont satisfait aux critères d'inclusion : sept des cohortes de naissance étaient européennes et quatre étaient nord-américaines. Huit cohortes étaient basées sur la population, alors que trois étaient des cohortes à haut risque (p. ex. sujets ayant des antécédents familiaux d'asthme ou d'allergies) et le nombre et la durée des suivis variaient entre les cohortes. Les études primaires ont utilisé une variété de techniques d'évaluation de l'exposition, y compris des modèles de RUT (sept cohortes), des modèles de dispersion (deux cohortes), un site de surveillance central (une cohorte) et l'utilisation d'un échantillonneur passif (une cohorte). Six cohortes ont également pris en considération la proximité de grandes routes. Cependant, les auteurs de la revue ne précisent pas à quel endroit étaient attribuées les expositions à la PACA dans le cadre des études individuelles. Les concentrations moyennes de CN variaient de 0,20 à 1,00 × 10−5/m dans le cadre des études individuelles. Pour le NO2, les concentrations moyennes variaient entre 3,40 et 17,90 µg/m3, et pour les NOx, les barèmes ont été établis par les auteurs de la revue (non fournis). Pour les PM2,5, les concentrations moyennes variaient entre 1,00 et 4,10 µg/m3, et pour les PM10, les barèmes ont été établis par les auteurs de la revue (non fournis). L'asthme et la respiration sifflante ont été les résultats cliniques les plus fréquemment mesurés; ils ont été signalés dans neuf et huit cohortes, respectivement, et ont été évalués séparément dans Bowatte et al. (2015). Ces résultats sur la santé ont été évalués principalement à partir de questionnaires remplis par les parents (neuf cohortes); deux cohortes ont signalé les résultats à l'aide du diagnostic posé par un allergologue pédiatre à simple insu, de la facturation de médecins et des dossiers de congé d'hôpital. Bien que la qualité des études ait été évaluée à l'aide de l'échelle Newcastle–Ottawa pour les études de cohorte, Bowatte et al. (2015) ne se sont pas prononcés sur la qualité générale des études primaires incluses. En ce qui concerne les facteurs de confusion potentiels, deux cohortes n'ont pas été ajustées pour la fumée secondaire, deux cohortes n'ont pas été ajustées pour la prédisposition allergique (hérédité) et une cohorte n'a été ajustée pour aucun de ces facteurs de confusion.
La méta-analyse à effets aléatoires a indiqué des liens positifs entre l'incidence d'asthme pendant l'enfance et la mesure longitudinale de l'exposition pendant l'enfance au NO2 (par augmentation de 10 µg/m3), aux PM2,5 (par augmentation de 2 µg/m3) et au CN (par augmentation de 1 × 10−5/m). Pour le NO2, quatre des cinq études incluses dans la méta-analyse présentaient des liens positifs, dont deux statistiquement significatifs; le RC regroupé était de 1,09 (IC à 95 % : 0,96-1,23). En ce qui concerne les PM2,5, chacune des quatre études incluses dans la méta-analyse présentait des liens positifs, dont deux statistiquement significatifs; le RC regroupé était de 1,14 (IC à 95 % : 1,00-1,30). De même, pour le CN, chacune des trois études incluses dans la méta-analyse présentait des liens positifs, dont deux statistiquement significatifs; le RC regroupé était de 1,20 (IC à 95 % : 1,05-1,38). L'hétérogénéité quant au NO2 et aux PM2,5 était considérable, avec des valeurs I2 de 75,5 % (p = 0,003) et de 77,1 % (p = 0,004), respectivement, mais minime quant au CN (I2 = 19,3 %, p = 0,290).
Une tendance généralement positive a été observée lorsque les RC de l'incidence propre à l'âge de la naissance à l'enfance et les polluants de la PACA étaient insérés dans des graphiques en forêt. Plus particulièrement, une augmentation du risque d'incidence d'asthme découlant de l'exposition au NO2 au début de l'enfance a été observée jusqu'à l'âge de 6 ans; aucune tendance claire n'a toutefois pu être dégagée chez les enfants plus âgés. Le nombre d'études examinées par groupe d'âge variait entre une et trois et, lorsque la méta-analyse était stratifiée selon l'âge, l'hétérogénéité (I2) variait entre 0 % et 62,6 % (p = 0,102 à 0,866). Parmi les cinq méta-analyses propres à l'âge effectuées, quatre ont indiqué un lien positif; l'estimation des risques était statistiquement significative pour les âges de 4 (RC = 1,14; IC à 95 % : 1,06-1,23) et de 7 ans (RC = 1,47; IC à 95 % : 1,01-2,13) et atteignait le seuil de signification statistique pour l'âge de 1 (RC = 1,06; IC à 95 % : 0,90-1,24) et de 8 ans (RC = 1,25; IC à 95 % : 0,98-1,60). Une hétérogénéité minimale (I2 de 0,0 % à 1,7 %; p = 0,313 à 0,866) a été observée pour quatre des cinq méta-analyses, y compris celles qui étaient statistiquement significatives. De même, une tendance à la hausse dans l'incidence d'asthme, avec une hétérogénéité minimale (I2 de 0 % à 23,7 %; p = 0,252 à 0,706), a été observée pour l'exposition au CN jusqu'à l'âge de 6 ans; il a été signalé que ces résultats étaient dominés par une cohorte en particulier (Étude PIAMA [PIAMA]). En revanche, l'exposition précoce aux PM2,5 a été liée à une tendance à la hausse du risque d'asthme de l'âge de 3 ans à l'âge de 12 ans; cependant, seules une ou deux études ont été examinées par groupe d'âge et l'hétérogénéité (I2) de la méta-analyse stratifiée selon l'âge variait de 0 % à 52,3 % (p = 0,148 à 0,797).
Bowatte et al. (2015) ont également évalué qualitativement le résultat de respiration sifflante ainsi que l'influence de la proximité de routes sur l'asthme et la respiration sifflante. Les liens entre l'incidence ou la prévalence de respiration sifflante et les oxydes d'azote (oxyde d'azote [NO], NO2, et NOx) et les PM étaient essentiellement positifs. Parmi les six cohortes (correspondant à 10 publications) ayant signalé des liens entre les oxydes d'azote et la prévalence ou l'incidence de respiration sifflante, seulement deux (cohorte PIAMA et cohorte de l'Étude COPSAC [COPSAC]) ont signalé des liens significatifs quant à l'augmentation du risque de prévalence d'incidence de respiration sifflante après l'exposition aux oxydes d'azote aux âges de 1, 2, 3, 4 et 6 ans. Dans le cas des PM, une seule cohorte (PIAMA) des cinq (correspondant à huit publications) a relevé une augmentation significative de la prévalence de respiration sifflante après l'exposition aux PM aux âges de 1, 2, 3, 4, 5, 6 et 8 ans. Pour le CN, trois cohortes (correspondant à cinq publications) ont évalué le lien entre la prévalence de respiration sifflante et le CN, et une seule des trois (PIAMA) a signalé une augmentation significative du risque de respiration sifflante aux âges de 2, 3, 4 et 6 ans. De plus, parmi les six cohortes ayant signalé des observations concernant le lien entre la proximité de routes et l'asthme (incidence et prévalence), seules les cohortes de la Cohorte GINI et de la Cohorte LISA ont signalé des liens significatifs aux âges de 2 et de 6 ans. De même, parmi les quatre cohortes ayant signalé des liens entre la proximité de routes et la respiration sifflante (incidence et prévalence), seulement deux cohortes (de l'Étude CCAAPS [CCAAPS] et du Columbia Center for Children's Environmental Health [CCCEH]) ont relevé des liens significatifs aux âges de 1 et de 5 ans.
Dans l'ensemble, Bowatte et al. (2015) ont révélé que l'exposition à la PACA pendant l'enfance était liée à une incidence accrue d'asthme chez les enfants et que l'ampleur de ce risque augmentait avec l'âge. Plus précisément, les risques découlant du NO2 et du CN augmentaient au cours des six premières années de vie, alors que l'ampleur du risque n'augmentait pas aux âges plus avancés. En comparaison, l'ampleur du risque découlant des PM2,5 augmentait au cours des 12 premières années de vie. Cependant, le nombre d'études regroupées à chaque âge était limité. D'ailleurs, une hétérogénéité considérable a été observée dans l'ensemble des études et était probablement attribuable à la diversité des définitions de l'exposition et des résultats, ainsi qu'aux facteurs de confusion non mesurés. Bien que les auteurs de la revue n'aient tiré aucune conclusion générale concernant l'incidence ou la prévalence de respiration sifflante, ils ont indiqué que la proximité de routes ne présentait pas de lien fort avec l'asthme.
Favarato et al. (2014) ont mené une RS-MA évaluant le lien entre le NO2 et la prévalence d'asthme dans des études basées sur une population nichée dans une communauté (c.-à-d. que la population de l'étude est comparée à celle de la même communauté, de façon à ce que le contraste en matière d'exposition soit attribuable à la proximité de la circulation automobile; les études sur l'exposition à l'échelle communautaire ont été exclues). Cette RS-MA traitait plus précisément sur les publications comportant des estimations quantitatives pour le NO2 et définissait la prévalence d'asthme comme la prévalence de symptômes d'asthme (respiration sifflante) sur 12 mois ou le diagnostic d'asthme. Ce dernier se fondait sur des questionnaires remplis par les parents. La plupart des 18 études individuelles ayant satisfait aux critères d'inclusion provenaient d'Europe (12 études; trois études provenaient d'Asie et trois autres des États-Unis) et comprenaient des enfants âgés de 5 à 12 ans (14 études; la tranche d'âge des sujets pour toutes les études était de 1 à 17 ans). Les mesures de NO2 ou de NOx ont été prises à l'adresse du domicile (10 études) ou à l'adresse de l'école (six études), ou une moyenne des mesures prises aux deux emplacements a été utilisée (deux études), et les méthodes d'évaluation de l'exposition comprenaient les suivantes : appareils de surveillance propres à l'étude (six études), RUT (six études), modèles de dispersion (quatre études) et interpolation à partir des appareils de surveillance (deux études). Le NO2 moyen variait entre 5,2 et 63 µg/m3 dans l'ensemble des études. Favarato et al. (2014) ont signalé que toutes les études ont pris en compte un ensemble varié, mais généralement large, de facteurs de confusion potentiels (p. ex. facteurs intérieurs, SSE, tabagisme et démographie). Cependant, la qualité des études primaires n'a pas été officiellement évaluée par Favarato et al. (2014).
Douze des 18 estimations propres aux études (16 pour les symptômes de respiration sifflante et deux pour le diagnostic d'asthme) incluses dans la méta-analyse indiquaient des liens positifs entre le NO2 et la prévalence d'asthme; deux de ces liens étaient significatifs. La méta-analyse à effets aléatoires fondée sur ces estimations propres aux études a démontré l'existence d'un lien positif au seuil de signification statistique entre le NO2 et la prévalence d'asthme, avec un RC de 1,06 (IC à 95 % : 1,00-1,11 par 10 µg/m3). Il y avait une hétérogénéité modérée (I2 = 32,8 %; p = 0,088) et aucune preuve de biais de publication (étude de petite envergure) selon la symétrie générale des graphiques en entonnoir et les tests de Begg et d'Egger. Dans le cadre des analyses de sensibilité, une méta-analyse à effets aléatoires stratifiée selon la méthode d'évaluation de l'exposition a également été réalisée; les RC variaient entre 1,00 (IC à 95 % : 0,93-1,06) et 1,23 (IC à 95 % : 0,89-1,71) pour les modèles de dispersion et pour l'interpolation à partir des appareils de surveillance, respectivement. Pour la surveillance propre à l'étude, le RC était de 1,13 (IC à 95 % : 1,00-1,28); cinq des six études ont mesuré le NO2 à l'adresse de l'école. Aucune preuve d'hétérogénéité entre les études n'a été observée (p = 0,261).
De façon générale, Favarato et al. (2014) ont signalé un lien entre le NO2 et une augmentation de la prévalence d'asthme chez les enfants dans le cadre d'études basées sur une population nichée dans la communauté, où le contraste en matière d'exposition est dû à la proximité de la circulation automobile. Une hétérogénéité considérable a été relevée par les auteurs de la revue quant à l'âge des sujets, la méthode d'attribution de l'exposition et le manque de normalisation des questionnaires dans les études primaires. De surcroît, les auteurs ont relevé de graves lacunes dans l'utilisation d'une mesure de la prévalence selon la période (c.-à-d. souvenirs du sujet quant à ses symptômes d'asthme sur une période antérieure) pour définir les cas; ces lacunes comprennent les suivantes : biais de rappel, quantification inadéquate de la fréquence, de la gravité et de la durée des épisodes d'asthme et incapacité à distinguer différents phénotypes d'asthme.
Gasana et al. (2012) ont mené une RS-MA pour examiner les liens potentiels entre l'exposition aux polluants de véhicules motorisés à long terme (aucune période fixe ou minimale précisée) au domicile et la respiration sifflante ainsi que l'asthme chez les enfants. Dix-neuf études ont satisfait aux critères d'inclusion des auteurs; neuf d'entre elles études des études de cohorte et 10 avaient une conception transversale. Les études ont été menées en Europe (neuf études), en Amérique du Nord (cinq études), en Asie (quatre études) et en Amérique latine (une étude). Les études primaires ont utilisé une variété de techniques d'évaluation de l'exposition, y compris des stations de surveillance fixes (11 études), la RUT (quatre études), des modèles de dispersion (trois études) et des modèles fondés sur le comptage de la circulation automobile (une étude). L'intervalle d'exposition aux différents polluants mesurés dans les études incluses n'a pas été fourni par Gasana et al. (2012). Les résultats d'asthme et de prévalence et d'incidence de respiration sifflante ont été déterminés en fonction de questionnaires (17 études) et du diagnostic d'un médecin (deux études). La qualité du signalement des études a été évaluée à l'aide de la liste de vérification Outil STROBE (STROBE). En ce qui concerne les facteurs de confusion potentiels (p. ex. tabagisme, SSE, facteurs héréditaires et facteurs intérieurs), les résultats des modèles ajustés ont été choisis pour l'analyse quantitative, le cas échéant. Les estimations des risques ont été standardisées selon un palier d'augmentation de 10 µg/m3 pour chacun des polluants pour la synthèse quantitative.
Des méta-analyses à effets aléatoires concernant la prévalence et l'incidence d'asthme et de respiration sifflante ont été effectuées pour divers polluants, y compris le NO2, les NOx, les PM, les PM2,5, les PM10, l'O3, le monoxyde de carbone (CO) et le dioxyde de soufre (SO2), et chaque méta-analyse à effets aléatoires se fondait sur deux à sept estimations propres aux études. Quatorze des 17 méta-analyses réalisées ont indiqué un lien positif entre les polluants atmosphériques individuels de la circulation automobile et la prévalence ou l'incidence d'asthme ou de respiration sifflante; parmi les 14, quatre étaient statistiquement significatives et deux autres étaient au seuil de signification statistique. Pour le NO2, un indicateur clé de la PACA, cinq des six estimations propres aux études incluses dans la méta-analyse présentaient des liens positifs quant à la prévalence d'asthme, dont aucun n'était statistiquement significatif, et deux des trois estimations propres aux études présentaient des liens positifs quant à l'incidence d'asthme, tous deux statistiquement significatifs; les RC regroupés étaient de 1,05 (IC à 95 % : 1,00-1,11; I2 = 0,0 %, p = 0,518) et de 1,14 (IC à 95 % : 1,06-1,24; I2 = 0,0 %; p = 0,410) pour la prévalence et l'incidence d'asthme, respectivement. De plus, pour le NO2, trois des quatre estimations propres aux études incluses dans la méta-analyse présentaient des liens positifs quant à la prévalence de respiration sifflante, dont aucun n'était statistiquement significatif, et trois des quatre estimations propres aux études incluses dans la méta-analyse présentaient des liens positifs quant à l'incidence de respiration sifflante, dont un était statistiquement significatif; les RC de la méta-analyse étaient de 1,02 (IC à 95 % : 0,98-1,07; I2 = 0,0 %; p = 0,816) et de 1,12 (IC à 95 % : 0,86-1,45; I2 = 77,4 %; p = 0,004) pour la prévalence et l'incidence de respiration sifflante, respectivement. En ce qui a trait aux PM2,5, un lien au seuil de signification statistique a été observé quant à la prévalence d'asthme (1,06 [IC à 95 % : 0,93-1,21]; I2 = 0,0 %; p = 0,366), alors qu'un lien positif non significatif a été défini quant à l'incidence d'asthme (1,40 [IC à 95 % : 0,77-2,5]; I2 = 72,7 %; p = 0,056); chacune des méta-analyses se fondait sur deux estimations positives propres aux études, dont une seule était significative quant à l'incidence d'asthme. Concernant les résultats sur la respiration sifflante et les PM, l'exposition a été limitée aux PM de façon générale (aucune fraction de taille particulière présentée), et un résultat statistiquement significatif a été observé quant à l'incidence de respiration sifflante (1,05 [IC à 95 % : 1,04-1,07]; I2 = 0,0 %; p = 0,554), alors que des valeurs nulles ont été définies quant à la prévalence de respiration sifflante (0,99 [IC à 95 % : 0,90-1,08]; I2 = 13,7 %; p = 0,314). Trois des quatre estimations propres aux études utilisées dans la méta-analyse concernant l'incidence de respiration sifflante étaient positives, dont une statistiquement significative, et deux des trois estimations propres aux études utilisées dans la méta-analyse pour la prévalence de respiration sifflante étaient positives, dont une statistiquement significative. De plus, les estimations regroupées indiquaient que l'exposition au NO2 était significativement liée à une prévalence plus élevée de respiration sifflante chez les enfants, alors que l'exposition aux NOx et au CO était liée à une prévalence plus élevée d'asthme pendant l'enfance; le lien était au seuil de signification statistique pour les NOx et significatif pour le CO.
Gasana et al. (2012) ont reconnu plusieurs limites dans leur méta-analyse, notamment : (1) l'utilisation d'études transversales qui n'ont pas permis d'évaluer l'aspect temporel des liens; (2) l'utilisation de différentes méthodes d'évaluation de l'exposition; (3) les résultats d'études fondés principalement sur des questionnaires; (4) les différences dans le nombre et les types de facteurs de confusion potentiels pris en compte, qui pourraient avoir réduit la cohérence dans l'ensemble des études, ainsi que la précision des estimations récapitulatives. Malgré ces limites, les auteurs de la revue ont conclu qu'il y avait un lien entre plusieurs polluants de la PACA et l'incidence et la prévalence d'asthme et de respiration sifflante chez les enfants vivant ou fréquentant une école à proximité des zones de circulation automobile élevée.
3.2.2 Revues systématiques et autres revues sélectionnées (sans méta-analyse)
En utilisant la même méthodologie que celle décrite dans Khreis et al. (2017), Khreis et Nieuwenhuijsen (2017) ont systématiquement examiné les méthodes d'évaluation de l'exposition utilisées dans l'étude épidémiologique de la PACA et de l'asthme pendant l'enfance (incidence ou prévalence à vie de la naissance jusqu'à l'âge de 18 ans). Parmi les méthodes d'évaluation de l'exposition utilisées dans les études primaires, la proximité des routes comme marqueur de substitution de la PACA entraînait la plus grande incohérence entre les études quant à la définition d'une augmentation du risque d'asthme lié à la PACA. Cependant, certaines des études primaires n'ayant révélé aucun lien entre la proximité de routes et l'asthme ont révélé une augmentation des risques pendant la modélisation de la RUT, une méthode d'évaluation de l'exposition plus précise. Les études primaires utilisant des modèles de dispersion étaient plus cohérentes quant à la définition de liens; cinq des huit études ayant utilisé des modèles de dispersion présentaient des estimations des risques positives et statistiquement significatives. Les études primaires ayant utilisé des stations de surveillance à site fixe et des modèles de RUT ont également, de façon générale, révélé une augmentation du risque d'asthme lié à la PACA; 17 des 22 études ayant utilisé des modèles de RUT présentaient des estimations des risques positives et statistiquement significatives. Des liens statistiquement significatifs entre l'exposition à la PACA et l'asthme ont également été observés dans le cadre d'une étude primaire ayant mesuré l'exposition au NO2 au domicile et d'une étude primaire ayant eu recours à la télédétection. La revue n'a abordé aucun facteur de confusion potentiel ni correction inclus dans les études primaires.
Koppen et al. (2011) ont concentré leur revue systématique sur des études publiées de cohortes de naissance afin d'évaluer le lien entre la PACA et l'apparition de symptômes respiratoires et allergiques. Les cohortes de naissance examinées étaient celles de l'ECCEH, de la CCAAPS, de l'Étude tchèque sur la santé au début de l'enfance (Czech Early Childhood Health study), du GINI et de LISA, de PIAMA, de la Cohorte BAMSE, d'Oslo, de la COPSAC et de l'Enquête FLEHS (FLEHS). La revue s'est également penchée sur deux cohortes d'enfance en continu : celle de l'Étude sur la santé des enfants (Children's Health Study) et une cohorte du Japon. Chacun des 15 articles d'études primaires inclus dans la revue a signalé des liens positifs entre les mesures de l'exposition à la PACA et les symptômes d'asthme, y compris la respiration sifflante, la toux et la bronchite, et une étude a signalé un résultat significatif. En ce qui a trait aux facteurs de confusion, les auteurs ont souligné que toutes les études avaient recueilli des renseignements au moins sur les facteurs clés, y compris les antécédents allergiques des parents, le SSE, la fumée secondaire du tabac à la maison, l'humidité du domicile, la moisissure visible à l'intérieur et la présence d'animaux de compagnie. Dans l'ensemble, ces études ont fourni des données probantes appuyant l'existence d'un lien de causalité entre les symptômes d'asthme pendant l'enfance et l'exposition à la PACA. Cependant, le rôle et le moment de l'exposition à la PACA et l'apparition d'asthme n'étaient pas clairs selon les études examinées. Une limite importante des études de cohorte de naissance était que les périodes de suivi examinées étaient relativement courtes, la moitié des études effectuant un suivi de deux ans ou moins et la durée de suivi la plus longue étant de six ans. Les participants à la plupart des études pourraient donc avoir été trop jeunes pour un diagnostic fiable d'asthme. Plusieurs des études ont mené une analyse transversale des données des cohortes, sans tirer avantage de leur conception longitudinale pour évaluer l'incidence. De plus, les disparités dans l'interprétation des symptômes respiratoires et des évaluations diagnostiques peuvent entraîner une incohérence entre les résultats des études. Dans certaines cohortes, l'exposition à la PACA au début de la vie, y compris in utero, était liée plus fortement à une augmentation du risque d'apparition subséquente d'asthme que l'exposition plus tard dans l'enfance.
Bråbäck et Forsberg (2009) ont mené une revue systématique afin d'évaluer des données probantes issues d'études prospectives évaluant le rôle de l'exposition à long terme à la PACA dans l'apparition de symptômes semblables à ceux de l'asthme et de sensibilisation allergique chez les enfants. Pour l'évaluation des symptômes semblables à ceux de l'asthme, la revue a inclus 13 articles publiés de cinq cohortes de naissances en Allemagne, aux Pays-Bas, en Suède, en Norvège et aux États-Unis, ainsi que de deux cohortes prospectives de la Californie et du Japon. Pour les études prospectives, les enfants étaient inscrits à l'entrée à l'école ou après. Les cohortes variaient en matière d'évaluation de l'exposition, incluant la proximité de la circulation automobile, les modèles de dispersion, les mesures de la pollution et les modèles de régression. Les cohortes variaient également relativement à l'âge des enfants pour la mesure des résultats et la définition des résultats sur la santé. Malgré ces différences, une augmentation du risque de symptômes respiratoires semblables à l'asthme a été démontrée avec une exposition à la circulation automobile dans toutes les études. Parmi les cinq cohortes de naissance, chacun des neuf articles a signalé un lien positif, dont sept étaient statistiquement significatifs. Les auteurs de la revue ont relevé que six études primaires avaient apporté des corrections pour des variables confusionnelles importantes (aucun renseignement supplémentaire fourni), alors que trois études primaires présentaient des limites dans le degré de contrôle pour les facteurs de confusion. Ensemble, les études de cohorte de naissance ont permis de déterminer que l'exposition aux gaz d'échappement de la circulation automobile pendant la petite enfance était liée à une augmentation du risque de toux, de bronchite asthmatique, d'infections des voies respiratoires supérieures, ou d'asthme diagnostiqué par un médecin. Un lien dose-réaction a été relevé entre la proximité d'une circulation automobile discontinue ainsi que le degré d'exposition à la suie et le risque de toux sans respiration sifflante pendant la première année de vie. Chez les enfants de 4 à 6 ans, les cohortes néerlandaises, allemandes et suédoises ont chacune signalé un lien entre l'exposition à la PACA et l'asthme diagnostiqué par un médecin ou une respiration sifflante. Cependant, les résultats des cohortes étaient incohérents, ce qui peut refléter des disparités dans la définition des résultats sur la santé. Au sein des cohortes prospectives d'enfants d'âge scolaire, il existait un certain lien entre la PACA ou le fait de demeurer près d'une grande route et la prévalence accrue d'asthme, puisque les quatre études ont indiqué des liens positifs, dont deux au seuil de signification statistique. Toutefois, ces études étaient limitées en raison d'évaluations moins précises des expositions, d'échantillons de taille inférieure et du potentiel de confusion.
Alors que les revues systématiques ci-dessus portaient sur les enfants, Jacquemin et al. (2012) ont mené une revue systématique sur l'apparition d'asthme à l'âge adulte liée à une exposition à la pollution atmosphérique. Les auteurs ont exclu les études portant sur l'asthme pendant l'enfance, l'exposition à la circulation automobile signalée par les sujets eux-mêmes et l'étude de symptômes ou d'exacerbation d'asthme. Six des sept articles inclus dans la revue incluaient une évaluation de l'exposition fondée sur la circulation automobile ou la PACA. Ces six articles se fondaient sur quatre études menées en Europe. Chacun des articles indiquait un lien positif entre l'exposition à la circulation automobile ou à la PACA et l'apparition d'asthme à l'âge adulte; cinq articles ont atteint le seuil de signification statistique. La plupart des études ont observé un lien plus fort avec la proximité du domicile à la circulation automobile ou à de grandes routes, comparativement aux concentrations modélisées de polluants liés à la circulation automobile. Cependant, les résultats des études étaient contradictoires. Un effet légèrement plus important chez les hommes a été observé dans le cadre de deux études, et une étude n'a signalé aucune différence entre les hommes et les femmes ou un effet plus important chez les femmes, selon la définition de l'asthme utilisée pour l'analyse. Deux études ont indiqué un effet plus important chez les sujets allergiques, alors qu'une étude a signalé que les sujets non allergiques étaient plus à risque. De plus, chacune des études a exclu les sujets atteints d'asthme ou de symptômes semblables à ceux de l'asthme au début de l'étude et a défini l'apparition d'asthme comme le signalement d'asthme lors du suivi. Cependant, dans trois des études, les « nouveaux cas » pouvaient inclure des personnes présentant des rémissions d'asthme infantile. Les facteurs de confusion potentiels, y compris le sexe, l'atopie, l'activité physique, l'alimentation, les comorbidités et le tabagisme, n'ont pas été pris en compte de façon cohérente dans chacune des études incluses. Les auteurs de la revue ont également évalué trois études primaires portant sur la prévalence d'asthme chez les adultes. Dans chacune des études, la grande proximité du domicile à la circulation automobile était liée à une augmentation de la prévalence d'asthme, mais aucun lien n'a été révélé concernant les concentrations modélisées de NOx. Dans l'ensemble, les auteurs ont jugé que les études ne suffisaient pas à tirer de conclusions quant au rôle causal des polluants atmosphériques dans l'apparition d'asthme à l'âge adulte. Les études prospectives indiquaient que la PACA jouait un rôle dans l'apparition d'asthme à l'âge adulte; cependant, les résultats incohérents des études de prévalence (c.-à-d., effet de la densité de la circulation automobile sans modélisation du NO2) ont limité la capacité des auteurs à tirer des conclusions fermes. Les auteurs de la revue n'ont pas déterminé si les expositions professionnelles ont été prises en compte comme facteurs de confusion potentiels dans les études primaires. Il n'est pas attendu que les résultats des études sur l'apparition d'asthme à l'âge adulte soient semblables à ceux des études traitant principalement de l'incidence d'asthme pendant l'enfance, car la physiopathologie et les mécanismes sous-jacents de l'apparition de la maladie peuvent être différents, limitant ainsi la capacité à généraliser les résultats entre les groupes d'âge.
Salam et al. (2008) ont examiné systématiquement les études évaluant le lien unissant l'asthme et la respiration sifflante à l'exposition à la circulation automobile ou à la PACA, selon les mesures de la proximité du domicile à des routes, de la densité de la circulation automobile autour des maisons ou des modèles de RUT. Les auteurs se sont penchés sur trois études de cohorte, une étude cas/témoins et huit études transversales. Les études primaires ont été menées en Europe, aux États-Unis et en Asie. Dans l'ensemble, les études examinées appuyaient l'existence d'un lien entre l'exposition à la circulation automobile au domicile et la présence ou l'exacerbation d'asthme (c.-à-d. la prévalence d'asthme) chez les enfants et les adultes. Les auteurs de la revue ont souligné les facteurs modificateurs du risque définis dans quelques études primaires, y compris l'asthme chez les parents et les polymorphismes des gènes impliqués dans l'activation des voies du stress oxydant. Un lien plus fort concernant la présence d'asthme chez les enfants dont les parents ne souffrent pas d'asthme a été signalé dans le cadre de deux études, ce qui indique un plus grand risque découlant d'expositions à la circulation automobile chez les enfants ne présentant aucun facteur de risque génétique. Les effets modificateurs des polymorphismes génétiques de la voie oxydative ont indiqué un lien possible entre le stress oxydatif et le risque d'asthme découlant de la PACA. Chez les adultes, la présence et l'exacerbation d'asthme étaient liées plus fréquemment aux mesures de la proximité et de la densité de la circulation automobile qu'aux concentrations de polluants. Une faible corrélation entre les mesures de la circulation automobile et les concentrations de polluants a été relevée dans certaines études. Les limites de la revue comprenaient l'inclusion d'études fondées sur des mesures de la circulation automobile signalées par les sujets eux-mêmes ou les parents, ce qui est susceptible d'avoir introduit des biais, comparativement à des mesures objectives, et les renseignements limités sur la correction de facteurs de confusion dans les études primaires. De plus, il était impossible d'exclure un biais de publication, car la plupart des études primaires ont signalé des liens significatifs avec au moins une mesure de la circulation automobile ou de la PACA. En effet, les auteurs de la revue ont défini un biais de déclaration possible, puisque les chercheurs pouvaient choisir parmi une variété de mesures pour l'exposition à la PACA, à la circulation automobile, ou aux deux, en vue de détecter un lien significatif aux fins de publication. Les auteurs de la revue ont aussi relevé que les modèles de RUT permettaient de mieux prévoir l'exposition et que l'incorporation de profils d'activité temporelle améliorerait également les estimations en matière d'exposition.
Heinrich (2011) a mené une autre revue sélectionnée concernant l'apparition d'asthme pendant l'enfance liée à des facteurs environnementaux intérieurs dans les pays occidentaux, y compris la pénétration de la PACA dans l'environnement intérieur. Cette revue, qui comprenait des revues d'études primaires et d'articles de revues systématiques, ainsi qu'une évaluation de la causalité, a été désignée comme une revue stratégique par l'auteur. La revue s'est penchée sur 14 articles provenant de plusieurs cohortes de naissance, plus précisément celles de PIAMA, du GINI et de LISA, de la BAMSE, de la CCAAPS, d'Oslo, d'East Boston et de la Colombie-Britannique. Ces études ont utilisé diverses méthodes d'évaluation de l'exposition, y compris la RUT, les modèles de dispersion, les distances du système d'information géographique (SIG) par rapport aux grandes artères de circulation automobile et un modèle de régression s'appuyant sur le SIG pour estimer l'exposition au NO2 et aux PM2,5 aux adresses domiciliaires. Toutes les cohortes de naissance, excepté celle d'Oslo, ont signalé une augmentation du risque d'asthme, mesurée en fonction de l'incidence d'asthme, de la prévalence d'asthme ou de la présence de respiration sifflante persistante au début de la vie, en association avec la PACA. Bien que toutes les estimations d'effets n'aient pas été statistiquement significatives, on a observé une estimation positive des effets pour toutes les études, sauf les deux fondées sur la cohorte de naissances d'Oslo. Deux autres cohortes d'enfants (inscrits à l'âge de 4 ans) ont signalé une augmentation du risque d'incidence d'asthme avec l'exposition à la PACA, alors qu'une étude basée sur la population en Angleterre n'en a pas signalé. L'auteur de la revue a relevé que la majorité des études primaires avaient été ajustées pour des facteurs de confusion importants (non spécifiés). Cette revue a conclu que, malgré certaines incohérences dans les résultats, l'exposition à la PACA au début de la vie est un facteur de risque d'apparition d'asthme pendant l'enfance. D'ailleurs, l'auteur de l'étude considérait que l'ensemble des données probantes évoquait un lien de causalité entre la PACA et l'apparition d'asthme chez les enfants.
Dans le cadre d'une autre revue sélectionnée, Boothe et Shendell (2008) ont examiné des études épidémiologiques évaluant les effets indésirables sur la santé liés à la proximité du domicile à la circulation automobile, y compris l'asthme et la respiration sifflante. Des liens significatifs ont été signalés dans quatre des six études évaluant la prévalence d'asthme, les visites médicales liées à l'asthme ou l'incidence d'asthme avec le fait de demeurer dans un rayon de 75, 100, 150 ou 300 m d'une circulation automobile dense. Ces études incluaient des adultes, des enfants ou les deux. Les liens significatifs ont été observés dans les études primaires menées aux États-Unis et en France et un lien dose-réaction (selon la densité de la circulation automobile) a été signalé dans deux des études. Dix études primaires ont évalué les symptômes de respiration sifflante signalés par les sujets eux-mêmes ou par les parents, parmi lesquelles sept ont signalé des liens statistiquement significatifs avec proximité de la circulation automobile. La respiration sifflante persistante ou aiguë a été associée au fait de demeurer dans un rayon de 50, 75 ou 150 m de routes passantes dans les études menées au Royaume-Uni, aux Pays-Bas, en Allemagne, aux États-Unis et en Éthiopie. La plupart des études sur l'asthme et la respiration sifflante examinées par les auteurs ont indiqué un lien avec la proximité du domicile à la circulation automobile. Cependant, les auteurs de la revue ont jugé que les preuves épidémiologiques étaient insuffisantes pour déterminer la causalité, en raison du manque d'évaluations individuelles de l'exposition et du potentiel de confusion attribuable à d'autres facteurs non mesurés. Cette revue n'a précisé l'existence d'aucune correction pour les facteurs de confusion dans aucune des études primaires.
3.2.3 Résumé/conclusion
Les cinq RS-MA ayant évalué le lien entre la PACA et l'asthme n'ont pas été publiées la même année et n'avaient pas les mêmes objectifs précis; elles incluaient donc différents nombres d'études primaires et différentes cohortes. Cependant, il existait un chevauchement considérable entre les études primaires incluses. Khreis et al. (2017) ont mené une RS-MA d'études épidémiologiques observationnelles portant sur le lien entre les expositions à la PACA et l'apparition subséquente d'asthme (incidence ou prévalence à vie) chez les enfants, de la naissance à l'âge de 18 ans. Heinrich et al. (2016) ont examiné le lien entre l'exposition à la PACA au début d'enfance et l'apparition subséquente d'asthme et les résultats sur la santé liés aux allergies à l'enfance et à l'adolescence en s'appuyant particulièrement sur la RS-MA menée par Bowatte et al. (2015). Bowatte et al. (2015) ont mis l'accent sur les cohortes de naissance pour comprendre le lien entre l'exposition à la PACA au début d'enfance et l'apparition subséquente d'asthme, d'allergies et de sensibilisation, et les auteurs de la revue ont inclus à la fois des cohortes basées sur la population et des cohortes à haut risque. Bien que Favarato et al. (2014) n'aient limité leur stratégie de recherche à aucun sous-groupe de la population lors de leur RS-MA sur le lien entre le NO2 et la prévalence d'asthme dans les études basées sur une population nichée dans la communauté, seules des études sur les enfants ont été extraites. Gasana et al. (2012) se sont concentrés sur les liens potentiels entre les polluants de véhicules motorisés et l'incidence et la prévalence de respiration sifflante et d'asthme chez les enfants. Contrairement à Khreis et al. (2017), qui ont spécifiquement omis la respiration sifflante pendant l'enfance de leurs analyses, Heinrichet al. (2016), Bowatte et al. (2015), et Gasana et al. (2012) ont évalué la respiration sifflante indépendamment de l'asthme, alors que Favarato et al. (2014) se sont penchés sur les deux résultats ensemble dans leurs analyses. La plupart des études primaires sur lesquelles se sont penchées ces RS-MA ont été menées en Amérique du Nord et en Europe; les résultats sont donc considérés comme pertinents dans le cadre d'une évaluation canadienne en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc.
Malgré la définition de plusieurs limites dans leurs méta-analyses, y compris l'inclusion d'études primaires ayant utilisé différentes définitions de l'asthme, méthodes d'évaluation de l'exposition à la PACA et corrections pour les facteurs de confusion, ainsi que d'études primaires fondées sur des questionnaires non standardisés, toutes les RS-MA ont signalé un lien positif entre l'asthme et la PACA. Plus particulièrement, Khreis et al. (2017), la RS-MA dont la publication est la plus récente, a révélé des estimations regroupées positives statistiquement significatives du lien entre l'exposition à la PACA et l'apparition subséquente d'asthme pendant l'enfance. Heinrich et al. (2016) ont également révélé des liens positifs entre les polluants de la PACA et l'incidence et la prévalence d'asthme et de symptômes de respiration sifflante, mais ces liens n'étaient pas significatifs sur le plan statistique; les auteurs de la revue ont donc conclu qu'il n'y avait pas suffisamment de preuves épidémiologiques pour appuyer l'existence d'un lien de causalité entre la PACA et l'asthme chez les enfants et les adolescents. Bowatte et al. (2015) ont conclu que l'exposition à la PACA pendant l'enfance était liée à une incidence accrue d'asthme chez les enfants et que l'ampleur de ce risque augmentait avec l'âge. Favarato et al. (2014) ont signalé une faible estimation regroupée des risques quant au lien entre le NO2 et une augmentation de la prévalence d'asthme chez les enfants dans le cadre d'études basées sur une population nichée dans la communauté, où le contraste en matière d'exposition est dû à la proximité de la circulation automobile. Gasana et al. (2012) ont conclu qu'il y a un lien entre plusieurs polluants de la PACA et l'incidence et la prévalence d'asthme et de respiration sifflante chez les enfants vivant ou fréquentant une école à proximité des zones de circulation automobile élevée.
La plupart des revues systématiques et des autres revues sélectionnées portaient sur des publications de cohortes de naissances et d'enfance évaluant le lien entre la PACA et l'asthme. Selon ces revues, les données probantes indiquent un lien entre l'exposition à la PACA et les symptômes et la prévalence d'asthme. La plupart des revues systématiques et des autres revues sélectionnées portaient sur les résultats d'études transversales, ce qui a rendu impossible d'évaluer l'incidence d'asthme. Des liens cohérents pour les symptômes d'asthme et la prévalence d'asthme ont été révélés dans les évaluations de cohortes de naissances et d'enfance, qui ont utilisé différentes méthodes d'évaluation de l'exposition. La principale limite est un manque de cohérence entre les études dans la définition des résultats sur la santé, ce qui peut entraîner une classification erronée. Le lien entre l'exposition à la PACA et l'asthme chez les adultes a été moins étudié et, par conséquent, il est moins bien caractérisé. Les données probantes divergent en ce qui a trait au lien entre l'exposition à la PACA et la prévalence d'asthme chez les adultes, et il n'existe pas suffisamment de données probantes pour évaluer l'incidence d'asthme au sein de ce groupe d'âge.
3.3 Allergies
Une RS-MA (Bowatte et al. 2015) et deux revues systématiques plus anciennes (Bråbäck et Forsberg, 2009; Koppen et al., 2011) évaluant le lien entre la PACA et les allergies ont été extraites lors de la revue de la portée. Une RS-MA supplémentaire (Heinrich et al., 2016) a été extraite au cours du processus de revue externe. Chaque revue s'est penchée exclusivement sur les effets chez les enfants et toutes les études primaires portant sur les allergies étaient fondées sur des cohortes de naissance. Les principaux résultats étudiés comprenaient la sensibilisation allergique (mesurée à la suite d'un test sérique d'IgE ou d'un test cutané), l'eczéma et le rhume des foins.
3.3.1 RS-MA
Heinrich et al. (2016) se sont appuyés sur une ancienne cohorte de naissances de Bowatte et al. (2015) (décrite ci-dessous) afin d'examiner le lien entre l'exposition à la PACA au début d'enfance et l'apparition subséquente d'asthme et les résultats sur la santé liés aux allergies à l'enfance et à l'adolescence. Plus précisément, la revue comprenait des études primaires n'ayant pas été extraites par Bowatte et al. (2015), en raison de la prolongation de la recherche documentaire identique de presque deux ans et de l'inclusion d'estimations individuelles d'analyses regroupées. Les détails pertinents de cette RS-MA figurent dans la section 3.2.1 et seuls les études et les résultats relatifs aux résultats en matière d'allergies sont décrits dans cette section. Huit des 15 cohortes de naissances qui répondaient aux critères d'inclusion ont été incluses dans les synthèses quantitatives concernant les résultats en matière d'allergies (c.-à-d. sensibilisation à tout allergène, sensibilisation aux aéroallergènes et rhume des foins); cinq cohortes provenaient d'Europe et trois du Canada. Les cohortes étaient toutes basées sur la population, à l'exception de celles qui comprenaient seulement des enfants dont les parents avaient des antécédents de maladies allergiques. La période de suivi pour la sensibilisation allergique variait entre 1 et 12 ans, alors que celle pour le rhume des foins variait entre 7 et 16 ans. Les estimations des risques pour les polluants de la PACA NO2 et PM2,5 ont été standardisées selon un palier d'augmentation de 10 µg/m3 et de 2 µg/m3, respectivement. Les valeurs p pour le test du χ2 de l'hétérogénéité n'ont pas été fournies.
Une méta-analyse à effets aléatoires n'a révélé aucun lien (1,00 [IC à 95 % : 0,98-1,02]; I2 = 49 %) entre le NO2 et la sensibilisation à tout allergène, d'après six études primaires, dont trois étaient positives, y compris une statistiquement significative. Lorsque la sensibilisation était limitée aux aéroallergènes, des liens au seuil de signification statistique ont été observés autant pour le NO2 (1,02 [IC à 95 % : 0,92-1,13]; I2 = 51 %) que les PM2,5 (1,05 [IC à 95 % : 1,00-1,11]; I2 = 0 %). Les estimations regroupées se fondaient sur huit études primaires, dont cinq positives, mais non significatives sur le plan statistique, pour le NO2 et sur six études primaires, dont cinq positives, mais pas non plus significatives sur le plan statistique, pour les PM2,5.
Une méta-analyse à effets aléatoires a également été menée concernant le rhume des foins et a indiqué des liens positifs non significatifs sur le plan statistique pour les polluants de la PACA. Pour le NO2, trois des six études incluses dans la méta-analyse présentaient des liens positifs, dont un seul statistiquement significatif; le RC regroupé était de 1,01 (IC à 95 % : 0,85-1,19; I2 = 62 %). En ce qui concerne les PM2,5, deux des cinq études incluses dans la méta-analyse présentaient des liens positifs, dont un seul statistiquement significatif; le RC regroupé était de 1,02 (IC à 95 % : 0,85-1,21; I2 = 55 %).
Dans les analyses de sensibilité desquelles la cohorte à haut risque et (uniquement pour la sensibilité aux aéroallergènes) la cohorte de très jeunes enfants ont été exclues, les liens demeuraient largement inchangés. Toutefois, en raison de faibles réductions des estimations regroupées, il n'y avait plus de lien entre le NO2 et la sensibilisation aux aéroallergènes ni le rhume des foins, avec des estimations groupées de 1,00 (IC à 95 % : 0,89-1,13) et de 1,00 (IC à 95 % : 0,82-1,22), respectivement.
Les facteurs de confusion potentiels n'ont pas été abordés dans Heinrich et al. (2016), bien que les auteurs aient mentionné des facteurs de confusion non mesurés (p. ex. SSE, fumée secondaire et prédisposition allergique), en plus d'autres facteurs (p. ex. urbanisation et mélange urbain/rural dans l'ensemble des cohortes), pour aider à expliquer l'hétérogénéité modérée à élevée observée dans les méta-analyses.
Cette RS-MA a révélé des liens positifs, mais non significatifs, entre les polluants clés de la PACA et les résultats en matière d'allergies, à l'exception du NO2 et de la sensibilisation à tout allergène, entre lesquels aucun lien n'a révélé. Aucune synthèse quantitative concernant PM2,5 et la sensibilisation à tout allergène ni les polluants de la PACA et l'eczéma n'ont été menées, en raison du nombre limité d'études primaires, des variations en matière de méthodologie ou d'une combinaison de ces raisons. Dans l'ensemble, Heinrich et al. (2016) ont conclu que les preuves appuyant l'existence d'un lien entre la PACA et le rhume des foins et la sensibilisation allergique étaient faibles.
Bowatte et al. (2015) ont mené une RS-MA de 11 études de cohorte de naissance visant à évaluer le lien entre l'exposition à la PACA au début de l'enfance et l'apparition subséquente d'asthme, de respiration sifflante, de sensibilisation allergique, d'eczéma et du rhume des foins. Cinq cohortes basées sur la population se sont penchées plus précisément sur les résultats en matière d'allergies, soit la sensibilisation aux allergènes (trois cohortes), le rhume des foins (trois cohortes) et l'eczéma (trois cohortes). Pour la sensibilisation aux allergènes, les concentrations d'IgE ont été mesurées en réaction aux aéroallergènes extérieurs (trois cohortes), aux aéroallergènes intérieurs (deux cohortes) et aux allergènes alimentaires (deux cohortes). Seuls les résultats relatifs à ces résultats sont abordés dans cette section. Quatre des cohortes étaient européennes et l'une était nord-américaine; seules les cohortes européennes ont été incluses dans l'analyse quantitative. Deux cohortes ont eu le suivi le plus long des participants à l'étude, incluant des mesures à l'âge de 8 ans. Les études primaires ont utilisé diverses techniques d'évaluation de l'exposition, y compris la RUT (trois cohortes), les modèles de dispersion (une cohorte) et la proximité de grandes routes (trois cohortes). Cependant, les auteurs de la revue ne précisent pas à quel endroit étaient attribuées les expositions à la PACA dans le cadre des études individuelles. L'intervalle d'exposition aux différents polluants mesurés dans les études incluses n'a pas été fourni par Bowatte et al. (2015). En ce qui concerne les facteurs de confusion potentiels, chacune des cohortes incluait des corrections pour le tabagisme et la prédisposition allergique (c.-à-d. l'hérédité).
La méta-analyse à effets aléatoires a démontré l'existence de liens essentiellement positifs (trois des quatre estimations), mais non significatifs, entre l'exposition au NO2 au début de l'enfance et la sensibilisation à divers allergènes. Les estimations des risques ont été calculées par augmentation de 10 µg/m3. Dans le cas des aéroallergènes extérieurs, seule l'une des trois estimations propres aux études incluses dans la méta-analyse était positive et significative sur le plan statistique; le RC regroupé était de 1,09 (IC à 95 % : 0,88-1,36; I2 = 36,3 %; p = 0,208). Dans le cas des aéroallergènes intérieurs, les deux estimations propres aux études incluses dans la méta-analyse étaient négatives et ont donné lieu à un RC regroupé de 0,96 (IC à 95 % : 0,74-1,25; I2 = 0,0 %; p = 0,912). Dans le cas des allergènes alimentaires, aux âges de 4 et de 8 ans, les méta-analyses incluaient chacune trois estimations propres aux études avec des liens positifs, dont deux à partir de l'âge de 4 ans étaient significatifs sur le plan statistique; les RC regroupés ont démontré l'existence de liens au seuil de signification statistique pour les allergènes alimentaires à l'âge de 4 ans (RC : 1,28 [IC à 95 % : 0,98-1,68]; I2 = 44,0 %; p = 0,181) ou de 8 ans (RC : 1,19 [IC à 95 % : 1,00-1,42]; I2 = 0,0 %; p = 0,779). De même, des liens positifs ont été observés entre l'exposition aux PM2,5 au début de l'enfance (par augmentation de 2 µg/m3) et la sensibilisation aux mêmes allergènes. Dans le cas des aéroallergènes extérieurs, deux des trois estimations propres aux études incluses dans la méta-analyse étaient positives, dont une significative sur le plan statistique; le RC regroupé était de 1,33 (IC à 95 % : 0,94-1,88; I2 = 73,7 %; p = 0,022). Dans le cas des aéroallergènes intérieurs, une des deux estimations propres aux études incluses dans la méta-analyse était positive, mais n'atteignait pas le seuil de signification statistique; le RC regroupé était de 1,00 (IC à 95 % : 0,80-1,24; I2 = 0,0 %; p = 0,649). Dans le cas des allergènes alimentaires, aux âges de 4 et de 8 ans, les méta-analyses incluaient chacune deux estimations positives propres aux études, dont une à partir de l'âge de 4 ans était significative sur le plan statistique; le RC regroupé pour les allergènes alimentaires était de 1,26 (IC à 95 % : 1,00-1,60; I2 = 44,0 %; p = 0,181) à l'âge de 4 ans et de 1,18 (IC à 95 % : 1,00-1,39; I2 = 0,0 %; p = 0,474) à l'âge de 8 ans.
Aucune méta-analyse des études signalant le rhume des foins ou l'eczéma comme résultats n'a été réalisée, en raison des différences dans le signalement des mesures des résultats. La plupart des liens entre l'exposition à la PACA et l'eczéma ou le rhume des foins étaient positifs (11/13 et 12/13, respectivement) pour les trois cohortes.
Dans l'ensemble, cette RS-MA a démontré une tendance positive en matière de liens entre la sensibilisation allergique et l'exposition à la PACA, mais, dans la plupart des cas, les estimations des risques n'étaient pas statistiquement significatives. Les liens les plus forts ont été observés pour les allergènes alimentaires. Il existe également certaines preuves que l'exposition à la PACA pendant l'enfance peut être associée à une augmentation des risques d'eczéma et de rhume des foins. Bien que la qualité des études ait été évaluée à l'aide de l'échelle Newcastle–Ottawa dans Bowatte et al. (2015), aucune analyse de sensibilité fondée sur la qualité des études n'a été effectuée et aucun RB n'a été évalué dans la méta-analyse.
3.3.2 Revues systématiques
Koppen et al. (2011) ont réalisé une revue systématique d'études de cohorte ayant examiné le lien entre les symptômes respiratoires et allergiques chez les enfants et l'exposition précoce à la PACA. En plus des études décrites ci-dessous, cette revue avait inclus une étude plus récente sur les cohortes du GINI et de LISA et avait fourni le premier rapport concernant la cohorte de naissance du FLEHS; cependant, la plupart des estimations des risques n'ont pas été signalées par les auteurs de la revue. En ce qui a trait aux facteurs de confusion, les auteurs ont souligné que toutes les études avaient recueilli des renseignements au moins sur les facteurs clés, y compris les antécédents allergiques des parents, le SSE, la fumée secondaire du tabac à la maison, l'humidité du domicile, la moisissure visible à l'intérieur et la présence d'animaux de compagnie. Dans les cohortes du GINI et de LISA, plusieurs liens positifs entre l'exposition à la PACA (c.-à-d. la distance par rapport à la grande route la plus proche, l'absorbance des PM2,5 et le NO2) et les symptômes d'allergies ainsi que la sensibilisation allergique ont été observés chez les enfants vivant dans la région métropolitaine de Munich. Un seul lien positif (on ignore s'il était significatif sur le plan statistique) a été observé entre l'absorbance des PM2,5 et la prévalence d'eczéma chez les enfants de 6 ans vivant dans une petite ville présentant de faibles degrés de pollution. Les résultats préliminaires de la cohorte de naissances du FLEHS ont indiqué qu'un résultat positif au test cutané chez les enfants de 3 ans, dont la plupart ont réagi au pollen de plantes herbacées ou aux acariens, était significativement et positivement lié à l'exposition au NO2 au cours des trois premiers mois de vie. Les auteurs de la revue n'ont tiré aucune conclusion quant aux allergies à la suite de leur revue des ouvrages scientifiques, car la publication portait principalement sur la PACA et la santé respiratoire.
Bråbäck et Forsberg (2009) ont mené une revue systématique de données probantes issues d'études prospectives menées chez des enfants afin d'évaluer le rôle de l'exposition à long terme à la PACA dans l'apparition d'asthme et de sensibilisation allergique. Cinq études provenant de cohortes de naissance européennes, y compris celles du GINI et de LISA, de la BAMSE, de PIAMA et d'Oslo, se sont penchées plus précisément sur la sensibilisation allergique comme résultat, mais la nature des allergènes étudiés différait entre les cohortes. Ces études utilisaient des modèles de dispersion et de régression pour évaluer l'exposition au NO2, aux PM2,5, aux NOx, aux PM liées à la circulation automobile et aux PM10. Des degrés de pollution atmosphérique extérieure semblables ont été signalés pour chacune des cohortes de naissance. Les auteurs de la revue ont relevé que les études des cohortes GINI et LISA, BAMSE et PIAMA comportaient des corrections pour des variables confusionnelles importantes (aucun détail fourni). Trois des études ont également été incluses dans la méta-analyse menée par Bowatte et al. (2015) (examinée ci-dessus à la section 3.3.1). Bien qu'aucun lien entre l'exposition à long terme à la PACA et la sensibilisation à tout allergène n'ait été observé chez les enfants d'âge scolaire plus avancé (âgés de 10 à 11 ans) à Oslo, en Norvège, des études provenant des cohortes du GINI et de LISA, de la BAMSE et de PIAMA ont révélé une augmentation du risque de sensibilisation allergique liée à la PACA chez les enfants âgés de 4 à 6 ans. La nature des allergènes différait entre les cohortes; la PACA a été liée à une sensibilisation aux allergènes extérieurs dans les cohortes du GINI et de LISA et de la BAMSE, ainsi qu'aux allergènes alimentaires dans la cohorte de PIAMA. De plus, une étude de la cohorte de la BAMSE a révélé que les variants génétiques du glutathion S-transférase P1 (GSTP1) et du facteur de nécrose tumorale (TNF) modifiaient le lien entre la sensibilisation et les NOx chez les enfants de 4 ans, entraînant Bråbäck et Forsberg (2009) à formuler une hypothèse selon laquelle les effets liés à la circulation automobile sur la sensibilisation pourraient se limiter aux personnes présentant un polymorphisme génétique précis et seraient donc difficile à détecter au sein d'une vaste population. Dans l'ensemble, Bråbäck et Forsberg (2009) ont conclu que, bien qu'un ensemble croissant de données probantes indique que la PACA pourrait provoquer une sensibilisation, peu d'études de cohorte ont évalué les effets sur la sensibilisation et les résultats n'étaient pas cohérents.
3.3.3 Résumé/conclusion
Deux RS-MA ont examiné le lien entre l'exposition à la PACA au début de l'enfance et des résultats subséquents sur la santé des enfants en matière d'allergie. Les études primaires sur lesquelles se sont penchés ces RS-MA ont été menées en Amérique du Nord et en Europe; les résultats sont donc considérés comme pertinents dans le cadre d'une évaluation canadienne en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc. Heinrich et al. (2016) se sont appuyés sur l'ancienne RS-MA de cohortes de naissance menées par Bowatte et al. (2015), en y intégrant d'autres études primaires et des estimations individuelles provenant d'analyses regroupées; Heinrich et al. (2016) ont également inclus une période de suivi plus longue, qui, pour le rhume des foins, s'est prolongée jusqu'à l'adolescence. La portée des analyses quantitatives des deux RS-MA différait également; Heinrich et al. (2016) se sont penchés sur la sensibilisation allergique à tout allergène et la sensibilisation aux aéroallergènes, alors que Bowatte et al. (2015) ont séparé la sensibilisation allergique en catégories : aéroallergènes extérieurs, aéroallergènes intérieurs, allergènes alimentaires à l'âge de 4 ans et allergènes alimentaires à l'âge de 8 ans. Bien qu'aucun lien n'ait été observé entre le NO2 et la sensibilisation à tout allergène, Heinrich et al. (2016) et Bowatte et al. (2015), respectivement, ont relevé des estimations regroupées positives, mais non significatives, du lien entre les polluants de la PACA (c.-à-d. NO2 et PM2,5) et la sensibilisation allergique aux aéroallergènes ou aux aéroallergènes extérieurs. Bowatte et al. (2015) ont également signalé des estimations regroupées positives, mais non significatives, du lien entre l'exposition à la PACA pendant l'enfance et la sensibilisation aux allergènes alimentaires; aucun lien positif n'a été relevé concernant les allergènes intérieurs et les polluants de la PACA. En ce qui concerne le rhume des foins, les estimations regroupées dans Heinrich et al. (2016) indiquaient des liens positifs non significatifs sur le plan statistique pour les deux polluants de la PACA, qui concordent avec les résultats de Bowatte et al. (2015) selon lesquels il existe certaines preuves que l'exposition à la PACA pendant l'enfance pourrait être associée à une augmentation des risques de rhume des foins. Dans l'ensemble, ces deux RS-MA indiquent que certains liens positifs existent entre l'exposition à la PACA et l'apparition d'allergies chez les enfants; cependant, les preuves sont actuellement faibles et limitées.
Les deux RS-MA sont plus récents que les revues qualitatives extraites pendant le processus de revue de la portée. Bowatte et al. (2015) se sont appuyés sur une ancienne revue qualitative de Bråbäck et Forsberg (2009), qui a révélé que, bien qu'il y ait un manque de cohérence entre les liens exposition-réaction et la nature des allergènes étudiés dans quelques cohortes, un ensemble croissant de données probantes indique un lien possible entre l'exposition à la PACA ou la proximité à une route et la sensibilisation chez les enfants. Koppen et al. (2011) ont également examiné les études pertinentes, mais n'ont tiré aucune conclusion quant aux allergies, car il ne s'agissait pas du sujet principal de la publication.
3.4 Fonction pulmonaire
Une RS-MA (Barone-Adesi et al., 2015) et deux revues systématiques (Schultz et al., 2017; Götschi et al., 2008) évaluant le lien entre la PACA et la fonction pulmonaire ont été extraites dans le cadre de la revue de la portée. Les mesures de la fonction pulmonaire ayant été évaluées comprennent le volume expiratoire maximal par seconde (VEMS), la capacité vitale forcée (CVF), le débit expiratoire de pointe (DEP), le débit expiratoire maximal entre 25 % et 75 % de la capacité vitale forcée (DEM25-75) et le débit expiratoire maximal médian (DEMM).
3.4.1 RS-MA
Barone-Adesi et al (2015) ont mené une RS-MA de liens transversaux entre l'exposition à la PACA et la fonction pulmonaire chez les enfants et les adolescents. Le NO2 extérieur a été choisi par les auteurs comme marqueur de substitution approprié de la PACA primaire et, dans les études primaires incluses, les estimations des risques ont été quantifiées selon des paliers de NO2. Seules les études primaires qui représentaient une période d'exposition à long terme (un an ou plus) ont été incluses dans l'analyse. Les 13 études primaires incluses dans la revue ont été menées en Europe (huit études), en Amérique du Nord (quatre études) et en Asie (une étude), et l'âge des sujets variait entre 4 et 16 ans; la plupart des études comprenaient des enfants âgés de 8 à 12 ans. Toutes les études, sauf une, apportaient certaines corrections pour la fumée secondaire dans la maison et le SSE. Chacune des six études primaires ayant évalué la différence absolue du VEMS a indiqué une relation inverse avec l'exposition au NO2 et deux d'entre elles ont atteint le seuil de signification statistique. Les études primaires ont utilisé une variété de techniques d'évaluation de l'exposition, y compris des stations de surveillance fixes (deux études), des modèles de dispersion (deux études) et des modèles de RUT (deux études). Le NO2 moyen variait entre 13 et 50 µg/m3 dans l'ensemble des études. La méta-analyse à effets aléatoires a démontré un effet significatif du NO2 sur la différence absolue du VEMS, avec une ampleur d'effet de −8 ml (IC à 95 % : −14 à −1 ml) par augmentation de 10 µg/m3 en NO2 (p = 0,016 pour l'estimation d'effets; I2 = 32 %; valeur p non fournie pour l'hétérogénéité). L'analyse de sensibilité par méthode d'évaluation de l'exposition concernant la différence absolue du VEMS n'a pas indiqué d'hétérogénéité entre les études à cet égard (p = 0,66). De plus, les auteurs ont extrait neuf études primaires évaluant la réduction du VEMS en pourcentage de la valeur prévue. Parmi ces études, sept ont indiqué une relation inverse avec l'exposition au NO2 et une étude a atteint le seuil de signification statistique. Huit des études primaires ont utilisé la RUT pour les évaluations de l'exposition et une étude a eu recours aux modèles de dispersion. La méta-analyse à effets aléatoires a démontré un effet faible, mais significatif, sur le VEMS de −0,7 % (IC à 95 % : −1,1 % à −0,3 %) par augmentation de 10 µg/m3 en NO2 (p = 0,001 pour l'estimation d'effets; I2 < 1 %; valeur p non fournie pour l'hétérogénéité). L'exclusion de l'unique étude de modélisation de dispersion n'a pas modifié les résultats de façon appréciable.
Les auteurs de la revue ont également mené une analyse de sensibilité tenant compte du diagnostic ou de l'absence de diagnostic d'asthme des sujets. Dans les études sur la différence absolue du VEMS, chez les sujets n'ayant pas reçu de diagnostic d'asthme, l'estimation d'effet regroupée pour le NO2 était de −14 ml par 10 µg/m3 (IC à 95 % : −26 à −3 ml; p = 0,01 pour l'estimation d'effets), alors qu'aucun lien n'a été révélé chez les sujets ayant reçu un diagnostic d'asthme (ampleur regroupée de l'effet de 1 ml [IC à 95 % : −15 à 17 ml]; p = 0,90 pour l'estimation d'effets). Des résultats semblables ont été observés lorsque l'on s'est penché sur pourcentage de variation du VEMS. Une estimation regroupée de −0,9 % (IC à 95 % : −1,4 % à −0,4 %; p = 0,001 pour l'estimation d'effets) a été révélée chez les sujets n'ayant pas reçu de diagnostic d'asthme, alors que chez les sujets ayant reçu un diagnostic d'asthme, aucun lien n'a été révélé (−0,5 % [IC à 95 % : −1,9 % à 1 %]; p = 0,51 pour l'estimation d'effets). Ces résultats indiquent que les effets subcliniques de l'exposition à la PACA ne sont limitent pas aux populations à risque. Il convient de souligner que l'utilisation de médicaments antiasthmatique par les sujets de l'étude pourrait avoir limité la capacité à détecter une différence dans les mesures de la fonction pulmonaire au sein du groupe asthmatique.
Dans l'ensemble, cette RS-MA a signalé un lien transversal significatif entre l'exposition à long terme à la PACA et une réduction de la fonction pulmonaire chez les enfants et les adolescents. Les graphiques en entonnoir étaient symétriques et les tests de Begg et d'Egger n'ont indiqué aucun biais d'étude de petite envergure ou de publication; cependant, le faible nombre d'études est susceptible d'avoir limité la puissance statistique de détection à cet égard. Parmi les études sur lesquelles se sont penchées les méta-analyses, toutes sauf une étaient ajustées pour la fumée secondaire à la maison et le SSE, qui sont tous deux considérés comme des facteurs de confusion clés quant au lien évalué.
3.4.2 Revues systématiques
Schultz et al. (2017) ont mené une revue systématique d'études épidémiologiques évaluant l'effet de l'exposition à la PACA sur la fonction pulmonaire chez les enfants et les adolescents. La revue a permis d'extraire 32 études transversales et 12 études de cohorte longitudinales. Presque toutes les études primaires ont signalé un lien négatif entre les mesures de la fonction pulmonaire et l'exposition à la PACA; cependant, seulement certaines des estimations ont atteint le seuil de signification statistique. Les auteurs de la revue n'ont pas fourni de renseignements détaillés sur la correction des facteurs de confusion. Parmi les 32 études, seules six études transversales ont obtenu des résultats nuls. Les études primaires ont utilisé diverses méthodes d'évaluation de l'exposition, y compris la RUT, les modèles de dispersion, la surveillance, le comptage de la circulation et la distance des routes. Compte tenu des différentes mesures de la fonction pulmonaire, on a observé une plus importante estimation d'effets pour le VEMS que pour la CVF dans plusieurs études; certaines études ont toutefois signalé les estimations les plus importantes pour les mesures de la CVF ou du DEM25-75. L'exposition à la PACA était liée à des déficits relativement faibles de la fonction pulmonaire, qui variaient de 0,5 % à 3 %. Les auteurs de la revue ont relevé que ces déficits ne seraient associés qu'à des effets physiologiques mineurs chez un individu, mais qu'à l'échelle d'une population, on prévoit qu'ils entraîneraient une augmentation de la prévalence de personnes présentant une fonction pulmonaire inférieure aux seuils cliniques. Les études longitudinales indiquaient également un lien entre l'exposition à la PACA et une diminution de la croissance de la fonction pulmonaire; cependant, bon nombre de ces études étaient axées principalement sur les enfants d'âge scolaire et, par conséquent, les répercussions potentielles des expositions au début de la vie demeurent indéterminées. Une évaluation des études primaires selon le moment de l'exposition (p. ex. début de la vie ou enfance) n'a pas été concluante quant à l'indication d'une période d'augmentation du risque. Toute exposition à la PACA à tout âge pendant l'enfance peut avoir des répercussions sur la fonction pulmonaire. Une récupération de la fonction pulmonaire a d'ailleurs été signalée lorsque l'exposition diminue. L'évaluation des estimations d'effets selon le sexe n'a pas été concluante, le nombre d'études ayant signalé des répercussions plus importantes chez les garçons étant presque égal au nombre ayant signalé le contraire. Les preuves concernant l'effet modificateur potentiel de l'asthme sur le lien entre la PACA et la fonction pulmonaire étaient limitées, car plusieurs études ont signalé un lien fort chez les sujets asthmatiques. Les données probantes indiquant que les allergies ou la sensibilisation peuvent modifier le lien entre la PACA et la fonction pulmonaire étaient non concluantes. Dans l'ensemble, la revue systématique a permis de conclure que les expositions à la PACA au début de la vie, pendant l'enfance et jusqu'à l'adolescence peuvent entraîner une diminution de la fonction pulmonaire, du moins jusqu'à l'adolescence, et que ces effets peuvent être observés avec l'exposition à tout âge pendant l'enfance. Les auteurs de la revue ont relevé que des évaluations supplémentaires des cohortes jusqu'à l'âge adulte sont nécessaires pour déterminer si les déficits de la fonction pulmonaire persistent.
Götschi et al. (2008) ont mené une revue systématique d'études évaluant les effets à long terme de la pollution atmosphérique sur la fonction pulmonaire. La revue comprenait plusieurs études fondées sur des expositions propres à la circulation automobile. Les auteurs se sont uniquement penchés sur des études évaluant quatre communautés ou plus ou comprenant une attribution individuelle des expositions, afin de réduire toute distorsion causée par des erreurs dans les mesures de l'exposition ou toute confusion causée par des facteurs à l'échelle communautaire. En ce qui a trait aux études transversales menées chez les enfants, trois des sept études examinées indiquaient un lien négatif (deux études ont atteint le seuil de signification statistique) entre les mesures de la circulation automobile et la fonction pulmonaire, alors qu'une étude a signalé un lien positif avec la fonction pulmonaire. Dans les trois études n'ayant relevé aucun lien avec la fonction pulmonaire, l'exposition à la circulation automobile était liée à une augmentation des symptômes respiratoires. Une étude transversale supplémentaire a révélé une amélioration réduite de la fonction pulmonaire chez des enfants est-allemands vivant dans un rayon de 50 m d'une rue passante, huit ans après la réunification. Une étude longitudinale menée chez les enfants a signalé des déficits significatifs dans la croissance de la fonction pulmonaire (VEMS et DEMM) sur une période de huit ans pour les enfants vivant à moins de 500 m d'une autoroute. En ce qui concerne les études transversales menées chez des adultes, les deux études ont signalé une réduction significative du VEMS et de la CVF avec une densité de circulation automobile accrue et une plus grande proximité de la circulation automobile. Les deux études ont indiqué un effet plus important de la circulation automobile sur la fonction pulmonaire chez les femmes, et une étude a également détecté un plus grand risque de MPOC (VEMS/CVF < 0,7) chez les femmes. En comparaison, une étude longitudinale n'a détecté aucune différence ni variation dans la fonction pulmonaire sur une période de trois ans chez les femmes relativement à l'exposition à la PACA. De façon générale, la revue a conclu que les études indiquaient un lien entre l'exposition à la circulation automobile et la diminution de la fonction pulmonaire chez les enfants et les adultes, tout en soulignant que la plupart des études comprenaient des corrections pour les facteurs personnels (p. ex. tabagisme), mais que seulement certaines études tenaient compte du SSE ou d'autres facteurs à l'échelle communautaire dans leur analyse.
3.4.3 Résumé/conclusion
Dans l'ensemble, les données probantes indiquent que l'exposition à la PACA a des répercussions négatives sur la fonction pulmonaire. La RS-MA menée par Barone-Adesi et al. (2015) a quantifié une réduction significative des mesures de la fonction pulmonaire chez les enfants et les adolescents, en s'appuyant sur des études transversales. Ce résultat concorde avec la conclusion de la revue systématique plus récente menée par Schultz et al. (2017) selon laquelle il y a un lien négatif entre l'exposition à la PACA et les mesures de la fonction pulmonaire chez les enfants et les adolescents et les déficits peuvent être observés avec l'exposition à tout âge pendant l'enfance dans les études transversales. Schultz et al. (2017) ont également défini un lien potentiel entre une diminution de la croissance de la fonction pulmonaire chez les enfants et les adolescents et l'exposition à la PACA dans des études de cohorte. Une revue systématique réalisée auparavant par Götschi et al. (2008) indiquait un lien entre l'exposition à la PACA ou à la proximité de routes et une réduction de la fonction pulmonaire chez les enfants et les adultes. D'ailleurs, étant donné que la plupart des études primaires sur lesquelles se sont penchées la RS-MA et les revues systématiques ont été menées en Amérique du Nord et en Europe, les résultats sont considérés comme pertinents dans le cadre d'une évaluation canadienne en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc.
Chapitre 4. Caractérisation du risque et évaluation de la causalité
4.1 Asthme
4.1.1 Données probantes tirées de la revue globale
Cinq RS-MA évaluant le lien potentiel entre l'exposition à la PACA et l'asthme ont été extraits pendant la revue de la portée ou plus tard, pendant le processus de revue externe; ces RS-MA étaient toutes limitées aux études menées chez les enfants et les adolescents, en raison soit de l'objectif précis de la revue systématique, soit des d'études primaires existantes répondant aux critères d'admissibilité. Les études primaires incluses dans les RS-MA ont été menées principalement en Europe et en Amérique du Nord et trois des RS-MA ont inclus un plus faible nombre d'études provenant d'Asie. Par conséquent, les résultats des RS-MA ont été considérés comme pertinents dans le cadre d'une évaluation canadienne, compte tenu des similitudes en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc., entre le Canada, les États-Unis et les pays européens. D'ailleurs, les articles d'études primaires se fondaient principalement sur des analyses d'études de cohorte de naissances qui fournissent une séquence temporelle pour les effets observés sur la santé. Pour l'analyse quantitative, chacune des RS-MA était limitée à des études primaires ayant signalé des concentrations mesurées ou modélisées de composants de la PACA (p. ex. NO2 et particules). Diverses méthodes d'évaluation de l'exposition ont été utilisées dans les études primaires, y compris la RUT, les modèles de dispersion et la surveillance.
Dans l'ensemble, les cinq RS-MA ont signalé de façon cohérente des estimations regroupées positives du lien entre la PACA et l'incidence et la prévalence d'asthme pendant l'enfance. Les graphiques en forêt des RC regroupés concernant l'incidence et la prévalence d'asthme pendant l'enfance ont été tracés pour démontrer la cohérence, la force et le gradient biologique des liens entre ces effets sur la santé et la PACA. Les graphiques en forêt pour le NO2, les PM2,5, le CN et les PM10 sont fournis aux figures 4.1 à 4.4, respectivement. Les estimations regroupées pour un palier standardisé de 10 µg/m3 de NO2 variaient entre 1,08 et 1,21 pour l'incidence d'asthme et entre 1,05 et 1,06 pour la prévalence d'asthme et étaient significatives sur le plan statistique ou au seuil de signification statistique. De même, les estimations regroupées pour un palier standardisé de 1 µg/m3 de PM2,5 variaient entre 1,03 et 1,07 pour l'incidence d'asthme et étaient toutes significatives sur le plan statistique ou au seuil de signification statistique. Une seule estimation regroupée des PM2,5, de 1,01, a été définie pour la prévalence d'asthme et elle était au seuil de signification statistique. Pour le CN et les PM10, les estimations regroupées de l'incidence d'asthme variaient entre 1,08 et 1,17 (standardisées selon un palier de 0,5 × 10− 5/m) et entre 1,04 et 1,09 (standardisées selon un palier de 2 µg/m3), respectivement; chacune des estimations regroupées standardisées pour le CN et les PM10 était significative sur le plan statistique ou au seuil de signification statistique. En ce qui a trait à la prévalence d'asthme, aucune estimation regroupée n'a été relevée concernant le CN et une estimation regroupée indiquant un lien nul a été relevée concernant les PM10. Il convient de souligner que les liens les plus forts unissant la PACA à l'incidence et à la prévalence d'asthme pendant l'enfance ont été observés pour le NO2 et le CN. Le dioxyde d'azote est considéré comme étant la mesure la plus directe de la PACA, car il a été signalé que les sources de circulation automobile locale sont responsables de jusqu'à 80 % du NO2 dans l'air ambiant (examiné dans Khreis et Nieuwenhuijsen, 2017), alors que le CN est fortement lié à la circulation de véhicules au diesel (Richmond-Bryant et al., 2009).
Figure 4.1 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 10 µg/m3 de NO2; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité.
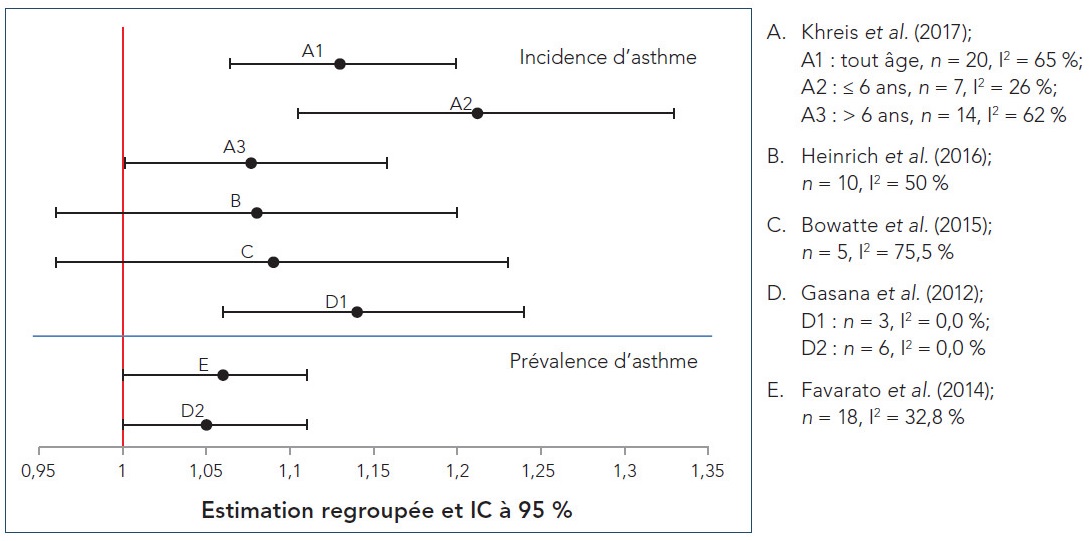
Équivalent textuel
La figure 4.1 illustre un graphique en forêt des RC regroupés selon des RS-MA sur l'incidence (en haut) et la prévalence (en bas) d'asthme pendant l'enfance qui ont été standardisées selon une augmentation de 10 µg/m3 de NO2. L'abscisse représente les estimations regroupées et IC à 95 % et s'échelonne de 0,95 à 1,35. Les informations suivantes sont illustrées dans cette figure :
| Effet sur la santé | Repère | RC regroupé (IC à 95 %) |
n | I2 | Référence |
|---|---|---|---|---|---|
| Incidence d'asthme | A1 (tout âge) | 1,13 (1,06–1,20) | 20 | 65 % | Khreis et al. (2017) |
| Incidence d'asthme | A2 (≤ 6 ans) | 1,21 (1,10–1,33) | 7 | 26 % | Khreis et al. (2017) |
| Incidence d'asthme | A3 (> 6 ans) | 1,08 (1,00–1,16) | 14 | 62 % | Khreis et al. (2017) |
| Incidence d'asthme | B | 1,08 (0,96–1,20) | 10 | 50 % | Heinrich et al. (2016) |
| Incidence d'asthme | C | 1,09 (0,96–1,23) | 5 | 75,5 % | Bowatte et al. (2016) |
| Incidence d'asthme | D1 | 1,14 (1,06–1,24) | 3 | 0,0 % | Gasana et al. (2012) |
| Prévalence d'asthme | E | 1,06 (1,00–1,11) | 18 | 32,8 % | Favarato et al. (2014) |
| Prévalence d'asthme | D2 | 1,05 (1,00–1,11) | 6 | 0,0 % | Gasana et al. (2012) |
Figure 4.2 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 1 µg/m3 de PM2,5; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité.
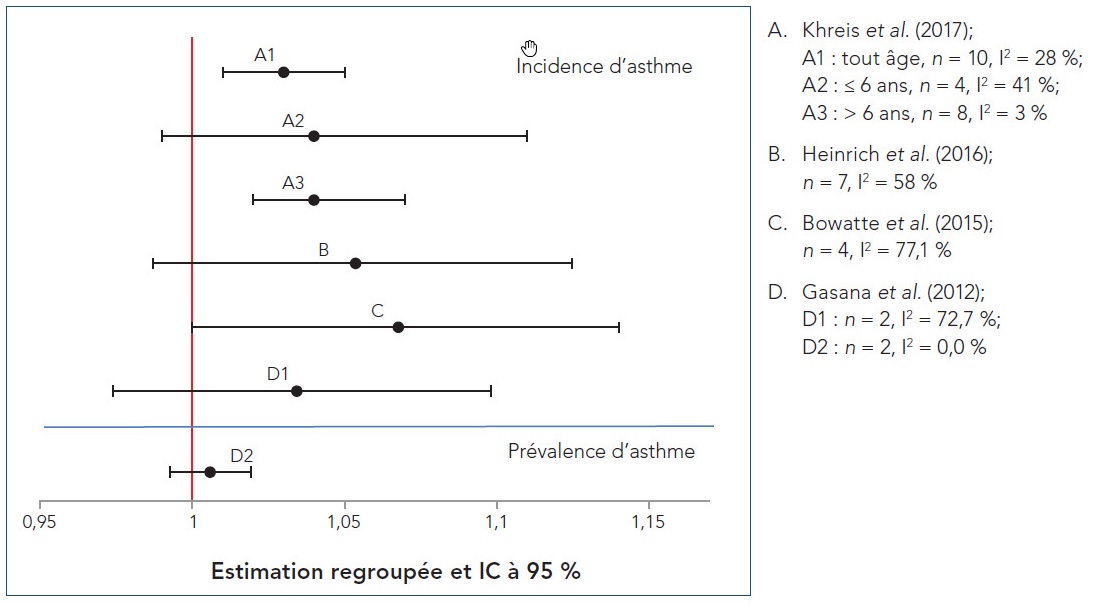
Équivalent textuel
La figure 4.2 illustre un graphique en forêt des RC regroupés selon des RS-MA sur l'incidence (en haut) et la prévalence (en bas) d'asthme pendant l'enfance qui ont été standardisées selon une augmentation de 1 µg/m3 de PM2,5. L'abscisse représente les estimations regroupées et IC à 95 % et s'échelonne de 0,95 à 1,15. Les informations suivantes sont illustrées dans cette figure :
| Effet sur la santé | Repère | RC regroupé (IC à 95 %) |
n | I2 | Référence |
|---|---|---|---|---|---|
| Incidence d'asthme | A1 (tout âge) | 1,03 (1,01–1,05) | 10 | 28 % | Khreis et al. (2017) |
| Incidence d'asthme | A2 (≤ 6 ans) | 1,04 (0,99–1,11) | 4 | 41 % | Khreis et al. (2017) |
| Incidence d'asthme | A3 (> 6 ans) | 1,04 (1,02–1,07) | 8 | 3 % | Khreis et al. (2017) |
| Incidence d'asthme | B | 1,05 (0,99–1,12) | 7 | 58 % | Heinrich et al. (2016) |
| Incidence d'asthme | C | 1,07 (1,00–1,14) | 4 | 77,1 % | Bowatte et al. (2016) |
| Incidence d'asthme | D1 | 1,03 (0,97–1,10) | 2 | 72,7 % | Gasana et al. (2012) |
| Prévalence d'asthme | D2 | 1,01 (0,99–1,02) | 2 | 0,0 % | Gasana et al. (2012) |
Figure 4.3 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence d'asthme pendant l'enfance, standardisée selon un palier de 0,5 × 10−5/m de CN; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité.
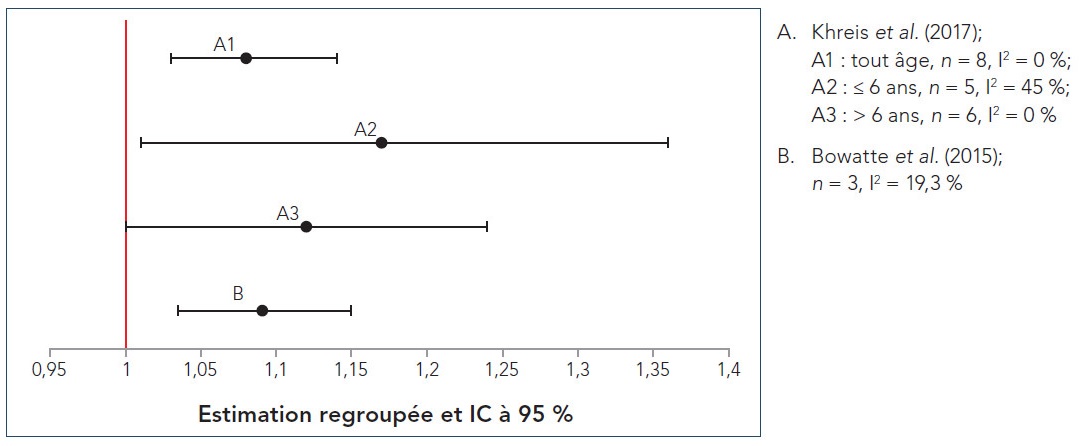
Équivalent textuel
La figure 4.3 illustre un graphique en forêt des RC regroupés selon des RS-MA sur l'incidence d'asthme pendant l'enfance qui a été standardisée selon une augmentation de 0,5×10-5/m de CN. L'abscisse représente les estimations regroupées et IC à 95 % et s'échelonne de 0,95 à 1,4. Les informations suivantes sont illustrées dans cette figure :
| Repère | RC regroupé (IC à 95 %) |
n | I2 | Référence |
|---|---|---|---|---|
| A1 (tout âge) | 1,08 (1,03–1,14) | 8 | 0 % | Khreis et al. (2017) |
| A2 (≤ 6 ans) | 1,17 (1,01–1,36) | 5 | 45 % | Khreis et al. (2017) |
| A3 (> 6 ans) | 1,12 (1,00–1,24) | 6 | 0 % | Khreis et al. (2017) |
| B | 1,09 (1,04–1,15) | 3 | 19,3 % | Bowatte et al. (2016) |
Figure 4.4 Graphiques en forêt des RC regroupés des RS-MA sur l'incidence et la prévalence d'asthme pendant l'enfance, standardisées selon un palier de 2 µg/m3 de PM10; n représente le nombre d'études incluses dans la méta-analyse et I2 représente l'hétérogénéité.
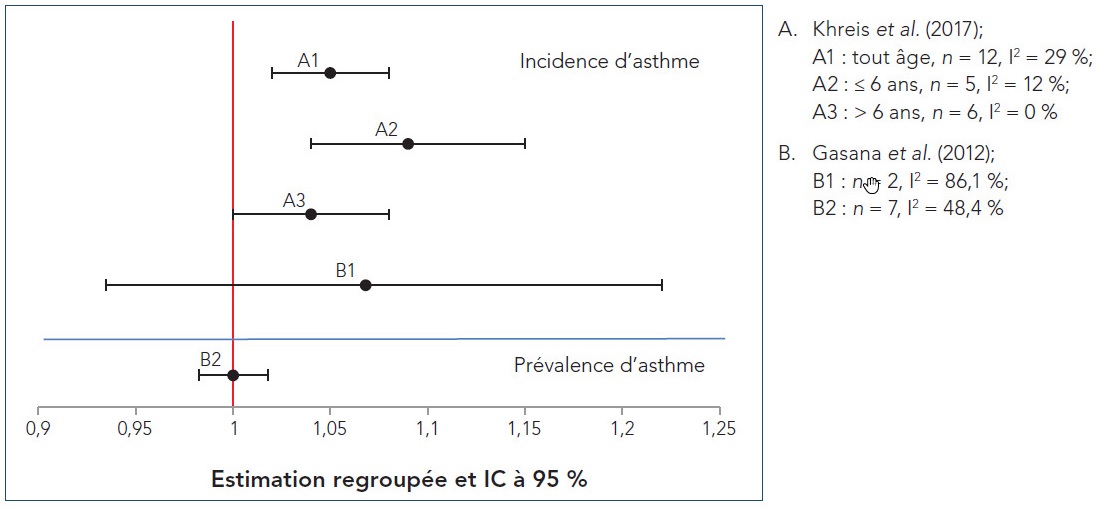
Équivalent textuel
La figure 4.4 illustre un graphique en forêt des RC regroupés selon des RS-MA sur l'incidence (en haut) et la prévalence (en bas) d'asthme pendant l'enfance qui ont été standardisées selon une augmentation de 2 µg/m3 de PM10. L'abscisse représente les estimations regroupées et IC à 95 % et s'échelonne de 0,9 à 1,25. Les informations suivantes sont illustrées dans cette figure :
| Effet sur la santé | Repère | RC regroupé (IC à 95 %) |
n | I2 | Référence |
|---|---|---|---|---|---|
| Incidence d'asthme | A1 (tout âge) | 1,05 (1,02–1,08) | 12 | 29 % | Khreis et al. (2017) |
| Incidence d'asthme | A2 (≤ 6 ans) | 1,09 (1,04–1,15) | 5 | 12 % | Khreis et al. (2017) |
| Incidence d'asthme | A3 (> 6 ans) | 1,04 (1,00–1,08) | 6 | 0 % | Khreis et al. (2017) |
| Incidence d'asthme | B1 | 1,07 (0,93–1,22) | 2 | 86,1 % | Gasana et al. (2012) |
| Prévalence d'asthme | B2 | 1,00 (0,98–1,02) | 7 | 48,4 % | Gasana et al. (2012) |
En ce qui concerne les sous-populations sensibles potentielles, des données probantes appuyaient l'existence d'un effet lié à l'âge. Les analyses stratifiées effectuées par Khreis et al. (2017) indiquaient une sensibilité potentiellement plus grande chez les enfants de 6 ans ou moins après l'exposition au NO2, au CN et aux PM10. Bowatte et al. (2015) ont également relevé une tendance à la hausse du risque d'incidence d'asthme entre les âges de 1 et de 6 ans pour le NO2 et le CN, mais cette analyse propre à l'âge se fondait sur des méta-analyses incluant seulement une à trois cohortes par groupe d'âge, limitant ainsi la robustesse des résultats. D'autres facteurs entraînant une augmentation du risque n'ont pas été évalués ou définis de façon adéquate dans les analyses.
Une hétérogénéité modérée à importante a été signalée pour la plupart des analyses, surtout concernant le NO2 et les PM2,5, ce qui pourrait être dû à des différences méthodologiques entre les études primaires, y compris en ce qui concerne les méthodes d'évaluation de l'exposition, la définition des résultats sur la santé et la correction pour les facteurs de confusion et les covariables. Au regard de l'hétérogénéité modérée à importante, les résultats des méta-analyses à effets aléatoires étaient considérés comme étant les plus appropriés. Chacune des RS-MA a utilisé les estimations des risques qui prenaient en compte les facteurs de confusion clés (p. ex. tabagisme, SSE et facteurs héréditaires), lorsque les estimations des risques ajustées étaient disponibles dans les études primaires, et la plupart des études primaires effectuaient certaines corrections. Néanmoins, il est attendu que les différences en matière de correction des facteurs de confusion entre les études primaires réduisent la précision des estimations d'effets regroupées (c.-à-d. qu'elles donnent lieu à de plus grands intervalles de confiance). Une autre limite clé des études primaires, relevée dans les RS-MA, était le recours à des questionnaires et au signalement des résultats sur la santé par les sujets eux-mêmes ou par leurs parents.
Les revues systématiques et les autres revues sélectionnées ayant fait l'objet d'une évaluation dans le cadre de la revue globale fournissent des données probantes concernant l'exposition à la PACA et la prévalence d'asthme. De même, la plupart de ces revues traitaient principalement d'études menées auprès de cohortes de naissance et d'enfance et ont systématiquement relevé un lien positif entre l'exposition à la PACA et les symptômes d'asthme ainsi que la prévalence d'asthme; des résultats significatifs ont été signalés dans certaines des études primaires (Koppen et al., 2011; Bråbäck et Forsberg, 2009; Boothe et Shendell, 2008; Salam et al., 2008) et Koppen et al. (2011) ont conclu qu'il y avait un lien de causalité entre l'exposition à la PACA les symptômes d'asthme pendant l'enfance. Une augmentation du risque de symptômes d'asthme relativement à l'exposition à la PACA a été relevée dans le cadre d'études menées dans de nombreux pays et utilisant différentes mesures de l'exposition (p. ex. modèles de RUT, modèles de dispersion, mesures de la circulation automobile et surveillance). Bien que seules des études ayant quantifié les concentrations de polluants aient été incluses dans les RS-MA, ces revues ont pris en compte un plus grand nombre d'études en raison de l'inclusion d'études comportant des mesures de la circulation automobile. Les revues systématiques et les autres revues sélectionnées se sont concentrées sur la prévalence d'asthme, car les données probantes étaient insuffisantes pour évaluer l'incidence d'asthme. Il convient de souligner que la plupart de ces revues ont été publiées avant les RS-MA et ont évalué une base de données d'ouvrages scientifiques plus ancienne comprenant plus d'analyses transversales des cohortes, plutôt que d'analyses à conception longitudinale.
Un nombre limité d'études, dont les résultats divergent, ont évalué les résultats en matière de PACA et d'asthme plus précisément chez les adultes, notamment une revue systématique portant principalement sur l'apparition d'asthme à l'âge adulte (Jacquemin et al., 2012) et une revue systématique incluant la prévalence d'asthme chez les adultes (Salam et al., 2008). Pour l'apparition d'asthme à l'âge adulte, bien que des liens positifs aient été observés, il existait certaines incohérences entre les études (p. ex. sensibilité chez les hommes comparativement aux femmes et chez les sujets atteints d'asthme allergique comparativement à non allergique). D'ailleurs, la possibilité de confusion liée à l'exposition professionnelle et à la rémission d'asthme infantile limite la capacité à tirer des conclusions sur l'incidence d'asthme chez les adultes. En ce qui concerne la prévalence d'asthme, des liens positifs ont été observés principalement avec des mesures de la proximité et de la densité de la circulation automobile, et non avec des concentrations de polluants, ce qui limite la force des preuves de façon générale.
4.1.2 Preuves expérimentales provenant d'autres évaluations
Pour examiner davantage le lien entre l'exposition à la PACA et l'asthme relevé dans le cadre de la revue globale, les aspects pertinents de l'évaluation des gaz d'échappement de la circulation automobile, des principaux composants de la PACA, ou des deux, par Santé Canada, l'HEI et l'EPA des É.‑U. ont été examinés en vue d'extraire leurs conclusions concernant cet effet sur la santé se fondant sur des études in vitro, des études de toxicologie animale et des études d'exposition contrôlée chez l'humain. Bien que bon nombre de ces études portent sur des périodes d'exposition à court terme, les réactions biologiques observées sont informatives, car elles fournissent des renseignements mécanistes sur les voies d'activation possibles pouvant entraîner les effets observés dans les études épidémiologiques à long terme. Un résumé des résultats offrant des preuves biologiques et mécanistes pertinentes quant aux liens définis dans les données probantes épidémiologiques existantes figure ci-dessous aux fins d'établissement de la plausibilité biologique.
Selon l'évaluation de la PACA par l'HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010), il existe des renseignements limités provenant d'études de panel indiquant que l'exposition à court terme à la PACA entraîne une augmentation des symptômes d'asthme, y compris l'inflammation et l'acidification des voies respiratoires, chez les adultes asthmatiques, et que les effets étaient plus importants après une provocation par un allergène. De plus, une réaction inflammatoire mineure a été observée dans les macrophages alvéolaires du rat après l'exposition à la PACA in vivo et dans une lignée de cellules épithéliales pulmonaires.
Selon les évaluations des GED (2016a) et des GEE (2017) menées par Santé Canada, plusieurs études d'exposition contrôlée chez l'humain ont signalé des symptômes de résultats indésirables en matière de santé respiratoire, y compris l'inflammation, la résistance des voies respiratoires, une altération de la fonction pulmonaire et une réaction oxydative, tant chez les adultes en bonne santé qu'asthmatiques, après l'exposition aux GED. Des résultats semblables, y compris une inflammation et une réactivité des voies respiratoires accrues, ont également été observés dans le cadre d'études expérimentales sur les animaux. En effet, la revue par le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a relevé que l'exposition à des concentrations élevées de GED entraînait une augmentation des marqueurs de l'inflammation (p. ex. neutrophiles, mastocytes et lymphocytes) chez des individus en bonne santé et que l'exposition à court terme aux GED augmentait l'hyperréactivité des voies respiratoires (HVR) chez les individus asthmatiques. Selon l'évaluation des risques liés aux GED par Santé Canada (2017), des études menées sur différents animaux de laboratoire ont signalé des augmentations des marqueurs de stress oxydatif et de réaction inflammatoire (p. ex. cytokines, macrophages et éosinophiles) dans les voies respiratoires après l'exposition aux GED. Un faible nombre d'études menées sur des animaux ont également signalé une exacerbation de l'HVR par suite de l'exposition aux particules dans le gaz d'échappement d'essence (PGEE). De même, des études in vitro sur des lignées de cellules pulmonaires ont révélé une augmentation de l'inflammation et du stress oxydatif après l'exposition aux GEE ou aux PGEE (Santé Canada, 2017).
Concernant les composants précis de la PACA, autant l'évaluation du NO2 par Santé Canada (2016b) que l'ISA de l'EPA des É.-U. du NO2 (2016) ont signalé une augmentation de l'HVR chez les enfants et les adultes asthmatiques exposés à des concentrations ambiantes de NO2. L'EPA des É.-U. (2016) a également déterminé que l'exposition au NO2 entraînait une réaction inflammatoire accrue dans le cadre d'études sur l'exposition contrôlée chez l'humain. En ce qui concerne les études de toxicologie animale, Santé Canada (2016b) a relevé une augmentation de l'HVR, des marqueurs de l'inflammation (p. ex. cytokines, éosinophiles et neutrophiles) et du stress oxydatif dans les voies respiratoires de modèles animaux exposés au NO2 à des concentrations supérieures aux concentrations dans l'air ambiant. Bien que l'EPA des É.-U. (2016) ait signalé de façon semblable que l'exposition au NO2 entraînait des augmentations des marqueurs inflammatoires, cette évaluation a relevé que les effets du NO2 sur le stress oxydatif divergeaient.
Autant l'évaluation des risques découlant des PM2,5 menée par Santé Canada (2013) que l'ISA des États-Unis concernant les PM (2009) ont relevé des résultats divergents des études d'exposition contrôlée chez l'humain au sujet de l'effet des particules concentrées dans l'air ambiant (PCAA) sur l'inflammation des voies respiratoires. De plus, l'EPA des É.-U. (2009) a déterminé qu'il y avait des signes d'une réaction de stress oxydatif dans les tissus respiratoires après l'exposition à concentrations ambiantes de PM. Chez les animaux, Santé Canada (2013) a signalé que l'exposition aux PM donnait lieu à une réaction inflammatoire caractérisée par une augmentation des cytokines, des neutrophiles et des macrophages et, dans une étude, une augmentation de l'HVR. L'exposition aux PM dans l'air ambiant entraînait également une réaction inflammatoire marquée par une augmentation des concentrations de cytokines dans les lignées de cellules respiratoires. De même, l'EPA des É.-U. (2009) a relevé que la plupart des études menées sur des animaux de laboratoire ont signalé des augmentations des marqueurs de l'inflammation et du stress oxydatif dans les poumons. Selon l'évaluation de la PACA par l'HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010), des résultats divergents ont été observés dans une paire d'études d'exposition contrôlée chez l'humain ayant analysé les effets de l'exposition aux PCAA sur la réaction inflammatoire dans les voies respiratoires chez les adultes en bonne santé. L'HEI a signalé que la plupart des études expérimentales examinées ont révélé que les animaux exposés aux PM présentaient une réaction inflammatoire accrue dans les tissus des voies respiratoires.
Dans l'ensemble, une vaste base de données d'études expérimentales, y compris des études d'exposition contrôlée chez l'humain, des études expérimentales menées sur des animaux et des études in vitro ayant évalué les effets de l'exposition à la PACA ou à ses composants polluants sur les biomarqueurs et les symptômes d'asthme, offre une cohérence quant aux données épidémiologiques. De nombreuses études ont signalé que l'exposition à la PACA ou à ses composants donnait lieu à une réaction inflammatoire dans le système respiratoire. Plusieurs études ont également relevé une augmentation de l'HRV et des marqueurs du stress oxydatif après l'exposition. Le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a proposé un mécanisme d'action possible : les composants de la PACA pénètrent dans les voies respiratoires et provoquent des réactions de stress oxydatif, ce qui entraîne la génération de radicaux libres, y compris de dérivés réactifs de l'oxygène (DRO). Ensuite, les DRO déclenchent une réaction inflammatoire, y compris la génération d'un plus grand nombre de DRO, entraînant éventuellement des lésions aux tissus pulmonaires.
4.1.3 Détermination de la causalité
D'après les éléments de preuve suivants : (i) les liens significatifs entre l'exposition à la PACA et l'incidence d'asthme chez les enfants relevés dans la RS-MA menée par Khreis et al. (2017) appuyés par les RS-MA menées par Gasana et al. (2012) et Bowatte et al. (2015) définissant des liens significatifs ou au seuil de signification statistique entre l'incidence d'asthme chez les enfants et l'exposition à la PACA; (ii) le fait que les liens les plus forts ont été observés pour le NO2 et le CN et que le NO2 est considéré comme étant la mesure la plus directe de la PACA et que le CN est un marqueur pour la circulation de véhicules au diesel; (iii) les preuves expérimentales appuyant la possibilité que la PACA puisse provoquer une inflammation des voies respiratoires et un stress oxydatif, la réactivité des voies respiratoires et l'HRV selon des études d'exposition contrôlée chez l'humain et des études expérimentales menées sur des animaux, il est conclu qu'il existe suffisamment de preuves d'un lien de causalité entre l'exposition à la PACA et l'incidence d'asthme chez les enfants .
D'après les éléments de preuve suivants : (i) les liens significatifs ou au seuil de signification statistique entre l'exposition à la PACA et la prévalence d'asthme chez les enfants relevés dans des RS-MA menées par Favarato et al. (2014) et Gasana et al. (2012) et plusieurs revues systématiques (sans méta-analyse) ayant défini de façon cohérente des liens positifs entre l'exposition à la PACA et les symptômes d'asthme ainsi que la prévalence d'asthme, avec des résultats significatifs signalés dans certaines des études primaires; (ii) le fait que les liens les plus forts ont été observés pour le NO2, qui est considéré comme étant la mesure la plus directe de la PACA; (iii) les preuves à l'appui provenant d'études de panel, d'études d'exposition contrôlée chez l'humain et d'études expérimentales menées sur des animaux indiquant que l'exposition à la PACA ou à ses composants peut exacerber les symptômes d'asthme et provoquer une inflammation des voies respiratoires et un stress oxydatif, la réactivité des voies respiratoires et l'HVR, il est conclu qu'il existe suffisamment de preuves d'un lien de causalité entre l'exposition à la PACA et la prévalence d'asthme chez les enfants .
D'après les éléments de preuve suivants : (i) le lien entre l'exposition à la PACA et l'incidence d'asthme chez les adultes, limité par des incohérences et une confusion potentielle, évalué dans le cadre d'une revue systématique (Jacquemin et al., 2012); et (ii) les preuves expérimentales appuyant la possibilité que la PACA ou ses composants puissent provoquer une inflammation des voies respiratoires et un stress oxydatif, la réactivité des voies respiratoires et l'HRV selon des études d'exposition contrôlée chez l'humain et des études expérimentales menées sur des animaux, il est conclu que les données probantes sont insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et l'incidence d'asthme chez les adultes .
D'après les éléments de preuve suivants : (i) le lien existant entre la prévalence d'asthme chez les adultes et les mesures de la circulation automobile, mais absent entre la prévalence d'asthme et les concentrations de polluants, relevé dans deux revues systématiques (Jacquemin et al., 2012; Salam et al., 2008); et (ii) les preuves expérimentales à l'appui tirées d'études de panel, d'études d'exposition contrôlée chez l'humain et d'études expérimentales menées sur des animaux indiquant que l'exposition à la PACA ou à ses composants peut exacerber les symptômes d'asthme et provoquer une inflammation des voies respiratoires et un stress oxydatif, la réactivité des voies respiratoires et l'HRV, il est conclu que les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et la prévalence d'asthme chez les adultes .
Un mécanisme d'action plausible pour la PACA ou ses composants donnant lieu à l'incidence et à la prévalence d'asthme est la médiation des effets par le stress oxydatif et la réaction inflammatoire dans les voies respiratoires, qui provoque un dysfonctionnement des voies respiratoires.
4.2 Allergies
4.2.1 Données probantes tirées de la revue globale
Deux RS-MA évaluant le lien potentiel entre l'exposition à la PACA et les résultats en matière d'allergies ont été extraites dans le cadre de la revue de la portée ou par la suite au cours du processus de revue externe; ces RS-MA étaient limitées aux études menées chez les enfants et les adolescents. Les études primaires incluses dans les RS-MA ont été menées en Europe et en Amérique du Nord. Par conséquent, les résultats des RS-MA ont été considérés comme pertinents dans le cadre d'une évaluation canadienne, compte tenu des similitudes en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc. Pour l'analyse quantitative, chaque RS-MA était limitée à des études primaires ayant signalé des concentrations modélisées de composants de la PACA (p. ex. NO2 et PM2,5). Des méthodes d'évaluation de l'exposition, y compris la RUT et, dans une moindre mesure, des modèles de dispersion, ont été utilisées dans les études primaires. D'ailleurs, les articles d'études primaires se fondaient principalement sur des analyses d'études de cohorte de naissances qui fournissent une séquence temporelle pour les effets observés sur la santé.
Dans l'ensemble, il existe des preuves indiquant l'existence d'un lien positif entre l'exposition à la PACA et les allergies chez les enfants, mais elles sont actuellement faibles et limitées à l'égard de la cohérence générale et de la force du lien. Une tabulation des RC regroupés, par palier de NO2 ou de PM2,5, en ce qui a trait aux résultats en matière d'allergies, figure dans le tableau 4.1. Aucun lien n'a été observé entre le NO2 et la sensibilisation à tout allergène. Cependant, lorsque la sensibilisation était limitée à des allergènes précis (p. ex. aéroallergènes, aéroallergènes extérieurs et allergènes alimentaires à l'âge de 4 et de 8 ans), excepté en ce qui concerne les aéroallergènes intérieurs, des liens positifs essentiellement au seuil de signification statistique ont été observés entre les polluants de la PACA (c.-à-d. NO2 et PM2,5) et les allergènes examinés. Les liens les plus forts ont été observés de façon cohérente pour la sensibilisation aux allergènes alimentaires aux âges de 4 et de 8 ans. Cependant, la majorité des estimations regroupées n'étaient fondées que sur deux ou trois études de cohorte et, par conséquent, la robustesse des résultats était limitée. De plus, une hétérogénéité modérée à élevée a été observée autant avec le NO2 que les PM2,5 pour bon nombre des résultats en matière d'allergies, ce qui pourrait être dû à des différences méthodologiques entre les études primaires, y compris le degré d'urbanisation, le mélange entre les régions urbaines et rurales étudiées dans chaque cohorte et la confusion attribuable au SSE, à la fumée secondaire et à la prédisposition allergique (hérédité) non mesurés. Bien que les méta-analyses à effets aléatoires aient été considérées comme étant les plus appropriées au regard de l'hétérogénéité modérée à importante, il est attendu que ces différences réduisent la précision des estimations d'effets regroupées (c.-à-d. qu'elles donnent lieu à de plus grands intervalles de confiance). Une autre limite clé des études primaires, relevée dans les RS-MA, était le recours à des questionnaires et au signalement des résultats sur la santé par les sujets eux-mêmes ou par leurs parents.
| Résultat en matière d'allergies | Nombre d'études incluses | RC regroupé (IC à 95 %) | Hétérogénéité (I2) |
|---|---|---|---|
| NO2 (par 10 µg/m3) | |||
| Sensibilisation (tout allergène)Tableau 4.1 Note de bas de page a | 6 | 1,00 (0,98–1,02) | 49 % |
| Sensibilisation (aéroallergènes)Tableau 4.1 Note de bas de page a | 8 | 1,02 (0,92–1,13) | 51 % |
| Sensibilisation (aéroallergène extérieur)Tableau 4.1 Note de bas de page b | 3 | 1,09 (0,88–1,36) | 36,3 % |
| Sensibilisation (aéroallergène intérieur)Tableau 4.1 Note de bas de page b | 2 | 0,96 (0,74–1,25) | 0,0 % |
| Sensibilisation (allergène alimentaire, 4 ans)Tableau 4.1 Note de bas de page b | 2 | 1,28 (0,98–1,68) | 44,0 % |
| Sensibilisation (allergène alimentaire, 8 ans)Tableau 4.1 Note de bas de page b | 2 | 1,19 (1,00–1,42) | 0,0 % |
| Rhume des foinsTableau 4.1 Note de bas de page a | 6 | 1,01 (0,85–1,19) | 62 % |
| PM2,5 (par 2 µg/m3) | |||
| Sensibilisation (aéroallergènes)Tableau 4.1 Note de bas de page a | 6 | 1,05 (1,00–1,11) | 0 % |
| Sensibilisation (aéroallergène extérieur)Tableau 4.1 Note de bas de page b | 3 | 1,33 (0,94–1,88) | 73,7 % |
| Sensibilisation (aéroallergène intérieur)Tableau 4.1 Note de bas de page b | 2 | 1,00 (0,80–1,24) | 0,0 % |
| Sensibilisation (allergène alimentaire, 4 ans)Tableau 4.1 Note de bas de page b | 2 | 1,26 (1,00–1,60) | 44,0 % |
| Sensibilisation (allergène alimentaire, 8 ans)Tableau 4.1 Note de bas de page b | 2 | 1,18 (1,00–1,39) | 0,0 % |
| Rhume des foinsTableau 4.1 Note de bas de page a | 5 | 1,02 (0,85–1,21) | 55 % |
|
|||
Il existe également certaines preuves, quoique limitées, que l'exposition à la PACA pendant l'enfance peut être associée à une augmentation des risques de rhume des foins et d'eczéma. Les estimations regroupées dans Heinrich et al. (2016) indiquaient des liens positifs non significatifs sur le plan statistique concernant les polluants de la PACA et le rhume des foins, ce qui concorde avec les liens essentiellement positifs entre l'exposition à la PACA et le rhume des foins, l'eczéma, ou les deux, signalés par Bowatte et al. (2015). Aucune des deux RS-MA n'a effectué d'analyse quantitative concernant les polluants de la PACA et l'eczéma, en raison des différences dans le signalement des mesures des résultats et du nombre limité d'études primaires.
Dans les analyses de sensibilité menées par Heinrich et al. (2016), par suite de l'exclusion de la cohorte à haut risque (antécédents parentaux de maladies allergiques) et de la cohorte de très jeunes enfants, l'estimation regroupée de la sensibilisation aux aéroallergènes avec l'exposition au NO2 était légèrement atténuée, ce qui a donné lieu à un lien nul. Une légère réduction, laquelle donne également lieu à un lien nul, a été observée de la même façon après le retrait de la cohorte à haut risque de l'analyse concernant le rhume des foins et l'exposition au NO2. Ces résultats indiquent que les risques peuvent être plus élevés pour les enfants dont les parents souffrent de maladies allergiques et pour les très jeunes enfants.
Les deux RS-MA sont plus récentes que les revues qualitatives extraites pendant le processus de revue de la portée. Bowatte et al. (2015) se sont appuyés sur une ancienne revue qualitative de Bråbäck et Forsberg (2009), qui a révélé que, bien qu'il y ait un manque de cohérence entre les liens exposition-réaction et la nature des allergènes étudiés dans quelques cohortes, un ensemble croissant de données probantes indique un lien possible entre l'exposition à la PACA ou la proximité à une route et la sensibilisation chez les enfants. Koppen et al. (2011) ont également examiné les études pertinentes, mais n'ont tiré aucune conclusion quant aux allergies, car le sujet principal de la publication était la PACA et la santé respiratoire.
4.2.2 Preuves expérimentales provenant d'autres évaluations
Pour examiner davantage le lien entre l'exposition à la PACA et les allergies relevé dans le cadre de la revue globale, les aspects pertinents de l'évaluation des gaz d'échappement de la circulation automobile, des principaux composants de la PACA, ou des deux, par Santé Canada, l'HEI et l'EPA des É.‑U. ont été examinés en vue d'extraire leurs conclusions concernant ce résultat en matière de santé se fondant sur des études d'exposition contrôlée chez l'humain, des études de toxicologie animale et des études in vitro. Bien que bon nombre de ces études portent sur des périodes d'exposition à court terme, les réactions biologiques observées sont informatives, car elles fournissent des renseignements mécanistes sur les voies d'activation possibles pouvant entraîner les effets observés dans les études épidémiologiques à long terme. Un résumé des résultats offrant des preuves biologiques et mécanistes pertinentes quant aux liens définis dans les données probantes épidémiologiques existantes figure ci-dessous aux fins d'établissement de la plausibilité biologique.
Selon l'évaluation de la PACA par l'HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010), une étude de panel menée auprès d'individus asthmatiques exposés à la PACA a signalé que la provocation par un allergène après l'exposition entraînait une augmentation des effets respiratoires, y compris l'exacerbation de l'asthme et l'inflammation. De plus, deux études de toxicologie animale ont démontré une augmentation de la réaction allergique lorsque les animaux subissaient une provocation par un allergène en combinaison avec les gaz d'échappement de la circulation automobile, comparativement à l'allergène seul. L'exposition à la PACA a également entraîné la libération de cytokines pro-inflammatoires dans une lignée de cellules pulmonaires humaines.
Selon l'évaluation des GED menée par Santé Canada (2016a), un effet adjuvant de l'exposition aux GED combinés à un allergène a été relevé dans des études d'exposition contrôlée chez l'humain, indiquant un rôle possible dans les maladies allergiques des voies respiratoires et la sensibilisation allergique pour les GED ou les particules dans les GED (PGED), ce qui a mené à la conclusion que le lien entre l'exposition aux GED et les effets immunologiques était susceptible d'en être un de causalité. La sensibilité individuelle à l'effet adjuvant était variable et pourrait être influencée par le génotype. Santé Canada (2016a) a relevé que la vaste base de données d'études menées sur des animaux appuyait les résultats d'études d'exposition contrôlée chez l'humain selon lesquels l'administration concomitante de GED et d'un allergène augmentait la réaction à un allergène. Plus précisément, plusieurs études menées sur des animaux ont signalé que l'exposition aux GED et à un allergène entraînait une exacerbation de l'inflammation allergique des voies respiratoires. De même, le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a signalé que, chez les humains souffrant d'allergies, l'exposition aux PGED entraînait une augmentation des marqueurs d'allergénicité (p. ex. cytokines et histamine) et d'une réaction inflammatoire dans les cellules respiratoires pouvant donner lieu à une exacerbation des allergies. Une vaste base de données d'études menées sur des animaux appuyait également les résultats d'études menées chez l'humain selon lesquels l'exposition aux GED et aux PGED exacerbait la réaction allergique (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010). De même, l'EPA des É.‑U. (2009) a signalé que l'exposition aux PGED entraînait une augmentation significative des marqueurs d'une réaction allergique (p. ex. immunoglobulines et cytokines) aux allergènes dans le cadre d'études d'exposition contrôlée chez l'humain. De plus, dans une étude, la provocation à l'aide d'un antigène suivie d'une exposition aux PGED a entraîné une sensibilisation allergique.
Contrairement aux résultats concernant les GED, Santé Canada (2017) a relevé que les preuves d'induction allergénique par les GEE divergeaient dans les modèles animaux; seul un nombre limité d'études animales ont signalé que l'exposition aux GEE entraînait une augmentation des marqueurs d'une réaction allergique dans les modèles sensibilisés.
En ce qui a trait aux composants précis de la PACA, le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a signalé que le NO2 n'exacerbait pas la réaction allergique chez les individus asthmatiques dans le cadre d'études d'exposition contrôlée chez l'humain. En revanche, une évaluation plus récente du NO2 menée par Santé Canada (2016b) a déterminé que les effets de l'exposition au NO2 sur les marqueurs de l'inflammation et des réactions allergiques chez les sujets atteints de rhinite allergique et d'asthme divergeaient. De plus, Santé Canada (2016b) a signalé que, dans certaines études menées sur des animaux, l'exposition au NO2, avant et après la sensibilisation aux allergènes, donnait lieu à une réduction de la production d'anticorps et des concentrations d'éosinophiles, entraînant une modulation de la réaction allergique. Une réaction allergique plus importante a été observée dans le cadre des études de sensibilisation aux allergènes et de provocation après l'exposition au NO2. De même, l'EPA des É.-U. (2016) a signalé que l'exposition au NO2 donnait lieu à une présence accrue de marqueurs d'une réaction allergique (p. ex. immunoglobulines, éosinophiles et neutrophiles), autant dans des études d'exposition contrôlée chez l'humain que des études toxicologiques menées sur des animaux.
Selon l'évaluation des PM2,5 menée par Santé Canada (2013), l'exposition aux PM2,5 dans l'air ambiant exacerbait la réaction allergique (p. ex. inflammation, HVR, immunoglobulines, éosinophiles et cytokines) lorsqu'administrée conjointement avec un antigène dans le cadre d'études de toxicologie animale. Ces effets adjuvants sont survenus avec différentes espèces et tailles de particules, mais les particules plus petites (p. ex. les particules ultrafines [PUF]) présentaient des effets allergiques plus importants. De même, le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a relevé que l'exposition aux PM entraînait l'exacerbation de la réaction allergique (p. ex. cytokines, immunoglobulines et éosinophiles) dans les modèles animaux sensibilisés. Dans l'ISA de l'EPA des É.-U. concernant les PM (2009), l'exposition aux PCAA était liée à une augmentation des marqueurs de réaction allergique (p. ex. éotaxine) chez les adultes en bonne santé dans le cadre d'études d'exposition contrôlée chez l'humain. L'exposition à différents dérivés de PM a également entraîné l'exacerbation de maladies allergiques existantes dans divers modèles animaux. De plus, l'administration concomitante d'un allergène et de PM favorisait la sensibilisation allergique, caractérisée par une augmentation des concentrations d'immunoglobulines, de cytokines et de lymphocytes T, dans les modèles animaux (EPA des É.-U., 2009).
Dans l'ensemble, il existe une vaste base de données d'études expérimentales (études d'exposition contrôlée chez l'humain, études menées sur des animaux et études in vitro) appuyant sur le plan mécaniste le rôle de la PACA dans l'apparition de sensibilisation allergique et de réactions allergiques accrues, ce qui offre une cohérence entre les preuves expérimentales et un appui aux données épidémiologiques limitées. L'exposition aux gaz d'échappement de la circulation automobile et à certains de ses composants individuels, y compris les GED et les PM, a été liée à un effet adjuvant, qui pourrait être médié par une présence accrue de cellules immunitaires (p. ex. éosinophiles, macrophages et lymphocytes T) et de molécules pro-inflammatoires (p. ex. immunoglobulines et interleukines), dont les IgE, principales responsables de la médiation des réactions allergiques et de la sensibilisation.
4.2.3 Détermination de la causalité
D'après les éléments de preuve suivants : (i) le lien entre l'exposition à la PACA et la fonction pulmonaire relevé dans les RS-MA menées par Heinrich et al. (2016) et Bowatte et al. (2015) et un faible nombre d'autres revues systématiques sans méta-analyse indiquant une tendance de liens positifs (c.-à-d. liens positifs essentiellement au seuil de signification lorsque la sensibilisation se limite à des allergènes précis); (ii) les preuves expérimentales à l'appui d'une sensibilisation allergique et d'une exacerbation des réactions allergiques tirées d'études chez l'humain et d'études expérimentales sur des animaux, il est conclu que les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et la sensibilisation allergique ainsi que les réactions allergiques .
Un mécanisme plausible pour les effets sur le système immunitaire entraînant une sensibilisation allergique et une exacerbation des réactions peut être attribuable aux effets adjuvants des GED et des PM, lesquels sont médiés par une augmentation des IgE (principaux médiateurs de la sensibilisation et des réactions allergiques) ainsi que des cellules immunitaires et des molécules pro-inflammatoires.
4.3 Fonction pulmonaire
4.3.1 Données probantes tirées de la revue globale
La RS-MA menée par Barone-Adesi et al. (2015) s'est penchée sur le lien entre l'exposition au NO2 dans l'air ambiant et la réduction absolue et en pourcentage des mesures de la fonction pulmonaire chez les enfants et les adolescents, en s'appuyant sur des études menées en Europe, en Amérique du Nord et en Asie. La méta-analyse à effets aléatoires a permis de définir une réduction significative du VEMS absolu (−8 ml [IC à 95 % : −14 à −1 ml]; p = 0,01) par augmentation de 10 µg/m3 en NO2, avec une hétérogénéité modérée (I 2 = 32 %) et une réduction du VEMS en pourcentage (−0,7 % [IC à 95 % : −1,1 % à −0,3 %]; p = 0,001) par augmentation de 10 µg/m3 en NO2, avec une faible hétérogénéité (I2 < 1 %). Chacune des études primaires incluses dans la méta-analyse a relevé une relation inverse entre le NO2 et la fonction pulmonaire, ce qui démontre une cohérence entre les études primaires. Cependant, la plupart n'ont pas signalé d'effet significatif, indiquant qu'un biais de publication est peu probable. D'ailleurs, étant donné que la plupart des études primaires sur lesquelles s'est penchée cette RS-MA ont été menées en Amérique du Nord et en Europe, les résultats sont considérés comme pertinents dans le cadre d'une évaluation canadienne en ce qui a trait au mélange de polluants atmosphériques, au niveau de vie, aux soins de santé, au climat, etc.
Les revues systématiques de Schultz et al. (2017) et de Götschi et al. (2008) appuient les résultats de la RS-MA de Barone-Adesi et al. (2015). Plus précisément, la revue systématique récente de Schultz et al. (2017) traite, elle aussi, principalement d'études transversales et longitudinales évaluant la fonction pulmonaire chez les enfants et les adolescents et les répercussions de l'exposition à la PACA. Les études examinées ont utilisé diverses méthodes d'évaluation de l'exposition, y compris la RUT, les modèles de dispersion, la surveillance, le comptage de la circulation automobile et la distance des routes. Presque toutes les études primaires ont indiqué l'existence de déficits de la fonction pulmonaire avec l'exposition à la PACA, bien que seul un faible nombre ait atteint le seuil de signification statistique. Dans l'ensemble, les estimations de l'ampleur de l'effet concernant les mesures de la fonction pulmonaire étaient faibles et sont susceptibles de ne pas être pertinentes sur le plan physiologique à l'échelle individuelle; cependant, lorsque la variabilité au sein d'une population est prise en compte, ces déficits pourraient augmenter la prévalence d'individus sous les seuils cliniquement pertinents. Les études longitudinales indiquaient un lien possible entre l'exposition à la PACA et une diminution de la croissance de la fonction pulmonaire chez les enfants d'âge scolaire et les adolescents; cependant, les répercussions des expositions au début de la vie n'ont pas été définies. De plus, l'exposition à la circulation automobile et à la PACA est omniprésente; les répercussions générales sur la santé publique pourraient donc être considérables. La revue systématique n'a pas permis de définir une période de risque; il est plutôt possible que toute exposition, des premiers stades de la vie jusqu'à l'adolescence, ait des répercussions sur la fonction pulmonaire.
4.3.2 Preuves expérimentales provenant d'autres évaluations
Les aspects pertinents de l'évaluation des gaz d'échappement de la circulation automobile, des principaux composants de la PACA, ou des deux, par l'HEI, Santé Canada et l'US EPA des É.-U., ont été examinés en vue d'extraire les conclusions fondées sur des études de toxicologie animale et des études d'exposition contrôlée chez l'humain afin de mieux comprendre le lien entre l'exposition à la PACA et les altérations de la fonction pulmonaire ainsi que les preuves pertinentes relativement aux résultats de la revue globale. Bien que bon nombre de ces études portent sur des périodes d'exposition à court terme, les réactions biologiques observées sont informatives, car elles fournissent des renseignements mécanistes sur les voies d'activation possibles pouvant entraîner les effets observés dans les études épidémiologiques à long terme. Un résumé des résultats offrant des preuves biologiques et mécanistes figure ci-dessous aux fins d'établissement de la plausibilité biologique.
Selon l'évaluation de la PACA par l'HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010), des effets sur la fonction pulmonaire ont été relevés dans plusieurs études menées auprès d'individus en bonne santé et d'individus asthmatiques, y compris une diminution du VEMS et de la CVF, avec des répercussions plus importantes chez les individus atteints de formes d'asthme plus graves.
Selon les évaluations des GED (2016a) et des GEE (2017) menées par Santé Canada, des études contrôlées sur l'exposition humaine ont démontré que l'exposition aux GED entraînait des augmentations de la résistance des voies aériennes (RA) et de la résistance spécifique des voies aériennes (sRAW) chez les individus en bonne santé et asthmatiques; cependant, toutes les études examinées ont été menées à des concentrations supérieures aux concentrations dans l'air ambiant. Dans le cadre d'études expérimentales sur les animaux, il a également été démontré que l'exposition à court terme aux GED altérait la RA. De plus, dans l'évaluation menée par le HEI (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010), il a été démontré que l'exposition chronique aux GED chez les animaux de laboratoire, à des concentrations beaucoup plus élevées que les concentrations dans l'air ambiant, modifiait la structure et la fonction pulmonaires. En ce qui concerne l'exposition aux GEE, des études menées sur des animaux de laboratoire ont indiqué des altérations de la fonction pulmonaire, y compris des changements dans la pression trachéale ainsi qu'une diminution du débit expiratoire moyen et du DEP.
En ce qui a trait aux composants précis de la PACA, dans l'évaluation du NO2 menée par Santé Canada (2016b), les études d'exposition contrôlée chez l'humain ont déterminé que l'exposition à des concentrations ambiantes de NO2 n'avait aucun effet sur la fonction pulmonaire, mesurée en fonction du VEMS, de la CVF, du volume gazeux thoracique, ou de la RA, chez les adultes en bonne santé avec et sans provocation bronchique. Chez les personnes souffrant d'asthme, de maladie pulmonaire obstructive chronique (MPOC) ou d'allergies, les résultats divergeaient, avec de faibles effets sur la fonction pulmonaire, y compris une diminution du VEMS et de la CVF, une augmentation de la sRAW et une diminution du DEP après l'exposition à des concentrations ambiantes de NO2 avec et sans provocation bronchique. Dans un faible nombre d'études menées sur des animaux, il a été signalé que l'exposition à des concentrations élevées de NO2 causait une augmentation de la RA et une réduction de la compliance ou de l'élasticité des poumons. En comparaison, l'ISA de l'EPA des É.-U. concernant le NO2 (2016) a déterminé qu'il existait de faibles preuves tirées d'études d'exposition contrôlée chez l'humain montrant qu'une exposition à court terme au NO2 affectait la fonction pulmonaire chez les adultes en bonne santé. Bien que la plupart des études n'aient révélé aucun effet, quelques études ont signalé de légères augmentations ou diminutions du VEMS et de la CVF après des expositions à court terme et à des doses répétées de concentrations plus élevées de NO2. Dans le cadre d'études expérimentales sur les animaux, des résultats divergents ont également été signalés quant à l'effet du NO2 sur la fonction pulmonaire.
Selon l'évaluation des PM2,5 menée par Santé Canada (2013), des études d'exposition contrôlée chez l'humain menées auprès d'adultes en bonne santé et d'adultes atteints d'affections médicales préexistantes, y compris d'asthme et de la MPOC, ont signalé que l'exposition aux PCAA n'avait aucun effet sur la fonction pulmonaire mesurée en fonction du VEMS et de la CVF. Une augmentation du volume courant a été signalée dans le cadre d'une étude ayant analysé l'effet des PCAA chez les personnes asthmatiques comparativement aux personnes en bonne santé. Il a été signalé que l'exposition aux PUF entraînait une diminution du DEM25-75, de la capacité de diffusion du CO et du volume courant chez les adultes en bonne santé. De plus, la revue menée par le Panel on the Health Effects of Traffic-Related Air Pollution de l'HEI (2010) a révélé qu'un petit nombre d'études toxicologiques chez l'humain ont signalé que l'exposition aux PCAA avait un faible effet sur la fonction pulmonaire (DEMM et saturation en oxygène) chez les adultes en bonne santé et, dans une moindre mesure, chez les adultes atteints de MPOC. L'ISA de l'EPA des É.-U. concernant les PM (2009) a révélé que, dans le cadre d'études de panel, les PM dans l'air ambiant (PM2,5 et PM10) étaient liées à une diminution des paramètres de la fonction pulmonaire, y compris le VEMS, chez les enfants asthmatiques. Des études de panel menées auprès d'adultes ont signalé que les PM étaient liées à une diminution de la fonction pulmonaire; cependant, le lien n'était pas aussi fort que chez les enfants.
Dans l'ensemble, les revues de la base de données expérimentales indiquent un lien potentiel entre l'exposition à la PACA, aux GED, aux GEE ou aux PM et les altérations des mesures de la fonction pulmonaire, indiquant une cohérence avec les preuves épidémiologiques, alors que les résultats divergeaient concernant le NO2. Un mécanisme d'action proposé est que les composants des gaz d'échappement de la circulation automobile provoquent un stress oxydatif et une inflammation dans les voies respiratoires, ce qui pourrait causer des lésions tissulaires. Les tissus touchés peuvent jouer un rôle dans la modification de la structure et de la fonction des poumons (HEI Panel on the Health Effects of Traffic-Related Air Pollution, 2010).
4.3.3 Détermination de la causalité
D'après les éléments de preuve suivants : (i) le lien significatif entre l'exposition à la PACA et la fonction pulmonaire relevé dans la RS-MA menée par Barone-Adesi et al. (2015) et un faible nombre de revues systématiques sans méta-analyse indiquant une relation inverse entre la fonction pulmonaire et l'exposition à la PACA; (ii) les preuves expérimentales à l'appui, tirées d'études de panel, d'études d'exposition contrôlée chez l'humain et d'études expérimentales menées sur des animaux indiquant une altération de la fonction pulmonaire après l'exposition à la PACA ou à ses composants, il est conclu qu'il existe suffisamment de preuves que le lien entre l'exposition à la PACA et les effets sur la fonction pulmonaire en est probablement un de causalité .
Un mécanisme d'action plausible pour les changements de la fonction pulmonaire est que les effets sont probablement médiés par un stress oxydatif et une réaction inflammatoire dans les voies respiratoires, ce qui peut altérer la fonction et les tissus pulmonaires.
Conclusion
À l'aide d'une approche de revue globale, cette évaluation des risques a évalué le lien entre l'exposition à long terme à la PACA et l'incidence et la prévalence d'asthme et d'allergies ainsi que de changements dans la fonction pulmonaire. Ces liens ont été évalués de même que les preuves expérimentales pertinentes recueillies à partir d'une revue des documents d'évaluation existants pour les composants de la PACA, dans le cadre d'une méthode du poids de la preuve visant à déterminer le rôle de l'exposition à long terme à la PACA sur les critères d'évaluation en matière de santé, soit l'asthme, les allergies et la fonction pulmonaire.
Selon l'ensemble du poids de la preuve, il est conclu que :
- les données sont suffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et l'incidence d'asthme chez les enfants;
- les données sont suffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et la prévalence d'asthme chez les enfants;
- les données sont insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et l'incidence d'asthme chez les adultes;
- les données sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et la prévalence d'asthme chez les adultes;
- les données sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à la PACA et la sensibilisation allergique et les réactions allergiques;
- les données sont suffisantes pour conclure à un lien de causalité probable entre l'exposition à la PACA et des effets sur la fonction pulmonaire.
Principales incertitudes et lacunes
Les conclusions de cette évaluation des risques se fondent sur la littérature épidémiologique évaluant les effets sur la santé liés aux polluants de la PACA. En ce qui concerne les effets sur la santé pris en compte dans cette évaluation des risques, la plupart des données probantes avaient trait au NO2 et, dans certains cas, étaient appuyées par des données sur les PM2,5 et le CN, offrant ainsi un certain degré de certitude que les conclusions sont attribuables à la PACA, car le NO2 est considéré comme la mesure la plus directe de la PACA. Bien que le NO2 soit largement utilisé comme marqueur de substitution pour la quantification de l'exposition à la PACA, le NO2 n'a pas été défini comme un agent causal pour les effets sur la santé. La plupart des estimations d'effets incluses dans les méta-analyses proviennent de modèles à polluants uniques; bien que cette méthode soit considérée comme appropriée, elle limite la capacité à définir un agent causal, compte tenu du degré élevé de corrélation entre les polluants de la PACA. D'autres études, y compris des modèles à polluants multiples, seraient donc nécessaires pour définir le ou les agents causals appartenant au mélange de la PACA responsables des effets observés sur la santé.
Bien que le processus de revue de la portée ait extrait plusieurs RS-MA et de nombreuses revues systématiques ou narratives fondées sur un ensemble considérable d'ouvrages scientifiques d'études primaires, d'importantes incertitudes demeurent quant au lien entre la PACA et l'asthme, les allergies et la fonction pulmonaire; ces incertitudes sont décrites ci-dessous.
L'ensemble des ouvrages scientifiques ayant évalué le lien entre l'exposition à la PACA et l'asthme était le plus important parmi tous les critères d'évaluation en matière de santé sur lesquels se penchait cette évaluation. Plus précisément, il y avait suffisamment d'études primaires pour l'élaboration et la publication de cinq RS-MA sur l'asthme, alors que seulement deux RS-MA sur les allergies et un seul RS-MA sur la fonction pulmonaire ont été extraites. Les cinq RS-MA évaluant l'asthme étaient fondées sur 57 articles d'études primaires. Malgré cette base de données d'ouvrages scientifiques relativement étendue, on connaît peu les répercussions de la PACA sur la santé liée à l'asthme chez les adultes, y compris concernant l'apparition d'asthme à l'âge adulte, car la plupart des études se sont concentrées sur les enfants et les jeunes. Chez les enfants et les jeunes, d'autres études sont nécessaires pour déterminer la ou les périodes de risque pour l'apparition d'asthme, y compris sur l'exposition à la PACA durant les premiers stades de la vie et in utero. Un faible nombre d'études primaires ont défini des interactions possibles entre les gènes et l'environnement qui pourraient jouer un rôle dans le risque d'asthme. Il convient de souligner un problème prédominant dans les études primaires existantes, soit un manque de cohérence quant aux définitions des résultats sur la santé liés à l'asthme. La normalisation des définitions réduirait le potentiel de biais d'erreur de classification dans de futures études. De plus, l'utilisation de données administratives ou de soins de santé concernant l'état pathologique pourrait réduire la dépendance aux questionnaires et au signalement des résultats sur la santé par les sujets eux-mêmes (ou les parents), afin de réduire également le potentiel de biais d'erreur de classification. Les RS-MA comprenaient les estimations des risques ayant été ajustées pour les facteurs de confusion (p. ex. tabagisme, SSE et facteurs héréditaires) des études primaires, le cas échéant; cependant, le nombre de facteurs de confusion pris en compte et précisés variait entre les études. La cohérence en matière d'inclusion et de précision des principaux facteurs de confusion améliorerait la robustesse des synthèses quantitatives. De plus, plusieurs méthodes ont été utilisées pour estimer l'exposition à la PACA dans les études primaires, ce qui a probablement contribué à l'hétérogénéité observée dans les RS-MA; cependant, il y a un manque de cohérence quant au signalement des analyses de sensibilité ou des méta-régressions pour évaluer de façon quantitative le degré d'hétérogénéité attribuable aux différences dans la méthodologie d'évaluation de l'exposition.
En ce qui concerne les allergies, la base de données d'ouvrages scientifiques est moins étendue, car seul un petit nombre de cohortes (comptant exclusivement des enfants) évaluant les effets de la PACA sur la santé incluaient des résultats liés aux allergies. Les deux RS-MA extraites pour cette évaluation étaient fondées sur 17 articles d'études primaires. À mesure qu'augmentera le nombre d'études de grande envergure portant sur la sensibilisation et les exacerbations allergiques, il sera possible d'explorer les liens potentiels entre l'exposition à la PACA, les allergies et l'asthme allergique. Il existe une indication d'un risque plus élevé chez les enfants très jeunes et chez les enfants dont les parents souffrent de maladies allergiques; des études supplémentaires sont nécessaires pour mieux comprendre les risques pour ces sous-populations potentiellement sensibles. En outre, d'autres études, y compris des études menées à d'autres stades de la vie, permettront de définir des périodes de risque et des facteurs modifiant les risques attribuables.
En ce qui concerne la fonction pulmonaire, la base de données d'ouvrages scientifiques traitait largement d'études menées chez les enfants et les jeunes. La seule RS-MA extraite pour cette évaluation était fondée sur neuf articles d'études primaires. D'autres études sont nécessaires pour déterminer la ou les périodes de risque et les effets potentiels à long terme d'une détérioration de la fonction pulmonaire ou d'un trouble de la fonction pulmonaire de l'enfance à l'âge adulte. De plus, d'autres études chez les adultes permettraient de définir les répercussions à ce stade de la vie et contribueraient à la compréhension des risques associés à l'exposition professionnelle à la PACA.
Les données épidémiologiques ont été évaluées à l'aide d'une approche de revue globale, qui comporte des limites inhérentes. Étant donné que l'analyse se fondait sur des revues publiées, tout article d'étude primaire publié après la revue la plus récente n'a pas été extrait. Dans le cadre de cette évaluation, les articles d'études primaires inclus dans les revues avaient été publiés au plus tard en 2016. D'ailleurs, toute erreur de la part des auteurs des revues lors de la synthèse des articles d'études primaires serait transposée dans la revue globale. Cette source potentielle d'erreur est limitée par l'inclusion d'articles examinés par les pairs uniquement dans la revue globale et par le fait qu'il existe un certain degré de chevauchement des études primaires synthétisées dans les articles de révision. Bien que ce chevauchement des études primaires constitue une force des revues globales, car il aide à déterminer si les revues systématiques répondant à des questions semblables ont indépendamment fait des observations semblables et atteint des conclusions généralement semblables, le chevauchement introduit également un potentiel de biais découlant de l'inclusion de la même étude primaire dans plus d'une revue systématique ou RS-MA, menant à une surreprésentation de certaines études primaires. Ce potentiel de biais est présenté à l'annexe C, indiquant qu'il existe un certain degré de chevauchement (mais pas un chevauchement complet) entre les études primaires dans les publications examinées. Cependant, pour toute revue globale, un certain chevauchement est attendu puisque les publications ont répondu à des questions de recherche semblables.
Dans le cadre de cette évaluation des risques, les preuves biologiques et mécanistes se fondaient sur des évaluations des risques publiées entre 2009 et 2017. Aucune revue détaillée des ouvrages scientifiques mécanistes publiés depuis l'achèvement de ces évaluations existantes n'a été effectuée; par conséquent, la compréhension mécaniste dans les ouvrages scientifiques pourrait être plus approfondie que celle décrite dans cette évaluation. D'après les preuves scientifiques examinées dans le cadre de cette évaluation, d'autres études expérimentales permettraient de mieux comprendre les modes d'action du rôle de la PACA dans les traitements de l'asthme, des allergies et de la fonction pulmonaire, particulièrement en ce qui concerne les effets de l'exposition à long terme. Actuellement, la plupart des preuves expérimentales sont fondées sur des expositions à court terme et appuient l'existence d'un rôle de l'exposition à la PACA dans l'exacerbation d'une maladie existante. Cependant, le rôle de l'exposition à la PACA dans l'apparition de la maladie n'est pas bien caractérisé par les preuves expérimentales existantes. À partir des preuves expérimentales examinées dans le cadre de cette évaluation des risques, les mécanismes d'action proposés ont défini le rôle central de l'inflammation et du stress oxydatif, indiquant un chevauchement possible ou une ou plusieurs voies d'effet partagées. De plus, une compréhension plus approfondie du mécanisme aiderait également à définir le ou les composants de la PACA qui sont l'agent ou les agents causals des effets observés sur la santé. Ces renseignements pourraient être utilisés dans l'optique de documenter des politiques ou des programmes destinés à réduire ou à atténuer l'exposition à un ou plusieurs polluants précis.
Références
- Aromataris E, Fernandez R, Godfrey CM, Holly C, Khalil H, Tungpunkom P. Summarizing systematic reviews: Methodological development, conduct and reporting of an umbrella review approach. Int J Evid Based Healthc 2015;13(3):132–40.
- Barone-Adesi F, Dent JE, Dajnak D, Beevers S, Anderson HR, Kelly FJ, Cook DG, Whincup PH. Long-term exposure to primary traffic pollutants and lung function in children: Cross-sectional study and meta-analysis. PLoS ONE 2015;10(11):e0142565.
- Boothe VL, Shendell DG. Potential health effects associated with residential proximity to freeways and primary roads: Review of scientific literature, 1999-2006. J Environ Health 2008;70(8):33–41,55–6.
- Bowatte G, Lodge C, Lowe AJ, Erbas B, Perret J, Abramson MJ, Matheson M, Dharmage SC. The influence of childhood traffic-related air pollution exposure on asthma, allergy and sensitization: A systematic review and a meta-analysis of birth cohort studies. Allergy 2015;70(3):245–56.
- Bråbäck L, Forsberg B. Does traffic exhaust contribute to the development of asthma and allergic sensitization in children: Findings from recent cohort studies. Environ Health 2009;8:17.
- Bradford Hill A. The environment and disease: Association or causation? Proc R Soc Med 1965;58(5):295–300.
- Brauer M, Hoek G, Van Vliet P, Meliefste K, Fischer PH, Wijga A, Koopman LP, Neijens HJ, Gerritsen J, Kerkhof M, Heinrich J, Bellander T, Brunekreef B. Air pollution from traffic and the development of respiratory infections and asthmatic and allergic symptoms in children. Am J Respir Crit Care Med 2002;166:1092–8.
- Brauer M, Hoek G, Smit HA, de Jongste JC, Gerritsen J, Postma DS, Kerkhof M, Brunekreef B. Air pollution and development of asthma, allergy and infections in a birth cohort. Eur Respir J 2007;29:879–88.
- Brauer M, Reynolds C, Hystad P. Traffic-related air pollution and health in Canada. CMAJ 2013;185(18):1557–8.
- Choudhary H, Tarlo SM. Airway effects of traffic-related air pollution on outdoor workers. Curr Opin Allergy Clin Immunol 2014;14(2):106–12.
- Favarato G, Anderson HR, Atkinson R, Fuller G, Mills I, Walton H. Traffic-related pollution and asthma prevalence in children. Quantification of associations with nitrogen dioxide. Air Qual Atmos Health 2014;7(4):459–66.
- Gasana J, Dillikar D, Mendy A, Forno E, Ramos Vieira E. Motor vehicle air pollution and asthma in children: A meta-analysis. Environ Res 2012;117:36–45.
- GBD 2017 Risk Factor Collaborators. Global, regional, and national comparative risk assessment of 84 behavioural, environmental and occupational, and metabolic risks or clusters of risks for 195 countries and territories, 1990–2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392(10159):1923–94.
- Gehring U, Cyrys J, Sedlmeir G, Brunekreef B, Bellander T, Fischer P, Bauer CP, Reinhardt D, Wichmann HE, Heinrich J. Traffic-related air pollution and respiratory health during the first 2 yrs of life. Eur Respir J 2002;19(4):690–8.
- Gehring U, Wijga AH, Brauer M, Fischer P, de Jongste JC, Kerkhof M, Oldenwening M, Smit HA, Brunekreef B. Traffic-related air pollution and the development of asthma and allergies during the first 8 years of life. Am J Respir Crit Care Med 2010;181(6):596–603.
- Götschi T, Heinrich J, Sunyer J, Künzli N. Long-term effects of ambient air pollution on long function: A review. Epidemiology 2008;19(5):690–701.
- Santé Canada. Les impacts sur la santé de la pollution de l'air au Canada : Estimation de la morbidité et des décès prématurés, Rapport 2019. Ottawa, Ontario, Canada : Santé Canada; 2019. http://publications.gc.ca/site/fra/9.874082/publication.html .
- Santé Canada. Évaluation des risques pour la santé humaine des gaz d'échappement des moteurs à essence. Ottawa, Ontario, Canada : Santé Canada; 2017. http://publications.gc.ca/collections/collection_2017/sc-hc/H144-52-2017-fra.pdf .
- Santé Canada. Évaluation des risques pour la santé humaine des gaz d'échappement des moteurs diesel. Ottawa, Ontario, Canada : Santé Canada; 2016a. http://publications.gc.ca/collections/collection_2016/sc-hc/H129-60-2016-fra.pdf .
- Santé Canada. Évaluation des risques pour la santé humaine du dioxyde d'azote ambiant. Ottawa, Ontario, Canada : Santé Canada; 2016b. http://publications.gc.ca/collections/collection_2016/sc-hc/H114-31-2016-fra.pdf .
- Santé Canada. Évaluation scientifique canadienne du smog, volume 2 : Effets sur la santé. Ottawa, Ontario, Canada : Santé Canada; 2013. http://publications.gc.ca/collections/collection_2014/sc-hc/En88-5-2-2013-fra.pdf .
- HEI Panel on the Health Effects of Traffic-Related Air Pollution. Traffic-related air pollution: A critical review of the literature on emissions, exposure, and health effects. HEI Special Report 17. Boston, MA: Health Effects Institute; 2010.
- Heinrich J, Guo F, Fuertes E. Traffic-related air pollution exposure and asthma, hayfever, and allergic sensitisation in birth cohorts: a systematic review and meta-analysis. Geoinfor Geostat: An Overview 2016;4:4.
- Heinrich J. Influence of indoor factors in dwellings on the development of childhood asthma. Int J Hyg Environ Health 2011;214(1):1–25.
- Hill DA, Spergel JM. The atopic march: Critical evidence and clinical relevance. Ann Allergy Asthma Immunol 2018;120(2):131–7.
- Jacquemin B, Schikowski T, Carsin AE, Hansell A, Krämer U, Sunyer J, Probst-Hensch N, Kauffmann F, Künzli N. The role of air pollution in adult-onset asthma: A review of the current evidence. Semin Respir Crit Care Med 2012;33(6):606–19.
- Khreis H, Nieuwenhuijsen MJ. Traffic-related air pollution and childhood asthma: Recent advances and remaining gaps in the exposure assessment methods. Int J Environ Res Public Health 2017;14(3):312.
- Khreis H, Kelly C, Tate J, Parslow R, Lucas K, Nieuwenhuijsen M. Exposure to traffic-related air pollution and risk of development of childhood asthma: A systematic review and meta-analysis. Environ Int 2017;100:1–31.
- Koppen G, Bloeman K, Colles A, Nelen V, Desager K, Schoeters G. Exposure to traffic-related air pollutants in the perinatal period of life in relation to respiratory health in infancy. Crit Rev Environ Sci Technol 2011;41(22):2003–25.
- Krämer U, Sugiri D, Ranft U, Krutmann J, von Berg A, Berdel D, Behrendt H, Kuhlbusch T, Hochadel M, Wichmann HE, GINIplus and LISAplus study groups. Eczema, respiratory allergies, and traffic-related air pollution in birth cohorts from small-town areas. J Dermatol Sci 2009;56(2):99–105.
- Kuruvilla ME, Lee FE, Lee GB. Understanding asthma phenotypes, endotypes, and mechanisms of disease. Clin Rev Allergy Immunol 2019;56(2):219–33.
- Liang BM, Lam DC, Feng YL. Clinical applications of lung function tests: A revisit. Respirology 2012;17(4):611–9.
- Matz CJ, Stieb DM, Egyed M, Brion O, Johnson M. Evaluation of daily time spent in transportation and traffic-influenced microenvironments by urban Canadians. Air Qual Atmos Health 2018;11(2):209–20.
- Matz CJ, Egyed M, Hocking R, Seenundun S, Charman N, Edmonds N. Human health effects of traffic-related air pollution (TRAP): A scoping review protocol. Syst Rev 2019;8:223.
- Morgenstern V, Zutavern A, Cyrys J, Brockow I, Gehring U, Koletzko S, Bauer CP, Reinhardt D, Wichmann HE, Heinrich J. Respiratory health and individual estimated exposure to traffic-related air pollutants in a cohort of young children. Occup Environ Med 2007;64(1):8–16.
- Morgenstern V, Zutavern A, Cyrys J, Brockow I, Koletzko S, Krämer U, Behrendt H, Herbarth O, von Berg A, Bauer CP, Wichmann HE, Heinrich J, GINI Study Group, LISA Study Group. Atopic diseases, allergic sensitization, and exposure to traffic-related air pollution in children. Am J Respir Crit Care Med 2008;177(12):1331–7.
- Nordling E, Berglind N, Melén E, Emenius G, Hallberg J, Nyberg F, Pershagen G, Svartengren M, Wickman M, Bellander T. Traffic-related air pollution and childhood respiratory symptoms, function and allergies. Epidemiology 2008;19(3):401–8.
- Oftedal B, Nystad W, Brunekreef B, Nafstad P. Long-term traffic-related exposures and asthma onset in schoolchildren in Oslo, Norway. Environ Health Perspect 2009;117(5):839–44.
- Pollock J, Shi L, Gimbel RW. Outdoor environment and pediatric asthma: An update on the evidence from North America. Can Respir J 2017;2017:8921917.
- Reber LL, Hernandez JD, Galli SJ. The pathophysiology of anaphylaxis. J Allergy Clin Immunol 2017;140(2):335–48.
- Richmond-Bryant J, Saganich C, Bukiewicz L, Kalin R. Associations of PM2.5 and black carbon concentrations with traffic, idling, background pollution, and meteorology during school dismissals. Sci Total Environ 2009;407(10):3357–64.
- Salam MT, Islam T, Gilliland FD. Recent evidence for adverse effects of residential proximity to traffic sources on asthma. Curr Opin Pulm Med 2008;14(1):3–8.
- Schultz ES, Litonjua AA, Melén E. Effects of long-term exposure to traffic-related air pollution on lung function in children. Curr Allergy Asthma Rep 2017;17(6):41.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, Moher D, Tugwell P, Welch V, Kristjansson E, Henry DA. AMSTAR 2: A critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ 2017;358:j4008.
- US EPA. Integrated Science Assessment for particulate matter (final report, December 2009). EPA/600/R-08/139F. Washington, DC: United States Environmental Protection Agency; 2009. https://ofmpub.epa.gov/eims/eimscomm.getfile?p_download_id=494959 .
- US EPA. Preamble to the Integrated Science Assessments (ISA). EPA/600/R-15/067. Washington, DC: United States Environmental Protection Agency; 2015.
- US EPA. Integrated Science Assessment for oxides of nitrogen – Health criteria (final report, 2016). EPA/600/R-15/068. Washington, DC: United States Environmental Protection Agency; 2016. http://ofmpub.epa.gov/eims/eimscomm.getfile?p_download_id=526855 .
Annexes
Annexe A. Stratégie de recherche plus précise pour la mise à jour de la documentation
Embase
Base(s) de données : Embase, de l'année 1974 au 29 octobre 2018
Stratégie de recherche :
| # | RecherchesFootnote a | Résultats |
|---|---|---|
| 1 | gaz d'échappement | 17 550 |
| 2 | exp véhicule motorisé/ | 36 574 |
| 3 | conduite automobile/ | 13 476 |
| 4 | exp circulation automobile/ | 123 574 |
| 5 | circulation et transport/ | 13 276 |
| 6 | oxyde d'azote/ | 9 857 |
| 7 | dioxyde d'azote/ | 10 413 |
| 8 | monoxyde de carbone/ | 33 146 |
| 9 | dioxyde de carbone/ | 81 049 |
| 10 | ozone/ | 25 237 |
| 11 | composé organique volatil/ | 15 161 |
| 12 | carbone noir/ | 1 979 |
| 13 | matières particulaires/ | 36 238 |
| 14 | exp hydrocarbure aromatique polycyclique/ | 69 576 |
| 15 | exp pollution atmosphérique/ | 138 272 |
| 16 | ((distanc* or proximit*) adj3 (circulation automobile* or route* or autoroute* or voie réservée*)).tw,kw. | 2 042 |
| 17 | exposition à la circulation automobile*.tw,kw. | 325 |
| 18 | émanation/ | 1 904 |
| 19 | ((automobil* or autocar* or autobus* or motor* or véhic* or taxi* or diesel* or pétrole* or moteur? or camion* or bus or autoroute* or stationnement* or circulation automobile*) adj4 (échappement? or émission* or pollut* or vapeur* or volatil* or effluv* or fum* or éman? or brum? or smog* or oxyde d'azote* or NOx or 11104-93-1 or monoxyde de carbone* or 630-08-0 or dioxyde de carbone or 124-38-9 or composés organiques volatiles or COV or nitrate de peroxyacétyle or 2278-22-0 or hydrocarbure aromatique polycyclique* or arene* or HAP or carbon* or hydrocarbure polynucléaire aromatique*)).tw,kw. | 18 886 |
| 20 | 1 or ((or/2-5) and (or/6-18)) or 19 [PACA] | 30 534 |
| 21 | exp santé/ | 610 569 |
| 22 | santé publique/ | 153 138 |
| 23 | « maladie physique par étiologie et pathogénèse »/ or « maladie aiguë »/ or exp aplasie/ or exp ascite/ or exp atrophie/ or exp saignement/ or exp calcification/ or exp canalopathie/ or trouble d'origine chimique/ or exp maladie chronique/ or exp complication/ or maladie grave/ or exp kyste/ or exp déformation/ or exp dégénération/ or exp diverticulite/ or exp dysplasie/ or exp dystrophie/ or exp tissu ectopique/ or exp œdème/ or exp épanchement/ or exp emphysema/ or maladie endémique/ or maladie environnementale/ or épidémie/ or exp fibrose/ or exp fistule/ or exp « troubles génétiques et familiaux »/ or exp guérison insuffisante/ or exp hernie/ or exp hyperplasie/ or exp hypertrophie/ or exp hypoplasie/ or exp hypotrophie/ or exp maladie iatrogénique/ or maladie idiopathique/ or exp infection/ or exp inflammation/ or exp ischémie/ or exp « lésions et malformations »/ or exp malnutrition/ or exp métaplasie/ or exp nécrose/ or maladie négligée/ or néointima/ or exp néoplasie/ or exp « néovascularisation (pathologie) »/ or maladie non transmissible/ or exp maladie professionnelle/ or pandémie/ or exp pseudo-tumeur/ or maladie rare/ or maladie récurrente/ or rechute/ or réaction de réversion/ or exp sclérose/ or exp « sténose, occlusion etobstruction »/ or exp formation de calculs/ or exp thésaurismose/ or exp enflure/ or syndrome/ or maladie systémique/ or maladie terminale/ or exp thromboembolie/ or exp torsion/ or exp « toxicité et intoxication »/ or exp ulcère/ | 12 680 502 |
| 24 | exp maladie mentale/ | 1 942 944 |
| 25 | maladie physique/ or exp maladie physique par structure anatomique/ or exp maladie physique par fonction de l'organisme/ or exp « maladie physique par composition des liquides corporels, des déjections et des sécrétions »/ or exp « maladie physique par âge de développement »/ | 15 858 535 |
| 26 | maladies/ | 144 951 |
| 27 | exp mortalité/ | 939 107 |
| 28 | risque de mortalité/ | 9 956 |
| 29 | exp épidémiologie/ | 2 970 940 |
| 30 | exp surveillance épidémiologique/ | 1 596 |
| 31 | exp données épidémiologiques/ | 3 001 068 |
| 32 | santé environnementale/ | 29 077 |
| 33 | génotoxicité/ | 30 263 |
| 34 | lésion génétique/ | 2 060 |
| 35 | activité mutagène/ | 2 443 |
| 36 | mutagénicité/ | 18 332 |
| 37 | exp développement postnatal / | 65 811 |
| 38 | exp toxicité/ | 626 744 |
| 39 | exp fonctions biologiques/ | 20 916 936 |
| 40 | santé environnementale/ | 29 077 |
| 41 | stress environmental / | 7 975 |
| 42 | « qualité de vie »/ | 402 513 |
| 43 | hospitalisation/ or admission à l'hôpital/ | 461 230 |
| 44 | (ÉIQ or écart interquartile*).tw,kw. | 100 168 |
| 45 | ((population* or humain* or citoyen* or nation* or public or communaut* or individu* or personne* or homme or femme* or enfant* or bas âge* or nouveau-né* or néonat* or bébé* or adolescen* or pré-adolescen* or prépub* or adult* or personne âgée*) adj3 (santé* or maladie*)).tw,kw. | 1 230 793 |
| 46 | or/21-45 [effets sur la santé] | 26 922 678 |
| 47 | limiter 46 à ((anglais ou français) et année = « 2000 – aujourd'hui ») | 16 566 835 |
| 48 | 20 and 47 [PACA + santé chez l'humain] | 14 701 |
| 49 | limiter 48 à humain | 7 714 |
| 50 | (humain* or personn* or homme? or femme or enfant* or bas âge* or nouveau-né* or néonat* or bébé or adolecen* or pré-adolescen* or prépub* or adult* or personne âgée*).tw,kw. | 8 485 534 |
| 51 | exp humain/ | 18 945 713 |
| 52 | 48 and (50 or 51) | 9 060 |
| 53 | non humain/ | 5 579 407 |
| 54 | 48 not 53 | 12 272 |
| 55 | 49 or 52 or 54 | 13 324 |
| 56 | limiter 55 à statut conférence résumé | 1 721 |
| 57 | 55 not 56 | 11 603 |
| 58 | exp fonction pulmonaire/ | 121 599 |
| 59 | exp test de la fonction pulmonaire/ | 152 815 |
| 60 | exp allergies voies respiratoires/ | 268 493 |
| 61 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj4 (hyperréacti* or hypersensib* or sensibili* or inflam* or allerg* or obstruct* or spasme* or mastocyte* or immunoglobuline E or immunoglobuline epsilon or IgE or eosinophil*)).tw,kw. | 236 826 |
| 62 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj4 (fonction* or dysfonction* or mécani?)).tw,kw. | 168 798 |
| 63 | (asthm* or alvéolite* or respiration sifflante* or « souffle court » or dyspnée* or rhinite or clairance mucociliaire*).tw,kw. | 318 766 |
| 64 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj3 (remodèl* or résist* or compliance or circulation or clairance* or diffus* or perfus* or éliminat* or ventilat* or absorb* or absorp* or volum* or échang*)).tw,kw. | 224 598 |
| 65 | (débit expiratoire forcé or ventilation or maxim* or expirat* or de pointe).tw,kw. | 32 519 |
| 66 | (respir* adj3 (débit* or transport* or espace vide* or son*)).tw,kw. | 35 282 |
| 67 | (capacité pulmonaire totale or volume de fermeture* or capacité fonctionnelle résiduelle* or capacité vitale* or manœuvre de Valsalva* or rapport ventilation perfusion? or « travail ventilatoire »).tw,kw. | 34 082 |
| 68 | (gazométrie sanguine* or gazomètre sanguin* or oxymétr* or provocation bronch* or capnograph* or épreuve à l'effort or respiratoire maxim* or spirométr* or bronchospiro* or épreuve respiratoire à l'hydrogène or rinçage d'azote or épreuve à l'azote or pneumograph* or tachygraphie pulmonaire or spirograph* or pléthysmograph* or épreuve de bronchodilatation).tw,kw. | 109 897 |
| 69 | or/58-68 [Lung Function and Hypersensitivity] | 1 000 518 |
| 70 | 20 and 69 [TRAP and Lung Fx] | 3 380 |
| 71 | limiter 70 à ((anglais ou français) and année = « 2000 – aujourd'hui ») | 2 820 |
| 72 | limiter 71 à human | 2 151 |
| 73 | 71 and (50 or 51) | 2 335 |
| 74 | 71 not 53 | 2 186 |
| 75 | 72 or 73 or 74 [limiter à humain] | 2 518 |
| 76 | limiter 75 à statut conférence résumé | 657 |
| 77 | 75 not 76 | 1 861 |
| 78 | 57 and (2000* or 2001* or 2002* or 2003* or 2004* or 2005* or 2006* or 2007* or 2008* or 2009* or 2010* or 2011* or 2012* or 2013* or 2014* or 2015* or 2016* or 2017* or "201801" or "201802" or "201803").dd,dc. [résultats obtenus auparavant] | 10 771 |
| 79 | 77 not 78 [nouveaux résultats seulement] | 167 |
Footnotes
|
||
Medline
Base(s) de données : Ovid MEDLINE® ALL, année 1946 au 29 octobre 2018
Stratégie de recherche :
| # | RecherchesFootnote a | Résultats |
|---|---|---|
| 1 | Émissions de véhicules/ | 8 973 |
| 2 | exp véhicules motorisés/ | 19 206 |
| 3 | transport/ | 9 191 |
| 4 | Conduite automobile/ | 17 575 |
| 5 | Stationnement/ | 354 |
| 6 | exp oxydes d'azote/ | 106 370 |
| 7 | Monoxyde de carbone/ | 17 162 |
| 8 | Dioxyde de carbone/ | 83 413 |
| 9 | Ozone/ | 13 376 |
| 10 | Composés organiques volatils/ | 7 244 |
| 11 | Suie/ | 1 224 |
| 12 | matières particulaires/ or exp poussière/ or smog/ | 34 446 |
| 13 | exp hydrocarbures aromatiques polycycliques/ | 421 412 |
| 14 | pollution atmosphérique/ or pollution de l'air pollution, intérieur/ | 38 935 |
| 15 | ((distanc* or proximit*) adj3 (circulation automobile* or route* or autoroute* or voie réservée*)).tw,kw. | 1 551 |
| 16 | exposition à la circulation automobile*.tw,kw. | 245 |
| 17 | ((automobil* or autocar* or autobus* or motor* or véhic* or taxi* or diesel* or pétrole* or moteur? or camion* or bus or autoroute* or stationnement* or circulation automobile*) adj4 (échappement? or émission* or pollut* or vapeur* or volatil* or effluv* or fum* or éman? or brum? or smog* or oxyde d'azote* or NOx or 11104-93-1 or monoxyde de carbone* or 630-08-0 or dioxyde de carbone or 124-38-9 or composés organiques volatiles or COV or nitrate de peroxyacétyle or 2278-22-0 or hydrocarbure aromatique polycyclique* or arene* or HAP or carbon* or hydrocarbure polynucléaire aromatique*)).tw,kw. | 12 401 |
| 18 | 1 or ((or/2-5) and (or/6-16)) or 17 [TRAP] | 16 709 |
| 19 | exp santé/ | 328 876 |
| 20 | exp « maladies (non mesh) »/ | 13 880 966 |
| 21 | exp troubles mentaux/ | 1 139 305 |
| 22 | exp morbidité/ | 497 580 |
| 23 | exp mortalité/ | 349 192 |
| 24 | exp épidémiologie/ | 25 193 |
| 25 | surveillance épidémiologique/ | 6 160 |
| 26 | exp « croissance et développement »/ | 1 309 018 |
| 27 | « qualité de vie »/ | 167 995 |
| 28 | exp hospitalisation/ | 212 739 |
| 29 | (ÉIQ or écart interquartile*).tw,kf. | 49 460 |
| 30 | (santé* or maladie* or mortalit* or morbidit* or trouble* or malad*).tw,kw. | 6 579 511 |
| 31 | or/19-30 [effets sur la santé] | 16 974 109 |
| 32 | limiter 31 à ((anglais ou français) and année = "2000 – aujourd'hui") | 8 572 367 |
| 33 | 18 and 32 [PACA + santé chez l'humain] | 5 937 |
| 34 | limiter 33 à humain | 4 101 |
| 35 | (humain* or personn* or homme? or femme or enfant* or bas âge* or nouveau-né* or néonat* or bébé or adolecen* or pré-adolescen* or prépub* or adult* or personne âgée*).tw,kw. | 6 930 547 |
| 36 | exp humain/ | 17 354 272 |
| 37 | 33 and (34 or 35) | 4 774 |
| 38 | exp modèles animaux/ | 520 311 |
| 39 | exp expérience sur les animaux/ | 8 843 |
| 40 | 33 not (37 or 38) | 1 098 |
| 41 | 34 or 37 or 40 | 5 872 |
| 42 | limiter 41 à éd. = 20170526-20171231 | 300 |
| 43 | limiter 41 à éd. = 20180101-20180405 | 158 |
| 44 | exp asthme/ or exp hypersensibilité respiratoire/ | 146 551 |
| 45 | exp épreuves fonction respiratoire/ | 223 640 |
| 46 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj4 (hyperréacti* or hypersensib* or sensibili* or inflam* or allerg* or obstruct* or spasme* or mastocyte* or immunoglobuline E or immunoglobuline epsilon or IgE or eosinophil*)).tw,kw. | 166 799 |
| 47 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj4 (fonction* or dysfonction* or mécani?)).tw,kw. | 117 476 |
| 48 | (asthm* or alvéolite* or respiration sifflante* or « souffle court » or dyspnée* or rhinite or clairance mucociliaire*).tw,kw. | 217 480 |
| 49 | ((voie respiratoire* or respir* or pulmon* or poumon* or bronch* or alvéol* or pneumo* or vascula*) adj3 (remodèl* or résist* or compliance or circulation or clairance* or diffus* or perfus* or éliminat* or ventilat* or absorb* or absorp* or volum* or échang*)).tw,kw. | 168 236 |
| 50 | (débit expiratoire forcé or ventilation or maxim* or expirat* or de pointe).tw,kw. | 25 456 |
| 51 | (respir* adj3 (débit* or transport* or espace vide* or son*)).tw,kw. | 26 531 |
| 52 | (capacité pulmonaire totale or volume de fermeture* or capacité fonctionnelle résiduelle* or capacité vitale* or manœuvre de Valsalva* or rapport ventilation perfusion? or « travail ventilatoire »).tw,kw. | 24 825 |
| 53 | (gazométrie sanguine* or gazomètre sanguin* or oxymétr* or provocation bronch* or capnograph* or épreuve à l'effort or respiratoire maxim* or spirométr* or bronchospiro* or épreuve respiratoire à l'hydrogène or rinçage d'azote or épreuve à l'azote or pneumograph* or tachygraphie pulmonaire or spirograph* or pléthysmograph* or épreuve de bronchodilatation).tw,kw. | 77 792 |
| 54 | or/44-53 [Fx pulmonaire and hypersensitibilité] | 739 366 |
| 55 | 18 and 54 [PACA and Fx pulmonaire] | 1 975 |
| 56 | limiter 55 à ((anglais ou français) and année = « 2000 – aujourd'hui »") | 1 570 |
| 57 | limiter 56 à humain | 1 097 |
| 58 | 56 and (34 or 35) | 1 221 |
| 59 | 56 not (37 or 38) | 380 |
| 60 | 57 or 58 or 59 [limiter à humain] | 1 531 |
| 61 | 41 and ((2000* or 2001* or 2002* or 2003* or 2004* or 2005* or 2006* or 2007* or 2008* or 2009* or 2010* or 2011* or 2012* or 2013* or 2014* or 2015* or 2016* or 2017* or "201801" or "201802" or « 201803 »).ed. or (2000* or 2001* or 2002* or 2003* or 2004* or 2005* or 2006* or 2007* or 2008* or 2009* or 2010* or 2011* or 2012* or 2013* or 2014* or 2015* or 2016* or 2017* or « 2018 01 » or « 2018 02 » or « 2018 03 »).dt.) [articles obtenus auparavant] | 5 529 |
| 62 | 60 not 61 [nouveaux résultats seulement] | 204 |
Footnotes
| ||
Annexe B. Tableau d'évaluation de la qualité des études utilisant l'outil d'évaluation AMSTAR 2 adapté aux études d'épidémiologie environnementale
| Khreis et al. 2017Annexe B Tableau 1 Note de bas de page a | Heinrich et al. 2016Annexe B Tableau 1 Note de bas de page a | Barone-Adesi et al. 2015Annexe B Tableau 1 Note de bas de page a | Bowatte et al. 2015Annexe B Tableau 1 Note de bas de page a | Favarato et al. 2014Annexe B Tableau 1 Note de bas de page a | Gasana et al. 2012Annexe B Tableau 1 Note de bas de page a | Khreis et Nieuwenhuijsen 2017 | Pollock et al. 2017 | Schultz et al. 2017 | Choudhary et al. 2014 | Jacquemin et al. 2012 | Heinrich 2011 | Koppen et al. 2011 | Bråbäck et Forsberg 2009 | Boothe et Shendell 2008 | Götschi et al. 2008 | Salam et al. 2008 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. Les auteurs de la revue ont-ils utilisé une stratégie de recherche documentaire exhaustive? | 1 | 1 | 0 | 0,5 | 0,5 | 1 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0,5 | 0 | 0 | 0,5 |
| 2. Les auteurs de la revue ont-ils fourni une description adéquatement détaillée des études incluses? | 1 | 1 | 0,5 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 3. Les auteurs ont-ils eu recours à une technique satisfaisante pour évaluer la qualité de l'étude ou évaluer le risque de biais (RB) des études individuelles incluses dans la revue? | 0,5 | 0,5 | 0 | 0,5 | 0 | 0,5 | 0 | 0 | 0 | 0 | 0 | 0,5 | 0 | 0 | 0 | 0 | 0 |
| 4. Les auteurs de la revue ont-ils tenu compte de la qualité de l'étude ou du RB des études individuelles lors de l'interprétation ou de la description des résultats de la revue? | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| 5. Les auteurs de la revue ont-ils fourni une explication satisfaisante et une description de toute hétérogénéité observée dans les résultats de la revue, le cas échéant? | 1 | 1 | 1 | 1 | 1 | 0,5 | 0,5 | 0,5 | 1 | 0 | 1 | 0,5 | 1 | 1 | 1 | 1 | 1 |
| 6. Si une méta-analyse a été réalisée, les auteurs ont-ils utilisé les méthodes appropriées pour le regroupement statistique des résultats? | 1 | 1 | 1 | 1 | 1 | 1 | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. |
| 7. Si une méta-analyse a été réalisée, les auteurs de la revue ont-ils évalué l'incidence potentielle de la qualité de l'étude ou du RB des études individuelles sur les résultats de la méta-analyse ou de la synthèse des données probantes? | 1 | 1 | 0 | 0 | 0 | 0 | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. |
| 8. S'ils ont effectué une synthèse quantitative, les auteurs de la revue se sont-ils suffisamment interrogés concernant tout biais de publication (biais d'étude de petite envergure) et ont-ils discuté de son incidence probable sur les résultats de la revue? | 1 | 0 | 1 | 0 | 1 | 0 | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. | S. O. |
| Note totale | 7,5Annexe B Tableau 1 Note de bas de page b | 6,5Annexe B Tableau 1 Note de bas de page b | 3,5Annexe B Tableau 1 Note de bas de page c | 4Annexe B Tableau 1 Note de bas de page c | 4,5Annexe B Tableau 1 Note de bas de page c | 4Annexe B Tableau 1 Note de bas de page c | 2,5Annexe B Tableau 1 Note de bas de page c | 1,5Annexe B Tableau 1 Note de bas de page d | 2Annexe B Tableau 1 Note de bas de page c | 1Annexe B Tableau 1 Note de bas de page d | 2Annexe B Tableau 1 Note de bas de page c | 3Annexe B Tableau 1 Note de bas de page c | 2Annexe B Tableau 1 Note de bas de page c | 2,5Annexe B Tableau 1 Note de bas de page c | 2Annexe B Tableau 1 Note de bas de page c | 2Annexe B Tableau 1 Note de bas de page c | 2,5Annexe B Tableau 1 Note de bas de page c |
|
Abréviations : S. O. : sans objet
|
|||||||||||||||||
Annexe C. Liste des études citées dans les revues incluses dans cette évaluation
| Auteur(s), année | Revue | Méthodologie- étude | Nombre de fois où l'article a été cité | Revues systématiques incluant une méta-analyse (RS-MA) | Revues systématiques sans méta-analyse | Autres revues sélectionnées | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Khreis et al. 2017 (AS) | Heinrich et al. 2016 (AS, AL) | Barone-Adesi et al. 2015 (FP) | Bowatte et al. 2015 (AS, AL) | Favarato et al. 2014 (AS) | Gasana et al. 2012 (AS) | Khreis et Nieuwenhuijsen, 2017 (AS) | Schultz et al. 2017 (FP) | Jacquemin et al. 2012 (AS) | Koppen et al. 2011 (AS, AL) | Bråbäck et Forsberg, 2009 (AS, AL) | Götschi et al. 2008 (FP) | Salam et al. 2008 (AS) | Heinrich, 2011 (AS) | Boothe et Shendell, 2008 (AS) | ||||
| Deng et al. 2016 | Chemosphere | transversale | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Hasunuma et al. 2016 | BMJ Open | cas/témoins nichée dans une cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Kim et al. 2016 | Allergy Asthma Proc | transversale | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Liu et al. 2016 | Environ Int | transversale | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Tétrault et al. 2016 | Environ Health Perspect | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Wang et al. 2016 | Int J Hyg Environ Health | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Yang et al. 2016 | Occup Environ Med | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Brunst et al. 2015 | Am J Respir Crit Care Med | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Deng et al. 2015 | Environ Res | transversale | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Gehring et al. 2015a | Lancet Respir Med | analyse regroupée des cohortes | 3 | X | X | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Gehring et al. 2015b | Epidemiology | cohorte | 4 | X | X | - | - | - | - | X | X | - | - | - | - | - | - | - |
| LeMasters et al. 2015 | Obesity | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Mölter et al. 2015 | Eur Respir J | analyse regroupée des cohortes | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Dell et al. 2014 | Environ Int | cas/témoins | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| MacIntyre et al. 2014 | Environ Health Perspect | analyse regroupée des cohortes | 3 | X | X | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Mölter et al. 2014 | J Epidemiol Community Health | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Ranzi et al. 2014 | Occup Environ Med | cohorte | 3 | X | X | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Yamazaki et al. 2014 | J Expo Sci Environ Epidemiol | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Fuertes et al. 2013 | PeerJ | cohorte | 3 | X | X | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Gruzieva et al. 2013 | Epidemiology | cohorte | 5 | X | X | - | X | X | - | X | - | - | - | - | - | - | - | - |
| Lindgren et al. 2013 | Environ Health | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Nishimura et al. 2013 | Am J Respir Crit Care Med | cas/témoins | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Carlsten et al. 2011 | Occup Environ Med | cohorte | 4 | X | X | - | X | - | - | X | - | - | - | - | - | - | - | - |
| Patel et al. 2011 | Environ Res | cohorte | 4 | X | X | - | X | - | - | X | - | - | - | - | - | - | - | - |
| Clark et al. 2010 | Environ Health Perspect | cas/témoins nichée dans une cohorte | 6 | X | X | - | X | - | X | X | - | - | - | - | - | - | X | - |
| Gehring et al. 2010 | Am J Respir Crit Care Med | cohorte | 7 | X | X | - | X | X | X | X | - | - | - | - | - | - | X | - |
| Kerkhof et al. 2010 | Thorax | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| McConnell et al. 2010 | Environ Health Perspect | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Krämer et al. 2009 | J Dermatol Sci | cohorte | 6 | X | X | - | X | X | - | X | - | - | X | - | - | - | - | - |
| Oftedal et al. 2009 | Environ Health Perspect | cohorte | 7 | X | X | - | X | X | X | X | - | - | - | - | - | - | X | - |
| Jerrett et al. 2008 | Environ Health Perspect | cohorte | 5 | X | - | - | - | - | - | X | - | - | X | X | - | - | X | - |
| Morgenstern et al. 2008 | Am J Respir Crit Care Med | cohorte | 8 | X | X | - | X | X | - | X | - | - | X | X | - | - | X | - |
| Brauer et al. 2007 | Eur Respir J | cohorte | 8 | X | X | - | X | - | - | X | - | - | X | X | - | X | X | - |
| Morgenstern et al. 2007 | Occup Environ Med | cohorte | 9 | X | X | - | X | - | X | X | - | - | X | X | - | X | X | - |
| Zmirou et al. 2004 | J Epidemiol Community Health | cas/témoins | 3 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | X |
| Shima et al. 2003 | Japan J Epidemiol | cohorte | 5 | X | - | - | - | - | - | X | - | - | X | X | - | - | X | - |
| Brauer et al. 2002 | Am J Respir Crit Care Med | cohorte | 7 | X | X | - | X | - | - | X | - | - | X | X | - | - | X | - |
| Shima et al. 2002 | Arch Environ Health | cohorte | 5 | X | - | - | - | - | X | X | - | - | X | X | - | - | - | - |
| Shima and Adachi 2000 | Int J Epidemiol | cohorte | 2 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| English et al. 1999 | Environ Health Perspect | cas/témoins | 3 | X | - | - | - | - | - | X | - | - | - | - | - | - | - | X |
| Huang et al. 2015 | Br J Dermatol | cohorte | 1 | - | X | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Sbihi et al. 2015 | Environ Health Perspect | cohorte | 1 | - | X | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Gruzieva et al. 2014 | J Allergy Clin Immunol | analyse regroupée des cohortes | 1 | - | X | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Fuertes et al. 2013b | J Allergy Clin Immunol | analyse regroupée des cohortes | 1 | - | X | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Gruzieva et al. 2012 | J Allergy Clin Immunol | cohorte | 2 | - | X | - | X | - | - | - | - | - | - | - | - | - | - | - |
| Esplugues et al. 2011 | Sci Total Environ | cohorte | 3 | - | X | - | X | X | - | - | - | - | - | - | - | - | - | - |
| Ryan et al. 2009 | Am J Respir Crit Care Med | cohorte | 2 | - | X | - | X | - | - | - | - | - | - | - | - | - | - | - |
| Nordling et al. 2008 | Epidemiology | cohorte | 6 | - | X | - | X | - | - | - | X | - | X | X | - | - | X | - |
| Ryan et al. 2005 | J Allergy Clin Immunol | cohorte | 6 | - | X | - | X | - | - | - | - | - | - | X | - | X | X | X |
| Gehring et al. 2002 | Eur Respir J | cohorte | 7 | - | X | - | X | - | X | X | - | - | X | X | - | - | X | - |
| Morales et al. 2015 | Thorax | liens transversaux | 2 | - | - | X | - | - | - | - | X | - | - | - | - | - | - | - |
| Urman et al. 2014 | Thorax | liens transversaux | 1 | - | - | X | - | - | - | - | - | - | - | - | - | - | - | - |
| Gehring et al. 2013 | Environ Health Perspect | cohorte | 2 | - | - | X | - | - | - | - | X | - | - | - | - | - | - | - |
| Svendsen et al. 2012 | Am J Epidemiol | cohorte | 3 | - | - | X | - | X | - | - | X | - | - | - | - | - | - | - |
| Lee et al. 2011 | Int J Hyg Environ Health | liens transversaux | 2 | - | - | X | - | - | - | - | X | - | - | - | - | - | - | - |
| Rosenlund et al. 2009 | Thorax | liens transversaux | 1 | - | - | X | - | - | - | - | - | - | - | - | - | - | - | - |
| Dales et al. 2008 | Environ Health Perspect | liens transversaux | 2 | - | - | X | - | - | - | - | X | - | - | - | - | - | - | - |
| Oftedal et al. 2008 | Epidemiology | cohorte | 5 | - | - | X | X | - | - | - | X | - | - | X | - | - | X | - |
| Peters et al. 1999 | Am J Respir Crit Care Med | cohorte | 3 | - | - | X | - | - | X | - | X | - | - | - | - | - | - | - |
| Andersen et al. 2008 | Thorax | cohorte | 2 | - | - | - | X | - | - | - | - | - | X | - | - | - | - | - |
| Sonnenschein-van der Voort et al. 2012 | Environ Health | cohorte | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Kim et al. 2011 | J Korean Med Sci | transversale | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Pénard-Morand et al. 2010 | Eur Respir J | transversale | 2 | - | - | - | - | X | X | - | - | - | - | - | - | - | - | - |
| Zhao et al. 2008 | Environ Health Perspect | transversale | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Mi et al. 2006 | Indoor Air | transversale | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Gauderman et al. 2005 | Epidemiology | transversale | 3 | - | - | - | - | X | X | - | - | - | - | - | - | - | - | X |
| Kim et al. 2004 | Am J Respir Crit Care Med | transversale | 2 | - | - | - | - | X | X | - | - | - | - | - | - | - | - | - |
| Janssen et al. 2003 | Environ Health Perspect | transversale | 4 | - | - | - | - | X | - | - | X | - | - | - | X | - | - | X |
| Krämer et al. 2000 | Epidemiology | transversale | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Pikhart et al. 2000 | Epidemiology | transversale | 1 | - | - | - | - | X | - | - | - | - | - | - | - | - | - | - |
| Hirsch et al. 1999 | Eur Respir J | transversale | 4 | - | - | - | - | X | X | - | X | - | - | - | X | - | - | - |
| Linares et al. 2010 | BMC Pulm Med | cohorte (longitudinale) | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Arnedo-Pena et al. 2009 | Arch Bronconeumol | transversale | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Sahsuvaroglu et al. 2009 | Environ Health | cohorte | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Hwang et al. 2005 | Thorax | transversale | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Nicolai et al. 2003 | Eur Respir J | transversale | 4 | - | - | - | - | - | X | - | X | - | - | - | X | - | - | X |
| Zhang et al. 2002 | Environ Health Perspect | transversale | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Pikhart et al. 2001 | Int Arch Occup Environ Health | transversale | 2 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Dockery et al. 1996 | Environ Health Perspect | transversale | 1 | - | - | - | - | - | X | - | - | - | - | - | - | - | - | - |
| Mölter et al. 2015 | Eur Respir J | analyse regroupée des cohortes | 1 | - | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Rancière et al. 2013 | Environ Health Perspect | cohorte | 1 | - | - | - | - | - | - | X | - | - | - | - | - | - | - | - |
| Cakmak et al. 2016 | J Environ Manage | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Neophytou et al. 2016 | Am J Respir Crit Care Med | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Rice et al. 2016 | Am J Respir Crit Care Med | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Schultz et al. 2016a | J Allergy Clin Immunol | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Barone-Adesi et al. 2015 | PLoS One | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Fuertes et al. 2015 | Int J Hyg Environ Health | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Gauderman et al. 2015 | N Engl J Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Wang et al. 2015 | Environ Health Perspect | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Eeftens et al. 2014 | Epidemiology | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Eenhuizen et al. 2013 | Eur Respir J | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Gao et al. 2013 | Arch Dis Child | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Mölter et al. 2013 | Environ Health Perspect | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Hoek et al. 2012 | Eur Respir J | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Schultz et al. 2012 | Am J Respir Crit Care Med | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Islam et al. 2011 | Am J Respir Crit Care Med | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| He et al. 2010 | Respir Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Gauderman et al. 2007 | Lancet | cohorte (longitudinale) | 2 | - | - | - | - | - | - | - | X | - | - | - | X | - | - | - |
| Rojas-Martinez et al. 2007 | Am J Respir Crit Care Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Sugiri et al. 2006 | Environ Health Perspect | transversale | 2 | - | - | - | - | - | - | - | X | - | - | - | X | - | - | - |
| Gauderman et al. 2004 | N Engl J Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Frye et al. 2003 | Environ Health Perspect | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Gauderman et al. 2002 | Am J Respir Crit Care Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Horak et al. 2002 | Eur Respir J | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Neuberger et al. 2002 | Atmos Environ | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Avol et al. 2001 | Am J Respir Crit Care Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Gauderman et al. 2000 | Am J Respir Crit Care Med | cohorte | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Brunekreef et al. 1997 | Epidemiology | transversale | 2 | - | - | - | - | - | - | - | X | - | - | - | X | - | - | - |
| Raizenne et al. 1996 | Environ Health Perspect | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Wjst et al. 1993 | BMJ | liens transversaux | 2 | - | - | - | - | - | - | - | X | - | - | - | X | - | - | - |
| Dockery et al. 1989 | Am Rev Respir Dis | transversale | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Schwartz 1989 | Environ Res | transversale | 2 | - | - | - | - | - | - | - | X | - | - | - | X | - | - | - |
| Schultz et al. 2016b | Am. J. Respir. Crit. Care Med. | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | X | - | - | - | - | - | - | - |
| Lindgren et al. 2010 | BMC Public Health | cas/témoins nichée dans une étude transversale | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Castro-Giner et al. 2009 | Environ Health Perspect | cohorte | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Jacquemin et al. 2009 | Eur Respir J | cohorte | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Künzli et al. 2009 | Thorax | cohorte | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Lindgren et al. 2009 | Int J Health Geogr | transversale | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Modig et al. 2009 | Eur Respir J | cohorte | 1 | - | - | - | - | - | - | - | - | X | - | - | - | - | - | - |
| Modig et al. 2006 | Eur Respir J | cas/témoins | 2 | - | - | - | - | - | - | - | - | X | - | - | - | X | - | - |
| Jedrychowski et al. 2009 | Environ Int | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Koppen et al. 2009 | Environ Int | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Schroer et al. 2009 | J Pediatr | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Melén et al. 2008 | Environ Health Perspect | cas/cohortes | 3 | - | - | - | - | - | - | - | - | - | X | X | - | - | X | - |
| Oftedal et al. 2007 | Clin Exp Allergy | cohorte | 2 | - | - | - | - | - | - | - | - | - | X | X | - | - | - | - |
| Ryan et al. 2007 | Environ Health Perspect | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Jedrychowski et al. 2005 | Eur J Epidemiol | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Guilbert et al. 2004 | J Allergy Clin Immunol | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Miller et al. 2004 | Chest | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| McConnell et al. 2002 | Lancet | cohorte | 1 | - | - | - | - | - | - | - | - | - | X | - | - | - | - | - |
| Clougherty et al. 2007 | Environ Health Perspect | cohorte | 2 | - | - | - | - | - | - | - | - | - | - | X | - | - | X | - |
| Islam et al. 2007 | Thorax | cohorte | 1 | - | - | - | - | - | - | - | - | - | - | X | - | - | - | - |
| Kan et al. 2007 | Thorax | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Hogervorst et al. 2006 | J Toxicol Environ Health A | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Schikowski et al. 2005 | Respir Res | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Sekine et al. 2004 | Occup Environ Med | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Fritz and Herbarth 2001 | Int J Hyg Environ Health | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Nakai et al. 1999 | Arch Environ Health | cohorte (longitudinale) | 1 | - | - | - | - | - | - | - | - | - | - | - | X | - | - | - |
| Brugge et al. 2007 | Environ Health | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Meng et al. 2007 | Ann Allergy Asthma Immunol | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Salam et al. 2007a | Am J Respir Crit Care Med | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Salam et al. 2007b | Thorax | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Bayer-Oglesby et al. 2006 | Am J Epidemiol | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Gordian et al. 2006 | J Expo Sci Environ Epidemiol | transversale | 2 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | X |
| Kuehni et al. 2006 | Int J Epidemiol | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Meng et al. 2006 | Policy Brief | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | X | - | - |
| Pujades-Rodríguez et al. 2009 | Occup Environ Med | rétrospective | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | X | - |
| Lewis et al. 2004 | Non précisé | Non précisé | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Lwebuga-Mukasa et al. 2004 | J Asthma | rétrospective | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Garshick et al. 2003 | Epidemiology | transversale | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Lin et al. 2002 | Environ Res | cas/témoins | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Wilkinson et al. 1999 | Thorax | cas/témoins | 1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Abréviations : AL : allergies; AS : asthme; FP : fonction pulmonaire. | ||||||||||||||||||
Annexe D. Tableau récapitulatif des principales revues incluses dans la revue globale
| Auteur | But/objectif | Période de recherche | Nombre d'études | Principaux résultats | Conclusions de l'article de revue | Facteurs de confusion ou à prendre en considération |
|---|---|---|---|---|---|---|
| Revues systématiques–méta-analyses | ||||||
Khreis et al. 2017 (asthme) |
Revue systématique et méta-analyse ayant examiné le lien entre l'exposition à la PACA et le l'apparition subséquente d'asthme pendant l'enfance |
Réalisée le 8 septembre 2016, sans limites à la date de publication initiale |
41 études/ (Études : 17 de l'Europe, 11 de l'Amérique du Nord, 5 du Japon, 3 de la Chine, 1 de la Corée, 1 de Taïwan et 3 de plusieurs cohortes combinées; 31 cohortes [24 cohortes de naissance], 6 cas/témoins [2 études nichées dans une cohorte de naissance] et 4 transversales) |
RC ajustés pour l'asthme – tout âge :
D+L : 1,08 (IC à 95 % : 1,03-1,14) I2 = 0 %; p = 0,87 I-V : 1,08 (IC à 95 % : 1,03-1,14)
D+L : 1,05 (IC à 95 % : 1,02-1,07) I2 = 65 %; p = 0,0001 I-V : 1,02 (IC à 95 % : 1,01-1,03)
D+L : 1,48 (IC à 95 % : 0,89-2,45); I2 = 87 %; p = 0,00001 I-V : 1,68 (IC à 95 % : 1,42-1,99)
D+L : 1,03 (IC à 95 % : 1,01-1,05) I2 = 28 %; p = 0,18 I-V : 1,03 (IC à 95 % : 1,02-1,04)
D+L : 1,05 (IC à 95 % : 1,02-1,08) I2 = 29 %; p = 0,16 I-V : 1,04 (IC à 95 % : 1,02-1,06) RC ajustés pour l'asthme chez les enfants de 6 ans ou moins :
D+L : 1,17 (IC à 95 % : 1,01-1,36) I2 = 45 %; p = 0,12 I-V : 1,09 (IC à 95 % : 1,03-1,16)
D+L : 1,08 (IC à 95 % : 1,04-1,12) I2 = 26 %; p = 0,23 I-V : 1,07 (IC à 95 % : 1,05-1,10)
D+L : 1,02 (IC à 95 % : 0,69-1,49); I2 = 69 %; p = 0,007 I-V : 1,68 (IC à 95 % : 1,42-1,99)
D+L : 1,04 (IC à 95 % : 0,99-1,11); I2 = 41 %; p = 0,16 I-V : 1,02 (IC à 95 % : 1,00-1,04)
D+L : 1,09 (IC à 95 % : 1,04-1,15) I2 = 12 %; p = 0,34 I-V : 1,09 (IC à 95 % : 1,04-1,14) RC ajustés pour l'asthme chez les enfants moins de 6 ans
D+L : 1,12 (IC à 95 % : 1,00-1,24); I2 = 0 %; p = 0,79 I-V : 1,12 (IC à 95 % : 1,00-1,24)
D+L : 1,03 (IC à 95 % : 1,00-1,06); I2 = 62 %; p = 0,001 I-V : 1,02 (IC à 95 % : 1,01-1,03)
D+L : 1,46 (IC à 95 % : 0,77-2,78); I2 = 89 %; p = 0,00001 I-V : 1,72 (IC à 95 % : 1,41-2,09)
D+L : 1,04 (IC à 95 % : 1,02-1,07) I2 = 3 %; p = 0,41 I-V : 1,04 (IC à 95 % : 1,02-1,06)
D+L : 1,04 (IC à 95 % : 1,00-1,08); I2 = 5 %; p = 0,39 I-V : 1,04 (IC à 95 % : 1,00-1,08) Des analyses de sensibilité ont également été effectuées. Les différences propres au sexe étaient incohérentes. Dans les 5 études ayant établi les phénotypes d'asthme comme allergique ou non allergique, les RC ont augmenté ou étaient plus élevés seulement pour l'asthme non allergique. L'hétérogénéité la plus faible a été observée pour les estimations de CN, une certaine hétérogénéité a été observée pour les estimations de PM2,5 et de PM10 et la plus grande hétérogénéité a été observée pour les estimations de NO2 et de NOx. |
Une méta-analyse générale a relevé des liens positifs et statistiquement significatifs avec 4 des 5 polluants examinés (CN, NO2, PM2,5 et PM10). « Il existe maintenant suffisamment de données probantes pour appuyer l'existence d'un lien entre l'exposition à la PACA et le l'apparition d'asthme pendant l'enfance. Le degré élevé de cohérence dans les résultats et les conclusions des études individuelles, les résultats de la méta-analyse et le soutien considérable des ouvrages scientifiques existants renforcent l'hypothèse selon laquelle l'exposition à la PACA contribue à l'apparition d'asthme chez les enfants. » |
Grande variabilité entre les définitions de l'asthme, les méthodes d'évaluation de l'exposition à la PACA et la correction pour les facteurs de confusion. 8 études se sont penchées sur la mobilité des enfants à des âges plus avancés. Une évaluation de la qualité a été effectuée; les études sélectionnées ont été jugées de bonne qualité (les limites comprennent des échantillons non représentatifs, l'évaluation de l'asthme par des questionnaires et l'absence de correction pour les facteurs de confusion importants). Il n'y a pas suffisamment d'études pour examiner de façon exhaustive le biais de publication, mais le risque est faible, excepté pour l'analyse des NOx, dont le graphique en entonnoir est asymétrique. Un risque de biais de rappel est introduit par le signalement des diagnostics du médecin par les parents. Possibilité de classification erronée de la maladie. |
Heinrich et al. 2016 (asthme, allergies) |
Revue systématique et méta-analyse d'études de cohorte de naissance portant sur le rôle causal de l'exposition à la PACA quant à l'asthme et aux affections allergiques |
Année 1960 à mars 2014 |
27 études/15 (Études incluses de 15 cohortes de naissance : 8 provenant d'Europe, 4 du Canada, 2 des États-Unis et 1 de Taïwan) |
Incidence d'asthme :
Après le retrait de la cohorte à haut risque :
Prévalence de respiration sifflante :
Après le retrait de la cohorte à haut risque :
Sensibilisation allergique : Tout allergène :
Aéroallergènes :
Après le retrait de la cohorte à haut risque pour les aéroallergènes :
Rhume des foins :
Après le retrait de la cohorte à haut risque :
Les études étaient trop hétérogènes (différents polluants et âges) pour la méta-analyse de l'eczéma. |
« Les données épidémiologiques appuyant l'existence d'un lien entre la PACA et l'asthme ainsi que d'autres résultats sur la santé liés aux allergies demeurent insuffisantes pour confirmer l'existence d'un lien de causalité. » Des liens positifs ont été définis, mais ils n'étaient pas significatifs sur le plan statistique. |
Les études incluses ont chacune obtenu une note minimale de 7/9 sur l'échelle de qualité Newcastle-Ottawa. La plupart des études se sont appuyées sur la déclaration des maladies et des symptômes par les sujets eux-mêmes et les parents. Un risque de biais est introduit par une diminution importante de la durée du suivi (> 40 %) ayant pu être mené auprès de certaines cohortes, en particulier celles dont les périodes de suivi étaient les plus longues. Typiquement, la période de suivi des études sur l'asthme durait environ 10 ans. La période de suivi pour la respiration sifflante était plus courte. Les degrés d'exposition variaient d'une étude à l'autre; cependant, tous étaient inférieurs à ceux cités dans les lignes directrices de l'Organisation mondiale de la Santé concernant les PM2,5 et le NO2. La plupart des études ont utilisé des méthodes de RUT; toutefois, certaines ont utilisé des modèles de dispersion aux fins d'évaluation de l'exposition. Plus grand nombre d'études incluses et périodes de suivi plus longues que Bowatte et al. (2015). Hétérogénéité. |
Barone-Adesi et al. 2015 (fonction pulmonaire) |
Revue systématique et méta-analyse des liens transversaux entre le NO2 et la fonction pulmonaire chez les enfants ou les adolescents |
1990–2015 |
13 études ont satisfait aux critères de sélection |
6 des 6 études sur la différence absolue du VEMS ont relevé une diminution significative (modèles linéaires). Méta-analyse : VEMS −8 ml (IC à 95 % : −14 à −1 ml par 10 µg/m3 de NO2); p = 0,016; I2 = 32 % L'analyse de sensibilité n'a pas relevé d'hétérogénéité en fonction de la méthodologie pour l'exposition (p. ex. RUT, modèles de dispersion ou stations de surveillance fixes) ( p = 0,66). Analyse de sensibilité fondée sur le diagnostic d'asthme : Aucun asthme : VEMS −14 ml (IC à 95 % : −26 à −3 ml); p = 0,001 Asthme : VEMS −1 ml (IC à 95 % : −15 à 17 ml); p = 0,90 1 des 9 études sur le pourcentage de variation du VEMS a relevé une réduction significative (modèles log-linéaires). 7 des 9 études ont relevé une relation inverse non significative. Méta-analyse : VEMS −0,7 % (IC à 95 % : −1,1 % à −0,3 % par 10 µg/m3 de NO2) p = 0,001; I2 < 1 % L'analyse de sensibilité n'a pas relevé d'hétérogénéité entre le projet ESCAPE et d'autres études (p = 0,30). Analyse de sensibilité fondée sur le diagnostic d'asthme : Aucun asthme : VEMS −0,9 % (IC à 95 % : −1,4 % à –0,4 %); p = 0,001 Asthme : VEMS −0,5 % (IC à 95 % : −1,9 % à 1 %); p = 0,51 |
Les méta-analyses ont relevé une réduction significative du VEMS absolu et du VEMS en pourcentage par 10 µg/m3 de NO2. |
Les graphiques en entonnoir étaient symétriques et les tests de Begg et d'Egger n'ont pas relevé de biais d'étude de petite envergure. Analyse de sensibilité se fondait sur le diagnostic d'asthme. Études incluses : 8 d'Europe, 1 d'Asie, 4 d'Amérique du Nord. Pour la méta-analyse, toutes les études sauf une ont été ajustées pour la fumée secondaire de tabac à domicile et le SSE. |
Bowatte et al. 2015 (asthme, allergies) |
Revue systématique et méta-analyse d'études de cohorte de naissances visant à évaluer l'influence de l'exposition à la PACA pendant l'enfance sur l'apparition d'asthme et d'allergies |
Année 1960 à mars 2014 |
19 articles ont satisfait aux critères d'inclusion |
Asthme : Exposition pendant l'enfance et incidence d'asthme :
D+L : 1,09 (IC à 95 % : 0,96-1,23); I2 = 75,5 %; p = 0,003 I-V : 1,06 (IC à 95 % : 1,01-1,72) Analyse de l'âge : augmentation du lien avec l'âge jusqu'à 6 ans (l'hétérogénéité variait toutefois de 0 % à 62,6 % avec p = 0,102 à 0,866); aucune tendance après l'âge de 6 ans.
D+L : 1,14 (IC à 95 % : 1,00-1,30); I2 = 77,1 %; p = 0,004 I-V : 1,05 (IC à 95 % : 1,01-1,08) Analyse de l'âge : tendance à la hausse pour le risque entre 3 et 12 ans (hétérogénéité de 0 % à 52,3 % avec p = 0,148 à 0,797).
D+L : 1,20 (1,05-1,38); I2 = 19,3 %; p = 0,290 I-V : 1,19 (IC à 95 % : 1,07-1,32) Analyse de l'âge : Tendance à la hausse pour l'incidence d'asthme jusqu'à l'âge de 6 ans (hétérogénéité de 0 % à 23,7 % avec p = 0,252 à 0,706)
1 des 6 cohortes a signalé des liens significatifs entre la proximité de routes et le risque d'asthme aux âges de 2 et de 6 ans. Exposition pendant l'enfance et respiration sifflante : NO2 : 2 des 6 cohortes ont signalé des liens significatifs entre les NOx et le risque de respiration sifflante aux âges de 1, 2, 3, 4 et 6 ans. PM2,5 : 1 des 4 cohortes a relevé un risque significativement plus élevé de respiration sifflante pour les expositions aux PM pendant l'enfance aux âges de 1, 2, 3, 4, 5, 6 et 8 ans. CN : 1 des 2 cohortes a signalé un risque significativement plus élevé de respiration sifflante aux âges de 2, 3, 4 et 6 ans. Proximité des routes : 2 des 4 cohortes ont signalé des liens significatifs avec la respiration sifflante aux âges de 1 an et de 5 ans. Allergies : Sensibilisation allergique NO2 (par augmentation de 10 µg/m3) :
D+L : 1,09 (IC à 95 % : 0,88-1,36); I2 = 36,6 %, p = 0,208 I-V : 1,10 (IC à 95 % : 0,92-1,30)
D+L : 0,96 (IC à 95 % : 0,74-1,25); I2 = 0 %; p = 0,912 I-V : 0,96 (IC à 95 % : 0,74-1,25)
D+L : 1,28 (IC à 95 % : 0,98-1,68); I2 = 44 %; p = 0,181 I-V : 1,30 (IC à 95 % : 1,13-1,50)
D+L : 1,19 (IC à 95 % : 1,00-1,42); I2 = 0 %; p = 0,779 I-V : 1,19 (IC à 95 % : 1,00-1,42) PM2,5 (par augmentation de 2 µg/m3) :
D+L : 1,33 (IC à 95 % : 0,94-1,88); I2 = 73,7 %; p = 0,022 I-V : 1,36 (IC à 95 % : 1,14-1,62)
D+L : 1,00 (IC à 95 % : 0,80-1,24); I2 = 0 %; p = 0,649 I-V : 1,00 (IC à 95 % : 0,80-1,24)
D+L : 1,26 (IC à 95 % : 1,00-1,60); I2 = 44 %; p = 0,181 I-V : 1,28 (IC à 95 % : 1,08-1,52)
D+L : 1,18 (IC à 95 % : 1,00-1,39); I2 = 0 %; p = 0,474 I-V : 1,18 (IC à 95 % : 1,00-1,39) Eczéma : Aucune méta-analyse n'a été réalisée (3 cohortes). NO2 : 3 des 4 études ont signalé un lien significatif. PM2,5 : 2 des 2 études ont signalé un risque neutre (estimations des risques = 1,00). CN : 4 études sur 4 ont signalé un lien positif, dont 1 significatif. Distance par rapport à la route la plus proche (< 50 m) : 2 études sur 3 ont signalé un lien positif. Rhume des foins : Aucune méta-analyse n'a été réalisée (3 cohortes). NO2 : 3 des 4 études ont signalé un lien positif, dont 1 risque neutre. PM2,5 : 2 des 2 études ont signalé un lien positif. CN : 4 études sur 4 ont signalé un lien positif, dont 1 significatif. Distance par rapport à la route la plus proche (< 50 m) : 2 études sur 3 ont signalé un lien positif. |
Asthme : « L'exposition à la PACA pendant l'enfance est associée à une incidence d'asthme plus élevée et à une augmentation du risque avec l'âge. » Une tendance à la hausse des risques découlant du NO2 et au CN a été liée aux 6 premières années de vie, alors qu'il s'agissait des 12 premières années pour les PM2,5. Les effets de l'exposition à la PACA pourraient être progressifs avec un décalage de 3 ans. La proximité de routes n'a pas été fortement associée à l'asthme. Allergies : Le NO2 et les PM2,5 étaient associés à la sensibilisation allergique. Données probantes limitées sur le rhume des foins et l'eczéma. La proximité de routes n'a pas été fortement associée à l'asthme ni à la sensibilisation allergique. |
Études incluant 11 cohortes de naissances; 7 provenant d'Europe et 4 d'Amérique du Nord. 8 cohortes étaient basées sur la population; 3 cohortes étaient des cohortes à haut risque (antécédents familiaux d'asthme ou d'allergies). 2 cohortes recrutées dans un seul hôpital. Dans 3 des cohortes, la fumée secondaire n'a pas été ajustée. Dans 3 des cohortes, la prédisposition allergique n'a pas été ajustée. Les études ont utilisé différentes mesures d'exposition, y compris la RUT, les modèles de dispersion, les échantillons passifs et un site de surveillance central, ce qui peut expliquer en partie l'hétérogénéité. L'analyse de l'âge comportait un petit nombre d'études dans certains groupes d'âge, ce qui réduit la précision des estimations. |
Favarato et al. 2014 (asthme) |
Revue systématique et méta-analyse visant à établir une fonction concentration–réaction pour le NO2 et la prévalence des symptômes d'asthme qui soit appropriée pour évaluer les effets de la circulation automobile sur la santé |
Jusqu'au 1er mars |
20 articles fondés sur 18 études ont satisfait aux critères d'inclusion (12 études d'Europe, 3 d'Asie et 3 des États-Unis) |
18 estimations de la prévalence propres aux études (16 pour la respiration sifflante et 2 pour le diagnostic d'asthme) ont été retenues sur les 39 estimations extraites des études; les RC variaient de 0,61 (IC à 95 % : 0,36-1,03) à 1,64 (IC à 95 % : 1,06-2,54). Période de prévalence de 12 mois prise en compte pour la respiration sifflante et les symptômes d'asthme. 4 des 18 RC étaient < 1,00, 2 des 18 RC étaient de 1,00 et 12 des 18 RC étaient > 1,00 (liens significatifs révélés dans 2 études). Exposition : Les mesures de NO2 ont été prises au domicile (10), à l'école (6) et aux deux endroits (2) à l'aide d'appareils de surveillance propres aux études (6), de RUT (6), de modèles de dispersion (4) ou d'interpolation à partir des appareils de surveillance (2).
Dans l'ensemble :
Stratification par méthode d'évaluation de l'exposition : RUT :
Appareil de surveillance de l'étude :
Dispersion :
Interpolation :
Hétérogénéité modérée; généralement, aucune preuve d'hétérogénéité entre les groupes : p = 0,261 La plupart (16) des estimations n'étaient pas statistiquement significatives au niveau de 5 %, mais l'estimation combinée était plus précise (IC réduite et atteinte du seuil de signification statistique au niveau de 5 %). |
Les résultats de la méta-analyse indiquaient que le NO2 « peut apporter une faible contribution proportionnelle à la prévalence d'asthme chez les enfants. » L'analyse stratifiée par méthode d'évaluation de l'exposition indiquait un effet plus important pour l'exposition selon les dispositifs de surveillance propres aux études, situés dans les écoles. Aucune preuve d'hétérogénéité entre les groupes selon la méthode d'évaluation de l'exposition. |
Toutes les études ont pris des facteurs de confusion en considération; la plupart ont inclus au moins un facteur de confusion de chacune des catégories suivantes : intérieur, socioéconomique, tabac, démographique et autre. Hétérogénéité considérable quant à l'âge des sujets, aux questionnaires et à la méthode d'attribution de l'exposition. Aucune preuve de biais de publication (étude de petite envergure) selon la symétrie des graphiques en entonnoir et les tests de Begg et d'Egger. Des analyses de sensibilité ont été effectuées. |
Gasana et al. 2012 (asthme) |
Méta-analyse visant à clarifier les liens potentiels entre les polluants atmosphériques de véhicules motorisés et la respiration sifflante ainsi que l'asthme chez les enfants |
Jusqu'en janvier 2011 |
19 études (Études : 9 d'Europe, 5 d'Amérique du Nord, 4 d'Asie et 1 d'Amérique latine; 9 de cohortes et 10 transversales) Aucun lien avec le SO2 et l'O3 relevé |
Correction des RC à l'aide d'un modèle à effets aléatoires pour une augmentation de 10 µg/m3 des concentrations de polluants : Prévalence d'asthme :
Prévalence de respiration sifflante :
Incidence d'asthme :
Incidence de respiration sifflante :
|
« Lien positif entre l'exposition à des concentrations supérieures de NO2 et une augmentation de la prévalence et de l'incidence d'asthme chez les enfants. » « Lien positif entre l'exposition à des concentrations supérieures de NOx et une augmentation de la prévalence d'asthme. » « Une augmentation de l'exposition aux particules a été associée positivement à une incidence plus élevée de respiration sifflante. » « L'exposition au CO a été associée positivement à une prévalence d'asthme plus élevée. » « La méta-analyse montre un lien entre plusieurs polluants atmosphériques liés à la circulation automobile et l'incidence et la prévalence d'asthme et de respiration sifflante chez les enfants vivant ou fréquentant une école à proximité des zones de circulation automobile élevée. » |
Une évaluation de la qualité a été effectuée. Symptômes signalés par le sujet lui-même au moyen de questionnaires (17 des 19 études). L'exposition a été évaluée différemment d'une étude individuelle à l'autre (p. ex. RUT, modèles de dispersion, sites de surveillance). NOx/NO2 : 11 études ont estimé la prévalence d'asthme ou de respiration sifflante; 6 études ont estimé l'incidence d'asthme ou de respiration sifflante. Particules : 7 études ont estimé la prévalence d'asthme ou de respiration sifflante; 6 études ont estimé l'incidence d'asthme ou de respiration sifflante. CO : 4 études ont estimé la prévalence d'asthme ou de respiration sifflante. |
| Revues systématiques | ||||||
Khreis et Nieuwen-huijsen, 2017 (asthme) |
Revue systématique des méthodes d'évaluation de l'exposition utilisées aux fins d'étude épidémiologique de la PACA et de l'asthme pendant l'enfance Même méthodologie que Khreis et al. (2017), excepté pour l'inclusion d'une étude primaire supplémentaire lors de la revue |
Année 1996 à août 2016 (Année 1988 à août 2016 pour la base de données |
42 études |
Renseignements limités sur les estimations des risques. Les renseignements pertinents suivants sont fournis :
|
Aucune conclusion sur le lien entre la PACA et l'asthme, excepté qu'une « évaluation de l'exposition plus précise pourrait améliorer les estimations des risque et faire la lumière sur les périodes critiques d'exposition, les agents présumés, les mécanismes sous-jacents et les facteurs d'hétérogénéité ». |
L'étude traite principalement de l'évaluation de l'exposition; les estimations des risques ne sont pas fournies et sont brièvement décrites. |
Schultz et al. 2017 (fonction pulmonaire) |
Résumé des données probantes épidémiologiques sur la PACA et la fonction pulmonaire chez les enfants et les adolescents |
Janvier 2006 à mars 2017 |
32 articles d'études transversales et 12 d'études longitudinales |
La plupart des études ont signalé un effet négatif de la PACA sur les mesures de la fonction pulmonaire. Une plus importante estimation d'effets est observée pour le VEMS que pour la CVF dans de nombreuses études, bien que certains montrent le contraire. Certaines études ont signalé le plus grand effet pour le DEM25-75. La plupart des déficits dans la fonction pulmonaire associés à la PACA vont de 0,5 % à 3 %. Les changements légers ne seraient que des effets physiologiques mineurs chez un individu, mais, à l'échelle d'une population, ils entraîneraient une augmentation de la prévalence au sein d'une population de sujets présentant une fonction pulmonaire inférieure aux seuils cliniques. On ne peut tirer de conclusion quant au moment de l'exposition – début de la vie, enfance ou adolescence – et l'effet sur la fonction pulmonaire. Toute exposition à n'importe quel point de la tranche d'âge est importante. Indication d'une récupération de la fonction pulmonaire avec la diminution du degré de pollution. Les études incluant une stratification selon le sexe ne permettaient de tirer aucune conclusion à ce sujet; des chiffres presque égaux indiquaient un effet plus important tantôt chez les garçons, tantôt chez les filles. Preuves limitées indiquant que l'asthme est susceptible de modifier les effets avec des liens forts dans plusieurs études. Données probantes non concluantes indiquant que les allergies ou la sensibilisation peuvent modifier le lien entre la PACA et la fonction pulmonaire. |
Les expositions à la PACA au début de la vie ou à l'âge scolaire peuvent entraîner une diminution de la fonction pulmonaire, du moins jusqu'à l'adolescence. L'influence relative du moment de l'exposition n'a pas été définie. À ce jour, des études indiquent que des effets peuvent être observés avec toute exposition au cours de toute la période s'étendant du début de la vie jusqu'à l'adolescence. |
Aucune description des facteurs de confusion. La diversité des études, y compris des mesures de la fonction pulmonaire et des méthodes d'évaluation de l'exposition, a rendu difficile la comparaison directe de résultats quantitatifs et a rendu impossible de faire un résumé quantitatif. |
Jacquemin et al. 2012 (asthme) |
Revue des preuves actuelles concernant la corrélation entre l'apparition d'asthme à l'âge adulte et la pollution atmosphérique à l'aide de marqueurs de l'exposition à la pollution dans l'air ambiant mesurés de façon objective (Toutes les études, sauf une, utilisaient des marqueurs locaux de la PACA pour caractériser l'exposition) |
Jusqu'en juin 2011 |
7 études (6 cohortes basées sur 4 populations étudiées et 1 étude cas/témoins incluses) |
7 des 7 études ont relevé des liens positifs et cohérents, mais pas tous significatifs, entre certaines mesures de l'exposition à long terme à la pollution dans l'air ambiant et l'incidence d'asthme. 6 des 7 études utilisaient des marqueurs de la PACA :
|
« L'analyse du rôle de la PACA dans l'apparition d'asthme à l'âge adulte est moins concluante que pour son apparition pendant l'enfance. » Selon les études prospectives évaluées, les résultats sont cohérents avec le rôle causal de la PACA dans l'apparition d'asthme à l'âge adulte (cohérence avec les observations chez les enfants). Cependant, il est impossible pour les auteurs de faire abstraction des incohérences observées dans les études de prévalence. |
Les protocoles, les définitions de l'asthme et l'attribution de l'exposition étaient hétérogènes. Manque d'indépendance des estimations (3 analyses fondées sur l'ECHRS). Les tendances signalées en matière de modification des effets (p. ex. par sexe, atopie ou tabagisme) étaient incohérentes. |
Koppen et al. 2011 (asthme, allergies) |
Revue d'études de cohorte ayant examiné le lien entre les symptômes respiratoires ou allergiques chez les enfants et l'exposition précoce à la PACA |
Non spécifié Années 2002 à 2009 selon les références |
Dans l'ensemble : 18 études de 10 cohortes de naissance (les auteurs ont examiné 17 études, mais le tableau contient 18 références) 6 études de 2 cohortes d'enfants en continu (référence supplémentaire ayant signalé les mêmes résultats) (Résultats résumés même s'il ne s'agissait pas du sujet principal de la revue) Allergies : 6 études (et un rapport préliminaire) de 5 cohortes de naissance |
Aucune estimation des risques fournie. Asthme : Pour les cohortes de naissance : Les 16 études ont signalé une augmentation du risque de symptômes respiratoires chez les enfants en bas âge ou ceux ayant été exposés à des hydrocarbures aromatiques polycycliques (HAP) avant la naissance ou à des marqueurs de la PACA après la naissance; certains des liens étaient considérés comme forts et positifs. Une étude a également évalué les polluants avant comme après la naissance jusqu'à l'âge de 1 an. Autres cohortes : 4 des 5 études ont signalé des liens entre l'asthme (et la respiration sifflante) et la PACA (distance d'une route, marqueurs de la PACA). Allergies : Pour les cohortes de naissance :
|
« Des données probantes indiquant un lien de causalité entre les symptômes d'asthme pendant l'enfance et l'exposition à la PACA. » Les auteurs n'ont tiré aucune conclusion précise quant aux allergies d'après leur revue des ouvrages scientifiques. « La cohérence entre les conclusions générales de toutes les études examinées indique que les gaz d'échappement émis par la circulation automobile contribuent à l'apparition de symptômes respiratoires. » |
Seuls des liens positifs ont été signalés. Seulement certaines estimations des risques ont été fournies. Recours à des questionnaires pour le signalement des symptômes ou signalement par les sujets eux-mêmes (dans la plupart des études) Pour ce qui est des allergies, les auteurs ont considéré 6 études comme positives, y compris la cohorte d'Oslo, où l'exposition à vie au NO2 n'était liée qu'à D. farinae. Ce lien a été attribué à des facteurs de confusion dans Bråbäck et Forsberg (2009). |
Bråbäck et Forsberg, 2009 (asthme, allergies) |
Évaluation des données probantes tirées d'études prospectives récentes menées chez les enfants visant à appuyer l'existence d'une contribution de la pollution liée à la circulation automobile à long terme à l'apparition de symptômes semblables à l'asthme et à la sensibilisation allergique |
2002 à 2008 |
15 études de 10 cohortes (6 cohortes de naissances et 4 études prospectives pour les enfants d'âge scolaire) Dont : 13 études de 9 cohortes sur la santé respiratoire et 5 études de 4 cohortes de naissances sur la sensibilisation |
Asthme : L'augmentation du risque de symptômes respiratoires a été démontrée dans toutes les études, mais le résultat variait selon l'âge de l'enfant. Enfants en bas âge (0 à 2 ans) :
4 à 6 ans :
Enfants d'âge scolaire :
Allergies : Sensibilisation :
|
« Les gaz d'échappement émis par la circulation automobile contribuent au développement de maladies respiratoires pendant l'enfance. » « De plus en plus de données probantes indiquent également que les polluants atmosphériques liés à la circulation automobile peuvent provoquer une sensibilisation. » |
Recours à des questionnaires pour le signalement des symptômes ou signalement par les sujets eux-mêmes (13 des 15 études) Utilisation de différents types d'évaluation d'exposition; l'efficacité supérieure de certains a été démontrée au moyen de validations internes. Dans le cas de l'asthme, les liens n'ont pas été signalés de façon cohérente dans le tableau (p. ex. références 28 et 29). Les études prospectives réalisaient une évaluation sommaire de l'exposition, étaient de petite taille ou n'étaient pas contrôlées pour les facteurs de confusion à l'échelle de la communauté. |
Götschi et al. 2008 (fonction pulmonaire) |
Revue de toutes les études sur les effets à long terme de la pollution atmosphérique sur la fonction pulmonaire publiées au cours des 20 dernières années. Par la suite, les études étaient limitées à celles qui comparaient la fonction pulmonaire dans 4 communautés ou plus ou à celles fondées sur une exposition attribuée individuellement. |
Non spécifié « Au cours des 2 dernières décennies » Années 1989 à 2007 selon les références |
58 publications au total :
|
La revue traitait principalement de pollution atmosphérique. Les résultats liés à la PACA figurent ci-dessous : Études transversales chez les enfants :
Études transversales chez les adultes :
Études longitudinales chez les enfants et les adolescents :
Études longitudinales chez les adultes :
|
Des études indiquent un lien entre l'exposition à la circulation automobile et une réduction de la fonction pulmonaire chez les adultes et les enfants. |
La majeure partie de la revue est axée sur les polluants individuels et non sur ceux propres à la circulation automobile ou à la PACA. Pour les études sur la circulation automobile, le SSE ainsi que d'autres facteurs de nature communautaire ne peuvent pas être entièrement ajustés. |
Salam et al. 2008 (asthme) |
Influence d'expositions liées à la circulation automobile au domicile sur la fréquence et la gravité de l'asthme |
Janvier 2006 à août 2007 |
12 études sur la fréquence de l'asthme et ses exacerbations (3 études de cohorte, 1 étude cas/témoins et 8 études transversales) |
Études prospectives de cohortes de naissances :
Études cas/témoins nichées :
Études transversales :
|
« La proximité du domicile aux sources de circulation automobile augmente la fréquence et les exacerbations de l'asthme. » Chez les enfants, le risque associé à la circulation automobile est plus élevé chez ceux dont les parents ne souffrent pas d'asthme. Les gènes impliqués dans le stress oxydatif et l'inflammation pourraient jouer un rôle dans la médiation des effets de la circulation automobile sur l'asthme. Les modèles de RUT validés permettaient de mieux prédire les degrés de pollution atmosphérique attribuable à la circulation automobile au domicile. |
Seulement certaines estimations des risques ont été fournies. Les incohérences dans les résultats pourraient être attribuables à l'utilisation de différentes méthodologies pour évaluer les expositions locales liées à la circulation automobile, au signalement de l'intensité de la circulation automobile par les sujets eux-mêmes ou par les parents, aux données manquantes sur le comptage de la circulation automobile et à la corrélation modérée à faible entre chaque mesure de la circulation automobile et les polluants modélisés dans l'air ambiant. Il était impossible d'exclure un biais de publication. Biais de déclaration dans les études individuelles. Biais de rappel pour les études sur les effets sur la santé et les expositions signalées par les sujets eux-mêmes ou les parents. |
| Autres revues sélectionnées | ||||||
Heinrich 2011 (asthme) |
Résumé et évaluation des résultats d'études épidémiologiques sur un large spectre de facteurs intérieurs et sur l'apparition d'asthme pendant l'enfance dans les pays « occidentaux » Seule la section relative aux polluants liés à la circulation automobile pénétrant à l'intérieur a été examinée. |
« Attention particulière à la dernière décennie » Études sur la PACA citées : 2002 à 2010 |
14 études sur 7 cohortes de naissance |
12 des 14 études (toutes les études sauf l'étude de cohorte d'Oslo) ont signalé une augmentation du risque d'asthme, de l'incidence d'asthme, de la prévalence d'asthme ou de respiration sifflante persistante comme symptôme clé d'asthme en début de vie. Seulement certaines estimations d'effets ont atteint le seuil de signification statistique, mais toutes étaient positives. Les estimations des risques n'ont pas été signalées en entier. Pour évaluer l'exposition, les études ont utilisé ce qui suit : RUT, modèle de dispersion, mesures de la circulation automobile du SIG, modèle de régression basé sur le SIG ou polluants liés à la circulation automobile. |
« Des données probantes indiquent qu'il existe un lien de causalité entre les polluants liés à la circulation automobile et l'apparition d'asthme pendant l'enfance. » |
Recours à des questionnaires pour le signalement des symptômes (9 des 14 études) |
Boothe et Shendell 2008 (asthme) |
Effets sur la santé associés à la proximité définie du domicile à la circulation automobile |
Janvier 1999 à juin 2006 |
19 études sur les effets sur la santé respiratoire |
7 des 10 études où les symptômes étaient signalés par les sujets eux-mêmes ou par les parents ont relevé des liens significatifs entre la proximité de la circulation automobile et la respiration sifflante; la respiration sifflante persistante et aiguë était liée au fait de demeurer dans un rayon de 50, 75 et 150 m d'une route passante, mais pas à de plus grandes distances. 3 des 5 études sur les visites chez le médecin et les hospitalisations liées aux symptômes respiratoires ont relevé des liens avec la proximité de la circulation automobile. 4 des 6 études portant sur la prévalence d'asthme ont relevé des liens statistiquement significatifs à la proximité de la circulation automobile; rayon de 75, 100, 150 et 300 m de circulation automobile dense aux États-Unis et en France. |
« Des liens statistiquement significatifs cohérents ont été signalés entre la proximité du domicile à la circulation automobile et : l'augmentation de la prévalence et de la gravité des symptômes d'asthme; une diminution de la fonction pulmonaire. » Conclusion de la revue critique : Les données probantes épidémiologiques étaient insuffisantes pour déterminer la causalité en raison des incertitudes quant aux évaluations de l'exposition (manque d'estimations d'exposition individuelles) et il est impossible d'exclure une confusion attribuable à des facteurs non mesurés. |
Biais de rappel pour les études sur les effets signalés par les sujets eux-mêmes Précision des signalements des enfants Diverses définitions et compréhensions de la respiration sifflante La proximité de la résidence à la circulation automobile ne tient pas compte des profils d'activité temporelle, de la variabilité de la pénétration de la pollution dans les résidences ni de sources intérieures de polluants. |
| Abréviations : D+L : modèle à effets aléatoires de DerSimonian et Laird; I-V : modèle à effets fixes (inverse de la variance) | ||||||
- Note de bas de page 1
-
Une revue systématique utilise des méthodes systématiques pour définir et évaluer les résultats de recherches primaires, ainsi qu'en faire une synthèse qualitative.
- Note de bas de page 2
-
Une revue systématique–méta-analyse est une revue systématique dans le cadre de laquelle une synthèse quantitative des résultats de recherches primaires est effectuée au moyen de techniques de méta-analyse.
- Note de bas de page 3
-
Un examen de la portée établit des liens de façon systématique entre les ouvrages scientifiques existants sur un sujet général en définissant les concepts clés, les types et les sources de renseignements et les lacunes dans la recherche.
- Note de bas de page 4
-
Seuil de signification statistique : 0,9 ≤ limite de confiance plus basse à 95 % ≤ 1,0.
