Pollution atmosphérique liée à la circulation automobile : évaluation des risques pour la santé humaine selon une revue systématique et méta-analyse axée sur la mortalité

Télécharger le format de rechange
(Format PDF, 9,2 Mo, 163 pages)
Organisation : Santé Canada
Publiée : 2025-03-18
Santé Canada – 2025
Remerciements
Cette évaluation des risques a été examinée par les experts scientifiques externes suivants :
Dan Crouse, M.Sc., Ph. D. (Health Effects Institute)
Stéphane Buteau, Ph. D. (Université de Montréal)
Table des matières
- Liste des tableaux
- Liste des figures
- Liste des abréviations
- Résumé
- Chapitre 1. Introduction
- Chapitre 2. Méthode
- Chapitre 3. Analyse documentaire et évaluation
- Chapitre 4. Caractérisation des risques et évaluation de la causalité
- Chapitre 5. Conclusion
- Références
- Annexe. Détails des études par mesure d'exposition
- A.1. Détails des études pour la mortalité par exposition à long terme au NO2
- A.2. Détails des études pour la mortalité par exposition à long terme au NOx
- A.3. Détails des études pour la mortalité par exposition à long terme au NO
- A.4. Détails des études pour la mortalité par exposition à long terme aux PM2,5
- A.5. Détails des études sur la mortalité par exposition à long terme au CÉ, à l'PM2,5 abs et au CN
- A.6. Détails des études sur la mortalité par exposition à long terme aux PM2,5-10 et aux PM10
- A.7. Détails de l'étude pour la mortalité par exposition à long terme au benzène
- A.8. Détails des études pour la mortalité par exposition à long terme au CO
- A.9. Détails des études pour la mortalité par exposition à long terme à la proximité du trafic
- A.10. Détails des études pour la mortalité par exposition à long terme à la densité du trafic
Liste des tableaux
- Tableau 1.1. Résumé des types de mortalité associés à l'exposition à la PACA et conclusions du HEI (2010, 2022)
- Tableau 1.2. Résumé des effets sur la santé et classification des liens de causalité selon Santé Canada (2020; 2022c)
- Tableau 2.1. Facteurs de conversion pour les unités dans la méta-analyse
- Tableau 2.2. Détermination de la causalité en fonction du poids de la preuve (d'après l'EPA des É.-U., 2015)
- Tableau 3.1. Nombre d'articles inclus dans l'évaluation des risques par date de publication et paramètre d'exposition pour chaque cause de mortalité
- Tableau 3.2. Caractéristiques générales des études selon l'emplacement géographique et l'année de publication pour l'exposition à long terme à la PACA
- Tableau 3.3. L'évaluation du RB
Liste des figures
- Figure 2.1. Processus de sélection de l'étude pour l'examen de la portée et l'évaluation de la mortalité fondée sur la revue systématique
- Figure 3.1. Lien entre la mortalité toutes causes confondues et l'exposition à long terme au NO2 dans la population générale
- Figure 3.2. Lien entre la mortalité toutes causes confondues et l'exposition à long terme au NOx dans la population générale
- Figure 3.3. Lien entre la mortalité toutes causes confondues et l'exposition à long terme aux PM2,5 dans la population générale
- Figure 3.4. Lien entre la mortalité toutes causes confondues et l'exposition à long terme au CÉ dans la population générale
- Figure 3.5. Lien entre la mortalité toutes causes confondues et l'exposition à long terme aux PM10 dans la population générale
- Figure 3.6. Graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité toutes causes confondues dans la population générale
- Figure 3.7. Graphique en forêt des estimations de risque d'exposition à long terme à la proximité de la circulation et de mortalité toutes causes confondues dans les populations de patients
- Figure 3.8. Graphique en forêt des estimations de risque d'exposition à long terme à la densité de la circulation et de mortalité toutes causes confondues dans la population générale
- Figure 3.9. Lien entre la mortalité par MSC et l'exposition à long terme au NO2 dans la population générale
- Figure 3.10. Lien entre la mortalité par MCO et l'exposition à long terme au NO2 dans la population générale
- Figure 3.11. Lien entre la mortalité par MCV et l'exposition à long terme au NO2 dans la population générale
- Figure 3.12. Lien entre la mortalité par MCO et l'exposition à long terme au NOx dans la population générale
- Figure 3.13. Lien entre la mortalité par MCV et l'exposition à long terme au NOx dans la population générale
- Figure 3.14. Lien entre la mortalité par MSC et l'exposition à long terme aux PM2,5 dans la population générale
- Figure 3.15. Lien entre la mortalité par MCO et l'exposition à long terme aux PM2,5 dans la population générale
- Figure 3.16. Lien entre la mortalité par MCV (AVC compris) et l'exposition à long terme aux PM2,5 dans la population générale
- Figure 3.17. Lien entre la mortalité par MCO et l'exposition à long terme au CÉ dans la population générale
- Figure 3.18. Lien entre la mortalité par MCV (y compris l'AVC) et l'exposition à long terme au CÉ dans la population générale
- Figure 3.19. Graphique en forêt des estimations de risque d'exposition à long terme à la proximité de la circulation et de mortalité par MSC dans la population générale
- Figure 3.20. Graphique en forêt des estimations de risque d'exposition à long terme à la proximité de la circulation et de mortalité par MCO et par MCV dans la population générale
- Figure 3.21. Graphique en forêt des estimations de risque d'exposition à long terme à la densité de la circulation et de mortalité par MSC et par MCO dans la population générale
- Figure 3.22. Lien entre la mortalité respiratoire et l'exposition à long terme au NO2 dans la population générale
- Figure 3.23. Lien entre la mortalité respiratoire et l'exposition à long terme au NOx dans la population générale
- Figure 3.24. Lien entre la mortalité respiratoire et l'exposition à long terme aux PM2,5 dans la population générale
- Figure 3.25. Graphique en forêt des estimations de risque d'exposition à long terme à la proximité de la circulation et de mortalité respiratoire dans la population générale
- Figure 3.26. Graphique en forêt des estimations de risque d'exposition à long terme à la densité de la circulation et de mortalité respiratoire dans la population générale
- Figure 4.1. Graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité toutes causes confondues dans la population générale; n représente le nombre d'études incluses dans la méta-analyse et I2 l'hétérogénéité.
- Figure 4.2. Graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité circulatoire dans la population générale; n représente le nombre d'études incluses dans la méta-analyse et I2 l'hétérogénéité.
- Figure 4.3. Graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité respiratoire dans la population générale; n représente le nombre d'études incluses dans la méta-analyse et I2 l'hétérogénéité.
Liste des abréviations
- ACS-CPSII
- American Cancer Society – Cancer Prevention Survey II [enquête sur la prévention du cancer II]
- AVC
- accident vasculaire cérébral
- CAD
- dollar canadien
- CCME
- Conseil canadien des ministres de l'environnement
- CÉ
- carbone élémentaire
- CI
- cardiopathie ischémique
- CIM
- Classification internationale des maladies
- CO
- monoxyde de carbone
- COV
- composés organiques volatils
- CN
- carbone noir
- CSERCan
- Cohorte santé et environnement du recensement canadien
- ECA
- événement coronarien aigu
- ER
- estimation des risques
- ESCAPE
- European Study of Cohorts for Air Pollution Effects [étude européenne des cohortes sur les effets de la pollution atmosphérique]
- É.-U.
- États-Unis d'Amérique
- FN
- fumée noire
- FRO
- forme réactive de l'oxygène
- GED
- gaz d'échappement des moteurs diesel
- HAP
- hydrocarbure aromatique polycyclique
- HEI
- Health Effects Institute [institut de recherche sur les effets sur la santé]
- IC
- intervalle de confiance
- ICA
- insuffisance cardiaque
- IM
- infarctus du myocarde
- IR
- indice de risque
- MCO
- maladie coronarienne
- MCP
- maladie cardiopulmonaire
- MCV
- maladie cérébrovasculaire
- MPOC
- maladie pulmonaire obstructive chronique
- MSC
- maladie du système circulatoire
- NHS
- Nurses' Health Study [étude sur la santé des infirmières]
- NLCS
- Netherlands Cohort Study on Diet and Cancer (étude de cohorte)
- NO
- oxyde nitrique
- NO2
- dioxyde d'azote
- NOx
- oxyde d'azote
- O3
- ozone
- OMS
- Organisation mondiale de la Santé
- PACA
- pollution atmosphérique liée à la circulation automobile
- PM
- matières particulaires
- PM2,5
- matière particulaire d'un diamètre inférieur à 2,5 micromètres
- PM2,5 abs
- absorbance de PM2,5
- PM10
- matière particulaire d'un diamètre inférieur à 10 micromètres
- PUF
- particules ultrafines
- RB
- risque de biais
- RC
- rapport de cotes
- REVEAL-HBV
- Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer Hepatitis B Virus [évaluation du risque d'élévation de la charge virale et des maladies du foie connexes, du virus de l'hépatite B ou du cancer]
- RR
- risque(s) relatif(s)
- RS-MA
- revue systématique – méta-analyse
- R.-U.
- Royaume-Uni
- RUT
- régression d'utilisation des terres
- SALIA
- Study on the influence of air pollution on lung function, inflammation and ageing [étude sur l'influence de la pollution de l'air sur la fonction pulmonaire, l'inflammation et le vieillissement]
- SIDIAP
- Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària
- SIG
- système d'information géographique
- S. O.
- sans objet
- SSE
- statut socioéconomique
- US EPA
- Environmental Protection Agency des États-Unis
- VFC
- variabilité de la fréquence cardiaque
Résumé
La pollution atmosphérique liée à la circulation automobile (PACA) est la contribution des véhicules routiers à la pollution atmosphérique. Elle rassemble un mélange de gaz d'échappement des véhicules, de polluants atmosphériques secondaires formés dans l'atmosphère, d'émissions de gaz d'évaporation des véhicules et d'émissions non causées par la combustion (p. ex. poussière de route, usure des freins et usure des pneus). La PACA est particulièrement préoccupante dans les zones urbaines et près des autoroutes, où les concentrations sont les plus élevées. Santé Canada a estimé qu'environ 4 Canadiens sur 10 vivent à moins de 250 m d'une route très passante et que la PACA est responsable de 1 200 décès prématurés par année au Canada, qui représentent une valeur monétaire annuelle estimée à 9 milliards de dollars (CAD 2015) (Santé Canada, 2022a, b).
Santé Canada a déjà évalué le lien entre l'exposition à la PACA et l'asthme, les allergies, la fonction pulmonaire et certains types de cancer (Santé Canada, 2020, 2022c). L'objectif de la présente évaluation des risques est d'évaluer le lien entre la mortalité et l'exposition à la PACA. Cette mesure éclairera et appuiera les programmes et les politiques conçus pour atténuer l'exposition à la PACA au Canada et ses effets sur la santé.
Dans le cas de cette évaluation des risques, la littérature épidémiologique (du 1er janvier 2000 au 11 juillet 2022) concernant les liens entre l'exposition à la PACA et la mortalité a été évaluée à l'aide de techniques de revue systématique, notamment la méta-analyse. Soixante-quatre articles principaux ont été inclus dans l'évaluation des risques à la suite d'un processus de recherche et de présélection assisté par un bibliothécaire. À partir de cette évaluation, une approche fondée sur le poids de la preuve a été utilisée pour déterminer le rôle causal de l'exposition à la PACA dans la mortalité toutes causes confondues, la mortalité liée à des affections circulatoires et certains sous-types, ainsi que la mortalité liée à des affections respiratoires et certains sous-types. Ce poids de la preuve comprenait 1) l'analyse quantitative des concentrations de polluants issus de la PACA, 2) l'analyse qualitative des polluants issus de la PACA pour lesquels une méta-analyse n'a pas pu être effectuée, et 3) les preuves qualitatives basées sur diverses mesures de la proximité de la circulation automobile et des réseaux routiers. De plus, les données mécanistes recueillies à partir des évaluations des risques de la PACA et de la littérature primaire pertinente ont été prises en compte pour évaluer la plausibilité biologique de ces liens et pour appuyer les déterminations de causalité. Les données probantes biologiques soutiennent que l'exposition à la PACA joue un rôle dans le dysfonctionnement cellulaire et tissulaire, y compris le stress oxydatif et l'inflammation, ainsi que dans l'accélération de la progression de la maladie, qui peut finalement conduire à la mortalité.
Selon l'ensemble du poids de la preuve, les conclusions sont les suivantes :
- les données probantes sont suffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité toutes causes confondues;
- les données probantes sont suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité due à la maladie du système circulatoire (MSC);
- les données probantes sont suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité due à la maladie coronarienne (MCO);
- les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité due aux maladies respiratoires;
- les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité due à la maladie pulmonaire obstructive chronique (MPOC);
- les données sont insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité due à la maladie cérébrovasculaire (MCV).
La taille de la base de données probantes variait considérablement selon la cause précise de mortalité évaluée, ce qui se reflète dans les conclusions relatives au lien de causalité. Les conclusions relatives au lien de causalité pour la mortalité toutes causes confondues, la mortalité liée à une MSC et la mortalité due à une MCO ont chacune été fondées sur une vaste base de données probantes et sur l'uniformité dans les méta-analyses. En revanche, il n'a pas été possible de déterminer un lien de causalité pour la mortalité attribuable à une MCV en raison de la base de données probantes limitée et du manque d'uniformité dans les méta-analyses. De plus, seul un nombre limité d'études ont été menées sur d'autres causes de mortalité telles que l'insuffisance cardiaque et l'infarctus du myocarde, ainsi que sur des populations qui peuvent être touchées de manière disproportionnée, y compris les populations de patients.
D'autres recherches et analyses visant à combler les lacunes repérées en matière de données seraient utiles pour mieux caractériser et comprendre le rôle de l'exposition à la PACA dans la mortalité. La désignation des populations qui pourraient être touchées de manière disproportionnée par l'exposition à la PACA pourrait également servir à élaborer des politiques ou des programmes ciblés qui réduiraient ou atténueraient leurs risques. Par conséquent, ces conclusions pourraient être mises à jour et élargies à l'avenir pour inclure d'autres causes précises de mortalité ou des sous-populations.
Chapitre 1. Introduction
1.1 Contexte
En tant que source de pollution atmosphérique, la pollution atmosphérique liée à la circulation automobile (PACA) est omniprésente et prédomine dans les zones urbaines. La PACA désigne le mélange de gaz d'échappement des véhicules, de polluants atmosphériques secondaires formés dans l'atmosphère par les émissions des véhicules, d'émissions par évaporation des véhicules et d'autres émissions non liées à la combustion (p. ex. poussière de route, usure des freins et usure des pneus). Environ 4 Canadiens sur 10 vivent à moins de 250 m d'une route très passante (p. ex. voies rapides, autoroutes, artères et routes principales), zone associée à un risque plus élevé d'exposition à la PACA (Santé Canada, 2022a). Santé Canada a également estimé que 1 200 décès prématurés par année sont attribuables à la PACA, d'après les contributions des émissions des véhicules routiers aux matières particulaires dont le diamètre aérodynamique moyen en masse est inférieur à 2,5 micromètres (PM2,5), aux concentrations ambiantes de dioxyde d'azote (NO2) et d'ozone (O3) au Canada (Santé Canada, 2022b). Cette analyse a également estimé que la PACA contribue à 2,7 millions de jours de symptômes respiratoires aigus, 1,1 million de jours d'activité restreinte, et 210 000 jours de symptômes de l'asthme par an au Canada. La valeur monétaireNote de bas de page 1 annuelle totale de ce fardeau pour la santé a été estimée à 9,5 milliards de dollars (CAD 2015), dont 9 milliards de dollars associés aux décès prématurés. À ce titre, l'étude des effets de la PACA sur la santé et du fardeau pour la santé est un domaine de recherche actif au Canada et dans le monde entier.
L'exposition à la PACA est particulièrement difficile à étudier en raison de sa grande variabilité spatiale et temporelle, de l'absence d'un marqueur unique pour cette source et de la composition variable du parc de véhicules dans l'espace et le temps (Khreis et Nieuwenhuijsen, 2017). Deux grandes catégories de mesures d'exposition servent couramment à évaluer la part des émissions liées à la circulation automobile dans la pollution atmosphérique ambiante : 1) les concentrations de chaque polluant lié à la circulation automobile, comme le NO2, l'oxyde d'azote (NOx), les PM2,5, les PM dont le diamètre aérodynamique moyen en masse est inférieur à 10 micromètres (PM10) et le carbone élémentaire (CÉ); et 2) les mesures fondées sur l'infrastructure du réseau routier et la circulation automobile, comme la distance par rapport à la route la plus proche et les mesures de la densité de la circulation (Panel on the Health Effects of Traffic-Related Air Pollution de l'Institut de recherche sur les effets sur la santé [HEI] 2010, 2022). Voici un bref résumé de la façon dont ces mesures d'exposition se rapportent précisément à la PACA :
- Le NOx est principalement émis par des sources de combustion et est composé d'oxyde nitrique (NO) et de NO2. Les émissions des véhicules sont principalement du NO qui est rapidement converti en NO2 (HEI, 2010; Santé Canada, 2016a). Dans les zones urbaines, la circulation automobile est souvent la principale source de NOx dans l'atmosphère et le principal facteur contribuant à la variabilité des niveaux de NOx (Hamra et coll., 2015). On considère que le NO2 est l'indicateur le plus direct de l'exposition à la PACA, car les sources de circulation locales sont responsables de jusqu'à 80 % du NO2 présent dans l'air ambiant en milieu urbain (Khreis et Nieuwenhuijsen, 2017). Compte tenu de la disponibilité des mesures du NO2 dans l'air ambiant, il s'agit de la mesure d'exposition la plus couramment utilisée pour estimer l'exposition à la PACA.
- Les matières particulaires (PM) sont un mélange complexe de petites matières particulaires liquides et solides et sont associées à de nombreuses sources, y compris les émissions des véhicules et la circulation. Les PM sont catégorisées en fonction de leur taille : PM10; les PM2,5-10 (les matières particulaires > 2,5 μm et < 10 μm de diamètre aérodynamique); PM2,5; et les particules ultrafines (PUF) [PM ≤ 0,1 μm de diamètre aérodynamique]. Les PM10, les PM2,5-10 et les PM2,5 sont généralement mesurées en fonction de la concentration massique (c.-à-d. μg/m3), tandis que les PUF sont généralement déclarées selon une concentration numérique. En ce qui concerne la PACA, les matières particulaires sont un polluant important dans le mélange, car la circulation locale est responsable de 9 % à 53 % des PM10 urbaines et de 9 % à 66 % des PM2,5 urbaines (Khreis et Nieuwenhuijsen, 2017). De plus, certains composants des matières particulaires sont couramment utilisés comme mesures d'exposition à la PACA, notamment le CÉ, le carbone noir (CN), la fumée noire (FN) et l'absorbance de PM2,5 (PM2,5 abs). Ces polluants carbonés sont des indicateurs des émissions de gaz d'échappement des moteurs diesel (GED), en particulier dans les villes, et sont définis par les techniques utilisées pour les mesurer, plutôt que par des différences fondamentales dans leurs propriétés chimiques (HEI, 2022).
- Le monoxyde de carbone (CO) anthropique est principalement formé par la combustion incomplète de combustibles contenant du carbone. Les véhicules routiers contribuent de façon notable aux émissions totales de CO au Canada, avec des contributions de 28 % selon l'inventaire du Canada des émissions pour 2015 (Santé Canada, 2022b).
- Le benzène est un constituant naturel du pétrole brut et se forme par la combustion incomplète de matières organiques (Canada, 1993). Les concentrations de benzène ont tendance à être plus élevées dans les véhicules et au bord des routes urbaines, les niveaux diminuant à mesure que la distance par rapport à la source augmente (p. ex. les concentrations diminuent du bord de la route vers les zones urbaines et les zones rurales) (Conseil canadien des ministres de l'environnement, 2012; HEI, 2010).
- Comparativement aux données sur des polluants atmosphériques précis, les mesures fondées sur des mesures de la circulation automobile et du réseau routier, comme la distance par rapport à une route et la densité de la circulation, sont propres aux sources de circulation, et leur acquisition est simple et efficiente (Khreis et Nieuwenhuijsen, 2017). Toutefois, ces mesures peuvent ne pas tenir compte du volume de circulation ou des types de véhicules (p. ex. la proportion de voitures et de camions) composant la circulation, qui influencent la concentration relative des polluants composant la PACA. Ces mesures peuvent également représenter plus que la pollution atmosphérique (p. ex. le bruit) et peuvent varier considérablement d'une étude à l'autre (p. ex. distances différentes par rapport à la chaussée, classifications routières différentes), ce qui limite la capacité de comparer et de contraster facilement les résultats.
En 2010, le HEI a publié une revue critique de la littérature sur les émissions, l'exposition et les effets de la PACA sur la santé (HEI, 2010). En ce qui a trait aux effets sur la santé, une évaluation de la littérature épidémiologique a été réalisée afin de cerner les liens de causalité entre l'exposition à la PACA et des effets sur la santé. Pour les besoins de cette évaluation, la littérature toxicologique a été examinée en vue de définir les mécanismes biologiques qui expliqueraient en quoi les émissions liées à la circulation automobile contribuent aux effets observés dans les études épidémiologiques. Cette revue a permis au HEI de classifier les liens de causalité entre l'exposition à la PACA et certains effets sur la santé. En raison de l'enrichissement de la base de données sur les effets sur la santé liés à l'exposition à la PACA et des progrès importants réalisés dans la réglementation et la technologie des véhicules, le HEI a publié un rapport spécial en 2022 axé sur la revue systématique des preuves épidémiologiques concernant les liens entre l'exposition à long terme à la PACA et certains effets indésirables sur la santé (HEI, 2022). Le comité a évalué la confiance dans la qualité de l'ensemble des preuves et a évalué le niveau de confiance dans la présence d'un lien entre l'exposition à long terme à la PACA et certains effets, plutôt que d'évaluer la causalité. Le tableau 1.1 présente un résumé des effets évalués en matière de mortalité ainsi que les conclusions des deux rapports du HEI (2010, 2022).
| Type de mortalité | Classification du lien de causalité (HEI, 2010) | Confiance globale dans les données probantes (HEI, 2022) |
|---|---|---|
| Mortalité toutes causes confondues | Données évocatrices, mais insuffisantes | Élevée |
| Mortalité cardiovasculaire Mortalité circulatoire |
Données évocatrices, mais insuffisantes — |
— Élevée |
| Mortalité par CI | S. O. | Élevée |
| Mortalité par AVC | S. O. | Faible à modérée |
| Mortalité respiratoire | S. O. | Modérée |
| Mortalité due à la MPOC | S. O. | Faible |
|
AVC : accident vasculaire cérébral; MPOC : maladie pulmonaire obstructive chronique; CI : cardiopathie ischémique; S. O. : sans objet
|
||
À l'aide d'une approche globale fondée sur l'examen, Santé Canada a évalué le lien entre la PACA et l'asthme, les allergies et la fonction pulmonaire (Santé Canada, 2020), ainsi que le lien entre la PACA et certains types de cancer (Santé Canada, 2022c). Les conclusions de ces évaluations sont présentées dans le tableau 1.2. Le présent rapport met l'accent sur l'exposition à la PACA et le risque de mortalité.
| Effets sur la santé | Classification du lien de causalité |
|---|---|
| Incidence de l'asthme (enfants) | Données suffisantes pour conclure à un lien de causalité |
| Prévalence de l'asthme (enfants) | Données suffisantes pour conclure à un lien de causalité |
| Incidence de l'asthme (adultes) | Données inadéquates pour conclure à un lien de causalité |
| Prévalence de l'asthme (adultes) | Données évocatrices, mais insuffisantes pour conclure à un lien de causalité |
| Fonction pulmonaire | Données suffisantes pour conclure à un lien de causalité probable |
| Sensibilisation allergique et réactions allergiques | Données évocatrices, mais insuffisantes pour conclure à un lien de causalité |
| Cancer du poumon (adultes) | Données suffisantes pour conclure à un lien de causalité |
| Cancer du sein (adultes) | Données évocatrices, mais insuffisantes pour conclure à un lien de causalité |
| Leucémie infantile | Données suffisantes pour conclure à un lien de causalité probable |
1.2 Objectifs et approche
L'objectif de cette évaluation des risques est d'utiliser des techniques de revue systématique, y compris une méta-analyse, dans l'évaluation de la littérature épidémiologique concernant les liens entre l'exposition à la PACA et la mortalité. Une approche fondée sur le poids de la preuve a été utilisée pour déterminer le rôle causal de la PACA dans la mortalité toutes causes confondues, la mortalité liée à des affections circulatoires et certains sous-types, ainsi que la mortalité liée à des affections respiratoires et certains sous-types. En outre, les données mécanistes recueillies à partir des récentes évaluations des risques de la PACA et de la littérature primaire publiée récemment ont été prises en compte pour évaluer la plausibilité biologique des liens déterminés dans l'examen des preuves épidémiologiques et pour appuyer les déterminations de causalité.
Le présent document d'évaluation des risques est présenté comme suit :
- Le chapitre 1 fournit des renseignements généraux et décrit les objectifs et l'approche.
- Le chapitre 2 décrit en détail la méthodologie adoptée pour cette évaluation des risques.
- Le chapitre 3 présente les données probantes tirées des articles primaires épidémiologiques inclus et de l'analyse des données.
- Le chapitre 4 évalue de façon critique les données probantes du chapitre 3 et présente des données biologiques à l'appui des résultats des études épidémiologiques pour la détermination de la causalité.
- Le chapitre 5 présente les conclusions et cerne les principales incertitudes et lacunes.
Un document à l'appui est également disponible sur demande. Il comprend la stratégie de recherche détaillée pour la mise à jour de la littérature, les lignes directrices sur le risque de biais (RB) utilisées pour évaluer les études de cohortes, des analyses quantitatives supplémentaires des études épidémiologiques et des récapitulatifs tabulaires des preuves biologiques.
Chapitre 2. Méthode
Dans le présent chapitre, la méthodologie utilisée pour cette évaluation des risques est décrite en détail. La section 2.1 résume le processus utilisé pour recenser la littérature épidémiologique pertinente sur l'exposition à la PACA et les effets néfastes sur la santé, y compris l'examen de la portée, le cadre d'exposition à la PACA et à la circulation automobile, ainsi que les mises à jour subséquentes de la recherche documentaire en fonction des paramètres de mortalité pris en compte dans cette évaluation des risques. La section 2.2 détaille l'examen préliminaire, l'extraction des données, l'évaluation du RB et l'analyse des données. La section 2.3 décrit de quelle façon les données biologiques relatives à la PACA et les paramètres de santé d'intérêt ont été utilisés pour évaluer la plausibilité biologique. Enfin, la section 2.4 présente les critères utilisés pour déterminer le niveau de causalité par la méthode du poids de la preuve.
2.1 Détermination de la littérature pertinente
2.1.1 Revue de la portée
Comme première étape, une revue de la portéeNote de bas de page 2 de la littérature épidémiologique traitant des effets de la PACA sur la santé humaine a été menée (Matz et coll., 2019). La principale question de recherche pour cette revue de la portée était la suivante : « quels sont les ouvrages scientifiques existants qui traitent du lien entre l'exposition à la PACA et les effets indésirables sur la santé humaine, y compris les effets touchant divers systèmes (respiratoire, cardiovasculaire, immunologique, reproducteur/développement et nerveux), ainsi que d'autres effets sur la santé, comme le cancer et la mortalité? » La revue de la portée comprenait des articles de recherche épidémiologique primaire et certains types de revues (décrits ci-dessous) qui avaient été publiés dans des revues évaluées par des pairs et qui répondaient aux objectifs de la revue de la portée. Les modèles d'études observationnelles pris en considération étaient les études cas-témoins, de cohorte, transversales, par panel, écologiques, de séries chronologiques et des études cas croisés. Les études biologiques ont été incluses uniquement si des sujets humains y avaient participé (c.-à-d. des études d'exposition contrôlée chez l'humain). Les types de revues inclus dans la revue de la portée comprenaient les revues systématiques, les méta-analyses, les revues de la portée et les revues critiques qui comprenaient une évaluation du lien de causalité. En ce qui a trait aux mesures de l'exposition à la PACA et à la circulation automobile, les critères d'inclusion ont été définis d'après la revue critique de la PACA par le HEI (2010). Ces critères ont permis aux évaluateurs d'extraire les études axées sur la PACA ou la circulation automobile d'un large éventail d'études sur la pollution atmosphérique en général. Les mesures d'exposition suivantes satisfaisaient aux critères d'inclusion : la distance par rapport aux routes; les mesures de la densité de la circulation automobile; la modélisation (p. ex. régression de l'utilisation des terres [RUT] et dispersion) visant à estimer l'exposition à la circulation automobile spécifiquement; la répartition des sources selon la circulation automobile; les professions caractérisées par l'exposition à la circulation automobile (p. ex. chauffeurs de taxi et camionneurs); les sujets dans des emplacements caractérisés par le degré d'exposition à la circulation automobile (p. ex. comparaison entre des emplacements à faible ou à forte exposition); et la surveillance des polluants liés à la PACA (p. ex. NO2 et CN) lorsque les mesures pouvaient raisonnablement être liées aux sources de circulation automobile (p. ex. la surveillance de routes en particulier). Afin de cibler les expositions liées à la PACA, les études qui caractérisaient l'exposition en fonction de la proximité des stations-service ont été exclues de la revue de la portée.
Les recherches documentaires ont été menées par un bibliothécaire de Santé Canada dans deux bases de données, Ovid Embase et Ovid MEDLINE, et ont couvert la période allant du 1er janvier 2000 au 4 avril 2018. La stratégie de recherche et les critères d'inclusion sont décrits plus en détail dans Matz et coll. (2019). Deux évaluateurs ont examiné de façon indépendante les références extraites de la recherche documentaire pour déterminer leur admissibilité, d'abord selon le titre et le résumé, puis le texte complet; les désaccords ont été résolus au moyen d'une approche consensuelle. Pour la schématisation des données probantes, l'extraction des données incluait les paramètres de conception de l'étude et les effets sur la santé humaine. Des tableaux récapitulatifs descriptifs ont été créés pour offrir un résumé général du nombre et des types d'articles évaluant les divers types d'effets sur la santé et une tabulation recoupée en fonction des paramètres de conception de l'étude. Le processus de revue a été géré entièrement à l'aide de DistillerSR (Evidence Partners, Ottawa, Ontario).
La revue de la portée a montré qu'il convenait d'évaluer le lien entre l'exposition à la PACA et la mortalité au moyen d'une évaluation des risques pour la santé humaine, car un nombre relativement important de publications primaires a été désigné dans la schématisation des données probantes. De plus, la mortalité est l'effet le plus grave pour la santé; il est donc important de comprendre les causes et les risques connexes pour la population.
2.1.2 Cadre d'évaluation de la circulation automobile et de l'exposition à la PACA
Le HEI a publié un protocole pour mener une revue systématique et une méta-analyse de certains effets sur la santé résultant d'une exposition à long terme à la PACA (HEI, 2019) dans le but d'appuyer son évaluation mise à jour de la PACA (2022). Ce protocole comprenait un cadre d'exposition mis à jour pour l'évaluation des effets de la PACA sur la santé dans les études épidémiologiques. Ce cadre a conservé les concepts fondamentaux du rapport de 2010 du HEI tout en affinant les critères de détermination des études dans lesquelles les contrastes d'exposition des polluants de la PACA étaient principalement dus à des sources de circulation automobile. Cette précision a aidé à la détermination et à la sélection d'études spécifiques à la PACA à partir de l'ensemble plus vaste de la recherche sur la pollution atmosphérique (c.-à-d. des études sur la pollution de l'air ambiant en tenant compte de toutes les sources). De plus, le protocole du HEI indiquait que les études sur l'exposition professionnelle à la PACA (p. ex. chez les chauffeurs de taxi et les camionneurs) n'avaient pas été jugées utiles dans le rapport de 2010 du HEI et que ces études seraient difficiles à combiner avec des études d'exposition ambiante. Par conséquent, les expositions professionnelles n'ont pas été prises en compte dans la portée du rapport mis à jour du HEI sur la PACA (HEI, 2019, 2022).
Dans le cadre de cette évaluation des risques liés à l'exposition à la PACA et à la mortalité, les études primaires déterminées à partir de l'examen de la portée et des mises à jour de la recherche documentaire ont également été évaluées en vue de leur inclusion ou de leur exclusion en fonction du cadre d'exposition mis à jour du HEI. Les détails du cadre d'évaluation de l'exposition élaboré par le HEI sont détaillés dans ses documents d'examen de la PACA (HEI, 2010, 2019, 2022) et les concepts clés sont résumés dans la présente section.
Pour toute zone urbaine, la qualité globale de l'air est composée de ce qui suit :
- les polluants atmosphériques régionaux de fond entrant dans la ville;
- les polluants atmosphériques de fond urbains dispersés à partir de sources primaires d'émissions, notamment la circulation automobile et d'autres sources, et les polluants atmosphériques secondaires associés à ces sources;
- la contribution directe des sources de circulation automobile locale (p. ex. les points chauds).
Dans les zones urbaines, les émissions de la PACA sont plus élevées dans les zones où la circulation automobile est plus élevée, et les niveaux accrus de polluants de la PACA dans ces zones sont facilement attribués au réseau routier et aux volumes de circulation automobile. Pour cet environnement près de la route, des facteurs tels que le volume de la circulation automobile, la composition du parc, la source de carburant et le comportement de conduite sont les principaux déterminants des émissions issues de la circulation automobile. Des tendances diurnes des concentrations de polluants sont observables en fonction des volumes de circulation automobile (p. ex. les pointes du matin et du soir associées à la circulation aux heures de pointe). De plus, à mesure que la distance par rapport aux routes augmente, les concentrations des principaux polluants de la PACA (p. ex. CO, NO, CÉ, PUF) diminuent. Comme les émissions primaires de la circulation automobile sont dispersées depuis l'environnement routier, elles se mélangent à d'autres polluants et sont soumises aux mêmes processus chimiques et physiques que les polluants provenant d'autres sources, et finissent par faire partie du paysage urbain global.
Compte tenu de cette complexité de la qualité de l'air en milieu urbain, trois stratégies ont été envisagées conjointement pour déterminer les études dans lesquelles les contrastes d'exposition des polluants de la PACA étaient principalement attribuables aux sources de circulation automobile :
- les polluants ou les mesures de la circulation automobile;
- l'échelle spatiale;
- la méthode d'évaluation de l'exposition et sa résolution spatiale.
Premièrement, comme il n'y a pas de polluant propre à la PACA, certains polluants ont été considérés comme représentant les sources de circulation automobile mieux que d'autres (p. ex. NO2 par rapport aux hydrocarbures aromatiques polycycliques [HAP]). Pour les polluants ayant des contributions régionales provenant d'autres sources (p. ex. PM2,5, PM2,5-10 et PM10), les contrastes d'exposition en milieu urbain (c.-à-d. les contrastes à l'intérieur de la ville) ont été considérés comme étant en grande partie attribuables aux sources de circulation automobile, car la composante régionale est en grande partie constante dans de grandes zones. De plus, si les preuves d'un lien avec des effets sur la santé visaient les matières particulaires, mais pas d'autres polluants présentant un lien bien plus étroit avec la PACA, tels que le NO2 ou le CÉ, le niveau de confiance dans le lien avec la PACA a été abaissé. Les mesures de la circulation fondées sur l'infrastructure du réseau routier (p. ex. la distance par rapport à la route ou la densité de la circulation automobile) ont été considérées comme des marqueurs très précis des variations de l'exposition à la circulation automobile, bien qu'elles soient des mesures indirectes de l'exposition à la PACA.
Deuxièmement, l'échelle spatiale d'une étude est un élément important de l'évaluation de la spécificité des contrastes d'exposition pour la PACA. Les échelles spatiales ont été définies comme étant régionales (>50 km), urbaines (de 5 km à 50 km), par quartier (de 1 km à 5 km) et locales (<1 km). À l'échelle régionale et urbaine, il est difficile d'isoler les contrastes dans la PACA par rapport aux contrastes dus à toutes les sources. En comparaison, les contrastes d'exposition à l'échelle du quartier et à l'échelle locale ont été jugés pertinents pour la PACA. Par conséquent, les études qui utilisaient des comparaisons à l'intérieur de la ville ont été incluses. Cependant, les études qui s'appuyaient sur des comparaisons entre les villes et les études qui portaient sur de très grandes zones géographiques (p. ex. des études à l'échelle nationale ou à l'échelle d'un État) ont été exclues en raison du manque de spécificité pour la PACA par rapport à d'autres sources – le contraste d'exposition étant considéré comme principalement attribuable à des différences régionales dans toutes les sources, et non à des différences dans la circulation.
Troisièmement, la résolution spatiale de la méthode d'évaluation de l'exposition a été évaluée pour sélectionner les études dans lesquelles les contrastes d'exposition étaient dus à des variations de la circulation automobile à l'intérieur de la ville, de l'échelle locale à l'échelle du voisinage. Ainsi, la résolution requise de la surface d'exposition aux polluants atmosphériques était ≤5 km (c.-à-d. grille de 5 x 5 km ou moins) correspondant à la plage supérieure de l'échelle du quartier. Pour les mesures indirectes de la PACA, fondées sur l'infrastructure du réseau routier, la résolution requise était ≤1 km (c.-à-d. ≤1 km d'une route principale ou d'une autoroute), ce qui correspond à la portée supérieure de l'échelle locale. De plus, la résolution spatiale requise des données d'adresse (p. ex. adresse exacte, code postal détaillé, îlots de recensement) des participants à l'étude a été déterminée à 5 km pour les polluants atmosphériques et à 100 m pour les mesures d'exposition indirecte.
2.1.3 Mise à jour de la recherche documentaire et recherche manuelle
Pour les besoins de la présente évaluation des risques, des mises à jour de la recherche documentaire à l'aide d'une stratégie de recherche améliorée, dont la portée se limite aux études sur la mortalité, ont été effectuées par un bibliothécaire de Santé Canada à l'aide de deux bases de données, Ovid Embase et Ovid Medline, le 16 octobre 2020 et le 11 juillet 2022. Cette stratégie de recherche est présentée à la section 1 de la documentation à l'appui. Les études primaires désignées dans les mises à jour de la recherche documentaire ont été évaluées en fonction des mêmes méthodes et critères que ceux utilisés dans l'examen de la portée (Matz et coll., 2019) et avec le cadre d'exposition mis à jour du HEI (HEI, 2019). L'examen préliminaire et la sélection des études primaires pertinentes à partir des mises à jour de la recherche documentaire ont été gérés à l'aide de DistillerSR (DistillerSR Inc., Ottawa, Ontario).
Pour compléter les recherches documentaires, les références de deux revues systématiques–méta-analyses (RS-MA) récentes de l'exposition à long terme au NO2 et de la mortalité (Huangfu et Atkinson, 2020; Stieb et coll., 2021) et une RS-MA récente de l'exposition à long terme aux PM2,5 (Chen et Hoek, 2020) ont fait l'objet d'une recherche manuelle. Deux de ces trois RS-MA (Huanfu et Atkinson, 2020; Chen et Hoek, 2020) avaient été menées pour éclairer les lignes directrices sur la qualité de l'air élaborées par l'Organisation mondiale de la Santé (OMS, 2021).
2.2 Examen préliminaire, extraction de données, évaluation du risque de biais et analyse des données
2.2.1 Examen préliminaire et extraction de données
Toutes les études relevées à partir de la revue de la portée (n = 110), des mises à jour de la recherche documentaire (n = 902) et de la recherche manuelle (n = 14) ont été examinées en fonction du cadre d'évaluation de l'exposition défini à la section 2.1.2 et pour l'évaluation de la mortalité comme effet sur la santé. Pour ce qui est de la mortalité, tant la mortalité toutes causes confondues que la mortalité par cause ont été prises en compte. Aux fins de cette évaluation, la mortalité toutes causes confondues faisait référence au nombre total de décès (c.-à-d. la mortalité toutes causes confondues) ainsi qu'aux décès qui n'étaient pas le résultat d'un accident ou d'un suicide (c.-à-d. non accidentels ou naturels). La mortalité par cancer du poumon a été exclue, car le lien entre l'exposition à la PACA et le cancer du poumon chez les adultes a déjà été évaluée par Santé Canada (2022c), qui avait déterminé un lien de causalité. L'examen préliminaire du titre et du résumé et l'examen préliminaire du texte intégral ont été effectués deux fois; toute divergence a été résolue par consensus ou par consultation d'un troisième évaluateur. Par conséquent, 64 articles primaires ont été inclus dans l'évaluation des risques. Aucune des études évaluant l'exposition à court terme aux polluants de la PACA ne répondait aux critères de particularité de la circulation automobile selon le cadre d'exposition décrit à la section 2.1.2 (p. ex. les expositions ont été attribuées au niveau de la ville).
Le processus de sélection de l'étude est illustré à la figure 2.1.
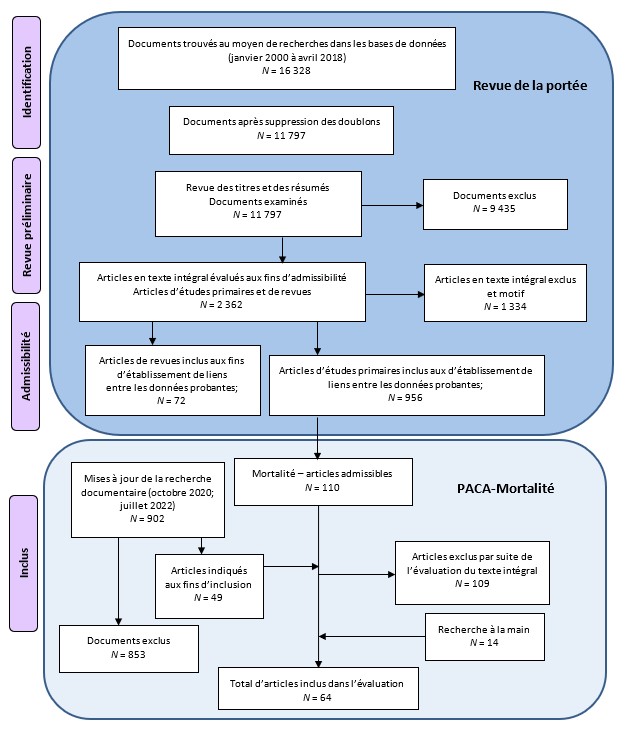
Figure 2.1 : Texte descriptif
La figure 2.1 illustre le flux d'informations à travers les différentes phases d'un examen systématique et indique le nombre d'enregistrements identifiés, inclus et exclus. Pour l'examen de la portée : 16 328 enregistrements ont été identifiés grâce à la recherche dans la base de données, dont 11 797 enregistrements sont restés après la suppression des doublons. 11 797 enregistrements ont ensuite été examinés pour le titre et le résumé, après quoi 9 435 enregistrements ont été exclus et le texte intégral de 2 362 articles primaires et de synthèse a été évalué pour leur éligibilité. Parmi ces articles en texte intégral, 1 334 ont été exclus avec raison, laissant 956 articles primaires et 72 articles de synthèse dans la carte des preuves. Pour l'évaluation de la PACA-Mortalité : 110 des 956 articles primaires étaient éligibles car ils portaient sur la mortalité et 49 des 902 articles primaires identifiés dans les mises à jour de la recherche documentaire ont été inclus comme articles éligibles. Ces mises à jour de la recherche documentaire ont été effectuées en octobre 2020 et en juillet 2022. Suite à l'évaluation du texte intégral des 159 articles, 109 ont été exclus avec raison et 14 articles supplémentaires ont été identifiés à partir de recherches secondaires, ce qui laisse 64 articles dans l'évaluation.
Pour chaque étude, plusieurs domaines de données ont été extraits : l'information bibliographique; la période et le lieu d'étude; la taille et les données démographiques de l'étude; la mesure du polluant ou de l'exposition, la méthode d'évaluation de l'exposition, l'échelle spatiale et la répartition de l'exposition; la cause du décès et les codes de la Classification internationale des maladies (s'il y a lieu); les covariables du modèle (y compris les facteurs de confusion potentiels); et les estimations des risques (ER), y compris les intervalles de confiance (IC) à 95 % et les incréments de polluants. Des analyses de cohorte complètes ont été sélectionnées plutôt que des analyses de cas-cohortes. L'extraction des données a été réalisée par deux évaluateurs avec un chevauchement partiel d'environ 30 % des études incluses; toute divergence a été résolue par consensus ou par consultation d'un troisième évaluateur.
2.2.2 Évaluation du risque de biais
En tant qu'élément important du processus de revue systématique, une évaluation du RB a été effectuée pour évaluer la validité des études incluses et pour établir la transparence dans la synthèse des données probantes pour les résultats (Higgins et coll., 2011). L'outil d'évaluation du RB utilisé pour cette évaluation des risques était basé sur les critères proposés par Lam et coll. (2016) dans une revue systématique et une méta-analyse sur la pollution atmosphérique et les troubles du spectre autistique; il a également été utilisé par Stieb et coll. (2021) et Santé Canada (2022d) avec des modifications mineures. Les définitions et les lignes directrices de l'outil sur le RB visant l'évaluation des études de cohortes sont présentées à la section 2 de la documentation à l'appui. Le RB au niveau de l'étude a été évalué pour les domaines suivants : biais de sélection et généralisabilité, évaluation de l'exposition en ce qui concerne la modélisation et la surveillance, domaine de confusion, évaluation des effets, exhaustivité des données sur les effets, rapports sélectifs sur les résultats, conflits d'intérêts et autres sources de biais. En ce qui concerne le domaine de confusion, l'âge, le sexe, le tabagisme et le statut socioéconomique (SSE) au niveau individuel ou régional ont été choisis a priori comme facteurs de confusion potentiels critiques. Les mêmes lignes directrices sur le RB ont été utilisées pour évaluer les études de contrôle de cas, à l'exception du domaine du biais de sélection, pour lequel le jugement professionnel a été exercé. Deux évaluateurs ont examiné le RB pour chaque étude, et les écarts entre leurs évaluations ont été résolus par consensus et par consultation d'un troisième évaluateur, au besoin.
2.2.3 Analyse des données
L'analyse des données a été effectuée séparément pour chaque paire individuelle exposition-effet (p. ex. NO2 – mortalité toutes causes confondues). Les candidats à l'exposition comprenaient le NO2, le NOx, le NO, les PM2,5, les PM10, le CÉ, le benzène, le CO, la proximité de la circulation automobile et sa densité. Les effets candidats se composaient de la mortalité toutes causes confondues, de la mortalité circulatoire et de ses causes particulières, ainsi que de la mortalité respiratoire et de ses causes particulières. Pour chaque paire exposition-effet, l'ER le plus approprié (c.-à-d. dérivé à l'aide du modèle statistique le plus approprié ou désigné comme les principaux résultats par les auteurs de l'étude) a été sélectionné dans chaque étude, et si deux études ou plus fournissaient des ER pour la même cohorte, une seule étude de la même cohorte a été sélectionnée pour l'analyse. L'expression « estimation du risque (ER) » est utilisée dans ce rapport pour englober chaque mesure du rapport de risques déterminée par les études individuelles lorsqu'on s'y réfère collectivement dans la méta-analyse.
La signification statistique des ER a été évaluée en fonction de l'IC à 95 %. Une ER était considérée comme significative si l'IC ne comprenait pas 1,0 (c.-à-d. l'association nulle) et au seuil de signification statistique si, pour les ER supérieures à 1, la limite inférieure de l'intervalle de confiance à 95 % était de 0,9 à 1,0 inclusivement, ou, pour les ER inférieures à 1, la limite supérieure de l'intervalle de confiance était de 1,0 à 1,1 inclusivement.
L'analyse des données a été entreprise quantitativement dans la mesure du possible, ou qualitativement lorsque l'analyse quantitative était impossible. Les paires exposition-effets présentant un nombre minimal d'ER (n = 4) ont été analysées quantitativement, et les paires polluant-effet qui n'atteignaient pas le nombre minimal d'ER ont été décrites qualitativement. Les mesures de la circulation automobile et de l'infrastructure du réseau routier (c.-à-d. la proximité et la densité de la circulation automobile) ont été analysées qualitativement, car il n'y a pas suffisamment d'uniformité et de normalisation dans ces paramètres pour permettre une synthèse quantitative.
Analyse quantitative : méta-analyse
Une méta-analyse a été effectuée dans le cas des paires polluant de la circulation-effet pour lesquelles un minimum de quatre ER étaient disponibles, à l'instar d'autres revues systématiques publiées avec méta-analyse dans ce domaine (Khreis et coll., 2017). Seules les ER fondées sur des modèles à un seul polluant qui pouvaient être recalculés à une échelle normalisée (c.-à-d. des effets continus, mais non dichotomiques ou transformés en logarithme) étaient admissibles pour être incluses dans la méta-analyse. Les ER des modèles multipolluants n'ont pas été retenus, car l'accent était mis sur le mélange de la PACA et non sur ses composants individuels. Il convient de noter que pour la plupart des études, les analyses ont été effectuées à l'aide de modèles à un seul polluant. Comme le HEI (2022), Santé Canada a déterminé qu'en raison d'un degré élevé d'hétérogénéité entre la population générale et les populations de patients, les études de ces deux groupes de population ne seraient pas regroupées, mais présentées séparément.
Une méta-analyse a été effectuée dans la version R 4.1.2 (R Core Team, 2021) à l'aide du paquet Metafor (Viechtbauer, 2010). Pour chaque paire exposition-effet, les ER propres à l'étude ont été regroupées à l'aide de l'approche de modélisation à effets aléatoires. L'approche à effets aléatoires a été choisie plutôt que l'approche à effets fixes, car elle permet de généraliser les conclusions au-delà de l'ensemble particulier d'études incluses dans l'analyse. Les modèles ont été ajustés à l'aide du maximum de vraisemblance restreinte. Les indices de risque (IR), les risques relatifs (RR) et les rapports de cotes (RC) étaient tous admissibles au regroupement dans la même méta-analyse, étant donné que le résultat présentant un intérêt est commun, mais que l'ampleur de l'effet est relativement faible (Davies et coll., 1998), conformément à ce qui a été fait dans les méta-analyses précédentes (Khreis et coll., 2017; HEI, 2022). Les facteurs de conversion des polluants à convertir en μg/m3 étaient fondés sur ceux présentés dans le HEI (2022) et sont décrits dans le tableau 2.1. Pour tous les polluants, à l'exception du CÉ, les ER regroupées ont été converties en une augmentation de 10 μg/m3 de polluant. Les ER regroupées pour le CÉ ont été converties en une augmentation de 1 μg/m3 de polluant. L'hétérogénéité a été évaluée à l'aide de la statistique I2, qui représente le pourcentage de variance totale attribuable à l'hétérogénéité. Des valeurs de 0 % à 40 %, de 30 % à 60 %, de 50 % à 90 % et de 75 % à 100 % correspondent aux catégories suivantes : peut ne pas être importante, peut représenter une hétérogénéité modérée, peut représenter une hétérogénéité substantielle et peut représenter une hétérogénéité considérable, respectivement (Higgins et coll., 2022).
| Polluant | Conversion | FacteurNote a |
|---|---|---|
| NO2 | ppb à µg/m3 | 1,88 |
| NO | ppb à µg/m3 | 1,23 |
| NOx | ppb à µg/m3 | 1,55 |
| CO | ppm à mg/m3 | 1,15 |
| CN | µg/m3 à µg/m3 CÉ | 1,25 |
| FN | µg/m3 à µg/m3 CÉ | 0,11 |
| PM2,5 abs | 10-5/m à µg/m3 CÉ | 1,1 |
|
||
La méta-analyse ne peut être effectuée que sur des cohortes uniques (Higgins et coll., 2022). Par conséquent, les justifications du choix de l'ER la plus appropriée à inclure dans la méta-analyse étaient les suivantes :
- Si deux études ou plus fournissaient des ER sur la même cohorte, l'étude avec la cohorte qui avait la plus longue durée de suivi, la plus grande taille d'échantillon et une plus grande exhaustivité globale des données nécessaires pour effectuer une méta-analyse (p. ex., ER, IC à 95 %) a été sélectionnée pour être incluse dans la méta-analyse.
- Si une étude présentait des ER fondées sur de multiples attributions d'exposition (p. ex. de référence, en moyenne, l'année dernière dans l'étude), l'ER calculée à l'aide d'une moyenne mobile, avec des moyennes de plus longue portée privilégiées, a été sélectionnée. Les moyennes mobiles sont souvent choisies pour stabiliser les ER (van Donkelaar et coll., 2015).
- Si une étude présentait des ER fondées sur de multiples méthodes de mesure de l'exposition (p. ex. modèle de RUT, modèle de dispersion), les ER fondées sur les modèles de RUT ont été choisies plutôt que les modèles de dispersion pour une meilleure représentation de la PACA (de Hoogh et coll., 2014).
D'autres analyses ont été effectuées pour déterminer la robustesse des résultats de la méta-analyse principale, en particulier les analyses de sous-groupes, les analyses de sensibilité et les tests d'influence et de biais de publication. Premièrement, l'analyse des sous-groupes a été effectuée en fonction de la méthodologie d'évaluation de l'exposition (p. ex. modélisation de RUT ou de la dispersion). L'analyse des sous-groupes du modèle de RUT comprenait également une évaluation de l'exposition à l'aide de modèles hybrides (c.-à-d. des méthodes d'évaluation qui combinaient plusieurs techniques de modélisation, comme un modèle de dispersion et un modèle de transport chimique), car ils étaient jugés suffisamment similaires aux fins de la méta-analyse. Aucune analyse de sous-groupes par région géographique n'a été effectuée en raison d'un nombre insuffisant d'études canadiennes ou nord-américaines. Deuxièmement, des analyses de sensibilité ont été effectuées pour déterminer si les études présentant un grand RB influaient sur les effets; seules les études présentant des cotes faibles ou probablement faibles pour le RB dans l'évaluation de l'exposition et les domaines de confusion ont été incluses. Enfin, l'influence des études individuelles sur l'ER globalement regroupée a été examinée à l'aide d'une analyse sans exclusion. Les preuves de l'effet potentiel du biais de publication ont été étudiées en déterminant l'asymétrie dans les diagrammes en entonnoir, en effectuant la corrélation des rangs de Begg et les tests de régression d'Egger, et en utilisant la méthode supprimer et remplacer.
2.3 Données biologiques
Une évaluation des données biologiques a été menée pour évaluer la plausibilité biologique des liens entre l'exposition à la PACA et la mortalité. Les études incluses dans l'évaluation des données biologiques tiennent généralement compte des expositions à court terme et sont conçues pour détecter des changements subtils dans les biomarqueurs qui sont liés aux effets à long terme sur la santé observés dans la littérature épidémiologique. Par souci d'efficacité, cette évaluation n'était pas exhaustive et s'appuyait sur les examens existants de la PACA par Santé Canada (2020, 2022c) et le HEI (2010, 2022). De plus, une recherche dans la littérature primaire des 10 dernières années (c.-à-d. de 2013 à 2022) a été effectuée afin de déterminer les études récentes les plus pertinentes. Cette recherche documentaire s'est concentrée sur les études sur les humains et les animaux de laboratoire qui ont évalué les expositions à la PACA dans le monde réel, car celles-ci fournissent la preuve la plus directe des effets biologiques connexes. Les études d'exposition contrôlée des gaz d'échappement des véhicules (c.-à-d. les GED) ont également été incluses, car elles ont été considérées comme représentant une composante importante du mélange total de la PACA. Par ailleurs, la conception des études d'exposition contrôlée aborde certaines des sources de confusion associées à la conception de l'étude par panel (p. ex. différences de bruit entre les lieux d'exposition). L'analyse documentaire a porté sur les effets sur la santé associés aux systèmes circulatoire et respiratoire, car ceux-ci ont été jugés les plus pertinents pour cette évaluation des risques, et ils représentaient la majorité de la documentation sur les données biologiques.
2.4 Détermination de la causalité
Les estimations quantitatives des concentrations de polluants de la PACA ont été considérées comme indiquant le niveau le plus élevé de preuve, tandis que l'analyse qualitative des mesures de la circulation automobile et de l'infrastructure du réseau routier et l'analyse des polluants de la PACA pour lesquels aucune analyse quantitative n'a été entreprise ont fourni un appui aux données probantes pour la détermination de la causalité. Les données biologiques ont été utilisées pour appuyer les associations observées dans la littérature épidémiologique ainsi que pour appuyer la détermination de la causalité.
Dans l'approche fondée sur le poids de la preuve utilisée dans cette évaluation pour déterminer le rôle causal de la PACA dans le développement des effets sur la santé particuliers, on tient compte d'un certain nombre de critères, notamment les critères d'inférence causale définis par Bradford Hill (1965). Ces critères, qui sont largement utilisés dans les revues de la littérature épidémiologique, sont considérés de façon collective dans l'évaluation du poids de la preuve :
- Plausibilité biologique : un mécanisme plausible peut être défini entre l'exposition et l'effet;
- Temporalité : l'exposition précède le résultat en matière de santé;
- Stabilité du lien : le lien est relevé par différents chercheurs, pour différentes conceptions d'étude, dans différentes populations, etc.;
- Cohérence : les résultats d'études toxicologiques, d'études d'exposition contrôlée chez l'humain et d'études épidémiologiques de divers types appuient les effets observés et les modes d'action possibles;
- Gradient biologique : il existe des indications d'un lien exposition-réponse;
- Force du lien : plus l'estimation du risque est grande, moins il est probable que la relation soit due à un facteur de confusion résiduel non contrôlé;
- Robustesse des liens : les liens sont robustes relativement aux spécifications des modèles et aux corrections pour tenir compte de possibles facteurs de confusion, comme les conditions météorologiques, les tendances temporelles et les copolluants.
Ces critères permettent la formulation de différentes conclusions quant au lien unissant l'exposition à la PACA à un effet sur la santé : lien de causalité, lien de causalité probable, évocateur d'un lien de causalité, données inadéquates pour conclure à un lien de causalité ou lien de causalité peu probable. Les définitions de ces conclusions concernant la causalité, d'après l'Environmental Protection Agency des États-Unis (EPA des É.-U.) (2015), figurent au tableau 2.2. Santé Canada a déjà utilisé un tel cadre d'analyse de la causalité dans les évaluations des risques associés aux GED (2016a), au NO2 (2016b), aux GEE (2017), à la PACA et à l'asthme, aux allergies et à la fonction pulmonaire (Santé Canada, 2020), ainsi qu'à la PACA et à certains cancers (Santé Canada, 2022c).
| Lien | Description |
|---|---|
| Lien de causalité | Les données probantes sont suffisantes pour conclure qu'il existe un lien de causalité avec des expositions aux polluants pertinentes (p. ex. doses ou expositions se comparant aux concentrations observées récemment, généralement à un ou deux ordres de grandeur près). Autrement dit, il a été constaté que le polluant entraîne des effets sur la santé dans des études où le hasard, les facteurs de confusion et les autres biais ont pu être exclus avec une certitude raisonnable. Par exemple : (1) des études d'exposition contrôlée chez l'humain qui montrent des effets constants ou (2) des études observationnelles qui ne peuvent s'expliquer autrement de façon plausible ou qui sont appuyées par d'autres sources de données (p. ex. des études sur des animaux ou des données sur le mode d'action). En général, la conclusion est fondée sur plusieurs études de qualité supérieure menées par plusieurs groupes de recherche. |
| Lien de causalité probable | Les données probantes sont suffisantes pour conclure qu'il existe probablement un lien de causalité avec des expositions aux polluants pertinentes. Autrement dit, il a été constaté que le polluant entraîne des effets sur la santé dans des études où le hasard, des facteurs de confusion et d'autres biais peuvent être exclus, mais des incertitudes persistent quant à l'ensemble de la preuve. Par exemple : (1) des études observationnelles montrent un lien, mais les expositions à des copolluants sont difficiles à étudier ou les autres sources de données (exposition contrôlée chez l'humain, études sur des animaux ou données sur le mode d'action) sont limitées ou incohérentes, ou (2) les résultats de plusieurs études toxicologiques réalisées sur des animaux par des laboratoires différents montrent des effets, mais les données humaines sont limitées ou inexistantes. De façon générale, la conclusion est fondée sur plusieurs études de qualité supérieure. |
| Données évocatrices, mais insuffisantes pour conclure à un lien de causalité | Les données évoquent un lien de causalité avec des expositions aux polluants pertinentes, mais ce lien demeure limité parce qu'il n'est pas possible d'écarter l'effet du hasard, des facteurs de confusion et d'autres biais. Par exemple : (1) si l'ensemble de données probantes est relativement petit, au moins une étude épidémiologique de qualité supérieure montre un lien avec un effet sur la santé ou au moins une étude toxicologique de qualité supérieure révèle des effets pertinents pour les humains chez des espèces animales, ou (2) si l'ensemble de données probantes est relativement grand, les résultats d'études de qualité variable sont généralement probants, mais pas toujours constants, et il peut y avoir cohérence entre les sources de données (p. ex. études sur des animaux ou renseignements sur le mode d'action) à l'appui de la conclusion. |
| Données inadéquates pour conclure à un lien de causalité | Les données ne permettent pas de déterminer s'il existe un lien de causalité avec des expositions aux polluants pertinentes. Le nombre, la qualité, la cohérence ou la puissance statistique des études disponibles sont insuffisants pour tirer une conclusion quant à la présence ou à l'absence d'un effet. |
| Lien de causalité peu probable | Les données indiquent qu'il n'existe pas de lien de causalité avec des expositions aux polluants pertinentes. Plusieurs études de qualité couvrant la gamme complète des degrés d'exposition connus auxquels sont soumis les êtres humains et examinant des populations à risque à différentes étapes du cycle de la vie montrent toutes qu'il n'y a pas d'effet, quel que soit le degré d'exposition. |
Chapitre 3. Analyse documentaire et évaluation
3.1 Caractéristiques des articles inclus
Dans l'ensemble, 64 articles primaires ont été inclus dans l'évaluation des risques (les détails sont fournis à la section 2.2.1); pour tous, il s'agissait d'études d'exposition à long terme. La plupart de ces articles étaient des études de cohorte (n = 62); les deux articles restants étaient des études cas-témoins (Rosenlund et coll., 2006, 2009).
La cause de décès la plus fréquemment examinée était la mortalité toutes causes confondues (y compris les causes naturelles et non accidentelles), suivie de la mortalité liée à des affections circulatoires et respiratoires (tableau 3.1). Les autres causes de mortalité évaluées dans plus d'un article comprenaient divers types de cancer autres que le cancer du poumon (n = 6), une proportion de la mortalité globale (c.-à-d. la mortalité globale, sans compter certaines causes particulières de mortalité; n = 6), le diabète (n = 3), les maladies du système digestif (n = 3) et les troubles endocriniens (n = 2). Le tableau 3.1 présente une ventilation des 64 articles inclus dans l'analyse avec le type de mesure de l'exposition mesurée pour chacune des causes de mortalité déclarées.
| Cause de décès | Nombre d'articles primaires | Date de publication entre 2013 et 2022 | Polluant de la PACA | Circulation automobile et infrastructure du réseau routier |
|---|---|---|---|---|
| Toutes causes confondues | 47 | 29 | 31 | 20 |
| Circulatoire | 41 | 22 | 27 | 19 |
| Respiratoire | 20 | 13 | 15 | 7 |
| Autre | 14 | 6 | 7 | 8 |
|
||||
Concernant la mortalité toutes causes confondues, ainsi que la mortalité liée à des affections circulatoires et respiratoires, la plupart des articles désignés étaient relativement récents, ayant été publiés après 2012. Les polluants de la PACA étaient plus couramment utilisés que la circulation automobile et l'infrastructure du réseau routier pour évaluer l'exposition à la PACA dans les articles sur la mortalité toutes causes confondues, ainsi que sur la mortalité liée à des affections circulatoires et respiratoires.
Les caractéristiques générales des études des 64 articles primaires sont présentées dans le tableau 3.2. Une synthèse globale de ces articles est présentée dans cette section, suivie d'une évaluation plus approfondie par cause de décès dans les sections suivantes du présent chapitre. Dans l'ensemble, les études de cohortes ont été menées au Canada (n = 10), aux États-Unis d'Amérique (É.-U.) (n = 12), en Europe (n = 30), en Asie (n = 8) et en Australie (n = 2), tandis que les études cas-témoins ont été menées en Europe (n = 2). Les études étaient principalement basées sur la population générale, à l'exception de 16 articles qui se rapportaient à des études auprès de diverses populations de patients, une combinaison de populations générales et de patients, ou des populations de patients pour seulement certains types de mortalité. Diverses méthodes d'évaluation de l'exposition ont été utilisées pour évaluer l'exposition à long terme à la PACA et la mortalité, y compris la modélisation comme la RUT (n = 22), la dispersion (n = 13) et les modèles hybrides ou autres (n = 7), ainsi que les mesures de la circulation automobile et de l'infrastructure du réseau routier (n = 32). Les polluants de la PACA les plus fréquemment évalués étaient le NO2 (n = 28), les PM2,5 (n = 20), les PM10 (n = 13) et le NOx (n = 13). Un certain nombre d'autres polluants attribués à la PACA ont également été utilisés pour évaluer l'exposition dans un nombre limité d'articles, y compris le CN (n = 6), le NO (n = 5), les PM2,5 abs (n = 6), les PM2,5-10 (n = 4), le CO (n = 2), le CÉ (n = 1) et le benzène (n = 1). Bien que les PUF soient un marqueur clé de la PACA, aucune étude n'a été répertoriée pour ce polluant. En ce qui concerne la circulation automobile et l'infrastructure du réseau routier, la proximité de la circulation (n = 26) était la mesure la plus couramment utilisée, suivie de la densité de la circulation automobile (n = 13).
| Premier auteur et année | CohorteFootnote a (période d'étude) | Lieu de l'étude | Population à l'étude | Polluant de la PACA/mesure | Méthode d'évaluation de l'exposition | Cause de décèsFootnote b |
|---|---|---|---|---|---|---|
| Canada | ||||||
| Finkelstein 2004 | (1992-2001) | Hamilton (Ontario) | Patient | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A |
| Finkelstein 2005 | (1985-1999) | Hamilton (Ontario) | Patient | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | C, R |
| Jerrett 2009 | (1992-2002) | Toronto (Ontario) | Patient | NO2 (tous), proximité de la circulation (A, C, O) | Modèle de RUT, circulation automobile et infrastructure du réseau routier | A, C, R, O |
| Gan 2010 | (1994-2002) | Vancouver (C.-B.) | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | C |
| Gan 2011 | (1994-2002) | Vancouver (C.-B.) | Généralités | NO, NO2, PM2,5, CN | Modèle de RUT | C |
| Chen 2013 | Cohorte d'impôts de l'Ontario (1982-2004) | Toronto, Hamilton, Windsor (Ontario) | Généralités | NO2, proximité de la circulation | Modèle de RUT, circulation automobile et infrastructure du réseau routier | C |
| Gan 2013 | (1999-2002) | Région métropolitaine de Vancouver (C.-B.) | Généralités | NO, NO2, PM2,5, CN | Modèle de RUT | R |
| Villeneuve 2013 | Cohorte d'impôts de l'Ontario (1982-2004) | Toronto (Ontario) | Généralités | NO2, benzène | Modèle de RUT | A, C, R, O |
| Crouse 2015 | Cohorte santé et environnement du recensement canadien (CSERCan) 1991 (1991-2006) | 10 villes (Edmonton, Hamilton, London, Montréal, Sarnia, Toronto, Vancouver, Victoria, Windsor, Winnipeg) | Généralités | NO2 | Modèle de RUT | A, C, R |
| Cakmak 2019 | CSERCan 1991 (1991-2011) | Canada | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C, R, O |
| É.-U. | ||||||
| Jerrett 2005 | American Cancer Society – Cancer Prevention Survey II (ACS-CPSII) [enquête sur la prévention du cancer II] (1982-2002) | Los Angeles (Californie) | Généralités | PM2,5 | Modèles hybrides ou autres | A, C, O |
| Medina-Ramón 2008 | Étude sur les insuffisances cardiaques de Worcester (2000-2005) | Worcester (Massachusetts) | Patient | Proximité de la circulation, densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | A |
| Krewski 2009 | ACS-CPSII (1982-2000) | New York (New York) Los Angeles (Californie) | Généralités | PM2,5 | Modèle de RUT | A, C, O |
| von Klot 2009 | Étude sur les crises cardiaques de Worcester (1995 à 2005) | Région métropolitaine de Worcester (Massachusetts) | Patient | CÉ | Modèle de RUT | A |
| Hart 2013 | Nurses' Health Study (NHS) [étude sur la santé des infirmières] (1990-2008) | Les 50 États | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A |
| Wilker 2013 | (1999-2012) | Boston (Massachusetts) | Patient | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A |
| Hart 2014 | NHS (1986-2012) | Les 50 États | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | C |
| Blount 2017 | (2000-2012) | Californie | Patient | Densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | A |
| Alexeeff 2018 | Kaiser Permanente Northern California (2010-2015) | Oakland (Californie) | Généralités | NO, NO2, CN | Modèles hybrides ou autres | C |
| Kulick 2018 | Étude du Nord de Manhattan (1993–2016) | Nord de Manhattan (New York) | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C |
| DuPré 2019 | NHS et NHS II (1988-2008) | NHS : 11 États NHS II : 14 États | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | O |
| Villanueva 2021 | (1996-2016) | Californie | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | O |
| Europe | ||||||
| Hoek 2002 | Netherlands Cohort Study on Diet and Cancer (NLCS) [étude de cohorte] (1986-1994) | Pays-Bas | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C, O |
| Nafstad 2004 | (1972-1998) | Oslo (Norvège) | Généralités | NOx | Modèle de dispersion | A, C, R |
| Gehring 2006 | Study on the influence of air pollution on lung function, inflammation and ageing (SALIA) [étude sur l'influence de la pollution de l'air sur la fonction pulmonaire, l'inflammation et le vieillissement] (1985-2003) | Rhénanie-du-Nord-Westphalie (Allemagne) | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C, O |
| Rosenlund 2006 | Cas-témoins (1992-1994) | Stockholm (Suède) | Généralités | NO2, PM10, CO | Modèle de dispersion | C |
| Naess 2007 | (1992-1998) | Oslo (Norvège) | Généralités | NO2 (C, R), PM10 (C, R), PM2,5 (tous) | Modèle de dispersion | A, C, R |
| Rosenlund 2008 | (1998-2005 [A]; 1998-2000 [C]) | Rome (Italie) | Patient (A), Général (C) | NO2 | Modèle de RUT | A, C |
| Beelen 2008 | Étude NLCS-AIR (1987-1996) | Pays-Bas | Généralités | Proximité de la circulation, densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | A, C, R, O |
| Beelen 2009 | NLCS (1987-1996) | Pays-Bas | Généralités | Proximité de la circulation, densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | C |
| Brunekreef 2009 | Étude NLCS-AIR (1986-1996; suivi de 1987-1996) | Pays-Bas | Généralités | Proximité de la circulation, densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | A, C, R, O |
| Rosenlund 2009 | Cas-témoins (1985-1996) | Stockholm (Suède) | Généralités | NO2, PM10, CO | Modèle de dispersion | C |
| Huss 2010 | Cohorte nationale suisse (2000-2005) | Suisse | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | C |
| Maheswaran 2010 | (1995-2006) | Londres (Royaume-Uni) [R.-U.] | Patient | NO2, PM10 | Modèles hybrides ou autres | A |
| Nawrot 2011 | (1997-2009) | Louvain (Belgique) | Patient | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A |
| Cesaroni 2012 | Étude longitudinale de Rome (2001-2006) | Rome (Italie) | Généralités | NO2 | Modèle de RUT | A |
| Raaschou-Nielsen 2012 | Étude de cohorte sur l'alimentation, le cancer et la santé (1993-2009) | Copenhague et Aarhus (Danemark) | Généralités | NO2, proximité de la circulation, densité de la circulation automobile | Modèles hybrides ou autres, circulation automobile et infrastructure du réseau routier | A, C |
| Carey 2013 | Clinical Practice Research Datalink (2003-2007) | Angleterre | Généralités | NO2, PM2,5, PM10 | Modèle de dispersion | A, C, R |
| Cesaroni 2013 | Étude longitudinale de Rome (2001-2010) | Rome (Italie) | Généralités | NO2, PM2,5, proximité de la circulation, densité de la circulation automobile | Modèle de RUT, modèle de dispersion, circulation automobile et infrastructure du réseau routier | A, C, R |
| Heinrich 2013 | SALIA (1985-2008) |
Rhénanie-du-Nord-Westphalie (Allemagne) | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C, R |
| Beelen 2014a | European Study of Cohorts for Air Pollution Effects (ESCAPE) [étude européenne des cohortes sur les effets de la pollution atmosphérique] (les premières en 1985; le suivi varie de 6,3 à 18,6 ans) | 13 pays | Généralités | NO2, NOx, PM2,5, PM2,5 abs, PM2,5-10, PM10, densité de la circulation automobile | Modèle de RUT, circulation automobile et infrastructure du réseau routier | A |
| Beelen 2014b | ESCAPE (les premières en 1985; le suivi varie de 6,3 à 18,6 ans) |
13 pays | Généralités | NO2, NOx, PM2,5, PM2,5 abs, PM2,5-10, PM10, densité de la circulation automobile | Modèle de RUT, circulation automobile et infrastructure du réseau routier | C |
| Dimakopoulou 2014 | ESCAPE (les premières en 1985; le suivi varie de 6,3 à 18,6 ans) |
11 pays | Généralités | NO2, NOx, PM2,5, PM2,5 abs, PM2,5-10, PM10, densité de la circulation automobile | Modèle de RUT, circulation automobile et infrastructure du réseau routier | R |
| Goeminne 2014 | (2006-2013) | Louvain (Belgique) | Patient | Proximité de la circulation, densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | A |
| Stockfelt 2015 | Étude de prévention primaire multifactorielle (1973-2007) |
Göteborg (Suède) | Généralités | NOx | Modèle de dispersion | A, C, R |
| Desikan 2016 | (2005-2012) | Londres (R.-U.) | Patient | NO, NO2, NOx, PM2,5, PM2,5-10, PM10 | Modèle de dispersion | A |
| Tonne 2016 | (2003-2010) | Grand Londres (R.-U.) | Patient | NO2, NOx, PM2,5 (échappement et non-échappement), PM10 (échappement et non-échappement), densité de la circulation | Modèle de dispersion, circulation automobile et infrastructure du réseau routier | A |
| Badaloni 2017 | Étude longitudinale de Rome (2001-2010) | Rome (Italie) | Généralités | PM2,5, PM2,5 abs, PM10 | Modèle de RUT | A, C |
| Ruttens 2017 | (1987-2013) | 10 pays | Patient | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A |
| Nieuwenhuijsen 2018 | Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària (SIDIAP) (2010-2014) | Barcelone, Espagne | Généralités | NO2, PM2,5, PM2,5 abs, PM10 | Modèle de RUT | A |
| Bauleo 2019 | (1996-2013) | Civitavecchia (Italie) | Généralités | NOx | Modèle de dispersion | A, C, R, O |
| Andersson 2020 | Cohorte de l'étude sur la prévention primaire (1970-2011) | Göteborg (Suède) | Généralités | NOx | Modèle de dispersion | A, C |
| So 2020 | Cohorte d'infirmières danoises (1993–2013) | Danemark (région de la capitale seulement) | Généralités | PM2,5 | Modèles hybrides ou autres | A |
| Carlsen 2022 | Cohorte sur l'alimentation et le cancer de Malmö (1991-1996) | Malmö (Suède) | Généralités | NOx, PM2,5, PM10, CN | Modèle de dispersion | C |
| Asie | ||||||
| Yorifuji 2010 | Cohorte de personnes âgées de Shizuoka (1999-2006) | Shizuoka (Japon) | Généralités | NO2 | Modèle de RUT | A, C, R, O |
| Yorifuji 2013 | Cohorte de personnes âgées de Shizuoka (1999-2009) | Shizuoka (Japon) | Généralités | NO2 | Modèle de RUT | A, C, R |
| Barratt 2018 | Services de santé aux personnes âgées de Hong Kong (1998-2011) | Hong Kong, Chine | Généralités | NO, NO2, PM2,5, CN | Modèle de RUT | A, C, R |
| Yang 2018 | Services de santé aux personnes âgées de Hong Kong (2001-2011) | Hong Kong, Chine | Généralités | NO2, PM2,5, CN | Modèle de RUT | A, C, R |
| Cohen 2019 | (2004-2017) | Israël | Patient | NOx | Modèle de RUT, modèle hybride ou autre, modèle de dispersion | A, O |
| Cohen 2021 | (1992–2018) | Israël | Général et patient | NOx | Modèle de RUT | A |
| Pan 2021 | Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer Hepatitis B Virus (REVEAL-HBV) [évaluation du risque d'élévation de la charge virale et des maladies du foie connexes, du virus de l'hépatite B ou du cancer] (2000-2014) | Taipei et Pingtung (Taïwan) | Généralités | Densité de la circulation automobile | Circulation automobile et infrastructure du réseau routier | C |
| Hadley 2022 | Étude de cohorte Golestan (2004-2008) | Province du Golestan (Iran) | Généralités | Proximité de la circulation | Circulation automobile et infrastructure du réseau routier | A, C |
| Australie | ||||||
| Dirgawati 2019 | Étude sur la santé chez les hommes (1996-2012) | Perth (Australie-Occidentale) | Généralités | NO2, NOx, PM2,5, PM2,5 abs | Modèle de RUT | A, C |
| Hanigan 2019 | Étude 45 et plus (2006-2015) | Sydney | Généralités | NO2, PM2,5 | Modèles hybrides ou autres | A |
Abréviations : RUT : régression d'utilisation des terres
|
||||||
Comme il est indiqué à la section 2.2.2 de cette évaluation des risques, une évaluation du RB a été effectuée afin d'évaluer la validité des études incluses et d'établir la transparence dans la synthèse des données probantes des effets. Les cotes du RB (où une cote plus élevée signifie un plus grand RB dans ce domaine) pour les études individuelles sont résumées au tableau 3.3. L'évaluation des effets et l'établissement de rapports sélectifs sur les résultats étaient les domaines présentant le RB le plus uniformément bas. Le risque de conflit d'intérêts a été noté comme faible ou probablement faible pour toutes les études. L'exhaustivité des données sur les effets a également été jugée faible ou probablement faible, à l'exception de trois études présentant une cote probablement élevée, ce qui a été largement attribué à des durées de suivi plus courtes (< 4 ans ou suivi médian de 5,5 ans). De même, le RB de sélection a été principalement évalué comme étant faible ou probablement faible, à l'exception de quatre études qui avaient une cote probablement élevée. Cette cote probablement élevée a été attribuée à un faible taux de réponse, au faible recrutement et à la faible rétention de certains participants (c.-à-d. l'autosélection pour l'inscription à un service de prévention), à la perte de suivi propre à certains groupes démographiques (p. ex. personnes âgées, fumeurs actuels, personnes atteintes de diabète, personnes financièrement non capables et zone plus polluée) ou à des incohérences dans le processus de sélection entre les cohortes. Le RB de l'évaluation de l'exposition a été jugé probablement faible pour la plupart des études, mais quatre études ont été évaluées à probablement élevé ou élevé dans ce domaine. La dernière cote était en grande partie attribuable à un manque de données sur la mobilité résidentielle ou les profils d'activité temporelle et à des problèmes d'exactitude spatiale ou temporelle des estimations de l'exposition. Parmi les domaines évalués, le domaine de confusion a montré la plus grande variabilité, avec un RB compris entre faible, probablement faible et probablement élevé. Pour ce qui est du domaine de confusion, une cote de RB probablement élevée était principalement attribuable au manque de prise en compte du tabagisme, et une étude n'a pas tenu compte du SSE. Une étude a été jugée comme ayant un RB élevé en ce qui concerne le domaine de confusion, car elle n'a fourni que des ER non ajustées.
| Référence | Biais de sélection | Évaluation de l'exposition | Domaine de confusion | Évaluation des effets | Exhaustivité des données sur les effets | Rapports sélectifs sur les résultats | Conflits d'intérêts | Autre |
|---|---|---|---|---|---|---|---|---|
| Hoek et coll., 2002 | 2 | 3 | 1 | 1 | 2 | 1 | 1 | 1 |
| Finkelstein et coll., 2004 | 2 | 2 | 3 | 1 | 2 | 1 | 2 | 1 |
| Nafstad et coll., 2004 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Finkelstein et coll., 2005 | 2 | 4 | 3 | 1 | 2 | 1 | 1 | 1 |
| Jerrett et coll., 2005 | 2 | 2 | 1 | 2 | 1 | 1 | 2 | 1 |
| Gehring et coll., 2006 | 2 | 2 | 1 | 1 | 1 | 1 | 2 | 1 |
| Rosenlund et coll., 2006Footnote a | 2 | 2 | 1 | 1 | 1 | 1 | 2 | 1 |
| Naess et coll., 2007 | 1 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| Beelen et coll., 2008 | 1 | 2 | 2 (cohorte complète); 1 (cas-cohorte) |
1 | 1 | 1 | 1 | 1 |
| Medina-Ramón et coll., 2008 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Rosenlund et coll., 2008 | 1 | 2 | 3 | 1 | 1 | 1 | 2 | 1 |
| Beelen et coll., 2009 | 2 | 3 | 1 | 1 | 1 | 1 | 1 | 1 |
| Brunekreef et coll., 2009 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Jerrett et coll., 2009 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 |
| Krewski et coll., 2009 (Los Angeles et New York) | 2 | 2 | 1 | 1 | 2 | 1 | 1 | 1 |
| Rosenlund et coll., 2009 a | 2 | 2 | 3 | 1 | 1 | 1 | 2 | 1 |
| von Klot et coll., 2009 | 1 | 2 | 2 | 1 | 1 | 1 | 2 | 1 |
| Gan et coll., 2010 | 1 | 1 | 3 | 1 | 1 | 1 | 2 | 1 |
| Huss et coll., 2010 | 1 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| Maheswaran et coll., 2010 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Yorifuji et coll., 2010 | 3 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Gan et coll., 2011 | 1 | 1 | 3 | 1 | 3 | 1 | 1 | 1 |
| Nawrot et coll., 2011 | 2 | 2 | 1 | 2 | 2 | 1 | 1 | 1 |
| Cesaroni et coll., 2012 | 1 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| Raaschou-Nielsen et coll., 2012 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Carey et coll., 2013 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Cesaroni et coll., 2013 | 1 | 1 | 3 | 1 | 1 | 1 | 1 | 1 |
| Chen et coll., 2013 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Gan et coll., 2013 | 1 | 1 | 3 | 1 | 2 | 1 | 2 | 1 |
| Hart et coll., 2013 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Heinrich et coll., 2013 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Villeneuve et coll., 2013 | 1 | 2 | 3 (NO2); 1 (benzène) |
1 | 1 | 1 | 1 | 1 |
| Wilker et coll., 2013 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Yorifuji et coll., 2013 | 3 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Beelen et coll., 2014a | 2 | 2 | 1 | 1 | 2 | 1 | 1 | 1 |
| Beelen et coll., 2014b | 2 | 2 | 1 | 1 | 2 | 1 | 1 | 1 |
| Dimakopoulou et coll., 2014 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Goeminne et coll., 2014 | 1 | 2 | 1 | 1 | 3 | 1 | 1 | 1 |
| Hart et coll., 2014 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Crouse et coll., 2015 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Stockfelt et coll., 2015 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Desikan et coll., 2016 | 1 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| Tonne et coll., 2016 | 2 | 2 | 1 | 1 | 1 | 1 | 2 | 1 |
| Badaloni et coll., 2017 | 1 | 2 | 1 | 1 | 1 | 1 | 2 | 1 |
| Blount et coll., 2017 | 1 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| Ruttens et coll., 2017 | 1 | 2 | 2 | 2 | 3 | 1 | 1 | 2 |
| Alexeeff et coll., 2018 | 1 | 2 | 1 | 1 | 2 | 1 | 2 | 1 |
| Barratt et coll., 2018 | 3 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Kulick et coll., 2018 | 1 | 2 | 1 | 2 | 1 | 1 | 1 | 1 |
| Nieuwenhuisjen et coll., 2018 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 1 |
| Yang et coll., 2018 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Bauleo et coll., 2019 | 1 | 3 | 3 | 1 | 1 | 1 | 1 | 1 |
| Cakmak et coll., 2019 | 1 | 2 | 1 | 1 | 1 | 1 | 2 | 1 |
| Cohen et coll., 2019 | 2 | 2 | 1 | 1 | 2 | 1 | 1 | 1 |
| Dirgawati et coll., 2019 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| DuPré et coll., 2019 | 2 | 1 | 1 | 2 | 1 | 1 | 1 | 1 |
| Hanigan et coll., 2019 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Andersson et coll., 2020 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Cohen et coll., 2021 | 3 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| Pan et coll., 2021 | 2 | 2 | 3 | 1 | 1 | 1 | 1 | 1 |
| So et coll., 2020 (région de la capitale seulement) | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Villanueva et coll., 2021 | 1 | 2 | 4 | 1 | 1 | 1 | 1 | 1 |
| Carlsen et coll., 2022 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Hadley et coll., 2022 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
|
Légende : 1 : RB faible; 2 : RB probablement faible; 3 : RB probablement élevé; 4 : RB élevé
|
||||||||
Une analyse documentaire et une évaluation des études sont présentées dans les sections ci-dessous pour la mortalité toutes causes confondues, ainsi que pour la mortalité liée à des affections circulatoires et respiratoires. Les détails des études, organisés par mesure de l'exposition, sont fournis à l'annexe A. D'autres analyses, y compris les analyses des sous-groupes, de la sensibilité, de l'exclusion et du biais de publication, sont fournies à la section 3 de la documentation à l'appui. Les autres causes de mortalité n'ont pas été prises en compte dans cette évaluation des risques en raison du nombre limité d'études répertoriées.
3.2 Mortalité toutes causes confondues
La mortalité toutes causes confondues (aussi appelée cause naturelle, cause non accidentelle et mortalité totale) a été évaluée dans 47 des 64 articles évaluant le lien entre l'exposition à long terme à la PACA et la mortalité.
3.2.1 Oxydes d'azote (NO, NO2 et NOx)
Le NO2 est le polluant de la PACA le plus fréquemment mesuré pour la mortalité toutes causes confondues, avec 19 études, tandis que le NO était parmi les polluants de la PACA les moins mesurés, avec seulement 2 études. Dix études utilisaient le NOx pour évaluer l'exposition à la PACA.
NO2
Pour les études du NO2, les détails des études concernant la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER sont fournis à l'annexe A.1. La plupart des études ont été menées en Europe (n = 10). Pour l'Amérique du Nord, 3 études ont été menées au Canada, tandis qu'aucune étude menée aux É.-U. n'a été désignée dans les recherches documentaires. La plupart des études (n = 14) provenaient de la population générale dont la taille de cohorte variait de 11 627 (Dirgawati et coll., 2019) à 1 265 058 (Cesaroni et coll., 2013). Pour ce qui est de l'évaluation de l'exposition des cohortes de la population générale, la modélisation de la RUT (n = 11) était la méthode la plus couramment utilisée, suivie de la modélisation hybride (n = 2) et de la modélisation de la dispersion (n = 1). Les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal ou du secteur de recensement, et les expositions moyennes (ou médianes) variaient de 5,2 à 104 μg/m3. Les expositions les plus faibles ont été attribuées à l'une des cohortes suédoises incluses dans l'étude ESCAPE (Beelen et coll., 2014a), tandis que les expositions les plus élevées ont été notées dans une étude menée à Hong Kong, en Chine (Yang et coll., 2018). Les 14 études présentaient l'âge et le sexe, ainsi que le SSE individuel ou le SSE au niveau de la région; deux études n'étaient pas ajustées en fonction du tabagisme (Cesaroni et coll., 2012, 2013). De nombreuses études ont également examiné d'autres facteurs de confusion, qui sont énumérés à l'annexe A.1.
L'ER la mieux ajustée, désignée à partir de chaque étude en ce qui concerne la mortalité toutes causes confondues, est également précisée à l'annexe A.1. Dans la population générale, 12 des 14 ER étaient positives, dont 4 étaient statistiquement significatives et 3 étaient au seuil de signification statistique. La figure 3.1 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité toutes causes confondues et le NO2 dans la population générale. Dix études ont été incluses dans la méta-analyse avec des ER allant de 1,00 à 1,12. L'ER regroupée pour le lien entre le NO2 et la mortalité toutes causes confondues était significativement positive, avec un indice de risque de 1,03 (IC à 95 % : 1,01 à 1,05) et l'hétérogénéité était substantielle (I2 = 89,62 %).
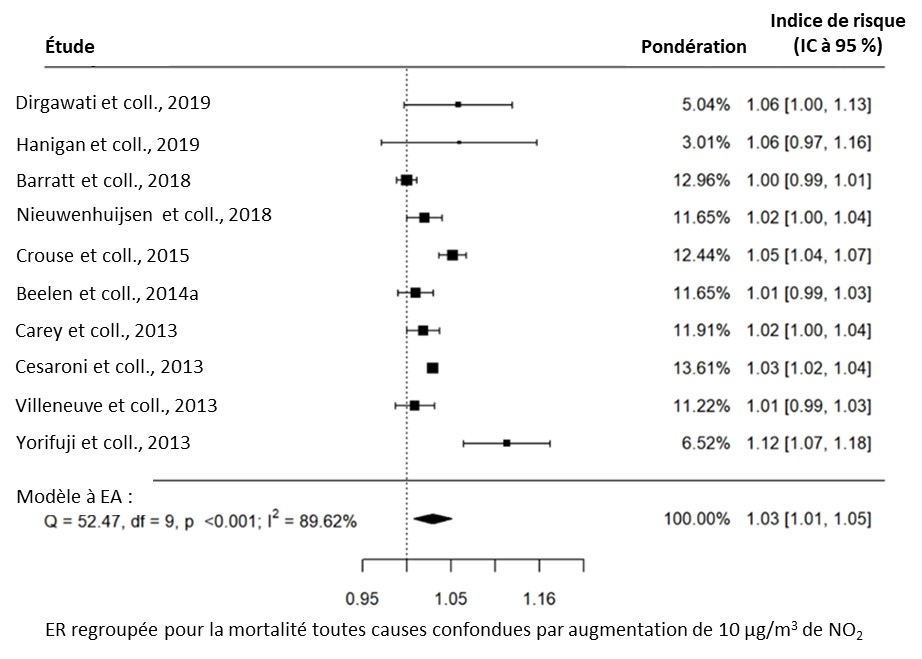
Figure 3.1 : Texte descriptif
La figure 3.1 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et l'exposition à long terme au NO2 dans la population générale. L'ER regroupée de cette méta-analyse de dix études individuelles est de 1,03 (IC à 95 % : 1,01 à 1,05) par augmentation de 10 μg/m3 de NO2. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 52,47, df = 9, p < 0,001 et I2 = 89,62 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Dirgawati et coll., 2019 |
5,04 % |
1,06 |
1,00 à 1,13 |
Hanigan et coll., 2019 |
3,01 % |
1,06 |
0,97 à 1,16 |
Barratt et coll., 2018 |
12,96 % |
1,00 |
0,99 à 1,01 |
Nieuwenhuijsen et coll., 2018 |
11,65 % |
1,02 |
1,00 à 1,04 |
Crouse et coll., 2015 |
12,44 % |
1,05 |
1,04 à 1,07 |
Beelen et coll., 2014a |
11,65 % |
1,01 |
0,99 à 1,03 |
Carey et coll., 2013 |
11,91 % |
1,02 |
1,00 à 1,04 |
Cesaroni et coll., 2013 |
13,61 % |
1,03 |
1,02 à 1,04 |
Villeneuve et coll., 2013 |
11,22 % |
1,01 |
0,99 à 1,03 |
Yorifuji et coll., 2013 |
6,52 % |
1,12 |
1,07 à 1,18 |
L'hétérogénéité est demeurée substantielle (I2 = 91,63 %) dans l'analyse des sous-groupes fondée sur la méthode d'évaluation de l'exposition lorsqu'elle était limitée aux études utilisant des modèles de la RUT/hybrides (ER : 1,03; IC à 95 % : 1,01 à 1,06), qui comprenaient toutes les études sauf une de l'analyse principale. L'analyse de sensibilité basée sur le RB n'a pas été effectuée pour le domaine d'exposition, car toutes les études incluses dans la méta-analyse ont obtenu une cote faible ou probablement faible dans ce domaine. Lorsque l'analyse s'est limitée aux seules études dont le RB était faible et probablement faible pour le domaine de confusion, l'estimation regroupée était robuste avec une ER de 1,04 (IC à 95 % : 1,01 à 1,07; I2 = 88,60 %). De même, l'analyse de l'exclusion a indiqué que les résultats étaient robustes, l'ER regroupée allant de 1,02 à 1,03. Il y avait des preuves de biais de publication, comme le démontre la répartition asymétrique du diagramme en entonnoir, mais cela n'a été soutenu ni par le test d'Egger (p = 0,0898) ni par celui de Begg (p = 0,7275). De plus, la méthode supprimer et remplacer a laissé entendre que deux études hypothétiques sont nécessaires pour rendre le diagramme en entonnoir symétrique.
Comme l'indique l'annexe A.1, cinq études examinant le lien entre la mortalité toutes causes confondues et le NO2 se sont concentrées exclusivement sur diverses populations de patients, y compris des patients d'une clinique traitant les maladies respiratoires à Toronto, en Ontario (Jerrett et coll., 2009); des patients ayant survécu à un accident coronarien à Rome, en Italie (Rosenlund et coll., 2008); des patients ayant survécu à un accident vasculaire cérébral (AVC) (Maheswaran et coll., 2010; Desikan et coll., 2016) et des patients atteints d'infarctus du myocarde (IM) (Tonne et coll., 2016) à Londres, au Royaume-Uni (R.-U.). La taille de la cohorte de ces études variait de 1 800 (Desikan et coll., 2016) à 18 138 (Tonne et coll., 2016). Les études ont utilisé des modèles de la RUT (n = 2), une modélisation de la dispersion (n = 2) et des modèles hybrides (n = 1) pour évaluer l'exposition. La majorité (n = 3) a tenu compte des principaux facteurs de confusion de l'âge, du sexe, du SSE et du tabagisme. Comme le résume l'annexe A.1, trois des cinq ER étaient positives, dont une était statistiquement significative et une était au seuil de signification statistique. Les ER des quatre études chez des patients atteints d'étiologie cardiovasculaire (Rosenlund et coll., 2008; Maheswaran et coll., 2010; Desikan et coll., 2016; Tonne et coll., 2016) ont été regroupées à l'aide d'une méta-analyse à effets aléatoires. Le graphique en forêt et les résultats de cette méta-analyse sont présentés dans le document à l'appui. L'ER regroupée était de 1,05 (IC à 95 % : 0,84 à 1,30) par exposition à 10 μg/m3 de NO2 et l'hétérogénéité a été considérée comme substantielle (I2 = 85,17 %).
NOx
Pour le NOx, 10 études menées en Europe (n = 7), en Israël (n = 2) et en Australie (n = 1) ont examiné le lien entre l'exposition à long terme au NOx et la mortalité toutes causes confondues. Les détails des études sont présentés à l'annexe A.2. Six de ces études ont été tirées de la population générale et la taille de ces cohortes variait de 6 304 (Andersson et coll., 2020) à 367 251 (Beelen et coll., 2014a). Une autre étude portant à la fois sur des cohortes de MCO basées sur la population et sur les patients a également signalé une ER pour la population générale (n = 2 393) (Cohen et coll., 2021). Pour les cohortes de la population générale, la plupart des études ont utilisé la modélisation de la dispersion (n = 4) suivie de la modélisation de la RUT (n = 3) pour évaluer l'exposition au NOx, et toutes les études ont attribué l'exposition au NOx à l'adresse résidentielle; les expositions moyennes (ou médianes) variaient de 5,80 à 107,3 μg/m3. Les expositions les plus faibles ont été estimées dans une étude menée à Civitavecchia, en Italie (Bauleo et coll., 2019), tandis que les expositions les plus élevées ont été modélisées dans l'une des cohortes italiennes incluses dans l'étude ESCAPE (Beelen et coll., 2014a). Toutes les études ont tenu compte des principaux facteurs de confusion de l'âge, du sexe et du SSE (au niveau individuel ou régional) et toutes les études sauf une (Bauleo et coll., 2019) ont également été ajustées en fonction du tabagisme. D'autres facteurs de confusion ont également été pris en compte dans ces études.
L'ER la mieux ajustée pour le NOx et la mortalité toutes causes confondues de chaque étude est résumée à l'annexe A.2. Au total, 6 des 10 ER étaient positives, dont 2 étaient statistiquement significatives et 2 étaient au seuil de signification statistique. La figure 3.2 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité toutes causes confondues et le NOx dans la population générale. Pour la population générale, six études, à l'exception d'Andersson et coll. (2020) qui a fourni des IR par quintile d'exposition, ont été incluses dans la méta-analyse avec des ER allant de 0,98 à 1,08 par 10 μg/m3 de NOx. L'ER regroupée pour le lien entre le NOx et la mortalité toutes causes confondues dans la population générale était positive et au seuil de signification statistique, avec un IR de 1,02 (IC à 95 % : 0,99 à 1,06; I2 = 88,02 %). L'hétérogénéité était substantielle et a été largement attribuée à Nafstad et coll. (2004), car aucune hétérogénéité (I2 = 0,00 %) n'a été observée lorsque cette étude a été retirée de la méta-analyse dans l'analyse de l'exclusion.
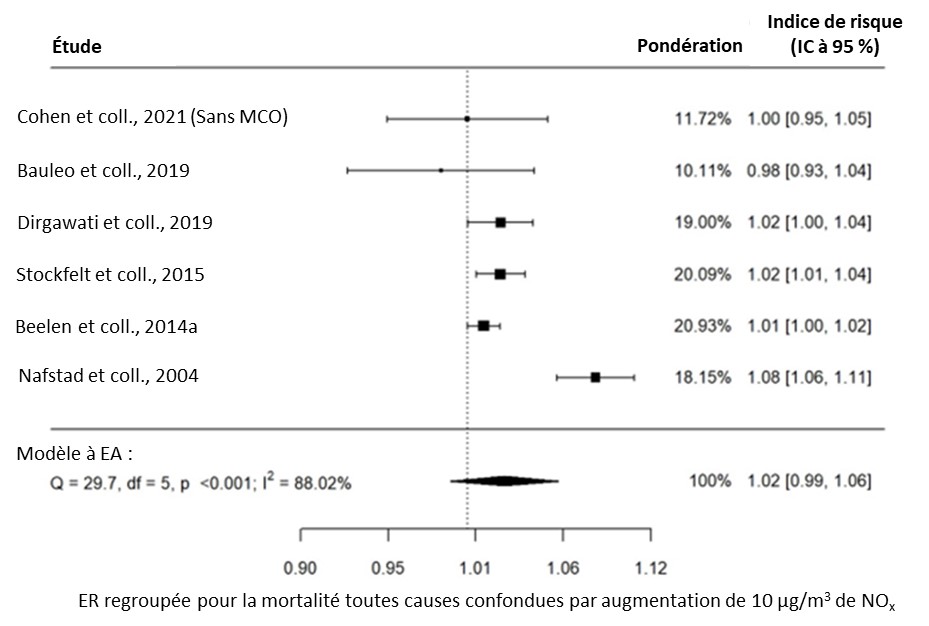
Figure 3.2 : Texte descriptif
La figure 3.2 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et l'exposition à long terme au NOx dans la population générale. L'ER regroupée de cette méta-analyse de six études individuelles est de 1,02 (IC à 95 % : 0,99 à 1,06) par augmentation de 10 µg/m3 de NOx. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 29,7, df = 5, p < 0,001 et I2 = 88,02 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Cohen et coll., 2021 (Sans MCO) |
11,72 % |
1,00 |
0,95 à 1,05 |
Bauleo et coll., 2019 |
10,11 % |
0,98 |
0,93 à 1,04 |
Dirgawati et coll., 2019 |
19,00 % |
1,02 |
1,00 à 1,04 |
Stockfelt et coll., 2015 |
20,09 % |
1,02 |
1,01 à 1,04 |
Beelen et coll., 2014a |
20,93 % |
1,01 |
1,00 à 1,02 |
Nafstad et coll., 2004 |
18,15 % |
1,08 |
1,06 à 1,11 |
L'analyse des sous-groupes fondée sur la méthodologie d'évaluation de l'exposition a indiqué des liens semblables à l'analyse principale lorsque l'analyse s'est limitée aux études utilisant la modélisation de la RUT et la modélisation de la dispersion avec des ER regroupées de 1,01 (IC à 95 % : 1,00 à 1,03; I2 = 0,00 %) et de 1,03 (IC à 95 % : 0,92 à 1,16; I2 = 91,34 %), respectivement. Aucune hétérogénéité n'a été observée pour les études regroupées utilisant la modélisation de la RUT pour évaluer l'exposition au NOx. En revanche, l'hétérogénéité était supérieure à l'analyse principale lorsqu'elle était limitée aux études utilisant la modélisation de la dispersion. L'analyse de sensibilité en ce qui concerne le RB a montré des liens solides entre le NOx et la mortalité toutes causes confondues lorsque seules les études avec un RB faible ou probablement faible pour le domaine d'exposition ou le domaine de confusion ont été incluses; la même étude (Bauleo et coll., 2019) a été exclue pour chacune de ces analyses, ce qui a donné lieu à une ER regroupée de 1,03 (IC à 95 % : 0,99 à 1,07; I2 = 89,75 %). L'analyse de l'exclusion a indiqué que l'analyse principale était robuste, car l'ER regroupée variait de 1,01 à 1,03 et que Nafstad et coll. (2004) était la principale source d'hétérogénéité. En effet, l'omission de cette étude a supprimé l'hétérogénéité de l'analyse principale (I2 = 0,00 %). Le biais de publication a été évalué, mais peut être d'une utilité limitée, car moins de 10 études ont été incluses dans la méta-analyse. La répartition asymétrique du diagramme en entonnoir a indiqué les preuves d'un biais de publication, mais cela n'a été soutenu ni par le test d'Egger (p = 0,4660) ni par celui de Begg (p = 1,0000). De plus, la méthode supprimer et remplacer a laissé entendre que deux études hypothétiques sont nécessaires pour rendre le diagramme en entonnoir symétrique.
Quatre études ont examiné le lien entre l'exposition à long terme au NOx et la mortalité toutes causes confondues chez les populations de patients (annexe A.2). Deux de ces études ont été menées chez des patients ayant subi un AVC (Desikan et coll., 2016) et un IM (Tonne et coll., 2016) à Londres, au R.-U. Les deux autres études ont été menées en Israël chez des patients subissant des interventions coronariennes percutanées (Cohen et coll., 2019) et dans des cohortes de patients atteints de MCO qui ont été appariées à des cohortes basées sur la population (Cohen et coll., 2021). La taille de la cohorte de ces études variait de 1 800 (Desikan et coll., 2016) à 18 138 (Tonne et coll., 2016). Pour l'évaluation de l'exposition, Desikan et coll. (2016) et Tonne et coll. (2016) ont utilisé la modélisation de la dispersion, et Cohen et coll. (2021) ont utilisé la modélisation de la RUT, tandis que Cohen et coll. (2019) ont utilisé trois méthodes différentes (c.-à-d. la modélisation de la dispersion, la modélisation de la RUT et la modélisation hybride) pour estimer l'exposition au NOx. Toutes les études ont tenu compte des principaux facteurs de confusion de l'âge, du sexe, du SSE et du tabagisme, à l'exception de Desikan et coll. (2016) dont l'étude n'a pas fait d'ajustement pour le tabagisme. Comme le résume l'annexe A.2, quatre des six ER relatives aux populations de patients étaient positives, dont une était statistiquement significative. Comme seulement trois de ces ER ont pu être regroupées, aucune méta-analyse n'a été effectuée.
NO
Les recherches documentaires ont permis de repérer deux études évaluant le lien entre la mortalité toutes causes confondues et le NO; les deux étaient fondés sur la population générale. Les détails des études sont présentés à l'annexe A.3. Une étude a été menée sur une cohorte de 1 800 participants à Londres, au R.-U. (Desikan et coll., 2016) et l'autre sur une cohorte de 60 548 participants résidant à Hong Kong, en Chine (Barratt et coll., 2018). Les deux études ont estimé l'exposition à l'adresse résidentielle; l'une a utilisé la modélisation de la dispersion (NO moyen = 34,39 μg/m3; Desikan et coll., 2016), tandis que l'autre a utilisé un modèle de la RUT (NO moyen = 489 μg/m3; Barratt et coll., 2018). Les deux études comprenaient également des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, ainsi que d'autres facteurs de confusion, mais Desikan et coll. (2016) n'ont pas fait d'ajustement en fonction du tabagisme. Comme il est indiqué à l'annexe A.3, ni l'une ni l'autre des ER n'a indiqué de lien.
3.2.2 PM
PM2,5
Les recherches documentaires ont permis de repérer 15 études évaluant le lien entre la mortalité toutes causes confondues et les PM2,5 qui reflétait une exposition à la PACA (section 2.1.2). Les détails des études, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.4. La plupart des études ont été menées en Europe (n = 9); aucune étude menée au Canada n'a été relevée dans les recherches documentaires. La plupart des études ont été menées dans des cohortes de population générale (n = 13), et la taille de ces cohortes variait de 11 627 (Dirgawati et coll., 2019) à 1 265 058 (Cesaroni et coll., 2013). Pour l'évaluation de l'exposition, les méthodes les plus courantes étaient la RUT (n = 7) et la modélisation de la dispersion (n = 6), et les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal ou du secteur de recensement. Les expositions moyennes ou médianes les plus faibles ont été estimées pour une étude menée en Australie (4,49 μg/m3; Hanigan et coll., 2019) et l'exposition la plus élevée a été estimée pour une étude menée à Hong Kong, Chine (42,4 μg/m3; Barratt et coll., 2018). Chacune des études comprenait des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, et comprenait généralement des facteurs de confusion supplémentaires. En ce qui concerne le tabagisme, trois études n'incluaient pas d'ajustement, direct ou indirect, pour le tabagisme individuel (Naess et coll., 2007; Cesaroni et coll., 2013; Desikan et coll., 2016).
L'annexe A.4 résume l'ER la mieux ajustée déterminée à partir de chaque étude. Pour les études menées sur la population générale, 11 des 13 ER étaient positives, 7 étaient statistiquement significatives et 4 étaient au seuil de signification statistique. La figure 3.3 présente le graphique en forêt et la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et des PM2,5. Dix études ont été incluses dans la méta-analyse avec des ER normalisées allant de 0,90 à 1,63. L'ER regroupée pour le lien entre les PM2,5 et la mortalité toutes causes confondues était importante à 1,06 (IC à 95 % : 1,03 à 1,08) et l'hétérogénéité était minime et probablement sans importance (I2 = 0,14 %).

Figure 3.3 : Texte descriptif
La figure 3.3 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et l'exposition à long terme aux PM2,5 dans la population générale. L'ER regroupée de cette méta-analyse de dix études individuelles est de 1,06 (IC à 95 % : 1,03 à 1,08) par augmentation de 10 µg/m3 de PM2,5. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 10,52, df = 9, p = 0,31 et I2 = 0,14 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
So et coll., 2020 |
1,57 % |
1,02 |
0,86 à 1,21 |
Dirgawati et coll., 2019 |
1,57 % |
1,14 |
0,97 à 1,36 |
Hanigan et coll., 2019 |
0,10 % |
1,63 |
0,84 à 3,18 |
Barratt et coll., 2018 |
22,98 % |
1,06 |
1,01 à 1,10 |
Nieuwenhuijsen et coll., 2018 |
9,52 % |
1,06 |
0,99 à 1,14 |
Badaloni et coll., 2017 |
50,95 % |
1,05 |
1,02 à 1,08 |
Beelen et coll., 2014a |
4,24 % |
1,14 |
1,03 à 1,27 |
Carey et coll., 2013 |
4,02 % |
1,00 |
0,90 à 1,11 |
Krewski et coll., 2009 (NYC) |
0,75 % |
0,90 |
0,70 à 1,15 |
Krewski et coll., 2009 (LA) |
4,30 % |
1,14 |
1,03 à 1,27 |
Étant donné que le RB des études primaires a été évalué comme faible ou probablement faible pour les domaines d'exposition et de confusion, aucune analyse de sensibilité fondée sur le RB n'a été effectuée. L'analyse par sous-groupes fondée sur la méthode d'évaluation de l'exposition (c.-à-d. la modélisation de la RUT ou la modélisation de la dispersion) n'a pas relevé de différence par rapport à l'analyse principale. L'analyse de l'exclusion a révélé que l'analyse principale était robuste (l'ER regroupée variait entre 1,05 et 1,07) et qu'aucune étude n'avait faussé l'ensemble des résultats. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,359; test de Begg p = 1,000). De plus, l'analyse selon la méthode supprimer et remplacer a indiqué qu'une étude hypothétique serait nécessaire pour rendre le diagramme en entonnoir symétrique.
Deux études fondées sur des populations de patients ont été trouvées lors des recherches documentaires. Les deux études ont été menées à Londres, au R.-U.; l'une concernait des patients ayant été victimes d'un AVC (n = 1 800) (Desikan et coll., 2016) et l'autre des patients ayant été victimes d'un IM (n = 18 138) (Tonne et coll., 2016). Les deux études ont utilisé la modélisation de la dispersion pour estimer l'exposition aux PM2,5. Tonne et coll. (2016) ont tenu compte des PM2,5 provenant de sources d'échappement de la circulation automobile et des PM2,5 provenant de sources autres que les gaz d'échappement (c.-à-d. poussière de freinage, usure des pneus et remise en suspension de la poussière). Chacune des trois ER était positive et statistiquement significative ou au seuil de signification statistique (annexe A.4) et les ER étaient semblables pour les sources d'échappement de trafic et non liées au trafic. Desikan et coll. (2016) ont signalé un lien plus fort, quoique moins précis, chez les patients victimes d'AVC (IR = 1,28, IC à 95 % = 1,08 à 1,52, par 1,86 μg/m3) comparativement aux liens signalés dans les études sur la population générale.
CÉ, PM2,5 abs et CN
Sept études qui évaluaient l'exposition au CÉ, aux PM2,5 abs ou au CN et le risque de mortalité ont été répertoriées; les détails des études sont fournis à l'annexe A.5. Compte tenu de l'interprétation similaire des mesures d'exposition de la PACA, le CN et les PM2,5 abs ont été convertis en estimations équivalentes au CÉ pour appuyer le regroupement des études pour méta-analyse (comme il est décrit à la section 2.2.3). Les études ont été menées en Europe (n = 3), en Asie (n = 2), aux É.-U. (n = 1) et en Australie (n = 1); les recherches documentaires n'ont permis de déterminer aucune étude menée au Canada. Six des études ont pris en compte la population générale tandis qu'une se fondait sur une population de patients. Dans le cas des études sur la population générale, la taille de l'étude variait de 11 627 (Dirgawati et coll., 2019) à 1 249 108 (Badaloni et coll., 2017). Chacune de ces études utilisait la modélisation de la RUT pour estimer l'exposition à l'adresse résidentielle et, selon les équivalents CÉ, les expositions moyennes ou médianes variaient de 0,55 (Beelen et coll., 2014a) à 16,4 μg/m3 (Barratt et coll., 2018). Des ajustements pour tenir compte des principaux facteurs de confusion (âge, sexe et SSE) ont été pris dans chacune des études; un ajustement direct ou indirect en fonction du tabagisme a été pris en compte dans chaque étude, à l'exception de Badaloni et coll. (2017).
L'annexe A.5 résume l'ER la mieux ajustée déterminée à partir de chaque étude. Pour la population générale, les six ER étaient positives; deux étaient statistiquement significatives et les quatre autres étaient au seuil de signification statistique. La figure 3.4 présente le graphique en forêt et la méta-analyse à effets aléatoires concernant la mortalité toutes causes confondues et le CÉ. Cinq études ont été incluses dans la méta-analyse avec des ER normalisées allant de 1,00 à 1,11. L'ER regroupée pour le lien entre l'exposition au CÉ et la mortalité toutes causes confondues était de 1,02 (IC à 95 % : 0,99 à 1,05) avec une hétérogénéité substantielle (I2 = 86,03 %).
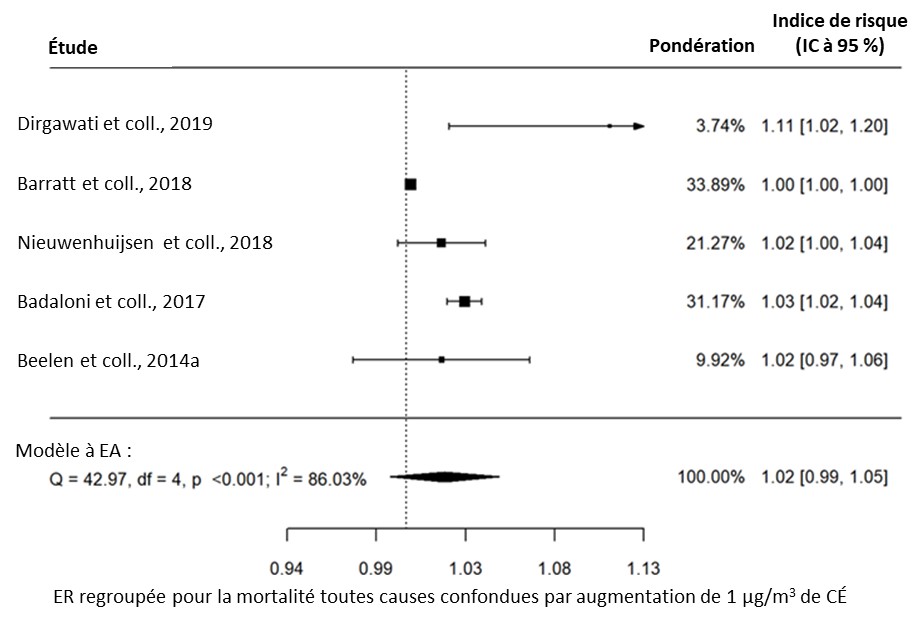
Figure 3.4 : Texte descriptif
La figure 3.4 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et l'exposition à long terme au CÉ dans la population générale. L'ER regroupée de cette méta-analyse de cinq études individuelles est de 1,02 (IC à 95 % : 0,99 à 1,05) par augmentation de 1 µg/m3 de CÉ. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 42,97, df = 4, p < 0,001 et I2 = 86,03 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Dirgawati et coll., 2019 |
3,74 % |
1,11 |
1,02 à 1,20 |
Barratt et coll., 2018 |
33,89 % |
1,00 |
1,00 à 1,00 |
Nieuwenhuijsen et coll., 2018 |
21,27 % |
1,02 |
1,00 à 1,04 |
Badaloni et coll., 2017 |
31,17 % |
1,03 |
1,02 à 1,04 |
Beelen et coll., 2014a |
9,92 % |
1,02 |
0,97 à 1,06 |
Étant donné que le RB des études primaires a été évalué comme faible ou probablement faible pour les domaines d'exposition et de confusion, aucune analyse de sensibilité fondée sur le RB n'a été effectuée. De même, comme chacune des études utilisait des modèles de RUT, aucune analyse des sous-groupes fondée sur l'évaluation de l'exposition n'a été effectuée. L'analyse de l'exclusion a indiqué que les résultats étaient robustes, l'ER regroupée allant de 1,01 à 1,03. Il n'y avait aucune indication de biais de publication, car l'analyse selon la méthode supprimer et remplacer n'a pas cerné d'études manquantes, et les tests n'ont pas fait état de biais (test d'Egger p = 0,1895; test de Begg p = 0,8167).
La seule étude sur la population de patients a été menée aux É.-U. et portait sur des adultes hospitalisés pour un IM aigu (von Klot et coll., 2009; résumé à l'annexe A.5). L'étude a cerné un lien positif statistiquement significatif entre la mortalité toutes causes confondues et l'exposition au CÉ et comprenait des ajustements pour l'âge, le sexe, le SSE et le tabagisme. Comme une seule étude a été cernée, aucune méta-analyse n'a été effectuée.
PM2,5-10 et PM10
Les recherches documentaires ont permis de cerner sept études sur les PM10 et deux études sur les PM2,5-10 qui ont évalué un lien avec la mortalité toutes causes confondues. Étant donné que la documentation disponible concernant les PM2,5-10 est limitée, la présente évaluation se concentrera sur la documentation sur les PM10. Les détails des études, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.6. Chacune des études a été menée en Europe; quatre concernent la population générale et trois des populations de patients. Aucune étude menée au Canada n'a été relevée lors des recherches documentaires. Dans le cas des études sur la population générale, la taille des échantillons était importante, allant de 322 159 (Beelen et coll., 2014a) à 1 249 108 (Badaloni et coll., 2017). Pour ce qui est de l'évaluation de l'exposition, trois des études ont utilisé des modèles de RUT et une a utilisé la modélisation de la dispersion, et les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal ou du secteur de recensement. Concernant les PM10, les expositions moyennes variaient de 13,5 à 48,1 μg/m3 (Beelen et coll., 2014a). Chacune des études a été ajustée en fonction des principaux facteurs de confusion (âge, sexe, SSE) et directement ou indirectement ajustée en fonction du tabagisme, à l'exception de Badaloni et coll. (2017), qui ne tenait pas compte du tabagisme.
L'annexe A.6 résume l'ER la mieux ajustée déterminée à partir de chaque étude. Pour la population générale, deux des quatre ER pour les PM10 étaient positives et statistiquement significatives ou au seuil de signification statistique, et deux indiquaient un effet nul. La figure 3.5 présente le graphique en forêt et la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et des PM10. Toutes les études sur la population générale ont été incluses dans la méta-analyse; les ER normalisées variaient de 1,00 à 1,04 et l'ER regroupée était de 1,02 (IC à 95 % : 1,00 à 1,03). Aucune hétérogénéité (I2 = 0,00 %) n'a été soulignée pour cette analyse principale.

Figure 3.5 : Texte descriptif
La figure 3.5 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité toutes causes confondues et l'exposition à long terme aux PM10 dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,02 (IC à 95 % : 1,00 à 1,03) par augmentation de 10 µg/m3 de PM10. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 2,49, df = 3, p = 0,477 et I2 = 0 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Nieuwenhuijsen et coll., 2018 |
7,08 % |
1,00 |
0,97 à 1,03 |
Badaloni et coll., 2017 |
88,05 % |
1,02 |
1,01 à 1,03 |
Beelen et coll., 2014a |
3,43 % |
1,04 |
1,00 à 1,09 |
Carey et coll., 2013 |
1,43 % |
1,00 |
0,94 à 1,07 |
Étant donné que le RB de chacune des études primaires de l'analyse primaire a été évalué comme faible ou probablement faible pour les domaines d'exposition et de confusion, aucune analyse de sensibilité fondée sur le RB n'a été effectuée. L'analyse par sous-groupes fondée sur la méthode d'évaluation de l'exposition (c.-à-d. la modélisation de la RUT ou la modélisation de la dispersion) n'a pas relevé de différence par rapport à l'analyse principale. L'analyse de l'exclusion n'indiquait pas qu'une seule étude influençait l'analyse principale (ER regroupée = 1,01 à 1,02). Il n'y avait aucune indication de biais de publication, car l'analyse selon la méthode supprimer et remplacer n'a pas cerné d'études manquantes, et les tests n'ont pas fait état de biais (test d'Egger p = 0,8851; test de Begg p = 1,000).
Trois études concernant des populations de patients ont été cernées. Chacune des études a été menée à Londres, au R.-U. Deux concernaient des patients ayant subi un AVC et une concernait des patients ayant subi un IM (résumé à l'annexe A.6). La taille des cohortes variait de 1 800 (Desikan et coll., 2016) à 18 128 (Tonne et coll., 2016). Deux des études utilisaient la modélisation de la dispersion et une utilisait la modélisation hybride. Pour les PM10, les deux ER étaient positives et statistiquement significatives ou au seuil de signification statistique. Tonne et coll. (2016) ont évalué le lien des PM10 provenant de sources d'échappement et de sources autres que d'échappement séparément, et les deux ER étaient positives et au seuil de signification statistique. Les expositions moyennes étaient d'un ordre de grandeur plus faible dans Tonne et coll. (2016) que dans les autres études sur les populations de patients. En raison du petit nombre d'études, aucune méta-analyse n'a été effectuée.
3.2.3 Autres polluants de la PACA : benzène
Une seule étude qui examinait le lien entre l'exposition à long terme au benzène, en tant que marqueur de la PACA, et la mortalité toutes causes confondues a été trouvée lors des recherches documentaires. Cette étude canadienne de Villeneuve et coll. (2013) a été menée auprès de la population générale de l'Ontario, a tenu compte des principaux facteurs de confusion, y compris l'ajustement indirect pour le tabagisme, et a fait état d'un lien significatif et positif (résumé à l'annexe A.7).
3.2.4 Circulation automobile et infrastructure du réseau routier
Proximité de la circulation
La proximité de la circulation ou la distance par rapport à la route était la mesure la plus couramment utilisée de la circulation automobile et de l'infrastructure du réseau routier examinant le lien entre la circulation et la mortalité toutes causes confondues dans le cadre de 18 études, dont 11 ont été menées auprès de la population générale et sept auprès de diverses populations de patients. Les détails des études concernant la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.9.
Pour ce qui de la population générale, la majorité des études ont été menées en Europe (n = 7), suivies des É.-U. (n = 2), du Canada (n = 1) et de l'Asie (n = 1). Leur taille variait de 3 287 (Kulick et coll., 2018) à 2 644 370 (Cakmak et coll., 2019). Toutes les études menées aux É.-U., au Canada et en Asie étaient fondées sur des cohortes uniques, tandis que celles menées en Europe étaient fondées sur quatre cohortes : NLCS-AIR (Hoek et coll., 2002; Beelen et coll., 2008; Brunekreef et coll., 2009); SALIA (Gehring et coll., 2006); étude de cohorte sur l'alimentation, le cancer et la santé (Raaschou-Nielsen et coll., 2012); étude longitudinale de Rome (Cesaroni et coll., 2013). Toutes les études ont tenu compte des principaux facteurs de confusion de l'âge, du sexe et du SSE (au niveau individuel ou régional) et toutes les études sauf deux (Cesaroni et coll., 2013; Cakmak et coll., 2019) ont également été ajustées en fonction du tabagisme. De nombreuses études ont également pris en compte d'autres facteurs de confusion. La proximité de la circulation a été mesurée directement dans un système d'information géographique (SIG) et était fondée sur l'adresse résidentielle exacte pour toutes les études sauf deux. L'étude canadienne a utilisé le centroïde du code postal résidentiel (Cakmak et coll., 2019), tandis que l'étude menée en Iran a utilisé le centre géographique de chaque village pour les résidents ruraux et l'emplacement du centre de soins de santé primaires pour les résidents urbains (Hadley et coll., 2022). Aucune définition ou catégorie uniforme n'a été utilisée pour évaluer la proximité de la circulation dans l'ensemble des études.
Les liens entre la proximité de la circulation et le risque de mortalité toutes causes confondues au sein de la population générale sont résumés à la figure 3.6; seules des cohortes uniques et des données non transformées sont incluses dans le graphique en forêt. Deux études ont considéré la proximité de la circulation comme une variable continue. Dans une étude pancanadienne, Cakmak et coll. (2019) ont signalé un lien positif et statistiquement significatif. En comparaison, Kulick et coll. (2018) n'ont observé aucun lien fondé sur la proximité de la transformation logarithmique. Lorsque la proximité de la circulation a été évaluée comme variable catégorique, 10 des 14 ER étaient positives, dont une était statistiquement significative, et le reste était au seuil de signification statistique. Parmi les trois études qui ont examiné les relations exposition-réponse, Cesaroni et coll. (2013) et Hart et coll. (2013) ont cerné un risque accru avec une exposition accrue, tandis que Kulick et coll. (2018) ne l'ont pas fait.

Figure 3.6 : Texte descriptif
La figure 3.6 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité toutes causes confondues dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,8 à 1,9. Les informations suivantes sont illustrées dans cette figure :
| Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|
Cakmak et coll., 2019 |
Cohorte CSERCan, Canada |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence, pour une augmentation de 1 108,6 m |
A |
1,05 |
1,04 à 1,05 |
Continu (par augmentation de l'écart interquartile) |
Hadley et coll., 2022 |
Étude de cohorte Golestan, Asie |
Vivant à ≤ 100 m d'une route secondaire ou à ≤ 500 m d'une route principale |
B |
1,04 |
0,96 à 1,12 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : < 100 m (groupe de référence ≥ 400 m) |
C1 |
0,95 |
0,81 à 1,13 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : 100 à < 200 m (groupe de référence ≥ 400 m) |
C2 |
1,04 |
0,90 à 1,21 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : 200 à < 400 m (groupe de référence ≥ 400 m) |
C3 |
1,04 |
0,91 à 1,18 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : < 50 m (groupe de référence ≥ 250 m) |
D1 |
1,02 |
1,00 à 1,01 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 50 à 100 m (groupe de référence ≥ 250 m) |
D2 |
1,01 |
0,99 à 1,03 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 100 à 150 m (groupe de référence ≥ 250 m) |
D3 |
1,01 |
0,99 à 1,02 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 150 à 250 m (groupe de référence ≥ 250 m) |
D4 |
0,99 |
0,98 à 1,01 |
Catégorique |
Hart et coll., 2013 |
NHS, É.-U. |
Vivant à ≤ 50 m de la route A3 ou à ≤ 150 m de la route A1 ou A2 : toujours proche (groupe de référence : toujours loin) |
E1 |
1,05 |
1,00 à 1,10 |
Catégorique |
Hart et coll., 2013 |
NHS, É.-U. |
Vivant à ≤ 50 m de la route A3 ou à ≤ 150 m de la route A1 ou A2 : de loin à proche (groupe de référence: toujours loin) |
E2 |
1,17 |
1,00 à 1,37 |
Catégorique |
Hart et coll., 2013 |
NHS, É.-U. |
Vivant à ≤ 50 m de la route A3 ou à ≤ 150 m de la route A1 ou A2 : de proche à loin (groupe de référence: toujours loin) |
E3 |
0,98 |
0,94 à 1,03 |
Catégorique |
Heinrich et coll., 2013 |
SALIA, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 voitures/jour) |
F |
1,42 |
1,12 à 1,79 |
Catégorique |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
G |
0,94 |
0,85 à 1,05 |
Catégorique |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Vivant près d'une route principale (à ≤ 100 m d'une autoroute ou à ≤ 50 m d'une route principale avec 10 000 véhicules à moteur/jour) |
H |
1,05 |
0,97 à 1,12 |
Catégorique |
La proximité de la circulation et le risque de mortalité toutes causes confondues ont également été examinés dans un groupe diversifié de populations de patients (résumé à l'annexe A.9 et à la figure 3.7). Ces études ont été menées au Canada (n = 2), aux É.-U. (n = 2) et en Europe (n = 3). À l'exception d'une étude qui n'a tenu compte d'aucun facteur de confusion (Finkelstein et coll., 2004), toutes ont tenu compte de l'âge et du sexe, cinq ont tenu compte du SSE, et trois ont tenu compte du tabagisme; de nombreuses études ont également tenu compte d'autres facteurs de confusion. Pour la majorité des études, l'exposition était fondée sur l'adresse résidentielle exacte, tandis que deux études utilisaient le code postal ou le code ZIP pour attribuer l'exposition (Finkelstein et coll., 2004; Medina-Ramón et coll., 2008). Dans le cas des deux études qui ont évalué l'exposition comme variable continue (Medina-Ramón et coll., 2008; Ruttens et coll., 2017), aucun lien n'a été observé en fonction de la distance par rapport à une route ou à une autoroute principale. Ruttens et coll. (2017) ont déterminé des liens positifs statistiquement significatifs ou au seuil de signification statistique si l'on tient compte de la longueur totale des routes dans les zones tampons, avec le plus grand risque pour une zone tampon de 100 m. Goeminne et coll. (2014) ont signalé que chaque multiplication par 10 de la distance jusqu'à une route principale entraînait une baisse importante du risque de décès (IR = 0,28; IC à 95 % : 0,10 à 0,77). Lorsque la proximité de la circulation a été évaluée comme variable catégorique, des liens positifs, statistiquement significatifs ou au seuil de signification statistique ont été observées, et Wilker et coll. (2013) ont observé une relation exposition-réponse.

Figure 3.7 : Texte descriptif
La figure 3.7 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité toutes causes confondues dans les populations de patients. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,8 à 2,1. Les informations suivantes sont illustrées dans cette figure :
| Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Distance jusqu'à l'autoroute, pour 1 233 m |
A1 |
0,987 |
0,964 à 1,012 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Distance par rapport à la route principale, pour 241 m |
A2 |
1,000 |
0,976 à 1,024 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Longueur totale des routes à l'intérieur de différentes zones tampons : 50 m, pour 108 m |
A3 |
1,055 |
0,955 à 1,112 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Longueur totale des routes à l'intérieur de différentes zones tampons : 100 m, pour 279 m |
A4 |
1,111 |
1,025 à 1,202 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Longueur totale des routes à l'intérieur de différentes zones tampons : 200 m, pour 756 m |
A5 |
1,094 |
1,030 à 1,779 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Longueur totale des routes à l'intérieur de différentes zones tampons : 500 m, pour 4 092 m |
A6 |
1,085 |
1,000 à 1,130 |
Continu (par augmentation de l'écart interquartile) |
Ruttens et coll., 2017 |
Patients ayant subi une transplantation pulmonaire dans 10 pays européens |
Longueur totale des routes à l'intérieur de différentes zones tampons : 1 000 m, pour 15 403 m |
A7 |
1,047 |
0,985 à 1,131 |
Continu (par augmentation de l'écart interquartile) |
Medina Ramón et coll., 2008 |
Étude sur les insuffisances cardiaques de Worcester, É.-U. |
Distance jusqu'à la route principale, pour 2 008 m |
B |
1,00 |
0,93 à 1,08 |
Continu (par augmentation de l'écart interquartile) |
Wilker et coll., 2013 |
Patients ayant subi un AVC ischémique, É.-U. |
Distance par rapport à la chaussée avec > 10 000 véhicules par jour : ≤ 100 m (référence > 400 m) |
C1 |
1,20 |
1,01 à 1,43 |
Catégorique |
Wilker et coll., 2013 |
Patients ayant subi un AVC ischémique, É.-U. |
Distance par rapport à la chaussée avec > 10 000 véhicules par jour : 100 à 200 m (référence > 400 m) |
C2 |
1,08 |
0,88 à 1,31 |
Catégorique |
Wilker et coll., 2013 |
Patients ayant subi un AVC ischémique, É.-U. |
Distance par rapport à la chaussée avec > 10 000 véhicules par jour : 200 à 400 m (référence > 400 m) |
C3 |
0,99 |
0,82 à 1,20 |
Catégorique |
Nawrot et coll., 2011 |
Patients ayant subi une transplantation pulmonaire avec un suivi à long terme à l'UZ de Louvain, en Belgique |
Vivant à ≤ 171 m d'une route principale |
D |
1,99 |
1,09 à 3,61 |
Catégorique |
Jerrett et coll., 2009 |
Patients d'une clinique de maladies respiratoires, Canada |
Vivant à ≤ 50 m d'une route principale ou à ≤ 100 m d'une autoroute |
E |
1,19 |
0,92 à 1,53 |
Catégorique |
Finkelstein et coll., 2004 |
Examen de la fonction pulmonaire en clinique, Canada |
Vivant à ≤ 50 m d'une route principale ou à ≤ 100 m d'une autoroute |
F |
1,18 |
1,02 à 1,38 |
Catégorique |
Densité de la circulation automobile
Les recherches documentaires ont permis de cerner neuf études qui évaluaient le lien entre la densité de la circulation et la mortalité toutes causes confondues; cinq études ont été menées au sein de la population générale et quatre ont été menées au sein des populations de patients. Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.10. Dans le cas des études portant sur la population générale, chacune a été menée en Europe et a pris en compte les risques au sein de la population générale. Leur taille variait de 52 061 (Raaschou-Nielsen et coll., 2012) à 1 265 058 (Cesaroni et coll., 2013). Les études de Beelen et coll. (2008) et Brunekreef et coll. (2009) ont été menées auprès de la même cohorte et ont obtenu des résultats identiques. Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE) et du tabagisme, à l'exception de Cesaroni et coll. (2013).
Les ER pour la densité de la circulation et la mortalité toutes causes confondues au sein de la population générale sont résumées dans un graphique en forêt (figure 3.8). L'étude ESCAPE (Beelen et coll., 2014a) et la cohorte NLCS-AIR (Brunekreef et coll., 2009) ont toutes deux pris en compte le trafic comme une variable continue. Pour ces deux études, des liens positifs, au seuil de signification statistique, ont été observés lorsqu'ils ont été évalués en fonction de la circulation sur la route la plus proche de la résidence et de la somme du trafic dans une zone tampon de 100 m autour de la résidence. Cesaroni et coll. (2013) ont évalué des quintiles de densité de la circulation dans une zone tampon de 150 m autour de la résidence et ont cerné un lien positif pour chaque quintile et un risque important d'augmentation de la tendance (p < 0,001).

Figure 3.8 : Texte descriptif
La figure 3.8 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la densité de la circulation et de mortalité toutes causes confondues dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,95 à 1,1. Les informations suivantes sont illustrées dans cette figure :
| Indicateur de trafic | Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|---|
Circulation sur la route la plus proche |
Beelen et coll., 2014a |
ESCAPE, Europe |
Circulation sur la route la plus proche (pour 5 000 véhicules/jour) |
A1 |
1,01 |
1,00 à 1,03 |
Continu |
Circulation sur la route la plus proche |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Circulation sur la route la plus proche (pour 10 000 véhicules/jour |
B1 |
1,03 |
1,00 à 1,08 |
Continu |
Somme de la circulation dans une zone tampon de 100 m |
Beelen et coll., 2014a |
ESCAPE, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 4 x 106 véhicule-m/jour) |
A2 |
1,01 |
0,98 à 1,05 |
Continu |
Somme de la circulation dans une zone tampon de 100 m |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 335 000 véhicules/jour) |
B2 |
1,02 |
0,97 à 1,07 |
Continu |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (0,25 à 1,63) x 106 (référence: < 0,25 x 106) |
C1 |
1,02 |
1,00 à 1,04 |
Catégorique |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (1,63 à 3,23) x 106 (référence: < 0,25 x 106) |
C2 |
1,03 |
1,01 à 1,05 |
Catégorique |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (3,23 à 6,66) x 106 (référence: < 0,25 x 106) |
C3 |
1,03 |
1,01 à 1,05 |
Catégorique |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : ≥ 6,66 x 106 (référence: < 0,25 x 106) |
C4 |
1,04 |
1,03 à 1,06 |
Catégorique |
Quatre études menées auprès de populations de patients ont été cernées lors des recherches documentaires (résumé à l'annexe A.10). Ces études, représentant un groupe diversifié de populations de patients, ont été menées aux É.-U. (n = 2) et en Europe (n = 2) et comportaient un large éventail de tailles d'études (183 [Goeminne et coll., 2014] à 32 875 [Blount et coll., 2017]). Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE), tandis que le tabagisme n'a été pris en compte que dans Goeminne et coll. (2014) et Tonne et coll. (2016). Un lien positif, statistiquement significatif ou au seuil de signification statistique entre la densité de la circulation et la mortalité toutes causes confondues, a été observé dans chaque étude.
3.2.5 Résumé
Le lien entre la PACA et la mortalité toutes causes confondues a été examiné dans 47 études de cohortes. La majorité de ces études concernaient une population générale et ont été menées en Europe. Plus de 60 % des études ont évalué l'exposition à la PACA en modélisant des polluants individuels, tandis que les autres ont utilisé des mesures de la circulation automobile et de l'infrastructure du réseau routier comme mesures indirectes de l'exposition. Presque toutes les études ont tenu compte des principaux facteurs de confusion (âge, sexe, SSE et tabagisme) et bon nombre d'entre elles ont considéré d'autres facteurs de confusion. Dans le cas des analyses regroupées concernant la population générale, un lien positif a été déterminé pour chacun des polluants évalués (c.-à-d. NO2, NOx, PM2,5, CÉ et PM10) et les liens avec des ER regroupées allant de 1,02 à 1,06 étaient statistiquement significatifs pour le NO2 et les PM2,5 et au seuil de signification statistique pour le NOx, le CÉ et les PM10. Même s'il n'y a que peu ou pas d'hétérogénéité pour les PM2,5 et les PM10, l'hétérogénéité était importante pour le NO2, le NOx et le CÉ. Les résultats des analyses regroupées ont été appuyés par l'analyse qualitative des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui a également fourni une certaine indication d'une relation exposition-réponse. Dans le cas des populations de patients, l'analyse regroupée n'a pu être effectuée que pour le NO2, où un lien positif statistiquement non significatif a été observé pour les patients présentant une étiologie cardiovasculaire. Pour ce qui est du NO et du benzène, les données probantes étaient limitées et n'appuyaient pas la réalisation d'une analyse regroupée.
3.3 Mortalité circulatoire
La mortalité circulatoire (aussi appelée mortalité cardiovasculaire) a été évaluée dans 41 des 64 articles évaluant le lien entre l'exposition à long terme à la PACA et la mortalité. Une évaluation des études examinant les effets de l'exposition à long terme à la PACA et la mortalité circulatoire est présentée ci-dessous par polluant ou mesure de la PACA. Ces études ont évalué la mortalité due aux maladies du système circulatoire (MSC) en tant que groupe, ainsi que la mortalité due à des causes plus précises (p. ex. MCO [également appelée cardiopathie ischémique], IM, insuffisance cardiaque [ICA] et maladie cérébrovasculaire [MCV], y compris AVC). Dans les quelques cas où les études ont rapporté une mortalité cardiopulmonaire ou cardiorespiratoire sans présenter les résultats de la mortalité circulatoire et respiratoire séparément, les études ont été considérées comme une mesure de la mortalité circulatoire, car ces causes dominent la catégorie combinée (HEI, 2022). De même, étant donné que l'AVC est la cause la plus fréquente de MCV, et conformément à l'approche adoptée par le HEI (2022), la mortalité par MCV et la mortalité par AVC ont été regroupées pour une méta-analyse ou qualitativement évaluées ensemble en l'absence d'une analyse quantitative.
3.3.1 Oxydes d'azote (NO, NO2 et NOx)
NO2
Pour les études du NO2 (n = 19), des détails, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.1. La plupart des études ont été menées en Europe (n = 8), au Canada (n = 5) et en Asie (n = 4). Deux des études avaient un plan d'étude cas-témoins (Rosenlund et coll., 2006, 2009) et les autres étaient des études de cohortes. Toutes les études canadiennes, sauf une (Jerrett et coll., 2009), concernaient la population générale dont la taille variait de 3 210 (Rosenlund et coll., 2006) à 1 265 058 (Cesaroni et coll., 2013). Pour l'évaluation de l'exposition des études menées au sein de la population générale, la modélisation de la RUT (n = 12) était la méthode la plus couramment utilisée, suivie de la modélisation de la dispersion (n = 4) et de la modélisation hybride (n = 2). Les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal et de l'îlot de recensement ou en fonction du quartier, les expositions moyennes (ou médianes) allant de 5,2 à 107 μg/m3. Les expositions les plus faibles ont été attribuées à l'une des cohortes suédoises incluses dans l'étude ESCAPE (Beelen et coll., 2014a), tandis que les expositions les plus élevées ont été notées dans une étude menée à Hong Kong, en Chine (Barratt et coll., 2018). Les études menées au sein de la population générale ont chacune examiné un ou plusieurs effets relatifs à la mortalité circulatoire, y compris la mortalité par MSC (n = 12), par MCO (n = 12), par MCV (n = 10) et AVC (n = 1), par IM (n = 3) et par dysrythmies, par ICA, et par arrêt cardiaque (n = 2). Les 18 études tenaient compte de l'âge et du sexe, ainsi que du SSE individuel ou du SSE au niveau régional; cinq études ne sont pas ajustées en fonction du tabagisme (Naess et coll., 2007; Rosenlund et coll., 2008, 2009; Gan et coll., 2011; Cesaroni et coll., 2013). De nombreuses études ont également pris en compte d'autres facteurs de confusion.
L'ER la mieux ajustée, désignée à partir de chaque étude pour les résultats pertinents concernant la mortalité circulaire, est également précisée à l'annexe A.1.
Au sein de la population générale, 12 des 15 ER liées à la mortalité par MSC étaient positives, dont 7 étaient statistiquement significatives, et 5 étaient au seuil de signification statistique. Quatre de ces ER ont été tirées de la même étude (Naess et coll., 2007) et correspondent à des groupes d'âge et à des sexes différents. La figure 3.9 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité par MSC et le NO2. Sept études ont été incluses dans la méta-analyse de la population générale avec des ER allant de 0,99 à 1,24. L'ER regroupée pour le lien entre le NO2 et la mortalité par MSC était au seuil de signification statistique, à 1,05 (IC à 95 % : 0,98 à 1,12) avec une hétérogénéité considérable (I2 = 96,64 %).
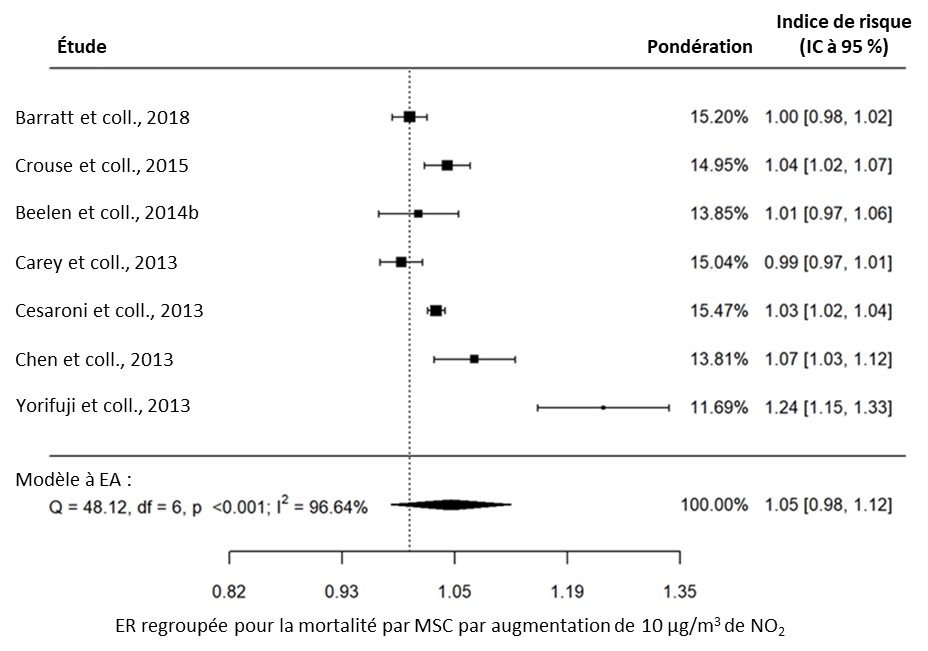
Figure 3.9 : Texte descriptif
La figure 3.9 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MSC et l'exposition à long terme au NO2 dans la population générale. L'ER regroupée de cette méta-analyse de sept études individuelles est de 1,05 (IC à 95 % : 0,98 à 1,12) par augmentation de 10 μg/m3 de NO2. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 48,12, df = 6, p < 0,001 et I2 = 96,64 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
15,20 % |
1,00 |
0,98 à 1,02 |
Crouse et coll., 2015 |
14,95 % |
1,04 |
1,02 à 1,07 |
Beelen et coll., 2014b |
13,85 % |
1,01 |
0,97 à 1,06 |
Carey et coll., 2013 |
15,04 % |
0,99 |
0,97 à 1,01 |
Cesaroni et coll., 2013 |
15,47 % |
1,03 |
1,02 à 1,04 |
Chen et coll., 2013 |
13,81 % |
1,07 |
1,03 à 1,12 |
Yorifuji et coll., 2013 |
11,69 % |
1,24 |
1,15 à 1,33 |
L'hétérogénéité est demeurée considérable (I2 = 96,68 %) lorsque l'analyse s'est limitée aux études qui utilisaient des modèles de RUT (ER : 1,06; IC à 95 % : 0,98 à 1,14), qui comprenaient toutes les études sauf une de l'analyse principale. L'analyse de sensibilité fondée sur le RB n'a pas été effectuée pour le domaine d'exposition, car toutes les études incluses dans la méta-analyse ont obtenu un score faible ou probablement faible pour ce domaine, mais lorsque l'analyse s'est limitée aux études avec un RB faible et probablement faible pour le domaine de confusion, l'ER regroupée était robuste (ER : 1,05; IC à 95 % : 0,97 à 1,14) et l'hétérogénéité était inchangée (I2 = 95,7 %). L'analyse de l'exclusion indiquait que les résultats étaient robustes pour toutes les études, à l'exception de Yorifuji et coll. (2013); l'élimination de cette dernière a entraîné une réduction de l'ER regroupée de 1,02 et une réduction de l'hétérogénéité (I2 = 80,96 %). Bien que le test d'Egger ait fourni la preuve d'un biais de publication (p = 0,04067), cela n'a pas été corroboré par le test de Begg (p = 0,2389) ou l'analyse selon la méthode supprimer et remplacer, qui n'a cerné aucune étude manquante.
Concernant la mortalité par MCO au sein de la population générale, 11 des 12 ER étaient positives, dont sept étaient statistiquement significatives et deux étaient au seuil de signification statistique. La figure 3.10 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité par MCO et provoquée par le NO2. Neuf études ont été incluses dans la méta-analyse de la population générale avec des ER allant de 1,00 à 1,29. L'ER regroupée pour le lien entre le NO2 et la mortalité par MCO était significative à 1,05 (1,03 à 1,07) et l'hétérogénéité était minime et probablement sans importance (I2 = 0,4 %).

Figure 3.10 : Texte descriptif
La figure 3.10 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCO et l'exposition à long terme au NO2 dans la population générale. L'ER regroupée de cette méta-analyse de neuf études individuelles est de 1,05 (IC à 95 % : 1,03 à 1,07) par augmentation de 10 μg/m3 de NO2. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 12,5, df = 8, p = 0,13 et I2 = 0,4 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Alexeeff et coll., 2018 |
0.15 % |
1,13 |
0,85 à 1,50 |
Barratt et coll., 2018 |
12,20 % |
1,03 |
1,00 à 1,07 |
Crouse et coll., 2015 |
9,93 % |
1,05 |
1,02 à 1,09 |
Beelen et coll., 2014b |
1,53 % |
1,00 |
0,91 à 1,09 |
Cesaroni et coll., 2013 |
58,54 % |
1,05 |
1,04 à 1,07 |
Chen et coll., 2013 |
3,55 % |
1,09 |
1,02 à 1,15 |
Yorifuji et coll., 2013 |
0,64 % |
1,29 |
1,12 à 1,48 |
Gan et coll., 2011 |
7,79 % |
1,05 |
1,01 à 1,09 |
Rosenlund et coll., 2008 |
5,67 % |
1,07 |
1,02 à 1,12 |
Étant donné que toutes les études primaires incluses dans la méta-analyse utilisaient des modèles de RUT pour évaluer l'exposition et qu'elles ont été évaluées comme ayant un RB faible ou probablement faible pour le domaine d'exposition, ni l'analyse des sous-groupes par évaluation de l'exposition ni l'analyse de sensibilité fondée sur un RB pour le domaine d'exposition n'ont été effectuées. Lorsque l'analyse s'est limitée aux études présentant un RB faible et probablement faible pour le domaine de confusion, ce qui a exclu trois études (c.-à-d. Rosenlund et coll., 2008, Gan et coll., 2011 et Cesaroni et coll., 2013), l'ER regroupée était robuste (ER : 1,06), mais il y avait une incertitude accrue autour de l'ER (IC à 95 % : 0,99 à 1,14) et l'hétérogénéité devenait substantielle (I2 = 61,9 %). L'analyse de l'exclusion n'indiquait pas qu'une seule étude influençait l'analyse principale; le lien restait statistiquement significatif avec une ER regroupée = 1,05. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,2371; test de Begg p = 0,1194), tandis que l'analyse selon la méthode supprimer et remplacer a indiqué que deux études hypothétiques seraient nécessaires pour rendre le diagramme en entonnoir symétrique.
Concernant la mortalité par MCV (mortalité par AVC comprise) dans de la population générale, sept des 11 ER étaient positives, dont une était statistiquement significative, et cinq étaient au seuil de signification statistique. La figure 3.11 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité par MCV et provoquée par le NO2. Huit études ont été incluses dans la méta-analyse de la population générale avec des ER allant de 0,93 à 1,57. L'estimation regroupée pour le lien entre le NO2 et la mortalité par MCV était au seuil de signification statistique à 1,01 (IC à 95 % : 0,98 à 1,04) et l'hétérogénéité était minime et probablement sans importance (I2 = 0,56 %).

Figure 3.11 : Texte descriptif
La figure 3.11 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCV et l'exposition à long terme au NO2 dans la population générale. L'ER regroupée de cette méta-analyse de huit études individuelles est de 1,01 (IC à 95 % : 0,98 à 1,04) par augmentation de 10 μg/m3 de NO2. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 12,65, df = 7, p = 0,081 et I2 = 0,56 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Dirgawati et coll., 2019 |
0,39 % |
0,93 |
0,72 à 1,20 |
Alexeeff et coll., 2018 |
0,08 % |
1,57 |
0,90 à 2,74 |
Barratt et coll., 2018 |
20,33 % |
1,00 |
0,97 à 1,04 |
Crouse et coll., 2015 |
9,06 % |
1,02 |
0,97 à 1,08 |
Beelen et coll., 2014b |
3,52 % |
1,01 |
0,93 à 1,10 |
Cesaroni et coll., 2013 |
60,71 % |
1,01 |
0,99 à 1,03 |
Chen et coll., 2013 |
4,10 % |
0,96 |
0,89 à 1,03 |
Yorifuji et coll., 2013 |
1,81 % |
1,19 |
1,06 à 1,34 |
Ni l'analyse des sous-groupes par évaluation de l'exposition ni l'analyse de sensibilité fondée sur le RB pour le domaine d'exposition n'a été effectuée, étant donné que toutes les études primaires incluses dans la méta-analyse utilisaient la modélisation de la RUT ou la modélisation hybride pour évaluer l'exposition et qu'elles ont été évaluées comme présentant un RB faible ou probablement faible pour le domaine d'exposition. Lorsque l'analyse s'est limitée aux études avec un RB faible et probablement faible pour le domaine de confusion, qui comprenait toutes les études sauf Cesaroni et coll. (2013), l'estimation regroupée était robuste (ER : 1,02), mais l'hétérogénéité devenait modérée (I2 = 50,81 %). Le fait de limiter l'analyse aux études évaluant exclusivement la mortalité par MCV (à l'exclusion de la mortalité par AVC) n'a pas modifié l'estimation regroupée (ER : 1,01) ni l'hétérogénéité (I2 = 0,54 %). De la même façon, l'analyse de l'exclusion n'indiquait pas qu'une seule étude influençait l'analyse principale (ER regroupée = 1,01 à 1,02). Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,4139; test de Begg p = 0,7195), tandis que l'analyse selon la méthode supprimer et remplacer a indiqué qu'une étude hypothétique serait nécessaire pour rendre le diagramme en entonnoir symétrique.
Un nombre limité d'études (trois ou moins) ont été cernées lors des recherches documentaires portant sur l'exposition au NO2 et la mortalité par IM et la mortalité par dysrythmie, par ICA, et par arrêt cardiaque dans la population générale; ces études ont signalé principalement des liens positifs qui étaient statistiquement significatifs ou au seuil de signification statistique.
La seule étude à examiner le lien entre l'exposition à long terme au NO2 et la mortalité circulatoire dans une population de patients a été menée chez des patients adultes d'une clinique de maladies respiratoires à Toronto, en Ontario (Jerrett et coll., 2009). Cette étude canadienne a tenu compte des principaux facteurs de confusion, y compris le tabagisme, et a fait état d'un lien significatif et positif entre le NO2 et la mortalité par MSC (résumé à l'annexe A.1).
NOx
Dans le cas du NOx, sept études ont examiné le lien entre l'exposition à long terme au NOx et les causes circulatoires de mortalité; les détails de l'étude sont présentés à l'annexe A.2. Elles ont été menées en Europe (n = 6) et en Australie (n = 1), et toutes concernent la population générale avec des cohortes allant de 6 304 (Andersson et coll., 2020) à 367 383 (Beelen et coll., 2014a). La plupart des études ont utilisé la modélisation de la dispersion (n = 5) suivie de la modélisation de la RUT (n = 2) pour évaluer l'exposition au NOx, et toutes les études ont attribué l'exposition au NOx à l'adresse résidentielle; les expositions moyennes (ou médianes) variaient de 5,80 à 107,3 μg/m3. Les expositions les plus faibles ont été estimées dans une étude menée à Civitavecchia, en Italie (Bauleo et coll., 2019), tandis que les expositions les plus élevées ont été modélisées dans l'une des cohortes italiennes incluses dans l'étude ESCAPE (Beelen et coll., 2014a). Chacune des études a examiné un ou plusieurs effets relatifs à la mortalité circulatoire, y compris la mortalité par MSC (n = 4), par MCO (n = 4), par MCV (n = 4), par AVC (n = 1), par IM (n = 3), par maladies cardiaques (n = 1) et par événements coronariens aigus (ECA; n = 1). Toutes les études ont tenu compte des principaux facteurs de confusion (âge, sexe et SSE, au niveau individuel ou régional) et toutes les études sauf une (Bauleo et coll., 2019) ont également été ajustées en fonction du tabagisme. D'autres facteurs de confusion ont également été pris en compte dans ces études.
L'ER la mieux ajustée, désignée à partir de chaque étude pour les résultats pertinents concernant la mortalité circulaire, est résumée à l'annexe A.2.
Concernant la mortalité par MCO, trois des quatre ER étaient positives, dont deux étaient au seuil de signification statistique et une était statistiquement significative. La figure 3.12 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité par MCO et liée au NOx au sein de la population générale. Quatre études ont été incluses dans la méta-analyse avec des ER allant de 0,86 à 1,08. L'ER regroupée pour le lien entre le NOx et la mortalité par MCO était au seuil de signification statistique à 1,02 (IC à 95 % : 0,93 à 1,13) et l'hétérogénéité était substantielle (I2 = 77,84 %).
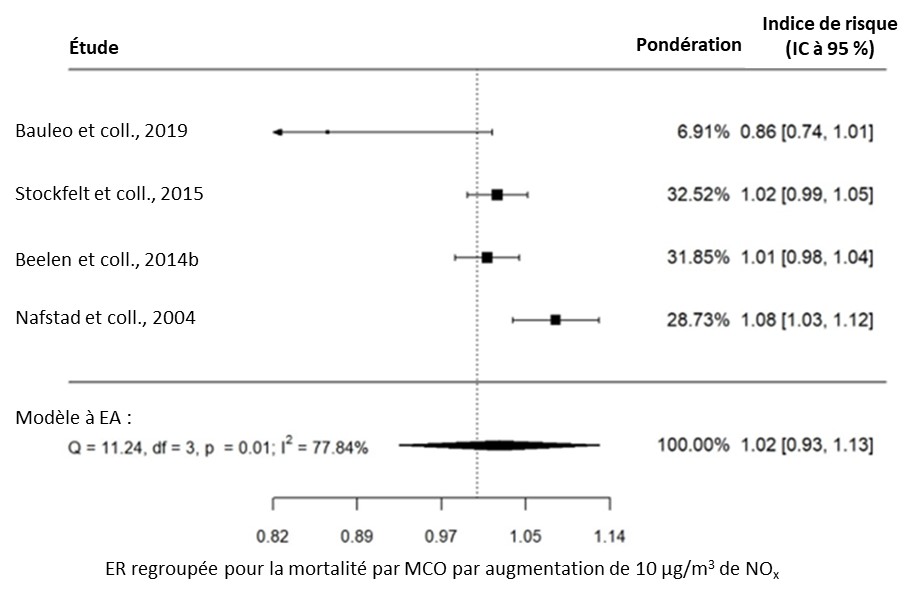
Figure 3.12 : Texte descriptif
La figure 3.12 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCO et l'exposition à long terme au NOx dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,02 (IC à 95 % : 0,93 à 1,13) par augmentation de 10 μg/m3 de NOx. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 11,24, df = 3, p = 0,01 et I2 = 77,84 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Bauleo et coll., 2019 |
6,91 % |
0,86 |
0,74 à 1,01 |
Stockfelt et coll., 2015 |
32,52 % |
1,02 |
0,99 à 1,05 |
Beelen et coll., 2014b |
31,85 % |
1,01 |
0,98 à 1,04 |
Nafstad et coll., 2004 |
28,73 % |
1,08 |
1,03 à 1,12 |
Lorsque l'analyse s'est limitée aux études utilisant la modélisation de la dispersion pour évaluer l'exposition, à savoir toutes les études sauf une de l'analyse principale, l'ER regroupée est demeurée positive, mais n'était pas statistiquement significative (ER : 1,01; IC à 95 % : 0,78 à 1,30) et l'hétérogénéité a augmenté (I2 = 91,16 %). En revanche, l'ER regroupée et l'hétérogénéité de l'analyse principale étaient robustes aux analyses de sensibilité fondées sur le RB (c.-à-d. à l'exclusion des études avec un RB élevé ou probablement élevé dans les domaines d'évaluation de l'exposition ou des facteurs de confusion). L'analyse de l'exclusion a révélé ce qui suit : 1) Nafstad et coll. (2004) étaient la principale source d'hétérogénéité, car l'omission de cette étude a éliminé l'hétérogénéité de l'analyse principale et 2) l'omission de Beelen et coll. (2014b) et de Stockfelt et coll. (2015) a accru l'incertitude entourant l'ER. Il n'y avait aucune preuve d'un biais de publication, comme le démontrent les tests de Begg (p = 0,7500) et d'Egger (p = 0,2366), et la méthode supprimer et remplacer a laissé entendre qu'une étude hypothétique était nécessaire pour rendre le diagramme en entonnoir symétrique.
En ce qui concerne la mortalité par MCV (y compris la mortalité par AVC), deux des cinq ER étaient positives et au seuil de signification statistique. La figure 3.13 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité par MCV et le NOx au sein de la population générale. Cinq études ont été incluses dans la méta-analyse avec des ER allant de 0,82 à 1,04. L'analyse regroupée a fait état d'un lien nul (ER : 1,00; IC à 95 % : 0,96 à 1,05) entre la mortalité attribuable au NOx et la mortalité par MCV avec une hétérogénéité minimale probablement sans importance (I2 = 0,10 %).

Figure 3.13 : Texte descriptif
La figure 3.13 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCV et l'exposition à long terme au NOx dans la population générale. L'ER regroupée de cette méta-analyse de cinq études individuelles est de 1,00 (IC à 95 % : 0,96 à 1,05) par augmentation de 10 μg/m3 de NOx. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 5,94, df = 4, p = 0,204 et I2 = 0,1 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Bauleo et coll., 2019 |
2,25 % |
0,82 |
0,68 à 1,00 |
Dirgawati et coll., 2019 |
8,46 % |
0,97 |
0,88 à 1,07 |
Stockfelt et coll., 2015 |
23,73 % |
1,03 |
0,97 à 1,09 |
Beelen et coll., 2014b |
57,62 % |
1,00 |
0,96 à 1,04 |
Nafstad et coll., 2004 |
7,95 % |
1,04 |
0,94 à 1,15 |
À l'exception de l'hétérogénéité plus élevée observée pour la modélisation de la dispersion (I2 = 70,44 %), l'analyse des sous-groupes fondée sur la méthode d'évaluation de l'exposition (c.-à-d. la modélisation de la RUT ou la modélisation de la dispersion) n'a pas indiqué de différence par rapport à l'analyse principale. En revanche, les analyses de sensibilité fondées sur le RB (c.-à-d. en excluant les études avec un RB élevé et probablement élevé pour le domaine de l'évaluation des facteurs de confusion ou de l'exposition) ou limitant l'analyse des études qui évaluent exclusivement la mortalité par MCV (à l'exclusion de la mortalité par AVC) ont donné lieu à un lien positif (ER : 1,01) au seuil de signification statistique (IC à 95 % : 0,97 à 1,04 et IC à 95 % : 0,94 à 1,07, respectivement). Dans chacun de ces cas, une étude a été exclue de l'analyse principale. De même, ces études (Bauleo et coll., 2019 et Dirgawati et coll., 2019) ont été les seules à influencer l'analyse principale dans le cadre de l'analyse de l'exclusion. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,2724; test de Begg p = 0,4833), tandis que l'analyse selon la méthode supprimer et remplacer a laissé entendre qu'une étude hypothétique était nécessaire pour rendre le diagramme en entonnoir symétrique.
Quatre études ont examiné le lien entre la mortalité par MSC et le NOx, dont l'une a fourni les ER par quintile d'exposition. Aucune relation exposition-réponse n'a pu être déterminée à partir de cette étude (Andersson et coll. 2020). Quatre des sept ER indiquées pour la mortalité par MSC étaient positives, dont trois étaient au seuil de signification statistique. De même, deux des trois ER relatives à la mortalité par IM étaient positives et au seuil de signification statistique. Une ER a été effectuée pour la mortalité par maladie cardiaque et la mortalité par ECA; ni l'une ni l'autre n'a fait état d'un lien positif.
NO
Les recherches documentaires ont permis de cerner trois études menées au Canada, aux É.-U. et en Asie qui évaluent le lien entre les causes circulatoires de mortalité et le NO; les détails des études sont présentés à l'annexe A.3. Elles concernaient la population générale, dont la taille des cohortes variait de 41 869 (Alexeeff et coll., 2018) à 406 232 (Gan et coll., 2011). L'exposition au NO a été évaluée par des modèles de la RUT (n = 2) ou des modèles hybrides (n = 1) fondés sur l'adresse résidentielle ou le code postal. Le NO moyen variait de 6,0 (Alexeeff et coll., 2018) à 489 μg/m3 (Barratt et coll., 2018). Chacune des études a examiné un ou plusieurs effets relatifs à la mortalité circulatoire, y compris la mortalité par MSC (n = 1), par MCO (n = 3) et par MCV (n = 2). Elles comprenaient également des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, ainsi que d'autres facteurs de confusion, mais Gan et coll. (2011) n'ont pas fait d'ajustements en fonction du tabagisme. D'après un nombre limité d'ER pour chaque effet sur la mortalité, des résultats mitigés ont été observés pour la MCO et les MCV, et il n'y avait aucune preuve de lien avec les MSC.
3.3.2 PM
PM2,5
Les recherches documentaires ont permis de repérer 12 études évaluant le lien entre la mortalité circulatoire et les PM2,5 qui était révélateur de l'exposition à la PACA (section 2.1.2). Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.4. La moitié des études ont été menées en Europe (n = 6), tandis qu'une étude a été menée au Canada. Toutes les études ont été menées dans des cohortes de la population générale, dont la taille variait de 10 126 (Dirgawati et coll., 2019) à 1 265 058 (Cesaroni et coll., 2013). Pour l'évaluation de l'exposition, les méthodes les plus couramment utilisées étaient la modélisation de la RUT (n = 7) et la modélisation de la dispersion (n = 4); les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal ou du quartier. Les expositions moyennes ou médianes les plus faibles ont été estimées pour une étude menée à Vancouver (Colombie-Britannique) (4,08 μg/m3; Gan et coll., 2011) et l'exposition la plus élevée a été estimée pour une étude menée à Hong Kong, en Chine (42,4 μg/m3; Barratt et coll., 2018). Chacune des études comprenait des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, et incluait généralement des facteurs de confusion supplémentaires. En ce qui concerne le tabagisme, trois études n'incluaient pas d'ajustement, direct ou indirect, pour le tabagisme individuel (Naess et coll., 2007; Gan et coll., 2011; Cesaroni et coll., 2013).
La plupart des études relevées ont évalué la mortalité par MSC (n = 9, y compris deux sur la mortalité par maladie cardiopulmonaire). Une plus petite part d'études ont évalué des causes spécifiques de la mortalité, y compris par MCO (n = 6), par MCV (n = 3), par AVC (n = 1) et par IM (n = 2). L'annexe A.4 résume l'ER la mieux ajustée déterminée à partir de chaque étude, pour chaque résultat pertinent. Pour la mortalité par MSC, 10 des 13 ER individuelles étaient positives, dont sept étaient statistiquement significatives et une était au seuil de signification statistique. La figure 3.14 présente le graphique en forêt et la méta-analyse à effets aléatoires de la mortalité par MSC et des PM2,5. Six études ont été incluses dans la méta-analyse avec des ER normalisées allant de 0,73 à 1,11. L'ER regroupée pour le lien entre les PM2,5 et la mortalité par MSC était au seuil de signification statistique à 1,06 (IC à 95 % : 0,96 à 1,16) et l'hétérogénéité était modérée (I2 = 40,03 %). L'analyse de l'exclusion a relevé que l'analyse principale était robuste (l'ER regroupée variait entre 1,02 et 1,08). Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,08633; test de Begg p = 0,2722). De plus, l'analyse selon la méthode supprimer et remplacer a indiqué que deux études hypothétiques avec des liens positifs seraient nécessaires pour rendre le diagramme en entonnoir symétrique.

Figure 3.14 : Texte descriptif
La figure 3.14 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MSC et l'exposition à long terme aux PM2,5 dans la population générale. L'ER regroupée de cette méta-analyse de six études individuelles est de 1,06 (IC à 95 % : 0,96 à 1,16) par augmentation de 10 μg/m3 de PM2,5. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 10,09, df = 5, p = 0,073 et I2 = 40,03 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
27,60 % |
1,11 |
1,04 à 1,19 |
Badaloni et coll., 2017 |
37,02 % |
1,08 |
1,03 à 1,12 |
Beelen et coll., 2014b |
8,60 % |
0,98 |
0,83 à 1,16 |
Carey et coll., 2013 |
12,85 % |
0,95 |
0,83 à 1,08 |
Krewski et coll., 2009 (NYC) |
2,18 % |
0,73 |
0,50 à 1,05 |
Krewski et coll., 2009 (LA) |
11,75 % |
1,11 |
0,97 à 1,28 |
Pour ce qui est de la mortalité par MCO, sept des huit ER individuelles étaient positives, dont quatre étaient statistiquement significatives, et trois étaient au seuil de signification statistique (résumé à l'annexe A.4). La figure 3.15 présente le graphique en forêt et la méta-analyse à effets aléatoires de la mortalité par MCO et des PM2,5. Six études ont été incluses dans la méta-analyse avec des ER normalisées allant de 0,96 à 1,59. L'ER regroupée pour le lien entre les PM2,5 et la mortalité par MCO était significative à 1,10 (IC à 95 % : 1,01 à 1,20) et l'hétérogénéité était minime et probablement sans importance (I2 = 0,09 %). L'analyse de l'exclusion a relevé que l'analyse principale était robuste (l'ER regroupée variait entre 1,09 et 1,15). Il n'y avait aucune indication de biais de publication, car l'analyse par la méthode supprimer et remplacer n'a pas cerné d'études manquantes, et les tests n'ont pas fait état de biais (test d'Egger p = 0,3804; test de Begg p = 1). D'après les analyses de sensibilité, lorsque l'analyse s'est limitée aux études avec un RB faible et probablement faible pour le domaine de confusion, l'ER regroupé était robuste (ER : 1,13), mais il y avait une incertitude accrue autour de l'ER (IC à 95 % : 0,97 à 1,32) et l'hétérogénéité devenait modérée (I2 = 39,74 %).

Figure 3.15 : Texte descriptif
La figure 3.15 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCO et l'exposition à long terme aux PM2,5 dans la population générale. L'ER regroupée de cette méta-analyse de six études individuelles est de 1,10 (IC à 95 % : 1,01 à 1,20) par augmentation de 10 μg/m3 de PM2,5. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 6,77, df = 5, p = 0,239 et I2 = 0,09 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
23,58 % |
1,06 |
0,94 à 1,18 |
Badaloni et coll., 2017 |
60,10 % |
1,09 |
1,02 à 1,17 |
Beelen et coll., 2014b |
0,97 % |
0,96 |
0,55 à 1,69 |
Gan et coll., 2011 |
6,48 % |
1,07 |
0,86 à 1,32 |
Krewski et coll., 2009 (NYC) |
1,54 % |
1,59 |
1,02 à 2,49 |
Krewski et coll., 2009 (LA) |
7,33 % |
1,33 |
1,08 à 1,63 |
En ce qui concerne la mortalité par MCV (y compris AVC), trois des quatre études ont fait état d'un lien positif, dont deux étaient significatives ou au seuil de signification statistique (résumé à l'annexe A.4). La figure 3.16 présente le graphique en forêt et la méta-analyse à effets aléatoires concernant ce lien. Concernant les quatre études incluses dans la méta-analyse, les ER normalisées variaient de 0,50 à 1,46. L'ER regroupée pour le lien entre les PM2,5 et la mortalité par MCV (AVC compris) était au seuil de signification statistique à 1,08 (IC à 95 % : 1,00 à 1,18) et l'hétérogénéité était minime et probablement sans importance (I2 = 0,03 %). L'analyse de l'exclusion a révélé que deux études (Barratt et coll., 2018 et Cesaroni et coll., 2013) avaient le plus influencé l'estimation regroupée, car aucun lien n'a été observé après le retrait de l'une de ces études. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,7566; test de Begg p = 1,000). De plus, l'analyse par la méthode supprimer et remplacer a indiqué qu'aucune étude hypothétique ne serait nécessaire pour rendre le diagramme en entonnoir symétrique. Les analyses de sensibilité, à l'exclusion de l'étude qui n'a pris en compte que l'AVC (Dirgawati et coll., 2019), ont donné lieu à un lien significatif (ER : 1,08 [IC à 95 % : 1,02 à 1,15]), et l'analyse fondée sur le RB (c.-à-d. à l'exclusion des études avec un RB élevé ou probablement élevé dans le domaine des facteurs de confusion) a donné lieu à un lien nul (ER : 0,99 [IC à 95 % : 0,30 à 3,31]).
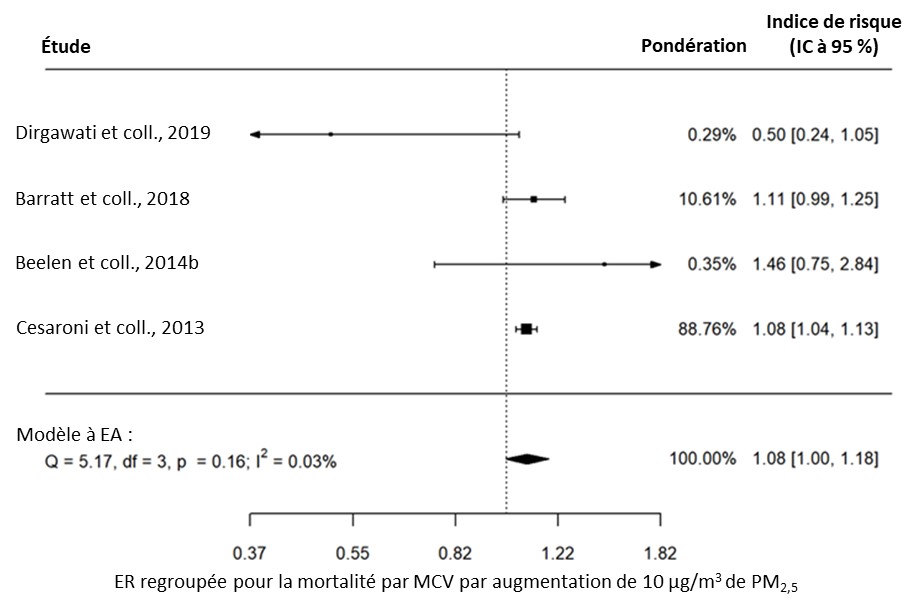
Figure 3.16 : Texte descriptif
La figure 3.16 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCV (AVC compris) et l'exposition à long terme aux PM2,5 dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,08 (IC à 95 % : 1,00 à 1,18) par augmentation de 10 μg/m3 de PM2,5. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 5,17, df = 3, p = 0,16 et I2 = 0,03 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Dirgawati et coll., 2019 |
0,29 % |
0,50 |
0,24 à 1,05 |
Barratt et coll., 2018 |
10,61 % |
1,11 |
0,99 à 1,25 |
Beelen et coll., 2014b |
0,35 % |
1,46 |
0,75 à 2,84 |
Cesaroni et coll., 2013 |
88,76 % |
1,08 |
1,04 à 1,13 |
Pour les autres causes spécifiques de mortalité circulatoire, il n'y avait pas suffisamment d'études pour effectuer une méta-analyse. Une augmentation au seuil de signification statistique a été rapportée pour la mortalité par MCO et aucun lien n'a été observé concernant la mortalité par IM.
CÉ, PM2,5 abs et CN
Huit études évaluant l'exposition aux PM2,5 abs ou au CN et la mortalité circulatoire ont été trouvées. Les détails de l'étude sont fournis à l'annexe A.5. Des études ont été menées au Canada (n = 1), en Europe (n = 3), en Asie (n = 2), aux É.-U. (n = 1) et en Australie (n = 1). Chacune des études portait sur la population générale, la taille de l'étude variant de 10 126 (Dirgawati et coll., 2019) à 1 249 108 (Badaloni et coll., 2017). Les méthodes d'évaluation de l'exposition comprenaient la modélisation de la RUT (n = 6), la modélisation hybride (n = 1) et la modélisation de la dispersion (n = 1), et l'exposition a été attribuée en fonction de l'adresse résidentielle ou du code postal. D'après les équivalents CÉ, les expositions moyennes ou médianes allaient de 0,45 (Alexeef et coll., 2018) à 16,4 μg/m3 (Barratt et coll., 2018). Des ajustements pour tenir compte des principaux facteurs de confusion (âge, sexe et SSE) ont été réalisés dans chacune des études; un ajustement direct ou indirect en fonction du tabagisme a été fait dans chaque étude, à l'exception de Gan et coll. (2011) et Badaloni et coll. (2017).
Les études ont examiné la mortalité par MSC (n = 6), par MCO (n = 4), par MCV (n = 3), par AVC (n = 1) et par IM (n = 2). L'annexe A.5 résume l'ER la mieux ajustée déterminée à partir de chaque étude. Il n'y avait pas suffisamment d'études avec des données à regrouper pour effectuer une méta-analyse de ces résultats, sauf pour la MCO et la MCV (AVC compris).
Concernant la MCO, les ER normalisées équivalentes au CÉ variaient de 0,98 à 1,06 et l'ER regroupée était positive et au seuil de signification statistique avec un IR de 1,03 (IC à 95 % : 0,99 à 1,08) (figure 3.17). L'hétérogénéité était substantielle (I2 = 81,92 %) et a été largement attribuée à Barratt et coll. (2018), car aucune hétérogénéité (I2 = 0 %) n'a été observée lorsque cette étude a été retirée de la méta-analyse dans l'analyse de l'exclusion. L'analyse de l'exclusion a aussi relevé que l'analyse principale était robuste (l'ER regroupée variait entre 1,02 et 1,05). Aucun des tests relatifs au biais de publication n'a suggéré la présence d'un biais (test d'Egger p = 0,9973; test de Begg p = 0,75), tandis que l'analyse selon la méthode supprimer et remplacer a indiqué qu'une étude hypothétique serait nécessaire pour rendre le diagramme en entonnoir symétrique. Étant donné que le RB de chacune des études primaires de l'analyse primaire a été évalué comme faible ou probablement faible pour les domaines d'évaluation de l'exposition et des facteurs de confusion, aucune analyse de sensibilité fondée sur le RB n'a été effectuée. Une analyse des sous-groupes fondée sur l'évaluation de l'exposition n'a pas non plus été effectuée puisque toutes les études utilisaient des modèles de la RUT.
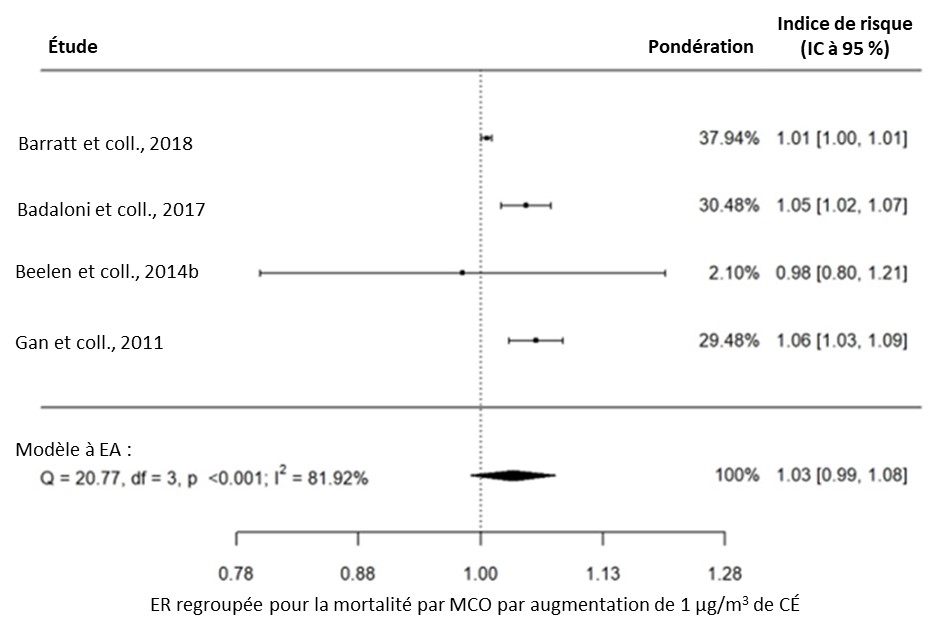
Figure 3.17 : Texte descriptif
La figure 3.17 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCO et l'exposition à long terme au CÉ dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,03 (IC à 95 % : 0,99 à 1,08) par augmentation de 1 μg/m3 de CÉ. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 20,77, df = 3, p < 0,001 et I2 = 81,92 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
37,94 % |
1,01 |
1,00 à 1,01 |
Badaloni et coll., 2017 |
30,48 % |
1,05 |
1,02 à 1,07 |
Beelen et coll., 2014b |
2,10 % |
0,98 |
0,80 à 1,21 |
Gan et coll., 2011 |
29,48 % |
1,06 |
1,03 à 1,09 |
Concernant la MCV, y compris l'AVC, les résultats étaient mitigés, les ER normalisées équivalentes au CÉ allant de 0,68 à 1,01. L'ER regroupée pour le lien entre le CÉ et la mortalité par MCV (y compris l'AVC) était nulle à 1,00 (IC à 95 % : 0,99 à 1,01) et il n'y avait aucune hétérogénéité (I2 = 0 %) (figure 3.18). L'analyse de l'exclusion a révélé que deux études (Barratt et coll., 2018 et Beelen et coll., 2014b) avaient le plus influencé l'analyse principale. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,3354; test de Begg p = 0,3333). De plus, l'analyse selon la méthode supprimer et remplacer a indiqué qu'une étude hypothétique serait nécessaire pour rendre le diagramme en entonnoir symétrique. À l'exclusion de l'étude qui ne tenait compte que de l'AVC (Dirgawati et coll., 2019), un lien nul a également été constaté (ER : 1,00 [IC à 95 % : 1,00 à 1,01]).

Figure 3.18 : Texte descriptif
La figure 3.18 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité par MCV (y compris l'AVC) et l'exposition à long terme au CÉ dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,00 (IC à 95 % : 0,99 à 1,01) par augmentation de 1 μg/m3 de CÉ. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 3,39, df = 3, p = 0,336 et I2 = 0 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Dirgawati et coll., 2019 |
0,03 % |
0,72 |
0,51 à 1,03 |
Alexeeff et coll., 2018 |
0,00 % |
0,68 |
0,08 à 5,83 |
Barratt et coll., 2018 |
99,87 % |
1,00 |
1,00 à 1,01 |
Beelen et coll., 2014b |
0,10 % |
1,01 |
0,84 à 1,22 |
En ce qui concerne la mortalité par MSC, cinq des études ont révélé un lien positif et quatre étaient statistiquement significatives; toutefois, l'analyse des cohortes ESCAPE n'a pas fait état d'un lien (Beelen et coll., 2014b).
PM2,5-10 et PM10
Les recherches documentaires ont permis de cerner sept études sur les PM10 et une étude sur les PM2,5-10 qui avait un lien avec la mortalité circulatoire. Étant donné que la documentation disponible concernant les PM2,5-10 est limitée, la présente évaluation se concentrera sur la documentation sur les PM10. Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.6. Chacune des études a été menée en Europe; cinq des études étaient fondées sur des cohortes de population générale et deux étaient des études cas-témoins basées sur la population. Aucune étude menée au Canada n'a été relevée lors des recherches documentaires. La taille des échantillons variait de 3 249 (Rosenlund et coll., 2006) à 1 249 108 (Badaloni et coll., 2017). Concernant l'évaluation de l'exposition, quatre des études ont utilisé la modélisation de la dispersion, trois ont utilisé la modélisation de la RUT, et les expositions ont été attribuées à l'adresse résidentielle, au code postal ou au niveau du quartier. Dans le cas des PM10, les expositions moyennes allaient de 2,2 (Rosenlund et coll., 2009) à 48,1 μg/m3 (Beelen et coll., 2014b). Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE). Le tabagisme a été pris en compte dans toutes les études, à l'exception de Naess et coll. (2007) et Rosenlund et coll. (2009).
Dans le cas des PM10, les études ont évalué la mortalité par MSC (n = 4) et les causes spécifiques de la mortalité circulatoire, y compris l'IM (n = 3), la MCO (n = 2) et la MCV (n = 1). Il n'y avait pas suffisamment d'études avec des données à regrouper pour effectuer une méta-analyse de l'un ou l'autre de ces résultats. Concernant la mortalité par MSC, sept ER ont été fournies dans les études, dont six étaient positives et quatre étaient statistiquement significatives. Concernant la mortalité par IM, les résultats ont été combinés avec deux études faisant état d'un lien (l'un significatif et l'autre non significatif) et deux autres, de liens nuls. De même, concernant la mortalité par MCO, une étude a fait état d'un lien au seuil de signification statistique et une autre, d'un lien nul. En ce qui concerne la mortalité par MCV, l'étude unique a fait état d'un lien non significatif.
3.3.3 Autres polluants de la PACA : CO et benzène
CO
Les recherches documentaires ont permis de trouver deux études cas-témoins basées sur la population menées à Stockholm, en Suède, et évaluant le lien entre la mortalité circulatoire et le CO; les détails de l'étude sont présentés à l'annexe A.8. L'exposition au CO a été évaluée par modélisation de la dispersion et attribuée en fonction de l'adresse résidentielle; le CO médian variait de 62,6 à 64,2 μg/m3. Les deux études ont fait état de liens positifs qui étaient au seuil de signification statistique ou statistiquement significatifs entre l'exposition au CO et la mortalité par IM. Elles ont tenu compte des principaux facteurs de confusion (âge, sexe et SSE), et une étude a été ajustée en fonction du tabagisme.
Benzène
Dans les recherches documentaires, une seule étude examinant le lien entre l'exposition à long terme au benzène comme marqueur de la PACA et la mortalité circulatoire. Cette étude canadienne de Villeneuve et coll. (2013) a été menée auprès de la population générale de l'Ontario et a tenu compte des principaux facteurs de confusion, y compris l'ajustement indirect pour le tabagisme. Elle a fait état d'un lien positif au seuil de signification statistique entre l'exposition au benzène et la mortalité par MSC (résumé à l'annexe A.7).
3.3.4 Circulation automobile et infrastructure du réseau routier
Proximité de la circulation
La proximité de la circulation ou la distance par rapport à la route était la mesure la plus couramment utilisée de la circulation automobile et de l'infrastructure du réseau routier examinant le lien entre la circulation et la mortalité circulatoire dans le cadre de 17 études, dont 15 ont été menées auprès de la population générale et deux auprès des populations de patients. Les détails de l'étude concernant la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER sont fournis à l'annexe A.9.
Concernant la population générale, la majorité des études ont été menées en Europe (n = 9), suivies du Canada (n = 3), des É.-U. (n = 2) et de l'Asie (n = 1), et la taille de la cohorte variait de 3 287 (Kulick et coll., 2018) à 2 644 370 (Cakmak et coll., 2019). Toutes les études menées aux É.-U., au Canada et en Asie étaient fondées sur des cohortes uniques, tandis que celles menées en Europe étaient fondées sur cinq cohortes : NLCS-AIR (Hoek et coll., 2002; Beelen et coll., 2008, 2009; Brunekreef et coll., 2009); SALIA (Gehring et coll., 2006, Heinrich et coll., 2013); cohorte nationale suisse (Huss et coll., 2010); étude de cohorte sur l'alimentation, le cancer et la santé (Raaschou-Nielsen et coll., 2012); étude longitudinale de Rome (Cesaroni et coll., 2013). Les études menées au sein de la population générale ont chacune examiné un ou plusieurs effets relatifs à la mortalité circulatoire, y compris la mortalité par MSC (n = 13, y compris trois études sur les maladies cardiopulmonaires), par MCO (n = 7), par MCV (n = 5) et AVC (n = 1), par IM aigu (n = 1), par mort subite d'origine cardiaque (n = 1), par ICA (n = 1) et par dysrythmie cardiaque (n = 1). La plupart des 15 études ont tenu compte des principaux facteurs de confusion (âge, sexe, SSE et tabagisme). Plus précisément, les 15 études tenaient compte de l'âge, du sexe et du SSE individuel ou du SSE régional, mais cinq études ne tenaient pas compte du tabagisme (Gan et coll., 2010; Huss et coll., 2010; Cesaroni et coll., 2013; Chen et coll., 2013; Cakmak et coll., 2019). De nombreuses études ont également pris en compte d'autres facteurs de confusion. La proximité de la circulation a été mesurée directement dans un SIG. Elle était fondée sur l'adresse résidentielle exacte (études européennes et américaines), le code postal résidentiel (études canadiennes) ou le centre géographique de chaque village pour les résidents ruraux ainsi que l'emplacement du centre de santé primaire pour les résidents urbains (étude iranienne). Aucune définition ou catégorie uniforme n'a été utilisée pour évaluer la proximité de la circulation dans l'ensemble des études.
Les liens entre la proximité de la circulation et le risque de mortalité par MSC au sein de la population générale sont résumés à la figure 3.19; seules des cohortes uniques et des données non transformées sont incluses dans le graphique en forêt. Deux études ont considéré la proximité de la circulation comme une variable continue. Dans une étude pancanadienne, Cakmak et coll. (2019) ont signalé un lien positif et statistiquement significatif. En comparaison, Kulick et coll. (2018) n'ont observé aucun lien fondé sur la proximité suite à une transformation logarithmique. Lorsque la proximité de la circulation a été évaluée comme variable catégorique, huit des 15 ER étaient positives, dont cinq étaient statistiquement significatives et trois étaient au seuil de signification statistique. Parmi les trois études qui ont examiné les relations exposition-réponse, Huss et coll. (2010) et Cesaroni et coll. (2013) ont cerné un risque accru avec une exposition accrue, tandis que Kulick et coll. (2018) ne l'ont pas observé.
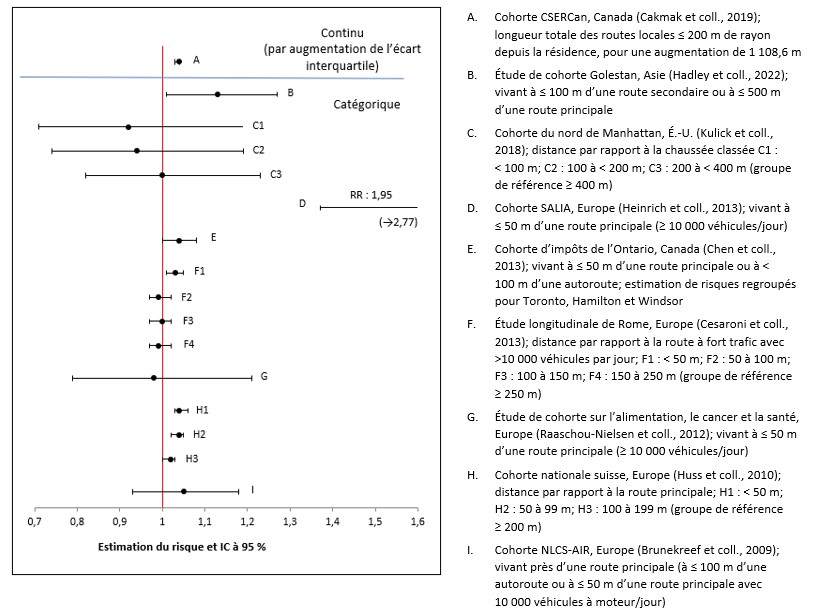
Figure 3.19 : Texte descriptif
La figure 3.19 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité par MSC dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,7 à 1,6. Les informations suivantes sont illustrées dans cette figure :
| Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|
Cakmak et coll., 2019 |
Cohorte CSERCan, Canada |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence, pour une augmentation de 1 108,6 m |
A |
1,04 |
1,03 à 1,04 |
Continu (par augmentation de l'écart interquartile) |
Hadley et coll., 2022 |
Étude de cohorte Golestan, Asie |
Vivant à ≤ 100 m d'une route secondaire ou à ≤ 500 m d'une route principale |
B |
1,13 |
1,01 à 1,27 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : < 100 m (groupe de référence ≥ 400 m) |
C1 |
0,92 |
0,71 à 1,19 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : 100 à < 200 m (groupe de référence ≥ 400 m) |
C2 |
0,94 |
0,74 à 1,19 |
Catégorique |
Kulick et coll., 2018 |
Cohorte du nord de Manhattan, É.-U. |
Distance par rapport à la chaussée classée : 200 à < 400 m (groupe de référence ≥ 400 m) |
C3 |
1,00 |
0,82 à 1,23 |
Catégorique |
Heinrich et coll., 2013 |
Cohorte SALIA, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
D |
1,95 |
1,37 à 2,77 |
Catégorique |
Chen et coll., 2013 |
Cohorte d'impôts de l'Ontario, Canada |
Vivant à ≤ 50 m d'une route principale ou à < 100 m d'une autoroute; estimation de risques regroupés pour Toronto, Hamilton et Windsor |
E |
1,04 |
1,00 à 1,08 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : < 50 m (groupe de référence ≥ 250 m) |
F1 |
1,03 |
1,01 à 1,05 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 50 à 100 m (groupe de référence ≥ 250 m) |
F2 |
0,99 |
0,97 à 1,02 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 100 à 150 m (groupe de référence ≥ 250 m) |
F3 |
1,00 |
0,97 à 1,02 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 150 à 250 m (groupe de référence ≥ 250 m) |
F4 |
0,99 |
0,97 à 1,02 |
Catégorique |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
G |
0,98 |
0,79 à 1,21 |
Catégorique |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : < 50 m (groupe de référence ≥ 200 m) |
H1 |
1,04 |
1,03 à 1,06 |
Catégorique |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : 50 à 99 m (groupe de référence ≥ 200 m) |
H2 |
1,04 |
1,02 à 1,05 |
Catégorique |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : 100 à 199 m (groupe de référence ≥ 200 m) |
H3 |
1,02 |
1,00 à 1,03 |
Catégorique |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Vivant près d'une route principale (à ≤ 100 m d'une autoroute ou à ≤ 50 m d'une route principale avec 10 000 véhicules à moteur/jour) |
I |
1,05 |
0,93 à 1,18 |
Catégorique |
La mortalité par MCO et par MCV (y compris les AVC) sont les seules causes spécifiques de mortalité circulatoire pour lesquelles des ER ont été trouvées en ce qui a trait à la proximité de la circulation dans trois cohortes uniques ou plus. Le risque de mortalité par MCO et par MCV au sein de la population générale est résumé à la figure 3.20; seules des cohortes uniques sont incluses dans le graphique en forêt. En ce qui concerne la mortalité par MCO, une seule étude canadienne a tenu compte de la proximité de la circulation comme une variable continue. Dans cette étude pancanadienne, Cakmak et coll. (2019) ont signalé un lien positif et statistiquement significatif. Lorsque la proximité de la circulation a été évaluée comme variable catégorielle, la plupart des ER (huit sur neuf) étaient positives, dont trois étaient statistiquement significatives et cinq étaient au seuil de signification statistique. Un risque accru associé à une exposition accrue a également été observé dans la seule étude qui a examiné les relations exposition-réponse (Cesaroni et coll., 2013). En ce qui concerne la mortalité par MCV, un lien positif statistiquement significatif et au seuil de signification statistique a été révélé dans la seule étude qui tenait compte de la proximité de la circulation comme variable continue (Cakmak et coll., 2019). Cependant, lorsque la proximité du trafic a été évaluée comme une variable catégorique, seules cinq des 10 ER étaient positives et au seuil de signification statistique. De plus, un risque accru avec une exposition accrue a été observé dans l'une des deux études qui examinaient les relations exposition-réponse (Huss et coll., 2010; Cesaroni et coll., 2013).

Figure 3.20 : Texte descriptif
La figure 3.20 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité par MCO et par MCV dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,6 à 1,5. Les informations suivantes sont illustrées dans cette figure :
| Effets sur la santé | Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|---|
Mortalité par MCO |
Cakmak et coll., 2019 |
Cohorte CSERCan, Canada |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence, pour une augmentation de 1 108,6 m |
A |
1,05 |
1,04 à 1,06 |
Continu (par augmentation de l'écart interquartile) |
Mortalité par MCO |
Hart et coll., 2014 |
NHS, É.-U. |
Vivant à < 500 m de la route la plus proche : A1 (routes principales, p. ex. autoroutes inter-États), A2 (routes primaires principales non inter-États et routes principales) ou A3 (routes secondaires plus petites, habituellement à plus de deux voies) |
B |
1,04 |
1,00 à 1,07 |
Catégorique |
Mortalité par MCO |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : < 50 m (groupe de référence ≥ 250 m) |
C1 |
1,05 |
1,01 à 1,09 |
Catégorique |
Mortalité par MCO |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 50 à 100 m (groupe de référence ≥ 250 m) |
C2 |
1,02 |
0,98 à 1,06 |
Catégorique |
Mortalité par MCO |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 100 à 150 m (groupe de référence ≥ 250 m) |
C3 |
0,99 |
0,95 à 1,04 |
Catégorique |
Mortalité par MCO |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 150 à 250 m (groupe de référence ≥ 250 m) |
C4 |
1,01 |
0,97 à 1,05 |
Catégorique |
Mortalité par MCO |
Chen et coll., 2013 |
Cohorte d'impôts de l'Ontario, Canada |
Vivant à ≤ 50 m d'une route principale ou à <100 m d'une autoroute; estimation de risques regroupés pour Toronto, Hamilton et Windsor |
D |
1,07 |
1,01 à 1,13 |
Catégorique |
Mortalité par MCO |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
E |
1,04 |
0,76 à 1,44 |
Catégorique |
Mortalité par MCO |
Gan et coll., 2010 |
Résidents de la région métropolitaine de Vancouver, Canada |
Vivant près d'une route principale (≤ 50 m de la route principale ou ≤ 150 m de l'autoroute) |
F |
1,29 |
1,18 à 1,41 |
Catégorique |
Mortalité par MCO |
Beelen et coll., 2009 |
NLCS-AIR, Europe |
Vivant à proximité d'une route principale (≤ 100 m de l'autoroute ou ≤ 50 m de la route locale avec une intensité de circulation de >10 000 véhicules à moteur/24 h) |
G |
1,15 |
0,99 à 1,34 |
Catégorique |
Mortalité par MCV |
Cakmak et coll., 2019 |
Cohorte CSERCan, Canada |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence, pour une augmentation de 1 108,6 m |
A |
1,01 |
0,99 à 1,02 |
Continu (par augmentation de l'écart interquartile) |
Mortalité par MCV |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : < 50 m (groupe de référence ≥ 250 m) |
C1 |
1,03 |
0,98 à 1,08 |
Catégorique |
Mortalité par MCV |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 50 à 100 m (groupe de référence ≥ 250 m) |
C2 |
1,01 |
0,95 à 1,06 |
Catégorique |
Mortalité par MCV |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 100 à 150 m (groupe de référence ≥ 250 m) |
C3 |
1,00 |
0,94 à 1,05 |
Catégorique |
Mortalité par MCV |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 150 à 250 m (groupe de référence ≥ 250 m) |
C4 |
1,00 |
0,96 à 1,05 |
Catégorique |
Mortalité par MCV |
Chen et coll., 2013 |
Cohorte d'impôts de l'Ontario, Canada |
Vivant à ≤ 50 m d'une route principale ou à < 100 m d'une autoroute; estimation de risques regroupés pour Toronto, Hamilton et Windsor |
D |
1,01 |
0,92 à 1,10 |
Catégorique |
Mortalité par MCV |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
E |
0,87 |
0,54 à 1,39 |
Catégorique |
Mortalité par MCV |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : < 50 m (groupe de référence ≥ 200 m) |
H1 |
1,01 |
0,98 à 1,05 |
Catégorique |
Mortalité par MCV |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : 50 à 99 m (groupe de référence ≥ 200 m) |
H2 |
0,99 |
0,95 à 1,03 |
Catégorique |
Mortalité par MCV |
Huss et coll., 2010 |
Cohorte nationale suisse, Europe |
Distance par rapport à la route principale : 100 à 199 m (groupe de référence ≥ 200 m) |
H3 |
1,02 |
0,98 à 1,06 |
Catégorique |
Mortalité par MCV |
Beelen et coll., 2009 |
NLCS-AIR, Europe |
Vivant à proximité d'une route principale (≤ 100 m de l'autoroute ou ≤ 50 m de la route locale avec une intensité de circulation de >10 000 véhicules à moteur/24 h |
G |
0,70 |
0,51 à 0,96 |
Catégorique |
Un nombre limité d'études ont également évalué d'autres causes de mortalité circulatoire (résumé à l'annexe A.9). On a observé un risque accru avec une exposition accrue pour la mortalité par IM et un lien positif statistiquement significatif a été signalé pour la mortalité par mort subite d'origine cardiaque. En revanche, aucun lien n'a été trouvé pour l'ICA ou la dysrythmie cardiaque.
Deux études canadiennes ont examiné le lien entre l'exposition à la proximité de la circulation et la mortalité circulatoire chez les populations de patients (résumé à l'annexe A.9). La taille de ces études variait de 2 360 (patients d'une clinique de maladies respiratoires à Toronto, en Ontario [Jerrett et coll., 2009]) à 5 228 (patients ayant subi des tests de la fonction pulmonaire dans une clinique de Hamilton, en Ontario [Finkelstein et coll., 2005]). Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE), tandis que le tabagisme n'a été pris en compte que dans Jerrett et coll. (2009). Un lien positif, au seuil de signification statistique ou statistiquement significatif, a été observé entre la proximité de la circulation et la mortalité par MSC dans chaque étude et entre la proximité de la circulation et la mortalité par MCV dans une étude.
Densité de la circulation automobile
Sept études ont été trouvées lors des recherches documentaires évaluant le risque de mortalité circulatoire et les mesures de la densité du trafic. Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.10. Les études ont été menées en Europe (n = 6) et en Asie (n = 1). Chaque étude était fondée sur des cohortes de la population générale dont la taille variait de 12 098 (Pan et coll., 2021) à 1 265 058 (Cesaroni et coll., 2013). Les études de Beelen et coll. (2008, 2009) et Brunekreef et coll. (2009) ont été menées auprès de la cohorte NLCS-AIR et ont obtenu des résultats identiques. Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE) et du tabagisme, à l'exception de Cesaroni et coll. (2013). Chacune des études a évalué la mortalité par MSC; les causes spécifiques de mortalité circulatoire ont été évaluées dans quatre des études (Beelen et coll., 2009, 2014; Raaschou-Nielsen et coll., 2012; Cesaroni et coll., 2013). Les études ont principalement fait état de liens positifs et au seuil de signification statistique pour la mortalité par MSC ou par MCO ainsi que de mesures de la densité de la circulation près de la résidence (résumé à la figure 3.21). Cesaroni et coll. (2013) ont souligné une tendance importante à l'augmentation du risque de MSC et de MCO pour les quintiles d'exposition. Beelen et coll. (2009) ont fait état d'un lien significatif avec la mortalité par MCO. Pour ce qui est des MCV, des résultats mitigés ont été soulignés entre les trois études et, pour d'autres causes spécifiques (p. ex., IM, ICA, dysrythmie), l'analyse unique a fait état de liens positifs.

Figure 3.21 : Texte descriptif
La figure 3.21 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la densité de la circulation et de mortalité par MSC et par MCO dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,85 à 1,25. Les informations suivantes sont illustrées dans cette figure :
| Effets sur la santé | Indicateur de trafic | Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|---|---|
Mortalité par MSC |
Circulation sur la route la plus proche |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Circulation sur la route la plus proche (pour 10 000 véhicules/jour) |
A1 |
1,05 |
0,99 à 1,12 |
Continu |
Mortalité par MSC |
Circulation sur la route la plus proche |
Beelen et coll., 2014b |
ESCAPE, Europe |
Circulation sur la route la plus proche (pour 5 000 véhicules/jour) |
B1 |
1,02 |
0,99 à 1,05 |
Continu |
Mortalité par MSC |
Circulation sur la route la plus proche |
Pan et coll., 2021 |
REVEAL-HBV, Asie |
log véhicule/jour |
C |
1,13 |
0,96 à 1,33 |
Continu |
Mortalité par MSC |
Somme de la circulation dans une zone tampon de 100 ou 200 m |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 335 000 véhicules/jour) |
A2 |
1,00 |
0,92 à 1,08 |
Continu |
Mortalité par MSC |
Somme de la circulation dans une zone tampon de 100 ou 200 m |
Beelen et coll., 2014b |
ESCAPE, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 4 x 106 véhicule-m/jour) |
B2 |
0,99 |
0,89 à 1,11 |
Continu |
Mortalité par MSC |
Somme de la circulation dans une zone tampon de 100 ou 200 m |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Doublement du trafic dans une zone tampon de 200 m |
D1 |
1,02 |
0,98 à 1,06 |
Continu |
Mortalité par MSC |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (0,25 à 1,63) x 106 (référence: < 0,25 x 106) |
E1 |
1,02 |
0,99 à 1,04 |
Catégorique |
Mortalité par MSC |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (1,63 à 3,23) x 106 (référence: < 0,25 x 106) |
E2 |
1,03 |
1,00 à 1,05 |
Catégorique |
Mortalité par MSC |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (3,23 à 6,66) x 106 (référence: < 0,25 x 106) |
E3 |
1,03 |
1,00 à 1,06 |
Catégorique |
Mortalité par MSC |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : ≥6,66 x 106 (référence: < 0,25 x 106) |
E4 |
1,05 |
1,02 à 1,07 |
Catégorique |
Mortalité par MCO |
Circulation sur la route la plus proche |
Beelen et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Circulation sur la route la plus proche (10 000 véhicules/jour) |
F |
1,11 |
1,03 à 1,20 |
Continu |
Mortalité par MCO |
Circulation sur la route la plus proche |
Beelen et coll., 2014b |
ESCAPE, Europe |
Circulation sur la route la plus proche (pour 5 000 véhicules/jour) |
B3 |
1,02 |
0,99 à 1,06 |
Continu |
Mortalité par MCO |
Somme de la circulation dans une zone tampon de 100 ou 200 m |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé, Europe |
Doublement du trafic dans une zone tampon de 200 m |
D2 |
1,01 |
0,95 à 1,07 |
Continu |
Mortalité par MCO |
Somme de la circulation dans une zone tampon de 100 ou 200 m |
Beelen et coll., 2014b |
ESCAPE, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 4 x 106 véhicule-m/jour) |
B4 |
1,02 |
0,88 à 1,18 |
Continu |
Mortalité par MCO |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (0,25 à 1,63) x 106 (référence: < 0,25 x 106) |
E5 |
1,00 |
0,95 à 1,04 |
Catégorique |
Mortalité par MCO |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (1,63 à 3,23) x 106 (référence: < 0,25 x 106) |
E6 |
1,01 |
0,97 à 1,04 |
Catégorique |
Mortalité par MCO |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (3,23 à 6,66) x 106 (référence: < 0,25 x 106) |
E7 |
1,04 |
1,00 à 1,09 |
Catégorique |
Mortalité par MCO |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : ≥6,66 x 106 (référence: < 0,25 x 106) |
E8 |
1,04 |
1,00 à 1,09 |
Catégorique |
3.3.5 Résumé
Le lien entre la PACA et la mortalité circulatoire a été évalué dans 39 cohortes et deux études cas-témoins; toutes les études sauf deux étaient fondées sur la population générale et la majorité ont été menées en Europe. Ces études ont évalué la mortalité par MSC en tant que groupe, ainsi que la mortalité par causes plus précises, y compris la MCO et les MCV (y compris les AVC). Plus de 60 % des études ont évalué l'exposition à la PACA en modélisant des polluants individuels liés à la circulation automobile, tandis que les autres ont utilisé des mesures de la circulation automobile et de l'infrastructure du réseau routier pour évaluer la contribution des émissions de la circulation à la pollution atmosphérique ambiante. Presque toutes les études ont tenu compte des principaux facteurs de confusion (âge, sexe, SSE et tabagisme) et bon nombre d'entre elles ont envisagé d'autres facteurs de confusion. Des analyses regroupées ont été effectuées sur les études auprès de la population générale.
En ce qui concerne la mortalité par MSC, les analyses regroupées des deux polluants évalués (NO2 et PM2,5) ont fait état d'un lien positif avec des estimations regroupées de 1,05 et 1,06, respectivement; les deux liens étaient au seuil de signification statistique. L'hétérogénéité était considérable pour le NO2 et modérée pour les PM2,5. Les résultats de la méta-analyse ont été appuyés par l'analyse qualitative 1) des autres polluants (c.-à-d. NOx, CN, PM2,5 abs, PM10 et benzène) et 2) des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui ont démontré certaines preuves d'une relation exposition-réponse.
En ce qui concerne la mortalité par MCO, les analyses regroupées ont fait état d'un lien positif pour chacun des polluants évalués (c.-à-d. NO2, NOx, PM2,5 et CÉ); ces liens avec des ER regroupées allant de 1,02 à 1,10 étaient statistiquement significatifs ou au seuil de signification statistique. L'hétérogénéité n'était probablement pas importante pour le NO2 et les PM2,5, mais importante pour le NOx et le CÉ. Les résultats de la méta-analyse ont été appuyés par l'analyse qualitative des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, avec démonstration d'une relation exposition-réponse. En revanche, les preuves relatives au NO et aux PM10 étaient mitigées, et le nombre limité d'études n'appuyait pas la réalisation d'une analyse regroupée.
En ce qui concerne la mortalité par MCV, les analyses regroupées des polluants évalués ont donné des résultats mitigés. Un lien positif au seuil de signification statistique a été déterminé pour le NO2 et les PM2,5 avec des ER de 1,01 et 1,08, respectivement, mais un lien nul a été déterminé pour le NOx et le CÉ. L'hétérogénéité n'avait probablement pas d'importance pour chacun des quatre polluants. Des résultats mitigés ont également été observés pour l'analyse qualitative des mesures de la circulation automobile et de l'infrastructure du réseau routier. Les données probantes du NO et des PM10 étaient limitées et n'appuyaient pas la réalisation d'une analyse regroupée.
Il y avait également des preuves de liens positifs pour d'autres causes de mortalité circulatoire et divers polluants atmosphériques liés à la circulation, mais ces preuves étaient limitées et n'appuyaient pas la réalisation d'une analyse regroupée.
3.4 Mortalité respiratoire
Sur la base du chevauchement des codes de la Classification internationale des maladies, les études individuelles font référence à la mortalité respiratoire comme la mortalité par maladies respiratoires, par maladies pulmonaires, par maladies respiratoires non malignes et par maladies respiratoires, à l'exclusion du cancer du poumon. Alors que certaines études incluaient la mortalité due à tous les troubles respiratoires, d'autres n'incluaient pas les maladies pulmonaires dues à des agents externes. Aux fins de cette évaluation des risques et conformément au HEI (2022), ces effets pour la santé ont été considérés comme similaires et sont appelés mortalité respiratoire (ou mortalité par trouble respiratoire dans l'annexe). La mortalité respiratoire a été évaluée dans 20 des 64 articles évaluant le lien entre l'exposition à long terme à la PACA et la mortalité. Une évaluation des études examinant les effets de l'exposition à long terme à la PACA et la mortalité respiratoire est présentée ci-dessous par mesure ou polluant de la PACA. Ces études ont évalué la mortalité due à des troubles respiratoires en tant que groupe, ainsi que due à des causes plus précises (p. ex. maladie pulmonaire obstructive chronique [MPOC], pneumonie et grippe/pneumonie).
3.4.1 Oxydes d'azote (NO, NO2 et NOx)
NO2
Les recherches documentaires ont permis de cerner 12 études évaluant le lien entre les causes respiratoires de mortalité et le NO2. Les détails de l'étude relatifs à cet effet sur la santé, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.1. Les études ont été menées au Canada (n = 4), en Europe (n = 4) et en Asie (n = 4). Toutes les études canadiennes, sauf une (Jerrett et coll., 2009), concernaient la population générale dont la taille variait de 12 029 (Yorifuji et coll., 2010) à 1 265 058 (Cesaroni et coll., 2013). Pour l'évaluation de l'exposition des études menées auprès de la population générale, la modélisation de la RUT (n = 9) était la méthode la plus couramment utilisée, suivie de la modélisation de la dispersion (n = 2). Les expositions ont été attribuées en fonction de l'adresse résidentielle, du code postal et du quartier, les expositions moyennes allant de 5,2 à 107 μg/m3. Les expositions les plus faibles ont été attribuées à l'une des cohortes suédoises incluses dans l'étude ESCAPE (Dimakopoulou et coll., 2014), tandis que les expositions les plus élevées ont été notées dans une étude menée à Hong Kong, en Chine (Barratt et coll., 2018). Les études menées auprès de la population générale ont chacune examiné un ou plusieurs effets relatifs à la mortalité respiratoire. La plupart des études concernaient l'évaluation de la mortalité respiratoire (n = 9), avec moins d'études tenant compte des causes spécifiques de mortalité, y compris les MPOC (n = 6), la grippe et la pneumonie (n = 2) et la pneumonie seule (n = 2). Les 11 études tenaient compte de l'âge et du sexe, ainsi que du SSE individuel ou du SSE au niveau régional; trois études n'ont pas fait d'ajustement pour le tabagisme (Naess et coll., 2007; Cesaroni et coll., 2013; Gan et coll., 2013). De nombreuses études ont également pris en compte d'autres facteurs de confusion.
L'ER la mieux ajustée, désignée à partir de chaque étude pour chaque effet pertinent, est précisée à l'annexe A.1.
Au sein de la population générale, six des neuf ER liées à la mortalité respiratoire étaient positives, dont quatre étaient statistiquement significatives et deux étaient au seuil de signification statistique. La figure 3.22 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité respiratoire et l'exposition au NO2. Sept études ont été incluses dans la méta-analyse de la population générale avec des ER allant de 0,97 à 1,19. L'ER regroupée pour le lien entre NO2 et mortalité respiratoire était au seuil de signification statistique à 1,04 (IC à 95 % : 0,99 à 1,09) et l'hétérogénéité était substantielle (I2 = 74,36 %).

Figure 3.22 : Texte descriptif
La figure 3.22 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité respiratoire et l'exposition à long terme au NO2 dans la population générale. L'ER regroupée de cette méta-analyse de sept études individuelles est de 1,43 (IC à 95 % : 0,99 à 1,09) par augmentation de 10 μg/m3 de NO2. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 22,8, df = 6, p < 0,001 et I2 = 74,36 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
19,73 % |
1,00 |
0,97 à 1,02 |
Crouse et coll., 2015 |
16,05 % |
1,09 |
1,04 à 1,13 |
Dimakopoulou et coll., 2014 |
9,61 % |
0,97 |
0,89 à 1,05 |
Carey et coll., 2013 |
17,12 % |
1,07 |
1,02 à 1,11 |
Cesaroni et coll., 2013 |
19,04 % |
1,03 |
1,00 à 1,06 |
Villeneuve et coll., 2013 |
12,33 % |
1,04 |
0,97 à 1,10 |
Yorifuji et coll., 2013 |
6,12 % |
1,19 |
1,06 à 1,34 |
Les analyses des sous-groupes et de sensibilité effectuées n'ont pas montré de différence par rapport à l'analyse principale. Plus précisément, l'ER regroupée et l'hétérogénéité étaient robustes lorsqu'on limitait l'analyse aux études qui utilisaient la modélisation de la RUT pour évaluer l'exposition (n = 6) ou à celles dont le RB était faible et probablement faible pour le domaine de confusion (n = 5). L'analyse de l'exclusion a indiqué que les résultats étaient robustes, l'ER regroupée allant de 1,03 à 1,05. L'hétérogénéité est restée substantielle. Il n'y avait aucune indication de biais de publication, car l'analyse selon la méthode supprimer et remplacer n'a pas cerné d'études manquantes et les tests n'ont pas fait état de biais (test d'Egger p = 0,3593; test de Begg p = 0,3813).
Concernant la mortalité par les MPOC au sein de la population générale, huit des neuf ER étaient positives, dont une était statistiquement significative et six étaient au seuil de signification statistique. Quatre des ER ont été tirées de la même étude (Naess et coll., 2007) et correspondent à des groupes d'âge et à des sexes différents. Pour cette paire exposition-effet, aucune méta-analyse n'a été effectuée, car il y avait un nombre insuffisant d'études qui correspondaient à des cohortes uniques et qui disposaient des données nécessaires pour effectuer une analyse quantitative.
Un nombre limité d'études ont été relevées dans les recherches documentaires portant sur l'exposition au NO2 et la mortalité attribuable à la grippe et à la pneumonie (combinées) ainsi qu'à la pneumonie seulement au sein de la population générale. Deux études ont été déterminées pour chaque effet et les deux études ont été menées dans la même cohorte pour chacun des effets. Bien qu'aucun lien n'ait été cerné concernant la mortalité attribuable à la pneumonie seule, un lien positif et au seuil de signification statistique a été signalé concernant la mortalité attribuable à la grippe et à la pneumonie (combinées).
La seule étude à examiner le lien entre l'exposition à long terme au NO2 et la mortalité respiratoire dans une population de patients a été menée chez des patients adultes d'une clinique de maladies respiratoires à Toronto, en Ontario (Jerrett et coll., 2009). Cette étude canadienne a tenu compte des principaux facteurs de confusion, y compris du tabagisme, et a fait état d'un lien positif, mais pas statistiquement significatif entre le NO2 et la mortalité respiratoire (résumé à l'annexe A.1).
NOx
Les recherches documentaires ont permis de cerner quatre études, toutes menées en Europe et conduites auprès de la population générale, évaluant le lien entre la mortalité respiratoire et le NOx. Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.2. La taille des cohortes variait de 7 494 (Stockfelt et coll., 2015) à 307 553 (Dimakopoulou et coll., 2014). La majorité des études ont utilisé la modélisation de la dispersion (n = 3), tandis qu'une étude a utilisé un modèle de la RUT pour évaluer l'exposition au NOx. Toutes les études ont attribué l'exposition au NOx à l'adresse résidentielle; les expositions moyennes (ou médianes) variaient de 5,80 à 96,1 μg/m3. Les expositions les plus faibles ont été estimées dans une étude menée à Civitavecchia, en Italie (Bauleo et coll., 2019), tandis que les expositions les plus élevées ont été modélisées dans une cohorte italienne incluse dans l'étude ESCAPE (Dimakopoulou et coll., 2014). Les quatre études ont examiné la mortalité respiratoire, et une étude a également évalué la mortalité par MPOC. Les études ont tenu compte des principaux facteurs de confusion de l'âge, du sexe et du SSE (au niveau individuel ou régional) et toutes les études sauf une (Bauleo et coll., 2019) ont également été ajustées en fonction du tabagisme. Elles ont également généralement envisagé d'autres facteurs de confusion.
L'ER la mieux ajustée, désignée à partir de chaque étude pour chaque effet pertinent, est résumée à l'annexe A.2. Concernant la mortalité respiratoire, deux des quatre ER étaient positives, dont une était au seuil de signification statistique. La figure 3.23 présente le graphique en forêt et les résultats de la méta-analyse à effets aléatoires pour la mortalité respiratoire et l'exposition au NOx au sein de la population générale. Quatre études ont été incluses dans la méta-analyse de la population générale avec des ER allant de 0,99 à 1,16. L'ER regroupée était au seuil de signification statistique à 1,05 (IC à 95 % : 0,93 à 1,20) et l'hétérogénéité était substantielle (I2 = 66,29 %).
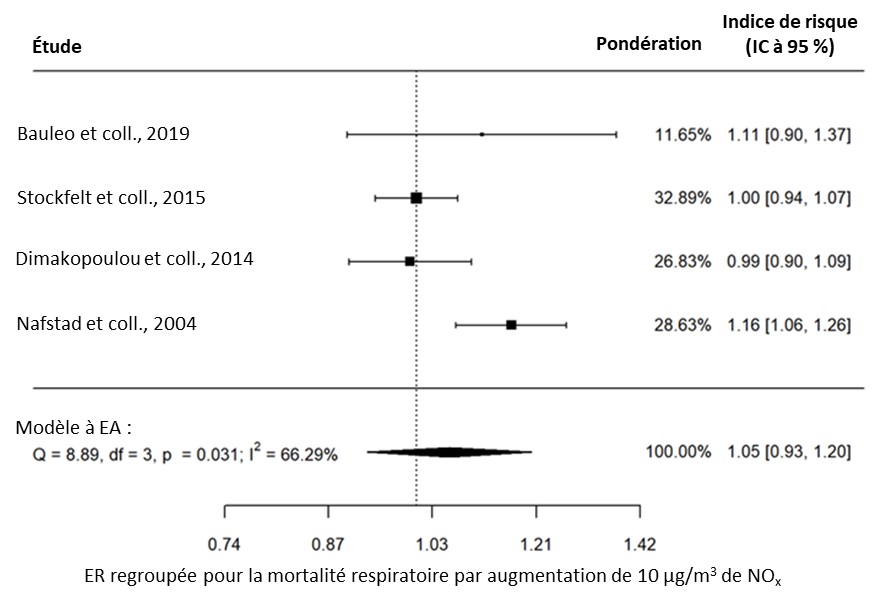
Figure 3.23 : Texte descriptif
La figure 3.23 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité respiratoire et l'exposition à long terme au NOx dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,05 (IC à 95 % : 0,93 à 1,20) par augmentation de 10 μg/m3 de NOx. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 8,89, df = 3, p = 0,031 et I2 = 66,29 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Bauleo et coll., 2019 |
11,65 % |
1,11 |
0,90 à 1,37 |
Stockfelt et coll., 2015 |
32,89 % |
1,00 |
0,94 à 1,07 |
Dimakopoulou et coll., 2014 |
26,83 % |
0,99 |
0,90 à 1,09 |
Nafstad et coll., 2004 |
28,63 % |
1,16 |
1,06 à 1,26 |
Lorsque l'analyse s'est limitée aux études utilisant la modélisation de la dispersion pour évaluer l'exposition, à savoir toutes les études sauf une de l'analyse principale, l'ER regroupée est demeurée positive, mais n'était pas statistiquement significative (ER : 1,08; IC à 95 % : 0,88 à 1,33). De la même façon, l'ER regroupée de l'analyse principale était robuste aux analyses de sensibilité fondées sur le RB (c.-à-d. à l'exclusion des études avec un RB élevé ou probablement élevé dans les domaines d'évaluation de l'exposition ou de confusion). L'hétérogénéité est demeurée substantielle pour toutes les analyses des sous-groupes et de sensibilité. L'analyse de l'exclusion a indiqué que Nafstad et coll. (2004) était la principale source d'hétérogénéité, car l'omission de cette étude a éliminé l'hétérogénéité de l'analyse principale. C'était aussi la seule étude qui, lorsqu'elle a été omise, a abouti à un lien nul. Un lien positif, mais non significatif, a été observé lorsque chacune des trois autres études a été omise. Il n'y avait aucune indication de biais de publication, car l'analyse selon la méthode supprimer et remplacer n'a pas cerné d'études manquantes, et les tests n'ont pas fait état de biais (test d'Egger p = 0,6812; test de Begg p = 0,7500).
Une seule ER a été cernée pour l'exposition au NOx et la mortalité attribuable aux MPOC. Cette ER était positive et au seuil de signification statistique.
NO
Deux études évaluant le lien entre la mortalité respiratoire et l'exposition au NO ont été déterminées dans les recherches documentaires; les deux étaient fondées sur la population générale. Les détails des études sont présentés à l'annexe A.3. Une étude a été menée sur une cohorte de 465 360 participants à Vancouver (Colombie-Britannique) (Gan et coll., 2013) et l'autre sur une cohorte de 60 548 participants résidant à Hong Kong, en Chine (Barratt et coll., 2018). Les deux études ont estimé l'exposition à l'aide de modèles de la RUT avec un NO moyen allant de 32,1 (Gan et coll., 2013) à 489 μg/m3 (Barratt et coll., 2018). Les deux études comprenaient des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, mais Barratt et coll. (2008) ont également fait des ajustements pour tenir compte du tabagisme ainsi que d'autres facteurs de confusion. Un lien positif au seuil de signification statistique a été signalé pour la mortalité par MPOC et l'exposition au NO dans chacune des études; cependant, aucun lien n'a été observé pour la mortalité respiratoire ou la mortalité par pneumonie et due au NO.
3.4.2 PM
PM2,5
Les recherches documentaires ont permis de cerner sept études évaluant le lien entre l'exposition à long terme aux PM2,5 et la mortalité respiratoire. Les détails de l'étude, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.4. Chacune des études a tenu compte des cohortes de la population générale et a été menée au Canada (n = 1), en Europe (n = 4) et en Asie (n = 2). La taille des cohortes variait de 60 458 (Barratt et coll., 2018) à 1 265 058 (Cesaroni et coll., 2013). Les évaluations de l'exposition ont été dérivées de la modélisation de la RUT (n = 4) ou de la modélisation de la dispersion (n = 3), les expositions ayant été attribuées à l'adresse résidentielle, au code postal ou au quartier. Les expositions moyennes ou médianes les plus faibles ont été estimées pour une étude menée à Vancouver (Colombie-Britannique) (4,10 μg/m3; Gan et coll., 2013) et l'exposition la plus élevée a été estimée pour une étude menée à Hong Kong, Chine (42,4 μg/m3; Barratt et coll., 2018). Chacune des études comprenait des ajustements pour tenir compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, et incluait généralement des facteurs de confusion supplémentaires. En ce qui concerne le tabagisme, trois études n'incluaient pas d'ajustement, direct ou indirect, pour le tabagisme individuel (Naess et coll., 2007; Gan et coll., 2011; Cesaroni et coll., 2013,).
Cinq des études évaluaient la mortalité respiratoire, quatre évaluaient la mortalité par MPOC et deux évaluaient la mortalité par pneumonie. L'annexe A.4 résume l'ER la mieux ajustée déterminée à partir de chaque étude, pour chaque effet pertinent. En ce qui concerne la mortalité respiratoire, quatre des études ont signalé un lien positif, dont un était statistiquement significatif et trois étaient au seuil de signification statistique, et une étude n'a rapporté aucun lien. La figure 3.24 présente le graphique en forêt et la méta-analyse à effets aléatoires de la mortalité respiratoire et des PM2,5. Quatre études ont été incluses dans la méta-analyse avec des ER normalisés allant de 0,79 à 1,43. L'ER regroupée pour le lien entre PM2,5 et mortalité respiratoire était statistiquement non significatif à 1,09 (IC à 95 % : 0,80 à 1,49) et l'hétérogénéité était substantielle (I2 = 88,34 %). L'analyse de l'exclusion a révélé que l'analyse principale était robuste (l'ER regroupée variait entre 1,03 et 1,13) et qu'aucune étude n'avait faussé l'ensemble des résultats. Aucun des tests relatifs au biais de publication n'a indiqué la présence d'un biais (test d'Egger p = 0,7017; test de Begg p = 1,000). De plus, l'analyse selon la méthode supprimer et remplacer a indiqué qu'une étude hypothétique serait nécessaire pour rendre le diagramme en entonnoir symétrique.

Figure 3.24 : Texte descriptif
La figure 3.24 illustre un graphique en forêt et les résultats de la méta-analyse à effets aléatoires de la mortalité respiratoire et l'exposition à long terme aux PM2,5 dans la population générale. L'ER regroupée de cette méta-analyse de quatre études individuelles est de 1,09 (IC à 95 % : 0,80 à 1,49) par augmentation de 10 μg/m3 de PM2,5. Les résultats suivants ont également été rapportés pour le modèle statistique : Q = 11,02, df = 3, p = 0,012 et I2 = 88,34 %.
Les informations suivantes sur les études individuelles incluses dans l'analyse groupée sont illustrées dans cette figure :
| Référence | Pondération | Indice de risque | IC à 95 % |
|---|---|---|---|
Barratt et coll., 2018 |
32,85 % |
1,04 |
0,96 à 1,12 |
Dimakopoulou et coll., 2014 |
8,47 % |
0,79 |
0,47 à 1,34 |
Carey et coll., 2013 |
24,52 % |
1,43 |
1,17 à 1,74 |
Cesaroni et coll., 2013 |
34,15 % |
1,03 |
0,97 à 1,08 |
Concernant la mortalité par MPOC, chacun des sept liens étaient positifs; un était statistiquement significatif et six étaient au seuil de signification statistique. Seules deux études ont évalué la mortalité par pneumonie et fait état de liens nuls. Il n'y avait pas suffisamment d'études avec des données à regrouper pour effectuer une méta-analyse de l'un ou l'autre de ces effets.
CÉ, PM2,5 abs et CN
Quatre études évaluant l'exposition aux PM2,5 abs ou au CN et la mortalité respiratoire ont été trouvées. Les détails de l'étude sont fournis à l'annexe A.5. Les études ont été menées au Canada (n = 1), en Europe (n = 1) et en Asie (n = 2). Chacune des études a pris en compte les cohortes de la population générale, et la taille des études variait de 60 548 (Barratt et coll., 2018) à 465 360 (Gan et coll., 2013). Chaque étude a utilisé la modélisation de la RUT pour évaluer les expositions, qui ont été attribuées au niveau de l'adresse résidentielle ou du code postal. Les expositions, fondées sur les équivalents CÉ, étaient de 1,1 μg/m3 pour les études menées au Canada et en Europe et de 12 μg/m3 pour les études menées en Asie. Des ajustements pour tenir compte des principaux facteurs de confusion (âge, sexe et SSE) ont été pris dans chacune des études; un ajustement direct ou indirect en fonction du tabagisme a été fait dans chaque étude, à l'exception de Gan et coll. (2013).
Les études ont examiné la mortalité associée aux troubles respiratoires (n = 3), à la MPOC (n = 4) et à la pneumonie (n = 2). Les deux études menées en Asie (Barratt et coll., 2018; Yang et coll., 2018) étaient fondées sur la même cohorte et ont obtenu des résultats identiques pour chaque mortalité par cause. Pour ce qui est de la mortalité par maladie respiratoire et par pneumonie, un lien négatif a été observé dans chacune des études. Dans le cas de la MPOC, un lien positif et au seuil de signification statistique a été rapporté pour l'étude canadienne (Gan et coll., 2013), tandis qu'un lien négatif a été rapporté dans les deux études asiatiques (Barratt et coll., 2018; Yang et coll., 2018). Trop peu de données ont pu être regroupées parmi les études pour effectuer une méta-analyse de l'un ou l'autre de ces résultats.
PM2,5-10 et PM10
Les recherches documentaires ont permis de cerner trois études sur les PM10 et une étude sur les PM2,5-10 qui démontraient un lien avec la morbidité respiratoire. Les détails de l'étude sont fournis à l'annexe A.6. Chacune des études a été menée en Europe, auprès de cohortes de la population générale dont la taille variait de 143 842 (Naess et coll., 2007) à 830 842 (Carey et coll., 2013). Concernant l'évaluation de l'exposition, deux études ont utilisé la modélisation de la dispersion (Naess et coll., 2007; Carey et coll., 2013) et une étude a utilisé la modélisation de la RUT (Dimakopoulou et coll., 2014); les expositions ont été attribuées au niveau de l'adresse résidentielle, du code postal ou du quartier. Dans le cas des PM10, les expositions moyennes variaient de 3,0 (Carey et coll., 2013) à 10 μg/m3 (Dimakopoulou et coll., 2014). Des ajustements ont été apportés dans chacune des études pour tenir compte des principaux facteurs de confusion (âge, sexe et SSE); un ajustement direct ou indirect en fonction du tabagisme a été apporté dans chaque étude, à l'exception de celle de Naess et coll. (2007).
Deux études évaluant la mortalité respiratoire et les PM10 ont produit des résultats contradictoires, car l'une a signalé un lien significatif et positif (Carey et coll., 2013) et l'autre, un lien positif et au seuil de signification statistique (Dimakopoulou et coll., 2014). De plus, on n'a observé aucun lien entre la mortalité respiratoire et les PM2,5-10. Pour ce qui est des MPOC, une étude a fait état de liens positifs (significatifs ou au seuil de signification statistique) avec les PM10 (Naess et coll., 2007). Trop peu de données ont pu être regroupées parmi les études pour effectuer une méta-analyse de l'un ou l'autre de ces résultats.
3.4.3 Autres polluants de la PACA : benzène
Les recherches documentaires ont permis de cerner une seule étude qui examinait le lien entre l'exposition à long terme au benzène, comme marqueur de la PACA, et la mortalité respiratoire. Menée auprès de la population générale de l'Ontario, cette étude canadienne de Villeneuve et coll. (2013) a tenu compte des principaux facteurs de confusion, y compris l'ajustement indirect pour le tabagisme, et a fait état d'un lien positif au seuil de signification statistique (résumé à l'annexe A.7).
3.4.4 Circulation automobile et infrastructure du réseau routier
Proximité de la circulation
Les recherches documentaires ont permis de cerner six études qui examinaient le lien entre la proximité de la circulation ou la distance par rapport à la route et la mortalité respiratoire. Cinq de ces études ont été menées auprès de la population générale et une, auprès d'une population de patients. Les détails des études sont fournis à l'annexe A.9.
Pour la population générale, quatre études ont été menées en Europe et une étude a été menée au Canada. La taille de ces études de cohorte variait de 4 752 (Heinrich et coll., 2013) à 2 644 370 sujets (Cakmak et coll., 2019). Elles étaient fondées sur des populations d'étude unique, à l'exception de deux études menées en Europe qui étaient toutes deux fondées sur la cohorte NLCS-AIR (Beelen et coll., 2008; Brunekreef et coll., 2009). Les cinq études ont évalué la mortalité par maladie respiratoire en tant que groupe; une étude a également examiné la mortalité par MPOC. Toutes les études ont tenu compte des principaux facteurs de confusion de l'âge, du sexe et du SSE (niveau individuel ou régional), et trois de ces études ont également été ajustées pour le tabagisme. Certaines études ont examiné d'autres facteurs de confusion. La proximité de la circulation a été mesurée directement dans un SIG, en fonction de l'adresse résidentielle exacte (études européennes) ou du code postal résidentiel (étude canadienne). Aucune définition ou catégorie uniforme n'a été utilisée pour évaluer la proximité de la circulation dans l'ensemble des études.
Les liens entre la proximité de la circulation et le risque de mortalité respiratoire au sein de la population générale sont résumés à la figure 3.25; seules des cohortes uniques et des données non transformées sont incluses dans le graphique en forêt. La proximité de la circulation a été considérée comme une variable continue dans une seule étude. Dans cette étude pancanadienne, Cakmak et coll. (2019) ont signalé un lien positif et statistiquement significatif. Lorsque la proximité de la circulation a été évaluée comme variable catégorique, quatre des six ER étaient positives; deux présentaient un vaste IC à 95 %, une était statistiquement significative et les études restantes étaient au seuil de signification statistique. Les deux ER qui n'ont montré aucun lien correspondaient à des distances plus éloignées des routes à forte circulation (c.-à-d. 100 à 150 m et 150 à 250 m) et faisaient partie d'une étude examinant les relations exposition-réponse (Cesaroni et coll., 2013). Cakmak et coll. (2019) ont également signalé une ER indiquant un lien positif et au seuil de signification statistique pour la mortalité par MPOC.

Figure 3.25 : Texte descriptif
La figure 3.25 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la proximité de la circulation et de mortalité respiratoire dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,9 à 1,7. Les informations suivantes sont illustrées dans cette figure :
| Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|
Cakmak et coll., 2019 |
Cohorte CSERCan, Canada |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence, pour une augmentation de 1 108,6 m |
A |
1,03 |
1,01 à 1,04 |
Continu (par augmentation de l'écart interquartile) |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : < 50 m (groupe de référence ≥ 250 m) |
B1 |
1,01 |
0,95 à 1,08 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 50 à 100 m (groupe de référence ≥ 250 m) |
B2 |
1,02 |
0,96 à 1,09 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 100 à 150 m (groupe de référence ≥ 250 m) |
B3 |
0,96 |
0,90 à 1,03 |
Catégorique |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour : 150 à 250 m (groupe de référence ≥ 250 m) |
B4 |
0,97 |
0,91 à 1,03 |
Catégorique |
Heinrich et coll., 2013 |
Cohorte SALIA, Europe |
Vivant à ≤ 50 m d'une route principale (≥ 10 000 véhicules/jour) |
C |
3,54 |
1,49 à 8,40 |
Catégorique |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Vivant près d'une route principale (à ≤ 100 m d'une autoroute ou à ≤ 50 m d'une route principale avec 10 000 véhicules à moteur/jour) |
D |
1,19 |
0,91 à 1,56 |
Catégorique |
Une seule étude recensée lors des recherches documentaires examinait le lien entre la proximité de la circulation et la mortalité respiratoire au sein d'une population de patients. Cette étude canadienne (Finkelstein et coll., 2005) menée auprès de patients ayant subi des tests de la fonction pulmonaire dans une clinique de Hamilton, en Ontario, a tenu compte des principaux facteurs de confusion de l'âge, du sexe et du SSE, et n'a signalé aucun lien (données résumées à l'annexe A.9).
Densité de la circulation automobile
Les recherches documentaires ont permis de recenser quatre études qui examinaient le risque de mortalité respiratoire et les mesures de la densité de la circulation automobile. Les détails des études, y compris la population à l'étude, l'évaluation de l'exposition, les facteurs de confusion et les ER, sont fournis à l'annexe A.10. La taille de ces études, menées en Europe auprès de cohortes de la population générale, variait de 105 296 (Brunekreef et coll., 2009) à 1 265 058 (Cesaroni et coll., 2013). Les études de Beelen et coll. (2008, 2009) et Brunekreef et coll. (2009) ont été menées auprès de la cohorte NLCS-AIR et ont obtenu des résultats identiques. Chacune des études a tenu compte des principaux facteurs de confusion (âge, sexe et SSE) et du tabagisme, à l'exception de Cesaroni et coll. (2013). Les études ont tenu compte de la mortalité respiratoire; aucune cause spécifique de mortalité n'a été prise en compte. Un risque accru de mortalité respiratoire fondé sur la densité de la circulation à proximité de la résidence a été signalé dans chacune des études (résumées à la figure 3.26), la plupart des ER étant statistiquement significatives ou au seuil de signification statistique.
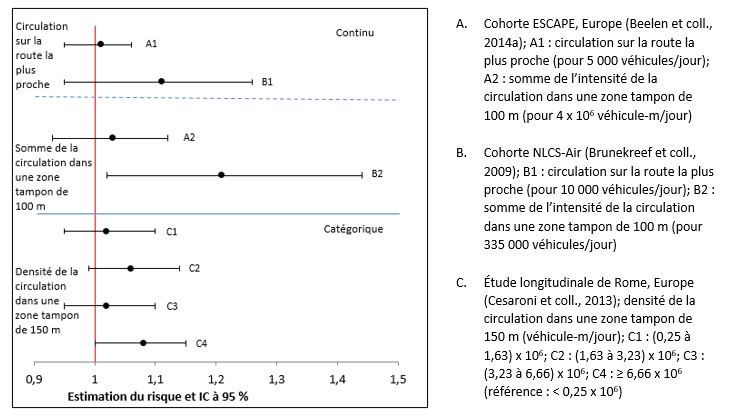
Figure 3.26 : Texte descriptif
La figure 3.26 illustre un graphique en forêt des estimations du risque d'une exposition à long terme à la densité de la circulation et de mortalité respiratoire dans la population générale. L'abscisse représente l'estimation du risque et IC à 95 % et s'échelonne de 0,9 à 1,5. Les informations suivantes sont illustrées dans cette figure :
| Indicateur de trafic | Référence | Cohorte, location de l'étude | Description | Repère | Estimation du risque | IC à 95 % | Type d'estimation de risque |
|---|---|---|---|---|---|---|---|
Circulation sur la route la plus proche |
Dimakopoulou et coll., 2014 |
ESCAPE, Europe |
Circulation sur la route la plus proche (pour 5 000 véhicules/jour) |
A1 |
1,01 |
0,95 à 1,06 |
Continu |
Circulation sur la route la plus proche |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Circulation sur la route la plus proche (pour 10 000 véhicules/jour |
B1 |
1,11 |
0,95 à 1,26 |
Continu |
Somme de la circulation dans une zone tampon de 100 m |
Dimakopoulou et coll., 2014 |
ESCAPE, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 4 x 106 véhicule-m/jour) |
A2 |
1,03 |
0,93 à 1,12 |
Continu |
Somme de la circulation dans une zone tampon de 100 m |
Brunekreef et coll., 2009 |
Cohorte NLCS-AIR, Europe |
Somme de l'intensité de la circulation dans une zone tampon de 100 m (pour 335 000 véhicules/jour) |
B2 |
1,21 |
1,02 à 1,44 |
Continu |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (0,25 à 1,63) x 106 (référence: < 0,25 x 106) |
C1 |
1,02 |
0,95 à 1,10 |
Catégorique |
Densité de la circulation dans la zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (1,63 à 3,23) x 106 (référence: < 0,25 x 106) |
C2 |
1,06 |
0,99 à 1,14 |
Catégorique |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : (3,23 à 6,66) x 106 (référence: < 0,25 x 106) |
C3 |
1,02 |
0,95 à 1,10 |
Catégorique |
Densité de la circulation dans une zone tampon de 150 m |
Cesaroni et coll., 2013 |
Étude longitudinale de Rome, Europe |
Densité de la circulation dans une zone tampon de 150 m (véhicule-m/jour) : ≥ 6,66 x 106 (référence: < 0,25 x 106) |
C4 |
1,08 |
1,00 à 1,15 |
Catégorique |
3.4.5 Résumé
Le lien entre la PACA et la mortalité respiratoire a été étudié dans 20 études de cohorte; toutes les études, sauf deux, ont été menées au sein de la population générale. Ces études ont évalué la mortalité due à des troubles respiratoires en tant que groupe, ainsi qu'à des causes plus spécifiques, dont la MPOC. La majorité de ces études ont été menées en Europe et au Canada et ont évalué l'exposition à la PACA en modélisant des polluants individuels liés à la circulation. Presque toutes les études ont tenu compte des principaux facteurs de confusion (âge, sexe, SSE et tabagisme) et bon nombre d'entre elles ont envisagé d'autres facteurs de confusion. Des analyses regroupées ont été effectuées sur les études menées auprès de la population générale.
Concernant la mortalité respiratoire (attribuable à tous les troubles respiratoires), les analyses regroupées ont indiqué un lien positif pour chacun des polluants évalués (c.-à-d. NO2, NOx et PM2,5) et ces liens avec des ER regroupés allant de 1,04 à 1,16 étaient au seuil de signification statistique pour le NO2 et le NOx, tout en étant non significatifs pour les PM2,5. L'hétérogénéité était substantielle pour chacun des trois polluants. Les preuves d'un lien ont été appuyées par l'analyse qualitative des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui démontrait une relation exposition-réponse. Pour les autres polluants (c.-à-d. NO, PM2,5 abs, CN, PM10 et benzène), les données probantes n'appuyaient pas les analyses regroupées, mais étaient fondées sur un nombre limité d'études qui ne pouvaient être regroupées.
Il n'a pas été possible d'effectuer des analyses regroupées pour une cause spécifique de mortalité respiratoire. En ce qui concerne la mortalité par MPOC, la plupart ou la totalité des ER pour le NO2, le NOx, le NO, les PM2,5 et les PM10 étaient positifs et significatifs ou au seuil de signification statistique. Les données probantes se limitaient à une ou à deux études pour les autres causes spécifiques de mortalité respiratoire.
Chapitre 4. Caractérisation des risques et évaluation de la causalité
4.1 Données probantes tirées d'études épidémiologiques à long terme
En raison du nombre limité d'études cernées pour un large éventail de populations de patients, la caractérisation du risque et la détermination de la causalité n'ont été menées que pour la population générale.
4.1.1 Mortalité toutes causes confondues
Aux fins de cette évaluation, la mortalité toutes causes confondues désigne le nombre total de décès ainsi que les décès qui n'ont pas été causés par un accident ou un suicide; les deux valeurs ont été évaluées conjointement, car la fraction des causes de décès non accidentelles est généralement élevée (Chen et Hoek, 2020). Quarante-sept études ont examiné le lien entre la PACA et la mortalité toutes causes confondues (section 3.2). La majorité de ces études étaient fondées sur la population générale. Toutes étaient des études de cohorte, ce qui signifie qu'elles peuvent fournir une séquence temporelle pour les effets sur la santé observés. La mortalité a été établie à l'aide des données des registres, y compris les registres nationaux des décès, les dossiers d'assurance et les dossiers hospitaliers. Les études ont été menées principalement en Europe et en Amérique du Nord. Par conséquent, les résultats de ces études ont été jugés pertinents pour une évaluation canadienne compte tenu des similitudes dans le mélange de polluants atmosphériques, le niveau de vie, les soins de santé, le climat, etc. entre le Canada, les É.-U. et les pays européens. De plus, le nombre d'études menées en Asie et en Australie était moins élevé. Plus de 60 % des études ont évalué l'exposition à la PACA en modélisant des polluants individuels, dont un nombre suffisant d'études (c.-à-d. égal ou supérieur à quatre études) ont été recensées pour le NO2, le NOx, les PM2,5, le CÉ et les PM10 pour effectuer une analyse quantitative. Les autres études ont utilisé des mesures de la circulation automobile et de l'infrastructure du réseau routier comme mesures indirectes de l'exposition. Presque toutes les études ont tenu compte des principaux facteurs de confusion liés à l'âge, au sexe, au SSE et au tabagisme, et bon nombre d'entre elles ont pris en considération d'autres facteurs de confusion (p. ex., mode de vie, régime alimentaire ou état de santé). La majorité des études ont été considérées comme étant de haute qualité d'après l'analyse du RB.
Des analyses regroupées ont été entreprises afin d'examiner objectivement l'uniformité, la relation exposition-réponse et la force du lien entre la mortalité toutes causes confondues et la PACA pour la population générale. Des modèles à effets aléatoires ont été utilisés pour examiner l'hétérogénéité dans les études primaires. Les estimations groupées de ces analyses sont présentées dans le graphique en forêt ci-dessous (figure 4.1) pour chacun des polluants atmosphériques suivants liés au trafic : NO2, NOx, PM2,5, CÉ et PM10. Ensemble, ces analyses représentent 35 observations uniques. Un lien positif a été établi pour chacun des polluants avec des ER regroupées allant de 1,02 à 1,06 par augmentation de polluant; tous étaient significatifs ou au seuil de signification statistique. Bien que l'ampleur des estimations regroupées ne soit pas facilement comparable, toutes ont démontré une relation exposition-réponse. Les ER regroupées étaient également robustes relativement aux analyses de sous-groupes et de sensibilité, le cas échéant. Un nombre insuffisant d'études a été mené au Canada ou en Amérique du Nord pour effectuer une analyse de sous-groupes par région, mais lorsque les études ont été regroupées par méthode d'évaluation de l'exposition, les estimations regroupées et le niveau de signification sont demeurés en grande partie inchangés. De même, l'analyse principale était robuste si on excluait les études ayant un RB élevé ou probablement élevé dans le domaine du facteur de confusion ou de l'exposition. La confiance dans le lien entre la mortalité toutes causes confondues et la PACA est également soutenue par l'inclusion des études ayant des caractéristiques de population différentes (p. ex., région géographique, répartition par âge, taille et type de population) dans les analyses regroupées, car il est peu probable que les biais potentiels aient une incidence sur les ER dans la même direction dans différentes populations. De même, les analyses regroupées ont été appuyées par l'analyse qualitative des différentes mesures de la circulation et de l'infrastructure du réseau routier, qui a également fourni une certaine indication d'une relation exposition-réponse.
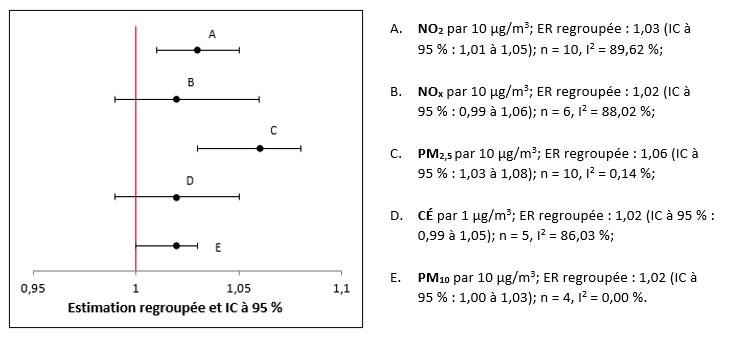
Figure 4.1 : Texte descriptif
La figure 4.1 illustre un graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité toutes causes confondues dans la population générale. L'abscisse représente l'estimation regroupée et IC à 95 % et s'échelonne de 0,95 à 1,1. Les informations suivantes sont illustrées dans cette figure :
| Repère | Polluant | Incrément | Estimation regroupée | IC à 95 % | n | I2 |
|---|---|---|---|---|---|---|
A |
NO2 |
10 μg/m3 |
1,03 |
1,01 à 1,05 |
10 |
89,62 % |
B |
NOx |
10 μg/m3 |
1,02 |
0,99 à 1,06 |
6 |
88,02 % |
C |
PM2,5 |
10 μg/m3 |
1,06 |
1,03 à 1,08 |
10 |
0,14 % |
D |
CÉ |
1 μg/m3 |
1,02 |
0,99 à 1,05 |
5 |
86,03 % |
E |
PM10 |
10 μg/m3 |
1,02 |
1,00 à 1,03 |
4 |
0,00 % |
L'hétérogénéité variait considérablement d'un polluant à l'autre, comme le montre la figure 4.1. Les polluants ayant une plus grande spécificité sur le plan de la circulation, tels que le NO2, le NOx et le CÉ, présentaient une hétérogénéité substantielle par rapport aux PM2,5 et aux PM10, qui présentaient une hétérogénéité nulle ou limitée. Ces résultats étaient attendus, étant donné que les polluants ayant une plus grande spécificité sur le plan de la circulation présentent une plus grande variation spatiale dans les estimations de l'exposition à la PACA, qui varient en fonction de facteurs tels que le volume de la circulation et la configuration du réseau routier. Pour ce qui est du NO2, l'hétérogénéité substantielle observée est conforme aux analyses rapportées par le HEI (2022) ainsi que par Huangfu et Atkinson (2020). Comme l'illustrent les graphiques en forêt de la section 3.2, l'hétérogénéité était principalement attribuable à l'ampleur des ER individuelles et non à la direction de l'association. Contrairement au NOx et au CÉ, pour lesquels l'hétérogénéité a été attribuée à une ou à deux ER, aucune ER individuelle n'a influencé l'hétérogénéité dans l'analyse du NO2. Les sources d'hétérogénéité peuvent être attribuées aux différences méthodologiques entre les études primaires, y compris les méthodologies d'évaluation de l'exposition, le lieu de l'étude, les critères d'inclusion et d'exclusion distincts, les caractéristiques de la population (p. ex., les tranches d'âge) et l'ajustement pour tenir compte des facteurs de confusion et des covariables. La gamme variable d'expositions entre les études primaires, les sources de la PACA (p. ex., la proportion de véhicules à essence par rapport aux véhicules diesel peut avoir une incidence sur la nature du mélange de la PACA), ainsi que les grandes variations dans la taille des études primaires, peuvent également avoir contribué à l'hétérogénéité.
4.1.2 Mortalité circulatoire
Quarante et une études ont examiné le lien entre l'exposition à long terme à la PACA et la mortalité circulatoire; toutes les études, sauf deux, étaient fondées sur la population générale (section 3.3). Ces études ont évalué la mortalité attribuable à des MSC en tant que groupe ou à des causes plus spécifiques. Cette évaluation s'est concentrée sur les MSC, les MCO et les MCV en raison du nombre limité d'études cernées pour les autres effets sur la santé. Toutes les études relatives à la MSC, à la MCO et à la MCV étaient des études de cohorte et, par conséquent, une séquence temporelle pourrait être déterminée pour les effets sur la santé observés. La mortalité a été établie à l'aide des données des registres, y compris les registres nationaux des décès, les dossiers d'assurance et les dossiers hospitaliers. Les études ont été menées principalement en Europe et en Amérique du Nord. Par conséquent, les résultats de ces études ont été jugés pertinents pour une évaluation canadienne, compte tenu des similitudes dans le mélange de polluants atmosphériques, le niveau de vie, les soins de santé, le climat, etc. entre le Canada, les É.-U. et les pays européens. De plus, le nombre d'études menées en Asie et en Australie était moins élevé. Plus de 60 % des études ont évalué l'exposition à la PACA en modélisant des polluants individuels, tandis que les autres études ont utilisé des mesures de la circulation et de l'infrastructure du réseau routier comme mesures indirectes de l'exposition. Presque toutes les études ont tenu compte des principaux facteurs de confusion liés à l'âge, au sexe, au SSE et au tabagisme, et bon nombre d'entre elles ont pris en considération d'autres facteurs de confusion (p. ex., mode de vie, régime alimentaire ou état de santé). La majorité des études ont été considérées comme étant de haute qualité d'après l'analyse du RB.
Lorsqu'un nombre suffisant d'études (c.-à-d. égal ou supérieur à quatre études) ont été recensées, des analyses regroupées ont été entreprises pour examiner objectivement la cohérence, la relation exposition-réponse et la force du lien entre les effets sur la santé évalués pour la mortalité circulatoire (c.-à-d. MSC, MCO et MCV) et la PACA au sein de la population générale. Des modèles à effets aléatoires ont été utilisés pour examiner l'hétérogénéité dans les études primaires. Les estimations regroupées de ces analyses sont présentées sur le graphique en forêt ci-dessous (figure 4.2).
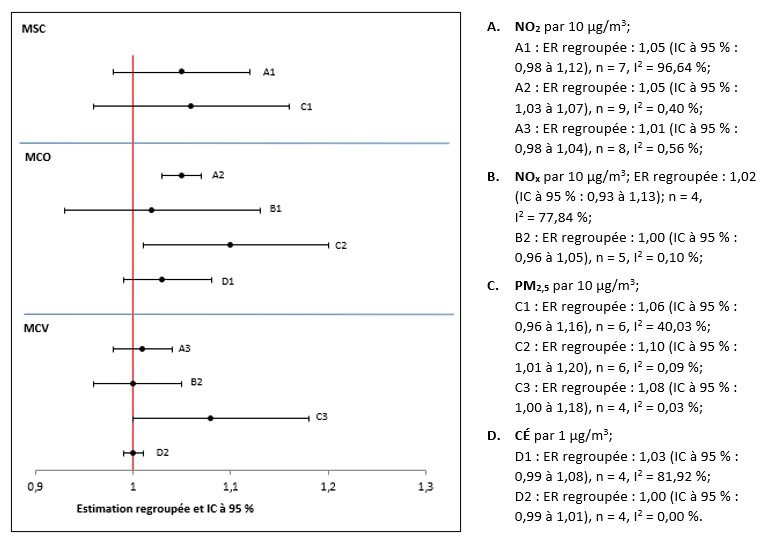
Figure 4.2 : Texte descriptif
La figure 4.2 illustre un graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité par MSC (en haut), par MCO (au milieu) et par MCV (en bas) dans la population générale. L'abscisse représente l'estimation regroupée et IC à 95 % et s'échelonne de 0,9 à 1,3. Les informations suivantes sont illustrées dans cette figure :
| Effets sur la santé | Repère | Polluant | Incrément | Estimation regroupée | IC à 95 % | n | I2 |
|---|---|---|---|---|---|---|---|
Mortalité par MSC |
A1 |
NO2 |
10 μg/m3 |
1,05 |
0,98 à 1,12 |
7 |
96,64 % |
Mortalité par MSC |
C1 |
PM2,5 |
10 μg/m3 |
1,06 |
0,96 à 1,16 |
6 |
40,03 % |
Mortalité par MCO |
A2 |
NO2 |
10 μg/m3 |
1,05 |
1,03 à 1,07 |
9 |
0,40 % |
Mortalité par MCO |
B1 |
NOx |
10 μg/m3 |
1,02 |
0,93 à 1,13 |
4 |
77,84 % |
Mortalité par MCO |
C2 |
PM2,5 |
10 μg/m3 |
1,10 |
1,01 à 1,20 |
6 |
0,09 % |
Mortalité par MCO |
D1 |
CÉ |
1 μg/m3 |
1,03 |
0,99 à 1,08 |
4 |
81,92 % |
Mortalité par MCV |
A3 |
NO2 |
10 μg/m3 |
1,01 |
0,98 à 1,04 |
8 |
0,56 % |
Mortalité par MCV |
B2 |
NOx |
10 μg/m3 |
1,00 |
0,96 à 1,05 |
5 |
0,10 % |
Mortalité par MCV |
C3 |
PM2,5 |
10 μg/m3 |
1,08 |
1,00 à 1,18 |
4 |
0,03 % |
Mortalité par MCV |
D2 |
CÉ |
1 μg/m3 |
1,00 |
0,99 à 1,01 |
4 |
0,00 % |
Pour ce qui est de la mortalité par MSC, une analyse quantitative a été effectuée pour deux polluants : le NO2, la mesure la plus directe de l'exposition à la PACA, et les PM2,5. Ils représentent 13 observations uniques. Un lien positif et au seuil de signification statistique a été déterminé pour les deux polluants, avec des ER regroupées de 1,05 et 1,06 par augmentation de 10 μg/m3 du polluant, pour le NO2 et les PM2,5, respectivement. Les ER regroupées pour le NO2 étaient généralement robustes pour les analyses de sous-groupe, de sensibilité et de l'exclusion effectuées. Elles ont également été appuyées par l'analyse qualitative du NO, du CÉ et des PM10 pour lesquels les ER n'ont pas été regroupées, ainsi que par l'analyse qualitative des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui a démontré certaines preuves d'une relation exposition-réponse. Cependant, des résultats mitigés ont été observés pour l'analyse qualitative du NOx.
Dans le cas de la mortalité par MCO, des ER regroupées représentant 23 observations uniques ont été calculées pour le NO2, le NOx, les PM2,5 et le CÉ. Un lien positif a été établi pour chacun des polluants avec des ER regroupées allant de 1,02 à 1,13 par augmentation progressive de polluant; tous étaient significatifs ou au seuil de signification statistique. Les analyses de sous-groupes et de sensibilité, lorsqu'elles ont été effectuées, ont donné lieu à des ER regroupées d'ampleur comparable à l'analyse principale. De même, il a été constaté qu'aucune étude sur le NO2 ou le CÉ n'influe sur l'analyse principale, mais quelques études, lorsqu'elles ont été omises, ont augmenté l'incertitude entourant l'ER regroupée pour le NOx et les PM2,5. Ces données probantes ont été appuyées par l'analyse qualitative des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui a démontré une relation exposition-réponse claire. En revanche, les données probantes provenant des autres polluants (c.-à-d. NO et PM10) étaient limitées et ne démontraient pas de lien évident entre la mortalité par MCO et la PACA.
En ce qui concerne la mortalité par MCV, les analyses regroupées des polluants évalués (NO2, NOx, PM2,5 et CÉ) ont donné des résultats mitigés. Plus précisément, un faible lien positif de 1,01 et un lien positif plus fort de 1,08 par augmentation de polluant ont été établis pour le NO2 et les PM2,5, respectivement, tandis que des liens nuls ont été déterminés pour le NOx et le CÉ. Les deux liens positifs étaient au seuil de signification statistique et les ER regroupées représentaient 21 observations uniques. Des résultats incohérents ont également été observés pour l'analyse qualitative des mesures de la circulation automobile et de l'infrastructure du réseau routier, et les données probantes provenant des autres polluants étaient limitées.
L'hétérogénéité variait considérablement selon les polluants et les résultats évalués sur le plan de la mortalité circulatoire, comme le montre la figure 4.2. L'estimation regroupée pour la majorité des paires exposition-effet présentait une hétérogénéité nulle ou faible, y compris la paire NO2 et mortalité par MCO, la paire PM2,5 et mortalité par MCO, ainsi que les paires pour les polluants de la PACA soumise à une analyse quantitative (c.-à-d. NO2, NOx, PM2,5 et CÉ) et mortalité par MCV. En revanche, l'hétérogénéité était considérable (I2 = 96,68 %) dans l'analyse regroupée pour la paire NO2 et mortalité par MSC. Deux tiers des ER dans l'analyse de la paire NO2 et mortalité par MSC ont produit des estimations d'effet qui allaient dans le même sens, et aucune ER individuelle n'a influé sur l'hétérogénéité. Une hétérogénéité substantielle (I2 = 77,84 %) a également été observée pour l'analyse de la paire NOx et mortalité par MCO; cette hétérogénéité a été attribuée à une étude (Nafstad et coll., 2004), car l'omission de cette étude de l'analyse regroupée a entraîné une hétérogénéité minimale. En revanche, en omettant l'une des trois études (Krewski et coll., 2009 [la cohorte de New York]; Carey et coll., 2013; Beelen et coll., 2014a) de l'analyse regroupée de la paire PM2,5 et mortalité par MSC, l'hétérogénéité a diminué, passant de modérée (I2 = 40,03 %) à minimale (I2 ≤ 0,12 %). La variabilité de l'hétérogénéité peut s'expliquer par la mesure dans laquelle un certain nombre de facteurs, y compris les différences dans les méthodologies des études primaires (décrites à la section 4.1.1), la gamme d'expositions entre les études primaires et la taille de l'étude primaire, sont semblables ou différents d'une étude regroupée à l'autre.
4.1.3 Mortalité respiratoire
Vingt études ont examiné le lien entre l'exposition à long terme à la PACA et la mortalité respiratoire; toutes les études, sauf deux, étaient fondées sur la population générale (section 3.4). Ces études ont évalué la mortalité attribuable à tous les troubles respiratoires (mortalité respiratoire) ou à des causes plus spécifiques. En raison du nombre limité d'études recensées pour d'autres causes respiratoires spécifiques, cette évaluation ne traite que de la mortalité due à la MPOC en tant que cause spécifique. À l'instar des effets sur la santé précédents examinés dans cette évaluation, toutes les études étaient des études de cohorte et, par conséquent, une séquence temporelle pourrait être déterminée pour les effets observés pour la santé. La mortalité a été établie à l'aide des données des registres, y compris les registres nationaux des décès, les dossiers d'assurance et les dossiers hospitaliers. Les études ont été menées principalement en Europe et au Canada et, comme il a été décrit précédemment, les résultats de ces études ont été jugés pertinents pour une évaluation canadienne. La majorité des études ont évalué l'exposition à la PACA en modélisant des polluants individuels, tandis que les autres études ont utilisé des mesures de la circulation automobile et de l'infrastructure du réseau routier comme mesures indirectes de l'exposition. Presque toutes les études ont tenu compte des principaux facteurs de confusion liés à l'âge, au sexe, au SSE et au tabagisme, et bon nombre d'entre elles ont pris en considération d'autres facteurs de confusion (p. ex., mode de vie, régime alimentaire ou état de santé). La majorité des études ont été considérées comme étant de haute qualité d'après l'analyse du RB.
Dans le cas de la population générale, des analyses regroupées ont été effectuées pour la mortalité respiratoire et l'exposition à long terme aux trois polluants suivants représentant l'exposition à la PACA : NO2, NOx et PM2,5. Des modèles à effets aléatoires ont été utilisés pour examiner l'hétérogénéité dans les études primaires. Les estimations regroupées de ces analyses représentant 15 observations uniques sont présentées sur le graphique en forêt ci-dessous (figure 4.3). Un lien positif a été déterminé pour chacun des polluants, avec des ER regroupées allant de 1,04 à 1,09 par augmentation de 10 μg/m3 du polluant, ce qui montre des liens constants et forts ainsi qu'une relation exposition-réponse. Le lien était au seuil de signification statistique pour le NO2 et le NOx, mais il était non significatif et imprécis pour les PM2,5, comme le montre le vaste IC à 95 %. Pour le NO2, les analyses de sous-groupes et de sensibilité, lorsqu'elles ont été effectuées, ont donné lieu à des ER regroupées d'ampleur et de précision comparable à l'analyse principale. En revanche, pour le NOx, bien que l'ER regroupée soit robuste, aucune signification statistique n'a été observée dans ces analyses. Un lien nul a également été noté pour le NOx lorsque l'étude de Nafstad et coll. (2004) a été omise de l'analyse de l'exclusion. Pour les PM2,5, les estimations regroupées des sous-groupes et des analyses de sensibilité variaient par rapport à l'analyse principale, et l'IC à 95 % est resté élevé; cela a été attribué au nombre limité d'études (n = 2 ou 3) comprises dans ces analyses. Le lien positif entre la mortalité respiratoire et l'exposition à la PACA a été appuyé par l'analyse qualitative de différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui a démontré certaines preuves d'une relation exposition-réponse, mais a également inclus certains liens imprécis. Les preuves de l'analyse qualitative des autres polluants représentant l'exposition à la PACA étaient limitées et ne démontraient pas de lien entre la mortalité respiratoire et l'exposition à la PACA.

Figure 4.3 : Texte descriptif
La figure 4.3 illustre un graphique en forêt des estimations regroupées de risque d'exposition à la PACA et de risque de mortalité respiratoire dans la population générale. L'abscisse représente l'estimation regroupée et IC à 95 % et s'échelonne de 0,8 à 1,5. Les informations suivantes sont illustrées dans cette figure :
| Repère | Polluant | Incrément | Estimation regroupée | IC à 95 % | n | I2 |
|---|---|---|---|---|---|---|
A |
NO2 |
10 μg/m3 |
1,04 |
0,99 à 1,09 |
7 |
74,36 % |
B |
NOx |
10 μg/m3 |
1,05 |
0,93 à 1,20 |
4 |
66,29 % |
C |
PM2,5 |
10 μg/m3 |
1,09 |
0,80 à 1,49 |
4 |
88,34 % |
L'hétérogénéité était substantielle dans les ER regroupées pour les trois polluants (comme l'indique la figure 4.3) et est demeurée importante dans toutes les analyses de sous-groupes et de sensibilité qui ont été effectuées avec un n supérieur ou égal à 3. Contrairement au NO2, pour lequel aucune étude n'a influé sur l'hétérogénéité, aucune hétérogénéité n'a été observée dans l'ER regroupée lorsque les études de Nafstad et coll. (2004) et de Carey et coll. (2013) ont été omises de l'analyse de l'exclusion pour le NOx et les PM2,5, respectivement. Les sources d'hétérogénéité sont décrites à la section 4.1.3.
Aucune analyse regroupée n'a été effectuée pour la mortalité par MPOC et l'exposition à la PACA, car il n'y avait pas suffisamment d'études provenant de cohortes uniques qui disposaient des données nécessaires pour effectuer une analyse quantitative. L'analyse qualitative a indiqué principalement des liens positifs qui étaient significatifs ou au seuil de signification statistique pour le NO2, le NOx, le NO, les PM2,5 et les PM10.
4.2 Données biologiques
Le HEI (2010) a établi que les effets sur la santé de l'exposition à la PACA ont été induits par le stress oxydatif, qui se produit lorsque les niveaux de formes réactives de l'oxygène (FRO) ou de génération de radicaux libres dépassent les systèmes de défense antioxydante dans les cellules. Ce processus cause des dommages oxydatifs aux lipides, aux protéines et à l'ADN, ce qui entraîne un affaiblissement de la fonction cellulaire et la mort cellulaire. En plus, l'état d'oxydoréduction modifié de la cellule a comme conséquence l'activation de l'expression des gènes des cytokines, des chémokines et des molécules d'adhésion qui participent aux réponses inflammatoires, contribuant ainsi au cycle de dommages oxydatifs des tissus. Le HEI (2022) a approfondi ces données et ciblé de nombreuses voies interdépendantes par lesquelles l'exposition à la PACA peut entraîner des effets indésirables pour la santé. Les particules de PACA inhalées pénètrent dans les poumons et déclenchent une série de réponses, notamment :
- une inflammation pulmonaire, qui peut faire en sorte que des médiateurs inflammatoires entrent dans la circulation systémique et induisent une réponse inflammatoire systémique;
- la formation directe d'intermédiaires biologiques (p. ex., macromolécules oxydées) qui peuvent entrer dans la circulation systémique et induire une réponse inflammatoire systémique;
- l'activation neuroendocrinienne, qui peut entraîner des symptômes respiratoires et modifier la fonction cardiorespiratoire;
- la translocation de particules des poumons dans la circulation sanguine où ils peuvent avoir des effets directs sur la vascularisation ou d'autres organes ou tissus dans le corps.
Ces mécanismes d'action peuvent également mener à l'affaiblissement cardiovasculaire et, finalement, à la morbidité et à la mortalité circulatoires par des effets sur le cœur (par exemple, variabilité de la fréquence cardiaque [VFC] altérée, arythmie), la vascularisation (par exemple, fonction endothéliale altérée, vasoconstriction modifiée, exacerbation de l'athérosclérose) et le sang (par exemple, coagulabilité accrue, diminution de l'activité des plaquettes).
Le HEI (2022) a également déterminé que l'exposition à la PACA provoque des effets respiratoires nocifs en influençant le stress oxydatif et les lésions tissulaires des voies respiratoires, la réactivité et le remodelage des voies respiratoires, les séquences inflammatoires et les réponses immunologiques, et en augmentant la sensibilisation aux aéroallergènes. Les mécanismes d'action sont complexes et influencés par la susceptibilité génétique, la fonction pulmonaire compromise et la susceptibilité accrue aux agents pathogènes bactériens et viraux.
Des mécanismes d'action similaires centrés sur la génération de FRO, le stress oxydatif et les réponses inflammatoires ont été cernés dans l'évaluation précédente des risques de la PACA par Santé Canada, démontrant ainsi une plausibilité biologique pour l'asthme, les allergies et la fonction pulmonaire (Santé Canada, 2020) et certains effets cancéreux (Santé Canada, 2022c). Comme il a été mentionné dans ces évaluations, bien que les études expérimentales tiennent principalement compte des expositions à court terme, les réponses biologiques sont utiles pour fournir un aperçu mécaniste des effets observés dans les études épidémiologiques à long terme.
Un examen de la littérature primaire récente a également révélé des effets nocifs de l'exposition à la PACA sur les systèmes circulatoire et respiratoire (résumés des tableaux fournis à la section 4 de la documentation à l'appui). Les études par panel qui ont évalué les réponses biologiques du système circulatoire aux expositions à la circulation dans le monde réel ont recensé les effets suivants : changements dans la VFC, la tension artérielle et la fréquence cardiaque; biomarqueurs accrus du stress oxydatif systémique, inflammation et lésions cardiaques; ou dysfonctionnement endothélial et raideur artérielle (Mallach et coll., 2023; Zhang et coll., 2022; Han et coll., 2021; Hudda et coll., 2021; Wang et coll., 2022; Bienne et coll., 2020; Liang et coll., 2018; Cole-Hunter et coll., 2016; Kubesch et coll., 2015; Ladva et coll., 2018; Sarnat et coll., 2014; Chu et coll., 2016; Mirowsky et coll., 2015; Jiang et coll., 2016; Weichenthal et coll., 2014; Brucker et coll., 2013; Bartell et coll., 2013; Huang et coll., 2013; Chuang et coll., 2013; Shields et coll., 2013). La plupart de ces études par panel ont été menées aux É.-U. (n = 7), ainsi qu'en Asie (n = 6) et au Canada (n = 3). Les études d'exposition contrôlée se sont concentrées sur l'exposition à court terme aux GED et ont fait état d'altérations de la VFC et de la pression artérielle, une augmentation des biomarqueurs du stress oxydatif systémique et de l'inflammation, une vasoconstriction et une modification de la chimie du sang (Cosselman et coll., 2020; Sack et coll., 2016; Jiang et coll., 2014; Tong et coll., 2014; Krishnan et coll., 2013). Un petit nombre d'études menées sur des animaux de laboratoire ont tenu compte de l'exposition en bordure de route ou des particules prélevées au bord des routes et ont évalué des durées plus longues (p. ex., des semaines à des mois). Ces études ont observé un stress oxydatif et une inflammation dans le tissu cardiaque associée à la fibrose (Edwards et coll., 2020) et des preuves d'une progression accrue de l'athérosclérose (Zhao et coll., 2020).
En ce qui concerne les effets de l'exposition à la PACA sur le système respiratoire, les études par panel sur les expositions réelles à la circulation automobile et les études d'exposition contrôlée sur les GED ont fait état d'un stress oxydatif et d'une inflammation des voies respiratoires ou d'une modification des paramètres de la fonction pulmonaire (Orach et coll., 2022; Xu et coll., 2022; Han et coll., 2019; Wang et coll., 2022; Jiang et coll., 2019; Matt et coll., 2016; Sarnat et coll., 2014; Zhao et coll., 2015). Ces études ont été menées principalement en Asie. Des études sur des animaux de laboratoire ont révélé que la PACA et les particules attribuables à la circulation augmentent le stress oxydatif et induisent des réponses inflammatoires dans les poumons et les voies respiratoires; modifient la fonction pulmonaire; induisent une hyperréactivité des voies respiratoires; et entraînent des changements dans les tissus respiratoires, y compris l'épaississement des parois alvéolaires, l'hypertrophie des muscles lisses, le remodelage matriciel et la dégénérescence cellulaire (Xiao et coll., 2022; Jheng et coll., 2021; Chuang et coll., 2020; Chan et coll., 2019; Samara et coll., 2015). De plus, des études in vitro sur des lignées cellulaires de tissus respiratoires ont fait état d'une génération de FRO, d'un stress oxydatif, de réponses inflammatoires et d'une viabilité cellulaire réduite associée aux particules de trafic (Gong et coll., 2022; van Den Heuvel et coll., 2016; Mirowski et coll., 2015; Shang et coll., 2013).
Lorsqu'elles sont considérées ensemble, de multiples sources de données fournissent une base biologique démontrant les effets nocifs sur la santé des systèmes circulatoire et respiratoire. En ce qui concerne la mortalité toutes causes confondues, le cancer et les causes circulatoires et respiratoires figurent parmi les principales causes non accidentelles de décès au Canada (Statistique Canada, 2022). Les données mécanistes résumées dans cette section décrivent des voies possibles par lesquelles l'exposition à la PACA peut perturber ou modifier la fonction cellulaire et tissulaire, ce qui peut amplifier la progression de la maladie et finalement conduire à la mortalité. Dans l'ensemble, les données expérimentales examinées dans le cadre de cette évaluation et par Santé Canada (2022c) indiquent la plausibilité biologique pour toutes les causes ainsi que pour la mortalité circulatoire et respiratoire.
4.3 Détermination de la causalité
4.3.1 Mortalité toutes causes confondues
Pour la mortalité toutes causes confondues (sections 3.2 et 4.1.1), d'après les données probantes suivantes :
- Le lien positif entre l'exposition à long terme à la PACA et la mortalité toutes causes confondues a été établi pour chacun des polluants atmosphériques associés à l'exposition à la PACA (c.-à-d. NO2, NOx, PM2,5, CÉ et PM10). Pour chacun des polluants, les ER regroupées variaient de 1,02 à 1,06 par augmentation de polluant et étaient significatives (pour le NO2 et les PM2,5) ou au seuil de signification statistique (pour le NOx, le CÉ et les PM10), démontrant ainsi une relation exposition-réponse et une cohérence dans l'association entre plusieurs polluants.
- Des preuves qualitatives considérables provenant des différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui ont également soutenu la présence d'une relation exposition-réponse.
- Un soutien des données biologiques, qui fournissent une base biologique pour les effets nocifs sur les systèmes circulatoire et respiratoire, car les causes circulatoires et respiratoires sont parmi les principales causes non accidentelles de décès.
Dans l'ensemble, les données probantes sont jugées suffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité toutes causes confondues.
4.3.2 Mortalité circulatoire
Pour ce qui est de la mortalité par MSC (sections 3.3 et 4.1.2), d'après les données probantes suivantes :
- Les liens positifs et au seuil de la signification statistique entre l'exposition à long terme à la PACA et la mortalité par MSC ont été déterminées pour le NO2 et les PM2,5, avec des ER regroupées de 1,05 et 1,06 par incrément, respectivement, indiquant un lien avec l'exposition et une cohérence dans les données probantes. Ces données sont appuyées par une analyse qualitative d'autres polluants de la PACA (c.-à-d. CN, PM2,5 abs, PM10 et benzène), tout en soulignant les données probantes limitées associées à ces polluants.
- Un soutien des données qualitatives fondées sur les différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui ont également indiqué la présence d'une relation exposition-réponse.
- Un soutien des preuves biologiques, qui fournissent une base biologique pour les effets nocifs sur le système circulatoire.
Dans l'ensemble, les données probantes sont jugées suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité par MSC.
Pour ce qui est de la mortalité par MCO (sections 3.3 et 4.1.2), d'après les données probantes suivantes :
- Le lien positif et significatif entre l'exposition à long terme à la PACA et la mortalité par MCO, déterminé pour le NO2 et les PM2,5 avec des ER regroupées de 1,05 et 1,10 par augmentation, respectivement, ainsi que des liens au seuil de signification statistique pour le NOx et le CÉ avec des ER regroupées de 1,02 et 1,03 par augmentation, respectivement. Ces synthèses quantitatives indiquent un lien avec l'exposition et une cohérence dans les données probantes sur ces polluants; cependant, des résultats mitigés ont été notés dans les études limitées sur le NO et les PM10.
- Un soutien des données qualitatives fondées sur différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, qui ont également indiqué la présence d'une relation exposition-réponse.
- Un soutien des preuves biologiques, qui fournissent une base biologique pour les effets nocifs sur le système circulatoire.
Dans l'ensemble, les données probantes sont jugées suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité par MCO.
Pour ce qui est de la mortalité par MCV (sections 3.3 et 4.1.2), d'après les données probantes suivantes :
- Les résultats mitigés entre l'exposition à long terme à la PACA et la mortalité par MCV pour les polluants de la PACA. Plus précisément, un lien positif au seuil de la signification statistique a été établi pour le NO2 et les PM2,5 avec des ER de 1,01 et 1,08 par augmentation, respectivement; toutefois, un lien nul a été établi pour le NOx et le CÉ. L'analyse qualitative du NO et des PM10 est limitée pour appuyer un lien.
- Un soutien limité des données qualitatives fondées sur les différentes mesures de la circulation automobile et de l'infrastructure du réseau routier, sans preuve claire d'une relation exposition-réponse.
- Un soutien des preuves biologiques, qui fournissent une base biologique pour les effets nocifs sur le système circulatoire.
Dans l'ensemble, les données probantes sont insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité par MCV.
4.3.3 Mortalité respiratoire
Pour la mortalité respiratoire (sections 3.4 et 4.1.3), d'après les données probantes suivantes :
- Les liens positifs et au seuil de la signification statistique entre l'exposition à long terme à la PACA et la mortalité respiratoire ont été déterminés pour le NO2 et le NOx, avec des ER regroupées de 1,04 et 1,05 par augmentation, respectivement, indiquant un lien avec l'exposition et une cohérence dans les données probantes. Dans le cas des PM2,5, un lien positif a été établi, avec une RE regroupée de 1,09; cependant, il était non significatif et imprécis. Des données probantes qualitatives limitées ont été relevées pour les autres polluants (c.-à-d. NO, PM2,5 abs, CN, PM10 et benzène).
- Un soutien des données qualitatives fondées sur les divers paramètres de la circulation automobile et de l'infrastructure du réseau routier, qui ont également suggéré la présence d'une relation exposition-réponse.
- Un soutien des données biologiques, qui fournissent une base biologique pour les effets nocifs sur le système respiratoire.
Dans l'ensemble, les données probantes sont jugées évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité respiratoire.
Pour la mortalité par MPOC (sections 3.4 et 4.1.3), d'après les données probantes suivantes :
- Bien qu'il n'ait pas été possible d'effectuer une synthèse quantitative pour la mortalité par MPOC, la plupart ou la totalité des ER pour les divers polluants de la PACA (c.-à-d. NO2, NOx, NO, PM2,5 et PM10) étaient positives et significatives ou au seuil de la signification statistique.
- Un soutien des données biologiques, qui fournissent une base biologique pour les effets nocifs sur le système respiratoire.
Dans l'ensemble, les données probantes sont jugées évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité par MPOC.
Chapitre 5. Conclusion
À l'aide de techniques de revue systématique, y compris la méta-analyse, cette évaluation des risques a examiné la littérature épidémiologique concernant les liens entre l'exposition à long terme à la PACA et la mortalité. Ces liens ont été évalués en parallèle avec des preuves biologiques pertinentes recueillies à partir de données mécanistes provenant d'évaluations récentes des risques associés à la PACA et de la littérature primaire récente dans le cadre d'une approche fondée sur le poids de la preuve pour déterminer le rôle causal de l'exposition à long terme à la PACA dans les effets de la mortalité toutes causes confondues, de la mortalité par MSC, de la mortalité par MCO, de la mortalité par MCV, de la mortalité respiratoire et de la mortalité par MPOC.
Selon l'ensemble du poids global de la preuve, les conclusions sont les suivantes :
- les données probantes sont suffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité toutes causes confondues;
- les données probantes sont suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité par MSC;
- les données probantes sont suffisantes pour conclure à un lien de causalité probable entre l'exposition à long terme à la PACA et la mortalité par MCO;
- les données sont insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité par MCV;
- les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité par maladie respiratoire;
- les données probantes sont évocatrices, mais insuffisantes pour conclure à un lien de causalité entre l'exposition à long terme à la PACA et la mortalité par MPOC.
Incertitudes et lacunes principales
Les conclusions de cette évaluation des risques ont été formulées en tenant compte de la documentation épidémiologique et biologique qui évalue les effets sur la santé associés à l'exposition aux polluants de la PACA. En ce qui concerne les causes de mortalité prises en compte dans cette évaluation, les preuves scientifiques étaient principalement fondées sur le NO2, le NOx, les PM2,5, les PM10, le CÉ, la proximité de la circulation et la densité de la circulation. Bien que ces marqueurs soient généralement utilisés pour évaluer ou quantifier l'exposition à la PACA, aucun agent causal définitif des effets sur la santé n'a été cerné à partir des études. Compte tenu du degré de corrélation élevé attendu entre les composants individuels de la PACA, d'autres études et l'utilisation de modèles à plusieurs polluants seraient nécessaires pour cibler le ou les agents causals dans le mélange de polluants de la PACA responsable des effets sur la santé.
Le cadre d'évaluation de l'exposition décrit à la section 2.1.2 a été rigoureusement appliqué pour confirmer la spécificité de la PACA. Par conséquent, les analyses entre les villes et les études à l'échelle nationale sans ajustement propre à la ville ont été exclues de cette évaluation, car elles sont davantage influencées par le climat, la topographie, la présence d'émetteurs de sources ponctuelles et la taille globale de la ville (Crouse et coll., 2015). Bien que cela ait limité la base de données probantes pour cette évaluation, cela a permis de cerner les études dans lesquelles les contrastes d'exposition étaient plus susceptibles d'être attribuables aux sources de la PACA. Des études supplémentaires avec des analyses intra-urbaines aideraient à élargir la base de données de la littérature spécifique à la PACA. Comme la plupart des études primaires ont estimé les expositions à la PACA à l'adresse résidentielle uniquement, la précision avec laquelle l'exposition à la PACA est attribuée pourrait également être améliorée dans les études futures en tenant compte de la mobilité des participants à l'étude et des changements d'adresse résidentielle.
Les analyses quantitatives de cette évaluation des risques étaient très comparables à celles rapportées par le HEI (2022), ce qui est attendu compte tenu des similitudes dans les approches adoptées. Toutefois, des différences clés dans les analyses ont été notées, y compris des différences dans les périodes de recherche documentaire et l'application des critères d'inclusion et d'exclusion. Cela a entraîné certaines différences dans les études incluses dans la synthèse quantitative ainsi que de légères variations dans certaines des estimations regroupées.
Dans presque toutes les études évaluées, la mortalité toutes causes confondues et la mortalité par causes spécifiques ont été déterminées à l'aide des données des registres et des causes de mortalité classées en fonction des codes de la CIM. Les registres de mortalité sont généralement complets, tout comme les liens entre les personnes et ces registres. Parmi le petit nombre d'études qui ne s'appuyaient pas sur les données des registres, les renseignements ont été tirés des dossiers médicaux, qui ont également été considérés comme des sources fiables de ces renseignements. La mortalité due à un large groupe de maladies, telles que les maladies circulatoires et respiratoires, est également moins susceptible d'être mal classifiée en comparaison des causes spécifiques de maladies, telles que la MCO, la MCV et la MPOC. Étant donné que les codes de la CIM ont été mis à jour au fil du temps et que des études ont utilisé différentes versions de ce code, il peut y avoir des incohérences dans la façon dont les causes spécifiques de la mortalité circulatoire et respiratoire ont été classées. En outre, cinq études ont fait état d'une mortalité cardiopulmonaire ou cardiorespiratoire, sans présenter les résultats pour la mortalité circulatoire et respiratoire séparément. Ces études ont été considérées comme une mesure de la mortalité circulatoire, car ces causes dominent la catégorie combinée, mais pourraient également entraîner une classification erronée des résultats.
Les ER de toutes les études, sauf une, présentaient un certain niveau d'ajustement pour tenir compte des facteurs de confusion (p. ex., âge, sexe, SSE, tabagisme et facteurs liés au mode de vie); toutefois, le niveau d'ajustement était variable entre les études. L'uniformité de l'inclusion et de la spécification des principaux facteurs de confusion améliorerait la robustesse des synthèses quantitatives. De plus, l'influence potentielle des caractéristiques environnementales, telles que le bruit de la circulation, les espaces verts et le potentiel piétonnier du quartier sur les résultats n'a été pris en compte que dans un nombre limité d'études. D'autres études explorant les effets potentiels de ces facteurs de confusion pourraient aider à affiner le risque attribuable à l'exposition à la PACA.
Bien qu'un nombre important de publications primaires ait été ciblé pour l'exposition et la mortalité à la PACA, la taille de la base de données probantes variait considérablement selon le type de mortalité. En ce qui concerne la mortalité toutes causes confondues, la base de données documentaires est bien développée, ce qui a donné lieu au plus grand nombre de paires exposition-effets et d'observations uniques, offrant ainsi une plus grande certitude dans les conclusions concernant la causalité. En comparaison, les conclusions concernant la causalité tirées pour la mortalité circulatoire et respiratoire et leurs sous-types étaient fondées sur une base de données de la littérature épidémiologique moins développée, ce qui a entraîné moins de paires exposition-effets et d'observations uniques. Bien que les données probantes globales aient été plus limitées, la cohérence, la force et la relation exposition-réponse du lien étaient suffisantes pour évaluer le lien et déterminer le niveau de causalité. Pour d'autres causes de mortalité telles que la MCV, la MCO, l'IM et l'ICA, seul un nombre limité d'études épidémiologiques ont été cernées; par conséquent, le lien de causalité n'a pas pu être déterminé. Des études supplémentaires sur ces effets sur la santé seraient utiles pour caractériser et comprendre davantage le rôle de l'exposition à la PACA dans la mortalité. De même, seul un nombre limité d'études ont été menées sur des populations qui pourraient être touchées de manière disproportionnée, y compris les populations de patients; à ce titre, ces études n'étaient pas suffisantes pour appuyer une conclusion pour l'ensemble des causes ou pour des causes particulières de mortalité. De plus, il serait utile de mener d'autres études qui porteraient sur les différences potentielles fondées sur le sexe en ce qui a trait au risque de mortalité attribuable à des causes spécifiques (p. ex., risque cardiovasculaire plus élevé chez les hommes) ainsi que sur l'influence de l'exposition à la PACA sur ces risques différentiels.
Aux fins de cette évaluation des risques, les données biologiques et mécanistes ont été tirées d'examens existants de la PACA par Santé Canada (2020, 2022c) et le HEI (2010, 2022) ainsi que d'une recherche dans la littérature primaire des 10 dernières années (c.-à-d. 2013-2023). D'après les preuves scientifiques prises en compte dans cette évaluation, il serait utile de mener d'autres études biologiques afin d'élucider davantage les mécanismes d'action associés au rôle de la PACA dans la mortalité, notamment en ce qui concerne les effets de l'exposition à long terme. À l'heure actuelle, la majorité des preuves expérimentales sont fondées sur des expositions à court terme et soutiennent que l'exposition à la PACA joue un rôle dans le dysfonctionnement cellulaire et tissulaire ainsi que dans l'accélération de la progression de la maladie, qui peuvent conduire à la mortalité. À partir des preuves expérimentales examinées dans cette évaluation des risques, les mécanismes d'action proposés ont établi le rôle central de l'inflammation et du stress oxydatif, ce qui laisse supposer un chevauchement possible ou une ou plusieurs voies d'effet communes. Une compréhension plus approfondie du mécanisme aiderait également à déterminer le ou les composants de la PACA qui sont le ou les agents causals des effets observés sur la santé. Ces renseignements pourraient être utilisés pour orienter les politiques ou les programmes visant à réduire ou à atténuer l'exposition à un ou plusieurs polluants précis.
Références
Alexeeff SE, Roy A, Shan J, et coll. High-resolution mapping of traffic related air pollution with Google street view cars and incidence of cardiovascular events within neighborhoods in Oakland, CA. Environ Health. 2018;17(1):38.
Andersson EM, Ögren M, Molnár P, Segersson D, Rosengren A, Stockfelt L. Road traffic noise, air pollution and cardiovascular events in a Swedish cohort. Environ Res. 2020;185:109446.
Badaloni C, Cesaroni G, Cerza F, Davoli M, Brunekreef B, Forastiere F. Effects of long-term exposure to particulate matter and metal components on mortality in the Rome longitudinal study. Environ Int. 2017;109:146-154.
Barratt B, Lee M, Wong P, et coll. A Dynamic Three-Dimensional Air Pollution Exposure Model for Hong Kong. Res Rep Health Eff Inst. 2018;(194):1-65.
Bartell SM, Longhurst J, Tjoa T, Sioutas C, Delfino RJ. Particulate air pollution, ambulatory heart rate variability, and cardiac arrhythmia in retirement community residents with coronary artery disease. Environ Health Perspect. 2013;121(10):1135-1141.
Bauleo L, Bucci S, Antonucci C, et coll. Long-term exposure to air pollutants from multiple sources and mortality in an industrial area: a cohort study. Occup Environ Med. 2019;76(1):48-57.
Beelen R, Raaschou-Nielsen O, Stafoggia M, et coll. Effects of long-term exposure to air pollution on natural-cause mortality: an analysis of 22 European cohorts within the multicentre ESCAPE project. Lancet. 2014a;383(9919):785-795.
Beelen R, Stafoggia M, Raaschou-Nielsen O, et coll. Long-term exposure to air pollution and cardiovascular mortality: an analysis of 22 European cohorts. Epidemiology. 2014b;25(3):368-378.
Beelen R, Hoek G, Houthuijs D, et coll. The joint association of air pollution and noise from road traffic with cardiovascular mortality in a cohort study. Occup Environ Med. 2009;66(4):243-250.
Beelen R, Hoek G, van den Brandt PA, et coll. Long-term effects of traffic-related air pollution on mortality in a Dutch cohort (NLCS-AIR study). Environ Health Perspect. 2008;116(2):196-202.
Biel R, Danieli C, Shekarrizfard M, et coll. Acute cardiovascular health effects in a panel study of personal exposure to traffic-related air pollutants and noise in Toronto, Canada. Sci Rep. 2020;10(1):16703.
Blount RJ, Pascopella L, Catanzaro DG, et coll. Traffic-Related Air Pollution and All-Cause Mortality during Tuberculosis Treatment in California. Environ Health Perspect. 2017;125(9):097026.
Bradford Hill A. The environment and disease: Association or causation? Proc R Soc Med 1965;58(5):295-300.
Brucker N, Moro AM, Charão MF, et coll. Biomarkers of occupational exposure to air pollution, inflammation and oxidative damage in taxi drivers. Sci Total Environ. 2013;463-464:884-893.
Brunekreef B, Beelen R, Hoek G, et coll. Effects of long-term exposure to traffic-related air pollution on respiratory and cardiovascular mortality in the Netherlands: the NLCS-AIR study. Res Rep Health Eff Inst. 2009;(139):5-89.
Cakmak S, Hebbern C, Vanos J, Crouse DL, Tjepkema M. Exposure to traffic and mortality risk in the 1991-2011 Canadian Census Health and Environment Cohort (CanCHEC). Environ Int. 2019;124:16-24.
Canada. Loi canadienne sur la protection de l'environnement. Liste des substances d'intérêt prioritaire. Rapport d'évaluation. Benzène. Ottawa, Ontario. Environnement Canada, Santé Canada; 1993. https://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/psl1-lsp1/benzene/benzene-fra.pdf.
Carey IM, Atkinson RW, Kent AJ, van Staa T, Cook DG, Anderson HR. Mortality associations with long-term exposure to outdoor air pollution in a national English cohort. Am J Respir Crit Care Med. 2013;187(11):1226-1233.
Carlsen HK, Andersson EM, Molnár P, et coll. Incident cardiovascular disease and long-term exposure to source-specific air pollutants in a Swedish cohort. Environ Res. 2022;209:112698.
CCME. Standard pancanadien relatif au benzène : Rapport final de 2010. Winnipeg, Manitoba, Canada : Conseil canadien des ministres de l'environnement. 2012. https://www.ccme.ca/files/Resources/fr_air/fr_benzene/2010_benzene_rpt_final_fr.pdf.
Cesaroni G, Badaloni C, Gariazzo C, et coll. Long-term exposure to urban air pollution and mortality in a cohort of more than a million adults in Rome. Environ Health Perspect. 2013;121(3):324-331.
Cesaroni G, Porta D, Badaloni C, et coll. Nitrogen dioxide levels estimated from land use regression models several years apart and association with mortality in a large cohort study. Environ Health. 2012;11:48.
Chan YL, Wang B, Chen H, et coll. Pulmonary inflammation induced by low-dose particulate matter exposure in mice. Am J Physiol Lung Cell Mol Physiol. 2019;317(3):L424-L430.
Chen J, Hoek G. Long-term exposure to PM and all-cause and cause-specific mortality: A systematic review and meta-analysis. Environ Int. 2020;143:105974.
Chen H, Goldberg MS, Burnett RT, Jerrett M, Wheeler AJ, Villeneuve PJ. Long-term exposure to traffic-related air pollution and cardiovascular mortality. Epidemiology. 2013;24(1):35-43.
Chu JH, Hart JE, Chhabra D, Garshick E, Raby BA, Laden F. Gene expression network analyses in response to air pollution exposures in the trucking industry. Environ Health. 2016;15(1):101.
Chuang HC, Chen YY, Hsiao TC, et coll. Alteration in angiotensin-converting enzyme 2 by PM1 during the development of emphysema in rats. ERJ Open Res. 2020;6(4):00174-2020.
Chuang HC, Lin LY, Hsu YW, Ma CM, Chuang KJ. In-car particles and cardiovascular health: an air conditioning-based intervention study. Sci Total Environ. 2013;452-453:309-313.
Cohen G, Steinberg DM, Keinan-Boker L, et coll. Preexisting coronary heart disease and susceptibility to long-term effects of traffic-related air pollution: A matched cohort analysis. Eur J Prev Cardiol. 2021;28(13):1475-1486.
Cohen G, Steinberg DM, Yuval, et coll. Cancer and mortality in relation to traffic-related air pollution among coronary patients: Using an ensemble of exposure estimates to identify high-risk individuals. Environ Res. 2019;176:108560.
Cole-Hunter T, Weichenthal S, Kubesch N, et coll. Impact of traffic-related air pollution on acute changes in cardiac autonomic modulation during rest and physical activity: a cross-over study. J Expo Sci Environ Epidemiol. 2016;26(2):133-140.
Cosselman KE, Allen J, Jansen KL, et coll. Acute exposure to traffic-related air pollution alters antioxidant status in healthy adults. Environ Res. 2020;191:110027.
Crouse DL, Peters PA, Villeneuve PJ, et coll. Within- and between-city contrasts in nitrogen dioxide and mortality in 10 Canadian cities; a subset of the Canadian Census Health and Environment Cohort (CanCHEC). J Expo Sci Environ Epidemiol. 2015;25(5):482-489.
Davies HT, Crombie IK, Tavakoli M. When can odds ratios mislead? BMJ. 1998 Mar 28;316(7136):989-91.
de Hoogh K, Korek M, Vienneau D, Keuken M, Kukkonen J, Nieuwenhuijsen MJ, Badaloni C, Beelen R, Bolignano A, Cesaroni G, Pradas MC. Comparing land use regression and dispersion modelling to assess residential exposure to ambient air pollution for epidemiological studies. Environment international. Déc. 2014 1;73:382-92.
Desikan A, Crichton S, Hoang U, et coll. Effect of exhaust- and nonexhaust-related components of particulate matter on long-term survival after stroke. Stroke. 2016;47(12):2916-2922.
Dimakopoulou K, Samoli E, Beelen R, et coll. Air pollution and nonmalignant respiratory mortality in 16 cohorts within the ESCAPE project. Am J Respir Crit Care Med. 2014;189(6):684-696.
Dirgawati M, Hinwood A, Nedkoff L, et coll. Long-term exposure to low air pollutant concentrations and the relationship with all-cause mortality and stroke in older men. Epidemiology. 2019;30 Suppl 1:S82-S89.
DuPré NC, Hart JE, Holmes MD, et coll. Particulate matter and traffic-related exposures in relation to breast cancer survival. Cancer Epidemiol Biomarkers Prev. 2019;28(4):751-759.
Edwards S, Zhao G, Tran J, et coll. Pathological cardiopulmonary evaluation of rats chronically exposed to traffic-related air pollution. Environ Health Perspect. 2020;128(12):127003.
Finkelstein MM, Jerrett M, Sears MR. Environmental inequality and circulatory disease mortality gradients. J Epidemiol Community Health. 2005;59(6):481-487.
Finkelstein MM, Jerrett M, Sears MR. Traffic air pollution and mortality rate advancement periods. Am J Epidemiol. 2004;160(2):173-177.
Gan WQ, FitzGerald JM, Carlsten C, Sadatsafavi M, Brauer M. Associations of ambient air pollution with chronic obstructive pulmonary disease hospitalization and mortality. Am J Respir Crit Care Med. 2013;187(7):721-727.
Gan WQ, Koehoorn M, Davies HW, Demers PA, Tamburic L, Brauer M. Long-term exposure to traffic-related air pollution and the risk of coronary heart disease hospitalization and mortality. Environ Health Perspect. 2011;119(4):501-507.
Gan WQ, Tamburic L, Davies HW, Demers PA, Koehoorn M, Brauer M. Changes in residential proximity to road traffic and the risk of death from coronary heart disease. Epidemiology. 2010;21(5):642-649.
Gehring U, Heinrich J, Krämer U, et coll. Long-term exposure to ambient air pollution and cardiopulmonary mortality in women. Epidemiology. 2006;17(5):545-551.
Goeminne PC, Bijnens E, Nemery B, Nawrot TS, Dupont LJ. Impact of traffic related air pollution indicators on non-cystic fibrosis bronchiectasis mortality: a cohort analysis. Respir Res. 2014;15(1):108.
Gong X, Zhu L, Liu J, et coll. Exposure to traffic-related fine particulate matter 2.5 causes respiratory damage via peroxisome proliferator-activated receptor gamma-regulated inflammation. Environ Toxicol. 2022;37(9):2178-2188.
Hadley MB, Nalini M, Adhikari S, et coll. Spatial environmental factors predict cardiovascular and all-cause mortality: Results of the SPACE study. PLoS One. 2022;17(6):e0269650.
Hamra GB, Laden F, Cohen AJ, Raaschou-Nielsen O, Brauer M, Loomis D. Lung cancer and exposure to nitrogen dioxide and traffic: A systematic review and meta-analysis. Environ Health Perspect. 2015;123(11):1107-1112.
Han B, Zhao R, Zhang N, et coll. Acute cardiovascular effects of traffic-related air pollution (TRAP) exposure in healthy adults: A randomized, blinded, crossover intervention study. Environ Pollut. 2021;288:117583.
Han B, Zhang N, Zhao R, et coll. A randomized, double-blind, crossover intervention study of traffic-related air pollution and airway inflammation in healthy adults. Environ Epidemiol. 2019;3(5):e066.
Hanigan IC, Rolfe MI, Knibbs LD, et coll. All-cause mortality and long-term exposure to low level air pollution in the "45 and up study" cohort, Sydney, Australia, 2006–2015. Environ Int. 2019;126:762-770.
Hart JE, Chiuve SE, Laden F, Albert CM. Roadway proximity and risk of sudden cardiac death in women. Circulation. 2014;130(17):1474-1482.
Hart JE, Rimm EB, Rexrode KM, Laden F. Changes in traffic exposure and the risk of incident myocardial infarction and all-cause mortality. Epidemiology. 2013;24(5):734-742.
Health Effects Institute. Protocol for a systematic review and meta-analysis of selected health effects of long-term exposure to traffic-related air pollution. Boston, MA : Health Effects Institute; 2019.
HEI Panel on the Health Effects of Long-Term Exposure to Traffic-Related Air Pollution. Systematic review and meta-analysis of selected health effects of long-term exposure to traffic-related air pollution. HEI Special Report 23. Boston, MA : Health Effects Institute; 2022.
HEI Panel on the Health Effects of Traffic-Related Air Pollution. Traffic-related air pollution: a critical review of the literature on emissions, exposure, and health effects. HEI Special Report 17. Boston, MA : Health Effects Institute; 2010.
Heinrich J, Thiering E, Rzehak P, et coll. Long-term exposure to NO2 and PM10 and all-cause and cause-specific mortality in a prospective cohort of women. Occup Environ Med. 2013;70(3):179-186.
Higgins JPT, Thomas J, Chandler J, et coll. (réviseurs). Cochrane Handbook for Systematic Reviews of Interventions version 6.3 (updated February 2022). Cochrane, 2022. Accessible à l'adresse www.training.cochrane.org/handbook.
Higgins JPT, Altman DG, Gøtzsche PC, et coll. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
Hoek G, Brunekreef B, Goldbohm S, Fischer P, van den Brandt PA. Association between mortality and indicators of traffic-related air pollution in the Netherlands: a cohort study. Lancet. 2002;360(9341):1203-1209.
Huang J, Deng F, Wu S, Lu H, Hao Y, Guo X. The impacts of short-term exposure to noise and traffic-related air pollution on heart rate variability in young healthy adults. J Expo Sci Environ Epidemiol. 2013;23(5):559-564.
Huangfu P, Atkinson R. Long-term exposure to NO2 and O3 and all-cause and respiratory mortality: A systematic review and meta-analysis. Environ Int. 2020;144:105998.
Hudda N, Eliasziw M, Hersey SO, et coll. Effect of reducing ambient traffic-related air pollution on blood pressure: a randomized crossover trial. Hypertension. 2021;77(3):823-832.
Huss A, Spoerri A, Egger M, Röösli M; Swiss National Cohort Study Group. Aircraft noise, air pollution, and mortality from myocardial infarction. Epidemiology. 2010;21(6):829-836.
Jerrett M, Finkelstein MM, Brook JR, et coll. A cohort study of traffic-related air pollution and mortality in Toronto, Ontario, Canada. Environ Health Perspect. 2009;117(5):772-777.
Jerrett M, Burnett RT, Ma R, et coll. Spatial analysis of air pollution and mortality in Los Angeles. Epidemiology. 2005;16(6):727-736.
Jheng YT, Putri DU, Chuang HC, et coll. Prolonged exposure to traffic-related particulate matter and gaseous pollutants implicate distinct molecular mechanisms of lung injury in rats. Part Fibre Toxicol. 2021;18(1):24.
Jiang Y, Niu Y, Xia Y, et coll. Effects of personal nitrogen dioxide exposure on airway inflammation and lung function. Environ Res. 2019;177:108620.
Jiang S, Bo L, Gong C, et coll. Traffic-related air pollution is associated with cardio-metabolic biomarkers in general residents. Int Arch Occup Environ Health. 2016;89(6):911-921.
Jiang R, Jones MJ, Sava F, Kobor MS, Carlsten C. Short-term diesel exhaust inhalation in a controlled human crossover study is associated with changes in DNA methylation of circulating mononuclear cells in asthmatics. Part Fibre Toxicol. 2014;11:71.
Judek S, Stieb D, Xi G, Jovic B, Edwards B. Air Quality Benefits Assessment Tool (AQBAT) – User Guide – Version 3. Healthy Environments and Consumer Safety Branch, Health Canada. 2019. 205 pp.
Khreis H, Nieuwenhuijsen MJ. Traffic-related air pollution and childhood asthma: Recent advances and remaining gaps in the exposure assessment methods. Int J Environ Res Public Health. 2017;14(3):312.
Khreis H, Kelly C, Tate J, Parslow R, Lucas K, Nieuwenhuijsen M. Exposure to traffic-related air pollution and risk of development of childhood asthma: A systematic review and meta-analysis. Environ Int. 2017;100:1-31.
Krewski D, Jerrett M, Burnett RT, et coll. Extended follow-up and spatial analysis of the American Cancer Society study linking particulate air pollution and mortality. Res Rep Health Eff Inst. 2009;(140):5-136.
Krishnan RM, Sullivan JH, Carlsten C, et coll. A randomized cross-over study of inhalation of diesel exhaust, hematological indices, and endothelial markers in humans. Part Fibre Toxicol. 2013;10:7.
Kubesch N, De Nazelle A, Guerra S, et coll. Arterial blood pressure responses to short-term exposure to low and high traffic-related air pollution with and without moderate physical activity. Eur J Prev Cardiol. 2015;22(5):548-557.
Kulick ER, Wellenius GA, Boehme AK, Sacco RL, Elkind MS. Residential proximity to major roadways and risk of incident ischemic stroke in NOMAS (The Northern Manhattan Study). Stroke. 2018;49(4):835-841.
Ladva CN, Golan R, Liang D, et coll. Particulate metal exposures induce plasma metabolome changes in a commuter panel study. PLoS One. 2018;13(9):e0203468.
Lam J, Sutton P, Kalkbrenner A, et coll. A systematic review and meta-analysis of multiple airborne pollutants and autism spectrum disorder. PLoS One. 2016;11(9):e0161851.
Liang D, Moutinho JL, Golan R, et coll. Use of high-resolution metabolomics for the identification of metabolic signals associated with traffic-related air pollution. Environ Int. 2018;120:145-154.
Maheswaran R, Pearson T, Smeeton NC, Beevers SD, Campbell MJ, Wolfe CD. Impact of outdoor air pollution on survival after stroke: population-based cohort study. Stroke. 2010;41(5):869-877.
Mallach G, Shutt R, Thomson EM, Valcin F, Kulka R, Weichenthal S. Randomized cross-over study of in-vehicle cabin air filtration, air pollution exposure, and acute changes to heart rate variability, saliva cortisol, and cognitive function. Environ Sci Technol. 2023;57(8):3238-3247.
Matt F, Cole-Hunter T, Donaire-Gonzalez D, et coll. Acute respiratory response to traffic-related air pollution during physical activity performance. Environ Int. 2016;97:45-55.
Matz CJ, Egyed M, Hocking R, Seenundun S, Charman N, Edmonds N. Human health effects of traffic-related air pollution (TRAP): A scoping review protocol. Syst Rev. 2019;8:223.
Medina-Ramón M, Goldberg R, Melly S, Mittleman MA, Schwartz J. Residential exposure to traffic-related air pollution and survival after heart failure. Environ Health Perspect. 2008;116(4):481-485.
Mirowsky JE, Peltier RE, Lippmann M, et coll. Repeated measures of inflammation, blood pressure, and heart rate variability associated with traffic exposures in healthy adults. Environ Health. 2015;14:66.
Naess Ø, Nafstad P, Aamodt G, Claussen B, Rosland P. Relation between concentration of air pollution and cause-specific mortality: four-year exposures to nitrogen dioxide and particulate matter pollutants in 470 neighborhoods in Oslo, Norway. Am J Epidemiol. 2007;165(4):435-443.
Nafstad P, Håheim LL, Wisløff T, et coll. Urban air pollution and mortality in a cohort of Norwegian men. Environ Health Perspect. 2004;112(5):610-615.
Nawrot TS, Vos R, Jacobs L, et coll. The impact of traffic air pollution on bronchiolitis obliterans syndrome and mortality after lung transplantation. Thorax. 2011;66(9):748-754.
Nieuwenhuijsen MJ, Gascon M, Martinez D, et coll. Air pollution, noise, blue space, and green space and premature mortality in Barcelona: a mega cohort. Int J Environ Res Public Health. 2018;15(11):2405.
OMS. WHO global air quality guidelines: particulate matter (PM2,5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide. Organisation mondiale de la santé. 2021. https://apps.who.int/iris/handle/10665/345329.
Orach J, Rider CF, Yuen ACY, Carlsten C. Concentration-dependent increase in symptoms due to diesel exhaust in a controlled human exposure study. Part Fibre Toxicol. 2022;19(1):66.
Pan WC, Yeh SY, Wu CD, et coll. Association between traffic count and cardiovascular mortality: A prospective cohort study in Taiwan. J Epidemiol. 2021;31(5):343-349.
R Core Team. R: A language and environment for statistical computing. In: R Foundation for Statistical Computing [Internet]. 2021 [cité le 6 septembre 2022]. Accessible à l'adresse https://www.R-project.org/.
Raaschou-Nielsen O, Andersen ZJ, Jensen SS, et coll. Traffic air pollution and mortality from cardiovascular disease and all causes: a Danish cohort study. Environ Health. 2012;11:60.
Rosenlund M, Bellander T, Nordquist T, Alfredsson L. Traffic-generated air pollution and myocardial infarction. Epidemiology. 2009;20(2):265-271.
Rosenlund M, Picciotto S, Forastiere F, Stafoggia M, Perucci CA. Traffic-related air pollution in relation to incidence and prognosis of coronary heart disease. Epidemiology. 2008;19(1):121-128.
Rosenlund M, Berglind N, Pershagen G, Hallqvist J, Jonson T, Bellander T. Long-term exposure to urban air pollution and myocardial infarction. Epidemiology. 2006;17(4):383-390.
Ruttens D, Verleden SE, Bijnens EM, et coll. An association of particulate air pollution and traffic exposure with mortality after lung transplantation in Europe. Eur Respir J. 2017;49(1):1600484.
Sack CS, Jansen KL, Cosselman KE, et coll. Pretreatment with antioxidants augments the acute arterial vasoconstriction caused by diesel exhaust inhalation. Am J Respir Crit Care Med. 2016;193(9):1000-1007.
Samara C, Kouras A, Kaidoglou K, et coll. Ultrastructural alterations in the mouse lung caused by real-life ambient PM10 at urban traffic sites. Sci Total Environ. 2015;532:327-336.
Santé Canada. Exposition à la pollution atmosphérique liée à la circulation automobile au Canada : une évaluation de la proximité des populations aux routes; 2022a. https://publications.gc.ca/collections/collection_2022/sc-hc/H144-99-2022-fra.pdf
Santé Canada. Impacts sanitaires de la pollution atmosphérique liée à la circulation automobile au Canada. Ottawa, Ontario, Canada : Santé Canada; 2022b. https://publications.gc.ca/collections/collection_2022/sc-hc/H144-91-2022-fra.pdf
Santé Canada. Pollution atmosphérique liée à la circulation automobile : évaluation des risques pour la santé humaine selon une revue globale axée sur certains types de cancer. Ottawa, Ontario, Canada : Santé Canada; 2022c.https://publications.gc.ca/collections/collection_2022/sc-hc/H144-97-2022-fra.pdf
Santé Canada. Cancer du poumon et PM2,5 ambiantes au Canada : revue systématique et méta-analyse. Ottawa, Ontario, Canada : Santé Canada; 2022d. https://publications.gc.ca/collections/collection_2022/sc-hc/H144-98-2022-fra.pdf
Santé Canada. Pollution atmosphérique liée à la circulation automobile : asthme, allergies et fonction pulmonaire. Ottawa, Ontario, Canada : Santé Canada; 2020. https://publications.gc.ca/site/fra/9.887339/publication.html
Santé Canada. Évaluation des risques pour la santé humaine des gaz d'échappement des moteurs à essence. Ottawa, Ontario, Canada : Santé Canada; 2017. https://publications.gc.ca/collections/collection_2017/sc-hc/H144-52-2017-fra.pdf
Santé Canada. Évaluation des risques pour la santé humaine du dioxyde d'azote ambiant. Ottawa, Ontario, Canada : Santé Canada; 2016a. https://publications.gc.ca/collections/collection_2016/sc-hc/H114-31-2016-fra.pdf
Santé Canada. Évaluation des risques pour la santé humaine des gaz d'échappement des moteurs diesel. Ottawa, Ontario, Canada : Santé Canada; 2016b. https://publications.gc.ca/collections/collection_2016/sc-hc/H129-60-2016-fra.pdf
Sarnat JA, Golan R, Greenwald R, et coll. Exposure to traffic pollution, acute inflammation and autonomic response in a panel of car commuters. Environ Res. 2014;133:66-76.
Shang Y, Fan L, Feng J, et coll. Genotoxic and inflammatory effects of organic extracts from traffic-related particulate matter in human lung epithelial A549 cells: the role of quinones. Toxicol In Vitro. 2013;27(2):922-931.
Shields KN, Cavallari JM, Hunt MJ, et coll. Traffic-related air pollution exposures and changes in heart rate variability in Mexico City: a panel study. Environ Health. 2013;12:7.
So R, Jørgensen JT, Lim YH, et coll. Long-term exposure to low levels of air pollution and mortality adjusting for road traffic noise: A Danish Nurse Cohort study. Environ Int. 2020;143:105983.
Statistique Canada. Les principales causes de décès, population totale, selon le groupe d'âge. Tableau : 13-10-0394-01. 2022. Les principales causes de décès, population totale, selon le groupe d'âge (statcan.gc.ca)
Stieb DM, Berjawi R, Emode M, et coll. Systematic review and meta-analysis of cohort studies of long term outdoor nitrogen dioxide exposure and mortality. PLoS One. 2021;16(2):e0246451.
Stockfelt L, Andersson EM, Molnár P, et coll. Long term effects of residential NO(x) exposure on total and cause-specific mortality and incidence of myocardial infarction in a Swedish cohort. Environ Res. 2015;142:197-206.
Tong H, Rappold AG, Caughey M, et coll. Cardiovascular effects caused by increasing concentrations of diesel exhaust in middle-aged healthy GSTM1 null human volunteers. Inhal Toxicol. 2014;26(6):319-326.
Tonne C, Halonen JI, Beevers SD, et coll. Long-term traffic air and noise pollution in relation to mortality and hospital readmission among myocardial infarction survivors. Int J Hyg Environ Health. 2016;219(1):72-78.
US EPA. Preamble to the Integrated Science Assessments (ISA). EPA/600/R-15/067. Washington, DC : United States Environmental Protection Agency; 2015.
Van Den Heuvel R, Den Hond E, Govarts E, et coll. Identification of PM10 characteristics involved in cellular responses in human bronchial epithelial cells (Beas-2B). Environ Res. 2016;149:48-56.
van Donkelaar A, Martin RV, Brauer M, Boys BL. Use of satellite observations for long-term exposure assessment of global concentrations of fine particulate matter. Environ Health Perspect. 2015 Feb;123(2):135–43.
Viechtbauer W. Conducting Meta-Analyses in R with the metafor Package. J Stat Soft. 2010 Aug 5;36(3):1–48.
Villanueva C, Chang J, Ziogas A, Bristow RE, Vieira VM. Ambient air pollution and ovarian cancer survival in California. Gynecol Oncol. 2021;163(1):155-161.
Villeneuve PJ, Jerrett M, Su J, et coll. A cohort study of intra-urban variations in volatile organic compounds and mortality, Toronto, Canada. Environ Pollut. 2013;183:30-39.
Von Klot S, Gryparis A, Tonne C, et coll. Elemental carbon exposure at residence and survival after acute myocardial infarction. Epidemiology. 2009;20(4):547-554.
Wang T, Xu H, Zhu Y, et coll. Traffic-related air pollution associated pulmonary pathophysiologic changes and cardiac injury in elderly patients with COPD. J Hazard Mater. 2022;424(Pt B):127463.
Weichenthal S, Hatzopoulou M, Goldberg MS. Exposure to traffic-related air pollution during physical activity and acute changes in blood pressure, autonomic and micro-vascular function in women: a cross-over study. Part Fibre Toxicol. 2014;11:70.
Wilker EH, Mostofsky E, Lue SH, et coll. Residential proximity to high-traffic roadways and poststroke mortality. J Stroke Cerebrovasc Dis. 2013;22(8):e366-e372.
Xiao J, Cheng P, Ma P, et coll. Toxicological effects of traffic-related air pollution on the lungs: Evidence, biomarkers and intervention. Ecotoxicol Environ Saf. 2022;238:113570.
Xu J, Zhang N, Zhang G, et coll. Short-term effects of the toxic component of traffic-related air pollution (TRAP) on lung function in healthy adults using a powered air purifying respirator (PAPR). Environ Res. 2022;214(Pt 1):113745.
Yang Y, Tang R, Qiu H, et coll. Long term exposure to air pollution and mortality in an elderly cohort in Hong Kong. Environ Int. 2018;117:99-106.
Yorifuji T, Kashima S, Tsuda T, et coll. Long-term exposure to traffic-related air pollution and the risk of death from hemorrhagic stroke and lung cancer in Shizuoka, Japan. Sci Total Environ. 2013;443:397-402.
Yorifuji T, Kashima S, Tsuda T, et coll. Long-term exposure to traffic-related air pollution and mortality in Shizuoka, Japan. Occup Environ Med. 2010;67(2):111-117.
Zhang Q, Du X, Li H, et coll. Cardiovascular effects of traffic-related air pollution: A multi-omics analysis from a randomized, crossover trial. J Hazard Mater. 2022;435:129031.
Zhao J, Mi X, Zhao L, et coll. Validation of PM2.5 model particle through physicochemical evaluation and atherosclerotic plaque formation in ApoE-/- mice. Ecotoxicol Environ Saf. 2020;192:110308.
Zhao J, Bo L, Gong C, et coll. Preliminary study to explore gene-PM2.5 interactive effects on respiratory system in traffic policemen. Int J Occup Med Environ Health. 2015;28(6):971-983.
Annexe. Détails des études par mesure d’exposition
Les détails de l’étude concernant la population à l’étude, l’évaluation de l’exposition, les facteurs de confusion et les ER sont fournis dans la présente annexe par polluant ou mesure de la circulation automobile et de l’infrastructure du réseau routier.
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | AugmentationNote a | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Gan et coll., 2011 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, en Colombie-Britannique, âgés de 45 à 85 ans Hommes : 45,3 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
406 232 |
MCO : |
8,4 μg/m3 |
MCO : |
Chen et coll., 2013 |
Cohorte d'impôts de l'Ontario |
Résidents de Toronto, Hamilton ou Windsor (Ontario) Les 3 villes : |
Modèle de la RUT (code postal résidentiel) Toronto : Hamilton : Windsor : |
Âge, sexe, SSE individuel, SSE régional, ajustement indirect pour le tabagisme (données de l'ESCC de 2001), état matrimonial |
Villes regroupées (Hamilton, Toronto, Windsor) : |
MSC : |
5 ppb (9,4 µg/m3) |
MSC : |
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
Gan et coll., 2013 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, en Colombie-Britannique, âgés de 45 à 85 ans Hommes : 47,1 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional |
465 360 |
MPOC : |
8,4 μg/m3 |
MPOC : |
Villeneuve et coll., 2013 |
Cohorte d'impôts de l'Ontario |
Canadiens produisant des déclarations de revenus sélectionnés de façon aléatoire dans dix régions urbaines de l'Ontario, limitées à Toronto, âgés de ≥ 35 ans Hommes : 50,4 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, indirectement ajusté en fonction du tabagisme |
58 760 |
Toutes causes confondues : |
5,92 ppb (11,13 µg/m3) |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Crouse et coll., 2015 |
Cohorte CSERCan (1991-2006) |
Participants de la cohorte âgés de ≥ 25 ans qui ont rempli le questionnaire détaillé du recensement dans dix villes (individuellement) du Canada Hommes : 48,0 % |
Modèle de la RUT (au sein de la ville; adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, ajustement indirect en fonction du tabagisme et de l'IMC, ascendance autochtone, statut de minorité, autres indicateurs du SSE individuel et au niveau régional |
735 590 |
Toutes causes confondues : |
5 ppb (9,4 µg/m3) |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV: |
MCV: |
|||||||
TR : |
TR : |
|||||||
| Canada – Population de patients | ||||||||
Jerrett et coll., 2009 |
Cohorte |
Patients adultes d'une clinique de maladies respiratoires à Toronto (Ontario) Hommes : 48 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, IMC et fonction pulmonaire |
2 360 |
Toutes causes confondues : |
4 ppb (7,52 µg/m3) |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
| É.-U. – Population générale | ||||||||
Alexeeff et coll., 2018 |
Cohorte |
Membres adultes du système de soins de santé Kaiser Permanente Northern California vivant à Oakland (Californie) pendant la période d'étude – ceux qui avaient des antécédents de MSC ont été exclus Hommes : 47,0 % |
Modèle hybride ou autre (adresse résidentielle)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, race, IMC, état de santé |
41 869 |
MCO : |
3,8 ppb (7,14 µg/m3) |
MCO : |
MCV : |
MCV : |
|||||||
| Europe – Population générale | ||||||||
Rosenlund et coll., 2006 |
Cas-témoins du programme d'épidémiologie cardiaque de Stockholm (1992-1994) |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 45 à 70 ans Hommes (cas; témoins) : 66 %; 65 % |
Modèle de dispersion (adresse résidentielle) Cas : Témoins : |
Âge, sexe, SSE individuel, tabagisme individuel, diabète, activité physique |
3 210 |
IM : |
30 µg/m3 |
IM : |
Naess et coll., 2007 |
Cohorte |
Résidents âgés de 51 à 90 ans des 470 quartiers d'Oslo (Norvège) |
Modèle de dispersion (au niveau du quartier)
|
Âge, sexe, SSE individuel, autres indicateurs du SSE |
143 842 |
MSC : 71 à 90 ans |
Augmentation du quartile (non précisée) |
MSC : 71 à 90 ans |
MPOC : 71 à 90 ans |
MPOC : 71 à 90 ans |
|||||||
Rosenlund et coll., 2008 |
Cohorte |
Résidents de Rome (Italie) âgés de 35 à 84 ans qui ont connu le premier événement coronarien Hommes : 68,3 % |
Modèle de la RUT (adresse résidentielle; îlot de recensement) 5e à 95e centile : 33,0 à 60,1 μg/m3 |
Âge, sexe, SSE au niveau régional |
11 167 |
MCO : |
10 µg/m3 |
MCO : |
Rosenlund et coll., 2009 |
Cas-témoins |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 15 à 79 ans Hommes (cas; témoins) : 69 %; 49 % |
Modèle de dispersion (adresse résidentielle) Cas : |
Âge, sexe, SSE individuel, année civile |
301 273 |
IM : |
30 µg/m3 |
IM : |
Cesaroni et coll., 2012 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de 45 à 80 ans qui résidaient à Rome (Italie) ≥ 5 ans Limité aux participants qui n'ont pas changé d'adresse pendant la période d'étude |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, lieu de naissance |
684 013 |
Toutes causes confondues : 45 006 |
10 µg/m3 |
Toutes causes confondues : |
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé (1993-2009) |
Adultes âgés de 50 à 64 ans vivant dans les régions de Copenhague et d'Aarhus, nés au Danemark et n'ayant jamais reçu de diagnostic de cancer Hommes : 47,5 % |
Modèle hybride (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, variables liées au mode de vie et à l'alimentation, exposition professionnelle, état matrimonial |
52 061 |
Toutes causes confondues : 5 534 |
Par doublement (transformé par log base 2) μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
Carey et coll., 2013 |
Cohorte |
Patients âgés de 40 à 89 ans de 205 cliniques en Angleterre (R.-U.) entièrement inscrits pour au moins 1 an le 1er janvier 2003 Hommes : 48,4 % |
Modèle de dispersion (centroïde du code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, IMC |
830 429 |
Toutes causes confondues : 82 421 |
10,7 μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Cesaroni et coll., 2013 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans
|
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 43,6 (8,4) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, lieu de naissance |
1 265 058 |
Toutes causes confondues : 144 441 |
10 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Âge moyen au niveau de référence (écart-type) : 41,1 (11,8) à 70,3 (8,1) ans |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 251 |
Toutes causes confondues : 29 076 |
10 µg/m3 |
Toutes causes confondues : |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 383 |
MSC : |
10 µg/m3 |
MSC : |
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
10 µg/m3 |
TR : |
Nieuwenhuijsen et coll., 2018 |
Cohorte |
Adultes ≥ 18 ans, inscrits dans le SIDIAP et vivant à Barcelone; le SIDIAP représente 80 % de la population totale de la Catalogne (Espagne) Hommes : 53 % |
Modèle de la RUT (secteur de recensement) Moyenne géométrique (IC à 95 %) : 53,42 (53,40 à 53,45) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
792 649 |
Toutes causes confondues : 28 391 |
5 µg/m3 |
Toutes causes confondues : |
| Europe – Population de patients | ||||||||
Rosenlund et coll., 2008 |
Cohorte |
Résidents de Rome (Italie) âgés de 35 à 84 ans qui ont survécu au premier événement coronarien (1998-2000) à ≥ 28 jours Hommes : 72,3 % |
Modèle de la RUT (adresse résidentielle; îlot de recensement)
|
Âge, sexe, SSE au niveau régional |
6 513 |
Toutes causes confondues : 1 802 |
10 µg/m3 |
Toutes causes confondues : |
Maheswaran et coll., 2010 |
Cohorte |
Patients résidant à Londres (R.-U.) qui ont subi le tout premier AVC, 1995 à 2005 À l'échelle des concentrations d'exposition catégorisées : |
Modèle hybride (adresse résidentielle) Moyenne (écart-type) : 41 (3,3) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, variables liées au mode de vie, comorbidités, variables médicales |
3 320 |
Toutes causes confondues : 1 856 |
10 µg/m3 |
Toutes causes confondues : |
Desikan et coll., 2016 |
Cohorte |
South London Stroke Register (R.-U.), un registre basé sur la population des AVC Hommes : 52,3 % |
Modèle de dispersion (code postal résidentiel) Moyenne (écart-type) : 44,59 (4,29) μg/m3 |
Âge, sexe, SSE au niveau régional, origine ethnique, variables propres à l'AVC |
1 800 |
Toutes causes confondues : |
5,04 μg/m3 |
Toutes causes confondues : |
Tonne et coll., 2016 |
Cohorte |
Patients > 25 ans du Grand Londres (R.-U.) admis à l'hôpital avec un IM, hôpitaux qui avaient > 10 admissions avec STEMI ou des admissions sans STEMI Hommes : 68 % |
Modèle de dispersion (centroïde du code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, antécédents médicaux, IM et variables propres aux STEMI |
18 138 |
Toutes causes confondues : 5 129 |
8 µg/m3 |
Toutes causes confondues : |
| Asie – Population générale | ||||||||
Yorifuji et coll., 2010 |
Cohorte de personnes âgées de Shizuoka |
Adultes ≥ 65 ans vivant à Shizuoka (Japon), en 1999 Femmes = 48 % à 49 % Participants exclus qui ont déménagé pendant la période d'études |
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 25 (12) μg/m3 |
Âge, sexe, SSE individuel, tabagisme individuel, IMC, comorbidités |
12 029 |
Toutes causes confondues : 1 232 |
10 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
Autres maladies cardiaquesNote c : |
Autres maladies cardiaquesNote c : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
G et P : |
G et P : |
|||||||
MPOC : |
MPOC : |
|||||||
Yorifuji et coll., 2013 |
Cohorte de personnes âgées de Shizuoka |
Adultes ≥ 65 ans vivant à Shizuoka (Japon), en 1999 Femmes : 48,9 % Participants exclus qui ont déménagé pendant la période d'études |
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 22 (15) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, IMC, comorbidités |
13 412 |
Toutes causes confondues : 1 663 |
10 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
Autres maladies cardiaquesNote c : |
Autres maladies cardiaquesNote c : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
G et P : |
G et P : |
|||||||
MPOC : |
MPOC : |
|||||||
Barratt et coll., 2018 |
Cohorte du service de santé aux personnes âgées |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong; les participants vivaient dans des immeubles de grande hauteur sous le 20e étage avec des fenêtres ouvrantes en bordure de rue Hommes : 32,6 % |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
60 548 |
Toutes causes confondues : 16 006 |
26 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Pneumonie : 2 057 |
Pneumonie : |
|||||||
MPOC : |
MPOC : |
|||||||
Yang et coll., 2018 |
Cohorte |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong Hommes : 33 % |
Modèle de la RUT (adresse résidentielle) Médiane : 104 μg/m3 |
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
61 386 |
Non explicite |
25,6 µg/m3 |
Toutes causes confondues : MSC : MCO : MCV : TR : Pneumonie : MPOC : |
| Australie – Population générale | ||||||||
Dirgawati et coll., 2019 |
Cohorte |
Hommes âgés de ≥ 65 ans, recrutés à l'origine pour un essai contrôlé randomisé sur l'anévrisme de l'aorte abdominale à Perth Âge moyen (écart-type) : 72,1 (4,4) ans |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel, tabagisme individuel, IMC |
Toutes causes confondues : |
Toutes causes confondues : 6 284 |
10 µg/m3 |
Toutes causes confondues : |
ACV : |
ACV : |
ACV : |
||||||
Hanigan et coll., 2019 |
Cohorte |
Participants ≥ 45 ans et < 80 ans résidant à Sydney Hommes : 47,6 % |
Modèle hybride (adresse résidentielle)
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, consommation d'alcool, IMC, état matrimonial, activité physique et autres variables démographiques |
75 145 |
Toutes causes confondues : 3 280 |
5 µg/m3 |
Toutes causes confondues : |
Abréviations : AVC : accident vasculaire cérébral; CSERCan : Cohorte santé et environnement du recensement canadien; EI : Écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; ESCC : Enquête sur la santé dans les collectivités canadiennes; G et P : grippe et pneumonie; IC : Intervalle de confiance; ICA : insuffisance cardiaque; IM : Infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MSC : Maladie du système circulatoire; MPOC : Maladie pulmonaire obstructive chronique; MCV : Maladie cérébrovasculaire; ppb : Parties par milliard; RR : Risque relatif; RTM : Ratio des taux de mortalité; RUT : Régression d'utilisation des terres; SIDIAP : Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària; SSE : Statut socio-économique; STEMI : Infarctus du myocarde avec élévation du segment ST; TR : Trouble respiratoire.
|
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et/ou covariables | Total N | Cas | AugmentationNote a | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Europe – Population générale | ||||||||
Nafstad et coll., 2004 |
Cohorte |
Hommes âgés de 40 à 49 ans résidant à Oslo (Norvège) |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE individuel, tabagisme individuel, activité physique, risque de maladies cardiovasculaires |
16 209 |
Toutes causes confondues : 4 227 |
10 µg/m3 |
Toutes causes confondues : |
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : 8,7 (5,7) à 107,3 (24,1) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 251 |
Toutes causes confondues : 29 076 |
20 µg/m3 |
Toutes causes confondues : |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : 8,7 (5,7) à 107,3 (24,1) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 383 |
MSC : |
20 µg/m3 |
MSC : |
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : 8,7 (5,7) à 96,1 (21,0) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
10 µg/m3 |
TR : |
Stockfelt et coll., 2015 |
Cohorte |
Hommes de Göteborg, nés en Suède de 1915 à 1925 (sauf 1923) Âge moyen (plage) : 53,2 (48 à 58) ans |
Modèle de dispersion (adresse résidentielle) Plage médiane : 17 à 44 μg/m3 |
Âge, sexe, SSE individuel, tabagisme individuel |
7 494 |
Toutes causes confondues : 4 047 |
10 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Bauleo et coll., 2019 |
Cohorte |
Tous les résidents (âgés de 18 ans et plus) vivant à Civitavecchia (Italie) le 1er janvier 1996 Femmes : 52,3 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE au niveau régional, lieu de naissance |
71 362 |
Toutes causes confondues : 13 687 |
12,77 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
Maladies cardiaques : |
Maladies cardiaques : |
|||||||
MCO : |
MCO : |
|||||||
ECA : |
ECA : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
MPOC : |
MPOC : |
|||||||
Andersson et coll., 2020 |
Cohorte de |
Tiers aléatoire de tous les hommes de Göteborg (Suède) nés entre 1915 et 1925 Âge moyen (en 1978) : 58,2 ans 80 % des membres de la cohorte décédés avant 2011 |
Modèle de dispersion (adresse résidentielle) NOx moyen passé de 53 μg/m3 en 1978 à 29 μg/m3 en 2010 Groupe de référence : |
Âge, sexe, SSE individuel, tabagisme individuel, état matrimonial, IMC, hérédité, variables de mode de vie, variables médicales |
6 304 |
Toutes causes confondues : 3 182 |
Par quintile : |
Toutes causes confondues; par quintile :
|
MSC : |
MSC; par quintile :
|
|||||||
Carlsen et coll., 2022 |
Cohorte sur l'alimentation et le cancer de Malmö |
Sélection aléatoire de personnes nées de 1923 à 1950 à Malmö (Suède); suivi moyen : 20 ans Femmes : 60,3 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, activité physique, état de santé, autres facteurs liés au mode de vie |
25 823 |
IM : |
9,62 μg/m3 |
IM : |
| Europe – Population de patients | ||||||||
Desikan et coll., 2016 |
Cohorte |
South London Stroke Register (R.-U.), un registre basé sur la population des AVC Hommes : 52,3 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE régional, origine ethnique, variables propres à l'AVC |
1 800 |
Toutes causes confondues : 729 |
13,99 μg/m3 |
Toutes causes confondues : |
Tonne et coll., 2016 |
Cohorte |
Patients > 25 ans du Grand Londres (R.-U.) admis à l'hôpital avec un IM, hôpitaux qui avaient > 10 admissions avec STEMI ou des admissions sans STEMI Hommes : 68 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, antécédents médicaux, IM et variables propres aux STEMI |
18 138 |
Toutes causes confondues : 5 129 |
19,2 μg/m3 |
Toutes causes confondues : |
| Asie – Patients/population mixte | ||||||||
Cohen et coll., 2019 |
Cohorte |
Patients subissant des interventions coronariennes percutanées au service de cardiologie du Rabin Medical Center en Israël Femmes : 24 % |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, comorbidités |
3 051 |
Toutes causes confondues : 1 606 |
Élevé par rapport à faible (ppb) |
Toutes causes confondues : |
Modèle de dispersion (adresse résidentielle) Plage : 8,7 à 57,6 ppb |
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, comorbidités |
3 051 |
Toutes causes confondues : 1 714 |
Élevé par rapport à faible (ppb) |
Toutes causes confondues : |
|||
Modèle hybride (adresse résidentielle) Exposition élevée (par RUT) : 25,0 à 86,4 ppb |
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, comorbidités |
3 051 |
Toutes causes confondues : 2 237 |
Élevé par rapport à faible (ppb) |
Toutes causes confondues : |
|||
Cohen et coll., 2021 |
Cohorte |
Résidents israéliens; 2 cohortes basées sur les patients atteints de MCO et 2 cohortes basées sur la population générale Patients appariés (1:1) à des participants sans MCO en fonction de l'âge (± 3 ans) et du sexe Cohorte appariée en fonction de l'âge et du sexe (2 393 paires) : |
Modèle de la RUT (adresse résidentielle) Sans MCO : Avec MCO : Valeur de |
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, comorbidités |
2 393 |
Toutes causes confondues : Sans MCO : 550 Avec MCO : 908 |
10 ppb 15,5 μg/m3 |
Toutes causes confondues : Sans MCO : IR = 1,00 (0,93 à 1,08) Avec MCO : IR = 1,13 (1,05 à 1,22) |
| Australie – Population générale | ||||||||
Dirgawati et coll., 2019 |
Cohorte |
Hommes âgés de ≥ 65 ans, recrutés à l'origine pour un essai contrôlé randomisé sur l'anévrisme de l'aorte abdominale à Perth (Australie) Âge moyen (écart-type) : 72,1 (4,4) ans |
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 32,3 (11,6) μg/m3 |
Âge, sexe, SSE individuel, tabagisme individuel, IMC |
Toutes causes confondues : |
Toutes causes confondues : 6 284 |
10 µg/m3 |
Toutes causes confondues : |
AVC : |
AVC : |
AVC : |
||||||
Abréviations : AVC : accident vasculaire cérébral; ECA : Événements coronariens aigus; EI : Écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; IC : Intervalle de confiance; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCV : Maladie cérébrovasculaire; MI : Infarctus du myocarde; MPOC : Maladie pulmonaire obstructive chronique; MSC : Maladie du système cardiovasculaire; ppb : Parties par milliard; RUT : Régression d'utilisation des terres; SSE : Statut socio-économique; STEMI : Infarctus du myocarde avec élévation du segment ST; TR : Trouble respiratoire.
|
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et/ou covariables | Total N | Cas | AugmentationNote a | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Gan et coll., 2011 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 45,3 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
406 232 |
MCO : |
13,2 μg/m3 |
MCO : |
Gan et coll., 2013 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 47,1 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional |
465 360 |
MPOC : |
13,2 μg/m3 |
MPOC : |
| É.-U. – Population générale | ||||||||
Alexeeff et coll., 2018 |
Cohorte |
Membres adultes du système de soins de santé Kaiser Permanente Northern California vivant à Oakland (Californie) pendant la période d'étude; ceux qui avaient des antécédents de MSC ont été exclus Hommes : 47,0 % |
Modèle hybride ou autre (adresse résidentielle)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, race, IMC, état de santé |
41 869 |
MCO : |
3,8 ppb (4,7 µg/m3) |
MCO : |
MCV : |
MCV : |
|||||||
| Europe – Population de patients | ||||||||
Desikan et coll., 2016 |
Cohorte |
South London Stroke Register (R.-U.), un registre basé sur la population des AVC Hommes : 52,3 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE régional, origine ethnique, variables propres à l'AVC |
1 800 |
Toutes causes confondues : |
8,86 μg/m3 |
Toutes causes confondues : |
| Asie – Population générale | ||||||||
Barratt et coll., 2018 |
Cohorte du service de santé aux personnes âgées |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong; les participants vivaient dans des immeubles de grande hauteur sous le 20e étage avec des fenêtres ouvrantes en bordure de rue Hommes : 32,6 % |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
60 548 |
Toutes causes confondues : 16 006 |
167 μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Pneumonie : |
Pneumonie : |
|||||||
MPOC : |
MPOC : |
|||||||
Abréviations : AVC : accident vasculaire cérébral; EI : Écart interquartile; IC : intervalle de confiance; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCV : Maladie cérébrovasculaire; MPOC : Maladie pulmonaire obstructive chronique; MSC : Maladie du système circulatoire ppb : Parties par milliard; RR : Risque relatif; RUT : Régression d'utilisation des terres; SSE : Statut socio-économique; TR : Trouble respiratoire.
|
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Gan et coll., 2011 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 45,3 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
406 232 |
MCO : |
1,58 μg/m3 |
MCO : |
Gan et coll., 2013 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 47,1 % |
Modèle de la RUT (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
465 360 |
MPOC : |
1,58 μg/m3 |
MPOC : |
| É.-U. – Population générale | ||||||||
Jerrett et coll., 2005 |
Cohorte |
Membres de la cohorte ACS-CPSII avec un code postal à Los Angeles (Californie) (pas plus de détails) |
Modèle hybride ou autre (code postal résidentiel) Plage : 9,0 à 27,1 μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel; comprenait 40 facteurs de confusion individuels (facteurs liés au mode de vie, à l'alimentation, à la démographie, à la profession et à l'éducation) et 8 variables écologiques pour le code postal (revenu, inégalité des revenus, éducation, taille de la population, composition raciale et chômage) |
22 905 |
Toutes causes confondues : |
10 µg/m3 |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
Krewski et coll., 2009 |
Cohorte |
Membres de la cohorte ACS-CPSII avec un code postal de la ville de New York (New York) Hommes : 56,3 % |
Modèle de RUT (code postal résidentiel)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel; comprenait 40 facteurs de confusion individuels (facteurs liés au mode de vie, à l'alimentation, à la démographie, à la profession et à l'éducation) |
44 056 |
Toutes causes confondues : |
1,5 μg/m3 |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
MCO : |
MCO : |
|||||||
Krewski et coll., 2009 |
Cohorte |
Membres de la cohorte ACS-CPSII avec un code postal à Los Angeles (Californie) Hommes : 57 % |
Modèle de RUT (code postal résidentiel)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel; comprenait 40 facteurs de confusion individuels (facteurs liés au mode de vie, à l'alimentation, à la démographie, à la profession et à l'éducation) |
22 905 |
Toutes causes confondues : |
10 µg/m3 |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
MCO : |
MCO : |
|||||||
| Europe – Population générale | ||||||||
Naess et coll., 2007 |
Cohorte |
Résidents âgés de 51 à 90 ans des 470 quartiers d'Oslo (Norvège) |
Modèle de dispersion (au niveau du quartier)
|
Âge, sexe, SSE individuel, autres indicateurs du SSE |
143 842 |
Toutes causes confondues : |
Non précisé |
Toutes causes confondues : |
MSC : 71 à 90 ans |
MSC : 71 à 90 ans |
|||||||
MPOC : 71 à 90 ans |
MPOC : 71 à 90 ans |
|||||||
Carey et coll., 2013 |
Cohorte Clinical Practice Research Datalink (2003-2007) |
Patients âgés de 40 à 89 ans de 205 cliniques en Angleterre (R.-U.) entièrement inscrits pour au moins 1 an le 1er janvier 2003 Hommes : 48,4 % |
Modèle de dispersion (code postal résidentiel)
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, IMC |
830 842 |
Toutes causes confondues : |
1,9 μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Cesaroni et coll., 2013 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans Hommes : 45,5 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, lieu de naissance |
1 265 058 |
Toutes causes confondues : |
10 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : 6,6 (1,2) à 31,0 (1,7) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
322 159 |
Toutes causes confondues : |
5 µg/m3 |
Toutes causes confondues : |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : 6,6 (1,2) à 31,0 (1,7) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 383 |
MSC : |
5 µg/m3 |
MSC : |
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
5 µg/m3 |
TR : |
Badaloni et coll., 2017 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans Hommes : 45,4 % |
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 20 (1,9) μg/m3 |
Âge, sexe, SSE individuel, SSE au niveau régional, ajustement indirect en fonction du tabagisme, état matrimonial, lieu de naissance |
1 249 108 |
Toutes causes confondues : |
6,6 μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
Nieuwenhuijsen et coll., 2018 |
Cohorte SIDIAP (2010-2014) |
Adultes ≥ 18 ans, inscrits dans le SIDIAP et vivant à Barcelone; le SIDIAP représente 80 % de la population totale de la Catalogne (Espagne) Hommes : 53 % |
Modèle de la RUT (secteur de recensement) Moyenne géométrique (IC à 95 %) : 16,08 (16,07, 16,08) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
792 649 |
Toutes causes confondues : |
5 µg/m3 |
Toutes causes confondues : |
So et coll., 2020 |
Cohorte d'infirmières danoises |
Infirmières de > 44 ans recrutées en 1993 ou qui ont eu 44 ans en 1993-1999, recrutées en 1999 Âge moyen (écart-type) au niveau de référence : 53,2 (8,0) ans |
Modèle hybride ou autre (adresse résidentielle) Au niveau de référence : |
Âge, sexe, SSE individuel, tabagisme individuel, IMC, variables du mode de vie, niveau d'activité, état matrimonial, utilisation de l'hormonothérapie |
24 526 |
Toutes causes confondues : |
4,39 μg/m3 |
Toutes causes confondues : |
Carlsen et coll., 2022 |
Cohorte sur l'alimentation et le cancer de Malmö |
Sélection aléatoire des personnes nées entre 1923 et 1950 à Malmö (Suède) Femmes : 60,3 % |
Modèle de dispersion (adresse résidentielle)
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, activité physique, état de santé, autres facteurs liés au mode de vie |
25 823 |
IM : |
1,63 μg/m3 |
IM : |
| Europe – Population de patients | ||||||||
Desikan et coll., 2016 |
Cohorte |
South London Stroke Register (R.-U.), un registre basé sur la population des AVC Hommes : 52,3 % |
Modèle de dispersion (code postal résidentiel)
|
Âge, sexe, SSE régional, origine ethnique, variables propres à l'AVC |
1 800 |
Toutes causes confondues : |
1,86 μg/m3 |
Toutes causes confondues : |
Tonne et coll., 2016 |
Cohorte |
Patients > 25 ans du Grand Londres (R.-U.) admis à l'hôpital avec un IM, hôpitaux qui avaient > 10 admissions avec STEMI ou des admissions sans STEMI Hommes : 68 % |
Modèle de dispersion (centroïde du code postal résidentiel) Véhicules, échappement :
Trafic, non-échappement :
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, antécédents médicaux, IM et variables propres aux STEMI |
18 138 |
Toutes causes confondues : |
Trafic, échappement : Trafic, non-échappement : |
Toutes causes confondues : Trafic, non-échappement : |
| Asie – Population générale | ||||||||
Barratt et coll., 2018 |
Cohorte du service de santé aux personnes âgées |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong; les participants vivaient dans des immeubles de grande hauteur sous le 20e étage avec des fenêtres ouvrantes en bordure de rue Hommes : 32,6 % |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
60 548 |
Toutes causes confondues : |
5,5 μg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Pneumonie : |
Pneumonie : |
|||||||
MPOC : |
MPOC : |
|||||||
Yang et coll., 2018 |
Cohorte du service de santé aux personnes âgées (2001-2011) |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong Hommes : 33 % |
Modèle de la RUT (adresse résidentielle)
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
61 386 |
Non explicite |
5,5 μg/m3 |
Toutes causes confondues : MSC : MCO : MCV : TR : Pneumonie : MPOC : |
| Australie – Population générale | ||||||||
Dirgawati et coll., 2019 |
Cohorte de l'étude sur la santé des hommes (HIMS) |
Hommes âgés de ≥ 65 ans, recrutés à l'origine pour un essai contrôlé randomisé sur l'anévrisme de l'aorte abdominale à Perth (Australie) Âge moyen (écart-type) : 72,1 (4,4) ans |
Modèle de la RUT (adresse résidentielle) Moyenne (écart-type) : 5,1 (1,7) μg/m3 |
Âge, sexe, SSE individuel, tabagisme individuel, IMC |
Toutes causes confondues : |
Toutes causes confondues : |
5 µg/m3 |
Toutes causes confondues : |
ACV : |
ACV : |
ACV : |
||||||
Hanigan et coll., 2019 |
Cohorte |
Participants de ≥ 45 ans et < 80 ans résidant à Sydney (Australie) Hommes : 47,6 % |
Modèle hybride ou autre (adresse résidentielle)
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, consommation d'alcool, IMC, état matrimonial, activité physique et autres variables démographiques |
75 268 |
Toutes causes confondues : |
1 µg/m3 |
Toutes causes confondues : |
Abréviations : ACS-CPSII : American Cancer Society – Cancer Prevention Survey II; AVC : accident vasculaire cérébral; EI : écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; IC : Intervalle de confiance; IM : infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCP : Maladie cardiopulmonaire; MCV : Maladie cérébrovasculaire; MPOC : Maladie pulmonaire obstructive chronique; MSC : Maladie du système circulatoire; RR : Risque relatif; RUT : Régression d'utilisation des terres; SIDIAP : Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària; STEMI : Infarctus du myocarde avec élévation du segment ST; SSE : Statut socio-économique; TR : Trouble respiratoire. |
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Gan et coll., 2011 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 45,3 % |
Modèle de la RUT (code postal résidentiel) CN :
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
406 232 |
MCO : |
CN : |
MCO : |
Gan et coll., 2013 |
Cohorte |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans Hommes : 47,1 % |
Modèle de la RUT (code postal résidentiel) CN :
|
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
465 360 |
MPOC : |
CN : |
MPOC : |
| É.-U. – Population générale | ||||||||
Alexeeff et coll., 2018 |
Cohorte |
Membres adultes du système de soins de santé Kaiser Permanente Northern California vivant à Oakland (Californie) pendant la période d'étude; ceux qui avaient des antécédents de MSC ont été exclus |
Modèle hybride ou autre (adresse résidentielle) CN :
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, race, IMC, état de santé |
41 869 |
MSC : |
CN : |
MSC : |
MCV : |
MCV : |
|||||||
| É.-U. – Population de patients | ||||||||
Von Klot et coll., 2009 |
Cohorte de l'étude sur les crises cardiaques de Worcester |
Patients adultes âgés de ≥ 25 ans de Worcester (Massachusetts), hospitalisés avec un IM aigu Hommes : 59 % |
Modèle de la RUT (adresse résidentielle) CÉ :
|
Âge, sexe, tabagisme individuel, état matrimonial, antécédents médicaux, variables cliniques |
3 169 |
Toutes causes confondues : |
CÉ : |
Toutes causes confondues : |
| Europe – Population générale | ||||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) PM2,5 abs : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
322 159 |
Toutes causes confondues : |
PM2,5 abs : |
Toutes causes confondues : |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Modèle de la RUT (adresse résidentielle) PM2,5 abs : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 383 |
MSC : |
PM2,5 abs : |
MSC : |
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Modèle de RUT (adresse résidentielle) PM2,5 abs : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
PM2,5 abs : |
TR : |
Badaloni et coll., 2017 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans Hommes : 45,4 % |
Modèle de la RUT (adresse résidentielle) PM2,5 abs :
|
Âge, sexe, SSE individuel, SSE régional, état matrimonial, lieu de naissance |
1 249 108 |
Toutes causes confondues : |
PM2,5 abs : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
Nieuwenhuijsen et coll., 2018 |
Cohorte SIDIAP (2010-2014) |
Adultes ≥ 18 ans, inscrits dans le SIDIAP et vivant à Barcelone; le SIDIAP représente 80 % de la population totale de la Catalogne (Espagne) Hommes : 53 % |
Modèle de la RUT (secteur de recensement) PM2,5 abs : Moyenne géométrique (IC à 95 %) : 2,64 (2,64 à 2,64) x 10-5/m |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
792 649 |
Toutes causes confondues : |
PM2,5 abs : |
Toutes causes confondues : |
Carlsen et coll., 2022 |
Cohorte sur l'alimentation et le cancer de Malmö |
Sélection aléatoire des personnes nées entre 1923 et 1950 à Malmö (Suède) Femmes : 60,3 % |
Modèle de dispersion (adresse résidentielle) CN :
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, activité physique, état de santé, autres facteurs liés au mode de vie |
25 823 |
IM : |
CN : |
IM : |
| Asie – Population générale | ||||||||
Barratt et coll., 2018 |
Cohorte du service de santé aux personnes âgées |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong; les participants vivaient dans des immeubles de grande hauteur sous le 20e étage avec des fenêtres ouvrantes en bordure de rue Hommes : 32,6 % |
Modèle de la RUT (adresse résidentielle) CN :
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, autres indicateurs du SSE |
60 548 |
Toutes causes confondues : |
CN : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Pneumonie : |
Pneumonie : |
|||||||
MPOC : |
MPOC : |
|||||||
Yang et coll., 2018 |
Cohorte |
Résidents de Hong Kong (Chine) de ≥ 65 ans inscrits au service de santé aux personnes âgées du ministère de la Santé du gouvernement de Hong Kong Hommes : 33 % |
Modèle de la RUT (adresse résidentielle) CN :
|
Âge, sexe, SSE individuel et au niveau régional, tabagisme individuel, ajustement indirect en fonction du tabagisme, IMC, activité physique, dépenses mensuelles, autres indicateurs du SSE au niveau régional |
61 386 |
Non explicite |
CN : |
Toutes causes confondues : MSC : MCO : MCV : TR : Pneumonie : MPOC : |
| Australie – Population générale | ||||||||
Dirgawati et coll., 2019 |
Cohorte |
Hommes âgés de ≥ 65 ans, recrutés à l'origine pour un essai contrôlé randomisé sur l'anévrisme de l'aorte abdominale à Perth (Australie) Âge moyen (écart-type) : 72,1 (4,4) ans |
Modèle de la RUT (adresse résidentielle) PM2,5 abs : Moyenne (écart-type) : 0,9 (0,3) x 10-5/m |
Âge, sexe, SSE individuel, tabagisme individuel, IMC |
Toutes causes confondues : |
Toutes causes confondues : |
PM2,5 abs : |
Toutes causes confondues : |
AVC : |
AVC : |
AVC : |
||||||
Abréviations : AVC : accident vasculaire cérébral; CÉ : Carbone élémentaire; CN : Carbone noir; CSD : Maladie du système circulatoire; EI : Écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; IC : Intervalle de confiance; IM : Infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCV : Maladie cérébrovasculaire; MPOC : Maladie pulmonaire obstructive chronique obstructive; MSC : Maladie du système circulatoire; PM2,5 abs : Absorbance de PM2,5; RR : Risque relatif; RUT : Régression d'utilisation des terres; SIDIAP : Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària; SSE : Statut socio-économique; TR : Trouble respiratoire. |
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Europe – Population générale | ||||||||
Rosenlund et coll., 2006 |
Cas-témoins du programme d'épidémiologie cardiaque de Stockholm (1992-1994) |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 45 à 70 ans Hommes (cas; témoins) : 66 %; 65 % Âge moyen (écart-type) |
Modèle de dispersion (adresse résidentielle) PM10 : Cas : |
Âge, sexe, SSE individuel, tabagisme individuel, diabète, activité physique |
3 210 |
IM : |
PM10 : |
IM : |
Naess et coll., 2007 |
Cohorte |
Résidents âgés de 51 à 90 ans des 470 quartiers d'Oslo (Norvège) |
Modèle de dispersion (au niveau du quartier) PM10 :
|
Âge, sexe, SSE individuel, autres indicateurs du SSE |
143 842 |
MSC : 71 à 90 ans |
PM10 : |
MSC : 71 à 90 ans |
MPOC : 71 à 90 ans |
MPOC : 71 à 90 ans |
|||||||
Rosenlund et coll., 2009 |
Cas-témoins |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 15 à 79 ans Hommes (cas; témoins) : 69 %; 49 % Cas mortels saisis |
Modèle de dispersion (adresse résidentielle) PM10 : Cas : |
Âge, sexe, SSE individuel |
301 273 |
IM : |
PM10 : |
IM : |
Carey et coll., 2013 |
Cohorte Clinical Practice Research Datalink (2003-2007) |
Patients âgés de 40 à 89 ans de 205 cliniques en Angleterre (R.-U.) entièrement inscrits pour au moins 1 an le 1er janvier 2003 Hommes : 48,4 % |
Modèle de dispersion (centroïde du code postal résidentiel) PM10 : Moyenne (écart-type) : 19,7 (2,3) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel, IMC |
830 842 |
Toutes causes confondues : |
PM10 : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) PM10 : Plage de moyennes (écart-type) : PM2,5-10 : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
322 159 |
Toutes causes confondues : |
PM10 : PM2,5-10 : |
Toutes causes confondues : PM2,5-10 IR = 1,04 (0,98 à 1,10) |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Modèle de la RUT (adresse résidentielle) PM10 : Plage de moyennes (écart-type) : PM2,5-10 : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
367 383 |
MSC : |
PM10 : PM2,5-10 : |
MSC : |
MCV : |
MCV : |
|||||||
MCO : |
MCO : |
|||||||
IM : |
IM : |
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Modèle de la RUT (adresse résidentielle) PM10 : Plage de moyennes (écart-type) : PM2,5-10 : Plage de moyennes (écart-type) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
PM10 : PM2,5-10 : |
TR : PM2,5-10 : |
Badaloni et coll., 2017 |
Cohorte de l'étude longitudinale de Rome |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans Hommes : 45,4 % |
Modèle de la RUT (adresse résidentielle) PM10 :
|
Âge, sexe, SSE individuel, SSE régional, état matrimonial, lieu de naissance |
1 249 108 |
Toutes causes confondues : |
PM10 : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
Nieuwenhuijsen et coll., 2018 |
Cohorte SIDIAP (2010-2014) |
Adultes ≥ 18 ans, inscrits dans le SIDIAP et vivant à Barcelone; le SIDIAP représente 80 % de la population totale de la Catalogne (Espagne) Hommes : 53 % |
Modèle de la RUT (secteur de recensement) PM10 : Moyenne géométrique (IC à 95 %) : 38,29 (38,28 à 38,30) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
792 649 |
Toutes causes confondues : |
PM10 : |
Toutes causes confondues : |
Carlsen et coll., 2022 |
Cohorte sur l'alimentation et le cancer de Malmö |
Sélection aléatoire des personnes nées entre 1923 et 1950 à Malmö (Suède) Femmes : 60,3 % |
Modèle de dispersion (adresse résidentielle) PM10 :
|
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, activité physique, état de santé, autres facteurs liés au mode de vie |
25 823 |
IM : |
PM10 : |
IM : |
| Europe – Population de patients | ||||||||
Maheswaran et coll., 2010 |
Cohorte |
Patients résidant à Londres (R.-U.) en 2001 qui ont subi le tout premier AVC, 1995 à 2005 Femmes : 48,6 % à 50,8 % |
Modèle hybride ou autre (adresse résidentielle) PM10 : Moyenne (écart-type) : 25 (1,3) μg/m3 |
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, variables liées au mode de vie, comorbidités, variables médicales |
3 320 |
Toutes causes confondues : |
PM10 : |
Toutes causes confondues : |
Desikan et coll., 2016 |
Cohorte |
South London Stroke Register (R.-U.), un registre basé sur la population des AVC Hommes : 52,3 % |
Modèle de dispersion (code postal résidentiel) PM10 :
PM2,5-10 :
|
Âge, sexe, SSE régional, origine ethnique, variables propres à l'AVC |
1 800 |
Toutes causes confondues : |
PM10 : PM2,5-10 : |
Toutes causes confondues : PM2,5-10 IR = 0,98 (0,87 à 1,10) |
Tonne et coll., 2016 |
Cohorte |
Patients > 25 ans du Grand Londres (R.-U.) admis à l'hôpital avec un IM, hôpitaux qui avaient > 10 admissions avec STEMI ou des admissions sans STEMI |
Modèle de dispersion (centroïde du code postal résidentiel) PM10, échappement :
PM10 non-échappement :
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, antécédents médicaux, IM et variables propres aux STEMI |
18 138 |
Toutes causes confondues : |
PM10, échappement : PM10, non-échappement : |
Toutes causes confondues : PM10, non-échappement, IR = 1,05 (1,00 à 1,09) |
Abréviations : AVC : accident vasculaire cérébral; EI : écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; IC : Intervalle de confiance; IM : Infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCV : Maladie cérébrovasculaire; MPOC : Maladie pulmonaire obstructive chronique; MSC : Maladie du système circulatoire; RC : rapport de cotes; RUT : Régression d'utilisation des terres; SIDIAP : Sistema d'Informació pel Desenvolupament de la Investigació en Atenció Primària; SSE : Statut socio-économique; STEMI : infarctus du myocarde avec élévation du segment ST; TR : Trouble respiratoire. |
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Villeneuve et coll., 2013 |
Cohorte d'impôts de l'Ontario |
Canadiens produisant des déclarations de revenus sélectionnés de façon aléatoire dans dix régions urbaines de l'Ontario, limitées à Toronto, âgés de ≥ 35 ans Hommes : 50,4 % |
Modèle de la RUT (code postal)
|
Âge, sexe, SSE individuel, SSE au niveau régional, ajusté indirectement en fonction du tabagisme |
58 760 |
Toutes causes confondues : |
0,13 µg/m3 |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
|
Abréviations : EI : Écart interquartile; IC : Intervalle de confiance; MSC : Maladie du système circulatoire; RUT : Régression d'utilisation des terres; SSE : Statut socio-économique; TR : Trouble respiratoire. |
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Europe – Population générale | ||||||||
Rosenlund et coll., 2006 |
Cas-témoins du programme d'épidémiologie cardiaque de Stockholm (1992-1994) |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 45 à 70 ans Hommes : Âge moyen (écart-type) |
Modèle de dispersion (adresse résidentielle) Cas : Témoins : |
Âge, sexe, SSE individuel, tabagisme individuel, diabète, activité physique |
3 210 |
IM : |
300 μg/m3 |
IM : |
Rosenlund et coll., 2009 |
Cas-témoins |
Cas-témoins basés sur la population à Stockholm (Suède); premiers événements d'IM chez la population âgée de 15 à 79 ans Hommes : Cas mortels saisis |
Modèle de dispersion (adresse résidentielle) Cas : Témoins : |
Âge, sexe, SSE individuel, année civile |
301 273 |
IM : |
300 μg/m3 |
IM : |
|
Abréviations : IC : Intervalle de confiance; IM : Infarctus du myocarde; RC : rapport de cotes; SSE : Statut socio-économique; STEMI : Infarctus du myocarde avec élévation du segment ST. |
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| Canada – Population générale | ||||||||
Gan et coll., 2010 |
Cohorte (1994-2002) |
Résidents de la région métropolitaine de Vancouver, Colombie-Britannique, âgés de 45 à 85 ans avec couverture par un régime provincial d'assurance-maladie Hommes : 45 % à 47 % |
SIG (code postal résidentiel) Exposition constante : Groupe de référence : |
Âge, sexe, SSE au niveau régional, comorbidités préexistantes |
414 793 |
MCO : |
Exposés contre référence |
MCO : |
Chen et coll., 2013 |
Cohorte d'impôts de l'Ontario |
Résidents de Toronto, de Hamilton ou de Windsor (Ontario), âgés de 35 à 85 ans, choisis au hasard dans la cohorte d'impôts de l'Ontario Pour les trois villes : |
SIG (code postal) Groupe exposé : Groupe de référence : |
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial |
205 440 (Hamilton, Toronto, Windsor) |
MSC : |
Exposés contre référence |
MSC : |
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
Cakmak et coll., 2019 |
Cohorte |
Résidents canadiens âgés de ≥ 25 ans au niveau de référence qui ont rempli le questionnaire détaillé du recensement Hommes (par quartile de longueur de route locale) : 49,3 % à 51,0 % |
SIG (centroïde du code postal) Longueur totale des routes locales à ≤ 200 m de rayon de résidence : |
Âge, sexe, SSE individuel, SSE au niveau régional, déterminants sociaux supplémentaires |
2 644 370 |
Toutes causes confondues : |
Longueur totale des routes locales à ≤ 200 m de rayon de résidence : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
MPOC : |
MPOC : |
|||||||
| Canada – Population de patients | ||||||||
Finkelstein et coll., 2004 |
Cohorte |
Adultes âgés de ≥ 40 ans qui ont passé une exploration fonctionnelle respiratoire dans une clinique de Hamilton (Ontario) Hommes (témoins; exposés) : 45 %; 42 % Âge médian (témoins; exposés) : 60,4 ans; 63,6 ans |
SIG (code postal) Groupe exposé : Résidence à moins de 50 m d'une route principale ou à 100 m d'une autoroute Groupe témoin : Vivant l'extérieur de la zone tampon |
Aucun |
5 228 |
Toutes causes confondues : |
Exposés contre témoins |
Toutes causes confondues : |
Finkelstein et coll., 2005 |
Cohorte |
Adultes âgés de ≥ 40 ans qui ont passé une exploration fonctionnelle respiratoire dans une clinique de Hamilton (Ontario) Hommes (témoins; exposés) : 45 %; 42 % |
SIG (code postal) Groupe exposé : Résidence à moins de 50 m d'une route principale ou à 100 m d'une autoroute Groupe de référence : Vivant à l'extérieur de la zone tampon |
Âge, sexe, SSE au niveau régional, IMC, variables cliniques |
5 228 |
MSC : |
Exposés contre référence |
MSC : |
MCV : |
MCV : |
|||||||
TR : |
TR : |
|||||||
Jerrett et coll., 2009 |
Cohorte |
Patients adultes d'une clinique de maladies respiratoires à Toronto (Ontario) Hommes : 48 % |
SIG (code postal) Groupe exposé : Résidence à moins de 50 m d'une route principale ou à 100 m d'une autoroute Groupe témoin : Vivant l'extérieur de la zone tampon 24 % de la population vivait à < 50 m d'une route principale ou à < 100 m d'une autoroute |
Âge, sexe, SSE au niveau régional, tabagisme individuel, IMC, variables cliniques |
2 360 |
Toutes causes confondues : |
Exposés contre témoins |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
| É.-U. – Population générale | ||||||||
Hart et coll., 2013 |
Cohorte |
Infirmières autorisées mariées des 50 États américains, âgées de 30 à 55 ans au moment de l'enregistrement Âge moyen (écart-type) : 63,8 (8,6) à 64,4 (8,7) ans (quartiles du trafic) |
SIG (adresse résidentielle) Près du traficNote b : Résidence à moins de 50 m de la route A3 ou à moins de 150 m de la route A1 ou A2 (pour la majorité de la cohorte et leurs années-personnes) Loin : En dehors de la zone tampon Groupe de référence : Toujours loin |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, race, variables du mode de vie, antécédents médicaux, variables des antécédents familiaux |
84 562 |
Toutes causes confondues : |
Toujours près contre référence De loin à près contre référence De près à loin contre référence |
Toutes causes confondues : |
Hart et coll., 2014 |
Cohorte |
Infirmières autorisées mariées des 50 États américains, âgées de 30 à 55 ans au moment de l'enregistrement Âge moyen (écart-type) : 64,3 (10,0) ans |
SIG (adresse résidentielle) Proximité du trafic de la route A1-A3 la plus procheNote b Modèles linéaires pour des distances de 0 à 499 m par rapport à des adresses à ≥ 500 m de distance |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, race, variables du mode de vie, antécédents médicaux, comorbidités, variables des antécédents familiaux |
107 130 |
MSOCNote c : |
Linéaire (par 100 m plus près) |
MSOC : |
MCO mortelle : 1 159 |
MCO mortelle : |
|||||||
Kulick et coll., 2018 |
Cohorte |
Population urbaine multiethnique sans AVC âgée de ≥ 40 ans résidant dans le nord de Manhattan (New York) Hommes : 37,2 % |
SIG (adresse résidentielle) Distance médiane par rapport à la route principale (A1 ou A2)Note b : 248,1 m Groupe de référence : ≥ 400 m 17 % des membres de la cohorte vivaient à < 100 m d'une route principale |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, race, variables liées à la mode de vie et aux activités, variables médicales |
3 287 |
Toutes causes confondues : |
< 100 m contre référence 100 à < 200 m contre référence 200 à < 400 m contre référence Variable continue calculée par transformation logarithmique (par EI) : 253,7 m |
Toutes causes confondues :
|
MSC : |
MSC :
|
|||||||
| É.-U. – Population de patients | ||||||||
Medina-Ramón et coll., 2008 |
Cohorte |
Résidents adultes du Grand Worcester (Massachusetts) hospitalisés pour ICA et ayant reçu leur congé de l'hôpital en 2000 Hommes : 43,8 % |
SIG (code postal) Distance par rapport à la route principale :
|
Âge, sexe, SSE au niveau régional, origine ethnique, antécédents médicaux et variables cliniques |
1 389 |
Toutes causes confondues : |
Distance par rapport à la route principale : |
Toutes causes confondues : |
Wilker et coll., 2013 |
Cohorte |
Patients âgés de ≥ 21 ans admis au Beth Israel Deaconess Medical Center avec un AVC ischémique; résidents de la grande région métropolitaine de Boston (Massachusetts) Femmes : 54,55 % |
SIG (adresse résidentielle) Distance de la route avec > 10 000 véhicules/jour Groupe de référence : ≥ 400 m |
Âge, sexe, SSE au niveau régional, tabagisme individuel, antécédents médicaux, comorbidités |
1 683 |
Toutes causes confondues : |
≤ 100 m contre référence > 100 à 200 m contre référence > 200 à 400 m contre référence |
Toutes causes confondues :
|
| Europe – Population générale | ||||||||
Hoek et coll., 2002 |
Cohorte |
Adultes âgés de 55 à 69 ans résidant aux Pays-Bas
|
SIG (adresse résidentielle) Groupe exposé : Résidence à moins de 100 m d'une autoroute ou à moins de 50 m d'une route urbaine principale |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, IMC, comorbidités, indice de Quetelet |
3 464 |
Toutes causes confondues : |
Exposés (concentration de fond de FN) Exposés (concentration de fond de NO2) |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
Gehring et coll., 2006 |
Cohorte SALIA |
Femmes au milieu de la cinquantaine de nationalité allemande vivant dans dix zones dans sept villes de Rhénanie-du-Nord-Westphalie, en Allemagne Âge : 50 à 59 ans |
SIG (adresse résidentielle) Distance des routes principales (définies comme des routes de ≥ 10 000 voitures/jour) Groupe exposé : ≤ 50 m Groupe de référence : > 50 m |
Sexe, SSE individuel, tabagisme individuel |
4 230 |
Toutes causes confondues : |
Exposés contre référence |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
Beelen et coll., 2008 |
Cohorte Analyses complètes de la cohorte |
Adultes âgés de 55 à 69 ans vivant dans 204 municipalités à travers les Pays-Bas Hommes (cas; non-cas) : 65,5 %; 45,4 % |
SIG (adresse résidentielle) Groupe exposé : Vivant à proximité d'une route principale (≤ 100 m d'une autoroute ou ≤ 50 m d'une route locale avec une intensité de trafic > 10 000 véhicules à moteur/24 h) Groupe de référence : Ne vivant pas près d'une route principale |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
117 528 |
Toutes causes confondues : |
Exposés contre référence Le modèle comprend la concentration de fond de FN. |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2009 |
Cohorte Analyses complètes de la cohorte |
Adultes âgés de 55 à 69 ans vivant dans 204 municipalités à travers les Pays-Bas Hommes (cas; non-cas) : 69,1 %; 47,2 % |
SIG (adresse résidentielle) Groupe exposé : Groupe de référence : |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
117 528 |
MSC : |
Exposés contre référence Le modèle comprend la concentration de fond de FN. |
MSC : |
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
ICA : |
ICA : |
|||||||
Dysrythmie cardiaque : |
Dysrythmie cardiaque : |
|||||||
Brunekreef et coll., 2009 (rapport de l'HEI) |
Cohorte Analyses complètes de la cohorte |
Adultes âgés de 55 à 69 ans vivant dans 203 municipalités à travers les Pays-Bas Hommes (cas; autres sujets) : 65,5 %; 45,4 % |
SIG (adresse résidentielle) Médiane : 485 m Groupe exposé : Vivant près d'une route principale (≤ 100 m d'une autoroute ou ≤ 50 m d'une route principale avec 10 000 véhicules à moteur/jour) Groupe de référence : Ne vivant pas près d'une route principale |
Âge, sexe, SSE au niveau régional, tabagisme individuel, variation régionale |
105 296 |
Toutes causes confondues : |
Exposés contre référence Le modèle comprend la concentration de fond moyenne de FN. |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Huss et coll., 2010 |
Cohorte nationale suisse |
Cohorte nationale suisse de personnes âgées de 30 ans et plus (Suisse) Femmes (par distance jusqu'au quartile de la route principale) : variaient de 52 % à 53 % Âge médian (par distance par rapport au quartile de la route principale) : variait de 50,2 à 51,2 ans |
SIG (adresse résidentielle) Distance par rapport à la route principale (réseau routier principal et réseau routier d'interconnexionNote e) Groupe de référence : ≥ 200 m |
Âge, sexe, SSE individuel, SSE au niveau régional |
4 580 311 |
MSC : |
< 50 m contre référence 50 à 99 m contre référence 100 à 199 m contre référence |
MSC :
|
IM aiguë : |
IM aiguë :
|
|||||||
AVC : |
AVC :
|
|||||||
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé (1993-2009) |
Adultes âgés de 50 à 64 ans vivant dans les régions de Copenhague et d'Aarhus, nés au Danemark et n'ayant jamais reçu de diagnostic de cancer Hommes : 47,5 % |
SIG (adresse résidentielle) Groupe exposé : Groupe de référence : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, variables liées au mode de vie et à l'alimentation, exposition professionnelle, état matrimonial |
52 061 |
Toutes causes confondues : |
Exposés contre référence |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
Cesaroni et coll., 2013 |
Cohorte |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans
|
SIG (adresse résidentielle) Distance par rapport à la route à fort trafic avec > 10 000 véhicules par jour
|
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, lieu de naissance |
1 265 058 |
Toutes causes confondues : |
< 50 m contre référence 50 à 100 m contre référence 100 à 150 m contre référence 150 à 250 m contre référence |
Toutes causes confondues :
|
MSC : |
MSC :
|
|||||||
MCO : |
MCO :
|
|||||||
MCV : |
MCV :
|
|||||||
TR : |
TR :
|
|||||||
Heinrich et coll., 2013 |
Cohorte SALIA |
Femmes au milieu de la cinquantaine de nationalité allemande vivant dans dix zones dans sept villes de Rhénanie-du-Nord-Westphalie, en Allemagne Âge : 50 à 59 ans |
SIG (adresse résidentielle) Proximité de la route principale (≥ 10 000 voitures/jour) Groupe exposé : ≤ 50 m Groupe de référence : > 50 m |
Âge, sexe, SSE individuel, tabagisme individuel |
4 752 |
Toutes causes confondues : |
Exposés contre référence |
Toutes causes confondues : |
MCP : |
MCP : |
|||||||
TR : |
TR : |
|||||||
| Europe – Population de patients | ||||||||
Nawrot et coll., 2011 |
Cohorte |
Patients ayant subi une transplantation pulmonaire en 1997-2008 avec un suivi à long terme à l'UZ de Louvain (Belgique) Femmes (près de la route principale; plus loin de la route principale) : 53 %; 41 % Âge moyen (près de la route principale; plus éloigné de la route principale) : 47,5 ± 14,3 ans; 46,3 ± 13,9 ans |
SIG (adresse résidentielle) À proximité d'une route principale (c.-à-d. autoroutes, routes nationales ou grandes routes locales) Groupe exposé : ≤ 171 m (attribué en fonction du tertile le plus bas) Groupe de référence : > 171 m |
Âge, sexe, SSE individuel, variables propres à la transplantation |
281 |
Toutes causes confondues : |
Exposés contre référence |
Toutes causes confondues : |
Goeminne et coll., 2014 |
Cohorte |
Patients de 18 à 65 ans atteints de bronchectasie non kystique qui ont visité une clinique externe à l'hôpital universitaire de Louvain (Belgique) Femmes : 55 % |
SIG (adresse résidentielle) Distance par rapport à une route principale (pas de renseignements supplémentaires) |
Âge, sexe, SSE individuel, tabagisme individuel, IMC, variables cliniques |
183 |
Toutes causes confondues : |
Multiplication par 10 de la distance (m) |
Toutes causes confondues : |
Ruttens et coll., 2017 |
Cohorte Groupe sans macrolide |
Patients ayant subi une transplantation pulmonaire pendant la période d'étude dans 13 grands centres de transplantation pulmonaire dans 10 pays européens Hommes = 52 % |
SIG (adresse résidentielle) Distance par rapport à l'autoroute : EI : 1 233 m Distance par rapport à une route principale : Longueur totale des routes à l'intérieur de différentes zones tampons :
|
Âge, sexe, variables propres à la transplantation |
3 556 |
Toutes causes confondues : |
Distance jusqu'à l'autoroute : 1 233 m Distance jusqu'à la route principale : 241 m Longueur totale des routes à l'intérieur des zones tampons :
|
Toutes causes confondues :
|
| Asie – Population générale | ||||||||
Hadley et coll., 2022 |
Étude de cohorte Golestan (2004-2008) |
Adultes âgés de 40 à 75 ans résidant dans le nord-est du Golestan (Iran); ~80 % de 326 villages ruraux (dont la taille varie de 20 à 150 résidents); 20 % ont été choisis de façon aléatoire dans la ville de Gonbad (130 000 résidents) Femmes : 57 % |
SIG (centre géographique du village pour les résidents ruraux; l'emplacement du centre de soins de santé primaires pour les résidents de la ville de Gonbad) Proximité du trafic Groupe exposéNote f : Groupe de référence : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, origine ethnique, état matrimonial, antécédents médicaux, consommation de substances |
45 052 |
Toutes causes confondues : |
Exposés contre référence |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
Abréviations : AVC : accident vasculaire cérébral; MCO : Maladie coronarienne; CSERCan : Cohorte santé et environnement du recensement canadien; EI : Écart interquartile; FN : fumée noire; IC : Intervalle de confiance; ICA : insuffisance cardiaque; IM : Infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MSC : Maladie du système circulatoire; MCP : Maladie cardiopulmonaire; MPOC : Maladie pulmonaire obstructive chronique; MSOC : Mort subite d'origine cardiaque; MCV : Maladie cérébrovasculaire; NLCS : Étude de cohorte sur l'alimentation et le cancer réalisée aux Pays-Bas; RR : Risque relatif; RTM : Ratio des taux de mortalité; SALIA : Étude sur l'influence de la pollution de l'air sur la fonction pulmonaire, l'inflammation et le vieillissement; SIG : Système d'information géographique; SSE : Statut socio-économique; TR : Trouble respiratoire.
|
||||||||
| Référence | Cohorte (période d'étude) | Population à l'étude | Méthode d'évaluation de l'exposition et distribution | Facteurs de confusion et covariables | Total N | Cas | Augmentation | Estimation des risques (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|
| É.-U. – Population de patients | ||||||||
Medina-Ramón et coll., 2008 |
Cohorte |
Résidents adultes du Grand Worcester (Massachusetts) hospitalisés pour l'ICA et ayant reçu leur congé de l'hôpital en 2000 Hommes : 43,8 % |
Trafic à moins de 100 m de la résidence (véhicule-km/jour)
Trafic à moins de 300 m de la résidence (véhicule-km/jour)
|
Âge, sexe, SSE au niveau régional, origine ethnique, antécédents médicaux et variables cliniques |
1 389 |
Toutes causes confondues : |
Trafic dans la zone tampon de 100 m : Trafic dans la zone tampon de 300 m : |
Toutes causes confondues : IR = 1,07 (0,98 à 1,16) |
Blount et coll., 2017 |
Cohorte |
Tous les cas de tuberculose pédiatrique et adulte signalés en Californie Mâles : 60,8 % et 58,3 % pour une densité de trafic élevée et faible, respectivement Âge médian au moment du diagnostic (EI) : 46,2 (30,5 à 62,2) ans et 47,7 (30,8 à 64,5) ans pour une densité de trafic élevée et faible, respectivement |
Trafic (véhicule-km/h) autour de la résidence : Trafic sur la route principale la plus près autour de la résidence (véhicules/jour) : Trafic sur les routes les plus fréquentées (véhicules/jour) : |
Âge, sexe, SSE individuel, origine ethnique, variables de mode de vie, variables propres à la tuberculose |
32 875 |
Toutes causes confondues : |
Trafic (véhicule-km/h) autour de la résidence :
Trafic sur la route principale la plus près autour de la résidence (véhicules/jour) :
Trafic sur les routes les plus fréquentées (véhicules/jour) :
|
Toutes causes confondues : Analyses des tendances
|
| Europe – Population générale | ||||||||
Beelen et coll., 2008 |
Cohorte Analyses complètes de la cohorte |
Adultes de 55 à 69 ans, comprend 204 municipalités (petites communautés rurales et grandes villes) des Pays-Bas Hommes : 65,5 % chez les sujets-cas; 45,4 % des autres sujets Âge médian : 64 ans (intervalle de 54 à 70 ans) chez les sujets-cas; 61 ans (intervalle de 54 à 70 ans) chez les autres sujets |
Trafic sur la route la plus proche de la résidence (véhicules/jour) :
Somme du trafic dans une zone tampon de 100 m autour de la résidence (véhicules/jour) :
|
Âge, sexe, SSE au niveau régional, tabagisme individuel |
117 528 |
Toutes causes confondues : |
Trafic sur la route la plus près : Somme du trafic dans la zone tampon de 100m : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Beelen et coll., 2009 |
Cohorte Analyses complètes de la cohorte |
Adultes âgés de 55 à 69 ans vivant dans 204 municipalités à travers les Pays-Bas Hommes (cas; non-cas) : 69,1 %; 47,2 % Âge médian (EI) [cas; non-cas] : 64 (61 à 67) ans; 62 (58 à 65) ans |
SIG (adresse résidentielle) Utilisation du SIG et du réseau routier numérique (à partir de 2001) pour caractériser l'intensité du trafic en 1986 Moyenne (écart-type) : 2 284 (3 767) véhicules à moteur/24 h |
Âge, sexe, SSE au niveau régional, tabagisme individuel |
117 528 |
MSC : |
10 000 véhicules automobiles/jour Le modèle comprend la concentration de fond de FN. |
MSC : |
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
ICA : |
ICA : |
|||||||
Dysrythmie cardiaque : |
Dysrythmie cardiaque : |
|||||||
Brunekreef et coll., 2009 |
Cohorte Analyses complètes de la cohorte |
Adultes de 55 à 69 ans, comprend 203 municipalités (petites communautés rurales et grandes villes) des Pays-Bas Hommes : 65,5 % chez les sujets-cas; 45,4 % des autres sujets Âge médian : 64 ans (intervalle de 54 à 70 ans) chez les sujets-cas; 61 ans (intervalle de 54 à 70 ans) chez les autres sujets |
Trafic sur la route la plus proche de la résidence (véhicules/jour) : Somme du trafic dans une zone tampon de 100 m autour de la résidence (véhicules/jour) : |
Âge, sexe, SSE au niveau régional, tabagisme individuel, variation régionale |
105 296 |
Toutes causes confondues : |
Trafic sur la route la plus près : Somme du trafic dans la zone tampon de 100m : |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
TR : |
TR : |
|||||||
Raaschou-Nielsen et coll., 2012 |
Étude de cohorte sur l'alimentation, le cancer et la santé |
Adultes âgés de 50 à 64 ans vivant dans les régions de Copenhague et d'Aarhus, nés au Danemark et n'ayant jamais reçu de diagnostic de cancer Hommes : 47,5 % |
Circulation à moins de 200 m de la zone tampon de la résidence (103 km/jour) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, variables liées au mode de vie et à l'alimentation, exposition professionnelle, état matrimonial |
52 061 |
Toutes causes confondues : |
Par doublement du trafic dans la zone tampon de 200 m |
Toutes causes confondues : |
MSC : |
MSC : |
|||||||
MCO : |
MCO : |
|||||||
MCV : |
MCV : |
|||||||
Cesaroni et coll., 2013 |
Cohorte |
Adultes âgés de ≥ 30 ans qui résidaient à Rome (Italie) ≥ 5 ans Hommes : 45,5 % |
Trafic dans une zone tampon de 150 m autour de la résidence (véhicule-m/jour) :
|
Âge, sexe, SSE individuel, SSE au niveau régional, état matrimonial, lieu de naissance |
1 265 058 |
Toutes causes confondues : |
Trafic dans une zone tampon de 150 m par quintile (véhicule-m/jour) x 106 :
|
Toutes causes confondues :
|
MSC : |
MSC :
|
|||||||
MCO : |
MCO :
|
|||||||
TR : |
TR :
|
|||||||
Beelen et coll., 2014a |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes : 47,7 % à 100 % 20 cohortes incluses pour l'intensité du trafic sur la route la plus près 21 cohortes incluses pour l'intensité du trafic sur les routes principales dans la zone tampon de 100 m |
Trafic sur la route la plus proche de la résidence (véhicules-km/jour) : Trafic sur les routes principales à moins de 100 m de la zone tampon (véhicule-km/jour) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
Trafic sur la route la plus près : Trafic sur les routes principales dans la zone tampon de 100 m : |
Toutes causes confondues : |
Trafic sur la route la plus près : Trafic sur les routes principales dans la zone tampon de 100 m : |
Toutes causes confondues : |
Beelen et coll., 2014b |
Cohorte ESCAPE |
22 cohortes de 13 pays; population générale Femmes (plage) : 63 % (48 % à 100 %) |
Trafic sur la route la plus proche de la résidence (véhicules-km/jour) : Trafic sur les routes principales à moins de 100 m de la zone tampon (véhicule-km/jour) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
Trafic sur la route la plus près : Trafic sur les routes principales dans la zone tampon de 100 m : |
MSC : |
Trafic sur la route la plus près : Trafic sur les routes principales dans la zone tampon de 100 m : |
MSC :
|
MCV : |
MCV :
|
|||||||
MCO : |
MCO :
|
|||||||
IM : |
IM :
|
|||||||
Dimakopoulou et coll., 2014 |
Cohorte ESCAPE |
16 cohortes de 11 pays; population générale Femmes (plage) : 47,7 % à 100 % |
Intensité du trafic sur la route la plus proche de la résidence Somme du trafic dans une zone tampon de 100 m autour de la résidence (longueur de la route des véhicules*/jour) : |
Âge, sexe, SSE individuel, SSE au niveau régional, tabagisme individuel, fumée de tabac ambiante, variables alimentaires et de mode de vie, état matrimonial, autres indicateurs du SSE |
307 553 |
TR : |
Trafic sur la route la plus près : Somme du trafic dans la zone tampon de 100m : |
TR : |
| Europe – Population de patients | ||||||||
Goeminne et coll., 2014 |
Cohorte |
Patients de 18 à 65 ans atteints de bronchectasie non kystique qui ont visité une clinique externe à l'hôpital universitaire de Louvain (Belgique) Femmes : 55 % |
Densité de trafic pondérée selon la distance dans une zone tampon de 100 ou 200 m autour de l'adresse résidentielle Distribution de l'exposition non fournie |
Âge, sexe, SSE individuel, tabagisme individuel, IMC, variables cliniques |
183 |
Toutes causes confondues : |
Multiplication par 10 de la densité de trafic pondérée selon la distance |
Toutes causes confondues : Zone tampon de 200 m : |
Tonne et coll., 2016 |
Cohorte |
Résidents du Grand Londres (R.-U.) de > 25 ans admis à l'hôpital avec IM, hôpitaux qui avaient > 10 admissions avec STEMI ou des admissions sans STEMI Hommes : 68 % |
Volume de poids lourds sur les routes principales dans la zone tampon autour du centroïde du code postal (pour 1 000 véhicules-km) :
|
Âge, sexe, SSE au niveau régional, tabagisme individuel, origine ethnique, antécédents médicaux, IM et variables propres aux STEMI |
18 138 |
Toutes causes confondues : |
Trafic de poids lourds (pour 1 000 véhicules-km) : |
Toutes causes confondues : |
| Asie – Population générale | ||||||||
Pan et coll., 2021 |
Cohorte |
Adultes de 30 à 65 ans en 1991 vivant à Taipei et à Pingtung (Taïwan) |
Trafic total de véhicules au site de surveillance le plus proche de la résidence : Distance médiane entre la résidence et le site de surveillance : 1,56 km |
Âge, sexe, tabagisme individuel, IMC et autres variables de santé et de mode de vie |
12 098 |
MSC : |
log véhicule/jour |
MSC : |
Abréviations : EI : Écart interquartile; ESCAPE : Étude européenne des cohortes pour les effets de la pollution atmosphérique; FN : fumée noire; IC : Intervalle de confiance; ICA : insuffisance cardiaque; IM : Infarctus du myocarde; IMC : Indice de masse corporelle; IR : Indice de risque; MCO : Maladie coronarienne; MCV : Maladie cérébrovasculaire; MPOC : Maladie pulmonaire obstructive chronique; MSC : Maladie du système circulatoire; NLCS : Étude de cohorte sur l'alimentation et le cancer réalisée aux Pays-Bas; REVEAL-HBV : évaluation du risque d'élévation de la charge virale et des maladies du foie ou du virus de l'hépatite B du cancer connexes; RR : Risque relatif; RTM : Ratio des taux de mortalité; SIG : Système d'information géographique; SSE : Statut socio-économique; STEMI : Infarctus du myocarde avec élévation du segment ST; TR : Trouble respiratoire. |
||||||||
Notes de bas de page
- Notes de bas de page 1
-
Les valeurs monétaires représentent des valeurs de bien-être économique qui tiennent compte des répercussions potentielles associées aux coûts de traitement, à la perte de productivité, à la douleur et à la souffrance, ainsi que des répercussions des changements dans le risque de mortalité (Judek et coll., 2019).
- Note de bas de page 2
-
Une revue de la portée permet de définir systématiquement la documentation disponible sur un sujet général. Ce type de revue permet de préciser les concepts clés, les types et les sources d'information, ainsi que les lacunes de la recherche.