Recommandations pour la qualité de l'eau potable au Canada : document technique – l'acide 2,4-dichlorophénoxyacétique

Télécharger le format de rechange
(Format PDF, 906 Ko, 40 pages)
Organisation : Santé Canada
Type : Lignes directrices
Date publiée : 2022-02-04
Sujets connexes
Valeur de la recommandation
La concentration maximale acceptable (CMA) pour l'acide 2,4-dichlorophénoxyacétique (2,4-D) dans l'eau potable est de 0,10 mg/L (100 µg/L).
Résumé
Ce document technique a été rédigé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, d'après les évaluations du 2,4-D réalisées par l'Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada et les documents à l'appui.
Exposition
Le 2,4-D est un herbicide principalement utilisé pour détruire les mauvaises herbes latifoliées. En 2018 (soit l'année la plus récente pour laquelle il existe des données), il comptait parmi les 10 ingrédients actifs les plus vendus au Canada. Il est utilisé sur le gazon, les forêts et les boisés, les cultures en milieu terrestre destinées à la consommation humaine ou animale ainsi que sur les sites industriels et résidentiels à vocation non alimentaire. Diverses formes du 2,4-D, notamment l'acide libre, les sels et les esters de la substance, sont employées dans les préparations d'herbicides et toutes ces formes libèrent l'acide en tant qu'ingrédient actif.
On s'attend à ce que l'exposition des Canadiens au 2,4-D soit faible malgré son emploi répandu. De faibles concentrations de 2,4-D dans des sources d'eau potable ont été mesurées dans de nombreuses provinces canadiennes. Le 2,4-D n'a pas tendance à s'accumuler dans les aliments et l'exposition par inhalation ne devrait pas être importante.
Effets sur la santé
Dans toutes les études menées sur des animaux, on a systématiquement constaté que le 2,4-D a des effets sur les reins chez la souris et le rat. Il n'existe pas d'études menées chez l'humain au sujet des effets du 2,4-D sur les reins. Bien que certains organismes estiment que le 2,4-D peut être cancérogène, les organisations internationales responsables de l'eau potable ont évalué le 2,4-D en se fondant sur ses effets non cancérogènes.
Analyse et traitement
Pour établir une recommandation sur la qualité de l'eau potable, il faut tenir compte de la capacité de mesurer le contaminant et de l'enlever des sources d'eau potable. Le 2,4-D peut être détecté à des concentrations bien inférieures à la CMA de 0,10 mg/L.
Il existe des procédés de traitement qui permettent de réduire efficacement la concentration de 2,4-D dans l'eau potable. L'adsorption sur charbon actif est considérée comme la meilleure technologie disponible. Les procédés de filtration biologique peuvent aussi abaisser les concentrations de 2,4-D. Les traitements conventionnels ne sont toutefois pas efficaces pour enlever le 2,4-D. Les procédés habituels d'oxydation et de désinfection utilisés dans le traitement de l'eau potable ont également une capacité limitée à réduire les concentrations de 2,4-D.
Il existe un certain nombre de dispositifs de traitement à usage résidentiel certifiés pour l'enlèvement du 2,4-D. Le fonctionnement de ces dispositifs s'appuie principalement sur les technologies d'adsorption (charbon actif) et d'osmose inverse.
Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité responsable en matière d'eau potable dans le territoire administratif concerné.
La recommandation pour le 2,4-D vise à offrir une protection contre les effets sur la santé associés à une exposition au 2,4-D par l'eau potable toute la vie durant. Tout dépassement de la CMA devrait faire l'objet d'une analyse suivie des mesures correctives, au besoin. Pour les dépassements dans la source d'approvisionnement en eau où il n'y a aucun traitement en place, une surveillance accrue visant à confirmer le dépassement doit être entamée. Si l'on confirme que les concentrations de 2,4-D dans la source d'approvisionnement en eau dépassent la CMA, une analyse visant à déterminer le moyen le plus approprié de réduire l'exposition au 2,4-D doit être menée. Les options possibles comprennent le recours à une autre source d'approvisionnement en eau ou l'installation de traitement. Si un dépassement se produit malgré la mise en place d'un traitement, une analyse du traitement doit être menée pour vérifier le traitement et déterminer si des ajustements visant à réduire la concentration dans l'eau traitée sous la CMA s'imposent.
Le 2,4-D est un herbicide à base d'acide chlorophénoxyacétique homologué au Canada à des fins commerciales et domestiques pour la lutte contre les mauvaises herbes latifoliées. Il peut également être appliqué pour le traitement des cultures agricoles, des zones boisées, des pelouses et du gazon (incluant les utilisations résidentielles), et d'autres sites industriels. L'application foliaire se fait quand les mauvaises herbes poussent activement. Étant donné son vaste profil d'emploi, elle peut se faire toute la saison (du printemps à l'automne). Dans les zones d'utilisation intensive, le 2,4-D peut pénétrer dans les eaux de surface, voire dans les eaux souterraines, par ruissellement et infiltration ou à la suite d'un déversement. Le 2,4-D est non persistant ou légèrement persistant dans l'eau et le sol et subit une dégradation biologique rapide dans des conditions aérobies. Cependant, dans un milieu privé d'oxygène, comme les eaux souterraines anaérobies, la dégradation biologique du 2,4-D est plutôt limitée.
Table des matières
- 1.0 Considérations liées à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations liées à l'analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste d'abréviations
- Annexe B : Données sur la qualité de l'eau au Canada
1.0 Considérations liées à l'exposition
1.1 Sources et utilisations
L'acide 2,4-dichlorophénoxyacétique, ou 2,4-D, est un herbicide systémique sélectif et analogue à l'acide indolacétique (une hormone végétale). Il est surtout utilisé pour détruire les mauvaises herbes latifoliées (Charles et coll., 1996a; OMS, 2003; U.S. EPA, 2005; Santé Canada, 2007). Le 2,4-D figurait sur la liste annuelle des 10 matières actives les plus vendues au Canada établie par l'Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada en 2018 (l'année la plus récente pour laquelle il existe des données). Plus de 1 000 000 kg de matière active (2,4-D) ont été vendus pour utilisation sur le gazon, les forêts et les boisés, les cultures en milieu terrestre destinées à la consommation animale ou humaine, ainsi que pour le traitement en milieu industriel et résidentiel de sites à vocation non alimentaire (Santé Canada, 2016, 2020). L'application foliaire se fait quand les mauvaises herbes poussent activement. Puisqu'il s'agit d'un produit avec un large éventail d'applications, elle peut se faire toute la saison (p. ex., du printemps à l'automne) (Santé Canada, 2019).
En raison de sa faible constante de dissociation (2,8), le 2,4-D sera présent sous sa forme ionique dans les conditions de pH caractéristiques de la plupart des sols et des plans d'eau canadiens (pH de 4,5 à 8,5). Étant donné qu'ils se dissocient dans l'eau en quelques minutes pour former un anion acide et un cation conjugué, les sels d'amine du 2,4-D se comportent dans l'environnement de façon semblable au 2,4-D. Le 2,4-D et ses dérivés sont non persistants, ou légèrement persistants, dans le sol et dans l'eau. Les principaux produits de transformation du 2,4-D sont le dioxyde de carbone, la chlorohydroquinone et le 2,4-dichlorophénol (2,4-DCP) comme fraction mineure (Santé Canada, 2007). Le 2,4-DCP est en général biodégradable, fortement volatil et non persistant dans les milieux aérobies (Santé Canada, 2007). Le 2,4-D a une durée de vie limitée dans des milieux aquatiques aérobies, sa demi-vie ne dépassant pas deux semaines selon la température, la teneur en matières organiques, la composition bactérienne et le pH de l'eau. En laboratoire, la demi-vie de biotransformation aérobie du 2,4-D varie entre 0,22 et 31 jours dans le sol et entre 0,25 et 29 jours dans l'eau (Santé Canada, 2007).
En raison de sa solubilité élevée dans l'eau et de son faible coefficient d'adsorption sur le carbone organique, le 2,4-D devrait rapidement atteindre les eaux souterraines par lessivage si le débit descendant de l'eau est rapide. La mobilité dans le sol augmente à mesure que le pH augmente et la teneur organique diminue (Johnson et coll., 1995; Prado et coll., 2001; U.S. EPA, 2005; Santé Canada, 2005a, 2007; HSDB, 2015). Si la vitesse de déplacement du 2,4-D dans le sol est faible, le lessivage sera compensé par une biotransformation rapide dans les horizons pédologiques supérieurs et une quantité limitée de 2,4-D atteindra les couches profondes en raison de la demi-vie relativement courte de cette substance dans le sol (Santé Canada, 2007).
Dans des conditions anaérobies, la biotransformation du 2,4-D n'est pas importante, et le 2,4-D persistera dans le sol et les milieux aquatiques. La dégradation bactérienne en conditions anaérobies dans l'eau souterraine est relativement lente (demi-vie de 41 à 1 610 jours) (Santé Canada, 2007).
Une bioaccumulation est peu probable, compte tenu du faible coefficient de partage n-octanol-eau (Koe) et de la dégradation rapide de la substance (OMS, 2003; Santé Canada, 2007). Les applications par pulvérisation peuvent entraîner une volatilisation, en particulier des esters du 2,4-D (Santé Canada, 2007).
1.2 Propriétés de la substance
Le 2,4-D (numéro CAS 94-75-7) est un solide cristallin blanc de formule moléculaire C8H6Cl2O3 dont le poids moléculaire est de 221,0 g/mol (U.S. EPA, 2005; Santé Canada, 2016). Étant donné ses propriétés physicochimiques (voir le tableau 1), il est très soluble dans l'eau, possède un faible potentiel de volatilisation et se dissocie rapidement en sa forme anionique aux pH observés dans l'environnement (Santé Canada, 2005a, 2007). Les produits commerciaux contiennent du 2,4-D sous différentes formes : acide libre, ester (ester de butoxyéthyle, ester 2-éthylhexylique), amine (diméthylamine [DMA], isopropylamine [IPA], triisopropanolamine [TIPA]) et sous forme de sels de choline (Santé Canada, 2016). L'acide parent (2,4-D) est la portion possédant une activité herbicide tandis que la portion amine ou ester est celle qui favorise une plus grande absorption dans la plante (Santé Canada, 2005a). Les formes ester et amine se dissocient rapidement (moins de 3 min) en acide tant dans l'environnement qu'à l'intérieur des systèmes biologiques (Santé Canada, 2007). Par conséquent, le 2,4-D mentionné dans ce document est la forme acide. Lorsqu'il est fait mention des autres formes, leurs quantités sont exprimées sous forme de 2,4-D. Comme ils ne sont pas des produits de transformation du 2,4-D et comme leur production et leur utilisation ont été abandonnées au Canada (Santé Canada, 2006), les sels de diéthanolamine (DEA) et les sels de sodium ne seront pas examinés dans le présent document.
Le 2,4-D est souvent mélangé à d'autres herbicides et à des additifs comme des agents antimoussants (Santé Canada, 2005a; Kennepohl et coll., 2010). Dans le passé, les procédés de fabrication entraînaient la présence de dioxines (p. ex., la 2,3,7,8-tétrachlorodibenzo-p-dioxine et la 2,3,7,8-tétrachlorodibenzofuranne) dans les préparations de 2,4-D. Cependant, avec l'adoption de nouvelles normes réglementaires et de méthodes de production améliorées, les concentrations de dioxine sont comparables, voire inférieures, aux concentrations de fond dans l'environnement (Santé Canada, 2005a, 2006; Kennepohl et coll., 2010).
| Propriété | 2,4-D | Sels solubles de 2,4-D (DMA, IPA, TIPA) |
InterprétationNote de bas de page a |
|---|---|---|---|
| No CAS | 94-75-7Note de bas de page b | 2008-39-1, 5742-17-6, 32341-80-3Note de bas de page b | Sans objet |
| Formule moléculaire | C8H6Cl2O3 | C10H13Cl2NO3, C11H15Cl2NO3, C17,H27Cl2NO6 Note de bas de page b | Sans objet |
| Poids moléculaire | 221,0 g/mol Note de bas de page b | 266,13; 280,04; 412,31Note de bas de page b | Sans objet |
| Coefficient de partage n-octanol-eau (Koe) | 0,04 à 2,14Note de bas de page a à un de pH 5 et à 25°C |
Non disponible — les sels se sont dissociés en acide dans l'eauNote de bas de page b | Bioaccumulation improbable |
| Constante de la loi d'Henry | 7,26 × 10-6 Pa m3 mol-1Note de bas de page a | Non disponible — les sels de DMA se sont rapidement dissociés en acideNote de bas de page d | Non volatil à partir de l'eau ou de surfaces humides |
| Densité | 1,416 à 25°CNote de bas de page b | 1,15 à 1,23 à 20°CNote de bas de page b | Sans objet |
| Solubilité dans l'eau | 24,3 g/LNote de bas de page f à 20°C | 17,4 à 72,9 g/100 mlNote de bas de page d | Très soluble dans l'eau |
| Coefficient d'adsorption sur le carbone organique (Koc) | 20 à 136Note de bas de page e | 72 à 136Note de bas de page c | Potentiel élevé de lessivage |
| Constante de dissociation (pKa) | 2,8Note de bas de page a | 2,6 (sous forme de DMA)Note de bas de page g | Se dissocie rapidement en anions aux pH environnementaux |
| Pression de vapeur à 25 °C | 1,87 ×10-2 mPaNote de bas de page a | Non disponible — les sels à base de sels de DMA se sont dissociés en acide dans l'eauNote de bas de page d | Faible potentiel de volatilisation |
|
|||
1.3 Exposition
Le 2,4-D, un herbicide, est appliqué délibérément sur les cultures vivrières. Il peut être présent sous forme de résidus dans les aliments, lesquels représentent souvent la principale source d'exposition non professionnelle au 2,4-D pour la population générale du Canada (Santé Canada, 2005a).
Les concentrations de 2,4-D dans l'eau potable sont souvent inférieures à la limite de détection (LD). Les concentrations décelées de 2,4-D dans les eaux naturelles et l'eau potable traitée étaient généralement inférieures à 1 μg/L (Santé Canada, 2005a, 2007). On estime que l'exposition par inhalation représente moins de 2 % de l'apport total (Kennepohl et coll., 2010). Un facteur d'attribution de 20 % est jugé approprié, car l'eau potable est une source peu importante d'exposition (Krishnan et Carrier, 2013).
Des données sur la surveillance de l'eau provenant des provinces et des territoires (approvisionnement municipal et non municipal), de l'ARLA et d'Environnement et Changement climatique Canada (Environnement Canada, 2011) (annexe B) ont été produites pour le 2,4-D et ont servi à obtenir une estimation de la concentration du 2,4-D dans l'eau potable canadienne, qui est inférieure à 1 μg/L (Santé Canada, 2007).
Les données demandées aux provinces et aux territoires montrent que les concentrations de 2,4-D sont inférieures à la limite de détection de la méthode ou LDM (qui varie de 0,005 à 1 μg/L) dans la plupart des échantillons d'eau souterraine, d'eau de surface, d'eau brute, d'eau traitée ou d'eau de distribution où il y a eu surveillance (Alberta Environment and Sustainable Resource Development, 2013; Manitoba Conservation and Water Stewardship, 2013; New Brunswick Department of Health, 2013; Ministère de l'Environnement et de la Lutte contre les changements climatiques, 2021; Nova Scotia Environment, 2021; Ontario Ministry of the Environment, 2021; Saskatchewan Water Security Agency, 2021).
En Alberta, le 2,4-D a été décelé à des concentrations de 0,002 à 1,235 μg/L dans une proportion de 18,4 % des échantillons d'eau potable traitée (75 % d'eau de surface, 25 % d'eau souterraine) entre 1995 et 2010 (n = 2 332, LD = 0,005 μg/L) (Alberta Environment and Sustainable Resource Development, 2013).
Au Manitoba, le 2,4-D a été détecté dans une proportion de 13 % des eaux de surface de l'environnement (rivière, lac, ruisseau) qui ont été l'objet d'un prélèvement d'échantillons entre 2001 et 2012, et la concentration maximale était de 8,4 μg/L (n = 1,860, LD = 0,005 μg/L) (Manitoba Conservation and Water Stewardship, 2013).
En Nouvelle-Écosse, la concentration de 2,4-D a été mesurée dans l'eau brute (eau souterraine et eau de surface) et dans l'eau potable traitée entre 2013 et 2019. Le 2,4-D a été détecté dans 2 échantillons. La concentration maximale était de 0,077 µg/L (n = 183; LDM = 0,05 à 1 µg/L) (Nova Scotia Environment, 2021). Le 2,4-D n'a pas été décelé dans les échantillons d'eau potable municipale, brute ou traitée, au Nouveau-Brunswick (n = 16, LDM = 0,05 µg/L) (New Brunswick Department of Health, 2013).
En Ontario, le 2,4-D a été détecté dans 0,16 % des échantillons d'eau potable, la concentration maximale de 2,4-D décelée dans les échantillons d'eau de surface et souterraine traitée prélevés entre 2010 et 2020 était de 1 µg/L et la concentration moyenne était de 0,48 µg/L (n = 8,947, LD non précisée) (Ontario − Ministre de l'Environnement, 2021). Entre 2013 et 2018, le 2,4-D a été trouvé dans 10,8 % des échantillons d'eau potable traitée au Québec et la concentration maximale était de 0,22 µg/L (n= 2 290 issus de 175 installations de distribution, LDM = 0,03 à 3,0 µg/L) (Ministère de l'Environnement et de la Lutte contre les changements climatiques, 2021).
En Saskatchewan, des concentrations de 2,4-D ont été mesurées dans des échantillons d'eau de surface, d'eau souterraine, d'eau potable traitée et d'eau provenant de réseaux de distribution prélevés entre 2001 et 2020. Seulement 5 échantillons sur 1 909 présentaient des concentrations supérieures à la LD de 0,1 à 0,5 µg/L, la concentration maximale détectée était de 12 µg/L et la concentration moyenne était de 3,28 µg/L (Saskatchewan Water Security Agency, 2021).
Les publications scientifiques faisaient état d'autres données de surveillance de l'eau canadiennes. Entre avril et septembre 2007, 19 sites situés dans 16 bassins hydrographiques dans l'ensemble du Canada ont été échantillonnés, dont 15 sites en aval de centres urbains. Du 2,4-D a été décelé dans 85 % des 150 échantillons recueillis. Les concentrations moyennes et médianes et les plages de concentrations de tous les échantillons de 2,4-D étaient de 172,1 ng/L, de 52,7 ng/L et de moins de 0,47 à 1 960 ng/L, respectivement (Glozier et coll., 2012). Les cours d'eau urbains de l'Ontario présentaient des concentrations significativement plus élevées de 2,4-D que toutes les autres zones (p < 0,001). Aucune différence saisonnière n'a été observée dans les concentrations de 2,4-D mesurées dans les cours d'eau à l'échelle du pays. Les échantillons prélevés après de fortes pluies affichaient des concentrations trois fois plus élevées de 2,4-D qu'en l'absence de précipitations. Dans les cours d'eau des provinces des Prairies, les échantillons obtenus en aval de centres urbains présentaient des concentrations de 2,4-D 1,6 fois plus élevées que ceux qui avaient été prélevés en amont (Glozier et coll., 2012).
Au Québec, on a échantillonné quatre cours d'eau situés dans des zones de culture intensive de maïs et de soja entre 1993 et 2001 (Giroux, 2002). Les concentrations annuelles moyennes et médianes de 2,4-D étaient de 0,027 à 0,504 μg/L et de 0,02 à 0,263 μg/L, respectivement, tandis que les concentrations annuelles maximales variaient entre 0,2 et 4,1 μg/L (Giroux, 2002).
En Ontario, entre 1998 et 2002, du 2,4-D a été décelé dans 12 % des échantillons d'eau de surface (n = 262) prélevés dans les bassins versants des rivières Don et Humber. La concentration moyenne était de 0,13 μg/L (LDM = 0,1 μg/L) et la concentration maximale, de 3,2 μg/L (Struger et Fletcher, 2007). Du 2,4-D était présent dans l'eau potable à des concentrations supérieures à la LD (0,05-0,1 µg/L) dans seulement 1 % (1/122) de l'eau sortant des robinets de cuisine des habitations échantillonnées dans le cadre de l'étude sur la santé des familles agricoles en Ontario (Arbuckle et coll., 2006). Dans le cadre du Programme de surveillance des Grands Lacs d'Environnement Canada, des échantillons d'eau de surface ont été prélevés dans tous les Grands Lacs, sauf le lac Michigan, entre 1994 et 2000. Les concentrations de 2,4-D variaient de 2,3 à 14,5 ng/L, de moins de 0,40 à 84,4 ng/L, de moins de 0,29 à 1,4 ng/L et de moins de 0,40 à 2,5 ng/L pour les lacs Ontario, Érié, Huron et Supérieur, respectivement (Struger et coll., 2004).
De 2003 à 2005, on a échantillonné des réservoirs et l'eau potable traitée qui leur est associée au Manitoba, en Saskatchewan et en Alberta (15 lieux au total) pour en mesurer la concentration en 2,4-D (Donald et coll., 2007). Tous les échantillons analysés (n = 206) présentaient des concentrations supérieures à la limite de détection (LD) de 0,47 ng/L. L'eau potable affichait une concentration annuelle moyenne de 75 ng/L et une concentration maximale de 589 ng/L, tandis que pour l'eau du réservoir, la concentration moyenne s'établissait à 123 ng/L et la concentration maximale, à 1 850 ng/L (Donald et coll., 2007).
Aucune donnée n'a été trouvée sur les concentrations de 2,4-D dans les aliments au Canada. Selon l'Organisation mondiale de la Santé (OMS, 2003), [traduction] « les données indiquent que les résidus de 2,4-D dépassent rarement quelques dizaines de μg/kg dans les aliments »; il est donc peu probable que le 2,4-D s'accumule dans les aliments. Santé Canada (2018a) a fixé un seuil maximal de résidus de 2,4-D pour divers produits alimentaires (notamment les fruits, les légumes et les tissus et organes d'animaux) de 0,01 à 5 ppm. On a estimé l'exposition par voie alimentaire au 2,4-D en se fondant sur la consommation moyenne de différents aliments, les valeurs moyennes de résidus sur ces aliments pour une durée de vie de 70 ans et les habitudes alimentaires de la population à divers stades de la vie. On a estimé l'apport de 2,4-D par voie alimentaire de la population générale, des nourrissons et enfants et des jeunes (âgés de 7 à 12 ans) à 0,12, 0,27 et à 0,16 µg/kg de poids corporel (p.c.) par jour, respectivement (Santé Canada, 2007).
En général, l'exposition au 2,4-D dans l'air est considérée faible. Le 2,4-D est le plus souvent décelé dans l'air immédiatement après une application (Tuduri et coll., 2006). Les résultats provisoires d'un programme national de surveillance de la qualité de l'air d'une durée de 3 ans du Canadian Atmospheric Network for Currently Used Pesticides (CANCUP) montrent que les concentrations atmosphériques de 2,4-D varient selon les années et les périodes ainsi qu'en fonction des caractéristiques régionales (Yao et coll., 2008). Des échantillons d'air ont été recueillis à huit endroits (six sites agricoles, un milieu humide et un milieu urbain) dans tout le Canada en 2004 et en 2005. Les concentrations moyennes variaient entre 10,0 et 730 pg/m3 en 2004 et entre 59,4 et 193 pg/m3 en 2005 (LDM = 1,4 pg/m3). Des concentrations de 2,4-D de 0 à 5 ng/m3 ont été mesurées dans l'air après une pulvérisation du gazon dans trois banlieues de la ville de Québec entre 2001 et 2002 (Giroux et Therrien, 2005). Les concentrations enregistrées en Saskatchewan entre 1989 et 2002 étaient de 190 à 2 730 pg/m3; les concentrations culminaient en juin, puis diminuaient progressivement par la suite (Tuduri et coll., 2006). En Alberta, l'Air Research Users Group du ministère de l'Environnement de l'Alberta a signalé que la plupart des concentrations étaient inférieures à 0,1 ng/m3, et la concentration maximale s'établissait à 0,36 ng/m3 (n = 4 emplacements; LDM = 0,05 mg/m3) (Kumar, 2001).
On n'a décelé du 2,4-D dans aucun site d'échantillonnage au cours de l'étude de surveillance du CANCUP en 2005 (n = 8 lieux, quatre échantillons par emplacement, LDM = 0,2 ng/g) (Yao et coll., 2008).
La plupart des Canadiens présentent de très faibles concentrations urinaires de 2,4-D, selon les mesures effectuées au cours du cycle 1 (2007–2009) et du cycle 2 (2009–2011) de l'Enquête canadienne sur les mesures de la santé (Santé Canada, 2013). Dans l'Enquête, la moyenne géométrique des concentrations urinaires de 2,4-D selon les groupes d'âge n'a pas été calculée lorsque plus de 40 % des échantillons présentaient des concentrations inférieures à la LD, qui était de 0,2 µg/L. Lorsque les données étaient stratifiées en fonction du sexe et de l'âge, la moyenne géométrique ne pouvait être calculée que pour les hommes des groupes d'âge de 6 à 11 ans, de 20 à 39 ans et de 40 à 59 ans au cours du cycle 2 ainsi que pour tous les âges (3 à 79 ans). La plage des concentrations variait de 0,24 à 0,29 µg/L (intervalle de confiance (IC) à 95 % : 0,20 à 0,39 µg/L).
Dans l'étude sur la santé des familles agricoles en Ontario et la Pesticide Exposure Assessment Pilot Study, on a fait état de concentrations urinaires moyennes de 2,4-D de 1,0 à 40,8 µg/L chez les préposés agricoles appliquant la substance (n = 126; 20 % sous la LD), de 0,7 à 2,0 µg/L chez leurs conjointes (n = 125; 84 % sous la LD) et de 0,7 à 2,9 µg/L chez leurs enfants (n = 92; 70 % sous la LD) (Arbuckle et coll., 1999b, 2004, 2005, 2006; Arbuckle et Ritter, 2005).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le 2,4-D, sont réglementés par l'ARLA de Santé Canada. L'ARLA effectue des évaluations approfondies et des examens cycliques des pesticides, y compris des informations non publiées et de nature exclusive. Des examens menés à l'étranger sont également effectués par d'autres organismes de réglementation comme l'U.S. EPA. À ce titre, la présente évaluation des risques pour la santé est principalement fondée sur les évaluations de l'ARLA et ses documents d'appui. (Santé Canada, 2005a, 2005b, 2006, 2007, 2018b, 2018c). De plus, tous les évaluations et documents pertinents diffusés depuis l'évaluation de l'ARLA ont également été pris en compte.
2.1 Cinétique
La pharmacocinétique du 2,4-D est assez uniforme d'une espèce à l'autre, à l'exception des chiens pour qui la demi-vie plasmatique est plus longue en raison de leur mécanisme de clairance rénale plus lent et de leur incapacité à excréter les acides organiques (van Ravenzwaay et coll., 2003; Timchalk, 2004). En raison de la charge corporelle considérablement plus élevée chez le chien à des doses comparables, il se peut que les données sur le chien ne soient pas pertinentes pour l'évaluation des risques pour la santé humaine (Timchalk, 2004).
La pharmacocinétique du 2,4-D après absorption cutanée diffère de celle qui suit une ingestion par voie orale (Kennepohl et coll., 2010). Étant donné que l'absorption cutanée n'est pas importante à la suite d'une exposition à de l'eau potable, les études pharmacocinétiques sur l'exposition cutanée n'ont pas été étudiées en profondeur. Puisque les sels et les esters du 2,4-D sont rapidement hydrolysés en acide dans l'eau après absorption (Frantz et Kropscott, 1993), seule la pharmacocinétique de la forme acide du 2,4-D sera examinée.
Absorption : Le 2,4-D est facilement absorbé par le tractus gastro-intestinal (de 92 % à 99 %) après ingestion orale chez le rat et l'humain, et son taux d'absorption diminue à mesure que la dose augmente (Sauerhoff et coll., 1977; Gorzinski et coll., 1987; Timchalk et coll., 1990; Kennepohl et coll., 2010). Le sexe n'a pas eu d'incidence sur le taux d'absorption dans une étude menée avec des rats Sprague-Dawley ayant reçu par voie orale 5 ou 200 mg/kg de 2,4-D (Griffin et coll., 1997).
Chez l'humain, des concentrations plasmatiques maximales de 25 à 40 µg/mL ont été atteintes entre 7 h et 24 h après l'ingestion de capsules contenant 5 mg/kg p.c. de 2,4-D par six volontaires mâles en bonne santé (Kohli et coll., 1974). Chez les rats Sprague-Dawley ayant reçu 5 mg/kg p.c. de 2,4-D par voie orale, les concentrations sanguines maximales de 7,5 µg/L chez les mâles et de 16,2 µg/L chez les femelles ont été atteintes en 26,8 minutes et 42,9 minutes, respectivement (Griffin et coll., 1997).
Distribution : Étant très hydrophile, le 2,4-D se distribue rapidement dans tout l'organisme, mais ne semble pas s'accumuler dans les tissus suite à l'administration de doses répétées (Erne, 1966; Munro et coll., 1992; OEHHA 2009; Kennepohl et coll., 2010). Le 2,4-D se lie fortement (93 à 97 %) aux protéines plasmatiques dans une vaste gamme de concentrations (Timchalk, 2004). La distribution était semblable chez plusieurs espèces (souris, hamsters, rats, porcs, veaux, poulets) qui ont reçu du 2,4-D par voie orale, et les valeurs les plus élevées ont été observées dans le foie, les reins, les poumons et la rate. Ces valeurs dépassaient parfois les valeurs plasmatiques (Erne, 1966; Griffin et coll., 1997). De faibles concentrations ont également été observées dans les gonades, le tissu adipeux et le cerveau (Griffin et coll., 1997). La pénétration du 2,4-D dans le tissu adipeux et dans le système nerveux central est limitée et s'explique probablement par le fait que le 2,4-D existe principalement sous forme ionisée à pH physiologique, ce qui le rend incapable de traverser facilement les membranes lipidiques (Erne, 1966; Munro et coll., 1992). Au fil du temps, la concentration de 2,4-D dans les reins finit par dépasser les concentrations détectées dans le sang ou le plasma, ce qui reflète le rôle important joué par les reins comme principale voie d'enlevement du 2,4-D (Timchaulk, 2004). Chez les rats ayant reçu des doses orales uniques, les concentrations de 2,4-D dans tous les tissus ont culminé après six heures, puis ont chuté rapidement après 24 heures (Munro et coll., 1992).
Dans des études animales utilisant des doses uniques radiomarquées, on a signalé que le 2,4-D traversait la barrière placentaire et qu'il a été détecté chez les fœtus de rats et de souris. Cependant, l'enlèvement chez les fœtus a été rapide, soit en 24 h (Munro et coll., 1992).
Métabolisation : Le 2,4-D n'est pas métabolisé de façon importante chez le rat et l'humain, peu importe la dose, la durée ou la voie d'exposition (Kohli et coll., 1974; Munro et coll., 1992). Seul le composé parent a été trouvé dans l'urine et les fèces de rats après l'administration orale de 5 à 200 mg/kg p.c. de 2,4-D (Frantz et Kropscott, 1993; Griffin et coll, 1997; van Ravenzwaay et coll., 2003). Chez le hamster et la souris, le 2,4-D est le principal composé présent dans l'urine, bien que des conjugués (glycine et taurine chez la souris; glycine, taurine et glucuronide chez le hamster) soient également présents à différentes concentrations (Griffin et coll., 1997; van Ravenzwaay et coll., 2003).
Enlèvement : L'excrétion rénale serait la principale voie d'élimination du 2,4-D chez les humains, les rats, les hamsters et les souris, tandis que les matières fécales et l'expiration représentent des voies d'élimination mineures (Timchalk et coll., 1990; Kennepohl et coll., 2010). Le 2,4-D est sécrété par les tubules rénaux proximaux chez le rat et l'humain au moyen d'un système de transport actif qui est saturable (Hasegawa et coll., 2003; Nozaki et coll., 2007; Kennepohl et coll., 2010). Chez le rat, la saturation se produit à des doses de 50 à 60 mg/kg p.c. (Gorzinski et coll., 1987; Hasegawa et coll., 2003; Nozaki et coll, 2007; Kennepohl et coll., 2010). La vitesse d'excrétion urinaire est inversement proportionnelle à la dose administrée (Kennepohl et coll., 2010). Chez l'humain, le composé parent a été décelé dans l'urine dans les 2h suivant une seule administration orale de 5 mg de 2,4-D/kg p.c., et 75 % a été excrété sous forme inchangée en 96 h (Kohli et coll., 1974). La demi-vie moyenne chez l'humain, après ingestion, varie de 18 h à 40 h bien qu'une valeur élevée de 220 h ait été rapportée (Friesen et coll., 1990). La variabilité de la demi-vie est probablement attribuable aux différences de pH urinaire et à cet effet sur la clairance rénale (Friesen et coll., 1990). Des rats ayant reçu des doses orales uniques de 10, de 50 ou de 150 mg/kg p.c. de 2,4-D ont présenté une clairance biphasique dont la demi-vie d'excrétion moyenne était de 0,9 h pour la phase alpha et de 18 h pour la phase bêta (Smith et coll., 1990). L'excrétion a atteint une saturation à 50 mg/kg p.c. (Smith et coll., 1990; van Ravenzwaay et coll., 2003). Les rates exposées à 200 mg/kg p.c. ont présenté une demi-vie d'enlèvement plus longue (139,4 h) que les rats (34,6 h) (Griffin et coll., 1997).
2.2 Effets sur la santé
À de très rares exceptions près (notamment la DEA), les effets et la toxicité relative des sels et des esters du 2,4-D sont très semblables à ceux de la forme acide (Santé Canada, 2005a; US EPA, 2005).
2.3 Effets sur les humains
Bien que certaines études épidémiologiques aient montré des associations entre l'exposition au 2,4-D et le risque de cancer, d'anomalies congénitales ou de maladie de Parkinson, les lacunes de l'étude (c.-à-d. des mesures inadéquates de l'exposition, d'autres facteurs de confusion comme l'exposition concomitante à d'autres pesticides ou contaminants, la petite taille des échantillons) ne permettent pas de tirer des conclusions définitives.
Les renseignements sur la toxicité aiguë se limitent aux cas d'ingestion accidentelle et intentionnelle de 2,4-D. Dans la plupart des cas, il a été question de l'ingestion de diverses formulations contenant du 2,4-D mélangé à d'autres herbicides (p. ex., dicamba, acide méthylchlorophénoxyacétique) et/ou solvants et émulsifiants, ce qui permet difficilement de distinguer la toxicité du 2,4-D de celle des autres substances. De plus, les patients vomissent souvent après ingestion. L'ingestion de mélanges et la présence de vomissements pourraient expliquer le large éventail de doses létales médianes (DL50) par voie orale chez les humains (300 à 1 000 mg/kg p.c.) signalées dans les publications scientifiques (Nielsen et coll., 1965; Kancir et coll., 1988; Friesen et coll., 1990; Durakovic et coll, 1992; Bradberry et coll, 2000; Brahmi et coll., 2003). Des signes consécutifs à l'ingestion orale de mélanges contenant du 2,4-D ont été observés dans un certain nombre d'organes et de systèmes ou appareils, y compris les reins, le système nerveux central, le tractus gastro-intestinal et le système cardiovasculaire. Le décès était causé par une défaillance grave de plusieurs organes ou un arrêt cardiaque dans les cas d'empoisonnement mortel (O'Reilly, 1984; Kancir et coll, 1988; Flanagan et coll, 1990; Friesen et coll, 1990; Durakovic et coll, 1992; Keller et coll, 1994; Bradberry et coll, 2000; Brahmi et coll, 2003). Aucun signe de toxicité n'a été observé chez les cinq volontaires mâles en bonne santé ayant reçu une dose unique de 5 mg/kg p.c. de 2,4-D de qualité analytique (Sauerhoff, 1977).
Cancer : Certaines études épidémiologiques ont fait état d'associations entre l'exposition au 2,4-D et le lymphome non hodgkinien (LNH), le sarcome des tissus mous (STM) et les cancers de la prostate et gastrique chez les travailleurs industriels et agricoles (Miligi et coll, 2003, 2006; Mills et coll. 2005; Mills et Yang, 2007), mais d'autres études n'ont pas réussi à étayer de telles associations (Wiklund et coll., 1987; De Roos et coll., 2003; Eriksson et coll., 2008; Goodman et coll., 2015, 2017). L'absence de mesures directes de l'exposition individuelle, la petite taille des cohortes et la présence d'autres contaminants tels d'autres pesticides rendent difficile l'établissement de conclusions définitives. De plus, la grande majorité des récentes études de suivi et de méta-analyse n'a révélé aucun lien entre l'exposition au 2,4-D et les cancers de l'estomac, de la prostate ou des tissus mous (Bloemen et coll., 1993; Kogevinas et coll., 1997; Burns et coll., 2011; Pahwa et coll, 2011; Burns et Swaen, 2012; Goodman et coll., 2017).
Des travailleurs finlandais pulvérisant exclusivement du 2,4-D n'ont pas présenté un nombre accru d'aberrations chromosomiques dans les lymphocytes périphériques. La durée de l'exposition variait de 9 à 28 jours. Les concentrations urinaires de 2,4-D dans l'urine à la fin de l'exposition variaient de 0,02 à 1,56 mg/L et présentait une grande variabilité entre les individus. L'utilisation d'équipement de protection individuelle n'a pas été précisée (Mustonen et coll., 1986).
Effets autres que le cancer : Une relation entre l'exposition au 2,4-D et la maladie de Parkinson a été suggérée, mais ces études ont souvent porté sur l'exposition globale aux pesticides plutôt que sur un pesticide en particulier (Semchuk et coll., 1992). À l'exception de Tanner et coll. (2009), les études les plus récentes n'ont pas établi d'association entre la maladie de Parkinson et l'exposition au 2,4-D (Kamel et coll., 2007; Dhillon et coll., 2008; Hancock et coll., 2008; Rugbjerg et coll., 2011; Burns et Swaen, 2012). Dans cette étude cas-témoin en milieu professionnel, on a observé une légère augmentation de la probabilité de la maladie de Parkinson et de l'utilisation du 2,4-D chez les hommes qui ont participé à huit essais cliniques en Amérique du Nord (rapport de cotes (RC) = 2,59, IC à 95 % = 1,03 à 6,48). Toutefois, l'étude comportait un certain nombre de lacunes, notamment un risque de biais de rappel, une exposition mal caractérisée, une exposition concomitante de certains sujets à d'autres pesticides et un IC inférieur supérieur à 1,0 (Tanner et coll., 2009).
Toxicité pour le développement et le système reproducteur : L'interprétation des résultats épidémiologiques sur les effets potentiels sur le développement et la reproduction était souvent faussée par des facteurs tels que l'utilisation de préparations de pesticides, l'intégration en général du 2,4-D dans d'autres classes de pesticides ou avec tous les herbicides du type phénoxy, le recours à des mesures indirectes de l'exposition, les facteurs de confusion et biais non mesurés et, dans les études antérieures, la contamination par les dioxines (Santé Canada, 2007). Dans l'étude sur la santé des familles rurales de l'Ontario, une étude rétrospective avec questionnaire menée en 2000 auprès de couples d'agriculteurs, l'exposition aux herbicides du type phénoxy avant et après la conception n'a pas augmenté les risques d'avortement spontané au cours du premier trimestre (Arbuckle et coll., 1999a). Dans une étude de Garry et coll., (1996), les probabilités d'anomalies du système nerveux central, circulatoires, respiratoires, urogénitales et musculaires chez les nouveau-nés (n = 4 935) des préposés à l'application de pesticides (n = 34 772) au Minnesota présentaient une association significative avec une exposition combinée aux herbicides et fongicides de type chlorophénoxy (RC = 1,86, IC 95 % = 1,69 à 2,05). Il n'existe pas de données sur l'exposition au 2,4-D.
Dans une étude mal décrite, l'analyse de spermatozoïdes (volume, nombre, mobilité, morphologie) de 32 préposés à la pulvérisation agricole exposés au 2,4-D (concentration urinaire moyenne de 9,02 mg/L de 2,4-D) a révélé une diminution significative de la motilité des spermatozoïdes et du nombre de spermatozoïdes vivants, ainsi qu'une augmentation significative du nombre de spermatozoïdes ayant une morphologie anormale comparativement aux témoins non exposés (n = 25; aucun 2,4-D détecté dans l'urine); toutefois, les résultats n'étaient pas uniformes d'une période d'exposition à une autre et les renseignements concernant le moment du prélèvement des urines et du sperme étaient insuffisants (Lerda et Rizzi, 1991). Dans une étude in vitro utilisant des spermatozoïdes provenant de volontaires en bonne santé, des doses supérieures ou égales à 10 µM de 2,4-D ont mené à une diminution proportionnelle à la dose de la motilité totale, de la motilité progressive et de la capacitation en présence de progestérone, tandis que les doses supérieures ou égales à 1 µM ont diminué la capacité des spermatozoïdes à pénétrer un milieu visqueux (Tan et coll., 2016). Des doses allant jusqu'à 200 µM n'ont eu aucun effet sur la viabilité des spermatozoïdes, la capacitation en l'absence de progestérone ou les réactions acrosomiques (Tan et coll., 2016). Les auteurs ont avancé l'hypothèse que le 2,4-D pouvait altérer les concentrations intracellulaires de calcium et induire un stress oxydatif (Tan et coll., 2016).
2.4 Effets sur les animaux de laboratoire
Les effets nocifs du 2,4-D qui ont été observés dans des études de toxicité subchronique et chronique chez les animaux comprenaient des effets toxiques sur les reins, le foie et la rétine, des variations du poids corporel et du poids des organes (thyroïde, rein, surrénales), et une altération des paramètres biochimiques du sang et des concentrations en hormones thyroïdiennes (Serota et coll., 1983a, 1983b; Gorzinski et coll., 1987; Schultze, 1991a, 1991b; Jeffries et coll., 1995; Charles et coll., 1996b; Mattsson et coll., 1997; Marty et coll., 2013; Neal et coll., 2017). Les composés de 2,4-D n'ont produit aucun effet cancérogène chez les animaux et le 2,4-D n'a généralement pas eu d'effets sur la reproduction ou le développement chez les rongeurs sauf aux doses toxiques pour la mère (Jeffries et coll., 1995; Charles et coll., 1996a; Kennephol et coll., 2010; Marty et coll., 2013; Pochettino et coll., 2016).
Le 2,4-D présente une toxicité aiguë modérée lorsqu'il est administré par voie orale à des animaux (Carreon et coll., 1983; Gorzinski et coll., 1987). Dans une étude menée par Mattsson et coll. (1997), des doses uniques de 15, 75 ou 250 mg/kg de 2,4-D ont été administrées par gavage à des groupes de 10 rats par sexe. Une altération légère ou minime de la démarche a été observée au jour 1 chez deux rats à la dose de 75 mg/kg. Une dose de 250 mg/kg p.c. a causé une modification légère et transitoire de la démarche et de la coordination, lesquelles étaient rétablies au jour 8. Les auteurs ont déterminé une NOAEL de 15 mg/kg. Les valeurs de la DL50 par voie orale chez des rats Fischer 344 (F344) étaient de 607 et de 726 mg/kg p.c. pour les mâles et les femelles, respectivement (Gorzinski et coll., 1987). Différentes formes de 2,4-D affichaient une toxicité orale semblable ou inférieure lorsqu'elles étaient considérées comme l'ingrédient actif, et les valeurs étaient de 536 mg/kg p.c. et 424 mg/kg p.c d'ingrédient actif chez les mâles et les femelles, respectivement, pour l'ester isobutyle et de 619 et 490 mg/kg p.c. d'ingrédient actif chez les mâles et les femelles, respectivement, pour la DMA (Gorzinski et coll., 1987). Les sels IPA ont une toxicité aiguë plus faible, et les valeurs de la DL50 par voie orale variaient entre 1 646 et 2 322 mg/kg p.c. pour les rates et les rats, respectivement (Carreon et coll., 1983).
Effets sur les reins : Des effets rénaux consistant en une légère modification de paramètres de biochimie clinique et du poids des reins ont été observés dans le cadre d'une étude de toxicité chronique/d'oncogénicité de deux ans au cours de laquelle des rats F344 (60 par sexe et par dose) ont reçu des aliments contenant 0, 5, 75 ou 150 mg/kg p.c. par jour de 2,4-D de qualité technique (pureté de 96,4 %) accompagnée d'un sacrifice en cours d'étude de 10 rats par sexe et par dose après 12 mois (Jeffries et coll., 1995; Charles et coll., 1996a). Le traitement n'a pas eu d'incidence sur la survie des animaux. Au bout de 2 ans, le poids des reins était inchangé chez les mâles; on a toutefois observé une légère diminution, statistiquement significative, chez les femelles à la dose de 150 mg/kg p.c. par jour et une augmentation statistiquement significative du rapport entre le poids des reins et le poids corporel à une dose de ≥75 mg/kg p.c. par jour. Une diminution de la consommation d'aliments a été remarquée chez les femelles à la dose de ≥75 mg/kg p.c. par jour, et chez les mâles, à la dose de 150 mg/kg p.c. par jour. Cet effet était accompagné d'une réduction du gain de poids. À la dose de ≥75 mg/kg p.c. par jour, l'azote uréique du sang (AUS) avait diminué chez les mâles seulement, tandis que la créatinine avait augmenté chez les femelles seulement. Lors du sacrifice en cours d'étude, les mâles et les femelles ayant reçu une dose de ≥75 mg/kg p.c. par jour présentaient une dégénérescence des tubules contournés proximaux, mais aucun effet sur l'histopathologie des reins n'a été relevé chez les rats sacrifiés au bout de 2 ans (Jeffries et coll., 1995; Charles et coll., 1996a).
Dans une étude semblable sur la substance administrée par voie alimentaire de 2 ans menée sur des rats F344 (60/sexe/dose) ayant reçu une dose de 0, 1, 5, 15 ou 45 mg/kg p.c. par jour de 2,4-D, aucun effet n'a été constaté sur les paramètres de biochimie clinique, la pathologie macroscopique ou le taux de survie (Serota, 1986). Le gain de poids corporel relatif avait considérablement diminué au bout de 12 et de 24 mois chez les femelles ayant reçu de fortes doses, bien que la consommation d'aliments n'ait diminué qu'au bout de 12 mois. Le poids absolu et le poids relatif des reins avaient augmenté chez les mâles (à ≥15 mg/kg p.c. par jour) et les femelles (à toutes les doses) au bout de 2 ans. Le gain de poids corporel relatif chez les femelles recevant la dose élevée a diminué de façon significative à 12 et 24 mois, bien que la consommation alimentaire ait diminué à 12 mois seulement. Le poids absolu et le poids relatif des reins avaient augmenté chez les mâles (à ≥15 mg/kg p.c. par jour) et les femelles (à toutes les doses) au bout de 2 ans. Une minéralisation du pelvis rénal a été remarquée chez les femelles à partir de 15 mg/kg p.c. par jour. Des changements dans l'histopathologie des reins (fréquence accrue d'une pigmentation brune des cellules tubulaires et de petites vacuoles cytoplasmiques dans le cortex rénal) ont été observés chez les deux sexes à partir d'une dose de 5 mg/kg p.c. par jour, bien que l'examen effectué par un groupe de travail de pathologie indépendant du Research Triangle Park de nouvelles coupes de rein et de lames provenant de l'étude n'ait relevé aucune différence dans la pigmentation des cellules tubulaires entre les groupes soumis au traitement et les groupes témoins (Santé Canada, 2005b). Le groupe de travail a également conclu que la nature du pigment observé chez tous les animaux à l'étude était morphologiquement semblable à celle du pigment qui pouvait apparaître spontanément chez les rats F344 de cet âge. On a estimé que la fréquence et la gravité de la minéralisation du pelvis étaient liées au traitement chez les mâles à la dose de 45 mg/kg p.c. et chez les femelles à des doses de 15 et de 45 mg/kg p.c. (Santé Canada, 2005b).
Dans une étude de 2 ans sur la substance administrée par voie alimentaire, les souris B6C3F1 femelles ont reçu une dose de 0, 5, 150 ou 300 mg/kg p.c. par jour de 2,4-D et les mâles, une dose de 0, 5, 62,5 et 125 mg/kg p.c. par jour (Jeffries et coll., 1995; Charles et coll., 1996a). Une augmentation liée au traitement du poids absolu et du poids relatif des reins a été constatée chez les deux sexes aux deux doses les plus élevées; cette hausse était associée à des altérations minimes de la branche descendante des tubules proximaux dans les reins. Une vacuolisation des tubules proximaux a aussi été relevée à ces doses.
Le rein était l'organe cible dans une étude exhaustive par voie alimentaire sur une génération (précédant la publication de la directive 443 de l'Organisation de coopération et de développement économique [OCDE]) dans laquelle des rats Crl:CD mâles et femelles (27/sexe/dose; génération parentale ou P1) ont reçu du 2,4-D à raison de 0, 7, 21 ou 40 mg/kg p.c. par jour jusqu'à la fin de la lactation et de 0, 6, 17 ou 45 mg/kg p.c. par jour jusqu'à 7 semaines après l'accouplement, respectivement (Marty et coll., 2013). Les régimes ont été administrés à la progéniture (F1) jusqu'au jour post-natal (JPN) 139, et des sacrifices en cours d'étude ont été effectués aux JPN 60, 70 et 90. Une augmentation statistiquement significative du poids absolu et du poids relatif des reins a été observée chez les mâles P1 ayant reçu une forte dose et chez les femelles F1 auxquelles une dose élevée avait été administrée au JPN 139. Des lésions rénales ont été signalées chez les mâles P1 ayant reçu une dose élevée, chez les mâles F1 ayant reçu une dose intermédiaire et chez les animaux F1 (des deux sexes) ayant reçu une dose élevée; ces lésions étaient caractérisées par une dégénérescence très légère à légère des tubules contournés proximaux. Les lésions étaient plus graves chez les mâles que chez les femelles.
Effets sur le foie : Dans une étude de toxicité chronique/oncogénicité de 2 ans, on a administré à des rats F344 (60/sexe/dose) des aliments contenant 0, 5, 75 ou 150 mg/kg p.c. par jour de 2,4-D de qualité technique (pureté de 96,4 %) et procédé au sacrifice en cours d'étude de 10 rats/sexe/dose après 12 mois (Jeffries et coll., 1995; Charles et coll., 1996a). Le traitement n'a pas eu d'incidence sur la survie des animaux. Chez les deux sexes, le poids du foie diminuait de façon significative aux deux doses les plus élevées, tandis que le taux de phosphatase alcaline (ALP) augmentait de façon significative. Chez les mâles seulement, le taux d'alanine transaminase (ALT)Note de bas de page 1 et d'aspartate transaminase (AST)Note de bas de page 2 a considérablement augmenté à la dose de 75 mg/kg p.c. par jour et plus. Un examen histopathologique a montré une coloration panlobulaire minime dans le foie, mais les auteurs ne considèrent pas ces résultats comme significatifs sur le plan toxicologique.
On a signalé des effets sur le foie (changements dans les paramètres biochimiques et histologiques) chez des rats F344 et des souris B6C3F1 ayant reçu des doses par voie alimentaire de 2,4-D pouvant atteindre 150 et 300 mg/kg p.c. par jour, respectivement, pendant 13 semaines (Serota et coll., 1983a, 1983b; Gorzinski et coll., 1987; Schultze, 1991a, 1991b). On a remarqué une diminution de l'activité de l'ALT, de l'AST, de l'ALP et des taux d'azote uréique sanguin chez les rats des deux sexes exposés à 15 et 45 mg/kg p.c. par jour pendant 13 semaines (Serota et coll., 1983a). En revanche, dans une autre étude de 13 semaines, des rats ayant reçu la dose la plus élevée de 2,4-D de qualité technique (150 mg/kg p.c. par jour) affichaient une légère hausse statistiquement significative de l'ALT chez les deux sexes, tandis que l'ALP et le poids relatif du foie avaient légèrement augmenté chez les femelles seulement (Gorzinski et coll., 1987). Les deux sexes présentaient des changements hépatocellulaires mineurs non spécifiques aux deux doses les plus élevées (100 et 150 mg/kg p.c. par jour) (Gorzinski et coll., 1987). De même, on a observé chez les rats mâles et femelles exposés à des doses de 2,4-D de 100 et de 300 mg/kg p.c. par jour une hausse des taux d'ALT et d'AST (variant de 1 à 300 mg/kg p.c. par jour pendant 13 semaines), accompagnée d'une augmentation du poids du foie, de lésions hépatiques et d'une hypertrophie hépatocellulaire centrilobulaire (Schultze, 1991b). Des souris exposées à 1 à 300 mg/kg p.c. par jour (les deux sexes) pendant 13 semaines présentaient aussi des lésions histopathologiques du foie (caractérisées par un hyperchromatisme nucléaire) et une baisse de glycogène dans les hépatocytes périportaux, mais seulement à la dose la plus élevée (Schultze, 1991a).
Effets sur le système endocrinien : Une augmentation du poids de la thyroïde, des changements histopathologiques non significatifs (hyperplasie nodulaire des cellules parfolliculaires) et une diminution des taux de thyroxine (T4) ont été observés à partir de 75 mg/kg p.c. par jour dans une étude de 2,4-D de deux ans sur la toxicité chronique et l'oncogénicité chez des rats F344 à qui on a administré des aliments contenant 0, 5, 75 ou 150 mg/kg p.c. de 2,4-D par jour (Jeffries et coll., 1995; Charles et coll., 1996a). Les taux de T4 ont également diminué de façon significative dans les deux groupes de rats F344 (femelles seulement) ayant reçu les doses les plus élevées de 2,4-D à raison de 0, 15, 60 et 150 mg/kg p.c. par jour pendant 13 semaines (Gorzinski et coll., 1987). Dans une autre étude sur la substance administrée par voie alimentaire de 13 semaines, on a observé chez des rats F344 une augmentation du poids absolu et du poids relatif de la thyroïde chez les mâles à toutes les doses de 2,4-D (1, 5, 15 ou 45 mg/kg p.c. par jour) et chez les femelles, aux trois doses les plus élevées, tandis que les taux de T4 augmentaient chez les mâles à des doses de 5 et de 15 mg/kg p.c. par jour (Serota et coll., 1983a). Dans une étude exhaustive de toxicité sur le plan de la reproduction chez le rat CD portant sur une génération où étaient examinés les effets androgéniques, œstrogéniques et ceux portant sur la fonction thyroïdienne, les effets liés au système endocrinien étaient limités à de légers changements dans les hormones thyroïdiennes chez les femelles gravides seulement et ont été considérés comme des effets adaptatifs par les auteurs (Marty et coll., 2013). On a remarqué une augmentation du poids de la glande surrénale chez des souris femelles à une dose de 5 mg/kg p.c. par jour et chez des rats F344 des deux sexes à des doses de 100 et de 300 mg/kg p.c. par jour; chez le rat, les changements ont été corrélés avec une hypertrophie cellulaire de la zone glomérulée (Serota et coll., 1983b; Schultze, 1991a).
Selon un examen exhaustif récent d'études in vitro et in vivo, le 2,4-D serait peu susceptible d'interagir avec le système endocrinien (Neal et coll., 2017). L'examen reposait sur une approche fondée sur le poids de la preuve et comportait un protocole détaillé pour la recherche documentaire ainsi que pour l'inclusion des études réglementaires et des études toxicologiques et épidémiologiques publiées sur les mammifères et l'évaluation de leur qualité. Il tenait aussi compte de la cohérence et de l'uniformité des résultats et des modes d'action potentiels et comprenait une évaluation des lacunes de la base de données. Dans le cadre de cet examen, on n'a trouvé aucune interaction entre le 2,4-D et les processus endocriniens (œstrogène, androgène, stéroïdogenèse ou thyroïde) (Neal et coll., 2017). Les résultats de cinq essais in vitro utilisés par l'Endocrine Disruptor Screening Program de l'U.S. EPA étaient également négatifs pour ce qui est des effets sur les processus endocriniens mettant en jeu les œstrogènes, les androgènes et la stéroïdogenèse (Coady et coll., 2014).
Effets oculaires : Dans des études alimentaires sur la toxicité subchronique et chronique chez des rats F344, le 2-4-D et ses esters ont causé des lésions histopathologiques des yeux (cataractes et dégénérescence rétinienne) aux doses administrées les plus élevées (300 mg/kg p.c. par jour dans des études de 13 semaines; 150 mg/kg p.c. par jour dans des études de 1 et 2 ans) (Schultze et coll,. 1991a; Szabo et Rachunek, 1991; Charles et coll., 1996b; Mattsson et coll., 1997).
Neurotoxicité : Outre la dégénérescence de la rétine mentionnée plus haut, l'étude sur la neurotoxicité d'une durée de 2 ans menée par Mattson et coll. (1997) chez le rat a révélé des altérations liées au traitement dans la force de préhension par rapport au poids corporel à la dose de 150 mg/kg p.c. par jour de 2,4-D (65 rats/dose; 0, 5, 75 et 150 mg/kg p.c. par jour). On n'a relevé aucun effet lié au traitement dans la batterie d'observations fonctionnelles, l'étalement de la patte à la réception au sol ou l'activité motrice. Les auteurs ont jugé que la dose de 75 mg/kg p.c. par jour était la NOAEL associée à une neurotoxicité chronique.
Toxicité pour la reproduction et le développement : Dans des études menées sur des animaux, les effets sur la reproduction n'ont été observés qu'à des concentrations qui dépassaient la clairance rénale, tandis que les effets fœtotoxiques ne survenaient qu'aux doses toxiques pour la mère (Rodwell, 1985; Charles et coll., 2001; Marouani et coll., 2017).
Dans une étude prolongée de toxicité sur la reproduction sur une génération (précédant la ligne directrice 443 de l'OCDE), où des rats CD ont été exposés à du 2,4-D ajouté aux aliments (de 6 à 45 mg/kg p.c. par jour) pendant des phases critiques du développement (avant accouplement, accouplement, gestation et lactation) (Marty et coll., 2013), aucun signe de toxicité pour la reproduction et le développement n'a été relevé.
La taille de la portée et le taux de résorption n'ont pas été touchés dans une série d'études menées chez des rates gravides (de 8 à 150 mg/kg p.c. par jour de 2,4-D à partir du jour de gestation [JG] 6 à 15) et des lapines gravides (de 10 à 90 mg/kg p.c. par jour de 2,4-D à partir des JG 6 à 18) ayant reçu par gavage du 2,4-D, ses sels et ses esters (Charles et coll., 2001). Des effets fœtaux importants (diminution du poids corporel fœtal et variations accrues des effets fœtaux) ont été observés chez des rates ayant reçu des doses toxiques pour la mère (90 mg/kg p.c. et plus par jour de 2,4-D), mais non chez des lapines. L'ARLA (Santé Canada, 2007) a estimé que les doses de 2,4-D sans effet nocif observé (NOAEL) pour la mère et le développement chez le rat étaient de 25 mg/kg p.c. par jour.
On n'a observé aucun effet sur le gain de poids corporel, le nombre de petits nés, le taux de mortalité néonatale ou les taux d'hormone de croissance chez les femelles gravides ayant reçu 70 mg/kg p.c. par jour de 2,4-D dans les aliments du jour de la gestion (JG) 16 jusqu'au JPN 23 ou chez les petits sevrés soumis au même régime jusqu'au JPN 45, 60 ou 90 (Pochettino et coll., 2016).
Aucun signe de toxicité maternelle n'a été observé chez des souris CD-1 gravides à qui on a administré un dérivé amine du 2,4-D dans l'eau potable à des doses équivalentes à 8,5, 37 ou 370 mg/kg p.c. par jour de 2,4-D les JG 6 à 16, bien qu'une diminution du poids corporel accompagnée d'une légère réduction du poids des reins a été constatée chez les petits femelles à des doses de 37 et de 370 mg/kg p.c. par jour. (Lee et coll., 2001).
Une toxicité pour la reproduction a été observée aux fortes doses dans une étude réalisée avec plusieurs générations de rats Fischer 344 (30/sexe/dose) nourris avec une alimentation contenant 0, 5, 20 ou 80 mg/kg p.c. par jour de 2,4-D durant 105 jours avant l'accouplement (génération F0), et durant l'accouplement, la gestation et la lactation (générations F0 et F1) (Rodwell, 1985). La génération F0, F1A et F1B a produit 2 portées. La portée F1B est devenue la génération F1 et a produit les portées F2A et F2B. L'administration de la dose élevée de 80 mg/kg p.c. par jour a été interrompue durant la période de la génération F1, car elle a entraîné une toxicité considérable chez les parents, se manifestant notamment par une baisse importante du poids corporel moyen chez les adultes et les petits de génération F1 devenus adultes. L'examen histopathologique a révélé une densité accrue de noyaux disposés en foyer dans la zone médullaire des tubules rénaux de la génération F0 à la dose de 20 et de 80 mg/kg p.c. par jour et chez les adultes de la F1 à la dose de 20 mg/kg p.c. par jour par rapport aux témoins. Le poids corporel des petits était significativement plus faible dans la génération F1B à la dose de 20 et de 80 mg/kg p.c. par jour et le poids des petits de la F1A était significativement plus faible à la dose de 80 mg/kg p.c. par jour. La viabilité des petits de la F1A et de la F1B n'a été touchée qu'à 80 mg/kg p.c. par jour. La taille des portées vivantes était réduite aux générations F1A et F1B. On a noté une diminution significative (p < 0,01) du rapport des sexes chez les petits de la F1A par rapport aux témoins. La mortalité des petits était significativement (p < 0.01) haussée à la génération F1B par rapport aux témoins, mais la viabilité des petits de la génération F2A et F2B est demeurée la même. Des effets ont été constatés aux doses supérieures au seuil de saturation de la clairance rénale et aux doses causant une toxicité chez les parents. On n'a noté aucun effet indésirable sur la fertilité chez les mâles ou les femelles, peu importe la dose ou la génération (Rodwell, 1985).
Des changements morphologiques dans les organes reproducteurs mâles, une augmentation des taux d'hormone folliculo-stimulante (FSH) et d'hormone lutéinisante (LH) et une modification du nombre et de la motilité des spermatozoïdes ont été observés chez des rats mâles gavés pendant 30 jours avec 100 ou 200 mg/kg p.c. par jour de 2,4-D, mais ces effets ont été observés à des doses dépassant la saturation rénale (Marouani et coll., 2017).
Aucun signe de neurotoxicité pour le développement n'a été décelé dans une étude prolongée sur la toxicité pour la reproduction sur une génération (précédant la ligne directrice 443 de l'OCDE) dans laquelle des rats CD ont été exposés à du 2,4-D ajouté aux aliments (6 à 45 mg/kg p.c. par jour) durant des phases critiques du développement (avant l'accouplement, pendant ce dernier, durant la gestation et durant la lactation) (Marty et coll., 2013). Les autres études sur la neurotoxicité n'étaient pas pertinentes à l'évaluation des risques car elles portaient sur une ou deux doses uniquement, mais elles pourraient indiquer une sensibilité potentielle des petits au 2,4-D.
Des rates Wistar gravides ont été nourries avec une alimentation contenant 70 mg/kg de 2,4-D du 16e jour de gestation (GD) au 23e jour postnatal (Bortolozzi et coll., 1999). Après sevrage, les petits ont été divisés en 2 groupes, dont l'un a reçu une diète avec 2,4-D jusqu'au 90e jour postnatal. Les petits traités présentaient un retard du réflexe de redressement et une géotaxie négative ainsi que des anomalies motrices et des comportements stéréotypés. Une fois adultes, le groupe des petits traités affichaient des comportements liés à un syndrome sérotoninergique, une catalepsie et une préférence pour se tourner vers la droite. À l'aide du même protocole, Bortolozzi et coll. (2003) ont montré que chez les petits traités, les systèmes monoaminergiques du cerveau étaient altérés.
Dans l'étude de Duffard et coll. (1996), l'exposition des petits par voie orale par le lait maternel (dose maternelle de 100 mg/kg p.c. par jour de 2,4-D administrée par injection intrapéritonéale) durant les jours postnataux 15 à 25, a occasionné un manque de myéline dans le système nerveux central des petits. Dans l'étude de De Duffard et coll. (1995), des rates Wistar gravides ont reçu 0 ou 70 mg/kg p.c. par jour de 2,4-D par injection intrapéritonéale du jour 9 au jour 25 postpartum. Les petits ont été exposés au 2,4-D durant l'allaitement et présentaient des changements dans les neurones immunoréactifs à la sérotonine.
Une diminution du poids corporel et du poids du cerveau dépendante de la dose et du temps ainsi qu'une baisse de la concentration des protéines et de l'ADN ont été notées chez les rats Wistar nouveau-nés à qui on a injecté par voie sous-cutanée 70 ou 100 mg/kg p.c. par jour de 2,4-D, aux jours postnataux 7 à 17, 7 à 25, 12 à 17 ou 12 à 25 (Rosso et coll., 1997). Dans une étude semblable où l'on a utilisé le même protocole, les petits ayant été traités présentaient un moins grand nombre de dépôts de myéline et des altérations du réflexe de redressement et de la géotaxie, un soutien plus faible des pattes avant et une modification des résultats des tests en milieu ouvert (Rosso et coll., 2000).
Strutz et coll. (2000) ont examiné des petits de mères ayant reçu une alimentation contenant 50, 70 ou 100 mg/kg de 2,4-D durant l'allaitement. Des résidus de 2,4-D ont été décelés dans le contenu de l'estomac, le sang, le cerveau et les reins des petits âgés de 4 jours. La concentration des résidus de la substance était à la fois dépendante de la dose et de la durée de l'exposition.
2.5 Génotoxicité et cancérogénicité
Des résultats négatifs ont été obtenus dans des essais in vitro suivants : essais portant sur la synthèse non programmée de l'acide désoxyribonucléique (ADN) dans des hépatocytes de rats, essais d'échange de chromatides sœurs (ECS) dans des cellules ovariennes de hamsters chinois, essais décelant les aberrations chromosomiques dans des lymphocytes périphériques humains, essais sur l'activité des sites apuriniques ou apyrimidiques dans des fibroblastes humains, et tests d'Ames réalisés sur plusieurs souches de Salmonella typhimurium avec et sans activation métabolique (Linnainmaa, 1984; Mustonen et coll., 1986; Clausen et coll., 1990; Charles et coll., 1999a; Gollapudi et coll., 1999). Deux études in vitro ont fait état d'effets génotoxiques. Gonzalez et coll. (2005) ont rapporté des augmentations liées à la dose de l'ECS et des ruptures de brins d'ADN dans des cellules ovariennes de hamsters chinois dans le test des comètes. Cependant, l'étude présentait un certain nombre de limites : une faible relation dose-réponse sans variation apparente en fonction du temps, une plage limitée de concentrations, l'absence d'un groupe témoin positif et la fusion des résultats obtenus pour le groupe non traité et le groupe témoin recevant l'excipient (Gonzalez et coll., 2005). Un essai sur la mutation du locus de l'hypoxanthine-guanine phosphoribosyltransférase réalisé avec des fibroblastes de hamster chinois (V79) a montré que le 2,4-D induisait des mutations génétiques, mais uniquement à des doses élevées qui étaient aussi cytotoxiques (Pavlica et coll., 1991).
Des résultats négatifs ont été obtenus dans deux études in vivo, dans un test de létalité récessive liée au sexe et une étude de dépistage des cassures et des pertes de chromosomes chez des mouches à fruit Drosophila melanogaster ayant reçu du 2,4-D (Woodruff et coll., 1983; Zimmering et coll., 1985). Quelques résultats positifs ont été signalés chez Drosophila, mais ces résultats étaient associés à de fortes doses et des souches instables (Munro et coll., 1992; Kaya et coll., 1999). Aucune anomalie chromosomique ou lésions de l'ADN n'ont été observées dans les hépatocytes, les lymphocytes ou les cellules de la moelle osseuse des rats, des souris et des hamsters chinois auxquels on avait administré du 2,4-D par voie orale et qui ont été soumis à l'essai d'induction des micronoyaux sur cellules de la moelle osseuse et à des essais de synthèse non programmée de l'ADN et ECS (Linnainmaa, 1984; Charles et coll., 1999a, 1999b). Une étude réalisée par Amer et Aly (2001) a montré des aberrations chromosomiques dans la moelle osseuse et des anomalies de la tête des spermatozoïdes chez des souris Swiss ayant reçu par gavage 3,3 et 333 mg/kg p.c. de 2,4-D pendant 3 ou 5 jours; cependant, seulement 500 cellules ont été comptées, et l'augmentation du pourcentage d'anomalie était assez faible.
Bien que certaines études aient produit des résultats positifs, l'absence générale de génotoxicité après une exposition in vitro et in vivo au 2,4-D est compatible avec les caractéristiques du composé (acide faible qui n'est pas métabolisé de façon importante et qui est excrété rapidement du corps) (Munro et coll., 1992).
Il n'y a eu aucune augmentation des néoplasmes dans une étude d'oncogénicité sur 2 ans dans laquelle on a administré à des souris B6C3F1 des aliments contenant jusqu'à 300 mg/kg p.c. par jour de 2,4-D (Jeffries et coll., 1995; Charles et coll., 1996a). Munro et coll. (1992) décrivent une étude non publiée dans laquelle la fréquence des astrocytomes (cancer du cerveau) avait légèrement augmenté chez les rats mâles ayant reçu 45 mg/kg p.c. par jour de 2,4-D; cependant, les caractéristiques des tumeurs n'étaient pas typiques d'un produit chimique cancérogène, et une nouvelle étude n'a pas permis de confirmer ces résultats (Jeffries et coll., 1995; Charles et coll., 1996a; Kennepohl et coll., 2010).
Le Centre international de recherche sur le cancer (CIRC) a classé le 2,4-D dans le groupe 2B, soit des « cancérogènes possibles pour l'humain », en se fondant sur les données limitées recensées chez les animaux, tandis que d'autres organismes ont utilisé une approche axée sur les effets non cancérogènes pour évaluer les risques de ce contaminant pour la santé humaine (Loomis et coll., 2015; CIRC, 2017). L'U.S. EPA (2005, 2007) a à plusieurs reprises décrit le 2,4-D comme non classable en regard de sa cancérogénicité pour l'humain. La Réunion conjointe Food and Agriculture Organisation (FOA)/OMS sur les résidus de pesticides (JMPR) a conclu que le potentiel cancérogène du 2,4-D ne pouvait être évalué à partir des études épidémiologiques existantes et que le 2,4-D ainsi que ses sels et ses esters n'étaient pas génotoxiques (OMS, 2017). Dans sa réévaluation aux fins du maintien de l'homologation de ce pesticide, Santé Canada (2005a, 2007) a en outre conclu que le 2,4-D n'était pas cancérogène, en se fondant sur l'absence de signes de cancer chez les animaux et d'association claire entre l'exposition et le cancer dans les études menées chez l'humain.
2.6 Mode d'action
Le rein est l'organe cible le plus sensible à la toxicité du 2,4-D (Gorzinski et coll., 1987; Charles et coll., 1996a, 1996b; Santé Canada, 2007). Les effets observés (augmentation du poids relatif et du poids absolu des reins, changements dans l'histopathologie des reins [en particulier dans les tubules proximaux] et altérations des paramètres de biochimie clinique) sont les mêmes pour toutes les espèces examinées dans les deux études de toxicité subchronique et chronique et sont liés à la saturation du mécanisme de clairance rénale (Serota, 1983a, 1983b; Gorzinski et coll., 1987; Schultze, 1991a; Munro et coll., 1992; Jeffries et coll., 1995; Charles et coll., 1996a, 1996b).
Dans le rein, le 2,4-D s'accumule dans les tubules proximaux sous l'action d'un transporteur d'anions organiques métaboliquement actif et situé dans les reins, le transporteur OAT1 (Hasegawa et coll. 2003; Timchalk, 2004; Nozaki et coll. 2007; Burns et Swaen, 2012; Saghir et coll., 2013). Le transporteur OAT1 joue un rôle déterminant dans la clairance rénale systémique dose-dépendante du 2,4-D chez le rat et il devient saturé à une dose d'environ 50 mg/kg p.c. administrée oralement, par gavage ou dans l'alimentation, à des rats Fischer 344 mâles recevant une dose unique de 2,4-D (Gorzinski et coll., 1987; Saghir et coll., 2013). Chez des rats Sprague-Dawley ayant reçu des doses quotidiennes de 2,4-D, la saturation rénale a été atteinte à la dose de 63 mg/kg p.c. par jour pour les mâles (soumis au traitement pendant 71 jours) et à la dose de 14 à 27 mg/kg p.c. par jour pour les femelles (soumises au traitement pendant 96 jours) (Saghir et coll., 2013).
Le mode d'action du 2,4-D n'a pas été clairement établi. Une hausse du stress oxydatif constitue le signe le plus probant du mode d'action toxique du 2,4-D chez les animaux et semble être responsable des altérations observées dans les reins (dégénérescence des tubules proximaux, vacuolisation des cellules tubulaires et perte de la bordure en brosse) (Bongiovanni et coll., 2011; Wafa et coll., 2011). Il a été démontré que le 2,4-D perturbait le métabolisme cellulaire, épuisait les réserves de glutathion (GSH) et abaissait les concentrations de thiol et stimulait les récepteurs activés par les proliférateurs de peroxysomes (PPAR). Ces effets précurseurs entraînent une augmentation de la production de dérivés réactifs de l'oxygène (DRO) pouvant causer une toxicité pour les reins, le foie et le système nerveux. Ceci pourrait aussi expliquer les effets génotoxiques observés à de fortes doses (Argese et coll., 2005). Une hausse des marqueurs de l'oxydation (radicaux hydroxyle, oxydation des protéines, groupes carbonyle, peroxydes lipidiques) et une diminution du rapport GSH:GSSG (disulfure de glutathion) et de la teneur en thiol des protéines ont été signalées chez des rats exposés par voie orale au 2,4-D (Ferri et coll., 2007; Nakbi et coll., 2012; Tayeb et coll., 2012; Pochettino et coll., 2013). Ces altérations étaient associées à une diminution de l'activité des enzymes antioxydantes des reins et du foie, comme la superoxyde dismutase, la catalase, la glutathion peroxydase et la glutathion réductase chez le rat. Des rats Wistar ayant reçu 15 à 150 mg/kg p.c. de butylglycol de 2,4-D par gavage présentaient une augmentation de la peroxydation des lipides hépatiques et une diminution de la catalase, de la glutathion peroxydase et de la glutathion réductase à toutes les doses ainsi que de la superoxyde dismutase à des doses élevées après 4 semaines, ce qui confirme que le stress oxydatif est le mode d'action de ce pesticide (Tayeb et coll., 2013).
Par ailleurs, des études in vitro réalisées sur des hépatocytes et des lignées de cellules de rein humain et de rat corroborent la production de DRO (Palmeira et coll., 1995; Duchnowicz et Koter, 2003; Bharadwaj et coll., 2005; Bukowska et coll., 2008; Troudi et coll., 2012).
2.7 Étude clé sélectionnée
Comme le 2,4-D a été étudié en détail, il existe une base de données toxicologiques d'envergure et exhaustive à son sujet. Dans le cadre de la réévaluation de sa toxicologie, l'ARLA a examiné attentivement l'entièreté de la base de données scientifiques, dont des études de toxicité de propriété exclusive (non publiées) et des études publiées, et a déterminé que le rein était l'organe cible le plus sensible de toute la base de données (Santé Canada, 2005a, 2007). Aucune étude épidémiologique ne porte sur les effets du 2,4-D sur les reins, mais des effets sur les reins ont été systématiquement observés dans les études subchroniques et chroniques chez la souris et le rat (Serota et coll, 1983a, 1983b; Serota, 1986; Gorzinski et coll., 1987; Schultze, 1991; Jeffries et coll., 1995; Charles et coll., 1996a).
L'ARLA (Santé Canada 2007, 2018a) a repéré deux études sur le rat de longue durée (Serota, 1986; Jeffries et coll., 1995) montrant des effets sur les reins, lesquelles ont été jugées être des études clés. Leur NOAEL de 5 mg/kg p.c. par jour a été considérée comme le point de départ (PDD) de l'évaluation des risques pour la santé humaine du 2,4-D et du calcul de l'apport quotidien acceptable (AQA).
Dans l'étude de Serota (1986), des rats F344 (60/sexe/dose) nourris avec une alimentation contenant 0, 1, 5, 15 ou 45 mg/kg p.c. par jour de 2,4-D durant 2 ans ne présentaient aucun effet sur les paramètres de biochimie clinique, la pathologie macroscopique ou la survie. Le gain relatif de poids corporel aux doses élevées chez les femelles était significativement réduit après 12 et 24 mois, mais la consommation d'aliments n'a diminué qu'à 12 mois. Le poids absolu et relatif des reins était accru à la fois chez les mâles (≥ 15 mg/kg p.c. par jour) et chez les femelles (à toutes les doses) au bout de 2 ans. Une minéralisation a été constatée dans le bassinet du rein chez les femelles à partir de la dose de 15 mg/kg p.c. par jour. On a noté des changements dans l'histopathologie des reins (fréquence accrue de pigments bruns dans les tubules et intensité accrue de la vacuolisation dans le cytoplasme des cellules de la corticale rénale) chez les deux sexes à partir de la dose de 5 mg/kg p.c. par jour. L'ARLA, dans son évaluation de 2005, (Santé Canada, 2005a) a proposé une NOAEL de 1 mg/kg p.c. par jour en se basant sur les travaux de Serota (1986) qui avait relevé des changements de pigmentation. Toutefois, d'autres données présentées durant la période de consultation ont conduit à une réévaluation de la NOAEL, soit 5 mg/kg p.c./jour qui est la valeur de cette étude (Santé Canada, 2005b). Les nouvelles données comprenaient une analyse d'échantillons de rein provenant de l'étude de Serota (1986) réalisée par un groupe indépendant spécialisé en pathologie. Ce groupe n'a pas relevé de différence quant à la pigmentation des cellules des tubules, entre les groupes ayant reçu une dose et le groupe témoin. On a conclu que la nature du pigment dans toutes les études menées avec des animaux était morphologiquement semblable au pigment qui apparaît spontanément chez les rats F344 de cet âge. La fréquence et la gravité de la minéralisation du bassinet ont été considérées comme étant liées au traitement chez les mâles à la dose de 45 mg/kg p.c. par jour et chez les femelles à 15 et à 45 mg/kg p.c. par jour. Sur la base de cet effet, on a établi une NOAEL de 5 mg/kg p.c. par jour (Santé Canada, 2005b, 2007).
Les effets rénaux qui consistent en une altération légère du poids des reins et des paramètres de biochimie clinique ont été observés dans une étude sur la toxicité et l'oncogénicité d'une durée de 2 ans menée par Jeffries et coll. (1995). Dans cette étude, des rats F344 (60/sexe/dose) ont été nourris avec une alimentation contenant 0, 5, 75 ou 150 mg/kg p.c. par jour de 2,4-D de qualité technique (pureté de 96,4 %) et on a effectué un sacrifice en cours d'étude de 10 rats/sexe/dose après 12 mois. La survie des animaux n'a pas été touchée par le traitement. Au bout de 2 ans, le poids des reins demeurait le même chez les mâles, alors que les femelles présentaient une diminution légère et statistiquement significative à la dose de 150 mg/kg p.c. par jour et une hausse statistiquement significative du rapport poids des reins/poids corporel aux doses ≥ 75 mg/kg p.c. par jour. Une baisse de la consommation d'aliments a été mise en évidence chez les femelles aux doses ≥ 75 mg/kg p.c. par jour et chez les mâles à la dose de 150 mg/kg p.c. par jour. Cet effet était accompagné d'un gain de poids plus faible. Aux doses ≥75 mg/kg p.c. par jour, l'azote uréique sanguin avait diminué uniquement chez les mâles, alors que la créatinine avait augmenté uniquement chez les femelles. Au moment du sacrifice en cours d'étude, autant les mâles que les femelles ayant reçu une dose ≥ 75 mg/kg p.c. par jour présentaient une dégénérescence des tubules contournés proximaux, mais aucun effet sur l'histopathologie des reins n'a été observé chez les rats sacrifiés au bout de 2 ans (Jeffries et coll., 1995). On a alors établi une NOAEL de 5 mg/kg p.c./jour sur la base des effets pathologiques sur les reins (dégénérescence de la branche descendante des tubules contournés proximaux) observés à la dose suivante. La dégénérescence de la branche descendante des tubules contournés proximaux n'a été relevée qu'au moment du sacrifice en cours d'étude et non au moment de l'interruption de l'étude, mais on a considéré cet effet comme étant toxicologiquement significatif, car il a été établi, d'après la base de données, que le rein est l'organe ciblé le plus sensible (Santé Canada, 2007).
Par ailleurs, le choix d'une NOAEL de 5 mg/kg p.c. par jour comme PDD du calcul de l'AQA était appuyé par la NOAEL de 5 mg/kg p.c. par jour établie dans l'étude à long terme chez la souris dans laquelle des effets pathologiques sur les reins (poids accru, dégénérescence accompagnée d'une regénérescence de la branche descendante des tubules proximaux, vacuolisation et minéralisation réduites dans les tubules proximaux, kystes multifocaux dans le cortex) survenus à des doses variant entre 62 et 300 mg/kg p.c. par jour (Jeffries et coll., 1995; Charles et coll., 1996a; Santé Canada, 2007, 2018). Cette étude n'a pas été choisie pour établir l'AQA, mais la valeur de la NOAEL, le paramètre et la durée de l'étude sont tous les mêmes que ceux qui ont servi à calculer l'AQA. Par conséquent, cette étude corrobore le PDD utilisé pour établir l'AQA.
Une toxicité pour les reins a été notée aux doses plus faibles que pour tout autre effet nocif, notamment la sensibilité chez les petits, dans la base de données sur le 2,4-D. L'étude de Serota et coll. (1986) portait sur cinq doses, soit 0, 1, 5, 15 et 45 mg/kg p.c./jour alors que l'étude menée par Jeffries et coll. (1995) portait sur quatre doses, soit 0, 5, 75 et 150 mg/kg p.c./jour. Dans les deux études, des effets pathologiques dans les reins ont été observés dans une grande fourchette de doses, c'est-à-dire de 15 à 150 mg/kg p.c. par jour. Chez les rats adultes, les effets neurotoxiques (manque de coordination et anomalies légères de la démarche) étaient manifestes à la suite d'une exposition à une dose unique élevée, mais ont disparu 4 jours plus tard (Mattsson et coll., 1997). Une exposition répétée à une dose élevée (150 mg/kg p.c. par jour) a aussi eu des répercussions sur la force de préhension des membres antérieurs et a induit une dégénérescence de la rétine (Mattsson et coll., 1997). Des études publiées dans lesquelles on a utilisé 1 ou 2 doses et où on a administré par voie intrapéritonéale 100 mg/kg p.c. par jour d'acide 2,4-D à des rates gravides, où on a administré par voie subcutanée 70 ou 100 mg/kg p.c. par jour à des petits ainsi que des études axées sur l'exposition par voie orale de petits allaités (doses chez la mère de 100 mg/kg p.c. par jour) durant les jours postnataux 15 à 25, ont fait état d'un manque de myéline dans le système nerveux central des petits (De Duffard et coll., 1995; Duffard et coll., 1996; Rosso et coll. 1997, 2000). Ces études ne pouvaient servir à l'évaluation des risques mais pourraient indiquer une sensibilité des petits au 2,4-D. Une autre étude où l'exposition prénatale et l'exposition postnatale étaient combinées (70 mg/kg p.c. par jour de 2,4-D dans l'alimentation des mères et des petits) a montré un retard de développement du réflexe de redressement sur une surface, de la réponse géotaxique et un manque de soutien des pattes arrières chez les ratons, lesquels étaient corrélés à des altérations dans le développement des systèmes monoaminergiques dans le cerveau de ces rats adultes (Bortolozzi et coll. 1999, 2003). On a aussi détecté des résidus de 2,4-D dans le cerveau des petits nés de mères ayant reçu un traitement (Sturtz et coll. 2000). Ces effets ont été constatés à des doses beaucoup plus élevées que les doses causant les principaux effets cibles (c.-à-d., toxicité pour les reins) dans les études de courte et de longue durée, mais ces observations pourraient être une indication de la sensibilité des petits après une exposition au 2,4-D pendant le développement prénatal et postnatal. Une sensibilité potentielle des petits a aussi été relevée dans l'étude sur la toxicité pour la reproduction avec résultats limités (Rodwell, 1985), qui a été jugée lacunaire à certains égards, notamment en raison de la mortalité excessive à 80 mg/kg p.c. par jour qui a entraîné l’enlèvement de cette dose après la première génération. En effet, comme cette dose dépassait la dose maximale tolérable, l'administration d'une mauvaise dose aux petits de la F1B a occasionné une mortalité excessive car il n'y a pas eu d'ajustement de la dose (Neal et coll., 2017).
3.0 Calcul de la valeur basée sur la santé
Comme nous l'avons déjà mentionné, l'évaluation des risques actuelle repose sur la NOAEL de 5 mg/kg p.c. par jour d'après les effets sur les reins chez le rat et la souris. Dans son calcul de l'AQA, l'ARLA a appliqué un facteur d'incertitude/de sécurité de 300 qui comprend un facteur d'incertitude standard de 10 pour l'extrapolation interspécifique et un facteur de 10 pour la variabilité intraspécifique, ainsi qu'un facteur d'incertitude additionnel de 3 pour tenir compte de la sensibilité potentielle chez les jeunes observée dans l'étude sur la toxicité pour la reproduction de portée limitée menée par Rodwell (1985) et dans une série d'études sur la neurotoxicité publiées (Santé Canada, 2007). L'étude sur la toxicité pour la reproduction était considérée lacunaire sur certains points et les études sur la neurotoxicité publiées ont établi une sensibilité chez les petits à partir de 20 mg/kg p.c./jour et 60 mg/kg p.c./jour, respectivement. Ces NOAEL étaient plus élevées que la NOAEL ayant servi à établir l'AQA et la base de données toxicologiques sur le 2,4-D contenait une évaluation approfondie des effets potentiels chez les petits. Cependant, compte tenu de l'absence d'une ligne directrice acceptable de l'OCDE et d'études conformes sur la toxicité pour la reproduction sur plusieurs générations et sur la neurotoxicité pour le développement examinant les effets potentiels chez les petits à cette époque, lesquelles sont généralement exigées pour l'homologation ou la réévaluation de pesticides, on estime que l'application d'un facteur d'incertitude de 3 est justifié dans le cadre des projets d'acceptabilité d'homologation continue PACR2005-01 et PACR2007-06 (Health Canada, 2005a, 2007).
Une étude prolongée sur la toxicité pour la reproduction sur une génération réalisée par Marty et coll. (2013) a été présentée à l'ARLA pour combler ces lacunes de données après la publication du document RVD2008-11 (Santé Canada, 2008, 2013). L'ARLA a établi une NOAEL de 21 mg/kg p.c./jour reposant sur la toxicité pour la progéniture observée dans l'étude de Marty et coll. (2013). Puisque la NOAEL de 5 mg/kg p.c./jour ayant servi à calculer l'AQA était plus faible que la NOAEL de 21 mg/kg p.c./jour établie d'après la toxicité pour la progéniture de cette étude, il n'a pas été jugé bon de revoir le choix du PDD sur lequel se base la détermination de l'AQA. Par ailleurs, cette NOAEL plus faible supportait le fait que le facteur d'incertitude de 3 qui a été appliqué dans l'évaluation d'origine conférait une protection suffisante contre les effets potentiels chez les petits. L'AQA (Santé Canada, 2007, 2018b) a été calculée comme suit :
Équation 1

Équation 1 - Description textuel
L'AQA pour le 2,4-D est de 0,017 mg/kg p.c. par jour. Cette valeur est calculée par divisant la NOAEL de 5 mg/kg p.c. par jour par le facteur d'incertitude de 300.
Où :
- 5 mg/kg p.c. par jour est la NOAEL, fondée sur les effets sur les reins;
- 300 est le facteur d'incertitude, choisi pour tenir compte de la variation interspécifique (×10), de la variation intraspécifique (×10) et de la sensibilité potentielle chez les petits, relevée dans une étude limitée sur la reproduction chez le rat et dans une série d'études de neurotoxicité publiées (×3).
En se fondant sur l'AQA de 0,017 mg/kg p.c. par jour, on a calculé comme suit la valeur basée sur la santé (VBS) pour le 2,4-D dans l'eau potable :
Équation 2
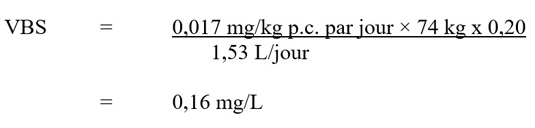
Équation 2 - Description textuel
La VBS pour le 2,4-D dans l'eau potable est de 0,16 mg/L. Cette valeur est calculée en multipliant l'AQA de 2,4-D (0,017 mg/kg p.c. par jour) par le facteur d'attribution de l'eau potable, 0,2, puis par 74 kg, le poids corporel moyen d'un adulte, et en divisant le résultat par 1.53 L/jour, le volume quotidien d'eau consommé par un adulte.
Où :
- 0,017 mg/kg p.c. par jour est l'AQA calculée avec une NOAEL de 5 mg/kg p.c./jour (Santé Canada, 2007);
- 74 kg est le poids corporel moyen d'un adulte canadien (Santé Canada, 2021);
- 1,53 L par jour correspond au volume quotidien en eau potable du robinet consommé par un adulte (Santé Canada, 2021);
- 0,20 est le facteur d'attribution par défaut pour l'eau potable, étant donné que l'eau potable n'est pas une source importante d'exposition au 2,4-D et qu'il existe des preuves de la présence du composé dans un autre milieu (aliments) (Krishnan et Carrier, 2013).
4.0 Considérations liées à l'analyse et au traitement
4.1 Méthodes d'analyse pour détecter le 2,4-D
Des méthodes normalisées pour l'analyse du 2,4-D dans l'eau à la source et l'eau potable et leurs limites de détection respectives sont résumées au tableau 2. Les limites de détection de la méthode (LDM) dépendent de la matrice de l'échantillon, de l'instrumentation et des conditions de fonctionnement choisies et varient d'un laboratoire à l'autre. Les LDM et les seuils de déclaration de la méthode (SDM) issus des données provinciales et territoriales se situent entre 0,005 et 1,0 μg/L (Ministère du Développement Durable, de l'Environnement, de la Faune et des Parcs du Québec, 2019; Nova Scotia Environment, 2019; PEI Department of Communities, Land and Environment, 2019).
Les responsables des services d'approvisionnement en eau potable devraient discuter des exigences d'échantillonnage avec le laboratoire accrédité qui effectue l'analyse, pour assurer la conformité aux procédures de contrôle de la qualité et veiller à ce que les SDM soient assez faibles pour assurer une surveillance précise à une concentration inférieure à la concentration maximale acceptable (CMA). Les facteurs à considérer pour l'analyse du 2,4-D dans les échantillons d'eau potable (p. ex. préservation et conservation des échantillons) sont décrites dans les documents de référence présentés au tableau 2. De plus, Clausen (2000) a signalé que le 2,4-D était retenu sur des filtres faits d'acétate de cellulose, de nylon ou de polyéthersulfone lorsque l'échantillonnage ou l'analyse comprenait la filtration de l'échantillon d'eau pour enlever les solides en suspension de la solution. On a constaté que les filtres faits de fluorure de polyvinylidène ou de polytétrafluoréthylène retenaient moins de 2,4-D.
| Méthode | Technique | LDM (µg/L) |
Interférences |
|---|---|---|---|
| EPA 515.1 ver. 4.1 (U.S. EPA, 1995a) |
Chromatographie en phase gazeuse avec détecteur à capture d'électrons (CG/DCE) | 0,078 | Substances alcalines, phénols et acides organiques, plastique, analyse d'un échantillon à faible concentration immédiatement après l'analyse d'un échantillon à concentration élevée |
| EPA 515.2 ver. 1.1 (U.S. EPA, 1995b) |
Extraction liquide-solide (ELS) et CG/DCE | 0,28 | Substances alcalines, phénols et acides organiques, plastique/phtalates |
| EPA 515.3 ver. 1.0 (U.S. EPA, 1996) |
Extraction liquide-liquide, suivie d'une dérivatisation (ELLD) et CG/DCE | 0,35Note de bas de page a à 0,36Note de bas de page b | Analyse d'un échantillon à faible concentration immédiatement après l'analyse d'un échantillon à concentration élevée, plastique/ phtalates, présence d'eau provenant du procédé d'estérification par catalyse basique |
| EPA 515.4 ver. 1.0 (U.S. EPA, 2000) |
Micro-extraction liquide-liquide, suivie d'une dérivatisation (MELLD) et CG/DCE | 0,055 à 0,066Note de bas de page c | Plastique/phtalates, sulfate de sodium |
| EPA 555 ver. 1.0 (U.S. EPA, 1992) |
Chromatographie liquide à haute performance avec à réseau de photodiodes UV (CLHP/RDP-UV) | 0,34 à 1,3Note de bas de page c | Sulfate de sodium |
| ASTM D5317-98 (réapprouvée en 2011) (ASTM, 2011) |
CG/DCE | 0,2 | Substances alcalines, phénols et acides organiques, esters de phtalate (p. ex., plastiques souples), analyse d'un échantillon à faible concentration immédiatement après l'analyse d'un échantillon à concentration élevée |
| Méthode standard 6640B ou version en ligne 6640B-01 (APHA, 2005, 2012, 2017) |
Micro-extraction liquide-liquide, suivie d'une dérivatisation (MELLD) et CG/DCE | 0,06 à 0,07Note de bas de page c | Esters de phtalate, éviter d'utiliser des plastiques dans le laboratoire |
|
|||
4.2 Considérations liées au traitement
Il existe des technologies de traitement qui permettent de diminuer efficacement la concentration de 2,4-D dans l'eau potable. L'adsorption sur charbon actif est reconnue comme la meilleure technologie existante pour l’enlèvement du 2,4-D (U.S. EPA, 2009b). Les procédés de filtration biologique permettent aussi d'abaisser les concentrations de 2,4-D; les traitements conventionnels ne sont toutefois pas efficaces pour enlever le 2,4-D. Les procédés habituels de désinfection utilisés dans le traitement de l'eau potable ont aussi une capacité limitée à diminuer les concentrations de 2,4-D. À l'échelle résidentielle, des dispositifs de traitement certifiés permettent également d'enlever le 2,4-D. Ces dispositifs s'appuient principalement sur des procédés d'adsorption (charbon actif) et d'osmose inverse.
4.2.1 Traitement à l'échelle municipale
Étant donné que les concentrations de 2,4-D sont faibles dans les sources d'approvisionnement en eau, les données sur les techniques de traitement présentées dans les publications reposent généralement sur de faibles concentrations dans l'eau à traiter (< 10 µg/L). Les renseignements sur l'efficacité d'enlèvement et les conditions opérationnelles tirés de ces études sont présentés ci-dessous, car ces études donnent une indication de l'efficacité de certaines technologies de traitement pour l'enlèvement du 2,4-D. Le choix d'un procédé de traitement approprié pour un approvisionnement d'eau en particulier dépend de nombreux facteurs, notamment la source d'eau brute et ses caractéristiques, les conditions de mise en œuvre de la méthode de traitement choisie et les objectifs de traitement du service d'approvisionnement en eau.
4.2.1.1 Traitement conventionnel
Les procédés conventionnels de traitement de l'eau potable, comme la coagulation chimique, la clarification, la filtration rapide sur sable et la chloration, ne seraient pas efficaces pour réduire la concentration de diverses classes de pesticides, notamment les pesticides polaires, comme les acides phénoxyacétiques (Robeck et coll., 1965; Miltner et coll., 1989; Croll et coll., 1992; Haist-Gulde et coll., 1993; Frick et Dalton, 2005; Chowdhury et coll., 2010; Hughes et Younker, 2011). La filtration biologique (voir la section 4.2.1.4) pourrait dans une certaine mesure permettre d'enlever les acides de type chlorophénoxy (Foster et coll., 1991, 1992) et plus particulièrement le 2,4-D (Woudneh et coll., 1996, 1997; Storck et coll., 2010; Zearley et Summers, 2012, 2015; Huntscha et coll., 2013).
4.2.1.2 Oxydation et hydrolyse
Chamberlain et coll. (2012) ont réalisé des essais en laboratoire afin de déterminer la mesure dans laquelle les pesticides devraient se dégrader naturellement dans l'environnement par hydrolyse ou photolyse et lorsqu'ils sont soumis aux procédés de désinfection couramment utilisés dans le traitement de l'eau potable. Les procédés courants d'oxydation ou de désinfection ont été évalués tel qu'indiqué au tableau 3. Des études en laboratoire ont été effectuées à 23 ± 1 °C, à des pH de 6,6 et de 8,6 et à une concentration initiale de 2,4-D de 25 µg/L. Les solutions ont été enrichies avec un oxydant ou soumises à une photolyse UV à 254 nm aux doses indiquées au tableau 3. Comme milieu de réaction pour les expériences d'hydrolyse, on a utilisé de l'eau de laboratoire tamponnée au phosphate de sodium à des pH de 2, 7 et 12. L'enlèvement du 2,4-D était faible dans toutes les expériences.
Les résultats obtenus pour l'ozone (O3), indiqués au tableau 3, sont compatibles avec les taux d'enlèvement prévus à l'aide de la constante de vitesse de la réaction de l'O3 avec le 2,4-D à des niveaux d'exposition typiques par l'eau potable (Yao et Haag, 1991; Xiong et Graham, 1992; Hu et coll., 2000; Benitez et coll., 2004; Giri et coll., 2007). Meijers et coll. (1995) ont aussi signalé de faibles réductions du 2,4-D à des doses typiques d'O3 (sous forme de rapport entre l'O3 et le carbone organique dissous [COD]) dans des expériences en laboratoire réalisées à 5 °C (pH de 7,2, O3:COD = 0,53, concentrations de 2,4-D dans l'eau à traiter = 0,9 à 6,4 µg/L). Cependant, l'enlèvement du 2,4-D augmentait à 48 % à 20 °C (pH de7,2, O3:COD = 0,55) et à 74 % à des pH et des doses d'O3 plus élevés (pH de 8,3, O3:COD = 0,95).
| Procédé | Dose utilisée | Plage de CDNote de bas de page a (mg·min/L) |
Réduction (%) |
|---|---|---|---|
| Chlore libre | 2 à 5 mg/L | 107 à 173 | < 20 |
| Monochloramine | 9 à 14 mg/L | 1 287 à 1 430 | < 20 |
| Permanganate | 3 à 5 mg/L | 134 à 164 | < 20 |
| Dioxyde de chlore | 2 à 3 mg/L | 38 à 73 | < 20 |
| Peroxyde d'hydrogène | 100 mg/L | 933 à 1 100 | < 20 |
| Ozone | 1 à 2 mg/L | 0,2 à 0,3 | < 20 |
| UV254 | 77 à 97 mV·s/cm2 | < 20 | |
Source : Chamberlain et coll. (2012) |
|||
Les résultats pour le traitement UV, incrits au tableau 3, concordent aussi avec les résultats des expériences réalisées en installation pilote par Kruithof et coll. (2002) et les expériences en laboratoire menées par Benitez et coll. (2004). Kruithof et coll. (2002) ont indiqué une réduction de 58 % du 2,4-D à une dose UV de 2 000 mJ/cm2, concentration beaucoup plus élevée que celle qui est nécessaire pour une désinfection. Benitez et coll. (2004) ont utilisé une lampe UV à basse pression et signalé une diminution de 30 % à 40 % après un temps de réaction de 100 min à des pH de 9 et de 7, respectivement (concentration initiale de 2,4-D de 50 mg/L).
4.2.1.3 Adsorption
L'adsorption sur charbon actif est une technologie largement utilisée pour réduire la concentration des micropolluants dans l'eau potable (Haist-Gulde et Happel, 2012; van der Aa et coll., 2012). Le charbon actif peut être appliqué de deux manières : applications d'une solution en suspension de charbon actif en poudre (CAP) ou réacteur à lit fixe utilisant du charbon actif en grains (CAG) (Chowdhury et coll., 2013).
Charbon actif en poudre
On a constaté que de nombreux pesticides sont fortement adsorbés sur le CAP (Chowdhury et coll., 2013). L'utilisation de CAP présente l'avantage de fournir du charbon vierge selon les besoins (durant la saison d'application de pesticide) (Miltner et coll., 1989). La capacité du CAP à enlever les pesticides par adsorption dépend de la dose de PAC, du temps de contact, des caractéristiques du CAP (type, taille des particules), de la capacité d'adsorption du contaminant et de la compétition avec la matière organique naturelle (MON) pour les sites d'adsorption sur le CAP (Haist-Gulde et Happel, 2012).
En dépit de la rareté des publications sur l'utilisation du CAP dans le traitement de l'eau potable pour adsorber le 2,4-D, si l'on tient compte des propriétés chimiques du CAP et des recherches publiées sur l'adsorption en tant que technologie, le CAP devrait enlever efficacement le 2,4-D (Haist-Gulde, 2014). Étant donné que l'efficacité d'enlèvement varie en fonction du type de CAP, il faudrait tenir compte de la cinétique d'adsorption lors de l'optimisation de systèmes au CAP (Gustafson et coll., 2003; Summers et coll., 2010). Des essais en bécher avec divers charbons et différentes conditions sont généralement utilisés pour établir une courbe des pourcentages d'enlèvement en fonction des concentrations de CAP.
Un accroissement de la concentration de CAP augmentera le pourcentage d'enlèvement d'un contaminant, mais de façon non proportionnelle (Robeck, 1965; Miltner et coll., 1989; Gustafson et coll., 2003; Westerhoff et coll., 2005; Chowdhury et coll., 2013). En utilisant un temps de contact plus long, on augmentera la quantité de pesticide enlevé, car il faut plus de temps pour atteindre l'équilibre (le temps de contact nécessaire pour atteindre le plein potentiel du CAP) que dans une station de traitement de l'eau (Gustafson et coll., 2003). Lorsque la taille des particules de CAP est plus petite, il faut moins de temps pour atteindre l'équilibre. Cependant, l'avantage lié à l'utilisation de particules plus petites est généralement neutralisé par la difficulté à retirer ces particules de la solution (Chowdhury et coll., 2013).
Généralement, la présence de MON ajoute à la complexité du traitement au CAP parce que la MON entre directement en compétition avec le 2,4-D pour occuper les sites d'adsorption ou encrasse le CAP en obstruant les pores (Chowdhury et coll., 2013). Robeck et coll. (1965) ont constaté qu'une concentration de CAP de 29 ppm était nécessaire pour réduire une concentration de lindane de 10 ppb à 1 ppb dans une eau de rivière (demande chimique en oxygène : 5 à 35 ppm) comparativement à une concentration de 2 ppm pour de l'eau distillée. Cet écart était attribuable à la présence de MON dans l'eau de rivière. Les autorités responsables devraient connaître l'incidence de la MON sur les systèmes de traitement au CAP, car cette interaction peut avoir des effets sur les objectifs de qualité de l'eau obtenus après l’enlèvement du 2,4-D. Par ailleurs, la quantité de CAP nécessaire à l'atténuation du goût et de l'odeur, une utilisation courante du CAP, est considérablement plus faible que pour celle employée pour enlever le 2,4-D.
Lorsque du CAP est ajouté en amont de certains procédés de traitement, il peut interagir avec les produits chimiques utilisés dans le traitement de l'eau, ce qui diminue la quantité de CAP disponible pour abaisser les concentrations de contaminants comme le 2,4-D (Greene et coll., 1994; Summers et coll., 2010). Selon Kouras et coll. (1998), l'ajout de CAP avant le dosage d'un coagulant faisait passer la concentration nécessaire de CAP de 20 mg/L à 40 mg/L pour atteindre une concentration cible de 0,1 µg/L pour le lindane. Les particules de CAP s'intègrent en effet à la structure du floc, ce qui réduit le nombre de sites d'adsorption disponibles.
Charbon actif en grains
L'utilisation de CAG est une approche efficace pour le traitement des contaminants organiques qui sont souvent présents en concentrations préoccupantes dans les sources d'approvisionnement en eau (Chowdhury et coll., 2013). Selon l'OMS (2011), un traitement au CAG devrait permettre de ramener les concentrations de 2,4-D à 1 µg/L. La capacité du CAG à enlever les pesticides par adsorption dépend de la vitesse de filtration, du temps de contact en lit vide (TCLV), des caractéristiques du CAG (type, taille des particules et méthode de réactivation), de la capacité d'adsorption du contaminant, de la durée du cycle de filtration et de la compétition avec la MON pour occuper les sites d'adsorption (Haist-Gulde et Happel, 2012).
Une étude pilote a permis d'illustrer la capacité du CAG à enlever le 2,4-D (Haist-Gulde et Happel, 2012). Trois adsorbeurs à lit fixe ont été installés en parallèle dans une station de traitement d'eau de surface et ont été remplis de trois sortes de charbons bitumineux. L'installation pilote a fonctionné pendant 21 mois dans des conditions normales, et des courbes de percée ont été établies pour les pesticides ioniques et leurs métabolites, y compris le 2,4-D. On a utilisé comme eau d'alimentation, l'influent du système de filtration au CAG de la station de traitement d'eau de surface à pleine échelle (COD = 1,3 mg/L), auquel on a ajouté 1 µg/L de 2,4-D. Le point de percée du 2,4-D a été mesuré à des profondeurs de lit de 0,5 m, de 1,0 m et de 1,5 m, ce qui correspond à des TCLV de 3 min, de 6 min et de 9 min, respectivement, à une vitesse de filtration de 10 m/h. Un enlèvement complet était possible jusqu'à environ 50 000 volumes de lit (VL) à une profondeur de lit de 1,5 m (Haist-Gulde et Happel, 2012), bien que les trois types de charbon aient donné un rendement inégal. Le nombre de VL traités avant un point de percée de 10 % s'établissait à 37 000, 56 000 et 73 000 (à une profondeur de lit de 1,5 m) pour les charbons 1, 2 et 3, respectivement. L'incidence de la profondeur du lit a également été évaluée; la durée de fonctionnement pour atteindre un point de percée de 20 % variait de 30 000 à 80 000 VL environ pour des profondeurs de lit de 0,5 m et de 1,5 m, respectivement. Généralement, l'efficacité à une profondeur de lit de 1,0 m était légèrement meilleure qu'à 0,5 m. On a conclu que la plupart des adsorbeurs au CAG devraient enlever le 2,4-D, que les faibles profondeurs de lit de CAG ne conviennent pas à l’enlèvement des pesticides ioniques, comme le 2,4-D, et que le choix du CAG doit reposer sur des études pilotes (Haist-Gulde et Happel, 2012).
Étant donné que les adsorbeurs à lit fixe de CAG fonctionnent généralement en continu, la MON est adsorbée sur le CAG pendant les périodes où les contaminants comme le 2,4-D sont absents de la source d'approvisionnement. Le CAG devient encrassé, ou préchargé de MON, ce qui a un effet nuisible sur le taux d'adsorption des contaminants ciblés comme le 2,4-D. Si le CAG est épuisé, il se peut qu'il soit entièrement ou partiellement inefficace pour enlever le 2,4-D (Knappe et coll., 1999; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
Les autorités responsables devraient connaître l'incidence de la MON sur les systèmes de traitement au CAP, car cette interaction peut avoir des répercussions sur les objectifs de qualité de l'eau pour l'enlèvement du 2,4-D. Il est recommandé de surveiller le COD, comme traceur conservateur de percée du contaminant (Corwin et Summers, 2012; Kennedy et coll., 2012).
4.2.1.4 Filtration biologique
Les procédés de filtration biologique comprennent la filtration lente sur sable, la filtration sur berge et la filtration biologique modifiée. Dans la filtration lente sur sable, le principal mécanisme d'enlèvement est la biodégradation (Woudneh et coll., 1997). Dans la filtration sur berge, les mécanismes d'enlèvement comprennent l'adsorption, la biodégradation et des processus de transport, comme la convection, la diffusion et la dispersion (Storck et coll., 2010). Cependant, l'adsorption joue un rôle secondaire pour les composés organiques polaires comme le 2,4-D (Huntscha et coll., 2013). La biofiltration modifiée est une variante de la filtration classique dans laquelle on laisse se développer dans le milieu filtrant (anthracite-sable ou CAG) un biofilm microbien qui contribue à l'enlèvement des particules fines et des matières organiques dissoutes (Symons et coll., 2000). Le milieu filtrant a un effet sur le mécanisme d'enlèvement; le CAG enlève le contaminant par adsorption et biodégradation (van der Aa et coll., 2012) et l'anthracite-sable, par biodégradation (Zearley et Summers, 2012, 2015). Bien que la filtration biologique permette de réduire les concentrations de 2,4-D, Benner et coll. (2013) ont constaté que les mécanismes d'enlèvement demeuraient largement inconnus. Les auteurs recommandent de mener des recherches plus poussées afin de combler les lacunes dans les connaissances et permettre l'optimisation du procédé pour l'enlèvement des micropolluants, y compris ceux qui sont moins biodégradables et ceux qui sont présents de façon intermittente.
Filtration lente sur sable
Une étude pilote a été réalisée au Royaume-Uni pour montrer que la filtration lente sur sable permettait d'enlever le 2,4-D (Woudneh et coll., 1996, 1997). Cette étude tenait compte des variations saisonnières (Woudneh et coll., 1996) et de l'incidence du vieillissement du filtre (Woudneh et coll., 1997) sur l'enlèvement du 2,4-D. En résumé, deux profondeurs de lit de filtration (300 mm et 500 mm) et deux débits (0,06 m/h et 0,12 m/h) ont été évalués dans le cadre d'une étude de 15 mois, divisée en trois périodes : 1) octobre à décembre 1994, 2) mars 1995 et 3) août et septembre 1995.
Pendant la première période de l'étude, des taux d'enlèvement d'environ 90 % ont été obtenus, comme il est indiqué au tableau 4.
| Profondeur du lit de filtration (mm) | Débit (m3/h) | Temps de contact (h) | Efficacité d'enlèvement (%) |
|---|---|---|---|
| 300 | 0,06 | 4,3 | 89,6Note de bas de page c |
| 0,12 | 2,15 | 90,5Note de bas de page d | |
| 500 | 0,06 | 7,16 | 93,3Note de bas de page c |
| 0,12 | 3,58 | 91,6Note de bas de page d | |
|
|||
Dans la deuxième période de l'étude, les lits filtrants ont été nettoyés, le sable a été remplacé et le pourcentage d'enlèvement est tombé à zéro. Au bout de 20 jours, la croissance biologique nécessaire à l'enlèvement complet du 2,4-D était rétablie. Les auteurs précisent toutefois que le rétablissement de la croissance biologique dans un lit filtrant dépend d'un certain nombre de facteurs, notamment la qualité chimique et microbiologique de l'eau et les conditions environnementales. Le temps nécessaire pour restaurer l'efficacité d'enlèvement du 2,4-D est propre à chaque site (Woudneh et coll., 1997).
Au cours de la troisième période de l'étude, les auteurs ont observé une percée complète du 2,4-D. Woudneh et coll. (1996) ont avancé l'hypothèse que la baisse de l'efficacité était due à 1) un changement dans les conditions aérobies du lit filtrant, causé par une diminution de la teneur de l'eau en oxygène dissous, ou à 2) un changement dans la MON, mesurée par une réduction importante de l'absorbance UV (à 254 nm) pendant les mois d'août et de septembre. Une absorbance UV plus faible semble indiquer la présence d'une MON plus hydrophile, pouvant facilement être transformée par les microorganismes. D'après les auteurs, la présence de cette source de nutriments (p. ex., MON hydrophile) empêchait les microorganismes de biodégrader le 2,4-D. Le 2,4-D a été de nouveau complètement enlevé en octobre lorsque l'absorbance UV a augmenté, ce qui laisse croire à la présence d'une MON plus hydrophobe. La MON hydrophobe tend à être plus récalcitrante, de sorte que le 2,4-D devient la source de nutriments que les microorganismes privilégient. Il est recommandé de procéder à un essai pilote afin de déterminer si la filtration lente sur sable permettra de traiter une source d'eau (Bellamy et coll., 1985a, 1985b; Logsdon et coll., 2002).
Filtration sur berge
L'atténuation naturelle par une filtration sur berge est l'une des méthodes les plus élémentaires et les moins coûteuses de traitement de l'eau (Verstraeten et Heberer, 2002; Sørensen et coll., 2006).
Huntscha et coll. (2013) ont mené des essais sur le terrain afin d'établir les courbes de percée du 2,4-D d'un site de filtration sur berge ayant de courts temps de parcours (quelques jours) d'une eau souterraine oxique la majeure partie du temps. L'activité microbienne in situ a été mesurée pour neuf micropolluants, y compris le 2,4-D. L'essai a été réalisé à plus de 16 °C avec une concentration initiale de 2,4-D de 100 ng/L. Les constantes de vitesse de premier ordre pour la dégradation du 2,4-D variaient de 0,1/h à 1,3/h, ce qui correspond à une demi-vie de 0,5 à 6,7 h. Les résultats de deux autres études sur le terrain portant sur la filtration sur berge d'une eau souterraine suboxique et anoxique sont présentés au tableau 5. Une efficacité d'enlèvement élevée a été observée aux deux endroits. La structure chimique et les propriétés physicochimiques du composé, le temps de séjour et les conditions d'oxydoréduction sont les principaux facteurs qui régissent l’enlèvement d'un micropolluant (Storck et coll., 2012).
| Concentration initiale (µg/L) |
Conditions d'oxydoréduction | Temps de séjour (jours) |
Efficacité d'enlèvement du 2,4-D (%) | Dilution (%) |
|---|---|---|---|---|
| 0,095 | Suboxique | < 1–3 | 86 | Aucune |
| 0,3 | Anoxique | 14 | > 97 | 20 |
|
||||
Filtration biologique modifiée
Deux études en laboratoire ont montré la capacité des biofiltres modifiés d'enlever le 2,4-D (Zearley et Summers, 2012, 2015). Dans les deux études, des biofiltres ont été conçus en utilisant du sable biologiquement actif provenant d'une station de traitement de l'eau potable à pleine échelle dont la source était contaminée en amont par des rejets d'eaux usées et des eaux de ruissellement agricoles et urbaines. Le sable présentait une taille effective de 0,45 mm et un coefficient d'uniformité d'environ 1,3. L'eau d'alimentation était de l'eau municipale déchlorée (pH = 7,7, alcalinité = 40 mg/L sous forme de CaCO3), à laquelle on avait ajouté de la matière organique dissoute pour obtenir une concentration totale cible de 3 mg/L de carbone organique. Des taux d'enlèvement de l'ordre de 30 % à 49 % ont été observés dans les deux études pendant les périodes d'acclimatation (100 à 159 jours).
Dans la première étude, on a évalué l'enlèvement à long terme du 2,4-D pour différents TCLV. On a réalisé l'étude à la température du laboratoire (20 ± 2 °C) à l'aide de deux colonnes montées en série fonctionnant à un taux de charge hydraulique de 2,4 m/h, de manière à obtenir un TCLV cible de 7,5 min dans la colonne du haut et de 7,5 min dans la colonne du bas (environ 15 min au total). On a ajouté à l'influent 13 micropolluants (concentration en 2,4-D de l'influent de 171 ± 57 ng/L) et laissé le système fonctionner pendant 350 jours. On a constaté que l'enlèvement du 2,4-D à l'équilibre était de 68 ± 11 % à un TCLV de 7,9 min et de 77 ± 13 % à un TCLV de 15,8 min (Zearley et Summers, 2012).
Dans la deuxième étude, sept biofiltres ont été utilisés pour évaluer les effets de conditions de charge intermittente (période sans enrichissement au 2,4-D). Le taux de charge hydraulique cible des biofiltres était de 2,2 m/h, de manière à atteindre un TCLV de 8,7 min avec un influent enrichi au 2,4-D à raison de 87 ng/L ± 7,6 ng/L. Dans le biofiltre témoin (charge constante de 2,4-D), on a observé un enlèvement à l'équilibre de 70 ± 3,8 % à un TCLV moyen de 8,2 min. Pour les six biofiltres restants, la période initiale d'enrichissement au 2,4-D de 60 à 96 jours était suivie de périodes sans enrichissement de cinq durées différentes : 0, 36, 83, 149 et 263 jours. Une acclimatation de la biomasse a été observée dans les biofiltres chargés par intermittence ayant des taux d'enlèvement de 35 % à 55 %. Après 209 jours de fonctionnement du biofiltre, un taux d'enlèvement de plus de 70 % a été mesuré (malgré une période sans enrichissement de 149 jours), ce qui indique qu'une exposition constante au 2,4-D n'était pas nécessaire à l'acclimatation de la biomasse. Les microorganismes adaptés pouvaient biodégrader le 2,4-D après des périodes sans exposition pouvant atteindre 5 mois; cependant, après 9 mois sans exposition, l'enlèvement du 2,4-D était nettement plus faible (environ 20 %) (Zearley et Summers, 2015).
4.2.1.5 Filtration sur membrane
Un nombre limité de publications scientifiques existent sur l'efficacité de l'enlèvement du 2,4-D dans l'eau potable par filtration sur membrane. Edwards et Schubert (1974) ont réalisé des expériences en laboratoire pour évaluer le taux d'enlèvement du 2,4-D d'une solution aqueuse à l'aide de membranes d'osmose inverse en acétate de cellulose soumises à une pression de 50 lb/po2. L'enlèvement du 2,4-D d'échantillons de 10 mL variait au départ entre 52 % et 65 %, mais a rapidement diminué dans les échantillons de 10 mL subséquents. Plakas et Karabelas (2012) ont examiné l'efficacité d'enlèvement de divers pesticides dans l'eau à l'aide de membranes de nanofiltration et de l'osmose inverse. Bien que le 2,4-D ne soit pas expressément étudié, les taux d'enlèvement variaient entre > 10 % et 100 %, selon le pesticide et le type de membrane. Les pesticides hydrophobes et polaires, comme le 2,4-D, tendent à présenter un taux d'enlèvement plus faible en raison d'une adsorption et d'une diffusion à travers la membrane ainsi que des interactions polaires avec les membranes chargées.
4.2.1.6 Procédés de traitement combinés
Donald et coll. (2007) ont étudié l'occurrence de 45 pesticides dans 15 réservoirs d'eau de surface non traitée au Manitoba, en Saskatchewan et en Alberta de mai 2003 à avril 2004. Les auteurs ont ensuite évalué l'efficacité des procédés de traitement associés aux réservoirs en juillet 2004 et en juillet 2005. Les concentrations moyennes de 2,4-D dans l'eau non traitée variaient entre 12 ng/L ± 6 ng/L et 597 ng/L ± 199 ng/L. La moyenne globale pour l'ensemble des sites était de 123 ng/L (n = 163). En juillet 2004 et en juillet 2005, on a prélevé simultanément 28 échantillons d'eau brute et d'eau traitée afin d'évaluer le taux de réduction des pesticides obtenu par les stations de traitement de l'eau associées à chaque réservoir d'eau de surface. Les procédés de traitement étaient différents aux 15 sites et comprenaient des procédés classiques et avancés. Treize installations utilisaient la filtration sur sable, une, la filtration sur membrane et la dernière n'utilisait aucun procédé de filtration. Toutes les installations avaient recours à la chloration, et deux ajoutaient également de l'ammoniac pour la chloramination; huit utilisaient du permanganate de potassium, trois, de la cendre chaux-soude et du carbonate de sodium et douze, une forme quelconque de charbon actif. Les auteurs ont mesuré une réduction moyenne de 39 % des concentrations de 2,4-D (données non fournies). Ils ont conclu que la diminution des concentrations des 29 pesticides décelés au cours de la période d'étude (y compris le 2,4-D) était extrêmement variable et qu'aucun lien clair ne pouvait être établi entre cette variabilité et les différences dans les procédés de traitement. Étant donné que l'étude ne visait pas à caractériser l'efficacité du traitement, on ne sait pas quels procédés de traitement ont contribué à la réduction des concentrations de 2,4-D.
4.2.1.7 Procédés d'oxydation avancée
Les procédés d'oxydation avancée (POA) font appel à une combinaison d'oxydants, d'irradiation UV et de catalyseurs pour produire dans l'eau des radicaux libres hydroxyle afin d'accélérer les réactions d'oxydoréduction ou de les rendre plus complètes (Foster et coll., 1991; Symons et coll., 2000).
Ozone et peroxyde d'hydrogène : Un nombre limité de publications scientifiques existent sur l'efficacité de l'O3 et du peroxyde d'hydrogène (O3/H2O2) pour l'enlèvement du 2,4-D de l'eau potable. Meijers et coll. (1995) ont mené des expériences en laboratoire et constaté que le 2,4-D était dégradé dans une proportion de 88 % à 95 % lorsque l'ozonation était précédée d'un ajout d'une dose de H2O2 (O3/COD = 1,4; H2O2/O3 = 0,5; pH de 7,2 à 8,3; température = 20 ºC). On a trouvé que le pH avait peu d'effet sur la dégradation de pesticide par des POA.
UV et peroxyde d'hydrogène : Wols et Hofman-Caris (2012) ont passé en revue les constantes de réaction photochimique nécessaires pour les POA à l'UV et ont prédit une faible réduction du 2,4-D (environ 30 %) pour les traitements utilisant des lampes UV à basse pression (400 mJ/cm2). Dans des expériences en laboratoire, Benitez et coll. (2004) ont remarqué qu'un procédé combiné UV/H2O2 permettait d'obtenir un taux d'enlèvement du 2,4-D plus élevé qu'un traitement UV seulement. Cependant, il a fallu 20 à 40 min pour obtenir une réduction de 80 %. Les concentrations initiales étaient élevées (50 mg/L) et les résultats ne faisaient pas état des concentrations finales de l'eau traitée. Alfano et coll. (2001) ont réalisé des expériences en laboratoire (concentration initiale de 2,4-D = 30 mg/L) et observé qu'un procédé combiné UV/H2O2 était 20 fois plus efficace qu'un traitement UV uniquement.
4.2.2 Traitement à l'échelle résidentielle
Dans les cas où l'enlèvement du 2,4-D est souhaitable au niveau résidentiel, par exemple lorsqu'une résidence obtient son eau potable d'un puits privé, une unité résidentielle de traitement peut servir à réduire les concentrations de 2,4-D dans l'eau potable. Avant l'installation d'une unité de traitement, l'eau doit être analysée pour déterminer les caractéristiques chimiques générales de l'eau et la concentration de 2,4-D dans la source d'approvisionnement en eau. Des analyses périodiques par un laboratoire accrédité devraient être effectuées avec l'eau entrant dans l'unité de traitement et l'eau traitée, afin de vérifier l'efficacité de l'unité de traitement. Les unités peuvent perdre leur capacité d'enlèvement avec l'utilisation et au fil du temps et doivent être entretenues et/ou remplacées. Les consommateurs devraient vérifier la longévité prévue des composants de l'unité de traitement conformément aux recommandations du fabricant et l'entretenir au besoin.
Santé Canada ne recommande aucune marque particulière d'unité de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des unités de traitement de l'eau potable dont la conformité aux normes NSF international / American National Standard Institute (NSF/ANSI) pertinentes est attestée par un organisme de certification accrédité. Ces normes assurent l'innocuité des matériaux et le rendement des produits qui entrent en contact avec l'eau potable.
Les organismes de certification garantissent qu'un produit est conforme aux normes en vigueur et doivent être accrédités par le Conseil canadien des normes (CCN). Parmi les organisations accréditées au Canada (CCN, 2019) se trouvent :
- Groupe CSA (www.csagroup.org);
- NSF International (www.nsf.org);
- Water Quality Association (www.wqa.org);
- UL LLC (www.ul.com);
- Bureau de normalisation du Québec (www.bnq.qc.ca);
- Truesdail Laboratories Inc. (www.truesdail.com);
- International Association of Plumbing and Mechanical Officials (www.iapmo.org).
On peut obtenir une liste à jour des organismes de certification accrédités en s'adressant au CCN (www.scc.ca).
Un certain nombre de dispositifs à usage résidentiel certifiés enlevant le 2,4-D de l'eau potable sont actuellement sur le marché. Le fonctionnement de ces dispositifs repose sur des procédés d'adsorption (charbon actif) et d'osmose inverse. Les dispositifs de traitement conçus pour enlever le 2,4-D de l'eau non traitée (comme celle d'un puits privé) peuvent être certifiés pour enlever soit le 2,4-D seul ou le groupe des composés organiques volatiles (COV) à l'aide d'un substitut qui permet d'enlever les COV et d'autres substances chimiques, dont le 2,4-D. En milieu résidentiel, les dispositifs de traitement de l'eau potable peuvent être installés au robinet (point d'utilisation) ou à l'endroit où l'eau entre dans la maison (point d'entrée) pour réduire les concentrations de contaminants.
Pour qu'un dispositif de traitement de l'eau potable soit certifié conforme à la norme NSF/ANSI 53 (Drinking Water Treatment Units – Health Effects) quant à l'enlèvement du 2,4-D, le dispositif doit réduire la concentration moyenne de l'eau à traiter de 0,210 mg/L à une concentration maximale finale dans l'eau traitée de 0,07 mg/L. Pour qu'un dispositif de traitement de l'eau potable soit certifié conforme à cette même norme à l'aide d'un substitut des COV, ce dispositif doit permettre de réduire par plus de 98 % la concentration moyenne de l'eau à traiter, qui est de 0,110 mg/L, et d'obtenir une concentration maximale dans l'eau traitée de 0,0017 mg/L (NSF/ANSI, 2018a).
Pour qu'un dispositif de traitement de l'eau potable soit certifié conforme à la norme NSF/ANSI 58 (Reverse Osmosis Drinking Water Treatment Systems) pour l'enlèvement des COV, ce dispositif doit permettre de réduire par plus de 98 % la concentration moyenne en 2,4-D de l'eau à traiter, qui est de 0,110 mg/L, et d'obtenir une concentration dans l'eau traitée de 0,0017 mg/L (NSF/ANSI, 2018b7). L'eau traitée au moyen de l'osmose inverse peut entraîner la corrosion des composants internes de la plomberie. Ainsi, ces unités devraient uniquement être installées au point d'utilisation (PU). Également, puisque de grandes quantités d'eau à traiter sont nécessaires pour obtenir le volume d'eau traitée requis, il n'est généralement pas pratique d'installer ces unités au point d'entrée.
5.0 Stratégies de gestion
Tous les responsables des services d'approvisionnement en eau devraient mettre en œuvre une approche de gestion des risques, comme l'approche de la source d'approvisionnement en eau au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau (CCME, 2004; OMS, 2011, 2012). Lorsque l'on adopte ces démarches, il faut procéder à une évaluation du système afin de caractériser la source d'approvisionnement en eau, de décrire les procédés qui préviennent ou réduisent la contamination, de recenser les conditions qui peuvent donner lieu à une contamination et de mettre en place des mécanismes de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles de fonctionnement et de gestion sont instaurés (p. ex. procédure normale d'exploitation, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est établie et d'autres protocoles de vérification du plan de gestion de la salubrité de l'eau sont adoptés (p. ex. tenue de registres, satisfaction de la clientèle). Les opérateurs doivent aussi recevoir une formation pour assurer en tout temps l'efficacité du plan pour la salubrité de l'eau (Smeets et coll., 2009).
5.1 Surveillance
Le 2,4-D peut être présent dans les eaux souterraines et les eaux de surface dans les régions où il est utilisé, selon le type et l'étendue de son application, les facteurs environnementaux (p. ex. quantité de précipitations, type de sol, milieu hydrogéologique, etc.) et le devenir dans l'environnement (p. ex. mobilité, potentiel de lessivage, dégradation, etc.) dans les zones à proximité. Les responsables des services d'approvisionnement en eau devraient tenir compte de l'éventualité de la contamination de la source d'approvisionnement en eau par du 2,4-D (p. ex. l'approvisionnement en eau brute du réseau d'eau potable) selon des facteurs propres au site.
Lorsqu'il est déterminé que du 2,4-D peut être présent et qu'une surveillance est nécessaire, les sources d'approvisionnement en eau de surface et souterraines devraient être caractérisées pour que soit déterminée la concentration de 2,4-D. Cela devrait comprendre la surveillance des sources d'eau de surface pendant les périodes d'utilisation maximale et les épisodes de précipitations et/ou la surveillance annuelle des eaux souterraines. Lorsque les données de base indiquent que le 2,4-D n'est pas présent dans la source d'approvisionnement en eau, la surveillance peut être diminuée.
Lorsqu'un traitement est nécessaire pour enlever le 2,4-D, une surveillance opérationnelle devrait être mise en œuvre pour confirmer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l'eau, des fluctuations de concentration de l'eau brute et du procédé de traitement. Les autorités responsables devraient connaître l'incidence de la matière organique naturelle sur les systèmes de charbon actif, car elle peut avoir des effets sur les objectifs de la qualité de l'eau en ce qui a trait à l'enlèvement du 2,4-D.
Lorsqu'un traitement est en place pour l'enlèvement du 2,4-D, une surveillance de la conformité (c.-à-d. appariement des échantillons d'eau de source et d'eau traitée pour confirmer l'efficacité du traitement) devrait être effectuée au minimum tous les ans et pendant les périodes d'utilisation maximale. Lorsque la surveillance opérationnelle périodique indique un risque de percée du contaminant, comme avec le CAG, la surveillance devrait être exercée chaque trimestre pour planifier la regénération ou le remplacement des matières filtrantes.
6.0 Considérations internationales
Cette section présente les recommandations, les normes et les lignes directrices sur l'eau potable d'autres organismes nationaux et internationaux. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées, et en fonction des différentes politiques et approches, tels que le choix de l'étude principale ou le recours à des taux de consommation, des poids corporels et des facteurs d'attribution liés à la source différents (tableau 6).
L'U.S EPA (1991, 2005, 2010) a fixé le maximum contaminant level (concentration maximale du contaminant ou MCL) et le maximum contaminant level goal (concentration maximale cible de contaminant ou MCLG) à 0,07 mg/L (70 µg/L) en se fondant sur une dose de référence (DRf) de 0,005 mg/kg p.c. par jour et sur les effets hématologiques, rénaux et hépatiques observés dans des études de toxicité subchronique et chronique menées sur des rats en appliquant un facteur d'incertitude de 100. L'U.S. EPA a conclu que le 2,4-D n'était pas classable pour ce qui est de sa cancérogénicité pour l'humain en raison de l'insuffisance des données issues d'études épidémiologiques et du manque de données pertinentes chez l'animal.
L'OMS (2017) a établi une recommandation de 0,03 mg/L en 1998, en se fondant sur un AQA de 0,01 mg/kg p.c. pour l'ensemble constitué du 2,4-D, de ses sels et de ses esters, exprimé sous forme de 2,4-D. L'AQA était basé sur la NOAEL de 1 mg/kg de poids corporel par jour établie dans une étude de toxicité d'un an réalisée sur des chiens (reposant sur les paramètres sériques biochimiques et les lésions histopathologiques du foie et du rein) et une étude de 2 ans menée sur des rats (fondée sur les effets sur le rein et utilisant un facteur d'incertitude de 100) (JMPR, 1996; OMS, 2003).
La recommandation australienne pour l'eau potable de 0,03 mg/L pour le 2,4-D a été d'abord adoptée en 1989, puis maintenue en 2006. Elle est fondée sur la dose sans effet observé (NOEL) de 1 mg/kg p.c. par jour reposant sur les effets sur les reins provenant d'une étude de 2 ans sur le rat et un facteur d'incertitude de 100 (NHMRC, NRMMC, 2011).
L'Union européenne (UE) n'a pas établi de valeur paramétrique chimique précise pour chaque pesticide; elle a plutôt établi une valeur de 0,1 µg/L pour tout pesticide individuel et une valeur de 0,5 µg/L pour les pesticides totaux décelés dans l'eau potable. En établissant ces valeurs, l'UE n'a pas tenu compte des données scientifiques relatives à chaque pesticide telles que les effets sur la santé. Les valeurs reposent plutôt sur une décision politique de retirer les pesticides de l'eau potable.
| Agence (année) |
Valeur (mg/L) |
Principal effet (Référence) |
NOAEL /NOEL (mg/kg p.c./j) |
FI | AQA (mg/kg p.c./j) |
PC (kg) |
EP Consommée (L/d) |
FA (%) |
Commentaires |
|---|---|---|---|---|---|---|---|---|---|
| CMA – SC (2021) |
0,10 | Effets sur les reins chez le rat et la souris (Serota, 1986; Jeffries et coll., 1995; Santé Canada, 2018b) | 5* | 300 | 0,017 | 74 | 1,53 | 20 | La VBS a été établie à 0,16 mg/L. *La NOAEL pour l'étude de Serota (1986) avait été fixée à 1 mg/kg/j, mais a été redéfinie par un Groupe de travail spécialisé en pathologie en 2005 et augmentée à 5 mg/kg/j (voir la section 2.4) |
| US EPA (1991) |
0,07 | Effets sur les reins et le foie chez le rat (Serota et coll., 1983a) | 1 | 100 | 0,01 | 70 | 2 | 20 | Serota et coll. (1983a) est le rapport provisoire rédigé à l'aide de l'étude de Serota (1986) et sur laquelle repose la CMA de SC. |
| OMS (1998) |
0,03 | Effets sur les reins et le foie chez le chien et effets sur les reins chez le rat (JMPR, 1996) | 1 | 100 | 0,01 | 60 | 2 | 10 | JMPR (1996) utilise une étude d'un an chez le chien (Dalgard, 1993) et une étude de deux ans (non examinée*) chez le rat (Serota, 1986) comme point de départ. |
| Australie (2011) |
0,03 | Effets sur les reins chez le rat | 1 | 100 | 0,01 | 70 | 2 | 10 | Aucune référence n'est fournie pour l'étude (NHMRC et NRMMC, 2011). |
| UE (1998) |
0,1 µg/L | L'UE a établi une valeur de 0,1 µg/L pour tout pesticide (individuel) et une valeur de 0,5 µg/L pour l'ensemble des pesticides présents dans l'eau potable. En établissant ces valeurs, l'UE n'a pas tenu compte des données scientifiques relatives à chaque pesticide telles que les effets sur la santé. Les valeurs reposent plutôt sur la décision stratégique visant à retirer les pesticides des sources d'eau potable. | |||||||
|
AQA – Apport quotidien acceptable EP – Eau potable FA – Facteur d'attribution FI – Facteur d'incertitude NOAEL – Concentration sans effet nocif observé NOEL – Concentration sans effet observé PC – Poids corporel |
|||||||||
7.0 Justification
Le 2,4-D est homologué au Canada pour une utilisation sur le gazon, les forêts et les boisés, les cultures en milieu terrestre destinées à la consommation humaine ou animale ainsi que pour le traitement antiparasitaire en milieu industriel et résidentiel de sites à vocation non alimentaire. Il compte parmi les 10 pesticides les plus vendus au Canada. Même s'il est largement utilisé au Canada, les données sur l'exposition ne font pas état de concentrations importantes dans l'eau potable (les données provinciales et territoriales indiquent que les concentrations dans l'eau potable sont généralement inférieures à 1 µg/L). Bien que le CIRC ait classé le 2,4-D dans le groupe 2B comme agent possiblement cancérogène pour l'humain (en se fondant sur des indications limitées chez les animaux), les organismes internationaux responsables de l'eau potable ont évalué le 2,4-D en se basant sur ses effets non cancérigènes. Les reins sont considérés comme la cible de la toxicité du 2,4-D. Bien qu'aucune étude n'ait porté sur les effets du 2,4-D sur les reins chez l'humain, des effets sur les reins ont été observés de façon systématique chez la souris et le rat. Une VBS de 0,16 mg/L a été calculée à partir des effets sur les reins chez la souris et le rat.
Santé Canada, conjointement avec le Comité fédéral-provincial-territorial sur l'eau potable, maintient la valeur de la CMA, qui est de 0,10 mg/L (100 µg/L) pour le 2,4-D dans l'eau potable, en se fondant sur les considérations suivantes.
- Bien qu'une VBS de 0,16 mg/L (160 µg/L) puisse être calculée, des provinces et territoires du Canada ont montré qu'ils pouvaient atteindre la CMA de 0,1 mg/L (100 µg/L).
- Aucun effet bénéfique appréciable pour la santé n'est attendu à la suite d'une augmentation de la CMA;
- Une augmentation de la CMA ne conférerait pas une meilleure protection de la santé et ne réduirait pas les coûts de mise en œuvre.
- Des méthodes d'analyse existent pour mesurer avec précision le 2,4-D à des concentrations bien inférieures à la CMA.
- On peut atteindre la CMA au moyen de procédés de traitement existants.
La CMA confère une protection contre les effets potentiels sur la santé, peut être mesurée de façon fiable au moyen des méthodes d'analyse existantes et peut être atteignable par des procédés de traitement à l'échelle municipale et résidentielle. Dans le cadre de son processus de révision des recommandations, Santé Canada continuera de surveiller les nouvelles recherches dans ce secteur, notamment les résultats des évaluations de l'ARLA, et de recommander toute modification de ce document technique jugée nécessaire.
8.0 Références
Alberta Environment et Sustainable Resource Development (2013). Communication personnelle avec D. LeClair et G. Byrtus.
Alfano, O.M., Brandi, R.J. et Cassano, A.E. (2001). Degradation kinetics of 2,4-D in water employing hydrogen peroxide and UV radiation. Chem. Eng. J., 82(1-3): 209-218.
Amer, S.M. et Aly, F.A.E. (2001). Genotoxic effect of 2,4-dichlorophenoxy acetic acid and its metabolite 2,4-dichlorophenol in mouse. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 494(1-2): 1-12.
APHA, AWWA et WEF (2005). Standard methods for the examination of water and wastewater. 21e édition. Eaton, A.D., Clesceri, L.S., Rice, E.W. and Greenberg, A.E. (eds.). American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC.
APHA, AWWA et WEF (2012). Standard methods for the examination of water and wastewater. 22e édition. Rice, E.W., Baird, R.B., Eaton, A.D. et Clesceri, L.S. (eds.). American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC.
APHA, AWWA et WEF (2017). Standard methods for the examination of water and wastewater. 23e édition. Baird, R.B., Eaton, A.D. et Rice, E.W. (eds.). American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC.
APVMA, Australian Pesticides and Veterinary Medicines Authority (2006). The reconsideration of approvals and registrations relating to 2,4-D. Australian Government. Canberra, Australia. Accès : https://apvma.gov.au/sites/default/files/publication/14236-2-4-d-phase-7-prf-summary.pdf.
Arbuckle, T.E. et Ritter, L. (2005). Phenoxyacetic acid herbicide exposure for women on Ontario farms. J. Toxicol. Environ. Health, Part A, 68(15): 1359-1370.
Arbuckle, T.E., Savitz, D.A., Mery, L.S. et Curtis, K.M. (1999a). Exposure to phenoxy herbicides and the risk of spontaneous abortion. Epidemiology, 10(6): 752-760.
Arbuckle, T.E., Schrader, S.M., Cole, D., Hall, J.C., Bancej, C.M., Turner, L.A. et Claman, P. (1999b). 2,4-Dichlorophenoxyacetic acid residues in semen of Ontario farmers. Repro. Toxicol., 13(6): 421-429.
Arbuckle, T.E., Cole, D.C., Ritter, L. et Ripley, B.D. (2004). Farm children's exposure to herbicides: Comparison of biomonitoring and questionnaire data. Epidemiology, 15(2): 187-194.
Arbuckle, T.E., Cole, D.C., Ritter, L. et Ripley, B.D. (2005). Biomonitoring of herbicides in Ontario farm applicators. Scand. J. Work Environ. Health, 31(SUPPL. 1): 90-97.
Arbuckle, T.E., Bruce, D., Ritter, L. et Hall, C. (2006). Indirect sources of herbicide exposure of families on Ontario farms. J. Expo. Sci. Envion. Epidemiol., 16: 98-104.
Argese, E., Bettiol, C., Marchetto, D., De Vettori, S., Zambon, A., Miana, P. et Ghetti, P.F. (2005). Study on the toxicity of phenolic and phenoxy herbicides using the submitochondrial particle assay. Toxicol. in Vitro, 19(8): 1035-1043.
ASTM (2011). Standard test method for determination of chlorinated organic acid compounds in water by gas chromatography with an electron capture detector. ASTM International, West Conshohocken, Pennsylvania.
Bellamy, W.D., Silverman, G.P., Hendricks, D.W. et Logsdon, G.S. (1985a). Removing Giardia cysts with slow sand filtration. J. Am. Water Works Assoc., 77(2): 52-60.
Bellamy, W.D., Hendricks, D.W. et Logsdon, G.S. (1985b). Slow sand filtration: Influences of selected process variables. J. Am. Water Works Assoc., 77(12): 62-66.
Benitez, F.J., Acero, J.L., Real, F.J. et Roman, S. (2004). Oxidation of MCPA and 2,4-D by UV radiation, ozone, and the combinations UV/H2O2 and O3/H2O2. J. Environ. Sci. Health B, 39(3): 393-409.
Benner, J., Helbling, D.E., Kohler, H-P.E., Wittebol, J., Kaiser, E., Prasse, C., Ternes, T.A., Albers, C.N., Aamand, J., Horemans, B., Springael, D., Walravens, E. et Boon, N. (2013). Is biological treatment a viable alternative for micropollutant removal in drinking water treatment processes? Water Res., 47(16): 5955-5976.
Bharadwaj, L., Dhami, K., Schneberger, D., Stevens, M., Renaud, C. et Ali, A. (2005). Altered gene expression in human hepatoma HepG2 cells exposed to low-level 2,4-dichlorophenoxyacetic acid and potassium nitrate. Toxicol. in Vitro, 19(5): 603-619.
Bloemen, L.J., Mandel, J.S., Bond, G.G., Pollock, A.F., Vitek, R.P. et Cook, R.R. (1993). An update of mortality among chemical workers potentially exposed to the herbicide 2,4-dichlorophenoxyacetic acid and its derivatives. J. Occup. Med., 35(12): 1208-1212.
Bongiovanni, B., Ferri, A., Brusco, A., Rassetto, M., Lopez, L.M., Evangelista de Duffard, A.M. et Duffard, R. (2011). Adverse effects of 2,4-dichlorophenoxyacetic acid on rat cerebellar granule cell cultures were attenuated by amphetamine. Neurotoxic. Res., 19(4): 544-555.
Bortolozzi, A.A., Duffard, R.O., et De Duffard, A.M.E. (1999). Behavioral alteration induced in rats by pre- and postnatal exposure to 2,4-dichlorophenoxyacetic acid. Neurotoxicol. Teratol., 24(4): 451-465.
Bortolozzi, A.A., Duffard, R.O., et De Duffard, A.M.E. (2003). Asymmetrical development of the monoamine system in 2,4-dichlorophenoxyacetic acid treated rats. Neurotoxicology, 24: 149-157.
Bradberry, S.M., Watt, B.E., Proudfoot, A.T. et Vale, J.A. (2000). Mechanisms of toxicity, clinical features, and management of acute chlorophenoxy herbicide poisoning: A review. J. Toxicol. Clin. Toxicol., 38(2): 111-122.
Brahmi, N., Ben Mokhtar, H., Thabet, H., Bouselmi, K. et Amamou, M. (2003). 2,4-D (chlorophenoxy) herbicide poisoning. Vet. Hum. Toxicol., 45(6): 321-322.
Bukowska, B., Rychlik, B., Krokosz, A. et Michalowicz, J. (2008). Phenoxyherbicides induce production of free radicals in human erythrocytes: Oxidation of dichlorodihydrofluorescine and dihydrorhodamine 123 by 2,4-D-Na and MCPA-Na. Food Chem. Toxicol., 46(1): 359-367.
Burns, C.J. et Swaen, G.M. (2012). Review of 2,4-dichlorophenoxyacetic acid (2,4-D) biomonitoring and epidemiology. Crit. Rev. Toxicol., 42(9): 768-786.
Burns, C., Bodner, K., Swaen, G., Collins, J., Beard, K. et Lee, M. (2011). Cancer incidence of 2,4-D production workers. Int. J. Environ. Res. Public Health, 8(9): 3579-3590.
Cantor, K.P., Blair, A., Everett, G., Gibson, R., Burmeister, L.F., Brown, L.M., Schuman, L. et Dick, F.R. (1992). Pesticides and other agricultural risk factors for non-Hodgkin's lymphoma among men in Iowa and Minnesota. Cancer Res., 52(9): 2447-2455.
Carreon, R.E., Johnson, K.A. et Wall., J.M. (1983). 2,4-Dichlorophenoxy-acetic acid isopropylamine salt: Acute toxicological properties. Rapport non publié de Dow Chemical Company, Midland, MI, États-Unis. Présenté à l'OMS par Industry Task Force II on 2,4-D Research Data, Indianapolis, Indiana, États-Unis, cité dans : Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment, 1996.
CCME (2004). De la source au robinet : Guide d'application de l'approche à barrières multiples pour une eau potable saine, Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba).
CCN (2019). Répertoire des organismes de certification accrédités de produits, de processus et de services. Conseil canadien des normes, Ottawa, Ontario. Peut être consulté à l'adresse : http://www.scc.ca/fr/accreditation/certification-de-produits-procedes-et-services/repertoire-des-organismes-de-certification-accredites
Chamberlain, E., Shi, H., Wang, T., Ma, Y., Fulmer, A. et Adams, C. (2012). Comprehensive screening study of pesticide degradation via oxidation and hydrolysis. J. Agric. Food Chem., 60(1): 354-363.
Charles, J.M., Bond, D.M., Jeffries, T.K., Yano, B.L., Stott, W.T., Johnson, K.A., Cunny, H.C., Wilson, R.D. et Bus, J.S. (1996a). Chronic dietary toxicity/oncogenicity studies on 2,4-dichlorophenoxyacetic acid in rodents. Fundam. Appl. Toxicol., 33(2): 166-172.
Charles, J., Cunny, H., Wilson, R. et Bus, J.S. (1996b). Comparative subchronic studies on 2,4-dichlorophenoxyacetic acid, amine and ester in rats. Fundam. Appl. Toxicol., 33(2): 161-165.
Charles, J.M., Cunny, H.C., Wilson, R.D., Bus, J.S., Lawlor, T.E., Cifone, M.A., Fellows, M. et Gollapudi, B. (1999a). Ames assays and unscheduled DNA synthesis assays on 2,4-dichlorophenoxyacetic acid and its derivatives. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 444(1): 207-216.
Charles, J.M., Cunny, H.C., Wilson, R.D., Ivett, J.L., Murli, H., Bus, J.S. et Gollapudi, B. (1999b). In vivo micronucleus assays on 2,4-dichlorophenoxyacetic acid and its derivatives. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 444(1): 227-234.
Charles, J.M., Hanley Jr., T.R., Wilson, R.D., van Ravenzwaay, B. et Bus, J.S. (2001). Developmental toxicity studies in rats and rabbits on 2,4-dichlorophenoxyacetic acid and its forms. Toxicol. Sci., 60(1): 121-131.
Chowdhury, Z., Traviglia, A., Carter, J., Brown, T., Summers, R.S., Corwin, C.J., Zearley, T., Thurman, M., Ferrara, I., Olson, J., Thacker, R. et Barron, P. (2010). Cost-effective regulatory compliance with GAC biofilters. Report No. 4155. Water Research Foundation, Denver, Colorado.
Chowdhury, Z.K., Summers, R.S., Westerhoff, G.P., Leto, B.J., Nowack, K.O. et Corwin, C.J. (2013). Activated carbon: Solutions for improving water quality. Passantino, L. B.(ed.). American Water Works Association. Denver, Colorado.
CIRC - Centre international de recherche sur le cancer (2017). IARC monographs on the evaluation of carcinogenic risks to humans: DDT, lindane, and 2,4-D. Volume 113. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (ed.). IARC Press, Lyons, France, p. 480.
Clausen, L. (2000). Retention of pesticides in filter membranes. J. Environ. Qual., 29(2): 654-657.
Clausen, M., Leier, G. et Witte, I. (1990). Comparison of the cytotoxicity and DNA-damaging properties of 2,4-D and U 46 D Fluid (dimethylammonium salt of 2,4-D). Arch. Toxicol., 64(6): 497-501.
Coady, K.K., Kan, H.L., Schisler, M.R., Gollapudi, B.B., Neal, B., Williams, A. et LeBaron, M.J. (2014). Evaluation of potential endocrine activity of 2,4-dichlorophenoxyacetic acid using in vitro assays. Toxicol. in Vitro, 28(5): 1018-1025.
Corwin, C.J. et Summers, R.S. (2012). Controlling trace organic contaminants with GAC adsorption. J. Am. Water Works Assoc., 104(1): E36-E47.
Croll, B.T., Chadwick, B. et Knight, B. (1992). The removal of atrazine and other herbicides from water using granular activated carbon. Water Sci. Technol. Water Supply 10(2): 111-120.
Dalgard, D.W. (1993). 52 Week dietary toxicity study with 2,4-D acid in dogs. Rapport non publié 2184-124 de Hazleton Laboratories America, Inc., Vienna, VA, USA. Soumis à l'OMS par l' Industry Task Force II on 2,4-D Research Data, Indianapolis, Indiana, USA, cité dans JMPR, 1996.
De Duffard, A.M., Brusco, A., Duffard, R., Garcia, G., et Pecci Saavedra, J. (1995). Changes in serotonin-immunoreactivity in the dorsal and median raphe nuclei of rats exposed to 2,4-Dichlorophenoxy acetic acid through lactation. Mol. Chem. Neuropathol., 26: 187-193.
De Roos, A.J., Zahm, S.H., Cantor, K.P., Weisenburger, D.D., Holmes, F.F., Burmeister, L.F. et Blair, A. (2003). Integrative assessment of multiple pesticides as risk factors for non-Hodgkin's lymphoma among men. J. Occup. Environ. Med., 60(9): e11.
Dhillon, A.S., Tarbutton, G.L., Levin, J.L., Plotkin, G.M., Lowry, L.K., Nalbone, J.T. et Shepherd, S. (2008). Pesticide/environmental exposures and Parkinson's disease in East Texas. J. Agromedicine, 13(1): 37-48.
Donald, D.B., Cessna, A.J., Sverko, E. et Glozier, N.E. (2007). Pesticides in surface drinking-water supplies of the Northern Great Plains. Environ. Health Perspect., 115: 1183-1191.
Duchnowicz, P. et Koter, M. (2003). Damage to the erythrocyte membrane caused by chlorophenoxyacetic herbicides. Cell. Mol. Biol. Lett., 8(1): 25-30.
Duffard, R., Rosso, G.S., Bortolozzy, A., Madariaga, M., Di Paolo, O., et De Duffard, A.M.E. (1996). Central nervous system myelin deficit in rats exposed to 2,4-dichlorophenoxy acetic acid throughout lactation. Neurotoxicol. Teratol.,18(6): 691-696.
Durakovic, Z., Durakovic, A., Durakovic, S. et Ivanovic, D. (1992). Poisoning with 2,4-dichlorophenoxyacetic acid treated by hemodialysis. Arch. Toxicol., 66(7): 518-521.
Edwards, V.H. et Schubert, P.F. (1974). Removal of 2,4-D and other persistent organic molecules from water supplies by reverse osmosis. J. Am. Water Works Assoc., 66(10): 610-616.
Environnement Canada (2011). Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens. Direction des sciences et de la technologie de l'eau. No de cat. En14-40/2011F-PDF.
Eriksson, M., Hardell, L., Carlberg, M. et Åkerman, M. (2008). Pesticide exposure as risk factor for non-Hodgkin lymphoma including histopathological subgroup analysis. Int. J. Cancer, 123(7): 1657-1663.
Erne, K. (1966). Distribution and elimination of chlorinated phenoxyacetic acids in animals. Acta Vet. Scand., 7: 240-256.
Feldmann, R.J. et Maibach, H.I. (1974). Percutaneous penetration of some pesticides and herbicides in man. Toxicol. Appl. Pharmacol., 28(1): 126-132.
Ferri, A., Duffard, R. et de Duffard, A.M.E. (2007). Selective oxidative stress in brain areas of neonate rats. Drug Chem. Toxicol., 30(1): 17-30.
Flanagan, R.J., Meredith, T.J., Ruprah, M., Onyon, L.J. et Liddle, A. (1990). Alkaline diuresis for acute poisoning with chlorophenoxy herbicides and ioxynil. Lancet, 335(8687): 454-458.
Foster, D.M., Rachwal, A.J. et White, S.L. (1991). New treatment processes for pesticides and chlorinated organics control in drinking water. J. Inst. Water Environ. Manage., 5(4): 466-476.
Foster, D.M., Rachwal, A.J. et White, S.L. (1992). Advanced treatment for the removal of atrazine and other pesticides. Water Sci. Technol. Water Supply 10(2): 133-146.
Frantz, S.W. et Kropscott, B.E. (1993). Pharmacokinetic evaluation of a single oral administration of the 2-ethylhexyl (isooctyl) ester of 2,4-D to Fischer 344 rats. J. Occup. Med. Toxicol., 2(1): 75-85.
Frick, E. A. et Dalton, M.S. (2005). Characterization of anthropogenic organic compounds in the source water and finished water for the City of Atlanta, octobre 2002 - septembre 2004. Dans Hatcher, K.S. (ed.) Proceedings of the 2005 Georgia Water Resources Conference, 25-27 avril, Institute of Ecology, University of Georgia, Athens, Georgia. Accès : https://smartech.gatech.edu/bitstream/handle/1853/47123/FrickE%20paper%20March15%20rev.pdf
Friesen, E.G., Jones, G.R. et Vaughan, D. (1990). Clinical presentation and management of acute 2,4-D oral ingestion. Drug Saf., 5(2): 155-159.
Garry, V.F., Schreinemachers, D., Harkins, M.E. et Griffith, J. (1996). Pesticide appliers, biocides, and birth defects in rural Minnesota. Environ. Health Perspect., 104(4): 394-399.
Giri, R.R., Ozaki, H., Ishida, T., Takanami, R. et Taniguchi, S. (2007). Synergy of ozonation and photocatalysis to mineralize low concentration 2,4-dichlorophenoxyacetic acid in aqueous solution. Chemosphere, 66(9): 1610-1617.
Giroux, I. (2002). Contamination de l'eau par les pesticides dans les régions de culture de maïs et de soya au Québec, Résultats des campagnes d'échantillonnage de 1999, 2000 et 2001 et évolution temporelle de 1992 à 2001. Gouvernement de Québec, Ministère de l'Environnement. ENV/2002/0365, QE/137, ISBN 2-550-40286-3.
Giroux, I. et Therrien, M. (2005). Les pesticides utilisés dans les espaces verts urbains: présence dans l'eau des rejets urbains et dans l'air ambiant. Direction du suivi de l'état de l'environnement, Ministère du Développement durable, de l'Environnement et des Parcs, ENV/2005/0165. QE/164.
Glozier, N.E., Struger, J., Cessna, A.J., Gledhill, M., Rondeau, M., Ernst, W.R., Sekela, M.A., Cagampan, S.J., Sverko, E., Murphy, C., Murray, J.L. et Donald, D.B. (2012). Occurrence of glyphosate and acidic herbicides in select urban rivers and streams in Canada, 2007. Environ. Sci. Pollut. Res. Int., 19(3): 821-834.
Gollapudi, B.B., Charles, J.M., Linscombe, V.A., Day, S.J. et Bus, J.S. (1999). Evaluation of the genotoxicity of 2,4-dichlorophenoxyacetic acid and its derivatives in mammalian cell cultures. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 444(1): 217-225.
Gonzalez, M., Soloneski, S., Reigosa, M.A. et Larramendy, M.L. (2005). Genotoxicity of the herbicide 2,4-dichlorophenoxyacetic and a commercial formulation, 2,4-dichlorophenoxyacetic acid dimethylamine salt. I. Evaluation of DNA damage and cytogenetic endpoints in Chinese Hamster ovary (CHO) cells. Toxicol. in Vitro, 19(2): 289-297.
Goodman, J.E., Loftus, C.T. et Zu, K. (2015). 2,4-Dichlorophenoxyacetic acid and non-Hodgkin's lymphoma, gastric cancer, and prostate cancer: Meta-analyses of the published literature. Ann. Epidemiol., 25(8): 626-636.
Goodman, J.E., Loftus, C.T. et Zu, K. (2017). 2,4-Dichlorophenoxyacetic acid and non-Hodgkin's lymphoma: results from the Agricultural Health Study and updated meta-analyses. Ann. Epidemiol., 27(4): 626-636.
Gorzinski, S.J., Kociba, R.J., Campbell, R.A., Smith, F.A., Nolan, R.J. et Eisenbrandt, D.L. (1987). Acute, pharmacokinetic, and subchronic toxicological studies of 2,4-dichlorophenoxyacetic acid. Fundam. Appl. Toxicol., 9(3): 423-435.
Griffin, R.J., Godfrey, V.B., Kim, Y.C. et Burka, L.T. (1997). Sex-dependent differences in the disposition of 2,4-dichlorophenoxyacetic acid in Sprague-Dawley rats, B6C3F1 mice, and Syrian hamsters. Drug Metab. Dispos., 25(9): 1065-1071.
Greene, B.E., Snoeyink, V.L. et Pogge, F.W. (1994). Adsorption of pesticides by powdered activated carbon. American Water Works Association Research Foundation and American Water Works Association, Denver, Colorado.
Gustafson, D.K., Carr, K.H., Carson, D.B., Fuhrman, J.D., Hackett, A.G., Hoogheem, T.J., Snoeyink, V.L., Curry, M., Heijman, B., Chen, S., Herti, P. et van Wesenbeeck, I. (2003). Activated carbon adsorption of chloroacetanilide herbicides and their degradation products from surface water supplies. J. Water Supply Res. Technol. AQUA, 52(6): 443-454.
Haist-Gulde, B. (2014). Communication personnelle, Technologiezentrum Wasser, Karlsruher, Allemagne.
Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report no. 4022. Water Research Foundation, Denver, Colorado.
Haist-Gulde, B., Baldauf, G. et Brauch, H.-J. (1993). Removal of pesticides from raw waters. Water Sci. Technol. Water Supply, 11(1): 187-196.
Hancock, D.B., Martin, E.R., Mayhew, G.M., Stajich, J.M., Jewett, R., Stacy, M.A., Scott, B.L., Vance, J.M. et Scott, W.K. (2008). Pesticide exposure and risk of Parkinson's disease: A family-based case-control study. BMC Neurol., 8: 6.
Hardell, L. et Sandstrom, A. (1979). Case-control study: soft-tissue sarcomas and exposure to phenoxyacetic acids or chlorophenols. Br. J. Cancer, 39(6): 711-717.
Hardell, L. (1981). Relation of soft-tissue sarcoma, malignant lymphoma and colon cancer to phenoxy acids, chlorophenols and other agents. Scand. J. Work Environ. Health, 7(2): 119-130.
Hardell, L. et Eriksson, M. (1999). A case-control study of non-Hodgkin lymphoma and exposure to pesticides. Cancer, 85(6): 1353-1360.
Harris, S.A. et Solomon, K.R. (1992). Percutaneous penetration of 2,4-dichlorophenoxyacetic acid and 2,4-D dimethyamine salt in human volunteers. J. Toxicol. Environ. Health, 36: 233-240.
Hasegawa, M., Kusuhara, H., Endou, H. et Sugiyama, Y. (2003). Contribution of organic anion transporters to the renal uptake of anionic compounds and nucleoside derivatives in rat. J. Pharmacol. Exp. Ther., 305(3): 1087-1097.
HSDB, Hazardous Substances Databank (2005). 2,4-D, dimethylamine. CASRN: 2008-39-1. U.S. National Library of Medicine, Division of Specialized Information Services, Bethesda, MD. Accès : https://toxnet.nlm.nih.gov/cgi-bin/sis/search/a?dbs+hsdb:@term+@DOCNO+2599
HSDB, Hazardous Substances Databank (2015). 2,4-D. CASRN: 94-75-7. U.S. National Library of Medicine, Division of Specialized Information Services, Bethesda, MD. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/search2/r?dbs+hsdb:@term+@DOCNO+202
Hoar, S.K., Blair, A., Holmes, F.F., Boysen, C.D., Robel, R.J., Hoover, R. et Fraumeni, J.F. (1986). Agricultural herbicide use and risk of lymphoma and soft-tissue sarcoma. J. Am. Med. Assoc., 256(9): 1141-1147.
Hu, J., Morita, T., Magara, Y. et Aizawa, T. (2000). Evaluation of reactivity of pesticides with ozone in water using the energies of frontier molecular orbitals. Wat. Res., 34(8): 2215-2222.
Hughes, W.B. et Younker, C.L. (2011). Organic compounds assessed in Chattahoochee River water used for public supply near Atlanta, Georgia, 2004-05. Fiche d'information 2011-3062. U.S. Geological Survey, Reston, Virginia. 6 p.
Huntscha, S., Rodriguez Velosa, D.M., Schroth, M.H. et Hollender, J. (2013). Degradation of polar organic micropollutants during riverbank filtration: Complementary results from spatiotemporal sampling and push-pull tests. Environ. Sci. Technol., 47(20): 11512-11521.
Jeffries, T.K., Yano, B.L., Ormand, J.R. et Battjes, J.E. (1995). 2,4-D: Chronic toxicity/oncogenicity study in Fischer 344 rats (Unpublished study). The Dow Chemical Company, Health and Environmental Sciences. Midland, MI, cité dans JMPR, 1996 et U.S. EPA, 1996.
JMPR, Réunion conjointe FAO/OMS sur les résidus de pesticides (1996). Pesticides residues in food: 1996 evaluations Part II Toxicology. International Programme on Chemical Safety-INCHEM (IPCS) Rowland, J.C. (ed.). US Environmental Protection Agency, Washington, DC. Accès : http://www.inchem.org/documents/jmpr/jmpmono/v96pr04.htm
Johnson, W.G., Lavy, T.L. et Gbur, E.E. (1995). Sorption, mobility and degradation of trichlopyr and 2,4-D on four soils. Weed Science, 43(4): 678-684.
Kamel, F., Tanner, C., Umbach, D., Hoppin, J., Alavanja, M., Blair, A., Comyns, K., Goldman, S., Korell, M., Langston, J., Ross, G. et Sandler, D. (2007). Pesticide exposure and self-reported Parkinson's disease in the Agricultural Health Study. Am. J. Epidemiol., 165(4): 364-374.
Kancir, C.B., Andersen, C. et Olesen, A.S. (1988). Marked hypocalcemia in a fatal poisoning with chlorinated phenoxy acid derivatives. J. Toxicol. Clin. Toxicol., 26(3-4): 257-264.
Kaya, B., Yanikoglu, A. et Marcos, R. (1999). Genotoxicity studies on the phenoxyacetates 2,4-D and 4-CPA in the Drosophila wing spot test. Teratog. Carcinog. Mutagen., 19(4): 305-312.
Keller, T., Skopp, G., Wu, M. et Aderjan, R. (1994). Fatal overdose of 2,4-dichlorophenoxyacetic acid (2,4-D). Forensic Sci. Int., 65(1): 13-18.
Kennedy, A., Reinert, A., Summers, R.S., Ferrer, I., Thurman, M. et Knappe, D.R.U. (2012). Scale-up of the GAC adsorption of trace organic compounds. Proceedings of the 2012 WQTC Conference, Toronto, Ontario. American Water Works Association, Denver, Colorado.
Kennepohl, E., Munro, I.C. et Bus, J.S. (2010). Chapter 84: phenoxy herbicides (2,4-D). In: Hayes' handbook of pesticide toxicology. 3rd edition. Krieger, R. (ed.). Academic Press, New York, p. 1829-1847.
Knappe, D.R.U., Snoeyink, V.L., Roche, P., Prados, M.J. et Bourbigot, M-M. (1999). Atrazine removal by preloaded GAC. J. Am. Water Works Assoc., 91(10): 97-109.
Kogevinas, M., Becher, H., Benn, T., Bertazzi, P.A., Boffetta, P., Bueno-de-Mesquita, H.B., Coggon, D., Colin, D., Flesch-Janys, D., Fingerhut, M., Green, L., Kauppinen, T., Littorin, M., Lynge, E., Mathews, J.D., Neuberger, M., Pearce, N. et Saracci, R. (1997). Cancer mortality in workers exposed to phenoxy herbicides, chlorophenols, and dioxins. An expanded and updated international cohort study. Am. J. Epidemiol., 145(12): 1061-1075.
Kohli, J.D., Khanna, R.N., Gupta, B.N., Dhar, M.M., Tandon, J.S. et Sircar, K.P. (1974). Absorption and excretion of 2,4-dichlorophenoxyacetic acid in man. Xenobiotica, 4(2): 97-100.
Kouras, A., Zouboulis, A., Samara, C. et Kouimtzis, Th. (1998). Removal of pesticides from aqueous solutions by combined physiochemical processes-the behaviour of lindane. Environ. Pollut., 103(2-3): 193-202.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B, 16(1): 39-51.
Kruithof, J.C., Kamp, P.C. et Belosevic, M. (2002). UV/H2O2-treatment: the ultimate solution for pesticide control and disinfection. J. Water Supply Res. Technol. AQUA, 2(1): 113-122.
Kumar, Y. (2001). Pesticides in ambient air in Alberta. Report prepared for the Air Research Users Group, Alberta Environment, Edmonton, Alberta. ISBN 0-7785-1889-4.
Lee, K., Johnson, V.L. et Blakley, B.R. (2001). The effect of exposure to a commercial 2,4-D formulation during gestation on the immune response in CD-1 mice. Toxicology, 165(1): 39-49.
Lerda, D. et Rizzi, R. (1991). Study of reproductive function in persons occupationally exposed to 2,4-dichlorophenoxyacetic acid (2,4-D). Mutat. Res., 262: 47-50.
Linnainmaa, K. (1984). Induction of sister chromatid exchanges by the peroxisome proliferators 2,4-D, MCPA, and clofibrate in vivo and in vitro. Carcinogenesis, 5(6): 703-707.
Logsdon, G.S., Kohne, R., Abel, S. et LaBonde, S. (2002). Slow sand filtration for small water systems. J. Environ. Eng. Sci., 1(5): 339-348.
Loomis, D., Guyton, K., Grosse, Y., El Ghissasi, F., Bouvard, V., Benbrahim-Tallaa, L., Guha, N., Mattock, H. et Straif, K. (2015). Carcinogenicity of lindane, DDT, and 2,4-dichlorophenoxyacetic acid. Lancet Oncol., 16(8): 891-892.
Manitoba Conservation and Water Stewardship (2013). Communication personnelle avec K. Philip and N. Armstrong.
Marouani, N., Tebourbi, O., Cherif, D., Hallegue, D., Yacoubi, M.T., Sakly, M., Benkhalifa, M. et Ben Rhouma, K. (2017). Effects of oral administration of 2,4-dichlorophenoxyacetic acid (2,4-D) on reproductive parameters in male Wistar rats. Environ. Sci. Pollut. Res. Int., 24(1): 519-526.
Marty, M.S., Neal, B.H., Zablotny, C.L., Yano, B.L., Andrus, A.K., Woolhiser, M.R., Boverhof, D.R., Saghir, S.A., Perala, A.W., Passage, J.K., Lawson, M.A., Bus, J.S., Lamb, J.C. 4th and Hammond, L. (2013). An F1-extended one-generation reproductive toxicity study in Crl:CD(SD) rats with 2,4-dichlorophenoxyacetic acid. Toxicol. Sci., 136(2): 527-547.
Mattsson, J.L., Charles, J.M., Yano, B.L., Cunny, H.C., Wilson, R.D. et Bus, J.S. (1997). Single-dose and chronic dietary neurotoxicity screening studies on 2,4-dichlorophenoxyacetic acid in rats. Fundam. Appl. Toxicol., 40(1): 111-119.
Meijers, R.T., Oderwald-Muller, E.J., Nuhn, P.A.N.M. et Kruithof, J.C. (1995). Degradation of pesticides by ozonation and advanced oxidation. Ozone Sci. Eng., 17(6): 673-686.
Miligi, L., Costantini, A.S., Bolejack, V., Veraldi, A., Benvenuti, A., Nanni, O., Ramazzotti, V., Tumino, R., Stagnaro, E., Rodella, S., Fontana, A., Vindigni, C. et Vineis, P. (2003). Non-Hodgkin's lymphoma, leukemia, and exposures in agriculture: Results from the Italian multicenter case-control study. Am. J. Ind. Med., 44(6): 627-636.
Miligi, L., Costantini, A.S., Veraldi, A., Benvenuti, A., Vineis, P., Nanni, O., Ramazzotti, V., Tumino, R., Stagnaro, E., Rodella, S., Fontana, A. et Vindigni, C. (2006). Cancer and pesticides: An overview and some results of the Italian multicenter case-control study on hematolymphopoietic malignancies. Ann. NY Acad. Sci., 1076: 366-377.
Mills, P.K. et Yang, R.C. (2007). Agricultural exposures and gastric cancer risk in Hispanic farm workers in California. Environ. Res., 104(2): 282-289.
Mills, P.K., Yang, R. et Riordan, D. (2005). Lymphohematopoietic cancers in the United Farm Workers of America (UFW), 1988-2001. Cancer Causes Control, 16(7): 823-830.
Miltner, R.J., Baker, D.B., Speth, T.F. et Fronk, C.A. (1989). Treatment of seasonal pesticides in surface waters. J. Am. Water Works Assoc., 81(1): 43-52.
Ministère de l'Environnement (2021). Communication personnelle avec A. Polegato.
Ministère de l'Environnement et de la Lutte contre les changements climatiques (2021). Communication personnelle avec P. Cantin.
Moody, R., Franklin, C., Ritter, L. et Maibach, H. (1990). Dermal absorption of the phenoxy herbicides 2,4-D, 2,4-D amine, 2,4-D isooctyl and 2,4,5-T in rabbits, rats, rhesus monkeys and humans: A cross-species comparison. J. Toxicol. Environ. Health, 29: 237-245.
Moody, R.P., Wester, R.C., Melendres, J.L. et Maibach, H.I. (1992). Dermal absorption of the phenoxy herbicide 2,4-D dimethylamine in humans: Effect of DEET and anatomic site. J. Toxicol. Environ. Health, 36: 241-250.
Morrison, H.I., Wilkins, K., Semenciw, R., Mao, Y. et Wigle, D. (1992). Herbicides and cancer. J. Natl. Cancer Inst., 84: 1866-1874.
Munro, I.C., Carlo, G.L., Orr, J.C., Sund, K.G., Wilson, R.M., Kennepohl, E., Lynch, B.S, Jablinske, M.et Lee, N.L. (1992). A comprehensive, integrated review and evaluation of the scientific evidence relating to the safety of the herbicide 2,4-D. J. Am. Coll. Toxicol., 11(5): 559-664.
Mustonen, R., Kangas, J., Vuojolahti, P. et Linnainmaa, K. (1986). Effects of phenoxyacetic acids on the induction of chromosome aberrations in vitro and in vivo. Mutagenesis, 1(4): 241-245.
Nakbi, A., Tayeb, W., Dabbou, S., Chargui, I., Issaoui, M., Zakhama, A., Miled, A. et Hammami, M. (2012). Hypolipidimic and antioxidant activities of virgin olive oil and its fractions in 2,4-diclorophenoxyacetic acid-treated rats. Nutrition, 28(1): 81-91.
Neal, B.H., Bus, J., Marty, M.S., Coady, K., Williams, A., Staveley, J. et Lamb, J.C. (2017). Weight-of-the-evidence of 2,4-D potential for interactions with the estrogen, androgen and thyroid pathways and steroidogenesis. Crit. Rev. Toxicol., 47(5): 354-401.
Nielsen, K., Kæmpe, B., et Jensen-Holm, J. (1965). Fatal poisoning in man by 2,4-dichlorophenoxyacetic acid (2,4-D): Determination of the agent in forensic materials. Acta Pharmacol. Toxicol., 22: 224-234.
New Brunswick Department of Health (2013). Communication personnelle avec K. Gould.
NHMRC, NRMMC (2011) National Water Quality Management Strategy: Australian Drinking Water Guidelines Paper 6. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra.
Nova Scotia Environment (2013). Communication personnelle avec C. Mosher.
Nozaki, Y., Kusuhara, H., Kondo, T., Hasegawa, M., Shiroyanagi, Y., Nakazawa, H., Okano, T. et Sugiyama, Y. (2007). Characterization of the uptake of organic anion transporter (OAT) 1 and OAT3 substrates by human kidney slices. J. Pharmacol. Exp. Ther., 321(1): 362-369.
NSF/ANSI (2018a). NSF International/American National Standards Institute Standard 53: Drinking water treatments units-Health effects. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2018b). NSF International/American National Standards Institute Standard 58: Reverse osmosis drinking water treatment systems. NSF International, Ann Arbor, Michigan.
Ntzani, E.E., Ntritsos, C.M., Evangelou, G. et Tzoulaki, E. (2013). Literature review on epidemiological studies linking exposure to pesticides and health effects. EFSA Supporting Publication 2013, 10(10): EN-497.
OEHHA-Office of Environmental Health Hazard Assessment (2009). Public health goal for 2,4-dichlorophenoxyacetic acid in drinking water. Pesticide and Environmental Toxicology Branch Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, Californie.
OMS (2003). 2,4-D in Drinking-water: Background document for development of WHO Guidelines for Drinking-water Quality. Organisation mondiale de la Santé, Genève, Suisse. Peut être consulté au lien suivant : https://www.who.int/water_sanitation_health/water-quality/guidelines/chemicals/24D.pdf?ua=1 en anglais seulement
OMS (2011). Guidelines for drinking-water quality. 4th ed. Organisation mondiale de la Santé, Genève, Suisse. ISBN 978 92 4 154815 1.
OMS (2012). Planifier la gestion de la sécurité sanitaire de l'eau pour l'approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève, Suisse. Peut être consulté au lien suivant : https://www.who.int/water_sanitation_health/publications/small-comm-water_supplies/fr/
OMS (2017). Directives de qualité pour l'eau de boisson : Quatrième édition intégrant le premier additif. Organisation mondiale de la Santé, CC BY-NC-SA 3.0 IGO, Genève, Suisse. Peut être consulté au lien suivant : https://www.who.int/water_sanitation_health/publications/drinking-water-quality-guidelines-4-including-1st-addendum/fr/.
Ontario - Ministère de l'Environnement (2021). Communication personnelle avec S. Deshpande.
O'Reilly, J.F. (1984). Prolonged coma and delayed peripheral neuropathy after ingestion of phenoxyacetic acid weedkillers. Postgrad. Med. J., 60(699): 76-77.
Pahwa, P., Karunanayake, C.P., Dosman, J.A., Spinelli, J.J. et McLaughlin, J.R. (2011). Soft-tissue sarcoma and pesticides exposure in men: Results of a Canadian case-control study. J. Occup. Environ. Med., 53(11): 1279-1286.
Palmeira, C.M., Moreno, A.J. et Madeira, V.M.C. (1995). Thiols metabolism is altered by the herbicides paraquat, dinoseb and 2,4-D: A study in isolated hepatocytes. Toxicol. Lett., 81(2-3): 115-123.
Pavlica, M., Papes, D. et Nagy, B. (1991). 2,4-Dichlorophenoxyacetic acid causes chromatin and chromosome abnormalities in plant cells and mutation in cultured mammalian cells. Mutat. Res., 263(2): 77-81.
Plakas, K.V. et Karabelas, A. J. (2012). Removal of pesticides from water by NF and RO membranes-A review. Desalination, 287: 255-265.
Pochettino, A.A., Bongiovanni, B., Duffard, R.O. et Evangelista de Duffard, A.M. (2013). Oxidative stress in ventral prostate, ovary, and breast by 2,4-dichlorophenoxyacetic acid in pre- and postnatal exposed rats. Environ. Toxicol., 28(1): 1-10.
Pochettino, A.A., Hapon, M.B., Biolatto, S.M., Madariaga, M.J., Jahn, G.A. et Konjuh, C.N. (2016). Effects of 2,4-dichlorophenoxyacetic acid on the ventral prostate of rats during the peri-pubertal, pubertal and adult stage. Drug Chem. Toxicol., 39(4): 392-399.
Prado, A.G.S, Vieria, E.M., et Olimpia de O. Rezende, M. (2001). Monitoring of the harmful concentrations of 2,4-dichlorophenoxyacetic acid (2,4-D) in soils with and without organic matter. J. Braz. Chem. Soc., 12(4): 485-488.
Qurratu, A. et Reehan, A. (2016). A review of 2,4-dichlorophenoxyacetic acid (2,4-D) derivatives: 2,4-D dimethylamine salt and 2,4-D butyl ester. Int. J. Appl. Engineer. Res., 11(19): 9946-9955.
Robeck, G., Dostal, K.A., Cohen, J.M. et Kreissl, J.F. (1965). Effectiveness of water treatment processes in pesticide removal. J. Am. Water Works Assoc., 57(2): 181-199.
Rodwell, D.E. (1985). A dietary two-generation reproduction study in Fischer 344 rats with dichlorophenoxy acetic acid. Unpublished report No. WIL-81137 from WIL Research Laboratories, Inc., OH, USA. Submitted to WHO by Industry Task Force II on 2,4-D Research Data, Indianapolis, Indiana, USA, as cited in: JMPR, 1996.
Rosso, S.B., Di Paolo, O.A., De Duffard, A.M.E., et Duffard, R. (1997). Effects of 2,4-dichlorophenoxy acetic acid on central nervous system of developmental rats. Associated changes in ganglioside pattern. Brain Res., 769: 163-167.
Rosso, S.B., Garcia, G.B., Madariaga, M.J., De Duffard, A.M.E., et Duffard, R.O. (2000). 2,4-Dichlorophenoxy acetic acid in developing rats alters behaviour, myelination and regions brain gangliosides pattern. Neurotoxicology, 21:155-164.Rugbjerg, K., Harris, M.A., Shen, H., Marion, S.A., Tsui, J.K..C. et Tesche, K. (2011). Pesticide exposure and risk of Parkinson's disease - A population-based case-control study evaluating the potential for recall bias. Scand. J. Work Environ. Health, 37(5): 427-236.
Saghir, S.A., Marty, M.S., Zablotny, C.L., Passage, J.K., Perala, A.W., Neal, B.H., Hammond, L. et Bus, J.S. (2013). Life-stage-, sex-, and dose-dependent dietary toxicokinetics and relationship to toxicity of 2,4-dichlorophenoxyacetic acid (2,4-D) in rats: Implications for toxicity test dose selection, design, and interpretation. Toxicol. Sci., 136(2): 297-307.
Santé Canada (1994). Loi canadienne sur la protection de l'environnement - Évaluation des risques pour la santé humaine des substances d'intérêt prioritaire, Ministre des Approvisionnements et Services Canada, Ottawa (Ontario).
Santé Canada (2005a). Projet d'acceptabilité d'homologation continue : Réévaluation des utilisations de l'acide (2,4-dichlorophénoxy) acétique (2,4-D) comme herbicide sur les pelouses et le gazon en plaques. PACR2005-01. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Ontario).
Santé Canada (2005b). Memorandum: Toxicology re-evaluation of additional data submitted by the 2,4-D TF II in response to issues raised by the PMRA during the 2,4-D turf assessment (PACR2005-01). Communication interne.
Santé Canada (2006). Note de réévaluation. REV2006-11. Utilisations de l'acide (2,4-dichlorophénoxy)acétique (2,4-D) comme herbicide sur les pelouses et le gazon en plaques - Mesures provisoires. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Ontario), 85 p. Peut être consultée au lien suivant : http://publications.gc.ca/collections/Collection/H113-5-2006-11F.pdf
Santé Canada (2007). Projet d'acceptabilité d'homologation continue : Réévaluation des utilisations de l'acide (2,4-dichlorophénoxy) acétique (2,4-D) comme herbicide sur les sites agricoles, forestiers, aquatiques et industriels. PACR2007-06. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Ontario).
Santé Canada (2008). Décision de réévaluation. RVD2008-11. Acide (2,4-dichlorophénoxy) acétique [2,4-D]. Agence de réglementation de la lutte antiparasitaire (ARLA); Santé Canada, Ottawa (Ontario). Peut être consultée au lien suivant : https://publications.gc.ca/collections/collection_2008/hc-sc/H113-28-2008-11F.pdf
Santé Canada (2013). Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 2 (2009 à 2011). 978-0-660-20754-4. Peut être consulté au lien suivant : http://publications.gc.ca/site/fra/9.881577/publication.htmlSanté Canada (2016). Note de réévaluation REV2016-08, Examen spécial du 2,4-D : Projet de décision aux fins de consultation. ARLA Santé Canada, Ottawa (Ontario). ISSN : 1925-0665. Numéro de catalogue : H113-5/2016-8F-PDF. Peut être consultée au lien suivant : https://www.canada.ca/fr/sante-canada/services/securite-produits-consommation/pesticides-lutte-antiparasitaire/public/consultations/notes-reevaluation/2016/examen-special-2-4-d/document.html
Santé Canada (2018a). Base de données pour les limites maximales de résidus pour pesticides : 2,4-D. Santé Canada, Sécurité des produits de consommation, Pesticides et lutte antiparasitaire. Peut être consulté au lien suivant : http://pr-rp.hc-sc.gc.ca/mrl-lrm/index-fra.php.
Santé Canada (2018b). Communication personnelle de la Direction de l'évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Santé Canada (2018c). Communication personnelle de la Direction de l'évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Santé Canada (2019). Communication personnelle de la Direction de l'évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Santé Canada (2020). Rapport sur les ventes de produits antiparasitaires en 2018. ARLA, Santé Canada, Ottawa (Ontario).
Santé Canada (2021). Facteurs d'exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Fiche de renseignements. Santé Canada, Ottawa (Ontario). À consulter au lien suivant : https://www.canada.ca/fr/sante-canada/services/substances-chimiques/fiches-renseignements/facteurs-exposition-evaluations-risques-sante-humaine-canada.html
Saskatchewan Water Security Agency (2021). Communication personnelle avec A. Thirunavukkarasu. Sauerhoff, M.W., Braun, W.H., Blau, G.E. et Gehring, P.J. (1977). The fate of 2,4-dichlorophenoxyacetic acid (2,4-D) following oral administration to man. Toxicology, 8(1): 3-11.
Schinasi, L. et Leon, M.E. (2014). Non-Hodgkin lymphoma and occupational exposure to agricultural pesticide chemical groups and active ingredients: A systematic review and meta-analysis. Int. J. Environ. Res. Public Health, 11(4): 4449-4527.
Schultze, G.E. (1991a) Subchronic toxicity study in mice with 2,4-D acid. Unpublished report No. 2184-117 from Hazleton Laboratories America, Inc., Vienna, VA, États-Unis. Présenté à l'OMS par Industry Task Force II on 2,4-D Research Data, Indianapolis, Indiana, États-Unis, cité dans : JMPR, 1996.
Schultze, G.E. (1991b). Subchronic toxicity study in rats with 2,4-D acid. Unpublished report No. 2184-116 from Hazleton Laboratories America, Inc., Vienna, VA, États-Unis. Présenté à l'OMS par l'Industry Task Force II on 2,4-D Research Data, Indianapolis, Indiana, États-Unis, cité dans : JMPR, 1996.
Semchuk, K.M., Love, E.J. et Lee, R.G. (1992). Parkinson's disease and exposure to agriculture work and pesticide chemicals. Neurology, 42(7): 1328-1335.
Serota, D.G. (1986). Combined chronic toxicity and oncogenicity study in rats with 2,4-D acid. Unpublished report. 2049. Hazleton Laboratories America, Vienna, VA, États-Unis, cité dans Munro et coll., 1992.
Serota, D., Burns, C., Burdock, G. et coll. (1983a). Subchronic toxicity study in rats-2,4-dichlorophenoxyacetic acid (2,4-D). Étude non publiée. Préparée par Hazleton Laboratories America, Inc., no de projet 2184-102, cité dans JMPR, 1996.
Serota, D., Colpean, B. et Burdock, G.E.A. (1983b). Subchronic toxicity study in mice: 2,4-dichlorophenoxyacetic acid (2,4-D). Étude non publiée. Préparée par Hazleton Laboratories America, Inc., no de projet 2184-100, cité dans JMPR, 1996.
Smeets, P.W.M.H., Medema, G.J., and van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drinking Water Engineering and Science, 2: 1-14.
Smith, F.A., Nolan, R.J., Hermann, E.A. et Ramsey, J.C. (1990). Pharmacokinetics of 2,4-dichlorophenoxyacetic acid (2,4-D) in Fischer 344 rats. Rapport non publié no 0697 de la Dow Chemical Company, présenté à l'OMS par l'Industry Task Force II on 2,4-D. Research Data, Indiana, Michigan, États-Unis, cité dans JMPR, 1996.
Sørensen, S.R., Schultz, A., Jacobsen, O.S. et Aamand, J. (2006). Sorption, desorption and mineralization of the herbicides glyphosate and MCPA in samples from two Danish soil and subsurface profiles. Environ. Pollut., 141(1):184-194.
Storck, F.R., Schmidt, C.K., Lange, F.T., Henson, J.W. et Hahn, K. (2010). Removal and fate of ECDs and PPCPs in bank filtration systems. ISBN - 978-1-60573-081-3. Water Research Foundation, Denver, Colorado et DVGW- Technologiezentrum Wasser, Karlsruhe, Allemagne.
Storck, F.R., Schmidt, C.K., Lange, F.T., Henson, J.W. et Hahn, K. (2012). Factors controlling micropollutant removal during riverbank filtration. J. Am. Water Works Assoc., 104(12): E643-E652.
Struger, J. et Fletcher, T. (2007). Occurrence of lawn care and agricultural pesticides in the Don River and Humber River watersheds (1998-2002). J. Great Lakes Res., 33(4): 887-905.
Struger, J., L'Italien, S. et Sverko, E. (2004). In-use pesticide concentrations in surface waters of the Laurentian Great Lakes, 1994-2000. J. Great Lakes Res., 30(3): 435-450.
Sturtz, Nelson, De Duffard, A.M.E., et Duffard, R. (2000). Detection of 2,4-dichlorophenoxy acetic acid (2,4-D) residues in neonates breast-fed by 2,4-D exposed dams. Neurotoxicology, 21:147-154.Summers, R.S., Knappe, D.R.U. et Snoeyink, V.L. (2010). Adsorption of organic compounds by activated carbon. Chapter 14 in: Water quality and treatment: A handbook on drinking water. 6e édition. Edzwald, J.K. (ed.). McGraw-Hill, New York, New York.
Symons, J.M., Bradley Jr., L.C. et Cleveland, T.C. (2000). The drinking water dictionary. American Water Works Association, Denver, Colorado.
Szabo, J.C. and Rachunek, B.L. (1991). 2,4-D butoxyethyl ester: A 13-week dietary toxicity study in Fischer 344 rats. Unpublished report No. K-007722-015. Dow Chemical Company, Midland, MI, USA, as cited in JMPR, 1996.
Tan, Z., Zhou, J., Chen, H., Zou, Q., Weng, S., Luo, T. et Tang, Y. (2016). Toxic effects of 2,4-dichlorophenoxyacetic acid on human sperm function in vitro. J. Toxicol. Sci., 41(4): 543-549.
Tanner, C.M., Webster Ross, G., Jewell, S.A., Hauser, R.A., Jankovic, J., Factor, S.A., Bressman, S., Deligtisch, A., Marras, C., Lyons, K.E., Bhudhikanok, G.S., Roucoux, D.F., Meng, C., Abbott, R.D. et Langston, J.W. (2009). Occupation and risk of parkinsonism: A multicenter case-control study. Arch. Neurol., 66(9): 1106-1113.
Tayeb, W., Nakbi, A., Trabelsi, M., Miled, A. et Hammami, M. (2012). Biochemical and histological evaluation of kidney damage after sub-acute exposure to 2,4-dichlorophenoxyacetic herbicide in rats: involvement of oxidative stress. Toxicol. Mech. Methods, 22(9): 696-704.
Tayeb, W., Nakbi, A., Cheraief, I., Miled, A. et Hammami, M. (2013). Alteration of lipid status and lipid metabolism, induction of oxidative stress and lipid peroxidation by 2,4-dichlorophenoxyacetic herbicide in rat liver. Toxicol. Mechan. Methods, 23(6): 449-458.
Timchalk, C. (2004). Comparative inter-species pharmacokinetics of phenoxyacetic acid herbicides and related organic acids: Evidence that the dog is not a relevant species for evaluation of human health risk. Toxicology, 200(1): 1-19.
Timchalk, C., Dryzga, M. et Brzak, K.A. (1990). 2,4-Dichlorophenoxy-acetic, tissue distribution and metabolism of (carbon 14)-labeled 2,4-dichlorophenoxyacetic acid in Fischer 344 rats: Final report: Lab project number: K-2372-47. Étude non publiée préparée par Dow Chemical Company, Michigan, États-Unis, cité dans U.S. EPA, 2005.
Troudi, A., Ben Amara, I., Samet, A.M. et Zeghal, N. (2012). Oxidative stress induced by 2,4-phenoxyacetic acid in liver of female rats and their progeny: Biochemical and histopathological studies. Environ. Toxicol., 27(3): 137-145.
Tuduri, L., Harner, T., Blanchard, P., Li, Y., Poissant, L., Waite, D.T., Murphy, C. et Belzer, W. (2006). A review of currently used pesticides (CUPs) in Canadian air and precipitation. Part 2: Regional information and perspectives. Atmos. Environ., 40(9): 1579-1589.
Union européenne (1998). Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine.
U.S. EPA (1991). National primary drinking water regulations-Synthetic organic chemicals and inorganic chemicals; monitoring for unregulated contaminants; national primary drinking water regulations implementations; national secondary drinking water regulations; Final rule. Fed. Reg., 56(20): 3526-3559.
U.S. EPA (1992). Determination of chlorinated acids in water by high performance liquid chromatography with a photodiode array ultraviolet detector revision 1.0. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/600/R-92-129).
U.S. EPA (1995a). Determination of chlorinated acids in water by gas chromatography with an electron capture detector revision 4.1. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/600/4-88-039).
U.S. EPA (1995b). Determination of chlorinated acids in water using liquid-solid extraction and gas chromatography with an electron capture detector revision 1.1. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/600/R-95-131).
U.S. EPA (1996). Determination of chlorinated acids in water by liquid-liquid extraction, derivation and gas chromatography with electron capture detector revision 1.0. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-R-00-014).
U.S. EPA (2000). Determination of chlorinated acids in drinking water by liquid-liquid microextraction, derivation and fast gas chromatography with electron capture detector revision 1.0. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/815/B-00-001).
U.S. EPA (2005). Registration eligibility decision for 2,4-D. List A. Case 0073. EPA 738-R-05-002. Available at: https://www3.epa.gov/pesticides/chem_search/reg_actions/reregistration/red_PC-030001_1-Jun-05.pdf.
U.S. EPA (2007). 2,4-D, 2,4-DP, and 2,4-DB; Decision not to initiate special review. Fed. Reg., 72(152): 44510-44511.
U.S. EPA (2009a). Analytical feasibility support document for the second six-year review of existing National Primary Drinking Water Regulations. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-003).
U.S. EPA (2009b). Water treatment technology feasibility support document for chemical contaminants for the second six-year review of National Primary Drinking Water Regulations. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-007).
U.S. EPA (2010). National primary drinking water regulations; Announcement of the results of EPA's review of existing drinking water standards and request for public comments and/or information on related issues. Fed. Reg., 75(59):15500-15503.
U.S. EPA (2016). Analytical methods approved for drinking water compliance monitoring of organic contaminants. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-14-003).
University of Hertfordshire (2018). PPDB: Pesticide Properties Database. 2,4-D (Ref: L 208). Hertfordshire, Royaume-Uni.
van der Aa, L.T.J., Kolpa, R.J., Rietveld, L.C. et van Dijk, J.C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153-163.
van Ravenzwaay, B., Hardwick, T.D., Needham, D., Pethen, S. et Lappin, G.J. (2003). Comparative metabolism of 2,4-dichlorophenoxyacetic acid (2,4-D) in rat and dog. Xenobiotica, 33(8): 805-821.
Verstraeten, I.M., et Heberer, T. (2002). Organic chemical removal issues. Chapter 17 in: Riverbank filtration: Improving source-water quality. Ray, C., Melin, G. et Linsky, R.B. (eds.). Springer, Kluwer Academic Publishers. Pays-Bas. p. 321-330.
Wafa, T., Amel, N., Issam, C., Imed, C., Abdelhedi, M. et Mohamed, H. (2011). Subacute effects of 2,4-dichlorophenoxyacetic herbicide on antioxidant defense system and lipid peroxidation in rat erythrocytes. Pestic. Biochem. Physiol., 99(3): 256-64.
Wester, R.C., Melendres, J., Sedik, L., Maibach, H. et Riviere, J.E. (1998). Percutaneous absorption of salicylic acid, theophylline, 2, 4-dimethylamine, diethyl hexyl phthalic acid, and p-aminobenzoic acid in the isolated perfused porcine skin flap compared to man in vivo. Toxicol. Appl. Pharmacol., 151: 159-165.
Westerhoff, P., Yoon, Y., Snyder, S. et Wert, E. (2005). Fate of endocrine-disruptor, pharmaceutical, and personal care product chemicals during simulated drinking water treatment processes. Environ. Sci. Technol., 39(17): 6649-6663.
Wiklund, K., Holm, L.E. et Dich, J. (1987). Soft tissue sarcoma risk among agricultural and forestry workers in Sweden. Chemosphere, 16(8-9): 2107-2110.
Wols, B.A. et Hofman-Caris, C.H.M. (2012). Review of photochemical reaction constants of organic micropollutants required for UV advanced oxidation processes in water. Water Res., 46: 2815-2827.
Woodruff, R.C., Phillips, J.P. et Irwin, D. (1983). Pesticide-induced complete and partial chromosome loss in screens with repair-defective females of Drosophila melanogaster. Environ. Mutagen., 5(6): 835-846.
Woudneh, M.B., Lloyd, B.J. et Stevenson, D. (1996). Removal of herbicides by biological filters. In: Advances in slow sand/alternative biofiltration. Graham, N. et Collins, M.R. (eds.).John Wiley & Sons. Chichester, United Kingdom. pp. 211-221.
Woudneh, M.B., Lloyd, B.J. et Stevenson, D. (1997). The behaviour of 2,4-D as it filters through slow sand filters. J. Water Supply Res. Technol. AQUA, 46(3): 144-149.
Xiong, F. et Graham, N.J.D. (1992). Rate constants for herbicide degradation by ozone. Ozone Sci. Eng., 14: 283-301.
Yao, C.C.D. et Haag, W.R. (1991). Rate constants for direct reactions of ozone with several drinking water contaminants. Wat. Res. 25(7): 761-773.
Yao, Y., Harner, T., Blanchard, P., Tuduri, L., Waite, D., Poissant, L., Murphy, C., Belzer, W., Aulagnier, F. et Sverko, E. (2008). Pesticides in the atmosphere across Canadian agricultural regions. Environ. Sci. Technol., 42: 5931-5937.
Zahm, S.H., Weisenburger, D.D., Babbitt, P.A., Saal, R.C., Vaught, J.B., Cantor, K.P. et Blair, A. (1990). A case-control study of non-Hodgkin's lymphoma and the herbicide 2,4-dichlorophenoxyacetic acid (2,4-D) in eastern Nebraska. Epidemiology, 1(5): 349-356.
Zearley, T.L. et Summers, R.S. (2012). Removal of trace organic micropollutants by drinking water biological filters. Environ. Sci. Technol., 46: 9412-9419.
Zearley, T.L. et Summers, R.S. (2015). MIB and 2,4-D removal by biofilters during episodic loading. J. Am. Water Works Assoc., 107(12): E666-E673.
Zimmering, S., Mason, J.M., Valencia, R. et Woodruff, R.C. (1985). Chemical mutagenesis testing in Drosophila. II. Results of 20 coded compounds tested for the National Toxicology Program. Environ. Mutagen., 7(1): 87-100.
Annexe A : Liste d' abréviations
- 2,4-D
- acide 2,4-dichlorophénoxyacétique
- 2,4-DCP
- 2,4-dichlorophénol
- ADN
- acide désoxyribonucléique
- ALP
- phosphatase alcaline
- ALT
- alanine transaminase
- ANSI
- American National Standards Institute
- AQA
- apport quotidien acceptable
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- AST
- aspartate transaminase
- CaCO3
- carbonate de calcium
- CAG
- charbon actif en grains
- CANCUP
- Canadian Atmospheric Network for Currently Used Pesticides
- CAP
- charbon actif en poudre
- CAS
- Chemical Abstracts Service
- CCN
- Conseil national des normes
- CEP
- Comité fédéral-provincial-territorial sur l'eau potable
- CG/DCE
- chromatographie en phase gazeuse avec détecteur à capture d'électrons
- CIRC
- Centre international de recherche sur le cancer
- CMA
- concentration maximale acceptable
- COD
- carbone organique dissous
- COV
- composés organiques volatils
- DEA
- diéthanolamine
- DL50
- dose létale médiane
- DMA
- diméthylamine
- DRO
- dérivés réactifs de l'oxygène
- ECMS
- Enquête canadienne sur les mesures de la santé
- ECS
- essais d'échange de chromatides-sœurs (sister chromatid exchange)
- F1
- progéniture (génération 1)
- GSH
- glutathion
- H2O2
- peroxyde d'hydrogène
- IC
- intervalle de confiance
- IPA
- isopropylamine
- JG
- jour de gestation
- JMPR
- Réunion conjointe FAO/OMS sur les résidus des pesticides
- JPN
- jour post-natal
- LD
- limite de détection
- LDM
- limite de détection de la méthode
- MON
- matière organique naturelle
- NOAEL
- dose sans effet nocif observé (no-observed-adverse-effect level)
- NOEL
- dose sans effet observé (no-observed-effect level)
- NSF
- NSF International
- O3
- ozone
- OCDE
- Organisation de coopération et de développement économique
- OMS
- Organisation mondiale de la santé
- P1
- génération parentale
- POA
- procédés d'oxydation avancée
- RC
- rapport de cotes
- SC
- Santé Canada
- SDM
- seuils de déclaration de la méthode
- T4
- thyroxine
- TCVL
- temps de contact en lit vide
- TIPA
- triisopropanolamine
- U.S. EPA
- United States Environmental Protection Agency
- UDS
- synthèse non programmée de l'AND (unscheduled DNA synthesis)
- UE
- Union européenne
- UV
- ultraviolet
- VBS
- valeur basée sur la santé
- VL
- volumes de lit
Annexe B : Données sur la qualité de l'eau au Canada
| Province ou territoire (année d'échantillon-nage) |
Nombre de détections/ échantillons |
LDM (ng/L) |
Plage (ng/L) |
25e centile (ng/L) |
Moyenne (ng/L) |
Médiane (ng/L) |
75e centile (ng/L) |
|
|---|---|---|---|---|---|---|---|---|
| Min | Max | |||||||
| Eau du robinet | ||||||||
| Alb. Sask., Man. communautés rurales (2004–2005) |
?/28 | n.d. | 10,50 | 589,00 | n.d. | 81,40 | n.d. | n.d. |
| Eau de surface | ||||||||
| C.-B. – Vallée du bas Fraser et bassin de l'Okanagan (2003–2005) |
59/92 | 0,5 | <0,5 | 1 230 | 0,680 | n.d. | 2,720 | 22,95 |
| C.-B. – Vallée du bas Fraser (2003–2005) |
n.d. | n.d. | 0,62 | 1 230 | n.d. | n.d. | n.d. | n.d. |
| C.-B. – bassin de l'Okanagan (2003–2005) |
n.d. | n.d. | 0,59 | 41,8 | n.d. | n.d. | n.d. | n.d. |
| Ont. (2003) | 156/160 | 0,47 | 1,3 | 2 850 | 7,06 | n.d. | 46,50 | 114,50 |
| Ont. (2004) | 184/228 | 0,47 | 0,71 | 8 240 | 1,84 | n.d. | 12,75 | 61,95 |
| Ont. (2005) | 148/183 | 0,47 | 0,92 | 4 220 | 1,59 | n.d. | 10,8 | 76,5 |
| Qc (2003) | 5/51 | 20 | <20 | 120 | n.d. | n.d. | n.d. | n.d. |
| Qc (2004) | 25/70 | 10–20 | <10 | 190 | n.d. | n.d. | n.d. | n.d. |
| Qc (2004)Note de bas de page b | 23/69 | 3–50 | <3 | 130 | n.d. | n.d. | n.d. | n.d. |
| Qc (2005) | 13/59 | 20 | <20 | 340 | n.d. | n.d. | n.d. | n.d. |
| N.-B. (2003–2005) |
0/57 | 100 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Î.-P.-É. (2003–2005) |
0/82 | 100 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| N.-É. (2003–2005) |
0/48 | 100 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Rivières | ||||||||
| Alb. Sask., Man. – 8 sites (2003) |
59/64 | 0,47 | <0,47 | 457 | 18,50 | n.d. | 46,00 | 65,00 |
| Eau de réservoirs | ||||||||
| Alb. Sask., Man. – 15 sites (2003–2004) |
205/206 | 0,47 | <0,47 | 1 850 | 23,85 | n.d. | 66,30 | 129,00 |
| Ruissellement | ||||||||
| C.-B. – Bassin de l'Okanagan (2003–2005) |
n.d. | n.d. | 0,61 | 445 | n.d. | n.d. | n.d. | n.d. |
| Eau souterraine | ||||||||
| C.-B. – Vallée du bas Fraser (2003–2005) |
n.d. | n.d. | n.d. | 5,01 | n.d. | n.d. | n.d. | n.d. |
| C.-B. – Vallée du bas Fraser (2003–2005)Note de bas de page a |
n.d. | n.d. | 0,001 | 4,93 | n.d. | n.d. | n.d. | n.d. |
LDM = limite de détection de la méthode
Remarque : Adapté d'Environnement Canada, 2011 |
||||||||
Note de bas de page
- Note de bas de page 1
-
Les termes ALT et SGPT (transaminase glutamo-pyruvique sérique) renvoient au même paramètre et sont interchangeables.
- Note de bas de page 2
-
Les termes AST et SGOT (transaminase glutamo-oxaloacétate sérique) renvoient au même paramètre et sont interchangeables.