Page 11 : Recommandations pour la qualité de l'eau potable au Canada : document technique – le toluène, l'éthylbenzène et les xylènes
10.0 Classification et évaluation
Les évaluations du toluène, de l'éthylbenzène et des xylènes ont été regroupées dans un seul document, étant donné que la co-exposition à ces trois composés (ainsi qu'au benzène) est susceptible de se produire durant un incident de contamination de l'eau potable. Bien qu'il y ait un certain chevauchement des effets des trois composés sur la santé (p. ex. troubles neurologiques), ils n'ont pas été évalués comme mélange, car les modes d'action intervenant dans les effets les plus importants varient d'un composé à l'autre. On ne sait pas si les modèles PBPK actuels permettent de caractériser adéquatement les interactions découlant de l'exposition orale à des mélanges de toluène, d'éthylbenzène et de xylènes (ainsi que de benzène) (ATSDR, 2004).
Les résultats des simulations générées à l'aide de modèles PBPK et des expositions expérimentales à des mélanges de toluène, d'éthylbenzène et de xylènes (ainsi que de benzène) chez le rat et chez l'humain indiquent que l'exposition par inhalation à des mélanges contenant les trois composés à une concentration d'environ 20 ppm est peu susceptible d'entraîner des concentrations sanguines des trois composés significativement plus élevées que l'exposition à chaque composé individuellement (Tardif et coll., 1997; Haddad et coll., 1999, 2000, 2001). Pour ces raisons, le toluène, l'éthylbenzène et les xylènes ont fait l'objet de modélisations distinctes excluant toute interaction métabolique et trois concentrations maximales acceptables (CMA) distinctes sont établies.
10.1 Toluène
Le toluène est un solvant couramment utilisé dans la fabrication des peintures, des diluants de peinture, des laques et des adhésifs. Il est aussi présent dans l'essence et il est utilisé comme intermédiaire dans les synthèses chimiques. Les effets du toluène sur la santé ont été étudiés chez l'humain dans plusieurs milieux de travail où l'utilisation du toluène était prédominante, notamment dans les industries de l'impression, de la peinture, du caoutchouc et de la chaussure. Les études ont révélé un éventail d'effets neurologiques, dont la perte de la perception des couleurs, de même que des troubles de la mémoire, de la concentration et des fonctions cognitives en général, à la suite d'une exposition à long terme par inhalation au toluène. Les études sur l'exposition orale chez l'animal appuient l'utilisation des effets indésirables neurologiques, qui se manifestent par l'altération du comportement, la modification des taux de neurotransmetteurs et la nécrose cérébrale, à titre de critères d'effets critiques de la toxicité du toluène. Le Centre international de recherche sur le cancer (CIRC, 1999) a déterminé que le toluène ne pouvait être classé quant à sa cancérogénicité pour l'humain (groupe 3). Par conséquent, Santé Canada s'est concentré sur les effets neurologiques pour établir le degré de risque associé à l'exposition au toluène par l'eau potable.
Compte tenu du nombre d'études épidémiologiques publiées et de la possibilité d'utiliser des modèles PBPK humains pour estimer les doses orales, l'évaluation des risques liés au toluène a été fondée sur des données concernant l'humain. On n'a trouvé aucune étude d'exposition orale chronique chez les animaux traitant d'effets neurologiques. Les effets neurologiques ont été définis comme les effets indésirables les plus importants, car ils ont été régulièrement observés chez des personnes exposées au toluène dans le cadre de leur emploi ainsi que chez les animaux de laboratoire exposés par voie orale et par inhalation. Plusieurs études menées en milieu de travail pour lesquelles il existait des données adéquates sur l'exposition avaient pour objet des effets neurologiques chroniques. Ces études concernaient notamment les effets indésirables sur l'ouïe et sur la vue (Nakatsuka et coll., 1992; Abbate et coll., 1993; Vrca et coll., 1995; Zavalic et coll., 1998; Cavalleri et coll., 2000) ainsi que des troubles d'ordre neurocomportemental et neurophysiologique (Foo et coll., 1990; Murata et coll., 1993; Boey et coll., 1997; Eller et coll., 1999; Neubert et coll., 2001; Seeber et coll., 2004, 2005).
Deux études visant la même population de personnes exposées dans 14 presses rotatives se sont démarquées des autres (Seeber et coll., 2004, 2005). Ces études englobaient tous les critères d'effets neurologiques mentionnés ci-dessus, y compris les seuils de perception de la vibration, la différenciation des couleurs, les seuils d'audition, l'attention (substitution de codes, orientation de l'attention et réaction simple), la mémoire (mémoire des chiffres dans l'ordre et à l'envers, reproduction immédiate et différée d'images) et la psychomotricité (stabilité, traçage de lignes, visée, pointage, panneau perforé). Les effets neurologiques ont aussi été évalués en fonction de la durée d'exposition, la durée d'exposition moyenne pondérée au cours de la vie étant de 21 ans et le niveau actuel d'exposition étant de 6 ans en moyenne. Les données à court terme étaient plus pertinentes pour le choix d'un point de départ, car les concentrations de toluène ont été mesurées quatre fois en 5 ans directement dans l'air respiré par les travailleurs tout au long de leur quart; les données à long terme, elles, ont été estimées à l'aide d'une matrice d'exposition professionnelle. En plus d'assurer une surveillance adéquate des expositions, les études menées par Seeber et coll. (2004, 2005) comportaient un échantillon de grande taille, un groupe témoin issu de la même population que le groupe exposé et des ajustements appropriés en fonction de l'âge, du niveau de scolarité et de la consommation d'alcool. Aucun des critères à l'étude ne penchait en faveur d'un effet indésirable à la suite de l'exposition au toluène. Par conséquent, une NOAEL de 26 ppm ou 98 mg/m 3 (moyenne des personnes fortement exposées) a été retenue comme point de départ. Il importe de noter que tous les effets examinés dans les autres études épidémiologiques ont été observés à des concentrations supérieures à 26 ppm. Bien que la véritable NOAEL pour les effets neurologiques puisse être plus élevée que 26 ppm, cette dose était considérée comme le meilleur point de départ à la lumière des études publiées.
Pour établir une dose orale dérivée d'une étude sur l'inhalation, on a appliqué une modélisation PBPK qui a permis d'estimer une concentration sanguine interne de toluène de 0,0075 mg/L à la suite d'une exposition par inhalation. Cette dose interne a ensuite été entrée dans le modèle PBPK pour établir la dose orale externe nécessaire à l'obtention d'une concentration sanguine semblable, en se fondant sur une consommation quotidienne de 1,5 L d'eau potable. La dose externe humaine ingérée dans l'eau potable a été fixée à 0,097 mg/kg p.c. par jour. Comme une exposition à une concentration moyenne pondérée de 45 ppm ou 170 mg/m3 pendant 21 ans n'a influé sur aucun des effets neurologiques évalués par Seeber et coll. (2004, 2005), il n'a pas été jugé nécessaire d'ajouter un facteur d'incertitude pour l'utilisation d'une étude de courte durée. Les études sur le toluène comprenaient également des études chroniques menées chez deux espèces, des études sur la toxicité pour le développement chez deux espèces ainsi qu'une étude sur la toxicité pour la reproduction sur deux générations. Comme le corpus de données était jugé adéquat, aucun autre facteur d'incertitude n'a été ajouté à cet égard. Cependant, on a ajouté un facteur d'incertitude pour prendre en compte la variabilité intraspécifique. À la lumière de ces considérations, l'apport quotidien tolérable (AQT) a été calculé comme suit :
Équation 1
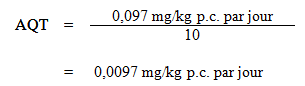
où :
- 0,097 mg/kg p.c. par jour est la dose orale externe nécessaire à l'obtention d'une concentration sanguine équivalente à la NOAEL de 26 ppm (Seeber et coll., 2004, 2005); et
- 10 est le facteur d'incertitude tenant compte de la variabilité intraspécifique.
Équation 1 - Description textuel
L'AQT a été utilisé pour calculer la CMA, comme suit :
Équation 2
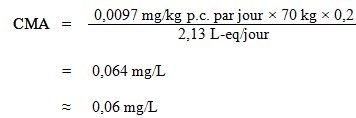
où :
- 0,0097 mg/kg p.c. par jour est l'AQT calculé ci dessus;
- 70 kg est le poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé comme valeur seuil étant donné que l'eau potable n'est pas une source importante d'exposition, et qu'il existe des preuves de sa présence courante dans au moins un autre milieu d'exposition (air, aliments, sol ou produits de consommation) (Krishnan et Carrier, 2013); et
- 2,13 L-eq est le volume quotidien d'eau consommé par un adulte, en tenant compte des diverses voies d'exposition (voir la section 5.6).
Équation 2 - Description textuel
10.2 Ethylbenzene
L'éthylbenzène est principalement utilisé comme un intermédiaire dans la production du styrène, mais il est aussi présent dans l'essence et dans les mélanges de xylènes. Les effets de l'éthylbenzène sur la santé ont été étudiés chez l'animal, et ils sont semblables d'une espèce à l'autre. Cependant, les effets chez l'humain sont relativement inconnus en raison de l'absence de milieux de travail où l'exposition à l'éthylbenzène est prédominante. Les données concernant l'animal ont permis d'établir que le foie et les reins sont les principaux organes ciblés par l'éthylbenzène. L'inhalation et l'ingestion d'éthylbenzène chez le rat et la souris ont mené à l'augmentation du volume du foie et des reins et à l'aggravation des néphropathies. Des études sur l'exposition chronique à l'éthylbenzène par inhalation et par ingestion indiquent que l'exposition peut entraîner la formation de tumeurs à plusieurs endroits. D'un point de vue mécaniste, la cancérogénèse induite par l'éthylbenzène pourrait s'expliquer par l'endommagement et la prolifération excessifs des tissus en l'absence de génotoxicité. Comme la cancérogénicité a été adéquatement démontrée chez les animaux de laboratoire, mais que les données concernant l'humain sont inadéquates, l'éthylbenzène a été classé comme peut-être cancérogène pour l'humain (groupe 2b) par le Centre international de recherche sur le cancer (CIRC, 2000). Santé Canada a pris en compte à la fois le cancer et les effets autres que le cancer pour établir une valeur basée sur la santé (VBS) concernant l'éthylbenzène.
10.2.1 Évaluation du risque de cancer
Des données solides montrent que l'éthylbenzène est cancérogène chez les animaux de laboratoire. L'inhalation d'éthylbenzène exerce un effet cancérogène chez l'animal en favorisant la formation de tumeurs dans les reins (rats mâles et femelles), dans les poumons (souris mâles), dans le foie (souris femelles) et dans les cellules interstitielles (rats mâles). Chez le rat, les cancers du rein découlant de l'exacerbation de la néphropathie progressive chronique, les tumeurs des cellules interstitielles découlant de la perturbation des concentrations sériques de testostérone et les tumeurs du foie découlant d'un mécanisme semblable à l'induction par le phénobarbital sont tous considérés comme non pertinents pour l'humain (voir la section 9.3). Cependant, le rôle potentiel des métabolites oxydatifs dans le mode d'action des tumeurs du poumon induites par l'éthylbenzène porte à croire que ces tumeurs pourraient être pertinentes pour l'humain. Le mode d'action des tumeurs du poumon laisse aussi deviner un seuil sous lequel aucune tumeur ne devrait se former. Santé Canada a donc jugé pertinent d'établir une VBS pour les tumeurs du poumon à l'aide d'une approche fondée sur un apport quotidien tolérable.
L'étude menée par le NTP (1999) a été jugée comme étant l'étude animale qui convenait le mieux pour l'établissement d'une VBS concernant la formation des tumeurs pulmonaires induite par l'exposition à l'éthylbenzène. Un modèle PBPK de souris a été utilisé pour dériver une dose orale pertinente pour l'humain. La concentration sanguine interne cumulative d'éthylbenzène au cours de la vie (en milligrammes de composé mère par litre de sang) obtenue à l'aide du modèle PBPK de souris a été jugée la meilleure mesure de la dose pour la représentation de la concentration d'éthylbenzène dans le poumon. Cette mesure de la dose est fondée sur le mode d'action proposé pour les tumeurs du poumon, selon lequel le métabolisme de l'éthylbenzène survient dans les poumons et produit des métabolites toxiques pouvant provoquer un stress oxydatif et favoriser la formation de tumeurs pulmonaires (voir la section 9.3). Comme l'éthylbenzène produit plusieurs métabolites pouvant induire un stress oxydatif, on a choisi la concentration sanguine du composé mère pour établir l'estimation la plus conservatrice du stress oxydatif dans les poumons. La modélisation PBPK permet d'utiliser une étude sur l'inhalation au lieu d'une étude sur l'ingestion et de prendre en compte les différences sur le plan du métabolisme entre, d'une part, l'animal et l'humain et, d'autre part, les doses élevées et les doses faibles. Bien qu'il soit probable que les autres tumeurs du poumon dans ce modèle expérimental soient dues à l'inhalation, on s'attend à ce que les effets toxiques de l'éthylbenzène touchent tout l'organisme. L'utilisation de concentrations sanguines permet d'établir une estimation plus conservatrice du risque de cancer que la dose interne dans le compartiment des poumons, et elle convient davantage à l'établissement d'une recommandation pour l'eau potable. Les concentrations sanguines ont donc servi à mesurer la dose dans l'évaluation du risque de cancer. Les doses externes associées aux tumeurs du poumon chez la souris dans l'étude menée par le NTP (1999) ont été entrées dans le modèle PBPK de souris pour estimer les concentrations sanguines internes cumulatives d'éthylbenzène au cours de la vie (en mg/L de sang). On a ensuite analysé, à l'aide du modèle log-logistique (modèle optimal) du logiciel BMD de l'U.S. EPA (U.S. EPA, 2010), ces doses internes afin de déterminer le meilleur point de départ pour le modèle humain; le point de départ chez l'animal a été fixé à la limite inférieure de l'intervalle de confiance à 95 % du logiciel BMD correspondant à une augmentation de 10 % du nombre de tumeurs du poumon (BMDL10), soit 1,43 mg d'éthylbenzène par litre de sang. Cette dose interne a ensuite été utilisée dans le modèle PBPK humain pour déterminer la dose externe humaine nécessaire à l'obtention d'une concentration sanguine semblable à celle observée chez la souris, en se fondant sur une consommation quotidienne de 1,5 L d'eau potable pendant 70 ans. La dose orale externe humaine a été établie à 10,17 mg/kg p.c. par jour. Cette dose externe humaine sert à calculer l'AQT pour l'éthylbenzène comme suit :
Équation 3
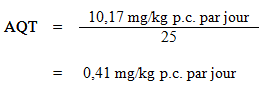
où :
- 10,17 mg/kg p.c. par jour est la BMDL10 pour les tumeurs du poumon observées chez la souris dans le cadre de l'étude menée par le NTP (1999); et
- 25 est le facteur d'incertitude tenant compte de la variabilité intraespèce (10) et interespèces (2,5) (voir ci dessous).
Équation 3 - Description textuel
Le facteur d'incertitude interspécifique comporte deux volets : un volet toxicocinétique (dose administrée) (x4) et un volet toxicodynamique (différence de sensibilité des tissus) (x2,5) (PISSC, 2005). La modélisation PBPK tient compte des différences toxicocinétiques entre l'animal et l'humain; par conséquent, le volet toxicocinétique du facteur d'incertitude interspécifique (x4) a pu être retiré du calcul de l'AQT. Comme la variation toxicodynamique (liée à la sensibilité des tissus) entre l'animal et l'humain est mal connue dans le cas de l'éthylbenzène, le volet toxicodynamique du facteur d'incertitude interspécifique a été retenu pour l'établissement de l'AQT.
L'AQT a été utilisé pour calculer la VBS, comme suit :
Équation 4
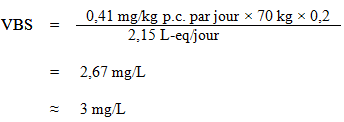
où :
- 0,41 mg/kg p.c. par jour est l'AQT calculé ci dessus;
- 70 kg est le poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé comme valeur seuil étant donné que l'eau potable n'est pas une source importante d'exposition, et qu'il existe des preuves de sa présence courante dans au moins un autre milieu d'exposition (air, aliments, sol ou produits de consommation) (Krishnan et Carrier, 2013); et
- 2,15 L-eq est le volume quotidien d'eau consommé par un adulte, en tenant compte des diverses voies d'exposition (voir la section 5.6).
Équation 4 - Description textuel
10.2.2 Évaluation du risque d'effets autres que le cancer
En raison de l'abondance d'études chez l'animal et de l'absence d'études épidémiologiques, les données concernant l'animal ont été prises en considération dans l'évaluation du risque d'effets autres que le cancer lié à l'éthylbenzène. Des études par voie orale et par inhalation, y compris une étude de deux ans d'expositions à l'éthylbenzène par inhalation, ont démontré que le foie et les reins des rongeurs exposés étaient affectés par le composé, lequel entraînait l'augmentation du poids de ces organes. L'exposition chronique à l'éthylbenzène a causé des lésions dans le foie, les poumons, la thyroïde et l'hypophyse chez la souris ainsi que dans les reins, la prostate, la moelle osseuse et le foie chez le rat. L'éthylbenzène n'est pas considéré comme tératogène, il n'est pas toxique pour la reproduction, il n'est pas sélectivement toxique pour le développement du système nerveux et n'affecte pas le système immunitaire. À la lumière d'une évaluation de toutes les données concernant les effets autres que le cancer chez la souris et le rat, une NOAEL de 75 ppm ou 326 mg/m3 a été dérivée de l'étude menée par le NTP (1999) pour l'hyperplasie de l'hypophyse et l'altération des cellules hépatiques chez la souris. Pour établir une dose orale pertinente pour l'humain, on a estimé les concentrations internes dans le sang et le foie des souris à 0,324 et 0,08 mg/L, respectivement, à l'aide d'une modélisation PBPK. La concentration dans le foie a été retenue pour calculer une VBS, car elle était plus faible que la concentration sanguine associée à la NOAEL. Cette dose interne a ensuite été utilisée dans le modèle PBPK humain pour déterminer la dose externe humaine nécessaire à l'obtention d'une concentration sanguine semblable à celle observée chez le rat, en se fondant sur une consommation quotidienne de 1,5 L d'eau potable. La dose externe humaine ainsi obtenue, qui correspond à une concentration dans le foie de 0,08 mg/L, est de 0,54 mg/kg p.c. par jour. Cette valeur a été utilisée pour calculer l'AQT :
Équation 5
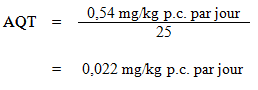
où :
- 0,54 mg/kg p.c. par jour est la dose orale externe humaine nécessaire à l'obtention d'une concentration sanguine équivalente à la NOAEL de 75 ppm fondée sur l'hyperplasie de l'hypophyse et l'altération des cellules hépatiques chez la souris (NTP 1999); et
- 25 est le facteur d'incertitude tenant compte de la variabilité intraspécifique (×10) et interspécifique (×2,5) (voir la section 10.2.1).
Équation 5 - Description textuel
L'AQT a été utilisé pour calculer la VBS, comme suit :
Équation 6
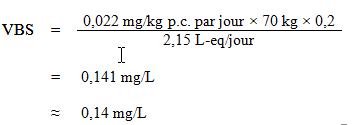
où :
- 0,022 mg/kg p.c. par jour est l'AQT calculé ci dessus;
- 70 kg est le poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé comme valeur seuil étant donné que l'eau potable n'est pas une source importante d'exposition, et qu'il existe des preuves de sa présence courante dans au moins un autre milieu d'exposition (air, aliments, sol ou produits de consommation) (Krishnan et Carrier, 2013); et
- 2,15 L-eq est le volume quotidien d'eau consommé par un adulte, en tenant compte des diverses voies d'exposition (voir la section 5.6).
Équation 6 - Description textuel
10.2.3 Comparaison des évaluations des risques de cancer et d'effets autres que le cancer
Dans la section 10.2.1, en suivant une approche fondée sur un AQT (seuil), on a établi à 3 mg/L la VBS permettant de prévenir les tumeurs du poumon induites par l'éthylbenzène. Dans la section 10.2.2, toujours en suivant une approche fondée sur un AQT, on a établi à 0,14 mg/L la VBS permettant de prévenir l'hyperplasie de l'hypophyse et l'altération des cellules hépatiques. Comme l'évaluation du risque d'effets autres que le cancer a produit une VBS plus conservatrice à l'endroit de l'éthylbenzène, la CMA de 0,14 mg/L est jugée protectrice à la fois contre le cancer et contre les effets autres que le cancer.
10.3 Xylènes
Les xylènes (isomères ortho, méta et para) sont utilisés comme solvants industriels, ainsi que comme intermédiaires de synthèse et solvants dans la fabrication des peintures, des revêtements, des dissolvants d'adhésifs et des diluants de peinture; ils sont aussi naturellement présents dans le pétrole. L'information tirée des études menées chez l'animal et des études épidémiologiques ne permet pas de déterminer si les xylènes sont cancérogènes pour l'humain; le CIRC et l'U.S. EPA considèrent tous deux que les xylènes ne sont pas classifiables quant à leur cancérogénicité pour l'humain. Les principaux effets des xylènes sur la santé touchent le système nerveux central (indépendamment de la voie d'exposition), les voies respiratoires (à la suite d'une exposition par inhalation) et le foie, les reins et le poids corporel (à la suite d'expositions orales élevées). La documentation scientifique indique que les isomères du xylène ont des propriétés toxicocinétiques et des effets toxicologiques semblables et qu'aucun isomère n'avait un effet plus marqué que les autres concernant un paramètre de santé donné. On a donc pris en considération les études portant aussi bien sur des mélanges d'isomères que sur des isomères individuels pour l'évaluation des risques. En raison de l'absence de preuves de formation de tumeurs et du mode d'action non génotoxique des xylènes, la CMA pour les xylènes repose sur des effets autres que le cancer.
Il existe peu d'études pour caractériser le risque associé aux xylènes, et la plupart d'entre elles n'ont pas adéquatement caractérisé la relation dose-réponse ni démontré les effets indésirables découlant d'une exposition. On n'a trouvé aucune étude appropriée de l'exposition par voie orale chez les animaux ou les humains. Les modifications neurocomportementales se sont avérées l'effet le plus courant parmi ceux examinés. Dans une étude en particulier, on a évalué la performance de rats mâles au test de la tige tournante pour faire ressortir les troubles de la coordination motrice (qui sont des signes d'effets indésirables neuromusculaires) après une exposition par inhalation à 50 et 100 ppm (ou 217 et 434 mg/m3) de m-xylène pendant 3 mois (Korsak et coll., 1994). Le test a eu lieu 24 heures après la dernière exposition, ce qui a permis aux animaux d'éliminer entièrement le m -xylène de leur organisme. Cette étude a été retenue comme la plus appropriée, étant donné qu'il s'agissait d'une étude chez l'animal rigoureusement contrôlée portant sur plusieurs doses, sans co-exposition à d'autres produits chimiques. L'établissement de la dose minimale avec effet nocif observé (LOAEL) à 100 ppm était également appuyé par une étude de 6 mois chez le rat ayant montré une diminution de la performance au test de la tige tournante à la même concentration (Korsak et coll., 1992). L'étude menée par Korsak et coll. (1992) n'a pas été prise en considération dans l'établissement du point de départ, car elle concernait une seule dose.
Comme le système nerveux central est la principale cible des xylènes dans plusieurs contextes d'exposition, l'exposition par inhalation a été jugée la mieux indiquée pour le calcul d'une CMA. L'augmentation des échecs au test de la tige tournante a montré une relation dose-réponse claire chez les animaux à l'étude. L'information considérée comme nécessaire pour une analyse par le logiciel BMD n'était pas disponible. Cependant, des effets significatifs clairs ont été observés à la concentration de 100 ppm. Par conséquent, le point de départ a été fixé à 50 ppm.
Pour établir une dose orale pertinente pour l'humain, on a estimé, à l'aide d'une modélisation PBPK, la concentration interne dans le sang à 0,1380 mg/L chez les rats exposés pendant 3 mois à 50 ppm. Cette dose interne a ensuite été utilisée dans le modèle PBPK humain pour déterminer les doses externes humaines nécessaires à l'obtention de concentrations sanguines semblables à celles observées chez le rat, en se fondant sur une consommation quotidienne de 1,5 L d'eau potable. Les doses externes humaines ainsi obtenues, qui correspondent à des concentrations de m-xylène dans le sang de 0,14 et 0,40 mg/L, sont de 1,00 et 2,91 mg/kg p.c. par jour, respectivement.
Les facteurs d'incertitude pris en compte dans le calcul de l'AQT comprennent la variabilité interspécifique et la variabilité intraspécifique, de même que l'utilisation d'une étude subchronique plutôt que chronique. Comme les effets observés au test de la tige tournante dans cette étude étaient uniformes 6 mois après l'exposition, le facteur d'incertitude lié à l'utilisation d'une étude subchronique a été réduit. L'AQT a été calculé comme suit :
Équation 7
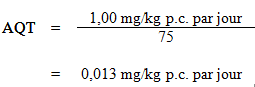
où :
- 1,00 mg/kg p.c. par jour est la dose orale externe humaine nécessaire à l'obtention d'une concentration sanguine équivalente à la NOAEL de 50 ppm chez le rat; et
- 75 est le facteur d'incertitude tenant compte de la variabilité intraspécifique (x10), de la variabilité interspécifique (x2,5) (voir la section 10.2.1) et de l'utilisation d'une étude subchronique plutôt que chronique (3).
Équation 7 - Description textuel
L'AQT a été utilisé pour calculer la CMA, comme suit :
Équation 8
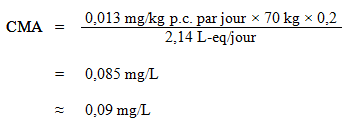
où :
- 0,013 mg/ kg p.c. par jour est l'AQT calculé ci dessus;
- 70 kg est le poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé comme valeur seuil étant donné que l'eau potable n'est pas une source importante d'exposition, et qu'il existe des preuves de sa présence courante dans au moins un autre milieu d'exposition (air, aliments, sol ou produits de consommation) (Krishnan et Carrier, 2013); et
- 2,14 L-eq est le volume quotidien d'eau consommé par un adulte, en tenant compte des diverses voies d'exposition (voir la section 5.6).
Équation 8 - Description textuel
10.4 Considérations internationales
La présente section décrit les diverses recommandations et normes sur l'eau potable adoptées par d'autres organisations internationales. La variation des limites peut s'expliquer simplement par l'année de l'évaluation ou par les différences entre les politiques et les approches, notamment le choix de l'étude clé ou l'utilisation de taux de consommation, de poids corporels et de facteurs d'attribution différents.
10.4.1 Toluène
L'U.S. EPA a établi à 1,0 mg/L (1 000 µg/L) le maximum contaminant level (MCL) pour le toluène dans l'eau potable en se fondant sur une NOAEL de 312 mg/kg p.c. par jour (ajustée à 223 mg/kg p.c. par jour calculée par son système IRIS (Integrated Risk Information System) (U.S. EPA, 2005a, 2005b) pour l'augmentation du volume des reins observée dans une étude par gavage de rats pendant 13 semaines (NTP, 1990) et en appliquant un facteur d'incertitude de 3 000 (100 pour les variations interspécifique et intraspécifique, 10 pour l'utilisation d'une étude de courte durée et 3 pour les lacunes du corpus de données et les données contradictoires concernant l'immunotoxicité). Un facteur d'attribution de 20 % a été utilisé pour l'eau potable dans le calcul de la valeur directrice finale.
L'OMS (2004) a établie une directive de qualité pour l'eau de boisson de 0,7 mg/L (700 µg/L) pour le toluène. Cette directive est fondée sur une LOAEL de 312 mg/kg p.c. par jour pour les effets hépatotoxiques marginaux observés dans une étude par gavage de souris pendant 13 semaines (NTP, 1990), après ajustement en fonction d'une fréquence d'exposition de 5 jours par semaine et application d'un facteur d'incertitude de 1 000 (100 pour la variabilité interspécifique et intraspécifique et 10 pour l'utilisation d'une étude de courte durée et d'une LOAEL au lieu d'une NOAEL). Un facteur d'attribution de 10 % a été utilisé pour l'eau potable dans le calcul de la directive finale.
Le California EPA (OEHHA, 1999) a établi un objectif de santé publique non obligatoire de 0,15 mg/L (150 µg/L) pour le toluène dans l'eau potable en se fondant sur une étude subchronique (Hsieh et coll., 1989) dans laquelle des souris ont été exposées au toluène par leur eau potable. Des augmentations significatives du volume du foie (hépatomégalie) et des diminutions significatives du volume du thymus ont été notées à la dose de 105 mg/kg p.c. par jour, mais non à la dose de 22 mg/kg p.c. par jour. Cette étude a mené à l'établissement d'une NOAEL de 22 mg/kg p.c. par jour. Étant donné la volatilité du toluène, on a estimé l'apport relatif des diverses sources à 40 % et la consommation d'eau potable par un adulte à 4 L par jour. Un facteur de 1 000 (10 pour la variation interspécifique, 10 pour la variabilité humaine et 10 pour l'utilisation d'une étude subchronique dans l'établissement d'une valeur applicable à la vie entière) a été utilisé pour tenir compte de l'incertitude dans le calcul de cet objectif.
10.4.2 Éthylbenzène
L'U.S. EPA a établi un MCL de 0,7 mg/L (700 µg/L) pour l'éthylbenzène dans l'eau potable en se fondant sur une NOAEL de 136 mg/kg p.c. par jour pour les modifications histopathologiques dans le foie et les reins notée dans le cadre d'une étude limitée de 6 mois chez le rat (Wolf et coll., 1956), après ajustement en fonction d'une fréquence d'exposition de 5 jours par semaine et application d'un facteur d'incertitude de 1 000 (100 pour la variabilité interspécifique et intraspécifique et 10 pour l'utilisation d'une étude de courte durée). Un facteur d'attribution de 20 % a été utilisé pour l'eau potable dans le calcul de la directive finale.
L'OMS (2003a) a établie une directive de qualité pour l'eau de boisson de 0,3 mg/L (300 µg/L)pour l'éthylbenzène. Cette directive est fondée sur une NOAEL de 136 mg/kg p.c. par jour pour l'hépatotoxicité et la néphrotoxicité observées dans une étude limitée de 6 mois chez le rat (Wolf et coll., 1956), après ajustement en fonction d'une fréquence d'exposition de 5 jours par semaine et application d'un facteur d'incertitude de 1 000 (100 pour la variabilité interspécifique et intraspécifique et 10 pour les lacunes du corpus de données et l'utilisation d'une étude de courte durée). Un facteur d'attribution de 10 % a été utilisé pour l'eau potable dans le calcul de la directive finale.
Le California EPA (OEHHA, 1997a) a établi un objectif de santé publique non obligatoire de 0,3 mg/L (300 µg/L) pour l'éthylbenzène dans l'eau potable en se fondant sur les effets non cancérogènes observés chez les animaux de laboratoire. L'étude menée par le NTP (1999) a fait ressortir des signes d'hépatotoxicité chez des souris exposées à 250 ppm d'éthylbenzène dans l'air pendant 2 ans. La NOAEL pour le foie a été estimée à 75 ppm dans le cas de l'étude menée par le NTP (1999), soit l'équivalent d'une dose quotidienne de 49 mg/kg p.c. Pour le calcul de cet objectif, on a utilisé un facteur d'incertitude de 1 000 incorporant l'incertitude dans l'extrapolation interspécifique, les sous-populations humaines potentiellement sensibles et le risque d'effet grave (cancer).
10.4.3 Xylènes
L'U.S. EPA (1987) a établi un MCL de 10,0 mg/L pour les xylènes totaux dans l'eau potable en se fondant sur une NOAEL de 250 mg/kg par jour pour la diminution du poids corporel et de la survie des rats mâles notée dans une étude par gavage pendant 2 ans (NTP, 1986). La NOAEL a été ajustée en fonction d'une fréquence d'exposition de 5 jours par semaine à une dose de 179 mg/kg p.c. par jour, et un facteur d'incertitude de 100 (pour la variabilité intraspécifique et interspécifique) a été appliqué pour établir une DR orale de 2 mg/kg p.c. par jour. L'apport relatif des diverses sources a été établi à 20 % pour le calcul de la CMC finale.
L'OMS (2003a) a établie une directive de qualité pour l'eau de boisson de 0,5 mg/L (500 µg/L), pour les xylènes. Cette directive est fondée sur une NOAEL de 250 mg/kg p.c. par jour pour la diminution du poids corporel dans une étude par gavage de rats pendant 103 semaines (NTP, 1986), après ajustement en fonction d'une fréquence d'exposition de 5 jours par semaine et application d'un facteur d'incertitude de 1 000 (100 pour la variabilité interspécifique et intraspécifique et 10 pour les critères d'effets toxicologiques limités). Un facteur d'attribution de 10 % a été utilisé pour l'eau potable dans le calcul de la directive finale.
Le California EPA (OEHHA, 1997b) a établi un objectif de santé publique non obligatoire de 1,8 mg/L à l'égard des isomères du xylène considérés individuellement et collectivement dans l'eau potable en se fondant sur les effets neurotoxiques de l'exposition chronique aux xylènes ayant été notés chez l'humain par Uchida et coll. (1993). La LOAEL de 7,5 mg/kg p.c. par jour tirée de cette étude a été divisée par un facteur de 30 (3 pour l'extrapolation d'une LOAEL à une NOAEL et 10 pour la différence de sensibilité d'une personne à l'autre), puis divisée de nouveau par 2 afin de tenir compte de l'exposition supplémentaire par inhalation liée aux systèmes d'approvisionnement en eau domestique, et ajustée en fonction d'un apport relatif des diverses sources d'eau potable de 40 %.