Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada - Les cyanobactéries et leurs toxines

Télécharger le format de rechange
(Format PDF, 1.17 Mo, 78 pages)
Organisation : Santé Canada
Type : Recommandations
Publiée : Février 2022
Avant-propos
Les Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada sont composées de plusieurs documents techniques qui tiennent compte des divers facteurs susceptibles de nuire à la salubrité des eaux utilisées à des fins récréatives du point de vue de la santé humaine. Il s'agit notamment de documents techniques sur la compréhension et la gestion des eaux récréatives, les organismes indicateurs de contamination fécale, les méthodes microbiologiques de surveillance de la contamination fécale, les cyanobactéries et leurs toxines, les caractéristiques physiques, esthétiques et chimiques, ainsi que les agents pathogènes microbiologiques et les autres dangers biologiques. Ces documents fournissent des valeurs indicatives pour des paramètres précis utilisés pour surveiller les dangers liés à la qualité de l'eau, et ils recommandent des stratégies de surveillance et de gestion des risques.
Par eaux utilisées à des fins récréatives, on entend les plans d'eaux douces, marines ou estuariennes naturelles utilisés à de telles fins. Cela comprend donc les lacs, les rivières et les ouvrages (p. ex., les carrières, les lacs artificiels) qui sont remplis d'eaux naturelles non traitées. Les divers ordres de gouvernement peuvent choisir d'appliquer ces recommandations à d'autres eaux naturelles qui font l'objet d'un traitement limité (p. ex., application à court terme d'un désinfectant pour une manifestation sportive), bien que l'application des recommandations dans ces scénarios doive se faire avec prudence, car la désinfection élimine plus facilement les organismes indicateurs que d'autres microorganismes pathogènes (comme les protozoaires pathogènes).
Les activités récréatives qui pourraient présenter un risque pour la santé humaine à la suite d'une immersion ou d'une ingestion intentionnelle ou accidentelle comprennent les activités entraînant un contact primaire (p. ex., la natation, la baignade, le pataugeage, la planche à voile et le ski nautique) et les activités entraînant un contact secondaire (p. ex., le canot, la navigation de plaisance ou la pêche).
Chaque document technique s'appuie sur des recherches scientifiques en cours et publiées concernant les effets sur la santé, les effets esthétiques et les considérations relatives à la gestion des plages. La qualité des eaux utilisées à des fins récréatives relève généralement de la compétence des provinces et des territoires et, par conséquent, les politiques et les approches, ainsi que les décisions de gestion, peuvent varier d'un gouvernement à l'autre. Les documents techniques sont destinés à guider les décisions des autorités provinciales et locales responsables de la gestion des eaux utilisées à des fins récréatives.
Ce document renferme des renseignements sur les cyanobactéries et leurs toxines. Pour une liste complète des documents techniques disponibles, veuillez consulter le document de synthèse des Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada sur le site Web de Santé Canada. Pour les questions reliées à l'eau potable, veuillez consulter les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
Gestion des cyanobactéries et de leurs toxines dans les eaux utilisées à des fins récréatives
Le présent document décrit les valeurs recommandées et certaines stratégies pour la gestion des risques sanitaires liés à l'exposition aux cyanobactéries (également appelées algues bleues) et à leurs toxines. La plupart des études scientifiques sur les toxines de cyanobactéries portent essentiellement sur les microcystines, car celles-ci sont considérées comme étant les cyanotoxines d'eau douce les plus importantes. Pour d'autres cyanotoxines, notamment l'anatoxine-a, la saxitoxine et la cylindrospermopsine, on dispose de renseignements plus limités.
La meilleure stratégie pour assurer la protection de la santé publique consiste en une approche de gestion des risques axée sur la détermination et la maîtrise des dangers liés à la qualité de l'eau et des risques connexes avant que l'utilisateur n'entre en contact avec les eaux récréatives. De plus amples renseignements sur la gestion des risques associés aux eaux utilisées à des fins récréatives sont disponibles dans le document technique Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada – Comprendre et gérer les risques dans les eaux récréatives (Santé Canada, en préparation).
Table des matières
- 1.0 Valeurs recommandées
- 2.0 Application des recommandations
- 3.0 Description et effets sur la santé
- 4.0 Voies d'exposition
- 5.0 Présence dans l'environnement
- 6.0 Indicateurs de cyanobactéries et de toxines cyanobactériennes
- 7.0 Méthodes d'analyse
- 8.0 Justification
- 9.0 Références
- Annexe A : Liste des acronymes
- Annexe B : Organigramme de surveillance des cyanobactéries planctoniques et de leurs toxines
1.0 Valeurs recommandées
Les valeurs recommandées pour les cyanobactéries et leurs toxines sont divisées en 1) mesures directes (recommandation pour les cyanotoxines) et 2) indicateurs de la présence potentielle de cyanotoxines (nombre total de cellules de cyanobactéries, biovolume total de cyanobactéries et chlorophylle a). Le présent document renferme différentes valeurs recommandées et offre ainsi une approche souple pour connaître la toxicité potentielle des efflorescences (aussi appelées « fleurs d'eau »). Ces valeurs recommandées ne constituent qu'un volet d'une approche préventive de gestion des risques liés aux cyanobactéries et à leurs toxines. Des conseils sur la façon d'appliquer les différentes recommandations relatives aux cyanobactéries, dans le cadre d'un plan de gestion de la qualité des eaux utilisées à des fins récréatives, figurent à la section 2.0.
1.1 Cyanotoxines
La concentration maximale de microcystines recommandée dans les eaux utilisées pour les activités récréatives de contact primaire est de 10 µg/L.
Concentration maximale de microcystines recommandée : 10 µg/L
La mesure des microcystines doit correspondre aux microcystines totales. Cela comprend les microcystines qui sont à la fois dissoutes dans l'eau (extracellulaires) et les microcystines liées à l'intérieur des cyanobactéries (intracellulaires). En outre, bien que la recommandation soit basée sur l'évaluation de la toxicité de la microcystine-LR (MC-LR), toutes les variantes mesurables des microcystines, et pas seulement la MC-LR, devraient faire l'objet de l'analyse.
Les recommandations présentées ici sur les cyanotoxines portent seulement sur les microcystines totales. La plupart des études scientifiques sur les toxines de cyanobactéries se concentrent sur les microcystines, car celles-ci sont répandues et stables dans l'environnement, et elles peuvent atteindre des concentrations élevées en cas d'efflorescence. Le présent document ne renferme pas de recommandations pour les autres cyanotoxines, notamment l'anatoxine-a, la saxitoxine et la cylindrospermopsine, car les données relatives à la santé ou à l'exposition sont limitées en ce qui concerne les autres toxines.
1.2 Indicateurs de la présence potentielle de cyanotoxines
Les indicateurs de la présence potentielle de cyanotoxines sont basés sur les mesures de la biomasse des cyanobactéries planctoniques. Ils sont dérivés de la recommandation relative aux microcystines et reposent sur la teneur en microcystines de Microcystis. Les indicateurs sont le nombre total de cellules de cyanobactéries, le biovolume total de cyanobactéries et la chlorophylle atotale. Les valeurs recommandées dans les eaux utilisées pour les activités récréatives de contact primaire sont les suivantes :
Nombre total de cellules de cyanobactéries : 50 000 cellules/mL
Biovolume total de cyanobactéries : 4,5 mm3/L
Chlorophylle a totale : 33 µg/L
* Ces mesures peuvent être utilisées seules ou en combinaison avec la recommandation relative aux microcystines totales. Le choix de la mesure utilisée peut varier selon la zone récréative et sera la décision de l'autorité responsable. Voir la section 2.0.
Ces recommandations peuvent servir à établir qu'une efflorescence planctonique est présente et que les cyanotoxines, si elles sont présentes, pourraient dépasser la valeur recommandée pour les microcystines totales. L'utilisation de ces indicateurs est décrite à la section 2.0. Les valeurs recommandées pour les indicateurs d'efflorescence de cyanobactéries benthiques n'ont pas encore été élaborées. De plus amples renseignements sur les populations benthiques figurent à la section 2.0.
2.0 Application des recommandations
Les recommandations de la présente section visent à donner de la souplesse aux autorités responsables en vue de l'élaboration d'approches appropriées pour la gestion des cyanobactéries sur leur territoire. L'objectif consiste à protéger la santé publique tout en évitant les fermetures inutiles des zones récréatives. L'évaluation des risques et les décisions qui en découlent à l'égard de la gestion des cyanobactéries et de leurs toxines (y compris les stratégies de prévention des efflorescences) doivent faire partie d'un plan de gestion de la zone récréative. De plus amples renseignements sur la gestion de la qualité des eaux utilisées à des fins récréatives en général figurent dans le document d'accompagnement intitulé Comprendre et gérer les risques dans les eaux récréatives (Santé Canada, en préparation). Les recommandations pour les cyanobactéries et leurs toxines sont divisées en 1) mesures directes des cyanotoxines et 2) indicateurs de la présence potentielle de cyanotoxines.
Dans le présent document, la seule mesure directe du risque pour la santé est la concentration de microcystines totales dans l'eau des zones suspectes. Bien que les efflorescences de cyanobactéries aient été associées à des effets néfastes pour la santé (irritation cutanée, troubles gastro-intestinaux), la concentration de biomasse cyanobactérienne à laquelle de tels effets ont été signalés est très variable. Voilà pourquoi seule une valeur basée sur la santé (VBS) pour les microcystines totales a été établie. Cette VBS vise à assurer une protection contre le risque d'exposition aux microcystines par ingestion accidentelle de l'eau et contre d'autres effets nocifs qui pourraient résulter de l'exposition aux matières cyanobactériennes. La VBS liée aux microcystines totales repose sur l'exposition des enfants dans un contexte récréatif, car les enfants sont plus susceptibles d'avaler accidentellement de l'eau contaminée par des toxines et passent souvent plus de temps dans l'eau que les adultes. On estime que cette valeur protège tous les segments de la population canadienne.
Les indicateurs de la présence potentielle de cyanotoxines sont le nombre total de cellules de cyanobactéries, le biovolume total de cyanobactéries et la chlorophylle atotale. Le nombre total de cellules de cyanobactéries et le biovolume total de cyanobactéries sont des mesures de la biomasse de cyanobactéries planctoniques, et la chlorophylle atotale est une mesure de la biomasse phytoplanctonique totale. Ces valeurs de biomasse sont établies à partir des relations avec les microcystines totales, selon des hypothèses prudentes (voir la section 8). L'autorité responsable peut modifier ces valeurs recommandées pour les zones récréatives où l'on dispose de renseignements propres au site sur le rapport maximal des microcystines au nombre total de cellules de cyanobactéries, au biovolume de cyanobactéries ou à la chlorophylle a. Si les valeurs sont modifiées, les autorités doivent continuer à surveiller le rapport maximal entre le paramètre et les microcystines pour s'assurer que les valeurs modifiées demeurent applicables. Des concentrations de biomasse dépassant les valeurs recommandées indiquent que le plan d'eau peut contenir des cyanotoxines à des concentrations préoccupantes pour la santé humaine. En général, les méthodes utilisées pour surveiller la biomasse peuvent être plus accessibles que l'analyse des microcystines dans de nombreuses zones où les eaux sont utilisées à des fins récréatives. Les valeurs de biomasse peuvent être utilisées pour déclencher des avis publics et d'éventuelles analyses de suivi des cyanotoxines. La surveillance de la biomasse peut également favoriser une meilleure couverture spatiotemporelle d'une efflorescence planctonique.
2.1 Surveillance
2.1.1 Sélection des plans d'eau à surveiller
Au Canada, il existe une abondance de rivières et de lacs utilisés à des fins récréatives, et il n'est ni possible ni recommandé de tous les surveiller pour détecter les efflorescences de cyanobactéries. Les autorités responsables devraient plutôt repérer les zones susceptibles de nécessiter la mise en place d'un plan de gestion. Les éléments suivants sont notamment à prendre en considération :
- types d'activités récréatives ayant cours dans la zone;
- fréquence d'utilisation des plages;
- degré d'exposition des personnes advenant une efflorescence de cyanobactéries.
Les autorités responsables pourront ensuite utiliser des critères pour cibler les zones qui présentent le plus grand risque de formation d'efflorescence. Les critères suivants peuvent notamment être utilisés :
- les caractéristiques liées à la qualité de l'eau (p. ex., le pH, les concentrations de phosphore total et la turbidité), puisqu'elles peuvent avoir des répercussions sur le développement d'efflorescences. Chorus et Testai (2021) suggèrent notamment que si les concentrations de phosphore total dans un plan d'eau ne dépassent pas 20 μg/L et que l'eau est limpide, avec des profondeurs d'après le disque de Secchi supérieures à 2 ou 3 mètres, il est très peu probable que des efflorescences s'y développent;
- les données historiques sur les efflorescences de cyanobactéries dans le bassin versant, notamment là où des écumes se sont accumulées dans le passé.
Ces renseignements peuvent ensuite servir à classer par ordre de priorité les zones où la formation d'effervescences devrait être surveillée et à déterminer une approche de surveillance (p. ex., quoi surveiller et à quelle fréquence). Il convient également de prendre en considération la fréquence de l'échantillonnage nécessaire pour caractériser un plan d'eau et le moment où cette surveillance peut être réduite, lorsque l'on connaît les conditions propres au site qui peuvent entraîner une efflorescence de cyanobactéries. Les zones récréatives qui ne sont pas sélectionnées pour la surveillance sont généralement celles qui présentent un risque moindre d'exposition humaine aux efflorescences de cyanobactéries.
Étant donné que de nombreux plans d'eau utilisés à des fins récréatives au Canada se classent dans la catégorie de risque faible, il convient d'encourager le grand public à signaler les problèmes potentiels liés aux cyanobactéries à l'autorité responsable désignée par la province ou le territoire ou au service de santé publique local. Ce signalement peut porter à la fois sur la présence potentielle d'efflorescences de cyanobactéries (p. ex., écumes de surface, eau de couleur verdâtre ou bleuâtre, particules ou amas inhabituels) ou sur l'incidence présumée d'effets sur la santé (p. ex. irritations cutanées, mort ou maladie chez des animaux exposés au plan d'eau). Les rapports peuvent donner lieu à des enquêtes supplémentaires.
Les eaux utilisées à des fins récréatives qui sont très fréquentées et où des efflorescences sont attendues ou possibles devraient faire l'objet d'une surveillance régulière, conformément au plan de surveillance établi (p. ex., chaque semaine ou aux deux semaines). De plus, un plan d'action devrait indiquer les mesures à prendre en cas d'efflorescence toxique. Il est très difficile d'établir un plan d'action pendant une efflorescence. Il est important de discuter au préalable avec les groupes locaux (p. ex., les autres parties potentiellement touchées, les organismes de protection des espèces sauvages, le secteur agricole, les laboratoires d'analyse) pour élaborer un plan d'action approprié à utiliser au besoin.
2.1.2 Sélection des paramètres à surveiller
Les paramètres inclus dans un plan de gestion des cyanobactéries varient selon les zones récréatives et sont définis par l'autorité responsable.
Pour les cyanobactéries planctoniques, la surveillance visuelle fait systématiquement partie des plans de gestion. Il peut s'agir d'inspections visuelles des efflorescences de surface et de tests simples, tels que l'examen de l'eau prélevée dans un bocal ou les mesures de la profondeur d'après le disque de Secchi. Les tests en bocal consistent à rechercher une teinte verdâtre ou bleuâtre visible dans l'eau, indiquant une croissance du phytoplancton. Les profondeurs d'après le disque de Secchi mesurent la transparence de l'eau; des profondeurs élevées sont rarement observées dans les plans d'eau où les cyanobactéries prédominent. Des valeurs seuils de la profondeur d'après le disque de Secchi peuvent être utilisées pour déclencher des investigations plus poussées, mais il est préférable d'établir ces profondeurs individuellement pour un plan d'eau donné, car de nombreux constituants de l'eau (par exemple, les sédiments inorganiques en suspension, les substances humiques) peuvent influencer la transparence de l'eau (Ibelings et coll., 2021b). En général, Chorus et Testai (2021) suggèrent une valeur seuil entre 1 et 2 m (niveau de vigilance) pour les profondeurs d'après le disque de Secchi.
En plus de la surveillance visuelle, les autorités responsables peuvent inclure des indicateurs de la présence potentielle de cyanotoxines, tels que ceux indiqués à la section 1.2. Comme les valeurs de ces indicateurs sont toutes calculées en fonction des microcystines, un seul indicateur est généralement inclus par site. Des méthodes moléculaires peuvent aussi être utilisées pour déterminer si des espèces productrices de toxines sont présentes, bien qu'elles ne fournissent pas d'information sur les concentrations potentielles de toxines. Les administrations peuvent enfin surveiller directement les cyanotoxines, au lieu d'utiliser des indicateurs.
De nombreux plans de gestion peuvent inclure à la fois une surveillance visuelle et une surveillance des indicateurs et des toxines. Par exemple, un paramètre indicateur peut faire l'objet d'une surveillance dans une zone de loisirs; en fonction des résultats, d'autres mesures seraient déclenchées, y compris une surveillance supplémentaire, des avis publics ou la collecte d'échantillons pour des tests de cyanotoxines. De plus amples informations sur la conception et la mise en œuvre de programmes de surveillance des eaux utilisées à des fins récréatives se trouvent dans diverses publications (p. ex., Chorus et Bartram, 1999; Newcombe, 2009; Chorus et Welker, 2021).
Les paramètres inclus dans un plan de gestion des cyanobactéries peuvent reposer sur de nombreuses considérations, telles que les capacités techniques et l'expertise disponible dans la région, l'historique des efflorescences dans le plan d'eau et le degré attendu d'exposition humaine en cas d'efflorescence. Il existe des avantages et des limites associés à tous les paramètres potentiels de surveillance des efflorescences planctoniques. De l'information détaillée sur les indicateurs de la biomasse des cyanobactéries est présentée dans la section 6.0.
En ce qui concerne les cyanobactéries benthiques, des indicateurs n'ont pas encore été élaborés pour les plans d'eau canadiens utilisés à des fins récréatives, mais une surveillance est tout de même recommandée (voir la section 2.1.4).
2.1.3 Approche générale de surveillance des cyanobactéries planctoniques
L'annexe B renferme un organigramme présentant l'approche générale de la surveillance des cyanobactéries planctoniques dans les eaux utilisées à des fins récréatives. Cet organigramme se veut un guide général. Les connaissances précises sur un site donné et divers facteurs locaux peuvent influer sur la pertinence de cette approche générale. Par conséquent, l'application des valeurs recommandées pour les cyanobactéries peut varier d'un endroit à l'autre.
Des échantillons peuvent être recueillis 1) à des fins d'inspection visuelle; 2) pour évaluer la concentration de cyanobactéries planctoniques (par exemple, le nombre total de cellules de cyanobactéries, le biovolume de cyanobactéries) ou de phytoplancton (par exemple, la chlorophylle a); 3) pour déterminer les concentrations de toxines ou 4) pour une combinaison de ces mesures. D'autres mesures, telles que les approches moléculaires ou l'utilisation d'images satellites, peuvent également faire partie d'un plan de surveillance, bien que ces méthodes doivent d'abord être validées pour le site.
La première étape d'un programme de surveillance consiste généralement à surveiller visuellement les eaux utilisées à des fins récréatives pour détecter l'accumulation de plancton ou l'apparition d'une efflorescence (voir la figure 1). L'inspection visuelle est extrêmement précieuse, car les cyanobactéries sont généralement visibles lorsqu'elles atteignent des concentrations potentiellement dangereuses (en présence ou non de quantités élevées de toxines). Étant donné que les toxines, si elles sont présentes, peuvent atteindre des concentrations élevées avant, pendant ou après le pic de production de la biomasse, il peut être utile d'établir les points de décision de la surveillance visuelle en fonction du comportement des efflorescences passées pour les plans d'eau où les efflorescences sont récurrentes. Certaines publications fournissent des exemples visuels d'efflorescences de cyanobactéries et peuvent servir à évaluer les conditions locales (Huynh et Seredak, 2006; Blais, 2008; New Zealand Ministry for the Environment and Health, 2009; Rosen et St. Amand, 2015; California Water Quality Monitoring Council, 2019). Ces publications (ou des publications similaires) peuvent également être utilisées pour éduquer la population à l'égard de l'identification des efflorescences de cyanobactéries. Certaines espèces de cyanobactéries peuvent atteindre des valeurs élevées de numération cellulaire sans produire d'écume de surface, de sorte que d'autres mesures, telles que les profondeurs d'après le disque de Secchi ou les tests en bocal, fourniront des informations précieuses.
Les efflorescences de cyanobactéries peuvent ne pas être visuellement différenciables des efflorescences d'autres types de phytoplancton, et pour confirmer que les échantillons contiennent des cyanobactéries ou leurs toxines, des analyses supplémentaires seraient requises (p. ex., microscopie, méthodes moléculaires, analyse de cyanotoxines). Comme la chlorophylle an'est pas spécifique aux cyanobactéries, il importe également de confirmer que l'on est bel et bien en présence d'efflorescences de cyanobactéries lorsqu'on utilise cet indicateur aux fins de surveillance. Il n'est pas possible non plus de déterminer visuellement si une efflorescence de cyanobactéries contient des toxines; les échantillons doivent être envoyés en laboratoire pour l'analyse. L'échantillonnage doit être effectué jusqu'après la disparition de l'efflorescence, conformément au plan de gestion des eaux utilisées à des fins récréatives. La densité cellulaire et la quantité de toxines dans une efflorescence peuvent varier considérablement dans le temps et dans l'espace, en particulier dans les grandes efflorescences. Il est donc difficile de caractériser avec précision les concentrations. Par mesure de précaution, on conseille généralement aux usagers d'éviter tout contact avec les efflorescences de cyanobactéries.
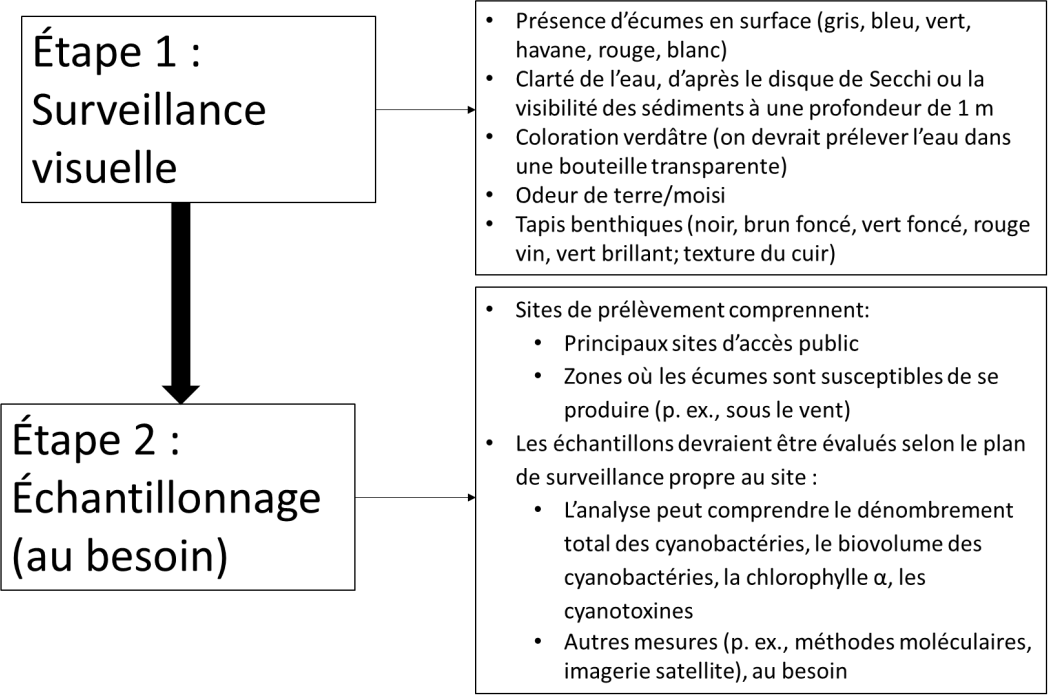
Figure 1 - Équivalent textuel
Cette figure montre les deux étapes de surveillance pour l'identification des proliférations de cyanobactéries. La première étape est la surveillance visuelle. La surveillance visuelle comprend cinq éléments à rechercher : Présence d'écume en surface (gris/bleu/vert/brun/rouge/blanc); clarté de l'eau grâce au disque de Secchi ou à la visibilité des sédiments à 1 mètre de profondeur; décoloration verte (l'eau doit être recueillie dans une bouteille transparente); odeur de renfermé/moisie; et tapis benthiques (noir, brun foncé, vert foncé, rouge vin, vert vif, coriace). La deuxième étape consiste à prélever des échantillons (si nécessaire). La deuxième étape comprend des informations sur deux sujets: (1) les sites de collecte qui comprennent les principaux lieux d'accès public et les zones où les écumeurs sont susceptibles de se produire (par exemple sous le vent); et (2) les échantillons doivent être évalués selon le plan de surveillance spécifique au site qui peut inclure l'évaluation des cellules totales de cyanobactéries, du biovolume de cyanobactéries, de la chlorophylle a, des cyanotoxines, ou l'utilisation d'autres mesures telles que les approches moléculaires ou l'imagerie par satellite.
Dans certains endroits, l'analyse des échantillons pour mesurer la biomasse de cyanobactéries ou de phytoplancton et les toxines de cyanobactéries peut présenter des défis techniques, notamment l'absence d'un accès à une expertise en laboratoire et des temps d'attente prolongés pour l'obtention des résultats d'échantillonnage. La caractérisation de la biomasse ou des concentrations de toxines peut également exiger beaucoup de travail et d'argent si les conditions sont très variables. Dans ces situations, une approche reposant sur l'inspection visuelle, accompagnée de bonnes stratégies de communications publiques, peut se révéler plus appropriée. Cependant, l'inconvénient de s'en remettre uniquement à un examen visuel est qu'on doit alors supposer que toutes les efflorescences sont toxiques, de sorte que des avis relatifs aux plages peuvent être publiés à des endroits où les concentrations de cyanotoxines respectent les valeurs recommandées (Watson et coll., 2017). En outre, la confirmation visuelle des efflorescences ne garantit pas la détection des concentrations de toxines pertinentes pour la santé si elles surviennent avant la détection visuelle. Bien que les efflorescences doivent être évitées par mesure de précaution, des informations supplémentaires sur la biomasse de cyanobactéries et les concentrations de toxines, y compris les comportements historiques dans les sites sujets aux efflorescences récurrentes, peuvent aider à prendre des décisions quant aux risques pour la santé publique dans chaque site.
En mettant en œuvre une approche souple en matière de gestion des cyanobactéries, les autorités responsables devraient être en mesure de relever certains des défis liés à la surveillance et de continuer à protéger et à promouvoir la santé publique.
2.1.4 Approche générale de surveillance des cyanobactéries benthiques
Dans les zones claires et peu profondes, la présence de tapis benthiques doit être évaluée visuellement. Comme pour les cyanobactéries planctoniques, il n'est pas possible de dire si un tapis benthique de cyanobactéries contient des toxines par un simple examen visuel. La présence de toxines ou d'espèces de cyanobactéries productrices de toxines dans les tapis benthiques nécessitera une analyse en laboratoire. En général, les tapis benthiques sont moins accessibles que les cyanobactéries planctoniques, d'où un risque d'exposition moindre dans une zone de loisirs. Cependant, dans certaines conditions environnementales, ces tapis peuvent se détacher du substrat ou être rejetés lorsque l'eau se retire et s'accumuler le long des rives, où ils sont plus accessibles aux humains et aux animaux. Lorsque les tapis sont accessibles, il convient de conseiller aux personnes d'éviter ces zones, et notamment de tenir les animaux domestiques à l'écart des zones touchées. De nombreuses publications qui fournissent des exemples visuels d'efflorescences de cyanobactéries contiennent également des images de tapis de cyanobactéries benthiques (Huynh et Seredak, 2006; Blais, 2008; New Zealand Ministry for the Environment and Ministry of Health, 2009; Wood et coll., 2015; California Water Quality Monitoring Council, 2019).
2.2 Avis
Les eaux dans lesquelles une efflorescence s'est formée, ou les eaux qui dépassent la valeur recommandée de microcystines totales, peuvent entraîner une exposition humaine à des cyanobactéries ou à des cyanotoxines en quantités nocives pour la santé humaine. En général, en raison de la difficulté à caractériser avec précision les concentrations de toxines dans une efflorescence, il faut éviter tout contact primaire avec les eaux récréatives qui contiennent des efflorescences visibles, et émettre un avis d'interdiction de baignade ou de contact à titre de précaution. L'autorité responsable, ainsi que le plan de gestion des cyanobactéries de la zone récréative, doivent être consultés pour obtenir des informations supplémentaires. Dans le cas des tapis benthiques, l'étendue et l'emplacement des tapis peuvent justifier la mise en place de panneaux indiquant les risques pour les humains et pour les animaux domestiques. Il se peut aussi que l'on doive conseiller d'éviter la pratique d'activités récréatives de contact primaire dans la zone touchée.
Les avis d'interdiction de baignade ou de contact doivent rester en place jusqu'à ce que le risque pour la santé soit jugé acceptable pour les activités récréatives dans la zone touchée. Les conditions requises pour lever l'avis doivent être déterminées par l'autorité responsable, d'après le plan de gestion des cyanobactéries en place pour la zone de loisirs ou, en l'absence d'un tel plan de surveillance, d'après les informations propres au site (par exemple, la dilution, les efflorescences antérieures). Dans le cas des efflorescences toxiques, les plans d'eau peuvent contenir des toxines pendant un certain temps après la dissipation de l'efflorescence (Zastepa et coll., 2014). La durée pendant laquelle les toxines restent préoccupantes dépend de nombreux facteurs, dont le taux de dilution de la zone, le type de toxine présent et la vitesse de biodégradation. Idéalement, pour que l'on puisse lever l'avis d'interdiction de baignade ou de contact, l'efflorescence doit s'être dissipée et les tests doivent indiquer que la concentration des toxines de cyanobactéries est inférieure à la valeur recommandée. En l'absence d'analyse de toxines, l'avis d'interdiction de baignade ou de contact doit rester en vigueur suffisamment longtemps après la dissipation de l'efflorescence pour permettre la dilution ou la dégradation des toxines présentes. Le temps nécessaire à la dissipation des toxines est déterminé en fonction du site.
Dans les plans d'eau où les efflorescences sont récurrentes tout au long de la saison récréative, les autorités responsables peuvent choisir de laisser les avis en place pour la saison quand une efflorescence se produit. Cela peut aider à informer les personnes des problèmes potentiels d'efflorescences de cyanobactéries dans le lieu de loisirs. Une telle précaution peut être particulièrement importante dans les endroits où les conditions de l'eau changent rapidement ou lorsque les ressources sont limitées pour effectuer des inspections fréquentes.
Les avis publics relatifs aux efflorescences de cyanobactéries doivent être simples et clairs. Chaque avis doit inclure les éléments suivants (US EPA, 2021) :
- le message clé – l'émission ou la levée de la fermeture ou de l'avertissement;
- la liste des activités autorisées et des activités non sécuritaires;
- la raison de l'avis, p. ex., des taux élevés de cyanobactéries ou de cyanotoxines;
- l'emplacement de la zone récréative visée par l'avis;
- les conséquences potentielles d'un contact avec la zone visée;
- les mesures prises par les gestionnaires de la plage pour surveiller l'efflorescence;
- les coordonnées des personnes à consulter si on désire des renseignements supplémentaires.
Il convient de fournir du matériel d'information décrivant les mesures que le public peut prendre pour réduire les risques personnels en cas d'efflorescence. Les conseils suivants peuvent notamment être transmis :
- éviter les zones qui contiennent des écumes visibles ou dont l'eau a une teinte verdâtre/bleue;
- en cas de contact accidentel avec des cyanobactéries, prendre une douche ou se laver, et laver tout objet ayant pu entrer en contact avec les cyanobactéries, dès que possible après avoir quitté l'eau;
- si des symptômes apparaissent à la suite d'une activité aquatique récréative, consulter un professionnel de la santé et, si nécessaire, alerter les autorités locales compétentes en matière de santé publique;
- veiller à ce que les animaux domestiques ne se baignent pas et ne boivent pas dans les zones où l'eau présente une coloration anormale pouvant être due à une efflorescence, ou dans lesquelles des accumulations de matières cyanobactériennes, y compris des tapis benthiques, sont visibles.
3.0 Description et effets sur la santé
3.1 Cyanobactéries
Les cyanobactéries sont des bactéries qui partagent des caractéristiques avec les algues, comme la photosynthèse produisant de l'oxygène grâce à leurs pigments photosynthétiques bleu-vert, et c'est pourquoi elles ont été par le passé appelées algues bleu-vert (OMS, 2021). Les efflorescences contenant des cellules actives intactes sont généralement d'apparence plus verte que bleue, cependant, d'autres couleurs allant du havane au rouge vif ou au rouge vin peuvent aussi apparaître. Les efflorescences dont les cellules sont mourantes peuvent paraître plus bleues. Cela est dû au fait que la bactériochlorophylle, le pigment responsable de la couleur verte, est rapidement blanchie par la lumière du soleil après la lyse des cellules, tandis que le pigment bleu (phycocyanine) persiste (Newcombe, 2009). Au microscope, la plupart des cyanobactéries planctoniques, y compris les espèces présentes dans les lacs canadiens, apparaissent sous forme de regroupements réguliers ou irréguliers de cellules ou de chaînes filamenteuses qui peuvent être droites, enroulées ou ramifiées (Falconer, 2005; Chorus et Welker, 2021). Au cours d'un été typique, un échantillon d'eau de lac peut contenir de nombreuses espèces de cyanobactéries, des souches toxiques et non toxiques, ainsi que des espèces d'algues. Les conditions qui favorisent généralement la formation d'efflorescences sont notamment les eaux eutrophes et les températures de l'eau plus élevées (ce qui entraîne une stratification plus stable de la colonne d'eau) (Huisman et coll., 2018).
De nombreuses cellules cyanobactériennes peuvent modifier leur position dans la colonne d'eau en changeant leur flottabilité ou leur mélange, ce qui modifie leur accès à la lumière du soleil et aux nutriments. L'intensité lumineuse est plus élevée à la surface et les macronutriments sont généralement plus concentrés près des sédiments du fond (Falconer, 2005). Dans des conditions calmes, il peut y avoir des proliférations intenses, créant une coloration visible et une accumulation de cellules, phénomène connu sous le nom d'efflorescence de cyanobactéries (Chorus et Bartram, 1999; Falconer, 2005). Des efflorescences de cyanobactéries peuvent augmenter leur densité d'un facteur de 1 000 ou plus en très peu de temps dans des conditions calmes (Chorus et coll., 2000). Les vents du large peuvent alors pousser ces écumes vers le rivage où elles peuvent s'accumuler (Chorus et Bartram, 1999; Falconer, 2005). Ces efflorescences peuvent être très denses et prendre l'apparence d'une gélatine ou la forme d'un amas de fins débris d'herbe, voire d'une masse trouble et homogène, comme si on avait déversé de la peinture verte dans l'eau (Falconer, 2005; OMS, 2021). Comme il est mentionné précédemment, les écumes peuvent également avoir d'autres couleurs, notamment rouge-bleu et havane.
Les efflorescences de cyanobactéries constituent un problème de santé publique, car elles peuvent contenir des cyanotoxines. Le contact avec des matières cyanobactériennes a été lié à des cas d'irritation cutanée et de maladies gastro-intestinales (voir la section 3.2). Au Canada, les genres de cyanobactéries toxiques planctoniques les plus problématiques correspondent à ceux que l'on observe le plus fréquemment ailleurs dans le monde : Dolichospermum (auparavant Anabaena), Aphanizomenon, Gloeotrichia, Microcystis, Planktothrix, Pseudoanabaena et Woronichinia (Winter et coll., 2011; MDDEP, 2012; ministère de l'Environnement de l'Ontario, 2012). Les efflorescences de cyanobactéries peuvent être constituées d'un mélange d'espèces et de souches, bien qu'une seule espèce (ou un petit nombre d'espèces) prédomine souvent. Chaque espèce peut produire ou non des toxines. Généralement, les toxines présentes, le cas échéant, persistent en majeure partie aussi longtemps que l'efflorescence. Certaines toxines peuvent persister pendant un certain temps après la dissipation de l'efflorescence (Chorus et Bartram, 1999; Falconer, 2005). Il faut un temps variable pour que les concentrations de toxines descendent sous la valeur représentant un risque pour la santé en cas d'exposition à l'eau à des fins récréatives; ce temps doit être déterminé en fonction du site. Des effets sur la santé ont également été associés au contact avec des matières cyanobactériennes (voir la section 8.2).
On peut observer des signes indiquant la présence de toxines de cyanobactéries, notamment la présence d'oiseaux aquatiques ou d'autres animaux sauvages morts le long du littoral ou des rapports d'empoisonnement d'animaux domestiques, en particulier les bovins et les chiens (Chorus et Bartram, 1999). Toutefois, certaines efflorescences surviennent parfois sans produire d'effets observables au sein des populations animales locales. Ainsi, toute efflorescence devrait être considérée comme potentiellement toxique.
Les cyanobactéries benthiques, ou celles qui croissent à la surface du fond du plan d'eau, peuvent être présentes dans les habitats d'eau douce au Canada (Wood et coll., 2020). Ces cyanobactéries pouvant produire des toxines sont des genres Oscillatoria, Phormidium et Lyngbya (Vis et coll., 2008; Lajeunesse et coll., 2012; Quiblier et coll., 2013). Cependant, il y a relativement peu d'information dans la base de données sur les populations de cyanobactéries benthiques toxiques (Quiblier et coll., 2013; Gaget et coll., 2017a; Burford et coll., 2019). Si les tapis benthiques se trouvent dans des zones récréatives ou si des cyanobactéries benthiques se détachent de la surface du fond, remontent à la surface de l'eau et s'accumulent le long des rives, l'exposition humaine aux cyanobactéries benthiques peut alors devenir préoccupante (Quiblier et coll., 2013; Gaget et coll., 2017a). On signale de plus en plus la présence de tapis benthiques (Burford et coll., 2019; Wood et coll., 2020), et plus on comprendra la toxicité des cyanobactéries benthiques, plus on en saura sur leur importance pour la santé humaine.
3.2 Toxines de cyanobactéries
Les efflorescences de cyanobactéries constituent un problème de santé publique, puisqu'elles produisent des cyanotoxines intracellulaires et potentiellement, des endotoxines de surface. Notre compréhension des endotoxines de surface reste incomplète. Elles peuvent provoquer une réaction irritante ou allergique chez l'humain à la suite d'un contact cutané (toxines irritantes), ainsi que des maladies potentielles par ingestion et inhalation (Lévesque et coll., 2014, 2016; Ohkouchi et coll., 2015; Otten et Paerl, 2015). Il est également possible que ces effets sur la santé soient liés à d'autres substances inconnues présentes dans les cyanobactéries ou à d'autres bactéries associées aux efflorescences de cyanobactéries. Des recherches supplémentaires s'imposent dans ce domaine.
Les cyanotoxines intracellulaires sont produites par une variété de cyanobactéries (mais pas toutes) et sont associées à divers effets nocifs chez l'humain (Otten et Paerl, 2015; Carmichael et Boyer, 2016; Chorus et Welker, 2021). Ces toxines sont généralement présentes dans les cyanobactéries intactes et sont libérées lors de la lyse des cellules, bien que certaines toxines intracellulaires puissent être libérées naturellement sans lyse cellulaire (p. ex., la cylindrospermopsine). Il existe plusieurs cyanotoxines intracellulaires connues, notamment les microcystines, les nodularines, les anatoxines, les cylindrospermopsines, les saxitoxines et les dermatotoxines. Les microcystines et les nodularines sont des peptides cycliques qui s'attaquent au foie (hépatotoxines), les anatoxines sont des alcaloïdes qui ciblent le système nerveux (neurotoxines), les saxitoxines ont également des effets sur les cellules nerveuses et musculaires (neurotoxines), et les cylindrospermopsines sont un alcaloïde qui touche le foie, bien qu'il ait été démontré qu'elles puissent aussi avoir des répercussions sur un large éventail d'organes (propriétés cytotoxiques), en particulier les reins (US EPA, 2015b; Chorus et Welker, 2021). Bien que ces toxines puissent entraîner des maladies graves, les principaux effets sur la santé découlant de l'ingestion accidentelle de cyanobactéries peuvent être de nature gastro-intestinale ou pseudogrippale et, par conséquent, ne sont souvent pas signalés ou sont souvent attribués à d'autres causes (Falconer, 2005; Lévesque et coll., 2014; Otten et Paerl, 2015).
3.2.1 Microcystines
Les microcystines (MC) sont des hépatotoxines qui appartiennent au groupe des peptides cycliques. Elles possèdent sept acides aminés reliés formant un peptide circulaire qui contient une chaîne latérale d'acides aminés unique (connue sous le nom de groupe Adda) et deux acides aminés variables à l'extrémité de la molécule, qui déterminent l'identité de chaque variante de microcystine. Par exemple, la variante MC-LR contient une leucine (L) et une arginine (R) aux positions d'acides aminés variables (Carmichael, 1992).
Les microcystines, souvent présentes dans les eaux douces et saumâtres, sont généralement considérées comme les cyanotoxines d'eau douce les plus répandues et les plus importantes, en raison de leur stabilité et de leur résistance à la dégradation chimique, de leur présence généralisée et de leur capacité à atteindre des concentrations élevées dans les efflorescences et les écumes (Boyer, 2007; Williams et coll., 2007; Winter et coll., 2011; Fastner et Humpage, 2021). Les microcystines sont en grande partie liées aux cellules (c.-à-d. présentes dans des cellules intactes) jusqu'à la mort et à la lyse des cellules. Plus de 200 variantes de microcystines ont été identifiées (Spoof et Arnaud, 2017; Bouaïcha et coll., 2019). La MC-LR est l'une des variantes les communément mesurées et les plus toxiques au monde (Graham et coll., 2010; Chernoff et coll., 2020), bien que des cas d'autres variantes dominant les efflorescences ou coexistant avec la MC-LR aient été rapportés (Kemp et John, 2006; Graham et coll., 2010; Li et coll., 2010; Sabart et coll., 2010; ministère de la Santé de la Colombie-Britannique, 2012; MDDEP, 2012; Srivastava et coll., 2012).
Un certain nombre de genres de cyanobactéries ont été établis comme producteurs de microcystines (Kotak et Zurawell, 2007; Funari et Testai, 2008; Pearson et coll., 2010; Martins et Vasconcelos, 2011; Carmichael et Boyer, 2016; Bernard et coll., 2017; Fastner et Humpage, 2021). Les genres les plus couramment observés en Amérique du Nord sont Dolichospermum (Anabaena), Microcystis, Planktothrix et Pseudoanabaena (Williams et coll., 2007; Winter et coll., 2011). Les espèces de Planktothrix semblent ne produire que des variantes de microcystines déméthylées (Fastner et coll., 1999; Briand et coll., 2005; Kurmayer et coll., 2004; Cerasino et coll., 2016), qui risquent de ne pas être détectées, selon la méthode d'analyse utilisée. Dans de nombreuses études de dépistage couvrant diverses régions du monde, des microcystines ont été détectées dans 20 à 100 % des échantillons d'eau analysés, la fréquence de détection correspondant généralement à l'état trophique des plans d'eau. Lorsque les plans d'eau renfermaient des espèces des genres Microcystis ou Planktothrix, de 80 à 100 % des échantillons étaient positifs (Fastner et Humpage, 2021). Dans les efflorescences dominées par Dolischopermum, la détection de microcystines était moins fréquente (Chorus, 2001).
Parmi les effets sur la santé associés à une exposition à des eaux récréatives compromises par des efflorescences de Microcystis et de Dolichospermum (Anabaena), on relève des maux de tête, des nausées, des vomissements, de la diarrhée, des douleurs abdominales, des douleurs musculaires, de la fièvre, des aphtes buccaux, des cloques sur les lèvres, des maux de gorge, des éruptions cutanées et des irritations des oreilles et des yeux (Otten et Paerl, 2015; Gaget et coll., 2017a; OMS, 2021). En Argentine, le contact accidentel avec une efflorescence cyanobactérienne contenant des microcystines a entraîné des symptômes de fièvre, des nausées et des douleurs abdominales, suivis d'une pneumonie atypique et d'effets hépatiques (Giannuzzi et coll., 2011). Un cas unique d'insuffisance hépatique aiguë a aussi été lié à une exposition aux microcystines (Vidal et coll., 2017). Des éclosions liées à une exposition à des efflorescences cyanobactériennes renfermant des microcystines ont aussi été signalées dans des plans d'eau utilisés à des fins récréatives. Aux États-Unis, on a signalé deux éclosions en 2003-2004 (Dziuban et coll., 2006) et huit en 2009-2010 (Hilborn et coll., 2014). La surveillance effectuée par l'entremise du système « One Health Harmful Algal Bloom » aux États-Unis a révélé 389 cas de maladies humaines causées par des toxines de cyanobactéries entre 2016 et 2018, les microcystines étant les toxines les plus souvent signalées (Roberts et coll., 2020). Les symptômes signalés lors de ces éclosions comprenaient des crampes abdominales, de la diarrhée, des nausées, des vomissements, de la fièvre, des maux de tête, des éruptions cutanées, une irritation des yeux, des maux d'oreille, des symptômes neurologiques, des picotements, de la confusion et des symptômes respiratoires (Hilborn et coll., 2014; Roberts et coll., 2020). Outre les effets aigus, des données indiquent que les microcystines peuvent être des promoteurs de tumeurs, et le CIRC (2010) a classé ces cyanotoxines comme étant possiblement carcinogènes pour l'humain. Pour de plus amples renseignements sur les microcystines, voir le document Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
3.2.2 Anatoxines
Les anatoxines (anatoxine-a, anatoxine-a(S), homoanatoxine-a) peuvent être produites par les espèces Dolichospermum (Anabaena) (anatoxine-a, anatoxine-a(S)), Aphanizomenon (anatoxine-a), Microcystis (anatoxine-a) et Oscillatoria (anatoxine-a, homoanatoxine-a) (Chorus et Bartram, 1999; Funari et Testai, 2008). L'espèce Cuspidothrix issatschenkoi (auparavant Aphanizomenon issatschenkoi) est également reconnue comme un producteur d'anatoxine-a en Europe et au Japon (Hodoki et coll., 2012). Dans des plans d'eau suffisamment clairs pour permettre la croissance de macrophytes et des cyanobactéries associées, le genre Tychonema peut également être un producteur d'anatoxine-a (Fastner et coll. 2016). Tout comme les microcystines, les anatoxines sont des toxines intracellulaires.
Les anatoxines sont des neurotoxines qui interfèrent avec l'activité de l'acétylcholine, un neurotransmetteur. Elles ont donc une incidence sur le fonctionnement du système nerveux en perturbant la communication entre les nerfs et les cellules musculaires. Les effets sur la santé associés à une exposition aux anatoxines comprennent la paralysie des muscles squelettiques et respiratoires, entraînant des tremblements, des convulsions et, finalement, la mort par insuffisance respiratoire (Rogers et coll., 2005). Des empoisonnements non mortels chez les humains, avec des symptômes de troubles gastro-intestinaux aigus, tels que nausées, vomissements et diarrhée, ont été signalés à la suite de l'ingestion d'eau contenant des espèces non précisées de Microcystis et Dolichospermum (Anabaena) (productrices d'anatoxine-a). Des réactions allergiques (telles que des éruptions cutanées papulo-vésiculaires) ont également été liées à la baignade dans des eaux contenant une efflorescence de Dolichospermum (Anabaena) (Schwimmer et Schwimmer, 1968). La détection de la véritable toxine – l'anatoxine-a – n'a cependant pas été signalée. Un seul décès humain a été possiblement associé à l'exposition à des neurotoxines de cyanobactérie dans les eaux naturelles : cette exposition s'est produite par l'ingestion d'eau compromise lors d'une immersion accidentelle dans un endroit où la baignade était interdite (Falconer, 2005). L'anatoxine-a a été associée à l'empoisonnement et à la mort de divers animaux après une exposition à de l'eau compromise par des cyanotoxines (Carmichael et Gorham, 1978; Edwards et coll., 1992; Gunn et coll., 1992; Puschner et coll., 2008; Stewart et coll., 2008; Backer et coll., 2013). Toutefois, les niveaux d'exposition n'ont pas été indiqués. Les symptômes cliniques étaient surtout de nature neurologique, les morts ayant été attribuées à l'apparition rapide d'une paralysie respiratoire (un effet néfaste caractéristique de l'anatoxine-a). Le nombre élevé de morts d'animaux signalées (contrairement à l'absence quasi totale des décès humains connus) dues à l'anatoxine-a est attribuable au volume d'eau beaucoup plus important que les animaux ingèrent par rapport aux humains exposés dans leurs activités récréatives. Pour de plus amples renseignements sur les anatoxines, veuillez consulter les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
3.2.3 Cylindrospermopsines
Les cylindrospermopsines sont principalement classées dans la catégorie des hépatotoxines, bien qu'il ait été démontré qu'elles sont également cytotoxiques dans d'autres organes tels que les reins, la rate, le thymus, le cœur et le tractus gastro-intestinal (OMS, 2020a). Contrairement aux microcystines, une quantité importante de cylindrospermopsines est libérée dans la colonne d'eau pendant le développement des efflorescences au lieu d'être liée aux cellules. La cylindrospermopsine est assez stable dans l'environnement par rapport à d'autres toxines (Wörmer et coll., 2008, 2009). Elle se retrouve plus couramment dans les régions tropicales et subtropicales du globe (Williams et coll., 2007). Cependant, il y a de plus en plus de rapports sur des espèces potentiellement productrices de toxines dans les eaux douces tempérées, ce qui laisse croire que la plage géographique des espèces productrices de cylindrospermopsines serait en expansion (Graham et coll., 2010; Xie et coll., 2011; Sinha et coll., 2012). Le premier incident d'empoisonnement humain par une cylindrospermopsine a été signalé en 1979, au large des côtes du Queensland, en Australie, et a été attribué à une efflorescence de Raphisiopsis (auparavant Cylindrospermopsis) raciborskii. Les symptômes associés à l'éclosion comprenaient des vomissements, des malaises, des maux de tête et de la constipation, suivis ultérieurement par une diarrhée sanglante et des signes de lésions hépatiques et rénales (Chorus et Bartram, 1999). À l'heure actuelle, aucun décès humain n'a été associé aux cylindrospermopsines, et aucun autre empoisonnement n'a été relevé, que ce soit par l'eau potable ou les eaux utilisées à des fins récréatives.
Les cylindrospermopsines peuvent être produites par de nombreuses espèces cyanobactériennes, notamment : Raphisiopsis (Cylindrospermopsis) raciborskii, Chrysosporum ovalisporum (auparavant Aphanizomenon ovalisporum), Aphanizomenon gracile, Umezakia natans, Anabaena bergii, Anabaena lapponica, Dolichospermum (Anabaena) planctonica, Lyngbya wollei, Rhaphidiopsis curvata et Rhaphidiopsis mediterranea (US EPA, 2015a). Aphanizomenon flos-aquae peut également produire la toxine (US EPA, 2015a). Cependant, des recherches supplémentaires sont nécessaires pour étudier les conditions dans lesquelles cela peut se produire (Lyon-Colbert et coll., 2018). Pour de plus amples renseignements sur la cylindrospermopsine, veuillez consulter les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
3.2.4 Nodularines
Les nodularines sont des hépatotoxines généralement produites par des souches du genre Nodularia, une cyanobactérie d'eaux saumâtres, bien que d'autres espèces, comme les cyanobactéries du genre Nostoc, soient capables de produire la toxine (Gehringer et coll. 2012; Wood et coll., 2012). De multiples variantes de nodularines ont été relevées, la nodularine-R étant la plus abondante forme de cette cyanotoxine (Mazur-Marzec et coll., 2006). Les toxines sont étroitement liées aux microcystines tant au niveau de leur structure que de leur fonction (Fastner et Humpage, 2021). Les données produites par des études expérimentales, bien qu'elles soient limitées, indiquent que les nodularines présentent une toxicité similaire à celle de la microcystine-LR. Les résultats d'études de toxicité chronique effectuées sur des modèles animaux portent à croire que les nodularines pourraient avoir un pouvoir tumorigène supérieur à celui des microcystines (Chorus et Bartram, 1999).
3.2.5 Saxitoxines
La saxitoxine et la soixantaine d'analogues apparentés constituent un groupe de toxines comprenant la saxitoxine, la néosaxitoxine, les gonyautoxines, les toxines C, les décarbamoylsaxitoxines et les lyngbyatoxines (OMS, 2020 b). Ces toxines agissent en bloquant les canaux sodiques dans les nerfs et les cellules musculaires, ce qui empêche la transmission d'impulsions électriques. On les appelle également toxines responsables de l'intoxication par phycotoxine paralysante, car elles sont largement associées à l'accumulation de toxines chez les mollusques et crustacés marins se nourrissant des efflorescences d'Alexandrium dans le plancton marin (Codd et coll., 1999). Il y a eu de nombreux cas de maladies et de décès chez les humains en lien avec l'intoxication par phycotoxine paralysante à la suite de la consommation de mollusques (Ibelings et coll., 2021a), mais à ce jour, aucune maladie liée à la saxitoxine n'a été signalée chez l'humain à la suite d'une exposition à l'eau potable ou aux eaux utilisées à des fins récréatives. Des décès d'animaux ont également été liés à un contact avec des efflorescences de cyanobactéries renfermant des saxitoxines (Negri et coll., 1995). On a signalé que des cyanobactéries des genres Dolichospermum (Anabaena), Aphanizomenon et Raphisiopsis (Cylindrospermopsis), ainsi que la cyanobactérie benthique Microseira (Lyngbya) produisent des saxitoxines (Aráoz et coll., 2010; Carmichael et Boyer, 2016; Testai, 2021). Pour de plus amples renseignements sur les saxitoxines, veuillez consulter les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
3.2.6 Dermatotoxines et autres toxines irritantes
Les dermatotoxines sont plus fréquentes dans les eaux marines que dans les eaux douces. La documentation établit clairement que certaines cyanobactéries marines, telles les espèces de Lyngbya, Oscillatoria et Schizothrix, provoquent des réactions attribuables aux dermatotoxines. Les récentes reclassifications taxonomiques du genre Lyngbya ont entraîné plusieurs nouveaux groupes de genres (comme Moorea, Dapis et Okeania), qui faisaient auparavant partie du genre Lyngbya (Osborne, 2021). Nous continuerons d'utiliser Lyngbya dans le présent document pour les données scientifiques présentées avant les changements taxonomiques.
Les espèces des genres Lyngbya, Oscillatoria et Schizothrix peuvent produire des toxines appelées aplysiatoxines et lyngbyatoxines qui, selon les signalements, provoquent des dermatites graves. En outre, les aplysiatoxines sont considérées comme de puissants promoteurs de tumeurs, et on pense qu'elles présentent d'autres propriétés qui peuvent être liées à la cancérogenèse (Chorus et Bartram, 1999). Certaines espèces de Lyngbya produisent également la débromoaplysiatoxine et l'apratoxine A, cette dernière étant hautement cytotoxique et pouvant induire l'apoptose des cellules (Luesch et coll., 2001). Les dossiers des premiers intervenants à l'île Fraser, en Australie, ont révélé qu'au cours d'une période de sept semaines durant laquelle Lyngbya majuscula(maintenant appelée Moorea producens) a été détectée dans les eaux, il y a eu une augmentation du nombre de personnes qui, après avoir fréquenté ces eaux marines à des fins récréatives, ont signalé des symptômes compatibles avec une exposition à L. majuscula(Osborne et Shaw, 2008). Les symptômes comprenaient généralement des éruptions cutanées douloureuses, une inflammation, des démangeaisons et une irritation du nez, des yeux et de la gorge. La majeure partie des personnes qui ont signalé des symptômes ont été en contact direct avec Lyngbya en se baignant, mais deux personnes ont déclaré des symptômes après avoir inhalé des embruns en conduisant le long de la plage.
Bien qu'elles n'aient pas été étudiées aussi à fond que les espèces marines, il a été signalé que les espèces de Lyngbya d'eau douce formant des tapis causaient une irritation de la peau et une dermatite chez des plongeurs (Floride), ainsi que chez les personnes nettoyant du varech échoué sur la plage dans une baie du lac Ontario infestée par Lyngbya (Carmichael et Boyer, 2016). Par conséquent, bien que les dermatotoxines soient principalement produites par des espèces cyanobactériennes marines, elles peuvent également être préoccupantes dans les lacs et les rivières d'eau douce.
D'autres composants des cellules de cyanobactéries peuvent être associés à des réponses allergiques ou irritantes pour la peau. Les réactions allergiques ressemblent à des réactions d'hypersensibilité immédiate, semblables à celles associées à des maladies telles que la rhinite saisonnière, la conjonctivite, l'asthme et l'urticaire (Stewart et coll., 2006a). Certains individus semblent avoir une prédisposition aux réactions allergiques (Chorus et Welker, 2021). Les réactions irritantes et allergiques peuvent être causées par les endotoxines de surface (c.-à-d. le composant lipopolysaccharidique de la paroi cellulaire des cyanobactéries) (Chorus et Bartram, 1999). On sait que les lipopolysaccharides présentent des propriétés inflammatoires, pyrogènes (provoquant la fièvre) et toxiques. On considère toutefois qu'en règle générale, les lipopolysaccharides des cyanobactéries sont beaucoup moins toxiques que ceux d'autres bactéries à Gram négatif comme Salmonella (Chorus et Bartram, 1999). Des chercheurs ont également signalé que les complexes phycobiliprotéiques sont responsables de réponses allergiques (Geh et coll., 2015). Des symptômes gastro-intestinaux ont également été signalés à la suite d'une exposition aux cyanobactéries (Lévesque et coll., 2014). Des incertitudes subsistent quant à la cause de ces différents impacts sur la santé et au rôle que les lipopolysaccharides des cyanobactéries pourraient jouer (Chorus et Testai, 2021; Welker, 2021). Il se peut que ces effets sur la santé soient liés à d'autres composants des cyanobactéries ou à d'autres bactéries associées aux efflorescences des cyanobactéries (p. ex., lipopolysaccharides de bactéries hétérotrophes; autres bactéries comme Vibrio cholerae).
3.2.7 Composé d'intérêt : β-méthylamino-L-alanine
L'acide aminé inhabituel β-méthylamino-L-alanine (BMAA), ses liens avec les cyanobactéries et les résultats des recherches concernant ses capacités neurotoxiques potentielles sont dignes d'intérêt. La BMAA est présente dans pratiquement tous les groupes de cyanobactéries, y compris les genres d'eau douce remarquables comme Dolichospermum (Anabaena), Aphanizomenon, Microcystis, Nodularia et Oscillatoria, ainsi que le genre de cyanobactéries marines Nostoc (Cox et coll., 2005; Banack et coll., 2007; Metcalf et coll., 2008). La BMAA peut également être co-présente avec d'autres cyanotoxines (Metcalf et coll., 2008).
L'intérêt pour la BMAA a débuté après son isolement dans les tissus cérébraux de patients atteints de sclérose latérale amyotrophique/complexe Parkinson-démence (SLA/CPD) à Guam. Les enquêtes subséquentes sur l'association entre sa présence et la SLA ou la maladie d'Alzheimer ont donné des résultats mitigés (Cox et coll., 2003; Murch et coll., 2004; Pablo et coll., 2009; Meneenly et coll., 2016). Des études ont également cherché à déterminer si les efflorescences cyanobactériennes, en tant que source de BMAA, pouvaient conduire à une bioamplification par la chaîne alimentaire (Cox et coll., 2003; Banack et coll., 2015). Bon nombre des études portant sur la BMAA ont utilisé des méthodes d'analyse qui surestimaient la présence et les concentrations de BMAA et qui ne permettaient pas d'établir une relation de cause à effet (Chernoff et coll., 2017, 2021). Par conséquent, des travaux supplémentaires sont nécessaires avant de pouvoir établir ou écarter une relation de cause à effet entre la BMAA et les maladies neurologiques (Holtcamp, 2012; ANSES, 2017). De même, les preuves sont insuffisantes à l'heure actuelle pour penser que l'eau ou les aliments pourraient constituer une source importante d'exposition à la BMAA. Les nouvelles données sur ce sujet continueront de faire l'objet d'un suivi.
4.0 Voies d'exposition
Les trois voies principales d'exposition humaine aux cyanobactéries et à leurs toxines dans les eaux utilisées à des fins récréatives sont l'ingestion, le contact cutané direct avec le corps et l'inhalation (Chorus et Bartram, 1999; NHMRC, 2008). Les cyanobactéries et leurs toxines peuvent être présentes à la fois dans la colonne d'eau et dans les tapis benthiques.
L'ingestion est la voie d'exposition la plus fréquemment documentée pour les cyanobactéries et leurs toxines. Des cas de maladie ont été signalés à la suite de l'ingestion accidentelle d'eaux altérées par une efflorescence (Chorus et Bartram, 1999; Stewart et coll., 2006b; OMS, 2021). Les activités impliquant une immersion soudaine ou répétée de la tête (p. ex., la planche à voile ou le kayak) peuvent mener à une exposition par ingestion et/ou par inhalation de l'eau par la bouche ou les voies nasales. Bien qu'elle ne soit pas directement liée à l'exposition aux eaux utilisées à des fins récréatives, l'ingestion d'aliments, notamment les poissons et les crustacés, et de suppléments alimentaires, notamment les suppléments d'algues, peut aussi constituer une source potentielle de cyanotoxines. De plus amples renseignements sur l'exposition par ingestion d'aliments sont disponibles dans le document : les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
On sait que le contact direct avec des cellules cyanobactériennes provoque des irritations plus ou moins graves, bien que les mécanismes exacts de ces irritations ne soient pas entièrement compris. Des réactions allergiques ont également été signalées. Il a été suggéré que les irritations ou allergies seraient dues à des composantes cyanobactériennes inconnues, distinctes des toxines (voir la section 3.2.6). Les maillots de bain et les combinaisons de plongée peuvent également exacerber le risque d'irritation cutanée en emprisonnant les cellules bactériennes et en libérant leur contenu par effet de friction contre la peau (Chorus et Bartram, 1999).
Les aérosols générés par le vent ou les activités récréatives peuvent contenir des cellules de cyanobactéries ou leurs toxines, ce qui peut constituer une voie d'exposition par inhalation, bien que les données quantitatives sur les niveaux d'exposition soient limitées (Chorus et Testai, 2021). Dans une étude réalisée sur l'exposition à des microcystines sous forme d'aérosols au cours d'activités récréatives dans deux lacs de la Californie, Backer et coll. (2010) ont signalé des concentrations détectables de microcystines dans les échantillons d'air individuels et des écouvillonnages du nez de 81 enfants (12 ans et plus) et adultes après les activités récréatives (ski nautique, motomarine, natation ou pataugeage). Toutefois, les microcystines n'ont pas été détectées dans les échantillons de sang, ce qui indique que les toxines en aérosol n'ont pas pénétré dans les poumons assez profondément pour être absorbées dans la circulation sanguine. D'autres études ont aussi confirmé que l'exposition par les aérosols est possible (Wood et Dietrich, 2011; Facciponte et coll., 2018). Bien que ces données indiquent une exposition potentielle par inhalation, des recherches supplémentaires sont nécessaires pour déterminer si les toxines en aérosol peuvent atteindre les voies respiratoires inférieures pour ensuite être absorbées par les poumons et pénétrer dans le sang. Par mesure de précaution, les activités qui génèrent des quantités importantes d'aérosols (par exemple, le motonautisme) et les activités où le risque d'immersion accidentelle est élevé (par exemple, le ski nautique ou la bouée tractable) doivent être évitées dans les zones contenant des efflorescences visibles de cyanobactéries.
En général, la probabilité qu'une exposition aux toxines de cyanobactéries en quantité suffisante constitue un risque chronique ou aigu pour la santé est jugée relativement faible au Canada, en raison du caractère saisonnier et de la nature localisée des efflorescences, de leur aspect esthétique peu attrayant et de la manière dont sont gérées les sources d'approvisionnement en eau potable et les zones récréatives surveillées. Si une zone récréative connaît des efflorescences prolongées et persistantes et des activités récréatives intensives s'y déroulent (p. ex., dans les zones récréatives qui ne sont pas surveillées ou gérées), les risques d'exposition aiguë peuvent être plus importants (Funari et Testai, 2008).
5.0 Présence dans l'environnement
5.1 Cyanobactéries
Les cyanobactéries sont un composant normal du phytoplancton aquatique et de la communauté benthique, de nombreuses espèces étant présentes dans les eaux douces. Les efflorescences de ces microorganismes dans les eaux de surface ne constituent pas un phénomène nouveau. On a signalé des efflorescences de cyanobactéries, liées à des empoisonnements d'animaux, dès le début des années 1900 au Canada. Cependant, l'enrichissement des eaux de surface en nutriments (eutrophisation) par l'azote et le phosphore a considérablement augmenté la quantité de cyanobactéries et a donc eu un impact important sur la fréquence et la gravité des efflorescences de cyanobactéries (Chorus et Bartram, 1999; Falconer, 2005; Newcombe, 2009; Chorus et Niesel, 2011; Huisman et coll., 2018).
5.1.1 Cyanobactéries planctoniques
La biomasse qui peut être présente dans un plan d'eau donné dépend de la concentration de nutriments nécessaire à sa survie, et les limites supérieures de la biomasse peuvent être estimées à partir des concentrations de phosphore total et d'azote total. Des études menées en Europe indiquent des seuils de phosphore total dans la plage de 25 à 100 µg/L. Sous cette concentration, il n'est plus nécessaire de tenir compte des cyanobactéries dans l'exposition par les eaux utilisées à des fins récréatives (Carvalho et coll., 2013; Phillips et coll., 2008; Chorus et Niesel, 2011). Cette fourchette dépend à un certain degré de la profondeur de la couche d'eau mélangée (épilimnion) (Fastner et coll., 2016). Parmi les autres facteurs qui peuvent favoriser la croissance des cyanobactéries, mentionnons le faible taux d'échange d'eau, une stratification thermique persistante et, pour certaines espèces, une turbidité élevée. Il est peu probable que des efflorescences se produisent dans des eaux acidifiées dont le pH est inférieur à 6-7 (Chorus et Nielsen, 2011). Les cyanobactéries peuvent également se développer dans une plage de températures (Chorus et Bartram, 1999; Falconer, 2005, Chorus and Welker, 2021), bien qu'elles aient des vitesses de croissance relativement faibles par rapport à de nombreuses algues eucaryotes, ce qui peut expliquer en partie pourquoi les efflorescences se produisent généralement à la fin de l'été, après la période nécessaire à la constitution d'une population importante.
La plupart des efflorescences de cyanobactéries sont constituées d'un mélange de clones de cyanobactéries dont la teneur en toxine varie, y compris des clones non toxigènes (Welker, 2021). Les facteurs responsables de la dominance de certains clones dans une efflorescence de cyanobactéries ne sont pas bien compris (Chorus et Bartram, 1999, Falconer, 2005; Welker et coll., 2021). Certaines recherches donnent à penser que la limitation en azote peut favoriser la sélection des clones de Microcystis ou de Planktothrix qui ne produisent pas de microcystines (Gobler et coll., 2016). D'autres recherches tendent à indiquer que l'infection ou la prédation peuvent modifier la composition clonale d'une efflorescence de cyanobactéries (Van Wichelen et coll., 2016). Bien que les facteurs contributifs ne soient pas bien compris, on sait que les variations des concentrations de toxines au sein d'une efflorescence sont principalement dues à l'augmentation et à la diminution des sous-populations de souches ayant des capacités de production de toxines différentes, par opposition aux changements du quota cellulaire de toxines des clones individuels (Welker, 2021). En raison de l'interaction des facteurs influant sur le développement des efflorescences, les concentrations de cyanobactéries et de leurs toxines peuvent varier considérablement d'une année à l'autre (Santé Canada, 2017).
La dissipation des cyanotoxines après la disparition d'une efflorescence de cyanobactéries dépend de nombreux facteurs, dont le degré de dilution, le type de toxine et la vitesse de biodégradation. Le temps nécessaire à la disparition complète de la toxine varie donc selon les sources d'eau. Le processus de biodégradation, notamment sa vitesse, comprend généralement une phase de latence, au cours de laquelle aucune dégradation ne se produit. Cette phase de latence peut correspondre au temps nécessaire pour que la population microbienne (responsable de la dégradation des cyanotoxines) atteigne une densité suffisante ou épuise d'autres sources de nutriments (Smith et coll., 2008). Cette phase de latence peut varier de zéro à 3 semaines (Jones et Orr, 1994; Grutzmacher et coll., 2010; Klitzke et Fastner, 2012), mais il a été démontré qu'elle est réduite dans les eaux exposées de façon répétée aux cyanotoxines (Christoffersen et coll., 2002; Smith et coll., 2008). Après la phase de latence (si elle se manifeste), la biodégradation peut se produire assez rapidement, selon la cyanotoxine. Par exemple, dans le cas de la microcystine-LR dissoute, 90 à 95 % de la dégradation s'est produite en 3 à 4 jours (Jones et Orr, 1994), alors qu'il a été déterminé que la demi-vie de diverses microcystines se situerait entre 0,2 et 5 jours (Zastepa et coll., 2014; Fastner et Humpage, 2021). À l'inverse, pour la cylindrospermopsine, les valeurs observées allaient d'une absence de biodégradation à une demi-vie de 2 à 4 jours (Humpage et Fastner, 2021).
5.1.2 Cyanobactéries benthiques
On dispose de moins d'information sur la présence de cyanobactéries benthiques (p. ex., Lyngbya spp.). Ces cyanobactéries peuvent former des tapis denses de matières cyanobactériennes recouvrant le fond (Chorus et Bartram, 1999; New Zealand Ministry for the Environment and Health, 2009; Wood et coll., 2020). Ces tapis se trouvent généralement dans des eaux claires et peu profondes où la lumière du soleil peut pénétrer jusqu'au fond, bien qu'ils puissent également être présents dans d'autres conditions environnementales. Ces amas, ou tapis, peuvent à l'occasion se détacher du fond et échouer sur la rive, où certains animaux peuvent s'en nourrir. En 2017, des isolats purifiés de tapis benthiques dans trois réservoirs d'eau potable différents en Australie ont été testés positifs pour la production de cyanotoxines (Gaget et coll., 2017a). En outre, l'abondance des tapis benthiques a augmenté dans les lacs fluviaux le long du fleuve Saint-Laurent au Québec et dans les lacs du parc provincial du Whiteshell au Manitoba (Macbeth, 2004; Lajeunesse et coll., 2012; Hudon et coll., 2016). À mesure que les plans d'eau se clarifient en raison de la diminution de l'eutrophisation, les cyanobactéries benthiques ainsi que celles qui se développent sur les macrophytes (p. ex., Tychonema sp..) peuvent devenir plus fréquentes (Fastner et coll., 2016).
5.1.3 Impacts d'un climat changeant
On prévoit que les changements climatiques auront un impact sur les populations de cyanobactéries; toutefois, l'effet de ces changements sur la prolifération des cyanobactéries dépendra des conditions de chaque plan d'eau (Chapra et coll., 2017; Ibelings et coll., 2021b). Des conditions favorables et défavorables peuvent se produire et avoir un impact sur la multiplication des cyanobactéries.
L'augmentation des températures peut favoriser la formation d'efflorescences de cyanobactéries dans certains plans d'eau, soit directement (p. ex., en raison de l'augmentation de la vitesse de croissance des cyanobactéries), soit indirectement (p. ex., en raison de l'augmentation de la stratification thermique du plan d'eau). D'autres effets, tels que les modifications des précipitations ou de la fonte des neiges, peuvent soit favoriser la prolifération des cyanobactéries (p. ex., une charge accrue en nutriments, une sécheresse augmentant le temps de séjour dans l'eau), soit lui être défavorables (p. ex., une hausse des précipitations entraînant un temps de séjour réduit, une activité orageuse diminuant la stratification thermique) (Ibelings et coll., 2021b). Ces effets varieront également en fonction des types de cyanobactéries présents. Par exemple, la vitesse de croissance de Microcystis repose davantage sur la température que celle des autres espèces de cyanobactéries et, par conséquent, l'augmentation de la température de l'eau peut accroître les probabilités de domination d'une efflorescence par Microcystis (Ibelings et al., 2021b). La stratification thermique procure également un avantage de croissance aux cyanobactéries qui peuvent changer activement leur position verticale dans l'eau, mais pas nécessairement aux autres types de cyanobactéries. Il a été démontré que dans le cas de certaines espèces (p. ex., R. raciborskii), ce n'est pas l'augmentation de la température estivale qui a permis à l'organisme de migrer vers des régions plus tempérées, mais le réchauffement des eaux plus tôt au printemps, qui favorise son établissement dans un plan d'eau (Wiedner et coll., 2007). Ce ne sont là que quelques exemples des divers impacts que peut avoir un changement climatique sur les cyanobactéries. D'autres informations sur les impacts potentiels des changements climatiques sont disponibles dans d'autres publications (O'Neil et coll., 2012; Paerl et Paul, 2012; Ibelings et coll., 2021b).
Bien que les répercussions des changements climatiques ne soient pas évidentes, les données canadiennes montrent que les efflorescences de cyanobactéries apparaissent plus tôt au printemps et se prolongent dans l'année (Santé Canada, 2017). Sans égard aux changements du climat, la prolifération des cyanobactéries sera toujours limitée par la quantité de nutriments disponibles. Par conséquent, la réduction de l'eutrophisation des plans d'eau est un élément efficace de la préparation aux changements climatiques (Ibelings et coll., 2021b).
5.2 Cyanotoxines
5.2.1 Microcystines
Les microcystines peuvent être produites par des cyanobactéries planctoniques et benthiques, et il existe des espèces toxiques et non toxiques pour tous les genres prédominants produisant des microcystines (Chorus et Bartram, 1999; Carillo et coll., 2003; Quiblier et coll., 2013; Ngwa et coll., 2014). La détection des gènes responsables de la production de microcystines (gènes mcy) peut être utilisée comme un outil pour distinguer les souches toxiques et non toxiques de Microcystis, Dolichospermum (Anabaena) et Planktothrix qui sont autrement impossibles à distinguer (Davis et coll., 2009; Ngwa et coll., 2014). De nombreuses études ont examiné la présence de cyanobactéries et de leurs toxines au Canada. Certaines de ces études sont présentées dans le tableau 1.
| Endroit | Résumé des conclusions | Référence |
|---|---|---|
Eaux douces partout au Canada (revue, 2001-2011) |
|
Orihel et coll. (2012) |
Eaux douces (QC) (revue, 2007-2012) |
|
Bourbonnais et Robert (2014) |
Baie Missisquoi (QC) |
|
Fortin et coll. (2010); Blais (2014, 2015, 2019); Bowling et coll. (2014) |
Lacs d'eau douce (QC) |
|
Giani et coll. (2005) |
Grands Lacs inférieurs (ON) |
|
Carmichael et Boyer (2016) |
Lac Ontario (ON) |
|
Watson et coll. (2017) |
Lake Érié (ON) |
|
Millie et coll. (2009) |
Lac des Bois (ON/MB) |
|
Chen et coll. (2007); Watson et Kling (2017); Zastepa et coll. (2017) |
Lac Érié (ON) |
|
Rinta-Kanto et coll. (2005) |
Lacs utilisés à des fins récréatives (MB) |
|
Jones et coll. (1998) |
Lacs d'eau douce (AB) |
|
Kotak et coll. (1996) |
TEQ = équivalent toxique. Comprend les concentrations totales de microcystine-LR et les différentes variantes de la microcystine-LR. Ces variantes sont incluses dans le total seulement si un facteur de toxicité équivalente est disponible et est appliqué.
5.2.2 Anatoxines
On retrouve des anatoxines dans le monde entier, y compris dans les régions climatiques tempérées, tropicales et froides. Elles ont des répercussions sur les eaux douces et saumâtres (Testai, 2021). Les efflorescences d'espèces productrices d'anatoxines ne sont pas systématiquement signalées dans les eaux canadiennes, bien qu'elles aient été détectées (Kotak et Zurawell, 2007; Bourbonnais et Robert, 2014; Zastepa et Chemali, 2021). Même si elles sont moins fréquentes que celles des cyanobactéries produisant les microcystines, on a constaté qu'elles étaient la cause d'empoisonnements d'animaux (Hoff et coll., 2007; Backer et coll., 2013). Au Canada, la faible fréquence de détection et les limites des méthodes d'analyse font en sorte qu'il existe peu de données sur les concentrations d'anatoxines dans les eaux naturelles touchées par les efflorescences de cyanobactéries. En outre, les anatoxines dissoutes dans l'eau sont relativement instables et, à ce titre, ne sont pas considérées comme aussi répandues que les microcystines dans les sources d'approvisionnement en eau (Chorus et Bartram, 1999; Bownik, 2010). Par conséquent, elles sont jugées moins préoccupantes que les microcystines du point de vue de l'utilisation des eaux récréatives au Canada. L'écologie des cyanobactéries benthiques fait de plus en plus l'objet de recherches. Des études ont documenté la détection des anatoxines (ainsi que des saxitoxines et la plupart des autres cytotoxines connues) dans les populations de cyanobactéries benthiques (Vis et coll., 2008; Lajeunesse et coll., 2012; Quiblier et coll., 2013; Hudon et coll., 2016). Bien que les risques pour la santé humaine liés aux anatoxines dans les matières benthiques soient probablement très faibles, de nombreux cas d'empoisonnements d'espèces sauvages et d'animaux domestiques ont été relevés (Ibelings et coll., 2021b). Des recherches supplémentaires s'imposent pour déterminer les effets de ces espèces benthiques sur les eaux utilisées à des fins récréatives et quel niveau de risque elles représentent pour la santé humaine.
5.2.3 Cylindrospermopsines
Le plus souvent, on trouve les cylindrospermopsines dans les régions tropicales et subtropicales du globe (Williams et coll., 2007). L'Australie et la Floride en particulier ont signalé de multiples cas de détection de cylindrospermopsines dans les lacs, les rivières et les réservoirs d'eau potable (Falconer et Humpage, 2006; de la Cruz et coll., 2013). Raphisiopsis (Cylindrospermosis) raciborskii est depuis longtemps reconnue comme l'espèce la plus largement répandue capable de produire la cylindrospermopsine. On signale de plus en plus d'espèces potentiellement productrices de toxines dans les eaux douces tempérées, notamment dans le nord des États-Unis et au Canada : dans l'Ohio (Conroy et coll., 2007), au Michigan (Hong et coll., 2006), au Minnesota (Sinha et coll., 2012), au Manitoba (Kling, 2009) et en Ontario (Hamilton et coll., 2005). Cela pourrait indiquer que la répartition géographique de ces espèces s'étend (Graham et coll., 2010; Xie et coll., 2011; Sinha et coll., 2012). Cependant, les souches de Raphisiopsis (Cylindrospermopsis) raciborskii isolées en Amérique du Nord sont non toxiques (Burford et Davis, 2011; Yilmaz et Phlips, 2011; Humpage et Fastner, 2021). La présence de cylindrospermopsines a été décelée, quoique rarement, dans les sources d'eaux de surface au Canada. Dans une étude menée au Québec, elles ont été détectées dans 2 des 12 échantillons d'efflorescence à des concentrations de 0,1 μg/L et de 0,2 μg/L (Roy-Lachapelle et coll., 2015). Cependant, elles n'ont pas été détectées lors d'une analyse ultérieure d'échantillons d'efflorescence (Fayad et coll., 2015). Elles ont également été décelées dans une étude des installations de traitement d'eau potable au Québec, dans l'écume qui s'était accumulée dans le système de filtration. Les espèces de cyanobactéries dominantes dans la source d'approvisionnement en eau et dans le lit de boue étaient M. aeruginosa et Dolichospermum (Anabaena) (Zamyadi et coll., 2012a). La plupart des eaux de surface analysées pour détecter les cylindrospermopsines au Canada ont livré des résultats négatifs (Carmichael et Boyer, 2016). Des cylindrospermopsines ont été détectées à l'occasion dans les eaux de surface aux États-Unis (Boyer, 2007; US EPA, 2015a), généralement isolées d'efflorescences dominées par Chrysosporum (Aphanizomenon) ou Dolichospermum (Anabaena) et Microcystis (Yilmaz and Phlips, 2011; US EPA, 2015a).
5.2.4 Autres toxines cyanobactériennes
On a signalé des efflorescences de Nodularia dans des lacs d'eau saumâtre en Australie et en Nouvelle-Zélande, ainsi que dans la mer Baltique. En règle générale, ces espèces préfèrent les eaux saumâtres et salines, bien que des efflorescences aient été relevées dans des lacs d'eau douce en Turquie (Akcaalan et coll., 2009). Nodularia a également été trouvé dans deux lacs américains (Beutel et coll., 2001). À ce jour, les espèces de Nodularia et Nostoc n'ont pas été trouvées dans les eaux canadiennes. Elles ne sont donc pas considérées comme une menace importante pour la santé publique dans les eaux utilisées à des fins récréatives au Canada.
La répartition géographique de Lyngbya est vaste, puisque ce genre englobe des espèces de cyanobactéries d'eau douce et d'eau de mer. Les efflorescences benthiques de Lyngbya se manifestent habituellement dans les climats plus chauds, notamment en Floride et à Hawaï, bien que certaines espèces soient courantes dans les lacs nord-américains et que de grands tapis apparaissent dans le lac Érié et le fleuve Saint-Laurent (Osborne et coll., 2001; Bridgeman et Penamon, 2010; Hudon et coll., 2014). Les dermatotoxines produites par Lyngbya sont principalement attribuables à des espèces de cyanobactéries marines. Néanmoins, elles demeurent préoccupantes dans les lacs et les rivières d'eau douce.
Les efflorescences contenant des saxitoxines sont très répandues dans les eaux marines en Australie (Osborne et coll., 2001), et des efflorescences toxiques ont également été détectées dans les eaux douces de nombreuses régions du monde, notamment (mais pas uniquement) au Brésil, en Europe et aux États-Unis (Teneva et coll., 2003; dos Anjos et coll., 2006; Vijayavel et coll., 2013). À ce jour, les saxitoxines ne sont pas considérées comme une préoccupation importante dans les eaux canadiennes utilisées à des fins récréatives. Toutefois, la détection d'analogues de saxitoxines dans les efflorescences benthiques de Lyngbya le long du fleuve
Saint-Laurent et dans deux de ses lacs fluviaux semble indiquer qu'une surveillance continue est indiquée (Lajeunesse et coll., 2012; Hudon et coll., 2016). Lorsque des efflorescences benthiques de Lyngbya sont trouvées dans des eaux utilisées à des fins récréatives, on pourra mieux déterminer les risques pour la santé en procédant à une analyse visant à déterminer la présence de toxines dans l'efflorescence.
5.3 Lutte contre les efflorescences de cyanobactéries
L'élément le plus efficace d'une stratégie à long terme visant à réduire la fréquence des efflorescences de cyanobactéries planctoniques consiste à contrôler l'apport de nutriments dans le plan d'eau, en particulier l'apport en phosphore et en azote, car leur disponibilité régule la croissance des cyanobactéries (Downing et coll., 2001; Jančula et Maršálek, 2011; Paerl et coll., 2011a; Matthijs et coll., 2012; Merel et coll., 2013; Glibert et coll., 2016; Hamilton et coll., 2016). Il se peut cependant que cela ne soit pas possible partout. Dans certains plans d'eau, une source importante de nutriments peut provenir de la charge interne de phosphore contenue dans les sédiments. Il est important d'établir si cette charge en phosphore provient de la dégradation de la matière organique récemment sédimentée et est donc susceptible de diminuer une fois que la charge externe diminue, ou s'il s'agit probablement d'un problème à long terme nécessitant des mesures correctives précises (p. ex., dans les plans d'eau où le taux d'échange d'eau est faible). Lorsque l'apport de nutriments résulte d'influences externes, une des façons de réduire les nutriments est de contrôler efficacement les pratiques agricoles, les eaux usées municipales et les pratiques d'élimination des déchets municipaux dans le bassin versant. Les précipitations peuvent avoir un effet sur l'apport de nutriments, par les effluents d'eaux usées et industriels, et le ruissellement provenant des zones urbaines, agricoles ou déboisées. Par conséquent, il sera important d'implanter une stratégie de lutte contre les nutriments qui tient compte du lien entre les changements climatiques et la charge en nutriments (Paerl et coll., 2011b; Carey et coll., 2012). Par ailleurs, on poursuit les efforts visant à élaborer des stratégies d'adaptation qui tiennent compte de la variabilité climatique croissante et des extrêmes météorologiques (Hamilton et coll., 2016; Paerl, 2017). Outre l'apport de nutriments, on a signalé que les herbicides issus des activités agricoles peuvent améliorer les conditions de croissance des cyanobactéries en diminuant les algues eucaryotes, éliminant ainsi cette espèce compétitrice (Beaulieu et coll., 2014).
D'autres approches ont également été utilisées pour réduire les efflorescences de cyanobactéries, généralement lorsqu'une action immédiate est nécessaire ou lorsque la gestion des nutriments est impossible. Il peut s'agir d'un contrôle direct ou indirect des cyanobactéries. On a employé des méthodes de lutte directe, par exemple l'ajout de sulfate de cuivre ou d'autres algicides aux efflorescences toxiques matures, mais cette approche n'est généralement pas recommandée. Même si elle entraîne la destruction des cellules cyanobactériennes, cela provoque également la libération de cyanotoxines intracellulaires dans les eaux environnantes si elles sont présentes dans les cellules. Jones et Orr (1994) ont signalé que la présence de microcystine-LR était décelable jusqu'à 21 jours après le traitement à l'algicide d'un lac utilisé à des fins récréatives ayant été atteint par une efflorescence toxique de Microcystis M. aeruginosa. Zastepa et coll. (2014) ont signalé des délais encore plus longs (soit jusqu'à 9,5 semaines) pour que les concentrations tombent sous 20μg/L dans un lac présentant très peu de dilution. On a également démontré que des traitements répétés avec des algicides peuvent entraîner le développement de cellules résistantes aux algicides (Garcia-Villada et coll., 2004). L'utilisation des algicides peut être recommandée comme mesure d'urgence dans les premiers stades d'une efflorescence, lorsque les concentrations de toxines qui en résultent et qui sont libérées par les cellules lysées sont faibles. Par ailleurs, il convient de mentionner que les algicides risquent également d'avoir des effets nocifs sur le fonctionnement des écosystèmes aquatiques, ce qui constitue une autre raison de ne pas y recourir. L'ajout de peroxyde d'hydrogène (H2O2) a également été utilisé pour lutter contre les efflorescences de cyanobactéries, car ces dernières sont plus sensibles au H2O2 que les autres organismes phytoplanctoniques (p. ex., les algues vertes, les diatomées) (Barroin et Feuillade, 1986; Barrington et Ghadouani, 2008). Le H2O2 présente l'avantage de se dégrader rapidement en hydrogène et en oxygène dans l'écosystème aquatique et, comme il s'agit d'un oxydant puissant, il peut également contribuer à la dégradation des cyanotoxines présentes dans l'efflorescence (Matthijs et coll., 2012). L'utilisation du H2O2 présente également des inconvénients, notamment la nécessité de manipuler de grands volumes de solution concentrée, la nécessité d'une distribution uniforme dans le plan d'eau et le besoin potentiel de déterminer les concentrations de H2O2 nécessaires en fonction du site (Matthijs et coll., 2012). Il existe également des méthodes indirectes de lutte contre les proliférations de cyanobactéries. Il peut s'agir du mélange artificiel et du rinçage. Avant de recourir à des mesures directes ou indirectes, il convient de prendre en compte les caractéristiques chimiques, physiques et biologiques du bassin versant, ainsi que les coûts, l'acceptabilité environnementale et sociale, et toute exigence réglementaire applicable à l'approche envisagée. Ce n'est qu'après une évaluation scientifique approfondie que l'on prendra une décision sur la meilleure solution pour lutter contre les cyanobactéries. De plus amples renseignements sur les mesures de lutte figurent dans les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017).
6.0 Indicateurs de cyanobactéries et de toxines cyanobactériennes
Il existe divers indicateurs pouvant être utilisés pour aider à évaluer les risques des cyanotoxines pour la santé dans les zones récréatives, et pour recueillir des informations sur la présence des cyanobactéries planctoniques afin de faciliter l'évaluation et la gestion des risques. L'ensemble des méthodes décrites dans les présentes recommandations offre une approche flexible pour comprendre la toxicité potentielle des efflorescences. Elles peuvent être utilisées seules ou en combinaison, selon le choix des autorités compétentes et compte tenu du plan de gestion de la qualité des eaux utilisées à des fins récréatives en vigueur. Le choix des indicateurs utilisés reposera également sur l'accès local aux méthodes. L'utilisation d'indicateurs pour évaluer les risques pour la santé présente des avantages et des limites (décrits ci-dessous). Il convient de noter en particulier que la nature conservatrice des indicateurs signifie qu'ils sont susceptibles de surestimer le risque.
6.1 Dénombrement cellulaire des cyanobactéries
Le dénombrement cellulaire total des cyanobactéries est une mesure de la biomasse des cyanobactéries planctoniques qui peut servir à indiquer qu'une efflorescence se développe.
Comme toutes les efflorescences doivent être présumées toxiques, sauf indication contraire, le dénombrement cellulaire des cyanobactéries peut être utilisé comme un indicateur des effets potentiels sur la santé. Puisque la recommandation relative au dénombrement cellulaire des cyanobactéries repose sur des hypothèses prudentes (voir la section 8.2), il est fort probable qu'une analyse subséquente des toxines indique un risque beaucoup plus faible que celui qui est indiqué par le dénombrement cellulaire à lui seul. Les résultats du dénombrement cellulaire total des cyanobactéries peuvent servir à étayer les décisions concernant la nécessité d'une surveillance supplémentaire ou d'analyses des toxines. Comme il est indiqué ci-dessus, le contact direct avec les matières cyanobactériennes a été associé à des effets sur la santé, notamment des effets allergiques ou irritants (Backer et coll., 2015) et des symptômes gastro-intestinaux potentiels (Lévesque et coll., 2014, 2016). La concentration de cellules cyanobactériennes à laquelle ces effets sur la santé sont observés est très variable, et dépend de facteurs tels que les personnes exposées (c.-à-d. celles qui ont une prédisposition allergique) et la composition des cyanobactéries présentes. Il existe également une incertitude quant à la composante de l'efflorescence cyanobactérienne responsable des maladies associées (Welker, 2021). La prise en compte de cette variabilité aboutirait à l'élaboration d'indicateurs inutilement prudents pour la plupart des situations, et c'est pourquoi les indicateurs présentés ici sont basés sur la présence potentielle de microcystines. De plus amples renseignements sur le calcul du nombre total de cellules de cyanobactéries figurent à la section 8.2.
Un inconvénient important du dénombrement cellulaire des cyanobactéries est la diversité de forme et de taille de ces cellules (Wood et coll., 2008). Selon les types de cyanobactéries présentes, les concentrations de cellules cyanobactériennes pourraient dépasser la valeur recommandée sans qu'il y ait de preuve visuelle d'une efflorescence de plancton. Par exemple, les plans d'eau qui contiennent de fortes concentrations de picocyanobactéries, qui sont de petites cyanobactéries d'un diamètre inférieur à 2 μm, pourraient dépasser les valeurs recommandées sans qu'il y ait de preuve d'efflorescence et sans risque accru pour la santé humaine. C'est pourquoi, lors du dénombrement cellulaire total des cyanobactéries, il est important de tenir compte également des types de cyanobactéries identifiées et, si possible, de leur potentiel de production de toxines. L'identification des types de cyanobactéries présentes est également la première étape du calcul du biovolume de cyanobactéries, paramètre dont il a été démontré qu'il était étroitement lié à la concentration de cyanotoxines (voir la section 6.2). Il est également important de noter que lorsque le nombre total de cellules diminue pendant la dissipation d'une efflorescence, il peut y avoir encore des concentrations élevées de cyanotoxines présentes, car les toxines intracellulaires sont libérées des cellules mourantes dans les eaux environnantes. Cela est important dans le cas des toxines généralement à l'intérieur des cellules intactes, comme les microcystines, mais cela est moins préoccupant pour d'autres toxines, comme la cylindrospermopsine, qui sont libérées naturellement par les cellules sans égard à la lyse cellulaire.
6.2 Biovolume de cyanobactéries
Le biovolume de cyanobactéries est une mesure de la biomasse des cyanobactéries planctoniques présentes dans un échantillon d'eau. Il s'obtient à partir des dénombrements cellulaires en déterminant le volume cellulaire moyen pour chaque unité ou taxon dénombré, puis en multipliant cette valeur par le nombre de cellules de l'échantillon (Padisák et coll., 2021). On peut utiliser ce paramètre pour révéler qu'une efflorescence se forme et peut présenter un risque pour la santé humaine. Le biovolume est une évaluation plus précise de la biomasse des cyanobactéries que le dénombrement cellulaire total, car ce paramètre tient compte de la surface de la cellule, ainsi que de la masse de toute matière ou biomasse cellulaire (Saccà, 2016). Le recours à la mesure du biovolume, par opposition au dénombrement cellulaire total des cyanobactéries, signifie que les petites cellules cyanobactériennes, dont les picocyanobactéries susmentionnées, n'ont pas un grand impact sur la concentration calculée. Comme pour le dénombrement cellulaire total, les types de cyanobactéries identifiés, ainsi que leur potentiel de production de toxines, doivent être pris en compte pour éviter d'émettre des avis inutiles d'interdiction de baignade ou de contact. On a constaté que les concentrations de cyanotoxines sont plus directement liées à la biomasse cellulaire qu'au nombre de cellules (Ibelings et coll. 2014; Dong et coll., 2016). Tout comme le dénombrement cellulaire total des cyanobactéries, les concentrations de cyanotoxines présentes peuvent être élevées pendant et juste après la dissipation d'une efflorescence, mais le biovolume mesuré sera faible. De plus amples renseignements sur le calcul de la valeur recommandée du biovolume figurent à la section 8.3.
6.3 Chlorophylle a
La chlorophylle aest un pigment vert photosynthétique présent dans les cyanobactéries et d'autres organismes du phytoplancton (Fiedor et coll., 2008; Søndergaard et coll., 2011). Elle est fréquemment utilisée comme indice d'eutrophisation et peut être employée dans le cadre d'un système d'alerte aux cyanobactéries pour déclencher des études et des actions supplémentaires (Bartram et coll., 1999). La chlorophylle aest particulièrement utile si on peut la combiner avec des observations qualitatives rapides par microscopie pour déterminer si la majorité du phytoplancton est constitué ou non de cyanobactéries. Pour cela, il faudrait identifier les cyanobactéries au niveau du genre, ce qu'un microbiologiste ayant une certaine formation en microscopie pourrait facilement faire. Les mesures de la chlorophylle aprésentent un avantage par rapport à d'autres indicateurs de la biomasse, dans la mesure où la méthode de détection est plus simple et si des méthodes in situ sont disponibles (voir la section 7.0). Comme d'autres organismes du phytoplancton contiennent également de la chlorophylle a, la relation entre la chlorophylle aet la biomasse des cyanobactéries est plus étroite lorsque les cyanobactéries sont les organismes principaux ou dominants présents. Des corrélations positives ont été trouvées entre les concentrations de chlorophylle aet la biomasse de cyanobactéries ou les concentrations de cyanotoxines dans diverses études (Huot et coll., 2007; Izydorczyk et coll., 2009; Du et coll., 2014; Yuan et coll., 2014), mais le principal avantage de la surveillance de la chlorophylle adans le cadre d'un système d'alerte aux cyanobactéries est la plus grande couverture temporelle et spatiale possible à un coût plus faible et à moindre effort.
La phycocyanine, un pigment photosynthétique accessoire de la chlorophylle a, a également été étudiée comme paramètre possible pour la surveillance des cyanobactéries. Les concentrations de ces deux pigments sont fortement corrélées et, comme pour la chlorophylle a, des corrélations positives ont été observées entre la teneur en phycocyanine et la biomasse de cyanobactéries (Brient et coll., 2008; McQuaid et coll., 2011; Kasinak, 2015; Pace et coll., 2017). Un avantage important de la phycocyanine est que ce pigment est plus spécifique aux cyanobactéries, et diverses études ont montré qu'elle est un prédicteur précis de l'abondance des cyanobactéries (Gregor et coll., 2007; Brient et coll., 2008; Ibelings et coll., 2014; Macario et coll., 2015). Il a été établi que la présence de producteurs de microcystines connus est fortement corrélée avec les concentrations de phycocyanine (Oh et coll., 2001). Toutefois, elle n'est pas directement liée à la teneur en microcystines cellulaires, car toutes les cyanobactéries possèdent ce pigment. Bien qu'aucune valeur recommandée n'ait été formulée pour la phycocyanine, ce pigment pourrait également être utilisé dans le cadre d'un système d'alerte signalant le développement d'une efflorescence de cyanobactéries. Son utilisation nécessiterait l'établissement de ratios propres au site entre la phycocyanine et la mesure d'intérêt (p. ex., microcystines, biovolume de cyanobactéries).
6.4 Méthodes moléculaires
D'autres mesures peuvent être utilisées pour indiquer la présence de cyanobactéries et de leurs toxines potentielles. En particulier, une variété de méthodes moléculaires peuvent servir à détecter les gènes correspondant à des espèces précises de cyanobactéries, ainsi que la présence ou l'expression de gènes produisant des toxines. Des études faisant appel à des techniques moléculaires ont révélé des corrélations entre, d'une part, les résultats du dénombrement cellulaire et la concentration de microcystine, respectivement obtenus par microscopie et par méthode ELISA (essai d'immuno-absorption enzymatique), et, d'autre part, les concentrations de copies des gènes ou l'expression génique active (Vaitomaa et coll., 2003; Sipari et coll., 2010; Chiu et coll., 2017; Lu et coll., 2020); une absence de corrélation a aussi été signalée (Beversdorf et coll., 2015). L'expression du gène associé à la microcystine, par opposition à sa simple présence, a aussi eu une certaine valeur prédictive à l'égard des concentrations de microcystine (Lu et coll., 2020).
Les méthodes moléculaires sont un domaine de recherche très prometteur et en constante évolution. La recherche dans ce domaine continuera d'être suivie. À l'heure actuelle, pour les gestionnaires de l'eau qui ont accès à des laboratoires spécialisés dans les méthodes moléculaires, celles-ci peuvent être utiles comme outil de dépistage pour déterminer la présence d'espèces de cyanobactéries et fournir une indication du potentiel de production de toxines. De plus amples renseignements sur les méthodes moléculaires figurent à la section 7.0.
7.0 Méthodes d'analyse
Un examen complet des méthodes d'analyse et des limites associées à chaque méthode figure dans la publication Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017). Des renseignements sur les méthodes de surveillance employées pour les eaux utilisées à des fins récréatives peuvent aussi être trouvés dans un document de l'Environmental Protection Agency des États-Unis (US EPA, 2017) et dans Meriluoto et coll., 2017. Il n'existe actuellement pas de méthode unique qui permette d'identifier et de quantifier simultanément tous les différents types de cyanotoxines et leurs variantes (Merel et coll., 2013). Un aperçu des méthodes couramment utilisées est présenté ci-dessous.
7.1 Microcystines
Afin de comparer la concentration de microcystines dans un échantillon aux valeurs recommandées, il est nécessaire de déterminer la concentration de microcystines totales, ce qui comprend les microcystines libres et les microcystines liées aux cellules. Des étapes de traitement initial sont requises pour extraire les toxines liées aux cellules et pour concentrer les toxines dissoutes dans l'échantillon. Ces étapes peuvent comprendre la concentration des cellules cyanobactériennes, leur lyse et l'extraction et la purification des toxines.
Les méthodes d'analyse des microcystines actuellement utilisées dans les laboratoires commerciaux et de recherches comprennent :
- la méthode ELISA (essai d'immuno-absorption enzymatique)
- l'analyse physico-chimique par séparation chromatographique, c.-à-d. la chromatographie liquide (CL) et ses variantes, comme la chromatographie liquide à haute performance (CLHP) et la chromatographie liquide à ultra haute performance (CLUHP) et détection par absorbance UV avec détecteur à réseau de photodiodes (RPD) ou spectrométrie de masse (SM);
- les essais d'inhibition de la protéine phosphatase (PPIA).
La chromatographie liquide couplée à la spectrométrie de masse est la méthode de laboratoire la plus couramment utilisée pour identifier et quantifier les variantes de microcystines, et constitue l'étalon de référence par rapport auquel les autres méthodes sont jugées. Il existe des protocoles normalisés pour cette méthode, et de nombreux laboratoires d'analyse possèdent l'instrumentation nécessaire pour réaliser cette analyse longue et techniquement exigeante. Une des limites de la spectrométrie de masse est la nécessité de disposer d'étalons de référence certifiés pour obtenir des résultats quantitatifs. Ces étalons ne sont pas disponibles pour toutes les variantes de microcystines pertinentes. En revanche, avec la méthode UV-RPD, seulement une petite quantité de microcystines est nécessaire pour quantifier les pics de toutes les autres microcystines (identifiées par leur spectre d'absorption caractéristique) dans un échantillon. Cependant, cette méthode est nettement moins sensible que la CL-SM, et présente une limite de détection proche de 1 μg/L (Santé Canada, 2017).
Les trousses d'essais ELISA et PPIA pour utilisation sur le terrain sont utiles, car elles fournissent une estimation des concentrations de microcystines dissoutes dans un échantillon (la lyse est nécessaire pour mesurer les microcystines intracellulaires), dans certaines plages de concentrations ou à des valeurs supérieures ou inférieures à une concentration donnée. Les méthodes ELISA et PPIA sont rapides et sensibles. Bien qu'elles ne soient pas suffisamment précises pour distinguer les différentes variantes des microcystines, elles peuvent, en pratique, suffire aux évaluations courantes des risques, lorsque l'on suppose que toutes les microcystines sont aussi toxiques que la microcystine-LR. Ces trousses ne donnent pas de résultats quantitatifs permettant de déterminer si les échantillons d'eau respectent la valeur recommandée, mais on peut les utiliser comme outil de détection pour déterminer la présence ou l'absence de toxines dans les eaux utilisées à des fins récréatives (Watson et coll., 2017). L'autorité responsable doit également savoir que certaines trousses d'essais détectent à la fois les microcystines et les nodularines.
7.2 Cellules cyanobactériennes, biovolumes et chlorophylle a
Les concentrations de cellules cyanobactériennes sont déterminées par dénombrement direct par microscopie à l'aide d'une chambre de dénombrement de dimensions connues, puis par rétrocalcul selon le volume de l'échantillon original (APHA, 2017; Chorus et Bartram, 1999). Les cellules cyanobactériennes sont de forme et de taille variées (de forme ronde à filamenteuse). Des groupes de cellules peuvent exister en colonies denses ou en longs filaments et les populations peuvent être composées d'un mélange de ces types et groupes de cellules. Il peut être difficile d'identifier les cyanobactéries au niveau de l'espèce, et cette difficulté est exacerbée par le fait que les principales caractéristiques morphologiques utilisées pour identifier les différents taxons peuvent changer selon l'environnement et le stade de croissance (Chorus et Bartram, 1999; Yoshida et coll., 2008; Carmichael et Boyer, 2016). Toutefois, aux fins de l'évaluation des risques, l'identification au niveau du genre est souvent suffisante. Le personnel de laboratoire peut donc apprendre à compter et à identifier les cellules cyanobactériennes s'il a une certaine expérience en microscopie et reçoit une formation pour identifier et quantifier les cyanobactéries.
Comme pour le dénombrement des cellules cyanobactériennes, on détermine les biovolumes en comptant d'abord au microscope le nombre de chaque espèce de cyanobactéries présente dans l'échantillon, puis on utilise le volume cellulaire moyen pour calculer les concentrations totales en biovolume (CEAEQ, 2012a, 2012b). Les volumes cellulaires moyens de nombreuses espèces de cyanobactéries courantes ont été publiés (Wood et coll., 2008; CEAEQ, 2012a, 2012 b). On peut aussi calculer le biovolume de chacune des cellules au lieu d'utiliser un volume cellulaire moyen (Zohary et coll., 2016). Les estimations de biovolume présentent de nombreuses difficultés méthodologiques similaires à celles du dénombrement cellulaire, et se compliquent davantage parce que le volume cellulaire peut varier considérablement au sein d'une même espèce, ainsi qu'entre les bassins versants et les régions.
Les mesures de la chlorophylle apeuvent être plus faciles à réaliser que le dénombrement cellulaire ou le calcul du biovolume des cyanobactéries. Ce pigment est facilement détecté à l'aide de méthodes spectrophotométriques, fluorimétriques ou par CLHP (Millie et coll., 2010; APHA, 2017). La surveillance in situ à l'aide de sondes submersibles a également été utilisée (Zamyadi et coll., 2012b). Il convient de noter que les mesures de la fluorescence de la chlorophylle dépendent des conditions environnementales et de l'état physiologique des cellules (Ibelings et coll. 2014), et dans certains cas, des corrections s'imposent pour obtenir des mesures précises (Bertone et coll., 2019).
7.3 Méthodes moléculaires
Les méthodes moléculaires sont largement utilisées pour détecter le matériel génétique dans les échantillons prélevés dans l'environnement. De nombreux outils moléculaires ont été mis au point pour détecter les cyanobactéries (Kurmayer et coll., 2017). Par exemple, on fait régulièrement état du recours à la PCR quantitative (qPCR) dans les publications. Ces méthodes utilisent des amorces ciblant des fragments de gènes propres à l'espèce pour distinguer les différentes espèces d'une population de cyanobactéries. Des amorces ont également été mises au point pour détecter les gènes de toxines, ce qui permet de savoir si les cellules sont capables de produire des toxines (Rinta-Kanto et coll., 2005). Par exemple, le nombre de cellules de Microcystis et le gène producteur de microcystines peuvent être détectés en utilisant une région de l'ARNr 16S propre à toutes les cellules de Microcystis et au gène mcy, respectivement (Tillett et coll., 2000; Kurmayer et Kutzenberger, 2003; Fortin et coll., 2010; Chiu et coll., 2017). La qPCR avec transcriptase inverse (RT-qPCR) a également été utilisée pour détecter l'expression du gène de la microcystine (Sipari et coll., 2010; Lu et coll., 2020). Des amorces ont également été publiées pour Raphisiopsis (Cylindrospermopsis), les cyanobactéries productrices de cylindrospermopsines, les saxitoxines et les nodularines (Chiu et coll., 2017; Gaget et coll., 2017b). Les recherches se poursuivent sur de nouvelles amorces). La mise au point d'outils moléculaires est un domaine de recherche très prometteur et en constante évolution, qui permettra d'améliorer les méthodes dont disposent les autorités responsables pour prendre des décisions de santé publique.
8.0 Justification
La valeur recommandée pour les microcystines totales dans les eaux utilisées à des fins récréatives au Canada est basée sur l'approche utilisée pour le calcul de la concentration maximale acceptable (CMA) pour la microcystine-LR, figurant dans les Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les toxines cyanobactériennes (Santé Canada, 2017). En bref, l'exposition aux microcystines devrait être de courte durée, et la meilleure étude disponible pour représenter ce type d'exposition est l'étude d'exposition à court terme menée par Heinze et coll. (1999). Dans cette étude d'une durée de 28 jours, la voie d'exposition était l'ingestion par l'eau potable. Il s'agit d'un changement par rapport à la valeur pour les microcystines totales figurant dans les Recommandations pour la qualité de l'eau potable au Canada de 2012, qui se basaient sur l'étude d'exposition à plus long terme (13 semaines) publiée par Fawell et coll., 1999. L'évaluation complète des risques pour la santé, y compris la manière dont l'étude clé a été sélectionnée, est décrite dans Santé Canada (2017). Le changement d'étude clé, ainsi que les modifications apportées aux facteurs d'incertitude et aux facteurs d'exposition, a entraîné une diminution de la valeur recommandée pour les microcystines totales. Les valeurs recommandées pour les cellules cyanobactériennes totales, le biovolume de toutes les cyanobactéries et la chlorophylle atotale sont basées sur la relation avec les microcystines. Aucune recommandation n'est établie pour d'autres cyanotoxines, notamment l'anatoxine-a, la saxitoxine et la cylindrospermopsine, car les données sur la santé et sur l'exposition à ces toxines sont limitées (voir Santé Canada, 2017).
Les valeurs recommandées visent à assurer une protection contre le risque d'exposition aux microcystines par ingestion accidentelle de l'eau et contre d'autres effets nocifs qui pourraient résulter d'une exposition à de fortes concentrations de cyanobactéries. Les valeurs recommandées sont basées sur l'exposition des enfants, car ceux-ci passent souvent plus de temps dans l'eau que les adultes et sont plus susceptibles d'avaler par inadvertance de l'eau compromise par des toxines.
8.1 Microcystines totales
La valeur recommandée pour les microcystines totales est calculée d'après la toxicité de la microcystine-LR et vise à assurer une protection contre l'exposition aux autres variantes de la microcystine qui peuvent être présentes. Pour la microcystine-LR, l'apport quotidien tolérable (AQT) pour l'exposition aux eaux récréatives est calculé comme suit :
AQT = LOAEL / IF = (50 µg/kg p.c./jour) / 900 ≈ 0,056 µg/kg p.c./jour
où :
- 50 μg/kg p.c./jour = dose minimale avec effet nocif observé (la LOAEL) pour une augmentation du poids du foie et des lésions hépatiques légères à modérées avec hémorragie chez le rat, selon Heinze (1999);
- 900 est le facteur d'incertitude (FI), soit ×10 pour la variabilité intraspécifique, ×10 pour la variabilité interspécifique, ×3 pour les lacunes dans la base de données sur les effets sur la santé et ×3 pour l'utilisation d'une dose minimale avec effet nocif observé (LOAEL) au lieu d'une dose sans effet nocif observé (NOAEL).
Cet AQT permet de calculer la valeur basée sur la santé (VBS) pour les microcystines totales, comme suit :
VBS = (0,056 µg/kg p.c./jour × 23 kg p.c. × 0,80) / 0,103 L/j = 10,0 µg/L pour les microcystines totales
où :
- 0,056 µg/kg p.c./j = l'AQT calculé ci-dessus;
- 23 kg p.c. = poids moyen d'un enfant de 4 à 8 ans (Santé Canada, non publié);
- 0,80 = facteur d'attribution de la « valeur plafond », car la majeure partie de l'exposition aux microcystines devrait se faire par ingestion d'eau pendant les activités récréatives; la valeur 0,20 restante permet de tenir compte d'autres expositions non négligeables à d'autres milieux (Krishnan et Carrier, 2013);
- 0,103 L/j (103 mL/j) = la quantité estimée d'eau ingérée accidentellement par jour lors d'activités nautiques récréatives par un enfant de 6 à 10 ans (38 mL/h × 2,7 h/j).
La quantité d'eau ingérée accidentellement par jour est calculée d'après les taux d'ingestion d'une étude américaine publiée par Dufour et coll. (2017). L'étude a porté sur 549 participants de 6 ans à l'âge adulte, qui s'adonnaient à des activités récréatives dans une piscine. L'utilisation de la piscine a permis aux chercheurs de déterminer la quantité d'eau ingérée par participant d'après une analyse de l'urine sur 24 heures pour un composé chimique chloré présent dans l'eau de la piscine. Le taux d'ingestion moyen de tous les participants à l'étude était de 32 mL/h. Comme les enfants constituent la population cible en raison de leur exposition accrue (voir ci-dessus) aux activités récréatives dans l'eau, le taux d'ingestion moyen des enfants a été utilisé au lieu du taux d'ingestion de la population générale. Les taux d'ingestion moyens de Dufour (2017), ventilés par catégories d'âge, sont publiés par l'Environmental Protection Agency des États-Unis (US EPA, 2019). Pour les enfants de 6 à 10 ans, cela correspond à un taux moyen d'ingestion accidentelle de 38 mL/h. Le taux d'ingestion moyen des adolescents (11-17 ans) était légèrement supérieur (40 mL/h). Cependant, comme leur poids corporel moyen est également plus élevé (42 kg pour les 9-13 ans; Santé Canada, non publié), les plus jeunes enfants demeurent le groupe le plus sensible. Cette étude ne fournit aucune donnée sur l'ingestion chez les enfants de moins de 6 ans. Les taux d'ingestion utilisés sont corroborés par ceux obtenus précédemment par Dufour et coll. (2006) dans une étude pilote similaire (moyenne de 21 mL/h pour les adultes et de 49 mL/h pour les enfants), et sont plus prudents que les résultats obtenus dans une étude distincte, de moindre envergure, en piscine par Suppes et coll. (2014) (moyenne de 3,5 mL/h pour les adultes et de 25,7 mL/h pour les enfants). Il n'est pas surprenant que les enfants consomment davantage d'eau lorsqu'ils s'amusent dans l'eau, car leurs activités de jeu augmentent leurs chances d'avaler de l'eau, notamment souffler de l'eau par la bouche, faire des bulles, faire le bouchon et s'éclabousser.
La durée de l'exposition aux eaux utilisées à des fins récréatives est basée sur les données recueillies lors de l'enquête National Human Activity Pattern Survey, aux États-Unis, présentées dans le document de l'US EPA « Exposure Factors Handbook ». Les données américaines ont été utilisées, car on n'a pas recueilli de telles données pour la population canadienne. Les données montrent que les enfants de 5 à 11 ans passent le plus de temps (dans les piscines extérieures) avec une exposition moyenne de 2,7 h/j (164,2 minutes/j), tandis que les enfants de 1 à 4 ans y passent 1,4 h/j (85,6 minutes/j) et les 12 à 17 ans y passent 1,6 h/j (97,0 minutes/j) (US EPA, 2011). Une autre grande étude, menée aux Pays-Bas, a montré que le temps moyen de séjour pour les enfants de 0 à 14 ans était de 1,4 heure (81 minutes), 1,3 heure (79 minutes) et 1,1 heure (65 minutes) dans les piscines, les eaux douces et les eaux marines, respectivement (Schets et coll., 2011). Le poids corporel moyen des enfants au Canada correspondant à la durée d'exposition la plus longue est de 23 kg (pour les 4 à 8 ans, Santé Canada, non publié). Comme les jeunes enfants (1 à 4 ans) passent environ la moitié moins de temps que les enfants de 5-11 ans dans une piscine, la valeur indicative calculée pour des enfants plus âgés assure également la protection pour ce groupe d'enfants plus jeunes.
8.2 Cellules cyanobactériennes totales
La recommandation pour les cellules cyanobactériennes totales représente une indication générale du potentiel de développement d'efflorescences et vise à assurer une protection contre l'exposition à des niveaux élevés de toxines de cyanobactérie et à des densités élevées de matières cyanobactériennes. Le calcul de la valeur recommandée pour les microcystines utilise une valeur de référence pour le quota de toxines de type microcystine par cellule de Microcystis.
Recommandation = (10,0 µg/L × 10−3 L/mL) / (2,0 × 10−7 µg/cellule) ≈ 50 000 cellules/mL pour les cyanobactéries totales
où :
- 10,0 µg/L = valeur basée sur la santé pour les microcystines totales dans les eaux utilisées à des fins récréatives, calculée à la section précédente;
- 2,0 × 10−7µg/cellule = quota de toxines pour les microcystines totales par cellule de
- Microcystis (Fitzgerald et coll., 1999; OMS, 2003);
- 10−3 L/mL = facteur de conversion des litres en millilitres.
Le quota moyen de toxines utilisé pour calculer cette valeur recommandée a également été utilisé ailleurs dans le monde pour calculer la valeur recommandée pour le dénombrement des cellules cyanobactériennes totales (NHMRC, 2008; OMS, 2003). D'autres teneurs en microcystines signalées pour les cellules de Microcystis dans les milieux naturels varient de 1,9 × 10−9 µg/cellule à 5,5 × 10−7 µg/cellule (Kurmayer et coll., 2003; Lyck et coll., 2003; Fahnenstiel et coll., 2008; Fastner et Humpage, 2021). Cette approche suppose que toutes les cellules de l'efflorescence produisent des microcystines, ce qui donne une estimation prudente du nombre de cellules cyanobactériennes. Cette valeur de dénombrement total des cellules exclut généralement les cellules de picocyanobactéries, car il s'agit de petites cyanobactéries qui peuvent excéder la valeur recommandée sans qu'il y ait de signe d'efflorescence ni de risque accru pour la santé humaine. La recommandation relative au dénombrement des cellules de cyanobactéries vise à assurer une protection contre l'exposition aux efflorescences d'autres cyanobactéries ayant un potentiel toxique, et non seulement d'espèces productrices de microcystines.
Bien que la recommandation relative au dénombrement cellulaire des cyanobactéries totales soit basée sur le potentiel de production de toxines, les cellules cyanobactériennes en soi ont eu des effets nocifs sur la santé. La concentration de cellules cyanobactériennes entraînant un effet nocif sur la santé varie considérablement. Backer et coll. (2015) ont examiné les données relatives aux efflorescences algales nuisibles (EAN) de 2007 à 2011, et ont fait état du nombre de cellules cyanobactériennes d'après les échantillons prélevés, en réponse à des événements sanitaires. Les valeurs du dénombrement cellulaire couvraient plusieurs ordres de grandeur, allant d'aussi peu qu'une centaine de cellules par millilitre à plusieurs millions de cellules par millilitre. Dans des études antérieures, Pilotto et coll. (1997, 2004) ont déclaré que la fréquence des symptômes gastro-intestinaux était significativement plus élevée après une exposition de plus d'une heure à des concentrations de cellules cyanobactériennes allant de 5 000 à 20 000 cellules/mL. Cependant, seul un petit nombre de personnes a été touché, et seulement sous forme d'une légère irritation. Une étude de Lévesque et coll. (2014) a également montré un lien entre la densité de cyanobactéries et les effets sur la santé gastro-intestinale. Cette étude signale des risques relatifs (RR) croissants pour trois plages de concentrations croissantes : < 20 000 cellules/mL (RR = 1,52, IC de 0,65 à 3,51); 20 000 à 100 000 cellules/mL (RR = 2,71, IC de 1,02 à 7,16); et > 100 000 cellules/mL (RR= 3,28, IC de 1,69 à 6,37). Cette relation a été observée avec les symptômes gastro-intestinaux considérés comme les plus sévères. Les symptômes gastro-intestinaux moins graves ne présentaient pas la même augmentation du RR avec l'augmentation des concentrations de cellules cyanobactériennes. Cependant, un RR de 2,26 (IC de 1,26 à 4,06) était encore observé lorsque les concentrations dépassaient 100 000 cellules/mL. Aucune relation n'a été observée avec les paramètres de santé non gastro-intestinaux. Dans une étude épidémiologique prospective utilisant la surface des cellules comme principale variable d'exposition, on a observé que les symptômes étaient plus susceptibles d'être signalés chez les personnes exposées à des concentrations modérées ou élevées (entre environ 20 000 cellules/mL et environ 100 000 cellules/mL) que chez celles exposées à de faibles concentrations de cyanobactéries (environ < 20 000 cellules/mL) (Stewart, 2004; Stewart et coll., 2006b). Les symptômes le plus fréquemment signalés étaient d'ordre respiratoire, mais leur degré de gravité était léger (p. ex., certaines difficultés respiratoires, toux sèche, mal de gorge, éternuements et écoulement nasal) en présence de concentrations de cyanobactéries élevées. En raison de cette variabilité, il n'a pas été possible d'établir une valeur recommandée basée sur le risque d'effets allergènes ou d'autres effets irritants causés par des concentrations de cyanobactéries inconnues. La valeur recommandée basée sur le potentiel de production de microcystines est destinée à assurer une protection contre l'exposition à des concentrations élevées de toxines, ainsi qu'à des concentrations élevées de matières cyanobactériennes.
8.3 Biovolume de cyanobactéries
La valeur recommandée pour le biovolume de cyanobactéries est calculée d'après la recommandation pour le dénombrement des cellules cyanobactériennes (voir la section 8.2), combinée avec le volume cellulaire moyen de Microcystis, car ces valeurs reflètent le scénario de danger le plus probable pour la qualité de l'eau due à une efflorescence toxique contenant des concentrations élevées de microcystines (Kemp et John, 2006). La valeur recommandée pour le biovolume de cyanobactéries est calculée comme suit :
Recommandation = 50 000 cellules/mL × 90 µ m3/cellule × 10-6 ≈ 4,5 mm3/L
où :
- 50 000 cellules/mL = recommandation pour les cellules cyanobactériennes totales dans les eaux utilisées à des fins récréatives, calculée ci-dessus;
- 90 µm3/cellule = volume moyen des grosses cellules de Microcystis (Wood et coll., 2008; NHMRC, 2011);
- 10-6 = unité de conversion de µm3/mL à mm3/L.
Le volume moyen des cellules de Microcystis a été utilisé ailleurs dans le monde pour élaborer des recommandations et des lignes directrices sur le biovolume des cyanobactéries (NHMRC, 2008; NHMRC, 2011). La valeur recommandée est prudente et vise à représenter le pire des scénarios. Cette valeur se situe également dans la fourchette présentée par Newcombe et coll. (2010) de 0,6 – 6 mm3/L, comme étant indicative d'un danger potentiel dû à des toxines, et est basée sur l'hypothèse que toutes les autres espèces de cyanobactéries dans une efflorescence peuvent contenir des toxines présentant un danger équivalent à celui de Microcystis. Ibelings et coll. (2021 b) signalent par ailleurs que dans les plans d'eau, les mélanges de clones ou de génotypes contiennent rarement plus de 3 μg de microcystines par mm3 de biovolume. En utilisant cette proportion, la valeur recommandée pour les microcystines totales, établie à 10 μg/L (voir la section 8.1), équivaudrait à un biovolume de 3,3 mm3/L, ce qui correspond à la fourchette présentée par Newcombe et coll. (2010) et s'apparente à la valeur calculée ci-dessus.
8.4 Chlorophylle a
La valeur recommandée pour la chlorophylle a totale est calculée d'après le ratio observé entre les microcystines et la chlorophylle a dans les efflorescences où Microcystis domine la population, car cela représente un scénario de danger pour la qualité de l'eau dû à des concentrations potentiellement élevées de microcystines (Carrasco et coll., 2006; Kemp et John, 2006) :
Recommandation = (10,0 µg microcystines/L) / (0,3 µg microcystines / µg chlorophylle a) ≈ 33 µg pour la chlorophylle atotale
où :
- 10,0 µg/L = valeur basée sur la santé (VBS) pour les microcystines totales dans les eaux utilisées à des fins récréatives (valeur calculée ci-dessus);
- 0,3 µg = teneur moyenne en microcystines par µg de chlorophylle a(Carrasco et coll., 2006).
La chlorophylle a est fréquemment utilisée comme indice d'eutrophisation et a été utilisée également comme indicateur de la biomasse des cyanobactéries ou des cyanotoxines. La valeur recommandée établie pour la chlorophylle aest basée sur des hypothèses prudentes et par conséquent il est peu probable qu'à cette valeur la concentration de microcystines (si elles sont présentes) dépasse la CMA de 10 μg/L.
La relation entre la chlorophylle aet le biovolume de cyanobactéries et les concentrations de cyanotoxines est variable et dépend des conditions environnementales. Des associations positives et négatives ont été constatées (Hartshorn et coll. 2016; Zastepa et coll., 2017). D'autres organismes du phytoplancton contiennent également de la chlorophylle a, de sorte que cette mesure fonctionne mieux lorsque les cyanobactéries sont les organismes dominants présents. Dans une analyse des données à l'échelle nationale aux États-Unis, des concentrations seuils de chlorophylle aassociées à une probabilité de plus de 50 % de dépassement des avis sanitaires pour les microcystines ont été signalées (p. ex., les concentrations de microcystines comprises entre 0,3 et 2,0 µg/L ont été associées à des concentrations de chlorophylle a comprises entre 23 et 104 µg/L) (Hollister et Kreakie, 2016). Bien que la relation entre les cyanobactéries et la chlorophylle a soit variable, cet indicateur peut être utile dans le cadre d'un système d'alerte aux cyanobactéries pour déclencher des analyses et des mesures supplémentaires (voir la section 2.0).
8.5 Autres toxines cyanobactériennes
Actuellement, les données disponibles pour l'anatoxine-a sont insuffisantes pour calculer une valeur recommandée assurant une qualité des eaux utilisées à des fins récréatives. Une recommandation pour la cylindrospermopsine n'est pas établie non plus, car cette toxine est rarement détectée dans les eaux de surface au Canada, selon les données disponibles sur leur présence. L'US EPA a établi une recommandation pour la cylindrospermopsine (US EPA, 2019). On trouvera de plus amples renseignements sur la cylindrospermopsine dans le document de Santé Canada (2017).
8.6 Considérations internationales
De nombreux autres pays dans le monde ont établi des valeurs recommandées pour les cyanobactéries et leurs toxines (voir les exemples dans le tableau 2). Ces recommandations ou normes peuvent différer des recommandations présentées dans ce document en raison de leur évaluation particulière, ainsi que l'emploi de politiques et d'approches différentes. En général, les évaluations des concentrations de microcystines présentant un danger pour la santé ont donné des valeurs similaires partout dans le monde. Un seul pays a élaboré une valeur acceptable pour la cylindrospermopsine (US EPA, 2019). Les paramètres utilisés comme indicateurs de risque pour la santé diffèrent, car de nombreux pays utilisent un système basé sur des niveaux d'alerte, au lieu d'une approche basée sur une valeur unique. En général, les valeurs de Santé Canada sont alignées avec les modes d'alerte ou d'action ou les valeurs de risque modérées fournies par l'Organisation mondiale de la Santé (OMS).
Notes de bas de page
- Note de bas de page 1
-
L'US EPA a aussi établi une recommandation de 15 µg/L pour la cylindrospermopsine.
- Note de bas de page 2
-
Les valeurs recommandées s'appliquent seulement aux efflorescences de cyanobactéries planctoniques.
- Note de bas de page 3
-
Bien qu'il ne s'agisse pas d'une recommandation, une valeur de 40 000 cellules/mL figure dans les lignes directrices de l'US EPA (2019) et peut être utilisée dans le cadre d'une stratégie de gestion des eaux.
- Note de bas de page 4
-
Les lignes directrices de l'OMS comprennent aussi des critères d'évaluation visuelle, des valeurs relatives à la transparence de l'eau au disque de Secchi et des valeurs recommandées pour la cylindrospermopsine, l'anatoxine-a et la saxitoxine.
- Note de bas de page 5
-
Lorsque les organismes dominants présents sont des cyanobactéries.
Pays/organisation |
Recommandations |
Référence |
|||
|---|---|---|---|---|---|
Concentration de microcystines |
Dénombrement cellulaire(cellules/mL)Note de bas de page b |
BiovolumeNote de bas de page b |
Chlorophylle aNote de bas de page b |
||
US EPANote de bas de page a |
8 µg/L |
Aucune valeur incluseNote de bas de page c |
Aucune valeur incluse |
Aucune valeur incluse |
US EPA, 2019 |
|
Niveau de vigilance Niveau d'alerte 1 Niveau d'alerte 2 |
> 24 µg/L |
Des valeurs propres au site peuvent être établies |
1 – 4 mm3/LNote de bas de page e > 4 – 8 mm3/LNote de bas de page e |
3 – 12 µg/LNote de bas de page e 12 – 24 µg/LNote de bas de page e |
OMS, 2021 |
Australie Mode surveillance Mode alerte Mode intervention |
— — ≥ 10 µg/L |
Microcystis : 500 – 5000 5000 – 50 000 ≥ 50 000 |
Microcystis : 0,04 – 0,4 mm3/L 0,4 – 4 mm3/L ≥ 4 mm3/L En l'absence de bactéries connues pour produire des toxines, la valeur du mode d'alerte est de 4 – 10 mm3/L, et celle du mode d'intervention ≥ 10 mm3/L |
Aucune valeur incluse |
NHMRC, 2008 |
Union européenne |
Aucune valeur incluse |
Cyanobactéries totales : 100 000 |
Aucune valeur incluse |
50 µg/L |
Commission européenne, 2009 |
Nouvelle-Zélande Mode surveillance Mode alerte Mode intervention |
— — ≥ 12 µg/L |
Cyanobactéries totales : 500 500 – 19 000 ≥ 19 000 |
Cyanobactéries totales : 0,5 mm3/L 0,5 – 10 mm3/L ≥ 10 mm3/L En présence de bactéries connues pour produire des toxines, la valeur du mode d'alerte est de 0,5 – 1,8 mm3/L, et celle du mode d'intervention ≥ 1,8 mm3/L |
Aucune valeur incluse |
New Zealand Ministry for the Environment and Ministry of Health, 2009 |
9.0 Références
Akcaalan, R., Mazur-Marzec, H., Zalewska, A. et Albay, M. (2009). Phenotypic and toxicological characterization of toxic Nodularia spumigena from a freshwater lake in Turkey. Harmful Algae, 8(2): 273-278.
ANSES (2017). Données relatives à la toxicité aiguë et chronique de la bêta-méthylamino-L-alanine (BMAA). Avis de l’Anses, Rapport d’expertise collective. Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. France.
APHA (2017). Standard methods for the examination of water and wastewater. American Public Health Association, American Water Works Association, and Water Environment Foundation. Washington, DC.
Aráoz, R., Molgó, J. et Tandeau de Marsac, N. (2010). Neurotoxic cyanobacterial toxins. Toxicon, 56(5): 813-828.
Backer, L.C., Landsberg, J.H., Miller, M., Keel, K. et Taylor, T.K. (2013). Canine cyanotoxin poisonings in the United States (1920-2012): Review of suspected and confirmed cases from three data sources. Toxins, 5(9): 1597-1628.
Backer, L.C., Manassaram-Baptiste, D., LePrell, R. et Bolton, B. (2015). Cyanobacteria and algae blooms: Review of health and environmental data from the harmful algal bloom-related illness surveillance system (HABISS) 2007-2011. Toxins, 7(4): 1048-1064.
Backer, L.C., McNeel, S.V., Barber, T., Kirkpatrick, B., Williams, C., Irvin, M., Zhou, Y., Johnson, T.B., Nierenberg, K., Aubel, M., LePrell, R., Chapman, A., Foss, A., Corum, S., Hill, V.R., Kieszak, S.M. et Cheng, Y.S. (2010). Recreational exposure to microcystins during algal blooms in two California lakes. Toxicon, 55(5): 909-921.
Banack, S.A., Caller, T., Henegan, P., Haney, J., Murby, A., Metcalf, J.S., Powell, J., Cox, P.A., et Stommel, E. (2015). Detection of cyanotoxins, β-N-methylamino-L-alanine and microcystins, from a lake surrounded by cases of amyotrophic lateral sclerosis. Toxins, 7:322-336.
Banack, S.A., Johnson, H.E., Cheng, R. et Cox, P.A. (2007). Production of the neurotoxin BMAA by a marine cyanobacterium. Marine Drugs, 5(4): 180-196.
Barrington, D.J., et Ghadouani, A. (2008). Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater. Environmental Science and Technology, 42(23): 8916-8921.
Barroin, G., et Feuillade, G. (1986). Hydrogen peroxide as a potential algicide for Oscillatoria rubescens D.C., Water Research, 20(5): 619-623.
Bartram, J., Burch, M., Falconer, I.R., Jonem, G., KuiperGoodman, T., 1999. Situation assessment, planning and management. In: Chorus, I., Bartram, J, (Eds.), Toxic Cyanobacteria in Water. A Guide to their Public Health Consequences, Monitoring and Management. E&FN Spon on behalf of the World Health Organization, London, pp. 179–209.
Beaulieu, M., Trudel, M., Marcil, G-K., Huot, Y., Lacey, J., Leconte, R., et Cabana, H. (2014). Pesticides et phytoplancton au Québec : Conditions propices aux efflorescences cyanobactériennes? Revue de littérature. Université de Sherbrooke, Sherbrooke, Canada
Bernard, C., Ballot, A., Thomazeau, S., Maloufi, S., Furey, A., Mankiewicz-Boczek, J., Pawlik-Skowrońska, Capelli, C., et Salmaso, N. (2017). Cyanobacteria associated with the production of cyanotoxins. In: Meriluoto, J., Spoof, L., and Codd, G.A. (Eds). Handbook of cyanobacterial monitoring and cyanotoxin analysis. Wiley, European Cooperation in Science and Technology, Cyanocost, United Kingdom.
Bertone, E., Chuang, A., Burford, M.A., et Hamilton, D.P. (2019). In-situ fluorescence monitoring of cyanobacteria: laboratory-based quantification of species-specific measurement accuracy. Harmful Algae, 87: 101625.
Beutel, M.W., Horne, A.J., Roth, J.C. et Barratt, N.J. (2001). Limnological effects of anthropogenic desiccation of a large, saline lake, Walker Lake, Nevada. Hydrobiologia, 466(1): 91-105.
Beversdorf, L.J., Chaston, S.D., Miller, T.R. et McMahon, K.D. (2015). Microcystin mcyA and mcyE gene abundances are not appropriate indicators of microcystin concentrations in lakes. PLoS One, 10(5): e0125353.
Blais, S. (2008). Guide d’identification des fleurs d’eau de cyanobactéries. Comment les distinguer des végétaux observés dans nos lacs et nos rivières, 3e édition, Direction du suivi de l’état de l’environnement, ministère du Développement durable, de l’Environnement et des Parcs, ISBN 978-2-550- 52408-3.
Blais, S. (2019). État de situation sur les cyanobactéries et les algues eucaryotes à la baie Missisquoi en 2014. Québec, ministère de l’Environnement et de la Lutte contre les changements climatiques, Direction générale du suivi de l’état de l’environnement, ISBN 978-2-550-77638-3.
Blais, S. (2014). État de situation sur les cyanobactéries à la baie Missisquoi de 2000 à 2008 en lien avec les seuils provisoires pour les eaux récréatives. Québec, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques, Direction du suivi de l’état de l’environnement, ISBN 978-2-550-71485-9.
Blais, S. (2015). Faits saillants – État de situation sur les cyanobactéries à la baie Missisquoi de 2000 à 2008 en lien avec les seuils provisoires pour les eaux récréatives. Québec, ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques, Direction du suivi de l’état de l’environnement, ISBN 978-2-550-72639-5.
Bouaïcha, N., Miles, C.O., Beach, D.G., Labidi, Z., Djabri, A., Benayache, N.Y., et Nguyen-Quang, T. (2019). Structural diversity, characterization and toxicology of microcystins. Toxins, 11(12): 714.
Bourbonnais, N. et Robert, C. (2014). Bilan de la gestion des épisodes de fleurs d’eau d’algues bleu-vert au Québec, de 2007 à 2012. Québec, Ministère du Développement durable, de l’Environnement, de la Faune et des Parcs, Direction du suivi de l’état de l’environnement, ISBN 978-2-550-70347-1.
Bowling, L., Blais, S., et Sinotte, M. (2014). An analysis of cyanobacterial bloom occurrence in Missisquoi Bay (Québec, Canada) between 2000 and 2008, and possible environmental factors underlying them. New South Wales Government, Department of Primary Industries, Office of Water, Australia.
Bownik, A. (2010). Harmful algae: effects of alkaloid cyanotoxins on animal and human health. Toxin Rev., 29: 99–114.
Boyer, G.L. (2007). The occurrence of cyanobacterial toxins in New York lakes: Lessons from the MERHAB-lower great lakes program. Lake Reserv. Manage., 23(2): 153-160.
Briand, J.F., Jacquet, S., Flinois, C., Avois-Jacquet, C., Maisonnette, C., Leberre, B., et Humbert, J.F. (2005). Variations in the microcystin production of Planktothrix rubescens (Cyanobacteria) assessed from a four-year survey of Lac du Bourget (France) and from laboratory experiments. Microb. Ecol., 50:418-28.
Bridgeman, T.B. et Penamon, W.A. (2010). Lyngbya wollei in Western Lake Erie. Journal of Great Lakes Research, 36(1): 167-171.
Brient, L., Lengronne, M., Bertrand, E., Rolland, D., Sipel, A., Steinmann, D., Baudin, I., Legeas, M., Le Rouzic, B. et Bormans, M. (2008). A phycocyanin probe as a tool for monitoring cyanobacteria in freshwater bodies. J. Environ. Monit., 10(2): 248-255.
Burford, M.A. et Davis, T.W. (2011). Physical and chemical processes promoting dominance of the toxic cyanobacterium Cylindrospermopsis raciborskii. Chin. J. Oceanol. Limnol., 29(4): 883-891.
Burford, M.A., Carey, C.C., Hamilton, D.P., Huisman, J., Paerl, H.W., Wood, S.A., et Wulff, A. (2019). Perspective: Advancing the research agenda for improving understanding of cyanobacteria in a future of global change. Harmful Algae.
California Water Quality Monitoring Council (2019). SWAMP – HAB field guide – visual guide to observing blooms.
Carey, C.C., Ibelings, B.W., Hoffmann, E.P., Hamilton, D.P. et Brookes, J.D. (2012). Eco-physiological adaptations that favour freshwater cyanobacteria in a changing climate. Water Research, 46(5): 1394-1407.
Carillo, E., Ferrero, L., M., Alonso-Andicoberry, C., Basanta, A., Martin, A., López-Rodas, V. et Costas, E. (2003). Interstrain variability in toxin production in populations of the cyanobacterium Microcystis aeruginosa from water-supply reservoirs of Andalusia and lagoons of Doñana National Park (Southern Spain). Phycologia, 42(3): 269-274.
Carmichael, W.W. (1992). Cyanobacteria secondary metabolites—The cyanotoxins. J. Appl. Bacteriol., 72: 445–459.
Carmichael, W.W. et Boyer, G.L. (2016). Health impacts from cyanobacteria harmful algae blooms: Implications for the North American Great Lakes. Harmful Algae, 54:194-212.
Carmichael, W.W. et Gorham, P.R. (1978). Anatoxins from clones of Anabaena flos-aquae isolated from lakes of Western Canada. Mitt. Int. Ver. Limnol, 21(1): 285-295.
Carrasco, D., Moreno, E., Sanchis, D., Wörmer, L., Paniagua, T., Del Cueto, A. et Quesada, A. (2006). Cyanobacterial abundance and microcystin occurrence in Mediterranean water reservoirs in central Spain: Microcystins in the Madrid area. Eur. J. Phycol., 41(3): 281-291.
Carvalho L., McDonald, C., de Hoyos, C., Mischke, U., Philipps, G., Borics, G., Poikane, S., Skjelbred, B., Lyche Solheim, A., van Wichelen, J., et Cardoso, A.C. (2013). Sustaining recreational quality of European lakes: minimizing the health risks from algal blooms through phosphorus control. J. Appl. Ecol., 50:315–323.
CEAEQ (Centre d’expertise en analyse environnementale du Québec). (2012a). Identification, dénombrement et estimation du biovolume des cyanobactéries et des algues. MA. 800 – Cya.alg 1.0, Québec, ministère du Développement durable, de l’Environnement et des Parcs.
CEAEQ (Centre d’expertise en analyse environnementale du Québec). (2012 b). Dépistage des cyanobactéries. MA. 800 – Cya.dep 1.0, Québec, ministère du Développement durable, de l’Environnement et des Parcs.
Cerasino, L., Shams, S., Boscaini, A., et Salmaso, N. (2016). Multiannual trend of microcystin production in the toxic cyanobacterium Planktothrix rubescens in Lake Garda (Italy). Chemistry and Ecology, 32(5), 492-50.
Chapra, S.C., Boehlert, B., Fant, C., Bierman Jr., V.J., Henderson, J., Mills, D., Mas, D.M.L., Rennels, L., Jantarasami, L., Martinich, J., Strzepek, K.M., et Paerl, H.W. (2017). Climate change impacts on harmful algal blooms in U.S. freshwaters: a screening-level assessment. Environ. Sci. Technol., 51: 8933-8943.
Chen, H., Burke, J., Paul Dinsmore, W., Prepas, E.,E. et Fedorak, P.,M. (2007). First assessment of cyanobacterial blooms and microcystin-LR in the Canadian portion of Lake of the Woods. Lake and Reservoir Management, 23(2): 169-178.
Chernoff, N., Faassen, E.J., et Hill, D.J. (2021). β-Methylamino-L-Alanine (BMAA). In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Chernoff, N., Hill, D., Diggs, D., Faison, B., Francis, B., Lang, J., Larue, M., Le, T., Loftin, K., Lugo, J., Schmid, J., et Winnik, W. (2017). A critical review of the postulated role of the non-essential amino acid, β-N-methylamino-L-alanine, in neurodegenerative disease in humans. J. Tox. Environ. Health, Part B, 20(4):183-229.
Chernoff, N., Hill, D., Lang, J., Schmid, J., Le, T., Farthing, A., et Huang, H. (2020). The comparative toxicity of 10 microcystin congeners administered orally to mice: clinical effects and organ toxicity. Toxins, 12:403.
Chiu, Y.T., Chen, Y.H., Wang, T.S., Yen, H.K. et Lin, T.F. (2017). A qPCR-based tool to diagnose the presence of harmful cyanobacteria and cyanotoxins in drinking water sources. Int. J. Environ. Res. Public. Health., 14(Article Number: 547): 1-17.
Chorus, I, et Testai, E. (2021). Recreation and occupational activities. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Chorus, I, et Welker M. (eds). (2021). Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Chorus, I. et Bartram, J. (eds.). (1999). Toxic cyanobacteria in water: A guide to their public health consequences, monitoring and management. E & FN Spon / Chapman & Hall, London, United Kingdom.
Chorus, I. et Niesel, V. (2011). Steps towards a statistical model to predict phytoplankton responses to changes in trophic state. Chorus, I., Schauser, I., (Eds), In: Oligotrophication of Lake Tegel and Schlachtensee, Berlin Analysis of system components, causalities and response thresholds compared to responses of other waterbodies. Umweltbundesamt, Dessau, DE. 109-39.
Chorus, I., Falconer, I.R., Salas, H.J. et Bartram, J. (2000). Health risks caused by freshwater cyanobacteria in recreational waters. J. Toxicol. Environ. Health B Crit. Rev., 3(4): 323-347.
Christoffersen, K., Lyck, S., et Winding, A. (2002). Microbial activity and bacterial community structure during degradation of microcystins. Aquat. Microb. Ecol., 27: 125-136.
Codd, G., Bell, S., Kaya, K., Ward, C., Beattie, K. et Metcalf, J. (1999). Cyanobacterial toxins, exposure routes and human health. Eur. J. Phycol., 34(4): 405-415.
Commission européenne (2009). Bathing water profiles: Best practice and guidance. Commission européenne, Direction générale de l’environnement, B-1049 Bruxelles.
Conroy, J.D., Quinlan, E.L., Kane, D.D. et Culver, D.A. (2007). Cylindrospermopsis in Lake Erie: Testing its association with other cyanobacterial genera and major limnological parameters. Journal of Great Lakes Research, 33(3): 519-535.
Cox, P.A., Banack, S.A. et Murch, S.J. (2003). Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. Proc. Natl. Acad. Sci. USA, 100(23): 13380-13383.
Cox, P.A., Banack, S.A., Murch, S.J., Rasmussen, U., Tien, G., Bidigare, R.R., Metcalf, J.S., Morrison, L.F., Codd, G.A. et Bergman, B. (2005). Diverse taxa of cyanobacteria produce β-N-methylamino-l-alanine, a neurotoxic amino acid. Proc. Natl. Acad. Sci. USA, 102(14): 5074-5078.
Davis, T.W., Berry, D.L., Boyer, G.L. et Gobler, C.J. (2009). The effects of temperature and nutrients on the growth and dynamics of toxic and non-toxic strains of Microcystis during cyanobacteria blooms. Harmful Algae, 8(5): 715-725.
de la Cruz, A.A., Hiskia, A., Kaloudis, T., Chernoff, N., Hill, D., Antoniou, M.G., He, X., Loftin, K., O'Shea, K., Zhao, C., Pelaez, M., Han, C., Lynch, T.J. et Dionysiou, D.D. (2013). A review on cylindrospermopsin: The global occurrence, detection, toxicity and degradation of a potent cyanotoxin. Environ. Sci. Process. Impacts, 15(11): 1979-2003.
Dong, X., Zeng, S., Bai, F., Li, D. et He, M. (2016). Extracellular microcystin prediction based on toxigenic Microcystis detection in a eutrophic lake. Sci. Rep., 6(Article Number: 20886): 1-8.
dos Anjos, F.M., Bittencourt-Oliveira, M.C., Zajac, M.P., Hiller, S., Christian, B., Erler, K., Luckas, B. et Pinto, E. (2006). Detection of harmful cyanobacteria and their toxins by both PCR amplification and LC-MS during a bloom event. Toxicon, 48(3): 239-245.
Downing, J.A., Watson, S.B. et McCauley, E. (2001). Predicting cyanobacteria dominance in lakes. Can. J. Fish. Aquat. Sci., 58(10): 1905-1908.
Du, S., Huang, S., Pan, H., Zang, C., Wu, M., Lin, C., Guo, Y., Gao, F. et Scholz, M. (2014). Monitoring algal bloom through relationships between chlorophyll a and phytoplankton. Environ. Eng. Manage. J., 13(4): 805-815.
Dufour, A., Behymer, T.D., Cantu, R., Magnuson, M. et Wymer, L. (2017). Ingestion of swimming pool water by recreational swimmers. Journal of Water and Health, 15(3): 429-437.
Dufour, A.P., Evans, O., Behymer, T.D. et Cantu, R. (2006). Water ingestion during swimming activities in a pool: A pilot study. J. Water. Health., 4(4): 425-430.
Dziuban, E.J., Liang, J.L., Craun, G.F., Hill, V., Yu, P.A., Painter, J., Moore, M.R., Calderon, R.L., Roy, S.L. et Beach, M.J. (2006). Surveillance for waterborne disease and outbreaks associated with recreational water-United States, 2003-2004. MMWR Surveill. Summ., 55(12): 1-30.
Edwards, C., Beattie, K.A., Scrimgeour, C.M. et Codd, G.A. (1992). Identification of anatoxin-A in benthic cyanobacteria (blue-green algae) and in associated dog poisonings at Loch Insh, Scotland. Toxicon, 30(10): 1165-1175.
Facciponte, D.N., Bough, M.W., Seidler, D., Carroll, J.L., Ashare, A., Andrew, A.S., Tsongalis, G.J., Vaickus, L.J., Henegan, P.L., Butt, T.H., et Stommel, E.W. (2018). Identifying aerosolized cyanobacteria in the human respiratory tract: a proposed mechanism for cyanotoxin-associated diseases. Sci. Total Environ., 645 : 1003-1013.
Fahnenstiel, G.L., Millie, D.F., Dyble, J., Litaker, R.W., Tester, P.A., McCormick, M.J., Rediske, R. et Klarer, D. (2008). Microcystin concentrations and cell quotas in Saginaw Bay, Lake Huron. Aquat. Ecosyst. Health Manage., 11(2): 190-195.
Falconer, I.R. (2005). Cyanobacterial toxins of drinking water supplies: Cylindrospermopsins and microcystins. CRC Press, Boca Raton, FL.
Falconer, I.R. et Humpage, A.R. (2006). Cyanobacterial (blue-green algal) toxins in water supplies: Cylindrospermopsins. Environ. Toxicol., 21(4): 299-304.
Fastner, J., Abella, S., Litt, A., Morabito, G., Vörös, L., Pálffy, K., Straile, D., Kümmerlin, R., Matthews, D., Phillips, M.G., et Chorus, I. (2016). Combating cyanobacterial proliferation by avoiding or treating inflows with high P load—experiences from eight case studies. Aquatic Ecology, 50(3): 367-383.
Fastner, J., Erhard, M., Carmichael, W.W., Sun, F., Rinehart, K.L., Rönicke, H., et Chorus, I. (1999). Characterization and diversity of microcystins in natural blooms and strains of the genera Microcystis and Planktothrix from German freshwaters. Arch. Hydrobiol., 145(2):147-63.
Fastner, J., et Humpage A. (2021). Hepatotoxic cyclic peptides – microcystins and nodularins. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Fayad, P.B., Roy-Lachapelle, A., Duy, S.V., Prévost, M. et Sauvé, S. (2015). On-line solid-phase extraction coupled to liquid chromatography tandem mass spectrometry for the analysis of cyanotoxins in algal blooms. Toxicon, 108: 167-175.
Fiedor, L., Kania, A., Myśliwa-Kurdziel, B., Orzeł, Ł. et Stochel, G. (2008). Understanding chlorophylls: Central magnesium ion and phytyl as structural determinants. Biochimica Et Biophysica Acta (BBA) - Bioenergetics, 1777(12): 1491-1500.
Fitzgerald, D.J., Cunliffe, D.A. et Burch, M.D. (1999). Development of health alerts for cyanobacteria and related toxins in drinking water in South Australia. Environ. Toxicol., 14(1): 203-209.
Fortin, N., Aranda-Rodriguez, R., Jing, H., Pick, F., Bird, D. et Greer, C.W. (2010). Detection of microcystin-producing cyanobacteria in Missisquoi Bay, Québec, Canada, using quantitative PCR. Appl. Environ. Microbiol., 76(15): 5105-5112.
Funari, E. et Testai, E. (2008). Human health risk assessment related to cyanotoxins exposure. Crit. Rev. Toxicol., 38(2): 97-125.
Gaget, V., Humpage, A.R., Huang, Q., Monis, P. et Brookes, J.D. (2017a). Benthic cyanobacteria: A source of cylindrospermopsin and microcystin in Australian drinking water reservoirs. Water Research, 124: 454-464.
Gaget, V., Lau, M., Sendall, B., Froscio, S., et Humpage, A.R. (2017b). Cyanotoxins: which detection technique for an optimum risk assessment? Water Research, 118: 227-238.
Garcı́a-Villada, L., Rico, M., Altamirano, M., Sánchez-Martı́n, L., López-Rodas, V., et Costas, E. (2004). Occurrence of copper resistant mutants in the toxic cyanobacteria Microcystis aeruginosa: characterisation and future implications in the use of copper sulphate as algaecide. Water Research, 38(8): 2207-2213.
Geh, E.N., Ghosh, D., McKell, M., de la Cruz, A.A., Stelma, G., et Bernstein, J.A. (2015). Identification of Microcystis aeruginosa peptides responsible for allergic sensitization and characterization of functional interactions between cyanobacterial toxins and immunogenic peptides. Environ. Health Perspect., 123:1159–1166.
Gehringer, M.M., Adler, L., Roberts, A.A., Moffitt, M.C., Mihali, T.K., Mills, T.J., Fieker, C. et Neilan, B.A. (2012). Nodularin, a cyanobacterial toxin, is synthesized in planta by symbiotic Nostoc sp. Isme j., 6(10): 1834-1847.
Giani, A., Bird, D.F., Prairie, Y.T. et Lawrence, J.F. (2005). Empirical study of cyanobacterial toxicity along a trophic gradient of lakes. Can. J. Fish. Aquat. Sci., 62(9): 2100-2109.
Giannuzzi, L., Sedan, D., Echenique, R. et Andrinolo, D. (2011). An acute case of intoxication with cyanobacteria and cyanotoxins in recreational water in Salto Grande Dam, Argentina. Mar. Drugs, 9(11): 2164-2175.
Glibert, P.M., Wilkerson, F.P., Dugdale, R.C., Raven, J.A., Dupont, C.L., Leavitt, P.R., Parker, A.E., Burkholder, J.M., et Kana, T.M. (2016). Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions. Limnol. Oceanogr., 61(1): 165-197.
Gobler, C.J., Burkholder, J.M., Davis, T.W., Harke, M.J., Johengen, T., Stow, C.A., et Van de Waal, D.B. (2016). The dual role of nitrogen supply in controlling the growth and toxicity of cyanobacterial blooms. Harmful Algae. 54:87–97.
Graham, J.L., Loftin, K.A., Meyer, M.T. et Ziegler, A.C. (2010). Cyanotoxin mixtures and taste-and-odor compounds in cyanobacterial blooms from the Midwestern United States. Environ. Sci. Technol., 44(19): 7361-7368.
Gregor, J., Maršálek, B. et Šípková, H. (2007). Detection and estimation of potentially toxic cyanobacteria in raw water at the drinking water treatment plant by in vivo fluorescence method. Water Research, 41(1): 228-234.
Grutzmacher, G., Wessel, G., Klitzke, S., et Chorus, I. (2010). Microcystin elimination during sediment contact. Environ. Sci. Technol., 44: 657-662.
Gunn, G.J., Rafferty, A.G., Rafferty, G.C., Cockburn, N., Edwards, C., Beattie, K.A. et Codd, G.A. (1992). Fatal canine neurotoxicosis attributed to blue-green algae (cyanobacteria). Vet. Rec., 130(14): 301-302.
Hamilton, D.P., Salmaso, N., et Paerl, H.W. (2016). Mitigating harmful cyanobacterial blooms: strategies for control of nitrogen and phosphorus loads. Aquat. Ecol., 50: 351-366.
Hamilton, P.B., Ley, L.M., Dean, S. et Pick, F.R. (2005). The occurrence of the cyanobacterium Cylindrospermopsis raciborskii in Constance Lake: An exotic cyanoprokaryote new to Canada. Phycologia, 44(1): 17-25.
Hartshorn, N., Marimon, Z., Xuan, Z., Cormier, J., Chang, N. et Wanielista, M. (2016). Complex interactions among nutrients, chlorophyll-a, and microcystins in three stormwater wet detention basins with floating treatment wetlands. Chemosphere, 144: 408-419.
Health Canada (2017). Recommandations pour la qualité de l’eau potable au Canada : Document technique – Les toxines cyanobactériennes. Préparé par le Comité fédéral-provincial-territorial sur l’eau potable du Comité fédéral-provincial-territorial sur la santé et l'environnement, Ottawa (Ont.).
Heinze, R. (1999). Toxicity of the cyanobacterial toxin microcystin-LR to rats after 28 days intake with the drinking water. Environ. Toxicol., 14(1): 57-60.
Hilborn, E.D., Roberts, V.A., Backer, L., Deconno, E., Egan, J.S., Hyde, J.B., Nicholas, D.C., Wiegert, E.J., Billing, L.M., Diorio, M., Mohr, M.C., Joan Hardy, F., Wade, T.J., Yoder, J.S. et Hlavsa, M.C. (2014). Algal bloom-associated disease outbreaks among users of freshwater lakes - United States, 2009-2010. Morb. Mortal. Wkly. Rep., 63(1): 11-15.
Hodoki, Y., Ohbayashi, K., Kobayashi, Y., Okuda, N. et Nakano, S. (2012). Detection and identification of potentially toxic cyanobacteria: Ubiquitous distribution of Microcystis aeruginosa and Cuspidothrix issatschenkoi in Japanese lakes. Harmful Algae, 16: 49-57.
Hoff, B., Thomson, G., et Graham, K. (2007) Ontario : Neurotoxic cyanobacterium (blue-green alga) toxicosis in Ontario. Can. Vet. J., 48(2): 147.
Hollister, J.W. et Kreakie, B.J. (2016). Associations between chlorophyll a and various microcystin health advisory concentrations. F1000research, 5: 151.
Holtcamp, W. (2012). The emerging science of BMAA: Do cyanobacteria contribute to neurodegenerative disease? Environ. Health Perspect., 120(3): a110-a116.
Hong, Y., Steinman, A., Biddanda, B., Rediske, R. et Fahnenstiel, G. (2006). Occurrence of the toxin-producing cyanobacterium Cylindrospermopsis raciborskii in Mona and Muskegon Lakes, Michigan. Journal of Great Lakes Research, 32(3): 645-652.
Hudon, C., De Sève, M. et Cattaneo, A. (2014). Increasing occurrence of the benthic filamentous cyanobacterium Lyngbya wollei: A symptom of freshwater ecosystem degradation. Freshwater Science, 33(2): 606-618.
Hudon, C., Gagnon, P., Poirier Larabie, S., Gagnon, C., Lajeunesse, A., Lachapelle, M. et Quilliam, M.A. (2016). Spatial and temporal variations of a saxitoxin analogue (LWTX-1) in Lyngbya wollei (cyanobacteria) mats in the St. Lawrence River (Québec, Canada). Harmful Algae, 57(Part A): 69-77.
Huisman, J., Codd, G.A., Paerl, H.W., Ibelings, B.W., Verspagen, J.M.H., et Visser, P.M. (2018). Cyanobacterial blooms. Nature Reviews – Microbiology, 16: 471- 483.
Humpage, A., et Fastner, J. (2021). Cylindrospermopsins. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Huot, Y., Babin, M., Bruyant, C., Grob, C., Twardowski, M.S. et Claustre, H. (2007). Does chlorophyll-a provide the best index of phytoplankton biomass for primary productivity studies? Biogeosciences, 4(2): 707-745.
Huynh, M. et N. Serediak. (2006). Identification des algues : guide de terrain. Agriculture et Agroalimentaire Canada. ISBN : 978-1-100-97038-7.
IARC (2010). Ingested nitrate and nitrite and cyanobacterial peptide toxins. International Agency for Research on Cancer, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 94, Lyon, France.
Ibelings, B.W., Backer, L.C., Kardinaal, W.E.A. et Chorus, I. (2014). Current approaches to cyanotoxin risk assessment and risk management around the globe. Harmful Algae, 40: 63-74.
Ibelings, B.W., Foss, A., et Chorus, I. (2021a). Food. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Ibelings, B.W., Kurmayer, R., Azevedo, S.M.F.O., Wood, S.A., Chorus, I., et Welker, M. (2021b). Understanding the occurrence of cyanobacteria and cyanotoxins. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Izydorczyk, K., Carpentier, C., Mrowczynski, J., Wagenvoort, A., Jurczak, T. et Tarczynska, M. (2009). Establishment of an alert level framework for cyanobacteria in drinking water resources by using the algae online analyser for monitoring cyanobacterial chlorophyll a. Water Res., 43(4): 989-996.
Jacoby, J.M. et Kann, J. (2007). The occurrence and response to toxic cyanobacteria in the Pacific Northwest, North America. Lake Reserv. Manage., 23(2): 123-143.
Jančula, D. et Maršálek, B. (2011). Critical review of actually available chemical compounds for prevention and management of cyanobacterial blooms. Chemosphere, 85(9): 1415-1422.
Jones, G., Gurney, S. et Rocan, D. (1998). Water quality in farm and recreational surface water supplies of Southwestern Manitoba: 1995 sampling results. Manitoba Environment, Report Number: 98-05, Winnipeg, MB.
Jones, G.J. et Orr, P.T. (1994). Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water Res., 28(4): 871-876.
Kasinak, J.E., Holt, B.M., Chislock, M.F. et Wilson, A.E. (2015). Benchtop fluorometry of phycocyanin as a rapid approach for estimating cyanobacterial biovolume. Journal of Plankton Research, 37(1): 248-257.
Kemp, A. et John, J. (2006). Microcystins associated with Microcystis dominated blooms in the southwest wetlands, Western Australia. Environ. Toxicol., 21(2): 125-130.
Kling, H. (2009). Cylindrospermopsis raciborskii (nostocales, cyanobacteria): A brief historic overview and recent discovery in the Assiniboine River (Canada). Fottea, 9(1): 45-47.
Klitzke, S., et Fastner, J. (2012) Cylindrospermopsin degradation in sediments – the role of temperature, redox conditions, and dissolved organic carbon. Wat. Res., 46: 1549-1555.
Kotak, B.G. et Zurawell, R.W. (2007). Cyanobacterial toxins in Canadian freshwaters: A review. Lake Reserv. Manage., 23(2): 109-122.
Kotak, B.G., Zurawell, R.W., Prepas, E.E. et Holmes, C.F. (1996). Microcystin-LR concentration in aquatic food web compartments from lakes of varying trophic status. Can. J. Fish. Aquat. Sci., 53(9): 1974-1985.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
Kurmayer, R. et Kutzenberger, T. (2003). Application of real-time PCR for quantification of microcystin genotypes in a population of the toxic cyanobacterium Microcystis sp. Appl. Environ. Microbiol., 69(11): 6723-6730.
Kurmayer, R., Christiansen, G. et Chorus, I. (2003). The abundance of microcystin-producing genotypes correlates positively with colony size in Microcystis sp. and determines its microcystin net production in Lake Wannsee. Appl. Environ. Microbiol., 69(2): 787-795.
Kurmayer, R., Christiansen, G., Fastner, J., et Börner, T. (2004). Abundance of active and inactive microcystin genotypes in populations of the toxic cyanobacterium Planktothrix spp. Environ. Microbiol., 6(8):831-41
Kurmayer, R., Sivonen, K., Wilmotte, S., et Salmaso, N (Eds.) (2017) Molecular tools for the detection and quantification of toxigenic cyanobacteria. John Wiley and Sons Ltd., USA.
Lajeunesse, A., Segura, P.A., Gélinas, M., Hudon, C., Thomas, K., Quilliam, M.A. et Gagnon, C. (2012). Detection and confirmation of saxitoxin analogues in freshwater benthic Lyngbya wollei algae collected in the St. Lawrence River (Canada) by liquid chromatography–tandem mass spectrometry. Journal of Chromatography A, 1219: 93-103.
Lam, A.K.Y., Prepas, E.E., Spink, D., et Hrudey, S.E. (1995). Chemical control of hepatotoxic phytoplankton blooms: implication for human health. Wat. Res., 29(8): 1845-1854.
Lévesque, B., Gervais, M., Chevalier, P., Gauvin, D., Anassour-Laouan-Sidi, E., Gingras, S., Fortin, N., Brisson, G., Greer, C. et Bird, D. (2014). Prospective study of acute health effects in relation to exposure to cyanobacteria. Science of the Total Environment, 466-467: 397-403.
Lévesque, B., Gervais, M., Chevalier, P., Gauvin, D., Anassour-Laouan-Sidi, E., Gingras, S., Fortin, N., Brisson, G., Greer, C. et Bird, D. (2016). Exposure to cyanobacteria: acute health effects associated with endotoxins. Public Health, 134:98-101.
Li, Z., Yu, J., Yang, M., Zhang, J., Burch, M.D. et Han, W. (2010). Cyanobacterial population and harmful metabolites dynamics during a bloom in Yanghe Reservoir, North China. Harmful Algae, 9(5): 481-488.
Lu, J., Struewing, I., Wymer, L., Tettenhorst, D.R., Shoemaker, J., et Allen, J. (2020). Use of qPCR and RT-qPCR for monitoring variations of microcystin producters and as an early warning system to predict toxin production in an Ohio inland lake. Water Res., 170: 115262.
Luesch, H., Yoshida, W.Y., Moore, R.E., Paul, V.J. et Corbett, T.H. (2001). Total structure determination of apratoxin A, a potent novel cytotoxin from the marine cyanobacterium Lyngbya majuscula. J. Am. Chem. Soc., 123(23) : 5418-5423.
Lyck, S. et Christoffersen, K. (2003). Microcystin quota, cell division and microcystin net production of precultured Microcystis aeruginosa CYA 228 (chroococcales, cyanophyceae) under field conditions. Phycologia, 42(6): 667-674.
Lyon-Colbert, A., Su, S., et Cude, D. (2018). A systematic literature review for evidence of Aphanizomenon flos-aquae toxigenicity in recreational waters and toxicity of dietary supplements: 2000-2017. Toxins (Basel), 10(7):254.
Macario, I.P.E., Castro, B.B., Nunes, M.I.S., Antunes, S.C., Pizarro, C., Coelho, C.M., Goncalves, F. et de Figueiredo, D.R. (2015). New insights towards the establishment of phycocyanin concentration thresholds considering species-specific variability of bloom-forming cyanobacteria. Hydrobiologia, 757: 155-165.
Macbeth, A.J. (2004). Investigation of an introduced subtropical alga (Lyngbya wollei) in Whiteshell Provincial Park, Manitoba. MSc Thesis, University of Manitoba. Winnipeg, Manitoba.
Martins, A. et Vasconcelos, V. (2011). Use of qPCR for the study of hepatotoxic cyanobacteria population dynamics. Arch. Microbiol., 193(9): 615-627.
Matthijs, H.C., Visser, P.M., Reeze, B., Meeuse, J., Slot, P.C., Wijn, G., Talens, R. et Huisman, J. (2012). Selective suppression of harmful cyanobacteria in an entire lake with hydrogen peroxide. Water Res., 46(5): 1460-1472.
Mazur-Marzec, H., Meriluoto, J., Plinski, M. et Szafranek, J. (2006). Characterization of nodularin variants in Nodularia spumigena from the Baltic Sea using liquid chromatography/mass spectrometry/mass spectrometry. Rapid Commun. Mass Spectrom., 20(13): 2023-2032.
McQuaid, N., Zamyadi, A., Prevost, M., Bird, D.F. et Dorner, S. (2011). Use of in vivo phycocyanin fluorescence to monitor potential microcystin-producing cyanobacterial biovolume in a drinking water source. J. Environ. Monit., 13(2): 455-463.
MDDEP (2005). Cyanobactéries et cyanotoxines au Québec : suivi à six stations de production d’eau potable (2001-2003). Ministère du Développement durable, de l’Environnement et des Parcs du Québec, Direction des politiques de l’eau, Direction générale des politiques, Envirodoq : ENV/2005/0099, Québec, Canada.
MDDEP (2012). Communication personnelle avec C. Robert.
Meneely, J.P., Chevallier, O.P., Graham, S., Greer, B., Green, B.D. et Elliott, C.T. (2016). Beta-methylamino-L-alanine (BMAA) is not found in the brains of patients with confirmed Alzheimer's disease. Sci. Rep., 6(Article number: 36363): 1-9.
Merel, S., Walker, D., Chicana, R., Snyder, S., Baurès, E. et Thomas, O. (2013). State of knowledge and concerns on cyanobacterial blooms and cyanotoxins. Environment International, 59: 303-327.
Meriluoto, J., Blaha, L., Bojadzija, G., Bormans, M., Brient, L., Codd, G.A., Drobac, D., Faassen, E.J., Fastner, J., Hiskia, A., Ibelings, B.W., Kaloudis, T., Kokocinski, M., Kurmayer, R., Pantelić, D., Quesada, A., Salmaso, N., Tokodi, N., Triantis, T.M., Visser, P.M., et Svirčev, Z. (2017). Toxic cyanobacteria and cyanotoxins in European waters – recent progress achieved through the CYANOCOST Action and challenges for further research. Advances in Oceanography and Limnology, 8(1): 161-178.
Metcalf, J.S., Banack, S.A., Lindsay, J., Morrison, L.F., Cox, P.A. et Codd, G.A. (2008). Co-occurrence of beta-N-methylamino-L-alanine, a neurotoxic amino acid with other cyanobacterial toxins in British waterbodies. Environmental Microbiology, 10(3): 702-708.
Millie, D.F., Fahnenstiel, G.L., Dyble Bressie, J., Pigg, R.J., Rediske, R.R., Klarer, D.M., Tester, P.A. et Litaker, R.W. (2009). Late-summer phytoplankton in Western Lake Erie (Laurentian Great Lakes): Bloom distributions, toxicity, and environmental influences. Aquat. Ecol., 43(4): 915-934.
Millie, D.F., Pigg, R.J., Fahnenstiel, G.L., et Carrick, H.J. (2010). Algal Chlorophylls: A synopsis of analytical methodologies. In: Algae Source to Treatment. AWWA Manual M57. American Water Works Association, Denver, CO., pp. 93-122.Murch, S.J., Cox, P.A., Banack, S.A., Steele, J.C. and Sacks, O.W. (2004). Occurrence of beta-methylamino-l-alanine (BMAA) in ALS/PDC patients from Guam. Acta Neurol. Scand., 110(4): 267-269.
Ministère de l’Environnement de l’Ontario (2012). Communication personnelle avec S. Deshpande.
Ministère de la Santé de la Colombie-Britannique (2012). Communication personnelle avec B. Boettger.
Negri, A.P., Jones, G.J. et Hindmarsh, M. (1995). Sheep mortality associated with paralytic shellfish poisons from the cyanobacterium Anabaena circinalis. Toxicon, 33(10): 1321-1329.
New Zealand Ministry for the Environment and Ministry of Health, (2009). New Zealand guidelines for cyanobacteria in recreational fresh waters – interim guidelines. Prepared for the New Zealand Ministry for the Environment and the Ministry of Health by Wood, S.A., Hamilton, D.P., Paul, W. J., Safi, K. A., and Williamson, W. M., Wellington: Ministry for the Environment.
Newcombe, G., (ed.) (2009). International guidance manual for the management of toxic cyanobacteria. Global Water Research Coalition, London, United Kingdom.
Newcombe, G., House, J., Ho, L., Baker, P. et Burch, M. (2010). Management strategies for cyanobacteria (blue-green algae): A guide for water utilities. Water Quality Research Australia, Report Number 74, Adelaide, Australia.
Ngwa, F.F., Madramootoo, C.A. et Jabaji, S. (2014). Comparison of cyanobacterial microcystin synthetase (mcy) E gene transcript levels, mcy E gene copies, and biomass as indicators of microcystin risk under laboratory and field conditions. Microbiologyopen, 3(4): 411-425.
NHMRC (2008). Guidelines for managing risks in recreational water. National Health and Medical Research Council, Australian Government, Canberra.
NHMRC (2011). Australian drinking water guidelines 6 - national water quality management strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra.
O’Neil, J.M., Davis, T.W., Burford, M.A., and Gobler, C.J. (2012). The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change. Harmful Algae, 14: 313-334.
Oh, H.M., Lee, S.J., Kim, J.H., Kim, H.S. et Yoon, B.D. (2001). Seasonal variation and indirect monitoring of microcystin concentrations in Daechung Reservoir, Korea. Appl. Environ. Microbiol., 67(4): 1484-1489.
Ohkouchi, Y., Tajima, S., Nomura, M., et Itoh, S. (2015). Inflammatory responses and potencies of various lipopolysaccharides from bacteria and cyanobacteria in aquatic environments and water supply systems. Toxicon, 97: 23-31.
OMS (2003). Guidelines for safe recreational water environments, Volume 1: Coastal and fresh waters. Organisation mondiale de la Santé, Genève, Suisse.
OMS (2020a). Cyanobacterial toxins: cylindrospermopsins. Background document for development of WHO Guidelines for Drinking-water Quality and Guidelines for Safe Recreational Water Environments. Organisation mondiale de la Santé, Genève, Suisse.
OMS (2020b). Cyanobacterial toxins: saxitoxins. Background document for development of WHO Guidelines for Drinking-water Quality and Guidelines for Safe Recreational Water Environments. Organisation mondiale de la Santé, Genève, Suisse.
OMS (2021). Guidelines on recreational water quality, Volume 1: Coastal and fresh waters. Organisation mondiale de la Santé, Genève, Suisse.
Orihel, D.M., Bird, D.F., Brylinsky, M., Chen, H., Donald, D.B., Huang, D.Y., Giani, A., Kinniburgh, D., Kling, H., Kotak, B.G., Leavitt, P.R., Nielsen, C.C., Reedyk, S., Rooney, R.C., Watson, S.B., Zurawell, R.W., et Vinebrooke, R.D. (2012). High microcystin concentrations occur only at low nitrogen-to-phosphorus ratios in nutrient-rich Canadian lakes. Can. J. Fish. Aquat. Sci., 69: 1457-1462.
Osborne, N.J. et Shaw, G.R. (2008). Dermatitis associated with exposure to a marine cyanobacterium during recreational water exposure. BMC Dermatol., 8(5).
Osborne, N.J., Webb, P.M. et Shaw, G.R. (2001). The toxins of Lyngbya majuscula and their human and ecological health effects. Environment International, 27(5): 381-392.
Otten, T.G., et Paerl, H.W. (2015). Health effects of toxic cyanobacteria in U.S. drinking and recreational waters: our current understanding and proposed direction. Curr. Envir. Health Rpt, 2:75-84.
Pablo, J., Banack, S.A., Cox, P.A., Johnson, T.E., Papapetropoulos, S., Bradley, W.G., Buck, A. et Mash, D.C. (2009). Cyanobacterial neurotoxin BMAA in ALS and Alzheimer's disease. Acta Neurol. Scand., 120(4): 216-225.
Pace, M.L., Batt, R.D., Buelo, C.D., Carpenter, S.R., Cole, J.J., Kurtzweil, J.T. et Wilkinson, G.M. (2017). Reversal of a cyanobacterial bloom in response to early warnings. Proc. Natl. Acad. Sci. USA, 114(2): 352-357.
Padisák, J., Chorus, I., Welker, M., Maršálek, B., et Kurmayer, R. (2021). Laboratory analyses of cyanobacteria and water chemistry. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Paerl, H.W. (2017). Controlling cyanobacterial harmful blooms in freshwater ecosystems. Microbial Biotechnology, 10(5): 1106-1110.
Paerl, H.W., et Paul, V.J. (2012). Climate change: links to global expansion of harmful cyanobacteria. Water Res., 46: 1349-1363.
Paerl, H.W., Hall, N.S. et Calandrino, E.S. (2011b). Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Science of the Total Environment, 409(10): 1739-1745.
Paerl, H.W., Xu, H., McCarthy, M.J., Zhu, G., Qin, B., Li, Y. et Gardner, W.S. (2011a). Controlling harmful cyanobacterial blooms in a hyper-eutrophic lake (Lake Taihu, China): The need for a dual nutrient (N & P) management strategy. Water Research, 45(5): 1973-1983.
Pearson, L., Mihali, T., Moffitt, M., Kellmann, R. et Neilan, B. (2010). On the chemistry, toxicology and genetics of the cyanobacterial toxins, microcystin, nodularin, saxitoxin and cylindrospermopsin. Mar. Drugs, 8(5): 1650-1680.
Phillips, G., Pietiläinen, O.P., Carvalho, L., Solimini, A., Lyche Solheim, A., et Cardoso, A.C. (2008). Chlorophyll-nutrient relationships of different lake types using a large European dataset. Aquat. Ecol., 42(2):213–226.
Pilotto, L., Hobson, P., Burch, M.D., Ranmuthugala, G., Attewell, R. et Weightman, W. (2004). Acute skin irritant effects of cyanobacteria (blue-green algae) in healthy volunteers. Aust. New Zealand J. Public Health, 28(3): 220-224.
Pilotto, L.S., Douglas, R.M., Burch, M.D., Cameron, S., Beers, M., Rouch, G.J., Robinson, P., Kirk, M., Cowie, C.T., Hardiman, S., Moore, C. et Attewell, R.G. (1997). Health effects of exposure to cyanobacteria (blue-green algae) during recreational water-related activities. Aust. N. Z. J. Public Health, 21(6): 562-566.
Puschner, B., Hoff, B. et Tor, E. (2008). Diagnosis of anatoxin-a poisoning in dogs from North America. Journal of Veterinary Diagnostic Investigation, 20: 89-92.
Quiblier, C., Wood, S., Echenique-Subiabre, I., Heath, M., Villeneuve, A. et Humbert, J.F. (2013). A review of current knowledge on toxic benthic freshwater cyanobacteria – ecology, toxin production and risk management. Water Research, 47(15): 5464-5479.
Rinta-Kanto, J.M., Ouellette, A.J., Boyer, G.L., Twiss, M.R., Bridgeman, T.B. et Wilhelm, S.W. (2005). Quantification of toxic Microcystis spp. during the 2003 and 2004 blooms in Western Lake Erie using quantitative real-time PCR. Environ. Sci. Technol., 39(11): 4198-4205.
Roberts, V.A., Vigar, M., Backer, L., Veytsel, G.E., Hillborn, E.D., Hamelin, E.I., Vanden Esschert, K.L., Lively, J.Y., Cope, J.R., Hlavsa, M.C., et Yoder, J.S. (2020). Surveillance for harmful algal bloom events and associated human and animal illnesses – One Health Harmful Algal Bloom System, United States, 2016-2018. MMWR, 69(50): 1889- 1894.
Rogers, E.H., Hunter, E.S., Moser, V.C., Phillips, P.M., Herkovits, J., Muñoz, L., Hall, L.L. et Chernoff, N. (2005). Potential developmental toxicity of anatoxin-a, a cyanobacterial toxin. Journal of Applied Toxicology, 25(6): 527-534.
Rosen, B.H., et St. Amand, A. (2015). Field and laboratory guide to freshwater cyanobacteria harmful algal blooms for Native American and Alaska Native Communities. U.S. Geological Survey Open-File Report 2015-1164.
Roy-Lachapelle, A., Solliec, M. et Sauvé, S. (2015). Determination of BMAA and three alkaloid cyanotoxins in lake water using dansyl chloride derivatization and high-resolution mass spectrometry. Anal. Bioanal Chem., 407(18): 5487-5501.
Sabart, M., Pobel, D., Briand, E., Combourieu, B., Salencon, M.J., Humbert, J.F. and Latour, D. (2010). Spatiotemporal variations in microcystin concentrations and in the proportions of microcystin-producing cells in several Microcystis aeruginosa populations. Appl. Environ. Microbiol., 76(14): 4750-4759.
Saccà, A. (2016). A simple yet accurate method for the estimation of the biovolume of planktonic microorganisms. Plos One, 11(5): e0151955.
Santé Canada (en préparation). Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada : Comprendre et gérer les risques dans les eaux récréatives. Document préparé par le Groupe de travail fédéral-provincial-territorial sur la qualité des eaux à usage récréatif du Comité fédéral-provincial-territorial sur la santé et l’environnement, Ottawa (Ont.).
Santé Canada (inédit). Canadian exposure factors used in human health risk assessments.
Schets, F.M., Schijven, J.F. et de Roda Husman, A.M. (2011). Exposure assessment for swimmers in bathing waters and swimming pools. Water Res., 45(7): 2392-2400.
Schwimmer, M. et Schwimmer, D. (1968). Medical aspects of phycology. In: Algae, man, and the environment. Jackson, D.F. (ed.). Syracuse University Press, New York, N.Y., pp. 279-358.
Sinha, R., Pearson, L.A., Davis, T.W., Burford, M.A., Orr, P.T. et Neilan, B.A. (2012). Increased incidence of Cylindrospermopsis raciborskii in temperate zones – is climate change responsible? Water Research, 46(5): 1408-1419.
Sipari, H., Rantala-Ylinen, A., Jokela, J., Oksanen, I., et Sivonen, K. (2010). Development of a chip assay and quantitative PCR for detection microcystin synthetase E gene expression. Appl. Environ. Microbiol., 76(12) : 3797-3805.
Smith, M.J., Shaw, G.R., Eaglesham, G.K., Ho, L., et Brookes, J.D. (2008). Elucidating the factors influencing the biodegradation of cylindrospermopsin in drinking water sources. Environmental Toxicology, DOI 10.1002/tox
Søndergaard, M., Larsen, S.E., Jørgensen, T.B. et Jeppesen, E. (2011). Using chlorophyll a and cyanobacteria in the ecological classification of lakes. Ecological Indicators, 11(5): 1403-1412.
Spoof, L., et Arnaud, C. (2017). Appendix 3. Tables of microcystins and nodularins. In: Meriluoto, J., Spoof, L., and Codd, G.A. (Eds). Handbook of cyanobacterial monitoring and cyanotoxin analysis. Wiley, European Cooperation in Science and Technology, Cyanocost, United Kingdom.
Srivastava, A., Choi, G., Ahn, C., Oh, H., Ravi, A.K. et Asthana, R.K. (2012). Dynamics of microcystin production and quantification of potentially toxigenic Microcystis sp. using real-time PCR. Water Research, 46(3): 817-827.
Stevens, D.K. et Krieger, R.I. (1991). Stability studies on the cyanobacterial nicotinic alkaloid anatoxin-a. Toxicon, 29: 167–179.
Stewart, I. (2004). Recreational exposure to freshwater cyanobacteria: Epidemiology, dermal toxicity and biological activity of cyanobacterial lipopolysaccharides. Doctor of Philosophy. University of Queensland, Australia.
Stewart, I., Seawright, A.A. et Shaw, G.R. (2008). Cyanobacterial poisoning in livestock, wild mammals and birds – an overview. In: Cyanobacterial harmful algal blooms: State of the science and research needs. Hudnell, H.K. (ed.). Springer, New York, NY, pp. 613-637.
Stewart, I., Webb, P.M., Schluter, P.J., Fleming, L.E., Burns, J.W., Gantar, M., Backer, L.C. et Shaw, G.R. (2006b). Epidemiology of recreational exposure to freshwater cyanobacteria - an international prospective cohort study. BMC Public Health, 6(Article Number: 93): 1-11.
Stewart, I., Webb, P.M., Schulter, P.J., et Shaw, G.R. (2006a). Recreational and occupational field exposure to freshwater cyanobacteria – a review of anecdotal and case reports, epidemiological studies and the challenges for epidemiologic assessment. Environmental Health: A Global Access Science Source, 5: 6.
Suppes, L.M., Abrell, L., Dufour, A.P. et Reynolds, K.A. (2014). Assessment of swimmer behaviors on pool water ingestion. J. Water. Health., 12(2): 269-279.
Teneva, I., Asparuhova, D., Dzhambazov, B., Mladenov, R. et Schirmer, K. (2003). The freshwater cyanobacterium Lyngbya aerugineo-coerulea produces compounds toxic to mice and to mammalian and fish cells. Environ. Toxicol., 18(1): 9-20.
Testai, E. (2021). Anatoxin-a and analogues. In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Tillett, D., Dittmann, E., Erhard, M., von Döhren, H., Börner, T. et Neilan, B.A. (2000). Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806: an integrated peptide–polyketide synthetase system. Chemistry & Biology, 7(10): 753-764.
US EPA (2011). Exposure Factors Handbook: 2011 Edition (Final). Washington, DC; EPA/600/R-09/052F.
US EPA (2015a). Drinking water health advisory for the cyanobacterial toxin cylindrospermopsin. United States Environmental Protection Agency, Office of Water, Document Number: EPA-820-R-15-101
US EPA (2015b). Health Effects Support Document for the Cyanobacterial Toxin Cylindrospermopsin. United States Environmental Protection Agency, Office of Water, Document Number: EPA/820/R-15/103.
US EPA (2017). Recommendations for Cyanobacteria and cyanotoxin monitoring in recreational waters. United States Environmental Protection Agency, Office of Water, Document Number: EPA 820-R-17-001.
US EPA (2019). Recommended Human Health Recreational Ambient Water Quality Criteria or Swimming Advisories for Microcystins and Cylindrospermopsin. Washington, DC. EPA/822/R-19/001. May 2019.
US EPA (2021). Communicating about cyanobacterial blooms and toxins in recreational waters.
Vaitomaa, J., Rantala, A., Halinen, K., Rouhiainen, L., Tallberg, P., Mokelke, L., et Sivonen, K. (2003). Quantitative real-time PCR for determination of microcystin synthetase E copy numbers for Microcystis and Anabaena in lakes. Appl. Environ. Microbiol., 69(12): 7289-7297.
Van Wichelen, J., Vanormelingen, P., Codd, G.A., et Vyverman, W. (2016). The common bloom-forming cyanobacterium Microcystis is prone to a wide array of microbial antagonists. Harmful Algae. 55:97–111.
Vidal, F., Sedan, D., D’Agostino, D., Cavalieri, M.L., Mullen, E., Parot Varela, M.M., Flores, C., Caixach, J. et Andrinolo, D. (2017). Recreational exposure during algal bloom in Carrasco Beach, Uruguay: A liver failure case report. Toxins (Basel), 9(Article Number: 267): 1-12.
Vijayavel, K., Sadowsky, M.J., Ferguson, J.A. et Kashian, D.R. (2013). The establishment of the nuisance cyanobacteria Lyngbya wollei in Lake St. Clair and its potential to harbor fecal indicator bacteria. Journal of Great Lakes Research, 39(4): 560-568.
Vis, C., Cattaneo, A. et Hudon, C. (2008). Shift from chlorophytes to cyanobacteria in benthic macroalgae along a gradient of nitrate depletion. J. Phycol., 44(1): 38-44.
Watson, S.B, et Kling, H. (2017). Lake of the Woods phyto- and picoplankton: spatiotemporal patterns in blooms, community composition, and nutrient status. Lake and Reservoir Management, 33(4): 415-432.
Watson, S.B., Zastepa, A., Boyer, G.L., et Matthews, E. (2017). Algal bloom response and risk management: on-site response tools. Toxicon, 129: 144-152.
Welker, M. (2021). Cyanobacterial lipopolysaccharides (LPS). In: Chorus I, Welker M; eds: Toxic Cyanobacteria in Water, 2nd edition. CRC Press, Boca Raton (FL), on behalf of the World Health Organization, Geneva, CH.
Wiedner, C., Rücker, J., Brüggemann, R., et Nixdorf, B. (2007). Climate change affects timing and size of populations of an invasive cyanobacterium in temperate regions. Oecologia. 152:473–484.
Williams, C.D., Aubel, M.T., Chapman, A.D. et D’Aiuto, P.E. (2007). Identification of cyanobacterial toxins in Florida's freshwater systems. Lake Reserv. Manage., 23(2): 144-152.
Winter, J.G., DeSellas, A.M., Fletcher, R., Heintsch, L., Morley, A., Nakamoto, L. et Utsumi, K. (2011). Algal blooms in Ontario, Canada: Increases in reports since 1994. Lake Reserv. Manage., 27(2): 107-114.
Wood, S.A., et Dietrick, D.R. (2011). Quantitative assessment of aerosolized cyanobacterial toxins at two New Zealand lakes. J. Environ. Monit., 13: 1617 – 1624.
Wood, S.A., et Puddick J. (2017). The abundance of toxic genotypes is a key contributor to anatoxin variability in Phormidium-dominated benthic mats. Marine Drugs, 15 (307): 1-11.
Wood, S.A., Hawes, I., McBride, G., Truman, P., et Dietrich, D. (2015). Advice to inform the development of a benthic cyanobacteria attribute. Prepared for New Zealand Ministry for the Environment. Cawthron Report No. 2752. 91 p.
Wood, S.A., Kelly, L.T., Bouma-Gregson, K., Humbert, J.F., Laughinghouse IV, H.D., Lazorchak, J., McAllister, T.G., McQueen, A., Pokrzywinski, K., Puddick, J., Quiblier, C., Reitz, L.A., Ryan, K.G., Vadeboncoeur, Y., Zastepa, A., et Davis, T.W. (2020). Toxic benthic freshwater cyanobacterial proliferations: challenges and solutions for enhancing knowledge and improving monitoring and mitigation. Freshwater Biol., 65: 1824-1842.
Wood, S.A., Kuhajek, J.M., de Winton, M. et Phillips, N.R. (2012). Species composition and cyanotoxin production in periphyton mats from three lakes of varying trophic status. FEMS Microbiol. Ecol., 79(2): 312-326.
Wood, S.A., Paul, W.J. et Hamilton, D.P. (2008). Cyanobacterial biovolumes for the Rotorua Lakes. Cawthorn Institute, Prepared for Environment Bay of Plenty, 1504, New Zealand.
Wörmer, L. et coll. (2008). Cylindrospermopsin is not degraded by co-occurring natural bacterial communities during a 40-day study. Harmful Algae, 7: 206–213.
Wörmer, L. et coll. (2009). Advances in solid phase extraction of the cyanobacterial toxin cylindrospermopsin. Limnol. Oceanogr. Methods, 7: 568–575.
Xie, L., Hagar, J., Rediske, R.R., O'Keefe, J., Dyble, J., Hong, Y. et Steinman, A.D. (2011). The influence of environmental conditions and hydrologic connectivity on cyanobacteria assemblages in two drowned river mouth lakes. Journal of Great Lakes Research, 37(3): 470-479.
Yilmaz, M. et Phlips, E.J. (2011). Diversity of and selection acting on cylindrospermopsin cyrB gene adenylation domain sequences in Florida. Appl. Environ. Microbiol., 77(7): 2502-2507.
Yoshida, M., Yoshida, T., Satomi, M., Takashima, Y., Hosoda, N., et Hiroishi, S. (2008). Intra-specific phenotypic and genotypic variation in toxic cyanobacterial Microcystis strains. Journal of Applied Microbiology, 105:407-415.
Yuan, L.A., Pollard, A.I., Pather, S., Oliver, J.L. et D’Anglada, L. (2014). Managing microcystin: Identifying national-scale thresholds for total nitrogen and chlorophyll a. Freshwater Biology, 59: 1970-1981.
Zamyadi, A., MacLeod, S.L., Fan, Y., McQuaid, N., Dorner, S., Sauvé, S., et Prévost, M. (2012a). Toxic cyanobacterial breakthrough and accumulation in a drinking water plant: a monitoring and treatment challenge. Water Research, 46: 1511-1523.
Zamyadi, A., McQuaid, N., Prévost, M., et Dorner, S. (2012b). Monitoring of potentially toxic cyanobacteria using an online multi-probe in drinking water sources. J. Environ Monit, 14:579-588.
Zastepa, A., et Chemali, C. (2021). Bloom announcement: Late season cyanobacterial blooms co-dominated by Microcystis flos-aquae, Lyngbya birgei, and Aphanizomenon flos-aquae complex in Hamilton Harbour (Lake Ontario), an area of concern impacted by industrial effluent and residential wastewater. Data in Brief, 35: 106800.
Zastepa, A., Pick, F.R., et Blais, J.M. (2014). Fate and persistence of particulate and dissolved microcystin-LA from Microcystis blooms. Human and Ecological Risk Assessment: An International Journal, 20(6): 1670-1686.
Zastepa, A., Watson, S.B., Kling, H. et Kotak, B. (2017). Spatial and temporal patterns in microcystin toxins in Lake of the Woods surface waters. Lake Reserv. Manage., 33(4): 433-443.
Zohary, T., Shneor, M. et Hambright, K.D. (2016). PlanktoMetrix – a computerized system to support microscope counts and measurements of plankton. Inland Waters, 6(2): 131-135.
Annexe A : Liste des acronymes
- ADN
- acide désoxyribonucléique
- AQT
- apport quotidien tolérable
- ARNr
- acide ribonucléique ribosomique
- BMAA
- β-méthylamino-L-alanine
- CL
- chromatographie liquide
- CLHP
- chromatographie liquide à haute performance
- CLUHP
- chromatographie liquide à ultra-haute performance
- EAN
- efflorescences algales nuisibles
- ELISA
- essai d'immuno-absorption enzymatique
- FI
- facteur d'incertitude
- IC
- intervalle de confiance
- LOAEL
- dose minimale avec effet nocif observé
- MC
- variante de microcystine (p. ex., MC-LR, MC-LA, MC-YA, MC-RR, MC-YR)
- NOAEL
- dose sans effet nocif observé
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- PCR
- réaction en chaîne de la polymérase
- RPD
- détecteur à réseau de photodiodes
- PPIA
- essai d'inhibition de la protéine phosphatase
- qPCR
- réaction en chaîne de la polymérase quantitative
- SLA
- sclérose latérale amyotrophique
- SLA/CPD
- sclérose latérale amyotrophique/complexe Parkinson-démence
- SM
- spectrométrie de masse
- SM/SM
- spectrométrie de masse en tandem
- TEQ
- équivalent toxique
- US EPA
- United States Environmental Protection Agency (agence des États-Unis pour la protection de l'environnement)
- UV
- ultraviolet
- VBS
- valeur basée sur la santé
Annexe B : Organigramme de surveillance des cyanobactéries planctoniques et de leurs toxines
Figure 2 - Équivalent textuel
Le processus de surveillance des cyanobactéries planctoniques et de leurs toxines est présenté dans un organigramme. Ce diagramme est constitué d'une série de boîtes reliées par des flèches unidirectionnelles qui se déplacent vers les boîtes suivantes. Certaines cases contiennent des questions, tandis que d'autres contiennent des recommandations ou des informations sur l'échantillonnage. Les cases qui contiennent des questions sont reliées à deux cases, et le chemin parcouru dépend de la réponse à la question, oui ou non. L'organigramme commence par conseiller à l'utilisateur de surveiller visuellement la formation de fleurs d'eau. Si aucune fleur n'est suspectée, l'organigramme fait une boucle et la surveillance visuelle des fleurs d'eau se poursuit. Si une fleur d'eau suspecte est détectée près d'une zone de loisirs, le chemin du "oui" est emprunté et une notification publique est affichée concernant la présence et concentration possible de cyanobactéries. C'est l'approche recommandée. Les paramètres et les méthodes de surveillance qui seront utilisés dépendront du plan de surveillance des cyanobactéries propre au site. L'organigramme permet également aux usagers de supposer que des cyanobactéries sont présentes sans surveillance et de mettre à jour la notification publique confirmant la présence de cyanobactéries. L'étape suivante de l'organigramme consiste à prélever des échantillons pour confirmer la présence/concentration de cyanobactéries. Si la fleur d'eau n'est pas constituée de cyanobactéries, l'avis public doit être retiré ou mis à jour et la surveillance visuelle de la formation de la fleur d'eau doit se poursuivre. Si la fleur d'eau est confirmée comme étant une cyanobactérie, la voie du "oui" est suivie. Cette voie nécessite de déterminer si les cyanobactéries ou leurs toxines sont à des concentrations dépassant les valeurs guides. Si la réponse est non, la surveillance doit se poursuivre jusqu'à ce que la prolifération disparaisse. Si la réponse est oui, la notification publique doit être mise à jour pour confirmer la présence de cyanobactéries. L'étape suivante consiste à poursuivre la surveillance jusqu'à ce que la prolifération disparaisse. Une fois la floraison disparue, la dernière étape de l'organigramme consiste à mettre à jour ou à supprimer la notification publique. Dans certains plans d'eau, les avis, une fois émis, peuvent rester en place pour la saison.