Dosage de l’eugénol dans le tabac entier : T-314
1 Portée
1.1
La présente méthode sert au dosage de routine de l'eugénol, sans nécessiter la formation d'un dérivé. Elle s'applique au tabac entier dans les produits du tabac. L'analyse est effectuée par chromatographie liquide haute performance (CLHP) en phase inversée avec détecteur ultraviolet (UV).
2 Normes applicables
2.1
Méthode officielle T-115 de Santé Canada, Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.2
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.3
Organisation internationale de normalisation, ISO 8243, Cigarettes - Échantillonnage, 2013.
2.4
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac - Méthodes d'échantillonnage, de conditionnement et d'analyse - Partie 1 : Échantillonnage, 2001.
3 Définitions
3.1
Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-301.
4 Résumé de la méthode
4.1
L'échantillon est pesé avec précision dans un tube à culture à bouchon à vis et de l'éthanol y est ajouté.
4.2
Le tube est scellé et le tabac est extrait.
4.3
Une portion de la solution est filtrée dans une seringue et recueillie dans un flacon à échantillonneur ambré, puis analysée par chromatographie liquide haute performance (CLHP) avec détecteur UV.
4.4
L'eugénol présent dans le tabac entier est dosé par des méthodes utilisant des étalons externes. La réponse obtenue avec les échantillons est comparée à une courbe d'étalonnage tracée à partir des résultats obtenus avec plusieurs étalons.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode d'essai peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode d'essai, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
5 Appareillage et équipement
5.1
Broyeur, Robot Coupe RS1 de 2 V, ou l'équivalent.
5.2
Sonicateur.
5.3
Pipette automatique de 10 -50 mL.
5.4
Balance pour analyses, précise à au moins quatre décimales.
5.5
Centrifugeuse.
5.6
Agitateur magnétique.
5.7
Fiole jaugée ambrée, de 10 et 100 mL, de classe A.
5.8
Éprouvette gradué en verre de 50 mL.
5.9
Tubes à culture/à centrifuger de 200 × 25 mm à bouchon à vis.
5.10
Bouchons en polypropylène blanc sans revêtement.
5.11
Micropipettes de 10 - 5000 µL, ou l'équivalent.
5.12
Pipettes de classe A de 2, 5 et 50 mL.
5.13
Filtre de seringue de 0,45 µm en PVDF.
5.14
Seringues jetables de 5 mL.
5.15
Pipettes Pasteur jetables en verre.
5.16
Entonnoir à filtrer en verre.
5.17
Parafilm® ou l'équivalent.
5.18
Flacons pour échantillonneur automatique à bouchon à vis avec septum revêtu de téflon.
5.19
Bain agitant.
5.20
Système de chromatographie en phase liquide haute performance comprenant :
5.20.1
Détecteur UV.
5.20.2
Colonne RP 18e, ou l'équivalent.
5.20.3
Colonne de garde jetable.
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité réactif pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Éthanol de qualité CLHP - [67-17-5].
6.3
Eugénol - [97-53-0], de pureté > 99 %.
6.4
Hélium (UHP) - [7440-59-7].
6.5
Isopropanol - [67-63-0].
6.6
Méthanol - [67-56-1].
6.7
Eau de type I, tel que stipulé dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination.
8 Préparation des étalons
8.1
Préparer la solution mère primaire d'eugénol (2,0 mg/mL) en pesant avec précision 200 mg d'eugénol pur dans une fiole jaugée de 100 mL et en complétant avec de l'éthanol.
8.2
Préparer des étalons de travail dans la gamme 2-1000 µg/mL en diluant de la solution mère primaire d'eugénol (0,01 à 5000 µL) jusqu'à 10 mL avec de l'éthanol. (Voir le tableau 1 de l'annexe 1.)
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir la gamme de réponses prévues avec les échantillons.
8.3
Transvaser les étalons dans des flacons ambrés pour échantillonneur automatique. Rincer d'abord les flacons et les remplir en laissant le moins d'espace possible au-dessus du liquide.
8.4
Conserver les flacons à 4 °C, et les laisser à l'abri de la lumière jusqu'à l'analyse.
8.5
Préparer des étalons d'eugénol frais tous les cinq jours.
9 Échantillonnage
9.1
L'échantillonnage des cigarettes aux fins des tests doit être effectué conformément à la norme ISO 8243.
9.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
9.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
9.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
9.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
10 Préparation des produits du tabac
10.1
La préparation des produits du tabac aux fins de tests doit être effectuée conformément à la méthode T-402.
Remarque : les échantillons doivent être analysés dans les 24 heures suivant la préparation des produits du tabac afin de minimiser les pertes possibles d'eugénol.
11 Préparation des échantillons
11.1
Extraction du tabac entier
11.1.1
Avant les essais, broyer l'échantillon jusqu'à ce qu'il passe un tamis de 20 mesh (20 mailles par pouce carré).
Remarque : dans le cas des échantillons ayant une haute teneur en humidité, qui ne peuvent être broyés de cette manière, l'extraction peut débuter à l'étape 11.1.2.
11.1.2
Peser avec précision 2 g de l'échantillon dans un tube à culture à bouchon à vis.
11.1.3
Ajouter 50 mL d'éthanol à l'échantillon. Visser le bouchon et le sceller avec du Parafilm®.
11.1.4
Extraire dans un bain agitant pendant deux heures à 50 °C.
11.1.5
Laisser l'échantillon refroidir à la température ambiante, puis en filtrer une portion dans un filtre monté sur une seringue jetable en recueillant le filtrat (en double) dans des flacons ambrés pour échantillonneur automatique. Boucher les flacons et entreposer à 4 °C.
Remarque : avant de pouvoir effectuer la filtration, il peut être nécessaire de centrifuger à une vitesse d'environ 1200 tr/min pendant 10 minutes pour comprimer le tabac entier.
12 Analyse des échantillons
12.1
Paramètres chromatographiques (analyse par CLHP en phase inversée)
- Température de la colonne :
- 30 °C
- Phase mobile :
- solvant A : méthanol/eau de type I (80/20) filtré et dégazé (par barbotage d'hélium UHP)
- Lavage de l'échantillon :
- solvant A
- Longueur d'onde du rayonnement UV :
- 280 nm
- Phase mobile :
- isocratique
- Débit :
- 0,7 mL/min
| Temps (min) |
Composition | ||
|---|---|---|---|
| A (%) |
B (%) |
C (%) |
|
| 0,0 | 100 | 0 | 0 |
| 20,0 | 100 | 0 | 0 |
| Fin de méthode | 100 | 0 | 0 |
Temps d'équilibre : 10 minutes
Remarque : il sera peut-être nécessaire de régler le gradient, selon les paramètres de l'instrument et de la colonne, et la résolution du pic de l'analyte.
Remarque : il sera peut-être nécessaire de modifier ces paramètres, qui dépendent du détecteur utilisé, afin d'obtenir une réponse linéaire dans l'intervalle de concentrations de l'analyte d'intérêt.
12.2
Analyse des échantillons
12.2.1
13 Calculs
13.1
Courbe d'étalonnage
13.1.1
Préparer une courbe d'étalonnage en rapportant la surface des pics obtenus en fonction de la concentration d'eugénol dans les étalons. Déterminer le facteur de réponse à partir de la courbe d'étalonnage.
13.2
Dosage de l'eugénol
13.2.1
Doser l'eugénol dans les échantillons de tabac par la méthode de l'étalon externe.
13.2.2
Identifier les pics par comparaison des temps de rétention avec ceux des étalons et par dopage des échantillons de tabac entier. (MF)
13.3
Détermination de la teneur en eugénol (µg/g)

Figure 13-3 : Équivalent textuel
Eugénol [mg/g] =
Aire sous le pic
divisé par
Facteur de réponse
×
mL de solution
divisé par
Masse (g) de tabac
13.3.1
Introduire dans l'équation les bons multiplicateurs (volume global de l'échantillon d'origine, exprimé en mL) et diviseur (masse d'échantillon d'origine, exprimée en g); la concentration d'eugénol est calculée automatiquement en µg/g.
13.3.2
Pour transformer cette concentration en pourcentage (%), diviser par 10 000 le résultat exprimé en µg/g.
13.3.3
Tous les résultats sont exprimés en fonction du tabac « à analyser ». Ils peuvent l'être en fonction de la « matière sèche » en tenant compte des résultats obtenus pour le degré d'humidité.
14 Contrôle de la qualité
14.1
14.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle sont hors des limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
14.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactif (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
14.2.2
Blanc fortifié (BF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
14.2.3
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre une matrice fortifiée (MF) afin de détecter toute interférence provenant de la matrice. Lors de la préparation des échantillons et/ou pendant l'exécution des analyses, diviser un échantillon et fortifier une des portions par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
14.2.4
Échantillon de contrôle
Pour évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon témoin. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra ainsi des données sur l'exactitude et la précision de la méthode d'analyse.
14.2.5
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux concentrations prévues.
14.3
Taux de récupération et niveaux de contamination
14.3.1
Les résultats de l'analyse du BR sont habituellement inférieurs à la limite de détection (LD).
14.3.2
Les taux de récupération du BF se situent habituellement dans un intervalle de 90 à 100 %.
14.3.3
Les taux de récupération de la MF se situent habituellement dans un intervalle de 85 à 105 %.
14.4
Limite de détection (LD) et limite de quantification (LQ)
14.4.1
La limite de détection (LD) est égale à trois fois l'écart-type des résultats obtenus en analysant l'étalon le moins concentré au moins 10 fois sur une période de plusieurs jours.
14.4.1.1
Une valeur de 0,81 µg/g constitue une LD typique, dans le cas de l'analyse d'un échantillon « tel que reçu ».
14.4.2
La limite de quantification (LQ) est égale à 10 fois l'écart-type des résultats obtenus en analysant l'étalon le moins concentré au moins 10 fois sur une période de plusieurs jours.
14.4.2.1
Une valeur de 2,69 µg/g constitue une LQ typique, dans le cas de l'analyse d'un échantillon « tel que reçu ».
14.5
Stabilité des réactifs et des solutions
14.5.1
Préparer de nouvelles solutions étalons primaires d'eugénol chaque semaine.
14.5.2
Préparer de nouveaux étalons de travail et de nouveaux solvants d'extraction chaque semaine.
14.5.3
Analyser tous les échantillons dans les 24 heures.
15 Références
15.1
Fischer, I. U.; Dengler, H. J. 1990. Sensitive High Performance Liquid Chromatographic Assay for the Determination of Eugenol in Body Fluids, Journal of Chromatography, 525: 369-377.
15.2
Myint, S. et al. 1995. Separation and Identification of Eugenol in Ethanol Extract of Cloves by Reversed-Phase High Performance Liquid Chromatography, Journal of American Oil Chemist Society, 72: 1231-1233.
15.3
Smith, R. M.; Beck, S. 1984. High Performance Liquid Chromatographic Analysis of Eugenol in Pimento using Ultraviolet and Electrochemical Detection, Journal of Chromatography, 291: 424-427.
15.4
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
Annexe 1
Tableau 1. Étalons d'eugénol
| Étalon no |
Volume de solution mère primaire d'eugénol (mL) |
Volume final (mL) |
Eugénol [µg/mL] |
|---|---|---|---|
| 1 | 5,0 | 10 | 1000 |
| 2 | 2,5 | 10 | 500 |
| 3 | 1,0 | 10 | 200 |
| 4 | 0,500 | 10 | 100 |
| 5 | 0,100 | 10 | 20,0 |
| 6 | 0,010 | 10 | 2,0 |
Remarque : la concentration d'eugénol varie selon la concentration exacte de l'étalon primaire qui a été préparé.
Remarque : il sera peut-être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
Annexe 2
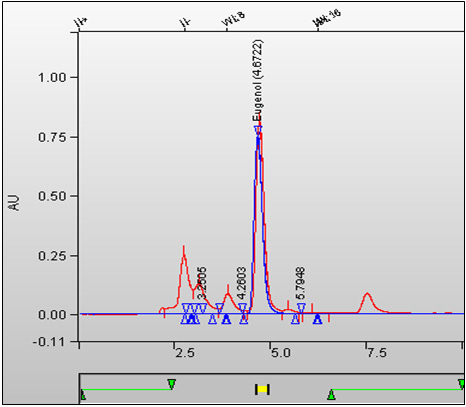
Figure 1. Superposition des chromatogrammes d'un échantillon de tabac entier (tabac à cigarette de type kretek) et de l'étalon. (Le pic de l'eugénol est caractérisé par un temps de rétention (TR) de 4,672 minutes.) : Équivalent textuel
Cette figure est une superposition des chromatogrammes d'un échantillon de tabac entier et de l'étalon. Le temps de rétention de l'eugénol est 4,672 minutes.
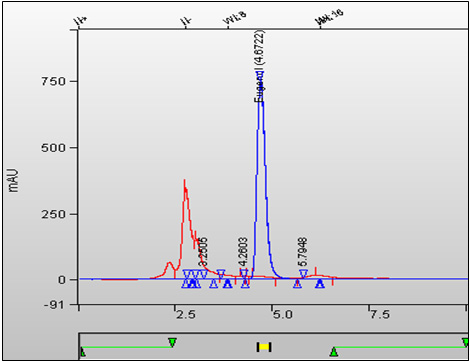
Figure 2. Superposition des chromatogrammes d'un échantillon de tabac entier (cigarette de type 1R4F) et de l'étalon. (Noter, dans le cas de l'échantillon, l'absence du pic correspondant à l'eugénol à TR = 4,672 minutes.) : Équivalent textuel
Cette figure est une superposition des chromatogrammes d'un échantillon de tabac entier (cigarette 1R4F) et d'un étalon. Le pic de l'eugénol est absent après 4,672 minutes de temps de rétention dans l'échantillon.
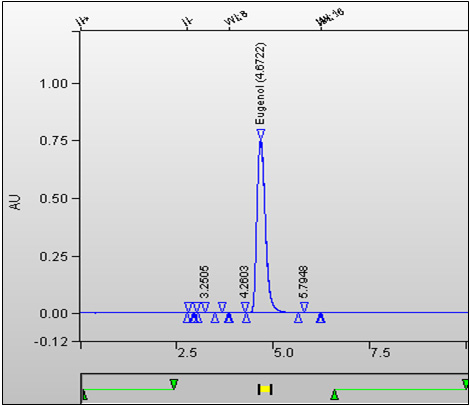
Figure 3. Chromatogramme de l'étalon d'eugénol. TR = 4,672 minutes. : Équivalent textuel
Cette figure est un chromatogramme de l'étalon d'eugénol. Le temps de rétention est de 4,672 minutes.