Dosage des humectants dans le tabac entier : T-304
1 Portée
1.1
La présente méthode s'applique au dosage du glycérol, du propylène glycol et du triéthylène glycol qui ont pu être ajoutés au tabac entier en tant qu'humectants.
1.2
Cette méthode n'est pas conçue pour le dosage de traces de contamination provenant de sources extérieures et ne permet pas de faire la distinction entre la quantité d'humectant ajouté et la quantité de ce même produit d'origine naturelle (le cas échéant).
2 Normes applicables
2.1
Méthode officielle TC 115 de Santé Canada, Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.2
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.3
Organisation internationale de normalisation, ISO 8243, Cigarettes – Échantillonnage, 2013.
2.4
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac – Méthodes d'échantillonnage, de conditionnement et d'analyse – Partie 1 : Échantillonnage, 2001.
2.5
AOAC INTERNATIONAL, méthode officielle de l'AOAC 971.02, Glycerol, Propylene Glycol, and Triethylene Glycol in Cased Cigarette Cut Filler and Ground Tobacco, Gas Chromatographic Method, Official Methods of Analysis of AOAC INTERNATIONAL., 20ème édition, 2016.
2.6
AOAC INTERNATIONAL, méthode officielle de l'AOAC 968.03, Menthol in Cigarette Filler, Gas Chromatographic Method, Official Methods of Analysis of AOAC INTERNATIONAL, 20ème édition, 2016.
3 Définitions
3.1
Pour les définitions et les termes utilisés dans le présent document, se reporter à la méthode T-301.
4 Résumé de la méthode
4.1
Cette méthode est une méthode d'analyse par chromatographie en phase gazeuse (CG) sur une colonne mégabore en silice fondue, avec détection par ionisation de flamme (DIF). On procède à l'extraction de tabac provenant d'une source fraîche (emballage ou boîte de tabac fine coupe) avec du méthanol, sur un agitateur mécanique. L'échantillon est ensuite mis dans le noir et laissé au repos jusqu'à ce que le surnageant soit limpide. Une partie du surnageant est transférée dans un contenant pour échantillonneur automatique et les teneurs en humectant, dosées par chromatographie en phase gazeuse (CG).
4.2
Les humectants sont analysés sur une colonne mégabore en silice fondue, garnie d'une phase stationnaire de polyéthylène glycol (PEG). Le dosage est réalisé avec un étalonnage interne avec étalons et en comparant les réponses du DIF pour les analytes dans les échantillons aux courbes d'étalonnage multipoints pour les humectants correspondants dans les étalons.
4.3
Afin de comparer avec exactitude la teneur en humectant d'une marque à l'autre et de calculer la teneur en humectant « en matière sèche », on détermine le degré d'humidité.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode d'essai peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode d'essai, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
5 Appareillage et équipement
5.1
Erlenmeyers de 125 mL avec bouchons, ou l'équivalent.
5.2
Fioles jaugées de 10, 100 et 2000 mL.
5.3
Pipettes de 20 mL.
5.4
Pipettes jaugées de diverses tailles.
5.5
Pipette automatique, 10-50 mL, ou l'équivalent.
5.6
Système de chromatographie en phase gazeuse avec détecteur à ionisation de flamme (DIF).
5.7
Échantillonneur automatique.
5.8
Flacons pour échantillonneur automatique, avec bouchon à vis et septum recouvert de téflon.
5.9
Colonne DB-Wax en silice fondue de 15 m × 0,53 mm × 1 µm, ou l'équivalent.
5.10
Agitateur oscillant mécanique.
5.11
Pipettes jetables.
5.12
Balance pour analyses, précise à au moins quatre décimales.
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité réactif.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Butane-1,3-diol – [107-88-0] - (utilisé comme étalon interne).
6.3
Glycérol – [56-81-5].
6.4
Méthanol – [67-56-1] - distillé dans du verre.
6.5
Propylène glycol – [57-55-6].
6.6
Triéthylène glycol – [112-27-6].
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination.
8 Préparation des solutions
8.1
Solution d'extraction (concentration approximative de butane-1,3-diol de 2 mg/mL)
8.1.1
Peser 20 g (± 0,05 g) de butane-1,3-diol dans une fiole jaugée de 100 mL et compléter avec du méthanol. Consigner le poids exact.
8.1.2
Apposer une étiquette indiquant « Solution mère de butane 1,3 diol ».
8.1.3
Pipeter 20 mL de solution mère et les verser dans une fiole jaugée de 2 L. Compléter avec du méthanol. Bien mélanger.
9 Préparation des étalons
9.1
Étalon mère primaire de glycérol (environ 100 mg/mL)
9.1.1
Peser 10 g (± 0,05 g) de glycérol dans une fiole jaugée de 100 mL et compléter avec de la solution d'extraction. Consigner le poids exact.
9.2
Étalon mère primaire de propylène glycol (environ 50 mg/mL)
9.2.1
Peser 5 g (± 0,05 g) de propylèneglycol dans une fiole jaugée de 100 mL et compléter avec de la solution d'extraction. Consigner le poids exact.
9.3
Étalon mère primaire de triéthylène glycol (environ 50 mg/mL)
9.3.1
Peser 5 g (± 0,05 g) de triéthylèneglycol dans une fiole jaugée de 100 mL et compléter avec de la solution d'extraction. Consigner le poids exact.
9.4
Étalon secondaire mixte (étalon de travail no 4)
9.4.1
Pipeter 4 mL de chacun des étalons mères primaires et les verser dans une fiole jaugée de 100 mL.
9.4.2
Compléter avec de la solution d'extraction.
9.5
Étalons de travail
9.5.1
Tous les étalons sont préparés dans des fioles jaugées avec les dilutions suivantes :
| Étalons no |
Volume d'étalon mixte (mL) |
Volume final (mL) | Glycérol [mg/mL] |
Propylène-glycol [mg/mL] |
Triéthylène-glycol [mg/mL] |
|---|---|---|---|---|---|
| 1 | 10 | 10 | 4,00 | 2,00 | 2,00 |
| 2 | 6 | 10 | 2,40 | 1,20 | 1,20 |
| 3 | 3 | 10 | 1,20 | 0,60 | 0,60 |
| 4 | 1,5 | 10 | 0,60 | 0,30 | 0,30 |
| 5 | 0,5 | 10 | 0,20 | 0,10 | 0,10 |
Remarque : les fioles jaugées sont complétées avec de la solution d'extraction (qui contient l'étalon interne).
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
10 Échantillonnage
10.1
L'échantillonnage des cigarettes à tester doit être effectué conformément à la norme ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
10.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
10.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
La préparation des produits du tabac à tester doit être effectuée conformément à la méthode T-402.
12 Préparation des échantillons
12.1
Extraction des échantillons
12.1.1
Peser 2 g d'échantillon dans un erlenmeyer de 125 mL. Consigner le poids exact.
12.1.2
Ajouter 25 mL de solution d'extraction.
12.1.3
Boucher les erlenmeyers et les placer sur un agitateur oscillant pendant 60 minutes.
12.1.4
Retirer les échantillons de l'agitateur, agiter le flacon en tournoyant de manière à faire passer tout le tabac dans le solvant.
12.1.5
Laisser les échantillons au repos 30 minutes, jusqu'à ce que le surnageant soit limpide.
12.1.6
Transférer le surnageant dans un flacon pour échantillonneur automatique et faire l'analyse par CG.
13 Analyse des échantillons
13.1
Conditions pour la chromatographie en phase gazeuse
- Injecteur :
- débit divisé (split)
- Colonne :
- DB-WAX, 15 m × 0,53 mm × 1,0 µm
- Détecteur :
- ionisation de flamme (DIF)
- Gaz vecteur :
- hélium
Remarque : les débits d'H2 et d'air extra sec pour le DIF doivent être réglés conformément aux spécifications du fabricant.
13.1.1
Programmation de température
- Injecteur :
- 220 ° C
- Détecteur :
- 260 ° C
- Température initiale de la colonne :
- 120 ° C, maintenue 2 minutes
- Taux :
- 15 ° C/min jusqu'à 180 ° C, puis maintenue à 180 ° C pendant 4 minutes
Temps total d'analyse : 10,00 minutes
Remarque : il sera peut-être nécessaire de régler ces paramètres en fonction de l'appareil et de la colonne, ainsi que de la résolution du pic de l'analyte.
13.1.2
Conditions pour l'échantillonneur automatique
Volume injecté : 1,0 µL
Remarque : le premier étalon doit être injecté au moins trois fois pour reconditionner la colonne.
13.1.3
La colonne DB-WAX renferme une phase stationnaire de polyéthylène glycol qui est idéale pour la séparation des glycols. Cependant, les problèmes de traînée peuvent être importants dans le cas du glycérol si les conditions chromatographiques sont inappropriées. Ces problèmes de traînée peuvent aussi être dus à un effet de solvant et/ou à une réactivité dans l'injecteur.
Remarque : le méthanol n'est, en général, pas un bon solvant à injecter dans un CG, car il produit une traînée énorme. Cet effet peut être réduit en utilisant une division importante du débit, une très grande vitesse linéaire, une phase stationnaire épaisse et en insérant des tubes en verre désactivé dans l'injecteur.
Remarque : la réactivité dans l'injecteur peut être réduite en y insérant des tubes en verre désactivé. Il est indispensable de remplacer ces tubes entre chaque série d'échantillons (environ tous les 40 échantillons réels), car la solution injectée est relativement sale et crée des sites actifs sur le tube après des injections répétées.
14 Calculs
14.1
Tous les résultats sont exprimés en fonction du tabac « tel que reçu ». Il est possible de les exprimer « en matière sèche » en tenant compte des résultats obtenus pour le degré d'humidité.
Résultats des analyses :
Analyte [mg/g] = [Aire(Analyte échantillon) / Aire(Étalon interne)] × FR(mg/mL) × [Multiplicateur(mL) /Diviseur(g)].
Où FR est calculé à partir de la courbe d'étalonnage.
Conversion en pourcentage (« tel que reçu ») :
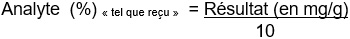
Figure 14.1-a : Équivalent textuel
Analyte (%) « tel que reçu » = Résultat (en mg/g)
divisé par
10
Conversion en pourcentage « en matière sèche » :
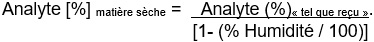
Figure 14.1-b : Équivalent textuel
Analyte [%] matière sèche = Analyte (%)« tel que reçu ».
divisé par
[1- (% Humidité / 100)]
où le % d'humidité est déterminé dans le même échantillon reçu aux fins du dosage des humectants.
15 Contrôle de la qualité
15.1
Pour le chromatogramme typique – voir l'annexe 1.
15.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle dépassent les limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactifs (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'ajout d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
15.2.3
Échantillon de contrôle
Afin d'évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon de contrôle. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.4
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
Les valeurs obtenues lors des analyses des BR sont faibles. On les donne dans le tableau suivant :
| BR (mg/g) |
|
|---|---|
| Propylène glycol | 0,000 ± 0,000 |
| Glycérol | 0,002 ± 0,003 |
| Triéthylène glycol | 0,000 ± 0,001 |
15.3.2
Les taux de récupération typiques observés pour des blancs fortifiés (BF) sont de 85 à 115 %.
15.3.3
Les taux de récupération typiques observés pour les matrices fortifiées (MF) sont de 90 à 110 %.
15.4
Limite de détection (LD) et limite de quantification (LQ)
15.4.1
La limite de quantification (LQ) est égale à la concentration de l'étalon de plus faible concentration, multipliée par le volume de dilution et divisée par le poids de l'échantillon utilisé pour préparer la courbe d'étalonnage (à l'exception du blanc).
Exemple : LQ du glycérol = 0,2 mg/mL × 25 mL / 2g
Des valeurs typiques sont présentées dans la section 15.4.3.
15.4.2
La limite de détection (LD) est égale à 0,3 fois la LQ.
15.4.3
Valeurs typiques de LQ et de LD pour les humectants :
| N/A | LQ (mg/g) |
LD (mg/g) |
|---|---|---|
| Propylène glycol | 1,25 | 0,375 |
| Glycérol | 2,50 | 0,750 |
| Triéthylène glycol | 1,25 | 0,375 |
15.5
Stabilité des réactifs et des échantillons
15.5.1
Les solutions mères sont stables pendant au moins un mois à 4 ° C.
15.5.2
Tous les échantillons doivent être analysés dans la semaine suivant leur extraction.
Annexe 1 :
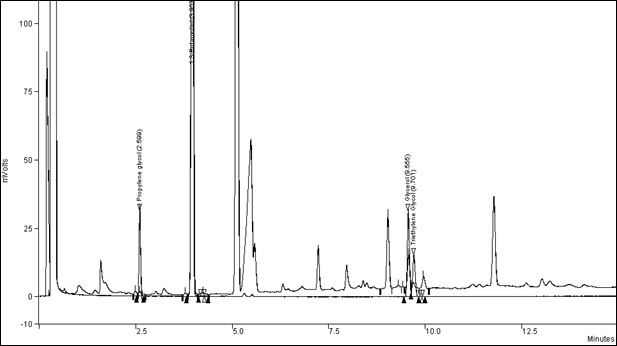
Courbe supérieure : tabac canadien Monitor 7; courbe inférieure : étalon
Figure 1. Chromatogramme typique des humectants : Équivalent textuel
Cette figure présente un exemple de chromatogramme pour le tabac canadien Monitor 7 par rapport à un étalon.
Temps de rétention typiques :
- Propylène glycol :
- 2,599 min
- Butane-1,3-diol (étalon interne) :
- 3,957 min
- Glycérol :
- 9,555 min
- Triéthylène glycol :
- 9,701 min