Dosage des nitrosamines spécifiques au tabac dans le tabac entier par le CPG-AET : T-309A
1 Portée
1.1
La présente méthode s'applique au dosage de 4 N-nitrosamines spécifiques du tabac (NAST) présentes dans le tabac entier :
N-nitrosonornicotine (NNN), 4-(methylnitrosoamino)-1-(3-pyridyl)-1-butanone (NNK), N-nitrosoanatabine (NAT) et N-nitrosoanabasine (NAB). Le dosage est réalisé par chromatographie en phase gazeuse couplée à un analyseur d'énergie thermique (CPG-AET).
2 Normes applicables
2.1
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.3
Méthode officielle T-115 de Santé Canada, Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.4
Organisation internationale de normalisation, ISO 8243, Cigarettes – Échantillonnage, 2013.
2.5
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac – Méthodes d'échantillonnage, de conditionnement et d'analyse – Partie 1 : Échantillonnage, 2001.
2.6
AOAC INTERNATIONAL, méthode officielle 966.02, Loss on Drying (Moisture) in Tobacco, Official Methods of Analysis of AOAC INTERNATIONAL, 20ème édition, 2016.
3 Définitions
3.1
Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-301.
4 Résumé de la méthode
4.1
Les NAST sont extraites avec un tampon aqueux contenant de l'acide ascorbique pour empêcher la formation d'artéfacts. Les NAST sont enrichies par extraction avec du dichlorométhane, puis par chromatographie sur colonne. La fraction renfermant les NAST est ensuite dosée par chromatographie en phase gazeuse couplée à une analyse d'énergie thermique (CPG-AET). La N-nitrosoguvacoline (NG) est utilisée comme étalon interne.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
Avertissement : Les 4 NAST visées ont des effets carcinogènes sur plusieurs espèces d'animaux de laboratoire. Elles doivent être manipulées avec un soin extrême. Les gaz émis par le détecteur de l'AET doivent être évacués convenablement de manière à réduire le plus possible toute exposition à une quantité excessive d'ozone (03).
5 Appareillage et équipement
5.1
Équipement nécessaire à la préparation du tabac en vue de l'analyse, tel que défini dans la méthode T-402.
5.2
Flacon de 250 mL avec col en verre rodé.
5.3
Fioles jaugées de 5 à 100 mL.
5.4
Feuille d'aluminium.
5.5
Agitateur oscillant.
5.6
Pipettes Pasteur en verre.
5.7
Turbo-évaporateur Zymark TurboVap II, muni de tubes de 200 mL avec extrémité graduée de 1 mL, ou l'équivalent.
5.8
Analyseur d'énergie thermique (Elutia 800 series ou l'équivalent) couplé au CG.
5.9
Système de chromatographie en phase gazeuse, avec injecteur à température programmable et contrôle électronique du débit (ou l'équivalent).
5.10
Colonne capillaire en silice fondue DB-1 pour CG, 30 m × 0,32 mm × 3,0 µm, ou l'équivalent.
5.11
Tube d'absorption Varian Chem-Elut CE201000, ou l'équivalent.
5.12
Éclairage exempt de rayonnement ultraviolet (UV).
5.13
Flacons ambres.
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité réactif pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Acétone - [67-64-1], distillée dans du verre.
6.3
Acide L-ascorbique - [50-81-7].
6.4
Acide citrique (anhydre) - [77-92-9].
6.5
Dichlorométhane (DCM) - [75-09-2], distillé dans du verre.
6.6
Méthanol - [67-56-1], distillé dans du verre.
6.7
Phosphate monosodique - [7558-79-4].
6.8
Sulfate de sodium anhydre - [7757-82-6].
6.9
Eau de type I, tel que stipulé dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
6.10
N- Nitrosoguvacoline (NG) > 98,7 % - [55557-02-3]
6.11
N- Nitrosonornicotine (NN) > 98 % - [64162-58-9]
6.12
N -Nitrosoanatabine (NAT) > 96 % - [71267-22-6]
6.13
N -Nitrosoanabasine (NAB) > 96,1 % - [1133-64-8]
6.14
4-(N-Méthyl-N-nitrosoamino)butan-1-one (NNK) > 98 % - [55557-02-3]
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination.
8 Préparation des solutions
8.1
Tampon citrate-phosphate contenant de l'acide L-ascorbique
8.1.1
Préparer 1 L de solution aqueuse renfermant :
8.1.1.1
55 mM d'acide citrique (0,055 × 192,12 = 10,6 g/L).
8.1.1.2
90 mM de phosphate monosodique (0,090 × 141,96 = 12,8 g/L).
8.1.1.3
20 mM d'acide L-ascorbique (0,02 × 176,13 = 3,5 g/L).
Remarque : le pH de la solution doit se situer entre 4,3 et 4,5.
9 Préparation des étalons
9.1
Étalon interne de N-nitrosoguvacoline (NG)
9.1.1
Préparer une solution à 5000 ng/mL dans du dichlorométhane.
9.1.2
Conserver dans un flacon ambré et protéger de la lumière.
9.2
Solution étalon mixte de NAST
9.2.1
Préparer une solution étalon mixte de NNN, de NAT, de NAB et de NNK dans du dichlorométhane, avec les concentrations suivantes :
- 3000 ng/mL de NNK.
- 1500 ng/mL de NNN et de NAT.
- 500 ng/mL de NAB.
Remarque : les solutions concentrées sont stables pendant environ six mois si elles sont conservées à - 20 ° C.
9.3
Solutions d'étalonnage
9.3.1
Préparer des solutions d'étalonnage dont la concentration varie de 20 ng/mL (pour la NAB) à 2000 ng/mL (pour la NNK), contenant toutes 500 ng/mL de NG comme étalon interne.
Remarque : les solutions mères individuelles d'étalonnage sont stables pendant deux mois si elles sont conservées à - 20 ° C.
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
10 Échantillonnage
10.1
L'échantillonnage des cigarettes aux fins de tests doit être effectué conformément à la norme ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
10.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
10.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
Préparation des échantillons
11.1.1
Retirer le produit de son emballage pour constituer un échantillon composite.
11.1.2
Préparer les échantillons de produits du tabac conformément à la méthode T-402.
12 Extraction d'échantillons
12.1
Extraction du tabac et des produits du tabac
12.1.1
L'éclairage dans les pièces où les échantillons sont analysés doit être exempt de rayons ultraviolets.
12.1.2
Peser 1 g de tabac entier dans un flacon de 250 mL.
12.1.3
Ajouter 50 mL de tampon de citrate-phosphate renfermant de l'acide L-ascorbique.
12.1.4
Ajouter 500 µL de la solution de NG (étalon interne).
12.1.5
Placer le flacon sur un agitateur oscillant et agiter pendant 60 minutes pour totalement saturer et extraire le tabac.
12.2
Purification des échantillons
12.2.1
Placer un tube de 200 mL pour turbo-évaporateur sous la colonne Chem-Elut.
Remarque : la taille du tube ou de la cartouche et la quantité de remplissage peuvent varier selon le fabricant et type de dispositif d'extraction en phase solide.
Remarque : le produit s'écoulant de la cartouche d'extraction en phase solide doit être dilué selon les instructions du fabricant, la taille de la cartouche et la quantité de remplissage, de sorte que les taux de récupération soient acceptables.
12.2.2
Verser tout l'extrait contenu dans le flacon sur la colonne Chem-Elut.
12.2.3
Rincer le ballon avec deux portions de 5 mL du tampon de citrate-phosphate, puis ajouter sur la colonne Chem-Elut.
12.2.4
Attendre cinq minutes pour que le remplissage puisse absorber la solution aqueuse.
12.2.5
Rincer le flacon avec 150 mL de dichlorométhane, puis verser le liquide de rinçage sur la colonne Chem-Elut.
12.2.6
Après passage de la portion de 150 mL de dichlorométhane dans la colonne et lorsque les gouttes s'échappent de la colonne à un rythme de moins de 1 goutte/seconde, répéter l'étape 12.2.5 en rinçant avec une autre portion de 150 mL de dichlorométhane.
12.2.7
Continuer de récupérer l'extrait jusqu'à l'obtention de 250 mL.
Remarque : pour ce faire, il faut récupérer la fraction de nitrosamines dans un deuxième tube dont le contenu sera combiné à celui du premier tube après réduction par évaporation.
12.2.8
Mettre l'échantillon dans le turbo-évaporateur réglé à 38 ° C et à une pression d'azote de 10 lb/po2.
12.2.9
Réduire le volume de l'échantillon à 3,5 mL (ceci prend environ 45 minutes).
12.2.10
Transférer le concentré dans une fiole jaugée de 5 mL et compléter avec le dichlorométhane utilisé pour le rinçage du turbo-évaporateur.
12.2.11
Transférer l'échantillon dans un flacon ambré pour échantillonneur automatique, muni d'un septum doublé de téflon, en vue de l'analyser par CG.
13 Analyse des échantillons
13.1
Paramètres pour la CPG-AET
- Débit du gaz vecteur (He) :
- 2,8 mL/min contrôlé électroniquement (vitesse = 60 cm/seconde)
- Température de l'injecteur :
- programmable de 35 à 220 ° C
- Température du four :
- programmée de 50 à 170, puis à 212 ° C
- Température de l'interface :
- avec l'AET : 275 ° C
- Température du four de l'AET :
- 500 - 525 ° C (selon la sensibilité de l'analyseur)
- Durée d'analyse :
- 35 minutes
- Volume injecté :
- 1,5 µL
Remarque : il sera peut-être nécessaire de régler ces paramètres, selon les paramètres de l'instrument et de la colonne et la résolution du pic de l'analyte.
13.2
Étalonnage du CG/AET
13.2.1
Injecter 1,5 µL de chaque solution étalon et calculer les aires sous les pics correspondant aux 4 constituants et à la NG (étalon interne).
13.3
Dosage des NAST
13.3.1
Injecter 1,5 µL de concentré d'échantillon (12.2.11) et déterminer l'aire sous les pics dont les temps de rétention correspondent à ceux de la NNN, de la NAT, de la NAB et de la NNK.
14 Calculs
14.1
La concentration, m (ng/g), d'une NAST donnée est calculée à l'aide de la formule suivante :
- M (ng/g) = CVs/N.
- dans laquelle :
- C = concentration de la NAST donnée, déterminée par étalonnage avec un étalon interne.
- Vs = volume final du concentré.
- N = poids (en g) de tabac extrait.
14.2
Pour convertir les résultats en ng/g de « matière sèche », il faut tenir compte du taux d'humidité, de la manière suivante = volume final du concentré. :
M (ng/g) matière sèche = M (ng/g) tel quel / (1 - (% Humidité/100)).
dans laquelle le % d'humidité est déterminé dans le même échantillon « dans son état initial de réception », selon la Méthode Officielle 966.02 de l'AOAC.
15 Contrôle de la qualité
15.1
Pour un chromatogramme typique, voir l'annexe 1.
15.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle dépassent les limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
Remarque : un échantillon de contrôle devrait être analysé dans chaque série d'analyses, alors que les autres vérifications de contrôle de la qualité peuvent être faites en tant que validation initiale et utilisées comme outils d'enquête en cas d'obtention de résultats non prévus et pas nécessairement lors de chaque test.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactifs (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Blanc fortifié (BF)
Chaque série d'analyses doit comprendre un blanc fortifié (BF) pour détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon
15.2.3
Matrice fortifiée (MF)
Chaque série d'analyses doit comprendre une matrice fortifiée (MF) pour détecter toute interférence provenant de la matrice. Lors de la préparation des échantillons et/ou pendant l'exécution des analyses, diviser un échantillon et fortifier une des portions par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
15.2.4
Échantillon de contrôle
Pour évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon de contrôle. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra ainsi des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.5
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
Les résultats de l'analyse du BR sont habituellement inférieurs à la limite de détection (LD).
15.3.2
Les taux de récupération du BF et de la MF se situent habituellement dans un intervalle de 85 à 115 %.
15.4
Limite de détection (LD) et limite de quantification (LQ)
15.4.1
La limite de détection (LD) est égale à trois fois l'écart-type des résultats obtenus en analysant le mélange étalon le moins concentré au moins 10 fois sur une période de plusieurs jours. (Voir la section 15.4.3 pour connaître les valeurs typiques.)
15.4.2
La limite de quantification (LQ) est égale à 10 fois l'écart-type des résultats obtenus en analysant le mélange étalon le moins concentré au moins 10 fois sur une période de plusieurs jours.
15.4.3
Voici des valeurs typiques pour les LD et LQ :
| S / O | LD (ng/g) |
LQ (ng/g) |
|---|---|---|
| NNN | 54 | 180 |
| NAT | 64 | 213 |
| NAB | 31 | 103 |
| NNK | 82 | 272 |
16 Références
16.1
Adams, J. D.; Brunnemann, K. D.; Hoffmann, D. 1983. Chemical studies on tobacco smoke. LXXV. Rapid method for the analysis of tobacco-specific N-nitrosamines by gas-liquid chromatography with a thermal energy analyser. J. Chromatogr., 256: 347-351.
16.2
Hecht, S. S.; Adams, J. D.; Hoffmann, D., 1983. Tobacco-specific nitrosamines in tobacco and tobacco smoke. In: Preussmann, R. et coll., éditeurs, Environmental Carcinogens- Selected Methods of Analysis,. 6, N-Nitroso Compounds (IARC Scientific Publications no 5), Lyon, Centre international de recherche sur le cancer, 93-101.
16.3
Hoffmann, D. et al. 1979. Assessment of tobacco-specific N-nitrosamines in tobacco products. Cancer Res., 39: 2505-2509.
16.4
Risner, C. H.; Wendelboe, F. N., 1994. Quantification of Tobacco Specific Nitrosamines in Tobacco. Tob. Sci., 38: 1-6.
16.5
Spiegelhalder, B.; Kubacki, S. J.; Fischer, S., 1989. Method for the Determination of Tobacco-specific Nitrosamines (TSNA), Nitrate and Nitrite in Tobacco Leaves and Processed Tobacco. Beitrage zur Tabakforschung International, 14 : 135-143.
16.6
United States. Protocol to Measure the Quantity of Nicotine Contained in Smokeless Tobacco Products Manufactured, Imported, or Packaged in the United States, 1997. Federal Registrar, 62 : 85.
16.7
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
Annexe 1 : Chromatogramme typique
Chromatogramme typique de l'extrait de tabac entier provenant d'une cigarette 1R4F.
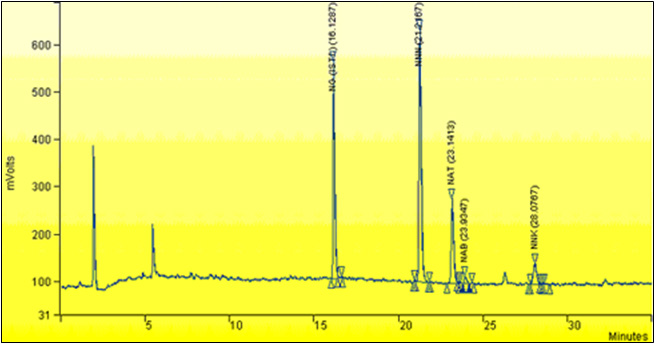
Annexe 1 : Chromatogramme typique: Équivalent textuel
La figure suivante est un exemple de chromatogramme d'extrait de tabac entier pour la cigarette 1R4F. La tension en millivolts est présentée en fonction du temps écoulé en minutes. Les pics enregistrés sont :
N-nitrosoguvacoline (NG-étalon interne) à 16,1287 min, N-nitrosonornicotine (NNN) à 21,2167 min, N-nitrosoanatabine (NAT) à 23,1413 min, N-nitrosoanabasine (NAB) à 23,9347 min et 4-(méthylnitrosamino)- -1-butanone (NNK) à 28,0767 min.