Protozoaires entériques : Giardia et Cryptosporidium

Télécharger le format de rechange
(Format PDF, 1,3 Mo, 135 pages)
Organisation : Santé Canada
Type : Recommandation
Publiée : 2019-04-12
Santé Canada, Ottawa, Ontario
Avril, 2019
Table des matières
- Partie I. Vue d'ensemble et application
- 1.0 Recommandation
- 2.0 Sommaire
- 3.0 Application de la recommandation
- Partie II. Science et considérations techniques
- 4.0 Description
- 5.0 Sources et exposition
- 6.0 Méthodes d'analyse
- 6.1 Prélèvement de l'échantillon
- 6.2 Filtration de l'échantillon et élution
- 6.3 Concentration et séparation de l'échantillon
- 6.4 Identification des kystes et des oocystes
- 6.5 Taux de récupération
- 6.6 Évaluation de la viabilité et de l'infectiosité
- 7.0 Techniques de traitement
- 7.1 Traitement à l'échelle municipale
- 7.2 Traitement à l'échelle résidentielle
- 8.0 Effets sur la santé
- 9.0 Évaluation des risques
- 10.0 Justification de la recommandation
- 11.0 Références
- Annexe A : Autres protozoaires entériques d'origine hydrique : Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis
- Annexe B : Sélection d'éclosions de Giardia et de Cryptosporidium
- Annexe C : Liste des abréviations
Partie I. Vue d'ensemble et application
1.0 Recommandation
Lorsqu'il est nécessaire d'effectuer un traitement pour les protozoaires entériques, la recommandation pour Giardia et Cryptosporidium dans l'eau potable est un objectif de traitement basé sur la santé correspondant à une élimination et une inactivation d'au moins 3 log des kystes et des oocystes. Selon la qualité de la source d'approvisionnment en eau, une élimination et inactivation logarithmique plus importante pourrait être nécessaire. Des techniques de traitement et des mesures de protection des sources d'approvisionnement en eau reconnues pour leur efficacité à réduire le risque de maladies d'origine hydrique doivent être mises en œuvre et maintenues si la source d'approvisionnement en eau est susceptible d'être contaminée par des matières fécales ou si elle a déjà causé des éclosions de maladies d'origine hydrique imputées à Giardia ou à Cryptosporidium.
2.0 Sommaire
Les protozoaires constituent un groupe diversifié de microorganismes. Ce sont, pour la plupart, des organismes libres qui peuvent vivre en eau douce et qui ne présentent aucun risque pour la santé humaine. Certains protozoaires entériques sont pathogènes et ils ont été associés à des éclosions de maladies transmises par l'eau potable. Les protozoaires les plus préoccupants au Canada sont Giardia et Cryptosporidium. Ces organismes peuvent se retrouver dans l'eau à la suite d'une contamination directe ou indirecte par des matières fécales d'humains ou d'animaux. La transmission de personne à personne est une voie d'exposition principale à Giardia et à Cryptosporidium.
Santé Canada a récemment terminé son examen des risques pour la santé découlant de la présence de protozoaires entériques dans l'eau potable. Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de protozoaires entériques dans l'eau potable. Il tient compte des nouvelles études et approches, ainsi que des limites des méthodes de détection des protozoaires dans l'eau potable. D'après cet examen, la recommandation pour les protozoaires entériques dans l'eau potable est un objectif de traitement basé sur la santé correspondant à une réduction d'au moins 3 log des protozoaires entériques.
2.1 Effets sur la santé
Les effets sur la santé découlant de l'exposition aux kystes et aux oocystes de Giardia et de Cryptosporidium, comme ceux d'autres organismes pathogènes, dépendent des caractéristiques de l'hôte, de l'agent pathogène et de l'environnement. L'état immunitaire de l'hôte, la virulence de la souche, l'infectiosité et la viabilité du kyste ou de l'oocyste, ainsi que le degré d'exposition, sont tous des facteurs déterminants de l'infection et de la maladie. L'infection par Giardia ou par Cryptosporidium peut causer des effets aigus et chroniques sur la santé.
En théorie, un seul kyste de Giardia suffirait à causer une infection. Cependant, les études ont seulement montré des infections causées par plus d'un seul kyste, et que le nombre de kystes nécessaires dépend de la virulence de la souche en cause. D'ordinaire, Giardia est un microorganisme non invasif, qui cause des infections asymptomatiques. La giardiase symptomatique se manifeste par des nausées, une diarrhée (habituellement soudaine et explosive), une anorexie, une sensation de gêne dans la partie supérieure de l'intestin, des malaises et, parfois, une légère fièvre ou des frissons. La phase aiguë de l'infection prend souvent fin de façon spontanée, et les organismes disparaissent généralement des fèces. Certains patients (p. ex. les enfants) souffrent d'accès récurrents de la maladie pendant des mois, voire des années.
Comme c'est le cas pour Giardia et d'autres agents pathogènes, un seul organisme de Cryptosporidium peut possiblement causer une infection, bien que les études aient seulement montré des infections causées par plus d'un oocyste. Les personnes infectées par Cryptosporidium risquent davantage d'être atteintes d'une maladie symptomatique que celles infectées par Giardia. Les symptômes comprennent une diarrhée aqueuse, des crampes, des nausées, des vomissements (particulièrement chez les enfants), une fièvre légère, une anorexie et une déshydratation. La durée de l'infection dépend de l'état du système immunitaire de la personne. Les sujets immunocompétents sont généralement porteurs de l'infection pendant une durée maximale de 30 jours. Chez les personnes immunodéprimées, l'infection peut engendrer le pronostic vital et persister pendant toute la période d'immunodépression.
2.2 Exposition
Les kystes de Giardia et les oocystes de Cryptosporidium peuvent survivre dans l'environnement pendant de longues périodes, selon les caractéristiques de l'eau. On a constaté qu'ils pouvaient résister à divers stress environnementaux, notamment la congélation et l'exposition à l'eau de mer. On trouve couramment des kystes et des oocystes dans les eaux de surface au Canada. L'afflux soudain et rapide de ces microorganismes dans des eaux de surface pour lesquelles les procédés de traitement pourraient ne pas être adéquats explique probablement le risque accru d'exposition par l'eau potable. On a également décelé de faibles concentrations de kystes et d'oocystes dans des approvisionnements en eau souterraine; la contamination résulte habituellement de la proximité du puits à des sources de contamination, notamment une filtration inadéquate dans certaines formations géologiques, et un concept ou un entretien inapproprié du puits.
Giardia et Cryptosporidium sont des causes fréquentes d'éclosions de maladies d'origine hydrique et ont été associés à des eaux de surface traitées de façon inadéquate et à des eaux de puits non traitées. Giardia est le protozoaire entérique le plus souvent signalé au Canada, en Amérique du Nord et dans le monde.
2.3 Analyse et traitement
Une approche de gestion des risques, tel l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, est la meilleure méthode pour réduire le nombre de protozoaires entériques et d'autres microorganismes pathogènes dans l'eau potable. Ce genre d'approche doit comporter une évaluation du système afin de caractériser la source d'approvisionnment en eau, de décrire les barrières de traitement en place, d'établir les conditions qui pourraient entraîner une contamination et de mettre en œuvre les mesures de contrôle requises pour atténuer les risques. Un aspect de la caractérisation de la source d'approvisionnment en eau consiste à effectuer une surveillance régulière et ciblée de Giardia et de Cryptosporidium. La surveillance des protozoaires dans les sources d'approvisionnment en eau peut être ciblée en utilisant des renseignements sur les sources de contamination fécale, conjugués aux données historiques sur les précipitations, la fonte des neiges et le débit et la turbidité des fleuves et des rivières, afin de repérer les conditions qui entraîneront vraisemblablement des pics de concentration de kystes et d'oocystes. Il existe une méthode validée pour détecter simultanément ces protozoaires. Lorsqu'il est impossible d'exercer une surveillance régulière de Giardia et de Cryptosporidium (p. ex. dans les approvisionnements en eau des petites collectivités), l'identification des conditions qui pourraient entraîner une contamination peut orienter le choix des mesures de gestion des risques à mettre en œuvre (p.ex., protection des sources d'approvisionnment en eau, traitement approprié, surveillance opérationnelle, procédures normales d'exploitation, plans de contingence).
Une fois établies les caractéristiques de la source d'approvisionnment en eau, il est possible de fixer des objectifs de réduction des organismes pathogènes et de mettre en œuvre des procédés efficaces de traitement afin d'atteindre des niveaux sécuritaires dans l'eau potable traitée. En général, tous les approvisionnements en eau provenant des eaux de surface ou des eaux souterraine sous l'influence directe d'eau de surface (ESSIDES) devraient inclure des processus de filtration (ou une technique équivalente) et de désinfection. Une élimination mécanique (p. ex. par filtration) combinée à des procédés d'inactivation (p. ex. la désinfection aux rayons ultraviolets [UV]) est la manière la plus efficace de diminuer les protozoaires dans l'eau potable, en raison de leur résistance aux désinfectants à base de chlore couramment utilisés.
L'absence de bactéries indicatrices (p. ex. Escherichia coli, coliformes totaux) ne signifie pas nécessairement l'absence de protozoaires entériques. L'application et le suivi d'une approche de la source au robinet ou d'un plan de gestion de la sécurité sanitaire de l'eau, comprenant la surveillance des procédés et de la conformité (p. ex. la turbidité, les conditions de désinfection, E. coli), sont importants pour vérifier si l'eau a été convenablement traitée et si elle est, par conséquent, d'une qualité microbiologique acceptable. Dans le cas de l'eau souterraine non traitée, il est utile de vérifier la présence de bactéries indicatrices afin d'évaluer le potentiel de contamination fécale, notamment par des protozoaires entériques.
2.4 Évaluation quantitative du risque microbien
L'évaluation quantitative du risque microbien (ÉQRM) est un outil qui emploie les données sur la qualité des sources d'approvisionnment en eau, l'information sur les procédés de traitement et les caractéristiques de l'agent pathogène pour estimer la charge de morbidité liée à l'exposition aux microorganismes pathogènes dans l'eau potable. L'utilisation de l'ÉQRM a généralement deux objectifs. Elle peut servir à établir des objectifs de réduction des organismes pathogènes au cours de l'élaboration de recommandations sur la qualité de l'eau potable, comme dans ce document. Elle peut également être utilisée pour établir un ordre de priorité parmi les risques pour un site précis, dans le cadre d'une approche de la source au robinet ou d'un plan de gestion de la sécurité sanitaire de l'eau.
On sélectionne des protozoaires pathogènes de référence parmi différents protozoaires entériques dont les caractéristiques en font de bons représentants de tous les protozoaires pathogènes similaires. On présume que si le traitement est efficace contre le protozoaire de référence, il le sera contre tous les protozoaires préoccupants similaires. Cryptosporidium parvum et Giardia lamblia ont été choisis comme protozoaires de référence pour la présente évaluation des risques en raison de leur taux de prévalence élevé, de leur fort potentiel à répandre la maladie, de leur résistance à la désinfection au chlore et de l'existence de modèles dose-réponse.
2.5 Considérations internationales
Les recommandations, normes ou directives relatives à la qualité de l'eau potable établies par des gouvernements étrangers ou des agences internationales peuvent varier en raison des connaissances scientifiques disponibles au moment de l'évaluation, ainsi que de l'utilisation de différentes politiques et approches.
Divers organismes ont établi des recommandations ou directives pour les protozoaires entériques. L'U.S. EPA impose généralement une élimination ou une inactivation de Giardia de 3 log, ainsi qu'une élimination ou une inactivation d'au moins 2 log de Cryptosporidium, dans les installations de production d'eau potable. Les résultats de la surveillance pour le Cryptosporidium dans la source d'approvisionnement en eau peuvent nécessiter un traitement supplémentaire pour le Cryptosporidium. L'Organisation mondiale de la santé recommende établir des objectifs d'efficacité fondés sur l'ÉQRM comme exigences pour la réduction des protozoaires entériques. Ni l'Union européenne, ni l'Australie (NHMRC) ont fixé une recommandation ou une directive pour la réduction des protozoaires entériques dans l'eau potable.
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
La mise en œuvre d'une méthode de gestion des risques pour les systèmes d'eau potable, comme l'approche de la source au robinet ou le plan de salubrité de l'eau, devrait réduire l'exposition à Giardia et à Cryptosporidium. Ces approches nécessitent une évaluation du système, qui consiste à : caractériser l'eau de la source; décrire les barrières de traitement qui empêchent ou réduisent la contamination; mettre en évidence les conditions qui pourraient donner lieu à une contamination; identifier les mesures de contrôle qui permettent d'atténuer les risques, dans les procédés de traitement et le réseau de distribution, jusqu'au consommateur.
3.1 Évaluations des sources d'approvisionnement en eau potable
Les évaluations des sources d'approvisionnement en eau potable doivent faire partie des évaluations régulières des systèmes. Elles doivent comprendre : la détermination des sources éventuelles de contamination fécale d'origine humaine et animale dans le bassin versant ou l'aquifère; les voies et les événements possibles (risque faible à élevé) qui pourraient permettre aux protozoaires d'atteindre l'eau à la source et de nuire à la qualité de l'eau; les conditions susceptibles de causer des pics de concentration. Idéalement, ces évaluations devraient aussi comporter la surveillance régulière de la présence de Giardia et de Cryptosporidium afin d'établir des paramètres de référence, suivie d'une surveillance ciblée à long terme pour trouver les pics de concentration pendant des évènements précis (p.ex. pluie, fonte des neiges, conditions de faible débit dans des rivières recevant des rejets d'usines de traitement des eaux usées). Lorsque la surveillance de Giardia et de Cryptosporidium n'est pas possible (p. ex. approvisionnement en eau de petites collectivités), d'autres approches, comme la mise en œuvre d'une approche de la source au robinet ou d'un plan de gestion de la sécurité sanitaire de l'eau, peuvent aider à définir et à mettre en application des mesures de gestion de risque appropriées (p. ex. protection de la source d'approvisionnment en eau, traitement adéquat, surveillance opérationnelle, procédures normales d'exploitation et plans de contingence).
Lorsque la surveillance est possible, on peut décider des fréquences et des lieux d'échantillonnage à l'aide des renseignements sur les sources de contamination fécale, conjugués aux données historiques sur les précipitations, la fonte des neiges, la turbidité et le débit des fleuves et des rivières. Les évaluations des sources d'approvisionnment en eau doivent également envisager le « pire scénario possible » pour le lieu étudiée. Il est important de bien comprendre comment les apports fécaux sont possibles dans le système afin de définir les « pires scénarios possibles », puisqu'ils seront propres au système. Par exemple, il peut y avoir une brève période où la qualité de la source d'eau est mauvaise après un orage. Cette dégradation à court terme représente parfois le gros du risque dans un système d'eau potable. Prélever et analyser des échantillons d'eau de la source pour détecter la présence de Giardia et de Cryptosporidium peut fournir des renseignements importants qui permettront de déterminer le degré de traitement nécessaire ainsi que les mesures d'atténuation (gestion des risques) à mettre en œuvre pour ramener la concentration de kystes et d'oocystes à un niveau acceptable.
Il faut évaluer les sources souterraines pour déterminer si l'approvisionnement est susceptible d'être contaminé par des protozoaires entériques (c.-à-d. sources de type ESSIDES) ou par d'autres organismes pathogènes entériques. Ces évaluations doivent inclure, au minimum, une étude hydrogéologique, une évaluation de l'intégrité du puits et une enquête sur les caractéristiques physiques de la région et sur les activités qui y sont menées. La présence d'algues contenant de la chlorophylle est considérée comme une preuve irréfutable de la présence d'eau de surface. Les administrations qui demandent une analyse microscopique particulaire dans le cadre de leur évaluation du caractère ESSIDES d'une source devraient s'assurer que les algues contenant de la chlorophylle représentent un élément essentiel de l'analyse. Les sources d'eau souterraine classées ESSIDES devraient atteindre une élimination ou une inactivation des protozoaires entériques d'au moins 3 log. Les sources d'eau souterraine qui ont été évaluées comme n'étant pas susceptibles d'être contaminées par des protozoaires entériques ne devraient contenir aucun protozoaire, si elles ont été correctement catégorisées. Cependant, toutes les sources souterraines sont vulnérables, dans une certaine mesure, et doivent faire l'objet de réévaluations périodiques. Il est important de bien classer les sources souterraines puisque de nombreuses éclosions de maladie d'origine hydrique ont été liées à la consommation d'eau de puits non traitée contaminée par des protozoaires entériques et d'autres organismes pathogènes entériques.
3.2 Procédés de traitement appropriés
La plupart des eaux de surface et des ESSIDES étant susceptibles d'être contaminées par des fèces, des techniques de traitement permettant d'éliminer ou d'inactiver au moins 3 log (99,9 %) de Cryptosporidium et de Giardia doivent être appliquées. Pour de nombreuses sources d'eau de surface, une réduction logarithmique plus importante est nécessaire.
Les réductions logarithmiques s'obtiennent au moyen de procédés d'élimination mécanique, comme la filtration, ou de procédés d'inactivation, comme la désinfection aux rayons ultraviolets. De manière générale, les systèmes approvisionnés par des eaux de surface ou des ESSIDES doivent au moins faire l'objet d'une filtration adéquate (ou d'un autre traitement permettant d'obtenir une réduction logarithmique équivalente) et d'une désinfection. Pour déterminer le type et le degré de traitement indiqués, il faut prendre en compte les fluctuations possibles de la qualité de l'eau, y compris la dégradation de la qualité de l'eau à court terme, ainsi que la variabilité de l'efficacité du traitement. Des essais pilotes ou d'autres procédés d'optimisation pourraient être utiles pour déterminer la variabilité du traitement.
Les propriétaires de puits privés (c.-à-d. approvisionnements semi-publics ou maisons unifamiliales) devraient évaluer la vulnérabilité de leur puits à la contamination fécale afin de déterminer si un traitement de l'eau est nécessaire. Les propriétaires de puits devraient être familiers avec la construction du puits, le genre de matériaux présents dans l'aquifère autour du puits et l'emplacement des sources de contamination fécale (p. ex. fosse septique, égouts sanitaires, déchets animaux) par rapport au puits. Les agences provinciales/territoriales sont typiquement en mesure de donner des conseils généraux sur la construction, l'entretien et la protection des puits, ainsi que sur les tests à effectuer.
Si un propriétaire de puits privé n'est pas capable d'évaluer la vulnérabilité de son puits à la contamination fécale, l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné doit être contactée pour déterminer les options de traitement possibles.
3.3 Entretien et exploitation appropriés des réseaux de distribution
La contamination des systèmes de distribution par des protozoaires entériques à causé des cas de maladies d'origine hydrique. Par conséquent, le maintien de l'intégrité physique et hydraulique du système de distribution et la minimisation d'occurrences de pression faible ou négative sont des éléments importants de l'approche de la source au robinet et du plan de salubrité de l'eau. Il faut effectuer une surveillance régulière de l'eau dans le réseau de distribution (p. ex. indicateurs microbiens, résiduels de désinfectant, turbidité, pH), mettre en place des programmes d'exploitation et d'entretien (p. ex. nettoyages des conduites principales, contrôle des jonctions fautives, gestion des actifs) et pratiquer une hygiène stricte pendant toute construction dans les conduites principales (p. ex. réparation, entretien, nouvelle installation) afin d'assurer le transport de l'eau potable jusqu'au consommateur tout en réduisant au minimum la perte de qualité.
Partie II. Science et considérations techniques
4.0 Description
Les protozoaires sont un groupe diversifié de microorganismes eucaryotes généralement unicellulaires. La plupart des protozoaires sont des organismes libres qui peuvent vivre en eau douce et qui ne présentent aucun risque pour la santé humaine. Cependant, certains protozoaires sont pathogènes pour les humains. Les protozoaires peuvent être classés dans deux groupes fonctionnels : les protozoaires entériques et les protozoaires libres. Les cas d'infection humaine causée par des protozoaires libres (p. ex. Naegleria, Acanthamoeba spp.) résultent généralement d'un contact durant la baignade (ou d'un usage domestique de l'eau autre que comme eau de boisson); par conséquent, ce groupe de protozoaires est étudié dans les Recommandations au sujet de la qualité des eaux utilisées à des fins récréatives au Canada (Santé Canada, 2012a). En revanche, les protozoaires entériques ont été mis en cause dans plusieurs éclosions de maladies transmises par l'eau potable, qui constitue une voie de transmission importante de ces organismes. Voici, par conséquent, une discussion portant sur les protozoaires entériques.
Les protozoaires entériques sont des parasites souvent présents dans l'intestin des humains et d'autres mammifères. Comme les bactéries et les virus entériques, ils peuvent se retrouver dans l'eau à la suite d'une contamination directe ou indirecte par les fèces d'humains ou d'autres animaux. Ces microorganismes sont transmissibles par l'eau potable; ils ont été mis en cause dans plusieurs éclosions de maladies d'origine hydrique en Amérique du Nord et ailleurs dans le monde (Schuster et coll., 2005; Karanis et coll., 2007; Baldursson et Karanis, 2011; Efstratiou et coll., 2017). La capacité de ce groupe de microorganismes à produire des kystes et des oocystes extrêmement résistants aux stress environnementaux et aux désinfectants à base de chlore couramment utilisés a facilité leur capacité à se propager et ainsi à causer des maladies.
Les protozoaires entériques les plus fréquemment mis en cause dans les maladies d'origine hydrique au Canada sont Cryptosporidium et Giardia. Ces protozoaires sont souvent présents dans les eaux de surface : certaines souches sont très pathogènes, peuvent survivre longtemps dans l'environnement et sont très résistantes à la désinfection au chlore. C'est la raison pour laquelle ils font l'objet de la discussion qui suit. Une brève description d'autres protozoaires entériques préoccupants pour la santé humaine (c.-à-d. Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis) se trouve à l'annexe A. Il est à noter que, par souci de clarté, le nom commun des protozoaires entériques est employé dans ce document. Le nom savant n'est utilisé que lorsqu'il le faut pour présenter de manière fiable des observations scientifiques.
4.1 Giardia
Giardia est un protozoaire parasite flagellé (embranchement des Metamonada, sous-embranchement des Trichozoa, superclasse des Eopharyngia, classe des Trepomonadea, sous-classe des Diplozoa, ordre des Giardiida, famille des Giardiidae) (Cavalier-Smith, 2003; Plutzer et coll., 2010). Il a été découvert pour la première fois dans des selles humaines en 1681, par Antonie van Leeuwenhoek (Boreham et coll., 1990). Il n'a toutefois été reconnu comme agent pathogène pour l'humain que dans les années 1960, après avoir causé des éclosions de maladies dans des collectivités et avoir été dépisté chez des voyageurs (Craun, 1986; Farthing, 1992). La maladie causée par ce parasite est appelée « giardiase ».
4.1.1 Cycle de vie
Giardia vit dans l'intestin grêle des humains et des animaux. Le trophozoïte, soit l'étape de son développement où il se nourrit, se loge surtout dans le duodénum, mais il est aussi souvent présent dans le jéjunum et l'iléon de l'intestin grêle. Les trophozoïtes (de 9 à 21 µm de long, de 5 à 15 µm de large et de 2 à 4 µm d'épaisseur) ont un corps en forme de poire avec une extrémité antérieure globalement arrondie; ils présentent deux noyaux, deux minces tiges médianes, quatre paires de flagelles, une paire de corps médians de coloration foncée et un large disque adhésif ventral (cystotome). Les trophozoïtes sont habituellement fixés à la surface des villosités intestinales, où ils se nourrissent surtout, présumément, de sécrétions muqueuses. Une fois détachés, les trophozoïtes binucléés forment des kystes (enkystement) qui se divisent ensuite de façon interne, de sorte que quatre noyaux deviennent visibles. Les kystes sont ovoïdes, font entre 8 et 18 µm de long et entre 5 et 15 µm de large (U.S. EPA, 2012), possèdent deux ou quatre noyaux et présentent des restes d'organites visibles. Les kystes stables dans l'environnement sont évacués dans les fèces, souvent en grand nombre. Une description complète du cycle de vie est donnée ailleurs (Adam, 2001; Carranza et Lujan, 2010).
4.1.2 Espèces
La taxonomie du genre Giardia change constamment, à mesure que des données sont recueillies sur de nouveaux génotypes et de nouvelles espèces, sur la phylogénie des souches et sur la spécificité pour l'hôte. La taxonomie actuelle du genre Giardia repose sur la définition des espèces proposée par Filice (1952), qui en a défini trois : G. duodenalis (syn. G. intestinalis, G. lamblia), G. muris et G. agilis, selon la forme de leur corps médian, un organite composé de microtubules très facilement observé chez le trophozoïte. Par la suite, d'autres espèces ont été décrites d'après la morphologie des kystes et l'analyse moléculaire. Actuellement, six espèces de Giardia sont reconnues (voir le tableau 1), bien que des travaux récents semblent indiquer que les assemblages A et B de Giardia duodenalis (syn. G. intestinalis, G. lamblia) sont peut-être des espèces distinctes et devraient changer de nom (Prystajecky et coll., 2015). Trois synonymes (G. lamblia, G. intestinalis et G. duodenalis) ont été et continuent d'être utilisés de manière interchangeable dans la documentation scientifique à propos des isolats humains de Giardia, bien que l'espèce puisse infecter une grande variété de mammifères. Elle sera appelée « G. lamblia » dans le présent document. La caractérisation moléculaire de cette espèce a montré l'existence d'assemblages génétiquement distincts : les assemblages A et B infectent les humains et d'autres mammifères, tandis que les assemblages C, D, E, F et G, n'ont pas encore été isolés chez des humains, semblent avoir une gamme d'hôtes limitée et représentent probablement différentes espèces ou divers groupes (voir le tableau 1) (Adam, 2001; Thompson, 2004; Thompson et Monis, 2004; Xiao et coll., 2004; Smith et coll., 2007; Plutzer et coll., 2010). En raison de la diversité génétique des assemblages A et B, ces groupes ont également été caractérisés en sous-assemblages (Cacciò et Ryan, 2008; Plutzer et coll., 2010).
En plus de montrer des différences génétiques, les variants de G. lamblia présentent des variations phénotypiques, notamment en ce qui concerne la sensibilité aux médicaments et le taux de croissance (Homan et Mank, 2001; Read et coll., 2002). Certains ont utilisé ces différences génétiques pour distinguer l'espèce de Giardia infectieuse pour les humains d'autres espèces ou souches (Amar et coll., 2002; Cacciò et coll., 2002, 2010; Read et coll., 2004). L'applicabilité de ce genre de méthode pour l'analyse de Giardia dans l'eau est toutefois limitée (voir la section 6.6). C'est pourquoi, à l'heure actuelle, il faut considérer que tout kyste de Giardia présent dans l'eau peut être infectieux pour les humains.
| Espèce (assemblage) | Principaux hôtes |
|---|---|
| G. agilis | Amphibiens |
| G. ardeae | Oiseaux |
| G. lamblia, syn. G. intestinalis, syn. G. duodenalis | |
(A) |
Humains, bétail, autres mammifères |
(B) |
Humains |
(C) |
Chiens |
(D) |
Chiens |
(E) |
Bovins et autre bétail |
(F) |
Chats |
(G) |
Rats |
| G. microti | Rats musqués, campagnols |
| G. muris | Rongeurs |
| G. psittaci | Oiseaux |
4.2 Cryptosporidium
Cryptosporidium est un protozoaire parasite (embranchement des Apicomplexa, classe des Gregarinomorphea, sous-classe des Cryptogregaria; Ryan et coll., 2016). Le genre Cryptosporidium est actuellement le seul membre de la sous-classe Cryptogregaria, nouvellement décrite. La maladie causée par ce parasite est appelée cryptosporidiose. La pathogénicité de Cryptosporidium pour les humains a été reconnue pour la première fois en 1976 chez un enfant de trois ans auparavant en bonne santé (Nime et coll., 1976). Un deuxième cas de cryptosporidiose a été observé deux mois plus tard chez un sujet immunodéprimé par une pharmacothérapie (Meisel et coll., 1976). Par la suite, la maladie est devenue plus courante chez les sujets immunodéprimés présentant des symptômes maintenant connus sous le nom de syndrome d'immunodéficience acquise ou SIDA (Hunter et Nichols, 2002).
4.2.1 Cycle de vie
Une fois établi le caractère pathogène pour l'être humain de Cryptosporidium, plus d'études ont été menées sur le cycle de vie de ce parasite et des recherches ont été effectuées sur les voies de transmission possibles. Le cycle de vie de Cryptosporidium comporte de multiples étapes. Il se déroule chez un seul hôte et comporte six grands stades, sexués et asexués : 1) le dékystement, au cours duquel les sporozoïtes sont libérés d'un oocyste enkysté; 2) la schizogonie (syn. mérogonie) au cours de laquelle s'effectue la reproduction asexuée; 3) la gamétogonie au cours de laquelle se forment les gamètes; 4) la fécondation du macrogamétocyte par un microgamète pour former un zygote; 5) la formation des parois de l'oocyste; 6) la sporogonie au cours de laquelle le sporozoïte se forme dans l'oocyste (Current, 1986). Une description complète et un diagramme du cycle de vie figurent ailleurs dans la documentation scientifique (Smith et Rose, 1990; Hijjawi et coll., 2004; Fayer et Xiao, 2008). La syzygie, un processus de reproduction sexuée au cours duquel les gamétocytes s'unissent bout à bout ou côte à côte avant la formation des gamètes, a récemment été observée chez deux espèces de Cryptosporidium, à savoir C. parvum et C. andersoni, ce qui a fourni de nouvelles données sur la biologie (cycle de vie) et la transmission de Cryptosporidium (Hijjawi et coll., 2002; Rosales et coll., 2005).
Étant donné qu'il s'agit d'un organisme pathogène d'origine hydrique, l'étape la plus importante du cycle de vie de Cryptosporidium est celle de l'oocyste rond, à parois épaisses, stable dans l'environnement et d'un diamètre de 4 à 6 µm. Les noyaux des sporozoïtes peuvent être colorés à l'aide d'un colorant fluorogénique, tel le 4',6-diamidino-2-phénylindole (DAPI). Lorsqu'il est ingéré par les humains, le parasite achève son cycle de vie dans le tractus gastro-intestinal. L'ingestion déclenche le dékystement de l'oocyste et libère quatre sporozoïtes, qui adhèrent aux entérocytes du tractus gastro-intestinal et les envahissent (Spano et coll., 1998; Pollok et coll., 2003). La vacuole parasitaire intracellulaire ainsi formée contient un organite nourricier qui est, tout comme le parasite, protégé par une membrane externe. La membrane externe provient de la cellule hôte. Le sporozoïte se reproduit de façon asexuée (schizogonie) et libère des mérozoïtes qui propagent l'infection aux cellules avoisinantes. La multiplication sexuée (gamétogonie) a ensuite lieu, produisant soit des microgamètes (« mâles »), soit des macrogamètes (« femelles »). Des microgamètes sont ensuite libérés pour féconder les macrogamètes et former des zygotes. Un petit nombre (20 %) de zygotes ne développe pas de paroi cellulaire; ils sont appelés « oocystes à paroi mince ». Ces oocystes éclatent après la formation des sporozoïtes, mais avant le passage des fèces, ce qui entretient l'infection chez l'hôte. La majorité des zygotes développe une épaisse paroi cellulaire résistante à l'environnement ainsi que quatre sporozoïtes, lesquels deviennent des oocystes matures, qui sont évacués dans les fèces.
4.2.2 Espèces
Notre compréhension de la taxonomie du genre Cryptosporidium s'améliore continuellement. C'est Tyzzer, en 1907, qui a été le premier à décrire Cryptosporidium; après avoir isolé l'organisme des glandes gastriques de souris, il l'a nommé Cryptosporidium muris. En 1912, Tyzzer a découvert un second isolat, qu'il a nommé C. parvum, dans l'intestin de la même espèce de souris. Cette espèce a depuis été renommée C. tyzzeri (Ryan et coll., 2014). À l'heure actuelle, 29 espèces valides de Cryptosporidium sont reconnues (voir le tableau 2) (Ryan et coll., 2014; Zahedi et coll., 2016). Les principales espèces de Cryptosporidium pathogènes pour l'être humain sont C. hominis et C. parvum. Elles causent plus de 90 % des cas de cryptosporidiose chez l'humain (Bouzid et coll., 2013). La majorité des autres cas chez l'humain sont causés par C. meleagridis et C. cuniculus. Un petit nombre de cas ont été attribués à C. ubiquitum, C. canis, C. felis et C. viatorum. D'autres espèces ont été trouvées dans de rares cas. Bien que de nombreuses espèces de Cryptosporidium n'aient pas encore été associées à des maladies chez l'humain, on ne saurait conclure à leur innocuité pour celui-ci. On peut seulement affirmer qu'à ce jour, elles n'ont pas été associées à des cas sporadiques ou à des éclosions de cryptosporidiose. Ces constatations ont des conséquences importantes pour les collectivités dont la source d'eau peut être contaminée par des matières fécales d'origine animale (voir le tableau 2). L'importance épidémiologique de ces génotypes demeure incertaine, mais les données portent à croire que certains génotypes sont adaptés aux humains et sont transmis (directement ou indirectement) de personne à personne. En conséquence, à l'heure actuelle, tous les oocystes de Cryptosporidium que l'on trouve dans l'eau sont habituellement considérés comme potentiellement infectieux pour les humains; cela dit, l'information sur le génotypage peut servir à éclairer les décisions de gestion des risques.
| Espèce (génotype) | Principaux hôtes | Préoccupation pour la santé humaineaconcernNote de bas de tableau 2 - a |
|---|---|---|
| C. andersoni | Bovins | + |
| C. baileyi | Volaille | - |
| C. bovis | Bovins | + |
| C. canis | Chiens | ++ |
| C. cuniculus | Lapins | ++ |
| C. erinacei | Hérissons et chevaux | + |
| C. fayeri | Marsupiaux | + |
| C. felis | Chats | ++ |
| C. fragile | Crapauds | - |
| C. galli | Roselins, poulets | - |
| C. hominis (genotype H, I or 1) | Humains, singes | +++ |
| C. huwi | Poissons | - |
| C. macropodum | Marsupiaux | - |
| C. meleagridis | Dindons, humains | ++ |
| C. molnari | Poissons | - |
| C. muris | Rongeurs | + |
| C. parvum (génotype C, II ou 2) | Bovins, autres ruminants, humains | +++ |
| C. rubeyi | Écureuil | - |
| C. ryanae | Bovins | - |
| C. scophthalmi | Turbot | - |
| C. scrofarum | Porcs | + |
| C. serpentis | Reptiles | - |
| C. suis | Porcs | + |
| C. tyzzeri | Rongeurs | + |
| C. ubiquitum | Ruminants, rongeurs, primates | ++ |
| C. varanii | Lézards | - |
| C. viatorum | Humains | ++ |
| C. wrairi | Cobayes | - |
| C. xiaoi | Moutons, chèvres | + |
Notes de bas de page tableau 2
- Note de bas de page tableau 2 - a
-
La mesure dans laquelle l'espèce est préoccupante pour la santé humaine n'est basée que sur la fréquence de la détection de l'espèce dans les cas de cryptosporidiose chez l'humain; la désignation peut changer à mesure que de nouveaux cas de cryptosporidiose se manifestent :
- +++ cause le plus fréquemment la maladie chez l'être humain;
- ++ cause la maladie chez l'être humain, mais rarement;
- + cause la maladie chez l'être humain, mais il n'y a eu que de très rares cas (très faible risque);
- - n'a jamais été isolée chez l'être humain.
Retour à la référence de la Note de bas de page tableau 2 - a
Outre les 29 espèces de Cryptosporidium qui ont été identifiées, plus d'une quarantaine de génotypes de Cryptosporidium, pour lesquels il n'existe pas de nom de souche, ont également été proposés chez divers groupes d'animaux, dont les rongeurs, les marsupiaux, les reptiles, les poissons, les oiseaux sauvages et les primates (Fayer, 2004; Xiao et coll., 2004; Feng et coll., 2007; Smith et coll., 2007; Fayer et coll., 2008; Xiao et Fayer, 2008; Ryan et coll., 2014). La recherche semble indiquer que ces génotypes varient en ce qui concerne leur croissance, leur sensibilité aux médicaments et les manifestations de la maladie (Chalmers et coll., 2002; Xiao et Lal, 2002; Thompson et Monis, 2004; Xiao et coll., 2004)
5.0 Sources et exposition
5.1 Giardia
5.1.1 Sources
Les principales sources de Giardia sont les matières fécales humaines et animales. La giardiase est endémique chez l'humain et plus d'une quarantaine d'espèces d'animaux, les taux de prévalence allant de 1 % à 5 % chez les humains, de 10 % à 100 % chez les bovins et de 1 % à 20 % chez les porcs (Olson et coll., 2004; Pond et coll., 2004; Thompson, 2004; Thompson et Monis, 2004). Les kystes de Giardia sont excrétés en grande quantité dans les fèces des personnes et des animaux infectés (symptomatiques et asymptomatiques). Il semble, par exemple, que les bovins infectés excrètent jusqu'à un million (106) de kystes par gramme de fèces (O'Handley et coll., 1999; Ralston et coll., 2003; O'Handley et Olson, 2006). D'autres mammifères, comme le castor, le chien, le chat, le rat musqué et le cheval excrètent aussi dans leurs fèces des espèces de Giardia qui infectent les humains (Davies et Hibler, 1979; Hewlett et coll., 1982; Erlandsen et Bemrick, 1988; Erlandsen et coll., 1988; Traub et coll., 2004, 2005; Eligio-García et coll., 2005). Le parasite Giardia peut également être présent dans les fèces d'ours, d'oiseaux et d'autres animaux, mais on ignore si ces souches sont pathogènes pour les humains (voir la section 5.1.3). Les kystes se dispersent facilement dans l'environnement et sont transmissibles par la voie fécale-orale, y compris par de l'eau contaminée par des fèces (directement, ou indirectement par des produits alimentaires), ainsi que par le contact direct avec des humains ou des animaux infectés (Karanis et coll., 2007; Plutzer et coll., 2010).
Des kystes de Giardia sont fréquemment présents dans les eaux usées et les eaux de surface, et se retrouvent parfois dans l'eau souterraine et l'eau traitée.
Eau de surface
Le Tableau 3 donne un aperçu de certaines études qui ont examiné la présence de Giardia dans les eaux de surface au Canada. En règle générale, la concentration de Giardia dans les eaux de surface va de 2 à 200 kystes/100 L (0,02 à 2 kystes/L). Des concentrations élevées, jusqu'à 8 700 kystes/100 L (87 kystes/L), ont été signalées et étaient associées à un ruissellement printanier exceptionnel, ce qui montre bien qu'il est important de procéder à un échantillonnage lorsque survient un phénomène particulier (Gammie et coll., 2000). Des études récentes ont également examiné les espèces présentes dans les eaux de surface au Canada. Les assemblages A et B de G. lamblia ont été les variants les plus souvent détectés (Edge et coll., 2013; Prystajecky et coll., 2014). C'est également le cas ailleurs dans le monde (Cacciò et Ryan, 2008; Alexander et coll., 2014; Adamska, 2015).
| Province | Lieu/bassin versant | Fréquence des échantillons positifs | Unité de mesure | Concentration de Giardia (kystes/100 L)Note de bas de tableau 3 - b | Reference |
|---|---|---|---|---|---|
| Enquête nationale | Divers | 245/1 173 | Maximum | 230 | Wallis et coll., 1996 |
| Alberta | Non disponible | 1/1 | Un seul échantillon | 494 | LeChevallier et coll., 1991a |
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 8–193 | Gammie et coll., 2000 |
| Maximum | 2 500Note de bas de tableau 3 - c | ||||
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 98 | EPCOR, 2005 |
| Maximum | 8 700 | ||||
| Colombie-Britannique | District d'irrigation du mont Black | 24/27 | Moyenne géométrique | 60,4 | Ong et coll., 1996 |
| District d'irrigation de Vernon | 68/70 | 26 | |||
| District d'irrigation du mont Black | 24/27 | Fourchette | 4,6–1 880 | ||
| District d'irrigation de Vernon | 68/70 | 2–114 | |||
| Colombie-Britannique | Seymour | 12/49 | MoyenneNote de bas de tableau 3 - d | 3,2 | Metro Vancouver, 2009 |
| Capilano | 24/49 | 6,3 | |||
| Coquitlam | 13/49 | 3,8 | |||
| Seymour | Maximum | 8,0 | |||
| Capilano | 20,0 | ||||
| Coquitlam | 12,0 | ||||
| Colombie-Britannique | Rivière Salmon | 38/49 | Médiane | 32 | Prystajecky et coll., 2014 |
| Ruisseau Coghlan | 59/65 | 107 | |||
| Rivière Salmon | Maximum | 730 | |||
| Ruisseau Coghlan | 3 800 | ||||
| Nouvelle-Écosse | Parc Collins | 1/26 | Maximum | 130 | Ministère de l'Environnement de la Nouvelle-Écosse, 2013 |
| East Hants | 2/12 | 10 | |||
| Stewiacke | 3/12 | 140 | |||
| Stellarton | 4/12 | 200 | |||
| Tatamagouche | 0/12 | <10 | |||
| Bridgewater | 0/12 | <10 | |||
| Middle Musquodoboit | 4/25 | 1 067 | |||
| Ontario | Rivière Grand | 14/14 | Médiane | 71 | Van Dyke et coll., 2006 |
| Maximum | 486 | ||||
| Ontario | Bassin versant de la rivière Grand | 101/104 | Médiane | 80 | Van Dyke et coll., 2012 |
| Maximum | 5 401 | ||||
| Ontario | Rivière des Outaouais | N/D | Moyenne | 16,8 | Douglas, 2009 |
| Ontario | Lac Ontario, prises d'eau des usines de traitement de l'eau | Maximum | Edge et coll., 2013 | ||
| UTE1 | 17/46 | 70 | |||
| UTE2 | 4/35 | 12 | |||
| UTE3 | 6/43 | 18 | |||
| Rivière Humber | 32/41 | 540 | |||
| Rivière Credit | 19/35 | 90 | |||
| Québec | Usine de traitement ROS, rivière des Mille-Îles, Montréal | 4/4 | Moyenne géométrique | 1 376 | Payment et Franco, 1993 |
| Usine de traitement STE, rivière des Mille-Îles, Montréal | 8/8 | 336 | |||
| Usine de traitement REP, rivière l'Assomption, Montréal | 4/5 | 7,23 | |||
| Québec | Fleuve Saint-Laurent | N/D | Moyenne géométrique | 200 | Payment et coll., 2000 |
| Québec | 15 sites d'eau de surface touchés par le ruissellement urbain et agricole | 191/194 | Médianes | 22–423 | MDDELCC, 2016 |
| Maximums | 70–2278 |
Notes de bas de tableau 3
- Note de bas de tableau 3 - a
-
On a choisi les études pour montrer l'éventail des concentrations, et non pour dresser une liste complète de toutes les études menées au Canada. Diverses méthodes d'échantillonnage et d'analyse ayant été utilisées dans ces études, il ne convient peut-être pas de comparer les concentrations de kystes. La viabilité et l'infectiosité des kystes ont rarement été évaluées, de sorte que peu de données existent sur le risque que la présence de Giardia dans ces échantillons représente pour la santé humaine.
Retour à la référence de la Note de bas de page tableau 3 - a
- Note de bas de tableau 3 - b
-
Les unités ont été normalisées au nombre de kystes par 100 litres.
Retour à la référence de la Note de bas de page tableau 3 - b
- Note de bas de tableau 3 - c
-
Concentration associée à un fort ruissellement printanier.
Retour à la référence de la Note de bas de page tableau 3 - c
- Note de bas de tableau 3 - d
-
Les résultats moyens ne proviennent que des filtres positifs.
Retour à la référence de la Note de bas de page tableau 3 - d
La fourchette caractéristique des concentrations de Giardia dans les eaux de surface canadiennes se trouve à l'extrémité inférieure de la plage décrite dans une étude internationale (Dechesne et Soyeux, 2007). Dechesne et Soyeux (2007) ont découvert que les concentrations de Giardia dans les sources d'eau partout en Amérique du Nord et en Europe variaient de 0,02 à 100 kystes/L, les concentrations les plus élevées ayant été notées aux Pays-Bas. Des données sur la surveillance de la qualité des sources d'eau (de surface et ESSIDES) ont également été recueillies pour neuf sources d'eau en Europe (en France, en Allemagne, aux Pays-Bas, en Suède et au Royaume-Uni) et pour une source d'eau australienne. Dans l'ensemble, Giardia a fréquemment été détecté à des concentrations relativement faibles qui variaient de 0,01 à 40 kystes/L. Une recherche précédente réalisée par Medema et coll. (2003) a révélé qu'en règle générale, les concentrations de kystes dans les eaux usées brutes et les eaux usées domestiques traitées (c.-à-d. provenant d'un effluent secondaire) variaient respectivement de 5 000 à 50 000 kystes/L et de 50 à 500 kystes/L.
Eau souterraine
Il existe peu de données sur la contamination des eaux souterraines par Giardia au Canada et ailleurs dans le monde. Les études disponibles traitent de divers types de sources qui proviennent du sous-sol. La plupart de ces études utilisent le terme « eau souterraine », bien qu'il soit clair, d'après les descriptions fournies par les auteurs, que les sources d'eau seraient considérées comme des ESSIDES ou des eaux de surface (p. ex. : puits d'infiltration, sources). Toutefois, dans le cadre du présent document, la terminologie utilisée par les auteurs a été maintenue.
La recension et l'analyse des organismes pathogènes entériques dans les eaux souterraines aux États-Unis et au Canada (1990–2013), menées par Hynds et coll. (2014), a repéré 102 études, dont 10 seulement ont porté sur la présence de Giardia, qui a été constatée dans trois de ces dix études. Aucun des sites positifs ne se trouvait au Canada. Trois études ont été effectuées au Canada (sur les dix qui ont été repérées). Deux l'ont été à l'Île-du-Prince-Édouard (Î.-P. –É.) et une en Colombie-Britannique (C. –B.). Au total, les études de l'Î.-P.-É. ont porté sur des échantillons d'eau provenant de 40 puits de fermes laitières et bovines (Budu-Amoako et coll., 2012a, 2012b). La présence de Giardia n'a été observée dans aucun de ces échantillons. Giardia n'était pas non plus présent dans les échantillons d'eau de puits de l'étude menée en C.-B. (Isaac-Renton et coll., 1999).
D'autres études publiées ont fait état de la présence de kystes dans les eaux souterraines (Hancock et coll., 1998; Gaut et coll., 2008; Khaldi et coll., 2011; Gallas-Lindemann et coll., 2013; Sinreich, 2014; Pitkänen et coll., 2015). Comme il a été mentionné plus haut, bon nombre des sources décrites dans ces études seraient considérées comme des ESSIDES ou des eaux de surface. Hancock et coll. (1998) ont constaté que Giardia était présent dans 6 % (12/199) des sites testés. Au total, 83 % (10/12) des sites positifs représentaient des sources, des galeries d'infiltration et des puits horizontaux, tandis que les autres sites positifs (2/12) correspondaient à des puits verticaux. La même étude indiquait également que la contamination était détectée de façon intermittente : de nombreux sites devaient faire l'objet de plusieurs échantillonnages avant que Giardia ne soit détecté. Toutefois, l'échantillonnage n'était pas toujours répété lorsque Giardia n'était pas présent dans le premier échantillon. Une telle approche pourrait avoir entraîné une sous-estimation de la prévalence de la contamination. Bon nombre des autres études mentionnées dans la documentation scientifique s'attachaient à des zones vulnérables, comme les aquifères karstiques (Khaldi et coll., 2011; Sinreich, 2014) ou les zones où la contamination par des matières fécales humaines et animales est plus susceptible d'avoir une retombée sur les eaux souterraines (c.-à-d. eaux souterraines peu profondes, ou proximité avec des sources d'eau de surface, d'eaux usées agricoles ou d'eaux d'égout résidentielles; Gaut et coll., 2008; Pitkänen et coll., 2015). Ces études ont fait état d'un taux de prévalence de Giardia allant de 0 % pour l'ensemble des puits (Gaut et coll., 2008) à 20 % des puits testés (Pitkänen et coll., 2015). Khaldi et coll. (2011) ont également constaté que les échantillons où Giardia était présent passaient de 0 % dans des conditions sans pompage à 11 % dans des conditions de pompage continu. Hynds et coll. (2014) ont signalé que la conception et l'intégrité du puits influencent considérablement la probabilité de détecter des protozoaires entériques.
Les études mentionnées ci-dessus font ressortir l'importance d'évaluer la vulnérabilité des sources souterraines à la contamination par les protozoaires entériques pour qu'on puisse vérifier que leur classement est approprié. Les sources souterraines jugées non vulnérables à la contamination par des protozoaires entériques, dans la mesure où elles sont correctement classées, ne devraient pas contenir de protozoaires. Cependant, toutes les sources d'eau souterraine sont vulnérables et devraient faire l'objet de réévaluations périodiques.
Eau traitée
Les tests visant à détecter la présence de Giardia dans l'eau traitée au Canada sont rarement effectués. Ceux qui ont été faits ont généralement révélé l'absence de kystes ou leur présence en très faibles concentrations (Payment et Franco, 1993; Ong et coll., 1996; Wallis et coll., 1996, 1998; EPCOR, 2005; Douglas, 2009), à quelques exceptions près. En 1997, après un important ruissellement printanier à Edmonton, en Alberta, la présence de 34 kystes/1 000 L dans l'eau traitée a été notée (Gammie et coll., 2000). Des kystes ont également été détectés dans l'eau traitée provenant de sources d'approvisionnement en eau de surface non filtrée (Payment et Franco, 1993; Wallis et coll., 1996).
5.1.2 Survie
Les kystes de Giardia peuvent survivre dans l'environnement pendant des semaines, voire des mois (et peut-être plus longtemps), en fonction de certains facteurs, notamment des caractéristiques propres de la souche et de l'eau, comme la température. L'effet de la température sur les taux de survie de Giardia a fait l'objet de nombreuses études. En général, plus la température augmente, plus la période de survie diminue. Par exemple, Bingham et coll. (1979) ont constaté que des kystes de Giardia peuvent survivre jusqu'à 77 jours dans l'eau du robinet à 8 °C, comparativement à 4 jours à une température de 37 °C. DeRegnier et coll. (1989) ont signalé un effet semblable dans les eaux fluviales et lacustres. Cet effet de la température explique, en partie, les pics de concentration de kystes de Giardia signalés durant les mois d'hiver (Isaac-Renton et coll., 1996; Ong et coll., 1996; Van Dyke et coll., 2012). D'autres facteurs, comme l'exposition aux rayons UV (McGuigan et coll., 2006; Heaselgrave et Kilvington, 2011) ou la prédation (Revetta et coll., 2005) peuvent également raccourcir le temps de survie de Giardia.
La viabilité des kystes de Giardia trouvés dans l'eau ne semble pas élevée. Les parois cellulaires des kystes présents dans les eaux de surface sont souvent perméables, comme le montre la coloration à l'iodure de propidium (IP) (Wallis et coll., 1995), ce qui donne à penser qu'ils ne sont probablement pas viables. Wallis et coll. (1996) ont constaté, au moyen de la coloration à l'IP, que seulement 25 % environ des échantillons d'eau potable où Giardia était présent contenaient des kystes viables. Les faits observés par LeChevallier et coll. (1991b) portent également à croire que la plupart des kystes présents dans l'eau ne sont pas viables : parmi les 46 kystes isolés qui étaient présents dans l'eau potable, 40 présentaient une morphologie « de type non viable » (c.-à-d. cytoplasme déformé ou rétréci). En Colombie-Britannique, des études plus récentes ayant utilisé la coloration au DAPI et la microscopie à contraste interférentiel différentiel (CID) ont conclu que la vaste majorité des kystes détectés au cours de la surveillance régulière de deux réservoirs d'eau potable n'avaient pas de structure interne, ce qui semble indiquer qu'ils sont âgés ou endommagés, et qu'ils ne sont vraisemblablement pas viables (Metro Vancouver, 2013). Les études ont fréquemment révélé la présence de kystes vides (« fantômes »), en particulier dans les eaux usées.
5.1.3 Exposition
La transmission de Giardia se fait le plus souvent de personne à personne (Pond et coll., 2004; Thompson, 2004). Les gens contractent l'infection par voie fécale-orale, que ce soit directement (c.-à-d. par un contact avec les fèces d'une personne contaminée, comme un enfant dans une garderie) ou indirectement (c.-à-d. par ingestion d'eau potable contaminée ou d'eau utilisée à des fins récréatives et, plus rarement, d'aliments contaminés). Étant donné que les personnes infectées constituent la principale source d'infection à Giardia chez l'humain, les sources d'eau touchées par les eaux d'égout résidentielles sont une importante voie d'exposition potentielle à Giardia.
Les animaux jouent peut-être également un rôle important dans la transmission zoonotique de Giardia, bien qu'on ne sache pas très bien dans quelle mesure. Les bovins, les chiens et les chats sont porteurs de l'espèce de Giardia (assemblage A) infectieuse pour les humains. Des génotypes de Giardia (assemblage A) ont également été détectés chez des animaux sauvages, dont le castor et le cerf (Plutzer et coll., 2010). Bien qu'il existe certaines preuves de la transmission zoonotique de Giardia, la plupart sont circonstancielles ou limitées par des contrôles inadéquats. Nous ignorons par conséquent à quelle fréquence et dans quelles circonstances la transmission zoonotique survient. Ensemble, ces données semblent indiquer que, la plupart du temps, les animaux ne constituent pas la source initiale d'infection de Giardia pour les humains. Cependant, dans certains cas, il est possible que les animaux amplifient les génotypes zoonotiques présents dans d'autres sources (p. ex. l'eau contaminée). Ainsi, le génotype de Giardia qui infecte le bétail (assemblage E) prédomine chez les bovins (Lalancette et coll., 2012); ceux-ci sont toutefois susceptibles d'être infectés par les génotypes (zoonotiques) de Giardia qui infectent les humains. Étant donné que les fèces du bétail, comme les veaux, infecté par Giardia contiennent habituellement de 105 à 106 kystes par gramme, ces animaux pourraient jouer un rôle important dans la transmission de Giardia. D'autres animaux d'élevage, comme les moutons, peuvent également être infectés par les génotypes qui infectent les humains. Il se peut que les éleveurs ou les sources d'eau contaminées véhiculent les génotypes zoonotiques au bétail, mais il existe également des preuves du contraire. Dans une étude portant sur l'utilisation d'eaux usées recyclées pour l'irrigation des pâturages, les génotypes infectieux pour l'humain présents dans les eaux usées n'ont pu être isolés des fèces des animaux de pâturage (Di Giovanni et coll., 2006).
Le rôle que les animaux sauvages jouent dans la transmission zoonotique de Giardia est également obscur. Bien que les animaux sauvages, y compris les castors, puissent être infectés par G. lamblia d'origine humaine (Davies et Hibler, 1979; Hewlett et coll., 1982; Erlandsen et Bemrick, 1988; Erlandsen et coll., 1988; Traub et coll., 2004, 2005; Eligio-García et coll., 2005) et qu'ils aient été associés à des éclosions de giardiase d'origine hydrique (Kirner et coll., 1978; Lopez et coll., 1980; Lippy, 1981; Isaac-Renton et coll., 1993), les données épidémiologiques et moléculaires ne confirment pas la théorie selon laquelle la transmission zoonotique par les animaux sauvages représente un risque important d'infection pour les humains (Hoque et coll., 2003; Stuart et coll., 2003; Berrilli et coll., 2004; Thompson, 2004; Hunter et Thompson, 2005; Ryan et coll., 2005a). Cependant, ces données semblent indiquer que les animaux sauvages peuvent être porteurs des génotypes de Giardia infectieux pour les humains, qu'ils contractent par des sources contaminées par les eaux usées domestiques. À mesure que la pression démographique et les activités humaines s'intensifient dans les bassins versants, la possibilité que les sources d'eau soient contaminées par des matières fécales augmente, et la possibilité de contamination par les eaux usées domestiques doit toujours être envisagée. Erlandsen et Bemrick (1988) ont conclu que les kystes de Giardia présents dans l'eau pouvaient provenir de nombreuses sources et que les études épidémiologiques qui se concentrent sur les castors pouvaient passer à côté d'importantes sources de contamination par les kystes. Il a été établi que certaines éclosions d'origine hydrique étaient imputables à une contamination par des eaux usées domestiques (Wallis et coll., 1998). Ongerth et coll. (1995) ont montré qu'il existe un lien statistiquement significatif entre l'utilisation accrue d'eau à des fins domestiques et récréatives et la prévalence de Giardia chez les animaux et dans les eaux de surface. On sait que le castor et le rat musqué peuvent être infectés par l'espèce de Giardia d'origine humaine (Erlandsen et coll., 1988) et que ces animaux sont fréquemment exposés à des eaux usées brutes ou partiellement traitées au Canada. L'utilisation des méthodes de génotypage a fourni de nouvelles preuves de l'existence de ce lien. Il est donc probable que les animaux sauvages et d'autres animaux jouent le rôle de réservoirs pour des souches de Giardia infectieuses pour les humains, en ingérant de l'eau contaminée par des eaux usées et qu'ils accroissent à leur tour les concentrations de kystes de Giardia dans l'eau. Si des animaux infectés vivent en amont ou très près des prises d'eau des usines de production d'eau potable, ils pourraient jouer un rôle important dans la transmission de Giardia par voie hydrique. Pour prévenir la maladie, il est donc important de gérer les bassins versants afin de limiter leur contamination par des matières fécales humaines et animales.
Comme c'est le cas pour les animaux d'élevage et les animaux sauvages, le rôle que les animaux domestiques jouent dans la transmission zoonotique de Giardia n'est pas bien connu. Bien que les chiens et les chats soient susceptibles d'être infectés par des génotypes zoonotiques de Giardia, peu d'études ont fourni des preuves directes de transmission entre eux et les humains (Eligio-García et coll., 2005; Shukla et coll., 2006; Thompson et coll., 2008).
5.2 Cryptosporidium
5.2.1 Sources
Les humains et les autres animaux, en particulier les bovins, sont des réservoirs importants de Cryptosporidium. Des cas de cryptosporidiose chez les humains ont été signalés dans plus de 90 pays répartis sur six continents (Fayer et coll., 2000; Dillingham et coll., 2002). Les taux signalés de prévalence de la cryptosporidiose chez les humains varient entre 1 % et 20 %, les taux les plus élevés étant signalés dans les pays en développement (Caprioli et coll., 1989; Zu et coll., 1992; Mølbak et coll., 1993; Nimri et Batchoun, 1994; Dillingham et coll., 2002; Cacciò et Pozio, 2006). Le bétail, particulièrement les bovins, est une source importante de C. parvum (Pond et coll., 2004). Dans une étude réalisée sur les animaux de ferme au Canada, la présence de Cryptosporidium a été détectée dans des échantillons de fèces de bovins (20 %), de moutons (24 %), de porcs (11 %) et de chevaux (17 %) (Olson et coll., 1997). Dans l'ensemble, les taux de prévalence allaient de 1 % à 100 % chez les bovins et de 1 % à 10 % chez les porcs (Pond et coll., 2004). La présence d'oocystes était plus fréquente chez les veaux que chez les animaux adultes; à l'inverse, elle était plus fréquente chez les porcs et chez les chevaux adultes que chez leurs petits. Les veaux infectés peuvent excréter jusqu'à 107 oocystes par gramme de fèces (Smith et Rose, 1990); ils constituent donc une source importante de Cryptosporidium dans les eaux de surface (voir la section 5.2.2). Les ongulés (animaux à sabots) sauvages et les rongeurs ne sont pas une source importante d'oocystes de Cryptosporidium susceptibles d'infecter les humains (Roach et coll., 1993; Ong et coll., 1996).
Les oocystes se dispersent facilement dans l'environnement et sont transmissibles par la voie fécale-orale. Cryptosporidium se transmet surtout de personne à personne, par l'eau potable contaminée, l'eau utilisée à des fins récréatives, les aliments et le contact avec des animaux, en particulier le bétail. Une analyse plus détaillée de la transmission zoonotique figure à la section 5.2.3.
Des oocystes de Cryptosporidium sont souvent présents dans les eaux d'égout et les eaux de surface, et le sont parfois dans l'eau souterraine et l'eau traitée.
Eau de surface
Le Tableau 4 donne un aperçu de certaines études qui ont examiné la présence de Cryptosporidium dans les eaux de surface au Canada.
| Province | Lieu/bassin versant | Fréquence des échantillons positifs | Unité de mesure | Concentration de Cryptosporidium (oocysts/100 L)Note de bas de tableau 4 - b | Référence |
|---|---|---|---|---|---|
| Enquête nationale | Divers | 55/1 173 | Maximum (pour la plupart des échantillons) | 0,5 | Wallis et coll., 1996 |
| Alberta | Not disponible | 1/1 | Un seul échantillon | 34 | LeChevallier et coll., 1991a |
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 6–83 | Gammie et coll., 2000 |
| Maximum | 10 300Note de bas de tableau 4 - c | ||||
| Alberta | Rivière Saskatchewan Nord, Edmonton | N/D | Moyenne géométrique annuelle | 9 | EPCOR, 2005 |
| Maximum | 69 | ||||
| Colombie-Britannique | District d'irrigation du mont Black | 14/27 | Moyenne géométrique | 3c5 | Ong et coll., 1996 |
| District d'irrigation de Vernon | 5/19 | 9,2 | |||
| District d'irrigation du mont Black | 14/27 | Fourchette | 1,7–44,3 | ||
| District d'irrigation de Vernon | 5/19 | 4,8–51,4 | |||
| Colombie-Britannique | Ruisseau Seymour | 0/49 | MoyenneNote de bas de tableau 4 - d | 0,0 | Metro Vancouver, 2009 |
| Capilano | 5/49 | 2,4 | |||
| Ocquitlam | 1/49 | 2,0 | |||
| Ruisseau Seymour | Maximum | 0,0 | |||
| Capilano | 4,0 | ||||
| Coquitlam | 2,0 | ||||
| Colombie-Britannique | Rivière Salmon | 36/49 | Médiane | 11 | Prystajecky et coll., 2014 |
| Ruisseau Coghlan | 36/65 | 333 | |||
| Rivière Salmon | Maximum | 126 | |||
| Ruisseau Coghlan | 20 600 | ||||
| Nouvelle-Écosse | Parc Collins | 1/26 | Maximum | 130 | Ministère de l'Environnement de la Nouvelle-Écosse, 2013 |
| East Hants | 0/12 | <10 | |||
| Stewiacke | 0/12 | <10 | |||
| Stellarton | 0/12 | <10 | |||
| Tatamagouche | 0/12 | <10 | |||
| Bridgewater | 0/12 | <10 | |||
| Middle Musquodoboit | 0/25 | <10 | |||
| Ontario | Rivière Grand | N/D | Maximum | 2 075 | Welker et coll., 1994 |
| Ontario | Rivière Grand | 33/98 | Moyenne | 6,9 | LeChevallier et coll., 2003 |
| Maximum | 100 | ||||
| Ontario | Rivière Grand | 13/14 | Médiane | 15 | Van Dyke et coll., 2006 |
| Maximum | 186 | ||||
| Ontario | Bassin versant de la rivière Grand | 92/104 | Médiane | 12 | Van Dyke et coll., 2012 |
| Maximum | 900 | ||||
| Ontario | Rivière des Outaouais | N/D/53 | Moyenne | 6,2 | Douglas, 2009 |
| Ontario | Lac Ontario, prises d'eau des usines de traitement de l'eau | Maximum | Edge et coll., 2013 | ||
| UTE1 | 5/46 | 40 | |||
| UTE2 | 5/35 | 3 | |||
| UTE3 | 3/43 | 1 | |||
| Rivière Humber | 18/41 | 120 | |||
| Rivière Credit | 21/35 | 56 | |||
| Ontario | Rivière Nation Sud (nombreux sites) | 317/674 | Moyenne | 3,3–170 | Ruecker et coll., 2012 |
| Québec | Usine de traitement ROS, rivière des Mille-Îles, Montréal | Moyenne géométrique | 742 | Payment et Franco, 1993 | |
| Usine de traitement STE, rivière des Mille-Îles, Montréal | <2 | ||||
| Usine de traitement REP, rivière l'Assomption, Montréal | <2 | ||||
| Québec | Fleuve Saint-Laurent | Moyenne géométrique | 14 | Payment et coll., 2000 | |
| Québec | 15 sites d'eau de surface touchés par le ruissellement urbain et agricole | 99/194 | Médianes | 2–31 | MDDELCC, 2016 |
| Maximums | 7–150 |
Notes de bas de tableau 4
- Note de bas de tableau 4 - a
-
Étant donné que les méthodes d'échantillonnage et d'analyse utilisées dans ces études variaient, il ne convient peut-être pas de comparer les concentrations d'oocystes. La viabilité et l'infectiosité des oocystes ont rarement été évaluées, de sorte que nous disposons de peu de données sur le risque que la présence de Cryptosporidium dans ces échantillons peut représenter pour la santé humaine.
Retour à la référence de la Note de bas de page tableau 4 - a
- Note de bas de tableau 4 - b
-
Les unités ont été normalisées au nombre d'oocystes par 100 litres. Cependant, le texte cite les concentrations par unités telles qu'elles sont décrites dans la documentation scientifique.
Retour à la référence de la Note de bas de page tableau 4 - b
- Note de bas de tableau 4 - c
-
Concentration associée à un fort ruissellement printanier.
Retour à la référence de la Note de bas de page tableau 4 - c
- Note de bas de tableau 4 - d
-
Les valeurs moyennes ne proviennent que des filtres positifs.
Retour à la référence de la Note de bas de page tableau 4 - d
La concentration de Cryptosporidium dans les eaux de surface au Canada est en général de l'ordre de 1 à 100 oocystes/100 L (0,001 à 1 oocyste/L), bien que des concentrations plus élevées aient été signalées. Des concentrations élevées, atteignant 10 300 oocystes/100 L (103 oocystes/L), ont été associées à un ruissellement printanier exceptionnel (Gammie et coll., 2000); elles ont atteint 20 600 oocystes/100 L (206 oocystes/L) pendant un programme de surveillance bihebdomadaire de deux ans (Prystajecky et coll., 2014). Ces résultats montrent que pour établir les caractéristiques d'une source d'eau, il est important d'exercer une surveillance régulière et de procéder également à un échantillonnage lorsque survient un événement particulier. L'analyse des données recueillies aux États-Unis a montré que la densité médiane des oocystes allait de 0,005/L à 0,5/L (Ongerth, 2013a).
Des études récentes ont également examiné les espèces de Cryptosporidium présentes dans les sources d'eau. Deux études menées dans les bassins versants de l'Ontario ont fait état de la fréquence de détection – qui s'établit à moins de 2 % des échantillons – de C. parvum et de C. hominis, les espèces ayant les plus souvent des répercussions pour l'être humain. (Ruecker et coll., 2012; Edge et coll., 2013). Par contre, une étude effectuée en Colombie-Britannique dans un bassin versant mixte, à la fois rural et urbain, a fait état d'un taux de détection de types pouvant infecter les humains autour de 30 % (Prystajecky et coll., 2014). Selon d'autres études menées au Canada, le pourcentage de génotypes infectant les humains se situe entre ces deux niveaux (Pintar et coll., 2012; Van Dyke et coll., 2012). Ces observations ne sont pas uniques. Un projet de recherche récent, portant sur la caractérisation du génotype des espèces de Cryptosporidium contenues dans 220 lames (présence confirmée par la technique d'immunofluorescence), a révélé que 10 % de ces lames renfermaient des génotypes humains (Di Giovanni et coll., 2014).
Une étude internationale des données sur la qualité des sources d'eau (eaux de surface et ESSIDES) a révélé que les concentrations de Cryptosporidium dans les sources d'eau partout en Amérique du Nord et en Europe variaient entre 0,006 et 250 oocystes/L (Dechesne et Soyeux, 2007). Bien que cette fourchette soit large, un examen plus minutieux de neuf sites européens et d'un site australien a montré que, dans l'ensemble, Cryptosporidium a souvent été détecté à des concentrations relativement faibles, allant de 0,05 à 4,6 oocystes/L. Dans une étude antérieure portant sur les effluents d'eaux usées, Medema et coll. (2003) ont fait état de concentrations d'oocystes allant de 1 000 à 10 000 oocystes/L dans les eaux usées brutes et de 10 à 1 000 oocystes/L dans les eaux usées domestiques traitées (c.-à-d. dans l'effluent secondaire).
Eau souterraine
Il y a peu d'information sur la contamination d'eaux souterraines par Cryptosporidium au Canada ou ailleurs. Les études disponibles traitent de divers types de sources qui proviennent du sous-sol. La plupart de ces études utilisent le terme « eau souterraine », bien qu'il soit clair, d'après les descriptions fournies par les auteurs, que les sources d'eau seraient classées dans la catégorie des ESSIDES ou des « eaux de surface » (p. ex. puits d'infiltration, sources). Toutefois, aux fins du présent document, la terminologie utilisée par les auteurs a été maintenue.
Hynds et coll. (2014) ont recensé les études sur les eaux souterraines effectuées au Canada et aux États-Unis entre 1990 et 2013. Neuf de ces études visaient à déterminer si Cryptosporidium était présent; seulement trois de ces neuf études ont été menées au Canada. Deux ont été effectuées à l'Île-du-Prince-Édouard (Budu-Amoako et coll., 2012a, 2012b) et une a été réalisée en C.-B. (Isaac-Renton et coll., 1999). L'étude réalisée en C.-B. n'a pas découvert de Cryptosporidium dans le puits communautaire pendant la période visée. Au cours des études à l'Î.-P.-É., 40 échantillons d'eau de puits prélevés dans des fermes laitières et bovines ont été analysés; quatre d'entre eux renfermaient des Cryptosporidium dont la densité de concentration allait de 0,1 à 7,2/L dans des échantillons de 100 L. Pour confirmer ces observations, les chercheurs ont de nouveau analysé l'eau des puits positifs et y ont découvert des indicateurs bactériens ainsi que Cryptosporidium.
D'autres études publiées ont fait état de la présence d'oocystes dans des eaux souterraines (Welker et coll., 1994; Hancock et coll., 1998; Gaut et coll., 2008; Khaldi et coll., 2011; Füchslin et coll., 2012; Gallas-Lindemann et coll., 2013; Sinreich, 2014). Comme il a été mentionné ci-dessus, nombre des sources décrites dans ces études seraient considérées comme des ESSIDES ou des eaux de surface. Welker et coll. (1994) ont signalé la présence de Cryptosporidium en faibles concentrations dans des puits d'infiltration induite situés à proximité de la rivière Grand. Hancock et coll. (1998) ont constaté la présence de Cryptosporidium dans 11 % (21/199) des sites testés. Parmi les sites positifs, 67 % (14/21) étaient composés de sources, de galeries d'infiltration et de puits horizontaux, et 33 % (7/21) étaient des puits verticaux. La même étude indiquait également que la contamination était détectée de façon intermittente : de nombreux sites devaient faire l'objet de plusieurs échantillonnages avant de pouvoir détecter Cryptosporidium. Toutefois, on mettait parfois fin à l'échantillonnage dans les sites où Cryptosporidium n'était pas présent dans le premier échantillon. Une telle approche peut avoir entraîné une sous-estimation de la fréquence de contamination. Bon nombre des autres études mentionnées dans la documentation scientifique se sont concentrées sur des zones vulnérables, comme les aquifères karstiques (Khaldi et coll., 2011; Sinreich, 2014) ou bien les zones où la contamination fécale humaine et animale est plus susceptible d'entraîner des répercussions sur les eaux souterraines (c.-à-d. eaux souterraines peu profondes ou proximité des sources d'eau de surface, d'eaux usées agricoles ou d'eaux usées domestiques; Gaut et coll., 2008; Füchslin et coll., 2012; Gallas-Lindemann et coll., 2013). Ces études ont révélé des taux de prévalence de Cryptosporidium allant de 8 % à 15 % des échantillons (Gaut et coll., 2008; Gallas-Lindemann et coll., 2013; Sinreich, 2014), jusqu'à 100 % des échantillons (provenant de trois puits) dans une petite étude menée en Suisse (Füchslin et coll., 2012). Khaldi et coll. (2011) ont également constaté que le taux d'échantillons contenant Cryptosporidium passait de 44 % dans des conditions sans pompage à 100 % dans des conditions avec pompage. Hynds et coll. (2014) ont signalé que la conception et l'intégrité du puits ont une incidence importante sur la probabilité de détecter des protozoaires entériques.
Les études mentionnées ci-dessus font ressortir l'importance d'évaluer la vulnérabilité des sources souterraines à la contamination par les protozoaires entériques, pour qu'on puisse veiller à leur classement approprié. Les sources souterraines jugées non vulnérables à la contamination par des protozoaires entériques, dans la mesure où elles sont correctement classées, ne devraient pas contenir de protozoaires. Cependant, toutes les sources d'eau souterraine sont vulnérables et devraient être réévaluées périodiquement.
Eau traitée
La présence de Cryptosporidium dans l'eau traitée au Canada a rarement été évaluée. Les analyses réalisées ont généralement révélé l'absence d'oocystes ou leur présence en très faibles concentrations (Payment et Franco, 1993; Welker et coll., 1994; Ong et coll., 1996; Wallis et coll., 1996, 1998; EPCOR, 2005; Douglas, 2009), exception faite de certains cas (Gammie et coll., 2000). Des oocystes ont également été détectés dans l'eau traitée provenant de sources d'approvisionnement en eau de surface non filtrée (Wallis et coll., 1996) et après la survenue d'événements de contamination graves. Par exemple, en 1997, un important ruissellement printanier à Edmonton, en Alberta, a entraîné une concentration de 80 oocystes/100 L dans l'eau traitée (Gammie et coll., 2000). Pendant l'éclosion de cryptosporidiose à Kitchener-Waterloo, Welker et coll. (1994) ont signalé que 2 des 17 échantillons d'eau filtrée avaient une concentration respective de 0,16 et de 0,43 oocystes/1 000 L.
Les eaux traitées font l'objet d'une large surveillance dans d'autres pays. La surveillance quotidienne de l'eau traitée effectuée au Royaume-Uni (entre 1999 et 2008) a montré que la prévalence des échantillons positifs pouvait atteindre 8 %, mais que grâce aux améliorations apportées aux systèmes d'eau potable, ce taux tombe à 1 % environ (Rochelle et coll., 2012). La méthode employée pour la surveillance quotidienne n'a pas livré d'information sur la viabilité ou l'infectiosité des oocystes. Le génotypage d'un sous-ensemble d'échantillons positifs a toutefois été effectué, et il s'est avéré que les espèces de Cryptosporidium les plus souvent détectées étaient C. ubiquitum (12,5 %), C. parvum (4,2 %) et C. andersonni (4,0 %) (Nichols et coll., 2010).
5.2.2 Survie
Il a été établi qu'en laboratoire, les oocystes de Cryptosporidium survivent dans l'eau froide (4 °C) pendant une période pouvant atteindre 18 mois (AWWA, 1988). Dans de l'eau tiède (15 °C), Cryptosporidium parvum peut rester viable et infectieux pendant sept mois (Jenkins et coll., 2003). En règle générale, le temps de survie des oocystes diminue à mesure que la température augmente (Pokorny et coll., 2002; King et coll., 2005; Li et coll., 2010). Robertson et coll. (1992) ont mentionné que les oocystes de C. parvum peuvent résister à divers stress environnementaux, y compris la congélation (viabilité fortement réduite) et l'exposition à l'eau de mer; les oocystes de Cryptosporidium courent toutefois un risque de dessiccation. Une étude en laboratoire portant sur la dessiccation a montré qu'après moins de deux heures, 3 % seulement des oocystes étaient encore viables et qu'en six heures, tous étaient morts (Robertson et coll., 1992).
Bien qu'on suppose fréquemment que la plupart des oocystes se trouvant dans l'eau sont viables, Smith et coll. (1993) ont constaté que la viabilité des oocystes dans les eaux de surface est souvent très faible. Une étude de LeChevallier et coll. (2003) a révélé que 37 % des oocystes détectés dans les eaux naturelles étaient infectieux. De plus, une étude réalisée par Swaffer et coll. (2014) a signalé que 3 % seulement des Cryptosporidium détectés étaient infectieux. En fait, la recherche a montré que, même parmi les oocystes récemment excrétés, seulement 5 % à 22 % d'entre eux étaient infectieux (Rochelle et coll., 2001, 2012; Sifuentes et Di Giovanni, 2007). Bien que le degré d'infectiosité dont il a été fait état jusqu'à maintenant soit faible et dépende de la méthode employée, les progrès récents de la méthodologie de culture cellulaire employée pour déterminer l'infectiosité de Cryptosporidium ont donné lieu à des augmentations importantes du nombre d'oocystes infectieux (43 % à 74 % d'oocystes infectieux) (King et coll., 2011; Rochelle et coll., 2015).
Il a également été fait état de la faible viabilité des oocystes dans les eaux filtrées. Une enquête réalisée par LeChevallier et coll. (1991b) a montré que dans les eaux filtrées, 21 oocystes sur 23 ont une morphologie « de type non viable » (c.-à-d. absence de sporozoïtes et déformation ou contraction du cytoplasme). Dans une étude plus récente portant sur 14 usines de production d'eau potable, aucun oocyste infectieux n'a été découvert dans les quelque 350 000 L d'eau potable traitée qui a été filtrée (Rochelle et coll., 2012).
5.2.3 Exposition
Le contact direct avec du bétail et le contact indirect avec des eaux contaminées par des fèces sont des voies importantes de transmission de Cryptosporidium (Fayer et coll., 2000; Robertson et coll., 2002; Stantic-Pavlinic et coll., 2003; Roy et coll., 2004; Hunter et Thompson, 2005). Les bovins sont une source importante de C. parvum dans les eaux de surface. Par exemple, un examen hebdomadaire d'échantillons d'eau d'un ruisseau, qui ont été prélevés durant une période de 10 mois en amont et en aval d'une exploitation bovine en Colombie-Britannique, a révélé que les concentrations d'oocystes de Cryptosporidium étaient nettement plus élevées en aval du ruisseau (moyenne géométrique de 13,3 oocystes/100 L, fourchette de 1,4 à 300 oocystes/100 L) qu'en amont (moyenne géométrique de 5,6/100 L, fourchette de 0,5 à 34,4 oocystes/100 L) (Ong et coll., 1996). Un pic important des concentrations d'oocystes a été observé dans les échantillons prélevés en aval du ruisseau après la mise bas à la fin de février. Durant une éclosion confirmée de cryptosporidiose d'origine hydrique survenue en Colombie-Britannique, des oocystes ont été détectés dans 70 % des échantillons de fèces de bovins prélevés dans le bassin versant, près de la prise d'eau du réservoir (Ong et coll., 1997). Les humains peuvent également être une source importante de Cryptosporidium dans les eaux de surface. Une étude menée en Australie a montré que les eaux de surface où se déroulaient des activités récréatives comptaient beaucoup plus de Cryptosporidium que celles où il n'y avait pas de telles activités (Loganthan et coll., 2012).
La sauvagine (gibier d'eau) peut également être une source de Cryptosporidium. Graczyk et coll. (1998) ont montré que les oocystes de Cryptosporidium restent infectieux pour les souris après avoir utilisé le canard comme premier hôte. Cependant, un examen histologique des appareils respiratoire et digestif des oiseaux, réalisé sept jours après l'inoculation, a montré que les protozoaires étaient incapables d'infecter les oiseaux. Dans une étude antérieure (Graczyk et coll., 1996), les auteurs ont constaté que les fèces de Bernaches du Canada migratrices recueillies sur sept des neuf sites étudiés dans la baie de Chesapeake contenaient des oocystes de Cryptosporidium. Les oocystes provenant de trois de ces sites se sont révélés infectieux pour les souris. D'après ces études et d'autres (Graczyk et coll., 2008; Quah et coll., 2011), il semble que la sauvagine transporte des oocystes de Cryptosporidium infectieux de son habitat vers d'autres endroits, y compris les sources d'eau potable.
5.3 Maladies d'origine hydrique
Giardia et Cryptosporidium sont les protozoaires intestinaux les plus souvent signalés en Amérique du Nord et partout dans le monde (Farthing, 1989; Adam, 1991). L'exposition à des protozoaires entériques par l'eau peut entraîner un taux endémique de maladies dans la population ainsi que des éclosions de maladies d'origine hydrique. Comme l'indique la section 4.0, certaines espèces et certains génotypes de Giardia et de Cryptosporidium, respectivement, sont plus couramment associés à la maladie humaine. Tous les cas de giardiase humaine sont imputables aux assemblages A et B de Giardia lamblia. Pour ce qui est de la cryptosporidiose, Cryptosporidium parvum et C. hominis sont les principales espèces associées à la maladie, mais on notera que C. hominis semble plus prévalent en Amérique du Nord et du Sud, en Australie et en Afrique, tandis que C. parvum a causé un plus grand nombre d'infections en Europe (McLauchlin et coll., 2000; Guyot et coll., 2001; Lowery et coll., 2001b; Yagita et coll., 2001; Ryan et coll., 2003; Learmonth et coll., 2004).
5.3.1 Maladies endémiques
Le fardeau annuel des maladies gastro-intestinales aiguës (MGA) endémiques au Canada, toutes sources confondues (aliments, eau, animaux, personne à personne), est estimé à 20,5 millions de cas (0,63 cas par année-personne; Thomas et coll., 2013). Environ 1,7 % (334 966) de ces cas, ou 0,015 cas par année-personne, sont estimés être associés à la consommation d'eau du robinet provenant de réseaux municipaux servant plus de 1 000 personnes au Canada (Murphy et coll., 2016a). Plus de 84 % de la population canadienne totale (environ 29 millions) dépend de ces systèmes; 73 % de la population (environ 25 millions) est approvisionnée par une source d'eau de surface; 1 % (0,4 million) des Canadiens comptent sur une source d'eau souterraine sous l'influence directe de l'eau de surface (ESSIDES); les 10 % restants (3,3 millions) utilisent une source d'eau souterraine (Statistique Canada, 2013a, 2013b). Selon Murphy et coll. (2016a), la majeure partie du fardeau de MGA (0,047 cas par année-personne) est due aux systèmes qui exploitent des sources d'eau de surface traitées uniquement avec du chlore ou du dioxyde de chlore, des sources de type ESSIDES sans traitement ou avec un traitement minimal, ou des sources d'eau souterraine sans traitement. En revanche, on estime que 0,007 cas par année-personne était associé à des systèmes qui utilisent des sources d'eau légèrement touchées et qui sont dotés de multiples barrières de traitement. En outre, les auteurs estiment que plus de 35 % des 334 966 cas de MGA étaient imputables au système de distribution.
Un peu plus de 3 800 cas confirmés de giardiase ont été signalés au Canada en 2012, ce qui représente une baisse importante par rapport aux 9 543 cas signalés en 1989. De fait, le nombre total de cas signalés diminue de façon constante depuis le début des années 1990. Les taux d'incidence ont également diminué au cours de cette période, passant de 34,98 à 11,12 cas pour 100 000 personnes; ASPC, 2015). Quant à la cryptosporidiose, devenue maladie à déclaration obligatoire en 2000, le nombre de cas signalés au Canada est demeuré relativement constant, variant entre 588 cas en 2002 et 875 cas en 2007 (ASPC, 2015). La seule exception est l'année 2001, où le nombre de cas signalés était plus du double (1 763 cas), en raison d'une éclosion d'origine hydrique à North Battleford (Saskatchewan). À l'échelle de la population canadienne, cela correspond à un taux d'incidence qui fluctue entre 1,82 et 2,69 cas pour 100 000 personnes par année, à l'exception de 2001, où le taux d'incidence était de 7,46 cas pour 100 000 personnes (ASPC, 2015). On considère que les taux d'incidence déclarés ne représentent qu'une fraction des maladies qui surviennent dans la population, en raison de la sous-déclaration et du sous-diagnostic, particulièrement à l'égard de maladies bénignes comme les troubles gastro-intestinaux. On estime que le nombre de maladies contractées au pays dues à Giardia et à Cryptosporidium est respectivement environ 40 et 48 fois plus élevé que les valeurs déclarées à l'échelle nationale (Thomas et coll., 2013). Toutefois, même si Giardia et Cryptosporidium sont des protozoaires intestinaux couramment déclarés, ils n'étaient respectivement responsables qu'environ 16 % et 4 % de toutes les maladies d'origine alimentaire ou hydrique en 2013 (ASPC, 2015).
Comme c'est le cas au Canada, les taux de giardiase aux États-Unis sont en baisse : en 2012, le taux moyen de giardiase était de 5,8 cas pour 100 000 personnes (Painter et coll., 2015a). Le taux de giardiase signalé aux États-Unis est inférieur à celui du Canada, mais cette différence peut s'expliquer, du moins en partie, par des différences dans la surveillance des maladies. En effet, la giardiase n'est pas une maladie à déclaration obligatoire dans tous les États américains, alors qu'il s'agit d'une maladie à déclaration obligatoire partout au Canada. Le taux d'incidence de la cryptosporidiose aux États-Unis en 2012-2013 était de 2,6 à 3 cas pour 100 000 personnes (toutes sources confondues, y compris l'eau potable; Painter et coll., 2015b). Ce taux est comparable au taux d'incidence au Canada.
5.3.2 Éclosions
Giardia et Cryptosporidium sont des causes courantes d'éclosions de maladies infectieuses d'origine hydrique au Canada et ailleurs (Fayer, 2004; Hrudey et Hrudey, 2004; Joachim, 2004; Smith et coll., 2006). Pour la période qui s'étend de 1974 à 2001, Giardia et Cryptosporidium étaient respectivement le premier et le troisième agent étiologique le plus fréquemment déclaré relativement à des éclosions de maladies infectieuses liées à l'eau potable au Canada (Schuster et coll., 2005). Giardia était lié à 51 des 138 éclosions pour lesquelles des agents étiologiques ont été établis, et Cryptosporidium était lié à 12 de ces 138 éclosions. La plupart des éclosions de Giardia (38/51; 75 %) et de Cryptosporidium (11/12; 92 %) étaient associées à des réseaux publics d'eau potable; une sélection de ces éclosions est présentée à l'annexe B. De 2002 à 2016, une seule éclosion de giardiase a été signalée au Canada relativement à une source d'eau potable (ASPC, 2009; Efstratiou et coll., 2017; Moreira et Bondelind, 2017). Aucune éclosion de cryptosporidiose liée à l'eau potable n'a été signalée au cours de la même période.
Aux États-Unis, des éclosions liées à l'eau potable mettant en cause Giardia ou Cryptosporidium ont été signalées (Craun, 1979; Lin, 1985; Moore et coll., 1993; Jakubowski, 1994; CDC, 2004; U.S. EPA, 2006a; Craun et coll., 2010). Giardia a été l'agent étiologique le plus fréquemment associé aux éclosions d'origine hydrique aux États-Unis entre 1971 et 2006 (16 % des éclosions; 126/780); quant à Cryptosporidium, il représentait 2 % (15/780) des cas. Ces éclosions ont été associées à 28 127 cas de giardiase et à 421 301 cas de cryptosporidiose (Craun et coll., 2010). La plupart des cas de cryptosporidiose (403 000) étaient associés à l'éclosion de Milwaukee en 1993 (U.S. EPA, 2006a).
Un examen mondial des éclosions de protozoaires d'origine hydrique a révélé que G. lamblia et Cryptosporidium représentaient respectivement 40,6 % et 50,6 % des 325 éclosions d'origine hydrique (toutes sources confondues, y compris les eaux utiliser aux fins récréatives) signalées entre 1954 et 2003 (Karanis et coll., 2007). La plus importante éclosion de giardiase liée à l'eau potable est survenue en 2004, en Norvège, avec environ 2 500 cas recensés (Robertson et coll., 2006; Baldursson et Karanis, 2011). Des mises à jour de cet examen, publiées en 2011 et en 2017, ont fait état de 199 éclosions de protozoaires entre 2004 et 2010 (Baldursson et Karanis, 2011) et de 381 autres éclosions de protozoaires entre 2011 et 2016 (Efstratiou et coll., 2017). Durant ces périodes, entre 35,2 % et 37 % des éclosions d'origine hydrique (toutes sources confondues, y compris les eaux de loisir) continuaient à être dues à Giardia, et entre 60,3 % et 63 % de ces éclosions continuaient à être dues à Cryptosporidium.
Plusieurs auteurs ont cherché à déterminer si les causes des éclosions liées à la présence de protozoaires entériques dans l'eau potable partageaient des points communs. Dans le cas des éclosions détectées au Canada, la contamination de sources d'eau par des eaux d'égout résidentielles et le traitement inadéquat (p. ex. filtration médiocre ou inexistante, recours à la chloration uniquement) semblent avoir été des facteurs importants des éclosions (Schuster et coll., 2005). Selon une analyse des éclosions survenues dans l'Union européenne (1990-2005) menée par Risebro et coll. (2007), la plupart des éclosions tiennent à plus d'un facteur. Comme l'avaient constaté précédemment Schuster et coll. (2005), de nombreuses éclosions dues à des protozoaires entériques étaient liées à une contamination de la source d'eau par des eaux usées ou des déchets fécaux d'animaux d'élevage (habituellement à la suite d'une chute de pluie) et à un échec du traitement (lié à des problèmes de filtration). Risebro et coll. (2007) ont également souligné que des lacunes à long terme dans le traitement, résultant d'une mauvaise compréhension ou de l'absence de prises de mesures à l'égard des résultats de tests antérieurs, ont entraîné des éclosions liées à l'eau potable. Bien que moins courants, les problèmes touchant le système de distribution, surtout ceux concernant les dispositifs de prévention des retours d'eau polluée, ont également causé des éclosions (Risebro et coll., 2007; Moreira et Bondelind, 2017).
Un récent examen des éclosions survenues entre 2000 et 2014 en Amérique du Nord et en Europe a révélé que des problèmes très semblables se présentaient encore (Moreira et Bondelind, 2017). Les éclosions causées par des protozoaires entériques étaient imputables à la contamination de la source d'eau par des eaux usées et des fèces d'animaux, habituellement à la suite de fortes pluies, et à l'inefficacité des barrières de traitement utilisées pour assurer la qualité de l'eau. Certaines des sources d'eau ont été décrites comme des sources d'approvisionnement en eau souterraine non traitées, mais nous ignorons si certaines d'entre elles seraient classées dans la catégorie ESSIDES. Wallender et coll. (2014) ont signalé que, sur 248 éclosions survenues aux États-Unis entre 1971 et 2008 et qui mettaient en cause des eaux souterraines non traitées : 14 (5,6 %) étaient attribuables à G. intestinalis; deux (0,8 %), à C. parvum et à G. intestinalis; cinq (2,0 %), à des étiologies multiples, dont certaines qui mettaient en cause G. intestinalis. La même étude a également révélé que 70 % de ces 248 éclosions étaient liées à des sources d'eau potable semi-publiques ou privées où l'on utilisait de l'eau de puits non traitée. De plus amples renseignements sur les éclosions imputables à des protozoaires entériques survenues au Canada et dans le monde se trouvent à l'annexe B.
5.4 Effet des conditions environnementales
Les concentrations de Giardia et de Cryptosporidium dans un bassin versant sont influencées par de multiples conditions et processus environnementaux, qui varient entre les bassins versants et dont les caractéristiques sont bien souvent mal connues. Cependant, certaines constatations semblent applicables à diverses sources d'eau. Lal et coll. (2013) fournissent une bonne analyse des changements environnementaux – dont les habitudes d'utilisation des terres, le climat et les déterminants sociaux et démographiques – qui peuvent, à l'échelle mondiale, avoir une incidence sur la transmission de la giardiase et de la cryptosporidiose.
De nombreuses études ont conclu que les précipitations ont une répercussion importante sur la qualité microbiologique des sources d'eau, bien que les conditions exactes qui entraînent un accroissement de la charge des agents pathogènes varient. On tend à classer les éclosions en fonction de leur lien à une source d'eau de surface ou à une source d'eau souterraine, mais il n'est pas possible de déterminer si la catégorie des eaux souterraines comprend toutes les sources souterraines ou seulement les systèmes aquifères conformes à cette classification. Curriero et coll. (2001) ont évalué le lien entre les chutes de pluie et les maladies d'origine hydrique aux États-Unis, et ont constaté que les éclosions étaient précédées d'épisodes de pluie dépassant le 90e centile des précipitations mensuelles accumulées. La corrélation entre les éclosions attribuables à la contamination des eaux de surface et les précipitations extrêmes était la plus significative au cours du mois de l'éclosion, tandis que la corrélation entre les éclosions attribuables à la contamination des eaux souterraines et les précipitations extrêmes était la plus significative deux mois avant l'éclosion. Au Canada, Thomas et coll. (2006) ont déclaré que les chutes de pluie dépassant le 93e centile de la moyenne mobile sur cinq jours des précipitations accumulées multiplient le risque d'une éclosion par 2,3. Une étude menée en Angleterre a analysé les données historiques sur les éclosions de maladies liées à l'eau potable (agents pathogènes bactériens, viraux et protozoaires) et sur les précipitations. Les auteurs ont conclu que le risque d'éclosion était lié à deux situations : de faibles niveaux de précipitations au cours des trois semaines antérieures et des précipitations excessives dans la semaine précédant l'éclosion (Nichols et coll., 2009). Drayna et coll. (2010) ont fait état d'un lien fort entre les chutes de pluie et les visites aux urgences pédiatriques pour des maladies gastro-intestinales dans une collectivité utilisant une eau de surface traitée : les visites ont augmenté de 11 % quatre jours après la pluie. Uejio et coll. (2014) ont constaté que les précipitations extrêmes étaient associées à une augmentation des MGA chez les enfants dans des collectivités dont l'approvisionnement municipal provient d'une source d'eau souterraine non traitée. Wallender et coll. (2014) ont signalé que de fortes pluies ou des inondations ont contribué à 36 des 248 éclosions liées à un approvisionnement en eau souterraine non traitée.
En Belgique, une étude a montré que les pics de concentration de Giardia coïncidaient avec les précipitations et la fonte des neiges (Burnet et coll., 2014). La même étude a également observé que la concentration de kystes peut fluctuer, passant d'un niveau inférieur au seuil de détection à des pics de concentration en trois jours; il est donc important de comprendre les éléments propres à un site qui conduisent à une hausse des concentrations de kystes dans les eaux de surface. Dans l'étude de Burnet et coll. (2014), des précipitations successives se sont produites au cours des trois jours séparant les collectes des échantillons, ce qui a entraîné une augmentation du débit pluvial et le transport des eaux de ruissellement contaminées depuis les emplacements en amont. Une méta-analyse examinant les effets des phénomènes météorologiques sur la présence de Giardia et de Cryptosporidium dans les eaux douces de surface à l'échelle mondiale a récemment été publiée. Les chercheurs ont conclu à un lien entre les phénomènes météorologiques violents et la probabilité de détection de ces organismes (Young et coll., 2015). Dans la même analyse, on a tenté de trouver un substitut facile à surveiller qui pourrait être utilisé pour Giardia et Cryptosporidium, mais on n'a pu établir de corrélation entre d'autres variables météorologiques, comme la température, la turbidité ou le débit de l'eau.
Les modifications du climat canadien jouent peut-être également un rôle dans la variation des concentrations de Giardia et de Cryptosporidium. Les changements climatiques entraînent non seulement des effets possibles sur les précipitations et les crues, lesquelles influent sur la présence de Giardia et de Cryptosporidium, mais également, selon des chercheurs qui étudient le lac Ontario, d'éventuelles répercussions sur les thermoclines estivales du lac. Selon l'hypothèse qui a été formulée, l'eau des rivières qui alimentent le lac pourrait donc être poussée à une plus grande profondeur, plus près des prises d'eau des usines de production d'eau potable (Edge et coll., 2013). Au cours de cette étude, c'est l'eau des rivières qui se déversent dans le lac qui renfermait le plus grand nombre d'organismes pathogènes fécaux et qui, par conséquent, pouvait entraîner une plus grande charge en agents pathogènes aux prises d'eau des usines de traitement.
Reckhow et coll. (2007) ont sondé 249 services d'eau de surface servant une population d'au moins 50 000 habitants afin de déterminer si certains contrôles étaient effectués en cas d'orage. En tout, 60,6 % des services d'eau ne vérifiaient pas la qualité de l'eau, 66,2 % des services ne contrôlaient pas le débit et 82,4 % des services n'examinaient pas la réaction du système.
5.5 Relation avec les organismes indicateurs
Aux fins du présent document, le terme « indicateur » désigne un microorganisme dont la présence dans l'eau indique une contamination. On entend par « substitut » un organisme, une particule ou une substance qui sert à évaluer le devenir d'un agent pathogène dans un environnement naturel (p. ex. le transport d'agents pathogènes) ou à la suite d'un traitement (p. ex. la désinfection de l'eau potable).
Les organismes indicateurs qui, selon l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, font régulièrement l'objet au Canada d'une surveillance visant à vérifier la qualité de l'eau potable sont E. coli et les coliformes totaux. La présence d'E. coli dans l'eau indique que celle-ci a été récemment contaminée par des matières fécales et qu'elle présente donc un risque élevé pour la santé, peu importe si des organismes pathogènes particuliers, comme les protozoaires entériques, sont observés. Cependant, l'absence d'E. coli ne témoigne pas nécessairement de l'absence de protozoaires entériques. Les coliformes totaux ne sont pas propres aux matières fécales et ne peuvent donc pas être utilisés pour révéler une contamination fécale (ni la présence possible d'agents pathogènes entériques). Les coliformes totaux révèlent plutôt des problèmes généraux de qualité de l'eau. Les documents techniques des recommandations sur E. coli et les coliformes totaux (Santé Canada, 2012b, 2012c) renferment plus de renseignements sur le rôle d'E. coli et des coliformes totaux dans la gestion de la qualité de l'eau.
5.5.1 Sources d'eau de surface
Plusieurs études ont examiné le lien entre les microorganismes indicateurs et la présence ou l'absence de protozoaires entériques dans des sources d'eau de surface. Globalement, les études ont révélé peu de corrélation entre les protozoaires et les indicateurs fécaux, dont E. coli (Medema et coll., 1997; Atherholt et coll., 1998; Payment et coll., 2000; Van Dyke et coll., 2012), voire aucune (Rose et coll., 1988, 1991; Chauret et coll., 1995; Stevens et coll., 2001; Hörman et coll., 2004; Dorner et coll., 2007; Sunderland et coll., 2007; Edge et coll., 2013; NSE, 2013; Prystajecky et coll., 2014). Lorsqu'une corrélation a été relevée, elle a été observée avec Giardia, et le microorganisme indicateur était présent à des concentrations très élevées. Payment et coll. (2000) ont également publié des données sur le fleuve Saint-Laurent selon lesquelles des niveaux plus élevés d'indicateurs dans ce bassin hydrographique indiquent une très forte probabilité que Giardia, Cryptosporidium ou des virus entériques soient présents. Un examen des données publiées pendant 40 ans sur les corrélations entre les indicateurs et les organismes pathogènes a conclu à l'absence probable de corrélation entre Cryptosporidium (rapport de cotes 0,41; intervalle de confiance de 95 % 0,25-0,69) ou Giardia (rapport de cotes 0,65; intervalle de confiance de 95 % 0,36-1,15) et les microorganismes indicateurs fécaux (Wu et coll., 2011). Cette absence générale de corrélation est vraisemblablement attribuable à divers facteurs, notamment aux différents taux de survie dans l'environnement, au lieu échantillonné et aux différences méthodologiques de l'analyse de l'eau (Payment et Pintar, 2006). Les caractéristiques des bassins versants, notamment les sources et les degrés de contamination fécale, ainsi que des facteurs géochimiques peuvent influer sur la corrélation entre les indicateurs fécaux et les protozoaires, ce qui explique les différences propres à chaque site (Chauret et coll., 1995). Lalancette et coll. (2014) ont examiné les données relatives à E. coli et à Cryptosporidium provenant de plusieurs études, afin de déterminer si ces systèmes d'approvisionnement en eau potable devraient être classés parmi ceux qui doivent subir un traitement supplémentaire pour Cryptosporidium; pour cela, les auteurs ont fait appel au règlement sur le traitement amélioré à long terme des eaux de surface 2 (Long-Term 2 Enhanced Surface Water Treatment Rule), élaboré par l'Agence des États-Unis pour la protection de l'environnement (U.S. EPA, 2006a), qui vise les petits systèmes et qui est basé sur les concentrations d'E. coli. Les auteurs ont conclu qu'E. coli était utile pour prévoir le risque que présente Cryptosporidium lorsque le bassin versant était compromis par des points de déversement des égouts situés à proximité immédiate. Cependant, ils ont trouvé que les concentrations d'E. coli sous-estiment le risque entourant Cryptosporidium si les points de déversement des égouts sont plus éloignés ou si des zones agricoles ou forestières représentent la principale source de matières fécales dans les eaux (Lalancette et coll., 2014). Cette étude suppose que tous les Cryptosporidium détectés peuvent avoir des effets néfastes sur la santé humaine. Bien que cela ne soit peut-être pas le cas, l'hypothèse est appliquée, à l'heure actuelle, dans la plupart des évaluations des risques entourant Cryptosporidium.
Ces observations ont soulevé des questions importantes concernant le bien-fondé de l'utilisation d'E. coli comme indicateur de la contamination des eaux de surface par les protozoaires. Elles ont également mis en évidence la nécessité d'exercer une surveillance régulière des protozoaires dans les eaux de surface afin de mieux comprendre le risque pour la santé publique. Il est possible d'intégrer la surveillance des organismes indicateurs (comme E. coli) à une approche de gestion des risques, particulièrement pour les systèmes où la surveillance des protozoaires n'est pas possible.
5.5.2 Sources d'eau souterraine
Quelques études ont signalé la présence de protozoaires entériques dans les eaux souterraines (voir les sections 5.1.1 et 5.2.1). Dans le contexte de la surveillance des protozoaires, certaines études ont également porté sur la présence de divers microorganismes indicateurs fécaux. D'après l'analyse de Hynds et coll. (2014), les entérocoques sont le seul indicateur fécal pour lequel il existe une corrélation positive avec la présence de protozoaires entériques. Les auteurs ont tout de même conclu que les organismes indicateurs fécaux constituaient un moyen peu efficace d'établir la présence de protozoaires. À la recherche d'une autre méthode pour la surveillance directe des protozoaires, les auteurs d'une étude récente menée au Nouveau-Mexique ont examiné le lien entre la présence d'indicateurs bactériens dans le puits domestiques individuels et la réaction de l'immunoglobuline G (IgG) à Cryptosporidium des individus desservies pas ces puits (Tollestrup et coll., 2014). Comme pour les études analysées par Hynds et coll. (2014), aucun lien n'a été découvert avec la présence d'indicateurs dans les puits, mais la réponse IgG a été reliée à la présence d'une fosse septique sur les lieux. Les limites de cette étude viennent de ce que l'eau des puits n'a été analysée qu'une seule fois et qu'il est donc possible que la contamination soit passée inaperçue (Tollestrup et coll., 2014).
Dans l'ensemble, selon les études qui ont été effectuées, la présence ou l'absence de microorganismes indicateurs fécaux dans une source d'eau souterraine ne permet pas de prévoir avec exactitude la contamination par des protozoaires entériques. Cependant, les tests de détection de bactéries indicatrices sont utiles pour évaluer l'éventualité d'une contamination fécale, qui peut inclure des protozoaires entériques ou d'autres organismes pathogènes entériques préoccupants.
5.5.3 Eau potable traitée
En règle générale, la surveillance des microorganismes indicateurs dans l'eau potable traitée a pour but de vérifier l'efficacité du traitement. Il n'y a pas de corrélation entre les microorganismes indicateurs fécaux couramment utilisés (p. ex. E. coli, coliformes totaux, entérocoques) et la présence de Giardia ou de Cryptosporidium dans les sources d'eau, de sorte que de tels indicateurs ne peuvent pas servir à indiquer la présence de ces protozoaires dans l'eau potable traitée. Les microorganismes indicateurs fécaux ne peuvent pas non plus être utilisés pour évaluer l'efficacité du traitement contre les protozoaires entériques. Les protozoaires entériques présentent différents taux d'élimination par des procédés mécaniques et sont plus résistants à de nombreux désinfectants couramment employés dans l'industrie de l'eau potable. À titre de preuve, des kystes de Giardia et des oocystes de Cryptosporidium ont été détectés dans l'eau potable traitée et filtrée qui satisfaisait aux normes réglementaires, et ils ont été reliés à des éclosions de maladies d'origine hydrique (LeChevallier et coll., 1991b; Welker et coll., 1994; Craun et coll., 1997; Marshall et coll., 1997; Rose et coll., 1997; Nwachuku et coll., 2002; Aboytes et coll., 2004).
Malgré ces limites, l'utilisation simultanée des indicateurs bactériens et des données sur le rendement du traitement (substitut) (voir la section 7.0) permet d'obtenir des renseignements sur le caractère adéquat du traitement de l'eau potable. En particulier, la présence d'E. coli dans l'eau à la sortie d'une usine de traitement signifie que le traitement est inadéquat et qu'il y a un risque accru que des agents pathogènes, y compris des protozoaires entériques, soient présents dans l'eau potable traitée.
6.0 Méthodes d'analyse
La méthode la plus reconnue et la plus utilisée pour détecter la présence de Cryptosporidium et de Giardia dans l'eau est la méthode 1623/1623.1 de l'U.S. EPA, parce qu'elle permet de détecter ces protozoaires simultanément et qu'elle a été validée pour l'analyse de l'eau (U.S. EPA, 2005a, 2006a, 2012). D'autres méthodes normalisées ont également été publiées (ISO, 2006; APHA et coll., 2012). Il est important de remarquer que la méthode 1623/1623.1 ne donne pas de renseignements sur la viabilité ou l'infectiosité des organismes. Il existe d'autres méthodes permettant de détecter la présence de Cryptosporidium et de Giardia dans l'eau, mais la plupart font preuve de taux de récupération plus faibles et de variations plus prononcées que ceux de la méthode EPA 1623 (Quintero-Betancourt et coll., 2002). La plupart des méthodes employées pour la détection de Giardia et de Cryptosporidium dans l'eau, y compris la méthode EPA 1623/1623.1, comprennent quatre étapes : 1) le prélèvement de l'échantillon; 2) la filtration de l'échantillon et l'élution; 3) la concentration et la séparation (purification) de l'échantillon; 4) l'identification des kystes et des oocystes. Ces étapes sont décrites dans les sections suivantes, qui traitent également de certaines méthodes de détection nouvelles, ainsi que des méthodes pour évaluer la viabilité et l'infectiosité des kystes et des oocystes et pour déterminer s'il s'agit d'espèces qui infectent les humains.
6.1 Prélèvement de l'échantillon
Une bonne collecte d'échantillons est importante pour pouvoir obtenir des estimations exactes des protozoaires entériques. Par conséquent, cette étape devrait comprendre une communication claire avec le laboratoire qui effectue l'analyse, pour qu'on puisse s'assurer que la procédure d'échantillonnage appropriée est suivie. Les échantillons d'eau peuvent être prélevés en vrac ou filtrés sur le terrain, puis placés sur de la glace et envoyés à un laboratoire afin d'y être traités en respectant le délai prescrit par la méthode d'analyse. Le volume d'eau recueilli dépend de la quantité prévue de kystes et d'oocystes dans l'eau (c.-à-d. propre à un site); plus la densité prévue des kystes ou des oocystes est faible, plus le volume des échantillons doit être grand. Dans la plupart des cas, entre 10 L et 1 000 L d'eau sont prélevés. Lorsqu'il s'agit d'analyser l'eau brute, les échantillons sont le plus souvent prélevés à proximité et à la profondeur de la prise d'eau potable, ou depuis un robinet d'eau brute dans l'usine de traitement, afin que l'échantillon obtenu soit représentatif de la source d'eau.
6.2 Filtration de l'échantillon et élution
Au Canada, les kystes et les oocystes sont généralement présents en petit nombre, même lorsque l'eau est contaminée par des matières fécales. Par conséquent, il est nécessaire de filtrer les échantillons d'eau en vrac pour concentrer les agents pathogènes jusqu'à ce que leur taux soit détectable. L'eau est généralement pompée à travers un filtre, qui permet de retenir les kystes et les oocystes ainsi que les particules étrangères. La filtration peut être réalisée à l'aide de divers types de filtres, notamment des filtres en bobine, à membrane ou à fibres creuses, et des filtres de mousse comprimée. Ces filtres varient selon le volume d'eau qu'ils peuvent traiter, leur vitesse de filtration, leur aspect pratique, leur compatibilité avec les étapes de traitement subséquentes, leur coût et leur capacité de rétention. Ces différences expliquent les grands écarts entre les taux de récupération mentionnés dans la documentation scientifique (Sartory et coll., 1998; DiGiorgio et coll., 2002; Quintero-Betancourt et coll., 2003; Ferguson et coll., 2004). Certains filtres ont été validés par la méthode EPA 1623/1623.1 (U.S. EPA, 2005a, 2012). Une fois la filtration terminée, on ajoute des solutions d'élution pour libérer les kystes et les oocystes retenus par le filtre, afin d'obtenir un éluat.
6.3 Concentration et séparation de l'échantillon
La centrifugation associée à la séparation immunomagnétique (SIM) est la méthode la plus souvent utilisée pour la concentration et la séparation des échantillons. Premièrement, pour concentrer l'échantillon, l'éluat est centrifugé, ce qui entraîne la formation d'un culot. Ce culot est remis en suspension dans une petite quantité de solution tampon pour produire un concentré. La SIM est utilisée pour séparer les kystes et les oocystes des autres contaminants de l'échantillon. Le concentré est mélangé à des anticorps monoclonaux anti-Cryptosporidium et anti-Giardia liés à des particules magnétiques (billes immunomagnétiques). Celles-ci se lient de manière sélective aux kystes et aux oocystes. Un champ magnétique est ensuite appliqué, qui sépare les complexes billes-kystes et billes-oocystes des particules étrangères. Ces particules sont retirées, les complexes billes-kystes et billes-oocystes sont dissociés, et les billes sont extraites; on obtient alors une suspension concentrée de kystes et d'oocystes. Plusieurs études ont évalué la capacité de récupération de la SIM employée seule. Selon Fricker et Clancy (1998), il est possible de récupérer à plus de 90 % les kystes et les oocystes ajoutés à des eaux dont la turbidité est faible. Par comparaison, le taux moyen de récupération des oocystes et des kystes présents dans des eaux turbides varie, de 55,9 % à 83,1 % pour les oocystes et de 61,1 % à 89,6 % pour les kystes (McCuin et coll., 2001). D'autres auteurs ont fait état de taux de récupération semblables (Moss et Arrowood, 2001; Rimhanen-Finne et coll., 2001, 2002; Sturbaum et coll., 2002; Ward et coll., 2002; Chesnot et Schwartzbrod, 2004; Greinert et coll., 2004; Hu et coll., 2004; Ochiai et coll., 2005; Ryan et coll., 2005b). Les changements de pH (par rapport au pH optimal de 7) peuvent nuire à la SIM (Kuhn et coll., 2002). Bien que la SIM aide à réduire le nombre de faux positifs en diminuant la quantité de débris sur les lames préparées à des fins d'analyse microscopique, c'est une technique relativement coûteuse. Il s'agit cependant de la seule méthode de séparation des échantillons qui fasse partie de la méthode EPA 1623/1623.1.
6.4 Identification des kystes et des oocystes
Une fois les échantillons concentrés et les kystes et les oocystes séparés des matières étrangères, il est possible d'avoir recours à un certain nombre de techniques de détection. La méthode la plus couramment utilisée est l'épreuve d'immunofluorescence (IFA). D'autres méthodes de détection, comme la cytométrie en flux et diverses techniques moléculaires, sont de plus en plus utilisées dans le milieu de la recherche, mais elles ne font pas encore partie des méthodes normalisées.
6.4.1 Épreuve d'immunofluorescence
Après la concentration et la séparation des substances contenues dans l'échantillon, la suspension de kystes et d'oocystes est transférée sur une lame pour coloration et examen. Pour colorer les échantillons, la lame est incubée en présence d'anticorps marqués par fluorescence et dirigés contre des antigènes spécifiques présents à la surface des kystes et des oocystes. Un microscope à immunofluorescence directe est ensuite utilisé pour localiser les corps fluorescents, qui pourraient être des kystes ou des oocystes. Ce procédé, appelé IFA, requiert du matériel spécialisé et une solide expertise technique. Il peut s'avérer hautement sensible. Cependant, étant donné que la taille et les caractéristiques de coloration de certaines algues naturellement fluorescentes ressemblent beaucoup à celles des kystes et des oocystes, l'identification définitive de ces derniers exige une autre coloration (au DAPI) et un autre examen au microscope. Le DAPI se lie à l'acide désoxyribonucléique (ADN) et met ainsi en évidence les noyaux des kystes et des oocystes, ce qui facilite leur identification. On se sert également du microscope à CID pour examiner les caractéristiques des structures morphologiques internes et externes des kystes et des oocystes présumés, afin de déceler les structures atypiques. La coloration au DAPI et le CID font partie des méthodes normalisées d'identification des kystes et des oocystes (ISO, 2006; APHA et coll., 2012; U.S. EPA, 2012).
6.4.2 Cytométrie en flux
La cytométrie en flux est une autre technique qui peut être utilisée pour détecter les kystes et les oocystes après l'étape de la concentration. Grâce à la cytométrie en flux, il est possible de trier, de dénombrer et d'examiner les particules microscopiques en suspension dans un liquide, en fonction de la diffusion de la lumière. Le tri de cellules marquées par fluorescence (fluorescently activated cell sorting, ou FACS) est une technique de cytométrie en flux qui sert à dénombrer et à séparer les kystes de Giardia et les oocystes de Cryptosporidium des autres particules de fond. Des anticorps immunofluorescents sont généralement ajoutés à la suspension de kystes et d'oocystes, puis celle-ci traverse le faisceau lumineux du cytomètre de flux. Lorsque les particules traversent le faisceau lumineux, leur fluorescence est mesurée, et elles sont alors triées et versées dans deux tubes, voire plus.
La technique FACS s'est révélée très sensible et très spécifique (Vesey et coll., 1997; Bennett et coll., 1999; Reynolds et coll., 1999; Delaunay et coll., 2000; Lindquist et coll., 2001; Kato et Bowman, 2002; Lepesteur et coll., 2003; Hsu et coll., 2005; Keserue et coll., 2011). Elle a l'avantage d'être rapide et de permettre un criblage à haut débit. Cependant, les cytomètres de flux sont dispendieux, et leur fonctionnement requiert une formation poussée de l'utilisateur. De plus, comme c'est le cas de la technique d'immunofluorescence, les résultats de la technique FACS peuvent être influencés de façon négative par la présence d'algues naturellement fluorescentes ainsi que par la réactivité croisée des anticorps avec d'autres organismes et particules. De nombreuses méthodes FACS nécessitent également de procéder à un examen au microscope pour confirmer la présence de kystes et d'oocystes; toutefois, cette étape ne sera peut-être pas nécessaire pour certaines méthodes en cours d'élaboration (Ferrari et Veal, 2003; Keserue et coll., 2011).
6.4.3 Méthodes moléculaires
Plusieurs méthodes moléculaires sont également utilisées pour détecter les kystes de Giardia et les oocystes de Cryptosporidium. Une brève description de certaines de ces méthodes est présentée ci-après. Il faut noter que les méthodes moléculaires ne font pas encore partie des méthodes normalisées de détection de la présence de Cryptosporidium et de Giardia dans l'eau.
6.4.3.1 Réaction en chaîne de la polymérase
La réaction en chaîne de la polymérase (polymerase chain reaction ou PCR) est la méthode moléculaire la plus couramment utilisée pour détecter les kystes et les oocystes. Elle consiste à lyser les kystes et les oocystes afin de libérer leur ADN, puis à introduire des amorces ciblant des régions codantes précises de Giardia ou de Cryptosporidium et à amplifier ces régions. Les régions codantes ciblées peuvent être spécifiques à un genre (p. ex. acide ribonucléique ribosomique [ARNr] 18S) ou spécifiques à une espèce ou à un nombre limité d'espèces (p. ex. hsp70, gp60). Un signal PCR positif est mis en évidence par électrophorèse en gel d'agarose, coloration au bromure d'éthidium et examen visuel à la lumière ultraviolette. La technique PCR peut être très sensible (degré de sensibilité correspondant à un seul kyste ou oocyste par éprouvette de réaction) et très spécifique (Deng et coll., 1997, 2000; Bukhari et coll., 1998; Di Giovanni et coll., 1999; Kostrzynska et coll., 1999; Rochelle et coll., 1999; Hallier-Soulier et Guillot, 2000; Hsu et Huang, 2001; McCuin et coll., 2001; Moss et Arrowood, 2001; Rimhanen-Finne et coll., 2001, 2002; Sturbaum et coll., 2002; Ward et coll., 2002); elle est également susceptible d'être automatisée.
La méthode classique de PCR décrite ci-dessus renseigne sur la présence ou l'absence de l'ADN ciblé dans l'échantillon analysé. Elle peut toutefois être combinée à d'autres techniques, comme le polymorphisme de longueur des fragments de restriction (restriction fragment length polymorphism ou RFLP) ou le séquençage de l'ADN, pour différencier les génotypes et les espèces de Giardia et de Cryptosporidium (Morgan et coll., 1997; Widmer, 1998; Lowery et coll., 2000, 2001a, 2001b; Xiao et coll., 2001; Ruecker et coll., 2012; Prystajecky et coll., 2014). Il est également possible de lui associer des techniques comme la culture cellulaire (Jenkins et coll., 2003; Keegan et coll., 2003; LeChevallier et coll., 2003), pour évaluer la viabilité et l'infectiosité des kystes et des oocystes (voir la section 6.6).
Des variations de la méthode classique de PCR ont été élaborées et sont utilisées pour la détection des agents pathogènes. La variation la plus fréquemment utilisée est la PCR quantitative (qPCR, également appelée PCR en temps réel). La qPCR est une technique de PCR modifiée utilisant des sondes oligonucléotidiques et des colorants qui deviennent fluorescents lorsqu'ils sont liés à un ADN à double brin. La fluorescence est mesurée en temps réel, simultanément à l'amplification de la région cible dans les kystes ou les oocystes, ce qui permet de quantifier les produits de la PCR. Cette méthode présente plusieurs avantages par rapport à la PCR classique, notamment l'élimination de l'analyse postérieure à la PCR, une plus grande capacité de criblage, la diminution de la probabilité de contamination (c.-à-d. système de tubes fermés), et la capacité de quantifier les kystes et les oocystes à l'aide d'une courbe d'étalonnage (MacDonald et coll., 2002; Fontaine et Guillot, 2003; Bertrand et coll., 2004), bien qu'en pratique, la quantification des oocystes ne soit pas toujours possible. La recherche a montré que la qPCR ne pouvait faire la distinction entre les signaux provenant de 1, 2, 5 ou 10 oocystes (Staggs et coll., 2013). En règle générale, la densité des oocystes doit augmenter de dix fois pour que les différences de concentration soient détectables (Di Giovanni et LeChevallier, 2005; Staggs et coll., 2013). La qPCR présente d'autres avantages uniques, dont sa capacité de différencier les espèces de Giardia et de Cryptosporidium (par l'analyse de la courbe de fusion) (Limor et coll., 2002; Ramirez et Sreevatsan, 2006) et la détection simultanée de différents microorganismes (c.-à-d. le multiplexage) (Guy et coll., 2003). Cette technique comporte plusieurs avantages par rapport à la PCR classique et à l'IFA, et elle s'est révélée utile pour l'identification et le dénombrement des kystes et des oocystes. On a également utilisé cette technique en combinaison avec le colorant monoazide de propidium afin de déterminer la viabilité des kystes ou des oocystes (Brescia et coll., 2009; Alonso et coll., 2014).
La PCR numérique est une nouvelle technique qui offre certains des avantages de la aPCR (p. ex. résultats en temps réel, multiplexage) et surmonte certains de ses inconvénients, comme la nécessité de générer une courbe d'étalonnage pour la quantification (Gutiérrez-Aguirre et coll., 2015; Cao et coll., 2015). Cette technique est utilisée dans un cadre clinique, mais elle n'est que depuis peu appliquée à des échantillons environnementaux. Comme la qPCR, elle exige un analyseur relativement coûteux.
La transcription inverse-PCR (RT-PCR, ou RT-qPCR) cible l'ARN plutôt que l'ADN et peut être utilisée pour différencier les kystes et les oocystes viables des non viables. D'autres renseignements sont fournis à ce sujet à la section 6.6.3.
Bien que les méthodes de PCR présentent de nombreux avantages, elles ont également plusieurs inconvénients. L'inhibition de la PCR par les cations divalents ainsi que les acides humiques et fulviques constitue un problème important (Sluter et coll., 1997). Afin d'éliminer ces inhibiteurs, les échantillons doivent passer par plusieurs étapes de purification. En plus de l'inhibition de la PCR, la lyse inefficace des kystes et des oocystes est souvent problématique. Malgré ces problèmes, on a mis au point de nombreuses épreuves PCR pour détecter les kystes et les oocystes d'origine hydrique (Stinear et coll., 1996; Kaucner et Stinear, 1998; Griffin et coll., 1999; Lowery et coll., 2000; Gobet et Toze, 2001; Karasudani et coll., 2001; Ong et coll., 2002; Sturbaum et coll., 2002; Ward et coll., 2002).
6.4.3.2 Autres méthodes moléculaires
Les autres méthodes moléculaires qui sont employées pour la détection des kystes et des oocystes sont l'hybridation in situ en fluorescence (fluorescence in situ hybridization ou FISH), les microréseaux et l'amplification isotherme induite par boucle. Ces méthodes ne sont pas régulièrement utilisées, mais elles l'ont été avec plus ou moins de succès dans des laboratoires de recherche. D'autres travaux seraient nécessaires pour valider et normaliser ces méthodes afin qu'elles soient utilisées au-delà du contexte de recherche.
6.5 Taux de récupération
Une partie intégrante du processus de détection de Giardia et de Cryptosporidium consiste à déterminer les taux de récupération. Comme cela a été dit précédemment, les procédés de concentration et de séparation peuvent entraîner des pertes importantes de kystes et d'oocystes. De plus, les caractéristiques de l'eau (p. ex. la présence d'algues et de solides en suspension) peuvent avoir des répercussions importantes sur le taux de récupération.
Le taux de récupération est mesuré par l'ajout (c.-à-d. l'ensemencement) d'un nombre connu de kystes et d'oocystes dans un échantillon d'eau avant que celui-ci ne soit analysé. Idéalement, le taux de récupération devrait être déterminé pour chaque échantillon; cependant, étant donné les coûts élevés afférents, on recueille habituellement des données sur l'efficacité de récupération pour un sous-ensemble d'échantillons. Par exemple, la méthode EPA 1623.1 exige qu'un échantillon d'efficacité de la récupération des oocystes soit analysé chaque semaine, ou tous les 20 échantillons si plus de 20 échantillons sont analysés chaque semaine (U.S. EPA, 2012). Avec l'introduction de préparations commerciales contenant un nombre certifié de kystes ou d'oocystes, l'évaluation de l'efficacité de la récupération est devenue plus rentable et courante.
Bien que le taux de récupération varie d'une étude à l'autre (U.S. EPA, 2001; Quintero-Betancourt et coll., 2003), la méthode EPA 1623 — la plus couramment utilisée — fait preuve d'une efficacité moyenne de récupération de 40 % pour Cryptosporidium et de 69 % pour Giardia (Jaidi et coll., 2009). Plusieurs études ont également évalué le taux de récupération obtenu par la méthode EPA 1623 à l'aide de différents types de filtres (McCuin et Clancy, 2003; Ferguson et coll., 2004; Hu et coll., 2004; Wohlsen et coll., 2004; Karim et coll., 2010). Les taux de récupération variaient beaucoup et corrélaient avec les variations de la qualité de l'eau brute. Comme l'efficacité de la récupération est inférieure à 100 %, la concentration estimée de kystes ou d'oocystes dans un échantillon d'eau est presque toujours supérieure à la densité mesurée. Ongerth (2013b) a montré qu'en corrigeant les mesures de la densité des kystes ou des oocystes pour la récupération, on multipliait l'estimation de la concentration résultante par un facteur de 2 à 10, selon l'efficacité de la récupération. Il a également été démontré que la méthode utilisée pour l'intégration des données sur la récupération peut fausser l'estimation de la concentration (Schmidt et coll., 2013). Par conséquent, les données sur l'efficacité de récupération devraient être déclarées, pour qu'on puisse les utiliser pour mieux estimer la concentration de kystes ou d'oocystes. Si l'estimation de la concentration de kystes ou d'oocystes a pris en compte l'efficacité de la récupération, il faut consigner l'approche utilisée à cette fin.
6.6 Évaluation de la viabilité et de l'infectiosité
Un gros inconvénient des méthodes couramment employées à l'heure actuelle pour détecter la présence de Giardia et de Cryptosporidium est qu'elles offrent très peu de renseignements sur la viabilité des kystes et des oocystes, ou sur leur infectiosité pour l'être humain, deux points essentiels pour déterminer leur importance en matière de santé publique.
Il est possible d'évaluer la viabilité des kystes et des oocystes à l'aide de méthodes in vitro, comme le dékystement, l'inclusion ou l'exclusion de colorants fluorogéniques (c.-à-d. la coloration), la RT-PCR et la FISH. Bien que ces méthodes puissent donner des renseignements sur la viabilité des kystes et des oocystes, elles ne disent pas s'ils appartiennent à des espèces ou à des types pouvant infecter les humains.
Pour évaluer l'infectiosité, il est possible d'employer des méthodes in vitro, comme le RFLP ou le séquençage de l'ADN, qui permettent de déterminer si les échantillons renferment des génotypes pouvant être infectieux pour l'humain. Ces méthodes ne renseignent toutefois pas sur la viabilité des microorganismes.
La culture cellulaire, par contre, est une méthode in vitro qui peut évaluer à la fois la viabilité et l'infectiosité. Les épreuves d'infectiosité sur les animaux sont des méthodes in vivo qui évaluent également la viabilité et l'infectiosité. Malheureusement, la culture cellulaire et les épreuves d'infectiosité sur les animaux sont coûteuses, car elles nécessitent d'avoir du personnel qualifié et de conserver des lignées cellulaires et des animaux; par conséquent, elles ne sont généralement pas utilisées pour l'évaluation systématique des kystes et des oocystes.
Les méthodes existant actuellement pour l'évaluation de la viabilité ou de l'infectiosité sont présentées brièvement dans les sections qui suivent.
6.6.1 Dékystement
On peut estimer la viabilité (mais non l'infectiosité) des kystes et des oocystes en les soumettant à des conditions semblables à celles qui existent dans l'intestin, afin de stimuler le dékystement (c.-à-d. la libération des trophozoïtes et des sporozoïtes). Les divers facteurs et les conditions de dékystement varient considérablement et peuvent conduire à des observations divergentes. Si les kystes et les oocystes sont capables de dékystement, ils sont considérés comme viables. Il est possible de dékyster Giardia en utilisant de l'acide et des enzymes, telles que la trypsine, puis de cultiver ce protozoaire dans un milieu TYI-S-33 (Diamond et coll., 1978; Rice et Schaefer 1981), mais le taux de dékystement est souvent faible. Il est également possible de dékyster des oocystes de Cryptosporidium parvum (Black et coll., 1996; Hijjawi, 2010); il a toutefois été établi que les méthodes de dékystement sont des indicateurs relativement médiocres de la viabilité des oocystes de Cryptosporidium. Neumann et coll. (2000b) ont constaté que des oocystes non dékystés, récupérés après l'application de méthodes de dékystement d'usage courant, demeuraient infectieux pour les souris nouveau-nées.
6.6.2 Colorants
Diverses méthodes de coloration ont été mises au point pour évaluer la viabilité des kystes et des oocystes; elles sont fondées sur l'inclusion ou l'exclusion de deux colorants, le DAPI et l'iodure de propidium (IP) (Robertson et coll., 1998; Freire-Santos et coll., 2000; Neumann et coll., 2000b; Gold et coll., 2001; Iturriaga et coll., 2001). Ces colorants servent à déterminer la perméabilité des parois des kystes et des oocystes. Les kystes et les oocystes peuvent être répartis en trois catégories : 1) viables (inclusion du DAPI, exclusion de l'IP); 2) non viables (inclusion du DAPI et de l'IP); 3) quiescents ou dormants (exclusion du DAPI et de l'IP, mais pouvant être viables). En général, une bonne corrélation est observée entre le DAPI et l'IP et le dékystement in vitro (Campbell et coll., 1992). Neumann et coll. (2000a) ont montré l'existence d'une forte corrélation entre l'intensité de la coloration par le DAPI et l'IP d'oocystes de C. parvum fraîchement isolés et leur infectiosité pour les animaux. Ces colorants, conjugués à des anticorps marqués par fluorescence (utilisés pour le tri de cellules par fluorescence), ont également été utilisés avec succès pour déterminer la viabilité et l'infectiosité des kystes et des oocystes dans des échantillons d'eau, parce que les spectres fluorescents de ces colorants ne recouvrent pas celui des anticorps (Belosevic et coll., 1997; Bukhari et coll., 2000; Neumann et coll., 2000b). Bien que des corrélations positives aient été signalées, il a également été démontré que l'inclusion ou l'exclusion de colorants, par exemple au cours des procédures de dékystement, donne lieu à une surestimation de la viabilité et de l'infectiosité potentielle des kystes et des oocystes et devrait donc être interprétée avec prudence (Black et coll., 1996; Jenkins et coll., 1997).
Le monoazide de propidium est un colorant vital utilisé dans le cadre de méthodes moléculaires, comme la qPCR, pour déterminer la viabilité des kystes et des oocystes. Ce colorant imprègne les kystes ou les oocystes endommagés, s'intercale dans leur ADN et peut former un complexe stable qui empêche l'amplification par PCR. Cette propriété permet la différenciation des organismes vivants ou morts (Brescia et coll., 2009; Alonso et coll., 2014). Vu que l'utilisation du monoazide de propidium aux fins de l'évaluation de la viabilité des kystes et des oocystes est une approche relativement nouvelle, il faut poursuivre les recherches sur les avantages et les limites de cette utilisation.
6.6.3 Réaction en chaîne de la
par le DAPI et l'IP, passe à 69 % avec la RT-PCR. Cette dernière technique a l'avantage de pouvoir être combinée à la méthode SIM, ce qui permet de détecter les kystes et les oocystes et de déterminer simultanément leur viabilité (Hallier-Soulier et Guillot, 2000, 2003). Cette méthode peut, en outre, être quantitative, bien que la quantification puisse être difficile étant donné que le nombre de copies de l'ARNm peut varier. Comme les autres méthodes fondées sur la PCR, la RT-PCR est très sensible aux inhibiteurs environnementaux et une l'extraction inefficace des acides nucléiques des kystes et des oocystes lui est préjudiciable.
6.6.4 Hybridation in situ en fluorescence
L'hybridation in situ en fluorescence (fluorescence in situ hybridization ou FISH) s'est révélée modérément efficace pour différencier les kystes et les oocystes vivants de ceux qui étaient morts (Davies et coll., 2005; Lemos et coll., 2005; Taguchi et coll., 2006); cependant, les résultats faussement positifs sont fréquents (Smith et coll., 2004). Puisque l'ARNr 18S est abondant dans les kystes et les oocystes viables, mais beaucoup moins fréquent dans les kystes et les oocystes non viables, il représente une cible utile pour l'évaluation de la viabilité. Tout comme la méthode de coloration par le DAPI et l'IP, la technique FISH ne permet pas d'évaluer l'infectiosité des kystes et des oocystes.
6.6.5 Méthodes de génotypage polymérase après transcription inverse
La RT-PCR peut également être appliquée à la détection directe de kystes et d'oocystes viables dans des concentrés d'eau (Kaucner et Stinear, 1998). La RT-PCR amplifie une molécule cible, soit l'acide ribonucléique messager (ARNm). Puisque seuls les organismes viables produisent de l'ARNm, cette méthode expérimentale pourrait se révéler utile pour évaluer la viabilité des kystes et des oocystes. Par exemple, la fréquence de détection des kystes viables de Giardia, qui se situe à 24 % avec la technique d'immunofluorescence
Les méthodes de génotypage, comme l'analyse RFLP et le séquençage de l'ADN, ont beaucoup été utilisées au cours des dernières années pour déterminer quelles espèces de Giardia et de Cryptosporidium sont présentes dans les échantillons d'eau positifs, pour savoir s'il s'agit de génotypes infectieux pour les humains. Les méthodes de génotypage peuvent être appliquées directement aux lames d'une IFA. L'ADN des puits positifs est extrait et la qPCR nichée est utilisée pour amplifier une cible d'ADN donnée, ce qui permet d'identifier le microorganisme jusqu'à l'espèce (et parfois, la souche). Plusieurs cibles d'ADN ont été utilisées pour l'amplification. D'habitude, le gène codant la petite sous-unité de l'ARNr est utilisé pour les méthodes de génotypage, puisqu'il est présent en multiples copies et qu'il présente des segments uniques et conservés qui peuvent servir d'outils d'identification. Cependant, d'autres cibles ont également été utilisées. Pour Giardia, le génotypage a été effectué à l'aide du gène 5.8S, des deux régions de l'espaceur transcrit interne voisines (Cacciò et coll., 2010) et du gêne β-Giardin (Cacciò et coll., 2002). Pour Cryptosporidium, le gène RNAr 18S est souvent ciblé pour l'identification de l'espèce (Ryan et coll., 2003; Loganthan et coll., 2012), mais d'autres gènes, comme hsp70, sont utilisés pour déterminer la souche. Le produit de la PCR est utilisé pour l'analyse RFLP ou le séquençage de l'ADN afin de déterminer quels génotypes sont présents (Ruecker et coll., 2012; Xiao et coll., 2013). Les deux méthodes sont parfois utilisées, surtout s'il y a de nombreuses espèces dans le même échantillon (Ruecker et coll., 2012). Si l'amplification de l'ADN est effectuée au moyen de la qPCR, une analyse de la courbe de fusion peut également être utilisée pour aider à l'identification des espèces.
Il faut davantage examiner la possibilité d'avoir recours aux méthodes de génotypage pendant l'analyse systématique des kystes et des oocystes. Récemment, une étude multilaboratoire à grande échelle a été menée aux États-Unis. Elle visait à déterminer si le génotypage peut être appliqué avec succès à des échantillons réglementaires déjà prélevés par des laboratoires en dehors d'un cadre de recherche. Les chercheurs ont constaté qu'avec une formation, mais sans expérience antérieure du génotypage, les laboratoires parvenaient à génotyper correctement 65 % des lames, dont beaucoup contenaient un faible nombre d'oocystes (Di Giovanni et coll., 2014). Ces résultats semblent indiquer qu'après d'autres recherches et après validation, il serait possible d'inclure le génotypage dans une méthode normalisée.
6.6.6 Épreuves d'infectiosité sur les animaux
La méthode la plus directe pour évaluer la viabilité et l'infectiosité des kystes et des oocystes consiste à inoculer un animal susceptible et à surveiller l'élimination des kystes et des oocystes ainsi que tout signe histologique d'évolution de la maladie. On utilise Giardia et Cryptosporidium pour infecter des animaux de laboratoire tels que des gerbilles (pour Giardia) (Belosevic et coll., 1983) et des souris CD-1 nouveau-nées (pour Cryptosporidium) (Finch et coll., 1993). Cette méthode s'est révélée modérément efficace (Delaunay et coll., 2000; Korich et coll., 2000; Matsue et coll., 2001; Noordeen et coll., 2002; Okhuysen et coll., 2002; Rochelle et coll., 2002), mais elle n'est pas pratique, puisqu'elle est coûteuse à réaliser et que la plupart des laboratoires d'analyse ne disposent pas de colonies d'animaux. Cette méthode n'est pas non plus assez sensible pour la surveillance environnementale (c.-à-d. dose infectieuse médiane [DI50] élevée). Ces épreuves sont généralement réservées à la recherche, par exemple pour évaluer l'efficacité d'un procédé de désinfection, plutôt que d'être utilisées pour l'évaluation systématique de la viabilité et de l'infectiosité des kystes et des oocystes.
6.6.7 Épreuves d'infectiosité en culture cellulaire
Comme nous l'avons déjà mentionné, les essais d'infectiosité par culture cellulaire sont des méthodes in vitro qui permettent d'évaluer à la fois la viabilité et l'infectiosité des microorganismes. Ces méthodes, élaborées pour l'évaluation de Cryptosporidium, ne servent pas à évaluer l'infectiosité de Giardia. Les épreuves in vitro en culture cellulaire pour Cryptosporidium consistent à exposer des oocystes à des stimuli de dékystement, puis à les inoculer à une lignée de cellules de mammifère en culture dans lesquelles le parasite est capable de croître et de se développer, telles que les cellules d'adénocarcinome iléo-cæcal humain (HCT-8). Les oocystes sont habituellement inoculés à des monocouches de cellules HCT-8. Après une incubation de 24 à 72 heures, on examine la monocouche de cellules par immunofluorescence indirecte (Slifko et coll., 1997) ou par PCR (Rochelle et coll., 1997; Di Giovanni et coll., 1999) pour vérifier la présence de Cryptosporidium en phase de reproduction. Une épreuve normalisée d'infectiosité en culture cellulaire a récemment été publiée (APHA et coll., 2012).
Cette méthode a été employée pour estimer l'infectiosité des oocystes dans l'eau (Di Giovanni et coll., 1999; Hijjawi et coll., 2001; Weir et coll., 2001; Rochelle et coll., 2002; Johnson et coll., 2005; Schets et coll., 2005; Coulliette et coll., 2006) et elle a donné des résultats semblables à ceux du modèle d'infectiosité pour les souris (Hijjawi et coll., 2001; Rochelle et coll., 2002; Slifko et coll., 2002). D'autres études de comparaison ont trouvé que la culture cellulaire, la méthode de dékystement et la coloration par le DAPI et l'IP présentaient des pourcentages moyens de viabilité semblables (Slifko et coll., 1997).
Les épreuves en culture cellulaire offrent plusieurs avantages, y compris une grande sensibilité (c.-à-d. détection d'un seul oocyste viable), l'applicabilité à l'analyse d'échantillons d'eau brute et d'eau traitée, la facilité d'exécution et la production rapide de résultats. Cette méthode permet de plus de conserver in vitro des oocystes de C. parvum et de C. hominis pendant 25 jours, ce qui facilite les études de viabilité et d'immunothérapie (Hijjawi, 2010). D'autre part, il est possible de combiner la culture cellulaire à d'autres méthodes, y compris la PCR et l'IFA, pour évaluer la viabilité et l'infectiosité avec plus de précision. La PCR à culture cellulaire intégrée (cell culture PCR, ou CC-PCR) s'est révélée utile pour évaluer la contamination des bassins versants et pour estimer les risques (Joachim et coll., 2003; LeChevallier et coll., 2003; Masago et coll., 2004). L'association de la culture cellulaire et de l'IFA (CC-IFA) peut avoir sur la CC-PCR et la CC-RT-PCR l'avantage de donner lieu à moins de faux positifs (Johnson et coll., 2012). Bien que les épreuves d'infectiosité en culture cellulaire offrent plusieurs avantages, elles présentent également certains inconvénients, notamment la nécessité de maintenir une lignée cellulaire et une faible reproductibilité entre des échantillons semblables pour procéder à des évaluations quantitatives. De plus, on ignore à l'heure actuelle si toutes les espèces de Cryptosporidium peuvent être détectées à l'aide des méthodes de culture cellulaire qui existent actuellement; il est toutefois prouvé que ces méthodes peuvent détecter les principaux génotypes qui infectent les humains, soit C. parvum, C. hominis at C. meleagridis (Rochelle et coll., 2012).
7.0 Techniques de traitement
Le principal objectif du traitement est de réduire le nombre d'organismes causant des maladies et les facteurs de risque connexes pour les ramener à un niveau acceptable ou sécuritaire. Il est possible d'y parvenir grâce à un ou à plusieurs procédés de traitement qui éliminent mécaniquement ces organismes ou qui les rendent inactifs. Pour assurer au mieux l'enlèvement ou l'inactivation des microbes pathogènes, il faut comprendre l'importance relative de chacun des procédés. Certains systèmes d'approvisionnement en eau utilisent plusieurs procédés redondants, de sorte que le traitement reste adéquat même en cas de faille de l'un des procédés. Dans les autres réseaux, tous les procédés en place doivent bien fonctionner pour que le degré de traitement requis soit obtenu. Par exemple, Cryptosporidium est extrêmement résistant aux désinfectants à base de chlore couramment utilisés (Korich et coll., 1990; U.S. EPA, 1991; Finch et coll., 1994, 1997). Dans de nombreux systèmes de traitement de l'eau, l'élimination des oocystes ne repose par conséquent que sur des procédés d'enlèvement mécaniques classiques (c.-à-d. la filtration). Pour ces systèmes, l'échec du procédé de filtration ou encore la nécessité de recourir à des procédés préalables au traitement (c.-à-d. la coagulation et la floculation pour la filtration avec procédé chimique) pourrait entraîner l'éclosion d'une maladie d'origine hydrique.
L'approche de la source au robinet, y compris la protection de l'eau à la source d'approvisionnement, est une méthode universellement acceptée de réduction des protozoaires entériques et des autres organismes pathogènes d'origine hydrique dans l'eau potable (O'Connor, 2002; CCME, 2004). Il faut également que les opérateurs aient reçu une formation pour assurer en tout temps le bon fonctionnement des procédés de traitement (Smeets et coll., 2009).
7.1 Traitement à l'échelle municipale
La manière la plus efficace de réduire les kystes et les oocystes dans l'eau potable consiste à associer les technologies d'élimination mécanique et d'inactivation. Il est essentiel d'atteindre les cibles en matière d'élimination mécanique et d'inactivation avant que l'eau ne parvienne au premier consommateur du réseau de distribution. Les procédés d'élimination mécanique, comme la technologie de filtration, se voient attribuer un crédit d'« élimination logarithmique » pour la réduction des niveaux de kystes et d'oocystes lorsque ces procédés atteignent certaines limites de turbidité de l'eau à la sortie des filtres, comme l'explique la section 7.1.2. Les procédés de désinfection primaire font partie des procédés d'inactivation. Les crédits d'« inactivation logarithmique » sont calculés à l'aide des concepts de désinfection présentés à la section 7.1.3. Les crédits d'« élimination logarithmique » et d'« inactivation logarithmique » sont additionnés et leur somme équivaut à la « réduction logarithmique » globale des kystes et des oocystes pour le procédé de traitement évalué. La désinfection secondaire sert à maintenir un résidu de désinfectant dans le réseau de distribution pour le protéger contre la revivification microbienne et pour servir de sentinelle pour les changements de la qualité de l'eau. Aucun crédit d'inactivation logarithmique n'est accordé pour les procédés de désinfection secondaire.
7.1.1 Degré de traitement nécessaire
Pour déterminer le degré de traitement nécessaire, il faut établir les caractéristiques des sources d'approvisionnment en eau potable de façon adéquate. La caractérisation des sources d'approvisionnement en eau comprend généralement plusieurs étapes, dont la délimitation de la zone de la source d'approvisionnment, le repérage des menaces qui pèsent sur la source d'approvisionnement et des risques qu'elle encourt, ainsi que la mesure de la qualité microbiologique, physique, chimique et radiologique de la source d'approvisionnment (OMS, 2012, 2017). Il est également important de surveiller les changements saisonniers pour que les services publics de distribution de l'eau potable produisent constamment de l'eau traitée de haute qualité, quelles que soient les conditions de l'eau brute (Valade et coll., 2009; Huck et Sozański, 2011).
Pour les sources d'eau de surface, on doit idéalement déterminer le degré de traitement nécessaire en mesurant les concentrations de Giardia et de Cryptosporidium dans des conditions normales et après le ruissellement de printemps ou les événements pluviaux-hydrologiques. Les résultats de l'échantillonnage doivent tenir compte du taux de récupération pour la méthode d'analyse et de la viabilité des organismes pathogènes afin d'obtenir l'évaluation la plus précise de la présence d'agents pathogènes infectieux dans les sources d'eau (Emelko et coll., 2008, 2010a; Schmidt et Emelko, 2010; Schmidt et coll., 2010, 2013). Lorsqu'il n'est pas possible d'échantillonner et d'analyser la source d'eau pour détecter Giardia et Cryptosporidium (p. ex. approvisionnement en eau des petites collectivités), la caractérisation des sources d'approviosnement en eau – y compris les paramètres de la qualité de l'eau qui peuvent renseigner sur le risque ou le niveau de contamination fécale – peut être employée pour établir le degré de traitement nécessaire. De plus amples renseignements sur la caractérisation des risques dans les petits systèmes sont donnés ailleurs (OMS, 2012). Il est possible d'avoir recours à des facteurs de sécurité ou à des traitements supplémentaires pour assurer la salubrité microbiologique de l'eau potable, en particulier si la qualité de la source d'eau est hautement variable.
Il faut évaluer les sources d'eau souterraine pour déterminer si l'approvisionnement est susceptible d'être contaminé par des protozoaires entériques (c.-à-d. sources de type ESSIDES) ou par d'autres organismes pathogènes entériques. Ces évaluations doivent inclure, au minimum, une étude hydrogéologique, une évaluation de l'intégrité du puits et une enquête sur les caractéristiques physiques de la région et sur les activités qui y sont menées. La présence d'algues contenant de la chlorophylle est considérée comme une preuve irréfutable de la présence d'eau de surface. Les administrations qui exigent une analyse microscopique particulaire dans le cadre de leur évaluation du caractère ESSIDES d'une source devraient s'assurer que les algues contenant de la chlorophylle représentent un élément essentiel de l'analyse (U.S. EPA, 2016). Les sources d'eau souterraine classées ESSIDES devraient atteindre une élimination ou une inactivation des protozoaires entériques de l'ordre d'au moins 3 log. Les sources d'eau souterraine qui ont été évaluées comme n'étant pas susceptibles d'être contaminées par des protozoaires entériques devraient être conformes aux recommandations énoncées dans le document technique sur les virus entériques (Santé Canada, 2011a). Il est important de bien classer les sources souterraines, puisque de nombreuses éclosions de maladies d'origine hydrique ont été liées à la consommation d'eau non traitée contaminée par des protozoaires entériques ou d'autres organismes pathogènes entériques (voir les sections 5.3 et 5.4) (Wallender et coll., 2014; U.S. EPA, 2016).
La plupart des eaux de surface et des ESSIDES étant susceptibles d'être contaminées par des fèces, des techniques de traitement permettant d'éliminer ou d'inactiver au moins 3 log (99,9 %) de Cryptosporidium et de Giardia doivent être appliquées. Grâce à ce niveau de traitement, une concentration moyenne de 21 kystes/100 L d'eau à la source peut être réduite à 2,1 × 10−2 kystes/100 L, ce qui satisfait à l'objectif basé sur la santé (10-6 années de vie corrigées de l'incapacité [AVCI] par personne par année, comme l'explique la section 9.0). De même, une concentration moyenne de 13 oocystes/100 L d'eau à la source peut être réduite à 1,3 × 10−2 oocystes/100 L. Comme les concentrations de kystes et d'oocystes sont plus élevées dans de nombreuses eaux de surface au Canada (voir les sections 5.1.1 et 5.2.1), il peut être nécessaire d'effectuer une élimination ou une inactivation supplémentaire pour atteindre les objectifs du traitement.
Le procédé de traitement le plus approprié est déterminé à la suite d'une évaluation du site et d'un essai pilote ou d'une analyse convenable. Les situations météorologiques plus instables se rattachant aux changements climatiques rendront encore plus important le choix d'un procédé adéquat (Huck et Coffey, 2004).
7.1.2 Élimination mécanique
Les kystes et les oocystes peuvent être éliminés mécaniquement par diverses technologies, dont la filtration avec produits chimiques, la filtration lente sur sable, la filtration à diatomées, la filtration sur membrane ou une autre technique de filtration approuvée. La filtration sur berge est une méthode de filtration passive d'élimination des microorganismes que l'autorité compétente en matière d'eau potable pourrait également envisager. En ce qui concerne la filtration avec produits chimiques, la filtration lente sur sable et la filtration à diatomées, il existe suffisamment d'études pilotes ou d'études à échelle réelle qui emploient les kystes et les oocystes pour documenter les éliminations logarithmiques atteintes par ces procédés. En ce qui a trait à la filtration sur membrane, les études publiées font état des éliminations logarithmiques en utilisant soit le microorganisme cible, soit un substitut approprié (U.S. EPA, 2005b). Pour la filtration sur berge, les éliminations logarithmiques peuvent être calculées à l'aide de Cryptosporidium ou d'un substitut de Cryptosporidium, et des paramètres hydrologiques et de la qualité de l'eau connexes nécessaires à l'estimation du ratio de dilution de l'eau souterraine et du décalage dans le temps par rapport au plan d'eau de surface (p. ex. température, conductivité, carbone organique dissous, chlorure, bromure, total des solides dissous, hydrogène, oxygène, uranium et autres isotopes; U.S. EPA, 2010). Les kystes et les oocystes étant rarement détectés dans les approvisionnements utilisant la filtration sur berge, les études publiées utilisent des substituts pour faire état des éliminations logarithmiques. Il n'existe toutefois pas de substitut ou de microorganisme indicateur, de série de microorganismes ou de paramètre physique (p. ex. la turbidité) universellement accepté qui pourrait servir à l'évaluation du devenir et du transport des contaminants microbiens dans les milieux souterrains (Schijven et coll., 2002; Pedley et coll., 2006; Emelko et coll., 2010b; Tufenkji et Emelko, 2011; Bradford et coll., 2016; Headd et Bradford, 2016). L'U.S. EPA (2010) recommande de surveiller au moins trois ou quatre microorganismes substituts au moyen d'échantillons appariés d'eaux de surface et d'eaux souterraines et énumèrer, pour calculer l'efficacité d'élimination logarithmique de la filtration sur berge, les substituts possibles suivants : les spores aérobies (p. ex. Bacillus subtilus), les spores anaérobies (p. ex. Clostridium perfringens), les coliformes totaux, E. coli, les entérocoques, les bactériophages, les coliphages ou les diatomées. D'autres substituts identifiés par l'U.S. EPA (2010) comprennent la turbidité, la numération des particules et l'analyse des particules microscopiques, bien que les résultats obtenus avec ces substituts ne permettent pas de calculer l'efficacité d'élimination logarithmique.
7.1.2.1 Filtration avec procédé chimique
L'objectif de la coagulation est de déstabiliser les particules colloïdales (c.-à-d. de neutraliser leur charge),y compris les organismes pathogènes, afin qu'elles s'agglomèrent bien pendant la floculation et soient par la suite enlevées par clarification (sédimentation ou flottation à l'air dissous). Les appareils à contact de boues, y compris les procédés de floculation lestée de sable, combinent la coagulation, la floculation et la clarification en un seul procédé. La filtration sur milieu granulaire peaufine le travail en enlevant les autres petites particules colloïdales qui n'ont pas été éliminées pendant la clarification. Pour que la filtration soit efficace, les particules colloïdales doivent être déstabilisées pendant la coagulation; c'est pour cette raison que la filtration sur milieu granulaire est reconnue comme un procédé de traitement physico-chimique et qu'elle est couramment appelée filtration avec procédé chimique. Les usines de filtration directe n'ont pas d'étape de clarification et les usines de filtration en ligne n'ont ni floculation ni clarification (AWWA, 2011a; MWH, 2012).
Énormément de recherches ont été effectuées pour établir le taux d'élimination logarithmique des kystes et des oocystes obtenu par filtration avec procédé chimique. Les taux d'élimination logarithmique moyens mentionnés dans les études à échelle réelle vont de > 1,54 à > 5,2 (médiane des moyennes > 3,02) pour Giardia et de > 1,2 à > 4,6 (médiane des moyennes > 2,34) pour Cryptosporidium (LeChevallier et coll., 1991c; LeChevallier et Norton, 1992; Payment et Franco, 1993; Nieminski et Ongerth, 1995; States et coll., 1997; Gammie et coll., 2000). Étant donné que les kystes et les oocystes sont rarement détectés dans l'eau traitée, l'efficacité du traitement dépend en bonne partie de leur concentration dans la source d'eau. Les limites de la détection analytique et les taux de récupération influencent également le calcul de l'élimination logarithmique.
De nombreuses études pilotes de provocation ont également été effectuées dans lesquelles des microorganismes ont été ajoutés à de l'eau brute en concentrations suffisantes pour qu'ils soient détectés dans l'eau traitée. Le tableau 5 résume les résultats des études pilotes publiées pour Giardia (intervalle = 1,0 à 5,5; médiane des moyennes = 3,4) et pour Cryptosporidium (intervalle = 0,73 à > 6,6; médiane des moyennes = 3,4). Bien que la plupart des études pilotes aient évalué l'élimination de Cryptosporidium, Giardia devrait être éliminé concurremment à échelle réelle. Cependant, étant donné que les concentrations de Giardia pourraient être plus élevées dans les eaux de source que celles de Cryptosporidium, l'objectif du traitement contre les protozoaires, en matière de taux d'élimination logarithmique, pourrait être fixé par Giardia (Tfaily et coll., 2015).
Les problèmes analytiques rattachés aux limites de détection et aux taux de récupération, ainsi que la façon de traiter les microorganismes non détectés, ont également des répercussions sur le calcul de l'élimination logarithmique à échelle pilote (Emelko et coll., 2005; Zhou et coll., 2015). Les facteurs expérimentaux qui influencent les résultats sont la concentration de kystes et d'oocystes utilisée pour l'ensemencement, et l'endroit où ils sont ensemencés (Hendricks et coll., 2005; Assavasilavasukul et coll., 2008a, 2008b; Campbell et coll., 2014). Par exemple, les taux minimums d'élimination logarithmique dont Assavasilavasukul et coll. (2008a, 2008b) ont fait état ont été attribués à la faible concentration utilisée pour l'ensemencement.
Sur le plan opérationnel, la chimie de la coagulation est considérée comme la variable la plus importante (Ongerth et coll., 1989; Ongerth et Pecoraro, 1995; Patania et coll., 1995; Edzwald et Kelley, 1998; Coffey et coll., 1999; Emelko et coll., 1999; Dugan et coll., 2001; Harrington et coll., 2001; Huck et coll., 2001, 2002; Dai et Hozalski, 2002; Lytle et coll., 2002; Emelko, 2003; Betancourt et Rose, 2004; Hendricks et coll., 2005; O'Melia, 2006; Hijnen et Medema, 2007a; Brown et Emelko, 2009). Patania et coll. (1995) et Hendricks et coll. (2005) ont fait état de taux d'élimination logarithmique sans prétraitement chimique de l'ordre de 0,0 à 0,84 pour Giardia et de 0,0 à 1,10 pour Cryptosporidium; Huck et coll. (2001) ont fait état de taux d'élimination logarithmique des oocystes allant de 0 à 0,86 sans prétraitement. Plusieurs études ont signalé que l'élimination des oocystes par filtration peut fortement décliner lorsque les conditions de la coagulation ne sont pas optimales (p. ex. l'efficacité du traitement diminuait de 2,0 à 3,4 log par comparaison à celle observée dans des conditions optimales) (Ongerth et Pecoraro, 1995; Patania et coll., 1995; Dugan et coll., 2001; Huck et coll., 2001).
| Étude | Élimination logarithmique Giardia |
Élimination logarithmique Cryptosporidium Cryptosporidium |
||||
|---|---|---|---|---|---|---|
| Min. | Max. | Moyenne | Min. | Max. | Moyenne | |
| Nieminski et Ongerth, 1995 (usine 1) | 2,20 | 3,90 | 3,40 | 1,94 | 3,98 | 2,98 |
| Nieminski et Ongerth, 1995 (usine 2) | 2,90 | 4,00 | 3,30 | 1,31 | 3,78 | 2,97 |
| Ongerth et Pecoraro, 1995 | 2,82 | 3,70 | 3,33 | 2,52 | 3,40 | 2,90 |
| Patania et coll., 1995 | 3,4 | 5,1 | 4,2 | 2,7 | 5,9 | 4,2 |
| Edzwald et Kelley, 1998 | Non analysé | 4,2 | 5 | Note de bas de tableau 5 - * | ||
| Swertfeger et coll., 1999 | 2,5 | 4,7 | 3,7 | 1,6 | 4,2 | 3,1 |
| Edzwald et coll., 2000 | 4.3Note de bas de tableau 5 - 1 | 5.5Note de bas de tableau 5 - 1 | Note de bas de tableau 5 - * | 5.3Note de bas de tableau 5 - 1 | 5.5Note de bas de tableau 5 - 1 | Note de bas de tableau 5 - * |
| Dugan et coll., 2001 | Non analysé | 4,5 | 5,4 | >5,0 | ||
| Huck et coll., 2001, 2002 (usine 1) | Non analysé | 4,7 | 5,8 | 5,5 | ||
| Huck et coll., 2001, 2002 (usine 2) | 2,9 | 4,9 | 4,4 | 2,0 | 5,0 | 3,0 |
| States et coll., 2002 | Non analysé | 2,3 | >6,6 | >5,8 | ||
| Emelko et coll., 2003a | Non analysé | 4,7 | 5,8 | 5,6 | ||
| Emelko, 2003 | Non analysé | 4,7 | 5,7 | 5,1 | ||
| Emelko et Huck, 2004 | Non analysé | 4,2 | 5,7 | Note de bas de tableau 5 - * | ||
| Hendricks et coll., 2005 (usine 1) | 3Note de bas de tableau 5 - 1 | 3.5Note de bas de tableau 5 - 1 | 3,2 | 3Note de bas de tableau 5 - 1 | 3,6Note de bas de tableau 5 - 1 | 3,4 |
| Hendricks et coll., 2005 (usine 2) | 2,9Note de bas de tableau 5 - 1 | 3,9Note de bas de tableau 5 - 1 | 3,24 | 2,5Note de bas de tableau 5 - 1 | 4,2Note de bas de tableau 5 - 1 | 3,38 |
| Assavasilavasukul et coll., 2008a, 2008b | 1,0 | 5,4 | Note de bas de tableau 5 - * | 0,73 | 5,2 | Note de bas de tableau 5 - * |
| Brown et Emelko, 2009 | Non analysé | 3,8Note de bas de tableau 5 - 1 | 4,7Note de bas de tableau 5 - 1 | Note de bas de tableau 5 - * | ||
Table 5 footnotes
- Note de bas de tableau 5 - *
-
Non précisé.
Retour à la référence de la Note de bas de page tableau 5 - *
- Note de bas de tableau 5 - 1
-
Interprétation graphique.
Retour à la référence de la Note de bas de page tableau 5 - 1
Les milieux utilisés (sable, anthracite et sable, charbon actif en grains [CAG] et sable) ont été considérés comme également efficaces (Hall et coll., 1995; Patania et coll., 1995; Swertfeger et coll., 1999; Dugan et coll., 2001; Hendricks et coll., 2005), bien que, selon Hijnen et coll. (2010), les filtres au CAG extrafins non chargés supprimaient 2,7 log de C. parvum comparativement à 1,2 log pour les filtres au CAG chargés; le taux moyen d'élimination de G. lamblia était de 2,1 log pour les filtres au CAG, qu'ils soient non chargés ou chargés. Le taux de filtration n'avait pas d'influence significative sur les résultats (Patania et coll., 1995; Edzwald et Kelley, 1998; Harrington et coll., 2001; Huck et coll., 2001).
D'après Patania et coll. (1995) et Hendricks et coll. (2005), la filtration classique est plus efficace que la filtration directe et celle en ligne. Plusieurs études pilotes et études de référence ont montré que, pour les sources d'eau qui renferment des algues, sont naturellement colorées ou contiennent de la matière organique naturelle (MON), la flottaison à l'air dissous peut éliminer de 2 à 3 log de Giardia et de Cryptosporidium, comparativement à 1 à 2 log pour la sédimentation. Dans ces types de sources, des floculats de faible densité ont tendance à se former et ils se prêtent mieux à la flottaison qu'à la sédimentation (Plummer et coll., 1995; Edzwald et Kelley, 1998; Edzwald et coll., 1999; Edzwald et coll., 2000; Harrington et coll., 2001; Edzwald et coll., 2003; Edzwald, 2010; Gregory et Edzwald, 2011).
D'après de nombreuses études, l'eau à la sortie du filtre doit renfermer au plus 0,1 unité de turbidité néphélémétrique (UTN) pour maximiser la réduction des kystes et des oocystes (Logsdon et coll., 1981; Logsdon et coll., 1985; Nieminski et Ongerth, 1995; Patania et coll., 1995; Harrington et coll., 2001; Huck et coll., 2001; Emelko et coll., 2003a; Emelko et coll., 2005; Hendricks et coll., 2005; Campbell et coll., 2014). Cependant, une turbidité de l'eau à la sortie du filtre inférieure à 0,1 UTN ne signifie pas qu'il n'y a pas de kystes ou d'oocystes dans l'eau traitée (Gammie et coll., 2000; Aboytes et coll., 2004).
Les périodes de maturation et de fin de vie du filtre sont également des périodes vulnérables (Logsdon et coll., 1981; Logsdon et coll., 1985; Ongerth et coll., 1989; Patania et coll., 1995; Huck et coll., 2001; Amburgey et coll., 2003; Emelko et coll., 2003a; Emelko et Huck, 2004; Amburgey et coll., 2005; Soucie et Sheen, 2007). Les filtres doivent par conséquent être soigneusement surveillés et lavés à contre-courant afin qu'il n'y ait pendant leur cycle de vie aucune période au cours de laquelle l'élimination est insuffisante. La technique de l'eau filtrée envoyée à l'égout et la prolongation de la phase de subfluidisation terminale du lavage sont des solutions pour réduire le risque pendant la période de maturation (Amburgey et coll., 2003, 2005; Soucie et Sheen, 2007). Il est recommandé de ne pas faire circuler de nouveau dans l'usine de traitement l'eau du lavage à contre-courant des filtres sans lui faire au préalable subir un traitement supplémentaire.
Pour résumer, les usines de filtration avec procédé chimique bien gérées qui sont optimisées pour l'enlèvement des particules et de la MON devraient pouvoir éliminer 3 log de kystes et d'oocystes (Hall et coll., 1995; Patania et coll., 1995; Huck et coll., 2002; Betancourt et Rose, 2004; Emelko et coll., 2005; Hijnen et Medema, 2007a). Pour que ce soit le cas, il est essentiel que les étapes de coagulation et de floculation qui précèdent soient optimisées. Des essais de floculation doivent être effectués pour optimiser le procédé de prétraitement (Hall et coll., 1995; U.S. EPA, 2004; AWWA, 2011b). Surveiller la charge en particules nettes de la surface après la coagulation peut également être utile lorsque la qualité de la source d'eau est très variable (Conio et coll., 2002; Newcombe et Dixon, 2006; AWWA, 2011b; Kundert, 2014; McVicar et coll., 2015; Sharp, 2015).
Outre la turbidité de l'eau à la sortie des filtres, d'autres paramètres, comme la concentration d'ions métalliques du coagulant qui se retrouvent dissous dans l'eau filtrée et la stabilité de la turbidité de l'eau clarifiée sont le signe de problèmes entourant le traitement et d'un risque accru que des kystes et des oocystes soient présents dans l'eau (Hall et coll., 1995; Hiltz, 2015). Le comptage des particules a également été considéré comme une mesure précise de l'efficacité du traitement, en particulier lorsque la turbidité de l'eau à la sortie des filtres est inférieure ou égale à 0,1 UTN (Jacangelo et coll., 1991; Coffey et coll., 1999; Emelko et coll., 1999; Huck et coll., 2001; Huck et coll., 2002).
7.1.2.2 Filtration lente sur sable et filtration à diatomées
Au cours de la filtration lente sur sable, de l'eau non traitée traverse en général lentement un lit de sable poreux submergé. Une croissance biologique se produit pendant l'opération dans le lit de sable et le substrat de gravier. Des bactéries et d'autres matières provenant de la source d'approvisionnement en eau s'accumulent de plus à la surface pour former un « film biologique ». La croissance biologique dans le filtre et dans le film biologique contribue à l'efficacité de la filtration lente sur sable. Selon la qualité de la source d'approvisionnment en eau, des semaines ou des mois peuvent être nécessaires pour que cette croissance biologique se produise. Il est recommandé de procéder à un essai pilote pour vérifier que la filtration lente sur sable parviendra à traiter une source d'approvisionnement en eau (Bellamy et coll., 1985a, 1985b; Logsdon et coll., 2002).
De nombreuses études pilotes de provocation ont été effectuées pour établir le taux d'élimination logarithmique des kystes et des oocystes pour la technique de filtration lente sur sable. Bellamy et coll. (1985a) ont fait état d'un taux d'élimination logarithmique de 2,07 pour Giardia à l'aide d'un filtre sur sable neuf qui ne possédait pas de population microbiologique mature. Lorsque la population microbiologique du lit de sable et du substrat de gravier est devenue mature, le taux d'élimination logarithmique est passé à 3,72, jusqu'à 4,22. Pyper (1985) a fait état d'un taux d'élimination logarithmique de 3,70 log pour Giardia par temps chaud; cependant, le taux d'élimination logarithmique chutait à une valeur située entre 2,19 et 3,05 lorsque la température était inférieure à 7 °C. Les taux d'élimination logarithmique ont diminué davantage (taux de 1,20) par temps froid (0,5 °C), lorsque des eaux d'égout ont été ajoutées pour simuler un bris des canalisations ou un autre événement entraînant la contamination par Giardia. Schuler et coll. (1991) ont fait état d'un taux d'élimination logarithmique de Giardia de 2,77 pour un filtre neuf pendant l'hiver et d'un taux > 4 log par temps chaud, lorsque le filtre était parvenu à maturité; le taux d'élimination logarithmique de Cryptosporidium a été ≥ 4 log pour la durée de l'étude (mars 1988 à janvier 1989). Timms et coll. (1995) ont fait état d'un taux d'élimination logarithmique de Cryptosporidium de 4,52 avec un lit de 50 cm de profondeur et n'ont observé aucun effet négatif lorsque la vitesse de la filtration est passée de 0,3 m/h à 0,4 m/h. DeLoyde et coll. (2006) ont signalé des taux moyens d'élimination logarithmique de Cryptosporidium de 2,0 à > 5,2 lorsque la vitesse de filtration était de 0,4 m/h et de 1,5 à 3,7 lorsque cette même vitesse était de 0,8 m/h. Les taux moyens d'élimination pour Giardia allaient de > 2,4 à 4,9, lorsque la vitesse de filtration était de 0,4 m/h et de > 2,5 à > 4,8 lorsque la vitesse était de 0,8 m/h. Selon Dullemont et coll. (2006), le taux d'élimination logarithmique de Cryptosporidium était en moyenne de 5,3 avec un filtre mature, à une vitesse de filtration de 0,3 m/h et à une température variant entre 8,2 °C et 18,8 °C. Hijnen et coll. (2007) ont ajusté ce résultat à 4,7 en utilisant une approche par bilan massique qui tenait compte du nombre de microorganismes traités, de microorganismes trouvés dans le filtrat et de microorganismes dans le lit de filtration. Il a été dit de cette dernière approche qu'elle représentait mieux les résultats non détectés qui faisaient partie des résultats nuls dans l'étude antérieure. Hijnen et Medema (2007b) ont procédé à une recension de la documentation scientifique sur la capacité de la filtration lente sur sable à éliminer les microbes et ont conclu qu'il est possible d'atteindre des taux moyens d'élimination logarithmique de 4,9 pour Giardia et de 4,8 pour Cryptosporidium. Fogel et coll. (1993) ont fait état de résultats à échelle réelle bien plus faibles à basse température (0,5 °C), soit 1,2 log pour Giardia et 0,3 log pour Cryptosporidium. Les auteurs ont noté que le sable utilisé avait un quotient d'uniformité de 3,5 plutôt que la spécification initiale (entre 1,8 et 2,2). La basse température peut également avoir eu un effet sur l'efficacité, puisque, selon Schijven et coll. (2013), l'élimination des microorganismes par la filtration lente sur sable est très sensible aux changements de température et à l'âge du film biologique.
Pour résumer, lorsque les dispositifs de filtration lente sur sable sont correctement conçus, construits, exploités et entretenus, ils parviennent à enlever les kystes et les oocystes des sources d'eau contaminée dans un large éventail de conditions d'opération. En raison de l'action biologique essentielle de la filtration lente sur sable, il est important de laisser un filtre devenir mature pendant un certain temps après l'avoir gratté et nettoyé (Collins et coll., 1991; Edzwald et coll., 1998; Heller et Ladeira Alves de Brito, 2006). D'autres précautions peuvent également être nécessaires pour atténuer les répercussions des basses températures (Schijven et coll., 2013).
La filtration à diatomées est effectuée par un filtre sous pression employant un milieu fait de diatomées. La couche de support est d'abord recouverte d'un filtre de diatomées (c.-à-d. d'un gâteau de boues) et de l'eau brute combinée à un nourrissement est pompée à travers le milieu. Les facteurs qui déterminent l'efficacité sont le grade des diatomées, le taux et l'épaisseur de la précouche, le taux de nourrissement, la vitesse de filtration et les caractéristiques des particules (comme la taille, la forme, la concentration et la charge de surface), de sorte qu'il s'agit d'un procédé complexe, difficile à appliquer (Logsdon et coll., 1981; Langé et coll., 1986; Ongerth et Hutton, 1997). D'après Logsdon et coll. (1981), le taux d'élimination logarithmique de Giardia allait de 2,19 à 4,15, alors que pour Pyper (1985), il se situait à 3,52. Langé et coll. (1986) ont fait état de l'élimination complète de Giardia dans 30 des 31 essais pilotes et d'une élimination logarithmique de 3,12 dans le cas du seul résultat pour lequel les concentrations étaient détectables. Schuler et Ghosh (1990) et Schuler et coll. (1991) ont fait état de l'élimination complète de Giardia lorsque la filtration à diatomées fonctionne correctement; l'élimination de Cryptosporidium était également excellente (> 3 log), mais l'élimination était rarement complète (dose d'alimentation = 1 200 à 3 000 oocystes/L) sauf lorsque de l'alun était utilisé avec les grades les plus fins de diatomées. Ongerth et Hutton (1997, 2001) ont fait état d'une élimination logarithmique > 6 pour Cryptosporidium. La filtration à diatomées est une technologie acceptée, mais elle exige plus de travail, d'énergie et de matières que la filtration lente par sable et elle est moins facile à appliquer lorsque la qualité de l'eau varie beaucoup (Pyper, 1985).
7.1.2.3 Filtration sur membrane
Quatre types de membranes sous pression sont utilisés à l'heure actuelle pour le traitement de l'eau potable : la microfiltration (MF), l'ultrafiltration (UF), la nanofiltration (NF) et l'osmose inverse (OI). Les membranes sont en général classées selon le type de substances qu'elles enlèvent, la pression d'opération et le diamètre des pores ou le seuil de rétention des molécules. Les membranes pour la MF et l'UF sont des membranes à faible pression qui sont utilisées pour l'enlèvement des particules et des organismes pathogènes. Le principal mécanisme d'élimination est la coloration ou l'exclusion basée sur la taille. Les membranes utilisées pour la NF et l'OI sont des membranes à forte pression qui servent à l'enlèvement des matières organiques (p. ex. la MON dissoute) et inorganiques (p. ex. le sodium, le chlorure, le calcium et le magnésium). Le mécanisme d'élimination repose principalement sur les différences de solubilité ou de diffusivité. Les grandes catégories de membranes, leurs dimensions et les substances qui sont enlevées sont analysées dans Kawamura (2000), AWWA (2005, 2011a) et MWH (2012).
Les membranes sont en général constituées de polymères; cependant, les membranes de céramique ont une application limitée (AWWA, 2005; Kommineni et coll., 2010; Huck et Sozański, 2011; MWH, 2012). Bien que les membranes de NF et d'OI puissent éliminer les kystes et les oocystes, elles ne sont habituellement pas conçues pour que l'élimination soit vérifiable (ANSI/AWWA, 2010). Kruithof et coll. (2001) ont toutefois dit avoir utilisé la conductivité et le sulfate pour surveiller l'intégrité de membranes d'OI. Les membranes de MF et d'UF, qui sont conçues pour que l'élimination soit vérifiable, sont les plus couramment utilisées pour l'élimination microbienne.
Jacangelo et coll. (1991) ont fait état de taux d'élimination logarithmique de G. muris allant de 4,0 à 5,1 à échelle pilote pour quatre sources d'eau de qualité variable, au moyen de membranes d'UF (seuil de rétention de molécules = 100 kilodaltons). Les auteurs ont noté que l'intégrité de la membrane était essentielle pour l'efficacité du procédé, puisque G. muris a été détecté dans le filtrat lorsque les membranes étaient détériorées (p. ex. fibres brisées). Jacangelo et coll. (1997) ont évalué l'élimination de G. muris et de C. parvum à échelle pilote pour trois sources d'eau de qualité variable au moyen de membranes de MF (diamètre des pores = 0,1 µm et 0,2 µm) et de membranes d'UF (seuil de rétention des molécules = 100, 300 et 500 kilodaltons). Les membranes de MF et d'UF ont toutes les deux éliminé G. muris et C. parvum jusqu'au seuil de détection, pourvu que la membrane fût intacte. Les taux d'élimination logarithmique dont il est fait état (6 à 7 pour G. muris et pour C. parvum) sont par conséquent fonction de la concentration des kystes et des oocystes ensemencés. Trimboli et coll. (2001) ont effectué un test de provocation à échelle réelle à l'aide de spores de bacilles dans une usine de MF d'une capacité de 36 millions de litres par jour. Selon les auteurs, les spores des bacilles ont été complètement rejetées et l'élimination logarithmique était supérieure à 5,9. Mi et coll. (2005) ont effectué des tests de provocation à échelle réelle à l'aide de spores de bacilles dans deux usines utilisant la filtration avec des membranes (une MF et une UF) dont l'intégrité était fragilisée. Dans l'usine à MF, cinq tests à échelle réelle ont été réalisés sur une des six grilles des membranes de MF. Le test a consisté à couper 0, 1, 3, 6 et 8 fibres, ce qui représente des ruptures de l'intégrité allant de 0 % à 0,0025 %. Les taux d'élimination logarithmique ont été respectivement de > 6,4, 6,0, 5,3, 4,8 et 4,6 pour 0, 1, 3, 6 et 8 fibres coupées. Dans l'usine à UF, trois tests à échelle réelle ont été effectués sur une des 11 grilles des membranes d'UF. Le test a consisté à couper 0, 1 et 3 fibres, ce qui représentait des ruptures de l'intégrité allant de 0 % à 0,0009 %. Les taux d'élimination logarithmique ont été respectivement de > 5,1, 4,8 et 4,5 pour 0, 1 et 3 fibres coupées. D'autres résumés des études sur l'élimination des organismes pathogènes se trouvent dans U.S. EPA (2001).
Le recours à des membranes à faible pression est un procédé bien établi de traitement de l'eau potable et on considère en règle générale que des membranes intactes peuvent réduire de plus de 3 log les concentrations de Giardia et de Cryptosporidium. Les ruptures de l'intégrité d'une membrane, cependant, peuvent en réduire la capacité d'élimination. Il est donc essentiel de procéder régulièrement à un examen pour vérifier l'intégrité des membranes. Guo et coll. (2010) présentent un examen complet des méthodes de surveillance de l'intégrité pour les membranes à faible pression. Parmi les nombreuses méthodes qui existent, la vérification du taux de décroissement de pression et le test de diffusion d'écoulement d'air sont les plus fréquemment utilisés pour évaluer l'intégrité des membranes. Dans les deux cas, il s'agit de pressuriser un côté de la membrane et de mesurer l'écoulement de l'air au travers des imperfections, dans des conditions définies (Johnson, 1998). Si le taux de décroissement de la pression dépasse la limite fixée pour le système et pour le site, il faut procéder à des essais diagnostiques et à des réparations. Les résultats du test d'intégrité doivent également être convertis en une valeur d'élimination logarithmique équivalente à l'aide des méthodes décrites dans U.S. EPA (2005b) ou dans ASTM (2010). La plupart des systèmes de MF et d'UF qui existent dans le commerce peuvent vérifier automatiquement le taux de décroissement de pression et calculer cette valeur.
Il convient de noter que toutes les membranes se salissent lorsqu'elles sont utilisées et que, par conséquent, le flux (débit par unité de surface) pour une différence de pression donnée peut diminuer considérablement (AWWA, 2005; MWH, 2012). Pour enlever les salissures accumulées, il est nécessaire de procéder régulièrement au lavage à contre-courant des membranes et d'effectuer périodiquement un nettoyage chimique à l'aide de produits spécialement formulés pour venir à bout de l'encrassement. Santé Canada recommande fortement que les produits chimiques de nettoyage soient certifiés par un organisme de certification accrédité comme étant conformes à la norme 60 de NSF International (NSF)/American National Standards Institute (ANSI) intitulée Drinking Water Treatment Chemicals – Health Effects (NSF International, 2017). Lorsqu'il n'est plus possible de ramener le flux à sa valeur de base, les membranes doivent être remplacées (Alspach et coll., 2014). Les programmes de nettoyage chimique peuvent créer des conditions difficiles pour le matériau de la membrane (D'Souza et Mawson, 2005). On suggère d'effectuer des tests d'intégrité directs à la suite d'un nettoyage chimique, pour s'assurer que les membranes demeurent intactes; ces tests devraient être effectués conformément aux recommandations du fabricant.
7.1.2.4 Filtration sur berge
La filtration sur berge (FB) consiste à installer des puits d'approvisionnement en eau verticaux ou horizontaux près d'une rivière afin d'utiliser les berges et l'aquifère adjacent comme filtre naturel pour éliminer les particules et les organismes pathogènes, les micropolluants et les autres composés organiques et inorganiques, y compris les composés biodégradables, comme la MON et l'ammoniac (Piet et Zoeteman, 1980; Bize et coll., 1981; Kuehn et Mueller, 2000; Ray et coll., 2002a, 2002b; Gollnitz et coll., 2004; Emelko et coll., 2010b; U.S. EPA, 2010). À mesure que l'eau descend vers la surface de la nappe phréatique, les concentrations de contaminant diminuent en raison de la filtration physique, des réactions géochimiques, de la biodégradation, de la prédation et de la dilution dans les eaux souterraines (Kuehn et Mueller, 2000; Ray et coll., 2002a; Gollnitz et coll., 2003; Weiss et coll., 2003; Partinoudi et Collins, 2007; Hubbs, 2010; Tufenkji et Emelko, 2011). Ray et coll. (2002a) affirment que les usines à FB correctement conçues et exploitées peuvent assurer l'élimination de 4 log de Cryptosporidium.
Le procédé de FB est complexe et dépend d'un certain nombre de facteurs qui peuvent varier selon les sites. Les facteurs propres au site sont les caractéristiques, la composition et l'épaisseur des matières de l'aquifère (p. ex. la répartition de la granulométrie, les caractéristiques de la surface des grains et la teneur en oxydes métalliques), la qualité de l'eau de la rivière (p. ex. le nombre et la taille des particules et des microorganismes, la concentration en MON, l'ammoniac, les éléments nutritifs et les autres polluants), les sédiments du lit de la rivière, la distance et la vélocité de la filtration, la température, le pH, la force ionique, la charge de surface des microbes et des sédiments, la concentration en oxygène et les effets de dilution des eaux souterraines (Sontheimer, 1980; McDowell-Boyer et coll., 1986; Johnson et Logan, 1996; Gollnitz et coll., 1997; Brush et coll., 1998, 1999; Walker et coll., 1998; Harter et Wagner, 2000; Kuehn et Mueller, 2000; Shaw et coll., 2000; Tufenkji et coll., 2002; Ray et coll., 2002a; Wang et coll., 2002; Tufenkji et coll., 2004, 2006; Gollnitz et coll., 2005; Hijnen et coll., 2005; Tufenkji et Elimelech, 2005; Partinoudi et Collins, 2007; Abudalo et coll., 2010; Faulkner et coll., 2010; Harvey et coll., 2010; Kim et coll., 2010; Metge et coll., 2010).
Schijven et coll. (2002) ont fait état de taux d'élimination logarithmique pour divers microorganismes à trois sites de FB aux Pays-Bas. Ils ont conclu que, dans des conditions relativement homogènes et dans un état stable, dans un aquifère sableux saturé, il est possible de supprimer 8 log des virus sur une distance de 30 mètres, en 25 jours à peu près, et que des taux d'élimination logarithmique plus élevés peuvent être obtenus pour les bactéries, les protozoaires et les algues dans les mêmes conditions. Les auteurs ont fait remarquer que la présence de Cryptosporidium a déjà été constatée dans des puits dont l'eau était filtrée par FB (Welker et coll., 1994; Hancock et coll., 1998; Moulton-Hancock et coll., 2000) et que la santé publique pourrait être en danger, mais qu'il n'y a pas suffisamment de données pour déterminer le risque pour la santé. Pendant deux ans, Wang et coll. (2002) ont mené une étude de démonstration d'un puits à drains rayonnants horizontal de 20 millions de gallons par jour (80 ML/j) qui tire son eau d'un aquifère glacial et confiné avec du sable et du gravier moyens, grossiers et très grossiers renfermant peu de fer et de manganèse. Ils ont estimé que le taux global de filtration se situait entre 0,15 et 0,37 m/j. En raison du petit nombre de Giardia et de Cryptosporidium détectés dans l'eau de la rivière et de ce puits, il a été impossible de calculer les taux d'élimination logarithmique de ces microorganismes. Le taux d'élimination du procédé FB a donc été calculé à l'aide de substituts du transport des agents pathogènes. Les taux moyens d'élimination logarithmique ont été de > 7,1 pour les algues (analyse de particules microscopiques), de > 6,7 pour les diatomées et de > 3,9 pour les spores aérobies. Les auteurs ont mentionné que la turbidité était constamment réduite à moins de 1,0 UTN. Gollnitz et coll. (2003, 2004) ont effectué une étude à échelle réelle d'une durée de 20 mois sur une installation de FB tirant son eau d'un aquifère alluvial constitué de sable et de gravier. Ils ont estimé que le taux d'infiltration était inférieur à 0,07 m/h (1,7 m/j) la plupart du temps, sauf pendant sept épisodes de montée des eaux au cours desquels il a parfois atteint 0,15 m/h (3,6 m/j). Comme ni Giardia ni Cryptosporidium n'ont été détectés dans les puits producteurs ou ceux de l'écoulement de l'eau, il a été impossible de calculer leurs taux d'élimination logarithmique. Ces taux ont été calculés à l'aide de substituts pour les puits ayant une courte ou une longue trajectoire d'écoulement depuis la rivière; les taux d'élimination logarithmique variaient de 4,8 log (trajectoire courte) à 6,2 log (trajectoire longue) pour les algues et de 4,9 log (trajectoire longue) à 5,0 log (trajectoire courte) pour les spores aérobies. Selon les auteurs, les salissures n'ont pas nui au procédé de FB pendant les épisodes de montée des eaux et la turbidité a constamment été ramenée à moins de 1,0 UTN. Gupta et coll. (2009) et Abbaszadegan et coll. (2011) ont également mentionné que les salissures n'avaient pas influencé l'élimination de C. parvum dans des expériences pilotes sur la FB.
Weiss et coll. (2003) ont mené une étude à échelle réelle d'une durée de deux ans sur trois sites de FB aux États-Unis. Comme pour les autres études, il n'y avait pas suffisamment de données pour calculer les taux d'élimination logarithmique de Giardia et de Cryptosporidium, et des substituts ont été utilisés. Les taux d'élimination logarithmique étaient de > 3,2 à > 3,4 pour Clostridium et de > 1,9 à > 3,3 pour les bactériophages. Gollnitz et coll. (2005) ont mené une étude à échelle réelle de 24 mois sur un aquifère de sable et de gravier dont la conductivité hydraulique allait de 76,3 m/j à 244 m/j; les distances que l'eau devait parcourir étaient comprises entre 6,1 m environ à plus de 304,8 m. Comme pour les autres études sur la FB, les données insuffisantes ne permettaient pas de calculer les taux d'élimination logarithmique de Giardia et de Cryptosporidium, et des substituts ont été utilisés. Les taux d'élimination logarithmique variaient de 3,70 à 5,50 pour les algues, de 6,70 à 7,50 pour les diatomées et de 1,50 à 2,10 pour les spores aérobies; les taux d'élimination logarithmique des coliformes totaux, d'E. coli et des entérocoques étaient de l'ordre de 2 log. Les auteurs ont indiqué que la turbidité était constamment réduite à moins de 0,3 UTN. Partinoudi et Collins (2007) ont surveillé quatre sites de FB à diverses fréquences pendant 8 à 20 mois. La distance du site à la rivière variait de 19,5 m à 55 m pour les trois sites utilisant des puits verticaux et elle était de 12,2 m pour le site utilisant des collecteurs horizontaux (caisson). Les temps de déplacement de l'eau dans le sol ont été estimés à 0,75 à 5,5 jours pour les puits verticaux et à 1,0 jour pour le caisson. Les taux d'élimination logarithmique variaient de ≥ 2,01 à ≥ 4,54 pour les spores aérobies, de ≥ 2,72 à ≥ 3,61 pour les coliformes totaux et de ≥ 1,00 à ≥ 1,74 pour E. coli. Les auteurs ont fait remarquer que les taux d'élimination logarithmique étaient bas, car les concentrations de microorganismes étaient faibles dans les eaux de surface et n'étaient pas détectables dans les eaux filtrées sur berge.
En résumé, beaucoup de recherches ont été effectuées pour expliquer le rôle des divers facteurs physiques, chimiques et biologiques sur le transport et l'élimination des microbes dans les milieux naturels souterrains; il est toutefois difficile de prédire et de quantifier ces taux d'élimination (Emelko et coll., 2003b; Tufenkji, 2007). À supposer que la trajectoire de l'écoulement et le temps de transport soient suffisamment longs, la FB peut suffisamment améliorer la qualité microbienne de l'eau pour que la santé publique soit protégée (Schijven et coll., 2002). Farkas et coll. (2015) ont constaté que les anticorps dirigés contre Cryptosporidium étaient moins nombreux chez les membres de collectivités employant la filtration sur berge que chez ceux de collectivités utilisant l'eau de surface, ce qui confirme la théorie selon laquelle la filtration sur berge permet d'améliorer la qualité microbienne de l'eau.
L'élimination et la réduction des microbes doivent être évaluées site par site, compte tenu du nombre de facteurs qui influencent le procédé de FB. Sinclair et coll. (2012) décrivent un processus permettant de sélectionner un ou plusieurs substituts représentatifs pour les systèmes naturels (ou artificiels).
Les aquifères regroupés, le substratum rocheux fissuré et les aquifères de calcaire karstique et de gravier ne sont en général pas accessibles aux crédits accordés à la FB (Berger, 2002; Wang et coll., 2002; U.S. EPA, 2010; ministère de l'Environnement de la Nouvelle-Écosse, 2012). La vitesse des eaux souterraines peut être élevée dans ces aquifères, et la contamination fécale peut parcourir de grandes distances en peu de temps (Harvey et coll., 2008; Khaldi et coll., 2011). La gestion des ressources en eau souterraine dans le karst et le substrat rocheux fracturé ne devrait pas s'effectuer de la même façon que celle des ressources dans les aquifères de sable et de gravier (Crowe et coll., 2003). Il est important de classer les sources souterraines, car de nombreuses éclosions ont été associées à la consommation d'eau non traitée provenant de ces sources (Wallender et coll., 2014; U.S. EPA, 2016).
7.1.2.5 Crédits d'élimination mécanique logarithmique
Les usines de traitement de l'eau potable qui respectent les limites de turbidité établies dans le document technique de la recommandation sur la turbidité (Santé Canada, 2012d) peuvent appliquer les crédits d'élimination moyens de Giardia et de Cryptosporidium qui sont présentés au Tableau 6. Ou encore, les taux d'élimination logarithmique peuvent être établis en fonction de l'efficacité observée ou d'études pilotes. En ce qui concerne la FB, il faudrait consulter la compétence responsable pour connaître les exigences propres au site.
Les crédits d'élimination mécanique logarithmique peuvent être combinés aux crédits de désinfection (voir la section 7.1.3) afin de répondre aux objectifs de traitement globaux. À titre d'exemple, si une élimination globale de 5 log (99,999 %) de Cryptosporidium est nécessaire dans un système de traitement donné et que la filtration classique assure une élimination de 3 log, la réduction restante de 2 log doit être obtenue à l'aide d'un autre procédé, comme la désinfection primaire.
| Procédé de traitement | Crédit d'élimination de Cryptosporidium | Crédit d'élimination de Giardia |
|---|---|---|
| Filtration classiquefiltrationNote de bas de tableau 6 - a | 3 logNote de bas de tableau 6 - b | 3 logNote de bas de tableau 6 - b |
| Filtration directefiltrationNote de bas de tableau 6 - a | 2,5 logNote de bas de tableau 6 - b | 2,5 logNote de bas de tableau 6 - b |
| Filtration lente sur sableNote de bas de tableau 6 - a | 3 logNote de bas de tableau 6 - b | 3 logNote de bas de tableau 6 - b |
| Filtration sur diatoméesNote de bas de tableau 6 - a | 3 logNote de bas de tableau 6 - b | 3 logNote de bas de tableau 6 - b |
| Microfiltration et ultrafiltrationNote de bas de tableau 6 - a | Démonstration et test de provocationNote de bas de tableau 6 - c | Démonstration et test de provocationNote de bas de tableau 6 - c |
| Nanofiltration et osmose inverseNote de bas de tableau 6 - a | Démonstration et test de provocationNote de bas de tableau 6 - c,Note de bas de tableau 6 - d | Démonstration et test de provocationNote de bas de tableau 6 - c,Note de bas de tableau 6 - d |
| Filtration sur berge | Propre au siteeNote de bas de tableau 6 - e | Propre au siteNote de bas de tableau 6 - e |
Table 6 footnotes
- Note de bas de tableau 6 - a
-
Les crédits sont accordés lorsque la turbidité de l'eau à la sortie des filtres respecte les valeurs établies dans les Recommandations pour la qualité de l'eau potable au Canada (Santé Canada, 2012d).
Retour à la référence de la Note de bas de page tableau 6 - a
- Note de bas de tableau 6 - b
-
Valeurs tirées de Santé Canada, 2012d.
Retour à la référence de la Note de bas de page tableau 6 - b
- Note de bas de tableau 6 - c
-
Efficacité de l'élimination démontrée par des tests de provocation et vérifiée par des tests d'intégrité directs.
Retour à la référence de la Note de bas de page tableau 6 - c
- Note de bas de tableau 6 - d
-
Les membranes NF/OI ne sont pas actuellement pas compatibles avec les tests d'intégrité directs. Il faudrait consulter l'autorité compétente pour connaître les méthodes de vérification acceptables.
- Table 6 footnote e
-
Comme l'exige l'autorité compétente.
7.1.3 Inactivation
La désinfection primaire devrait fournir les crédits de réduction logarithmique qui sont encore nécessaires pour atteindre les objectifs du traitement. La désinfection primaire permet de protéger la santé publique en éliminant ou en inactivant les protozoaires, les bactéries et les virus nocifs, tandis que la désinfection secondaire sert à maintenir un résidu dans le réseau de distribution. Il importe que les opérateurs comprennent et maintiennent les valeurs CT/IT requises pour la désinfection primaire (voir les sections 7.1.3.1 et 7.1.3.2), en plus de respecter les exigences relatives aux résidus de chlore pour la désinfection secondaire.
Généralement, la désinfection primaire est effectuée après les traitements qui retirent les particules et la MON. Cette stratégie contribue à assurer l'inactivation efficace des organismes pathogènes et réduit au minimum la formation de sous-produits de désinfection (SPD). Il est important de remarquer que, dans la description de la désinfection microbienne de l'eau potable, le terme « inactivation » indique que l'agent pathogène n'est pas infectieux et ne peut se répliquer dans un hôte convenable, mais qu'il peut encore être présent.
Cinq désinfectants sont souvent utilisés pour le traitement de l'eau potable : le chlore libre, la monochloramine, l'ozone, le dioxyde de chlore et les rayons UV. À l'exception des rayons UV, qui utilisent la radiation électromagnétique, ce sont tous des agents oxydants. Les désinfectants chimiques rendent les microorganismes inactifs en détruisant ou en endommageant la structure de leurs cellules, leur métabolisme, leur biosynthèse et leur croissance, alors que les rayons UV endommagent l'acide nucléique des organismes pathogènes, ce qui empêche leur réplication et les rend par conséquent incapables d'accomplir des cycles infectieux.
Le chlore libre est le produit chimique le plus souvent utilisé pour la désinfection primaire, parce qu'il est facile de s'en procurer, qu'il est relativement peu coûteux et qu'il fournit un résidu qui peut également être utilisé pour la désinfection secondaire afin de maintenir la qualité de l'eau dans le réseau de distribution. Les concentrations ou les temps de contact doivent cependant être relativement élevés pour que le chlore libre rende Giardia inactif, et il ne peut inactiver Cryptosporidium aux doses et aux temps de contact généralement utilisés pour le traitement de l'eau (Korich et coll., 1990). Les systèmes de traitement qui utilisent le chlore libre pour la désinfection primaire doivent donc éliminer ou inactiver Cryptosporidium à l'aide d'un procédé de traitement supplémentaire (p. ex. la filtration ou un autre désinfectant, comme l'ozone ou les rayons UV). L'utilisation de la monochloramine est en général limitée à la désinfection secondaire (c.-à-d. l'entretien résiduel), en raison de son faible pouvoir oxydant. L'ozone et le dioxyde de chlore sont des désinfectants efficaces contre Giardia et Cryptosporidium, mais ils sont d'habitude plus coûteux et plus difficiles à appliquer, en particulier pour les petits systèmes. L'ozone se dégradant rapidement après son application, il ne fournit pas de résidu et ne peut être utilisé pour la désinfection secondaire. Le dioxyde de chlore n'est pas non plus recommandé pour la désinfection secondaire parce qu'il se dégrade relativement vite (Santé Canada, 2008a). Clancy et coll. (1998, 2002) ont montré que la désinfection par les rayons UV est hautement efficace pour ce qui est d'inactiver Giardia et de nombreuses souches de Cryptosporidium parvum. Johnson et coll. (2005) ont confirmé que Cryptosporidium hominis ne résiste pas non plus à la désinfection par les rayons UV.
7.1.3.1 Désinfection chimique
Il est possible de prédire l'efficacité des désinfectants chimiques d'après la concentration résiduelle d'un désinfectant en particulier et les facteurs qui influencent son efficacité, principalement la température, le pH, le temps de contact et le degré de désinfection requis (AWWA, 1991). Cette relation est communément appelée « concept CT », où CT représente le produit de « C » (concentration résiduelle du désinfectant, en mg/L) par « T » (temps de contact avec le désinfectant, en minutes) pour un microorganisme particulier et dans des conditions définies (p. ex. la température et le pH). Pour tenir compte de la dégradation du désinfectant, on détermine habituellement la concentration résiduelle à la sortie de la chambre de contact au lieu d'utiliser la dose appliquée ou la concentration initiale. Le calcul du temps de contact T fait souvent appel à une valeur T10, qui correspond à la durée de rétention de l'eau pendant laquelle le temps de contact requis est atteint ou dépassé pour 90 % de l'eau. On peut estimer cette valeur T10 en multipliant la durée de rétention hydraulique théorique (c.-à-d. le volume du réservoir divisé par le débit) par le facteur de déflexion de la chambre de contact. L'U.S. EPA (1991) fournit les facteurs de déflexion pour certaines chambres de contact. Une autre méthode consiste à effectuer un essai de traçage hydraulique pour déterminer le temps de contact réel dans les conditions d'écoulement de l'usine. La valeur T dépend des performances hydrauliques liées à la construction de l'usine de traitement d'eau. Pour respecter les exigences relatives à CT, il est plus efficace d'améliorer les caractéristiques hydrauliques (c.-à-d. d'augmenter le facteur de déflexion) que d'accroître la dose de désinfectant; cela peut se faire par des modifications physiques, tel que l'ajout de déflecteurs dans la chambre ou le bassin de contact.
U.S. EPA (1991) présente des tableaux CT pour l'inactivation de Giardia, tandis que U.S. EPA (2006a) présente des tableaux CT pour l'inactivation de Cryptosporidium. Certaines valeurs CT sont présentées au Tableau 7 pour une inactivation de Giardia et de Cryptosporidium de 2 log (99 %) réalisée à l'aide du chlore, de la monochloramine, du dioxyde de chlore et de l'ozone. Les valeurs CT confirment que le pouvoir oxydant de la monochloramine est limité, puisqu'il faut des concentrations de monochloramine ou des temps de contact beaucoup plus élevés que ceux observés avec les autres désinfectants chimiques cités pour atteindre le même degré d'inactivation de Giardia. La monochloramine n'est donc pas un désinfectant primaire recommandé contre les protozoaires. Les valeurs CT montrent également que Cryptosporidium est beaucoup plus résistant que Giardia aux désinfectants chimiques, particulièrement à basses températures (Oppenheimer et coll., 2000). En règle générale, pour Giardia et pour Cryptosporidium, la valeur CT doit doubler ou tripler pour chaque baisse de la température de 10 °C (Hoff, 1986; U.S. EPA, 1991). Lorsque la température de l'eau avoisine 0 °C, comme c'est souvent le cas en hiver au Canada, l'efficacité de la désinfection est réduite, et il faut augmenter la concentration de désinfectant ou le temps de contact pour obtenir le même degré d'inactivation. Il est donc important de confirmer que l'on peut respecter les exigences relatives à l'inactivation dans des conditions de température minimale.
L'efficacité de certains désinfectants varie également selon le pH. L'utilisation du chlore libre, qui fait passer le pH de 6 à 9, réduit de trois fois le taux d'inactivation de Giardia (U.S. EPA, 1991). Par contre, il a été établi que le pH a peu d'effets lorsque du dioxyde de chlore ou de l'ozone sont utilisés (U.S. EPA, 2006a).
| Temp. (°C) |
Valeurs CT | |||||||
|---|---|---|---|---|---|---|---|---|
| Chlore libre [pH 7,5, concentration résiduelle 1 mg/L] |
Monochloramine [pH 6–9] |
Dioxyde de chlore | Ozone | |||||
| GiardiaNote de bas de tableau 7 - a | Crypto-sporidium | GiardiaNote de bas de tableau 7 - a | Crypto-sporidium | GiardiaNote de bas de tableau 7 - a | Crypto-sporidiumNote de bas de tableau 7 - b | GiardiaNote de bas de tableau 7 - a | Crypto-sporidiumNote de bas de tableau 7 - b | |
| 0,5 | 169 | -- | -- | -- | -- | -- | -- | -- |
| 1 | -- | -- | 2 535 | -- | 42 | 1 200 | 1,9 | 46 |
| 5 | 99 | -- | 1 470 | -- | 17 | 858 | 1,3 | 32 |
| 25 | 25 | 7 200Note de bas de tableau 7 - c | 500 | 7 200Note de bas de tableau 7 - c | 7,3 | 150 | 0,32 | 4,9 |
Notes de bas de tableau 7
- Note de bas de tableau 7 - a
-
U.S. EPA (1991).
Retour à la référence de la Note de bas de page tableau 7 - a referrer
- Note de bas de tableau 7 - b
-
U.S. EPA (2006a).
Retour à la référence de la Note de bas de page tableau 7 - b referrer
- Note de bas de tableau 7 - c
-
Korich et coll. (1990).
Retour à la référence de la Note de bas de page tableau 7 - c referrer
La réduction de la turbidité est un préalable important pour l'inactivation de Giardia, de Cryptosporidium et d'autres microorganismes, puisque les particules peuvent inhiber la désinfection chimique. De plus, la turbidité neutralise l'action des désinfectants et réduit l'efficacité de la désinfection chimique. Selon LeChevallier et coll. (1981), le pouvoir désinfectant du chlore libre diminue de huit fois lorsque la turbidité passe de 1 à 10 UTN. L'effet de la turbidité sur l'efficacité du traitement est étudié plus en détail dans le document technique de la recommandation sur la turbidité (Santé Canada, 2012d).
Lorsqu'on choisit un désinfectant chimique, il est important de tenir compte des conditions de fonctionnement, comme la température, le pH et la turbidité, puisqu'elles peuvent avoir une influence considérable sur l'inactivation des organismes pathogènes. La température et le pH peuvent également influencer la formation de sous-produits chimiques de la désinfection.
La désinfection chimique peut entraîner la formation de sous-produits, dont certains présentent un risque pour la santé. Le chlore, le désinfectant le plus couramment utilisé, réagit avec la MON pour former des trihalométhanes et des acides haloacétiques, ainsi que d'autres composés organiques halogénés (Rook, 1976; Krasner et coll., 2006). Les systèmes qui utilisent la monochloramine et, dans une moindre mesure, ceux qui utilisent le chlore libre peuvent également voir la formation de diméthylnitrosamine. Du bromate peut se former dans le cas des systèmes qui utilisent des solutions d'hypochlorite produites sur les lieux ou achetées dans le commerce (Santé Canada, 2016). L'utilisation d'ozone et de dioxyde de chlore peut également entraîner la formation de sous-produits inorganiques, comme le bromate (dans le cas de l'ozone) et le chlorite/chlorate (dans le cas du dioxyde de chlore). Il faut tenir compte de l'effet éventuel des SPD lorsqu'un désinfectant chimique est choisi, mais il est essentiel que les tentatives de réduction de la formation de sous-produits ne nuisent pas à l'efficacité de la désinfection. Les documents techniques appropriés renferment plus de renseignements à ce sujet (Santé Canada, 2006, 2008a, 2008b, 2011b, 2016).
7.1.3.2 Désinfection par les rayons ultraviolets
Pour la désinfection par les rayons UV, le produit de l'intensité lumineuse « I » (mesurée en mW/cm2 ou en W/m2) et du temps « T » (mesuré en secondes) est la dose calculée (fluence) en mJ/cm2 pour un microorganisme donné. Cette relation est appelée concept IT. La désinfection par les rayons UV s'effectue à l'aide de lampes à basse pression (BP) qui émettent des rayons UV essentiellement sur une seule longueur d'ondes (~ 254 nm) (lampes monochromatiques), ou de lampes à pression moyenne (PM), qui émettent des rayons sur un spectre plus large (lampes polychromatiques). La diode électroluminescente à ultraviolets (DEL-UV) est une nouvelle technologie utilisée pour le traitement de l'eau par rayonnement ultraviolet (Wright et coll., 2012). Cependant, Song et coll. (2016) ont conclu, à l'issue d'un examen des études publiées sur l'application des DEL-UV, qu'il faut établir une méthode normalisée de détermination des doses de rayons UV émises par les DEL-UV pour réduire l'incohérence et l'incompatibilité des données sur la dose-réponse qui figurent actuellement dans la documentation scientifique.
Des études ont montré que des doses de rayons UV relativement faibles peuvent permettre une inactivation notable des protozoaires (Clancy et coll., 1998; Bukhari et coll., 1999; Craik et coll., 2000, 2001; Belosevic et coll., 2001; Drescher et coll., 2001; Linden et coll., 2001, 2002; Shin et coll., 2001; Campbell et Wallis, 2002; Mofidi et coll., 2002; Rochelle et coll., 2002). En se fondant sur ces études et sur d'autres, l'U.S. EPA (2006a) a établi les doses de rayons UV – présentées au Table 8 – nécessaires pour l'inactivation de Giardia lamblia et de Cryptosporidium. Toutefois, au moment de choisir une dose appropriée, il faut envisager la façon dont Giardia lamblia répare les dommages causés par les rayons UV, telle que décrite ci-dessous. On doit également tenir compte des conditions de température minimale, étant donné qu'une basse température peut réduire l'intensité de la lumière « I » et influer sur les seuils de déclenchement des alarmes. Le système devrait être conçu pour ces conditions, faute de quoi il faudra peut-être prévoir une augmentation du temps « T » dans des conditions de température minimale (Oosterveld, 2017). De plus, l'accumulation de dépôts (encrassement) sur les manchons de quartz risque de nuire au processus de désinfection si ces dépôts absorbent le rayonnement qui servirait autrement à l'inactivation des organismes pathogènes (Wait et coll., 2005, 2007; Wait et Blatchley, 2010). Le fer et le calcium sont les principales formes d'encrassement, mais des dépôts d'aluminium, de manganèse et de zinc peuvent également se former (Wait et Blatchley, 2010). Wait et coll. (2005) ont constaté qu'il est impossible de prévoir le potentiel d'encrassement uniquement à la lumière de la teneur en minéraux, car le potentiel d'oxydoréduction a une influence considérable sur le processus d'encrassement. On a notamment signalé un encrassement minimal pour les eaux souterraines non traitées contenant une teneur élevée en fer (0,9 à 6,1 mg/L) et des concentrations de calcium modérées à élevées (91 à 236 mg/L), tandis qu'après la chloration, l'accumulation de dépôts était dix fois plus importante, et le taux d'éclairement énergétique ramené à 0 % en trois jours (Wait et coll., 2005, 2007). Talbot et coll. (2011) ont signalé un encrassement important des manchons de lampe à UV à pression moyenne (PM) non nettoyés pour une source d'approvisionnement en eau lorsque les concentrations en fer et en manganèse étaient respectivement d'environ 200 µg/L et 40 µg/L, tandis que les manchons de lampe à basse pression (BP) non nettoyés ne présentaient pas d'encrassement important. Wait et coll. (2005, 2007) recommandent que l'utilisation des réacteurs à rayons UV précède l'application des mesures d'oxydation (afin que l'encrassement soit réduit au minimum) ou suive l'élimination des particules précipitées. Il faudrait peut-être mener des essais pour évaluer le potentiel d'encrassement. Il est nécessaire d'enlever les dépôts accumulés pour maintenir le rendement élevé du réacteur à rayons UV (Bolton et Cotton, 2008).
Plusieurs chercheurs ont confirmé qu'il n'y a pas à craindre que les dommages causés par les rayons UV soient réparés lorsque les oocystes de Cryptosporidium parvum sont irradiés par des lampes à BP ou à PM, même à de très faibles doses (1 à 3 mJ/cm2) (Shin et coll., 2001; Oguma et coll., 2001; Zimmer et coll., 2003; Rochelle et coll., 2004). Pour les kystes de Giardia lamblia, les chercheurs signalent que l'infectiosité n'est pas restaurée après que le microorganisme ait été exposé à des doses de rayons UV (lampes à BP) de 16 mJ/cm2 et de 40 mJ/cm2, mais que l'activité réparatrice du microorganisme est importante lorsque la dose est de 1 mJ/cm2 (Shin et Linden, 2015). Toutefois, il n'existe aucune donnée sur les doses de rayons UV entre 1 et 16 mJ/cm2 pour les kystes de Giardia. En revanche, aucune réparation n'a été détectée lorsque les kystes de Giardia lamblia ont été exposés à une dose de 1 mJ/cm2 de rayons UV PM (Shin et coll., 2010). De plus, Li et coll. (2008) ont signalé que les trophozoïtes de Giardia lamblia peuvent survivre et éventuellement être réactivités après une exposition à des doses de rayons UV BP atteignant 10 mJ/cm2. À des doses de rayons UV de lampes à BP de 20 mJ/cm2 et de 40 mJ/cm2, la preuve de la survie ou de la réactivation du microorganisme était ambiguë et n'était pas statistiquement concluante. Bien que cette étude ait été menée sur des trophozoïtes plutôt que sur des kystes, cela signifie qu'une dose minimale est nécessaire pour empêcher la réparation des dommages induits aux kystes de Giardia lamblia par les rayons UV. Les exigences relatives aux doses de rayons UV de l'U.S. EPA n'étaient pas fondées sur la possibilité de réparation de Giardia. Cependant, il est probable que des réparations en phase obscure se soient produites au cours des études et qu'elles aient été prises en compte par la force des choses. Il faudrait entreprendre d'autres recherches pour déterminer la dose exacte à laquelle Giardia peut réparer les lésions causées par les rayons UV BP (Linden, 2017). D'ici à ce que d'autres recherches soient menées, il est recommandé de tenir compte de la capacité de Giardia lamblia de réparer les dommages causés par les rayons UV et d'administrer une dose supérieure à 10 mJ/cm2 lorsque des réacteurs à rayons UV LP sont utilisés, comme l'ont signalé Li et coll. (2008). Plusieurs administrations exigent une dose de rayons UV minimale de 40 mJ/cm2 parce qu'elle permet d'obtenir une inactivation de 4 log de nombreux agents pathogènes nocifs, y compris des bactéries, des virus, des kystes et des oocystes (ÖNORM, 2001, 2003; DVGW, 2006a, 2006b, 2006c; ministère de l'Environnement de l'Ontario, 2006; ministère de l'Environnement de la Nouvelle-Écosse, 2012). Il faut communiquer avec l'administration compétente pour confirmer les exigences relatives aux doses.
En pratique, la dose de rayons UV administrée dans les usines de traitement à grande échelle dépend d'un certain nombre de facteurs, dont le profil hydraulique du réacteur, la vitesse de filtration, le facteur de transmission des rayons UV de l'eau, l'intensité des rayons UV, la puissance lumineuse des lampes, l'endroit où les lampes sont placées, l'âge des lampes, les salissures et les cinétiques d'inactivation des microbes (U.S. EPA, 2006c; Bolton et Cotton, 2008). Il est nécessaire d'effectuer des tests de validation visant à déterminer les conditions de fonctionnement dans lesquelles le réacteur produira la dose de rayons UV. Il existe plusieurs approches pour mener les tests de validation des doses de rayons UV, et elles sont abordées dans ÖNORM (2001, 2003), dans DVGW (2006a, 2006b, 2006c) et dans U.S. EPA (2006c). Ces approches sont fondées sur des essais biodosimétriques visant à déterminer l'inactivation logarithmique de microorganismes présentant des défis particuliers, pour un réacteur donné et en combinaison avec des relations fluence-réponse connues. Il faut constamment surveiller le réacteur au moyen de capteurs régulièrement étalonnés pour vérifier qu'il reste dans les limites des conditions validées et qu'il administre la dose requise. Il faut également tenir compte des questions opérationnelles afin que l'efficacité du réacteur ne soit pas compromise (p. ex. mise en marche, panne, encrassement et nettoyage des lampes, entretien des capteurs UV) (U.S. EPA, 2006c).
| Inactivation logarithmique | Dose de rayons UV (mJ/cm2) nécessaire pour l'inactivation | |
|---|---|---|
| Cryptosporidium | Giardia lamblia | |
| 0,5 | 1,6 | 1,5 |
| 1 | 2,5 | 2,1 |
| 1,5 | 3,9 | 3,0 |
| 2 | 5,8 | 5,2 |
| 2,5 | 8,5 | 7,7 |
| 3 | 12 | 11 |
| 3,5 | 15 | 15 |
| 4 | 22 | 22 |
La désinfection par les rayons UV est généralement utilisée après les procédés d'enlèvement des particules, comme la filtration, pour empêcher que les particules en suspension ne protègent les organismes pathogènes. Plusieurs études ont examiné l'effet des particules sur l'efficacité de la désinfection par les rayons UV et la plupart ont conclu que la réaction des microorganismes à la dose de rayons UV n'était pas influencée par des variations de turbidité inférieures à 10 UTN (Christensen et Linden, 2002; Oppenheimer et coll., 2002; Batch et coll., 2004; Mamane-Gravetz et Linden, 2004; Passantino et coll., 2004; Amoah et coll., 2005). Par contre, Mahmud et coll. (2006) ont fait état de taux d'inactivation plus faibles lorsque la coagulation était sous-optimale (turbidité entre 1 et 2 UTN), un phénomène qui a été attribué à l'agrégation ou à l'agglutination des particules, qui a protégé les kystes et les oocystes. De plus, Templeton et coll. (2007) ont constaté que l'inactivation des bactériophages était moins importante pendant les périodes de maturation du filtre et de fin de vie du filtre, lorsque la turbidité était supérieure à 0,3 UTN. Templeton et coll. (2005) ont constaté que les particules organiques qui absorbent les rayons UV (c.-à-d. les substances humifères) protégeaient des UV les bactériophages liés aux particules, contrairement aux particules inorganiques de kaolinton; Templeton et coll. (2005) ont par conséquent conclu que les caractéristiques des particules étaient plus pertinentes que le degré de turbidité. Pour les approvisionnements en eau souterraine dont la teneur en fer est élevée, Templeton et coll. (2006) ont constaté que le précipité d'oxyde de fer dans les échantillons d'eau souterraine oxydés par l'air pouvait interférer avec la désinfection par les rayons UV. Le degré de protection des kystes et des oocystes contre les rayons UV dépend très probablement du type de particules (p. ex. la taille, la structure, la composition chimique), du nombre de grosses particules (p. ex. 25 µm), du degré d'agrégation des kystes et des oocystes avec la matière particulaire et du niveau d'inactivation désiré (Caron et coll., 2007; Hargy et Landry, 2007; Templeton et coll., 2008; Kollu et Örmeci, 2012). Les services publics devraient par conséquent s'efforcer de maintenir des conditions de filtration optimales en amont de la désinfection par les rayons UV (Templeton et coll., 2007).
On s'attend à ce que les rayons UV ne génèrent que peu de SPD (Hijnen et coll., 2006; Bolton et Cotton, 2008). Wang et coll. (2015) ont toutefois fait état de la formation de chlorate et de bromate pour les procédés d'oxydation avancée utilisant les rayons UV et le chlore (UV > 1 000 mJ/cm2; chlore libre = 5 à 10 mg/L), et les rayons UV et le peroxyde d'hydrogène (données non présentées). Selon la documentation scientifique, des nitrites se forment également à partir des nitrates; Sharpless et Linden (2001) ont cependant fait état de la formation de moins de 0,1 mg/L d'azote sous forme de nitrite à partir d'une concentration d'azote des nitrates de 10 mg/L lorsque la dose de rayons UV utilisée atteignait 400 mJ/cm2. Les auteurs ont conclu que la formation de nitrite est peu susceptible de représenter un risque pour la santé pendant la désinfection aux rayons UV à l'aide de lampes à PM. Comme pour les désinfectants chimiques, il faut tenir compte des répercussions éventuelles des SPD lorsque les rayons UV sont utilisés. Il est essentiel, cependant, que les tentatives de réduction de la formation de SPD ne nuisent pas à l'efficacité de la désinfection. Plus de renseignements à ce sujet se trouvent dans les documents techniques de la recommandation sur le chlore et le chlorate, et sur le bromate (Santé Canada, 2008a, 2016).
7.1.3.3 Utilisation de plusieurs désinfectants
Une stratégie faisant appel à au moins deux étapes de désinfection primaire (c.-à-d. la combinaison séquentielle de désinfectants) parvient à inactiver les protozoaires et d'autres microorganismes présents dans l'eau potable. Par exemple, il est possible d'utiliser les rayons UV et le chlore libre de façon complémentaire afin d'inactiver les protozoaires, les virus et les bactéries. Puisque les rayons UV inactivent très efficacement les protozoaires (mais moins les virus) et que le chlore inactive très efficacement les bactéries et les virus (mais moins les protozoaires), la stratégie consistant à utiliser plusieurs désinfectants permet d'utiliser des doses plus faibles de chlore. Cette stratégie réduit donc la formation de SPD. Certaines usines de traitement utilisent de l'ozone pour éliminer les composés engendrant un goût et une odeur à l'eau, puis procèdent à une désinfection au chlore. Pendant cette période, on pourrait considérer que l'ozone et le chlore remplissent l'exigence de désinfection globale, tant que l'on rencontre les exigences pour la valeur CT (voir la section 7.1.3.1).
7.1.4 Réseau de distribution
Pour que le réseau de distribution fournisse de l'eau potable saine, le bon entretien du réseau est une composante essentielle de l'approche à barrières multiples (Fisher et coll., 2000). Howe et coll. (2002) ont indiqué qu'il était encore possible de détecter des oocystes à de faibles concentrations 19 jours après qu'une éclosion de cryptosporidiose a entraîné le remplacement d'une source d'approvisionnement en eau contaminée par une source d'approvisionnment non contaminée. Ils ont supposé que la lente diminution des concentrations d'oocystes après le changement de la source d'approvsionnment en eau était due à la libération d'oocystes présents dans le biofilm à la surface des conduites du réseau de distribution. Aucun autre cas d'infection causé par cette exposition n'a toutefois été signalé. Warnecke (2006) a confirmé que les conduites du réseau de distribution peuvent accumuler et libérer des oocystes pendant une longue période. Des problèmes d'interconnexion et de refoulement ont également été liés à des éclosions (voir la section 5.3.2 et Annexe B).
Puisque les oocystes peuvent se fixer aux biofilms des conduites, s'accumuler dans le réseau de distribution et par la suite se détacher, des mesures de protection des sources d'approvisionnement en eau, l'optimisation du traitement, le maintien de l'intégrité physique et hydraulique du réseau de distribution et la réduction du nombre de phénomènes de pression négative ou de basse pression sont essentiels pour limiter l'entrée des kystes et des oocystes dans le réseau de distribution (Karim et coll., 2003; Friedman et coll., 2004; Fleming et coll., 2006; Angles et coll., 2007).
La qualité de l'eau du réseau de distribution doit être régulièrement surveillée (p. ex. les indicateurs microbiens, le chlore résiduel, la turbidité, le pH), des programmes de fonctionnement et d'entretien doivent être en place (p. ex. nettoyage de la conduite principale, prévention des retours d'eau polluée, gestion des biens) et une hygiène rigoureuse doit être pratiquée pendant les réparations de la conduite principale afin que l'eau potable soit acheminée jusqu'au consommateur sans perdre beaucoup de sa qualité (Kirmeyer et coll., 2001, 2014). L'AWWA (2015) encourage l'utilisation de la surveillance en ligne du chlore résiduel dans le réseau de distribution.
7.2 Traitement à l'échelle résidentielle
Le traitement de l'eau potable dans les installations municipales vise à réduire la présence d'organismes pathogènes ainsi que les risques connexes pour la santé, et à les ramener à un niveau acceptable ou sécuritaire. Par conséquent, l'emploi d'appareils dans les habitations pour traiter l'eau déjà traitée par les installations municipales n'est habituellement pas nécessaire; il s'agit essentiellement d'un choix individuel. Dans les cas où un ménage ou un réseau semi-public tire son eau potable d'un approvisionnement privé, il faut déterminer la qualité microbiologique de la source d'approvisionnment en eau et évaluer à quel point elle pourrait être contaminée. L'eau de surface n'est pas recommandée pour l'approvisionnement privé ou semi-public en eau, à moins qu'elle ne soit correctement filtrée et désinfectée, et que la qualité de l'eau soit surveillée. L'eau des puits peut également être contaminée et peut devoir être traitée. De nombreuses éclosions ont été associées à la consommation d'eau de puits non traitée contaminée par des protozoaires entériques (Wallender et coll., 2014).
Lorsque l'eau potable provient d'un puits privé, il faut évaluer la vulnérabilité de la source à la contamination fécale. Bien qu'il soit difficile pour les propriétaires de puits d'effectuer une évaluation détaillée de la vulnérabilité du puits à la contamination fécale, il est possible de prendre des mesures pour réduire au minimum la probabilité qu'un puits soit contaminé. Les administrations provinciales ou territoriales sont généralement en mesure de fournir des conseils généraux concernant la construction, l'entretien et la protection des puits, ainsi que les tests qu'il est nécessaire d'effectuer. Les propriétaires de puits devraient comprendre la structure du puits et connaître les matériaux présents dans l'aquifère autour du puits ainsi que l'emplacement des sources de contamination fécale (p. ex. fosses septiques, égouts sanitaires et matières fécales d'animaux) par rapport au puits. Les propriétaires peuvent obtenir ces renseignements dans les dossiers reçus pendant la construction du puits et de la fosse septique, ainsi qu'en consultant les bases de données de registres, les cartes de vulnérabilité des aquifères et les évaluations régionales des eaux souterraines, qu'ils peuvent généralement se procurer auprès de leur administration provinciale ou territoriale. S'il n'y a pas suffisamment d'information pour déterminer si un puits est vulnérable à la contamination fécale, le traitement du puits représente une façon de réduire le risque.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispositifs dont la conformité aux normes pertinentes de NSF/ANSI est attestée par un organisme de certification accrédité. Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification garantissent qu'un produit ou un service est conforme aux normes en vigueur. Au Canada, le Conseil canadien des normes (CCN) a accrédité un certain nombre d'organismes qu'il autorise à certifier les dispositifs de traitement de l'eau potable qui satisfont aux normes pertinentes de NSF et de l'ANSI :
- Canadian Standards Association International (www.csa-international.org);
- NSF International (www.nsf.org);
- Water Quality Association (www.wqa.org);
- Underwriters Laboratories Inc. (www.ul.com);
- Bureau de Normalisation du Québec (www.bnq.qc.ca); and
- International Association of Plumbing & Mechanical Officials (www.iapmo.org).
Une liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN (2016).
Les responsables d'approvisionnements privés et semi-publics qui utilisent la filtration peuvent consulter plusieurs normes NSF/ANSI sur l'élimination des protozoaires entériques, notamment la norme 53 (Drinking Water Treatment Units – Health Effects) (NSF/ANSI, 2016a), la norme 58 (Reverse Osmosis Drinking Water Treatment Systems) (NSF/ANSI, 2016b) et la norme 62 (Drinking Water Distillation Systems) (NSF/ANSI, 2016c). Ces normes exigent une réduction d'au moins 3 log pour que l'allégation de réduction des kystes soit certifiée. Les systèmes d'osmose inverse (OI) et de distillation certifiés selon ces normes ne sont censés être installés qu'au point d'utilisation, parce que l'eau traitée par ces systèmes peut être corrosive pour les composantes internes de plomberie. Ces systèmes exigent également de grandes quantités d'influent pour que le volume d'eau potable requis soit obtenu et ne sont habituellement pas pratiques pour une installation au point d'entrée.
À l'heure actuelle, les unités certifiées conformes à la norme NSF/ANSI 53 ne sont généralement pas en mesure d'atteindre la capacité supérieure requise pour certains systèmes semi-publics (de 15 à 800 gallons par minute). Par conséquent, les réseaux d'eau potable nécessitant une plus grande capacité peuvent envisager deux options de traitement : les filtres à ultrafiltration ou les filtres à cartouche.
Les unités d'ultrafiltration qui sont certifiées conformes à la norme NSF/ANSI 419 (Public Drinking Water Equipment Performance – Filtration) (NSF/ANSI, 2015) peuvent permettre l'élimination de plus de 3 log de Cryptosporidium. Ces unités d'ultrafiltration peuvent comprendre des essais d'intégrité directs visant à confirmer que les membranes demeurent intactes pour la réduction logarithmique de Cryptosporidium. Étant donné qu'une rupture de l'intégrité de la membrane peut compromettre la capacité d'élimination des protozoaires, il est important d'effectuer une surveillance régulière de l'intégrité de la membrane. La certification antérieure en vertu du programme ETV de l'EPA des États-Unis peut être acceptable en attendant la transition vers la certification selon la norme NSF/ANSI 419, à condition que le fabricant puisse démontrer que le produit testé dans le cadre de ce programme n'a pas changé. Les propriétaires de système d'approvisionnement en eau devraient demander les résultats de la certification propre au produit lorsqu'ils examinent ces systèmes, et établir des critères de rendement (p. ex. à l'égard de la réduction logarithmique des protozoaires) et des objectifs de qualité de l'eau traitée pour réduire au minimum l'encrassement (p. ex. carbone organique, couleur, fer, manganèse, alcalinité et dureté) et pour veiller à ce que les critères de turbidité soient respectés. Le prétraitement peut s'avérer nécessaire selon la qualité de l'eau de la source.
Les filtres à cartouche qui sont certifiés conformes à la norme NSF/ANSI 419 pour l'élimination de Cryptosporidium (NSF/ANSI, 2015) peuvent également être utilisés à l'égard de systèmes qui nécessitent une capacité plus grande. Une administration peut également choisir d'approuver les filtres à cartouches qui ont fait l'objet d'essais d'efficacité de l'élimination de Cryptosporidium réalisés par un tiers (GLUMRB, 2012). Toutefois, elle devrait également s'assurer que ces filtres sont certifiés conformes à la norme NSF/ANSI 61 (NSF/ANSI, 2016d) relative au contact avec l'eau potable. Les filtres à cartouche sont acceptés comme technologie de rechange aux fins de la conformité avec l'exigence de filtration de la Surface Water Treatment Rule des États-Unis (U.S. EPA, 1991, 2006a). Les filtres à cartouche sont des filtres jetables qu'on utilise jusqu'à ce que la pression différentielle maximale nominale soit atteinte (en général, 30 psi), avant de les remplacer. Il n'y a donc pas de tests d'intégrité directs.
Les systèmes semi-publics et privés qui ont recours à la désinfection utilisent généralement le chlore ou les rayons UV en raison de leur disponibilité et de leur facilité d'utilisation relative. Il est important de remarquer que l'inactivation de Giardia au moyen de chlore libre requiert des concentrations ou des temps de contact relativement élevés et que la chloration n'inactive pas Cryptosporidium. Les appareils de traitement qui satisfont à la norme NSF/ANSI 55 pour les systèmes de désinfection par les rayons ultraviolets (catégorie A) rendent inactifs les microorganismes, dont les bactéries, les virus, les kystes et les oocystes, présents dans l'eau contaminée (NSF/ANSI, 2016e); ils ne sont pas conçus pour le traitement des eaux usées ou des eaux contaminées par les eaux usées brutes et ils doivent être installés dans de l'eau limpide à l'œil nu. Les systèmes de catégorie B ne sont pas conçus pour la désinfection de l'eau microbiologiquement insalubre. Ils ne sont certifiés que pour le traitement bactéricide supplémentaire d'approvisionnements publics en eau potable désinfectée ou d'autres approvisionnements en eau qui ont été analysés et que la compétence responsable considère comme acceptables pour la consommation humaine. Les systèmes de catégorie B ne réduisent que les microorganismes non pathogènes naturellement présents dans l'eau. Lorsqu'un traitement aux rayons UV est appliqué à des systèmes d'approvisionnement en eau dont la dureté ou le contenu minéral sont moyens ou élevés, comme c'est le cas des eaux souterraines, le colmatage et l'encrassement de la surface de la lampe UV constituent un problème courant pour lequel un prétraitement peut s'avérer nécessaire.
Les approvisionnements privés et semi-privés qui utilisent le chlore entre autres désinfectants (voir la section 7.1.3.3) doivent utiliser des produits qui satisfont à la norme NSF/ANSI 60 (Drinking Water Treatment Chimical – Health Effects) (NSF/ANSI , 2017) et doivent, dans le cas de solutions d'hypochlorite, suivre les recommandations relatives à la manutention et à l'entreposage présentées dans le document technique sur le bromate (Santé Canada, 2016).
Un laboratoire agréé doit régulièrement analyser les niveaux d'E. coli et de coliformes totaux dans l'eau à l'entrée et à la sortie du dispositif de traitement, pour vérifier l'efficacité de ce dernier. La capacité d'élimination des dispositifs de traitement diminue avec le temps et l'utilisation, et il faut entretenir ou remplacer ces dispositifs. Les consommateurs doivent vérifier la longévité prévue des composantes de leur dispositif de traitement selon les recommandations du fabricant, et établir un calendrier d'entretien clair. Les dispositifs de traitement doivent être inspectés et entretenus selon le calendrier d'entretien et les recommandations du fabricant.
8.0 Effets sur la santé
Les effets sur la santé de l'exposition à Giardia et à Cryptosporidium, comme ceux attribuables à d'autres organismes pathogènes, dépendent des caractéristiques de l'hôte, de l'agent pathogène et de l'environnement. L'état immunitaire de l'hôte, l'infectiosité des kystes et des oocystes et le degré d'exposition (c.-à-d. le nombre de kystes et d'oocystes ingérés) sont tous des facteurs déterminants de l'infection et de la maladie. L'infection par Giardia ou par Cryptosporidium peut causer à la fois des effets aigus et des effets chroniques sur la santé, lesquels sont décrits dans les sections suivantes.
8.1 Giardia
8.1.1 Infection
En théorie, un seul kyste de Giardia suffit, tout au moins dans certaines circonstances, à causer une infection. Cependant, des études ont montré que la DI50 (la dose requise pour observer une infection pour 50 % des sujets participant au test) est supérieure à un seul kyste et dépend de la virulence de la souche en cause. Des essais d'alimentation réalisés auprès de sujets adultes volontaires portent à croire que la DI50 de Giardia est d'environ 50 kystes (Hibler et coll., 1987), bien que certaines personnes puissent contracter une infection à une dose beaucoup plus faible (Rendtorff, 1978; Stachan et Kunstýr, 1983). Il est possible d'extrapoler la DI50 de Giardia pour les humains à partir des courbes de la relation dose-réponse. Cette façon de procéder permet de déterminer que la DI50 de Giardia pour les humains est d'environ 35 kystes (Rose et Gerba, 1991), un résultat comparable à celui qui est indiqué ci-dessus. Il faut souvent moins de kystes pour que les souches de Giardia qui se sont bien adaptées à leurs hôtes (p. ex. par des passages successifs) infectent ces hôtes (Hibler et coll., 1987). Par exemple, dans le cadre d'une étude menée sur des sujets volontaires, Rendtorff (1978) a montré que la DI50 est de 19 kystes lorsque des kystes de Giardia d'origine humaine sont utilisés.
La période de prépatence (qui s'écoule entre l'ingestion des kystes et l'excrétion de nouveaux kystes) est de 6 à 16 jours pour la giardiase (Rendtorff, 1978; Stachan et Kunstýr, 1983; Nash et coll., 1987), bien que cette période puisse varier selon la souche. Des recherches menées sur des modèles animaux ont montré que de plus petites doses entraînent des périodes de prépatence plus longues, mais que la quantité résultante de parasites ne change pas (Belosevic et Faubert, 1983).
8.1.2 Pathogenèse et réponse immunitaire
Les mécanismes précis par lesquels Giardia provoque la giardiase ne sont pas bien compris, et aucun facteur de virulence particulier n'a été relevé. Certains affirment que Giardia entraîne une irritation mécanique ou une lésion de la muqueuse en s'attachant à la bordure en brosse du tractus intestinal. D'autres ont avancé que la diarrhée est le résultat de l'attachement des kystes de Giardia à l'épithélium intestinal, qui entraîne une repopulation dans cette région par des entérocytes relativement immatures présentant une capacité d'absorption réduite.
La relation hôte-parasite est complexe et il a été établi que l'expression des antigènes varie chez Giardia (Nash, 1994), de sorte qu'il est peu probable que l'immunité soit permanente et universelle. La réponse immunitaire humorale se traduit par une augmentation des taux d'anticorps circulants (immunoglobuline G [IgG] et immunoglobuline M [IgM]) et la sécrétion d'anticorps (immunoglobuline A [IgA]) dans le lait, dans la salive et peut-être dans le mucus intestinal. Ces anticorps combattent peut-être la maladie (Heyworth, 1988), mais la durabilité de cette immunité n'a pas été prouvée. On sait très peu de choses sur l'immunité cellulaire, mais une destruction spontanée de trophozoïtes par les monocytes du sang périphérique humain a été décrite (denHollander et coll., 1988).
8.1.3 Symptômes et traitement
D'ordinaire, Giardia est un microorganisme non invasif qui cause des infections asymptomatiques. Selon des données recueillies aux États-Unis, 40 % des personnes infectées par Giardia contractent une maladie symptomatique (Nash et coll., 1987). La giardiase symptomatique peut se manifester par des nausées, une anorexie, une sensation de gêne dans la partie supérieure de l'intestin, des malaises et, parfois, une légère fièvre ou des frissons. L'apparition de la diarrhée est généralement soudaine et explosive, avec des selles pâles, aqueuses, graisseuses et nauséabondes (Wolfe, 1984; MSSS, 2015). La phase aiguë de l'infection prend souvent fin de façon spontanée; les organismes disparaissent généralement des fèces. L'assemblage A a été associé à une diarrhée légère et intermittente, tandis que l'assemblage B a été lié à une diarrhée grave, aiguë ou persistante (Homan et Mank, 2001; Read et coll., 2002). L'infection par Giardia peut également mener à une déficience en lactase (c.-à-d. à une intolérance au lactose) et au syndrome de malabsorption; des recherches récentes donnent à penser qu'elle pourrait de plus mener au syndrome du côlon irritable ou au syndrome de fatigue chronique pour certaines personnes (Cotton et coll., 2011; Wensaas et coll., 2012; Hanvik et coll., 2014). Certains patients deviennent des porteurs asymptomatiques de kystes pendant un certain temps et ne présentent plus de signes cliniques. D'autres, particulièrement les enfants, souffrent d'accès récurrents de la maladie qui peuvent persister pendant des mois, voire des années (Lengerich et coll., 1994). Selon les estimations, 4 600 personnes sont hospitalisées chaque année aux États-Unis en raison d'une giardiase grave, un taux similaire à celui de la shigellose (Lengerich et coll., 1994). La durée médiane des séjours à l'hôpital est de quatre jours.
La giardiase peut être traitée par plusieurs médicaments, comme le métronidazole, la quinacrine, la furazolidone, le tinidazole, l'ornidazole, le nitazoxanide et le nimorazole. Olson et coll. (1994) ont montré qu'il est possible de mettre au point un vaccin, mais que les infections et les symptômes ne seraient qu'atténués et que l'infection ne peut être prévenue pour le moment.
8.2 Cryptosporidium
8.2.1 Infection
Des essais d'alimentation réalisés sur des sujets volontaires immunocompétents ont fourni des données sur la relation dose-réponse pour Cryptosporidium. Comme c'est le cas pour Giardiaet d'autres agents pathogènes, un seul microorganisme peut provoquer une infection, mais les études n'ont confirmé que des infections causées par plus d'un microorganisme (DuPont et coll., 1995; Okhuysen et coll., 1998, 2002; Chappell et coll., 1999, 2006). Des études portent à croire que la DI50 de Cryptosporidium se situe entre 9 et 2066 oocystes (DuPont et coll., 1995; Okhuysen et coll., 1998, 1999, 2002; Chappell et coll., 1999, 2006; Messner et coll., 2001), ce qui signifie que les isolats de Cryptosporidium peuvent différer considérablement quant à leur pouvoir infectant et à leur capacité à provoquer une cryptosporidiose symptomatique. Ainsi, l'isolat TAMU de C. parvum (isolé à l'origine chez un poulain) avait une DI50 de 9 oocystes et un taux d'atteinte morbide de 86 %, tandis que l'isolat UCP de C. parvum (isolé chez un veau) avait une DI50 de 1 042 oocystes et un taux d'atteinte morbide de 59 % (Okhuysen et coll., 1999). Par contre, les isolats Iowa et Moredun de C. parvum avaient respectivement une DI50 de 132 oocystes et d'environ 300 oocystes, tandis que leurs taux d'atteinte morbide étaient semblables (c.-à-d. 55 % à 65 %) (DuPont et coll., 1995; Okhuysen et coll., 2002). D'après une méta-analyse de ces essais d'alimentation, la DI50 des isolats a été estimée à 12,1 oocystes pour TAMU, à 2066 oocystes pour UCP et à 132 oocystes pour Iowa (Messner et coll., 2001). L'origine génétique de ces différences n'est pas connue, bien que plusieurs facteurs de virulence aient été découverts (Okhuysen et Chappell, 2002). Une autre méta-analyse de données d'études menées sur des humains et portant sur les isolats TAMU, UCP et Iowa a estimé que la probabilité d'infection à la suite de l'ingestion d'un seul oocyste infectieux se situait entre 4 % et 16 % (U.S. EPA, 2006a). Cette estimation est confirmée par des données sur des éclosions, y compris des observations faites durant l'éclosion survenue en 1993 à Milwaukee (Gupta et Haas, 2004). Une nouvelle analyse récente des données disponibles sur la relation dose-réponse donne à penser que Cryptosporidium pourrait être plus infectieux qu'on ne le croyait précédemment (Messner et Berger, 2016), mais une étude plus approfondie s'impose.
La période de prépatence est de 4 à 9 jours pour la cryptosporidiose (Ma et coll., 1985; DuPont et coll., 1995; Okhuysen et coll., 1999, 2002), mais la période peut varier selon l'isolat.
8.2.2 Pathogenèse et réponse immunitaire
Les infections de Cryptosporidium spp. dans l'intestin humain provoquent au moins des lésions muqueuses transitoires, notamment une atrophie villositaire et un allongement de la crypte (Tzipori, 1983). Cependant, les mécanismes moléculaires par lesquels Cryptosporidium provoque ces lésions ne sont pas connus. On croit que plusieurs molécules (notamment les glycoprotéines, les lectines et d'autres complexes protéiques, les antigènes et les ligands) exercent une influence sur la mobilité des oocystes, leur attachement aux cellules hôtes et l'invasion de celles-ci (Okhuysen et Chappell, 2002; Tzipori et Ward, 2002). La plupart des données pathologiques disponibles proviennent de patients atteints du SIDA, et l'évaluation des lésions imputables à Cryptosporidium a été compliquée par la présence d'autres organismes pathogènes opportunistes.
Le principal mécanisme de défense de l'hôte semble être l'immunité cellulaire (McDonald et coll., 2000; Lean et coll., 2002; Riggs, 2002), bien que l'immunité humorale est connue pour jouer également un rôle (Riggs, 2002; Okhuysen et coll., 2004; Priest et coll., 2006). Des études de modèles animaux ont démontré l'importance des lymphocytes T auxiliaires (CD4+), de l'interféron gamma (IFN-γ) et de l'interleukine 12 (IL-12) dans le processus de guérison de la cryptosporidiose (Riggs, 2002). Des réponses anticorps dirigées contre certaines glycoprotéines qui participent à l'attachement du parasite Cryptosporidium ont également été mises en évidence (Riggs, 2002).
On ne sait pas avec certitude si une exposition à Cryptosporidium offre une protection contre la maladie ou les infections subséquentes. Okhuysen et coll. (1998) ont signalé qu'une première exposition à Cryptosporidium ne protège pas contre les accès futurs de cryptosporidiose. Bien que les taux de diarrhée aient été similaires après chaque exposition, la diarrhée était moins grave après une nouvelle exposition. Selon Chappell et coll. (1999), les sujets volontaires qui étaient porteurs d'anticorps préexistants contre C. parvum (ce qui donne à penser qu'ils avaient déjà été infectés) présentaient une plus grande résistance à l'infection que ceux qui n'étaient pas porteurs de ces anticorps, comme l'a montré une augmentation importante de la DI50 pour ces sujets. Cependant, contrairement aux observations précédentes (Okhuysen et coll., 1998), la gravité de la diarrhée (définie par le nombre d'épisodes et la durée de la maladie) était plus importante pour les sujets soupçonnés d'avoir déjà été infectés.
8.2.3 Symptômes et traitement
Les personnes infectées par Cryptosporidium risquent davantage d'être atteintes d'une maladie symptomatique que celles infectées par Giardia (Macler et Regli, 1993; Okhuysen et coll., 1998, 1999). Le symptôme le plus fréquemment associé à la cryptosporidiose est la diarrhée, qui est caractérisée par des selles très aqueuses et non sanguinolentes. Le volume de diarrhée peut être très important. Pour des hôtes immunocompétents, un volume de 3 L/j est courant; le volume peut atteindre 17 L/j pour des patients immunodéprimés (Navin et Juranek, 1984). Ce symptôme peut s'accompagner de crampes, de nausées, de vomissements (particulièrement chez les enfants), d'une légère fièvre (moins de 39 °C), d'une anorexie et d'une déshydratation. Des cas de cryptosporidiose touchant d'autres organes que l'intestin (c.-à-d. les poumons, l'oreille moyenne, le pancréas, etc.), voire de décès, ont été signalés, surtout chez les personnes atteintes du sida, mais sont considérés comme rares (Farthing, 2000; Mercado et coll., 2007).
La durée de l'infection dépend de l'état du système immunitaire (Juranek, 1995) et peut être répartie en trois catégories : 1) les personnes immunocompétentes, qui se débarrassent de l'infection en 7 à 14 jours; 2) les personnes atteintes du sida ou dont le système immunitaire est fortement affaibli (p. ex. les personnes présentant une numération de cellules CD4 < 180 cellules/mm3) et qui, dans la plupart des cas signalés, ne se débarrassent jamais complètement de l'infection (qui peut se transformer en infection caractérisée par de longues périodes de rémission suivies de symptômes légers); 3) les personnes immunodéprimées par suite d'une chimiothérapie, d'une dépression ou d'une maladie de courte durée (p. ex. la varicelle) ou d'une malnutrition. Dans les cas où l'immunodépression n'est pas liée au sida, l'infection disparaît généralement (aucune excrétion d'oocystes et disparition des symptômes) dans les 10 à 15 jours suivant l'apparition des symptômes. Des cas où l'infection a persisté pendant 30 jours chez des enfants ont toutefois été signalés. La sensibilité du diagnostic de la cryptosporidiose par l'examen des selles est faible — si faible que des personnes qui excrètent des oocystes peuvent être prématurément classées parmi les cas négatifs. L'utilisation d'outils de diagnostic plus sensibles et plus rapides, tels les essais immunochromatographiques à flux latéral, permettra de réduire le nombre de résultats faussement négatifs (Cacciò et Pozio, 2006). Les sujets immunocompétents sont généralement porteurs de l'infection pendant 30 jours maximum. À l'exception des personnes atteintes du sida, les sujets peuvent continuer à éliminer des oocystes pendant 24 jours. Durant une éclosion survenue dans une garderie, des enfants ont éliminé des oocystes pendant une période allant jusqu'à cinq semaines (Stehr-Green et coll., 1987). On pense que le taux déclaré d'infection asymptomatique est faible, mais un rapport sur une éclosion survenue dans une garderie à Philadelphie, en Pennsylvanie, a conclu que jusqu'à 11 % des enfants n'avaient présenté aucun symptôme (Alpert et coll.1986). Ungar (1994) a examiné trois études différentes, menées dans des garderies où le taux d'infection asymptomatique variait entre 67 % et 100 %. Une hypothèse a été formulée, selon laquelle un grand nombre de ces cas asymptomatiques étaient des cas bénins qui avaient été incorrectement diagnostiqués (Navin et Juranek, 1984).
Le nitazoxanide est le seul médicament homologué pour le traitement de la cryptosporidiose des enfants et des adultes (Fox et Saravolatz, 2005), bien que plus de 200 médicaments aient été mis à l'essai in vitro et in vivo (Tzipori, 1983; O'Donoghue, 1995; Armson et coll., 2003; Cacciò et Pozio, 2006). Ce qui peut s'expliquer, en partie, par le fait que la plupart des inhibiteurs ciblent les voies biochimiques dans l'apicoplaste (organite dérivé du plaste) (Wiesner et Seeber, 2005), une structure absente chez C. parvum (Abrahamsen et coll., 2004) et C. hominis (Xu et coll., 2004). La recherche pharmaceutique doit par conséquent trouver de nouvelles cibles, notamment des composés qui ciblent le métabolisme énergétique et la synthèse des lipides. Il est très coûteux de trouver de nouvelles cibles médicamenteuses, si bien que d'autres travaux examinent si des médicaments actuellement homologués sur le marché ont des propriétés anti-cryptosporidiennes (Ryan et Hijjawi, 2015).
La séquence complète du génome de plusieurs espèces de Cryptosporidium est disponible (Ryan et Hijjawi, 2015); ces séquences sont actuellement utilisées pour établir quels sont les déterminants de la virulence et les mécanismes de la pathogenèse, une connaissance qui facilitera la mise au point d'antimicrobiens (Umejiego et coll., 2004), de vaccins (Wyatt et coll., 2005; Boulter-Bitzer et coll., 2007) et d'immunothérapies (Crabb, 1998; Enriquez et Riggs, 1998; Schaefer et coll., 2000; Takashima et coll., 2003) contre Cryptosporidium.
9.0 Évaluation des risques
L'évaluation quantitative du risque microbien (ÉQRM) est un procédé qui utilise la modélisation mathématique, des données sur la qualité de la source d'approvisionnement en eau, des renseignements sur les barrières de traitement et les caractéristiques de l'agent pathogène pour estimer la charge de morbidité liée à une exposition à des microorganismes particuliers dans une source d'approvisionnenent en eau potable. L'ÉQRM peut être utilisée de deux façons, soit pour la gestion d'un système d'eau potable dans le cadre d'une approche de la source au robinet ou, comme c'est le cas pour le présent document, pour appuyer l'élaboration de recommandations sur la qualité de l'eau potable.
D'autres renseignements et recommandations sur l'utilisation de l'ÉQRM dans le cadre d'une approche de la source au robinet sont publiés ailleurs (OMS, 2016; Santé Canada, 2018). Le présent document technique n'aborde que l'utilisation de l'ÉQRM pour l'élaboration d'une recommandation sur la qualité de l'eau potable pour les protozoaires entériques.
9.1 Objectifs basés sur la santé
Les objectifs basés sur la santé sont les buts que l'on doit atteindre pour garantir la salubrité de l'eau potable. Au Canada, on tente souvent de réduire les dangers microbiologiques en cherchant à répondre à deux types d'objectifs : les objectifs de qualité de l'eau et les objectifs de traitement basés sur la santé. La recommandation bactériologique concernant E. coli constitue un exemple d'objectif de qualité de l'eau; elle établit une concentration maximale acceptable pour ce microorganisme dans l'eau potable (Santé Canada, 2012b). Les objectifs de traitement basés sur la santé précisent à quelle réduction des organismes pathogènes il faut parvenir à l'aide de mesures comme les procédés de traitement (voir la section 7.0). Les objectifs de traitement aident à choisir les procédés de traitement et devraient être définis en fonction de la qualité des sources d'approvisionnement en eau (voir la section 9.3.2). En raison du large éventail de microorganismes pathogènes, il est difficile d'évaluer tous les risques potentiels; les objectifs de traitement sont donc généralement définis en fonction des catégories de microorganismes (p. ex. bactéries, virus, protozoaires) plutôt que d'organismes pathogènes en particulier. Pour Giardia et Cryptosporidium, l'objectif de traitement basé sur la santé est une élimination ou une inactivation d'au moins 3 log des kystes et des oocystes. Dans le cas des eaux de surface, il faudrait peut-être parvenir à une élimination ou à une inactivation logarithmique plus grande pour que le niveau de risque demeure acceptable.
9.2 Niveau de risque de référence
Le niveau de risque de référence est la charge de morbidité rattachée à l'eau potable qui est estimée tolérable ou acceptable. Cette valeur sert à fixer les objectifs de traitement basés sur la santé.
Les niveaux de risque sont exprimés de plusieurs façons. Les Directives de qualité pour l'eau de boisson de l'OMS (OMS, 2017) utilisent les années de vie corrigées de l'incapacité (AVCI) comme unité de mesure du risque. Les AVCI permettent d'obtenir une valeur tenant compte du risque de maladie ou de blessure, et de la répercussion des effets connexes sur la santé (Murray et Lopez, 1996a; Havelaar et Melse, 2003). Les directives de l'OMS (2017) adoptent une valeur de 10−6 AVCI par personne par année comme niveau de risque de référence. Le document National Guidelines for Water Recycling (NRMMC-EPHC, 2006), de l'Australie, mentionne la même valeur. Par contre, d'autres organismes établissent des niveaux de risque microbien acceptables en s'appuyant sur le risque d'infection, sans tenir compte de la probabilité ou de la gravité des effets connexes sur la santé. Par exemple, les États-Unis (U.S. EPA) et les Pays-Bas utilisent un objectif en matière de santé correspondant à un risque d'infection annuel inférieur à 1/10 000 personnes (10-4) (Regli et coll., 1991; VROM, 2005).
L'évaluation des risques effectuée dans le présent document technique estime la charge de morbidité à l'aide des AVCI. L'utilisation des AVCI offre plusieurs avantages. En effet, elles prennent en compte à la fois le nombre d'années perdues en raison d'un décès, ainsi que le nombre d'années vécues avec une incapacité (par comparaison à l'individu moyen en bonne santé dans la région), et permettent de déterminer les répercussions sur la santé d'un seul type d'agent pathogène. L'utilisation des AVCI permet également de comparer les effets sur la santé de divers organismes pathogènes et, peut-être, de différents dangers microbiologiques et de certains dangers chimiques. Bien qu'aucune unité de mesure commune de la santé n'ait été acceptée à l'échelle internationale, les AVCI sont utilisées par de nombreux groupes, et l'on dispose de données publiées et évaluées par des pairs. Dans la présente évaluation des risques, le niveau de référence de l'OMS (2017), soit 10−6 AVCI par personne par année, est retenu comme niveau de risque acceptable.
9.3 Évaluation quantitative du risque microbien
Le but de ce document est d'appuyer l'élaboration d'un objectif de traitement basé sur la santé pour les protozoaires entériques dans l'eau potable. L'ÉQRM est un outil important pour établir de tels objectifs. L'ÉQRM suit une stratégie courante en évaluation du risque, qui comporte quatre volets : l'identification des dangers, l'évaluation de l'exposition, l'évaluation de la relation dose-réponse et la caractérisation des risques. Dans ce cas-ci, le risque est déjà caractérisé par un niveau de référence de 10-6 AVCI par personne par année. Cette évaluation des risques examine la performance de traitement nécessaire pour abaisser la concentration de protozoaires entériques dans l'eau à la source à un niveau qui permet d'atteindre le résultat sur la santé, compte tenu d'une qualité donnée de la source d'eau, de conditions d'exposition établies et des renseignements précis sur la dose-réponse.
9.3.1 Identification des dangers
Au Canada, les protozoaires entériques les plus préoccupants pour la santé humaine dans les sources d'eau potable sont Giardia et Cryptosporidium. D'autres protozoaires entériques, comme Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis, peuvent également être présents dans l'eau, mais ce ne sont pas les protozoaires entériques les plus préoccupants (voir Annenxe A). Bien que tous les protozoaires entériques qui peuvent nuire à la santé humaine soient identifiés, les évaluations des risques tiennent rarement compte de chacun d'eux. Elles ne portent au contraire que sur des protozoaires entériques précis qui, en raison de leurs caractéristiques, sont représentatifs de tous les protozoaires pathogènes similaires. On présume que si le traitement est efficace contre le protozoaire de référence, il le sera contre tous les protozoaires préoccupants similaires. Idéalement, le protozoaire de référence est celui du pire scénario : il fait preuve à la fois d'une grande fréquence, d'une concentration élevée et d'une longue période de survie dans la source d'eau, il est mal éliminé ou inactivé au cours du traitement, et il possède un pouvoir pathogène élevé pour tous les groupes d'âge. Giardia et Cryptosporidium ont été choisis comme protozoaires de référence pour la présente évaluation des risques. Ces organismes peuvent provoquer des maladies graves chez les sujets immunocompétents et les sujets immunodéprimés. La cryptosporidiose est une maladie plus grave, car elle peut être mortelle, particulièrement pour les sujets immunodéprimés, et peut provoquer des lésions extra-intestinales (p. ex. lésions pulmonaires ou pancréatiques). Giardia et Cryptosporidium ont des taux de prévalence élevés, peuvent provoquer des maladies largement répandues, résistent à la désinfection au chlore et il existe des modèles publiés dose-réponse à leur sujet. On présume que, si la charge de morbidité de Giardia et de Cryptosporidium est ramenée à un niveau tolérable, le risque que représentent les autres protozoaires entériques le sera également.
9.3.2 Évaluation de l'exposition
L'exposition correspond à la dose quotidienne d'agents pathogènes ingérée par un consommateur. La consommation d'eau potable est la principale voie d'exposition qui ait été prise en compte dans la présente évaluation des risques. Pour évaluer l'exposition, il faut connaître ou estimer la concentration de Giardia ou de Cryptosporidium dans l'eau potable ainsi que le volume d'eau ingéré.
9.3.2.1 Estimation des concentrations dans les sources d'eau
Le processus d'ÉQRM a été utilisé en sens inverse afin de guider l'élaboration d'objectifs de traitement basés sur la santé. On a utilisé le processus d'ÉQRM pour répondre à la question suivante : quelles sont les concentrations de Giardia et de Cryptosporidium dans la source d'approvisonnment en eau qui seraient associées à un niveau de risque de référence de 10-6 AVCI par personne par année, compte tenu d'un volume moyen d'eau ingéré (voir la section 9.3.2.3) et des diminutions par le traitement relevées pour le système d'eau potable (voir la section 9.3.2.2)? Les résultats obtenus sont censés représenter les concentrations moyennes de ces protozoaires entériques dans l'eau à la source. On tient également pour acquis que les concentrations sont corrigées en fonction des taux de récupération de la méthode et que tous les protozoaires entériques décelés sont capables d'infecter des êtres humains.
Il a été démontré que des concentrations moyennes sont appropriées pour quantifier des objectifs de traitement pour l'exposition par l'eau potable (Petterson et coll., 2015). Lorsque l'on détermine les concentrations moyennes dans la source d'approvisionnement en eau, il faut se demander si la présence des protozoaires est continue ou intermittente, s'il existe des fluctuations saisonnières et quelles sont les répercussions des phénomènes rares, comme les sécheresses ou les inondations, sur les concentrations. Les pics à court terme des concentrations de Giardia ou de Cryptosporidium peuvent augmenter considérablement les risques de maladie et même occasionner des éclosions de maladies d'origine hydrique. Les programmes de surveillance doivent donc tenir compte de ces facteurs pour saisir la variabilité qui se produit dans la source d'approvisonnment en eau (Dechesne et Soyeux, 2007). Selon le projet MicroRisk, il faut procéder à un échantillonnage mensuel pendant un an pour établir les niveaux de référence, puis caractériser au moins deux phénomènes complets afin de comprendre les conditions des pics de concentration (Medema et coll., 2006). Il convient également de noter que, dans le cas des sources fluviales recevant un volume élevé d'effluents d'usines de traitement des eaux usées, les épisodes de pics de contamination peuvent survenir dans des conditions de faible débit (Deschesne et Soyeux, 2007). Aux États-Unis, l'U.S. EPA exige également des échantillonnages mensuels pour évaluer la concentration de Cryptosporidium, pour une période de deux ans (ou bien des échantillonnages plus fréquents pendant un an), afin d'établir les besoins en traitement d'un système d'eau potable (U.S. EPA, 2006a). Outre la surveillance, l'analyse d'incertitude doit également être utilisée pour faciliter l'évaluation des concentrations estimées dans les sources d'eau (Petterson et coll., 2015). D'autres renseignements sur la manière de surveiller ou d'estimer les concentrations d'agents pathogènes dans l'eau à la source se trouvent dans Santé Canada (2018). Les autres facteurs qui doivent être pris en compte au moment de déterminer les concentrations dans les sources d'eau, s'ils sont disponibles, sont le taux de récupération des méthodes de détection de Giardia et de Cryptosporidium, qui est bien inférieur à 100 %, et le danger éventuel que les kystes et les oocystes découverts représentent pour la santé humaine. Comme il a été mentionné précédemment, les taux de récupération devraient être déterminés systématiquement avec la surveillance des kystes et des oocystes. Toutefois, la plupart des services publics ne pourront déterminer si les kystes ou les oocystes présents représentent un danger pour la santé humaine, sauf si une analyse plus poussée est effectuée (p. ex. des études de génotypage). À défaut d'une telle analyse, tous les kystes et oocystes devraient être considérés comme potentiellement infectieux pour les humains.
9.3.2.2 Diminutions par le traitement
Dans cette évaluation des risques, on a examiné plusieurs combinaisons de réduction logarithmique obtenues par différents procédés de traitement à plusieurs concentrations de Giardia et de Cryptosporidium dans l'eau à la source, et on les a comparées à un critère de risque défini. Il est important de noter que de nombreux facteurs peuvent influer sur le traitement (voir la section 7.0). On présume que tout kyste de Giardia ou tout oocyste de Cryptosporidium qui n'a pas été éliminé ou inactivé pendant le traitement est encore capable de causer une infection et une maladie.
9.3.2.3 Volume d'eau ingéré
Pour estimer le volume d'eau ingéré, il ne faut prendre en compte que l'eau du robinet non bouillie, puisque l'ébullition entraîne l'inactivation des agents pathogènes; si l'eau bouillie est prise en compte, l'exposition sera surestimée. (Gale, 1996; Payment et coll., 1997; OMS, 2017). Au Canada, chaque personne consomme en moyenne environ 1 L d'eau du robinet non bouillie par jour (Statistique Canada, 2004; Statistique Canada, 2008). Dans la présente évaluation des risques, une consommation moyenne de 1 L d'eau par personne et par jour est par conséquent utilisée pour estimer les risques entourant l'exposition aux organismes pathogènes. Cette estimation est comparable aux habitudes de consommation observées dans d'autres pays développés (Westrell et coll., 2006; Mons et coll., 2007). Dans ses Directives de qualité pour l'eau de boisson, l'OMS recommande également d'estimer à 1 L le volume d'eau du robinet non bouillie ingéré (OMS, 2017). La concentration des microorganismes dans l'eau potable traitée et le volume d'eau ingéré peuvent ainsi être utilisés pour déterminer l'exposition, c.-à-d. la dose de kystes et d'oocystes que chaque personne consomme chaque jour.
9.3.3 Évaluation de la relation dose-réponse
L'évaluation de la relation dose-réponse utilise des modèles dose-réponse pour estimer la probabilité d'infection (Pinfection) et le risque de maladie après une exposition aux kystes et aux oocystes. Comme on le fait dans la présente évaluation, on peut également utiliser cette relation dose-réponse pour estimer la concentration de Giardia ou de Cryptosporidium associée à un niveau de risque précis dans des conditions définies. Le modèle exponentiel permet d'expliquer plus clairement les données de la relation dose-réponse pour Giardia et pour Cryptosporidium (Haas et coll., 1999) :
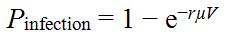
Équivalent textuel : Équation 1
La probabilité d'infection à une certaine dose estimative par jour est calculée en soustrayant de 1 le résultat de ce qui suit : le logarithme de base naturel (e), à la puissance de la valeur négative du produit de la fraction d'organismes ingérés qui survivent pour provoquer l'infection (r), le nombre d'organismes par litre dans le volume consommé (µ) et le volume unique de liquide consommé (V).
Le modèle exponentiel fournit une description mathématique de la distribution des probabilités individuelles de tout microorganisme de survivre et de provoquer une infection, V étant le volume unique de liquide consommé, µ, le nombre d'organismes par litre dans le volume ingéré et r, la fraction des organismes ingérés qui survit pour provoquer l'infection. Dans la présente évaluation, r = 0,0199 pour Giardia (Rose et Gerba, 1991) et r = 0,018 pour Cryptosporidium (Messner et coll., 2001). Le paramètre r est tiré d'études de la relation dose-réponse menées auprès de sujets en bonne santé; il se peut donc qu'il ne représente pas de façon adéquate les effets sur des sous-groupes sensibles, comme les personnes immunodéprimées, les jeunes enfants et les personnes âgées. Bien que le modèle exponentiel ait été choisi pour la présente évaluation des risques, le modèle dose-réponse bêta-Poisson est également utilisé (Petterson et coll., 2006; Schijven et coll., 2011).
La dose quotidienne de microorganismes qu'ingère une personne est estimée au moyen des renseignements provenant de l'évaluation de l'exposition (voir la section 9.3.2). La probabilité annuelle d'infection d'une personne est estimée à l'aide de l'équation (2) ci-après. Pour la présente évaluation des risques, on présume qu'il n'y a aucune propagation secondaire de l'infection.
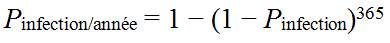
Équivalent textuel : Équation 2
La probabilité d'infection par année est calculée en soustrayant de 1 le résultat de ce qui suit : 1, moins la probabilité d'infection (de l'équation 1), élevé à la puissance 365.
Ce ne sont pas toutes les personnes infectées qui contracteront une maladie symptomatique. Le risque de maladie par an pour une personne est estimé au moyen de l'équation (3) :
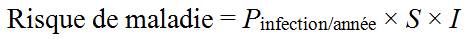
Équivalent textuel : Équation 3
Le risque de maladie est calculé en multipliant la probabilité d'infection par année (de l'équation 2) par la proportion de la population susceptible à l'infection (S) (0,70 pour Cryptosporidium et 0,4 for Giardia) et par la proportion de personnes présentant des symptômes de la maladie après avoir été infectées (I) (1 pour Cryptosporidium et Giardia).
où :
- Pinfection/année
- = probabilité d'infection obtenue par le modèle exponentiel
- S
- = proportion de la population susceptible de contracter l'infection
- I
- = proportion des personnes qui présentent une maladie symptomatique après l'infection
L'évaluation des risques est fondée sur des valeurs I de 0,4 pour Giardia (Nash et coll., 1987) et de 0,7 pour Cryptosporidium (Okhuysen et coll., 1998). La valeur S est présumée égale à 1.
L'évaluation utilise les AVCI comme unité de mesure commune du risque pour convertir le risque annuel de maladie pour une personne, en charge de morbidité par personne. Le principal avantage cité des AVCI comme unité de mesure de la santé publique est son caractère global, qui combine les années de vie perdues (AVP) aux années vécues avec une incapacité (AVI) pour calculer la charge de morbidité. Le calcul des AVCI s'effectue comme suit :
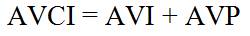
Équivalent textuel : Équation 4
Le coefficient de pondération correspondant à la gravité de l'infection à Cryptosporidium et Giardia en années de vie corrigées de l'incapacité par cas est calculé en multipliant le nombre d'années vécues avec une incapacité par le nombre d'années de vie perdues. Le nombre d'années vécues avec une incapacité correspond à la somme de la fraction de l'effet multiplié par la durée et par le coefficient de pondération correspondant à la gravité pour chacun des effets sur la santé contribuant à la morbidité. Le nombre d'années de vie perdues est calculé en soustrayant l'âge au moment du décès de l'espérance de vie, puis en multipliant le résultat par le coefficient de pondération correspondant à la gravité.
où :
- AVI
- = somme de [(fraction de l'effet) × (durée) × (poids de la gravité)] pour chaque effet sur la santé jouant un rôle dans la morbidité
- AVP
- = [(espérance de vie) − (âge au moment du décès)] × poids de la gravité
Pour Giardia et Cryptosporidium, la gravité des effets sur la santé varie, allant d'une diarrhée légère à une diarrhée grave, voire un décès. Il est important de remarquer que, puisqu'aucune donnée sur le taux de mortalité dû à Giardia n'a été publiée, on présume, dans la présente évaluation des risques, que le risque de décès lié à Giardia est le même que celui imputé à Cryptosporidium. La charge de morbidité que représente la gastro-entérite survenant à la suite d'une infection par Giardia ou par Cryptosporidium dans l'eau potable est de 1,67 AVCI/1 000 cas (1,67 × 10−3 AVCI/cas) (tableau 9).
| AVCI | Effet sur la santé | Proportion de la population touchéeNote de bas de tableau 9 - a | Durée de la maladieNote de bas de tableau 9 - b | Poids de la gravitéNote de bas de tableau 9 - c | AVCI/cas |
|---|---|---|---|---|---|
| Morbidity (AVI) | Diarrhée légère | 0,99999 | 0,01918 an (7 jours) | 0,067 | 1,29 × 10−3 |
| Mortalité (AVP) | Décès | 0,00001 | Espérance de vieNote de bas de tableau 9 - d; âge au moment du décès age at deathNote de bas de tableau 9 - e | 1 | 3,90 × 10−4 |
| Charge de morbidité | 1,67 × 10−3 | ||||
Notes de bas de tableau 9
- Note de bas de tableau 9 - a
-
Macler et Regli (1993)
- Note de bas de tableau 9 - b
-
Havelaar et Melse (2003)
- Note de bas de tableau 9 - c
-
Murray et Lopez (1996b)
- Note de bas de tableau 9 - d
-
Espérance de vie de la population canadienne = 80,88 ans (Statistique Canada, 2012)
- Note de bas de tableau 9 - e
-
L'âge au moment du décès représente l'âge pondéré moyen de la population (on présume que le taux de létalité est le même, quel que soit l'âge) = 38,98
Au moyen de cette charge de morbidité (AVCI/cas) et du risque annuel de maladie pour une personne, la charge de morbidité en AVCI par personne par année peut être estimée comme suit :

Équivalent textuel : Équation 5
La charge de morbidité en années de vie corrigées de l'incapacité par personne par année est calculé en multipliant le risque de maladie (de l'équation 3) par le coefficient de pondération correspondant à la gravité en années de vie corrigées de l'incapacité par cas (1,67 x 10-3).
où :
- Risque de maladie = valeur calculée au moyen de l'équation (3)
- Charge de morbidité (AVCI/cas) = 1,67 × 10−3
Comme indiqué précédemment, puisque la charge de morbidité est établie comme étant égale au niveau de risque de référence, les calculs des AVCI sont utilisés pour convertir le niveau de risque de référence en valeurs pour les modèles dose-réponse pour Giardia et pour Cryptosporidium.
9.3.4 Caractérisation des risques
Dans cette évaluation des risques, l'étape de caractérisation des risques est utilisée pour établir un objectif minimal de traitement basé sur la santé permettant d'atteindre le niveau de risque de référence.
Comme l'illustrent les figures 1 et 2, à mesure que la concentration de kystes et d'oocystes augmente dans l'eau à la source, la réduction logarithmique doit être plus importante pour que le traitement permette toujours d'atteindre le niveau de risque de référence. Par exemple, lorsque la concentration de Giardia est de 21 kystes/100 L dans la source d'approvisionnenent en eau et que l'usine de traitement parvient constamment à une réduction d'au moins 3 log, la charge de morbidité pour la population répond au niveau de référence de 10-6 AVCI par personne par année (moins de 1 cas/1 000 personnes par année). De même, pour Cryptosporidium, une concentration de 13 oocystes/100 L dans la source d'approvisionnenent en eau exige que l'usine de traitement parvienne constamment à réduire la concentration d'oocystes de 3 log afin d'atteindre le niveau de risque de référence. Ces concentrations de kystes et d'oocystes dans la source d'approvisionnenent en eau entrent dans la fourchette habituelle des concentrations des kystes et des oocystes observées dans les sources d'eau au Canada (voir la section 5.0). À titre de comparaison, il faut une réduction approximative de 5 log pour que la charge de morbidité soit acceptable si la concentration est de 2 500 kystes/100 L ou de 900 oocystes/100 L. Bien que la plupart des sources d'eau de surface au Canada n'aient pas de concentrations moyennes exigeant une réduction de 5 log, certaines ont des pics de concentration à ce niveau (voir la section 5.0). Même si, dans la plupart des cas, les pics de concentration ne sont pas maintenus pendant longtemps, il est tout de même important que les fournisseurs d'eau potable tiennent compte de ces phénomènes de pics dans leur évaluation d'un site, afin de comprendre pleinement les risques éventuels qu'ils entraînent pour leur eau potable (Santé Canada, 2018).
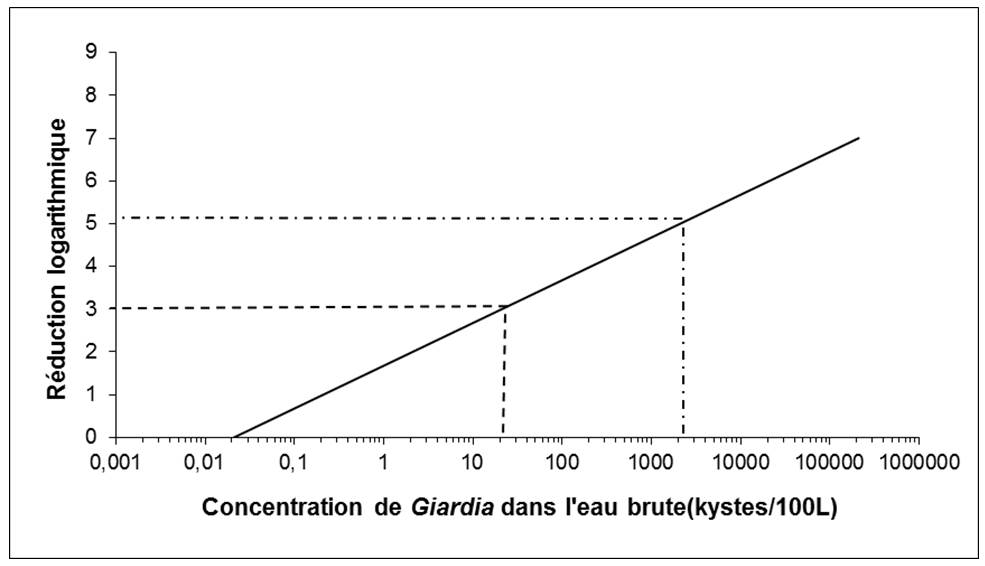
Équivalent textuel : Figure 1
Le degré de traitement requis pour atteindre un niveau de risque acceptable selon une consommation de 1 litre, pour des concentrations de Giardia allant de 21 kystes pour 100 litres à 2100 kystes pour 100 litres d'eau brute, est présenté sous forme de graphique. L'axe des x correspond aux concentrations de kystes pour 100 litres d'eau brute, selon une échelle logarithmique. L'axe des y correspond à l'élimination logarithmique, selon une échelle linéaire. La relation entre les valeurs de l'axe des x et celles de l'axe des y, pour un niveau de risque de 10-6 AVCI par personne par année, forme une diagonale. Sur le graphique, deux exemples de degrés de traitement sont illustrés en ligne pointillée. Dans le premier, la ligne pointillée horizontale part de l'axe des y à une valeur d'élimination d'environ 3 log, puis croise la diagonale à une valeur d'environ 21 kystes pour 100 litres d'eau brute. Dans le deuxième, la ligne pointillée horizontale part de l'axe des y à une valeur d'élimination d'environ 5 log, puis croise la diagonale à une valeur d'environ 2100 kystes pour 100 litres d'eau brute.
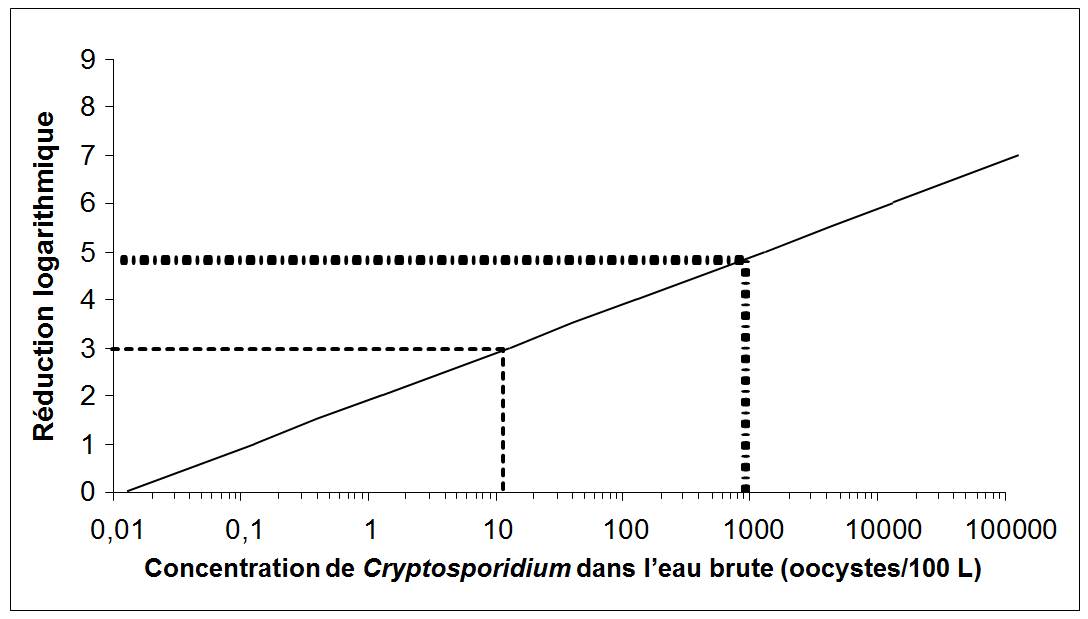
Équivalent textuel : Figure 2
Le degré de traitement requis pour atteindre un niveau de risque acceptable selon une consommation de 1 litre, pour des concentrations de Cryptosporidium allant de 13 kystes pour 100 litres à 900 kystes pour 100 litres d'eau brute, est présenté sous forme de graphique. L'axe des x correspond aux concentrations de kystes pour 100 litres d'eau brute, selon une échelle logarithmique. L'axe des y correspond à l'élimination logarithmique, selon une échelle linéaire. La relation entre les valeurs de l'axe des x et celles de l'axe des y, pour un niveau de risque de 10-6 AVCI par personne par année, forme une diagonale. Sur le graphique, deux exemples de degrés de traitement sont illustrés en ligne pointillée. Dans le premier, la ligne pointillée horizontale part de l'axe des y à une valeur d'élimination d'environ 3 log, puis croise la diagonale à une valeur d'environ 13 kystes pour 100 litres d'eau brute. Dans le deuxième, la ligne pointillée horizontale part de l'axe des y à une valeur d'élimination d'environ 5 log, puis croise la diagonale à une valeur d'environ 900 kystes pour 100 litres d'eau brute.
Selon les données dont nous disposons sur les protozoaires entériques dans les sources d'eau de surface au Canada, un objectif de traitement basé sur la santé correspondant à une réduction de 3 log de Giardia et de Cryptosporidium représente une exigence minimale. Il peut toutefois être nécessaire d'obtenir un plus fort taux d'élimination ou d'inactivation pour atteindre les objectifs du traitement. Il faut évaluer le site pour déterminer quel taux de réduction des kystes et des oocystes doit être obtenu pour une source d'eau donnée. Une surveillance des sources d'eau pour y détecter la présence de Giardia et de Cryptosporidium permettra d'obtenir la meilleure évaluation du site qui soit. Cependant, s'il est impossible d'effectuer des mesures, les informations tirées d'évaluations régulières du système, de même que les renseignements sur d'autres paramètres de la qualité de l'eau, peuvent servir à estimer le risque et le degré de contamination fécale des sources d'eau. Ces renseignements peuvent ensuite aider à déterminer si la concentration des protozoaires entériques présents dans l'eau exige plus que le traitement minimal.
Il est également important de comprendre les réductions logarithmiques auxquelles l'usine de traitement peut parvenir lorsqu'elle fonctionne dans des conditions optimales, ainsi que les répercussions des perturbations à court et à long terme du traitement sur les réductions logarithmiques. En comprenant les variations de la qualité de l'eau à la source et de l'eau à l'usine de traitement, et en planifiant en conséquence, il est possible de créer un système plus robuste pouvant comporter des marges de sécurité. Il est également important de tenir compte de l'incertitude relative à l'ÉQRM, afin que le traitement en place produise une eau de qualité acceptable. Une analyse de la sensibilité effectuée au moyen d'un modèle d'ÉQRM peut également aider à déterminer les points de contrôle critiques et leurs limites. D'autres renseignements sur les évaluations propres aux sites et sur l'utilisation de l'ÉQRM comme outil dans une approche de la source au robinet sont donnés ailleurs (Santé Canada, 2018).
9.4 Considérations internationales
Les organismes internationaux et les gouvernements d'autres pays, à tous les échelons, utilisent de plus en plus l'ÉQRM pour prendre des décisions éclairées sur les risques sanitaires que représentent les microorganismes pathogènes de l'eau potable. L'OMS, la Commission européenne, les Pays-Bas, l'Australie et les États-Unis ont tous réalisé des progrès importants en ce qui concerne la validation de l'ÉQRM et les méthodes correspondantes (Staatscourant, 2001; Medema et coll., 2006; NRMMC-EPHC, 2006; U.S. EPA, 2006a, 2006b; OMS, 2017). Ces organismes et ces gouvernements ont adopté des approches qui utilisent l'ÉQRM pour établir les objectifs sanitaires (c.-à-d. les niveaux de risque de référence ou les niveaux de maladie) et pour éclairer la gestion des risques (p. ex. les plans de gestion de la sécurité sanitaire de l'eau, tels que décrits dans OMS, 2017). Des lignes directrices sur l'ÉQRM de l'eau potable ont été publiées par le projet MicroRisk de la Commission européenne (Medema et coll., 2006), par l'U.S. EPA (2014), et par l'OMS (2016).
Les Pays-Bas et les États-Unis (U.S. EPA) ont adopté des approches réglementaires fondées sur l'ÉQRM. Aux Pays-Bas, conformément à l'approche employée par l'OMS, les fournisseurs d'eau doivent réaliser une ÉQRM propre au site pour tous les systèmes d'approvisionnement en eau de surface afin de déterminer si ceux-ci peuvent satisfaire à un niveau de risque précisé. Les autorités hollandaises peuvent également exiger une ÉQRM dans le cas des approvisionnements en eau souterraine vulnérables. Aux États-Unis, l'U.S. EPA, quant à elle, a récemment effectué une évaluation des risques pour la santé imputables aux agents pathogènes d'origine hydrique au moyen d'une ÉQRM et s'est servie des renseignements obtenus pour établir des exigences nationales en matière d'efficacité du traitement (U.S. EPA, 2006a, 2006b). En général, pour les systèmes d'eau potable, une élimination ou une inactivation de Giardia de l'ordre de 3 log doit être obtenue (U.S. EPA, 1989). Pour réduire les risques liés à Cryptosporidium, il faut surveiller les sources d'eau des systèmes d'eau potable, calculer la concentration moyenne de Cryptosporidium et utiliser les résultats pour déterminer si la source est susceptible d'être contaminée et si elle requiert un traitement supplémentaire au minimum de 2 log. Les systèmes d'approvisionnement en eau sont classés dans des catégories de risque établies en fonction de la présence ou de l'absence d'un système de filtration; ces catégories fournissent également des renseignements sur les exigences supplémentaires en matière d'élimination ou d'inactivation des espèces de Cryptosporidium (U.S. EPA, 2006a).
Santé Canada et le Comité fédéral-provincial-territorial sur l'eau potable ont adopté la même approche que l'OMS (2017), en fournissant des objectifs d'efficacité fondés sur l'ÉQRM comme exigences minimales. L'ÉQRM propre à un site est également recommandée comme outil qui peut être utilisé dans le cadre d'une approche de la source au robinet. L'ÉQRM effectuée pour un site en particulier offre plusieurs avantages, notamment : 1) la capacité de comparer les risques associés à des groupes d'agents pathogènes représentatifs (p. ex. virus, protozoaires, bactéries) dans une évaluation globale; 2) la transparence des hypothèses; 3) la prise en compte de la variabilité et de l'incertitude liées aux estimations; 4) l'élimination des facteurs de sécurité cachés (qui peuvent être appliqués consciemment par les organismes de réglementation à la fin du processus, s'ils le désirent); 5) l'établissement des points de contrôle critiques et des limites propres au site au moyen d'analyses de la sensibilité; 6) une bonne connaissance des effets de la gestion d'un système sur un paramètre de santé publique. D'autres renseignements sur l'utilisation de l'ÉQRM pour l'évaluation d'un site en particulier se trouvent dans Santé Canada (2018).
10.0 Justification de la recommandation
On sait que Giardia lamblia et de nombreuses espèces et de nombreux génotypes de Cryptosporidium infectent les humains. Ces organismes pathogènes sont excrétés dans les matières fécales des personnes et des animaux infectés et peuvent être présents dans les sources d'eau. Leur présence dans les sources d'eau varie au fil du temps et peut être considérablement influencée par des températures extrêmes ou par des déversements ou des événements perturbateurs (c.-à-d. augmentation du nombre de kystes et d'oocystes associée à ces événements). La meilleure façon de prévenir la présence de Cryptosporidium et de Giardia en concentrations dangereuses dans l'eau potable consiste à appliquer l'approche de la source au robinet. Cette approche englobe la protection des sources d'approvisionnement en eau et le traitement adéquat, assurés grâce au contrôle approprié des procédés, avant la vérification de l'absence de microorganismes indicateurs dans l'eau traitée. Fixer des objectifs de traitement basés sur la santé permet d'assurer la protection de la santé publique. Or, pour fixer ces objectifs, il faut établir le niveau de risque acceptable. Le Comité fédéral-provincial-territorial sur l'eau potable a retenu le niveau de risque de référence utilisé par l'OMS, soit 10-6 AVCI par personne par année. Il s'agit d'une décision de gestion des risques qui offre un équilibre entre, d'une part, la charge de morbidité estimée pour Cryptosporidium et Giardia et, d'autre part, le manque d'informations sur la fréquence de la présence de ces organismes pathogènes dans les sources d'eau, les limites en matière de surveillance des maladies et les variations de l'efficacité des différentes techniques de traitement de l'eau.
Au Canada, bon nombre de sources d'eau de surface présentent des concentrations de Cryptosporidium et de Giardia variant de 1 à 200 kystes et oocystes par 100 L d'eau. L'approche fondée sur l'ÉQRM utilisée dans le présent document montre que, si une source d'approvisionnment en eau présente une concentration de kystes et d'oocystes correspondant aux valeurs minimales de cette fourchette de concentrations—par exemple, 21 kystes de Giardia/100 L ou 13 oocystes de Cryptosporidium/100 L—l'usine de traitement doit constamment réduire d'au moins 3 log la concentration des kystes et des oocystes afin de respecter le niveau de référence de 10-6 AVCI par personne par année. Par conséquent, si l'eau doit être traitée en raison de la présence de protozoaires entériques, l'élimination ou l'inactivation d'au moins 3 log de Giardia et de Cryptosporidium a été établie comme objectif de traitement basé sur la santé. Certaines eaux de surface au Canada peuvent nécessiter une réduction supérieure à l'objectif de traitement minimal pour respecter le niveau de risque de référence. Il faut évaluer les sources d'eau souterraine pour déterminer si l'approvisionnement peut être contaminé par des protozoaires entériques (c.-à-d. sources de type ESSIDES). Le traitement des sources souterraines identifiées comme étant des ESSIDES doit permettre une élimination ou une inactivation d'au moins 3 log de Giardia et de Cryptosporidium. Il faut protéger autant que possible les bassins versants ou les aquifères qui servent de sources d'eau potable, en réduisant au minimum la contamination par les matières fécales.
11.0 Références
- Abbaszadegan, M., Rauch-Williams, T., Johnson, W.P. and Hubbs, S.A. (2011). Methods to assess GWUDI and bank filtration performance. Water Research Foundation, Denver, Colorado.
- Aboytes, A., Di Giovanni, G.D., Abrams, F.A., Rheinecker, C., McElroy, W., Shaw, N. and LeChevallier, M.W. (2004). Detection of infectious Cryptosporidium in filtered drinking water. J. Am. Water Works Assoc., 96:88–98.
- Abrahamsen, M.S., Templeton, T.J., Enomoto, S., Abrahante, J.E., Zhu, G., Lancto, C.A., Deng, M., Liu, C., Widmer, G., Tzipori, S., Buck, G.A., Xu, P., Bankier, A.T., Dear, P.H., Konfortov, B.A., Spriggs, H.F., Iyer, L., Anantharaman, V., Aravind, L. and Kapur, V. (2004). Complete genome sequence of the apicomplexan, Cryptosporidium parvum. Science, 304(5669):441–445.
- Abudalo, R.A., Ryan, J.N., Harvey, R.W., Metge, D.W. and Landkamer, L. (2010). Influence of organic matter on the transport of Cryptosporidium parvum oocysts in a ferric oxyhydroxide-coated quartz sand saturated porous medium. Water Res., 44(4): 1104–1113.
- Adam, R.D. (1991). The biology of Giardia spp. Microbiol. Rev., 55:706–732.
- Adam, R.D. (2001). Biology of Giardia lamblia. Clin. Microbiol. Rev. 14(3):447–475.
- Adamska, M. (2015). Molecular characterization of Cryptosporidium and Giardia occurring in natural water bodies in Poland. Parasitol. Res. 114:687–692.
- Alexander, C., Jones, B., Inverarity, D. and Pollock, K.G.J. (2014). Genotyping of Giardia isolates in Scotland: a descriptive epidemiological study. Epidemiol. Infect., 142:1636–1639.
- Alonso, J.L., Amorós, I. and Guy, R.A. (2014). Quantification of viable Giardia cysts and Cryptosporidium oocysts in wastewater using propidium monoazide quantitative real-time PCR. Parasitol. Res., 113(7):2671–2678.
- Alpert, G.L., Bell, M., Kirkpatrick, C.E., Budinick, L.D., Campos, J.M., Friedman, H.M. and Plotkin, S.A. (1986). Outbreak of cryptosporidiosis in a day care center. Pediatrics, 77:152–157.
- Alspach, B., Delphos, P., Pressman, J., Beaty, J., Cooke, T., Voutchkov, N., Schaefer, J., Noack, R., Marascia, F. and Konstanski, D. (2014). Metrics and methods for MF/UF system optimization. In: Proceedings of the Membrane Technology Conference. American Water Works Association, Denver, CO.
- Amar, C.F., Dear, P.H., Pedraza-Díaz, S., Looker, N., Linnane, E. and McLauchlin, J. (2002). Sensitive PCR-restriction fragment length polymorphism assay for detection and genotyping of Giardia duodenalis in human feces. J. Clin. Microbiol., 40(2):446–452.
- Amburgey, J.E., Amirtharajah, A., Brouckaert, B.M. and Spivey, N.C. (2003). An enhanced backwashing technique for improved filter ripening. J. Am. Water Works Assoc., 95(12):81–94.
- Amburgey, J.E., Amirtharajah, A., York, M.T., Brouckaert, B.M., Spivey, N.C. and Arrowood, M.J. (2005). Comparison of conventional and biological filter performance for Cryptosporidium and microsphere removal. J. Am. Water Works Assoc., 97(12):77–91.
- Amoah, K., Craik, S., Smith, D.W. and Belosevic, M. (2005). Inactivation of Cryptosporidium oocysts and Giardia cysts by ultraviolet light in the presence of natural particulate matter. J. Water Supply Res. Technol. AQUA., 54(3):165–178.
- Andersson, T., Bjelkmar, P., Hulth, A., Lindh, J., Stenmark, S. and Widerström, M. (2014). Syndromic surveillance for local outbreak detection and awareness: evaluating outbreak signals of acute gastroenteritis in telephone triage, web-based queries and over-the-counter pharmacy sales. Epidemiol. Infect. 142 (2): 303–313.
- Angles, M.L., Chandy, J.P., Cox, P.T., Fisher, I.H. and Warnecke, M.R. (2007). Implications of biofilm-associated Cryptosporidium oocysts for the water industry. Trends Parasitol., 23(8):352–356.
- ANSI/AWWA. (2010). ANSI/AWWA B110-09 – Membrane systems. American Water Works Association, Denver, Colorado.
- APHA/AWWA/WEF (2012). Infectivity of Cryptosporidium in cell culture. In: Standard Methods for the Examination of Water and Wastewater 22nd Edition. American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC. 9711D.
- Aramini, J.J., Stephen, C., Dubey, J.P., Engelstoft, C., Schwantje, H. and Ribble, C.S. (1999). Potential contamination of drinking water with Toxoplasma gondii oocysts. Epidemiol. Infect., 122(2):305–315.
- Armson, A., Thompson, R.C. and Reynoldson, J.A. (2003). A review of chemotherapeutic approaches to the treatment of cryptosporidiosis. Expert Rev. Anti Infect. Ther., 1(2):297–305.
- Assavasilavasukul, P., Harrington, G.W., Lau., B.L.T., Hoffman, R.M. and Borchardt, M.A. (2008a). Effect of pathogen load on pathogen removal by conventional treatment. American Water Works Association Research Foundation and American Water Works Association. Denver, Colorado.
- Assavasilavasukul, P., Lau, B. L. T., Harrington, G.W., Hoffman, R.M. and Borchardt, M.A. (2008b). Effect of pathogen concentrations on removal of Cryptosporidium and Giardia by conventional drinking water treatment. Water Res., 42(10–11):2678–2690.
- ASTM (2010). Standard practice for integrity testing of water filtration membrane systems. Designation: D6908-06 (Reapproved 2010). ASTM International, West Conshohocken, PA.
- Atherholt, T.B., LeChevallier, M.W., Norton, W.D. and Rosen, J.S. (1998). Effect of rainfall on Giardia and Cryptosporidium. J. Am. Water Works Assoc., 90:66–80.
- AWWA (1988). Roundtable: Cryptosporidium. American Water Works Association. J. Am. Water Works Assoc., 80:14–28.
- AWWA (1991). Guidance manual for compliance with the filtration and disinfection requirements for public water systems using surface water sources. American Water Works Association, Denver, Colorado.
- AWWA (2005). Microfiltration and ultrafiltration membranes for drinking water: Manual of water supply practices – M53. 1st edition. American Water Works Association, Denver, Colorado.
- AWWA (2006). Waterborne pathogens: Manual of water supply practices – M48. 2nd edition. American Water Works Association, Denver, Colorado.
- AWWA (2011a). Water quality and treatment: a handbook of community water supplies. 6th edition. J.K. Edzwald (ed.). McGraw-Hill, New York, New York.
- AWWA (2011b). Operational control of coagulation and filtration processes: Manual of water supply practices – M37. 3rd edition. American Water Works Association, Denver, Colorado.
- AWWA (2015). Disinfection residual strategy panel memorandum: Panel findings. July 31, 2015. American Water Works Association, Denver, Colorado.
- Baldursson, S. and Karanis, P. (2011). Waterborne transmission of protozoan parasites: review of worldwide outbreaks – An update 2004–2010. Water Res. 45:6603–6614.
- Barbour, A.G., Nichols, C.R. and Fukushima, T. (1976). An outbreak of giardiasis in a group of campers. Am. J. Trop. Med. Hyg. 25(3):384–389.
- Barwick, R.S., Levy, D.A., Craun, G.F., Beach, M.J. and Calderon, R.L. (2000). Surveillance for waterborne-disease outbreaks: United States, 1997 – 1998. MMWR Morb. Wkly. Rep. 49: 1–21.
- Batch, L.F., Schulz, C.R. and Linden, K.G. (2004). Evaluating water quality effect on UV disinfection of MS2 coliphage. J. Am. Water Works Assoc., 96(7):75–87.
- BCCDC. (1996). Outbreak of cryptosporidiosis associated with municipal drinking water: Cranbrook, British Columbia, June. British Columbia Centre for Disease Control. B.C. Health Dis. Surveill., 5(10):93–103.
- Bell, T., Sibbald, C. and Booth, N.E. (1991). Giardiasis outbreak in Edinburgh. Environ. Health Scotland, 3: 6–7.
- Bellamy, W.D., Silverman, G.P., Hendricks, D.W. and Logsdon, G.S. (1985a). Removing Giardia cysts with slow sand filtration. J. Am. Water Works Assoc., 77(2):52–60.
- Bellamy, W.D., Hendricks, D.W. and Logsdon, G.S. (1985b). Slow Sand Filtration: Influences of selected process variables. J. Am. Water Works Assoc., 77(12):62–66.
- Belosevic, M. and Faubert, G.M. (1983). Giardia muris: correlation between oral dosage, course of infection, and trophozoite distribution in the mouse small intestine. Exp. Parasitol., 56:352–365.
- Belosevic, M., Faubert, G.M., Guy, R., MacLean, J.D., Law, C. and Croll, N.A. (1983). Giardia lamblia infections in Mongolian gerbils: an animal model. J. Infect. Dis., 147:222–226.
- Belosevic, M., Guy, R.A., Taghi-Kilani, R., Neumann, N.F., Gyurek, L.L., Liyanage, L.R., Millard, P.J. and Finch, G.R. (1997). Nucleic acid stains as indicators of Cryptosporidium parvum oocyst viability. Int. J. Parasitol., 27(7):787–798.
- Belosevic, M., Craik, S.A., Stafford, J.L., Neumann, N.F., Kruithof, J. and Smith, D.W. (2001). Studies on the resistance/reactivation of Giardia muris cysts and Cryptosporidium parvum oocysts exposed to medium-pressure ultraviolet radiation. FEMS Microbiol. Lett., 204(1):197–203.
- Bennett, J.W., Gauci, M.R., Le Moenic, S., Schaefer, F.W. III, and Lindquist, H.D. (1999). A comparison of enumeration techniques for Cryptosporidium parvum oocysts. J. Parasitol., 85(6):1165–1168.
- Berger, P. (2002). Removal of Cryptosporidium using bank filtration. In: Riverbank filtration: Understanding contaminant biogeochemistry and pathogen removal. C. Ray (ed.). Kluwer Academic Publishers, Dordrecht, The Netherlands. pp. 85–121.
- Berrilli, F., Di Cave, D., De Liberato, C., Franco, A., Scaramozzino, P. and Orecchia, P. (2004). Genotype characterisation of Giardia duodenalis isolates from domestic and farm animals by SSU-rRNA gene sequencing. Vet. Parasitol., 122(3):193–199.
- Bertrand, I., Gantzer, C., Chesnot, T. and Schwartzbrod, J. (2004). Improved specificity for Giardia lamblia cyst quantification in wastewater by development of a real-time PCR method. J. Microbiol. Meth., 57(1):41–53.
- Betancourt, W.Q. and Rose, J.B. (2004). Drinking water treatment processes for removal of Cryptosporidium and Giardia. Vet. Parasitol., 126(1–2):219–234.
- Bingham, A.K., Jarroll, E.L., Jr. and Meyer, E.A. (1979). Giardia sp.: physical factors of excystation in vitro, and excystation vs. eosin exclusion as determinants of viability. Exp. Parasitol., 47:284–291.
- Birkhead, G., Janoff, E.N., Vogt, R.L. and Smith, P.D. (1989). Elevated levels of immunoglobulin A to Giardia lamblia during a waterborne outbreak of gastroenteritis. J. Clin. Microbiol., 27(8):1707–1710.
- Bize, J., Grenet, B. and Maneglier, H. (1981). Le pouvoir épurateur du complexe alluvial en bordure de rivière. Techniq. Sci. Municip. L’eau, July:393–401.
- Black, E.K., Finch, G.R., Taghi-Kilani, R. and Belosevic, M. (1996). Comparison of assays for Cryptosporidium parvum oocysts viability after chemical disinfection. FEMS Microbiol. Lett., 135:187–189.
- Bolton, J.R. and Cotton, C.A. (2008). The ultraviolet disinfection handbook. American Water Works Association, Denver, Colorado.
- Boreham, P.F., Upcroft, J.A. and Upcroft, P. (1990). Changing approaches to the study of Giardia epidemiology: 1681–2000. Int. J. Parasitol., 20(4):479–487.
- Boulter-Bitzer, J.I., Lee, H. and Trevors, J.T. (2007). Molecular targets for detection and immunotherapy in Cryptosporidium parvum. Biotechnol. Adv., 25(1):13–44.
- Bouzid, M., Hunter, P.R., Chalmers, R.M. and Tyler, K.M. (2013). Cryptosporidium pathogenicity and virulence. Clin. Microbiol. Rev., 26(1):115–134.
- Bowie, W.R., King, A.S., Werker, D.H., Isaac-Renton, J.L., Bell, A., Eng, S.B. and Marion, S.A. (1997). Outbreak of toxoplasmosis associated with municipal drinking water. The B.C. Toxoplasma Investigation Team. Lancet, 350(9072):173–177.
- Bradford, S.A., Kim, H., Headd, B. and Torkzaban, S. (2016). Evaluating the transport of Bacillus subtilis spores as a potential surrogate for Cryptosporidium parvum oocysts. Environ. Sci. Technol., 50(3): 1295-1303.
- Brady, P. G., and Wolfe, J. C. (1974). Waterborne giardiasis. Ann. Intern. Med., 81: 498–499.
- Braeye, T., De Schrijver, K., Wollants, E., van Ranst, M. and Verhaegen, J. (2015). A large community outbreak of gastroenteritis associated with consumption of drinking water contaminated by river water, Belgium, 2010. Epi. Infect., 143(4):711–719.
- Brescia, C.C., Griffin, S.M., Ware, M.W., Varughese, E.A., Egorov, A.I. and Villegas, E.N. (2009). Cryptosporidium propidium monoazide-PCR, a molecular biology-based technique for genotyping of viable Cryptosporidium oocysts. Appl. Environ. Microbiol., 75(21):6856–6863.
- Brown, T.J. and Emelko, M.B. (2009). Chitosan and metal salt coagulant impacts on Cryptosporidium and microsphere removal by filtration. Water Res., 43(2):331–338.
- Brush, C.F., Walker, M.F. Anguish, L.J. and Ghiorse, W.C. (1998). Influence of pretreatment and experimental conditions on electrophoretic mobility and hydrophobicity of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 64(11):4439–4445.
- Brush, C.F., Ghiorse, W.C., Anguish, L.J. Parlange, J-Y. and Grimes, H.G. (1999). Transport of Cryptosporidium parvum oocysts through saturated columns. J. Environ. Qual., 28(3):809–815.
- Bryck, J.M.G., Walker, B.L. and Hendricks, D.W. (1988). Removal of Giardia through slow sand filtration: 100 Mile House, British Columbia. In: Advances in Giardia Research, Ed. P.M. Wallis and B.R. Hammond, University of Calgary Press, Calgary, pp 87–93.
- Budu-Amoako, E., Greenwood, S.J., Dixon, B.R., Barkema, H.W. and McClure, J.T. (2012a). Giardia and Cryptosporidium on dairy farms and the role these farms may play in contaminating water sources in Prince Edward Island, Canada. J. Vet. Intern. Med., 26:668–673.
- Budu-Amoako, E., Greenwood, S.J., Dixon, B.R., Barkema, H.W. and McClure, J.T. (2012b). Occurrence of Cryptosporidium and Giardia on beef farms and water sources within the vicinity of the farms on Prince Edward Island, Canada. Vet. Parasitol. 184:1–9.
- Bukhari, Z., McCuin, R.M., Fricker, C.R. and Clancy, J.L. (1998). Immunomagnetic separation of Cryptosporidium parvum from source water samples of various turbidities. Appl. Environ. Microbiol., 64(11):4495–4499.
- Bukhari, Z., Hargy, T.M., Bolton, J.R., Dussert, B. and Clancy, J.L. (1999). Medium-pressure UV for oocyst inactivation. J. Am. Water Works Assoc., 91(3):86–94.
- Bukhari, Z., Marshall, M.M., Korich, D.G., Fricker, C.R., Smith, H.V., Rosen, J. and Clancy, J.L. (2000). Comparison of Cryptosporidium parvum viability and infectivity assays following ozone treatment of oocysts. Appl. Environ. Microbiol., 66(7):2972–2980.
- Burnet, J.B, Penny, C., Ogorzaly, L. and Cauchie, H.M. (2014). Spatial and temporal distribution of Cryptosporidium and Giardia in a drinking water resource: implications for monitoring and risk assessment. Sci. Total Environ., 472:1023–1036.
- Cacciò, S.M. and Pozio, E. (2006). Advances in the epidemiology, diagnosis and treatment of cryptosporidiosis. Expert Rev. Anti Infect. Ther., 4(3):429–443.
- Cacciò, S.M. and Ryan, U. (2008). Molecular epidemiology of giardiasis. Mol. Biochem. Parasitol., 160:75–80.
- Cacciò, S.M., De Giacomo, M. and Pozio, E. (2002). Sequence analysis of the beta-giardin gene and development of a polymerase chain reaction–restriction fragment length polymorphism assay to genotype Giardia duodenalis cysts from human faecal samples. Int. J. Parasitol., 32(8):1023–1030.
- Cacciò, S.M., Beck, R., Almeida, A., Bajer, A. and Pozio, E. (2010). Identification of Giardia species and Giardia duodenalis assemblages by sequence analysis or the 5.8S rDNA gene and internal transcribed spacers. Parasitology, 137:919–925.
- Campbell, A.T. and Wallis, P. (2002). The effect of UV irradiation on human-derived Giardia lamblia cysts. Water Res., 36(4):963–969.
- Campbell, A.T., Robertson, L.J. and Smith, H.V. (1992). Viability of Cryptosporidium parvum oocysts: correlation of in vitro excystation with inclusion or exclusion of fluorogenic vital dyes. Appl. Environ. Microbiol., 58:3488–3493.
- Campbell, A., Douglas, I., Emelko, M.B., McLellan, N. and Banihashemi, A. (2014). Evaluating pathogen log performance through pilot-plant challenge studies. Canadian National Conference on Drinking Water, Ottawa, Ontario.
- Cao, Y., Raith, M.R. and Griffith, J.F. (2015). Droplet digital PCR for simultaneous quantification of general and human-associated fecal indicators for water quality assessment. Water Res., 70:337–349.
- Caprioli, A., Gentile, G., Baldassari, L., Bisicchia, R., Romoli, E. and Donelli, G. (1989). Cryptosporidium as a common cause of childhood diarrhoea in Italy. Epidemiol. Infect., 102:537–540.
- Caron, E., Chevrefils Jr., G., Barbeau, B., Payment, P and Prévost, M. (2007). Impact of microparticles on UV disinfection of indigenous aerobic spores. Water Res. 41(19):4546–4556.
- Carranza, P.G. and Lujan, H.D. (2010). New insights regarding the biology of Giardia lamblia. Microbes Infect., 12:71–80.
- Cavalier-Smith, T. (2003). Protist phylogeny and the high-level classification of protozoa. Europ. J. Protistol. 39: 338–348.
- CCME. (2004). From source to tap: guidance on the multi-barrier approach to safe drinking water. Canadian Council of Ministers of the Environment Winnipeg, Manitoba. Available at: www.ccme.ca/files/Resources/water/source_tap/mba_guidance_doc_e.pdf
- CDC (1975). Giardiasis in residents of Rome, New York, and in travelers to the Soviet Union. Morb. Mortal Wkly Rep., 24: 371.
- CDC (1977a). Giardiasis – California, Colorado. Morb. Mortal. Wkly. Rep., 26(7):60.
- CDC (1977b). Waterborne giardiasis outbreaks: Washington, New Hampshire. Morb. Mortal. Wkly. Rep., 26(21):169–175.
- CDC (1978). Giardiasis: Vail, Colorado. Morb. Mortal. Wkly. Rep., 27(19):155.
- CDC (1980). Waterborne giardiasis: California, Colorado, Oregon, Pennsylvania. Morb. Mortal. Wkly. Rep., 29(11):121–123.
- CDC (2004). Surveillance for waterborne-disease outbreaks associated with drinking water — United States, 2001–2002. United States Centers for Disease Control and Prevention MMWR Morb. Mortal. Wkly. Rep., 53(SS08):23–45. Available at: www.cdc.gov/mmwr/preview/mmwrhtml/ss5308a4.htm
- CDR (1996). Surveillance of waterborne disease and water quality: January to June 1996. CDR Wkly., 6(34):301-302.
- CDR (2001). Surveillance of waterborne disease and water quality: January to June 2001, and summary of 2000. CDR Wkly., 11(45).
- Chalmers, R.M. (2012) Waterborne outbreaks of cryptosporidiosis. Ann. 1st. Super Sanità, 48(4): 429-446.
- Chalmers, R.M., Elwin, K., Reilly, W.J., Irvine, H., Thomas, A.L. and Hunter, P.R. (2002). Cryptosporidium in farmed animals: the detection of a novel isolate in sheep. Int. J. Parasitol., 32:21–26.
- Chalmers, R.M., Robinson, G., Elwin, K., Hadfield, S., Thomas, E., Watkins, J., Casemore, D. and Kay, D. (2010). Detection of Cryptosporidium species and sources of contamination with Cryptosporidium hominis during a waterborne outbreak in northwest Wales. J. Water Health, 8(2): 311-325.
- Chappell, C.L., Okhuysen, P.C., Sterling, C.R., Wang, C., Jakubowski, W. and DuPont, H.L. (1999). Infectivity of Cryptosporidium parvum in healthy adults with pre-existing anti-C. parvum serum immunoglobulin G. Am. J. Trop. Med. Hyg., 60(1):157–164.
- Chappell, C.L., Okhuysen, P.C., Langer-Curry, R., Widmer, G., Akiyoshi, D.E., Tanriverdi, S. and Tzipori, S. (2006). Cryptosporidium hominis: experimental challenge of healthy adults. Am. J. Trop. Med. Hyg., 75(5):851–857.
- Chauret, C., Armstrong, N., Fisher, J., Sharma, R., Springthorpe, S. and Sattar, S. (1995). Correlating Cryptosporidium and Giardia with microbial indicators. J. Am. Water Works Assoc., 87(11):76–84.
- Chesnot, T. and Schwartzbrod, J. (2004). Quantitative and qualitative comparison of density-based purification methods for detection of Cryptosporidium oocysts in turbid environmental matrices. J. Microbiol. Methods, 58(3):375–386.
- Christensen, J. and Linden, K. (2002). New findings regarding the impacts of suspended particles on UV disinfection of drinking water. In: Proceedings of the Annual Conference of the American Water Works Association, New Orleans, LA, June 16–20. American Water Works Association, Denver, Colorado.
- Clancy, J.L., Hargy, T.M., Marshall, M.M. and Dyksen, J.E. (1998). UV light inactivation of Cryptosporidium oocysts. J. Am. Water Works Assoc., 90(9):92–102.
- Clancy, J. L., Hargy, T. M., Battigelli, D. A., Marshall, M. M., Korich, D. G. and Nicholson, W. L. (2002). Susceptibility of Multiple Strains of C. Parvum to UV Light. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- Coffey, B. M., Huck, P. M., Maurizio, D. D., Emelko, M. B., Douglas, I. P. and Van Den Oever, J. (1999). The effect of optimizing coagulation on the removal of Cryptosporidium parvum and Bacillus subtilis. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
- Collins, M.R., Eighmy, T.T. and Malley, Jr., J.P. (1991). Evaluating Modifications to slow sand filters. J. Am. Water Works Assoc., 83(9):62–70.
- Conio, O., Chioetto, M. and Hargesheimer, E. (2002). Organic monitors. In: Online Monitoring for Drinking Water Utilities. E. Hargesheimer, O. Conio and J. Papovicova (eds.). Awwa Research Foundation, Denver, Colorado. pp. 163–202.
- Cotton, J.A., Beatty, J.K. and Buret, A.G. (2011). Host parasite interactions and pathophysiology in Giardia infections. Int. J. Parasitol., 41(9):925–933.
- Coulliette, A.D., Huffman, D.E., Slifko, T.R. and Rose, J.B. (2006). Cryptosporidium parvum: treatment effects and the rate of decline in oocyst infectivity. J. Parasitol., 92(1):58–62.
- Crabb, J.H. (1998). Antibody-based immunotherapy of cryptosporidiosis. Adv. Parasitol., 40:121–149.
- Craik, S.A., Finch, G.R., Bolton, J.R. and Belosevic, M. (2000). Inactivation of Giardia muris cysts using medium-pressure radiation in filtered drinking water. Water Res., 34(18):4325–4332.
- Craik, S.A., Weldon, D., Finch, G.R., Bolton, J.R. and Belosevic, M. (2001). Inactivation of Cryptosporidium parvum oocysts using medium- and low-pressure ultraviolet radiation. Water Res., 35(6):1387–1398.
- Craun, G.F. (1979). Waterborne outbreaks of giardiasis. In: Waterborne transmission of giardiasis. W. Jakubowski and J.C. Hoff (eds.). U.S. Environmental Protection Agency, Cincinnati, Ohio. pp. 127–149 (EPA 600/9-79-001).
- Craun, G.F. (1986). Waterborne giardiasis in the United States 1965–1984. Lancet, 328 (8505):513–514.
- Craun, G.F., Berger, P.S. and Calderon, R.L. (1997). Coliform bacteria and waterborne disease outbreaks. J. Am. Water Works Assoc., 89(3):96–104.
- Craun, G.F., Hubbs, S.A., Frost, F., Calderon, R.L. and Via, S.H. (1998). Waterborne outbreaks of cryptosporidiosis. J. Am. Water Works Assoc., 90:81–91.
- Craun, G.F., Brunkard, J.M., Yoder, J.S., Roberts, V.A., Carpenter, J., Wade, T., Calderon, R.L., Roberts, J.M., Beach, M.J. and Roy, S.L. (2010). Causes of outbreaks associated with drinking water in the United States from 1971 to 2006. Clin. Microbiol. Rev., 23(3):507–528.
- Crowe, A.S., Schaefer, K.A., Kohut, A., Shikaze, S.G. and Ptacek, C.J. (2003). Linking water science to policy: groundwater quality. Canadian Council of Ministers of the Environment, Winnipeg, Manitoba.
- Current, W. (1986). Cryptosporidiosis. J. Am. Vet. Med. Assoc., 187:1334–1338.
- Curriero, F.C., Patz, J.A., Rose, J.B. and Lele, S. (2001). The association between extreme precipitation and waterborne disease outbreaks in the United States, 1948-1994. Am. J. Public Health, 91(8): 1194-1199.
- Dai, X. and Hozalski, R.M. (2002). Effect of NOM and biofilm on the removal of Cryptosporidium parvum oocysts in rapid filters. Water Res., 36(14):3523–3532.
- Dalle, F., Roz, P., Dautin, G., Di-Palma, M., Kohli, E., Sire-Bidault, C., Fleischmann, M.G., Gallay,A., Carbonel, S., Bon, F., Tillier, C., Beaudeau, P. and Bonnin, A. (2003). Molecular characterization of isolates of waterborne Cryptosporidium spp. collected during an outbreak of gastroenteritis in South Burgundy, France. J. Clin. Microbiol., 41(6): 2690-2693.
- Davies, R.B. and Hibler, C.P. (1979). Animal reservoirs and cross-species transmission of Giardia. In: Waterborne transmission of giardiasis. W. Jakubowski and J.C. Hoff (eds.). U.S. Environmental Protection Agency, Cincinnati, Ohio. pp. 104–126 (EPA 600/9-79-001).
- Davies, C.M., Altavilla, N., Krogh, M., Ferguson, C.M., Deere, D.A. and Ashbolt, N.J. (2005). Environmental inactivation of Cryptosporidium oocysts in catchment soils. J. Appl. Microbiol., 98(2):308–317.
- Dechesne, M. and Soyeux, E. (2007). Assessment of source water pathogen contamination. J. Water Health, 5(Suppl. 1):39–50.
- Delaunay, A., Gargala, G., Li, X., Favennec, L. and Ballet, J.J. (2000). Quantitative flow cytometric evaluation of maximal Cryptosporidium parvum oocyst infectivity in a neonate mouse model. Appl. Environ. Microbiol., 66(10):4315–4317.
- DeLoyde, J.L., Anderson, W.B., Cleary, S.A., Ndiongue, S., LeCraw, R.A., Galan, M. and Huck, P.M. (2006). Removal of Cryptosporidium oocysts and Giardia cysts by pilot-scale multi-stage slow sand filtration. In: Recent progress in slow sand and alternative biofiltration processes. Gimbel, R., Graham, N.J.D. and Collins, M.R. (eds.). IWA Publishing, Cornwall, United Kingdom.
- Deng, M.Q., Cliver, D.O. and Mariam, T.W. (1997). Immunomagnetic capture PCR to detect viable Cryptosporidium parvum oocysts from environmental samples. Appl. Environ. Microbiol., 63(8):3134–3138.
- Deng, M.Q., Lam, K.M. and Cliver, D.O. (2000). Immunomagnetic separation of Cryptosporidium parvum oocysts using MACS MicroBeads and high gradient separation columns. J. Microbiol. Methods, 40(1):11–17.
- denHollander, N., Riley, D. and Befus, D. (1988). Immunology of giardiasis. Parasitol. Today, 4:124–131.
- deRegnier, D.P., Cole, L., Schupp, D.G. and Erlandsen, S.L. (1989). Viability of Giardia cysts suspended in lake, river, and tap water. Appl. Environ. Microbiol., 55:1223–1229.
- DeSilva, M.B., Schafer, S., Kendall Scott, M., Robinson, B., Hills, A., Buser, G.L., Salis, K., Gargano, J., Yoder, J., Hill, V., Xiao, L., Roellig, D. and Hedberg, K. (2016). Communitywide cryptosporidiosis outbreak associated with a surface water-supplied municipal water system – Baker City, Oregon, 2013. Epi. Infect., 144(2):274–284.
- Diamond, L.P., Harlow, D.R. and Cunnick, C.C. (1978). A new medium for the axenic cultivation of Entamoeba histolytica and other Entamoeba. Trans. R. Soc. Trop. Med. Hyg., 72:431–432.
- DiGiorgio, C.L., Gonzalez, D.A. and Huitt, C.C. (2002). Cryptosporidium and Giardia recoveries in natural waters by using Environmental Protection Agency Method 1623. Appl. Environ. Microbiol., 68(12):5952–5955.
- Di Giovanni, G.D., Hashemi, F.H., Shaw, N.J., Abrams, F.A., LeChevallier, M.W. and Abbaszadegan, M. (1999). Detection of infectious Cryptosporidium parvum oocysts in surface and filter backwash water samples by immunomagnetic separation and integrated cell culture–PCR. Appl. Environ. Microbiol., 65(8):3427–3432.
- Di Giovanni, G.D. and LeChevallier, M.W. (2005) Quantitative-PCR assessment of Cryptosporidium parvum cell culture infection. Appl. Environ. Microbiol., 71(3):1495-1500.
- Di Giovanni, G.D., Betancourt, W.Q., Hernandez, J., Assadian, N.W., Margez, J.P.F. and Lopez, E.J. (2006). Investigation of potential zooantroponotic transmission of cryptosporidiosis and giardiasis through agricultural use of reclaimed wastewater. Int. J. Environ. Health. Res. 16(6):405–418.
- Di Giovanni, G.D. Hoffman, R.M. and Sturbaum, G.D. (2014) Cryptosporidium genotyping workshop and round robin. Water Research Foundation, Denver, Colorado.
- Dillingham, R.A., Lima, A.A. and Guerrant, R.L. (2002). Cryptosporidiosis: epidemiology and impact. Microbes Infect., 4(10):1059–1066.
- Dorner, S.M., Anderson, W.B., Gaulin, T., Candon, H.L., Slawson, R.M., Payment, P. and Huck, P.M. (2007). Pathogen and indicator variability in a heavily impacted watershed. J. Water Health, 5(2):241–257.
- Douglas, I. (2009). Using quantitative microbial risk assessment (QMRA) to optimize drinking water treatment. In: Proceedings of the AWWA water quality technology conference & exposition, Seattle, WA, November 16–18, 2009. American Water Works Association, Denver, Colorado.
- Drayna, P., McLellan, S.L., Simpson, P., Li, S.H. and Gorelick, M.H. (2010). Association between rainfall and pediatric emergency department visits for acute gastrointestinal illness. Environ. Health Perspect., 118(10): 1439-1443.
- Drescher, A.C., Greene, D.M. and Gadgil, A.J. (2001). Cryptosporidium inactivation by low-pressure UV in a water disinfection device. J. Environ. Health, 64(3):31–35.
- D'Souza, N.M. and Mawson, A.J. (2005). Membrane cleaning in the dairy industry: A review. Crit. Rev. Food Sci. Nutr., 45(2): 125-134.
- Dubey, J.P. (1998). Toxoplasma gondii oocyst survival under defined temperatures. J. Parasitol., 84(4):862–865.
- Dugan, N.R., Fox, K.R., Owens, J.H. and Miltner, R.J. (2001). Controlling Cryptosporidium Oocysts using Conventional Treatment. J. Am. Water Works Assoc., 93(12):64–76.
- Dullemont, Y.J., Schijven, J.F., Hijnen, W.A.M., Colin, M., Magic-Knezev, A. and Oorthuizen, W.A. (2006). Removal of microorganisms by slow sand filtration. In: Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham and M.R. Collins (eds.). IWA Publishing, London, United Kingdom. pp. 12–20.
- DuPont, H.L., Chappell, C.L., Sterling, C.R., Okhuysen, P.C., Rose, J.B. and Jakubowski, W. (1995). The infectivity of Cryptosporidium parvum in healthy volunteers. N. Engl. J. Med., 332:855–859.
- DVGW (2006a). German national standard: DVWG W 294-1:2006: UV disinfection equipment for water supply systems – Part 1: Design and construction, function and operation. Deutscher Verein des Gas und Wasserfachs e.V., Bonn, Germany.
- DVGW (2006b). German national standard: DVWG W 294-2:2006: UV disinfection equipment for water supply systems – Part 2: Testing (construction, function and efficiency). Deutscher Verein des Gas und Wasserfachs e.V., Bonn, Germany.
- DVGW (2006c). German national standard: DVWG W 294-3:2006: UV disinfection equipment for water supply systems – Part 3: Measuring windows and sensors for monitoring UV disinfection equipment – Requirements, testing and calibration. Deutscher Verein des Gas und Wasserfachs e.V., Bonn, Germany.
- Eberhard, M.L., Ortega, Y.R., Hanes, D.E., Nace, E.K., Do, R.Q., Robl, M.G., Won, K.Y., Gavidia, C., Sass, N.L., Mansfield, K., Gozalo, A., Griffiths, J., Gilman, R., Sterling, C.R. and Arrowood, M.J. (2000). Attempts to establish experimental Cyclospora cayetanensis infection in laboratory animals. J. Parasitol., 86(3):577–582.
- Edge, T.A., Khan, I.U.H., Bouchard, R., Guo, J., Hill, S., Locas, A., Moore, L., Neumann, N., Nowak, E., Payment, P., Yang, R., Yerubandi, R. and Watson, S. (2013). Occurrence of waterborne pathogens and Escherichia coli at offshore drinking water intakes in Lake Ontario. Appl. Environ. Microbiol., 79(19):5799–5813.
- Edzwald, J.K. (2010). Dissolved air flotation and me. Water Res., 44(7):2077–2106.
- Edzwald, J.K. and Kelley, M.B. (1998). Control of Cryptosporidium: From reservoirs to clarifiers to filters. Water Sci. Technol., 37(2):1–8.
- Edzwald, J.K., Bottero, J.Y., Ives, K.J. and Klute, R. (1998). Particle alteration and particle production processes. In: Treatment process selection for particle removal. J.B. McEwen (ed.). AWWA Research Foundation and International Water Supply Association, Denver, Colorado. pp. 73–122.
- Edzwald, J.K., Tobiason, J.E., Parento, L.M., Kelley, M.B., Kaminski, G.S., Dunn, H.J. and Gallant, P.B. (1999). Clarification and filtration performance for removal of Giardia and Cryptosporidium. In: Proceedings of the AWWA water quality technology conference. American Water Works Association, Denver, Colorado.
- Edzwald, J.K., Tobiason, J.E., Parento, L.M., Kelley, M.B., Kaminski, G.S., Dunn, H.J. and Gallant, P.B. (2000). Giardia and Cryptosporidium removals by clarification and filtration under challenge conditions. J. Am. Water Works Assoc., 92(12):70–84.
- Edzwald, J.K., Tobiason, J.E., Udden, C.T., Kaminski, G.S., Dunn, H.J., Gallant, P.B. and Kelley, M.B. (2003). Evaluation of the effect of recycle of waste filter backwash water on plant removals of Cryptosporidium. J. Water Supply Res. Technol. AQUA, 52(4):243–258.
- Efstratiou, A., Ongerth, J.E. and Karanis, P. (2017). Waterborne transmission of protozoan parasites: review of worldwide outbreaks – an update 2011-2016. Water Res., 114: 14–22.
- Eligio-García, L., Cortes-Campos, A. and Jiménez-Cardoso, E. (2005). Genotype of Giardia intestinalis isolates from children and dogs and its relationship to host origin. Parasitol. Res., 97(1):1–6.
- Emelko, M.B. (2003). Removal of viable and inactivated Cryptosporidium by dual- and tri-media filtration. Water Res., 37(12):2998–3008.
- Emelko, M.B. and Huck, P.M. (2004). Microspheres as surrogates for Cryptosporidium filtration. J. Am. Water Works Assoc., 96(3): 94–105.
- Emelko, M.B., Huck, P.M. and Slawson, R.M. (1999). Design and operational strategies for optimizing Cryptosporidium removal by filters. In: Proceedings of the AWWA water quality technology conference. American Water Works Association, Denver, Colorado.
- Emelko, M.B., Huck, P.M. and Douglas, I.P. (2003a). Cryptosporidium and microsphere removal during late-in-cycle filtration. J. Am. Water Works Assoc., 95(5):173–182.
- Emelko, M.B., Watling, M.T. and Coté, M.M. (2003b). Laboratory and field strategies for assessing pathogen removal by riverbank filtration. In: Second international riverbank filtration conference program and abstracts. National Water Research Institute, Fountain Valley, CA.
- Emelko, M.B., Huck, P.M. and Coffey, B.M. (2005). A review of Cryptosporidium removal by granular media filtration. J. Am. Water Works Assoc., 95(12):101–115.
- Emelko, M.B., Schmidt,. P.J. and Roberson, J.A. (2008). Quantification of uncertainty in microbial data: reporting and regulatory implications. J. Am. Water Works Assoc., 100(3):94–104.
- Emelko, M.B., Schmidt, P.J. and Reilly P.M. (2010a). Particle and microorganism enumeration data: Enabling quantitative rigor and judicious interpretation. Environ. Sci. Technol., 44(5):1720–1727.
- Emelko, M.B., Tufenkji, N., Stone, M., Rudolph, D. and Marsalek, J. (2010b). Mitigation of urban stormwater and polluted river water impacts on water quality with riverbank filtration. In: Effects of urbanization on groundwater: An engineering case-based approach for sustainable development. N-B. Chang (ed.). ASCE Publications, Reston, VA. pp. 165–198.
- Enriquez, F.J. and Riggs, M.W. (1998). Role of immunoglobulin A monoclonal antibodies against P23 in controlling murine Cryptosporidium parvum infection. Infect. Immunol., 66(9):4469–4473.
- EPCOR. (2005). Edmonton water performance report. EPCOR Water Services Inc., Edmonton, Alberta. Available at: www.epcor.ca
- Erlandsen, S.L. and Bemrick, W.J. (1988). Waterborne giardiasis: sources of Giardia cysts and evidence pertaining to their implication in human infection. In: Advances in Giardia research. P.M. Wallis and B.R. Hammond (eds.). University of Calgary Press, Calgary, Alberta. pp. 227–236.
- Erlandsen, S.L., Sherlock, L.A., Januschka, M., Schupp, D.G., Schaefer, F.W., III, Jakubowski, W. and Bemrick, W.J. (1988). Cross-species transmission of Giardia spp.: inoculation of beavers and muskrats with cysts of human, beaver, mouse and muskrat origin. Appl. Environ. Microbiol., 54:2777–2785.
- Eroglu, F. and Koltas, I.S. (2010). Evaluation of the transmission mode of B. hominis by using PCR method. Parasitol. Res., 107:841–845.
- Farkas, K., Plutzer, J., Moltchanova, E., Török, A., Varró, M.J., Domokos, K., Frost, F. and Hunter, P.R. (2015). Serological responses to Cryptosporidium antigens in inhabitants of Hungary using conventionally filtered surface water and riverbank filtered drinking water. Epidemiol. Infect., 143(13): 2743-2747.
- Farthing, M.J.G. (1989). Giardiasis as a disease. In: Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, United Kingdom. pp. 15–37.
- Farthing, M.J.G. (1992). Giardia comes of age: progress in epidemiology, immunology and chemotherapy. J. Antimicrob. Chemother., 30(5):563–566.
- Farthing, M.J. (2000). Clinical aspects of human cryptosporidiosis. Contrib. Microbiol., 6:50–74.
- Faulkner, B.R., Olivas, Y., Ware, M.W., Roberts, M.G., Groves, J.F., Bates, K.S. and McCarty, S.L. (2010). Removal efficiencies and attachment coefficients for Cryptosporidium in sandy alluvial riverbank sediment. Water Res., 44(9): 2725–2734.
- Fayer, R. (2004). Cryptosporidium: a water-borne zoonotic parasite. Vet. Parasitol., 126(1–2):37.
- Fayer, R. and Xiao, L. (2008). Cryptosporidium and cryptosporidiosis. 2nd edition. CRC Press, Boca Raton, Florida.
- Fayer, R., Morgan, U. and Upton, S.J. (2000). Epidemiology of Cryptosporidium: transmission, detection and identification. Int. J. Parasitol., 30(12–13):1305–1322.
- Fayer, R., Santín, M. and Trout, J.M. (2008). Cryptosporidium ryanae n. sp. (Apicomplexa: Cryptosporidiidae) in cattle (Bos taurus). Vet. Parasitol., 156(3–4):191–198.
- Feng, Y., Alderisio, K.A., Yang, W., Blancero, L.A., Kuhne, W.G., Nadareski, C.A., Reid, M. and Xiao, L. (2007). Cryptosporidium genotypes in wildlife from a New York watershed. Appl. Environ. Microbiol., 73(20):6475–6483.
- Ferguson, C., Kaucner, C., Krogh, M., Deere, D. and Warnecke, M. (2004). Comparison of methods for the concentration of Cryptosporidium oocysts and Giardia cysts from raw waters. Can. J. Microbiol., 50(9):675–682.
- Ferrari, B.C. and Veal, D. (2003) Analysis-only detection of Giardia by combining immunomagnetic separation and two-color flow cytometry. Cytometry, 51(2):133–5.
- Filice, F.P. (1952). Studies on the cytology and life history of a Giardia from a laboratory rat. Univ. Calif. Publ. Zool., 57:53–146.
- Finch, G.R., Daniels, C.W., Black, E.K., Schaefer, F.W., and Belosevic, M. (1993). Dose response of Cryptosporidium parvum in outbred neonatal CD-1 mice. Appl. Environ. Microbiol., 59:3661–3665.
- Finch, G.R., Black, E.K., Gyürék, L.L. and Belosevic, M. (1994). Ozone disinfection of Giardia and Cryptosporidium. American Water Works Association Research Foundation and American Water Works Association, Denver, Colorado.
- Finch, G.R., Gyürék, L., Liyanage, L.R.J. and Belosevic, M. (1997). Effect of various disinfection methods on the inactivation of Cryptosporidium. American Water Works Association Research Foundation, Denver, Colorado. 66 pp.
- Fisher, I., Angles, M., Chandy, J., Cox, P., Warnecke, M., Kasti, G. and Jegatheesan, V. (2000). Biofilms – A sticky situation for drinking water? Water, 27(2):33–37.
- Fleming, K.K., Dugandzic, J.P., LeChevallier, M.W. and Gullick, R.W. (2006). Susceptibility of distribution systems to negative pressure transients. Awwa Research Foundation and American Water Works Association, Denver, CO and IWA Publishing.
- Fogel, D., Isaac-Renton, J., Guasparini, R., Moorehead, W. and Ongerth, J. (1993). Removing Giardia and Cryptosporidium by slow sand filtration. J. Am. Water Works Assoc., 85(11):77–84.
- Fontaine, M. and Guillot, E. (2003). An immunomagnetic separation–real-time PCR method for quantification of Cryptosporidium parvum in water samples. J. Microbiol. Methods, 54(1):29–36.
- Fox, L.M. and Saravolatz, L.D. (2005). Nitazoxanide: a new thiazolide antiparasitic agent. Clin. Infect. Dis., 40(8):1173–1180.
- Freire-Santos, F., Oteiza-Lopez, A.M., Vergara-Castiblanco, C.A. and Ares-Mazas, E. (2000). Study of the combined influence of environmental factors on viability of Cryptosporidium parvum oocysts in water evaluated by fluorogenic vital dyes and excystation techniques. Vet. Parasitol., 89(4):253–259.
- Fricker, C. and Clancy, J. (1998). Crypto’s protocol prospects. Water Qual. Int., May/June:11–15.
- Friedman, M., Radder, L, Harrison, S., Howie, D., Britton, M., Boyd, G., Wang, H., Gullick, R., LeChevallier, M., Wood, D. and Funk, J. (2004). Verification and Control of pressure transients and intrusion in distribution systems. Awwa Research Foundation, Denver, Colorado.
- Füchslin, H.P., Kötzsch, S. and Egli, T. (2012) Cryptosporidium spp. in drinking water: samples from rural sites in Switzerland. Swiss Med. Wkly., 142:w13683.
- Furtado, C., Adak, G.K., Stuart, J.M., Wall, P.G., Evans, H.S. and Casemore, D.P. (1998). Outbreaks of waterborne infectious intestinal disease in England and Wales, 1992–95. Epidemiol. Infect., 121(1):109–119.
- Gale, P. (1996). Developments in microbiological risk assessment models for drinking water—a short review. J. Appl. Bacteriol., 81:403–410.
- Gallas-Lindemann, C., Sotiriadou, I., Plutzer, J. and Karanis, P. (2013). Prevalence and distribution of Cryptosporidium and Giardia in wastewater and the surface, drinking and groundwaters in the Lower Rhine, Germany. Epidemiol. Infect., 141:9–21.
- Gammie, L., Goatcher, L. and Fok, N. (2000). A Giardia/Cryptosporidium near miss? In: Proceedings of the 8th National Conference on Drinking Water, Quebec City, Quebec, October 28–30, 1998. Canadian Water and Wastewater Association, Ottawa, Ontario.
- Gaut, S., Robertson, L., Gjerde, B., Dagestad, A. and Brattli, B. (2008). Occurrence of Cryptosporidium oocysts and Giardia cysts in Norwegian groundwater wells in bedrock. J. Water Health, 6(3):383–388.
- Gillin, F.D. and Diamond, L.S. (1980). Entamoeba histolytica and Entamoeba invadens: effects of temperature and oxygen tension on growth and survival. Exp. Parasitol., 49(3):328–338.
- Glaberman, S., Moore, J., Lowery, C., Chalmers, R., Sulaiman, I., Elwin, K., Rooney, P.J., Millar, B.C., Dooley, J.S., Lal, A.A. and Xiao, L. (2002). Three drinking water associated Cryptosporidiosis outbreaks, Northern Ireland. Emerg. Infect. Dis., 8(6): 631-633.
- GLUMRB (2012). Recommended standards for water works. Health Education Services, Great Lakes – Upper Mississippi River Board of State and Provincial Public Health and Environmental Managers, Albany, New York.
- Gobet, P. and Toze, S. (2001). Relevance of Cryptosporidium parvum hsp70 mRNA amplification as a tool to discriminate between viable and dead oocysts. J. Parasitol., 87(1):226–229.
- Gold, D., Stein, B. and Tzipori, S. (2001). The utilization of sodium taurocholate in excystation of Cryptosporidium parvum and infection of tissue culture. J. Parasitol., 87(5):997–1000.
- Gollnitz, W.D., Clancy, J.L. and Garner, S.C. (1997). Reduction of microscopic particulates by aquifers. J. Am. Water Works Assoc., 89(11):84–93.
- Gollnitz, W.D., Clancy, J.L., Whitteberry, B.L. and Vogt, J.A. (2003). RBF as a Microbial Treatment Process. J. Am. Water Works Assoc., 95(12):56–66.
- Gollnitz, W.D., Whitteberry, B.L. and Vogt, J.A. (2004). Riverbank filtration: Induced Infiltration and Groundwater Quality. J. Am. Water Works Assoc., 96(12):98–110.
- Gollnitz, W.D., Clancy, J.L., McEven, J.B. and Garner, S.C. (2005). Riverbank filtration for IESWTR compliance. J. Am. Water Works Assoc., 97(12):64–76.
- Graczyk, T.K., Cranfield, M.R., Fayer, R. and Anderson, M.S. (1996). Viability and infectivity of Cryptosporidium parvum oocysts are retained upon intestinal passage through a refractory avian host. Appl. Environ. Microbiol., 62:3234–3237.
- Graczyk, T.K., Fayer, R., Trout, J.M., Lewis, E.J., Farley, C.A., Sulaiman, I. and Lal, A.A. (1998). Giardia sp. cysts and infectious Cryptosporidium parvum oocysts in the feces of migratory Canada geese (Branta canadensis). Appl. Environ. Microbiol., 64:2736–2738.
- Graczyk, T.K., Majewska, A.C. and Schwab, K.J. (2008). The role of birds in dissemination of human waterborne enteropathogens. Trends Parasitol., 24(2):55–59.
- Gregory, R. and Edzwald, J.K. (2011). Sedimentation and flotation. In: Water Quality and Treatment. J.K. Edzwald (ed.). McGraw Hill, New York. pp. 9.1–9.98 (Chapter 9).
- Greinert, J., Furtado, D., Smith, J., Monte Barardi, C. and Simões, C. (2004). Detection of Cryptosporidium oocysts and Giardia cysts in swimming pool filter backwash water concentrates by flocculation and immunomagnetic separation. Int. J. Environ. Health Res.,14(6):395–404.
- Griffin, D.W., Gibson, C.J. III, Lipp, E.K., Riley, K., Paul, J.H. III and Rose, J.B. (1999). Detection of viral pathogens by reverse transcriptase PCR and of microbial indicators by standard methods in the canals of the Florida Keys. Appl. Environ. Microbiol., 65(9):4118–4125.
- Guo, H., Wyart, Y., Perot, J., Nauleau, F. and Moulin, P. (2010). Low-pressure membrane integrity tests for drinking water treatment: A review. Water Res., 44(1):41–57.
- Gupta, M. and Haas, C.N. (2004). The Milwaukee Cryptosporidium outbreak: assessment of incubation time and daily attack rate. J. Water Health, 2(2):59–69.
- Gupta, V., Johnson, W.P., Shafieian, P., Ryu, H., Alum, A., Abbaszadegan, M., Hubbs, S.A. and Rauch-Williams, T. (2009). Riverbank filtration: Comparison of pilot scale transport with theory. Environ. Sci. Technol., 43(3):669–676.
- Gutiérrez-Aguirre, I., Rački, N., Dreo, T., Ravnikar, M. (2015). Droplet digital PCR for absolute quantification of pathogens. Christophe Lacomme (ed.) Plant Pathology: Techniques and Protocols, Methods in Molecular Biology. Vol 1302. Springer Science Business Media, New York.
- Guy, R.A., Payment, P., Krull, U.J. and Horgen, P.A. (2003). Real-time PCR for quantification of Giardia and Cryptosporidium in environmental water samples and sewage. Appl. Environ. Microbiol., 69(9):5178–5185.
- Guyot, K., Follet-Dumoulin, A., Lelievre, E., Sarfati, C., Rabodonirina, M., Nevez, G., Cailliez, J.C., Camus, D. and Dei-Cas, E. (2001). Molecular characterization of Cryptosporidium isolates obtained from humans in France. J. Clin. Microbiol., 39:3472–3480.
- Guzman-Herrador, B., Carlander, A., Ethelberg, S., Freiesleben de Blasio, B., Kuusi, M., Lund, V., Löfdahl, M., MacDonald, E., Nichols, G., Schönning, C., Sudre, B., Trönnberg, L., Vold, L., Semenza, J.C. and Nygård, K. (2015). Waterborne outbreaks in the Nordic countries, 1998 to 2012. Euro Surveill., 20(24):1–10.
- Haas, C.N., Rose, J.B. and Gerba, C.P. (1999). Quantitative microbial risk assessment. John Wiley, New York, New York.
- Hall, T., Pressdee, J., Gregory, R. and Murray, K. (1995). Cryptosporidium removal during water treatment using dissolved air flotation. Water Sci. Technol., 31(3–4):125–135.
- Hallier-Soulier, S. and Guillot, E. (2000). Detection of cryptosporidia and Cryptosporidium parvum oocysts in environmental water samples by immunomagnetic separation–polymerase chain reaction. J. Appl. Microbiol., 89(1):5–10.
- Hallier-Soulier, S. and Guillot, E. (2003). An immunomagnetic separation–reverse transcription polymerase chain reaction (IMS-RT-PCR) test for sensitive and rapid detection of viable waterborne Cryptosporidium parvum. Environ. Microbiol., 5(7):592–598.
- Hancock, C.M., Rose, J.B. and Callahan, M. (1998). Prevalence of Cryptosporidium and Giardia in US groundwaters. J. Am. Water Works Assoc., 90(3):58–61.
- Hargy, T. and Landry, L. (2007). An Evaluation of the effects of Coquitlam source water turbidity on ozone and UV disinfection. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
- Harrington, G.W., Chen, H-W., Harris, A.J., Xagoraraki, I., Battigelli, D.A. and Standridge, J.H. (2001). Removal of emerging waterborne pathogens. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- Harter, T. and Wagner, S. (2000). Colloid transport and filtration of Cryptosporidium parvum in sandy soils and aquifer sediments. Environ. Sci. Technol., 34(1):62–70.
- Harvey, R.W., Metge, D.W., Shapiro, A.M., Renken, R.A., Osborn, C.L., Ryan, J.N., Cunningham, K.J. and Landkamer, L. (2008). Pathogen and chemical transport in the karst limestone of the Biscayne aquifer: 3. Use of microspheres to estimate the transport potential of Cryptosporidium parvum oocysts. Water Resour. Res., 44(8).
- Harvey, R.W., Metge, D.W., Barber, L.B. and Aiken, G.R. (2010). Effects of altered groundwater chemistry upon the pH-dependency and magnitude of bacterial attachment during transport within an organically contaminated sandy aquifer. Water Res., 44(4):1062–1071.
- Havelaar, A. and Melse, J.M. (2003). Quantifying public health risk in the WHO Guidelines for drinking-water quality: a burden of disease approach. Rijkinstituut voor Volskgezondheid en Milieu, Bilthoven, Netherlands (RIVM Report 734301022).
- Headd, B. and Bradford, S.A. (2016). Use of aerobic spores as a surrogate for Cryptosporidium oocysts in drinking water supplies. Water Res., 90: 185-202.
- Health Canada. (2006). Guidelines for Canadian drinking water quality: Guideline technical document — Trihalomethanes. Water Quality and Health Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-trihalomethanes-eau/index-eng.php
- Health Canada (2008a). Guidelines for Canadian drinking water quality: Guideline technical document — Chlorite and chlorate. Water Quality and Health Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-chlorite-chlorate-eau/index-eng.php
- Health Canada (2008b). Guidelines for Canadian drinking water quality: Guideline technical document — Haloacetic Acids. Water Quality and Health Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-haloacetic-haloacetique-eau/index-eng.php
- Health Canada (2011a). Guidelines for Canadian drinking water quality: Guideline technical document — Enteric Viruses. Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-enteric-virus-enterique-eau/index-eng.php
- Health Canada (2011b). Guidelines for Canadian drinking water quality: Guideline technical document — N-Nitrosodimethylamine (NDMA). Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-nitrosodimethylamine-eau/index-eng.php
- Health Canada (2012a). Guidelines for Canadian recreational water quality, Third edition. Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-recreational-recreative-eau/index-eng.php
- Health Canada (2012b). Guidelines for Canadian drinking water quality: Guideline technical document —Escherichia coli. Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-ecoli-eau/index-eng.php
- Health Canada (2012c). Guidelines for Canadian drinking water quality: Guideline technical document—Total coliforms. Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-coliforms-coliformes-eau/index-eng.php
- Health Canada (2012d). Guidelines for Canadian drinking water quality: Guideline technical document — Turbidity. Water, Air and Climate Change Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: http://healthycanadians.gc.ca/publications/healthy-living-vie-saine/water-turbidity-turbidite-eau/index-eng.php
- Health Canada (2016). Guidelines for Canadian drinking water quality: Guideline technical document — Bromate. Water and Air Quality Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: www.canada.ca/en/health-canada/services/environmental-workplace-health/reports-publications/water-quality.html
- Health Canada (2018). Guidance on the use of quantitative microbial risk assessment in drinking water. Water and Air Quality Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: https://www.canada.ca/en/health-canada/programs/consultations-guidance-quantitative-microbial-risk-assessment-drinking-water/document.html
- Heaselgrave, W. and Kilvington, S. (2011). The efficacy of simulated solar disinfection (SODIS) against Ascaris, Giardia, Acanthamoeba, Naeglaria, Entamoeba, and Cryptosporidium. Acta Trop., 119(2–3):138–143.
- Heller, L. and Ladeira Alves de Brito, L. (2006). The retention of Cryptosporidium sp. oocysts at varying depths in slow sand filters: A pilot study. J. Water Supply Res. Technol. AQUA, 55(3):193–206.
- Hendricks, D.W., Clunie, W.F., Sturbaum, G.D., Klein, D.A., Champlin, T.L., Kugrens, P., Hirsh, J., McCourt, B., Nordby, G.R., Sobsey, M.D., Hunt, J. and Allen, M.J. (2005). Filtration removals of microorganisms and particles. J. Environ. Eng., 131(12):1621–1632.
- Herwaldt, B.L., Craun, G.F., Stokes, S.L. and Juranek, D.D (1992). Outbreaks of waterborne disease in the United States, 1989 – 1990. J. Am. Wat. Wks. Assoc., 84: 129–135.
- Hewlett, E.L., Andrews, J.S., Ruffier, J. and Schaefer, F.W., III. (1982). Experimental infection of mongrel dogs with Giardia lamblia cysts and cultured trophozoites. J. Infect. Dis., 145:89–93.
- Heyworth, M.F. (1988). Immunology of Giardia infections. In: Advances in Giardia research. P.M. Wallis and B.R. Hammond (eds.). University of Calgary Press, Calgary, Alberta. pp. 45–48.
- Hibler, C.P., Hancock, C.M., Perger, L.M., Wegrzyn, J.G. and Swabby, K.D. (1987). Inactivation of Giardia cysts with chlorine at 0.5 to 5.0°C. American Water Works Association, Denver, Colorado. 39 pp. (Technical Research Series).
- Hijjawi, N. (2010). Cryptosporidium: New developments in cell culture. Exp. Parasitol., 124:54–60.
- Hijjawi, N.S., Meloni, B.P., Morgan, U.M. and Thompson, R.C. (2001). Complete development and long-term maintenance of Cryptosporidium parvum human and cattle genotypes in cell culture. Int. J. Parasitol., 31(10):1048–1055.
- Hijjawi, N.S., Meloni, B.P., Ryan, U.M., Olson, M.E. and Thompson, R.C. (2002). Successful in vitro cultivation of Cryptosporidium andersoni: evidence for the existence of novel extracellular stages in the life cycle and implications for the classification of Cryptosporidium. Int. J. Parasitol., 32(14):1719–1726.
- Hijjawi, N.S., Meloni, B.P., Ng’anzo, M., Ryan, U.M., Olson, M.E., Cox, P.T., Monis, P.T. and Thompson, R.C. (2004). Complete development of Cryptosporidium parvum in host cell–free culture. Int. J. Parasitol., 34(7):769–777.
- Hijnen, W.A.M. and Medema, G. (2007a). Microbial elimination capacity of conventional water treatment for viruses, bacteria and protozoan (oo)cysts. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, CO.
- Hijnen, W.A.M. and Medema, G. (2007b). Elimination of micro-organisms by drinking water treatment process: A review. Kiwa Water Research, Nieuwegein, The Netherlands.
- Hijnen, W.A.M., Brouwer-Hanzens, A., Charles, K.J. and Medema, G.J. (2005). Transport of MS2 Phage, Escherichia coli, Clostridium perfringens, Cryptosporidium parvum, and Giardia intestinalis in a gravel and sandy soil. Environ. Sci. Technol., 39(20):7860–7868.
- Hijnen, W.A.M., Beerendonk, E.F. and Medema, G.J. (2006). Inactivation credit of UV radiation for viruses, bacteria and protozoan (oo)cysts in water: A review. Water Res. 40(1):3–22.
- Hijnen, W.A.M., Dullemont, Y.J., Schijven, J.F., Brouwer-Hanzens, A.J., Rosielle, M. and Medema, G. (2007). Removal and fate of Cryptosporidium parvum, Clostridium perfringens and small-sized centric diatoms (Stephanodiscus hantzschii) in slow sand filters. Water Res., 41(10):2151–2162.
- Hijnen, W.A.M., Suylen, G.M.H., Bahlman, J.A., Brouwer-Hanzens, A. and Medema, G.J. (2010). GAC adsorption filters as barriers for viruses, bacteria and protozoan (oo)cysts in water treatment. Water Res., 44(4): 1224–1234.
- Hilborn, E.D., Wade, T., Hicks, L., Garrison, L. and Gargano, J. (2013). Surveillance for waternorne disease outbreaks associated with drinking water and other nonrecreational water – United States, 2009 – 2010. Centre for Disease Control and Prevention, Atlanta.
- Hiltz, T. (2015). Personal communication. Town of Bridgewater, Nova Scotia.
- Hoff, J.C. (1986). Inactivation of microbial agents by chemical disinfectants. U.S. Environmental Protection Agency, Cincinnati, OH (Report No. EPA/600/S286/067).
- Homan, W.L. and Mank, T.G. (2001). Human giardiasis: genotype linked differences in clinical symptomatology. Int. J. Parasitol., 31(8):822–826.
- Hopkins, R.S., Shillam, P., Gaspard, B., Eisnach, L. and Karlin, R.J. (1985). Waterborne disease in Colorado: three years’ surveillance and 18 outbreaks. Am. J. Public Health, 75(3): 254–257.
- Hoque, M.E., Hope, V.T., Scragg, R. and Kjellstrom, T. (2003). Children at risk of giardiasis in Auckland: a case–control analysis. Epidemiol. Infect., 131(1):655–662.
- Hörman, A., Rimhanen-Finne, R., Maunula, L., von Bonsdorff, C., Torvela, N., Heikinheimo, A. and Hänninen, M. (2004). Campylobacter spp., Giardia spp., Cryptosporidium spp., noroviruses, and indicator organisms in surface water in southwestern Finland, 2000–2001. Appl. Environ. Microbiol., 70(1):87–95.
- Howe, A.D., Forster, S., Morton, S., Marshall, R., Osborn, K.S., Wright, P. and Hunter, P.R. (2002). Cryptosporidium oocysts in a water supply associated with a cryptosporidiosis outbreak. Emerg. Infect. Dis., 8(6): 619–624.
- HPSC. (2007). Annual report 2006. Health Protection Surveillance Centre, Dublin.
- Hrudey, S.E. and Hrudey, E.L. (2004). Safe drinking water: lessons from recent outbreaks in affluent nations. IWA Publishing, London, United Kingdom. 486 pp.
- Hsu, B.M. and Huang, C. (2001). Performances of the immunomagnetic separation method for Cryptosporidium in water under various operation conditions. Biotechnol. Prog., 17(6):1114–1118.
- Hsu, B.M., Wu, N.M., Jang, H.D., Shih, F.C., Wan, M.T. and Kung, C.M. (2005). Using the flow cytometry to quantify the Giardia cysts and Cryptosporidium oocysts in water samples. Environ. Monit. Assess., 104(1–3):155–162.
- Hu, J., Feng, Y., Ong, S.L., Ng, W.J., Song, L., Tan, X. and Chu, X. (2004). Improvement of recoveries for the determination of protozoa Cryptosporidium and Giardia in water using Method 1623. J. Microbiol. Methods, 58(3):321–325.
- Hubbs, S.A. (2010). Laboratory-simulated RBF particle removal processes. J. Am. Water Works Assoc., 102(12): 57–66.
- Huck, P.M., Emelko, M.B., Coffey, B.M., Maurizio, D. and O’Melia, C. (2001). Filter operation effects on pathogen passage. American Water Works Association Research Foundation, Denver, Colorado (Report No. 90874).
- Huck, P.M., Coffey, B.M., Emelko, M.B., Maurizio, D.D., Slawson, R.M., Anderson, W.B., Van Den Oever, J., Douglas, I.P. and O’Melia, C.R. (2002). Effects of filter operation on Cryptosporidium removal. J. Am. Water Works Assoc., 94(6):97–111.
- Huck, P.M. and Coffey, B.M. (2004). The importance of robustness in drinking-water systems. J. Toxicol. Environ. Health A, 67(20–22):1581–1590.
- Huck, P. and Sozański, M. (2011). 3.16 – Chemical basis for water technology. In: Treatise on water science. P. Wilderer (ed.). Oxford: Elsevier. pp. 429–469.
- Hunter, P. (1999). Outbreak of cryptosporidiosis in north west England. Eurosurveill. Wkly, 3(20), May 13, 1999. Available from: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=1403.
- Hunter, P.R. and Nichols, G. (2002). Epidemiology and clinical features of Cryptosporidium infection in immunocompromised patients. Clin. Microbiol. Rev., 15(1):145–154.
- Hunter, P.R. and Thompson, R.C. (2005). The zoonotic transmission of Giardia and Cryptosporidium. Int. J. Parasitol., 35(11–12):1181–1190.
- Hynds, P.D., Thomas, M.K. and Pintar, K.D.M. (2014). Contamination of groundwater systems in the US and Canada by enteric pathogens, 1990–2013: a review and pooled-analysis. PLOSOne, 9(5): e93301.
- Isaac-Renton, J.L., Cordeiro, C., Sarafis, K. and Shahriari, H. (1993). Characterization of Giardia duodenalis isolates from a waterborne outbreak. J. Infect. Dis., 167:431–440.
- Isaac-Renton, J.L., Lewis, L.F., Ong, C.S. and Nulsen, M.F. (1994). A second community outbreak of waterborne giardiasis in Canada and serological investigation of patients. Trans. R. Soc. Trop. Med. Hyg., 88(4):395–399.
- Isaac-Renton, J., Moorehead, W. and Ross, A. (1996). Longitudinal studies of Giardia contamination in two community drinking water supplies: cyst levels, parasite viability and health impact. Appl. Environ. Microbiol., 62:47–54.
- Isaac-Renton, J., Bowie, W.R., King, A., Irwin, G.S., Ong, C.S., Fung, C.P., Shokeir, M.O. and Dubey, J.P. (1998). Detection of Toxoplasma gondii oocysts in drinking water. Appl. Environ. Microbiol., 64(6):2278–2280.
- Isaac-Renton, J., Blatherwick, J., Bowie, W.R., Fyfe, M., Khan, M., Li, A., King, A., McLean, M., Medd, L., Moorehead, W., Ong, C.S., Robertson, W. (1999). Epidemic and endemic seroprevalence of antibodies to Cryptosporidium and Giardia in residents of three communities with different drinking water supplies. Am. J. Trop. Med. Hyg., 60(4):578–583.
- ISO. (2006). ISO 15553:2006 Water Quality – Isolation and identification of Cryptosporidium oocysts and Giardia cysts from water.
- Iturriaga, R., Zhang, S., Sonek, G.J. and Stibbs, H. (2001). Detection of respiratory enzyme activity in Giardia cysts and Cryptosporidium oocysts using redox dyes and immunofluorescence techniques. J. Microbiol. Methods, 46(1):19–28.
- Jacangelo, J.G., Laîné, J-M., Carns, K.E., Cummings, E.W. and Mallevialle, J. (1991). Low-pressure membrane filtration for removing Giardia and microbial indicators. J. Am. Water Works Assoc., 83(9):97–106.
- Jacangelo, J.G., Adham, S. and Laîné, J-M. (1997). Membrane filtration for microbial removal. AWWA Research Foundation and American Water Works Association, Denver, CO.
- Jaidi, K., Barbeau, B., Carrière, A., Desjardins, R. and Prévost, M. (2009). Including operational data in QMRA model: development and impact of model inputs. J. Water Health, 7(1):77–95.
- Jakubowski, W. (1994). Personal communication. U.S. Environmental Protection Agency, Cincinnati, Ohio.
- Jenkins, M.B., Anguish, L.J., Bowman, D.D., Walker, M.J. and Ghiorse, W.C. (1997). Assessment of a dye permeability assay for determination of inactivation rates of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 63:3844–3850.
- Jenkins, M., Trout, J.M., Higgins, J., Dorsch, M., Veal, D. and Fayer, R. (2003). Comparison of tests for viable and infectious Cryptosporidium parvum oocysts. Parasitol. Res., 89:1–5.
- Jennings, P. and Rhatigan, A., (2002). Cryptosporidiosis outbreak in Ireland linked to public wate supply. Eurosurveillance, 6(22). Available from: www.eurosurveillance.org/ViewArticle.aspx?ArticleId=2089.
- Jephcott, A. E., Begg, N. T. and Baker, I. A. (1986). Outbreak of giardiasis associated with mains water in the United Kingdom. Lancet, 1(8483): 730–732.
- Joachim, A. (2004). Human cryptosporidiosis: an update with special emphasis on the situation in Europe. J. Vet. Med. B Infect. Dis. Vet. Public Health, 51(6):251–259.
- Joachim, A., Eckert, E., Petry, F., Bialek, R. and Daugschies, A. (2003). Comparison of viability assays for Cryptosporidium parvum oocysts after disinfection. Vet. Parasitol., 111(1):47–57.
- Johnson, A.M., Linden, K., Ciociola, K.M., De Leon, R., Widmer, G. and Rochelle, P.A. (2005). UV inactivation of Cryptosporidium hominis as measured in cell culture. Appl. Environ. Microbiol., 71(5):2800–2802.
- Johnson, A.M., Di Giovanni, G.D. and Rochelle, P.A. (2012). Comparison of assays for sensitive and reproducible detection of cell culture-infectious Cryptosporidium parvum and Cryptosporidium hominis in drinking water. Appl. Environ. Microbiol., 78(1):156–162.
- Johnson, W.T. (1998). Predicting Log removal performance of membrane systems using in-situ integrity testing. Filtr. Sep., 35(1):26–29.
- Johnson, W.P. and Logan, B.E. (1996). Enhanced Transport of bacteria in porous media by sediment-phase and aqueous-phase natural organic matter. Water Res., 30(4):923–931.
- Juranek, D.D. (1995). Cryptosporidiosis: sources of infection and guidelines for prevention. Clin. Infect. Dis., 21(Suppl.):S57–S61.
- Karanis, P., Kourenti, C. and Smith, H. (2007). Waterborne transmission of protozoan parasites: a worldwide review of outbreaks and lessons learnt. J. Water Health, 5(1):1–38.
- Karasudani, T., Aoki, S., Takeuchi, J., Okuyama, M., Oseto, M., Matsuura, S., Asai, T. and Inouye, H. (2001). Sensitive detection of Cryptosporidium oocysts in environmental water samples by reverse transcription–PCR. Jpn. J. Infect. Dis., 54(3):122–124.
- Karim, M.R., Abbaszadegan, M. and LeChevallier, M. (2003). Potential for pathogen intrusion during pressure transients. J. Am. Water Works Assoc., 95(5):134–146.
- Karim, H., Sylvain, S., Laurence, L., Lucien, H. and Henry-Michel, C. (2010). Comparison of three methods to concentration Giardia cysts and Cryptosporidium oocysts from surface and drinking waters. Water Sci. Technol., 62(1):196–201.
- Kato, S. and Bowman, D.D. (2002). Using flow cytometry to determine the viability of Cryptosporidium parvum oocysts extracted from spiked environmental samples in chambers. Parasitol. Res., 88(4):326–331.
- Kaucner, C. and Stinear, T. (1998). Sensitive and rapid detection of viable Giardia cysts and Cryptosporidium parvum oocysts in large-volume water samples with wound fiberglass cartridge filters and reverse transcription–PCR. Appl. Environ. Microbiol., 64(5):1743–1749.
- Kawamura, S. (2000). Integrated design and operation of water treatment facilities. 2nd edition. John Wiley & Sons, New York, New York.
- Keegan, A.R., Fanok, S., Monis, P.T. and Saint, C.P. (2003). Cell culture-Taqman PCR assay for evaluation of Cryptosporidium parvum disinfection. Appl. Environ. Microbiol., 69(5):2505–2511.
- Kent, G.P., Greenspan, J.R., Herndon, J.L., Mofenson, L.M., Harris, J.A., Eng, T.R. and Waskin, H.A. (1988). Epidemic giardiasis caused by a contaminated public water supply. Am. J. Public Health, 78(2): 139-143.
- Keserue, H.A., Füchslin, H.P. and Egli, T. (2011). Rapid detection and enumeration of Giardia lamblia cysts in water samples by immunomagnetic separation and flow cytometric analysis. Appl. Environ. Microbiol. 77(15): 5420–5427.
- Khaldi, S., Ratajczak, M., Gargala, G., Fournier, M., Berthe, T., Favennec, L. and Dupont, J.P. (2011). Intensive exploitation of a karst aquifer leads to Cryptosporidium water supply contamination. Water Res., 45:2906–2914.
- Kim, H.N., Walker, S.L. and Bradford, S.A. (2010). Coupled factors influencing the transport and retention of Cryptosporidium parvum oocysts in saturated porous media. Water Res., 44(4):1213–1223.
- Kirner, J.C., Littler, J.D. and Angelo, L.A. (1978). A waterborne outbreak of giardiasis in Camas, Washington. J. Am. Water Works Assoc., 70:35–40.
- King, B.J., Keegan, A.R., Monis, P.T. and Saint, C.P. (2005). Environmental temperature controls Cryptosporidium oocyst metabolic rate and associated retention of infectivity. Appl. Environ. Microbiol., 71(7):3848–3857.
- King, B.J., Keegan, A.R., Robinson, B.S. and Monis, P.T. (2011). Cryptosporidium cell culture infectivity assay design. Parasitology, 138(6):671–681.
- Kirmeyer, G.J., Friedman, M., Martel, K., Howie, D., LeChevallier, M., Abbaszadegan, M., Karim, M., Funk J. and Harbour, J. (2001). Pathogen intrusion into the distribution system. AWWA Research Foundation and American Water Works Association, Denver, CO.
- Kirmeyer, G.J., Thomure, T.M., Rahman, R., Marie, J.L, LeChevallier, M.W., Yang, J., Hughes, D.M. and Schneider, O. (2014). Effective microbial control strategies for main breaks and depressurization. Water Research Foundation, Denver, CO.
- Kollu, K. and Örmeci, B. (2012). Effect of particles and bioflocculation on ultraviolet disinfection of Escherichia coli. Water Res., 46(3):750–760.
- Kommineni, S.N., Bryck, J., Stringer, C., Stevens, C, Meyers, N., Karnik, B., Hoffman, R. and Sullivan, L. (2010). Evaluation of an emerging water treatment technology: ceramic membranes. Water Sci. Technol. Water Supply, 10(5):765–770.
- Korich, D.G., Mead, J.R., Madore, M.S., Sinclair, N.A. and Sterling, C.R. (1990). Effects of ozone, chlorine dioxide, chlorine, and monochloramine on Cryptosporidium parvum oocyst viability. Appl. Environ. Microbiol., 56(5):1423–1428.
- Korich, D.G., Marshall, M.M., Smith, H.V., O’Grady, J., Bukhari, Z., Fricker, C.R., Rosen, J.P. and Clancy, J.L. (2000). Inter-laboratory comparison of the CD-1 neonatal mouse logistic dose–response model for Cryptosporidium parvum oocysts. J. Eukaryot. Microbiol., 47(3):294–298.
- Kostrzynska, M., Sankey, M., Haack, E., Power, C., Aldom, J.E., Chagla, A.H., Unger, S., Palmateer, G., Lee, H., Trevors, J.T. and De Grandis, S.A. (1999). Three sample preparation protocols for polymerase chain reaction based detection of Cryptosporidium parvum in environmental samples. J. Microbiol. Methods, 35(1):65–71.
- Kramer, M.H., Herwaldt, B., Craun, G., Calderon, R. and Juranek, D. (1996). Waterborne disease: 1993 and 1994. J. Am. Wat. Wks Assoc., 88: 66-80.
- Krasner, S.W., Weinberg, H.S., Richardson, S.D., Salvador, J.P., Chinne, R., Sclimenti, M.J., Onstad, G.D. and Thruston, A.D. (2006). Occurrence of a new generation of disinfection byproducts. Environ. Sci. Technol., 40:7175–7185.
- Kruithof, J.C., Kamp, P.C., Folmer, H.C., Nederlof, M.M. and van Hoof, S.C.J.M. (2001). Development of a membrane integrity monitoring strategy for the UF/RO Heemskerk drinking water treatment plant. Water Sci. Technol. Water Supply, 1(5–6):261–271.
- Kucik, C.J., Martin, G.L. and Sortor, B.V. (2004). Common intestinal parasites. Am. Fam. Physician, 69(5):1161–1168.
- Kuehn, W. and Mueller, U. (2000). Riverbank filtration: An overview. J. Am. Water Works Assoc., 92(12):60–69.
- Kuhn, R.C., Rock, C.M. and Oshima, K.H. (2002). Effects of pH and magnetic material on immunomagnetic separation of Cryptosporidium oocysts from concentrated water samples. Appl. Environ. Microbiol., 68(4):2066–2070.
- Kundert, K. (2014). Alberta Flood 2013 – City of Calgary water treatment system resiliency. Canadian National Conference on Drinking Water, Ottawa, Ontario.
- Kuroki, T., Watanabe, Y., Asai, Y., Yamai, S., Endo, T., Uni, S., Kimata, I. and Iseki, M. (1996). An outbreak of waterborne cryptosporidiosis in Kanagawa, Japan. Kansenshugaku Zasshi, 70(2): 132-140.
- Lal, A., Baker, M.G., Hales, S. and French, N.P. (2013). Potential effects of global environmental changes on cryptosporidiosis and giardiasis transmission. Trends Parasitol., 29(2):83–90.
- Lalancette, C., Généreux, M., Mailly, J., Servais, P., Côté, C., Michaud, A., Di Giovanni, G.D. and Prévost, M. (2012). Total and infectious Cryptosporidium oocyst and total Giardia cyst concentrations from distinct agricultural and urban contamination sources in eastern Canada. J. Water Health, 10(1):147–160.
- Lalancette, C., Papineau, I., Payment, P., Dorner, S., Servais, P., Barbeau, B., Di Giovanni, G.D. and Prévost, M. (2014). Changes in Escherichia coli to Cryptosporidium ratios for various fecal pollution sources and drinking water intakes. Water Res., 55:150–161.
- Langé, K.P., Bellamy, W.D., Hendricks, D.W. and Logsdon, G.S. (1986). Diatomaceous earth filtration of Giardia cysts and other substances. J. Am. Water Works Assoc., 78(1):76–84.
- Lean, I.S., McDonald, V. and Pollok, R.C. (2002). The role of cytokines in the pathogenesis of Cryptosporidium infection. Curr. Opin. Infect. Dis., 15(3):229–234.
- Learmonth, J.J., Ionas, G., Ebbett, K.A. and Kwan, E.S. (2004). Genetic characterization and transmission cycles of Cryptosporidium species isolated from humans in New Zealand. Appl. Environ. Microbiol., 70:3973–3978.
- LeChevallier, M.W. and Norton, W.D. (1992). Examining relationships between particle counts and Giardia, Cryptosporidium, and turbidity. J. Am. Water Works Assoc., 84(12):54–60.
- LeChevallier, M.W., Evans, T.M. and Seidler, R.J. (1981). Effect of turbidity on chlorination efficiency and bacterial persistence in drinking water. Appl. Environ. Microbiol., 42:159–167.
- LeChevallier, M.W., Norton, W.D. and Lee, R.G. (1991a). Occurrence of Giardia and Cryptosporidium spp. in surface water supplies. Appl. Environ. Microbiol., 57:2610–2616.
- LeChevallier, M.W., Norton, W.D. and Lee, R.G. (1991b). Occurrence of Giardia and Cryptosporidium spp. in filtered drinking water supplies. Appl. Environ. Microbiol., 57:2617–2621.
- LeChevallier, M.W., Norton, W.D., Lee, R.G. and Rose, J.B. (1991c). Giardia and Cryptosporidium in water supplies. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- LeChevallier, M.W., Di Giovanni, G.D., Clancy, J.L., Bukhari, Z., Bukhari, S., Rosen, J.S., Sobrinho, J. and Frey, M.M. (2003). Comparison of Method 1623 and cell culture–PCR for detection of Cryptosporidium spp. in source waters. Appl. Environ. Microbiol., 69(2):971–979.
- Lee, S.H., Levy, D., Craun, G., Beach, M. and Calderon, R. (2002). Surveillance for waterborne-disease outbreaks – United States, 1999 – 2000. Morb. Mortal Wkly Rep., 51: 1-47.
- Leelayoova, S., Rangsin, R., Taamasri, P., Naaglor, T., Thathaisong, U. and Mungthin, M. (2004). Evidence of waterborne transmission of Blastocystis hominis. Am. J. Trop. Med. Hyg., 70(6):658–662.
- Lemos, V., Graczyk, T.K., Alves, M., Lobo, M.L., Sousa, M.C., Antunes, F. and Matos, O. (2005). Identification and determination of the viability of Giardia lamblia cysts and Cryptosporidium parvum and Cryptosporidium hominis oocysts in human fecal and water supply samples by fluorescent in situ hybridization (FISH) and monoclonal antibodies. Parasitol. Res., 98(1):48–53.
- Lengerich, E.J., Addiss, D.G. and Juranek, D.D. (1994). Severe giardiasis in the United States. Clin. Infect. Dis., 18:760–763.
- Lepesteur, M., Blasdall, S. and Ashbolt, N.J. (2003). Particle dispersion for further Cryptosporidium and Giardia detection by flow cytometry. Lett. Appl. Microbiol., 37(3):218–229.
- Levy, D. A., Bens, M. S., Craun, G. F., Calderon, R. L. and Herwaldt, B. L. (1998). Surveillance for waterborne disease outbreaks: United States, 1995–1996. Morb. Mortal Wkly Rep., 47: 1–34.
- Li, D., Craik, S.A., Smith, D.W. and Belosevic, M. (2008). Survival of Giardia lamblia trophozoites after exposure to UV light. FEMS Microbiol Lett., 278(1):56–61.
- Li, X., Atwill, E.R., Dunbar, L.A. and Tate, K.W. (2010). Effect of daily temperature fluctuation during the cool season on the infectivity of Cryptosporidium parvum. Appl. Environ. Microbiol., 76(4):989–993.
- Liang, J., Dziuban, E., Craun, G., Hill, V., Moore, M., Gelting, R., Calderon, R., Beach, M. and Roy, S. (2006). Surveillance for waterborne disease and outbreaks associated with drinking water and water not intended for drinking – United States, 2003 – 2004. Morbidity and Mortality Weekly, Report 55, 31-58.
- Limor, J.R., Lal, A.A. and Xiao, L. (2002). Detection and differentiation of Cryptosporidium parasites that are pathogenic for humans by real-time PCR. J. Clin. Microbiol., 40(7):2335–2338.
- Lin, S.D. (1985). Giardia lamblia and water supply. J. Am. Water Works Assoc., 77:40–47.
- Linden, K.G. (2017). Personal communication. University of Colorado, Boulder, Colorado.
- Linden, K.G., Shin, G. and Sobsey, M.D. (2001). Comparative effectiveness of UV wavelengths for the inactivation of Cryptosporidium parvum oocysts in water. Water Sci. Technol., 43(12):171–174.
- Linden, K.G., Shin, G.A., Faubert, G., Cairns, W. and Sobsey, M.D. (2002). UV disinfection of Giardia lamblia cysts in water. Environ. Sci. Technol., 36(11):2519–2522.
- Lindquist, H.D., Ware, M., Stetler, R.E., Wymer, L. and Schaefer, F.W., III. (2001). A comparison of four fluorescent antibody-based methods for purifying, detecting, and confirming Cryptosporidium parvum in surface waters. J. Parasitol., 87(5):1124–1131.
- Lippy, E.C. (1981). Waterborne disease: occurrence is on the upswing. J. Am. Water Works Assoc., 73:57–62.
- Loganthan, S., Yang, R., Bath, A., Gordon, C. and Ryan, U. (2012). Prevalence of Cryptosporidium species in recreational versus non-recreational water sources. Exp. Parasitol., 131:399–403.
- Logsdon, G.S., Symons, J.M., Hoye Jr., R.L. and Arozarena, M.M. (1981). Alternative filtration methods for removal of Giardia cysts and cyst models. J. Am. Water Works Assoc., 73(2):111–118.
- Logsdon, G.S., Thurman, V.C., Frindt, E.S. and Stoecker, J.G. (1985). Evaluating sedimentation and various filter media for removal of Giardia cysts. J. Am. Water Works Assoc., 77(2):61–66.
- Logsdon, G.S., Kohne, R., Abel, S. and LaBonde, S. (2002). Slow sand filtration for small water systems. J. Environ. Eng. Sci., 1(5):339–348.
- Lopez, C.E., Dykes, A.C., Juranek, D.D., Sinclair, S.P., Conn, J.M., Christie, R.W., Lippy, E.C., Schultz, M.G. and Mires, M.H. (1980). Waterborne giardiasis: a community-wide outbreak of disease and a high rate of asymptomatic infection. Am. J. Epidemiol., 112:495–507.
- Lowery, C.J., Moore, J.E., Millar, B.C., Burke, D.P., McCorry, K.A., Crothers, E. and Dooley, J.S. (2000). Detection and speciation of Cryptosporidium spp. in environmental water samples by immunomagnetic separation, PCR and endonuclease restriction. J. Med. Microbiol., 49(9):779–785.
- Lowery, C.J., Nugent, P., Moore, J.E., Millar, B.C., Xiru, X. and Dooley, J.S. (2001a). PCR-IMS detection and molecular typing of Cryptosporidium parvum recovered from a recreational river source and an associated mussel (Mytilus edulis) bed in Northern Ireland. Epidemiol. Infect., 127(3):545–553.
- Lowery, C.J., Moore, J.E., Millar, B.C., McCorry, K.A., Xu, J., Rooney, P.J. and Dooley, J.S. (2001b). Occurrence and molecular genotyping of Cryptosporidium spp. in surface waters in Northern Ireland. J. Appl. Microbiol., 91(5):774–779.
- Lytle, D.A., Johnson, C.H. and Rice, E.W. (2002). A systematic comparison of the electrokinetic properties of environmentally important microorganisms in water. Colloids Surf. B. Biointerfaces, 24(2):91–101.
- Ma, P., Kaufman, D.L., Helmick, C.G., D’Souza, A.J. and Navin, T.R. (1985). Cryptosporidiosis in tourists returning from the Caribbean. N. Engl. J. Med., 312:647–648.
- MacDonald, L.M., Sargent, K., Armson, A., Thompson, R.C. and Reynoldson, J.A. (2002). The development of a real-time quantitative-PCR method for characterisation of a Cryptosporidium parvum in vitro culturing system and assessment of drug efficacy. Mol. Biochem. Parasitol., 121(2):279–282.
- MacKenzie, W. R., Hoxie, N. J., Proctor, M. E., Gradus, M. S., Blair, K. A., Peterson, D. E., Kazmierczak, J. J., Addiss, D. G., Fox, K. R., Rose, J. B. and Davis, J. P. (1994). A massive outbreak in Milwaukee of Cryptosporidium infection transmitted through the public water supply. N. Engl. J. Med., 331: 161–167.
- Macler, B.A. and Regli, S. (1993). Use of microbial risk assessment in setting US drinking water standards. Int. J. Food Microbiol., 18(4):245–256.
- Mahmud, F., Craik, S.A. and Belosevic, M. (2006). The effect of upstream treatment processes on the UV inactivation of Cryptosporidium parvum. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
- Mamane-Gravetz, H. and Linden, K.G. (2004). Impact of particle aggregated microbes on UV disinfection. Presented at the AWWA Water Quality Technology Conference, San Antonio, Texas, November 14–18. American Water Works Association, Denver, Colorado.
- Marshall, M.M., Naumovitz, D., Ortega, Y. and Sterling, C.R. (1997). Waterborne protozoan pathogens. Clin. Microbiol. Rev., 10(1):67–85.
- Masago, Y., Oguma, K., Katayama, H., Hirata, T. and Ohgaki, S. (2004). Cryptosporidium monitoring system at a water treatment plant, based on waterborne risk assessment. Water Sci. Technol., 50(1):293–299.
- Mason, B.W., Chalmers, R.M., Carnicer_Pont, D. and Casemore, D.P. (2010). A Cryptosporidium hominis outbreak in north-west Wales associated with low oocyst counts in treated drinking water. J. Water Health, 8(2): 299-310.
- Matsue, T., Fujino, T., Kajima, J. and Tsuji, M. (2001). Infectivity and oocyst excretion patterns of Cryptosporidium muris in slightly infected mice. J. Vet. Med. Sci., 63(3):319–320.
- McClure, S. and McKenzie, I. B. (1988). A regulatory agency’s experience with Giardia. In: Advances in Giardia Research (ed. P. M. Wallis and B. R. Hammond), University of Calgary
- Press, Calgary, pp. 129–131.
- McCuin, R.M. and Clancy, J.L. (2003). Modifications to United States Environmental Protection Agency methods 1622 and 1623 for detection of Cryptosporidium oocysts and Giardia cysts in water. Appl. Environ. Microbiol., 69(1):267–274.
- McCuin, R.M., Bukhari, Z., Sobrinho, J. and Clancy, J.L. (2001). Recovery of Cryptosporidium oocysts and Giardia cysts from source water concentrates using immunomagnetic separation. J. Microbiol. Methods, 45(2):69–76.
- McDonald, V., Smith, R., Robinson, H. and Bancroft, G. (2000). Host immune responses against Cryptosporidium. Contrib. Microbiol., 6:75–91.
- McDowell-Boyer, L.M., Hunt, J.R. and Sitar, N. (1986). Particle transport through porous media. Water Resour. Res., 22(13):1901–1921 .
- McGuigan, K.G., Méndez-Hermida, F., Castro-Hermida, J.A., Ares-Mazás, E., Kehoe, S.C., Boyle, M., Sichel, C., Fernández-Ibáñez, P., Meyer, B.P., Ramalingham, S. and Meyer, E.A. (2006). Batch solar disinfection inactivates oocysts or Cryptosporidium parvum and cysts of Giardia muris in drinking water. J. Appl. Microbiol., 101(2):453–463.
- McLauchlin, J., Amar, C., Pedraza-Diaz, S. and Nichols, G.L. (2000). Molecular epidemiological analysis of Cryptosporidium spp. in the United Kingdom: results of genotyping Cryptosporidium spp. in 1,705 fecal samples from humans and 105 fecal samples from livestock animals. J. Clin. Microbiol., 38(11):3984–3990.
- McVicar, M., Bickerton, B., Chaulk, M. and Walsh, M. (2015). UV254 and streaming current monitors can improve coagulation control in challenging conditions. Opflow, 41(7):26–28.
- MDDELCC (2016). Bilan de la qualité de l’eau potable au Québec 2010-2014. Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques. Gouvernement du Québec.
- Medema, G.J., Bahar, M. and Schets, F.M. (1997). Survival of Cryptosporidium parvum, Escherichia coli, faecal enterococci and Clostridium perfringens in river water: influence of temperature and autochthonous microorganisms. Water Sci. Technol., 35(11–12):249–252.
- Medema, G.J., Shaw, S., Waite, M., Snozzi, M., Morreau, A. and Grabow, W. (2003). Catchment characterisation and source water quality. In: Assessing microbial safety of drinking water: improving approaches and methods. A. Dufour, M. Snozzi, W. Koster, J. Bartram, E. Ronchi and L. Fewtrell (eds.). World Health Organization, Geneva, Switzerland. pp. 111–158.
- Medema, G., Loret, J.-F., Stenström, T.-A. and Ashbolt, N. (eds.). (2006). Quantitative microbial risk assessment in the water safety plan. April 2006. European Union MicroRisk Project. Report for the European Commission under the Fifth Framework Programme, Theme 4: Energy, environment and sustainable development.
- Meisel, J.L., Perera, D.R., Meligro, C. and Robin, C.E. (1976). Overwhelming watery diarrhoea associated with a Cryptosporidium in an immunosuppressed patient. Gastroenterology, 70:1156–1160.
- Mercado, R., Buck, G.A., Manque, P.A. and Ozaki, L.S. (2007). Cryptosporidium hominis infection of the human respiratory tract. Emerg. Infect. Dis., 13(3):462–464.
- Messner, M.J., Chappell, C.L. and Okhuysen, P.C. (2001). Risk assessment for Cryptosporidium: a hierarchical Bayesian analysis of human dose response data. Water Res., 35:3934–3940.
- Messner, M.J. and Berger, P. (2016). Cryptosporidium infection risk: results of new dose-response modelling. Risk Analysis, 36(10):1969–1982.
- Metge, D.W., Harvey, R.W., Aiken, G.R., Anders, R., Lincoln, G. and Jasperse, J. (2010). Influence of organic carbon loading, sediment associated metal oxide content and sediment grain size distributions upon Cryptosporidium parvum removal during riverbank filtration operations, Sonoma County, CA. Water Res., 44(4): 1126-1137.
- Metro Vancouver (2009). The Greater Vancouver Water District quality control annual report 2009, Volume 1.
- Metro Vancouver (2013). Greater Vancouver water district 2013 quality control annual report, Volume 1. Available at: www.metrovancouver.org/services/water/WaterPublications/2013_Water_Quality_Annual_Report_Volume1.pdf
- Meyer, W. T. (1973). Epidemic giardiasis. A continued elusive entity. Rocky Mt. Med. J., 70: 48–49.
- Mi, B., Mariñas, B.J., Curl, J., Sethi, S., Crozes, G. and Hugaboom, D. (2005). Microbial passage in low pressure membrane elements with compromised integrity. Environ. Sci. Technol., 39(11):4270–4279.
- Mofidi, A.A., Meyer, E.A., Wallis, P.M., Chou, C.I., Meyer, B.P., Ramalingam, S. and Coffey, B.M. (2002). The effect of UV light on the inactivation of Giardia lamblia and Giardia muris cysts as determined by animal infectivity assay (P-2951-01). Water Res., 36(8):2098–2108.
- Mølbak, K., Højlyng, N., Gottschau, A., Sá, J.C.C., Ingholt, L., da Silva, A.P.J. and Aaby, P. (1993). Cryptosporidiosis in infancy and childhood mortality in Guinea Bissau, West Africa. Br. Med. J., 307:417–420.
- Mons, M.N., van der Wielen, J.M.L., Blokker, E.J.M., Sinclair, M.I., Hulshof, K.F.A.M., Dangendorf, F., Hunter, P.R. and Medema, G.J. (2007). Estimation of the consumption of cold tap water for microbiological risk assessment: an overview of studies and statistical analysis of data. J. Water Health, 5(Suppl. 1):151–170.
- Moon, S., Kwak, W., Lee, S., Kim, W., Oh, J. and Youn, S. (2013). Epidemiological characteristics of the first water-borne outbreak of cryptosproridiosis in Seoul, Korea. J. Korean Med. Sci., 28: 983-989.
- Moore, A.C., Herwaldt, B.L., Craun, G.F., Calderon, R.L., Highsmith, A.K. and Juranek, D.D. (1993). Surveillance for waterborne disease outbreaks — United States, 1991–1992. MMWR Morb. Mortal. Wkly. Rep., 42:1–35.
- Moorehead, W., Guasparini, R., Donovan, C., Mathias, R., Cottle, R. and Baytalan, G. (1990). Giardiasis outbreak from a chlorinated community water supply. Can. J. Public Health, 81:358–362.
- Moreira, N.A., and Bondelind, M. (2017). Safe drinking water and waterborne outbreaks. J. Water Health, 15(1): 83-96.
- Morgan, U.M., Constantine, C.C., Forbes, D.A. and Thompson, R.C. (1997). Differentiation between human and animal isolates of Cryptosporidium parvum using rDNA sequencing and direct PCR analysis. J. Parasitol., 83(5):825–830.
- Moss, D.M. and Arrowood, M.J. (2001). Quantification of Cryptosporidium parvum oocysts in mouse fecal specimens using immunomagnetic particles and two-color flow cytometry. J. Parasitol., 87(2):406–412.
- Moulton-Hancock, C., Rose, J.B., Vasconcelos, G.J., Harris, S.I. and Sturbaum, G.D. (2000). Giardia and Cryptosporidium occurrence in groundwater. J. Am. Water Works Assoc., 92(9):117–123.
- MSSS (2015). Prévention et contrôle des infections dans les services de garde à l’enfance. Ministère de la Santé et des Services sociaux du Québec. Available at : http://publications.msss.gouv.qc.ca/msss/document-000374/
- Murphy, H.M., Thomas, M.K., Medeiros, D.T., McFadyen, S. and Pintar, K.D. (2016a). Estimating the number of cases of acute gastrointestinal illness (AGI) associated with Canadian municipal drinking water systems. Epidemiol. Infect., 144(7): 1371–1385.
- Murray, C.J.L. and Lopez, A.D. (eds.) (1996a). The global burden of disease: a comprehensive assessment of mortality and disability from disease, injury and risk factors in 1990 and projected to 2020. Harvard University Press, Cambridge, MA (Global Burden of Disease and Injury Series, Vol. 1).
- Murray, C. and Lopez, A. (1996b). Global health statistics. Harvard School of Public Health, Cambridge, MA (Global Burden of Disease and Injury Series, Vol. 2).
- MWH. (2012). Water treatment principles and design. 3rd edition. John Wiley & Sons, New York, New York.
- National Research Council (1980). Drinking water and health, Volume 2. National Academy Press. Washington, D.C.
- Nash, T.E. (1994). Immunology: the role of the parasite. In: Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, UK. pp. 139–154.
- Nash, T.E., Herrington, D.A., Losonsky, G.A. and Levine, M.M. (1987). Experimental human infections with Giardia lamblia. J. Infect. Dis., 156:974–984.
- Navin, T.R. and Juranek, D.D. (1984). Cryptosporidiosis: clinical, epidemiologic and parasitological review. Rev. Infect. Dis., 6:313–327.
- Navin, T. R., Juranek, D. D., Ford, M., Minedew, D. J., Lippy, E. C. and Pollard, R. A. (1985). Case-control study of waterborne giardiasis in Reno, Nevada. Am. J. Epidemiol., 122: 269–275.
- Neringer, R., Andersson, Y. and Eitrem, R. (1987). A waterborne outbreak of giardiasis in Sweden. Scand. J. Infect. Dis., 19: 85–90.
- Neumann, N.F., Gyurek, L.L., Finch, G.R. and Belosevic, M. (2000a). Intact Cryptosporidium parvum oocysts isolated after in vitro excystation are infectious to neonatal mice. FEMS Microbiol. Lett., 183:331–336.
- Neumann, N.F., Gyurek, L.L., Gammie, L., Finch, G.R. and Belosevic, M. (2000b). Comparison of animal infectivity and nucleic acid staining for assessment of Cryptosporidium parvum viability in water. Appl. Environ. Microbiol., 66(1):406–412.
- Newcombe, G. and Dixon, D. (2006). Introduction. In: Interface science in drinking water treatment – theory and applications. G. Newcombe and D. Dixon (eds.). Academic Press, London, UK. pp. 1–4.
- Nichols, G., Chalmers, R., Lake, I., Sopwith, W., Regan, M., Hunter, P., Grenfell, P., Harrison, F. and Lane, C. (2006). Cryptosporidiosis: a report on the surveillance and epidemiology of cryptosporidium infection in England and Wales. Drinking Water Directorate Contract Number DWI 70/2/201, 129.
- Nichols, G., Lane, C., Asgari, N., Verlander, N.Q. and Charlett, A. (2009). Rainfall and outbreaks of drinking water related disease in England and Wales. J. Water Health, 7(1):1–8.
- Nichols, R.A.B., Connelly, L., Sullivan, C.B. and Smith, H.V. (2010). Identification of Cryptosporidium species and genotypes in Scottish raw and drinking waters during a one-year monitoring period. Appl. Environ. Microbiol., 76(17):5977–5986.
- Nieminski, E.C. and Ongerth, J.E. (1995). Removing Giardia and Cryptosporidium by conventional treatment and direct filtration. J. Am. Water Works Assoc., 87(9):96–106.
- Nime, F.A., Burek, J.D., Page, D.L., Holscher, M.A. and Yardley, J.H. (1976). Acute enterocolitis in a human being infected with the protozoan Cryptosporidium. Gastroenterology, 70(4):592–598.
- Nimri, L.F. and Batchoun, R. (1994). Prevalence of Cryptosporidium species in elementary school children. J. Clin. Microbiol., 32:1040–1042.
- Noordeen, F., Horadagoda, N.U., Faizal, A.C., Rajapakse, R.P., Razak, M.A. and Arulkanthan, A. (2002). Infectivity of Cryptosporidium parvum isolated from asymptomatic adult goats to mice and goat kids. Vet. Parasitol., 103(3):217–225.
- Nova Scotia Environment (2012). Nova Scotia treatment standards for municipal drinking water systems. Available at: www.novascotia.ca/nse/water/docs/Treatment_Standards_for_Municipal_Drinking_Water_Systems.pdf.
- Nova Scotia Environment (2013). Assessing protozoan risks for surface drinking water supplies in Nova Scotia. Prepared by: Centre for Water Resources Studies, Dalhousie University, Nova Scotia.
- NRMMC-EPHC (2006). Australian guidelines for water recycling: managing health and environmental risks (Phase 1). Natural Resource Management Ministerial Council, Environment Protection and Heritage Council, Australian Health Ministers Conference, Adelaide, Australia.
- NSF/ANSI (2015). Standard 419—Public drinking water equipment performance - filtration. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2016a). Standard 53—Drinking water treatment units – health effects. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2016b). Standard 58—Reverse osmosis drinking water treatment systems. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2016c). Standard 62—Drinking water distillation systems. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2016d). Standard 61—Drinking water system components – health effects. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2016e). Standard 55—Ultraviolet microbiological water treatment systems. NSF International, Ann Arbor, Michigan.
- NSF/ANSI (2017). Standard 60— Drinking water treatment chemicals health effects. NSF International, Ann Arbor, Michigan.
- Nwachuku, N., Craun, G.F. and Calderon, R.L. (2002). How effective is the TCR in assessing outbreak vulnerability? J. Am. Water Works Assoc., 94(9):88–96.
- Nygård, K., Schimmer, B., Søbstad, Ø., Walde, A., Tveit, I., Langeland, N., Hausken, T. and Aavitsland, P. (2006). A large community outbreak of waterborne giardiasis-delayed detection in a non-endemic urban area. BMC Pulbic Health, 6:141.
- Ochiai, Y., Takada, C. and Hosaka, M. (2005). Detection and discrimination of Cryptosporidium parvum and C. hominis in water samples by immunomagnetic separation–PCR. Appl. Environ. Microbiol., 71(2):898–903.
- O’Connor, D.R. (2002). Part two report on the Walkerton inquiry: A strategy for safe drinking water. Ontario Ministry of the Attorney General (ISBN 0-7794-25600X).
- O’Donoghue, P.J. (1995). Cryptosporidium and cryptosporidiosis in man and animals. Int. J. Parasitol., 25:139–195.
- Oguma, K., Katayama, H., Mitani, H., Morita, S., Hirata, T. and Ohgaki, S. (2001). Determination of pyrimidine dimers in Escherichia coli and Cryptosporidium parvum during UV light inactivation, photoreactivation and dark repair. Appl. Environ. Microbiol., 67(10):4630–7.
- O’Handley, R.M. and Olson, M.E. (2006). Giardiasis and cryptosporidiosis in ruminants. Vet. Clin. North Am. Food Anim. Pract., 22(3):623–643.
- O’Handley, R.M., Cockwill, C., McAllister, T.A., Jelinski, M., Morck, D.W. and Olson, M.E. (1999). Duration of naturally acquired giardiasis and cryptosporidiosis in dairy calves and their association with diarrhea. J. Am. Vet. Med. Assoc., 214(3):391–396.
- Okhuysen, P.C. and Chappell, C.L. (2002). Cryptosporidium virulence determinants—are we there yet? Int. J. Parasitol., 32:517–525.
- Okhuysen, P.C., Chappell, C.L., Serling, C.R., Jakubowski, W. and DuPont, H.L. (1998). Susceptibility and serologic response of healthy adults to reinfection with Cryptosporidium parvum. Infect. Immunol., 66:441–443.
- Okhuysen, P.C., Chappell, C.L., Crabb, J.H., Sterling, C.R. and DuPont, H.L. (1999). Virulence of three distinct Cryptosporidium parvum isolates for healthy adults. J. Infect. Dis., 180:1275–1281.
- Okhuysen, P.C., Rich, S.M., Chappell, C.L., Grimes, K.A., Widmer, G., Feng, X. and Tzipori, S. (2002). Infectivity of a Cryptosporidium parvum isolate of cervine origin for healthy adults and interferon-gamma knockout mice. J. Infect. Dis., 185(9):1320–1325.
- Okhuysen, P.C., Rogers, G.A., Crisanti, A., Spano, F., Huang, D.B., Chappell, C.L. and Tzipori, S. (2004). Antibody response of healthy adults to recombinant thrombospondin-related adhesive protein of Cryptosporidium 1 after experimental exposure to Cryptosporidium oocysts. Clin. Diagn. Lab. Immunol., 11(2):235–238.
- Olson, M.E., Morck, D.W. and Ceri, H. (1994). Vaccination against Giardia in domestic kittens. In: Giardia from molecules to disease. R.C.A. Thompson, J.A. Reynoldson and A.J. Lymbery (eds.). CAB International, Cambridge, UK. pp. 366–367.
- Olson, M.E., Thorlakson, C.L., Deselliers, L., Worck, D.W. and McAllister, T.A. (1997). Giardia and Cryptosporidium in Canadian farm animals. Vet. Parasitol., 68:375–381.
- Olson, M.E., O’Handley, R.M., Ralston, B.J., McAllister, T.A. and Thompson, R.C. (2004). Update on Cryptosporidium and Giardia infections in cattle. Trends Parasitol., 20(4):185–191.
- O’Melia, C.R. (2006). Fundamentals of particle stability. In: Interface science in drinking water treatment – theory and applications. G. Newcombe and D. Dixon (eds.). Academic Press, London, United Kingdom. pp. 317–362.
- Ong, C., Moorehead, W., Ross, A. and Isaac-Renton, J. (1996). Studies of Giardia spp. and Cryptosporidium spp. in two adjacent watersheds. Appl. Environ. Microbiol., 62:2798–2805.
- Ong, C.S.L., Pearce, M., Eisler, D., Goh, S.H., King, A.S., Bowie, W.R., Isaac-Renton, J.L. and Beard, C.B. (1997). An outbreak of cryptosporidiosis in southeastern British Columbia, Canada. In: Proceedings of the 1997 international symposium on waterborne Cryptosporidium, March 2–5, 1997, Newport Beach, CA. C.R. Fricker and J.L. Clancy (eds.). American Water Works Association, Denver, Colorado.
- Ong, C.S., Eisler, D.L., Goh, S.H., Tomblin, J., Awad-El-Kariem, F.M., Beard, C.B., Xiao, L., Sulaiman, I., Lal, A., Fyfe, M., King, A., Bowie, W.R. and Isaac-Renton, J.L. (1999). Molecular epidemiology of cryptosporidiosis outbreaks and transmission in British Columbia, Canada. Am. J. Trop. Med. Hyg., 61(1):63–69.
- Ong, C.S., Eisler, D.L., Alikhani, A., Fung, V.W., Tomblin, J., Bowie, W.R. and Isaac-Renton, J.L. (2002). Novel Cryptosporidium genotypes in sporadic cryptosporidiosis cases: first report of human infections with a cervine genotype. Emerg. Infect. Dis., 8(3):263–268.
- Ongerth, J.E., Riggs, J. and Crook, J. (1989). A study of water treatment practices for the removal of Giardia lamblia cysts. American Water Works Association Research Foundation and American Water Works Association, Denver, Colorado.
- Ongerth, J.E. (2013a). LT2 Cryptosporidium data: what do they tell us about Cryptosporidium in surface water in the United States? Environmental Science and Technology, 47:4029–4038.
- Ongerth, J.E. (2013b). The concentration of Cryptosporidium and Giardia in water – the role and importance of recovery efficiency. Water Res., 47:2479–2488.
- Ongerth, J.E. and Hutton, P.E. (1997). DE filtration to remove Cryptosporidium. J. Am. Water Works Assoc., 89(12):39–46.
- Ongerth, J.E. and Hutton, P.E. (2001). Testing of diatomaceous earth filtration for removal of Cryptosporidium oocysts. J. Am. Water Works Assoc., 93(12):54–63.
- Ongerth, J.E. and Pecoraro, J.P. (1995). Removing Cryptosporidium using multimedia filters. J. Am. Water Works Assoc., 87(12):83–89.
- Ongerth, J.E., Hunter, G.D. and DeWalle, F.B. (1995). Watershed use and Giardia cyst presence. Water Res., 29:1295–1299.
- ÖNORM (2001). Austrian national standard: ÖNORM M 5873-1E, plants for disinfection of water using ultraviolet radiation: requirements and testing, part 1: low pressure mercury lamp plants . Austrian Standards Institute, Vienna, Austria.
- ÖNORM (2003). Austrian national standard: ÖNORM 5873-2 E, plants for disinfection of water using ultraviolet radiation: requirements and testing, part 2: medium pressure mercury lamp plants. Austrian Standards Institute, Vienna, Austria.
- Ontario Ministry of Environment (2006). Procedure for disinfection of drinking water in Ontario. PIBS 4448e01. Available at: https://dr6j45jk9xcmk.cloudfront.net/documents/1182/99-disinfection-of-drinking-water-en.pdf
- Oosterveld, A. (2017). Personal communication. Viqua, Guelph, Ontario.
- Oppenheimer, J.A., Aleta, E.M., Trussell, R.R., Jacangelo, J.G. and Najm, I. (2000). Evaluation of Cryptosporidium inactivation in natural waters. AWWA Research Foundation and American Water Works Association, Denver, CO.
- Oppenheimer, J., Gillogly, T., Stolarik, G. and Ward, R. (2002). Comparing the efficiency of low and medium pressure UV light for inactivating Giardia muris and Cryptosporidium parvum in waters with low and high levels of turbidity. In: Proceedings of the Annual Conference and Exhibition of the American Water Works Association, New Orleans, LA, June 16–20. American Water Works Association, Denver, Colorado.
- O’Toole, C.E., Jennings, P., Meagher, G. and Kelly, I. (2004) Cryptosporidium outbreak in a continuously tested public water supply. Epi-Insight (National Disease Surveillance Centre, Ireland), 5(10):1.
- Painter, J.E., Gargano, J.W., Collier, S.A. and Yoder, J.S. (2015a). Giardiasis surveillance – United States, 2011–2012. MMWR Surveill. Summ., 64(3):15–25.
- Painter, J.E., Hlavsa, M.C., Collier, S.A., Xiao, L. and Yoder, J.S. (2015b). Cryptosporidiosis surveillance – United States, 2011–2012. MMWR Surveill. Summ., 64(3):1–13.
- Partinoudi, V. and Collins, M.R. (2007). Assessing RBF reduction/removal mechanisms for microbial and organic DBP precursors. J. Am. Water Works Assoc., 99(12):61–71.
- Passantino, L., Malley, J., Knudson, M., Ward, R. and Kim, J. (2004). Effect of low turbidity and algae on UV disinfection performance. J. Am. Water Works Assoc., 96:128–137.
- Patania, N.L, Jacangelo, J.G., Cummings, L., Wilczak, A., Riley, K. and Oppenheimer, J. (1995). Optimization of filtration for cyst removal. American Water Works Association Research Foundation and American Water Works Association. Denver, Colorado.
- Payment, P. and Franco, E. (1993). Clostridium perfringens and somatic coliphages as indicators of the efficiency of drinking water treatment for viruses and protozoan cysts. Appl. Environ. Microbiol., 59:2418–2424.
- Payment, P. and Pintar, K. (2006). Waterborne pathogens: a critical assessment of methods, results and data analysis. Rev. Sci. Eau, 19(3):233–245.
- Payment, P., Siemiatycki, J., Richardson, L., Renaud, G., Franco, E. and Prévost, M. (1997). A prospective epidemiological study of gastrointestinal health effects due to the consumption of drinking water. Int. J. Environ. Health Res., 7:5–31.
- Payment, P., Berte, A., Prévost, M., Ménard, B. and Barbeau, B. (2000). Occurrence of pathogenic microorganisms in the Saint Lawrence River (Canada) and comparison of health risks for populations using it as their source of drinking water. Can. J. Microbiol., 46(6):565–576.
- Pedley, S., Yates, M., Schijven, J F., West, J., Howard, G. and Barrett, M. (2006). Pathogens: Health relevance, transport and attenuation. In: Protecting Groundwater for Health: Managing the Quality of Drinking-water Sources. O. Schmoll, G. Howard, J. Chilton. and I. Chorus (eds.). IWA Publishing, London, UK. pp. 49–80.
- Peldszus, S., Hallé, C., Peiris, R.H., Hamouda, M., Jin, X., Legge, R.L., Budman, H., Moresoli, C. and Huck, P.M. (2011). Reversible and irreversible low-pressure membrane foulants in drinking water treatment: Identification by principal component analysis of fluorescence EEM and mitigation by biofiltration pretreatment. Water Res., 45(16): 5161–5170.
- Pelly, H., Cormican, M., O’Donovan, D., Chalmers, R.M., Hanahoe, B., Cloughley, R., McKeown, P. and Borbett-Feeney, G. (2007). A large outbreak of cryptosporidiosis in western Ireland linked to a public water supply: a preliminary report. Eurosurveillance 12(18). Available from: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=3187.
- Perez, E., Pena, A., Tango, M., Perez, M., Maldonado, M. and Rodriguez, M. (2000). Outbreak of cryptosporidiosis in Guadarrama (autonomous community of Madrid). Rev. Esp. Salud. Publica, 74: 527–536.
- Pett, B., Smith, F. and Stendahl, D. (1993). Cryptosporidiosis outbreak from an operations point of view. Kitchener-Waterloo, Ontario, Spring 1993. In: Proceedings of the AWWA Water Quality Technology Conference, Miami, FL. American Water Works Association, Denver, Colorado. pp. 1739–1766.
- Petterson, S., Signor, R., Ashbolt, N. and Roser, D. (2006). QMRA methodology. In: MicroRisk – Microbiological risk assessment: a scientific basis for managing drinking water safety from source to tap. April 2006.
- Petterson, S., Roser, D. and Deere, D. (2015). Characterizing the concentration of Cryptosporidium in Australian surface waters for setting health-based targets for drinking water treatment. J. Water Health, 13(3):879–896.
- PHAC (2009). C-Enternet 2007 annual report, National integrated enteric pathogen surveillance program. Canada.
- PHAC (2015). Notifiable diseases online. Available at: http://diseases.canada.ca/notifiable/?c=pl
- Piet, G.J. and Zoeteman, B.C.J. (1980). Organic water quality changes during sand bank and dune filtration of surface waters in the Netherlands. J. Am. Water Works Assoc., 72(7):400–404.
- Pintar, K.D.M., Fazil, A., Pollari, F., Waltner-Toews, D., Charron, D.F., McEwen, S.A. and Walton, T. (2012). Considering the risk of infection by Cryptosporidium via consumption of municipally treated drinking water from a surface water source in a southwestern Ontario community. Risk Anal., 32(7):1122–1138.
- Pitkänen, T., Juselius, T., Isomäki, E., Miettinen, I.T., Valve, M., Kivimäki, A-L., Lahti, K. and Hänninen, M-L. (2015). Drinking water quality and occurrence of Giardia in Finnish small groundwater supplies. Resources, 4(3): 637-654.
- Plummer, J.D., Edzwald, J.K. and Kelley, M.B. (1995). Removing Cryptosporidium by dissolved air flotation. J. Am. Water Works Assoc., 87(9):85–95.
- Plutzer, J., Törökné, A. and Karanis, P. (2010). Combination of ARAD microfiber filtration and LAMP methodology for simple, rapid and cost-effective detection of human pathogenic Giardi duodenalis and Cryptosporidium spp. in drinking water. Lett. Appl. Microbiol.. 50:82–88.
- Pokorny, N.J., Weir, S.C., Carreno, R.A., Trevors, J.T. and Lee, H. (2002). Influence of temperature on Cryptosporidium parvum oocyst infectivity in river water samples as detected by tissue culture assay. J. Parasitol., 88(3):641–643.
- Pollok, R.C., McDonald, V., Kelly, P. and Farthing, M.J. (2003). The role of Cryptosporidium parvum-derived phospholipase in intestinal epithelial cell invasion. Parasitol. Res., 90(3):181–186.
- Pond, K., Rueedi, J. and Pedley, S. (2004). MicroRisk literature review—Pathogens in drinking water sources. Centre for Public and Environmental Health, University of Surrey, Guildford, Surrey, UK.
- Pozio, E., Rezza, G., Boschini, A., Pezzotti, P., Tamburrini, A., Rossi, P., Di Fine, M., Smacchia, C., Schiesari, A., Gattei, E. Zucconi, R. and Ballarini, P. (1997). Clinical cryptosporidiosis and
- Human Immunodeficiency Virus (HIV)-induced immunosuppression: Findings from a longitudinal study of HIV-positive and HIV-negative former injection drug users. J. Infect. Dis., 176: 969–975.
- Priest, J.W., Bern, C., Xiao, L., Roberts, J.M., Kwon, J.P., Lescano, A.G., Checkley, W., Cabrera, L., Moss, D.M., Arrowood, M.J., Sterling, C.R., Gilman, R.H. and Lammie, P.J. (2006). Longitudinal analysis of Cryptosporidium species-specific immunoglobulin G antibody responses in Peruvian children. Clin. Vaccine Immunol., 13(1):123–131.
- Prystajecky, N., Huck, P.M., Schreier, H. and Isaac-Renton, J.L. (2014). Assessment of Giardia and Cryptosporidium spp. as a microbial source tracking tool for surface water: application in a mixed-use watershed. Appl. Environ. Microbiol. 80(8):2328–2336.
- Prystajecky, N., Tsui, C.K.M., Haiao, W.W.L., Uyaguari-Diaz, M.L., Ho, J., Tang, P. and Isaac-Renton, J. (2015). Giardia spp. are commonly found in mixed assemblages in surface water, as revealed by molecular and whole-genome characterization. Appl. Environ. Microbiol.. 81(14):4827–4834.
- Pyper, G.R. (1985). Slow sand filter and package treatment plant evaluation: Operating costs and removal of bacteria, Giardia, and trihalomethanes. U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA/600/S2-85/052).
- Quah, J.X., Ambu, S., Lim, Y.A., Mahdy, M.A. and Mak, J.W. (2011). Molecular identification of Cryptosporidium parvum from avian hosts. Parasitology, 138(5):573–577.
- Quintero-Betancourt, W., Peele, E.R. and Rose, J.B. (2002). Cryptosporidium parvum and Cyclospora cayetanensis: a review of laboratory methods for detection of these waterborne parasites. J. Microbiol. Methods, 49(3):209–224.
- Quintero-Betancourt, W., Gennaccaro, A.L., Scott, T.M. and Rose, J.B. (2003). Assessment of methods for detection of infectious Cryptosporidium oocysts and Giardia cysts in reclaimed effluents. Appl. Environ. Microbiol., 69(9):5380–5388.
- Rajah, S.H., Suresh, K.G., Vellayan, S., Mak, J.W., Khairul, A.A., Init, I., Vennila, G.D., Saminathan, R. and Ramakrishnan, K. (1999). Blastocystis in animal handlers. Parasitol. Res., 85:1032–1033.
- Ralston, B.J., McAllister, T.A. and Olson, M.E. (2003). Prevalence and infection pattern of naturally acquired giardiasis and cryptosporidiosis in range beef calves and their dams. Vet. Parasitol., 14(2):113–122.
- Ramirez, N.E. and Sreevatsan, S. (2006). Development of a sensitive detection system for Cryptosporidium in environmental samples. Vet. Parasitol., 136(3–4):201–213.
- Ray, C., Schubert, J., Linsky, R.B. and Melin, G. (2002a). Introduction. In: riverbank filtration: Improving source-water quality. C. Ray, G. Melin and R.B. Linsky (eds.). Kluwer Academic Publishers, Dordrecht, The Netherlands. pp. 1–15.
- Ray, C., Grischek, T., Schubert, J., Wang, J.Z. and Speth, T.F. (2002b). A perspective of riverbank filtration. J. Am. Water Works Assoc., 94(4):149–160.
- Read, C., Walters, J., Robertson, I.D. and Thompson, R.C. (2002). Correlation between genotype of Giardia duodenalis and diarrhoea. Int. J. Parasitol., 32(2):229–231.
- Read, C.M., Monis, P.T. and Thompson, R.C. (2004). Discrimination of all genotypes of Giardia duodenalis at the glutamate dehydrogenase locus using PCR-RFLP. Infect. Genet. Evol., 4(2):125–130.
- Reckhow, D.A., Rees, P.L., Nüsslein, K., Makdissy, G., Devine, G., Conneely, T., Boutin, A. and Bryan, D. (2007). Long-term variability of BDOM and NOM as precursors in watershed sources. Awwa Research Foundation, Denver, Colorado.
- Regli, S., Rose, J.B., Haas, C.N. and Gerba, C.P. (1991). Modeling the risk from Giardia and viruses in drinking water. J. Am. Water Works Assoc., 83(11):76–84.
- Rendtorff, R.C. (1978). The experimental transmission of Giardia lamblia among volunteer subjects. In: Waterborne transmission of giardiasis. W. Jakubowski and J.C. Hoff (eds.). U.S. Environmental Protection Agency, Cincinnati, OH. pp. 64–81 (EPA 600/9-79-001).
- Revetta, R.P., Rodgers, M.R. and Kinkle, B.K. (2005). Isolation and identification of freshwater bacteria antagonistic to Giardia intestinalis cysts. J. Water Health, 3(1):83–88.
- Reynolds, D.T., Slade, R.B., Sykes, N.J., Jonas, A. and Fricker, C.R. (1999). Detection of Cryptosporidium oocysts in water: techniques for generating precise recovery data. J. Appl. Microbiol., 87(6):804–813.
- Rice, E.W. and Schaefer, F.W., III. (1981). Improved in vitro excystation procedure for Giardia lamblia cysts. J. Clin. Microbiol., 14:709–710.
- Riggs, M.W. (2002). Recent advances in cryptosporidiosis: the immune response. Microbes Infect., 4(10):1067–1080.
- Richardson, A. J., Frankenberg, R. A., Buck, A. C., Selkon, J. B., Colbourne, J. S., Parsons, J. W. and Mayon-White, R. T. (1991). An outbreak of waterborne cryptosporidiosis in Swindon and Oxfordshire. Epidemiol. Infect., 107: 485–495.
- Rimhanen-Finne, R., Ronkainen, P. and Hanninen, M.L. (2001). Simultaneous detection of Cryptosporidium parvum and Giardia in sewage sludge by IC-PCR. J. Appl. Microbiol., 91(6):1030–1035.
- Rimhanen-Finne, R., Horman, A., Ronkainen, P. and Hanninen, M.L. (2002). An IC-PCR method for detection of Cryptosporidium and Giardia in natural surface waters in Finland. J. Microbiol. Methods, 50(3):299–303.
- Risebro, H.L., Doria, M.F., Andersson, Y., Medema, G., Osborn, K., Schlosser, O., and Hunter, P.R. (2007). Fault tree analysis of the causes of waterborne outbreaks. J. Water Health., 05 (Suppl. 1): 1-18.
- Roach, P.D., Olson, M.E., Whitley, G. and Wallis, P.M. (1993). Waterborne Giardia cysts and Cryptosporidium oocysts in the Yukon, Canada. Appl. Environ. Microbiol., 59:67–73.
- Robertson, B., Sinclair, M.I., Forbes, A.B., Veitch, M., Kirk, M., Cunliffe, D., Willis, J. and Fairley, C.K. (2002). Case–control studies of sporadic cryptosporidiosis in Melbourne and Adelaide, Australia. Epidemiol. Infect., 128(3):419–431.
- Robertson, L.J., Campbell, A.T. and Smith, H.V. (1992). Survival of Cryptosporidium parvum oocysts under various environmental pressures. Appl. Environ. Microbiol., 58:3494–3500.
- Robertson, L.J., Campbell, A.T. and Smith, H.V. (1998). Viability of Cryptosporidium parvum oocysts: assessment by the dye permeability assay. Appl. Environ. Microbiol., 64(9):3544–3545.
- Robertson, L.J., Hermansen, L., Gjerde, B.K., Strand, E., Alvsvåg, J.O. and Langeland, N. (2006). Application of genotyping during an extensive outbreak of waterborne giardiasis in Bergen, Norway, during autumn and winter 2004. Appl. Environ. Microbiol., 72(3):2212–2217.
- Rochelle, P.A., Ferguson, D.M., Handojo, T.J., De Leon, R., Stewart, M.H. and Wolfe, R.L. (1997). An assay combining cell culture with reverse transcriptase PCR to detect and determine the infectivity of waterborne Cryptosporidium parvum. Appl. Environ. Microbiol., 63:2029–2037.
- Rochelle, P.A., De Leon, R., Johnson, A., Stewart, M.H. and Wolfe, R.L. (1999). Evaluation of immunomagnetic separation for recovery of infectious Cryptosporidium parvum oocysts from environmental samples. Appl. Environ. Microbiol., 65(2):841–845.
- Rochelle, P.A., Ferguson, D.M., Johnson, A.M. and De Leon, R. (2001). Quantitation of Cryptosporidium parvum infection in cell culture using a colorimetric in situ hybridization assay. J. Eukaryot. Microbiol., 48(5):565–574.
- Rochelle, P.A., Marshall, M.M., Mead, J.R., Johnson, A.M., Korich, D.G., Rosen, J.S. and De Leon, R. (2002). Comparison of in vitro cell culture and a mouse assay for measuring infectivity of Cryptosporidium parvum. Appl. Environ. Microbiol., 68(8):3809–3817.
- Rochelle, P.A., Modifi, A.A., Marshall, M.M., Upton, S.J., Montelone, B., Woods, K. and Di Giovanni, G. (2004). An investigation of UV disinfection and repair in Cryptosporidium parvum. AWWA Research Foundation, Denver, Colorado.
- Rochelle, P.A., Johnson, A.M., De Leon, R. and Di Giovanni, G.D. (2012). Assessing the risk of infectious Cryptosporidium in drinking water. J. Am. Water Works Assoc., 104:E325–E336.
- Rochelle, P.S., Johnson, A.M. and Di Giovanni, G.D., (2015). Still optimizing a cell culture infectivity assay for Cryptosporidium. In: American Water Works Association International Symposium on Waterborne Pathogens Conference Proceedings, Savannah, Georgia.
- Rook, J.J. (1976). Haloforms in drinking water. J. Am. Water Works Assoc., 68(3):168–172.
- Rosales, M.J., Cordón, G.P., Moreno, M.S. and Sánchez, C.M. (2005). Extracellular like-gregarine stages of Cryptosporidium parvum. Acta Trop., 95(1):74–78.
- Rose, J.B. and Gerba, C.P. (1991). Use of risk assessment for development of microbial standards. Water Sci. Technol., 24:29–34.
- Rose, J.B., Darbin, H. and Gerba, C.P. (1988). Correlations of the protozoa, Cryptosporidium and Giardia, with water quality variables in a watershed. Water Sci. Technol., 20(11/12):271–276.
- Rose, J.B, Gerba, C.P. and Jakubowski, W. (1991). Survey of potable water supplies for Cryptosporidium and Giardia. Environ. Sci. Technol., 25(8):1393–1400.
- Rose, J.B., Lisle, J.T. and LeChevallier, M. (1997). Waterborne cryptosporidiosis: incidence, outbreaks and treatment strategies. In: Cryptosporidium and cryptosporidiosis. R. Fayer (ed.). CRC Press, Boca Raton, Florida. pp. 93–109.
- Roy, S.L., DeLong, S.M., Stenzel, S.A., Shiferaw, B., Roberts, J.M., Khalakdina, A., Marcus, R., Segler, S.D., Shah, D.D., Thomas, S., Vugia, D.J., Zansky, S.M., Dietz, V. and Bea, M.J. (2004). Risk factors for sporadic cryptosporidiosis among immunocompetent persons in the United States from 1999 to 2001. J. Clin. Microbiol., 42(7):2944–2951.
- Ruecker, N.J., Matsune, J.C., Wilkes, G., Lapen, D.R., Topp, E., Edge, T.A., Sensen, C.W., Xiao, L. and Neumann, N.F. (2012). Molecular and phylogenetic approaches for assessing sources of Cryptosporidium contamination in water. Water Res., 46:5135–5150.
- Ryan, U., Xiao, L., Read, C., Zhou, L., Lal, A.A. and Pavlasek, I. (2003). Identification of novel Cryptosporidium genotypes from the Czech Republic. Appl. Environ. Microbiol., 69:4302–4307.
- Ryan, U.M., Bath, C., Robertson, I., Read, C., Elliot, A., McInnes, L., Traub, R. and Besier, B. (2005a). Sheep may not be an important zoonotic reservoir for Cryptosporidium and Giardia parasites. Appl. Environ. Microbiol., 71(9):4992–4997.
- Ryan, U., Read, C., Hawkins, P., Warnecke, M., Swanson, P., Griffith, M., Deere, D., Cunningham, M. and Cox, P. (2005b). Genotypes of Cryptosporidium from Sydney water catchment areas. J. Appl. Microbiol., 98(5):1221–1229.
- Ryan, U., Fayer, R. and Xiao, L. (2014). Cryptosporidium species in humans and animals: current understanding and research needs. Parasitology. 141:1667–1685.
- Ryan, U. and Hijjawi, N. (2015). New developments in Cryptosporidium research. Int. J. Parasitol., 45:367–373.
- Ryan U., Paparini, A., Monis, P. and Hijjawi, N. (2016). It’s official ˗ Cryptosporidium is a gregarine: what are the implications for the water industry? Water Res., 105: 305-313.
- Sartory, D.P., Parton, A., Parton, A.C., Roberts, J. and Bergmann, K. (1998). Recovery of Cryptosporidium oocysts from small and large volume water samples using a compressed foam filter system. Lett. Appl. Microbiol., 27(6):318–322.
- SCC (2016). Directory of accredited product, process and service certification bodies. Standards Council of Canada, Ottawa, Ontario. Available at: www.scc.ca/en/accreditation/product-process-and-service-certification/directory-of-accredited-clients
- Schaefer, D.A., Auerbach-Dixon, B.A. and Riggs, M.W. (2000). Characterization and formulation of multiple epitope-specific neutralizing monoclonal antibodies for passive immunization against cryptosporidiosis. Infect. Immunol., 68(5):2608–2616.
- Schets, F.M., Engels, G.B., During, M. and de Roda Husman, A.M. (2005). Detection of infectious Cryptosporidium oocysts by cell culture immunofluorescence assay: applicability to environmental samples. Appl. Environ. Microbiol., 71(11):6793–6798.
- Schijven, J., Berger, P. and Miettinen, I. (2002). Removal of pathogens, surrogates, indicators, and toxins using riverbank filtration. In: Riverbank filtration: improving source-water quality. C. Ray, G. Melin and R.B. Linsky (eds.). Kluwer Academic Publishers, Dordrecht, The Netherlands. pp. 73–116.
- Schijven, J.F., Teunis, P.F.M., Rutjes, S.A., Bouwknegt, M. and de Roda Husman, A.M. (2011). QMRAspot: a tool for quantitative microbial risk assessment from surface water to potable water. Water Res., 45:5564–5576.
- Schijven, J.F., van den Berg, H.H.J.L., Colin, M., Dullemont, Y., Hijnen, W.A.M., Magic-Knezev, A., Oorthuizen, W.A. and Wubbels, G. (2013). A mathematical model for removal of human pathogenic viruses and bacteria by slow sand filtration under variable operational conditions. Water Res., 47(7):2592–2602.
- Schmidt, P.J. and Emelko, M.B. (2010). QMRA and decision-making: Are we handling measurement errors associated with pathogen concentration data correctly? Water Res., 45(2):461–472.
- Schmidt, P.J., Reilly, P.M. and Emelko, M.B. (2010) Quantification of analytical recovery in particle and microorganism enumeration methods. Environ. Sci. Technol., 44(5):1705–1712.
- Schmidt, P.J., Emelko, M.B. and Thompson, M.E. (2013). Analytical recovery of protozoan enumeration methods: Have drinking water QMRA models corrected or created bias. Water Res., 47:2399–2408.
- Schuler, P.F. and Ghosh, M.M. (1990). Diatomaceous earth filtration of cysts and other particulates using chemical additives. J. Am. Water Works Assoc., 82(12):67–75.
- Schuler, P.F., Ghosh, M.M. and Gopalan, P. (1991). Slow sand and diatomaceous earth filtration of cysts and other particulates. Water Res., 25(8):995–1005.
- Schuster, C.J., Ellis, A.G., Robertson, W.J., Charron, D.F., Aramini, J.J., Marshall, B.J. and Medeiros, D.T. (2005). Infectious disease outbreaks related to drinking water in Canada, 1974–2001. Can. J. Public Health, 96(4):254–258.
- Sharp, E. (2015). Using online zeta potential measurements for coagulation control: A first for the UK Water Industry. International water association specialist conference on natural organic matter in drinking water, Malmo, Sweden.
- Sharpless, C.M. and Linden, K.G. (2001). UV photolysis of nitrate: Effects of natural organic matter and dissolved inorganic carbon and implication for UV water disinfection. Environ. Sci. Technol., 35(14): 2949–2955.
- Shaw, K, Walker, S. and Koopman, B. (2000). Improving filtration of Cryptosporidium. J. Am. Water Works Assoc., 92(11):103–111.
- Shin, G. and Linden, K.G. (2015). Reactivation of Giardia lamblia cysts after exposure to low-pressure UV irradiation. Can. J. Microbiol., 61(7):513–516.
- Shin, G., Linden, K.G., Arrowood, M.J. and Sobsey, M.D. (2001). Low-pressure UV inactivation and DNA repair potential of Cryptosporidium parvum oocysts. Appl. Environ. Microbiol., 67(7):3029–3032.
- Shin, G., Linden, K.G. and Faubert, G. (2010). Reactivation of Giardia lamblia cysts after exposure to polychromatic UV light. Lett. Appl. Microbiol., 51(4):395–9.
- Shukla, R., Giraldo, P., Kraliz, A., Finnigan, M. and Sanchez, A.L. (2006). Cryptosporidium spp. and other zoonotic enteric parasites in a sample of domestic dogs and cats in the Niagara region of Ontario. Can. Vet. J., 47(12):1179–1184.
- Siembida-Lösch, B., Anderson, W.B., Bonsteel, J. and Huck, P.M. (2014). Pretreatment impacts on biopolymers in adjacent ultrafiltration plants. J. Am. Water Works Assoc., 106(9): E372–E382.
- Sifuentes, L.Y. and Di Giovanni, G.D. (2007). Aged HCT-8 cell monolayers support Cryptosporidium parvum infection. Appl. Environ. Microbiol., 73(23):7548–7551.
- Sinclair, R.G., Rose, J.B., Hashsham, S.A., Gerba, C.P. and Haase, C.N. (2012). Criteria for selection of surrogates used to study the fate and control of pathogens in the environment. Appl. Environ. Microbiol., 78(6): 1969–1977.
- Sinreich, M., Pronk, M. and Kozel, R. (2014). Microbiological monitoring and classification of karst sprints. Environ. Earth Sci., 71:563–572.
- Slifko, T.R., Friedman, D., Rose, J.B. and Jakubowski, W. (1997). An in vitro method for detecting infectious Cryptosporidium oocysts with cell culture. Appl. Environ. Microbiol., 63:3669–3675.
- Slifko, T.R., Huffman, D.E., Dussert, B., Owens, J.H., Jakubowski, W., Haas, C.N. and Rose, J.B. (2002). Comparison of tissue culture and animal models for assessment of Cryptosporidium parvum infection. Exp. Parasitol., 101(2–3):97–106.
- Sluter, S.D., Tzipori, S. and Widmer, G. (1997). Parameters affecting polymerase chain reaction detection of waterborne Cryptosporidium parvum oocysts. Appl. Microbiol. Biotechnol., 48(3):325–330.
- Smeets, P.W.M.H., Medema, G.J. and Van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2(1):1–14.
- Smith, A., Reacher, M., Smerdon, W., Adak, G.K., Nichols, G. and Chalmers, R.M. (2006). Outbreaks of waterborne infectious intestinal disease in England and Wales, 1992–2003. Epidemiol. Infect., 134(6):1141–1149.
- Smith, H. V., Patterson, W. J. and Hardie, R. (1989). An outbreak of waterborne cryptosporidiosis caused by post-treatment contamination. Epidemiol. Infect., 103: 703–715.
- Smith, H.V. and Rose, J.B. (1990). Waterborne cryptosporidiosis. Parasitol. Today, 6:8–12.
- Smith, H.V., Parker, J.F.W., Bukhari, Z., Campbell, D.M., Benton, C., Booth, N. and McCreadie, A. (1993). Significance of small numbers of Cryptosporidium sp. oocysts in water. Lancet, 342(8866):312–313.
- Smith, H.V., Cacciò, S.M., Cook, N., Nichols, R.A. and Tait, A. (2007). Cryptosporidium and Giardia as foodborne zoonoses. Vet. Parasitol., 149(1–2):29–40.
- Smith, J.J., Gunasekera, T.S., Barardi, C.R., Veal, D. and Vesey, G. (2004). Determination of Cryptosporidium parvum oocyst viability by fluorescence in situ hybridization using a ribosomal RNA-directed probe. J. Appl. Microbiol., 96(2):409–417.
- Soave, R. (1996). Cyclospora: an overview. Clin. Infect. Dis., 23(3):429–435.
- Solo-Gabriele, H. and Neumeister, S. (1996). US outbreaks of cryptosporidiosis. J. Am. Wat. Wks Assoc., 88: 76–86.
- Song, K., Mohseni, M. and Taghipour, F. (2016). Application of ultraviolet light-emitting diodes (UV-LEDs) for water disinfection: A review. Water Res., 94: 341-349.
- Sontheimer, H. (1980). Experience with Riverbank Filtration Along the Rhine River. J. Am. Water Works Assoc., 72(7):366–390.
- Soucie, W.J. and Sheen, B.J. (2007). Filter-to-waste optimization. J. Am. Water Works Assoc., 99(5):148–157.
- Spano, F., Putignani, L., Naitza, S., Puri, C., Wright, S. and Crisanti, A. (1998). Molecular cloning and expression analysis of a Cryptosporidium parvum gene encoding a new member of the thrombospondin family. Mol. Biochem. Parasitol., 92(1):147–162.
- Staatscourant. (2001). Dutch Drinking Water Decree. Dutch Government Gazette, January 9, 2001.
- Stachan, R. and Kunstýr, I. (1983). Minimal infectious doses and prepatent periods in Giardia muris, Spironucleus muris and Trichomonas muris. Zentralbl. Bakteriol. Hyg. A, 256:249–256.
- Staggs, S.E., Beckman, E.M., Keely, S.P., Mackwan, R., Ware, M.W., Moyer, A.P., Ferretti, J.A., Sayed, A., Xiao, L. and Villegas, E.N. (2013). The applicability of TaqMan-based quantitative real-time PCR assays for detecting and enumerating Cryptosporidium spp. oocysts in the environment. PLOSOne, 8(6):e66562.
- Stantic-Pavlinic, M., Xiao, L., Glaberman, S., Lal, A.A., Orazen, T., Rataj-Verglez, A., Logar, J. and Berce, I. (2003). Cryptosporidiosis associated with animal contacts. Wien. Klin. Wochenschr., 115(34):125–127.
- Starko, K. M., Lippy, E. C., Dominquez, L. B., Haley, C. E. and Fisher, H. J. (1980). Diarrhea in Arizona Campers. CDC, Atlanta, Georgia, Unpublished manuscript.
- States, S., Stadterman, K., Ammon, L., Vogel, P. Baldizar, J., Wright, D., Conley, L. and Sykor, J. (1997). Protozoa in river water: sources, occurrence and treatment. J. Am. Water Works Assoc., 89(9):74–83.
- States, S., Tomko, R., Scheuring, M. and Casson, L. (2002). Enhanced coagulation and removal of Cryptosporidium. J. Am. Water Works Assoc., 94(11):67–77.
- Statistics Canada (2004). Data source: Canadian community health survey, Cycle 2.2 – nutrition (Wave 3): General health and 24-hour dietary recall.
- Statistics Canada (2008). User guide: Canadian community health survey (CCHS), Cycle 2.2 (2004), nutrition – general health (including vitamin & mineral supplements) & 24-hour dietary recall components. Ottawa.
- Statistics Canada (2012). Life tables, Canada, provinces and territories 2007–2009. Ministry of Industry (ISBN 978-1-100-21498-6). Availble at: www.statcan.gc.ca/pub/84-537-x/84-537-x2013003-eng.pdf
- Statistics Canada (2013a). Households and the environment survey 2011.
- Statistics Canada (2013b). Survey of drinking water plants 2011.
- Stehr-Green, J.K., McCaig, L., Remsen, H.M., Rains, C.S., Fox, M. and Juranek, D.D. (1987). Shedding of oocysts in immunocompetent individuals infected with Cryptosporidium. Am. J. Trop. Med. Hyg., 36:338–342.
- Stenzel, D.J. and Boreham, P.F.L. (1996). Blastocystis hominis revisited. Clin. Microbiol. Rev.. 9(4):563–584.
- Stevens, M.N., Ashbolt, N.J. and Cunliffe, D. (2001). Microbial indicators of drinking water quality—A NHMRC discussion paper. National Health and Medical Research Council, Canberra, Australia.
- Stinear, T., Matusan, A., Hines, K. and Sandery, M. (1996). Detection of a single viable Cryptosporidium parvum oocyst in environmental water concentrates by reverse transcription–PCR. Appl. Environ. Microbiol., 62(9):3385–3390.
- Stirling, R., Aramini, J., Ellis, A., Lim, G., Meyers, R., Fleury, M., Werker, D. (2001). Waterborne cryptosporidiosis outbreak, North Battleford, Saskatchewan, spring 2001. Can. Commun. Dis. Rep., 27(22):185–192.
- Stuart, J.M., Orr, H.J., Warburton, F.G., Jeyakanth, S., Pugh, C., Morris, I., Sarangi, J. and Nichols, G. (2003). Risk factors for sporadic giardiasis: a case–control study in southwestern England. Emerg. Infect. Dis., 9(2):229–233.
- Sturbaum, G.D., Klonicki, P.T., Marshall, M.M., Jost, B.H., Clay, B.L. and Sterling, C.R. (2002). Immunomagnetic separation (IMS)–fluorescent antibody detection and IMS-PCR detection of seeded Cryptosporidium parvum oocysts in natural waters and their limitations. Appl. Environ. Microbiol., 68(6):2991–2996.
- Sunderland, D., Graczyk, T.K., Tamang, L. and Breysse, P.N. (2007). Impact of bathers on levels of Cryptosporidium parvum oocysts and Giardia lamblia cysts in recreational beach waters. Water Res., 41:3483– 3489.
- Swaffer, B.A., Vial, H.M., King, B.J., Daly, R., Frizenschaf, J. and Monis, P.T. (2014). Investigating source water Cryptosporidium concentration, species and infectivity rates during rainfall-runoff in a multi-use catchment. Water Res., 67:310–320.
- Swertfeger, J., Metz, D.H., DeMarco, J., Braghetta, A. and Jacangelo, J.G. (1999). Effect of filter media on cyst and oocyst removal. J. Am. Water Works Assoc., 91(9):90–100.
- Taguchi, T., Shinozaki, Y., Takeyama, H., Haraguchi, S., Yoshino, M., Kaneko, M., Ishimori, Y. and Matsunaga, T. (2006). Direct counting of Cryptosporidium parvum oocysts using fluorescence in situ hybridization on a membrane filter. J. Microbiol. Methods, 67(2):373–380.
- Takashima, Y., Xuan, X., Kimata, I., Iseki, M., Kodama, Y., Nagane, N., Nagasawa, H., Matsumoto, Y., Mikami, T. and Otsuka, H. (2003). Recombinant bovine herpesvirus-1 expressing p23 protein of Cryptosporidium parvum induces neutralizing antibodies in rabbits. J. Parasitol., 89(2):276–282.
- Talbot, C., Heath, M., Wright, H. and Peters, D. (2011). 12-month UV fouling study on unfiltered source water. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
- Templeton, M.R., Andrews, R.C. and Hofmann, R. (2005). Inactivation of particle-associated viral surrogates by ultraviolet light. Water Res., 39(15):3487–3500.
- Templeton, M.R., Andrews, R.C. and Hofmann, R. (2006). Impact of iron particles in groundwater on the UV inactivation of bacteriophages MS2 and T4. J. Appl. Microbiol., 101(3):732–741.
- Templeton, M.R., Andrews, R.C. and Hofmann, R. (2007). Removal of particle-associated bacteriophages by dual-media filtration at different filter cycle stages and impacts on subsequent UV disinfection. Water Res., 41(11):2393–2406.
- Templeton, M.R., Andrews, R.C. and Hofmann, R. (2008). Particle-associated viruses in water: impacts on disinfection processes. Critical Reviews in Environmental Science and Technology, 38(3):137–164.
- Tfaily, R., Papineau, I., Andrews, R.C. and Barbeau, B. (2015). Application of quantitative microbial risk assessment at 17 Canadian water treatment facilities. J. Am. Water Works Assoc., 107(10):E497–E508.
- Thomas, M.K., Charron, D.F., Waltner-Toews, D., Schuster, C., Maarouf, A.R. and Holt, J.D. (2006). A role of high impact weather events in waterborne disease outbreaks in Canada, 1975-2001. Int. J. Environ. Health Res., 16(3): 167-180.
- Thomas, M.K., Murray, R., Flockhart, L., Pintar, K., Pollari, F., Fazil, A., Nesbitt, A. and Marshall, B. (2013). Estimates of the burden of foodborne illness in Canada for 30 specified pathogens and unspecified agents, circa 2006. Foodborne Pathog. Dis., 10(7):639–648.
- Thompson, R.C. (2004). The zoonotic significance and molecular epidemiology of Giardia and giardiasis. Vet. Parasitol., 126(1–2):15–35.
- Thompson, R.C. and Monis, P.T. (2004). Variation in Giardia: implications for taxonomy and epidemiology. Adv. Parasitol., 58:69–137.
- Thompson, R.C., Palmer, C.S. and O’Handley, R. (2008). The public health and clinical significance of Giardia and Cryptosporidium in domestic animals. Vet. J., 177(1):18–25.
- Timms, S., Slade, J.S. and Fricker, C.R. (1995). Removal of Cryptosporidium by slow sand filtration. Water Sci. Technol., 31(5-6):81–84.
- Tollestrup, K., Frost, F.J., Kunde, T.R., Yates, M.V. and Jackson, S. (2014) Cryptosporidium infection, onsite wastewater systems and private wells in the arid southwest. J. Water Health, 12(1):161–172.
- Traub, R.J., Monis, P.T., Robertson, I., Irwin, P., Mencke, N. and Thompson, R.C. (2004). Epidemiological and molecular evidence supports the zoonotic transmission of Giardia among humans and dogs living in the same community. Parasitology, 128(Pt. 3):253–262.
- Traub, R.J., Robertson, I.D., Irwin, P.J., Mencke, N. and Thompson, R.C. (2005). Canine gastrointestinal parasitic zoonoses in India. Trends Parasitol., 21(1):42–48.
- Trimboli, P., Lozier, J. and Johnson, W. (2001). Demonstrating the integrity of a large scale microfiltration plant using a Bacillus spore challenge test. Water Sci. Technol. Water Supply, 1(5-6):1–12.
- Tufenkji, N. (2007). Modeling microbial transport in porous media: Traditional approaches and recent developments. Adv. Water Resour., 30(6–7):31455–31469.
- Tufenkji, N. and Elimelech, M. (2005). Spatial distribution of Cryptosporidium oocysts in porous media: Evidence for dual mode deposition. Environ. Sci. Technol., 39(10):3620–3629.
- Tufenkji, N. and Emelko, M.B. (2011). Fate and transport of microbial contaminants. In: Encyclopedia of Environmental Health. J.O. Nriagu (ed.). Elsevier B.V. pp. 715–726.
- Tufenkji, N., Ryan, J.N. and Elimelech, M. (2002). The promise of bank filtration. Environ. Sci. Technol., 36(21):422A–428A.
- Tufenkji, N., Miller, G.F., Ryan, J.N., Harvey, R.W. and Elimelech, M. (2004). Transport of Cryptosporidium oocysts in porous media: role of straining and physiochemical filtration. Environ. Sci. Technol., 38(22): 5932–5938.
- Tufenkji, N., Dixon, D.R., Considine, R. and Drummond, C.J. (2006). Multi-scale Cryptosporidium/sand interactions in water treatment. Water Res., 40(18):3315–3331.
- Tyzzer, E.E. (1907). A sporozoan found in the peptic glands of the common mouse. Proc. Soc. Exp. Biol. Med., 5:12–13.
- Tyzzer, E.E. (1912). Cryptosporidium parvum (sp. nov.): a coccidian found in the small intestine of the common mouse. Arch. Protistenk., 26:394–418.
- Tzipori, S. (1983). Cryptosporidiosis in animals and humans. Microbiol. Rev., 47:84–96.
- Tzipori, S. and Ward, H. (2002). Cryptosporidiosis: biology, pathogenesis and disease. Microbes Infect., 4(10):1047–1058.
- Uejio, C.K., Yale, S.H., Malecki, K., Borchardt, M.A., Anderson, H.A. and Patz, J.A. (2014). Drinking water systems, hydrology, and childhood gastrointestinal illness in Central and Northern Wisconsin. Am. J. Public Health, 104(4): 639-646.
- Umejiego, N.N., Li, C., Riera, T., Hedstrom, L. and Striepen, B. (2004). Cryptosporidium parvum IMP dehydrogenase: identification of functional, structural, and dynamic properties that can be exploited for drug design. J. Biol. Chem., 279(39):40320–40327.
- Ungar, B.L.P. (1994). Cryptosporidium and cryptosporidiosis. In: Textbook of AIDS medicine. S. Broder, D. Bolognesi and T.C. Merigan, Jr. (eds.). Williams and Wilkins, Baltimore, Maryland. Chapter 21.
- U.S. EPA (1989). Part V, Environmental Protection Agency, 40 CFR Parts 141 and 142. National Primary Drinking Water Regulations: Filtration; disinfection; turbidity; Giardia lamblia; viruses; Legionella, and heterotrophic bacteria; Final rule. Fed. Regist., 54:27485–27541.
- U.S. EPA (1991). Guidance manual for compliance with filtration and disinfection requirements for public water systems using surface water sources. U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (2001). Low-pressure membrane filtration for pathogen removal: Application, implementation and regulatory issues. U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA 815-C-01-001).
- U.S. EPA (2004). Long Term 1 Enhanced Surface Water Treatment Rule – Turbidity provisions technical guidance manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC. (EPA 816-R-04-007).
- U.S. EPA (2005a). Method 1623: Cryptosporidium and Giardia in water by filtration/IMS/FA. Office of Water, Office of Science and Technology, Engineering and Analysis Division, U.S. Environmental Protection Agency, Washington, DC (EPA 821-R-01-025).
- U.S. EPA (2005b). Membrane filtration guidance manual. U.S. Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (2006a). National Primary Drinking Water Regulations: Long Term 2 Enhanced Surface Water Treatment; final rule. Fed. Regist., 71(3):678–671; 782–783.
- U.S. EPA (2006b). 40 CFR Parts 9, 141 and 142. National Primary Drinking Water Regulations: Ground Water Rule. Final rule. Fed. Regist., 71.
- U.S. EPA (2006c). Ultraviolet disinfection guidance manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC (EPA 815-R-06-007).
- U.S. EPA (2010). Long Term 2 Enhanced Surface Water Treatment Rule Toolbox Guidance Manual. Office of Water, U.S. Environmental Protection Agency, Washington, DC. (EPA 815-R-09-016).
- U.S. EPA (2012). Method 1623.1: Cryptosporidium and Giardia in water by filtration/IMS/FA. Office of Water, Office of Science and Technology, Engineering and Analysis Division, U.S. Environmental Protection Agency, Washington, DC (EPA 821-R-01-025).
- U.S. EPA (2014). Microbiological risk assessment (MRA) tools, methods, and approaches for water media. Office of Water, Office of Science and Technology. U.S. Environmental Protection Agency, Washington, DC. (EPA-820-R-14-009).
- U.S. EPA (2016). Six-year review 3 technical support document for microbial contaminant regulations. Office of Water. U.S. Environmental Protection Agency, Washington, DC. (EPA-810-R-16-010).
- Valade, M.T., Becker, W.C. and Edzwald, J.K. (2009). Treatment selection guidelines for particle and NOM removal. J. Water Supply Res. Technol. AQUA, 58(6):424–432.
- Van Dyke, M.I., Morton, V., Anderson, W.B., Isaac-Renton, J.L. and Huck, P. (2006). The occurrence of selected bacterial and protozoan pathogens in the Grand River watershed. In: Proceedings of the 12th National Conference on Drinking Water, Saint John, New Brunswick, April 1–4, 2006. Canadian Water and Wastewater Association, Ottawa, Ontario.
- Van Dyke, M.I., Ong, C.S.L., Prystajecky, N.A., Isaac-Renton, J.L. and Huck, P.M. (2012). Identifying host sources, human health risk and indicators of Cryptosporidium and Giardia in a Canadian watershed influenced by urban and rural activities. J. Water. Health., 10(2):311–323.
- Vernon, T. M. (1973). Giardiasis probe inconclusive. Colorado Health. Colorado Department of Health, Denver.
- Vesey, G., Griffiths, K.R., Gauci, M.R., Deere, D., Williams, K.L. and Veal, D.A. (1997). Simple and rapid measurement of Cryptosporidium excystation using flow cytometry. Int. J. Parasitol., 27(11):1353–1359.
- VROM. (2005). Inspectorate guideline. Assessment of the microbial safety of drinking water. VROM Inspectorate, the Netherlands,
- Wait, I.W., Johnston, C.T., Schwab, A.P. and Blatchley III, E.R. (2005). The influence of oxidation reduction potential on inorganic fouling of quartz surfaces in UV disinfection systems. In: Proceedings of the AWWA Water Quality Technology Conference. American Water Works Association, Denver, Colorado.
- Wait, I.W., Johnston, C.T. and Blatchley III, E.R. (2007). The influence of oxidation reduction potential and water treatment processes on quartz lamp sleeve fouling in ultraviolet disinfection reactors. Water Res., 41(11): 2427-2436.
- Wait, I.W. and Blatchley III, E.R. (2010). Model of radiation transmittance by inorganic fouling on UV reactor lamp sleeves. Water Environ. Res., 82(11): 2272-2278
- Walker, M.J., Montemagno, C.D. and Jenkins, M.B. (1998). Source water assessment and nonpoint sources of acutely toxic contaminants: A review of research related to survival and transport of Cryptosporidium parvum. Water Resour. Res., 34(12):3383–3392.
- Wallender, E.K., Ailes, E.C., Yoder, J.S., Roberts, V.A. and Brunkard, J.M. (2014). Contributing factors to disease outbreaks associated with untreated groundwater. Groundwater, 52(6): 886–897.
- Wallis, P. M. (1987). Development of criteria for Giardia in drinking water. Unpublished report to Health and Welfare Canada.
- Wallis, P.M., Isaac-Renton, J.L., Erlandsen, S.L. and Olson, M.E. (1995). Risk assessment for waterborne giardiasis and cryptosporidiosis in Canada. Unpublished report to Health Canada.
- Wallis, P.M., Erlandsen, S.L., Isaac-Renton, J.L., Olson, M.E., Robertson, W.J. and van Keulen, H. (1996). Prevalence of Giardia cysts and Cryptosporidium oocysts and characterization of Giardia spp. isolated from drinking water in Canada. Appl. Environ. Microbiol., 62(8):2789–2797.
- Wallis, P.M., Primrose, B. and Robertson, W.J. (1998). Outbreak of waterborne giardiasis caused by sewage contamination of drinking water. Environ. Health Rev., 42(2):44–51.
- Wallis, P. M., Matson, D., Jones, M. and Jamieson, J. (2001). Application of monitoring data for Giardia and Cryptosporidium to boil water advisories. Risk Anal., 21: 1077–1085.
- Wang, D., Bolton, J.R., Andrews, S.A. and Hofmann, R. (2015). Formation of disinfection by-products in the ultraviolet/chlorine advanced oxidation process. Sci. Total Environ., 518-519:49–57.
- Wang, J.Z., Hubbs, S.A. and Song, R. (2002). Evaluation of Riverbank Filtration as a Drinking Water Treatment Process. AWWA Research Foundation and American Water Works Association, Denver, CO.
- Ward, P.I., Deplazes, P., Regli, W., Rinder, H. and Mathis, A. (2002). Detection of eight Cryptosporidium genotypes in surface and waste waters in Europe. Parasitology, 124(Pt. 4):359–368.
- Ware, M.W., Augustine, W.A.J., Erisman, D.O., See, M.J., Wymer, L., Hayes, S.L., Dubey, J.P., and Villegas, E.N. (2010). Determining UV inactivation of Toxoplasma gondii oocysts by using cell culture and a mouse bioassay. Appl. Environ. Microbiol., 76(15): 5140-5147.
- Warnecke, M. (2006). Cryptosporidium oocyst interactions with drinking water pipe biofilms. Cooperative Research Centre for Water Quality and Treatment, Salisbury, AU.
- Webber, C. (2002). Outbreak of giardiasis in Bay of Plenty and Manawatu. In: Annual Summary of Outbreaks in New Zealand 2001, Report for the Ministry of Health, April 2002, pp. 38–39.
- Weir, S.C., Pokorny, N.J., Carreno, R.A., Trevors, J.T. and Lee, H. (2001). Improving the rate of infectivity of Cryptosporidium parvum oocysts in cell culture using centrifugation. J. Parasitol., 87(6):1502–1504.
- Weiss, W.J., Bouwer, E.J., Ball, W.P., O’Melia, C.R., LeChevallier, M.W., Arora, H. and Speth, T.F. (2003). Riverbank Filtration – Fate of DBP Precursors and Selected Microorganisms. J. Am. Water Works Assoc., 95(10):68–81.
- Welker, R., Porter, R., Pett, W.B., Provart, M.R. and Schwartz, K.T. (1994). Cryptosporidiosis outbreak in Kitchener-Waterloo: identification, assessment and future prevention. In: Proceedings of the Sixth National Conference on Drinking Water, Victoria, BC, October 16–18, 1994. W. Robertson, T. Kauri and S. Irwin (eds.). American Water Works Association, Denver, Colorado.
- Weniger, B. G., Blaser, M. J., Gedrose, J., Lippy, E. C.and Juranek, D. D. (1983). An outbreak of waterborne giardiasis associated with heavy water runoff due to warm weather and volcanic ashfall. Am.J. Public Health, 73: 868–872.
- Wensaas, K.A., Langeland, N., Hanevik, K., Mørch, K., Eide, G.E., Rortveit, G. (2012). Irritable bowel syndrome and chronic fatigue 3 years after acute giardiasis: historic cohort study. Gut., 61:214–219.
- Westrell, T., Andersson, Y. and Stenström, T.A. (2006). Drinking water consumption patterns in Sweden. J. Water Health, 4(4):511–522.
- WHO (2012). Water safety planning for small community water supplies. World Health Organization, Geneva, Switzerland. Available at: www.who.int/water_sanitation_health/publications/small-comm-water_supplies/en/
- WHO (2016). Quantitative microbial risk assessment. Application for water safety management. World Health Organization, Geneva, Switzerland. Available at: www.who.int/water_sanitation_health/publications/qmra/en/
- WHO (2017). Guidelines for Drinking Water Quality. 4th Edition.World Health Organization, Geneva, Switzerland. Available at: https://www.who.int/water_sanitation_health/publications/drinking-water-quality-guidelines-4-including-1st-addendum/en/
- Widerström, M., Schönning, C., Lilja, M., Lebbad, M., Ljung, T., Allestam, G., Ferm, M., Björkholm, B., Hansen, A., Hiltula, J., Långmark, J., Löfdahl, M., Omberg, M., Reuterwall, C., Samuelsson, E., Widgren, K., Wallensten, A. and Lindh, J. (2014). Large outbreak of Cryptosporidium hominis infection transmitted through the public water supply, Sweden. Emerg. Infect. Dis. 20(4): 581-589.
- Widmer, G. (1998). Genetic heterogeneity and PCR detection of Cryptosporidium parvum. Adv. Parasitol., 40:223–239.
- Wiesner, J. and Seeber, F. (2005). The plastid-derived organelle of protozoan human parasites as a target of established and emerging drugs. Expert Opin. Ther. Targets, 9:23–44.
- Wohlsen, T., Bates, J., Gray, B. and Katouli, M. (2004). Evaluation of five membrane filtration methods for recovery of Cryptosporidium and Giardia isolates from water samples. Appl. Environ. Microbiol., 70(4):2318–2322.
- Wolfe, M.S. (1984). Symptomatology, diagnosis and treatment. In: Giardia and giardiasis: biology, pathogenesis and epidemiology. S.L. Erlandsen and E.A. Meyer (eds.). Plenum Press, New York, New York. pp. 147–161.
- Wright, H., Gaithuma, D., Heath, M., Schulz, C. Bogan, T., Cabaj, A. and Schmalweiser, A. (2012). UV Disinfection Knowledge Base. Water Research Foundation, Denver, CO.
- Wu, J., Long, S.C., Das, D. and Dorner, S.M. (2011). Are microbial indicators and pathogens correlated? A statistical analysis of 40 years of research. J. Water Health, 9(2):265–278.
- Wyatt, C.R., Lindahl, S., Austin, K., Kapil, S. and Branch, J. (2005). Response of T lymphocytes from previously infected calves to recombinant Cryptosporidium parvum P23 vaccine antigen. J. Parasitol., 91(5):1239–1242.
- Xiao, G., Qiu, Z., Qi, J., Chen, J., Liu, F., Liu, W., Lou, J. and Shu, W. (2013). Occurrence and potential health risk of Cryptosporidium and Giardia in the Three Gorges reservoir, China. Water Res., 47:2431–2445.
- Xiao, L. and Fayer, R. (2008). Molecular characterisation of species and genotypes of Cryptosporidium and Giardia and assessment of zoonotic transmission. Int. J. Parasitol., 38(11):1239–1255.
- Xiao, L. and Lal, A. (2002). Molecular detection and differentiation of Cryptosporidium oocysts in water: the challenge and promise. In: Proceedings of the AWWA Water Quality Technology Conference, Seattle, Washington. American Water Works Association, Denver, Colorado.
- Xiao, L., Bern, C., Limor, J., Sulaiman, I., Roberts, J., Checkley, W., Cabrera, L., Gilman, R.H. and Lal, A.A. (2001). Identification of 5 types of Cryptosporidium parasites in children in Lima, Peru. J. Infect. Dis., 183(3):492–497.
- Xiao, L., Fayer, R., Ryan, U. and Upton, S.J. (2004). Cryptosporidium taxonomy: recent advances and implications for public health. Clin. Microbiol. Rev., 17(1):72–97.
- Xu, P., Widmer, G., Wang, Y., Ozaki, L.S., Alves, J.M., Serrano, M.G., Puiu, D., Manque, P., Akiyoshi, D., Mackey, A.J., Pearson, W.R., Dear, P.H., Bankier, A.T., Peterson, D.L., Abrahamsen, M.S., Kapur, V., Tzipori, S. and Buck, G.A. (2004). The genome of Cryptosporidium hominis. Nature, 431(7012):1107–1112.
- Yagita, K., Izumiyama, S., Tachibana, H., Masuda, G., Iseki, M., Furuya, K., Kameoka, Y., Kuroki, T., Itagaki, T. and Endo, T. (2001). Molecular characterization of Cryptosporidium isolates obtained from human and bovine infections in Japan. Parasitol. Res., 87:950–955.
- Young, I., Smith, B.A. and Fazil, A. (2015). A systematic review and meta-analysis of the effects of extreme weather events and other weather-related variables on Cryptosporidium and Giardia in fresh surface waters. J. Water Health, 13(1):1–17.
- Zahedi, A., Paparini, A., Jian, F., Robertson, I. and Ryan, U. (2016). Public health significance of zoonotic Cryptosporidium species in wildlife: critical insights into better drinking water management. International Journal for Parasitology: Parasites and Wildlife. 5: 88-109.
- Zhou, Y., Hamouda, M.A., Douglas, I.P., Anderson, W.B. and Huck, P.M. (2015). Accounting for reported variability in Cryptosporidium removal. Ontario Water Works Association, Annual Conference, Toronto, ON.
- Zimmer, J.L, Slawson, R.M. and Huck, P.M. (2003). Inactivation and potential repair of Cryptosporidium parvum following low- and medium-pressure ultraviolet irradiation. Water Res. 37(14):3517–3523.
- Zu, S.-X., Zhu, S.-Y. and Li, J.-F. (1992). Human cryptosporidiosis in China. Trans. R. Soc. Trop. Med. Hyg., 86:639–640.
Annexe A : Autres protozoaires entériques d'origine hydrique : Toxoplasma gondii, Cyclospora cayetanensis, Entamoeba histolytica et Blastocystis hominis
Toxoplasma gondii est un parasite intracellulaire obligatoire qui infecte presque tous les animaux à sang chaud et les humains. Il se transmet généralement par ingestion de kystes tissulaires à la suite de la consommation de viande infectée crue ou insuffisamment cuite, par ingestion d'oocystes sporulés à la suite de la consommation d'eau ou d'aliments contaminés, ou par la manipulation de sol contaminé ou de fèces d'un chat infecté. Les oocystes sont extrêmement résistants aux conditions environnementales, y compris la sécheresse, et semblent demeurer infectieux pendant plusieurs mois (à des températures de -5 °C) (Dubey, 1998). Même si cet organisme provoque généralement des symptômes bénins pseudo-grippaux, il peut mettre en danger la vie des sujets immunodéprimés et des femmes enceintes. L'infection peut entraîner une déficience intellectuelle, une perte de vision, une déficience auditive et un décès chez les enfants infectés de façon congénitale. Nous ne savons pas grand-chose de la distribution de cet organisme dans les sources d'eau, mais, selon des chercheurs, les oocystes survivent jusqu'à 17 mois dans l'eau du robinet. Six éclosions de toxoplasmose humaine liées à l'ingestion d'eau ou de sol contaminé ont été signalées, dont une en Colombie-Britannique en 1995 (Karanis et coll., 2007). Au cours de cette éclosion, 110 cas aigus ont été recensés, dont 42 touchant des femmes enceintes et 11 frappant des nouveau-nés (Bowie et coll., 1997); cette éclosion a été imputée à la contamination d'un réservoir d'eau par les fèces de chats domestiques et sauvages (Isaac-Renton et coll., 1998; Aramini et coll., 1999). Les renseignements disponibles sur l'efficacité des procédés de traitement de l'eau visant à éliminer ou à inactiver T. gondii sont limités. En raison de sa taille (10 à 12 μm), on devrait pouvoir le retirer facilement au moyen de procédés d'élimination mécanique, comme la filtration. Il résiste au chlore (AWWA, 2006), mais s'est montré sensible à la désinfection par les rayons UV (Ware et coll., 2010). Ware et coll. (2010) ont signalé une inactivation de 3 log d'oocystes de T. gondii à 10 mJ/cm2 à l'aide de lampes BP. Les auteurs préviennent que l'étude a été menée avec des chats infectés en laboratoire, dans des conditions idéales : comme aucun échantillon prélevé dans l'environnement n'a été évalué, ils recommandent la tenue d'études supplémentaires pour confirmer la sensibilité de T. gondii à la désinfection par les rayons UV.
Cyclospora cayetanensis est un parasite intracellulaire obligatoire de la classe des coccidies, qui a pour seul hôte naturel l'humain (Eberhard et coll., 2000). Des cas de cyclosporiase ont été signalés partout dans le monde, mais cette maladie semble endémique dans l'ensemble des pays tropicaux (Soave, 1996). Toute la lumière n'a pas encore été faite sur les voies de transmission de ce parasite, bien que la transmission de personne à personne soit improbable (c.-à-d. que les oocystes non sporulés sont éliminés dans les fèces et nécessitent une période de maturation). La transmission se fait probablement par de l'eau ou des aliments contaminés par des matières fécales humaines. Bien que Cyclospora cayetanensis ait été détecté dans des échantillons prélevés dans l'environnement, notamment dans l'eau et dans les eaux usées, la détection de ce parasite demeure un défi. Peu d'études ont été menées sur la fréquence de la présence de ce parasite, en raison du manque de méthodes sensibles, notamment des méthodes visant à évaluer sa viabilité et son infectiosité. L'infection par Cyclospora cayetanensis provoque des symptômes qui ressemblent à ceux causés par Cryptosporidium (p. ex. nausées, anorexie, diarrhée). La maladie est habituellement spontanément résolutive, mais des effets à long terme sur la santé ont été signalés y compris une arthrite réactionnelle (syndrome oculo-urétro-synovial). Les données épidémiologiques portent fortement à croire que C. cayetanensis peut se transmettre par l'eau. En effet, la première éclosion de cyclosporiase ayant été associée à l'eau potable est survenue en 1990 parmi le personnel d'un hôpital de Chicago, en Illinois (Karanis et coll., 2007). Elle a été imputée à un système d'approvisionnement en eau chlorée, ce qui indiquerait que C. cayetanensis est résistant au niveau de chlore utilisé dans les systèmes de traitement de l'eau potable. L'efficacité des procédés de traitement de l'eau potable visant à éliminer ou à inactiver C. cayetanensis n'a pas été évaluée, mais des maladies ont été liées à un approvisionnement en eau chlorée (AWWA, 2006). Il est attendu que l'enlèvement physique de C. cayetanensis par filtration devraient être au moins aussi efficace que pour Cryptosporidium, étant donné que les oocystes de C. cayetanensis sont plus gros (8-10 µm) que ceux de Cryptosporidium.
Entamoeba histolytica est un parasite obligatoire qui infecte les humains et les primates. Les humains sont les seuls réservoirs importants, car ils éliminent les trophozoïtes ou les kystes dans leurs fèces. Entamoeba histolytica peut se transmettre à la suite de l'ingestion d'eau ou d'aliments contaminés par des matières fécales, mais on pense que le contact de personne à personne constitue la principale voie de transmission. La plupart des infections sont asymptomatiques, mais certaines peuvent causer une maladie grave (c.-à-d. l'amibiase). Les infections symptomatiques entraînent fréquemment une diarrhée, une fièvre et des douleurs abdominales. Des effets plus graves sur la santé, notamment une colite chronique, des abcès du foie et un décès ont été signalés (Kucik et coll., 2004). Les kystes d'Entamoeba histolytica sont résistants à la dégradation environnementale; leur survie dépend toutefois principalement de la température. Les kystes meurent rapidement lorsqu'ils sont exposés à une faible chaleur ou lorsqu'ils sont congelés (Gillin et Diamond, 1980). Bien qu'aucune éclosion d'amibiase d'origine hydrique n'ait été signalée au Canada, il a été fait état d'éclosions aux États-Unis et ailleurs dans le monde (Karanis et coll., 2007). Ces éclosions sont survenues lorsque l'eau chlorée a été contaminée par les eaux usées (AWWA, 2006), ce qui suggère que les kystes résistent à la chloration. On a déclaré une valeur CT de 1,5 pour une réduction de 1 log à 19 °C à l'aide d'ozone (National Research Council, 1980). Cela signifie que E. histolytica résiste davantage à l'ozonation que Giardia, mais pas autant que Cryptosporidium. En raison de sa taille (10 à 12 μm), on devrait pouvoir le retirer facilement au moyen de procédés d'élimination mécanique, comme la filtration. Nous n'avons trouvé aucune information publiée sur la désinfection par les rayons UV.
Blastocystis hominis est un protozoaire unicellulaire qui provoque une diarrhée, des nausées, des douleurs abdominales, des vomissements et des ballonnements. Bien que B. hominis ait été identifié au début des années 1900, son épidémiologie suscite encore beaucoup la controverse. La fréquence de ce microorganisme varie de 1,5 % à 10 % pour les pays industrialisés et de 50 % à 60 % pour les pays en développement; il s'agit de l'un des parasites intestinaux les plus fréquents chez l'être humain (Stenzel et Boreham, 1996). Cependant, un fort pourcentage des infections aboutissent à l'hébergement asymptomatique du parasite, d'où les controverses entourant sa pathogénicité. Les animaux semblent être un réservoir important de Blastocystis. Des études ont montré que les personnes en contact étroit avec des animaux sont plus susceptibles de contracter une infection (Rajah et coll., 1999; Eroglu et Koltas, 2010). Comme pour les autres organismes pathogènes entériques d'origine hydrique, le cycle biologique de Blastocystis renferme une forme kystique, qui est responsable de la transmission par la voie fécale-orale. La taille des kystes de Blastocystis est comprise entre 3 μm et 5 μm; les kystes ont fait preuve d'une résistance au niveau de chlore utilisé pour le traitement de l'eau potable (Leelayoova et coll., 2004). Il y a peu d'information sur l'élimination ou l'inactivation de Blastocystis au moyen de procédés de traitement de l'eau potable. Comme la taille de ces kystes est très semblable à celle des oocystes de Cryptosporidium, on suppose que les procédés de filtration de l'eau potable devraient éliminer ces deux microorganismes de la même manière. Nous n'avons trouvé aucune information publiée sur la désinfection par les rayons UV.
Annexe B : Sélection d'éclosions de Giardia et de Cryptosporidium
| Date | Lieu | Agent étiologique | Portée de l'éclosion | Causes premières | Références |
|---|---|---|---|---|---|
| 20 mars – 26 avril 2001 | North Battleford (Sask.) | Cryptosporidium | 25 cas confirmés en laboratoire; selon les estimations, entre 5 800 et 7 100 personnes auraient été touchées |
|
Stirling et coll., 2001 |
| 2 juin – 12 juillet 1996 | Cranbrook (C.-B.) | Cryptosporidium | 29 cas confirmés en laboratoire; 107 cas cliniques; nombre de cas estimé à 2 000 |
|
BCCDC, 1996; Ong et coll., 1997, 1999 |
| Février – mai 1994 | Temagami (Ont.) | Giardia | 26 cas confirmés en laboratoire; entre 160 et 330 cas cliniques |
|
Wallis et coll., 1998 |
| Février – mai 1993 | Kitchener-Waterloo (Ont.) | Cryptosporidium | 143 cas confirmés en laboratoire |
|
Pett et coll., 1993; Welker et coll., 1994 |
| Janvier – avril 1990 | Creston et Erikson (C.-B.) | Giardia | 124 cas confirmés en laboratoire |
|
Isaac-Renton et coll., 1993, 1994 |
| Juin – août, nov. 1986 | Penticton (C.-B) | Giardia | 362 cas confirmés en laboratoire; nombre de cas estimé à 3 100 |
|
Moorehead et coll., 1990 |
| Nov. – déc. 1985 | Creston (C.-B.) | Giardia | 83 cas confirmés en laboratoire |
|
Isaac-Renton et coll., 1993 |
Notes de bas de tableau B.1
- Note de bas de tableau B.1 - a
-
Il s'agit d'éclosions bien documentées.
Retour à la référence de la Note de bas de page tableau B.1 - a
| Cause de l'éclosion | Facteurs | Références |
|---|---|---|
| Contamination des eaux souterraines |
|
Brady et Wolfe, 1974; CDC, 1977a; Craun, 1979; Herwaldt et coll., 1992; Moore et coll., 1993; Kramer et coll., 1996; Solo-Gabriele et Neumeister, 1996; Craun et coll., 1998; Furtado et coll., 1998; Levy et coll., 1998; Smith et Rose, 1990; Barwick et coll., 2000; CDR, 2001; Howe et coll., 2002; Lee et coll., 2002; Liang et coll., 2006; HPSC, 2007 |
| Contamination des eaux de surface |
|
Meyer, 1973; CDC, 1975; Barbour et coll., 1976; CDC, 1977a, 1977b; CDC, 1978; Craun, 1979; Hopkins et coll., 1985; Wallis, 1987; Bryck et coll., 1988; Erlandsen et Bemrick, 1988; Kent et coll., 1988; McClure et McKenzie, 1988; Birkhead et coll., 1989; Moorehead et coll., 1990; Richardson et coll., 1991; Herwaldt et coll., 1992; Isaac-Renton et coll., 1994; CDR, 1996; Solo-Gabriele et Neumeister, 1996; Wallis et coll., 1996; Craun et coll., 1998; Furtado et coll., 1998; Levy et coll., 1998; Hunter, 1999; Barwick et coll., 2000; Wallis et coll., 2001; Jennings et Rhatigan, 2002; Nygård et coll., 2006; Nichols et coll., 2006; Pelly et coll., 2007; Mason et coll., 2010; Chalmers et coll., 2010; Widerström et coll., 2014; Andersson et coll., 2014; Guzman-Herrador et coll., 2015; DeSilva et coll., 2016 |
| Traitement inadéquatTable B.2 footnote b |
|
Vernon, 1973; CDC, 1977b; CDC, 1978; Kirner et coll., 1978; Craun, 1979; CDC, 1980; Hopkins et coll., 1985; Navin et coll., 1985; Erlandsen et Bemrick, 1988; Birkhead et coll., 1989; Herwaldt et coll., 1992; Moore et coll., 1993; MacKenzie et coll., 1994; Kramer et coll., 1996; Solo-Gabriele et Neumeister, 1996; Pozio et coll., 1997; Craun et coll., 1998; Furtado et coll., 1998; Levy et coll., 1998; Perez et coll., 2000; CDR, 2001; Stirling et coll., 2001; Lee et coll., 2002; Webber et coll., 2002; O'Toole et coll., 2004; |
| Problèmes liés au système de distribution |
|
Starko et coll., 1980; Weniger et coll., 1983; Jephcott et coll., 1986; Neringer et coll., 1987; Smith et coll., 1989; Bell et coll., 1991; Moore et coll., 1993; Kramer et coll., 1996; Craun et coll., 1998; Kuroki et coll., 1996; Barwick et coll., 2000; Glaberman et coll., 2002; Lee et coll., 2002; Dalle et coll., 2003; Chalmers, 2012; Hilborn et coll., 2013; Moon et coll., 2013; Braeye et coll., 2015 |
Notes de bas de tableau B.2
- Note de bas de tableau B.2 - a
-
D'après des synthèses réalisées par Schuster et coll., 2005; Karanis et coll., 2007; Moreira et Bondelind, 2017; Efstratiou et coll., 2017.
Retour à la référence de la Note de bas de page tableau B.2 - a
- Note de bas de tableau B.2 - b
-
Comprend seulement les éclosions où un problème a été signalé à l'égard du système de traitement actuel. Les systèmes où aucun traitement n'a été appliqué (p. ex. les systèmes sans filtrage) ont été inclus ailleurs.
Retour à la référence de la Note de bas de page tableau B.2 - b
Annexe C : Liste des abréviations
- ADN
- acide désoxyribonucléique
- ANSI
- American National Standards Institute
- ARNm
- acide ribonucléique messager
- ARNr
- acide ribonucléique ribosomique
- AVCI
- années de vie corrigées de l'incapacité
- AVI
- années vécues avec une incapacité
- AVP
- années de vie perdues
- BP
- basse pression
- CC
- culture cellulaire
- CCN
- Conseil canadien des normes
- CID
- contraste interférentiel différentiel
- CT
- concentration x temps
- DAPI
- 4′,6-diamidino-2-phénylindole
- DEL
- diode électroluminescente
- DI50
- dose infectieuse médiane
- ÉQRM
- évaluation quantitative du risque microbien
- ESSIDES
- eau souterraine sous l'influence directe d'eau de surface
- FACS
- tri de cellules marquées par fluorescence
- FB
- filtration sur berge
- FISH
- hybridation in situ en fluorescence
- HCT-8
- cellules d'adénocarcinome iléo-cæcal humain
- IFA
- épreuve d'immunofluorescence
- IFN
- interféron (p. ex. IFN-γ)
- Ig
- immunoglobuline (p. ex. IgA, IgG, IgM)
- IL
- interleukine (p. ex. IL-12)
- IP
- iodure de propidium
- MF
- microfiltration
- MON
- matière organique naturelle
- NF
- nanofiltration
- NSF
- NSF International
- OMS
- Organisation mondiale de la Santé
- OI
- osmose inverse
- PCR
- réaction en chaîne de la polymérase
- PM
- pression moyenne
- RFLP
- polymorphisme de longueur des fragments de restriction
- qPCR
- réaction en chaîne de la polymérase quantitative
- RT-PCR
- transcription inverse-réaction en chaîne de la polymérase
- sida
- syndrome d'immunodéficience acquise
- SIM
- séparation immunomagnétique
- SPD
- sous-produit de désinfection
- T10
- temps de séjour durant lequel 90 % de l'eau qui traverse l'unité de traitement est retenue dans le bassin
- UF
- ultrafiltration
- U.S. EPA
- United States Environmental Protection Agency
- UTN
- unité de turbidité néphélémétrique
- UV
- ultraviolet