Processus d'intégration des données économiques dans les recommandations fédérales relatives aux vaccins
Télécharger le format de rechange
(Format PDF, 6.31 MB, 91 pages)
Organisation :
Agence de la santé publique du Canada
Publiée : 22 février, 2021
Commentaires issus de consultation des intervenants
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ASPC) des conseils continus et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique.
Alors que le mandat du CCNI se rapportait à l'innocuité, à l'efficacité potentielle ou réelle et à l'immunogénicité des vaccins ainsi qu'au fardeau des maladies, l'ASPC a élargi celui-ci pour inclure la prise en compte systématique de facteurs programmatiques dans l'élaboration de recommandations fondées sur des données probantes afin de faciliter la prise de décisions opportunes concernant les programmes de vaccination financés par l'État à l'échelle provinciale et territoriale. Les autres facteurs que le CCNI doit systématiquement prendre en compte sont l'économie, l'éthique, l'équité, la faisabilité et l'acceptabilité.
Le processus économique du CCNI décrit la manière dont le CCNI intègre les données économiques à ses recommandations et le moment où il le fait.
Le CCNI cherche maintenant à obtenir des commentaires sur l'ébauche du processus économique de la part des intervenants, y compris, mais sans s'y limiter, les suivants :
- les provinces et les territoires;
- le Comité canadien sur l'immunisation;
- le Groupe de travail sur l'innocuité des vaccins;
- le Conseil des médecins hygiénistes en chef;
- les groupes techniques consultatifs nationaux sur la vaccination (GTCNV);
- les groupes techniques consultatifs provinciaux sur la vaccination (GTCPV);
- les agences d'évaluation des technologies de la santé;
- des chercheurs;
- des responsables des politiques;
- l'industrie;
- d'autres parties intéressées.
Le questionnaire a été élaboré pour qu'il vous soit plus facile de faire participer vos collègues à l'examen du processus économique et d'exprimer votre position et vos commentaires généraux. Le questionnaire traite de chaque section du processus économique et comporte des questions clés auxquelles vous devez répondre. Modules A, B et J sont obligatoires, alors que modules C à I sont facultatives. Des instructions supplémentaires pour compléter le questionnaire seront fournis lorsque vous cliquez sur le lien ci-dessous.
Tous les commentaires reçus seront pris en compte par le Secrétariat du CCNI lors de son examen final du processus économique avant qu'ils soient présentés pour approbation finale par le CCNI et rendus publiques.
Sur cette page
- Version provisoire du Processus économique (Questionnaire obligatoire module A)
- Outil de soutien no 1: Guide sur l'établissement des priorités relatives aux données économiques (Questionnaire obligatoire module B)
- Outil de soutien no 2: Critères de soumission des évaluations économiques fondées sur un modèle (Questionnaire obligatoire module C)
- Outil de soutien no 3: Modèle de présentation pour la proposition sur les données économiques (Questionnaire facultatif module D)
- Outil de soutien no 4: Lignes directrices provisoires pour l'évaluation économique des vaccins : Canada (Questionnaire facultatif module E)
- Outil de soutien no 5: Procédure opératoire normalisée sur la production de rapports sur les évaluations économiques des vaccins au Canada (Questionnaire facultatif module F)
- Outil de soutien no 6: Procédure opératoire normalisée (pon) du comité consultatif national de l'immunisation : examens systématiques des évaluations économiques (Questionnaire facultatif module G)
- Outil de soutien no 7: Modèle de présentation pour la présentation des évaluations économiques (Questionnaire facultatif module H)
- Outil de soutien no 8: Modèle de présentation pour la présentation des examens systématique (Questionnaire facultatif module I)
Comité consultatif national de l'immunisation (CCNI) : Processus d'intégration des données économiques dans les recommandations fédérales en matière de vaccins
Module A
VERSION PROVISOIRE du Processus économique
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ASPC) des conseils continus et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique. Grâce au travail de groupes de travail et avec l'appui d'un secrétariat de l'Agence de la santé publique du Canada, le CCNI fait des recommandations sur l'utilisation de vaccins destinés aux humains qui sont actuellement ou nouvellement approuvés au Canada.
Traditionnellement, le CCNI évaluait l'innocuité, l'efficacité théorique, l'immunogénicité, l'efficacité et le fardeau de la maladie. L'ASPC a récemment élargi ce mandat de façon à pouvoir y inclure l'étude systématique des facteurs programmatiques - économie, éthique, équité, faisabilité et acceptabilité des vaccins - dans la formulation de recommandations fondées sur des données probantes. Ce mandat élargi vise à faciliter la prise de décisions en temps opportun en ce qui a trait aux programmes de vaccination financés par des fonds publics à l'échelle provinciale et territoriale.
Au cours des années à venir, le CCNI s'emploiera à peaufiner ses approches méthodologiques dans le but de tenir compte de ces facteurs programmatiques. Les déclarations du CCNI incluront divers degrés d'analyse programmatique visant les programmes de santé publique.
Le Processus économique du CCNI explique à quel moment et de quelle façon le CCNI intègre des données économiques probantes dans ses recommandations de vaccins.
Pour éclairer la mise au point du Processus, l'information présentée a été recueillie auprès d'organismes canadiens et internationaux d'évaluation des technologies de la santé, le Comité de l'industrie des vaccins (CIV) et autres Groupes techniques consultatifs nationaux pour la vaccination (GTCV) de plusieurs pays.
La consultation des intervenants vise à obtenir les commentaires des partenaires et des intervenants pour garantir le produit le plus précis et utile.
Aperçu du processus économique
Types de données économiques
Ce document fait référence aux deux types communs de données économiques : l'évaluation économique et l'analyse de l'impact budgétaire (Figure 1). Il renvoie également à des examens systématiques (d'évaluations économiques) qui sont des synthèses d'analyses existantes coût-utilité, coût-efficacité, coût-avantage, etc.
Figure 1. Deux types de données économiques probantes couramment utilisées dans la prise de décisions

Figure 1 - Description textuelle
Cette figure offre Deux types de données économiques probantes couramment utilisées dans la prise de décisions.
- Évaluation économique - Est-ce rentable?
- Comprend entre autres les analyses coût-utilité, coût-efficacité, coût-avantage.
- Analyse des résultats pour la santé et des coûts des solutions de rechange en matière d'interventions en santé.
- Examine le rapport qualité-prix.
- Analyse d'impact budgétaire - Combien cela coûtera-t-il?
- Analyse d'un changement probable dans les dépenses d'un responsable de budget résultant d'une décision de rembourser une nouvelle intervention dans les soins de santé (ou d'une modification de politique) pour l'ensemble d'une population.
- Examine le budget.
Selon les commentaires reçus des provinces et des territoires (PT) les analyses économiques du CCNI intégreront des considérations relatives au rapport coût-efficacité dans les lignes directrices du CCNI. Les discussions portant sur les analyses d'impact budgétaire seront revues par le CCNI à une date ultérieure. Par conséquent, dans la suite du présent document, le terme « données économiques probantes » renvoie aux évaluations économiques (nouvelles évaluations économiques et examens systématiques des évaluations économiques existantes).
Plan de travail du CCNI
Le plan de travail du CCNI comprend des projets qui ont été priorisés pour un exercice financier donné. Ces projets ne seront pas nécessairement achevés au cours de l'exercice financier. Le plan de travail pourra être réévalué à la lumière des besoins émergents en matière de santé publique. La Figure 2 décrit les raisons possibles menant à la mise sur pied de groupes de travail et à l'élaboration de nouveaux documents d'orientation par le CCNI ou à l'adoption de nouvelles priorités.
Figure 2. Facteurs qui déterminent le plan de travail du CCNI
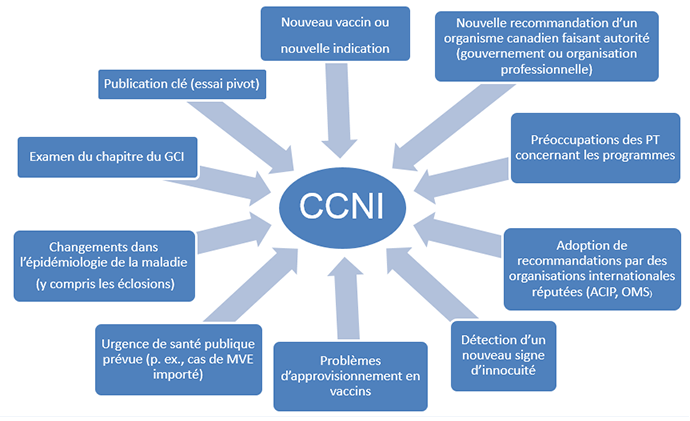
Figure 2 - Description textuelle
Cette figure illustre les éléments déclencheurs susceptibles de mener à la création de groupes de travail et à l'élaboration de nouveaux documents d'orientation du CCNI ou à l'établissement de nouvelles priorités. Les éléments déclencheurs comprends : nouveau vaccin ou nouvelle indication, nouvelle recommandation d'un organisme canadien faisant autorité (gouvernement ou organisation professionnelle), préoccupations des PT relatives au programme, adoption de recommandations par des organisations internationales réputées (ACIP, OMS), nouveau signe de problème d'innocuité détecté, problèmes liés à l'approvisionnement en vaccins, urgence de santé publique anticipée (p. ex. cas importés de MVE), changements quant à l'épidémiologie de la maladie (y compris les éclosions), revue du chapitre du GCI, ou publication clé (essai majeur). Abréviations : ACIP = Advisory Committee on Immunization Practices (Centers for Disease Control and Prevention des États-Unis); GCI = Guide canadien d'immunisation; MVE = maladie à virus Ebola; PT = provinces et territoires; OMS = Organisation mondiale de la Santé
Il existe plusieurs groupes de travail qui élaborent des versions préliminaires de produits à des fins d'examen et de vote par le CCNI. Les groupes de travail sont composés de membres du CCNI et d'experts externes. Les groupe de travail peuvent exiger les données probantes suivantes pour éclairer les orientations du CCNI :
- Données cliniques (y compris l'innocuité, l'efficacité théorique, l'immunogénicité, l'efficacité et le fardeau de la maladie)
- Considérations liées à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité (ÉÉFA)
- Données économiques probantes
La Figure 3 décrit le processus utilisé pour déterminer la façon dont le CCNI intègre les données économiques dans ses lignes directrices et le moment opportun de les intégrer. Veuillez voir chaque étape dans la section « Processus économique en détail ».
Figure 3. Aperçu du processus économique du CCNI
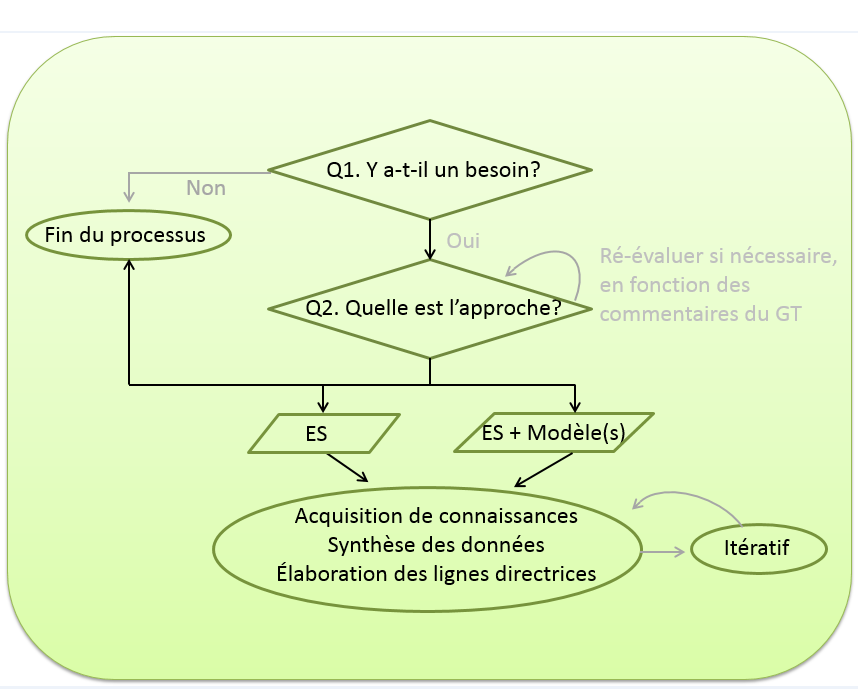
Figure 3 - Description textuelle
Cette figure est un organigramme illustrant le processus économique général du CCNI. La première étape consiste à déterminer s'il est nécessaire d'effectuer une évaluation économique. Si une telle évaluation n'est pas nécessaire, il n'y a pas d'autres étapes à suivre. Si une évaluation est nécessaire, la prochaine étape consiste à déterminer l'approche pour produire des données économiques. Cette approche peut prendre la forme d'un examen systématique des évaluations économiques ou d'un examen systématique et un ou plusieurs modèles. L'approche (ou la décision d'aller de l'avant avec une évaluation économique) peut être réévaluée en fonction de la rétroaction du GT. La dernière étape est un processus itératif d'acquisition de connaissances, de synthèse des données et d'élaboration de recommandations. Abréviations : Q, question; ES, examen systématique; GT, groupe de travail
Processus économique en détail
Le « Processus économique » comprend trois étapes fondamentales :
- Évaluation des besoin
- Détermination de la méthode
- Acquisition de connaissances, synthèse des données, élaboration des lignes directrices
1. Évaluation des besoins
Une fois qu'un élément du plan de travail du CCNI a été identifié, la première étape du Processus économique consiste à déterminer si des données économiques sont requises pour que le CCNI puisse faire une recommandation de vaccin.
- Le plan de travail annuel est élaboré grâce à un processus de collaboration entre le CCN et les PT. Ce processus s'effectue sous la forme d'un sondage et/ou des discussions mené auprès des membres du CCNI et les provinces et territoires canadiens (p. ex. le Comité canadien sur l'immunisation (CCI) et/ou le Conseil des médecins hygiénistes en chef (CMHC)). En fonction de ces priorités, quelques éléments clés du plan de travail sont sélectionnés chaque année pour que le CCNI fasse enquête.
Outil de soutien no 1 : Outil d'établissement des priorités économiques
L'Outil d'établissement des priorités économiques est un outil qualitatif qui sert à évaluer le besoin et l'urgence de générer ou de synthétiser des données économiques pour chaque question de politique. L'évaluation se fonde sur l'épidémiologie, l'innocuité, l'économie et les valeurs sociales. Il n'y a pas d'échelle de notation quantitative ni de pondération des critères évalués. L'Outil d'établissement des priorités économiques vise plutôt à fournir une structure et une orientation pour évaluer le besoin d'obtenir des données économiques probantes, et en cas d'urgence, d'obtenir de telles données. L'Outil d'établissement des priorités économiques sera élaboré et fera l'objet de délibérations par le président ou le vice-président du GT, le Secrétariat (y compris au moins un épidémiologiste ou un médecin spécialiste, et un économiste de la santé), et si nécessaire, des experts en la matière supplémentaires du GT.
- Une fois que le plan de travail annuel du CCNI est finalisé, l'Outil d'établissement des priorités économiques sera appliqué afin d'évaluer le besoin et l'urgence.
Si l'on détermine qu'il y a un besoin, le Secrétariat fera passer le sujet du plan de travail à la deuxième étape du processus économique (section 2). Les preuves économiques ne seront pas incluses pour un sujet de plan de travail qui n'en a pas suffisamment besoin.
2. Détermination de la méthode
La deuxième étape du Processus économique consiste à choisir la méthode à adopter afin de générer des données économiques probantes pour le sujet du plan de travail. Une analyse du contexte de la documentation évaluée par les pairs, de la littérature grise et des commentaires reçus des experts et des intervenants seront utilisés à cette étape.
Plusieurs facteurs seront pris en compte :
- le type de base de données économiques probantes nécessaire
- le moment opportun pour la publication des lignes directrices du CCNI
- les considérations opérationnelles
Voici trois options de « trousse d'information » pouvant constituer la base de données économiques probantes utilisée au cours du processus décisionnel du CCNI :
- l'examen systématique;
- l'examen systématique ET l'évaluation économique fondée sur un modèle de novo (c.-à-d. construit sur mesure) ou fondée sur un modèle adapté;
- l'examen systématique ET la comparaison de plusieurs modèles.
Prenez note que les trois options comprennent un examen systématique pendant lequel la qualité de l'étude sera évaluée et les données seront extraites des évaluations économiques incluses. Dans la deuxième et troisième option, un modèle de novo (ou adapté) supplémentaire et une comparaison de plusieurs modèles seront inclus dans la base de données probantes, respectivement. Ceux-ci sont décrits ci-après. Une fois qu'une approche a été décidée, un modèle de présentation des preuves économiques proposées est disponible pour décrire la justification.
- Évaluation économique fondée sur un modèle de novo (ou adapté) - Il s'agit soit d'une nouvelle évaluation économique (c.-à-d. construit sur mesure), ou soit d'une évaluation économique existante qui sera mis-à-jour ou adaptée aux fins du CCNI.
- Selon des consultations distinctes menées auprès du CCNI, des PT et du Groupe consultatif en matière d'éthique en santé publique de l'ASPC, un modèle adapté ne sera pas fondé sur un modèle élaboré par le secteur (c.-à-d. élaboré par des employés du secteur ou par des consultants commandités par le secteur).
- Pour déterminer l'évaluation économique existante à actualiser ou à adapter de nombreux facteurs seront pris en considération, dont les suivants : i) la capacité de discuter avec les auteurs (c.-à-d. la volonté des auteurs d'actualiser ou d'adapter leur travail pour les besoins du CCNI); ii) la pertinence de l'évaluation économique par rapport aux besoins du CCNI sur le plan de la population, de l'intervention, du comparateur, des résultats, de l'applicabilité (c.-à-d. région, récence, sources de données); iii) la qualité de l'étude; iv) les sources de financement de l'étude et le rôle des bailleurs de fonds.
- Comparaison de plusieurs modèles - Il s'agit de la comparaison de deux ou plusieurs évaluations économiques fondées sur un modèle. Les structures, les intrants, les hypothèses et les résultats du modèle seront évalués et comparés.
- L'une des évaluations économiques utilisées dans une comparaison de plusieurs modèles deviendra un modèle de novo/adapté.
- Les autres évaluations économiques incluses peuvent être élaborées ou financées par d'autres parties intéressées, comme le milieu universitaire, le gouvernement, un organisme de financement reconnu et le secteur.
- Les fabricants concernés seront invités à soumettre leurs modèles économiques au cas où le CCNI chercherait à effectuer une comparaison multimodèle. Les parties intéressées qui choisissent de soumettre leur modèle économique au CCNI doivent consulter les Critères de soumission des évaluations économiques fondées sur un modèle. Les parties intéressées de l'industrie peuvent obtenir des renseignements à jour sur les sujets du plan de travail du CCNI en consultant le site Web du CCNI.
Outil d'appui no 2 : Critères de soumission des évaluations économiques fondées sur un modèle
Les Critères de soumission des évaluations économiques fondées sur un modèle décrivent les normes à respecter avant de soumettre un modèle économique au CCNI. Les critères comprennent la manière de réaliser l'évaluation économique et de produire un rapport sur celle-ci, les exigences en matière de logiciel et de durée d'exécution, ainsi que la soumission du code modèle.
Outil de soutien no 3 : Modèle de présentation des données économiques probantes proposées
Le Modèle de présentation des données économiques probantes proposées décrit la justification de la méthode proposée. Plus précisément, il décrit les résultats de l'Outil d'établissement des priorités économiques, les résultats de l'analyse du contexte et d'autres considérations.
3. Acquisition de connaissances, synthèse des données, élaboration des lignes directrices
La troisième étape du Processus économique consiste à acquérir des connaissances, à synthétiser les données et à élaborer des lignes directrices du CCNI. Le travail de base consiste à dresser le plan de projet pour le sujet du plan de travail; à générer et à synthétiser des données économiques probantes; examiner et discuter (au sein du GT) les éléments du plan de travail; et à rédiger un rapport économique pouvant être intégré aux lignes directrices du CCNI. Le CCNI a mis au point les cinq outils suivants pour réaliser et présenter des évaluations économiques et des examens systématiques et pour produire des rapports sur ces ceux-ci :
Outil de soutien no 4 : Lignes directrices provisoires pour l'évaluation économique des vaccins : Canada
Ces Lignes directrices provisoires ont pour but de déterminer les pratiques exemplaires à adopter lors des nouvelles évaluations économiques des vaccins au Canada. Il s'agit de s'assurer que les données sur l'économie sont normalisées, crédibles et pertinentes pour les décideurs du système de soins de santé public du Canada.
Les Lignes directrices provisoires doivent être utilisées pendant que les lignes directrices officielles sont élaborées par le Groupe de travail sur les lignes directrices en matière d'économie du CCNI. Le Groupe de travail s'est réuni en janvier 2019 et se compose d'experts internationaux qui ont une expertise en économie, en modélisation, en maladies infectieuses et en vaccins, ainsi qu'une expérience dans des groupes de travail d'élaboration de lignes directrices. En plus d'avoir une représentation provinciale et territoriale parmi ses membres, le Groupe de travail continuera de solliciter d'autres commentaires des PT par l'entremise du CCI et du CMHC. Les commentaires d'autres intervenants, dont le secteur, le milieu de la recherche au Canada, les organismes d'évaluation des technologies de la santé et le public, seront sollicités. De plus amples renseignements au sujet de la consultation publique seront communiqués dès que nous en disposerons. Les lignes directrices officielles ne sont pas prises en compte dans le cadre du présent processus de consultation publique qui porte sur le Processus économique.
Outil de soutien no 5 : Lignes directrices en matière de production de rapports sur les évaluations économiques des vaccins : Canada
Les Lignes directrices en matière de production de rapports fournissent des conseils sur la production de rapports sur les évaluations économiques destinés au CCNI. Les utilisateurs sont notamment le Secrétariat, ses sous-traitants et les parties intéressées de l'industrie qui soumettent des documents au CCNI dans le cadre d'une comparaison de plusieurs modèles.
Outil de soutien no 6 : Procédure opératoire normalisé (PON) pour les examens systématiques des évaluations économiques portant sur des vaccins
Le PON sert à fournir des conseils sur la réalisation et la présentation d'un examen systématique des évaluations économiques destiné au CCNI.
Outil de soutien no 7 : Modèle de présentation des évaluations économiques
Le Modèle de présentation des évaluations économiques sert à garantir l'uniformité de la présentation, la clarté et l'excellente qualité des évaluations économiques présentées aux groupes de travail et au CCNI.
Outil de soutien no 8 : Modèle de présentation des examens systématiques
Le Modèle de présentation des examens systématiques sert à garantir l'uniformité de la présentation, la clarté et l'excellente qualité des examens systématiques présentés aux groupes de travail et au CCNI.
Mot de la fin
En résumé, les données économiques probantes peuvent être une composante des lignes directrices du CCNI. Les autres éléments comprennent les données cliniques probantes (c.-à-d. l'innocuité, l'efficacité théorique, l'immunogénicité, l'efficacité et le fardeau de la maladie) ainsi que les facteurs liés à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité (ÉÉFA). Les lignes directrices du CCNI seront publiées sur le site Web du CCNI et des avis seront envoyés aux parties intéressées et aux abonnés sur le Web, et généralement avec un avis dans le Relevé des maladies transmissibles au Canada (RMTC).
Abréviations
- ACIP
- Advisory Committee on Immunization Practices (Centers for Disease Control and Prevention des États-Unis)
- ACMTS
- Agence canadienne des médicaments et des technologies de la santé
- ASPC
- Agence de la santé publique du Canada
- CCI
- Comité canadien sur l'immunisation
- CCNI
- Comité consultatif national de l'immunisation
- CMHC
- Conseil des médecins hygiénistes en chef
- ÉÉFA
- Éthique, équité, faisabilité, acceptabilité
- GCI
- Guide canadien d'immunisation
- GT
- Groupe de travail
- GTCV
- Groupes techniques consultatifs nationaux pour la vaccination
- MVE
- Maladie à virus Ebola
- OMS
- Organisation mondiale de la Santé
- PON
- Procédure opératoire normalisé
- PT
- Provinces et territoires
- RMTC
- Relevé des maladies transmissibles au Canada
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 1
Guide sur l'établissement des priorités relatives aux données économiques
Module B
Préambule
- Adaptation à partir de l'outil d'établissement des prioritésNote de bas de page 25 de Qualité des services de santé Ontario et révision pour répondre aux besoins propres aux évaluations de vaccins.
- Collecte de commentaires à itérations multiples auprès de différents intervenants (c.-à-d. Comité canadien sur l'immunisation [CCI], CCNI, Groupe de travail sur l'économie du CCNI) et lors de la mise à l'épreuve au sein du secrétariat du CCNI.
Pour les utilisateurs
- Objet : Fournir une structure et une orientation pour évaluer le besoin d'obtenir des données économiques et le degré d'urgence de ce besoin.
- L'outil se veut qualitatif.
- Aucune évaluation ou pondération quantitative des critères.
- Destiné à être utilisé pour une question de politique précise (c.-à-d. de préférence avec une question établie avec l'approche PICO).
Guide sur l'établissement des priorités relatives aux données économiques du CCNI
- Date à laquelle l'outil a été utilisé
- Liste des utilisateurs et des rôles
- Question d'intérêt en matière de politique
| Critères | Sous-critères | Évaluation | Raison de l'évaluation | ||||
|---|---|---|---|---|---|---|---|
| Élevé | Moyen | Faible | Inconnu | ||||
| Fardeau des maladies | a) | Incidence ou prévalence (niveaux endémiques) et potentiel d'éclosion | Incidence ou prévalence moyenne à élevée, ou potentiel d'éclosion moyen à élevé | Incidence ou prévalence faible, ou potentiel d'éclosion limité | En cours d'éradication ou aucun potentiel d'éclosion | Inconnu | aucune donnée disponible |
| b) | Gravité de la maladie (manifestations, séquelles) | Mortalité ou morbidité importante | Certaine mortalité ou morbidité | Aucun effet prévu sur la mortalité ou la morbidité | Inconnu | aucune donnée disponible | |
| c) | Besoin non satisfait en matière de santé (s'il existe des produits disponibles établissant une norme de soins pour des [sous-]populations d'intérêt, c.-à-d. par groupes d'âge) |
Besoins non satisfaits importants | Certains besoins non satisfaits | Aucun besoin non satisfait | Inconnu | aucune donnée disponible | |
| d) | Fardeau économique de la maladie (fardeau direct pour le système de santé) | Fardeau économique important | Certain fardeau économique | Fardeau économique faible | Inconnu | aucune donnée disponible | |
| Avantage proposé et problèmes de sécurité possibles | a) | Efficacité : Potentiel d'amélioration des résultats pour la santé par rapport aux autres solutions existantes | Avantage possible important | Certain avantage | Aucun avantage attendu ou avantage inférieur possible | Inconnu | aucune donnée disponible |
| b) | Modification de la dynamique de la maladie ou des effets indirects du programme | Avantage possible important | Certain avantage | Aucun avantage attendu | Inconnu | aucune donnée disponible | |
| c) | Fardeau possible en raison des problèmes de sécurité (incidence, gravité) | Aucune préoccupation liée à la sécurité | Certaines préoccupations liées à la sécurité | Importantes préoccupations liées à la sécurité | Inconnu | aucune donnée disponible | |
| Considérations économiques | a) | Coûts différentiels pour rendre le vaccin disponible (coût par personne complètement vaccinée, vaccin + son administration) | Plus de 300 $ | De 100 $ à 300 $ | Moins de 100 $ | Inconnu | aucune donnée disponible |
| b) | Effet possible sur le budget (à partir de la mise en œuvre du programme de vaccination) | Effet important sur le budget | Certain effet sur le budget | Peu d'effet sur le budget | Inconnu | aucune donnée disponible | |
| c) | Compensation des coûts pour le système de santé (c.-à-d. en raison de diminutions multiples : consultations médicales, morbidité, mortalité, coûts de traitement, etc.) | Compensation importante attendue | Certaine compensation attendue | Aucune compensation attendue | Inconnu | aucune donnée disponible | |
| Considérations relatives aux valeurs sociales | a) | Effet possible sur les valeurs sociales et l'équité (voir le cadre sur l'EEFA [éthique, équité, faisabilité et acceptabilité]) | Importants problèmes relatifs aux valeurs sociales et à l'équité | Certains problèmes relatifs aux valeurs sociales et à l'équité | Aucun effet notable sur les valeurs sociales ou l'équité | Inconnu | aucune donnée disponible |
Quel est le besoin de données économiques? : Élevé, moyen ou faible Les principales considérations pour cette décision étaient les suivantes :
Etc. |
|||||||
| Critères | Sous-critères | Évaluation | Raison de l'évaluation | ||||
|---|---|---|---|---|---|---|---|
| Élevé | Moyen | Faible | Inconnu | ||||
| Urgence | a) | Recommandation canadienne (p. ex. CCMTMV, SCP, SOGC, provinces/territoires) | Trois organisations ou plus Forte recommandation |
Une ou deux organisations Recommandation moyenne |
Aucune organisation Faible recommandation |
Unknown | aucune donnée disponible |
| b) | Disponibilité actuelle du vaccin (financement public) | Largement disponible (trois provinces ou plus) |
Certaine disponibilité (une ou deux provinces) |
Disponibilité limitée ou inexistante | Inconnu | aucune donnée disponible | |
| c) | Recommandation internationale (p. ex. ACIP, JCVI, ATAGI) | Nombreuses régions internationales | Une région internationale | Aucune | Inconnu | aucune donnée disponible | |
| d) | Préoccupations des provinces/territoires concernant les programmes | Forte demande/Trois provinces ou plus | Certaine demande/Une ou deux provinces | Aucune | Inconnu | aucune donnée disponible | |
| e) | Demande d'intervenants, ce qui comprend le public, les cliniciens, les fabricants, etc. | Demande de nombreux intervenants ou d'au moins un intervenant national | Demande d'un intervenant ou d'au moins un intervenant provincial | Aucune | Inconnu | aucune donnée disponible | |
Quelle est l'urgence des données économiques? : Élevée, moyenne ou faible Les principales considérations pour cette décision étaient les suivantes :
Etc. Abréviations : CCMTMV, Comité consultatif de la médecine tropicale et de la médecine des voyages; SCP, Société canadienne de pédiatrie; SOGC, Société des obstétriciens et gynécologues du Canada; ACIP, US Advisory Committee on Immunization Practices; JCVI, UK Joint Committee on Vaccination and Immunisation; ATAGI, Australian Technical Advisory |
|||||||
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 2
Critères de soumission des évaluations économiques fondées sur un modèle
Module C
Les parties intéressées qui soumettent au CCNI des évaluations économiques fondées sur un modèle doivent se conformer aux critères suivants :
- respecter les Lignes directrices provisoires pour l'évaluation économique des vaccins du CCNI. Ce document décrira les exigences applicables aux évaluations économiques, y compris la perspective, le taux d'actualisation et le comparateur;
- les Lignes directrices en matière de production de rapports sur les évaluations économiques du CCNI. Ce document décrira les exigences applicables au rapport qui doit être soumis en même temps que l'évaluation économique fondée sur un modèle;
- fournir un accès complet au code de programmation (p. ex., les macros et le code VBA). Le CCNI doit pouvoir faire varier chacun des paramètres, afficher les calculs et exécuter le modèle afin de générer des résultats. Autrement dit, le modèle doit être entièrement déverrouillé et exécutable;
- utiliser les logiciels suivants : Excel, TreeAge et R.
- Avant d'utiliser un autre logiciel spécialisé, il faut d'abord communiquer avec le CCNI pour s'assurer que cet autre logiciel est acceptable. S'il est jugé acceptable, les parties intéressées recevront des instructions sur la façon dont le modèle et le logiciel doivent être fournis dans le cadre de la soumission (p. ex., licences, logiciels). Ces derniers leur seront retournés à la fin du processus d'examen à leurs frais;
- fournir des renseignements de base sur la façon de modifier les paramètres d'entrée et d'exécuter le modèle;
- s'assurer que la durée d'exécution du modèle n'est pas trop longue sur un ordinateur personnel (c'est-à-dire qu'elle ne dépasse pas un jour ouvrable ou huit heures sur un ordinateur standard).
Tout écart par rapport à ces exigences doit être mentionné au CCNI et accepté par ce dernier avant la soumission. Veuillez transmettre les données complètes sur les écarts par rapport à ces exigences à phac.naci-ccni.aspc@canada.ca.
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 3
Modèle de présentation pour la proposition sur les données économiques
Module D
Diapositive 3-1. Proposition sur les données économiques: Sujet

Diapositive 3-1 - Description textuelle
Proposition sur les données économiques: Sujet
Diapositive 3-2. Outil d'établissement des priorités économiques : Sommaire

Diapositive 3-2 - Description textuelle
- Question: [question de recherche selon l'approche PICO]
- Besoin de données économiques? [Élevé, moyen ou faible]
- Raison(s)
- Ex. : Fardeau de la maladie (p. ex., incidence, prévalence ou éclosions; gravité de la maladie; besoin non satisfait), avantage proposé et problèmes de sécurité possibles, considérations économiques (coûts différentiels, effet sur le budget, compensation des coûts), considérations relatives aux valeurs sociales
- Urgence des données économiques? [Élevée, moyenne ou faible]
- Raison(s)
- Ex. : Recommandations canadiennes (p. ex., CCMTMV), disponibilité actuelle du vaccin, recommandation internationale (p. ex., Advisory Committee on Immunization Practices [ACIP], préoccupations liées au programme des provinces et territoires, demande d'intervenants
Diapositive 3-3. Outil d'établissement des priorités économiques: sommaire

Diapositive 3-3 - Description textuelle
- Analyse de la conjoncture :
- Ex. : Un modèle canadien existant (analyse coût-utilité [ACU]). Les auteurs ont conclu que le programme de vaccination est rentable à 100 $ par année de vie ajustée en fonction de la qualité (AVAQ).
- Un modèle au Chili (ACU). La population à l'étude était plus vaste que notre population d'intérêt. Les auteurs ont conclu que le programme de vaccination permet des économies.
- Considérations :
- Ex. : Étant donné qu'il existe un modèle canadien pertinent, nous souhaitons accorder un contrat pour la mise à jour du modèle. Nous sommes en discussion avec les auteurs.
- Ex. : Il existe de nombreux modèles économiques, dont cinq études canadiennes pertinentes pour notre approche PICO. Un nouveau modèle économique pourrait s'avérer redondant. Un examen systématique devrait s'avérer suffisant. / Une comparaison de plusieurs modèles pourrait faciliter la compréhension des résultats hétérogènes.
- Ex. : Il s'agit d'un nouveau vaccin. Un modèle économique est nécessaire pour la prise de décisions.
[Sujet] :
Le GT propose [un examen systématique OU un examen systématique + au moins un modèle économique.]
ou
Aucun données économiques sont proposé sur le sujet pour l'exercice en cours.
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 4
Lignes directrices provisoires pour l'évaluation économique des vaccins : Canada
Module E
Objet
Ces Lignes directrices provisoires ont pour but d'informer les pratiques exemplaires à adopter pour effectuer de nouvelles évaluations économiques des vaccins au Canada. Il s'agit de s'assurer que les données sur l'économie sont normalisées, crédibles et pertinentes pour les décideurs du système public de soins de santé du Canada.
Contexte
Traditionnellement, le Comité consultatif national de l'immunisation (CCNI) du Canada évaluait les vaccins en fonction de leur efficacité clinique et de leur innocuité. En 2016, il a élargi son mandat et, depuis, tient compte de considérations liées à l'économie, à l'équité, à l'éthique, à la faisabilité et à l'acceptabilité dans la formulation de ses recommandations sur l'utilisation des vaccins.
Le Canada dispose actuellement de lignes directrices sur l'évaluation économique générale des technologies de la santé. L'Agence canadienne des médicaments et des technologies de la santé (ACMTS) a révisé ces lignes directrices en 2016Note de bas de page 1. Les technologies de la santé comprennent entre autres les médicaments, les instruments médicaux, les produits diagnostiques et les procédures.
Même si les recommandations formulées dans les Lignes directrices de l'ACMTS s'appliquent de manière générale aux vaccins, il a été établi que ces derniers doivent faire l'objet de lignes directrices particulières en raison de leur caractère unique et des maladies infectieuses qu'ils servent à éviter.
Le Groupe de travail sur les lignes directrices en matière d'économie du CCNI élabore actuellement des lignes directrices particulières portant sur les vaccins. D'ici leur publication, le CCNI appliquera les présentes Lignes directrices provisoires à la réalisation des évaluations économiques. Elles sont largement inspirées des Lignes directrices de l'ACMTS, qui ont été modifiées ou auxquelles des commentaires ont été ajoutés en fonction des particularités des vaccins.
Énoncés des lignes directrices
Veuillez vous reporter aux 15 énoncés des lignes directrices figurant dans les Lignes directrices de l'ACMTS.Note de bas de page 1 Les Lignes directrices provisoires sont conformes aux recommandations de l'ACMTS, sauf indication contraire dans le présent document. La lettre « M » dans le tableau ci-dessous indique que l'énoncé provisoire diffère de l'énoncé original de l'ACMTS (et que ce dernier a été modifié). La lettre « A » signifie qu'un commentaire a été ajouté à l'énoncé de l'ACMTS, mais que ce dernier n'a pas été modifié. Les modifications et les commentaires supplémentaires sont présentés dans la section suivante.
| # | Sujet | Modification? | Énoncé |
|---|---|---|---|
| 1 | Problème de décision | - | aucune donnée disponible |
| 2 | Types d'évaluations | - | aucune donnée disponible |
| 3 | Population cible | - | aucune donnée disponible |
| 4 | Comparateurs | - | aucune donnée disponible |
| 5 | Perspective | M | ACMTS : Énoncé provisoire : |
| 6 | Horizon temporel | M | ACMTS : Énoncé provisoire : Ne pas définir l'horizon temporel à l'échelle de la population avant de procéder à l'analyse, car la modélisation se poursuivra jusqu'à l'atteinte de l'état stable. |
| 7 | Actualisation | A | aucune donnée disponible |
| 8 | Modélisation | M | ACMTS : Énoncé provisoire : |
| 9 | Efficacité | A | aucune donnée disponible |
| 10 | Mesure et évaluation de la santé | A | aucune donnée disponible |
| 11 | Utilisation et coût des ressources | A | aucune donnée disponible |
| 12 | Analyse | M | ACMTS : Énoncé provisoire : Dans le cas des modèles dynamiques, faire preuve de jugement pour déterminer si l'analyse probabiliste est appropriée. Dans le cas des analyses de sensibilité, envisager d'appliquer une analyse déterministe de l'incertitude paramétrique (p. ex. unidirectionnelle, multidirectionnelle, analyse de seuil). |
| 13 | Incertitude | - | aucune donnée disponible |
| 14 | Équité | - | aucune donnée disponible |
| 15 | Compte rendu de l'évaluation | - | aucune donnée disponible |
| A = commentaire ajouté, mais énoncé de l'ACMTS non modifié; M = modifications de l'énoncé de l'ACMTS. Abréviation : ACMTS = Agence canadienne des médicaments et des technologies de la santé. | |||
Énoncés modifiés ou commentaires supplémentaires
5. Perspective
Énoncé(s) de l'ACMTS :
« 5.1. Dans l'analyse de référence, la perspective est celle du payeur public des soins de santé. La perspective de l'évaluation économique est fonction du problème de décision.
5.3 Lorsque d'autres perspectives que celle adoptée dans l'analyse de référence revêtent un intérêt pour le décideur et sont susceptibles d'avoir des effets importants sur les résultats de l'analyse, les intégrer à d'autres analyses. »
Commentaire du CCNI :
Dans le contexte des vaccins et des maladies infectieuses, la perspective sociétale pourra s'avérer particulièrement intéressante pour le décideur. Aux États-Unis, l'Advisory Committee on Immunization Practices (ACIP) recommande d'adopter une perspective sociétale, à moins qu'il soit fortement justifié de faire autrementNote de bas de page 2. Cette perspective recouvre un large éventail de coûts et d'effets en plus de ceux liés à la santé.
Les coûts non liés à la santé comprennent les coûts assumés par les parties suivantesNote de bas de page 1 :
- Gouvernement : services sociaux comme l'aide à domicile ou La Popote roulante;
- Assureur privé : services communautaires, les soins en maison de soins;
- Patients et aidants : débours personnels (p. ex. la quote-part à payer), coût des déplacements, rémunération des aidants, primes versées à des assureurs privés, temps que le patient consacre aux déplacements et aux traitements;
- Coûts liés à la productivité : perte de productivité en raison de périodes d'absence du travail ou des études, temps de travail perdu par le patient ou ses aidants consacrés à du travail non rémunéré (p. ex. à des tâches ménagères), coûts assumés par l'employeur pour l'embauche et la formation de remplaçants.
Effets non liés à la santéNote de bas de page 1,Note de bas de page 3
- Amélioration du niveau de scolarité
- Accroissement du rendement au travail
- Diminution du risque financier pour le ménage
- Hausse du pouvoir d'attraction touristique
- Accès à l'information pour les patients
- Diminution des comportements criminels
Veiller à ne pas comptabiliser en double les coûts et les effets non liés à la santéNote de bas de page 4.
Énoncé provisoire du CCNI :
Dans l'analyse de référence, la perspective est celle du payeur public des soins de santé. S'il y a lieu, une perspective sociétale pourra être adoptée dans le cadre d'analyses complémentaires.
6. Horizon temporel
Énoncé(s) de l'ACMTS :
« 6.1. Dans l'analyse de référence, déterminer un horizon temporel suffisamment long pour détecter toutes les différences pertinentes entre les interventions quant à leurs coûts et à leurs résultats (effets sur la santé) futurs. L'horizon temporel devrait être déterminé en fonction de la maladie et de l'effet probable de l'intervention. »
Commentaire du CCNI :
Dans le cas des maladies chroniques, le modèle économique fait le suivi de personnes atteintes de la maladie en question sur une période donnée, que l'on appelle « horizon temporel ». Dans le cas des maladies infectieuses, le modèle économique peut faire le suivi (i) des personnes atteintes de l'infection uniquement ou (ii) des personnes atteintes de l'infection et de celles qui ne le sont pas, sur une période donnée. Lorsque le suivi ne porte que sur les personnes atteintes, la dynamique de la maladie (c.-à-d. la transmission de pathogènes entre des personnes ou des segments de la population) n'est pas prise en compte. Par conséquent, l'horizon temporel du modèle portant sur une maladie infectieuse peut être très semblable à celui du modèle portant sur une maladie chronique. Cet horizon temporel peut être qualifié d'horizon temporel individuel. Lorsque le suivi porte sur les personnes atteintes de l'infection et sur celles qui ne le sont pas, le modèle tient compte de la dynamique de la maladie. Cet horizon temporel peut être qualifié d'horizon temporel populationnel ou à l'échelle du programme.
Horizon temporel individuel : période de suivi d'une cohorte unique/de personnes. Les chercheurs qui choisissent cet horizon temporel doivent tenir compte des facteurs suivants :
- durée de l'efficacité du vaccinNote de bas de page 3;
- réduction des séquelles chroniques (p. ex. de la surdité ou des déficits neurologiques faisant suite à une méningite) attribuables au vaccinNote de bas de page 3;
- report de l'issue de la maladie (p. ex. du cancer du col de l'utérus ou hépatopathie décompensée) attribuable au vaccinNote de bas de page 3.
Il est souvent recommandé d'adopter un horizon temporel vie entière lorsqu'il est prévu que le vaccin aura une incidence sur la survie ou que ses effets bénéfiques perdureront tout au long de la vie de la personneNote de bas de page 5,Note de bas de page 6. Toutefois, ce type d'horizon temporel vie entière exige presque toujours que les données soient extrapolées au-delà de la période de suivi des essais cliniques ou des études d'observation disponibles. Ce facteur ajoute à l'incertitude de l'analyse. L'utilisation d'un horizon temporel court peut se justifier si la durée de l'efficacité du vaccin et les coûts et effets pertinents sont consignés pendant cette période. Ainsi, l'utilisation d'un horizon temporel court est appropriée dans le cas d'une infection aiguë sans séquelles à long termeNote de bas de page 6. Des analyses de sensibilité doivent être réalisées selon différents horizons temporels.
Horizon temporel populationnel : période requise pour obtenir un effet d'immunité collective après l'instauration d'un programme de vaccination. En d'autres termes, il s'agit du nombre de cohortes modélisées. En général, les modèles dynamiques simulent l'épidémiologie avant l'instauration du programme de vaccination (période d'adaptation et de rodage), après l'instauration du programme (période d'évaluation) et après que les estimations ont atteint un plateau (c.-à-d. après que les estimations épidémiologiques, notamment l'issue de la maladie, se sont stabilisées et ont cessé d'évoluer dans le temps)Note de bas de page 5. Cette dernière étape porte le nom d'« état stable ». Laisser le modèle courir jusqu'à l'atteinte de l'état stable; en d'autres termes, ne pas définir l'horizon temporel populationnel avant d'amorcer l'analyseNote de bas de page 5.
L'horizon temporel peut avoir des effets importants sur les résultats du modèle dynamiqueNote de bas de page 7. C'est pourquoi, en Allemagne, le comité permanent de la vaccination (STIKO) recommande de rendre compte des résultats relatifs au rapport coût/efficacité à l'étape de l'état stable ainsi qu'à différents moments de la période précédant cet étatNote de bas de page 8.
Énoncé provisoire du CCNI :
Dans l'analyse de référence, déterminer un horizon temporel individuel suffisamment long pour détecter toutes les différences pertinentes entre les interventions quant à leurs coûts et à leurs résultats (effets sur la santé) futurs. Déterminer l'horizon temporel en fonction de la maladie et de l'effet probable de l'intervention.
Ne pas définir l'horizon temporel à l'échelle de la population avant de procéder à l'analyse, car la modélisation se poursuivra jusqu'à l'atteinte de l'état stable.
7. Actualisation
Énoncé(s) de l'ACMTS :
« 7.1. Dans l'analyse de référence, actualiser les coûts et les résultats (effets) des interventions pour une période dépassant la première année afin de présenter les valeurs selon un taux de 1,5 % par an.
7.2. Évaluer le retentissement de l'incertitude liée au taux d'actualisation en comparant les résultats de l'analyse de référence à ceux d'analyses complémentaires à l'aide des taux de 0 % et de 3 % par an. »
Commentaire du CCNI :
Contrairement à celui d'autres traitements curatifs, le rapport coût/efficacité des programmes de vaccination variera probablement fortement en fonction de l'actualisationNote de bas de page 9. Ceci parce que les effets bénéfiques ne surviennent pas nécessairement immédiatement après la vaccination, mais plutôt à long terme. Ainsi, un vaccin qui serait administré aujourd'hui pourrait faire effet après plusieurs années (p. ex. le vaccin contre le virus du papillome humain pourra protéger une femme contre le cancer du col de l'utérus plusieurs années après son administration). Ou, les effets bénéfiques des vaccins qui permettent d'éviter un décès prématuré ou une incapacité chronique à un jeune âge (comme le vaccin contre la polio ou le vaccin contre le rotavirus mortel) peuvent se faire sentir pendant la vie entière de la personne vaccinée et même chez les générations suivantesNote de bas de page 9. Le rapport coût/efficacité des programmes de vaccination varie fortement en fonction de l'actualisation des effets bénéfiques à long terme, car il se peut que l'on accorde peu d'importance à ces effets bénéfiques.
C'est pourquoi certains économistes de la santé avancent que les effets sur la santé devraient être actualisés à un taux plus faible que les coûts (actualisation différentielle)Note de bas de page 9. L'actualisation différentielle peut toutefois donner lieu à des situations paradoxales (paradoxe de Keeler-Cretin)Note de bas de page 10. En bref, les meilleurs résultats en matière de coût/efficacité pourraient théoriquement être obtenus en reportant indéfiniment une intervention. La plupart des lignes directrices recommandent d'actualiser les coûts et les résultats au même tauxNote de bas de page 9. Un organisme a suggéré d'étudier l'effet de taux d'actualisation plus faibles dans le cadre de l'analyse de sensibilité lorsque l'horizon temporel est de plus de 30 ansNote de bas de page 11. D'autres ont suggéré d'étudier l'effet de taux d'actualisation non constants (décroissants)Note de bas de page 9.
Les analyses méthodologiques de l'actualisation continueront d'évoluer. Les Lignes directrices provisoires suivront les recommandations de l'ACMTS quant à l'application de taux d'actualisation constants de 1,5 %, 0 % et 3 % aux coûts et aux effets. Les résultats en matière de rapport coût/efficacité actualisés à 0 % (aussi appelés « non actualisés ») et les résultats actualisés à 3 % constituent la fourchette des résultats possibles attribuables à l'actualisation. Les résultats en matière de rapport coût/efficacité obtenus au moyen de taux d'actualisation différentiels et de taux d'actualisation décroissants doivent se situer dans cette fourchette.
Énoncé provisoire du CCNI :
Aucune modification de l'énoncé de l'ACMTS
8. Modélisation
Énoncé(s) de l'ACMTS :
« 8.1. Conceptualiser et élaborer le modèle en fonction du problème de décision.
[p. 33 [Conceptualisation du modèle] Il s'agit de concevoir la structure du modèle en fonction d'états ou d'évènements précis et de leurs interrelations formant le cheminement clinique relatif à l'affection d'intérêt et aux interventions comparées.]
8.4. Justifier le choix de la technique de modélisation. Ne pas complexifier la démarche plus qu'il ne le faut pour s'attaquer au problème de décision.
[p. 33 Le chercheur qui entreprend une évaluation économique a le choix de nombreuses techniques de modélisation décisionnelle, notamment l'arbre de décision, le modèle d'une cohorte en transition entre des états de santé (modèle de Markov), le modèle d'un patient en transition entre des états de santé (microsimulation ou simulation de Monte Carlo du premier ordre), le modèle de la dynamique du système, la simulation d'évènements discrets et le modèle multi-agents.] »
Commentaire du CCNI :
Conceptualisation du modèle : Dans le cas des maladies infectieuses, l'histoire naturelle de l'infection et de la maladie est communément représentée par les structures de modèle suivantes :
- SIS (susceptible-infectieux-susceptible) : suppose l'absence d'immunité naturelle;
- SIR (susceptible-infectieux-remis) : suppose que l'hôte ne peut être infecté qu'une seule fois dans le cadre de l'horizon temporel du modèle;
- SIRS (susceptible-infectieux-remis-susceptible) : suppose que l'hôte est protégé contre une réinfection après guérison jusqu'à ce que son immunité naturelle décline;
- SEIR (susceptible-exposé-infectieux-remis) : suppose un modèle SIR auquel s'ajoute une période de latence où l'hôte est infecté, mais ne peut transmettre l'infection.
Technique de modélisation : la modélisation permet de prévoir l'effet des vaccins sur l'épidémiologie de la maladie à l'échelle populationnelle plutôt qu'à l'échelle individuelleNote de bas de page 12. Les différents modèles peuvent être décrits sous forme de combinaisons des trois caractéristiques suivantesNote de bas de page 13:
- Modèle statique ou modèle dynamique
- Modèle statique : suppose un risque d'infection (force de l'infection) constant chez les sujets réceptifs. Bien qu'ils ne puissent rendre compte de la transmissibilité des maladies infectieuses, les modèles statiques peuvent malgré tout servir à modéliser l'épidémiologie de la maladie dans les cas suivants :
- la couverture vaccinale est faible (ce qui signifie que le vaccin est peu susceptible de modifier la force de l'infection)Note de bas de page 14;
- le groupe ciblé aux fins de la vaccination n'a pas d'incidence sur la transmission globale du pathogène ou ne peut empêcher sa circulation (ce qui signifie que le vaccin est peu susceptible de modifier la force de l'infection); (p. ex. la vaccination contre l'hépatite A de voyageurs qui viennent de pays où l'incidence de la maladie est faible et qui se rendent dans des pays où cette dernière est élevée)Note de bas de page 14;
- le vaccin n'a pas d'effets négatifs potentiels directs ou indirects sur la santé (p. ex. modification de l'âge moyen des personnes infectées, remplacement du sérotype ou modification de la périodicité des éclosions selon les taux de couverture)Note de bas de page 3;
- le décideur ne souhaite obtenir qu'une estimation prudente du rapport coût/efficacité d'un vaccin comparativement à l'absence d'interventionNote de bas de page 12. (Par exemple, si le modèle statique indique que le vaccin présente un bon rapport coût/efficacité, le modèle dynamique indiquera probablement que le vaccin présente un rapport coût/efficacité encore meilleur. Ceci parce que le modèle dynamique peut rendre compte de la protection indirecte découlant de l'immunité collective et prévoir une diminution plus rapide du nombre d'infectionsNote de bas de page 12.)
- Modèle dynamique : suppose que le risque d'infection chez les sujets réceptifs est fonction de la proportion de la population qui est infectée. Les mesures du risque d'infection couramment utilisées sont le taux de reproduction de base et le taux de reproduction effectif. Les modèles dynamiques peuvent rendre compte d'effets indirects, comme ceux liés à l'immunité collective, à l'immunité naturelle et aux modifications dans la répartition selon l'âge. Ces modèles conviennent à la modélisation de l'épidémiologie de la maladie dans les cas suivants :
- le vaccin a une incidence sur la transmission de la maladie (p. ex. en réduisant la proportion des sujets réceptifs [notamment grâce à une vaccination de masse], les taux de contact entre les personnes [notamment en fermant les écoles pendant les pandémies], la durée de l'infectiosité ou la probabilité de transmission par acte)Note de bas de page 14;
- lorsque le vaccin exerce des pressions sélectives sur ce pathogène, ce qui donne un avantage concurrentiel à certains autres types de pathogènes (remplacement de la souche)Note de bas de page 14.
- Modèle statique : suppose un risque d'infection (force de l'infection) constant chez les sujets réceptifs. Bien qu'ils ne puissent rendre compte de la transmissibilité des maladies infectieuses, les modèles statiques peuvent malgré tout servir à modéliser l'épidémiologie de la maladie dans les cas suivants :
- Modèle déterministe ou modèle stochastique
- Modèle déterministe : les événements se déroulent de manière prédéterminée en fonction des valeurs paramétriques et des conditions initiales du modèleNote de bas de page 13.
- Modèle stochastique : le déroulement des événements du modèle relève du hasardNote de bas de page 13.
- Modèle populationnel ou modèle individuel
- Modèle populationnel : suivi de groupes. Les personnes sont affectées à différents compartiments (aussi appelés « états de santé ») et l'on suppose que les personnes classées dans chacun forment des groupes homogènes. Elles passent d'un état de santé à un autre en fonction des valeurs paramétriques, au niveau des données regroupées.
- Modèle individuel : suivi de personnes. Les personnes sont modélisées en tenant compte de leurs propres caractéristiques en tant que patients, ce qui permet de saisir l'hétérogénéité de la population. Elles passent d'un compartiment à un autre en fonction des valeurs paramétriques individuelles et leurs antécédents peuvent faire l'objet d'un suivi. Les modèles individuels sont par nature des modèles stochastiques (non déterministes)Note de bas de page 13.
Les combinaisons d'attributs de modèle suivantes sont courantes dans la modélisation des maladies infectieuses :
- dynamique, stochastique, populationnel, comme dans le cas du modèle de la dynamique du système, où les groupes de personnes passent d'un état de santé à un autre en fonction d'équations différentielles;
- dynamique, stochastique, individuel, comme dans le cas du modèle multiagent et de la simulation d'événements discrets, où les personnes (et non les groupes) passent d'un état de santé à un autre. Le modèle multiagent et la simulation d'événements discrets se distinguent principalement par l'unité de modélisation utilisée. Dans le premier cas, les personnes (ou agents) servent d'unités et dans le deuxième, ce sont les événementsNote de bas de page 16;
- statique, déterministe, populationnel, comme dans le cas de l'arbre de décision, du modèle d'une cohorte en transition entre des états de santé (modèle de Markov) ou d'un modèle hybride issu de la combinaison de ces deux modèlesNote de bas de page 13. Ces modèles sont couramment utilisés dans les évaluations économiques des maladies chroniques;
- statique, stochastique, individuel, comme dans le cas de la microsimulation de la transition entre des états de santé.
Énoncé provisoire du CCNI :
Justifier le choix de la technique de modélisation. Ne pas complexifier la démarche plus qu'il ne le faut pour s'attaquer au problème de décision. Tenir compte de la dynamique de transmission s'il y a lieu.
Figure 4. Diagramme d'aide au choix du modèle, Organisation mondiale de la santé adoptée par Ultsch.5
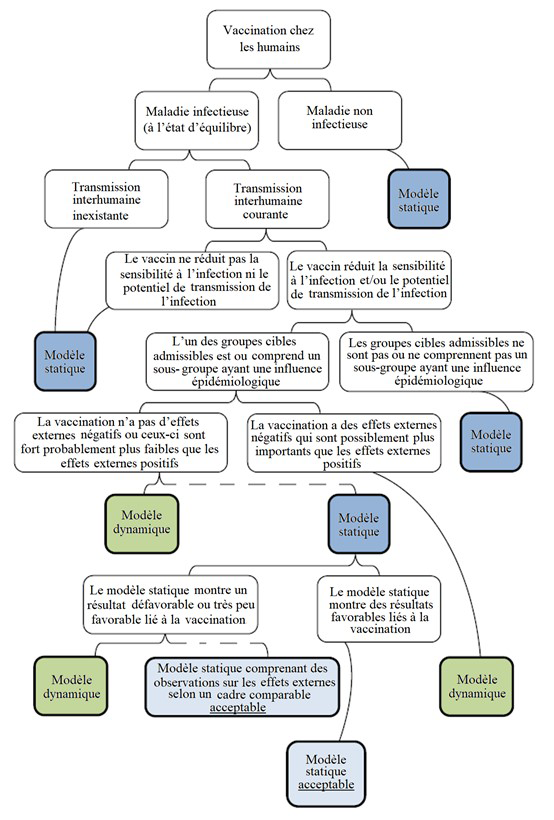
Figure 4 - Description textuelle
Cette figure est un organigramme élaboré par l'Organisation mondiale de la Santé pour aider les chercheurs à sélectionner le type de modèle (dynamique ou statique). L'organigramme commence en haut, avec le concept de modéliser la vaccination chez les humains. Deux différentes catégories sont possibles pour ce concept : les maladies infectieuses (à l'état d'équilibre), à la gauche, et les maladies non infectieuses, à la droite. Pour une maladie non infectieuse, un modèle statique est recommandé. Pour une maladie infectieuse, l'organigramme se divise selon si la transmission interhumaine est courante (droite) ou si elle est inexistante (gauche). Lorsqu'il n'y a pas de transmission interhumaine, un modèle statique est recommandé. Si la transmission interhumaine est courante, l'organigramme se divise de nouveau selon si un vaccin réduit (droite) ou non (gauche) la sensibilité à l'infection ou le potentiel de transmission de l'infection. Si le vaccin ne réduit pas la sensibilité à l'infection ni le potentiel de transmission de l'infection, un modèle statique est recommandé. Par ailleurs, l'organigramme se divise selon si l'un des groupes cibles admissibles est ou comprend un sous-groupe ayant une influence épidémiologique (gauche) ou non (droite). Si les groupes cibles ne comprennent pas un sous-groupe ayant une influence épidémiologique, un modèle statique est recommandé. Sinon, l'organigramme se divise selon s'il y a des effets externes négatifs qui sont possiblement plus importants que les effets externes positifs (droite) ou non (gauche). S'il y a des effets externes négatifs, un modèle dynamique est recommandé. S'il n'y a pas d'effets externes négatifs, ou si ceux-ci sont fort probablement plus faibles que les effets externes positifs, alors un modèle dynamique est recommandé. Une ligne pointillée indique qu'un modèle statique pourrait également être acceptable selon d'autres considérations. L'organigramme montre ces considérations en séparant le modèle statique selon si le modèle montre un résultat défavorable ou très peu favorable lié à la vaccination (droite) ou non (gauche). Si le modèle statique montre des résultats favorables liés à la vaccination, ce modèle est acceptable. Si le modèle statique ne montre pas un résultat favorable (ou montre un résultat très peu favorable) lié à la vaccination, on recommande un modèle dynamique; un modèle statique comprenant des observations sur les effets externes selon un cadre comparable est acceptable aussi.
9. Efficacité
Énoncé(s) de l'ACMTS :
« 9.1. Effectuer une recherche documentaire exhaustive afin d'appuyer l'estimation de l'efficacité clinique et de l'innocuité des interventions à l'étude. Faire état des études retenues et des méthodes de sélection ou de regroupement des données.
9.3. Évaluer et justifier la validité de tout critère de substitution (indicateur intermédiaire) utilisé aux fins d'estimation d'un paramètre. L'analyse probabiliste de l'analyse de référence prend en compte l'incertitude quant au lien entre le critère de substitution et le critère clinique auquel il se substitue. L'analyse de scénarios appropriés permet également d'étudier cette incertitude. L'analyse de l'incertitude prend en compte l'existence de plusieurs critères de substitution, le cas échéant. Lorsqu'un biomarqueur est choisi à titre d'indicateur de substitution, évaluer et justifier sa validité et la mesure dans laquelle il répond aux critères d'un indicateur de substitution. »
Commentaire du CCNI :
Les données sur l'efficacité potentielle et sur l'efficacité réelle des vaccins proviennent souvent, respectivement, d'essais randomisés contrôlés et d'études de surveillance. L'efficacité potentielle des vaccins est sous-estimée dans les données issues d'essais randomisés contrôlés du fait que leurs effets indirects ne sont pas pris en compteNote de bas de page 14. Les essais étant effectués auprès d'une partie infime de la population, ils ne peuvent rendre compte de la réduction de la force de l'infectionNote de bas de page 14. En outre, les essais portent souvent sur l'évaluation d'indicateurs de substitution, comme la réaction immunitaire. Par conséquent, extrapoler pour obtenir des indicateurs forts comme la mortalité et la morbiditéNote de bas de page 14. Effectuer des analyses de sensibilité à l'égard de différentes hypothèses pour extrapoler les futurs effets bénéfiques des vaccins (effet du traitement ininterrompu, effet ponctuel, effet de rebond, etc.)Note de bas de page 4. Dans l'utilisation de données issues d'études de surveillance, tenir compte du fait que seules les personnes dont les symptômes sont passablement graves font appel au système de soins de santé pour obtenir un diagnostic et des soinsNote de bas de page 14. L'incidence de la maladie peut, par conséquent, être sous-estimée tandis que sa gravité, les hospitalisations qui en découlent et sa létalité peuvent être surestiméesNote de bas de page 14.
Il se peut qu'aucun incident indésirable découlant de l'immunisation ne soit observé pendant les essais cliniques (en raison de leur petite taille, comparativement à celle des programmes de vaccination). Tenir compte des signaux dans l'analyse de sensibilité.
Les autres données nécessaires pour établir des modèles épidémiologiques sont les suivantes :
- Incidence de la maladie et mortalitéNote de bas de page 3
- Couverture vaccinaleNote de bas de page 3
- Baisse de l'immunitéNote de bas de page 3
- Force de l'infectionNote de bas de page 3
- Matrice des contacts sociauxNote de bas de page 3
- Respect des calendriers completsNote de bas de page 15
Énoncé provisoire :
Aucune modification de l'énoncé de l'ACMTS
10. Mesure et évaluation de la santé
Énoncé(s) de l'ACMTS :
« 10.1. Dans l'analyse de référence, exprimer la valeur de l'effet de l'intervention par les années de vie gagnées ajustées en fonction de la qualité (AVAQ). »
Commentaire du CCNI :
Dans la documentation sur la vaccination et dans les évaluations économiques, la santé est souvent évaluée au moyen du nombre d'années de vie ajustées en fonction de l'incapacité (AVAI) évitées, mais également des AVAQ gagnées. L'utilisation de l'une ou l'autre de ces mesures semble reposer sur des motifs historiques plutôt que sur leurs avantages inhérentsNote de bas de page 17. Dans l'étude sur le fardeau mondial de la santé (Global Burden of Disease), l'OMS utilise les AVAI. Les études sur le coût par AVAI sont courantes dans les pays à faible revenu et à revenu moyen/inférieur, tandis que les études sur le coût par AVAQ sont courantes dans les pays à revenu moyen/supérieur et à revenu élevéNote de bas de page 17. Dans les Lignes directrices provisoires, nous utilisons les AVAQ, comme le recommande l'ACMTS.
Évaluer les effets non liés à la santé, dans la mesure du possible et s'il y a lieu, puisque la perspective sociétale revêt souvent de l'intérêt dans le contexte de la vaccination (voir la section 5 : Perspective).
Énoncé provisoire du CCNI :
Aucune modification de l'énoncé de l'ACMTS
11. Utilisation et coût des ressources
Énoncé(s) de l'ACMTS :
« 11.1. Pour les besoins de l'analyse de référence, relever, mesurer et valoriser de manière systématique toutes les ressources pertinentes, et en faire état, conformément à la perspective du payeur public des soins de santé. Dans l'éventualité où diverses perspectives sont pertinentes au problème de décision, classer les ressources et leurs coûts dans des catégories correspondant aux perspectives et présenter séparément les résultats pour la perspective de l'analyse de référence et les autres perspectives. »
Commentaire du CCNI :
La modélisation des vaccins et des maladies infectieuses peut comprendre les coûts directs suivantsNote de bas de page 15 :
- fournitures (achat de vaccins, seringues et boîtes de sécurité);
- coûts de programme (coûts de main-d'œuvre et d'administration des vaccins; les coûts peuvent différer selon les provinces/territoires et en fonction des volumes des établissements);
- coûts liés à la santé publique (coûts de recherche des contacts, de l'intervention en cas d'éclosion);
- surveillance de la maladie;
- système de distribution (transport et entreposage au froid);
- perte de vaccins et gestion des déchets;
- incidents indésirables découlant de l'immunisation.
Évaluer les coûts non liés à la santé, dans la mesure du possible et s'il y a lieu, puisque la perspective sociétale revêt souvent de l'intérêt dans le contexte de la vaccination (voir la section 5 : Perspective). Prenez en considération « tout effet s'étendant à d'autres personnes que la population à qui sont destinées les interventions. Par exemple, une intervention destinée à des patients peut avoir des répercussions sur les aidants si le niveau de soins requis par les patients changeNote de bas de page 1. »
Il peut y avoir des écarts importants sur le plan de l'épidémiologie (c.-à-d. du fardeau de la maladie) et des coûts d'administration des vaccins entre les provinces/territoires. Envisager d'utiliser des valeurs canadiennes moyennes dans un cas comme dans l'autre. Envisager également la possibilité d'utiliser des estimations propres à chaque province et territoire pour établir différents scénarios et obtenir un éventail des résultats possibles en matière de rapport coût/efficacité.
Énoncé provisoire du CCNI :
Aucune modification de l'énoncé de l'ACMTS
12. Analyse
Énoncé(s) de l'ACMTS :
« 12.4. Dans l'analyse de référence, calculer la valeur probable des coûts et des résultats dans le cadre d'une analyse probabiliste, où l'on précise les lois de probabilité des paramètres incertains. »
Commentaire du CCNI :
Plusieurs des lignes directrices en vigueur recommandent d'effectuer des analyses probabilistes dans le cadre de l'analyse de sensibilitéNote de bas de page 3,Note de bas de page 6,Note de bas de page 15. Les Lignes directrices de l'ACMTS semblent se distinguer à cet égard, puisqu'elles recommandent de réaliser des analyses probabilistes plutôt qu'une analyse de sensibilité, à titre d'analyse de référenceNote de bas de page 1.
En 2012, le groupe de travail sur la modélisation dynamique de l'International Society for Pharmacoeconomics and Outcomes Research (ISPOR) ne mentionne pas l'analyse de dsensibilité probabiliste dans ses recommandations en matière de pratiques exemplairesNote de bas de page 14. Il précise que les modèles dynamiques présentent des défis méthodologiques, puisque plusieurs des paramètres relatifs au mélange et à la transmission sont corrélés et que ces corrélations doivent être préservées pour assurer la sensibilité des modèles et un ajustement raisonnable aux donnéesNote de bas de page 14. En 2018, un autre groupe de travail sur les vaccins de l'ISPOR a recommandé d'exécuter des analyses de sensibilité probabilistes pour générer des courbes d'acceptabilitéNote de bas de page 3.
Énoncé provisoire du CCNI :
Dans l'analyse de référence des modèles statiques, calculer la valeur probable des coûts et des résultats dans le cadre d'une analyse probabiliste, où l'on précise les lois de probabilité des paramètres incertains.
Dans le cas des modèles dynamiques, faire preuve de jugement pour déterminer si l'analyse probabiliste est appropriée.
Dans le cas des analyses de sensibilité, envisager d'appliquer l'analyse déterministe de l'incertitude paramétrique (p. ex. unidirectionnelle, multidirectionnelle, analyse de seuil).
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 5
Procédure opératoire normalisée sur la production de rapports sur les évaluations économiques des vaccins au Canada
Module F
Objectif
La procédure opératoire normalisée (PON) a pour objectif de fournir des conseils sur la production des rapports visant les évaluations économiques destinés au Comité consultatif national de l'immunisation (CCNI).
Élaboration de la PON
Le CCNI avons analysé le contexte de la littérature grise pour déterminer les lignes directrices pertinentes sur la manière de produire des rapports sur les évaluations économiques. Nous avons examiné ce qui suit :
- Matière grise : un outil pratique de recherche de la littérature grise sur la santé de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) - Ce document contient une liste complète des organismes d'évaluation des technologies de la santé au Canada et à l'étranger;
- Moteur de recherche Google;
- EQUATOR Network - Il s'agit d'une base de données en ligne qui publie des lignes directrices en matière de production de rapports;
- Groupes techniques consultatifs nationaux pour la vaccination (GTCV).
Nous avons examiné des lignes directrices et des éléments regroupés afin de déterminer la norme minimale en matière de rapports :
- Consolidated Health Economic Evaluation Reporting Standards (CHEERS)Note de bas de page 18
- Méthodologie de l'évaluation économique des technologies de la santé de la part de l'ACMTS - Section 15 - Compte rendu de l'évaluation Note de bas de page 1
- WHO guide for standardization of economic evaluations of immunization programmesNote de bas de page 19
- Standard Operating Procedure for Economic Evaluation du West Wales Organisation for Rigorous Trials in Health (WWORTH)Note de bas de page 20,
- Guidelines for the Economic Evaluation of Health Technologies in Ireland de la Health information and quality authority (HIQA), 2018Note de bas de page 21
- European Network for Health Technology Assessment (UNETHTA)Note de bas de page 22
- Developing NICE guidelines: the Manual, section Approaches to bespoke economic evaluationNote de bas de page 23
- Belgian guidelines for economic evaluations and budget impact analyses: Second editionNote de bas de page 24
- Évaluations des technologies de la santé : Guide des méthodes et des processus de Health Quality Ontario (HQO)Note de bas de page 25
- Choix méthodologiques pour l'évaluation économique de la Haute Autorité de Santé (HAS), 2012Note de bas de page 26
- Guideline for Economic Evaluations in Healthcare du Zorginstituut Nederland, 2016Note de bas de page 27
- Methods for Health Economic Evaluation of Vaccines and Immunization Decision Frameworks: A Consensus Framework from a European Vaccine Economics CommunityNote de bas de page 5
- Economic evaluation using decision analytical modelling: design, conduct, analysis, and reportingNote de bas de page 28
- Increasing the generalizability of economic evaluations: recommendations for the design, analysis, and reporting of studiesNote de bas de page 29
- Good Research Practices for Cost-Effectiveness Analysis Alongside Clinical Trials: The ISPOR RCT-CEA Task Force ReportNote de bas de page 30
- Economic evaluation alongside randomised controlled trials: design, conduct, analysis, and reportingNote de bas de page 31
- U.S. Advisory Committee on Immunization Practices (ACIP) Handbook for Developing Evidence-based RecommendationsNote de bas de page 32
- Modelling methods for predicting epidemiological and health economic effects of vaccinations - Guidance for analyses to be presented to the German Standing Committee on Vaccination (STIKO)Note de bas de page 8
- Peter J. Neumann, Theodore G. Ganiats, Louise B. Russell, Cost-Effectiveness in health and medicine, Oxford University Press, New York, 2017Note de bas de page 33
Vous trouverez ci-dessous des conseils sous forme de liste de contrôle, ainsi que des modèles types de tableaux et de figures à utiliser dans les rapports présentés au CCNI. Le contenu recommandé peut être inséré dans le rapport principal ou l'annexe technique.
Lignes directrices en matière de production de rapports - Liste de contrôle
| Section | Recommandations pour la production de rapports |
|---|---|
| 1. Titre |
|
| 2. Résumé |
|
| 3. Contexte et problème de décision |
|
| 4. Population et sous-groupes cibles |
|
| 5. Interventions et comparateurs |
|
| 6. Perspective de l'étude |
|
| 7. Horizon temporel |
|
| 8. Taux d'actualisation |
|
| 9. Choix de résultats sur la santé |
|
| 10. Mesure de l'efficacité |
|
| 11. Mesure et évaluation des résultats fondés sur les préférences |
|
| 12. Utilisation et coût des ressources |
Exemple : Coûts indirects des aidants, indemnités de maladie, perte de productivitéNote de bas de page 22. |
| 13. Devise, prix, date et conversion |
|
| 14. Modélisation |
|
| 15. Paramètres de l'étude |
|
| 16. Hypothèses |
Exemple : Les hypothèses liées aux vaccins peuvent comprendre ce qui suit :
Les autres hypothèses peuvent comprendre ce qui suit :
|
| 17. Caractérisation de l'hétérogénéité |
|
| 18. Caractérisation de l'incertitude |
|
| 19. Méthodes d'analyse |
|
| 20. Validation et calage |
|
| 21. Coûts et résultats différentiels |
|
| 22. Limitations, généralisabilité et principales conclusions |
|
| 23. Considérations relatives à l'équité |
|
| 24. Sources de financement |
|
| 25. Conflits d'intérêts |
|
Lignes directrices en matière de production de rapports - Modèles de tableaux et figures
Vous trouverez ci-dessous des exemples de modèles à consulter :
| Type d'analyse | Analyse coût/utilité |
|---|---|
| Maladie | Maladie pneumococcique (pneumonie, otite moyenne, maladie pneumococcique invasive) |
| Population | Nourrissons (cohorte de naissances) |
| Intervention | PCV13 |
| Comparateurs | Aucun vaccin |
| Résultats | Cas, décès, AVAI ou AVAQ, coût |
| Perspective | Payeur des soins de santé |
| Horizon temporel | Vie entière |
| Actualisation | 1,5 % |
| Analyse de sensibilité | Cas de base, scénarios, analyse de sensibilité déterministe |
| Type de modèle | Une seule maladie à multiples manifestations; arbre de décision |
| Variable | Description | Moyenne | Intervalle/répartition et paramètres (p. ex. É.-T., IC 95 %, α1, α2, etc.) | Source |
|---|---|---|---|---|
| Analyse de référence : | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| A. | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| B | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Analyse de scénario : | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| A. | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| B | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Abréviations : É.-T. = écart-type; IC = intervalle de confiance | ||||
| Variable de coût | Coût unitaire | Nombre d'unités | Code de facturation/Description | Source |
|---|---|---|---|---|
| A. | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| B | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| C | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | Programme de vaccination A | Programme de vaccination B | Programme de vaccination C |
|---|---|---|---|
| Résultats cliniques : | |||
| Années de vie | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Cas évités | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Hospitalisations évitées | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Décès évités | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| AVAQ | |||
| Coûts : | |||
| Liés au vaccin | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Ultérieurs | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Total | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Coût différentiel par gain d'AVAQ (RCED) : | |||
| Par rapport au programme A | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| RCED séquentiel | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
Le cas échéant, c'est-à-dire si l'intervention n'est ni dominée ni dominante. Envisagez de signaler les intervalles de confiance et les intervalles de crédibilité. Abréviations : RCED = rapport coût/efficacité différentiel; AVAQ = année de vie ajustée en fonction de la qualité. |
|||
Envisager de rapporter d'autres tables ou figures :
- esquisse d'une structure de modélisation
- rapport coût/efficacité
- courbe d'acceptabilité du rapport coût/efficacité
- diagramme en tornade
- analyse de sensibilité bidirectionnelle pour le coût du vaccin et son efficacité
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 6
Procédure opératoire normalisée (pon) du comité consultatif national de l'immunisation : examens systématiques des évaluations économiques
Module G
Objectif
La présente procédure opératoire normalisée (PON) décrit les étapes à suivre pour mener un examen systématique des évaluations économiques à l'intention du Comité consultatif national de l'immunisation (CCNI).
Introduction
Le CCNI produit régulièrement des recommandations, des déclarations et des mises à jour concernant l'utilisation de vaccins déjà ou nouvellement approuvés pour usage humain au Canada. Le Centre de l'immunisation et des maladies respiratoires infectieuses (CIMRI) de l'Agence de la santé publique du Canada (ASPC) soutient directement ce travail. Ce soutien comprend la réalisation d'évaluations économiques ou d'examens systématiques d'évaluations économiques portant sur divers vaccins afin de recueillir des données probantes.
Recherche et développement
1.1 Question de recherche, grille PICO(TS)
Tout examen systématique des évaluations économiques doit être mené conformément aux lignes directrices intitulées Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMANote de bas de page 34). Les questions de recherche et les objectifs associés à un examen systématique des évaluations économiques sont définis et comprennent la population, l'intervention, un ou des comparateurs et un ou des résultats visés. S'il y a lieu, les questions de recherche visent également à déterminer si une période précise ou le type d'étude et de milieu sont des éléments d'intérêt (PICO[TS]).
1.2 Critères d'inclusion et d'exclusion
Les critères d'inclusion des examens systématiques doivent comprendre les suivants : population à l'étude, intervention, langue, dates comprises, pays et types d'études; analyse coût/utilité (ACU), analyse coût/efficacité (ACE) et analyse coût/avantages (ACA); et tout autre élément pertinent pour l'examen systématique.
1.3 Enregistrement dans PROSPERO
L'examen systématique des évaluations économiques doit être enregistré dans PROSPERO au cours des étapes initiales du développement de la recherche. PROSPERONote de bas de page 35 est une base de données internationale d'examens systématiques enregistrés dans les domaines de la santé et des services sociaux, du bien-être, de la santé publique, de l'éducation, de la criminalité, de la justice et du développement international, quand il s'agit d'un résultat lié à la santé. Les caractéristiques du protocole sont enregistrées et conservées dans un dossier permanent. PROSPERO est produit par le Centre for Reviews and Dissemination et financé par le National Institute for Health Research (NIHR - Royaume-Uni).
1.4 Élaboration de la stratégie de recherche
La stratégie de recherche doit être élaborée avec un bibliothécaire de recherche (Santé Canada) à l'aide de vedettes-matières médicales (MeSH) et de mots de texte liés aux évaluations économiques, au rapport coût/efficacité et au type de maladie. Le CCNI recommande fortement d'utiliser les filtres de recherche de l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) pour la catégorie « Évaluations économiques/Coût/Modèles économiquesNote de bas de page 36 ». Il est recommandé qu'une recherche soit effectuée au minimum dans les trois bases de données électroniques suivantes : MEDLINE, EMBASE et la Bibliothèque Cochrane. Cette dernière comprend la Health Technology Assessment Database (HTA), l'Economic Evaluation Database (EED) du National Health Service (NHS) et la Database of Abstracts of Reviews of Effects (DARE). Le bibliothécaire de Santé Canada peut effectuer la recherche et fournir les résultats obtenus.
1.5 Stratégie de recherche dans la littérature grise
Le CCNI recommande d'utiliser l'outil de recherche dans la littérature grise de l'ACMTS qui est axé sur les évaluations des technologies de la santé et les évaluations économiquesNote de bas de page 37. (Voir le Tableau 1 de l'extraction de la littérature grise.) De plus, veuillez communiquer directement avec les organismes pour obtenir la littérature grise qui n'est pas accessible au public.
1.6 Organisation des références et DistillerSR
Le CCNI recommande l'utilisation du logiciel DistillerSRNote de bas de page 38 ou d'un logiciel équivalent pour gérer le processus de tri et en faire le suivi, mais il est également possible d'utiliser Excel. DistillerSR est un logiciel d'examen systématique qui permet de gérer, de suivre et de simplifier les processus de tri, d'extraction de données et de préparation de rapport menés dans le cadre d'examens systématiques et de revues de la littérature.
1.7 Révision de la stratégie de recherche proposée, des critères d'inclusion et d'exclusion, de la grille PICO(TS) et de l'enregistrement dans PROSPERO
La stratégie de recherche, les critères d'inclusion et d'exclusion des études, les éléments de la grille PICO(TS) et l'enregistrement dans PROSPERO doivent être déterminés en consultation avec l'ASPC, les groupes de travail (GT) et les bibliothécaires de Santé Canada. Révisez en fonction des commentaires reçus de ces groupes.
TRI, extraction de données et évaluations de la qualité
2.1 Obtenir les résumés et la documentation pertinente
Obtenez les résumés et la documentation pertinente trouvés à la suite de la recherche du bibliothécaire de Santé Canada.
2.2 Effectuer un tri des résumés et des articles en texte intégral
Effectuez un tri des résumés et des articles en texte intégral en fonction des critères d'inclusion et d'exclusion. Au début du processus de tri, effectuez un calibrage à l'aide d'un échantillon du nombre total d'études (taille d'échantillon de 5 % suggérée ou autre proportion raisonnable) entre deux évaluateurs pour assurer l'uniformité. Les deux évaluateurs effectuent un tri de premier niveau des résumés et un tri de deuxième niveau des articles en texte intégral. Les différends doivent être résolus par le dialogue et, au besoin, en faisant appel à un troisième examinateur.
2.3 Recherche manuelle des bibliographies des études incluses
Effectuez une recherche manuelle des bibliographies des études incluses.
2.4 Remplir le modèle d'extraction de données
Les deux évaluateurs remplissent le modèle d'extraction de données en double, puis s'entendent sur les résultats. (Voir les Tableaux 1a, 1b and 1c, qui peuvent être fusionnés en un seul tableau aux fins de l'extraction.) Le CCNI encourage le recours à une méthode adéquate pour consigner l'extraction de données. Les formulaires d'extraction de données doivent être soumis à l'ASPC. Ces données peuvent également être rendues accessibles au public.
2.5 Évaluation de la qualité
Pour évaluer la qualité des études incluses, utilisez l'outil « Critical Appraisal Checklist for Economic Evaluations » du Joanna Briggs Institute (liste de contrôle du JBI)Note de bas de page 39. Les deux évaluateurs mènent chacun une évaluation de qualité, puis s'entendent sur le résultat de l'évaluation. L'évaluation de la qualité peut être effectuée dans le logiciel DistillerSR ou Excel en même temps que l'extraction de données ou après celle-ci. (Voir le Tableau 2 d'extraction de données et Figure 1 du rapport.)
Les évaluateurs doivent collaborer avec l'ASPC et le GT du CCNI afin de décider s'il faut inclure les études de faible qualité ou s'il convient plutôt de les exclure. Par exemple, ils peuvent fournir seulement les « meilleures données probantes » en incluant des études jugées de haute qualité ou acceptables et en excluant les études inacceptablesNote de bas de page 40. Les examinateurs peuvent collaborer avec l'ASPC et le GT du CCNI pour déterminer les questions d'évaluation essentielles. Les études peuvent être jugées « de haute qualité » si elles répondent aux questions d'évaluation essentielles et ne présentent pas de lacunes graves. Les études peuvent être jugées « acceptables » si elles répondent aux questions d'évaluation essentielles, mais présentent quelques lacunes mineures dans d'autres sections de l'évaluation de la qualité. Les études peuvent être jugées « inacceptables » s'il y a des problèmes manifestes qui touchent l'ensemble des questions essentielles de l'évaluation de la qualité. En rejetant ces études de faible qualité, il est possible d'éviter d'introduire un biais dans l'ensemble de données final et de générer des résultats pouvant être trompeurs.
La liste de contrôle du JBI ne fournit pas une note sommaire, mais les diagrammes à barres empilées (Figure 1 du rapport) peuvent donner une représentation visuelle de la qualité des études. Si les évaluateurs souhaitent utiliser d'autres outils d'évaluation de la qualité en fonction de la question de recherche, ils en discuteront avec l'ASPC et le GT du CCNI.
2.6 Évaluation propre au modèle de vaccin
Pour l'évaluation propre au modèle de vaccin, servez-vous du chapitre 6 du guide sur la normalisation des évaluations économiques des programmes d'immunisation de l'Organisation mondiale de la Santé (OMS)Note de bas de page 15. Les deux évaluateurs mènent chacun une évaluation de la qualité, puis s'entendent sur le résultat de l'évaluation. (Voir le Tableau 3 d'extraction de données et la Figure 1 du rapport.)
Remarque : Pour évaluer le modèle, les évaluateurs se pencheront sur des éléments propres au vaccin comme les suivants :
- Immunité collective;
- Immunité naturelle;
- Fournitures (p. ex. vaccins, seringues et boîtes de sécurité);
- Coûts liés à la santé publique (p. ex. recherche des contacts);
- Surveillance des maladies;
- Système de distribution (p. ex. transport et entreposage au froid);
- Perte de vaccins et gestion des déchets.
2.7 Évaluation de l'applicabilité et de la transférabilité
Transférabilité des rapports coût/efficacité différentiels (RCED) : Le CCNI recommande d'utiliser un outil d'applicabilité et de transférabilité pour mesurer si une étude s'applique au contexte canadien (voir le Tableau 3 d'extraction de données et la Figure 1 du rapport.)
Les outils recommandés sont soit :
- les critères de généralisabilité de Heyland
- l'indice de transférabilité d'AntonanzasNote de bas de page 42 (la formule n'est pas nécessaire; servez-vous seulement de la liste de contrôle);
- ou une combinaison des deux.
Résumé et résultats
3.1 Inclusion d'études
Les examinateurs préciseront s'ils présentent les résultats de toutes les études ou seulement les résultats d'études sélectionnées en fonction de leur qualité ou de l'absence de conflits d'intérêts.
Pour ce qui est des articles de la littérature grise non accessibles au public, précisez le nom des organismes qui ont été joints, et indiquez si plusieurs tentatives ont été faites pour entrer en communication avec eux et si vous avez réussi à obtenir la littérature grise en question.
Les examinateurs peuvent commenter le biais de publication.
Ils peuvent également envisager de mener une analyse stratifiée si les études présentant des conflits d'intérêts sont exclues de l'analyse.
3.2 Résumé
Préparez un résumé des études incluses. Préparez un diagramme de processus PRISMA, faites le suivi des documents et synthétisez les études qui ont été incluses pour l'ASPC et le ou les groupes de travail pertinents du CCNI afin qu'ils puissent les commenter. Le résumé doit contenir une synthèse de haut niveau de la documentation trouvée et inclure les éléments suivants, sans s'y limiter (utilisez une version des Tableaux 1a, 1b et 1c ou Tableau 1 du rapport):
- Lieu de l'étude;
- Année de l'étude;
- Population et sous-groupes;
- Tranche d'âge/âge gestationnel;
- Problème de santé;
- Intervention/comparateur;
- Financement;
- Couverture vaccinale et durée de la protection;
- Calendrier de vaccination évalué;
- Conception de l'étude;
- Type de modèle d'étude et technique d'analyse;
- Perspective de l'étude;
- Horizon temporel et taux d'actualisation;
- Résultats en matière de coûts;
- Résultats en matière d'efficacité;
- Résultats, RCED, avantage pécuniaire/avantage pour la santé net, réduction du nombre d'hospitalisations, etc.;
- Paramètres influents de l'analyse de sensibilité et résultats associés à ces paramètres;
- Analyse stratifiée excluant les études présentant des conflits d'intérêts.
3.3 Inflation des rapports coût/efficacité différentiels (RCED)
Rajustez les RCED (ou les résultats financiers) à la hausse pour qu'ils soient en dollars canadiens courants en convertissant la devise locale en dollars canadiens à l'aide des taux de parité du pouvoir d'achat de l'Organisation de coopération et de développement économiques (OCDE), puis des taux d'inflation de la Banque du Canada. Remarque : Conservez les RCED rajustés et non rajustés aux fins d'analyse.
3.4 Préparation des tableaux de données probantes et des mesures sommaires
Préparez des tableaux de données probantes et toute mesure sommaire nécessaire pour l'ensemble des études incluses, conformément à la méthodologie précisée par le CCNI. (Voir les Tableaux 1 à 3 du rapport.)
Mettez à jour la revue de la littérature avant de préparer le rapport, puis en tenant compte des commentaires reçus de l'ASPC, du ou des GT pertinents du CCNI et, s'il y a lieu, du CCNI. Le CCNI incite les évaluateurs à bien documenter l'ensemble des tableaux de données probantes et des mesures sommaires. Les tableaux de données probantes et les mesures sommaires doivent tous être soumis à l'ASPC. Ces données peuvent être rendues accessibles au public.
À inclure dans le rapport
4.1 Qu'est-ce qui doit être inclus dans le rapport?
1. Sommaire/résumé
2. Introduction
3. Méthodes du rapport technique détaillé
- Méthodes : stratégie de recherche, numéro d'enregistrement dans PROSPERO
- Grille PICO(TS), critères d'admissibilité (critères d'inclusion et d'exclusion)
- Tri, extraction de données, évaluation de la qualité et évaluation propre au modèle de vaccin
- Évaluation critique/analyse prévue (analyse d'un sous-groupe) et synthèse des données probantes (ou rapport descriptif)
- Conflits d'intérêts ou sources de financement des évaluateurs
4. Résultats
- Diagrammes de processus PRISMA des études sélectionnées et incluses dans l'examen, utilisation des lignes directrices PRISMA1 :Note de bas de page 34
- Résumé/aperçu des études incluses (caractéristiques des patients, caractéristiques des études) (Tableau 1 du rapport)
- Résumé de la technique d'analyse économique, structure du modèle (le cas échéant), perspective, horizon temporel, taux d'actualisation, résultats pour la santé mesurés, résultats en matière de coûts mesurés et coûts de la vaccination
- Principaux résultats et conclusions :
- Il est préférable que les évaluateurs fournissent à la fois les résultats actualisés et les résultats non actualisés.
- Poutes les études réalisées à l'extérieur du Canada, indiquez le seuil de rentabilité du pays.
Il est préférable que les évaluateurs fournissent à la fois les RCED non convertis et les RCED convertis (en dollars canadiens et convertis/rajustés selon l'inflation) dans le tableau des résultats (Tableaux 2 et 3 du rapport). - Représentation graphique des RCED (p. ex. diagramme de dispersion ou histogramme) pour illustrer la rentabilité sur un plan coût/efficacité ou par rapport à une autre variable (p. ex. incidence de X, âge des patients).
- Résultats canadiens et conclusions (Tableau 2 ou 3 du rapport)
- Les points forts des études canadiennes, résumé des résultats
- Résumé des RCED
- Conclusions
- Comparaison des études canadiennes
- Description de l'analyse de sensibilité/analyse des scénarios (c.-à-d. unidirectionnelle, analyse de sensibilité probabiliste, analyse de seuil, etc.; façon dont a été abordée l'incertitude liée à la méthodologie, aux paramètres et à la structure). Décrivez également les conclusions de l'analyse de sensibilité et les variables auxquelles l'analyse était sensible.
- Parrainage de l'étude et toute incidence potentielle sur les résultats en matière de rapport coût/efficacité. Analyse stratifiée excluant les études présentant des conflits d'intérêts. Les examinateurs peuvent également fournir un résumé narratif des résultats obtenus par l'industrie par rapport à d'autres résultats.
5. Discussion/conclusions générales
- Bref résumé des principales conclusions
- Limites et forces de l'examen
- Transférabilité des RCED : Il est recommandé d'utiliser un outil d'applicabilité et de transférabilité pour mesurer si une étude s'applique au contexte canadien.
- Les outils recommandés sont : soit les critères de généralisabilité de Heyland;
- soit l'indice de transférabilité d'Antonanzas (la formule n'est pas nécessaire; servez-vous seulement de la liste de contrôle);
- soit une combinaison des deux.
Veuillez répondre aux questions dans le document Excel en indiquant « oui », « non » ou « incertain » et en justifiant votre réponse (voir le Tableau 4 d'extraction de données).
4.2 Tableaux/figures/annexes
- Stratégie de recherche complète
- Diagramme de processus PRISMA
- Tableau 1 d'extraction de la littérature grise
- Tableau d'extraction de données : caractéristiques des études examinées (Tableau 1a, 1b, et 1c d'extraction de données)
- Tableau du rapport : Caractéristiques détaillées des études incluses (exemples : auteur, année, perspective, type d'étude, comparateurs, population, type de modèle, horizon temporel, taux d'actualisation, seuil de rentabilité, interventions visées et résultats) Tableau 1 du rapport ou une combinaison des Tableaux 1a, 1b, et 1c d'extraction de données)
- Tableau/figure : Évaluation critique, évaluation du modèle, évaluation de la transférabilité des études individuelles (Tableaux 2, 3 et 4 d'extraction de données ) et figure sommaire (diagrammes à barres empilées) (Figure 1 du rapport)
- Liste/historique de fréquence des paramètres influents associés à l'analyse de sensibilité
- Représentation graphique supplémentaire des RCED (p. ex. diagramme de dispersion ou histogramme) pour illustrer la rentabilité sur un plan coût/efficacité ou par rapport à une autre variable (p. ex. incidence de X, âge des patients). Il est possible d'ajouter d'autres graphiques pour des sous-groupes d'intérêt.
- Tableau des résultats en matière de rapport coût/efficacité (Tableaux 2 et 3 du rapport)
- Analyse stratifiée excluant les études présentant des conflits d'intérêts (Tableau 2 ou 3 du rapport, modifié afin d'exclure les études menées par l'industrie ou les études présentant des conflits d'intérêts)
Définitions
- PON : Procédure opératoire normalisée
- CCNI : Comité consultatif national de l'immunisation
- CIMRI : Centre de l'immunisation et des maladies respiratoires infectieuses
- ASPC : Agence de la santé publique du Canada
- PRISMA : Preferred Reporting Items for Systematic Reviews and Meta-Analyses
- PICO(TS) : Population, intervention, comparateurs et résultats d'intérêt (période précise ou type d'étude et de milieu précis)
- ACU : Analyse coût/utilité
- ACE : Analyse coût/efficacité
- ACA : Analyse coût/avantages
- PROSPERO : Base de données internationale d'examens systématiques enregistrés dans les domaines de la santé et des services sociaux, du bien-être, de la santé publique, de l'éducation, de la criminalité, de la justice et du développement international, quand les examens comprennent un résultat lié à la santé. Les caractéristiques du protocole sont enregistrées et conservées dans un dossier permanent. PROSPERO est produit par le Centre for Reviews and Dissemination et financé par le National Institute for Health Research (NIHR).
- SC : Santé;Canada
- MeSH : Vedettes-matières médicales
- ACMTS : Agence canadienne des médicaments et des technologies de la santé
- HTA : Health Technology Assessment Database
- EED : Economic Evaluation Database du NHS
- DARE : Database of Abstracts of Reviews of Effects
- DistillerSR est un logiciel d'examen systématique qui permet de gérer, de suivre et de simplifier les processus de tri, d'extraction de données et de préparation de rapport menés dans le cadre d'examens systématiques et de revues de la littérature.
- GT : Groupe de travail
- OMS : Organisation mondiale de la Santé
- RCED : Rapport coût/efficacité différentiel
- OCDE : Organisation de coopération et de développement économiques
- ASP : Analyse de sensibilité probabiliste
- ID : Identifiant
- ESSI : Effets secondaires suivant l'immunisation
- CE : Coût/efficacité
- AG : Âge gestationnel
- AVAQ : Année de vie ajustée en fonction de la qualité
- CI : Conflit d'intérêts
Modèle de stratégie de recherche dans la littérature grise
Tous les tableaux ne sont que des exemples et des éléments peuvent être modifiés, ajoutés ou supprimés, à votre discrétion et selon l'examen que vous menez. Le CCNI incite les évaluateurs à bien documenter l'ensemble des tableaux de données probantes, des figures et des mesures sommaires. Cette documentation doit être soumise à l'ASPC. Ces données peuvent être rendues accessibles au public.
| Ressource/site Web | Termes de recherche | Nombre de résultats triés | Nombre de résultats retenus |
|---|---|---|---|
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
Modèles d'extraction de données
Tous les tableaux ne sont que des exemples et des éléments peuvent être modifiés, ajoutés ou supprimés, à votre discrétion et selon l'examen que vous menez. Le CCNI encourage le recours à une méthode adéquate pour bien documenter l'extraction de données. Les formulaires d'extraction de données doivent être soumis à l'ASPC. Ces données peuvent également être rendues accessibles au public.
| Auteur, année | Tranche d'âge / âge gestationnel | Lieu de l'étude | Population et sous-groupes | Caractéristiques de la population et milieu | Problème de santé | Intervention / comparateur | Effet d'immunité collective | Couverture vaccinale et durée de la protection | Financement / sa source t |
|---|---|---|---|---|---|---|---|---|---|
| aucune donnée disponible | aucune donnée disponible | (Pays) | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | (Oui/non) | aucune donnée disponible | (Oui/non) et source |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
(Tous les tableaux peuvent être subdivisés en un plus grand nombre de catégories, au besoin.) * Catégories optionnelles : ID de la référence, efficacité directe du vaccin, sources couvertes du vaccin, protection contre les porteurs de maladie et effets secondaires suivant l'immunisation (ESSI). |
|||||||||
| Auteur, année | Technique d'analyse | Conception de l'étude | Perspective de l'étude | Calendrier de vaccination évalué | Horizon temporel et taux d'actualisation | Résultats en matière de coûts | Coût de l'intervention | Résultats en matière d'efficacité | Seuil utilisé |
|---|---|---|---|---|---|---|---|---|---|
| aucune donnée disponible | (p. ex. ACA, ACE, ACU) | (p. ex. analyse des décisions, modèle de Markov, etc.) | aucune donnée disponible | aucune donnée disponible | (Années, %) | (Devise, année) | aucune donnée disponible | ($/AVAQ, nombre d'hospitalisa-tions évitées) | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
(Tous les tableaux peuvent être subdivisés en un plus grand nombre de catégories, au besoin.) * Catégories optionnelles : ID de la référence, taux d'hospitalisation, taux de mortalité, réduction du nombre d'hospitalisations et réduction de la mortalité. |
|||||||||
| Auteur, année | Résultats liés au rapport coût/efficacité ou résultats pour la santé | Résultats liés au rapport coût/efficacité ou résultats pour la santé Unités |
Contexte des résultats | Conclusion tirée à partir des résultats | Type d'analyse de sensibilité | Paramètres influents de l'analyse de sensibilité | Résultats des paramètres influents |
|---|---|---|---|---|---|---|---|
| aucune donnée disponible | (chiffres absolus, coût/AVAQ, réduction du nombre d'hospitalisations, etc.) | $/AVAQ | aucune donnée disponible | (rentable ou non?) | (p. ex. unidirection-nelle, ASP) | (p. ex. coût/efficacité ou non, et vice versa) | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
(Tous les tableaux peuvent être subdivisés en un plus grand nombre de catégories, au besoin.) * Catégories optionnelles : ID de la référence, analyse des scénarios et résultats de l'analyse des scénarios. **Des tableaux de notes peuvent être utilisés pour l'extraction de données ou aux fins d'inclusion dans le rapport. |
|||||||
| Auteur, année | Oui/non/incertain | Commentaires |
|---|---|---|
| Q1 : Y a-t-il une question bien définie? | aucune donnée disponible | aucune donnée disponible |
| Q2 : Y a-t-il une description exhaustive des solutions de rechange? | aucune donnée disponible | aucune donnée disponible |
| Q3 : Les coûts et les résultats importants et pertinents sont-ils précisés pour chacune des solutions de rechange? | aucune donnée disponible | aucune donnée disponible |
| Q4 : L'efficacité clinique a-t-elle été établie? | aucune donnée disponible | aucune donnée disponible |
| Q5 : Les coûts et les résultats sont-ils mesurés de façon précise? | aucune donnée disponible | aucune donnée disponible |
| Q6 : Les coûts et les résultats sont-ils évalués de façon crédible? | aucune donnée disponible | aucune donnée disponible |
| Q7 : Les coûts et les résultats sont-ils rajustés pour tenir compte des différentes périodes visées? | aucune donnée disponible | aucune donnée disponible |
| Q8 : Y a-t-il une analyse supplémentaire des coûts et des conséquences? | aucune donnée disponible | aucune donnée disponible |
| Q9 : Des analyses de sensibilité ont-elles été menées pour évaluer l'incertitude associée aux estimations des coûts ou des conséquences? | aucune donnée disponible | aucune donnée disponible |
| Q10 : Les résultats de l'étude englobent-ils toutes les questions d'intérêt pour les utilisateurs? | aucune donnée disponible | aucune donnée disponible |
| Q11 : Les résultats peuvent-ils être généralisés pour qu'ils soient appliqués au milieu concerné par l'examen? | aucune donnée disponible | aucune donnée disponible |
| Auteur, année | Oui/non/incertain | Commentaires |
|---|---|---|
| Q1 : Structure du modèle et hypothèses | aucune donnée disponible | aucune donnée disponible |
| Q2 : Type de modèle | aucune donnée disponible | aucune donnée disponible |
| Q3 : Validation (p. ex. vérification et calibrage) | aucune donnée disponible | aucune donnée disponible |
| Q4 : Considérations propres au vaccin : | aucune donnée disponible | aucune donnée disponible |
| a. Immunité collective | aucune donnée disponible | aucune donnée disponible |
| b. Immunité naturelle | aucune donnée disponible | aucune donnée disponible |
| c. Fournitures (p. ex. vaccins, seringues et boîtes de sécurité) | aucune donnée disponible | aucune donnée disponible |
| d. Coûts liés à la santé publique (p. ex. recherche des contacts) | aucune donnée disponible | aucune donnée disponible |
| e. Surveillance des maladies | aucune donnée disponible | aucune donnée disponible |
| f. Système de distribution (p. ex. transport et entreposage au froid) | aucune donnée disponible | aucune donnée disponible |
| g. Perte de vaccins et gestion des déchets | aucune donnée disponible | aucune donnée disponible |
Questions pour l'évaluation propre au modèle de vaccin
- La structure du modèle et les hypothèses implicites ou explicites sont-elles clairement décrites?
- Le type de modèle (statique, dynamique ou stochastique) est-il clairement indiqué et justifié compte tenu des changements qui sont susceptibles de toucher la vigueur de l'infection et le rôle du hasard dans le processus de transmission? Les forces et les faiblesses du modèle ont-elles été analysées?
- Le modèle a-t-il été validé? Le cas échéant, a-t-il été validé à l'aide du plus grand nombre possible de facettes de validation?
- Considérations propres au vaccin :
- Immunité collective;
- Immunité naturelle;
- Fournitures (p. ex. vaccins, seringues et boîtes de sécurité);
- Coûts liés à la santé publique (p. ex. recherche des contacts);
- Surveillance des maladies;
- Système de distribution (p. ex. transport et entreposage au froid);
- Perte de vaccins et gestion des déchets.
Veuillez répondre aux questions dans le document Excel en indiquant « oui », « non » ou « incertain » et en justifiant votre réponse pour les critères de généralisabilité de Heyland ou l'indice de transférabilité d'Antonanzas (sans la formule), ou une combinaison des deux.
Exemple : Critères de généralisabilité de Heyland
| Auteur, année | Oui/non/incertain | Commentaires |
|---|---|---|
| Q1 : Généralisabilité clinique; les patients décrits dans l'analyse sont-ils semblables à ceux de votre propre milieu? | aucune donnée disponible | aucune donnée disponible |
| Q2 : Généralisabilité des systèmes; le point de vue est-il pertinent pour votre milieu ou situation clinique? | aucune donnée disponible | aucune donnée disponible |
| Q3 : L'intervention visée par l'étude peut-elle être généralisée pour l'appliquer à votre milieu? | aucune donnée disponible | aucune donnée disponible |
| Q4 : Méthodes d'établissement des coûts applicables | aucune donnée disponible | aucune donnée disponible |
| Q4a : Prix unitaire | aucune donnée disponible | aucune donnée disponible |
| Q4b : Le mélange de ressources utilisées est-il le même? | aucune donnée disponible | aucune donnée disponible |
| Q4c : Le coût moyen par patient est-il similaire d'un système à l'autre? | aucune donnée disponible | aucune donnée disponible |
| Q4d : Les bons taux de change ont-ils été appliqués pour convertir les devises d'autres pays? | aucune donnée disponible | aucune donnée disponible |
| Q5 : Les résultats mesurés sont-ils pertinents pour votre milieu? | aucune donnée disponible | aucune donnée disponible |
| Q5a : La méthode utilisée pour mesurer les résultats est-elle compatible? | aucune donnée disponible | aucune donnée disponible |
| Q5B : Les préférences de vos patients sont-elles les mêmes que celles utilisées dans l'analyse? | aucune donnée disponible | aucune donnée disponible |
| Q6 : Un taux d'actualisation s'applique-t-il à votre milieu? | aucune donnée disponible | aucune donnée disponible |
Modèles pour le rapport : tableaux et figures
Veuillez vous servir des modèles suivants de tableaux et de figures pour la rédaction du rapport destiné au CCNI. Les éléments des tableaux peuvent être modifiés, ajoutés ou supprimés, à votre discrétion et selon l'examen que vous menez. Conserver toutefois le même format.
Le CCNI incite les évaluateurs à bien documenter l'ensemble des tableaux de données probantes, des figures et des mesures sommaires. Cette documentation doit être soumise à l'ASPC. Ces données peuvent être rendues accessibles au public.
| Problèmes de santé déclarés | Nombre d'études* |
|---|---|
| Naissance prématurée | aucune donnée disponible |
| AG supérieur à 32 semaines | aucune donnée disponible |
| AG de 32 à 35 semaines | aucune donnée disponible |
| Problèmes de santé | aucune donnée disponible |
| Autres facteurs de risque | aucune donnée disponible |
| Non déclarés ou en santé | aucune donnée disponible |
| Pays | Nombre d'études |
| États-Unis | aucune donnée disponible |
| Canada | aucune donnée disponible |
| Royaume-Uni, etc. | aucune donnée disponible |
| Âge (mois) | Nombre cumulatif d'estimations provenant de toutes les études* |
| < 3 mois | aucune donnée disponible |
| < 6 mois | aucune donnée disponible |
| < 12 mois | |
| < 24 mois | aucune donnée disponible |
| Non déclaré | aucune donnée disponible |
| Résultats | Nombre d'études |
| Coût par cas évité | aucune donnée disponible |
| Coût par hospitalisation évitée | aucune donnée disponible |
| Coût par AVAQ | aucune donnée disponible |
| Autre | aucune donnée disponible |
| Études parrainées par l'industrie | Nombre d'études |
| Oui | aucune donnée disponible |
| Non | aucune donnée disponible |
* Peut dépasser le total (n) étant donné que certaines études fournissent des données pour plusieurs populations, scénarios et résultats (d'autres résultats peuvent être ajoutés selon les caractéristiques propres à l'étude). |
|
| Auteurs, année | Pays | Perspective | Technique d'analyse | Conception de l'étude | Mesure des résultats | Population | Horizon temporel | Financement de l'industrie |
|---|---|---|---|---|---|---|---|---|
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
* Technique d'analyse = ACU, ACE ou ACA; conception de l'étude = modèle de Markov, étude couplée, etc. |
||||||||
Figure 1a du rapport : Évaluation de la qualité - proportion des éléments de l'évaluation respectés par chaque étude Évaluation propre au modèle de vaccin : proportion des éléments de l'évaluation respectés par chaque étude Évaluation de la transférabilité : proportion des critères jugés généralisables ou applicables dans chaque étude
Figure 1a du rapport - Description textuelle
Cette figure générique est un graphique à barres empilées horizontalement. Chaque barre horizontale représente une étude, et son auteur et l'année de publication figurent sur l'axe des y. L'axe des x représente le pourcentage atteint; il varie de 0 à 100 %. Le but de la figure est d'indiquer la proportion des éléments ou des critères atteints par chaque étude. Autrement dit, si on utilise cette figure pour illustrer les résultats de l'évaluation de la qualité, le graphique à barres empilées indiquera combien des éléments d'évaluation de la liste de contrôle ont été atteints ou non atteints, ou si les résultats n'étaient pas clairs. Afin de montrer cette information de façon visuelle, chaque barre horizontale de l'étude est composée d'un maximum de trois barres - le vert représente les objectifs atteints, le rouge, les objectifs non atteints, et le gris indique que les résultats n'étaient pas clairs. Le total des petites barres est toujours de 100 %.
Figure 1b du rapport : Évaluation de la qualité - proportion des études respectant chaque élément de l'évaluation
Évaluation propre au modèle de vaccin - proportion des études respectant chaque élément de l'évaluation
Évaluation de la transférabilité - proportion des études jugées généralisables ou applicables pour chaque critère
Figure 1b du rapport - Description textuelle
Cette figure générique est un graphique à barres empilées horizontalement. Chaque barre horizontale représente un élément ou un critère de la liste de contrôle, identifié comme « Élément 1 », « Élément 2 » et ainsi de suite sur l'axe des y. L'axe des x représente la proportion des études qui ont atteint chacun des objectifs des éléments ou des critères de la liste de contrôle, et varie de 0 à 100 %. Chaque barre horizontale d'un élément ou d'un critère est composée d'un maximum de trois barres - le vert représente les objectifs atteints, le rouge, les objectifs non atteints, et le jaune, les résultats qui ne sont pas clairs. Le total des petites barres est toujours de 100 %. Il est à noter que cette figure est semblable à celle de la figure 1, mais ses axes sont inversés.
| aucune donnée disponible | Problèmes de santé* | ||||||
|---|---|---|---|---|---|---|---|
| aucune donnée disponible | Dysplasie broncho-pulmonaire (DBP) | Cardiopathie congénitale | En santé | Naissance prématurée | Naissance prématurée avec DBP | Naissance prématurée avec facteurs de risque | Autres facteurs de risque* |
| Nombre d'estimations | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| RCED (minimum) | aucune donnée disponible | aucune donnée disponible | Dominant | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | Dominant |
| RCED (maximum) | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Proportion de rapports coût/efficacité estimés à 50 000 $/AVAQ | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Proportion de rapports coût/efficacité estimés à 100 000 $/AVAQ | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Proportion de rapports coût/efficacité estimés à 200 000 $/AVAQ | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
* Problèmes de santé qui correspondent à votre examen systématique des évaluations économiques |
|||||||
| Auteur et année de l'étude | Problème de santé | AG en semaines | Perspective | RCED (initial) | Année de la devise | RCED (dollars canadiens de 2017 par AVAQ) |
|---|---|---|---|---|---|---|
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
Comité consultatif national de l'immunisation (CCNI) : Outil de soutien no 7
Modèle de présentation pour la présentation des évaluations économiques
Module H
Diapositive 7-1. Titre de l'étude (doit correspondre clairement à la question à l'étude)

Diapositive 7-1 - Description textuelle
Diapositive 7-1. Titre de l'étude (doit correspondre clairement à la question à l'étude)
Noms et affiliations des auteurs
Des logos peuvent servir à indiquer l'affiliation des auteurs.
Diapositive 7-2. Conflits d'intérêts et financement

Diapositive 7-2 - Description textuelle
Diapositive 7-2. Conflits d'intérêts et financement
- Indiquez tout conflit d'intérêts pour chaque auteur. S'il n'y a aucun conflit d'intérêts possible, il faut l'indiquer à l'aide d'un énoncé (p. ex., Auteur A : Aucun conflit d'intérêts).
- Décrivez le mode de financement de l'étude et le rôle du bailleur de fonds dans la détermination, la conception, la réalisation et le rapport de l'analyse. Décrivez les autres sources non monétaires.
Diapositive 7-3. Problème soumis à une décision

Diapositive 7-3 - Description textuelle
Diapositive 7-3. Problème soumis à une décision
- La question à l'étude est bien définie, énoncée de manière à obtenir une réponse et pertinente pour la décision que doit prendre le public cible.
- Par exemple : Quel est la rentabilité d'une vaccination systématique du groupe d'âge XX contre la maladie Y à l'aide du vaccin Z comparativement à l'approche actuelle A?
Diapositive 7-4. Méthodes (page de titre)

Diapositive 7-4 - Description textuelle
Diapositive 7-4. Méthodes (page de titre)
Diapositive 7-5. Méthodes : PICO

Diapositive 7-5 - Description textuelle
Diapositive 7-5. Méthodes : PICO
- Énoncé qui précise les interventions incluses, ce qui comprend le ou les facteurs de comparaison. Justifiez le facteur de comparaison.
- Énoncé qui détermine la ou les populations (ce qui comprend les sous-groupes) visées directement ou indirectement par les interventions à l'étude. Décrivez ce qui suit :
- les données démographiques (p. ex., âge, sexe, statut socioéconomique), conditions spécifiques, gravité de la maladie, comorbidités, facteurs de risque, etc.
- Énoncé qui précise les résultats sur la santé mesurés (p. ex., cas, décès, hospitalisation, consultations à l'hôpital, années de vie ajustées en fonction de la qualité).
Diapositive 7-6. Méthodes : conception de l'étude

Diapositive 7-6 - Description textuelle
Diapositive 7-6. Méthodes : conception de l'étude
- Énoncé sur le contexte, la perspective, les catégories de coûts et les résultats.
- L'énoncé sur la période visée et l'horizon d'analyse est clair. Décrivez en quoi leur durée respective dépend du type de vaccin évalué, de l'intervention, de la population cible et, conséquemment, du type de modèle élaboré.
- Énoncé sur le taux d'actualisation utilisé.
Diapositive 7-7. Méthodes : modèle économique

Diapositive 7-7 - Description textuelle
Diapositive 7-7. Méthodes : modèle économique
- Précisez la méthode d'analyse.
- Déterminez la mesure synthétique.
- Il peut s'agir d'une équation formée à l'aide de mots, par exemple :
- Coût par cas évité = etc.
- Il peut s'agir d'une équation formée à l'aide de mots, par exemple :
- Déterminez la mesure synthétique.
- Énoncé simple du modèle économique
- Schéma de la structure du modèle
- Décrivez - et justifiez - le type de modèle de décision analytique utilisé. Le cas échéant, expliquez pourquoi un modèle dynamique n'a pas été utilisé.
Diapositive 7-8. Méthodes : modèle dynamique

Diapositive 7-8 - Description textuelle
Diapositive 7-8. Méthodes : modèle dynamique
- Utilisez la diapositive qui suit si le modèle dynamique a été élaboré indépendamment du modèle économique.
- Précisez le type de modèle dynamique utilisé (p. ex., SIR [susceptible-infectieux-remis]).
- Décrivez le modèle (c.-à-d. combien de temps faut-il pour atteindre l'immunité collective, couverture vaccinale minimale pour atteindre l'immunité collective, etc.).
- Présentez un diagramme schématique et des annotations pertinentes.
- Dans un tel diagramme, les annotations sont faites sans recourir à des notations mathématiques. On demande aux auteurs de veiller à ce que ces diagrammes schématiques soient faciles à comprendre sans lecture exhaustive du texte principal.
Diapositive 7-9. Méthodes : hypothèses principales

Diapositive 7-9 - Description textuelle
Diapositive 7-9. Méthodes : hypothèses principales
- Énoncé sur les hypothèses principales. Elles peuvent comprendre ce qui suit :
- des stocks de vaccins adéquats;
- une baisse de l'immunité conférée par la vaccination;
- le gaspillage de vaccins (c.-à-d. la somme des vaccins rejetés, perdus, endommagés ou détruits);
- les hypothèses formulées lorsqu'un vaccin n'a pas encore été mis au point ou que les données sur l'efficacité d'un vaccin ne font pas partie du domaine public;
- les hypothèses nécessaires au transfert des données sur les coûts quand elles sont appliquées à partir d'autres pays;
- les hypothèses sur le nombre d'infections faisant l'objet d'une intervention médicale;
- les hypothèses relatives aux effets de la maladie sur différentes sous-populations;
- les hypothèses sur la variation des coûts selon les sous-populations.
Diapositive 7-10. Scénario de référence : données d'entrée principales

Diapositive 7-10 - Description textuelle
Diapositive 7-10. Scénario de référence : données d'entrée principales
| Variable | Description | Moyenne | Intervalle ou distribution | Source |
|---|---|---|---|---|
| aucune donnée disponible | Il peut y avoir plus d'une diapositive du genre. Les données d'entrée qu'il faudrait toujours présenter comprennent ce qui suit :
|
|||
Diapositive 7-11. Méthodes : analyses de sensibilité

Diapositive 7-11 - Description textuelle
Diapositive 7-11. Méthodes : analyses de sensibilité
- Une description des analyses de sensibilité réalisées.
- Type (c.-à-d., probabiliste, analyse de sensibilité à deux critères pour le coût et l'efficacité du vaccin, analyses de seuil, analyses de scénario pour les perspectives pertinentes, pire ou meilleur scénario)
- Variables incluses
- Intervalles ou distributions et sources de données
Diapositive 7-12. Sommaire des méthodes
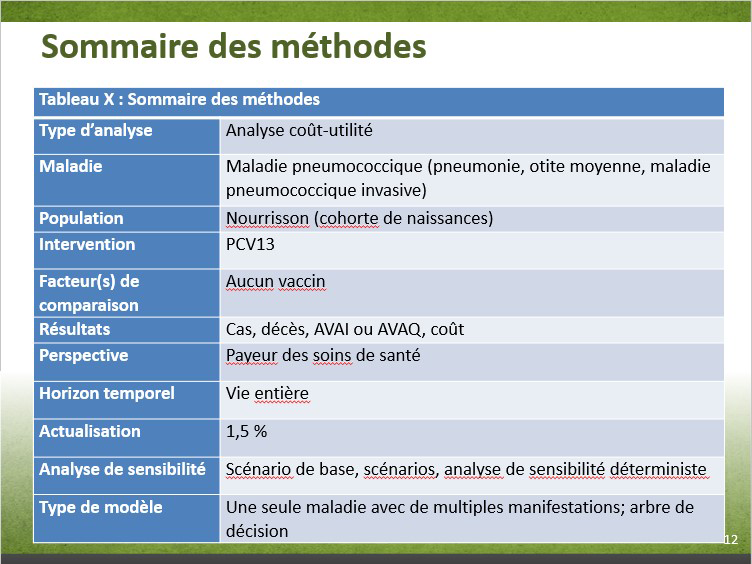
Diapositive 7-12 - Description textuelle
Diapositive 7-12. Sommaire des méthodes
- Type d'analyse
- Analyse coût-utilité
- Maladie
- Maladie pneumococcique (pneumonie, otite moyenne, maladie pneumococcique invasive)
- Population
- Nourrisson (cohorte de naissances)
- Intervention
- PCV13
- Facteur(s) de comparaison
- Aucun vaccin
- Résultats
- Cas, décès, AVAI ou AVAQ, coût
- Perspective
- Payeur des soins de santé
- Horizon temporel
- Vie entière
- Actualisation
- 1,5 %
- Analyse de sensibilité
- Scénario de base, scénarios, analyse de sensibilité déterministe
- Type de modèle
- Une seule maladie avec de multiples manifestations; arbre de décision
Slide 7-13. Résultats (page de titre)

Slide 7-13 - Description textuelle
Slide 7-13. Résultats (page de titre)
Diapositive 7-14. Résultats

Diapositive 7-14 - Description textuelle
Diapositive 7-14. Résultats
- Présentez :
- les résultats pour la santé;
- les coûts;
- la ou les mesures synthétiques - combinaison des résultats pour la santé et des coûts.
- Cette présentation peut prendre la forme d'un tableau ou d'un graphique. (Voir l'exemple de tableau à la diapositive suivante. Voir également les MON pour les figures et tableaux recommandés.)
Diapositive 7-15. Tableau X : Résultats d'une évaluation économique
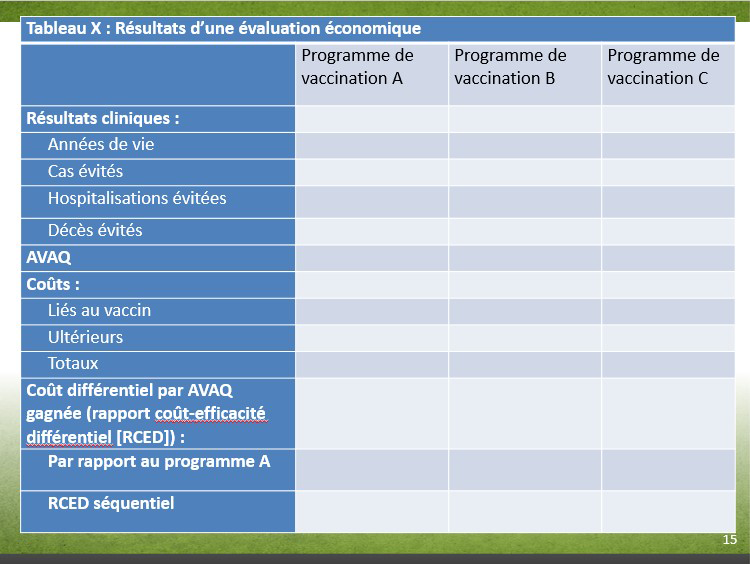
Diapositive 7-15 - Description textuelle
Diapositive 7-15. Tableau X : Résultats d'une évaluation économique
| aucune donnée disponible | Programme de vaccination A | Programme de vaccination B | Programme de vaccination C |
|---|---|---|---|
| Résultats cliniques : | |||
| Années de vie | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Cas évités | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Hospitalisations évitées | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Décès évités | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| AVAQ | |||
| Coûts : | |||
| Liés au vaccin | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Ultérieurs | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Total | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| Coût différentiel par AVAQ gagnée (rapport coût-efficacité différentiel [RCED]) : | |||
| Par rapport au programme A | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
| RCED séquentiel | aucune donnée disponible | aucune donnée disponible | aucune donnée disponible |
Diapositive 7-16. Résultats : autres résultats

Diapositive 7-16 - Description textuelle
Diapositive 7-16. Résultats : autres résultats
- Un ou deux tableaux ou graphiques qui présentent certains résultats additionnels (voir les MON pour les figures et tableaux recommandés)
Diapositive 7-17. Résultats : analyses de sensibilité

Diapositive 7-17 - Description textuelle
Diapositive 7-17. Résultats : analyses de sensibilité
- Une ou deux diapositives qui présentent des tableaux ou des graphiques illustrant les résultats des analyses de sensibilité
Diapositive 7-18. Résultats : variables influentes

Diapositive 7-18 - Description textuelle
Diapositive 7-18. Résultats : variables influentes
- Liste, tableau ou graphique des variables influentes (de trois à cinq en général) (voir les MON pour les figures et tableaux recommandés)
- Indiquez en quoi elles peuvent modifier les résultats.
Diapositive 7-19. Limitations et généralisabilité

Diapositive 7-19 - Description textuelle
Diapositive 7-19. Limitations et généralisabilité
- Liste des limitations importantes et de leur effet possible sur les conclusions
- Formulez des commentaires sur la généralisabilité (c.-à-d., différences régionales sur le plan de l'épidémiologie des maladies, caractéristiques démographiques, profils de pratiques cliniques, profils d'utilisation des ressources, coûts unitaires et autres facteurs pertinents. En cas de différences, examinez les effets sur les résultats (orientation et ampleur attendues) et les conclusions.
Diapositive 7-20. Principales conclusions

Diapositive 7-20 - Description textuelle
Diapositive 7-20. Principales conclusions
- Faites la synthèse des principales conclusions de l'étude
Diapositive 7-21. Liens avec d'autres études

Diapositive 7-21 - Description textuelle
Diapositive 7-21. Liens avec d'autres études
- S'il y a lieu, comparez les résultats aux résultats d'autres études, ce qui comprend un examen approfondi de la comparabilité, des différences et de l'importance. Cela peut prendre la forme d'une liste ou d'un tableau.
Diapositive 7-22. Références

Diapositive 7-22 - Description textuelle
Diapositive 7-22. Références
Diapositive 7-23. Documents supplémentaires

Diapositive 7-23 - Description textuelle
Diapositive 7-23. Documents supplémentaires
National Advisory Committee on Immunization (NACI): Outil de soutien no 8
Modèle de présentation pour la présentation des examens systématique
Module I
Diapositive 8-1. Titre de l'examen systématique des évaluations économiques (doit représenter clairement la question étudiée)

Diapositive 8-1 - Description textuelle
Diapositive 8-1. Titre de l'examen systématique des évaluations économiques (doit représenter clairement la question étudiée)
Noms et affiliations des auteurs
Il est possible d'inclure des logos pour indiquer leur affiliation.
Diapositive 8-2. Conflits d'intérêts et financement

Diapositive 8-2 - Description textuelle
Diapositive 8-2. Conflits d'intérêts et financement
- Énumérer les conflits d'intérêts potentiels pour chaque auteur. S'il n'y en a aucun, inclure une déclaration à cet effet (p. ex. Auteur A : aucun conflit d'intérêts).
- Décrire la façon dont l'étude a été financée et le rôle du bailleur de fonds en ce qui concerne le choix, la conception, la réalisation et le compte rendu de l'analyse. Décrire les autres sources non monétaires.
Slide 8-3. Question de recherche :

Slide 8-3 - Description textuelle
Slide 8-3. Question de recherche :
- Définir la question PICO(TS).
- Le cas échéant, indiquer le type d'étude et de milieu
Diapositive 8-4. Méthodes [limitez-vous à une ou deux diapositives]
![Diapositive 8-4. Méthodes [limitez-vous à une ou deux diapositives]. Équivalent textuel ci-dessous.](/content/dam/phac-aspc/images/programs/process-incorporating-economic-evidence-federal-vaccine-recommendations-stakeholder-consultation/slide8-4-fra.png)
Diapositive 8-4 - Description textuelle
Diapositive 8-4. Méthodes [limitez-vous à une ou deux diapositives]
Stratégie de recherche :
- Indiquer la période couverte par la recherche et fournir une justification (le cas échéant).
Critères d'inclusion et d'exclusion :
- Les énumérer.
Production du rapport :
- Les résultats sont présentés en dollars canadiens [année de référence].
Si des méthodes divergent de celles mentionnées dans la PON du CCNI, les décrire brièvement ici (en termes de stratégie de recherche, d'outils d'évaluation utilisés, etc.).
Slide 8-5. Diagramme PRISMA

Slide 8-5 - Description textuelle
Slide 8-5. Diagramme PRISMA
- Cette diapositive marque le début de la section des résultats.
- Fournir un diagramme.
Diapositive 8-6. Aperçu des études incluses (N = )

Diapositive 8-6 - Description textuelle
Diapositive 8-6. Aperçu des études incluses (N = )
Caractéristiques des études
- Pays/juridictions (n = )
- Fondées sur un modèle (n = ) ou non fondées sur un modèle (n = )
- Études financées par l'industrie (n = )
- Année de publication
- Etc.
Caractéristiques des patients
- Pertinence de la question PICO d'intérêt (c.-à-d. âge, affection, comparateur, etc.)
Diapositive 8-7. I. Aperçu des études non fondées sur un modèle (N = ) [telles que celles fondées sur des essais, celles fondées sur des données administratives, etc.]
![Diapositive 8-7. I. Aperçu des études non fondées sur un modèle (N = ) [telles que celles fondées sur des essais, celles fondées sur des données administratives, etc.]. Équivalent textuel ci-dessous.](/content/dam/phac-aspc/images/programs/process-incorporating-economic-evidence-federal-vaccine-recommendations-stakeholder-consultation/slide8-7-fra.png)
Diapositive 8-7 - Description textuelle
Diapositive 8-7. I. Aperçu des études non fondées sur un modèle (N = ) [telles que celles fondées sur des essais, celles fondées sur des données administratives, etc.]
- Comparateurs
- Perspective
- Types d'analyses de sensibilité
- Taille du ou des échantillons
- Horizon(s) temporel(s)
- Choix des résultats en matière d'efficacité/résultats intermédiaires
- Analyse : Comparer les soins administrés selon un protocole à la pratique clinique et décrire la façon dont les données manquantes, censurées ou biaisées ont été traitées.
- Etc.
Diapositive 8-8. II. Aperçu des modèles économiques (N = )

Diapositive 8-8 - Description textuelle
Diapositive 8-8. II. Aperçu des modèles économiques (N = )
- Types de modèles (p. ex. Markov, multiagent, etc.)
- Commenter la structure du modèle, si possible (c.-à-d. préciser les affections).
- Perspective(s) adoptée(s)
- Horizon(s) temporel(s) utilisé(s)
- Types d'analyses de sensibilité réalisées
- Évaluation de la qualité des études
- Etc.
Diapositive 8-9. II. Modèles économiques Paramètres des modèles principaux

Diapositive 8-9 - Description textuelle
Diapositive 8-9. II. Modèles économiques Paramètres des modèles principaux
- Fournir la moyenne et l'intervalle de certains des principaux paramètres des modèles.
- Il est impératif de définir les variables suivantes : coût des vaccins, leur efficacité, épidémiologie (c.-à-d. incidence).
- Paramètres influents.
- Etc.
- Pour la validité apparente.
Diapositive 8-10. Sommaire des résultats

Diapositive 8-10 - Description textuelle
Diapositive 8-10. Sommaire des résultats
- Indiquer les résultats cliniques, les résultats quant aux coûts et les résultats liés au RCED sous forme de graphique ou de tableau.
- Envisager d'indiquer les résultats séparément.
- Préciser si les RCED ont été calculés de manière séquentielle ou en comparant un scénario de référence (préciser le comparateur).
- Envisager de présenter les principaux paramètres (c.-à-d. prix des vaccins, leur efficacité, épidémiologie, etc.) en même temps que les résultats.
- Envisager de décrire les analyses de sensibilité (c.-à-d. déterministes, probabilistes).
- Voir les exemples de tableaux de la PON (c.-à-d. les Tableaux 2 et 3 du rapport ainsi que les deux diapositives suivantes)
Diapositive 8-11. Exemple de premier tableau de présentation des résultats

Diapositive 8-11 - Description textuelle
Diapositive 8-11. Exemple de premier tableau de présentation des résultats
| Rapports coût/efficacité différentiels | |
|---|---|
| Nombre d'estimations | aucune donnée disponible |
| RCED (minimum) | aucune donnée disponible |
| RCED (maximum) | aucune donnée disponible |
| Proportion des estimations d'économies | aucune donnée disponible |
| Nombre d'estimations du RCE à 50 000 $/AVAQ | aucune donnée disponible |
| Nombre d'estimations du RCE à 100 000 $/AVAQ | aucune donnée disponible |
Diapositive 8-12. Exemple de second tableau de présentation des résultats
Diapositive 8-12 - Description textuelle
Diapositive 8-12. Exemple de second tableau de présentation des résultats
| Auteur, année | Étude 1 | Étude 2 |
|---|---|---|
| Population | aucune donnée disponible | aucune donnée disponible |
| Intervention | aucune donnée disponible | aucune donnée disponible |
| Comparateur | aucune donnée disponible | aucune donnée disponible |
| Résultats cliniques | aucune donnée disponible | aucune donnée disponible |
| Résultats quant aux coûts | aucune donnée disponible | aucune donnée disponible |
| RCED (préciser s'il a été calculé de manière séquentielle ou en comparant un scénario de référence) | aucune donnée disponible | aucune donnée disponible |
Diapositive 8-13. Résultats stratifiés

Diapositive 8-13 - Description textuelle
Diapositive 8-13. Résultats stratifiés
- Distinguer les résultats de l'industrie de ceux d'une agence de santé publique ou de ceux d'un organisme de financement reconnu.
- Il est possible d'envisager de présenter la perspective de l'étude, c.-à-d. une perspective axée sur les soins de santé par rapport à une perspective sociétale.
- Il est possible d'envisager de distinguer les études de qualité médiocre de celles de grande qualité.
- Il est possible de fournir une gamme de résultats ou une brève description.
Diapositive 8-14. Études canadiennes (N = )

Diapositive 8-14 - Description textuelle
Diapositive 8-14. Études canadiennes (N = )
- Présenter les principales conclusions.
- Comparer les résultats de ces études aux études non canadiennes.
- Financement de l'industrie (n = ).
- Indiquer la qualité des études et leur applicabilité à la question PICO d'intérêt.
Diapositive 8-15. Principales conclusions et analyse

Diapositive 8-15 - Description textuelle
Diapositive 8-15. Principales conclusions et analyse
- Quel est le message à retenir pour les décideurs?
- Envisager de décrire les résultats d'études les plus pertinentes pour les décideurs (c.-à-d. études d'excellente qualité, études canadiennes de grande qualité);
- Prendre en considération...
- Éviter de préciser l'incidence sur les politiques générales et les seuils coût/efficacité explicites ou implicites. Il revient au CCNI de déterminer l'incidence sur les politiques générales;
- Par exemple, les examinateurs ne peuvent pas dire « D'après l'examen systématique, l'intervention semble être rentable », mais peuvent dire : « D'après le seuil régional utilisé par chaque étude, la plupart des études incluses (n =9) ont conclu que l'intervention est rentable ».
- A-t-il été possible d'établir un consensus entre les études? Les études étaient-elles trop hétérogènes?
- Récapitulation : Liste des paramètres les plus influents décrits dans les études incluses.
- Récapitulation : Commenter la qualité des études.
Slide 8-16. Forces et limites

Slide 8-16 - Description textuelle
Slide 8-16. Forces et limites
- Points forts et limités aux études incluses (c.-à-d. la dynamique de la maladie a-t-elle été correctement prise en compte? Les sources de données étaient-elles appropriées?)
- Points forts et limites de l'examen systématique comme tel.
Diapositive 8-17. Généralisabilité

Diapositive 8-17 - Description textuelle
Diapositive 8-17. Généralisabilité
- Commenter la généralisabilité (c.-à-d. différences régionales sur le plan de l'épidémiologie, caractéristiques de la population, modes de pratique clinique, schémas d'utilisation des ressources, coûts unitaires et autres facteurs pertinents. En cas de différences, expliquer leur incidence sur les résultats [direction et ampleur prévues de l'effet] et les conclusions.)
- Les principaux paramètres à décrire sont le prix des vaccins, leur efficacité ainsi que l'épidémiologie.
- Envisagez d'utiliser les outils de transférabilité pour orienter l'examen.
Slide 8-18. Références

Slide 8-18 - Description textuelle
Slide 8-18. Références
Diapositive 8-19. Documents complémentaires

Diapositive 8-19 - Description textuelle
Diapositive 8-19. Documents complémentaires
Références
- Référence 1
-
Agence canadienne des médicaments et des technologies de la santé. Lignes directrices de l'évaluation économique des technologies de la santé au Canada, 4e édition, Ottawa : ACMTS, mars 2017.
- Référence 2
-
Lieu T, Meltzer M, ML M. Guidance for health economics studies presented to the Advisory Committee on Immunization Practices (ACIP). Centers for Disease Control and Prevention. Atlanta, GA. 2008. Accessible à l'adresse : www.cdc.gov/vaccines/recs/acip/economic-studies.htm.
- Référence 3
-
Mauskopf J, Standaert B, Connolly M, et al. ISPOR Task Force Report: Economic Analysis of Vaccination Programs. Value Health. Oct. 2018;21(10):1133-1149. doi : 1110.1016/j.jval.2018.1108.1005.
- Référence 4
-
Drummond MF. Methods for the economic evaluation of health care programmes. Oxford; New York: Oxford University Press; 1997.
- Référence 5
-
Ultsch B, Damm O, Beutels P, et al. Methods for Health Economic Evaluation of Vaccines and Immunization Decision Frameworks: A Consensus Framework from a European Vaccine Economics Community. Pharmacoeconomics. Mars 2016;34(3):227-244. doi : 210.1007/s40273-40015-40335-40272.
- Référence 6
-
Drummond MF. Methods for the economic evaluation of health care programmes. Oxford; New York: Oxford University Press; 1997.
- Référence 7
-
Mauskopf J, Talbird S, Standaert B. Categorization of methods used in cost-effectiveness analyses of vaccination programs based on outcomes from dynamic transmission models. Expert review of pharmacoeconomics & outcomes research. Juin 2012;12(3):357-371.
- Référence 8
-
STIKO. Modelling methods for predicting epidemiological and health economic effects of vaccinations - Guidance for analyses to be presented to the German Standing Committee on Vaccination (STIKO). Berlin: STIKO; mars 2016.
- Référence 9
-
Ungar W. Economic evaluation in child health. Oxford; Toronto: Oxford University Press, 2010.
- Référence 10
-
Keeler E, Cretin S. Discounting of life-saving and other nonmonetary effects. Management Science. 1983;29(3):300-306.
- Référence 11
-
Wilkinson T, Sculpher MJ, Claxton K, et al. The International Decision Support Initiative Référence Case for Economic Evaluation: An Aid to Thought. Value in health : the journal of the International Society for Pharmacoeconomics and Outcomes Research. Déc. 2016;19(8):921-928.
- Référence 12
-
Jit M, Brisson M. Modelling the epidemiology of infectious diseases for decision analysis: a primer. PharmacoEconomics. Mai 2011;29(5):371-386.
- Référence 13
-
Kim S-Y, Goldie SJ. Cost-Effectiveness Analyses of Vaccination Programmes. PharmacoEconomics. 1er mars 2008;26(3):191-215.
- Référence 14
-
Pitman R, Fisman D, Zaric GS, et al. Dynamic transmission modeling: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force--5. Value in health : the journal of the International Society for Pharmacoeconomics and Outcomes Research. Sept.-oct. 2012;15(6):828-834.
- Référence 15
-
Organisation mondiale de la santé. WHO guide for standardization of economic evaluations of immunization programmes. Genève: Organisation mondiale de la santé. http://www.who.int/iris/handle/10665/69981. 2008.
- Référence 16
-
Marshall DA, Burgos-Liz L, MJ IJ, et al. Selecting a dynamic simulation modeling method for health care delivery research-part 2 : report of the ISPOR Dynamic Simulation Modeling Emerging Good Practices Task Force. Value in health : the journal of the International Society for Pharmacoeconomics and Outcomes Research. Mars 2015;18(2):147-160.
- Référence 17
-
Neumann PJ, Anderson JE, Panzer AD, et al. Comparing the cost-per-QALYs gained and cost-per-DALYs averted literatures. Gates open research. 2018;2:5-5.
- Référence 18
-
Husereau D., Drummond M., Petrou S., Carswell C., Moher D., Greenberg D. et al. Consolidated Health Economic Evaluation Reporting Standards (CHEERS), BMJ, 2013, 25 mars 2013;346:f1049.
- Référence 19
-
Walker DG., Hutubessy R., Beutels P. WHO Guide for Standardization of Economic Evaluations of Immunization Programmes, Vaccine, 2009, 9 juil. 2009; 28(11):2356-9.
- Référence 20
-
West Wales Organisation for Rigorous Trials in Health (WWORTH) - the Clinical Trials Unit in Swansea, SOP 26: Standard Operating Procedure for Economic Evaluation, version 2.2, 11 juil. 2014.
- Référence 21
-
Health information and quality authority (HIQA). Guidelines for the Economic Evaluation of Health Technologies in Ireland, 17 janv. 2018.
- Référence 22
-
Kristensen FB., Mäkelä M., Neikter SA., Rehnqvist N., Håheim LL., Mørland B. et al. European network for health technology assessment, EUnetHTA: planning, development, and implementation of a sustainable European network for health technology assessment, Int J Technol Assess Health Care, 2009; 25(S2):107-16.
- Référence 23
-
National Institute for Health and Care Excellence (NICE). Developing NICE guidelines: the Manual, Royaume-Uni, oct. 2014.
- Référence 24
-
Centre fédéral d'expertise des soins de santé. Belgian Guidelines for Economic Evaluations and Budget Impact Analyses: second edition, rapport no 183C, 8 déc. 2015.
- Référence 25
-
Health Quality Ontario (HQO). Évaluations des technologies de la santé : Guide des méthodes et des processus, version 2.0, mars 2018.
- Référence 26
-
Haute Autorité de Santé (HAS) - Service évaluation économique et santé publique. Choix méthodologiques pour l'évaluation économique, oct. 2012.
- Référence 27
-
Zorginstituut Nederland. Guideline for Economic Evaluations in Healthcare, 16 juin 2016.
- Référence 28
-
Petrou S., Gray A. Economic evaluation using decision analytical modelling: design, conduct, analysis, and reporting, BMJ, 11 avril 2011; 342:d1766.
- Référence 29
-
Drummond M., Manca A., Sculpher M. Increasing the generalizability of economic evaluations: recommendations for the design, analysis, and reporting of studies, Int J Technol Assess Health Care, 2005; 21(2):165-71.
- Référence 30
-
Ramsey S., Willke R., Briggs A., Brown R., Buxton M., Chawla A., et al. Good Research Practices for Cost-Effectiveness Analysis Alongside Clinical Trials: The ISPOR RCT-CEA Task Force Report, Value Health, 2005, sept.-oct. 2005; 8(5):521-33.
- Référence 31
-
Petrou S., Gray A. Economic evaluation alongside randomised controlled trials: design, conduct, analysis, and reporting, BMJ, 11 avril 2011; 342:d1548.
- Référence 32
-
Ahmed F. U.S. Advisory Committee on Immunization Practices (ACIP) Handbook for Developing Evidence-based Recommendations, version 1.2, Centers for Disease Control and Prevention (CDC), Atlanta, Géorgie (États-Unis), 1er nov. 2013.
- Référence 33
-
Neumann, Peter J., Ganiats, Theodore G., Russell, Louise B., Sanders, Gillian D., Siegel, Joanna E., Oxford University Press. Cost-Effectiveness in health and medicine, Oxford University Press, New York, 2017.
- Référence 34
-
Moher, D., Liberati, A., Tetzlaff, J., Altman, D.G., The PRISMA Group. « Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement ». PLoS Medicine. 21 juil. 2009; 6(7) : e1000097.
- Référence 35
-
PROSPERO [Internet]. Accessible à l'adresse : https://www.crd.york.ac.uk/prospero/.
- Référence 36
-
Filtres de recherche des évaluations économiques de l'ACMTS [Internet]; 2016 [mis à jour le 13 nov. 2018]. Accessible à l'adresse : https://www.cadth.ca/fr/ressources/trouver-les-preuves/ficeler-la-recherche#eco.
- Référence 37
-
Matière grise : un outil pratique de recherche de la littérature grise sur la santé [Internet]. Ottawa : ACMTS; 2018 [mis à jour en août 2018]. Accessible à l'adresse : https://www.cadth.ca/fr/ressources/trouver-les-preuves/matiere-grise.
- Référence 38
-
DistillerSR [Internet]. Accessible à l'adresse : https://v2dis-prod.evidencepartners.com/Login/Login.php.
- Référence 39
-
The Joanna Briggs Institute, « Critical Appraisal Checklist for Economic Evaluations » [Internet]. Accessible à l'adresse : http://joannabriggs.org/assets/docs/critical-appraisal-tools/JBI_Critical_Appraisal-Checklist_for_Economic_Evaluations2017.pdf.
- Référence 40
-
Ting, E.E.K. Systematic Review of the Cost-effectiveness of Influenza Immunization Programs: A Canadian Perspective [dissertation]. Toronto: Institute of Health Policy, Management and Evaluation; 2015.
- Référence 41
-
Heyland, D.K., Kernerman, P., Gafni, A., Cook, D.J. « Economic evaluations in the critical care literature: do they help us improve the efficiency of our unit? ». Crit Care Medicine. 1er sept. 1996; 24(9) : p. 1591-1598.
- Référence 42
-
Antonanzas, F., Rodriguez-Ibeas, R., Juarez, C. H.F., Lorente, R., Pinillos, M. « Transferability indices for health economic evaluations: methods and applications ». Health Economics. 7 mai 2009; 18(6) : p. 629-643.
