Résumé de l'évaluation du risque pour la santé publique au Canada associé au virus de la grippe aviaire A(H7N9) en Chine
L'évaluation du risque est examinée de façon périodique et actualisée au besoin.
8 mars 2018
Dernières nouvelles
- Le résumé de l'événement, la courbe épidémiologique et la carte de la répartition spatiale pour le virus A(H7N9) ont été actualisés dans le but de refléter les cas déclarés depuis la dernière actualisation de la présente évaluation du risque (le 30 juin 2017).
- Au total, 34 nouveaux cas d'infection humaine par le virus A(H7N9) ont été signalés à l'OMS depuis la dernière actualisation, soit 31 dans la cinquième vague et 3 dans la sixième vague.
- La sixième vague a commencé le 1er octobre 2017 avec trois cas signalés dans la province de Guangdong, la région autonome de Xinjiang Uygur et la province de Yunnan, en Chine, avec l'apparition des symptômes du 21 novembre 2017 au 3 février 2018.
Résumé
- Le risque pour la santé publique que pose le virus de la grippe aviaire A(H7N9) au Canada demeure faible.
- Les cas d'infection humaine causée par le virus de la grippe aviaire A(H7N9) en Chine se manifestent de façon saisonnière et augmentent (par « vagues ») d'ordinaire chaque année entre janvier et mai.
- Au total, 766 cas ont été signalés au cours de la cinquième vague : il s'agit du nombre de cas signalés le plus élevé de toutes les vagues depuis l'apparition en mars 2013. De plus, les cas sont répartis sur une plus grande étendue comparativement aux vagues précédentes, mais il n'y a pas eu de changement sur le plan de la transmissibilité, de la gravité de l'infection et de l'évaluation du risque général.
- Le nombre de cas signalé au cours de la cinquième vague a atteint un point culminant en janvier 2017, avec 110 cas au cours de ce mois. Depuis le 10 janvier 2017, on a découvert que les isolats du virus A(H7N9) de 32 cas humains constituaient de l'influenza aviaire hautement pathogène (IAHP) (Organisation des Nations Unies pour l'alimentation et l'agriculture, 2018).
- On a commencé la surveillance de la sixième vague de virus de la grippe aviaire A(H7N9) le 1er octobre 2017. En date du 8 mars 2018, il y a eu trois cas déclarés au cours de la sixième vague.
- L'infection est associée à une exposition à des volailles infectées ou à des milieux contaminés et se développe la plupart du temps en maladie grave sur le plan clinique.
- En janvier 2017, on a détecté des souches hautement pathogènes du virus de la grippe aviaire A(H7N9) dans des échantillons provenant de marché d'oiseaux vivants et deux cas humains à Guangdong, en Chine (CDAEC, 2017c).
- De 7 % à 9 % des virus de la grippe aviaire A(H7N9) hautement pathogènes analysés présentent une sensibilité réduite à au moins une administration d'inhibiteur de la neuraminidase, un agent antiviral, y compris oseltamivir (Centre européen de prévention et de contrôle des maladies [ECDC], 2017b).
- Parmi les cinq épidémies, on a signalé 14 et 26 des cas de virus A(H7N9) comme étant une transmission interhumaine probable et possible respectivement (Zhou et coll., 2018) et la probabilité de transmission interhumaine soutenue reste faible (ECDC, 2017b).
- En date du 5 mars 2018, l'Organisation mondiale de la Santé (OMS) a désigné quatre vaccins candidats pour le virus A(H7N9), à savoir A/Guangdong/17SF003/2016, A/Hong Kong/125/2017, A/Shanghai/2/2013 et A/Anhui/1/2013. Le vaccin candidat A/Hunan/02650/2016 est en cours de préparation.
- À l'heure actuelle, les voyages en Chine et l'importation de la maladie de ce pays constituent les risques les plus probables pour les Canadiennes et Canadiens de contracter l'infection par l'exposition à de la volaille ou à des milieux contaminés.
- Ce rapport est le résumé. Vous pouvez commander le rapport complet.
Évaluation du risque
Le virus de la grippe aviaire A(H7N9) est un nouveau pathogène zoonotique infectieux largement répandu dans plusieurs provinces de la Chine. Le virus se transmet avec efficacité parmi les volailles et, ici et là, parmi les humains exposés à des volailles infectées ou à des milieux contaminés. On n'a observé qu'une transmission rare et non soutenue parmi les humains. Jusqu'à maintenant, aucun réservoir animal pour le virus de la grippe aviaire A(H7N9) n'a été signalé au Canada. Pour l'instant, le risque pour la santé publique au Canada associé au virus de la grippe aviaire A(H7N9) est considéré comme faible selon les renseignements accessibles. Cependant, le risque peut évoluer avec l'obtention de nouveaux renseignements.
Le virus de la grippe aviaire A(H7N9) constitue un nouveau virus réassorti dont on ignorait qu'il pouvait circuler parmi les humains.
L'information accessible porte à croire que ce virus ne se transmet pas facilement entre les humains. Les grappes signalées semblent indiquer qu'une transmission interhumaine limitée peut avoir lieu lors d'un contact étroit non-protégé avec des cas. En raison de mutations dans les souches d'influenza aviaire faiblement pathogène (IAFP) à de nombreux sites de clivage d'acides aminés basiques, soit un indicateur de pathogénicité élevée avec les volailles, on a détecté de nouvelles souches d'IAHP du virus A(H7N9) chez des volailles et des cas humains en Chine. Cependant, il n'y a pas de preuve de transmission interhumaine soutenue du virus de la grippe aviaire A(H7N9) hautement pathogène.
Étant donné que le virus de la grippe aviaire A(H7N9) est largement répandu en Chine, la menace la plus probable pour la population canadienne consiste en un risque d'importation au Canada par des voyageurs infectés à la suite d'une exposition à des volailles ou milieux contaminés dans ce pays. En janvier 2015, le Canada a signalé les premiers cas d'infection humaine par le virus A(H7N9) en Amérique du Nord associés à un voyage. Bien que des cas associés à des voyages aient été signalés dans d'autres pays, notamment le Canada, rien n'indique une propagation à l'échelle internationale. Cependant, ces renseignements laissent entendre un risque continu d'infection importée sporadique parmi les personnes ayant voyagé en Chine. On prévoit une augmentation des déplacements en Chine et en provenance de Chine tous les ans à l'occasion du Nouvel An lunaire. L'Agence de la santé publique du Canada surveille la situation de près et actualise l'évaluation du risque pour la santé publique et les conseils de santé aux voyageurs en conséquence.
Résistance aux antiviraux
Environ le tiers des infections au virus A(H7N9) chez les humains depuis l'apparition ont été signalés pendant la cinquième vague en Chine (CIDRAP, 2017). De plus, environ 7 % des virus isolés des cas humains de grippe aviaire A(H7N9) au cours de la cinquième vague possédaient un marqueur génétique qui est associé à la résistance aux inhibiteurs de la neuraminidase comme l'oseltamivir, un des antiviraux utilisés pour traiter l'infection grippale. Presque tous les isolats du virus A(H7N9) avec des marqueurs de résistance à la neuraminidase ont été isolés chez les humains traités au moyen d'antiviraux. Ces renseignements laissent entendre que les marqueurs de résistance à la neuraminidase se sont développés après le traitement et n'ont pas été propagés par les volailles. De plus, une analyse supplémentaire des virus A(H7N9) de la cinquième vague est en cours dans le but d'évaluer la sensibilité in vitro à la catégorie d'antiviraux contenant les inhibiteurs de la neuraminidase. Lors de l'analyse des virus A(H7N9) des vagues précédentes d'infection humaine, tous les virus analysés comportaient la mutation S31N de la protéine M2, ce qui indique une résistance à l'amantadine et la rimantadine (OMS, 2017e). Des analyses génétiques continues des virus isolés avant et après le traitement des humains sont nécessaires pour éliminer la possibilité de circulation des virus avec des mutations de la résistance aux inhibiteurs de la neuraminidase chez les humains. L'OMS et les pays membres surveillent de près les modifications génétiques des virus A(H7N9) concernant la résistance aux inhibiteurs de la neuraminidase. Cependant, à l'heure actuelle, rien ne laisse entendre des modifications au traitement clinique de l'infection humaine au virus A(H7N9).
Transmission du virus A(H7N9) chez les oiseaux
Les virus de la grippe aviaire A(H7N9) ont été détectés chez des oiseaux sauvages et captifs. Cependant, les nouveaux virus H7N9 d'IAHP sont associés à une infectiosité plus élevée chez les volailles que les souches de faible pathogénicité connexes (ECDC, 2017b). De plus, les virus d'IAHP sont associés à un taux élevé d'adaptation moléculaire. Ces processus d'adaptation peuvent occasionner des infections chez les oiseaux tant résidents que migrateurs, ce qui entraîne un risque de propagation mondiale par les oiseaux migrateurs. Depuis l'apparition du virus A(H7N9) d'IAFP en 2013, cette souche a circulé parmi les volailles domestiques en Chine. En janvier 2017, le virus A(H7N9) d'IAHP est apparu chez les volailles à Guangdong, en Chine, et s'est répandu rapidement à d'autres provinces. Cependant, la plupart des virus détectés chez les volailles pendant la cinquième vague étaient des virus d'IAFP. Ce virus semble bien adapté à la volaille, avec une transmission limitée aux oiseaux sauvages.
Transmission du virus A(H7N9) chez les humains
Récemment, en Chine, on a mené une analyse descriptive sur les 40 grappes de cas de virus A(H7N9) confirmés en laboratoire signalés du 1er février 2013 au 30 juin 2017 (Zhou et coll., 2018). Parmi les grappes déclarées pour les cinq épidémies, on a signalé une distribution de 14 cas probables (35 %) et 26 cas possibles (65 %) de transmission interhumaine. Parmi les 14 cas secondaires avec transmission interhumaine probable, quatre cas étaient associés à une exposition à domicile, tandis que 10 cas étaient associés à des milieux de soins. Le pourcentage de grappes avec transmission interhumaine probable ne différait pas de manière considérable selon l'épidémie (p=0,842). Une grappe de trois infections dans la cinquième vague présentait une transmission interhumaine possible et probable. On a déterminé deux grappes semblables pendant la quatrième vague. Dans la présente étude, des similarités au chapitre du nombre de grappes et de leur taille, ainsi que du pourcentage de grappes avec transmission interhumaine probable dans l'ensemble des vagues laissent entendre qu'il n'y a pas eu de changement sur le plan du risque de transmission interhumaine.
Résumé de la situation
La sixième vague a commencé le 1er octobre 2017 et est toujours en cours. En date du 8 mars 2018, on a signalé un total de trois cas de virus A(H7N9) à l'OMS pour la sixième vague. Ces cas sont répartis à l'échelle de la Chine dans la province de Guangdong, la région autonome de Xinjiang Uygur et la province de Yunnan. Les cas allaient de 59 à 72 ans, avec un âge médian de 64 ans. Deux des trois cas étaient des hommes et les trois cas ont été exposés à de la volaille avant l'apparition des symptômes. Pour l'un des cas, l'infection a été mortelle. Il n'y a toujours pas de signe de transmission interhumaine soutenue (OMS, 2017a).
Figure 1. Incidence à l'échelle mondiale des cas humains de grippe aviaire A(H7N9) par mois d'apparition des symptômes ou première date enregistrée, entre mars 2013 et le 28 février 2018.
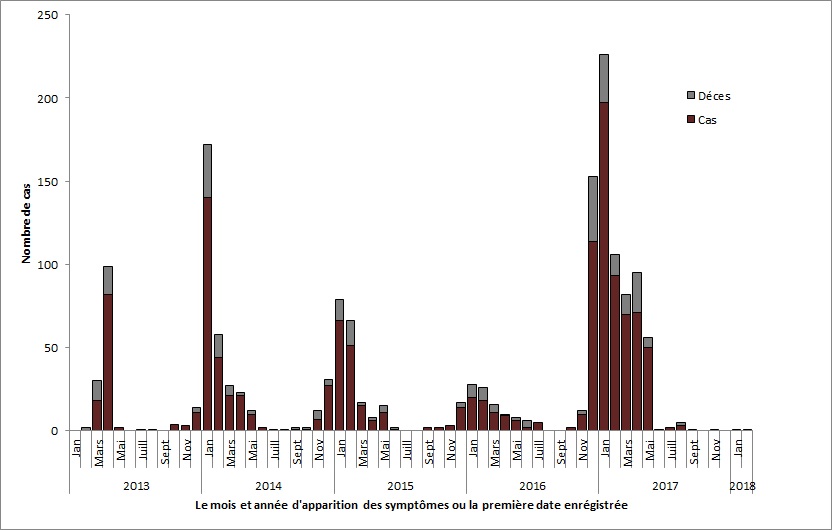
Équivalent textuel - Figure 1
Incidence à l’échelle mondiale des cas humains de grippe aviaire A(H7N9) par mois d’apparition des symptômes ou première date enregistrée, entre mars 2013 et le 28 février 2018.
Courbe épidémique du virus de la grippe aviaire A(H7N9). Depuis 2013, six vagues ont eu lieus : vague 1 (février 2013 à septembre 2013), vague 2 (octobre 2013 à septembre 2014), vague 3 (octobre 2014 à septembre 2015), vague 4 (octobre 2015 à septembre 2016), vague 5 (octobre 2016 à septembre 2017), et vague 6 (octobre 2017 au présent). Les cas se manifestent de façon saisonnière : ceux-ci augmentent en décembre et culminent en janvier. Le plus grand nombre de cas a été observé dans la cinquième vague. Au présent, la courbe épidémiologique inclut 1272 cas et 299 décès : 103 cas et 32 décès dans la vague 1; 258 cas et 61 décès dans la vague 2; 187 cas et 47 décès dans la vague 3; 89 cas et 27 décès dans la vague 4; 633 cas et 131 décès dans la vague 5 ; et 2 cas et 1 décès dans la vague 6.
| Anneé | Mois | Cas | Déces |
|---|---|---|---|
| 2013 | Jan | 0 | 0 |
| 2013 | Févr | 0 | 2 |
| 2013 | Mars | 18 | 12 |
| 2013 | Avr | 82 | 17 |
| 2013 | Mai | 2 | 0 |
| 2013 | Juin | 0 | 0 |
| 2013 | Juill | 0 | 1 |
| 2013 | Aout | 1 | 0 |
| 2013 | Sept | 0 | 0 |
| 2013 | Oct | 4 | 0 |
| 2013 | Nov | 3 | 0 |
| 2013 | Déc | 11 | 3 |
| 2014 | Jan | 140 | 32 |
| 2014 | Févr | 44 | 14 |
| 2014 | Mars | 21 | 6 |
| 2014 | Avr | 21 | 2 |
| 2014 | Mai | 10 | 2 |
| 2014 | Juin | 2 | 0 |
| 2014 | Juill | 0 | 1 |
| 2014 | Aout | 1 | |
| 2014 | Sept | 1 | 1 |
| 2014 | Oct | 1 | 1 |
| 2014 | Nov | 7 | 5 |
| 2014 | Déc | 27 | 4 |
| 2015 | Jan | 66 | 13 |
| 2015 | Févr | 51 | 15 |
| 2015 | Mars | 15 | 2 |
| 2015 | Avr | 6 | 2 |
| 2015 | Mai | 11 | 4 |
| 2015 | Juin | 1 | 1 |
| 2015 | Juill | 0 | 0 |
| 2015 | Aout | 0 | 0 |
| 2015 | Sept | 2 | 0 |
| 2015 | Oct | 2 | 0 |
| 2015 | Nov | 3 | 0 |
| 2015 | Déc | 14 | 3 |
| 2016 | Jan | 20 | 8 |
| 2016 | Févr | 18 | 8 |
| 2016 | Mars | 11 | 5 |
| 2016 | Avr | 9 | 1 |
| 2016 | Mai | 6 | 2 |
| 2016 | Juin | 2 | 4 |
| 2016 | Juill | 5 | 0 |
| 2016 | Aout | 0 | 0 |
| 2016 | Sept | 0 | 0 |
| 2016 | Oct | 2 | 0 |
| 2016 | Nov | 10 | 2 |
| 2016 | Déc | 114 | 39 |
| 2017 | Jan | 197 | 29 |
| 2017 | Févr | 93 | 13 |
| 2017 | Mars | 70 | 12 |
| 2017 | Avr | 71 | 24 |
| 2017 | Mai | 50 | 6 |
| 2017 | Juin | 1 | 0 |
| 2017 | Juill | 2 | 0 |
| 2017 | Aout | 3 | 2 |
| 2017 | Sept | 1 | 0 |
| 2017 | Oct | 0 | 0 |
| 2017 | Nov | 1 | 0 |
| 2017 | Déc | 0 | 0 |
| 2018 | Jan | 0 | 1 |
| 2018 | Févr | 1 | 0 |
Remarque : Les données sur les quatre premières vagues ont été préparées à l’aide de l’information fournie par le Réseau mondial d’information en santé publique (RMISP) de l’Agence de la santé publique du Canada (n=809). Les données sur les cinquième et sixième vague ont été tirées du résumé mensuel de l’évaluation des risques liés à l’interface entre l’homme et l’animal de l’Organisation mondiale de la Santé (en date du 25 janvier 2018) et les rapports du site d’information sur la situation de l’OMS (les données sont en date du 8 mars 2018) et comprennent 769 cas (766 de la cinquième vague et 3 de la sixième vague).
Vingt-sept zones administratives de la Chine avaient signalé des cas pendant la cinquième vague (plage pour les vagues un à quatre : 12 à 15) (Figure 2). La répartition selon l’âge et le sexe était comparable à celle des vagues précédentes.
Figure 2. Distribution spatiale des cas humains de grippe aviaire A(H7N9), en Chine, entre mars 2013 et le 28 février 2018.
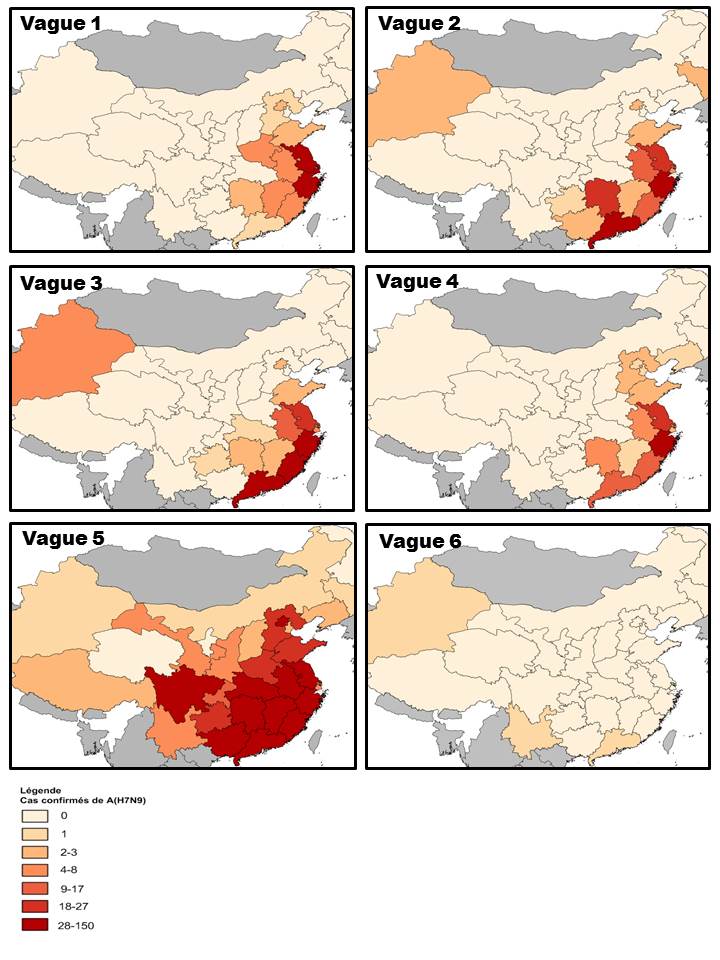
Remarque : Les données sur les quatre premières vagues ont été préparées à l’aide de l’information fournie par le Réseau mondial d’information en santé publique (RMISP) de l’Agence de la santé publique du Canada (n=809). Les données sur les cinquième et sixième vagues ont été tirées du résumé mensuel de l’évaluation des risques liés à l’interface entre l’homme et l’animal de l’Organisation mondiale de la Santé (en date du 25 janvier 2018) et les rapports du site d’information sur la situation de l’OMS (les données sont en date du 8 mars 2018) et comprennent 769 cas (766 de la cinquième vague et 3 de la sixième vague).
Équivalent textuel - Figure 2
Distribution spatiale des cas d'A (H7N9) par vague. Au cours des six vagues, les cas se sont surtout produits dans la région du sud-est de la China. Dans la cinquième vague, la répartition de cas est plus intense et plus répandue par rapport aux vagues précédentes.
| Nom | ID | vague 1 | vague 2 | vague 3 | vague 4 | vague 5 | vague 6 |
|---|---|---|---|---|---|---|---|
| Anhui | 1 | 4 | 14 | 16 | 5 | 62 | 0 |
| Beijing | 2 | 2 | 2 | 2 | 1 | 28 | 0 |
| Chongqing | 3 | 0 | 0 | 0 | 0 | 9 | 0 |
| Fujian | 4 | 0 | 17 | 41 | 12 | 35 | 0 |
| Gansu | 5 | 0 | 0 | 0 | 0 | 5 | 0 |
| Guangdong | 6 | 1 | 108 | 75 | 16 | 63 | 1 |
| Guangxi | 7 | 0 | 3 | 0 | 0 | 28 | 0 |
| Guizhou | 8 | 0 | 1 | 1 | 0 | 18 | 0 |
| Hainan | 9 | 0 | 0 | 0 | 0 | 0 | 0 |
| Hebei | 10 | 1 | 0 | 0 | 2 | 27 | 0 |
| Heilongjiang | 11 | 0 | 0 | 0 | 0 | 0 | 0 |
| Henan | 12 | 4 | 0 | 0 | 0 | 24 | 0 |
| Hubei | 13 | 0 | 0 | 1 | 0 | 29 | 0 |
| Hunan | 14 | 2 | 22 | 2 | 8 | 59 | 0 |
| Jiangsu | 15 | 28 | 27 | 23 | 26 | 148 | 0 |
| Jiangxi | 16 | 6 | 2 | 3 | 1 | 38 | 0 |
| Jilin | 17 | 0 | 2 | 0 | 0 | 1 | 0 |
| Liaoning | 18 | 0 | 0 | 0 | 1 | 3 | 0 |
| Nei Mongol | 19 | 0 | 0 | 0 | 0 | 1 | 0 |
| Ningxia Hui | 20 | 0 | 0 | 0 | 0 | 0 | 0 |
| Qinghai | 21 | 0 | 0 | 0 | 0 | 0 | 0 |
| Shaanxi | 22 | 0 | 0 | 0 | 0 | 7 | 0 |
| Shandong | 23 | 2 | 3 | 3 | 2 | 19 | 0 |
| Shanghai | 24 | 33 | 8 | 8 | 3 | 5 | 0 |
| Shanxi | 25 | 0 | 0 | 0 | 0 | 3 | 0 |
| Sichuan | 26 | 0 | 0 | 0 | 0 | 38 | 0 |
| Tianjin | 27 | 0 | 0 | 0 | 1 | 3 | 0 |
| Xinjiang Uygur | 28 | 0 | 2 | 8 | 0 | 1 | 1 |
| Xizang | 29 | 0 | 0 | 0 | 0 | 3 | 0 |
| Yunnan | 30 | 0 | 0 | 0 | 0 | 7 | 1 |
| Zhejiang | 31 | 46 | 93 | 45 | 34 | 91 | 0 |
Le 31 mars 2013, la Chine a signalé les premiers cas d'infection humaine par le nouveau virus réassorti de la grippe aviaire A(H7N9) à l'Organisation mondiale de la santé (OMS). Depuis, d'autres cas ont été signalés par 20 provinces de la Chine (Anhui, Guangdong, Guangxi, Guizhou, Hebei, Henan, Hubei, Hunan, Fujian, Jiangsu, Jiangxi, Jilin, Liaoning, Shandong, Sichuan, Yunnan, Gansu, Shaanxi, Shanxi et Zhejiang), quatre municipalités (Beijing, Chongqing, Tianjin et Shanghai) et quatre régions/territoires autonomes (Hong Kong, Macao, Tibet et Xinjiang Uyghur). Des échantillons environnementaux et de volaille ont donné des résultats positifs pour le virus de la grippe aviaire A(H7N9) dans toutes les régions mentionnées ci-dessus, à l'exception de Beijing (Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO), 2017). La plupart des infections humaines sont censées avoir eu lieu après une exposition à des volailles infectées ou à des milieux contaminés. De plus, des cas associés à des voyages ont été signalés en Malaisie, à Taïwan et au Canada.
Depuis mars 2013, l'OMS a signalé plus de 1 500 cas humains confirmés, dont au moins 613 décès (Organisation mondiale de la Santé, 2017d). Pour les renseignements les plus récents sur les cas et les décès, veuillez consulter le site Web Flambées épidémiques de l'OMS.
Depuis la première émergence du virus en 2013, les éclosions de grippe A(H7N9) chez les humains se sont produites en six vagues. Le début de la première vague a été marqué, en mars 2013, par la détection du nouveau virus de la grippe aviaire A(H7N9) chez trois patients en Chine, dont deux à Shanghai et un à Anhui. Les cas suivants qui furent signalés étaient concentrés dans les provinces de l'est de la Chine, soit Shanghai, Zhejiang et Jiangsu. La première vague a duré jusqu'en mai 2013.
La deuxième vague d'infections humaines causées par le virus de la grippe aviaire A(H7N9) a commencé en octobre 2013 et a pris fin au printemps 2014. On a observé un changement du profil épidémiologique du virus A(H7N9) au cours de la deuxième vague. Un déplacement géographique de la répartition des cas d'infections au virus A(H7N9) a eu lieu vers la province du Guangdong, située au sud, ce qui laisse croire que le virus s'était répandu dans son réservoir d'oiseaux domestiques. En outre, la deuxième vague était beaucoup plus étendue que la première, tant en nombre de cas que de décès.
La troisième vague d'infections humaines a commencé en octobre 2014 et a connu une baisse du nombre de cas au printemps 2015. La plupart des cas furent signalés au cours des mois de janvier et de février dans la province du Guangdong. Le premier cas importé d'infection humaine par le virus de la grippe aviaire A(H7N9) en provenance de la Chine a été confirmé au Canada le 26 janvier 2015. Un deuxième cas a été confirmé le 29 janvier 2015. Il s'agissait des premiers Nord-Américains reconnus comme ayant été infectés par ce virus. Ces personnes habitaient en Colombie-Britannique et ont voyagé ensemble en Chine. Les deux voyageurs n'ont pas eu besoin d'être admis à l'hôpital et se sont complètement rétablis depuis. Le nombre de cas et de décès signalés au cours de cette troisième vague était semblable à celui observé au cours de la deuxième vague.
La quatrième vague d'infections par le virus de la grippe A(H7N9) a été annoncée par l'Organisation des Nations Unies pour l'alimentation et l'agriculture le 15 octobre 2015, après que deux nouveaux cas de grippe A(H7N9) aient été signalés en Chine. Au total, 121 cas (y compris 34 décès) ont été signalés pendant la quatrième vague, ce qui est inférieur au nombre total de chacune des vagues précédentes. Le profil épidémiologique n'a connu aucun changement par rapport aux deuxième et troisième vagues.
La cinquième vague a commencé le 1er octobre 2016 et s'est terminée en septembre 2017. Huit cas ont été signalés entre le 1er octobre et le 30 novembre 2016, soit dans la fourchette prévue pour cette période (Zhou et coll., 2017). À partir du 1er décembre 2016, on a constaté une hausse marquée du nombre de cas, soit 766 dans la cinquième vague, ce qui est supérieur au nombre total déclaré lors de chaque vague précédente (Figure 1) (Organisation mondiale de la Santé, 2017c).
Bien que la plupart des cas humains aient développé une maladie grave sur le plan clinique, les infections humaines au virus de la grippe aviaire A(H7N9) peuvent présenter une gamme de symptômes, allant de malaises légers à des troubles plus graves. La plupart des enfants infectés par le virus n'ont présenté aucun symptôme ou que des symptômes légers (Yi et col., 2015). Étant donné que des cas graves continuent d'être signalés et que la surveillance du syndrome grippal a permis la détection de plusieurs cas moins graves, il faut rester vigilant (Organisation mondiale de la Santé, 2014b). L'OMS continue de recommander aux pays de poursuivre la surveillance épidémiologique et virologique de la grippe, en signalant au besoin les infections humaines conformément au Règlement sanitaire international (RSI) (2005), ainsi que d'adopter d'autres mesures de préparation en matière de santé sur le plan national.
Sommaire de la littérature
À ce jour, les données probantes semblent indiquer que les infections au virus de la grippe aviaire A(H7N9) chez les humains font l'objet d'une tendance saisonnière. Cette tendance atteint un sommet au cours de l'hiver et comprend des cas sporadiques au cours de l'été. Cette tendance saisonnière observée n'est pas un résultat inattendu puisque des études antérieures ont signalé une circulation accrue des virus de la grippe aviaire par temps frais et une circulation moindre par temps chaud (Q. Li et coll., 2014).
La répartition selon l'âge et le sexe des cas d'infection humaine par le virus de la grippe aviaire A(H7N9) tend vers les hommes d'âge moyen ou âgé. Cette différence fondée sur le sexe n'est pas bien comprise; cependant, certains chercheurs l'attribuent aux pratiques culturelles telles que les marchés de volailles vivantes auxquels prennent part surtout les hommes (Jernigan et Cox, 2015). De plus en plus de données probantes semblent indiquer que les volailles infectées et les milieux contaminés, notamment les marchés de volailles vivantes, constituent une source fondamentale d'infection au virus A(H7N9) chez les humains (Jernigan et Cox, 2015; J. Li et coll., 2015; Spackman, Pantin-Jackwood, Swayne, Suarez, et Kapczynski, 2015; Yi et coll., 2015). La vaste majorité (environ 85 %) des personnes atteintes ont été exposées à de la volaille ou à des marchés de volailles vivantes (Jernigan et Cox, 2015; Qin et coll., 2015). Des études récentes montrent que la circulation du virus peut s'amplifier dans ces marchés par la transmission entre oiseaux, servant ainsi de source continue d'infection au virus A(H7N9) chez les humains (Jernigan et Cox, 2015). Des échantillons de volailles et milieux de plusieurs marchés de volaille vivante en Chine ont donné des résultats positifs pour le virus, avec des séquences génomiques semblables à celles trouvées chez les humains infectés (Jernigan et Cox, 2015; Kang et coll., 2015; Spackman et coll., 2015; Organisation mondiale de la Santé, 2017a; Yi et coll., 2015). Depuis le 10 janvier 2017, on a détecté le virus de la grippe aviaire A(H7N9) hautement pathogène chez 54 échantillons de volailles ou milieux, soit 42 poulets, 2 canards et 10 échantillons de milieux (Organisation des Nations Unies pour l'alimentation et l'agriculture, 2018). Contrairement aux cas d'infection humaine par le virus A(H7N9), celui-ci ne semble pas causer de maladie grave chez la volaille. Il est difficile de détecter et de contrôler le virus chez la volaille étant donné l'absence de maladie dans cette population.
Bien que la majorité des cas ait été associée à une exposition à la volaille, on a signalé 24 grappes (2 ou 3 cas) dans les quatre premières vagues associées à des personnes en contact étroit avec des personnes infectées (Organisation mondiale de la Santé, 2013a; Organisation mondiale de la Santé, 2015). Des investigations épidémiologiques semblent indiquer que dans certains cas, les membres de la famille et les pourvoyeurs de soins aux personnes infectées pourraient avoir fait l'objet d'une transmission secondaire (Y. Liu et coll., 2015; Organisation mondiale de la Santé, 2013a; Organisation mondiale de la Santé, 2015; Yi et coll., 2015). Il convient de noter qu'une grappe associée aux soins de santé signalée pendant la quatrième vague à Shantou, en Chine, en février 2015 indique un risque pour les travailleurs de la santé (Farooqui et coll., 2016; Y. Liu et coll., 2015). Une étude publiée en mai 2015 a signalé que les cas secondaires infectés par le virus A(H7N9) étaient plus jeunes et présentaient des malaises plus légers que les cas index ou sporadiques (Jernigan et Cox, 2015; Qin et coll., 2015). Ces résultats viennent confirmer d'autres études qui indiquent que la détection de personnes infectées par le virus A(H7N9) est partiale envers les personnes âgées et les cas graves et n'est pas susceptible de représenter les populations plus jeunes (Centre for Health Protection du ministère de la Santé de HK, 2017b). Les investigations épidémiologiques de ces grappes semblent indiquer la possibilité d'une transmission interhumaine limitée, sans preuve de transmission soutenue au sein de la collectivité.
Caractéristiques du virus
La grippe aviaire A(H7N9) est un virus de la grippe A triple réassorti avec des gènes HA de la lignée eurasienne du virus de la grippe aviaire A(H7), des gènes NA de la grippe aviaire A(H11N9) et A(H7N9) et des gènes internes de la grippe aviaire A(H9N2) (Centre européen de prévention et de contrôle des maladies, 2017b; D. Liu et coll., 2013; Wu et coll., 2015). Jusqu'en février 2017, ce nouveau virus de la grippe aviaire faiblement pathogène ne semblait pas provoquer de maladie grave chez les oiseaux. Cependant, des mutations dans la protéine hémagglutinine pouvant rendre le virus plus pathogène chez la volaille ont été détectées depuis. Cette situation ne devrait pas avoir d'incidence sur la gravité de la maladie chez les humains (Organisation mondiale de la Santé, 2017b). Des mutations identifiées dans les souches du virus A(H7N9) sont favorables à une affinité élevée avec les récepteurs humains des voies respiratoires supérieures. Il n'existe toutefois aucune preuve de transmission interhumaine soutenue (Organisation mondiale de la Santé, 2013b). En février 2017, on a détecté une mutation de la protéine neuraminidase qui conférait une résistance à l'oseltamivir dans des échantillons du virus prélevés chez des cas humains en Chine (Conférence de presse de l'OMS : Expert briefing on the current waves of avian influenza outbreaks – 1er mars, 7 h 30 HNE 2017; Organisation mondiale de la Santé, 2017b).
On a récemment examiné la virulence et la transmissibilité du virus de la grippe aviaire A(H7H9) (Subarao, 2018). Tant la virulence que la transmissibilité du virus de la grippe aviaire A(H7N9) hautement pathogène sont semblables au virus prototype d'influenza aviaire faiblement pathogène (IAFP) de 2013, A/Anhui/1/2013. À la suite de la réplication chez les mammifères, les virus de la grippe aviaire présentent souvent des mutations de la protéine polymérase PB2 associée à un accroissement de la virulence et la transmission par voie respiratoire (Subarao, 2018). De plus, des études antérieures sur la transmission des virus A(H7N9) de 2013 avec des furets indiquent également que le virus peut se transmettre avec efficacité par un contact direct, mais de façon inefficace par les gouttelettes respiratoires (OMS, 2017e). On a récupéré les virus d'IAHP avec mutations de la protéine PB2 de furets ayant subi une infection expérimentale par le virus H7N9 d'IAFP. Ces virus étaient mortels chez les souris et aussi transmissibles que le virus d'IAFP A/Anhui/1/2013, mais plus virulents chez les furets (Richard et coll., 2013). Ces constatations sont conformes à un rapport récent sur un isolat humain du virus H7N9 d'IAHP (Imai et coll., 2017). Ces données laissent entendre que la descendance des virus de la grippe aviaire A(H7N9) a présenté des mutations des protéines PB2.
La plupart des cas de grippe aviaire A(H7N9) signalés dans la cinquième vague étaient associés à la lignée Yangtze River Delta (Public Health England, 2018). Cette situation contraste avec les vagues précédentes, pour lesquelles la plupart des cas de virus A(H7N9) étaient associés à des souches de la lignée Pearl River Delta. Ce changement sur le plan de la lignée des souches n'est pas associé à un changement de transmissibilité du virus ni à un changement considérable avec les caractéristiques démographiques des cas et la gravité de l'infection, ce qui laisse croire que rien ne change avec l'évaluation du risque. Cependant, le changement en matière de distribution géographique et de nombre de cas humains pendant la cinquième vague en Chine laisse entendre l'importance de procéder à une surveillance étroite des nouveaux cas et de considérer les souches de la lignée Yangtze River Delta en tant que virus vaccinaux candidats.
Mesures de prévention médicales
Les virus candidats de la grippe qui entreront dans la composition des vaccins ont été sélectionnés par les centres collaborateurs de l'OMS à des fins de préparation en cas de pandémie. Les virus vaccinaux candidats comprennent les virus analogues à A/Anhui/1/2013 et à A/Shanghai/2/2013 (Organisation mondiale de la Santé, 2014a). Deux nouveaux virus vaccinaux candidats ont été recommandés par l'OMS en mars 2017 (Organisation mondiale de la Santé, 2017a). Cependant, conformément aux consultations de l'OMS sur la composition du vaccin contre l'influenza, les virus hautement pathogènes d'abord détectés pendant la cinquième vague et certains des virus faiblement pathogènes en circulation à l'heure actuelle se distinguent sur le plan génétique et antigénique des virus vaccinaux candidats A(H7N9) actuels (Centre européen de prévention et de contrôle des maladies, 2017a). Les séquences sont partagées par le biais de l'Initiative mondiale relative à l'échange de données sur la grippe aviaire (Global Initiative on Sharing All Influenza Data (GISAID)) avec des centres collaborateurs de l'OMS et d'autres partenaires, et ce, dans le but d'améliorer les diagnostics et de créer des vaccins candidats. La caractérisation en temps opportun des virus A(H7N9) et le partage des données de séquençage restent essentiels à la création d'un virus vaccinal A(H7N9). Aucune recommandation n'a encore été faite concernant la fabrication à grande échelle d'un vaccin contre le virus de la grippe aviaire A(H7N9) (Organisation mondiale de la Santé, 2013b).
Des essais effectués en laboratoire ont confirmé que le virus de la grippe aviaire A(H7N9) est sensible aux inhibiteurs de la neuramidase oseltamivir et zanamivir, deux antiviraux qui sont stockés dans la Réserve nationale d'antiviraux et le Système de la réserve nationale d'urgence afin de pouvoir être utilisés pour traiter la population canadienne en cas de besoin. L'OMS a émis des directives quant à l'utilisation de chimioprophylaxie antivirale post-exposition pour la grippe aviaire A(H7N9) (document PDF (en anglais)). De récents cas humains de mutations conférant une résistance aux inhibiteurs de la neuraminidase ont été signalés au cours de la cinquième vague.
Le Laboratoire national de microbiologie (LNM) de l'Agence a élaboré des méthodes de diagnostic (tests) lui permettant de détecter le nouveau virus de la grippe aviaire A(H7N9) avec rapidité. On a partagé ces tests avec les laboratoires provinciaux et territoriaux pour permettre aux provinces de mener leurs propres essais au besoin.
Circulation zoonotique en Amérique du Nord
À l'heure actuelle, on considère que ce virus de la grippe aviaire A(H7N9) constitue un agent de maladie animale exotique (MAE) puisqu'il pourrait y avoir des conséquences si cet agent pathogène circulait au sein des populations aviaires du Canada. Aucune circulation de souche eurasienne de l'influenza de type A(H7N9) n'a été signalée chez les oiseaux sauvages ou domestiques en Amérique du Nord. Le virus de la grippe aviaire A(H7N9) hautement et faiblement pathogénique nord-américain signalé chez la volaille aux États-Unis diffère de la souche eurasienne associée à la cinquième vague en Chine (département de l'Agriculture des É.‑U., 2017) (Department of Agriculture and Industries de l'Alabama, 2017).
Recommandations pour le Canada
Surveillance
Sous le régime du Règlement sanitaire international, il faut déclarer les personnes souffrant de la grippe aviaire A(H7N9) par le biais du système de notification du Canada. On encourage les professionnels de la santé à maintenir la vigilance à l'égard des cas d'infection par le virus de la grippe aviaire A(H7N9) et à aviser les services de santé publique locaux concernés lorsqu'une personne fait l'objet d'une enquête. On utilise également les définitions nationales de cas pour la grippe aviaire A(H7N9) pour la surveillance de la grippe aviaire A(H7N9). Pour obtenir des conseils quant aux objectifs et activités de surveillance, se référer aux Lignes directrices nationales provisoires sur la surveillance des cas d'infection humaine causée par les virus de la grippe aviaire A(H7N9).
On demande aux provinces et territoires de signaler les cas confirmés d'infection par le virus de la grippe aviaire A(H7N9) à l'Agence de la santé publique du Canada au moyen du Formulaire de déclaration des cas d'agents pathogènes respiratoires émergents et les infections respiratoires aiguë sévères (IRAS).
Conseils de santé aux voyageurs
L'Agence publie des conseils de santé aux voyageurs qui expliquent les risques potentiels envers les voyageurs et le public canadiens, en plus de recommander des mesures à prendre pour réduire ces risques. Les conseils de santé aux voyageurs relatifs à la grippe aviaire A(H7N9) sont affichés sur le site Web du Gouvernement du Canada, voyage.gc.ca.
Prévention des infections
L'Agence fournit des recommandations pour la prévention des infections et les mesures de contrôle à l'intention des patients se présentant à l'hôpital, au cabinet du médecin et dans une autre clinique avec une infection soupçonnée ou confirmée par le virus de la grippe aviaire A(H7N9) dans son document de Directives provisoires – Lignes directrices sur la prévention et le contrôle des infections dans les établissements de soins actifs. Ces directives seront actualisées à mesure que de nouvelles données probantes sont accessibles.
Biosécurité
Étant donné le tableau clinique, caractérisé par une atteinte respiratoire grave et des décès chez l'humain, ainsi que le potentiel pandémique de ce virus, et étant donné que le virus est considéré à l'heure actuelle comme un agent de maladie animale exotique, le virus de la grippe aviaire A(H7N9) est classé comme un agent du groupe de risque 3, pathogène pour l'humain et les animaux, nécessitant un niveau de confinement 3 pour l'ensemble des activités prolifératives in vitro ou in vivo. On peut réaliser les activités cliniques ou diagnostiques n'entraînant aucune prolifération dans une installation de niveau de confinement 2 selon certaines exigences supplémentaires. En présence d'un échantillon humain non négatif, il est fortement recommandé d'interrompre les manipulations sur l'échantillon et de l'acheminer au Laboratoire national de microbiologie (LNM). Lorsqu'un échantillon non négatif est détecté par un laboratoire de diagnostic vétérinaire, les manipulations sont interrompues et l'échantillon est acheminé au Centre national des maladies animales exotiques (CNMAE), conformément à la politique des Normes de confinement pour les laboratoires de diagnostic des maladies animales exotiques. On peut consulter l'Avis de biosécurité sur le site Web de l'Agence.
Références
- Alabama Department of Agriculture and Industries, 2017. Press release: Additional poultry flocks test positive for low pathogenic avian influenza, page consultée le 22 mars 2017, http://www.agi.alabama.gov/s/avian-influenza/additional-poultry-flocks-test-positive-for-low-pathogenic-avian-influenza
- Centre européen de prévention et de contrôle des maladies, 2017a. Rapid risk assessment Influenza A(H7N9) virus in China – Implications for Public Health: Seventh Update, Stockholm : ECDC, 2017.
- Centre européen de prévention et de contrôle des maladies, 2017b. Rapid risk assessment: Human infection with avian influenza A(H7N9) virus - fifth update No. 5, Stockholm : ECDC, 2017.
- Centre européen de prévention et de contrôle des maladies, 2017c. Mutation of avian influenza A(H7N9): now highly pathogenic for poultry but risk of human-to-human transmission remains low, commentaire de l'ECDC, février 2017, https://ecdc.europa.eu/en/news-events/mutation-avian-influenza-ah7n9-now-highly-pathogenic-poultry-risk-human-human
- Centre for Health Protection of the Department of Health HK, 2017. Avian influenza Report 2017 [semaines 17 à 20], page consultée le 24 mai 2017, http://www.chp.gov.hk/en/guideline1_year/29/134/332.html
- CIDRAP, 2017. WHO: H7N9 antiviral resistance likely arose after treatment, H7N9 Avian Influenza Avian Influenza (Bird Flu) (http://www.cidrap.umn.edu/news-perspective/2017/03/who-h7n9-antiviral-resistance-likely-arose-after-treatment)
- Département de l'Agriculture des É.-U., 2017. USDA issues update on highly pathogenic avian influenza in Tennessee, page consultée le 1er mars 2017, http://www.phac-aspc.gc.ca/eri-ire/h7n9/risk_assessment-evaluation_risque-eng.php
- Conférence de presse de l'OMS : Expert briefing on the current waves of avian influenza outbreaks – 1er mars, 7 h 30 HNE (2017), à l'Organisation mondiale de la Santé (Éd.), Stockholm : Organisation mondiale de la Santé, 2013a. Flambées épidémiques de l'OMS : Human infection with influenza A(H7N9) virus in China, page consultée le 4 mars 2014, http://www.who.int/csr/don/2013_04_01/en/
- FAROOQUI, A., W. LIU, D. J. KELVIN, H7N9 Shantou Working Group, T. ZENG, Y. LIU, et coll., 2016. « Probable hospital cluster of H7N9 influenza infection », The New England Journal of Medicine, 374(6), 596-598, doi : 10.1056/NEJMc1505359 [doi]
- IMAI, M., T. WATANNABE, M. KISO, et coll., 2017. « A Highly Pathogenic Avian H7N9 Influenza Virus Isolated From a Human Is Lethal in Some Ferrets Infected via Respiratory Droplets », Cell Host & Microbe, 22 : 615-624.
- JERNIGAN, D. B., et N. J. COX, 2015. « H7N9: Preparing for the unexpected in influenza », Annual Review of Medicine, 66, 361-371. doi : 10.1146/annurev-med-010714-112311 [doi]
- KANG, M., J. HE, T. SONG, S. RUTHERFORD, J. WU, J. LIN, et coll., 2015. « Environmental Sampling for Avian Influenza A(H7N9) in Live-Poultry Markets in Guangdong, China », PLOS ONE, 10(5 e0126335. doi : 10.1371/journal.pone.0126335 [doi].
- LI, J., J. CHEN, G. YANG, Y. X. ZHENG, S. H. MAO, W. P. ZHU, et coll., 2015. « Case-control study of risk factors for human infection with avian influenza A(H7N9) virus in Shanghai, China, 2013 », Epidemiology and Infection, 143(9), 1826-1832. doi : 10.1017/S0950268814003264 [doi]
- LI, Q., L. ZHOU, M. ZHOU, Z. CHEN, F. LI, H. WU, et coll., 2014. « Epidemiology of human infections with avian influenza A(H7N9) virus in China », The New England Journal of Medicine, 370(6), 520-532, doi : 10.1056/NEJMoa1304617 [doi]
- LIU, D., W. SHI, Y. SHI, D. WANG, H. XIAO, W. LI, et coll., 2013. « Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: Phylogenetic, structural, and coalescent analyses », Lancet (Londre, Angleterre), 381(9881), 1926-1932. doi : 10.1016/S0140-6736(13)60938-1 [doi]
- LIU, Y., S. G. PAQUETTE, L. ZHANG, A. J. LEON, W. LIU, W. XIUMING, et coll., 2015. « The third wave: H7N9 endemic reassortant viruses and patient clusters », The Journal of Infection in Developing Countries, 9(2), 122-127. doi : 10.3855/jidc.6759 [doi]
- Organisation des Nations Unies pour l'alimentation et l'agriculture, 2017. H7N9 situation update-24 January 2017, page consultée le 28 février 2017, http://www.fao.org/ag/againfo/programmes/en/empres/H7N9/situation_update.htm
- Organisation des Nations Unies pour l'alimentation et l'agriculture, 2018. H7N9 situation update-28 February 2018, http://www.fao.org/ag/againfo/programmes/en/empres/h7n9/situation_update.html
- Organisation mondiale de la Santé, 2013b. WHO recommendation on influenza A(H7N9) vaccine virus, page consultée le 11 mars 2017, http://www.who.int/influenza/human_animal_interface/influenza_h7n9/201309_h7n9_recommendation.pdf
- Organisation mondiale de la Santé, 2014a. Summary of status of development and availability of avian influenza A(H7N9) candidate vaccine viruses and potency testing reagents, page consultée le 11 mars 2017, http://www.who.int/influenza/vaccines/virus/candidates_reagents/summary_a_h7n9_cvv_20140213.pdf
- Organisation mondiale de la Santé, 2014b. WHO risk assessment: Human infection with avian influenza A(H7N9), No. 4, Genève : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé, 2015. WHO risk assessment of human infections with avian influenza A(H7N9) virus, No. 8, Genève : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé, 2017a. Antigenic and genetic characteristics of zoonotic influenza viruses and development of candidate vaccine viruses for pandemic preparedness, No. 21, Genève : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé, 2017b. Flambées épidémiques de l'OMS : Human infection with avian influenza A(H7N9) virus – China, page consultée le 28 février 2017, http://www.who.int/csr/don/27-february-2017-ah7n9-china/en/
- Organisation mondiale de la Santé, 2017c. Influenza at the human-animal interface: Summary and assessment, 17 May 2017 to 15 June 2017, Government No. 127, Genève : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé, 2017d. Influenza at the human-animal interface: Summary and assessment, 8 December 2017 to 25 January 2018, Government No. 133, Genève : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé, 2017e. Analysis of recent scientific information on avian influenza A(H7N9) virus, page consultée le 10 février 2017, http://www.who.int/influenza/human_animal_interface/avian_influenza/riskassessment_AH7N9_201702/en/
- Public Health England, 2018. Risk assessment of avian influenza A(H7N9) – 6th update, 17 janvier 2018, https://www.gov.uk/government/publications/avian-influenza-a-h7n9-public-health-england-risk-assessment/risk-assessment-of-avian-influenza-ah7n9-sixth-update
- QIN, Y., P. W. HORBY, T. K. TSANG, E. CHEN, L. GAO, J. OU, et coll., 2015. Differences in the epidemiology of human cases of avian influenza A(H7N9) and A(H5N1) viruses infection. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 61(4), 563-571. doi : 10.1093/cid/civ345 [doi]
- RICHARD M, EJ SCHRAUWEN, M. de GRAAF, TM BESTEBROER, MI SPRONKEN, et coll., 2013. « Limited airborne transmission of H7N9 influenza A virus between ferrets », Nature. 26; 501 (7468) : 560-3. doi : 10.1038/nature12476. Epub, 7 août 2013.
- SPACKMAN, E., M. PANTIN-JACKWOOD, D. E. SWAYNE, D. L. SUAREZ, et D. R. KAPCZYNSKI, 2015. « Impact of route of exposure and challenge dose on the pathogenesis of H7N9 low pathogenicity avian influenza virus in chickens », Virology, 477, 72-81. doi : 10.1016/j.virol.2015.01.013 [doi]
- SUBARAO, Kanta, 2018. « Avian Influenza H7H9 viruses: a rare second warning », Cell Research, 28 : 1-2. doi : 10.1038/cr.2017.154; diffusé en ligne le 1er décembre 2017.
- WU, D., S. ZOU, T. BAI, J. LI, X. ZHAO, L. YANG, et coll., 2015. « Poultry farms as a source of avian influenza A (H7N9) virus reassortment and human infection », Scientific Reports, 5, 7630. doi : 10.1038/srep07630 [doi]
- YI, L., D. GUAN, M. KANG, J. WU, X. ZENG, J. LU, et coll., 2015. « Family clusters of avian influenza A H7N9 virus infection in Guangdong Province, China », Journal of Clinical Microbiology, 53(1), 22-28. doi : 10.1128/JCM.02322-14 [doi]
- ZHOU, L., R. REN, L. YANG, C. BAO, J. WU, D. WANG, et coll., 2017. « Sudden increase in human infection with avian influenza A(H7N9) virus in China, September-December 2016 », Western Pacific Surveillance and Response, 8(1)
- ZHOU, L., E. CHEN, C. BAO, N. XIANG, J. WU, S. WU, J. SHI, X. WANG, et coll., 2018. « Clusters of human infection and human-to-human transmission of Avian Influenza A(H7N9) virus, 2013-2017 », Emerging Infectious Diseases, 24 (2) : 397-400. DOI : https://doi.org/10.3201/eid2402.171565