Recommandations sur la durée de la période d’observation post-vaccinale pour la vaccination antigrippale pendant la pandémie de COVID-19
Une déclaration d'un comité consultatif (DCC)
Comité consultatif national de l'immunisation (CCNI)
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ci-après appelée l'ASPC) des conseils continus et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique.
Outre le fardeau d'une maladie et les caractéristiques du vaccin, l'ASPC a élargi le mandat du CCNI pour inclure la prise en compte de facteurs programmatiques dans l'élaboration de recommandations fondées sur des données probantes afin de faciliter la prise de décisions opportunes concernant les programmes de vaccination financés par les fonds publics à l'échelle provinciale et territoriale.
Les autres facteurs que le CCNI doit prendre en compte sont l'économie, l'éthique, l'équité, la faisabilité et l'acceptabilité. Au cours des prochaines années, le CCNI peaufinera ses approches méthodologiques afin d'inclure ces facteurs. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de tous les facteurs programmatiques. Alors que le CCNI travaille à la mise en œuvre complète de son mandat élargi, certaines déclarations incluront des analyses programmatiques à des degrés divers pour les programmes de santé publique.
L'ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Téléchargez le format alternative
(PDF format, 47 pages)
Organization: Agence de la santé publique du Canada
Date publiée : 2020-10-15
Sujets connexes
Table des matières
- Sommaire de l'information contenue dans la présente déclaration du CCNI
- I. Introduction
- II. Méthodologie
- III. Apparition des effets secondaires suivant l'immunisation
- IV. Recommandations
- Tableaux et figures
- Liste des abréviations
- Remerciements
- Références
Sommaire de l'information contenue dans la présente déclaration du CCNI
Les faits saillants suivants font ressortir l'information importante pour les vaccinateurs. Veuillez consulter le reste de la présente déclaration pour obtenir plus de précisions.
1. Quoi
- Il est important de poursuivre les programmes de vaccination systématique pendant la pandémie de COVID-19, en particulier pour la saison grippale à venir, ce qui permettra de prévenir la morbidité et la mortalité liées à la grippe et contribuera à réduire le fardeau pesant sur le système de soins de santé canadien. Cela est particulièrement important en prévision d'une éventuelle résurgence de la COVID-19 à l'automne ou en hiver.
- Pendant la pandémie de COVID-19, la présence d'une foule importante dans les cliniques d'immunisation contre la grippe pourrait contribuer à accroître les risques de transmission du SRAS-CoV-2 si elle n'est pas gérée correctement; il pourrait donc être nécessaire d'adapter les pratiques d'immunisation habituelles et l'aménagement des cliniques.
- En plus d'autres mesures de santé publique et de prévention et de contrôle des infections, la réduction de la période d'observation post-vaccinale dans les aires d'observation post-vaccination offre une option pour réduire la surpopulation. La diminution des interactions étroites entre les personnes vaccinées et entre les personnes vaccinées et le personnel des cliniques peut contribuer à atténuer le risque de transmission du SRAS-CoV-2 en milieu clinique. Les personnes vaccinées qui ne répondent pas aux critères de réduction de la période d'observation post-vaccinale auront également accès à une salle d'attente moins encombrée après la vaccination. Cette intervention peut également permettre de vacciner un plus grand nombre d'individus sur une période donnée (augmenter le « débit » de vaccination).
2. Qui
- Paramètres permettant de vacciner contre la grippe pour la saison grippale à venir pendant la pandémie de COVID-19.
3. Comment
- Le CCNI recommande que la période d'observation post-vaccinale actuelle, telle que précisée dans le Guide canadien d'immunisation (GCI) Référence a, soit maintenue pour les établissements de vaccination antigrippale qui peuvent respecter les mesures adéquates Référence b de santé publique et de prévention et de contrôle des infections pour réduire la transmission du SRAS-CoV-2, en particulier l'éloignement physique (forte recommandation du CCNI).
- Le CCNI conclut qu'il existe des données probantes suffisantes pour maintenir une période d'observation de 15 minutes après la vaccination pendant la pandémie de COVID-19 pour les personnes n'ayant pas d'antécédents connus de réactions allergiques graves (y compris l'anaphylaxie) à l'un des composants du vaccin antigrippal dont l'administration est envisagée ou d'antécédents d'autres réactions immédiates après la vaccination (p. ex., syncope avec ou sans convulsions) (données probantes de catégorie B).
- Le CCNI recommande qu'une période d'observation post-vaccinale plus courte, entre 5 et 15 minutes après la vaccination contre la grippe, puisse être envisagée pendant la pandémie de COVID-19, mais seulement pendant les périodes où un éloignement physique adéquat dans les salles d'attente après la vaccination ne peut être maintenu en raison du volume de personnes qui demandent à être vaccinées, et seulement lorsque des conditions particulières sont remplies Endnotes * (recommandation discrétionnaire du CCNI).
- Le CCNI conclut qu'il n'y a pas suffisamment de données probantes provenant de rapports issus d'études de séries de cas rétrospectives et passives sur les effets secondaires suivant l'immunisation (ESSI) pour justifier une période d'observation post-vaccinale réduite. Toutefois, d'autres facteurs peuvent être pris en considération pour justifier une période d'observation post-vaccinale réduite, si cela se révèle nécessaire à des fins de santé publique et de prévention et de contrôle des infections (données probantes de catégorie I).
Notes de fin *
- Note de fin *
-
Une période d'observation plus courte ne peut être envisagée que si la personne ayant reçu le vaccin remplit les conditions suivantes Reference c :
- Antécédents d'administration du vaccin antigrippal et absence d'antécédents connus de réactions allergiques graves (y compris l'anaphylaxie) à l'un des composants du vaccin antigrippal dont l'administration est envisagée (il convient de noter que les personnes ayant reçu un vaccin de nouvelle technologie ne devraient pas pouvoir faire l'objet de la période d'observation post-vaccinale réduite) Référence d.
- Aucun antécédent d'autres réactions post-vaccinales immédiates (p. ex., syncope avec ou sans convulsions) après réception d'un vaccin.
- La personne vaccinée est accompagnée d'un parent ou tuteur (dans le cas d'un enfant) ou d'un adulte responsable qui fera office de chaperon pour surveiller la personne vaccinée pendant au moins 15 minutes après la vaccination. Dans le cas de deux adultes responsables, les deux peuvent être vaccinés aux fins de ce critère, si tous deux acceptent de se surveiller mutuellement après la vaccination.
- La personne ayant reçu le vaccin ne doit pas conduire de véhicule motorisé ou de moyen de transport à roues motorisé ou non (p. ex., bicyclette, planche à roulettes, patins à roues alignées, scooter), ni de machine pendant au moins 15 minutes après la vaccination.
- La personne vaccinée et le parent/tuteur ou l'accompagnateur adulte responsable savent quand et comment demander des conseils post-vaccination et reçoivent des instructions sur ce qu'il faut faire si une assistance et des services médicaux sont nécessaires.
- La personne vaccinée et le parent/tuteur ou l'adulte responsable s'engagent à rester dans la salle d'attente après la vaccination pendant la période d'observation post-vaccinale et à informer le personnel si la personne se sent ou semble mal avant de partir. Ils devraient être informés qu'une personne présentant tout symptôme laissant penser à une évolution des ESSI à la fin de la période d'observation post-vaccinale raccourcie nécessite une période d'observation plus longue en clinique.
4. Pourquoi
- Il est peu probable qu'un établissement de vaccination capable de maintenir les mesures recommandées de santé publique et de prévention et de contrôle des infections, telles que l'éloignement physique dans les aires post-vaccination, parvienne à réduire davantage le risque de transmission du SRAS-CoV-2 en mettant en place une période d'observation post-vaccinale plus courte.
- Une clinique de vaccination qui n'est parfois pas en mesure de maintenir l'éloignement physique recommandé dans les aires post-vaccination peut envisager de mettre en place une période d'observation post-vaccinale plus courte afin de réduire le risque de transmission du SRAS-CoV-2 dans des conditions particulières.
- Les évènements indésirables graves (ÉIG) dans les minutes qui suivent la vaccination et qui peuvent nécessiter une intervention médicale sont relativement rares.
I. Introduction
Un regroupement de cas de pneumonie d'origine inconnue a été signalé à Wuhan, dans la province de Hubei, en Chine, en décembre 2019. Il a été déterminé que ces cas étaient attribuables à un nouveau coronavirus (SRAS-CoV-2) qui provoque une maladie désormais appelée maladie à coronavirus 2019 (COVID-19). L'Organisation mondiale de la Santé (OMS) a qualifié la COVID-19 de pandémie le 11 mars 2020Note de bas de page 1.
Les provinces et territoires canadiens ont mis en place une série de mesures de santé publique visant à limiter la transmission du SRAS-CoV-2 et à réduire le fardeau pesant sur le système de soins de santé, notamment le report temporaire des services médicaux non essentiels. Reconnaissant la nécessité de poursuivre les programmes de vaccination systématique pendant la pandémie, l'Agence de la santé publique du Canada (ASPC), en consultation avec le Comité consultatif national de l'immunisation (CCNI) et le Comité canadien d'immunisation, a publié des orientations provisoires sur les populations prioritaires pour les programmes de vaccination au Canada,Note de bas de page 2 ainsi que des orientations sur les stratégies et les modifications des processus habituels des cliniques de vaccination pour la saison grippale à venir afin de réduire le risque de transmission du SRAS-CoV-2 dans diverses cliniques de vaccinationNote de bas de page 3.
Diverses modifications de processus (contrôles administratifs, environnementaux et techniques, et mesures de protection personnelle) peuvent être mises en œuvre dans une clinique de vaccination pour prévenir la transmission du SRAS-CoV-2, par exemple en favorisant un éloignement physique (au moins deux mètres) entre les personnes vaccinées, le personnel et leurs collègues. Une autre mesure possible pourrait être de réduire la période d'observation post-vaccinale, qui sert à déceler les ESSI rares mais graves. Raccourcir le temps que les personnes vaccinées passent dans la clinique de vaccination après la vaccination pourrait réduire le risque de transmission du SRAS-CoV-2 à partir d'un cas de COVID-19 infectieux non reconnu. Toutefois, toute considération relative à une réduction de la période d'observation post-vaccinale doit évaluer le risque éventuel de détermination tardive d'un évènement indésirable (ÉI) pouvant nécessiter une intervention médicale immédiate par rapport aux avantages éventuels d'une réduction du risque de transmission du SRAS-CoV-2 et de la possibilité de vacciner davantage de personnes (augmenter le « débit » des cliniques de vaccination) dans une période donnée.
Au Canada, il est recommandé que les personnes vaccinées restent en observation pendant au moins 15 minutes après la vaccination, à moins qu'il y ait une préoccupation particulière concernant une éventuelle allergie au vaccin, auquel cas une période d'observation de 30 minutes après la vaccination est jugée plus sûreNote de bas de page 4. Les directives relatives à l'observation post-vaccinale dans d'autres pays varientNote de bas de page 5 Note de bas de page 6 Note de bas de page 7 Note de bas de page 8. En avril 2020, l'Australian Technical Advisory Group on Immunization (ATAGI) a publié une recommandation selon laquelle la période d'observation post-vaccinale pourrait être réduite de 15 minutes à 5 minutes dans les cliniques de vaccination où il est impossible d'assurer un éloignement physique suffisant, pour autant que des critères précis soient respectésNote de bas de page 9. L'orientation de l'ATAGI se fondait sur une revue ciblée de la littérature et sur des opinions d'experts.
Objectif de l'orientation
La présente déclaration du CCNI vise à examiner les données probantes sur le moment de l'apparition des ESSI graves (anaphylaxie, syncope avec ou sans convulsions). Ces données seront utilisées pour évaluer l'impact éventuel d'une réduction de la période d'observation post-vaccinale sur le risque d'identification tardive d'un ÉIG pouvant nécessiter une intervention médicale immédiate, évalué par rapport aux avantages éventuels d'une réduction de la transmission du SRAS-CoV-2 dans les établissements de vaccination antigrippale et à la possibilité de vacciner davantage de personnes au cours d'une période donnée. L'analyse servira à fournir des orientations aux programmes de vaccination provinciaux et territoriaux et aux cliniciens de première ligne sur la durée de la période d'observation post-vaccinale pour la vaccination antigrippale pendant la pandémie de COVID-19.
II. Méthodologie
Revue rapide de la littérature
En prévision de la mise en place des cliniques de vaccination antigrippale à l'automne 2020, une revue rapide de la littérature a été menée pour déterminer la probabilité de manquer des ESSI graves (anaphylaxie, syncope avec ou sans convulsions) dans le cas de périodes d'observation post-vaccinale raccourcies. La stratégie de recherche de la revue rapide a été élaborée en collaboration avec une bibliothécaire documentaliste fédérale et a été utilisée pour rechercher, dans une base de données électronique unique, des études sur le moment où les ESSI graves se produisent chez les enfants et les adultes (tous âges et populations).
Question de recherche
Quelle est la période d'observation minimale nécessaire après la vaccination pour observer un ESSI grave?
- P (population):
- Personnes âgées de six mois et plus
- I (intervention):
- Période d'observation post-vaccinale, tout vaccin
- C (comparaison):
- S.O.
- O (résultats):
- Délai avant l'apparition d'un ESSI grave
Depuis sa création jusqu'au 22 mai 2020, la base de données électronique (EMBASE) a été consultée en utilisant les termes de recherche suivants : convulsions, syncope, anaphylaxie, évènement indésirable (ÉI), vaccination, réaction à la vaccination, réaction allergique et réaction post-vaccinale. Les recherches se sont limitées aux articles publiés en anglais et en français. Deux examinateurs (NF, PDP) ont examiné indépendamment les titres et les résumés ainsi que le texte intégral des articles admissibles, mais pas en double. Le diagramme PRISMA est présenté à l'Annexe A. La stratégie de recherche complète est disponible sur demande.
Les études ont été incluses si elles satisfaisaient aux critères suivants :
- L'étude a enregistré le moment précis de l'apparition d'au moins un sous-ensemble d'ESSI et a signalé les évènements survenus dans les 30 minutes suivant la vaccination.
- L'étude a évalué l'incidence des ESSI graves suivants : anaphylaxie, syncope avec ou sans convulsions.
Les études ont été exclues si elles satisfaisaient à au moins l'un des critères suivants :
- L'étude était rédigée dans une langue autre que l'anglais ou le français.
- L'article était un éditorial, une opinion, un résumé de conférence ou un reportage.
- La période d'observation minimale des ESSI était supérieure à 30 minutes.
- L'étude ne faisait pas état du délai d'apparition des ESSI graves.
Les études admissibles repérées ont été réparties entre trois examinateurs (NF, PDP, GC). Les examinateurs ont indépendamment extrait les données des études qui leur avaient été attribuées dans des tableaux de données probantes et ont évalué le risque de biais dans ces études. L'extraction des données et les évaluations du risque de biais n'ont été effectuées en double pour aucune des études admissibles.
Les données extraites ont été utilisées pour résumer les principales caractéristiques des études et pour analyser le risque de biais, en utilisant un outil modifié de l'Institute of Health Economics (IHE)Note de bas de page 10, car toutes les études incluses étaient des études de cas ou des études de séries de cas. Une synthèse narrative des données extraites a été créée pour résumer les résultats estimés d'intérêt (nombre d'ESSI, gravité, délai d'apparition et incidence, s'ils étaient signalés). Comme tous les articles désignés n'évaluaient pas les résultats en fonction de la gravité, le nombre de rapports sérieux déterminés a été compilé à partir des rapports explicitement classés comme étant graves, ainsi qu'à partir de l'inférence de séquelles déclarées pour des cas individuels qui respecteraient les définitions habituelles de résultats graves (p. ex., décès, maladie potentiellement mortelle, hospitalisation, hospitalisation prolongée, incapacité permanente).
Système canadien de surveillance des effets secondaires suivant l'immunisation
La base de données du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) a été consultée pour trouver des rapports d'ESSI concernant des cas d'anaphylaxie, de syncope et de convulsions afébriles associés à une date d'administration du vaccin comprise entre 2014 et 2018. Les termes du Dictionnaire médical des activités de réglementation (MedDRA) utilisés pour coder les rapports du SCSESSI ont été utilisés pour rechercher, dans le SCSESSI, les rapports relatifs aux trois résultats estimés d'intérêt. Les rapports d'anaphylaxie devaient répondre à la définition de la Brighton Collaboration pour l'anaphylaxieNote de bas de page 11 et l'individu dans le rapport devait être géré comme tel. Le SCSESSI utilise la définition de l'OMS d'un ESSINote de bas de page 12 grave : un effet qui menace le pronostic vital, qui entraîne l'hospitalisation ou la prolongation de l'hospitalisation, qui entraîne une invalidité persistante ou marquée, ou qui entraîne une malformation congénitale ou la mort. Les rapports qui n'incluaient pas de délai avant l'apparition des symptômes ont été exclus.
Le délai d'apparition des symptômes pour chaque ESSI a été résumé par intervalles de 5 minutes dans les 15 premières minutes suivant la vaccination, si disponible; et par le temps d'apparition qui comprend 25 %, 50 %, 75 %, 95 %, et 100 % de tous les rapports. Ces mesures sommaires ont été analysées par groupes d'âge : moins de 2 ans, 2 ans à moins de 7 ans, 7 ans à moins de 18 ans, 18 ans à moins de 50 ans, 50 ans à moins de 65 ans, 65 ans et plus, tous les âges), et selon tous les rapports par rapport aux ESSI graves.
Évaluation qualitative de la réduction de la période d'observation post-vaccinale
Il est difficile de quantifier avec précision l'impact d'une réduction de la période d'observation post-vaccinale sur le risque de transmission du SRAS-CoV-2 dans un établissement de vaccination. C'est particulièrement vrai, car les milieux cliniques au Canada sont divers; la prévalence communautaire du SRAS-CoV-2 varie entre les collectivités et fluctue au fil du temps au sein même des collectivités; et car cette mesure serait l'une des nombreuses mesures de santé publique et de prévention et de contrôle des infections mises en œuvre pour réduire le risque de transmission dans ces milieux. Par conséquent, une évaluation qualitative de cette intervention a été entreprise afin d'évaluer le risque éventuel de tout retard dans la détermination des cas graves d'ESSI pouvant nécessiter une intervention médicale immédiate par rapport à l'avantage éventuel de réduire le risque de transmission du SRAS-CoV-2 et d'améliorer la capacité à vacciner un plus grand nombre de personnes au cours d'une période donnée (augmenter le « débit » des cliniques de vaccination).
Élaboration de recommandations
L'ébauche de la déclaration a été élaborée par le Groupe de travail sur l'influenza (GTI) du CCNI, en collaboration avec le groupe de travail du CCNI sur l'innocuité des vaccins. Ces trois analyses, décrites ci-dessus, ont ensuite été utilisées par le CCNI pour rédiger des recommandations sur la possibilité de réduire la durée de la période d'observation post-vaccinale dans le contexte de la pandémie de COVID-19. Le CCNI a effectué l'évaluation critique des données probantes disponibles et il a approuvé la recommandation finale le 13 août 2020.
III. Apparition des effets secondaires suivant l'immunisation
Vingt-deux études sur le délai avant l'apparition d'un ESSI grave ont été repérées grâce à la revue rapide. Le risque de biais a été évalué pour toutes les études à l'aide d'un outil modifié de l'IHE. Toutes ont été considérées comme présentant un risque sérieux de biais, à l'exception de deux études, qui ont été considérées comme présentant un risque de biais peu clairNote de bas de page 14 Note de bas de page 19. Les deux études pour lesquelles le risque de biais n'est pas clair ont décrit l'incidence de l'anaphylaxie après l'administration du vaccin en utilisant un ensemble restreint de codes CIM-9 (Classification statistique internationale des maladies et des problèmes de santé connexes-9) pour effectuer des recherches dans une base de données de soins de santé, processus jugé plus sensible pour repérer les épisodes d'anaphylaxie que le fait de se fier aux rapports soumis aux systèmes passifs de signalement des ESSI. McNeil et al.Note de bas de page 19 ont utilisé le même ensemble de codes que Bohlke et al.Note de bas de page 14, mais ont complété leurs travaux de recherche par des codes d'allergie combinés à des codes d'administration d'épinéphrine. La plupart des articles inclus utilisaient des données provenant de systèmes de surveillance passive, et présentaient des limites telles que la sous-déclaration, l'insuffisance des renseignements sur les cas signalés, l'absence de dénominateurs et l'incohérence des définitions de cas. Pour établir si l'intervention en question était décrite, les articles étaient considérés comme étant peu biaisés s'ils indiquaient le nom et le fabricant du vaccin et s'il s'agissait de la première dose de vaccination ou d'une dose ultérieure, le cas échéant. Un sommaire visuel du risque d'évaluations biaisées est fourni sur la Figure 2.
Les conclusions de la revue rapide doivent être interprétées avec prudence à la lumière des conclusions de l'évaluation du risque de biais pour les articles désignés dans la revue rapide et des limites inhérentes aux données obtenues à partir d'études de séries de cas rétrospectives qui reposent sur des systèmes de surveillance passive des ESSI. À titre d'exemple, le caractère volontaire de la déclaration dans la plupart de ces systèmes peut conduire à une sous-déclaration des ESSI; le caractère rétrospectif de ces études peut rendre difficile l'obtention des données cliniques nécessaires pour vérifier les résultats et déterminer que les résultats correspondent aux définitions de cas; les études peuvent également ne pas avoir accès aux données sur les séquelles pour les individus figurant dans les études de cas, ce qui peut conduire à une sous-estimation de la gravité de certains résultats. Il est souvent impossible d'accéder aux données du dénominateur (c.-à-d. le nombre de doses de vaccin distribuées ou, idéalement, le nombre de doses administrées) pour estimer l'incidence des résultats. En outre, les estimations de l'incidence basées sur un nombre relativement faible d'études de cas peuvent être peu fiables (c.-à-d. que relativement peu de cas signalés supplémentaires peuvent modifier de manière significative le taux calculé) et les taux générés dans des populations hétérogènes peuvent ne pas être comparables.
III.1 Anaphylaxie
Revue rapide de la littérature
Délai avant l'apparition des symptômes de l'anaphylaxie
Au total, 16 articles (12 études de séries de cas rétrospectives Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 17 Note de bas de page 18 Note de bas de page 19 Note de bas de page 20 Note de bas de page 21 Note de bas de page 22 Note de bas de page 23 Note de bas de page 24, 4 études de cas Note de bas de page 25 Note de bas de page 26 Note de bas de page 27 Note de bas de page 28) ont été désignés dans la revue rapide comme fournissant des données sur le moment où des cas d'anaphylaxie sont signalés après l'administration du vaccin. Les études de séries de cas rétrospectives utilisent principalement les systèmes de surveillance des ESSI pour examiner les cas d'anaphylaxie chez les personnes vaccinées. Sur l'ensemble des articles désignés, 981 cas signalés de réactions anaphylactiques ont été décrits, dont 816 (83 %) ont été évalués par rapport à la définition de l'anaphylaxie de la Brighton Collaboration et aux critères des trois niveaux de certitude diagnostique (niveau 1 : 413 rapports; niveau 2 : 372; niveau 3 : 14; autre/niveau non déclaré : 17). Sur les 981 cas signalés d'anaphylaxie, 729 (74 %) ont été classés comme étant graves.
Dans l'ensemble, 873 (89 %) cas signalés d'anaphylaxie enregistraient un certain délai avant l'apparition des symptômes, dont la majorité (492/873, soit 56 %) est survenue dans les 30 minutes suivant la vaccination. La plupart des données (735/873, soit 84 %) proviennent d'une seule étude utilisant les études de cas de la base de données du Vaccine Adverse Events Reporting System (VAERS) du Department of Health and Human Service des États-Unis (É.-U.), qui classe les délais d'apparition par intervalles relativement larges (dans les 30 minutes, de 30 à 119 minutes, de 2 à 4 heures, de 4 à 8 heures et de 8 à 24 heures)Note de bas de page 23.
Au total, 8 études de séries de cas rétrospectives Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 17 Note de bas de page 19 Note de bas de page 22 Note de bas de page 24 et 3 études de cas Note de bas de page 25 Note de bas de page 26 Note de bas de page 28 ont désigné 55 rapports qui ont fourni des descriptions ou des délais réels de l'apparition des symptômes d'anaphylaxie dans des intervalles compris dans les 15 premières minutes suivant la vaccination. Sur ces 55 cas, 35 (64 %) sont survenus entre 0 et 5 minutes après la vaccination, 4 (7 %) « dans les minutes » ou « dans les quelques minutes », 9 (16 %) entre 5 et 10 minutes, 1 (2 %) entre 10 et 15 minutes, et 6 (11 %) dans les 5 à 15 minutes.
Trois des études de séries de cas rétrospectives Note de bas de page 13 Note de bas de page 20 Note de bas de page 23 ont fourni des mesures sommaires du délai d'apparition des symptômes d'anaphylaxie après la vaccination. Baxter et al. ont évalué, dans la base de données de l'Australian Surveillance of Adverse Events following Vaccination in the Community (SAEFVIC), les cas signalés d'anaphylaxie survenant dans les 60 premières minutes suivant la vaccination chez les enfants d'âge préscolaire (<5 ans). L'étude a révélé que les 12 cas d'anaphylaxie déterminés présentaient un délai d'apparition des symptômes de 0 à 40 minutes, avec une moyenne de 7,5 minutes et une médiane de 5 minutesNote de bas de page 13. Su et al., en utilisant les cas signalés d'anaphylaxie du VAERS de 1990 à 2016, ont trouvé 828 études de cas survenus dans le jour suivant la vaccination. Dans ces cas, le délai médian d'apparition des symptômes après la vaccination était de 20 minutes (allant de <1 minute à 24 heures)Note de bas de page 23. Enfin, Pahud et al., qui ont examiné les ÉIG mais non mortels signalés au VAERS à la suite de l'administration du vaccin contre le virus H1N1 2009 chez les enfants (<18 ans) d'octobre 2009 à janvier 2010, ont découvert que 12 réactions allergiques réelles (c.-à-d. pas seulement des cas d'anaphylaxie signalés) sont apparues dans les 3 heures suivant la vaccination, avec une médiane de 30 minutes (fourchette : entre 5 minutes et 3 heures) Note de bas de page 20.
Estimations de l'incidence de l'anaphylaxie fondées sur la littérature
Six études de séries de cas rétrospectives (Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 18 Note de bas de page 23 ont eu accès aux données sur le nombre de doses de vaccin distribuées ou administrées pendant la période de l'étude; ces données ont été utilisées pour calculer des estimations globales, ou propres au vaccin, de l'incidence de l'anaphylaxie pendant la période de l'étude.
L'incidence de l'anaphylaxie était assez uniforme d'une étude à l'autre, malgré quelques variations. Ces variations pourraient être attribuables au petit nombre d'études de cas d'anaphylaxie et aux différents dénominateurs utilisés pour calculer l'incidence (doses distribuées ou doses administrées). McNeil et al. ont signalé une incidence globale d'anaphylaxie chez les enfants et les adultes de 1,31 pour 1 000 000 de doses administréesNote de bas de page 18. Deux autres études ont calculé l'incidence de l'anaphylaxie chez les enfants de moins de 18 ans; les estimations allaient de 0,65 à 1,3 pour 1 000 000 de dosesNote de bas de page 13 Note de bas de page 14.
Quatre études ont fait état d'estimations de l'incidence de vaccins précis qui variaient considérablement selon le vaccin et l'étude (de 0,1 à 26 pour 1 000 000 de doses) Note de bas de page 15 Note de bas de page 16 Note de bas de page 18 Note de bas de page 23. L'incidence la plus élevée a été signalée dans une étude fondée sur les cas d'anaphylaxie soumis à la New South Wales Health Immunization Unit pour le vaccin contre le virus du papillome humain (VPH)Note de bas de page 15 et l'incidence la plus faible a été signalée pour le vaccin antigrippal sur la base des rapports soumis au VAERSNote de bas de page 23. L'incidence de l'anaphylaxie estimée après l'administration du vaccin antigrippal était de 0,1 à 1,8 pour 1 000 000 de doses (administrées ou distribuées)Note de bas de page 18 Note de bas de page 23.
Système canadien de surveillance des effets secondaires suivant l'immunisation
Délai avant l'apparition des symptômes de l'anaphylaxie
Sur un total de 136 cas d'anaphylaxie déterminés, 112 (82 %) ont été classés comme étant graves. Un peu plus de la moitié de tous les cas d'anaphylaxie ont été signalés chez des personnes âgées de 7 à moins de 18 ans (n=30, 22 %) et de 18 à moins de 50 ans (n=46, 34 %). Il y a eu moins de cas d'ESSI dans chacune des autres groupes d'âge (fourchette : de 9 à 20 cas d'ESSI par groupe d'âge).
Pour tous les âges combinés, 25 % des cas d'anaphylaxie signalés sont apparus dans les 5 minutes suivant la vaccination, ce chiffre passant à 50 % des cas signalés 15 minutes après la vaccination, avec un délai médian global de 15 minutes avant l'apparition des symptômes (fourchette : de 1 minute à 48 heures). La proportion de personnes dont les symptômes sont apparus dans les 15 premières minutes suivant la vaccination ne variait pas de manière significative selon le groupe d'âge, à l'exception des enfants de moins de 2 ans (6 minutes contre 15 minutes pour tous les âges) et des personnes de 50 à moins de 65 ans (45 minutes contre 15 minutes) (Tableau 1). En comparant le délai avant l'apparition des symptômes pour tous les cas signalés d'anaphylaxie avec les cas classés comme étant graves, des tendances similaires ont été trouvées. Pour tous les âges combinés, 29 % des cas signalés ont vu l'apparition des symptômes dans les 5 minutes suivant la vaccination, 46 % dans les 10 minutes suivant la vaccination et 54 % dans les 15 minutes suivant la vaccination. Ces proportions ne diffèrent pas de manière significative selon le groupe d'âge, à l'exception des enfants de moins de 2 ans (50 % dans les 5 minutes, 67 % dans les 15 minutes) et des personnes de 50 à moins de 65 ans (8 % dans les 5 minutes, 31 % dans les 15 minutes) (données non présentées), ce qui reflète les différences de délai médian avant l'apparition des symptômes dans ces groupes d'âge (Tableau 1).
| Groupe d'âge (ans) | Nombre de cas (%) | Pourcentage de cas signalés selon le délai d'apparition des symptômes | |||||
|---|---|---|---|---|---|---|---|
| 25 % des cas | 50 % des cas | 75 % des cas | 95 % des cas | 100 % des cas | Médiane (fourchette) |
||
| Moins de 2 | 15 (11 %) | 3 minutes | 6 minutes | 40 minutes | 3 heures | 3 heures | 6 minutes (de 1 minute à 3 heures |
| de 2 à moins de 7 | 20 (15 %) | 5 minutes | 13 minutes | 32 minutes | 25 heures | 48 heures | 13 minutes (de 1 minute à 48 heures) |
| de 7 à moins de 18 | 30 (22 %) | 5 minutes | 15 minutes | 30 minutes | 60 minutes | 2 heures | 15 minutes (de 1 minute à 2 heures) |
| de 18 à moins de 50 | 46 (34 %) | 7 minutes | 15 minutes | 30 minutes | 6 heures | 19 heures | 15 minutes (de 1 minute à 19 heures) |
| de 50 à moins de 65 | 16 (12 %) | 17 minutes | 45 minutes | 7 heures | 48 heures | 48 heures | 45 minutes (de 1 minute à 48 heures) |
| 65 et plus | 9 (7 %) | 6 minutes | 18 minutes | 25 minutes | 2 heures | 2 heures | 18 minutes (de 5 minutes à 2 heures) |
| Tous les âges | 136 | 5 minutes | 15 minutes | 31 minutes | 7 heures | 48 heures | 15 minutes (de 1 minute à 48 heures) |
III.2 Syncope et convulsions
Comme les convulsions peuvent être secondaires à une syncope, les deux résultats sont examinés ensemble dans cette section.
Revue rapide de la littérature
Délai avant l'apparition des symptômes de syncope ou de convulsions
Au total, 8 articles (7 études de séries de cas rétrospectives Note de bas de page 19 Note de bas de page 21 Note de bas de page 29 Note de bas de page 30 Note de bas de page 31 Note de bas de page 32 Note de bas de page 33, 1 étude de casNote de bas de page 34) ont été désignés dans la revue rapide comme fournissant des données sur les résultats de la syncope ou des convulsions résultant de l'administration du vaccin. Les études de séries de cas rétrospectives ont toutes utilisé les systèmes de surveillance des ESSI pour évaluer les cas de syncope et de convulsions chez les personnes vaccinées. Dans les 8 articles qui ont repéré des cas de syncope ou de convulsions, il y a eu 1 180 cas signalés de syncope seule (c.-à-d. non associée à un signalement de convulsions), 199 cas signalés de convulsions associées à une syncope (« convulsions avec syncope ») et 16 cas signalés de convulsions seules (soit afébriles, soit fébriles) pour un total de 1 395 cas signalés. Sur les 1 395 cas, 103 (7 %) ont été considérés comme étant graves (97 syncopes seules, 1 cas de convulsions avec syncope et 5 cas de convulsions fébriles).
Sur les 1 180 cas signalés de syncope seule, 453 (38 %) indiquaient le délai d'apparition des symptômes. La fourchette des délais d'apparition des symptômes variait de 5 minutes à 2 jours. Cependant, 340 (75 %) des cas signalés de syncope avec un délai d'apparition des symptômes enregistré sont survenus dans les 15 premières minutes suivant la vaccination. Au total, 24 (5 %) de ces cas signalés provenaient de quatre études Note de bas de page 19 Note de bas de page 21 Note de bas de page 31 Note de bas de page 32 utilisant des données tirées d'études de séries de cas rétrospectives : 15 (63 %) cas présentaient une apparition dans les 0 à 5 minutes suivant la vaccination et 1 (4 %) cas présentait une apparition dans les 10 à 15 minutes. Le délai d'apparition des 8 cas restants n'a pas été fourni dans les mêmes intervalles de 5 minutes : 4 (17 %) sont apparus dans les 10 minutes suivant la vaccination et 4 (17 %) dans les 15 minutes suivant la vaccination.
Parmi les études désignées, une cinquième étudeNote de bas de page 29 utilisant également des données issues d'études de séries de cas rétrospectives a fourni le plus grand nombre d'études de cas de syncope avec apparition de symptômes dans les 15 premières minutes suivant la vaccination. Cette étude de Braun et al. évaluait les cas de syncope survenant dans les 12 heures suivant la vaccination et signalés au VAERS et les cas signalés de blessures pour des chutes liées à la syncope, tirés du programme d'indemnisation en cas de préjudice vaccinal des É.-U. chez des personnes de tout âge entre 1990 et octobre 1995. Sur les 571 cas signalés qui indiquaient un délai avant l'apparition des symptômes (81,9 % du total des cas), 323 (63,2 %) sont survenus dans les 5 minutes suivant la vaccination, passant à 416 (81,4 %) dans les 10 minutes, et 454 (88,8 %) dans les 15 minutes suivant la vaccination. Sur les 454 épisodes de syncope, 153 étaient accompagnés de « crises tonico-cloniques » (« convulsions avec syncope ») : 138 (30,4 %) survenant dans les 15 minutes suivant la vaccination et 15 (12,8 %) plus de 15 minutes après la vaccination. Il est à noter que 67 (9,6 %) cas ont fait l'objet d'une hospitalisation ultérieure. Six personnes ont subi des blessures à la tête après des chutes provoquées par une syncope, qui comprenaient des fractures du crâne, des contusions cérébrales, des hématomes cérébraux et un cas d'hémorragie cérébrale majeure. Trois de ces blessures ont nécessité une neurochirurgie pour soulager un gonflement ou une hémorragie cérébrale et deux personnes présentaient encore des déficits neurologiques importants jusqu'à deux ans après les incidents. Ces six blessures à la tête sont toutes attribuables à des épisodes de syncope survenus dans les 15 minutes suivant la vaccination.
Dans l'étude de Sutherland et al., 10 blessures secondaires ont été enregistrées parmi les 26 cas de syncope graves : des blessures à la tête après une chute attribuable à la syncope (n=9), dont le décès d'un garçon de 15 ans en raison d'une hémorragie intracrânienne, et un incident de véhicule à moteur après une perte de conscience au volant (n=1). Au total, 7 (70 %) des blessures sont survenues dans les 15 minutes suivant la vaccination Note de bas de page 32.
Une description du délai d'apparition des symptômes était disponible pour 154 (77 %) des 199 cas signalés de convulsions associées à des épisodes de syncope (« convulsions avec syncope ») et pour les 16 (100 %) cas de convulsions seules. Deux articles ont fourni les données sur les convulsions avec syncope après l'administration du vaccin Note de bas de page 29 Note de bas de page 31. Braun et al.Note de bas de page 29 ont rapporté 153 cas signalés de syncope avec des « crises tonico-cloniques » connexes : 138 (90,2 %) sont survenus dans les 15 minutes suivant la vaccination et 15 (9,8 %) plus de 15 minutes après la vaccination. Le cas restant, signalé dans la deuxième étude, s'est produit 0 minute après la vaccination (c.-à-d. immédiatement)Note de bas de page 31. Les 16 cas de convulsions ont été repérés dans deux études Note de bas de page 30 Note de bas de page 19. Crawford et al. ont analysé les renseignements cliniques détaillés sur les cas signalés, par le SAEFVIC, de syncope et de convulsions après administration du vaccin quadrivalent contre le VPH chez des femmes de 12 à 26 ans vaccinées dans le cadre du programme national australien de vaccination contre le VPH de mai 2007 à avril 2009 Note de bas de page 30. L'étude a désigné 31 épisodes de syncope avec convulsions connexes, mais le délai avant l'apparition des convulsions n'a été signalé que pour 3 cas de convulsions afébriles, tous survenus chez des personnes dont l'épilepsie sous-jacente a été confirmée. Aucun décès n'a été signalé dans la population étudiée, mais 7 blessures ont été déclarées : des blessures à la tête (n=5), des saignements de bouche (n=1) et une fracture des vertèbres T5/T6 (n=1). L'étude de Milstien et al. Note de bas de page 19 a permis de repérer 13 cas signalés répondant à la définition de cas de la Food and Drug Administration (FDA) des É.-U. pour des convulsions potentiellement associées à un vaccin, 4 cas de convulsions afébriles et 9 cas de convulsions fébriles. Le délai d'apparition des convulsions afébriles était de 30 minutes, 2 heures, 24 heures et 2 jours après la vaccination.
Estimations de l'incidence des syncopes ou des convulsions fondées sur la littérature
Trois études de séries de cas rétrospectives ont eu accès aux données sur le nombre de doses de vaccin distribuées ou administrées pendant la période de l'étude, permettant de calculer des estimations globales, ou propres au vaccin, de l'incidence des syncopes ou des convulsions pendant la période de l'étude Note de bas de page 30 Note de bas de page 31 Note de bas de page 32.
Dans une analyse des cas signalés, par le SAEFVIC, de syncope et de convulsions après administration du vaccin quadrivalent contre le VPH dans le cadre du programme national australien de vaccination contre le VPH, Crawford et al. ont estimé une incidence de 7,8 et 2,6 pour 100 000 doses de vaccin distribuées, pour la syncope et les convulsions respectivementNote de bas de page 30. Subelj et al. ont estimé l'incidence de la syncope et des convulsions associées à la syncope à 13,4 et 3,4 pour 100 000 doses, respectivement, en se basant sur les données recueillies pendant quatre ans dans le cadre des rapports obligatoires à l'Institut national de la santé publique d'un programme d'administration du vaccin quadrivalent contre le VPH (VPH4) en milieu scolaire ciblant les filles de 11 à 14 ans en Slovénie Note de bas de page 31. Sutherland et al. ont évalué les cas signalés de « syncope » ou de « syncope vasovagale » survenant chez des individus âgés de ≥5 ans le même jour que la vaccination, soumis au système de surveillance VAERS entre le 1er janvier 2005 et le 31 juillet 2007, et ont comparé les taux de syncope au taux de cas signalés au VAERS entre 2002 et 2004 Note de bas de page 32. Le taux de cas de syncope pour 1 000 000 de doses de vaccin distribuées aux É.-U. au cours des périodes d'étude respectives a augmenté en 2005-2006 (0,31-0,54) par rapport à 2002-2004 (0,28-0,35), tout comme la proportion de cas signalés chez des femmes (77,5 % contre 61,6 %) et chez des personnes âgées de 11 à 18 ans (62,0 % contre 47,3 %).
Système canadien de surveillance des effets secondaires suivant l'immunisation
Délai avant l'apparition des symptômes de syncope ou de convulsions
Sur les 52 cas signalés de syncope, 20 (38 %) ont été classés comme étant graves. Les personnes âgées de 7 ans à moins de 18 ans (n=33, 65 %) et de 18 ans à moins de 50 ans (n=8, 16 %) représentaient la majorité des 52 cas. Il y a eu très peu de cas signalés d'ESSI dans chacun des groupes d'âge restants (N est compris entre 2 et 4 pour chacun).
| Groupe d'âge (ans) | Nombre de cas (%) | Pourcentage de cas signalés selon le délai d'apparition des symptômes | |||||
|---|---|---|---|---|---|---|---|
| 25 % des cas | 50 % des cas | 75 % des cas | 95 % des cas | 100 % des cas | Médiane (fourchette) |
||
| Moins de 2 | 2 (4 %) | 5 jours | 12 jours | 18 jours | 18 jours | 18 jours | 12 jours (5 à 18 jours) |
| de 2 à moins de 7 | 2 (4 %) | 4 minutes | 7 minutes | 10 minutes | 10 minutes | 10 minutes | 7 minutes (4 à 10 minutes) |
| de 7 à moins de 18 | 33 (65 %) | 1 minute | 2 minutes | 6 minutes | 20 minutes | 35 minutes | 2 minutes (1 à 35 minutes) |
| de 18 à moins de 50 | 8 (16 %) | 2 minutes | 63 minutes | 48 heures | 29 jours | 29 jours | 63 minutes (1 minute à 29 jours) |
| de 50 à moins de 65 | 2 (4 %) | 1 minute | 31 minutes | 60 minutes | 60 minutes | 60 minutes | 31 minutes (1 à 60 minutes) |
| 65 et plus | 4 (8 %) | 2 heures | 11 heures | 33 heures | 48 heures | 48 heures | 11 heures (de 1 minute à 48 heures) |
| Tous les âges | 52 | 1 minute | 3 minutes | 15 minutes | 5 jours | 29 jours | 3 minutes (1 minute à 29 jours) |
Pour tous les âges combinés, 25 % des cas de syncope signalés sont apparus dans la minute suivant la vaccination, ce chiffre passant à 50 % des cas signalés dans les 3 minutes après la vaccination et à 75 % dans les 15 minutes, avec un délai médian global de 3 minutes avant l'apparition des symptômes (fourchette : de 1 minute à 29 jours) (Tableau 2). Les proportions étaient similaires pour les cas de syncope classés comme étant graves (données non présentées).
Il y a eu 61 cas signalés de convulsions afébriles entre 2014 et 2018, dont 50 (82 %) ont été classés comme étant graves. La majorité (74 %) des cas concernaient des personnes de moins de 2 ans. Il y a eu très peu de cas signalés d'ESSI dans les autres groupes d'âge. Pour tous les âges combinés, le délai médian avant l'apparition des convulsions afébriles était de 21 heures (fourchette : 1 minute à 29 jours). Ce n'est que pour le groupe d'individus âgés de 7 ans à moins de 18 ans qu'une proportion significative (25 %) des convulsions afébriles a été signalée dans les 2 minutes suivant la vaccination, sur la base d'un petit nombre de cas signalés (n=8).
III.3. Évaluation risques-avantages
La raison pour laquelle on pourrait envisager une réduction de la période d'observation post-vaccinale dans les centres de vaccination antigrippale pendant la pandémie de COVID-19 est de raccourcir le temps que les personnes vaccinées passent avec d'autres personnes dans les aires post-vaccination et de réduire potentiellement le nombre de contacts des personnes vaccinées dans les centres de vaccination. Cela pourrait alors réduire le risque de transmission du SRAS-CoV-2 à partir d'un cas de COVID-19 infectieux non reconnu et permettre de vacciner plus de personnes (augmenter le « débit » des cliniques de vaccination) dans un laps de temps donné. Toutefois, il est très difficile de quantifier l'impact d'une réduction de la période d'observation post-vaccinale sur le risque de transmission du SRAS-CoV-2, indépendamment des autres mesures de santé publique et de prévention et de contrôle des infections (contrôles techniques, environnementaux et administratifs, et équipement de protection individuelle) qui seront probablement mises en œuvre dans les centres de vaccination antigrippale pendant la pandémie de COVID-19. En outre, on notera des différences dans le risque de transmission, compte tenu de la variabilité de la prévalence de la maladie selon l'endroit et le moment. Toute considération de réduction de la période d'observation post-vaccinale serait un écart par rapport à la pratique standard actuelle dans les provinces et territoires canadiens. La norme actuelle fixant une période d'observation de 15 minutes après la vaccination vise à repérer les cas graves d'ESSI qui peuvent nécessiter une intervention médicale immédiate. Il convient d'évaluer ces éventualités par rapport aux avantages potentiels de la réduction du risque de transmission du SRAS-CoV-2 et de la possibilité de vacciner un plus grand nombre d'individus (augmenter le « débit » des cliniques de vaccination) dans une période donnée.
Avantages potentiels d'une période d'observation post-vaccinale réduite
- La réduction de l'encombrement dans les salles d'attente après la vaccination dans les cliniques de vaccination améliorera la probabilité de maintenir un éloignement physique entre les personnes vaccinées et entre les personnes vaccinées et le personnel de la clinique.
- La réduction de l'attente après la vaccination peut encourager les membres du public à se rendre dans les cliniques de vaccination si le risque d'infection par la COVID-19 est perçu comme étant moindre en raison de la diminution de l'encombrement dans les cliniques de vaccination et si le temps nécessaire pour se faire vacciner est globalement plus court. La perception d'un risque réduit d'infection sera renforcée par les autres mesures de prévention et de contrôle des infections prises dans le cadre de la COVID-19 qui réduiront également l'encombrement dans les cliniques de vaccination (p. ex., les rendez-vous de vaccination prévus, l'arrivée juste à l'heure aux rendez-vous, le dépistage du personnel et des personnes présentes).
- Un nombre réduit de personnes se trouvant dans les salles d'attente après la vaccination bénéficierait aux personnes vaccinées qui ne répondent pas aux critères d'une période d'observation post-vaccinale réduite, et qui peuvent rester sur place pendant la période d'observation standard de 15 minutes ou une période d'observation de 30 minutes s'il existe une préoccupation particulière concernant une éventuelle allergie au vaccin.
- Une période d'observation post-vaccinale réduite peut permettre de vacciner plus d'individus (augmenter le « débit » des cliniques de vaccination) dans une période donnée et permettre également aux personnes vaccinées d'être en contact avec moins d'individus.
Risques potentiels d'une période d'observation post-vaccinale réduite
- Il y aurait un risque faible mais potentiellement accru de désignation tardive d'ÉI pouvant nécessiter une intervention médicale immédiate (p. ex., anaphylaxie et syncope avec ou sans convulsions).
- La réduction de la période d'observation post-vaccinale pourrait n'avoir qu'un impact indépendant relativement modeste sur la réduction du risque de transmission du SRAS-CoV-2 dans les cliniques de vaccination pendant la pandémie de COVID-19, par rapport aux autres mesures de santé publique et de prévention et de contrôle des infections (p. ex., contrôles environnementaux et techniques, procédures administratives, équipement de protection individuelle). Le risque global dépendra également de facteurs tels que la prévalence locale de la maladie dans les cliniques de vaccination.
- La réduction de la période d'observation post-vaccinale peut être perçue comme étant une mesure prise principalement pour améliorer l'efficacité des cliniques plutôt que comme étant une mesure importante de prévention des infections.
IV. Recommandations
Après une revue approfondie des données probantes résumées ci-dessus, le CCNI a formulé deux recommandations pour la prise de décisions concernant les programmes de santé publique. Ces recommandations sont fondées sur les preuves scientifiques et les avis d'experts actuellement disponibles et ne sont pertinentes que pendant la pandémie de COVID-19, après quoi il conviendra de suivre les orientations actuelles pour la période d'observation post-vaccinale, telles qu'elles sont définies dans la partie 2 du GCI Note de bas de page 4.
Dans l'examen de ces recommandations et aux fins de la mise en œuvre des programmes financés par des fonds publics, les provinces et territoires peuvent tenir compte de facteurs économiques et d'autres facteurs opérationnels locaux (p. ex., programmes de vaccination en cours, ressources). Reconnaissant qu'il existe des différences dans les contextes opérationnels au Canada, il est conseillé aux administrations de se référer à l'épidémiologie locale de la COVID-19 et aux directives supplémentaires de l'ASPC Note de bas de page 3 pour déterminer les bienfaits relatifs de la modification de la période d'observation post-vaccinale. Le CCNI continuera de suivre les ouvrages scientifiques pour connaître les avancées liées à la période d'observation post-vaccinale et mettra à jour ses recommandations au fur et à mesure de l'évolution des données probantes, si nécessaire.
Veuillez noter :
- Une recommandation forte s'applique à la plupart des populations/personnes et doit être suivie à moins qu'il n'existe une justification claire et convaincante d'utiliser une autre approche.
- Une recommandation discrétionnaire peut être envisagée pour certaines populations/personnes dans certaines circonstances. D'autres approches peuvent être acceptables.
Voir le Tableau 3 pour obtenir une explication de la force des recommandations du CCNI et de la catégorie de l'ensemble des données probantes.
IV.1 Recommandations relatives au processus décisionnel à l'échelle des programmes de santé publique
- Le CCNI recommande que la période d'observation post-vaccinale actuelle, telle que précisée dans le Guide canadien d'immunisationRéférence a, soit maintenue pour les établissements de vaccination antigrippale qui peuvent respecter les mesures adéquatesRéférence b de santé publique et de prévention et de contrôle des infections pour réduire la transmission du SRAS-CoV-2, en particulier l'éloignement physique (forte recommandation du CCNI).
- Le CCNI conclut qu'il existe des données probantes suffisantes pour maintenir une période d'observation de 15 minutes après la vaccination pendant la pandémie de COVID-19 pour les personnes n'ayant pas d'antécédents connus de réactions allergiques graves (y compris l'anaphylaxie) à l'un des composants du vaccin antigrippal dont l'administration est envisagée, ou d'antécédents d'autres réactions immédiates après la vaccination (p. ex., syncope avec ou sans convulsions) (données probantes de catégorie B).
Données probantes et justification
- Une période d'observation post-vaccinale de 15 minutes est la norme canadienne pour les personnes n'ayant pas d'antécédents connus de réaction allergique grave ou toute autre réaction immédiate après la vaccination.
- Il est peu probable qu'un établissement de vaccination capable de maintenir les mesures recommandées de santé publique et de prévention et de contrôle des infections, y compris l'éloignement physique dans les aires post-vaccination, parvienne à réduire davantage le risque de transmission du SRAS-CoV-2 en mettant en place une période d'observation post-vaccinale plus courte.
- Le CCNI recommande qu'une période d'observation post-vaccinale plus courte, entre 5 et 15 minutes après la vaccination contre la grippe, puisse être envisagée pendant la pandémie de COVID-19, mais seulement pendant les périodes où un éloignement physique adéquat dans les salles d'attente après la vaccination ne peut être maintenu en raison du volume de personnes qui demandent à être vaccinées, et seulement lorsque des conditions particulières sont rempliesRéférence * (recommandation discrétionnaire du CCNI).
- Le CCNI conclut qu'il n'y a pas suffisamment de données probantes provenant de rapports issus d'études de séries de cas rétrospectives et passives sur les effets secondaires suivant l'immunisation (ESSI) pour justifier une période d'observation post-vaccinale réduite. Toutefois, d'autres facteurs peuvent être pris en considération pour justifier une période d'observation post-vaccinale réduite, si cela se révèle nécessaire à des fins de santé publique et de prévention et de contrôle des infections (données probantes de catégorie I).
Notes de fin *
- Note de fin *
-
Une période d'observation plus courte ne peut être envisagée que si la personne ayant reçu le vaccin remplit les conditions suivantes Référence c :
- Antécédents d'administration du vaccin antigrippal et absence d'antécédents connus de réactions allergiques graves (y compris l'anaphylaxie) à l'un des composants du vaccin antigrippal dont l'administration est envisagée (il convient de noter que les personnes ayant reçu un vaccin de nouvelle technologie ne devraient pas pouvoir faire l'objet de la période d'observation post-vaccinale réduite) Référence d.
- Aucun antécédent d'autres réactions post-vaccinales immédiates (p. ex., syncope avec ou sans convulsions) après réception d'un vaccin.
- La personne vaccinée est accompagnée d'un parent ou tuteur (dans le cas d'un enfant) ou d'un adulte responsable qui fera office de chaperon pour surveiller la personne vaccinée pendant au moins 15 minutes après la vaccination. Dans le cas de deux adultes responsables, les deux peuvent être vaccinés aux fins de ce critère, si tous deux acceptent de se surveiller mutuellement après la vaccination.
- La personne ayant reçu le vaccin ne doit pas conduire de véhicule motorisé ou de moyen de transport à roues motorisé ou non (p. ex., bicyclette, planche à roulettes, patins à roues alignées, scooter), ni de machine pendant au moins 15 minutes après la vaccination.
- La personne vaccinée et le parent/tuteur ou l'accompagnateur adulte responsable savent quand et comment demander des conseils post-vaccination et reçoivent des instructions sur ce qu'il faut faire si une assistance et des services médicaux sont nécessaires.
- La personne vaccinée et le parent/tuteur ou l'adulte responsable s'engagent à rester dans la salle d'attente après la vaccination pendant la période d'observation post-vaccinale réduite et à informer le personnel si la personne se sent ou semble mal avant de quitter la clinique. Ils devraient être informés qu'une personne présentant tout symptôme laissant penser à une évolution des ESSI à la fin de la période d'observation post-vaccinale raccourcie nécessite une période d'observation plus longue en clinique.
Données probantes et justification
- Des mesures de santé publique et de prévention et de contrôle des infections (c.-à-d. contrôles techniques, environnementaux et administratifs, et équipement de protection individuelle) doivent être mises en œuvre pour réduire le risque de transmission du SRAS-CoV-2.
- Avant de réduire la période d'observation post-vaccinale, il faut évaluer le risque potentiel de tout retard dans la détermination d'ÉIG pouvant nécessiter une intervention médicale immédiate par rapport aux avantages potentiels de la réduction des contacts avec autrui et du risque connexe de transmission du SRAS-CoV-2; et la possibilité de vacciner un plus grand nombre de personnes au cours d'une période donnée. Il est reconnu que plusieurs facteurs peuvent influencer la prise de décision et l'applicabilité des recommandations :
- Les niveaux de transmission du SRAS-CoV-2 dans la collectivité au moment de la vaccination en clinique influenceront le risque de transmission du SRAS-CoV-2 dans les établissements de vaccination. Ce risque variera au fil du temps selon les administrations et au sein de celles-ci.
- Une augmentation imprévue ou sans précédent du nombre de personnes se présentant pour une vaccination en milieu clinique à un moment donné pourrait temporairement submerger les autres mesures de santé publique et de prévention des infections en place.
- On ignore dans quelle mesure une période d'observation post-vaccinale réduite, indépendante des autres mesures de santé publique et de prévention et de contrôle des infections, contribue à réduire le risque de transmission du SRAS-CoV-2 dans les établissements de vaccination.
- Les données probantes issues d'études de séries de cas rétrospectives et passives sur les ESSI sont insuffisantes pour justifier la réduction de la période d'observation post-vaccinale.
- Les estimations globales de l'incidence de l'anaphylaxie d'après les données des études de séries de cas rétrospectives provenant des systèmes de surveillance passive des ESSI variaient, mais étaient conformes aux estimations de l'incidence de l'anaphylaxie pour les vaccins couramment administrés (de 1 pour 100 000 à 1 pour 1 000 000 de doses) citées par la World Allergy Organization dans son Consensus international sur les réactions allergiques aux vaccins Note de bas de page 35.
- Les estimations de l'incidence de la syncope, fondées sur les données d'études de série de cas passives, varient considérablement, mais sont toujours beaucoup plus élevées que pour l'anaphylaxie.
- Les données issues de la revue rapide indiquent qu'une période d'observation post-vaccinale raccourcie peut encore repérer une majorité d'épisodes de syncope, mais pas la majorité des épisodes d'anaphylaxie.
- L'étude de Braun et al. Note de bas de page 29, qui a évalué le plus grand nombre de cas signalés de syncope, a découvert que 63,2 % se produisaient dans les 5 minutes suivant la vaccination, passant à 416 (81,4 %) dans les 10 minutes, et 454 (88,8 %) dans les 15 minutes suivant la vaccination. D'après les données du SCSESSI, pour tous les âges combinés, 25 % des cas de syncope signalés sont apparus dans la minute suivant la vaccination, ce chiffre passant à 50 % des cas signalés dans les 3 minutes après la vaccination et à 75 % dans les 15 minutes, avec un délai médian global de 3 minutes avant l'apparition des symptômes (fourchette : de 1 minute à 29 jours).
- Un peu plus de la moitié de tous les cas signalés d'anaphylaxie présentant un délai d'apparition enregistré des symptômes sont survenus dans les 30 minutes suivant la vaccination, mais la proportion de ces cas survenant dans les 15 premières minutes après la vaccination n'a pas été signalée. Dans l'étude de série de cas contenant le plus grand nombre de cas signalés d'anaphylaxie, le délai médian avant l'apparition de l'anaphylaxie après la vaccination était de 20 minutes (fourchette : de <1 à 24 heures). D'après les rapports du SCSESSI, pour tous les âges combinés, 25 % des cas d'anaphylaxie signalés sont apparus dans les 5 minutes suivant la vaccination, ce chiffre passant à 50 % des cas signalés 15 minutes après la vaccination, avec un délai médian global de 15 minutes avant l'apparition des symptômes (fourchette : de 1 minute à 48 heures). Des tendances similaires ont été constatées pour les cas signalés d'anaphylaxie classés comme étant graves.
- Le recours à une période d'observation post-vaccinale raccourcie devrait s'accompagner de mesures de protection, comme indiqué dans la recommandation, afin de réduire au minimum les situations qui exposeraient la personne vaccinée à un risque de blessure involontaire si des ÉI survenaient après la période d'observation raccourcie, mais dans les 15 minutes que compte la période d'observation post-vaccinale normale.
Tableaux et figures
| FORCE DE LA RECOMMANDATION DU CCNI | CATÉGORIE DES DONNÉES PROBANTES |
|---|---|
| D'après les facteurs ne se limitant pas à la force des données probantes (p. ex., besoins en matière de santé publique) | D'après l'évaluation de l'ensemble des données probantes |
Forte « devrait/ne devrait pas être réalisée »
|
A - Bonnes données probantes pour recommander l'immunisation |
B - Données probantes passables pour recommander l'immunisation |
|
C - Données probantes contradictoires; toutefois, d'autres facteurs peuvent influer sur la prise de décision |
|
D - Données probantes passables pour déconseiller l'immunisation |
|
E - Bonnes données probantes pour déconseiller l'immunisation |
|
I - Données probantes insuffisantes (en qualité ou en quantité); toutefois, d'autres facteurs peuvent influer sur la prise de décision |
|
Discrétionnaire « peut être considéré »
|
A -Bonnes données probantes pour recommander l'immunisation |
B - Données probantes passables pour recommander l'immunisation |
|
C - Données probantes contradictoires; toutefois, d'autres facteurs peuvent influer sur la prise de décision |
|
D - Données probantes passables pour déconseiller l'immunisation |
|
E - Bonnes données probantes pour déconseiller l'immunisation |
|
I - Données probantes insuffisantes (en qualité ou en quantité); toutefois, d'autres facteurs peuvent influer sur la prise de décision |
| Niveau | Description |
|---|---|
| I | Données probantes provenant d'un ou de plusieurs essais contrôlés randomisés |
| II-1 | Données probantes provenant d'un ou de plusieurs essais contrôlés sans randomisation |
| II-2 | Données probantes obtenues dans le cadre d'études analytiques de cohortes ou cas-témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité potentielle du vaccin |
| II-3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes |
| III | Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d'experts |
| Cote de qualité | Description |
|---|---|
| Bonne | Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieNote de bas de page *. |
| Passable | Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins un des critères relatifs à la méthodologie, mais ne comportant aucune « lacune fatale » connue. |
| Mauvaise | Une étude (y compris les méta-analyses ou les examens systématiques) ayant au moins une « lacune fatale » propre à la méthodologie ou une accumulation de lacunes moins importantes ne permettant pas de formuler des recommandations à partir des résultats de l'étude. |
Tableau 5 : Notes de tableau
|
|
| Étude | Vaccin | Plan de l'étude | Participants | Sommaire des principaux résultats | Niveau des données proban-tes | Qualité |
|---|---|---|---|---|---|---|
| Étude de série de cas | ||||||
Baxter et al., 2018 |
Tout vaccin |
Étude de série de cas Australie Système de surveillance passive du SAEFVIC De juillet 2007 à juin 2015 |
Enfants de moins de 5 ans. |
Anaphylaxie L'incidence de l'anaphylaxie s'est révélée à 0,13 pour 100 000 doses de vaccin. L'intervalle entre la dose de vaccin et l'apparition de l'anaphylaxie variait de 0 à 40 minutes (n=12), avec une moyenne de 7,5 minutes et une médiane de 5 minutes. Au total, 10 cas (83 %) ont développé des symptômes d'anaphylaxie dans les 5 minutes, 2 cas (17 %) ont eu une apparition tardive des symptômes, l'un à 20 minutes et l'autre à 40 minutes après l'administration du vaccin. Dans la majorité des cas (68 %), plusieurs vaccins ont été administrés avant l'apparition de l'anaphylaxie. |
III |
Mauvaise |
Bohlke et al., 2003 |
Tout vaccin |
Étude de série de cas É.-U. De 1991 à 1997 |
Enfants de 17 ans ou moins inscrits dans l'une des quatre organisations de soins intégrés de la santé participant au projet américain Vaccine Safety Datalink du CDC |
Anaphylaxie Au total, 5 cas d'anaphylaxie potentiellement associés au vaccin ont été repérés après l'administration de 7 644 049 doses de vaccin. L'incidence de l'anaphylaxie était de 0,65 cas pour 1 000 000 de doses (IC à 95 % : 0,21 à 1,53). Aucun des épisodes n'a été mortel. Parmi les 5 cas désignés, 1 (20 %) s'est produit dans les 5 à 10 minutes suivant l'administration du vaccin et les 4 autres (80 %) se sont produits plus d'une heure après l'administration. Sur les 5 cas, un seul cas de réaction anaphylactique s'est produit à la suite de l'administration d'un seul vaccin (vaccin contre la rougeole, la rubéole et les oreillons [RRO]). |
III |
Mauvaise |
Braun et al., 1997 |
Tout vaccin |
Étude de série de cas É.-U. Système de surveillance passive du VAERS De 1990 à 1995 |
Tous les enfants et adultes (aucune restriction d'âge) |
Syncope Au total, 697 épisodes de syncope ont été signalés, survenus dans les 12 heures suivant l'administration du vaccin. Une hospitalisation a été signalée dans 9,6 % des cas. Sur les 571 (73,3 %) cas de syncope dont le moment d'apparition est connu, 511 (89,5 %) sont survenus 1 heure ou moins après la vaccination. Parmi ces cas, 323 (63,2 %) sont survenus dans les 5 minutes ou moins, 93 (18,2 %) dans les 10 minutes et 38 (7,4 %) dans les 15 minutes suivant l'administration du vaccin. Six patients ont subi des fractures du crâne, une hémorragie cérébrale ou des contusions cérébrales après des chutes; trois d'entre eux ont dû subir une neurochirurgie. Toutes les chutes sont survenues 15 minutes ou moins après la vaccination, dans ou près de la clinique ou du bureau. |
III |
Mauvaise |
Brotherton et al., 2008 |
Vaccin |
Étude de série de cas Australie 2007 |
Femmes adultes et enfants de 12 à 26 ans qui ont reçu le vaccin contre le VPH4 dans le cadre du programme national australien de vaccination contre le VPH à l'école ou dans une clinique de soins primaires |
Anaphylaxie Au total, 12 cas d'anaphylaxie présumée ont été désignés. Sur les 11 cas qui ont donné leur consentement pour être inclus dans l'étude, 8 (73 %) répondaient à la définition de cas de Brighton pour l'anaphylaxie (niveau 1; n=1 et niveau 2; n=7). Tous les cas ont été signalés comme ayant débuté dans les 15 minutes suivant la vaccination; 4 (50 %) cas ont été enregistrés dans les 5 minutes et 3 (37,5 %) cas sont survenus entre 5 et 10 minutes après l'administration du vaccin. |
III |
Mauvaise |
Cheng et al., 2015 |
Tout vaccin |
Étude de série de cas Australie Système de surveillance passive du SAEFVIC De mai 2007 à mai 2013 |
Enfants de moins de 18 ans |
Anaphylaxie Au total, 25 cas répondant aux critères de la Brighton Collaboration en matière d'anaphylaxie ont été déterminés. Parmi ces cas, 9 (26 %) ont atteint le niveau 1 de certitude du diagnostic, 15 (60 %) le niveau 2 et 1 le niveau 3 (4 %). Dans la majorité des cas, les symptômes sont apparus rapidement : 13 (52 %) cas sont apparus dans les 5 minutes, 18 (72 %) dans les 15 premières minutes et 20 (80 %) dans les 30 premières minutes suivant la vaccination. Dans l'ensemble, 20 % (5/25) des cas ont développé leurs premiers symptômes d'anaphylaxie ≥30 minutes après la vaccination. |
III |
Mauvaise |
Crawford et al., 2011 |
Vaccin |
Étude de série de cas |
Femmes et filles de 12 à 26 ans ayant reçu le vaccin contre le VPH4 dans le cadre du programme national australien de vaccination contre le VPH |
Syncope et convulsions L'incidence globale après la vaccination contre le VPH4 était de 7,8 pour 100 000 doses distribuées pour la syncope et de 2,6 pour 100 000 doses pour les convulsions associées à la syncope. Sur les 94 épisodes de syncope, 67 % (63/94) ont eu une syncope seule, et 33 % (31/94) ont eu des convulsions connexes, dont 23 % (7/31) avec une incontinence urinaire. Le vaccin VPH4 a été administré seul dans 85 % (82/97) des cas, et avec les vaccins concomitants suivants pour le reste : hépatite B (6); vaccin acellulaire diphtérie-tétanos-coqueluche (DTC) (6); varicelle (1); et vaccin contre la varicelle et l'hépatite B (2). Trois patientes ont été désignées comme ayant des convulsions afébriles sans syncope et toutes présentaient un trouble épileptique sous-jacent confirmé. Une patiente a eu des convulsions généralisées 4 heures après le vaccin VPH4 (dose 2). Une autre a eu une exacerbation des convulsions partielles complexes 4 heures après le vaccin VPH4 (dose 2). Une autre patiente a subi des convulsions tonico-cloniques généralisées 2 jours après avoir reçu le vaccin VPH4 (dose 1). Cela a entraîné un tassement cunéiforme de la colonne vertébrale, qui a été traitée de manière conservatrice. Un trouble épileptique généralisé a été confirmé, et des médicaments anticonvulsifs ont commencé à être administrés. |
III |
Mauvaise |
Johann-Liang et al., 2011 |
Tout vaccin |
Étude de série de cas É.-U. Vaccine Injury Compensation Program (VICP) De janvier 2000 à décembre 2009 |
Adultes et enfants de tous âges |
Anaphylaxie Au total, 53 cas uniques affirmant une « anaphylaxie ou un choc anaphylactique » ont été déterminés dans le cadre du VICP, ce qui représente 3 % du total des 1 819 demandes d'indemnisation sans lien avec l'autisme pour la période étudiée. Parmi ces cas, 9 (17 %) ont été définis comme une anaphylaxie. Un cas s'est produit entre quelques minutes et 1 heure, 2 cas sont survenus dans les 5 minutes, 1 cas est apparu à 15 minutes, 2 cas sont survenus entre 20 et 30 minutes et 3 cas sont survenus plus d'une heure après l'administration du vaccin (1 cas à 1 heure, 1 cas à 2 heures et 1 cas à 2 ou 3 heures). |
III |
Mauvaise |
McNeil et al., 2016 |
Tout vaccin |
Étude de série de cas É.-U. De janvier 2009 à décembre |
Adultes et enfants de tous âges inscrits à un plan de santé dans l'un des 9 sites participant au programme Vaccine Safety Datalink |
Anaphylaxie Au total, 76 cas d'anaphylaxie confirmés par les dossiers médicaux ont été désignés, répondant aux critères des niveaux 1 et 2 de la Brighton Collaboration. Parmi eux, 33 cas d'anaphylaxie [niveau 1 de la Brighton Collaboration (n=12; 36 %) et niveau 2 (n=21; 64 %)] ont été associés à la vaccination et 43 ont été attribués à d'autres causes. Au total, 29 cas (87,9 %) d'anaphylaxie ont été documentés : 8 cas (24 %) sont survenus dans les 30 minutes, 8 (24 %) entre 30 et 120 minutes, 10 (30 %) entre 2 et 4 heures et 3 cas (10 %) sont apparus entre 4 et 20 heures après l'administration du vaccin. Un seul cas présentait un délai de réaction particulier, c.-à-d. une réaction immédiate après l'administration de plusieurs vaccins. |
III |
Mauvaise |
Milstien et al., 1987 |
Vaccin anti-Hib |
Étude de série de cas É.-U. D'avril 1985 à mai 1986 |
Enfants de 18 à 23 mois à haut risque de maladie invasive attribuable à Hib et enfants de 2 à 5 ans qui ne sont pas à haut risque |
Anaphylaxie Deux cas de réactions de type anaphylactique ont été signalés. Un cas concernait un garçon de 3 ans qui est devenu pâle et hypotendu et a commencé à avoir une respiration sifflante 5 minutes après la vaccination. L'autre cas concernait un garçon de 4 ans qui a eu des nausées, est devenu pâle et a souffert de bradycardie; une cyanose péribuccale s'est développée 20 minutes après la vaccination. Les deux cas ont réagi rapidement à l'épinéphrine et à l'oxygène. Syncope Sept cas signalés de syncope ont été déterminés, dont trois mentionnant un traitement à l'épinéphrine ou au Benadryl. Tous les épisodes sauf trois sont survenus dans les 10 minutes suivant la vaccination (d'autres sont survenus à 30 minutes, 2 heures et 24 heures). Tous les épisodes concernaient des enfants âgés de 3 à 5 ans. Convulsions Au total, 13 patients dont les réactions correspondaient aux définitions de cas pour les convulsions ont été désignés : 4 pour des convulsions afébriles et 9 pour des convulsions fébriles. En outre, 5 patients souffrant de convulsions fébriles ont été hospitalisés. Toutes les réactions sont survenues plus de 2 heures après l'administration du vaccin, à l'exception d'un cas de convulsions afébriles qui s'est produit dans les 30 minutes. Le délai moyen d'apparition des convulsions fébriles après réception du vaccin était de 24 heures (médiane : 12 heures). Deux des enfants présentaient des antécédents de convulsions fébriles, et pour trois autres, des antécédents de convulsions fébriles avaient été détectés chez un frère, une sœur ou un parent. |
III |
Mauvaise |
Pahud et al., 2013 |
Vaccin antigrippal monovalent contre la souche H1N1 de 2009 |
Étude de série de cas É.-U. Système de surveillance passive du VAERS D'octobre 2009 à janvier 2010 |
Enfants de moins de 18 ans |
Anaphylaxie Au total, 3 928 cas signalés et 214 (5,4 %) classés comme présentant un état grave et non mortel. 109 cas ont été renvoyés pour une revue plus approfondie, dont 99 comportaient des renseignements cliniques complets. Sur les 99 cas, ils ont trouvé 15 réactions allergiques présumées. Les diagnostics signalés comprenaient l'anaphylaxie (n=5), la réaction d'hypersensibilité (n=3), l'œdème de Quincke (n=3), l'urticaire (n=3) et la réaction allergique (n=1). Une véritable anaphylaxie causée par un vaccin était présente dans 4 cas, de l'urticaire ou d'autres manifestations cutanées résultant d'une véritable réaction allergique dans 6 cas et une réaction allergique à un vaccin avec des symptômes respiratoires dans 2 cas. Deux cas ont été considérés comme étant des réactions d'anxiété et un cas a été considéré comme probablement attribuable à une infection virale indépendante. Tous les cas d'anaphylaxie ou de véritables réactions allergiques (n=12) sont survenus dans les 3 heures suivant la vaccination (médiane, 30 minutes; fourchette, 5 minutes - 3 heures). |
III |
Mauvaise |
Patja et al., 2000 |
Vaccin RRO |
Étude de série de cas Finlande Système de surveillance passive De 1982 à 1996 |
Adultes et enfants de tous âges |
Anaphylaxie 30 cas suspects d'anaphylaxie ont été déterminés, qui sont tous apparus dans les 20 minutes suivant la vaccination, à l'exception d'un cas qui a développé des symptômes plusieurs heures après la vaccination. Convulsions Au total, 52 personnes vaccinées ont déclaré des convulsions fébriles entre 12 heures et 15 jours après la vaccination. À l'exception de 3 enfants âgés de 3 à 6 ans, tous les cas signalés concernaient des enfants de moins de 3 ans. Des convulsions indéfinies ont été observées chez 4 enfants, entre 2 et 12 jours après la vaccination. |
III |
Mauvaise |
Schumacher et al., 2010 |
Tout vaccin |
Étude de série de cas Suisse Système de surveillance passive De 1991 à 2001 |
Adultes et enfants de tous âges |
Anaphylaxie Au total, 18 cas de réaction anaphylactique non mortelle ont été signalés. Deux sont survenus dans les minutes qui ont suivi la vaccination, 5 dans les 6 heures, 4 dans les 6 à 24 heures, et 7 après un intervalle de temps inconnu. Sur les 7 (3,6 %) cas d'ESSI graves qui ont été évalués comme étant très probablement ou certainement liés à la vaccination, on comptait 5 cas de réaction anaphylactique avec un délai d'apparition des symptômes allant de 1 minute à 1 heure après l'administration du vaccin. Un cas s'est produit plusieurs minutes après le vaccin combiné DTC), 1 cas après 1 minute après le vaccin combiné DTC, 1 cas après 5 minutes après le vaccin combiné DTC, 1 cas après 1 heure après le vaccin combiné DTC et 1 cas après la vaccination RRO sans information sur le moment de l'apparition des symptômes. |
III |
Mauvaise |
Su et al., 2019 |
Tout vaccin |
Étude de série de cas É.-U. Système de surveillance passive du VAERS De janvier 1990 à décembre |
Adultes et enfants de tous âges |
Anaphylaxie Au total, 828 cas signalés répondant à la définition de cas de Brighton ou comportant un diagnostic d'anaphylaxie posé par un médecin, et décrivant également les symptômes dans les 24 heures suivant la réception du vaccin. Parmi les cas présentant également le délai d'apparition des symptômes, 77 % ont décrit des symptômes moins de 2 heures après la vaccination, avec un délai médian d'apparition après la vaccination de 20 minutes (fourchette; de <1 minute à 24 heures). En outre, 402 (49 %) cas signalés présentaient un délai d'apparition des symptômes <30 minutes après la vaccination. Enfin, les auteurs ont déterminé 8 rapports de décès. Sur 7 cas présentant également le délai d'apparition des symptômes, 3 (43 %) cas sont survenus dans les 5 minutes et 4 (57 %) dans les 15 minutes suivant la vaccination. Les autres cas de décès ont eu lieu à 20 minutes, à 258 minutes ou le jour même de l'administration du vaccin. |
III |
Mauvaise |
Subelj et al., 2016 |
Vaccin |
Étude de série de cas Slovénie De septembre |
Filles de 11 à 14 ans qui ont reçu le vaccin contre le VPH4 dans le cadre d'un programme de vaccination en milieu scolaire |
Syncope Au total, 8 cas de syncope, représentant 3,8 % de tous les ESSI signalés, ont été désignés. L'incidence était de 13,4 pour 100 000 doses de vaccin contre le VPH4 distribuées. Deux épisodes de syncope ont été jugés graves. Un évènement est apparu immédiatement, et un autre s'est produit 5 minutes après l'administration du vaccin. Convulsions Deux cas de convulsions, représentant 0,9 % de tous les ESSI signalés, ont été désignés. L'incidence était de 3,4 pour 100 000 doses de vaccin contre le VPH4 distribuées. Un cas de convulsions a été jugé grave et a eu lieu immédiatement après l'administration du vaccin. |
III |
Mauvaise |
Sutherland et al., 2008 |
Tout vaccin |
Étude de série de cas É.-U. Système de surveillance passive du VAERS De janvier 2002 à décembre |
Adultes et enfants de 5 ans ou plus |
Syncope Au total, 26 (5,6 %) des 463 cas signalés de syncope post-vaccinale en 2005-2007 ont été codés comme étant graves, ce qui n'est pas très différent des 20 (9,9 %) cas graves signalés en 2002-2004. Parmi les 23 patients pour lesquels le moment de la vaccination et l'apparition de la syncope étaient indiqués, 12 (52,2 %) sont survenus dans les 5 minutes suivant la vaccination, et 16 (69,6 %) dans les 15 minutes. |
III |
Mauvaise |
Woo et al., 2005 |
Tout vaccin |
Étude de série de cas É.-U. Système de surveillance passive du VAERS De 2000 à 2005 |
Adultes et enfants de tous âges ayant subi une syncope/présyncope et une blessure accidentelle le jour de la vaccination |
Syncope Au total, 107 cas signalés de syncope/présyncope et de blessures involontaires le jour de la vaccination ont été désignés. Parmi les blessures signalées, 100 sont survenues dans les 20 minutes suivant la vaccination. Trois cas de blessures graves à la tête ont été signalés, dont un qui a été jugé mortel en raison d'une syncope vasovagale. Après la troisième dose du vaccin contre l'hépatite B, un garçon de 15 ans, sans antécédent d'effets indésirables ni problème médical, a subi une syncope vasovagale plusieurs minutes après la vaccination. Il est tombé en arrière et s'est cogné la tête, a perdu momentanément conscience, puis s'est plaint de douleurs à la poitrine et aux bras. Puis, il a apparemment eu des convulsions et fait un arrêt cardiopulmonaire. Un homme de 21 ans a fait une hémorragie intracérébrale après être tombé à la renverse sur le sol 3 minutes après avoir reçu le vaccin contre l'hépatite B, l'anatoxine tétanique et le vaccin contre la diphtérie. Il se serait rétabli sans séquelles. Une femme de 18 ans a été victime d'un accident de voiture mortel après s'être « évanouie au volant de sa voiture » environ 7 heures après avoir reçu le vaccin polysaccharidique contre le méningocoque; l'intervalle de 7 heures entre la vaccination et la collision rend peu probable une syncope vasovagale liée au vaccin. |
III |
Mauvaise |
Zafack et al., 2019 |
Tout vaccin |
Étude de série de cas Base de données du système de surveillance passive De janvier 1998 à décembre |
Au total, 5 600 enfants et adultes de tous âges recevant des doses supplémentaires de vaccins précédemment associés temporairement à des ESSI |
Anaphylaxie Sur les 5 600 personnes désignées qui avaient connu des ESSI, 18 patients ont eu une réaction anaphylactique, dont 14 (77,8 %) présentaient des renseignements concernant le délai d'apparition après la vaccination. Parmi les 18 patients ayant déclaré une anaphylaxie, 3 ont atteint le niveau 1 de certitude diagnostique de la Brighton Collaboration, 8 ont atteint le niveau 2, 6 ont atteint le niveau 3 et 1 n'a pas fourni de description des signes et symptômes. Parmi les 14 patients pour lesquels le délai d'apparition des symptômes a été fourni, 4 (28,6 %) ont connu des symptômes dans les 5 minutes, 9 (64,3 %) dans les 10 minutes et 10 (71,4 %) ont vu leurs symptômes apparaître dans les 30 minutes suivant l'administration du vaccin. |
III |
Mauvaise |
Études de cas |
||||||
Poddighe et al., 2014 |
Vaccin VPH2 |
Étude de cas d'un médecin Financement : |
Une jeune fille de 14 ans |
Syncope Une jeune fille de 14 ans a signalé des effets secondaires après la deuxième dose du vaccin bivalent contre le VPH. La patiente a ressenti un malaise général soudain et d'autres symptômes après l'administration du vaccin. Elle s'est évanouie environ 60 minutes après l'injection intramusculaire. La patiente n'avait pas de maladies ni d'affections physiques ou psychiatriques antérieures. Après une nouvelle évaluation dans les jours suivants, la patiente a été diagnostiquée avec un syndrome neuropsychiatrique. |
III |
Mauvaise |
Stone et al., 2019 |
RRO, Varicelle, et vaccin DCaT-VPI |
Étude de cas d'un médecin Financement : |
Un garçon de 5 ans avec des antécédents d'allergie à l'alphagal |
Anaphylaxie Cinq minutes après avoir reçu les vaccins, l'enfant de 5 ans a développé un essoufflement, une respiration sifflante, une urticaire diffuse et un œdème de Quincke du visage et de l'oropharynx, ce qui a provoqué une visite au service des urgences où il a reçu de l'épinéphrine, de la diphénhydramine, de la prednisone et de la famotidine, avec un soulagement des symptômes en 10 minutes. Il n'avait pas d'antécédents d'allergies aux œufs, au latex, aux produits laitiers ou à la gélatine et avait reçu sans incident toutes les vaccinations infantiles antérieures. |
III |
Mauvaise |
Stone et al., 2017 |
Vaccin vivant atténué contre le zona |
Étude de cas d'un médecin Financement : |
Une femme de 71 ans avec des antécédents documentés d'allergie à la viande rouge |
Anaphylaxie Une femme de 71 ans ayant des allergies avérées à la viande rouge a dû être traitée aux urgences et recevoir de l'épinéphrine après avoir reçu un vaccin vivant atténué contre le virus du zona contenant la souche Oka VZV. Le vaccin a été administré dans une pharmacie locale et en quelques minutes, la femme a eu une sensation de torpeur évoluant vers des étourdissements, une respiration sifflante et un serrement de gorge. Elle s'est autoadministré 50 mg de diphénhydramine 5 minutes après l'apparition des symptômes. Trente minutes après sa vaccination, elle a demandé des soins d'urgence. À ce moment-là, on a constaté qu'elle souffrait de dyspnée, qu'elle avait des bouffées de chaleur, un œdème de Quincke facial, oral et uvulaire et des infections conjonctivales bilatérales avec des signes vitaux et une tension artérielle stables, sans qu'il y ait de respiration sifflante documentée à l'examen pulmonaire. Ses symptômes ont disparu en 20 à 30 minutes. On lui a plus tard diagnostiqué une allergie à l'alphagal, et les effets secondaires ont été attribués à la présence de produits d'origine animale dans le vaccin. |
III |
Mauvaise |
Turktas et al., 1999 |
Vaccin DTC à germes entiers |
Étude de cas d'un médecin Financement : |
Un nourrisson âgé de 6 mois |
Anaphylaxie Un nourrisson de 6 mois a souffert d'anaphylaxie après la troisième dose du vaccin DTC à germes entiers. Le nourrisson a souffert de somnolence, suivie d'une perte de conscience, d'une éruption urticarienne sur tout le corps et d'un gonflement des yeux. Il a été amené dans un hôpital communautaire 20 minutes après l'administration du vaccin, puis a été transféré dans le service de pédiatrie dans les 2 heures suivant la vaccination. Au cours du suivi, le patient a eu de légers épisodes mensuels de respiration sifflante et de toux en hiver, ainsi qu'une rhinite permanente tout au long de l'année. |
III |
Mauvaise |
Worm et al., 2000 |
Vaccin contre l'encépha-lite transmise par les tiques |
Étude de cas Financement : |
Une femme de 29 ans |
Anaphylaxie La patiente a développé une urticaire généralisée, une dyspnée et une hypotension quelques minutes après la troisième vaccination. Elle a immédiatement reçu des antihistaminiques et des stéroïdes par voie intraveineuse et les symptômes ont complètement disparu en 1 heure. |
III |
Mauvaise |
Abréviations : CDC, Centers for Disease Control and Prevention (États-Unis); DTC, diphtérie, tétanos, coqueluche; ESSI, effet secondaire suivant l'immunisation; E.U., États-Unis; vaccin DCaT-VPI, vaccin contre la diphtérie, la coqueluche, le tétanos et la poliomyélite; RRO, rougeole, oreillons, et rubéole; SAEFVIC, Surveillance of Adverse Events following Vaccination in the Community; S.O., sans objet; VAERS, Vaccine Adverse Event Reporting System; VICP, Vaccine Injury Compensation Program; VPH, virus du papillome humain |
||||||
Annexe A. Revue rapide - Organigramme PRISMA
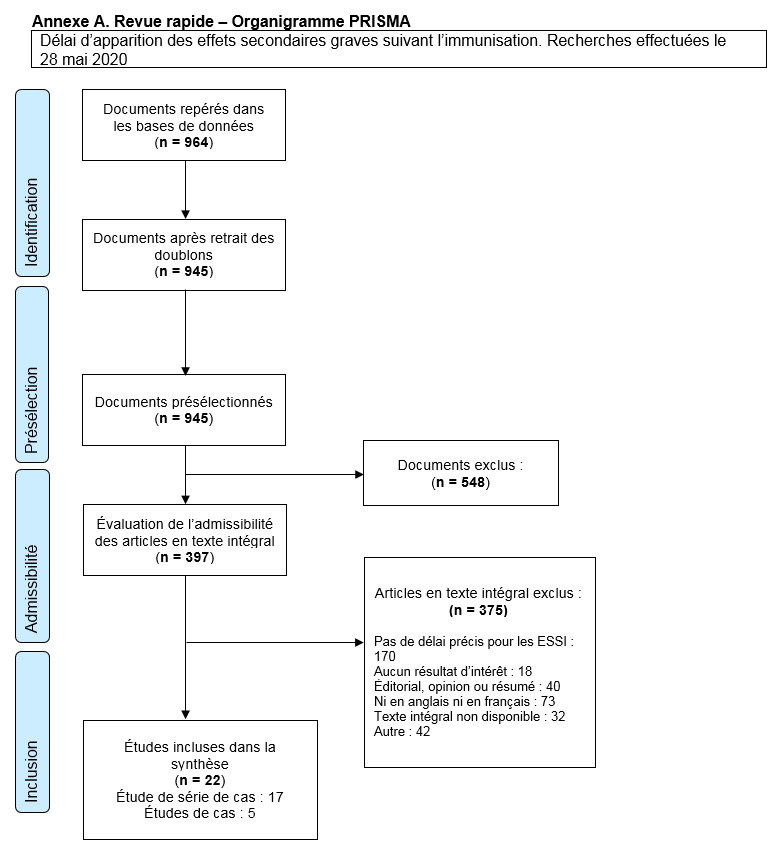
Organigramme PRISMA : Équivalent textuel
L'organigramme PRISMA décrit le processus par lequel les documents ont été sélectionnés pour la revue de la littérature. Le processus se divise en quatre étapes : l'identification, la présélection, l'admissibilité et l'inclusion.
Étape 1: Identification
- 964 documents ont été repérés le 28 mai 2020 lors de la recherche dans les bases de données.
- De ces documents, il en restait 945 après l'élimination des doublons.
Étape 2: Présélection
- 945 documents sont ensuite passés à l'étape de la présélection.
- 548 documents en ont été exclus.
Étape 3: Admissibilité
- 397 articles en texte intégral ont fait l'objet d'une évaluation de l'admissibilité.
- Sur les 397 articles en texte intégral, 375 ont été exclus : 170 avaient pas de délai précis pour les ESSI, 18 étaient aucun résultats d'intérêts, 40 étaient des éditoriaux, opinions ou résumés, 73 étaient ni en anglais ni en français, 32 étaient des textes intégrals non disponible et 42 étaient classifiés autres.
Étape 4: Inclusion
- La synthèse finale comprenait 22 articles : 17 études de série de cas et 5 études de cas.
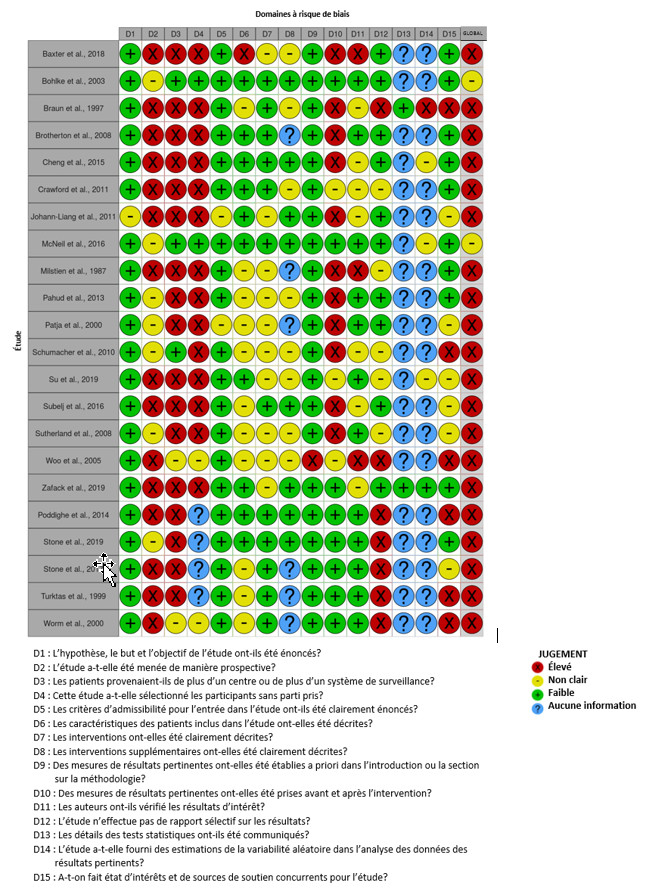
Figure 2. Évaluation des domaines à risque de biais (outil modifié de l'IHE): Équivalent textuel
| Étude | Domaine 1 | Domaine 2 | Domaine 3 | Domaine 4 | Domaine 5 | Domaine 6 | Domaine 7 | Domaine 8 | Domaine 9 | Domaine 10 | Domaine 11 | Domaine 12 | Domaine 13 | Domaine 14 | Domaine 15 | Global |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Baxter et al., 2018 | Faible | Élevé | Élevé | Élevé | Faible | Élevé | Non clair | Non clair | Faible | Élevé | Élevé | Faible | Aucune information | Aucune information | Faible | Élevé |
| Bohlke et al, 2003 | Faible | Non clair | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Aucune information | Aucune information | Faible | Non clair |
| Braun et al., 1997 | Faible | Élevé | Élevé | Élevé | Faible | Non clair | Faible | Non clair | Faible | Élevé | Non clair | Élevé | Faible | Élevé | Élevé | Élevé |
| Brotherton et al., 2008 | Faible | Élevé | Élevé | Élevé | Faible | Faible | Faible | Aucune information | Faible | Élevé | Faible | Faible | Aucune information | Aucune information | Faible | Élevé |
| Cheng et al., 2015 | Faible | Élevé | Élevé | Élevé | Faible | Faible | Faible | Faible | Faible | Élevé | Non clair | Faible | Aucune information | Non clair | Faible | Élevé |
| Crawford et al., 2011 | Faible | Élevé | Élevé | Élevé | Faible | Faible | Faible | Non clair | Faible | Non clair | Non clair | Non clair | Aucune information | Aucune information | Faible | Élevé |
| Johann-Liang et al., 2011 | Non clair | Élevé | Élevé | Élevé | Non clair | Faible | Non clair | Faible | Faible | Élevé | Non clair | Faible | Aucune information | Aucune information | Non clair | Élevé |
| McNeil et al., 2016 | Faible | Non clair | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Aucune information | Non clair | Faible | Non clair |
| Millstein et al., 1987 | Faible | Élevé | Élevé | Élevé | Faible | Non clair | Non clair | Aucune information | Faible | Élevé | Élevé | Non clair | Aucune information | Aucune information | Faible | Élevé |
| Pahud et al., 2013 | Faible | Non clair | Élevé | Élevé | Faible | Non clair | Non clair | Non clair | Faible | Élevé | Faible | Faible | Aucune information | Aucune information | Faible | Élevé |
| Patja et al., 2000 | Faible | Non clair | Élevé | Élevé | Non clair | Non clair | Non clair | Aucune information | Faible | Élevé | Faible | Faible | Aucune information | Aucune information | Non clair | Élevé |
| Schumacher et al., 2010 | Faible | Non clair | Faible | Élevé | Faible | Non clair | Non clair | Non clair | Faible | Élevé | Non clair | Non clair | Aucune information | Aucune information | Élevé | Élevé |
| Su et al., 2019 | Faible | Élevé | Élevé | Élevé | Faible | Faible | Non clair | Non clair | Faible | Non clair | Faible | Non clair | Aucune information | Non clair | Non clair | Élevé |
| Subelj et al., 2016 | Faible | Élevé | Élevé | Élevé | Faible | Non clair | Faible | Faible | Faible | Élevé | Non clair | Faible | Aucune information | Aucune information | Non clair | Élevé |
| Sutherland et al., 2008 | Faible | Non clair | Élevé | Élevé | Faible | Non clair | Non clair | Non clair | Faible | Élevé | Faible | Non clair | Aucune information | Aucune information | Non clair | Élevé |
| Woo et al., 2005 | Faible | Élevé | Non clair | Non clair | Faible | Non clair | Non clair | Non clair | Élevé | Non clair | Élevé | Élevé | Aucune information | Aucune information | Élevé | Élevé |
| Zafack et al., 2019 | Faible | Élevé | Élevé | Élevé | Faible | Faible | Non clair | Faible | Faible | Faible | Non clair | Faible | Faible | Faible | Faible | Élevé |
| Poddighe et al., 2014 | Faible | Élevé | Élevé | Aucune information | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Élevé | Aucune information | Aucune information | Élevé | Élevé |
| Stone et al., 2019 | Faible | Non clair | Élevé | Aucune information | Faible | Faible | Faible | Faible | Faible | Faible | Faible | Élevé | Aucune information | Aucune information | Faible | Élevé |
| Stone et al., 2017 | Faible | Élevé | Élevé | Aucune information | Faible | Non clair | Faible | Aucune information | Faible | Faible | Faible | Élevé | Aucune information | Aucune information | Non clair | Élevé |
| Turktas et al., 1999 | Faible | Élevé | Élevé | Aucune information | Faible | Non clair | Faible | Aucune information | Faible | Faible | Faible | Élevé | Aucune information | Aucune information | Élevé | Élevé |
| Worm et al. 2000 | Faible | Élevé | Non clair | Non clair | Faible | Non clair | Faible | Aucune information | Faible | Faible | Faible | Élevé | Aucune information | Aucune information | Élevé | Élevé |
Liste des abréviations
| Abréviation | Terme |
|---|---|
| ASPC | Agence de la santé publique du Canada |
| ATAGI | Australian Technical Advisory Group on Immunisation |
| CCNI | Comité consultatif national de l'immunisation |
| DTC | Diphtérie, tétanos, coqueluche |
| ÉI | Évènements indésirables |
| ÉIG | Évènement indésirable grave |
| ESSI | Effet secondaire suivant l'immunisation |
| É.-U. | États-Unis |
| FDA | Food and Drug Administration, États-Unis |
| GCI | Guide canadien d'immunisation |
| GTI | Groupe de travail sur l'influenza |
| IHE | Institute of Health Economics |
| MedDRA | Dictionnaire médical des activités de réglementation |
| RRO | Rougeole, oreillons et rubéole |
| SAEFVIC | Surveillance of Adverse Events following Vaccination in the Community |
| SCSESSI | Système canadien de surveillance des effets secondaires suivant l'immunisation |
| Vaccin VPH4 | Vaccin quadrivalent contre le virus du papillome humain |
| VAERS | Vaccine Adverse Event Reporting System |
| VPH | Virus du papillome humain |
Remerciements
La présente déclaration a été préparée par : R. Stirling, P. Doyon-Plourde, N. Forbes, K. Young et R. Harrison, au nom du Groupe de travail sur l'influenza (GTI) du CCNI et a été approuvée par le CCNI.
Le CCNI remercie vivement les personnes suivantes de leur contribution : G. Crichlow, H. Anyoti, A. House, K. Johnson, M. Laplante, A. Sinilaite, M. Tunis et E. Westhaver
Groupe de travail sur l'influenza du CCNI
Membres : R. Harrison (présidente), N. Dayneka, I. Gemmill, K. Klein, D. Kumar, J. Langley, J. McElhaney, A. McGeer, D. Moore, S. Smith et B. Warshawsky
Représentants de liaison : L. Grohskopf (Centers for Disease Control and Prevention [CDC], États-Unis)
Représentants d'office : L. Whitmore (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), A. Gartley (Direction générale de la santé des Premières Nations et des Inuits [DGSPNI], Services aux Autochtones Canada [SAC]) et J. Xiong (Direction des médicaments biologiques et radiopharmaceutiques [DMBR], Santé Canada [SC]).
CCNI
Membres : C. Quach (présidente), S. Deeks (vice-présidente), J. Bettinger, N. Dayneka, P. De Wals, E. Dubé, V. Dubey, S. Gantt, R. Harrison, K. Hildebrand, K. Klein, J. Papenburg, B. Sander, S. Smith et S. Wilson.
Représentants de liaison : L. M. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (CDC, États-Unis), L. Dupuis (Association des infirmières et infirmiers du Canada), J. Emili (Collège des médecins de famille du Canada), D. Fell (Association canadienne pour la recherche et l'évaluation en immunisation), M. Lavoie (Conseil des médecins hygiénistes en chef), D. Moore (Société canadienne de pédiatrie), M. Naus (Comité canadien d'immunisation) et A. Pham-Huy (Association pour la microbiologie médicale et l'infectiologie Canada)
Représentants d'office : D. Danoff (Direction des produits de santé commercialisés, SC), E. Henry (CIMRI, ASPC), M. Lacroix (Groupe consultatif en matière d'éthique en santé publique, ASPC), J. Pennock (CIMRI, ASPC), R. Pless (DMBR, SC), G. Poliquin (Laboratoire national de microbiologie, ASPC), V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes), et T. Wong (DGSPNI, SAC).
Références
Références
- Référence a
-
Les vaccinés devraient demeurer en observation pendant au moins 15 minutes après la vaccination, mais une période de 30 minutes est plus sûre lorsqu'on craint particulièrement une allergie possible à un vaccin.
- Référence b
-
Les mesures adéquates de santé publique et de prévention et de contrôle des infections doivent être déterminées par l'autorité sanitaire publique responsable dans la province ou le territoire de la clinique de vaccination.
- Référence c
-
Adapté de l'Australian Technical Advisory Group on Immunisation (ATAGI), « Statement on the duration of observation after vaccination in the context of minimizing risk of exposure to COVID-19 at health care facilities » [Déclaration sur la durée d'observation post-vaccinale dans le contexte de réduction du risque d'exposition à la COVID-19 dans les établissements de soins de santé]
- Référence d
-
Voir la déclaration du CCNI sur les vaccins antigrippaux issus de cultures cellulaires de mammifères
Notes de bas de page
- Note de bas de page 1
-
OMS. Coronavirus disease 2019 (COVID-19) Situation Report - 51. [en ligne] Accès : https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200311-sitrep-51-covid-19.pdf?sfvrsn=1ba62e57_10
- Note de bas de page 2
-
ASPC. Lignes directrices provisoires sur la continuité des programmes d'immunisation pendant la pandémie de COVID-19. Mis à jour le 13 mai 2020. [en ligne] Accès : /content/canadasite/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/lignes-directrices-provisoires-programmes-immunisation-pendant-pandemie-covid-19.html
- Note de bas de page 3
-
ASPC. Lignes directrices sur l'administration de vaccins contre la grippe en présence de la COVID-19. [en ligne] Accès : /content/canadasite/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/lignes-directrices-administration-vaccins-contre-grippe-covid-19.html
- Note de bas de page 4
-
ASPC. Guide canadien d'immunisation : Partie 2 - Innocuité des vaccins. [en ligne] Accès : /content/canadasite/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-2-innocuite-vaccins/page-4-innocuite-vaccins-effets-secondaires-suivant-immunisation.html
- Note de bas de page 5
-
US CDC. 2017. General Best Practice Guidelines for Immunization: Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP). [en ligne] Accès : https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/adverse-reactions.html
- Note de bas de page 6
-
The Vaccine Administration Task Force. 2001. United Kingdom Guidance on Best Practice in Vaccine Administration [en ligne] Accès : http://www.wales.nhs.uk/sitesplus/documents/861/UK%20best%20practice%20guidance%20vacc%20admin%202001.pdf
- Note de bas de page 7
-
Ministère de la Santé de la Nouvelle-Zélande. 2018. Immunisation Handbook 2017 (2nd ed.). Wellington: Ministry of Health. [en ligne] Accès : https://www.health.govt.nz/system/files/documents/publications/immunisation-handbook-2017-2nd-edition-mar18-v9_1.html
- Note de bas de page 8
-
Ministère de la Santé de l'Australie. 2019. Australian Immunisation Handbook. [en ligne] Accès : https://immunisationhandbook.health.gov.au/vaccination-procedures/after-vaccination
- Note de bas de page 9
-
Australian Technical Advisory Group on Immunisation (ATAGI). 2020. ATAGI Clinical Statement on Vaccination Observation Time. [en ligne] Accès : https://www.health.gov.au/resources/publications/atagi-clinical-statement-on-vaccination-observation-time
- Note de bas de page 10
-
Guo B, Moga C, Harstall C, Schopflocher D. A principal component analysis is conducted for a case series quality appraisal checklist. Journal of clinical epidemiology. 2016 Jan 1; 69:199-207.
- Note de bas de page 11
-
Rüggeberg JU, Gold MS, Bayas JM, Blum MD, Bonhoeffer J, Friedlander S, de Souza Brito G, Heininger U, Imoukhuede B, Khamesipour A, Erlewyn-Lajeunesse M. Anaphylaxis: case definition and guidelines for data collection, analysis, and presentation of immunization safety data. Vaccine. 2007 Aug 1; 25(31):5675-84.
- Note de bas de page 12
-
ASPC. Système canadien de surveillance des effets secondaires suivant l'immunisation [en ligne] Accès : /content/canadasite/fr/sante-publique/services/immunisation/systeme-canadien-surveillance-effets-secondaires-suivant-immunisation.html
- Note de bas de page 13
-
Baxter CM, Clothier HJ, Perrett KP. Potential immediate hypersensitivity reactions following immunization in preschool aged children in Victoria, Australia. Human Vaccines & Immunotherapeutics. 2018 Aug 3; 14(8):2088-92.
- Note de bas de page 14
-
Bohlke K, Davis RL, Marcy SM, Braun MM, DeStefano F, Black SB, Mullooly JP, Thompson RS. Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics. 2003 Oct 1; 112(4):815-20.
- Note de bas de page 15
-
Brotherton JM, Gold MS, Kemp AS, McIntyre PB, Burgess MA, Campbell-Lloyd S. Anaphylaxis following quadrivalent human papillomavirus vaccination. Cmaj. 2008 Sep 9; 179(6):525-33.
- Note de bas de page 16
-
Cheng DR, Perrett KP, Choo S, Danchin M, Buttery JP, Crawford NW. Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013. Vaccine. 2015 Mar 24; 33(13):1602-7.
- Note de bas de page 17
-
Johann-Liang R, Josephs S, Dreskin SC. Analysis of anaphylaxis cases after vaccination: 10-year review from the National Vaccine Injury Compensation Program. Annals of Allergy, Asthma & Immunology. 2011 May 1; 106(5):440-3.
- Note de bas de page 18
-
McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, Hambidge SJ, Lee GM, Jackson LA, Irving SA, King JP. Risk of anaphylaxis after vaccination in children and adults. Journal of Allergy and Clinical Immunology. 2016 Mar 1; 137(3):868-78.
- Note de bas de page 19
-
Milstien JB, Gross TP, Kuritsky JN. Adverse reactions reported following receipt of Haemophilus influenzae type b vaccine: an analysis after 1 year of marketing. Pediatrics. 1987 Aug 1; 80(2):270-4.
- Note de bas de page 20
-
Pahud BA, Williams SE, Dekker CL, Halsey N, LaRussa P, Baxter RP, Klein NP, Marchant CD, Sparks RC, Jakob K, Aukes L. Clinical assessment of serious adverse events in children receiving 2009 H1N1 vaccination. The Pediatric infectious disease journal. 2013 Feb 1; 32(2):163-8.
- Note de bas de page 21
-
Patja A, Davidkin I, Kurki T, Kallio MJ, Valle M, Peltola H. Serious adverse events after measles-mumps-rubella vaccination during a fourteen-year prospective follow-up. The Pediatric infectious disease journal. 2000 Dec 1; 19(12):1127-34.
- Note de bas de page 22
-
Schumacher Z, Bourquin C, Heininger U. Surveillance for adverse events following immunization (AEFI) in Switzerland-1991-2001. Vaccine. 2010 May 28; 28(24):4059-64.
- Note de bas de page 23
-
Su JR, Moro PL, Ng CS, Lewis PW, Said MA, Cano MV. Anaphylaxis after vaccination reported to the Vaccine Adverse Event Reporting System, 1990-2016. Journal of Allergy and Clinical Immunology. 2019 Apr 1; 143(4):1465-73.
- Note de bas de page 24
-
Zafack JG, Toth E, Landry M, Drolet JP, Top KA, De Serres G. Rate of Recurrence of Adverse Events Following Immunization: Results of 19 Years of Surveillance in Quebec, Canada. The Pediatric infectious disease journal. 2019 Apr 1; 38(4):377-83.
- Note de bas de page 25
-
Stone CA, Commins SP, Choudhary S, Vethody C, Heavrin JL, Wingerter J, Hemler JA, Babe K, Phillips EJ, Norton AE. Anaphylaxis after vaccination in a pediatric patient: further implicating alpha-gal allergy. The Journal of Allergy and Clinical Immunology: In Practice. 2019 Jan 1; 7(1):322-4.
- Note de bas de page 26
-
Stone CA, Hemler JA, Commins SP, Schuyler AJ, Phillips EJ, Peebles RS, Fahrenholz JM. Anaphylaxis after zoster vaccine: Implicating alpha-gal allergy as a possible mechanism. Journal of Allergy and Clinical Immunology. 2017 May 1; 139(5):1710-3.
- Note de bas de page 27
-
Türktas I, Ergenekon E. Anaphylaxis following diphtheria-tetanus-pertussis vaccination-a reminder. European journal of pediatrics. 1999 Apr 1; 158(5):434.
- Note de bas de page 28
-
Worm M, Sterry W, Zuberbier T. Gelatin-induced urticaria and anaphylaxis after tick-borne encephalitis vaccine. Acta dermato-venereologica. 2000; 80(3).
- Note de bas de page 29
-
Braun MM, Patriarca PA, Ellenberg SS. Syncope after immunization. Archives of pediatrics & adolescent medicine. 1997 Mar 1; 151(3):255-9.
- Note de bas de page 30
-
Crawford NW, Clothier HJ, Elia S, Lazzaro T, Royle J, Buttery JP. Syncope and seizures following human papillomavirus vaccination: a retrospective case series. Medical journal of Australia. 2011 Jan; 194(1):16-8.
- Note de bas de page 31
-
Šubelj M, Učakar V, Kraigher A, Klavs I. Adverse events following school-based vaccination of girls with quadrivalent human papillomavirus vaccine in Slovenia, 2009 to 2013. Eurosurveillance. 2016 Apr 7; 21(14):30187.
- Note de bas de page 32
-
Sutherland A, Izurieta H, Ball R, Braun MM, Miller ER, KR Broder KR, Slade BA, Iskander JK, Kroger AT, Markowitz LE, Huang WT. Syncope after vaccination--United States, January 2005-July 2007. MMWR. Morbidity and mortality weekly report. 2008 May 2; 57(17):457.
- Note de bas de page 33
-
Woo EJ, Ball R, Braun MM. Fatal syncope-related fall after immunization. Archives of pediatrics & adolescent medicine. 2005 Nov 1; 159(11):1083.
- Note de bas de page 34
-
Poddighe D, Castelli L, Marseglia GL, Bruni P. A sudden onset of a pseudo-neurological syndrome after HPV-16/18 AS04-adjuvated vaccine: might it be an autoimmune/inflammatory syndrome induced by adjuvants (ASIA) presenting as a somatoform disorder?.Immunologic research. 2014 Dec 1; 60(2-3):236-46.
- Note de bas de page 35
-
Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM. International Consensus (ICON): Allergic reactions to vaccines. World Allergy Organ J. 2016; 9:32.
- Note de bas de page 36
-
McGuinness, LA, Higgins, JPT. Risk-of-bias VISualization (robvis): An R package and Shiny web app for visualizing risk-of-bias assessments. Res Syn Meth. 2020; 1-7. https://doi.org/10.1002/jrsm.1411
