Recommandations au niveau de la santé publique sur l’utilisation des vaccins contre le pneumocoque chez les adultes, y compris l’utilisation des vaccins conjugués 15-valent et 20-valent
Télécharger en format PDF
(1,49 Mb, 100 pages)
Organisation : Agence de la santé publique du Canada
Cat. : HP5-153/1-2023F-PDF
ISBN : 978-0-660-47231-7
Pub. : 220713
Publiée : 2023-02-24
Une déclaration du comité consultatif (DCC)
Comité consultatif national de l'immunisation (CCNI)
Table des matières
- Sommaire des renseignements contenus dans la présente déclaration du CCNI
- I. Introduction
- II. Méthodologie
- III. Épidémiologie
- III.1 Fardeau de la pneumococcie au Canada
- III.2 Distribution des sérotypes de l'infection invasive à pneumocoques au Canada, 2016-2020
- III.3 Fardeau de la pneumonie d'origine communautaire à pneumocoques au Canada
- III.4 Groupes à haut risque
- III.5 Résumé de la couverture vaccinale antipneumococcique au Canada
- IV. Vaccin
- IV.1 Préparation autorisée au Canada
- IV.2 Efficacité potentielle et efficacité réelle
- IV.3 Immunogénicité
- IV.4 Persistance de la réponse immunitaire
- IV.5 Administration et calendrier des vaccins
- IV.6 Tests sérologiques
- IV.7 Conditions d'entreposage
- IV.8 Administration concomitante avec d'autres vaccins
- IV.9 Innocuité des vaccins
- IV.10 Contre-indications et précautions
- V. Vaccination de populations spécifiques
- VI. Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité à prendre en considération
- VII. Économie
- VIII. Recommandations
- IX. Priorités de recherche
- X. Questions liées à la surveillance
- XI. Caractéristiques des études incluses
- Liste des abréviations
- Remerciements
- Annexe A : Tableaux supplémentaires
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) et un organisme consultatif externe qui donne à l'Agence de la santé publique du Canada (ASPC) des conseils indépendants, continus et à jour dans le domaine de la médecine, des sciences et de la santé publique liés aux questions de l'ASPC concernant l'immunisation.
En plus de la prise en compte du fardeau associé aux maladies et des caractéristiques vaccinales, l'ASPC a élargi le mandat du CCNI de façon à lui permettre d'inclure l'étude systématique des facteurs liés aux programmes dans la formulation de ses recommandations axées sur des données probantes. Cette initiative devrait aider le CCNI à prendre des décisions en temps opportun en ce qui a trait aux programmes de vaccination à fonds publics à échelle provinciale et territoriale.
Les nouveaux facteurs que le CCNI devra examiner de façon systématique sont les suivants : économie, équité, éthique, acceptabilité et faisabilité. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Même si l'étude systématique des facteurs liés aux programmes sera effectuée à l'aide d'outils fondés sur des données probantes afin de cerner les problèmes distincts susceptibles d'avoir une incidence sur la prise de décision pour l'élaboration des recommandations, seuls les problèmes distincts considérés comme étant propres au vaccin ou à la maladie évitable par la vaccination seront inclus.
Cette déclaration contient les conseils et recommandations indépendants du CCNI, qui reposent sur les connaissances scientifiques les plus récentes, et diffuse ce document aux fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait autoriser les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Sommaire des renseignements contenus dans la présente déclaration du CCNI
Les faits saillants suivants font ressortir les renseignements importants pour les vaccinateurs. Voir le reste de la Déclaration pour obtenir plus de précisions.
1. Quoi
Les infections à pneumocoques (IP) chez les adultes comprennent l'infection invasive à pneumocoques (IIP), une maladie transmissible aiguë et grave avec des manifestations comme la méningite, la bactériémie et la pneumonie bactériémique et l'empyème, ainsi que les infections non invasives à pneumocoques comme la pneumonie communautaire et l'otite moyenne aiguë chez les enfants. Elle est causée par la bactérie Streptococcus pneumoniae. Parmi les plus de 100 sérotypes de cette bactérie, un petit nombre provoque la majorité des maladies. La pneumonie bactériémique à pneumocoques est la manifestation la plus courante de l'IIP chez les adultes.
Deux vaccins conjugués contre le pneumocoque (PNEU-C) dont l'utilisation a été récemment autorisée par Santé Canada en se fondant sur les données sur l'immunogénicité relatives aux vaccins conjugués et polysaccharidiques précédemment autorisés sont le vaccin conjugué 15-valent contre le pneumocoque (PNEU-C-15) et le vaccin conjugué 20-valent contre le pneumocoque (PNEU-C-20). Le PNEU-C-15 est autorisé pour les nourrissons, les enfants et les adolescents de 6 semaines à 17 ans et les adultes de 18 ans et plus avec une indication pour la prévention de l'IIP causée par 15 sérotypes de S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F). Le PNEU-C-20 est autorisé pour les adultes de 18 ans et plus avec une indication pour la prévention de la pneumonie et de l'IIP causées par 20 sérotypes de S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F). On ne dispose d'aucune donnée sur l'efficacité potentielle (EP) du PNEU-C-15 ou du PNEU-C-20.
D'après les données sur l'immunogénicité relatives aux vaccins conjugués contre le pneumocoque (PNEU-C) et aux vaccins polysaccharidiques contre le pneumococcique (PNEU-P) déjà autorisés, Santé Canada a récemment autorisé deux nouveaux vaccins PNEU-C :
- Le vaccin PNEU-C-15 (15-valent) est autorisé pour les nourrissons, les enfants et les adolescents de 6 semaines à 17 ans et les adultes de 18 ans et plus, avec une indication de prévention des IIP causées par 15 ST de S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F).
- Le vaccin PNEU-C-20 (20-valent) est autorisé chez les adultes de 18 ans et plus avec une indication de prévention de la pneumonie et des IIP causées par 20 ST de S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F).
Aucune donnée sur l'EP n'est actuellement disponible pour le vaccin PNEU-C-15 ou le vaccin PNEU-C-20.
2. Qui
L'IIP s'observe le plus souvent chez les très jeunes enfants, les personnes âgées et les groupes présentant des problèmes médicaux et (ou) ou d'autres facteurs de risque qui les exposent à un haut risque d'IIP (voir Tableau 1).
Le CCNI recommande l'utilisation du PNEU-C-20, ou du PNEU-C-15 suivi du vaccin polysaccharidique contre le pneumocoque (PNEU-P-23), chez les adultes présentant un risque accru d'IIP.
- Tous les adultes de 65 ans et plus devraient recevoir une dose unique de PNEU-C-20.
- Les adultes de 50 à 64 ans et présentant des problèmes médicaux sous-jacents et (ou) d'autres facteurs de risque qui les exposent à un haut risque d'IIP devraient recevoir une dose unique de PNEU-C-20.
- Les adultes de 18 ans et plus présentant une maladie immunodéficiente devraient également recevoir une dose unique de PNEU-C-20.
- Le PNEU-C-15 suivi du PNEU-P-23 peut être offert comme solution de rechange si le PNEU-C-20 n'est pas disponible.
Des détails supplémentaires, notamment la vaccination des adultes ayant reçu une greffe de cellules souches hématopoïétiques (GCSH), ainsi que les intervalles entre les vaccins contre le pneumocoque précédents et le PNEU-C-15/PNEU-C-20, sont abordés à la Section VII.
| États non immunodéprimés | Problèmes entraînant une maladie immunodéficienteNote de bas de page a | Autres facteurs de risque |
|---|---|---|
|
|
Personnes
|
|
||
3. Comment
Le PNEU-C-15 et le PNEU-C-20 sont fournis dans une seringue préremplie à dose unique. Le PNEU-C-15 et le PNEU-C-20 doivent être administrés par voie intramusculaire (IM). Le calendrier standard de vaccination prévoit une dose de 0,5 ml. Les contre-indications à l'administration du PNEU-C-15 ou du PNEU-C-20 comprennent l'hypersensibilité (p. ex., l'anaphylaxie) au vaccin ou à l'un de ses composants. Les vaccins contre le pneumocoque peuvent être administrés en même temps que d'autres vaccins, à l'exception d'une autre formulation du vaccin contre le pneumocoque (p. ex., utilisation simultanée d'un conjugué et d'un polysaccharidique).
4. Pourquoi
L'infection pneumococcique peut provoquer des infections sévères et entraîner une mortalité et une morbidité importantes avec des complications à vie. Le moyen le plus efficace de prévenir ces infections est la vaccination.
I. Introduction
I.1 Objectif des directives
La nécessité de cette déclaration du Comité consultatif national de l'immunisation (CCNI) sur l'utilisation des vaccins contre le pneumocoque a été déclenchée par l'approbation de 2 vaccins conjugués contre le pneumocoque supplémentaires chez les adultes de 18 ans et plus, un vaccin 15-valent, le PNEU-C-15 (VaxneuvanceMC) le 16 novembre 2021 et un vaccin 20-valent, le PNEU-C-20 (Prevnar 20MC) le 9 mai 2022. Le principal objectif de la présente déclaration est d'examiner les données probantes sur l'EP, l'ER, l'immunogénicité, l'innocuité et le rapport coût/efficacité des vaccins PNEU-C-15 et PNEU-C-20 et de formuler des recommandations quant à leur utilisation, compte tenu du fardeau de la maladie au Canada chez les adultes pour lesquels la vaccination contre le pneumocoque est actuellement recommandée :
- adultes qui sont immunocompétents de 65 ans et plus
- adultes qui sont immunocompétents présentant un risque accru de pneumococcie (Tableau 1)
- adultes qui sont immunocompétents résidant dans des établissements de soins de longue durée
- adultes qui sont immunodéprimés, y compris les receveurs de GCSH.
I.2 Contexte des vaccins contre le pneumocoque, des programmes de vaccination et des recommandations pour les adultes au Canada
Pour prévenir l'IIP chez l'adulte, 2 vaccins sont actuellement disponibles dans le cadre de programmes financés à même les fonds publics : lePNEU-P-23 et le vaccin conjugué 13-valent contre le pneumocoque (PNEU-C-13). Les vaccins conjugués induisent la formation de cellules à mémoire à long terme, offrent une durée de protection plus longue et permettent de renforcer la réponse immunitaire au vaccin en impliquant les lymphocytes T, ce qui n'est pas le cas des vaccins polysaccharidiques.
Précédemment, le PNEU-P-23 a été recommandé par le CCNI pour la vaccination systématique contre l'IIP de tous les adultes de 65 ans et plus. Le PNEU-P-23 a également été recommandé pour les adultes de 18 à 64 ans résidant dans des établissements de soins de longue durée, les fumeurs ou les personnes ayant un trouble lié à la consommation d'alcool, les sans-abris, ainsi que pour les personnes souffrant d'affections sous-jacentes immunodépressives ou non immunodépressives qui les exposent à un risque accru d'IIP. Une liste complète des affections médicales sous-jacentes qui augmentent le risque d'IIP ainsi que la dose et le calendrier sont disponibles dans le chapitre sur les vaccins contre le pneumocoque du Guide canadien d'immunisation.
En octobre 2013, le PNEU-C-13 en série avec le PNEU-P-23 a été recommandé par le CCNINote de bas de page 1 pour les adultes de 18 ans et plus atteints d'une immunodépression entraînant un haut risque d'IIP. Pour une liste complète des affections immunodépressives qui augmentent le risque d'IIP, voir le Tableau 1 du chapitre sur les vaccins contre le pneumocoque du Guide canadien d'immunisation.
Le PNEU-C-13 a également été recommandé par le CCNI en 2016Note de bas de page 2 et en 2018Note de bas de page 3 sur une base individuelle pour les adultes de 65 ans et plus qui sont immunocompétents et qui souhaitent se protéger contre les 13 sérotypes inclus dans le vaccin pour la prévention de la pneumonie d'origine communautaire (POC) et de l'IIP. Le PNEU-C-13 n'a pas été recommandé dans le cadre des programmes de vaccination systématique financés à même les fonds publics en raison de son rapport coût/efficacité.
II. Méthodologie
En bref, voici les étapes de la préparation d'une déclaration du comité consultatif du CCNI :
- Synthèse des connaissances : récupération et résumé des études individuelles, évaluation du risque de biais (RB) des études incluses (résumé dans les Tableaux sommaires des données probantes de l'annexe).
- Sommaire des données probantes : avantages (immunogénicité) et inconvénients potentiels (innocuité), compte tenu du degré de certitude des données probantes synthétisées et, le cas échéant, de l'ampleur des effets observés dans l'ensemble des études.
- Utilisation des données probantes pour éclairer les recommandations.
Le CCNI utilise également un cadre publié, revu par des pairs, et des outils fondés sur des données probantes pour s'assurer que les questions liées à l'éthique, l'équité, la faisabilité et l'acceptabilité (ÉÉFA) sont systématiquement évaluées et intégrées dans ses directives. Le CCNI a évalué les considérations éthiques suivantes lors de la formulation de ses recommandations : promouvoir le bien-être et minimiser le risque de méfaits, maintenir la confiance, respecter les personnes et favoriser l'autonomie, et promouvoir la justice et l'équité.
Des renseignements complémentaires sur les méthodes et les processus du CCNI sont disponibles ailleurs.
Pour cette déclaration, le CCNI a examiné les données probantes relatives au fardeau de l'IIP dans la ou les populations cibles, l'innocuité, l'immunogénicité, l'EP et l'efficacité réelle (ER) du ou des vaccins, les calendriers de vaccination et d'autres aspects de la stratégie globale de vaccination contre le pneumocoque chez l'adulte. La synthèse des connaissances a été réalisée par le Secrétariat du CCNI et examinée par le Groupe de travail sur le pneumocoque (GTP). Après l'évaluation critique de chacune des études, des tableaux sommaires assortis de cotes de qualité des données probantes s'inspirant de l'approche GRADE ont été préparésNote de bas de page 4Note de bas de page 5Note de bas de page 6. Une évaluation utilisant le cadre décisionnel a été préparée pour chaque question, et des recommandations relatives à l'utilisation des vaccins ont été proposéesNote de bas de page 7. Le CCNI a examiné les données probantes disponibles le 19 mai 2022, le 4 juillet 2022 et le 12 septembre 2022. La description des considérations pertinentes, la justification des décisions particulières et les lacunes dans les connaissances sont élaborées.
II.1 Fardeau de l'infection invasive à pneumocoques
Au Canada, l'IIP est une maladie à déclaration obligatoire au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) depuis 2000, toutes les administrations provinciales et territoriales signalant les cas correspondant à la définition nationale de cas. Les cas non saisis par le SCSMDO peuvent inclure ceux qui ne font pas l'objet de soins médicaux, ceux pour lesquels des mesures cliniques ont été appliquées sans qu'aucun spécimen ne soit prélevé. Les renseignements, comme le sérotype, la sensibilité aux antimicrobiens, la couverture vaccinale ainsi que d'autres données épidémiologiques améliorées sur les patients ne sont pas rapportées par l'intermédiaire du SCSMDO.
Les données de la liste de surveillance nationale utilisées pour évaluer le fardeau de l'IIP dans les différents groupes d'âge provenaient du SCSMDO pour 6 provinces (C.-B., Alb., Sask., Ont., Qc et Î.-P.-É.) et du programme Surveillance circumpolaire internationale (SCI) pour les 3 territoires (YK, NU et NT). Certaines provinces (MB, N.-É., NL, NB) n'ont pas été incluses dans la liste de surveillance nationale, car elles fournissaient des données agrégées avec de larges intervalles de groupes d'âge qui ne pouvaient pas être ventilés pour comparer le fardeau de l'IIP dans différents groupes d'âge parmi les personnes plus âgées au Canada. Tous les cas ont été présumés comme étant conformes à la définition nationale de l'IIP. De plus amples renseignements sur les données du SCSMDO sont disponibles sur le site Web des maladies à déclaration obligatoire en direct.
Les régions nordiques du Canada prises en compte dans le système de SCI sont le Nunavut, les Territoires du Nord-Ouest (T.N.-O.), le Yukon, le nord du Labrador et le nord du Québec. L'incidence de l'IIP dans ces régions a été comparée à celle des autres provinces et territoires en utilisant les données agrégées du SCSMDO.
Le Laboratoire national de microbiologie (LNM) collabore avec les laboratoires de santé publique provinciaux et territoriaux pour effectuer une surveillance passive en laboratoire de l'IIP au CanadaNote de bas de page 8. Tous les isolats d'IIP provenant des laboratoires de santé publique provinciaux/territoriaux sont sérotypés par le LNM, bien que la collecte d'échantillons puisse être limitée par des normes régionales variables, la nature préliminaire de certaines données et la disponibilité d'isolats bactériens aux fins d'analyse. Les données sur les sérotypes peuvent également être biaisées par une surreprésentation des sérotypes les plus virulents pour lesquels un traitement médical est recherché et des échantillons cliniques prélevés. Malgré ces limites, le programme de surveillance nationale passive de 2015 à 2019, y compris les données supplémentaires soumises par les laboratoires de référence provinciaux de l'Alberta et du Québec, a permis de signaler en temps opportun les distributions de sérotypes et a représenté de 80 à 98 % de tous les cas d'IIP signalés au SCSMDO. En 2020Note de bas de page 9, un total de 2 067 isolats a été déclaré au LNM, soit 94,3 % des 2 193 déclarés par l'ensemble des provinces et territoires au SCSMDO (données préliminaires de 2020).
Pour les regroupements de sérotypes vaccinaux, le sérotype 6C a été inclus avec les sérotypes du PNEU-C-13 en raison de la protection croisée avec le 6ANote de bas de page 10. Les sérotypes 15B et 15C ont été regroupés sous l'appellation 15B/C en raison du passage réversible entre les 2 types de sérotypes rapportés in vivo au cours de l'infection, ce qui rend difficile la différenciation précise des 2 typesNote de bas de page 11Note de bas de page 12.
II.2 Revue de la littérature des études sur le PNEU-C-15 et le PNEU-C-20
La question de politique abordée dans cette déclaration est la suivante : Quelles sont l'EP, l'ER et l'innocuité du PNEU-C-15 et du PNEU-C-20, administrés en série avec ou sans PNEU-P-23, lorsqu'ils sont utilisés dans le but de réduire le risque d'IIP chez les adultes.
Population : Adultes de 50 ans ou plus sans facteurs de risque d'IIP; adultes de 18 ans ou plus avec facteurs de risque d'IIP (Tableau 1).
Intervention : Le PNEU-C-15 ou le PNEU-C-20, seuls et en série avec le PNEU-P-23 (selon le groupe de population concerné).
Comparateur : Calendrier de vaccination contre le pneumocoque adapté à l'âge et aux facteurs de risque actuellement recommandé.
Résultats : Mortalité attribuable à S. pneumoniae de sérotype évitable par la vaccination, l'IIP attribuable à un sérotype du pneumocoque évitable par la vaccination, l'IIP attribuable à tout sérotype du pneumocoque (évitable par la vaccination et non évitable par la vaccination), pneumonie d'origine communautaire (POC) attribuable à un sérotype évitable par la vaccination, évènements indésirables graves (ÉIG), évènements indésirables (ÉI) systémiques sévères et ÉI systémiques légers/modérés suivant l'administration du vaccin. Les résultats étaient accompagnés de définitions et sont résumés dans l'annexe (Annexe A, Tableau 7).
En l'absence de données sur les mesures de la maladie et la mortalité, l'immunogénicité (activité opsonophagocytaire [AOP], moyenne géométrique des titres [MGT] et pourcentage de sérorépondeurs définis par une augmentation d'un facteur de 4 ou plus du rapport de MGT de l'AOP entre les périodes pré- et post-administration du vaccin) a été évaluée.
Les données sur l'innocuité et l'immunogénicité du PNEU-C-15 et du PNEU-C-20 chez les adultes provenant des principaux essais cliniques, des études publiées et des données supplémentaires obtenues auprès des fabricants ont été examinées. Les données ont été extraites des études admissibles concernant le plan de l'étude, la population, l'intervention, le comparateur et les résultats d'intérêt. Le RB (Annexe A, Tableau 8) de chaque étude a été évalué à l'aide du Cochrane Risk of Bias ToolNote de bas de page 13. Le cadre GRADE (Grading of Recommendations, Assessment, Development and Evaluation) (Annexe A, Tableau 6) a été utilisé pour évaluer la certitude des données probantes.
Des techniques de méta-analyse ont été utilisées pour synthétiser les données sur les ÉI; l'hétérogénéité statistique a été prise en compte en utilisant une combinaison de facteurs (direction des estimations, chevauchement des intervalles de confiance (IC), et statistiques Q de Cochran [p<0,10] et I au carré). Pour les statistiques de l'I au carré, un guide approximatif de faible (de 0 à 25 %), modéré (de 25 à 50 %), substantiel (de 50 à 75 %) et considérable (de 75 à 100 %) a été utilisé. Pour les résultats binaires et lorsque les taux d'évènements étaient faibles (en utilisant 1 % à titre indicatif), le rapport de cotes (RC) de Peto a été utilisé; sinon, le rapport de risques a été utilisé. Autant que possible, des mesures relatives des effets ont été employées pour calculer les différences de risque (DR), conformément à l'approche GRADE. Pour l'immunogénicité, des synthèses narratives ont été utilisées, et l'hétérogénéité a été déterminée en fonction de la direction de l'effet, en se servant de l'ampleur des estimations. Le point central des rapports de MGT était la démonstration par les investigateurs de l'étude de la non-infériorité pour les sérotypes communs entre les vaccins. Pour le pourcentage de sérorépondeurs, des estimations ponctuelles ont été utilisées pour évaluer la direction de l'effet sur la base de ces magnitudes. Il est important de noter, toutefois, qu'aucun corrélat immunologique de protection n'a été établi pour l'IP.
Pour les évaluations GRADE de la certitude des données probantes (Annexe A, Tableau 6), les données du groupe témoin des études ont été utilisées pour estimer le risque de base. L'emploi de mesures de substitution a été le principal facteur responsable du caractère indirect. Les tailles de renseignements revus, soit 400 personnes avec des évènements pour les données binaires, au moins 4 000 personnes analysées pour les petits taux d'évènements et 800 personnes pour les données continues, ont été utilisées pour éclairer l'imprécision lorsque les IC n'étaient pas suffisamment larges. Des analyses de sous-groupes planifiées n'ont pas été entreprises pour la recommandation basée sur l'âge en raison de la nature des données et du nombre insuffisant d'études. Des analyses de sensibilité ont été effectuées pour restreindre les analyses aux études présentant un faible RB, le cas échéant, afin de voir si les résultats changeaient de manière appréciable. Trop peu d'études ont été localisées pour effectuer un test sur les effets des petites études.
Modifications du champ d'application et du processus pendant la réalisation de la revue : (a) une évaluation pour le groupe de 75 ans et plus a été ajoutée pour la recommandation fondée sur l'âge; (b) l'élargissement de l'admissibilité pour inclure des vaccins supplémentaires administrés en même temps que les vaccins contre le pneumocoque, et (c) la vérification complète de l'extraction des données, les évaluations du RB et les évaluations GRADE ont été réduites à une vérification partielle ou à une revue par une seule personne pour faciliter une revue rapide des données probantes.
II.3 Revue de la littérature sur le rapport coût/efficacité du PNEU-C-15 et du PNEU-C-20
Revue systématique du rapport coût/efficacité des vaccins PNEU-C-15 et PNEU-C-20 pour prévenir l'IIP. La recherche a porté sur des évaluations économiques réalisées chez des adultes de 18 ans ou plus, comparant les vaccins actuellement utilisés pour prévenir l'IIP avec le PNEU-C-15 ou le PNEU-C-20. Les composantes de la question de recherche sont résumées comme suit :
- Population : Adultes de 18 ans ou plus
- Intervention : PNEU-C-15 ou PNEU-C-20 (seul ou en série avec d'autres vaccins contre le pneumocoque)
- Comparateur : Vaccins contre le pneumocoque actuels (PNEU-C-7, PNEU-C-10, PNEU-C-13, PNEU-P-23)
- Résultats : Mesures du rapport coût/efficacité (coût différentiel par année de vie ajustée par la qualité [AVAQ], coût différentiel par année de vie corrigée du facteur invalidité [CCFI], coût par année de vie, etc.)
Des détails supplémentaires sur la revue de la littérature économique sont fournis dans une annexe sur les données probantes économiques supplémentaires.
II.4 Analyse coût/utilité et comparaison à modèles multiples du CCNI
Une analyse coût/utilité fondée sur un modèle a été réalisée des points de vue du système de santé et de la société. Un modèle de cohorte de Markov a été élaboré pour comparer les avantages (en AVAQ) et les coûts (en dollars canadiens de 2022) associés à l'utilisation du PNEU-C-15 ou du PNEU-C-20, seul ou en série avec le PNEU-P-23, en comparaison du PNEU-P-23 seul. La vaccination a été évaluée à l'âge de 50, de 65 ou de 75 ans. Les Territoires du Nord canadien ont été évalués séparément du reste du Canada pour tenir compte de l'incidence accrue de l'IP dans le Nord. Le principal résultat était le rapport coût/efficacité différentiel (RCED). L'analyse a utilisé un horizon temporel à vie et un taux d'actualisation de 1,5 %. Des analyses de scénario et de sensibilité ont été réalisées pour examiner l'impact des incertitudes dans les paramètres et les hypothèses du modèle.
Afin d'évaluer la robustesse du modèle coût/utilité, une comparaison à modèles multiples a été réalisée à l'aide de 2 autres modèles coût/utilité développés par les fabricants du PNEU-C-15 et du PNEU-C-20 avec des structures et des hypothèses différentes. Dans la mesure du possible, tous les modèles ont été modifiés pour utiliser les mêmes paramètres d'entrée. Les RCED pour un seul scénario de référence ont été comparés entre les modèles.
Des détails supplémentaires sur l'analyse coût/utilité et la comparaison à modèles multiples sont fournis dans une annexe de données probantes économiques supplémentaires.
III. Épidémiologie
III.1 Fardeau de la pneumococcie au Canada
D'après les données du SCSMDO, le taux d'incidence de l'IIP chez les enfants de moins de 5 ans a diminué, pour passer de 41,8 cas à 15,7 cas par 100 000 habitants de 2003 à 2006. Après quelques années d'augmentation de l'incidence, les taux d'incidence de l'IIP chez les enfants de moins de 5 ans sont demeurés relativement stables à environ 12 cas par 100 000 habitants depuis 2012 (Figure 1). Les enfants de 5 à 17 ans ont toujours eu le taux d'incidence le plus faible d'IIP, restant inférieur à 5 cas par 100 000 habitants pendant la période d'étude de 2001 à 2019. Les Canadiens de 18 à 49 ans, de 50 à 64 ans et de 65 ans et plus ont présenté des tendances similaires avec une augmentation de l'incidence de l'IIP de 2001 à 2004, probablement en raison de l'amélioration des diagnostics et des déclarations, suivie de taux d'incidence relativement stables au cours des 15 années suivantes. Le taux d'incidence chez les adultes de 65 ans et plus a été signalé comme étant systématiquement plus élevé d'environ 10 à 15 cas par 100 000 habitants que chez les adultes de 50 à 64 ans (p. ex., en 2019, il a été signalé à 25 cas et 14 cas par 100 000 habitants, respectivement). Les adultes de 18 à 49 ans ont toujours eu le deuxième taux d'incidence le plus faible d'IIP par rapport aux autres groupes d'âge, maintenant une incidence d'environ 5 cas par 100 000 habitants de 2001 à 2019.
Figure 1 : Taux d'incidence annuel de l'infection invasive à pneumocoques par groupe d'âge déclaré au Système canadien de surveillance des maladies à déclaration obligatoire, 2001-2019
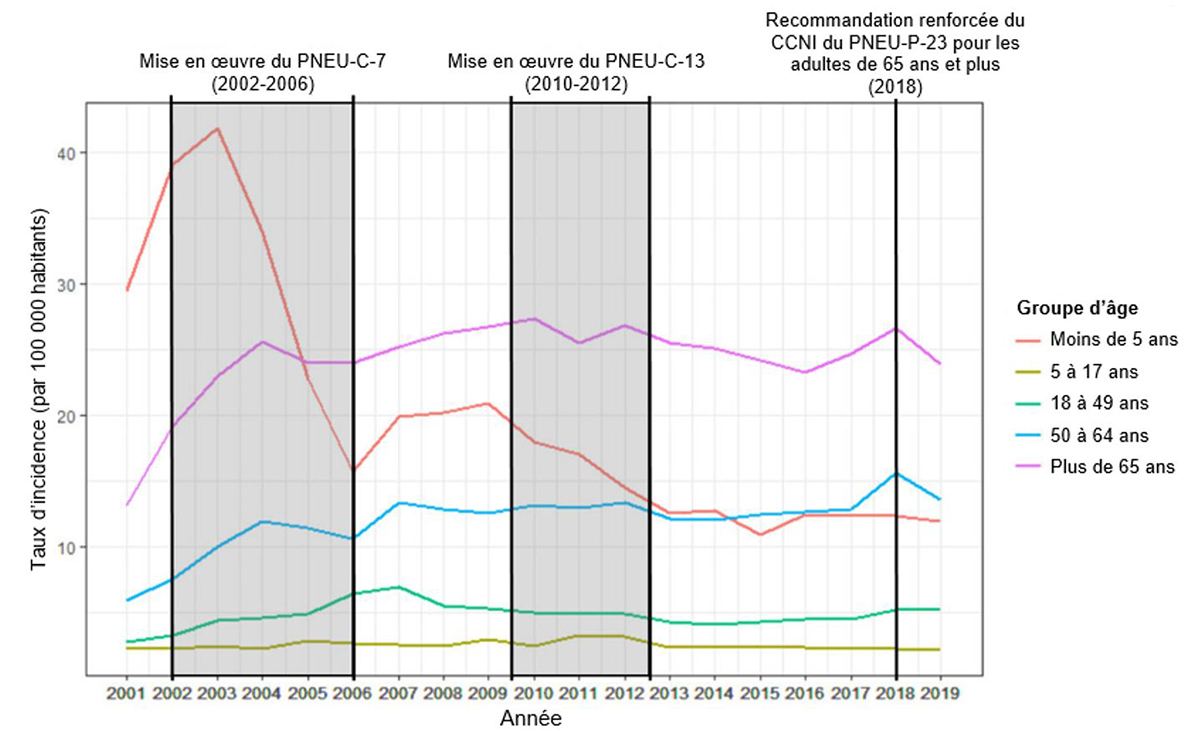
Description longue
La Figure 1 montre le taux d'incidence de l'IIP (axe vertical) par 100 000 habitants par année par incréments d'un an (axe horizontal) de 2001 à 2019 au Canada, regroupés par catégorie d'âge. Les cases ombragées fournissent un contexte supplémentaire concernant la mise en œuvre du PNEU-C-7 pour la population pédiatrique (2002-2006) et du PNEU-C-13 pour la population pédiatrique (2010-2012) au Canada. La recommandation du PNEU-P-23 pour tous les Canadiens de 65 ans et plus (2018) est indiquée par une ligne. Les taux d'incidence ont été calculés à l'aide des données du programme SCI pour les 3 territoires du Canada, et des données du SCSMDO pour les 6 provinces pour lesquelles des données sur la liste des lignes étaient disponibles (AB, CB, ON, QC, SK et IPE).
| Année | Groupe d’âge | Taux d’incidence (par 100,000 habitants) |
|---|---|---|
| 2001 | Moins de 5 ans | 29.5 |
| 5 à 17 ans | 2.2 | |
| 18 à 49 ans | 2.7 | |
| 50 à 64 ans | 5.9 | |
| 65 ans et plus | 13.2 | |
| 2002 | Moins de 5 ans | 39.1 |
| 5 à 17 ans | 2.2 | |
| 18 à 49 ans | 3.2 | |
| 50 à 64 ans | 7.5 | |
| 65 ans et plus | 19.2 | |
| 2003 | Moins de 5 ans | 41.8 |
| 5 à 17 ans | 2.4 | |
| 18 à 49 ans | 4.4 | |
| 50 à 64 ans | 10.0 | |
| 65 ans et plus | 22.9 | |
| 2004 | Moins de 5 ans | 34.0 |
| 5 à 17 ans | 2.2 | |
| 18 à 49 ans | 4.6 | |
| 50 à 64 ans | 11.9 | |
| 65 ans et plus | 25.5 | |
| 2005 | Moins de 5 ans | 22.7 |
| 5 à 17 ans | 2.9 | |
| 18 à 49 ans | 4.9 | |
| 50 à 64 ans | 11.4 | |
| 65 ans et plus | 23.9 | |
| 2006 | Moins de 5 ans | 15.7 |
| 5 à 17 ans | 2.6 | |
| 18 à 49 ans | 6.4 | |
| 50 à 64 ans | 10.5 | |
| 65 ans et plus | 24.0 | |
| 2007 | Moins de 5 ans | 19.8 |
| 5 à 17 ans | 2.5 | |
| 18 à 49 ans | 6.9 | |
| 50 à 64 ans | 13.3 | |
| 65 ans et plus | 25.1 | |
| 2008 | Moins de 5 ans | 20.2 |
| 5 à 17 ans | 2.4 | |
| 18 à 49 ans | 5.5 | |
| 50 à 64 ans | 12.8 | |
| 65 ans et plus | 26.2 | |
| 2009 | Moins de 5 ans | 20.9 |
| 5 à 17 ans | 2.9 | |
| 18 à 49 ans | 5.3 | |
| 50 à 64 ans | 12.5 | |
| 65 ans et plus | 26.7 | |
| 2010 | Moins de 5 ans | 17.9 |
| 5 à 17 ans | 2.5 | |
| 18 à 49 ans | 4.9 | |
| 50 à 64 ans | 13.1 | |
| 65 ans et plus | 27.3 | |
| 2011 | Moins de 5 ans | 17.0 |
| 5 à 17 ans | 3.2 | |
| 18 à 49 ans | 4.8 | |
| 50 à 64 ans | 12.9 | |
| 65 ans et plus | 25.5 | |
| 2012 | Moins de 5 ans | 14.4 |
| 5 à 17 ans | 3.1 | |
| 18 à 49 ans | 4.9 | |
| 50 à 64 ans | 13.4 | |
| 65 ans et plus | 26.8 | |
| 2013 | Moins de 5 ans | 12.5 |
| 5 à 17 ans | 2.3 | |
| 18 à 49 ans | 4.3 | |
| 50 à 64 ans | 12.1 | |
| 65 ans et plus | 25.4 | |
| 2014 | Moins de 5 ans | 12.7 |
| 5 à 17 ans | 2.3 | |
| 18 à 49 ans | 4.1 | |
| 50 à 64 ans | 12.0 | |
| 65 ans et plus | 25.1 | |
| 2015 | Moins de 5 ans | 10.9 |
| 5 à 17 ans | 2.4 | |
| 18 à 49 ans | 4.2 | |
| 50 à 64 ans | 12.4 | |
| 65 ans et plus | 24.2 | |
| 2016 | Moins de 5 ans | 12.4 |
| 5 à 17 ans | 2.3 | |
| 18 à 49 ans | 4.5 | |
| 50 à 64 ans | 12.6 | |
| 65 ans et plus | 23.3 | |
| 2017 | Moins de 5 ans | 12.3 |
| 5 à 17 ans | 2.2 | |
| 18 à 49 ans | 4.4 | |
| 50 à 64 ans | 12.8 | |
| 65 ans et plus | 24.7 | |
| 2018 | Moins de 5 ans | 12.3 |
| 5 à 17 ans | 2.2 | |
| 18 à 49 ans | 5.2 | |
| 50 à 64 ans | 15.6 | |
| 65 ans et plus | 26.6 | |
| 2019 | Moins de 5 ans | 11.9 |
| 5 à 17 ans | 2.1 | |
| 18 à 49 ans | 5.2 | |
| 50 à 64 ans | 13.6 | |
| 65 ans et plus | 23.8 |
L'incidence de l'IIP est directement proportionnelle à l'âge chez les personnes de 50 ans et plus (Figure 2). De 2011 à 2019, les taux d'incidence de l'IIP étaient les plus élevés dans le groupe d'âge le plus élevé (de 85 ans et plus). Dans les autres groupes d'âge, les taux d'incidence ont légèrement fluctué mais sont restés relativement stables de 2011 à 2019. Chez les Canadiens de 85 ans et plus, l'incidence a toutefois diminué de 50 à 40 cas par 100 000 habitants entre 2011 et 2016. Après 2016, les taux d'incidence ont fluctué entre 39 et 46 cas par 100 000 habitants, avec une moyenne de 42 cas par 100 000 habitants. Les taux d'incidence dans les autres groupes d'âge étaient d'environ 12 ou 13 cas par 100 000 habitants dans le groupe des 50 à 64 ans; de 19 ou 20 cas par 100 000 habitants dans le groupe des 65 à 74 ans, et de 26 à 28 cas par 100 000 habitants dans le groupe des 75 à 84 ans.
Figure 2. Taux d'incidence annuel de l'IIP chez les adultes canadiens de 50 ans et plus, déclaré au Système canadien de surveillance des maladies à déclaration obligatoire, 2001-2019
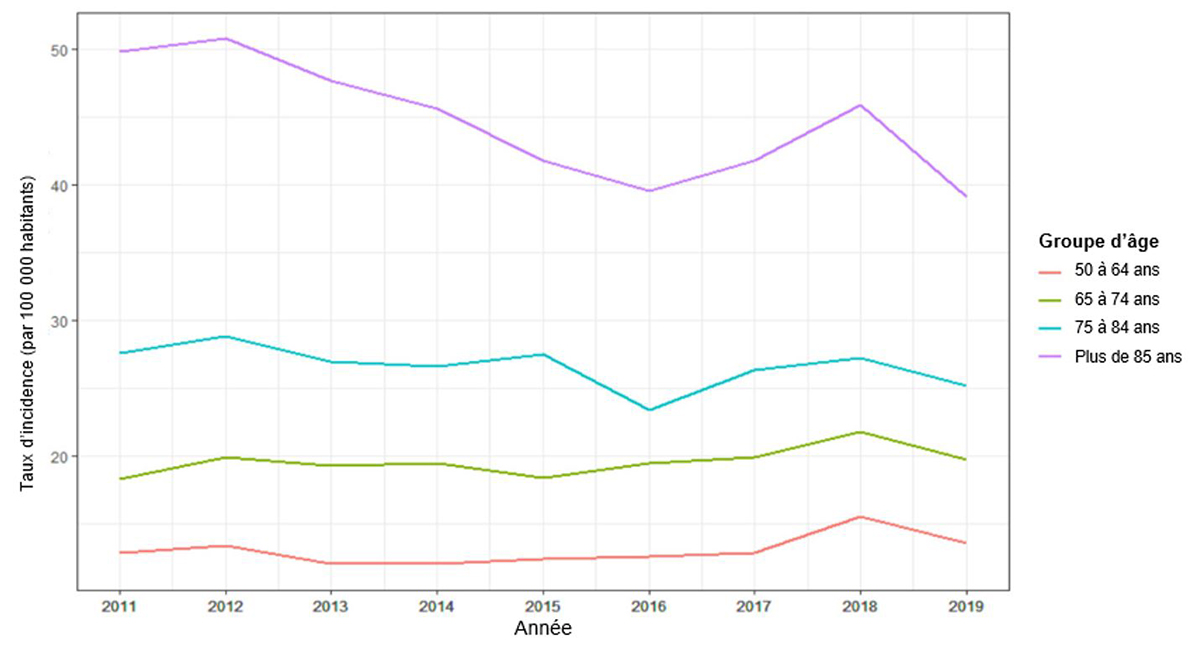
Description longue
La Figure 2 montre le taux d'incidence de l'IIP chez les Canadiens de plus de 50 ans pour 100 000 habitants (axe vertical) de 2011 à 2019 avec des incréments d'un an (axe horizontal), regroupés par catégorie d'âge. Les catégories d'âge utilisées permettent de comparer l'incidence de l'IIP dans la population adulte canadienne et sont représentées par des couleurs distinctes (de 50 à 64 ans en rouge, de 65 à 74 ans en vert, de 75 à 84 ans en turquoise et plus de 85 ans en violet). Les taux d'incidence ont été calculés à l'aide des données du programme SCI pour les 3 territoires du Canada, et des données du SCSMDO pour les 6 provinces pour lesquelles des données sur la liste des lignes étaient disponibles (AB, CB, ON, QC, SK et IPE).
| Année | Groupe d’âge | Taux d’incidence (par 100,000 habitants) |
|---|---|---|
|
2011 |
50 à 64 ans | 12.9 |
| 65 à 74 ans | 18.3 | |
| 75 à 84 ans | 27.6 | |
| 85 ans et plus | 49.8 | |
|
2012 |
50 à 64 ans | 13.4 |
| 65 à 74 ans | 19.9 | |
| 75 à 84 ans | 28.8 | |
| 85 ans et plus | 50.8 | |
|
2013 |
50 à 64 ans | 12.1 |
| 65 à 74 ans | 19.3 | |
| 75 à 84 ans | 26.9 | |
| 85 ans et plus | 47.6 | |
|
2014 |
50 à 64 ans | 12.0 |
| 65 à 74 ans | 19.5 | |
| 75 à 84 ans | 26.6 | |
| 85 ans et plus | 45.7 | |
|
2015 |
50 à 64 ans | 12.4 |
| 65 à 74 ans | 18.3 | |
| 75 à 84 ans | 27.5 | |
| 85 ans et plus | 41.8 | |
|
2016 |
50 à 64 ans | 12.6 |
| 65 à 74 ans | 19.5 | |
| 75 à 84 ans | 23.4 | |
| 85 ans et plus | 39.5 | |
|
2017 |
50 à 64 ans | 12.8 |
| 65 à 74 ans | 19.9 | |
| 75 à 84 ans | 26.3 | |
| 85 ans et plus | 41.8 | |
|
2018 |
50 à 64 ans | 15.6 |
| 65 à 74 ans | 21.8 | |
| 75 à 84 ans | 27.2 | |
| 85 ans et plus | 45.8 | |
|
2019 |
50 à 64 ans | 13.6 |
| 65 à 74 ans | 19.7 | |
| 75 à 84 ans | 25.2 | |
| 85 ans et plus | 39.1 |
Le Toronto Invasive Bacterial Diseases Network (TIBDN)Note de bas de page 14, un programme de surveillance active dans la métropole de Toronto et la région de Peel, a constaté qu'entre 2012-2013 et 2018-2019, l'incidence de l'IIP chez les adultes de 15 à 64 ans a augmenté de manière significative, passant de 3,7 à 5,4 cas/100 000/an. Au cours de cette même période, l'incidence de l'IIP chez les adultes de 65 ans et plus est passée de 22,8 à 18,7 cas/100 000/an; toutefois, ce changement n'était pas significatif. Le TIBDN a également constaté que de 2018-2019 à 2020, l'incidence de l'IIP chez les adultes de 15 à 64 ans est passée de 5,4 à 2,6 cas/100 000/an et l'incidence de l'IIP chez les adultes de 65 ans et plus est passée de 18,7 à 8,7 cas/100 000/an.
III.1.2 Incidence de l'infection invasive à pneumocoques dans le nord du Canada
Le taux d'incidence normalisé selon l'âge dans le nord du Canada, basé sur les données soumises à SCI, était significativement plus élevé (25,8 cas par 100 000 habitants, intervalle de confiance [IC] à 95 % : 23,5 à 28,1 %) que dans le reste du Canada (9,1 cas par 100 000 habitants, IC à 95 % : 9,1 à 9,2 %) entre 2001 et 2019 (Figure 3)Note de bas de page 15.
Dans le nord du Canada, le taux d'incidence de l'IIP chez les Canadiens autochtones était significativement plus élevé, soit 31,3 cas par 100 000 habitants par an, que chez les Canadiens non autochtones, soit 7,0 cas par 100 000 habitants par an (p<0,0001) pour la même périodeNote de bas de page 15.
Figure 3. Taux d'incidence annuel de l'infection invasive à pneumocoques dans le nord du Canada, Surveillance circumpolaire internationale 2001-2021, et dans le reste du Canada, 2001-2019, SCSMDO
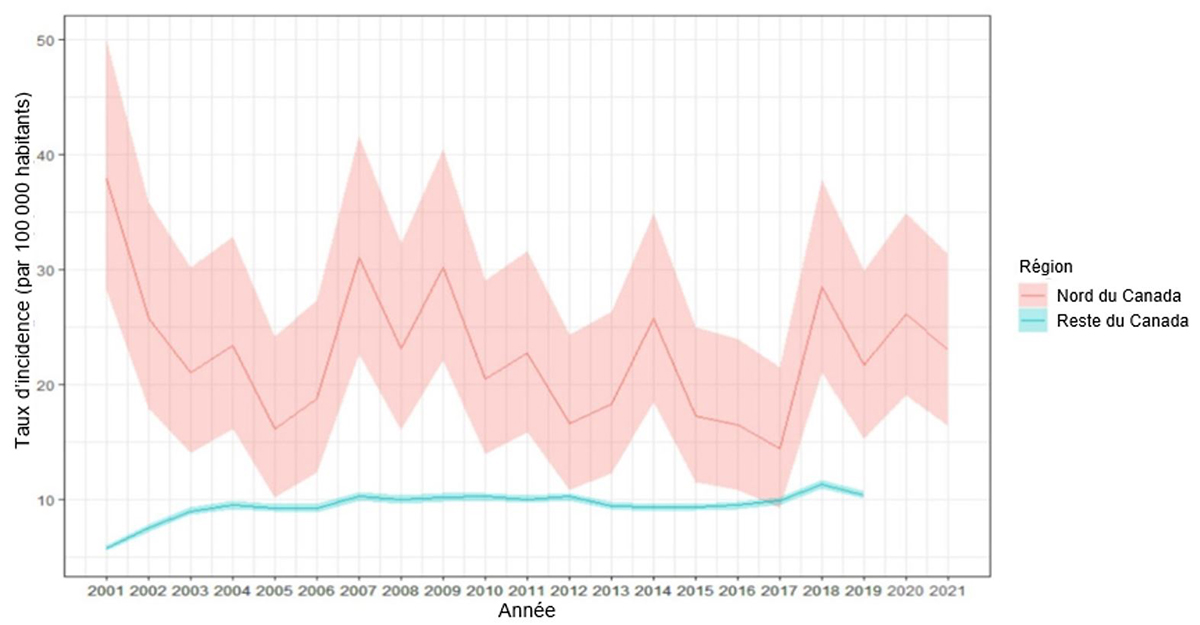
Description longue
La Figure 3 montre la comparaison des taux d'incidence annuels de l'IIP avec des intervalles de confiance à 95 % entre le nord du Canada (en rouge) et le reste du Canada (en bleu) pour 100 000 habitants (axe vertical) de 2001 à 2021 (axe horizontal). Les données du nord du Canada ont été extraites du programme SCI et comprennent les 3 territoires du Canada (Nunavut, Yukon et Territoires du Nord-Ouest), ainsi que le nord du Labrador et le nord du Québec. Les données pour le reste du Canada proviennent du SCSMDO. Les données sur l'IIP pour le reste du Canada pour les années 2020-2021 n'étaient pas encore disponibles.
Le taux d'incidence de l'IIP était constamment et significativement plus élevé dans le nord du Canada par rapport au reste du Canada, à l'exception de l'année 2017, où le taux d'incidence de la maladie était le plus faible dans le nord du Canada, soit environ 15 cas pour 100 000 habitants. Cette année, l'incidence était encore plus élevée dans le nord du Canada mais pas de manière significative. Le taux d'incidence global maximal de l'IIP dans le nord du Canada a été enregistré en 2001, avec 38 cas pour 100 000 habitants. Le taux d'incidence a ensuite diminué à 16 cas pour 100 000 habitants en 2005, à la suite de l'introduction de la vaccination pédiatrique contre le pneumocoque au Canada. Depuis 2005, le taux d'incidence de l'IIP a fluctué mais est resté relativement stable, et a été estimé pour la dernière fois à 23 cas pour 100 000 habitants en 2021. Les cas de la maladie sont restés légèrement élevés de 2018 à 2021 par rapport à 2015 à 2017.
| Année | Nord du Canada Incidence brute (par 100,000 habitants) |
Reste du Canada Incidence brute (par 100,000 habitants) |
|---|---|---|
| 2001 | 37.95 | 5.58 |
| 2002 | 25.78 | 7.24 |
| 2003 | 21.02 | 8.66 |
| 2004 | 23.39 | 9.19 |
| 2005 | 16.12 | 8.94 |
| 2006 | 18.78 | 8.92 |
| 2007 | 31.07 | 9.94 |
| 2008 | 23.12 | 9.67 |
| 2009 | 30.23 | 9.83 |
| 2010 | 20.51 | 9.90 |
| 2011 | 22.74 | 9.69 |
| 2012 | 16.61 | 9.92 |
| 2013 | 18.32 | 9.14 |
| 2014 | 25.71 | 9.00 |
| 2015 | 17.30 | 9.04 |
| 2016 | 16.49 | 9.19 |
| 2017 | 14.46 | 9.59 |
| 2018 | 28.49 | 10.96 |
| 2019 | 21.72 | 10.08 |
III.2 Distribution des sérotypes de l'infection invasive à pneumocoques au Canada, 2016-2020
Distribution des sérotypes de l'infection invasive à pneumocoques au Canada, 2016-2020.
De 2016 à 2020, 15 234 isolats combinés de S. pneumoniae causant des maladies invasives ont été caractérisés par le LNM, 34 % d'entre eux étant repérés chez des adultes de 65 ans ou plus. La majorité des cas d'IIP ont été causés par des sérotypes contenus dans le vaccin (Figure 4). Les sérotypes 3 et 22F ont été établis comme étant les causes les plus fréquentes de l'IIP dans l'ensemble et chez les adultes plus âgés sur la base des isolats soumis au LNM (Figure 4).
Globalement, la proportion d'isolats d'IIP inclus dans chaque vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15 et PNEU-P-23/non-PNEU-C-20) est restée relativement stable depuis 2016 (Figure 5). En 2020, chez les adultes de 65 ans ou plus, 27,4 % des sérotypes en circulation étaient inclus dans le PNEU-C-13, 40,6 % dans le PNEU-C-15, 55,8 % dans le PNEU-C-20 et 66,9 % dans le PNEU-P-23. Les sérotypes en circulation non couverts par un vaccin contre le pneumocoque s'élevaient à 33,1 %.
La distribution des sérotypes pour l'IIP chez les adultes est résumée dans l'Annexe A, Tableaux 21-23.
Figure 4. Proportion d'isolats de S. pneumoniae invasif pour tous les âges et les adultes de 65 ans et plus au Canada, par sérotype, 2016 à 2020, total combiné
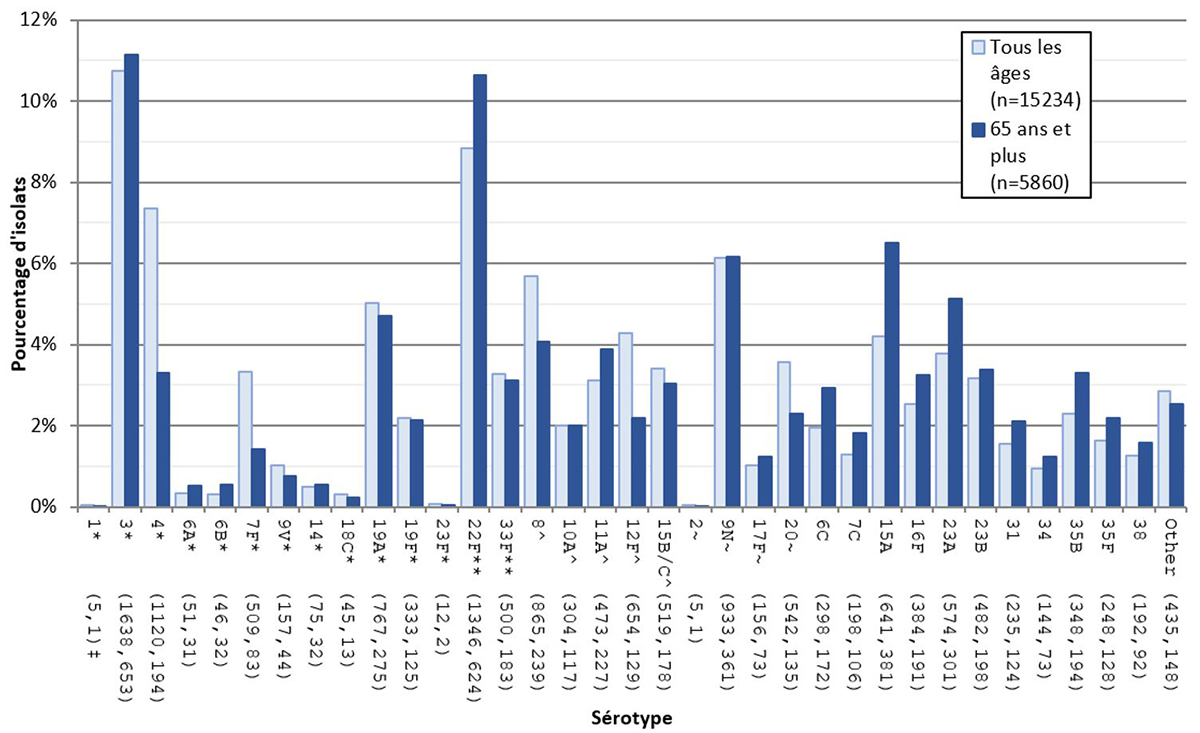
* Composante du PNEU-C-13; ** Composante du PNEU-C-15; ^ Composante du PNEU-C-20; ~ Composante du PNEU-P-23; ‡ Nombre d'isolats pour tous les âges et les adultes de 65 ans et plus, respectivement (2016-2020, total combiné).
Description longue
Un graphique à barres affichant le pourcentage de ST de Streptococcus pneumoniae de 2016 à 2020 (total combiné) sur la base du nombre total d'isolats testés annuellement, pour tous les âges et les adultes de 65 ans et plus.
| Sérotype (n par groupe d’âge) | Tous les âges (n=15234) | 65 ans et plus (n=5860) |
|---|---|---|
| 1* (5,1)‡ | 0.0% | 0.0% |
| 3* (1638,653) | 10.8% | 11.1% |
| 4* (1120,194) | 7.4% | 3.3% |
| 6A* (51,31) | 0.3% | 0.5% |
| 6B* (46,32) | 0.3% | 0.5% |
| 7F* (509,83) | 3.3% | 1.4% |
| 9V* (157,44) | 1.0% | 0.8% |
| 14* (75,32) | 0.5% | 0.5% |
| 18C* (45,13) | 0.3% | 0.2% |
| 19A* (767,275) | 5.0% | 4.7% |
| 19F* (333,125) | 2.2% | 2.1% |
| 23F* (12,2) | 0.1% | 0.0% |
| 22F** (1346,624) | 8.8% | 10.6% |
| 33F** (500,183) | 3.3% | 3.1% |
| 8^ (865,239) | 5.7% | 4.1% |
| 10A^ (304,117) | 2.0% | 2.0% |
| 11A^ (473,227) | 3.1% | 3.9% |
| 12F^ (654,129) | 4.3% | 2.2% |
| 15B/C^(519,178) | 3.4% | 3.0% |
| 2~ (5,1) | 0.0% | 0.0% |
| 9N~ (933,361) | 6.1% | 6.2% |
| 17F~ (156,73) | 1.0% | 1.2% |
| 20~ (542,135) | 3.6% | 2.3% |
| 6C (298,172) | 2.0% | 2.9% |
| 7C (198,106) | 1.3% | 1.8% |
| 15A (641,381) | 4.2% | 6.5% |
| 16F (384,191) | 2.5% | 3.3% |
| 23A (574,301) | 3.8% | 5.1% |
| 23B (482,198) | 3.2% | 3.4% |
| 31 (235,124) | 1.5% | 2.1% |
| 34 (144,73) | 0.9% | 1.2% |
| 35B (348,194) | 2.3% | 3.3% |
| 35F (248,128) | 1.6% | 2.2% |
| 38 (192,92) | 1.3% | 1.6% |
| Autres (435,148) | 2.9% | 2.5% |
La Figure 5 montre la proportion d'isolats d'IIP par année parmi tous les isolats testés et les personnes âgées. En 2020, la proportion d'isolats avec PNEU-C-20/non-PNEU-C-13 (c.-à-d. les sérotypes 8, 10A, 11A, 12F, 15B/C, 22F et 33F) parmi tous les cas d'IIP représentait 30,4 % et parmi les cas d'IIP chez les adultes de 65 ans ou plus, 28,4. La proportion d'IIP isolée incluse dans chaque vaccin chez les jeunes adultes de 18 à 49 ans et de 50 à 64 ans est présentée à l'Annexe A (Figure 6).
Figure 5. Proportion d'isolats de l'infection invasive à pneumocoques de 2016 à 2020 par vaccin, pour tous les âges et les adultes de 65 ans et plus
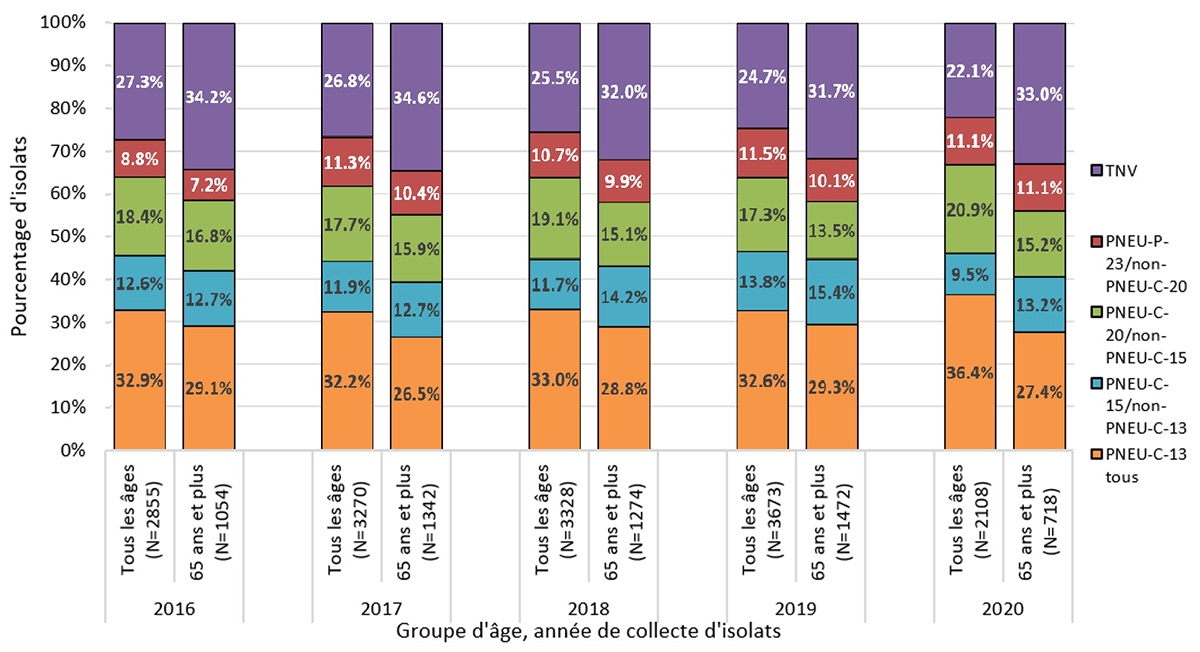
*Les sérotypes vaccinaux comprennent le PNEU-C-13 (1, 3, 4, 5, 6A/C, 6B, 7F, 9V, 14, 19A, 19F, 18C, 23F); le PNEU-C-15 (tous les PNEU-C-13 plus 22F et 33F); le PNEU-C-20 (tous les PNEU-C-15 plus 8, 10A, 11A, 12F, 15 B/C) et le PNEU-P-23 (sérotypes PNEU-C-20 sauf 6A, plus 2, 9N, 17F, 20); TNV = tous les sérotypes non inclus dans le PNEU-C-13, le PNEU-C-15, le PNEU-C-20 et le PNEU-P-23. Sérotype 6C inclus dans les sérotypes du PNEU-C-13 en raison de la protection croisée avec le 6A. Les sérotypes 15B et 15C ont été regroupés sous l'appellation 15B/C en raison du passage réversible entre les 2 types de sérotypes rapportés in vivo au cours de l'infection, ce qui rend difficile une différenciation précise entre les 2 types.
Description longue
Un graphique à barres empilées affichant le pourcentage de Streptococcus pneumoniae collecté dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres ST non vaccinaux), pour tous les âges et les adultes de 65 ans et plus, de 2016 à 2020.
| Groupe d’âge | Année | PNEU-C-13 (%, N) |
PNEU-C-15/ non-PNEU-C-13 (%, N) |
PNEU-C-20/ non-PNEU-C-15 (%, N) |
PNEU-P-23/ non-PNEU-C-20 (%, N) |
TNV (%, N) |
Totale | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tous les âges | 2016 | 32.9% | (938) | 12.6% | (360) | 18.4% | (526) | 8.8% | (251) | 27.3% | (780) | (2855) |
| 2017 | 32.2% | (1054) | 11.9% | (390) | 17.7% | (578) | 11.3% | (371) | 26.8% | (877) | (3270) | |
| 2018 | 33.0% | (1099) | 11.7% | (388) | 19.1% | (634) | 10.7% | (357) | 25.5% | (850) | (3328) | |
| 2019 | 32.6% | (1198) | 13.8% | (507) | 17.3% | (637) | 11.5% | (423) | 24.7% | (908) | (3673) | |
| 2020 | 36.4% | (767) | 9.5% | (201) | 20.9% | (440) | 11.1% | (234) | 22.1% | (466) | (2108) | |
| 65 ans et plus | 2016 | 29.1% | (307) | 12.7% | (134) | 16.8% | (177) | 7.2% | (76) | 34.2% | (360) | (1054) |
| 2017 | 26.5% | (355) | 12.7% | (171) | 15.9% | (213) | 10.4% | (139) | 34.6% | (464) | (1342) | |
| 2018 | 28.8% | (367) | 14.2% | (181) | 15.1% | (192) | 9.9% | (126) | 32.0% | (408) | (1274) | |
| 2019 | 29.3% | (431) | 15.4% | (226) | 13.5% | (199) | 10.1% | (149) | 31.7% | (467) | (1472) | |
| 2020 | 27.4% | (197) | 13.2% | (95) | 15.2% | (109) | 11.1% | (80) | 33.0% | (237) | (718) | |
Distribution des sérotypes de l'infection invasive à pneumocoques dans le nord du Canada
La distribution de l'IIP dans le nord du Canada a été évaluée à l'aide de données provenant des 5 régions arctiques saisies dans le système SCI. Au total, 159 isolats de S. pneumoniae invasif ont été caractérisés entre 2016 et 2020 : 26 % des isolats de S. pneumoniae étaient des sérotypes de PNEU-C-13, 14 % des sérotypes de PNEU-C-15/non-PNEU-C-13, 23 % des sérotypes de PNEU-C-20/non-PNEU-C-15, 20 % des sérotypes de PNEU-P-23/non-PNEU-C-20 et 16 % des sérotypes de type non vaccinal. Toutefois, les tendances étaient difficiles à établir en raison du petit nombre de cas et de la population relativement moins nombreuse dans le nord.
III.3 Fardeau de la pneumonie d'origine communautaire à pneumocoques au Canada
À l'aide des données de Surveillance des cas graves (SOS) du Réseau canadien de recherche sur l'immunisation (RCRI) provenant de 13 hôpitaux répartis dans 5 provinces, Leblanc et al. (2022) ont rapporté l'incidence de la POC chez les adultes hospitalisés de 2010 à 2017Note de bas de page 16. Au cours de cette période, 14,2 % (1 264/8 912) des POC toutes causes confondues étaient attribuables à S. pneumoniae, 64,1 % (811/1264) étant non bactériémiques et 35,9 % (455/1264) étant bactériémiques. Parmi les cas de POC à S. pneumoniae chez les adultes, 49,8 % sont survenus chez les plus de 65 ans, 31,3 % chez les 50 à 64 ans et 19,0 % chez les 16 à 49 ans. Parmi tous les cas de POC à S. pneumoniae, 89,1 % présentaient une ou plusieurs comorbidités et 28,6 % présentant une maladie immunodéficiente. Parmi tous les cas de POC à S. pneumoniae recensés pendant la période d'étude, la distribution des sérotypes a montré que les sérotypes 3, 7F, 9N, 11A, 19A et 22F étaient courants.
Les données de la Base de données des résumés de congés de 2018 à 2019 (Institut canadien d'information sur la santé, 2022) ont fait état de cas de POC par 100 000 patients hospitalisés avec la pneumonie comme diagnostic important (à l'exclusion de la pneumonie causée par la grippe). Ces données montrent que pour les adultes de 75 ans et plus, il y avait 5 104 cas/100 000 habitants dans le nord du Canada et 2 846 cas/100 000 habitants dans le reste du Canada; pour les adultes de 60 à 74 ans, on comptait 1 777 cas/100 000 habitants dans le nord du Canada et 871 cas/100 000 habitants dans le reste du Canada, et pour les adultes de 50 à 64 ans, on calculait 569 cas/100 000 habitants dans le nord du Canada et 348 cas/100 000 habitants dans le reste du Canada.
III.4 Groupes à haut risque
Le TIBDNNote de bas de page 17 a constaté que, dans sa population, l'incidence de l'IIP chez les personnes de 15 à 64 ans souffrant d'une maladie chronique sous-jacente a augmenté de manière significative, passant de 7,3 cas/100 000/an en 2012 à 11,0 cas/100 000/an en 2019. Au cours de la même période, l'incidence de l'IIP chez les adultes de 65 ans et plus a diminué chez les personnes présentant une maladie sous-jacente, principalement parce que les cas d'IIP attribuables aux sérotypes contenus dans le PNEU-C-13 sont passés de 10,0 à 4,6 cas/100 000/an chez les personnes présentant une maladie chronique sous-jacente, et de 27,0 à 16,0 cas/100 000/an chez les personnes présentant une maladie immunodéficiente.
CASPER (Calgary Area Streptococcus pneumoniae Epidemiology Research)Note de bas de page 18, un programme de surveillance active à Calgary, a révélé qu'entre 2000 et 2013, le taux d'incidence de l'IIP chez les adultes présentant des comorbidités sous-jacentes a diminué de 37 % (de 11,8 cas/100 000/an avant l'introduction des vaccins conjugués contre le pneumocoque [2000-2001] à 7,4 cas/100 000/an dans la période post-PNEU-C-13 [2010-2013]).
III.5 Résumé de la couverture vaccinale antipneumococcique au Canada
Le programme de surveillance de la couverture et de l'ER des vaccins de l'ASPC recueille des renseignements sur la couverture vaccinale contre le pneumocoque chez les Canadiens dans le cadre de l'enquête sur la couverture vaccinale contre la grippe saisonnièreNote de bas de page 19. L'enquête la plus récente menée au cours de la saison grippale 2020-2021 a montré qu'environ 55 % des adultes de 65 ans et plus ont déclaré avoir reçu un vaccin contre le pneumocoque à l'âge adulte. La couverture était plus élevée chez les femmes (60 %) que chez les hommes (40 %). Dans l'ensemble, 26 % des adultes de 18 à 64 ans présentant une pathologie sous-jacente ont déclaré avoir reçu un vaccin contre le pneumocoque. L'enquête ne fait aucune distinction entre les 2 vaccins contre le pneumocoque recommandés pour les adultes.
IV. Vaccin
IV.1 Préparation autorisée au Canada
Quatre formulations de vaccin contre le pneumocoque sont actuellement autorisées pour les adultes au Canada (Tableau 2).
Le PNEU-C-13 (PrevnarMD 13)Note de bas de page 20 est une solution stérile d'antigènes capsulaires polysaccharidiques de 13 sérotypes de S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F et 23F). Chaque antigène est conjugué séparément à une protéine diphtérique porteuse Corynebacterium diphtheriae (CRM)197. Cette protéine est adsorbée sur du phosphate d'aluminium à titre d'adjuvant. Chaque dose de vaccin contient 4,4 microgrammes (mcg) de polysaccharide pour le sérotype 6B et 2,2 mcg de polysaccharide pour chacun des autres sérotypes. Le PNEU-C-13 est disponible sous forme de seringue préremplie à dose unique de 0,5 ml.
Le PNEU-C-15 (VaxneuvanceMD)Note de bas de page 21 est une suspension stérile de polysaccharides capsulaires purifiés provenant de 15 sérotypes de S. pneumoniae (sérotypes PCV13 plus sérotypes 22F et 33F). Chaque antigène est conjugué séparément à une protéine diphtérique porteuse CRM197. Cette protéine est adsorbée sur du phosphate d'aluminium à titre d'adjuvant. Chaque dose de vaccin contient 32 mcg de polysaccharide pneumococcique total (2,0 mcg de chacun des polysaccharides de sérotypes 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F, et 4,0 mcg de polysaccharide de sérotype 6B) conjugué à 30 mcg de protéine porteuse CRM197. Le PNEU-C-15 est disponible sous forme de seringue préremplie à dose unique de 0,5 ml.
Le PNEU-C-20 (Prevnar 20MC)Note de bas de page 22 est une suspension stérile de saccharides des antigènes capsulaires de 20 sérotypes de S. pneumoniae (sérotypes PCV13 + sérotypes 8, 10 A, 11A, 12F, 15B, 22F et 33F). Chaque antigène est conjugué séparément à une protéine diphtérique non toxique CRM197. Cette protéine porteuse est absorbée sur du phosphate d'aluminium à titre d'adjuvant. Chaque dose de vaccin contient 4,4 mcg de polysaccharide pour le sérotype 6B et 2,2 mcg de polysaccharide pour chacun des autres sérotypes. Le PNEU-C-20 est disponible sous forme de seringue préremplie à dose unique de 0,5 ml.
Le PNEU-P-23 (PneumovaxMD 23)Note de bas de page 23 est une solution stérile de 23 polysaccharides capsulaires hautement purifiés (sérotypes PCV13 à l'exception du 6 A, plus les sérotypes 2, 9N,17F et 20). Le PNEU-P-23 est disponible sous forme d'un flacon unidose contenant 0,5 ml de vaccin liquide et une seringue préremplie à dose unique de 0,5 ml.
| PREVNARMD 13 (PNEU-C-13) |
VAXNEUVANCEMD (PNEU-C-15) | PREVNAR 20MC (PNEU-C-20) |
PNEUMOVAX 23MD (PNEU-P-23) |
|
|---|---|---|---|---|
Fabricant |
Pfizer |
Merck |
Pfizer |
Merck |
Date de l'autorisation initiale au Canada |
21 décembre 2009 |
16 novembre 2021 |
9 mai 2022 |
23 décembre 1983 |
Type vaccinal |
Vaccin conjugué |
Vaccin conjugué |
Vaccin conjugué |
Vaccin polysaccharidique |
Composition |
2,2 mcg de chaque saccharide pour les sérotypes 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F et 23F de S. pneumoniae, 4,4 mcg de saccharide pour le sérotype 6B, 34 mcg de protéine porteuse CRM197, 4,25 mg de chlorure de sodium, 100 mcg de polysorbate 80, 295 mcg d'acide succinique et 125 mcg d'aluminium comme phosphate d'aluminium à titre d'adjuvant et eau pour injection |
32 mcg de polysaccharide pneumococcique total (2,0 mcg de chacun des polysaccharides de sérotype 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F et 4,0 mcg de polysaccharide de sérotype 6B) conjugué à 30 mcg de protéine porteuse CRM197, 125 mcg d'aluminium (phosphate d'aluminium à titre d'adjuvant), 1,55 mg de L-histidine, 1 mg de polysorbate 20, 4,5 mg de chlorure de sodium et eau pour injection |
Environ 2,2 mcg de chaque saccharide pour les sérotypes 1, 3, 4, 5, 6A, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de S. pneumoniae, 4,4 mcg de saccharide 6B, 51 mcg de protéine porteuse CRM197, 100 mcg de polysorbate 80, 295 mcg d'acide succinique, 4,4 mg de chlorure de sodium et 125 mcg d'aluminium (phosphate d'aluminium à titre d'adjuvant) et eau pour injection. |
25 mcg de polysaccharides capsulaires de chacun des sérotypes 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F et 33F de S. pneumoniae, chlorure de sodium 0,9 % p/p, phénol 0,25 % p/p et eau pour injection au volume. |
Programme pour les adultes immunocompétents |
Calendrier à 1 dose |
Calendrier à 1 dose |
Calendrier à 1 dose |
Calendrier à 1 dose |
Voie d'administration |
Injection IM |
Injection IM |
Injection IM |
Injection IM ou sous-cutanée |
Indications pour les adultes |
Indiqué pour l'immunisation active des adultes de 18 ans et plus pour la prévention de la pneumonie et de l'IIP causée par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F et 23F de Streptococcus pneumoniae |
Indiqué pour l'immunisation active des adultes de 18 ans ou plus pour la prévention de l'infection invasive causée par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F de Streptococcus pneumoniae |
Indiqué pour l'immunisation active des adultes de 18 ans et plus pour la prévention de la pneumonie et de l'IIP causée par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de Streptococcus pneumoniae |
Indiqué pour l'immunisation active des adultes de 18 ans et plus pour la prévention de l'IP causée par les types de pneumocoques inclus dans le vaccin (1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F et 33F) |
Contre-indications |
|
|
|
|
Précautions |
|
|
|
|
Conditions d'entreposage |
Seringue préremplie à dose unique. Réfrigérer à 2 °C jusqu'à 8 °C. Ne pas congeler. Conserver dans l'emballage d'origine. |
Seringue préremplie à dose unique. Réfrigérer à 2 °C jusqu'à 8 °C. Ne pas congeler. Protéger de la lumière. Administrer dès que possible après la sortie du réfrigérateur. |
Seringue préremplie à dose unique. Réfrigérer à 2 °C jusqu'à 8 °C. Conserver les seringues horizontalement au réfrigérateur. Ne pas congeler. Administrer dès que possible après la sortie du réfrigérateur. |
Flacon multidose. |
IV.2 Efficacité potentielle et efficacité réelle
On ne dispose actuellement d'aucune donnée sur l'EP ou l'ER du PNEU-C-15 ou du PNEU-C-20, quelles que soient les indications chez l'adulte.
Des revues systématiques récemment rapportées continuent de soutenir l'ER du PNEU-C-13 contre l'IIP et les pneumonies à pneumocoques chez les adultes de 65 ans et plusNote de bas de page 24Note de bas de page 25. Deux études d'observation incluses dans la revue systématique de Childs et al. ont trouvé une ER du vaccin PNEU-C-13 contre la pneumonie causée par les sérotypes contenus dans le vaccin de l'ordre de 38 à 68 %. Trois études d'observation de la revue systématique de Farrar et al. ont trouvé une ER du PNEU-C-13 contre l'IIP par les sérotypes contenus dans le vaccin de l'ordre de 59 à 68 %.
Farrar et alNote de bas de page 24. a rapporté une ER groupée du PNEU-P-23 contre l'IIP causée par les sérotypes contenus dans le vaccin chez les adultes de 65 ans et plus, de l'ordre de 38 % (n-12 études d'observation). Childs et al.Note de bas de page 25 a révélé une protection limitée contre la pneumonie causée par les sérotypes contenus dans le vaccin (ER regroupée de 18 % provenant de 3 études d'observation avec le PNEU-P-23 administré aux adultes de 65 ans et plus moins de 5 ans avant le début de la maladie).
IV.3 Immunogénicité
IV.3.1 Mesures de l'immunogénicité
Des tests d'AOP ont été utilisés pour évaluer la réponse immunitaire pour le PNEU-C-15 et le PNEU-C-20. Bien qu'aucun seuil spécifique du titre d'AOP n'ait été identifié en corrélation avec la protection contre l'IIP ou la pneumonie chez les adultes, les réponses d'AOP ont été utilisées comme substitution établie de la protection pour déduire l'EP lors de la comparaison avec un vaccin efficace.
Auparavant, les réponses d'AOP ont été utilisées comme marqueur de substitution de l'EP du vaccin contre l'IIP et la pneumonie lors de l'approbation du PNEU-C-13 chez les adultes.
IV.3.2 Immunogénicité du PNEU-C-15
Résumé des caractéristiques de l'étude du vaccin PNEU-C-15
L'immunogénicité du PNEU-C-15 a été évaluée dans deux essais de Phase 2Note de bas de page 26Note de bas de page 27 et 5 essais de phase 3Note de bas de page 28Note de bas de page 29Note de bas de page 30Note de bas de page 31Note de bas de page 32. Trois études ont évalué des adultes de 50 ans ou plus, stables sur le plan médical et n'ayant jamais été vaccinés, et une étude s'est concentrée sur des adultes de65 ans et plus déjà vaccinés. Les données relatives aux adultes de 18 ans et plus présentant des facteurs de risque médicaux pour l'IP étaient disponibles dans 2 études (dont une sous forme d'analyse de sous-ensemble de la population étudiée). Une étude a évalué des adultes atteints du VIH. La plupart des études avaient des participants majoritairement de race blanche et avec un équilibre entre les sexes (Tableau 5). Les évaluations de l'immunogénicité présentaient un faible RB (Annexe A, Tableau 8).
Résumé des données probantes sur l'immunogénicité du PNEU-C-15
Chez les adultes qui sont immunocompétents de 65 ans et plus n'ayant jamais reçu de vaccin contre le pneumocoque, pour les sérotypes communs, le PNEU-C-15 a présenté des réponses immunitaires globalement similaires, y compris pour le sérotype 3, par rapport au PNEU-C-13 (Annexe A, Tableaux 9). Toutes les analyses pour les sérotypes non couverts par le PNEU-C-13 ont montré des réponses numériquement plus élevées avec le PNEU-C-15. Toutefois, les séroréponses (SR) variaient pour les sérotypes communs. Les résultats des études comparant le PNEU-C-15 au PNEU-P-23 ont montré des résultats similaires, bien que la SR soit plus élevée avec le sérotype 3 avec le PNEU-C-15 (Annexe A, Tableaux 9, et 10).
Bien qu'aucune étude n'ait évalué la non-infériorité pour les autres groupes d'âge (de 50 à 64 ans; de 65 à 74 ans; de 75 ans et plus), les comparaisons par observation entre les groupes d'âge et les données des sous-groupes d'âge pour la SR sont rapportées dans l'Annexe A, Tableaux 9 et 10. La non-infériorité pour les sérotypes communs n'a pas été évaluée dans la comparaison avec le PNEU-C-13 pour les adultes ayant déjà reçu le PNEU-P-23 (Annexe A, Tableau 12) et les adultes présentant une maladie immunodéficiente (Annexe A, Tableau 14).
Chez les adultes de plus de 65 ans n'ayant jamais reçu de vaccin contre le pneumocoque, le PNEU-C-15 administré en même temps que le vaccin quadrivalent contre la grippe saisonnière, les SR se sont révélées similaires pour le sérotype 3 mais numériquement plus faibles pour les autres sérotypes communs (Annexe A, Tableau 11). Chez les adultes qui ont reçu ensuite le PNEU-P-23 après avoir reçu le PNEU-P-15, on a observé une proportion numériquement plus faible de sérorépondeurs avec le sérotype 3, les sérotypes uniques du PNEU-C-15, ainsi que certains sérotypes communs, par rapport aux taux de SR après une vaccination antérieure au PNEU-C-13 en série avec le PNEU-P-23 pour certains sérotypes communs (Annexe A, Tableau 15).
La non-infériorité pour les sérotypes communs n'a pas été évaluée dans la comparaison avec le PNEU-C-13 chez les adultes ayant déjà reçu le PNEU-P-23 (Annexe A, Tableau 12), ainsi que les personnes de 18 à 64 ans souffrant de maladies chroniques (MC) (Annexe A, Tableau 13) et les personnes qui sont immunodéprimées (Annexe A, Tableau 14).
IV.3.3. Immunogénicité du PNEU-C-20
Résumé des caractéristiques de l'étude du vaccin PNEU-C-20
L'immunogénicité du PNEU-C-20 a été évaluée dans un essai de Phase 2Note de bas de page 33 et deux essais de Phase 3Note de bas de page 34Note de bas de page 35. Deux essais ont évalué des adultes en bonne santé n'ayant jamais été vaccinés, ainsi que des adultes souffrant de MC sous-jacentes. Parmi ces études, l'une a recruté des participants de 60 à 64 ans, tandis que l'autre a rassemblé des participants de 18 ans ou plus répartis en 3 cohortes d'âges (c.-à-d., de 18 à 49 ans, de 50 à 59 ans, 60 ans et plus). Une étude a évalué les réponses immunitaires chez des adultes de 65 ans ou plus ayant déjà reçu le PNEU-P-23. Les études ont été évaluées comme présentant un faible RB (Annexe A, Tableau 8).
Résumé des données probantes sur l'immunogénicité du PNEU-C-20
Les critères de non-infériorité ont été respectés après l'administration du PNEU-C-20 dans des populations de plus de 60 ans n'ayant jamais été vaccinées. Toutefois, on a observé une proportion plus faible de sérorépondeurs par rapport au PNEU-C-13 pour les sérotypes communs (Annexe A, Tableau 16). Bien que le PNEU-C-20 n'ait pas été directement comparé au PNEU-C-13 ou au PNEU-P-23, les personnes ayant déjà reçu le PNEU-P-23, le PNEU-C-13 ou les 2, ont présenté des réponses immunitaires robustes après l'administration du PNEU-C-20 (Annexe A, Tableaux 17 et 18). Le PNEU-C-20 n'a pas été évalué chez les adultes présentant des maladies immunodéficientes.
IV.4 Persistance de la réponse immunitaire
La persistance de la réponse immunitaire au PNEU-C-15 a été observée 8 semainesNote de bas de page 29, 6 moisNote de bas de page 30 et 1 anNote de bas de page 31 après l'administration séquentielle du PNEU-P-23 chez des adultes de 18 ans ou plus présentant une maladie immunodéficiente, chez des adultes de 18 à 49 ans atteints d'une maladie chronique et chez des adultes en bonne santé de 65 ans ou plus. En général, les MGT de l'AOP à 8 semaines, à 6 mois et à 1 an étaient plus faibles qu'au jour 30 après l'administration du vaccin PNEU-C-15 mais plus élevées qu'au départ. Le PNEU-C-15 a provoqué une réponse immunitaire comparable à celle du PNEU-C-13 à 30 jours, à 8 semaines, à 6 mois et à 12 mois suivant l'administration du vaccin pour les 13 sérotypes communs et supérieurs à celle du PNEU-C-13 pour les 2 sérotypes 22F et 33F propres au PNEU-C-15.
Persistance de la réponse immunitaire du PNEU-C-20
La persistance de la réponse immunitaire au PNEU-C-20 a été observée à 12 mois chez des adultes de 60 à 64 ans en bonne santé sans antécédents de vaccination contre le pneumocoqueNote de bas de page 33. Les MGT de l'AOP à 12 mois ont diminué par rapport à celles enregistrées 30 jours suivant l'administration du vaccin mais sont restées élevées par rapport aux valeurs de base. Le même schéma de diminution des anticorps dans les 12 mois suivant la vaccination a été observé précédemment avec le PNEU-C-13. Toutefois, l'ER du vaccin contre la pneumonie attribuable aux sérotypes contenus dans le vaccin même n'a pas diminué au cours des 4 années de suiviNote de bas de page 36.
IV.5 Administration et calendrier des vaccins
Le PNEU-C-15 et le PNEU-C-20 sont fournis dans une seringue préremplie à dose unique.
Une dose de 0,5 ml de PNEU-C-15 devrait être administrée par voie IM. Le calendrier standard de vaccination est d'une dose. La nécessité d'une dose de rappel ou d'une revaccination n'est pas indiquée. Voir la monographie du produit pour de plus amples détailsNote de bas de page 21.
Une dose de 0,5 ml de PNEU-C-20 devrait être administrée par voie IM. Le calendrier standard pour les adultes en bonne santé est d'une dose. Voir la monographie du produit pour de plus amples détailsNote de bas de page 22.IV.6 Tests sérologiques
Les tests sérologiques ne sont pas recommandés avant ou après l'administration du vaccin contre le pneumocoque.
IV.7 Conditions d'entreposage
Le PNEU-C-15 devrait être réfrigéré à 2 °C jusqu'à 8 °C. Le vaccin ne devrait pas être congelé. Protéger le vaccin de la lumière. Les seringues préremplies devraient être administrées le plus rapidement possible après leur sortie du réfrigérateurNote de bas de page 21.
Le PNEU-C-20 devrait être réfrigéré à 2 °C jusqu'à 8 °C. Les seringues préremplies devraient être conservées à l'horizontale dans le réfrigérateur afin de minimiser le temps de redispersion. Le vaccin devait être jeté s'il a été congelé. Le vaccin devrait être administré le plus rapidement possible après avoir été retiré du réfrigérateurNote de bas de page 22.
IV.8 Administration concomitante avec d'autres vaccins
Le PNEU-C-15 et le PNEU-C-20 peuvent être administrés de façon concomitante avec le vaccin inactivé quadrivalent contre la grippe (VIQ) chez les adultes, pourvu que l'administration concomitante ait été démontrée comme étant immunogénique et efficaceNote de bas de page 37. Toutefois, des MGT de l'AOP plus faibles ont été signalées lorsque les vaccins contre le pneumocoque ont été coadministrés avec le VIQ par rapport aux vaccins contre le pneumocoque administrés seulsNote de bas de page 32Note de bas de page 37Note de bas de page 38. Aucune donnée n'est disponible sur l'administration conjointe du PNEU-C-15 ou du PNEU-C-20 avec d'autres vaccins pour adultes. Les données préliminaires sur la coadministration du PNEU-C-20 et du vaccin à ARNm Comirnaty de Pfizer-BioNTech contre la COVID-19 n'ont montré aucune interférence significative dans la réponse immunitaireNote de bas de page 39.
IV.9 Innocuité des vaccins
Résumé des caractéristiques de l'étude du vaccin PNEU-C-15
L'innocuité du PNEU-C-15 a été évaluée dans 2 essais de Phase 2Note de bas de page 26Note de bas de page 27 et 5 essais de Phase 3Note de bas de page 28Note de bas de page 29Note de bas de page 30Note de bas de page 31Note de bas de page 32. Des données sur les ÉI locaux et systémiques ont été sollicitées au moyen de bulletins électroniques sur la vaccination pendant 2 semaines après chaque dose, ainsi que par un suivi des évènements graves pendant 6 mois. Les résultats rapportés comprenaient les ÉIG, les ÉIG liés au vaccin, ainsi que les ÉI systémiques légers/modérés et sévères (c.-à-d. fièvre, fatigue, céphalées, douleurs musculaires et articulaires). Les données sur l'innocuité ont été rapportées pour les personnes n'ayant jamais reçu de vaccin contre le pneumocoque, pour l'administration concomitante avec le vaccin antigrippal saisonnier et pour des populations d'intérêt spécifiques, notamment les adultes de 18 à 64 ans souffrant de MC ou d'une maladie immunodéficiente et les adultes de 65 ans ou plus ayant déjà été vaccinés. 6 études présentaient un faible RB pour tous les domaines. Dans une étude, les raisons de l'absence de données n'ont pas été signalées dans l'évaluation des ÉIG et des ÉIG liés au vaccin, ce qui pose problème.
Résumé de l'innocuité du PNEU-C-15
Les essais cliniques n'ont fait état que de peu ou aucune différence entre le PNEU-C-15 et le PNEU-P-23 ou le PNEU-C-13 pour tous les ÉI systémiques légers/modérés et graves survenus dans les 14 jours suivant la vaccination ainsi que pour les ÉIG signalés jusqu'à 6 mois suivant l'administration du vaccin dans toutes les populations évaluées (Annexe A, Tableaux 9, 10 et 13 à 15). Les résultats étaient similaires après l'administration séquentielle du PNEU-P-23 après le PNEU-C-15 ou le PNEU-C-13 chez les adultes de 65 ans ou plus présentant une maladie immunodéficiente (Annexe A, Tableaux 14 et 15).
Il y avait peu ou aucune différence dans les ÉIG pour le PNEU-C-15 administré en même temps que le VIQ chez les adultes n'ayant jamais été vaccinés (Annexe A, Tableau 11). Les résultats étaient similaires en ce qui concerne la fatigue sévère, les douleurs articulaires et musculaires jusqu'à 14 jours suivant l'administration du vaccin. Il n'y avait aucune différence entre les groupes pour les ÉI systémiques sévères et légers/modérés.
Résumé des caractéristiques de l'étude sur le vaccin PNEU-C-20
L'innocuité du PNEU-C-20 a été principalement évaluée pour GRADE dans un essai de Phase 2Note de bas de page 33 et deux essais de Phase 3Note de bas de page 34Note de bas de page 35. Des données étaient disponibles pour les adultes de 18 ans et plus n'ayant jamais reçu de vaccin contre le pneumocoque et les adultes de 65 ans et plus déjà vaccinés. L'évaluation complète de l'innocuité comprenait 6 essais cliniques préautorisation, la collecte des données sur l'innocuité qui incluaient les réactions locales sollicitées dans les 10 jours suivant la vaccination et les évènements systémiques dans les sept jours. Les évènements non sollicités ont été recueillis pendant un mois suivant l'administration du vaccin et les ÉIG et les maladies chroniques nouvellement diagnostiquées dans les 6 mois suivant la vaccination.
Innocuité du PNEU-C-20
Il y avait peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne les ÉIG jusqu'à un mois suivant l'administration du vaccin chez les adultes de 60 ans ou plus n'ayant jamais été vaccinés. Les résultats n'ont montré aucune différence pour tous les ÉI systémiques légers/modérés et sévères jusqu'à 7 jours suivant l'administration du vaccin. La certitude des données probantes varie selon les évaluations, allant de modérée à élevée (Annexe A, Tableau 16).
Chez les adultes de 65 ans et plus ayant déjà reçu le PNEU-P-23 un à 5 ans auparavant, les ÉIG jusqu'à 6 mois et les ÉI systémiques 7 jours suivant l'administration du vaccin étaient similaires entre le PNEU-C-20 et le PNEU-C-13 (Annexe A, Tableau 18). Les résultats étaient similaires lorsque l'on comparait le PNEU-C-20 et le PNEU-P-23 chez les personnes déjà vaccinées avec le PNEU-13 au moins 6 mois auparavant (Annexe A, Tableau 17).
IV.10 Contre-indications et précautions
Le PNEU-C-15 et le PNEU-C-20 sont contre-indiqués chez les personnes ayant des antécédents de réaction allergique sévère (p. ex., anaphylaxie) à l'un des composants du vaccin ou à tout vaccin contenant de l'anatoxine diphtérique. L'administration du vaccin devrait être retardée chez les personnes atteintes d'une maladie fébrile aiguë sévère.
V. Vaccination de populations spécifiques
V.1. Vaccination pendant la grossesse et l'allaitement
Il n'existe pas d'études adéquates et bien contrôlées du PNEU-C-15 et du PNEU-C-20 chez les personnes enceintes ou qui allaitent.
V.2. Vaccination des personnes qui sont immunodéprimées
Les personnes dont l'immunocompétence est altérée, y compris celles qui reçoivent un traitement immunosuppresseur, peuvent avoir une réponse immunitaire réduite au vaccin.
VI. Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité à prendre en considération
Le CCNI utilise un cadre publié et revu par des pairs ainsi que des outils fondés sur des données probantes pour s'assurer que les questions liées à l'ÉÉFA sont systématiquement évaluées et intégrées dans ses directivesNote de bas de page 40.
Le CCNI a évalué les considérations éthiques suivantes lors de la formulation de ses recommandations : promouvoir le bien-être et minimiser le risque de méfaits, maintenir la confiance, respecter les personnes et favoriser l'autonomie, et promouvoir la justice et l'équité. Le CCNI a tenu compte des données probantes disponibles issues des études cliniques du PNEU-C-15 et du PNEU-C-20, ainsi que des données probantes en situation réelle sur l'efficacité et l'innocuité des vaccins contre le pneumocoque actuellement disponibles, le PNEU-C-13 et le PNEU-P-23, ainsi que des données sur le fardeau de l'IP et l'évolution de la distribution des sérotypes, et des facteurs de risque, en particulier pour l'IIP.
L'un des objectifs de la Stratégie nationale d'immunisation du Canada est d'atteindre une couverture vaccinale chez 80 % des adultes de 65 ans ou plus par un vaccin contre le pneumocoque, ainsi que de réduire de 5 % le fardeau global de la maladie d'ici 2025. Toutefois, l'adoption du vaccin chez les adultes de 65 ans ou plus est bien en deçà de l'objectif, puisqu'environ 55 % d'entre eux déclarent avoir reçu un vaccin contre le pneumocoque au Canada. Le taux de couverture vaccinale est encore plus faible chez les jeunes adultes de 18 à 64 ans présentant un problème médical sous-jacent qui les prédispose à l'IP (environ 26 %). Selon une enquête menée au Québec en 2020, le fait de ne pas savoir que le vaccin contre le pneumocoque est nécessaire ou recommandé est la raison la plus fréquente de ne pas se faire vacciner.
Les nouveaux vaccins conjugués contre le pneumocoque à valent plus élevé offrent la possibilité de protéger les personnes contre des sérotypes supplémentaires et de réduire davantage le fardeau de la maladie chez les adultes. Le PNEU-C-20 couvre plus de 90 % des sérotypes inclus dans le PNEU-P-23, avec les avantages supplémentaires des vaccins conjugués. Ainsi, le PNEU-C-20 peut être proposé dans les programmes en tant que dose unique sans dose ultérieure de PNEU-P-23, contrairement au PNEU-C-15 qui est recommandé d'administrer en série avec le PNEU-P-23 pour optimiser la protection. Un calendrier vaccinal à dose unique minimise la complexité et le coût d'un programme de vaccination et peut faciliter la vaccination de populations qui sont autrement difficiles à atteindre pour compléter une série nécessitant plus d'une dose.
Parmi les facteurs qui peuvent contribuer à l'inégalité en matière de santé, tels que décrits dans le cadre de l'ÉÉFA du CCNI, les maladies préexistantes, les facteurs sociaux, le lieu de résidence et l'âge sont importants à prendre en compte dans les recommandations relatives au pneumocoque. Le fardeau de l'IP augmente avec l'âge et les adultes souffrant d'affections préexistantes sont plus exposés. Il est donc possible de réduire les inégalités en formulant des recommandations fondées sur l'âge et le risque et en tenant compte des contextes où le fardeau de la malade est plus élevé.
Les communautés des Premières Nations, des Métis ou des Inuits du Canada sont plus jeunes que la population canadienne en général mais on a observé qu'elles présentent un risque accru d'IP sévère en raison de divers facteurs croisés, notamment des problèmes médicaux sous-jacents et un accès potentiellement réduit aux soins de santé. Par conséquent, les recommandations basées sur l'âge devront peut-être être modifiées pour offrir une protection efficace aux personnes de ces communautés. Les décisions autonomes devraient être prises par les peuples autochtones avec le soutien des partenaires de santé et de la santé publique, conformément à la Déclaration des Nations Unies sur les droits des peuples autochtones.
VII. Économie
Une revue systématique, une évaluation économique fondée sur un modèle de novo et une comparaison à modèles multiples ont été utilisées comme données probantes économiques pour soutenir la prise de décision concernant l'utilisation du PNEU-C-15 et du PNEU-C-20.
Les détails complets de ces analyses, y compris les hypothèses et les limites, sont fournis dans une annexe supplémentaire.
Une revue de la littérature évaluée par les pairs et de la littérature grise a permis de recenser 4 études coût/utilité du PNEU-C-15 et du PNEU-C-20 par rapport aux recommandations actuelles en matière de vaccination des adultes aux États-Unis (à savoir le PNEU-P-23 plus le PNEU-C-13 facultatif dans le cadre d'une prise de décision clinique partagée pour les adultes de 65 ans ou plus; le PNEU-P-23 au moment du diagnostic d'une MC s'ils ont moins de 65 ans; et le PNEU-C-13 en série avec le PNEU-P-23 au moment du diagnostic d'une maladie immunodéficiente s'ils ont moins de 65 ans)Note de bas de page 41. Les études ont généralement révélé que l'utilisation du PNEU-C-20 chez les adultes plus âgés était associée à une augmentation des AVAQ et à des RCED inférieurs lorsque le vaccin était utilisé chez les adultes de 65 ans et plus par rapport aux programmes destinés aux adultes de 50 ans et plus. Les estimations du RCED quant à l'utilisation du PNEU-C-15 en série avec le PNEU-P-23 à l'âge de 65 ans ont montré une variabilité entre les études. L'incidence estimée de l'ajout de programmes basés sur le risque pour les jeunes adultes qui sont atteints de MC ou immunodéprimés à une stratégie basée sur l'âge dépendait du produit vaccinal, avec des RCED inférieurs pour le PNEU-C-20 que pour le PNEU-C-15 en série avec le PNEU-P-23.
Un modèle coût/utilité élaboré par le CCNI a été utilisé pour évaluer le rapport coût/efficacité de différentes recommandations fondées sur l'âge pour les vaccins PNEU-C-15 et PNEU-C-20 (utilisés seuls ou en série avec le PNEU-P-23) dans la population canadienne en fonction des recommandations actuelles. Les résultats sont présentés dans la perspective du système de santé. L'analyse du scénario de référence, étayée par des analyses de scénarios, indique que le PNEU-C-20 utilisé seul est probablement une stratégie rentable à l'âge de 65 ou 75 ans, avec des RCED allant de 6 500 $ à 17 400 $ par AVAQ gagnée. Les RCED du PNEU-C-20 à l'âge de 50 ans étaient plus élevés qu'à l'âge de 65 ou de 75 ans. Dans l'analyse séquentielle qui comparait toutes les stratégies de vaccination possibles, le PNEU-C-15 était dominé (plus coûteux et moins efficace) ou soumis à une dominance étendue (c.-à-d. qu'il ne serait jamais l'option optimale quel que soit le seuil de rentabilité) par le PNEU-C-20. Le PNEU-C-20 plus le PNEU-P-23 à 65 ou 75 ans présentaient des RCED allant de 80 000 à 113 500 dollars par AVAQ gagnée. Les résultats étaient sensibles aux prix supposés des vaccins PNEU-C-15 et PNEU-C-20 (voir l'annexe supplémentaire). L'analyse des populations du nord du Canada a montré des tendances similaires à celles du reste du Canada.
Dans une comparaison à modèles multiples, 3 modèles coût/utilité avec des valeurs de paramètres harmonisées et utilisant la même perspective du système de santé et le même taux d'actualisation, ont montré des résultats qualitativement cohérents malgré des structures et des hypothèses de modèles différentes. La comparaison a appuyé la conclusion selon laquelle, d'après les données actuellement disponibles, le PNEU-C-20 utilisé seul (de 4 100 à 106 000 $ par AVAQ gagnée) pourrait être une stratégie rentable à utiliser dans la population adulte canadienne, selon le seuil de rentabilité utilisé. Tous les modèles ont estimé que le PNEU-C-15 ou le PNEU-C-15 en série avec le PNEU-P-23 était dominé (plus coûteux et moins efficace) ou soumis à une dominance étendue (ne serait jamais l'option optimale quel que soit le seuil de rentabilité) par le PNEU-C-20.
VIII. Recommandations
À la suite de la revue des données probantes disponibles résumées ci-dessus, le CCNI formule les recommandations suivantes en ce qui concerne la prise de décision au niveau de la santé publique. Les considérations du tableau des options de gestion devraient également être revues afin d'éclairer la prise de décision.
Une forte recommandation s'applique à la majeure partie des populations/personnes et devrait être suivie, à moins qu'il n'existe une justification claire et convaincante pour adopter une autre approche.
Une recommandation discrétionnaire peut être envisagée pour certaines populations/personnes dans certaines circonstances. D'autres approches peuvent se révéler acceptables.
Voir l'Annexe A pour obtenir une explication plus détaillée de la force des recommandations du CCNI (Tableau 19) et de l'évaluation GRADE de l'ensemble des données probantes (Tableau 6).
Le CCNI continuera à surveiller de près les développements scientifiques liés à la vaccination contre le pneumocoque chez les adultes et mettra à jour ses recommandations si ces données évoluent.
VIII.1 Recommandations relatives au processus décisionnel à l'échelle des programmes de santé publique
Dans la revue de ces recommandations du CCNI pour les programmes de vaccination financés par le secteur public et aux fins de la mise en œuvre des programmes également financés à même les fonds publics, les provinces et les territoires peuvent tenir compte d'autres facteurs opérationnels locaux (p. ex., les programmes de vaccination actuels, les ressources). En sachant qu'il existe des différences dans les contextes opérationnels au Canada, les administrations peuvent se reporter aux tableaux des options de gestion 3 et 4 ci-dessous pour obtenir un résumé des considérations relatives à l'utilisation de différents produits (p. ex., en ce qui concerne le rapport coût/efficacité et la faisabilité).
Pour les adultes qui n'ont jamais reçu de vaccin contre le pneumocoque, ou les adultes dont le statut vaccinal est inconnu
- Le CCNI recommande que le vaccin conjugué contre le pneumocoque PNEU-C-20 soit proposé aux adultes n'ayant pas reçu de vaccin contre le pneumocoque ou aux adultes dont le statut vaccinal est inconnu et qui sont âgés de 65 ans et plus, ou de 50 à 64 ans vivant avec des facteurs de risque les exposant à un risque plus élevé d'infection à pneumocoques, ou qui sont âgés de 18 à 49 ans et vivent avec une maladie immunodéficiente (Forte recommandation du CCNI).
Sommaire des données probantes et justification
- Les vaccins conjugués induisent une mémoire, offrent une durée de protection plus longue et permettent un renforcement grâce aux lymphocytes T, ce que ne peuvent pas faire les vaccins polysaccharidiques. La protection plus durable offerte par les vaccins conjugués peut entraîner une diminution du nombre de cas d'IP, même s'ils protègent contre un nombre moindre de sérotypes que le vaccin polysaccharidique.
- Chez les adultes immunocompétents de 65 ans et plus, il a été démontré que le
PNEU-C-20 produit une réponse immunitaire similaire (non inférieure) par rapport au PNEU-C-13, bien que l'on ait noté que les réponses immunitaires étaient plus faibles après l'administration du PNEU-C-20, et des réponses immunitaires supérieures par rapport au PNEU-C-23 pour les sérotypes communs. - Aucune étude sur le PNEU-C-20 n'a été menée chez les adultes qui sont immunodéprimés. Chez les personnes présentant une maladie immunodéficiente pour l'IP, le PNEU-C-20 devrait avoir une efficacité similaire à celle du PNEU-C-13 contre les maladies attribuables aux 13 sérotypes appariés.
- Le PNEU-C-20 a un profil d'innocuité comparable à celui du PNEU-C-13 chez les adultes.
- L'immunisation avec le vaccin PNEU-C-20 des personnes âgées devrait être rentable, compte tenu du fardeau actuel de l'IIP et des hypothèses concernant le prix du PNEU-C-15, du PNEU-C-20 et du PNEU-P-23.
- Les personnes dont l'âge augmente et (ou) qui présentent certains problèmes médicaux sous-jacents (qu'elles soient ou non immunodéprimées) et d'autres facteurs de risque ont un risque accru d'IIP (voir le Tableau 1). Les adultes de 65 ans et plus présentent le taux d'incidence le plus élevé d'IIP par rapport aux autres groupes d'âge adulte, suivis par les adultes de 50 à 64 ans. Toutefois, on s'attend à ce que l'avantage de vacciner les adultes de 50 à 64 ans présentant des problèmes médicaux sous-jacents ou d'autres facteurs de risque qui les exposent à un risque accru d'IIP, soit plus important que celui de vacciner tous les adultes de ce groupe d'âge.
- Les recommandations fondées sur l'âge peuvent devoir être modifiées pour les collectivités dont la répartition par âge est plus jeune. Dans les communautés des Premières Nations, des Métis ou des Inuits, les décisions autonomes devraient être prises par les peuples autochtones avec le soutien des partenaires de santé et de la santé publique, conformément à la Déclaration des Nations Unies sur les droits des peuples autochtones.
- L'adoption actuelle des vaccins contre le pneumocoque chez les adultes âgés et les adultes atteints de problèmes médicaux sous-jacents, qu'ils soient ou non immunodéficients, est bien inférieure aux objectifs nationaux.
- La faisabilité du programme ainsi que l'acceptabilité et l'adoption du vaccin peuvent être supérieures avec une dose unique de PNEU-C-20 par rapport à une stratégie
PNEU-C-15 + PNEU-P-23, cette dernière nécessitant la coordination de 2 doses de produits vaccinaux différents.
- Le CCNI recommande que le PNEU-C-15 suivi du PNEU-P-23 puisse être proposé comme une option au PNEU-C-20 aux adultes n'ayant pas reçu de vaccin contre le pneumocoque ou aux adultes dont le statut vaccinal est inconnu et qui sont âgés de 65 ans et plus, ou de 50 à 64 ans vivant avec des facteurs de risque les exposant à un risque accru d'infection à pneumocoques, ou qui sont âgés de 18 à 64 ans et atteints d'une maladie immunodéficiente (Recommandation discrétionnaire du CCNI).
Sommaire des données probantes et justification
- Chez les adultes immunocompétents de 65 ans et plus, il a été démontré que le PNEU-C-15 produit une réponse immunitaire similaire (non inférieure) à celle du PNEU-C-13 pour les sérotypes communs.
- Chez les adultes présentant des problèmes médicaux sous-jacents, y compris des maladies immunodéficientes, le PNEU-C-15 a montré des réponses immunitaires comparables à celles du PNEU-C-13 pour 13 sérotypes communs.
- Un intervalle d'un an entre le PNEU-C-15 et le PNEU-P-23 est recommandé pour les adultes de 65 ans et plus et les adultes de 50 à 64 ans présentant des facteurs de risque d'IP, afin de fournir une protection élargie à 8 sérotypes supplémentaires qui ne figurent pas dans le PNEU-C-15.
- Un intervalle de 8 semaines entre le PNEU-C-15 et le PNEU-P-23 est recommandé pour les adultes de 18 à 64 ans atteints d'une maladie immunodéficiente afin de fournir une protection élargie à des sérotypes supplémentaires qui ne figurent pas dans le PNEU-C-15, ce qui permet de compléter plus rapidement la série au sein de la population vulnérable. Un intervalle plus long peut entraîner moins d'atténuation des réponses immunitaires et pourrait être envisagé si le risque d'IP est faible.
- Bien que le PNEU-C-15 ne devrait pas présenter les mêmes avantages épidémiologiques au niveau de la population que le PNEU-C-20 et qu'il nécessite une deuxième dose avec le PNEU-P-23, on s'attend à ce qu'il améliore les résultats de la maladie par rapport à l'administration du PNEU-P-23 seul.
- Bien que le PNEU-C-20 ait dominé le PNEU-C-15 + PNEU-P-23 dans les analyses coût/efficacité, les résultats étaient sensibles au prix du vaccin. Un écart de prix du vaccin suffisamment important entre le PNEU-C-20 et le PNEU-C-15 + PNEU-P-23 entraînerait un rapport coût/efficacité similaire (c.-à-d. que le PNEU-C-15 + PNEU-P-23 ne serait plus dominé).
Pour les adultes ayant déjà reçu un vaccin contre le pneumocoque
- Le CCNI recommande que le vaccin conjugué contre le pneumocoque PNEU-C-20 soit proposé aux adultes de 65 ans et plus qui ont déjà reçu le PNEU-P-23 seul, ou le PNEU-C-13 et le PNEU-P-23 en série, s'il s'est écoulé au moins 5 ans depuis la dernière dose d'un vaccin contre le pneumocoque (PNEU-P-23 ou PNEU-C-13). (Forte recommandation du CCNI)
Sommaire des données probantes et justification
- Des réponses immunitaires robustes ont été signalées pour le PNEU-C-20 chez des adultes ayant déjà reçu le PNEU-P-23 seul ou avec le PNEU-C-13 mais les données n'étaient pas comparables à celles du PNEU-C-13.
- Le PNEU-C-20 a montré peu ou aucune différence dans les profils d'innocuité par rapport au PNEU-C-13 chez les adultes de 65 ans et plus qui sont déjà vaccinés.
- Un intervalle de 5 ans entre le PNEU-P-23 et le PNEU-C-20 permet de tirer parti de la durée d'ER estimée du PNEU-P-23 et du renforcement anticipé avec le PNEU-C-20; il permet également de maximiser la durée totale de la protection contre l'IP.
- Si le PNEU-C-20 n'est pas disponible, il pourrait être avantageux d'offrir le PNEU-C-15 aux adultes de 65 ans et plus qui ont reçu le PNEU-P-23 seul. Pour les adultes de 65 ans et plus qui présentent également le risque le plus haut d'IIP, une dose supplémentaire de PNEU-P-23 peut être proposée un an plus tard. L'avantage d'administrer le PNEU-C-15 aux personnes ayant reçu le PNEU-C-13 est limité, car il n'offre qu'une protection contre 2 sérotypes supplémentaires.
- Le CCNI recommande que le vaccin conjugué contre le pneumocoque PNEU-C-20 puisse être proposé aux adultes de 65 ans et plus qui ont déjà reçu le PNEU-C-13 seul, si un an s'est écoulé depuis la dernière dose de PNEU-C-13. (Recommandation discrétionnaire du CCNI)
Sommaire des données probantes et justification
- Des réponses immunitaires robustes ont été rapportées pour le PNEU-C-20 chez des adultes qui ont déjà reçu le PNEU-C-13 seul. Toutefois, les données n'étaient pas comparables au PNEU-C-13.
- Un intervalle d'un an entre le PNEU-C-13 et le PNEU-C 20 permet d'étendre la couverture des sérotypes offerte par le PNEU-C-13 de manière efficace dans le temps.
- Un intervalle plus court de 8 semaines pourrait être envisagé pour s'aligner sur les cliniques et (ou) programmes de vaccination.
- L'avantage supplémentaire d'offrir le PNEU-C-15 est limité, car le PNEU-C-15 n'offre qu'une protection contre 2 sérotypes supplémentaires. Toutefois, le PNEU-C-15 en série avec le PNEU-P-23 ou le PNEU-P-23 seul peut être envisagé si le PNEU-C-20 est indisponible ou inaccessible.
Pour les receveurs de greffe de cellules souches hématopoïétiques
- Le CCNI recommande que le vaccin conjugué contre le pneumocoque PNEU-C-20 soit proposé aux adultes de 18 ans ou plus ayant reçu une greffe de cellules souches hématopoïétiques (GCSH) après une consultation du spécialiste de la greffe. Les 3 doses de la série primaire de PNEU-C-20 débutant de 3 à 9 mois après la greffe devraient être administrées à au moins 4 semaines d'intervalle et être suivies par une dose de rappel du vaccin PNEU-C-20 12 à 18 mois après la greffe (de 6 à 12 mois après la dernière dose du vaccin PNEU-C-20). (Forte recommandation du CCNI)
Sommaire des données probantes et justification
- Aucune étude évaluant l'immunogénicité et l'innocuité du PNEU-C-20 chez les receveurs de GCSH n'était disponible mais on s'attend à ce que le PNEU-C-20 ait un profil d'immunogénicité et d'innocuité similaire à celui du PNEU-C-13 dans cette population.
- Le moment recommandé pour l'administration du PNEU-C-20 aux receveurs de GCSH doit être déterminé en consultation avec le spécialiste de la greffe du receveur.
- Le PNEU-C-15 peut être envisagé si le PNEU-C-20 est indisponible ou inaccessible afin de s'assurer que ces personnes recevront la protection nécessaire.
Considérations sur la poursuite de l'utilisation de PNEU-C-13 et de PNEU-P-23 et d'autres groupes à risque
- Le CCNI est favorable au maintien de l'utilisation du PNEU-C-13 et du PNEU-P-23 chez les adultes uniquement lorsque le PNEU-C-15 et (ou) le PNEU-C-20 sont indisponibles ou inaccessibles.
- À l'heure actuelle, il n'existe aucune recommandation au niveau de la santé publique sur l'utilisation du PNEU-C-15 ou du PNEU-C-20 pour les adultes de 18 à 49 ans présentant des facteurs de risque sans maladie immunodéficiente qui les exposent à un haut risque d'IIP, car des analyses supplémentaires sur le rapport coût/efficacité du PNEU-C-15 et du PNEU-C-20 conjugués dans cette population sont nécessaires. Le PNEU-C-15 ou le PNEU-C-20 peuvent être considérés à l'appréciation du clinicien pour ces adultes.
Options de gestion
Il existe des options pour le calendrier vaccinal, le type vaccinal (TV), la cohorte d'âges et le groupe à risque, et la décision quant à l'option à privilégier peut dépendre d'une ou plusieurs considérations exposées ci-dessous.
| Options : Choix du produit |
Facteurs à prendre en considération |
Points de décision |
|---|---|---|
Vaccin conjugué contre le pneumocoque - PNEU-C-20 |
La couverture des sérotypes entraîne une couverture des cas d'IIP supérieure de 15 à 20 % à celle du PNEU-C-15 et de 30 à 32 % à celle du PNEU-C-13. Les données sur l'EP et l'ER ne sont pas encore disponibles. L'immunogénicité (fondée sur les MGT de l'AOP et le % de SR) est non inférieure à celle du PNEU-C-13 pour les sérotypes communs mais les réponses immunitaires sont numériquement inférieures. Le profil d'innocuité du PNEU-C-20 correspond à celui du PNEU-C-13, tant chez les personnes n'ayant jamais reçu le vaccin que chez celles qui l'ont reçu. L'analyse coût/utilité estime que l'utilisation du PNEU-C-20 est probablement une stratégie rentable, indépendamment de l'âge ou de la région. Une recommandation simplifiée prévoyant un seul vaccin devrait augmenter l'acceptabilité tant pour les receveurs que pour la mise en œuvre du programme de vaccination, d'où la possibilité de prévenir davantage de maladies. |
Épidémiologie L'âge est un facteur de risque majeur pour l'IIP. L'incidence augmente fortement chez les personnes de 65 ans et plus. Éléments inconnus Vitesse de remplacement des sérotypes. Ampleur du remplacement des sérotypes. Impact sur le fardeau de la maladie chez les adultes lorsque des vaccins conjugués à valent contre le pneumocoque plus élevés seront disponibles pour être utilisés dans le cadre des programmes de vaccination pédiatrique. Durée de la protection L'affaiblissement de la protection conférée par les vaccins conjugués contre le pneumocoque semble se produire à un rythme plus lent que celui des vaccins polysaccharidiques contre le pneumocoque. Éléments inconnus ER et durée de protection du PNEU-C-15 et du PNEU-C-20 Immunogénicité
Éléments inconnus Corrélats de la protection Innocuité Les 2 vaccins sont sûrs chez les personnes immunocompétentes. Économie Sur la base d'une analyse coût/utilité : Le PNEU-C-20 était rentable par rapport aux recommandations actuelles chez les adultes de ≥65 ans. Lorsque le PNEU-C-20 est disponible, le PNEU-C-15 est plus coûteux et moins efficace que l'administration du PNEU-C-20 seul. Si le PNEU-C-20 n'est pas disponible, le PNEU-C-15 en série avec le PNEU-P-23 est plus rentable que le
PNEU-C-15 seul. Rapport coût/efficacité dans d'autres populations à haut risque Faisabilité et acceptabilité Le PNEU-C-15 devrait être offert en série avec le PNEU-P-23 pour optimiser la protection contre un plus grand nombre de sérotypes. Cela en ferait une série de 2 produits, par rapport au PNEU-C-20, qui ne comporte qu'une seule dose. Il faudrait envisager d'améliorer l'adhésion et l'acceptabilité de la 2e dose, ainsi que des coûts opérationnels supplémentaires pour l'administration de la 2e dose. Éléments inconnus On ne sait pas quelle sera l'adhésion au calendrier complet de vaccination à 2 produits avec le PNEU-C-15 et le |
Vaccin conjugué contre le pneumocoque - PNEU-C-15 |
La couverture des sérotypes entraîne une couverture de 10 à 12 % supérieure des cas d'IIP par rapport au PNEU-C-13. Les données sur l'EP et l'ER ne sont pas encore disponibles. L'immunogénicité (fondée sur les MGT de l'AOP et le % de SR) a montré une non-infériorité pour les sérotypes communs avec le PNEU-C-13 et des résultats mitigés dans la proportion de sérorépondeurs par rapport au PNEU-C-13. Le profil d'innocuité du PNEU-C-15 correspond à celui du PNEU-C-13, tant chez les personnes n'ayant jamais reçu le vaccin que chez celles qui l'ont reçu. Les coûts d'administration du programme combiné avec le PNEU-P-23 sont plus élevés que ceux du programme à dose unique de PNEU-C-20, quels que soient l'âge et la région. Le PNEU-P-23 peut être moins efficace pour les sérotypes communs que le PNEU-P-20, surtout à long terme. Le calendrier mixte nécessiterait la coordination de 2 doses et produits. |
|
Vaccin conjugué contre le pneumocoque - PNEU-C-13 |
Moins de cas d'IIP causés par les sérotypes de PNEU-C-13 que ceux couverts par le PNEU-C-15 et le PNEU-C-20 Les données sur l'EP et l'ER ne sont pas encore disponibles. Le PNEU-C-13 est efficace contre l'IIP chez les adultes de 65 ans et plus. Les résultats d'études d'observation confirment l'EP contre la pneumonie et l'IIP de TV. Le calendrier mixte nécessiterait la coordination de 2 doses et produits. L'acceptabilité de la vaccination contre le pneumocoque chez les adultes à risque est inférieure à l'objectif national. |
L'utilisation du PNEU-C-13 est autorisée au Canada et ailleurs depuis plus de 10 ans et les recommandations du CCNI pour les adultes sont en place depuis 2013. Faisabilité et acceptabilité |
Vaccin polysaccharidique contre le pneumocoque - PNEU-P-23 |
Plus grande proportion de cas d'IIP causés par les sérotypes PNEU-P-23 que le PNEU-C-15 ou le PNEU-C-20 Certaines données sur l'ER sont disponibles, bien que limitées et incertaines. L'analyse groupée de 8 études observationnelles montre que le PNEU-P-23 est efficace contre l'IIP chez les adultes de 65 ans et plus. Les données regroupées sur l'ER du vaccin contre la pneumonie TV provenant d'études observationnelles récentes suggèrent que le PNEU-P-23 offre une protection limitée contre la pneumonie TV dans les 5 ans suivant la vaccination. L'acceptabilité du PNEU-P-23 a été inférieure à l'objectif national de vaccination pour les adultes de 65 ans ou plus et pour les adultes de 18 ans ou plus vivant avec des problèmes médicaux sous-jacents. |
L'utilisation du PNEU-P-23 est autorisée au Canada et ailleurs depuis près de 40 ans et les recommandations du CCNI sont en vigueur depuis 1984. Faisabilité et acceptabilité Le PNEU-P-23 a la plus grande couverture sérologique de tous les vaccins contre le pneumocoque autorisés. L'affaiblissement de la protection est plus rapide (dans les 5 ans suivant la vaccination) par rapport aux vaccins conjugués, en raison de son mode d'action indépendant des cellules T. |
| Options Âge et cohortes | Facteurs à prendre en considération | Points de décision |
|---|---|---|
Les 18 à 49 ans présentant des facteurs de risque d'IIP |
|
18 à 49 ans
|
50 ans et plus |
|
50 ans et plus
|
65 ans et plus |
65 ans et plus
|
|
75 ans et plus |
75 ans et plus
|
IX. Priorités de recherche
- Estimations/évaluations de l'ER des vaccins PNEU-C-15 et PNEU-C-20 dans la population générale des personnes de 65 ans et plus et dans d'autres populations (p. ex., les populations autochtones, les personnes atteintes de MC, de problèmes sociaux et de maladies immunodéficientes).
- Analyses coût/efficacité de l'utilisation du PNEU-C-15 et du PNEU-C-20 chez les adultes de 18 à 49 ans présentant des facteurs de risque qui les exposent à un haut risque d'IIP.
- Évaluation des effets d'immunité collective et du remplacement du sérotype des programmes pour enfants par le vaccin PNEU-C-15 au fil du temps sur l'incidence de l'IIP, de l'IIP TV, de la POC et de la POC TV et sur le portage dans la population canadienne des personnes de 65 ans et plus et dans d'autres populations (p. ex. les Autochtones, les personnes atteintes de MC, de problèmes sociaux et de maladies immunodéficientes).
- Estimations de l'EP et de l'ER des doses de rappel du PNEU-C-15 et du PNEU-C-20 chez les adultes immunocompétents de plus de 65 ans.
- Évaluation des programmes de vaccination contre le pneumocoque sur la réduction des infarctus du myocarde et des accidents vasculaires cérébraux.
X. Questions liées à la surveillance
La surveillance continue est fondamentale pour la planification, la mise en œuvre, l'évaluation et la prise de décision fondée sur des données probantes. (Indiquez si la maladie à prévenir est à déclaration obligatoire au niveau national). Pour appuyer ces efforts, le CCNI encourage les améliorations de la surveillance dans les domaines suivants :
- On ne dispose pas actuellement de données représentatives à l'échelle nationale sur le fardeau de la PAC et de la POCP de TV au Canada
- Les données de surveillance nationale sur le statut vaccinal ne sont pas disponibles pour les cas identifiés d'IIP et d'IIP TV au Canada, ce qui limite l'ampleur des conclusions
- La surveillance nationale de la couverture vaccinale contre le pneumocoque en fonction de l'âge et du temps écoulé depuis l'administration du vaccin (et à l'avenir) et du nombre de doses reçues est limitée
- Les facteurs de risque supplémentaires (p. ex., les comorbidités) ne sont pas disponibles pour les cas identifiés d'IIP et d'IIP TV, ce qui limite l'ampleur des résultats aux groupes à haut risque en raison des états de santé sous-jacents
- Il y avait des données manquantes dans les ensembles de données de la SCSMDO et du LNM.
- Surveillance renforcée incluant les personnes à haut risque et pouvant fournir l'incidence de l'IIP stratifiée par facteurs de risque et sérotypes pour les personnes de plus de 65 ans.
XI. Caractéristiques des études incluses
| Étude | Comparaisons | Plan de l'étude | Participants |
|---|---|---|---|
| Études sur le vaccin PNEU-C-15 | |||
Ermlich et al., Vaccine, 2018; 36 (45) : 6875-6882 V114-002 Multicentre : 25 sites au Canada, au Danemark, en Israël, en Norvège, en Pologne, en Espagne, en Suède et aux É.-U Période d'étude : de mars 2012 à février 2013 Financement : Merck |
|
Phase 2. Randomisé à PNEU-C-15 (N=230),
Total randomisé = 691 |
Adultes de ≥50 ans vivant dans la collectivité et n'ayant jamais été vaccinés Sexe (étude totale) : 53 % de femmes Ethnicité (étude totale) : 93 % de non-Hispaniques ou de non-Latinos Race (étude totale) : 93 % de Blancs Âge (étude totale) :
Les auteurs déclarent que les participants étaient similaires d'un groupe à l'autre en ce qui concerne la répartition de l'âge, du sexe, de la race/ethnie, des principaux problèmes médicaux préexistants (cardiopathie chronique, MPOC, diabète sucré) et des traitements antérieurs et concomitants. |
Song et al., Vaccine, 2021; 39 (43) : 6422-6436 V114-016 Multicentre : 22 sites aux É.-U., en République de Corée, en Espagne, à Taiwan Période d'étude : De juin 2018 à décembre 2016 Financement : Merck Sharp et Dohme Corp. |
Série de vaccins à 12 mois d'intervalle |
Phase 3, randomisé à une dose unique de PNEU-C-15 (N=327) ou de PNEU-C-13 (N=325) au jour 1 suivie d'une dose unique de Total randomisé = 652 |
Adultes de ≥50 ans, en bonne santé et (ou) présentant des problèmes médicaux sous-jacents stables, sans antécédents d'IIP et n'ayant jamais été vaccinés Sexe (étude totale) : 56,8 % de femmes Ethnicité (étude totale) : 87,4 % non-Hispaniques ou non-Latinos Race (étude totale) : 61,6 % de Blancs Âge médian : 65,0 ans Âge (étude totale) :
Les auteurs déclarent que les participants étaient similaires d'un groupe à l'autre en ce qui concerne la distribution des variables, notamment l'âge, le sexe, la race et l'origine ethnique. |
Platt et al., Vaccine, 2022; 40 (1) : 162-172 V114-019 Multicentre : 30 sites au Canada, aux É.-U., au Japon, en Espagne et à Taiwan Période d'étude : De juin 2019 à mars 2020 Financement : Merck Sharp et Dohme Corp. |
PNEU-C-15 c. PNEU-C-13 |
Phase 3, Randomisé à une dose unique de PNEU-C-15 (N=604) ou de PNEU-C-13 (601) Total des personnes randomisées = 1 205 |
Adultes de ≥50 ans, en bonne santé et (ou) présentant des problèmes médicaux sous-jacents stables, sans antécédents d'IIP et n'ayant jamais été vaccinés Sexe (étude totale) : 57,3 % de femmes Ethnicité (étude totale) : 78,0 % de non-Hispaniques ou de non-Latinos Race (étude totale) : 67,7 % de Blancs Âge médian : 66,0 ans Âge (étude totale) :
Les auteurs déclarent que les données démographiques des participants étaient similaires entre les groupes. |
Peterson et al., Human vaccines & immunotherapeutics, 2019; 15 (3): 540–548 V114-007 Multicentre : 17 sites aux É.-U. Période d'étude : De novembre 2015 à janvier 2016 Financement : Merck |
PNEU-C-15 c. PNEU-C-13 |
Phase 2. Randomisé au PNEU-C-15 (N=127) ou au PNEU-C-13 (N=126) Total randomisé = 253 La randomisation a été stratifiée en fonction de l'âge et du temps écoulé depuis la vaccination (les groupes sont indiqués dans la colonne adjacente). |
Adultes de ≥65 ans, avec des antécédents de vaccination antérieure par le PNEU-P-23 au moins un an avant la participation à l'étude Sexe (ensemble de l'étude) : 59,7 % de femmes Âge médian (étude complète) : 72,0 ans Répartition par âge : de 65 à 74 ans, 70 %; ≥75 ans, 30 % Race (ensemble de l'étude) : 94,1 % de Blancs Ethnicité (ensemble de l'étude) : 84,6 % non-Hispaniques ou non-Latinos Les auteurs déclarent que les groupes étaient similaires en ce qui concerne le sexe, l'âge, l'ethnie/race, les conditions préexistantes, les traitements antérieurs et l'intervalle de temps depuis la vaccination avec le PNEU-P-23. |
Hammitt et al., Open forum infectious diseases, 2022; 9 (3): ofab605 V114-017 Multicentrique : 79 sites de 7 pays (É.-U., Canada, Chili, Pologne, Russie, Australie, Nouvelle-Zélande) Période d'étude : Juillet 2018 à juillet 2020 Financement : Merck |
Série de vaccins à 6 mois d'intervalle |
Total randomisé : 1515 |
Adultes de 18 à 49 ans, immunocompétents, avec ou sans facteur(s) de risque d'IP Sexe (étude totale) : 52 % de femmes Ethnicité (étude totale) : 87 % de non-Hispaniques ou non-Latinos Race (étude totale) : 51 % de Blancs, 39 % d'Autochtones (É.-U.). 39 % des participants provenaient de sites du Center for American Indian Health (CAIH) des É.-U. Âge moyen : 36,0 ans Par facteur de risque (étude totale) : Aucun facteur de risque : 25 % ≥1 facteur de risque : 75 % Les facteurs de risque étaient les suivants : maladie pulmonaire chronique, y compris asthme, tabagisme, diabète sucré, maladie hépatique chronique, maladie cardiaque chronique et consommation d'alcool. Tous les sujets sans facteur de risque et les sujets avec un seul facteur de risque de consommation d'alcool ont été inscrits dans les sites du CAIH. Les auteurs déclarent que les caractéristiques démographiques et de base étaient similaires entre les groupes. |
Mohapi et al., AIDS (Londres, Angleterre), 2022;36 (3) : 373-382 V114-018 Multicentre : 13 sites en France, au Pérou, en Afrique du Sud, en Thaïlande et aux É.-U. Période d'étude : De juillet 2018 à janvier 2020 Financement : Merck |
Série de vaccins à 8 semaines d'intervalle |
Phase 3. Randomisé au PNEU-C-15+
Randomisation stratifiée par le nombre de cellules CD4+, avec une intention de ≥50 % de participants inscrits dans la strate intermédiaire : de ≥50 à <200; de ≥200 à <500, et ≥500 cellules/μL |
Adultes de >=18 ans, séropositifs (CD4+ ≥50 cellules/μL et ARN VIH plasmatique <50 000 copies/mL), n'ayant jamais été vaccinés et n'ayant pas présenté d'IIP ou de pneumocoque lié à une culture positive dans les 3 années précédentes. Sexe (étude totale) : 21 % de femmes Ethnicité (étude totale) : 68 % de non-Hispaniques ou de non-Latinos Race (étude totale) : 31 % de Noirs, 30 % de Blancs, 21 % plus d'une race, 18 % d'Asiatiques Âge médian : 41 ans. Sur l'ensemble de l'étude, 72 % avaient 18 à 49 ans. Peu de participants (3,6 %) avaient ≥65 ans. Par le nombre de cellules T CD4+ (cellules/µL) :
Les auteurs déclarent que les caractéristiques démographiques et de base étaient similaires entre les groupes. |
Severance et al. Human Vaccines & Immunotherapeutics, 2022; 18 (1); e1976581 V114-021 Multicentre : 45 sites aux É.-U. Période d'étude : Du 24 septembre 2018 au 24 juin 2019 Financement : Merck Sharp & Dohme Corp. |
PNEU-C-15+VIQ, avec placebo au jour 30 (concomitant) c. VIQ + placebo, avec PNEU-C-15 au jour 30 (non concomitant) |
Phase 3, randomisée en groupes concomitant (N=600) ou non concomitant (N=600). Total randomisé = 1 200 La randomisation était 1:1 mais stratifiée en fonction de l'âge (de 50 à 64 ans, de 65 à 74 ans, ≥75 ans) et des antécédents de vaccination avec le PNEU-P-23. |
Adultes de ≥50 ans, en bonne santé et (ou) présentant des problèmes médicaux sous-jacents stables et sans antécédents d'IIP ou autre IP. La vaccination antérieure avec le PNEU-P-23 est admissible si elle a été effectuée >12 mois avant la première visite de l'étude mais il est prévu qu'au moins 50 % des participants ne soient pas vaccinés. Sexe (étude totale) : 56,1 % de femmes Ethnicité (étude totale) : 78,8 % non-Hispaniques ou non-Latinos Race (étude totale) : 82,5 % de Blancs Âge médian : 65,0 ans Âge (étude totale) :
Vaccination antérieure avec le PNEU-P-23 : 20,9 % Les auteurs déclarent que les groupes étaient similaires en ce qui concerne les caractéristiques de base, notamment l'âge, le sexe, la race, l'origine ethnique, les problèmes médicaux sous-jacents et la vaccination antérieure avec le PNEU-P-23. |
| Études sur le PNEU-C-20 | |||
Hurley et al., Clinical Infectious Diseases, 2021; 73 (7): e1489-1497 Multicentre : 14 sites aux É.-U. Période d'étude : NS Financement : Pfizer Inc. |
Série livrée |
Phase 2, randomisée à une dose unique de PNEU-C-20 (N=222) ou de PNEU-C-13 (N=222) suivie d'une dose unique de solution saline (bras PNEU-C-20) ou de PNEU-P-23 (bras PNEU-C-13) un mois après la première vaccination Total randomisé = 444 |
Adultes de 60 à 64 ans, généralement en bonne santé (y compris ceux présentant des problèmes médicaux sous-jacents stables), sans antécédents d'IIP confirmée en laboratoire et n'ayant jamais été vaccinés Sexe (étude totale) : 56,0 % de femmes Ethnicité (étude totale) : 87,4 % non-Hispaniques ou non-Latinos Race : 75,4 % de Blancs Âge médian : 62,0 ans Les auteurs déclarent que les données démographiques des participants étaient similaires entre les groupes. |
Essink et al., Pivotal Phase 3 Randomized Clinical Trial of the Safety, Tolerability, and Immunogenicity of 20-valent Pneumococcal Conjugate Vaccine in Adults Aged ≥18 Years, Clinical Infectious Diseases, 2022; ciab990. En ligne avant impression Multicentre : Sites aux É.-U. et en Suède Période d'étude : De décembre 2018 à décembre 2019 Financement : Pfizer Inc. |
Adultes ≥60 ans : PNEU-C-13 suivi du PNEU-P-23 (intervalle de 1 mois) Adultes de 18 à 49 ans et de 50 à 59 ans : PNEU-C-13 seul |
Phase 3, Randomisation stratifiée par sous-groupe d'âge : Les participants de 60 ans et plus ont été randomisés pour recevoir une dose unique de PNEU-C-20 (N=1514) ou de PNEU-C-13 (N=1495) suivie d'une dose unique de solution saline (bras PNEU-C-20) ou de PNEU-P-23 (bras PNEU-C-13) un mois après la première vaccination. Les participants de 50 à 59 ans ont été randomisés pour recevoir une dose unique de PNEU-C-20 (N=334) ou de PNEU-C-13 (N=111). Les participants de 18 à 49 ans ont été randomisés pour recevoir une dose unique de PNEU-C-20 (N=336) ou de PNEU-C-13 (N=112).
|
Adultes de ≥18 ans sans trouble chronique grave ou autre MC ou psychiatrique aiguë ou chronique, sans antécédents d'IIP confirmée en laboratoire et n'ayant jamais été vaccinés Sexe, % de femmes (par cohorte d'âges) :
Ethnie, % de non Hispaniques ou non Latinos (par cohorte d'âges) :
Race, % de Blancs (par cohorte d'âges) :
Âge (cohorte de ≥60 ans) :
Les auteurs déclarent que les données démographiques des participants étaient similaires entre les groupes d'intervention pour chacune des cohortes selon l'âge. |
Cannon et al., Vaccine, 2021 : 39 (51):7494-7502 Multicentre : 33 sites aux É.-U. et 8 sites en Suède Période d'étude : De février 2019 à février 2020 Financement : Pfizer Inc. |
La comparaison dépend de la cohorte :
|
Phase 3. Randomisé 2:1 :
Total randomisé comme pertinent pour cette revue : 750 |
Adultes de ≥65 ans ayant déjà reçu le PNEU-P-23 ou le PNEU-C-13. Les participants présentant des problèmes médicaux sous-jacents stables et sans infection préalable par S. pneumoniae étaient admissibles Une troisième cohorte ayant déjà reçu à la fois le PNEU-P-23 et le PNEU-C-13 n'a pas été prise en compte dans le cadre de cette étude, car il ne s'agissait pas d'une comparaison randomisée. Données démographiques (dans le sous-ensemble de groupes concernés) : Sexe : de 52,5 à 56,5 % de femmes Ethnie : de 94,0 à 97,6 % de non Hispaniques ou non Latinos Race : fourchette de 90,2 à 93,3 % de Blancs Âge moyen : fourchette de 69,6 à 70,7 ans Les auteurs déclarent que les caractéristiques démographiques étaient similaires entre les groupes. |
Liste des abréviations
- AOP
- Activité opsonophagocytaire
- ASPC
- Agence de la santé publique du Canada
- AVAQ
- Années de vie ajustées par la qualité
- CCNI
- Comité consultatif national de l'immunisation
- CRM
- Corynebacterium diphtheriae
- DR
- Différence de risque
- ECR
- Essai contrôlé randomisé
- ÉÉFA
- éthique, équité, faisabilité, acceptabilité
- ÉI
- Évènement indésirable
- ÉIG
- Évènement indésirable grave
- EP
- Efficacité potentielle
- ER
- Efficacité réelle
- GCSH
- Greffe de cellules souches hématopoïétiques
- GRADE
- Grading of Recommendations, Assessment, Development and Evaluation
- IC
- Intervalle de confiance
- IP
- Infection à pneumocoques
- IIP
- Infection invasive à pneumocoques
- IM
- Intramusculaire
- LNM
- Laboratoire national de microbiologie
- mcg
- Microgramme
- MC
- Maladie chronique
- MGT
- Moyenne géométrique des titres
- MI
- Maladie immunodéficiente
- PNEU-C
- Vaccin conjugué contre le pneumocoque
- PNEU-C-13 (PREVNAR13)
- Vaccin conjugué 13-valent contre le pneumocoque
- PNEU-C-15 (Vaxneuvance)
- Vaccin conjugué 15-valent contre le pneumocoque
- PNEU-C-20 (PREVNAR20)
- Vaccin conjugué 20-valent contre le pneumocoque
- PNEU-P
- Vaccin polysaccharidique contre le pneumocoque
- PNEU-P-23
- Vaccin polysaccharidique 23-valent contre le pneumocoque
- POC
- Pneumonie d'origine communautaire
- POCP
- Pneumonie d'origine communautaire à pneumocoques
- RB
- Risque de biais
- RC
- Rapport des cotes
- RCED
- Rapport coût/efficacité différentiel
- RR
- Risque relatif
- SCI
- Surveillance circumpolaire internationale
- SCSMDO
- Système canadien de surveillance des maladies à déclaration obligatoire
- SNV
- Sérotype non vaccinal
- SR
- Séroréponse
- ST3
- Sérotype 3
- SV
- Sérotype vaccinal
- TNV
- Type non vaccinal
- TV
- Type vaccinal
- VIH
- Virus de l'immunodéficience humaine
Remerciements
La présente déclaration a été préparée par : K. Hildebrand, A. Nam, R. Pless, A. Stevens, A. Tuite, A. Wierzbowski et E. Wong au nom du Groupe de travail sur le pneumocoque du CCNI et a été approuvée par le CCNI.
Le CCNI tient à remercier M. Hersi, N. Islam, C.Y. Jeong, A. Li, R. MacTavish, A. Golden, W. Demczuk, A. Griffith, I. Martin, E. Tarrataca, C. Tremblay, M. Tunis, M. W. Yeung, K. Young et R. Ximenes pour leur contribution.
Groupe de travail sur le pneumocoque du CCNI
Membres : K. Hildebrand (président), J. Bettinger, N. Brousseau, P. De Wals, D. Fisman, J. Kellner, A. McGeer, J. Papenburg, S. Rechner et G. Tyrell.
Représentants d'office : G. Coleman (Direction des médicaments biologiques et radiopharmaceutiques [DMBR], Santé Canada [SC]), M. Kobayashi (Centre for Disease Control [CDC], É.-U.), A. Li (Surveillance des maladies évitables par la vaccination [SMÉV], ASPC), I. Martin (Laboratoire national de microbiologie [LNM], ASPC), G. Metz (Innocuité des vaccins [IV], ASPC) et A. Monohan (Direction générale de la santé des Premières Nations et des Inuits [DGSPNI], Services aux Autochtones Canada [SAI])
Participants de l'ASPC : A. Wierzbowski (responsable technique), R. Pless (responsable médical), N. Islam, A. Y. Li, I. Martin, A. Stevens, C. Tremblay, A. Tuite et K. Young.
CCNI
Membres du CCNI : S. Deeks (président), R. Harrison (vice-président), M. Andrew, J. Bettinger, N. Brousseau, H. Decaluwe, P. De Wals, E. Dubé, V. Dubey, K. Hildebrand, K. Klein, M. O'Driscoll, J. Papenburg, A. Pham-Huy, B. Sander et S. Wilson.
Anciens membres du CCNI : S. Smith.
Représentants de liaison : L. Bill/N. Nowgesic (Canadian Indigenous Nurses Association), LM. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et gynécologues du Canada), J. Comeau (l'Association pour la microbiologie médicale et l'infectiologie Canada), J. MacNeil (Center for Disease Control and Prevention, É.-U.), S. Funnell (Indigenous Physicians Association of Canada), J. Potter (Collège des médecins de famille du Canada), M. Lavoie (Conseil des médecins hygiénistes en chef), D. Moore (Société canadienne de pédiatrie), M. Naus (Comité canadien sur l'immunisation) et A. Ung (Association des pharmaciens du Canada).
Anciens représentants de liaison : L. Dupuis (Association des infirmières et infirmiers du Canada), D. Fell (Association canadienne pour la recherche et l'évaluation en immunisation), J. Hu (Collège des médecins de famille du Canada)
Représentants d'office : V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes), E. Henry (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), M. Lacroix (Groupe consultatif en matière d'éthique en santé publique, ASPC), C. Pham (Direction des médicaments biologiques et radiopharmaceutiques, SC), D. MacDonald (COVID-19 Épidémiologie et surveillance, ASPC), S. Ogunnaike-Cooke (CIMRI, ASPC), P. Fandja (Direction des produits de santé commercialisés, SC), M. Routledge (Laboratoire national de microbiologie, ASPC), et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services autochtones Canada).
Anciens représentants d'office : C. Lourenco (Direction des médicaments biologiques et radiopharmaceutiques, SC), K. Robinson (Direction des produits de santé commercialisés, SC)
Annexe A : Tableaux supplémentaires
| Classement GRADE | Description |
|---|---|
| Élevé | Confiance élevée : l'effet réel est proche de celui de l'estimation de l'effet. |
| Modéré | Confiance modérée : l'effet réel est probablement proche de l'effet mais il est possible qu'il soit sensiblement différent. |
| Faible | Confiance faible : l'effet réel peut être sensiblement différent de l'estimation de l'effet. |
| Très faible | Confiance très faible : l'effet réel est susceptible d'être sensiblement différent de l'estimation de l'effet. |
| Résultat | Définition |
|---|---|
| Résultats cliniques : Avantages | |
| Toutes les infections invasives à pneumocoques (IIP) | Une preuve clinique de pneumonie avec bactériémie, bactériémie sans site d'infection connu, et (ou) méningite avec confirmation en laboratoire de l'infection et isolement de Streptococcus pneumoniae ou de son ADN à partir d'un site normalement stérile |
| IIP de sérotype vaccinal (TV) | Une preuve clinique d'IIP (pneumonie avec bactériémie, bactériémie sans site d'infection connu et (ou) méningite) avec confirmation en laboratoire de l'infection et isolement de Streptococcus pneumoniae ou de son ADN à partir d'un site normalement stérile confirmé par sérotypage comme étant S. pneumoniae de sérotype (ST) 4, 9V, 6B, 14, 18C, 19F, 23F, 1, 5, 7F, 3, 6A, 19A, 2, 8, 9N, 10A, 11A, 12F, 15B, 17F, 20, 22F ou 33F |
| Toutes les pneumonies d'origine communautaire (POC) | Une POC est définie si une présentation est survenue dans les 72 heures suivant l'admission à l'hôpital avec un infiltrat pulmonaire nouveau ou évolutif sur la radiographie pulmonaire évoquant une pneumonie, avec ≥2 signes ou symptômes (température >38 °C, toux, expectorations, essoufflement, douleur thoracique pleurétique, crépitations ou consolidation à l'examen thoracique). |
| Pneumonie d'origine communautaire à pneumocoques (POCP) | Une POCP est un cas de POC dont la présence de S. pneumoniae a été confirmée par la détection d'antigènes urinaires ou par l'isolement de S. pneumoniae dans une culture de sang ou d'expectoration. |
| POCP attribuable à un sérotype évitable par la vaccination | Une confirmation en laboratoire de l'infection et isolement de Streptococcus pneumoniae ou de son ADN à partir d'un site non stérile (expectoration) confirmé par sérotypage comme étant le sérotype 4, 9V, 6B, 14, 18C, 19F, 23F, 1, 5, 7F, 3, 6A, 19A, 2, 8, 9N, 10A, 11A, 12F, 15B, 17F, 20, 22F ou 33F de S. pneumoniae |
| Décès attribuable à un sérotype évitable par la vaccination | Un décès causé par une infection à S. pneumoniae dont le laboratoire a confirmé qu'il s'agissait du sérotype 4, 9V, 6B, 14, 18C, 19F, 23F, 1, 5, 7F, 3, 6A, 19A, 2, 8, 9N, 10A, 11A, 12F, 15B, 17F, 20, 22F ou 33F de S. pneumoniae. |
| Décès toutes causes confondues | Décès, quelle qu'en soit la cause |
| Résultats en matière d'immunogénicité - Avantages | |
| Déterminé par l'activité opsonophagocytaire (AOP) | L'AOP représente des anticorps fonctionnels capables d'opsoniser les polysaccharides capsulaires du pneumocoque pour les présenter aux cellules phagocytaires qui les engloutissent et les tuent ensuite et elle est considérée comme une importante mesure immunologique de substitution de la protection contre l'infection à pneumocoques (IP). |
| Réponse immunitaire |
Elle est évaluée par le test AOP spécifique au sérotype et la moyenne géométrique des titres (MGT) de l'AOP suivant l'administration du vaccin. Elle peut également être mesurée par les facteurs d'augmentation des titres moyens géométriques de l'AOP spécifiques du sérotype avant et après l'administration du vaccin, le pourcentage de participants dont les titres de l'AOP ont augmenté de plus de 4 fois avant et après l'administration du vaccin et le pourcentage de participants dont les titres de l'AOP sont supérieurs ou égaux à la limite inférieure de quantification (LIQ) suivant l'administration du vaccin. On a calculé le pourcentage de participants dont le titre de l'AOP pneumococcique spécifique au sérotype a augmenté d'un facteur >4 (sérorépondeurs) entre les périodes pré- et post-administration du vaccin, ainsi que les IC bilatéraux à 95 % correspondants. |
| Non-infériorité |
Elle est définie sur la base de la limite inférieure de l'IC bilatéral à 95 % du rapport de MGT de l'AOP entre l'intervention et le comparateur qui doit être supérieur à 0,5 à un moment prédéterminé (p. ex., 30 jours) suivant l'administration du vaccin. Sur la base des comparaisons entre les groupes des MGT de l'AOP et des proportions de participants présentant une augmentation ≥4 fois des titres de l'AOP spécifiques au sérotype entre les périodes prévaccination et post-vaccination |
| Supériorité | La conclusion de supériorité pour le sérotype 3 est fondée sur la limite inférieure de l'IC à 95 % pour le rapport de MGT estimé (intervention/comparateur) étant > 1,2. La conclusion de supériorité pour les sérotypes uniques est fondée sur la limite inférieure de l'IC à 95 % pour le rapport de MGT estimé (comparateur/intervention) étant > 2,0. |
| Résultats cliniques - Méfaits | |
| Réactions indésirables locaux |
Des réactions sollicitées de rougeur, de gonflement, de douleur au site d'injection surveillées pendant une période déterminée (de 7 à 10 jours) suivant l'administration du vaccin |
| Rougeur | Une rougeur et un gonflement définis comme étant légers (supérieurs à [>], p. ex., de 2,0 à 5,0 cm), modérés (de >5,0 à 10,0 cm) et sévères (>10,0 cm) |
| Douleur | La douleur au site d'injection a été classée en 3 catégories : légère (ne gênant pas l'activité), modérée (gênant l'activité) et sévère (empêchant l'activité quotidienne). |
| Réaction systématique locale | Des réactions sollicitées de fatigue, de maux de tête, de douleurs musculaires, de douleurs articulaires ou de fièvre surveillées pendant une période spécifique (p. ex., 7 jours) suivant l'administration du vaccin La fièvre a été définie comme étant supérieure ou égale (>) à 38,0 degrés Celsius (C) et catégorisée de >38,0 à 38,4 degrés Celsius, de >38,4 à 38,9 degrés Celsius, de >38,9 à 40,0 degrés Celsius et >40,0 degrés Celsius. La fatigue, les maux de tête, les douleurs musculaires et les douleurs articulaires ont été classés comme étant légers (n'interférant pas avec l'activité), modérés (interférant quelque peu avec l'activité) et sévères (empêchant l'activité quotidienne). |
| Évènements indésirables sévères dans les 6 mois suivant la vaccination | Un ÉIG est défini comme étant tout évènement médical indésirable qui entraîne la mort, qui met la vie en danger (risque immédiat de mort), qui nécessite une hospitalisation ou la prolongation d'une hospitalisation existante, qui entraîne une invalidité/incapacité persistante ou significative (perturbation substantielle de la capacité à mener les fonctions normales de la vie), qui entraîne une anomalie congénitale/défaut de naissance ou qui est considéré comme étant un évènement médical important. |
| Maladies chroniques nouvellement diagnostiquées dans les 6 mois suivant la vaccination | Les maladies chroniques nouvellement diagnostiquées sont définies comme étant une maladie ou des problèmes médicaux, non identifiées précédemment, susceptibles de persister ou d'avoir des effets durables. |
| Étude | Domaines de risque de biaisTableau 8 Note de bas de page a | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| GSA | DA | A-PP | A-ÉR | DMR | DLB | RS | ||||
| Immunogénicité | ÉI | Immunogénicité | ÉI | |||||||
| Études sur le vaccin PNEU-C-15 | ||||||||||
| Ermlich 2018 | F | F | F | F | F | F | F | F | F | |
| Chanson 2021 | F | F | F | F | F | F | F | F | F | |
| Platt 2022 | F | F | F | F | F | F | FTableau 8 Note de bas de page b | Q | F | L |
| Peterson 2018 | F | F | F | F | F | F | F | F | F | |
| Hammitt 2022 | F | F | F | F | F | F | F | F | F | |
| Mohapi 2022 | F | F | F | F | F | F | F | F | F | |
| Severance 2022 | F | F | F | F | F | F | F | F | F | |
| Études sur le vaccin PNEU-C-20 | ||||||||||
| Hurley 2021 | F | F | F | F | F | F | F | F | F | |
| Essink 2022 | F | F | F | F | F | F | F | F | F | |
| Canon 2021 | F | F | F | s.o. | É | F | F | F | F | |
Abréviations : É = risque élevé de biais; ÉI = évènements indésirables; F = faible risque de biais; Q = quelques préoccupations ou imprécis; s.o. = sans objet
|
||||||||||
Tableaux de synthèse des données probantes
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs avec PNEU-C-15 c. PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données d'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses.) |
Classement GRADE de la certitude des données probantes (Tableau 1) |
|---|---|---|---|
Moyenne géométrique des titres (MGT) (par protocole) 1 mois après le vaccin |
1 ECR (Platt 2022)
|
Sérotypes communs Tous sauf ST3 : L'estimation du rapport de MGT varie de 0,68 (ST4) à 1,23 (ST6B). ST3 : 1,60. La non-infériorité du PNEU-C-15 est respectée pour tous les sérotypes communs (marge >0,5; limite inférieure de l'IC pour tous les sérotypes 0,57 [ST4]). Données supplémentaires (non GRADE) : Sérotypes uniques, 22F, 33 F. Le rapport de MGT est estimé à 31,83 et 7,11, respectivement. Réponses numériquement plus élevées pour les sérotypes uniques Deux études supplémentaires menées chez des adultes de ≥50 ans ont fourni des renseignements sur l'immunogénicité (n>500 combinés par analyse des sérotypes). Une étude a utilisé un seuil de non-infériorité calculé pour une autre comparaison, tandis que l'autre n'a pas été évaluée pour la non-infériorité. Dans les 2 études, la plupart des sérotypes présentaient des estimations ponctuelles du rapport de MGT numériquement plus élevées et différaient quant aux sérotypes présentant des estimations ponctuelles numériquement plus faibles (ST4 et 7F dans une étude; 19F dans l'autre étude). Sous-groupes pour l'âge (de 50 à 64 ans c. ≥65 ans) Aucune étude n'a évalué la non-infériorité en fonction d'une population de 50 à 64 ans. Une étude (V114-019; Platt 2022) a fourni suffisamment de renseignements pour évaluer visuellement le chevauchement entre 50 à 64 ans et ≥65 ans. Il y avait un chevauchement important pour la plupart des sérotypes communs. Les sérotypes5, 14 et 23F présentaient des estimations numériques apparemment plus élevées, en particulier le ST14. Un chevauchement avec une estimation apparente plus élevée dans le groupe des ≥65 ans a été observé pour le ST3 par rapport au groupe de 50 à 64 ans. Il y avait un chevauchement important avec 22F et 33 F. En général, il y avait une congruence entre les sous-groupes parmi les sérotypes. Sous-groupes pour l'âge (de 65 à 74 ans c. ≥75 ans) Aucune étude n'a évalué la non-infériorité en fonction d'une population de ≥75 ans. Une étude (V114-019; Platt 2022) a fourni suffisamment de renseignements pour évaluer visuellement le chevauchement entre 65 à 74 ans et ≥75 ans. Il y avait un chevauchement important pour la plupart des sérotypes communs. Le sérotype19A présentait une estimation numérique apparemment plus élevée, en particulier le 6B. Pour le sérotype18C, il n'y avait aucun chevauchement avec le PNEU-C-15 qui présentait des valeurs plus élevées. Il y avait un chevauchement substantiel des groupes d'âge pour le ST3 et les sérotypes uniques 22F et 33 F. En général, il y avait une congruence entre les sous-groupes parmi les sérotypes. |
ModéréTableau 9 Note de bas de page a Le PNEU-C-15 n'est probablement pas inférieur au PNEU-C-13 en ce qui concerne la réponse immunitaire pour les sérotypes communs. |
% sérorépondeurs (risque ≥4 fois plus élevé dans le risque de l'AOP spécifique au sérotype) - Sérotypes communs sauf Sérotypes 3 1 mois après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021) PNEU-C-15 : Fourchette N=1 031 à 1 108 analysée parmi les sérotypes PNEU-C-13 : Fourchette N=1 044 à 1 110 analysée parmi les sérotypes |
Sérotypes communs sauf ST3. Résultats variables parmi les études. Dans la plus grande étude (N~1100), près de 2 tiers des sérotypes ont montré une proportion numériquement plus faible de sérorépondeurs avec le PNEU-C-15 que le PNEU-C-13. Dans les autres études (N~900-1000 combinés), la plupart des sérotypes ont montré une plus grande proportion numérique de sérorépondeurs avec le PNEU-C-15. Les ST6B, 18C et 23F présentent un nombre de sérorépondeurs numériquement plus élevé dans toutes les études. Aucun sérotype n'a montré de manière constante une SR plus faible avec le PNEU-C-15 dans les 3 études. Données supplémentaires (non GRADE) : Sous-groupes d'âge (de 50 à 64 ans c. ≥65 ans). Une étude (V114-002; Ermlich 2018) a fourni des renseignements par sous-groupe (de 50 à 64 ans, de 65 à 74 ans, de ≥75 ans) mais elle est fondée sur des échantillons de petite taille (fourchette de 132 à 144 analysée dans tous les sous-groupes). Des résultats variables selon les sérotypes. Les sérotypes1, 3 et 9V présentent une estimation ponctuelle numérique plus élevée avec le PNEU-C-15 pour tous les sous-groupes; une estimation ponctuelle numérique plus faible a été observée dans tous les sous-groupes pour les sérotypes6A, 7F et 19F. Pour le sérotype5, les 50 à 64 ans et les 65 à 74 ans présentent tous deux une estimation numérique plus élevée. Pour le sérotype6B, le sous-groupe des 50 à 64 ans présente une estimation numérique ponctuelle plus faible, contrairement aux 2 autres sous-groupes. Pour les sérotypes14, 18C et 19A, seul le sous-groupe des 65 à 74 ans présente une estimation numérique supérieure avec le PNEU-C-15. Sous-groupes d'âge (de 65 à 74 ans c. ≥75 ans) Une étude (V114-002; Ermlich 2018) a fourni des renseignements par sous-groupe (de 65 à 74 ans, de ≥75 ans) mais est fondée sur des échantillons de petite taille (fourchette de 132 à 144 analysée dans tous les sous-groupes). Des résultats similaires sont observés pour la plupart des sérotypes. À l'inverse de la tranche d'âge de 65 à 74 ans, le sous-groupe de ≥75 ans présente moins de sérorépondeurs numériques au PNEU-C-15 pour les sérotypes5, 14, 18C, 19A et 23 F. Les 2 groupes d'âge présentent plus de sérorépondeurs numériques avec le PNEU-C-15 pour ST3 et un nombre moindre avec le 6A. |
FaibleTableau 9 Note de bas de page bTableau 9 Note de bas de page c Il peut y avoir une variabilité entre les sérotypes communs (sauf ST3) quant à savoir si une proportion numériquement plus élevée de sérorépondeurs est observée avec le PNEU-C-15. |
% de sérorépondeurs
(risque ≥4 fois plus élevé dans le risque de l'AOP spécifique au sérotype) 1 mois après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Sérotype commun, ST3. Estimation numérique de la SR plus élevée avec le PNEU-C-15 (RR de 1,13 à 1,41; DR de 9,9 % à 21 %) Données supplémentaires (non GRADE) : voir ci-dessus |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page d Il y a probablement une plus grande proportion numérique de sérorépondeurs avec le PNEU-C-15 pour le ST3. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans l'augmentation des moyennes géométriques) - Sérotypes uniques 1 mois après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Sérotypes uniques. Proportion numériquement plus élevée de sérorépondeurs avec le PNEU-C-15. 22F : RR de 4,41 à 6,47; DR de 56,3 % à 64,6 %. 33F : RR de 6,61 à 20,43; DR de 50,4 % à 58,3 %. Données supplémentaires (non GRADE) : Sous-groupes d'âge (de 50 à 64 ans c. ≥65 ans). Des estimations ponctuelles numériques plus élevées sont observées pour les sérotypes22F et 33F dans tous les sous-groupes (fourchette de 125 à 137 analysée dans tous les sous-groupes). Sous-groupes d'âge (de 65 à 74 ans c. ≥75 ans). Des estimations ponctuelles numériques plus élevées sont observées pour les sérotypes22F et 33F dans tous les sous-groupes (fourchette de 125 à 137 analysée dans tous les sous-groupes). |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page d Il y a probablement une plus grande proportion numérique de sérorépondeurs au PNEU-C-15 avec les sérotypes22F et 33F. |
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
2 ECR (Platt 2022, Ermlich 2018)
|
Aucun ÉIG lié au vaccin n'a été observé dans les 2 groupes. |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e |
ÉIG Jusqu'à 6 mois après le vaccin |
2 ECR (Platt 2022, Ermlich 2018)
|
Effets relatifs : Peto RC 1,00 (de 0,46 à 2,17) Effets absolus : 0 de moins pour 1 000 (11 de moins à 23 de plus) ÉIG signalés dans Ermlich 2018. PNEU-C-15 : occlusion de l'artère coronaire, appendicite, cancer anal, anxiété. PNEU-P-23 : insuffisance cardiaque, infarctus du myocarde, vertiges, troubles gastro-intestinaux, décès, appendicite, néoplasme bénin des voies urinaires La deuxième étude ne fournissant pas de liste d'ÉIG a indiqué qu'aucun décès n'était survenu pendant la période d'étude. |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition d'ÉIG jusqu'à 6 mois après l'administration du vaccin. Aucun de ces évènements n'a été considéré comme étant lié au vaccin par les auteurs de l'étude. |
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : Peto RC 0,86 (de 0,29 à 2,55) Effets absolus : 1 de moins pour 1 000 (4 de moins à 9 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition d'une fatigue sévère dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : Peto RC 0,86 (de 0,29 à 2,55) Effets absolus : 1 de moins pour 1 000 (4 de moins à 9 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition de maux de tête sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - douleur musculaire Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : Peto RC 0,40 (0,12 à 1,31) Effets absolus : 4 de moins pour 1 000 (6 de moins à 2 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs musculaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : Peto RC 1,00 (de 0,14 à 7,13) Effets absolus : 0 de moins pour 1 000 (1 de moins à 10 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Fièvre Jusqu'à 5 jours après le vaccin |
2 ECR (Platt 2022, Song 2021)
|
Effets relatifs : Peto RC 1,49 (de 0,26 à 8,60) Effets absolus : 1 de plus pour 1 000 (2 de moins à 16 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition de fièvre sévère dans les 5 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : RR 1,20 (de 0,89 à 1,63) Effets absolus : 34 de plus pour 1 000 (19 de moins à 108 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page f Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition d'une fatigue légère/modérée dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : RR 1,11 (de 0,83 à 1,48) Effets absolus : 13 de plus pour 1 000 (21 de moins à 58 de plus) |
FaibleTableau 9 Note de bas de page cTableau 9 Note de bas de page g Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de maux de tête légers/modérés dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : RR 1,43 (de 1,18 à 1,73) Effets absolus : 56 de plus pour 1 000 (23 de plus à 95 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il existe probablement une différence banale entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs musculaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
3 ECR (Platt 2022, Ermlich 2018, Song 2021)
|
Effets relatifs : RR 1,00 (de 0,76 à 1,31) Effets absolus : 0 de moins pour 1 000 (19 de moins à 24 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 5 jours après le vaccin |
2 ECR (Platt 2022, Song 2021)
|
Effets relatifs : Peto RC 0,42 (de 0,15 à 1,20) Effets absolus : 6 de moins pour 1 000 (9 de moins à 2 de plus) |
ModéréTableau 9 Note de bas de page cTableau 9 Note de bas de page e Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de fièvre légère/modérée dans les 5 jours suivant l'administration du vaccin. |
Abréviations : c. = contre; DR = différence de risque; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; MGT = moyenne géométrique des titres; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; ECR = essai contrôlé randomisé; RC = rapport des cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs avec le PNEU-C-15 c. le PNEU-P-23. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
1 ECR (Ermlich 2018);
|
Sérotypes communs Tous sauf ST3 : L'estimation du rapport de MGT varie de 0,77 (19F) à 5,64 (ST23F). ST3 : 1,96. La non-infériorité du PNEU-C-15 a été respectée pour les 14 sérotypes communs (marge ≥ 0,33; limite inférieure de l'IC pour tous les sérotypes 0,55 [19F]). Données supplémentaires (non GRADE) : Sérotype unique, 6A. Estimation du rapport de MGT 8,59. Réponse numériquement plus élevée pour le sérotype unique Sous-groupes par âge. Rapports de MGT. La non-infériorité pour les groupes d'âge de 65 à 74 ans (n=65 à 67) et ≥75 ans (n=70 à 72) n'était pas disponible. Dans tous les sérotypes, la plupart des rapports de MGT > 1, sauf pour le 19F (dans les 2 groupes d'âge). Pour le ST3, les rapports de MGT étaient de 2,68 et 1,44, respectivement. Pour le ST6A, les rapports de MGT étaient de 9,61 et 8,67, respectivement. |
FaibleTableau 10 Note de bas de page aTableau 10 Note de bas de page b Le PNEU-C-15 peut être non inférieur au PNEU-P-23 en ce qui concerne la réponse immunitaire pour les sérotypes communs. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans l'AOP spécifique au sérotype) (par protocole) 1 mois après le vaccin |
1 ECR (Ermlich 2018);
|
Sérotypes communs : Tous sauf ST3 : RR de 0,92 à 1,24; DR de -5,4 % (33F) à 17 % (23F). ST3 : RR 1,18, DR 12,9 %. Favorise le Sérotype unique, 6A : RR 1,36, DR 21,6 % Proportion numériquement plus élevée de sérorépondeurs avec la plupart des sérotypes, favorisant le PNEU-C-15 Données supplémentaires (non GRADE) : Parmi les sérotypes, la plupart montrent une proportion numérique plus élevée de sérorépondeurs avec le PNEU-C-15 dans les groupes d'âge de 65 à 74 ans (RR de 0,94 à 1,31; DR de -4,61 % à 18,46 %) et ≥75 ans (RR de 0,83 à 1,37; DR de -12,02 % à 21,86 %), avec une variation des exceptions entre les groupes d'âge. Les valeurs de ST6A étaient les plus élevées dans ces groupes (RR 1,25 et DR 16,48; RR 1,51 et DR 26,06, respectivement. |
FaibleTableau 10 Note de bas de page aTableau 10 Note de bas de page b Le PNEU-C-15 peut entraîner une proportion numériquement plus élevée de sérorépondeurs pour la plupart des sérotypes par rapport au |
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
1 ECR (Ermlich 2018);
|
Aucun ÉIG lié au vaccin n'a été observé dans les 2 groupes. |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c |
ÉIG Jusqu'à 6 mois après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : Peto RC 0,58 (de 0,17 à 1,90) Effets absolus : 13 de moins pour 1 000 (de 25 de moins à 26 de plus)
|
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-P-23 en ce qui concerne les ÉIG. Aucun n'était lié à un vaccin. |
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : Peto RC 0,51 (de 0,10 à 2,56) Effets absolus : 8 de moins pour 1 000 (de 16 de moins à 26 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence en matière de fatigue sévère entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : Peto RC 2,75 (de 0,38 à 19,64) Effets absolus : 8 de plus pour 1 000 (3 de moins à 75 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page d Il y a probablement peu ou aucune différence en matière de maux de tête sévères entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique sévère - Douleurs musculaires Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : Peto RC 0,51 (de 0,14 à 0,90) Effets absolus : 13 de moins pour 1 000 (22 de moins à 22 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence dans les douleurs musculaires sévères entre le |
ÉI systémique sévère - Douleurs articulaires Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : Peto RC 0,37 (de 0,05 à 2,62) Effets absolus : 8 de moins pour 1 000 (12 de moins à 20 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence dans les douleurs articulaires sévères entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique sévère - Fièvre Jusqu'à 14 jours après le vaccin |
Non signalé par sévérité |
||
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : RR 0,92 (de 0,67 à 1,27) Effets absolus : 21 de moins pour 1 000 (85 de moins à 69 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence en matière de fatigue légère/modérée entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : RR 1,53 (de 0,95 à 2,44) Effets absolus : 58 de plus pour 1 000 (5 de moins à 157 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page d Il y a probablement peu ou aucune différence dans les maux de tête légers/modérés entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : RR 1,19 (de 0,87 à 1,63) Effets absolus : 45 de plus pour 1 000 (31 de moins à 148 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page d Il y a probablement peu ou aucune différence dans les douleurs musculaires légères/modérées entre le PNEU-C-15 et le PNEU-P-23. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Ermlich 2018);
|
Effets relatifs : RR 1,00 (de 0,67 à 1,51) Effets absolus : 0 de moins pour 1 000 (55 de moins à 84 de plus) |
ModéréTableau 10 Note de bas de page bTableau 10 Note de bas de page c Il y a probablement peu ou aucune différence dans les douleurs articulaires légères/modérées entre le PNEU-C-15 et le |
ÉI systémique léger/modéré - Fièvre Jusqu'à 14 jours après le vaccin |
Non signalé par sévérité |
||
Abréviations : c. = contre; DR = différence de risque; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; PNEU-C-23 = vaccin polysaccharidique 23-valent contre le pneumocoque; RC = rapport des cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs avec le PNEU-C-15+ en concomitance avec le VIQ c. le PNEU-C-15+ sans concomitance avec le VIQ. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
1 ECR (Severance 2022);
|
Tous sauf ST3 : L'estimation du rapport de MGT varie de 0,66 (ST1) à 1,02 (ST19F). ST3 : 0,94. La non-infériorité du PNEU-C-15 administré en concomitance avec le VIQ a été respectée pour les 15 sérotypes (marge >0,5; limite inférieure de l'IC pour tous les sérotypes 0,54 [ST1]). Données supplémentaires (non GRADE) : Souches grippales. Le VIQ administré en concomitance avec le PNEU-C-15 n'était pas inférieur à l'administration non concomitante pour les 4 souches grippales (marge > 0,5; IC le plus faible lié à toutes les souches 0,86 [B-Victoria]). Sous-groupe par âge. Une étude (Severance 2022) a signalé des rapports de MGT pour les 50 à 64 ans, les 65 à 74 ans et les ≥75 ans. Dans l'ensemble des sous-groupes, les MGT de l'AOP spécifiques au sérotype avaient tendance à être plus élevées pour les plus jeunes (50 à 64 ans) par rapport aux plus âgés. Toutefois, il y avait un chevauchement substantiel dans les IC du rapport de MGT. Sous-groupe selon les antécédents de vaccination avec le PNEU-P-. L'étude a également effectué une analyse de sous-groupe en fonction des antécédents de vaccination avec le PNEU-P-23 et a signalé des rapports généralement similaires en comparaison avec la population globale de l'étude. |
ModéréTableau 11 Note de bas de page a Le PNEU-C-15 administré en concomitance avec le VIQ n'est probablement pas inférieur au PNEU-C-15 administré sans concomitance avec le VIQ. |
% sérorépondeurs 1 mois après le vaccin |
1 ECR (Severance 2022);
|
Sérotypes sauf Sérotype 3. Proportion numériquement plus faible de sérorépondeurs en cas d'administration concomitante par rapport à l'administration non concomitante pour tous les sérotypes communs, sauf les sérotypes 7F, 9V, 19F et 23F Les données de sous-groupes selon l'âge et les antécédents de vaccination avec le PNEU-P-23 ne sont pas fournies. |
ModéréTableau 11 Note de bas de page a Le PNEU-C-15 administré avec le VIQ entraîne probablement une proportion numériquement plus faible de sérorépondeurs pour la plupart des sérotypes par rapport au PNEU-C-15 administré de façon non concomitante avec le VIQ. |
% sérorépondeurs (risque ≥4 fois plus élevé d'AOP spécifique au sérotype) – Sérotype 3. 1 mois après le vaccin |
1 ECR (Severance 2022);
|
SÉROTYPE 3. Estimation de la SR similaire entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ (RR : 1,00; DR : -0,1 %) Les données de sous-groupes selon l'âge et les antécédents de vaccination avec le PNEU-P-23 ne sont pas fournies. |
ModéréTableau 11 Note de bas de page a Le PNEU-C-15 administré avec le VIQ entraîne probablement une proportion similaire de sérorépondeurs pour ST3 par rapport au PNEU-C-15 administré de façon non concomitante avec le VIQ. |
ÉIG lié au vaccin Jusqu'à 7 mois après le vaccin |
1 ECR (Severance 2022);
|
Aucun évènement lié au vaccin n'a été observé dans les 2 groupes. |
ModéréTableau 11 Note de bas de page b Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition d'ÉIG jusqu'à 7 mois après l'administration du vaccin. Aucun de ces évènements n'a été considéré comme étant lié au vaccin par les auteurs de l'étude. Les ÉI énumérés concernaient l'ensemble de la population étudiée qui comprenait 50 % de la population âgée de moins de 65 ans. |
ÉIG Jusqu'à 7 mois après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 1,45 (0,62 à 3,40) Effets absolus : 13 de plus pour 1 000 (11 de moins à 65 de plus) |
|
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 0,32 (de 0,13 à 0,82) Effets absolus : 16 de moins pour 1 000 (20 de moins à 4 de moins) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il existe probablement une différence banale entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ dans l'apparition d'une fatigue sévère dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 1,64 (de 0,41 à 6,59) Effets absolus : 3 de plus pour 1 000 (3 de moins à 27 de plus) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ dans l'apparition de maux de tête sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 0,36 (de 0,13 à 0,97) Effets absolus : 13 de moins pour 1 000 (17 de moins pour 1 de moins) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il existe probablement une différence banale entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ dans l'apparition de douleurs musculaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Douleur articulaire |
1 ECR (Severance 2022); |
Effets relatifs : Peto RC 0,18 (de 0,06 à 0,58) Effets absolus : 15 de moins pour 1 000 (17 de moins à 8 de moins) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il existe probablement une différence banale entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ dans l'apparition de douleurs articulaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 0,13 (de 0,01 à 1,29) Effets absolus : 4 de moins pour 1 000 (5 de moins à 1 de plus) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ dans l'apparition d'une fièvre sévère dans les 5 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : RR 0,96 (de 0,79 à 1,15) Effets absolus : 11 de moins pour 1 000 (58 de moins à 42 de plus) |
ModéréTableau 11 Note de bas de page dTableau 11 Note de bas de page e Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition d'une fatigue légère/modérée dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : RR 0,89 (de 0,72 à 1,11) Effets absolus : 25 de moins pour 1 000 (64 de moins à 25 de plus) |
ModéréTableau 11 Note de bas de page dTableau 11 Note de bas de page e Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition de maux de tête légers/modérés dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : RR 1,18 (de 0,95 à 1,48) Effets absolus : 35 de plus pour 1 000 (10 de moins à 93 de plus) |
ModéréTableau 11 Note de bas de page dTableau 11 Note de bas de page e Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition de douleurs musculaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : RR 0,94 (de 0,66 à 1,34) Effets absolus : 6 de moins pour 1 000 (33 de moins à 33 de plus) |
ModéréTableau 11 Note de bas de page dTableau 11 Note de bas de page e Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition de douleurs articulaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Severance 2022);
|
Effets relatifs : Peto RC 1,77 (de 0,62 à 5,08) Effets absolus : 6 de moins pour 1 000 (3 de moins à 33 de plus) |
ModéréTableau 11 Note de bas de page cTableau 11 Note de bas de page d Il y a probablement peu ou aucune différence entre l'administration concomitante et non concomitante du PNEU-C-15 et du VIQ en ce qui concerne l'apparition d'une fièvre légère/modérée dans les 5 jours suivant l'administration du vaccin. |
Abréviations : c = contre; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; RC = rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme le PNEU-C-15 c. le PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
1 ECR (Peterson);
|
La non-infériorité n'a pas été évaluée. Données supplémentaires (non GRADE) Sérotypes communs Tous sauf Sérotype 3: L'estimation du rapport de MGT varie de 0,68 (4) à 1,23 (6B). Sérotype 3: 1,6. Sérotypes uniques. 22F : 13,9; 33F : 3,5. Réponses numériquement plus élevées pour les sérotypes uniques |
Aucun classement GRADETableau 12 Note de bas de page a. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans l'augmentation des moyennes géométriques) (par protocole) 1 mois après le vaccin |
1 ECR (Peterson);
|
Sérotypes communs : Tous sauf Sérotype 3: L'intervalle des RR est de 0,80 à 1,25. Sérotype 3: RR 1,37. Favorise le PNEU-C-15 sauf pour les sérotypes4, 5, 6A, 6B et 7 F. Sérotypes uniques, 22F : RR 5,13; 33F : RR 6,10. Proportion numériquement plus élevée de sérorépondeurs avec la plupart des sérotypes, favorisant le PNEU-C-15. |
FaibleTableau 12 Note de bas de page bTableau 12 Note de bas de page c Le PNEU-C-15 peut entraîner une proportion numériquement plus élevée de sérorépondeurs pour la plupart des sérotypes par rapport au PNEU-C-13. |
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
1 ECR (Peterson);
|
Aucun évènement lié au vaccin n'a été observé dans les 2 groupes. |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne les ÉIG chez les personnes ayant déjà reçu le PNEU-P-23. Aucun n'était lié à un vaccin. |
ÉIG Jusqu'à 6 mois après le vaccin |
1 ECR (Peterson);
|
Effets relatifs : Peto RC 0,13 (de 0,01 à 2,14) Effets absolus : 14 de moins pour 1 000 (de 16 de moins à 17 de plus) |
|
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Peterson);
|
Effets relatifs : Peto RC : 0,99 (de 0,06 à 15,95) Effets absolus : 7 de moins pour 1 000 (de 16 de moins à 105 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence en matière de fatigue sévère entre le PNEU-C-15 et le PNEU-C-13. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Peterson);
|
Effets relatifs : Peto RC : 0,13 (de 0,003 à 6,77) Effets absolus : 7 de moins pour 1 000 (8 de moins à 21 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne les maux de tête sévères chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique sévère - Douleurs musculaires Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : Peto RC : 7,33 (de 0,15 à 369,5) Effets absolusde : 10 de plus pour 1 000 (10 de moins à 30 de plus pour 1 000). |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence dans les douleurs musculaires sévères entre le PNEU-C-15 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Aucun évènement n'a été observé dans les 2 groupes. |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence dans les douleurs articulaires sévères entre le PNEU-C-15 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique sévère - Fièvre Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Aucun évènement n'a été observé dans les 2 groupes. |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence en matière de fièvre sévère entre le PNEU-C-15 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : RR 0,95 (de 0,56 à 1,61) Effets absolus : 9 de moins pour 1 000 (80 de moins à 111 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence en matière de fatigue légère/modérée entre le PNEU-C-15 et le PNEU-C-13 chez les personnes ayant déjà reçu le |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : RR 0,89 (de 0,48 à 1,63) Effets absolus : 17 de moins pour 1 000 (78 de moins à 95 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence dans les maux de tête légers/modérés entre le PNEU-C-15 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : RR 1,33 (de 0,70 à 2,53) Effets absolus : 37 de plus pour 1 000 (33 de moins à 170 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne les douleurs musculaires légères/modérées chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : RR 0,63 (de 0,25 à 1,58) Effets absolus : 32 de moins pour 1 000 (65 de moins à 51 de plus) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne les douleurs articulaires légères/modérées chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 14 jours après le vaccin |
1 RCT (Peterson);
|
Effets relatifs : Peto RC : 7,39 (de 0,46 à 118,80) Effets absolusd : 20 de plus pour 1 000 (10 de moins à 40 de plus pour 1 000) |
ModéréTableau 12 Note de bas de page cTableau 12 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne la fièvre légère/modérée chez les personnes ayant déjà reçu le PNEU-P-23. |
Abréviations : c. = contre; DR = différence de risque; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; MGT = moyenne géométrique des titres; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; PNEU-P-23 = vaccin polysaccharidique 23-valent contre le pneumocoque; RC= rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-15 c. PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
2 ECR (Ermlich 2018; Hammitt 2022)
|
Sérotypes communs La non-infériorité n'a pas été évaluée dans le cadre de ces études. Données supplémentaires (non GRADE) Données partagées sur les sérotypes. Tous sauf Sérotype 3. Résultats variables entre les études et par condition, en utilisant le rapport de MGT de 1 comme seuil mais les analyses par condition avaient une faible puissance. Sérotype 3. Toutes les analyses avec un rapport de MGT >1. Sérotypes uniques, 22F, 33 F. Estimations du rapport de MGT >1 dans toutes les études/analyses. Réponses numériquement plus élevées pour les sérotypes uniques mais certaines analyses avaient une faible puissance. |
Aucun classement GRADETableau 13 Note de bas de page a On ne sait pas si le PNEU-C-15 est non inférieur au PNEU-C-13. |
% de sérorépondeurs (risque ≥4 fois supérieur au risque d'AOP spécifique au ST) 1 mois après le vaccin |
2 ECR (Ermlich 2018; Hammitt 2022)
|
Sérotypes communs sauf Sérotype 3. Résultats variés entre les études et entre les conditions dans les sérotypes présentant une estimation numérique de la SR plus élevée avec le PNEU-C-15. Sérotype 3. Proportion numériquement plus élevée de séropositifs avec le PNEU-C-15 (RR de 1,10 à 1,18; DR de 5,4 % à 14 %). Sérotypes uniques. Analyses montrant une proportion numériquement plus élevée de sérorépondeurs avec le PNEU-C-15 pour toutes les analyses sauf une (22F pour le sous-groupe du diabète). |
FaibleTableau 13 Note de bas de page b Il pourrait y avoir une plus grande proportion numérique de sérorépondeurs avec le PNEU-C-15 pour les sérotypes uniques (22F, 33F) et Sérotype 3 mais il est incertain pour les autres sérotypes communs. |
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
1 ECR (Hammitt 2022)
|
Aucun évènement lié au vaccin n'a été observé. |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le Cette étude n'a rapporté que le nombre de décès dans chaque groupe (3 c. 2). |
ÉIG Jusqu'à 6 mois après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : RR 1,45 (0,68 à 3,10) Effets absolus : 13 de plus pour 1 000 (9 de moins à 60 de plus) Les ÉIG par groupe de population concerné n'ont pas été répertoriés. |
|
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022) |
Effets relatifs : Peto RC 1,21 (de 0,36 à 4,08) Effets absolus : 2 de plus pour 1 000 (5 de moins à 24 de plus) |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : Peto RC 1,21 (de 0,36 à 4,08) Effets absolus : 1 de plus pour 1 000 (3 de moins à 16 de plus) |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le |
ÉI systémique sévère - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : Peto RC 0,45 (de 0,06 à 3,40) Effets absolus : 3 de moins pour 1 000 (5 de moins à 12 de plus) |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : Peto RC 3,80 (de 0,39 à 36,65) Effets absolus : 0 pour 1 000 (0 à 10 de plus) |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Fièvre Jusqu'à 5 jours après le vaccin |
Aucune étude n'a abordé ce résultat. |
||
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : RR 0,93 (de 0,79 à 1,08) Effets absolus : 25 de moins pour 1 000 (76 de moins à 29 de plus) |
Élevé Il y a peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition d'une fatigue légère/modérée dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : RR 1,05 (de 0,86 à 1,29) Effets absolus : 12 de plus pour 1 000 (34 de moins à 71 de plus) |
ModéréTableau 13 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : RR 1,10 (de 0,91 à 1,34) Effets absolus : 26 de plus pour 1 000 (23 de moins à 88 de plus) |
Élevé Il y a peu ou aucune différence entre le PNEU-C-15 et le |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Hammitt 2022)
|
Effets relatifs : RR 1,06 (de 0,77 à 1,46) Effets absolus : 7 de plus pour 1 000 (27 de moins à 54 de plus) |
ModéréTableau 13 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 5 jours après le vaccin |
Aucune étude n'a abordé ce résultat. |
||
Abréviations : c. = contre; ECR = essai contrôlé randomisé; DR = différence de risque; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; RC = rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-15 c. PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses.) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
1 ECR (Mohapi 2022) |
La non-infériorité n'a pas été évaluée Données supplémentaires (non GRADE) : Une étude (Mohapi 2022) chez des adultes ≥18 ans atteints du VIH a rapporté des MGT de l'AOP (fourchette N=299 à 300 dans tous les groupes selon l'analyse des sérotypes). Tous les sérotypes, à l'exception des sérotypes 4 et 7F, ont présenté des MGT numériquement plus élevés pour le PNEU-C-15 que pour le PNEU-C-13. Les rapports de MGT allaient de 0,55 (4) à 1,81 (18C) pour les sérotypes communs et la limite inférieure de l'IC à 95 % la plus basse pour tous les sérotypes était de 0,38. Pour les sérotypes uniques, les rapports de MGT étaient de 42,86 (IC à 95 % 26,53 à 69,25 %) et de 5,41 (de 4,07 à 7,19 %) pour les ST22F et ST33F, respectivement. Sous-groupes pour l'âge (de 18 à 49 ans c. 50 ans et plus), sérotypes communs. Une étude (Mohapi 2022) a rapporté les MGT de l'AOP pour les sous-groupes de 18 à 49 ans et ≥50 ans; toutefois, les rapports de MGT et les IC à 95 % correspondants n'ont pas été fournis. Les MGT étaient numériquement plus élevées pour le PNEU-C-15 dans tous les sous-groupes pour les sérotypes suivants : 1, 3, 6A, 6B, 9V, 14, 18C, 19A et 19F. Le ST 4 a montré une MGT numériquement inférieure pour le PNEU-C-15 dans les 2 sous-groupes. Pour les autres sérotypes (c.-à-d. 5, 7F, 23F), les MGT étaient numériquement plus élevées pour le PNEU-C-15 pour les 3 sérotypes du sous-groupe de 50 ans et plus mais numériquement plus faibles pour les mêmes sérotypes pour le sous-groupe de 18 à 49 ans. Sous-groupes pour l'âge (de 18 à 49 ans c. 50 ans et plus), sérotypes uniques. Les MGT étaient numériquement plus élevées pour le PNEU-C-15 pour les 2 sérotypes uniques (c.-à-d. 22F et 33F) dans tous les sous-groupes. |
Aucun classement GRADETableau 14 Note de bas de page a. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST)– Sérotypes communs, sauf Sérotype 3 1 mois après le vaccin |
1 ECR (Mohapi 2022);
|
Sérotypes communs, sauf Sérotype 3. Proportion numériquement plus élevée de sérorépondeurs avec le PNEU-C-15 que le PNEU-C-13 pour tous les sérotypes communs, sauf les sérotypes 1, 4, 5 et 7 F. |
FaibleTableau 14 Note de bas de page b Le PNEU-C-15 peut entraîner une proportion numériquement plus élevée de sérorépondeurs pour la plupart des sérotypes communs par rapport au PNEU-C-13. |
% de sérorépondeurs 1 mois après le vaccin |
1 ECR (Mohapi 2022);
|
ST commun, Sérotype 3. Estimation numérique de la SR plus élevée avec le PNEU-C-15 (RR 1,53; DR 20,3) |
FaibleTableau 14 Note de bas de page b Le PNEU-C-15 peut entraîner une proportion numériquement plus élevée de sérorépondeurs pour Sérotype 3 par rapport au PNEU-C-13. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST)– Sérotypes uniques 1 mois après le vaccin |
1 ECR (Mohapi 2022);
|
ST unique, ST22F. Estimation numérique de la SR plus élevée avec le PNEU-C-15 (RR 5,68; DR 64,1) ST unique, ST33F. Estimation numérique de la SR plus élevée avec le PNEU-C-15 (RR 11,04; DR 49,2) |
FaibleTableau 14 Note de bas de page b Le PNEU-C-15 peut donner lieu à une proportion numériquement plus élevée de sérorépondeurs pour les 2 sérotypes uniques par rapport au PNEU-C-13. |
ÉIG lié au vaccin Jusqu'à la semaine 8 |
1 ECR (Mohapi 2022);
|
Aucun ÉIG lié au vaccin n'a été observé dans les 2 groupes. |
|
ÉIG Jusqu'à la semaine 8 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 7,39 (de 0,76 à 71,59) Effets absolus : 0 moins pour 1 000 (0 de moins à 0 de moins) Les 3 évènements liés au PNEU-C-15 étaient les suivants : troubles musculo-squelettiques/du tissu conjonctif, accident ischémique transitoire (système nerveux), suicide Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 18 à 49 ans c. 50 ans et plus). Une étude (Mohapi 2022) a fourni des données sur les ÉIG pour les 18 à 49 ans et les ≥50 ans. En raison du nombre trop faible d'études, les analyses de sous-groupes n'ont pas pu être réalisées. Les IC autour des estimations de l'effet relatif se chevauchent entre les groupes d'âge; toutefois, il y a eu un petit nombre d'évènements [de 18 à 49 ans — Peto RC 7,67, IC à 95 % : de 0,15 à 386,82 %; ≥50 ans — RC de Peto 6,62, IC à 95 % : de 0,40 à 108,34 %]. |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne les ÉIG. Aucun n'était lié à un vaccin. |
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Aucun évènement n'a été observé. |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition d'une fatigue sévère dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,99 (de 0,06 à 15,85) Effets absolus : 0 moins pour 1 000 (6 de moins à 89 de plus) |
ModéréTableau 14 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition de maux de tête sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Aucun évènement n'a été observé. |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs musculaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Aucun évènement n'a été observé. |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Aucun évènement n'a été observé. |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de fièvre sévère jusqu'à 5 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 1,53 (de 0,91 à 2,56) Effets absolus : 71 de plus pour 1 000 (12 de moins à 208 de plus) |
ModéréTableau 14 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition d'une fatigue légère/modérée dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 1,34 (de 0,70 à 2,57) Effets absolus : 32 de plus pour 1 000 (28 de moins à 147 de plus) |
ModéréTableau 14 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition de maux de tête légers/modérés dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 1,34 (de 0,70 à 2,57) Effets absolus : 32 de plus pour 1 000 (28 de moins à 147 de plus) |
ModéréTableau 14 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs musculaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,82 (de 0,25 à 2,72) Effets absolus : 7 de moins pour 1 000 (30 de moins à 62 de plus) |
ModéréTableau 14 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 dans l'apparition de douleurs articulaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 1,93 (de 0,20 à 18,7) Effets absolus : 6 de plus pour 1 000 (5 de moins à 105 de plus) |
ModéréTableau 14 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15 et le PNEU-C-13 en ce qui concerne l'apparition de fièvre légère/modérée jusqu'à 5 jours suivant l'administration du vaccin. |
Abréviations : c. = contre; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; évènements indésirables graves; DR = différence de risque; MGT = moyenne géométrique des titres; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; RR = risque relatif; ST = sérotype; RC = rapport de cotes
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-15+PNEU-P-23 c. PNEU-C-13+PNEU-P-23. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses.) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 12 semaines (1 mois après le vaccin PNEU-P-23) |
1 ECR (Mohapi 2022) |
Aucune étude n'a évalué la non-infériorité. Données supplémentaires (non GRADE) : Une étude menée chez des adultes de ≥18 ans atteints du VIH a rapporté des MGT de l'AOP (intervalle N=299 à 300 dans tous les groupes selon l'analyse des sérotypes) mais n'a pas évalué la non-infériorité. Tous les sérotypes, à l'exception des sérotypes 4 et 33F, ont présenté des MGT numériquement plus élevées pour le PNEU-C-15+PNEU-P-23 par rapport au |
Aucun classement GRADETableau 15 Note de bas de page a. |
% des sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST) - Sérotypes communs sauf Sérotype 3 12 semaines (1 mois après le vaccin PNEU-P-23) |
1 ECR (Mohapi 2022);
|
Sérotypes communs, sauf Sérotype 3. Proportion numériquement plus élevée de sérorépondeurs avec le PNEU-C-15+PNEU-P-23 que le PNEU-C-13+PNEU-P-23 pour tous les sérotypes communs, à l'exception des sérotypes 9 V. |
BasTableau 15 Note de bas de page b Le PNEU-C-15+
PNEU-P-23 peut entraîner une proportion numériquement plus élevée de sérorépondeurs pour la plupart des sérotypes communs par rapport au PNEU-C-13+ |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST) - Sérotype 3 12 semaines (1 mois après le vaccin PNEU-P-23) |
1 ECR (Mohapi 2022);
|
ST commun, Sérotype 3. Estimation numérique de la SR plus faible avec le PNEU-C-15+PNEU-P-23 (RR 0,97; DR -1,8) par rapport au PNEU-C-13+PNEU-P-23 |
FaibleTableau 15 Note de bas de page b Le PNEU-C-15+ PNEU-P-23 peut entraîner une proportion numériquement plus faible de sérorépondeurs pour le Sérotype 3 par rapport au PNEU-C-13+ PNEU-P-23. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST) - Sérotypes uniques 12 semaines (1 mois après le vaccin |
1 ECR (Mohapi 2022);
|
ST unique, ST22F. Estimation numérique de la SR plus faible avec le PNEU-C-15+PNEU-P-23 (RR 0,98; DR -1,7) ST unique, ST33F. Estimation numérique de la SR plus faible avec le PNEU-C-15+PNEU-P-23 (RR 0,90; DR -6,9) |
FaibleTableau 15 Note de bas de page b Le PNEU-C-15+ PNEU-P-23 peut entraîner une proportion numériquement plus faible de sérorépondeurs pour les 2 sérotypes uniques par rapport au PNEU-C-13+ PNEU-P-23. |
ÉIG lié au vaccin De la semaine 8 au 6e mois |
1 ECR (Mohapi 2022);
|
Aucun ÉIG lié au vaccin n'a été observé dans les 2 groupes. |
|
ÉIG De la semaine 8 au 6e mois |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,35 (de 0,09 à 1,44) Effets absolus : 26 de moins pour 1 000 (37 de moins à 17 de plus) Les 2 évènements avec le PNEU-C-15+PNEU-P-23 étaient une appendicite et une embolie pulmonaire. Les évènements avec le PNEU-C-13+PNEU-P-23 étaient les suivants : douleur thoracique, zona, péritonite, infection des tissus mous, fracture du pied et gangrène sèche. |
ModéréTableau 15 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 en ce qui concerne les ÉIG. Aucun n'était lié à un vaccin. |
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,99 (de 0,06 à 15,85) Effets absolus : 0 de moins pour 1 000 (6 moins à 91 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 en ce qui concerne l'apparition d'une fatigue sévère dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,13 (de 0,00 à 6,73) Effets absolus : 6 de moins pour 1 000 (- à 37 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de maux de tête sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - douleur musculaire Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 7,29 (de 0,14 à 367,49) Effets absolus : 0 de moins pour 1 000 (0 de moins à 0 de moins) |
ModéréTableau 15 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de douleurs musculaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 7,29 (de 0,14 à 367,49) Effets absolus : 0 de moins pour 1 000 (0 de moins à 0 de moins) |
ModéréTableau 15 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de douleurs articulaires sévères dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Aucun évènement n'a été observé. |
ModéréTableau 15 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de fièvre sévère jusqu'à 5 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 1,18 (de 0,62 à 2,26) Effets absolus : 18 de plus pour 1 000 (39 de moins à 128 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 en ce qui concerne l'apparition d'une fatigue légère/modérée dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 1,07 (de 0,50 à 2,27) Effets absolus : 6 de plus pour 1 000 (41 de moins à 103 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de maux de tête légers/modérés dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : RR 0,88 (de 0,47 à 1,65) Effets absolus : 15 de moins pour 1 000 (64 de moins à 79 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de douleurs musculaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin PNEU-P-23 |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 1,48 (de 0,25 à 8,64) Effets absolus : 6 de plus pour 1 000 (10 de moins à 92 de plus) |
ModéréTableau 15 Note de bas de page d Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de douleurs articulaires légères/modérées dans les 14 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 5 jours après le vaccin |
1 ECR (Mohapi 2022);
|
Effets relatifs : Peto RC 0,66 (de 0,19 à 2,28) Effets absolus : 14 de moins pour 1 000 (33 de moins à 52 de plus) |
ModéréTableau 15 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-15+ PNEU-P-23 et le PNEU-C-13+ PNEU-P-23 dans l'apparition de fièvre légère/modérée jusqu'à 5 jours suivant l'administration du vaccin. |
Abréviations : c. = contre; DR = différence de risque; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-15 = vaccin conjugué 15-valent contre le pneumocoque; PNEU-P-23 = vaccin polysaccharidique 23-valent contre le pneumocoque; RC = rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-20 c. PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses. Pour les données sur l'immunogénicité, les sérotypes spécifiques sont indiqués entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT (par protocole) 1 mois après le vaccin |
1 ECR (Essink 2021);
|
Sérotypes communs Tous sauf Sérotype 3: L'estimation du rapport de MGT varie de 0,76 (ST6A) à 1,00 (ST14). Sérotype 3: 0,85. La non-infériorité du PNEU-C-20 a été respectée pour tous les sérotypes communs (marge >0,5; limite inférieure de l'IC pour tous les sérotypes 0,66 [ST6A]). Données supplémentaires (non GRADE) : Sérotypes communs. Une étude supplémentaire (Hurley 2021) menée chez des adultes de 60 à 64 ans a fourni des renseignements sur l'immunogénicité (intervalle N=400 à 413 dans tous les groupes selon l'analyse des sérotypes) mais n'a pas évalué la non-infériorité. Tous les sérotypes ont présenté des MGT numériquement inférieurs pour le PNEU-C-20 par rapport au PNEU-C-13 (rapport de MGT <1,00 pour tous les sérotypes). Sous-groupes pour l'âge (de 50 à 59 ans c. 60 à 64 ans). Une étude (Essink 2021) a établi un lien entre les réponses immunitaires déclenchées par le PNEU-C-20 chez des participants plus jeunes (de 50 à 59 ans) et chez des adultes plus âgés (de 60 à 64 ans). Le PNEU-C-20 a atteint la non-infériorité pour les 13 sérotypes communs chez les participants de 50 à 59 ans par rapport à ceux de 60 à 64 ans. |
ModéréTableau 16 Note de bas de page aTableau 16 Note de bas de page b Le PNEU-C-20 n'est probablement pas inférieur au PNEU-C-13 en ce qui concerne la réponse immunitaire pour les sérotypes communs. |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST) - Sérotypes communs, sauf Sérotype 3 1 mois après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Sérotypes communs, sauf Sérotype 3. Les 2 études font état d'une proportion numériquement plus faible de sérorépondeurs présentant le PNEU-C-20 que le PNEU-C-13 pour tous les sérotypes, sauf un. Les seuls sérotypes présentant une proportion plus élevée de sérorépondeurs avec le PNEU-C-20 étaient le ST14 dans une étude et le ST6A dans la deuxième étude. |
ModéréTableau 16 Note de bas de page aTableau 16 Note de bas de page b Le PNEU-C-20 entraîne probablement une proportion numériquement plus faible de sérorépondeurs pour la plupart des sérotypes par rapport au PNEU-C-13. Données non disponibles pour les sérotypes uniques pour cette comparaison |
% de sérorépondeurs (risque ≥4 fois plus élevé dans le risque d'AOP spécifique au ST) - Sérotypes communs Sérotype 3 1 mois suivant l'administration du vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
ST commun, Sérotype 3. Estimation numérique de la SR plus faible avec le PNEU-C-20 (fourchette de RR de 0,91 à 0,93; fourchette de DR de -5,2 à -5,6 %). |
ModéréTableau 16 Note de bas de page aTableau 16 Note de bas de page b Le PNEU-C-20 entraîne probablement une proportion numériquement plus faible de sérorépondeurs pour le Sérotype 3 par rapport au PNEU-C-13. |
ÉIG lié au vaccin Jusqu'à 1 mois après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Aucun ÉIG lié au vaccin n'a été observé dans les 2 groupes. |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c |
ÉIG Jusqu'à 1 mois après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 0,88 (de 0,34 à 2,28) Effets absolus : 1 de moins pour 1 000 (3 de moins à 7 de plus) Les études n'ont pas signalé le type d'ÉIG survenus après le premier vaccin (PNEU-C-20 ou PNEU-C-13). Les types d'ÉIG n'ont été signalés que lors d'un suivi plus long (après le deuxième vaccin avec une solution saline ou le PNEU-P-23). Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. ≥60 ans). Une étude (Essink 2021) a fourni des données sur les ÉIG ainsi que sur les ÉI systémiques légers/modérés et sévères chez les personnes de 50 à 59 ans et de 60 ans et plus. En raison du nombre trop faible d'études, les analyses de sous-groupes n'ont pas pu être réalisées. Les IC autour des estimations de l'effet relatif se chevauchent entre les groupes d'âge pour les ÉIG et tous les évènements systémiques; toutefois, il y avait un petit nombre d'évènements pour certains résultats d'innocuité (c.-à-d. les ÉIG et les évènements systémiques sévères). |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 dans l'apparition d'ÉIG après l'administration du vaccin. Aucun de ces évènements n'a été considéré comme étant lié au vaccin par les auteurs de l'étude. |
ÉI systémique sévère - Fatigue Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 0,85 (de 0,46 à 1,58) Effets absolus : 2 de moins pour 1 000 (7 de moins à 7 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. ≥60 ans). Comme ci-dessus. |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne l'apparition d'une fatigue sévère dans les 7 jours suivant l'administration du vaccin. |
ÉI systémique sévère - Maux de tête Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 1,55 (de 0,61 à 3,90) Effets absolus : 2 de plus pour 1 000 (2 de moins à 12 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. ≥60 ans). Comme ci-dessus. |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 dans l'apparition de maux de tête sévères dans les 7 jours suivant l'administration du vaccin. |
ÉI systémique sévère - douleur musculaire Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 0,84 (de 0,28 à 2,51) Effets absolus : 1 de moins pour 1 000 (3 de moins à 6 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. ≥60 ans). Comme ci-dessus. |
ModérébTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le |
ÉI systémique sévère - Douleur articulaire Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 1,23 (de 0,33 à 4,57) Effets absolus : 1 de plus pour 1 000 (2 de moins à 8 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le |
ÉI systémique sévère - Fièvre Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 1,63 (de 0,41 à 6,51) Effets absolus : 1 de plus pour 1 000 (1 de moins à 10 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le |
ÉI systémique léger/modéré - Fatigue Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : RR 0,99 (de 0,90 à 1,10) Effets absolus : 3 de moins pour 1 000 (29 de moins à 29 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
HautTableau 16 Note de bas de page b Il y a peu ou aucune différence entre le PNEU-C-20 et le |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : RR 0,91 (de 0,80 à 1,03) Effets absolus : 21 de moins pour 1 000 (46 de moins à 7 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
HautTableau 16 Note de bas de page b Il y a peu ou aucune différence entre le PNEU-C-20 et le |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : RR 1,07 (de 0,98 à 1,16) Effets absolus : 26 de plus pour 1 000 (7 de moins à 59 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
HautTableau 16 Note de bas de page b Il y a peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 dans l'apparition de douleurs musculaires légères/modérées dans les 7 jours suivant l'administration du vaccin. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : RR 0,93 (de 0,79 à 1,11) Effets absolus : 9 de moins pour 1 000 (28 de moins à 15 de plus) Données supplémentaires (non GRADE) : Sous-groupes pour l'âge (de 50 à 59 ans c. de 60 à 64 ans). Comme ci-dessus. |
HautTableau 16 Note de bas de page b Il y a peu ou aucune différence entre le PNEU-C-20 et le |
ÉI systémique léger/modéré - Fièvre Jusqu'à 7 jours après le vaccin |
2 ECR (Essink 2021, Hurley 2021)
|
Effets relatifs : Peto RC 0,89 (de 0,36 à 2,19) Effets absolus : 1 de moins pour 1 000 (4 de moins à 7 de plus) |
ModéréTableau 16 Note de bas de page bTableau 16 Note de bas de page c Il y a probablement peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 dans l'apparition de fièvre légère/modérée dans les 7 jours suivant l'administration du vaccin. |
Abréviations : c. = contre; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; ÉIG = évènements indésirables graves; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-P-23 = vaccin polyosidique 23-valent contre le pneumocoque; RC = rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-20 c. PNEU-C-13. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT % de sérorépondeurs |
Aucune donnée comparative sur l'immunogénicité n'est disponible. |
||
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
1 ECR (Cannon 2021);
|
Aucun évènement lié au vaccin n'a été observé dans les 2 groupes. |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne les ÉIG chez les personnes ayant déjà reçu le PNEU-P-23. Aucun n'était lié à un vaccin. |
ÉIG Jusqu'à 6 mois après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC 0,44 (de 0,05 à 3,65) Effets absolus : 9 de moins pour 1 000 ( 16 de moins à 41 de plus) Le type d'ÉIG n'a pas été signalé. |
|
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC : 0,04 (0,004 à 0,51) Effets absolus : 24 de moins pour 1 000 (25 de moins à 12 de moins) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fatigue sévère entre le PNEU-C-20 et le |
ÉI systémique grave - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC : 4,39 (de 0,07 à 289,42) Effets absolus : 0 pour 1 000 (10 de moins à 20 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de maux de tête sévères entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
ÉI systémique sévère - Douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC : 0,14 (de 0,02 à 1,15) Effets absolus : 21 de moins pour 1 000 (24 de moins à 4 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne les douleurs musculaires sévères chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC : 0,05 (de 0,001 à 3,00) Effets absolus : 8 de moins pour 1 000 (8 de moins à 16 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence dans les douleurs articulaires sévères entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique sévère - Fièvre Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Aucun évènement n'a été observé dans les 2 groupes. |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fièvre sévère entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : RR 1,45 (de 0,97 à 2,19) Effets absolus : 89 de plus pour 1 000 (6 de moins à 236 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fatigue légère/modérée entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : RR 0,96 (de 0,60 à 1,52) Effets absolus : 7 de moins pour 1 000 (73 de moins à 95 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence dans les maux de tête légères/modérées entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : RR 0,68 (de 0,33 à 1,37) Effets absolus : 32 de moins pour 1 000 (66 de moins à 37 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence dans les douleurs articulaires légères/modérées entre le PNEU-C-20 et le PNEU-C-13 chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : RR 1,09 (de 0,78 à 1,53) Effets absolus : 26 de plus pour 1 000 (64 de moins à 153 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne les douleurs musculaires légères/modérées chez les personnes ayant déjà reçu le PNEU-P-23. |
EI systémique léger/modéré - Fièvre Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2021);
|
Effets relatifs : Peto RC : 4,39 (de 0,23 à 85,53) Effets absolus : 10 de plus pour 1 000 (10 de moins à 20 de plus) |
FaibleTableau 17 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-20 et le PNEU-C-13 en ce qui concerne la fièvre légère/modérée chez les personnes ayant déjà reçu le PNEU-P-23. |
Abréviations : c = contre; ECR = essai contrôlé randomisé; DR = différence de risque; EI = évènements indésirables; ÉIG = évènements indésirables graves; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-20 = vaccin conjugué 20-valent contre le pneumocoque; PNEU-P-23 = vaccin polysaccharidique 23-valent contre le pneumocoque; RC = rapport de cotes; RR = risque relatif; ST = sérotype;
|
|||
| Résultat | Études fournissant des données; n/N (le cas échéant) | Résultat synthétisé (Effets relatifs comme PNEU-C-20 c. PNEU-P-23. Effets relatifs et absolus indiqués avec IC à 95 % entre parenthèses) |
Classement GRADE de la certitude des données probantes |
|---|---|---|---|
MGT % de sérorépondeurs |
Aucune donnée comparative sur l'immunogénicité n'est disponible. |
||
ÉIG lié au vaccin Jusqu'à 6 mois après le vaccin |
1 ECR (Cannon 2022);
|
Aucun évènement lié au vaccin n'a été observé dans les 2 groupes. |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière d'ÉIG entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉIG Jusqu'à 6 mois après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : Peto RC 4,65 (de 0,85 à 25,46) Effets absolus : 20 de plus pour 1 000 (0 à 5 de plus) Le type d'ÉIG n'est pas fourni. |
|
ÉI systémique sévère - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : Peto RC : 4,58 (de 0,42 à 50,32) Effets absolus : 10 de plus pour 1 000 (10 de moins à 30 de plus) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fatigue sévère entre le PNEU-C-20 et le |
ÉI systémique léger/modéré - Fatigue Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : RR 0,89 (de 0,65 à 1,22) Effets absolus : 37 de moins pour 1 000 (127 de moins à 73 de plus) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fatigue légère/modérée entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique sévère - Douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : Peto RC : 0,05 (de 0,01 à 0,57) Effets absolus : 23 de moins pour 1 000 (24 de moins à 10 de moins) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence entre le PNEU-C-20 et le PNEU-P-23 en ce qui concerne les douleurs musculaires sévères chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique sévère - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Aucun évènement n'a été observé dans les 2 groupes. |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de maux de tête sévères entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique léger/modéré - Maux de tête Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : RR 0,63 (de 0,40 à 1,00) Effets absolus : 79 moins pour 1 000 (129 de moins à 0 de moins) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de maux de tête légères/modérées entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique sévère - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Aucun évènement n'a été observé dans les 2 groupes. |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence dans les douleurs articulaires sévères entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique léger/modéré - Douleur articulaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : RR 0,75 (de 0,44 à 1,26) Effets absolus : 40 de moins pour 1 000 (89 de moins à 41 de plus) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence dans les douleurs articulaires légères/modérées entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique sévère - Fièvre Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Aucun évènement n'a été observé dans les 2 groupes. |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fièvre sévère entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique léger/modéré - douleur musculaire Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : RR 0,77 (de 0,60 à 1,01) Effets absolus : 100 de moins pour 1 000 (175 de moins à 4 de plus) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de douleurs musculaires légères/modérées entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
ÉI systémique léger/modéré - Fièvre Jusqu'à 14 jours après le vaccin |
1 ECR (Cannon 2022);
|
Effets relatifs : Peto RC : 0,05 (de 0,002 à 0,98) Effets absolus : 15 de moins pour 1 000 (16 de moins à 0 de moins) |
FaibleTableau 18 Note de bas de page a Il se peut qu'il y ait peu ou aucune différence en matière de fièvre légère/modérée entre le PNEU-C-20 et le PNEU-P-23 chez les personnes ayant déjà reçu le PNEU-C-13. |
Abréviations : c. = contre; DR = différence de risque; ECR = essai contrôlé randomisé; ÉI = évènements indésirables; évènements indésirables graves; PNEU-C-13 = vaccin conjugué 13-valent contre le pneumocoque; PNEU-C-20 = vaccin conjugué 20-valent contre le pneumocoque; PNEU-P-23 = vaccin polysaccharidique 23-valent contre le pneumocoque; RC = rapport de cotes; RR = risque relatif; ST = sérotype
|
|||
| Forte | Discrétionnaire | |
|---|---|---|
| Libellé | « devrait/ne devrait pas être réalisée » | « peut/ne peut pas être réalisée » |
| Justification | Les avantages connus/prévus l'emportent sur les inconvénients connus/prévus (« devrait »), ou Les inconvénients connus/prévus l'emportent sur les avantages connus/prévus (« ne devrait pas ») |
Les avantages connus/prévus sont à peu près équivalents aux inconvénients connus/prévus, ou Les données probantes n'indiquent pas avec certitude les avantages et des inconvénients |
| Implications | Une recommandation forte s'applique à la majeure partie des populations/personnes et doit être suivie, à moins qu'il n'existe une justification claire et convaincante d'utiliser une autre approche. | Une recommandation discrétionnaire peut être proposée pour certaines populations/personnes dans certaines circonstances. D'autres approches peuvent être acceptables. |
Tableaux d'épidémiologie
| Sérotype (n par année) | 2016 (n=2 855) | 2 017 (n=3 270) | 2 018 (n=3 328) | 2 019 (n=3 673) | 2 020 (n=2 108) |
|---|---|---|---|---|---|
| 1Note de bas de page * (4, 0, 0, 0, 1) Note de bas de page ‡ | 0,1 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| 3Note de bas de page * (272, 312, 398, 427, 229) | 9,5 % | 9,5 % | 12,0 % | 11,6 % | 10,9 % |
| 4Note de bas de page * (182, 234, 205, 262, 237) | 6,4 % | 7,2 % | 6,2 % | 7,1 % | 11,2 % |
| 6ANote de bas de page * (19, 7,14, 8, 3) | 0,7 % | 0,2 % | 0,4 % | 0,2 % | 0,1 % |
| 6BNote de bas de page * (20, 9, 8, 8, 1) | 0,7 % | 0,3 % | 0,2 % | 0,2 % | 0,0 % |
| 7FNote de bas de page * (109, 116, 106, 119, 59) | 3,8 % | 3,5 % | 3,2 % | 3,2 % | 2,8 % |
| 9VNote de bas de page * (5, 15, 35, 48, 54) | 0,2 % | 0,5 % | 1,1 % | 1,3 % | 2,6 % |
| 14Note de bas de page * (16, 29, 13, 11, 6) | 0,6 % | 0,9 % | 0,4 % | 0,3 % | 0,3 % |
| 18CNote de bas de page * (9, 8, 4, 15, 9) | 0,3 % | 0,2 % | 0,1 % | 0,4 % | 0,4 % |
| 19ANote de bas de page * (179, 165, 181, 154, 88) | 6,3 % | 5,0 % | 5,4 % | 4,2 % | 4,2 % |
| 19FNote de bas de page * (46, 91, 75, 75, 46) | 1,6 % | 2,8 % | 2,3 % | 2,0 % | 2,2 % |
| 23FNote de bas de page * (4, 2, 2, 2, 2) | 0,1 % | 0,1 % | 0,1 % | 0,1 % | 0,1 % |
| 22FNote de bas de page ** (260, 283, 292, 362, 149) | 9,1 % | 8,7 % | 8,8 % | 9,9 % | 7,1 % |
| 33FNote de bas de page ** (100,107, 96, 145, 52) | 3,5 % | 3,3 % | 2,9 % | 3,9 % | 2,5 % |
| 8Note de bas de page ^ (148, 158, 187, 221, 151) | 5,2 % | 4,8 % | 5,6 % | 6,0 % | 7,2 % |
| 10ANote de bas de page ^ (51, 67, 65, 69, 52) | 1,8 % | 2,0 % | 2,0 % | 1,9 % | 2,5 % |
| 11ANote de bas de page ^ (93, 95 117, 100, 68) | 3,3 % | 2,9 % | 3,5 % | 2,7 % | 3,2 % |
| 12FNote de bas de page ^ (102, 127, 160, 145, 120) | 3,6 % | 3,9 % | 4,8 % | 3,9 % | 5,7 % |
| 15B/CNote de bas de page ^ (132, 131, 105, 102, 49) | 4,6 % | 4,0 % | 3,2 % | 2,8 % | 2,3 % |
| 2Note de bas de page ~ (0, 1, 4,0, 0) | 0,0 % | 0,0 % | 0,1 % | 0,0 % | 0,0 % |
| 9NNote de bas de page ~ (141, 214, 189, 254, 135) | 4,9 % | 6,5 % | 5,7 % | 6,9 % | 6,4 % |
| 17FNote de bas de page ~ (29, 38, 37, 35, 17) | 1,0 % | 1,2 % | 1,1 % | 1,0 % | 0,8 % |
| 20Note de bas de page ~ (81, 118, 127, 134, 82) | 2,8 % | 3,6 % | 3,8 % | 3,6 % | 3,9 % |
| 6C (73, 66, 58, 69, 32) | 2,6 % | 2,0 % | 1,7 % | 1,9 % | 1,5 % |
| 7C (45, 28, 57, 44, 24) | 1,6 % | 0,9 % | 1,7 % | 1,2 % | 1,1 % |
| 13 (9, 6, 10, 9, 4) | 0,3 % | 0,2 % | 0,3 % | 0,2 % | 0,2 % |
| 15A (123, 155, 130, 159, 74) | 4,3 % | 4,7 % | 3,9 % | 4,3 % | 3,5 % |
| 16F (72, 77, 71, 107, 57) | 2,5 % | 2,4 % | 2,1 % | 2,9 % | 2,7 % |
| 21 (14, 21, 15, 12, 4) | 0,5 % | 0,6 % | 0,5 % | 0,3 % | 0,2 % |
| 23A (108, 155, 115, 132, 64) | 3,8 % | 4,7 % | 3,5 % | 3,6 % | 3,0 % |
| 23B (90, 104, 118, 118, 52) | 3,2 % | 3,2 % | 3,5 % | 3,2 % | 2,5 % |
| 24F (24, 27, 24, 20, 4) | 0,8 % | 0,8 % | 0,7 % | 0,5 % | 0,2 % |
| 28A (5, 10, 10, 9, 7) | 0,2 % | 0,3 % | 0,3 % | 0,2 % | 0,3 % |
| 29 (10, 4, 7, 6, 1) | 0,4 % | 0,1 % | 0,2 % | 0,2 % | 0,0 % |
| 31 (50, 51, 54, 45, 35) | 1,8 % | 1,6 % | 1,6 % | 1,2 % | 1,7 % |
| 34 (30, 29, 33, 35, 17) | 1,1 % | 0,9 % | 1,0 % | 1,0 % | 0,8 % |
| 35B (64, 79, 76, 81, 48) | 2,2 % | 2,4 % | 2,3 % | 2,2 % | 2,3 % |
| 35F (58, 51, 46, 55, 38) | 2,0 % | 1,6 % | 1,4 % | 1,5 % | 1,8 % |
| 38 (48, 53, 51, 27, 13) | 1,7 % | 1,6 % | 1,5 % | 0,7 % | 0,6 % |
| NT (6, 4, 10, 13, 2) | 0,2 % | 0,1 % | 0,3 % | 0,4 % | 0,1 % |
| Autres (24, 23, 23, 36, 22) | 0,8 % | 0,7 % | 0,7 % | 1,0 % | 1,0 % |
|
|||||
| Sérotype | 2016 | 2017 | 2018 | 2019 | 2020 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-13 tous | 40,9 % | (259) | 43,6 % | (281) | 38,4 % | (286) | 42,0 % | (343) | 47,1 % | (262) | 1 431 |
| 4 | 15,0 % | (95) | 16,9 % | (109) | 11,8 % | (88) | 14,5 % | (118) | 20,9 % | (116) | 526 | |
| 6B | 0,2 % | (1) | 0,0 % | (0) | 0,1 % | (1) | 0,2 % | (2) | 0,0 % | (0) | 4 | |
| 9V | 0,3 % | (2) | 0,8 % | (5) | 1,1 % | (8) | 2,1 % | (17) | 5,6 % | (31) | 63 | |
| 14 | 0,6 % | (4) | 0,6 % | (4) | 0,5 % | (4) | 0,2 % | (2) | 0,5 % | (3) | 17 | |
| 18C | 0,5 % | (3) | 0,3 % | (2) | 0,0 % | (0) | 0,5 % | (4) | 0,4 % | (2) | 11 | |
| 19F | 1,7 % | (11) | 2,6 % | (17) | 1,9 % | (14) | 2,2 % | (18) | 2,0 % | (11) | 71 | |
| 23F | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,1 % | (1) | 0,2 % | (1) | 2 | |
| 1 | 0,3 % | (2) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,2 % | (1) | 3 | |
| 3 | 8,5 % | (54) | 8,4 % | (54) | 10,1 % | (75) | 10,0 % | (82) | 8,8 % | (49) | 314 | |
| 5 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 6A/C* | 2,4% | (15) | 0,8% | (5) | 1,7% | (13) | 0,5% | (4) | 0,7% | (4) | 41 | |
| 7F | 6,6 % | (42) | 8,2 % | (53) | 6,7 % | (50) | 7,4 % | (60) | 4,9 % | (27) | 232 | |
| 19A | 4,7 % | (30) | 5,0 % | (32) | 4,4 % | (33) | 4,3 % | (35) | 3,1 % | (17) | 147 | |
| PNEU-C-15 (non PNEU-C-13) |
PNEU-C-15 tous | 10,0 % | (63) | 7,8 % | (50) | 7,7 % | (57) | 10,5 % | (86) | 6,7 % | (37) | 293 |
| 22F | 6,8 % | (43) | 5,9 % | (38) | 5,8 % | (43) | 6,9 % | (56) | 4,5 % | (25) | 205 | |
| 33F | 3,2 % | (20) | 1,9 % | (12) | 1,9 % | (14) | 3,7 % | (30) | 2,2 % | (12) | 88 | |
| PNEU-C-20 (non PNEU-C-15) |
PNEU-C-20 tous | 20,5 % | (130) | 21,3 % | (137) | 23,0 % | (171) | 21,3 % | (174) | 26,1 % | (145) | 757 |
| 8 | 7,6 % | (48) | 7,6 % | (49) | 9,3 % | (69) | 9,3 % | (76) | 11,0 % | (61) | 303 | |
| 10A | 0,9 % | (6) | 0,8 % | (5) | 1,5 % | (11) | 1,2 % | (10) | 1,1 % | (6) | 38 | |
| 11A | 3,2 % | (20) | 2,2 % | (14) | 2,2 % | (16) | 1,2 % | (10) | 2,0 % | (11) | 71 | |
| 12F | 6,5 % | (41) | 8,1 % | (52) | 9,0 % | (67) | 8,2 % | (67) | 11,2 % | (62) | 289 | |
| 15B/C | 2,4 % | (15) | 2,6 % | (17) | 1,1 % | (8) | 1,3 % | (11) | 0,9 % | (5) | 56 | |
| PNEU-P-23 unique | PNEU-P-23 tous | 11,7 % | (74) | 12,9 % | (83) | 13,2 % | (98) | 11,9 % | (97) | 10,1 % | (56) | 408 |
| 2 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 9N | 6,2 % | (39) | 7,1 % | (46) | 6,0 % | (45) | 7,1 % | (58) | 5,9 % | (33) | 221 | |
| 17F | 0,8 % | (5) | 0,5 % | (3) | 1,3 % | (10) | 0,6 % | (5) | 0,2 % | (1) | 24 | |
| 20 | 4,7 % | (30) | 5,3 % | (34) | 5,8 % | (43) | 4,2 % | (34) | 4,0 % | (22) | 163 | |
| TNV | TNV tous | 16,9 % | (107) | 14,4 % | (93) | 17,7 % | (132) | 14,2 % | (116) | 10,1 % | (56) | 504 |
| 23A | 2,4 % | (15) | 3,4 % | (22) | 2,0 % | (15) | 2,6 % | (21) | 1,8 % | (10) | 83 | |
| 15A | 1,6 % | (10) | 2,2 % | (14) | 2,3 % | (17) | 1,8 % | (15) | 1,4 % | (8) | 64 | |
| 23B | 1,7 % | (11) | 1,2 % | (8) | 2,4 % | (18) | 2,1 % | (17) | 1,4 % | (8) | 62 | |
| 16F | 2,1 % | (13) | 2,0 % | (13) | 1,1 % | (8) | 2,0 % | (16) | 0,7 % | (4) | 54 | |
| 31 | 1,7 % | (11) | 0,9 % | (6) | 1,3 % | (10) | 0,9 % | (7) | 1,4 % | (8) | 42 | |
| 35B | 2,1 % | (13) | 0,5 % | (3) | 0,9 % | (7) | 1,0 % | (8) | 1,1 % | (6) | 37 | |
| 7C | 0,9 % | (6) | 0,3 % | (2) | 1,1 % | (8) | 0,9 % | (7) | 0,5 % | (3) | 26 | |
| 35F | 0,5 % | (3) | 0,9 % | (6) | 0,9 % | (7) | 0,5 % | (4) | 0,2 % | (1) | 21 | |
| 34 | 0,5 % | (3) | 0,5 % | (3) | 1,1 % | (8) | 0,6 % | (5) | 0,2 % | (1) | 20 | |
| 28A | 0,5 % | (3) | 0,8 % | (5) | 0,8 % | (6) | 0,0 % | (0) | 0,2 % | (1) | 15 | |
| 38 | 0,2 % | (1) | 0,3 % | (2) | 0,8 % | (6) | 0,6 % | (5) | 0,2 % | (1) | 15 | |
| Autre | 2,8 % | (18) | 1,4 % | (9) | 3,0 % | (22) | 1,3 % | (11) | 0,9 % | (5) | 65 | |
| Total | (633) | (644) | (744) | (816) | (556) | 3 393 | ||||||
| Sérotype | 2016 | 2017 | 2018 | 2019 | 2020 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-13 tous | 35,7 % | (274) | 37,1 % | (332) | 37,1 % | (357) | 32,8 % | (337) | 37,8 % | (249) | 1 549 |
| 4 | 7,8 % | (60) | 9,8 % | (88) | 7,8 % | (75) | 8,4 % | (86) | 11,4 % | (75) | 384 | |
| 6B | 0,4 % | (3) | 0,2 % | (2) | 0,3 % | (3) | 0,0 % | (0) | 0,0 % | (0) | 8 | |
| 9V | 0,1 % | (1) | 0,1 % | (1) | 1,4 % | (13) | 1,6 % | (16) | 2,1 % | (14) | 45 | |
| 14 | 0,4 % | (3) | 0,9 % | (8) | 0,2 % | (2) | 0,2 % | (2) | 0,2 % | (1) | 16 | |
| 18C | 0,4 % | (3) | 0,6 % | (5) | 0,2 % | (2) | 0,3 % | (3) | 0,9 % | (6) | 19 | |
| 19F | 1,4 % | (11) | 2,8 % | (25) | 2,2 % | (21) | 1,0 % | (10) | 1,8 % | (12) | 79 | |
| 23F | 0,0 % | (0) | 0,1 % | (1) | 0,2 % | (2) | 0,0 % | (0) | 0,2 % | (1) | 4 | |
| 1 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 3 | 11,3 % | (87) | 11,2 % | (100) | 13,2 % | (127) | 11,5 % | (118) | 12,6 % | (83) | 515 | |
| 5 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 6A/C* | 1,6% | (12) | 2,1% | (19) | 1,9% | (18) | 2,5% | (26) | 2,0% | (13) | 88 | |
| 7F | 4,6 % | (35) | 4,1 % | (37) | 4,2 % | (40) | 3,6 % | (37) | 2,9 % | (19) | 168 | |
| 19A | 7,7 % | (59) | 5,1 % | (46) | 5,6 % | (54) | 3,8 % | (39) | 3,8 % | (25) | 223 | |
| PNEU-C-15 (non PNEU-C-13) | PNEU-C-15 tous | 12,6 % | (97) | 11,7 % | (105) | 10,0 % | (96) | 12,2 % | (126) | 7,1 % | (47) | 471 |
| 22F | 8,9 % | (68) | 8,4 % | (75) | 7,3 % | (70) | 9,4 % | (97) | 5,2 % | (34) | 344 | |
| 33F | 3,8 % | (29) | 3,3 % | (30) | 2,7 % | (26) | 2,8 % | (29) | 2,0 % | (13) | 127 | |
| PNEU-C-20 (non PNEU-C-15) | PNEU-C-20 tous | 15,9 % | (122) | 15,8 % | (142) | 19,2 % | (185) | 19,2 % | (198) | 21,2 % | (140) | 787 |
| 8 | 4,2 % | (32) | 5,0 % | (45) | 6,4 % | (62) | 7,7 % | (79) | 8,6 % | (57) | 275 | |
| 10A | 1,6 % | (12) | 1,8 % | (16) | 1,2 % | (12) | 1,9 % | (20) | 1,8 % | (12) | 72 | |
| 11A | 3,3 % | (25) | 2,8 % | (25) | 3,6 % | (35) | 2,9 % | (30) | 2,7 % | (18) | 133 | |
| 12F | 3,5 % | (27) | 4,4 % | (39) | 6,2 % | (60) | 4,4 % | (45) | 5,8 % | (38) | 209 | |
| 15B/C | 3,4 % | (26) | 1,9 % | (17) | 1,7 % | (16) | 2,3 % | (24) | 2,3 % | (15) | 98 | |
| PNEU-P-23 unique | PNEU-P-23 tous | 11,7 % | (90) | 14,6 % | (131) | 12,3 % | (118) | 15,7 % | (162) | 13,8 % | (91) | 592 |
| 2 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 9N | 6,6 % | (51) | 7,9 % | (71) | 5,9 % | (57) | 8,9 % | (92) | 6,8 % | (45) | 316 | |
| 17F | 1,7 % | (13) | 1,6 % | (14) | 1,1 % | (11) | 0,9 % | (9) | 0,8 % | (5) | 52 | |
| 20 | 3,4 % | (26) | 5,1 % | (46) | 5,2 % | (50) | 5,9 % | (61) | 6,2 % | (41) | 224 | |
| TNV | TNV tous | 24,1 % | (185) | 20,8 % | (186) | 21,4 % | (206) | 20,0 % | (206) | 20,0 % | (132) | 915 |
| 23A | 4,2 % | (32) | 3,1 % | (28) | 3,7 % | (36) | 2,5 % | (26) | 2,9 % | (19) | 141 | |
| 15A | 3,8 % | (29) | 3,3 % | (30) | 2,9 % | (28) | 2,6 % | (27) | 3,6 % | (24) | 138 | |
| 23B | 2,6 % | (20) | 2,5 % | (22) | 2,6 % | (25) | 3,1 % | (32) | 1,8 % | (12) | 111 | |
| 16F | 2,9 % | (22) | 1,9 % | (17) | 2,3 % | (22) | 3,1 % | (32) | 2,6 % | (17) | 110 | |
| 35B | 1,6 % | (12) | 2,3 % | (21) | 2,0 % | (19) | 1,4 % | (14) | 1,7 % | (11) | 77 | |
| 35F | 2,0 % | (15) | 1,3 % | (12) | 1,1 % | (11) | 1,3 % | (13) | 1,7 % | (11) | 62 | |
| 31 | 2,3 % | (18) | 1,7 % | (15) | 0,9 % | (9) | 0,7 % | (7) | 1,5 % | (10) | 59 | |
| 7C | 1,2 % | (9) | 0,7 % | (6) | 1,7 % | (16) | 1,3 % | (13) | 0,8 % | (5) | 49 | |
| 34 | 0,5 % | (4) | 0,9 % | (8) | 0,9 % | (9) | 1,1 % | (11) | 0,9 % | (6) | 38 | |
| 38 | 1,0 % | (8) | 0,4 % | (4) | 1,0 % | (10) | 0,3 % | (3) | 0,6 % | (4) | 29 | |
| Autre | 2,1 % | (16) | 2,6 % | (23) | 2,2 % | (21) | 2,7 % | (28) | 2,0 % | (13) | 101 | |
| Total | (768) | (896) | (962) | (1 029) | (659) | 4 314 | ||||||
| Sérotype | 2016 | 2017 | 2018 | 2019 | 2020 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-13 tous | 29,1 % | (307) | 26,5 % | (355) | 28,8 % | (367) | 29,3 % | (431) | 27,4 % | (197) | 1 657 |
| 4 | 2,4 % | (25) | 2,7 % | (36) | 3,2 % | (41) | 3,6 % | (53) | 5,4 % | (39) | 194 | |
| 6B | 1,3 % | (14) | 0,5 % | (7) | 0,3 % | (4) | 0,4 % | (6) | 0,1 % | (1) | 32 | |
| 9V | 0,2 % | (2) | 0,7 % | (9) | 0,9 % | (12) | 0,8 % | (12) | 1,3 % | (9) | 44 | |
| 14 | 0,8 % | (8) | 1,0 % | (14) | 0,3 % | (4) | 0,3 % | (5) | 0,1 % | (1) | 32 | |
| 18C | 0,2 % | (2) | 0,1 % | (1) | 0,2 % | (2) | 0,5 % | (7) | 0,1 % | (1) | 13 | |
| 19F | 1,4 % | (15) | 2,6 % | (35) | 2,2 % | (28) | 2,1 % | (31) | 2,2 % | (16) | 125 | |
| 23F | 0,1 % | (1) | 0,1 % | (1) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 2 | |
| 1 | 0,1 % | (1) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 1 | |
| 3 | 9,1 % | (96) | 9,6 % | (129) | 12,4 % | (158) | 13,2 % | (195) | 10,4 % | (75) | 653 | |
| 5 | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 0 | |
| 6A/C* | 5,4% | (57) | 3,4% | (45) | 3,1% | (39) | 3,1% | (45) | 2,4% | (17) | 203 | |
| 7F | 2,2 % | (23) | 1,5 % | (20) | 1,2 % | (15) | 1,2 % | (17) | 1,1 % | (8) | 83 | |
| 19A | 6,0 % | (63) | 4,3 % | (58) | 5,0 % | (64) | 4,1 % | (60) | 4,2 % | (30) | 275 | |
| PNEU-C-15 (non PNEU-C-13) |
PNEU-C-15 tous | 12,7 % | (134) | 12,7 % | (171) | 14,2 % | (181) | 15,4 % | (226) | 13,2 % | (95) | 807 |
| 22F | 10,1 % | (106) | 10,1 % | (135) | 11,0 % | (140) | 11,5 % | (169) | 10,3 % | (74) | 624 | |
| 33F | 2,7 % | (28) | 2,7 % | (36) | 3,2 % | (41) | 3,9 % | (57) | 2,9 % | (21) | 183 | |
| PNEU-C-20 (non PNEU-C-15) |
PNEU-C-20 tous | 16,8 % | (177) | 15,9 % | (213) | 15,1 % | (192) | 13,5 % | (199) | 15,2 % | (109) | 890 |
| 8 | 5,2 % | (55) | 4,2 % | (57) | 3,5 % | (44) | 3,9 % | (58) | 3,5 % | (25) | 239 | |
| 10A | 1,5 % | (16) | 1,9 % | (26) | 2,0 % | (25) | 2,2 % | (32) | 2,5 % | (18) | 117 | |
| 11A | 4,2 % | (44) | 3,6 % | (48) | 4,5 % | (57) | 3,2 % | (47) | 4,3 % | (31) | 227 | |
| 12F | 2,6 % | (27) | 2,2 % | (30) | 2,0 % | (25) | 1,9 % | (28) | 2,6 % | (19) | 129 | |
| 15B/C | 3,3 % | (35) | 3,9 % | (52) | 3,2 % | (41) | 2,3 % | (34) | 2,2 % | (16) | 178 | |
| PNEU-P-23 unique | PNEU-P-23 tous | 7,2 % | (76) | 10,4 % | (139) | 9,9 % | (126) | 10,1 % | (149) | 11,1 % | (80) | 570 |
| 2 | 0,0 % | (0) | 0,1 % | (1) | 0,0 % | (0) | 0,0 % | (0) | 0,0 % | (0) | 1 | |
| 9N | 4,2 % | (44) | 6,8 % | (91) | 6,2 % | (79) | 6,3 % | (93) | 7,5 % | (54) | 361 | |
| 17F | 0,9 % | (10) | 1,3 % | (17) | 1,2 % | (15) | 1,4 % | (20) | 1,5 % | (11) | 73 | |
| 20 | 2,1 % | (22) | 2,2 % | (30) | 2,5 % | (32) | 2,4 % | (36) | 2,1 % | (15) | 135 | |
| TNV | TNV tous | 34,2 % | (360) | 34,6 % | (464) | 32,0 % | (408) | 31,7 % | (467) | 33,0 % | (237) | 1 936 |
| 15A | 7,1 % | (75) | 7,1 % | (95) | 6,0 % | (77) | 6,8 % | (100) | 4,7 % | (34) | 381 | |
| 23A | 5,0 % | (53) | 6,7 % | (90) | 3,8 % | (49) | 5,1 % | (75) | 4,7 % | (34) | 301 | |
| 16F | 3,2 % | (34) | 3,2 % | (43) | 2,8 % | (36) | 3,3 % | (48) | 4,2 % | (30) | 198 | |
| 35B | 2,8 % | (30) | 3,4 % | (45) | 3,3 % | (42) | 3,4 % | (50) | 3,8 % | (27) | 194 | |
| 23B | 2,9 % | (31) | 3,4 % | (46) | 4,0 % | (51) | 3,3 % | (49) | 2,9 % | (21) | 191 | |
| 35F | 2,7 % | (28) | 1,8 % | (24) | 1,7 % | (22) | 2,1 % | (31) | 3,2 % | (23) | 128 | |
| 31 | 1,9 % | (20) | 2,1 % | (28) | 2,7 % | (34) | 1,7 % | (25) | 2,4 % | (17) | 124 | |
| 38 | 2,2 % | (23) | 1,9 % | (26) | 1,6 % | (20) | 1,0 % | (15) | 1,1 % | (8) | 106 | |
| 7C | 1,9 % | (20) | 1,5 % | (20) | 2,4 % | (30) | 1,5 % | (22) | 1,9 % | (14) | 92 | |
| 34 | 2,0 % | (21) | 1,0 % | (13) | 1,1 % | (14) | 1,2 % | (17) | 1,1 % | (8) | 73 | |
| 24F | 1,1 % | (12) | 1,0 % | (13) | 0,9 % | (11) | 0,5 % | (7) | 0,3 % | (2) | 45 | |
| Autre | 1,2 % | (13) | 1,6 % | (21) | 1,7 % | (22) | 1,9 % | (28) | 2,6 % | (19) | 104 | |
| Total | (1 054) | (1 342) | (1 274) | (1 472) | (718) | 5 860 | ||||||
Figure 6. Proportion d'isolats de l'infection invasive à pneumocoques de 2016 à 2 020 par vaccin, pour les groupes d'âge de 18 à 49 ans et de 50 à 64 ans

*Les sérotypes vaccinaux comprennent le PNEU-C-13 (1, 3, 4, 5, 6A/C, 6B, 7F, 9V, 14, 19A, 19F, 18C, 23F); le PNEU-C-15 (tous les PNEU-C-13 plus 22F et 33F); le PNEU-C-20 (tous les PNEU-C-15 plus 8, 10A, 11A, 12F, 15 B/C) et le PNEU-P-23 (sérotypes PNEU-C-20, sauf 6A, plus 2, 9N, 17F, 20); TNV = tous les sérotypes non inclus dans le PNEU-C-13, le PNEU-C-15, le PNEU-C-20 et le PNEU-P-23. ST 6C inclus dans les sérotypes du PNEU-C-13 en raison de la protection croisée avec le 6A. Les sérotypes 15B et 15C ont été regroupés sous l'appellation 15B/C en raison du passage réversible entre les 2 types de sérotypes rapportés in vivo au cours de l'infection, ce qui rend difficile une différenciation précise entre les 2 types.
Description longue
Diagramme à barres empilées affichant le pourcentage de Streptococcus pneumoniae collecté dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres ST non vaccinaux) pour les groupes d'âge de 18 à 49 et de 50 à 64 ans, de 2016 à 2020.
| Groupe d’âge | Année | PNEU-C-13 (%, N) |
PNEU-C-15/ non-PNEU-C-13 (%, N) |
PNEU-C-20/ non-PNEU-C-15 (%, N) |
PNEU-P-23/ non-PNEU-C-20 (%, N) |
TNV (%, N) |
Totale | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tous les âges | 2016 | 40.9% | (259) | 10.0% | (63) | 20.5% | (130) | 11.7% | (74) | 16.9% | (107) | (657) |
| 2017 | 43.6% | (281) | 7.8% | (50) | 21.3% | (137) | 12.9% | (83) | 14.4% | (93) | (659) | |
| 2018 | 38.4% | (286) | 7.7% | (57) | 23.0% | (171) | 13.2% | (98) | 17.7% | (132) | (762) | |
| 2019 | 42.0% | (343) | 10.5% | (86) | 21.3% | (174) | 11.9% | (97) | 14.2% | (116) | (834) | |
| 2020 | 47.1% | (262) | 6.7% | (37) | 26.1% | (145) | 10.1% | (56) | 10.1% | (56) | (567) | |
| 65 ans et plus | 2016 | 35.7% | (274) | 12.6% | (97) | 15.9% | (122) | 11.7% | (90) | 24.1% | (185) | (768) |
| 2017 | 37.1% | (332) | 11.7% | (105) | 15.8% | (142) | 14.6% | (131) | 20.8% | (186) | (896) | |
| 2018 | 37.1% | (357) | 10.0% | (96) | 19.2% | (185) | 12.3% | (118) | 21.4% | (206) | (962) | |
| 2019 | 32.8% | (337) | 12.2% | (126) | 19.2% | (198) | 15.7% | (162) | 20.0% | (206) | (1029) | |
| 2020 | 37.8% | (249) | 7.1% | (47) | 21.2% | (140) | 13.8% | (91) | 20.0% | (132) | (659) | |
Références
- Note de bas de page 1
-
Warshawsky B, Gemmill I, Crowcroft N, Et. Al. Déclaration du CCNI : vaccin conjugué contre le pneumocoque -13-valent chez les adultes [Internet]. Agence de la santé publique du Canada. 2013 [cité 16 juin 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2013-39/declaration-utilisation-vaccin-conjugue-contre-pneumocoque-13-valent-chez-adulte-pneu-13.html
- Note de bas de page 2
-
Comité consultatif national de l’immunisation (CCNI). Mise à jour sur l'utilisation du vaccin conjugué 13-valent (Pneu-C-13) en plus du vaccin polysaccharidique 23-valent contre le pneumocoque (Pneu-P-23) chez les adultes immunocompétents âgés de 65 ans et plus – Recommandation provisoire [Internet]. Agence de la santé publique du Canada. 2016 [cité 16 juin 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/mise-a-jour-utilisation-vaccin-conjugue-13-valent-pneu-c-13-en-plus-vaccin-polysaccharidique-23-valent-contre-pneumocoque-pneu-p-23-adultes-immunocompetents-ages-65-ans-plus-recommandation-provisoire.html
- Note de bas de page 3
-
Kraicer-Melamed H, Baclic O, De Wals P, Et. Al. Une déclaration d'un comité consultatif (DCC) du Comité consultatif national de l'immunisation (CCNI): Mise à jour sur l’utilisation de vaccins contre le pneumocoque chez les adultes de 65 ans et plus – une perspective de santé publique [Internet]. Agence de la santé publique du Canada. 2018 [cité 16 juin 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/mise-a-jour-sur-l-utilisation-de-vaccins-contre-le-pneumocoque-chez-les-adultes-de-65-ans-et-plus.html
- Note de bas de page 4
-
Guyatt G, Oxman A, Akl E, Et. Al. « GRADE Guidelines: 1. Introduction-GRADE Evidence Profiles and Summary of Findings Tables. » J Clin Epidemiol. 2011;64(4):383‑94.
- Note de bas de page 5
-
Balshem H, Helfand M, Schünemann H, Et. Al. « GRADE Guidelines: 3. Rating the Quality of Evidence. » J Clin Epidemiol. 2011;64(4):401‑6.
- Note de bas de page 6
-
Moher D, Shamseer L, Clarke M, Et. Al. « Preferred Reporting Items for Systematic Review and Meta-Analysis Protocols (PRISMA-P) 2015 Statement. » Syst Rev. 2015;4(1):1.
- Note de bas de page 7
-
Alonso-Coello P, Schünemann H, Moberg J, Et Al. « GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. » 1: Introduction. BMJ. 2016;353:i2016.
- Note de bas de page 8
-
Agence de la santé publique du Canada. Surveillance nationale en laboratoire de la maladie invasive due au streptocoque au Canada - Rapport sommaire annuel 2019 [Internet]. Gouvernement du Canada. 2021 [cité 6 juin 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/publications/medicaments-et-produits-sante/surveillance-nationale-laboratoire-maladie-invasive-due-streptocoque-canada-rapport-sommaire-annuel-2019.html
- Note de bas de page 9
-
Golden A, Griffith A, Demczuk W, Et. Al. « Invasive Pneumococcal Disease Surveillance in Canada, 2020. » Can Commun Dis Rep. 2022;48(9):396‑406.
- Note de bas de page 10
-
Cooper D, Yu X, Sidhu M, Et. Al. « The 13-Valent Pneumococcal Conjugate Vaccine (PCV13) Elicits Cross-Functional Opsonophagocytic Killing Responses in Humans to Streptococcus pneumoniae Serotypes 6C and 7A. » Vaccine. 2011;29(41):7201‑11.
- Note de bas de page 11
-
Venkateswaran P, Stanton N, Austrian R. « Type Variation of Strains of Streptococcus pneumoniae in Capsular Serogroup 15. » J Infect Dis. 1983;147(6):1041‑54.
- Note de bas de page 12
-
van Selm S, van Cann L, Kolkman M, Et. Al. « Genetic basis for the structural difference between Streptococcus pneumoniae serotype 15B and 15C capsular polysaccharides. » Infect Immun. 2003;71(11):6192‑8.
- Note de bas de page 13
-
Higgins J, Altman D, Gøtzsche P, Et. Al. « The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. » BMJ. 2011;343:d5928.
- Note de bas de page 14
-
Shigayeva A, Chung H, Kwong J, Et. Al. « Burden of Invasive Pneumococcal Disease among Adults with Underlying Chronic Conditions Post Implementation of PCV13 Immunization Programs in South Central Ontario Canada. » Affiche présentée à: ISPPD 12. Toronto (ON): Mount Sinai Hospital; 2022.
- Note de bas de page 15
-
Huang G, Martin I, Tsang R, Et. Al. « Invasive Bacterial Diseases in Northern Canada, 1999 to 2018. » Can Commun Dis Rep. 2021;47(11):491‑9.
- Note de bas de page 16
-
LeBlanc J, El Sherif M, Ye L, Et. Al. « Recalibrated Estimates of Non-Bacteremic and Bacteremic Pneumococcal Community Acquired Pneumonia in Hospitalized Canadian Adults From 2010 to 2017 With Addition of an Extended Spectrum Serotype-Specific Urine Antigen Detection Assay. » Vaccine. 2022;40(18):2635‑46.
- Note de bas de page 17
-
Shigayeva A, Rudnick W, Green K, Et. Al. « Invasive Pneumococcal Disease Among Immunocompromised Persons: Implications for Vaccination Programs. » Clin Infect Dis. 2016;62(2):139, 147.
- Note de bas de page 18
-
Cabaj J, Nettel-Aguirre A, MacDonald J, Et. Al. « Influence of Childhood Pneumococcal Conjugate Vaccines on Invasive Pneumococcal Disease in Adults With Underlying Comorbidities in Calgary, Alberta (2000-2013). » Clin Infect Dis. 2016;62(12):1521‑6.
- Note de bas de page 19
-
Gouvernement du Canada. Objectifs nationaux de couverture vaccinale et cibles nationales de réduction des maladies évitables par la vaccination d’ici 2025 [Internet]. 2022 [cité 10 juill 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/priorites-immunization-et-vaccins/strategie-nationale-immunisation/vaccination-objectifs-nationaux-couverture-vaccinale-cibles-nationales-reduction-maladies-evitables-2025.html
- Note de bas de page 20
-
Pfizer Canada. Monographie de produit : PrevnarTM 13 Vaccin antipneumococcique triskaïdécavalent conjugué (protéine diphtérique CRM197) [Internet]. 2019 [cité 10 juill 2022]. Disponible à: https://pdf.hres.ca/dpd_pm/00053003.PDF
- Note de bas de page 21
-
Merck Canada. Monographie du produit: VaxneuvanceMD Pneumococcal 15-valent Conjugate Vaccine [Protéine CRM197], adsorbé [Internet]. 2021 [cité 16 juin 2022]. Disponible à: https://pdf.hres.ca/dpd_pm/00066824.PDF
- Note de bas de page 22
-
Pfizer Canada. Monographie de produit avec renseignements destinés aux patients : PrevnarTM (Vaccin antipneumococcique 20-valent conjugué (protéine diphtérique CRM197)) [Internet]. 2022 [cité 16 juin 2022]. Disponible à: https://pdf.hres.ca/dpd_pm/00065899.PDF
- Note de bas de page 23
-
Merck Canada. Monographie de produit : PneumovaxMD 23 (vaccin polyvalent antipneumococcique, norme de MSD) [Internet]. 2016 [cité le 24 oct. 2022]. Consultable en ligne : https://pdf.hres.ca/dpd_pm/00008630.PDF
- Note de bas de page 24
-
Farrar J, Kobayashi M, Childs L, Et. Al. « Systematic Review and Meta-Analysis of Pneumococcal Vaccine Effectiveness against Invasive Pneumococcal Disease among Adults. » Open Forum Infectious Diseases. 2021;8(Supp 1):S134‑5.
- Note de bas de page 25
-
Childs L, Kobayashi M, Farrar J. « The Efficacy and Effectiveness of Pneumococcal Vaccines against Pneumococcal Pneumonia among Adults: A Systematic Review and Meta-Analysis. » Open Forum Infectious Diseases. 2021;8(Supp 1):S130‑1.
- Note de bas de page 26
-
Ermlich S, Andrews C, Folkerth S, Et. Al. « Safety and Immunogenicity of 15-Valent Pneumococcal Conjugate Vaccine in Pneumococcal Vaccine-Naïve Adults ≥50 Years of Age. » Vaccine. 2018;36(45):6875‑82.
- Note de bas de page 27
-
Peterson J, Stacey H, MacNair J, Et. Al. « Safety and Immunogenicity of 15-Valent Pneumococcal Conjugate Vaccine Compared to 13-Valent Pneumococcal Conjugate Vaccine in Adults ≥65 Years of Age Previously Vaccinated with 23-Valent Pneumococcal Polysaccharide Vaccine. » Hum Vaccin Immunother. 2019;15(3):540‑8.
- Note de bas de page 28
-
Platt H, Cardona J, Haranaka M, Et. Al. « A phase 3 Trial of Safety, Tolerability, and Immunogenicity of V114, 15-Valent Pneumococcal Conjugate Vaccine, Compared with 13-Valent Pneumococcal Conjugate Vaccine in Adults 50 Years of Age and Older (PNEU-AGE). » Vaccine. 2022;40(1):162‑72.
- Note de bas de page 29
-
Mohapi L, Pinedo Y, Osiyemi O, Et. Al. « Safety and Immunogenicity of V114, a 15-Valent Pneumococcal Conjugate Vaccine, in Adults Living with HIV. » AIDS. 2022;36(3):373‑82.
- Note de bas de page 30
-
Hammitt L, Quinn D, Janczewska E, Et. Al. « Immunogenicity, Safety, and Tolerability of V114, a 15-Valent Pneumococcal Conjugate Vaccine, in Immunocompetent Adults Aged 18-49 Years With or Without Risk Factors for Pneumococcal Disease: A Randomized Phase 3 Trial (PNEU-DAY). » Open Forum Infect Dis. 2021;9(3):ofab605.
- Note de bas de page 31
-
Song JY, Chang C, Andrews C, Et. Al. « Safety, Tolerability, and Immunogenicity of V114, a 15-Valent Pneumococcal Conjugate Vaccine, Followed by Sequential PPSV23 Vaccination in Healthy Adults Aged ≥50Yyears: A Randomized Phase III Trial (PNEU-PATH). » Vaccine. 2021;39(43):6422‑36.
- Note de bas de page 32
-
Severance R, Schwartz H, Dagan R, Et. Al. « Safety, tolerability, and immunogenicity of V114, a 15-valent pneumococcal conjugate vaccine, administered concomitantly with influenza vaccine in healthy adults aged ≥50 years: a randomized phase 3 trial (PNEU-FLU). » Hum Vaccin Immunother. 2022;18(1):1‑14.
- Note de bas de page 33
-
Hurley D, Griffin C, Young M, Et. Al. « Safety, Tolerability, and Immunogenicity of a 20-Valent Pneumococcal Conjugate Vaccine (PCV20) in Adults 60 to 64 Years of Age. » Clin Infect Dis. 2021;73(7):e1489‑97.
- Note de bas de page 34
-
Essink B, Sabharwal C, Cannon K, Et. Al. « Pivotal Phase 3 Randomized Clinical Trial of the Safety, Tolerability, and Immunogenicity of 20-Valent Pneumococcal Conjugate Vaccine in Adults 18 Years and Older. » Clin Infect Dis. 2021;75(3):390‑8.
- Note de bas de page 35
-
Cannon K, Elder C, Young M, Et. Al. « A Trial To Evaluate the Safety and Immunogenicity of a 20-Valent Pneumococcal Conjugate Vaccine in Populations of Adults ≥65 Years of Age with Different Prior Pneumococcal Vaccination. » Vaccine. 2021;39(51):7494‑502.
- Note de bas de page 36
-
Bonten M, Huijts S, Bolkenbaas M, Et. Al. « Polysaccharide Conjugate Vaccine Against Pneumococcal Pneumonia in Adults. » N Engl J Med. 2015;372(12):1114‑25.
- Note de bas de page 37
-
Kobayashi M, Farrar J, Gierke R, Et. Al. « Use of 15-Valent Pneumococcal Conjugate Vaccine Among U.S. Children: Updated Recommendations of the Advisory Committee on Immunization Practices — United States, 2022. » MMWR Morb Mortal Wkly Rep. 2022;71:1174‑81.
- Note de bas de page 38
-
Cannon, Et. Al. « Immunogenicity and Safety of a 20-Valent Pneumococcal Conjugate Vaccine (PCV20) Administered Concomitantly With a Quadrivalent Inactivated Influenza Vaccine in Adults Over 65 Years of Age. » Affiche présentée à: 32e European Congress of Clinical Microbiology & Infectious Diseases (ECCMID). Lisbon (PT). 23 avr 2022;
- Note de bas de page 39
-
Fitz-Patrick, Et. Al. « Safety, Tolerability, and Immunogenicity of BNT162b2 COVID-19 Vaccine Coadministered with 20-Valent Pneumococcal Conjugate Vaccine (PCV20) in Adults 65 Years of Age and Above. » Affiche présentée à: 32e European Congress of Clinical Microbiology & Infectious Diseases (ECCMID). Lisbon (PT). 23 avr 2022;
- Note de bas de page 40
-
Langley J. ARCHIVÉ - Relevé des maladies transmissibles au Canada: Recommandations pour l'immunisation fondées sur des données probantes - Méthodes du Comité consultatif national de l'immunisation [Internet]. Agence de la santé publique du Canada. 2009 [cité 10 juill 2022]. Disponible à: https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2009-35/methodes-comite-consultatif-national-immunisation.html
- Note de bas de page 41
-
Matanock A, Lee G, Gierke R, Et. Al. « Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine Among Adults Aged ≥65 Years: Updated Recommendations of the Advisory Committee on Immunization Practices. » MMWR Morb Mortal Wkly Rep. 2019;68(46):1069‑75.
