Ligne directrice canadienne sur la biosécurité : Activités de diagnostic humain
Télécharger le format de rechange
(5,31 Mo, 78 pages)
Organisation : Agence de la santé publique du Canada
Date publiée : 2021-06-01
Table des matières
- Préface
- Abréviations et sigles
- Chapitre 1 - Introduction
- Chapitre 2 - Risques associés aux activités de diagnostic
- Chapitre 3 - Considérations physiques en matière de confinement
- Chapitre 4 - Pratiques opérationnelles
- Chapitre 5 - Décontamination et gestion des déchets
- Chapitre 6 - Glossaire
- Chapitre 7 - Références et ressources
- Annexe A - Exigences relatives à la délivrance de permis lorsque seul le Règlement sur la santé des animaux s'applique
- Annexe B - Hygiène des mains adéquate
Préface
La ligne directrice Activités de diagnostic humain a été élaborée par l'Agence de la santé publique du Canada (ASPC) dans le cadre d'une série de publications électroniques qui s'étendent sur les concepts liés à la biosécurité et la biosûreté présentés dans l'édition actuelle du Guide canadien sur la biosécurité (GCB), soit le document complémentaire à la Norme canadienne sur la biosécurité (NCB). Cette ligne directrice fournit des recommandations pour les installations où des activités de diagnostic humain (c.-à-d. des tests diagnostiques ou des analyses de laboratoire impliquant un agent pathogène humain) sont effectuées. Ceci comprend les installations effectuant des activités avec des agents pathogènes ou des toxines qui sont exclues de la Loi sur les agents pathogènes humains et les toxines (LAPHT), celles qui sont exemptées de l'obligation d'obtenir un permis et celles qui mènent des activités réglementées en vertu d'un permis visant des agents pathogènes et des toxines émis par l'ASPC.
Au Canada, les installations où sont manipulés et entreposés des agents pathogènes humains ou des toxines du groupe de risque 2, 3 et 4 sont réglementées par l'ASPC en vertu de la LAPHT et du Règlement sur les agents pathogènes humains et les toxines (RAPHT). L'importation d'agents zoopathogènes, d'animaux infectés, de produits d'animaux, de sous-produits d'animaux (p. ex. du sang, du sérum) ou d'autres substances qui pourraient être porteuses d'un agent zoopathogène en entier ou en partie (p. ex. une toxine) est réglementée par l'ASPC ou l'Agence canadienne d'inspection des aliments (ACIA) en vertu de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA).
La figure suivante illustre la hiérarchie des documents qu'utilisent l'ASPC et l'ACIA pour surveiller les activités de biosécurité et de biosûreté. Chaque niveau de la pyramide correspond à un type de document. Les documents sont placés en ordre de priorité du haut de la pyramide vers le bas. Les lois et les règlements se trouvent au sommet de la pyramide, car ce sont ces documents qui transmettent l'autorité légale de l'ASPC et de l'ACIA. Le matériel d'orientation et les éléments techniques se trouvent au bas de la pyramide, car ils sont uniquement destinés à résumer les recommandations et les connaissances scientifiques.
Figure 1 : La hiérarchie des documents en matière de biosécurité et de biosûreté de l'Agence de la santé publique du Canada
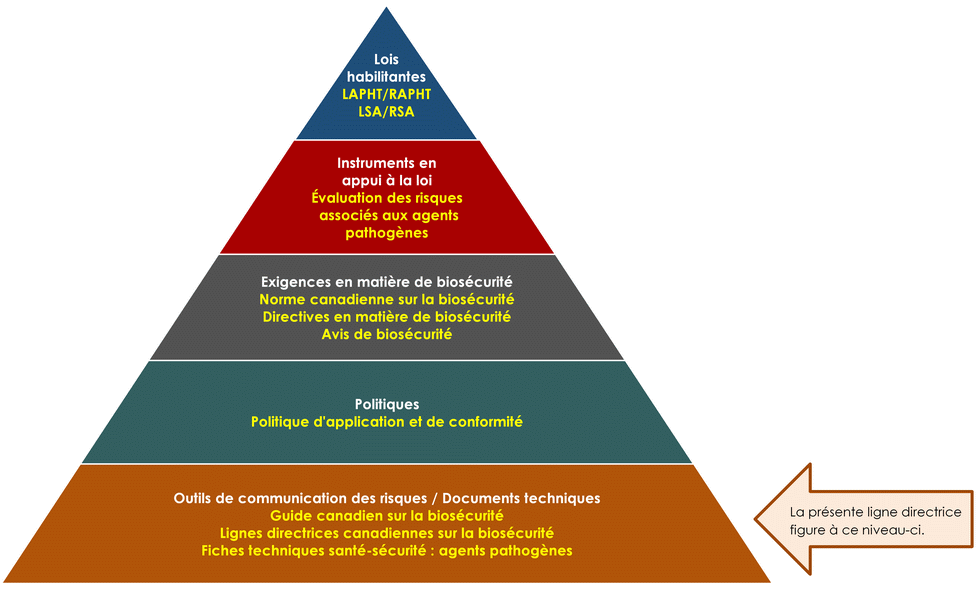
Figure 1 - Équivalent textuel
Figure sous la forme d'une pyramide représentant la hiérarchie des documents utilisés par l'ASPC pour superviser les opérations de biosécurité et de biosûreté. Chacun des cinq niveaux de la pyramide correspond à un type de document, dont l'ordre de préséance augmente du bas vers le haut.
Au sommet, se trouve la législation habilitante, c'est-à-dire la LAPHT, le RAPHT, la LSA et le RSA, qui transmet les autorités légales à l'ASPC. Au-dessous des lois et des règlements figurent les Instruments à l'appui de la législation, et ceux-ci sont les évaluations des risques liés aux agents pathogènes. La prochaine étape est intitulée les Exigences en matière de biosécurité, notamment la Norme canadienne sur la biosécurité, les Directives en matière de biosécurité et les Avis de biosécurité. Le deuxième niveau du bas est Documents de politique, soit la Politique de conformité et d'application de la loi. Le matériel d'orientation et les pièces techniques trouvés au bas de la pyramide, sous l'en-tête des Outils de communication des risques et documents techniques, visent seulement à résumer les recommandations et les informations scientifiques. Il s'agit notamment du Guide canadien sur la biosécurité, des Lignes directrices canadiennes sur la biosécurité et des Fiches techniques santé-sécurité : agents pathogènes.
La ligne directrice Activités de diagnostic humain est un document en constante évolution et fait l'objet d'une amélioration continue. L'ASPC accueille avec intérêt les commentaires, les demandes de clarification et les suggestions visant l'amélioration des versions subséquentes de ce document. Veuillez envoyer toute information ou suggestion (accompagnée de ses références lorsqu'applicable) à l'adresse suivante :
- Adresse courriel de l'ASPC : PHAC.pathogens-pathogenes.ASPC@canada.ca
Abréviations et sigles
- ABCSE
- Agent biologique à cote de sécurité élevée
- ACIA
- Agence canadienne d'inspection des aliments
- ASB
- Agent de la sécurité biologique
- ASPC
- Agence de la santé publique du Canada
- ELR
- Évaluation locale des risques
- EPI
- Équipement de protection individuel
- ESB
- Enceinte de sécurité biologique
- GCB
- Guide canadien sur la biosécurité
- GR
- Groupe de risque (c.-à-d. GR1, GR2, GR3, GR4)
- ICL
- Intoxication ou infection contractée en laboratoire
- LAPHT
- Loi sur les agents pathogènes humains et les toxines
- LSA
- Loi sur la santé des animaux
- NC
- Niveau de confinement (c.-à-d. NC1, NC2, NC3, NC4)
- NCB
- Norme canadienne sur la biosécurité
- PON
- Procédures opératoires normalisées
- RAPHT
- Règlement sur les agents pathogènes humains et les toxines
- RSA
- Règlement sur la santé des animaux
Chapitre 1 - Introduction
Les mots en caractères gras sont définis dans le glossaire au chapitre 6.
Les maladies infectieuses et les affections causées par les agents pathogènes touchent des millions de Canadiens chaque année. Les installations de diagnostic remplissent une fonction cruciale pour le système de soins de santé du Canada en offrant des services essentiels qui aident les professionnels de la santé à diagnostiquer une maladie ou une affection chez leurs patients.
Au Canada, les installations où sont menées des activités réglementées avec des agents pathogènes humains du groupe de risque 2 (GR2), GR3 et GR4, y compris les agents pathogènes zoonotiques, ou des toxines sont réglementées par l'Agence de la santé publique du Canada (ASPC) en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) et du Règlement sur les agents pathogènes humains et les toxines (RAPHT)Note de bas de page 1 Note de bas de page 2. À moins qu'elles ne soient expressément exclues de la LAPHT ou exemptées de l'exigence relative à la délivrance de permis en vertu de la LAPHT ou du RAPHT, ces installations doivent détenir un permis visant des agents pathogènes et des toxines (ci-après appelé « permis ») pour mener intentionnellement des activités réglementées avec un agent pathogène humain ou une toxine. Les activités réglementées comprennent la possession, la manipulation ou l'utilisation, la production, l'entreposage, le transfert, l'importation ou l'exportation, le rejet ou l'abandon, ainsi que l'élimination d'un agent pathogène humain ou d'une toxine, de même que le fait d'en permettre l'accès.
Qu'une matière ou une activité soit exclue de la LAPHT ou exemptée de l'obligation d'obtenir un permis, l'importation et le transfert d'agents zoopathogènes, d'animaux infectés, de produits d'animaux (p. ex. de la crème, du lait, des œufs) ou de sous-produits d'animaux (p. ex. du sang, du sérum, des tissus) ou d'autres organismes porteurs d'un agent zoopathogène ou une partie de celui-ci (p. ex. une toxine) sont règlementés en vertu de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA) et nécessitent un permis d'importation d'agents zoopathogènes ou une autorisation de transfert d'agents zoopathogènes délivré par l'ASPC ou l'Agence canadienne d'inspection des aliments (ACIA)Note de bas de page 3 Note de bas de page 4.
Les sections qui suivent décrivent les types de matières exclues de la LAPHT qui peuvent être manipulées dans une installation de diagnostic, ainsi que les activités comportant des agents pathogènes humains et des toxines qui sont exemptées de l'obligation d'obtenir un permis.
1.1 Agents pathogènes humains et toxines exclus de la LAPHT
Nonobstant d'autres critères d'exclusion (c.-à-d. une drogue sous forme posologique ou un agent pathogène humain ou une toxine présent dans une telle drogue), la LAPHT ne s'applique pas à un agent pathogène humain ou une toxine qui est dans son milieu naturel, pourvu qu'il n'ait été ni cultivé (p. ex. mis en culture) ni recueilli ou extrait intentionnellement (p. ex. par centrifugation, chromatographie) [LAPHT 4(a)]. Les agents pathogènes humains et les toxines sont considérés comme étant dans leur milieu naturel dans les échantillons primaires (p. ex. le sang, le plasma, les écouvillons, l'urine, les fèces, le liquide céphalorachidien, les tissus, le lait) prélevés sur des patients qui sont infectés par un agent pathogène humain ou ont été exposés à une toxine. Les activités avec des échantillons primaires (p. ex. les tests diagnostiques pour identifier la cause d'une infection) qui n'augmentent pas la quantité ou la concentration de l'agent pathogène, comme celles conçues pour détecter les protéines, les anticorps ou les acides nucléiques, sont également exclues de la LAPHT. Il n'y a aucune obligation légale en vertu de la LAPHT pour les installations où uniquement ces activités sont menées. Néanmoins, l'information fournie dans cette ligne directrice peut être utilisée comme référence pour les meilleures pratiques en matière de biosécurité afin de protéger la santé et la sécurité des membres du personnel et de la communauté.
1.2 Exemption de l'exigence relative à la délivrance de permis en vertu de la LAPHT pour les activités d'identification avec un agent pathogène humain
En vertu du paragraphe 27(1) du RAPHT, toute personne qui effectue des tests diagnostiques ou des analyses de laboratoire avec un agent pathogène humain qui n'est pas un prion ni un agent pathogène humain précisé (c.-à-d. un agent biologique à cote de sécurité élevée [ABCSE]) est exemptée de l'obligation d'obtenir un permis. Toutefois, cette exemption ne s'applique que si :
-
La personne ne cultive pas (p. ex. la mise en culture) d’agent pathogène humain ou n’en produit pas d’une autre manière.
Par exemple, l’extraction d’acides nucléiques à partir du sang ou du plasma pour des analyses subséquentes de réaction en chaîne par polymérase (PCR).
-
Lorsqu'il y a production, celle-ci est effectuée dans un contenant scellé qui empêche le rejet de l'agent pathogène et qui est décontaminé avant son élimination ou sa réutilisation (c.-à-d. le contenant demeure scellé jusqu'à ce que la décontamination ait été effectuée).
Par exemple, l'inactivation d'un agent pathogène dans un tube de culture fermé par une méthode vérifiée pour son efficacité (p. ex. un traitement par la chaleur, l'ajout de produits chimiques à travers un septum) préalablement aux manipulations subséquentes.
Les boîtes de Pétri ou les tubes de culture peuvent être considérés comme des contenants scellés s'ils sont ensemencés, scellés pour empêcher le rejet de l'agent pathogène (p. ex. avec un film scellant), incubés, examinés pour une croissance et décontaminés sans être ouverts ou sans avoir effectué de cultures secondairesNote de bas de page 5. L'exemption de l'obligation d'obtenir un permis s'applique également aux personnes qui, durant le processus de mener des analyses de laboratoire et des tests diagnostiques, manipulent des échantillons de contrôle de la qualité ou des épreuves de compétence contenant des agents pathogènes humains du GR2 ou GR3 infectieux qui imitent les échantillons primaires et servent à confirmer l'exactitude continue des analyses diagnostiques (p. ex. pour étalonner un instrument, pour déterminer la performance des tests ou des mesures en laboratoire, pour surveiller la compétence continue du laboratoire)Note de bas de page 5. Si des activités avec des échantillons humains, des échantillons de contrôle de la qualité ou des épreuves de compétence ne sont pas menées conformément aux critères indiqués au RAPHT 27(1), ces activités nécessitent l'obtention d'un permis permettant les activités réglementées avec la matière réglementée. Lorsque de telles activités sont effectuées sans le permis approprié, le laboratoire de diagnostic est considéré en possession involontaire d'une matière réglementée lorsque l'agent pathogène est identifié, ce qui nécessite une notification à l'ASPC. Comme une possession involontaire peut causer un incident d'exposition, l'ASPC doit aussi être avisée de la possibilité d'un incident d'exposition.
Les installations exemptées de l'exigence relative à la délivrance de permis sont tout de même réglementées en vertu de la LAPHT et, à ce titre, doivent prendre toutes les précautions raisonnables pour protéger la santé et la sécurité publiques contre les risques que présentent les activités impliquant des agents pathogènes humains et des toxines [LAPHT 6]. Ces installations peuvent faire l'objet d'une inspection par l'ASPC pour vérifier si toutes les précautions raisonnables ont été prises. Les pratiques énoncées dans cette ligne directrice peuvent être mises en œuvre dans les installations exemptées pour démontrer que toutes les précautions raisonnables ont été prises pour protéger la santé et la sécurité des membres du personnel et de la communauté. À titre de pratique exemplaire, les installations exemptées peuvent aussi démontrer qu'elles répondent à cette exigence en suivant les exigences physiques et de pratiques opérationnelles applicables énoncées dans la Norme canadienne sur la biosécurité (NCB)Note de bas de page 6. Des lignes directrices supplémentaires de l'ASPC sur la biosécurité sont aussi disponibles pour appuyer davantage les installations exemptéesNote de bas de page 7.
L'arbre de décision présenté à la figure 1-1 décrit les cas où la LAPHT et le RAPHT s'appliquent aux activités de tests diagnostiques impliquant un agent pathogène humain, selon le type d'activité menée dans l'installation.
Figure 1-1 : Surveillance législative des activités de tests diagnostiques impliquant un agent pathogène humain en vertu de la LAPHT et du RAPHT
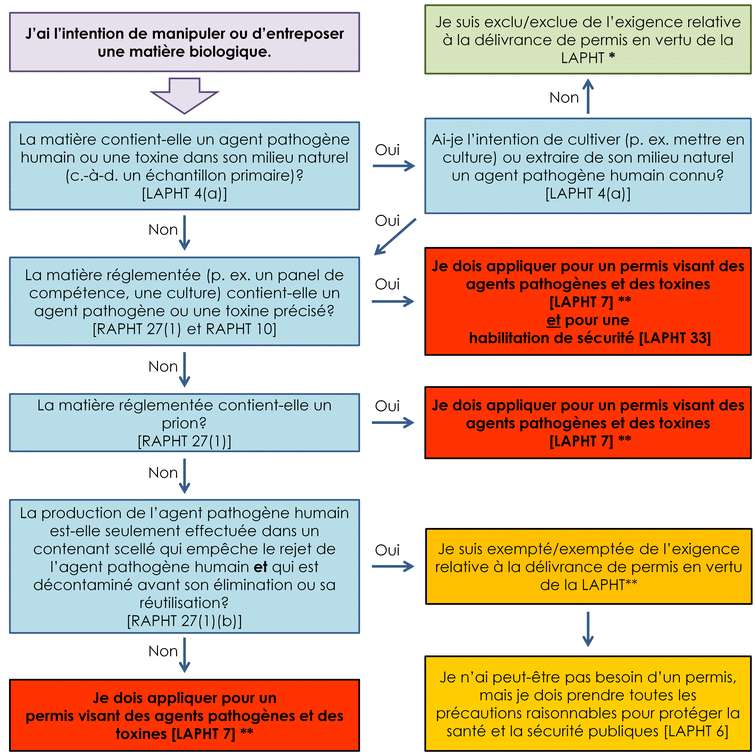
- Figure 1-1 note *
-
Les exigences du RSA peuvent s'appliquer si l'agent pathogène humain est aussi un agent zoopathogène (voir l'annexe A). Je dois aussi informer l'ASPC sans délai d'une production involontaire d'un agent pathogène humain ou une toxine. [LAPHT 12(2)]
- Figure 1-1 note **
-
Lorsque l'agent pathogène humain est un agent zoopathogène :
- un permis délivré par l'ACIA est exigé pour tout agent zoopathogène qui cause une maladie animale émergente (MAÉ) ou une maladie animale exotique (MAE);
- un permis visant des agents pathogènes et des toxines délivré par l'ASPC qui comprend un permis d'agents pathogènes d'animaux terrestres est exigé si la matière est importée ou a été importée (en vertu du RSA).
Figure 1-1 - Équivalent textuel
La figure est un arbre de décision qui décrit lorsque les installations de diagnostic doivent détenir un permis visant des agents pathogènes et des toxines et lorsqu'elles sont exclues de la LAPHT ou sont exemptées de l'exigence relative à la délivrance de permis en vertu de la LAPHT et n'ont pas l'obligation d'appliquer pour un permis.
Une installation où la matière biologique contient un agent pathogène humain ou une toxine dans son milieu naturel (c.-à-d. un échantillon primaire) et où il n'y a aucune intention de cultiver (p. ex. mettre en culture) ou extraire de son milieu naturel un agent pathogène humain connu est exclue de l'exigence relative à la délivrance de permis en vertu de la LAPHT [LAPHT 4(a)]. Néanmoins, les exigences du RSA peuvent s'appliquer si l'agent pathogène humain est aussi un agent zoopathogène (voir l'annexe A). L'ASPC doit aussi être informée sans délai s'il y a production involontaire d'un agent pathogène humain ou d'une toxine.
Lorsqu’une matière biologique contient un agent pathogène humain ou une toxine qui n’est pas dans son milieu naturel ou que l’agent pathogène humain ou la toxine est dans son milieu naturel (c.-à-d. un échantillon primaire), mais qu’il y a intention de le cultiver (p. ex. le mettre en culture) ou l’extraire de son milieu naturel, un permis visant des agents pathogènes et des toxines et une habilitation de sécurité sont exigées pour les matières réglementées (p. ex. un panel de compétence, une culture) qui contiennent un agent pathogène ou une toxine précisé [LAPHT 7, LAPHT 33, RAPHT 27(1) et RAPHT 10].
Lorsqu’une matière biologique contient un agent pathogène humain ou une toxine qui n’est pas dans son milieu naturel ou que l’agent pathogène humain ou la toxine est dans son milieu naturel (c.-à-d. un échantillon primaire), mais qu’il y a intention de le cultiver (p. ex. le mettre en culture) ou l’extraire de son milieu naturel, un permis visant des agents pathogènes et des toxines est exigé lorsque la matière réglementée contient un prion [LAPHT 7 et RAPHT 27(1)].
Lorsqu’une matière biologique contient un agent pathogène humain ou une toxine qui n’est pas dans son milieu naturel ou que l’agent pathogène humain ou la toxine est dans son milieu naturel (c.-à-d. un échantillon primaire), mais qu’il y a intention de le cultiver (p. ex. le mettre en culture) ou l’extraire de son milieu naturel, un permis visant des agents pathogènes et des toxines est exigé si la production de l’agent pathogène humain n’est pas effectuée dans un contenant scellé qui empêche le rejet de l’agent pathogène humain et qui peut être décontaminé avant son élimination ou sa réutilisation [LAPHT 7 et RAPHT 27(1)(b)].
Lorsqu’une matière biologique contient un agent pathogène humain ou une toxine qui n’est pas dans son milieu naturel ou que l’agent pathogène humain ou la toxine est dans son milieu naturel (c.-à-d. un échantillon primaire), mais qu’il y a intention de le cultiver (p. ex. le mettre en culture) ou l’extraire de son milieu naturel, une installation est exemptée de l’exigence relative à la délivrance de permis en vertu de la LAPHT si la production de l’agent pathogène humain est effectuée dans un contenant scellé qui empêche le rejet de l’agent pathogène humain et qui peut être décontaminé avant son élimination ou sa réutilisation [RAPHT 27(1)(b)]. Bien qu’une installation peut ne pas être obligée de détenir un permis, toutes les précautions raisonnables doivent être prises pour protéger la santé et la sécurité publiques [LAPHT 6].
Dans tous les scenarios de l’arbre de décision, si une installation doit détenir un permis visant des agents pathogènes ou des toxines ou si elle est exemptée de l’exigence relative à la délivrance de permis en vertu de la LAPHT et que l’agent pathogène humain manipulé est un agent zoopathogène :
- un permis délivré par l'ACIA est exigé pour tout agent zoopathogène qui cause une maladie animale émergente (MAÉ) ou une maladie animale exotique (MAE);
- un permis visant des agents pathogènes et des toxines délivré par l'ASPC qui comprend un permis d'agents pathogènes d'animaux terrestres est exigé si la matière est importée ou a été importée (en vertu du RSA).
Qu'ils soient ou non réglementés en vertu de la LAPHT et du RAPHT, les agents pathogènes présents dans les échantillons primaires provenant de personnes symptomatiques ou asymptomatiques présentent tout de même un risque en matière de biosécurité pour les membres du personnel, la communauté et l'environnement. La pratique qui consiste à manipuler les échantillons primaires comme s'ils contiennent à tout le moins un agent pathogène du GR2 préviendra une exposition et un rejetNote de bas de page 8. Ceci peut être accompli en manipulant de tels échantillons dans une installation qui rencontre les exigences de niveau de confinement 2 (NC2) énoncées dans la NCB. S'il y a lieu de croire qu'un échantillon primaire peut contenir un agent pathogène associé à un risque plus élevé, le fait d'avoir en place un confinement physique et des pratiques opérationnelles appropriés pour le risque associé à l'agent pathogène permettra de protéger la sécurité des membres du personnel et la communauté (p. ex. manipuler des échantillons soupçonnés de contenir un agent pathogène humain du GR3 au NC3).
1.3 Portée
La ligne directrice Activités de diagnostic humain offre des conseils pour la manipulation sécuritaire des échantillons prélevés d'humains qui peuvent être infectés par un agent pathogène humain du GR2, GR3 ou GR4. Elle fournit également des conseils sur la gestion des risques liés à une exposition des membres du personnel à une matière infectieuse qui peut entraîner une transmission dans la communauté, et sur la prévention de rejet d'agents pathogènes dans l'environnement.
La présente ligne directrice s'adresse à toutes les personnes qui effectuent des tests diagnostiques ou des analyses de laboratoire avec une toxine ou un agent pathogène humain exclu de la loi (c.-à-d. qui est dans son milieu naturel) ou qui mènent des activités qui sont exemptées de l'exigence relative à la délivrance de permis. Cette ligne directrice peut également servir de référence pour les personnes qui effectuent des activités réglementées en vertu d'un permis délivré par l'ASPC pour les aider à satisfaire aux exigences énoncées dans la NCB.
Les renseignements fournis dans la ligne directrice Activités de diagnostic humain ne sont présentés qu'à titre indicatif afin d'améliorer la biosécurité dans les installations où sont menées des activités visant à diagnostiquer des maladies infectieuses humaines et ne doivent pas être interprétés comme des exigences.
1.4 Comment utiliser la ligne directrice Activités de diagnostic humain
Une liste détaillée de l'ensemble des abréviations et des sigles utilisés dans cette ligne directrice se trouve au début du document. Chaque mot ou terme est épelé au long à sa première utilisation dans la ligne directrice, suivi de l'abréviation entre parenthèses. Après avoir été définie, l'abréviation est utilisée exclusivement dans le reste du document. Cette ligne directrice contient également un glossaire complet des définitions des termes techniques au chapitre 6. Les termes techniques définis dans le glossaire apparaissent en caractères gras lors de leur première utilisation dans la ligne directrice. Une liste des références et d'autres ressources est présentée au chapitre 7.
Chapitre 2 - Risques associés aux activités de diagnostic
La biosécurité nécessite l'application uniforme de mesures de sécurité (c.-à-d. des caractéristiques physiques en matière de confinement et des pratiques opérationnelles) qui sont essentielles pour prévenir tout préjudice aux membres du personnel, à la communauté et à l'environnement causé par une exposition à, ou le rejet, des agents pathogènes ou des toxines manipulés dans une installation. L'application uniforme des mesures est réussie grâce à la mise en œuvre d'un programme de biosécurité complet qui comprend des éléments tels que la formation, la surveillance médicale, l'intervention d'urgence et les procédures opératoires normalisées (PON) pour des pratiques de travail sécuritaires. Les mesures d'atténuation qui sont appropriées pour un agent pathogène, une zone de confinement, un espace de travail ou une procédure en particulier sont prises en fonction des évaluations des risques, soit la base sur laquelle reposent toutes les composantes d'un programme de biosécurité.
Les installations où des analyses de laboratoire ou des tests diagnostiques comportant des agents pathogènes humains sont effectués répondent souvent à des exigences ou à des normes rigoureuses en matière de gestion de la qualité et de la sécurité (p. ex. par la surveillance d'organismes d'accréditation ou de certification externes)Note de bas de page 9 Note de bas de page 10 Note de bas de page 11. Ces systèmes de sécurité et de contrôle de la qualité englobent souvent des considérations en matière de biosécurité (p. ex. l'équipement de protection individuel [EPI], les PON pour des pratiques de travail sécuritaires, l'adhésion aux bonnes pratiques et procédures microbiologiques), et, à ce titre, ces installations peuvent déjà satisfaire à certaines des exigences énoncées dans la NCBNote de bas de page 6 Note de bas de page 12 Note de bas de page 13.
De plus, les pratiques de base, les précautions universelles et les précautions standard qui consistent à traiter tous les échantillons de sang, de liquides organiques ou de tissus comme s'ils contiennent un agent pathogène humain, sont utilisées dans plusieurs installations de diagnostic, ce qui améliore la biosécurité dans ces installationsNote de bas de page 8 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16.
2.1 Possession involontaire
La possession involontaire (y compris la possession résultant d'une production involontaire) d'un agent pathogène peut se produire dans tout laboratoire de diagnostic. Où des tests diagnostiques sont effectués dans une installation ne détenant pas de permis, le fait d'ouvrir un contenant scellé avant sa décontamination est considéré comme étant une possession involontaire lorsqu'un agent pathogène du GR2, GR3 ou GR4 a été identifié. La possession involontaire peut également être le résultat d'une activité règlementée avec un prion ou un agent pathogène qui est un ABCSE. Dans chacun de ces cas, l'activité ne répond plus aux critères d'exemption de l'exigence relative à la délivrance de permis [RAPHT 27(1)] et elle doit être déclarée sans délai à l'ASPC en tant que possession involontaire d'un agent pathogène humain [LAPHT 12(2)]. La déclaration doit être effectuée par l'agent de la sécurité biologique (ASB) ou, dans le cas des installations ne détenant pas de permis, par l'entremise de l'autorité interne appropriée. De plus, dans un délai de 30 jours, il faut disposer de l'agent pathogène comme il se doit (c.-à-d. décontaminé) ou le transférer dans une installation autorisée à manipuler l'agent pathogène [RAPHT 4(1)(f)].
Selon la situation, il est possible que l'ouverture d'une culture scellée contenant un agent pathogène avec des précautions en matière de biosécurité inadéquates (p. ex. à un niveau de confinement inférieur, sans EPI approprié, à l'extérieur d'une enceinte de sécurité biologique [ESB]) doive également être déclarée à l'ASPC comme une exposition possible [LAPHT 13]. Bien qu'il ne s'agisse pas d'une exigence au NC2, la tenue d'un registre de toutes les personnes qui sont entrées dans le laboratoire au moment d'un incident permettra d'identifier celles qui ont pu être à risque d'exposition. La tenue d'un tel registre est particulièrement importante puisque l'identité de l'agent pathogène pourrait demeurer inconnue plusieurs jours après sa manipulation.
Si le titulaire d'un permis a des motifs de croire qu'un incident mettant en cause un agent pathogène humain ou une toxine qui est en sa possession a causé ou peut avoir causé une maladie chez une personne, le titulaire de permis doit en aviser l'ASPC sans délai et lui soumettre toute l'information disponible [LAPHT 13].
2.2 Intoxications ou infections contractées en laboratoire
Les intoxications ou infections contractées en laboratoire (ICL) dans les laboratoires de diagnostic présentent un risque pour la santé des individus ainsi que du public (c.-à-d. par le risque de transmission subséquente à l'intérieur de la communauté). Historiquement, au Canada, l'absence d'un cadre de déclaration structuré a entraîné un manque de données précises, et probablement sous-déclarées, sur les ICL dans les laboratoires de diagnostic et les laboratoires cliniquesNote de bas de page 17. La source des ICL peut être difficile à identifier, compte tenu :
- des voies d'expositions variées, qui comprennent le contact direct avec l'agent pathogène (p. ex. l'inoculation percutanée, l'inhalation d'aérosols) ou le contact indirect (p. ex. un contact entre des muqueuses et des objets contaminés)Note de bas de page 18;
- du délai entre l'exposition et la manifestation de symptômes cliniques ou de signes d'infection (c.-à-d. la période d'incubation);
- des infections asymptomatiques.
Souvent, la cause directe d'une ICL demeure inconnue, ce qui indique que l'incident qui y a contribué (p. ex. la défaillance du confinement, la production d'aérosols, le contact des mains contaminées avec les yeux, l'incapacité à reconnaître l'agent pathogène, le non-respect des PON) est passé inaperçuNote de bas de page 19.
Selon les ouvrages scientifiques, il est estimé que l'incidence des ICL varie de 1,4 à 4,0 pour 1 000 membres du personnel de laboratoire clinique; environ 45 % des ICL symptomatiques déclarées entre 1979 et 2004 étaient associées aux activités de laboratoire clinique, et 99 % des infections étaient d'origine bactérienne ou viraleNote de bas de page 17. Dans une revue de la littérature portant sur les infections virales chez les membres du personnel de laboratoire et les travailleurs de la santé, l'inhalation d'aérosols infectieux représentait la principale voie d'infection pour les membres du personnel de laboratoire, probablement en raison de la prédominance des procédures de travail susceptibles de produire des aérosols infectieux (p. ex. la centrifugation, le pipetage)Note de bas de page 20. Il est alarmant de constater que l'inhalation d'aérosols infectieux représente une voie d'infection pour les virus qui ne sont pas transmis naturellement par les aérosols ou par inhalation (p. ex. les arbovirus, les virus à diffusion hématogène, les virus normalement transmis par voie percutanée)Note de bas de page 17.
Du point de vue canadien, l'ASPC rapporte que 46 % de toutes les notifications d'incident reçues entre 2016 et 2019 ont eu lieu dans les laboratoires hospitaliers ou dans le secteur de la santé publiqueNote de bas de page 21 Note de bas de page 22 Note de bas de page 23 Note de bas de page 24. Bien que la majorité (n = 218) des incidents déclarés au cours de cette période n'ont causé qu'une exposition, vingt-et-un incidents ont mené à des ICL présumées (n = 16) ou confirmées (n = 5). Au total, les incidents déclarés entre 2016 et 2019 ont mené à l'exposition de 539 personnes, les deux voies d'exposition les plus communes étant l'inhalation et les inoculations avec des objets pointus ou tranchants.
Bien que l'identité de l'agent pathogène causant une infection chez un patient nécessitant un traitement médical peut être soupçonnée (p. ex. en fonction de la présentation clinique, des facteurs tels que les voyages du patient et l'exposition à une personne infectée), son identité demeure inconnue jusqu'à ce que l'analyse de laboratoire ou les tests diagnostiques soient terminés. Une erreur d'identification (p. ex. un agent pathogène du GR3 identifié comme étant un agent pathogène du GR2) au cours des analyses diagnostiques préliminaires peut être un facteur contribuant à ce que les membres du personnel manipulent sans le savoir des agents pathogènes sans prendre les précautions appropriées (p. ex. un agent pathogène du GR3 manipulé au NC2, un EPI inadéquat). Les risques de contracter des ICL dans les installations de diagnostic peuvent également être associés à des erreurs des membres du personnel causées par un stress accru, des contraintes de temps et une lourde charge de travail plutôt que par des pratiques de travail non sécuritaires ou une formation insuffisanteNote de bas de page 25 Note de bas de page 26. Le fait que des ICL continuent de survenir dans les laboratoires de diagnostic souligne l'importance d'effectuer des évaluations locales des risques (ELR) pour prévenir l'exposition des membres du personnel aux agents pathogènes humains ainsi que le rejet involontaire d'agents pathogènes hors du confinementNote de bas de page 25.
2.3 Évaluations des risques associés à l'agent pathogène
Les microorganismes sont classés dans l'un des quatre groupes de risque (c.-à-d. GR1, GR2, GR3, GR4) en fonction des résultats d'une évaluation des risques associés à l'agent pathogène, qui étudie les caractéristiques inhérentes de l'organisme qui contribuent au risque qu'il présente pour un humain ou un animal individuellement, et pour la santé publique et la population animale. L'ASPC a élaboré les Fiches techniques santé-sécurité : agents pathogènes (FTSSP) à partir des évaluations des risques associés à des agents pathogènes bien caractérisés; ces fiches sont disponibles sur le site Web du gouvernement du CanadaNote de bas de page 27. De plus, la base de données sur les groupes de risque ePATHogène peut être consultée pour trouver la classification par groupe de risque de milliers d'agents pathogènes humains et d'agents zoopathogènesNote de bas de page 28. L'ASPC procède de façon proactive aux évaluations des risques associés aux agents pathogènes nouveaux et émergents. Lorsque les données obtenues à partir de ces évaluations des risques révèlent que des caractéristiques physiques en matière de confinement ou des pratiques opérationnelles particulières sont requises pour travailler de manière sécuritaire avec un agent pathogène nouveau ou émergent, des avis de biosécurité sont élaborés, et les renseignements sont communiqués aux parties réglementées.
2.3.1 Niveau de confinement
Les niveaux de confinement décrivent les exigences physiques en matière de confinement et les exigences opérationnelles minimales qu'une zone de confinement (c.-à-d. un espace physique identifié qui satisfait aux exigences pour un niveau de confinement particulier) nécessite pour la manipulation sécuritaire d'agents pathogènes ou de toxines. Il existe quatre niveaux de confinement, allant du laboratoire de base pour le travail avec des matières biologiques (c.-à-d. de niveau de confinement 1 [NC1]) jusqu'aux installations hautement sophistiquées pour le travail avec des agents pathogènes à risque élevé (c.-à-d. de NC4). L'évaluation du niveau de confinement prend en considération l'évaluation des risques associés à l'agent pathogène et les risques associés aux activités de la zone de confinement. En règle générale, le groupe de risque d'un agent pathogène est identique au niveau de confinement dans lequel il doit être manipulé (c.-à-d. les agents pathogènes du GR2 sont habituellement manipulés au NC2). Bon nombre des exigences physiques en matière de confinement et des exigences opérationnelles au NC3 visent à réduire les risques associés aux agents pathogènes pouvant être aéroportés ou transmis par aérosols. Par conséquent, certaines activités impliquant des agents pathogènes du GR3 qui ne sont pas reconnus comme étant transmissibles par inhalation, ou des activités qui comportent un risque plus faible de transmission par aérosols (p. ex. des activités d'identification des agents pathogènes), peuvent parfois être menées à un niveau de confinement inférieur (p. ex. un NC2). Dans de tels cas, l'ASPC et l'ACIA peuvent élaborer des directives en matière de biosécurité pour préciser les exigences en matière de confinementNote de bas de page 29.
2.4 Évaluations locales des risques
Les ELR sont des évaluations menées à un endroit en particulier afin d'identifier les dangers associés aux activités menées avec un agent pathogène ou une toxine. Elles servent à identifier et quantifier les risques, puis à déterminer les mesures d'atténuation appropriées (p. ex. les pratiques de travail sécuritaires), qui sont ensuite intégrées aux PON pour contrôler les risques pour les membres du personnel et prévenir le rejet des agents pathogènes. Les ELR examinent toutes les activités de travail (p. ex. les procédures avec des agents pathogènes et des toxines) et peuvent appuyer l'évaluation globale des risques. Les ELR qui sont suffisamment génériques permettent d'évaluer une vaste gamme de risques possibles associés au type d'échantillon analysé, aux agents pathogènes (et leurs groupes de risque) qui peuvent être présents et aux activités de diagnostic menéesNote de bas de page 30. L'ASPC et l'ACIA ont développé une ligne directrice pour effectuer des ELRNote de bas de page 31.
Une ELR efficace prendra en considération les caractéristiques uniques de l'agent pathogène (p. ex. la voie d'infection, la résistance aux médicaments, l'efficacité des vaccins disponibles) et les dangers associés à l'activité (p. ex. les procédures qui peuvent produire des aérosols) dans le but d'identifier des mesures d'atténuation efficaces. Bon nombre des exigences physiques en matière de confinement et des exigences opérationnelles précisées dans la NCB visent à prévenir la création d'aérosols, à contenir les aérosols et à protéger les membres du personnel. Le fait de prendre en considération les activités susceptibles de produire des aérosols (p. ex. ouvrir des cultures liquides, pipeter, centrifuger, mélanger avec un agitateur vortex, homogénéiser, gratter) peut aider à déterminer les mesures physiques et opérationnelles à prendre pour atténuer le risqueNote de bas de page 32.
2.4.1 Activités d'identification des agents pathogènes et tests diagnostiques impliquant des agents pathogènes et des toxines
Les installations de diagnostic sont sujettes à être en présence de nombreux types d'échantillons et de cultures, chacun présentant des risques particuliers. De plus, les procédures effectuées dans une installation de diagnostic influencent le risque qui est associé aux échantillons et cultures et sont prises en considération lors des évaluations du niveau de confinement.
2.4.1.1 Activités avec des matières biologiques inactivées
Une matière biologique inactivée est une matière biologique qui a été inactivée à l'aide d'une méthode validée et régulièrement vérifiée. Des exemples de méthodes d'inactivation comprennent notamment la chaleur, les produits chimiques et l'irradiation. Le processus de destruction ou d'inactivation rend l'échantillon exempt d'agents pathogènes et peu susceptible d'être infectieux. L'inactivation avec une méthode efficace, validée et régulièrement vérifiée doit être effectuée au niveau de confinement exigé pour l'agent pathogène et peut seulement être effectuée à un niveau de confinement inférieur si le contenant de culture demeure fermé pendant le processus d'inactivation (p. ex. si la culture d'un agent pathogène du GR3 a été effectuée au NC2 dans un récipient scellé, la décontamination peut également être effectuée au NC2 si le récipient demeure scellé). Une fois la matière inactivée, les activités subséquentes avec la matière inactivée ne sont pas réglementées par l'ASPC ou l'ACIA. Les tests d'antigènes, les analyses par transcriptase inverse et l'extraction d'acides nucléiques sont des exemples d'activités avec une matière inactivée. Les activités avec une matière (p. ex. de l'ADN) extraite par le biais d'une méthode physique (p. ex. la lyse cellulaire par cisaillement ou par l'utilisation d'une presse française) ne sont pas réglementées par l'ASPC ou l'ACIA lorsque la matière extraite n'est pas infectieuse.
2.4.1.2 Activités d'identification sans mise en culture d'échantillons primaires
Les échantillons primaires sont des liquides biologiques (p. ex. le sang total ou les composants sanguins, l'urine, les fèces, le lait, la salive, les expectorations, le lavage bronchique, le liquide céphalorachidien, les écouvillons), des cellules ou des tissus prélevés directement sur des humains ou des animaux exposés naturellement, ou des matières prélevées dans l'environnement, généralement pour identifier un agent pathogène, pour diagnostiquer une maladie ou à des fins de surveillance.
Les échantillons primaires contiennent généralement une concentration beaucoup plus faible d'agents pathogènes que les cultures en laboratoire. Par conséquent, les échantillons primaires contenant un agent pathogène humain sont exclus de la LAPHT, à moins qu'un agent pathogène humain ou une toxine présent dans l'échantillon n'ait été mis en culture, ou bien recueilli ou extrait intentionnellement. Bien qu'un permis délivré par l'ASPC ne soit pas exigé pour la manipulation des échantillons primaires (à moins qu'un agent pathogène humain n'ait été mis en culture, ou bien intentionnellement recueilli ou extrait à partir de l'échantillon), l'importation ou le transfert d'échantillons primaires contenant un agent zoopathogène ou un agent pathogène zoonotique nécessite un permis d'importation d'agents zoopathogènes délivré par l'ACIA ou un permis délivré par l'ASPC.
Une ELR peut être utilisée pour déterminer si les activités avec des échantillons primaires peuvent être menées en toute sécurité au NC2 (p. ex. la manipulation d'agents pathogènes peu susceptibles d'être transmis par des aérosols, l'utilisation de méthodes peu susceptibles de produire des aérosols). Le fait de manipuler tous les échantillons primaires comme si l'agent pathogène soupçonné est présent (c.-à-d. avec les caractéristiques physiques en matière de confinement et les pratiques opérationnelles appropriées) et de respecter les bonnes pratiques et procédures microbiologiques dans les espaces de travail où des échantillons primaires sont manipulés prévient l'exposition à tous les agents pathogènes qui pourraient être présents dans un échantillon, ainsi que le rejet d'agents pathogènes hors du laboratoireNote de bas de page 8.
Des exemples d'activités d'identification sans mise en culture d'échantillons primaires comprennent la formule sanguine complète, les analyses biochimiques du sang, l'essai immuno-enzymatique (ELISA), la centrifugation d'échantillons primaires (p. ex. pour séparer le plasma, et non pour concentrer un agent pathogène dans un culot) et l'extraction ou l'amplification des acides nucléiques.
2.4.1.3 Activités de mise en culture in vitro
Lorsqu'un agent pathogène humain est mis en culture (p. ex. cultivé) ou concentré à partir d'un échantillon primaire, il ne se trouve plus dans son milieu naturel et est donc visé par la LAPHT. Les activités comportant ces agents pathogènes exigent un permis délivré par l'ASPC, sauf si elles sont expressément exemptées de l'exigence relative à la délivrance de permis [c.-à-d. selon le RAPHT 27(1)(b)]. L'importation ou le transfert de cultures d'agents zoopathogènes est réglementé par l'ASPC ou l'ACIA en vertu de la LSA et du RSA. Si l'agent pathogène ou la toxine mis en culture, concentré ou isolé est un ABCSE, des exigences supplémentaires en matière de biosûreté s'appliquent, dont l'obtention d'une habilitation de sécurité en vertu de la LAPHT.
Les activités de mise en culture in vitro comprennent les activités qui impliquent :
- la mise en culture d'un agent pathogène en le cultivant, y compris les cultures mères d'isolats cliniques ou les cultures souches de référence de l'agent pathogène et les cultures utilisées à des fins diagnostiques à partir desquelles un agent pathogène a été cultivé, ou bien recueilli ou extrait intentionnellement (c.-à-d. l'agent pathogène de l'échantillon), ainsi que le traitement de telles cultures en vue de leur emballage et de leur distribution à d'autres laboratoires.
- la concentration d'un agent pathogène par le biais de diverses procédures, par exemple par centrifugation, filtration ou chromatographie.
La mise en culture des agents pathogènes augmente la concentration et la quantité d'organismes, ce qui augmente considérablement l'infectiosité de l'échantillon. Les activités de mise en culture in vitro avec des agents pathogènes du GR2, GR3 et GR4 et des toxines sont réglementées par l'ASPC. Lorsqu'un agent pathogène dans un échantillon est identifié (ou l'identité est confirmée) grâce à des activités de mise en culture, il est de bonne pratique d'atténuer les risques en menant toutes les activités au niveau de confinement requis pour l'agent pathogène soupçonné.
2.5 Considérations supplémentaires pour les évaluations locales des risques
Certaines activités menées dans les installations de diagnostic comportent intrinsèquement un risque plus élevé. Des mesures d'atténuation appropriées peuvent être mises en place en évaluant les risques associés à ces activités dans le cadre d'une ELR. Les exemples de dangers qui suivent peuvent survenir au cours des activités de diagnostic.
2.5.1 Manipuler des matières inactivées
De nombreuses méthodes de laboratoire couramment utilisées sont censées inactiver les agents pathogènes. Des exemples de telles méthodes comprennent les méthodes pour extraire les protéines ou les acides nucléiques, fixer les tissus (p. ex. au formol) et lyser les échantillons de sérum pour les analyses d'antigènes ou d'anticorps. Puisque toutes les méthodes ne pourront pas inactiver de manière efficace tous les agents pathogènes, il est important de valider et de vérifier régulièrement l'efficacité de la méthode d'inactivation contre l'agent pathogène manipulé. Autrement, les échantillons peuvent être manipulés comme s'ils demeurent infectieux; dans de telles situations, les activités sont menées au niveau de confinement approprié pour l'agent pathogène.
La capacité d'une méthode à inactiver un agent pathogène doit être validée et vérifiée régulièrement à l'interne (p. ex. en cultivant régulièrement un aliquot de la matière inactivée) ou déterminée en fonction des pratiques exemplaires publiées (p. ex. l'efficacité de l'eau de Javel ou d'une méthode de lyse contre des microorganismes particuliers). Cependant, ces pratiques publiées doivent être évaluées avec précaution. Les méthodes de laboratoire censées pouvoir inactiver une vaste gamme d'organismes peuvent avoir une efficacité limitée contre certains agents pathogènes particuliers. Par exemple, une matière fixée au formol ou enrobée de paraffine pourrait demeurer infectieuse après avoir été soumise à une méthode d'inactivation régulière. Cet échec de l'inactivation pourrait être attribuable à une perméation incomplète d'un tissu ou à la présence d'un agent pathogène qui est résistant aux effets d'un produit chimique (p. ex. des prions, des spores, Mycobacterium tuberculosis).
2.5.2 Renifler les plaques de culture
Bien que cette pratique soit de moins en moins répandue à l'ère de l'automatisation, certains microbiologistes expérimentés continuent de renifler les plaques de culture en raison des odeurs caractéristiques et identifiables produites par certains microorganismesNote de bas de page 33 Note de bas de page 34. Cette méthode d'identification est fortement déconseillée, car elle a été associée à de nombreuses ICL, notamment des infections à Brucella spp.Note de bas de page 17 Note de bas de page 35 Note de bas de page 36 Note de bas de page 37.
2.5.3 Manipuler des cultures liquides
Les cultures liquides contiennent généralement de plus fortes concentrations d'agents pathogènes que les échantillons primaires. Étant liquides, elles présentent également un risque plus important de déversement et de production d'aérosols. Les mesures à considérer pour atténuer les risques associés aux cultures liquides comprennent l'utilisation de contenants en plastique ou recouverts de plastique, l'utilisation de bouchons filetés ventilés (filtrants), la fixation sécuritaire des flacons à l'intérieur des incubateurs-agitateurs, l'ouverture des contenants seulement à l'intérieur d'une ESB et l'utilisation d'incubateurs avec des caractéristiques en matière de confinement (p. ex. des joints d'étanchéité, un filtre HEPA).
2.5.4 Entreposer des échantillons dans l'azote liquide
En plus des dangers associés à l'utilisation de l'azote liquide dans un cadre professionnel, les risques de biosécurité comprennent l'éclatement de fioles cryogéniques contenant un agent pathogène et la contamination de l'azote liquide par des fioles brisées, qui fuient ou qui sont mal décontaminées. Si de l'azote liquide s'infiltre dans une fiole, ou si celle-ci demeure scellée, la pression à l'intérieur de la fiole peut être suffisante pour la faire éclater pendant le processus de décongélation. Les fioles peuvent être congelées et conservées en phase gazeuse pour éviter que cela ne se produise. Lors de la décongélation, les fioles peuvent être enveloppées de gaze ou de papier et placées dans des contenants scellés à paroi épaisse afin de contenir les matières et les aérosols qui pourraient se disperser si la fiole éclate.
Si l'azote liquide d'un réservoir cryogénique devient contaminé par des agents pathogènes, ces derniers peuvent survivre et contaminer la surface des autres fioles entreposées dans le réservoir. Ils peuvent également entraîner la formation d'aérosols infectieux lorsque l'azote liquide est en ébullitionNote de bas de page 38. Les risques associés à l'utilisation de l'azote liquide sont atténués lorsque les cryotubes qui sont certifiés pour être utilisés dans l'azote liquide sont scellés adéquatement, la surface de ces tubes est décontaminée avant l'entreposage et les tubes sont entreposés dans la phase gazeuseNote de bas de page 37.
2.5.5 Manipuler des objets pointus ou tranchants et des aiguilles
Bien que les données concernant les ICL soient incomplètes, les incidents percutanés représentent la voie d'exposition aux agents pathogènes dans un cadre professionnel la plus fréquente chez les travailleurs de la santé. Les objets pointus ou tranchants et les aiguilles peuvent causer des blessures, des coupures ou des perforations qui peuvent entraîner une exposition à des agents pathogènes.
Dans la mesure du possible, il est préférable d'éviter d'utiliser des objets pointus ou tranchants et des aiguilles dans le laboratoire. Si aucune substitution appropriée n'est possible, il est possible de prendre certaines précautions, comme ne jamais plier, couper, ou briser les aiguilles, ne jamais remettre le capuchon sur celles-ci, ou porter des gants résistants aux coupures ou aux perforations. Le fait de ranger les objets pointus ou tranchants et les aiguilles dans des contenants résistants aux perforations qui sont conçus pour les objets pointus ou tranchants et qui sont situés près de l'endroit où ils sont utilisés peut réduire le risque d'incidents pendant leur élimination. De plus amples renseignements sur les contenants pour objets pointus ou tranchants sont disponibles dans la Norme nationale du Canada publiée par l'Association canadienne de normalisation (CSA) CSA Z316.6, Protection contre les blessures par perforants – Exigences et méthodes d'essai- Conteneurs pour objets tranchantsNote de bas de page 39.
2.5.6 Manipuler des prions soupçonnés
Les prions sont des protéines infectieuses qui causent un groupe de maladies neurodégénératives progressives chez les humains et les animaux appelées encéphalopathies spongiformes transmissibles (EST). Il existe très peu de cas documentés d'ICL avec des prions; cependant, cette observation peut être biaisée par la longue période d'incubation entre le moment de l'infection et la présentation des symptômes, qui peut prendre jusqu'à 30 ansNote de bas de page 40 Note de bas de page 41. La voie de transmission des prions infectieux la plus probable pour les membres du personnel est l'inoculation accidentelle avec des instruments contaminés, mais la transmission par une exposition des muqueuses à des aérosols (p. ex. par inhalation) ou à des éclaboussures demeure possibleNote de bas de page 42.
Bien que la plupart des prions infectieux soient classés comme des agents pathogènes humains du GR3, ils peuvent être manipulés de manière sécuritaire dans une installation de NC2 avec des caractéristiques physiques en matière de confinement et des pratiques opérationnelles supplémentaires. Les analyses de laboratoire (p. ex. la formule sanguine complète, l'analyse biochimique du sang, les niveaux de protéines) avec des échantillons primaires pouvant contenir des prions sont exclues de la LAPHT, sauf si un agent pathogène humain ou une toxine est cultivé ou intentionnellement recueilli ou extrait de ces échantillons. Néanmoins, le risque d'exposition et d'infection demeure, tout comme la difficulté de décontaminer les espaces où ces échantillons sont manipulés. Le Guide de prévention des infections - La maladie de Creutzfeldt-Jakob classique au Canada - Guide de consultation rapide 2007 développé par l'ASPC peut être consulté pour connaître les pratiques visant à prévenir l'exposition et à réduire le risque de contaminationNote de bas de page 43.
Les prions sont très stables dans l'environnement et sont résistants aux procédures et procédés de décontamination de routine. Une décontamination efficace nécessite des températures élevées (p. ex. 132 °C), un milieu très alcalin ou une combinaison de chaleur et de produits chimiques. Ainsi, il n'est pas recommandé d'utiliser de l'équipement automatisé pour mener des activités de diagnostic avec du liquide céphalorachidien soupçonné de contenir des prions en raison des procédures complexes nécessaires pour décontaminer les prionsNote de bas de page 44 Note de bas de page 45. Afin de réduire au minimum les surfaces et le matériel à décontaminer, un espace ou une salle de laboratoire, de même que de l'équipement et de l'EPI (préférablement jetable) peuvent être réservés à la manipulation d'échantillons pouvant contenir des prionsNote de bas de page 46.
À l'exception des échantillons de prions qui sont exclus de la LAPHT (c.-à-d. dans leur milieu naturel), la manipulation et l'entreposage des prions nécessitent un permis délivré par l'ASPC et doivent être menés conformément aux exigences applicables énoncées dans la NCBNote de bas de page 6.
2.5.7 Travailler avec de l'équipement de laboratoire particulier
Dans certains cas, l'équipement utilisé dans les laboratoires de diagnostic peut augmenter le risque d'exposition et devrait être documenté dans une ELR. La décontamination des déchets liquides produits par l'équipement de laboratoire préalablement à leur rejet dans les égouts sanitaires peut également être considérée. Les sections suivantes sont des exemples à considérer lors de l'évaluation de l'équipement utilisé dans une installation où des activités de diagnostic sont menées.
2.5.7.1 Spectromètre de masse à temps de vol couplé à une source de désorption-ionisation laser assistée par matrice
L'utilisation d'un spectromètre de masse à temps de vol couplé à une source de désorption-ionisation laser assistée par matrice (MALDI-TOF MS) a amélioré la vitesse, la précision et la rentabilité de l'identification bactérienne dans les laboratoires diagnostiques cliniquesNote de bas de page 47. Cependant, l'utilisation accrue du MALDI-TOF MS soulève également quelques préoccupations importantes en matière de biosécurité.
Une erreur d'identification d'un agent pathogène de risque plus élevé (c.-à-d. du GR3) comme étant un agent pathogène lié génétiquement de risque plus faible (c.-à-d. du GR2) a mené à des expositions possibles en laboratoire des membres du personnel effectuant les tests de confirmation au NC2Note de bas de page 48. Cette erreur d'identification peut se produire lorsque les bases de données de référence utilisées pour le MALDI-TOF MS ne contiennent pas le spectre de masse d'agents pathogènes de risque plus élevéNote de bas de page 49. Une erreur d'identification des agents pathogènes génétiquement liés peut être évitée en ajoutant le spectre de masse des organismes de risque plus élevé dans la base de données de spectres utilisée à titre de référenceNote de bas de page 50. Si une erreur d'identification des agents pathogènes du GR3 comme étant des agents pathogènes du GR2 demeure une possibilité, des PON peuvent être élaborées, en fonction des ELR, afin d'atténuer les risques de manipuler un agent pathogène du GR3 identifié incorrectement au NC2.
Il existe aussi la possibilité d'une inactivation incomplète des agents pathogènes sur les plaques cibles de MALDI-TOF MS. Il est possible que des cultures vivantes appliquées en couche mince directement sur des plaques cibles de MALDI-TOF MS ne soient pas complètement inactivées par la solution matrice superposée, comme dans le cas de certains agents pathogènes produisant des sporesNote de bas de page 51. Une inactivation incomplète peut être de faible conséquence lorsqu'un agent pathogène du GR2 est manipulé dans un laboratoire de diagnostic de NC2; cependant, cela devient un problème plus sérieux lorsqu'un agent pathogène du GR3 est manipulé involontairement au NC2.
2.5.7.2 Analyseurs automatiques
Les analyseurs automatiques (p. ex. pour la formule sanguine complète, l'analyse biochimique du sang, l'extraction des acides nucléiques) sont couramment utilisés dans les installations de diagnostic. Afin d'obtenir un rendement élevé, ils contiennent souvent des pièces qui se déplacent vite ou distribuent des fluides rapidement, ce qui peut mener à la production possible d'aérosols infectieux. Bien que certains analyseurs ont des caractéristiques qui leur permettent de contenir ou de réduire au minimum la propagation des aérosols infectieux produits (p. ex. des analyseurs fermés), il est possible qu'ils ne soient pas conçus pour être la seule barrière qui limite le risque d'exposition, donc des précautions supplémentaires sont nécessaires pour pouvoir les utiliser de manière sécuritaireNote de bas de page 25 Note de bas de page 37. La facilité de décontaminer les analyseurs et la méthode de décontamination sont des considérations importantes en matière de biosécurité lors du choix du matériel approprié pour une tâche donnée.
2.5.7.3 Dispositifs fonctionnant sous vide
Les dispositifs qui créent un vide ou fonctionnent sous vide (p. ex. les dispositifs automatisés pour la manipulation de liquides, les lave-plaques, les pompes à vide) peuvent produire des aérosols infectieux. Certains mécanismes, comme des petits filtres en ligne et des siphons désinfectants, aident à réduire le risque de rejet d’agents pathogènes et de contamination interne du dispositif. L’utilisation de flacons recouverts de plastique ou à paroi épaisse peut réduire le risque d’implosion, mais il faut tout de même prendre des précautions pour éviter des dommages physiques à l’équipement soumis à des différences de pression (p. ex. des flacons à vide, une cloche en verre). L’utilisation d’une ESB peut aider à contenir les aérosols produits durant des activités qui impliquent une aspiration créée sous vide (p. ex. l’aspiration des milieux de culture, l’utilisation d’un lave-plaques)Note de bas de page 37.
2.5.7.4 Incubateurs-agitateurs
Le mouvement d'un incubateur-agitateur peut mener à la production d'aérosols. De plus, les flacons de cultures liquides peuvent être échappés ou se renverser dans l'incubateur, menant à des déversements. Certains incubateurs ont des caractéristiques en matière de confinement, tels que des joints d'étanchéité et de la filtration HEPA, ce qui prévient la contamination du laboratoire et simplifie le nettoyage en cas de déversement ou de production d'aérosols.
Les incidents peuvent être évités en fixant de manière sécuritaire et appropriée les flacons avant de commencer le cycle d'agitation. Les flacons de plastique ou les flacons de verre recouverts de plastique préviennent les bris s'ils sont échappés, et l'utilisation de bouchons ventilés filtrants qui peuvent être vissés fermement est préférée aux bouchons de gaze ou de mousse qui peuvent être délogés plus facilement. Suite à l'incubation, la manipulation de la culture dans une ESB prévient le rejet des aérosols qui pourraient être présents dans le flacon.
Chapitre 3 - Considérations physiques en matière de confinement
Dans les installations où des tests diagnostiques ou des analyses de laboratoire sont effectués, la conception de l'installation (p. ex. l'emplacement du laboratoire, le revêtement des surfaces, le contrôle de l'accès) et la disposition de l'équipement de biosécurité (p. ex. les ESB) sont soigneusement étudiées et déterminées afin de prévenir l'exposition des membres du personnel aux matières possiblement infectieuses et de limiter la propagation des agents pathogènes à l'intérieur et à l'extérieur de l'installation. Des caractéristiques de base pour la sécurité, les urgences et la sûreté sont également intégrées afin de protéger les membres du personnel et la communauté.
Puisqu'il est recommandé de manipuler les échantillons primaires comme s'ils contiennent, à tout le moins, un agent pathogène du GR2, la bonne pratique dicterait que les installations où ces échantillons sont manipulés respectent les exigences physiques en matière de confinement minimales du NC2 précisées dans le chapitre 3 de la NCB.
3.1 Caractéristiques de conception physique générales
L'objectif premier de la conception physique est d'établir une barrière ou une séparation entre les espaces où les agents pathogènes et les toxines sont manipulés et entreposés et les espaces environnants. Vu la diversité des agents pathogènes, des types d'échantillons et des activités, il n'existe pas de modèle de conception unique qui soit idéal pour toutes les installations de diagnostic. Les caractéristiques de conception physique qui suivent sont à considérer pour les installations de diagnostic.
3.1.1 Séparation des espaces de travail en laboratoire
Le fait de séparer les espaces de travail en laboratoire des endroits publics (p. ex. la réception, les aires administratives, les bureaux) et des postes de travail réservés aux papiers et ordinateurs peut aider à prévenir la propagation de la contamination à l'intérieur et à l'extérieur de l'installation. Les mesures de séparation peuvent prendre la forme de cloisons physiques, comme des portes ou des fenêtres qui peuvent être fermées et verrouillées sur le périmètre du laboratoire. Dans certains cas, la séparation d'un espace de travail en laboratoire d'un poste de travail pour papier et ordinateur à l'intérieur d'une même pièce peut se faire en délimitant les espaces avec du ruban adhésif. Lorsqu'une ouverture présente dans un mur ne permet pas l'aménagement d'une porte (p. ex. pour un comptoir de réception d'échantillons), une porte-rideau qui peut être verrouillée, ou une autre alternative appropriée, peut être utilisée. La capacité de fermer le laboratoire procure un certain niveau de sûreté (p. ex. pour empêcher l'accès non autorisé) et constitue une barrière importante en cas de déversement de matières infectieuses pouvant produire des aérosols infectieux.
De plus, les activités de diagnostic avec certains agents pathogènes humains peuvent présenter un risque accru pour les membres du personnel de laboratoire ainsi que pour la santé publique. Par exemple, l'inhalation est la principale voie d'infection de certains agents pathogènes du GR2 (p. ex. certaines souches du virus de l'influenza A, le virus varicelle-zona), et certaines procédures de diagnostic sont très susceptibles de produire des aérosols infectieux. Le fait d'avoir un espace désigné pour les procédures ou pour les agents pathogènes à risque plus élevé qui est séparé physiquement réduit le risque d'exposition pour les membres du personnel travaillant dans les espaces environnants et prévient la propagation de la contamination. Un tel aménagement peut également permettre de limiter le port obligatoire de l'EPI supplémentaire aux personnes travaillant dans l'espace séparé.
3.1.2 Matériaux et revêtements de surface
L'utilisation de matériaux résistants aux égratignures et non absorbants permettra un nettoyage et une décontamination faciles du mobilier et des surfaces de laboratoire, y compris les chaises, l'intérieur des tiroirs, les armoires et les étagères. Des exemples de matériaux appropriés comprennent l'acier inoxydable, la résine époxy ou les stratifiés de plastique résistants aux produits chimiques pour les paillasses, ainsi que l'uréthane ou le vinyle pour les tabourets et les chaises. Le bois non fini est poreux et peut absorber des matières possiblement infectieuses, ce qui rend la décontamination pratiquement impossible. Dans une installation de diagnostic, l'utilisation de matériaux comme le bois non fini (p. ex. les tiroirs, les étagères, les supports coulissants) devrait être limitée aux espaces où le risque de contamination est faible, selon une ELR. Sinon, les matériaux poreux peuvent être scellés pour empêcher l'absorption de liquides contaminés.
3.1.3 Lavabos destinés au lavage des mains
Le fait d'avoir des lavabos près des sorties de l'espace de travail facilite le lavage des mains par les membres du personnel lorsqu'ils quittent cet espace. De plus, lorsque les lavabos sont situés à l'extérieur de l'espace, des mesures automatisées (p. ex. des portes automatiques) et des PON réduiront le risque que les membres du personnel contaminent involontairement d'autres surfaces (p. ex. des poignées de porte).
Les lavabos destinés au lavage des mains munis d'un dispositif mains libres, comme les robinets électroniques sans contact, des pédales à actionner avec le pied ou un robinet que l'on ouvre à l'aide du coude, empêchent la contamination des robinets et du lavabo qui pourrait mener à la recontamination des mains lavées.
3.1.4 Confinement primaire
Les ESB sont les dispositifs de confinement primaire les plus souvent utilisés pour empêcher le rejet d'aérosols infectieux produits pendant les procédures de laboratoire. Lorsqu'elles sont utilisées correctement, les ESB protègent les membres du personnel et l'environnement contre les aérosols infectieux et les toxines aérosolisées. Les ESB peuvent également protéger les matières manipulées de la contamination. Les dispositifs de confinement primaire comprennent également les enceintes faites sur mesure pour l'équipement automatisé (p. ex. les lave-plaques, les lecteurs de microplaques, les analyseurs de cellules, les robots manipulant des liquides) qui peut produire des aérosols infectieux.
Compte tenu des risques d'exposition et d'infection, y compris par des agents pathogènes qui ne sont pas transmis par l'air normalement, il est de bonne pratique d'effectuer toute procédure susceptible de créer des aérosols infectieux dans une ESB. Le type et la catégorie de l'ESB choisie dépendront de l'utilisation prévue (p. ex. si des produits chimiques volatils ou des radionucléides seront manipulés), en fonction d'une ELR.
L'utilisation d'une ESB à elle seule ne suffit pas pour éliminer le risque d'exposition à des agents pathogènes et des toxines, ni leur rejet. Le respect des bonnes pratiques et procédures microbiologiques, le port d'un EPI approprié et l'utilisation adéquate de l'ESB, selon les PON, sont essentielsNote de bas de page 52. Dans les situations où une ESB conventionnelle ne convient pas (p. ex. pour un microscope ou une pièce d'équipement particulière), un dispositif de confinement primaire spécialisé peut être utiliséNote de bas de page 53. Des exemples de dispositifs de confinement primaire autres que les ESB comprennent les isolateurs, les centrifugeuses avec des godets de sécurité scellés ou des rotors scellés, les fermenteurs et les boîtes à gants. Les évaluations des risques guideront le choix et l'utilisation d'un dispositif de confinement primaire approprié pour une activité de diagnostic particulière.
3.1.5 Centrifugeuses
Communément utilisées dans les laboratoires de diagnostic, les centrifugeuses comportent le risque de produire des aérosols infectieux, soit à cause de l'éclatement des fioles, des bouteilles ou des tubes pendant le processus, ou d'une contamination possible de l'extérieur des fioles, des bouteilles et des tubes. Les godets et les rotors de centrifugation qui sont scellés offrent un confinement efficace lorsqu'ils sont entretenus. L'entretien adéquat et régulier des centrifugeuses (p. ex. l'entretien ou le remplacement des joints toriques et autres joints d'étanchéité) et l'utilisation de tubes à centrifugation de qualité appropriée aideront à empêcher qu'une exposition ou un rejet causé par un incident survienne. Le risque de rejeter des agents pathogènes peut également être réduit en déchargeant les godets de sécurité ou les rotors scellés dans une ESB.
Chapitre 4 - Pratiques opérationnelles
Les pratiques opérationnelles font référence aux mesures de contrôle administratif (p. ex. la gestion du programme de biosécurité, la formation) et procédural (p. ex. les pratiques de travail, l'EPI, la décontamination) mises en place pour prévenir l'exposition involontaire des membres du personnel à des agents pathogènes et à des matières possiblement infectieuses, ainsi que le rejet d'agents pathogènes hors de l'installation de diagnostic.
Puisqu'il est recommandé de manipuler les échantillons primaires comme s'ils contiennent, à tout le moins, un agent pathogène du GR2, la bonne pratique dicterait que les installations où ces échantillons sont manipulés respectent les exigences opérationnelles minimales du NC2 précisées au chapitre 4 de la NCB. Les sections suivantes décrivent brièvement les considérations relatives aux pratiques opérationnelles visant à réduire les risques associés aux activités de diagnostic.
4.1 Pratiques de travail sécuritaires
Le respect des PON pour les pratiques de travail sécuritaires lors de la manipulation de matières infectieuses dans le cadre des activités de diagnostic aide à protéger les membres du personnel et la communauté contre une exposition à des agents pathogènes. Les pratiques de travail sécuritaires comprennent l'utilisation et l'entretien adéquats de l'équipement de laboratoire et de biosécurité (p. ex. les centrifugeuses, les ESB), ainsi que certains aspects d'entretien général (p. ex. garder tout en ordre, éviter l'encombrement) de l'espace où les activités de diagnostic sont menées.
En mettant à la disposition de tous les membres du personnel des techniques et des pratiques de travail sécuritaires bien documentées qui font partie des programmes de formation et qui sont comprises dans les PON, la direction démontre qu'elle prend la sécurité au sérieux et fait la promotion d'une culture de la sécurité chez les membres du personnel.
4.1.1 Bonnes pratiques et procédures microbiologiques
Le terme « bonnes pratiques et procédures microbiologiques » décrit un ensemble de pratiques et de procédures sécuritaires de base établies dans les laboratoires de microbiologie, qui représentent la base de la biosécurité aux niveaux de confinement supérieursNote de bas de page 12 Note de bas de page 13. Les membres du personnel peuvent les adopter pour prévenir une exposition et la contamination des échantillons et de l'environnement dans tout espace de travail où sont menées des activités de laboratoire comportant des matières possiblement infectieuses. Elles comprennent les techniques aseptiques, l'utilisation adéquate de l'EPI (p. ex. les gants, les tabliers, les lunettes de sécurité), le lavage des mains et le nettoyage et la décontamination en général pour protéger les travailleurs des matières infectieuses.
4.1.2 Pratiques de base, précautions universelles et précautions standard
Les pratiques de base, les précautions universelles et les précautions standard sont des pratiques de prévention des infections qui ont été élaborées pour les milieux de soins de santé afin de protéger les personnes contre une exposition à des sources possibles d'agents pathogènesNote de bas de page 8 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16. Elles visent à prévenir la transmission d'agents pathogènes causée par un contact avec des sujets primaires (p. ex. des patients, des animaux), des échantillons sanguins (p. ex. du sang total, du sérum, du plasma) ou d'autres échantillons biologiques (p. ex. de l'urine, des fèces, de la salive, du lait, des échantillons de tissus) dans un cadre professionnelNote de bas de page 54.
Les pratiques de base reposent sur cinq éléments principaux : les évaluations des risques, l'hygiène des mains, l'EPI, les mesures de contrôle environnemental (p. ex. des installations adéquates pour l'élimination des déchets, du linge sale et des objets pointus ou tranchants) et les mesures de contrôle administratif (p. ex. la formation, le programme de sécurité pour les objets pointus ou tranchants, les techniques aseptiques)Note de bas de page 8. Bon nombre des éléments des bonnes pratiques et procédures microbiologiques sont communs aux précautions universelles et aux pratiques de base.
Les pratiques de base, les précautions universelles et les précautions standard consistent à traiter tous les patients comme s'ils étaient infectés par un agent pathogène et tous les échantillons prélevés chez ces patients, tels que le sang, les liquides organiques ou les tissus, comme s'ils contenaient un agent pathogène humain. Le respect de ces pratiques et de ces précautions protégera les membres du personnel et les autres personnes contre une exposition et préviendra toute propagation ou rejet possible d'agents pathogènes qui peuvent être transmis par des humains ou des animaux symptomatiques ou asymptomatiquesNote de bas de page 8.
4.1.3 Réception des échantillons
Les échantillons primaires reçus par les laboratoires de diagnostic sont généralement accompagnés de renseignements du clinicien demandeur. Ces renseignements (p. ex. les analyses demandées, l'historique de voyage, l'exposition) peuvent permettre d'évaluer le risque associé à un échantillon puisqu'ils devraient toujours indiquer le type de matière (p. ex. de l'urine, un écouvillon, du sang, des fèces, du liquide céphalorachidien, des expectorations) et peuvent fournir un indice sur les agents pathogènes humains ou les toxines soupçonnés d'être présents dans l'échantillon. Dans certains cas, les renseignements peuvent être incomplets et ne pas fournir de bons indices sur les agents pathogènes qui sont possiblement présents.
Vu les conditions incertaines entourant le prélèvement d'un échantillon et son transport ou son déplacement vers l'installation de diagnostic, et la possibilité que des renseignements soient manquants, le fait de manipuler les contenants primaires comme s'ils sont possiblement contaminés réduira le risque d'exposition des membres du personnel et préviendra la contamination du laboratoire. Le fait d'examiner tous les contenants reçus pour déceler des fuites, des bouchons desserrés, des fissures et une contamination visible de la surface externe à l'arrivée et avant toute activité permettra de confirmer l'intégrité du contenant et de l'échantillon. Un seul contenant endommagé ou qui fuit à l'intérieur d'un colis peut contaminer tout l'envoi et possiblement entraîner une exposition ou une contamination du laboratoire. Si un contenant qui fuit ou qui est endommagé est reçu, la décontamination de tous les contenants et du matériel possiblement contaminés (p. ex. le formulaire de demande d'analyse, le manifeste d'expédition, le matériel d'emballage) réduira la possibilité d'exposition et de contamination du laboratoire. Les documents et la notification de l'incident à l'autorité interne ou externe appropriée (p. ex. le superviseur, le gestionnaire, l'ASPC, l'ACIA) aideront à apporter des améliorations aux PON (p. ex. pour le prélèvement, le transport et le déplacement des échantillons) et aideront à prévenir d'autres incidents semblablesNote de bas de page 37. Au Canada, le transport des marchandises dangereuses, y compris les substances infectieuses, est réglementé par Transports Canada en vertu du Règlement sur le transport des marchandises dangereuses (RTMD)Note de bas de page 55.
Le déplacement d'échantillons contenant un agent pathogène ou une toxine à l'intérieur d'une installation ou d'un bâtiment (p. ex. de l'espace de prélèvement d'échantillons ou de phlébotomie au laboratoire, d'un laboratoire à un autre situé dans une zone de confinement ou un bâtiment différent) en utilisant des sacs ou contenants étanches et un chariot empêche le rejet (p. ex. par une fuite, une chute ou un déversement) d'agents pathogènes ou de toxines.
4.1.4 Flux de travail unidirectionnel
La mise en place d'itinéraires pour circuler et travailler à l'intérieur de l'installation facilitera le déplacement des membres du personnel et des matières entre les espaces « propres » (c.-à-d. les espaces à faible risque de contamination) et les espaces « sales » (c.-à-d. les espaces à risque élevé de contamination) de manière à réduire au minimum la propagation de la contamination. Ceci peut être mis en place à tous les niveaux, qu'il s'agisse du travail à l'intérieur d'une ESB (p. ex. les pipettes et milieux propres d'un côté, les déchets de l'autre) ou la désignation de salles ou d'espaces de laboratoire réservés. Par exemple, la réception des échantillons peut être effectuée dans un espace (ou une salle), le traitement initial dans un autre, et la mise en culture et les manipulations après la mise en culture dans un troisième.
4.1.5 Hygiène des mains
Le lavage des mains est le moyen le plus efficace de prévenir la transmission de l'infection et la propagation de la contamination à l'intérieur et à l'extérieur de l'installation, car ceci peut éliminer tous les types d'agents pathogènes de la surface des mains. En règle générale, le lavage des mains est effectué conformément aux PON :
- après avoir effectué une tâche comportant des échantillons primaires ou des matières infectieuses;
- lorsque les mains ont été contaminées;
- après le retrait des gants;
- avant de quitter l'installation de diagnostic.
Bien que les gants offrent une protection, ils peuvent être poreux et s'user pendant l'utilisation. Le lavage des mains après le retrait des gants ajoute une protection supplémentaire contre la contamination qui peut avoir franchi la barrière des gants ou être survenue lors du retrait des gants. Des instructions détaillées sur le lavage des mains se trouvent à l'annexe A.
Les désinfectants pour les mains à base d'alcool ne sont pas aussi efficaces que le lavage des mains avec du savon et de l'eau et ne peuvent pas éliminer tous les types d'agents pathogènesNote de bas de page 56. Cependant, un désinfectant pour les mains peut s'avérer une solution de rechange adéquate lorsque des lavabos pour le lavage des mains ne sont pas accessibles facilement pour réduire la propagation de la contamination jusqu'à ce que les mains puissent être lavées.
4.2 Gestion du programme de biosécurité
L'élaboration de politiques de biosécurité et d'un programme de biosécurité est fondamentale pour mettre en œuvre des pratiques de travail sécuritaires et améliorer la performance en matière de sécurité afin de prévenir une exposition aux agents pathogènes et leur rejet accidentel. Le programme de biosécurité est créé pour atténuer les risques identifiés dans le cadre d'une évaluation globale des risques de l'installation et de ses activités générales. Un programme de biosécurité complet comprend des PON, un plan de biosûreté, un programme de surveillance médicale, un programme de formation, un plan d'intervention d'urgence et un programme de nettoyage et d'entretien de l'installation et de l'équipement.
4.2.1 Procédures opératoires normalisées
Les PON sont des documents qui fournissent des instructions détaillées, étape par étape, pour effectuer une tâche et traitent de questions de biosécurité propres à une installation ou à une activité. Elles sont présentées au cours de la formation et révisées par les membres du personnel avant d'effectuer une procédure pour la toute première fois, pour se familiariser avec des procédures peu fréquentes, et chaque fois qu'une PON est modifiée. Les PON peuvent être révisées par des vérificateurs internes ou externes et permet de plus facilement évaluer le respect des exigences du programme par les membres du personnel. Le fait de garder les PON dans un endroit facilement accessible à tous les membres du personnel de l'installation, que ce soit en format papier ou électronique, facilitera la sensibilisation des membres du personnel aux pratiques de travail sécuritaires qui sont mises en œuvre dans l'installation (p. ex. l'utilisation de l'EPI, l'entrée et la sortie, la gestion des déchets) et le respect de celles-ci.
4.2.2 Programme de surveillance médicale
Le programme de surveillance médicale vise à prévenir ou à remarquer toute maladie chez les employés résultant d'une exposition à un agent pathogène humain ou à une toxine. Le programme de surveillance médicale tient compte des agents pathogènes susceptibles d'être présents lors des activités de diagnostic et détermine les mesures d'atténuation appropriées. Les programmes varient en fonction de la taille, de la structure et de la complexité de l'installation; ainsi, ils peuvent traiter de sujets comme les examens médicaux préalables au placement, le dépistage ou la conservation de sérum, les PON pour le traitement post-exposition (p. ex. la prophylaxie) et l'immunisation.
Une évaluation médicale préalable au placement permet de cerner toute condition médicale sous-jacente (p. ex. une immunosuppression, une grossesse, le diabète, une maladie du foie ou des reins) susceptible d'augmenter le risque d'infection et de préjudice associé aux activités prévues. L'évaluation peut prendre la forme d'une entrevue avec le professionnel de la santé au travail de l'installation ou d'une analyse des antécédents médicaux de la personne à l'aide d'un questionnaire. Un échantillon de sérum peut être prélevé avant qu'un membre du personnel ne commence à travailler en laboratoire (et possiblement selon un horaire préétabli par la suite) pour déterminer s'il a une immunité ou une infection préexistante et, dans certains cas, établir la séroréactivité de référence qui permettra les comparaisons après toute exposition possible (p. ex. pour détecter une augmentation du taux d'anticorps suite à une exposition en laboratoire au virus varicelle-zona). L'évaluation médicale offre l'opportunité d'informer les membres du personnel de tous les risques associés aux agents pathogènes humains qui peuvent être manipulés dans le cadre des activités de diagnostic, ainsi que les symptômes liés aux maladies causées par ces agents pathogènes. Vu la vaste gamme d'agents pathogènes pouvant être présents dans le milieu de diagnostic clinique, il se peut qu'il ne soit ni possible ni pratique d'informer les membres du personnel de tous les agents pathogènes qu'ils peuvent rencontrer. Il est parfois plus raisonnable de renseigner les membres du personnel sur les symptômes dont il faut le plus s'inquiéter, par exemple lorsque des agents pathogènes inhabituels ont été identifiés dans le laboratoire (p. ex. des champignons causant des symptômes de pneumonie).
Le programme de surveillance médicale sert également à informer les membres du personnel sur les mesures préventives (p. ex. les vaccins) ou les traitements (p. ex. les antibiotiques) disponibles contre les agents pathogènes manipulés et entreposés dans l'installation, ainsi que les risques et les avantages de ces mesures. Les étapes à suivre en cas d'une exposition possible, notamment les mesures de premiers soins appropriées, la déclaration de l'incident, l'administration rapide de prophylaxie post-exposition et les traitements médicaux, sont abordées dans le plan d'intervention d'urgence et communiquées aux membres du personnel dans les PON et la formation.
4.2.2.1 Vaccination
Les vaccins sont des produits biologiques complexes fortement réglementés qui sont conçus pour provoquer une réponse immunitaire efficace et protectrice. Les vaccins disponibles sur le marché protègent contre des agents pathogènes viraux et bactériens et peuvent servir de méthode prophylactique pour accompagner les mesures de contrôle physique et opérationnel mises en place lorsque la vaccination peut atténuer les conséquences d'une exposition à un agent pathogène (p. ex. l'influenza, la rage, l'hépatite B). Le fait d'informer les membres du personnel des vaccins à leur disposition leur permet de discuter des risques et des avantages avec un professionnel de la santé et de prendre une décision éclairée sur s'ils se font vacciner ou non avant de commencer à travailler avec l'agent pathogène. Dans certaines situations, les installations peuvent décider de rendre la vaccination obligatoire avant la manipulation de certains agents pathogènes.
4.2.3 Programme de formation
Le programme de formation repose sur une évaluation des besoins en matière de formation et comprend des approches théoriques et pratiques, de même qu'une évaluation des connaissances et des compétences (p. ex. la supervision). Il constitue un élément essentiel au succès du programme de biosécurité. La fréquence des incidents est réduite au minimum lorsque les membres du personnel sont conscients des risques associés aux échantillons et aux agents pathogènes qu'ils manipulent, et qu'ils connaissent les pratiques et les outils disponibles pour se protéger.
L'examen des connaissances des membres du personnel et de leur progression dans la formation est une occasion d'évaluer continuellement la compréhension des procédures de biosécurité et le respect des procédures apprises en formation. La tenue d'un registre sur la formation (p. ex. terminée, prévue, exigée) pour tous les membres du personnel est essentielle pour déterminer les besoins futurs en matière de formation, y compris la formation d'appoint.
4.2.4 Plan d'intervention d'urgence
Le plan d'intervention d'urgence décrit les procédures à suivre en cas d'urgence et est essentiel pour protéger la santé des membres du personnel et de la communauté, les biens, l'environnement, et prévenir le rejet d'agents pathogènes et de toxines. Le plan d'intervention d'urgence repose sur l'évaluation globale des risques et il décrit les scénarios d'urgence prévisibles et les mesures à prendre pour intervenir de façon proportionnelle à l'ampleur et à la nature de l'urgence. Les situations d'urgence sont notamment les incidents ou accidents, les urgences médicales, les déversements biologiques, les pannes de courant, la défaillance des dispositifs de confinement primaire (p. ex. une ESB) ou les catastrophes naturelles. Le plan d'intervention d'urgence peut également comprendre des plans d'urgence pour poursuivre les activités de manière sécuritaire et en toute sûreté.
Les déversements sont le type d'incident de laboratoire le plus courant qui peut entraîner une exposition des membres du personnel à des agents pathogènes et à des toxines et le rejet de ceux‑ci hors du confinement. Les déversements peuvent contaminer les surfaces, l'équipement, les échantillons et les membres du personnel. À ce titre, le fait d'avoir des PON décrivant les procédures d'intervention en cas de déversement aidera les membres du personnel à réagir rapidement et de manière sécuritaire et appropriée.
4.2.5 Déclarations des incidents
L'enquête menée après tout incident impliquant un agent pathogène humain ou une toxine, y compris les accidents, les accidents évités de justesse, et d'autres événements dangereux tels que la production, la possession ou le rejet involontaire d'un agent pathogène ou d'une toxine, les ICL et les agents pathogènes ou les toxines disparus, permet de cerner la ou les causes fondamentales, ce qui mène à l'élaboration de mesures correctives pour empêcher que l'incident survienne à nouveau. Ce processus est facilité par l'élaboration et le maintien de procédures internes qui décrivent la marche à suivre pour définir, consigner, déclarer et enquêter sur les incidents impliquant des matières infectieuses ou des toxines.
Dans une installation visée par un permis, l'ASB est la personne-ressource pour l'ASPC et l'ACIA, et est aussi responsable de participer aux enquêtes sur les incidents. Le fait de déclarer immédiatement tous les incidents impliquant des agents pathogènes ou des toxines à l'autorité interne appropriée (p. ex. le superviseur, l'ASB) permettra d'établir une intervention appropriée et d'enclencher l'enquête plus rapidement. Le fait de mettre en œuvre une approche non punitive en ce qui a trait à la déclaration des incidents encouragera les membres du personnel à les déclarer.
Dans les installations assujetties à la LAPHT (c.-à-d. les installations visées par un permis de même que celles exemptées de l'exigence relative à la délivrance de permis), la déclaration des incidents (à l'interne et à l'ASPC) est une exigence, tout comme la notification à l'ASPC en temps opportun puisqu'il existe une obligation d'informer la Ministre [LAPHT 12, 13, 14 et 15]. Cette mesure vise à accélérer l'intervention en santé publique en cas de besoin et à assurer l'exactitude des renseignements sur les cas d'exposition en laboratoire et les ICL. Malgré le fait que les agents pathogènes dans leur milieu naturel (p. ex. les échantillons de diagnostic) soient exclus de la LAPHT, il est recommandé que les incidents impliquant de tels échantillons dans une installation visée ou non par un permis soient déclarés à l'ASPC sur une base volontaire si l'identité de l'agent pathogène est connue. Même en l'absence d'infection, d'exposition ou de rejet, le fait de documenter tous les incidents (y compris ceux évités de justesse) permet l'utilisation de ces renseignements pour améliorer les procédures et mesurer l'efficacité du programme de biosécurité.
4.2.6 Mesure de l'efficacité du programme
L'examen et l'amélioration continus du programme de biosécurité par la haute direction permettent d'en assurer la pertinence et l'efficacité. Pour ce faire, les rapports du programme peuvent être examinés régulièrement ou les réalisations (p. ex. la réduction du nombre d'incidents) peuvent être comparées aux objectifs du programme afin de déceler les lacunes du programme. Tout problème soulevé permettra d'apporter des améliorations au programme. Ce système est communément connu sous le nom de « cycle de gestion PFVA » pour planifier, faire, vérifier, agirNote de bas de page 57.
Chapitre 5 - Décontamination et gestion des déchets
La décontamination efficace des déchets, du matériel, de l'équipement et des surfaces qui sont entrés en contact avec des matières possiblement infectieuses ou des toxines est fondamentale pour limiter la propagation de la contamination à l'extérieur de l'espace de travail et de l'installation. Les déchets contaminés peuvent être décontaminés sur place au moyen de systèmes de décontamination ou transportés à une installation désignée pour ce faire.
5.1 Décontamination
La décontamination est un élément clé du confinement, car elle rend le matériel et les surfaces raisonnablement exempts d'agents pathogènes et de toxines et donc sécuritaires à manipuler. Le fait de ne pas décontaminer un équipement ou de ne pas mettre en place des procédés de décontamination appropriés peut entraîner un rejet d'agents pathogènes et de toxines hors de l'installation ou une exposition des membres du personnel. Une décontamination efficace peut nécessiter une désinfection, une inactivation ou une stérilisation, selon les circonstances. Les systèmes de décontamination peuvent fonctionner par des moyens chimiques, thermiques ou physiques (p. ex. un lavage), ou une combinaison de ces moyens. Les méthodes de décontamination les plus courantes sont décrites ci-dessous.
Les désinfectants chimiques servent couramment à décontaminer les échantillons et les contenants d'échantillons, les liquides, les surfaces de la pièce, l'équipement qui ne peut pas être autoclavé et les déversements de matières infectieuses. Les désinfectants sont moins efficaces à décontaminer les matières infectieuses que la stérilisation, qui élimine complètement tous les microorganismes vivants, y compris les spores bactériennes. Les désinfectants chimiques les plus couramment utilisés sont le chlore (p. ex. l'eau de Javel [NaOCl; hypochlorite de sodium], le dioxyde de chlore [ClO2]), l'alcool (p. ex. l'alcool éthylique ou isopropylique à 70 % dans l'eau), l'iode (p. ex. les solutions aqueuses, les teintures, les iodophores), les composés phénoliques et ammoniques quaternaires, ainsi que le peroxyde d'hydrogène. Bon nombre de ces désinfectants chimiques sont utilisés seuls ou avec des désinfectants disponibles sur le marché. Le désinfectant est sélectionné en fonction de sa capacité à décontaminer de manière efficace les agents pathogènes manipulés. La charge organique, la concentration chimique, la durée de contact, la température, l'humidité relative, le pH et la stabilité peuvent tous avoir une incidence significative sur l'efficacité d'un désinfectant chimique.
L'inactivation consiste en la destruction de l'activité biologique d'un agent pathogène (p. ex. un virus, un prion) ou d'une toxine par la chaleur, ou bien par des moyens chimiques ou physiques, et est souvent utilisée avant les activités de traitement qui ont lieu à l'extérieur de la zone de confinement (p. ex. l'extraction ou l'analyse des acides nucléiques, les analyses d'antigènes)Note de bas de page 58.
La décontamination thermique comprend la stérilisation à la chaleur sèche, le compostage, la décontamination des effluents liquides, l'incinération et la stérilisation à la vapeur (p. ex. en utilisant un autoclave). La méthode la plus couramment utilisée pour la décontamination régulière des déchets de laboratoire est l'autoclavage. L'efficacité du procédé dépend du temps, de la température et du contact direct de la vapeur avec les agents infectieux. L'incinération nécessite une combustion à haute température et est la seule technologie capable de traiter à la fois les déchets biologiques non toxiques et toxiques (y compris les déchets cytotoxiques et composés volatiles).
5.1.1 Décontamination des prions
Les prions sont particulièrement résistants aux méthodes de décontamination thermiques et chimiques de routine, y compris l'ébullition et les traitements à la chaleur sèche, au formol et à l'alcoolNote de bas de page 59. Ces méthodes peuvent légèrement réduire l'infectiosité, mais peu d'entre elles sont suffisamment efficaces pour éliminer les prions infectieux. Une ELR peut permettre de déterminer les meilleures procédures de nettoyage et de décontamination lorsque des prions sont présents dans l'installation de diagnostic. La destruction par incinération est la méthode de décontamination la plus sécuritaire et sûre pour éliminer le risque d'infectiosité résiduelle sur les instruments et d'autres matériels contaminésNote de bas de page 37.
Les procédés de traitement thermique et chimique peuvent être combinés pour décontaminer l'équipement, le matériel réutilisable et les déchets qui ne peuvent pas être incinérés. La combinaison des deux types de procédés permet d'assurer une meilleure efficacité de l'inactivation des prions qu'un traitement par des agents chimiques seul. Les instruments jetables, l'EPI et le revêtement des surfaces de travail peuvent être incinérés pour éviter d'avoir recours à des procédures d'inactivation moins efficaces, ce qui est particulièrement important puisque l'inactivation complète des prions est difficile à accomplirNote de bas de page 37.
5.1.2 Validation et vérification de la décontamination
La validation démontre que l'équipement et les méthodes de décontamination peuvent décontaminer, inactiver ou éliminer de manière efficace un agent pathogène ou une toxine en particulier, et que le procédé de décontamination convient à l'utilisation prévue, ainsi qu'au type et à la quantité de matières. Par exemple, la validation d'un cycle d'autoclavage peut être effectuée en utilisant une charge représentative (c.-à-d. un volume et un contenu de déchets typiques prévus, mais composés de matières non contaminées ou inutilisées) et des indicateurs biologiques placés à l'intérieur de la charge. La validation de méthodes couramment acceptées (p. ex. l'efficacité de l'eau de Javel contre une espèce de bactérie) peut être fondée sur des pratiques exemplaires publiées.
La vérification est la surveillance régulière de l'équipement et des procédés pour confirmer qu'ils continuent de respecter les paramètres validés. Dans le cas d'un autoclave, des indicateurs biologiques ou des dispositifs de surveillance paramétriques peuvent être utilisés. Pour la décontamination de surface ou l'inactivation d'échantillons, le fait de mettre un aliquot en culture, selon les PON, peut confirmer l'absence de croissance.
Un indicateur biologique est une population standardisée de spores bactériennes qui est utilisée pour démontrer des conditions de stérilisation efficaces dans une charge de déchets. Le fait d'atteindre un niveau cible de réduction des spores viables indique que le procédé de décontamination a été efficace. Les dispositifs de surveillance paramétriques comprennent des thermocouples ou des jauges qui mesurent la durée du cycle, la température et la pression afin de surveiller avec précision le rendement de l'équipement de décontamination.
5.2 Gestion des déchets
Même après la décontamination efficace des déchets contaminés ou représentant un danger biologique, il n'est pas toujours approprié de les éliminer dans le flux normal des déchets. D'autres considérations ou exigences en matière de gestion des déchets précisées par les autorités provinciales, territoriales ou locales (c.-à-d. municipales) peuvent s'appliquer et doivent être prises en considération au moment d'établir et de mettre en œuvre un programme de gestion des déchets.
Les installations de diagnostic sont susceptibles de produire des déchets solides et liquides représentant un danger biologique ou non, ainsi que des déchets pointus ou tranchants, dans le cadre de leurs activités habituelles. La première étape d'un programme de gestion des déchets consiste à déterminer s'il est possible de réduire la quantité de déchets produits, en particulier les déchets contaminés. Cela peut être aussi simple que de réduire au minimum la quantité de matériel d'emballage (p. ex. les boîtes de carton, le matériel d'emballage) et excédentaire qui entre dans l'installation de diagnostic.
Le fait de placer rapidement tous les déchets infectieux et possiblement infectieux dans des contenants à déchets étanches et bien étiquetés permet de prévenir le rejet d'agents pathogènes à l'intérieur et à l'extérieur de l'installation. Ceci empêche également le rejet d'agents pathogènes pendant le transport ou le déplacement, ce qui protège les personnes qui manipulent, nettoient et éliminent les déchets.
Les Lignes directrices sur la gestion des déchets biomédicaux au Canada du Conseil canadien des ministres de l'environnement (CCME) décrivent les pratiques minimales recommandées à respecter pour la gestion des déchets biomédicaux, y compris les déchets animaux, les déchets de laboratoire et les déchets pointus ou tranchants; toutefois, les lignes directrices du CCME ne s'appliquent que lorsqu'elles sont adoptées par une loi provinciale ou un règlement municipalNote de bas de page 60. Les règlements municipaux peuvent être plus stricts que les lignes directrices recommandées par le CCME. Lors de l'élaboration et de la mise en œuvre d'un bon programme de gestion des déchets, d'autres considérations relatives à la manipulation des déchets biomédicaux se trouvent dans la norme CSA Z317.10, Manipulation des déchets de soins de santéNote de bas de page 11.
En cas de bris ou de fuite d'un contenant à déchets, les travailleurs qui manipulent et éliminent des déchets biologiques infectieux ou possiblement infectieux peuvent être à risque d'être exposés à des agents pathogènes et à des toxines. Les déchets pointus ou tranchants, en particulier, présentent un risque important lorsqu'ils sont mélangés avec d'autres types de déchets, ou lorsqu'ils ne sont pas bien séparés, car ils peuvent alors devenir un danger caché pouvant entraîner des incidents associés aux objets pointus ou tranchants (p. ex. des blessures par piqûres d'aiguilles, une inoculation). Après utilisation, les objets pointus ou tranchants doivent être éliminés de manière sécuritaire directement dans un contenant résistant aux perforations, conformément à la norme CSA Z316.6, Protection contre les blessures par perforants - Exigences et méthodes d'essai - Conteneurs pour objets tranchantsNote de bas de page 39. Le fait de suivre attentivement les consignes relatives aux contenants pour objets pointus ou tranchants, par exemple en les utilisant conformément aux instructions du manufacturier, en gardant le couvercle bien en place et en ne les remplissant jamais trop pour s'assurer que le couvercle reste fermé pendant le transport et l'élimination, aidera à prévenir les incidents impliquant des déchets pointus ou tranchants.
Le transport de déchets infectieux et biomédicaux pour leur élimination est réglementé au Canada en vertu du RTMDNote de bas de page 55. Conformément au RTMD, les contenants utilisés pour le transport des déchets infectieux et biomédicaux doivent satisfaire aux exigences de la Norme nationale du Canada (CAN) publiée par l'Office des normes générales du Canada (ONGC) CAN/CGSB-43.125, Emballages pour matières infectieuses de catégorie A et de catégorie B (classe 6.2) et déchet d'hôpital, (bio) médical ou médical réglementéNote de bas de page 61. Les déchets biologiques peuvent être entreposés temporairement avant d'être éliminés. La réfrigération ou la congélation aidera à réduire le taux de croissance microbienne, la putréfaction et l'odeur. Le fait de limiter l'accès aux lieux où sont entreposées les matières possiblement infectieuses, ou confirmées de l'être, aux membres du personnel autorisés permettra de réduire le risque d'incidents résultant d'un accès non autorisé.
En vertu des lois fédérales, provinciales et territoriales, y compris la Loi canadienne sur la protection de l'environnement (1999), la personne produisant des déchets dangereux demeure responsable de ses déchets « du berceau à la tombe » (c.-à-d. de leur production jusqu'à leur destination finale)Note de bas de page 62. S'il se produit un accident pendant le transport hors de l'installation, le producteur des déchets (p. ex. le laboratoire de diagnostic) en demeure le responsable, même si un contracteur de tierce partie est impliqué dans le transport ou l'élimination des déchets; par conséquent, la planification d'urgence en cas d'accident ou de déversement est un volet important à considérer dans le cadre du programme de gestion des déchets et du plan d'intervention d'urgence (p. ex. les PON pour les déversements à l'extérieur de l'installation fournissent au contracteur les coordonnées pour rejoindre les membres du personnel appropriés de l'installation). Tous les travailleurs partagent la responsabilité de faire preuve de diligence raisonnable en tout temps en ce qui a trait à la manipulation, au traitement et à l'élimination appropriés de tout déchet infectieux produit afin de prévenir tout rejet ou exposition.
Chapitre 6 - Glossaire
Il est important de souligner que, même si certaines des définitions fournies dans le glossaire sont universellement reconnues, beaucoup d'entre elles ont été établies expressément pour la NCB ou le Guide canadien sur la biosécurité (GCB). Certaines définitions ont été modifiées pour être applicables dans le contexte de la Ligne directrice canadienne sur la biosécurité - Activités de diagnostic humain.
- Activités de diagnostic
- Activités (p. ex. les analyses d’anticorps, l’analyse des acides nucléiques, la culture, l’examen histologique, la chimie clinique) avec des échantillons primaires dans le but d’identifier une infection, une intoxication ou une maladie. Ces activités sont régulièrement menées dans les hôpitaux et les laboratoires cliniques.
- Aérosol
- Fines particules solides ou gouttelettes en suspension dans un milieu gazeux (p. ex. l'air) qui peuvent être créées durant une activité qui provoque un transfert d'énergie dans une matière liquide ou semi-liquide.
- Agent pathogène
- Microorganisme, acide nucléique ou protéine ayant la capacité de causer une maladie ou une infection chez l'humain ou l'animal. Des exemples d'agents pathogènes humains figurent aux annexes 2, 3 et 4 et à la partie 2 de l'annexe 5 de la Loi sur les agents pathogènes humains et les toxines, mais ils ne constituent pas une liste exhaustive. Des exemples d'agents zoopathogènes peuvent être trouvés dans ePATHogène - la base de données sur les groupes de risque de l'Agence de la santé publique du Canada.
- Agent pathogène zoonotique
- Agent pathogène qui cause une maladie chez l'humain et l'animal et qui peut être transmis des animaux aux humains et vice versa (c.-à-d. une zoonose). Ces agents sont considérés à la fois comme des agents pathogènes humains et des agents zoopathogènes.
- Agents biologiques à cote de sécurité élevée (ABCSE)
- Sous-ensemble d'agents pathogènes humains et de toxines qui présentent un risque accru en matière de biosûreté en raison de la possibilité qu'on les utilise comme arme biologique. Les ABCSE sont identifiés comme des agents pathogènes et des toxines « précisés » dans le paragraphe 10 du Règlement sur les agents pathogènes humains et les toxines. Les ABCSE comprennent donc tous les agents pathogènes du GR3 et du GR4 qui se retrouvent sur la Liste des agents pathogènes humains et animaux et des toxines réglementés à l'exportation, publiée par le Groupe d'Australie et sujette à modifications, à l'exception du virus Duvenhage, du virus rabique et de tous les autres membres du genre Lyssavirus, du virus de la stomatite vésiculaire ainsi que du virus de la chorioméningite lymphocytaire. Les ABCSE comprennent aussi toutes les toxines qui se trouvent à la fois à l'annexe 1 de la Loi sur les agents pathogènes humains et les toxines et sur la Liste des agents pathogènes humains et animaux et des toxines réglementés à l'exportation et qui sont présentes en quantités supérieures aux quantités seuils énoncées au paragraphe 10(2) du Règlement sur les agents pathogènes humains et les toxines. Des exemples d'ABCSE qui sont plus probables d'être manipulés dans un laboratoire de diagnostic au Canada comprennent Brucella spp. et Francisella tularensis, mais des différences régionales sont possibles.
- Aire administrative
- Salle ou salles attenantes réservées à des activités qui ne comportent pas de matières biologiques, dont les matières infectieuses. Les bureaux, les aires de photocopie, les salles de réunion et les salles de conférence sont des exemples d'aires administratives.
- Biosécurité
- Ensemble des principes, des technologies et des pratiques liés au confinement mis en œuvre pour prévenir l'exposition involontaire à des matières infectieuses, ou leur rejet accidentel.
- Biosûreté
- Ensemble des mesures visant à prévenir la perte, le vol, le mésusage, le détournement ou le rejet intentionnel d'agents pathogènes ou d'autres ressources liées à l'installation (p. ex. les membres du personnel, l'équipement, les animaux).
- Bonnes pratiques et procédures microbiologiques
- Code de déontologie fondamental régissant toutes les activités de laboratoire comportant des matières biologiques. Ce code sert à protéger les membres du personnel de laboratoire et à prévenir la contamination de leur milieu de travail et des échantillons utilisés.
- Caractéristiques de conception physique
- Contrôles d'ingénierie et caractéristiques d'aménagement de l'installation qui protègent les membres du personnel, l'environnement et, ultimement, la communauté des matières biologiques.
- Contamination
- Présence non désirée de matières infectieuses sur une surface (p. ex. la paillasse, les mains, les gants), dans l'environnement ou dans d'autres matières (p. ex. les échantillons de laboratoire, les cultures cellulaires).
- Culture
- Multiplication in vitro de microorganismes, de cellules tissulaires ou d'autres matières vivantes dans des conditions contrôlées (p. ex. la température, l'humidité, les nutriments) afin d'accélérer l'augmentation du nombre ou de la concentration de ces organismes ou de ces cellules. Dans le contexte des Lignes directrices canadiennes sur la biosécurité, le terme « culture cellulaire » réfère à des cellules d'origine humaine ou animale.
- Déchet
- Matière solide ou liquide produite par une installation et destinée à être éliminée.
- Décontamination
- Procédé qui consiste à traiter des matières et des surfaces pour que leur manipulation soit sécuritaire et qu'elles soient relativement exemptes de microorganismes, de toxines ou de prions. La décontamination s'effectue par désinfection, inactivation ou stérilisation.
- Déplacement
- Fait de déplacer (p. ex. amener, apporter, conduire, relocaliser) des personnes, des matières ou des animaux d'un emplacement à un autre, dans un même édifice.
- Désinfection
- Procédé qui élimine la plupart des formes de microorganismes vivants; la désinfection est beaucoup moins efficace pour éliminer les matières infectieuses que peut l'être la stérilisation.
- Dispositif de confinement primaire
- Appareil ou équipement conçus pour empêcher le rejet d’agents pathogènes et de toxines et créer une barrière physique entre les matières biologiques et la personne et/ou le milieu de travail. Des exemples de dispositifs de confinement primaire comprennent les enceintes de sécurité biologique, les isolateurs, les centrifugeuses munies de godets ou de rotors étanches, l’équipement de procédé, les fermenteurs, les cages de micro-isolation et les étagères à cages ventilées.
- Échantillons primaires
- Échantillons provenant directement d'un humain ou d'un animal (p. ex. du sang, de l'urine, de la salive, de la peau, des cheveux).
- Enceinte de sécurité biologique (ESB)
- Dispositif de confinement primaire qui offre une protection aux membres du personnel, à l'environnement et aux produits (selon la catégorie d'ESB) lors de travaux avec des matières biologiques.
- Équipement de protection individuel (EPI)
- Équipement ou vêtements portés par les membres du personnel à titre de barrière contre les matières infectieuses manipulées afin de réduire le risque d'exposition à celles-ci. Les sarraus, les blouses, les vêtements de protection couvrant toutes les parties du corps, les gants, les chaussures de sécurité, les lunettes de sécurité, les masques et les appareils de protection respiratoire sont tous des exemples d'EPI.
- Espace de travail en laboratoire
- Une salle ou un espace réservé à l'intérieur d'une installation, conçu et équipé de façon à pouvoir y mener des activités in vitro avec des matières biologiques.
- Évaluation globale des risques
- Évaluation générale qui appuie le programme de biosécurité dans son ensemble et qui peut comprendre plusieurs espaces de travail de laboratoire au sein d'un établissement ou d'une organisation. Les stratégies d'atténuation et de gestion des risques tiennent compte du type de programme de biosécurité nécessaire pour protéger les membres du personnel d'une exposition et prévenir le rejet de matières infectieuses.
- Évaluation locale des risques (ELR)
- Évaluation propre à un endroit en particulier réalisée pour repérer les dangers associés aux matières infectieuses utilisées et aux activités menées. Cette évaluation permet d'élaborer des stratégies d'atténuation des risques et de gestion des risques qui seront intégrées aux éléments de conception physique et aux pratiques opérationnelles de l'installation.
- Exposition
- Contact ou proximité étroite avec des matières infectieuses pouvant causer une infection. Les voies d'exposition comprennent l'inhalation, l'ingestion, l'inoculation et l'absorption.
- Groupe de risque (GR)
- Groupe dans lequel les matières biologiques sont classées en fonction de leurs caractéristiques inhérentes, comme la pathogénicité, la virulence, le risque de propagation et l'existence d'un traitement prophylactique ou thérapeutique efficace. Le groupe de risque indique quel est le risque pour la santé des personnes et du public ainsi que la santé des animaux et des populations animales. Des exemples d'agents pathogènes humains du GR2, du GR3 et du GR4 figurent aux annexes 2, 3 et 4 (respectivement) de la Loi sur les agents pathogènes humains et les toxines et dans ePATHogène – la base de données sur les groupes de risque.
- Incident
- Événement ou situation pouvant causer une blessure, du mal, une infection, une maladie ou un dommage. Les incidents peuvent comprendre un déversement biologique, une exposition, un rejet involontaire d'une matière biologique, un membre du personnel qui se blesse ou qui développe une maladie, un échantillon disparu, l'accès non autorisé à la zone de confinement, une panne de courant, un incendie, une explosion, une inondation ainsi que toutes les autres situations de crise (p. ex. un séisme, un ouragan). Les accidents et ceux évités de justesse sont considérés comme des incidents.
- Installations
- Structures, édifices ou espaces définis à l'intérieur de structures ou d'édifices dans lesquels sont manipulées ou entreposées des matières infectieuses. Il peut s'agir d'uniques laboratoires de recherche ou de diagnostic, d'aires de production à grande échelle ou de zones où des animaux sont hébergés. Ce terme peut également désigner un ensemble de salles de ce type ou un édifice où se trouvent plusieurs espaces de ce type.
- Intoxication ou infection contractée en laboratoire (ICL)
- Intoxication ou infection due à une exposition dans un endroit où des agents pathogènes ou des toxines sont manipulés ou entreposés, ou dans un endroit où des animaux sont manipulés ou hébergés.
- Matière biologique
- Microorganisme, protéine ou acides nucléiques pathogènes ou non pathogènes, ou toute autre matière biologique pouvant contenir un de ces éléments, en partie ou en entier. Les bactéries, les virus, les champignons, les prions, les toxines, les organismes génétiquement modifiés, les acides nucléiques, les échantillons de tissus, les échantillons de diagnostic, les vaccins vivants et les isolats d'un agent pathogène (p. ex. les cultures pures, les suspensions, les spores purifiées) sont tous des exemples de matière biologique.
- Matière infectieuse
- Tout isolat d'un agent pathogène ou toute matière biologique qui contient des agents pathogènes humains ou des agents zoopathogènes et, donc, qui représente un risque pour la santé humaine ou animale.
- Microorganisme
- Entité microbiologique cellulaire ou non cellulaire capable de se répliquer ou de transférer son matériel génétique, et ne pouvant pas raisonnablement être décelable à l'œil nu. Les microorganismes comprennent les bactéries, les champignons, les virus et les parasites, qu'ils soient pathogènes ou non.
- Niveau de confinement (NC)
- Exigences physiques en matière de confinement et exigences opérationnelles minimales visant la manipulation sécuritaire d'agents pathogènes ou de toxines dans les laboratoires, les zones de production à grande échelle et les environnements de travail avec des animaux. Il existe quatre niveaux de confinement, allant du niveau de base (NC1) au niveau le plus élevé (NC4).
- Plan d'intervention d'urgence
- Document énonçant les mesures à prendre et les parties responsables en cas d’urgence, par exemple en cas de déversement, d’exposition, de rejet de matières infectieuses, de blessure ou de maladie chez un membre du personnel, de panne de courant, d’incendie, d’explosion ou de toute autre situation d’urgence (p. ex. une inondation, un tremblement de terre, un ouragan).
- Pratiques de base
- Un ensemble complet de mesures de contrôle en prévention des infections qui ont été développées pour l'utilisation dans les milieux de soins et qui consistent à traiter tous les échantillons de sang, de liquides organiques ou de tissus comme s'ils contenaient un agent pathogène humain.
- Pratiques opérationnelles
- Mesures ou procédures administratives respectées dans un espace de travail en laboratoire pour protéger les membres du personnel, l'environnement et, ultimement, la communauté contre les matières infectieuses.
- Précautions universelles
- Les précautions universelles sont un sous-ensemble des pratiques de base propres aux agents pathogènes à diffusion hématogène transmis par le sang et les liquides cérébrospinal, pleural et amniotique. Les pratiques de base sont plus générales et visent à protéger les membres du personnel contre une exposition à tous les agents pathogènes résultant d'un contact avec des liquides organiques, des excrétions, les muqueuses, la peau endommagée et des items possiblement contaminés.
- Risque
- Probabilité qu'un événement indésirable (p. ex. un accident, un incident, un rejet involontaire) survienne et les conséquences de cet événement.
- Système de décontamination
- Équipement dont la capacité à rendre des matières sécuritaires à manipuler et relativement exemptes de microorganismes, de toxines ou de prions a été validée. Les autoclaves, les incinérateurs, les digesteurs et les systèmes de décontamination des effluents sont des exemples de systèmes de décontamination.
- Toxine
- Substance toxique produite par un microorganisme, ou dérivée de celui-ci, qui peut avoir des effets graves sur la santé humaine ou animale. Les toxines humaines règlementées sont énumérées à l'annexe 1 et à la partie 1 de l'annexe 5 de la Loi sur les agents pathogènes humains et les toxines.
- Transport
- Fait de transporter (p. ex. envoyer, acheminer) des agents pathogènes ou des toxines vers un édifice ou un emplacement différent du sien (c.-à-d. dont l’adresse n’est pas la même), au Canada ou à l’étranger, conformément à la Loi sur le transport des marchandises dangereuses et au Règlement sur le transport des marchandises dangereuses.
- Validation
- Fait de confirmer qu'une méthode a permis d'atteindre l'objectif visé en observant que des conditions particulières ont été respectées. Des exemples comprennent l'utilisation d'indicateurs biologiques pour confirmer qu'un cycle précis d'autoclavage peut décontaminer une charge représentative de déchets, ou l'application de désinfectant sur une plaque contenant des microorganismes. La validation permet de conclure qu'une méthode convient aux fins prévues. Dans certains cas, les preuves publiées (p. ex. pour l'utilisation de l'eau de Javel) peuvent être acceptables.
- Vérification
- Surveillance régulière de l'équipement et des procédés visant à garantir leur efficacité continue entre les validations. La comparaison de l'exactitude d'une pièce d'équipement avec celle prévue par une norme ou une procédure opératoire normalisée applicable (p. ex. soumettre une enceinte de sécurité biologique de catégorie I à des essais, conformément aux spécifications du fabricant) est une méthode de vérification. Lorsqu'une méthode est utilisée pour inactiver un agent pathogène (p. ex. pour l'extraction d'ADN), la vérification peut impliquer la mise en culture d'un aliquot pour confirmer qu'il ne reste plus de microorganismes viables.
Chapitre 7 - Références et ressources
- Ae, R., Hamaguchi, T., Nakamura, Y., Yamada, M., Tsukamoto, T. et al. (2018). Update: Dura Mater Graft-Associated Creutzfeldt-Jakob Disease - Japan, 1975-2017. Morbidity and Mortality Weekly Report, 67(9):274-278.
- Agence de la santé publique du Canada. (2007). Guide de prévention des infections - La maladie de Creutzfeldt-Jakob classique au Canada - Guide de consultation rapide 2007. Consulté le 10 septembre 2019 à l'adresse https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/nois-sinp/pdf/cjd-fra.pdf
- Agence de la santé publique du Canada. (2012). Pratiques en matière d'hygiène des mains dans les milieux de soins. Ottawa, ON, Canada : Agence de la santé publique du Canada.
- Agence de la santé publique du Canada. (2016). Exemptions de l'exigence relative à la délivrance de permis en vertu de la Loi sur les agents pathogènes humains et les toxines et du Règlement sur les agents pathogènes humains et les toxines. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/loi-agents-pathogenes-toxines/exemptions-exigence-relative-a-delivrance-permis-vertu-loi-agents-pathogenes-humains-toxines-reglement-agents-pathogenes-humains-toxines.html
- Agence de la santé publique du Canada. (2017). Pratiques de base et précautions additionnelles visant à prévenir la transmission des infections dans les milieux de soins. Ottawa, ON, Canada : Agence de la santé publique du Canada.
- Aguzzi, A. et Glatzel, M. (2006). Prion infections, blood and transfusions. Nature Clinical Practice Neurology, 2(6):321-329.
- Barkham, T. et Taylor, M. B. (2002). Sniffing Bacterial Cultures on Agar Plates: a Useful Tool or a Safety Hazard? Journal of Clinical Microbiology, 40(10):3877.
- Baron, E. J. et Miller, J. M. (2008). Bacterial and Fungal Infections among Diagnostic Laboratory Workers: Evaluating the Risks. Diagnostic Microbiology and Infectious Disease, 60(3):241-246.
- Bienek, A., Heisz, M. et Su, M. (2017). Surveillance of Laboratory Exposures to Human Pathogens and Toxins: Canada 2016. Canada Communicable Disease Report, 43(11):228-235.
- Block, S. S. (Éd.). (2001). Disinfection, Sterilization, and Preservation, 5e éd., Philadelphie, PA, États-Unis : Lippincott Williams & Wilkins.
- Brandel, J.-P., Vlaicu, M. B., Culeux, A., Belondrade, M., Bougard, D. et al. (2020). Variant Creutzfeldt-Jakob Disease Diagnosed 7.5 Years after Occupational Exposure. The New England Journal of Medicine, 383(1):83-85.
- Broussard, I. M. et Kahwaji, C. I. (2019). Universal Precautions. Dans : StatPearls [Internet]. Treasure Island (FL) : StatPearls Publishing. Consulté le 16 octobre 2019 à l'adresse https://www.ncbi.nlm.nih.gov/books/NBK470223/
- Byers, K. B. et Harding, A. L. (2017). Laboratory-Associated Infections. Dans Wooley, D. P. et Byers, K. B. (éds.). Biological Safety: Principles and Practices, 5e éd., p. 59-92, Washington, DC, États-Unis : ASM Press.
- CAN/CGSB-43.125-2016, Emballages pour matières infectieuses de catégorie A et de catégorie B (classe 6.2) et déchet d'hôpital, (bio) médical ou médical réglementé. (2016). Gatineau, QC, Canada : Office des normes générales du Canada.
- Centre canadien d'hygiène et de sécurité au travail. (2018). Fiches d'information Réponses SST : Pratiques courantes. Consulté le 3 mars 2021 à l'adresse https://www.cchst.ca/oshanswers/prevention/universa.html
- Choucrallah, D., Sarmiento, L., Ettles, S., Tanguay, F., Heisz, M. et Falardeau, E. (2019). Surveillance of laboratory exposures to human pathogens and toxins: Canada 2018. Canada Communicable Disease Report, 45(9):244-251.
- Conseil canadien des ministres de l'environnement. (1992). Lignes directrices sur la gestion des déchets biomédicaux au Canada. Mississauga, ON, Canada : Association canadienne de normalisation.
- Cox, C. R., Jensen, K. R., Saichek, N. R. et Voorhees, K. J. (2015). Strain-level bacterial identification by CeO2-catalyzed MALDI-TOF MS fatty acid analysis and comparison to commercial protein-based methods. Scientific Reports, 5:10470.
- CSA ISO 15190:21, Medical Laboratories – Requirements for Safety. (2021). Toronto, ON, Canada : Association canadienne de normalisation.
- CSA Z316.6:20, Protection contre les blessures par perforants – Exigences et méthodes d'essai – Conteneurs pour objets tranchants. (2020). Toronto, ON, Canada : Association canadienne de normalisation.
- CSA Z317.10:15 (C2020), Manipulation des déchets de soins de santé. (2015). Toronto, ON, Canada : Association canadienne de normalisation.
- DeMarco, M. (2015). The Lab and CJD: Safe Handling of Infectious Prion Proteins. Consulté le 19 mai 2017 à l'adresse https://www.aacc.org/publications/cln/articles/2015/november/the-lab-and-cjd-safe-handling-of-infectious-prion-proteins
- Engelkirk, P. G. et Duben-Engelkirk, J. L. (2008). Laboratory Diagnosis of Infectious Diseases: Essentials of Diagnostic Microbiology. Baltimore, MD, États-Unis : Lippincott Williams & Wilkins.
- Evans, M. R., Henderson, D. K. et Bennett, J. E. (1990). Potential for laboratory exposures to biohazardous agents found in blood. American Journal of Public Health, 80(4):423-427.
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/deuxieme-edition.html
- Gouvernement du Canada. (2016). Guide canadien sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/guide-deuxieme-edition.html
- Gouvernement du Canada. (2017). Ligne directrice canadienne sur la biosécurité - Évaluation locale des risques. Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices.html
- Gouvernement du Canada. (2018). Directives et avis en matière de biosécurité. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/directives-avis-avis-speciaux-matiere-biosecurite.html
- Gouvernement du Canada. (2018). Lignes directrices canadiennes sur la biosécurité. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices.html
- Gouvernement du Canada. ePATHogène – la base de données sur les groupes de risque. Disponible à l'adresse https://health.canada.ca/fr/epathogene
- Gouvernement du Canada. Fiche Technique Santé-Sécurité : Agents Pathogènes. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques.html
- Health and Safety Executive. (2005). Biological agents: Managing the risks in laboratories and healthcare premises. Royaume-Uni : Health and Safety Executive.
- ISO 15189:2012, Laboratoires de biologie médicale – Exigences concernant la qualité et la compétence. (2012). Genève, Suisse : Organisation internationale de normalisation.
- ISO 9001:2015, Systèmes de management de la qualité - Exigences. (2015). Genève, Suisse : Organisation internationale de normalisation.
- Leunda, A., Van Vaerenbergh, B., Baldo, A., Roels, S. et Herman, P. (2013). Laboratory activities involving transmissible spongiform encephalopathy causing agents: Risk assessment and biosafety recommendations in Belgium. Prion, 7(5):420-433.
- Lien, A., Abalos, C., Atchessi, N., Edjoc, R. et Heisz, M. (2020). Surveillance of laboratory exposures to human pathogens and toxins, Canada 2019. Canada Communicable Disease Report, 46(9):292-298.
- Lim, D. (2003). Microbiology, 3e éd., Dubuque, IA, États-Unis : Kendall/Hunt Publishing Company.
- Loi canadienne sur la protection de l'environnement (1999) (L.C. 1999, ch. 33).
- Loi sur la santé des animaux (L.C. 1990, ch. 21).
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24).
- Noble, M. A. (2015). Prevention of Laboratory-Acquired Infections. Dans Jorgensen, J. H., Pfaller, M. A., Carroll, K. C., Funke, G., Landry, M. L., Richter, S. S. et Warnock, D. W. (éds.). Manual of Clinical Microbiology, 11e éd., p. 169-182, Washington, DC, États-Unis : ASM Press.
- Occupational Safety and Health Administration et American Biological Safety Association Alliance. Principles of Good Microbiological Practice. Consulté le 3 mars 2021 à l'adresse https://absa.org/wp-content/uploads/2017/01/PrinciplesGoodMicroPracticesFactSheet.pdf
- Office fédéral de l'environnement. (2014). Directive pour l'emploi d'un poste de sécurité microbiologique lors de l'utilisation de microorganismes pathogènes pour l'homme, 2e éd., Berne, Suisse : Office fédéral de l'environnement.
- Office fédéral de l'environnement. (2015). Mesures de sécurité dans les laboratoires de diagnostic microbiologique médical, 2e éd., Berne, Suisse : Office fédéral de l'environnement.
- Organisation mondiale de la Santé. (2000). WHO infection control guidelines for Transmissible Spongiform Encephalopathies: report of a WHO consultation, Geneva, Switzerland, 23-26 March 1999. Genève, Suisse : Organisation mondiale de la Santé.
- Organisation mondiale de la Santé. (2020). Laboratory Biosafety Manual, 4e éd., Genève, Suisse : Organisation mondiale de la Santé.
- Patel, R. (2015). MALDI-TOF MS for the Diagnosis of Infectious Diseases. Clinical Chemistry, 61(1):100-111.
- Pedrosa, P. B. S. et Cardoso, T. A. O. (2011). Viral infections in workers in hospital and research laboratory settings: a comparative review of infection modes and respective biosafety aspects. International Journal of Infectious Diseases, 15(6):e366-e376.
- Pike, R. M. (1979). Laboratory-associated infections: incidence, fatalities, causes, and prevention. Annual Review of Microbiology, 33:41–66.
- Pomerleau-Normandin, D., Heisz, M. et Su, M. (2018). Misidentification of Risk Group 3/Security Sensitive Biological Agents by MALDI-TOF MS in Canada: November 2015–October 2017. Canada Communicable Disease Report, 44(5):110-115.
- Pomerleau-Normandin, D., Heisz, M. et Tanguay, F. (2018). Surveillance of laboratory exposures to human pathogens and toxins: Canada 2017. Canada Communicable Disease Report, 44(11):297-303.
- Règlement sur la santé des animaux (C.R.C., ch. 296).
- Règlement sur le transport des marchandises dangereuses (DORS/2001-286).
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44).
- Santé Canada. (2009). Ligne directrice - Médicaments antiseptiques à usage humain. Ottawa, ON, Canada : Santé Canada.
- Sewell, D. L. (1995). Laboratory-Associated Infections and Biosafety. Clinical Microbiology Reviews, 8(3):389-405.
- Singh, K. (2009). Laboratory-Acquired Infections. Clinical Infectious Diseases: an official publication of the Infectious Diseases Society of America, 49(1):142-147.
- Stuart, D. G. (1999). Primary Containment (Chapter 3). Journal of the American Biological Safety Association, 4(1):6-16.
- Tedder, R. S., Zuckerman, M. A., Goldstone, A. H., Hawkins, A. E., Fielding, A. et al. (1995). Hepatitis B transmission from contaminated cryopreservation tank. Lancet, 346(8968):137-140.
- Tracz, D. M., Tober, A. D., Antonation, K. S. et Corbett, C. R. (2018). MALDI-TOF mass spectrometry and high-consequence bacteria: safety and stability of biothreat bacterial sample testing in clinical diagnostic laboratories. Journal of Medical Microbiology, 67(3):341-346.
- Tracz, D. M., Tyler, A. D., Cunningham, I., Antonation, K. S. et Corbett, C. R. (2017). Custom database development and biomarker discovery methods for MALDI-TOF mass spectrometry-based identification of high-consequence bacterial pathogens. Journal of Microbiological Methods, 134:54-57.
- United Kingdom Department of Health, Engineering and Science Advisory Committee into the Decontamination of Surgical Instruments Including Prion Removal (ESAC‑Pr). (2008). New Technologies Working Group Report on Prion Inactivating Agents. Londres, Royaume-Uni : Department of Health.
- United States Centers for Disease Control. (1987). Recommendations for Prevention of HIV Transmission in Health-Care Settings. Morbidity and Mortality Weekly Report, 36(2):1S-18S.
- United States Centers for Disease Control and Prevention. (2012). Guidelines for Safe Work Practices in Human and Animal Medical Diagnostic Laboratories - Recommendations of a CDC-convened, Biosafety Blue Ribbon Panel. Morbidity and Mortality Weekly Report, 61(1):1-101.
- United States Centers for Disease Control and Prevention. (2020). Show Me the Science – When & How to Use Hand Sanitizer in Community Settings. Consulté le 3 mars 2021 à l'adresse http://www.cdc.gov/handwashing/show-me-the-science-hand-sanitizer.html
- United States Department of Labor. (2001). Occupational Safety and Health Standards: 1910.1030 - Bloodborne Pathogens. Washington, DC, États-Unis : United States Department of Labor.
Annexe A - Exigences relatives à la délivrance de permis lorsque seul le Règlement sur la santé des animaux s'applique
L’arbre de décision présenté à la figure A-1 décrit les exigences en vertu du RSA lorsque les activités sont exclues des exigences relatives à la délivrance de permis en vertu de la LAPHT. L’arbre de décision peut aider à déterminer si un permis visant des agents pathogènes et des toxines ou un permis d’importation est exigé en vertu du RSA.
Figure A-1 : Surveillance législative des activités de tests diagnostiques impliquant un agent pathogène en vertu du RSA
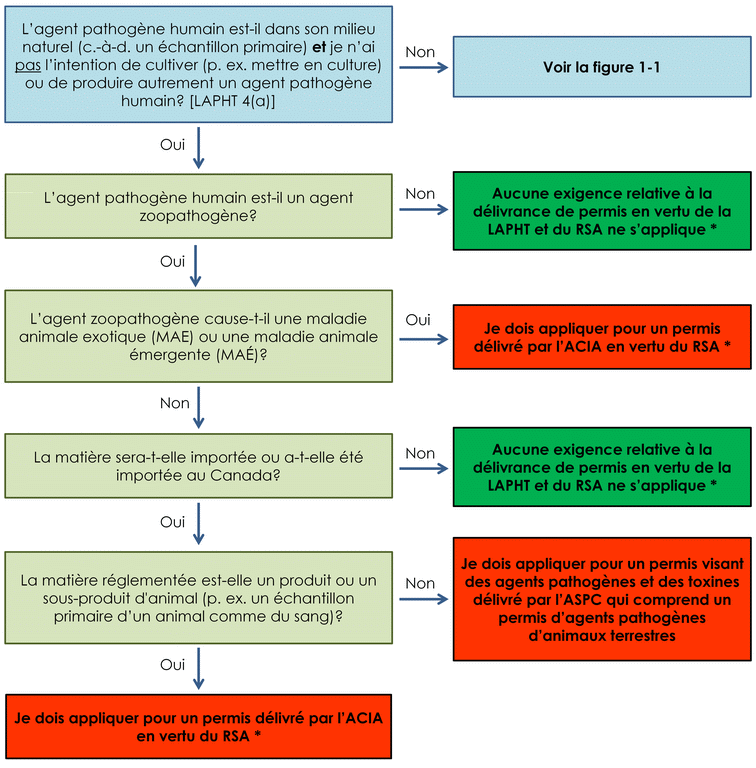
- Figure A-1 note *
-
Je dois informer l'ASPC sans délai de la production involontaire d'un agent pathogène humain ou d'une toxine. [LAPHT 12(2)]
Figure A-1 - Équivalent textuel
La figure est un arbre de décision qui décrit quand les installations de diagnostic doivent obtenir un permis visant des agents pathogènes et des toxines ou un permis délivré par l'ACIA en vertu du RSA et quand elles n'ont pas besoin de permis puisqu'aucune exigence relative à la délivrance de permis en vertu de la LAPHT et du RSA ne s'applique.
Lorsque la matière biologique manipulée contient un agent pathogène humain qui n’est pas dans son milieu naturel ou s’il y a intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, les exigences relatives à la délivrance de permis sont décrites dans la figure 1-1 de cette ligne directrice.
Lorsque la matière biologique manipulée contient un agent pathogène humain dans son milieu naturel (c.-à-d. un échantillon primaire), qu’il n’y a aucune intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, et que l’agent pathogène humain n’est pas un agent zoopathogène, aucune exigence relative à la délivrance de permis en vertu de la LAPHT et du RSA ne s’applique [LAPHT 4(a)].
Lorsque la matière biologique manipulée contient un agent pathogène humain dans son milieu naturel (c.-à-d. un échantillon primaire), qu’il n’y a aucune intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, et que l’agent pathogène humain est un agent zoopathogène qui cause une maladie animale exotique (MAE) ou une maladie animale émergente (MAÉ), un permis délivré par l’ACIA en vertu du RSA est exigé. De plus, l’ASPC doit aussi être informée sans délai s’il y a production involontaire d’un agent pathogène humain ou d’une toxine [LAPHT 12(2)].
Lorsque la matière biologique manipulée contient un agent pathogène humain dans son milieu naturel (c.-à-d. un échantillon primaire), qu’il n’y a aucune intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, que l’agent pathogène humain est un agent zoopathogène qui ne cause pas une maladie animale exotique (MAE) ou une maladie animale émergente (MAÉ), et que la matière n’est pas importée ou ne sera pas importée au Canada, il n’y a aucune exigence relative à la délivrance de permis en vertu de la LAPHT et du RSA qui s’applique. Néanmoins, l’ASPC doit aussi être informée sans délai s’il y a production involontaire d’un agent pathogène humain ou d’une toxine [LAPHT 12(2)].
Lorsque la matière biologique manipulée contient un agent pathogène humain dans son milieu naturel (c.-à-d. un échantillon primaire), qu’il n’y a aucune intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, que l’agent pathogène humain est un agent zoopathogène qui ne cause pas une maladie animale exotique (MAE) ou une maladie animale émergente (MAÉ), que la matière est importée ou sera importée au Canada, et que la matière réglementée est un produit ou un sous-produit animal (p. ex. un échantillon primaire animal comme du sang), un permis délivré par l’ACIA en vertu du RSA est exigé. De plus, l’ASPC doit aussi être informée sans délai s’il y a production involontaire d’un agent pathogène humain ou d’une toxine [LAPHT 12(2)].
Lorsque la matière biologique manipulée contient un agent pathogène humain dans son milieu naturel (c.-à-d. un échantillon primaire), qu’il n’y a aucune intention de cultiver (p. ex. mettre en culture) ou de produire autrement un agent pathogène humain, que l’agent pathogène humain est un agent zoopathogène qui ne cause pas une maladie animale exotique (MAE) ou une maladie animale émergente (MAÉ), que la matière est importée ou sera importée au Canada, et que la matière réglementée n’est pas un produit ou un sous-produit animal (p. ex. un échantillon primaire humain comme du sang), un permis délivré par l’ASPC qui comprend un permis d’agents pathogènes d’animaux terrestres est exigé.
Annexe B - Hygiène des mains adéquate
Le lavage des mains est la méthode la plus courante pour décontaminer les mains et le moyen le plus efficace pour prévenir la transmission des infections. Le lavage des mains avec du savon et de l'eau courante propre est un moyen efficace pour enlever la saleté et les matières organiques visibles et pour éliminer tous les types d'agents pathogènes de la surface des mains.
Lavage des mains adéquat (savon et eau)Note de bas de page 63
- Mouiller les mains sous l'eau courante.
- Utiliser suffisamment de savon pour faire mousser toutes les surfaces des mains, y compris les doigts, le bout des doigts, les surfaces entre les doigts, les paumes, le dos des mains et les pouces, la base des pouces et, en cas de port de bague, sur et sous la bague.
- Frotter vigoureusement la paume et le dos de chaque main, croiser et remuer les doigts pour s’assurer que les doigts et les pouces sont frottés pour enlever la saleté et les matières organiques visibles pendant 15 à 30 secondes.
- Rincer les mains complètement sous l'eau courante en les pointant vers le bas.
- Sécher les mains entièrement en les tapotant à l'aide d'une serviette à usage unique.
- Utiliser des serviettes de papier pour fermer les robinets manuels afin que les mains ne soient pas contaminées à nouveau par ce processus.
- La procédure complète du lavage des mains (se rendre au lavabo, mouiller les mains, les savonner, les mousser, les rincer et les sécher) prend environ de 40 à 80 secondes.
Facteurs à considérer pour l'utilisation de désinfectants pour les mains à base d'alcool
- Les désinfectants pour les mains à base d'alcool ou d'autres ingrédients actifs, comme le gluconate de chlorhexidine, tels que décrits dans la Ligne directrice - Médicaments antiseptiques à usage humain et dans la Loi sur les aliments et drogues, ne peuvent éliminer tous les types d'agents pathogènes et ne sont pas aussi efficaces que le lavage des mains avec de l'eau et du savon, surtout lorsque les mains sont visiblement sales ou graisseusesNote de bas de page 56 Note de bas de page 64.
- Pour empêcher la propagation de la contamination, un désinfectant pour les mains qui s'est révélé efficace contre les agents pathogènes ou les toxines utilisés dans l'installation peut être une solution de rechange lorsque des lavabos pour le lavage des mains ne sont pas facilement accessibles. Dans ce cas, le lavage des mains devrait être effectué dès qu'un lavabo adéquat pour le lavage des mains est accessible.
- Le fait d'appliquer du désinfectant pour les mains sur des mains mouillées diluera l'ingrédient actif et pourrait le rendre inefficace.
- Le fait de suivre les consignes du fabricant à la lettre, comme celles de frotter toutes les surfaces des mains et d'éviter d'essuyer ou de sécher les mains à l'aide d'une serviette de papier avant que le produit n'ait séché, permettra un temps de contact approprié et une décontamination plus efficace des mains.
- Les désinfectants pour les mains à base d'alcool sont inflammables et peuvent altérer la porosité des gants. Ces problèmes peuvent être évités en laissant sécher complètement les mains désinfectées avant d'entrer en contact avec un milieu riche en oxygène et avant de mettre des gants.
- Les lingettes imprégnées de savon, d'antimicrobiens ou d'alcool ne sont pas des solutions de rechange aux désinfectants pour les mains à base d'alcool ou d'un autre ingrédient actif pour assurer l'antisepsie des mains, car elles ne parviennent pas à décontaminer les mains efficacement.
Références
- Note de bas de page 1
-
Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24).
- Note de bas de page 2
-
Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44).
- Note de bas de page 3
-
Loi sur la santé des animaux (L.C. 1990, ch. 21).
- Note de bas de page 4
-
Règlement sur la santé des animaux (C.R.C., ch. 296).
- Note de bas de page 5
-
Agence de la santé publique du Canada. (2016). Exemptions de l'exigence relative à la délivrance de permis en vertu de la Loi sur les agents pathogènes humains et les toxines et du Règlement sur les agents pathogènes humains et les toxines. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/loi-agents-pathogenes-toxines/exemptions-exigence-relative-a-delivrance-permis-vertu-loi-agents-pathogenes-humains-toxines-reglement-agents-pathogenes-humains-toxines.html
- Note de bas de page 6
-
Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/deuxieme-edition.html
- Note de bas de page 7
-
Gouvernement du Canada. (2018). Lignes directrices canadiennes sur la biosécurité. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices.html
- Note de bas de page 8
-
Agence de la santé publique du Canada. (2017). Pratiques de base et précautions additionnelles visant à prévenir la transmission des infections dans les milieux de soins. Ottawa, ON, Canada : Agence de la santé publique du Canada.
- Note de bas de page 9
-
ISO 15189:2012, Laboratoires de biologie médicale – Exigences concernant la qualité et la compétence. (2012). Genève, Suisse : Organisation internationale de normalisation.
- Note de bas de page 10
-
CSA ISO 15190:21, Medical Laboratories – Requirements for Safety. (2021). Toronto, ON, Canada : Association canadienne de normalisation.
- Note de bas de page 11
-
CSA Z317.10:15 (C2020), Manipulation des déchets de soins de santé. (2015). Toronto, ON, Canada : Association canadienne de normalisation.
- Note de bas de page 12
-
Occupational Safety and Health Administration et American Biological Safety Association Alliance. Principles of Good Microbiological Practice. Consulté le 3 mars 2021 à l'adresse https://absa.org/wp-content/uploads/2017/01/PrinciplesGoodMicroPracticesFactSheet.pdf
- Note de bas de page 13
-
Organisation mondiale de la Santé. (2020). Laboratory Biosafety Manual, 4e éd., Genève, Suisse : Organisation mondiale de la Santé.
- Note de bas de page 14
-
Centre canadien d'hygiène et de sécurité au travail. (2018). Fiches d'information Réponses SST : Pratiques courantes. Consulté le 3 mars 2021 à l'adresse https://www.cchst.ca/oshanswers/prevention/universa.html
- Note de bas de page 15
-
Broussard, I. M. et Kahwaji, C. I. (2019). Universal Precautions. Dans : StatPearls [Internet]. Treasure Island (FL) : StatPearls Publishing. Consulté le 16 octobre 2019 à l'adresse https://www.ncbi.nlm.nih.gov/books/NBK470223/
- Note de bas de page 16
-
United States Centers for Disease Control. (1987). Recommendations for Prevention of HIV Transmission in Health-Care Settings. Morbidity and Mortality Weekly Report, 36(2):1S-18S.
- Note de bas de page 17
-
Byers, K. B. et Harding, A. L. (2017). Laboratory-Associated Infections. Dans Wooley, D. P. et Byers, K. B. (éds.). Biological Safety: Principles and Practices, 5e éd., p. 59-92, Washington, DC, États-Unis : ASM Press.
- Note de bas de page 18
-
Sewell, D. L. (1995). Laboratory-Associated Infections and Biosafety. Clinical Microbiology Reviews, 8(3):389-405.
- Note de bas de page 19
-
Pike, R. M. (1979). Laboratory-associated infections: incidence, fatalities, causes, and prevention. Annual Review of Microbiology, 33:41–66.
- Note de bas de page 20
-
Pedrosa, P. B. S. et Cardoso, T. A. O. (2011). Viral infections in workers in hospital and research laboratory settings: a comparative review of infection modes and respective biosafety aspects. International Journal of Infectious Diseases, 15(6):e366-e376.
- Note de bas de page 21
-
Bienek, A., Heisz, M. et Su, M. (2017). Surveillance of Laboratory Exposures to Human Pathogens and Toxins: Canada 2016. Canada Communicable Disease Report, 43(11):228-235.
- Note de bas de page 22
-
Pomerleau-Normandin, D., Heisz, M. et Tanguay, F. (2018). Surveillance of laboratory exposures to human pathogens and toxins: Canada 2017. Canada Communicable Disease Report, 44(11):297-303.
- Note de bas de page 23
-
Choucrallah, D., Sarmiento, L., Ettles, S., Tanguay, F., Heisz, M. et Falardeau, E. (2019). Surveillance of laboratory exposures to human pathogens and toxins: Canada 2018. Canada Communicable Disease Report, 45(9):244-251.
- Note de bas de page 24
-
Lien, A., Abalos, C., Atchessi, N., Edjoc, R. et Heisz, M. (2020). Surveillance of laboratory exposures to human pathogens and toxins, Canada 2019. Canada Communicable Disease Report, 46(9):292-298.
- Note de bas de page 25
-
Noble, M. A. (2015). Prevention of Laboratory-Acquired Infections. Dans Jorgensen, J. H., Pfaller, M. A., Carroll, K. C., Funke, G., Landry, M. L., Richter, S. S. et Warnock, D. W. (éds.). Manual of Clinical Microbiology, 11e éd., p. 169-182, Washington, DC, États-Unis : ASM Press.
- Note de bas de page 26
-
Evans, M. R., Henderson, D. K. et Bennett, J. E. (1990). Potential for laboratory exposures to biohazardous agents found in blood. American Journal of Public Health, 80(4):423-427.
- Note de bas de page 27
-
Gouvernement du Canada. Fiche Technique Santé-Sécurité : Agents Pathogènes. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques.html
- Note de bas de page 28
-
Gouvernement du Canada. ePATHogène – la base de données sur les groupes de risque. Disponible à l'adresse https://health.canada.ca/fr/epathogene
- Note de bas de page 29
-
Gouvernement du Canada. (2018). Directives et avis en matière de biosécurité. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/directives-avis-avis-speciaux-matiere-biosecurite.html
- Note de bas de page 30
-
Health and Safety Executive. (2005). Biological agents: Managing the risks in laboratories and healthcare premises. Royaume-Uni : Health and Safety Executive.
- Note de bas de page 31
-
Gouvernement du Canada. (2017). Ligne directrice canadienne sur la biosécurité - Évaluation locale des risques. Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices.html
- Note de bas de page 32
-
Office fédéral de l'environnement. (2015). Mesures de sécurité dans les laboratoires de diagnostic microbiologique médical, 2e éd., Berne, Suisse : Office fédéral de l'environnement.
- Note de bas de page 33
-
Barkham, T. et Taylor, M. B. (2002). Sniffing Bacterial Cultures on Agar Plates: a Useful Tool or a Safety Hazard? Journal of Clinical Microbiology, 40(10):3877.
- Note de bas de page 34
-
Engelkirk, P. G. et Duben-Engelkirk, J. L. (2008). Laboratory Diagnosis of Infectious Diseases: Essentials of Diagnostic Microbiology. Baltimore, MD, États-Unis : Lippincott Williams & Wilkins.
- Note de bas de page 35
-
Singh, K. (2009). Laboratory-Acquired Infections. Clinical Infectious Diseases: an official publication of the Infectious Diseases Society of America, 49(1):142-147.
- Note de bas de page 36
-
Baron, E. J. et Miller, J. M. (2008). Bacterial and Fungal Infections among Diagnostic Laboratory Workers: Evaluating the Risks. Diagnostic Microbiology and Infectious Disease, 60(3):241-246.
- Note de bas de page 37
-
United States Centers for Disease Control and Prevention. (2012). Guidelines for Safe Work Practices in Human and Animal Medical Diagnostic Laboratories - Recommendations of a CDC-convened, Biosafety Blue Ribbon Panel. Morbidity and Mortality Weekly Report, 61(1):1-101.
- Note de bas de page 38
-
Tedder, R. S., Zuckerman, M. A., Goldstone, A. H., Hawkins, A. E., Fielding, A. et al. (1995). Hepatitis B transmission from contaminated cryopreservation tank. Lancet, 346(8968):137-140.
- Note de bas de page 39
-
CSA Z316.6:20, Protection contre les blessures par perforants – Exigences et méthodes d’essai – Conteneurs pour objets tranchants. (2020). Toronto, ON, Canada : Association canadienne de normalisation.
- Note de bas de page 40
-
Brandel, J.-P., Vlaicu, M. B., Culeux, A., Belondrade, M., Bougard, D. et al. (2020). Variant Creutzfeldt-Jakob Disease Diagnosed 7.5 Years after Occupational Exposure. The New England Journal of Medicine, 383(1):83-85.
- Note de bas de page 41
-
Ae, R., Hamaguchi, T., Nakamura, Y., Yamada, M., Tsukamoto, T. et al. (2018). Update: Dura Mater Graft-Associated Creutzfeldt-Jakob Disease - Japan, 1975-2017. Morbidity and Mortality Weekly Report, 67(9):274-278.
- Note de bas de page 42
-
Aguzzi, A. et Glatzel, M. (2006). Prion infections, blood and transfusions. Nature Clinical Practice Neurology, 2(6):321-329.
- Note de bas de page 43
-
Agence de la santé publique du Canada. (2007). Guide de prévention des infections - La maladie de Creutzfeldt-Jakob classique au Canada - Guide de consultation rapide 2007. Consulté le 10 septembre 2019 à l'adresse https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/nois-sinp/pdf/cjd-fra.pdf
- Note de bas de page 44
-
DeMarco, M. (2015). The Lab and CJD: Safe Handling of Infectious Prion Proteins. Consulté le 19 mai 2017 à l'adresse https://www.aacc.org/publications/cln/articles/2015/november/the-lab-and-cjd-safe-handling-of-infectious-prion-proteins
- Note de bas de page 45
-
Organisation mondiale de la Santé. (2000). WHO infection control guidelines for Transmissible Spongiform Encephalopathies: report of a WHO consultation, Geneva, Switzerland, 23-26 March 1999. Genève, Suisse : Organisation mondiale de la Santé.
- Note de bas de page 46
-
Leunda, A., Van Vaerenbergh, B., Baldo, A., Roels, S. et Herman, P. (2013). Laboratory activities involving transmissible spongiform encephalopathy causing agents: Risk assessment and biosafety recommendations in Belgium. Prion, 7(5):420-433.
- Note de bas de page 47
-
Patel, R. (2015). MALDI-TOF MS for the Diagnosis of Infectious Diseases. Clinical Chemistry, 61(1):100-111.
- Note de bas de page 48
-
Pomerleau-Normandin, D., Heisz, M. et Su, M. (2018). Misidentification of Risk Group 3/Security Sensitive Biological Agents by MALDI-TOF MS in Canada: November 2015–October 2017. Canada Communicable Disease Report, 44(5):110-115.
- Note de bas de page 49
-
Cox, C. R., Jensen, K. R., Saichek, N. R. et Voorhees, K. J. (2015). Strain-level bacterial identification by CeO2-catalyzed MALDI-TOF MS fatty acid analysis and comparison to commercial protein-based methods. Scientific Reports, 5:10470.
- Note de bas de page 50
-
Tracz, D. M., Tyler, A. D., Cunningham, I., Antonation, K. S. et Corbett, C. R. (2017). Custom database development and biomarker discovery methods for MALDI-TOF mass spectrometry-based identification of high-consequence bacterial pathogens. Journal of Microbiological Methods, 134:54-57.
- Note de bas de page 51
-
Tracz, D. M., Tober, A. D., Antonation, K. S. et Corbett, C. R. (2018). MALDI-TOF mass spectrometry and high-consequence bacteria: safety and stability of biothreat bacterial sample testing in clinical diagnostic laboratories. Journal of Medical Microbiology, 67(3):341-346.
- Note de bas de page 52
-
Office fédéral de l'environnement. (2014). Directive pour l'emploi d'un poste de sécurité microbiologique lors de l'utilisation de microorganismes pathogènes pour l'homme, 2e éd., Berne, Suisse : Office fédéral de l'environnement.
- Note de bas de page 53
-
Stuart, D. G. (1999). Primary Containment (Chapter 3). Journal of the American Biological Safety Association, 4(1):6-16.
- Note de bas de page 54
-
United States Department of Labor. (2001). Occupational Safety and Health Standards: 1910.1030 - Bloodborne Pathogens. Washington, DC, États-Unis : United States Department of Labor.
- Note de bas de page 55
-
Règlement sur le transport des marchandises dangereuses (DORS/2001-286).
- Note de bas de page 56
-
United States Centers for Disease Control and Prevention. (2020). Show Me the Science – When & How to Use Hand Sanitizer in Community Settings. Consulté le 3 mars 2021 à l'adresse http://www.cdc.gov/handwashing/show-me-the-science-hand-sanitizer.html
- Note de bas de page 57
-
ISO 9001:2015, Systèmes de management de la qualité - Exigences. (2015). Genève, Suisse : Organisation internationale de normalisation.
- Note de bas de page 58
-
Block, S. S. (Éd.). (2001). Disinfection, Sterilization, and Preservation, 5e éd., Philadelphie, PA, États-Unis : Lippincott Williams & Wilkins.
- Note de bas de page 59
-
United Kingdom Department of Health, Engineering and Science Advisory Committee into the Decontamination of Surgical Instruments Including Prion Removal (ESAC-Pr). (2008). New Technologies Working Group Report on Prion Inactivating Agents. Londres, Royaume-Uni : Department of Health.
- Note de bas de page 60
-
Conseil canadien des ministres de l'environnement. (1992). Lignes directrices sur la gestion des déchets biomédicaux au Canada. Mississauga, ON, Canada : Association canadienne de normalisation.
- Note de bas de page 61
-
CAN/CGSB-43.125-2016, Emballages pour matières infectieuses de catégorie A et de catégorie B (classe 6.2) et déchet d'hôpital, (bio) médical ou médical réglementé. (2016). Gatineau, QC, Canada : Office des normes générales du Canada.
- Note de bas de page 62
-
Loi canadienne sur la protection de l'environnement (1999) (L.C. 1999, ch. 33).
- Note de bas de page 63
-
Agence de la santé publique du Canada. (2012). Pratiques en matière d'hygiène des mains dans les milieux de soins. Ottawa, ON, Canada : Agence de la santé publique du Canada.
- Note de bas de page 64
-
Santé Canada. (2009). Ligne directrice - Médicaments antiseptiques à usage humain. Ottawa, ON, Canada : Santé Canada.
