Directives sur l’utilisation des vaccins contre la COVID-19 pour la période allant de 2025 à l’été 2026
Télécharger en format PDF
(336 Ko, 26 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 2025-01-10
Cat. : HP40-376/2025F-PDF
ISBN : 978-0-660-74984-6
Pub. : 240717
Sur cette page
- Préambule
- Contexte
- Méthodologie
- Aperçu des données probantes et des considérations
- Innocuité des vaccins
- Économie
- Éthique, équité, faisabilité et acceptabilité
- Recommandations
- Priorités de recherche
- Abréviations
- Remerciements
- Notes de bas de page
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) et un organisme consultatif externe qui donne à l'Agence de la santé publique du Canada (ASPC) des conseils indépendants, continus et à jour dans le domaine de la médecine, des sciences et de la santé publique liés aux questions de l'ASPC concernant l'immunisation.
L'ASPC a élargi le mandat du CCNI de façon à inclure, en plus de l'impact des maladies et des caractéristiques vaccinales, l'étude systématique des facteurs liés aux programmes dans la formulation de ses recommandations fondées sur les données probantes afin de favoriser la prise de décisions opportunes concernant les programmes de vaccination financés par le secteur public à l'échelle provinciale et territoriale.
Les nouveaux facteurs que le CCNI devra examiner de façon systématique sont les suivants : économie, équité, éthique, acceptabilité et faisabilité. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Même si l'étude systématique des facteurs liés aux programmes sera effectuée à l'aide d'outils fondés sur des données probantes afin de cerner les problèmes distincts susceptibles d'avoir une incidence sur la prise de décision pour l'élaboration des recommandations, seuls les problèmes distincts considérés comme étant propres au vaccin ou à la maladie pouvant être prévenue par un vaccin seront inclus.
La présente déclaration contient les conseils indépendants et les recommandations du CCNI, qui reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin devraient également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les membres de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Contexte
La circulation endémique du SRAS-CoV-2 a permis aux programmes de santé publique de s'orienter vers une planification à plus long terme pour une approche plus durable de la gestion de la COVID-19. Au niveau international, des évaluations régulières de la sélection des souches pour les vaccins contre la COVID-19 ont eu lieu, les vaccins contre la COVID-19 étant mis à jour une fois par an, avant la saison respiratoire d'automne/hiver. Les activités et les programmes de surveillance du SRAS-CoV-2 évoluent pour répondre aux besoins de renseignements dans le contexte de la circulation continue du virus. Au niveau national, la surveillance canadienne du SRAS-CoV-2 a été intégrée au Système de surveillance et de détection des virus respiratoires (SSDVR), en place depuis longtemps. Toutefois, l'épidémiologie des maladies en cours reste incertaine et les programmes de vaccination devront s'y adapter.
Les provinces et territoires canadiens ont accès aux vaccins contre la COVID-19 achetés et payés par le gouvernement fédéral depuis qu'ils sont devenus disponibles en décembre 2020. Par rapport à d'autres programmes de vaccination systématique financés par les provinces et les territoires, cette situation s'est avérée unique dans le cas de la pandémie de COVID-19. Les administrations seront éventuellement responsables des coûts d'achat des vaccins contre la COVID-19. Ce changement important sera mis en œuvre à partir de l'automne 2025. Les vaccins à ARNm contre le variant KP.2 utilisés au cours de la saison respiratoire 2024-2025 sont les derniers vaccins contre la COVID-19 couverts par les accords d'achat anticipé mis en place par le gouvernement fédéral pendant la pandémie. Ce changement a donné l'occasion au CCNI de revoir les principales considérations relatives au programme de vaccination contre la COVID-19, ainsi que le cadre général et l'approche des conseils connexes à l'avenir.
Plusieurs vaccins contre la COVID-19 ont été autorisés au Canada, et le CCNI a déjà publié des directives recommandant que les vaccins à ARNm et à sous-unités protéiques contre la COVID-19 puissent être utilisés chez les groupes d'âge autorisés pour une protection contre l'infection par le SRAS-CoV-2.Cette déclaration vise à faciliter la planification du programme de vaccination contre la COVID-19 pour 2025 et jusqu'à l'été 2026. Il est incertain quels produits seront disponibles pendant cette période; le chapitre COVID-19 du Guide canadien de l'immunisation (GCI) sera mis à jour pour refléter les produits disponibles, le cas échéant. Le CCNI continuera à suivre l'évolution de l'épidémiologie de la COVID-19 et des renseignements sur le vaccin et des directives actualisées seront fournies, le cas échéant.
Méthodologie
Le groupe de travail sur la COVID-19 du CCNI (GT COVID-19) a examiné les renseignements disponibles concernant les vaccins XBB.1.5, notamment l'efficacité réelle des vaccins et la durée de la protection. Le GT COVID-19 du CCNI a également examiné les données disponibles sur l'épidémiologie du SRAS-COV-2 ainsi que d'autres considérations liées aux programmes de vaccination contre la COVID-19, notamment le rapport coût/efficacité, le calendrier et la faisabilité de l'administration du vaccin.
Les 19 septembre et 19 novembre 2024, le CCNI a examiné les données probantes présentées au GT COVID-19. Après un examen approfondi des données probantes et une consultation lors des réunions du CCNI, le comité a voté des recommandations particulières. La déclaration a été approuvée le 6 décembre 2024.
Des renseignements supplémentaires sur le processus et les procédures du CCNI sont disponibles ailleurs Note de bas de page 1 Note de bas de page 2.
Aperçu des données probantes et des considérations
Épidémiologie
- La COVID-19 est une infection respiratoire causée par le SRAS-CoV-2 et peut provoquer une maladie légère à grave, pouvant aller jusqu'à l'hospitalisation et la mort. Certaines populations, comme les jeunes enfants, les personnes âgées et les personnes souffrant de maladies chroniques, sont plus exposées aux maladies graves.
- La trajectoire évolutive du SRAS-CoV-2 est incertaine, mais le virus subit des modifications antigéniques au fil du temps, entraînant l'apparition de variants ou de sous-variants distincts qui ne sont pas aussi bien neutralisés par les anticorps induits par les vaccins antérieurs conçus sur la base des variants ou de sous-variants. Les changements antigéniques ont entraîné des réévaluations régulières de la ou des souches sélectionnées pour les vaccins contre la COVID-19 au niveau international.
- Le caractère saisonnier du SRAS-CoV-2 n'a pas été établi. Toutefois, les données du SSDVR sur le SRAS-CoV-2 des dernières années ont fourni quelques indications générales sur l'épidémiologie du COVID-19 au Canada Note de bas de page 3. Contrairement à d'autres virus respiratoires, tels que la grippe, le virus respiratoire syncytial (VRS) ou d'autres coronavirus humains, le SRAS-CoV-2 circule toute l'année, avec des poussées périodiques d'activité de la maladie. En 2023, l'activité de la COVID-19, déterminée par un pourcentage de positivité inférieur à 10 %, a été la plus faible en juin et en juillet et, en 2024, en février, mars, avril et mai (voir la figure 1,). Le pourcentage de positivité a augmenté au cours de l'été et a été systématiquement élevé au cours des mois d'automne en 2022, 2023 et 2024 jusqu'à présent.
- Depuis l'émergence du variant Omicron, la séroprévalence de l'infection acquise dans la population canadienne est élevée. Par le passé, il a été observé que chez les adultes, la séroprévalence de l'infection diminue avec l'âge, les personnes âgées ayant des niveaux d'immunité plus élevés grâce à la vaccination que les groupes d'âge plus jeunes Note de bas de page 4.
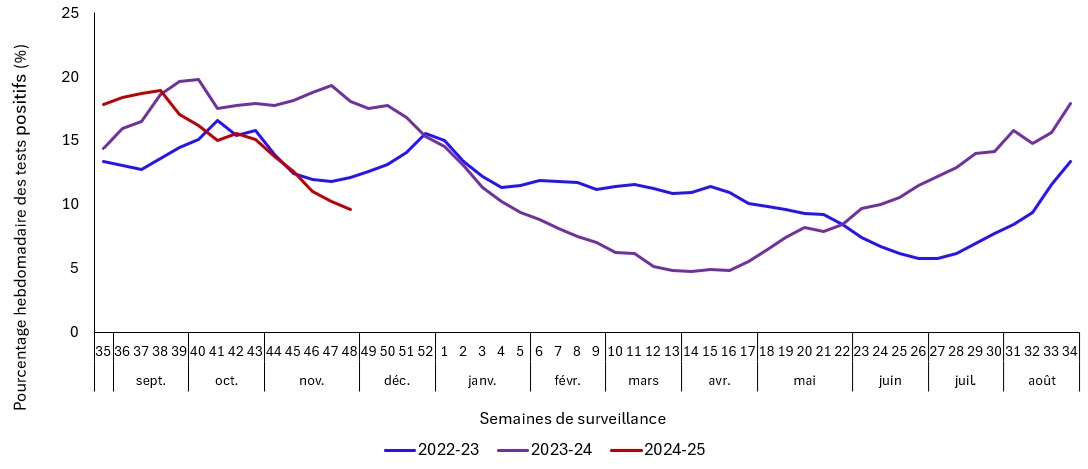
Figure 1 : Texte descriptif
| Semaines de surveillance | 2022-23 | 2023-24 | 2024-25 |
|---|---|---|---|
| 35 | 13.4% | 14.4% | 17.9% |
| 36 | 13.1% | 15.9% | 18.4% |
| 37 | 12.7% | 16.5% | 18.7% |
| 38 | 13.6% | 18.6% | 18.9% |
| 39 | 14.4% | 19.6% | 17.0% |
| 40 | 15.1% | 19.8% | 16.1% |
| 41 | 16.6% | 17.5% | 15.0% |
| 42 | 15.4% | 17.8% | 15.6% |
| 43 | 15.8% | 17.9% | 15.1% |
| 44 | 13.9% | 17.7% | 13.8% |
| 45 | 12.4% | 18.2% | 12.5% |
| 46 | 12.0% | 18.8% | 11.0% |
| 47 | 11.8% | 19.3% | 10.2% |
| 48 | 12.1% | 18.0% | 9.6% |
| 49 | 12.6% | 17.5% | no data |
| 50 | 13.1% | 17.8% | no data |
| 51 | 14.1% | 16.8% | no data |
| 52 | 15.5% | 15.4% | no data |
| 1 | 15.0% | 14.5% | no data |
| 2 | 13.4% | 13.0% | no data |
| 3 | 12.2% | 11.4% | no data |
| 4 | 11.3% | 10.2% | no data |
| 5 | 11.5% | 9.3% | no data |
| 6 | 11.9% | 8.8% | no data |
| 7 | 11.8% | 8.1% | no data |
| 8 | 11.7% | 7.5% | no data |
| 9 | 11.2% | 7.0% | no data |
| 10 | 11.4% | 6.2% | no data |
| 11 | 11.6% | 6.1% | no data |
| 12 | 11.3% | 5.2% | no data |
| 13 | 10.8% | 4.9% | no data |
| 14 | 10.9% | 4.7% | no data |
| 15 | 11.4% | 4.9% | no data |
| 16 | 10.9% | 4.8% | no data |
| 17 | 10.1% | 5.5% | no data |
| 18 | 9.8% | 6.5% | no data |
| 19 | 9.6% | 7.4% | no data |
| 20 | 9.3% | 8.2% | no data |
| 21 | 9.2% | 7.9% | no data |
| 22 | 8.5% | 8.5% | no data |
| 23 | 7.4% | 9.7% | no data |
| 24 | 6.7% | 10.0% | no data |
| 25 | 6.2% | 10.6% | no data |
| 26 | 5.8% | 11.5% | no data |
| 27 | 5.7% | 12.2% | no data |
| 28 | 6.1% | 12.9% | no data |
| 29 | 6.9% | 14.0% | no data |
| 30 | 7.7% | 14.2% | no data |
| 31 | 8.4% | 15.8% | no data |
| 32 | 9.4% | 14.8% | no data |
| 33 | 11.6% | 15.6% | no data |
| 34 | 13.4% | 17.9% | no data |
Efficacité réelle du vaccin et durée de la protection vaccinale
- Les mesures de l'efficacité réelle (ER) du vaccin contre la COVID-19 sont influencées par : le temps écoulé depuis la dernière dose de vaccin contre la COVID-19; les souches en circulation du virus et leur parenté avec la souche vaccinale; les pressions d'infection dans la communauté (ce qui peut entraîner une sous-estimation de l'ER, le groupe non vacciné étant immunisé à la suite d'une infection récente); la population étudiée (influencée par des facteurs tels que l'âge et les conditions d'immunodépression); et les résultats mesurés (p. ex, infection, maladie symptomatique, hospitalisation ou résultats critiques tels que l'admission en unité de soins intensifs [USI] ou le décès, ainsi que l'incidence du vaccin sur l'état post-COVID-19).
- Le groupe de comparaison des études d'évaluation de l'ER peut également influencer les estimations et donner lieu à différents types d'estimations de l'ER : ER absolue (lorsque le groupe de comparaison n'est pas vacciné), ER relative (lorsque le groupe de comparaison a déjà été vacciné) et ER progressive (lorsque le groupe de comparaison est constitué de toute personne qui n'a pas reçu le vaccin pour lequel l'ER est mesurée, indépendamment de ses antécédents en matière de vaccination ou d'infection).
- Bien qu'il était possible d'estimer l'ER absolue au début de la pandémie, avec l'augmentation de la couverture vaccinale, elle est aujourd'hui plus difficile à déterminer. Pour les vaccins XBB.1.5, un certain nombre d'études ont mesuré la protection supplémentaire conférée par le vaccin chez les personnes ayant reçu le vaccin XBB.1.5 par rapport à celles qui ne l'ont pas reçu (indépendamment de leurs antécédents en matière de vaccination ou d'infection). Les estimations de l'ER sont donc des estimations progressives, décrivant le bénéfice supplémentaire du vaccin dans les populations immunisées par des taux élevés de vaccinations et d'infections antérieures.
- Les données sur l'ER et la durée de la protection du vaccin XBB.1.5 proviennent de plusieurs sources, notamment de l'Ontario, du Québec et des États-Unis.
- Les chercheurs de l'Ontario ont fait état d'un modèle test-négatif impliquant des personnes de 50 ans et plus ayant reçu au moins deux vaccins à ARNm et ayant été testées par réaction en chaîne de la polymérase (PCR) entre le 24 septembre 2023 et le 1erjuin 2024 Note de bas de page 5. L'étude a porté sur 4 895 cas dont le test de dépistage du SRAS-CoV-2 s'est révélé positif et qui ont été hospitalisés ou sont décédés, ainsi que sur 23,223 témoins symptomatiques dont le test s'est révélé négatif. L'étude a évalué l'ER progressive du vaccin XBB.1.5 pour les personnes l'ayant reçu et celles qui ne l'ont pas reçu, en ce qui concerne les issues graves (hospitalisation et décès).
- Dans la période à prédominance XBB, l'ER ajustée aux covariables était de 64 % jusqu'à moins de 3 mois après la vaccination, avec des intervalles de confiance (IC) à 95 % qui excluent le zéro.
- Dans la période à prédominance JN/KP, l'ER ajustée était de 57 % jusqu'à moins de 3 mois après la vaccination, de 44 % entre 3 et moins de 6 mois après la vaccination et de 21 % entre 6 et moins de 9 mois après la vaccination. Les IC à 95 % excluaient le zéro pour les estimations dans les 6 mois suivant la vaccination et incluaient le zéro pour les estimations entre 6 et moins de 9 mois suivant la vaccination.
- Les chercheurs du Québec ont fait état des hospitalisations en utilisant une étude test-négatif qui reliait les dossiers sur la base des résultats des tests de laboratoire (les cas étant les personnes présentant des symptômes de COVID-19 qui ont été déclarées positives par un test d'amplification des acides nucléiques dans un hôpital de soins aigus et qui ont été admises en raison de la COVID-19 principalement, et les témoins étant les personnes présentant des symptômes compatibles avec la COVID-19 qui ont été testées négatives dans un hôpital de soins aigus) Note de bas de page 6. Les participants à l'étude étaient de 60 ans et plus et l'étude s'est déroulée entre le 29 octobre 2023 et le 17 août 2024. Les résultats de l'évaluation de l'ER du vaccin XBB.1.5 ci-dessous correspondent à l'évaluation de l'ER progressive chez les personnes ayant reçu un vaccin XBB.1.5 au cours de la période d'étude par rapport à celles qui ne l'ont pas reçu, mais qui ont reçu un vaccin monovalent ou bivalent entre juillet et décembre 2022. Les sept premiers jours après la vaccination ont été exclus de l'analyse :
- Au cours de la période XBB, l'ER a varié de 53,2 % (intervalle de confiance à 95 % [IC] : 43,5 à 61,3 %) au premier mois à 60,4 % (IC 95 % : 46,0 à 70,9 %) au deuxième mois après la vaccination. Il n'y a pas eu d'estimations supérieures à deux mois pour la période XBB.
- Au cours de la période JN, l'ER a varié de 27,8 % (IC 95 % : 3,4 à 46,0 %) au premier mois à 19,8 % (IC 95 % : 0,2 à 35,5 %) au quatrième mois. Au cours des mois 5 à 7,il n'y avait probablement pas de protection vaccinale supplémentaire.
- Au cours de la période PK, l'ER était de 67,4 % (IC 95 % : 34,7 à 83,7 %) au premier mois et de 57,2 % (IC 95 % : 29,3 à 74,1 %) au deuxième mois. Les résultats de l'évaluation de l'ER des mois 3 à 10 suggère qu'il n'y avait probablement pas de protection vaccinale supplémentaire
- Les Centers for Disease Control and Prevention (US CDC) des États-Unis surveillent l'ER des vaccins à partir d'un certain nombre de réseaux, en utilisant le modèle test-négatif qui évalue l'augmentation de l'ER chez les personnes ayant reçu un vaccin XBB.1.5 par rapport à celles qui ne l'ont pas reçu (indépendamment des antécédents de vaccination ou d'infection) :
- Le réseau de pharmacies communautaires Increasing Community Access to Testing (ICATT), avec des données allant de septembre 2023 à mai 2024, a démontré l'ER du XBB.1.5 contre les maladies symptomatiques chez les personnes de 18 ans et plus : 53 % (95 % IC : 44 à 61 %) dans les 7 à 59 jours suivant la vaccination; 34 % (IC 95 % : 22 à 44 %) dans les 60 à 119 jours suivant la vaccination et 47 % (IC 95 % : 28 à 60 %) dans les 120 à 179 jours suivant la vaccination Note de bas de page 7. Si l'on considère l'intervalle de 60 à 119 jours après la vaccination, les résultats étaient plus élevés pour les souches qui étaient probablement non JN. 1 (c'est-à-dire probablement XBB) (58 %, 95 IC : 33 à 73 %) que pour ceux qui étaient probablement JN. 1 (37 %, IC 95 % : 13 à 51 %).
- Dans le réseau d'hôpitaux VISION, l'ER contre les consultations au service des urgences de septembre 2023 à août 2024 chez les adultes immunocompétents de 18 ans et plus était : 48 % (95 % IC : 45 à 52 %) dans les 7 à 59 jours suivant la vaccination; 28 % (IC 95 % : 23 à 32 %) dans les 60 à 119 jours suivant la vaccination; 17 % (IC 95 % : 10 à 23 %) dans les 120 à 179 jours suivant la vaccination et -5 % (IC 95 % : -11 à 1 %) dans les 180 à 299 jours suivant la vaccination Note de bas de page 8.
- Les estimations de l'ER contre l'hospitalisation dans le réseau VISION chez les adultes immunocompétents de 18 ans et plus de septembre 2023 à août 2024 sont les suivantes : 50 % (95 % IC : 44 à 55 %) dans les 7 à 59 jours suivant la vaccination; 38 % (IC 95 % : 31 à 44 %) dans les 60 à 119 jours suivant la vaccination; 21 % (IC 95 % : 10 à 31 %) dans les 120 à 179 jours suivant la vaccination et -8 % (IC 95 % : -19 à 3 %) dans les 180 à 299 jours suivant la vaccinationNote de bas de page 8. Les estimations pour les personnes immunodéprimées étaient légèrement inférieures à celles des personnes immunocompétentes, avec une tendance comparable à l'affaiblissement au fil du temps.
- Les estimations de l'ER contre les maladies graves (telles que les admissions en soins intensifs et les décès) dans le réseau VISION chez les personnes de 18 ans et plus de septembre 2023 à août 2024 sont les suivantes : 67 % (95 % IC : 55 à 75 %) dans les 7 à 59 jours suivant la vaccination; 56 % (IC 95 % : 42 à 67 %) dans les 60 à 119 jours suivant la vaccination; 40 % (IC 95 % : 16 à 58 %) dans les 120 à 179 jours suivant la vaccination et 21 % (IC 95 % : -3 à 40 %) dans les 180 à 299 jours suivant la vaccination Note de bas de page 8.
- Les chercheurs de l'Ontario ont fait état d'un modèle test-négatif impliquant des personnes de 50 ans et plus ayant reçu au moins deux vaccins à ARNm et ayant été testées par réaction en chaîne de la polymérase (PCR) entre le 24 septembre 2023 et le 1erjuin 2024 Note de bas de page 5. L'étude a porté sur 4 895 cas dont le test de dépistage du SRAS-CoV-2 s'est révélé positif et qui ont été hospitalisés ou sont décédés, ainsi que sur 23,223 témoins symptomatiques dont le test s'est révélé négatif. L'étude a évalué l'ER progressive du vaccin XBB.1.5 pour les personnes l'ayant reçu et celles qui ne l'ont pas reçu, en ce qui concerne les issues graves (hospitalisation et décès).
- Dans l'ensemble, les estimations de l'ER pour les vaccins XBB.1.5 ont démontré que la vaccination augmente la protection contre les maladies symptomatiques, les hospitalisations et les maladies graves, même dans les populations immunisées par des taux élevés d'infections ou de vaccinations antérieures, comparable aux résultats obtenus avec les précédents vaccins contre la COVID-19 (vaccins originaux et bivalents). Avec le vaccin XBB.1.5, l'ER contre les maladies graves était un peu plus élevée que celle contre l'hospitalisation Note de bas de page 8. La protection contre l'hospitalisation conférée par le vaccin XBB.1.5 semble être la plus élevée au cours des deux premiers mois suivant la vaccination et diminuer pour atteindre celle du groupe n'ayant pas reçu le vaccin XBB.1.5 au bout de quatre à six mois. La protection contre les souches plus proches de la souche vaccinale semble généralement être un peu plus élevée que contre les souches JN.1/ KP.2 plus éloignées lorsque l'on tient compte du temps écoulé depuis la vaccination, avec des ER élevées inattendues dans l'étude de Carazo et al. au cours de la période KP, alors que l'ER peu après la vaccination était semblable au cours des périodes XBB et JN Note de bas de page 6.
- Le mécanisme de protection accrue par un vaccin contre la COVID-19 mis à jour est probablement une combinaison d'une vaccination récente qui renforce la réponse immunitaire et d'un vaccin qui est plus proche de la souche en circulation. La contribution relative de chacun de ces facteurs est incertaine.
- Comme pour les précédents vaccins contre la COVID-19, on s'attend à ce que les vaccins à ARNm contre la souche KP.2 augmentent la protection contre une série d'effets, avec un déclin ultérieur au fil du temps. Les estimations de l'ER pour les vaccins contre la souche KP.2 devraient être disponibles avec l'augmentation de leur utilisation.
- L'immunité hybride offre une plus grande protection contre l'infection et la maladie grave que l'infection préalable ou la vaccination seule, en particulier lorsque l'immunité hybride s'inscrit dans le contexte d'une infection récente. Toutefois, cette protection s'estompe également avec le temps Note de bas de page 9 Note de bas de page 10 Note de bas de page 11 Note de bas de page 12 Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 17.
Innocuité des vaccins
- Les essais cliniques sur la COVID-19 et la surveillance nationale et internationale de l'innocuité du vaccin contre la COVID-19 fournissent des données probantes sur le sujet. Aucun nouvel événement indésirable n'a été identifié à ce jour lors de l'utilisation des vaccins contre la COVID-19 mis à jour.
Pour de plus amples renseignements, veuillez consulter la section sur l'innocuité et les événements indésirables indésirables dans le chapitre sur la COVID-19 du (GCI).
Économie
- Une analyse de l'environnement des évaluations économiques prises en compte par d'autres groupes techniques consultatifs nationaux pour la vaccination (GTCV) a été réalisée, afin d'orienter les directives les plus récentes du programme de vaccination contre la COVID-19. Une évaluation économique utilisant un nouveau modèle coût/utilité canadien a également été réalisée.
- Deux évaluations économiques pertinentes provenant d'autres GTCV ont été identifiées.
- Les évaluations économiques menées pour orienter les recommandations de vaccination contre la COVID-19 de l'automne 2025 et du printemps 2026 par le Joint Committee on Vaccination and Immunisation (JCVI) du Royaume-Uni ont soutenu la vaccination universelle en fonction de l'âge chez les personnes âgées, la vaccination de tous les résidents d'un établissement de soins pour personnes âgées et la vaccination de toutes les personnes de 6 mois et plus immunodéprimées Note de bas de page 18. L''âge limite final pour la vaccination en fonction de l'âge était déterminé par le prix du vaccin, qui n'est actuellement pas connu. En utilisant un seuil de coût/efficacité de 35 226 $ (20 000 £) par année de vie ajustée en fonction de la qualité (AVAQ), la vaccination pour tous les adultes de 75 ans et plus a été recommandée dans l'analyse primaire, qui a supposé un coût combiné du vaccin et de l'administration de 44 $ Note de bas de page 19. Lorsque le coût des vaccins est moins élevé, (par exemple, inférieur à un coût combiné de 44 $), il est recommandé d'étendre le programme aux adultes de 70 à 74 ans. Si l'on considère des coûts de vaccin plus élevés, le seuil d'âge recommandé serait alors supérieur à 75 ans.
- Une évaluation économique présentée au Advisory Committee on Immunization Practices (ACIP) aux États-Unis a estimé les ratios coût/efficacité différentiels (RCED) pour zéro, une ou deux doses par an du vaccin contre la COVID-19 mis à jour du point de vue sociétal pour les différents groupes d'âge Note de bas de page 20. Chez les adultes âgés de 65 ans et plus, le RCED pour une dose par an était de 80 443 $ par AVAQ et le RCED pour deux doses par an était de 487 311 $ par AVAQ. Chez les personnes de 5 à 64 ans, les RCED allaient de 284 068 $ à 457 892 $ par AVAQ pour une dose annuelle et supérieur à 1 000 000 $ par AVAQ gagnée pour deux doses par an.
- Deux nouvelles analyses de rapport coût/efficacité ont été utilisées pour soutenir la prise de décision concernant l'utilisation des vaccins contre la COVID-19 au Canada.
- La première était une évaluation d'un programme de vaccination avec des caractéristiques similaires aux recommandations de la CCNI au moment de l'analyse Note de bas de page 21.
- La deuxième était une analyse séquentielle qui évaluait le rapport coût/efficacité des programmes en fonction de l'éligibilité des groupes d'âge et des groupes à risque médical de plus en plus larges, afin d'identifier les caractéristiques optimales des programmes. L'objectif de cette deuxième analyse était d'identifier le rapport coût/efficacité de différentes options de programme à mesure que l'approvisionnement en vaccins contre la COVID-19 passe de l'approvisionnement fédéral à l'approvisionnement provincial et territorial Note de bas de page 22.
- Le nouveau modèle statique de coût/utilité basé sur les individus, utilisant les perspectives du système de santé et de la société ainsi que les données canadiennes, a montré qu'une stratégie de vaccination comportant les principales caractéristiques du programme de vaccination actuellement recommandé était probablement rentable par rapport à une stratégie de non-vaccination Note de bas de page 21. Ces caractéristiques clés consistaient en une vaccination semestrielle pour tous les adultes de 65 ans et plus et en une vaccination annuelle contre la COVID-19 pour les personnes de moins de 65 ans souffrant d'une ou de plusieurs affections médicales chroniques (AMC). Cette analyse a porté sur le rapport coût/efficacité global du programme de vaccination et n'a pas étudié le rapport coût/efficacité dans les différents groupes d'âge et de risque médical.
- Le passage de l'approvisionnement fédéral à l'approvisionnement provincial et territorial des vaccins a offert l'opportunité d'évaluer le rapport coût/efficacité du programme actuellement recommandé par rapport à d'autres options et d'identifier les stratégies de vaccination optimales. Pour ce faire, une analyse coût/utilité supplémentaire, utilisant le même modèle canadien, a été utilisée pour examiner le rapport coût/efficacité de la vaccination de différents groupes d'âge et de risque médical, de manière additive (c'est-à-dire en commençant par aucun programme de vaccination et en ajoutant progressivement des groupes de population) afin d'identifier les groupes de population pour lesquels la vaccination présentait le meilleur rapport qualité-prix Note de bas de page 22. Cette analyse a montré que le bénéfice économique dépendait du risque de subir des conséquences graves. Ainsi, la vaccination des groupes d'âge inférieurs à 65 ans n'était pas susceptible d'être rentable en utilisant les seuils communs. Les résultats des comparaisons séquentielles sont fournis pour toutes les stratégies qui n'ont pas été exclues en raison de leur dominance.
- Par rapport à l'absence de vaccination, la vaccination annuelle des adultes de 65 ans et plus était la plus efficace, avec un RCED de 7 830 $ par AVAQ dans l'analyse primaire, qui supposait un prix du vaccin de 43 $ par dose et un taux de gaspillage de 10 %. Les RCED sont restés inférieurs à 46 000 $ par AVAQ dans les scénarios prévoyant une augmentation du prix des vaccins (jusqu'à 107 $ par dose) ou une plus grande perte de vaccins (jusqu'à 30 %).
- Par rapport à la limitation de la vaccination annuelle aux adultes de 65 ans et plus, e le RCED pour la vaccination annuelle des adultes de 50 à 64 ans présentant une AMC était de 69 400 $.
- Par rapport à la vaccination annuelle des adultes âgés de 50 à 64 ans présentant une AMC et de tous les adultes de 65 ans et plus le RCED pour l'ajout d'une seconde dose à un intervalle de 6 mois pour les adultes de 65 ans et plus était de 137 505 $ par AVAQ.
- Par rapport à la vaccination annuelle pour les adultes de 50 à 64 ans présentant une AMC et à la vaccination semestrielle pour tous les adultes de 65 ans et plus, le RCED pour l'ajout de la vaccination annuelle pour la population âgés de moins de 50 ans présentant une ou plusieurs AMC était de 279 975 $ par AVAQ.
- Les résultats étaient sensibles aux hypothèses concernant la distribution saisonnière des cas et le moment de la vaccination par rapport au sommet d'activité de la COVID-19. Si le nombre de cas survenant au printemps et en été est plus élevé que prévu dans l'analyse primaire, ou si la date de début du programme est plus précoce, et qu'une deuxième dose est administrée à un intervalle de quatre mois pour mieux s'aligner sur les tendances à court terme de l'incidence de la COVID-19, la vaccination semestrielle des adultes de 65 ans et plus serait la stratégie optimale, sur la base d'un seuil de coût/efficacité de 50 000 $ par AVAQ.
- Les limites de cette analyse comprennent l'exclusion des effets indirects, qui peuvent sous-estimer les estimations du rapport coût/efficacité, et l'absence de modélisation pour d'autres groupes dont la vaccination est recommandée pour la saison 2023-2024 du virus respiratoire, notamment : les personnes appartenant ou provenant des communautés des Premières Nations, des Inuits et des Métis, les membres des communautés racialisées et d'autres communautés en quête d'équité, les femmes enceintes et les personnes enceintes, les personnes qui fournissent des services communautaires essentiels, les résidents des maisons de soins de longue durée et d'autres milieux de vie collectifs, ainsi que les personnes à risque moyen de 6 mois à moins de 65 ans pour lesquelles une recommandation discrétionnaire du CCNI a été émise. De plus, les personnes immunodéprimées ont été exclues du modèle pour la vaccination semestrielle.
- En l'absence de listes de prix du vaccin contre la COVID-19 au Canada, l'analyse primaire a utilisé un prix de vaccin de 43 $ par dose correspondant à 40 % du prix de la liste publique du CDC américain, sur la base d'une analyse non publiée de l'écart de prix relatif entre les listes de prix publiques du CDC américain et les prix de vaccins négociés au Canada pour tous les vaccins. En raison de l'utilisation de technologies vaccinales plus récentes et du passage d'un financement fédéral à un financement provincial et territorial, des prix plus élevés pour les vaccins sont possibles et ont été évalués dans le cadre d'analyses supplémentaires. Lorsque les administrations planifient l'ampleur du programme et son incidence sur le budget, il peut s'avérer prudent d'utiliser des prix estimés plus élevés afin d'éviter de sous-estimer le coût du programme.
- Les taux de maladies graves augmentant avec l'âge, le rapport coût/efficacité des programmes de vaccination contre la COVID-19 devient plus favorable avec des seuils d'âge plus élevés. Si l'on souhaite réduire la taille du programme pour des raisons budgétaires, il pourrait être envisageable d'augmenter le seuil d'âge pour la population adulte plus âgée et ainsi utiliser plus efficacement les ressources, en reconnaissant que moins de cas de maladies graves seront évités avec des seuils d'âge plus élevés.
Éthique, équité, faisabilité et acceptabilité
- Le CCNI vise toujours à simplifier les recommandations en matière de COVID-19 dans la mesure du possible, en équilibrant les données probantes scientifiques disponibles, les avis d'experts et les considérations programmatiques. Alors que les recommandations générales favorisent l'accès à la vaccination des personnes qui le souhaitent, les recommandations fondées sur le risque mettent en évidence les personnes pour lesquelles la vaccination est particulièrement importante et peuvent faciliter une communication plus adaptée des conseils aux personnes présentant un risque élevé. La complexité des recommandations vaccinales peut avoir une incidence sur l'utilisation des vaccins, la détermination du public cible pour l'administration des vaccins contre la COVID-19 mis à jour étant difficile pour les prestataires.
- L'utilisation du vaccin contre la COVID-19 a diminué au fil du temps avec chaque mise à jour, mais continue d'être la plus élevée chez les adultes plus âgés (en particulier les personnes de 80 ans et plus).
- Les membres des communautés des Premières Nations, Inuits et Métis du Canada sont plus jeunes que l'ensemble de la population canadienne, mais il a été observé qu'ils présentent un risque accru de développer une infection à la COVID-19 grave en raison d'une variété de facteurs, y compris des conditions médicales résultant de déterminants de la santé croisés. Ces déterminants de la santé, qui se recoupent, comprennent des facteurs sociaux, environnementaux et économiques, enracinés dans la colonisation historique et permanente et le racisme systémique (c'est-à-dire l'iniquité structurelle). Par conséquent, ces déterminants démographiques et sanitaires croisés devraient être pris en compte lors de l'élaboration de recommandations basées sur l'âge pour les programmes de vaccination, afin d'offrir une protection optimale aux personnes appartenant à ces communautés ou qui en proviennent. Les décisions autonomes doivent être prises par les peuples autochtones avec le soutien des partenaires de santé adaptés à la culture et de la santé publique, conformément à la Déclaration des Nations Unies sur les droits des peuples autochtones (DNUDPA).
- Les inégalités sociales ont contribué à un risque accru d'exposition au SARS-CoV-2 et de maladie grave lié à ce virus. Tout au long de la pandémie, la CCNI a reconnu que les populations racialisées, marginalisées et celles privées d'équité au Canada ont été touchées de manière disproportionnée par la COVID-19. Les barrières systémiques à l'accès aux soins de soutien nécessaires pour la COVID-19 comprenaient des facteurs tels que la pauvreté, le racisme systémique et l'absence de logement.
Calendrier des programmes d'immunisation et de vaccination
- Jusqu'à présent, les programmes de vaccination contre la COVID-19 lancés à l'automne se sont appuyés sur l'infrastructure en place depuis longtemps pour les campagnes de vaccination contre la grippe, les deux vaccins étant proposés au cours de la même période. Bien que cette approche soit avantageuse d'un point de vue opérationnel, elle est essentiellement programmée pour offrir le vaccin antigrippal (à partir d'octobre/novembre) avant l'augmentation de l'activité grippale qui débute généralement en novembre. Les programmes de vaccination contre la COVID-19 proposés au printemps ont également varié d'une administration à l'autre, avec des différences d'admissibilité, de calendrier et d'étendue de la promotion du programme.
- En 2023 et 2024, les programmes de vaccination contre la COVID-19 n'ont pas été programmés de manière optimale pour obtenir des bénéfices maximaux, que ce soit pour les doses d'automne ou de printemps. Sur la base de l'épidémiologie des deux dernières années, représentée par le pourcentage de tests positifs dans la figure 1, l'activité du SRAS-CoV-2 semble être la plus faible au printemps, avec des augmentations de l'activité à partir du début ou de la fin de l'été. Le maintien de la tendance à la baisse de l'activité du SRAS-CoV-2 au printemps est incertain pour les années à venir, ainsi que son utilisation pour planifier le calendrier de la prochaine vaccination contre la COVID-19.
- Depuis la fin du mois d'août 2022, des augmentations du pourcentage de positivité au SRAS-CoV-2 ont été régulièrement observées de la fin de l'été jusqu'au début du mois de janvier. La recrudescence de la COVID-19 qui se produit lorsque d'autres virus respiratoires d'automne et d'hiver circulent également peut aggraver l'incidence sur le système de santé.
- Comme nous l'avons vu dans la section précédente, le rapport coût/efficacité du programme de vaccination contre la COVID-19, en particulier pour les personnes à qui l'on recommande deux doses par an, est influencé par le calendrier du programme.
- Dans l'idéal, le calendrier des programmes de vaccination pourrait être établi en fonction de l'évolution de l'épidémiologie. Toutefois, les délais nécessaires pour planifier, communiquer et mettre en œuvre les programmes de vaccination pourraient rendre difficile la mise en œuvre de cette approche. Si les observations basées sur le pourcentage de positivité des deux années précédentes se poursuivent (ce qui est incertain) et si l'on se base sur une protection supplémentaire d'environ 4 à 6 mois contre les maladies graves résultant d'une vaccination récente (qui est la plus élevée dans les deux premiers mois suivant la vaccination), le calendrier optimal des vaccinations pourrait être en juillet et en novembre. Cette possible approche comporte toutefois un certain nombre de considérations importantes de faisabilité et d'acceptabilité, en particulier si le vaccin contre la COVID-19 mis à jour est autorisé en septembre/octobre (ce qui a été le cas les années précédentes) ce qui limite son utilité potentielle, notamment :
- La nécessité de proposer la dose de juillet avec la formulation de l'année précédente, ce qui pourrait entraîner une ER réduite et une moins bonne acceptation par le public que l'utilisation d'un vaccin mis à jour.
- La dose de juillet nécessiterait un programme de vaccination distinct du programme contre la grippe, alors que la dose de novembre pourrait ne pas être administrée en même temps que le vaccin antigrippal dans certaines administrations ou certains programmes. Le fait de séparer la vaccination contre la COVID-19 de la vaccination contre la grippe entraîne une augmentation des ressources et des coûts nécessaires à ces programmes, ainsi qu'un plus grand nombre de visites de patients pour se faire vacciner.
- Il est possible que le tableau épidémiologique basé sur les dernières années ne se maintienne pas. Des années supplémentaires de données épidémiologiques permettront de mieux comprendre les schémas d'activité endémique du SRAS-CoV-2.
- Si l'épidémiologie actuelle du SRAS-CoV-2 indique que l'activité est la plus faible au printemps, qu'elle augmente au cours de l'été et qu'elle reste élevée jusqu'au début du mois de janvier, il serait optimal d'avancer le moment de la sélection, de l'autorisation et de la mise à disposition de la souche pour permettre la disponibilité d'un vaccin contre la COVID-19 mis à jour au début de l'été.
Autres considérations
- En raison de l'incertitude concernant le calendrier optimal des programmes de vaccination contre la COVID-19, il fautéviter de faire référence à des doses de « printemps et d'automne » pour les personnes déjà vaccinées, mais de mentionner plutôt une à deux doses par an, avec un intervalle minimum de trois mois entre elles, afin de permettre une flexibilité maximale dans le choix du calendrier.
- Le CCNI fournit actuellement des conseils pour l'ensemble de l'année 2025 et la première moitié de l'année 2026, et poursuivra l'évaluation du calendrier des conseils en matière de vaccination en fonction des besoins, en tenant compte de facteurs tels que l'épidémiologie de la maladie et tout produit vaccinal contre la COVID-19 nouvellement autorisé.
- Le paysage des vaccins contre la COVID-19 continue d'évoluer avec le développement de la maladie et des vaccins combinés contre la grippe. Les facteurs qui seront pris en considération en ce qui concerne les produits combinés sont les suivants : l'épidémiologie des deux maladies, y compris le moment de la circulation du virus; l'immunogénicité ou l'efficacité potentielle et réelle et l'innocuité des vaccins combinés par rapport à chacun de ses composants administrés séparément; le coût du produit combiné par rapport à la somme de ses composants; et des considérations de faisabilité, y compris la facilité d'administrer un seul produit au lieu de deux, ainsi que des considérations de stockage et de manipulation.De plus, il est prévu qu'il y ait une opportunité de revoir les facteurs de risque de la COVID-19, y compris chez les femmes enceintes et les personnes enceintes.
Pour de plus amples renseignements sur les recommandations du CCNI concernant l'utilisation des vaccins contre la COVID-19, veuillez consulter les Déclarations et publications et le chapitre sur le vaccin contre la COVID-19 du GCI du CCNI.
Choix du vaccin contre la COVID-19
- La décision d'inclure des vaccins particuliers dans les programmes provinciaux et territoriaux dépend de plusieurs facteurs, notamment la disponibilité, les caractéristiques des vaccins, l'évaluation du rapport coût/efficacité et d'autres facteurs programmatiques et opérationnels, tels que les stratégies de mise en œuvre.
- Le contexte particulier du vaccin contre la COVID-19 réside dans le fait que l'acceptabilité et l'accès aux vaccins ont été influencés par des recommandations préférentielles antérieures pour les vaccins à ARNm. La recommandation préférentielle n'est plus en vigueur (voir la Mise à jour des directives sur l'utilisation du vaccin à sous-unités protéiques contre la COVID-19 [Nuvaxovid de Novavax] du CCNI). Les préférences en matière de produits peuvent subsister au sein de la population en raison des produits reçus par le passé et de la sensibilisation considérable du public qui s'est développée au cours de la pandémie autour des produits particuliers du vaccin contre la COVID-19. Les programmes de santé publique doivent tenir compte de l'incidence des limites d'accès à une seule plateforme vaccinale contre la COVID-19 sur l'acceptation et l'adoption du vaccin.
Recommandations
Veuillez consulter le tableau 1 pour une explication des fortes recommandations et des recommandations discrétionnaires du CCNI.
Les recommandations suivantes s'appliquent à l'ensemble de l'année 2025 et jusqu'à l'été 2026.
Les recommandations 1A et 1B concernent à la fois les personnes déjà vaccinées et les personnes non vaccinées, alors que les recommandations 2A et 2B ne concernent que les personnes déjà vaccinées.
Pour les personnes déjà vaccinées :
- Les recommandations 1A et 1B indiquent qui devrait ou qui peut recevoir au moins une dose par an, respectivement.
- Les recommandations 2A et 2B indiquent qui devrait et qui peut recevoir deux doses par an, respectivement.
Recommandation 1A. Le CCNI recommande un vaccin contre la COVID-19 pour les personnes déjà vaccinées et les personnes non vaccinées présentant un risque accru d'exposition par le SRAS-CoV-2 ou de maladie grave liée à la COVID-19, ce qui inclut les personnes suivantes :
- Tous les adultes de 65 ans et plus
- Les personnes de 6 mois et plus qui répondent à l'un des critères suivants :
- Les résidents d'établissements de soins de longue durée ou d'autres milieux de vie collectifs
- Les personnes ayant des affections médicales sous-jacentes qui les exposent à un risque plus élevé de maladie grave liée à la COVID-19, y compris les enfantsNote de bas de page a ayant des besoins de santé complexes
- Les femmes enceintes et les personnes enceintes
- Les personnes provenant des communautés des Premières Nations, des Métis et des Inuits ou qui y viventNote de bas de page b
- Les travailleurs de la santé et autres prestataires de soins dans les établissements et les collectivitésNote de bas de page c
- Les membres de communautés racialisées et d'autres communautés en quête d'équitéNote de bas de page d
(Forte recommandation du CCNI)
Recommandation 1B. Le CCNI recommande que toutes les autres personnes (6 mois et plus), vaccinées ou non, qui ne présentent pas de risque accru d'exposition par le SRAS-CoV-2 ou de maladie grave liée à la COVID-19 (c'est-à-dire qui ne figurent pas dans la liste ci-dessus), puissent recevoir un vaccin contre la COVID-19.
(Recommandation discrétionnaire du CCNI)
Considérations :
- Les personnes non vaccinées peuvent se voir proposer la vaccination contre la COVID-19 à tout moment, puisque le SRAS-CoV-2 circule tout au long de l'année. Les personnes non vaccinées recevraient le vaccin contre la COVID-19 selon le calendrier recommandé en fonction de l'âge, avec une ou deux doses supplémentaires pour les personnes modérément à sévèrement immunodéprimées.
- Les nouveaux receveurs d'une greffe de cellules souches hématopoïétiques (GCSH) et d'une thérapie par cellules T à récepteur antigénique chimérique (CAR) sont considérés comme naïfs sur le plan immunologique et devraient être vaccinés 3 à 6 mois suivant la greffe ou la thérapie, sans tenir compte des antécédents de vaccination. Ces personnes doivent recevoir une série de trois doses du vaccin contre la COVID-19, à un intervalle de 4 à 8 semaines.
- Veuillez consulter le chapitre sur la COVID-19 du GCI pour connaître les calendriers de vaccination des personnes non vaccinées.
- Les personnes déjà vaccinées recevraient une dose de vaccin contre la COVID-19 par année, à l'exception de celles mentionnées dans les recommandations 2A et 2B, qui devraient ou pourraient recevoir deux doses au cours d'une année donnée, respectivement.
- Pour les personnes déjà vaccinées, les provinces et les territoires détermineront le calendrier de l'administration de la dose annuelle en tenant compte de facteurs tels que la possibilité accrue d'une administration simultanée avec le vaccin antigrippal, le moment de la disponibilité des vaccins contre la COVID-19 mis à jour, les schémas épidémiologiques de la COVID-19 des années précédentes et les informations épidémiologiques émergentes, le cas échéant, disponibles et réalisables. L'intervalle minimum entre deux doses est de trois mois.
- Les vaccins contre la COVID-19 les plus récents doivent être utilisés pour l'administration de la dose annuelle aux personnes déjà vaccinées et pour l'immunisation des personnes non vaccinées.
- Sachant que la protection vaccinale est plus élevée peu de temps après la vaccination, les personnes pourraient décider individuellement du moment optimal pour recevoir leur dose de vaccin contre la COVID-19, en tenant compte de facteurs tels que le temps écoulé depuis la dernière dose de vaccin ou l'infection par le SRAS-CoV-2 confirmée par un test, l'étendue de la circulation du SRAS-CoV-2 dans la collectivité et les événements majeurs à venir tels que les voyages, les interventions médicales importantes ou les grands rassemblements.
- Dans le contexte épidémiologique actuel, le CCNI a axé ses recommandations pour les groupes professionnels sur les travailleurs de la santé (TS) et les autres prestataires de soins, ces personnes pouvant être amenées à s'occuper de personnes atteintes de la COVID-19 ou à travailler dans des environnements où des patients atteints de cette maladie sont traités. Ces travailleurs pourraient être exposés à un risque d'exposition en raison de leur travail et, en vertu du principe éthique de réciprocité, ils devraient avoir accès à des mesures de protection contre l'infection et les complications qui en découlent, y compris à des équipements de protection individuelle et à la vaccination.
En plus de la recommandation 1A, il est recommandé à certaines personnes déjà vaccinées et présentant un risque accru de maladie grave lié à la COVID-19 de recevoir une deuxième dose de vaccin contre la COVID-19 par année.
Recommandation 2A. Le CCNI recommande que les personnes suivantes doivent recevoir une deuxième dose de vaccin contre la COVID-19 par année :
- Les adultes de 80 ans et plus
- Les résidents d'établissements de soins de longue durée ou d'autres milieux de vie collectifs
- Les personnes de 6 mois et plus qui sont modérément à sévèrement immunodéprimées (en raison d'une affection sous-jacente ou d'un traitement)
(Forte recommandation du CCNI)
Recommandation 2B. Le CCNI recommande que les personnes suivantes puissent recevoir une deuxième dose de vaccin contre la COVID-19 par année :
- Adultes de 65 à 79 ans
(Recommandation discrétionnaire du CCNI)
Considérations :
- Certaines personnes présentant un risque accru de maladie grave liée à la COVID-19 pourraient bénéficier de deux doses de vaccin contre la COVID-19 par année, compte tenu de la circulation du SRAS-CoV-2 tout au long de l'année et de la durée prévue de la protection vaccinale.
- Les provinces et les territoires détermineront le calendrier où les deux doses seront administrées aux personnes déjà vaccinées qui présentent un risque accru de maladie grave liée à la COVID-19, et devront tenir compte des schémas épidémiologiques de la COVID-19 des années précédentes et des informations épidémiologiques émergentes, le cas échéant, disponibles et réalisables. L'intervalle minimum entre les doses est de trois mois.
- Au cours du premier semestre 2025, le vaccin JN.1/KP.2, disponible depuis l'automne 2024, sera utilisé dans les programmes de vaccination. La disponibilité d'un vaccin contre la COVID-19 mis à jour en 2025 déterminera le produit utilisé plus tard dans l'année (c'est-à-dire à l'automne 2025) et au cours du premier semestre 2026.
- L'âge et le cadre de vie continuent d'être utilisés comme indicateurs de la fragilité chez les personnes âgées, étant plus faciles à mesurer et à mettre en œuvre. Le risque de maladie grave lié à la COVID-19 est le plus élevé chez les adultes de 80 ans et plus, ainsi que chez les personnes les plus fragiles à tout âge. Comme le risque de maladie grave lié à la COVID-19 suit un gradient lié à l'âge chez les personnes âgées, il reste important que les adultes de 65 à 79 ans puissent bénéficier de la vaccination semestrielle contre la COVID-19.
Résumé des données probantes et de la justification :
- L'utilisation des termes « dose annuelle » ou « deux doses par an » plutôt que de « dose d'automne/de printemps » offre une certaine souplesse aux programmes pour déterminer le meilleur moment pour offrir des programmes de vaccination en fonction de facteurs tels que l'épidémiologie locale ou régionale et la faisabilité, bien qu'il soit possible que les vaccins continuent d'être offerts pendant les périodes d'automne et de printemps.
- Le CCNI fait désormais référence à un intervalle minimum entre les doses de vaccin (de trois mois), afin de permettre aux provinces et aux territoires de déterminer le calendrier idéal pour mettre en place leurs programmes de vaccination. De même, les individus ou les vaccinateurs pourraient envisager de retarder de trois mois la vaccination contre la COVID-19 des personnes déjà vaccinées, si elles présentent une infection récente par le SRAS-CoV-2 confirmée par un test.
- En fonction de l'âge et de la disponibilité du vaccin, un vaccin à ARNm (pour les personnes de 6 mois et plus) ou à sous-unité protéique contre la COVID-19 (pour les personnes de 12 ans et plus) peut être utilisé chez les personnes non vaccinées ou déjà vaccinées qui ne présentent pas de contrindications au vaccin.
- Conformément aux recommandations précédentes, les vaccins contre la COVID-19 pourraient être administrés simultanément (c'est-à-dire le même jour) ou à tout moment avant ou après les vaccins autres que ceux contre la COVID-19 (y compris les vaccins vivants et non vivants).
- Les programmes de vaccination contre la COVID-19 peuvent être rentables lorsqu'ils sont axés sur des groupes présentant un risque plus élevé de maladie grave. Si l'on souhaite réduire la taille du programme pour des raisons budgétaires, il pourrait être envisageable d'augmenter le seuil d'âge pour la population adulte plus âgée et ainsi utiliser plus efficacement les ressources, en reconnaissant que moins de cas de maladies graves seront évités avec des seuils d'âge plus élevés.
- Les administrations pourraient envisager d'utiliser un prix estimé du vaccin plus élevé pour la planification du programme que celui utilisé dans les modèles économiques de la présente déclaration, afin d'éviter de sous-estimer les besoins budgétaires face à l'incertitude des prix des vaccins.
- Les souches de SRAS-CoV-2 pourraient continuer à muter, avec l'apparition de différents variants ou sous-lignées qui ne sont pas aussi étroitement liés aux vaccins disponibles. Les organismes de réglementation pourraient recommander une ou plusieurs mises à jour de la cible antigénique des vaccins contre la COVID-19 en 2025. L'utilisation d'un vaccin mis à jour devrait permettre d'obtenir de meilleures réponses immunitaires contre les souches de SRAS-CoV-2 en circulation que les vaccins antérieurs. Toutefois, on peut s'attendre à un certain degré de réaction immunitaire croisée et à une protection croisée associée à une vaccination récente, quelle que soit la souche contenue dans le vaccin, d'après les données recueillies à ce jour avec les vaccins contre la COVID-19.
- Dans le contexte post-pandémique, et comme pour tout programme de vaccination, il convient de continuer à prendre en compte les besoins des différents groupes de population, en fonction de leur état de santé, de leur appartenance ethnique ou culturelle, de leurs capacités et d'autres facteurs socioéconomiques et démographiques susceptibles de placer les individus dans une situation de vulnérabilité (par exemple, vulnérabilités professionnelles, sociales, économiques ou biologiques). Ces efforts devraient inclure l'intégration des valeurs et des préférences de ces populations dans la planification des programmes de vaccination et le renforcement des capacités pour garantir l'accès,la commodité et l'acceptation des services de vaccination.
Priorités de recherche
- Le suivi continu des données relatives à l'innocuité, à l'immunogénicité, à l'efficacité potentielle et à l'efficacité réelle des vaccins contre la COVID-19, y compris avec des vaccins mis à jour, par le biais d'essais cliniques et d'études en situation réelle, y compris le degré et la durée de la protection conférée contre les variants et sous-lignées en circulation. La recherche devrait également prendre en compte les implications cliniques d'une infection antérieure par le SRAS-CoV-2 et d'une immunisation répétée. Des études visant à évaluer l'ER du vaccin par rapport à une série de résultats, notamment l'infection asymptomatique, la transmission, la maladie symptomatique, la maladie grave, et les conséquences potentielles à long terme de l'infection par le SRAS-CoV-2, telles que l'état post-COVID-19 et le déclin fonctionnel persistant. L'impact de la nouvelle souche par rapport à un vaccin récent (quelle que soit la souche) sur l'augmentation de l'ER doit être évalué si possible.
- Surveillance continue de l'ER dans des populations spéciales à haut risque d'issues graves. Il s'agirait notamment de poursuivre l'évaluation du calendrier vaccinal optimal et de la dose de vaccin pour les personnes modérément à sévèrement immunodéprimées, afin d'assurer une ER et une durée de protection optimales.
- La surveillance continue de l'épidémiologie de la COVID-19, y compris des variants ou des sous-lignées du SRAS-CoV-2 et des tendances saisonnières, afin d'orienter les programmes futurs et leurs calendriers optimaux.
- L'incidence sur l'immunité à court et à long terme, ainsi que les implications à long terme (c'est-à-dire le risque d'affection post-COVID-19, les liens avec d'autres problèmes de santé [par exemple, le développement d'une maladie auto-immune ou métabolique]) lorsque la première exposition immunologique est l'infection par rapport à la vaccination, et inversement.
- De nouvelles évaluations de l'innocuité, de l'immunogénicité et de l'ER de l'administration simultanée des vaccins contre la COVID-19 avec d'autres vaccins dans différents groupes d'âge.
- Le suivi continu de l'acceptation et de la couverture vaccinale au Canada, pour les vaccins contre la COVID-19 et d'autres vaccins systématiques, y compris l'examen des mesures susceptibles de réduire le risque de disparités dans la confiance et l'acceptation des vaccins au sein de différentes sous-populations (y compris les personnes appartenant à des communautés racialisées et à d'autres communautés en quête d'équité, qui peuvent être touchées de manière disproportionnée en raison de facteurs d'équité croisés).
| Force de la recommandation du CCNI (fondée sur des facteurs qui ne se limitent pas à la force des données probantes, tels que le besoin en santé publique) | Forte | Discrétionnaire |
|---|---|---|
| Libellé | « devrait/ne devrait pas être réalisée » | « peut/peut ne pas être réalisée » |
| Justifications | Les avantages connus/attendus l'emportent sur les inconvénients connus/attendus (« devrait »); ou les inconvénients connus/attendus l'emportent sur les avantages connus/attendus (« ne devrait pas »). |
Les avantages connus/attendus sont à peu près équivalents aux inconvénients connus/attendus ou les données probantes n'indiquent pas avec certitude les avantages et les inconvénients. |
| Conséquences | Une recommandation forte s'applique à la plupart des populations/personnes et devrait être suivie, à moins qu'il n'existe une justification claire et convaincante d'utiliser une autre approche. | Une recommandation discrétionnaire peut être offerte ou non pour certaines populations/personnes dans certaines circonstances. D'autres approches peuvent être acceptables. |
Abréviations
- ACIP
- Advisory Committee on Immunization Practices (États-Unis)
- AMC
- Affectation médicale chronique
- ASPC
- Agence de la santé publique du Canada
- AVAQ
- Année de vie ajustée en fonction de la qualité
- CAR
- Récepteur antigénique chimérique
- CCNI
- Comité consultatif national de l'immunisation
- CDC
- Centers for Disease Control and Prevention des États-Unis
- DNUDPA
- Déclaration des Nations Unies sur les droits des peuples autochtones
- ER
- Efficacité réelle
- GCI
- Guide canadien d'immunisation
- GCSH
- Greffe de cellules souches hématopoïétiques
- GT COVID-19
- Groupe de travail sur la COVID-19
- GTCV
- Groupe technique consultatif pour la vaccination
- IC
- Intervalle de confiance
- JCVI
- Joint Committee on Vaccination and Immunisation du Royaume-Uni
- PCR
- Réaction en chaîne de la polymérase
- RCED
- Rapport coût/efficacité différentiel
- SSDVR
- Système de surveillance de la détection des virus respiratoires
- TS
- Travailleurs de la santé
- USI
- Unité de soins intensifs
- VRS
- Virus respiratoire syncytial
Remerciements
La présente déclaration a été préparée par : E Wong, B Warshawsky, A Tuite, A Simmons, S Wilson et R Harrison, au nom du CCNI.
Le CCNI remercie vivement les personnes suivantes pour leur contribution : J Daniel, R Miranda, M Salvadori, A Howarth et le secrétariat du CCNI.
CCNI
Membres du CCNI : R Harrison (président), V Dubey (vice-président), M Andrew, J Bettinger, N Brousseau, A Buchan H Decaluwe, P De Wals, E Dubé, K Hildebrand, K Klein, M O'Driscoll, J Papenburg, A Pham-Huy, B Sander et S Wilson.
Représentants de liaison : L Bill/M Nowgesic (Canadian Indigenous Nurses Association), S Buchan (Association canadienne pour la recherche et l'évaluation en immunisation), E Castillo (Société des obstétriciens et gynécologues du Canada), J Comeau (Association pour la microbiologie médicale et l'infectiologie Canada), M Lavoie (Conseil des médecins hygiénistes en chef), J MacNeil (Center for Disease control and Prevention), M McIntyre (Association des infirmières et infirmiers du Canada), D Moore (Société canadienne de pédiatrie), M Osmack (Association des médecins autochtones du Canada), J Potter (Collège des médecins de famille du Canada), D Singh (Comité canadien d'immunisation) et A Ung (Association des pharmaciens du Canada).
Représentants d'office : E Ebert (Défense nationale et Forces armées canadiennes), P Fandja (Direction des produits de santé commercialisés, Santé Canada), E Henry (Centre pour la surveillance et les programmes d'immunisation [CSPI], ASPC), M Lacroix (Groupe consultatif d'éthique en santé publique, ASPC), J Stothart (Centre de surveillance de l'immunisation, ASPC), J Kosche (Centre de préparation vaccinale et thérapeutique [CPVT], ASPC), C Pham (Direction des produits biologiques et radiopharmaceutiques, Santé Canada), M Routledge (Laboratoire national de microbiologie, ASPC), M Su (Épidémiologie et surveillance de la COVID-19, ASPC) et T Wong (Direction générale de la santé des Premières Nations et des Inuits, Services aux Autochtones Canada).
Groupe de travail du CCNI sur les vaccins contre la COVID-19
Membres : S Wilson (président), M Andrew, H Decaluwe, P De Wals, D Moore, B Sander, A Buchan, Y-G Bui, M Miller, L Panagiotakopoulos, D Singh, L Roper, et M Willcott.
Participants de l'ASPC : H Birdi, P Doyon-Plourde, C Jensen, R Krishnan, M Salvadori, A Tuite, A Simmons, A Howarth, MC Tunis, B Warshawsky, E Wong, L Lee, E Kovacs, G Gebretekle, N Forbes, et J Zafack.
Notes de bas de page
- Note de bas de page a
-
Il existe peu de données sur les facteurs de risque cliniques de la maladie grave liée à la COVID-19 dans les populations pédiatriques. Les enfants présentant un risque accru d'issue grave peuvent être médicalement fragiles ou avoir des problèmes médicaux complexes, souffrir de plusieurs comorbidités, être atteints de troubles neurologiques, souffrir de maladies pulmonaires chroniques, être atteints du syndrome de Down (trisomie 21) ou présenter d'autres conditions d'immunodépression.
- Note de bas de page b
-
Les décisions autonomes doivent être prises par les peuples autochtones avec le soutien des partenaires de santé et de la santé publique, conformément à la DNUDPA
- Note de bas de page c
-
Aux fins de la présente déclaration, les travailleurs de la santé (TS) et autres prestataires de soins dans les établissements et les milieux communautaires désignent les TS, les prestataires de soins, le personnel d'intervention d'urgence (c'est-à-dire les premiers intervenants, y compris les pompiers, la police et les ambulanciers), les personnes qui travaillent dans des établissements ou des résidences de soins continus ou de longue durée, les personnes qui fournissent des soins à domicile aux personnes à haut risque, et les étudiants des services de santé connexes. Les travailleurs de la santé désignent toute personne, rémunérée ou non, qui fournit des services, travaille, se porte volontaire ou suit une formation dans un hôpital, une clinique ou un autre établissement de soins de santé.
- Note de bas de page d
-
Les inégalités sociales ont contribué à accroître le risque d'exposition au SRAS-CoV-2 et de maladie grave. Durant la pandémie, le CCNI a reconnu que les populations racialisées, marginalisées et autres populations victimes d'un manque d'équité au Canada étaient touchées de manière disproportionnée par la COVID-19. Les obstacles systémiques à l'accès aux soins de soutien nécessaires pour la COVID-19 comprennent des facteurs tels que la pauvreté, le racisme systémique et l'itinérance. Ces groupes restent des populations recommandées pour la vaccination, afin de reconnaître les inégalités de santé auxquelles ces personnes peuvent continuer à être confrontées dans le contexte post-pandémique.
Références
- Note de bas de page 1
-
Ismail SJ, Langley JM, Harris TM, et al. Canada's National Advisory Committee on Immunization (NACI): evidence-based decision-making on vaccines and immunization. Vaccine. 19 avr;28 Suppl 1:A58-63. http://doi.org/10.1016/j.vaccine.2010.02.035. https://www.ncbi.nlm.nih.gov/pubmed/20412999
- Note de bas de page 2
-
Ismail SJ, Hardy K, Tunis MC, et al. A framework for the systematic consideration of ethics, equity, feasibility, and acceptability in vaccine program recommendations. Vaccine. 10 aoû;38(36):5861-5876. http://doi.org/10.1016/j.vaccine.2020.05.051
- Note de bas de page 3
-
Public Health Agency of Canada. Respiratory virus detections in Canada. Ottawa (ON). Public Health Agency of Canada; 10 juil 2024 [cited 9 déc 2024]. Disponible à : https://www.canada.ca/en/public-health/services/surveillance/respiratory-virus-detections-canada.html
- Note de bas de page 4
-
COVID-19 Immunity Task Force (CITF). Seroprevalence in Canada. Data cut-off 31 décembre 2023 [Internet]. Montreal (QC). COVID-19 Immunity Task Force; [cited 9 déc 2024]. Disponible à : https://www.covid19immunitytaskforce.ca/seroprevalence-in-canada/
- Note de bas de page 5
-
Kwong JC. Personal communication: COVID-19 XBB vaccine effectiveness against Omicron severe outcomes – preliminary results. 7 oct 2024 et 4 déc 2024.
- Note de bas de page 6
-
Carazo S, Skowronski DM, Brousseau NM, et al. Monovalent mRNA XBB.1.5 vaccine effectiveness against COVID-19 hospitalization in Quebec, Canada: impact of variant replacement and waning protection during 10-month follow-up. medRxiv. 13 nov 2024.11.13.24317190. http://doi.org/10.1101/2024.11.13.24317190
- Note de bas de page 7
-
Link-Gelles R. Effectiveness of COVID-19 (2023-2024 Formula) vaccines [slides presented at the Advisory Committee on Immunization Practices meeting on 26 juin 2024] [Internet]. Atlanta (GA): CDC; 26 juin 2024 [cited 9 déc 2024]. Disponible à : https://www.cdc.gov/acip/downloads/slides-2024-06-26-28/03-COVID-Link-Gelles-508.pdf
- Note de bas de page 8
-
Link-Gelles R. Effectiveness of COVID-19 vaccines [slides presented at the Advisory Committee on Immunization Practices meeting on 23 octobre 2024] [Internet]. Atlanta (GA): CDC; 23 oct 2024 [cited 9 déc 2024]. Disponible à : https://www.cdc.gov/acip/downloads/slides-2024-10-23-24/04-COVID-Link-Gelles-508.pdf
- Note de bas de page 9
-
Altarawneh HN, Chemaitelly H, Ayoub HH, et al. Effects of previous infection and vaccination on symptomatic Omicron infections. N Engl J Med. 15 juin 2022;387(1):21-34. http://doi.org/10.1056/NEJMoa2203965
- Note de bas de page 10
-
Bobrovitz N, Ware H, Ma X, et al. Protective effectiveness of previous SARS-CoV-2 infection and hybrid immunity against the omicron variant and severe disease: a systematic review and meta-regression. Lancet Infect Dis. mai 2023;23(5):556-567. http://doi.org/10.1016/S1473-3099(22)00801-5
- Note de bas de page 11
-
Carazo S, Skowronski DM, Brisson M, et al. Protection against omicron (B.1.1.529) BA.2 reinfection conferred by primary omicron BA.1 or pre-omicron SARS-CoV-2 infection among health-care workers with and without mRNA vaccination: a test-negative case-control study. Lancet Infect Dis. jan 2023;23(1):45-55. http://doi.org/10.1016/S1473-3099(22)00578-3
- Note de bas de page 12
-
Carazo S, Skowronski DM, Brisson M, et al. Prior infection- and/or vaccine-induced protection against Omicron BA.1, BA.2 and BA.4/BA.5-related hospitalisations in older adults: a test-negative case-control study in Quebec, Canada. medRxiv. 21 décembre 2022.12.21.22283740. http://doi.org/10.1101/2022.12.21.22283740
- Note de bas de page 13
-
Cerqueira-Silva T, de Araujo Oliveira V, Paixao ES, et al. Vaccination plus previous infection: protection during the omicron wave in Brazil. Lancet Infect Dis. juil 2022;22(7):945-946. http://doi.org/10.1016/S1473-3099(22)00288-2
- Note de bas de page 14
-
Chin ET, Leidner D, Lamson L, et al. Protection against Omicron from vaccination and previous infection in a prison system. N Engl J Med. 10 nov 2022;387(19):1770-1782. http://doi.org/10.1056/NEJMoa2207082
- Note de bas de page 15
-
Spreco A, Dahlstrom O, Joud A, et al. Effectiveness of the BNT162b2 mRNA vaccine compared with hybrid immunity in populations prioritized and non-prioritized for COVID-19 vaccination in 2021-2022: A naturalistic case-control study in Sweden. Vaccines (Basel). 7 aoû 2022;10(8). http://doi.org/10.3390/vaccines10081273
- Note de bas de page 16
-
Vicentini M, Venturelli F, Mancuso P, et al. Risk of SARS-CoV-2 reinfection by vaccination status, predominant variant, and time from previous infection: A cohort study in Italy. SSRN Electronic Journal. juin 2022. http://doi.org/10.2139/ssrn.4132329
- Note de bas de page 17
-
Lind ML, Robertson AJ, Silva J, et al. Effectiveness of primary and booster COVID-19 mRNA vaccination against Omicron variant SARS-CoV-2 infection in people with a prior SARS-CoV-2 infection. medRxiv. 19 avr 2022.04.19.22274056. http://doi.org/10.1101/2022.04.19.22274056
- Note de bas de page 18
-
Joint Committee on Vaccination and Immunisation. JCVI statement on COVID-19 vaccination in 2025 and spring 2026. United Kingdom. 14 nov 2024 [cited 9 déc 2024]. Disponible à : https://www.gov.uk/government/publications/covid-19-vaccination-in-2025-and-spring-2026-jcvi-advice/jcvi-statement-on-covid-19-vaccination-in-2025-and-spring-2026
- Note de bas de page 19
-
Keeling MJ, Hill EM, Petrou S, et al. Cost-effectiveness of routine COVID-19 adult vaccination programmes in England. medRxiv. 8 nov 2024.11.08.24316972. http://doi.org/10.1101/2024.11.08.24316972
- Note de bas de page 20
-
University of Michigan COVID-19 Vaccination Modelling Team. Economic analysis of an additional dose of the 2024-2025 COVID-19 vaccine [slides presented at the Advisory Committee on Immunization Practices meeting on 23 octobre 2024] [Internet]. Atlanta (GA): CDC; 23 oct 2024 [cited 9 déc 2024]. Disponible à : https://www.cdc.gov/acip/downloads/slides-2024-10-23-24/05-COVID-Prosser-508.pdf
- Note de bas de page 21
-
Simmons AE, Miranda RN, Li MWZ, et al. Cost-utility analysis of current COVID-19 vaccination program recommendations in Canada. [manuscript]. medRxiv. 2024:2024.12.13.24318988. https://doi.org/10.1101/2024.12.13.24318988.
- Note de bas de page 22
-
Miranda RN, Simmons AE, Li MWZ, et al. Cost-utility analysis of COVID-19 vaccination strategies for endemic SARS-CoV-2 circulation in Canada. medRxiv. 6 déc 2024.12.06.24318620. http://doi.org/10.1101/2024.12.06.24318620
