Archivée - Mises à jour du Guide canadien d'immunisation

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 44-12 : Vaccination des adultes
Date de publication : 6 décembre 2018
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 44-12, le 6 décembre 2018 : Vaccination des adultes
Aperçu
Quoi de neuf dans le Guide canadien d’immunisation (de novembre 2016 à novembre 2018)?
A Fleurant-Ceelen1, M Tunis1, A House1, au nom du Comité consultatif national de l’immunisation (CCNI)*
Affiliation
1 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa (Ontario)
Correspondance
Citation proposée
Fleurant-Ceelen A, Tunis M, House A, au nom du Comité consultatif national de l’immunisation (CCNI). Quoi de neuf dans le Guide canadien d’immunisation (de novembre 2016 à novembre 2018)?, Relevé des maladies transmissibles au Canada 2018;44(12):398-403. https://doi.org/10.14745/ccdr.v44i12a06f
Mots clés : Immunisation, CCNI, Canada, mise à jour, vaccin
Résumé
Le Guide canadien d’immunisation est une ressource en ligne présentant aux fournisseurs de soins de santé et aux professionnels de la santé publique du Canada des recommandations fondées sur des données probantes relativement à l’utilisation des vaccins et aux méthodes d’administration des vaccins. Son contenu est fondé sur les plus récentes recommandations du Comité consultatif national de l’immunisation (CCNI) et du Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV). Le Guide canadien d’immunisation (GCI) est fréquemment actualisé en ligne afin de tenir compte de nouvelles données probantes et de modifications aux indications de produits. Entre novembre 2016 et novembre 2018, de nouvelles recommandations ont été ajoutées au Guide, ou des recommandations y ont été actualisées. Ces nouveautés concernent notamment les chapitres sur les Méthodes d’administration des vaccins et l’Immunisation des sujets immunodéprimés, l’Immunisation durant la grossesse et l’allaitement, ainsi que sept vaccins actifs (le choléra, la diarrhée du voyageur, la grippe, l’hépatite A, l’hépatite B, l’herpès zoster, le virus du papillome humain et la coqueluche). Il comprend aussi des mises à jour récentes sur la prophylaxie post-exposition contre la rougeole.
Introduction
Depuis 1964, le Comité consultatif national de l’immunisation (CCNI) prodigue des conseils sur les vaccins aux gouvernements et aux professionnels, aussi bien au Canada qu’à l’étranger. Pour ce faire, il distribue une série de produits d’information répondant aux besoins d’une variété d’auditoires. Le CCNI met au point des produits techniques détaillés, par exemple des analyses documentaires ou des déclarations, à l’intention des experts en immunisation et des décideurs. Le CCNI élabore aussi des produits sommatifs et translationnels, notamment des sommaires de déclarations publiés dans le Relevé des maladies transmissibles au Canada, ainsi que des mises à jour dans le Guide canadien d’immunisation (GCI). Ces produits sont destinés aux professionnels de première ligne de la santé publique et des soins cliniques. La figure 1 donne un aperçu du processus de production du CCNI.
Depuis 1979, le GCI renseigne les dispensateurs de vaccins de première ligne sur les mesures cliniques à prendre en matière d’immunisation Note de bas de page 2. Depuis 2012, le GCI est devenu un document évolutif offert en ligne Note de bas de page 3. Il est régulièrement mis à jour au fur et à mesure que le CCNI formule de nouvelles recommandations. Il comprend également des recommandations formulées par le Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV) relativement aux vaccins et à des questions connexes. Le GCI ne traite pas de questions économiques ou sociales liées à l’immunisation. Toutefois, il met en évidence l’évolution de l’épidémiologie des maladies, les indices de problèmes liés à l’innocuité et les difficultés en matière d’approvisionnement de vaccins.
Le GCI est divisé en cinq parties : Information clé sur l’immunisation; Innocuité des vaccins; Vaccination de populations particulières; Vaccins actifs; et Agents d’immunisation passive.
La présente mise à jour vise à donner un aperçu des modifications apportées au GCI entre novembre 2016 et novembre 2018. Ces modifications touchent de l’information clé sur l’immunisation, la vaccination de populations particulières, les vaccins actifs et la prophylaxie post-exposition contre la rougeole.
Figure 1 : Comité consultatif national sur l’immunisation – Processus de production
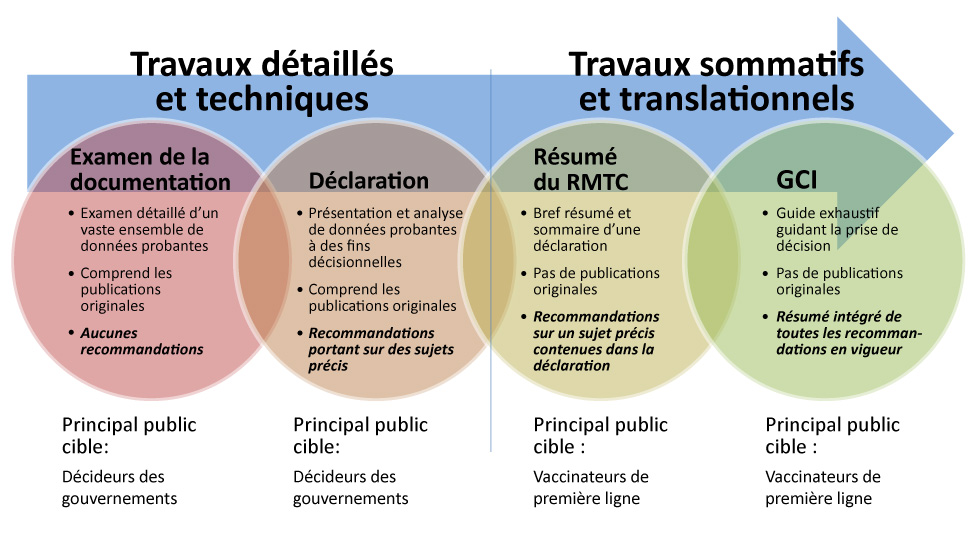
Description textuelle : Figure 1
Cette figure illustre le processus de production du Comité consultatif national de la vaccination (CCNI). Une flèche indique un continuum entre les types de produits : à gauche se trouvent les travaux détaillés et technique et à droite, les travaux sommatifs and translationnels. Quatre types de produits du CCNI sont présentés: examen de la documentation, Déclaration, Résumé du RMTC, et Guide canadien de l’immunisation.
À gauche du continuum, l’examen de la documentation est décrit comme un produit détaillé et technique qui fournit un examen détaillé d’un vaste ensemble de données probantes et qui comprend les publications originales mais aucunes recommandations. Le public cible est les décideurs des gouvernements.
En continuité dans le continuum, la déclaration est aussi catégorisée comme produit détaillé et technique présentant et analysant les données probantes à des fins décisionnelles. La déclaration comprend des recommandations portant sur des sujets précis. Son public cible est les décideurs des gouvernements.
Plus loin dans le continuum, le résumé du Relevé des maladies transmissibles au Canada est décrit comme un produit sommatif et translationnel qui présente un bref résumé et sommaire d’une déclaration mais n’inclut pas de publications originales. Le résumé du RMTC contient les recommandations sur un sujet précis contenues dans une déclaration du CCNI. Son public cible est les vaccinateurs de première ligne.
À droite du continuum, le Guide canadien d'immunisation est aussi décrit comme un produit sommatif et translationnel. Il constitue un guide exhaustif guidant la prise de décision et ne comprend aucune publication originale. Le CIG est un résumé intégré de toutes les recommandations en vigueur; son principal public cible est les vaccinateurs de première ligne.
Information clé sur l’immunisation
Le chapitre sur les Méthodes d’administration des vaccins Note de bas de page 4 a été mis à jour. Il comprend maintenant des Lignes directrices pour le choix de l’aiguille mettant l’accent sur l’importance de choisir la longueur de l’aiguille selon chaque cas pour une injection intramusculaire, et d’évaluer le niveau de viscosité de l’agent immunisant, ainsi que l’âge, le poids et la masse musculaire du bénéficiaire. L’utilisation d’aiguilles à filtre n’est pas recommandée, car des ingrédients actifs comme les adjuvants pourraient être filtrés pendant l’injection. On y note qu’une injection peut être pratiquée sur un tatouage ou une marque de naissance superficielle, mais qu’il faut éviter les endroits où le système lymphatique pourrait être perturbé. Ce chapitre comprend aussi un nouveau tableau présentant des stratégies de gestion de la douleur liée à la vaccination, destinées à des patients de tout âge. Au sujet de la combinaison du contenu des flacons multidoses, on conseille aux fournisseurs de soins de santé de s’en tenir aux politiques de la province ou du territoire, ou de l’organisation.
Vaccination de populations particulières
Deux chapitres ont fait l’objet de mises à jour : Immunisation des sujets immunodéprimés et Immunisation durant la grossesse et l’allaitement.
Le chapitre consacré à l’Immunisation des sujets immunodéprimés Note de bas de page 5 comprend maintenant des tableaux présentant des recommandations sur l’immunisation par vaccin, en tenant compte de l’immunodéficience primaire et de l’immunodéficience acquise (secondaire), des candidats à une transplantation ou des receveurs d’une transplantation et des personnes infectées par le VIH. On y trouvera de l’information inédite sur les déficiences de l’immunité naturelle, les facteurs à prendre en considération pour les vaccins contre la rougeole, les oreillons et la rubéole, ainsi que la varicelle chez les sujets qui présentent des déficits partiels en lymphocytes T; des contre-indications en matière d’administration de vaccins viraux vivants pour certains cas de déficit en cellule phagocytaires et de traitement immunosuppresseur.
Le chapitre Immunisation durant la grossesse et l’allaitement Note de bas de page 6 a été mis à jour pour tenir compte d’une nouvelle recommandation préconisant l’administration du vaccin contre la coqueluche entre la 27e et la 32e semaine de grossesse. Il y est clairement dit que les vaccins contenant du thimérosal sont sûrs pendant la grossesse et devraient être administrés si c’est indiqué. L’administration d’immunoglobulines anti-Rh et d’autres produits sanguins, et l’administration d’une série de vaccins (antiméningococcique conjugué quadrivalent; antiméningococcique B; fièvre jaune; encéphalite japonaise) pendant la grossesse font également l’objet de nouvelles considérations.
Vaccins actifs et immunisation passive
Sept chapitres consacrés à des vaccins actifs ont été mis à jour, et l’information concernant la prophylaxie post-exposition contre la rougeole à l’aide de produits à base d’immunoglobuline a été actualisée.
Choléra et Escherichia coli entérotoxinogène (diarrhée du voyageur)
Les avantages de ce vaccin étant limités, le vaccin oral contre le choléra ne fait plus partie des recommandations courantes pour prévenir la diarrhée du voyageur. Le CCMTMV note qu’il peut être conseillé pour les personnes présentant un risque particulièrement élevé d’infection, de complications de santé ou qui risquent d’être fortement incommodées par la diarrhée du voyageur, par exemple les travailleurs humanitaires, les professionnels de la santé travaillant dans des pays endémiques, les voyageurs courant un risque élevé d’être exposés à de l’eau ou à de la nourriture contaminée, les sujets immunodéprimés et ceux atteints d’une maladie chronique qui courent un plus grand risque de souffrir des conséquences graves de la diarrhée du voyageur. De plus, le CCMTMV recommande que toutes les autres personnes prennent les mesures d’hygiène courantes (hygiène des mains, précautions relatives aux aliments et aux boissons) et se procurent les médicaments en vente libre pour la gestion de la diarrhée du voyageur Note de bas de page 7Note de bas de page 8.
Grippe
Les recommandations relatives au vaccin contre la grippe saisonnière sont mises à jour chaque année en prévision de la grippe saisonnière Note de bas de page 9.
Hépatite A
La posologie recommandée pour l’administration intramusculaire d’immunoglobulines (Ig IM) en prophylaxie pré-exposition et post-exposition pour l’hépatite A a été augmentée conformément à de nouvelles indications dans la monographie de produit.
Hépatite B
En s’appuyant sur les données relatives à l’immunogénicité et l’innocuité du vaccin contre l’hépatite B, le CCNI a révisé sa recommandation relative à la dose de Recombivax HBMD. Pour les nourrissons (nés de mères non infectées par le virus de l’hépatite B) et les enfants jusqu’à 11 ans, la dose est passée de 0,25 ml à 0,5 ml. La dose de 0,25 ml est jugée adéquate pour les enfants qui sont déjà immunisés et il n’est donc pas nécessaire de la répéter. Après la vaccination de personnes dont le système immunitaire est affaibli, on peut envisager une surveillance annuelle des niveaux d’anticorps contre le virus de l’hépatite B Note de bas de page 11.
Herpès zoster (zona)
Le nouveau vaccin sous-unitaire recombinant (VRZ) ayant été homologué au Canada (ShingrixMD), le CCNI recommande maintenant d’offrir ce vaccin aux personnes de 50 ans et plus qui ne présentent pas de contre-indication, y compris à celles qui ont reçu le VVVCZ ou vaccin à virus vivant contre le zona (ZostavaxMD), à condition que ce dernier ait été administré au moins un an auparavant. Le CCNI recommande d’offrir deux doses du VRZ aux personnes qui ne présentent pas de contre-indication et qui ont connu un épisode de zona, et ce, au moins un an après le dernier épisode. Dans les cas où le VRZ est contre-indiqué, s’il est impossible à obtenir ou qu’il est trop cher, on peut envisager l’administration du VVVCZ aux personnes d’au moins 50 ans qui sont immunocompétentes et qui ne présentent pas de contre-indication. Le VRZ (mais pas le VVVCZ) peut être envisagé au cas par cas pour les adultes de 50 ans et plus dont le système immunitaire est affaibli Note de bas de page 12Note de bas de page 13Note de bas de page 14. Les lignes directrices se sont enrichies de deux tableaux résumant les facteurs à prendre en considération pour choisir le vaccin contre le zona et pour l’administrer Note de bas de page 12.
Papillome humain
Le vaccin contre le papillome humain (VPH), VPH9, est maintenant recommandé pour les garçons et les filles immunocompétents de 9 à 14 ans selon un calendrier de vaccination à deux ou trois doses. Cependant, le CCNI continue de recommander que le vaccin soit offert aux jeunes femmes et jeunes hommes de 15 à 26 ans selon un calendrier à trois doses, de même qu’aux personnes de plus de 26 ans susceptibles d’être exposées au virus de manière continue. Cette recommandation est la même pour les vaccins VPH2 (pour les filles seulement) et VPH4. Le calendrier de vaccination contre le VPH (VPH2, VPH4 ou VPH9) à deux ou trois doses doit toujours prévoir au moins 24 semaines entre la première et la dernière dose. Les sujets immunodéprimés devraient toujours être immunisés selon un calendrier à trois doses prévoyant au moins 24 semaines entre la première et la dernière dose Note de bas de page 15.
Coqueluche
Selon des données récentes, il serait possible de protéger efficacement les nourrissons contre la coqueluche en administrant le vaccin anticoquelucheux acellulaire (dcaT) pendant la grossesse. Il est maintenant recommandé d’administrer ce vaccin entre la 27e et la 32e semaine de grossesse. Si, pour une raison ou une autre, le vaccin ne peut pas être administré pendant cette période, il est possible d’offrir le dcaT à n’importe quel moment entre la 13e semaine de grossesse et l’accouchement Note de bas de page 16.
Rougeole
De nouvelles données probantes indiquent que la dose d’immunoglobulines (Ig) recommandée auparavant n’offre plus une protection optimale pour la prophylaxie post-exposition (PPE) contre la rougeole. Le CCNI a mis à jour comme suit ses recommandations relatives à la posologie, aux indications et aux voies d’administration d’immunoglobulines humaines contre la rougeole en PPE Note de bas de page 17 :
- Les sujets immunocompétents de six mois et plus qui ont été exposés au virus de la rougeole et qui ne présentent pas de contre-indication devraient recevoir le vaccin contre la rougeole, la rubéole et les oreillons dans les 72 heures qui suivent l’exposition
- Si le volume d’injection n’est pas une préoccupation importante, les nourrissons de moins de six mois devraient recevoir les Ig IM à raison de 0,5 mL/kg, jusqu’à une dose maximale de 15 mL administrée sur plusieurs sites d’injection
- Si le volume d’injection n’est pas une préoccupation importante, les nourrissons de six à 12 mois, dont l’exposition à la rougeole est décelée après 72 heures et dans les six jours suivants devraient recevoir des immunoglobulines par voie intramusculaire (à raison de 0,5 mL/kg), jusqu’à une dose maximale de 15 mL administrée sur plusieurs sites d’injection
- Si le volume d’injection n’est pas une préoccupation importante, les personnes susceptibles qui sont enceintes ou immunodéprimées peuvent recevoir des Ig IM à raison de 0,5 mL/kg, tout en tenant compte du fait que les personnes de 30 kg ou plus ne recevront pas les concentrations d’anticorps contre la rougeole qui sont jugées nécessaires pour offrir une protection complète
- Lorsque le volume d’injection est une préoccupation importante ou chez les personnes de 30 kg ou plus, l’immunoglobuline peut être administrée par voie intraveineuse (Ig IV) à une dose de 400 mg/kg Note de bas de page 17
- Le CCNI ne recommande pas la PPE pour l’administration d’Ig contre la rougeole chez les personnes réceptives et immunocompétentes de plus de 12 mois en raison du faible risque de complications liées à la maladie et des défis cliniques liés à l’administration pour la prise en charge des cas et des contacts
Un résumé des modifications apportées aux recommandations touchant les vaccins actifs est présenté dans le tableau 1.
Maladies évitables par la vaccination |
Recommandation antérieure | Nouvelle recommandation |
|---|---|---|
| Choléra et diarrhée du voyageur | Pas recommandé systématiquement pour les voyageurs | Peut être envisagé pour des voyageurs qui présentent un risque élevé d’infection, de complications ou qui risquent d’être fortement incommodés |
| Grippe | De nouvelles recommandations sont formulées chaque année en prévision de la prochaine grippe saisonnière | |
| Hépatite A | Pour une protection de moins de trois mois, la dose d’immoglobuline administrée par voie intramusculaire est de 0,02 mL/kg de poids corporel Pour une protection de 3 mois ou plus, il faut administrer 0,06 mL/kg de poids corporel et répéter tous les six mois |
La dose normale d’immoglobuline administrée par voie intramusculaire est de 0,1 mL/kg pour les cas de contacts avec le virus de l’hépatite A en milieu familial ou institutionnel
Pour les personnes se rendant dans des zones à risque élevé, les doses prophylactiques sont comme suit :
|
| Hépatite B | Dose de Recombivax HBMD pour les enfants entre 0 et 10 ans (nés de mères non infectées par le virus de l’hépatite B) : 0,25 mL | Il est recommandé d’augmenter à 0,5 mL la dose de Recombivax HB |
| Zona | VRZ (ZostavaxMD) est recommandé pour les adultes de 50 ans et plus ne présentant aucune contre-indication |
|
| Papillome humain | Le vaccin VPH9 est recommandé selon un calendrier d’immunisation en trois doses, alors que les vaccins VPH2 et VPH4 doivent être administrés selon un calendrier en deux ou trois doses chez certains groupes de la population |
|
| Coqueluche (toux coquelucheuse) | Le vaccin dcaT devrait être offert aux femmes enceintes pendant une éclosion de coqueluche. | Pour protéger les nourrissons, le vaccin dcaT devrait être offert à chaque grossesse, idéalement entre la 27e et la 32e semaine de gestation |
| Rougeole | Posologie : lorsqu’indiqué, administrer une dose d’immunoglobulines de 0,25 mL/kg par voie intramusculaire ou de 0,5 mL/kg pour les sujets immunodéprimés Populations : Immunoglobulines par voie intramusculaire aux personnes fragilisées de tout âge qui se présentent entre 72 heures et six jours après l’exposition; et aux nourrissons de moins de six mois, aux femmes enceintes, ou aux sujets immunodéprimés qui ont été exposés au cours des six derniers jours tout au plus |
|
Résumé et conclusion
Le GCI continue de fournir des recommandations pratiques fondées sur des données probantes, formulées par le CCNI et le CCMTMV à l’intention des professionnels de la santé, afin d’éclairer les méthodes d’immunisation de première ligne. Le résumé des modifications se trouve périodiquement dans le Relevé des maladies transmissibles au Canada. On trouve également en ligne la liste des mises à jour des chapitres du GCI Note de bas de page 18. Cette liste est mise à jour presque en temps réel. On peut également s’inscrire à la liste de distribution du CCNI et du GCI pour recevoir des avis faisant état des dernières recommandations du CCNI, de ses déclarations, mises à jour et modifications aux chapitres du GCI Note de bas de page 19.
Déclaration des auteurs
AFC — Rédaction de la première ébauche, examen et révision
MT — Examen et révision
AH — Examen et révision
Conflit d’intérêts
Aucuns.
Remerciements
Membres du CCNI : C Quach (présidente), W Vaudry (vice-présidente), N Dayneka, S Deeks, P DeWals, V Dubey, R Harrison, M Lavoie, M Salvadori, B Sander, C Rotstein, N Sicard, R Warrington
Représentants de liaison : J. Brophy (Association canadienne pour la recherche et l’évaluation en immunisation), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, États-Unis), T. Cole (Comité canadien sur l’immunisation), J. Emili (Collège des médecins de famille du Canada), C. Mah (Association canadienne de santé publique), D. Moore (Société canadienne de pédiatrie), A. Pham-Huy (Association pour la microbiologie médicale et l’infectiologie Canada)
Représentants d’office : K Barnes (ministère de la Défense nationale et Forces armées canadiennes), G. Charos (Centre de l’immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de la santé publique du Canada [ASPC]), J Gallivan (Direction des produits de santé commercialisés, Santé Canada [SC]); J Pennock (CIMRI, ASPC), R Pless (Direction des produits biologiques et des thérapies génétiques, SC), T Wong (Direction générale de la santé des Premières nations et des Inuits, SC)
Financement
Les travaux du CCNI sont financés par l’Agence de la santé publique du Canada.