Archivée - Résumé du CCNI sur le vaccin sous-unitaire et le vaccin antigrippal à virion fragmenté

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDF Publié par : L’Agence de la santé publique du Canada
Numéro : Volume 44-6 : Mise à jour sur les vaccins
Date de publication : 7 juin 2018
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 44-6, le 7 juin 2018 : Mise à jour sur les vaccins
Examen
Résumé de l'examen de la littérature du Comité consultatif national sur l'immunisation (CCNI) sur l'efficacité comparative des vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés chez les personnes âgées
I Gemmill1,2, K Young3 au nom du Comité consultatif national sur l'immunisation (CCNI)*
Affiliations
1 Président du Groupe de travail sur l'influenza du CCNI, Kingston (Ontario)
2 Service de santé publique de Kingston, Frontenac et Lennox et Addington, Kingston (Ontario)
3 Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa (Ontario)
Correspondance
Citation proposée
Gemmill I, Young K au nom du Comité consultatif national de l'immunisation (CCNI). Résumé de l'examen de la littérature du Comité consultatif national sur l'immunisation sur l'efficacité comparative des vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés chez les personnes âgées. Relevé des maladies transmissibles au Canada 2018;44(6):145-9. https://doi.org/10.14745/ccdr.v44i06a02f
Mots-clés : Comité consultatif national de l'immunisation, vaccin grippal, vaccin sous-unitaire, vaccin à virions fragmentés
Résumé
Contexte : Les vaccins antigrippaux inactivés (VAI) sous-unitaires et à virions fragmentés sont deux types de vaccins antigrippaux saisonniers couramment utilisés au Canada. L'efficacité comparée de ces deux formulations est particulièrement appropriée pour les personnes âgées chez qui l'efficacité du vaccin antigrippal est réduite et la grippe plus grave que chez les personnes plus jeunes.
Objectif : Comparer l'efficacité et l'immunogénicité du VAI sous-unitaire sans adjuvant à dose normale avec le VAI à virions fragmentés sans adjuvant à dose normale chez les personnes de 65 ans et plus.
Méthodologie : Un protocole écrit a priori a été élaboré en se fondant sur une méthode d'examen rapide des études publiées depuis 2007 dans EMBASE, MEDLINE et les bases de données ClinicalTrials.gov en fonction des termes précisés dans l'objectif. En raison de la faible quantité de données recueillies, une liste bibliographique manuelle a été constituée, la date limite de publication a été supprimée, trois autres bases de données (registre central d'essais cliniques comparatifs de la Collaboration Cochrane, Scopus et Web of Science) ont été consultées et des études portant sur les adultes de 60 ans et plus ont été ajoutées. Les données des études ajoutées ont été extraites et saisies dans des tableaux de données probantes et une évaluation de leur qualité a été effectuée. Les résultats ont été synthétisés sous forme descriptive.
Résultats : Huit études admissibles ont été répertoriées. Dans les trois études qui ont abordé l'efficacité des VAI sous-unitaires et à virions fragmentés, on n'a observé aucune différence statistiquement significative dans l'éfficacité du vaccin chez les adultes de 65 ans et plus contre une infection confirmée par un laboratoire par toute souche de virus grippal ou contre une infection confirmée par un laboratoire par le virus de la grippe A(H1N1), A(H3N2) ou B, plus précisément. Dans les cinq études qui ont abordé l'immunogénicité, les résultats observés n'étaient pas concordants et la qualité globale des données probantes sur l'immunogénicité était médiocre.
Conclusion : Le Comité consultatif national de l'immunisation (CCNI) a conclu que les données probantes sont insuffisantes pour déterminer des différences significatives dans l'efficacité ou dans l'immunogénicité des VAI sous-unitaires et à virions fragmentés sans adjuvant à dose normale chez les personnes de 65 ans et plus (données probantes de catégorie I).
Introduction
Diverses technologies sont actuellement utilisées dans la formulation des vaccins grippaux. Les vaccins antigrippaux inactivés (VAI) à virions fragmentés et sous-unitaires, composés tous deux de particules virales rompues, comptent parmi les premières technologies élaborées à la suite des premiers vaccins à virus entier inactivés élaborés dans les années 1940Note de bas de page 1. Les vaccins à virions fragmentés contiennent des virus entiers inactivés, qui ont été fragmentés au moyen d’un détergent, d’un éther ou de ces deux substances, alors que les vaccins sous-unitaires sont constitués d’hémagglutinine (HA) et de neuraminidase.
De nouvelles technologies et formulations pour les vaccins antigrippaux ont depuis été introduites parmi lesquelles des doses supérieures d’antigène ou une combinaison d’antigène et d’adjuvants. Toutefois, les VAI sous-unitaires et à virions fragmentés à dose normale sont encore les vaccins antigrippaux saisonniers les plus souvent utilisés, ces vaccins ayant un profil d’innocuité bien établi et étant moins chers que les nouvelles formulations. Les VAI sous-unitaires et à virions fragmentés à dose normale sont offerts en grand nombre au Canada comme vaccins antigrippaux saisonniersNote de bas de page 2.
Le CCNI n'a pas encore procédé à une évaluation critique des données probantes sur l'efficacité comparée et l'immunogénicité des VAI sous-unitaires par rapport aux VAI à virions fragmentés dans toutes les tranches d'âge. Si l'un des types de vaccins s'avérait plus efficace, il serait important de le savoir, en particulier pour les Canadiens âgés de 65 ans et plus qui sont le plus à risque d'hospitalisationsNote de bas de page 3 et de décèsNote de bas de page 4 liés à la grippe. Les personnes âgées peuvent aussi voir l'efficacité de leur vaccin diminuer contre l'infection grippale par rapport aux tranches d'âge plus jeunesNote de bas de page 5.
La présente revue de la littérature a pour objet de comparer l’efficacité et l’immunogénicité du VAI sous-unitaire sans adjuvant à dose normale par rapport au VAI à virions fragmentés sans adjuvant à dose normale chez les personnes de 65 ans et plus. Un rapport complet est accessible en ligneNote de bas de page 6.
Méthodologie
Une méthode d'examen rapide a été utilisée en se fondant sur les méthodes élaborées par Tricco et al.Note de bas de page 7. La question de recherche abordée dans la présente revue est celle-ci : l'efficacité et/ou l'immunogénicité des VAI diffèrent-elles selon qu'il s'agit de VAI sous-unitaires sans adjuvant à dose normale ou de VAI à virions fragmentés sans adjuvant à dose normale chez les personnes de 65 ans et plus?
Stratégie de recherche a priori
Une stratégie de recherche a été élaborée en collaboration avec un bibliothécaire de référence fédéral en fonction de termes de recherche sur le vaccin antigrippal sous-unitaire, le vaccin antigrippal à virions fragmentés, l'efficacité du vaccin antigrippal et l'immunogénicité. La recherche a été limitée aux études publiées en anglais ou en français dans les bases de données EMBASE, MEDLINE et ClinicalTrials.gov depuis 2007.
Critères d'inclusion et d'exclusion
Les études sélectionnées devaient satisfaire aux critères suivants :
- l'étude comparait directement ou indirectement l'efficacité ou l'immunogénicité d'un VAI sous-unitaire sans adjuvant à dose normale avec un VAI à virions fragmentés sans adjuvant à dose normale;
- la population de l'étude se trouvait dans la tranche d'âge visée (65 ans et plus).
Les études ignorées devaient satisfaire à l'un ou à plusieurs des critères suivants :
- l'étude n'abordait pas l'efficacité ou l'immunogénicité des deux vaccins visés;
- l'étude était publiée dans une langue autre que le français ou l'anglais;
- l'étude était réalisée sur des organismes vivants non humains ou encore in vivo ou in vitro;
- l'article se présentait sous forme éditoriale, d'opinion ou de reportage;
- l'étude ne présentait que des renseignements obtenus de source indirecte.
L'évaluation préalable et l'admissibilité des données ont été effectuées par un seul et même examinateur.
Extraction de données, synthèse et évaluation de la qualité
Les données des études incluses ont été extraites et saisies dans des tableaux de données probantes définis a priori. La qualité (validité interne) des études incluses a été évaluée au moyen de critères énoncés par Harris et al.Note de bas de page 8. L'extraction des données et l'évaluation de leur qualité ont été réalisées par un premier examinateur, puis vérifiées par un deuxième examinateur. Les résultats des études incluses ont été synthétisés sous forme descriptive.
Modifications post-hoc
En raison de la faible quantité d'articles recueillis à l'origine à partir des bases de données, les critères de recherche ont été modifiés. La date limite de publication a été supprimée, trois autres bases de données ont été ajoutées (registre central d'essais cliniques comparatifs de la Collaboration Cochrane, Scopus et Web of Science) et, puisqu'un certain nombre d'études ciblaient les personnes âgées de 60 ans et plus tout en étant par ailleurs admissibles, les critères d'admissibilité ont été modifiés pour inclure les adultes de 60 ans et plus.
Résultats
La recherche initiale dans les bases de données a permis de recueillir 30 articles, mais seules trois études répondaient aux critères d'inclusion. Une fois les modifications ad hoc apportées, 41 études uniques ont été répertoriées dans la littérature et huit ont satisfait les critères d'inclusion révisés (voir figure 1). Trois des études répertoriées abordaient l'efficacité du vaccin antigrippal et cinq, l'immunogénicité. Aucune des études répertoriées ne comparait les formulations de VAI sous-unitaire ou à virions fragmentés quant à leur caractère trivalent ou quadrivalent. Les caractéristiques des études incluses sont indiquées dans le tableau 1 ci-dessous.
Figure 1 : Organigramme de l'efficacité et de l'immunogénicité comparées de vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés chez les personnes âgées : octobre 2017 Figure 1 note a
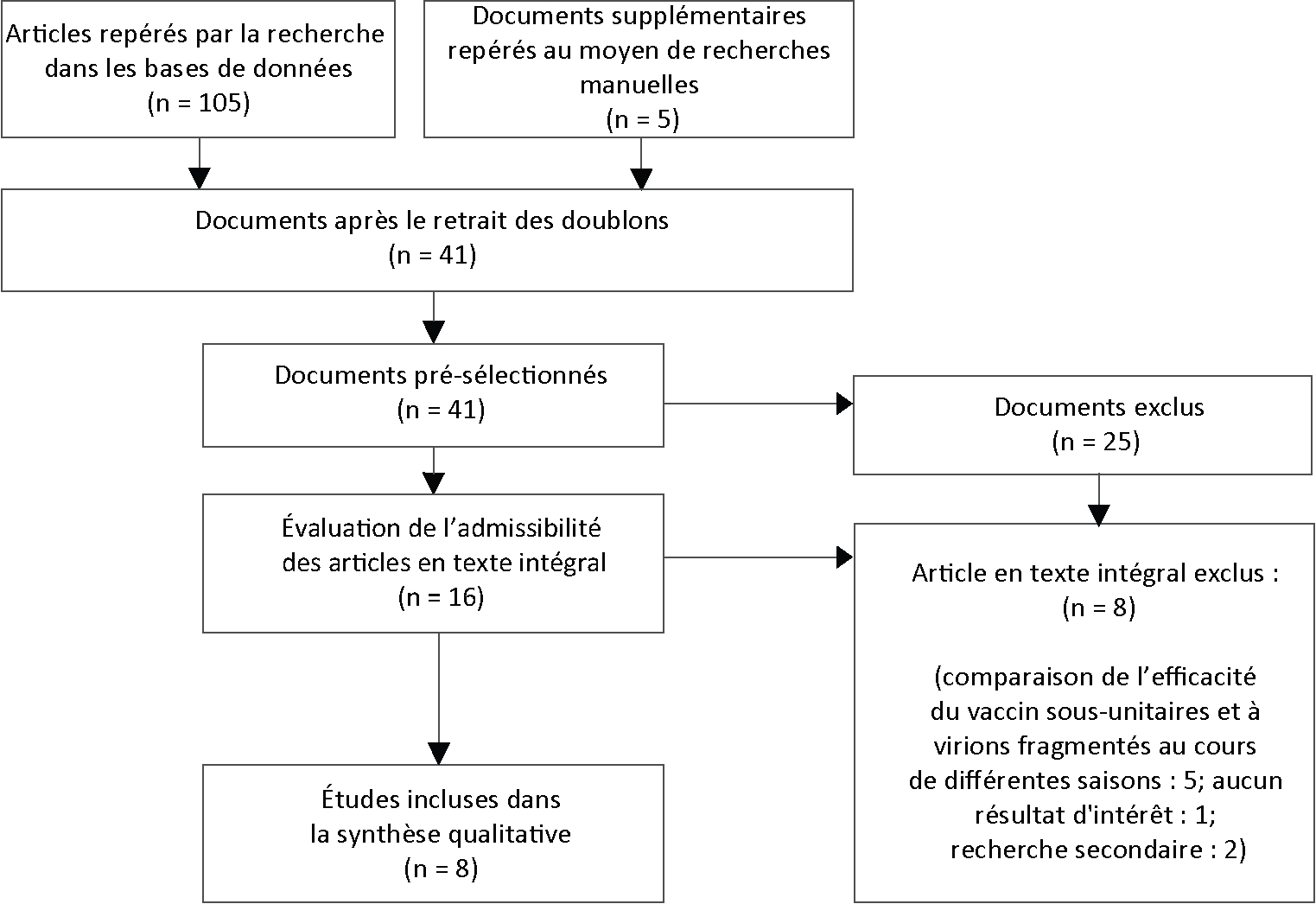
Description textuelle : Figure 1
Figure 1 : Organigramme de l'efficacité et de l'immunogénicité comparées de vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés chez les personnes âgées : octobre 2017 Figure 1 note a
La recherche initiale a été effectuée le 13 octobre 2017, puis reprise avec modifications le 16 octobre 2017.
Le diagramme d’attrition décrit le processus par lequel les articles ont été sélectionnés pour l’examen de la littérature. Le processus se divise en quatre étapes : l’identification, la sélection, l’admissibilité et l’inclusion.
Étape 1 : Identification
Cent cinq articles ont été répertoriés à l’aide de recherches dans les bases de données. Cinq autres articles ont été répertoriés par d’autres moyens.
Quarante et un articles ont été conservés après le retrait de doublons pour 110 articles.
Étape 2 : Sélection
Quarante et un articles ont été sélectionnés.
De ces 41 articles, 25 ont été exclus.
Étape 3 : Admissibilité
Seize articles en texte intégral ont été évalués quant à leur admissibilité.
De ces 16 articles en texte intégral, huit ont été exclus. L’exclusion se répartit comme suit :
- n = 5 : Efficacité comparée des vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés lors de différentes saisons
- n = 1 : Aucun résultat d’intérêt
- n = 2 : Renseignements obtenus de source indirecte
Étape 4 : Inclusion
Des 16 articles en texte intégral évalués pour leur admissibilité, huit ont été inclus dans la synthèse qualitative.
| Étude | Endroit | Saison | Plan | Population | Résultat |
|---|---|---|---|---|---|
| Camilloni, 2016Note de bas de page 9 | Italie | 1988–1989 à 2014–2015 |
Cohorte | 60 ans et plus | Immunogénicité |
| Del Giudice, 2006Note de bas de page 10 | Non indiqué | 2003–2004 | Non indiqué | 60 ans et plus | Immunogénicité |
| Kissling, 2014Note de bas de page 11 | Sept pays européens | 2012–2013 | Test négatif et cas-témoins | 60 ans et plus | Efficacité du vaccin |
| Morales, 2003Note de bas de page 12 | Colombie | 1999–2000 | ECR | 60 ans et plus | Immunogénicité |
| Rondy, 2017Note de bas de page 13 | 11 pays européens | 2015–2016 | Test négatif et cas-témoins | 65 ans et plus | Efficacité du vaccin |
| Skowronski, 2012Note de bas de page 14 | Canada | 2011–2012 | ECR | 65 ans et plus | Immunogénicité |
| Talbot, 2015Note de bas de page 15 | États-Unis | 2008–2009, 2010–2011 et 2011–2012 |
Test négatif et cas-témoins | 50 ans et plus (sous-population : 65 ans et plus) | Efficacité du vaccin |
| Zei, 1991Note de bas de page 16 | Italie | 1989–1990 | ECC | 60 ans et plus | Immunogénicité |
| Abréviations : ECC, essai clinique comparatif; ECR, essai contrôlé randomisé | |||||
Efficacité des vaccins
Trois des études incluses ont abordé l'efficacité du vaccin antigrippal des VAI sous-unitaires et à virions fragmentés sans adjuvant à dose normaleNote de bas de page 11Note de bas de page 13Note de bas de page 15 alors qu'une seule a fourni une estimation directe de la différence dans l'efficacité du vaccin antigrippal entre les deux types de vaccins antigrippauxNote de bas de page 15. Les trois études ont eu recours à l'approche du test négatif et de cas-témoins et toutes les trois ont reçu une cote « assez bonne » en fonction des critères énoncés par Harris et al.Note de bas de page 8. Aucune d'elles n'a fait état d'une différence significative dans l'efficacité du vaccin antigrippal entre les VAI sous-unitaires et les VAI à virions fragmentés contre toute souche de virus grippal confirmée par un laboratoireNote de bas de page 11Note de bas de page 15 contre la grippe A(H1N1), A(H3N2) ou BNote de bas de page 11Note de bas de page 15 plus précisément, ou contre l'hospitalisation attribuable à la grippeNote de bas de page 13.
Immunogénicité
Cinq études répertoriées abordaient l'immunogénicité des vaccins antigrippaux sous-unitaires et à virions fragmentés trivalentsNote de bas de page 9Note de bas de page 10Note de bas de page 12Note de bas de page 14Note de bas de page 16. Parmi elles, deux seulement ont abordé une comparaison directe entre les deux types de vaccinsNote de bas de page 9Note de bas de page 16. Trois des cinq études pouvaient être évaluées selon les critères de Harris et al.Note de bas de page 9Note de bas de page 12Note de bas de page 16 dont l'une a obtenu une cote « assez bonne »Note de bas de page 12 et deux, une cote « médiocre »Note de bas de page 9Note de bas de page 16. Les deux autres études n'ont pas abordé leur méthodologie de manière suffisamment détaillée pour en évaluer la qualitéNote de bas de page 10Note de bas de page 14. Les résultats sur le plan de l'immunogénicité telle qu'évaluée par les études répertoriées comprenaient le facteur d'augmentation de la moyenne géométrique des titres d'anticorps anti-HA (c.-à-d. le rapport des titres moyens géométriques avant et après l'immunisation), le taux de séroprotection (c.-à-d. la proportion de participants présentant des titres HA d'au moins 40 après l'immunisation) et le taux de séroconversion (c.-à-d. la proportion de participants présentant au moins une multiplication par quatre des titres HA après l'immunisation, ces titres passant de moins de 10 avant l'immunisation à au moins 40 après celle-ci, ou dans les deux cas). Quatre études ont évalué la protection contre les souches du virus grippal contenues dans les vaccins. Deux d'entre elles ont abordé une comparaison directe entre les mesures l'immunogénicitéNote de bas de page 9Note de bas de page 16 alors que deux autres ont abordé une comparaison indirecte à cet égardNote de bas de page 10Note de bas de page 12. Dans l'ensemble, les études n'ont montré aucune différence significative dans le facteur d'augmentation de la moyenne géométrique, le taux de séroprotection ou le taux de séroconversion entre les VAI à virions fragmentés et les VAI sous-unitaires contre la grippe A(H1N1), A(H3N2) ou B. De plus, deux études ont évalué indirectement la protection croisée contre les souches de la variante de la grippeNote de bas de page 10Note de bas de page 14. Aucune de ces études n'a établi une différence significative dans le facteur d'augmentation de la moyenne géométrique, le taux de séroprotection ou le taux de séroconversion entre les VAI à virions fragmentés et les VAI sous-unitaires.
Discussion
La qualité globale des données probantes sur l'efficacité du vaccin antigrippal était assez bonne alors qu'une étude fournissait une estimation directe de l'efficacité du vaccin antigrippal et que deux études fournissaient une estimation indirecte de l'efficacité du vaccin antigrippal. Les estimations de l'efficacité du vaccin antigrippal des VAI à virions fragmentés et des VAI sous-unitaires affichaient toutes des intervalles de confiance se chevauchant largement. Toutefois, sans une comparaison directe, il s'avère difficile de tirer des conclusions sur une comparaison de l'efficacité du vaccin antigrippal pour les deux types de vaccins. Les auteurs de l'une des études rapportent également qu'il existe probablement d'importantes différences entre les sites d'étude qui n'étaient pas pris en compte et que toute comparaison entre l'efficacité du vaccin antigrippal des VAI sous-unitaires et des VAI à virions fragmentés doit être interprétée avec prudenceNote de bas de page 13.
Les résultats des études qui abordaient l'immunogénicité n'étaient pas concordants et la qualité globale des données probantes sur l'immunogénicité était médiocre. Toutes les études soulevaient au moins une préoccupation importante, la plus courante étant la comparabilité entre les groupes de l'intervention. Deux études ne fournissaient pas suffisamment de renseignements pour en évaluer la qualitéNote de bas de page 10Note de bas de page 14. De plus, toutes les études ont évalué l'immunogénicité au moyen d'épreuves d'inhibition de l'HA. Ces épreuves évaluent les anticorps par opposition à la réponse à médiation cellulaire, mais cette réponse s'est révélée être une corrélation de protection plus solide chez les adultes plus âgésNote de bas de page 17. En outre, la quantité d'antigène d'HA dans les VAI sous-unitaires et les VAI à virions fragmentés sans adjuvant à dose normale est normalisée. Ainsi, les titres d'anticorps anti-HA ne constituent pas nécessairement une mesure appropriée de l'immunogénicité en réponse à la question de recherche.
Limitations
En raison de la faible quantité d'articles recueillis lors de la recherche initiale dans les bases de données, des modifications au protocole post-hoc ont été apportées afin d'assurer une meilleure concordance avec l'examen systématique traditionnel plutôt qu'avec le protocole d'examen rapide initial. Toutefois, la sélection des articles était toujours effectuée par un seul et même examinateur. Une étude menée par Edwards et al. révèle qu'une sélection effectuée par un seul examinateur omet environ 8 % des études admissibles par rapport à une sélection effectuée par deux examinateursNote de bas de page 18. Par conséquent, certaines études peuvent être exclues à tort. Les répercussions de cette façon de faire sur les résultats fondés sur un examen rapide ne sont toujours pas claires. En outre, il est possible que la stratégie de recherche dans les bases de données omette certaines études qui abordent l'efficacité du vaccin antigrippal ou l'immunogénicité par type de vaccins dans les sous-analyses ou dans l'analyse secondaire. Toutefois, les listes bibliographiques manuelles permettraient de réduire le nombre d'articles de ce type pouvant être exclus par les critères de recherche. Une autre limite importante de cette étude se rapporte au fait que la plupart des études incluses définissent les adultes âgés comme des participants âgés de 60 ans et plus. L'inclusion des adultes de 60 à 64 ans peut accentuer le biais quant à l'efficacité sanitaire du vaccin puisque les adultes de cette tranche d'âge sont généralement en meilleure santé que ceux de 65 ans et plus. Par conséquent, les estimations fournies dans ces études doivent être interprétées avec prudence, en particulier dans le contexte canadien où les personnes âgées sont généralement définies comme des adultes de 65 ans et plus.
Conclusion
Le CCNI conclut que les données probantes sont insuffisantes pour déterminer des différences significatives dans l'efficacité ou dans l'immunogénicité des VAI sous-unitaires et à virions fragmentés sans adjuvant à dose normale chez les personnes de 65 ans et plus (données probantes de catégorie I). Les données probantes ne sont pas concordantes et sont de qualité ou en nombre insuffisants pour formuler des recommandations précises sur l'utilisation sélective des VAI sous-unitaires et à virions fragmentés sans adjuvant à dose normale chez les personnes âgées.
Déclaration des auteurs
I. G. – Rédaction – ébauche originale, rédaction – rédaction et révision
K. Y. – Rédaction – ébauche initiale, rédaction – rédaction et révision
La revue de la littérature du CCNI sur l'efficacité comparée et sur l'immunogénicité des vaccins antigrippaux inactivés sous-unitaires et à virions fragmentés chez les personnes de 65 ans et plus a été élaborée par K. Young, L. Zhao., R. Stirling et M. K. Doll, puis approuvée par le CCNI.
Conflit d'intérêt
Aucun.
Remerciements
Membres du Groupe de travail sur l'influenza : I. Gemmill (président), C. Bancej, L. Cochrane, N. Dayneka, L. Grohskopf, G. Jayaraman, D. Kumar, J. Langley, M. Lavoie, J. McElhaney, A. McGeer, D. Moore, B. Warshawsky et J. Xiong
Membres du CCNI : C. Quach (présidente), W. Vaudry (vice-présidente), N. Dayneka, S. Deeks, P. DeWals, V. Dubey, R. Harrison, M. Lavoie, C. Rotstein, M. Salvadori, B. Sander, N. Sicard et R. Warrington
Agents de liaison : J. Brophy (Association canadienne pour la recherche et l'évaluation), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, États-Unis), T. Cole (Comité canadien d'immunisation), J. Emili (Collège des médecins de famille du Canada), K. Klein (Conseil des médecins hygiénistes en chef), C. Mah (Association canadienne de santé publique), D. Moore (Société canadienne de pédiatrie) et A. Pham-Huy (Association pour la microbiologie médicale et l'infectiologie Canada)
Membres d'office : K. Barnes (Défense nationale et Forces armées canadiennes), G. Charos (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de la santé publique du Canada [ASPC]), G. Coleman (Direction des produits biologiques et des thérapies génétiques, Santé Canada [SC]), J. Gallivan (Direction des produits de santé commercialisés, Santé Canada), G. Poliquin (Laboratoire national de microbiologie, ASPC), J. Pennock (CIMRI, ASPC) et T. Wong (Direction générale de la santé des Premières nations et des Inuits, SC)
Le Comité consultatif national sur l'immunisation tient à souligner la contribution de L. Glandon, A. House, M. Laplante, K. Moncion et T. Museau à l'examen de la littérature.
Financement
Les travaux du Comité consultatif national sur l'immunisation sont appuyés par l'Agence de la santé publique du Canada.