Archivée - Toxoplamsa gondii : de l'Amazonie à l'Arctique

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 45-7/8 : Maladies zoonotiques
Date de publication : 4 juillet 2019
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 45-7/8, le 4 juillet 2019 : Maladies zoonotiques
Aperçu
Toxoplasma gondii : comment un parasite amazonien est devenu un enjeu en matière de santé pour les Inuit
SJ Reiling1, BR Dixon1
Affiliation
1 Bureau des dangers microbiens, Direction des aliments, Santé Canada, Ottawa, Ontario
Correspondance
Citation proposée
Reiling SJ, Dixon BR. Toxoplasma gondii : comment un parasite amazonien est devenu un enjeu en matière de santé pour les Inuit. Relevé des maladies transmissibles au Canada 2019;45(7/8):203–10. https://doi.org/10.14745/ccdr.v45i78a03f
Mots-clés : toxoplasmose, mammifères marins, poissons, changement climatique, oiseaux migrateurs
Résumé
Toxoplasma gondii est un parasite protozoaire venant d’Amazonie. Les félidés (des mammifères de la famille des chats) constituent les seuls hôtes définitifs. Ces animaux perdent des ookystes infectieux en grand nombre dans l’environnement, ce qui par la suite peut infecter de nombreux hôtes intermédiaires comme des oiseaux, des mammifères et peut-être des poissons. La séroprévalence de l’infection à T. gondii chez l’humain est élevée dans certaines parties de l’Arctique canadien et on l’associe à des conséquences néfastes sur la santé parmi la population inuit. Étant donné que le territoire des félidés n’atteint pas l’Arctique, la façon à laquelle ce parasite s’est rendu en Arctique à partir de l’Amazonie ne saute pas aux yeux. Le présent aperçu a pour objectifs de résumer les répercussions de l’infection à T. gondii sur la santé des Inuit dans le Nord canadien, ainsi que de considérer la manière à laquelle l’infection a atteint le milieu nordique. Le présent article examine la prévalence de l’infection à T. gondii chez les animaux terrestres et marins de l’Arctique canadien et aborde leur rôle potentiel dans la transmission d’origine alimentaire de ce parasite à l’humain. Deux facteurs de distribution semblent plausibles. En premier lieu, les félidés des habitats plus au sud peuvent libérer des ookystes infectieux dans les cours d’eau. Puisque ces ookystes restent viables pendant plusieurs mois, ils peuvent être transportés vers le nord par le courant des rivières, fleuves et océans et infecter les poissons arctiques puis, au bout du compte, les mammifères marins qui se nourrissent de ces poissons. En second lieu, les hôtes intermédiaires terrestres et marins migrateurs peuvent transporter des kystes tissulaires de T. gondii dans l’Arctique, où ils peuvent ensuite transmettre l’infection aux carnivores. Le changement climatique fait en sorte que la migration des félidés vers le nord peut accroître la prévalence de l’infection à T. gondii au sein de la faune de l’Arctique. Les hôtes intermédiaires infectés chassés aux fins de subsistance accroissent le risque de transmission du parasite T. gondii à la population inuit, qui consomme souvent des aliments prélevés dans la nature, préparés selon les traditions.
Introduction
Infection à Toxoplasma gondii chez l’humain
Toxoplasma gondii est un parasite protozoaire pouvant infecter presque l’ensemble des oiseaux et mammifèresNote de bas de page 1. Bien qu’au départ, ce parasite se soit développé dans la région de l’Amazonie de l’Amérique du SudNote de bas de page 2Note de bas de page 3, on estime qu’il infecte maintenant deux milliards de personnes à travers le monde, avec un foyer de prévalence élevée en Amérique latine, en Europe orientale/centrale, au Moyen-Orient, en Asie du Sud-Est et en Afrique, de même qu’une prévalence moindre dans de nombreux pays européens, au Canada et aux États-UnisNote de bas de page 4. L’infection chez l’humain peut se faire par trois voies de transmission :
- Ingestion de kystes tissulaires lors de la consommation de la viande crue fraîche ou des organes crus frais d’un hôte intermédiaire infecté;
- Ingestion d’ookystes sporulés pouvant persister pendant plusieurs mois ou années dans le sol ou l’eau;
- Sur le plan congénital, de la mère au fœtus, lorsqu’une femme enceinte souffre de toxoplasmose aiguëNote de bas de page 5.
Lors de la phase d’infection initiale d’un hôte intermédiaire, y compris chez l’humain, l’infection à T. gondii se réplique rapidement et se propage dans les tissus, dont le cerveau (toxoplasmose aiguë). Chez l’humain, les symptômes peuvent être discrets et des personnes autrement en santé peuvent ne pas remarquer qu’elles sont infectées. Au bout du compte, la réplication parasitaire ralentit et les protozoaires se regroupent dans des kystes tissulaires (toxoplasmose latente). Les personnes atteintes de toxoplasmose latente qui deviennent immunocompromis peuvent développer une toxoplasmose réactivée, au cours de laquelle les parasites dormants dans les kystes tissulaires recommencent à se répliquer. Cette réactivation peut entraîner des symptômes semblables à la grippe graves, une vision trouble ou une encéphalite toxoplasmique. On associe également la toxoplasmose latente à des changements sur le plan des voies de signalisation cellulaire pouvant mener à des troubles neurologiques dont la schizophrénie, l’épilepsie, la maladie d’Alzheimer et la maladie de ParkinsonNote de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11. De plus, on a fait une association positive entre l’infection à T. gondii et le comportement de recherche du risque accru chez l’humainNote de bas de page 12Note de bas de page 13. La transmission congénitale peut mener à la mortinaissance ou des complications neurologiques graves.
Les facteurs socioéconomiques peuvent avoir des conséquences importantes sur l’exposition humaine à ce parasite. Les facteurs qui influencent la séroprévalence chez l’humain comprennent la proximité des hôtes des réservoirs d’animaux domestiqués et sauvages, l’accès à l’eau potable, le style de vie urbain par rapport à rural, les types d’aliments consommés, la préparation des aliments (crus par rapport à la congélation, la cuisson et le séchage) et l’hygiène (se laver les mains et rincer les produits agricoles frais)Note de bas de page 14.
T. gondii de l’Amazonie à l’Arctique
L’infection à Toxoplasma gondii s’est développée dans la forêt amazonienneNote de bas de page 2Note de bas de page 3. Elle est très commune dans la région amazonienne et les populations autochtones du bassin de l’Amazone présentent le taux d’infection connu le plus élevé au monde : dans le cours supérieur de la rivière Negro, la séroprévalence de l’infection à T. gondii dépasse les 90 %Note de bas de page 15. Malgré sa distribution internationale, c’est seulement en Amazonie que l’infection à T. gondii se caractérise par un niveau élevé de diversité génétique et la présence de nombreux génotypes uniquesNote de bas de page 3. L’analyse du flux génétique des génotypes uniques indique qu’un petit nombre de lignées ancestrales a mené à la diversité actuelle de l’infection à T. gondiiNote de bas de page 2. L’hypothèse principale pour la propagation mondiale de l’infection à T. gondii est que le trafic maritime facilite le déplacement de chats domestiques et d’hôtes intermédiaires infectés vers d’autres continentsNote de bas de page 1. Le parasite se reproduit dans l’intestin grêle des félidés qui constituent des hôtes définitifs et des millions d’ookystes sont répandus dans l’environnementNote de bas de page 5Note de bas de page 14. Le mode de propagation de l’infection à T. gondii de la forêt tropicale brésilienne à l’Arctique canadien est inconnu. Dans le présent article, les frontières de l’Arctique sont définies selon ce que décrit la Conservation de la flore et de la faune arctiques (CFFA), qui constitue le groupe de biodiversité du Conseil de l’Arctique. Le seul félidé sauvage qui habite dans le Nord canadien est le lynx du Canada, qui présente une séroprévalence de l’infection à T. gondii de 14 %Note de bas de page 16; cependant, le territoire du lynx ne s’étend pas au nord de la limite forestière (la forêt boréale ou la région subarctique). De plus, il y a peu de chats domestiques au sein des collectivités de l’Arctique canadien. Par conséquent, tandis que la présence de félidés infectés peut expliquer la propagation de l’infection à T. gondii dans la majeure partie de l’Amérique du Nord, elle n’explique pas la présence du parasite dans l’Arctique; de plus, malgré la rareté des félidés potentiellement infectés, l’infection à T. gondii reste présente dans un vaste éventail d’animaux de l’Arctique.
Pour compléter le cycle de vie du parasite, les ookystes répandus par les félidés qui constituent des hôtes définitifs doivent sporuler (figure 1) et être ingérés par les hôtes intermédiaires, qui constituent des proies potentielles pour les félidés et comprennent presque tous les animaux à sang chaud. L’infection à Toxoplasma gondii envahit les tissus de l’hôte intermédiaire et se répartit partout dans le corps, dont le cerveauNote de bas de page 1. Cependant, les hôtes intermédiaires ne produisent pas d’ookystes; par conséquent, le mécanisme (ou les mécanismes) de dispersion géographique de l’infection à T. gondii, sans hôte définitif reste inconnu.
Figure 1 : Cycle de vie de Toxoplasma gondii dans le Nord canadien
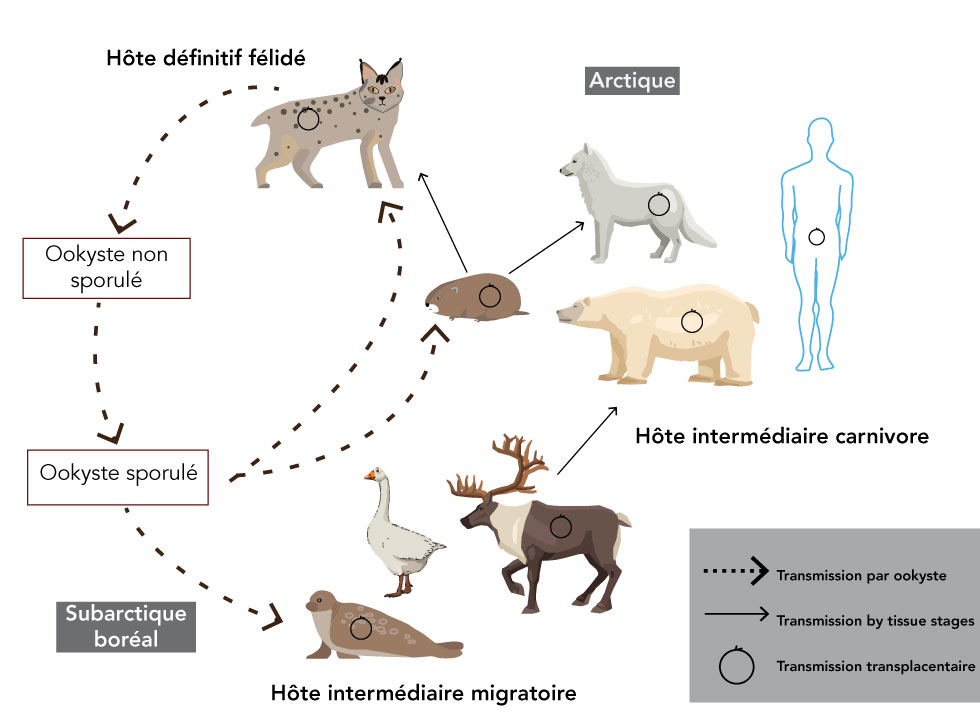
Description textuelle : Figure 1
Figure 1 : Cycle de vie de Toxoplasma gondii dans le Nord canadien
Figure 1 est le cycle de vie de Toxoplasma gondii dans le Nord. La transmission par ookyste a lieu dans les régions boréales et subarctiques où les hôtes définitifs (félidés) sont présents et circulent librement. Les hôtes intermédiaires migratoires (comme les oies nidifiant dans l’Arctique, le caribou de la toundra et les mammifères marins) peuvent devenir infectés par la consommation d’ookystes lorsqu’ils migrent de manière saisonnières dans les terres ou dans les eaux subarctiques contaminées avec des ookystes. Les carnivores des régions arctiques deviennent infectés par la consommation de kystes tissulaires des hôtes intermédiaires migratoires. Dans tous les hôtes intermédiaires mammaliens, incluant les félidés et les humains, la transmission verticale peut avoir lieu dans les femelles infectées pendant la grossesse.
Le présent examen cherche à souligner l’incidence de ce parasite dans l’Arctique canadien et ses répercussions sur les populations inuit, ainsi qu’à considérer la manière à laquelle ce parasite est arrivé et est devenu endémique dans un milieu avec un manque d’hôtes définitifs.
Toxoplasma gondii dans l’Arctique
T. gondii chez l’Inuit du Canada
Les infections à Toxoplasma gondii ont été signalées pour la première fois chez l’Inuit dans les années 1980Note de bas de page 17Note de bas de page 18Note de bas de page 19. Des études plus récentes indiquent que la séroprévalence de l’infection à T. gondii chez l’Inuit dans l’Arctique canadien varie de manière considérable selon la régionNote de bas de page 17. La séroprévalence de l’infection à Toxoplasma gondii chez l’adulte dans trois régions inuit canadiennes a été signalée à 8 % au Nunatsiavut, 28 % au Nunavut et 60 % dans le NunavikNote de bas de page 20Note de bas de page 21Note de bas de page 22Note de bas de page 23Note de bas de page 24. Le nombre de données existantes ne suffit pas à déterminer si la prévalence de l’infection à T. gondii chez l’Inuit est stable ou a évolué au fil des décennies.
La nourriture traditionnelle a une grande importance culturelle pour les Inuit et est généralement considérée comme étant sûr et nutritif pour la majorité des gens. Par contre, il semble que T. gondii soit associée à la récolte et la consommation d’« aliments prélevés dans la nature », en particulier la viande et les organes, qu’on peut consommer crusNote de bas de page 19Note de bas de page 25. La corrélation entre la séroprévalence de l’infection à T. gondii et les diverses pratiques de chasse et différentes habitudes alimentaires a fait l’objet d’un débatNote de bas de page 26Note de bas de page 27Note de bas de page 28Note de bas de page 29. Contrairement aux communautés inuit, les communautés cries voisines qui, en général, font cuire leur viande, présentent une séroprévalence de l’infection à T. gondii de seulement 5 %Note de bas de page 29. On a démontré que cuire la viande ou la faire congeler pendant plusieurs jours à des températures inférieures à zéro permet de tuer les agents pathogènes présents dans les kystes tissulairesNote de bas de page 30.
Tandis que la toxoplasmose est souvent asymptomatique chez les personnes en santé, les femmes enceintes atteintes de toxoplasmose aiguë risquent de transmettre le parasite au fœtus en développement. En 1987, on a signalé une éclosion de toxoplasmose avec des femmes enceintes dans le NunavikNote de bas de page 19. L’infection était associée à l’écorchage des animaux et la consommation de viande de caribou crueNote de bas de page 19.
T. gondii sans hôte définitif
Une étude de Svalbard, en Norvège, laisse entendre qu’on accorde trop d’importance au rôle des ookystes dans la transmission de l’infection à T. gondii aux animaux terrestres arctiquesNote de bas de page 31. L’archipel de Svalbard ne présente pas de chats domestiques ou sauvages, ce qui élimine la propagation d’ookystes de T. gondii infectieux dans l’environnementNote de bas de page 31. L’absence d’ookystes de T. gondii à Svalbard est appuyée par des conclusions selon lesquelles les herbivores et oiseaux non migrateurs étaient séronégatifs pour l’infection à T. gondiiNote de bas de page 31. Cependant, les carnivores (renards) ont obtenu un résultat positif pour l’infection à T. gondii. Par conséquent, les oiseaux migrateurs pourraient avoir introduit le parasite T. gondii à Svalbard et, par la suite, les carnivores locaux sont devenus infectés en mangeant des proies infectées. Ainsi, il est possible pour l’infection à T. gondii d’être transmise d’un hôte intermédiaire à l’autre (p. ex., de l’oiseau au carnivore) sans reproduction sexuée du parasite chez un félidé qui constitue un hôte définitif. Ce cycle de transmission entre de nombreux hôtes intermédiaires peut expliquer la prévalence de l’infection à T. gondii dans l’Arctique, y compris l’Arctique canadien, surtout chez les carnivores autres que des félidés. Cette hypothèse est soutenue par des constatations selon lesquelles tous les oiseaux migrateurs et carnivores locaux de Svalbard analysés ont obtenu un résultat positif pour l’infection à T. gondiiNote de bas de page 31.
Animaux terrestres de l’Arctique canadien
Sans égard à la source de l’infection (ookystes environnementaux vs kystes tissulaires des proies infectées), de nombreux mammifères et oiseaux du Nord canadien ont obtenu un résultat positif pour l’infection à T. gondii (tableau 1). On a démontré que les oiseaux de partout au monde sont susceptibles de contracter une infection à T. gondiiNote de bas de page 31 et au Canada, les oiseaux migrateurs, tels que les oies, passent l’hiver dans des zones où les félidés sont communs et où il est possible de trouver des ookystes de T. gondii infectieux en grand nombre dans l’environnementNote de bas de page 32Note de bas de page 33Note de bas de page 34. On a détecté l’infection à Toxoplasma gondii dans les trois espèces d’oies analysées, avec la prévalence la plus élevée chez l’oie de Ross (34,5 %) et la plus faible chez la bernache du Canada (5,8 %). Parmi les espèces de lagopèdes analysées, un seul lagopède alpin a obtenu un résultat positif pour l’infection à T. gondii, possiblement en raison de la faible exposition aux ookystes au sein de leurs habitats de la toundra arctiques, subarctiques et alpins.
| Nom commun (références) | Nom latin | Nombre analysé | Nombre de résultats positifs | Pourcentage de résultats positifs |
|---|---|---|---|---|
| Oiseaux | ||||
| Lagopède alpinNote de bas de page 35 | Lagopus muta | 25 | 1 | 4,0 % |
| Lagopède des saulesNote de bas de page 35 | Lagopus lagopus | 24 | 0 | 0,0 % |
| Oie de RossNote de bas de page 36Note de bas de page 37 | Chen rossii | 357 | 123 | 34,5 % |
| Petite oie des neigesNote de bas de page 36Note de bas de page 37 | Chen caerulescens | 354 | 110 | 31,1% |
| Bernache du CanadaNote de bas de page 35Note de bas de page 38 | Branta canadensis | 240 | 14 | 5,8 % |
| Mammifères | ||||
| Rongeurs | ||||
| Lemming brun néarctiqueNote de bas de page 37 | Lemmus trimucronatus | 84 | 0 | 0,0 % |
| Lagomorphes | ||||
| Lièvre d’AmériqueNote de bas de page 35 | Lepus americanus | 8 | 0 | 0,0 % |
| Lièvre arctiqueNote de bas de page 35 | Lepus arcticus | 2 | 0 | 0,0 % |
| Ongulés | ||||
| Caribou de la toundraNote de bas de page 39 | Rangifer tarandus groenlandicus | 117 | 43 | 36,8 % |
| CaribouNote de bas de page 35 | Rangifer tarandus | 97 | 11 | 11,3 % |
| Bœuf musquéNote de bas de page 35Note de bas de page 40 | Ovibus moschatus | 348 | 16 | 4,6 % |
| Carnivores | ||||
| Renard arctiqueNote de bas de page 41 | Vulpes lagopus | 39 | 17 | 43,6 % |
| Lynx du CanadaNote de bas de page 16Note de bas de page 35 | Lynx canadensis | 173 | 44 | 25,4 % |
| CarcajouNote de bas de page 42 | Gulo gulo | 41 | 17 | 41,5 % |
| Loup grisNote de bas de page 35 | Canis lupus | 37 | 7 | 18,9 % |
| Ours noirNote de bas de page 35Note de bas de page 43 | Ursus americanus | 43 | 16 | 37,2 % |
Les rongeurs et lagomorphes arctiques canadiens ne présentaient pas de prévalence pour l’infection à T. gondii. Les lemmings bruns néarctiques ont obtenu un résultat négatif, tout comme les lièvres arctiques et les lièvres d’Amérique (tableau 1). La seule voie de transmission de l’infection à T. gondii pour les herbivores non migrateurs serait par l’ingestion de sol, de plantes ou d’eau contaminés par des ookystes infectieux. L’absence de prévalence de l’infection à T. gondii chez les rongeurs et lagomorphes de l’Arctique canadien appuie l’hypothèse selon laquelle les herbivores arctiques non migrateurs sont peu ou pas exposés aux ookystes de T. gondii infectieuxNote de bas de page 31.
L’exposition à l’infection à T. gondii des ongulés variait entre les espèces. Le caribou présente une prévalence de l’infection à T. gondii de 11,3 %, tandis que la sous-espèce caribou de la toundra présente une prévalence de 36,8 %. Il est difficile de comprendre pourquoi le caribou de la toundra présente une prévalence de l’infection à T. gondii si élevée. Le bœuf musqué présente une prévalence de l’infection à T. gondii de seulement 4,6 % (tableau 1).
La prévalence de l’infection à T. gondii chez les carnivores était élevée dans toutes les espèces analysées, comme on pourrait s’y attendre même lorsque la prévalence du parasite dans leurs proies est relativement faible. Au Canada, on a constaté que la prévalence de l’infection à T. gondii était de 43,6 % chez le renard arctique, 25,4 % chez le lynx du Canada, 41,5 % chez le carcajou, 18,9 % chez le loup gris et 37,2 % chez l’ours noir (tableau 1).
Mammifères marins de l’Arctique canadien
La plupart des pinnipèdes de l’Arctique canadien ont obtenu un résultat positif pour l’infection à T. gondii, y compris le phoque commun (16,4 %), le phoque annelé (10,7 %), le phoque barbu (10,0 %), le phoque à capuchon (1,7 %) et le morse (14,7 %) (tableau 2). On n’a pas détecté d’infection à Toxoplasma gondii chez le phoque du Groenland et d’autres études pourraient s’avérer utiles pour déterminer si des habitudes alimentaires différentes les protègent d’une exposition aux proies infectées.
| Nom commun (références) | Nom latin | Nombre analysé | Nombre de résultats positifs | Pourcentage de résultats positifs |
|---|---|---|---|---|
| Pinnipèdes | ||||
| Phoque communNote de bas de page 26 | Phoca vitulina | 311 | 51 | 16,4 % |
| Phoque anneléNote de bas de page 26Note de bas de page 35 | Phoca hispida | 896 | 96 | 10,7 % |
| Phoque du GroenlandNote de bas de page 35Note de bas de page 44 | Phoca groenlandica | 113 | 0 | 0,0 % |
| Phoque barbuNote de bas de page 26 | Erignathus barbatus | 20 | 2 | 10,0 % |
| Phoque à capuchonNote de bas de page 44 | Cystophora cristata | 60 | 1 | 1,7 % |
| MorseNote de bas de page 35 | Odobenus rosmarus | 34 | 5 | 14,7 % |
| Ours | ||||
| Ours blancNote de bas de page 35Note de bas de page 44Note de bas de page 45Note de bas de page 46Note de bas de page 47 | Ursus maritimus | 599 | 67 | 11,2 % |
| Cétacés | ||||
| BélugaNote de bas de page 35Note de bas de page 48 | Delphinapterus leucas | 69 | 13 | 18,8 % |
| Baleine boréaleNote de bas de page 35 | Balaena mysticetus | 2 | 1 | 50,0 % |
Les ours blancs constituent les seuls ursidés considérés comme des mammifères marins, puisqu’ils dépendent de l’océan pour la nourriture et l’habitat. On a détecté l’infection à Toxoplasma gondii chez l’ours blanc dans la partie continentale canadienne et la mer de Beaufort, avec une prévalence globale de 11,2 %.
On a analysé deux espèces de cétacés arctiques pour l’infection à T. gondii : le béluga et la baleine boréale (tableau 2). La prévalence de l’infection à Toxoplasma gondii chez les bélugas de l’ouest de l’Arctique canadien était de 18,8 % (tableau 2). Parmi les deux baleines boréales analysées, un animal a obtenu un résultat positif pour l’infection à T. gondiiNote de bas de page 35.
T. gondii dans les eaux de l’Arctique
On a détecté l’ADN du parasite Toxoplasma gondii dans jusqu’à 77 % des échantillons d’eau de surface et de puits traitée et non traitée à l’échelle mondialeNote de bas de page 49Note de bas de page 50. Dans certaines régions du Canada, on a associé la hausse des précipitations aux nombres élevés d’ookystes de T. gondii dans l’eau de surfaceNote de bas de page 51. La plupart des rivières et fleuves canadiens coulent vers le nord; 39 % de l’eau douce du pays se jette dans la baie d’Hudson et 36 %dans l’océan ArctiqueNote de bas de page 52. Les ookystes emportés dans l’eau de mer peuvent rester infectieux pendant deux ans et se répandre à l’aide des courants océaniquesNote de bas de page 20Note de bas de page 53Note de bas de page 54Note de bas de page 55.
On a avancé l’hypothèse selon laquelle les poissons pourraient constituer le chaînon manquant entre les ookystes qui se retrouvent dans les bassins versants et l’infection chez les mammifères marinsNote de bas de page 56. On a trouvé des ookystes de Toxoplasma gondii dans le tube digestif d’un poisson sauvageNote de bas de page 57 et on a prouvé que les ookystes peuvent rester infectieux dans le tube digestif d’un poisson pendant plusieurs heuresNote de bas de page 58, fournissant de ce fait une source d’infection possible pour les superprédateurs. Jusqu’à maintenant, on a uniquement signalé une infection expérimentale de poissons avec des kystes tissulaires de T. gondii chez le poisson zèbre et uniquement dans des conditions strictement contrôléesNote de bas de page 57. On a également signalé une infection à Toxoplasma gondii dans une gamme de mollusques et crustacés à l’échelle mondialeNote de bas de page 59, ce qui pourrait fournir une autre source d’infection chez les mammifères marins et l’humain, bien que ce point n’ait pas encore été consigné ni confirmé dans l’Arctique.
Afin de déterminer si les poissons de l’Arctique constituent une source potentielle de T. gondii, nous avons analysé les tissus musculaires de 121 poissons d’eau douce et euryhalins du Nunavik pour déceler la présence d’ADN du parasite T. gondii. Quinze poissons (12,4 %) ont obtenu un résultat positif pour T. gondii au moyen de la réaction en chaîne de la polymérase pour l’amplification de l’ADN, suivie du séquençage de Sanger. Le saumon atlantique et l’omble chevalier présentent une prévalence de l’infection à T. gondii de 26,7 % et 12,0 %, respectivement. Les autres espèces de poissons ayant obtenu un résultat positif pour l’ADN du parasite T. gondii sont le touladi (2,9 %) et l’omble de fontaine (16,7 %). On a détecté l’infection à Toxoplasma gondii dans un chabot (n=1), mais pas chez le brochet ou le grand corégone, possiblement en raison de la petite taille de l’échantillon (n=2 et 6, respectivement) (Reiling, S.J., R. Boone, H. Merks et B.R. Dixon. Données non publiées, 2018). Il s’agit de conclusions préliminaires et un plus grand nombre de poissons de l’Arctique canadien sont en cours d’analyse dans notre laboratoire pour détecter la présence de T. gondii.
Discussion
Il existe de nombreux mécanismes par lesquels le parasite T. gondii peut avoir été introduit dans l’Arctique canadien. Le parasite Toxoplasma gondii pourrait avoir été introduit par des oiseaux et mammifères migrateurs qui ont contracté l’infection lors de l’ingestion d’ookystes (qui peuvent persister dans le sol et l’eau des régions géographiques où l’on trouve des félidés) ou de proies infectées, dans leurs habitats au sud, pour ensuite transporter l’infection avec eux vers le nord. Le parasite pourrait ensuite être transmis d’un hôte intermédiaire à l’autre dans l’Arctique, et ce, même sans hôte définitif. De plus, les prédateurs tels que le renard arctique, le carcajou et le loup gris présentent une prévalence de l’infection à T. gondii élevée, ce qui laisse entendre que le carnivorisme pourrait également constituer une importante voie de transmission dans l’Arctique. Les ookystes répandus par les félidés dans le sud et transportés vers le nord au moyen des cours d’eau pourraient constituer une autre source d’infection des animaux aquatiques dans l’Arctique. Jusqu’à tout récemment, on ignorait que les poissons constituaient une source potentielle d’infection à T. gondii. Cependant, nos conclusions préliminaires laissent entendre qu’on peut trouver l’infection à T. gondii dans les poissons de l’Arctique canadien et qu’ils pourraient constituer une autre source d’infection chez les humains et les mammifères piscivores.
Les facteurs environnementaux qui accroissent la prévalence de l’infection à T. gondii chez les animaux chassés par les Inuit aux fins de subsistance peuvent représenter une menace croissante pour la santé des Inuit dans les régions arctiques du Canada. D’autres études sont nécessaires pour déterminer l’influence des changements environnementaux et socioéconomiques sur la prévalence de l’infection à T. gondii chez les animaux et les humains de l’Arctique canadien.
Le changement climatique et la hausse des températures peuvent favoriser la croissance forestière dans des régions qui, auparavant, étaient trop froidesNote de bas de page 60Note de bas de page 61Note de bas de page 62. L’accroissement du couvert forestier pourrait élargir l’habitat des félidés sauvages, augmentant de ce fait la perte d’ookystes de T. gondii dans l’environnementNote de bas de page 20. Les nombres élevés d’ookystes combinés au réchauffement des températures pourraient accroître le potentiel d’infection des hôtes intermédiaires, y compris les oiseaux et mammifères dont on ignore encore qu’ils constituent des hôtes du parasite T. gondii dans l’Arctique canadien. Cette situation pourrait ensuite ouvrir de nouvelles voies de transmission chez les humains qui consomment des aliments prélevés dans la nature préparés selon les traditions.
Conclusion
La toxoplasmose est maintenant répandue dans une grande partie de l’Amérique du Nord et du Sud, principalement par l’entremise de félidés. Malgré l’absence de félidés dans ce terretoire, T. gondii est maintenant présent dans l’Arctique Canadien et pose un risque de santé aux Inuit, principalement aux femmes enceintes et aux personnes immunodéprimées. La source d’infection à T. gondii la plus probable chez les Inuit est via les hôtes intermédiaires infectés et la consommation de mets préparés de manière traditionnelle, la viande et les abats pouvant être consommés crus. La prévention des infections par la cuisson et la congélation complète du poisson, de la viande et des abats ainsi qu’une meilleure compréhension des modes de transmissions des zoonoses aideront à réduire ce risque.
Déclaration des auteurs
S. J. R. a recueilli et analysé les données. S. J. R. et B. R. D. ont rédigé, révisé et approuvé le manuscrit.
Conflit d’intérêts
Aucun.
Remerciements
Nous souhaitons remercier A. Iqbal et S. Lamhoujeb d’avoir fourni l’ADN des poissons. R. Boone et H. Merks ont fourni une excellente assistance technique.
Financement
Le présent travail a reçu l’appui du Conseil de recherches en sciences naturelles et en génie (CRSNG) du Canada, du Programme de bourses de recherche scientifique dans les laboratoires du gouvernement canadien (S. J. R.) et de Santé Canada (B. R. D.).

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International