Archivée - Les Escherichia coli producteurs de toxines de Shiga, Colombie-Britannique, 2011 à 2017

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 45–9 : Éclosions
Date de publication : 5 septembre 2019
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 45–9, le 5 septembre 2019 : Éclosions
Surveillance
Les Escherichia coli producteurs de toxines de Shiga en Colombie-Britannique, entre 2011 et 2017 : Analyse visant à éclairer les directives d’exclusion
K Noftall1,2, M Taylor1, L Hoang3,4, E Galanis1,2
Affiliations
1 Centre de contrôle des maladies de la Colombie-Britannique, Vancouver, Colombie-Britannique
2 École de santé publique et de santé des populations, Université de la Colombie-Britannique, Vancouver, Colombie-Britannique
3 Laboratoire de santé publique du Centre de contrôle des maladies de la Colombie-Britannique, Vancouver, Colombie-Britannique
4 Département de pathologie et de médecine de laboratoire, Faculté de médecine, Université de la Colombie-Britannique, Vancouver, Colombie-Britannique
Correspondance
Citation proposée
Noftall K, Taylor M, Hoang L, Galanis E. Les Escherichia coli producteurs de toxines de Shiga en Colombie-Britannique, entre 2011 et 2017 : Analyse visant à éclairer les directives d’exclusion. Relevé des maladies transmissibles au Canada 2019;45(9):261–7. https://doi.org/10.14745/ccdr.v45i09a03f
Mots-clés : toxine de Shiga, Escherichia coli, directives, surveillance, STEC
Résumé
Contexte : Les Escherichia coli producteurs de toxines de Shiga (STEC) peuvent provoquer des maladies graves comme la diarrhée sanglante et le syndrome hémolytique urémique (SHU) en raison de la production de toxines de Shiga 1 (Stx1) et 2 (Stx2). Dans les années 1980 et 1990, E. coli O157:H7 était le sérotype le plus fréquemment détecté, mais les améliorations apportées aux méthodes de laboratoire ont permis la détection accrue des STEC non O157. Les STEC non O157 produisant uniquement le type Stx1 ont tendance à causer des maladies cliniques plus bénignes. Les directives d’exclusion limitent le retour à un poste de travail ou dans des environnements à haut risque pour les cas de STEC, mais la plupart ne font pas la différence entre les sérogroupes de STEC et les types de Stx.
Objectif : Analyser les données de surveillance et de laboratoire de la Colombie-Britannique (C.-B.) pour éclairer les directives d’exclusion fondée sur les STEC en C.-B.
Méthodes : Pour tous les cas de STEC signalés en C.-B. entre 2011 et 2017, les données de laboratoire et épidémiologiques ont été obtenues à partir des laboratoires provinciaux et des systèmes électroniques sur les maladies à déclaration obligatoire, respectivement. L’incidence a été mesurée pour tous les STEC cumulés ainsi que par sérogroupe. On a mesuré les associations entre sérogroupes, types de Stx et résultats cliniques.
Résultats : Sur une période de sept ans, 984 cas de STEC ont été signalés. On a constaté une diminution de l’incidence d’O157, alors que les taux des cas non O157 ont augmenté. Le sérogroupe O157 était associé de façon significative au type Stx2. On a constaté des associations significatives entre le type Stx2 et la diarrhée sanglante, l’hospitalisation et le SHU.
Conclusion : L’épidémiologie des STEC a changé en C.-B. à mesure que les laboratoires ont pu différencier les cas O157 des cas non O157 et identifier le type de Stx. Il semble que les cas non O157 avec le type Stx1 soient moins graves que les cas O157 avec le type Stx2. Les directives d’exclusion fondée sur les STEC en C.-B. ont été mises à jour pour tenir compte des résultats de cette analyse.
Introduction
On sait depuis longtemps que les Escherichia coli font partie de la flore normale du tube digestif. Certaines souches de E. coli ont évolué et ont acquis des facteurs virulents comme la toxine de Shiga qui provoquent des maladies chez les humains. Ces organismes ont été renommés ainsi : E. coli producteurs de toxines de Shiga (STEC)Note de bas de page 1. Le sérotype de STEC le plus connu, E. coli O157:H7, a d’abord été détecté dans les années 1980 chez des patients souffrant de maladies graves comme la colite hémorragique et le syndrome hémolytique urémique (SHU)Note de bas de page 2Note de bas de page 3. Dans les années 1990, après que les laboratoires ont commencé à faire le dépistage systématique de E. coli O157:H7, celui-ci a été reconnu comme la cause de vastes et graves épidémies principalement associées au bœuf insuffisamment cuitNote de bas de page 4Note de bas de page 5.
Au début des années 2000, les laboratoires ont commencé à mettre en place des méthodes de détection d’autres sérotypes de STECNote de bas de page 6Note de bas de page 7. On a ainsi pu constater que les STEC non O157 peuvent contaminer une grande variété de sources et provoquer de vastes épidémiesNote de bas de page 8Note de bas de page 9. Toutefois, les STEC non O157 demeurent sous-déclarés parce que de nombreux laboratoires de première ligne n’en font pas le dépistage systématiqueNote de bas de page 10. Néanmoins, en 2016, environ 35 % de toutes les infections aux STEC signalées au Programme national de surveillance des maladies entériques étaient causées par des sérotypes non O157Note de bas de page 11.
Les gènes stx des STEC produisent des toxines de Shiga 1 (Stx1) et 2 (Stx2). Le type Stx2 est associé à des maladies graves et au SHUNote de bas de page 8Note de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20. En outre, le type Stx2 est associé aux STEC O157, ce qui explique la pathogénicité supérieure de ce sérogroupeNote de bas de page 17Note de bas de page 21Note de bas de page 22. En 2013, un test de réaction en chaîne par polymérase (PCR) a été mis en œuvre par le Laboratoire de santé publique du Centre de contrôle des maladies de la Colombie-Britannique (LSP CCMCB) pour détecter et différencier les gènes stx 1 et 2.
Afin de protéger la population contre des maladies graves, la plupart des organismes de santé publique excluent les personnes infectées par STEC d’un retour à un travail ou dans des environnements à haut risqueNote de bas de page 23Note de bas de page 24. Ainsi, les directives du CCMCB produites en 2006 stipulaient qu’une personne qui a reçu un diagnostic de STEC et qui travaille comme manipulateur d’aliments, qui est travailleur de la santé, qui travaille au sein d’une garderie ou qui fréquente une garderie doit être exclue de cet environnement jusqu’à ce qu’elle ait fourni deux échantillons de selles négatifsNote de bas de page 25.
La détection croissante de cas de STEC non O157 et leur association avec le type Stx1 et des maladies moins graves nous ont amenés à remettre en question la pertinence des directives d’exclusion qui ne font pas la différence entre les sérogroupes et les types de Stx. Un examen des directives actuelles a permis de constater que quatre régions ont récemment mis à jour leurs recommandations dans le but de stratifier par sérogroupe et type de Stx l’exclusion des milieux de travail et des garderiesNote de bas de page 26Note de bas de page 27Note de bas de page 28Note de bas de page 29.
Le présent document a pour objectif d’analyser les données de surveillance et de laboratoire de la Colombie-Britannique (C.-B.) pour éclairer les directives d’exclusion fondée sur les STEC en C.-B.
Méthodes
Échantillon d’étude
Cette étude a porté sur tous les cas confirmés de STEC qui étaient résidents de la C.-B. et qui ont été déclarés dans le système provincial d’information électronique de santé publique entre le 1er janvier 2011 et le 31 décembre 2017Note de bas de page 30. Pour ces cas, tous les résultats de culture, le sérogroupe de STEC et le test PCR pour le gene stx proviennent du système d’information du LSP CCMCB.
Données de laboratoire
En C.-B., les échantillons de selles peuvent être traités dans un laboratoire privé, dans le laboratoire d’un hôpital ou au LSP CCMCB. Dans les laboratoires privés et hospitaliers, les STEC sont identifiés au moyen de méthodes de culture ou moléculaires. Les isolats de STEC qui sont positifs à la Stx ou au O157, ainsi que les échantillons qui sont visiblement sanglants ou qui proviennent d’un cas pour lequel on a diagnostiqué le SHU, sont envoyés au LSP CCMCB pour des tests supplémentaires et pour la sérotypie. Jusqu’en 2013, les Stx étaient détectées au moyen d’un dosage sur lignées cellulaires Véro au LSP CCMCB; depuis 2013, les gènes stx 1 et 2 sont détectés par test PCR dans des échantillons de selles et dans des isolats de STEC suspects provenant d’échantillons de selles positifs au stx provenant de laboratoires privés et hospitaliers. Les isolats de stx positifs sont sérotypés pour les antigènes O157 et H7, et subissent un test PCR O-Typer portant sur les six sous-groupes les plus fréquemment constatés en C.-B. : O26, O45, O103, O111, O121 et O145. Tout isolat positif au stx ne pouvant pas être sérotypé est envoyé au Laboratoire national de microbiologie pour identification.
Les variables incluses dans les données du LSP CCMCB étaient le type de Stx et le sérogroupe. Si on a eu recours au dosage sur lignées cellulaires Véro, le résultat sur les Stx a été déclaré comme étant positif; lorsqu’on a exécuté le test PCR, le gène stx a été enregistré. Lorsque plusieurs résultats de test de laboratoire étaient disponibles pour des cas individuels, le résultat de sérotypie le plus spécifique a été retenu.
Données de surveillance
Les cas de STEC sont des maladies à déclaration obligatoire en C.-B. et les personnes sont interviewées par des professionnels de la santé publique au moyen d’un formulaire de surveillance standardNote de bas de page 30Note de bas de page 31. Toutes les instances sanitaires régionales signalent les cas de STEC au niveau provincial dans le système provincial d’information électronique de santé publique de la C.-B. Les données autodéclarées sur la démographie, les symptômes cliniques, le statut d’hospitalisation et du SHU ont été extraites de ce système. Les données de laboratoire peuvent également être entrées dans ce système dans le cadre de la surveillance ordinaire par l'instance sanitaire régionale.
Le statut d’hospitalisation et les informations d’exclusion étaient disponibles uniquement pour les cas signalés entre 2015 et 2017. Les données cliniques étaient disponibles chez quatre des cinq instances sanitaires régionales. On a estimé qu’un cas avait un symptôme ou un résultat si « oui » avait été enregistré dans ce champ de données. Si aucun résultat de laboratoire n’était disponible auprès du LSP CCMCB, on a utilisé les données de laboratoire entrées par les instances sanitaires régionales dans le système d’information de santé publique.
Analyse
Les données de surveillance des STEC du CCMCB et les données de laboratoire des STEC du LSP CCMCB de 2011 à 2017 ont été reliées par un identifiant de cas commun. Les taux d’incidence ont été calculés à partir des informations démographiques de la C.-B.Note de bas de page 32. Les différences de taux d’incidence de STEC entre les hommes et les femmes ont été obtenues au moyen du test de Wilcoxon. Les données cliniques ont été comparées par sérogroupe et par type de Stx pour tous les symptômes ainsi que pour le SHU et l’hospitalisation au moyen de la méthode exacte de Fisher. On a utilisé un niveau alpha de 0,05 pour déterminer la significativité, et tous les tests statistiques ont été réalisés au moyen du programme statistique RNote de bas de page 33. Lorsque les informations d’exclusion étaient disponibles, on a classé les cas exclus par sérogroupe et par type de Stx.
Résultats
Entre 2011 et 2017, 984 cas de STEC ont été signalés en C.-B., soit une moyenne de 141 cas par année (étendue : entre 108 et 184). L’incidence de STEC globale durant cette période était de 3,0 cas pour 100 000. Des épidémies ont eu lieu en 2013, 2016 et 2017. Il y a eu plus de cas chez les femmes (57,4 %) que chez les hommes (42,6 %), mais il n’y a eu aucune différence significative des taux par sexe pour tous les cas de STEC ou par sérogroupe (ces données ne sont pas illustrées). L'âge médian était de 31 ans (étendue : <1 -113), l'incidence la plus élevée étant chez les enfants de 1 à 9 ans avec 4,9 cas pour 100 000.
Au total, 58 sérogroupes ont été identifiés. Près de 10 % des échantillons étaient négatifs à la culture et positifs au stx uniquement (tableau 1). Les six sérogroupes les plus fréquents étaient O157, O121, O26, O103, O117 et O111. Le sérogroupe le plus signalé était O157 à tous les ans sauf en 2017, où les cas avec O121 étaient les plus fréquents.
| Sérogroupe | N | (%) |
|---|---|---|
| O157 | 369 | (37,5) |
| O121 | 102 | (10,4) |
| O26 | 86 | (8,7) |
| O103 | 44 | (4,5) |
| O117 | 38 | (3,9) |
| O111 | 34 | (3,5) |
| Autres sérogroupes | 152 | (15,4) |
| Positif à la Stx uniquement | 93 | (9,5) |
| InconnuNote a de Tableau 1 | 66 | (6,7) |
| Toxine de Shiga | N | (%) |
| Positif à la StxNote b de Tableau 1 | 111 | (11,3) |
| Stx1 | 270 | (27,4) |
| Stx1 et Stx2 | 239 | (24,3) |
| Stx2 | 274 | (27,8) |
| Stx inconnueNote c de Tableau 1 | 90 | (9,1) |
Dans l’ensemble, entre 2011 et 2017, les taux de type O157 ont baissé de 1,1 à 0,5 pour 100 000 (figure 1). Par contre, entre 2011 et 2017, les taux de type non O157 ont beaucoup augmenté, de 0,6 à 2,4 pour 100 000.
Figure 1 : Incidence de Escherichia coli producteurs de toxines de Shiga par sérogroupe, Colombie-Britannique, entre 2011 et 2017 (N = 984)
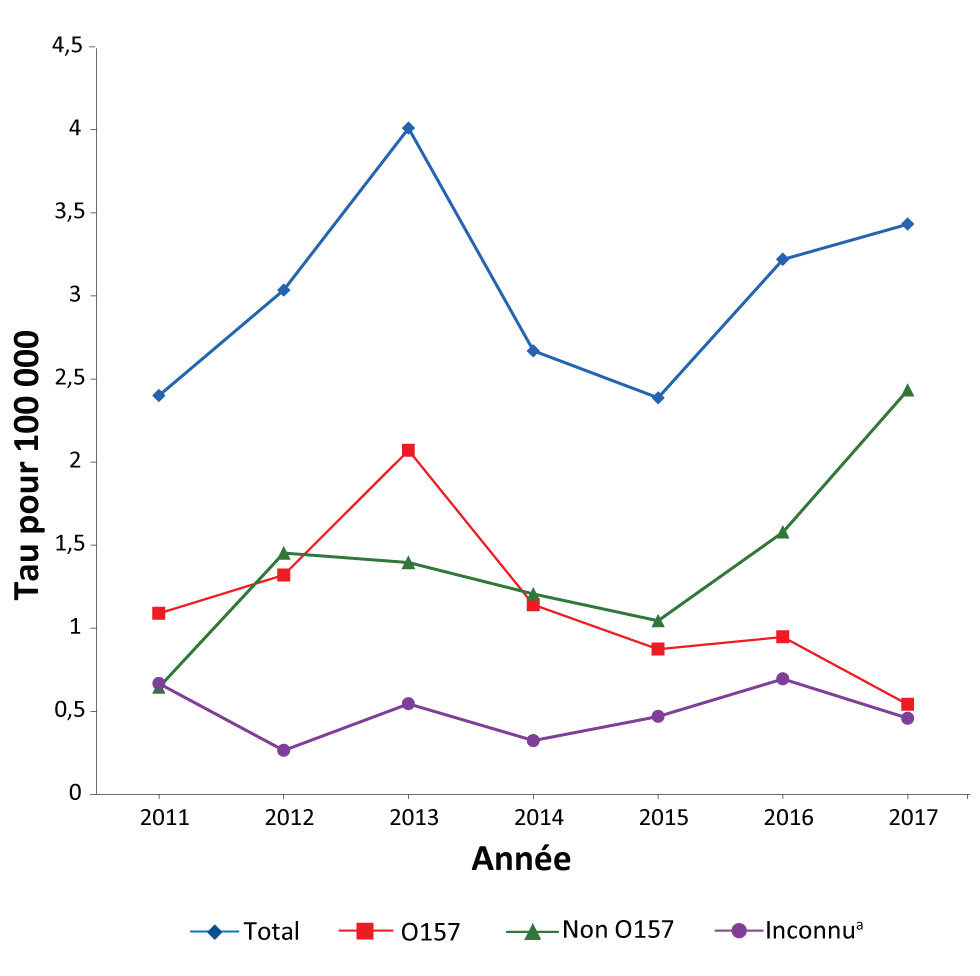
Description textuelle : Figure 1
Figure 1 : Incidence de Escherichia coli producteurs de toxines de Shiga par sérogroupe, Colombie-Britannique, entre 2011 et 2017 (N = 984)
| Année | O157 | Non O157 | InconnuFigure 1 note a | Total |
|---|---|---|---|---|
| 2011 | 1,1 | 0,6 | 0,7 | 2,4 |
| 2012 | 1,3 | 1,5 | 0,3 | 3,0 |
| 2013 | 2,1 | 1,4 | 0,5 | 4,0 |
| 2014 | 1,1 | 1,2 | 0,3 | 2,7 |
| 2015 | 0,9 | 1,0 | 0,5 | 2,4 |
| 2016 | 0,9 | 1,6 | 0,7 | 3,2 |
| 2017 | 0,5 | 2,4 | 0,5 | 3,4 |
La présence de Stx a été confirmée dans 894 cas (90,1 %; tableau 1). Dans 111 cas (11,3 %), la Stx a été détectée par dosage sur lignées cellulaires Véro uniquement, et le type de Stx spécifique n’était pas disponible. Parmi les 783 cas pour lesquels le gène stx a été identifié par test PCR, 270 (34,5 %) étaient positifs au stx1 uniquement, 274 (35,0 %) étaient positifs au stx2 uniquement, et 239 (30,5 %) provenaient de STEC contenant à la fois stx1 et stx2. Ainsi, 65,5 % des cas pour lesquels le gène stx a été détecté ont affiché un résultat positif pour le stx2 (seul ou en combinaison). Lorsque le sérogroupe et le gène stx ont tous deux été identifiés (N = 711), 97,7 % des STEC O157 contenaient le stx2 seul ou en combinaison, par rapport à 42,9 % des sérogroupes non O157 (rapport des cotes = 56,5; p ≤ 0,001).
Les données cliniques étaient disponibles pour 594 cas (60,4 %). Les symptômes les plus fréquemment signalés étaient la diarrhée (90,2 %), le malaise abdominal (70,2 %), la diarrhée sanglante (56,6 %), les vomissements (24,6 %), la fièvre (21,4 %) et la fatigue (13,6 %). Dix-huit cas (3,0 %) ont indiqué avoir le SHU au moment de l’interview de santé publique. Les cas infectés avec E. coli O157 étaient plus susceptibles de souffrir de diarrhée sanglante et de fatigue et d’être hospitalisés que les cas non O157 (tableau 2). Même si une proportion plus élevée des cas O157 (4,9 %) que des cas non O157 (1,9 %) avait le SHU, cela n'était pas statistiquement significatif. Les cas avec stx2 étaient nettement plus susceptibles d’avoir la diarrhée sanglante et le SHU et d’être hospitalisés que les cas avec stx1 uniquement (tableau 2).
| Résultat clinique | Sérogroupe | Type de toxine de Shiga | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| O157 | Non O157 | Valeur de p | Stx2 présentes | Stx1 uniquement | Valeur de p | |||||
| N | (%) | N | (%) | N | (%) | N | (%) | |||
| Malaise abdominal | 177 | (72,5) | 189 | (70,3) | 0,625 | 262 | (73,8) | 106 | (69,3) | 0,330 |
| Diarrhée | 221 | (90,5) | 250 | (92,9) | 0,339 | 321 | (90,4) | 138 | (90,2) | 1,000 |
| Diarrhée sanglante | 168 | (68,9) | 136 | (50,6) | <0,001 | 231 | (65,1) | 69 | (45,1) | <0,001 |
| Fatigue | 46 | (18,9) | 25 | (9,3) | 0,002 | 53 | (14,9) | 17 | (11,1) | 0,326 |
| Fièvre | 57 | (23,4) | 50 | (18,6) | 0,193 | 78 | (22,0) | 27 | (17,6) | 0,285 |
| Vomissements | 63 | (25,8) | 64 | (23,8) | 0,610 | 85 | (23,9) | 34 | (22,2) | 0,733 |
| SHU | 12 | (4,9) | 5 | (1,9) | 0,081 | 15 | (4,2) | 1 | (0,7) | 0,048 |
| HospitalisationNote b de Tableau 2 | 29 | (35,4) | 25 | (16,1) | 0,001 | 52 | (31,7) | 13 | (13,8) | 0,002 |
Les informations d’exclusion étaient disponibles pour 276 (64 %) cas entre 2015 et 2017. Quarante-trois cas (16 %) ont été exclus de postes de travail ou d’environnements à haut risque. Parmi ceux-ci, dix étaient positifs au O157 (23,3 %), 28 étaient positifs aux STEC non O157 (65,1 %) et cinq avaient un sérogroupe inconnu (11,6 %). Vingt et un cas (48,8 %) avaient des STEC avec stx2 présent, 20 (46,5 %) avaient des STEC avec stx1 uniquement et deux (4,7 %) avaient des STEC avec des résultats PCR stx indéterminés. Tous les cas de STEC O157 étaient positifs au stx2.
Discussion
L’analyse des données de laboratoire et de surveillance en C.-B. a montré un changement dans la distribution des sérogroupes de STEC entre 2011 et 2017 : l’incidence de la souche O157 est en baisse et l’incidence des souches non O157 est en hausse, en particulier entre 2015 et 2017. Ce résultat est en accord avec la diminution de l’incidence de la souche O157 qui a été constatée à l’échelle du CanadaNote de bas de page 34 et aux États-UnisNote de bas de page 6Note de bas de page 8Note de bas de page 22Note de bas de page 35Note de bas de page 36. La diminution de la souche O157 au Canada peut provenir d’améliorations sanitaires dans la transformation du bœuf ainsi que d’une meilleure sensibilisation à la salubrité des aliments auprès des consommateursNote de bas de page 34. L’augmentation de l’incidence des souches non O157 en C.-B. et ailleurs peut résulter d’un plus grand recours à des méthodes de laboratoire qui permettent la détection de sources non O157Note de bas de page 6Note de bas de page 36.
On a constaté un lien marqué entre le sérogroupe O157 et la Stx2; en effet, près de 98 % des cas O157 sont positifs à la Stx2, ce qui est conforme aux études antérieuresNote de bas de page 15Note de bas de page 16Note de bas de page 21Note de bas de page 22. On a aussi constaté un lien entre les cas de STEC O157 et les résultats cliniques graves comme la colite hémorragique et l’hospitalisationNote de bas de page 17Note de bas de page 22Note de bas de page 37. On relève un lien significatif entre le stx2 et le SHU, la diarrhée sanglante et l’hospitalisation. Les variantes de Stx (stx2d, par exemple), qui se sont révélées des indicateurs plus spécifiques de maladie grave que le type de Stx, ne sont pas encore disponibles en C.-B.Note de bas de page 13Note de bas de page 15Note de bas de page 16Note de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 38.
Cette analyse a été effectuée pour éclairer les directives d’exclusion fondée sur les STEC en C.-B. En conformité avec nos constatations et d’autres directives récemment mises à jour concernant la stratification de l’exclusion par sérogroupe et StxNote de bas de page 26Note de bas de page 27Note de bas de page 28Note de bas de page 29, les nouvelles directives de la C.-B. tiennent maintenant compte du fait que les STEC produisant uniquement le type Stx1 provoquent des maladies moins gravesNote de bas de page 39. Selon les directives révisées indiquant que les cas de STEC non O157 produisant uniquement le type stx1 sans symptômes cliniques graves peuvent retourner à un poste de travail ou dans des environnements à haut risque lorsqu’ils sont asymptomatiques, 16 cas exclus (37,2 %) entre 2015 et 2017 auraient vu leur exclusion levée plus tôt. En présumant que la durée médiane des symptômes est de sept jours et que la durée médiane d’excrétion est de 20 joursNote de bas de page 40Note de bas de page 41, cela aurait permis d’éviter jusqu’à 208 jours de productivité perdue pour ces personnes.
La présente étude comporte quelques limites. La pratique de laboratoire pour la détection des Stx a changé au cours de la période à l’étude, et il n’a été possible de différencier les types de Stx entre 2011 et 2013. Les symptômes étaient autodéclarés et disponibles uniquement pour quatre des cinq régions sociosanitaires de la province. Malgré tout, la proportion des cas avec symptômes était semblable à celle qui a été constatée dans d’autres étudesNote de bas de page 22Note de bas de page 42. Il n’existe aucune raison de penser que les symptômes et les résultats pour la même maladie seraient différents dans la seule région sociosanitaire pour laquelle ces données n’étaient pas disponibles. Le nombre de cas de SHU est probablement sous-estimé étant donné qu’il est possible que le SHU ne se soit pas encore développé au moment où l’entrevue de santé publique a eu lieu, une ou deux semaines après l’apparition des symptômesNote de bas de page 43. Néanmoins, on a constaté une association significative avec le stx2, qui pourrait être renforcée avec un nombre plus élevé de cas de SHU. Les informations d’exclusion n’étaient pas disponibles avant 2015 et n’ont pas toujours été enregistrées par la suite. C’est pourquoi seule une analyse descriptive a été réalisée pour les cas exclus.
On recommande une évaluation de la présente modification aux directives en C.-B. pour s’assurer que celle-ci aura produit les résultats escomptés. En outre, il faudra passer en revue les directives au fur et à mesure que progressent les méthodes de laboratoire de détection des Stx et des STEC, par exemple pour identifier les variantes spécifiques des Stx.
Conclusion
Les données de la C.-B. sont en accord avec les observations faites ailleurs et qui montrent que les bactéries STEC provoquent un éventail de maladies et que cela, du moins en partie, est déterminé par le type de Stx. À la suite de cette analyse, les directives d’exclusion fondée sur les STEC en C-.B. ont été mises à jour en février 2019 de façon à permettre aux cas infectés aux STEC non O157 produisant uniquement le type stx1 sans symptômes cliniques graves de retourner dans des environnements à haut risque lorsqu’ils sont sans symptômes.
Déclaration des auteurs
- K. N. — A analysé les données et a rédigé l’article
- M. T. — A conçu l’étude, a interprété les donné et a révisé l’article
- L. H. — A interprété les données et a révisé l’article
- E. G. — A conçu l’étude, a interprété les données, a rédigé certaines parties et a révisé l’article
Conflit d’intérêts
Aucun.
Remerciements
Les auteurs remercient A. Paccagnella et les membres du groupe des politiques entériques de la Colombie-Britannique (O. Bitzikos, D. Hoyano, M. McKinley, S. Mema, P. Rydings, J. Stone, D. Tam) qui ont fourni des données ou qui ont participé à la prise de décision concernant les modifications aux directives. Les auteurs tiennent aussi à remercier la rédactrice en chef du Relevé des maladies transmissibles au Canada (RMTC) pour ses contributions éditoriales.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International