Défis en matière de création d’un vaccin contre le virus respiratoire syncytial

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–4 : Virus respiratoire syncytial (VRS)
Date de publication : 2 avril 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–4, le 2 avril 2020 : Virus respiratoire syncytial (VRS)
Recherche
Aperçu de la filière de candidats vaccins contre le virus respiratoire syncytial au Canada
April Killikelly1, Matthew Tunis1, Althea House1, Caroline Quach2, Wendy Vaudry3, Dorothy Moore4
Affiliations
1 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa, ON
2 Centre Hospitalier Universitaire Sainte-Justine, Université de Montréal, Montréal, QC
3 Hôpital pour enfants Stollery, Université d’Alberta, Edmonton, AB
4 Université McGill, Montréal, QC
Correspondance
Citation proposée
Killikelly A, Tunis M, House A, Quach C, Vaudry W, Moor D. Aperçu de la filière de candidats vaccins contre le virus respiratoire syncytial au Canada. Relevé des maladies transmissibles au Canada 2020;46(4):63–70. https://doi.org/10.14745/ccdr.v46i04a01f
Mots-clés : vaccin, Comité consultatif national sur l’immunisation, CCNI, immunisation, VRS, virus respiratoire syncytial
Résumé
Un vaccin contre le virus respiratoire syncytial (VRS) est activement recherché depuis plus de 60 ans en raison des effets de la maladie du VRS sur la santé des nourrissons. Toutefois, la seule mesure préventive disponible actuellement au Canada et ailleurs se limite à l’immunisation passive des nourrissons et enfants à haut risque avec un anticorps monoclonal.
Plusieurs obstacles empêchent la création d’un vaccin contre le VRS, notamment l’aggravation de la maladie chez les nourrissons causée par le vaccin. Au cours des dix dernières années, plusieurs avancées importantes dans les domaines de l’immunologie cellulaire et de la structure des protéines ont conduit au passage de nouveaux produits en phase finale de développement clinique. En date de juillet 2019, 16 organismes mènent 121 essais cliniques sur la mise au point d’un vaccin contre le VRS. Cinq technologies dominent le domaine de la création d’un vaccin contre le VRS : quatre agents d’immunisation active (vaccins vivants atténués, à base de particules, à sous-unités et à base de vecteurs) et un nouvel agent d’immunisation passive (anticorps monoclonal). Des essais cliniques de phase 3 des candidats vaccins pour les femmes enceintes, les nourrissons, les enfants et les personnes âgées sont en cours. La prévention du VRS changera énormément dans les dix prochaines années.
Introduction
L’infection causée par le virus respiratoire syncytial (VRS) représente un important fardeau de maladie au Canada et dans le monde. La répartition par âge du fardeau de maladie liée au VRS est bimodale : l’impact le plus important se fait sentir au cours des deux premières années de la vie et chez les adultes âgés. Le VRS serait à l’origine de 3,4 millions d’hospitalisations et de 100 000 décès dans le monde chaque annéeNote de bas de page 1. Au Canada, le fardeau des maladies et des hospitalisations causées par le VRS est saisi par divers systèmes de surveillance. Il existe des interventions médicales de prévention et d’assistance pour prévenir ou traiter le VRS, mais la vaccination est porteuse d’espoir en tant que méthode pour réduire le fardeau sanitaire et économique du VRS.
Le VRS est un orthopneumovirus de la famille des pneumoviridae. Il s’agit d’un virus à ARN monocaténaire de polarité négative ayant 11 protéinesNote de bas de page 2. La protéine F à la surface de la membrane virale est le médiateur de la fusion entre le virus et la cellule hôte. Deux conformations de la protéine F ont été définies : la préfusion et la post-fusion. Certains épitopes neutralisants sont présents sur les deux conformations, notamment le site II ciblé par le palivizumab. D’autres épitopes neutralisants ne sont présents que sur la préfusion F, notamment les sites V (ciblés par le suptavumab) et ø (ciblés par le nirsevimab). Sans stabilisation ou modification spécifique, la protéine F existera dans un spectre de conformations, qui auront des profils antigéniques et de neutralisation différents. Sans stabilisation, cet immunogène s’installera dans une conformation post-fusion au fil du temps.
Deux sous-types de VRS ont été définis, le VRS/A et le VRS/B. Le sous-type A est plus prévalent que le sous-type BNote de bas de page 3. Le VRS infecte les cellules des voies respiratoires humaines, y compris les cellules épithéliales polarisées, différenciées et ciliées, et provoque l’infection des voies respiratoires supérieures et inférieures. Les maladies graves se manifestent cliniquement par des affections pseudo-grippales et des infections des voies respiratoires inférieures (IVRI), la bronchiolite étant la forme grave la plus courante chez les jeunes enfants. Les premières infections par le VRS peuvent entraîner des IVRI symptomatiques, dont une minorité nécessite une hospitalisation. Une surveillance canadienne visant à déterminer le fardeau du VRS dans différentes populations est en cours.
La seule contre-mesure actuellement disponible pour le VRS est le palivizumab, un anticorps monoclonal administré à titre prophylactique aux nourrissons et aux enfants de moins de deux ans présentant un risque élevé d’infection grave.
Un vaccin contre le VRS est recherché depuis plus de 60 ans en raison de ses effets potentiels sur la santé de diverses tranches d’âge. Une ombre a été jetée sur la création des vaccins dans les années 1960, lors de l’essai d’un vaccin contre le VRS inactivé au formol (VRS-IF) chez des enfants séronégatifs, c’est-à-dire naïfs aux antigènes du VRS. Au lieu d’induire une protection, l’immunisation a entraîné une aggravation des symptômes respiratoires (ASR) lors d’une infection ultérieure par le VRS, ce qui a entraîné deux décèsNote de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7.
Récemment, l’élaboration d’un vaccin contre le VRS a permis de mieux comprendre la biologie des lymphocytes T et la structure des protéines, ainsi que de mieux délimiter les différentes populations à risque pour le VRS. En date de juillet 2019, 16 organismes ont entrepris la création d’un vaccin contre le VRS dans le cadre de 121 essais cliniques. Des candidats vaccins sont en cours d’élaboration pour les enfants, les personnes âgées et les femmes enceintes. Des essais cliniques de phase 3 ciblant les populations pédiatriques, les adultes âgés et les femmes enceintes sont en cours.
Cinq technologies dominent le domaine de la création d’un vaccin contre le VRS : quatre agents d’immunisation active (vaccins vivants atténués, à base de particules, à sous-unités et à base de vecteurs) et un nouvel agent d’immunisation passive (anticorps monoclonal). D’autres essais sont à la fin de la phase préclinique et au début de la phase clinique.
L’objectif de cet aperçu est de résumer les candidats vaccins dans les cinq différentes technologies vaccinales pour trois populations cibles et de définir les contraintes actuelles empêchant la création d’un vaccin contre le VRS.
Résultats clés
Technologies et stratégies d’immunisation
Des essais cliniques concernant les mères, enfants et adultes âgés sont en cours. La figure 1, basée sur les données recueillies jusqu’au 1er juillet 2019, représente les produits de vaccination contre le VRS en cours d’élaboration pour chaque population cible à risque pour le VRS. Des essais cliniques de phase 3 qui ciblent les femmes enceintes, les enfants et les adultes âgés sont en cours. Nous résumons ci-dessous les avancées pour chaque type de candidat vaccin, en particulier les produits aux stades ultérieurs du développement clinique (essais cliniques de phase 2 ou 3).
Figure 1 : Résumé des populations cibles du vaccin contre le VRS
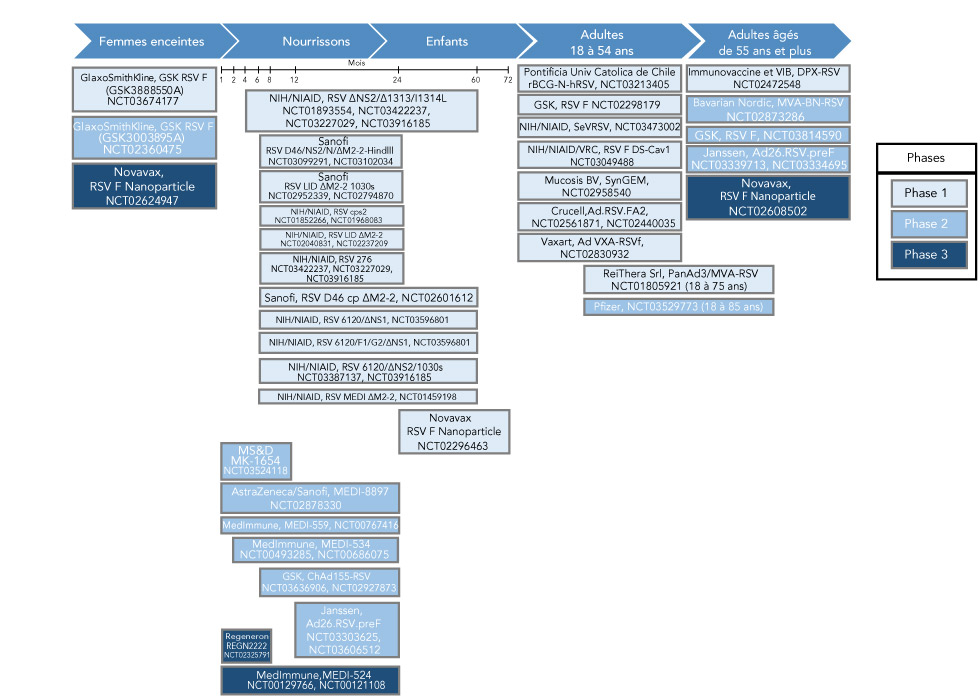
Description textuelle : Figure 1
Figure 1 : Résumé des populations cibles du vaccin contre le VRS
La figure 1 est un organigramme des différents vaccins contre le virus respiratoire syncytial et des populations cibles, dans leurs différentes phases de développement clinique. La figure commence par une flèche pour identifier les populations cibles. Les cinq populations cibles sont : les femmes enceintes, les nourrissons, les enfants, les adultes (18 à 54 ans) et les adultes de plus de 55 ans.
Trois vaccins en différentes phases sont prévus pour la population cible des femmes enceintes : phase 1 : GlaxoSmithKline, GSK RSV F (GSK3888550A) NCT03674177; phase 2 : GSK RSV F (GSK3003895A) NCT02360475; et phase 3 : Novavax, RSV F Nanoparticle NCT02624947.
Dans la population cible des nourrissons et des enfants, un marqueur d’âge mensuel définit les enfants de 1 à 73 mois. Immédiatement en dessous du marqueur mensuel, 12 vaccins sont identifiés en phase 1. La première phase s’étend sur une période de 4 à 60 mois : 1) NIH/NIAID, RSV ∆NS2/∆1313/I1314L NCT01893554, NCT03422237, NCT03227029, NCT03916185. Les cinq prochains se situent entre 6 et environ 54 mois : 2) Sanofi RSV D46/NS2/N/ΔM2-2-Hindlll, NCT03099291, NCT03102034; 3) Sanofi, RSV LID ΔM2-2 1030s NCT02952339, NCT02794870; 4) NIH/NIAID, RSV cps2, NCT01852266, NCT01968083; 5) NIH/NIAID, RSV LID ΔM2-2 NCT02040831, NCT02237209; 6) NIH/NIAID, RSV 276 NCT03422237, NCT03227029, NCT03916185. Les cinq prochains se situent entre 6 et 60 mois : 7) Sanofi, RSV D46 cp ΔM2-2, NCT02601612; 8) NIH/NIAID, RSV 6120/∆NS1, NCT03596801; 9) NIH/NIAID, RSV 6120/F1/G2/∆NS1, NCT03596801; 10) NIH/NIAID, RSV 6120/∆NS2/1030s, NCT03387137, NCT03916185; 11) NIH/NIAID, RSV MEDI ΔM2-2, NCT01459198 et 12) se situe entre 24 et 72 mois : Novavax RSV F Nanoparticle, NCT02296463.
Dans la population cible des nourrissons et des enfants, en phase 2, il y en a six qui se situent entre 1 et 24 mois. Entre 1 et 8 mois : 1) MS&D, MK-1654, NCT03524118. Entre 1 et 24 mois : 2) AstraZeneca/Sanofi, MEDI-8897, NCT02878330, 3) MedImmune, MEDI-559, NCT00767416. Entre 4 et 24 mois : 4) MedImmune, MEDI-534, NCT00493285, NCT00686075. Entre 6 et 24 mois : 5) GSK, ChAd155-RSV, NCT03636906, NCT02927873. Entre 12 et 24 mois : 6) Janssen, Ad26.RSV.preF, NCT03303625, NCT03606512. Deux vaccins sont en phase 3. Le premier se situe entre 1 et 8 mois : Regeneron, REGN2222, NCT02325791, et le second se situe entre 1 et 24 mois : MedImmune,MEDI-524, NCT00129766, NCT00121108.
La population cible des adultes de 18 à 54 ans compte sept entreprises en phase 1 : 1) Pontificia Univ Catolica de Chile rBCG-N-hRSV, NCT03213405; 2) GSK, RSV F NCT02298179; 3) NIH/NIAID, SeVRSV, NCT03473002; 4) NIH/NIAID/VRC, RSV F DS-Cav1 NCT03049488; 5) Mucosis BV, SynGEM, NCT02958540; 6) Crucell,Ad.RSV.FA2, NCT02561871, NCT02440035; et 7) Vaxart, Ad VXA-RSVf, NCT02830932.
Les deux prochains se situent entre les adultes de 18 à 54 ans et ceux de plus de 55 ans. En phase 1 : ReiThera Srl, PanAd3/MVA-RSV NCT01805921 (18 à 75 ans) et en phase 2 : Pfizer, NCT03529773 (18 à 85 ans).
Cinq vaccins sont prévus pour les personnes âgées de 55 ans et plus. Un en phase 1 : Immunovaccine and VIB, DPX-RSV NCT02472548. Trois en phase 2 : 1) Bavarian Nordic, MVA-BN-RSV NCT02873286; 2) GSK, RSV F, NCT03814590; 3) Janssen, Ad26.RSV.preF NCT03339713, NCT03334695. Un en phase 3 : Novavax, RSV F Nanoparticle NCT02608502.
Vaccins vivants atténués
Les vaccins vivants atténués sont des versions du VRS capables de se répliquer, mais qui ont été modifiées pour réduire le risque de maladies graves. Ils peuvent être créés à partir de techniques traditionnelles (par sensibilité thermique ou chimique) ou par la génétique inverse pour obtenir un vaccin compétent à réplication atténuée. La difficulté de cette technique consiste à diminuer la pathogénicité du virus tout en conservant sa fonction de réplication pour stimuler les réponses immunitaires. L’un des principaux inconvénients, cependant, est la possibilité d’une réversion partielle vers le virus de type sauvageNote de bas de page 9.
Cette technique présente plusieurs avantages : possibilité d’administration sans aiguille par voie intranasale; absence d’aggravation de la maladieNote de bas de page 10; réplication en présence d’anticorps maternels dans le cas de vaccin intranasalNote de bas de page 11; et stimulation de l’immunité cellulaire et humorale de façon systémique et localeNote de bas de page 12. Aucun candidat vaccin de ce type n’a dépassé la phase 2 des essais cliniques. La nature réplicative de ce vaccin et la réduction du risque d’ASR en font une stratégie intéressante pour les nourrissons séronégatifs.
Vaccins à base de vecteurs
Les vaccins à base de vecteurs sont créés à partir de composants du VRS insérés dans un vecteur porteur, créant ainsi un vecteur chimérique. Ce vecteur chimérique se réplique selon les propriétés du vecteur porteur et induit des réponses immunitaires à la fois à la séquence d’insertion et à la séquence porteuse. L’objectif est que le vecteur porteur améliore les réponses aux composants du VRS. Cette plateforme est intéressante pour les populations pédiatriques et les adultes âgés en raison du risque réduit d’ASR. Contrairement aux vaccins vivants atténués, la nature chimérique de ces vecteurs signifie qu’il n’y a aucun risque de réversion vers le VRS de type sauvage. De plus, les vecteurs de réplication sont capables de stimuler les réponses immunitaires aux séquences insérées. Plusieurs entreprises utilisent des variantes de cette plateforme comme candidats vaccins contre le VRS. (Voir l’aperçu des produits de chaque fabricant dans l'infographie).
- Bavarian Nordic (BN) développe un vecteur à partir du virus modifié de la Vaccinia Ankara (MVA), basé sur le virus orthopox utilisé comme vaccin contre la varicelle. Ce vecteur est utilisé pour exprimer plusieurs antigènes du VRS, y compris les protéines de type sauvage F, G, N, M2-1, et potentiellement d’autres protéines. Ce candidat est en phase 2 des essais cliniques du MVA-BN-RSV chez les adultes âgés [National Clinical Trial (NCT)02873286] pour une stratégie à une ou deux doses par voie intramusculaire. Cet essai a démontré que ce vaccin induit à la fois des réponses des lymphocytes B et T et des anticorps neutralisants.
- GlaxoSmithKline (GSK) développe un vecteur non répliquant à partir de l’adénovirus 155 du chimpanzé (ChAd155), un adénovirus simien conçu par GSK pour produire la protéine F, N et M2-1. La version de la protéine F du VRS insérée dans ce vecteur n’avait pas le domaine transmembranaire et la conformation de F est inconnue. Chez les adultes, ce vaccin intramusculaire était sûr et bien toléré, et a induit des réponses immunitaires cellulaires et humorales. Ce vaccin est actuellement en essais cliniques de phase 2 chez des nourrissons séropositifs âgés de six mois et plus (NCT03636906). Des essais cliniques de phase 2 chez des nourrissons séronégatifs (âgés de 6 à 11 mois) sont en cours.
- Janssen développe un vecteur à partir de l’adénovirus 26 (Ad26), un adénovirus humain, utilisé comme vecteur porteur des antigènes de la protéine F en conformation préfusion. Ce vecteur est en cours d’évaluation chez les adultes âgés et les nourrissons dans le cadre d’essais cliniques de phase 2 (NCT03606512 ; NCT03982199). Chez les personnes âgées, ce vecteur est évalué seul et en conjonction avec une protéine de sous-unité (NCT03502707).
Vaccins à sous-unités
Les vaccins à sous-unités sont composés de protéines virales purifiées. Ils sont administrés seuls ou avec un adjuvant, souvent sous forme de solution aqueuse ou d’émulsion, selon la voie d’administration ou l’adjuvant utilisé pour stimuler des réponses immunitaires. On s’attend à ce que ce type de vaccin induise principalement des réponses humorales et l’activation des lymphocytes T CD4+Note de bas de page 13. L’absence de réponse des lymphocytes T CD8+ et les antécédents d’ASR imposent la prudence dans l’utilisation de ce type de vaccin chez les nourrissons séronégatifs. Dans les populations séropositives, y compris les personnes âgées et les femmes enceintes, ces types de vaccins offrent la possibilité de stimuler les réponses d’anticorps protecteurs. Les vaccins à base de protéines hybrides ou en conformation préfusion peuvent ou non être synonymes en fonction de leurs profils d’antigénicité ou des caractéristiques de leurs structures à haute résolution.
- GSK travaille sur la création d’un candidat vaccin à base de protéine stabilisée en conformation préfusion. Ce produit en cours d’élaboration pour les populations maternelles et en phase 2 pour les personnes âgées (NCT03814590). Lors des essais de phase 1, l’adjuvant à l’alun n’a eu aucun effet sur la neutralisation des réponses des anticorps (NCT02298179). Le produit sans adjuvant était destiné à un essai clinique de phase 2 chez les femmes enceintes, mais il a été retiré en raison de problèmes de stabilité des protéines pendant la fabrication (NCT03191383).
- Janssen développe un candidat vaccin à sous-unités qui est en cours d’évaluation avec et sans vaccin d’adénovirus. Cette protéine se trouverait dans la conformation préfusion. Un nouveau candidat de la protéine hybride stabilisée dans sa conformation préfusion est maintenant en essais de phase 2 pour les populations d’adultes âgés et maternelles. Ce programme est actuellement en essais cliniques de phase 1/2 (NCT03502707).
Vaccins à base de particules
Les vaccins à base de particules sont composés de particules nanoscopiques synthétisées qui présentent au système immunitaire de multiples copies d’un antigène sélectionné. L’objectif est de renforcer les réponses immunologiques aux immunogènes à partir d’un nombre élevé de copies et des propriétés de renforcement du système immunitaire de la matrice de particules.
- Novavax a créé un vaccin recombinant à particules de protéines hybrides avec du polysorbate 80, le ResVax. La conformation de cet immunogène était une forme pré-fusogène à clivage uniqueNote de bas de page 14. Lors des essais cliniques de phase 1 chez les populations âgées et les femmes enceintes, ResVax s’est révélé sûr et a mené à la production d’anticorps concurrents au palivizumabNote de bas de page 15. Cependant, lors des essais cliniques de phase 3 dans des populations âgées, ce candidat n’a pas atteint le résultat primaire (prévenir les maladies des voies respiratoires inférieures modérées à graves associées au VRS) ni le résultat secondaire (réduire toutes les maladies respiratoires symptomatiques dues au VRS) (NCT02608502). Actuellement, un essai de phase 2 est prévu pour évaluer une reformulation. Lors des essais cliniques de phase 3 chez les femmes enceintes, ce vaccin n’a pas atteint son objectif primaire (prévention des IVRI médicalement significatives liées au VRS chez les jeunes nourrissons), mais a tout de même démontré une efficacité de 39 % pour réduire les IVRI induites par le VRS dans les 90 premiers jours de vie, et une efficacité de 44 % dans la réduction de l’hospitalisation, la protection la plus importante étant observée lorsque le vaccin était administré avant 33 semaines de grossesse (NCT02624947).
Anticorps monoclonaux
Des anticorps monoclonaux contre le VRS sont utilisés comme agents d’immunisation passive. Même après la création de programmes de vaccination, les anticorps monoclonaux peuvent continuer à fournir une prophylaxie dans les populations où l’immunisation active ne sera pas efficace, comme les personnes immunodéprimées, ou les enfants très prématurés qui reçoivent peu ou pas d’anticorps maternels. L’inconvénient de cette technologie est que les anticorps passifs protègent uniquement lorsqu’ils sont en circulation. La protection passive de l’anticorps monoclonal passif actuellement accessible, le palivizumab, dure environ un mois. De nouveaux anticorps monoclonaux sont en cours d’élaboration pour améliorer leur puissance et prolonger leur durée.
- AstraZeneca/Sanofi Pasteur élabore le nirsevimab (MEDI8897), un anticorps monoclonal anti-VRS humain recombinant conçu avec une triple substitution d’acides aminés dans le domaine constant pour augmenter sa demi-vie sérique. Cet anticorps cible un site sensible à la neutralisation, ø, situé à l’apex de la protéine F en conformation préfusion. L’efficacité d’une dose de ce produit pourrait atteindre 5 à 6 mois et assurer une protection pendant toute une saison de VRS en raison de l’augmentation de sa puissance et de sa demi-vieNote de bas de page 16. La période de grande efficacité réelle de ce produit pourrait particulièrement profiter aux collectivités rurales et éloignées qui ont un accès réduit aux ressources de soins de santé et qui doivent actuellement se déplacer chaque mois pour obtenir du palivizumab.
- Regeneron a travaillé sur l’élaboration de REGN2222 (suptavumab), un anticorps monoclonal. Ce produit est passé rapidement de la phase 1 à la phase 3 des essais cliniques réalisés par la Food and Drug Administration en octobre 2015, mais n’a pas atteint son objectif primaire de prévention de l’infection par le VRS médicalement assistée dans les 150 premiers jours de vie (NCT02325791).
En résumé, cinq stratégies différentes sont poursuivies pour surmonter les difficultés concernant l’élaboration d’un vaccin contre l’infection par le VRS. Plus de 100 essais sont menés pour 38 candidats, et huit nouveaux essais ont été lancés rien que l’année dernière. La figure 2, basée sur les données recueillies jusqu’au 1er juillet 2019, décrit le calendrier des essais cliniques des produits en phase avancée de développement clinique. Ce pipeline de création de produits pour contrer le VRS gagne en importance, et il est possible que de nouveaux vaccins contre le VRS soient introduits sur le marché canadien dans les 2 à 5 prochaines années.
Figure 2 : Résumé du calendrier des produits de vaccination contre le VRSFigure 2 note a
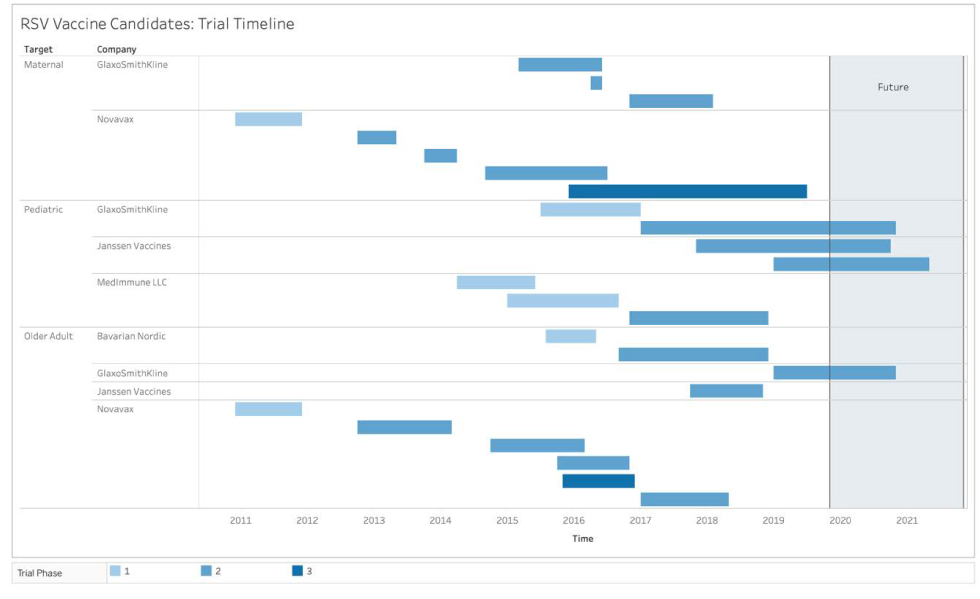
Description textuelle : Figure 2
Figure 2 : Résumé du calendrier des produits de vaccination contre le VRSFigure 2 note a
La figure 2 est un diagramme chronologique sur dix ans pour la mise à l’essai du vaccin contre le VRS. Vous trouverez ci-dessous les phases et les entreprises avec la population cible de chaque essai et le calendrier correspondant.
Phase 1
Novavax : cible les mères et les personnes âgées; 2011 à 2012
AstraZeneca/Sanofi Pasteur : cible les nourrissons et les enfants. Deux produits : le premier de mi-2014 à mi-2015 et le second de 2015 à fin 2016.
Bavarian Nordic : cible les personnes âgées; fin 2015 à la mi-2016.
GlaxoSmithKline : cible les nourrissons et les enfants; de mi-2015 à la mi-2017.
Phase 2
GlaxoSmithKline : cible les mères; le premier du début de 2015 jusqu’à la mi-2016; le deuxième à partir de 2016 pendant quelques mois; et le troisième de la fin de 2016 au début de 2018. Pour les nourrissons et les enfants : commence en 2017 et se poursuit jusqu’à la fin de 2020. Pour les adultes âgés : de la mi-2019 à la fin de 2020.
Novavax : cible les mères; le premier de la fin de 2012 à la mi-2013; le deuxième de la fin de 2013 au début de 2014; le troisième de la mi-2014 à la mi-2016. Cible les personnes âgées; un essai de la fin de 2012 à la mi-2014; un deuxième essai de la fin de 2014 à la mi-2016; un troisième de la fin de 2015 à la fin de 2016; et un quatrième du début de 2017 à la mi-2018.
Janssen Vaccine : cible les adultes âgés; de la fin de 2017 à la fin de 2018.
Bavarian Nordic : cible les adultes âgés; de la fin de 2016 au début de 2019.
Phase 3
Novavax : cible les adultes âgés pour l’année 2016 et les mères de 2016 à la mi-2019.
Les obstacles à l’élaboration d’un vaccin contre le VRS
Diversité des antigènes
Un candidat vaccin efficace tiendra compte de la diversité des antigènes présentés par le VRS, c’est-à-dire de la variabilité structurelle des protéines à la surface du virus. La réponse des anticorps protecteurs et neutralisants au VRS est dominée par des anticorps ciblant la protéine F en conformation préfusion à la surface du VRSNote de bas de page 17Note de bas de page 18. La séquence génétique de la protéine F ne varie pas beaucoup entre les souches de VRS [89 % de sa séquence est identique dans les souches A et BNote de bas de page 19], mais les acides aminés varient dans les épitopes spécifiques à la conformation préfusion. À mesure que de nouveaux produits seront autorisés et que leur utilisation se répandra, il sera essentiel de comprendre les réponses séro-épidémiologiques de la population pour savoir si les anticorps anti-conformation préfusion ou post-fusion sont des réponses dominantes et si celles-ci démontrent une protection équivalente contre le VRS de type A et B.
L’infection par le VRS amortit la réponse immunitaire
Le deuxième grand obstacle à l’élaboration d’un vaccin contre le VRS concerne les réponses immunitaires cellulaires et humorales : l’infection par le VRS amortit la réponse immunitaire. Les protéines de surface et internes du VRS peuvent déclencher des réponses immunitaires cellulaires et une cytotoxicité cellulaire dépendante des anticorps, parallèlement aux réponses immunitaires humorales. Par contre, plusieurs mécanismes viraux agissent pour diminuer les réponses prolifératives et effectrices spécifiques au virusNote de bas de page 20. Même lorsque les réponses cellulaires ne sont pas amorties par les mécanismes viraux, elles peuvent ne pas offrir de protection. La réponse au VRS médiée par les lymphocytes T CD8 est complexe et associée à la fois à la clairance virale et à la pathologie de la maladie, selon le type et l’emplacement des cellulesNote de bas de page 21Note de bas de page 22. De plus, la réponse médiée par les lymphocytes T CD4+ n’est pas simple, car les réponses CD4 biaisées du sous-ensemble 2 des lymphocytes T auxiliaires ont été associées à des réactions vaccinales indésirables, mais elles sont nécessaires pour induire des réponses médiées par les anticorps et d’autres réponses cellulaires, notamment les lymphocytes T-folliculaires auxiliaires et les cellules effectricesNote de bas de page 23Note de bas de page 24. La clé de la création de vaccins consiste à renforcer les réponses immunitaires, malgré l’effet modérateur du VRS, pour atteindre les objectifs du programme de vaccination : les réponses humorales peuvent être ciblées pour prévenir l’infection et les réponses cellulaires peuvent être augmentées pour prévenir les maladies gravesNote de bas de page 25. Des définitions claires des corrélats de protection pour chacune de ces réponses immunitaires sont nécessaires pour garantir que la séroconversion au cours des essais se traduise par l’efficacité du vaccin.
Il n’y a pas de corrélats clairs de protection
La troisième grande difficulté est l’absence de corrélats clairs de protection pour les populations à risque. L’infection naturelle n’induit pas de protection. En effet, le fait que 100 % des enfants sont infectés à l’âge de deux ans, mais que la maladie du VRS se répète dans toutes les tranches d’âge le prouve. Des études longitudinales ont permis de constater que les enfants peuvent être naturellement réinfectés par la même souche de virus, mais que la deuxième infection et les suivantes sont moins gravesNote de bas de page 26Note de bas de page 27. Des résultats similaires ont été obtenus chez les adultesNote de bas de page 28. La raison n’est pas claire; il peut s’agir d’une combinaison d’une faible immunogénicité virale ou d’un renforcement immunologique entravé par des infections récurrentesNote de bas de page 29. Les marqueurs biologiques de protection actuels sont humoraux, tels que mesurés par des tests qui déterminent la particularité des anticorps (y compris le test de concurrence du palivizumab) et leur fonction (tests de neutralisation). Par contre, ce n’est peut-être pas suffisant, comme l’illustre la défaillance tardive d’un anticorps monoclonal du Regeneron (suptavumab).
Des corrélats de protection différents peuvent être nécessaires pour les deux populations à risque de maladie grave due au VRS : les nourrissons et les adultes âgés. La vaccination des nourrissons est problématique, car les capacités immunitaires de ceux-ci sont sous-développées. Cette population peut être sensible à l’ASR induite par le vaccin, comme on l’a observé dans les essais sur le VRS inactivé par la formaline. L’ASR a été attribuée à une faible efficacité des anticorpsNote de bas de page 30 et à des réponses immunitaires CD4 biaisées par le Th2Note de bas de page 31Note de bas de page 32Note de bas de page 33. Les objectifs des programmes d’immunisation directe et indirecte des nourrissons comprennent la protection contre les infections, les maladies graves et l’hospitalisationNote de bas de page 34. Des discussions sont en cours dans certaines administrations pour définir les seuils de protection dans de multiples corrélats humoraux et cellulaires de protection nécessaires avant de procéder aux essais cliniques dans les populations séronégativesNote de bas de page 35.
Les personnes âgées sont confrontées à un problème différent : les réponses immunitaires qu’elles ont développées s’affaiblissent en raison de l’immunosénescence. La vaccination des personnes âgées peut avoir des objectifs différents et des corrélats de protection différents selon les priorités sanitaires de l’administrationNote de bas de page 34. Pour prévenir l’infection, les corrélats humoraux de protection peuvent être surveillés. Pour prévenir les maladies graves, les corrélats cellulaires de protection peuvent être surveillés. Ces deux objectifs ne sont pas incompatibles, mais un candidat vaccin peut être plus apte à atteindre l’un des deux objectifs que l’autre. Pour créer un vaccin à la fois efficace et performant, les fabricants de vaccins doivent tenir compte des objectifs de santé publique des programmes de vaccination et utiliser des corrélats de protection qui s’alignent sur ces objectifs dans les phases précliniques et cliniques de développement.
Discussion
La clé de la création de vaccins sera de susciter une réponse immunitaire adaptée à l’âge dans chaque population cible. Les stratégies vaccinales actuelles tiennent compte des antécédents d’ASR ainsi que des caractéristiques immunologiques uniques et de la vulnérabilité des enfants séronégatifs. Les vaccins à virus vivant atténué et à virus vecteur sont deux stratégies de vaccination attrayantes pour les nourrissons et les enfants, car les vaccins répliquants ne protègent pas contre la maladie du VRS renforcée par le vaccinNote de bas de page 10Note de bas de page 36Note de bas de page 37. Par ailleurs, les nouveau-nés peuvent acquérir une immunité contre le VRS auprès de leur mère. Le transfert actif d’anticorps transplacentaires commence à la 28e à 30e semaine de grossesse, et la vaccination maternelle pour stimuler la réponse anti-VRS est destinée à renforcer la protection du nourrisson post-partumNote de bas de page 38. Des stratégies d’immunisation des mères et des enfants sont mises en œuvre pour cibler directement et indirectement la population infantile.
Les personnes âgées font face à des problèmes différents : elles sont déjà séropositives, mais aussi confrontées à l’immunosénescence. Pour renforcer le répertoire immunologique de cette population à risque, des stratégies d’immunisation directe et indirecte, comme la vaccination des enfants (comme pour le rotavirus)Note de bas de page 39, peuvent être poursuivies.
Le domaine de l’élaboration de vaccins contre les virus respiratoires est en pleine expansion. Les technologies testées et prouvées efficaces dans un domaine suscitent un développement généralisé. La conception d’immunogènes basée sur la structure, stimulée par la publication de la structure pré-F en 2013Note de bas de page 40, a favorisé la création de nouveaux vaccins contre le VRS sur de multiples plateformes vaccinales (voir figure 2). Les technologies permettant d’identifier et d’isoler les cellules B avec des récepteurs d’intérêt permettent l’identification d’anticorps monoclonaux présentant des caractéristiques utiles. Les délais de réglementation et de production de ces produits peuvent être plus courts que pour les vaccins traditionnels, ce qui fait pression sur les groupes de spécialistes pour qu’ils élaborent des directives en peu de temps. En ce sens, les vaccins à base d’ARNm peuvent réduire davantage les délais de production.
Conclusion
Des progrès substantiels sont réalisés dans le domaine de la mise au point d’un vaccin contre le VRS. Les ministères fédéraux, provinciaux et territoriaux de la santé publique au Canada et à l’étranger doivent être informés des nouveaux produits à mesure qu’ils se rapprochent du marché — comment ils ont surmonté les principaux obstacles d’élaboration du vaccin contre le VRS et comment ils travaillent pour atteindre les objectifs de santé publique de chaque administration concernant le VRS.
Déclaration des auteurs
- A. K. — Rédaction de la première version, administration du projet, conceptualisation
- M. T. — Rédaction-révision et édition, conceptualisation, supervision
- A. H. — Rédaction-révision et édition, conceptualisation, supervision
- C. Q. — Rédaction-révision et édition, conceptualisation, supervision
- W. V. — Rédaction-révision et édition, conceptualisation, supervision
- D. M. — Rédaction-révision et édition, conceptualisation, supervision
Conflit d’intérêts
Aucun.
Remerciements
Les auteurs tiennent à souligner l’importante contribution de N. Winters à la création des figures.
Financement
Ce travail est financé par l’Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International