La transmission de la COVID-19 à l’aide d’IDSIM de l’application de bureau de modélisation épidémiologique

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 48-10, octobre 2022 : Équité, diversité et inclusion en santé publique
Date de publication : octobre 2022
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 48-10, octobre 2022 : Équité, diversité et inclusion en santé publique
Science de la mise en œuvre
Modélisation de la transmission de la COVID-19 à l'aide d'IDSIM, une application de bureau de modélisation épidémiologique dotée de capacités d'immunisation à plusieurs niveaux
Eleodor Nichita1, Mary-Anne Pietrusiak2, Fangli Xie2, Peter Schwanke1, Anjali Pandya2
Affiliations
1 Université Ontario Tech, Oshawa, ON
2 Bureau de santé de Durham, Whitby, ON
Correspondance
Citation proposée
Nichita E, Pietrusiak M-A, Xie F, Schwanke P, Pandya A. Modélisation de la transmission de la COVID-19 à l'aide d'IDSIM, une application de bureau de modélisation épidémiologique dotée de capacités d'immunisation à plusieurs niveaux. Relevé des maladies transmissibles au Canada 2022;48(10):496–511. https://doi.org/10.14745/ccdr.v48i10a05f
Mots-clés : COVID-19, modèle épidémiologique compartimenté, application IDSIM, niveaux de vaccination, baisse d'immunité, variants
Résumé
Contexte : La pandémie de maladie à coronavirus 2019 (COVID-19) a imposé des demandes sans précédent aux unités de santé publique locales de l'Ontario, au Canada, dont le besoin de capacités internes de modélisation épidémiologique. L'objectif de cette étude est de développer une application de bureau Windows pour la modélisation épidémiologique, qui sera utilisée par les épidémiologistes des unités de santé publique pour prédire la transmission de la COVID-19 dans la région de Durham.
Méthodes : L'application développée consiste en la mise en œuvre d'un modèle épidémiologique compartimenté et stratifié à plusieurs degrés qui peut prendre en charge plusieurs variants du virus et niveaux de vaccination, ainsi que des mesures de santé publique comme la distanciation physique, le suivi des contacts suivi par la quarantaine et les tests suivis par l'isolement. Elle a permis d'étudier les effets de divers facteurs sur la transmission de la COVID-19, y compris la couverture vaccinale, l'efficacité du vaccin, la baisse de l'immunité conférée par le vaccin et l'arrivée du variant Omicron. La date de début de la simulation était le 22 novembre 2021.
Résultats : Pour le variant Delta, au moins 90 % de la population devrait être vaccinée pour obtenir l'immunité collective. Une courbe épidémiologique du variant Delta seulement serait aplatie dès le début en l'absence d'une baisse de l'immunité et dans les six mois en présence d'une baisse de l'immunité. Le pourcentage d'infections causées par le variant Omicron devrait passer de 1 % à 97 % au cours du premier mois de la simulation. Le total des infections à Omicron devrait baisser, respectivement, de 26 % ou de 41 % si 3 000 ou 5 000 doses de rappel étaient administrées par jour.
Conclusion : Dans le cas du variant Delta, l'immunité naturelle et l'immunité conférée par la vaccination sont toutes deux nécessaires pour obtenir l'immunité collective, et la baisse de l'immunité conférée par le vaccin allonge le temps nécessaire pour obtenir l'immunité collective. En l'absence de mesures de santé publique supplémentaires, on a prédit qu'une vague provoquée par le variant Omicron poserait d'importants problèmes de santé publique, avec un pic d'infections prévu dans les deux à trois mois suivant le début de la simulation, selon le taux d'administration des doses de rappel.
Introduction
Le 11 mars 2020, l'Organisation mondiale de la Santé a déclaré l'épidémie de maladie à coronavirus 2019 (COVID-19), causée par le coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2), une pandémie. À l'instar d'autres pays touchés, le Canada et ses provinces ont mis en place des mesures d'urgence en santé publique pour contrôler la transmission du virus, sous la forme d'obligation du masque, de détection, d'isolement et de quarantaine, de restrictions aux déplacements internationaux, de travail à domicile, de fermetures d'écoles et d'entreprises, et même d'ordonnances de confinement à domicile Note de bas de page 1 Certaines de ces mesures ont coûté cher sur le plan économique, et le nombre d'infections excessivement élevé était inacceptable en raison de la pression qu'elles auraient exercée sur les services médicaux. Par conséquent, il est devenu très important de modéliser la pandémie et d'utiliser des modèles de prévisions pour évaluer les demandes sur le système de santé et orienter les décisions stratégiques sur les mesures de santé publique.
À l'échelle fédérale, l'Agence de la santé publique du Canada a créé un réseau canadien de modélisation de la COVID-19 composé de modélisateurs et d'épidémiologistes fédéraux, provinciaux, territoriaux et universitaires Note de bas de page 2. Les résultats de la modélisation ont permis d'éclairer les politiques, d'orienter les mesures de santé publique et de communiquer avec le public.
Dans la province de l'Ontario, la Table de concertation sur la modélisation de la COVID-19 a été créée en mars 2020 pour réunir plusieurs groupes d'experts, de dirigeants du système de santé et de décideurs principaux, et produire des estimations consensuelles fondées sur plusieurs résultats de modélisation et d'opinions d'experts. Ces estimations ont permis d'éclairer les décisions stratégiques sur les mesures de santé publique, de communiquer avec le public et d'évaluer l'état et les exigences du système de santé Note de bas de page 3.
Pour modéliser la transmission de la COVID selon différents scénarios, un grand nombre de modèles ont été élaborés au Canada et dans le monde à l'aide d'une gamme de progiciels. Par exemple, les efforts de modélisation à l'Agence de la santé publique du Canada ont abouti à l'élaboration de modèles à la fois compartimentés Note de bas de page 4 et basés sur les agents Note de bas de page 5. Le premier a été mis en œuvre à l'aide du progiciel Analytica, tandis que le second a été mis en œuvre à l'aide du progiciel AnyLogic. Tuite et al. Note de bas de page 6 ont mis au point un autre modèle compartimenté dans le but précis de modéliser la transmission de la COVID en Ontario. En Europe, une équipe basée à l'Université de Cambridge a élaboré un autre modèle compartimenté Note de bas de page 7 et l'a mis en œuvre à l'aide d'un solveur différentiel de valeur initiale préemballé et développé dans le langage de programmation Python. Pratiquement tous les modèles disponibles étaient axés sur l'évaluation des interventions non pharmaceutiques (e.g. tests et traçage, distanciation physique). Ils n'avaient pas la capacité de simuler l'effet des vaccins, en particulier ceux administrés à plusieurs doses ni la baisse de l'immunité conférée par le vaccin. Les modèles disponibles ne convenaient pas non plus aux bureaux de santé publique (BSP) individuels, car ils exigeaient une connaissance des progiciels précis utilisés pour les mettre en œuvre. En réalité, cela signifiait qu'une équipe multidisciplinaire composée à la fois d'épidémiologistes et de chercheurs en informatique était nécessaire pour utiliser correctement et efficacement les modèles et les progiciels correspondants.
Au cours de l'été 2020, alors que la province de l'Ontario se remettait de la première vague d'infections à la COVID-19, il est devenu évident qu'une deuxième vague se préparait. On a demandé aux BSP locales de faire des prévisions sur l'évolution future des cas, d'estimer les demandes sur les hôpitaux et de recommander des interventions en santé publique à un moment où les ressources de modélisation, tant informatiques qu'humaines, étaient rares. Les résultats de modélisation préparés au niveau national ou provincial par d'importantes équipes d'épidémiologistes et de mathématiciens ne s'appliquaient qu'en partie aux situations locales.
La Municipalité régionale de Durham, qui comprend des régions situées à l'est de Toronto et qui compte une population d'environ 750 000 habitants, était confrontée à des défis communs à toutes les BSP de l'Ontario. Pour pallier la pénurie de ressources de modélisation, le Bureau de santé de Durham a établi une collaboration avec l'Université Ontario Tech afin de renforcer des capacités internes de modélisation épidémiologique de la COVID-19. L'objectif immédiat était de créer un modèle et un progiciel sous la forme d'une application de bureau Windows qui permettrait aux épidémiologistes du personnel d'effectuer des prévisions et éclairer les décisions stratégiques sans avoir besoin de systèmes informatiques à haute performance ni de formation avancée.
Par souci de simplicité et de commodité, un modèle compartimenté dynamique (déterministe) élaboré par l'Agence de la santé publique du Canada Note de bas de page 4 a été adopté au départ. Ce modèle initial comprenait sept segments (susceptibles, exposés, exposés en quarantaine, infectieux, isolés, hospitalisés et retirés), et n'autorisait qu'une seule souche ancestrale. Il a été mis en œuvre comme un code Modern Fortran (Fortran avec des fonctionnalités de programmation axées sur les objets) avec une interface utilisateur Excel/Visual-Basic. À mesure que des variants ont émergé et que les vaccins sont devenus disponibles, des capacités supplémentaires ont été ajoutées au modèle, et la mise en œuvre a basculé vers une application de bureau MS-Windows avec un système dorsal de traitement de données Modern Fortran. L'application s'appelait IDSIM (Infectious-Disease SIMulator). Ce travail présente le modèle IDSIM (novembre 2021) et illustre certaines de ses capacités en effectuant quatre simulations de transmission de la COVID-19 dans des conditions différentes.
Modèle épidémiologique
Le modèle épidémiologique est un modèle compartimenté et stratifié à plusieurs degrés qui peut prendre en charge plusieurs variants de virus et niveaux de vaccination, ainsi que des mesures de santé publique comme la distanciation physique, le suivi des contacts suivi par la quarantaine et les tests suivis par l'isolement.
Compartiments et organigramme
Le diagramme du modèle épidémiologique est présenté à la figure 1.

Figure 1 - Description textuelle
La figure montre un diagramme détaillé du modèle compartimenté. La zone bleue couvre toutes les personnes exposées, qu'elles soient mises en quarantaine ou dans la communauté. La zone verte couvre toutes les personnes infectieuses. Les trois rectangles distincts font respectivement référence aux personnes infectieuses dans la communauté, testées et isolées, et mises en quarantaine. La zone rose couvre les personnes hospitalisées.
La population de chaque segment est classée par strate combinée (indice g), statut d'immunisation (indice i) et variant (indice v). Les équations différentielles régissant la transition d'un segment à un autre sont présentées à l'appendice.
Variants
L'indice v de variant s'applique à tous les segments autres que celui qui comprend des personnes susceptibles.
Strates combinées
Chaque strate combinée est une combinaison de strates correspondant à plusieurs stratifications. Par exemple, si une population donnée était stratifiée par âge en deux strates, celles de moins de 50 ans et celles de 50 ans et plus, et par sexe en deux strates, femme et homme, l'indice g prendrait des valeurs comprises entre 1 et 4, correspondant aux quatre strates combinées : les femmes de moins de 50 ans, les femmes de 50 ans et plus, les hommes de moins de 50 ans et les hommes de 50 ans et plus.
Statut d'immunisation
Le statut d'immunisation peut avoir autant de niveaux que nécessaire, indiqué par l'indice i. Par exemple, l'indice i peut prendre des valeurs entre 1 et 5, avec les significations suivantes : 1) non vacciné; 2) première dose administrée, première dose de protection non encore obtenue; 3) première dose de protection obtenue; 4) deuxième dose administrée, la deuxième dose de protection n'est pas encore obtenue et 5) deuxième dose de protection obtenue.
Les personnes passent d'un niveau d'immunisation à l'autre, soit par la vaccination, soit avec le fil du temps. À l'aide de l'exemple ci-dessus, les personnes passeraient du niveau 1 au niveau 2 et du niveau 3 au niveau 4 en passant par la vaccination (définie par le nombre de personnes vaccinées par jour), et du niveau 2 au niveau 3 et du niveau 4 au niveau 5 par le simple fil du temps (défini par le temps moyen nécessaire pour obtenir une protection après la vaccination). Cela est illustré dans la figure 2.
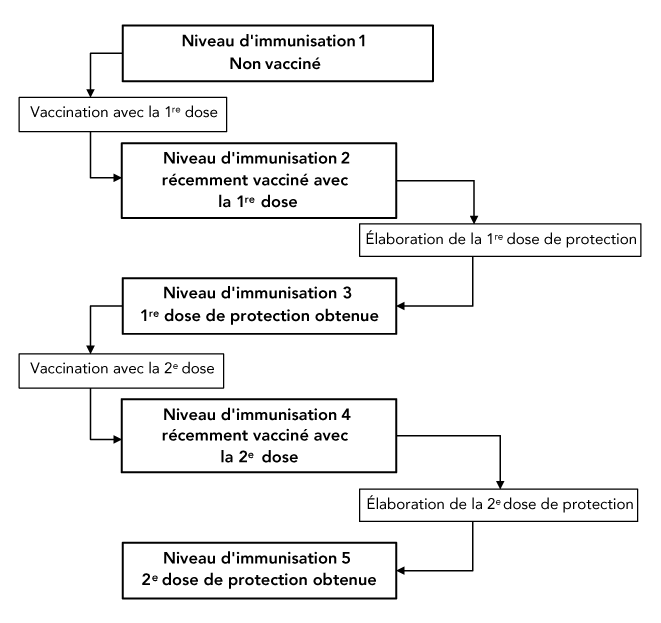
Figure 2 - Description textuelle
La figure montre une stratégie d'immunisation avec cinq niveaux d'immunisation. Les personnes passent du niveau 1 au niveau 2 et du niveau 3 au niveau 4 au moyen de la vaccination. Ils passent du niveau 2 au niveau 3 et du niveau 4 au niveau 5 par le simple passage du temps, à mesure que l'immunité conférée par le vaccin augmente.
Modèle de transmission
Les personnes sont exposées par contact avec une ou plusieurs personnes infectieuses. Le taux d'exposition est caractérisé par le nombre de contacts par personne par jour et par la probabilité de transmission par contact. Le premier est caractérisé par un nombre moyen de contacts quotidiens pour la population. Le dernier est caractérisé par un nombre moyen pour la population qui est ensuite modulé par des facteurs dépendants du variant et de la vaccination.
Paramètres de stratification
Chaque stratification peut avoir un nombre différent de strates. Chaque strate est définie par les paramètres suivants :
- Fraction de la population appartenant à la strate
- Module de susceptibilité (facteur qui multiplie la probabilité de transmission par contact pour les personnes susceptibles appartenant à la strate)
- Module de gravité (facteur qui multiplie la fraction des personnes symptomatiques dans la strate et qui développent des symptômes graves). Par exemple, dans le groupe d'âge de 80 ans et plus, une valeur supérieure à une serait appropriée pour représenter la probabilité plus élevée de résultats graves pour ce groupe d'âge
Paramètres de variant
Chaque variant, y compris la souche ancestrale, est défini par les paramètres suivants :
- Temps de latence (depuis l'exposition)
- Durée d'incubation (depuis l'exposition)
- Durée d'hospitalisation pour les cas graves (depuis l'exposition)
- Délai de rétablissement pour les cas non graves (depuis l'exposition)
- Temps de guérison après l'hospitalisation (pour les cas graves qui se rétablissent)
- Heure de décès après l'hospitalisation (pour les cas graves qui ne se rétablissent pas)
- Probabilité de transmission par contact
- Fraction des personnes infectieuses symptomatiques
- Fraction des personnes symptomatiques infectieuses qui présentent des symptômes graves
- Fraction des personnes hospitalisées en rétablissement
Paramètres du niveau d'immunisation
Chaque niveau d'immunisation est défini par les paramètres suivants :
- Facteur de transmissibilité (facteur, habituellement inférieur ou égal à un, qui multiplie la probabilité de transmission par contact pour les personnes infectieuses ayant un niveau de vaccination précis)
- Pour les personnes infectieuses qui ne sont pas vaccinées ou qui ont été vaccinées récemment (avant de développer une protection), ce facteur ne serait qu'un. Pour les personnes qui sont vaccinées et infectieuses et qui ont déjà développé une certaine protection, le facteur serait normalement inférieur à un pour représenter le fait que ces personnes sont moins contagieuses
- Facteur de susceptibilité (facteur, habituellement inférieur ou égal à un, qui multiplie la probabilité de transmission par contact pour les personnes susceptibles ayant un niveau de vaccination précis)
- Pour les personnes susceptibles qui ne sont pas vaccinées ou qui ont été vaccinées récemment (avant de développer une protection), ce facteur ne serait qu'un. Pour les personnes susceptibles qui ont déjà développé une certaine protection, le facteur serait normalement inférieur à un pour représenter le fait que ces personnes sont moins susceptibles de devenir infectées. Ce facteur est essentiellement égal à un moins l'efficacité du vaccin
- Facteur de gravité (un facteur, généralement inférieur ou égal à un, qui multiplie la fraction des personnes symptomatiques présentant des symptômes graves)
- Pour les personnes symptomatiques qui ne sont pas vaccinées ou qui ont été vaccinées récemment (avant de développer une protection), ce facteur ne serait qu'un. Pour les personnes symptomatiques infectieuses qui ont déjà développé une certaine protection, le facteur serait normalement inférieur à un, pour représenter le fait que ces personnes sont moins susceptibles de développer des symptômes graves
- Taux auquel les personnes passent d'un niveau d'immunisation à un autre, exprimé comme suit :
- Personnes vaccinées par unité de temps (jour)
- Durée moyenne (jours) avant les changements de niveau de protection après la vaccination
Paramètres des mesures de santé publique
Les mesures de santé publique sont caractérisées par les paramètres suivants :
- Fraction des personnes exposées qui sont mises en quarantaine avec succès
- Fraction des personnes infectieuses testées et isolées avec succès
- Coefficient pour d'autres mesures de santé publique non précisées. Ce facteur général, généralement inférieur ou égal à 1, apparaît dans la force de l'infection pour tenir compte de mesures comme le port du masque ou la distanciation physique. Il peut également être ajusté manuellement pour adapter les prévisions du modèle aux données réelles consignées
Modélisation de la baisse de la protection conférée par le vaccin au fil du temps et par la troisième dose
Le statut d'immunisation à plusieurs niveaux peut servir à modéliser la baisse de la protection conférée par le vaccin et le besoin subséquent d'une troisième dose une fois la protection réduite à un certain niveau. Un exemple est d'utiliser huit niveaux d'immunisation comme suit :
- Non vacciné
- Première dose administrée, protection pas encore obtenue après la première dose
- Première dose administrée, protection obtenue après la première dose
- Deuxième dose administrée, protection pas encore obtenue après la deuxième dose
- Deuxième dose administrée, protection obtenue après la deuxième dose
- Baisse de la protection après la deuxième dose
- Troisième dose administrée, protection pas encore obtenue après la troisième dose
- Troisième dose administrée, protection obtenue après la troisième dose
Le passage du niveau 5 au niveau 6 se fait au fil du temps (e.g. trois mois pour une baisse de 20 % de la protection conférée par le vaccin). Le passage du niveau 6 au niveau 7 se fait par administration de la troisième dose de vaccin. Le passage du niveau 7 au niveau 8 se fait au fil du temps (e.g. deux semaines pour une protection accrue).
Hypothèses du modèle
Dans sa forme actuelle, le modèle formule plusieurs hypothèses :
- Le rétablissement d'un variant offre une immunité totale et permanente contre tous les variants
- La répartition par strates dans une stratification précise est indépendante des autres stratifications. Comme dans l'exemple de stratification précédent, si 50 % de la population était des femmes et 50 % de la population était des hommes, on suppose que c'est vrai tant pour les personnes de moins de 50 ans que pour les personnes de 50 ans et plus. De même, si 60 % de la population est âgés de moins de 50 ans et que 40 % sont âgés de 50 ans et plus, on suppose que c'est vrai pour les populations masculine et féminine
- Tous les cas graves sont hospitalisés
- Le nombre de contacts par jour par personne est le même pour toutes les strates combinées et indépendamment du niveau de vaccination d'une personne. On suppose que les personnes en quarantaine, isolées ou hospitalisées n'ont aucun contact
Points de départ et de fin de la simulation
Les conditions initiales au « Jour 0 » peuvent être précisées, y compris la population de chaque segment par strate, statut de vaccination et variant. Cela permet de commencer les simulations par des données réalistes acquises sur le terrain plutôt que par des hypothèses génériques d'une personne infectieuse. Le point de fin d'une simulation peut être enregistré et utilisé comme point de départ d'une nouvelle simulation, permettant ainsi la prolongation indéfinie de l'intervalle de temps de simulation.
Paramètres épidémiologiques temporels
On peut simuler des paramètres temporels en supposant qu'ils soient constants sur des intervalles de temps finis, avec des changements d'étape d'un intervalle à l'autre. Par exemple, la simulation d'une année entière peut être effectuée par intervalles de 30 jours, avec des paramètres mis à jour au début de chaque intervalle de simulation.
Simulations de transmission de la COVID-19
Quatre simulations ont été effectuées pour étudier l'effet de facteurs précis sur la transmission de la COVID-19 dans la région de Durham :
- Simulation 1 : Effet des différentes valeurs de couverture vaccinale, la vaccination étant la seule mesure de santé publique, en supposant que l'immunité conférée par le vaccin ne baisse pas avec le temps
- Simulation 2 : Effet des différentes valeurs d'efficacité du vaccin avec des mesures de santé publique précises en place, en supposant qu'aucune baisse de l'immunité conférée par le vaccin ne se produit au fil du temps
- Simulation 3 : Effet de la baisse de l'immunité conférée par le vaccin après trois mois, en supposant des mesures de santé publique précises
- Simulation 4 : Effet de l'arrivée du variant Omicron, et incidence des vaccins de rappel contre la COVID-19 sur la transmission et la gravité des variants Delta et Omicron en supposant des mesures sanitaires précises et une baisse de l'immunité conférée par le vaccin au fil du temps
Pfizer-BioNTech (Comirnaty, BNT162b2) et Moderna (Spikevax, mRNA-1273) étaient les deux principaux types de vaccins contre la COVID-19 offerts dans la région de Durham. L'efficacité du vaccin contre l'infection à la COVID-19 a chuté de trois à six mois. On a supposé que les personnes de la région de Durham ont reçu leur deuxième dose, en moyenne, quatre mois avant la date de début de la simulation.
La stratification par groupe d'âge n'a pas été utilisée. Cette simplification a été adoptée parce qu'il n'y avait pas de données fiables sur l'âge, comme la transmissibilité, la gravité et l'efficacité du vaccin. Même si des matrices de contact fondées sur l'âge pour une période antérieure à la COVID-19 étaient disponibles Note de bas de page 8, elles n'ont pas été utilisées, parce que de telles matrices auraient eu un effet sur les résultats globaux de simulation seulement si la transmissibilité et l'efficacité du vaccin étaient également ventilées par groupe d'âge.
Les paramètres généraux de simulation sont présentés au tableau 1 et ont été fondés sur les renseignements disponibles en novembre 2021. Les meilleures estimations pour certains des paramètres du tableau 1 (e.g. la période de latence, la période d'incubation, la durée du séjour à l'hôpital, l'efficacité du vaccin, la gravité) ont depuis changé. Les paramètres propres aux simulations individuelles sont présentés au tableau 2. Pour toutes les simulations, le jour 0 était le 22 novembre 2021.
| Paramètre | Valeur | Source |
|---|---|---|
| Nombre de strates | 1 | Propre à l'utilisateur |
| Nombre de personnes infectieuses au jour 0 | 200 cas actifs déclarés le jour 0. Pour chaque cas signalé, il y a trois cas non détectés dans la collectivité, pour un total de 800 personnes infectieuses | Données du BSP, Note de bas de page 9 |
| Nombre de contacts par jour | 10 | Note de bas de page 10 Note de bas de page 11 |
| Période de latence | 3 jours pour Delta 1 jour pour Omicron |
Note de bas de page 12 Note de bas de page 13 Note de bas de page 14 |
| Temps d'incubation | 5 jours pour Delta 3 jours pour Omicron |
Note de bas de page 12Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 |
| Durée d'hospitalisation (depuis l'exposition) | 10 jours pour Delta et Omicron | Données du BSP |
| Délai de rétablissement pour les cas non graves (depuis l'exposition) | 14 jours pour Delta et Omicron | Données du BSP |
| Délai de rétablissement après l'hospitalisation | 14 jours pour Delta 10 jours pour Omicron |
Données du BSP, Note de bas de page 14 |
| Heure de décès après l'hospitalisation | 15 jours pour Delta et Omicron | Données du BSP |
| Probabilité de transmission par contact | 0,058 pour Delta (estimation basée sur R0, période infectieuse et taux de contact) 0,232 pour Omicron |
Note de bas de page 16 Note de bas de page 17 |
| Fraction des cas symptomatiques (infectieux) | 0,85 pour Delta et Omicron | Données du BSP |
| Fraction des cas graves (symptomatiques) | 0,03 pour Delta 0,012 pour Omicron |
Données du BSP, Note de bas de page 18 |
| Fraction des cas rétablis après l'hospitalisation | 0,6 pour Delta 0,8 pour Omicron |
Données du BSP, Note de bas de page 19 |
| Facteur de transmissibilité pour les non vaccinés | 1 pour Delta et Omicron | Note de bas de page 20 |
| Facteur de susceptibilité pour les non vaccinés | 1 pour Delta et Omicron | Note de bas de page 20 |
| Facteur de gravité pour les non vaccinés | 1 pour Delta et Omicron | Note de bas de page 19 |
| Facteur de transmissibilité après 1 dose | 0,8 pour Delta et Omicron | Note de bas de page 19 Note de bas de page 20 |
| Facteur de susceptibilité après 1 dose | 0,7 pour Delta et Omicron | Note de bas de page 20 Note de bas de page 21 |
| Facteur de gravité après 1 dose | 0,3 pour Delta et Omicron | Note de bas de page 19 |
| Facteur de transmissibilité après 2 doses | 0,5 pour Delta 0,6 pour Omicron |
Note de bas de page 20 |
| Facteur de susceptibilité après 2 doses | 0,2 pour Delta 0,6 pour Omicron |
Note de bas de page 20 Note de bas de page 22 Note de bas de page 23 |
| Facteur de gravité après 2 doses | 0,2 pour Delta 0,3 pour Omicron |
Note de bas de page 13 Note de bas de page 24 |
| Facteur de transmissibilité après 3 doses | 0,5 pour Delta 0,5 pour Omicron |
Note de bas de page 20 |
| Facteur de susceptibilité après 3 doses | 0,1 pour Delta 0,3 pour Omicron |
Note de bas de page 22 |
| Facteur de gravité après 3 doses | 0,06 pour Delta 0,1 pour Omicron |
Note de bas de page 13 Note de bas de page 24 |
| Fraction de la population avec 1 dose le jour 0 | 0,01–0,03 | Données du BSP |
| Fraction de la population avec 2 doses le jour 0 | 0,72–0,74 | Propre à l'utilisateur |
| Fraction de la population avec 3 doses le jour 0 | 0 | Propre à l'utilisateur |
| Nombre de personnes exposées le jour 0 | 218 | Données du BSP |
| Période infectieuse | 11 jours pour Delta 13 jours pour Omicron |
Calculée selon la période de rétablissement |
| Population | 738 000 | Données du recensement |
| Nombre de personnes rétablies le jour 0 | 110 700 | Données du BSP |
| Nombre de personnes décédées le jour 0 | 389 | Données du BSP |
|
||
| Paramètre | Simulation 1 : Différentes valeurs de couverture vaccinale |
Simulation 2 : Différentes valeurs de l'efficacité du vaccin |
Simulation 3 : Cas avec ou sans baisse de l'immunité |
Simulation 4 : Évolution des variants Delta et Omicron et effet des doses de rappel |
|---|---|---|---|---|
| Répartition des variants au jour 0 | Delta à 100 % | Delta à 99 % et Omicron à 1 % | ||
| Niveaux de vaccination | Non vacciné Deux doses |
Non vacciné Dose 1 Dose 2 |
Non vacciné Dose 1 Dose 2 Immunité réduite |
Non vacciné Dose 1 Dose 2 (immunité réduite) Dose 3 |
| Couverture vaccinale | Comparer la transmission selon différentes proportions de vaccination : 70 %, 80 %, 90 % et 100 % | Commencer par une couverture vaccinale de 2 % pour la dose 1, 72 % pour la dose 2 400 Dose 1 administrées par jour 300 Dose 2 administrées par jour |
Commencer par une couverture vaccinale de 1 % pour la dose 1, 74 % pour la dose 2 et 0 % pour la dose 3 500 Dose 1 administrées par jour 200 Dose 2 administrées par jour 3 000 ou 5 000 dose 3 administrées par jour |
|
| Mesures de santé publique | Le coefficient de mesure de santé publique est de 1, aucun isolement et aucune mise en quarantaine | Le coefficient de mesure de santé publique est de 0,8 (ajusté pour correspondre à la valeur estimée de Rt ≈ 1 pour la région de Durham le jour 0) Tous les cas signalés sont isolés et 5 % des cas exposés sont mis en quarantaine |
||
| Efficacité du vaccin | L'efficacité du vaccin est de 80 % Le vaccin réduit la transmission de 50 % après la dose 2 et réduit la gravité de 85 % |
Comparer les suivants : Taux d'efficacité de 33 % pour la dose 1 et de 80 % pour la dose 2 Taux d'efficacité de 56 % pour la dose 1 et de 87 % pour la dose 2 |
Efficacité à deux semaines : 33 % pour la dose 1; 80 % pour la dose 2 Transmissibilité à deux semaines : 83 % pour la dose 1; 50 % pour la dose 2 |
Le variant Omicron est quatre fois plus transmissible que le variant Delta |
| Baisse de l'immunité après la vaccination | Aucune | Aucune | Efficacité du vaccin à 12 semaines après la dose 2 : 45 % Transmissibilité à 12 semaines après la dose 2 : 76 % |
Protection réduite pour les personnes qui n'avaient que deux doses de vaccin |
Résultats et discussion
La première simulation a été effectuée pour quantifier l'incidence de diverses proportions de vaccination sur la transmission de la COVID-19, en supposant que la vaccination était la seule mesure de contrôle de la santé publique et qu'aucune vaccination supplémentaire n'ait été effectuée pendant la période de simulation.
La figure 3 montre les résultats de simulation pour les nouvelles infections signalées quotidiennement pour diverses proportions de vaccination. Les résultats prédisaient que le nombre de cas de COVID-19 signalés quotidiennement diminuerait considérablement avec une augmentation des proportions de vaccination; toutefois, même avec une couverture vaccinale de 80 %, il y aurait encore un très grand nombre de cas quotidiens signalés. Au moins 90 % de la population totale devrait être vacciné pour contrôler une épidémie consistant du variant Delta. En réalité, il aurait été difficile d'atteindre une couverture vaccinale aussi élevée, surtout lorsque les groupes d'âge plus jeunes n'étaient pas admissibles à la vaccination. Les résultats suggèrent que même de petites augmentations de la couverture vaccinale peuvent réduire considérablement la transmission de la COVID-19, mais que d'autres mesures de contrôle seraient également nécessaires. Les mesures de contrôle de la santé publique autres que la vaccination peuvent comprendre la détection des cas, la recherche des contacts et la mise en quarantaine, la distanciation physique, la limitation des rassemblements sociaux, l'utilisation du masque, l'autosurveillance et d'autres mesures de « confinement ».
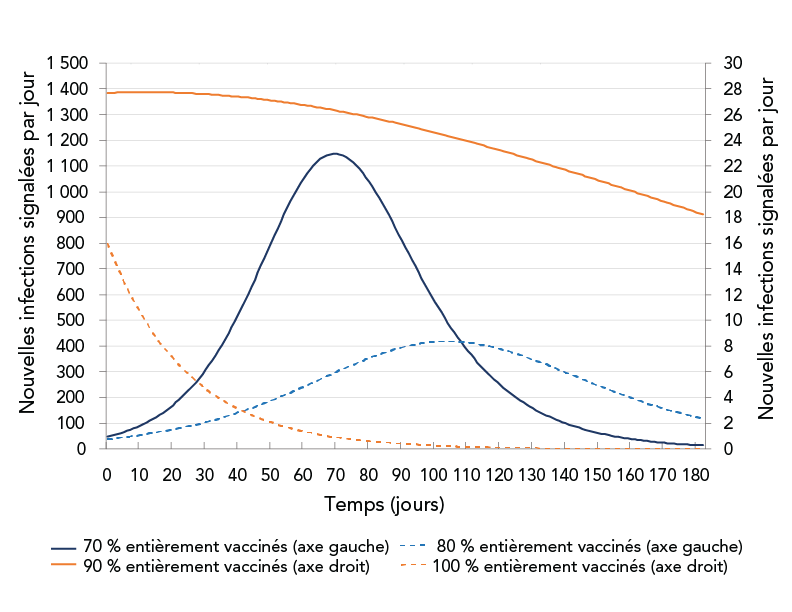
Figure 3 - Description textuelle
La figure montre les nouvelles infections signalées quotidiennement en fonction du temps pour diverses proportions de vaccination : 70 %, 80 %, 90 %, 100 %. Les courbes correspondant à une couverture de 70 % ou de 80 % montrent une augmentation suivie d'une baisse. Les courbes correspondant à une couverture de 90 % ou de 100 % montrent que le nombre de nouvelles infections quotidiennes diminue depuis le début de la simulation.
La deuxième simulation a évalué l'incidence de deux valeurs différentes d'efficacité du vaccin sur la transmission de la COVID-19 dans le cadre des mesures de contrôle de la santé publique en vigueur dans la région de Durham en novembre 2021, comme le montre le tableau 2. Les deux ensembles de valeurs pour l'efficacité du vaccin ont été tirés d'une étude du Royaume-Uni Note de bas de page 20 et d'une étude de l'Ontario Note de bas de page 21. L'étude de l'Ontario a révélé une efficacité vaccinale plus élevée que l'étude du R.-U. En vertu des mesures de contrôle en vigueur en novembre 2021, le nombre de reproductions net, Rt, estimé d'après les données de cas quotidiens, était d'environ 1,0. Pour tenir compte de toutes les mesures de santé publique qui n'ont pas été modélisées explicitement (e.g. utilisation du masque, distanciation physique), le coefficient de mesure de santé publique a été ajusté manuellement, de sorte que le jour 0, le Rt prévu correspondait à l'estimation de Rt ≈ 1 dans la région de Durham pour le mois de novembre 2021. La fraction vaccinale de la population de départ était de 2 % pour la dose-1 et de 72 % pour la dose-2. Chaque jour, on a supposé que 400 personnes étaient vaccinées avec la première dose et 300 personnes étaient vaccinées avec la deuxième dose. Cela correspondait à 92 % de la population totale ayant reçu deux doses à la fin de la période de simulation de 180 jours. Les résultats de simulation pour les deux jeux de données sur l'efficacité du vaccin sont présentés à la figure 4.
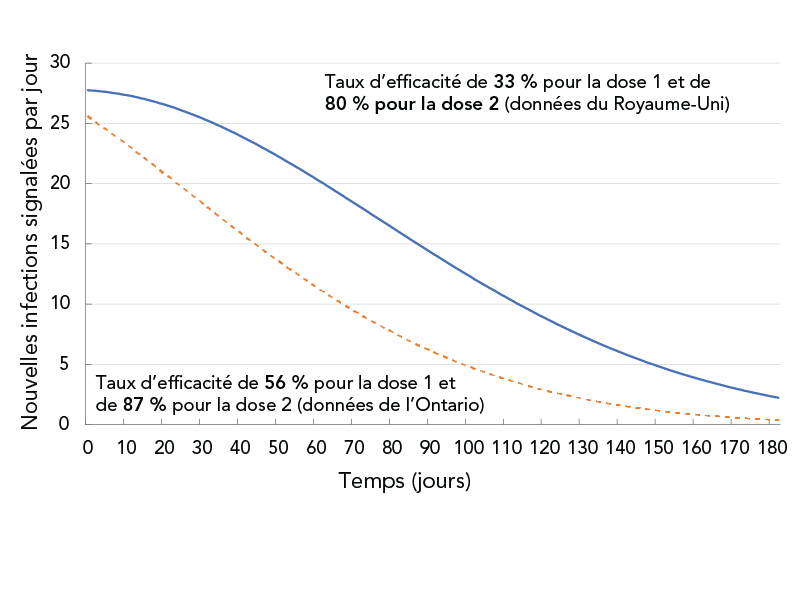
Figure 4 - Description textuelle
La figure montre les nouvelles infections signalées quotidiennement en fonction du temps pour deux jeux de données sur l'efficacité des vaccins. La courbe solide correspond à 33 % d'efficacité après la dose 1 et 80 % après la dose 2. La courbe en pointillés correspond à 56 % d'efficacité après la dose 1 et 87 % après la dose 2. La courbe solide montre une baisse plus lente que la courbe pointillée.
Avec la vaccination (novembre 2021) et d'autres mesures de contrôle de la santé publique à jour au moment de l'intervention, on prévoyait que les nouvelles infections quotidiennes (en supposant seulement le variant Delta) diminueraient avec le temps. Cependant, au jour 90, la projection basée sur les données sur l'efficacité du vaccin du Royaume-Unis a montré deux fois plus d'infections signalées quotidiennement que la prévision basée sur les données sur l'efficacité du vaccin en Ontario.
En plus de comparer l'efficacité de diverses mesures de contrôle, l'application de modélisation peut également servir à comprendre l'incidence de la baisse de l'immunité conférée par le vaccin sur la transmission de la COVID-19.
La troisième simulation a été effectuée pour estimer l'incidence d'une baisse de l'efficacité du vaccin au fil du temps. Il a comparé le cas d'aucune baisse d'immunité au cas de baisse d'immunité au bout de trois mois. Pour tenir compte de toutes les mesures de santé publique qui n'ont pas été modélisées explicitement, le coefficient de mesure de santé publique a été ajusté manuellement, de sorte que le jour 0, le Rt prévu correspondait à l'estimation de Rt ≈ 1 dans la région de Durham pour le mois de novembre 2021. Les résultats sont illustrés dans la figure 5.
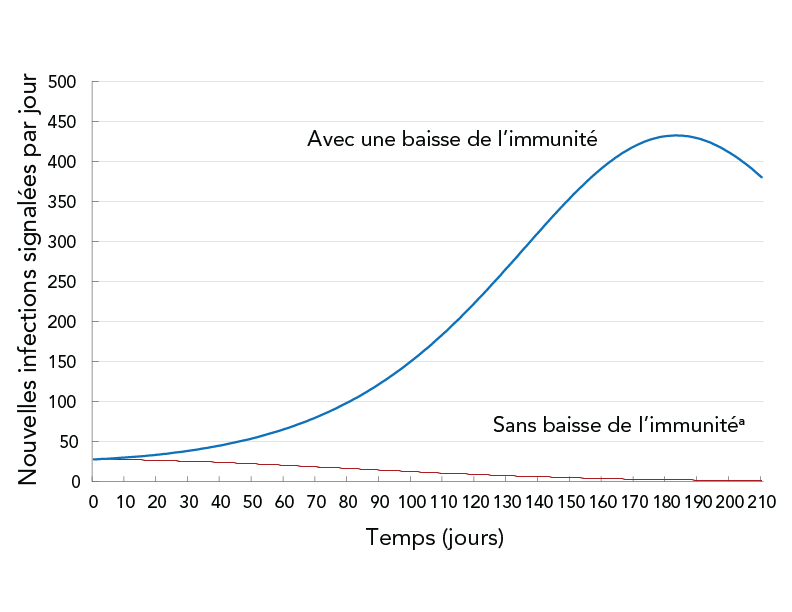
Figure 5 - Description textuelle
La figure montre les nouvelles infections signalées quotidiennement en fonction du temps pour deux scénarios : immunité permanente conférée par le vaccin (courbe en pointillés) et immunité conférée par le vaccin (courbe solide). La courbe en pointillés montre une baisse depuis le début de la simulation, tandis que la courbe solide montre une augmentation suivie d'une baisse.
- Note de bas de page a
-
12 semaines après la vaccination complète, on suppose que l'efficacité du vaccin diminue de 80 % à 45 % et que la réduction de la transmissibilité chez les personnes vaccinées diminue de 50 % à 24 %
Dans le cadre du programme de vaccination (novembre 2021) et d'autres mesures de santé publique à jour au moment de l'intervention, en supposant que l'immunité ne diminue pas après la vaccination, la courbe épidémiologique devrait être aplatie dès le début, et les nouvelles infections signalées quotidiennement devraient diminuer. La baisse de l'immunité réduit la probabilité d'être protégé contre l'infection à la COVID-19 (efficacité de la vaccination) et augmente la probabilité que les personnes entièrement vaccinées transmettent la maladie. En supposant une baisse de l'immunité, le nombre de nouvelles infections signalées quotidiennement devrait être plus élevé et la courbe épidémiologique devrait s'aplatir six mois après le début de la période de simulation.
L'application de modélisation peut également simuler la transmission de maladies avec plusieurs variants. La quatrième simulation a examiné l'arrivée du variant Omicron en plus du variant Delta, ainsi que l'efficacité d'une troisième dose (de rappel) du vaccin à acide ribonucléique messager (ARNm) pour prévenir l'infection à la COVID-19, l'hospitalisation et la mort. On a supposé que le variant Omicron était quatre fois plus transmissible que le variant Delta Note de bas de page 21. Le jour 0 de la simulation, 99 % des infections existantes étaient dues au variant Delta et 1 % au variane Omicron. Pour tenir compte de toutes les mesures de santé publique qui n'ont pas été modélisées explicitement, le coefficient de mesure de santé publique a été ajusté manuellement, de sorte que le jour 0, le Rt prévu correspondait à l'estimation de Rt ≈ 1 dans la région de Durham pour le mois de novembre 2021. Les infections, hospitalisations et décès liés à la COVID-19 ont été comparés pour trois scénarios : 1) aucune troisième dose (rappel) du vaccin à ARNm; 2) 3 000 doses de rappel administrées par jour; et 3) 5 000 doses de rappel administrées par jour. On a supposé que la couverture de la dose de rappel commencerait à 0 % le jour 0 de la simulation, et que les doses de rappel étaient administrées jusqu'à ce que la couverture de rappel atteigne 93 % de la population admissible (18 ans ou plus). Il aurait fallu 180 jours pour atteindre une couverture de rappel de 93 %, 3 000 doses de rappel étant administrées par jour et 110 jours pour atteindre ce niveau de couverture, 5 000 doses de rappel étant administrées par jour.
La figure 6 montre l'incidence prévue du variant Omicron et de la troisième dose du vaccin sur la transmission de la maladie. Le nombre de nouvelles infections au variant Omicron devait dépasser le nombre de nouvelles infections au variant Delta après seulement deux semaines à partir du Jour 0, en mi-décembre 2021. En un mois, Omicron devait devenir le variant dominant et représenter la majorité (97 %) des infections. Des résultats similaires ont été trouvés par la Table consultative scientifique sur la COVID-19 de l'Ontario Note de bas de page 25.
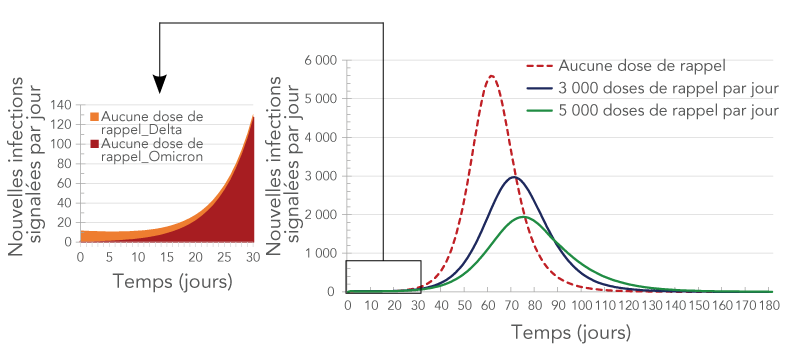
Figure 6 - Description textuelle
La figure montre le nombre de nouvelles infections signalées quotidiennement en fonction du temps en présence de deux variantes (Delta et Omicron) pour trois taux d'administration de doses de rappel : aucune dose de rappel (courbe brune), 3 000 doses de rappel par jour (courbe verte) et 5 000 doses de rappel par jour (courbe bleue). La courbe brune a le pic le plus élevé, suivie de la courbe verte et de la courbe bleue. Le panneau-détail montre la répartition par variante des nouveaux cas quotidiens en fonction du temps en l'absence de doses de rappel. La courbe correspondant à la variante Omicron montre une forte augmentation avec le temps tandis que la courbe correspondant à la variante Delta montre une baisse avec le temps.
Les résultats de la simulation ont suggéré que les doses de rappel auraient une incidence considérable sur les infections, les hospitalisations (y compris les hospitalisations et les unités de soins intensifs) et les décès liés à la COVID-19 (figure 6, figure 7 et figure 8). On prévoyait que plus d'un quart des infections (26 %) seraient évitées si 3 000 doses de rappel étaient administrées chaque jour dans la région de Durham, et que 41 % des infections seraient évitées si 5 000 doses de rappel étaient administrées chaque jour. L'administration de 5 000 doses de rappel par jour devrait également prévenir plus de la moitié des hospitalisations et près de la moitié des décès (tableau 3, tableau 4 et figure 8).
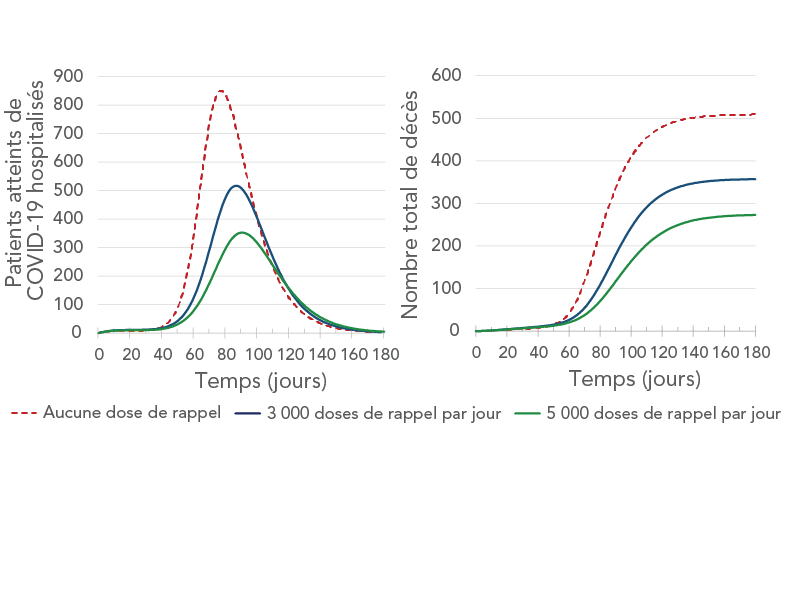
Figure 7 - Description textuelle
La figure montre le nombre de patients hospitalisés (panneau de gauche) et le nombre cumulé de décès (panneau de droite) en fonction du temps correspondant à trois taux d'administration de dose de rappel : aucune dose de rappel (courbe brune), 3 000 doses de rappel par jour (courbe bleue) et 5 000 doses de rappel par jour (courbe verte). Sur le panneau de gauche, la courbe brune a le pic le plus élevé, suivie de la courbe bleue et de la courbe verte. Sur le panneau de droite, les trois courbes commencent par augmenter, puis elles plafonnent toutes. Le plateau de la courbe brune est le plus élevé, suivi du plateau de la courbe bleue et du plateau de la courbe verte.
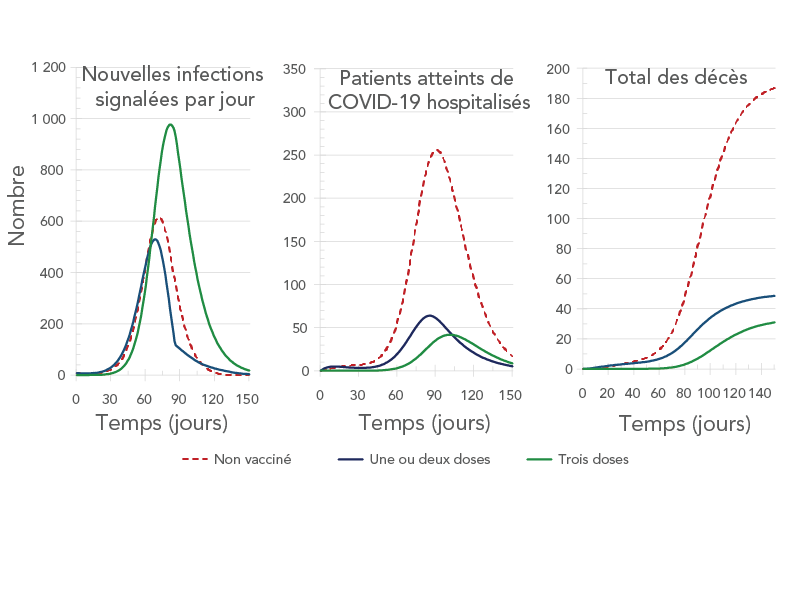
Figure 8 - Description textuelle
La figure montre les nouvelles infections quotidiennes (panneau de gauche), le nombre de patients hospitalisés (panneau central) et le nombre cumulé de décès (panneau de droite) en fonction du temps. Chaque panneau montre trois courbes correspondant à aucune vaccination (courbe brune), une ou deux doses (courbe bleue) et trois doses (courbe verte). Le panneau de gauche montre que les trois courbes ont des pics, le plus élevé étant celui de la courbe verte, suivi de celui de la courbe brune et celui de la courbe bleue. Le panneau central montre que les trois courbes ont des pics, le plus élevé étant celui de la courbe brune, suivi de celui de la courbe bleue et celui de la courbe verte. Sur le panneau de droite, les trois courbes commencent par augmenter, puis elles plafonnent toutes. Le plateau de la courbe brune est le plus élevé, suivi du plateau de la courbe bleue et du plateau de la courbe verte.
| Groupe | Nombre total d'infections | Baisse du pourcentage du nombre total d'infections | Nbre maximal d'hospitalisations en une seule journée | Baisse du pourcentage du pic d'hospitalisations | Total des hospitalisations | Baisse du pourcentage du total des hospitalisations | Total des décès | Baisse du pourcentage du total des décès |
|---|---|---|---|---|---|---|---|---|
| Sans dose de rappel | 558 841 | - | 851 | - | 2 558 | - | 509 | - |
| 3 000 doses de rappel par jour | 411 500 | 26 % | 517 | 39 % | 1 766 | 31 % | 357 | 30 % |
| 5 000 doses de rappel par jour | 328 533 | 41 % | 352 | 59 % | 1 354 | 47 % | 273 | 46 % |
|
||||||||
| Indicateur | Nombre | Proportions | |||||
|---|---|---|---|---|---|---|---|
| Non vacciné | 1 ou 2 doses | 3 doses | Total | Non vacciné | 1 ou 2 doses | 3 doses | |
| Nombre total d'infections | 90 288 | 74 919 | 163 327 | 328 533 | 27 % | 23 % | 50 % |
| Pic d'hospitalisations | 256 | 64 | 42 | 362 | 71 % | 18 % | 12 % |
| Total des hospitalisations | 946 | 241 | 167 | 1 354 | 70 % | 18 % | 12 % |
| Total des décès | 190 | 50 | 33 | 273 | 70 % | 18 % | 12 % |
La figure 8 montre le nombre prévu de nouvelles infections signalées quotidiennement, de patients hospitalisés un jour donné, et le total des décès par statut de vaccination pour le scénario de 5 000 doses de rappel par jour. Même si l'on a prédit que les personnes vaccinées représentaient près des trois quarts des infections à la COVID-19 au 180e jour, on prédisait qu'elles ne représentaient que 30 % des cas graves (mesurés par les hospitalisations et les décès).
Il est instructif de comparer les données réelles avec les résultats de simulation qui sont les plus proches du scénario qui s'est développé dans la vie réelle, à savoir la quatrième simulation, en supposant 3 000 doses de rappel administrées par jour. Les données réelles sur l'occupation des hôpitaux n'étaient pas directement disponibles et ont été estimées à partir des données d'admission quotidiennes du BSP, en supposant un séjour moyen à l'hôpital de cinq jours pour la vague dominée par Omicron. Le séjour moyen à l'hôpital a été estimé en fonction de la durée moyenne de séjour à l'hôpital selon l'âge pour une vague dominée par Omicron Note de bas de page 26 et de la répartition par âge des admissions à l'hôpital pour le BSP de Durham. La comparaison est présentée à la figure 9 pour les cas signalés quotidiennement et l'occupation des hôpitaux. Une analyse détaillée des valeurs des paramètres de simulation conduirait à la meilleure concordance entre les nombres prévus et réels impliquerait un étalonnage rigoureux du modèle en utilisant la moindre analyse de minimisation des carrés, qui ne faisait pas partie du travail déclaré ici, donc seule une analyse sommaire est fournie avec la mise en garde pour traiter cette analyse simple avec prudence. La figure 9 montre que les cas réels déclarés quotidiennement commencent à augmenter sensiblement deux semaines plus tôt que prévu par la simulation. Nous supposons que c'est parce que le jour 0 de la simulation, la vague Omicron était déjà plus avancée que prévu. En d'autres termes, la prévalence de 1 % d'Omicron supposée dans la simulation était probablement une description plus exacte de la situation le 8 novembre 2021, plutôt que le 22 novembre 2021. En ce qui concerne l'occupation des hôpitaux, il semblerait d'abord que les prévisions et les chiffres réels augmentent en même temps; toutefois, il s'agit d'un artéfact qui consiste à assumer un séjour moyen à l'hôpital de 10 jours, alors que le séjour réel à l'hôpital pour la vague menée par Omicron était d'environ cinq jours. Cela signifie que l'occupation de l'hôpital a été surestimée par un facteur d'environ deux. Pour estimer l'accord si le point de départ de la simulation a été déplacé au 8 novembre 2021, et si le séjour à l'hôpital a été supposé être de cinq jours au lieu de 10, on peut regarder les lignes en pointillés de la figure 9, qui montrent le nombre prévu de cas déclarés et la moitié de l'occupation prévue de l'hôpital avec les deux courbes décalées dans le temps de 14 jours. L'accord entre les prévisions et les infections réelles déclarées quotidiennement est maintenant assez bon pour les ~50 premiers jours de la simulation (jusqu'à la fin de décembre). Après le 28 décembre 2021, les prévisions et la courbe réelle commencent à diverger de façon marquée, le nombre réel de nouvelles infections signalées diminuant brusquement tandis que le nombre prévu continue d'augmenter. Cela pourrait être attribué à une combinaison de facteurs comme le changement de comportement public (probablement à la suite de messages publics, puisque les mesures de santé publique n'avaient pas été modifiées à ce moment-là) et une modification des règles de dépistage et de déclaration pour les nouvelles infections le 31 décembre 2021 Note de bas de page 27. L'occupation prévue de l'hôpital est également proche de celle réelle pour les deux premiers mois de la simulation une fois le décalage horaire et la durée du séjour à l'hôpital pris en compte. La courbe d'occupation prévue de l'hôpital mène la courbe d'occupation réelle de l'hôpital d'environ deux jours; ce qui peut s'expliquer par une sous-estimation de la durée entre l'apparition des symptômes et l'hospitalisation pour les cas d'Omicron hospitalisés.
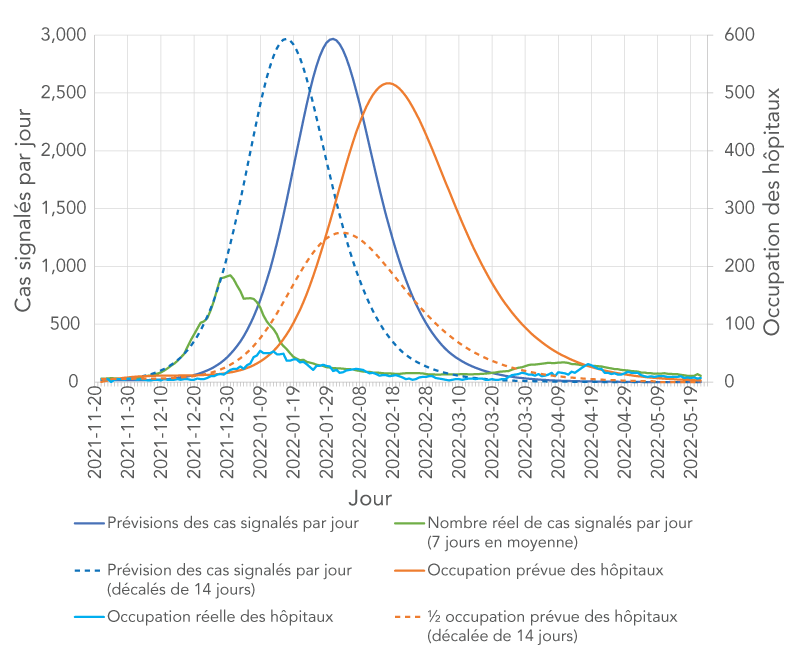
Figure 9 - Description textuelle
La figure montre les cas déclarés quotidiennement (axe Y à gauche) et l'occupation des hôpitaux (axe Y à droite) en fonction du temps. Six courbes sont affichées : 1) prévisions des cas signalés quotidiennement (ligne bleue solide), 2) prévisions des cas signalés quotidiennement décalés de 14 jours (ligne bleue pointillée), 3) cas réels signalés quotidiennement (ligne verte solide), 4) prévisions de l'occupation des hôpitaux (ligne bronzée solide), 5) moitié de l'occupation prévue des hôpitaux décalée de 14 jours (ligne bronzée pointillée), 6) occupation réelle des hôpitaux (ligne fuchsia solide). Toutes les lignes représentant les cas signalés quotidiennement affichent des pics à des moments différents. Les lignes d'occupation des hôpitaux montrent des pics décalés d'environ 14 jours par rapport aux pics des cas signalés quotidiennement.
Limites
Les limites du modèle actuel comprennent l'hypothèse d'une immunité complète et permanente après l'infection et l'hypothèse que l'infection avec un variant offrira l'immunité contre tous les autres variants.
Conclusion
Une nouvelle application de bureau de modélisation épidémiologique conviviale a été développée à partir d'un modèle épidémiologique déterministe à plusieurs compartiments. On peut télécharger l'application à partir du site web IDSIM. L'application peut modéliser divers niveaux d'immunité conférée par le vaccin, ainsi que l'augmentation et la baisse de l'immunité avec le temps après la vaccination. La fonctionnalité de l'application a été démontrée en l'utilisant pour simuler les effets de facteurs précis sur la transmission de la COVID-19. Les résultats de la simulation ont donné plusieurs conclusions :
- Pour le variant Delta, il est impossible de réaliser l'immunité collective uniquement au moyen de la vaccination. Pour maintenir un nombre de reproduction inférieur à un, des mesures de santé publique doivent être en place jusqu'à ce que l'immunité naturelle obtenue par l'infection par le virus, ainsi que l'immunité par la vaccination, portent l'immunité globale au niveau nécessaire pour l'immunité collective. L'immunité collective est encore plus difficile à atteindre avec le variant Omicron plus transmissible.
- La baisse de l'immunité conférée par le vaccin prolonge le temps nécessaire pour que les mesures de santé publique restent en place et le temps nécessaire pour s'approcher de l'immunité collective par des infections supplémentaires.
- Le variant Omicron a rapidement surpassé le variant Delta. Les résultats suggèrent que cela se produira dans les deux semaines suivant le début de la simulation et que le nombre de nouveaux cas quotidiens devrait commencer à diminuer après deux à trois mois, selon le taux d'administration des doses de rappel.
- Les doses de rappel contribuent grandement à atténuer les effets de la baisse de l'immunité et de l'évasion immunitaire en réduisant les infections, les hospitalisations et les décès par la COVID-19.
- L'application IDSIM peut aider les BSP en leur fournissant un contrôle sur les simulations dont ils ont besoin en fonction de la situation locale et de la nature changeante de la COVID-19, y compris de nouveaux variants et sous-variants, en modifiant l'admissibilité, la couverture et l'efficacité des vaccins et en modifiant les mesures de santé publique. L'outil fournit des résultats propres au BSP qui peuvent servir à améliorer d'autres renseignements locaux, provinciaux, nationaux et internationaux. Dans la région de Durham, des prévisions hebdomadaires ont été produites pour les dirigeants du ministère de la Santé et communiquées au réseau hospitalier local pour aider à se préparer à d'éventuelles augmentations des cas et des hospitalisations.
Le modèle est en cours d'extension pour inclure des options en vue de modéliser la réinfection avec le même variant ou un variant différent, ainsi que le nombre de contacts par jour selon la strate. L'inclusion de ces nouvelles fonctions permettra des simulations plus réalistes, y compris l'étude d'épidémies annuelles, peut-être saisonnières, dans des conditions endémiques.
Même si la COVID-19 a donné l'impulsion à ce travail, le modèle élaboré et l'application de bureau sont suffisamment souples pour s'appliquer à d'autres maladies transmissibles surveillées par les BSP. On s'attend donc à ce que l'IDSIM soit un complément bienvenu aux outils actuellement utilisés par les épidémiologistes dans les BSP.
Déclaration des auteurs
Voici les contributions de chaque auteur au travail déclaré.
E. N. — Conceptualisation, méthodologie, logiciel, rédaction de l'ébauche initiale, rédaction, révision et édition, supervision, administration de projet, acquisition de financement
M. P. — Conceptualisation, méthodologie, rédaction, révision et édition, supervision
F. X. — Conceptualisation, méthodologie, analyse officielle, enquête, traitement des données, rédaction de l'ébauche initiale, rédaction-révision et édition, visualisation
P. S. — Conceptualisation, méthodologie, logiciel, rédaction, révision et édition, visualisation
A. P. — Conceptualisation, méthodologie, traitement des données, rédaction, révision et édition
Le contenu de l'article et les points de vue qui y sont exprimés n'engagent que les auteurs et ne correspondent pas nécessairement à ceux du gouvernement du Canada.
Intérêts concurrents
Aucun.
Remerciements
Les travaux déclarés ont été appuyés en partie par une subvention COVID-19 de l'Alliance du Conseil de recherches en sciences naturelles et en génie (CRSNG) du Canada.
Financement
Ce travail a été appuyé par le CRSNG et par la municipalité régionale de Durham.
Références
- Note de bas de page 1
-
Gouvernement de l'Ontario. Communiqué. L'Ontario déclare la situation d'urgence pour protéger la population. Toronto, ON : Gouvernement de l'Ontario; 12 mars 2020. https://news.ontario.ca/fr/release/56356/lontario-declare-la-situation-durgence-pour-proteger-la-population
- Note de bas de page 2
-
Agence de la santé publique du Canada. Modélisation mathématique et la COVID-19. Ottawa, ON : ASPC; (modifié 2022-04-01). https://www.canada.ca/fr/sante-publique/services/maladies/maladie-coronavirus-covid-19/recherches-donnees-epidemiologiques-economiques/modelisation-mathematique.html
- Note de bas de page 3
-
Hillmer MP, Feng P, McLaughlin JR, Murty VK, Sander B, Greenberg A, Brown AD. Ontario's COVID-19 Modelling Consensus Table: mobilizing scientific expertise to support pandemic response. Can J Public Health 2021;112(5):799–806. https://doi.org/10.17269/s41997-021-00559-8
- Note de bas de page 4
-
Ogden NH, Fazil A, Arino J, Berthiaume P, Fisman DN, Greer AL, Ludwig A, Ng V, Tuite AR, Turgeon P, Waddell LA, Wu J. Modelling scenarios of the epidemic of COVID-19 in Canada. Can Commun Dis Rep 2020;46(8):198–204. https://doi.org/10.14745/ccdr.v46i06a08
- Note de bas de page 5
-
Ng V, Fazil A, Waddell LA, Bancej C, Turgeon P, Otten A, Atchessi N, Ogden NH. Projected effects of nonpharmaceutical public health interventions to prevent resurgence of SARS-CoV-2 transmission in Canada. CMAJ 2020;192(37):E1053–E1064. https://doi.org/10.1503/cmaj.200990
- Note de bas de page 6
-
Tuite AR, Fisman DN, Greer AL. Mathematical modelling of COVID-19 transmission and mitigation strategies in the population of Ontario, Canada. CMAJ 2020;192(19):E497–E505. https://doi.org/10.1503/cmaj.200476
- Note de bas de page 7
-
Chowdhury R, Heng K, Shawon MSR, Goh G, Okonofua D, Ochoa-Rosales C, Gonzalez-Jaramillo V, Bhuiya A, Reidpath D, Prathapan S, Shahzad S, Althaus CL, Gonzalez-Jaramillo N, Franco OH; Global Dynamic Interventions Strategies for COVID-19 Collaborative Group. Dynamic interventions to control COVID-19 pandemic: a multivariate prediction modelling study comparing 16 worldwide countries. Eur J Epidemiol 2020;35(5):389–399. https://doi.org/10.1007/s10654-020-00649-w
- Note de bas de page 8
-
Prem K, Cook AR, Jit M. Projecting social contact matrices in 152 countries using contact surveys and demographic data. PLoS Comput Biol 2017;13(9):e1005697. https://doi.org/10.1371/journal.pcbi.1005697
- Note de bas de page 9
-
Santé publique Ontario. Résumé épidémiologique amélioré. COVID-19 : mortalité clinique, identification des cas et taux d'attaque en Ontario. Toronto, ON : SPO; 2020. https://www.publichealthontario.ca/-/media/documents/ncov/epi/2020/06/covid19-epi-case-identification-age-only-template.pdf?sc_lang=fr
- Note de bas de page 10
-
Mossong J, Hens N, Jit M, Beutels P, Auranen K, Mikolajczyk R, Massari M, Salmaso S, Tomba GS, Wallinga J, Heijne J, Sadkowska-Todys M, Rosinska M, Edmunds WJ. Social Contacts and Mixing Patterns Relevant to the Spread of Infectious Diseases. PLoS Med 2008;5(3):e74. https://doi.org/10.1371/journal.pmed.0050074
- Note de bas de page 11
-
Feehan DM, Mahmud AS. Quantifying population contact patterns in the United States during the COVID-19 pandemic. Nat Commun 2021;12(1):893. https://doi.org/10.1038/s41467-021-20990-2
- Note de bas de page 12
-
Li B, Deng A, Li K, Hu Y, Li Z, Shi Y, Xiong Q, Liu Z, Guo Q, Zou L, Zhang H, Zhang M, Ouyang F, Su J, Su W, Xu J, Lin H, Sun J, Peng J, Jiang H, Zhou P, Hu T, Luo M, Zhang Y, Zheng H, Xiao J, Liu T, Tan M, Che R, Zeng H, Zheng Z, Huang Y, Yu J, Yi L, Wu J, Chen J, Zhong H, Deng X, Kang M, Pybus OG, Hall M, Lythgoe KA, Li Y, Yuan J, He J, Lu J. infection and transmission in a large well-traced outbreak caused by the Delta SARS-CoV-2 variant. Nat Commun 2022;13(1):460. https://doi.org/10.1038/s41467-022-28089-y
- Note de bas de page 13
-
Jansen L, Tegomoh B, Lange K, Showalter K, Figliomeni J, Abdalhamid B, Iwen PC, Fauver J, Buss B, Donahue M. Investigation of a SARS-CoV-2 B.1.1.529 (Omicron) Variant Cluster — Nebraska, November–December 2021. MMWR Morb Mortal Wkly Rep 2021;70(5152):1782–4. https://doi.org/10.15585/mmwr.mm705152e3
- Note de bas de page 14
-
Hay JA, Kissler SM, Fauver JR, Mack C, Tai CG, Samant RM, Connolly S, Anderson DJ, Khullar G, MacKay M, Patel M, Kelly S, Manhertz A, Eiter I, Salgado D, Baker T, Howard B, Dudley JT, Mason CE, Ho DD, Grubaugh ND, Grad YH. Viral dynamics and duration of PCR positivity of the SARS-CoV-2 Omicron variant. medRxiv 2022.01.13.22269257. https://doi.org/10.1101/2022.01.13.22269257
- Note de bas de page 15
-
Wang Y, Chen R, Hu F, Lan Y, Yang Z, Zhan C, Shi J, Deng X, Jiang M, Zhong S, Liao B, Deng K, Tang J, Guo L, Jiang M, Fan Q, Li M, Liu J, Shi Y, Deng X, Xiao X, Kang M, Li Y, Guan W, Li Y, Li S, Li F, Zhong N, Tang X. Transmission, viral kinetics and clinical characteristics of the emergent SARS-CoV-2 Delta VOC in Guangzhou, China. EClinicalMedicine 2021;40:101129. https://doi.org/10.1016/j.eclinm.2021.101129
- Note de bas de page 16
-
Liu Y, Rocklov J. The reproductive number of the Delta variant of SARS-CoV-2 is far higher compared to the ancestral SARS-CoV-2 virus. J Travel Medicine 2021;28(7):taab124. https://doi.org/10.1093/jtm/taab124
- Note de bas de page 17
-
Ito K, Piantham C, Nishiura H. Relative instantaneous reproduction number of Omicron SARS-CoV-2 variant with respect to the Delta variant in Denmark. J Med Virol 2022;94(5):2265–8. https://doi.org/10.1002/jmv.27560
- Note de bas de page 18
-
Santé publique Ontario. Premières estimations de la gravité d'Omicron en Ontario d'après une étude de cohorte appariée portant sur des cas survenus entre le 22 novembre et le 24 décembre 2021. Toronto, ON : SPO; 2021. https://www.publichealthontario.ca/-/media/documents/ncov/epi/covid-19-epi-enhanced-estimates-omicron-severity-study.pdf?sc_lang=fr#:~:text=Among%20matched%20Omicron%20cases%20with,22%20and%20December%2024%2C%202021%3A&text=3%2F9%2C087%20(%3C0.1%25),9%2C087%20(0.3%25)%20Delta%20cases.&text=53%2F9%2C087%20(0.6%25)%20matched,9%2C087%20(1.4%25)%20Delta%20cases
- Note de bas de page 19
-
Santé publique Ontario. L'efficacité des vaccins contre la COVID-19 en conditions réelles : ce que nous savons jusqu'à présent. Toronto, ON : SPO; 2021. https://www.publichealthontario.ca/-/media/documents/ncov/covid-wwksf/2021/04/wwksf-vaccine-effectiveness.pdf?sc_lang=fr#:~:text=5%2C22%20A%20further%20analysis,second%20dose%20of%20mRNA%20vaccine
- Note de bas de page 20
-
Eyre DW, Taylor D, Purver M, Chapman D, Fowler T, Pouwels KB, Walker AS, Peto TEA. The impact of SARS-CoV-2 vaccination on Alpha & Delta variant transmission. medRXiv 2021.09.28.21264260. https://doi.org/10.1101/2021.09.28.21264260
- Note de bas de page 21
-
Nasreen S, Chung H, He S, Brown KA, Gubbay JB, Buchan SA, Fell DB, Austin PC, Schwartz KL, Sundaram ME, Calzavara A, Chen B, Tadrous M, Wilson K, Wilson SE, Kwong JC. Effectiveness of COVID-19 vaccines against variants of concern, Canada. medRxiv 2021.06.28.21259420. https://doi.org/10.1101/2021.06.28.21259420
- Note de bas de page 22
-
UK Health Security Agency. SARS-CoV-2 variants of concern and variants under investigation in England: Technical briefing 33. London, UK: UKHSA; December 23, 2021. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1043807/technical-briefing-33.pdf
- Note de bas de page 23
-
Andrews N, Stowe J, Kirsebom F, Toffa S, Rickeard T, Gallagher E, Gower C, Kall M, Groves N, O'Connell AM, Simons D, Blomquist PB, Zaidi A, Nash S, Iwani Binti Abdul Aziz N, Thelwall S, Dabrera G, Myers R, Amirthalingam G, Gharbia S, Barrett JC, Elson R, Ladhani SN, Ferguson N, Zambon M, Campbell CNJ, Brown K, Hopkins S, Chand M, Ramsay M, Lopez Bernal J. Effectiveness of COVID-19 vaccines against the Omicron (B.1.1.529) variant of concern. N Engl J Med 2022;386(16):1532–46. https://doi.org/10.1056/NEJMoa2119451
- Note de bas de page 24
-
Thompson MG, Natarajan K, Irving SA, Rowley EA, Griggs EP, Gaglani M, Klein NP, Grannis SJ, DeSilva MB, Stenehjem E, Reese SE, Dickerson M, Naleway AL, Han J, Konatham D, McEvoy C, Rao S, Dixon BE, Dascomb K, Lewis N, Levy ME, Patel P, Liao IC, Kharbanda AB, Barron MA, Fadel WF, Grisel N, Goddard K, Yang DH, Wondimu MH, Murthy K, Valvi NR, Arndorfer J, Fireman B, Dunne MM, Embi P, Azziz-Baumgartner E, Zerbo O, Bozio CH, Reynolds S, Ferdinands J, Williams J, Link-Gelles R, Schrag SJ, Verani JR, Ball S, Ong TC. Effectiveness of a Third Dose of mRNA Vaccines Against COVID-19–Associated Emergency Department and Urgent Care Encounters and Hospitalizations Among Adults During Periods of Delta and Omicron Variant Predominance — VISION Network, 10 States. MMWR Morb Mortal Wkly Rep 2022;71(4):139–145. https://doi.org/10.15585/mmwr.mm7104e3
- Note de bas de page 25
-
Ontario COVID Dashboard: Percentage of Cases Caused by Different Variants in Ontario. Ontario COVID-19 Science Advisory Table. January 2022. https://covid19-sciencetable.ca/ontario-dashboard/
- Note de bas de page 26
-
Tobin RJ, Wood JG, Jayasundara D, Sara G, Walker J, Martin GE, McCaw JM, Shearer FM, Price DJ. Hospital length of stay in a mixed Omicron and Delta epidemic in New South Wales, Australia. medRxiv 2022.03.16.22271361. https://doi.org/10.1101/2022.03.16.22271361
- Note de bas de page 27
-
Gouvernement de l'Ontario. Communiqué. L'Ontario met à jour ses mesures et ses directives de santé publique en réponse au variant Omicron. Les élèves retourneront physiquement en classe le 5 janvier 2022. Toronto, ON : Gouvernement de l'Ontario; 5 janvier, 2022. https://news.ontario.ca/fr/release/1001386/lontario-met-a-jour-ses-mesures-et-ses-directives-de-sante-publique-en-reponse-au-variant-omicron
Appendice : Modèles d'équations
A.1 Notes
Les équations du présent appendice utilisent les notes suivantes.
Paramètres généraux, quantités et identifiants
Ns Nombre de stratifications
k Indice de stratification (k = 1,2,…Ns)
nk Nombre de strates dans la stratification k
sk Indice de strate pour stratification k (sk = 1,2...nk)
g Indice de strate combinée (g = {s1, s2…sNs})
ns Nombre total de strates combinées (ns = ΠNsk=1[nk])
C Identifiant de segment. Les identifiants de segment sont décrits à la section 2.1 du document principal. Par exemple, C = EQ indique le segment « Exposé en quarantaine ».
NCg,I,v(t) Nombre de personnes dans le segment C appartenant à la strate g combinée, avec le niveau d'immunisation i, touchées par le variant v, au moment t. Par exemple, NEQg,I,v(t) indique le nombre de personnes exposées et mises en quarantaine.
N Population totale
χ Probabilité de transmission avec contact (avec une personne infectieuse)
Φ Taux de contact (nombre de contacts [avec d'autres personnes] qu'une personne [susceptible] a par unité de temps [jour])
Paramètres de stratification
αsusk,sk Modulateur de susceptibilité pour la strate sk de stratification k
αsusg Modulateur de susceptibilité pour la strate combinée g (αsusg =ΠNsk=1[αsusk,sk])
αsevk,sk Module de gravité pour la strate sk de stratification k
αsevg Module de gravité pour la strate combinée g (αsevg =ΠNsk=1[αsevk,sk])
Paramètres de variant
Tlatv Temps de latence (depuis l'exposition) pour le variant v
Tincv Durée d'incubation (depuis l'exposition) pour le variant v
Thosv Durée d'hospitalisation pour les cas graves (depuis l'exposition) pour le variant v
Trecv Délai de rétablissement pour les cas non graves (depuis l'exposition) pour le variant v
Thos-recv Temps de guérison après l'hospitalisation (pour les cas graves qui se rétablissent)
Thos-decv Heure de décès après l'hospitalisation (pour les cas graves qui ne se rétablissent pas)
χv Probabilité de transmission par contact
γsymv Fraction des personnes infectieuses symptomatiques
γsevv Fraction des personnes symptomatiques infectieuses qui présentent des symptômes graves
γhos-recv Fraction des personnes hospitalisées en rétablissement
Paramètres d'immunisation
θtrai,v Facteur de transmission pour le variant v et le niveau d'immunisation i
θsusi,v Facteur de susceptibilité pour le variant v et le niveau d'immunisation i
θsevi,v Facteur de gravité pour le variant v et le niveau d'immunisation i
Rvaci Personnes avec un niveau d'immunité i vaccinées par unité de temps (jour)
Tvaci Temps (jours) passé au niveau d'immunité i avant de passer au niveau d'immunité i + 1
Remarque : Pour les niveaux d'immunisation i, pour lesquels la progression vers le niveau i + 1 se fait par la vaccination, Rvaci ≠ 0 et Tvaci = 0. Pour les niveaux d'immunisation, i, pour lesquels la progression vers le niveau i + 1 se fait par le simple passage du temps (par exemple dans le cas de l'augmentation de la protection après la vaccination ou en cas de baisse de protection), Rvaci = 0 et 1/ Tvaci ≠ 0. En bref, soit Rvaci ou Tvaci, mais pas les deux, s'applique à un niveau d'immunité i, et Rvaci / Tvaci = 0.
Paramètres des mesures de santé publique
γq Fraction des personnes exposées qui sont mises en quarantaine avec succès
γti Fraction des personnes infectieuses testées et isolées avec succès
σphm Coefficient pour d'autres mesures de santé publique non précisées
A.2 Force d'infection
La force (risque) d'infection est la probabilité d'exposition par unité de temps d'une personne susceptible. La force de l'infection est signalée par λg,i,v(t) et contient l'expression suivante :
#1
λ g,i,v(t)= σphm ×αsusg × θsusi,v × χv × Σi'[ θtrai',v×Φ/(N- Σg'',i'',v''[NDg'',i'',v''(t)])× Σg'[ΣC ⸦infectious in the community [NCg',i',v(t)]]]
Pour un petit nombre de décès, Σg',i'',v'[NDg',i'',v'(t)]<<N, la force d'infection peut être estimée par :
#2
λ g,i,v(t)≈σphm×αsusg×θsusi,v×Σi' [θtrai',v×χv×Φ/N×Σg'[ΣC ⸦infectieux, dans la communauté [NCg',i',v(t)]]
A.3 Vaccination
Seules les personnes qui sont susceptibles ou qui sont autrement dans la communauté (ni isolées ni mises en quarantaine) et qui ne sont pas symptomatiques sont vaccinées dans des circonstances normales. Par conséquent, le nombre de personnes « vaccinables » ayant un niveau d'immunisation i, à un moment donné, est le suivant :
#3
Nvaci(t)=Σg[NSg,i(t)]+Σg[Σv[NECg,i,v(t)]]+Σg[Σv[NICAg,i,v(t)]]+Σg[Σv[NICPMg,i,v(t)]]+Σg[Σv[NICPSg,i,v(t)]]
Si les personnes exposées et infectieuses sont beaucoup moins nombreuses que les personnes susceptibles, on peut supposer que seules les personnes susceptibles sont vaccinées, et le nombre de personnes vaccinables peut être estimé comme suit :
#4
Nvaci(t)≈Σg[NSg,i(t)]
Ce travail suppose que seules les personnes susceptibles sont vaccinées.
Avec les notes ci-dessus, les équations de bilan pour chaque segment sont écrites comme ci-dessous.
A.4 Équations de bilan
#5
d/dt[NSg,i(t)]=-(Iv[Ag,i,v(t)])xNSg,i(t)+Rvaci-1xNSg,i-1(t)/Nvaci-1(t)+NSg,i-1(t)/Tvaci-1-Rvaci-1xNSg,i(t)/Nvaci(t)-NSg,i(t)/Tvaci
Les quatrième et cinquième termes à droite représentent le taux auquel les personnes ayant le niveau actuel d'immunisation passent au niveau i + 1. Comme on l'explique dans la remarque liée aux paramètres d'immunisation, un seul des deux termes est différent de zéro. De même, les termes deux et trois sur la droite représentent le taux auquel les personnes ayant le niveau actuel d'immunisation i - 1 passent au niveau i, et seul l'un d'entre eux est différent de zéro.
#6
d/dt[NECg,i,v(t)]=(1-γq)×λg,i,v(t)×NSg,i,v(t)+NECg,i-1,v(t)/Tvaci-1-NECg,i,v(t)/Tvaci
#7
d/dt[NEQg,i,v(t)]=γq×λg,i,v(t)×NSg,i,v(t)+NEQg,i-1,v(t)/Tvaci-1-NEQg,i,v(t)/Tvaci
#8
d/dt[NICAg,i,v(t)]=(1-γsymv)×(1-γti)×NECg,i,v(t)/Tlatv-NICAg,i,v(t)/(Trec-nsv-Tlatv)+NICAg,i-1,v(t)/Tvaci-1- NICAg,i,v(t)/Tvaci
#9
d/dt[NICPMg,i,v(t)]=(1-αsevg×γsevv)×γsymv×(1-γti)× NECg,i,v(t)/Tlatv-NICPMg,i,v(t)/(Tincv-Tlatv)+NICPMg,i-1,v(t)/Tvaci
#10
d/dt[NICPSg,i,v(t)]=αsevg×γsevv×γsymv×(1-γti)×NECg,i,v(t)/Tlatv-NICPSg,i,v(t)/(Tincv-Tlatv)+NICPSg,i-1,v(t)/Tvaci-1-NICPSg,i,v(t)/Tvaci
#11
d/dt[NIIAg,i,v(t)]=(1-γsymv)×γti×NECg,i,v(t)/Tlatv-NIIAg,i,v(t)/(Trec-nsv-Tlatv)+NIIAg,i-1,v(t)/Tvaci-1-NIIAg,i,v(t)/Tvaci
#12
d/dt[NIIPMg,i,v(t)]=(1-αsevg×γsevv)×γsymv×γti×NECg,i,v(t)/Tlatv-NIIPMg,i,v(t)/(Tincv-Tlatv)+NIIPMg,i-1,v(t)/Tvaci-1-NIIPMg,i,v(t)/Tvaci
#13
d/dt[NIIPSg,i,v(t)]=αsevg×γsevv×γsymv×γti×NECg,i,v(t)/Tlatv-NIIPSg,i,v(t)/(Tincv-Tlatv)+NIIPSg,i-1,v(t)/Tvaci-1- NIIPSg,i,v(t)/Tvaci
#14
d/dt[NIQAg,i,v(t)]=(1-γsymv)×NEQg,i,v(t)/Tlatv-sNIQAg,i,v(t)/(Trec-nsv-Tlatv)+NIQAg,i-1,v(t)/Tvaci-1-NIQAg,i,v(t)/Tvaci
#15
d/dt[NIQPMg,i,v(t)]=(1-αsevg×γsevv)×γsymv×NEQg,i,v(t)/Tlatv-NIQPMg,i,v(t)/(Tincv-Tlatv)+NIQPMg,i-1,v(t)/Tvaci-1-NIQPMg,i,v(t)/Tvaci
#16
d/dt[NIQPSg,i,v(t)]=αsevg×γsevv×γsymv×NEQg,i,v(t)/Tlatv-NIQPSg,i,v(t)/(Tincv-Tlatv)+NIQPSg,i-1,v(t)/Tvaci-1-NIQPSg,i,v(t)/Tvaci
#17
d/dt[NICSMg,i,v(t)]=NICPMg,i,v(t)/(Tincv-Tlatv)-NICSMg,i,v(t)/(Trec-nsv-Tincv)+NICSMg,i-1,v(t)/Tvaci-1-NICSMg,i,v(t)/Tvaci
#18
d/dt[NICSSg,i,v(t)]=NICPSg,i,v(t)/(Tincv-Tlatv)-NICSSg,i,v(t)/(Thosv-Tincv)+NICSSg,i-1,v(t)/Tvaci-1-NICSSg,i,v(t)/Tvaci
#19
d/dt[NIISMg,i,v(t)]=NIIPMg,i,v(t)/(Tincv-Tlatv)-NIISMg,i,v(t)/(Trec-nsv-Tincv)+NIISMg,i-1,v(t)/Tvaci-1-NIISMg,i,v(t)/Tvaci
#20
d/dt[NIISSg,i,v(t)]=NIIPSg,i,v(t)/(Tincv-Tlatv)-NIISSg,i,v(t)/(Thosv-Tincv)+NIISSg,i-1,v(t)/Tvaci-1-NIISSg,i,v(t)/Tvaci
#21
d/dt[NIQSMg,i,v(t)]=NIQPMg,i,v(t)/(Tincv-Tlatv)-NIQSMg,i,v(t)/(Trec-nsv-Tincv)+NIQSMg,i-1,v(t)/Tvaci-1-NIQSMg,i,v(t)/Tvaci
#22
d/dt[NIQSSg,i,v(t)]=NIQPSg,i,v(t)/(Tincv-Tlatv)-NIQSSg,i,v(t)/(Thosv-Tincv)+NIQSSg,i-1,v(t)/Tvaci-1-NIQSSg,i,v(t)/Tvaci
#23
d/dt[NHRg,i,v(t)]=γhos-recv×[NICSSg,i,v(t)+NIISSg,i,v(t)+NIQSSg,i,v(t)]/(Thosv-Tincv)-NHRg,i,v(t)/Thos-recv+NHRg,i-1,v(t)/Tvaci-1-NHRg,i,v(t)/Tvaci
#24
d/dt[NHDg,i,v(t)]=(1-γhos-recv)×[NICSSg,i,v(t)+NIISSg,i,v(t)+NIQSSg,i,v(t)]/(Thosv-Tincv)-NHDg,i,v(t)/Thos-decv+NHDg,i-1,v(t)/Tvaci-1-NHDg,i,v(t)/Tvaci
#25
d/dt[NRg,i,v(t)]=NICAg,i,v(t)/(Trec-nsv-Tlatv)+NICSMg,i,v(t)/(Trec-nsv-Tincv)+NIIAg,i,v(t)/(Trec-nsv-Tlatv)+NIISMg,i,v(t)/(Trec-nsv-Tincv)+NIQAg,i,v(t)/(Trec-nsv-Tlatv)+NIQSMg,i,v(t)/(Trec-nsv-Tincv)-NHRg,i,v(t)/Thos-recv+NRg,i-1,v(t)/Tvaci-1-NRg,i,v(t)/Tvaci
#26
d/dt[NDg,i,v(t)]=NHDg,i,v(t)/Thos-decv
Dans les équations de bilan no 6 à no 25, correspondant à tout segment C autre que S, les deux termes du côté droit du type NCg,i-1,v(t)/Tvaci-1 et NCg,i,v(t)/Tvaci représentent, respectivement, le taux auquel les personnes atteintes du niveau d'immunisation i - 1 actuel passent au niveau d'immunisation i et le taux auquel les personnes atteintes du niveau d'immunisation actuel passent au niveau d'immunisation i + 1, au fil du temps. Selon le type de simulation souhaité, un ou les deux termes peuvent être nuls (voir aussi la remarque précédente pour les paramètres d'immunisation).

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International