Surveillance de la faune en Ontario et au Québec en raison du SRAS-CoV-2

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 48-6, juin 2022 : Infections acquises par transmission vectorielle–partie 2 : faune & animaux de compagnie
Date de publication : juin 2022
ISSN : 1481-8531
Soumettre un article
À propos du RMTC
Naviguer
Volume 48-6, juin 2022 : Infections acquises par transmission vectorielle–partie 2 : faune & animaux de compagnie
Surveillance
Surveillance du SRAS-CoV-2 dans la faune en Ontario et au Québec
Janet E Greenhorn1, Jonathon D Kotwa2, Jeff Bowman1, Laura Bruce1, Tore Buchanan1, Peter A Buck3, Christina M Davy4, Antonia Dibernardo5, Logan Flockhart3, Marianne Gagnier6, Aaron Hou2, Claire M Jardine7, Stephane Lair8, L Robbin Lindsay5, Ariane Massé6, Pia K Muchaal3, Larissa A Nituch1, Angelo Sotto2, Brian Stevens7, Lily Yip2, Samira Mubareka2,9
Affiliations
1 Section de la recherche et de la surveillance de la faune, ministère du Développement du Nord, des Mines, des Richesses naturelles et des Forêts de l’Ontario, Peterborough, ON
2 Sunnybrook Research Institute, Toronto, ON
3 Centre des maladies infectieuses d’origine alimentaire, environnementale et zoonotique, Agence de la santé publique du Canada
4 Département de biologie, Université Carleton, Ottawa, ON
5 Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg, MB
6 Ministère des Forêts, de la Faune et des Parcs du Québec, Québec, QC
7 Réseau canadien pour la santé de la faune, Ontario-Nunavut, Département de pathobiologie, Université de Guelph, Guelph, ON
8 Centre québécois sur la santé des animaux sauvages - Réseau canadien pour la santé de la faune, Québec, Saint-Hyacinthe, QC
9 Département de médecine de laboratoire et de pathobiologie, Université de Toronto, Toronto, ON
Correspondance
Citation proposée
Greenhorn JE, Kotwa JD, Bowman J, Bruce L, Buchanan T, Buck PA, Davy CM, Dibernardo A, Flockhart L, Gagnier M, Hou A, Jardine CM, Lair S, Lindsay LR, Massé A, Muchaal PK, Nituch LA, Sotto A, Stevens B, Yip L, Mubareka S. Surveillance du SRAS-CoV-2 dans la faune en Ontario et au Québec. Relevé des maladies transmissibles au Canada 2022;48(6):270–9. https://doi.org/10.14745/ccdr.v48i06a02f
Mots-clés : SRAS-CoV-2, faune, surveillance, Ontario, Québec
Résumé
Contexte : Le coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2), le virus responsable de la pandémie de maladie à coronavirus 2019, pourrait infecter diverses espèces sauvages. Les animaux sauvages qui vivent en contact étroit avec l’homme courent un risque accru d’exposition au SRAS-CoV-2 et, s’ils sont infectés, ils pourraient constituer un réservoir de l’agent pathogène, ce qui en compliquerait le contrôle et la gestion. L’objectif de cette étude est de mener une surveillance du SRAS-CoV-2 dans la faune urbaine de l’Ontario et du Québec, afin d’accroître nos connaissances sur l’épidémiologie du virus et notre capacité à détecter le passage de celui-ci de l’homme à la faune.
Méthodes : En utilisant une approche « Un monde, une santé », nous avons profité des activités des programmes de recherche, de surveillance et de réhabilitation existants au sein de multiples agences pour collecter des échantillons sur 776 animaux de 17 espèces sauvages différentes entre juin 2020 et mai 2021. Les échantillons de tous les animaux ont été testés pour la présence d’acide ribonucléique viral du SRAS-CoV-2, et un sous-ensemble d’échantillons provenant de 219 animaux de trois espèces différentes (le raton laveur, Procyon lotor; la mouffette rayée, Mephitis mephitis; et le vison, Neovison vison) ont également été soumis à des tests pour la présence d’anticorps neutralisants.
Résultats : Aucune trace d’acide ribonucléique viral du SRAS-CoV-2 ou d’anticorps neutralisants n’a été détectée dans les échantillons analysés.
Conclusion : Bien que nous n’ayons pas été en mesure d’identifier des cas positifs de SRAS-CoV-2 chez la faune, la poursuite des activités de recherche et de surveillance est essentielle pour mieux comprendre le portrait des espèces animales sensibles, qui évolue rapidement. La collaboration entre les secteurs universitaire, public et de la santé animale devrait inclure des experts des domaines concernés afin de mettre en place une surveillance concertée et une capacité d’intervention.
Introduction
Le coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2) est responsable de la pandémie mondiale de maladie à coronavirus 2019 (COVID-19) et s’est maintenu par transmission interhumaine. Cependant, l’homme n’est pas la seule espèce susceptible d’être infectée. Au cours de la pandémie actuelle, il a été signalé qu’une série d’espèces animales domestiques et sauvages étaient soit naturellement infectées par le SRAS-CoV-2, soit sensibles au virus lors d’infections expérimentalesNote de bas de page 1Note de bas de page 2Note de bas de page 3Note de bas de page 4. Au 30 avril 2022, 36 pays avaient signalé à l’Organisation mondiale de la santé animale des cas positifs de SRAS-CoV-2 chez 23 espèces animales différentesNote de bas de page 5. D’autres espèces ont été identifiées comme hôtes potentiels sur la base de l’analyse de la séquence du récepteur de la cellule hôte du SRAS-CoV-2, l’angiotensine 1 de conversion de l’enzyme 2 et de l’affinité de liaison prévueNote de bas de page 6Note de bas de page 7.
De nombreuses espèces animales sauvages, telles que les ratons laveurs, les mouffettes et les chauves-souris, colonisent les milieux occupés par les humains et courent donc un risque accru d’être exposées au SRAS-CoV-2Note de bas de page 8. Il a été démontré expérimentalement que plusieurs espèces péridomestiques peuvent être infectées par le SRAS-CoV-2 et excréter le virusNote de bas de page 9Note de bas de page 10. L’infection par le SRAS-CoV-2 a également été signalée chez des animaux sauvages ou en liberté qui y ont été exposés en milieu naturel, notamment le vison d’Amérique (Neovison vison) en EspagneNote de bas de page 11 et, plus récemment, le cerf de Virginie (Odocoileus virginianus) à plusieurs endroits en Amérique du NordNote de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16. En Ontario, cela comprend l’identification d’un cas probable de transmission virale du cerf à l’hommeNote de bas de page 16. L’infection chez les animaux peut entraîner des symptômes légers à graves de maladie respiratoire pouvant aller jusqu’à la mort par pneumonie interstitielle (e.g. chez le vison)Note de bas de page 17Note de bas de page 18. D’autres espèces ne présentent pas de signes cliniques d’infection (e.g. les mouffettes) Note de bas de page 9Note de bas de page 10 ou ne présentent que des symptômes légers et transitoires chez certains individus, comme une température élevée (e.g. le cerf de Virginie)Note de bas de page 19.
Le concept « Un monde, une santé » reconnaît une interdépendance entre la santé humaine et la santé animaleNote de bas de page 20. La propagation du virus de l’homme ou des animaux domestiques à la faune est préoccupante, non seulement en raison des effets néfastes possibles sur la faune, mais aussi parce que ces populations d’animaux sauvages pourraient servir de réservoir pour le SRAS-CoV-2. Les agents pathogènes qui ont un réservoir animal sont par nature plus difficiles à contrôler et la propagation du SRAS-CoV-2 dans les populations animales pourrait contribuer au développement de variants préoccupants, ce qui pourrait compromettre l’efficacité des mesures de prévention et de lutte telles que les antiviraux et les vaccinsNote de bas de page 21Note de bas de page 22. C’est pourquoi des appels ont été lancés afin d’accroître la surveillance à l’interface entre l’homme et la fauneNote de bas de page 23. Les zones urbaines du monde entier ont fait l’objet d’une attention particulièreNote de bas de page 24Note de bas de page 25Note de bas de page 26. La densité plus élevée des populations humaines et de certaines espèces sauvages périurbaines dans les centres urbains peut entraîner des contacts plus fréquents entre l’homme et la faune et, par conséquent, plus de possibilités de transmission de maladies. En outre, les personnes qui ont un contact étroit avec la faune, comme les biologistes, les spécialistes de la réhabilitation, les chasseurs et les trappeurs, peuvent courir un plus grand risque d’être exposées au virus et d’en faciliter la propagation parmi les animaux sauvages. L’impact de l’infection par le SRAS-CoV-2 sur la santé des animaux sauvages n’est pas entièrement compris. La détection précoce de toute propagation est donc essentielle pour prévenir et résoudre ces problèmes.
Compte tenu du risque de transmission du SRAS-CoV-2 par rétro-zoonose et de notre manque de connaissances sur le virus dans la faune locale, il était urgent d’élucider l’épidémiologie du virus à l’interface entre l’homme et la faune pour aider les responsables de la gestion de la faune et de la santé publique à mieux communiquer les risques et à planifier les stratégies de gestion. Nous avons donc effectué une surveillance du SRAS-CoV-2 chez les animaux sauvages de l’Ontario et du Québec, en mettant l’accent sur les régions du sud des deux provinces. Ces zones ont des densités de population humaine élevées et comprennent des grands centres urbains comme Toronto et Montréal. Entre le printemps 2020 et le printemps 2021, les cas de COVID-19 ont atteint un sommet à Montréal et dans les régions environnantes au début du mois de janvier 2021, avec des taux dépassant 400 cas pour 100 000 habitants à Montréal et à LavalNote de bas de page 27. Les cas entre le printemps 2020 et le printemps 2021 dans la région du Grand Toronto ont atteint un sommet en avril 2021, les taux de cas dans la ville de Toronto et dans la région de Peel dépassant également 400 pour 100 000 habitantsNote de bas de page 27.
Méthodes
De nombreux experts ont recommandé une approche « Un monde, une santé » pour le dépistage du SRAS-CoV-2 chez les animaux, laquelle concilie les préoccupations relatives à la santé humaine et à la santé animale et se fonde sur les connaissances d’experts dans les deux domainesNote de bas de page 28Note de bas de page 29. Ainsi, nous avons réalisé notre travail grâce à la concertation et la collaboration d’une grande variété d’organisations : l’Agence de la santé publique du Canada, le ministère du Développement du Nord, des Mines, des Ressources naturelles et des Forêts (DNMRNF) de l’Ontario, le ministère des Forêts, de la Faune et des Parcs du Québec, le Réseau canadien pour la santé de la faune (RCSF), le ministère de l’Agriculture, de l’Alimentation et des Affaires rurales de l’Ontario, l’Agence canadienne d’inspection des aliments, le Western College of Veterinary Medicine, le zoo de Granby, le Laboratoire national de microbiologie (LNM) de l’Agence de la santé publique du Canada et le Sunnybrook Research Institute. Tous les échantillons à analyser ont été récoltés entre juin 2020 et mai 2021 dans le cadre de partenariats préexistants ou dans le cadre de travaux de recherche, de surveillance ou de réhabilitation (tableau 1).
| Espèce | Organisation ayant effectué les prélèvements | Source des échantillons | Lieu de provenance des échantillons | Périodes de la collecte | Nombre de spécimens testés | Types d'échantillons testés | Test effectuéTableau 1 footnote a | |
|---|---|---|---|---|---|---|---|---|
| Raton laveur (Procyon lotor) | RCSF | Surveillance de la rage (échantillons du Québec), examen post-mortem | Sud de l'Ontario, sud du Québec | Août 2020 à févr. 2021 | 11 | Tissu respiratoire | PCR | |
| Sud du Québec | Nov. à déc. 2020 | 68 | Tissu respiratoire, écouvillon rectal | |||||
| Sud de l'Ontario, sud du Québec | Oct. 2020 à juin 2021 | 15 | Tissu respiratoire et intestinal | |||||
| Sud-ouest du Québec | Janv. 2021 | 3 | Écouvillon nasal | |||||
| Sud du Québec | Janv. à juin 2021 | 54 | Écouvillons nasaux et rectaux | |||||
| DNMRNF et RCSF | Surveillance de la rage, examen post-mortem | Hamilton, Ontario | Déc. 2020 | 1 | Écouvillons oraux et rectaux, tissus respiratoires et intestinaux | |||
| DNMRNF | Surveillance de la rage | Sud-ouest de l'Ontario | Juin 2020 à Janv. 2021 | 100 | Écouvillons oraux et rectaux | |||
| Étude de séroprévalence de la rage | Oakville, Ontario | Sept. à oct. 2020 | 141 | Écouvillons oraux et rectaux | ||||
| Sérums | Anticorps | |||||||
| Nombre total de ratons laveurs testés | 393 | - | ||||||
| Mouffette rayée (Mephitis mephitis) | RCSF | Surveillance de la rage (échantillons du Québec), examen post-mortem | Sud du Québec | Janv. à juin 2021 | 66 | Écouvillon nasal | PCR | |
| Sud de l'Ontario, sud du Québec | Juill. à déc. 2020 | 55 | Tissu respiratoire | |||||
| Sud de l'Ontario, sud-ouest du Québec, Saint-Félicien, Québec |
Oct. 2020 à avril 2021 | 9 | Tissu respiratoire et intestinal | |||||
| DNMRNF | Surveillance de la rage, étude de séroprévalence de la rage | Sud-ouest de l'Ontario | Sept. 2020 à mai 2021 | 104 | Écouvillons oraux et rectaux | |||
| Étude de séroprévalence de la rage | Oakville, Ontario | Sept. à oct. 2020 | 36 | Écouvillons oraux et rectaux | ||||
| Sérums | Anticorps | |||||||
| Nombre total de mouffettes testées | 270 | - | ||||||
| Vison d'Amérique (Neovision vison) | RCSF | Examen post-mortem | Thornhill, Ontario | Juill. 2020 | 1 | Tissu respiratoire | PCR | |
| DNMRNF | Récolteurs de fourrures enregistrés, animaux tués sur la route, surveillance de la rage | Sud de l'Ontario | Automne 2020 au printemps 2021 | 42Tableau 1 footnote b | Écouvillons oraux et rectaux, tissus pulmonaires et intestinaux | |||
| Sang cardiaque ou bandelettes Nobuto | Anticorps | |||||||
| Nombre total de visons testés | 43 | - | ||||||
| Grande chauve-souris brune (Eptesicus fuscus) | Zoo de Granby | Programme de réhabilitation | Sud-ouest du Québec | Nov. 2020 à mars 2021 | 15 | Écouvillons oraux | PCR | |
| 2 | Guano | |||||||
| 15 | Écouvillons oraux et guano | |||||||
| Nombre total de grandes chauves-souris brunes testées | 32 | - | ||||||
| Chauve-souris cendrée (Lasiurus cinerus) | RCSF | Examen post-mortem | Etobicoke, Ontario | Déc. 2020 | 1 | Tissu respiratoire et intestinal | PCR | |
| Martre d'Amérique (Martes americana) | RCSF | Examen post-mortem | Sainte-Anne-de-Bellevue, Québec | Nov. 2020 | 1 | Tissu respiratoire et intestinal | PCR | |
| Pékan (Pekania pennanti) | RCSF | Examen post-mortem | Ouest du Québec | Mai 2021 | 2 | Tissu respiratoire et intestinal | PCR | |
| Ours noir (Ursus americanus) | RCSF | Examen post-mortem | Nord de l'Ontario | Sept. 2020 | 2 | Tissu respiratoire | PCR | |
| Killaloe, Ontario | Oct. 2020 | 1 | Tissu respiratoire et intestinal | |||||
| Nombre total d'ours noirs testés | 3 | - | ||||||
| Dauphin à flancs blancs (Lagenorhynchus actus) | RCSF | Examen post-mortem | Carleton-sur-Mer, Québec | Juin 2021 | 1 | Tissu intestinal | PCR | |
| Sept-Îles, Québec | Mars 2021 | 1 | Tissu respiratoire et intestinal | |||||
| Nombre total de dauphins à flancs blancs testés | 2 | - | ||||||
| Marsouin commun (Phocoena phocoena) | RCSF | Examen post-mortem | La Montée, Québec | Déc. 2020 | 1 | Tissu respiratoire et intestinal | PCR | |
| Phoque commun (Phoca vitulina) | RCSF | Examen post-mortem | Matane, Québec | Déc. 2020 | 1 | Tissu respiratoire et intestinal | PCR | |
| Coyote (Canis latrans) | RCSF | Examen post-mortem | Saint-Alexandre-d'Iberville, Québec | Avril 2021 | 1 | Tissu respiratoire et intestinal | PCR | |
| Loup de l'Est (Canus lupus lycaon) | RCSF | Examen post-mortem | Parc provincial Algonquin, Ontario | Oct. 2020 | 1 | Tissu respiratoire | PCR | |
| Sud et centre de l'Ontario | 4 | Tissu respiratoire et intestinal | ||||||
| Nombre total de loups de l'Est testés | 5 | - | ||||||
| Renard gris (Urocyon cinereoargenteus) | RCSF | Examen post-mortem | Châteauguay, Québec | Déc. 2020 | 1 | Tissu respiratoire et intestinal | PCR | |
| Renard roux (Vulpes vulpes) | RCSF | Examen post-mortem | Mercier, Québec | Janv. 2021 | 1 | Écouvillons nasaux et rectaux | PCR | |
| Sud-ouest du Québec | Nov. à déc. 2020 | 4 | Tissu respiratoire, écouvillons rectaux | |||||
| Sud, Ontario | Juill. à oct. 2020 | 5 | Tissu respiratoire | |||||
| Dunham, Québec | Déc. 2020 | 1 | Tissu respiratoire et intestinal | |||||
| Nombre total de renards roux testés | 11 | - | ||||||
| Opossum de Virginie (Didelphis virginiana) | RCSF | Examen post-mortem | Bolton-Est, Québec | Juin 2021 | 1 | Écouvillons nasaux et rectaux | PCR | |
| Sud de l'Ontario | Juill. à oct. 2020 | 2 | Tissu respiratoire | |||||
| Sud-ouest de l'Ontario, Saint-Jean-sur-Richelieu, Québec | Oct. 2020, mars 2021 | 3 | Tissu respiratoire et intestinal | |||||
| Nombre total d'opossums de Virginie testés | 6 | - | ||||||
| Cerf de Virginie (Odocoileus virginianus) | RCSF | Examen post-mortem | London, Ontario, sud-ouest du Québec | Oct. à déc. 2020 | 3 | Tissu respiratoire et intestinal | PCR | |
Ratons laveurs et mouffettes
Les ratons laveurs (Procyon lotor) et les mouffettes rayées (Mephitis mephitis) sont des espèces péridomestiques qui sont de bons candidats pour la surveillance des rétro-zoonoses en raison de leur forte densité dans les zones urbaines et de leur contact étroit fréquent avec des personnes, des animaux domestiques et des déchets. Actuellement, ils font également l’objet d’opérations de surveillance de la rage en Ontario et au Québec, ce qui facilite leur échantillonnage. En Ontario, la surveillance et le dépistage de la rage chez les animaux sauvages sont effectués par le DNMRNF sur les animaux morts suivant une collision avec un véhicule, les animaux trouvés morts pour d’autres raisons et les animaux sauvages malades ou ayant un comportement suspect de rage. Les soumissions proviennent principalement du sud-ouest de l’Ontario, et la plupart des animaux reçus par l’entremise du programme et, par la suite, sélectionnés et analysés pour le SRAS-CoV-2 provenaient de centres urbains de cette région ou avaient des antécédents de contact étroit avec des personnes (figure 1). Au Québec, un programme similaire de surveillance de la rage des animaux sauvages est coordonné par le ministère des Forêts, de la Faune et des Parcs du Québec et les analyses et autres examens post-mortem sont effectués par le RCSF du Québec. Comme ce fut le cas en Ontario, les animaux sélectionnés par le RCSF du Québec pour le dépistage du SRAS-CoV-2 provenaient principalement de zones urbaines (figure 1). Le laboratoire du RCSF de l’Ontario a également fourni un petit nombre d’échantillons de ratons laveurs et de mouffettes provenant d’animaux qui lui ont été soumis pour examen post-mortem. Les carcasses ont été analysées en utilisant une combinaison d’écouvillons oraux, nasaux et rectaux, de tissus respiratoires et de tissus intestinaux (tableau 1). Les écouvillons ont été conservés dans des tubes individuels de 2 ml avec ~1 ml de milieu Universal Transport Medium (UTM; Sunnybrook Research Institute) et les échantillons de tissus de 30 à 60 mg ont été conservés à sec dans des tubes.
Figure 1 : Localisation d’origine des animaux soumis à des tests de dépistage du coronavirus du syndrome respiratoire aigu sévère 2 de juin 2020 à mai 2021 (N = 776)
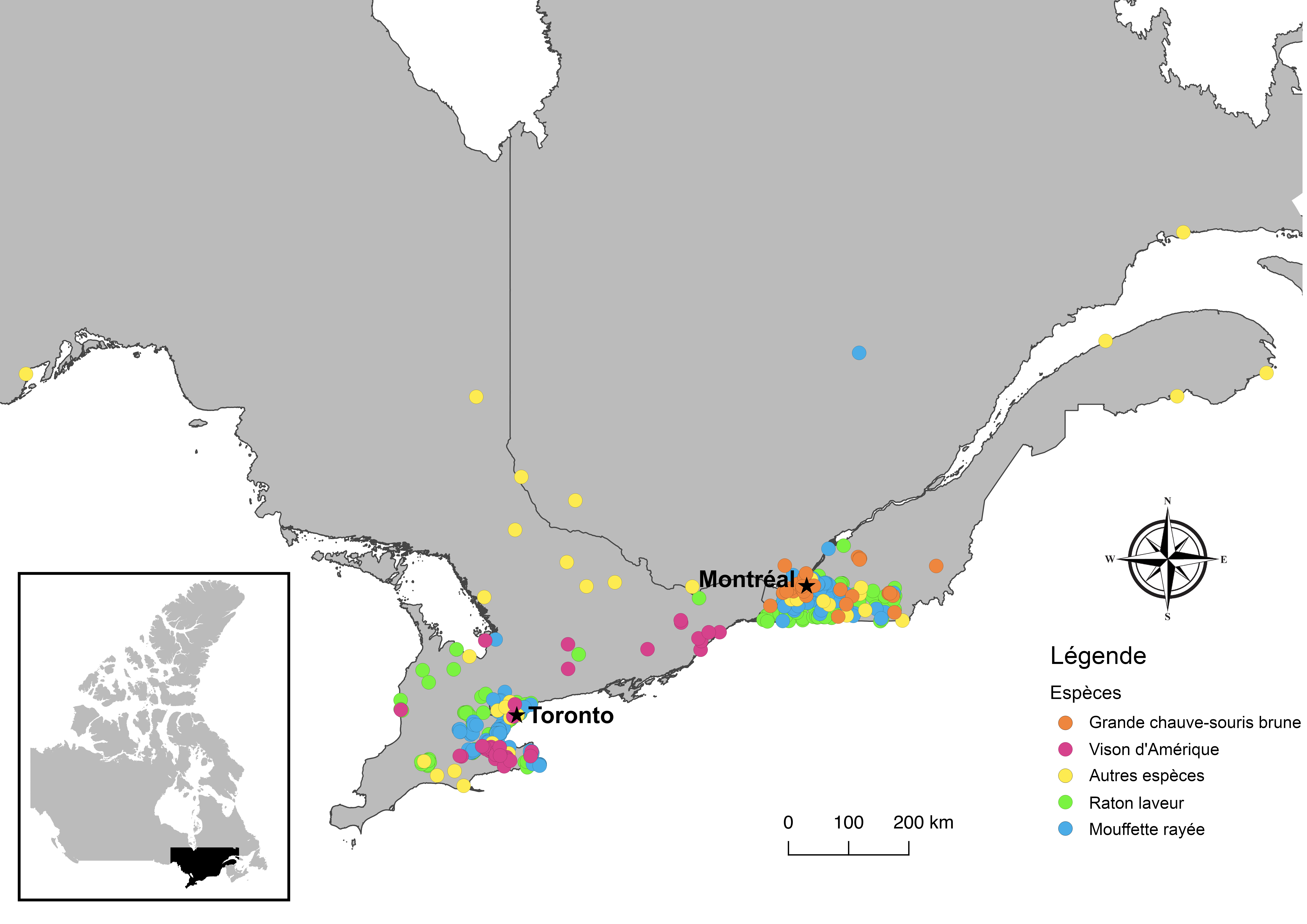
Description textuelle : Figure 1
Cette figure représente une carte de l’Ontario et du Québec, au Canada, au sud de la Baie James. Les lieux de collecte des animaux échantillonnés pour le dépistage du coronavirus aigu sévère 2 (SRAS-CoV-2) sont indiqués par des points de couleur. Les grandes chauves-souris brunes ont été récoltées autour de la ville de Montréal, au Québec, ainsi que dans des secteurs au sud et à l’est de cette ville. Des visons ont été prélevés dans tout le sud de l’Ontario, le plus grand nombre provenant des régions de Hamilton et de Niagara. Les ratons laveurs et les mouffettes ont été récoltés principalement dans les régions du sud-ouest des deux provinces. Les autres espèces ont été prélevées principalement dans les régions du sud des deux provinces, mais quelques individus ont été soumis dans le centre de l’Ontario et, à Thunder Bay, en Ontario, ainsi que dans les régions de la Gaspésie et de l’Abitibi-Témiscamingue, au Québec. Le nombre d’individus récoltés de chaque espèce et leur localisation sommaire sont décrits dans le tableau 1.
De plus, des échantillons ont été prélevés sur des ratons laveurs et des mouffettes vivants au cours d’une étude annuelle de séroprévalence menée par le DNMRNF à Oakville, en Ontario, afin d’évaluer l’efficacité de l’appât vaccinal contre la rage (Wildlife Animal Care Committee Protocol #358 du DNMRNF). Les animaux ont été capturés vivants dans des pièges et transportés vers un centre de traitement où ils ont été anesthésiés. Des écouvillons oraux et rectaux ont été prélevés pour les tests de réaction en chaîne par polymérase (PCR). Du sang a été prélevé dans la veine brachiocéphalique et 0,2 à 1,0 ml de sérum a été prélevé pour la recherche d’anticorps. Une fois bien rétablis, les animaux ont été ramenés à l’endroit de leur capture et relâchés.
Vison
Des cas d’infection par le SRAS-CoV-2 chez le vison ont déjà été trouvés dans plusieurs pays, dont le Canada, et les visons d’élevage infectés se sont révélés capables de transmettre le virus à des congénères naïfs, à des humains et à des animaux de compagnieNote de bas de page 17Note de bas de page 30Note de bas de page 31Note de bas de page 32Note de bas de page 1. Au moment de la rédaction du présent document, aucune éclosion dans un élevage de visons n’a été signalée en Ontario ou au Québec, mais il a déjà été démontré que les élevages de visons en Ontario servent de points d’infection pour d’autres virus (par exemple, la maladie aléoutienne du vison), qui peuvent se propager aux populations de visons sauvagesNote de bas de page 34.
La majorité des carcasses de visons que nous avons sélectionnées pour le dépistage du SRAS-CoV-2 ont été soumises au DNMRNF par des récolteurs de fourrures autorisés, dans le cadre d’une collaboration avec l’Ontario Fur Managers Federation. Le personnel du DNMRNF a prélevé des écouvillons oraux et rectaux, des tissus pulmonaires et intestinaux sur les carcasses, ainsi que des échantillons de sang par ponction cardiaque pour la recherche d’anticorps. S’il n’était pas possible d’obtenir du sang du cœur, du liquide était prélevé dans la cavité thoracique sur une bandelette filtrante Nobuto (Advantec MFS, inc., Dublin, Californie, États-Unis). Les bandelettes Nobuto ont été laissées à sécher à l’air libre, puis placées dans des enveloppes pour pièces de monnaie individuelles.
Grandes chauves-souris brunes
Les chauves-souris sont des animaux porteurs connus de coronavirusNote de bas de page 35Note de bas de page 36Note de bas de page 37. C’est pourquoi des inquiétudes ont été soulevées quant à la susceptibilité possible des chauves-souris nord-américaines au SRAS-CoV-2Note de bas de page 38. Des espèces telles que la grande chauve-souris brune (Eptesicus fuscus) niche fréquemment dans les bâtiments, ce qui les met en contact étroit avec les gens et augmente la probabilité d’exposition au SRAS-CoV-2. Afin d’effectuer des tests PCR du SRAS-CoV-2, des écouvillons buccaux de grande chauve-souris brune et des échantillons de guano ont été recueillis par le personnel du Zoo de Granby, qui mène un programme de réhabilitation pendant l’hiver pour soigner les chauves-souris qui ont été perturbées pendant leur hibernation. Les échantillons de guano ont été conservés à sec dans des tubes de 2 ml.
Autres espèces
D’autres échantillons pour l’analyse PCR du SRAS-CoV-2 ont été obtenus de façon opportuniste par l’intermédiaire des laboratoires régionaux du RCSF de l’Ontario et du Québec, qui reçoivent une grande variété d’espèces sauvages pour examen post-mortem (tableau 1). Les animaux ont été sélectionnés pour l’échantillonnage en fonction de leur potentiel d’infection par le SRAS-CoV-2, lequel pouvait être lié à leur présence dans habitat en milieu urbain, à un contact humain ou à la sensibilité potentielle des espèces selon les résultats de recherches antérieures. Le nombre et le type d’échantillons prélevés variaient selon les carcasses et dépendaient de l’état de la carcasse (tableau 1).
Extraction de l’acide ribonucléique
L’extraction de l’acide ribonucléique (ARN) et les tests PCR ont été réalisés au Sunnybrook Research Institute de Toronto, en Ontario. Tous les échantillons d’écouvillons, de tissus et de guano ont été conservés à -80 °C avant d’être analysés. Pour les échantillons prélevés par écouvillon oral, rectal ou nasal, des extractions d’ARN ont été réalisées à partir de 140 µl d’échantillon au moyen de la mini trousse d’ARN viral QIAmp (Qiagen, Mississauga, Ontario) ou du Nuclisens EasyMag en utilisant le protocole générique 2.0.1 (bioMérieux Canada Inc., St-Laurent, Québec) en suivant les instructions du fabricant. L’ARN des échantillons de guano (80 mg) a été extrait au moyen de la mini trousse d’ARN viral QIAmp et élué dans 40 µl dans un laboratoire de confinement de niveau 3 à l’Université de Toronto. Les échantillons de tissus ont été dégelés, pesés, hachés avec un scalpel et homogénéisés dans un tampon de lyse de 600 µl à l’aide du Next Advance Bullet Blender (Next Advance, Troy, New York, É.-U.) et d’une bille en acier inoxydable de 5 mm à 5 m/s pendant 3 minutes. L’ARN des échantillons de tissu de 30 mg a été extrait au moyen de la trousse RNeasy Plus Mini (Qiagen, Mississauga, Ontario) ou du Nuclisens EasyMag en utilisant le protocole spécifique B 2.0.1; l’ARN a été élué dans 50 µl. Toutes les extractions ont été réalisées avec un contrôle positif et négatif. La différence d’efficacité de l’extraction entre les trousses a été évaluée en comparant les contrôles d’extraction positifs.
Analyse de la réaction en chaîne par polymérase du coronavirus du syndrome respiratoire aigu sévère 2
La réaction en chaîne par polymérase en temps réel (RT-PCR) a été réalisée à l’aide de la trousse Luna Universal Probe One-Step RT-qPCR (NEB). Deux cibles génétiques ont été utilisées pour la détection de l’ARN du SRAS-CoV-2 : la région 5' non traduite (UTR) et le gène de l’enveloppe (E)Note de bas de page 39. Ce test a été adapté des Shared Hospital Labs de l’Institut de recherche de St. Joseph Hamilton pour une utilisation chez les animaux. Les conditions de cyclage étaient les suivantes : un cycle de dénaturation à 60 °C pendant 10 minutes, puis à 95 °C pendant 2 minutes, suivi de 44 cycles d’amplification à 95 °C pendant 10 secondes et à 60 °C pendant 15 secondes. Le logiciel Quantstudio 3 (Thermo Fisher Scientific Inc., Waltham, Massachusetts, É.-U.) a été utilisé pour déterminer les seuils de cycle (Ct). Tous les échantillons ont été analysés en double et les échantillons présentant des Ct inférieurs à 40 pour les deux cibles génétiques dans au moins une réplique ont été considérés comme positifs.
Recherche d’anticorps
Les tests d’anticorps ont été effectués sur des échantillons de sang cardiaque, de liquide de la cavité thoracique et de sérum au LNM de Winnipeg, au Manitoba. Tous les échantillons ont été stockés à -20 °C avant d’être testés. Les échantillons de sang cardiaque ont été recueillis sur des bandelettes filtrantes Nobuto en saturant la longueur de la bande avec 100 µl de sang. Pour obtenir la dilution 1:9 requise pour les tests, les bandelettes Nobuto saturées ont été coupées en 4 à 5 morceaux et placées dans un tube de 2 ml contenant 360 µl de solution saline dans un tampon phosphate pH 7,4 contenant 0,05 % de Tween 20 et éluées pendant la nuit à 4 °C. Les bandelettes Nobuto prélevées dans le liquide de la cavité thoracique ont été traitées de la même manière, tandis que les échantillons de sérum ont été dilués à 1:9 avec le tampon de dilution des échantillons. Les échantillons ont été mélangés par mouvement tourbillonnaire et analysés à l’aide de la trousse de détection d’anticorps de neutralisation du SRAS-CoV-2 GenScriptcPass™ (GenScript US, Inc. Piscataway, New Jersey, É.-U.) en suivant le protocole du fabricant.
En bref, 60 µl d’un échantillon ont été ajoutés à 60 µl de solution de RBD conjuguée à la HRP et incubés à 37 °C pendant 30 minutes. Une aliquote de 100 µl du mélange a été transférée sur la plaque de test ELISA à micropuits et incubée à 37 °C pendant 15 minutes. Les micropuits ont été lavés quatre fois avec 260 µl de tampon de lavage puis 100 µl de substrat TMB ont été ajoutés à chaque puits. Après une incubation de 20 minutes dans l’obscurité à température ambiante, 50 µl de solution d’arrêt ont été ajoutés à chaque puits. L’absorbance a été lue immédiatement à 450 nm.
Chaque plaque d’essai comprenait des contrôles positifs et négatifs qui répondaient aux paramètres de contrôle de qualité requis. Le pourcentage d’inhibition a été calculé pour chaque échantillon en utilisant l’équation suivante :
% d’inhibition = (1 − échantillon de densité optique / contrôle négatif de densité optique) x 100 %
Les échantillons présentant une inhibition supérieure ou égale à 30 % ont été considérés comme positifs pour les anticorps neutralisants du SRAS-CoV-2.
Résultats
Nous avons analysé 776 animaux provenant de 17 espèces différentes d’animaux sauvages pour le SRAS-CoV-2. Ces animaux ont été collectés principalement dans des zones urbaines du sud de l’Ontario et du Québec entre juin 2020 et mai 2021 (tableau 1). Nous n’avons trouvé aucune indication d’ARN viral du SRAS-CoV-2 dans aucun des échantillons analysés et aucune preuve d’anticorps neutralisants dans un sous-ensemble de 219 individus (141 ratons laveurs, 36 mouffettes rayées, 42 visons).
Discussion
Notre étude n’a détecté aucune transmission du SRAS-CoV-2 de l’humain à la faune en Ontario et au Québec. Les ratons laveurs et les mouffettes sont les espèces qui ont été le plus fréquemment analysées. Les résultats d’études expérimentales ont suggéré que ces espèces pourraient être sensibles au SRAS-CoV-2, mais l’absence et la faible quantité de virus infectieux répandue par les ratons laveurs et les mouffettes, respectivement, suggèrent qu’ils constituent un réservoir peu probable pour le SRAS-CoV-2 en l’absence d’adaptations viralesNote de bas de page 9Note de bas de page 10. De même, une étude de provocation menée sur de grandes chauves-souris brunes a montré que celles-ci sont résistantes à l’infection par le SRAS-CoV-2 et n’excrètent pas de virus infectieuxNote de bas de page 40. À l’inverse, les visons sont sensibles à l’infection par le SRAS-CoV-2, mais aucun signe de SRAS-CoV-2 n’a été détecté chez les visons échantillonnés. Bien que cela puisse être attribué à la faible taille réelle de l’échantillon, à ce jour, le SRAS-CoV-2 a rarement été détecté dans les populations de visons sauvages à l’échelle mondiale. Il convient toutefois de noter que ces études expérimentales sur les ratons laveurs, les mouffettes et les grandes chauves-souris brunes Note de bas de page 9Note de bas de page 10Note de bas de page 40 ont été réalisées avec le SRAS-CoV-2 parental. La sensibilité de ces espèces aux variants préoccupants n’est actuellement pas connue et peut différer de la sensibilité à la souche parentaleNote de bas de page 41. En outre, les études de provocation évaluant la sensibilité ont tendance à être menées sur un petit nombre de jeunes individus en bonne santé, de sorte que les résultats peuvent ne pas refléter toute la gamme des réponses possibles à l’infection en milieu naturel.
Au fur et à mesure de la progression de la pandémie, on récolte de nouvelles données sur les animaux sauvages sensibles qui peuvent agir comme des réservoirs compétents pour le virus. Par exemple, le cerf de Virginie est maintenant considéré comme une espèce d’intérêt pour la surveillance du SRAS-CoV-2 à la lumière de sa sensibilité déterminée expérimentalement ainsi que des données concernant son exposition généralisée au virus récoltées au moyen de tests d’anticorps et de tests PCR dans toute l’Amérique du NordNote de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 19. Les efforts de surveillance en continu doivent être adaptatifs et inclure des tests ciblés sur des espèces de grand intérêt, au fur et à mesure de leur identification. En Ontario et au Québec, il s’agit du vison, du cerf de Virginie et de la souris sylvestre (Peromyscus maniculatus)Note de bas de page 9Note de bas de page 42. Il est important de continuer à inclure des espèces moins sensibles, étant donné la plasticité génomique virale en cours et l’évolution de la gamme d’hôtes des variants préoccupants.
Limites
Cette étude présente plusieurs limites qu’il convient de reconnaître. Premièrement, la majorité de nos tests de dépistage du SRAS-CoV-2 ont été effectués par RT-PCR, lequel est seulement capable de détecter une infection active. Les tests d’anticorps, qui identifient une infection ou une exposition résolue, sont plus susceptibles de déceler des traces du SRAS-CoV-2 dans les études de surveillance, car les résultats dépendent moins du moment de la collecte des échantillons. Les tests d’anticorps nécessitent généralement des échantillons provenant d’animaux vivants ou de carcasses fraîches, ce qui a limité notre capacité à les utiliser. Toutefois, les analyses effectuées ont permis de valider les tests sur des ratons laveurs, des mouffettes et des visons, ce qui pourrait faciliter la réalisation d’un plus grand nombre de tests d’anticorps dans le futur. Deuxièmement, nous avons utilisé des trousses différentes pour l’extraction de l’ARN en raison de problèmes logistiques. Sur la base de nos contrôles d’extraction, la mini trousse d’ARN QIAamp a donné des résultats légèrement meilleurs que le Nuclisens EasyMag (~2 Ct) pour les échantillons prélevés par écouvillon. À l’inverse, le Nuclisens EasyMag a donné des résultats légèrement meilleurs (~2 Ct) que ceux de la trousse RNeasy mini plus pour les échantillons de tissus. Troisièmement, le type d’échantillons que nous avons prélevés peut également avoir limité notre capacité à détecter l’infection par le SRAS-CoV-2. La réplication virale peut varier selon les types de tissus et, par conséquent, certains tissus sont plus propices que d’autres à la détection de l’ARN viralNote de bas de page 1. Dans le présent travail, les animaux ont été sélectionnés de manière opportuniste dans le cadre de programmes préexistants, et nous n’avons pas été en mesure de collecter systématiquement les mêmes séries d’échantillons. De plus, les types d’échantillons proviennent d’animaux vivants et de carcasses et ne sont pas optimaux; certains types d’échantillons étaient parfois indisponibles (par exemple, les échantillons de tissus d’animaux vivants) ou n’étaient pas suffisants pour être prélevés.
Conclusion
Une approche « Un monde, une santé » est essentielle pour la compréhension et la gestion des risques associés à un pathogène zoonotique émergent comme le SRAS-CoV-2. Nous avons profité des activités des programmes de recherche, de surveillance et de réhabilitation existants et de l’expertise de multiples domaines pour collecter et analyser efficacement 1 690 échantillons d’animaux sauvages. L’absence d’échantillons d’animaux sauvages positifs pour le SRAS-CoV-2 n’exclut pas la transmission de l’homme à la faune canadienne, compte tenu des limites mentionnées ci-dessus. La poursuite de la recherche dans ce domaine est à la fois importante et urgente, en particulier lorsque de nouveaux variants préoccupants apparaissent. Les secteurs de la santé publique et de la santé animale doivent continuer à travailler en collaboration avec les partenaires universitaires et gouvernementaux pour aider à prévenir la propagation du SRAS-CoV-2 de l’homme à la faune, à en surveiller la propagation et à résoudre tout problème éventuel. Il est urgent de mettre en place un programme coordonné de surveillance du SRAS-CoV-2 chez la faune au Canada. Cette approche permettra de protéger la santé des Canadiens et des espèces sauvages, présentement et pour le futur.
Déclaration des auteurs
- J. E. G. et J. D. K. ont contribué à parts égales à ce travail.
- J. E. G., J. D. K., J. B., T. B., P. A. B., C. M. D., L. F., M. G., C. M. J., A. M., P. K. M., L. A. N., S. M. — Conceptualisation
- J. E. G., L. B., M. G., C. M. J., S. L., A. M., B. S. — Collecte et coordination des échantillons
- J. D. K., A. D., A. H., L. R. L., A. S., L. Y., S. M. — Essais sur échantillon
- J. E. G., J. D. K. — Ressources
- J. E. G., J. D. K., A. D., L. F. — Rédaction, projet initial
- J. E. G., J. D. K., J. B., L. B., T. B., P. A. B., C. M. D., A. D., L. F., M. G., A. H., C. M. J., S. L., L. R. L., A. M., P. K. M., L. A. N., A. S., B. S., L. Y., S. M. — Rédaction, révision et édition
- J. B., T. B., P. A. B., C. M. D., P. K. M. — Acquisition de financement
Intérêts concurrents
Aucun.
Remerciements
Les auteurs souhaitent remercier B. Pickering et J. Tataryn pour avoir facilité les partenariats interagences qui ont rendu ce travail possible, ainsi que pour leur révision et leurs commentaires réfléchis sur le manuscrit. Nous souhaitons également remercier B. Pickering pour avoir aidé à organiser les tests d’anticorps, et N. Toledo pour avoir effectué les tests d’anticorps. Nous souhaitons remercier M. Anderson du ministère de l’Agriculture, de l’Alimentation et des Affaires rurales de l’Ontario et V. Misra du Western College of Veterinary Medicine pour leurs conseils avisés et leur participation aux discussions concernant cette étude. Nous remercions D. Bulir pour son travail de développement du test PCR utilisé dans cette étude. Nous tenons à remercier L. Lazure et le personnel du Zoo de Granby, les techniciens du programme de surveillance de la rage au Québec, ainsi que V. Casaubon et J. Viau du Centre québécois sur la santé des animaux sauvages - Réseau canadien pour la santé de la faune (CQSAS-RCSF) pour leur aide dans la collecte des échantillons. Nous remercions également N. Pulham, S. Konieczka, J. Adams, G. McCoy, T. McGee, L. Pollock et K. Bennett, de la Section de la recherche et de la surveillance de la faune du ministère du Développement du Nord, des Mines, des Ressources naturelles et des Forêts (DNMRNF), ainsi que L. Dougherty, L. Shirose et M. Alexandrou, de la Société canadienne de la faune de l’Ontario, pour leur aide dans la collecte des échantillons. Enfin, nous souhaitons remercier les récolteurs de fourrures autorisés qui ont soumis des visons aux analyses.
Financement
Ce travail a été soutenu par l’Agence de la santé publique du Canada, avec des contributions en nature fournies par tous les partenaires collaborateurs.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International