Une analyse de PICNIC de la bactériémie de Haemophilus influenzae chez les enfants

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 49-9, septembre 2023 : Maladies infectieuses courantes causées par des bactéries
Date de publication : septembre 2023
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 49-9, septembre 2023 : Maladies infectieuses courantes causées par des bactéries
Étude épidémiologique
Analyse descriptive multicentrique canadienne du réseau PICNIC (Pediatric Investigators Collaborative Network on Infections in Children) sur la bactériémie à Haemophilus influenzae chez les enfants : sérotypes émergents
Craig Frankel1, Joan Robinson2, Sarah Khan3, Mohammad Alghounaim4, Jane McDonald4, Alison Lopez5, Sergio Fanella5, John Gunawan2, Jacqueline Wong3, Jeannette Comeau6, Jennifer Bowes7, Robert Slinger7, Angela Kalia8, Ashley Roberts8, Kirk Leifso9, Marina Ulanova10, Michelle Barton1
Affiliations
1 Département de pédiatrie, Children’s Hospital, London Health Sciences Centre, London, ON
2 Département de pédiatrie, Hôpital pour enfants Stollery, Edmonton, AB
3 Département de pédiatrie, Hôpital pour enfants McMaster, Hamilton, ON
4 Département de pédiatrie, Hôpital de Montréal pour enfants, Montréal, QC
5 Département de pédiatrie et de santé de l’enfant, Hôpital pour enfants de Winnipeg, Winnipeg, MB
6 Département de pédiatrie, Hôpital IWK Centre, Halifax, NS
7 Département de pédiatrie, Centre hospitalier pour enfants de l’est de l’Ontario, Ottawa, ON
8 Département de pédiatrie, Hôpital pour enfants de la Colombie-Britannique, Vancouver, BC
9 Département de pédiatrie, Centre des sciences de la santé de Kingston, Kingston, ON
10 Université de l’École de médecine du Nord de l’Ontario, Thunder Bay, ON
Correspondance
Citation proposée
Frankel C, Robinson J, Khan S, Alghounaim M, McDonald J, Lopez A, Fanella S, Gunawan J, Wong J, Comeau JL, Bowes J, Slinger R, Kalia A, Roberts A, Leifso K, Ulanova M, Barton M. Analyse descriptive multicentrique canadienne du réseau PICNIC (Pediatric Investigators Collaborative Network on Infections in Children) sur la bactériémie à Haemophilus influenzae chez les enfants : sérotypes émergents. Relevé des maladies transmissibles au Canada 2023;49(9):405−12. https://doi.org/10.14745/ccdr.v49i09a02f
Mots-clés : Haemophilus influenzae, maladie invasive, bactériémie, méningite, sérotype a, sérotype b, sérotype f, non typable, enfants
Résumé
Contexte : Le nombre d’infections à Haemophilus influenzae de sérotype b (Hib) a considérablement diminué depuis l’introduction des vaccins Hib, mais les enfants continuent de souffrir de graves maladies invasives à Haemophilus influenzae (Hi) causées par divers sérotypes et bactéries non typables. L’objectif de cette étude était de décrire la distribution des sérotypes et le spectre clinique de la bactériémie Hi chez les enfants admis dans les hôpitaux canadiens.
Méthodes : Tous les enfants atteints de bactériémie Hi admis de 2013 à 2017 dans 10 centres à travers le Canada ont été inclus. Nous avons recueilli des données démographiques, cliniques, de traitement et de résultats.
Résultats : Une bactériémie à Hi est survenue chez 118 enfants d’un âge médian de 12 mois (écart interquartile : 7–48 mois). 43 (36 %) isolats étaient non typables (NTHi) et 8 n’ont pas été typés. Sur les 67 typables (THi), Hia (H. influenzae sérotype a) (n = 36, 54 %), Hif (sérotype f) (n = 19, 26 %) et Hib (sérotype b) (n = 9, 13 %) dominaient. La bactérie THi était plus susceptible que la bactérie NTHi de se présenter sous forme de méningite (p < 0,001), en particulier de sérotype a (p = 0,04), et moins susceptible de se présenter sous forme de pneumonie (p < 0,001). Une maladie compliquée (définie comme l’admission dans une unité de soins intensifs, la nécessité d’une intervention chirurgicale, des séquelles à long terme ou le décès) est survenue dans 31 (26 %) cas, qui étaient plus susceptibles d’avoir une méningite (p < 0,001) que ceux dont la maladie n’était pas compliquée.
Conclusion : À l’ère des vaccins conjugués efficaces contre Hib, NTHi, Hia et Hif sont devenus les principales causes de maladies invasives à Hi chez les enfants canadiens, Hia étant le plus susceptible d’entraîner une méningite et une maladie compliquée. L’idéal serait de disposer d’un vaccin contre toutes les NTHi et THi, mais la connaissance de la charge de morbidité actuelle due aux souches en circulation permettra d’établir des priorités pour les cibles de vaccinations.
Introduction
Haemophilus influenzae sérotype b (Hib) était la principale cause de maladie invasive à Hi jusqu’à l’introduction des vaccins Hib dans le calendrier de vaccination systématique des enfants aux États-Unis et au Canada à la fin des années 1980Note de bas de page 1. Cette évolution a été suivie par l’émergence du sérotype Hia, en particulier chez les enfants autochtones du Canada et de l’AlaskaNote de bas de page 2Note de bas de page 3Note de bas de page 4. De récentes publications américaines font état d’une augmentation de l’incidence des maladies invasives à Hi chez les enfants, probablement due à une augmentation de l’incidence des cas dus à Hi non typable (NTHi)Note de bas de page 5Note de bas de page 6. Nous avons cherché à décrire la distribution des sérotypes et le spectre clinique de la bactériémie Hi chez les enfants canadiens dans plusieurs provinces et à déterminer les facteurs associés à une maladie compliquée.
Méthodes
Population et conception de l’étude
Dix centres du réseau PICNIC (Pediatric Investigators Collaborative Network on Infections in Canada) ont recruté rétrospectivement tous les enfants hospitalisés de moins de 18 ans ayant des isolats d’hémoculture de Hi entre le 1er janvier 2013 et le 31 décembre 2017. Pour neuf centres (London, Ontario; Hamilton, Ontario; Ottawa, Ontario; Kingston, Ontario; Winnipeg, Manitoba; Edmonton, Alberta; Vancouver, Colombie-Britannique; Halifax, Nouvelle-Écosse et Montréal, Québec), il s’agissait d’une sous-étude issue d’une cohorte rétrospective de bactériémies à Gram négatif, tandis que le dixième centre (Sioux Lookout, Ontario) a été ajouté à cette sous étude en raison de son incidence élevée connue d’infections à Hi. L’approbation éthique a été obtenue dans chaque centre participant et le consentement parental n’a pas été requis.
Définitions de l’étude
Le foyer d’infection a été classé comme suit : méningite, pneumonie, épiglottite, infection de la peau et des tissus mous, infection ostéo-articulaire, autre ou aucun (bactériémie isolée sans foyer). La maladie multifocale a été définie comme une bactériémie avec deux foyers ou plus.
La maladie a été définie comme compliquée si l’un des événements suivants s’est produit en rapport avec la maladie à Hi : admission en unité de soins intensifs (USI); défaillance d’un organe; interventions chirurgicales, y compris amputations pour purpura fulminans ou drainage de collections purulentes (l’arthrocentèse n’a pas été prise en compte si elle n’a pas été effectuée plus d’une fois); complications liées à la focalisation de la maladie, y compris déficits moteurs, convulsions, hydrocéphalie, déficits visuels ou auditifs, ou infections nécrosantes de la peau ou des poumons; et décès.
Sérotypage
Le sérotypage des isolats a été réalisé à l’aide d’antisérums monovalents dans des laboratoires de référence. Les souches ont été classées par type capsulaire (a à f) ou comme non typables. Lorsque le sérotypage n’était pas disponible, les isolats ont été enregistrés comme non typés.
Collecte de données
Les données démographiques, cliniques, microbiologiques, le traitement, les résultats et le suivi ont été extraits des dossiers médicaux et saisis dans les outils REDCap (Research Electronic Data Capture) hébergés à l’Université de l’Alberta par chaque centre participantNote de bas de page 7.
Analyse statistique
Une analyse descriptive a été réalisée. Le test du khi carré ou la méthode exacte de Fisher ont été utilisés pour comparer les variables catégorielles et les tests non paramétriques ont été utilisés pour comparer les variables continues. Une analyse univariée a été utilisée pour explorer les facteurs potentiels associés à la maladie de Hia et à l’évolution compliquée de la maladie. Les variables ayant une valeur p univariée ≤ 0,2 et les facteurs de confusion potentiels (par exemple l’âge et le sexe) ont été pris en compte pour être inclus dans un modèle de régression logistique multivariable visant à déterminer les facteurs de risque indépendants de complication de la maladie. La version 28 de SPSS d’IBM a été utilisée pour l’analyse statistique.
Résultats
Il y a eu 118 cas de bactériémie Hi, dont 74 (63 %) étaient des garçons (tableau 1). L’âge médian était de 12 mois (écart interquartile [ÉI] : 7–48 mois), 7 cas (6 %) étant des nouveau-nés et 25 (21 %) étant âgés de 5 ans ou plus.
| CaractéristiquesNote de bas de page a | Total N = 118 |
THi (a−f) n = 67 |
Hia n = 36 |
Hib n = 9 |
Hic n = 1 |
Hie n = 3 |
Hif n = 18 |
NTHi n = 43 |
Non typé n = 8 |
|---|---|---|---|---|---|---|---|---|---|
| Données démographiques | |||||||||
| Âge médian en mois, [ÉI]Note de bas de page b | 12 [7–48] |
12 [7–36] |
12 [7–24] |
7 [6–12] |
8 | 48 [12–108] |
18 [12–60] |
24 [5–60] |
30 [7–96] |
| Âge inférieur ou égal à 1 mois | 7 (6 %) | 2 (3 %) | 0 (0 %) | 1 (11 %) | 0 (0 %) | 0 (0 %) | 1 (6 %) | 4 (9 %) | 1 (13 %) |
| Âge inférieur à 12 mois | 43 (36 %) | 24 (36 %) | 14 (39 %) | 5 (56 %) | 1 (100 %) | 0 (0 %) | 4 (22 %) | 17 (40 %) | 2 (25 %) |
| Âge inférieur à 24 mois | 69 (58 %) | 45 (67 %) | 26 (72 %) | 8 (89 %) | 1 (100 %) | 1 (33 %) | 9 (50 %) | 20 (47 %) | 4 (50 %) |
| Âge inférieur à 60 mois | 93 (79 %) | 59 (88 %) | 32 (89 %) | 9 (100 %) | 1 (100 %) | 2 (67 %) | 13 (72 %) | 31 (72 %) | 5 (63 %) |
| Sexe masculin | 74 (63 %) | 38 (57 %) | 16 (44 %) | 9 (100 %) | 1 (100 %) | 1 (33 %) | 11 (61 %) | 30 (70 %) | 6 (75 %) |
| Foyers cliniquesNote de bas de page c | |||||||||
| Méningite | 25 (21 %) | 21 (31 %) | 14 (39 %) | 3 (33 %) | 1 (100 %) | 0 (0 %) | 3 (17 %) | 3 (7 %) | 1 (13 %) |
| IPTM | 8 (7 %) | 8 (12 %) | 4 (11 %) | 4 (44 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) |
| Infection ostéo-articulaire | 6 (5 %) | 6 (9 %) | 4 (11 %) | 2 (22 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) |
| Pneumonie | 41 (35 %) | 13 (19 %) | 5 (14 %) | 0 (0 %) | 0 (0 %) | 1 (33 %) | 7 (39 %) | 23 (53 %) | 5 (63 %) |
| Épiglottite | 1 (1 %) | 1 (1 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 1 (6 %) | 0 (0 %) | 0 (0 %) |
| Endocardite infectieuseNote de bas de page d | 1 (1 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 1 (2 %) | 0 (0 %) |
| Maladie multifocaleNote de bas de page c | 7 (6 %) | 7 (10 %) | 5 (14 %)
1) SNC/EI |
0 (0 %) | 0 (0 %) | 0 (0 %) | 2 (11 %) 1) Hommes/EI |
0 (0 %) | 0 (0 %) |
| Bactériémie isolée | 29 (25 %) | 11 (16 %) | 4 (11 %) | 0 (0 %) | 0 (0 %) | 2 (67 %) | 5 (28 %) | 16 (37 %) | 2 (25 %) |
| Microbiologie | |||||||||
| Nombre d’isolats avec co-infection virale confirmée en laboratoirNote de bas de page e | 32 (27 %) | 14 (21 %) | 10 (28 %) | 1 (11 %) | 0 (0 %) | 0 (0 %) | 3 (17 %) | 15 (35 %) | 1 (13 %) |
| Nombre d’isolats présentant une résistance à l’ampicilline | 25/106 (24 %) | 6/63 (10 %) | 0/34 (0 %) | 2/8 (25 %) | 0/1 (0 %) | 0/3 (0 %) | 4/17 (24 %) | 18/35 (51 %) | 1/8 (13 %) |
| Résultat | |||||||||
| Durée médiane de l’antibiothérapieNote de bas de page a (jours), [ÉI] | 13,5 [10–23] |
14 [10–28] |
15 [11–29] |
21 [10–31] |
53 | 11 [11–11] |
13 [9–16] |
13 [10–21] |
10 [10–19] |
| Admission en USINote de bas de page f | 39 (33 %) | 21 (31 %) | 13 (36 %) | 1 (13 %) | 1 (100 %) | 0 (0 %) | 6 (33 %) | 14 (33 %) | 4 (50 %) |
| Évolution compliquéeNote de bas de page f [% avec complication du SNC] | 31 (26 %) [18/31 (58 %)] |
24 (36 %) [15/24 (63 %)] |
14 (39 %) [11/14 (79 %)] |
2 (22 %) [1/2 (50 %)] |
1 (100 %) [1/1 (100 %)] |
0 (0 %) [0 (0 %)] |
7 (39 %) [2/7 (29 %)] |
6 (14 %) [2/6 (33 %)] |
1 (13 %) [1/1 (100 %)] |
| Durée médiane du séjourNote de bas de page g (jours), [ÉI] | 10 [5–21] |
9 [4–16,5] |
10 [4–18] |
13 [7–20] |
55 | 1 [0–5] |
7 [2–13] |
12 [7–30] |
12 [8–30] |
| Décès | 2 (2 %) | 2 (3 %) | 2 (6 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) | 0 (0 %) |
| Décès/séquellesNote de bas de page h | 17 (14 %) | 14 (21 %) | 9 (25 %) | 2 (22 %) | 1 (100 %) | 0 (0 %) | 2 (11 %) | 2 (5 %) | 1 (13 %) |
Le typage était disponible pour 110 isolats d’Hi, dont 67 (61 %) étaient Haemophilus influenzae typables (THi) et 43 (39 %) des NTHi. Les sérotypes a, f et b étaient les principaux sérotypes, représentant respectivement 36 (54 %), 18 (27 %) et 9 (13 %) des THi (tableau 1). La répartition de l’âge selon les sérotypes n’était pas significativement différente (tableau 1). Le nombre de cas était similaire d’une année à l’autre de l’étude (moyenne : 23,6 ± 7,33), avec un pic en 2016 (figure 1). Les contributions spécifiques des centres sont présentées dans la figure 2. Les centres de Winnipeg, Montréal et London ont contribué à la plupart des cas d’Hi, la maladie étant principalement causée par la THi.
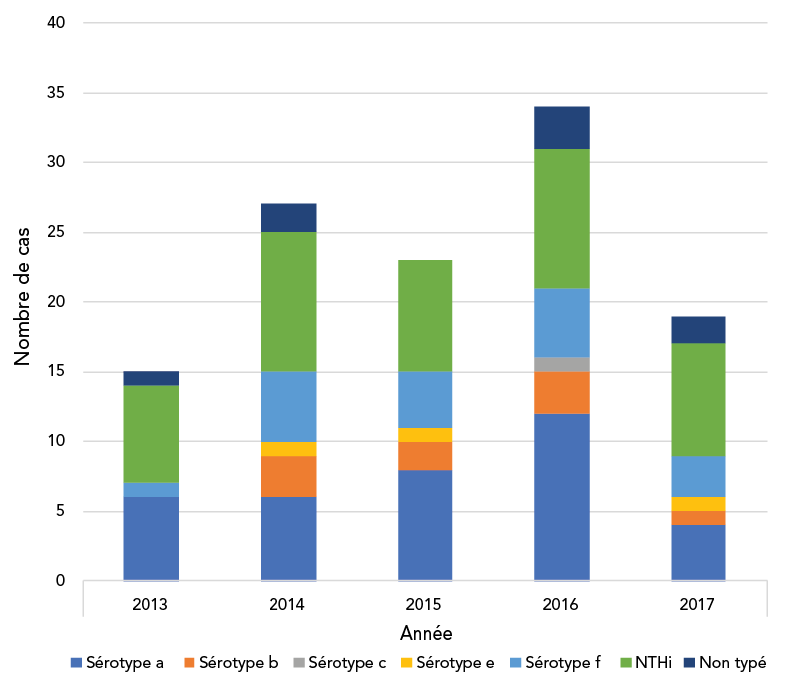
Figure 1 - Équivalent textuel
| Sérotype | Année | ||||
|---|---|---|---|---|---|
| 2013 | 2014 | 2015 | 2016 | 2017 | |
| Sérotype a | 6 | 6 | 8 | 12 | 4 |
| Sérotype b | 0 | 3 | 2 | 3 | 1 |
| Sérotype c | 0 | 0 | 0 | 1 | 0 |
| Sérotype e | 0 | 1 | 1 | 0 | 1 |
| Sérotype f | 1 | 5 | 4 | 5 | 3 |
| NTHi | 7 | 10 | 8 | 10 | 8 |
| Non typé | 1 | 2 | 0 | 3 | 2 |
Figure 2 - Équivalent textuel
| Centre | Hia | Hib | Hic | Hie | Hif | NTHi | THi |
|---|---|---|---|---|---|---|---|
| Winnipeg | 7 | 2 | 0 | 0 | 6 | 7 | 15 |
| Montréal | 7 | 3 | 0 | 1 | 4 | 3 | 15 |
| London | 9 | 4 | 0 | 0 | 1 | 4 | 14 |
| Edmonton | 6 | 0 | 1 | 0 | 3 | 2 | 10 |
| Vancouver | 2 | 0 | 0 | 0 | 2 | 9 | 4 |
| Ottawa | 2 | 0 | 0 | 0 | 0 | 5 | 2 |
| Hamilton | 1 | 0 | 0 | 0 | 1 | 6 | 2 |
| Sioux | 2 | 0 | 0 | 2 | 0 | 1 | 4 |
| Kingston | 0 | 0 | 0 | 0 | 1 | 3 | 1 |
| Halifax | 0 | 0 | 0 | 0 | 0 | 3 | 0 |
La fréquence annuelle des cas était comprise entre 15 et 34, le pic de fréquence ayant été atteint en 2016. Le H. influenzae non typable, suivi du sérotype a puis du sérotype f, ont été les principales causes de la maladie de Hi en 2013, 2014 et 2017. Le sérotype a, suivi de NTHi, puis du sérotype f, ont été les principales causes en 2015 et 2016.
Winnipeg, Montréal, London et Edmonton ont enregistré le plus grand nombre de cas de THi. Les sérotypes a et f représentaient la plupart des cas de THi dans tous les centres, à l’exception de London, qui a identifié principalement des cas de sérotypes a et b. La fréquence de Hia et de Hib était la plus élevée à London. Vancouver, Winnipeg, Ottawa et Hamilton ont enregistré le plus grand nombre de cas de NTHi.
Trente et un (27 %) des 116 enfants dont les données cliniques étaient disponibles (données manquantes pour deux cas) présentaient au moins un problème de santé sous-jacente : prématurité (n = 11; 9 %), tumeur maligne (n = 11; 9 %), immunodéficience (n = 9; 8 %) et syndrome génétique ou métabolique (n = 8; 7 %). Sur les 108 enfants sérotypés dont les données étaient disponibles, 13/67 (19 %) des THi contre 15/41 (35 %) des NTHi présentaient une pathologie sous-jacente (p = 0,048). Parmi les 6 cas de Hib pour lesquels on disposait d’informations sur les antécédents vaccinaux, 5 (83 %) n’avaient pas reçu de vaccin Hib (n = 3) ou avaient reçu un nombre de doses insuffisant par rapport à leur âge (n = 2).
Vingt-cinq (24 %) des 106 isolats pour lesquels des rapports de sensibilité étaient disponibles étaient résistants à l’ampicilline, tandis qu’aucun n’était résistant à la ceftriaxone (tableau 1). Les isolats de NTHi étaient plus susceptibles de présenter une résistance à l’ampicilline que les isolats de THi (n = 18/35, 51 % contre n = 6/63, 9 %; p < 0,001).
Parmi les 67 enfants atteints de THI, 11 (16 %) ont présenté une bactériémie isolée sans foyer infectieux. Quarante-neuf avaient un seul foyer, dont la méningite (n = 21), la pneumonie (n = 13), l’infection de la peau et des tissus mous (n = 8), l’infection ostéo-articulaire (n = 6) et l’épiglottite (n = 1) (tableau 1). Une maladie multifocale est apparue chez sept autres enfants (cinq dus à Hia et deux dus à Hif), avec cinq cas où la méningite était l’un des foyers.
Parmi les 43 enfants atteints de NTHi, 16 (37 %) ont présenté une bactériémie isolée sans foyer, contre 11/67 (16 %) de THi (p = 0,013). Les 27 autres enfants présentaient un seul foyer : pneumonie (n = 23), méningite (n = 3) et endocardite infectieuse (n = 1) (tableau 1).
La méningite était plus fréquente avec les THi qu’avec les NTHi (n = 26/67, 39 % vs. n = 3/43, 7 %; p < 0.001) et était aussi fréquente avec les Hia et les Hib (47 % vs. 33 %; p > 0,05). La pneumonie (en tant que foyer unique) était plus fréquente avec les NTHi qu’avec les THi (n = 23/43, 53 % contre n = 13/67, 19 %; p < 0,001).
La durée médiane de l’antibiothérapie dans la cohorte était de 13 jours [ÉI : 10–23] avec une durée prolongée pour l’infection ostéo-articulaire et la méningite d’une durée médiane de 30 jours [ÉI : 26–41] et 24,5 jours [ÉI : 12–43], respectivement (tableau 1). Trente (26 %) des 113 cas pour lesquels des informations étaient disponibles et ayant reçu une médiane de 14 jours (IQR : 11–28) au total sont passés d'une antibiothérapie parentérale après une médiane de 7 jours (IQR : 4–13) à une antibiothérapie orale pour terminer le reste du traitement par voie orale.
La maladie compliquée était plus fréquente avec la THi qu’avec la NTHi (n = 24/67, 36 % contre n = 6/43, 14 %; p = 0,015). Les cas mortels ont tous deux été causés par Hia et sont survenus chez un nourrisson atteint de méningite et d’endocardite malgré l’absence de cardiopathie congénitale et chez un enfant de quatre ans atteint d’une méningite compliquée d’un empyème sous-dural. Un nourrisson atteint d’une méningite à Hib a dû être amputé d’un membre bilatéral en raison d’un purpura fulminans, mais il a survécu. Le résultat composite de la mortalité ou des séquelles à la sortie de l’hôpital était significativement associé à la maladie Hia par rapport à la maladie non Hia (n = 9/36, 25 % vs. n = 7/74, 9 %; p < 0.001) (voir l’appendice).
Dans l’analyse univariée (après ajustement pour les comparaisons multiples), les cas de Hi avec méningite (p < 0,001) étaient plus susceptibles d’avoir une évolution clinique compliquée, tandis que ceux avec une bactériémie isolée l’étaient moins (p < 0,001) (tableau 2). Dans l’analyse multivariée, la méningite (p < 0,001) prédisait une évolution compliquée de la maladie après prise en compte de l’âge (p > 0,05) et du sérotype Hia (p > 0,05) (tableau 2).
CaractéristiquesNote de bas de page a |
Tous N = 118 |
Maladie compliquée n = 31 |
Maladie non compliquée n = 87 |
Signification p < 0,006Note de bas de page b |
Analyse multivariéeNote de bas de page c | |
|---|---|---|---|---|---|---|
| Rapport de cotes; [IC à 95 %] | Valeur p | |||||
| Données démographiques | ||||||
| Garçons | 74 (63 %) | 21 (68 %) | 55 (63 %) | 0,800 | 1,27 [0,445–3,62] |
0,67 |
| Âge médian (mois), [ÉI] | 12 [7–48] |
12 [6–36] |
12 [9–60] |
0,021 | 1,02 [1,00–1,03] |
0,12 |
| Patients âgés de moins d’un an | 43 (36 %) | 15 (48 %) | 28 (32 %) | 0,107 | s.o. | s.o. |
| Spectre clinique | ||||||
| Bactériémie isolée | 29 (25 %) | 1 (3 %) | 30 (34 %) | < 0,001 | 14,77 [5,22–41,76] |
< 0,001 |
| Méningite | 29 (25 %) | 20 (65 %) | 9 (10 %) | < 0,001 | s.o. | s.o. |
| Pneumonie | 43 (36 %) | 11 (35 %) | 33 (38 %) | 0,809 | s.o. | s.o. |
| Microbiologie | ||||||
| NTHi | 43 (36 %) | 6 (19 %) | 25 (29 %) | 0,029 | s.o. | s.o. |
| Hia | 36 (31 %) | 14 (45 %) | 21 (24 %) | 0,028 | s.o. | s.o. |
| Marqueurs d’inflammations | ||||||
| Nombre médian de globules blancs au pic, [ÉI] | 18,1 [12,1–26,3] |
21,3 [16,3–30,3] |
16,7 [11,8–21,3] |
0,072 | s.o. | s.o. |
| Protéine C-réactive médiane (mg/L), [ÉI] | 155 [72–223] |
194 [134–301] |
114 [65–194] |
0,03 | s.o. | s.o. |
| Traitement | ||||||
| Durée médiane de l’antibiothérapie (jours), [ÉI] | 14 [10–23] |
26 [11–44] |
13 [10–20] |
0,039 | s.o. | s.o. |
| Durée médiane du séjour (jours), [ÉI] | 10 [5–21] |
18,5 [9–43,5] |
9 [4–16] |
0,043 | s.o. | s.o. |
Discussion
Cette étude multicentrique menée dans 10 sites au Canada donne un aperçu de la répartition actuelle des sérotypes de la bactérie Hi chez les enfants canadiens. Avant l’ère du vaccin contre Hib, la maladie invasive de Hi était très rare chez les enfants de plus de quatre ans, alors qu’environ un quart de nos cas étaient plus âgés. Les maladies invasives et non invasives de Hi de 2013 à 2019 ont été examinées à partir des données épidémiologiques d’un seul site canadien avec une population autochtone prédominante (Sioux Lookout)Note de bas de page 8. Dans ce centre, la maladie invasive de Hi a été identifiée chez 10 enfants de moins de 4 ans, chez deux enfants âgés de 5 à 15 ans et chez huit enfants âgés de 16 ans et plusNote de bas de page 8, ce qui suggère une distribution bimodale qui diffère de l’époque précédant l’introduction du vaccin contre Hib, où les enfants plus jeunes étaient principalement touchés. Nos données montrent que les centres pédiatriques de Winnipeg, Montréal, London et Edmonton sont ceux qui contribuent le plus à THi, ce qui peut s’expliquer par le fait que ces centres sont des centres de référence pour de grandes communautés d’enfants autochtones ainsi que pour des communautés où l’administration du vaccin contre Hib est réduite. Les cas de Hib représentaient encore près de 10 % des cas dans l’étude actuelle. Comme on s’y attendait, l’Hib est apparu principalement chez les enfants non vaccinés ou insuffisamment vaccinés.
Les sérotypes a et f étaient les plus fréquents, représentant respectivement 55 % et 25 % des THi, ce qui est cohérent avec la littérature récenteNote de bas de page 4Note de bas de page 6. Si la méningite Hia était significativement associée à une évolution compliquée, elle reflétait par ailleurs l’expérience Hib en matière d’âge et de syndromes cliniques. Les enfants atteints de Hif étaient souvent plus âgés et la pneumonie était le foyer de l’infection.
Les NTHi moins virulentes représentaient un peu plus d’un tiers de l’ensemble des événements bactériémiques Hi, où heureusement l’incidence de la maladie compliquée n’était que de 4 %. Les cas de NTHi se sont présentés sous la forme d’une bactériémie ou d’une pneumonie isolée et rarement sous la forme d’une maladie du système nerveux central, conformément aux données américaines récentesNote de bas de page 5Note de bas de page 6. Les affections comorbides constituaient un facteur de risque pour le développement de la maladie à NTHi. Dans une étude de surveillance rétrospective des maladies invasives à NTHi chez les enfants et les adultes aux Pays-Bas, des conditions comorbides chez les enfants, y compris l’immunodépression, la malignité, la maladie neurologique et d’autres conditions, ont été identifiées dans une grande proportion des cas de NTHi (n = 327/396, 83 %) sur une période de sept ansNote de bas de page 9.
Il est intéressant de noter que les essais de phase I d’un vaccin contre Hia débuteront au Canada en 2023Note de bas de page 10 (communication personnelle, M. Ulanova, Réseau canadien de recherche sur l’immunisation, 2022). Un vaccin s’est avéré rentable dans le territoire canadien du Nunavut, compte tenu de l’incidence élevée de Hia chez les enfants autochtones et de leur risque élevé de maladieNote de bas de page 11. Les études de post-commercialisation des vaccins pneumococciques multivalents qui utilisent la protéine D de NTHi comme protéine porteuse suggèrent qu’ils préviennent certaines otites moyennes dues à des maladies de la NHTi, et il est donc plausible que ces vaccins puissent également prévenir la bactériémie HiNote de bas de page 12.
Limites
L’une des limites importantes de notre étude est qu’elle n’a pas recueilli de données sur l’origine ethnique ou la race, car cette variable n’est pas enregistrée de manière fiable dans les dossiers médicaux au Canada. Ceci est particulièrement important étant donné les taux élevés de Hia dans les populations autochtonesNote de bas de page 4. Notre étude peut sous-estimer la charge et le spectre de la maladie de Hi étant donné qu’elle s’est limitée aux cas bactériémiques. Les hémocultures ne sont pas toujours prélevées avant l’administration d’antibiotiques et peuvent être faussement négatives si on obtient un volume inadéquat. Les données sur le développement neurologique et le suivi à long terme n’étant pas uniformément disponibles, nous avons rapporté les séquelles documentées à la sortie de l’hôpital ou avant.
Conclusion
Notre étude fournit des comparaisons cliniques détaillées entre les THi et les NTHi, mettant en évidence les schémas cliniques et les résultats spécifiques à chaque sérotype. Bien qu’il y ait eu une réduction spectaculaire des cas de Hib depuis l’introduction des vaccins contre Hib, les enfants sont encore victimes de graves maladies invasives causées à la fois par les sérotypes NHTi et les sérotypes non B, en particulier Hia. Des stratégies préventives sont nécessaires pour réduire la morbidité associée à cette maladie.
Déclaration des auteurs
- C. F. — Collecte des données, interprétation des données, rédaction de la première ébauche, rédaction−révision et édition, approbation finale
- J. R., S. K. — Acquisition des données, rédaction de la première ébauche, rédaction–révision et édition, approbation finale
- M. A., J. M., A. L., S. F., J. G., J. W., J. C., J. B., R. S., A. K., A. R., K. L. et M. U. — Acquisition des données, révision du manuscrit
- M. B. — Conceptualisation, acquisition des données, analyse des données, interprétation des données, rédaction−révision et édition, approbation finale
Le contenu et les opinions exprimés dans cet article n’engagent que les auteurs et ne reflètent pas nécessairement ceux du gouvernement du Canada.
Intérêts concurrents
Aucun.
Remerciements
Aucun.
Financement
Aucun.
Appendice
Caractéristiquesa |
Tous N = 110 (exclu non typé) |
Hia n = 36 |
Non-Hia n = 74 |
Signification de l’analyse univariée p < 0,006Note de bas de page b |
|---|---|---|---|---|
| Données démographiques | ||||
| Filles | 42 (38 %) | 20 (56 %) | 22 (30 %) | 0,009 |
| Âge médian (mois), [ÉI] | 12 [7–48] | 12 [7–24] | 12 [7–60] | 0,155 |
| Spectre clinique | ||||
| Méningite | 29 (26 %) | 17 (47 %) | 12 (16 %) | < 0,001 |
| Pneumonie | 38 (35 %) | 7 (19 %) | 31 (42 %) | 0,021 |
| Bactériémie | 27 (25 %) | 4 (11 %) | 23 (31 %) | 0,032 |
| Maladie compliquée | 30 (27 %) | 14 (39 %) | 16 (22 %) | 0,002 |
| Traitement/résultat | ||||
| Durée médiane de l’antibiothérapie (jours), [ÉI] | 14 [10–24] | 15 [11–29] | 13 [10–21] | 0,097 |
| Durée médiane du séjour (jours), [ÉI] | 14 [10–24] | 10 [4–18] | 10,5 [5–21] | 0,987 |
| Décès/séquellesNote de bas de page c | 16 (15 %) | 9 (25 %) | 7 (9 %) | < 0,001 |

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International