Mise à jour du CCNI sur l’épidémiologie de la prévention de l’épidémiologie de la méningococcie invasive

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 49-9, septembre 2023 : Maladies infectieuses courantes causées par des bactéries
Date de publication : septembre 2023
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 49-9, septembre 2023 : Maladies infectieuses courantes causées par des bactéries
Déclaration du comité consultatif
Mise à jour du Comité consultatif national de l’immunisation (CCNI) sur l’épidémiologie de la méningococcie invasive (MI) et considérations pertinentes pour les programmes de prévention de la MI chez les personnes à haut risque d’exposition
Anne Pham-Huy1, Joseline Zafack2, Courtney Primeau3, Oliver Baclic2, Marina Salvadori3,4, Shelley Deeks5 au nom du Comité consultatif national de l’immunisation
Affiliations
1 Département de pédiatrie, Centre hospitalier pour enfants de l’est de l’Ontario, Université d’Ottawa, Ottawa, ON
2 Centre des programmes d’immunisation, Agence de la santé publique du Canada, Ottawa, ON
3 Centre d’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa, ON
4 Département de pédiatrie, Université McGill, Montréal, QC
5 Ministère de la santé et du bien-être de la Nouvelle-Écosse, Halifax, NS
Correspondance
Citation proposée
Pham-Huy A, Zafack J, Deeks S, Zafack J, Primeau C, Baclic O, Salvadori M, Deeks S au nom du Comité consultatif national de l’immunisation. Mise à jour du Comité consultatif national de l’immunisation (CCNI) sur l’épidémiologie de la méningococcie invasive (MI) et considérations pertinentes pour les programmes de prévention de la MI chez les personnes à haut risque d’exposition. Relevé des maladies transmissibles au Canada 2023;49(9):394−404. https://doi.org/10.14745/ccdr.v49i09a01f
Mots-clés : Comité consultatif national de l’immunisation, CCNI, méningococcie invasive, adolescents et jeunes adultes, vaccin contre le méningocoque, politique relative à la vaccination, directives
Résumé
Compte tenu des récentes éclosions de méningococcie invasive (MI) au Canada et de la mise à jour des directives provinciales de vaccination, le Comité consultatif national de l’immunisation (CCNI) a procédé à un examen ciblé des données probantes en mettant l’accent sur l’immunisation des adolescents et des jeunes adultes. Le CCNI a examiné les recommandations nationales et internationales en matière d’immunisation des populations à haut risque de contracter la MI, l’épidémiologie nationale de la MI et les considérations pertinentes pour le programme. Compte tenu de la diversité de l’épidémiologie de la MI, le CCNI estime qu’il est actuellement difficile de recommander un programme pancanadien ciblé et que des programmes régionaux pourraient être mieux adaptés afin de prévenir la MI au sein des groupes de population qui présentent un risque élevé d’exposition à la maladie. Plus de données sont nécessaires afin de déterminer les facteurs de risque actuels de MI (y compris les activités et les environnements liés à la contamination, au portage et à la transmission des bactéries) et d’estimer le coût réel des infections à méningocoques évitables par la vaccination au Canada. Dans le but d’aider les provinces et les territoires dans leur prise de décision, un aperçu des éléments programmatiques pertinents devant être pris en considération est proposé.
Introduction
La méningococcie invasive (MI) est une maladie bactérienne rare, mais grave, qui présente un taux de létalité relativement haut et d’importantes séquelles à long terme, notamment des amputations de membres et des lésions permanentes du système nerveux centralNote de bas de page 1. Compte tenu des cas récents de MI sur les campus universitaires, au cours de l’hiver 2022–2023, au Canada atlantiqueNote de bas de page 2 et des recommandations subséquentes de certain(e)s provinces et territoires (PT) concernant l’immunisation des étudiants de niveau postsecondaire et d’autres jeunes adultes vivant dans des milieux de vie collectiveNote de bas de page 3Note de bas de page 4, le Conseil des médecins hygiénistes en chef a demandé à l’Agence de la santé publique du Canada et au Comité consultatif national de l’immunisation (CCNI) de réviser les directives nationales actuelles sur l’utilisation des vaccins contre le méningocoque du sérogroupe B et des doses de rappel du vaccin conjugué quadrivalent contre le méningocoque (Men-C-ACYW) au sein des établissements d’enseignement postsecondaire. Plus précisément, la question examinée par le CCNI était la suivante : « Est-il nécessaire de proposer à d’autres populations à haut risque d’infection un vaccin contre le méningocoque du sérogroupe B et un vaccin de rappel Men-C-ACYW afin de prévenir les éclosions de MI chez les adolescents et jeunes adultes, âgés de 15 à 24 ans?
Méthodes
Afin de répondre à cette question, le CCNI a procédé à un examen ciblé des données probantes, se concentrant principalement sur les adolescents et les jeunes adultes. Cet examen incluait les lignes directrices nationales et internationales concernant la prévention de la MI au sein des populations à haut risque d’exposition à la MI, les définitions nationales et internationales des populations à haut risque, les caractéristiques du vaccin contre le méningocoque, ainsi que les considérations en matière d’éthique, d’équité, de faisabilité et de l’acceptabilité (ÉÉFA) liées à la vaccination des personnes à haut risque d’exposition à la MI. Les données épidémiologiques des cas de MI survenus entre le 1er janvier 2012 et le 31 décembre 2019 au Canada ont été obtenues à partir d’une analyse préalableNote de bas de page 5. L’Agence de la santé publique du Canada a compilé des données épidémiologiques canadiennes à jour, y compris une analyse sur les éclosions de MI survenues entre 2020 et 2022, par l’intermédiaire d’une demande des données aux PT participants au Système national de surveillance améliorée de la méningococcie invasive qui permet aux PT de déclarer de manière volontaire des données épidémiologiques sur les cas annuels confirmés de MI. Une demande de données a également été faite aux PT ne participant pas actuellement au Système national de surveillance améliorée de la méningococcie invasive afin d’obtenir ces données pendant la même période. Les données de 12 des 13 PT ont été validées, tandis que les analyses de la PT restante étaient fondées sur les soumissions d’isolats fournies au Laboratoire national de microbiologie pour confirmer le sérogroupe et pour la caractérisation plus approfondie de la souche. L’ensemble des analyses étaient normalisées selon l’âge et effectuées selon la méthode directe en utilisant les données du recensement du Canada de 2011. Le groupe de travail MI du CCNI s’est réuni les 10 et 24 mai 2023, le comité complet a examiné les données probantes présentées au groupe de travail MI du CCNI le 5 juin 2023. Le CCNI a approuvé les conclusions le 14 juillet 2023.
Recommandations nationales et internationales en matière de vaccination
Actuellement, le CCNI recommande que les adolescents et les jeunes adultes, en fonction de l’épidémiologie locale et des considérations programmatiques, reçoivent systématiquement une dose de vaccin conjugué monovalent contre le méningocoque de sérogroupe C (Men-C-C) ou de vaccin quadrivalent Men-C-ACYW à l’âge de 12 ans (sixième ou septième année), même s’ils ont déjà été vaccinés lorsqu’ils étaient nourrissons ou enfants en bas âgeNote de bas de page 6. Le CCNI recommande également l’utilisation de vaccin contre le méningocoque à base de protéines qui ciblent principalement le sérogroupe B (vaccin contre le méningocoque du sérogroupe B : Bexsero™, 4CMenB; ou Trumenba™, MenB-fHBP) sur une base individuelle en prenant en compte les préférences individuelles, l’épidémiologie régionale du sérogroupe B et la sensibilité des souches. En ce qui concerne les personnes à haut risque d’infection de MI en raison d’une exposition accrue à la maladie ou de problèmes de santé sous-jacents, le CCNI recommande l’immunisation avec un vaccin contre le méningocoque du sérogroupe B et un vaccin quadrivalent Men-C-ACYW, ainsi qu’une dose de rappel du vaccin Men-C-ACYW pour les personnes dont le risque persisteNote de bas de page 7.
Au Canada, la dose du vaccin Men-C-ACYW destinée aux adolescents est principalement administrée dans le cadre de programmes de vaccination en milieu scolaire, de la quatrième à la douzième année (enfants âgés de 9 à 17 ans)Note de bas de page 8Note de bas de page 9. Huit PT (Île-du-Prince-Édouard [PE], Colombie-Britannique [BC], Alberta [AB], Nunavut [NU], Nouveau-Brunswick [NB], Yukon [YT], Territoires du Nord-Ouest [NT], Québec [QC]) administrent actuellement ce vaccin en neuvième année ou plus tard, c’est à dire typiquement moins de cinq ans avant le début des études postsecondaires. Selon l’hypothèse généralement acceptée que la protection conférée par la vaccination persiste pendant au moins cinq ans, la vaccination proposée dans le cadre de programmes scolaires à la fin de l’adolescence devrait permettre de conserver une protection au cours des premières années de l’enseignement postsecondaire. Récemment, PE et la Nouvelle-Écosse [NS] ont également élargi leurs programmes d’immunisation contre la MI du sérogroupe B afin d’immuniser les adolescents et les jeunes adultes qui résident en groupe au cours des leurs études postsecondaires (e.g. dans un dortoir ou une autre résidence) ou qui vivent pour la première fois dans un établissement d’hébergement collectif pour jeunes Note de bas de page3Note de bas de page 4.
En 2021, 89 % des adolescents de 17 ans au Canada avaient reçu au moins une dose de vaccin contre le méningocoque, ce qui est conforme à l’objectif national de 90 % de couverture vaccinale à cet âgeNote de bas de page 10Note de bas de page 11. En outre, grâce aux actuels programmes de vaccination, le Canada a également atteint son objectif de réduction du nombre d’infections de la maladie, à savoir moins de cinq cas par an de MI causés par le sérogroupe C chez les enfants de moins de 18 ansNote de bas de page 10. La plupart des cas de MI du sérogroupe C surviennent actuellement chez des adultes non vaccinés âgés de plus de 40 ansNote de bas de page 5.
Bien que la majorité des cas de MI au Canada soient sporadiques, des éclosions d’ampleur variable se sont produites à travers le pays. Dans le cadre des mesures générales de santé publique prises pour lutter contre ces éclosions, les PT canadiens ont déjà mis en place des programmes de vaccination ciblésNote de bas de page 12. Plus récemment, les vaccins contre le méningocoque ont été utilisés afin de maîtriser les souches hypervirulentes des sérogroupes B (ST-269) et W (ST-11) au niveau provincial et régional au Québec, en Colombie-Britannique et en Alberta Note de bas de page12Note de bas de page 13.
Sur le plan international, plusieurs administrations recommandent un rappel ou une dose supplémentaire de vaccin contre le méningocoque aux adolescents et aux jeunes adultes qui suivent des études postsecondaires ou qui vivent dans un environnement fermé, y compris les étudiants universitaires qui résident dans des résidences universitaires ou dans des logements résidentiels. Les États-Unis, le Royaume-Uni, l’Australie et la Nouvelle-Zélande considèrent que les étudiants des établissements d’enseignement postsecondaire, notamment ceux en première année d’études et ceux vivant dans un environnement fermé, courent un risque accru de contracter la MI et recommandent donc la vaccinationNote de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 17. Le risque accru de contracter la MI de sérogroupe B dans ces pays est environ trois fois plus élevé chez les jeunes étudiants que chez les jeunes qui ne sont pas aux études, mais qui appartiennent au même groupe d’âgeNote de bas de page 18Note de bas de page 19.
Épidémiologie de la méningococcie invasive au Canada, 2012–2022
Le CCNI a analysé les risques épidémiologiques liés aux différents sérogroupes de la MI au Canada, en fonction du groupe d’âge et de la zone géographique. Depuis l’introduction des programmes de vaccination contre le méningocoque au début des années 2000, l’épidémiologie de la MI au Canada a eu des changements importants. L’incidence de la MI causée par le sérogroupe C a diminué de 93 % et l’incidence générale de MI a diminué de 55 % de la période avant la vaccination à 2015Note de bas de page 20.
Entre 2012 et 2022, un total de 1 196 cas de MI ont été déclarés au Canada. Globalement, l’incidence moyenne de MI au cours de cette période était de 0,31 cas pour 100 000 habitants par an (tableau 1). Toutefois, la répartition selon le nombre de cas, les taux d’incidence et les sérogroupes variait considérablement selon les groupes d’âge et les PT (figure 1).
| Groupe d’âge (années) | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020Note de bas de page b | 2021Note de bas de page b | 2022Note de bas de page b | 2012–2022 (moyenne) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Moins de 1 an | 3,42 | 3,65 | 4,96 | 2,86 | 1,56 | 3,38 | 4,20 | 4,46 | 2,16 | 1,94 | 1,63 | 3,11 |
| 1 à 4 | 1,18 | 1,17 | 0,97 | 0,91 | 0,84 | 0,51 | 0,83 | 1,02 | 0,65 | 0,39 | 0,60 | 0,82 |
| 5 à 9 | 0,44 | 0,27 | 0,10 | 0,05 | 0,20 | 0,20 | 0,05 | 0,15 | 0,20 | 0,10 | 0,15 | 0,17 |
| 10 à 14 | 0,68 | 0,16 | 0,11 | 0,21 | 0,10 | 0,16 | 0,05 | 0,10 | 0,00 | 0,10 | 0,28 | 0,18 |
| 15 à 19 | 1,17 | 0,73 | 0,84 | 0,66 | 0,52 | 0,71 | 0,47 | 0,47 | 0,14 | 0,19 | 0,47 | 0,58 |
| 20 à 24 | 0,51 | 0,25 | 0,17 | 0,33 | 0,25 | 0,79 | 0,37 | 0,53 | 0,36 | 0,24 | 0,28 | 0,37 |
| 25 à 29 | 0,25 | 0,25 | 0,12 | 0,12 | 0,16 | 0,08 | 0,12 | 0,39 | 0,15 | 0,11 | 0,18 | 0,18 |
| 30 à 39 | 0,13 | 0,13 | 0,06 | 0,15 | 0,10 | 0,10 | 0,16 | 0,20 | 0,19 | 0,07 | 0,09 | 0,13 |
| 40 à 59 | 0,31 | 0,16 | 0,18 | 0,20 | 0,13 | 0,15 | 0,31 | 0,20 | 0,19 | 0,09 | 0,15 | 0,19 |
| 60 ans et plus | 0,28 | 0,42 | 0,22 | 0,33 | 0,41 | 0,42 | 0,52 | 0,42 | 0,20 | 0,06 | 0,14 | 0,31 |
| Général (taux brut) | 0,45 | 0,35 | 0,29 | 0,30 | 0,27 | 0,33 | 0,37 | 0,37 | 0,23 | 0,13 | 0,21 | 0,30 |
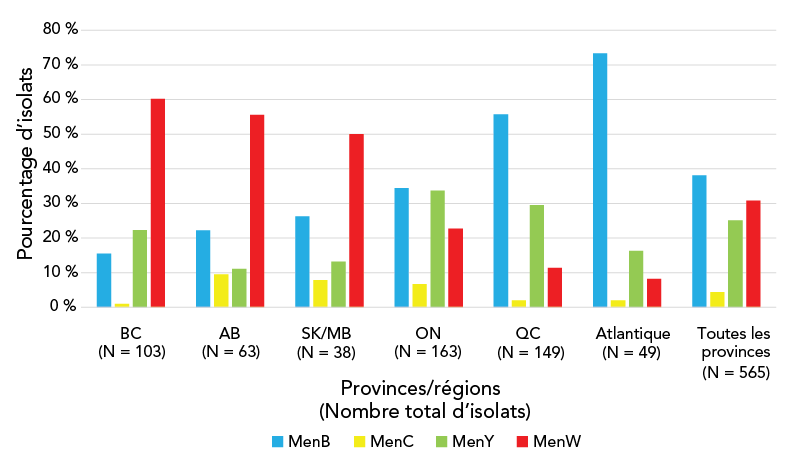
Figure 1 - Équivalent textuel
Pourcentage d’isolats |
Provinces/régions (nombre total d’isolatsNote de bas de page a) | ||||||
|---|---|---|---|---|---|---|---|
| BC (N = 103) |
AB (N = 63) |
SK/MB (N = 38) |
ON (N = 163) |
QC (N = 149) |
Provinces de l’Atlantique (N = 49) |
Toutes les provinces (N = 565) |
|
| B | 16 % | 22 % | 26 % | 34 % | 56 % | 73 % | 38 % |
| C | 1 % | 10 % | 8 % | 7 % | 2 % | 2 % | 4 % |
| Y | 20 % | 11 % | 13 % | 34 % | 30 % | 16 % | 25 % |
| W | 60 % | 56 % | 50 % | 23 % | 11 % | 8 % | 31 % |
Lorsqu’on prend en considération l’âge, les taux d’incidence annuels les plus élevés entre 2012 et 2022 ont été observés chez les nourrissons de moins d’un an (incidence moyenne : 3,11 cas pour 100 000 habitants), suivis par les enfants de 1 à 4 ans (0,82 cas pour 100 000 habitants). Les adolescents de 15 à 19 ans et les jeunes adultes de 20 à 24 ans avaient une incidence moyenne légèrement inférieure à celle des enfants de 1 à 4 ans, avec respectivement 0,58 cas pour 100 000 habitants et 0,37 cas pour 100 000 habitants. Au cours de 2012 à 2022, les enfants de moins de cinq ans présentaient le plus grand nombre de cas (N = 265, soit 23 % du total des cas de MI), suivis par les adolescents de 15 à 19 ans (N = 138, soit 12 % du total des cas de MI) et les adultes de 20 à 24 ans (N = 98, soit 8 % du total des cas de MI).
Entre 2012 et 2022, l’incidence la plus élevée de MI concernait le sérogroupe B (0,14 cas pour 100 000 habitants), suivi du sérogroupe W et du sérogroupe Y (0,06 cas pour 100 000 habitants, respectivement). L’incidence du sérogroupe B était la plus élevée chez les enfants de moins d’un an et les enfants de la tranche d’âge 1 à 4 ans (2,03 et 0,59 cas pour 100 000 habitants, respectivement), suivie du sérogroupe W chez les enfants de moins d’un an (0,48 cas pour 100 000 habitants) et du sérogroupe B dans les groupes d’âge 15 à 19 et 20 à 24 ans (0,34 et 0,17 cas pour 100 000 habitants, tableau 2). Au cours de cette période, le plus grand nombre de cas a été signalé pour le sérogroupe B dans les groupes d’âge de moins de cinq ans (N = 189), de 15 à 19 ans (N = 79) et de 20 à 24 ans (N = 46). Ces cas sont suivis des cas causés par les sérogroupes W et Y chez les enfants de moins de cinq ans (N = 39 cas de sérogroupe W), les adolescents de 15 à 19 ans (N = 15 et N = 30 cas de sérogroupes W et Y, respectivement) et les jeunes adultes de 20 à 24 ans (N = 18 et N = 23 cas de sérogroupes W et Y, respectivement).
| Sérogroupe | Groupe d’âge (années) | Général | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Moins de 1 an | 1 à 4 | 5 à 9 | 10 à 14 | 15 à 19 | 20 à 24 | 25 à 29 | 30 à 39 | 40 à 59 | 60 ans et plus | ||
| B | 2,03 | 0,59 | 0,12 | 0,10 | 0,34 | 0,17 | 0,10 | 0,05 | 0,06 | 0,09 | 0,14 |
| C | 0,07 | 0,01 | 0,01 | 0,01 | 0,02 | 0,02 | 0,00 | 0,02 | 0,02 | 0,02 | 0,02 |
| W | 0,48 | 0,09 | 0,01 | 0,01 | 0,06 | 0,06 | 0,04 | 0,02 | 0,05 | 0,08 | 0,06 |
| Y | 0,17 | 0,02 | 0,01 | 0,03 | 0,13 | 0,07 | 0,03 | 0,02 | 0,05 | 0,09 | 0,06 |
| Non groupale | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,001 |
| AutreNote de bas de page b | 0,00 | 0,00 | 0,01 | 0,00 | 0,01 | 0,01 | 0,00 | 0,00 | 0,00 | 0,00 | 0,003 |
| InconnuNote de bas de page c | 0,24 | 0,06 | 0,01 | 0,01 | 0,03 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 |
La plupart des PT avaient un taux d’incidence annuel moyen de MI inférieur à 0,50 cas pour 100 000 habitants (tableau 3). Cependant, les taux d’incidence normalisés selon l’âge étaient les plus élevés au NU (1,15 cas pour 100 000 habitants par an, IC à 95 % : 0,28–2,00), suivi par NT (0,49 cas pour 100 000 habitants par an, IC à 95 % : 0,07–1,10), NS (0,47 cas pour 100 000 habitants par an, IC à 95 % : 0,27–0,66) et QC (0,44 cas pour 100 000 habitants, IC à 95 % : 0,29–0,59).
| Provinces et territoires | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | 2012–2022 Moyenne (IC à 95 %) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Colombie-Britannique | 0,36 | 0,24 | 0,29 | 0,22 | 0,18 | 0,54 | 0,52 | 0,52 | 0,25 | 0,13 | 0,08 | 0,30 (0,19–0,41) |
| Alberta | 0,41 | 0,35 | 0,22 | 0,28 | 0,19 | 0,20 | 0,58 | 0,32 | 0,28 | 0,19 | 0,10 | 0,28 (0,20–0,37) |
| Saskatchewan | 0,26 | 0,24 | 0,24 | 0,07 | 0,16 | 0,26 | 0,21 | 0,17 | 0,23 | 0,1 | 0,27 | 0,20 (0,15–0,25) |
| Manitoba | 0,16 | 0,66 | 0,23 | 0,36 | 0,60 | 0,41 | 0,37 | 0,48 | 0,27 | 0,34 | 0,53 | 0,40 (0,30–0,51) |
| Ontario | 0,26 | 0,17 | 0,19 | 0,25 | 0,20 | 0,22 | 0,26 | 0,25 | 0,16 | 0,07 | 0,17 | 0,20 (0,16–0,24) |
| Québec | 0,92 | 0,74 | 0,47 | 0,43 | 0,40 | 0,41 | 0,29 | 0,44 | 0,30 | 0,14 | 0,28 | 0,44 (0,29–0,59) |
| Nouveau-Brunswick | 0,83 | 0,45 | 0,26 | 0,72 | 0 | 0,16 | 0,95 | 0,58 | 0 | 0,31 | 0,08 | 0,39 (0,17–0,62) |
| Nouvelle-Écosse | 0,10 | 0 | 0,35 | 0,82 | 0,44 | 0,66 | 0,70 | 0,60 | 0,34 | 0,26 | 0,85 | 0,47 (0,27–0,66) |
| Terre-Neuve-et-Labrador | 0,24 | 0 | 0,41 | 0 | 0,68 | 0,62 | 0 | 0,71 | 0,45 | 0,23 | 0,41 | 0,34 (0,16–0,52) |
| Île-du-Prince-Édouard | 0,76 | 0 | 0 | 0,70 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,13 (0,07–0,33) |
| Yukon | 0 | 0 | 0 | 0 | 0 | 0 | 2,30 | 0 | 0 | 0 | 0 | 0,21 (0,03–0,67) |
| Territoires du Nord-Ouest | 1,79 | 0 | 0 | 0 | 1,87 | 0 | 0 | 1,76 | 0 | 0 | 0 | 0,49 (0,07–1,10) |
| Nunavut | 1,34 | 0 | 3,74 | 0 | 0 | 1,28 | 2,51 | 2,36 | 0 | 1,38 | 0 | 1,15 (0,28–2,00) |
Des tendances à des différences géographiques entre les juridictions canadiennes ont récemment été observées pour les sérogroupes prévalents. Entre 2015 et 2020, les cas de MI confirmés par culture et causés par le sérogroupe W étaient courants dans l’Ouest canadien, représentant plus de cas (60,2 % et 55,6 % des MI en Colombie-Britannique et en Alberta, respectivement) que tous les autres sérogroupes combinés. En revanche, la MI causée par le sérogroupe B était plus fréquente dans l’Est canadien, au Québec et dans les provinces de l’Atlantique, représentant respectivement 55,3 % et 73,3 % des cas de MI (figure 1).
Dans l’ensemble, la majorité des cas de MI au Canada sont survenus au cours des mois d’automne et d’hiver, un pic d’apparition a été observé au mois de janvier (N = 116, 11,8 %), mars (N = 111, 11,3 %) et décembre (N = 97, 9,9 %) (figure 2).
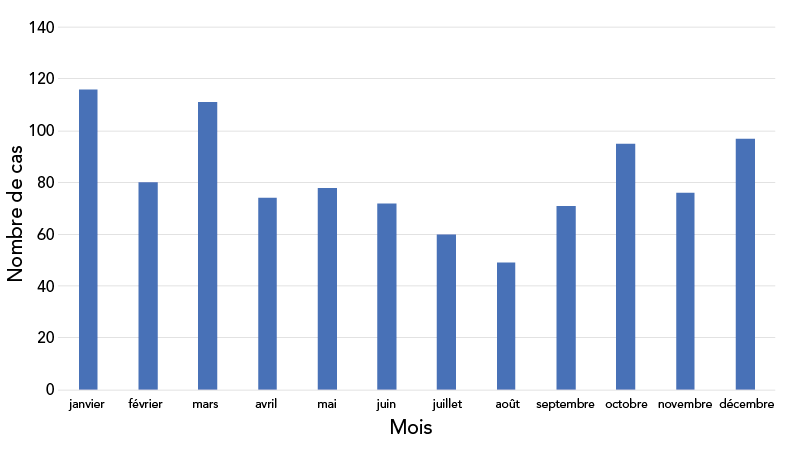
Figure 2 - Équivalent textuel
| Mois | Cas |
|---|---|
| Janvier | 116 |
| Février | 80 |
| Mars | 111 |
| Avril | 74 |
| Mai | 78 |
| Juin | 72 |
| Juillet | 60 |
| Août | 49 |
| Septembre | 71 |
| Octobre | 95 |
| Novembre | 76 |
| Décembre | 97 |
Selon les tests génétiques effectués par le Laboratoire national de microbiologie sur les souches de MI des provinces canadiennes pour la période de 2010 à 2020, plus de 90 % des souches du sérogroupe B devraient avoir une expression des antigènes suffisante pour provoquer une réponse immunitaire chez les personnes ayant reçu l’un des deux vaccins contre le méningocoque du sérogroupe B actuellement autorisésNote de bas de page 21Note de bas de page 22Note de bas de page 23. De même, selon le niveau d’expression de la surface de l’antigène bactérien déterminé par le système de typage des antigènes méningococciques, il a été prédit que le vaccin 4CMenB conférait une protection contre une grande proportion d’isolats de MI du sérogroupe B collectés entre 2010 et 2014 dans toutes les régions du CanadaNote de bas de page 21.
Protection vaccinale contre la méningococcie invasive
Des niveaux élevés d’anticorps sont importants pour la protection contre la MI en raison de la progression rapide de la maladie, et parce que l’activité bactéricide (le mécanisme immunologique principal de protection présumé) est principalement obtenue par l’activation du complément lié à la présence d’anticorpsNote de bas de page 24Note de bas de page 25. Les données disponibles indiquent que la protection contre la MI diminue chez de nombreux adolescents et jeunes adultes au cours des cinq années suivant la vaccination avec les vaccins conjugués contre le méningocoqueNote de bas de page 14Note de bas de page 17Note de bas de page 26Note de bas de page 27Note de bas de page 28. Même si les données sur l’efficacité des vaccins contre le méningocoque du sérogroupe B sont limitées, on estime que plus de 50 % des personnes vaccinées sont protégées jusqu’à quatre ans après la vaccinationNote de bas de page 13Note de bas de page 29Note de bas de page 30Note de bas de page 31Note de bas de page 32Note de bas de page 33Note de bas de page 34. Les vaccins contre le méningocoque du sérogroupe B sont également susceptibles de prolonger la protection contre le méningocoque des sérogroupes non B exprimant les antigènes contenus dans le vaccin. Bien qu’il ne soit pas autorisé pour cet usage, le 4CMenB pourrait également conférer une protection croisée contre le gonocoqueNote de bas de page 29Note de bas de page 35Note de bas de page 36Note de bas de page 37. Cependant, aucun des vaccins pour le sérogroupe B ne semble avoir d’effet sur le portage et, par conséquent, sur l’immunité collectiveNote de bas de page 38Note de bas de page 39Note de bas de page 40.
Évaluation du risque de méningococcie invasive et considérations pertinentes pour le programme
En plus de l’évaluation du fardeau de la maladie, des caractéristiques des vaccins et des programmes de vaccination provinciaux/territoriaux existants, le CCNI a examiné les éléments ÉÉFA pertinents au programme, dans le contexte des définitions du Guide canadien d’immunisation et des recommandations du CCNI concernant les groupes à haut risque en raison d’un risque accru d’exposition.
Conformément au principe d’équité et d’éthique, il a été reconnu que tous les groupes de population à haut risque d’exposition doivent être pris en considération et doivent avoir accès à la vaccination contre la MI. Toutefois, il a également été reconnu que, compte tenu du nombre très limité de cas et du coût élevé des vaccins contre le méningocoque, la vaccination de toutes les personnes qui pourraient présenter un risque accru d’exposition pourrait ne pas être réalisable de la même manière dans tous les PT.
En général, le CCNI a conclu que, compte tenu des particularités du système de santé canadien et des différences en matière de fardeau de la maladie au sein des PT, il est important de laisser aux PT la possibilité de prendre leurs propres décisions quant aux populations à vacciner en priorité. Toutefois, si le niveau de risque varie en fonction de l’épidémiologie locale ainsi que de la période et du type des programmes des PT destinés aux adolescents, il a été reconnu que les recommandations permissives ne devraient pas entraîner une inégalité plus importante en ce qui concerne l’accès aux vaccins (e.g. selon le lieu de résidence ou la capacité des personnes à haut risque d’acheter les vaccins recommandés).
Afin de soutenir les PT dans leur prise de décision, le CCNI a fourni un aperçu des éléments programmatiques pertinents devant être pris en considération lors de l’évaluation du niveau de risque d’un groupe de population et de la prise de décision quant à la nécessité d’un programme MI pour cette population (tableau 4).
| Facteurs programmatiques pertinents | Éléments à prendre en considération |
|---|---|
| Épidémiologie et facteurs de risque |
|
| Caractéristiques du vaccin |
|
| Éthique et équité |
|
| Faisabilité |
|
| Acceptabilité |
|
| Autres |
|
Conclusion
Au Canada, les groupes d’âge qui présentent une incidence plus élevée de MI sont les enfants âgés de moins de cinq ans, suivis des personnes âgées de 15 à 24 ans. En raison des limites des données actuellement collectées, il est difficile de déterminer des facteurs de risque spécifiques (e.g les facteurs associés à une activité ou à un environnement particulier) autres que l’âge et les affections médicales sous-jacentes. Puisque l’épidémiologie de la MI à travers le pays, les administrations présentant une incidence plus élevée dans des groupes des populations particuliers pourraient envisager d’introduire des programmes ciblés (e.g. offrir un vaccin contre le méningocoque adapté au sérogroupe dans un groupe d’âge ayant un taux d’incidence élevé de la MI), incluant également les populations identifiées comme à haut risque d’exposition à la maladie (e.g. étudiants résidant dans des établissements collectifs, enfants et adolescents vivant dans des régions où circulent des clones hypervirulents). Lors de la planification de programmes ciblés, une attention particulière doit être accordée aux souches en circulation dans la région et à l’épidémiologie.
Compte tenu des différences provinciales/territoriales sur les souches circulantes et l’épidémiologie, le CCNI a conclu que la recommandation d’un programme pancanadien unique ciblant d’autres groupes des populations à haut risque d’exposition serait difficile et que des programmes régionaux seraient mieux adaptés pour s’attaquer aux sérogroupes actuellement en circulation et prévenir la MI dans les groupes des populations à plus haut risque d’exposition à la maladie.
Bien que les connaissances sur les MI soient étendues, des études supplémentaires sont nécessaires afin de mieux comprendre les facteurs de risque actuels des MI au sein des groupes des populations les plus touchées (y compris les adolescents et jeunes adultes) au Canada, incluant les activités et les environnements liés à la contamination, au portage et à la transmission de la bactérie. De plus, des recherches supplémentaires sont nécessaires afin d’estimer les coûts réels de la MI et des infections à méningocoques au Canada, y compris les coûts liés à l’absence de programmes de vaccination (e.g. les coûts liés à la recherche des contacts, perturbations scolaires, à la gestion des éclosions, etc.). Il est nécessaire de mettre en place des systèmes de surveillance solides et d’améliorer la collecte de données afin d’assurer un suivi continu des maladies évitables par la vaccination, d’évaluer les programmes et d’ajuster en temps utile les recommandations axées sur l’équité.
Déclaration des auteurs
- A. P. H. — Révision, édition
- J. Z. — Rédaction de la version préliminaire, révision et édition
- C. P. — Rédaction, révision, édition
- O. B. — Rédaction, révision, édition
- M. S. — Révision, édition
- S. D. — Révision, édition
Cette mise à jour a été préparée par J. Zafack, C. Primeau, A. Pham-Huy et S. Deeks, au nom du groupe de travail sur la méningococcie invasive du Comité consultatif national de l’immunisation (CCNI) et a été approuvée par le CCNI.
Intérêts concurrents
Aucun.
Remerciements
Le Comité consultatif national de l’immunisation (CCNI) remercie R. Tsang, K. Franklin, L. Coward, S. Kelly, M. Tunis et K. Young pour leur contribution à cette mise à jour.
Groupe de travail MI du CCNI
Membres : A. Pham-Huy (président), J. Bettinger, Y. Bui, S. Crowe, P. De Wals, V. Dubey, J. Embree, M. Lavoie, C. Muecke, M. O’Driscoll, et M. Sadarangani.
Participants de l’ASPC : O. Baclic, H. Birdi, G. Coleman, L. Coward, K. Franklin, C. Primeau, M. Salvadori, F. Schwarz, R. Tsang, K. Young et J. Zafack.
CCNI
Membres : S. Deeks (président), R. Harrison (vice-président), R. Harrison (vice-président), M. Andrew, J. Bettinger, N. Brousseau, H. Decaluwe, P. De Wals, E. Dubé, V. Dubey, K. Hildebrand, K. Klein, M. O’Driscoll, J. Papenburg, A. Pham-Huy, B. Sander, et S. Wilson.
Représentants de liaison : L. Bill/M. Nowgesic (Association des infirmières et infirmiers autochtones du Canada), L. M. Bucci (Association canadienne de santé publique), S. Buchan (Association canadienne pour la recherche et l’évaluation en immunisation), E. Castillo (Société des obstétriciens et gynécologues du Canada), J. Comeau (Association pour la microbiologie médicale et l’infectiologie Canada), M. Lavoie (Conseil des médecins hygiénistes en chef), J. MacNeil (Centers for Disease Control and Prevention, États-Unis), D. Moore (Société canadienne de pédiatrie), M. Naus (Comité canadien d’immunisation), M. Osmack (Indigenous Physicians Association of Canada), J. Potter (Collège des médecins de famille du Canada) et A. Ung (Association des pharmaciens du Canada).
Représentants d’office : V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes), E. Henry (Centre pour l’immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de santé publique du Canada [ASPC]), M. Lacroix (Groupe consultatif d’éthique en santé publique, ASPC), P. Fandja (Direction des produits de santé commercialisés, Santé Canada), M. Su (Épidémiologie et surveillance de COVID-19, ASPC), S. Ogunnaike-Cooke (CIMRI, ASPC), C. Pham (Direction des médicaments biologiques et radiopharmaceutiques, Santé Canada), M. Routledge (Laboratoire national de microbiologie, ASPC) et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services aux Autochtones Canada).
Financement
Les travaux du Comité consultatif national de l’immunisation sont financés par l’Agence de santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International