Surveillance nationale de l’innocuité des vaccins par le SCSESSI, 2018–2019

 Téléchargez cet article en format PDF (415 ko)
Téléchargez cet article en format PDF (415 ko)Publié par : L'Agence de la santé publique du Canada
Numéro : RMTC : Volume 50-1/2, janvier/février 2024 : Virus Respiratoire Syncytial (VRS)
Date de publication : janvier/février 2024
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 50-1/2, janvier/février 2024 : Virus Respiratoire Syncytial (VRS)
Surveillance
Surveillance nationale de l'innocuité des vaccins par le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI), 2018–2019
Maryem El Jaouhari1, Karin Johnson1, Helen Anyoti1, Yuhui Xu1, Charlotte Wells1, Ashley Weeks1, Allison Yeung1, Amanda Shaw1, Susanna Ogunnaike-Cooke1
Affiliation
1 Centre de surveillance de l'immunisation, Agence de la santé publique du Canada, Ottawa, ON
Correspondance
Citation proposée
El Jaouhari M, Johnson K, Anyoti H, Xu Y, Wells C, Weeks A, Yeung A, Shaw A, Ogunnaike-Cooke S. Surveillance nationale de l'innocuité des vaccins par le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI), 2018–2019. Relevé des maladies transmissibles au Canada 2024;50(1/2):56–65. https://doi.org/10.14745/ccdr.v50i12a06f
Mots-clés : innocuité des vaccins, pharmacovigilance, effets indésirables après la vaccination
Résumé
Contexte : Le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) est un système intégré de surveillance de l'innocuité des vaccins qui comprend une surveillance passive et active des vaccins administrés au Canada. Ce travail présente un résumé des événements indésirables associés à la vaccination (EIAV) à l'échelle nationale pour 2018 et 2019.
Méthodes : Les données extraites du SCSESSI comprenaient toutes les déclarations de manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation reçues par l'Agence de la santé publique du Canada avant le 30 avril 2022, pour les vaccins commercialisés au Canada et administrés entre le 1er janvier 2018 et le 31 décembre 2019. Des statistiques descriptives ont été réalisées sur les déclarations de MCI à la suite d'une immunisation par type de programme de surveillance (i.e., actif ou passif), les MCI à la suite d'une immunisation, les données démographiques, l'utilisation des soins de santé, les résultats, la gravité des effets indésirables et le type de vaccin.
Résultats : Entre 2018 et 2019, 5 875 déclarations de MCI à la suite d'une immunisation ont été reçues de partout au Canada. Le taux annuel moyen de déclaration de MCI à la suite d'une immunisation était de 10,9/100 000 doses distribuées au Canada pour les vaccins administrés en 2018–2019 et s'est avéré inversement proportionnel à l'âge. La majorité des déclarations (91 %) étaient des événements sans gravité, impliquant des réactions au site de vaccination, des éruptions cutanées et des manifestations allergiques. Dans l'ensemble, il y a eu 511 déclarations d'événements indésirables graves (EIG) au cours de la période 2018–2019. Parmi les rapports d'événements indésirables graves, les MCI primaires à la suite d'une immunisation les plus fréquents étaient l'anaphylaxie, suivie des crises d'épilepsie. Aucun problème inattendu lié à l'innocuité des vaccins n'a été relevé, pas plus qu'une augmentation de la fréquence ou de la gravité des effets indésirables.
Conclusion : La surveillance continue par le Canada de l'innocuité des vaccins commercialisés au cours de l'année 2018–2019 n'a pas mis en évidence d'augmentation de la fréquence ou de la gravité des MCI primaires, des MCI précédemment inconnus ou de domaines nécessitant une enquête ou une recherche plus approfondie.
Introduction
La surveillance de l'innocuité des vaccins est essentielle pour détecter tout problème émergent ou tout changement dans la fréquence des MCI à la suite d'une immunisation. L'Agence de la santé publique du Canada (l'Agence) et Santé Canada se partagent la surveillance de l'innocuité des vaccins au Canada.
Le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) est un système fédéral, provincial et territorial (FPT) de surveillance de l'innocuité des vaccins après leur mise sur le marché Note de bas de page 1. Le SCSESSI est géré par l'Agence et est unique en ce sens qu'il comprend à la fois une surveillance passive (rapports spontanés des FPT) et une surveillance active. Les principaux objectifs du SCSESSI sont les suivants : 1) surveiller en permanence l'innocuité des vaccins commercialisés au Canada; 2) repérer les augmentations de la fréquence ou de la gravité des réactions liées aux vaccins déjà relevées; 3) repérer les cas de manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation précédemment inconnus qui pourraient être liés à un vaccin; 4) relever les domaines qui nécessitent des enquêtes ou des recherches plus approfondies; 5) fournir en temps opportun des renseignements sur les profils de déclaration des MCI à la suite d'une immunisation pour les vaccins commercialisés au Canada, ce qui pourrait contribuer à l'élaboration de programmes et de lignes directrices en matière de vaccination Note de bas de page 1.
Au Canada, les prestataires de soins de santé, les fabricants et le public ont tous un rôle à jouer dans la pharmacovigilance des vaccins Note de bas de page 2. Les responsables fédéraux, provinciaux et territoriaux de la santé publique surveillent l'innocuité des vaccins par l'intermédiaire du Groupe de travail sur la vaccinovigilance (GTVV) du Comité canadien sur l'immunisation (CCI). Le GTVV comprend des représentants de tous les programmes de vaccination FPT au pays, ainsi que des organismes de réglementation de Santé Canada et d'IMPACT, le programme canadien de surveillance active de l'immunisation.
Pour de plus amples renseignements sur le SCSESSI, sur IMPACT et sur le GTVV, veuillez vous référer à l'annexe technique, matériel supplémentaire, pour les rapports annuels sur l'innocuité des vaccins. En outre, une description plus complète des rôles et des responsabilités en matière de pharmacovigilance après la mise sur le marché est disponible dans le Guide canadien d'immunisation et sur la page Web du SCSESSI Note de bas de page 1Note de bas de page 2. Des détails sur les calendriers de vaccination provinciaux et territoriaux sont disponibles sur le site Internet de l'Agence Note de bas de page 3. Des rapports nationaux sur les données de surveillance de l'innocuité des vaccins ont été publiés périodiquement à partir des données du SCSESSI Note de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12Note de bas de page 13Note de bas de page 14Note de bas de page 15.
Les objectifs de ce rapport sont de fournir 1) une analyse descriptive des déclarations de MCI à la suite d'une immunisation soumises au SCSESSI pour les vaccins administrés au Canada en 2018–2019, 2) un examen descriptif de l'utilisation des soins de santé et des résultats à la suite d'une MCI à la suite d'une immunisation et 3) une analyse des événements indésirables graves (EIG).
Méthodes
Définitions
Une MCI à la suite d'une immunisation est définie comme tout événement médical fâcheux qui suit la vaccination, mais qui n'a pas nécessairement de relation de cause à effet avec l'administration du vaccin. L'événement indésirable peut être un signe, un symptôme ou une maladie définie Note de bas de page 15.
Dans le cadre du SCSESSI, une MCI grave à la suite d'une immunisation est relevée, sur la base des exigences techniques de la Conférence internationale sur l'harmonisation des exigences techniques relatives à l'homologation des produits pharmaceutiques à usage humain (CIH), comme un événement entraînant la mort, mettant en jeu le pronostic vital et nécessitant une hospitalisation ou la prolongation d'une hospitalisation existante, entraînant une invalidité/incapacité persistante ou importante ou une anomalie congénitale/une malformation congénitale. Tout événement médical qui ne met pas immédiatement la vie en danger, mais qui nécessite une intervention pour prévenir l'une des conséquences énumérées ci-dessus peut également être considéré comme grave Note de bas de page 16.
Sources de données
Le SCSESSI combine les rapports de la surveillance passive et de la surveillance active. La surveillance active est assurée par IMPACT, un réseau de 12 hôpitaux pédiatriques de soins tertiaires au Canada, qui examine les admissions à l'hôpital pour détecter des MCI à la suite d'une immunisation spécifiques. La surveillance passive est mise en place au niveau local de la santé publique et repose sur la déclaration des MCI à la suite d'une immunisation par les prestataires de soins de santé, les personnes vaccinées ou les personnes qui s'occupent d'elles.
Nous avons recherché dans le SCSESSI toutes les déclarations de MCI à la suite d'une immunisation reçues avant le 30 avril 2022 et dont la date d'administration du vaccin se situait entre le 1er janvier 2018 et le 31 décembre 2019. Les formulaires de déclaration des MCI à la suite d'une immunisation utilisés au Canada recueillent des renseignements sur le sexe, l'âge, le vaccin administré, les antécédents médicaux, les médicaments concomitants et les événements indésirables vécus. En outre, les rapports historiques des MCI à la suite d'une immunisation avec une date d'administration du vaccin entre 2008 et 2017 ont été extraits du SCSESSI afin d'évaluer les tendances au fil du temps. Il convient de noter que pour une province ou un territoire, toutes les déclarations de MCI à la suite d'une immunisation n'ont pas été incluses en raison de problèmes techniques liés au téléchargement des renseignements sur la plateforme SCSESSI. Les déclarations de cette province ou de ce territoire qui n'ont pas été incluses étaient d'un volume suffisamment faible pour que ce problème n'ait pas d'incidence sur la confiance que nous accordons aux résultats.
Analyse des données
Des analyses descriptives ont été réalisées pour les déclarations des MCI à la suite d'une immunisation par année, par type de surveillance (active ou passive), par raison principale de la déclaration, par gravité, par utilisation des soins de santé et par résultat. Les taux de MCI à la suite d'une immunisation ont été calculés en utilisant, dans la mesure du possible, des données distribuées par dose. Les taux de MCI à la suite d'une immunisation spécifiques au sexe et à l'âge ont été calculés en utilisant les estimations de la population comme dénominateur. Les données manquantes ont été exclues des calculs. Tous les rapports ont fait l'objet d'un examen médical et seuls les rapports ayant abouti à un décès ont fait l'objet d'une évaluation de la causalité pour ce rapport. Toutes les analyses ont été réalisées à l'aide de SAS EG 7.1 et de Microsoft Excel 2016.
Annexe technique
L'annexe technique contient des descriptions méthodologiques détaillées du processus de déclaration des MCI à la suite d'une immunisation ainsi que de l'extraction et de l'analyse des données de surveillance. En outre, l'annexe contient des renseignements sur les définitions de la surveillance des MCI à la suite d'une immunisation (MCI primaire, surveillance active et passive), sur la manière dont les taux sont rapportés, sur les limites du SCSESSI, sur les abréviations des noms des vaccins et les noms commerciaux/produits commercialisés, sur les catégories/sous-catégories de MCI à la suite d'une immunisation de l'examen des cas médicaux et sur la classification de la gravité des MCI primaires à la suite d'une immunisation dans l'examen des cas médicaux.
Résultats
Principales constatations
Notre recherche a permis de relever un total de 5 875 déclarations de MCI à la suite d'une immunisation entre 2018 et 2019 dans le SCSESSI provenant de 12 provinces et territoires : 2 911 déclarations de MCI à la suite d'une immunisation en 2018 et 2 964 déclarations de MCI à la suite d'une immunisation en 2019. Au cours de cette période, plus de 50 millions de doses de vaccin ont été distribuées. Ces résultats représentent un taux de déclaration de MCI à la suite d'une immunisation de 11,5 pour 100 000 doses distribuées en 2018 et en 2019. Au cours des 11 années précédentes, le taux de déclaration de MCI à la suite d'une immunisation a diminué, passant de 22,5 en 2008 à 11,2 pour 100 000 doses distribuées en 2019 (p < 0,01) (figure 1). La réduction du nombre de déclarations provient de la source de surveillance passive, tandis que le nombre annuel de déclarations provenant de la surveillance active est resté généralement stable au fil du temps.
Figure 1 : Nombre total de MCI à la suite d'une immunisation et taux de déclaration par source de déclaration, 2008–2019 (N = 5 875)Figure 1 note de bas de page a

Figure 1 - Équivalent textuel
| Année | Système passif | Système actif | Total | Doses distribuées | Taux de déclaration des manifestations cliniques inhabituelles (MCI) pour 100 000 doses distribuées |
|---|---|---|---|---|---|
| 2008 | 4 413 | 94 | 4 507 | 20 042 661 | 22,5 |
| 2009 | 3 846 | 116 | 3 962 | 21 650 423 | 18,3 |
| 2010 | 3 958 | 109 | 4 067 | 22 146 408 | 18,4 |
| 2011 | 3 801 | 114 | 3 915 | 23 743 216 | 16,5 |
| 2012 | 3 966 | 100 | 4 066 | 23 717 989 | 17,1 |
| 2013 | 3 356 | 101 | 3 457 | 21 979 521 | 15,7 |
| 2014 | 3 369 | 129 | 3 498 | 23 228 970 | 15,1 |
| 2015 | 3 292 | 108 | 3 400 | 24 762 130 | 13,7 |
| 2016 | 3 185 | 139 | 3 324 | 25 320 590 | 13,1 |
| 2017 | 3 193 | 127 | 3 320 | 23 452 909 | 14,2 |
| 2018 | 2 815 | 96 | 2 911 | 24 484 118 | 11,9 |
| 2019 | 2 856 | 108 | 2 964 | 26 395 876 | 11,2 |
Répartition des événements indésirables après la vaccination par groupe d'âge
L'âge médian de tous les cas signalés en 2018–2019 au moment de la vaccination était de 12 ans (intervalle : nouveau-né à 100 ans). La majorité (55 %) des déclarations de MCI à la suite d'une immunisation concernaient des enfants et des adolescents de moins de 18 ans. Les taux de déclaration par âge étaient plus élevés pour les groupes plus jeunes et plus faibles pour les groupes plus âgés. Les taux étaient les plus élevés pour les enfants de moins d'un an (123,9 pour 100 000 habitants), suivis par les enfants d'un an à moins de deux ans (123,6 pour 100 000 habitants) (figure 2). Dans les autres groupes d'âge, les taux de déclaration étaient inférieurs à 50 pour 100 000 habitants.
Figure 2 : Taux annuel d'événements indésirables associés à la vaccination, par groupe d'âge, 2008–2019 (N = 5 814)Figure 2 note de bas de page a

Figure 2 - Équivalent textuel
| Groupe d'âge | Taux de déclaration des manifestations cliniques inhabituelles (MCI) pour 100 000 doses par année | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | |
| Moins de 1 an | 140,8 | 160,7 | 154,3 | 148,5 | 153,3 | 141,7 | 154,8 | 135,0 | 152,7 | 134,3 | 123,9 | 122,8 |
| 1 à < 2 ans | 327,8 | 267,6 | 252,5 | 237,3 | 197,6 | 145,6 | 143,9 | 144,0 | 153,5 | 153,3 | 123,6 | 124,8 |
| 2 à < 7 ans | 33,8 | 30,2 | 31,3 | 33,2 | 29,5 | 20,9 | 22,2 | 16,3 | 16,0 | 16,3 | 12,0 | 17,0 |
| 7 à < 18 ans | 15,5 | 12,3 | 12,4 | 11,1 | 13,0 | 12,1 | 11,7 | 11,7 | 12,1 | 12,8 | 8,9 | 9,3 |
| 18 à < 65 ans | 5,3 | 4,8 | 4,6 | 4,5 | 5,7 | 4,9 | 5,0 | 5,1 | 4,1 | 4,1 | 3,9 | 3,8 |
| 65 ans et plus | 6,6 | 3,8 | 6,9 | 5,6 | 6,4 | 6,0 | 4,7 | 5,8 | 5,4 | 5,9 | 6,1 | 5,8 |
Dans l'ensemble, entre 2008 et 2019, les taux de déclaration des MCI à la suite d'une immunisation ont diminué dans tous les groupes d'âge. La diminution la plus importante (−62 %) a été observée dans le groupe d'âge de 1 à 2 ans, suivi par le groupe d'âge de 2 à 7 ans (−50 %). Le taux dans ce dernier groupe d'âge a légèrement augmenté entre 2018 et 2019 (+40 %).
Répartition par sexe des MCI à la suite d'une immunisation
Sur les 5 875 déclarations, 60,5 % concernaient des femmes. Comme le montre la figure 3, il semble y avoir une légère prédominance masculine dans les événements indésirables observés chez les enfants de moins de sept ans. La plupart des groupes d'âge présentaient des taux relativement semblables pour les hommes et les femmes; toutefois, dans les groupes d'âge de 18 à 64 ans et de 65 ans et plus, le taux était plus élevé pour les femmes.
Figure 3 : Nombre et taux de déclaration des événements indésirables associés à la vaccination, par groupe d'âge et par sexe, 2018–2019 (N = 5 814)Figure 3 note de bas de page a

Figure 3 - Équivalent textuel
| Groupe d'âge | Nombre de MCI et taux de déclaration pour 100 000 habitants par groupe d'âge et par sexe | |||||
|---|---|---|---|---|---|---|
| Nombre de femmes | Population féminine | Taux de femmes | Nombre d'hommes | Population masculine | Taux d'hommes | |
| Moins de 1 an | 442 | 364 715 | 121,2 | 476 | 383 468 | 124,1 |
| 1 à < 2 ans | 420 | 371 070 | 113,2 | 519 | 391 368 | 132,6 |
| 2 à < 7 ans | 233 | 1 940 339 | 12,0 | 340 | 2 035 358 | 16,7 |
| 7 à < 18 ans | 398 | 4 362 618 | 9,1 | 404 | 4 537 001 | 8,9 |
| 18 à < 65 ans | 1 459 | 23 531 527 | 6,2 | 344 | 23 793 288 | 1,4 |
| 65 ans et plus | 598 | 7 007 036 | 8,5 | 166 | 5 948 526 | 2,8 |
Raison principale de la déclaration de MCI à la suite d'une immunisation
Le tableau 1 présente une ventilation des motifs de soumission d'une déclaration de MCI grave à la suite d'une immunisation pour chaque sous-catégorie de MCI et pour la catégorie globale est indiqué dans le tableau. Les réactions au point de vaccination ont été la MCI à la suite d'une immunisation la plus fréquemment signalée (n = 2 283, 40 %), suivies par les manifestations allergiques ou de type allergique (n = 915, 16 %) et les éruptions cutanées (n = 653, 11 %). Ces trois catégories combinées représentent 67 % de toutes les MCI à la suite d'une immunisation et 14 % de toutes les déclarations d'EIG soumises en 2018–2019. La figure 4 montre que la proportion d'événements graves est la plus élevée dans la catégorie des événements neurologiques (44 %), suivie par celle des infections/syndromes/symptômes systémiques (20 %). Il convient de noter qu'une seule déclaration faisait état d'erreurs de vaccination, ce qui ne constituait pas un événement grave. Toutes les déclarations de MCI à la suite d'une immunisation ont fait l'objet d'un examen médical.
| Principale raison de la déclaration | Motif détaillé de déclarationTableau 1 note de bas de page a | Nombre de déclarations | Déclarations d'événements graves (%) |
|---|---|---|---|
| Manifestations allergiques ou de type allergique | Événements gérés comme une anaphylaxie | 101 | 100 |
| Syndrome oculorespiratoire | 61 | 0 | |
| Autres événements allergiquesTableau 1 note de bas de page b | 753 | 1 | |
| Total | 915 | 12 | |
| Infection/syndrome/symptômes systémiquesTableau 1 note de bas de page c | Fièvre uniquement | 22 | 9 |
| Syndrome grippal | 13 | 0 | |
| Infection | 79 | 27 | |
| Éruption cutanée accompagnée de fièvre et/ou d'autres maladies | 115 | 4 | |
| Syndromes | 39 | 82 | |
| Systémique | 75 | 12 | |
| Total | 343 | 20 | |
| Anxiété liée à la vaccination | Autres problèmes liés à l'anxiétéTableau 1 note de bas de page d | 9 | 0 |
| Présyncope | 12 | 8 | |
| Syncope | 37 | 3 | |
| Total | 58 | 3 | |
| Événements neurologiques | Méningite aseptique | 5 | 100 |
| Ataxie/ataxie cérébelleuseTableau 1 note de bas de page e | 3 | 67 | |
| Paralysie de Bell | 14 | 14 | |
| Encéphalite/encéphalomyélite aiguë disséminée/myélite | 14 | 100 | |
| Syndrome de Guillain-Barré | 13 | 92 | |
| Autres événements neurologiquesTableau 1 note de bas de page f | 64 | 30 | |
| Crise d'épilepsie | 223 | 43 | |
| Total | 336 | 44 | |
| Autre | Arthralgies | 34 | 6 |
| Arthrite | 20 | 10 | |
| Événement gastro-intestinal | 452 | 7 | |
| Épisode hypotonique hyperactif | 48 | 31 | |
| Intussusception | 16 | 75 | |
| Autres événementsTableau 1 note de bas de page g | 427 | 9 | |
| Paresthésie/anesthésie | 61 | 2 | |
| Parotidite | 8 | 0 | |
| Pleurs persistants | 37 | 0 | |
| Syndrome de la mort subite | 2 | 100 | |
| Thrombocytopénie | 30 | 90 | |
| Échec de la vaccination | 1 | 100 | |
| Total | 1 136 | 11 | |
| Éruption cutanée seule | Étendue inconnue | 36 | 0 |
| Généralisée | 530 | 0 | |
| Localisé | 87 | 0 | |
| Total | 653 | 0 | |
| Erreur de vaccination | Total | 1 | 0 |
| Réactions au site de vaccination | Abcès | 21 | 19 |
| Cellulite | 649 | 4 | |
| Gonflement important des membresTableau 1 note de bas de page h | 187 | 2 | |
| Autres réaction localesTableau 1 note de bas de page i | 1 291 | 1 | |
| Douleur à un membre depuis plus de 7 jours | 135 | 1 | |
| Total | 2 283 | 2 | |
|
|||
Figure 4 : Effets indésirables primaires suivant la catégorie de vaccination, par gravité, 2018–2019 (N = 5 726)Figure 4 note de bas de page aFigure 4 note de bas de page bFigure 4 note de bas de page c
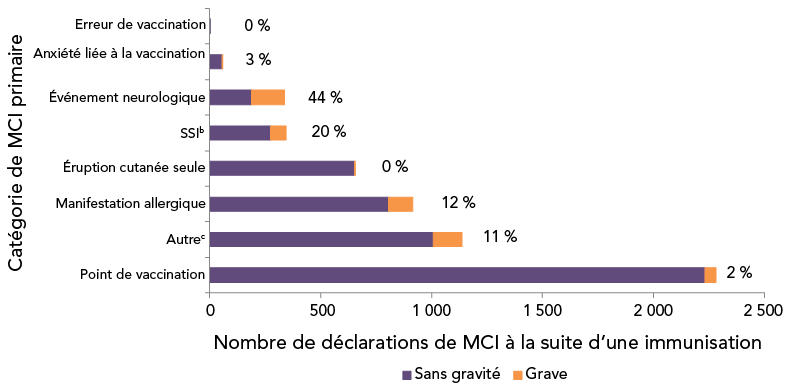
Figure 4 - Équivalent textuel
| MCI primaire | Nombre de déclarations sans gravité | Nombre de déclarations graves | Pourcentage de déclarations graves |
|---|---|---|---|
| Point de vaccination | 2 233 | 50 | 2 |
| Autre | 1 008 | 129 | 11 |
| Manifestation allergique | 805 | 110 | 12 |
| Éruption cutanée seule | 652 | 1 | 0 |
| SSI | 274 | 69 | 20 |
| Événement neurologique | 187 | 149 | 44 |
| Anxiété liée à la vaccination | 56 | 2 | 3 |
| Erreur de vaccination | 1 | 0 | 0 |
La figure 5 montre la répartition des MCI à la suite d'une immunisation par motif principal de déclaration et par groupe d'âge. Les réactions au site de vaccination représentaient le plus grand nombre de MCI à la suite d'une immunisation pour tous les groupes d'âge, sauf pour les enfants de moins d'un an. Chez les enfants de moins d'un an, à l'exclusion de la catégorie d'événements « Autres », la MCI à la suite d'une immunisation la plus fréquemment rapportée était l'éruption cutanée, suivie de l'événement allergique.
Figure 5 : Répartition des événements indésirables associés à la vaccination signalés par groupe d'âge, 2018–2019 (N = 5 726)Figure 5 note de bas de page aFigure 5 note de bas de page bFigure 5 note de bas de page c

Figure 5 - Équivalent textuel
| MCI primaire | Mois de 1 an | 1 à < 2 ans | 2 à < 7 ans | 7 à < 18 ans | 18 à < 65 ans | 65 ans et plus |
|---|---|---|---|---|---|---|
| Manifestation allergique | 13,1 | 11,7 | 15,1 | 16,9 | 20,5 | 10,7 |
| SSI | 8,1 | 13,0 | 5,2 | 3,1 | 3,3 | 3,7 |
| Anxiété liée à la vaccination | 0,1 | 0,0 | 1,2 | 3,5 | 1,1 | 0,3 |
| Événement neurologique | 8,3 | 13,7 | 5,2 | 3,6 | 2,8 | 2,4 |
| Autre | 44,0 | 14,7 | 13,3 | 13,6 | 16,4 | 12,7 |
| Éruption cutanée | 16,8 | 17,4 | 9,0 | 11,8 | 7,2 | 6,5 |
| Erreur de vaccination | 0,1 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Point de vaccination | 8,5 | 26,8 | 49,1 | 44,0 | 45,7 | 61,2 |
Déclaration d'événements indésirables graves
Il y a eu 511 rapports d'EIG sur plus de 50 millions de doses de vaccin distribuées au cours de la période de référence. Ces résultats représentent un taux de déclaration de 0,7/100 000 doses distribuées et de 9 % de toutes les déclarations de MCI à la suite d'une immunisation pour la période 2018–2019. La figure 6 montre la répartition des rapports d'EIG par motif de gravité, l'hospitalisation (77 %) et les événements mettant en jeu le pronostic vital (19 %) étant les plus fréquents.
Figure 6 : Classification des déclarations d'événements indésirables graves, 2018–2019Figure 6 note de bas de page a

Figure 6 - Équivalent textuel
| Classification des déclarations d'événements indésirables graves, 2018–2019 | ||
|---|---|---|
| Sévérité | Fréquence | Pourcentage |
| Décès | 10 | 2,0 |
| Hospitalisation | 394 | 77,1 |
| Menace vitale | 95 | 18,6 |
| Hospitalisation prolongée | 2 | 0,4 |
| Handicap résiduel | 2 | 0,4 |
| Pourcentage de déclarations graves et sans gravité, 2018–2019 | ||
| Sans gravité | 5 364 | 91,3 |
| Grave | 511 | 8,7 |
La raison la plus fréquemment citée pour la déclaration était les événements gérés comme une anaphylaxie (n = 101, 20 %), suivie par les crises d'épilepsie (n = 95, 18,6 %). La majorité (n = 364, 71 %) des patients victimes des EIG signalés étaient complètement rétablis au moment de la déclaration. Pour les patients qui n'étaient pas complètement rétablis au moment de la déclaration, ces déclarations ont été révisées si le SCSESSI a reçu des renseignements actualisés de la part de l'autorité sanitaire fédérale, provinciale ou territoriale déclarante. Les autres résultats des rapports d'EIG comprenaient l'issue fatale (n = 10, 2 %) et l'invalidité/incapacité permanente (n = 2, 0,4 %). La majorité des rapports d'EIG concernaient des enfants et des adolescents de moins de 18 ans (n = 397, 78 %), les trois quarts (75 %) de ces déclarations concernant des enfants de moins de deux ans.
Les 10 rapports de décès ont fait l'objet d'un examen médical minutieux et aucun n'a été considéré comme lié aux vaccins administrés. Sept décès ont été enregistrés chez des enfants de moins de cinq ans; trois de ces décès ont été considérés comme le résultat de conditions médicales préexistantes et trois autres étaient dus à des infections non liées à la vaccination. Dans le septième cas, les renseignements étaient insuffisants et la cause du décès était inconnue. Trois décès ont été signalés chez des adultes de plus de 70 ans et étaient dus à des conditions médicales préexistantes. Dans deux autres cas, les résultats de l'invalidité persistante/significative étaient présents au moment de la déclaration. Aucune information sur les résultats à long terme n'a été obtenue pour ces cas.
Utilisation des soins de santé
Le tableau 2 présente le niveau de soins le plus élevé demandé dans le cas d'une MCI à la suite d'une immunisation. Le plus souvent, il s'agissait d'une visite pour obtenir des soins de santé non urgents (43 %). La plupart des personnes ayant subi une MCI à la suite d'une immunisation (91 %) n'ont pas eu besoin d'être hospitalisées. Dans 24 % des cas, aucun soin de santé n'a été demandé, et il peut s'agir d'autodéclarations de MCI à la suite d'une immunisation moins graves pour les services de santé publique ou les prestataires de soins de santé.
| Niveau de soins le plus élevé demandé (N = 5 489Tableau 2 note de bas de page a) | n | %Tableau 2 note de bas de page b |
|---|---|---|
| Visite non urgente | 2 369 | 43 |
| Aucun | 1 319 | 24 |
| Visite en urgence | 1 119 | 20 |
| Hospitalisation obligatoire | 405 | 7 |
| Conseils téléphoniques d'un professionnel de la santé | 195 | 4 |
| Prolongation de l'hospitalisation en cours | 1 | 0 |
| Clinique de vaccination | 1 | 0 |
| InconnuTableau 2 note de bas de page c | 80 | 1 |
Résultats
Le tableau 3 présente les résultats obtenus au moment de la déclaration pour toutes les déclarations de MCI à la suite d'une immunisation. Une guérison complète a été indiquée dans 74 % des rapports et 0,2 % des rapports ont fait état d'un décès.
| Résultats | Nombre de déclarations | Proportion de déclarations %Tableau 3 note de bas de page b |
|---|---|---|
| Totalement rétabli | 4 244 | 74 |
| Pas encore rétabli | 1 222 | 21 |
| InconnuTableau 3 note de bas de page c | 275 | 5 |
| Invalidité/incapacité permanente | 2 | 0,0 |
| Décès | 10 | 0,2 |
Discussion
En 2018–2019, le taux global de déclaration des MCI à la suite d'une immunisation était de 11,5 pour 100 000 doses distribuées et représentait une diminution statistiquement significative des taux de déclaration au cours des 11 années précédentes. La baisse des taux de déclaration au fil du temps peut être due à une plus grande familiarité avec les effets secondaires attendus des vaccins (associée à une réduction des recours aux soins de santé pour les effets indésirables), à une sous-déclaration et à des modifications des exigences de déclaration par les juridictions au fil du temps. En comparaison avec les taux de déclaration annuels australiens de 2018 et 2019, respectivement de 16,9 et 14,9 pour 100 000 habitants, le taux de déclaration canadien est plus faible, ce qui peut être en partie dû aux différences dans les définitions de cas utilisées, les calendriers de vaccination, les systèmes de surveillance des EIAV, les pratiques de déclaration et les caractéristiques démographiques de la population Note de bas de page 20Note de bas de page 21. Aucun problème d'innocuité des vaccins ou d'augmentation de la fréquence ou de la gravité des événements indésirables n'a été relevé par le GTVV au cours de la période couverte par le rapport.
La majorité des cas de MCI à la suite d'une immunisation concernaient des vaccins administrés à des nourrissons et à de jeunes enfants de moins de deux ans. Ces résultats étaient prévisibles, étant donné que ce groupe d'âge reçoit de nombreux vaccins, à la fois lors d'une seule visite et à des intervalles plus rapprochés, ce qui multiplie les occasions d'associer temporellement des événements indésirables à la vaccination et de les signaler à un prestataire de soins de santé. Pour tous les groupes d'âge, une diminution significative des déclarations de MCI à la suite d'une immunisation a été observée au cours des 11 dernières années, la baisse la plus importante ayant été observée dans le groupe d'âge d'un an à moins de deux ans. Une plus grande proportion de rapports concernait des femmes, ce qui est semblable à d'autres résultats où l'on a constaté que les adultes de sexe féminin rapportaient systématiquement plus d'événements indésirables Note de bas de page 6Note de bas de page 13Note de bas de page 14Note de bas de page 22Note de bas de page 23. Les différences signalées entre les sexes dans les nombres et les taux de MCI à la suite d'une immunisation en fonction de l'âge peuvent également s'expliquer en partie par une couverture vaccinale plus élevée chez les adultes de sexe féminin Note de bas de page 24. Ce résultat est semblable à celui d'autres études portant sur les différences spécifiques au sexe dans les taux de déclaration des MCI à la suite d'une immunisation Note de bas de page 20Note de bas de page 21Note de bas de page 22Note de bas de page 23Note de bas de page 25.
La majorité des événements indésirables signalés pour les quelque 50 millions de doses de vaccin distribuées au Canada étaient des réactions sans gravité au point de vaccination, comme des douleurs et des rougeurs, et des manifestations allergiques, comme une hypersensibilité et des éruptions cutanées. En 2018–2019, 9 % des MCI à la suite d'une immunisation signalées étaient des EIG. En comparaison avec d'autres pays qui utilisent la même définition pour un EIG, cette proportion est plus élevée que celle rapportée en Nouvelle-Zélande (3,5 %) pour la même période Note de bas de page 26 et est inférieure à celle rapportée en Australie en 2018 et 2019 (16 % et 12 %) Note de bas de page 20Note de bas de page 21. Elle est également semblable à celle des années précédentes au Canada (8 % et 9 %)Note de bas de page 6Note de bas de page 14. Les variations de proportions observées entre les différents pays peuvent être dues en partie à des différences de méthodologie, comme indiqué précédemment.
La majorité des EIG déclarés sont survenus chez des enfants et des adolescents, ce qui peut s'expliquer en partie par le programme IMPACT, qui recherche activement des cibles de surveillance spécifiques chez les enfants admis dans 12 hôpitaux pédiatriques de soins tertiaires au Canada, ce qui se traduit par un taux de déclaration plus élevé dans ce groupe d'âge Note de bas de page 27Note de bas de page 28Note de bas de page 29. Le programme IMPACT a contribué à 6 % de toutes les déclarations de MCI à la suite d'une immunisation et à 50 % de toutes les déclarations d'événements graves chez les enfants de moins de 18 ans, ce qui est semblable aux résultats rapportés dans les rapports 2013–2016 et 2017 pour ce groupe d'âge. Dans toutes les catégories d'âge, la proportion d'EIG était la plus élevée dans la catégorie des événements neurologiques, pour laquelle IMPACT effectue des recherches spécifiques. Aucune tendance discernable n'a été remarquée pour le nombre d'événements indésirables graves spécifiques signalés au cours de la période 2008–2019. En ce qui concerne la raison la plus fréquemment citée parmi les déclarations d'EIG, tous groupes d'âge confondus, le nombre et le taux de déclarations de crises d'épilepsie ont diminué de 0,45 à 0,19 pour 100 000 doses distribuées depuis 2016 et sont inférieurs à la fréquence attendue (très rare : moins de 1/10 000 doses distribuées) identifiée par l'Organisation mondiale de la Santé Note de bas de page 30. Le nombre et le taux de déclarations d'événements gérés comme des anaphylaxies sont restés relativement stables depuis 2016, avec un taux de déclaration annuel de 0,20 pour 100 000 doses distribuées (deux par million de doses distribuées), ce qui se situe dans la fourchette attendue de un à dix épisodes par million de doses de vaccins administrées Note de bas de page 31. En ce qui concerne la déclaration de crises d'épilepsie et les déclarations d'événements gérés comme des anaphylaxies, ces déclarations ont été réparties sur plusieurs âges et vaccins, sans qu'il y ait d'agrégats spécifiques à un lot. Il convient de noter que les définitions de cas pour les événements gérés comme de l'anaphylaxie varient légèrement d'une province ou d'un territoire à l'autre. En général, la définition de l'anaphylaxie est intentionnellement très sensible pour garantir que tous les cas potentiels d'anaphylaxie sont pris en compte. Au moment de la rédaction du rapport, la majorité des personnes ayant subi des EIG s'étaient complètement rétablies. Sur les dix décès signalés au cours de cette période de deux ans, aucun ne s'est avéré lié aux vaccins administrés.
Limites
La surveillance passive des infections respiratoires aiguës est sujette à des limitations telles que la sous-déclaration, le manque de certitude quant à la validité diagnostique d'un événement signalé, l'absence d'information concernant d'autres causes potentielles telles que des conditions médicales préexistantes ou des médicaments concomitants, et des pratiques de déclaration des infections respiratoires aiguës différentes d'une juridiction à l'autre au sein du Canada. La surveillance passive détecte les événements temporels; cependant, à partir des MCI à la suite d'une immunisation décrits dans cet article, il n'est pas possible de faire des inférences causales puisque l'évaluation de la causalité n'a été effectuée que pour les rapports qui mentionnaient le décès comme résultat. Malgré ces limites, la surveillance passive est un outil essentiel pour détecter les signaux potentiels d'innocuité des vaccins, en particulier les effets indésirables nouveaux ou inhabituels, trop rares pour être évalués au cours des essais cliniques. La saisonnalité n'a pas été analysée comme une variable potentielle dans ce rapport.
La surveillance active présente également des limites. Le programme IMPACT fait appel à des cibles de MCI à la suite d'une immunisation prédéterminées (comme l'épilepsie), ce qui peut limiter sa capacité à relever de nouvelles réactions indésirables à la vaccination. En outre, si IMPACT couvre 90 % des lits pédiatriques de soins tertiaires et des admissions hospitalières au Canada, il se concentre sur les cas pédiatriques admis, ce qui signifie que seuls les cas les plus graves sont détectés Note de bas de page 29Note de bas de page 30.
Le nombre de doses administrées dans la population n'étant pas disponible au niveau national, le dénominateur utilisé dans le calcul des taux était soit les doses distribuées, soit les statistiques de la population. L'utilisation des doses distribuées comme dénominateur peut sous-estimer les taux, car les doses non utilisées et le gaspillage ne sont pas considérés. En outre, les doses distribuées au cours d'une année peuvent ne pas être administrées au cours de cette même année, ce qui limite encore la précision du dénominateur des doses distribuées. Malgré ces limites, un dénominateur basé sur les doses distribuées pour le calcul des taux a été utilisé dans la mesure du possible dans ce rapport, car un dénominateur basé sur la population suppose une distribution semblable des doses de vaccin dans les sous-groupes de la population, ce qui ne se produit pas forcément dans tous les cas.
Conclusion
Les données du SCSESSI ne font état d'aucun problème d'innocuité vaccinale ni d'aucune augmentation de la fréquence ou de la gravité des effets indésirables attendus. La majorité des MCI à la suite d'une immunisation signalées étaient prévisibles et de nature bénigne, et la proportion globale d'événements indésirables graves était semblable à celle des années précédentes.
Déclaration des auteurs
- M. E. J. — Conceptualisation, méthodologie, investigation, logiciel, analyse formelle, validation, rédaction–version originale, rédaction–révision et édition
- K. J. — Conceptualisation, méthodologie, rédaction–version originale, rédaction–révision et édition
- Y. X. — Conceptualisation, rédaction–révision et édition, supervision
- C. W. — Rédaction–projet initial, rédaction–révision et édition, méthodologie, validation
- H. A. — Enquête, rédaction–version originale, rédaction–révision et édition
- A. W. — Validation, rédaction–révision et édition
- A. Y. — Rédaction–révision et édition
- A. S. — Rédaction–révision et édition, supervision
- S. O. — Rédaction–révision et édition, supervision
Intérêts concurrents
Aucun.
Remerciements
Ce rapport n'aurait pas été possible sans la contribution du public, des fournisseurs de soins de santé, des professionnels de la santé publique, des enquêteurs et des infirmières monitrices du Programme canadien de surveillance active de l'immunisation (IMPACT), de la Société canadienne de pédiatrie et des autorités de santé publique locales/régionales et provinciales/territoriales qui soumettent des rapports au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI), ainsi que sans la collaboration continue des membres du Groupe de travail sur la vaccinovigilance (GTVV). En outre, nous tenons à remercier les membres de ce groupe, y compris les réviseurs médicaux et les codeurs du SCSESSI, pour leur contribution et leur soutien à l'élaboration de ce rapport. Nous tenons à remercier toutes les personnes qui ont pris le temps de soumettre une déclaration d'événement indésirable associé à la vaccination pour leur contribution à l'innocuité des vaccins au Canada.
Financement
Ce travail a été financé par l'Agence de la santé publique du Canada.
Matériel supplémentaire
Ces documents peuvent être consultés dans le dossier Matériel supplémentaire.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International