Comité scientifique sur le Plan de gestion des produits chimiques (PGPC) Exposé des objectifs Réunion no 5; 16 et 17 novembre 2016 Intégrer des méthodologies fondées sur une nouvelle approche dans le PGPC Identification des priorités pour l'évaluation des risques Programme de l'évaluation des risques des substances existantes
Table des matières
Liste des tableaux et figures
- Figure 3-1. Critères utilisés pour la classification de la Liste intérieure des substances
- Figure 3-2. Mécanismes d'identification des priorités
- Tableau 4-1. Modèles de R(Q)SA disponibles utilisés pour les évaluations de la mutagénicité bactérienne
- Figure 4-1: Établir le niveau de priorité ou de préoccupation en fonction de l'écart (c.-à-d. RBE) entre la bioactivité (convertie en une dose) et l'exposition estimative
- Figure B-1. Cadre conceptuel général de l'approche RISK21
- Figure B-2. Cadre NextGen de l'EPA des É.U. pour la science du risque
- Figure B-3. Feuille de route d'évaluation de l'innocuité d'aliments et d'ingrédients
- Figure B-4a. Organigramme présentant le niveau 1 du cadre proposé
- Figure B-4b. Organigramme présentant le niveau 2 du cadre proposé
1.0 Objectifs de la réunion
Santé Canada (SC) et Environnement et Changement climatique Canada (ECCC) travaillent à l'élaboration d'une feuille de route d'intégration de méthodologies fondées sur une nouvelle approche (MNA)Note de bas de page1 à l'évaluation des risques traditionnelle. Il est prévu de solliciter des commentaires du Comité scientifique sur le PGPC à diverses étapes. La feuille de route devrait aborder de multiples aspects de l'évaluation des risques liés aux produits chimiques, notamment l'établissement des priorités, la caractérisation des dangers, la caractérisation de l'exposition et la caractérisation du risque. L'élaboration de la feuille de route sera réalisée par étape et contribuera tant aux initiatives à court terme (soit la phase 3 du PGPC) qu'à long terme (après 2020).
Cette réunion met l'accent sur les outils et méthodologies nouveaux et émergents pouvant être appliqués à l'identification des priorités en matière d'évaluation des risques. Les objectifs de cette réunion comportent deux volets : 1) obtenir des commentaires généraux sur l'élaboration d'une feuille de route pour l'intégration des MNA au modèle d'évaluation des risques; 2) obtenir des commentaires précis sur la façon d'améliorer les approches actuelles d'établissement des priorités grâce à l'intégration des MNA.
Le Comité scientifique sur le PGPC a reçu le mandat de répondre à plusieurs questions stratégiques figurant dans le présent exposé dans le contexte du programme de l'évaluation des risques pour des substances existantes de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)].
2.0 Vers une feuille de route pour l'intégration des MNA dans le programme d'évaluation des risques
Près de 10 ans se sont écoulés depuis la publication du rapport du Conseil national de recherches sur les essais de toxicité au 21e siècle (CNR, 2007) et nous commençons maintenant à voir l'incidence des percées dans les sciences et technologies biologiques au moyen de criblages à haut débit (CHD), des données -- omiques, et des méthodes in silico pour l'évaluation du risque potentiel pour la santé humaine posé par les produits chimiques. En outre, la nécessité d'élaborer des stratégies d'essais pour l'évaluation des risques environnementaux a été relevée par le Centre européen d'écotoxicologie et toxicologie des produits chimiques (ECETOC) (ECETOC, 2007). Ces stratégies d'essais comprennent l'utilisation de seuils de préoccupation toxicologique (SPT), des relations (quantitatives) structure-activité (R(Q)SA), des méthodes des références croisées, des protocoles d'essais in vitro et l'établissement de la priorité d'essais d'écotoxicité sur des organismes invertébrés. De plus, l'ECETOC (2007) a reconnu l'utilisation de renseignements sur le mode d'action (MA) pour des substances chimiques à action précises et la nécessité de traiter des lacunes en matière de données.
Depuis la publication des premiers rapports fondamentaux, l'intérêt international envers l'utilisation de technologies émergentes pour l'évaluation des risques réglementaire a beaucoup progressé. Notamment, sur demande du ministre de la Santé (au nom de l'Agence de réglementation de la lutte antiparasitaire), le Conseil des académies canadiennes (CAC) a publié, en 2012, un rapport intitulé « Nouvelles technologies et évaluation de la sécurité chimique ». Le groupe d'experts a conclu que les éléments probants disponibles suggéraient que le défi actuel du manque de données sur la toxicité de nombreux produits chimiques industriels pourrait être relevé en adoptant des approches intégrées en matière d'essais et d'évaluation (IATA) des produits chimiques (CCA, 2012).
En fait, certaines des stratégies émergentes en matière d'essais et d'évaluation des risques de toxicité commencent à être appliquées dans la pratique comme l'illustrent des études de cas prototypiques (Karmaus et coll., 2016; Pham et coll., 2016; Shah et Greene, 2014), alors que d'autres sont intégrées dans les outils existants (p. ex., le modèle pharmacocinétique physiologique, le modèle de dose de référence, la régression catégorielle et la boîte à outils des RQSA de l'Organisation de coopération et de développement économiques (OCDE)) pour rehausser et renforcer les pratiques en matière d'évaluation des risques. En adoptant une approche d'étude de cas pour sensibiliser l'auditoire international présent, un récent atelier scientifique topique de l'Agence européenne des produits chimiques (AEPC) a approfondi l'utilisation de données et de renseignements de MNA pour un certain nombre d'activités réglementaires, y compris le criblage et l'établissement des priorités, les techniques de référence croisées et les activités futures d'évaluation des risques (voir AEPC, 2016 pour les principaux résultats et conclusions de l'atelier). Il est intéressant de noter que le besoin d'une meilleure compréhension de la taxonomie de méthodes qui pourraient être appliquées a été reconnu et que l'utilisation flexible et novatrice de nouvelles approches pourrait engendrer un changement dans les pratiques futures d'évaluation réglementaire (AEPC, 2016).
La feuille de route planifiée est vue comme une stratégie qui cartographie les objectifs à court et à plus long terme du programme avec des outils et applications MNA spécifiques existants et émergents. La feuille de route préciserait les outils MNA disponibles ou émergents et illustrerait leur utilisation respective et scientifiquement solide dans des contextes de prise de décision précis liés à l'établissement des priorités et à l'évaluation des risques. La feuille de route guidera nos efforts de modernisation du programme d'évaluation des risques et facilitera l'acceptation de l'utilisation de technologies émergentes dans les pratiques futures d'établissement des priorités et d'évaluation des risques et, ultimement, renforcera nos programmes globaux d'établissement des priorités et d'évaluation des risques. Le processus d'élaboration de la feuille de route contribuera également à cerner les lacunes en matière de connaissances où des recherches ou une expertise additionnelles sont nécessaires. En raison de l'avancement rapide des MNA, la feuille de route sera en « évolution continue » et intégrera des outils additionnels à mesure qu'ils seront développés.
Le gouvernement du Canada a présenté sa méthodologie d'établissement des priorités et d'évaluation des risques en mettant en place le programme actuel d'évaluation des risques des substances de la LCPE (1999). Elle comprend ce qui suit :
- Processus initial d'établissement des priorités utilisé en 2006 pour trier ou « classifier » la totalité des 23 000 substances chimiques figurant sur la Liste intérieure des substances (LIS) nécessitant davantage d'attention en vertu du PGPCNote de bas de page2;
- Processus continu d'identification des priorités en matière d'évaluation des risques (IPER)Note de bas de page3, qui est utilisé pour mettre à jour nos priorités en matière d'évaluation des risques de manière continue (c.-à-d., le processus postérieur à 2006 pour relever les « nouvelles » priorités); et
- Approches d'exécution d'évaluations des risques en vertu du PGPC (boîte à outils d'évaluation des risques)Note de bas de page4.
À l'heure actuelle, ces approches n'incorporent pas de MNA de manière importante. Toutefois, des stratégies conceptualisées (voir la section 2.21) ont été décrites par d'autres, lesquelles s'attardent sur l'utilité potentielle des MNA pour l'établissement des priorités et l'évaluation des risques. Dans la section 2.21 figurent des exemples résumés de ces stratégies, y compris le projet de « Next Generation Compliance » (NextGen) de l'Environmental Protection Agency (EPA) des É.-U. et le projet d'Évaluation des risques au 21e siècle (RISK21). Ces stratégies conceptuelles sont utiles pour présenter quels types de MNA pourraient être intégrées dans le processus d'IPER ou la boîte à outils d'évaluation des risques et sont utilisées au soutien de l'évaluation des risques liée à la prise de décision. Toutefois, SC et ECCC cherchent ultimement à élaborer une feuille de route composée d'applications spécifiques et pratiques qui pourraient être intégrées dans les méthodologies citées plus haut pour l'établissement des priorités et la caractérisation des risques. Un exemple d'outil spécifique, nommément un cadre fondé sur des données d'essais de toxicité (Thomas et coll., 2013), figure à la section 2.2. Cet outil illustre les types d'applications spécifiques et pratiques que SC et ECCC envisagent pour la feuille de route alors que nous travaillons à l'atteinte de nos objectifs d'intégration de MNA qui conviennent aux fins d'établissement des priorités et d'évaluation des risques en vertu de la LCPE (1999).
2.1 Stratégies conceptuelles d'intégration de MNA à l'établissement des priorités et à l'évaluation des risques
Stratégie RISK21 de l'International Life Sciences Institute de l'Institut scientifique de la santé et de l'environnement
La stratégie RISK21 a été élaborée par l'Institut scientifique de la santé et de l'environnement (ISSE) au sein de l'International Life Science Institute (ILSI) au moyen de la collaboration de scientifiques provenant de nombreux pays représentant des gouvernements, des institutions d'enseignement, des organisations non gouvernementales ainsi que sectoriellesNote de bas de page5(Embry et coll., 2014). La stratégie d'évaluation intégrée précise les considérations qui peuvent être utilisées pour la prise de décision à diverses étapes de l'évaluation du risque (c.-à-d. de l'établissement de la priorité jusqu'à l'évaluation quantitative du risque). Le processus comprend la formulation de problèmes ainsi que des considérations relatives à l'exposition et à la toxicité (et leurs croisements) afin d'évaluer si des perfectionnements additionnels sont nécessaires à une prise de décision donnée en matière d'évaluation des risques (Embry et coll., 2014). La stratégie d'évaluation du risque fondée sur l'exposition utilise le concept de sources hiérarchisées de renseignements, une complexité accrue et davantage de ressources étant nécessaires pour les évaluations de niveaux supérieurs. La stratégie promeut l'utilisation d'un niveau approprié qui permet l'utilisation la plus efficiente qui soit des ressources pour prendre une décision fournissant le niveau de précision nécessaire dans un contexte de décision donné. Embry et ses collègues ont relevé les niveaux 0 à 3 pour la caractérisation du danger, où les SPT et les RQSA sont jugées être de niveau 0, les essais in vitro avec une extrapolation appropriée in vitro à in vivo (EIVIV) de niveau 1 et les analyses des extrémités apicales in vivo et du mode d'action sont jugées être des sources de renseignements respectivement de niveaux 2 et 3.
De la même manière, pour la caractérisation des expositions, la complexité et les besoins en ressources augmentent pour des approches à plusieurs niveaux. Des exemples d'approches de niveau 0 comprennent des estimations conservatrices fondées sur des renseignements limités comme les propriétés physicochimiques et les utilisations. Les approches d'exposition de niveaux 1, 2 et 3 comprennent respectivement les approches déterministe, probabiliste et de biosurveillance (Embry et coll., 2014). La stratégie est reproduite à la Figure B-1 de l'Annexe B. Il convient de noter que cette philosophie de répondre aux fins recherchées se reflète également dans la boîte à outils d'évaluation des risques du PGPC (GC, 2016).
Projet NextGen de l'EPA des É.-U. : Un cadre pour la science du risque de prochaine génération
En 2011, l'EPA des É.-U. a entamé les travaux sur le projet NextGen, un cadre qui modernise et élabore un paradigme en science des risques qui intègre les récentes percées de la méthodologie toxicologique et liée aux expositions (EPA des É.-U., 2014). Le cadre traite de la formulation de problèmes, de l'évaluation du risque et de la gestion du risque. À l'étape d'évaluation du risque, des méthodes d'identification du danger, d'évaluation de la dose-réponse et d'évaluation de l'exposition qui utilisent de nouveaux outils et nouvelles technologies scientifiques sont proposées. Cela comprend des CHD et des méthodes computationnelles en biologie et en toxicologie pour l'identification du danger et l'évaluation de la dose-réponse; des méthodes d'EIVIV (pour le calibrage de la dosimétrie in vitro et humaine); l'épidémiologie moléculaire et génétique (pour identifier les voies de perturbation toxique dans des études basées sur des populations) et une spectrométrie de masse à haute performance (pour générer des données d'exposition humaine afin d'évaluer le risque) (Krewski et coll., 2014). Cette stratégie proposée est reproduite à la Figure B-2 de l'Annexe B.
Nouvelles méthodologies dans les stratégies d'évaluation de l'innocuité des aliments et des ingrédients
Une stratégie pour envisager de nouvelles méthodologies dans l'évaluation de nouveaux aliments, ingrédients et mélanges a été proposée par divers scientifiques de groupes universitaires et sectoriels en Europe. Cette stratégie comprend l'utilisation de R(Q)SA, de SPT et de modèles d'EIVIVet des considérations de stratégies intégrées d'essais fondées sur des voies de résultats défavorables (Blaauboer et coll., 2016). Cette stratégie est reproduite à la Figure B-3 de l'Annexe B.
2.2 Exemple d'un outil spécifique fondé sur les MNA
Cadre fondé sur des données du 21e siècle pour une évaluation à plusieurs niveaux
Un cadre fondé sur des données pour les essais de toxicité, dirigé par le Hamner Institutes for Health Sciences, avec des contributions de divers experts (y compris des chercheurs de SC) a été élaboré (Thomas et coll., 2013). Ces travaux intégraient des MNA dans une approche à plusieurs niveaux avec la possibilité d'une application internationale élargie au sein de nombreuses agences réglementaires. Le premier niveau du cadre proposé intègre l'utilisation de criblages in vitro à haut débit pour attribuer des substances chimiques dans des MA sélectifs et non sélectifs. Dans les deux cas, les concentrations des criblages in vitro (c.-à-d., la bioactivité in vitro) sont converties en doses appliquées au moyen de l'EIVIV. Des modèles d'exposition à haut débit sont alors utilisés pour estimer l'exposition humaine et une mesure de type marge d'exposition (ME) est générée en comparant ces estimations avec la bioactivité in vitro convertie en dose appliquée (Thomas et coll., 2013). Bien que le terme ME soit utilisé dans la publication, afin de distinguer ce type de calcul d'un calcul traditionnel de la marge d'exposition (qui suppose habituellement un effet néfaste), il est souvent appelé le ratio bioactivité-exposition (RBE). Si ce RBE est supérieur à une certaine valeur préétablie, aucun autre essai n'est nécessaire et une valeur de référence (p. ex., une dose de référence) peut être établie en fonction de la stratégie d'essai de niveau 1. Si le RBE est inférieur à la valeur préétablie, un essai de niveau 2 est exécuté. L'essai de niveau 2 est composé d'études transcriptomiques in vivo à court terme pour des substances chimiques non sélectives et des études ciblées in vivo pour confirmer le MA de substances chimiques sélectives. De la même manière, les ME sont générés et comparés à une valeur préétablie; s'ils sont inférieurs à cette valeur, la substance passe à l'essai de niveau 3, qui est composé d'études de toxicité de référence standard (Thomas et coll., 2013). L'organigramme de ce cadre est présenté dans les Figures B-4a et B-4b de l'Annexe B.
Le National Center for Computational Toxicology de l'EPA des É.-U. continue de faire progresser l'avancement d'une stratégie multidimensionnelle à plusieurs niveaux pour l'application de MNA, qui comprend l'utilisation d'essais transcriptomiques à haut débit qui comportent la compétence métabolique comme méthode préalable de criblage.
Question stratégique 1 : Le comité a-t-il des commentaires pour SC et ECCC alors qu'ils progressent dans l'élaboration d'une feuille de route d'intégration de méthodologies fondées sur une nouvelle approche (MNA) et sur la modernisation des évaluations des risques?
3.0 Identification des priorités en matière d'évaluation du risque
Comme il a été mentionné, le deuxième objectif de cette réunion est d'examiner les méthodes actuelles du gouvernement du Canada utilisées pour identifier les priorités en matière d'évaluation des risques (section 3.0) et cerner les outils basés sur les MNA qui peuvent être utilisés pour soutenir, étendre et améliorer les pratiques actuelles d'établissement des priorités.
3.1 Processus historiques et actuels
Les travaux principaux en matière d'évaluation des risques actuellement menés sur les substances existantes en vertu du PGPC touchent les quelque 4 300 substances identifiées au cours de la classification. Le processus de classification a pris fin en 2006 et était fondé sur les renseignements alors disponibles. La Figure 3.1 présente les critères utilisés par SC et ECCC pour identifier les priorités lors de la classification de la LIS.
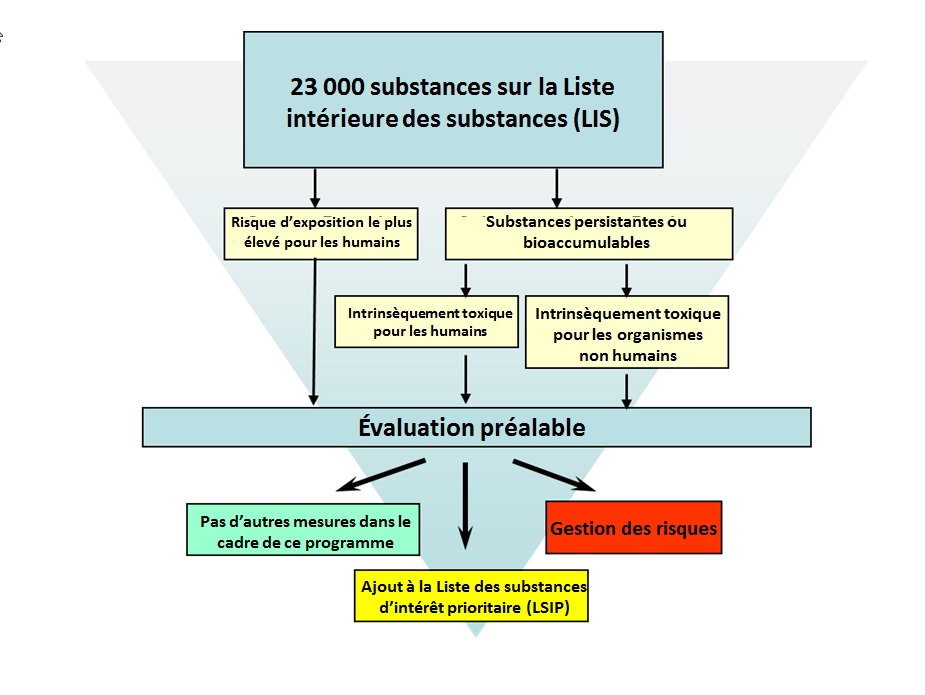
Longue description pour la figure 3-1
La classification des substances de la Liste intérieure des substances (LIS) comprend l'évaluation de ces substances par Santé Canada et Environnement et Changement climatique Canada. Ces deux ministères utilisent des critères différents pour identifier les substances figurant sur la LIS qui nécessitent plus d'attention de la part du gouvernement du Canada.
Environnement et Changement climatique Canada est chargé d'examiner toutes les substances de la LIS et d'établir celles qui sont persistantes et bioaccumulables selon le Règlement sur la persistance et la bioaccumulation. Les substances qui sont persistantes ou bioaccumulables et qui sont également, selon Environnement et Changement climatique Canada, intrinsèquement toxiques pour les organismes non humains, sont classifiées comme nécessitant une plus grande attention au moyen d'une évaluation préalable.
Santé Canada examine également ces substances persistantes ou bioaccumulables, et celles qu'il juge intrinsèquement toxiques pour les humains sont classifiées comme nécessitant une plus grande attention au moyen d'une évaluation préalable. Santé Canada est également chargé d'identifier les substances sur la LIS qui présentent le potentiel le plus élevé d'exposition humaine, et ces substances sont également ajoutées à la liste des substances classifiées comme nécessitant une plus grande attention au moyen d'une évaluation préalable.
Lorsque l'évaluation préalable est achevée, il y a trois résultats possibles : 1) aucune mesure additionnelle en vertu du programme; 2) ajout à la Liste des substances prioritaires; 3) gestion du risque.
En plus de ces critères, SC a également identifié comme prioritaires toutes les substances qui ont été jugées comme posant un danger élevé envers la santé humaine (c.-à-d. classifiées par une autre agence en fonction de leur cancérogénicité, leur mutagénicité ou leur toxicité pour le développement ou la reproduction, tel qu'identifiés par l'outil de SC « Simple Hazard »). Plus de détails sur les approches utilisées figurent sur les sites Web de SC et d'ECCCFootnote6.
À l'automne 2009, un rapport sur des substances toxiques préparé par le Bureau du vérificateur général (BVG) soulignait la nécessité que le programme demeure à jour. Le rapport du BVG a mentionné qu'« Étant donné que les renseignements et la recherche scientifiques ne sont pas immuables, il est important qu'Environnement Canada et Santé Canada se tiennent au courant des nouveaux renseignements, comme les dangers et les voies d'exposition, concernant les substances toxiques. » (BVG, 2009) En 2011, le Rapport d'évaluation de Phase 1 du PGPC a fourni une orientation additionnelle : « Élaborer et mettre en œuvre un processus officiel et des critères, pour le déclenchement de la réévaluation des substances lorsque de nouvelles données sont publiées. » (Santé Canada, 2011) En réponse à ces rapports, en 2014, ECCC et SC ont publié le rapport intitulé « Approche d'identification des substances chimiques et des polymères jugés prioritaires pour l'évaluation des risques en vertu de la Partie 5 de la LCPE de 1999 » (IPER) qui présentait les améliorations dans la façon dont les nouveaux renseignements étaient acquis, évalués et intégrés dans la planification prospective et officialisait la stratégie d'identification des priorités en matière d'évaluation des risques. L'approche de l'IPER a été appliquée pendant deux années consécutives, une fois en 2015 et une fois en 2016; l'approche et les résultats de l'examen de 2015 sont disponibles sur le site Web des substances chimiquesFootnote7.
Le processus d'IPER est divisé en trois étapes : Acquisition, Évaluation et Action. Chaque étape est expliquée ci-après.
Acquisition
La Figure 3-2 présente le mécanisme de collecte des renseignements actuellement pris en compte dans l'approche de l'IPER. Les données sont recueillies de manière continue et le processus d'examen tient compte de tous les renseignements disponibles à l'égard d'une substance donnée comme base pour une recommandation (c.-à-d. l'évaluation des risques, la collecte ou la génération de données additionnelles ou aucun autre travail nécessaire à cette étape). L'approche d'IPER n'est pas normative en ce qui concerne les sources des données utilisées et il est prévu que la liste des sources de données envisagées au cours des cycles d'examen futurs s'allongera comme il convient. Toutefois, en raison des défis que présente le fait de demeurer au fait de nouveaux renseignements à l'égard de longues listes de substances comme la LIS, les sources de données actuellement incluses dans le processus se limitent à celles qui sont facilement accessibles -- et consistent habituellement en des compilations de décisions, classifications ou autres données tabulées internationales. Cela limite la quantité et le type de sciences émergentes qui peuvent être identifiées au moyen du processus actuel puisqu'elles sont souvent disponibles dans la littérature accessible et non dans des bases de données ou en format Microsoft Excel (p. ex., avec la tabulation des numéros de registre du Chemical Abstracts Service (NE CAS) et des résultats). Les substances qui ont été jugées comme ne nécessitant pas d'autres travaux au cours d'un cycle d'examen seront prises en compte dans un cycle d'examen ultérieur si de nouveaux renseignements deviennent disponibles.
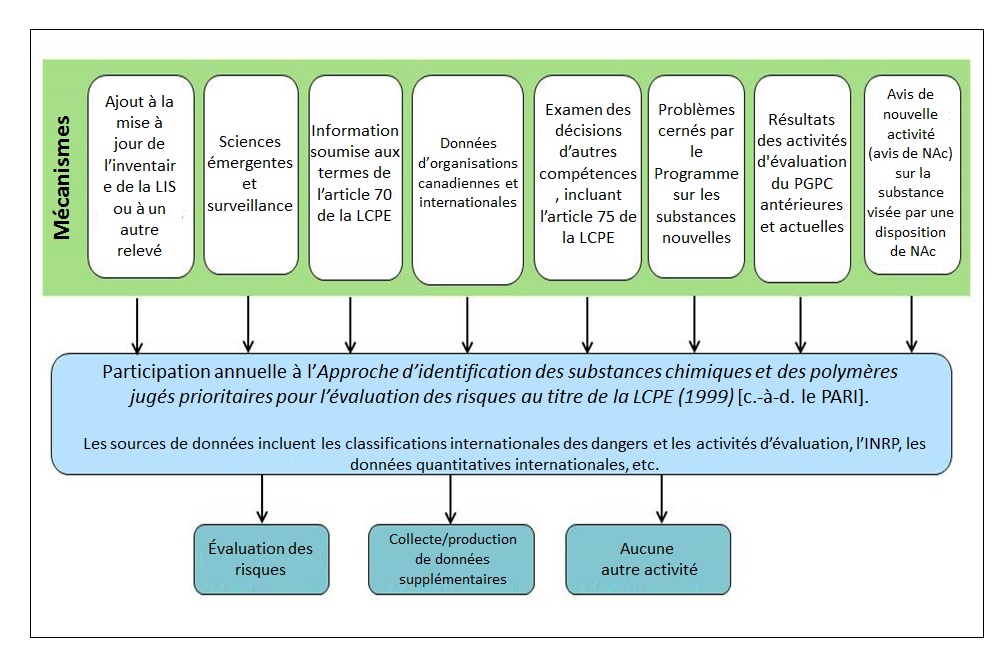
Longue description pour la figure 3-2
Pour identifier les substances prioritaires, huit mécanismes sont utilisés. Ces mécanismes conduiront à une évaluation du risque, ou la collecte ou à la production de données additionnelles, ou n'entraîneront pas de travaux additionnels.
(Abréviations : INRP, Inventaire national des rejets de polluants; DRNAI, Dispositions relatives à une nouvelle activité d'importance.)
Mise à jour de l'inventaire de la LIS ou autre relevé : Des initiatives de collecte de renseignements, comme des avis émis en vertu de l'article 71 de la LCPE de 1999 où des quantités et des utilisations canadiennes sont déclarées, permettent d'identifier des substances à fort potentiel d'exposition ou faisant l'objet d'un changement de statut commercial. Ces renseignements peuvent être comparés avec des indicateurs de danger pour identifier les substances présentant une préoccupation potentielle.
Sciences émergentes et surveillance : Des scientifiques au sein de programmes relèvent des sciences émergentes qui suggèrent qu'une substance suscite une préoccupation. La surveillance exercée en vertu du PGPC constitue une source de données canadiennes sur l'exposition utilisées pour identifier les substances décelées chez des humains ou dans l'environnement. La prise en compte de données de MNA pourrait s'inscrire dans ce mécanisme.
Article 70 : Cet article de la LCPE de 1999 nécessite que les intervenants fournissent des renseignements à l'ECCC lorsque les résultats soutiennent raisonnablement la conclusion que la substance est toxique ou est en mesure de le devenir, identifiant ainsi les substances possiblement dangereuses.
Données d'organisations canadiennes et internationales : Un certain nombre de sources de données intérieures et internationales sont comprises dans l'examen pour identifier les indicateurs de danger ou d'exposition. Par exemple, des substances de plus en plus déversées dans l'environnement peuvent être identifiées à l'aide des données de l'Inventaire national des rejets de polluants de l'ECCC. Les activités internationales d'identification des dangers font également l'objet d'un suivi pour voir quelles substances sont priorisées pour évaluation ailleurs et à l'égard de quelles substances il y a eu accroissement de l'importation ou de la fabrication. À ce jour, les sources spécifiques de renseignements utilisées dans le cadre de l'examen d'IPER comprennent ce qui suit :
- Les classifications du danger d'agences internationales (p. ex., le Centre international de recherche sur le cancer (CIRC) de l'Organisation mondiale de la santé)
- Les classifications du Système général harmonisé (SGH) de classification et d'étiquetage des produits chimiques (p. ex., à partir des renseignements de classification et d'étiquetage harmonisés de l'AEPC)
- Listes internationales des substances restreintes ou interdites ou autres priorités internationales (p. ex., substances extrêmement préoccupantes (SEP) de la liste de candidats de l'AEPC)
- Avis à Santé Canada relatifs aux substances utilisées dans les cosmétiques
- Données non confidentielles déclarées en vertu de la règle de signalement de données chimiques de la EPA des E.U.
- Biosurveillance, surveillance environnementale et données de surveillance
Examen des décisions d'autres compétences, incluant l'article 75 : Les décisions réglementaires prises dans d'autres juridictions sont également utilisées pour indiquer les substances potentiellement préoccupantes ou pouvant faire l'objet d'un examen en vertu de l'article 75.
Problèmes balisés par le Programme des nouvelles substances d'ECCC : Le programme des nouvelles substances reçoit des études d'Avis de nouvelles substances qui peuvent soulever des préoccupations pour d'autres substances semblables commercialisées au Canada. Ces données sur des substances analogues peuvent également guider l'identification de priorités futures en matière d'évaluation des risques.
Résultats des activités d'évaluation antérieures au PGPC : Les données utilisées dans le cadre d'évaluations antérieures ou continues du PGPC qui révèlent un danger élevé peuvent également être pertinentes pour d'autres substances non actuellement identifiées comme une priorité en matière d'évaluation (p. ex., des substances analogues).
Avis de nouvelle activité : Lorsqu'un Avis de nouvelle activité (NAc)) est reçu à l'égard d'une substance visée par une disposition relative aux nouvelles activités importantes, une évaluation est exécutée.
Évaluation : Le personnel d'ECCC et de SC effectue une analyse périodique des renseignements ayant été acquis. Une série de facteurs est prise en compte et pondérée, tandis que des jugements sont portés quant à l'importance relative de différents indicateurs. L'évaluation peut être complexe puisque, pour chaque substance, on comptera des types de renseignements complètement différents et que les activités réalisées précédemment au sujet d'une substance sont prises en compte. Les décisions en matière d'établissement des priorités sont guidées par un ensemble de principes et de considérations précisées dans le document de la Stratégie d'IPER (ECCC, 2014).
Mesure : Si une substance est identifiée comme candidate à des travaux additionnels, les mesures qui suivent peuvent être prises :
- Évaluation des risques
- La substance peut être ajoutée au plan de travail actuel sur l'évaluation des risques (p. ex., similitude avec des substances d'un groupe déjà inscrit; possibilité de collaborer avec d'autres; situation d'urgence) ou des activités futures d'évaluation des risques peuvent être prévues à son égard.
- Collecte/production de données supplémentaires
- La substance peut être incluse dans des activités futures de collecte de données si des renseignements additionnels, en eux-mêmes ou parallèlement aux mesures mentionnées plus haut, contribuaient à établir la prochaine étape appropriée.
- De plus, des partenaires internes ou externes peuvent participer à la collecte ou à la génération de renseignements additionnels (y compris au moyen de recherches, de suivis ou de surveillance).
- Aucun travail additionnel pour l'instant
- L'indicateur de danger ou d'exposition peut ne pas justifier des travaux additionnels pour l'instant. Ces substances pourraient être signalées au cours de cycles futurs d'IPER si de nouveaux renseignements deviennent disponibles.
En général, pour qu'une substance soit identifiée à titre de priorité en matière d'évaluation des risques, le processus relèverait des indicateurs de risque, c'est-à-dire la présence d'indicateurs tant en matière de danger que d'exposition au Canada. Si seuls des indicateurs de danger sont identifiés (ou si seules des données internationales en matière d'exposition sont disponibles), la mesure proposée serait habituellement de confirmer l'exposition canadienne au moyen de la collecte de renseignements additionnels. Si les résultats de cette collecte de renseignement indiquent qu'il y a un fort potentiel d'exposition, la substance serait alors signalée pour une évaluation des risques au cours du cycle suivant d'IPER.
3.2 Résultats
L'examen de 2015 a permis de relever 28 substances à titre de candidates à une évaluation des risques et 194 substances devant être assujetties à une collecte de renseignements additionnels.
Les substances candidates à une évaluation des risques ont été identifiées en fonction de la présence de forts indicateurs tant en matière de danger humain ou écologique que d'exposition au Canada. Il a été recommandé d'intégrer ces substances aux plans actuels d'évaluation des risques du PGPC et, dans la plupart des cas, accroissent les groupes de substances qui sont déjà prioritaires dans le PGPC3.
Les substances candidates à une collecte de données ont été identifiées en fonction de leurs indicateurs en matière de danger et d'exposition internationale. Elles nécessitent que des données additionnelles soient recueillies pour établir si elles sont prioritaires à l'égard d'une évaluation des risques. Habituellement, la raison est que le statut commercial au Canada est incertain. Il existe plusieurs options disponibles pour combler ce besoin en données y compris, mais sans s'y limiter, leur ajout à des avis futurs en vertu de l'article 71 comme des mises à jour d'inventaires ou des avis ciblés, et leur ajout à des plans de recherche et de suivi.
Par le passé, l'établissement de la priorité des substances a été exécuté en fonction d'une préoccupation écologique lorsqu'il y a des éléments probants de toxicité et de persistance ou de bioaccumulation. Toutefois, au cours de l'examen d'IPER de 2016, des données de MNA ont été utilisées comme sources de données additionnelles pour identifier les substances potentiellement préoccupantes sur le plan écologique. Ces données ont été utilisées pour signaler des substances nécessitant une collecte de renseignements additionnels lorsqu'il existait des concentrations et des quantités d'utilisation potentiellement élevées, sans égard aux éléments probants en matière de persistance ou de bioaccumulation. Plus spécifiquement, les substances comportant un indicateur d'alerte, des données expérimentales indiquant une toxicité élevée et des quantités d'utilisation élevées à l'échelle internationale ont été priorisées pour la collecte de données. Bien que les données de MNA aient été utilisées au sein de l'IPER à titre de source de données pour identifier les substances potentiellement préoccupantes sur le plan écologique, elles n'ont pas constitué le seul élément utilisé dans cette approche pour identifier les substances devant subir une évaluation des risques.
3.3 Leçons apprises
Le processus d'IPER continue d'être adapté à mesure de l'expérience acquise au cours des examens. Les sources de données utilisées dans le processus font l'objet d'un suivi continu à des fins de mises à jour et la liste de sources s'allonge lorsque de nouvelles sources sont cernées. En raison de la grande quantité de travail nécessaire pour mener cet exercice, les sources de données les plus pratiques sont constituées de compilations ou de bases de données de décisions, de classification ou d'autres données tabulées internationales (p. ex., le CDR des É.-U. ou les données sur les quantités canadiennes de l'article 71). Par conséquent, il a été difficile d'identifier les nouvelles priorités en fonction des données publiées dans la littérature. À ce jour, nous n'avons pas élaboré de processus réalisable pour l'examen de publications scientifiques individuelles. Nous nous appuyons fortement sur d'autres juridictions et organisations pour l'examen de la littérature et les ajouts aux compilations ou aux bases de données que nous utilisons déjà ou pour identifier de nouvelles substances à titre de priorités dans leur juridiction. La définition d'un processus au moyen duquel nous pourrions identifier et utiliser des outils et technologies en émergence pour recueillir et colliger des renseignements individuels serait bénéfique pour le Canada pour identifier les priorités en matière d'évaluation.
En outre, bien que nous ayons maintenant accès à la science émergente sous la forme de bases de données (p. ex., les résultats de CHD), qui peut être intégrée dans le processus d'IPER, il est nécessaire de rechercher des renseignements sur la meilleure façon d'interpréter ces résultats et de les appliquer à l'identification de nouvelles priorités en matière d'évaluation des risques.
Alors que les données sur le danger sont universelles (c.-à-d. que la toxicité n'est pas tributaire de l'emplacement), l'exposition peut varier d'un pays à l'autre. Bien que le processus d'IPER cherche à identifier les indicateurs d'exposition des substances, il a été ardu d'identifier des renseignements utiles en matière d'exposition sans collecte de données additionnelles (p. ex. au moyen d'avis sur les utilisations au Canada). Les approches d'identification des renseignements sur l'exposition au Canada, ou des données de remplacement, seraient utiles à la formulation de meilleures recommandations en matière d'évaluation des risques.
4.0 Établissement des priorités à l'avenir
Après l'achèvement des deux premiers cycles du processus d'IPER, des ajustements sont envisagés pour tenir compte de certaines des leçons apprises et améliorer l'ensemble du processus. Les ajustements envisagés comprennent les suivants : 1) approches computationnelles systématiques pour atténuer la charge de travail associée à l'activité et, possiblement, intégrer une approche systématique de classement du danger, de l'exposition et du risque; et 2) intégration de MNA (tant du point de vue de l'exposition que du danger) afin de mieux traiter les produits chimiques pour lesquels les sources de données traditionnelles sont insuffisantes et pour exploiter et utiliser la science émergente.
4.1 Approches computationnelles systématiques
Afin d'améliorer l'efficience et l'efficacité des cycles d'IPER futurs, une approche plus systématique, s'appuyant sur des éléments computationnels est recherchée. La collecte de renseignements auprès de sources de données nouvelles et émergentes pourrait être facilitée par l'utilisation de techniques de collecte de données computationnelles. Par la suite, il est concevable qu'une approche de classement soit appliquée pour identifier les priorités en matière d'évaluation sans s'appuyer aussi lourdement sur d'autres juridictions et organisations.
Par le passé, des scénarios systématiques ont été élaborés pour utilisation dans le programme existant d'évaluation des risques des substances pour soutenir l'établissement des priorités, y compris : 1) les critères écologiques (Robinson et coll., 2004) et de santé humaine précisés pour le processus de classification de la LIS (c.-à-d., SimHaz et ComHaz (outils de dangers simple et complexe)) (Hughes, Paterson et Meek, 2009); 2) les critères écologiques précisés dans le document Approche à la classification des risques écologiques (CRE) des substances organiques d'ECCC (ECCC, 2016). Un autre exemple est l'exercice d'établissement des priorités ayant guidé le plan de travail de la Toxic Substances Control Act de 2014 de l'EPA des É.-U.
Plus particulièrement, un élément de ce scénario systématique comprenait l'attribution d'une note pour chaque produit chimique en fonction du danger qu'il présentait, de son exposition et de son potentiel de persistance ou de bioaccumulation. L'ensemble de l'approche est bien documentée et les décisions individuelles en matière d'établissement des priorités sont décrites de façon transparente au moyen de l'utilisation de notes normalisées.
Comme il est mentionné plus haut, le processus actuel utilisé pour relever de nouvelles priorités en matière d'évaluation des risques au sein du programme existant d'évaluation des risques de substances a été exécuté manuellement et nécessite beaucoup de travail. À l'avenir, nous recherchons un processus plus efficient et efficace à l'aide d'approches systématiques. Certains travaux ont été étudiés par les ministères pour intégrer des techniques de traitement automatique de données et autres outils computationnels (p. ex., des scripts qui traitent les données et calculent les mesures de risque) pour faciliter le processus d'établissement des priorités. Il est également envisagé que des approches basées sur les MNA pourraient être intégrées dans ces approches systématiques.
Question stratégique 2 : Le comité a-t-il des commentaires à l'intention de SC et d'ECCC sur l'utilisation des approches systématiques dans le cadre du processus d'IPER? Le Comité a-t-il connaissance d'approches computationnelles particulières qui pourraient servir à réduire les ressources requises pour compléter l'IPER?
4.2 Les MNA pour contribuer à faciliter l'établissement des priorités
Comme il a été mentionné plus haut, un élément clé pour le développement de l'approche d'IPER a été d'officialiser l'approche d'IPER du programme. L'intégration de MNA dans le processus d'IPER permettra d'apporter des améliorations aux méthodes actuelles d'identification des indicateurs de danger et d'exposition. Normalement, la génération de renseignements de MNA requiert moins de ressources que des études de référence in vivo typiques et ces renseignements sont donc générés plus rapidement par diverses organisations de par le monde. Puisque nombre de substances existantes commercialisées au Canada comportent peu de données traditionnelles, les MNA fournissent l'occasion d'identifier des priorités en l'absence de telles données. Plus loin figure une introduction à certaines approches envisagées à l'avenir pour l'identification de nouvelles priorités en matière d'évaluation des risques (de la documentation connexe est également fournie). L'aperçu constitue une amorce quant à l'état actuel des connaissances et de l'expérience du gouvernement du Canada à ce jour en matière de MNA. Le Comité est chargé de fournir des commentaires sur les exemples inclus, toutefois, il est également demandé au Comité d'élargir la portée des possibilités en identifiant de nouvelles approches, méthodologies et considérations pour améliorer le processus actuel d'établissement des priorités.
Exposition : Comme il est mentionné plus haut, une des limites du processus actuel d'établissement des priorités est la disponibilité d'outils qui faciliteraient le processus d'identification des indicateurs d'exposition. Des méthodes additionnelles de criblage ou d'essais contribueraient à l'identification de nouvelles priorités en matière d'évaluation des risques (p. ex., méthodes de criblages ciblés, soupçonnés ou non ciblés). Les approches de criblages non ciblés constituent une autre option pour l'IPER ou pour cibler des activités futures de recherche ou de surveillance. Le criblage ciblé (criblage semi-quantitatif ou qualitatif) de mélanges pour lesquels des normes de références existent a été utilisé pour l'obtention rapide d'un aperçu d'un grand nombre de contaminants connus (souvent dans la surveillance d'aliments et l'analyse de résidus) et à fait la distinction facile entre les résultats positifs et négatifs sous un certain seuil de détection. Lorsque la présence d'un produit chimique est soupçonnée, ce criblage a également été utilisé pour confirmer cette présence (p. ex., soupçons de présence de produits de dégradation).
Pendant un criblage non ciblé, aucun renseignement sur une substance présente dans un échantillon n'est disponible; ces renseignements sont plutôt uniquement tirés de chromatogrammes et de spectres de masse. Ces nouvelles approches de criblage ont déjà été étudiées à l'aide d'échantillons environnementaux (p. ex., eau potable et usée, poussière) (Commission européenne, 2013; Ferrero et coll., 2015; Krauss, Singer et Hollender, 2010; Miljo-Direktoratet, 2013; Rager et coll., 2016) et plus récemment, à l'aide d'échantillons humains (Plassmann et coll., 2016). Toutefois, ces méthodes comportent également des processus d'évaluation des données nécessitant une grande quantité de travail, le besoin d'une validation additionnelle et d'autres stratégies pour réduire les milliers de pics relevés dans un seul échantillon.
D'autres nouvelles méthodes d'approches envers l'exposition peuvent comprendre l'élaboration de fourchettes d'exposition pour une sous-population donnée pour des scénarios d'exposition communs (p. ex., eau potable, cosmétiques, additifs alimentaires, peintures), l'étude d'autres modèles en matière d'exposition et l'intégration de données provenant de diverses bases de données d'expositions. Elles comprennent la modélisation d'expositions par rapport à un éventail de formulations ou de concentrations possibles en fonction des utilisations historiques ou des données de composition connues, semblables aux travaux menés par Isaacs et collègues (2016) à l'égard de produits de soins personnels et des données d'expositions comme la base de données sur les catégories de produits chimiques (Dionisio et coll., 2015). Ces approches sont particulièrement utiles lorsque les renseignements à l'égard de la concentration d'une substance pour une utilisation donnée sont inconnus mais trouvés dans d'autres juridictions. Elles peuvent également comprendre la capacité de comparer des résultats de modèles avec des expositions connues à l'aide de données de biosurveillance humaine pour des expositions groupées pour contribuer à l'établissement des priorités de types d'expositions, de manière semblable aux travaux du projet de modèle informatique de prédiction des expositions à haut débit (ExpoCasttm) de l'EPA des É.-U. ou l'étude d'autres approches de modélisation (p. ex., le Stochastic Human Exposure and Dose Simulation [SHEDS] - Modèle d'exposition légère (EPA des É.-U., 2016). Enfin, l'utilisation de ces résultats d'évaluations d'exposition à haut débit pourrait être étudiée plus en profondeur, y compris la comparaison de résultats de CHD des dangers afin d'établir la priorité de substances aux fins d'évaluation des risques dans le cadre du processus d'IPER.
Question stratégique 3 : Dan le but d'estimer l'exposition humaine et écologique aux fins de l'établissement des priorités (IPER), le Comité scientifique sur le PGPC a-t-il des suggestions d'outils basés sur les MNA qui pourraient faire l'objet d'une analyse subséquente?
Danger
Modèles in silico (p. ex., R(Q)SA) : Des modèles in silico constituent également un outil qui peut être intégré dans le processus d'IPER. Les modèles in silico guident actuellement la façon dont les priorités écologiques sont établies en vertu de l'IPER. L'identification d'alertes mécanistes et de profilages de concentrations élevées a été exécutée par ECCC à l'aide d'un logiciel de profilage chimique (appelé le Profileur chimique d'ECCC). Le profileur chimique d'ECCC est un outil de criblage pour les substances persistantes, bioaccumulables et toxiques (PBT) et la toxicité mécanistique. Il utilise le Simplified Molecular-Input Line-Entry System (SMILES) pour générer le profil d'un produit chimique en fonction :
- des alertes structurelles pour les mécanismes de toxicité;
- des modèles R(Q)SA, et
- des données expérimentales disponibles pour les extrémités choisies.
Plusieurs des résultats pertinents de la boîte à outils des RQSA de l'OCDE (2015) et des modèles de l'OASOS-CATALOGIS (2014) et de l'OASIS-TIMES (2014) du Laboratoire de chimie mathématique sont intégrés dans le logiciel de profilage chimique d'ECCC. Des données empiriques sont recueillies à partir de bases de données disponibles dans la boîte à outils RQSA de l'OCDE, ainsi que dans certaines bases de données personnalisées d'autres sources. Le cycle d'examen 2016 de l'IPER a tenu compte des alertes structurelles basées sur un mécanisme qui suivent du profileur chimique : liaison de protéine à l'ADN, liaison du récepteur aryl-hydrocarbone et affinité de liaison entre le récepteur d'œstrogène et le récepteur d'androgène. Les données du prédicteur de toxicité de l'EPA des É.-U. (ToxCast) n'ont pas été utilisées pour guider l'identification des priorités en matière de préoccupation écologique en raison de la difficulté liée à l'extrapolation fondée sur des résultats néfastes.
Bien que non utilisés à l'heure actuelle pour l'identification des indicateurs de dangers pour la santé dans le processus d'IPER, SC a une expérience approfondie de l'utilisation de modèles de R(Q)SA à titre de renseignement à l'appui des évaluations des risques pour la santé humaine dans le cadre du PGPC.
Une des méthodes proposées pour l'utilisation de modèles de R(Q)SA serait d'appliquer la directive du Conseil international d'harmonisation des exigences techniques pour l'enregistrement des médicaments à usage humain (CIH) M7 pour l'évaluation des impuretés réactives de l'ADN dans les produits pharmaceutiques (FDA, 2015) dans le processus d'IPER. La directive recommande d'utiliser deux méthodes de R(Q)SA complémentaires pour prédire la mutagénicité bactérienne d'une impureté. Selon la directive, une méthodologie de R(Q)SA doit être fondée sur la règle experte et la seconde doit s'appuyer sur la statistique. L'absence d'alertes structurelles de ces deux méthodologies complémentaires de R(Q)SA est suffisante pour conclure qu'il n'y a pas de raisons de s'inquiéter de la mutagénicité de l'impureté, auquel cas il n'est pas recommandé d'effectuer d'autres analyses (FDA, 2015). SC et ECCC ont récemment publié une nouvelle méthodologie fondée sur une approche d'espace chimique qui utilise d'importantes bases de données toxicologiques internationales pour rehausser la confiance dans les prédictions du modèle de R(Q)SA (Kulkarni, Barton-Maclaren et Benfenati, 2016). Plus tôt, nous avons élaboré une approche consensuelle de R(Q)SA qui intègre les prédictions d'une série de modèles de R(Q)SA, chacune fondée sur un algorithme prédictif unique, pour obtenir une prédiction fiable du potentiel de mutagénicité d'un produit chimique (Kulkarni etd Barton-Maclaren, 2014). Dans le cadre de notre collaboration internationale, nous avons également élaboré de nouveaux modèles de R(Q)SA conçus pour des catégories précises de composés organiques et avec une prédictivité rehaussée pour la mutagénicité d'Ames (Manganelli et coll., 2016). De telles approches pourraient être utilisées pour étudier les indicateurs de danger liés à la mutagénicité, pour ensuite établir la priorité de ces substances pour une collecte de données additionnelles ou à titre de candidates à une évaluation des risques. Nous reconnaissons que la validation du modèle est une étape importante de l'application de tout nouvel outil de prédiction (ou existant); par conséquent nous avons mené des exercices de validation à l'égard de toutes les nouvelles approches ou modèles que nous avons élaborés. Des logiciels qui utilisent les deux types d'approches de modélisation sont actuellement utilisés dans le cadre du programme et des exemples sont fournis dans le Tableau 4.1. Tous les modèles énumérés sont conformes aux principes de validation des R(Q)SA de l'OCDE (OCDE, 2014).
| Nom du modèle | Type de méthodologie | Référence |
| Derek Nexus (v4.1.0) Sous-modèle : Mutagénicité in vitro (bactérienne) |
Fondée sur la règle experte | Lhasa Limited, 2014 |
| Toxtree (v2.6.13) Sous-modèle : Mutagénicité in vitro (essai d'Ames) par intersouche Istituto superior di Sanità (ISS) |
Fondée sur la règle experte | Ideaconsult Ltd., 2015 |
| Applicateur de modèles Leadscope (v2.1) Sous-modèle : Série d'alertes de génotoxicité d'experts (mutagénicité bactérienne) |
Fondée sur la règle experte | Leadscope, 2013 |
| Applicateur de modèles Leadscope (v2.1) Sous-modèle : Mutation génétique in vitro microbienne (salmonelle) |
Fondée sur la statistique | Leadscope, 2013 |
| OASIS-TIMES (v2.27.19) Sous-modèle : Mutagénicité d'Ames activée S9 |
Hybride (reconnaissance de caractéristique fondée sur la règle experte + structure fondée sur la statistique) jumelé à un simulateur métabolique | Laboratoire de chimie mathématique, 2015 |
| MultiCASE CASEUltra (Modèle de souche mixte de mutagénicité de la salmonelle) |
Fondée sur la statistique | MultiCASE Inc., 2015 |
| MultiCASE CASEUltra (règle d'expert pour la mutagénicité bactérienne) |
Fondée sur la règle experte | MultiCASE Inc., 2015 |
| ACD/Percepta (modèle d'Ames sur la salmonelle) |
Fondée sur la statistique | Advanced Chemistry Development, Inc., 2016 |
| CEASAR (modèle d'Ames sur la salmonelle) |
Fondée sur la statistique | VEGA, 2015 |
Les exemples qui figurent dans le Tableau 4.1 mettent l'accent sur la prédiction de mutagénicité, toutefois, pour d'autres effets d'intérêt pour l'établissement des priorités, il y a d'autres modèles disponibles. Rybacka et collègues (2014) ont évalué l'utilité de modèles prédictifs en libre accès et commerciaux pour établir la priorité des essais de toxicité de produits chimiques industriels à faible volume en vertu du programme de Règlement de la Communauté européenne relatif à la déclaration, l'évaluation, l'autorisation et la restriction des substances chimiques (DEARS) de l'AEPC. Les effets liés à la classification et à l'étiquetage sont analysés, y compris leur cancérogénicité, leur mutagénicité et leur toxicité pour la reproduction. Au cours de leur analyse de validation, des prédictions fiables ont été obtenues pour la cancérogénicité, toutefois, d'autres effets (comme la toxicité pour la reproduction) ont été jugées être moins fiables. Dans l'ensemble, davantage d'orientation pour les proposants a été nécessaire afin d'intégrer l'outil pour la DEARS (Rybacka, Rudén, et Andersson, 2014). Dans le cadre de nos travaux en collaboration, nous avons également travaillé à l'élaboration d'approches visant à rehausser la confiance dans l'utilisation d'outils prédictifs pour des effets complexes, comme la toxicité pour le développement (Marzo et coll., 2016).
Criblages in vitro à haut débit : Des criblages in intro à haut débit sont utilisés pour générer rapidement des courbes concentration-réponse pour une gamme d'activités biologiques dans un large éventail de concentrations, pour un grand nombre de composés. Un exemple d'une telle initiative pour générer ce type de données figure dans le programme ToxCast de l'EPA des É.-U. À ce jour, les efforts combinés du consortium formé de ToxCast et de Toxicologie au 21e siècle (Tox21)Note de bas de page8ont permis d'analyse plus de 8 000 produits chimiques.
Peut-être l'une des approches les plus développées d'application des criblages à haut débit pour guider un programme réglementaire est l'élaboration récente du modèle de bioactivité du récepteur d'œstrogène (RO) fondée sur le ToxCast pour utilisation dans le Programme de criblage des perturbateurs endocriniens (PCPE) de l'EPA des É.-U. En bref, les résultats des 18 criblages de RO de ToxCast sont intégrés dans un modèle computationnel qui peut distinguer la bioactivité des interférences propres aux criblages des répondes liées à la cytotoxicité (Browne et coll., 2015). Le modèle fournit une note, allant de 0 (substances inactives) à 1 (bioactivité pour le 17β-estradiol). Une note de 0 est jugée signifier « inactive », entre 0 et 0,1 « non concluant », et supérieur(e) u égal(e) à 0.1, « active ». Les résultats du modèle de bioactivité des RO des produits chimiques analysés sont disponibles en ligneNote de bas de page9. Ce modèle a été évalué par rapport à un ensemble de produits chimiques de référence dont les études de référence étaient disponibles pour les criblages utéro-trophiques in vivo et se sont révélées hautement prédictifs (Browne et coll., 2015). Après des discussions au cours de diverses réunions de groupes consultatifs scientifiques, l'EPA des É.U. « a l'intention qu'un receveur futur d'un ordre d'essai de PCPE soit en mesure de répondre à l'exigence de criblage pour le RO, la TARO [transactivation du récepteur d'œstrogène] et les criblages utéro-trophiques d'une des trois manières qui suivent : 1) citer le « Modèle de RO » existant de ToxCast pour des données de bioactivité comme « d'autres renseignements scientifiquement pertinents); 2) générer de nouvelles données s'appuyant sur les 18 criblages à haut débit de RO et le « Modèle de RO » de ToxCast pour la bioactivité; ou 3) générer leurs propres données en utilisant les criblages de niveau 3 actuels de liaison de RO, de TARO et utéro-trophiques. Par conséquent, l'intention est d'accepter le Modèle RO comme une alternative aux criblages de niveau 1. Le développement se poursuit à l'égard d'autres modèles fondés sur ToxCast, y compris des modèles de bioactivité du récepteur d'androgène (RA), de la stéroïdogenèse (STR) et de la thyroïde pour le programme de PCPE (EPA É.-U. 2015).
Des travaux exploratoires ont aussi été menés à l'égard d'un modèle de ToxCast basé sur la bioactivité pour la prédiction de l'hépatoxicité. Liu et collègues (2015) ont examiné la bioactivité et la structure moléculaire in vitro de ToxCast parallèlement à d'autres descripteurs pour étudie les associations avec l'hépatoxicité in vivo afin d'élaborer un modèle de prédiction de l'hépatoxicité chronique chez les rats.
Santé Canada juge que l'intégration des résultats du Modèle de RO à titre d'indicateur de danger, et si des indicateurs d'exposition importants sont également présents, les substances pourraient possiblement être jugés comme candidates pour la collecte de données additionnelles ou une évaluation des risques. Alors que d'autres modèles fondés sur la bioactivité in vitro deviendront disponibles, ils pourraient également être intégrés dans le processus d'IPER.
ECCC cherche également à établir la portée de l'applicabilité des données de CHD du modèle de RO de l'EPA pour guider des initiatives d'évaluations écologiques. Alors qu'il est reconnu que la plupart des données des programmes ToxCast et Tox21 de l'EPA des É.-U. sont fondées sur les lignées de santé humaine, l'utilisation de tous les renseignements disponibles (y compris des données sur les mammifères) pourrait faciliter la découverte et la compréhension de mécanismes d'action pertinents sur le plan écologique, ciblant par conséquent les organismes appropriés pour les criblages (ECETOC, 2007; Worth et coll., 2014).
Un certain nombre d'approches et d'outils fondés sur les MNA ont été résumés par la Commission européenne dans un récent rapport sur les méthodes alternatives en toxicologie réglementaire (Worth et coll., 2014). De nombreuses MNA décrites dans les présentes se partagent des applications en santé humaine et écologiques; toutefois, à ce jour, elles ont principalement été élaborées du point de vue de la santé humaine. Il y a une occasion de tirer parti des travaux actuels et d'examiner comment des MNA peuvent être utilisées pour guider, améliorer et accélérer l'établissement des priorités écologiques et les objectifs d'évaluation des risques à court terme (c.-à-d., le PGPC3) et à plus long terme (après 2020).
Deux MNA prometteuses d'un point de vue écologique comprennent les cadres de SPT et de parcours de résultats néfastes (PRD). L'approche du SPT est fondée sur la prémisse qu'il y a une limite d'exposition aux produits chimiques sous laquelle aucun risque pour l'environnement n'est prévu. Ces seuils peuvent être établis à l'aide de différents ensembles de données et il peut exister une application pour les ensembles de données de criblage in vitro utile à cet égard. Le cadre de PRD confère une compréhension biologique et une pertinence aux effets mécanistiques qui sont habituellement évaluées à l'échelle des gènes ou des cellules. Essentiellement les PRD établissent un lien plausible entre un événement moléculaire déclencheur et un résultat néfaste au niveau biologique de l'organisation pertinent à l'évaluation des risques.
Les travaux sur la convenance de ces approches basées sur les MNA dans le contexte écologique sont menés par l'intermédiaire de l'OCDE et d'autres organismes. Le Comité prévoit que les R(Q)SA et les criblages in vitro deviendront une partie fondamentale des approches, particulièrement puisqu'il y a un accent grandissant sur la prise en compte de « mécanismes d'action » dans les évaluations des dangers. Par conséquent, la capacité d'élaborer des modèles EIVIV pour les espèces écologiques (p. ex., les poissons) de manière fiable est une composante importante de la feuille de route d'établissement de priorités ou d'évaluations écologiques qui intègrent des données in vitro.
Question stratégique 4a : Dans le but d'identifier des dangers aux fins de l'établissement des priorités (IPER), le Comité scientifique sur le PGPC a-t-il des suggestions d'outils basés sur les MNA? Comment ces MNA peuvent-elles être intégrées aux points de décision du processus d'IPER?
Question stratégique 4 b : Étant donné que les voies biologiques sont souvent conservées d'une espèce à l'autre, le comité a-t-il des commentaires sur la façon dont les MNA basées sur la santé humaine peuvent guider des approches écologiques d'IPER et vice versa?
Question stratégique 4 b : En tenant compte des MNA associées au danger relevées par SC et ECCC et celles identifiées par le comité (question 4a), quelles possibilités et quels défis à court terme associe-t-on à la mise en œuvre des MNA aux fins de l'identification de nouvelles priorités pour l'évaluation des risques?
Classement fondé sur le risque
L'utilisation de criblages in vitro et d'outils in silico concurremment comme méthode d'identification d'indicateurs de dangers pourrait aussi être une approche importante dans le raffinement du processus d'IPER. Toutefois, la seule présence ou absence d'un indicateur de danger in vitro ne brosse pas un portrait complet pour l'établissement de priorités fondé sur le risque. Les criblages in vitro, lorsqu'ils sont examinés en exclusion, ne fournissent pas une indication des expositions qui seraient nécessaires pour provoquer un changement dans la bioactivité observée. De la même manière, les modèles R(Q)SA mentionnés ne fournissent pas à eux seuls des renseignements sur la dose-réponse de l'indicateur de danger respectif.
Une mesure prometteuse fondée sur le risque serait l'approche du RBE (décrite à la section 2.2) qui utilise la bioactivité in vitro extrapolée à une dose appliquée au moyen de modèles de l'EIVIV et qui la compare à une estimation d'exposition. Aux fins de l'IPER, si les données requises sont disponibles pour en tirer un RBE, alors l'ampleur pourrait être utilisée comme méthode d'établissement des priorités soit pour la collecte de données additionnelles ou pour l'identification à titre de candidat à une évaluation des risques de niveau supérieur. Dans la Figure 4-1, l'écart entre la bioactivité et l'exposition estimative (c.-à-d. le RBE) indique si le produit chimique est prioritaire en matière d'exécution de travaux additionnels. Il est également prévu que lorsque le RBE surpasse une limite élevée (suggérant un faible potentiel de danger et d'exposition), l'approche pourrait servir à titre d'approche d'évaluation générale conforme à une approche de Type 2 dans la boîte à outils d'évaluation des risques du PGPC. Cette approche d'évaluation de niveau peu élevé est étudiée à titre d'élément de la feuille de route plus générale d'évaluation des risques.
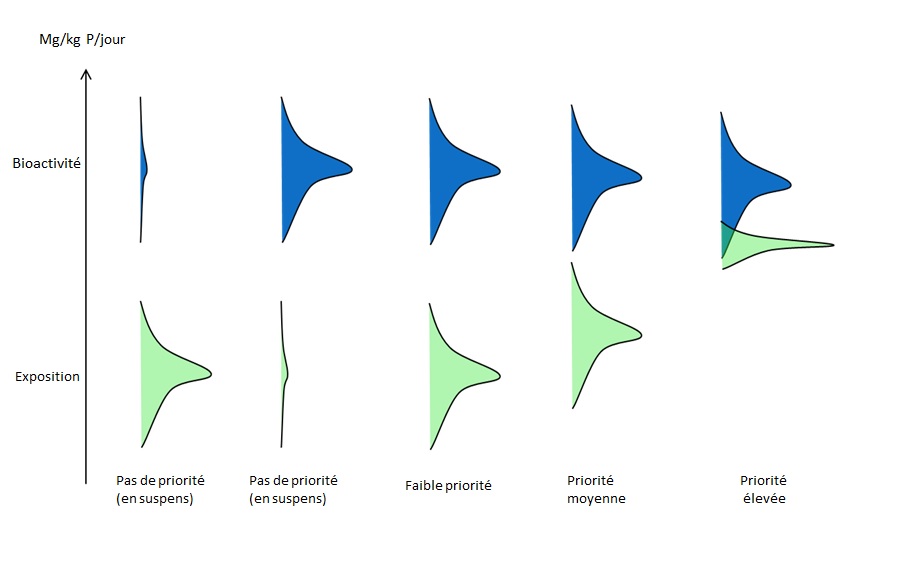
Longue description pour la figure 4-1
TLe niveau de priorité ou de préoccupation d'une substance peut être établi à l'aide d'une approche fondée sur le ratio d'exposition à la bioactivité (REB). Cette approche utilise la bioactivité in vitro extrapolée à une dose appliquée au moyen d'extrapolations in vitro et in vivo et la compare avec une exposition estimative. La relation entre la bioactivité convertie en dose (mg/kg p.c./jour) et l'exposition indique si la substance est une priorité.
Plus l'écart entre la bioactivité et l'exposition est mince, plus la substance est prioritaire. Les substances pour lesquelles la bioactivité ou l'exposition estimative est basse ne sont pas jugées prioritaires.
(Source : adapté à partir d'une communication personnelle de D. Dix, EPA des É.-U., octobre 2014, sans référence.)
Question stratégique 5a : Le Comité scientifique sur le PGPC a-t-il des suggestions d'outils basés sur les MNA qui peuvent servir à l'élaboration de paramètres de risque pour l'établissement des priorités (IPER)? Comment ces MNA peuvent-elles être intégrées aux points de décision du processus d'IPER?
Charge Question 5b : Au sujet des MNA pouvant servir à l'élaboration de paramètres de risque relevées par les ministères et celles identifiées par le comité (question 5a), quelles possibilités et quels défis à court terme associe-t-on à la mise en œuvre des MNA aux fins de l'identification de nouvelles priorités pour l'évaluation des risques?
Bibliographie
Advanced Chemistry Development, Inc. ACD/Labs Percepta Platform [prediction module]-latest version v2016.1. 2016. Toronto (ON): Advanced Chemistry Development, Inc.
Blaauboer BJ, Boobis AR, Bradford B, Cockburn A, Constable A, Daneshian M, Edwards G, Garthoff JA, Jeffery B, Krul C, Schuermans J. 2016. Considering new methodologies in strategies for safety assessment of foods and food ingredients. Food Chem Toxicol 91:19-35.
Browne P, Judson RS, Casey WM, Kleinstreuer NC, Thomas RS. 2015. Screening chemicals for estrogen receptor bioactivity using a computational model. Environ Sci Technol 49(14):8804-8014.
[CCA] Council of Canadian Academies. 2012. Integrating emerging technologies into chemical safety assessment: the expert panel in the integrated testing of pesticides.
Dionisio KL, Frame AM, Goldsmith MR, Wambaugh JF, Liddell A, Cathey T, Smith D, Vail J, Ernstoff AS, Fantke P, Jollie, Ol, Judston RS. 2015. Exploring consumer exposure pathways and patterns of use for chemicals in the environment. Environment Toxicol Rep 2:228-237.
[ECCC] Environment and Climate Change Canada. 2014. Approach for identification of chemicals and polymers as risk assessment priorities under Part 5 of the Canadian Environmental Protection Act, 1999 (CEPA).
[ECCC] Environment and Climate Change Canada. 2016. Ecological risk classification of organic substances.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2007. Intelligent testing strategies in ecotoxicology: mode of action approach for specifically acting chemicals. Brussels, Belgium: ECETOC.
[ECHA] European Chemicals Agency. 2016. New approach methodologies in regulatory science: proceedings of a scientific workshop. Helsinki, Finland, 19-20 April 2016.
Embry MR, Bachman AN, Bell DR, Boobis AR, Cohen SM, Dellarco M, Dewhurst IC, Doerrer NG, Hines RN, Moretto A, Pastoor TP, Phillips RD, Rowlands JC, Tanir JY, Wolf DC, Doe JE. 2014. Risk assessment in the 21st century: roadmap and matrix. Crit Rev Toxicol 44(S3):6-16.
European Commission. 2013. State-of-the-art of screening methods for the rapid identification of chemicals in drinking water. EUR 26155 EN. June 2013.
[FDA] US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research, Center for Biologics Evaluation and Research. 2015. M7 assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk: guidance for industry.
Ferrero PG, Schymanski EL, Bletsou AA, Aalizadeh R, Hollender J, Thomaidis NS. 2015. Extended suspect and non-target strategies to characterize emerging polar organic contaminants in raw wastewater with LC-HRMS/MS. Environ Sci Technol 49(20):12333-12341. DOI: 10.1021/acs.est.5b03454.
[GoC] Government of Canada Chemicals Substances. [modified 2016 May 30]. The risk assessment toolbox. Ottawa (ON): Government of Canada. [accessed 2016 Oct 7].
Health Canada. 2011. Chemicals Management Plan (CMP) horizontal evaluation: final report. Ottawa (ON): Health Canada. [accessed 2016 Oct 7].
Hughes K, Paterson J, Meek ME. 2009. Tools for the prioritization of substances on the Domestic Substances List in Canada on the basis of hazard. Regulatory Toxicology and Pharmacology 55:382-393.
Ideaconsult Ltd. 2015. Toxtree (Toxic Hazard Estimation by decision tree approach) [prediction module v2.6.13]. Sofia (BG): Ideaconsult Ltd.
Isaacs KK, Goldsmith M, Egeghy P, Phillips K, Brooks R, Hong T, Wambaugh, JF. 2016. Characterization and prediction of chemical functions and weight fractions in consumer products. Toxicology Reports 3: 723-732.
Karmaus AL, Filer DL, Martin MT, Houck KA. 2016. Evaluation of food-relevant chemicals in the ToxCast high-throughput screening program. Food Chem Toxicol 92:188-196.
Krauss M, Singer H, Hollender J. 2010. LC-high resolution MS in environmental analysis: from target screening to the identification of unknowns. Anal Bioanal Chem 397: 943. doi:10.1007/s00216-010-3608-9.
Krewski D, Westphal M, Andersen ME, Paoli GM, Chiu WA, Al-Zoughool M, Croteau MC, Burgoon LD, Cote I. 2014. A framework for the next generation of risk science. Environ Health Perspect 122(8):796-805.
Kulkarni SA, Barton-Maclaren TS. 2014. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. J Env Sci Health, Part C: Env Car Eco Rev 32(1):46-82.
Kulkarni SA, Barton-Maclaren TS, Benfenati E. 2016. Improving the confidence in (Q)SAR predictions under the Canada's Chemicals Management Plan-a chemical space approach (restricted access). SAR QSAR Environ Res 27 (in press).
Leadscope. 2013. Model Applier[prediction module v2.1]. Columbus, OH: Leadscope.
Lhasa Limited. Derek Nexus [toxicity prediction module]. 2014. v4.1.0. Leeds (UK): Lhasa Limited.
Liu J, Mansouri K, Judson RS, Martin MT, Hong H, Chen M, Xu X, Thomas RS, Shah I. 2015. Predicting hepatotoxicity using ToxCast in vitro bioactivity and chemical structure. Chem Res Toxicol 28(4):738-51.
Manganelli S, Benfenati E, Manganaro A, Kulkarni S, Barton-Maclaren TS, Honma M. 2016. New quantitative structure-activity relationship models improve predictability of Ames mutagenicity for aromatic azo compounds. Toxicol Sci 153(2):316-326.
Marzo M, Roncaglioni A, Manganaro A, Benfenati E, Kulkarni S, Barton-Maclaren TS, Wu S, Lester C. 2016. Integrating in silico models to enhance predictivity for developmental toxicity (restricted access). Toxicology 370:127-137.
Miljo-Direktoratet. 2013. Non-target screening--a powerful tool for selecting environmental pollutants. M-27/2013.
MultiCASE Inc. 2015. CASEUltra [prediction module for toxicity and bioactivity of chemicals v.1.4].
[NRC] National Research Council of the National Academies of Sciences, Engineering, and Medicine. 2007. Toxicity testing in the 21st century: a vision and a strategy. Washington (DC): The National Academies Press.
[OAG] Office of the Auditor General of Canada. 2009. 2009 fall report of the Commissioner of the Environment and Sustainable Development.
[OASIS-CATALOGIC] Laboratory of Mathematical Chemistry. 2014. [Environmental fate and ecotoxicity model v.5.11.15]. Bourgas, BG: Laboratory of Mathematical Chemistry.
[OASIS-TIMES] Laboratory of Mathematical Chemistry. 2015. TIssue MEtabolism Simulator [prediction module v.2.27.19]. Bourgas, BG: Laboratory of Mathematical Chemistry.
[OECD] Organisation for Economic Co-operation and Development. 2014. Guidance document on the validation of (quantitative)structure-activity relationships [(Q)SAR] models. Paris, France: OECD, Environment Directorate.
OECD QSAR Toolbox. 2015. [v3.2]. Available from: http://www.oecd.org/chemicalsafety/risk-assessment/theoecdqsartoolbox.htm.
Pham N, Iyer S, Hackett E, Lock BH, Sandy M, Zeise L, Marty M. 2016. Using ToxCast to explore chemical activities and hazard traits: a case study with ortho-phthalates. Toxicological Sciences 151(2):286-301. doi:10.1093/toxsci/kfw049.
Plassmann MM, Tengstrand E, Aberg KM, Benskin JP. 2016. Non-target time trend screening: a data reduction strategy for detecting emerging contaminants in biological samples. Anal Bioanal Chem 408:4203-4208.
Rager JE, Strynar MJ, Liang S, McMahen RL, Richard AM, Grulke CM, Wambaugh JF, Isaacs KK, Judson R, Williams AJ, Sobus JR. 2016. Linking high resolution mass spectrometry data with exposure and toxicity forecasts to advance high-throughput environmental monitoring. Environment International 88:269-280.
Robinson P, MacDonald D, Davidson N, Okonski A, Sene A. 2004. Use of quantitative structure activity relationships (QSARs) in the categorization of discrete organic substances on Canada's Domestic Substances List (DSL). International Society for Environmental Information Sciences. 2: 122-130.
Rybacka A, Rudén C, Andersson PL. 2014. On the use of in silico tools for prioritising toxicity testing of the low-volume industrial chemicals in REACH. Basic Clin Pharmacol Toxicol 115(1):77-87.
Shah F, Greene N. 2014. Analysis of Pfizer compounds in EPA's ToxCast chemicals-assay space. Chemical Research in Toxicology 27(1):86-98.
Thomas RS, Philbert MA, Auerbach SS, Wetmore BA, Devito MJ, Cote I, Rowlands JC, Whelan MP, Hays SM, Andersen ME, Meek MEB, Reiter LW, Lambert JC, Clewell HJ, Stephens ML, Zhao QJ, Wesselkamper SC, Flowers L, Carney EW, Pastoor TP, Petersen DD, Yauk CL, Nong A. 2013. Incorporating new technologies into toxicity testing and risk assessment: moving from 21st century vision to a data-driven framework. Toxicol Sci 136(1):4-18.
US EPA. 2012. TSCA work plan chemicals: methods document. Environmental Protection Agency, Office of Pollution Prevention and Toxics, February 2012.
US EPA. 2014. Next Generation Risk Assessment: Incorporation of Recent Advances in Molecular, Computational, and Systems Biology (Final Report). Environmental Protection Agency, EPA/600/R-14/004.
US EPA. 2016. Rapid chemical exposure and dose research: evaluating high-throughput exposure predictions.
VEGA. 2015. CAESAR [prediction platform]. Milano, Italy: Instituto di Ricerche Farmacologiche Mario Negri Milano.
Worth A, Barroso J, Bremer S, Burton J, Casati S, Coecke S, Corvi R, Desprez B, Dumont C, Gouliarmou V, Goumenou M, Gräpel R, Griesinger C, Halder M, Janusch Roi A, Kienzler A, Madia F, Munn S, Nepelska M, Paini A, Price A, Prieto P, Rolaki A, Schäffer M, Triebe J, Whelan M, Wittwehr C, Zuang V. 2014. Alternative methods for regulatory toxicology-a state-of-the-art review. Ispra (IT): European Commission Joint Research Centre Report EUR 26797 EN.
Annexes
Annexe A : Documentation principale
Processus d'IPER actuel
- [ECCC] Environment and Climate Change Canada and Health Canada. 2014. Approach for identification of chemicals and polymers as risk assessment priorities under Part 5 of the Canadian Environmental Protection Act, 1999 (CEPA).
- [ECCC] Environment and Climate Change Canada and Health Canada. 2015. Identification of risk assessment priorities: results of the 2015 review.
Résumé de l'atelier
- European Chemicals Agency. 2016. New approach methodologies in regulatory science: proceedings of a scientific workshop. Helsinki, Finland, 19-20 April 2016.
Exemples de stratégies pour l'intégration de MNA pour l'établissement de priorités et l'évaluation des risques
- Krewski D, Westphal M, Andersen ME, Paoli GM, Chiu WA, Al-Zoughool M, Croteau MC, Burgoon LD, Cote I. 2014. A framework for the next generation of risk science. Environ Health Perspect 122(8):796-805.
- Embry MR, Bachman AN, Bell DR, Boobis AR, Cohen SM, Dellarco M, Dewhurst IC, Doerrer NG, Hines RN, Moretto A, Pastoor TP, Phillips RD, Rowlands JC, Tanir JY, Wolf DC, Doe JE. 2014. Risk assessment in the 21st century: roadmap and matrix. Crit Rev Toxicol 44(S3):6-16.
- Blaauboer BJ, Boobis AR, Bradford B, Cockburn A, Constable A, Daneshian M, Edwards G, Garthoff JA, Jeffery B, Krul C, Schuermans J. 2016. Considering new methodologies in strategies for safety assessment of foods and food ingredients. Food Chem Toxicol 91:19-35.
Exemples d'outils spécifiques basés sur les MNA
- Thomas RS, Philbert MA, Auerbach SS, Wetmore BA, Devito MJ, Cote I, Rowlands JC, Whelan MP, Hays SM, Andersen ME, Meek MEB, Reiter LW, Lambert JC, Clewell HJ, Stephens ML, Zhao QJ, Wesselkamper SC, Flowers L, Carney EW, Pastoor TP, Petersen DD, Yauk CL, Nong A. 2013. Incorporating new technologies into toxicity testing and risk assessment: moving from 21st century vision to a data-driven framework. Toxicol Sci 136(1):4-18.
- Browne P, Judson RS, Casey WM, Kleinstreuer NC, Thomas RS. 2015. Screening chemicals for estrogen receptor bioactivity using a computational model. Environ Sci Technol 49(14):8804-14.
- Liu J, Mansouri K, Judson RS, Martin MT, Hong H, Chen M, Xu X, Thomas RS, Shah I. 2015. Predicting hepatotoxicity using ToxCast in vitro bioactivity and chemical structure. Chem Res Toxicol 28(4):738-51.
- [FDA] US Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research, Center for Biologics Evaluation and Research. 2015. M7 assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals to limit potential carcinogenic risk: guidance for industry.
Annexe B : Présentations de cadres et de stratégies existants
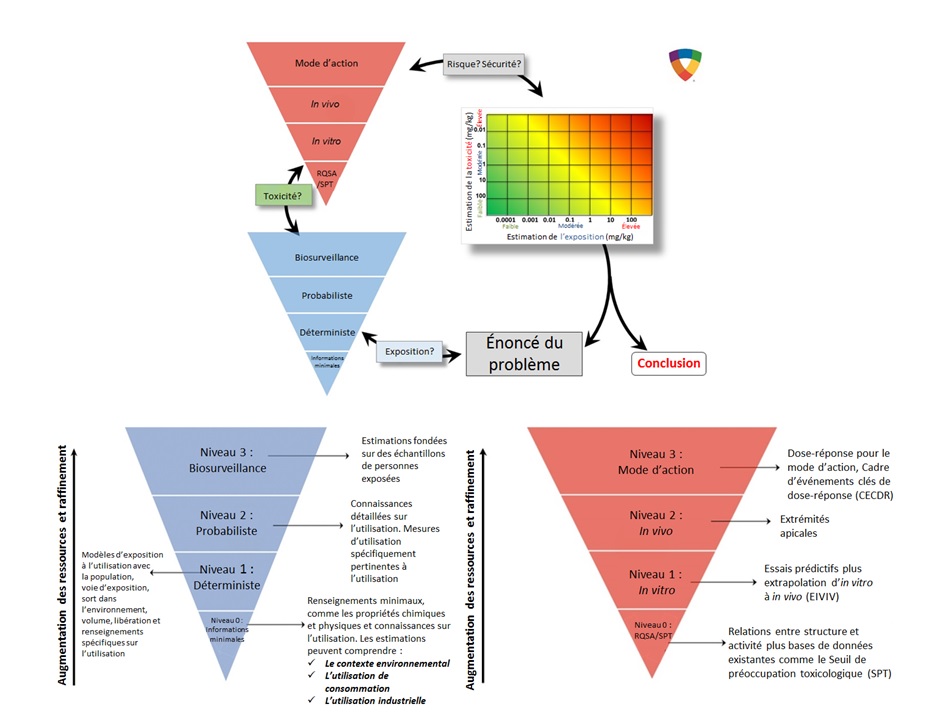
Longue description pour la figure B-1
Le cadre d'approche de la stratégie RISK21 précise les considérations qui peuvent être utilisées pour la prise de décision à diverses étapes de l'évaluation du risque (c.-à-d. de l'établissement de la priorité jusqu'à l'évaluation quantitative du risque). La stratégie d'évaluation du risque fondée sur l'exposition utilise le concept de sources hiérarchisées de renseignements, une complexité accrue et davantage de ressources étant nécessaires pour les évaluations de niveaux supérieurs. Le processus comprend la formulation du problème et des considérations en matière d'exposition et de toxicité pour contribuer à une prise de décision à l'égard de l'évaluation du risque.
La stratégie promeut l'utilisation d'un niveau approprié pour permettre l'utilisation des ressources la plus efficiente qui soit pour prendre une décision fournissant le niveau de précision nécessaire dans un contexte de décision donné. Une pyramide inversée illustre l'accroissement de la complexité et des ressources nécessaires pour chaque niveau (niveaux 0 à 3). Cela s'applique tant à la caractérisation du danger que de l'exposition.
Pour la caractérisation du danger, le seuil de préoccupation toxicologique (SPT) et les relations quantitatives structure-activité (RQSA) sont jugées être de niveau 0, les essais in vitro avec une extrapolation appropriée in vitro à in vivo (EIVIV) de niveau 1, et les analyses des extrémités apicales in vivo et du mode d'action sont jugées être des sources de renseignements respectivement de niveaux 2 et 3.
Pour la caractérisation de l'exposition, l'approche de niveau 0 comprend des estimations conservatrices fondées sur des renseignements imités comme les propriétés physiochimiques et les utilisations. Les approches d'exposition de niveaux 1, 2 et 3 comprennent respectivement les approches déterministe, probabiliste et de biosurveillance.
(Source : reproduit d'Embry et coll., 2014).
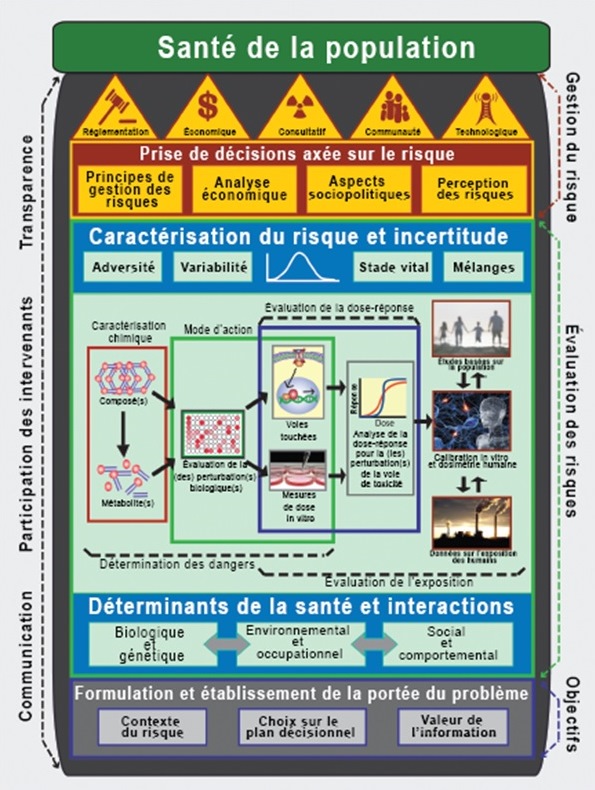
Longue description pour la figure B-2
Le cadre de prochaine génération modernise et élabore un paradigme en science des risques qui intègre les récentes percées de la méthodologie toxicologique et liée aux expositions. Le cadre traite de la formation de problèmes, de l'évaluation du risque et de la gestion du risque.
L'étape de la formulation de problèmes comprend l'établissement du contexte du risque, des options possibles en matière de prise de décision et de la valeur des renseignements.
À l'étape d'évaluation du risque, des méthodes d'identification du danger, d'évaluation de la dose-réponse et d'évaluation de l'exposition qui utilisent de nouveaux outils et nouvelles technologies scientifiques sont proposées. Cela comprend des criblages à haut débit et des méthodes computationnelles en biologie et en toxicologie pour l'identification du danger et l'évaluation de la dose-réponse; des méthodes d'extrapolation d'in vitro à in vivo pour le calibrage de la dosimétrie in vitro et humaine; l'épidémiologie moléculaire et génétique pour identifier les voies de perturbation toxique dans des études basées sur des populations, et une spectrométrie de masse à haute performance pour générer des données d'exposition humaine afin d'évaluer le risque. Le risque et l'incertitude sont caractérisés, et une décision fondée sur le risque est prise.
Des principes de gestion du risque, une analyse économique et des considérations de perception du risque et sociopolitiques guident les mesures de gestion du risque. Le cadre illustre les communications, la participation des intervenants et la transparence contribuant à toutes les étapes de la science fondée sur le risque.
(Source : Reproduit de Krewski et coll., 2014).
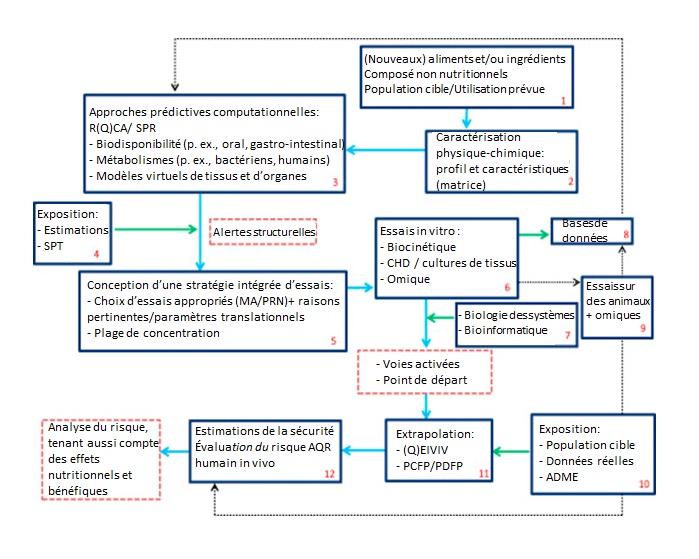
Longue description pour la figure B-3
Une feuille de route décrit une stratégie pour envisager de nouvelles méthodologies dans l'évaluation de nouveaux aliments, ingrédients et mélanges. La stratégie comprend l'utilisation de relations quantitatives structure-activité , R(Q)SA), du seuil de préoccupation toxicologique (SPT), des essais in vitro, des extrapolations d'in vitro à in vivo (EIVIV) et des considérations de stratégies intégrées d'essais fondées sur des pistes de résultats défavorables.
Dans l'évaluation, le flux principal comprend sept cases, des cases additionnelles représentent les informations liées à l'exposition, et à divers points, le résultat d'une case précédente est présenté. Sur la feuille de route figurent des chemins de rétroaction pour de nouvelles informations à prendre ou à reprendre en compte pour les étapes suivantes. Le flux d'évaluation présenté dans la feuille de route se présente comme suit :
- (Nouveaux) aliments et/ou ingrédients composés non nutritionnels Population cible/Utilisation prévue
- Caractérisation physique chimique : profil et caractéristiques (matrice)
- Approches prédictives computationnelles :
- (Q) SAR/résonance plasmonique de surface (RPS)
- Biodisponibilité (par exemple, orale, gastro-intestinale)
- Métabolisme (par exemple, bactérien, humain)
- Modèles virtuels de tissus et d'organes
- Estimations d'exposition/SPT
Résultat des alertes structurelles - Conception d'une stratégie intégrée d'essais :
- Choix d'essais appropriés (Mode d'action (MA/Piste de résultat défavorable (PRD)+ lectures pertinentes/paramètres translationnels
- Plage de concentration
- Essais in vitro :
- Biocinétique
- CHD / cultures de tissus
- omique
- Biologie et bio-informatique des systèmes (liés aux expositions)
- Bases de données (liées aux expositions)
- Essais et technologies -omiques (liés aux expositions)
(Voies activées et résultat du point de départ) - Lien avec une exposition :
- Population cible
- Données réelles
- absorption, distribution, métabolisme et excrétion (ADME)
- Extrapolation :
- (Q)IVIVE
- Connaissance du domaine fondée sur des processus (CDFP)/ pharmacocinétique axée sur la physiologie (PCAP)
- Estimations de la sécurité Évaluation du risque in vivo apport nutritionnel recommandé (ANR) pour les humains
(Analyse du risque, tenant aussi compte des effets nutritionnels et bénéfiques)
Les nombres représentent le flux; les cases à traits pleins avec des flèches bleues représentent la voie principale. Les renseignements fournis par les cases avec des flèches vertes sont liés à l'exposition. Les cases à lignes pointillées sont des « résultats » des cases antérieures; les lignes pointillées sont des voies de rétroaction et peuvent fournir des renseignements additionnels à prendre (ou reprendre) en compte au cours des prochaines étapes.
(Source : reproduit [accès libre] de Blaauboer et coll., 2016).
Abréviations : ADME, absorption, distribution, métabolisme et excrétion; PRD, pistes de résultats défavorables; CHD, criblage à haut débit; MA, mode d'action; CDFP, connaissance du domaine fondée sur des processus; PCAP, pharmacocinétique axée sur la physiologie (modèle); (Q)IVIVE, quantitatif/qualitatif in vitro à in vivo (modèles d'extrapolation); R(Q)SA, relations quantitatives/qualitatives structure-activité; ANR, apport nutritionnel recommandé; RPS, résonance plasmon de surface (biosenseurs); SPT, seuil de préoccupation toxicologique.
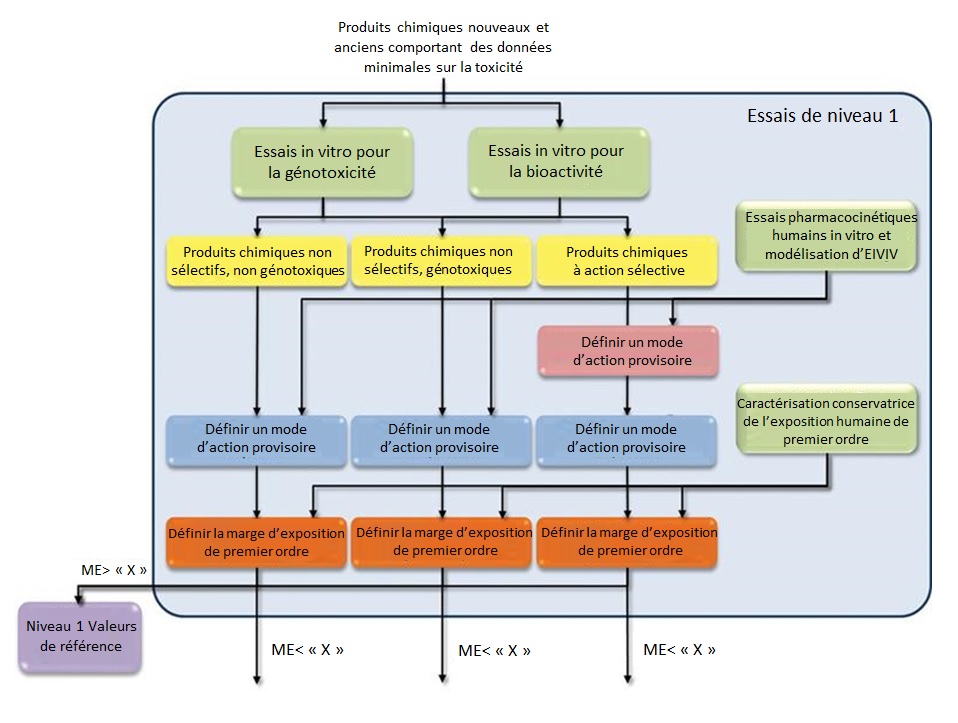
Longue description pour la figure B-4a
Un organigramme présentant les essais de niveau 1 figurant dans le cadre proposé basé sur les données du 21e siècle. La première rangée de cases illustre l'ensemble de données de niveau 1 qui comprennent les résultats de données expérimentales et de modélisation computationnelle qui servent d'intrants dans le cadre. Au cours de la prochaine étape, les substances sont divisées en catégories chimiques établies par les essais in vitro de génotoxicité et les criblages à haut débit. Les catégories sont les suivantes : 1) substances chimiques non sélectives, non génotoxiques, 2) substances chimiques non sélectives, génotoxiques, et 3) substances chimiques à action sélective. Pour les substances chimiques à action sélective, le mode d'action provisoire est établi selon quels criblages in vitro à haut débit ont été sélectivement activés ou inhibés. Le point de départ et la marge d'exposition (ME) à l'aide, respectivement, de renseignements pharmacocinétiques et d'exposition additionnels, sont estimés. Pour les substances chimiques ayant une ME plus élevée qu'un niveau prédéfini, aucun autre essai n'est mené, et des valeurs de référence de niveau 1 sont publiées. Les substances chimiques dont la ME est inférieure au niveau prédéfini passent au niveau 2.
Les cases vertes illustrent les ensembles de données de niveau 1 qui comprennent des données expérimentales et des résultats de modélisation computationnelle qui servent d'intrants dans le cadre. Les cases jaunes constituent des catégories de produits chimiques établies en fonction des criblages de génotoxicité in vitro et des criblages in vitro à haut début. Pour les produits sélectifs, la case rouge représente l'établissement du MA provisoire fondé sur les criblages in vitro à haut débit ayant été sélectivement activés ou inhibés. Les cases bleues et oranges représentent l'estimation du point de départ et du ME à l'aide, respectivement, de renseignements additionnels pharmacocinétiques et relatifs à l'exposition. Pour les substances chimiques ayant une ME plus élevée qu'un niveau prédéfini, aucun autre essai n'est mené, et des valeurs de référence de niveau 1 sont publiées. Les substances chimiques dont la ME est inférieure au niveau prédéfini passent au niveau 2.
(Source : reproduit [accès libre] de Thomas et coll., 2013).
Abréviations : EIVIV, in vitro à in vivo; ME, marge d'exposition.
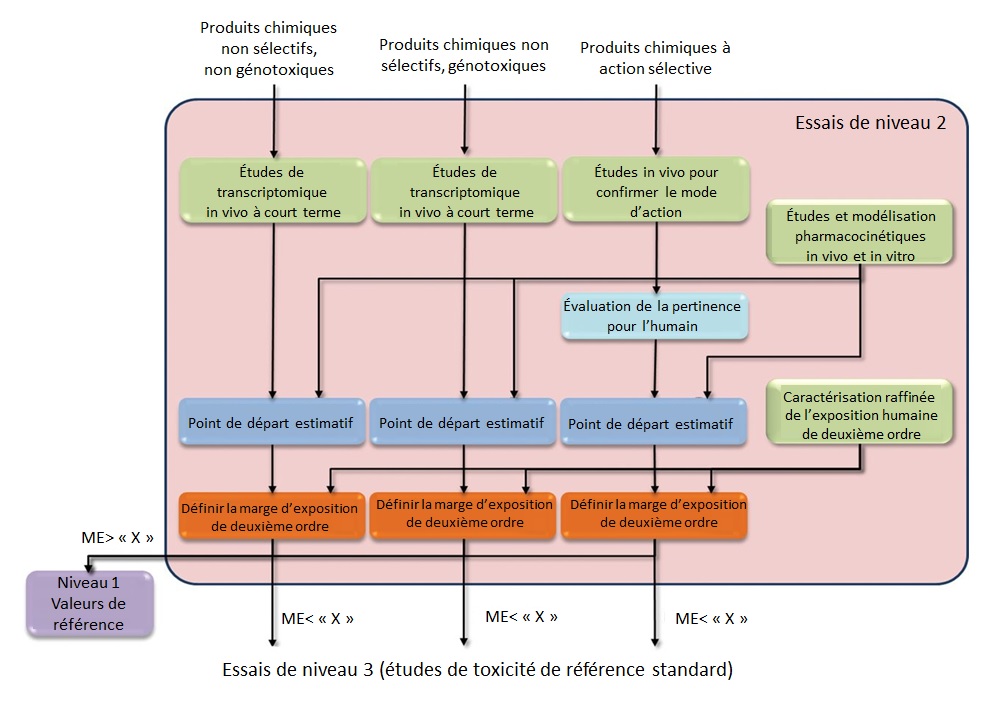
Longue description pour la figure B-4b
Un organigramme présentant les essais de niveau 2 figurant dans le cadre proposé basé sur les données du 21e siècle. L’ensemble de données de niveau 2 comprend les résultats de données expérimentales et de modélisation computationnelle qui servent d’intrants dans le cadre. Les catégories chimiques établies par les essais in vitro de génotoxicité et les criblages à haut débit du niveau 1 sont retenues (1) substances chimiques non sélectives, non génotoxiques, 2) substances chimiques non sélectives, génotoxiques, et 3) substances chimiques à action sélective). Pour les substances chimiques à action sélective, la pertinence pour l’humain du mode d’action est établie. Le point de départ et la marge d’exposition (ME) à l’aide, respectivement, de renseignements pharmacocinétiques et d’exposition élargis, sont estimés. Pour les substances chimiques ayant une ME plus élevée qu’un niveau prédéfini, aucun autre essai n’est mené, et des valeurs de référence de niveau 2 sont publiées. Les substances chimiques dont la ME est inférieure au niveau prédéfini passent au niveau 3. Le niveau 3 comprend des études de toxicité de référence standard.
Les cases vertes illustrent les ensembles de données de niveau 2 qui comprennent des données expérimentales et des résultats de modélisation computationnelle qui servent d'intrants dans le cadre. Les catégories de produits chimiques établies en fonction des criblages de génotoxicité in vitro et des criblages in vitro à haut début proviennent du niveau 1. Pour les produits sélectifs, la case bleue représente l'établissement de la pertinence humaine du MA. Les cases bleues et oranges représentent l'estimation du point de départ et du ME à l'aide, respectivement, de renseignements élargis pharmacocinétiques et relatifs à l'exposition. Pour les substances chimiques ayant une ME plus élevée qu'un niveau prédéfini, aucun autre essai n'est mené, et des valeurs de référence de niveau 2 sont publiées. Les substances chimiques dont la ME est inférieure au niveau prédéfini passent au niveau 3.
(Source : reproduit [accès libre] de Thomas et coll., 2013).
Abréviation : ME, marge d'exposition.