Ébauche d’évaluation préalable groupe des esters
Titre officiel : Ébauche d’évaluation préalable - Groupe des esters
Environnement et Changement climatique Canada
Santé Canada
Mars 2022
Résumé
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable de 14 des 16 substances désignées collectivement sous le nom « groupe des esters » dans le Plan de gestion des produits chimiques (PGPC). Il a été déterminé que l’évaluation de ces 14 substances était prioritaire, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine. Deux des 16 substances ont été jugées peu préoccupantes selon d’autres méthodes, et les décisions proposées concernant ces substances sont présentées dans un rapport distinctNote de bas de page 1. Par conséquent, la présente évaluation préalable porte sur les 14 substances énumérées dans le tableau ci‑dessous, désignées par l’appellation « groupe des esters ». Le tableau présente le numéro d’enregistrement du Chemical Abstracts Service (n° CASNote de bas de page 2), le nom sur la Liste intérieure des substances (LIS) et le nom commun de ces substances.
| N° CAS | Nom sur la LIS | Nom commun |
|---|---|---|
| 79-20-9a | Acétate de méthyle | Acétate de méthyle |
| 102-76-1 | Triacétine | Triacétine |
| 106-70-7 a | Hexanoate de méthyle | Hexanoate de méthyle |
| 109-60-4 | Acétate de propyle | Acétate de propyle |
| 110-19-0 | Acétate d’isobutyle | Acétate d’isobutyle |
| 111-82-0 | Laurate de méthyle | Laurate de méthyle |
| 577-11-7 | Docusate sodique | Docusate sodique |
| 623-42-7a | Butyrate de méthyle | Butyrate de méthyle |
| 1119-40-0 | Glutarate de diméthyle | Glutarate de diméthyle |
| 3234-85-3 | Myristate de tétradécyle | Myristate de tétradécyle |
| 6846-50-0 | Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène | Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène |
| 25265-77-4 | Acide isobutyrique, monoester avec 2,2,4-triméthylpentane-1,3-diol | Texanol |
| 68990-53-4b | Glycérides en C14-22, mono- | Monoglycérides en C14‑22 |
| 70657-70-4a | Acétate de 2-méthoxypropyle | Acétate de 2-méthoxypropyle |
a Cette substance n’a pas été retenue en vertu du paragraphe 73(1) de la LCPE, mais elle est visée par la présente évaluation, car elle est considérée comme prioritaire en raison d’autres préoccupations liées à la santé humaine.
b Ce n° CAS correspond à celui d’une substance UVCB (substance de composition inconnue ou variable, produit de réactions complexes ou matière biologique).
Selon les renseignements fournis lors d’enquêtes menées en vertu de l’article 71 de la LCPE, 12 de ces 14 substances ont été fabriquées ou importées au Canada en 2009 ou 2011. L’acétate de méthyle, l’acétate d’isobutyle, le glutarate de diméthyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène et le docusate sodique ont été fabriqués au Canada à des volumes compris entre 100 kg et 10 000 kg, tandis que la triacétine a été fabriquée en quantités comprises entre 10 000 kg et 100 000 kg. Les quantités importées déclarées des substances du groupe des esters variaient d’environ 5 000 kg à plus de 3 000 000 kg. L’hexanoate de méthyle et le butyrate de méthyle n’ont été ni importés ni fabriqués en quantités supérieures aux seuils de déclaration de l’enquête en 2011.
Sept des 14 substances du groupe des esters (acétate de méthyle, triacétine, hexanoate de méthyle, acétate de propyle, acétate d’isobutyle, laurate de méthyle et butyrate de méthyle) sont naturellement présentes dans divers fruits ou plantes. Plusieurs substances du groupe des esters sont principalement utilisées comme solvants, notamment l’acétate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le glutarate de diméthyle, la triacétine et le diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène. Parmi les autres utilisations principales, il y a les plastifiants (triacétine, diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) ou les agents revitalisants pour la peau (myristate de tétradécyle). La plupart des substances du groupe des esters sont utilisées dans une gamme de produits industriels et commerciaux et sont également utilisées dans des produits disponibles aux consommateurs, y compris les cosmétiques, les produits de santé naturels, les médicaments sur ordonnance ou en vente libre, ainsi que dans les peintures, les adhésifs, les assainisseurs d’air, les décapants, les produits de réparation de la fibre de verre et les produits de réparation des fissures du béton. L’acétate de méthyle, la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle et le butyrate de méthyle peuvent être utilisés comme agents aromatisants alimentaires. La triacétine et le docusate sodique sont des additifs alimentaires autorisés au Canada. Les monoglycérides en C14‑22 sont inclus avec les substances « monoglycérides » ou « mono- et diglycérides », qui sont également des additifs alimentaires autorisés au Canada.
Les risques pour l’environnement associés aux substances du groupe des esters ont été caractérisés à l’aide de la Classification du risque écologique (CRE) des substances organiques, laquelle est une méthode fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition, et sur une pondération des multiples éléments de preuve en vue de classer les risques. Les profils de danger sont établis principalement sur la base de paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition incluent le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. D’après les résultats de la CRE, il est peu probable que les substances du groupe des esters soient nocives pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le risque que les substances du groupe des esters soient nocives pour l’environnement est faible. Il est proposé de conclure que l’acétate de méthyle, la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne répondent pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
En ce qui concerne la santé humaine, il a été déterminé que 8 des 14 substances du groupe des esters présentent un faible danger, à savoir la triacétine, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le texanol et les monoglycérides en C14‑22. Le risque que posent ces substances pour la santé humaine est donc jugé faible.
La toxicité pour le développement est un effet critique potentiel de l’acétate de méthyle en raison de l’hydrolyse rapide de la substance en méthanol. Les effets potentiels du méthanol sur le développement ont été examinés dans l’ébauche d’évaluation préalable du groupe des alcools dans le cadre du PGPC et ont été pris en considération dans la caractérisation des risques pour la santé humaine liés à l’exposition à l’acétate de méthyle. On s’attend à ce que les principales voies d’exposition à l’acétate de méthyle de la population générale soient la présence naturelle de cette substance dans les aliments et l’air intérieur et l’utilisation de divers produits contenant cette substance, notamment les produits pour les ongles, les produits de nettoyage, les produits pour l’automobile (p. ex., les peintures en aérosol, les nettoyants pour pneus), les adhésifs (p. ex., les adhésifs pour la construction, les adhésifs en aérosol pour les tissus et les colles pour chambres à air), les décapants pour adhésifs, les lubrifiants, les décapants pour peinture et les revêtements de sol. D’après la comparaison entre d’une part les concentrations d’exposition à l’acétate de méthyle par divers milieux naturels et les aliments ainsi que par l’utilisation de produits disponibles aux consommateurs décrits ci‑dessus (à l’exclusion des décapants pour peinture et des adhésifs en aérosol), et d’autre part les concentrations de référence établis pour le méthanol qui ont été ajustées pour l’exposition à l’acétate de méthyle, le risque pour la santé humaine devrait être faible. Les concentrations de référence pour l’exposition au méthanol ont été utilisées, parce que le méthanol est un produit d’hydrolyse de l’acétate de méthyle et parce qu’il n’existe actuellement aucune concentration de référence pour l’acétate de méthyle. L’utilisation de produits décapants pour peinture et d’adhésifs en aérosol contenant de l’acétate de méthyle entraînait une exposition estimée à l’acétate de méthyle supérieure aux concentrations de référence établies pour le méthanol (après ajustement pour tenir compte de l’exposition à l’acétate de méthyle), ce qui semble indiquer un risque pour la santé humaine.
Une fois absorbés, l’hexanoate de méthyle et le butyrate de méthyle devraient être hydrolysés pour former leurs acides carboxyliques respectifs (c.‑à‑d. l’acide hexanoïque et l’acide n‑butyrique, respectivement) et du méthanol.
La toxicité pour le développement est un effet critique potentiel de l’hexanoate de méthyle et du butyrate de méthyle en raison de l’hydrolyse de ces substances qui donne du méthanol.
L’exposition de la population générale à l’hexanoate de méthyle et au butyrate de méthyle peut se produire par l’air intérieur ou leur utilisation comme agent aromatisant alimentaire. L’hexanoate de méthyle est également présent dans les produits pour les ongles. D’après la comparaison entre d’une part les concentrations d’exposition à l’hexanoate de méthyle et au butyrate de méthyle et d’autre part les concentrations de référence établies pour le méthanol (avec des valeurs de référence pour le méthanol ajustées pour tenir compte de l’exposition à l’hexanoate de méthyle et au butyrate de méthyle, respectivement), le risque pour la santé humaine devrait être faible. Les concentrations de référence pour le méthanol ont été utilisées parce que le méthanol est un produit d’hydrolyse de l’hexanoate de méthyle et du butyrate de méthyle et parce qu’il n’existe actuellement aucune concentration de référence pour ces deux substances.
La toxicité pour le développement est considérée comme l’effet critique de l’acétate de 2‑méthoxypropyle. Les sources potentielles d’exposition à l’acétate de 2‑méthoxypropyle pour la population générale devraient être l’air et l’eau, et l’utilisation de produits tels que les cosmétiques, les peintures en aérosol ou les mastics. Les marges d’exposition entre l’exposition estimée à l’acétate de 2‑méthoxypropyle et les doses critiques sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Les renseignements disponibles sur les effets sur la santé du diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène indiquent que cette substance a des effets potentiels sur le système reproducteur. On s’attend à ce que les sources d’exposition au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène pour la population générale soient principalement l’air intérieur et l’utilisation de divers produits contenant cette substance, notamment les produits pour les ongles, les adhésifs cosmétiques, les produits de santé naturels, les apprêts en aérosol, la peinture pour piscine, les peintures pour le bricolage, les produits de réparation de la fibre de verre et les produits de réparation des fissures du béton. L’exposition par voie orale des enfants au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène peut également résulter du transfert de cette substance contenue dans les biberons fabriqués avec des matériaux utilisés comme substituts du polycarbonate, et dans les jouets en plastique. Les marges d’exposition entre les effets critiques et l’exposition estimée au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Le docusate sodique a fait l’objet d’un examen dans le cadre de la caractérisation préliminaire des dangers des substances de la catégorie des sulfosuccinates en 2009 par l’Environmental Protection Agency des États‑Unis (US EPA), et la présente évaluation tient compte de cet examen pour caractériser les effets sur la santé. Les effets critiques après l’exposition subchronique par voie orale au docusate sodique consistaient en effets au site de contact dans le tractus gastrointestinal et une diminution de la prise de poids corporel observée chez les rats. L’exposition répétée par voie orale au docusate sodique chez les rats a également été associée à des effets sur le développement, mais seulement en présence d’une toxicité maternelle. Les sources d’exposition au docusate sodique pour la population générale devraient être dues à son utilisation en tant qu’additif alimentaire autorisé et à l’utilisation de produits contenant cette substance, notamment les cosmétiques, les produits de santé naturels, les médicaments sur ordonnance ou en vente libre, les produits de nettoyage, ainsi que les produits d’activation et de durcissement de la colle pour papier peint. Les marges d’exposition entre l’exposition estimée au docusate sodique et la concentration causant des effets critiques sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
À la lumière des renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l'acétate de méthyle satisfait au critère du paragraphe 64c) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que l’acétate de méthyle répond à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé que l’acétate de méthyle satisfait aux critères de persistance, mais non aux critères de bioaccumulation, tels qu’énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable de 14 des 16 substances désignées collectivement sous le nom « groupe des esters » dans le Plan de gestion des produits chimiques (PGPC), afin de déterminer si ces 14 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Il a été jugé prioritaire d’évaluer ces 14 substances, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine (ECCC et SC [modifié 2017]).
Le di(acétate) d’éthylène, portant le n° CAS 111-55-7, et l’acétate de phényle portant le n° CAS 122-79-2 ont été examinés à l’aide de la Classification du risque écologique (CRE) des substances organiques et de l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC 2016a; Santé Canada 2016), et ils ont été jugés peu préoccupants pour la santé humaine et l’environnement. Par conséquent, la suite du rapport n’en traite pas. Les conclusions pour ces 2 substances figurent dans le document Évaluation préalable – Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) (ECCC, SC 2018). Les 14 substances traitées dans la présente évaluation préalable seront ci‑après dénommées « groupe des esters ».
Les risques pour l’environnement associés aux substances du groupe des esters ont été caractérisés au moyen de la CRE (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition potentielle des organismes dans les milieux aquatique et terrestre en fonction de facteurs comme le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les divers éléments de preuve sont combinés pour trouver les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
Certaines substances du groupe des esters ont été examinées par diverses instances ailleurs dans le monde, notamment l’Union européenne (UE), l’Environnemental Protection Agency des États-Unis (US EPA) et le Programme d’évaluation coopérative des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE). Santé Canada juge ces évaluations fiables; elles ont d'ailleurs été utilisées pour caractériser les effets sur la santé dans cette évaluation préalable.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques des substances, leur devenir dans l’environnement, leurs dangers, leurs utilisations et l’exposition à celles-ci, ainsi que de renseignements soumis par les parties intéressées. Nous avons relevé des données pertinentes publiées jusqu’en mars 2016. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont été utilisés pour formuler nos conclusions. Des renseignements pertinents présentés dans des évaluations faites par d’autres instances ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des renseignements fournis par divers programmes de ces ministères. Les parties du présent document portant sur la santé humaine ont fait l’objet d’un examen ou d’une consultation externe par des pairs. M. Warren Foster (Université McMaster), M. David Dorman (North Carolina State University) et M. Calvin Willhite (Risk Sciences International) ont présenté des commentaires sur les parties techniques relatives à la santé humaine. Les commentaires formulés lors d’un examen externe par les pairs, et présentés dans la section concernant le méthanol dans l’ébauche d’évaluation préalable sur le groupe des alcools, étaient également pertinents pour la présente évaluation. La partie de la présente évaluation qui porte sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de consultation publique de 60 jours. Bien que des commentaires externes aient été pris en compte, le contenu final et la conclusion de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable, axée sur des données critiques pour déterminer si les substances en cause répondent aux critères de l’article 64 de la LCPE, s’appuie sur l’examen de renseignements scientifiques et sur une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 3. Dans la présente ébauche d’évaluation préalable, nous présentons ces renseignements et les considérations critiques sur lesquels sont basées nos conclusions.
2. Identité des substances
Le numéro CAS, le nom figurant sur la Liste intérieure des substances (LIS) et le nom commun (le cas échéant) de chacune des substances ou des substances représentatives dans le groupe des esters sont présentés dans les tableaux 2‑1 à 2‑4. Bien que chaque ester soit évalué individuellement, nous les avons organisés en quatre sous-groupes basés sur la similarité de leur structure chimique, afin de faciliter la présentation de l’information dans la présente évaluation préalable. Le sous‑groupe A est constitué d’esters d’alcools acycliques linéaires ou ramifiés avec un ou plusieurs acides carboxyliques linéaires; le sous‑groupe B contient des esters de di/triols; le sous‑groupe C contient des esters de 2,2,4-triméthylpentane-1,3-diol avec l’acide isobutyrique; et le sous‑groupe D contient une substance individuelle qui est un sel d’un diester.
| No CAS |
Nom sur la LIS (nom commun) |
Structure chimique et formule développée | Poids moléculaire (g/mol) |
|---|---|---|---|
| 79-20-9 | Acétate de méthyle | 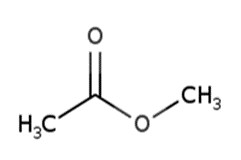 C4H6O2
C4H6O2
|
74,08 |
| 106-70-7 | Hexanoate de méthyle | 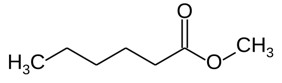 C7H14O2
C7H14O2
|
130,19 |
| 109-60-4 | Acétate de propyle | 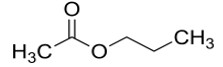 C5H10O2
C5H10O2
|
102,13 |
| 110-19-0 | Acétate d’isobutyle | 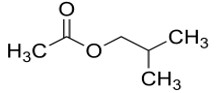 C6H12O2
C6H12O2
|
116,16 |
| 111-82-0 | Laurate de méthyle | 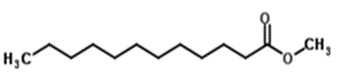 C13H26O2
C13H26O2
|
214,35 |
| 623-42-7 | Butyrate de méthyle | 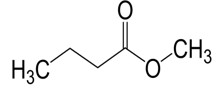 C5H10O2
C5H10O2
|
102,13 |
| 1119-40-0 | Glutarate de diméthyle | 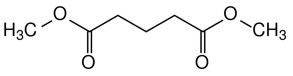 C7H12O4
C7H12O4
|
160,17 |
| 3234-85-3 | Myristate de tétradécyle |  C28H56O2
C28H56O2
|
424,75 |
| 70657-70-4 | Acétate de 2‑méthoxypropyle | 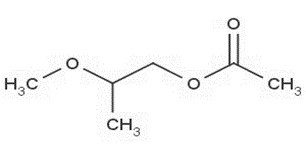 C6H12O3
C6H12O3
|
132,16 |
| No CAS |
Nom sur la LIS (nom commun) |
Structure chimique et formule développée | Poids moléculaire (g/mol) |
|---|---|---|---|
| 102-76-1 | Triacétine | 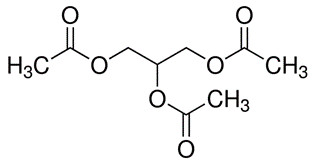 C9H14O6
C9H14O6
|
218,20 |
| 68990-53-4 a | Glycérides en C14-22, mono-(monoglycérides en C14‑22) |
Structures représentatives : 1-monoacylglycérol :CO](/content/dam/eccc/images/pded/esters-group/20211123-Table2-2-2.jpg) 2-monoacylglycérol : CO](/content/dam/eccc/images/pded/esters-group/20211123-Table2-2-3.jpg)
|
S.O. |
Abréviation – S.O. : sans objet.
a La substance de ce no CAS est un UVCB (substances de composition inconnue ou variable, produit de réactions complexes ou matière biologique). Ces matières sont dérivées de sources naturelles ou de réactions complexes et ne peuvent pas être synthétisées par simple combinaison de composants individuels. Les UVCB ne sont pas des mélanges intentionnels de substances distinctes et sont considérées comme des substances simples.
| No CAS |
Nom sur la LIS (nom commun) |
Structure chimique et formule développée | Poids moléculaire (g/mol) |
|---|---|---|---|
| 6846-50-0 | Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène | 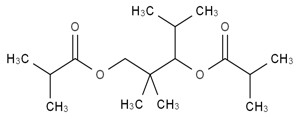 C16H30O4
C16H30O4
|
286,41 |
| 25265-77-4 | Acide isobutyrique, monoester avec le 2,2,4-triméthylpentane-1,3-diol (texanol) | 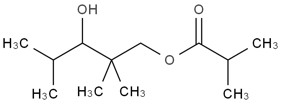 C12H24O3
C12H24O3
|
216,32 |
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule développée | Poids moléculaire (g/mol) |
|---|---|---|---|
| 577-11-7 | Docusate sodique | ![[Na+].CCCCC(CC)COC(=O)CC(C(=O)OCC(CC)CCCC)S(=O)(=O)[O-]](/content/dam/eccc/images/pded/esters-group/20211123-Table2-4-1.jpg) C20H37NaO7S
C20H37NaO7S
|
444,57 |
2.1 Utilisation des données sur les métabolites et les analogues
Les données concernant les métabolites et les analogues ont été utilisées pour éclairer l’évaluation des effets de certaines substances du sous‑groupe A sur la santé humaine. Une fois absorbés, les esters sont rapidement hydrolysés par les estérases non spécifiques présentes dans l’organisme. Les données sur les métabolites attendus (acides et alcools) ont été utilisées pour éclairer l’évaluation des effets de certaines substances du sous‑groupe A sur la santé humaine. Les analogues qui étaient structurellement ou fonctionnellement similaires aux substances de ce groupe (propriétés physico-chimiques, toxicocinétique similaires) ont été sélectionnés et utilisés pour la méthode de lecture croisée. Une liste des différents métabolites et analogues utilisés pour l’évaluation du groupe des esters est présentée dans les tableaux 2-5 et 2‑6, respectivement. De plus amples renseignements sur les propriétés physico-chimiques des analogues figurent à l’annexe A. Les sections pertinentes du présent rapport traitent plus en détail du choix des analogues.
| No CAS | Nom commun | Structure chimique et formule développée | Poids moléculaire (g/mol) | Utilisé pour éclairer l’évaluation des substances ci‑dessous |
|---|---|---|---|---|
| 67-56-1 | Méthanol | 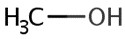 CH3OH
CH3OH
|
32,04 | Acétate de méthyle; hexanoate de méthyle; butyrate de méthyle |
| 142-62-1 | Acide hexanoïque | 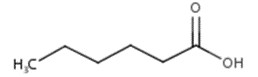 C6H12O2
C6H12O2
|
116,16 | Hexanoate de méthyle |
| 71-23-8 | Alcool n‑propylique | 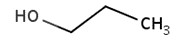 C3H8O
C3H8O
|
60,10 | Acétate de propyle |
| 78-83-1 | 2-Méthylpropan-1-ol (isobutanol) | 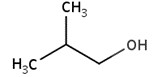 C4H10O
C4H10O
|
74,12 | Acétate d’isobutyle |
| 107-92-6 | Acide butyrique (acide n‑butyrique) | 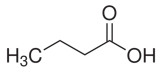 C4H8O2
C4H8O2
|
88,11 | Butyrate de méthyle |
| 544-63-8 | Acide myristique | 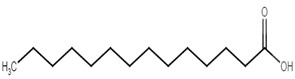 C14H28O2
C14H28O2
|
228,37 | Myristate de tétradécyle |
| 75782-87-5 | Alcools en C14‑15 | 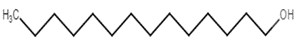 C14H30O
C14H30O
|
214,39 | Myristate de tétradécyle |
| 112-72-1 | Tétradécanol | 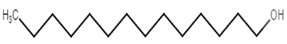 C14H30O
C14H30O
|
214,39 | Myristate de tétradécyle |
| 1589-47-5 | 2-Méthoxy-propanol | 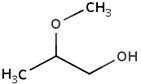 C4H10O2
C4H10O2
|
90,12 | Acétate de 2‑méthoxypropyle |
| No CAS | Nom commun (acronyme) | Structure chimique et formule développée | Poids moléculaire (g/mol) | Utilisé pour éclairer l’évaluation des substances ci‑dessous |
|---|---|---|---|---|
| 111-82-0 | Laurate de méthyle |  C13H26O2
C13H26O2
|
214,35 | Hexanoate de méthyle; butyrate de méthyle |
| 141-78-6 | Acétate d’éthyle | 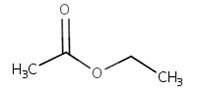 C4H8O2
C4H8O2
|
88,11 | Acétate de propyle |
| 123-86-4 | Acétate de n-butyle | 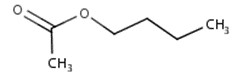 C6H12O2
C6H12O2
|
116,16 | Acétate de propyle |
| 95481-62-2 | Esters dibasiques (DBE) |
Mélange : Succinate de diméthyle (n° CAS 106-65-0) Glutarate de diméthyle Adipate de diméthyle |
S.O. | Glutarate de diméthyle |
| 868839-23-0 | Octanoate de 2-propylheptyle | 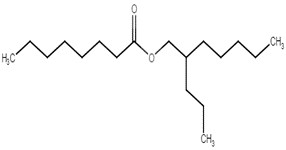 C18H36O2
C18H36O2
|
284,48 | Myristate de tétradécyle |
| 20292-08-4 | Laurate de 2-éthylhexyle | 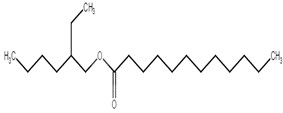 C20H40O2
C20H40O2
|
312,53 | Myristate de tétradécyle |
| 94247-10-6 | Laurate d’isodécyle | 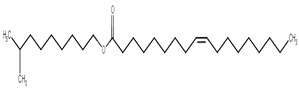 C22H44O2
C22H44O2
|
340,59 | Myristate de tétradécyle |
| 110-27-0 | Myristate d’isopropyle | 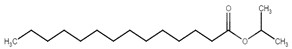 C17H34O2
C17H34O2
|
270,45 | Myristate de tétradécyle |
| 59231-34-4 | Oléate d’isodécyle | 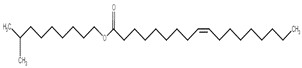 C28H54O2
C28H54O2
|
422,73 | Myristate de tétradécyle |
| 22393-85-7 | Oléate de tétradécyle | 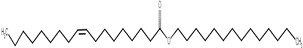 C32H62O2
C32H62O2
|
478,84 | Myristate de tétradécyle |
| 17671-27-1 | Docosanoate de docosyle | 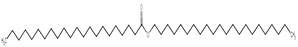 C44H88O2
C44H88O2
|
649,18 | Myristate de tétradécyle |
| 22047-49-0 | Stéarate de 2‑éthylhexyle | 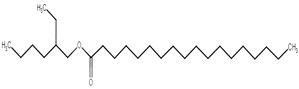 C26H52O2
C26H52O2
|
396,69 | Myristate de tétradécyle |
| 4324-37-2 | Acide 2-méthoxy-propanoïque | 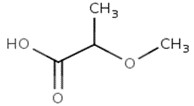 C4H8O3
C4H8O3
|
104,10 | Acétate de 2‑méthoxypropyle |
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du groupe des esters est présenté par sous‑groupe dans les tableaux 3‑1 à 3‑3. Lorsque les données expérimentales étaient limitées ou non disponibles pour une propriété particulière, on a utilisé des modèles de relation quantitative (structure-activité) (QSAR) pour générer les valeurs prévues pour la substance. D’autres propriétés physiques et chimiques sont présentées dans le document d’ECCC (2016b).
| Propriétés | Acétate de méthyle | Hexanoate de méthyle | Acétate de propyle | Acétate d’isobutyle | Laurate de méthyle |
|---|---|---|---|---|---|
| État physique | Liquide | Liquide | Liquide | Liquide | Liquide |
| Point de fusion (°C) | -98,0 | -71 | -93 | -98,8 | 5,2 |
| Pression de vapeur (Pa) | 28800 | 496 | 4786 | 2373 | 0,55 |
| Constante de la loi d’Henry (atm·m³/mol) | 1,15 × 10-4 | 3,67 × 10-4 | 2,18 × 10-4 | 4,54 × 10-4 | 2,98 × 10-3a |
| Solubilité dans l’eau (mg/L) | 243000 (à 20 °C) | 1330 (à 20 °C) | 18900 (à 20 °C) | 6300 | 0,9-1,4a |
| Log Koe (sans dimension) | 0,18 | 2,34a | 1,24 | 1,78 | 5,41 |
| Log Kco (sans dimension) | 0,49-0,96a | 1,55-2,1a | 1,0-1,5a | 1,2-1,8a | 3,1-3,9a |
| pKa (sans dimension) | -7b | -7b | -7b | -7b | -7b |
Abréviations : Koe = coefficient de partage octanol-eau; log Kco = coefficient de partage carbone organique-eau; pKa = log négatif de la constante de la constante de dissociation acide.
Toutes les références sont tirées de ChemIDplus (1993-), sauf indication contraire.
a Estimation à l’aide du logiciel EPI Suite (c2000-2012).
b Wishart et al. (2013) (valeurs estimées trouvées dans (Human Metabolome Database (HMDB)).
| Propriétés | Butyrate de méthyle | Glutarate de diméthyle | Myristate de tétradécyle | 2-Méthyoxyacétate de propyle |
|---|---|---|---|---|
| État physique | Liquide | Liquide | Solide | Liquide |
| Point de fusion (°C) | -85,8 | -42,5 | 162,8 a | -50,3 a |
| Pression de vapeur (Pa) | 4306 | 24 | 2,1 × 10-6 a | 1029 a |
| Constante de la loi d’Henry (atm·m³/mol) | 2,05 × 10-4 | 6,43 × 10-7 |
2,1 × 10-1 – 6,3 × 10-1 a |
3,62 × 10-6 – 5,9 × 10-7 a |
| Solubilité dans l’eau (mg/L) | 15000 | 59000 | 3,4 × 10-8 a | 32660 a |
| Log Koe (sans dimension) | 1,29 | 0,62 | 12,7 a | 0,52 a |
| Log Kco (sans dimension) | 1,0-1,6 a | 1,0-1,1 a | 7,0-7,9 a | 0,60-1,1 a |
| pKa (sans dimension) | -7 b | S.O. | S.O. | S.O. |
Abréviations : Koe = coefficient de partage octanol-eau; log Kco = coefficient de partage carbone organique-eau; pKa = log négatif de la constante de dissociation acide; S.O. = sans objet.
Toutes les références sont tirées de ChemIDplus (1993-), sauf indication contraire.
a Valeurs modélisées à l’aide du logiciel EPI Suite (c2000-2012).
b Wishart et al. (2013) (valeurs estimées trouvées dans la base de données HMDB).
| Propriétés | Triacétine | Monoglycérides en C14‑22 | Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène | Texanol | Docusate sodique |
|---|---|---|---|---|---|
| État physique | Liquide | Solide a | Liquide | Liquide | Solide |
| Point de fusion (°C) | -78,0 | 139 b | -70 c | -50 c ;-70 d | 176 |
| Pression de vapeur (Pa) | 0,33 | 6,4 × 10-7 b | 1,13 b | 1,3 c (à 20 °C) | 1,63 × 10-12 b |
| Constante de la loi d’Henry (atm·m³/mol) | 1,23 × 10-8 b |
1,2 × 10-8 – 3,1 × 10-12 b |
1,1 × 10-5 b |
1,1 × 10-7 – 8,21 × 10-8 b |
5,00 × 10-12 b |
| Solubilité dans l’eau (mg/L) | 58000 | Insoluble dans l’eau a | 0,94 b- 13 d | 322 b | 71000 |
| Log Koe (sans dimension) | 0,25 | 4,65 b | 4,91 b | 3,0 b | 2,0 g – 3,95 b |
| Log Kco (sans dimension) | 0,9-1,6 b | 1,9-2,6< sup>b | 2,7-3,5 b | 1,5 – 2,1 b | 2,80 b |
| pKa (sans dimension) | -6,5 e | S.O. | S.O. | 16,97 f | S.O. |
Abréviations : Koe = coefficient de partage octanol-eau; log Kco = coefficient de partage carbone organique-eau; pKa = log négatif de la constante de dissociation acide; S.O. = sans objet.
Toutes les références sont tirées de ChemIDplus (1993-), sauf indication contraire.
a Norn (2015.)
b Valeurs modélisées à l’aide du logiciel EPI Suite (c2000-2012).
c PubChem (NCBI 2004-).
d ECHA (c2007-2017a).
e Wishart et al. (2013) (valeurs estimées trouvées dans la base de données HMDB).
f ECHA (c2007-2017b) (valeur estimée).
g ECHA (c2007-2017c).
4. Sources et utilisations
Toutes les substances du groupe des esters ont été l’objet d’enquêtes menées conformément à l’article 71 de la LCPE (Canada 2009, 2012). Le tableau 4‑1 présente un résumé des données déclarées sur les quantités totales fabriquées et importées pour le groupe des esters. Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, ni l’hexanoate de méthyle ni le butyrate de méthyle n’ont été fabriqués ou importés au Canada en quantités supérieures au seuil de déclaration de 2011 (Environnement Canada 2013). Pour les 12 autres esters, les quantités fabriquées allaient de 0 kg à 100 000 kg et les quantités importées allaient de 5 000 kg à plus de 3 000 000 kg en 2011 (pour 11 substances) ou en 2009 (pour le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) (Environnement Canada 2009, 2013).
|
Nom commun (n° CAS) |
Quantité totale fabriquée a (kg) | Quantité totale importée a (kg) | Année de déclaration |
|---|---|---|---|
|
Acétate de méthyle (79-20-9) |
9600 | 323602 | 2011 |
|
Hexanoate de méthyle (106-70-7) |
N.D. | N.D. | 2011 |
|
Acétate de propyle (109-60-4) |
N.D. | 3341393 | 2011 |
|
Acétate d’isobutyle (110-19-0) |
710 | 100000 – 1000000 | 2011 |
|
Laurate de méthyle (111-82-0) |
N.D. | 10000 – 100000 | 2011 |
|
Butyrate de méthyle (623-42-7) |
N.D. | N.D. | 2011 |
|
Glutarate de diméthyle (1119-40-0) |
1000 – 10000 | 122144 | 2011 |
|
Myristate de tétradécyle (3234-85-3) |
N.D. | 31626 | 2011 |
|
Acétate de 2‑méthoxypropyle (70657-70-4) |
N.D. | 5752 | 2011 |
|
Triacétine (102-76-1) |
10000 – 100000 | 100000 – 1000000 | 2011 |
|
Monoglycérides en C14‑22 (68990-53-4) |
N.D. | 43000 | 2011 |
|
Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène (6846-50-0) |
100 – 10000 | 594600 | 2009 |
|
Texanol (25265-77-4) |
N.D. | 2541030 | 2011 |
|
Docusate sodique (577-11-7) |
100 – 1000 | 1081185 | 2011 |
Abréviation : N.D. = aucune substance n’a été déclarée en quantité supérieure au seuil de déclaration de 100 kg.
a Les valeurs représentent les quantités déclarées dans le cadre des enquêtes réalisées en vertu de l’article 71 de la LCPE (Canada 2009 et 2013). Voir les enquêtes pour les inclusions ou les exclusions spécifiques (annexes 2 et 3).
Sous‑groupe A
L’acétate de méthyle est principalement utilisé comme solvant dans divers produits commerciaux et produits disponibles aux consommateurs au Canada, notamment les peintures et les revêtements, les décapants pour peinture, les adhésifs et les agents d’étanchéité, les produits de nettoyage et les produits d’entretien de l’ameublement (Environnement Canada 2013; FDS 2018a). L’acétate de propyle a des utilisations déclarées comme solvant, pigment et additif de peinture dans une gamme de produits commerciaux et de produits disponibles aux consommateurs, y compris les peintures et les revêtements, les encres, les encres en poudre et les colorants et les produits de soins personnels (Environnement Canada 2013). L’acétate d’isobutyle est utilisé comme solvant dans les peintures et les revêtements (Environnement Canada 2013). Le laurate de méthyle est utilisé comme solvant dans les produits de nettoyage ou de dégraissage (Environnement Canada 2013). Le glutarate de diméthyle est utilisé comme auxiliaire de traitement, adhésif, agent d’étanchéité et solvant dans les produits commerciaux et dans les produits disponibles aux consommateurs, y compris les peintures et les revêtements, les produits de soins personnels (cosmétiques), les adhésifs et les agents d’étanchéité, et les matériaux de construction, ainsi que dans l’extraction du pétrole et du gaz naturel et dans les applications pour l’automobile, l’aéronautique et le transport (Environnement Canada 2013). Le myristate de tétradécyle est principalement utilisé comme agent revitalisant pour la peau dans les produits de soins personnels et les cosmétiques au Canada (Environnement Canada 2013). Quant à l’acétate de 2‑méthoxypropyle, il est principalement utilisé dans les peintures et les revêtements, ainsi que dans les matières plastiques et les caoutchoucs dans lesquels il sert d’agent de finition (Environnement Canada 2013).
L’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle et le butyrate de méthyle sont présents à l’état naturel dans les aliments et peuvent être utilisés ailleurs dans le monde comme agents aromatisants alimentaires dans une variété d’aliments (Burdock 2010). On ne dispose d’aucune donnée définitive concernant les utilisations potentielles de ces substances comme agents aromatisants alimentaires au Canada. Cependant, comme ces substances sont identifiées comme agents aromatisants alimentaires ailleurs dans le monde, il est possible qu’elles soient présentes comme agents aromatisants dans les aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments (DA), Santé Canada (SC) au Bureau d’évaluation du risque des substances existantes (BERSE), SC, 5 décembre 2016 et 15 mars 2021; sans référence).
L’acétate de méthyle, l’acétate de propyle, l’acétate d’isobutyle et l’acétate de 2‑méthoxypropyle peuvent être utilisés comme composants dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments. Le glutarate de diméthyle et le myristate de tétradécyle ont été identifiés comme composants dans des additifs indirectsNote de bas de page 4 (p. ex., nettoyants et désinfectants pour les mains) utilisés dans des établissements de transformation sans contact direct avec les aliments (communication personnelle, courriels de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
Le glutarate de diméthyle est un ingrédient médicinal dans deux produits désinfectants homologués. Le myristate de tétradécyle est un ingrédient non médicinal dans plusieurs produits thérapeutiques à application topique en vente libre, notamment des gels, des crèmes et des lotions ainsi que des baumes hydratants pour lèvres (communication personnelle, courriel de la Direction des produits thérapeutiques (DPT), SC, au BERSE, SC, 6 décembre 2016; sans référence).
L’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle et le butyrate de méthyle figurent dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) en tant qu’ingrédient non médicinal pour utilisation comme exhausteur de goût. Le glutarate de diméthyle figure dans la BDIPSN en tant qu’ingrédient non médicinal pour utilisation comme solvant. Le myristate de tétradécyle figure dans la BDIPSN en tant qu’ingrédient non médicinal pour utilisation topique seulement, jusqu’à 17 %, lorsqu’il est formulé pour être un agent revitalisant pour la peau non irritant – c’est‑à‑dire un émollient ou un agent revitalisant pour la peau sous pansement occlusif (BDIPSN [modifiée 2021]). Le myristate de tétradécyle figure dans la Base de données sur les produits de santé naturels homologués (BDPSNH) comme ingrédient non médicinal dans les produits de santé naturels au Canada, tandis que l’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le butyrate de méthyle et le glutarate de diméthyle n’y figurent pas (BDPSNH [modifiée 2021]).
Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, l’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le glutarate de diméthyle et le myristate de tétradécyle sont utilisés dans certains cosmétiques au Canada. L’acétate de méthyle est utilisé dans des produits tels que les vernis à ongles, les dissolvants de vernis à ongles, les nettoyants, les produits pour le bain, les produits de maquillage, les exfoliants et les hydratants. L’hexanoate de méthyle est utilisé dans les produits hydratants pour les ongles. Selon les notifications, l’acétate de propyle est utilisé dans des produits tels que les vernis à ongles, les produits de maquillage et les produits de mise en plis. L’acétate d’isobutyle est utilisé dans les produits pour les ongles et les produits hydratants. Le laurate de méthyle a été trouvé dans des crèmes hydratantes pour le visage. Le glutarate de diméthyle est utilisé dans divers produits tels que les nettoyants, les décapants pour adhésifs et les dissolvants de vernis à ongles. Le myristate de tétradécyle est utilisé dans divers produits tels que les antisudorifiques, les produits pour le bain, les décolorants, les nettoyants, les revitalisants, les exfoliants, les produits parfumants, les colorants capillaires, les produits de maquillage, les produits de massage, les hydratants, les vernis à ongles, les shampoings, les produits de rasage, les produits de mise en plis et les produits autobronzants (communication personnelle, courriel de la Direction de la Sécurité des produits disponibles aux consommateurs et des produits dangereux [DSPCPD], SC, au BERSE, SC, 5 mars 2021; sans référence).
L’acétate de 2‑méthoxypropyle est décrit sur la Liste critique des ingrédients de cosmétiques : Ingrédients interdits et d’usage restreint (plus connue sous le nom de Liste critique des ingrédients de cosmétiques) comme étant une substance interdite. Cette liste est un outil administratif que Santé Canada utilise pour faire savoir que certaines substances peuvent contrevenir à l’interdiction générale énoncée à l’article 16 de la Loi sur les aliments et drogues (LAD), ou à une ou plusieurs dispositions du Règlement sur les cosmétiques. L’article 16 de la LAD stipule ce qui suit : « Il est interdit de vendre un cosmétique qui, selon le cas, contient une substance – ou en est recouvert – susceptible de nuire à la santé de l’individu qui en fait usage ». En outre, la Liste critique comprend certaines substances qui peuvent rendre improbable le classement d’un produit comme étant un cosmétique en vertu de la LAD (Santé Canada 2015).
Le butyrate de méthyle n’a pas été déclaré comme substance utilisée dans les cosmétiques au Canada (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence).
Les substances suivantes du sous‑groupe A ont été identifiées comme produits de formulation dans des produits antiparasitaires homologués au Canada : l’acétate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle et l’acétate de 2‑méthoxypropyle.
L’acétate de méthyle et l’acétate d’isobutyle ont été identifiés comme ingrédients possibles dans les produits de vapotage (US FDA 2019), ce qui peut représenter une source supplémentaire d’exposition à l’acétate de méthyle et à l’acétate d’isobutyle. Les produits de vapotage (tels que les cigarettes électroniques et les dispositifs de vapotage contenant du cannabis) font l’objet de cadres législatifs distincts (SC [modifié 2020]).
Les tableaux 4-2 et 4-3 présentent un résumé des principales utilisations des esters du sous‑groupe A selon les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Des utilisations supplémentaires des esters du sous‑groupe A sont également présentées dans le tableau 4-5.
| Principales utilisations a | Acétate de méthyle | Acétate de propyle | Acétate d’isobutyle | Laurate de méthyle | Glutarate de diméthyle |
|---|---|---|---|---|---|
| Adhésifs et produits d'étanchéité | O | N | O | N | O |
| Automobiles, aéronefs et transports | N | O | O | N | O |
| Batteries | O | N | N | N | N |
| Matériaux de construction | N | N | N | N | O |
| Nettoyage et entretien des meubles | O | N | N | N | N |
| Tissus, textiles et articles en cuir | O | N | N | N | N |
| Encre, encre en poudre et colorants | O | O | N | N | O |
| Produits de santé naturels | O | N | N | N | N |
| Extraction du pétrole et du gaz | N | N | N | N | O |
| Peintures et revêtements | O | O | O | N | O |
| Produits, mélanges ou articles manufacturés en papier | O | N | N | N | N |
| Soins personnels et cosmétiques | N | O | N | N | O |
| Matériaux en plastique et en caoutchouc qui ne sont pas mentionnés ailleurs | O | O | N | N | N |
| Jouets, équipement pour les terrains de jeu et les sports | N | N | N | N | O |
| Traitement de l’eau | N | N | N | N | N |
| Autres b | O | O | O | O | O |
Abréviations : O = oui; N = non.
a Utilisations non confidentielles déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
b La catégorie « autres » comprend les utilisations mineures ou les utilisations qui ne peuvent pas être divulguées en raison de demandes de confidentialité.
| Principales utilisations a | Myristate de tétradécyle | Acétate de 2‑méthoxypropyle |
|---|---|---|
| Automobiles, aéronefs et transports | N | O |
| Médicaments | O | N |
| Produits de santé naturels | O | N |
| Soins personnels et cosmétiques | O | N |
| Matériaux en plastique et en caoutchouc qui ne sont pas mentionnés ailleurs | N | O |
Abréviations : O = oui; N = non.
a Utilisations non confidentielles déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
Sous‑groupe B
Selon les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE, les applications déclarées de la triacétine comprennent son utilisation dans les produits de soins personnels et les produits cosmétiques, les encres, les encres en poudre et les colorants, les adhésifs et les agents d’étanchéité et dans les aliments et les boissons au Canada (Environnement Canada 2013).
La triacétine a été identifiée comme composant d’un additif indirect (lubrifiant) utilisé dans les établissements de transformation des aliments, sans contact direct avec les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence). Les substances dites « glycérides en C14-22, mono- » ont été trouvées dans les matériaux d’emballage alimentaire comme composant des matériaux à base de polystyrène (p. ex., les gobelets et les conteneurs en mousse) et des matériaux à base de polypropylène (p. ex., les conteneurs, les pailles) et ont été trouvées dans les additifs indirects (p. ex., les lubrifiants et les agents de démoulage) (communication personnelle, courriel de la DA, SC, au BERSE, SC, 23 novembre 2015; sans référence).
La triacétine et les monoglycérides en C14‑22 sont considérés comme des additifs alimentaires autorisés au Canada. L’utilisation de la triacétine est autorisée comme agent mouillant dans des mélanges à gâteau et comme solvant dans les arômes, tel que le prescrit la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées et la Liste des solvants de support ou d’extraction autorisés, respectivement, incorporées par renvoi dans leurs autorisations de mise en marché respectives délivrées en vertu de la Loi sur les aliments et drogues. Les substances dites « glycérides en C14-22, mono- » seraient incluses dans les monoglycérides et des mono- et diglycérides autorisés en tant qu’additifs alimentaires, dont l’utilisation est permise comme agent émulsifiant, gélifiant, stabilisant ou épaississant, comme agent antimousse, humectant ou de démoulage et comme véhicule ou solvant d’extraction dans une variété d’aliments, comme il est indiqué dans la Liste des agents émulsifiants, gélifiants, stabilisants ou épaississants autorisés, la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées et la Liste des solvants de support ou d’extraction autorisés, incorporées par renvoi dans leurs autorisations de mise en marché respectives délivrées en vertu de la Loi sur les aliments et drogues.
La triacétine figure dans la BDIPSN en tant qu’ingrédient non médicinal utilisé comme biocide cosmétique, exhausteur de goût, ingrédient de parfum, agent humectant, plastifiant ou solvant, ainsi que dans la BDPSNH en tant qu’ingrédient non médicinal présent dans les produits de santé naturels au Canada (BDIPSN [modifiée 2021]; BDPSNH [modifiée 2021]). La triacétine est également utilisée comme ingrédient non médicinal dans environ 25 médicaments sur ordonnance ou en vente libre homologués au Canada. Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, la triacétine est utilisée dans certains cosmétiques au Canada, comme les adhésifs, les nettoyants, les exfoliants, les produits de maquillage, les démaquillants, les produits de massage, les hydratants et les vernis à ongles (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). La triacétine est également un produit de formulation dans des produits antiparasitaires homologués au Canada.
Sous‑groupe C
Selon les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE, les principales utilisations du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène au Canada sont comme solvant dans les matières plastiques et le caoutchouc, ainsi que dans les encres, les encres en poudre, les colorants, les adhésifs et les agents d’étanchéité (Environnement Canada 2009). Il est également utilisé comme agent de durcissement et initiateur de polymérisation, ainsi que dans les peintures et les revêtements, les revêtements de sol et les pièces formées pour l’automobile. Selon une enquête distincte, on a signalé que le texanol était utilisé dans les peintures et les revêtements, les adhésifs et les agents d’étanchéité, les matériaux de construction, les applications pour l’automobile, l’aéronautique et le transport, les revêtements de sol et les carburants et les produits connexes (Environnement Canada 2013).
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène et le texanol peuvent être tous deux utilisés comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments (communication personnelle, courriels de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène figure dans la BDIPSN comme ingrédient non médicinal pour usage topique seulement, jusqu’à 9,8 %, comme plastifiant, ainsi que dans la BDPSNH comme ingrédient non médicinal dans un produit de santé naturel au Canada (BDIPSN [modifiée 2021]; BDPSNH [modifiée 2018]).
Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est utilisé dans certains cosmétiques au Canada, comme les adhésifs, les hydratants pour les ongles, les vernis à ongles et les dissolvants de vernis à ongles. Le texanol (identifié par International Nomenclature of Cosmetic Ingredients [INCI] sous le nom de diisobutyrate de triméthyle pentanyle) est utilisé dans les vernis à ongles et les produits de maquillage au Canada (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). Le texanol est également un produit de formulation dans des produits antiparasitaires homologués au Canada.
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est un plastifiant et peut migrer depuis les biberons fabriqués avec des matériaux utilisés comme substituts du polycarbonate. On l’a également mesuré dans des jouets en plastique et d’autres articles en plastique destinés aux enfants (Onghena et al. 2016; Simoneau et al. 2012; Bouma et Schakel 2002; Tonning et al. 2009; Janssen et Bremmer 2009).
Sous‑groupe D
Le docusate sodique est principalement utilisé au Canada dans l’extraction du pétrole et du gaz naturel, dans les aliments et les boissons, les médicaments ainsi que dans les peintures et les revêtements. L’une des principales fonctions du docusate sodique est de servir d’agent tensio-actif (Environnement Canada 2013). Parmi les autres applications au Canada, mentionnons les utilisations dans les matières plastiques et le caoutchouc, comme agent de séchage, adhésif et agent d’étanchéité, dans les produits de soins personnels et les cosmétiques, les carburants et les produits connexes, les mélanges ou les articles manufacturés, les produits de nettoyage et d’entretien de l’ameublement, le traitement de l’eau, les matériaux de construction, les produits de papier, les encres, les encres en poudre et les colorants, les revêtements de sol, la lessive et le lavage de la vaisselle et les applications minières (Environnement Canada 2013). L’utilisation du docusate sodique (sous forme de sulfosuccinate de dioctyle de sodium) est autorisée dans un nombre limité d’aliments, comme le prescrit la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées, incorporée par renvoi dans son autorisation de mise en marché délivrée en vertu de la Loi sur les aliments et drogues. Le docusate sodique peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 15 mars 2021; sans référence).
Le docusate sodique figure également dans la BDIPSN comme ingrédient non médicinal, c’est‑à‑dire comme agent émulsifiant, agent solubilisant ou agent mouillant, et comme ingrédient de produit de santé non naturel parce qu’il n’est pas une substance d’origine naturelle incluse dans l’annexe 1 du Règlement sur les produits de santé naturels. Il figure dans la BDPSNH comme ingrédient non médicinal dans les produits de santé naturels au Canada (BDIPSN [modifiée 2021]; BDPSNH [modifiée 2021]). Le docusate sodique est un principe actif dans les médicaments sur ordonnance ou en vente libre (principalement des laxatifs) au Canada et un ingrédient non médicinal présent dans une vaste gamme de produits, notamment des produits pour application orale et topique et des désinfectants en aérosol (communication personnelle, courriel de la DPT, SC, au BERSE, SC, 5 décembre 2016 et 18 mars 2021; sans référence). Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le docusate sodique (nom de l’INCI : sulfosuccinate de diéthylhexyle de sodium) est utilisé dans certains cosmétiques au Canada comme les adhésifs, les produits pour le bain, les agents de blanchiment, les nettoyants, les exfoliants, les colorants capillaires, les produits de maquillage, les démaquillants, les shampoings, les produits de rasage, les produits de mise en pli et les produits autobronzants (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). Le docusate sodique est un produit de formulation dans des produits antiparasitaires homologués au Canada.
Le tableau 4-4 résume les principales utilisations des esters des sous‑groupes B, C et D déclarées lors d’enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013). Des utilisations supplémentaires des esters des sous‑groupes B, C et D sont décrites dans le tableau 4-5.
| Principales utilisations a | Triacétine | Monoglycérides en C14‑22 | Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène | Texanol | Docusate sodique |
|---|---|---|---|---|---|
| Adhésifs et produits d'étanchéité | O | N | O | O | O |
| Automobiles, aéronefs et transports | N | N | N | O | O |
| Matériaux de construction | N | N | N | O | O |
| Nettoyage et entretien des meubles | N | N | O | N | O |
| Médicaments | N | N | N | N | O |
| Tissus, textiles et articles en cuir | N | N | O | N | N |
| Revêtements de sol | N | N | O | O | O |
| Aliments et boissons | O | N | N | N | O |
| Emballage des aliments | N | O | N | N | O |
| Carburants et produits, mélanges ou articles manufacturés connexes | N | N | N | O | O |
| Encre, encre en poudre et colorants | O | N | O | N | O |
| Lavage du linge et de la vaisselle | N | N | N | N | O |
| Extraction du pétrole et du gaz | N | N | N | N | O |
| Peintures et revêtements | N | N | O | O | O |
| Produits, mélanges ou articles manufacturés en papier | N | N | N | N | O |
| Soins personnels et cosmétiques | O | N | N | N | O |
| Matériaux en plastique et en caoutchouc qui ne sont pas mentionnés ailleurs | N | N | O | N | O |
| Traitement de l’eau | N | N | N | N | O |
| Autres b | O | N | O | N | N |
Abréviations : O = oui; N = non.
a Utilisations non confidentielles déclarées lors d’enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
b La catégorie « autres » comprend les utilisations mineures ou les utilisations qui ne peuvent pas être divulguées en raison de demandes de confidentialité.
| Utilisation | Sous‑groupe A | Sous‑groupe B | Sous‑groupe C | Sous‑groupe D |
|---|---|---|---|---|
| Additif alimentaire a | N |
Triacétine Monoglycérides en C14‑22 b,c |
N | Docusate sodique |
| Exhausteur de goût a |
Acétate de méthyle Hexanoate de méthyle c Acétate de propyle Acétate d’isobutyle c Laurate de méthyle Butyrate de méthyle |
Triacétine | N | N |
| Matériaux d’emballage alimentaire a |
Acétate de méthyle Acétate de propyle Acétate d’isobutyle c Acétate de 2‑méthoxypropyle |
Monoglycérides en C14‑22 c |
Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène Texanol |
Docusate sodique |
| Additif indirect |
Glutarate de diméthyle Myristate de tétradécyle |
Triacétine Monoglycérides en C14‑22 c |
N | N |
| Présents dans la Base de données interne sur les produits pharmaceutiques, présents comme ingrédients médicinaux ou non médicinaux dans les désinfectants ou dans des médicaments destinés aux humains ou aux animaux au Canada d |
Laurate de méthyle Myristate de tétradécyle |
Triacétine | N | Docusate sodique |
| Présents dans la Base de données sur les ingrédients des produits de santé naturels e |
Acétate de méthyle Hexanoate de méthyle Acétate de propyle Acétate d’isobutyle Laurate de méthyle Butyrate de méthyle Glutarate de diméthyle Myristate de tétradécyle |
Triacétine | Diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène | Docusate sodique |
| Présents la Base de données des produits de santé naturels homologués – utilisation comme ingrédient médicinal ou non médicinal dans les produits de santé naturels au Canada e | Myristate de tétradécyle | Triacétine | Diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène | Docusate sodique |
| Présents la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques f | Acétate de 2‑méthoxypropyle | N | N | N |
| Présence déclarée dans les cosmétiques, d’après les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques f |
Acétate de méthyle Hexanoate de méthyle Acétate de propyle Acétate d’isobutyle Laurate de méthyle Glutarate de diméthyle Myristate de tétradécyle |
Triacétine | Diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène Texanol | Docusate sodique |
| Produit de formulation dans des produits antiparasitaires homologués au Canada g |
Acétate de méthyle Acétate de propyle Acétate d’isobutyle Laurate de méthyle Acétate de 2‑méthoxypropyle |
Triacétine | Texanol | Docusate sodique |
Abréviation : N = cette utilisation n’a pas été déclarée pour ce sous-groupe.
a Communication personnelle, courriels de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence.
b Les « glycérides en C14‑22, mono- » sont inclus sur la liste pour deux additifs alimentaires approuvés au Canada. Désignés comme monoglycérides ou mono- et diglycérides, selon la Liste des additifs alimentaires autorisés au Canada (voir le sous‑groupe B à la section 4, pour plus de détails).
c Communication personnelle, courriel du Bureau de la gestion des risques, SC, au BERSE, SC, 17 août 2015; sans référence.
d Communication personnelle, courriel de la DPT, SC, au BERSE, SC, 6 décembre 2016 et 3 mars 2021; sans référence.
e Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), SC, au BERSE, SC, 6 décembre 2016 et 11 février 2021; sans référence.
f Communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 8 décembre 2016 et 5 mars 2021; sans référence.
g Communication personnelle, courriel du BGR, SC, au BERSE, SC, 12 décembre 2016; sans référence; communication personnelle courriel de l’Agence de réglementation de la lutte antiparasitaire, SC, au BERSE, SC, 26 mars 2021; sans référence.
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
Selon les modèles utilisés dans la CRE (ECCC 2016b), l’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le butyrate de méthyle et le glutarate de diméthyle devraient persister dans l’air, mais non dans l’eau, les sédiments ou les sols.
Selon les modèles utilisés dans la CRE (ECCC 2016b), le docusate sodique devrait persister dans l’eau, les sédiments et les sols, mais non dans l’air.
Selon les modèles utilisés dans la CRE (ECCC 2016b), la triacétine, le laurate de méthyle, le myristate de tétradécyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne devraient pas persister dans l’air, l’eau, les sédiments ou les sols.
5.2 Potentiel de bioaccumulation
Compte tenu de leurs faibles valeurs log Koe et de leurs faibles facteurs de bioconcentration (FBC) (ECCC 2016b), l’acétate de méthyle, la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le texanol et l’acétate de 2‑méthoxypropyle ne devraient pas se bioaccumuler de manière significative dans les organismes.
Bien que les valeurs log Koe du laurate de méthyle, du myristate de tétradécyle et des monoglycérides en C14‑22 vont de modérées à élevées, les FBC pour ces substances sont faibles (ECCC 2016b). Par conséquent, elles ne devraient pas se bioaccumuler de manière significative dans les organismes.
Bien que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène présente un log Koe élevé, et comme cette substance a un FBC élevé selon les résultats empiriques (5 340 L/kg) (ECCC 2016b), on s’attend à ce qu’il se bioaccumule de manière significative dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation du risque pour l’environnement
Les risques écologiques des substances du groupe des esters ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) (ECCC 2016a). Cette approche tient compte de plusieurs paramètres liés au danger et à l’exposition et pondère plusieurs éléments de preuve pour obtenir un classement du risque. Elle combine les divers éléments de preuve de façon à différentier les substances plus ou moins dangereuses et les potentiels d’exposition plus ou moins grands dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un unique paramètre dans un seul milieu (p. ex., la concentration létale médiane, CL50). La méthode, qui est décrite en détail par ECCC (2016a), est résumée ci-dessous.
Les données sur les propriétés physico-chimiques, sur le devenir (demi‑vie de la substance chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de substances chimiques importées ou fabriquées au Canada ont été colligées à partir de publications scientifiques, de bases de données empiriques (p. ex., boîte à outils QSAR de l’OCDE, 2014) et des résultats des enquêtes menées en vertu de l’article 71 de la LCPE. Les données peuvent aussi être obtenues par modélisation de la relation quantitative structure-activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de la substance.
Les profils de danger ont été établis principalement à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été calculés à partir de plusieurs paramètres, dont les taux de rejet potentiels, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance comme étant faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) afin de raffiner les classifications préliminaires du danger et de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape consiste à ajuster les résultats de la classification du risque de modéré ou élevé à faible lorsque l’estimation du taux de rejet dans l’eau d’une substance après son passage par un système de traitement d’eaux usées prédisait un faible risque d’exposition. La deuxième étape sert à réévaluer les résultats d’un classement de risque faible par rapport à des scénarios de risques relativement prudents à l’échelle locale (dans la zone à proximité du point de rejet) et conçus pour protéger l’environnement afin de déterminer si l’on devrait accroître le classement du risque.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une classification supérieure ou inférieure du danger, de l’exposition et du risque subséquent. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Dans ce qui suit, nous discutons de deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient conduire à une modification du classement du danger, en particulier dans le cas des paramètres liés aux concentrations de résidus dans les tissus (le mode d’action toxique), dont un grand nombre sont prévues à partir de modèles QSAR (OCDE, QSAR Toolbox 2014). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) des résidus dans les tissus qui servira à l’analyse critique des résidus corporels. L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profil structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Des changements ou des erreurs dans les quantités de substances chimiques pourraient produire des différences dans le classement de l’exposition, car les classifications de l’exposition et du risque sont très sensibles aux taux d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas représenter les tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres aux substances du groupe des esters, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans ECCC (2016 b).
La classification du danger et de l’exposition pour les substances du groupe des esters est résumée dans le tableau 6-1.
| Substance | Classement du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Acétate de méthyle | faible | faible | faible |
| Triacétine | faible | faible | faible |
| Hexanoate de méthyle | faible | faible | faible |
| Acétate de propyle | faible | élevée | faible |
| Acétate d’isobutyle | faible | élevée | faible |
| Laurate de méthyle | faible | faible | faible |
| Docusate sodique | modéré | faible | faible |
| Butyrate de méthyle | faible | faible | faible |
| Glutarate de diméthyle | faible | faible | faible |
| Myristate de tétradécyle | faible | faible | faible |
| Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène | modéré | faible | faible |
| Texanol | faible | faible | faible |
| Monoglycérides en C14‑22 | faible | faible | faible |
| Acétate de 2‑méthoxypropyle | faible | faible | faible |
Sur la base de la classification de danger faible et d’exposition faible selon les renseignements examinés dans le cadre de la CRE, l’acétate de méthyle, la triacétine, l’hexanoate de méthyle, le laurate de méthyle, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ont été classés comme substances à faible potentiel de risque écologique. Il est donc improbable que ces substances soient préoccupantes pour l’environnement au Canada.
Selon les renseignements examinés dans le cadre de la CRE, le docusate sodique a été classé comme présentant un faible potentiel d’exposition et un potentiel de risque modéré, ce dernier étant basé sur la concordance entre le mode d’action réactif et le rapport d’écotoxicité élevé, qui indiquent tous deux que cette substance chimique possède probablement une puissance élevée. Toutefois, les effets potentiels et leurs manifestations possibles dans l’environnement n’ont pas été étudiés en profondeur, étant donné la faible exposition à cette substance. Compte tenu des profils d’emploi actuels, il est peu probable que le docusate sodique suscite des préoccupations pour l’environnement au Canada.
Selon les renseignements examinés dans le cadre de la CRE, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a été classé comme présentant un faible potentiel d’exposition et un potentiel modéré de danger, cette dernière classification étant fondée sur un potentiel modéré de provoquer des effets nocifs dans les réseaux alimentaires aquatiques compte tenu de son potentiel modéré de bioaccumulation. Toutefois, les effets potentiels et leurs manifestations possibles dans l’environnement n’ont pas été étudiés en profondeur, étant donné la faible exposition à cette substance. Il est peu probable que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène suscite des préoccupations pour l’environnement au Canada.
Selon les renseignements examinés dans le cadre de la CRE, l’acétate de propyle et l’acétate d’isobutyle ont été classés comme présentant un potentiel d’exposition élevé en raison des quantités annuelles relativement grandes importées et de leur longue demi-vie dans l’air. Les deux substances ont été classées comme présentant un faible danger et un faible potentiel de risque écologique. Bien que les profils d’emploi actuels donnent lieu à un potentiel d’exposition élevé, il est peu probable que l’acétate de propyle et l’acétate d’isobutyle suscitent des préoccupations pour l’environnement au Canada compte tenu de leur faible potentiel de danger.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Sous‑groupe A : Esters d’alcool acyclique linéaire/ramifié avec acides carboxyliques linéaires
7.1.1 Acétate de méthyle
Évaluation de l’exposition
Milieux naturels
L’acétate de méthyle est un liquide dont la pression de vapeur est très élevée. Cette substance a été mesurée dans l’air ambiant dans quatre études canadiennes dans les villes de Windsor, Regina, Halifax et Edmonton (Santé Canada 2010a, 2010b, 2012, 2013a). Les concentrations d’acétate de méthyle dans l’air ambiant, selon ces études, allaient de moins de la limite de détection de la méthode (LDM) à 6,32 mg/m³, avec une concentration moyenne géométrique allant de moins de la LDM à 0,22 mg/m³. La concentration d’acétate de méthyle la plus élevée au 95e centile dans l’air ambiant, basée sur un échantillonnage important (c.‑à‑d. > 30), a été sélectionnée comme étant représentative de la population générale pour exposition par l’air ambiant (0,57 mg/m³, d’après des échantillons sur 24 heures prélevés dans l’étude d’Edmonton) (Santé Canada 2013a).
L’acétate de méthyle a également été mesuré dans l’air intérieur dans les quatre études canadiennes susmentionnées. Les concentrations d’acétate de méthyle dans l’air intérieur allaient de moins de la LDM à 34,32 mg/m³, avec une concentration moyenne géométrique allant de 0,41 mg/m³ à 2,4 mg/m³ dans l’ensemble de ces études de surveillance de l’air intérieur au Canada. La concentration la plus élevée dans l’air intérieur au 95e centile, selon les quatre études, était de 11,5 mg/m³, selon les données de l’étude de Windsor obtenues en 2006 (Santé Canada 2010a). Cette valeur a été utilisée pour estimer l’exposition de la population générale du Canada par l’air intérieur.
Dans le cadre de l’étude d’évaluation de l’exposition à Windsor, on a également prélevé des échantillons d’air individuels, et dans cette étude les participants adultes portaient une cartouche filtrant les composés organiques volatils (COV) de 1,0 L, pendant 24 heures sur 24, sur 5 jours consécutifs. La concentration d’acétate de méthyle dans les échantillons d’air individuels allait de moins de la LDM à 10,1 mg/m³ en 2005. La moyenne géométrique des concentrations d’air individuelles dans les échantillons prélevés en hiver et en été 2005 était de 0,72 mg/m³ et 2,5 mg/m³, respectivement, tandis que le 95e centile de la concentration mesurée en hiver et en été était de 2,4 mg/m³ et 7,0 mg/m³, respectivement.
L’acétate de méthyle est très soluble dans l’eau. Toutefois, sa constante mesurée de la loi d’Henry, soit 1,15 × 10-4 atm m³/mol, indique que la volatilisation à partir des surfaces d’eau est probable (HSDB 1983- ). On n’a trouvé aucune donnée portant sur l’acétate de méthyle mesuré dans l’eau au Canada. Les concentrations dans les eaux de surface ont été estimées à l’aide des feuilles de calcul pour l’eau potable établies par l’Unité d’évaluation environnementale (UEE) du Bureau de l’évaluation et du contrôle des substances nouvelles (BECSN) à l’aide du scénario de rejets industriels (Santé Canada 2015a). Cette estimation de la présence potentielle de la substance dans l’eau est jugée prudente, car une grande partie de l’acétate de méthyle est susceptible de se volatiliser.
On n’a pas trouvé d’acétate de méthyle dans les études sur les sols ou la poussière au Canada ou à l’étranger. On s’attend à ce que l’acétate de méthyle ait une très grande mobilité dans le sol et qu’il se volatilise à partir des surfaces humides et sèches du sol.
Aliments
L’acétate de méthyle peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments. Par conséquent, on ne prévoit pas d’exposition par les aliments (communication personnelle, courriels de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
L’acétate de méthyle a été mesuré dans plusieurs aliments, principalement en raison de sa présence naturelle dans ceux‑ci. En outre, l’acétate de méthyle peut être utilisé comme agent aromatisant dans les aliments. Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a évalué les esters d’alcools primaires aliphatiques acycliques avec des acides carboxyliques saturés linéaires aliphatiques (y compris l’acétate de méthyle) selon la Procédure d’évaluation de l’innocuité des agents aromatisants et a conclu que l’acétate de méthyle ne présentait « aucun problème d’innocuité » compte tenu des concentrations actuellement ingérées en tant qu’agent aromatisant alimentaire (OMS 1998). Dans le cadre de cette évaluation, le JECFA a estimé que l’absorption d’acétate de méthyle par personne aux États‑Unis était de 110 mg/personne/j (1,8 mg/kg p.c./j sur la base d’un poids corporel moyen de 60 kg pour la population générale). L’absorption est estimée à l’aide de l’absorption journalière maximale établie par une enquête (MSDI), basée sur la quantité de production annuelle déclarée d’acétate de méthyle aux États-Unis (International Organization of the Flavour Industry 1995, citée dans OMS 1998; US National Academy of Sciences 1987, citée dans OMS 1998).
On s’attend à ce que l’exposition alimentaire potentielle découlant des utilisations alimentaires possibles de l’acétate de méthyle comme agent aromatisant soit faible par rapport à l’absorption de cette substance en raison de sa présence naturelle dans les aliments. Stofberg et Grundschober (1984) ont calculé les ratios de consommation pour divers agents aromatisants, en comparant l’absorption moyenne de l’agent aromatisant ajouté aux quantités consommées du fait de leur présence naturelle dans les aliments. Ils ont indiqué que cette substance est principalement consommée en raison de sa présence naturelle dans les aliments plutôt que par son ajout comme agent aromatisant.
Afin de caractériser l’exposition potentielle de la population générale par des sources alimentaires d’acétate de méthyle en raison de sa présence naturelle dans les aliments, l’estimation quantitative de l’exposition a été calculée (communication personnelle, courriel de la DA, SC, au BERSE, SC, 8 décembre 2017). L’acétate de méthyle figure dans la base de données Volatile Compounds in Food (VCF) comme étant présent dans une gamme d’aliments, notamment la pomme, la banane, la cerise, les agrumes, la goyave, le raisin, le melon, les nectarines, l’ananas, la tomate, le vinaigre, la bière et le xérès (Nijssen et al. 1963-2016). L’estimation quantitative de l’exposition a été calculée à partir des données sur la consommation de catégories d’aliments comparables tirées de l’Enquête sur la santé dans les collectivités canadiennes (ESCC, cycle 2.2) sur la consommation de catégories d’aliments définies pour l’ensemble de la population (Santé Canada 2015). Les valeurs sur sa présence, obtenues par l’analyse des données tirées de la base VCF et de la littérature scientifique, ont été appliquées à la consommation de chaque catégorie d’aliments, le cas échéant. L’ensemble de données sur la présence d’acétate de méthyle était suffisamment détaillé pour une grande variété d’aliments, de sorte qu’il a été jugé approprié d’évaluer la consommation par l’ensemble de la population. Le tableau 7-1 présente les valeurs estimées de l’exposition à l’acétate de méthyle due à sa présence naturelle dans les aliments. L’exposition alimentaire la plus élevée au 90e centile pour la population générale était de 33,1 mg/kg p.c./j, d’après le groupe d’âge des 1 à 2 ans.
| Groupe d’âge | 0 à 5 mois | 6 à 11 mois | 1 an | 14 à 18 ans | 14 à 18 ans | 14 à 18 ans | 14 à 18 ans | 19 ans et + |
|---|---|---|---|---|---|---|---|---|
| Moyenne | 0,0 | 8,6 | 14,2 | 13,5 | 10,1 | 6,7 | 5,0 | 8,9 |
| 90e centile | 0,0 | 28,1 | 33,1 | 28,3 | 21,9 | 15,0 | 11,2 | 12,1 |
L’exposition de la population générale à l’acétate de méthyle par les milieux naturels et les aliments (d’après le 90e centile de l’exposition par voie alimentaire) varie de 6 mg/kg p.c./j à 43 mg/kg p.c./j (voir l’annexe B, tableau B-1). Sur la base des renseignements disponibles, on estime que les sources prédominantes d’exposition à l’acétate de méthyle par les milieux naturels et les aliments, pour la population générale, sont l’air intérieur et le régime alimentaire. On s’attend à ce que la majeure partie de l’exposition alimentaire à l’acétate de méthyle résulte de sa présence naturelle dans les aliments.
Produits disponibles aux consommateurs
L’acétate de méthyle sert d’agent parfumant et de solvant dans les cosmétiques (Commission européenne 2008- ) et est présent dans les nettoyants, les exfoliants, les produits de maquillage pour les yeux, les hydratants, les masques faciaux, les vernis à ongles et les dissolvants de vernis à ongles au Canada (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence).
L’acétate de méthyle a une pression de vapeur très élevée et devrait demeurer peu de temps sur la peau dans le cas des produits qui ne sont pas rincés. Bien que l’on s’attende à ce que l’exposition cutanée contribue à l’exposition globale pendant l’utilisation du produit, l’inhalation est considérée comme la principale voie d’exposition.
Le tableau 7-2 résume les estimations de la concentration dans l’air associée à l’utilisation de cosmétiques contenant de l’acétate de méthyle pour les groupes d’âge pertinents. Ces valeurs représentent la concentration moyenne sur une période de 24 heures dans l’air, jugée pertinente pour la comparaison avec la concentration de référence dans l’air. Les valeurs de concentration dans l’air n’ont pas été estimées dans le cas des cosmétiques à rincer, en raison du potentiel limité d’exposition par inhalation. Les concentrations moyennes dans l’air sur 24 heures associées à l’utilisation des produits de maquillage ont été jugées inférieures à 0,03 mg/m³.
| Scénario d’utilisation du produit | Concentration d’acétate de méthyle a | Concentration moyenne le jour de l’exposition b (mg/m³) |
|---|---|---|
| Vernis à ongles (19 ans et +) | 30 % | 4,3 |
| Vernis à ongles (2-3 ans) | 30 % | 1,4 |
| Dissolvant de vernis à ongles (19 ans et +) | 100 % | 9 |
| Dissolvant de vernis à ongles (2-3 ans) | 100 % | 3,6 |
a Communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence.
b Les estimations de la concentration dans l’air ont été calculées à l’aide du logiciel Consumer Exposure Web Model (ConsExpo Web 2016); voir l’annexe C-3 pour de plus amples renseignements sur les paramètres d’entrée.
En plus des cosmétiques, l’acétate de méthyle est utilisé dans divers autres produits disponibles aux consommateurs qui peuvent entraîner une exposition de la population générale au Canada. Bon nombre de ces produits sont des aérosols, notamment les produits de nettoyage/polissage de cuisine (SDS 2015a), les produits pour l’automobile (p. ex., la peinture [FDS 2019], les nettoyants en vaporisateur pour pneus [SDS 2014a], les décapants pour adhésifs [SDS 2014b]) et les adhésifs en aérosol (SDS 2018b). Les produits qui ne sont pas en aérosol comprennent les décapants pour peinture (FDS 2018a), les produits d’étanchéité pour gouttières (SDS 2011), les adhésifs pour la construction, les toitures et l’aménagement paysager (FDS 2018c), les produits de revêtement de sol de garage (SDS 2015b) et les adhésifs à usage général (SDS 2015c). Les concentrations atmosphériques potentielles associées à l’utilisation de ces produits disponibles aux consommateurs ont été estimées à l’aide du logiciel ConsExpo Web (ConsExpo 2016) et sont résumées dans le tableau 7-3. Tout comme pour les cosmétiques, la période de 24 heures a été jugée pertinente pour les comparaisons avec la concentration de référence.
| Scénario d’utilisation du produit | Concentration d’acétate de méthyle dans le produit | Concentration dans l’air sur 24 heures le jour de l’exposition a (mg/m³) |
|---|---|---|
| Produit de nettoyage/polissage en aérosol | 2,5–10 % | 0,73 |
| Peinture en aérosol pour automobile (p. ex., jantes de pneus) | 5–26 % | 34 |
| Nettoyant en aérosol pour pneus (automobile) | 60 % | 6 |
| Nettoyant pour pneus en pulvérisateur à gâchette | 60 % | 7,4 |
| Décapant pour adhésif en aérosol (automobile) | 80 % | 0,6 |
| Adhésif en aérosol (pour automobile/usage ménager) | 40 % | 52 |
| Adhésif pour construction; produit de jointage | 1–5 % | 10 |
| Colle pour chambres à air | 50–100 % | 3,4–6,4 |
| Lubrifiant en aérosol | 10 % | 0,94 |
| Décapant pour peinture b - Petits projets (taux de renouvellement d’air faible/élevé) | 70 % | 79 / 246 c |
| Décapant pour peinture b - Grands projets (taux de renouvellement d’air faible/élevé) | 70 % | 712 / 2153 c |
| Décapant pour peinture b - Baignoire | 70 % | 1136 |
| Revêtement de sol pour garage | 15 % (mélange/charge) 10 % (application) d | 44 |
a Les estimations de la concentration dans l’air ont été calculées à l’aide du logiciel Consumer Exposure Web Model (ConsExpo Web 2016); voir l’annexe C-3 pour de plus amples renseignements sur les paramètres d’entrée ainsi que les valeurs maximales de concentration dans l’air et les valeurs ponctuelles.
b Les scénarios pour le décapant pour peinture ont été divisés en plusieurs scénarios : deux tailles de projets (petits et grands), chacun avec des taux de renouvellement de l’air différents, ainsi qu’un scénario d’utilisation pour baignoire. Les détails sont présentés à l’annexe C-3.
c Deux valeurs de concentration dans l’air représentent les deux scénarios de renouvellement de l’air.
d La valeur de 15 % représente la quantité de substance dans un composant d’un produit à deux composants; une fois mélangé, le produit appliqué contient 10 % de substance.
En plus des produits mentionnés ci-dessus, on a signalé qu’il y avait dégazage d’acétate de méthyle par des matériaux de construction utilisés au Canada, notamment les agents de calfeutrage, les planchers de bois franc, les panneaux de fibre de densité moyenne et les panneaux à copeaux orientés (Won et Lusztyk 2011). Dans les pièces, les concentrations dans l’air variaient de 0,03 µg/m³ à 98,2 µg/m³ sur 24 heures (Won et Lusztyk 2011). Cette source d’exposition est prise en compte par la caractérisation de l’exposition due aux autres scénarios décrits dans le tableau 7-3 (p. ex., produits de polissage et de nettoyage en aérosol), qui donne lieu à des concentrations probablement supérieures à celles qui sont dues aux matériaux de construction.
Évaluation des effets sur la santé
Aux fins de la présente évaluation, la caractérisation des effets de l’acétate de méthyle sur la santé s’est appuyée sur le Rapport d’évaluation des risques de l’Union européenne (EU RAR 2003) pour l’acétate de méthyle. Une recherche a été effectuée dans la littérature afin de trouver des données publiées entre l’année précédant la publication du rapport susmentionné de l’Union européenne (c.‑à‑d. janvier 2002) et décembre 2020. Pour l’acétate de méthyle, on n’a trouvé aucune étude sur les effets sur la santé susceptible d’avoir un impact sur la caractérisation des risques réalisée dans le cadre du rapport RAR de l’UE (c.‑à‑d. de présenter les critères d’effet critiques différents ou à des points de départ inférieurs à ceux qui sont indiqués dans le RAR de l’UE de 2003). Le principal métabolite de l’acétate de méthyle, le méthanol, a fait l’objet d’un examen à l’étranger par l’ECHA (2015a, 2016a) et l’EPA (US EPA 2013a, 2013b). Ces examens ont également été utilisés pour l’évaluation des effets de l’acétate de méthyle sur la santé. On a recherché des données sur le méthanol dans la littérature pour trouver des renseignements publiés jusqu’au mois d’avril 2020, et on n’a relevé aucune étude susceptible de donner lieu à une évaluation des effets sur la santé différente de celle des agences susmentionnées. Le méthanol a été examiné dans le projet d’évaluation préalable pour le groupe des alcools dans le cadre du PGPC (ECCC, SC 2022).
Le RAR de l’UE (2003) présentait un résumé de la toxicocinétique de l’acétate de méthyle. Une fois absorbé, l’acétate de méthyle subit une hydrolyse rapide pour former du méthanol et de l’acide acétique par des estérases non spécifiques présentes dans le sang et les tissus. La disponibilité systématique de l’acétate de méthyle est faible. D’après les données in vitro disponibles, la demi-vie de l’acétate de méthyle dans le sang a été estimée à 2 à 3 heures chez le rat et à environ 2 heures chez l’humain. Immédiatement après une exposition par inhalation de 6 heures chez le rat (2 000 parties par million [ppm] ou 6 040 mg/m³), on a constaté que les concentrations sanguines étaient inférieures à la limite de quantification (moins de 4,6 mg/L), ce qui indique une hydrolyse et une forte clairance de la substance (RAR de l’UE 2003).
Toxicité à doses répétées
Le RAR de l’UE (2003) indique qu’il n’y avait pas d’étude à doses répétées pour l’acétate de méthyle après une exposition par voie orale ou cutanée, et qu’aucune étude de toxicité chronique ou subchronique par inhalation n’avait été trouvée. Les données concernant le principal métabolite de l’acétate de méthyle, le méthanol, ont été examinées par l’UE dans son évaluation de l’acétate de méthyle. Cependant, les études sur l’exposition par inhalation dans lesquelles des animaux ont été exposés au méthanol ont été jugées de moindre qualité que l’étude sur l’inhalation à court terme pour l’acétate de méthyle présentée ci‑dessous (RAR de l’UE 2003).
Dans une étude d’exposition répétée à court terme, des rats Sprague-Dawley ont été exposés à l’acétate de méthyle par inhalation, étude sur laquelle le RAR de l’UE (2003) s’est fondé pour choisir une dose critique pour les effets locaux et systémiques. Dans cette étude, les animaux de laboratoire (10/sexe/dose) ont été exposés à l’acétate de méthyle (par voie nasale uniquement) à des concentrations de 0, 75, 350 ou 2 000 ppm (concentrations analytiques moyennes de 79, 335 et 2 018 ppm, équivalant à 227, 1 057 et 6 040 mg/m³, respectivement), 6 heures par jour, 5 jours par semaine pendant 28 jours. On a établi dans le RAR de l’UE (2003) une concentration sans effet nocif observé (CSENO) de 350 ppm (1 057 mg/m³), d’après la dégénérescence et la nécrose observées de la muqueuse olfactive des rats à la concentration suivante de 2 000 ppm (6 040 mg/m³). Ces effets ont été considérés comme des effets sur le site de contact. En ce qui concerne les effets systémiques, les concentrations faible et moyenne ont été associées à une réduction des taux de cholestérol et à des modifications du poids des surrénales et du thymus. Toutefois, ces changements ont été qualifiés de « légers » et sont survenus uniquement chez les femelles. À la concentration maximale, des effets ont été observés chez les deux sexes, notamment une diminution du poids corporel et de la consommation alimentaire, une diminution des taux de cholestérol, une augmentation de l’activité de l’alanine aminotransférase, une augmentation du poids des surrénales, une augmentation de la diurèse, une diminution du poids du thymus et une augmentation des taux d’érythrocytes, d’hémoglobine, d’hématocrite et de calcium (HMR 1999a, cité dans le RAR de l’UE 2003). Bien qu’aucun changement morphologique n’ait été observé, le RAR de l’UE (2003) a indiqué que les résultats susmentionnés représentaient des effets nocifs minimes liés au traitement à l’acétate de méthyle et a calculé une CSENO systémique de 1 057 mg/m³ sur la base des effets observés à la concentration suivante de 6 040 mg/m³.
On n’a trouvé aucune étude sur l’exposition chronique à doses répétées pour l’acétate de méthyle.
Toxicité pour la reproduction et le développement
On n’a trouvé aucune donnée sur la toxicité de l’acétate de méthyle pour la reproduction. En raison de l’hydrolyse rapide de la substance, le RAR de l’UE (2003) a estimé qu’il était justifié de baser la caractérisation des effets de l’acétate de méthyle sur la reproduction et le développement sur son principal métabolite, le méthanol, dont les effets sur le développement ont été démontrés chez les rongeurs (RAR de l’UE 2003).
L’EPA (US EPA 2013a) a évalué diverses études de toxicité du méthanol comprenant des données provenant de différentes espèces et pour différents critères d’effet et a établi une dose de référence (DRf) de 2 mg/kg p.c./j et une concentration de référence (CRf) de 20 mg/m³ d’après les effets sur le développement. Les valeurs DRf et CRf ont été calculées pour une population présentant une concentration de fond de méthanol dans le sang égal ou inférieur à 2,5 mg/L en raison du métabolisme et de la consommation d’aliments (fruits et légumes) contenant naturellement du méthanol. Les effets sur le développement comprennent des malformations du squelette (côtes cervicales ou côtes surnuméraires), des fentes palatines et des exencéphalies chez les souriceaux en l’absence de toute toxicité maternelle, une réduction du poids du cerveau chez les rats adultes et les ratons, et des signes d’effets sur le développement chez les singes après une exposition par inhalation à doses répétées (Kavet et Nauss 1990; Burbacher et al. 1999a, 1999b, 2004a, 2004b; Rogers et al. 1993; NEDO 1987; Fisher et al. 2000, OCDE 2004). Selon l’EPA, ces études ont montré des effets cohérents sur le développement à des doses similaires chez les souris et les rats. Entre autres, la signification biologique de ces effets est jugée pertinente pour les humains, car une augmentation du SNR et une diminution du poids du cerveau peuvent se produire chez les humains et sont considérées comme des effets indésirables (US EPA 2013a, 2013b; Chernoff 2004). En raison de la nature progressive de ces effets, la dose et la concentration de référence sont considérées comme pertinentes pour l’exposition à court et à moyen terme. L’EPA a noté que même s’il existe des incertitudes quant à la pertinence pour l’humain des effets observés chez les rongeurs, il y avait suffisamment de signes d’effets potentiels sur le développement chez les primates, ainsi qu’un manque de connaissances sur le métabolisme du méthanol chez les nourrissons humains pour justifier l’utilisation des études sur les rongeurs afin de déterminer les points de départ pour l’exposition par inhalation et par voie orale. Les valeurs DRf et CRf pour le méthanol (2 mg/kg p.c./j et 20 mg/m³, respectivement) ont été ajustées pour refléter l’exposition à l’acétate de méthyle (4,6 mg/kg p.c./j et 46 mg/m³, respectivement) en supposant que l’acétate de méthyle se dégrade immédiatement en méthanol à un rapport molaire de 1.
Le Comité d’évaluation des risques (RAC – Committee for Risk Assessment) de l’ECHA a déterminé que sur la base des renseignements disponibles, il n’y a pas suffisamment de preuves pour classer le méthanol pour ce qui est de sa toxicité pour le développement chez l’humain (ECHA 2015a). Ce comité a conclu que le critère le plus pertinent pour l’exposition de la population générale par inhalation et par voie cutanée était les effets neurologiques transitoires et a soutenu une dose dérivée sans effet (DNEL) de 43,3 mg/m³ et 6,66 mg/kg p.c./j pour ces voies d’exposition, d’après les valeurs limites indicatives d’une exposition professionnelle existantes dans l’UE. L’ECHA a ensuite proposé une DNEL orale de 88 mg/kg p.c. pour couvrir la toxicité aiguë du méthanol par absorption. Cette DNEL était basée sur une acuité visuelle significativement réduite à 260 mg/kg p.c. (ECHA 2016b).
On a rapporté qu’une exposition de courte durée à l’acétate de méthyle en suspension dans l’air chez l’humain entraînait une irritation des yeux, du nez, de la gorge et de la trachée après une exposition à partir d’environ 15 000 mg/m³ (Reus 1933, cité dans le RAR de l’UE 2003). D’autres effets comme des troubles visuels, des symptômes du système nerveux central, des difficultés respiratoires, etc., ont également été signalés, bien que ces études ne contenaient pas suffisamment de renseignements sur l’exposition et/ou étaient liées à des mélanges de produits.
Il a été rapporté que le principal métabolite de l’acétate de méthyle, le méthanol, causait des étourdissements, des maux de tête, des nausées, des insomnies, une vision trouble et une conjonctivite (US EPA 2005). Dans une étude sur un lieu de travail, l’exposition à une concentration moyenne dans l’air de 1 060 ppm (1 400 mg/m³) de méthanol provoquait une fréquence significativement accrue de maux de têtes, de nausées, d’étourdissements et de vision trouble chez des enseignants (Frederick et al. 1984). Dans une autre étude, des travailleurs ont fait état d’une irritation oculaire après avoir été exposés pendant 25 minutes à 1 025 ppm (1 300 mg/m³) de méthanol dans l’air (NIOSH 1981). Les concentrations de méthanol dans l’air causant ces effets ont été utilisées pour estimer les concentrations d’acétate de méthyle dans l’air (en supposant que l’acétate de méthyle se dégrade immédiatement en méthanol à un rapport molaire de 1), ce qui a donné des estimations de 2 990 mg/m³ à 3 220 mg/m³ (basées sur 1 300 mg/m³ et 1 400 mg/m³ de méthanol, respectivement).
Génotoxicité
L’UE a conclu qu’il n’y avait pas lieu de s’inquiéter de la génotoxicité de l’acétate de méthyle (RAR de l’UE 2003). L’acétate de méthyle s’est révélé négatif dans les tests de mutation bactérienne, en l’absence ou en présence d’une activation métabolique (RAR de l’UE 2003). Des résultats négatifs ont également été rapportés dans un test in vivo du micronoyau de la moelle osseuse chez les rats, des animaux (5/sexe/groupe) ayant été exposés par inhalation à des doses de 75, 350 et 2 000 ppm pendant 6 heures, 5 jours par semaine pendant 28 jours (HMR 1999b, cité dans le RAR de l’UE 2003). Le potentiel génotoxique du méthanol a été jugé négatif dans la majorité des tests in vitro et in vivo (IPCS 1997; NTP 2004; OCDE 2004).
Cancérogénicité
Le RAR de l’UE (2003) concluait : « aucune donnée disponible ne permet de craindre une cancérogénicité à la suite d’une exposition à l’acétate de méthyle ». Il n’existe pas de données sur le potentiel cancérogène de l’acide acétique, un métabolite (RAR de l’UE 2003). Le méthanol n’a pas été classé comme cancérogène par l’EPA, le Centre international de recherche sur le cancer (CIRC) ou le National Toxicology Program (NTP) (Cruzan 2009; CIRC 2018). Sur la base de ces renseignements et en l’absence de preuve d’un potentiel mutagène pour l’acétate de méthyle, l’UE a conclu que « l’acétate de méthyle n’est apparemment pas cancérogène » (RAR de l’UE 2003).
Caractérisation du risque
L’acétate de méthyle a été examiné par l’UE. Le RAR de l’UE (2003) a conclu qu’il n’existe aucun signe que l’acétate de méthyle puisse être associé à des effets cancérogènes ou génotoxiques, selon les données empiriques disponibles pour l’acétate de méthyle et son principal métabolite, le méthanol.
Étant donné que les seuls effets signalés observés à la suite d’une exposition par inhalation à l’acétate de méthyle étaient sur le site de contact et consistaient en effets systémiques mineurs (probablement liés à une réaction de stress) à des concentrations élevées, la présente évaluation n’a pas comporté de caractérisation quantitative du risque à l’aide d’un critère d’effet pour l’acétate de méthyle. Aucune étude de toxicité pour la reproduction ou le développement n’a été trouvée pour l’acétate de méthyle.
Bien qu’on n’ait pas trouvé d’études sur la toxicité de l’acétate de méthyle pour le développement, des effets potentiels sur le développement sont associés au méthanol, son principal métabolite, et sont pris en compte dans la présente évaluation. La DRf et la CRf pour l’exposition au méthanol par voie orale et par inhalation, calculées par l’EPA, étaient respectivement de 2 mg/kg p.c./j et 20 mg/m³. La DRf et la CRf pour le méthanol ont été ajustées sur la base des différences de Poids moléculaire (en supposant qu’à la suite d’une exposition à l’acétate de méthyle, celui‑ci se dégrade immédiatement en méthanol à un rapport molaire de 1). Lorsque les valeurs DRf et CRf du méthanol sont ajustées pour refléter l’exposition à l’acétate de méthyle, les valeurs résultantes sont respectivement de 4,6 mg/kg p.c./j et de 46 mg/m³. Les valeurs ajustées ont été comparées à l’exposition estimée des Canadiens à l’acétate de méthyle.
Les principales voies d’exposition environnementale à l’acétate de méthyle pour la population générale sont dues à sa présence naturelle dans les aliments et dans l’air intérieur. L’exposition par inhalation peut également se produire à la suite de l’utilisation de produits disponibles aux consommateurs.
Le tableau 7-4 présente les valeurs pertinentes d’exposition ou de concentration dans l’air pour l’acétate de méthyle par rapport à la CRf et à la DRf du méthanol (valeurs ajustées pour l’acétate de méthyle). Ces valeurs ont été utilisées pour caractériser le risque pour la santé humaine lié à l’exposition à l’acétate de méthyle.
| Scénario | Exposition (mg/kg p.c./j) ou concentration estimée moyenne sur 24 h dans l’air (mg/m³) a | L’exposition dépasse-t-elle la DRf ou la CRf pour le méthanol (avec ajustement pour l’exposition à l’acétate de méthyle)? |
|---|---|---|
| Milieux naturels et présence naturelle dans les aliments (exposition chronique par voie orale; nourrissons de 1 an) | 0,43 mg/kg p.c./j | Non |
| Vernis à ongles (30 %) | 4,3 mg/m³ | Non |
| Dissolvant de vernis à ongles (100 %) | 9 mg/m³ | Non |
| Produit de polissage en aérosol pour acier inoxydable (10 %) | 0,73 mg/m³ | Non |
| Peinture en aérosol (automobile; 26 %) | 34 mg/m³ | Non |
| Nettoyant en aérosol pour pneus (automobile; 60 %) | 6 mg/m³ | Non |
| Nettoyant pour pneus en pulvérisateur à gâchette (automobile; 60 %) | 7,4 mg/m³ | Non |
| Décapant pour adhésif en aérosol (automobile; 80 %) | 0,6 mg/m³ | Non |
| Adhésif en aérosol (pour automobile/usage ménager; 40 %) | 52 mg/m³ | Oui |
| Adhésif pour construction – produit de jointage (5 %) | 10 mg/m³ | Non |
| Colle pour chambres à air (100 %) | 6,4 mg/m³ | Non |
| Lubrifiant en aérosol (10 %) | 0,94 mg/m³ | Non |
| Décapants pour peinture (70 %) - Petit projet | 79 – 246 mg/m³ | Oui |
| Décapants pour peinture (70 %) - Grand projet | 712 – 2153 mg/m³ | Oui |
| Décapants pour peinture (70 %) - Baignoire | 1136 mg/m³ | Oui |
| Revêtement de sol pour garage; (produit : 15 %; pendant l’application : 10 %) | 44 mg/m³ | Non |
Abréviations : DRf = dose de référence; CRf = concentration de référence; h = heure.
a Les valeurs de concentration dans l’air pour l’acétate de méthyle reflètent les concentrations moyennes sur 24 heures le jour de l’exposition; les concentrations moyennes sur 24 heures dans l’air ont été jugées pertinentes pour la comparaison avec la concentration de référence établie d’après la valeur du méthanol.
L’exposition à l’acétate de méthyle par les milieux naturels et en raison de sa présence naturelle dans les aliments est inférieure à la DRf du méthanol (ajustée pour l’acétate de méthyle) et n’est donc pas jugée préoccupante pour la santé humaine. La contribution de l’absorption due à l’utilisation potentielle d’acétate de méthyle comme agent aromatisant alimentaire serait minime par rapport à l’exposition totale par les milieux naturels et en raison de sa présence naturelle dans les aliments.
La population générale du Canada peut également être exposée à l’acétate de méthyle par inhalation lors de l’utilisation de divers produits disponibles aux consommateurs contenant cette substance, y compris les produits pour les ongles, les produits de nettoyage, les produits pour l’automobile (p. ex., les peintures en aérosol, les adhésifs en aérosol), les adhésifs (p. ex., les adhésifs pour la construction, les adhésifs pour chambres à air), les lubrifiants, les décapants pour peinture et les revêtements de sol. Toutes les concentrations moyennes dans l’air calculées sur 24 heures, associées à l’utilisation de produits disponibles aux consommateurs, sauf les adhésifs en aérosol et les décapants pour peinture, sont inférieures à la CRf pour le méthanol (valeurs ajustées pour l’exposition à l’acétate de méthyle) et ne sont donc pas jugées préoccupantes. Dans le cas des décapants pour peinture (trois scénarios), les concentrations moyennes dans l’air estimées sur 24 heures sont, estime-t-on, supérieures à la CRf pour le méthanol (valeurs ajustées pour l’acétate de méthyle) et sont donc potentiellement préoccupantes.
Il est à noter qu’on a observé que des concentrations supérieures à 15 000 mg/m³ pour l’exposition à l’acétate de méthyle dans l’air entraînaient une irritation. De plus, on a observé que des concentrations supérieures à 1 025 ppm (1 300 mg/m³) pour l’exposition au méthanol dans l’air (équivalant à environ 2 990 mg/m³ d’acétate de méthyle) entraînaient une irritation et des étourdissements après une exposition de courte durée chez les travailleurs (US EPA 2005; Frederick et al. 1984; NIOSH 1980). Dans le cas des scénarios avec décapant pour peinture ou vernis qui donnent des concentrations moyennes par événement ou maximales de méthanol supérieures à cette valeur, l’exposition par inhalation peut être autolimitée par la gêne que l’utilisateur peut ressentir lors de son exposition au produit.
7.1.2 Hexanoate de méthyle
Évaluation de l’exposition
L’hexanoate de méthyle a été détecté dans moins de 10 % des échantillons dans deux études de l’air intérieur menées au Canada. Dans l’étude nationale canadienne sur l’air intérieur menée en 2009-2011 dans le cadre du cycle 2 de l’Enquête canadienne sur les mesures de santé (ECMS), on a détecté l’hexanoate de méthyle dans seulement 5 % des échantillons (la concentration au 95e centile était de 0,18 µg/m³) (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale (BSRSE), SC, au BERSE, SC, décembre 2012; sans référence). Dans une étude de l’air intérieur dans des maisons de la ville de Québec (échantillonnage entre novembre 2008 et mars 2010), l’hexanoate de méthyle n’a été détecté que dans 8 % des échantillons (concentration maximale rapportée de 0,33 mg/m³) (Won et Lusztyk 2011).
On n’a pas trouvé de concentrations mesurées d’hexanoate de méthyle dans l’air ambiant, l’eau ou la poussière au Canada.
L’exposition de la population générale à l’hexanoate de méthyle par les milieux naturels (air intérieur) variait de 0,06 mg/kg p.c./j à 0,17 mg/kg p.c./j.
L’hexanoate de méthyle a été évalué par le JECFA en tant qu’agent aromatisant alimentaire, qui a conclu que la substance ne posait « aucun problème d’innocuité » sur la base des concentrations actuellement ingérées sous la forme d’agent aromatisant (OMS 2009). En l’absence de données sur l’utilisation réelle de cette substance au Canada, s’il y en a une, les estimations de l’absorption par habitant pour la population américaine, établies par le JECFA à 41 µg/personne/j (1 µg/kg p.c./j sur la base d’un poids corporel moyen de 60 kg pour la population générale) constituent une valeur acceptable de l’exposition alimentaire possible à l’hexanoate de méthyle au Canada en raison de son utilisation potentielle comme agent aromatisant alimentaire par la population générale (1 an et plus) (OMS 2009; communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence).
L’hexanoate de méthyle a été trouvé dans des cosmétiques, en particulier dans des produits hydratants pour les ongles, à des concentrations atteignant 10 % (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’exposition cutanée à l’hexanoate de méthyle a été estimée d’après un scénario d’application de dissolvant de vernis à ongles. L’exposition estimée la plus élevée par voie cutanée a été estimée à 5,4 mg/kg p.c./j pour le groupe d’âge de 9 à 13 ans.
Cette substance n’a pas été déclarée comme ayant été importée ou fabriquée au Canada. Par conséquent, on ne s’attend pas à des rejets de sources industrielles.
Évaluation des effets sur la santé
Une recherche a été effectuée dans la littérature pour trouver des articles publiés jusqu’en décembre 2020. On n’a trouvé que des données limitées sur les effets sur la santé. L’hexanoate de méthyle a eu des effets négatifs sur les souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium à des concentrations allant de 8 μg/plaque à 5 000 μg/plaque avec et sans activation métabolique (Anonymous 1996, cité dans ECHA c2007-2017d).
Une fois absorbé, on s’attend à ce que l’hexanoate de méthyle soit hydrolysé par des estérases non spécifiques présentes dans le sang et les tissus pour former de l’acide hexanoïque (n° CAS 142-62-1) et du méthanol (n° CAS 67-56-1). Les données sur les deux métabolites ont été examinées afin d’éclairer l’évaluation des effets de l’hexanoate de méthyle sur la santé humaine.
L’hexanoate de méthyle est également structurellement similaire à un autre ester de son sous-groupe, en l’occurrence le laurate de méthyle (n° CAS 111-82-0). Le laurate de méthyle ayant été identifié comme analogue potentiel de l’hexanoate de méthyle, les données concernant le laurate de méthyle ont également été examinées pour éclairer l’évaluation des effets de l’hexanoate de méthyle sur la santé humaine.
Acide hexanoïque
Toxicité à doses répétées
L’OCDE a examiné l’acide hexanoïque dans le cadre de l’évaluation de la catégorie des acides aliphatiques. Dans son rapport de 2014, l’OCDE a conclu que l’exposition répétée par voie orale (par gavage ou par voie alimentaire) aux acides aliphatiques (y compris l’acide hexanoïque) n’entraînait pas de toxicité générale, les doses sans effet nocif observé (DSENO) étant supérieures à 1 000 mg/kg p.c./j. L’OCDE a identifié l’acide docosanoïque (n° CAS 112-85-6) comme étant l’analogue structurel le plus proche de l’acide hexanoïque, d’après les données disponibles. Dans un essai combiné de toxicité à doses répétées et de toxicité pour la reproduction et le développement, des rats (13/sexe/groupe) ont reçu de l’acide docosanoïque par gavage oral à des doses de 0, 100, 300 ou 1 000 mg/kg/j. Chez les mâles, la période d’exposition était de 42 jours, chez les femelles, elle allait de 14 jours avant l’accouplement au 3e jour de lactation (minimum de 39 jours d’exposition). La DSENO a été établie à 1 000 mg/kg p.c./j sur la base de l’absence de morts ou de modifications de l’état général, de modifications de la prise de poids corporel ou de la consommation alimentaire, et de l’absence d’effets histopathologiques, hématologiques ou biochimiques indésirables à toutes les doses d’essai (OCDE 2014).
Aucune étude d’exposition par inhalation ou par voie cutanée n’a été trouvée.
Toxicité pour la reproduction et le développement
L’OCDE (2014) a identifié l’acide docosanoïque comme l’analogue structurel le plus proche de l’acide hexanoïque, d’après les données disponibles. Dans l’essai combiné à doses répétées et de toxicité pour la reproduction et le développement décrit ci‑dessus au sujet de l’acide docosanoïque, on n’a relevé aucun effet sur la reproduction jusqu’à la dose maximale d’essai. La DSENO pour la toxicité pour la reproduction était supérieure ou égale à 1 000 mg/kg p.c./j chez les mâles et les femelles. En plus, on n’a observé aucun effet sur les paramètres du développement. Les valeurs de la DSENO pour la toxicité maternelle et la toxicité pour le développement étaient égales ou supérieures à 1 000 mg/kg p.c./j (OCDE 2014).
Selon le rapport de l’OCDE (2014), on n’a observé aucun effet sur la fertilité ou les organes reproducteurs ni aucun effet sur le développement dans les études sur les acides aliphatiques examinées dans le rapport. L’OCDE a indiqué que le poids de la preuve corrobore l’absence de toxicité potentielle pour la reproduction et le développement des acides aliphatiques.
Génotoxicité
Des résultats négatifs ont été rapportés pour un test d’Ames sur l’acide hexanoïque sur les souches TA98, TA100, TA1535 et TA1537 de Salmonella typhimurium, avec et sans activation métabolique (OCDE 2014). Selon l’OCDE (2014), les acides aliphatiques ne sont ni mutagènes ni clastogènes in vitro ou in vivo. L’OCDE a déclaré que « le poids de la preuve indique que les acides aliphatiques [comme l’acide hexanoïque] ne devraient pas être génotoxiques ».
Méthanol
Le méthanol a été examiné dans l’ébauche d’évaluation préalable pour le groupe des alcools dans le cadre du PGPC (ECCC, SC 2022), et les données sont également résumées à la section 7.1.1 (Évaluation des effets sur la santé) du présent document. En utilisant une approche similaire à celle qui est présentée à la section 7.1.1, les valeurs CRf et DRf pour le méthanol, établies par l’EPA (20 mg/m³ et 2 mg/kg p.c./j, respectivement), ont été ajustées pour refléter l’exposition à l’hexanoate de méthyle (ce qui donne des valeurs ajustées de 80 mg/m³ et 8 mg/kg p.c./j, respectivement), en supposant que l’hexanoate de méthyle se dégrade immédiatement en méthanol à un rapport molaire de 1.
Laurate de méthyle
L’évaluation de cette substance est présentée à la section 7.1.5. Selon l’OCDE (2013), le laurate de méthyle présente « un faible profil de danger », d’après l’ensemble de données disponible. On n’a observé aucun effet nocif lié au traitement dans une étude préliminaire de toxicité pour le développement et la reproduction combinée à une étude orale à doses répétées, à des doses atteignant la dose limiteNote de bas de page 5 de 1 000 mg/kg p.c./j. De plus, le laurate de méthyle a été jugé non génotoxique in vitro. Selon l’OCDE, cette substance présente une faible priorité pour ce qui est des futurs travaux.
Caractérisation du risque
Après l’absorption, on s’attend à ce que l’hexanoate de méthyle soit hydrolysé par des estérases non spécifiques présentes dans l’organisme pour former de l’acide hexanoïque et du méthanol.
L’acide hexanoïque a été examiné par l’OCDE (2014) dans le cadre de l’évaluation de la catégorie des acides aliphatiques. L’exposition orale à doses répétées (gavage ou régime alimentaire) aux acides aliphatiques n’a pas entraîné de toxicité générale. En outre, l’OCDE a indiqué que le poids de la preuve corrobore l’absence de toxicité potentielle pour la reproduction et le développement pour la catégorie des acides aliphatiques. En outre, toujours selon l’OCDE (2014), les acides aliphatiques ne devraient pas être génotoxiques.
Le méthanol est formé par hydrolyse de l’hexanoate de méthyle. La présente évaluation tient compte des effets potentiels sur le développement associés au méthanol. La CRf et la DRf établies par l’EPA pour l’exposition par inhalation et par voie orale au méthanol (20 mg/m³ et 2 mg/kg p.c./j, respectivement) ont été ajustées pour refléter l’exposition à l’hexanoate de méthyle, ce qui a donné des valeurs de 80 mg/m³ et 8 mg/kg p.c./j (en supposant que l’hexanoate de méthyle se dégrade immédiatement en méthanol à un rapport molaire de 1). La concentration maximale rapportée dans l’air intérieur (0,33 µg/m³) et l’exposition estimée de la population générale par l’air intérieur et l’utilisation possible de cette substance comme agent aromatisant alimentaire est de 0,001 mg/kg p.c./j. L’utilisation de l’hexanoate de méthyle dans les cosmétiques donnait lieu à une exposition estimée de 5,4 mg/kg p.c./j pour le groupe d’âge des 9 à 13 ans, en supposant que toute la substance est absorbée par voie cutanée. Toutes les valeurs d’exposition sont inférieures aux valeurs de référence pour le méthanol mentionnées ci‑dessus (ajustées pour l’exposition à l’hexanoate de méthyle).
Aucun potentiel génotoxique ou cancérogène n’a été observé pour le méthanol.
L’hexanoate de méthyle est structurellement similaire au laurate de méthyle, que l’OCDE (2013) a considéré comme présentant un « faible profil de danger ».
Compte tenu des renseignements disponibles pour les métabolites et l’analogue laurate de méthyle, le risque pour la santé humaine dû à l’exposition à l’hexanoate de méthyle est jugé faible.
7.1.3 Acétate de propyle
Évaluation de l’exposition
L’acétate de propyle étant considéré comme une substance présentant un faible potentiel de danger (voir la section Évaluation des effets sur la santé ci-dessous), aucune estimation quantitative de l’exposition de la population générale n’a été calculée. La présente section fournit des renseignements généraux sur l’exposition à l’acétate de propyle.
On n’a pas trouvé de concentrations mesurées d’acétate de propyle dans l’air ambiant, l’air intérieur, l’eau ou la poussière au Canada. Compte tenu de son important volume importé au Canada (> 3 341 000 kg), de sa pression de vapeur élevée et de sa solubilité dans l’eau, l’acétate de propyle peut être présent dans l’air et dans l’eau. On s’attend à ce qu’il se volatilise à partir des surfaces d’eau, compte tenu de sa constante de la loi d’Henry (2,18 × 10-4 atm-m³/mol).
L’acétate de propyle a été évalué comme substance aromatisante par le JECFA, qui a conclu que cette substance ne présente aucun problème d’innocuité lorsqu’elle est utilisée comme agent aromatisant (OMS 1998). Au Canada, l’acétate de propyle est utilisé dans les matériaux d’emballage alimentaire comme solvant dans la fabrication de polyéthylène, de la nitrocellulose, de la cire et des produits stratifiés et comme composant des encres et des matériaux à base de pigment, tous ces produits ne présentant pas de potentiel de contact direct avec les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 15 mars 2021; sans référence).
L’acétate de propyle a été déclaré comme ingrédient dans un grand nombre de produits cosmétiques de consommation au Canada, principalement dans les vernis à ongles. Les plages de concentrations déclarées pour les vernis à ongles vont de moins de 0,1 % jusqu’à 30 % à 100 % (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence).
L’acétate de propyle a également été trouvé dans une gamme de produits disponibles aux consommateurs au Canada, notamment des peintures en aérosol, des peintures pour automobile et des adhésifs (SDS 2013a, 2015d, 2017a).
Évaluation des effets sur la santé
L’acétate de propyle a été examiné par l’OCDE (2008) et pour la présente évaluation nous avons utilisé ces données pour caractériser les effets de cette substance sur la santé.
Une recherche a été effectuée dans la littérature afin de trouver des données publiées entre l’année précédant la publication du Rapport d’évaluation initiale (SIAR) de l’Ensemble de données de dépistage (EDD) de l’OCDE (janvier 2007) et décembre 2020. De plus, nous avons trouvé un rapport supplémentaire provenant d’une étude sur la toxicité pour la reproduction.
L’OCDE a identifié l’acétate d’éthyle (n° CAS 141-78-6) et l’acétate de n‑butyle (n° CAS 123-86-4) comme étant des analogues structurels de l’acétate de propyle. L’acétate d’éthyle et l’acétate de n‑butyle présentent des profils de toxicité similaires. Cependant, les doses avec effet sont plus faibles pour l’acétate d’éthyle que pour l’acétate de n‑butyle et, selon l’OCDE, on s’attend à ce que l’acétate de propyle ait des doses avec effet compris entre ceux de ces deux substances (OCDE 2008). De plus, après son absorption, l’acétate de propyle est rapidement hydrolysé en alcool n‑propylique (n° CAS 71-23-8). L’OCDE a également examiné les données sur cette substance.
Toxicité à doses répétées
On n’a trouvé aucune étude par inhalation à doses répétées pour l’acétate de propyle. Cependant, il existait des études de toxicité par inhalation pour l’alcool n‑propylique et les substances analogues, en l’occurrence l’acétate d’éthyle et l’acétate de n‑butyle. Les effets sur la santé rapportés pour l’acétate d’éthyle et l’acétate de n‑butyle se manifestaient principalement sur le site de contact, généralement à des concentrations élevées. Selon l’OCDE, des effets similaires sur l’épithélium olfactif sont à prévoir après une exposition répétée par inhalation à l’acétate de propyle.
Pour ce qui est de l’alcool n‑propylique, on n’a observé aucune mortalité, aucune modification du poids des organes, aucune modification des paramètres hématologiques, histopathologiques ou de chimie clinique, ni aucune lésion macroscopique ou microscopique chez des rats Sprague-Dawley exposés par inhalation dans une étude à court terme (9 jours) et à doses répétées (OCDE 2008).
Dans une étude à doses répétées menée sur des rats exposés à des vapeurs d’acétate d’éthyle durant 6 heures/jour, 5 jours/semaine, pendant 13 semaines, l’effet critique et le critère de danger correspondant consistaient en une concentration minimale entraînant un effet nocif observé (CMENO) de 350 ppm (1 280 mg/m³), la plus faible dose d’essai, basée sur la nécrose de l’épithélium olfactif chez quelques rats. Aux deux doses les plus élevées (750 ppm ou 2 750 mg/m³, et 1 500 ppm ou 5 490 mg/m³), tous les rats ont présenté une nécrose de l’épithélium olfactif, ainsi qu’une diminution de la consommation alimentaire, une diminution de la prise de poids corporel et une diminution transitoire de la rapidité de réaction à un stimulus auditif (OCDE 2008).
Une autre étude de toxicité subchronique par inhalation a été menée sur des rats avec de l’acétate de n‑butyle. Les animaux ont été exposés à des vapeurs d’acétate de n‑butyle à 0, 500, 1 500 ou 3 000 ppm (0, 2 350, 7 050 ou 14 100 mg/m³) durant 6 heures/jour, 5 jours/semaine, pendant 13 semaines. La dose critique a été définie comme étant une CSENO de 500 ppm (2 350 mg/m³) sur la base d’effets multiples incluant des signes d’irritation nasale et de nécrose de l’épithélium olfactif observés chez 10/20 rats (4 mâles et 6 femelles) exposés à 1 500 ppm et chez tous les animaux à la concentration maximale. Des signes d’irritation de l’estomac ont été observés chez les femelles à la concentration maximale d’essai. D’autres effets ont été observés : écoulement nasal de porphyrine et diminution de la consommation alimentaire à toutes les concentrations, diminution de la prise de poids corporel et augmentation de la salivation à 3 000 ppm, réduction du poids corporel moyen et réduction minime de l’activité à 1 500 ppm et 3 000 ppm, augmentation du poids des testicules à 1 500 ppm et 3 000 ppm, augmentation du poids des surrénales chez les femelles à 1 500 ppm et chez les deux sexes à 3 000 ppm, diminution du poids de la rate et augmentation du poids des poumons chez les mâles à 3 000 ppm (OCDE 2008).
Sur la base des résultats des études de neurotoxicité subchronique chez les rats exposés à l’acétate d’éthyle et à l’acétate de n‑butyle par inhalation, l’OCDE a conclu que ces deux substances ne présentent que des effets neurologiques minimes. Aucun effet neurotoxique n’a été observé dans une étude de toxicité subchronique réalisée avec de l’acétate de n‑butyle jusqu’à la concentration maximale d’essai de 3 000 ppm (14 100 mg/m³). La CSENO a donc été établie à 3 000 ppm (14 100 mg/m³) (OCDE 2008). Dans le cas de l’acétate d’éthyle, la CSENO pour la neurotoxicité subchronique était de 750 ppm (2 750 mg/m³) d’après la réduction de l’activité motrice observée chez les rates exposées à 1 500 ppm (5 490 mg/m³) (OCDE 2008).
Toxicité pour la reproduction et le développement
Aucune étude de toxicité pour la reproduction et/ou le développement n’a été trouvée pour l’acétate de propyle. Cette substance figure actuellement sur la liste du Plan d’action continue communautaire (CoRAP) de l’ ECHA en vue d’une évaluation (dont le début est prévu pour 2022) en raison de préoccupations liées à l’utilisation largement dispersive, à l’exposition des travailleurs et au potentiel « reprotoxique » identifié d’après les données disponibles sur l’alcool propylique et l’acétate de n‑butyle.
Sur la base des données relatives au métabolite alcool propylique et à l’analogue acétate de n‑butyle, l’OCDE a constaté que l’inhalation d’acétate de propyle pourrait induire une toxicité pour la reproduction et le développement (modifications réversibles de la fertilité des mâles, malformations et variations fœtales), mais uniquement à des concentrations très élevées.
Dans une étude portant sur l’alcool n‑propylique, des rats (18/sexe/concentration) ont été exposés à des concentrations de 0, 3 500 ou 7 000 ppm (0, 8 610 ou 17 200 mg/m³) 7 heures/jour, 7 jours/semaine, pendant 62 jours, avant d’être accouplés avec des rats non exposés du sexe opposé. La CSENO pour la fertilité des femelles était de 7 000 ppm (17 200 mg/m³) et la CSENO pour la fertilité des mâles était de 3 500 ppm (8 610 mg/m³) d’après une réduction marquée de la fertilité des mâles exposés à la concentration maximale (réduction résorbée après une période de récupération de 13 semaines) (OCDE 2008).
Pour ce qui est de l’acétate de n‑butyle, on a trouvé un rapport sur une étude de toxicité sur deux générations chez des rats exposés par inhalation à 0, 750, 1 500 et 2 000 ppm (équivalant à environ 0, 3 563, 7 126 et 9 502 mg/m³) (Anonymous 2010, cité dans ECHA c2007-2020a). Aucun effet nocif sur la reproduction lié au traitement n’a été observé jusqu’à la concentration maximale d’essai de 2 000 ppm (9 502 mg/m³). De plus, dans une étude de toxicité subchronique décrite précédemment (OCDE 2008), on n’a observé aucun effet sur la fertilité des mâles (aucune différence dans le nombre de têtes de spermatides dans les testicules ou le nombre de spermatozoïdes épididymaires par rapport aux témoins) à aucune des concentrations d’essai (jusqu’à 14 100 mg/m³). Dans une autre étude dans laquelle des rates ont été exposées à l’acétate de n‑butyle durant 7 heures/jour, 5 jours/semaine, pendant 3 semaines avant l’accouplement avec des mâles non exposés, on n’a observé aucun effet sur la fertilité des femelles (accouplement et performance de la reproduction) à aucune des concentrations d’essai (jusqu’à 7 050 mg/m³) (OCDE 2008).
On disposait d’une étude sur la toxicité de l’alcool n‑propylique pour le développement. Dans cette étude, des rates gravides ont été exposées à des concentrations de 0, 3 500, 7 000 ou 10 000 ppm (0, 8 610, 17 200 ou 24 600 mg/m³, respectivement) durant 7 heures/jour, entre les jours de gestation (JG) 1 à 19. La CSENO pour la toxicité maternelle et le développement était de 3 500 ppm (8 610 mg/m³) d’après une réduction de la consommation alimentaire chez les mères exposées aux deux concentrations les plus élevées et d’une diminution de la prise de poids corporel chez les mères à 10 000 ppm, et également d’une augmentation des pertes pré- et post-implantatoires (entraînant une augmentation des résorptions et une diminution des petits vivants par portée), une diminution du poids corporel des fœtus et une augmentation liée à la fréquence des malformations squelettiques, viscérales et externes chez les rats exposés à 10 000 ppm et 7 000 ppm (24 600 mg/m³ et 17 200 mg/m³, respectivement) d’alcool n‑propylique (OCDE 2008).
En ce qui concerne l’acétate de n‑butyle, des études de toxicité pour le développement par inhalation ont été menées sur des rats et des lapins. Dans les deux études, les animaux ont été exposés à l’acétate de n‑butyle pour des durées variables pendant la grossesse. Les deux études ont donné des CMENO pour la toxicité pour le développement de 1 500 ppm (7,05 mg/L ou 7 050 mg/m³) d’après la toxicité maternelle (diminution de la consommation alimentaire et de la prise de poids corporel) et l’augmentation des variations ou anomalies squelettiques, mais sans augmentation des malformations fœtales, à la seule dose utilisée (OCDE 2008).
Génotoxicité
Sur la base des données disponibles pour l’acétate de propyle (résultat négatif dans un test de mutation bactérienne), son métabolite et ses analogues (résultat négatif pour l’alcool n‑propylique et l’acétate d’éthyle dans des tests d’échange de chromatides sœurs [SCE] in vitro et dans un test du micronoyau in vitro, et résultat négatif pour l’acétate d’éthyle et l’acétate de n‑butyle dans des tests d’aberration chromosomique in vitro), l’OCDE a conclu qu’il est peu probable que cette substance induise des effets génotoxiques in vivo (OCDE 2008).
Cancérogénicité
Il n’existe pas d’étude de cancérogénicité pour l’acétate de propyle. Aucune étude n’a été trouvée concernant l’alcool n‑propylique ou ses analogues structurels que sont l’acétate de n‑butyle et l’acétate d’éthyle (OCDE 2008). Dans son évaluation des esters d’acétate, le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) a conclu que selon les données disponibles limitées, les substances de ce groupe, dont l’acétate de propyle, ne sont pas susceptibles d’être cancérogènes pour l’humain (ADGH 2014).
Caractérisation du risque
Nous avons utilisé l’examen de l’OCDE (2008) pour éclairer la caractérisation des effets de l’acétate de propyle sur la santé. L’OCDE (2008) a pris en compte les données sur l’acétate d’éthyle et l’acétate de n‑butyle, deux analogues structurels de l’acétate de propyle, ainsi que les renseignements sur l’alcool n‑propylique, formé par hydrolyse de l’acétate de propyle, une fois absorbé.
L’inhalation est la principale voie d’exposition à l’acétate de propyle pour la population générale du Canada, en raison de l’utilisation intermittente de produits disponibles aux consommateurs (p. ex., les produits pour les ongles, les peintures en aérosol, les adhésifs). L’exposition par voie orale à l’acétate de propyle peut se produire par les aliments en raison de son utilisation potentielle comme agent aromatisant alimentaire. Toutefois, le JECFA a évalué cette utilisation et a conclu que la substance ne présentait « aucun problème d’innocuité » compte tenu des concentrations actuellement ingérées (OMS 1998).
Les principaux effets sur la santé signalés pour l’acétate d’éthyle et l’acétate de n‑butyle à la suite d’une exposition par inhalation consistaient en effets sur le site de contact, généralement à des concentrations élevées. Selon l’OCDE (2008), des effets similaires sur le site de contact dans l’épithélium olfactif sont à prévoir à la suite d’une exposition répétée par inhalation à l’acétate de n‑propyle. Dans des études à doses répétées, on a observé une diminution de la consommation alimentaire et de la prise de poids corporel, mais aucun effet nocif de toxicité générale. Il est peu probable que l’acétate de propyle ait un potentiel génotoxique ou cancérogène. On a observé une modification de la fertilité des mâles et de la toxicité pour le développement (malformations et/ou variations fœtales) à la suite de l’exposition à l’alcool n‑propylique et à son analogue, l’acétate de n‑butyle. Cependant, les modifications observées dans la fertilité des mâles étaient réversibles, des effets sur le développement ont été notés en présence d’une toxicité maternelle (diminution de la consommation alimentaire et diminution de la prise de poids corporel chez les mères), et ces effets ont été observés uniquement à des concentrations excessives très élevées (17 200 mg/m³ pour la fertilité des mâles avec l’alcool n‑propylique; 7 050 mg/m³ pour la toxicité pour le développement (variations squelettiques seulement) et 17 200 mg/m³ avec l’acétate de n‑butyle et l’alcool n‑propylique, respectivement). Aux fins de la présente évaluation préalable, on estime donc que l’acétate de propyle présente un faible danger.
Comme on estime que l’acétate de propyle présente un faible danger, il n’a pas été jugé utile de calculer des estimations de l’exposition, et le risque pour la santé humaine est jugé faible.
7.1.4 Acétate d’isobutyle
Évaluation de l’exposition
Comme on estime que l’acétate d’isobutyle présente un faible danger (voir la section Évaluation des effets sur la santé ci-dessous), aucune estimation quantitative de l’exposition de la population générale n’a été calculée. La présente section fournit des renseignements généraux sur l’exposition à l’acétate d’isobutyle.
Les concentrations d’acétate d’isobutyle dans l’air ambiant ont été mesurées dans le cadre de quatre études au Canada, soit à Windsor, Regina, Halifax et Edmonton (Santé Canada 2010a, b, 2012, 2013). Les concentrations moyennes géométriques dans l’air ambiant étaient inférieures à la LDM, les valeurs maximales étant de < LDM à 4,9 µg/m³ (Santé Canada 2010a, b, 2012, 2013). La fréquence de détection allait de 0 % à 17 %.
Les concentrations d’acétate d’isobutyle dans l’air intérieur ont également été mesurées dans les quatre mêmes études canadiennes mentionnées ci‑dessus. Les concentrations moyennes géométriques variaient de < LDM à 0,15 µg/m³, et les valeurs maximales de < LDM à 58,0 µg/m³ (Santé Canada 2010a, 2010b, 2012, 2013). On disposait également de données agrégées sur l’acétate d’isobutyle mesuré dans l’air intérieur de maisons dans la ville de Québec, selon un échantillonnage passif réalisé entre novembre 2008 et mars 2010 (Won et Lusztyk 2011). L’acétate d’isobutyle a été détecté dans 64 % des échantillons. La moyenne géométrique et les concentrations maximales rapportées d’acétate d’isobutyle dans l’air intérieur étaient de 0,27 µg/m³ et 3,0 µg/m³, respectivement.
On n’a pas trouvé de concentration mesurée d’acétate d’isobutyle dans l’eau ou la poussière au Canada.
L’acétate d’isobutyle a été évalué comme substance aromatisante par le JECFA, qui a conclu que la substance ne présentait « aucun problème d’innocuité » étant donné les concentrations actuellement ingérées sous la forme d’agent aromatisant (OMS 1998). On ne dispose pas de données définitives concernant l’utilisation potentielle de l’acétate d’isobutyle comme agent aromatisant alimentaire au Canada, mais une telle utilisation, le cas échéant, pourrait entraîner une exposition orale de la population générale du Canada. L’acétate d’isobutyle peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments et l’exposition par les aliments n’est donc pas à prévoir (communication personnelle, courriel du BGR, SC, au BERSE, SC, 17 août 2015; sans référence).
On a trouvé de l’acétate d’isobutyle dans des produits cosmétiques de consommation au Canada, principalement des produits pour les ongles (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’utilisation de ces produits peut entraîner une exposition par inhalation à la substance.
L’acétate d’isobutyle est présent dans une gamme de produits disponibles aux consommateurs au Canada, notamment les apprêts, les mastics, les laques et les peintures en aérosol (SDS 2014d, 2018e; FDS 2018d). L’utilisation de ces produits peut entraîner une exposition par inhalation et par voie cutanée pour la population générale au Canada.
Évaluation des effets sur la santé
L’OCDE a examiné l’acétate d’isobutyle (2003a), et cet examen a servi à éclairer la caractérisation des effets de cette substance sur la santé. Nous avons recherché dans la littérature les données publiées entre l’année précédant la publication du SIAR de l’OCDE (janvier 2002) et décembre 2020. Aucune étude sur les effets sur la santé n’a été trouvée.
L’OCDE a estimé que l’acétate d’isobutyle provoquait une irritation de la peau, des yeux et des voies respiratoires, ainsi que des effets transitoires pouvant se manifester uniquement à des doses d’exposition élevées. Selon l’OCDE, cette substance présente une faible priorité pour ce qui est des futurs travaux (OCDE 2003a).
L’exposition à l’acétate d’isobutyle par voie cutanée, par inhalation et par voie orale entraîne l’apparition rapide de l’isobutanol (n° CAS 78-83-1) dans la circulation générale en raison de l’hydrolyse complète de la substance par les estérases présentes dans la peau, les poumons et le tractus gastrointestinal. Comme l’exposition à l’acétate d’isobutyle entraîne une exposition générale à l’isobutanol, les données concernant cette substance ont été prises en considération par l’OCDE pour son évaluation de la toxicité générale de l’acétate d’isobutyle (OCDE 2003a).
Toxicité à doses répétées
Aucune étude de toxicité à doses répétées pour l’acétate d’isobutyle n’a été trouvée. Deux études sur l’isobutanol ont été considérées comme des études clés par l’OCDE, qui a conclu que « l’exposition répétée à des concentrations modérées à élevées d’isobutanol par inhalation et par voie orale est bien tolérée chez le rat » (OCDE 2003a).
Une étude de toxicité subchronique (90 jours) a été menée sur des rats exposés par inhalation à des concentrations de 0, 758, 3 030 et 7 575 mg/m³ (0, 250, 1 000 et 2 500 ppm, respectivement) d’isobutanol. La dose critique, établie par l’OCDE, était une CSENO de 3 030 mg/m³ basée sur une très légère augmentation (9 %) des paramètres des globules rouges (numération érythrocytaire, mesure de l’hémoglobine et de l’hématocrite) chez les rates exposées à 7 575 mg/m³. L’OCDE a noté que ces légers changements avaient une signification biologique discutable. Aucun signe d’effets neurotoxicologiques n’a été observé à aucune des concentrations utilisées (jusqu’à 7 575 mg/m³) (OCDE 2003a).
Dans une étude de toxicité subchronique (13 semaines) par gavage chez des rats (30/sexe/groupe) exposés à l’isobutanol à des doses de 0, 100, 316 et 1 000 mg/kg p.c./j, la dose critique et le critère d’effet dangereux correspondant, établis par l’OCDE, consistaient en une DSENO de 316 mg/kg p.c./j, d’après l’hypoactivité et l’ataxie observées à la dose suivante (1 000 mg/kg p.c./j), effets qui s’étaient résorbés après quatre semaines de récupération (OCDE 2003a).
Toxicité pour la reproduction et le développement
Aucune étude de toxicité pour la reproduction et/ou le développement n’a été trouvée pour l’acétate d’isobutyle.
Dans une étude de toxicité pour la reproduction par inhalation sur deux générations, menée chez des rats avec de l’isobutanol, on a obtenu une dose critique (CSENO) de 7 575 mg/m³ d’après l’absence de toxicité générale pour les parents, pour la reproduction ou pour la phase néonatale à la dose maximale d’essai (OCDE 2003a).
Dans deux études de toxicité pour le développement, des rats et des lapins ont été exposés par inhalation à des concentrations de 0, 0,5, 2,5 ou 10 mg/L (0, 500, 2 500 et 10 000 mg/m³) d’isobutanol pendant 6 heures/jour entre les JG 6 et 15 chez les rats et les JG 7 et 19 chez les lapins. On n’a observé aucun effet sur le développement ou la fœtotoxicité à aucune des concentrations utilisées chez l’une ou l’autre des espèces, dans l’une ou l’autre de ces études (OCDE 2003a).
Génotoxicité
L’acétate d’isobutyle ne s’est pas avéré mutagène dans un test d’Ames utilisant Salmonella typhimurium, ce qui indique que cette substance n’est pas génotoxique (OCDE 2003a). De plus, l’isobutanol a donné un résultat négatif dans une étude in vivo du micronoyau chez la souris, l’isobutanol ayant été administré une fois par voie orale à des souris NMRI mâles et femelles à des doses atteignant 2 000 mg/kg p.c. (OCDE 2003a).
Cancérogénicité
Il n’existe pas d’étude sur la cancérogénicité de l’acétate d’isobutyle. Dans son évaluation des esters d’acétate, le NICNAS (2014) a conclu d’après les données limitées disponibles que les substances de ce groupe (comme l’acétate d’isobutyle) ne sont pas susceptibles d’être cancérogènes pour les humains (ADGH 2014).
Caractérisation du risque
L’examen fait par l’OCDE (2003a) a aidé à caractériser les effets de l’acétate d’isobutyle sur la santé. L’exposition à l’acétate d’isobutyle par voie cutanée, par inhalation et par voie orale entraîne l’apparition rapide d’isobutanol dans la circulation générale, et l’OCDE a tenu compte des données disponibles sur l’isobutanol dans son évaluation de l’acétate d’isobutyle (OCDE 2003a).
On s’attend à ce que l’exposition de la population générale du Canada à l’acétate d’isobutyle se produise principalement par inhalation, en raison de sa présence dans les produits disponibles aux consommateurs, notamment les vernis à ongles, les mastics, les apprêts et les peintures en aérosol, et en raison de sa présence dans l’air intérieur ou ambiant. L’exposition par voie orale peut se produire par les aliments en raison de son utilisation potentielle comme agent aromatisant alimentaire.
Aucun effet systématique nocif n’a été observé dans les études disponibles sur l’isobutanol (à des doses atteignant 1 000 mg/kg p.c./j après une exposition subchronique par voie orale et à des concentrations atteignant 7 575 mg/m³, la concentration maximale d’essai, après une exposition subchronique par inhalation). Dans des études de toxicité pour la reproduction et le développement menées avec l’isobutanol, on n’a rapporté aucun effet nocif sur les parents, la reproduction ou la néonatalité chez les animaux exposés par inhalation à des concentrations atteignant 10 000 mg/m³. Il est peu probable que l’acétate d’isobutyle ait un potentiel génotoxique ou cancérogène.
Aucun effet nocif sur le système nerveux central ou périphérique n’a été observé chez le rat après une exposition subchronique à l’isobutanol par voie orale et par inhalation. Seuls des effets légers et transitoires ont été observés chez les animaux exposés, notamment une réduction de la réponse à un stimulus externe chez les rats exposés par inhalation et une hypoactivité et une ataxie chez les rats exposés par gavage à 1 000 mg/kg p.c./j d’isobutanol pendant 13 semaines.
Selon l’OCDE, cette substance présente une faible priorité pour ce qui est des futurs travaux (OCDE 2003a).
Compte tenu des renseignements disponibles sur les effets de l’isobutanol sur la santé, l’acétate d’isobutyle est considéré comme une substance présentant un faible danger.
Comme l’acétate d’isobutyle est considéré comme une substance présentant un faible danger, la caractérisation du potentiel d’exposition (c.‑à‑d. le calcul d’une estimation de l’exposition) n’était pas justifiée. On estime que le risque pour la santé humaine est faible.
7.1.5 Laurate de méthyle
Évaluation de l’exposition
Comme le laurate de méthyle est considéré comme une substance présentant un faible danger (voir la section Évaluation des effets sur la santé ci‑dessous), on n’a pas calculé d’estimations quantitatives de l’exposition de la population générale. La présente section fournit des renseignements généraux sur l’exposition au laurate de méthyle.
Le laurate de méthyle a une volatilité modérée, et une faible solubilité dans l’eau. L’exposition de la population générale au laurate de méthyle peut se produire par inhalation, par voie orale ou par voie cutanée.
Won et Lusztyk (2011) ont mesuré les concentrations de laurate de méthyle dans l’air intérieur de maisons de la ville de Québec entre novembre 2008 et mars 2010 en utilisant un échantillonnage passif, et l’ont détecté dans 6 % des échantillons. La moyenne géométrique et la concentration maximale rapportées de laurate de méthyle dans l’air intérieur étaient de 0,63 µg/m³ et 1,01 µg/m³, respectivement. Le laurate de méthyle a également été trouvé dans la poussière domestique recueillie dans 50 échantillons de poussière provenant de maisons de la ville de Québec (Won et Lusztyk 2011). La concentration moyenne géométrique de laurate de méthyle dans les échantillons de poussière était de 0,87 μg/g de poussière (fréquence de détection de 10 %) avec une valeur maximale de 18,7 μg/g de poussière.
Le laurate de méthyle a été évalué en tant que substance aromatisante par le JECFA, qui a conclu que la substance ne présentait « aucun problème d’innocuité » compte tenu des concentrations actuellement ingérées sous la forme d’agent aromatisant (OMS 1998). On ne dispose pas de données définitives concernant l’utilisation potentielle du laurate de méthyle comme agent aromatisant alimentaire au Canada. Toutefois, cette utilisation, le cas échéant, pourrait entraîner une exposition orale de la population générale du Canada.
Le laurate de méthyle est présent comme ingrédient non médicinal dans un médicament d’ordonnance et/ou en vente libre appliqué par voie cutanée, et l’utilisation de ce produit peut entraîner une exposition cutanée de la population générale au Canada. Le laurate de méthyle est également présent dans des crèmes hydratantes pour le visage utilisées comme cosmétiques.
Évaluation des effets sur la santé
L’OCDE (2013) a résumé les données de la littérature sur les effets du laurate de méthyle sur la santé. Cette évaluation a servi à caractériser les effets du laurate de méthyle sur la santé dans la présente évaluation préalable.
Une recherche a été effectuée dans la littérature pour trouver les données publiées entre l’année de publication du document SIAR de l’OCDE (janvier 2012) et décembre 2020. Aucune étude sur les effets sur la santé n’a été trouvée.
L’OCDE a estimé que le laurate de méthyle présente un « faible profil de danger » d’après les données disponibles. On n’a observé aucun effet nocif lié au traitement chez le rat dans une étude préliminaire de toxicité pour le développement et la reproduction combinée à une étude orale à doses répétées, à des doses atteignant la dose limite de 1 000 mg/kg p.c./j. De plus, le laurate de méthyle a été jugé non génotoxique in vitro. On ne dispose d’aucune donnée sur la cancérogénicité de cette substance.
L’OCDE n’a pas relevé d’effets préoccupants pour la santé humaine et a classé cette substance comme peu prioritaire pour de futurs travaux. Le laurate de méthyle est donc considéré comme une substance présentant un faible danger.
Caractérisation du risque
Comme le laurate de méthyle est considéré comme une substance présentant un faible danger, il n’a pas été jugé utile de caractériser le potentiel d’exposition (c.‑à‑d. calculer l’estimation de l’exposition) et le risque pour la santé humaine est jugé faible.
7.1.6 Butyrate de méthyle
Évaluation de l’exposition
Le butyrate de méthyle a été mesuré dans seulement 4 % des échantillons d’air intérieur de maisons de la ville de Québec entre novembre 2008 et mars 2010, avec une concentration maximale rapportée de 0,18 µg/m³ (Won et Lusztyk 2011).
On n’a pas trouvé de concentrations mesurées de butyrate de méthyle dans l’air ambiant, l’eau, le sol ou la poussière au Canada. Cette substance n’a pas été déclarée comme ayant été importée ou fabriquée en quantités supérieures au seuil de déclaration au Canada. Par conséquent, on ne s’attend pas à ce qu’il y ait des rejets de sources industrielles.
Le butyrate de méthyle a été évalué comme substance aromatisante par le JECFA, qui a conclu que la substance ne présentait « aucun problème d’innocuité » étant donné les concentrations actuellement ingérées sous la forme d’agent aromatisant (OMS 1998). En l’absence de données sur l’utilisation actuelle, le cas échéant, au Canada de cette substance, l’estimation de l’absorption par habitant pour la population américaine calculée par le JECFA, soit 44 µg/personne/j (0,73 µg/kg p.c./j sur la base d’un poids corporel moyen de 60 kg pour la population générale), est une estimation acceptable de l’exposition alimentaire possible au Canada au butyrate de méthyle en raison de son utilisation potentielle comme agent aromatisant alimentaire pour la population générale (1 an et plus) (OMS 1998; communication personnelle, courriel de la DA, SC, au BERSE, SC, 15 mars 2021; sans référence).
Évaluation des effets sur la santé
Une recherche a été effectuée dans la littérature pour trouver des articles publiés jusqu’en décembre 2020. Aucune étude sur les effets sur la santé n’a été trouvée.
On s’attend à ce que le butyrate de méthyle, une fois absorbé, soit hydrolysé rapidement par les estérases non spécifiques présentes dans le sang et les tissus pour former de l’acide n‑butyrique (n° CAS 107-92-6) et du méthanol (n° CAS 67-56-1). Les données disponibles sur les deux métabolites ont été examinées pour éclairer l’évaluation des effets du butyrate de méthyle sur la santé humaine. L’acide n‑butyrique et le méthanol ont tous deux été examinés dans le cadre du PGPC. L’acide n‑butyrique a été examiné dans le cadre de l’évaluation préalable du groupe des acides carboxyliques (ECCC, SC 2019) et le méthanol a été examiné dans le cadre de l’ébauche d’évaluation préalable du groupe des alcools (ECCC, SC 2022).
Le butyrate de méthyle est également structurellement similaire à un autre ester de ce groupe, le laurate de méthyle (n° CAS 111-82-0). Les données disponibles sur cette substance ont également été prises en compte pour la présente évaluation.
Acide n‑butyrique
Toxicité à doses répétées
L’acide n‑butyrique a été examiné par l’OCDE (2003), et cet examen a été utilisé pour éclairer la caractérisation des effets de cette substance sur la santé, dans l’évaluation préalable du groupe des acides carboxyliques (ECCC, SC 2019).
L’évaluation préalable du groupe des acides carboxyliques a conclu que d’après les données disponibles sur les précurseurs de l’acide n‑butyrique (le n-butanol et l’acétate de n‑butyle), l’acide n‑butyrique ne devrait pas avoir de potentiel cancérogène ou génotoxique ni d’effets sur la reproduction et le développement. Des effets généraux (p. ex., augmentation du poids des testicules et des surrénales) ont été observés chez des animaux de laboratoire après une exposition répétée par inhalation à l’acide n‑butyrique pendant 13 semaines, mais seulement à des doses élevées (p. ex., atteignant 7 128 ou 14 256 mg/m³), doses qui sont jugées non pertinentes par rapport aux doses d’exposition potentielle chez l’humain. De plus, on n’a observé des effets transitoires qu’à la dose maximale d’essai dans une étude à doses répétées par voie orale. L’acide n‑butyrique a donc été jugé comme une substance présentant un faible danger.
Méthanol
Le méthanol a été examiné dans l’ébauche d’évaluation préalable pour le groupe des alcools dans le cadre du PGPC (ECCC, SC 2022), et les données sont résumées à la section 7.1.1 (Évaluation des effets sur la santé) du présent document. En utilisant une approche similaire à celle qui a été employée pour l’acétate de méthyle et l’hexanoate de méthyle pour le butyrate de méthyle (c.‑à‑d. qu’il se dégrade immédiatement en méthanol à un rapport molaire de 1), on a ajusté les valeurs de référence du méthanol pour refléter l’exposition au butyrate de méthyle afin d’obtenir des valeurs de 6,4 mg/kg p.c./j et de 64 mg/m³.
Laurate de méthyle
L’évaluation de cette substance est présentée à la section 7.1.5. Selon l’OCDE (2013), le laurate de méthyle présente « un faible profil de danger », d’après l’ensemble de données disponible. On n’a observé aucun effet nocif lié au traitement dans une étude préliminaire de toxicité pour le développement et la reproduction combinée à une étude orale à doses répétées, à des doses atteignant la dose limite de 1 000 mg/kg p.c./j. De plus, le laurate de méthyle a été jugé non génotoxique in vitro. Selon l’OCDE, cette substance présente une faible priorité pour ce qui est de futurs travaux.
Caractérisation du risque
Une fois absorbé, le butyrate de méthyle devrait s’hydrolyser pour former de l’acide n‑butyrique et du méthanol.
L’acide n‑butyrique et le méthanol ont tous deux été évalués dans le cadre du PGPC (ECCC, SC 2019; ECCC, SC 2022). Dans l’évaluation du PGPC, l’acide n‑butyrique a été considéré comme une substance présentant un faible potentiel de danger, et le risque pour la santé humaine dus à l’exposition à cette substance est faible également. Aucun potentiel génotoxique ou cancérogène n’a été observé pour le méthanol. La présente évaluation tient compte des effets potentiels sur le développement associés au méthanol. La CRf et la DRf calculées par l’EPA pour l’exposition par inhalation et par voie orale au méthanol (20 mg/m³ et 2 mg/kg p.c./j, respectivement) ont été ajustées pour refléter l’exposition au butyrate de méthyle, donnant des valeurs de 64 mg/m³ et 6,4 mg/kg p.c./j, respectivement (en supposant que le butyrate de méthyle se dégrade immédiatement en méthanol à un rapport molaire de 1:1). La concentration maximale déclarée dans l’air (0,18 µg/m³) et par absorption (0,73 µg/kg p.c./j) pour le butyrate de méthyle est bien en deçà des valeurs de référence ajustées par inhalation et par voie orale pour le méthanol.
Le butyrate de méthyle est également structurellement similaire à un autre ester du sous‑groupe A, le laurate de méthyle. Selon l’OCDE (2013), le laurate de méthyle présente un « faible profil de danger ».
Compte tenu des renseignements disponibles pour les métabolites et l’analogue laurate de méthyle, le risque pour la santé humaine dû à l’exposition au butyrate de méthyle est jugé faible.
7.1.7 Glutarate de diméthyle
Évaluation de l’exposition
Comme le glutarate de diméthyle est considéré comme une substance présentant un faible potentiel danger (voir la section Évaluation des effets sur la santé ci‑dessous), aucune estimation quantitative de l’exposition de la population générale n’a été calculée. La présente section fournit des renseignements généraux sur l’exposition au glutarate de diméthyle.
Le glutarate de diméthyle est un liquide dont la pression de vapeur est modérée et la solubilité dans l’eau très élevée. Aucune donnée empirique n’a été trouvée pour le glutarate de diméthyle dans l’air ambiant, l’eau ou le sol au Canada. Cependant, on l’a trouvé dans la poussière domestique recueillie dans 50 échantillons de poussière provenant de maisons de la ville de Québec (Won et Lusztyk 2011). La concentration moyenne géométrique du glutarate de diméthyle dans les échantillons de poussière était de 0,34 μg/g de poussière (fréquence de détection de 32 %) avec une valeur maximale de 7,8 μg/g de poussière.
Le glutarate de diméthyle peut être utilisé comme composant dans un additif indirect (désinfectant pour les mains) utilisé dans les établissements de transformation des aliments au Canada, sans possibilité de contact alimentaire direct avec les aliments. Par conséquent, on ne prévoit pas d’exposition par voie alimentaire (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence).
Cette substance est présente dans les adhésifs, les nettoyants et les dissolvants de vernis à ongles au Canada (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’utilisation de ces produits pourrait entraîner une exposition par voie cutanée ou par inhalation pour la population générale du Canada.
Le glutarate de diméthyle est utilisé dans divers produits disponibles aux consommateurs qui pourraient entraîner une exposition de la population générale au Canada par voie cutanée ou par inhalation, notamment des serviettes et des essuie-mains préhumidifiés, des décapants pour peinture et vernis, des agents d’étanchéité faisant partie de trousses de remise à neuf de comptoir, des décapants pour graffitis et des produits désodorisants (SDS [date inconnue], 2013b; FDS 2015e; Household Products Database 1993- ).
Lors d’enquêtes antérieures réalisées au Danemark, le glutarate de diméthyle a été détecté à de faibles concentrations dans certains produits (p. ex., les brosses à dents, les jouets en bois pour enfants et les jouets sexuels (Svendsen et al. 2004; Nilsson et al. 2006; Hansen et Pedersen 2005). Ces enquêtes n’ont pas permis de conclure que le glutarate de diméthyle devrait faire l’objet d’une analyse plus approfondie ou être priorisé.
Évaluation des effets sur la santé
On a seulement trouvé des renseignements limités sur les effets du glutarate de diméthyle sur la santé. Toutefois, on a trouvé des données sur un mélange d’esters dibasiques (DBE; n° CAS 95481-62-2). Le DBE contient principalement du glutarate de diméthyle (55 % à 75 %) et deux autres constituants structurellement similaires, l’adipate de diméthyle (15 % à 27 %; n° CAS 627-93-0) et le succinate de diméthyle (10 % à 25 %; n° CAS 106-65-0) (US EPA 2014). Les données concernant ce mélange ont été prises en compte et ont été utilisées pour la présente évaluation des effets sur la santé humaine.
Toxicité à doses répétées
Dans une étude à doses répétées par voie orale (gavage), le DBE n’a pas entraîné de toxicité générale chez les rats ayant reçu des doses quotidiennes pendant 1 mois atteignant 1 000 mg/kg p.c./j, la dose maximale d’essai (HPVIS 2017).
En ce qui concerne la voie cutanée, aucun effet lié au traitement n’a été observé lorsque des rats (10/sexe/dose) ont été exposés jusqu’à 1 000 mg/kg p.c./j de DBE, pendant 6 heures/jour, 7 jours/semaine, pendant 2 semaines (Anonymous 2000, cité dans ECHA c2007-2017e).
Une étude de toxicité subchronique par inhalation (corps entier) a été réalisée avec le glutarate de diméthyle chez le rat. Les animaux d’essai (36/sexe/dose) ont été exposés à 0, 10, 50 et 400 mg/m³ 6 heures/jour, 5 jours/semaine, pendant 90 jours. La CSENO était de 50 mg/m³. Dans les groupes exposés à 400 mg/m³, on a observé une diminution de la prise de poids corporel chez les mâles et une diminution de la consommation alimentaire, ainsi qu’une dégénérescence/atrophie de la muqueuse olfactive chez les deux sexes. Des modifications hormonales ont également été observées (p. ex., diminution des concentrations sériques de testostérone et d’hormones lutéinisantes (LH)), mais les auteurs ont considéré que ces effets n’avaient pas de signification toxicologique, car la diminution des concentrations d’hormones n’a pas entraîné la réduction du nombre de spermatozoïdes épididymaires (HPVIS 2017; Anonymous 2000, cité dans ECHA c2007-2017f).
Une autre étude de toxicité subchronique par inhalation (corps entier) a été réalisée chez des rats (10/sexe/dose), exposés pendant 6 heures/jour, 5 jours/semaine, pendant 14 semaines à 0, 160, 400 et 1 000 mg/m³ du mélange DBE. Des effets dégénératifs sur l’épithélium olfactif, liés à la dose, ont été observés à toutes les doses. Cependant, l’examen pathologique de tous les autres tissus, à l’exception de l’épithélium olfactif, n’a révélé aucun effet de l’exposition au DBE à des concentrations atteignant 1 000 mg/m³. Une diminution du poids relatif du foie a été signalée chez tous les groupes exposés. Cependant, selon les auteurs de l’étude, la signification biologique des effets sur le foie n’est pas connue en raison de l’absence d’une période de récupération et de l’absence d’anomalies histopathologiques dans le foie (HPVIS 2017; Anonymous 1987, cité dans ECHA c2007-2017g).
Dans une autre étude d’exposition par inhalation (corps entier), des rats ont été exposés jusqu’à 13 semaines au DBE. Des animaux d’essai (40/sexe/dose totale) ont été exposés à raison de 6 heures/jour, 5 jours/semaine, à 0, 20, 76 et 390 mg/m³. Après 13 semaines, une dégénérescence de l’épithélium olfactif était présente à toutes les concentrations de DBE chez les rates, mais seulement aux concentrations moyenne et élevée chez les rats mâles, ce qui a donné une CMENO pour les femelles et une CSENO pour les mâles de 20 mg/m³. À la fin de la période de récupération de 6 semaines, on a observé des changements histologiques associés à la réparation de la muqueuse olfactive. Le poids du foie des femelles exposées à 390 mg/m³ a diminué par rapport aux témoins, mais cet effet n’a pas été observé à la fin de la période de récupération. Une légère diminution de la concentration de sodium sérique a été observée après 13 semaines chez tous les rats exposés aux deux doses les plus élevées, et cet effet s’est principalement résorbé au cours de la période de récupération (Keenan et al. 1990; Anonymous 1987, cité dans ECHA c2007-2017h).
L’EPA (US EPA 2014) a suggéré que la dégénérescence de la muqueuse olfactive était liée à l’hydrolyse du glutarate de diméthyle par les carboxylestérases situées dans l’épithélium nasal/olfactif en raison d’un métabolite, à savoir l’acide dicarboxylique. Selon l’EPA, ces effets locaux devraient avoir un impact beaucoup plus faible chez l’humain en raison de différences anatomiques et physiologiques majeures entre les rats et les humains. Par rapport aux humains, les rats ont un épithélium olfactif couvrant une plus grande superficie, un débit d’air et un mode de respiration différents (le rat a une respiration nasale obligatoire), et l’activité des carboxylestérases est plus importante dans l’épithélium nasal/olfactif. Des études in vitro avec des homogénats du tissu nasal humain semblent indiquer que le métabolisme du mélange DBE dans le tissu nasal humain est 100 à 1 000 fois moins actif que dans le tissu nasal du rat. Compte tenu de l’absence de toxicité générale et du fait que l’on s’attend à ce que les humains soient beaucoup moins sensibles aux réponses olfactives que les rongeurs, l’EPA a conclu que les effets locaux n’étaient pas suffisamment indésirables pour être utilisés comme critère d’évaluation des risques (US EPA 2014).
Toxicité pour la reproduction et le développement
Dans les études de toxicité pour la reproduction et le développement menées avec le glutarate de diméthyle et le DBE, on n’a observé aucun effet sur la reproduction ou le développement. On a observé des effets après une exposition par inhalation à ces substances uniquement sur le site de contact (dégénérescence de la muqueuse olfactive), ainsi qu’une diminution de la consommation alimentaire et de la prise de poids corporel chez les parents.
Une étude sur une génération a été menée chez le rat pour le DBE par voie d’inhalation. Les animaux testés (20/sexe/dose) ont été exposés à 0, 160, 400 et 1 000 mg/m³ à raison de 6 heures/jour, 5 jours/semaine, pendant 14 semaines avant l’accouplement. Aucun effet sur la performance de l’accouplement, la fertilité, la durée de la gestation ou le nombre, la structure et la viabilité de la descendance n’a été constaté. Cependant, une diminution statistiquement significative du poids des petits a été notée à la naissance et pendant le sevrage dans le groupe ayant reçu 1 000 mg/m³, en présence de toxicité parentale. La CSENO pour la toxicité parentale était de 160 mg/m³ sur la base d’une diminution du poids corporel et du poids relatif du foie, et de la présence d’une métaplasie squameuse légère à modérée de l’épithélium olfactif chez les deux sexes à des concentrations plus élevées (Anonymous 1988 et 1998, cité dans ECHA c2007-2017i; Kelly et al. 1998).
Une étude de toxicité pour le développement a été menée chez les lapins avec du glutarate de diméthyle par voie d’inhalation. Les animaux testés (22 femelles/dose) ont été exposés (corps entier) à 0, 30, 100, 300 et 1 000 mg/m³, pendant 6 heures/jour entre les JG 7 et 28. La CSENO pour la toxicité pour le développement était de 1 000 mg/m³, sur la base de l’absence d’effets sur le développement. La CSENO pour la toxicité maternelle était de 100 mg/m³, sur la base d’une diminution de la prise de poids corporel à partir de 300 mg/m³. La consommation alimentaire a également diminué de manière significative à 1 000 mg/m³ (Anonymous 2003, cité dans ECHA c2007-2017j).
Une étude de toxicité pour le développement a également été menée chez le rat avec du DBE par inhalation (corps entier). Les animaux testés (20-24 femelles/dose) ont été exposés à 0, 160, 400 et 1 000 mg/m³, pendant 6 heures/jour entre les JG 7 et 16. Les mères ont été sacrifiées au JG 21. La CSENO pour la toxicité pour le développement était de 1 000 mg/m³, d’après l’absence d’effets sur le développement. La CSENO pour la toxicité maternelle était de 160 mg/m³, soit la plus faible concentration d’essai, sur la base d’une diminution significative du poids corporel des mères et de la consommation alimentaire à 400 mg/m³ et d’une augmentation des taches périanales et d’une fourrure humide (effet significatif à la concentration maximale) (Alvarez et al. 1995; Anonymous 1995, cité dans ECHA c2007-2017k).
Génotoxicité
Le glutarate de diméthyle s’est révélé négatif dans les tests de mutation bactérienne utilisant les souches TA97, TA98, TA100 et TA1535 de Salmonella typhimurium, avec et sans activation métabolique (NTP 2016). Le glutarate de diméthyle n’a pas présenté de potentiel mutagène dans le test de mutation cellulaire in vitro avec HGPRT (hypoxanthine-guanine phosphoribosyltransférase) sur les cellules ovariennes de hamsters chinois, avec et sans activation métabolique (Anonymous 2002, cité dans ECHA c2007-2017l). Des résultats négatifs ont également été rapportés pour le DBE dans un test d’aberration chromosomique in vitro chez les mammifères réalisé avec des lymphocytes de sang périphérique humain, avec et sans activation métabolique (HPVIS 2017).
Dans des essais in vivo, le glutarate de diméthyle n’a pas provoqué de dommages chromosomiques ni de toxicité pour les cellules de la moelle osseuse chez les rats (5/sexe/dose) exposés à des doses atteignant 2 000 mg/m³ par inhalation (corps entier), 6 heures/jour pendant 2 jours (Anonymous 2001, cité dans ECHA c2007-2017m; Huntingdon Life Sciences, Ltd 2001, cité dans HPVIS 2017).
Cancérogénicité
Il n’existe pas de données sur le potentiel cancérogène du glutarate de diméthyle et du mélange DBE. Cependant, l’EPA a conclu que le glutarate de diméthyle ne présentait pas d’alertes particulières, et ne devrait pas être cancérogène chez l’humain (US EPA 2014).
Caractérisation du risque
On a trouvé des renseignements limités seulement sur les effets du glutarate de diméthyle sur la santé. Il y avait des données pour le mélange DBE, lequel est composé principalement de glutarate de diméthyle et de deux autres composants structurellement similaires, en l’occurrence l’adipate de diméthyle et le succinate de diméthyle.
Dans les études à doses répétées par voie orale et voie cutanée (exposition à court terme et subchronique), aucun effet n’a été observé chez des animaux ayant reçu des doses atteignant 1 000 mg/kg p.c./j. Dans les études par inhalation, les seuls effets observés étaient réversibles, notamment la diminution de la consommation alimentaire et la prise de poids corporel, ainsi que des effets sur le site de contact (dégénérescence de la muqueuse olfactive). Ces effets au site de contact pourraient être considérés comme transitoires sur la base des preuves de réparation de la muqueuse 6 semaines après l’exposition (Keenan et al. 1990; Anonymous 1987, cité dans ECHA c2007-2017h), et pourraient ne pas être pertinents pour les humains, étant donné les différences de sensibilité à la réponse olfactive entre les humains et les rats (US EPA 2014). Bien que la diminution du poids relatif du foie ait été observée chez les rats dans une étude de toxicité subchronique et une étude sur une génération avec le DBE, cette diminution n’était pas associée à des anomalies histopathologiques dans le foie et était transitoire et réversible. Aucun effet sur la reproduction ou le développement n’a été constaté chez les animaux exposés à des concentrations atteignant 1 000 mg/m³. L’EPA a conclu que le glutarate de diméthyle ne présente pas d’alertes particulières et ne s’attend pas à ce qu’il soit cancérogène chez l’humain (US EPA 2014). Aucun signe de génotoxicité n’a été observé dans les données empiriques disponibles pour ces deux substances.
Compte tenu des données disponibles pour le glutarate de diméthyle et le mélange DBE, on considère que le glutarate de diméthyle présente un faible potentiel de danger, et par conséquent il n’apparaît pas utile de caractériser le potentiel d’exposition (c.‑à‑d. calculer les estimations de l’exposition). On estime que le risque pour la santé humaine est faible.
7.1.8 Myristate de tétradécyle
Évaluation de l’exposition
Comme on considère que le myristate de tétradécyle présente un faible potentiel de danger (voir la section Évaluation des effets sur la santé ci‑dessous), on n’a pas estimé quantitativement l’exposition de la population générale. Cette section présente des renseignements généraux sur l’exposition au myristate de tétradécyle.
Le myristate de tétradécyle est un solide dont la pression de vapeur est négligeable et la solubilité dans l’eau très faible. On n’a trouvé aucune donnée empirique sur le myristate de tétradécyle dans l’air (intérieur ou ambiant), l’eau, la poussière ou le sol au Canada.
Le myristate de tétradécyle peut être utilisé comme composant dans un additif indirect (nettoyant pour les mains) utilisé dans les établissements de transformation des aliments, sans potentiel de contact alimentaire direct, et par conséquent on ne prévoit pas d’exposition par voie alimentaire (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence).
Dans les cosmétiques, le myristate de tétradécyle est souvent identifié comme myristate de myristyle. On le trouve dans plus de 900 cosmétiques au Canada, y compris les antisudorifiques/désodorisants, les produits pour le bain, les produits capillaires, les produits pour la peau, les décolorants, les nettoyants, les produits parfumants, les produits de massage, les vernis à ongles, les shampoings, les produits de rasage et les produits autobronzants (courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’utilisation de ces produits pourrait donner lieu principalement à une exposition cutanée de la population générale au Canada.
Le myristate de tétradécyle est présent comme ingrédient non médicinal dans des produits de santé naturels d’application topique et dans des médicaments sur ordonnance ou en vente libre au Canada, y compris les produits de maquillage, les antisudorifiques, les hydratants, les écrans solaires et les baumes pour lèvres, ainsi que certains produits destinés expressément aux enfants. Ces produits peuvent donner lieu à une exposition orale ou cutanée de la population générale au Canada.
Évaluation des effets sur la santé
On a trouvé peu de renseignements sur les effets du myristate de tétradécyle sur la santé. Une fois absorbé, on s’attend à ce que le myristate de tétradécyle soit hydrolysé rapidement en un acide gras (acide myristique; n° CAS 544-63-8) et en alcools à longue chaîne (tétradécanol [n° CAS 112-72-1] et alcools en C14‑15 [n° CAS 75782-87-5]). L’acide myristique a été examiné par l’OCDE (2014) dans le cadre de l’évaluation de la catégorie des acides aliphatiques. Le tétradécanol et les alcools en C14-15 ont également été examinés par l’OCDE (2006) dans le cadre de son évaluation des alcools à longue chaîne. Ces examens ont servi à éclairer la caractérisation des effets sur la santé du myristate de tétradécyle. On a recherché dans la littérature les articles publiés entre un an avant la publication de l’évaluation de l’OCDE et décembre 2020, et on n’a trouvé aucune étude décrivant des effets additionnels sur la santé et qui auraient pu constituer des points de départ inférieurs à ceux qui ont été trouvés par l’OCDE (2006, 2014).
Des données sur le danger posé par des analogues ont également été utilisées pour éclairer l’évaluation des effets du myristate de tétradécyle sur la santé. Les analogues ont été trouvés sur la base de leur similarité structurelle, de leur similarité des propriétés physico-chimiques, de leur disponibilité des données et des sous‑groupes utilisés dans les rapports du Cosmetic Ingredient Review (CIR) (Becker et al. 2010; CIR 2013). Ces analogues comprennent l’octanoate de 2-propylheptyle (n° CAS 868839-23-0), le laurate de 2-éthylhexyle (n° CAS 20292-08-4), le laurate d’isodécyle (n° CAS 94247-10-6), le myristate d’isopropyle (n° CAS 110-27-0), l’oléate d’isodécyle (n° CAS 59231-34-4), l’oléate de tétradécyle (n° CAS 22393-85-7), le docosanoate de docosyle (n° CAS 17671-27-1) et le stéarate de 2-éthylhexyle (n° CAS 22047-49-0) (voir la section 2.1 et l’annexe A pour de plus amples renseignements sur leur structure et leurs propriétés physico-chimiques, respectivement). Des recherches ont été faites dans la littérature pour trouver des articles publiés jusqu’en juin 2017 au sujet de ces substances.
Toxicocinétique
Aucune donnée toxicocinétique n’a été trouvée pour le myristate de tétradécyle et ses analogues. Seules des données limitées ont été trouvées pour ses métabolites attendus, à savoir l’acide myristique, le tétradécanol et les alcools en C14‑15. Les acides aliphatiques à longue chaîne (> 12 atomes de carbone), notamment l’acide myristique, sont absorbés dans l’intestin et distribués dans le sang sous forme de chylomicrons (OCDE 2014). Les alcools aliphatiques sont efficacement éliminés et ne devraient donc pas présenter de potentiel de rétention ou de bioaccumulation dans les tissus (Bevan 2001). Les alcools aliphatiques sont efficacement métabolisés, et les produits de biotransformation sont très similaires ou indiscernables de ceux provenant de sources alimentaires courantes (triglycérides).
Toxicité à doses répétées
Il n’y a pas de données disponibles sur la toxicité du myristate de tétradécyle à doses répétées. On a trouvé des données sur l’exposition par voie orale pour ses métabolites et ses analogues. Cependant, on n’a trouvé aucune étude sur la toxicité par inhalation ou par voie cutanée.
L’OCDE (2014) a indiqué qu’à doses répétées par voie orale (gavage ou régime alimentaire), l’exposition à des acides aliphatiques, dont l’acétate myristique, un métabolite du myristate de tétradécyle, n’a pas entraîné de toxicité générale, avec des DSENO supérieures à 1 000 mg/kg p.c./j. L’OCDE a identifié l’acide docosanoïque (n° CAS 112-85-6) comme étant l’analogue structurel le plus proche de l’acide myristique avec données à l’appui. Dans une étude de toxicité à doses répétées combinée à une évaluation préliminaire de toxicité pour la reproduction et le développement, des rats (13/sexe/groupe) ont reçu de l’acide docosanoïque par gavage oral à des doses de 0, 100, 300 et 1 000 mg/kg p.c./j. Chez les mâles, la période d’exposition était de 42 jours, et chez les femelles elle allait de 14 jours avant l’accouplement au 3e jour de lactation (minimum de 39 jours d’exposition). Aucun décès ou changement de l’état général, aucune modification de la prise de poids corporel ou de la consommation alimentaire, et aucun effet histopathologique, hématologique ou biochimique indésirable n’ont été observés à toutes les doses d’essai (OCDE 2014).
Une faible toxicité générale était à prévoir pour toutes les voies après une exposition de courte durée et subchronique au tétradécanol et les alcools en C14-15, un autre métabolite du myristate de tétradécyle. Selon l’OCDE (2006), l’exposition répétée aux alcools aliphatiques n’entraîne généralement pas de résultat toxicologique général significatif, et on considère que la catégorie des alcools à longue chaîne présente une faible toxicité en cas d’exposition répétée.
On a également obtenu des renseignements sur les résultats des études à doses répétées avec des analogues du myristate de tétradécyle.
Dans une étude d’exposition subchronique à doses répétées, des rats ont reçu du caprylate de propylheptyle par gavage. Les animaux testés (10/sexe/dose) ont été exposés 7 jours/semaine, pendant 90 jours, à 0, 100, 300 et 1 000 mg/kg p.c./j de caprylate de propylheptyle dans de l’huile de soja. On n’a observé aucune mortalité liée à la substance d’essai. On n’a constaté également aucun signe clinique de toxicité lié à la substance, aucune modification du poids corporel, de la consommation alimentaire ou du cycle œstral, ni aucun effet sur le sperme, et aucun effet sur les paramètres de chimie clinique ou d’hématologie. Chez les animaux exposés à la dose maximale, on a constaté une augmentation statistiquement significative du poids absolu et relatif du foie. Aucun autre changement macroscopique ou microscopique dans les organes n’a été noté. On a considéré que les changements dans le poids du foie constituaient un changement adaptatif non spécifique à la charge de travail élevée du foie à la dose maximale (LPT 2006; ADGH 2008).
Dans une étude d’exposition orale à court terme, des rats des deux sexes (nombre non indiqué) ont reçu des doses atteignant 4 500 mg/kg p.c./j de laurate d’isodécyle, 6 jours/semaine, pendant 4 semaines successives. Aucun changement lié au traitement n’a été observé, à quelque dose que ce soit (ADGH 1998; CIR 2013).
Une étude de détermination des doses a été menée avec l’oléate d’isodécyle afin de déterminer les doses appropriées pour une étude de toxicité à doses répétées combinée à une évaluation préliminaire de la toxicité pour la reproduction et le développement. Dans cette étude, des rats (5/sexe/dose) ont été exposés par gavage à 100, 300 et 1 000 mg/kg p.c./j d’oléate d’isodécyle, 7 jours/semaine, pendant 14 jours. Il n’y a pas eu de mortalité pendant la période d’étude. Aucun signe clinique lié au traitement n’a été observé. Le poids corporel, la prise de poids corporel et la consommation alimentaire moyenne étaient comparables entre le groupe témoin et le groupe traité pendant la période d’étude. Aucune modification pathologique macroscopique n’a été observée, notamment l’apparence et la taille des gonades, des surrénales, de l’utérus et des organes reproducteurs accessoires (Anonymous 2012, cité dans ECHA c2007-2017n).
Dans l’étude combinée de toxicité à doses répétées, des rats (10/sexe/dose) ont été exposés par gavage à 100, 300 et 1 000 mg/kg p.c./j d’oléate d’isodécyle, 7 jours/semaine. Chez les mâles, l’administration quotidienne de la substance d’essai a commencé 2 semaines avant l’accouplement et s’est poursuivie jusqu’au 35e jour d’essai, soit 1 jour avant le sacrifice. Chez les femelles, l’administration quotidienne de la substance d’essai a commencé 2 semaines avant l’accouplement et s’est poursuivie au moins jusqu’au 3e jour de la lactation (56 jours de traitement au maximum). La DSENO chez les femelles était de 300 mg/kg p.c./j, d’après une diminution statistiquement significative (-9,7 %) du poids corporel pendant la lactation et une réduction statistiquement significative (-21,7 %) de la consommation alimentaire à la dose suivante de 1 000 mg/kg p.c./j. Aucun effet n’a été observé chez les mâles, à quelque dose que ce soit (Anonymous 2013, cité dans ECHA c2007-2017o).
Dans une étude de détermination des doses, des rats (3/sexe/dose) ont été exposés par gavage à 100, 300 et 1 000 mg/kg p.c./j d’oléate de tétradécyle, 7 jours/semaine, pendant 2 semaines. Des changements mineurs ont été observés dans le poids des organes, y compris la diminution du poids absolu et relatif du thymus (environ -18 %) chez les mâles ayant reçu 1 000 mg/kg/j et une diminution statistiquement significative du poids absolu et relatif des reins (-12 %, pour le poids absolu) chez les femelles ayant reçu 1 000 mg/kg/j. On a déterminé que la DSENO était supérieure à 1 000 mg/kg p.c./j chez les mâles et les femelles (Anonymous 2013, cité dans ECHA c2007-2017p).
Dans une étude de toxicité à doses répétées combinée à une évaluation préliminaire de la toxicité pour la reproduction et le développement, des rats (10/sexe/dose) ont été exposés par gavage à 100, 300 et 1 000 mg/kg p.c./j d’oléate de tétradécyle, 7 jours/semaine. Chez les mâles, l’administration quotidienne de la substance d’essai a commencé 2 semaines avant l’accouplement et a duré jusqu’au jour 28 ou 29 de l’essai, soit 1 jour avant le sacrifice. Chez les femelles, l’administration quotidienne de la substance d’essai a commencé 2 semaines avant l’accouplement et s’est poursuivie jusqu’au jour 3 post-partum (54 jours de traitement au maximum). Des fluctuations statistiquement significatives de certains paramètres biochimiques (valeurs moyennes par groupe) ont été observées, notamment une augmentation du glucose chez les mâles ayant reçu 100 et 1 000 mg/kg p.c./j (48 %), une augmentation de l’urée chez ceux ayant reçu 100 mg/kg p.c./j (19 %), une augmentation des aspartates aminotransférases chez les femelles ayant reçu 300 mg/kg p.c./j (35 %), ainsi qu’une diminution de la bilirubine (81 %) et une augmentation du potassium (10 %) chez les animaux traités avec la dose maximale par rapport aux témoins. En raison du manque de relation entre la dose et le sexe et de l’absence d’autres effets pertinents, les altérations susmentionnées ont été considérées sans lien avec le traitement, et on a déterminé que la DSENO était de 1 000 mg/kg p.c./j (Anonymous 2014, cité dans ECHA c2007-2017q).
Dans une étude de détermination des doses, des rats (3/sexe/dose) ont été exposés par gavage à 100, 500 et 1 000 mg/kg p.c./j de docosanoate de docosyle, 7 jours/semaine, pendant 2 semaines. Aucun effet indésirable n’a été signalé, à quelque dose que ce soit (Anonymous 2012, cité dans ECHA c2007-2017r). Dans une étude de toxicité à doses répétées combinée à une évaluation préliminaire de la toxicité pour la reproduction et le développement, des rats (10/sexe/dose) ont reçu du docosanoate de docosyle à des doses de 100, 300 et 1 000 mg/kg p.c./j par gavage. Les mâles ont été exposés pendant 2 semaines avant l’accouplement et au moins jusqu’à la veille du sacrifice (49e jour du traitement). Les femelles ont été exposées 2 semaines avant l’accouplement et au moins jusqu’au jour précédant le sacrifice (jour post‑partum 4). Aucun effet n’a été observé à quelque dose que ce soit chez les deux sexes (Anonymous 2014, cité dans ECHA c2007-2017s).
Dans une étude à court terme, des rats (10/sexe/dose) ont reçu 0, 100, 500 et 1 000 mg/kg p.c./j de myristate d’isopropyle par gavage, 5 jours/semaine, pendant 28 jours. Aucun changement lié au traitement n’a été observé, à quelque dose que ce soit (Anonymous 1983, cité dans ECHA c2007-2017t).
Toxicité pour la reproduction et le développement
On n’a trouvé aucune donnée disponible sur la toxicité du myristate de tétradécyle pour la reproduction. Nous présentons ci‑dessous un résumé des données disponibles sur les deux métabolites prévus.
Dans une étude de toxicité à doses répétées combinée à l’évaluation de la toxicité pour la reproduction et le développement décrite ci‑dessus pour l’acide docosanoïque, on n’a observé aucun effet sur la reproduction ou sur les paramètres de développement, à quelque dose que ce soit (jusqu’à 1 000 mg/kg p.c./j) (OCDE 2014). De plus, aucun effet sur la fertilité ou sur les organes reproducteurs et aucun effet sur le développement n’ont été observés dans les études menées avec les acides aliphatiques. L’OCDE a indiqué que le poids de la preuve soutient l’absence de toxicité potentielle des acides aliphatiques pour ce qui est de la reproduction et du développement (OCDE 2014).
Dans un rapport de l’OCDE (2006), on a conclu que la catégorie des alcools à longue chaîne, qui comprend le tétradécanol et les alcools en C14‑15, ne présente pas de potentiel d’effets indésirables sur la fertilité, ni de toxicité pour la reproduction. De même, les études de toxicité pour le développement menées avec les alcools aliphatiques ont confirmé l’absence de toxicité maternelle et d’effets potentiels de ces substances sur le développement.
On a également trouvé des données sur la toxicité des analogues du myristate de tétradécyle pour la reproduction et le développement.
Dans l’étude de toxicité à doses répétées combinée à l’étude de toxicité pour la reproduction et le développement décrite ci‑dessus pour l’oléate d’isodécyle (Anonymous 2013, cité dans ECHA c2007-2017o), la DSENO pour la toxicité pour la reproduction a été établie à 300 mg/kg p.c./j sur la base d’une augmentation statistiquement significative des pertes post-implantatoires, d’une diminution non statistiquement significative de l’indice de naissance et d’une augmentation du nombre de mort-nés, conduisant à une réduction statistiquement significative de l’indice de naissances vivantes à la dose maximale d’essai. La DSENO pour la toxicité parentale était également de 300 mg/kg p.c./j, d’après une légère réduction du poids corporel et de la consommation alimentaire chez les femelles à la dose maximale. Aucun effet sur les mâles n’a été signalé.
Dans l’étude de toxicité à doses répétées combinée à l’évaluation préliminaire de toxicité pour la reproduction et le développement décrite ci‑dessus pour l’oléate de tétradécyle et le docosanoate de docosyle (Anonymous 2014, cité dans ECHA c2007-2017q, Anonymous 2014, cité dans ECHA c2007-2017s), aucun effet systémique ou sur la reproduction n’a été observé pour l’une ou l’autre substance.
Une étude de toxicité pour le développement a été menée dans laquelle des rates ont reçu des doses de 0, 100, 300 et 1 000 mg/kg p.c./j de stéarate de 2‑éthylhexyle, une fois par jour entre les JG 6 et 15. Les mères ont été sacrifiées au JG 20. Aucun effet sur le développement n’a été observé (Anonymous 2000, cité dans ECHA c2007-2017u).
Dans l’ensemble, le myristate de tétradécyle n’est pas considéré comme ayant une toxicité potentielle pour la reproduction et le développement. On prévoit que les deux principaux métabolites n’auront aucun effet. De plus, on n’a observé aucun effet de l’analogue stéarate de 2‑éthylhexyle sur le développement. Bien que des effets sur la reproduction aient été notés dans une étude menée avec l’oléate d’isodécyle, ces effets n’ont été observés qu’à la dose limite (1 000 mg/kg p.c./j) et en présence d’une toxicité maternelle. Aucun effet équivalent sur la reproduction ou les parents n’a été observé dans des études similaires de toxicité pour la reproduction et le développement réalisées avec les deux analogues que sont l’oléate de tétradécyle et le docosanoate de docosyle.
Génotoxicité
Le myristate de tétradécyle a donné des résultats négatifs sur les souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium, avec et sans activation métabolique (Anonymous 2000, cité dans ECHA c2007-2017v).
L’OCDE (2014) a déterminé que l’acide docosanoïque est l’analogue structurel le plus proche, d’après les données, du métabolite acide myristique. Des résultats négatifs ont été observés lorsque les souches TA98, TA100, TA1535 et TA1537 de Salmonella typhimurium et la souche WP2 uvrA d’Escherichia coli ont été exposées à l’acide docosanoïque en présence et en l’absence d’activation métabolique. Selon l’OCDE (2014), le poids de la preuve indique que les acides aliphatiques ne devraient pas être génotoxiques.
Un test d’Ames réalisé sur les alcools en C14‑15 a donné des résultats négatifs. Selon l’OCDE (2006), les données disponibles montrent une absence constante d’activité mutagène dans toute la gamme des alcools linéaires, qui comprend le tétradécanol et les alcools en C14‑15. Les alcools à longue chaîne ne présentent pas de potentiel génotoxique.
On a également trouvé des données sur le potentiel génotoxique des analogues du myristate de tétradécyle.
Le caprylate de propylheptyle s’est révélé négatif dans un essai de mutation bactérienne sur les souches TA98, TA100, TA102, TA1535 et TA1573 de Salmonella typhimurium, avec et sans activation métabolique. Il n’était pas clastogène pour les fibroblastes pulmonaires V79 du hamster chinois ni dans un test d’aberration chromosomique sur mammifères in vitro (ADGH 2008).
Dans le cas du laurate d’isodécyle, on a obtenu des résultats négatifs dans un essai de mutation bactérienne sur les souches TA98, TA100 et TA102 de Salmonella typhimurium (ADGH 1998; CIR 2013).
Pour ce qui est du myristate d’isopropyle, des résultats négatifs ont été observés dans des essais de mutation bactérienne sur les souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium, avec et sans activation métabolique (Anonymous 1981, cité dans ECHA c2007-2017w; Anonymous 2014, cité dans ECHA c2007-2017x).
Cancérogénicité
Il n’y a pas de données sur le potentiel cancérogène du myristate de tétradécyle et de ses analogues.
Des données limitées ont été trouvées pour le métabolite tétradécanol et les alcools en C14‑15. Selon l’OCDE (2006), le développement de tumeurs de la peau n’a pas été observé pour plusieurs membres de la catégorie des alcools aliphatiques à longue chaîne (notamment l’hexan‑1‑ol, l’octan‑1‑ol, le décan‑1‑ol, le dodécan‑1‑ol, le tétradécan‑1‑ol, l’hexadécan‑1‑ol et l’octadécan‑1‑ol) dans des études sur l’effet de la peinture sur la peau de souris, avec des applications répétées pendant des périodes allant jusqu’à 60 à 70 semaines (Sicé 1966; Bingham 1969; Van Duuren 1976), ce qui indique qu’il n’y a pas de signe de potentiel cancérogène pour cette catégorie de substances. Les alcools aliphatiques à longue chaîne ne contiennent pas d’éléments structurels dénotant une interaction potentielle avec l’ADN et ne sont pas mutagènes (OCDE 2006).
Caractérisation du risque
Une fois absorbé, on s’attend à ce que le myristate de tétradécyle soit rapidement hydrolysé en un acide gras (acide myristique) et un alcool à longue chaîne (tétradécanol ou alcools en C14‑15). L’acide myristique a été examiné par l’OCDE (2014) dans le cadre de l’évaluation de la catégorie des acides aliphatiques. L’exposition orale répétée aux acides aliphatiques chez les animaux de laboratoire n’a pas entraîné d’effets indésirables systémiques à des doses atteignant 1 000 mg/kg p.c./j. De plus, on n’a observé aucun effet sur la fertilité ou les organes reproducteurs ni aucun effet sur le développement dans des études réalisées avec des acides aliphatiques. Les acides aliphatiques ne devraient pas être génotoxiques.
L’OCDE (2006) a examiné le tétradécanol et les alcools en C14‑15 dans le cadre de l’évaluation des alcools à longue chaîne. Selon l’OCDE (2006), on considère que la catégorie des alcools à longue chaîne présente un faible degré de toxicité en cas d’exposition répétée. On estime également que les substances faisant partie de cette catégorie ont un faible potentiel d’effets toxiques nocifs sur la fertilité, la reproduction et le développement. Les alcools aliphatiques à longue chaîne ne contiennent pas d’éléments structurels dénotant une interaction potentielle avec l’ADN et ne sont pas génotoxiques.
On a également tenu compte des données pour plusieurs analogues (caprylate de propylheptyle, laurate de 2-éthylhexyle, laurate d’isodécyle, myristate d’isopropyle, docosanoate de docosyle, myristate d’isopropyle). Des études à doses répétées à court terme et de toxicité subchronique ainsi que des études combinées à doses répétées et de toxicité pour la reproduction et le développement, ont été trouvées pour les analogues. On n’a observé aucune toxicité générale chez les animaux de laboratoire après une exposition à des doses répétées atteignant 1 000 mg/kg p.c./j pour tous ces analogues. En outre, les renseignements disponibles indiquent que les analogues ne devraient pas avoir de toxicité potentielle pour la reproduction et le développement. D’après les renseignements disponibles, il est peu probable que les analogues aient un potentiel génotoxique.
Compte tenu des données disponibles sur les effets des métabolites et des analogues sur la santé, on estime que le myristate de tétradécyle présente un faible potentiel de danger et, par conséquent, on n’a pas jugé utile de caractériser le potentiel d’exposition (c.‑à‑d. le calcul d’estimations de l’exposition). On estime que le risque pour la santé humaine est faible.
7.1.9 Acétate de 2‑méthoxypropyle
Évaluation de l’exposition
Milieux naturels
Aucune donnée empirique n’a été trouvée pour l’acétate de 2‑méthoxypropyle dans l’air, l’eau ou le sol au Canada ou ailleurs. L’acétate de 2‑méthoxypropyle est un liquide ayant une pression de vapeur élevée et une très grande solubilité dans l’eau. Compte tenu de ses propriétés physiques et chimiques, l’acétate de 2‑méthoxypropyle peut être présent dans l’air et dans l’eau.
L’acétate de 2‑méthoxypropyle est une impureté potentielle de l’acétate de 1‑méthoxy‑2‑propanol (également connu sous le nom d’acétate d’éther monométhylique de propylèneglycol, PGMEA ou PMA), et sa présence a été signalée dans une fourchette de 0,3 % à 0,5 % (OCDE 2003b). Le PMA est déclaré à l’Inventaire national des rejets de polluants depuis 2005, les rejets déclarés étant de l’ordre de 400 tonnes par an (principalement dans l’air) (INRP 2017). Selon l’INRP, le PMA serait rejeté dans l’atmosphère par 71 installations au Canada (ECCC 2019). L’outil de modélisation SCREEN3 de l’EPA (SCREEN3 2011) a été utilisé pour estimer les concentrations de PMA dans l’air ambiant au Canada d’après les rejets déclarés à l’INRP en 2019 et les renseignements sur les installations, en supposant que l’acétate de 2‑méthoxypropyle peut être présent dans le PMA en tant qu’impureté jusqu’à 0,5 %. Une installation a rejeté environ 33 tonnes de PMA dans l’air en 2019 (ECCC 2019). À une distance de 300 m (soit la distance entre l’installation source et les zones résidentielles), la concentration atmosphérique quotidienne (sur 24 heures) d’acétate de 2‑méthoxypropyle était de 4,61 × 10-3 mg/m³. On trouvera à l’annexe E de plus amples renseignements sur le modèle SCREEN3 et les paramètres utilisés pour calculer cette concentration.
Les concentrations d’acétate de 2‑méthoxypropyle dans l’air intérieur, l’eau potable et le sol au Canada ont été estimées d’après sa présence en tant qu’impureté potentielle dans le PMA, et en utilisant le modèle de fugacité de niveau III connu sous le nom de ChemCAN (ChemCAN 2003). Le volume total de PMA utilisé au Canada étant inconnu, on a supposé une valeur limite supérieure de 100 000 tonnes (100 000 000 kg) de PMA au Canada. Ce volume de PMA a été considéré comme la limite supérieure pour le Canada, car il s’agit de la valeur déclarée aux fins de fabrication et/ou d’importation dans l’Espace économique européen (ECHA 2007-2017y). En supposant que l’acétate de 2‑méthoxypropyle peut être présent dans le PMA jusqu’à 0,5 %, on a estimé une valeur de 500 000 kg comme limite supérieure du volume total d’acétate de 2‑méthoxypropyle utilisé au Canada. Les concentrations modélisées d’acétate de 2‑méthoxypropyle obtenues par cette approche ont servi à estimer l’exposition de la population générale du Canada (voir le tableau B-2 de l’annexe B).
L’exposition de la population générale à l’acétate de 2‑méthoxypropyle par les milieux naturels atteignait 0,44 µg/kg p.c./j pour les nourrissons de 1 an (voir le tableau B-2, annexe B).
Aliments
L’acétate de 2‑méthoxypropyle peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments et donc l’exposition par les aliments n’est pas à prévoir (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
Produits disponibles aux consommateurs
L’acétate de 2‑méthoxypropyle (aussi connu sous le nom de 2-méthoxypropyl-1-acétate) figure sur la liste des ingrédients dont l’utilisation est interdite dans les cosmétiques au Canada (Santé Canada [modifiée 2015]). Dans les cosmétiques, le PMA (ou methoxyisopropyl acetate selon l’INCI) figure sur la liste des ingrédients dont l’utilisation est restreinte dans les cosmétiques au Canada, avec une concentration maximale autorisée de 0,5 % au total de 2-méthoxypropanol et/ou de 2-méthoxypropyl-1-acétate (Santé Canada [modifiée 2015]). On a estimé l’exposition par inhalation, dans un scénario de la pire éventualité, en supposant que les vernis à ongles contiennent de l’acétate de 2‑méthoxypropyle en concentration < 0,05 % (en supposant que le vernis à ongles contient 10 % de PMA). La concentration moyenne par événement (c.‑à‑d. pendant l’application) est estimée à 0,12 mg/m³, et la concentration moyenne pondérée dans l’air sur 6 heures est estimée à 0,012 mg/m³.
On a trouvé de l’acétate de 2‑méthoxypropyle dans un produit (stylo de réparation de rayures pour automobile) (SDS 2017b). L’exposition associée à ce produit devrait être minime. Le PMA, une source potentielle d’acétate de 2‑méthoxypropyle, est utilisé dans des produits ménagers tels que les nettoyants, les peintures, les laques et les vernis. Au Canada, on a trouvé du PMA dans une gamme de produits disponibles aux consommateurs, y compris les peintures en aérosol et les vernis (FDS 2018f), les produits pour l’automobile comme les mastics de finition (SDS 2020), les trousses de réparation des éraflures et rayures (SDS 2017b), les antipoussières pour jantes (SDS 2014e) et les produits d’étanchéité (SDS 2017c). Les concentrations habituelles de PMA dans les produits disponibles aux consommateurs sont de 5 % à 15 %, et atteignent parfois 20 % (Dow 2015).
Bien qu’on n’ait pas trouvé de concentrations spécifiques d’acétate de 2‑méthoxypropyle à proprement dit dans ces produits, on a calculé l’exposition estimée par inhalation pour des produits sentinelles en supposant une concentration maximale de 0,1 % d’acétate de 2‑méthoxypropyle (c.‑à‑d. 20 % de PMA dans les produits, avec du PMA contenant jusqu’à 0,5 % d’acétate de 2‑méthoxypropyle). Le tableau 7-5 présente les valeurs estimées de l’exposition par inhalation à l’acétate de 2‑méthoxypropyle dans les produits contenant du PMA. Bien que l’on s’attende à ce que l’exposition cutanée contribue à l’exposition globale pendant l’utilisation des produits, en raison de la pression de vapeur élevée de l’acétate de 2‑méthoxypropyle, la principale voie d’exposition serait l’inhalation.
| Scénario d’utilisation du produit | Concentration de d’acétate de 2-méthoxypropyle | Concentration MPT sur 7 heures par événement a (mg/m³) | Concentration MPT sur 6 heures par événement a (mg/m³) |
|---|---|---|---|
| Peinture en aérosol | 0,1 % | 4,6 | 0,25 |
| Mastic de finition | 0,1 % | 0,7 | 0,48 |
Abréviations : MPT = moyenne pondérée dans le temps.
Évaluation des effets sur la santé
L’acétate de 2‑méthoxypropyle est classé comme substance toxique pour la reproduction (Repr 1B) dans le tableau de classification et d’étiquetage harmonisé de l’annexe VI du Règlement relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges (Règlement CLP) (ECHA 2008).
L’acétate de 2‑méthoxypropyle est rapidement hydrolysé en 2-méthoxypropanol par les estérases de l’organisme (DECOS 1993; ECETOC 2005a). Le 2-méthoxypropanol est ensuite métabolisé en acide 2‑méthoxypropanoïque, son principal métabolite. Les renseignements disponibles sur les effets de ces deux substances sur la santé sont jugés pertinents pour éclairer l’évaluation des effets de l’acétate de 2‑méthoxypropyle sur la santé.
Santé Canada a évalué le 2-méthoxypropanol lors d’une évaluation préliminaire dans le cadre du PGPC (ECCC, SC 2009). Dans cette évaluation, les données sur l’acétate de 2‑méthoxypropyle et l’acide 2‑méthoxypropanoïque ont été prises en compte. On a recherché dans la littérature les articles publiés sur l’acétate de 2‑méthoxypropyle, le 2‑méthoxypropanol et l’acide 2‑méthoxypropanoïque entre juin 2007 (année de la dernière recherche dans la littérature lors de l’évaluation préliminaire) et décembre 2020, et aucune étude supplémentaire sur les effets sur la santé n’a été relevée. De plus amples détails sur les études de toxicité prises en compte dans la présente évaluation figurent dans l’évaluation préalable du 2-méthoxypropanol. Un résumé de ces renseignements est présenté ci‑dessous (ECCC, SC 2009).
Toxicité à doses répétées
Des effets hématologiques ont été observés chez des rats mâles après 10 jours d’exposition par voie orale (gavage) à 1 800 mg de 2-méthoxypropanol/kg p.c./j ou 2 600 mg d’acétate de 2‑méthoxypropyle/kg p.c./j (Ma-Hock et al. 2005). Lorsque des rats ont été exposés par inhalation à l’acétate de 2‑méthoxypropyle à des concentrations de 0, 600, 3 000 et 15 000 mg/m³, 6 heures/jour, 5 jours/semaine pendant 28 jours, on a observé des altérations hématologiques et biochimiques à la dose maximale. Une atrophie du thymus ainsi qu’une réduction de la prise de poids corporel et une irritation respiratoire ont également été observées à cette concentration (Ma-Hock et al. 2005).
Toxicité pour la reproduction et le développement
On a observé des effets sur le développement chez des rates et des lapines gravides exposées à l’acétate de 2‑méthoxypropyle par inhalation. Les effets comprenaient une augmentation significative de la résorption fœtale, une incision des vertèbres thoraciques et des vertèbres fendues (chez les rates à 14 900 mg/m³), et des malformations du sternum, des pattes, des principaux vaisseaux sanguins et du cœur (chez les lapines à 3 000 mg/m³). On a également observé une toxicité maternelle (réduction significative du poids corporel des mères, irritation respiratoire et oculaire et sédation chez les rates à 3 000 mg/m³ et 14 900 mg/m³ et réduction du poids corporel chez les lapines à 3 000 mg/m³) (ECETOC 2005a).
Des lapines gravides exposées par inhalation au 2-méthoxypropanol pendant 6 heures/jour entre les JG 6 et 18 ont montré une résorption fœtale et une fréquence significativement accrues de malformations et de variations viscérales et squelettiques, liées à la dose, ainsi qu’une réduction significative du poids corporel des fœtus à partir de 843 mg/m³ en l’absence de toxicité maternelle. L’auteur a déterminé que la CSENO était de 543 mg/m³ (équivalente à une CSENO de 796 mg/m³ pour l’acétate de 2‑méthoxypropyle sur la base d’une conversion du poids moléculaire, en supposant la même quantité molaire). Des rates gravides exposées à des concentrations plus élevées de 2-méthoxypropanol ont eu des fœtus présentant des incisions des vertèbres thoraciques et des vertèbres fendues (BASF 1986).
On n’a trouvé aucun renseignement sur la toxicité potentielle pour le développement de l’acétate de 2‑méthoxypropyle et du 2-méthoxypropanol administrés par voie orale. Dans une étude par gavage oral menée chez des lapines gravides avec l’acide 2‑méthoxypropanoïque entre les JG 7 et 19, on a observé une augmentation significative de la résorption fœtale et de la fréquence des variations et des malformations chez les fœtus (côtes manquantes, ossification retardée, uretère rétrocave et kyste paraovarien) à 78 mg/kg p.c./j (équivalant à 99 mg d’acétate de 2‑méthoxypropyle/kg p.c./j, d’après une conversion du poids moléculaire pour une même quantité molaire), avec une DSENO de 26 mg/kg p.c./j (équivalant à 33 mg d’acétate de 2‑méthoxypropyle/kg p.c./j) (Carney et al. 2003).
Génotoxicité
Aucune étude de génotoxicité de l’acétate de 2‑méthoxypropyle n’a été trouvée dans la littérature et on dispose de données limitées seulement sur la génotoxicité du 2‑méthoxypropanol. Dans des tests d’Ames sur diverses souches de Salmonella, il n’a pas induit de mutation génétique, avec ou sans activation métabolique (BASF 1988).
Cancérogénicité
En ce qui concerne la cancérogénicité potentielle ou la toxicité chronique de l’acétate de 2‑méthoxypropyle, aucune étude à long terme n’a été trouvée.
Caractérisation du risque
Une fois absorbé, l’acétate de 2‑méthoxypropyle est rapidement hydrolysé en 2‑méthoxypropanol par des estérases présentes dans l’organisme (DECOS 1993; ECETOC 2005a). Les renseignements disponibles sur le 2-méthoxypropanol et son principal métabolite, l’acide 2‑méthoxypropanoïque, ont donc été jugés pertinents pour éclairer la caractérisation des effets de l’acétate de 2‑méthoxypropyle sur la santé.
L’effet critique pour la caractérisation du risque de l’acétate de 2‑méthoxypropyle pour la santé humaine est la toxicité pour le développement. En outre, l’acétate de 2‑méthoxypropyle a été classé comme substance toxique pour la reproduction (Repr 1B, peut nuire au fœtus) dans le tableau harmonisé de classification et d’étiquetage de l’annexe VI du Règlement CLP (ECHA 2008).
Une CSENO de 543 mg/m³ pour le 2-méthoxypropanol a été trouvée dans une étude de toxicité pour le développement chez des lapins exposés par inhalation. La CSENO équivalente pour l’acétate de 2‑méthoxypropyle a été établie à 796 mg/m³ sur la base d’une conversion du poids moléculaire pour une même quantité molaire. À la dose suivante (843 mg/m³), les effets ont consisté en une augmentation significative de la résorption fœtale et de la fréquence des malformations et variations viscérales et squelettiques chez les fœtus et une réduction significative du poids corporel des fœtus, en l’absence de toxicité maternelle (Hellwig et al. 1994). Pour ce qui est de la voie orale, la dose critique a été définie comme étant une DSENO de 26 mg d’acide 2‑méthoxypropanoïque/kg p.c./j (équivalant à 33 mg d’acétate de 2‑méthoxypropyle/kg p.c./j sur la base d’une conversion du poids moléculaire pour une même quantité molaire), selon une étude de toxicité pour le développement dans laquelle des lapines gravides ont reçu de l’acide 2‑méthoxypropanoïque par gavage. Dans cette étude, une résorption fœtale et l’occurrence de variations et de malformations fœtales, notamment des côtes manquantes, une ossification retardée, un uretère rétrocave et un kyste paraovarien, ont été observées à 78 mg d’acide 2‑méthoxypropanoïque/kg p.c./j (équivalant à 99 mg d’acétate de 2‑méthoxypropyle/kg p.c./j) (Carney et al. 2003).
La population générale peut être exposée à l’acétate de 2‑méthoxypropyle par les milieux naturels, principalement par l’air et l’eau. Les concentrations d’acétate de 2‑méthoxypropyle dans les milieux naturels ont été estimées selon par modélisation utilisant un volume total estimé de PMA dans le commerce et en supposant que l’acétate de 2‑méthoxypropyle est présent comme impureté potentielle dans le PMA (jusqu’à 0,5 %).
On a supposé que la population générale du Canada peut également être exposée à l’acétate de 2‑méthoxypropyle lorsqu’elle utilise divers produits contenant du PMA renfermant de l’acétate de 2‑méthoxypropyle comme impureté potentielle. Les cosmétiques contenant jusqu’à 10 % de PMA et les peintures en aérosol et les mastics contenant jusqu’à 20 % de PMA ont été identifiés comme produits représentatifs. Le tableau 7-6 présente les valeurs d’exposition et de danger pertinentes pour l’acétate de 2‑méthoxypropyle ainsi que les marges d’exposition (ME) résultantes pour la caractérisation des risques.
| Scénario d’exposition | Exposition | dose critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Exposition totale par les milieux naturels | 0,00044 mg/kg p.c./j | DSENO = 33 mg/kg p.c./jour | Augmentation significative de la résorption fœtale et de la fréquence des variations et malformations fœtales | 75000 |
|
Vernis à ongles (scénario d’inhalation maximal estimé pour les cosmétiques (0,05 %) (inhalation intermittente) |
0,012 mg/m³ | CSENO = 796 mg/m³ a | Augmentation significative de la résorption fœtale et de la fréquence des malformations et variations viscérales et squelettiques et réduction significative du poids corporel des fœtus | 66333 |
|
Peinture en aérosol (inhalation intermittente) |
0,25 mg/m³ | CSENO = 796 mg/m³ a | Augmentation significative de la résorption fœtale et de la fréquence des malformations et variations viscérales et squelettiques et réduction significative du poids corporel des fœtus | 3184 |
|
Mastic (inhalation intermittente) |
0,48 mg/m³ | CSENO = 796 mg/m³ a | Augmentation significative de la résorption fœtale et de la fréquence des malformations et variations viscérales et squelettiques et réduction significative du poids corporel des fœtus | 1658 |
Abréviations : ME = marge d’exposition; CSENO = concentration sans effet nocif observé; DSENO = dose sans effet nocif observé.
a Conversion du poids moléculaire à partir de la CSENO = 543 mg/m³.
Sur la base des approches prudentes utilisées pour estimer l’exposition à l’acétate de 2‑méthoxypropyle par les milieux naturels et pour modéliser l’exposition par inhalation due à l’utilisation de produits disponibles aux consommateurs, on estime que les ME calculées sont adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Bien que l’exposition de la population générale à l’acétate de 2‑méthoxypropyle ne soit pas préoccupante aux concentrations actuelles, on estime que les effets de cette substance sur la santé sont préoccupants en raison de sa toxicité potentielle pour le développement. Par conséquent, il peut y avoir une préoccupation pour la santé humaine si l’exposition à l’acétate de 2‑méthoxypropyle devait augmenter.
7.2 Sous‑groupe B : Esters de di/triol
7.2.1 Triacétine
Évaluation de l’exposition
Comme le potentiel de danger de la triacétine est jugé faible (voir la section Évaluation des effets sur la santé ci-dessous), on n’a pas estimé quantitativement l’exposition de la population générale. La présente section fournit des renseignements généraux sur l’exposition à la triacétine.
La triacétine est un liquide dont la pression de vapeur est modérée et la solubilité dans l’eau très élevée. D’après sa constante de la loi d’Henry, la triacétine devrait être essentiellement non volatile à partir des surfaces d’eau, et la volatilisation à partir des surfaces de sol humide n’est pas un processus important de son devenir (HSDB 1983- ).
Won et Lusztyk (2011) ont présenté des données agrégées sur la triacétine mesurée dans l’air intérieur de maisons de la ville de Québec en utilisant un échantillonnage passif entre novembre 2008 et mars 2010. La triacétine a été détectée dans 76 % des échantillons, et les concentrations moyennes géométriques et maximales rapportées dans l’air intérieur étaient de 0,52 µg/m³ et 7,77 µg/m³, respectivement. La triacétine a également été trouvée dans la poussière domestique prélevée dans 50 échantillons de poussière provenant de maisons de la ville de Québec (Won et Lusztyk 2011). La concentration moyenne géométrique de triacétine dans les échantillons de poussière était de 0,77 μg/g de poussière (fréquence de détection de 26 %), avec une valeur maximale de 8,6 μg/g. On n’a pas trouvé de concentrations mesurées de triacétine dans l’air ambiant ou dans l’eau au Canada.
La triacétine est un additif alimentaire autorisé pour utilisation comme il est prescrit sur la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées et la Liste des solvants de support ou d’extraction autorisés, incorporées par renvoi dans leurs autorisations de mise en marché respectives délivrées en vertu de la Loi sur les aliments et drogues. Le JECFA l’a évaluée comme substance aromatisante, et a conclu que la substance ne présentait « aucun problème d’innocuité » compte tenu des concentrations actuellement ingérées sous la forme d’agent aromatisant (JECFA 2002). Cependant, on ne dispose pas de données définitives concernant l’utilisation potentielle de la triacétine comme agent aromatisant alimentaire au Canada. La triacétine peut être utilisée comme composant dans un additif indirect (lubrifiant) dans les établissements de transformation des aliments sans possibilité de contact alimentaire direct avec les aliments, et par conséquent on ne s’attend pas à ce qu’il y ait une exposition par les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence).
Cette substance est présente dans plus de 100 cosmétiques au Canada, notamment des adhésifs, des nettoyants, des exfoliants, des produits de maquillage, des démaquillants, des produits de massage et des vernis à ongles. Les concentrations vont de moins de 0,1 % à 30 % (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’utilisation de ces produits pourrait entraîner une exposition par voie cutanée ou par inhalation pour la population générale du Canada.
La triacétine est utilisée comme ingrédient non médicinal dans plus de 400 produits de santé naturels au Canada. La plupart des produits sont administrés par voie orale, et une faible quantité l’est par application topique, dentaire et sublinguale (communication personnelle, courriel de la DPSNSO, SC, au BERSE, SC, 6 décembre 2016; sans référence). La triacétine est également utilisée comme ingrédient non médicinal dans plus de 25 médicaments sur ordonnance ou en vente libre, y compris pour application topique, sous-cutanée, transdermique, orale, vaginale et intracervicale (communication personnelle, courriel de la DPT, SC, au BERSE, SC, 6 décembre 2016; sans référence), et donc la population générale du Canada qui utilise ces produits peut être exposée à la triacétine.
Évaluation des effets sur la santé et caractérisation des risques
L’OCDE (2002) a résumé les articles trouvés dans la littérature traitant des effets de la triacétine sur la santé. Cette évaluation a été utilisée pour éclairer la caractérisation des effets sur la santé dans la présente évaluation préalable.
Une recherche a été effectuée dans la littérature pour trouver les données publiées entre l’année précédant la publication du document SIAR de l’OCDE (janvier 2001) et décembre 2020. On n’a trouvé aucune étude sur les effets sur la santé qui aurait pu donner lieu à une caractérisation différente des effets sur la santé par rapport à ce qu’avait déterminé l’OCDE (2002).
L’OCDE a estimé que la triacétine présente un « faible potentiel de danger » d’après les données disponibles. Dans des études de toxicité par inhalation et par voie orale à doses répétées, on n’a observé aucun effet nocif lié au traitement chez des animaux de laboratoire, à aucune des doses (atteignant 10 000 mg/kg p.c./j) ou concentrations (2 220 mg/m³ à 73 700 mg/m³ [saturation]) par voie orale testées. Aucun effet indésirable n’a été observé dans une étude préliminaire comportant une étude à doses répétées combinée à une étude de toxicité pour le développement et la reproduction, dans laquelle les doses ont été testées jusqu’à la dose limite de 1 000 mg/kg p.c./j, inclusivement. De plus, en tenant compte de toutes les données, la triacétine a été considérée comme non génotoxique in vitro. On ne dispose d’aucune donnée sur la cancérogénicité de cette substance.
Comme l’a mentionné l’OCDE (2002), le JECFA considère qu’il n’est pas nécessaire d’attribuer une dose journalière admissible (DJA) pour la triacétine, car cette substance est métabolisée comme les autres triglycérides dans les aliments. Sur la base des données disponibles et de la dose journalière prévue, le JECFA a conclu que la triacétine ne représentait pas un danger pour la santé (OCDE 2002). Plus récemment, le Comité scientifique de l’alimentation humaine de l’UE a approuvé cette position dans son évaluation de la triacétine (OCDE 2002).
L’OCDE n’a pas relevé d’effets préoccupants pour la santé humaine et a attribué à la triacétine une faible priorité pour ce qui est de futurs travaux. Par conséquent, on considère que la triacétine présente un faible potentiel de danger et donc que la caractérisation de son potentiel d’exposition (c.‑à‑d. le calcul de l’estimation de l’exposition) n’est pas jugée utile. On estime que le risque pour la santé humaine est faible.
7.2.2 Monoglycérides en C14‑22
Évaluation de l’exposition
Étant donné que l’on considère que les monoglycérides en C14‑22 présentent un faible potentiel de danger (voir la section Évaluation des effets sur la santé ci‑dessous), on n’a pas calculé d’estimation quantitative de l’exposition de la population générale. La présente section fournit des renseignements généraux sur l’exposition aux monoglycérides en C14‑22.
L’exposition de la population générale du Canada aux monoglycérides C14‑C22 devrait se faire principalement par voie orale, c’est‑à‑dire par l’absorption d’aliments en raison de leur utilisation comme additifs alimentaires autorisés au Canada.
Les monoglycérides en C14‑22 figurent sur les listes pour deux additifs alimentaires approuvés au Canada, à savoir les monoglycérides et les mono- et diglycérides, figurant sur la Liste des additifs alimentaires autorisés, et constitueraient donc un additif alimentaire acceptable pour ces utilisations approuvées au Canada. Les mono- et diglycérides ont été reconnus par la FDA américaine comme substances généralement reconnues comme sûres (GRAS) en tant qu’ingrédients alimentaires humains directs (US eCFR 2017).
Les monoglycérides en C14‑22 peuvent être utilisés comme composants dans la fabrication de matériaux d’emballage alimentaire qui sont en contact direct avec les aliments. Cependant, on s’attend à ce que l’exposition par les aliments soit minime par rapport à l’exposition due à leur utilisation comme additifs alimentaires autorisés. Ils peuvent également être utilisés comme composants dans des additifs indirects (p. ex., les lubrifiants et les agents de démoulage) dans les établissements de transformation des aliments. L’exposition par les aliments, le cas échéant, est jugée négligeable (communication personnelle, courriel de la DA, SC, au BERSE, SC, 23 novembre 2015; sans référence).
Évaluation des effets sur la santé et caractérisation des risques
On n’a trouvé aucune étude sur les effets des monoglycérides en C14‑22 sur la santé.
Dans l’organisme, les monoglycérides sont métabolisés comme les autres triglycérides présents dans les graisses alimentaires. Les monoglycérides sont métabolisés en acides gras libres et en glycérol, tous deux étant ensuite disponibles pour la resynthèse des triglycérides dans la muqueuse intestinale. Rien n’indique que la présence des monoglycérides ou des diglycérides dans les graisses alimentaires ait un quelconque effet nocif sur les cellules ou les tissus. Chez les humains, les mono- et diglycérides sont consommés chaque jour dans tout régime mixte normal et se forment également lors de la digestion et de l’absorption d’aliments contenant des graisses. Aucun effet nocif n’a été expressément associé aux mono- et diglycérides (OMS 1974). Par conséquent, le JECFA a assigné une dose journalière admissible (DJA) sans indication explicite d’une limite supérieure pour l’absorption (« sans limite ») de mono- et diglycérides (OMS 1974).
On estime que les monoglycérides en C14‑22 présentent un faible potentiel de danger et la caractérisation de l’exposition potentielle (c.‑à‑d. le calcul de l’estimation de l’exposition) n’a pas été jugée utile. On estime que le risque pour la santé humaine est faible.
7.3 Sous‑groupe C : Esters de 1-isopropyl-2,2-diméthyltriméthylène avec acide isobutyrique
7.3.1 Diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène
Évaluation de l’exposition
Milieux naturels
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est un liquide dont la pression de vapeur est modérée. Won et Lusztyk (2011) ont présenté des données agrégées sur le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène mesuré dans l’air intérieur de maisons de la ville de Québec en utilisant un échantillonnage passif entre novembre 2008 et mars 2010. Les concentrations dans l’air intérieur allaient de 0,5 à 200,5 µg/m³, avec une concentration moyenne géométrique de 6,55 µg/m³ (et écart‑type géométrique de 2,47). Won et Lusztyk (2011) ont observé que les émissions de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène provenaient de peintures à base d’eau, de cire acrylique pour les sols, de dalles de plafond acoustiques et de sous-tapis en mousse de polyuréthane. Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a également été mesuré dans les produits de dégazage de matériaux de construction solides (revêtements de sol en vinyle, tapis, sous-tapis, adhésifs composites pour revêtement de sol et mousse de polyuréthane) jusqu’à 10 000 µg/m2/h, ainsi que par des matériaux de construction liquides (peintures, apprêts, teintures, vernis, agents de calfeutrage) jusqu’à 77 µg/m2/h (Won et Yang 2012). Ces derniers auteurs ont également noté que des émissions provenaient de produits disponibles aux consommateurs, comme des peintures à l’huile pour artistes et des bougies, jusqu’à des taux de 0,24 µg/m2/h.
Ailleurs dans le monde, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a également été mesuré dans l’air intérieur dans plusieurs études menées aux États‑Unis, en Allemagne, en Islande, en Estonie et en Suède, dans des sites comprenant des maisons typiques, des maisons nouvellement fabriquées et construites, des unités de logement temporaire, des salles de stockage et des salles de classe (Sahlberg et al. 2013; Kim et al. 2007; Wieslander et al. 1997; Hodgson et al. 2000; Maddalena 2009; Markowicz et Larsson 2015; Choi et al. 2010). D’après ces études, les concentrations moyennes dans l’air variaient de 1,5 µg/m³ à 73 µg/m³.
En Suède, deux études ont porté sur l’échantillonnage de l’air individuel chez des peintres pendant une journée de travail de 8 heures (Norbäck et al. 1995; Wieslander et Norbäck 2010), et ont rapporté des concentrations moyennes géométriques allant de 6 µg/m³ à 10 µg/m³, avec des valeurs maximales de 14 µg/m³ et 40 µg/m³, respectivement.
Pour estimer l’exposition de la population générale au Canada, on a utilisé la concentration maximale canadienne dans l’air intérieur pour le diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène, d’après l’étude de l’air intérieur dans des maisons de la ville de Québec (200,5 µg/m³).
Les concentrations dans l’air ambiant des classes dans huit écoles en Suède ont été mesurées en même temps (Kim et al. 2007). Huit échantillons d’air ambiant sur 4 heures ont été prélevés avec des valeurs allant de 0,24 µg/m³ à 0,75 µg/m³, et une concentration moyenne de 0,41 µg/m³. Aucune mesure du diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène dans l’air ambiant au Canada n’a été trouvée. Selon une approche prudente, la concentration maximale dans l’air intérieur au Canada (200,5 µg/m³) a été appliquée à l’air ambiant pour estimer l’exposition quotidienne au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène de la population générale canadienne par des sources environnementales.
On estime que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a une solubilité modérée dans l’eau. D’après une valeur estimée de la constante de la loi d’Henry de 1,1 × 10-5 atm-m³/mol, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène devrait se volatiliser depuis les surfaces d’eau (HSDB 1983- ). On n’a trouvé aucune donnée sur la mesure du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans l’eau au Canada.
Cinquante échantillons de poussière ont été prélevés dans des résidences de la ville de Québec (Won et Lusztyk 2011). Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a été détecté dans 62 % des échantillons, avec une plage de concentrations déclarées de 1,0 µg/g à 715 µg/g et une valeur moyenne géométrique de 21,2 µg/g. La concentration maximale dans la poussière, selon cette étude canadienne (715 µg/g), a été utilisée comme donnée d’entrée pour estimer l’absorption quotidienne de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par la population générale par des sources environnementales.
L’exposition de la population générale au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par l’air ambiant, l’air intérieur et la poussière variait de 41 à 148 µg/kg p.c./j (voir le tableau B-3, annexe B). Le groupe d’âge le plus exposé était celui des nourrissons de 1 an, et l’air intérieur a été considéré comme la source d’exposition environnementale la plus importante au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène.
Aliments
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments et on ne s’attend donc pas à une exposition par les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
Surveillance biologique
On a analysé deux métabolites du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène (plus précisément le 2,2,4-triméthyl-1,3-pentanediol [TMPD] et l'acide 2,2,4-triméthyl-3-hydroxyvalérique [HTMV]) trouvés dans l’urine de participants âgés de 3 à 79 ans au cycle 5 (2016–2017) de l’Enquête canadienne sur les mesures de santé (ECMS). La toxicocinétique du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène chez les humains n’est pas bien étudiée. Les études sur les animaux indiquent que les métabolites sont principalement éliminés dans l’urine dans les 72 heures. Une plus petite fraction est éliminée dans les matières fécales sur une période d’environ 1 semaine (CIR 2017, cité dans Santé Canada 2019). Les études sur les animaux indiquent que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est principalement éliminé sous forme de l’O-glucuronide du TMPD dans l’urine, et dans une moindre mesure sous forme de HTMV et de ses glucuronides, en l’occurrence l’acide 2‑méthylmalonique et le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène inchangé (CIR 2017, cité dans Santé Canada 2019). Les données du cycle 5 de l’ECMS indiquent une fréquence de détection supérieure à 95 % dans tous les groupes de population. La concentration moyenne géométrique dans l’urine du TMPD (métabolite primaire) pour les personnes de 3 à 79 ans est de 17 µg/L et le 90e centile est de 69 µg/L. Les concentrations maximales de TMPD ont été observées chez les enfants de 3 à 5 ans (moyenne géométrique de 25 µg/L; 95e centile de 140 µg/L), et ensuite chez les enfants de 6 à 11 ans (moyenne géométrique de 23 µg/L; 90e centile de 74 µg/L).
Produits disponibles aux consommateurs
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est présent dans les adhésifs (le maquillage pour les yeux, les hydratants pour les ongles, les vernis à ongles et les dissolvants de vernis à ongles au Canada (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence).
L’exposition par voie cutanée et par inhalation a été estimée pour ces produits aux concentrations déclarées maximales. Comme on a constaté que l’exposition par inhalation pour les cosmétiques représentait moins de 1 % de l’exposition globale, seules les estimations de l’exposition cutanée sont présentées.
Le tableau 7-7 résume les estimations de l’exposition cutanée par les cosmétiques contenant du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène d’après les scénarios sentinelles (c.‑à‑d. les combinaisons de produits, concentrations et groupes d’âge présentant les valeurs d’exposition maximale). On trouvera à l’annexe C-3 de plus amples détails sur la méthode et les paramètres utilisés pour estimer l’exposition cutanée au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par les cosmétiques.
| Scénario d’utilisation du produit | Concentration de la substance a | Exposition cutanée externe b (mg/kg p.c./j) |
|---|---|---|
| Adhésif (maquillage pour les yeux) (basé sur un scénario d’utilisation de mascara; 4-8 ans) | 30 % | 0,23 |
| Vernis à ongles (2-3 ans) | 30 % | 1,2 |
| Dissolvant de vernis à ongles (9‑13 ans) | 1 % | 0,54 |
a Communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence.
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est également présent en tant qu’ingrédient non médicinal comme plastifiant dans un produit de santé naturel, un dissolvant de verrues à application topique. On a estimé l’exposition à ce produit en supposant une application d’environ 0,1 mL (équivalant à 2 gouttes/jour) et une concentration de 20 % de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène (selon la concentration de l’ingrédient médicinal [27 %] et en tenant compte des autres ingrédients non médicinaux présents dans le produit), ce qui donne 0,86 mg/kg p.c./j et 0,48 mg/kg p.c./j pour les enfants de 4 à 8 ans et de 9 à 13 ans, respectivement.
La population générale du Canada pourrait également être exposée au diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène lors de l’utilisation de divers produits contenant cette substance, y compris les apprêts en aérosols, les peintures pour piscine, les durcisseurs liquides et trousses de réparation de la résine de fibre de verre, les trousses de réparation de fissures dans le béton, les encaustiques pour plancher et les peintures pour bricolage (SDS 2012, 2013, 2016b, 2017d; FDS 2015f, 2015g, 2017e). Le tableau 7-8 résume les estimations de l’exposition par inhalation et par voie cutanée pour les produits disponibles aux consommateurs contenant du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène. On trouvera de plus amples détails à l’annexe C-3 sur la méthode et les paramètres utilisés pour estimer l’exposition au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par les cosmétiques.
| Scénario d’utilisation du produit | Concentration de la substance | Exposition par inhalation (mg/kg p.c./j) | Exposition cutanée externe (mg/kg p.c./j) | Exposition totale a (mg/kg p.c./j) |
|---|---|---|---|---|
| Apprêts en aérosol b (19 ans et +) | 5 % | 0,24 | 1,01 | 1,24 |
| Peinture pour piscine et usage marin (19 ans et +) | 5 % | S.O. | 3,6 | 3,6 |
| Durcisseur liquide; trousse de réparation de fibre de verre (M/C et application) (19 ans et +) | 30 % (0,5 % pendant l’application) | 0,014 | 0,21 | 0,22 |
| Produit de réparation de fissures dans le béton (19 ans et +) | 40 % | 0,025 | 0,27 | 0,30 |
| Peinture pour bricolage (2-3 ans) | 3 % | S.O. | 0,1 | 0,1 |
Abréviations : M/C = mélange et chargement; S.O. = sans objet.
a L’estimation de l’exposition totale est la combinaison de l’exposition par inhalation et par voie cutanée, et on suppose que l’absorption par ces deux voies est équivalente à l’absorption après absorption par voie orale.
b D’après les valeurs d’entrée des modèles, car le modèle d’évaporation donnait de plus faibles estimations des concentrations dans l’air. L’exposition totale comprend également les particules ingérées par voie orale (non inhalées).
Les estimations de l’exposition présentées dans le tableau 7-8 ont été prises en compte pour d’autres scénarios qui devraient entraîner un potentiel d’exposition plus faible, notamment l’utilisation d’un durcisseur pour usage marin (la concentration de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans le produit pouvant atteindre 60 %, mais le volume d’utilisation est faible [moins de 1 mL]) et d’une encaustique à plancher (concentration de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène pouvant atteindre 0,5 %, mais le produit est utilisé avec un applicateur mécanique).
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est utilisé comme plastifiant et on l’a trouvé dans une gamme d’articles, y compris des produits destinés aux enfants.
On a également démontré que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène migre à partir de biberons fabriqués avec des matériaux utilisés comme substituts du polycarbonate, d’après une étude de biberons achetés en Belgique (Onghena et al. 2016), ainsi qu’à partir de biberons disponibles sur le marché européen provenant de plusieurs pays, dont le Canada (bien qu’on n’ait pas fourni de détails précis sur les échantillons canadiens) (Simoneau et al. 2012).
Simoneau et al. (2012) ont examiné 277 biberons faits de divers matériaux, dont le polypropylène, le polyamide, le polycarbonate, le polyéthersulfone, un nouveau copolyester (TritonTM) et le silicone, achetés dans 26 pays de l’UE, au Canada, en Suisse et aux États‑Unis. Dans cette étude, présentée comme évaluation préliminaire du rejet potentiel de substances par différents types de biberons, les biberons ont été stérilisés avant le test de migration, et les tests ont été effectués selon les protocoles prescrits dans le Règlement 10/2011 de l’UE (conditions de remplissage à chaud, 2 heures à 70 °C) et de l’éthanol à 50 % comme produit simulant le lait. Les tests de migration ont été répétés deux fois. La migration du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a été associée à des bouteilles en polypropylène, en silicone et en polyamide. Les concentrations de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène étaient comprises entre 1 µg/kg et 62 µg/kg, avec une moyenne de 5 µg/kg pour le polypropylène (72 détections sur 149), entre 14 µg/kg et 574 µg/kg avec une moyenne de 159 µg/kg pour les bouteilles en silicone (5 détections sur 5) et 2 µg/kg dans 3 des 28 bouteilles en polyamide.
Dans une étude, Onghena et al. (2016) ont analysé 6 biberons dans une série de tests (p. ex., tests de stérilisation au micro‑ondes, à la vapeur et à l’eau de vaisselle). Une concentration de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a été mesurée à 348 µg/kg dans une bouteille en silicone en utilisant les conditions standards de l’UE pour les tests de migration avec usage répétitif. Les concentrations variaient de < LQ (6,4 µg/kg) à 13 µg/kg (pour une bouteille en silicone) dans les tests de chauffage par micro‑ondes et de < LQ (6,4 µg/kg) à 247 µg/kg (première étape de migration) dans le test de stérilisation en autoclave. La concentration maximale de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène pour la 10e répétition du traitement était de 128 µg/kg pour le cycle de stérilisation en autoclave.
L’exposition par voie orale des nourrissons de 0 à 1 mois associée à la migration du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène depuis les biberons a été estimée entre 57,5 µg/kg p.c./j et 96,4 µg/kg p.c./j (détails présentés à l’annexe C-1).
On a trouvé (mais non quantifié) du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans 15 des 47 jouets en polychlorure de vinyle (PVC) (Bouma et Schakel 2002). La concentration mesurée de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène était de 21 µg/g dans le matériau extérieur de la paume d’une mitaine pour enfants de 2 ans, dans une enquête danoise qui a examiné les produits chimiques dans des produits disponibles aux consommateurs (Tonning et al. 2009). Les résultats agrégés des mesures de migration de trois plastifiants non-phtalates, dont le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, à partir de 12 types différents de jouets pour enfants ont également été rapportés par Janssen et Bremmer (2009). Dans ce rapport, on a déterminé les valeurs de migration en immergeant des échantillons circulaires des jouets dans un simulant de salive mis en rotation à 60 tours/minute pendant 60 minutes à 20 °C. La migration moyenne et maximale pour le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène était de 0,87 µg/min × 10 cm2 et 2,25 µg/min × 10 cm2, respectivement. La US Consumer Product Safety Commission (CPSC) a également mesuré la migration du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène à partir d’articles pour enfants en plastique. La migration moyenne maximale était de 11,3 µg/min × 10 cm2 (US CPSC 2010).
L’exposition orale des jeunes enfants (6 mois à 1 an) due au mâchonnement de jouets en plastique contenant du PVC a été estimée à 149 µg/kg p.c./j (détails présentés à l’annexe C-2). L’exposition par voie cutanée et par le transfert main-bouche des enfants (1 an) manipulant des jouets a également été estimée sur la base des mêmes données sur la migration. L’exposition totale au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène chez les enfants de 1 an était estimée à 1 849 µg/kg p.c./j (détails présentés à l’annexe C-2).
Au Canada, on a mesuré les rejets de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par divers matériaux, dont les tuiles acoustiques, la peinture à base d’eau, les encaustiques de plancher acryliques, les thibaudes en mousse de polyuréthane et les feuilles de vinyle (Won et Lusztyk 2011). La concentration dans l’air des pièces variait de 11,7 µg/m³ à 418,7 µg/m³ sur 24 heures (Won et Lusztyk 2011). On estime que ces expositions sont prises en compte par les autres scénarios du tableau 7-8, p. ex., les apprêts en aérosol, qui donnent lieu à une exposition probablement plus élevée que celles dues aux matériaux de construction.
Évaluation des effets sur la santé
L’OCDE (1995) a examiné le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, et cet examen a été utilisé pour éclairer la caractérisation des effets sur la santé pour cette substance. L’OCDE a considéré que le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène présentait un faible risque et donc une faible priorité pour de futurs travaux.
Une recherche a été effectuée dans la littérature pour trouver des articles sur le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène publiés entre l’année précédant la publication de l’examen de l’OCDE (c.‑à‑d. janvier 1994) et décembre 2020. De nouvelles études traitant des effets sur la santé ont été trouvées, et sont prises en compte dans la présente évaluation.
Toxicité à doses répétées
Il n’y a pas d’étude à doses répétées pour le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène après une exposition par inhalation ou par voie cutanée. Les effets du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène sur la santé à la suite d’une exposition par voie orale ont été étudiés chez le rat (n = 12 animaux/groupe) dans le cadre d’une évaluation préliminaire combinée de la toxicité à doses répétées et de la toxicité pour la reproduction et le développement menée conformément aux lignes directrices de l’OCDE. Dans cette étude, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène a été administré par gavage à des doses de 0, 30, 150 et 750 mg/kg p.c./j, 7 jours/semaine. Chez les rats mâles, la période d’exposition était de 44 jours, dont 12 jours avant l’accouplement (2 semaines avant l’accouplement, 2 semaines pendant la phase d’accouplement et 2 semaines après la fin de la période d’accouplement). Chez les femelles, la période d’exposition était comprise entre 14 jours avant l’accouplement et le jour 3 de la lactation. On a observé une augmentation de la créatinine et de la bilirubine totale chez les rats ayant reçu 150 mg/kg p.c./j et 750 mg/kg p.c./j, et on a observé une augmentation des protéines totales chez les rats mâles ayant reçu 750 mg/kg p.c./j. Une augmentation du poids du foie a été observée chez les rats mâles à 150 mg/kg p.c./j et 750 mg/kg p.c./j, et une fréquence accrue de foie présentant une couleur brunâtre a été observée chez les rats mâles exposés à la dose maximale. Cependant, on n’a rapporté aucune modification histopathologique dans le foie. On a observé une augmentation du poids des reins chez les rats mâles exposés à la dose maximale. Les anomalies histopathologiques observées dans les reins comprenaient des changements accrus dans le ratio des basophiles de l’épithélium tubulaire rénal et une dégénérescence des gouttelettes hyalines chez les rats mâles exposés aux deux doses maximales. Chez les mâles exposés à la dose maximale, on a également observé une nécrose et une fibrose du tubule proximal, la dilatation du tube distal et une diminution des changements graisseux. Ces effets sont considérés comme propres aux rats mâles et ne sont pas jugés nuisibles. On a également observé un léger gonflement des cellules du foie à cette dose (OCDE 1995). Une dose sans effet observé (DSEO) de 30 mg/kg p.c./j et une dose minimale avec effet observé (DMEO) de 150 mg/kg p.c./j ont été établies par l’OCDE, d’après les effets sur le foie et les reins des parents.
Depuis la publication de l’examen de l’OCDE en 1995, une étude de toxicité subchronique par voie orale a été menée sur un plus grand échantillon de rats avec le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène. Les animaux d’essai (20/sexe/dose) ont reçu dans leur régime alimentaire des doses de 0, 30, 150 et 750 mg/kg p.c./j de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène pendant 90 jours. Chez les mâles, les taux de cholestérol, de bilirubine et de créatinine ont présenté une augmentation statistiquement significative à la dose maximale. On a également observé une augmentation significative du poids relatif des reins et une fréquence significativement accrue des gouttelettes hyalines et de la fréquence (mais non de la gravité) de la néphropathie chronique progressive chez les mâles à 750 mg/kg p.c./j. Des gouttelettes hyalines dans les reins ont également été observées à des doses plus faibles. Les auteurs de l’étude n’ont pas considéré que cette observation était négative, car les rats mâles sont prédisposés à cette affection. Aucun effet sur les reins n’a été constaté chez les femelles, dans aucun groupe. À 750 mg/kg p.c./j chez les femelles, les effets étaient limités à une augmentation statistiquement significative du taux de cholestérol. Les auteurs ont établi une DMEO de 750 mg/kg p.c./j pour les mâles et une DSENO de 750 mg/kg p.c./j pour les femelles (Anonymous 1981, cité dans ECHA c2007-2017z). Cependant, comme les effets chez les mâles n’ont pas été jugés indésirables, une DSENO de 750 mg/kg p.c./j a été établie pour les rats mâles et femelles d’après cette étude.
Toxicité pour la reproduction et le développement
Dans l’étude à doses répétées combinée à une étude de toxicité pour la reproduction et le développement, décrite précédemment, les auteurs de l’étude n’ont observé aucun effet lié à l’accouplement, à la fertilité et au cycle œstral à quelque dose que ce soit. Aucun autre effet lié au traitement n’a été observé chez les mères pendant la période de gestation et de lactation, ni chez les petits après leur naissance (OCDE 1995).
Depuis l’examen de l’OCDE (1995), une évaluation préliminaire de la toxicité pour la reproduction et le développement et une étude de toxicité pour le développement (toutes deux réalisées conformément aux lignes directrices de l’OCDE) ont été menées chez le rat avec le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène. Dans la première étude, les animaux testés (12/sexe/dose) ont été nourris avec des aliments contenant 0, 1,5, 4,5 et 15 mg de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par gramme d’aliment (les doses chez les mâles et les femelles calculées d’après les concentrations alimentaires étaient respectivement de 0, 91/120, 276/359 et 905/1 135 mg/kg p.c./j) (Study Submission 2001; Anonymous 2001, cité dans ECHA c2007-2017za). Tous les rats mâles ont été traités entre le début de la période de pré‑accouplement jusqu’au traitement final des rates, soit un total de 51 jours. Les femelles ont été traitées entre le début de la période de pré‑accouplement jusqu’au 4e jour de lactation, pour un total de 40 à 51 traitements.
Des effets sur la reproduction, notamment une réduction statistiquement significative du nombre moyen de sites d’implantation et une diminution non statistiquement significative du nombre de corps jaunes, ont été observés chez les animaux traités à raison de 905/1 135 mg/kg p.c./j, soit la dose maximale d’essai. À cette dose, le poids moyen des portées a également diminué de 19 % à 20 % entre les jours post-natal (JPN) 0 et 4 et le nombre de petits vivants par portée était inférieur de 17 % au JPN 4 (12,0 dans le groupe ayant reçu une dose élevée contre 14,5 dans le groupe témoin; p ≤ 0,05). Le nombre moyen de petits morts entre les JPN 0 et 4 était plus élevé pour les portées des groupes ayant reçu la dose moyenne et la dose élevée, mais l’augmentation n’était pas liée à la dose et n’était statistiquement significative qu’à la dose moyenne (0,5 ± 0,7 à la dose moyenne contre 0,0 ± 0,0 pour les animaux témoins et 0,2 ± 0,4 pour la dose la plus élevée). Ces résultats sont d’une pertinence incertaine, car aucune tendance claire n’en ressort. Aucun changement n’a été signalé pour les autres paramètres examinés.
Ces effets sur la reproduction ont été observés en présence de toxicité générale chez les parents. On a observé une diminution transitoire de la prise de poids corporel et de la consommation alimentaire chez les adultes exposés à la dose maximale au jour 7 de la phase pré‑accouplement. La prise moyenne de poids corporel a été significativement réduite de 27 % et 48 %, et la consommation alimentaire de 15 % et 21 % chez les rats mâles et femelles, respectivement. On a constaté une réduction minime du nombre de spermatozoïdes dans les testicules et/ou les épididymes des rats mâles traités, mais cette réduction n’a pas été jugée significative sur le plan toxicologique par les auteurs (Anonymous 2001, cité dans ECHA c2007-2017za). Un examen de l’étude par des experts a également confirmé la non‑pertinence de ces résultats (Eastman 2007).
Dans l’ensemble, la dose critique trouvée par les auteurs de cette étude de toxicité pour la reproduction était une DSENO de 276 mg/kg p.c./j chez les mâles et de 359 mg/kg p.c./j chez les femelles. Ces valeurs étaient basées sur une réduction statistiquement significative du nombre moyen de sites d’implantation et une diminution non significative du nombre de corps jaunes à la dose maximale d’essai (équivalente à 1 135 mg/kg p.c./j pour les femelles) (Anonymous 2001, cité dans ECHA c2007-2017za).
Dans une étude de toxicité pour le développement prénatal menée conformément à la Ligne directrice 414 de l’OCDE, des rates ont été exposées par voie alimentaire à 0, 0,15, 0,45 ou 1,50 % de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène (0, 118, 343 ou 1 077 mg/kg p.c./j, respectivement) entre les JG 0 et 20. La DSENO pour la toxicité maternelle, la croissance fœtale et la toxicité pour le développement a été établie par les auteurs à 343 mg/kg p.c./j. À la dose maximale d’essai (1 077 mg/kg p.c./j), on a observé une réduction significative du poids corporel moyen et de la consommation alimentaire chez les mères pendant toute la période d’exposition. On a également observé une réduction importante et dépendante de la dose du poids corporel moyen des mâles et des femelles et des fœtus combinés chez les descendants du groupe ayant reçu la dose élevée, par rapport au groupe témoin. Des effets sur le poids corporel des fœtus à la dose de 1 077 mg/kg p.c./j ont été observés en présence d’une toxicité maternelle. Aucune malformation externe et viscérale liée à la substance d’essai ni aucune variation du développement n’ont été notées (Anonymous 2015, cité dans ECHA c2007-2017zb).
Dans le rapport produit par une autre étude de toxicité pour le développement en phase prénatale, des lapins néo-zélandais blancs (n = 22/groupe) ont reçu par gavage 0, 100, 300 ou 1 000 mg/kg p.c./j de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène entre les JG 1 et 28 (Anonymous 2018, cité dans ECHA c2007-2020b). Le nombre moyen de résorptions précoces et donc de pertes post-implantatoires était en dehors des fourchettes historiques à 1 000 mg/kg p.c./j. Cependant, aucun détail sur la signification statistique n’a été fourni et les auteurs ont décrit l’effet comme étant une réduction « légère » de la taille moyenne des portées vivantes. Chez les fœtus survivants, aucun effet sur la croissance ou le développement n’a été observé. Les auteurs du rapport ont établi une DSENO de 300 mg/kg p.c./j d’après la réduction de la survie des embryons et des fœtus à la dose suivante de 1 000 mg/kg p.c./j.
Génotoxicité
Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène n’a pas induit de mutagénicité dans les bactéries et n’a pas induit d’aberration chromosomique dans les cellules des mammifères (OCDE 1995). Le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène est considéré comme non génotoxique (EFSA 2006).
Cancérogénicité
On n’a trouvé dans la littérature aucune étude sur la cancérogénicité ou la toxicité chronique du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène.
Caractérisation du risque
On n’a trouvé dans la littérature aucune étude sur la cancérogénicité du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène. Les données empiriques disponibles pour cette substance n’indiquaient aucune génotoxicité. Sur la base des renseignements disponibles, les effets critiques associés au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène sont considérés comme étant des effets sur la reproduction.
Dans une évaluation préliminaire de la toxicité pour la reproduction et le développement, on a établi une DSENO de 276 mg/kg p.c./j chez les mâles et de 359 mg/kg p.c./j chez les femelles, d’après une réduction statistiquement significative du nombre moyen de sites d’implantation et une diminution non significative du nombre de corps jaunes à la dose suivante (1 135 mg/kg p.c./j pour les femelles) (Study Submission 2001; Anonymous 2001, cité dans ECHA c2007-2017za). Cependant, dans une étude à doses répétées combinée à une étude de toxicité pour la reproduction et le développement, aucun effet nocif n’a été observé chez les animaux de laboratoire ayant reçu des doses atteignant 750 mg/kg p.c./j (c.‑à‑d. une DSENO de 750 mg/kg p.c./j) (OCDE 1995). L’étude précédente (c.‑à‑d. l’évaluation préliminaire de la toxicité pour la reproduction et le développement) ne comportait pas de dose d’essai de 750 mg/kg p.c./j; on avait seulement examiné les effets à 276/359 mg/kg p.c./j, puis à 905/1 135 mg/kg p.c./j. Comme les paramètres examinés et la durée d’exposition entre ces deux études étaient similaires (environ 6 à 8 semaines), la DSENO plus élevée de 750 mg/kg p.c./j a été choisie pour la toxicité du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène pour la reproduction, d’après les effets sur la reproduction se manifestant à une dose orale chez les mères de 1 135 mg/kg p.c./j (Anonymous 2001, cité dans ECHA c2007-2017za).
La principale voie d’exposition au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par les milieux naturels pour la population générale est par l’air intérieur. La population générale du Canada peut également être exposée au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène lorsque les personnes utilisent divers produits contenant la substance, notamment les produits pour les ongles, les adhésifs cosmétiques, les apprêts en aérosol, la peinture pour piscine, les durcisseurs liquides/trousses de réparation de résine de fibre de verre, les trousses de réparation du béton et la peinture pour bricolage. Les enfants peuvent également être exposés par voie orale au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène présent dans les jouets et biberons en plastique.
Les données de surveillance biologique du cycle 5 de l’ECMS indiquent que les métabolites du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène sont courants dans l’urine des personnes de 3 à 79 ans au Canada. Les données pharmacocinétiques sont limitées et empêchent l’utilisation fiable des données de surveillance biologique afin de caractériser quantitativement le risque. Nous utiliserons donc une estimation de l’exposition par modélisation pour caractériser le risque lié au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène.
Les estimations d’exposition pertinentes, les doses avec effets critiques sur la santé et les ME résultantes pour le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène sont présentés pour les adultes/adolescents et les enfants dans les tableaux 7-9 et 7-10, respectivement.
| Scénario d’exposition | Exposition b (mg/kg p.c./j) | Marge d’exposition (ME) |
|---|---|---|
| Exposition totale par les milieux naturels (1 an) (chronique) | 0,148 | 5067 |
| Adhésif pour maquillage des yeux (14–18 ans) (voie cutanée, chronique) | 0,09 | 8333 |
| Vernis à ongles (9–13 ans) (voie cutanée, intermittente) | 0,77 | 974 |
| Dissolvant de vernis à ongles (14–18 ans) (intermittente) | 0,36 | 2083 |
| Apprêts en aérosol (19 ans et +) (intermittente) | 1,24 | 604 |
| Peinture pour piscine et usage marin (19 ans et +) (voie cutanée, intermittente) | 3,6 | 208 |
| Durcisseur liquide/ trousse de réparation de fibre de verre (19 ans et +) (intermittente) | 0,22 | 3409 |
| Trousse de réparation de fissures dans le béton (19 ans et +) (intermittente) | 0,30 | 2500 |
| Peinture pour bricolage (19 ans et +) (voie cutanée, intermittente) | 0,05 | 15000 |
|
Ingrédient non médicinal comme plastifiant dans un dissolvant de verrues (9–13 ans) (voie cutanée, court terme) |
0,48 | 1562 |
Abréviation : ME = marge d’exposition.
a La dose critique (750 mg/kg p.c./j) est déterminée d’après une réduction statistiquement significative du nombre moyen de sites d’implantation et de la diminution du nombre de corps jaunes à la dose suivante de 1 135 mg/kg p.c./j dans une étude de toxicité pour la reproduction par voie orale.
b On présume que l’absorption cutanée est équivalente à l’absorption après l’absorption par voie orale.
| Scénario d’exposition | Exposition (mg/kg p.c./j) | Marge d’exposition (ME) |
|---|---|---|
| Biberons (0 à 1 mois) (exposition chronique par voie orale) | 0,058 – 0,096 | 12931 – 7 812 |
| Enfants portant à la bouche des jouets en plastique (nourrissons de 1 an) (exposition chronique par voie orale) | 0,15 | 5000 |
| Enfants en contact cutané et par transfert main-bouche avec des jouets en plastique (nourrissons de 1 an) (exposition chronique par voie orale) | 1,85 | 405 |
| Adhésif pour maquillage des yeux (4–8 ans) (voie cutanée, chronique) | 0,23 | 3261 |
| Vernis à ongles (2–3 ans) (voie cutanée, intermittente) | 1,2 | 625 |
|
Dissolvant de vernis à ongles (9–13 ans) (voie cutanée, intermittente) |
0,54 | 1388 |
| Ingrédient non médicinal comme plastifiant dans un dissolvant de verrues (4–8 ans) (voie cutanée, court terme) | 0,86 | 872 |
Abréviation : ME = marge d’exposition.
a La dose critique (750 mg/kg p.c./j) est déterminée en fonction de l’absence d’effets nocifs dans des études à doses répétées par voie orale dans lesquelles des animaux ont été exposés jusqu’à 750 mg/kg p.c./j, la dose maximale d’essai (OCDE 1995; Anonymous 2001, cité dans ECHA c2007-2017za).
Sur la base des approches prudentes utilisées pour estimer l’exposition, les marges entre les effets critiques et les estimations de l’exposition au diisobutyrate de 1‑isopropyl-2,2-diméthyltriméthylène sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
7.3.2 Texanol
Évaluation de l’exposition
Comme l’acide isobutyrique, monoester avec 2,2,4-triméthylpentane-1,3-diol, aussi appelé texanol, est considéré comme une substance présentant un faible potentiel de danger (voir la section Évaluation des effets sur la santé ci‑dessous), on n’a pas estimé quantitativement l’exposition de la population générale. La présente section fournit des renseignements généraux sur l’exposition au texanol.
Le texanol est un liquide dont la pression de vapeur est modérée. Des données agrégées sur le texanol mesuré dans l’air intérieur de maisons de la ville de Québec en utilisant un échantillonnage passif entre novembre 2008 et mars 2010 ont été présentées par Won et Lusztyk (2011). Les concentrations de texanol dans l’air intérieur variaient de 0,36 µg/m³ à 633,4 µg/m³, avec une concentration moyenne géométrique de 13,4 µg/m³. Le texanol a également été mesuré dans les émissions par des matériaux de construction solides (revêtements de sol en vinyle et mousses de polyuréthane) jusqu’à 132 µg/m2/h et des matériaux de construction liquides (peintures, apprêts, teintures, vernis, agents de calfeutrage et adhésifs) jusqu’à 127 µg/m2/h (Won et Yang 2012). Won et Yang (2012) ont également mesuré les émissions par des produits disponibles aux consommateurs, notamment les peintures à l’huile pour artistes et les assainisseurs d’air, à des doses d’émission atteignant 74 µg/m2/h. En procédant à un échantillonnage dans une microchambre, on a mesuré les taux d’émission d’une peinture d’intérieur au latex acrylique, qui atteignaient 88 837 µg/m2/h (Won et al. 2014).
On n’a trouvé aucune mesure du texanol dans l’air ambiant au Canada. Aucune donnée empirique n’a été trouvée pour le texanol dans l’eau, la poussière ou le sol au Canada.
Le texanol peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments. Par conséquent on ne s’attend pas à une exposition par les aliments (communication personnelle, courriel de la DA, SC, au BERSE, SC, 5 décembre 2016; sans référence).
Dans les cosmétiques, le texanol joue le rôle de plastifiant (Commission européenne 2008- ) et on le trouve dans les vernis à ongles et les produits de maquillage au Canada à des concentrations atteignant 10 % (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence). L’utilisation de ces produits pourrait entraîner une exposition par voie cutanée ou par inhalation pour la population générale du Canada.
Le texanol est utilisé dans un certain nombre de peintures (p. ex., teintures, agents d’étanchéité) et de produits adhésifs au Canada qui pourraient entraîner une exposition par voie cutanée ou par inhalation (SDS 2015h, 2017g; FDS 2017f).
Évaluation des effets sur la santé
Le texanol a été examiné par l’OCDE (1993) et cet examen a été utilisé pour éclairer la caractérisation des effets de cette substance sur la santé. L’OCDE (1993) a conclu que le texanol présente une toxicité relativement faible, et donc a une priorité faible également pour ce qui est de futurs travaux.
Une recherche a été effectuée dans la littérature pour trouver des articles sur le texanol publiés entre l’année précédant le rapport de l’OCDE (c.‑à‑d. janvier 1992) et décembre 2020. De nouvelles études traitant des effets sur la santé ont été trouvées, et sont prises en compte dans la présente évaluation.
Toxicité à doses répétées
On ne dispose d’aucune étude à doses répétées pour le texanol après une exposition par inhalation ou par voie cutanée. L’OCDE a trouvé deux études par voie orale, décrites ci‑dessous.
La toxicité orale du texanol chez les rats a été examinée dans une étude à doses répétées combinée à une étude de toxicité pour la reproduction et le développement (Ligne directrice 422 de l’OCDE). Des rats exposés par gavage à 0, 100, 300 et 1 000 mg/kg p.c./j pendant un maximum de 51 jours consécutifs ont permis d’établir une DSENO pour les deux sexes de 1 000 mg/kg p.c./j, en raison de l’absence d’effets significatifs liés au traitement sur la mortalité, les signes cliniques, le poids corporel et la prise de poids corporel, la consommation alimentaire ou des effets macroscopiques chez les rats mâles. Une hépatomégalie centrolobulaire a été observée dans le foie des rats aux deux doses maximales, mais cela a été considéré comme une réponse adaptative, car aucun changement dégénératif n’a été observé dans cet organe. Les lésions rénales chez les rats mâles étaient typiques d’une néphropathie à l’alpha 2-μ globuline et considérées comme des effets propres aux rats, peu susceptibles d’être pertinents pour les humains (OCDE 1993; Anonymous 1992, cité dans ECHA c2007-2017zc).
Lorsque des rats (5/sexe/dose) ont reçu le texanol, un ester d’alcool, par gavage à raison de 0, 100 et 1 000 mg/kg p.c./j, 5 jours/semaine, pendant 11 jours sur une période de 15 jours, aucun effet significatif lié au traitement n’a été observé chez les deux sexes. Une légère augmentation du poids du foie a été observée chez les deux sexes à 1 000 mg/kg p.c./j. Cependant, aucune lésion macroscopique ou modification de la chimie clinique liée au traitement n’a été observée chez les deux sexes et la dégénérescence mineure des gouttelettes hyalines observée est un effet propre au sexe et à l’espèce. Bien qu’une DSEO ait été établie à moins de 100 mg/kg p.c./j pour les rats mâles et à 100 mg/kg p.c./j pour les rates, les auteurs ont considéré que la DSENO était de 1 000 mg/kg p.c./j pour les deux sexes (OCDE 1993; Anonymous 1984, cité dans ECHA c2007-2017zd).
Depuis l’examen de l’OCDE (1993), une étude à court terme par voie orale a été menée sur des rats avec du texanol. Dans l’étude menée conformément à la Ligne directrice 407 de l’OCDE, les animaux testés (5/sexe/groupe) ont reçu chaque jour du texanol par gavage à raison de 0, 15, 150 et 1 000 mg/kg p.c./j pendant 28 jours. La DSENO pour les effets systémiques chez les mâles et les femelles a été établie à 1 000 mg/kg p.c./j par les auteurs. Aucune mortalité, aucun effet lié au traitement sur le poids corporel et la consommation alimentaire, ni aucun changement lié à la substance dans les résultats cliniques, la chimie clinique et l’hématologie n’ont été observés. Une augmentation statistiquement significative du poids du foie a été observée chez les rates exposées à 1 000 mg/kg p.c./j, la dose maximale d’essai. Cependant, seule une hypertrophie minime des hépatocytes centrolobulaires a été observée chez 2 des 5 rates exposées à cette dose, ce qui a été considéré comme un effet réactif et non défavorable. Une augmentation de la fréquence et du degré d’inclusions éosinophiles dans le tube cortical, liée à la dose, a été observée chez les rats mâles ayant reçu 150 mg/kg p.c./j (quantités à l’état de traces chez 3 animaux sur 5) et 1 000 mg/kg p.c./j (quantités minimes chez 2 des 5 animaux, et modérées chez 3 des 5 animaux) (Anonymous 1995, cité dans ECHA c2007-2017ze).
Toxicité pour la reproduction et le développement
Aucune étude de toxicité pour la reproduction ou le développement n’a été menée avec le texanol par inhalation ou par voie cutanée.
Dans l’étude de toxicité orale à doses répétées combinée à une étude de toxicité pour la reproduction et le développement, décrite précédemment pour le texanol, on n’a observé aucun effet sur le nombre moyen de petits vivants ou morts par portée, le nombre total d’implantations, les pertes prénatales, le pourcentage de survie, le poids total de la portée, le poids moyen des petits, la survie des petits, les défauts externes et la croissance postnatale. La DSENO pour la toxicité pour la reproduction et le développement était la dose maximale d’essai de 1 000 mg/kg p.c./j. Aucun effet nocif n’a été observé chez les parents. La DSENO pour les effets systémiques chez les parents dans cette étude était également de 1 000 mg/kg p.c./j (OCDE 1993; Anonymous 1992, cité dans ECHA c2007-2017zf).
Depuis la publication de l’examen de l’OCDE (1993), une étude de toxicité pour le développement a été réalisée chez le rat avec le texanol. Dans cette étude réalisée conformément à la Ligne directrice 414 de l’OCDE, des rates ont reçu 0, 100, 300 et 1 000 mg/kg p.c./j de texanol par gavage oral, entre les JG 1 et 19. Aucun effet sur la croissance intra‑utérine, la survie et la morphologie externe, viscérale et squelettique des fœtus n’a été observé. La DSENO pour la toxicité maternelle a été établie à 300 mg/kg p.c./j d’après une réduction statistiquement significative de la consommation alimentaire moyenne et de la prise de poids corporel moyenne chez les mères à 1 000 mg/kg p.c./j. On a observé une réduction de la consommation alimentaire aux JG 1-3 et 3-6, tandis qu’une réduction de la prise de poids corporel a été notée aux JG 1-3 et 3-6, ainsi que pendant toute la période d’administration de la dose (JG 1-19) (Anonymous 2015, cité dans ECHA c2007-2017zg).
Génotoxicité
Le texanol a donné des résultats négatifs sur les souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium et la souche WP2 uvrA/PKM101 d’Escherichia coli, avec et sans activation métabolique (Anonymous 1985, cité dans ECHA c2007-2017zh; Anonymous 1995, cité dans ECHA c2007-2017zi). Des résultats négatifs ont également été signalés in vivo dans un test du micronoyau sur la moelle osseuse de la souris, dans lequel des groupes de 5 mâles et 5 femelles ont reçu une fois le texanol par gavage à des doses de 0, 200, 1 000 et 2 000 mg/kg p.c. (OCDE 1993; Anonymous 1992, cité dans ECHA c2007-2017zj).
Cancérogénicité
Aucune étude de toxicité chronique ou de cancérogénicité du texanol n’a été trouvée dans la littérature.
Caractérisation du risque
Aucun effet jugé indésirable n’a été trouvé dans des études à doses répétées (court terme ou toxicité subchronique) ou pour la reproduction et le développement dans lesquelles des animaux de laboratoire ont été exposés par voie orale au texanol à des doses atteignant la dose limite de 1 000 mg/kg p.c./j. On n’a trouvé aucune étude de cancérogénicité dans la littérature pour cette substance, mais le texanol ne présentait aucun potentiel génotoxique. L’étude de l’OCDE (1993) a conclu que le texanol est associé à une toxicité relativement faible, et représente donc une faible priorité pour de futurs travaux.
Compte tenu des renseignements disponibles sur les effets du texanol sur la santé, on considère que cette substance a un faible potentiel de danger, et donc que la caractérisation de son potentiel d’exposition (c.‑à‑d. le calcul des estimations de l’exposition) n’est pas utile. On estime que le risque pour la santé humaine est faible.
7.4 Sous‑groupe D : Substance individuelle - sel d’un diester
7.4.1 Docusate sodique
Évaluation de l’exposition
Milieux naturels
Le docusate sodique est un solide dont la pression de vapeur est très faible. S’il est rejeté dans l’atmosphère, il sera présent principalement dans la phase particulaire (HSDB 1983- ). En phase vapeur, il se dégradera dans l’atmosphère par réaction avec des radicaux hydroxyles produits par photochimie, avec une demi-vie estimée à 18 heures (HSDB 1983- ). La constante de la loi d’Henry pour le docusate sodique a été estimée à 5 × 10-12 atm-m³/mol (EPI Suite c2000-2012), ce qui indique que la substance est essentiellement non volatile depuis l’eau (HSDB 1983- ).
Aucune donnée empirique n’a été trouvée pour le docusate sodique dans l’air ou dans l’eau au Canada. Le docusate sodique a été mesuré dans les eaux de surface du golfe du Mexique après son utilisation comme dispersant chimique pour solubiliser le pétrole et réduire au minimum la formation de nappes de pétrole en surface à la suite du rejet de pétrole par la plateforme Deepwater Horizon en 2010 (Gray et al. 2014). Une étude des eaux intérieures réalisée dans une collectivité locale a tenté de déterminer si la présence de produits chimiques était associée à leur utilisation à la suite de l’accident de Deepwater Horizon (Hayworth et Clement 2012). Cette étude a déterminé que la présence de docusate sodique dans les échantillons d’eau pouvait être attribuée à des rejets d’eaux pluviales de source ponctuelle et non ponctuelle provenant de 13 endroits, et non à une intervention faisant suite à l’accident, avec une concentration maximale de 19 ppb ou 19 µg/L dans les échantillons d’eau.
Les concentrations dans les eaux de surface au Canada ont été estimées à l’aide des feuilles de calcul pour l’eau potable par l’Unité d’évaluation environnementale (UEE) du BECSN (Santé Canada 2015a). Les détails des paramètres du modèle sont présentés à l’annexe D. En utilisant les données sur les importations totales de docusate sodique au Canada (Environnement Canada 2013), le modèle a calculé une concentration dans les eaux de surface de 5,6 × 10-4 mg/L.
Des études du sol ou de la poussière au Canada n’ont pas relevé la présence de docusate sodique. Ailleurs dans le monde, le docusate sodique a été mesuré dans le sol (galettes de sable) à la suite du déversement de Deepwater Horizon (McDaniel et al. 2015). Ces valeurs n’ont pas été jugées pertinentes pour l’exposition de la population générale au Canada.
Aliments
Le docusate sodique (répertorié comme dioctyl sulfosuccinate sodique) est un additif alimentaire autorisé pour les utilisations prescrites sur la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées, et est incorporé par renvoi dans son autorisation respective de mise en marché délivrée en vertu de la Loi sur les aliments et drogues. L’exposition au docusate sodique a été estimée d’après son utilisation permise dans les boyaux de saucisse pour en réduire la rupture (maximum de 200 ppm dans le boyau) et comme agent humidifiant dans les bases sèches de boissons acidulées à l’acide fumarique (maximum de 10 ppm dans la boisson finie), comme il est indiqué sur la Liste des additifs alimentaires autorisés.
Les estimations de l’exposition ont été calculées pour divers groupes d’âge à partir des scénarios de concentrations de consommation moyennes et au 95e centile pour la consommation de saucisses et de boissons aux fruits d’après le cycle 2.2 de l’ESCC (2004), avec l’hypothèse que les boyaux représentent 1 % du poids des saucisses et que toutes les saucisses et boissons aux fruits consommées contiennent du docusate sodique à la concentration maximale autorisée. Le groupe d’âge présentant les valeurs d’exposition maximales au 95e centile était les enfants de 2 à 3 ans, avec 337,5 μg/kg p.c./j. L’exposition estimée au docusate sodique due à l’utilisation d’additifs alimentaires pour les différents groupes d’âge est présentée dans le tableau 7-11.
| Groupe d’âge | 0 – < 6 mois | 6 à 11 mois | 1 an | 2 à 3 ans | 4 à 8 ans | 9 à 13 ans | 14 à 18 ans | 19 ans et + |
|---|---|---|---|---|---|---|---|---|
| Moyenne | - | - | 49,5 | 66,4 | 64,2 | 48,1 | 28,3 | 8,2 |
| 95e centile | - | - | 270,7 | 337,5 | 274,5 | 210,0 | 134,2 | 58,6 |
a Valeurs moyenne et au 95e centile pour toutes les personnes : consommation de saucisses et de boissons aux fruits, selon le cycle 2.2 de l’ESCC.
Les valeurs d’exposition au 95e centile due à l’utilisation d’additifs alimentaires pour les divers groupes d’âge ont été combinées aux estimations de l’exposition par l’eau potable afin d’estimer l’absorption quotidienne totale pour la population générale du Canada (voir le tableau B-4 de l’annexe B). L’absorption totale maximale par toutes les voies d’exposition était de 338 μg/kg p.c./j pour les enfants de 2 à 3 ans.
Le docusate sodique peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire sans contact direct avec les aliments et donc on ne s’attend pas à une exposition par les aliments (communication personnelle, courriels de la DA, SC, au BERSE, SC, 5 décembre 2016 et 15 mars 2021; sans référence).
L’exposition de la population générale au docusate sodique par l’eau potable et les aliments allait de 0,05 µg/kg p.c./j à 338 µg/kg p.c./j (voir le tableau B-4, annexe B). Le groupe d’âge le plus exposé parmi la population était celui des 2 à 3 ans. Les aliments semblent être une source d’exposition plus importante que l’eau potable. Cependant, les estimations de l’exposition au docusate sodique utilisé comme additif alimentaire sont jugées prudentes.
Produits disponibles aux consommateurs
Le docusate sodique joue le rôle d’agent nettoyant, d’agent émulsifiant, d’hydrotrope ou d’agent tensio-actif dans les cosmétiques (Commission européenne 2008- ) et on le trouve dans plus de 100 cosmétiques au Canada, y compris les adhésifs, les produits pour le bain, les décolorants, les nettoyants, les exfoliants, les produits parfumants, les colorants capillaires, les produits de maquillage (non permanents), les démaquillants, les hydratants, les shampoings, les produits de rasage, les produits de mise en plis et les produits autobronzants (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence).
Les estimations de l’exposition par voie cutanée et par inhalation ont été calculées pour ces produits aux concentrations maximales.
Le tableau 7-12 résume les estimations de l’exposition par inhalation et par voie cutanée pour les cosmétiques contenant du docusate sodique. Le tableau indique les estimations de l’exposition pour les adultes et le groupe d’âge pertinent le plus jeune pour chaque type de produit. On trouvera à l’annexe C-3 de plus amples détails sur la méthode et les paramètres utilisés pour estimer l’exposition par inhalation et par voie cutanée au docusate sodique présent dans les cosmétiques.
| Scénario d’utilisation du produit | Concentration de docusate sodique a | Exposition par voie cutanée (mg/kg p.c./j) b | Exposition par inhalation b (mg/kg p.c./j) |
|---|---|---|---|
|
Huile de bain (9–13 ans) |
0,3 % | 0,001 | S.O. |
|
Nettoyant facial (9–13 ans) |
30 % | 0,27 | S.O. |
|
Shampoing (2–3 ans) |
10 % | 0,62 | S.O. |
|
Produit parfumant : huile de massage (0–5 mois) |
0,3 % | 0,86 | S.O. |
|
Fond de teint (4–8 ans) |
10 % | 0,26 | S.O. |
|
Démaquillant (4–8 ans) |
10 % | 1,0 | S.O. |
|
Produit autobronzant (14–18 ans) |
1 % | 0,04 | S.O. |
|
Décolorant capillaire (14–18 ans) |
3 % | 1,0 | S.O. |
|
Colorant/reflets capillaires (14-18 ans) |
3 % d | 0,9 | S.O. |
|
Produit de mise en plis : aérosol (4–8 ans) |
0,1 % | 0,026 |
1,5 × 10-4 (0,00035 mg/m³) c |
Abréviations : S.O. = sans objet.
a Communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 5 mars 2021; sans référence.
b L’absorption présumée par voie cutanée et par inhalation est équivalente à l’absorption par voie orale.
c Concentration moyenne le jour de l’exposition.
d Concentration dans la trousse de reflets capillaires (p. ex., poudre); substance mélangée avec une solution en vue de son application.
Le docusate sodique est présent comme ingrédient non médicinal dans six produits de santé naturels au Canada. La plupart de ces produits sont destinés à être administrés par voie orale, mais l’un d’entre eux est destiné à une application topique. L’exposition a été estimée pour les produits de santé naturels administrés par voie orale, selon un scénario sentinelle basé sur un comprimé contenant 20 mg de docusate sodique comme ingrédient non médicinal utilisé à des fins d’agent solubilisant, pris une fois par jour. L’exposition estimée d’un adulte, basée sur 20 mg de docusate sodique, est de 0,28 mg/kg p.c./j. On considère que l’exposition cutanée potentielle associée à l’utilisation du produit appliqué par voie topique est prise en compte par l’exposition estimée par voie cutanée à des fins cosmétiques.
Le docusate sodique est présent comme principe actif dans plus de 70 produits cathartiques et laxatifs en vente libre au Canada et comme ingrédient non médicinal dans plus de 30 médicaments sur ordonnance ou en vente libre, y compris des produits pour usage oral (comprimé ou capsule) ou topique. On a estimé l’exposition aux produits oraux en supposant l’absorption de 6 mg de docusate sodique par comprimé (un comprimé par jour) pour les adultes, ce qui donne une exposition estimée de 0,08 mg/kg p.c./j. Il a été déclaré ou estimé que les produits topiques contenaient des concentrations allant de < 0,05 % à 0,2 % de docusate sodique. On a estimé que l’exposition associée aux produits appliqués par voie topique était prise en compte dans l’estimation de l’exposition aux cosmétiques par voie cutanée. Le docusate sodique est également présent dans des produits considérés comme des médicaments désinfectants, en tant qu’ingrédient de désinfectants en aérosol et en lingettes pour les locaux où se trouvent des aliments, les établissements ou les hôpitaux.
Le docusate sodique est utilisé dans divers produits disponibles aux consommateurs pouvant entraîner une exposition de la population générale canadienne, notamment les nettoyants extérieurs pour la maison, les lingettes nettoyantes, les produits pour l’automobile comme les aérosols de protection de pneus, les nettoyants pour pneus (en mousse, en aérosol et en pulvérisateur à gâchette), les adhésifs liquides et les produits de durcissement du bois (SDS 2013c, 2014f, 2014g, 2015i, 2015j; FDS 2017f; HPD 1993b). Le tableau 7-13 résume les valeurs estimées de l’exposition par inhalation et par voie cutanée pour les produits disponibles aux consommateurs contenant du docusate sodique.
| Scénario d’utilisation du produit | Concentration de docusate sodique | Concentration a (mg/kg p.c./j) |
|---|---|---|
| Nettoyant pour extérieur de maison et anti-moisissures |
10 % (M/C) 0,5 % b (appl.) |
0,014 (M/C) 0,61 (appl.) 0,62 (M/C + appl.) |
| Lingettes/tissus humides de nettoyage | 5 % | 0,63 |
| Nettoyant en aérosol pour pneus (aérosol/mousse) | 10 % | 0,31 |
| Activateur de pâte liquide (papier peint) | 0,18 % c | 0,18 |
| Produit durcisseur du bois | 20 % d | 0,81 |
Abréviations : M/C = activités de mélange/chargement, appl. = activités d’application.
a On suppose que l’absorption par voie cutanée est équivalente à l’absorption orale.
L’exposition par inhalation est estimée en supposant un taux de respiration de 16,2 m3/j (Santé Canada 1998).
b Le produit contient du docusate sodique dans une solution de 10 %; après mélange et chargement, le produit est appliqué à une dilution de 1:20.
c Le produit contient 30 %, et il est appliqué dans une solution (produit:eau) de 0,6 %.
d On suppose une concentration de 20 % dans le produit (concentration indiquée comme renseignement exclusif sur le produit).
Évaluation des effets sur la santé
Le docusate sodique a été examiné dans le cadre de la caractérisation préliminaire des dangers de la catégorie des sulfosuccinates par l’EPA (US EPA 2009), et cet examen a été utilisé pour éclairer la caractérisation des effets sur la santé dans la présente évaluation.
Une recherche a été effectuée dans la littérature pour trouver des articles publiés entre l’année précédant l’évaluation de l’EPA (janvier 2009) et décembre 2020. On n’a trouvé aucune étude additionnelle sur les effets sur la santé qui aurait abouti à une caractérisation des effets sur la santé différente de celle de l’évaluation de l’EPA (US EPA 2009).
Toxicité à doses répétées
L’EPA (2009) a trouvé trois études par voie orale. Il n’y avait aucune étude à doses répétées pour le docusate sodique après exposition à celui‑ci par inhalation ou voie cutanée.
Une étude d’exposition subchronique à doses répétées a été réalisée sur des rats mâles Osborne-Mendel de 21 jours. Les animaux testés (5/dose) ont reçu du docusate sodique dans leur alimentation à des concentrations de 0 %, 2 %, 4 % et 8 % (correspondant à 0 et environ 2 000, 4 000 et 8 000 mg/kg p.c./j, respectivement) pendant 16 semaines. La dose critique et le critère de danger correspondant ont été retenus comme DMENO de 2000 mg/kg p.c./j, la plus faible dose d’essai, d’après une diminution de la prise de poids corporel et des signes d’irritation gastrointestinale lors de l’autopsie. Un seul animal exposé à 4 000 mg/kg p.c./j a survécu pendant toute la durée de l’étude. Les animaux exposés à la dose maximale ont présenté des symptômes gastrointestinaux et sont morts au cours de la première semaine de traitement (US EPA 2009).
Une autre étude d’exposition subchronique à doses répétées a été menée chez des rats (souche non indiquée; 12/sexe/dose) auxquels on a administré du docusate sodique dans l’alimentation à des concentrations de 0 %, 0,5 %, 1,0 % et 1,5 % (correspondant à 0 et environ 250, 500 et 750 mg/kg p.c./j, respectivement) pendant 26 semaines. La dose critique et le critère de danger correspondant ont constitué une DSENO de 250 mg/kg p.c./j d’après une faible prise de poids et une gastroentérite hémorragique observées chez des rats exposés à 500 mg/kg p.c./j. Deux animaux témoins et quatre animaux testés (sexe non précisé) exposés à la dose maximale sont morts. Deux des quatre animaux morts traités présentaient une gastroentérite hémorragique. Aucun autre effet sur le poids corporel, la consommation alimentaire, la chimie clinique ou l’histopathologie n’a été observé (US EPA 2009).
Dans la troisième étude, des chiens Beagle (4/sexe/dose) ont reçu du docusate sodique sous forme de comprimés oraux à des doses de 0 ou 30 mg/kg p.c. une fois par jour, 7 jours/semaine, pendant 1 an. On n’a observé aucun effet lié au traitement sur le poids corporel, la consommation alimentaire, les paramètres de chimie clinique, d’hématologie et d’analyse d’urine ou d’histopathologie, à la seule dose testée. Aucun signe d’irritation gastrique n’a été noté (US EPA 2009).
Dans l’ensemble, l’EPA (US EPA 2009) a conclu que l’exposition orale répétée au docusate sodique chez le rat présentait des irritations et des effets localisés sur le tractus gastrointestinal à 500 mg/kg p.c./j, et que la DSENO pour la toxicité générale était de 250 mg/kg p.c./j, sur la base d’une diminution de la prise de poids corporel observée chez les rats exposés à 500 mg/kg p.c./j et à des doses plus élevées.
Toxicité pour la reproduction et le développement
L’EPA (US EPA 2009) a trouvé une étude de toxicité pour la reproduction et deux études de toxicité pour le développement. Il n’y a pas d’étude disponible sur la toxicité du docusate sodique pour la reproduction ou le développement après exposition à celui-ci par inhalation ou par voie cutanée.
Une étude de toxicité pour la reproduction sur trois générations par voie orale a été trouvée par l’EPA (US EPA 2009) pour le docusate sodique. Dans cette étude, des rats Crl:CD(SD)BR mâles et femelles ont reçu la substance dans leur alimentation à des concentrations de 0, 0,1, 0,5 et 1 % (correspondant à environ 0, 100, 500 et 1 000 mg/kg p.c./j, respectivement) pendant la période de pré‑accouplement, d’accouplement et de gestation pour trois générations (F0, F1, F2) jusqu’au sevrage de la troisième génération (F3). La dose critique établie dans cette étude était une DSENO de 100 mg/kg p.c./j pour la toxicité générale et la toxicité pour la reproduction et le développement. On a observé une diminution de la consommation alimentaire et du poids corporel chez les animaux adultes à une concentration de 500 mg/kg p.c./j et plus. Les petits mâles et femelles (sur les trois générations) nés d’animaux traités à raison de 500 mg/kg p.c./j ou de 1 000 mg/kg p.c./j pesaient moins que les témoins au jour 21. On a également constaté un effet sur la lactation chez les animaux ayant reçu 500 mg/kg p.c./j et plus. Aucun lait n’a été trouvé dans l’abdomen au jour 4 de lactation chez 3 petits F2 témoins, 7 petits F2 dans le groupe ayant reçu la dose de 100 mg/kg p.c./j, 18 petits F2 et 1 petit F3 dans le groupe ayant reçu la dose de 500 mg/kg p.c./j, et 10 petits F2 et 17 petits F3 dans le groupe ayant reçu la dose de 1 000 mg/kg p.c./j. Aucun effet lié au traitement n’a été observé sur le nombre total de petits ou de portées, la taille des portées, le rapport des sexes, ou la survie périnatale des petits chez les trois générations. Il n’y a pas eu non plus de mortalité liée au traitement ou d’anomalies microscopiques chez les animaux examinés (adultes F0, F1 et F2, et petits F3) (US EPA 2009).
Dans une étude de toxicité pour le développement, des groupes de rates gravides ont reçu du docusate sodique dans leur alimentation à des concentrations de 0 %, 1 % et 2 % (correspondant à environ 0, 500 et 1 000 mg/kg p.c./j, respectivement) entre les JG 6 et 15. La DSENO pour la toxicité maternelle et développementale établie par l’EPA était de 500 mg/kg p.c./j, sur la base d’une réduction de la prise de poids corporel chez les mères et d’une augmentation significative des résorptions fœtales et du pourcentage de fœtus présentant des malformations externes à 1 000 mg/kg p.c./j. Les anomalies consistaient principalement en une exencéphalie de degrés et de gravité variables. On a également observé une ossification incomplète de divers os crâniens et des colonnes vertébrales courbées ou ouvertes (US EPA 2009). Dans une deuxième étude, des rates gravides ont été exposées au docusate sodique dans leur alimentation à des concentrations de 0 % et 2 % (correspondant à environ 0 mg/kg p.c./j et 1 000 mg/kg p.c./j) entre les JG 6 et 16. L’EPA a établi une DMENO pour la toxicité maternelle et développementale, de 1 000 mg/kg p.c./j, soit la seule dose testée. Cette DMENO était basée sur une diminution du poids corporel, de la consommation alimentaire et de la prise de poids corporel des mères, une diminution du poids corporel des fœtus et de la taille vertex-talon et une augmentation des anomalies du squelette (sternèbres non ossifiées) (US EPA 2009).
L’exposition répétée par voie orale au docusate sodique chez le rat était associée à des effets sur le développement, notamment une réduction du poids corporel des fœtus et des petits, des résorptions, des malformations et des anomalies squelettiques, observés à 500 mg/kg p.c./j ou 1 000 mg/kg p.c./j, mais uniquement en présence d’une toxicité maternelle.
Génotoxicité
Le docusate sodique n’était pas mutagène dans les cellules bactériennes et n’a pas induit d’aberrations chromosomiques dans les cellules de mammifères in vitro (US EPA 2009).
Cancérogénicité
Le docusate sodique n’a pas présenté de potentiel cancérogène chez le rat (US EPA 2009). Dans une étude de toxicité chronique, des rats Osborne-Mendel mâles (12/dose) ont reçu 0,25 %, 0,5 % ou 1,0 % de docusate sodique dans leur alimentation pendant 2 ans. On n’a observé aucun effet de cette substance sur la consommation alimentaire. Cependant, on a noté une diminution significative de la prise de poids chez les animaux exposés à 1 % de docusate sodique. Aucun autre effet lié au traitement n’a été observé (US EPA 2009).
Caractérisation du risque
Le docusate sodique a été examiné dans le cadre de la caractérisation des dangers de la catégorie des sulfosuccinates par l’EPA (US EPA 2009), et cet examen a été utilisé pour éclairer la caractérisation des effets sur la santé dans la présente évaluation. Aucun signe de cancérogénicité ou de génotoxicité n’a été relevé dans les données empiriques disponibles pour cette substance.
Après une exposition subchronique par voie orale au docusate sodique, on a observé des effets sur le site de contact dans le tractus gastrointestinal et une diminution de la prise de poids corporel chez les rats à partir de 500 mg/kg p.c./j. L’exposition par voie orale à doses répétées au docusate sodique chez le rat a été associée à des effets sur le développement, notamment une réduction du poids corporel des fœtus et des petits, des résorptions, des malformations et des anomalies squelettiques, ces effets ayant tous été observés en présence d’une toxicité maternelle.
La dose critique établie était une DSENO de 100 mg/kg p.c./j basée sur la toxicité générale et sur la toxicité pour la reproduction et le développement dans une étude de toxicité orale pour la reproduction sur trois générations. On a observé une diminution de la consommation alimentaire et du poids corporel chez les animaux adultes à une concentration de 500 mg/kg p.c./j et plus. Les petits mâles et femelles (sur les trois générations) nés d’animaux traités à raison de 500 mg/kg p.c./j ou de 1 000 mg/kg p.c./j pesaient moins que les témoins. On a observé également un effet sur la lactation (absence de lait dans l’abdomen) chez les animaux traités à raison de 500 mg/kg p.c./j et plus (US EPA 2009).
La principale voie d’exposition au docusate sodique par les milieux naturels et les aliments pour la population générale était par les aliments, en raison de son utilisation comme additif alimentaire autorisé.
La population générale du Canada peut également être exposée au docusate sodique lors de l’utilisation de divers produits contenant cette substance, notamment les nettoyants, les revitalisants capillaires, les huiles de massage, les produits de maquillage, les hydratants corporels, les produits autobronzants, les décolorants capillaires, les vernis à ongles, les produits de mise en plis, divers produits de nettoyage (nettoyants liquides pour l’extérieur de la maison, nettoyants en pulvérisateur à gâchette, nettoyants pour pneus d’automobile), les produits d’activation et de durcissement de la colle pour papier peint. L’exposition au docusate sodique due à l’utilisation de ces produits devrait se faire principalement par voie cutanée. Le tableau 7-14 présente les estimations pertinentes de l’exposition, les doses avec effets critiques sur la santé et les ME résultantes aux fins de caractérisation du risque pour la santé humaine dû à l’exposition au docusate sodique.
| Scénario d’exposition | Exposition totale a (mg/kg p.c./j) | ME basée sur une DSENO orale de 100 mg/kg p.c./j b |
|---|---|---|
| Exposition totale par les milieux naturels et utilisation comme additif alimentaire autorisé (exposition chronique par voie orale; 2–3 ans) | 0,338 | 296 |
| Exposition par voie orale associée à son utilisation comme ingrédient non médicinal dans les médicaments sur ordonnance ou en vente libre, ou produit de santé naturel (19 ans et +) | 0,28 | 357 |
| Huile de bain (9–13 ans) | 0,001 | 100000 |
| Nettoyant facial (9–13 ans) (voie cutanée, chronique) | 0,27 | 370 |
| Shampoing (2–3 ans) (voie cutanée, chronique) | 0,62 | 161 |
| Huile de massage (0–5 mois) (voie cutanée, intermittente) | 0,86 | 116 |
| Produits de maquillage du visage (4–8 ans) (voie cutanée, chronique) | 0,26 | 384 |
| Démaquillants (4–8 ans) | 1,0 | 100 |
|
Produits autobronzants (14–18 ans) (voie cutanée, intermittente) |
0,04 | 2500 |
|
Décolorant capillaire (14–18 ans) (voie cutanée, intermittente) |
1,0 | 100 |
| Teinture capillaire (14–18 ans) (voie cutanée, intermittente) | 0,9 | 111 |
| Produit de mise en plis (4–8 ans) (voie cutanée, chronique) | 0,026 | 4545 |
| Nettoyant pour l’extérieur de la maison (19 ans et +) (voie cutanée, intermittente) | 0,62 | 161 |
| Lingettes nettoyantes (19 ans et +) (voie cutanée, chronique) | 0,63 | 159 |
| Nettoyant en aérosol pour pneus (automobile) (19 ans et +) (voie cutanée, intermittente) | 0,31 | 322 |
| Papier peint : activateur de pâte liquide (19 ans et +) (voie cutanée, intermittente) | 0,18 | 555 |
| Produit de durcissement du bois (19 ans et +) (voie cutanée, intermittente) | 0,81 | 123 |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé.
a Basé sur l’hypothèse que l’absorption cutanée est équivalente à l’absorption orale.
b Étude de toxicité générale et de toxicité pour la reproduction et le développement, dans une étude de toxicité pour la reproduction sur trois générations (US EPA 2009).
Dans l’ensemble, les ME sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
7.5 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Source clé d’incertitude | Fréquence |
|---|---|
| Exposition | N/A |
| Dans le cas de l’acétate de méthyle, l’exposition due à sa présence naturelle dans les aliments est basée sur les données trouvées dans la base de données Volatile Compounds in Food. On a supposé que les quantités mesurées de substance rejetée par les aliments sont consommées. | + |
| Pour les applications en aérosol, on a utilisé des modèles d’émission instantanée comme approche prudente. | + |
| Les incertitudes associées à l’estimation de l’exposition des enfants au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans les produits en plastique comprennent l’utilisation de données de migration basées sur un simulant de salive, la pertinence des données de migration pour les biberons au Canada et la variabilité des surfaces et du temps de contact avec l’objet. | +/- |
| On a supposé que la pénétration cutanée est équivalente à l’absorption orale pour le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène et le docusate sodique. | + |
| Dangers | N/A |
| Ensembles limités de données sur les dangers pour l’acétate de méthyle, le glutarate de diméthyle et l’acétate de 2‑méthoxypropyle. | +/- |
| Il n’y a pas de données ou les données sont limitées en ce qui concerne les effets de doses répétées pour certaines voies d’exposition et durées pertinentes concernant l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le butyrate de méthyle, le myristate de tétradécyle et les monoglycérides en C14‑22. | +/- |
| Absence d’étude de toxicité chronique/cancérogénicité pour l’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, l’acétate de 2‑méthoxypropyle, la triacétine, les monoglycérides en C14‑22, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol et le docusate sodique. | +/- |
| Incertitude associée à l’utilisation de données toxicologiques disponibles pour les métabolites et analogues afin de caractériser le risque posé à la santé humaine par l’acétate de méthyle, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle et l’acétate de 2‑méthoxypropyle. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque; N/A = non applicable.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les risques pour l’environnement associés aux 14 substances du groupe des esters sont faibles. Il est proposé de conclure que l’acétate de méthyle, la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne répondent pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’acétate de méthyle répond aux critères énoncés à l’alinéa 64c) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Compte tenu de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que l’acétate de méthyle répond à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est donc proposé également de conclure que la triacétine, l’hexanoate de méthyle, l’acétate de propyle, l’acétate d’isobutyle, le laurate de méthyle, le docusate sodique, le butyrate de méthyle, le glutarate de diméthyle, le myristate de tétradécyle, le diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, le texanol, les monoglycérides en C14‑22 et l’acétate de 2‑méthoxypropyle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que l’acétate de méthyle satisfait aux critères de persistance, mais non aux critères de bioaccumulation, tels qu’énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[AGDH] Australian Government Department of Health. 1998. Dodecanoic acid, dimethyloctyl ester. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). Existing Chemical Hazard Assessment Report. (Disponible en anglais seulement).
[AGDH] Australian Government Department of Health. 2008. Cetiol Sensoft. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). Existing Chemical Hazard Assessment Report. (Disponible en anglais seulement).
[AGDH] Australian Government Department of Health. 2014. Inventory Multi-Tiered and Prioritisation (IMAP): Human Health Tier II Assessment for Acetate esters (C2-C4). Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). (Disponible en anglais seulement).
Alvarez L, Driscoll C, Kelly DP, Staples RE, Chromey NC, Kennedy Jr GL. 1995. Developmental toxicity of dibasic esters by inhalation in the rats. Drug Chem Toxicol. 18(4):295-314. (Disponible en anglais seulement).
[ANSES] Agence nationale de sécurité sanitaire alimentation, environnement, travail. 2016. Jouets et équipements en matière plastique destinés aux enfants de moins de trois ans [PDF]. Edition scientifique.
Babich MA. 2010. Phthalates and phthalate substitutes in children’s toys [PDF]. US Consumer Product Safety Commission, Bethesda, MD. March 2010. (Disponible en anglais seulement).
[BASF] BASF Aktiengesellschaft. 1986. Initial submission: Prenatal toxicity investigation of 2-methoxypropylacetate-1 in rats and rabbits and 2-methoxypropanol-1 in rats with cover letter dated 04/21/92. OTS 0536311 [cité dans Environnement Canada, Santé Canada 2009]. (Disponible en anglais seulement).
[BASF] BASF. 1988. Pranatale toxizitat von 2-methoxypropanol-1 am kaninchen nach inhalativer aufnahme (85/510). BASF, Ludwigshafen, Germany. (Disponible en allemand seulement).
Batterman S, Chunrong J, Hatzivasilis G. 2007. Migration of volatile organic compounds from attached garages to residences: A major exposure source. Environ Res. 104:224-240. (Disponible en anglais seulement).
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]. [modifié le 4 mai 2021]. Ottawa (Ont.), gouvernement du Canada.
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [modifié le 8 avril 2021]. Ottawa (Ont.), gouvernement du Canada.
Becker LC, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Marks JG, Shank RC, Slaga TJ, Snyder PW, Andersen FA. 2010. Final report of the amended safety assessment of myristic acid and its salts and esters as used in cosmetics. Int J Toxicol. 29 (Supplement 3);162S-186S. (Disponible en anglais seulement).
Bevan C. 2001. Monohydric alcohols-C7 to C18, aromatic and other alcohols. In: Bingham E, Cohrssen B, Powell CH, editors. Patty’s Toxicology, 5th edition, vol. 6. New York (NY): J. Wiley & Sons. [cité dans OECD 2006]. (Disponible en anglais seulement).
Bingham E and Falk HL. 1969. Environmental carcinogens: the modifying effect of cocarcinogens on the threshold response. Arch Environ Health 19(6):779-783. (Disponible en anglais seulement).
Bouma K, Schakel DJ. 2002. Migration of phthalates from PVC toys into saliva simulant by dynamic extraction. Food Addit Contam. 19(6):602-610. (Disponible en anglais seulement).
Bremmer HF, Prud’homme de Lodder LCH, van Engelen JGM. 2006. Cosmetics Fact Sheet [PDF]. RIVM report 320104001/2006. (Disponible en anglais seulement).
Burbacher TM, Shen D, Grant K, Sheppard L, Damian D, Ellis S, Liberato N. 1999a. Reproductive and offspring developmental effects following maternal inhalation exposure to methanol in nonhuman primates Part I: methanol disposition and reproductive toxicity in adult females. Cambridge, MA: Health Effects Institute. (Disponible en anglais seulement).
Burbacher TM, Grant K, Shen D, Damian D, Ellis S, Liberato N. 1999b. Reproductive and offspring developmental effects following maternal inhalation exposure to methanol in nonhuman primates Part II: developmental effects in infants exposed prenatally to methanol. Cambridge, MA: Health Effects Institute. (Disponible en anglais seulement).
Burbacher TM, Shen DD, Lalovic B, Grant KS, Sheppard L, Damian D, Ellis S, Liberato N. 2004a. Chronic maternal methanol inhalation in nonhuman primates (Macaca fascicularis): exposure and toxicokinetics prior to and during pregnancy. Neurotoxicol Teratol. 26:201-221. (Disponible en anglais seulement).
Burbacher TM, Grant KS, Shen DD, Sheppard L, Damian D, Ellis S, Liberato N. 2004b. Chronic maternal methanol inhalation in nonhuman primates (Macaca fascicularis): reproductive performance and birth outcome. Neurotoxicol Teratol. 26:639-650. (Disponible en anglais seulement).
Burdock GA. 2010. Fenaroli’s handbook of flavor ingredients. 6th ed. Orlando (FL): Burdock Group. (Disponible en anglais seulement).
Canada. Ministère de l’Environnement. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 143, nº 40, p. 2945-2956.
Canada. Ministère de l’Environnement. 2012. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol.146, nº 48, Supplément.
Canada. [1978]. Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada. [1999]. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, nº 3.
Carney EW, Pottenger LH, Johnson KA, Liberacki AB, Tornesi B, Dryzga MD, Hansen SC, Breslin WJ. 2003. Significance of 2-methoxypropionic acid formed from b-propylene glycol monomethyl ether: integration of pharmacokinetic and developmental toxicity assessments in rabbits. Toxicol Sci: 71(2):217-228. (Disponible en anglais seulement).
Cekola PL, Czerkies LA, Storm HM, Wang MH, Roberts J, Saavedra JM. 2015. Growth and tolerance of term infants fed formula with probiotic Lactobacillus reuteri. Clin Pediatr. 54(12):1175-84. (Disponible en anglais seulement).
ChemIDplus [database]. 1993- . Bethesda (MD): US National Library of Medicine. [mise à jour quotidienne; accès en juin 2016]. (Disponible en anglais seulement).
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON): Trent University, Canadian Center for Environmental Modelling and Chemistry. (Disponible en anglais seulement).
Chernoff N, Rogers JM. 2004. Supernumerary ribs in developmental toxicity bioassays and in human populations: Incidence and biological significance. J Toxicol Environ Health B Crit Rev. 7:437-449. (Disponible en anglais seulement).
Choi H, Schmidbauer N, Spengler J, Bornehag CG. 2010. Sources of propylene glycol and glycol ethers in air at home. Int J Environ Res Public Health. 7:4213-4237. (Disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 1982. Final report on the safety assessment of myristyl myristate and isopropyl myristate. Journal of American college of toxicology. 1(4):55-80. (Disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 2013. Amended Safety Assessment of Alkyl Esters as used in Cosmetics. Washington (DC). 1:82. (Disponible en anglais seulement).
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (Non disponible en français).
Cruzan G. 2009. Assessment of the cancer potential of methanol. Crit Rev Toxicol. 39(4): 347-363. (Disponible en anglais seulement).
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary of the results of surveys of the amount and frequency of use of cosmetic products by women. Report prepared by Pitkin B, Rodericks JV, Turnbull D. Environ Corporation, Washington, DC. (Disponible en anglais seulement).
[DECOS] Dutch Expert Committee on Occupational Standards. 1993. Health-based recommended occupational exposure limits for 1-methoxypropanol-2, 1-mehoxypropylacetate-methoxypropylacetate-2, 2-methoxypropanol-1, 2-methoxypropylacetate-1. RA 5/93. Sdu Utigeverij Plantijnstraat, The Hague (NL): Health Council of the Netherlands, DECOS [cite dans Environnement Canada, Santé Canada 2009]. (Disponible en anglais seulement).
Dow. 2015. Product Safety Assessment. Dowanol PMA Glycol Ether Acetate [Propylene Glycol Methyl Ether Acetate] [PDF]. [accès en mars 2020]. (Disponible en anglais seulement).
[Eastman] Eastman Chemical Company. 2007. Toxicity summary for Eastman TXIB® formulation additive [PDF]. (Disponible en anglais seulement).
[ECB] European Chemicals Bureau. 2004. Table 1a-1c: Substances with concern for developmental effects. ECBI/56/02 Add 12, Rev 6. [révisé le 22 janvier 2004]. [cite dans Environnement Canada, Santé Canada 2009]. (Disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Available from: substances@ec.gc.ca.
[ECCC] Environnement et Changement climatique Canada. 2019. Tableaux de données pour une année, par installation – Rejets, transferts et éliminations. Gatineau (Qué.), ECCC.
[ECCC, SC] Environnement Canada, Santé Canada. 2009. Évaluation préalable pour le Défi concernant le 2-Méthoxypropanol, CAS RN 1589-47-5. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d'évaluation des risques : résultats de l'examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017a. Évaluation préalable rapide des substances pour lesquelles l'exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada.
[[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2019. Évaluation préalable groupe des acides carboxyliques [PDF]. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2022. Ébauche d’évaluation préalable Groupe des alcools. Ottawa (ON), Gouvernement du Canada.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2005a. The toxicology of glycol ethers and its relevance to man. Technical Report No. 95, vol. I. Brussels (BE): ECETOC. (Disponible en anglais seulement).
ECHA] European Chemicals Agency. c2007-2020a. Registered substances database; search results for CAS RN 123-86-4. Helsinki (FI): ECHA. [mise à jour le 14 octobre 2020; accès en novembre 2020]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2020b. Registered substances database; search results for CAS RN 6846-50-0. Helsinki (FI): ECHA. [mise à jour le 19 octobre 2020; accès en novembre 2020]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017a. Registered substances database; search results for CAS RN 6846-50-0. Helsinki (FI): ECHA. [accès le 18 janvier 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017b. Registered substances database; search results for CAS RN 25265-77-4. Helsinki (FI): ECHA. [accès le 18 janvier 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017c. Registered substances database; search results for CAS RN 577-11-7. Helsinki (FI): ECHA. [accès le 18 janvier 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017d. Methyl hexanoate, CAS RN 106-70-7. Industry Submission to ECHA dated 1996, Exp. In vitro gene mutation study in bacteria. 004. [mise à jour le 26 avril 2017; cite en mai 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017e. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 2000, Exp Key Repeated dose toxicity: dermal. 001. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017f. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 2000, Exp Key Repeated dose toxicity: inhalation. 001. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017g. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 1987, Exp Supporting Repeated dose toxicity: inhalation. 003. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017h. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 1987, Exp Supporting Repeated dose toxicity: inhalation. 002. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017i. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 1988 and 1998, Exp Key Toxicity to reproduction. 001. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017j. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 2003, Exp Key Developmental toxicity / teratogenicity. 001. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017k. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 1995, Exp Supporting Developmental toxicity / teratogenicity. 002. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017l. Dimethyl glutarate, CAS RN 1119-40-0. Industry Submission to ECHA dated 2002, Exp Supporting in vitro gene mutation study in mammalian cells. 003. [mise à jour le 5 juillet 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017m. 1-isopropyl-2,2-dimethyltrimethylene diisobutyrate, CAS RN 6846-50-0. Industry Submission to ECHA dated 2001, Exp Supporting Toxicity to reproduction. 001. [mise à jour le 21 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017n. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2012, Supporting Read-across (Category). 006. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017o. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2013, Supporting Read-across (Category). 011. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017p. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2013, Supporting Read-across (Category). 010. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017q. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2014, Supporting Read-across (Category). 009. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017r. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2012, Supporting Read-across (Category). 008. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017s. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 2014, Supporting Read-across (Category). 007. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017t. Isopropyl myristate, CAS RN 110-27-0. Industry Submission to ECHA dated 1983, Exp Key Repeated dose toxicity: oral. 002. [mis à jour le 27 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017u. 2-ethylhexyl stearate, CAS RN 22047-49-0. Industry Submission to ECHA, Exp Weight of evidence developmental toxicity/ teratogenicity. 002. [mise à jour le 21 septembre 2017; cité en sept 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017v. Tetradecyl myristate, CAS RN 3234-85-3. Industry Submission to ECHA dated 1994, Exp Key Genetic toxicity: in vitro. 003. [mis à jour le 25 août 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017w Isopropyl myristate, CAS RN 110-27-0. Industry Submission to ECHA dated 1981, Exp Supporting Genetic toxicity: in vitro. 003. [mis à jour le 27 juillet 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. C2007-2017x. Isopropyl myristate, CAS RN 110-27-0. Industry Submission to ECHA dated 2014, Exp Key Genetic toxicity: in vitro. 001. [mis à jour le 27 juillet 2017; cité en août 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017y. Substance information; search results for CAS RN 108-65-6. Helsinki (FI): ECHA. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017z. 1-isopropyl-2,2-dimethyltrimethylene diisobutyrate, CAS RN 6846-50-0. Industry Submission to ECHA dated 2005, Exp Key Repeated dose toxicity:oral. 001. [mise à jour le 21 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017za. 1-isopropyl-2,2-dimethyltrimethylene diisobutyrate, CAS RN 6846-50-0. Industry Submission to ECHA dated 2001, Exp Supporting Toxicity to reproduction. 001. [mise à jour le 21 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zb. 1-isopropyl-2,2-dimethyltrimethylene diisobutyrate, CAS RN 6846-50-0. Industry Submission to ECHA dated 2015, Exp Key Developmental toxicity / teratogenicity. 001. [mise à jour le 21 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zc. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1992, Exp Key Repeated dose toxicity:oral. 001. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zd. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1984, Exp Supporting Repeated dose toxicity:oral. 004. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017ze. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1995, Exp Supporting Repeated dose toxicity: oral. 003. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zf. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1992, Exp Key Toxicity to reproduction. 001. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zg. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 2015, Exp Key Developmental toxicity / teratogenicity. 001. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zh. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1985, Exp Key Genetic toxicity: in vitro. 002. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zi. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1995, Exp Key Genetic toxicity: in vitro. 001. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017zj. Isobutyric acid, monoester with 2,2,4-trimethylpentane-1,3-diol, CAS RN 25265-77-4. Industry Submission to ECHA dated 1992, Exp Key Genetic toxicity in vivo. [mis à jour le 26 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2008. Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2015a. Substance Evaluation Report, Methanol. Helsinki, Finland. [accès le 10 janvier 2019]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2015b. Substance evaluation conclusion as required by REACH article 48 and evaluation report for dimethyl glutarate EC No 214-277-2, CAS No 1119-40-0. Community rolling action plan (CoRAP); 2015 October 15; Bureau for Chemical Substances, Poland. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2016a. Methanol. Committee for risk assessment (RAC), Committee for socio-economic analysis (SEAC). Helsinki, Finland. [accès le 15 mars 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2016b. Methanol. Committee for risk assessment (RAC), Committee for socio-economic analysis (SEAC). Background document. Helsinki, Finland. [accès le 15 mars 2018]. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. 2017. 1-isopropyl-2,2-dimethyltrimethylene diisobutyrate, CAS RN 6846-50-0. Industry Submission to ECHA, Endpoint summary. [mise à jour le 21 septembre 2017; cité en déc 2017]. (Disponible en anglais seulement).
[EFSA] European Food Safety Authority. 2006. Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) on a request related to a 12th list of substances for food contact materials. EFSA Journal 395 to 401:1-21. (Disponible en anglais seulement).
[EFSA] European Food Safety Authority. 2014. Scientific opinion on the re-evaluation of propionic acid (E 280), sodium propionate (E281), calcium propionate (E 282) and potassium propionate (E 283) as food additives. EFSA Journal. 12(7):3779. (Disponible en anglais seulement).
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement).
European Commission. 1997. Classification and Labelling of Dangerous Substances. Meeting at ECB Ispra, 16–18 April 1997. European Commission, Directorate-General of the Joint Research Centre, Environment Institute, European Chemicals Bureau. ECBI/21/97 – Rev. 2. [cité dans Environment Canada, Health Canada 2009]. (Disponible en anglais seulement).
European Commission (2008- ) CosIng: Cosmetic Ingredient and Substance Database. [accès en novembre 2017]. (Disponible en anglais seulement).
[ESIS] European Chemical Substances Information System [database on the Internet]. 2007. Version 5. 2-Methoxypropanol, CAS No. 1589-47-5. European Chemicals Bureau (ECB). [cite en mai 2007]. [cité dans Environment Canada, Health Canada 2009]. (Disponible en anglais seulement).
[EU RAR] European Union Risk Assessment Report. 2003. European Union Risk Assessment Report [CAS No.: 79-20-9 and EINECS No.: 201-185-2] methyl acetate. Institute for Health and Consumer Protection, European Chemicals Bureau: Existing Substances. 2003. Volume 34. (Disponible en anglais seulement).
[FDS] Fiche de données de sécurité [date inconnue]. EZ Strip all purpose remover [PDF]. Windsor (Ont.), EZ Strip USA. [Accès 26 janvier 2018].
[FDS] Fiche de données de sécurité. 2015e. Countertop Transformation Kit [PDF]. Concord (Ont.), Rust-Oleum Consumer Brands Canada. [accès le 26 janvier 2018].
[FDS] Fiche de données de sécurité. 2015g. Résine renforcée de fibre de verre Bondo® [PDF]. London (Ont.), 3M.
[FDS] Fiche de données de sécurité. 2017e. Specialty Chalkboard Tint Base [PDF]. Vernon Hills (IL), Rust-Oleum.
[FDS] Fiche de données de sécurité. 2017f. Jomax House Cleaner Mildew [PDF]. Vernon Hills (IL), Rust-Oleum.
[FDS] Fiche de données de sécurité. 2018a. Super décapant nouvelle génération [PDF]. Granby (Qué.), Super Remover. [accès en septembre 2019].
[FDS] Fiche de données de sécurité. 2018c. LePage PL400 Subfloor and Deck Adhesive [PDF]. Mississauga (Ont.), Henkel [accès le 31 mars 2020].
[FDS] Fiche de données de sécurité. 2018d. Watco 6X319GM Lacquer Clear Gloss [PDF]. Concord (Ont.), Rust-Oleum Consumer Brands Canada. [accès le 2 octobre 2018].
[FDS] Fiche de données de sécurité. 2018f. Rust-Oleum Chalked Aerosol [PDF]. Concord (Ont.), Rust-Oleum Consumer Brands Canada. [accès le 31 mars 2020].
[FDS] Fiche de données de sécurité. 2019. Dupli-color High Performance Wheel Coating; Mississauga (Ont.), Dupli-Color Products Company. [accès le 4 décembre 2020].
[FDS] Fiche de données de sécurité 2019. Super Décapant nouvelle génération [PDF]. Distribution J. Des Serres Inc. Granby (Québec). [date: 18 juin 2019]
Ficheux AS, Morriset T, Chevillotte G, Postic C, Roudot AC. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food Chem Toxicol. 66:36-43. (Disponible en anglais seulement).
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement).
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem Toxicol. 90: 130-141. (Disponible en anglais seulement).
Fisher AA. 1986. Contact dermatitis. 3rd edition. Lea & Febiger, Philadelphia, 1986. p.853 and 886 [cite dans EU RAR 2003]. (Disponible en anglais seulement).
Fisher, JW, Dorman DC, Medinsky MA, Welsch F, Conolly RB. 2000. Analysis of Respiratory Exchange of Methanol in the Lung of the Monkey Using a Physiological Model. Toxicol Sci. 53:185-193. (Disponible en anglais seulement).
Frederick LJ, Schulte PA, Apol A. 1984. Investigation and control of occupational hazards associated with the use of spirit duplicators. Am Ind Hyg Assoc J. 45:51-55. (Disponible en anglais seulement).
Garcia-Hidalgo, Sottas V, von Goetz N, Hauri U, Bogdal C, Hungerbühler K. 2017. Occurrence and concentrations of isothiazolinones in detergents and cosmetics in Switzerland. Contact Dermatitis. 76(2):96-106. (Disponible en anglais seulement).
Goliff WS, Fitz DR, Cocker K, Bumiller K., Bufalino C, Switzer D. 2012. Ambient measurements of 2,2,4-trimethyl, 1,3-pentanediol monoisobutyrate in Southern California. J Air Waste Manag Assoc. 62(6):680-685. (Disponible en anglais seulement).
Gray J, Kanagy L, Furlong E, Kanagy C, McCoy J, Mason A, Lauenstein G. 2014. Presence of the Corexit component dioctyl sodium sulfosuccinate in Gulf of Mexico waters after the 2010 Deepwater Horizon oil spill. Chemosphere. 95:124-130. (Disponible en anglais seulement).
Hansen OE, Pedersen E. 2005. Migration and health assessment of chemical substances in surface treated wooden toys [PDF]. Survey of Chemical Substances in Consumer Products, No. 60. (Disponible en anglais seulement).
Hansen PL, Tønning K, Malmgren-Hansen B, Jacobsen E. 2008. Survey and health assessment of chemical substances in hobby products for children. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Survey of Chemical Substances in Consumer Products, No. 93. (Non disponible en français).
Hayworth J, Clement TP. 2012. Provenance of Corexit-related chemical constituents found in nearshore and inland Gulf Coast waters. Mar Pollut Bull. 64(10):2005-2014. (Disponible en anglais seulement).
Hodgson AT, Rudd AF, Beal D, Chandra S. 2000. Volatile organic compound concentrations and emission rates in new manufactured and site-built houses. Indoor Air. 10:178-192. (Disponible en anglais seulement).
Hodgson AT, Faulkner D, Sullivan DP, DiBartolomeo DL, Russell, ML, Fisk WJ. 2003. Effect of outside air ventilation rate on volatile organic compound concentrations in a call center. Atmos Environ. 37:5517-5527. (Disponible en anglais seulement).
Household Products Database [database]. 1993a. Bethesda (MD): US National Library of Medicine. [mise à jour en 2017; accès le 26 janvier 2018]. (Disponible en anglais seulement).
Household Products Database [database]. 1993b. Bethesda (MD): US National Library of Medicine. [mise à jour en 2017; accès le 31 janvier 2018]. (Disponible en anglais seulement).
[HPVIS] High Production volume information system. 2017. Registered substances database: search result for CAS RN 1119-40-0. [EPA] US Environmental Protection Agency. [mise à jour le 29 novembre 2002; accès le 30 juin 2017]. (Disponible en anglais seulement).
[HSDB] Hazardous Substances Data Bank [database]. 1983. Bethesda (MD): US National Library of Medicine. [accès de Janvier à novembre 2017]. (Disponible en anglais seulement).
Huntingdon Life Sciences, Ltd. 2001. Dimethyl Glutarate Rat Micronucleus Test. Submitted to SOCMA. SOA 001/004850 [cité dans HPVIS 2017]. (Disponible en anglais seulement).
[IARC] International Agency for Research on Cancer. 2018. Search conducted for Methanol. [dernière mise à jour en juin 2018]. (Disponible en anglais seulement).
[INSPQ] Institut National de Santé Publique du Québec. 2001. Mieux vivre avec notre enfant de la grossesse à deux ans – Guide pratique pour les mères et les pères.
[IPCS] International Programme on Chemical Safety. 1997. Methanol. Health and Safety Guide No. 105. World Health Organization (WHO), Geneva. (Disponible en anglais seulement).
[IPCS] International Programme on Chemical Safety. 2001. Methanol. Poisons Information Monograph (PIM) 335. Milan, IPCS, Geneva. (Disponible en anglais seulement).
Isomura H, Takimoto H, Miura F, Kitazawa S, Takeuchi T, Itabashi K, Kato N. 2011. Type of milk feeding affects hematological parameters and serum lipid profile in Japanese infants. Pediatr Int. 53(6):807-13. (Disponible en anglais seulement).
Janssen PJCM, Bremmer HJ 2009. Risk assessment non-phthalate plasticizers in toys. National Institute for Public Health and the Environment RIVM. Bilthoven. RIVM. 27 pages. (Disponible en anglais seulement).
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 1975. 19th Report of the Joint FAO/WHO Expert Committee on Food Additives. FAO Nutrition Meeting report series 8 [cité dans OECD 2002]. (Disponible en anglais seulement).
[JECFA] Joint FAO/WHO Expert Committee on Food Additives 2002. Evaluation of certain food additives: fifty-ninth report of the Joint FAO/WHO Expert Committee on Food Additives. Geneva. (Disponible en anglais seulement).
Kavet R. Nauss KM. 1990. The toxicity of inhaled methanol vapors. Crit Rev Toxicol. 21:21-50. [accès le 14 février 2018]. (Disponible en anglais seulement).
Keenan CM, Kelly DP, Bogdanffy MS. 1990. Degeneration and recovery of rat olfactory epithelium following inhalation of dibasic esters. Fundam Appl Toxicol. 15(2):381-93. (Disponible en anglais seulement).
Kelly DP, Kennedy Jr GL, Keenan CM. 1998. Reproduction study with dibasic esters following inhalation in the rat. Drug Chem Toxicol. 21(3):253-267. (Disponible en anglais seulement).
Kim JL, Elfman L, Mi Y, Wieslander G, Smedje G, Norback D. 2007. Indoor molds, Bacteria, microbial volatile organic compounds and plasticizers in schools – associations with asthma and respiratory symptoms in pupils. Indoor Air. 17:153-153. (Disponible en anglais seulement).
Lasekan JB, Jacobs J, Reisinger KS, Montalto MB, Frantz MP, Blatter MM. 2011. Lactose-free milk protein-based infant formula: Impact on growth and gastrointestinal tolerance in infants. Clin Pediatr. 50(4):330-7. (Disponible en anglais seulement).
Lasekan J, Baggs G, Acosta S, Mackey A. 2015. Soy protein-based infant formulas with supplemental fructooligosaccharides: Gastrointestinal tolerance and hydration status in newborn infants. Nutrients. 7(4):3022-37. (Disponible en anglais seulement).
Lonnerdal B, Kvistgaard AS, Peerson JM, Donovan SM, Peng Y. 2016. Growth, nutrition, and cytokine response of breast-fed infants and infants fed formula with added bovine osteopontin. J Pediatr Gastroenterol Nutr. 62(4):650-7. (Disponible en anglais seulement).
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. 43:279-291. (Disponible en anglais seulement).
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, et al. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol 44: 2008-2018. (Disponible en anglais seulement).
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, et al. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol 46: 1516-1524. (Disponible en anglais seulement).
[LPT] Laboratory of Pharmacology and Toxicology GmbH & Co. KG. 2006. Repeated dose 90-day oral toxicity study in rats. Rapport non publié submitted by Cognis Australia Pty Ltd: Study No., 19934/06, 03 November 2006) [cite dans AGDH 2008]. (Disponible en anglais seulement).
Maddalena R, Russell M, Sullivan DP, Apte MG. 2009. Formaldehyde and other volatile organic chemical emissions in four FEMA temporary housing units. Env Sci Technol. 43:5626-5632. (Disponible en anglais seulement).
Ma-Hock L, Klimisch HJ, Gembardt C, Deckardt K, Jäckh R. 2005. Investigations on the subchronic toxicity of 2-methoxypropanol-1(acetate) in rats. Hum Exp Toxicol. 24:95-99. (Disponible en anglais seulement).
Markowicz P, Larsson L. 2015. Influence of relative humidity on VOC concentrations in indoor air. Environ Sci Pollut Res. Int. 22:5772-5779. (Disponible en anglais seulement).
McDaniel LD, Basso J, Pulster E, Paul JH. 2015. Sand patties provide evidence for the presence of Deepwater Horizon oil on the beaches of the West Florida Shelf. Mar Pollut Bull. 97:67-77. (Disponible en anglais seulement).
Merkle J, Klimisch HJ, Jäckh R. 1987. Prenatal Toxicity of 2-Methoxypropylacetate-1 rats and rabbits. Fundam Appl Toxicol. 8:71-79. (Disponible en anglais seulement).
[NCBI] National Centre for Biotechnology Information. c2004. PubChem Compound Database; CID 7997. (Disponible en anglais seulement).
[NCHS] National Center for Health Statistics. 2000. CDC Growth Charts [Internet]. 2000. Hyattsville (MD): US Department of Health and Human Services, Centers Disease Control and Prevention. [mise à jour le 7 mars 2008; cite le 13 mars 2008]. (Disponible en anglais seulement).
[NEDO] New Energy Development Organization. 1987. Toxicological Research of methanol as a fuel for power station: summary report on tests with monkeys, rats and mice. Tokyo, Japan. 296 pages. (Disponible en anglais seulement).
NICNAS. 2009. Priority Existing Chemical Assessment Report No. 30 Triclosan [Internet]. Sydney (Australia): National Industrial Chemicals Notification and Assessment Scheme. (Disponible en anglais seulement).
Njissen LM, Ingen-Visscher CA van, Donders JJH [editors]. 1963-2016. VCF Volatile Compounds in Food online database. Version 16.3. Zeist (The Netherlands): Triskelion B.V. [mis à jour en nov 2016; accès en novembre 2017]. (Non disponible en français).
Nilsson NH, Malmgren-Hansen B, Bernth N, Pedersen E, Pommer K. 2006. Survey and health assessment of chemicals substances in sex toys [PDF]. Survey of Chemical Substances in Consumer Products, No. 77 Danish Technological Institute. (Non disponible en français).
[NIOSH] National Institute for Occupational Safety and Health. 1981. Health hazard evaluation report No. HETA-81-177, 178-988, University of Washington, Seattle. National Institute of Occupational Safety and Health, Cincinnati, OH, USA. (Disponible en anglais seulement).
Norbäck D, Wieslander G, Edling C. 1995. Occupational exposure to volatile organic compounds (VOCs), and other air pollutants from the indoor application of water-based paints. Ann Occup Hyg. 39(6):783-794. (Non disponible en français). (Disponible en anglais seulement).
NRC. 1997. Modelling of Volatile Organic Compound (VOC) Emissions from Building Materials/Furnishings – A literature review. Internal report no IRC-IR-755. Dec. 1997. (Disponible en anglais seulement).
[NTP] National Toxicology Program. 2004. Review. NTP-CERHR expert panel report on the reproductive and developmental toxicity of methanol. Repro Tox. 18:303-390. (Disponible en anglais seulement).
[NTP] National Toxicology Program. 2016. NTP Investigation of Dimethyl Glutarate. Genetic toxicity evaluation of dimethyl glutarate in Salmonella/E.coli mutagenicity test or Ames test. Study A20348. US Department of Health and Human Services. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 1993. SIDS Initial Assessment Report: Texanol: CAS No:25265-77-4. UNEP Publications. 47 pages. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 1995. SIDS Initial Assessment Report: 2,2,4-Trimethyl-1,3-pentanediol diisobutyrate: CAS No. 6846-50-0. SIAM [SIDS Initial Assessment Meeting] 3; 13-15 February 1995. UNEP Publications. Williamsburg, Virginia, USA. 34 pages. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2002. SIDS Initial Assessment Report: Triacetin: CAS No. 102-76-1. SIAM [SIDS Initial Assessment Meeting] 15; 22-25 October 2002. UNEP Publications. Boston. USA. 169 pages. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2003a. SIDS Initial assessment report: Isobutyl Acetate: CAS No. 110-19-0. SIAM [SIDS Initial Assessment Meeting] 17; 2003 November 11-14; Arona, Italy: 1-24. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development (OECD). 2003b. SIDS Initial Assessment Report 1-methoxy-2-propanol acetate (CAS No. 108-65-6). UNEP Publication. Boston. USA. 228 pages. (Disponible en anglais seulement).
[OECD] Organization for Economic Cooperation and Development. 2004. SIDS Initial Assessment Profile. Methanol. Summary Conclusions of the SIAR. SIAM 19. 19-22 October. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2006. SIDS Initial Assessment Report for SIAM 22: Long chain alcohols. Paris, France. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2003. SIDS initial assessment report: n-butyric acid. CAS No. 107-09-4. SIDS Initial Assessment Meeting 16; May 27-30, 2003; Helsinki, Finland. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2008. SIDS Initial assessment report: n-Propyl Acetate: CAS No. 109-60-4. SIAM [SIDS Initial Assessment Meeting] 27, 2008 October 14-16; Ottawa, Canada. 33 pages. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2013. SIDS Initial assessment report: methyl laurate: CAS No. 111-82-0. CoCAM [Cooperative Chemicals Assessment Meeting] 4; 2013 April 16-18; Paris, France: 1-22. (Disponible en anglais seulement).
[OECD] Organisation for Economic Co-operation and Development. 2014. SIDS Initial assessment profile (SIAP). Aliphatic Acids Category. CoCAM [Cooperative Chemicals Assessment Meeting] 6. 2014 September 30-October 3: 1-41. (Disponible en anglais seulement).
OECD QSAR Toolbox [read-across tool]. 2014. Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement).
Onghena M, Van Hoeck E, Negreira N, Quirynen L, Van Loco J, Covaci A. 2016. Evaluation of the migration of chemicals from baby bottles under standardised and duration testing conditions. Food Addit Contam Part A. 33(5):893-904. (Disponible en anglais seulement).
Rogers JM, Mole ML, Chernoff N, Barbee BD, Turner CI, Logson TR, Kavlock RJ. 1993. The developmental toxicity of inhaled methanol in the CD-1 mouse, with quantitative dose-response modeling for estimation of benchmark doses. Teratology. 47:175-188. (Disponible en anglais seulement).
Sahlberg B, Gunnbjörnsdottir M, Soon A, Jogi R, Gislason T, Wieslander G, Janson C, Norback D. 2013. Airborne molds and bacteria, microbial volatile organic compounds (MVOC), plasticizers and formaldehyde in dwellings in three North European cities in relation to sick building syndrome (SBS). Sci Total Environ. 444:433-440. (Disponible en anglais seulement).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ont.), gouvernement du Canada. (Disponible en anglais seulement).
Santé Canada. 2010a. Étude d’évaluation de l'exposition à Windsor (2005-2006) [PDF] : Sommaire des données d’échantillonnage des composés organiques volatiles. Ottawa (Ont.), gouvernement du Canada. 85 p.
Santé Canada. 2010b. Étude de la qualité de l’air intérieur à Regina (2007) [PDF] : Sommaire des données d’échantillonnage des composés organiques volatiles. Ottawa (Ont.), gouvernement du Canada. 164 p.
Santé Canada. 2012. Étude de la qualité de l’air intérieur à Halifax (2009) : Sommaire des données des composés organiques volatils (COV). Ottawa (Ont.), gouvernement du Canada. 49 p.
Santé Canada. 2013a. Étude de la qualité de l’air intérieur à Edmonton (2010) [PDF] : Sommaire des données des composés organiques volatils (COV). Ottawa (Ont.), gouvernement du Canada. 51 p.
Santé Canada. 2015. Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, Cycle 2.2, Nutrition (2004), réalisé par Statistique Canada, fichier partagé. Ottawa (Ont.).
Santé Canada. [modifié le 14 décembre 2015]. Liste critique des ingrédients de cosmétiques – Liste des ingrédients dont l'usage est interdit dans les cosmétiques. Ottawa (Ont.), Santé Canada, Direction de la Sécurité des produits de consommation et des produits dangereux. [Accès le 27 novembre 2017].
Santé Canada. 2015a. Environmental Assessment Unit Drinking Water Spreadsheets [format Excel]. Ottawa (Ont.), Santé Canada. [Accès le 3 mars 2020]. (Disponible en anglais seulement).
Santé Canada. 2016. Document sur l'approche scientifique – Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2017. Tableau de la consommation d’eau fondé sur l’Enquête sur la santé dans les collectivités canadiennes, Cycle 2.2, Nutrition (2004), réalisé par Statistique Canada, fichier partagé..
Santé Canada. 2018. Draft backgrounder document on default values for breast milk and formula intakes. Rapport non publié. Ottawa (Ont.), gouvernement du Canada. (Disponible en anglais seulement).
Santé Canada. 2019. Cinquième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Ottawa (Ont.), gouvernement du Canada.
SCREEN3 [computer model]. 2011. Ver. 3.5.0. Research Triangle Park (NC): US Environmental Protection Agency, Office of Air Quality Planning and Standards, Emissions, Monitoring, and Analysis Division. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2011a. LePage GS-121 VOC Gutter Sealant [PDF]. Mississauga (ON): Henkel. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2011b. Krylon Camouflage Paint System. Cleveland (OH): Krylon. [accès le 2 octobre 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2012. Water based paints for paint sets [PDF]. Rockford (IL): The Testor Corporation. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2013a. LePage Pres-Tite Contact Cement [PDF]. Mississauga (ON): Henkel. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2013b. Great Stuff Work Wipes [PDF]. Calgary (AB): Dow. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2013c. PC Petrifier. Allentown (PA): Protective Coatings Co. Version de 2018 disponible en français [PDF].
[SDS] Safety Data Sheet 2014a. Hot Shine Tire Coating Aerosol [PDF]. Irvine (CA): Meguiar’s. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2014b. 3M Adhesive Remover. St. Paul (MN): 3M. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2014c. Loctite PL 400 Subfloor Adhesive [PDF]. Rocky Hill (CT): Henkel. Version française de 2021.
[SDS] Safety Data Sheet 2014d. Dupli-Color Self-Etching Primer [PDF]. Cleveland (OH): Dupli-Color Products Company. [accès le 2 octobre 2018]. (Disponible en anglais seulement).
SDS] Safety Data Sheet 2014e. Meguiar’s G150 Hot Rims Brake Dust Blocker. Irvine (CA): Meguiar’s. [accès le 2 octobre 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2014f. Wallpaper Hang-Rite. Montreal (QC): Swing Paints Ltd. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2014g. Scrubs in-a bucket [PDF]. Olathe (KA): ITW Pro Brands. Version française de 2013 disponible [PDF].
[SDS] Safety Data Sheet 2015a. Stainless Steel Cleaner and Polish. Addison (IL): Sprayaway Inc. [accès le 26 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015b. Epoxy Kit Premium Clear Low VOC. Concord (ON): Rust-Oleum Consumer Brands Canada. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015c. UHU All Purpose Adhesive [PDF]. Baden, Germany: UHUl. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015d. Dupli-color Scratch Fix All-in-1, Poppy Red [PDF]. Cleveland (OH). [accès le 5 septembre 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015f. Kilz Odorless Aerosol. Imperial (MO). Masterchem Industries LLC. [accès le 31 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015h. Kwik Seal Plus Premium Kitchen and Bath Adhesive Sealant White [PDF]. Scarborough (ON). Dap. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2015i. Black Magic Foaming All Wheel Cleaner [PDF]. Houston (TX): ITW Global Brands. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2016a. Everglaze Glazing Spot Putty [PDF]. Cincinnati (OH): Evercoat. [accès le 3 octobre 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2016b. Waterborne Swimming Pool Paint. Concord (ON): Insl-X; manufactured for Benjamin Moore and Co. Ltd. [accès le 30 janvier 2018]. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2017a. Krylon Looking Glass Paint. Cleveland (OH): Krylon Products Group. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2017b. Scratch-Seal. Cleveland (OH): Dupli-color Products Company. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2017c. Krylon Make it Last! Clear coat Sealer; Mississauga (ON): Krylon Products Group. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2017d. Fastset concrete crack repair [PDF]. Atlanta (GA): Quikrete Cement and Concrete Products. (Disponible en anglais seulement).
[SDS] Safety Data Sheet 2018b. 3M Headliner & Fabric Adhesive. St. Paul (MN): 3M Canada Company. [accès le 27 août 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet 2018e. Bondo Gray Filler Primer PN 720. St. Paul (MN): 3M. [accès le 2 octobre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet 2020. 3M Dynatron Glazing and Spot Putty. St. Paul (MN): 3M. [accès le 31 mars 2020]. (Disponible en anglais seulement)
Seal N, Weaver M, Best LG. 2011. Correlates of the FTO gene variant (rs9939609) and growth of American Indian infants. Genet Test Molec Biomark. 15(9):633-8. (Disponible en anglais seulement).
Sicé J. 1966. Tumor-promoting activity of n-alkanes and l-alkanols. Toxicol App Pharmacol: 9(1):70-74. (Disponible en anglais seulement).
Simoneau C, Van den Eede L, Valzacchi S. 2012. Identification and quantification of the migration of chemicals from plastic baby bottles used as substitutes for polycarbonate. Food Addit Contam: Part A. 29(3):469-480. (Disponible en anglais seulement).
Stofberg J, Grundschober F. 1987. Consumption Ratio and Food Predominance of Flavoring Materials. Perfumer and Flavorist. 12(4);27. (Disponible en anglais seulement).
Study Submission. 2001. Étude confidentielle non publiée présentée à Santé Canada. Ottawa (Ont.), Bureau d'évaluation du risque des substances existantes, Santé Canada, gouvernement du Canada.
Svendsen N, Pedersen SF, Hansen OC, Mossing JT, Bernth. 2004. Survey of chemical substances in toothbrushes [PDF]. No. 42. Danish Technological Institute. 93 pp. (Non disponible en français).
Tonning K, Jacobson E, Pederson E. Strange M, Poulsen P, Moller L, Boyd H. 2009. Survey and health assessment of the exposure of 2-year-olds to chemical substances in consumer products. Survey of Chemical Substances in Consumer Products No. 102. (Disponible en anglais seulement).
[US CPSC] United States Consumer Product Safety Commission. 2010. Phthalates and phthalates substitutes in children’s toys. Memo from M. Dreyfus to M. Babich; March 31 2010. (Disponible en anglais seulement).
[US eCFR]. US Electronic Code of Federal Regulations. 2017. Title 21, c. 1, subchapter B, part 184, subpart B. Washington (DC): National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 1992. Screening procedures for estimating the air quality impact of stationary sources, revised. Washington (DC): US EPA, Office of Air Quality. p 102. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2005. Interim Acute Exposure Guideline Levels (AEGLs) - Methanol. Washington (DC): US EPA. National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2009. Screening-Level Hazard Characterization, Sulfosuccinates Category, Succinic acid, sulfo-, 1,4-bis(2-ethylhexyl) ester, sodium salt (CASRN 577-11-7), Succinic acid, sulfo-, 1,4-bis(1,3-dimethylbutyl) ester, sodium salt (CASRN 2373-38-8), Succinic acid, sulfo-, 1,4-bis(dicyclohexyl) ester, sodium salt (CASRN 23386-52-9). Hazard Characterization Document, September 2009. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2011. Chapter 6: Inhalation Rates. Exposure Factors Handbook 2011 Edition (Final). Washington (DC): US EPA. EPA/600/R-09/052F. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2013a. Toxicological Review of Methanol (Noncancer) (CAS RN 67-56-1) in support of summary information on the integrated risk information system (IRIS) [PDF]. (EPA/635/R-11-001) Washington (DC): US EPA. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2013b. IRIS Chemical Assessment Summary. Methanol (CAS RN 67-56-1) [PDF]. Washington (DC): US EPA. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2014. Dimethyl esters of glutaric acid (i.e., dimethyl glutarate), succinic acid (i.e. dimethyl succinate), and Adipic Acid (i.e., Dimethyl adipate); exemption from the requirement of a tolerance [PDF]. Document Number 2013-31582. January 6, 2014. Rules and Regulations. Federal Register Vol. 79, No. 3:582-588. (Disponible en anglais seulement).
[US FDA] United States Food and Drug Administration. 2019. Premarket Tobacco Product Applications for Electronic Nicotine Deliver Systems: Guidance for Industry. (Disponible en anglais seulement).
[USGS] US Geological Survey. 2016. National Water information Systems data available on the World Wide Web (USGS Water Data for the Nation). [accès le 30 novembre 2017]. (Disponible en anglais seulement).
Van Duuren BL and Goldschmidt BM. 1976. Cocarcinogenic and tumor-promoting agents in tobacco carcinogenesis. J Natl Cancer Inst: 56(6):1237- 1242. (Disponible en anglais seulement).
Van Veen MP, Fortezza F, Spaans E, Mensinga TT. 2002. Non-professional paint stripping, model prediction and experimental validation of indoor dichloromethane levels. Indoor Air. 12:92-97. (Disponible en anglais seulement).
Weerdesteijn MCH, Bremmer HJ, Zeilmaker MJ, van Veen MP. 1999. Hygienic Cleaning Products used in the kitchen; Exposure and risks [PDF]. RIVM Rapport 612810008. (Non disponible en français).
Wieslander G, Norbäck D, Björnsson E, Janson C, Boman G. 1997. Asthma and the indoor environment: the significance of emission of formaldehyde and volatile organic compounds from newly painted indoor surfaces. Int Arch Occup Environ Health. 69:115-124. (Disponible en anglais seulement).
Wieslander G, Norbäck D. 2010. Ocular symptoms, tear film stability, nasal patency, and biomarkers in nasal lavage in indoor painters in relation to emissions from water-based paint. Int Arch Occup Environ Health. 83(7):733-741. (Disponible en anglais seulement).
[Wilson and Meridian] Wilson Scientific Consulting Inc. and Meridian Environmental Inc. 2015 modified. Critical review of soil ingestion rates for use in contaminated site human health risk assessments in Canada. Rapport d’entrepreneur préparé pour la Division des lieux contaminés, Programme de la sécurité des milieux, Santé Canada, Ottawa (Ont.). (Disponible en anglais seulement).
Wishart DS, Jewison T, Guo AC, Wilson M, Knox C, et al. 2013. HMDB 3.0 — The Human Metabolome Database in 2013. Nucleic Acids Res. Jan;41(Database issue):D801-7. [accès en janvier 2018]. (Disponible en anglais seulement).
[WHO] World Health Organization. 1974 Toxicological evaluation of some food additives including anticaking agents, antimicrobials, antioxidants, emulsifiers and thickening agents. Prepared by the Joint FAO/WHO Expert Committee on Food Additives. Geneva (CH): World Health Organization, International Programme on Chemical Safety. (Disponible en anglais seulement).
[WHO] World Health Organization. 1998. Safety Evaluation of Certain Food Additives and Contaminants (WHO Food Additive Series 40). Prepared by the forty-ninth meeting of the Joint FAO/WHO Expert Committee on Food Additives. Esters of aliphatic acyclic primary alcohols with aliphatic linear saturated carboxylic acids. Geneva (CH): World Health Organization, International Programme on Chemical Safety. (Disponible en anglais seulement).
[WHO] World Health Organization. 2009. Evaluation of Certain Food Additives (WHO Technical Report Series 952) [PDF]. Sixty-ninth report of the Joint FAO/WHO Expert Committee on Food Additives. Geneva (CH): World Health Organization, Food and Agriculture Organization of the United Nations. (Disponible en anglais seulement).
Won D, Lusztyk E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Final Report. Ottawa (ON): NRC. 158 p. Report No.: B3332.2. (Disponible en anglais seulement).
Won D, Yang W. 2012. Material Emission Information from 105 Building Materials and Consumer Products. Final Report. Ottawa (ON): NRC. 165 p. Report No.: B3341.1. (Disponible en anglais seulement).
Won D, Nong G, Yang W, Collins P. 2014. Material Emissions Testing: VOCs from Wood, Paint, and Insulation Materials. Final Report. Ottawa (ON): NRC. 165 p. Report No.: A1-000342.2. (Disponible en anglais seulement).
Annexes
Annexe A. Propriétés physico-chimiques des analogues des substances du groupe des esters
|
Nom commun (n° CAS) |
MM (g/mol) | Pression de vapeur (mm Hg) | Solubilité dans l’eau (mg/L) | Log Koe (sans dimension) | Analogue(s) utilisé(s) pour éclairer l’évaluation de la substance |
|---|---|---|---|---|---|
|
Laurate de méthyle (111-62-6) |
214,3464 | 0,00411 | 1,13 | 5,41 |
Hexanoate de méthyle Butyrate de méthyle |
|
Acétate d’éthyle (141-78-6) |
116,159 | 11,5 | 8400 | 1,78 | Acétate de propyle |
|
Acétate de n-butyle (123-86-4) |
60,0952 | 21 | 1,00E+06 | 0,25 | Acétate de propyle |
|
Esters dibasiques (DBE/DME) Adipate de diméthyle (627-93-0) |
174,195 | - | 6000 | 1,03 | Glutarate de diméthyle |
|
Esters dibasiques (DBE/DME) Succinate de diméthyle (106-65-0) |
146,141 | 0,422 | 2,50E+04 | 0,35 | Glutarate de diméthyle |
|
Caprylate de propylheptyle (868839-23-0) |
284,4804 | - | 0,004287 | - | Myristate de tétradécyle |
|
Laurate de 2-éthylhexyle (20292-08-4) |
312,534 | 3,16E-05 | 1,44E-03 | 8,03 | Myristate de tétradécyle |
|
Laurate d’isodécyle (94247-10-6) |
340,5876 | - | 4,21E-05 | - | Myristate de tétradécyle |
|
Myristate d’isopropyle (110-27-0) |
270,4536 | 3,29E-04 | 0,0014 | 7,17 | Myristate de tétradécyle |
|
Oléate d’isodécyle (59231-34-4) |
422,733 | - | 6,13E-08 | 12,759 | Myristate de tétradécyle |
|
Oléate de tétradécyle (22393-85-7) |
478,84 | 3,44E-10 | 4,93E-10 | 14,4 | Myristate de tétradécyle |
|
Docosanoate de docosyle (17671-27-1) |
649,177 | 1,21E-13 | 2,34E-16 | 21,96 | Myristate de tétradécyle |
|
Stéarate de 2‑éthylhexyle (22047-49-0) |
396,6948 | - | 4,02E-07 | 11,994 | Myristate de tétradécyle |
|
Acide 2‑méthoxypropanoïque (4324-37-2) |
104,104 | 1,17 | 4,72E+05 | -0,26 | Acétate de 2‑méthoxypropyle |
Abréviations : PM = Poids moléculaire; Koe = coefficient de partage octanol-eau.
Annexe B. Estimations de l’absorption quotidienne par les milieux naturels et les aliments
| Catégorie d’âge | Air ambiant a | Air intérieur b | Eau potable c | Aliments et boissons d | Absorption totale |
|---|---|---|---|---|---|
| 0 à 5 mois e (nourris au lait maternel)f | 0,04 | 5,91 | S.O. | 0,00 | 5,95 |
| 0 à 5 mois e (nourris à la préparation pour nourrissons) g | 0,04 | 5,91 | 10,4 | 0,00 | 16,4 |
| 6 à 11 mois h | 0,04 | 5,97 | 6,7 | 28,1 | 40,8 |
| 1 an i | 0,05 | 7,32 | 2,6 | 33,1 | 43,1 |
| 2 à 3 ans j | 0,04 | 6,17 | 2,3 | 28,3 | 36,8 |
| 4 à 8 ans k | 0,03 | 4,86 | 1,8 | 21,9 | 28,6 |
| 9 à 13 ans l | 0,02 | 3,33 | 1,4 | 15,0 | 19,8 |
| 14 à 18 ans m | 0,02 | 2,58 | 1,4 | 11,2 | 15,2 |
| 19 ans et plus n | 0,01 | 2,05 | 1,7 | 12,1 | 15,85 |
Abréviation : S.O. = sans objet.
a Estimations de l’exposition par l’air ambiant basées sur le 95e centile des mesures de l’acétate de méthyle (0,57 µg/m³) dans l’étude d’Edmonton (Santé Canada 2013a). On a présumé que les Canadiens passaient 3 heures par jour à l’extérieur (Santé Canada 1998).
b Estimations de l’exposition par l’air intérieur basées sur le 95e centile des concentrations mesurées dans l’air intérieur (11,5 µg/m³) dans l’étude de Windsor (Santé Canada 2010a). On a présumé que les Canadiens passaient 21 heures par jour à l’intérieur (Santé Canada, 1998).
c Les concentrations dans les eaux de surface ont été estimées à l’aide d’un modèle interne d’eau potable (scénario de rejets industriels) (Santé Canada 2015a); on a estimé une valeur pour les eaux de surface de 79,7 µg/L, valeur qui a été utilisée pour estimer l’absorption quotidienne par l’exposition à l’eau potable.
d Les estimations de l’exposition de la population générale par les aliments au 90e centile sont basées sur la présence naturelle d’acétate de méthyle dans les aliments. Les données sur les aliments sont basées sur les concentrations figurant dans la base de données Volatile Compounds in Food (Njissen et al. 1963-2016). Les taux de consommation alimentaire sont décrits dans Santé Canada (2015).
e On présume que le nourrisson pèse 6,3 kg (Santé Canada 2015b), respire 3,7 m³ d’air par jour (US EPA 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume que les soins habituellement prodigués n’ont pas entraîné d’ingestion de sol.
f On présume que les nourrissons allaités seulement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire. On n’a trouvé aucune étude de surveillance de l’acétate de méthyle dans le lait maternel.
g Nourris exclusivement avec des préparations pour bébés, en supposant l’absorption de 0,826 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. On n’a trouvé aucune étude de surveillance de l’acétate de méthyle dans les préparations pour nourrissons. Par conséquent, l’absorption par voie alimentaire est due seulement à l’eau. Voir la note de bas de page sur l’eau potable pour plus de détails.
h On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015b), respire 5,4 m³ d’air par jour (US EPA 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). Pour les enfants allaités, on a présumé une consommation de 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les enfants nourris avec une préparation, on a présumé une consommation de 0,764 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
i On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
l On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
m On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
n On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
| Catégorie d’âge | Air ambiant a | Air intérieur b | Eau potable c | Sol d | Absorption totale |
|---|---|---|---|---|---|
| 0 à 5 moise(nourris au lait maternel)f | 0,34 | 0,01 | S.O. | S.O. | 0,35 |
| 0 à 5 moise (nourris à la préparation pour nourrissons)g | 0,34 | 0,01 | 0,004 | S.O. | 0,39 |
| 6 à 11 mois h | 0,34 | 0,01 | 0,03 | 1,4E-6 | 0,38 |
| 1 an i | 0,42 | 0,01 | 0,01 | 1,4E-6 | 0,44 |
| 2 à 3 ans j | 0,35 | 0,01 | 9,17E-3 | 7,4E-7 | 0,37 |
| 4 à 8 ans k | 0,28 | 8,23E-3 | 7,37E-3 | 6,81E-7 | 0,29 |
| 9 à 13 ans l | 0,19 | 5,68E-3 | 5,64E-3 | 2,96E-7 | 0,20 |
| 14 à 18 ans m | 0,15 | 4,40E-3 | 5,63E-3 | 4,1E-8 | 0,16 |
| 19 ans et plus n | 0,12 | 3,50E-3 | 6,62E-3 | 3,89E-8 | 0,13 |
Abréviation : S. O. = sans objet.
a D’après les résultats du modèle SCREEN3, une concentration dans l’air ambiant (4,61 µg/m³) a été utilisée comme approche prudente pour estimer l’exposition quotidienne par l’air ambiant. On a présumé que les Canadiens passaient 3 heures par jour à l’extérieur (Santé Canada 1998).
b On n’a trouvé aucune donnée de surveillance dans l’air ambiant ou l’air intérieur au Canada. Par conséquent, les résultats de ChemCAN pour la concentration dans l’air (1,96 ng/m³) ont été utilisés comme approche prudente pour estimer l’exposition quotidienne par l’air ambiant et par l’air intérieur. On a présumé que les Canadiens passaient 21 heures par jour à l’intérieur (Santé Canada, 1998).
c On n’a trouvé aucune donnée sur la surveillance de l’eau au Canada. Par conséquent, on a utilisé les résultats de ChemCAN pour la concentration dans l’eau (0,032 µg/L) pour estimer l’absorption quotidienne par l’eau potable.
d On n’a trouvé aucune donnée sur la surveillance des sols au Canada. Par conséquent, on a utilisé les résultats de ChemCAN pour la concentration dans le sol (0,18 ng/g) pour estimer l’absorption quotidienne par le sol.
e On présume que le nourrisson pèse 6,3 kg (Santé Canada 2015b), respire 3,7 m³ d’air par jour (US EPA 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume que les soins habituellement prodigués n’ont pas entraîné d’ingestion de sol.
f On présume que les nourrissons allaités seulement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire. Aucune donnée de surveillance du lait maternel pour l’acétate de 2‑méthoxypropyle n’a été trouvée.
g Nourris exclusivement avec des préparations pour bébés, en supposant l’absorption de 0,826 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Aucune donnée de surveillance sur l’acétate de 2‑méthoxypropyle dans les préparations pour nourrissons n’a été trouvée; par conséquent, l’absorption quotidienne par voie alimentaire est due uniquement à l’eau. Voir la note de bas de page sur l’eau potable pour plus de détails.
h On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015b), respire 5,4 m³ d’air par jour (US EPA 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). Pour les enfants allaités, on a présumé une consommation de 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les enfants nourris avec une préparation, on a présumé une consommation de 0,764 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
i On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
l On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
m On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
n On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
| Catégorie d’âge | Air ambiant a | Air intérieur b | Poussière c | Absorption totale |
|---|---|---|---|---|
| 0 à 5 mois d (nourris au lait maternel) e | 14,7 | 103,0 | 2,45 | 120,2 |
| 0 à 5 mois d (nourris à la préparation pour nourrissons) f | 14,7 | 103,0 | 2,45 | 120,2 |
| 6 à 11 mois g | 14,9 | 104,1 | 2,12 | 121,1 |
| 1 an h | 18,2 | 127,6 | 2,28 | 148,1 |
| 2 à 3 ans i | 15,4 | 107,6 | 1,02 | 124,0 |
| 4 à 8 ans j | 12,1 | 84,7 | 0,76 | 97,5 |
| 9 à 13 ans k | 8,29 | 58,1 | 0,41 | 66,8 |
| 14 à 18 ans l | 6,43 | 45,0 | 0,02 | 51,4 |
| 19 ans et plus m | 5,11 | 35,8 | 0,03 | 40,9 |
a On n’a trouvé aucune donnée de surveillance dans l’air ambiant ou l’air intérieur au Canada; la concentration maximale dans l’air ambiant, d’après l’air intérieur canadien (200,5 µg/m³) (Won et Lusztyk 2011), a été utilisée pour estimer l’exposition quotidienne par l’air ambiant. On a présumé que les Canadiens passaient 3 heures par jour à l’extérieur (Santé Canada 1998).
b La concentration dans l’air intérieur est basée sur la concentration maximale dans des échantillons d’air intérieur mesurés dans la ville de Québec (200,5 µg/m³) (Won et Lusztyk 2011). On a présumé que les Canadiens passaient 21 heures par jour à l’intérieur (Santé Canada, 1998).
c La valeur maximale de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans la poussière de maisons (715 µg/g) dans la ville de Québec a été utilisée pour estimer l’exposition quotidienne par la poussière (Won et Lusztyk 2011).
d On présume que le nourrisson pèse 6,3 kg (Santé Canada 2015b), respire 3,7 m³ d’air par jour (US EPA 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume que les soins habituellement prodigués n’ont pas entraîné d’ingestion de sol.
e On présume que les nourrissons allaités seulement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
f Nourris exclusivement avec des préparations pour bébés, en supposant l’absorption de 0,826 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
g On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015b), respire 5,4 m³ d’air par jour (US EPA 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). Pour les enfants allaités, on a présumé une consommation de 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les enfants nourris avec une préparation, on a présumé une consommation de 0,764 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
h On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
l On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
m On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
| Catégorie d’âge | Eau potable a | Aliments et boissons b | Absorption totale |
|---|---|---|---|
| 0 à 5 mois c (nourris au lait maternel) d | S.O. | S.O. | S.O. |
| 0 à 5 mois c (nourris à la préparation pour nourrissons) e | 0,07 | S.O. | 0,07 |
| 6 à 11 mois f | 0,05 | 0 | 0,05 |
| 1 an g | 0,02 | 270,7 | 270,7 |
| 2 à 3 ans h | 0,02 | 337,5 | 337,5 |
| 4 à 8 ans i | 0,01 | 274,5 | 274,5 |
| 9 à 13 ans j | 9,9E-3 | 210,0 | 210,0 |
| 14 à 18 ans k | 9,9E-3 | 134,2 | 134,2 |
| 19 ans et plus l | 0,01 | 58,6 | 58,6 |
Abréviation : S. O. = sans objet.
a On n’a trouvé aucune donnée sur la surveillance de l’eau au Canada. Par conséquent, la concentration dans l’eau (calculée à l’aide des feuilles de calcul de l’Unité d’évaluation environnementale (UEE) du BECSN pour l’eau potable) (0,56 µg/L) a été utilisée pour estimer l’absorption quotidienne par l’eau potable.
b Valeurs dans les aliments obtenues de la Direction des aliments. Elles représentent les valeurs au 95e centile de chaque groupe d’âge d’après la consommation de saucisses et de boissons aux fruits, en supposant que le docusate sodique est présent à la concentration maximale permise (à titre d’additif alimentaire autorisé). Les taux de consommation alimentaire sont décrits dans Santé Canada (2015).
c On présume que le nourrisson pèse 6,3 kg (Santé Canada 2015b), respire 3,7 m³ d’air par jour (US EPA 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume que les soins habituellement prodigués n’ont pas entraîné d’ingestion de sol.
d On présume que les nourrissons allaités seulement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
e Nourris exclusivement avec des préparations pour bébés, en supposant l’absorption de 0,826 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. On n’a trouvé aucune donnée de surveillance du docusate sodique dans les préparations pour nourrissons. Par conséquent, l’apport par les aliments est dû uniquement à l’eau. Voir la note de bas de page sur l’eau potable pour plus de détails.
f On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015b), respire 5,4 m³ d’air par jour (US EPA 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). Pour les enfants allaités, on a présumé une consommation de 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les enfants nourris avec une préparation, on a présumé une consommation de 0,764 L d’eau par jour (Santé Canada 2018), l’eau servant à reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
g On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
l On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
Annexe C. Paramètres d’exposition
Annexe C-1. Estimations de l’absorption quotidienne de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène par les nourrissons, due à sa présence dans les biberons
Les concentrations de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans les préparations pour nourrissons ont été associées à l’utilisation de biberons (Onghena et al. 2016; Simoneau et al. 2012). Bien que de nouveaux biberons puissent être introduits à tout moment au cours de la petite enfance, on a conçu un scénario pour couvrir les tout premiers temps des nourrissons (c.‑à‑d. 0 à 1 mois) à titre d’approche prudente en supposant que : 1) les concentrations de diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène dans les préparations pour nourrissons seraient observées jusqu’à la moyenne la plus élevée rapportée dans la littérature (348 µg/kg), sur la base de la troisième migration à partir des biberons à 70 °C pendant 2 heures (Onghena et al. 2016); et 2) ce groupe d’âge serait strictement nourri au biberon.
| Groupe d’âge des nourrissons | Poids corporel (kg) | Conc. maximale (µg/kg) | Taux d’absorption moyen (kg/j) | Taux d’absorption maximal (kg/j) | Absorption minimale (conc. maximale + absorption moyenne) (μg/kg p.c./j) | Absorption maximale (conc. maximale + absorption maximale) (µg/kg p.c./j) |
|---|---|---|---|---|---|---|
| 0 à 1 mois | 3,9 a | 348 b | 0,644 c | 1,08 c | 57,5 | 96,4 |
Abréviations : p.c. = poids corporel; max. = maximum; conc. = concentration.
a Basé sur le poids moyen d’un nourrisson de sexe féminin de 3,9 kg (NCHS 2000).
b Valeur de migration basée sur des tests classiques sur un biberon en silicone, d’après Onghena et al. (2016). L’étude de Simoneau et al. 2012 a été considérée comme une étude d’évaluation préliminaire et portait sur la migration précoce à partir des biberons.
c Consommation moyenne et maximale de préparation pour nourrissons de 644 g/j et de 1 080 g/j respectivement (INSPQ 2001).
Annexe C-2. Estimations de l’absorption quotidienne par les enfants de 6 à 11 mois due au mâchonnement et à l’exposition cutanée au diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène d’après les données sur les jouets en plastique destinés aux enfants de 6 mois à 4 ans
Les taux de migration du diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène provenant des jouets en plastique dans la salive simulée ont été utilisés pour estimer l’exposition des jeunes enfants qui portent les jouets à la bouche et leur exposition cutanée par les jouets en plastique (Babich 2010). Les données sur les taux de migration provenant du RIVM et de l’ANSES ont également été prises en compte. Cependant, la valeur moyenne maximale de la CPSC a été utilisée dans l’évaluation (VWA 2009, citée par Janssen et Bremmer 2009; ANSES 2016).
Les paramètres et l’estimation de l’absorption pour l’exposition orale par la mise à la bouche d’objets ainsi que l’exposition potentielle totale par contact cutané ou la main à la bouche sont présentés dans le tableau C-2.
Exposition par voie orale ou par mise à la bouche : On a supposé qu’un enfant d’un poids corporel de 9,1 kg (âgé de 6 à 11 mois) porte un jouet à sa bouche pendant 1 à 2 heures par jour (cas moyen et pire cas).
Exposition cutanée et de la main à la bouche : On a supposé qu’un enfant d’un poids corporel de 11 kg (âgé de 1 an) avait un contact cutané avec une surface de 100 cm2 d’un jouet pendant 3 heures par jour. Comme on n’avait aucune donnée sur l’absorption cutanée du diisobutyrate de 2,4-trimethyl-1,3-pentanediol, on a supposé que toute la substance déposée sur la peau serait absorbée. Cette hypothèse tient compte également de l’exposition potentielle par le transfert de la main à la bouche.
| Groupe d’âge | p.c. (kg) | Migration (µg/min × 10 cm2) | Temps de mâchonnement / contact (min/j) | Superficie mise à la bouche / touchée (cm2) | Absorption (µg/kg p.c./j) |
|---|---|---|---|---|---|
| 6 à 11 mois | 9,1 | 11,3 a | 60 – 120 | 10 | 74 – 149 |
| 1 an | 11 | 11,3 a | 180 | 100 | 1849 |
Abréviation : p.c. = poids corporel.
a US CPSC (2010).
Annexe C-3. Paramètres permettant d’estimer l’exposition aux produits disponibles aux consommateurs
L’exposition aux produits a été estimée à l’aide du logiciel ConsExpo Web (2016).
L’exposition par les cosmétiques a été estimée à l’aide du logiciel ConsExpo Web (2016), combinée à des paramètres spécifiques obtenus dans la littérature publiée. Les estimations de l’exposition ont été calculées en fonction du poids corporel par défaut de 74 kg pour les adultes (19 ans et plus), 62 kg pour les 14 à 18 ans, 42 kg pour les 9 à 13 ans,15 kg pour les 2 à 3 ans, 11 kg pour les nourrissons de 1 an, 9,1 kg pour les 6 à 11 mois et 6,3 kg pour les 0 à 5 mois (Santé Canada 2015). Les paramètres d’exposition par inhalation ou par voie cutanée estimés pour les cosmétiques et autres produits disponibles aux consommateurs sont décrits dans le tableau C-3. Sauf indication contraire, les valeurs des paramètres sont tirées de la fiche d’information ConsExpo pertinente pour le scénario présenté.
| Scénario d’exposition | Hypothèses |
|---|---|
| Scénarios d’utilisation des cosmétiques | - |
| Exfoliant (mécanique) (adolescents/adultes) |
Fréquence d’utilisation : Quantité de produit : Facteur de rétention : 0,1 |
|
Vernis à ongles (2-3 ans/adulte) (acétate de méthyle, acétate de 2‑méthoxypropyle, diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène, docusate sodique) On suppose que 2 couches de vernis à ongles sont appliquées aux ongles des mains et des orteils. |
D’après la fiche d’information sur les cosmétiques (RIVM 2007b), avec des renseignements additionnels sur les quantités appliquées et les superficies couvertes; modèle d’évaporation, car les substances sont volatiles. Durée de l’exposition : 35 minutes. Taux de renouvellement d’air : 1 h-1 Voie cutanée : |
| Dissolvant pour vernis à ongles (2-3 ans/9-13 ans; adultes) (acétate de méthyle, hexanoate de méthyle, diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
D’après la fiche d’information sur les cosmétiques (RIVM 2007b), avec des renseignements additionnels sur les quantités appliquées et les superficies couvertes; modèle d’évaporation, car les substances sont volatiles. Inhalation : Voie cutanée : |
| Adhésif pour maquillage pour les yeux (valeur basée sur l’utilisation de mascara) (adultes/enfants) (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
Fréquence d’utilisation : Quantité de produit : Facteur de rétention : 1 |
| Huile de bain (adultes/adolescents) (docusate sodique) |
Quantité de produit : Facteur de rétention : 0,001 (NICNAS 2009) |
| Nettoyant facial (enfants/adultes) (docusate sodique) |
Fréquence d’utilisation : Quantité de produit : Facteur de rétention : 0,01 |
| Revitalisant capillaire : à rincer (2–3 ans/adultes) (docusate sodique) |
Fréquence d’utilisation : Quantité de produit : Facteur de rétention : 0,01 |
| Produit parfumant : huile de massage (nourrissons/adultes) (docusate sodique) |
Quantité de produit : |
| Poudre pour maquillage facial (adolescents/adultes) (docusate sodique) |
Fréquence d’utilisation : Quantité de produit : |
| Produit autobronzant (docusate sodique) |
Quantité de produit : Facteur de rétention : 0,1 |
| Décolorant capillaire (adolescents/adultes) (docusate sodique) |
Quantité de produit : Facteur de rétention : 0,01 |
| Colorant/reflets capillaires (14–18 ans) (docusate sodique) |
Quantité de produit : Facteur de rétention : 0,01 |
| Produit de mise en plis (aérosol) (docusate sodique) |
Scénario : aérosol capillaire – exposition aux embruns de pulvérisation Durée de la pulvérisation : 0,24 minute Voie cutanée : Facteur de rétention : 0,09 |
| Autres produits disponibles aux consommateurs | - |
| Produit de nettoyage/polissage en aérosol; nettoyant pour surfaces en acier inoxydable de cuisine (acétate de méthyle) |
Scénario : utilisation d’un nettoyant en pulvérisateur d’après la fiche d’information des produits nettoyants (RIVM 2007b), mais on a utilisé le modèle d’exposition à la vapeur et d’évaporation, car les substances sont volatiles. Durée de l’exposition : 60 minutes |
|
Peinture en aérosol pour automobile (p. ex., jantes de pneus) (acétate de méthyle) |
Scénario : utilisation d’une bombe aérosol d’après la fiche d’information sur les peintures (RIVM 2007b), exposition à la vapeur et rejet instantané. Durée de l’exposition : 60 minutes |
| Nettoyant pour pneus en aérosol (automobile) (acétate de méthyle) |
Scénario : utilisation d’une bombe aérosol d’après la fiche d’information sur les produits de nettoyage (RIVM 2007b); modèle d’évaporation pour les substances volatiles; on présume que la substance est pulvérisée, qu’on la laisse reposer et qu’on l’essuie sur quatre pneus. Durée de l’exposition : 60 minutes |
| Nettoyant pour pneus en pulvérisateur à gâchette (automobile) (acétate de méthyle) |
Scénario : nettoyant tout-usage en pulvérisateur, d’après la fiche d’information sur les produits de nettoyage (RIVM 2007b); modèle d’évaporation, car les substances sont volatiles; on présume qu’on pulvérise le produit, qu’on le laisse reposer et qu’on essuie quatre pneus. Durée de l’exposition : 60 minutes |
| Décapant pour adhésif en aérosol (automobile) (acétate de méthyle) |
Scénario : utilisation d’une bombe aérosol d’après la fiche d’information sur les peintures (RIVM 2007b). Modèle d’exposition à la vapeur – évaporation. Scénario : on a présumé une petite superficie pour le décapant pour adhésif (autocollant pour parechoc); Durée de l’exposition : 10 minutes |
| Adhésif en aérosol (pour automobile/usage ménager) (acétate de méthyle) |
Scénario : utilisation d’un adhésif en aérosol d’après la fiche d’information sur les produits de bricolage (RIVM 2007b); modèle de pulvérisation – rejet instantané (substance volatile) Durée de l’exposition : 60 minutes |
| Adhésifs pour la construction (produit de jointage) (acétate de méthyle) |
Scénario : application au pistolet à cartouche ou au pistolet à calfeutrer ; d'après le scénario de mastic d'assemblage, selon la fiche d'information sur les produits de bricolage, mastic d'assemblage (RIVM 2007b); modèle d’évaporation, car les substances sont volatiles Durée de l’exposition : 240 minutes |
| Colle pour chambres à air (acétate de méthyle) |
Scénario : colle pour chambres à air (colle contact) d’après la fiche d’information sur les produits de bricolage (tur Burg et al. 2007) Durée de l’exposition : 30 minutes (jugée appropriée pour les petits travaux; contenant de 18 mL) |
| Lubrifiant en aérosol (p. ex., nettoyage d’arme à feu) (acétate de méthyle) |
Scénario : pulvérisation en aérosol, scénario adapté d’après la fiche d’information sur les produits de nettoyage (RIVM 2007b) – nettoyage; modèle d’évaporation; on présume qu’on pulvérise le produit sur l’arme à feu, qu’on le laisse reposer et qu’on essuie l’arme à feu. Durée de l’exposition : 60 minutes |
| Décapant pour peinture (acétate de méthyle) |
Scénario : décapant pour peinture, approche adaptée d’après la fiche d’information sur les produits de bricolage (RIVM 2007a); modèle d’exposition à la vapeur avec évaporation. Période d’exposition : 90 minutes (application de 20 minutes; attente de 20 minutes (pas dans la pièce; la concentration dans l’air pendant ce temps n’est pas incluse dans l’estimation); élimination pendant 50 minutes). Type de projet, quantité de produit, superficie de rejet, volume de la pièce, taux de renouvellement d’air : - Petit projet : 868 g (1 m2), 34 m3; 0,5–2,5 h-1 Facteur d’émission : 50 % (représente la quantité de substance disponible pour l’évaporation afin de tenir compte de la présence possible d’obstacles à l’évaporation (utilisés dans le produit pour en augmenter l’efficacité); d’après la littérature indiquant que 10 % à 30 % du produit chimique s’évaporent (adapté de Van Veen et al. 2002). Fraction pondérale de la substance : 70 % Les concentrations moyennes dans l’air estimées sur 24 heures sont présentées dans le tableau 7-3. Les concentrations maximales et par événement sont présentées ci‑dessous : Concentrations maximales : Concentrations par événement : |
| Revêtement de sol pour garage (acétate de méthyle) |
Scénario : revêtement général sur un sol de garage, d’après la fiche d’information sur les produits de bricolage (RIVM 2007a) Durée de l’exposition : 90 minutes |
| Peinture en aérosol (acétate de 2‑méthoxypropyle) |
Scénario : utilisation d’une bombe aérosol d’après la fiche d’information sur les peintures (RIVM 2007b). Modèle d’exposition à la vapeur – évaporation. Durée de l’exposition : 20 minutes Voie cutanée : |
| Mastic (acétate de 2‑méthoxypropyle) |
Scénario : Substance pour colmater de grands trous, d’après la fiche d’information sur les produits de bricolage (RIVM 2007b); modèle d’évaporation Durée de l’exposition : 240 minutes Voie cutanée : |
| Apprêt en aérosol (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) (modèle de pulvérisation) |
Scénario : utilisation d’une bombe aérosol d’après la fiche d’information sur les peintures (RIVM 2007b); on a utilisé l’exposition à la substance vaporisée (l’exposition à la vapeur était plus faible) Durée de la pulvérisation : 15 minutes Voie cutanée : |
| Peinture pour piscine et usage marin (extérieur; exposition cutanée seulement) (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
Basé sur l’application de peinture au rouleau et au pinceau : Voie cutanée : |
| Durcisseur liquide; trousse de réparation de fibre de verre (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
Scénario : fiche d’information sur les produits de bricolage (RIVM 2007b); modèle d’évaporation; on a utilisé le scénario de colle à 2 composants Mélange/chargement – inhalation : Mélange/chargement – exposition cutanée : Application – inhalation : Voie cutanée : |
| Trousse de réparation de fissures dans le béton (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
Scénario : fiche d’information sur les produits de bricolage (RIVM 2007b); mastic d’après le modèle d’évaporation pour le mastic contenu dans un tube Durée de l’exposition : 240 minutes Voie cutanée : |
| Peinture pour bricolage (diisobutyrate de 1-isopropyl-2,2-diméthyltriméthylène) |
Scénario de peinture sur des mains légèrement tachées, avec quantité d’environ 50 mg. On a supposé qu’une quantité de 50 mg était déposée sur la main de l’enfant lors du bricolage. |
| Nettoyant pour l’extérieur de la maison et anti‑moisissures (docusate sodique) |
Scénario : produit d’élimination des algues vertes, d’après la fiche d’information sur les produits désinfectants (RIVM 2007b) Mélange/chargement : Application :< |
| Nettoyant en pulvérisateur à gâchette (docusate sodique) |
Scénario : pulvérisateur à gâchette; exposition à la substance pulvérisée Durée de la pulvérisation : 0,23 minute Voie cutanée (pulvérisation) : Voie cutanée (frottage) : |
| Lingettes nettoyantes/tissus humides (docusate sodique) |
Scénario : lingettes de tissus humides (mains) (Ficheux et al. 2016) Voie cutanée : |
| Nettoyant en aérosol pour pneus : mousse (docusate sodique) |
Scénario : d’après des éléments du scénario de détachant ponctuel en mousse et en pulvérisateur pour tapis, d’après la fiche d’information sur les produits de nettoyage (RIVM 2007b) Durée présumée de pulvérisation : 10 s par pneu = 40 s |
| Activateur de pâte liquide (papier peint) (docusate sodique) |
Voie cutanée : |
| Produit de durcissement du bois (docusate sodique) |
Produit liquide à appliquer au pinceau : d’après la durée de contact pour l’exposition à la peinture appliquée au pinceau. Voie cutanée : |
Annexe D. Paramètres d’estimation de l’exposition par l’eau potable
| Substance | Acétate de méthyle | Docusate sodique |
|---|---|---|
| Scénario | Rejet industriel | Rejet industriel |
| Quantité sur le site | Importations totales de la substance, selon l’enquête menée en vertu de l’article 71 (323 602 kg) | Importations totales de la substance, selon l’enquête menée en vertu de l’article 71 (1 081 185 kg) |
| Proportion éliminée par les usines de traitement des eaux usées (%) a | 0 | 27,83 |
| Nombre de sites industriels | 1 b | 30 |
| Jours de rejet (par année) b | 250 | 250 |
| Rejet quotidien dans les eaux usées (%) | 1 c | 1 d |
| Plan d’eau récepteur b | Rivière Thames, London (ON) | Rivière Thames, London (ON) |
a ECCC (2016a).
b Valeur par défaut selon les feuilles de calcul de l’Unité d’évaluation environnementale (UEE) du BECSN pour l’eau potable.
c Facteur d’émission générique.
d Basé sur des rejets de 1 % dus à la manipulation de la substance sous forme de poudre et de 0 % en tant que résidus dans les canalisations de transfert et/ou de traitement pour la substance sèche.
Annexe E. SCREEN3 : modèle et intrants
SCREEN3 est un modèle de dispersion gaussienne utilisé à l’étape de l’évaluation préliminaire, basé sur le modèle Industrial Source Complex (ISC), et permet d’évaluer les concentrations de polluants provenant de diverses sources dans un complexe industriel (SCREEN3 2011). Le facteur déterminant de la dispersion atmosphérique dans le modèle SCREEN3 est le vent. La concentration d’exposition maximale calculée est sélectionnée d’après une matrice intégrée de données météorologiques pour différentes combinaisons de conditions météorologiques, dont la vitesse du vent, la turbulence et l’humidité. Ce modèle fournit des prédictions directes des concentrations attribuables aux rejets d’une source ponctuelle, surfacique ou volumique. SCREEN3 donne les concentrations maximales d’une substance à une hauteur choisie des récepteurs et à diverses distances d’une source de rejet dans la direction du vent en provenance du vent dominant une heure après un rejet donné. Au cours d’une période de 24 heures dans le cas des émissions de source ponctuelle, la concentration maximale pendant une heure (évaluée par la version 3 de l’ISC) est multipliée par un facteur de 0,4 pour tenir compte des directions variables du vent. On obtient ainsi une estimation de la concentration dans l’air sur une période d’exposition de 24 heures (US EPA 1992a; SCREEN3 2011). De même, en ce qui concerne les expositions qui se sont produites au cours d’une année donnée, on peut s’attendre à ce que la direction des vents dominants soit plus variable et sans aucune corrélation avec la direction du vent lors d’un événement ponctuel. Par conséquent, la concentration d’exposition maximale amortie sur une année s’obtient en multipliant l’exposition maximale après une heure par un facteur de 0,08 (US EPA 1992; SCREEN3 2011). Les paramètres utilisés pour estimer les concentrations d’acétate de 2‑méthoxypropyle dans l’air ambiant à l’aide du modèle SCREEN3 sont présentés dans le tableau E-1 ci‑dessous.
| Paramètre | Intrant |
|---|---|
| Type de source | Secteur |
| PV (Pa) b | 150 m × 100 m |
| Hauteur du récepteur b | 1,74 m |
| Hauteur de la source de rejet a | 5 m |
| Facteur d’ajustement c | 0,4 |
| Option milieu urbain / milieu rural | Milieu rural |
| Météorologie d | 1 (conditions météorologiques complètes) |
| Distance minimale et maximale | 0-3000 m |
| Distance entre l’installation source et les zones résidentielles a | 300 m |
a Propre au site; valeur fondée sur l’analyse de photographies aériennes et le jugement professionnel.
b Taille moyenne d’un adulte (Curry et coll 1993).
c Facteur pour tenir compte de la direction variable du vent sur une période de 24 heures (US EPA 1992).
d Valeur par défaut dans SCREEN3.

 C8H14O4
C8H14O4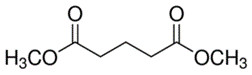 C7H12O4
C7H12O4 C6H10O4
C6H10O4