Ébauche d’évaluation préalable Groupe des alcools
Titre officiel : Ébauche d’évaluation préalable - Groupe des alcools
Environnement et Changement climatique Canada
Santé Canada
Mars 2022
Sommaire
En vertu de l’article 68 ou de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont procédé à l’évaluation préalable des 21 substances collectivement appelées « groupe des alcools » dans le Plan de gestion des produits chimiques. Ces substances ont été jugées prioritaires aux fins d’évaluation, car elles répondent aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été jugées prioritaires en raison d’autres préoccupations pour la santé humaine. Ces substances sont présentées dans le tableau ci‑dessous.
D’après leur structure chimique commune, leurs propriétés dangereuses ou leurs profils d’exposition, nous évaluons ces alcools en différents sous‑groupe
| N° CAS a | Nom sur la Liste intérieure des substances (nom commun ou abréviation) | Nom du sous‑groupe |
|---|---|---|
| 111‑27‑3 | Hexan‑1‑ol | Alcools à longue chaîne |
| 111‑87‑5 | Octan‑1‑ol | Alcools à longue chaîne |
| 143‑08‑8 | Nonan‑1‑ol | Alcools à longue chaîne |
| 112‑30‑1 | Décan‑1‑ol | Alcools à longue chaîne |
| 112‑53‑8 | Dodécan‑1‑ol | Alcools à longue chaîne |
| 112‑72‑1 | Tétradécanol | Alcools à longue chaîne |
| 36653‑82‑4 | Hexadécan‑1‑ol | Alcools à longue chaîne |
| 67762‑30‑5b | Alcools en C14‑C18 | Alcools à longue chaîne |
| 8027‑33‑6b,c | Alcools de lanoline | S.O. – alcool individuel |
| 124‑41‑4c | Méthanolate de sodium (méthylate de sodium) | S.O. – alcool individuel |
| 67‑56‑1 | Méthanol | S.O. – alcool individuel |
| 71‑36‑3 | Butan‑1‑ol | S.O. – alcool individuel |
| 108‑93‑0 | Cyclohexanol | Alcools en C6 |
| 108‑11‑2 | 4‑Méthylpentan‑2‑ol | Alcools en C6 |
| 77‑99‑6 | Propylidynetriméthanol | Alcools en C6 |
| 108‑46‑3 | Résorcinol | Alcools aromatiques |
| 100‑51‑6 | Alcool benzylique | Alcools aromatiques |
| 122‑97‑4 | 3‑Phénylpropan‑1‑ol | Alcools aromatiques |
| 104‑76‑7 | 2‑Éthylhexan‑1‑ol | S.O. – alcool individuel |
| 96‑23‑1c | 1,3‑Dichloropropan‑2‑ol (1,3‑DCP) | S.O. – alcool individuel |
| 107‑18‑6c | Alcool allylique | S.O. – alcool individuel |
a Le numéro de registre du Chemical Abstracts Service (n° CAS) est la propriété de l’American Chemical Society et toute utilisation ou redistribution, sauf quand cela est requis pour des exigences réglementaires et/ou pour des rapports au gouvernement du Canada quand l’information et les rapports sont requis en vertu d’une loi ou d’une politique administrative, est interdite sans autorisation écrite préalable de l’American Chemical Society.
b Cette substance est un UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
c Cette substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais fait l’objet de la présente évaluation parce qu’elle a été jugée prioritaire en raison d’autres préoccupations à l’égard de la santé humaine.
Les risques écologiques associés aux substances du groupe des alcools ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) des substances organiques, laquelle est une méthode fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition, et sur la prise en compte de multiples éléments de preuve ayant subi une pondération. Les profils de danger reposent principalement sur des paramètres touchant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne établis à partir du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. La méthode utilise une matrice du risque pour attribuer à ces substances un degré de préoccupation potentielle faible, modéré ou élevé, en fonction de leurs profils de danger et d’exposition. D’après la conclusion de l’analyse par la méthode CRE, il est peu probable que les substances du groupe des alcools causent des effets nocifs pour l’environnement.
Compte tenu de toutes les données probantes présentées dans la présente ébauche d’évaluation préalable, les 21 alcools évalués présentent un faible risque de danger pour l’environnement. Il est proposé de conclure que les 21 substances du groupe des alcools ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Les alcools à longue chaîne sont des produits chimiques industriels, fabriqués principalement à partir de matières premières oléochimiques ou pétrochimiques. Selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, trois des alcools à longue chaîne ont été fabriqués au Canada en 2011 et les substances visées par l’enquête ont été importées au Canada cette année‑là. Ces alcools sont utilisés comme matières premières et comme agents de surface. Ils sont également utilisés dans une gamme de produits disponibles aux consommateurs, comme les agents de nettoyage et les cosmétiques. Certains des alcools à longue chaîne peuvent être utilisés comme agents aromatisants alimentaires, comme composants dans la fabrication de matériaux d’emballage alimentaire et comme additifs indirects utilisés dans les établissements de transformation des aliments. Les alcools à longue chaîne ne présentent pas un danger pour la santé humaine selon les classifications faites par des instances nationales ou internationales en fonction de leur cancérogénicité, leur génotoxicité, leur toxicité pour le développement ou leur toxicité pour la reproduction. Compte tenu de leur faible profil de danger, le risque associé aux alcools à longue chaîne pour la santé humaine devrait être faible.
Les alcools de lanoline sont des produits chimiques industriels utilisés comme intermédiaires ou comme carburant pour le biodiesel dans les installations industrielles. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, cette substance n’a pas été fabriquée au Canada en 2011, mais elle a été importée au Canada cette année‑là. En ce qui concerne les produits disponibles aux consommateurs, les alcools de lanoline sont largement utilisés dans la formulation de cosmétiques, et l’exposition de la population générale se fait principalement par voie cutanée. Les alcools de lanoline ne présentent pas un danger pour la santé humaine selon les classifications faites par des instances nationales ou internationales en fonction de leur cancérogénicité, leur génotoxicité, leur toxicité pour le développement ou leur toxicité pour la reproduction. Sur la base de leur faible danger pour la santé humaine, le risque des alcools de lanoline pour la santé humaine devrait être faible.
Le méthanolate de sodium (aussi appelé méthylate de sodium) est principalement utilisé comme intermédiaire chimique dans la fabrication de produits chimiques spéciaux. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, cette substance n’a pas été fabriquée au Canada en 2011, mais elle a été importée au Canada cette année‑là. Le méthanolate de sodium est très réactif dans l’eau. Cette substance ne présente pas un danger pour la santé humaine selon la classification faite par des organismes nationaux ou internationaux en fonction de sa cancérogénicité. L’effet critique du méthanolate de sodium est dû à la formation d’hydroxyde de sodium après contact avec l’humidité, ce qui entraîne une corrosivité pour la peau et les yeux en cas de contact direct et une toxicité aiguë à doses répétées par voie orale, par voie cutanée ou par inhalation. Compte tenu de l’exposition minimale de la population générale, le risque du méthanolate de sodium pour la santé humaine devrait être faible.
Le méthanol est un produit chimique industriel qui est fabriqué et importé en grandes quantités au Canada. Le méthanol est principalement utilisé dans des applications limitées à un site ou à une industrie, le marché le plus important étant la production de formaldéhyde. Il est utilisé dans les cosmétiques, les agents de nettoyage, les adhésifs et les décapants à peinture et à vernis. Le méthanol peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire et c’est un additif alimentaire autorisé. Le méthanol est présent à l’état naturel dans certains aliments et boissons alcoolisées. Cette substance a été examinée par les organismes de réglementation internationaux. L’exposition au méthanol peut se faire par voie orale, par inhalation ou par voie cutanée. Les effets critiques du méthanol comprennent des effets sur le développement, notamment des malformations squelettiques chez la souris et une diminution du poids du cerveau chez le rat. Compte tenu de tous les renseignements disponibles et des voies d’exposition de la population générale, il a été déterminé que les concentrations d’exposition au méthanol par inhalation résultant de l’utilisation de certains décapants à peinture et à vernis peuvent présenter un risque pour la santé. Pour toutes les autres utilisations du méthanol, on ne s’attend pas à ce que la population générale soit exposée à des concentrations élevées de méthanol dans des conditions normales. Par conséquent, les risques pour la santé humaine liés à la présence de méthanol dans les produits autres que certains décapants à peinture et à vernis devraient être faibles.
Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le butan‑1‑ol n’a pas été fabriqué au Canada en 2011, mais a été importé au Canada cette année‑là. Le butan‑1‑ol est utilisé dans les cosmétiques, les produits de santé naturels (PSN), les médicaments en vente libre et sur ordonnance, les agents de nettoyage, les laques, les produits d’entretien automobile et comme solvant dans les produits de peinture et d’encre. Le butan‑1‑ol est naturellement produit au cours de la fermentation et peut également être utilisé comme agent aromatisant alimentaire et comme composant dans la fabrication de matériaux d’emballage alimentaire. L’exposition au butan‑1‑ol peut se faire par inhalation, par voie orale ou par voie cutanée. Les effets critiques du butan‑1‑ol comprennent des effets sur le développement. Une comparaison des concentrations de butan‑1‑ol provenant de l’utilisation de laque avec les concentrations associées aux effets sur la santé donne des marges d’exposition (ME) qui sont potentiellement inadéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Les alcools en C6 sont le cyclohexanol, le 4‑méthylpentan‑2‑ol et le propylidynetriméthanol. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, les trois alcools en C6 n’ont pas été fabriqués au Canada au‑delà du seuil de 100 kg en 2011, mais ont été importés au Canada cette année‑là. Ces substances sont utilisées comme solvants dans la production de polymères et de résines et dans l’exploitation minière. Dans les produits disponibles aux consommateurs, elles peuvent être utilisées dans les peintures ou glaçures pour céramique, les produits d’entretien automobile, les adhésifs et les produits d’étanchéité, et les cosmétiques. En outre, les alcools en C6 peuvent être utilisés comme composant dans la fabrication de matériaux d’emballage alimentaire et être présents comme additifs indirects dans les établissements de transformation des aliments. Ils peuvent également être utilisés comme agents aromatisants alimentaires. La population générale peut être exposée à ces substances, principalement par absorption cutanée des agents de nettoyage et par inhalation. Ces substances n'ont pas été considérées comme présentant un risque élevé pour la santé humaine sur la base de classifications faites par des organismes nationaux ou internationaux en fonction de leur cancérogénicité, leur génotoxicité, leur toxicité pour le développement ou leur toxicité pour la reproduction. Une comparaison des concentrations d’exposition aux alcools en C6 auxquels la population générale peut être exposée avec les concentrations associées aux effets sur la santé démontre que les ME pour l’exposition au cyclohexanol et au propylidynetriméthanol sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Les alcools aromatiques comprennent le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le résorcinol et l’alcool benzylique ont été fabriqués au Canada en 2011, mais le 3‑phénylpropan‑1‑ol n’a pas été fabriqué au Canada au‑delà du seuil de 100 kg. Ces trois alcools ont été importés au Canada. Le résorcinol et l’alcool benzylique sont principalement utilisés comme solvants dans la production de polymères et de résines et dans l’exploitation minière. Dans les produits disponibles aux consommateurs, les alcools aromatiques sont utilisés dans les produits pour l’automobile, les produits d’entretien ménager, les produits de construction et de peinture, les cosmétiques et les PSN, ainsi que dans les médicaments en vente libre et sur ordonnance. Les alcools aromatiques peuvent également être utilisés comme agents aromatisants alimentaires, et l’alcool benzylique est un additif alimentaire autorisé. La population générale peut être exposée à ces substances, principalement par voie cutanée et par inhalation. Les effets critiques de l’alcool benzylique sont des effets sur le système nerveux, et ceux du résorcinol et du 3‑phénylpropan‑1‑ol sont des effets sur la reproduction et/ou le développement. Une comparaison des concentrations d’alcool benzylique présentes dans certains cosmétiques et PSN auxquels la population générale peut être exposée avec les concentrations associées aux effets sur la santé indique que les ME pour ces expositions sont potentiellement inadéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé. Une comparaison des concentrations de résorcinol et de 3‑phénylpropan‑1‑ol auxquels la population générale peut être exposée avec les concentrations associées aux effets sur la santé montre que les ME pour l’exposition au résorcinol et au 3‑phénylpropan‑1‑ol sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Le 2‑éthylhexan‑1‑ol est présent à l’état naturel dans plusieurs aliments. Il peut être utilisé comme agent aromatisant alimentaire et comme composant dans la fabrication de matériaux d’emballage alimentaire. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, cette substance n’a pas été fabriquée au Canada en 2011, mais a été importée au Canada cette année‑là. Cette substance peut être formée lors du traitement thermique de certains aliments. Ces aliments comprennent la sauce soja et les produits à base de soja, la viande et les produits carnés, ainsi que les aliments contenant des produits protéiques hydrolysés. L’effet critique sur la santé du 2‑éthylhexan‑1‑ol était une diminution des concentrations d’enzymes sériques. Une comparaison des concentrations de 2‑éthylhexan‑1‑ol auxquels la population générale peut être exposée avec les concentrations associées aux effets sur la santé indique que les ME sont adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Le 1,3‑dichloropropan‑2‑ol (ci‑après appelé le 1,3‑DCP) est un composé d’origine anthropique. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, cette substance a été fabriquée et importée au Canada en 2011. Les estimations moyenne et maximale de l’exposition orale au 1,3‑DCP par diverses sources alimentaires, établies en 2006 par le Comité mixte d’experts des additifs alimentaires (Organisation des Nations Unies pour l’alimentation et l’agriculture / Organisation mondiale de la santé) ont été utilisées pour la présente évaluation. Ces estimations, qui correspondent au scénario le plus défavorable, sont jugées prudentes. Une comparaison des concentrations de 1,3‑DCP auxquels la population générale peut être exposée par les aliments avec les concentrations associes aux effets sur la santé montre que les ME pour cette substance sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Bien que l’exposition de la population générale au 1,3‑DCP ne soit pas préoccupante aux concentrations actuelles, on estime que cette substance présente un effet préoccupant pour la santé en raison de sa désignation comme substance cancérogène du groupe 2B par le Centre international de recherche sur le cancer. Par conséquent, l’exposition pourrait devenir préoccupante pour la santé humaine si elle devait augmenter. Des options sont envisagées pour établir des activités de suivi afin de surveiller les changements dans l’exposition au 1,3‑DCP.
L’alcool allylique est utilisé par l’industrie pour la synthèse du glycérol et d’autres produits chimiques spécialisés. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, l’alcool allylique n’a pas été fabriqué au Canada en 2011, mais a été importé au Canada cette année‑là. Il peut être utilisé dans la fabrication de matériaux d’emballage alimentaire. Cette substance est présente à l’état naturel dans la chair de crabe, les moules en décomposition et par l’activation des enzymes lors du broyage de l’ail. Elle peut également être formée par l’hydrolyse d’esters allyliques utilisés comme agents aromatisants alimentaires. Les estimations de l’exposition à cette substance par les aliments sont basées sur la concentration mesurée d’alcool allylique dans différentes catégories d’aliments. Une comparaison des concentrations d’alcool allylique auxquels la population générale peut être exposée avec les concentrations associées aux effets sur la santé montre que les ME pour cette substance sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le méthanol, le butan‑1‑ol et l’alcool benzylique satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie et la santé humaines.
De plus, il est proposé de conclure que les 18 autres substances du groupe des alcools ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie et la santé humaines.
Par conséquent, il est proposé de conclure que le méthanol, le butan‑1‑ol et l’alcool benzylique satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE et que les 18 autres substances du groupe des alcools ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que le méthanol répond aux critères de persistance, mais non de bioaccumulation et que le butan‑1‑ol et l’alcool benzylique ne répondent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de 21 alcools désignés collectivement sous l’appellation « Groupe des alcools », pour déterminer si ces substances sont nocives pour la santé ou dangereuses pour l’environnement ou la santé humaine. Ces deux substances font partie des substances jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été jugées d’intérêt prioritaire en raison d’inquiétudes ayant trait à la santé humaine (ECCC, SC [modifié 2007]).
Les risques écologiques des substances du groupe des alcools ont été caractérisés selon l’approche CRE (ECCC 2016a), laquelle décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition potentielle des organismes dans les milieux aquatique et terrestre en fonction de divers facteurs, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les divers éléments de preuve sont combinés afin de déterminer si les substances nécessitent une évaluation plus poussée de leurs effets nocifs potentiels sur l’environnement ou si elles présentent un faible risque d’avoir de tels effets.
Pour la présente ébauche d’évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Nous avons recensé les données pertinentes en faisant des recherches dans les publications jusqu’en avril 2020. Nous avons utilisé des données empiriques tirées d’études clés ainsi que certains résultats de modélisation pour tirer nos conclusions. Lorsqu’ils étaient disponibles et pertinents, nous avons utilisé les renseignements contenus dans les évaluations effectuées par d’autres instances.
Certains sous‑groupes du groupe des alcools ont été examinés ailleurs dans le monde, notamment par l’Environnemental Protection Agency des États‑Unis (US EPA), l’Organisation de coopération et de développement économiques (OCDE), l’Agence européenne des produits chimiques (ECHA), le Comité mixte d’experts des additifs alimentaires (JECFA) de l’Organisation des Nations Unies pour l’alimentation et l’agriculture / Organisation mondiale de la santé (FAO/OMS) et le Centre international de recherche sur le cancer (CIRC). Ces évaluations font l’objet d’un examen rigoureux (y compris un examen par les pairs) et sont approuvées. En particulier, dans le cas des évaluations de l’OCDE, Santé Canada et Environnement et Changement climatique Canada participent activement à ces processus et considèrent que ces évaluations sont fiables. Les divers examens internationaux seront présentés dans les chapitres traitant des divers sous‑groupes d’alcools.
Le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada a rédigé la présente ébauche d’évaluation préalable qui inclut la contribution d’autres programmes de ces deux ministères. Le volet écologique de cette évaluation est basé sur l’approche de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen par des pairs et d’une période de consultation publique de 60 jours. Le volet santé humaine a également fait l’objet d’un examen externe par des pairs, soit R. Manderville (Université de Guelph), P. Autier (iPRI France) et T. Schulz (Université du Tennessee). Bien que des commentaires de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada demeurent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable porte sur des renseignements essentiels pour déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, les renseignements scientifiques ont été étudiés et l’examen s’est appuyé sur une méthode fondée sur le poids de la preuve et le principe de précaution Note de bas de page 1 . La présente ébauche d’évaluation préalable décrit les données et les considérations essentielles sur lesquelles les conclusions proposées sont basées.
2. Alcools à longue chaîne
2.1 Identité des substances
Les renseignements concernant l’identité des alcools à longue chaîne sont résumés dans le Tableau 2‑1. Les noms communs de ces produits chimiques sont également indiqués entre parenthèses, ainsi que leur nom sur la Liste intérieure des substances (LIS).
| N° CAS | Nom sur la LIS (nom commun) | Formule moléculaire | Structure moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 111‑27‑3 | Hexan‑1‑ol | C6H14O | 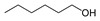 |
102,2 |
| 111‑87‑5 | Octan‑1‑ol (alcool caprylique) | C8H18O | 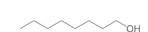 |
130,2 |
| 143‑08‑8 | Nonan‑1‑ol | C9H20O | 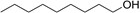 |
144,3 |
| 112‑30‑1 | Décan‑1‑ol (alcool caprique) | C10H22O | 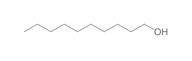 |
158,3 |
| 112‑53‑8 |
Dodécan‑1‑ol (alcool laurylique) |
C12H26O | 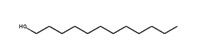 |
186,3 |
| 112‑72‑1 | 1‑Tétradecanol (alcool myristiques) | C14H30O | 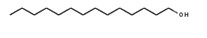 |
214,4 |
| 36653‑82‑4 | Hexadécan‑1‑ol (alcool cétylique) | C16H34O | 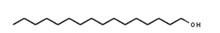 |
242,4 |
| 67762‑30‑5 | Alcools en C14‑C18 | UVCB | UVCB | UVCB |
Les alcools en C14‑C18 sont désignés comme substances UVCB Note de bas de page 2 . Ces substances sont un mélange d’alcools, dont chaque constituant contient une chaîne carbonée dans la plage de longueurs indiquée. La distribution du nombre total d’atomes de carbone dans la chaîne, la structure chimique et le degré de ramification et de saturation dépendent du procédé de fabrication (OCDE 2006a). Indépendamment de la variation inhérente aux substances du sous‑groupe des alcools à longue chaîne, elles présentent toutes des propriétés physiques et chimiques similaires.
2.2 Propriétés physiques et chimiques
On dispose de valeurs mesurées des propriétés physiques et chimiques des alcools à longue chaîne, et les plages observées sont indiquées dans le Tableau 2‑2. Lorsque le nombre d’atomes de carbone augmente dans ce sous‑groupe de substances, le point de fusion, le point d’ébullition et le log Koe augmente, tandis que la pression de vapeur et la solubilité dans l’eau diminuent. D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Propriété | Plage de valeurs a, b |
|---|---|
| Point de fusion (ºC) | ₋50 à +72,5 |
| Point d’ébullition (ºC) | 158 à 400 |
| Masse volumique (kg/m3) | 800 à 850 |
| Pression de vapeur (hPa) | 1,22 à 8,2 × 10‑8 |
| Log Koe (sans dimension) | 2,03 à > 7 |
| Solubilité dans l’eau (mg/L) | 5 900 à 0,001 |
Abréviation : Koe = coefficient de partage octanol‑eau.
a La première valeur est pour le 2‑éthylhexan‑1‑ol (qui contient 6 atomes de carbone) et la deuxième valeur est pour les alcools en C14–C18.
b OCDE 2006a.
2.3 Sources et utilisations
Certains des alcools à longue chaîne sont présents en quantités appréciables dans la nature. Cependant, ces alcools sont fabriqués à partir de matières premières oléochimiques ou pétrochimiques par diverses voies de synthèse, et leur production est largement d’origine anthropique. Les procédés et les matières premières utilisés régissent la linéarité, la saturation et la répartition des longueurs de chaîne pour ces alcools à longue chaîne. Les volumes totaux de fabrication et d’importation des alcools à longue chaîne en 2011 au Canada, déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE, sont indiqués dans le Tableau 2‑3 (Environnement Canada 2013).
| Nom | Production totale (kg) a | Importations totales (kg) a |
|---|---|---|
| Hexan‑1‑ol | N.D. | 100 000 – 1 000 000 |
| Octan‑1‑ol | S.O. | S.O. |
| Nonan‑1‑ol | N.D. | 100 000 – 1 000 000 |
| Décan‑1‑ol | 100 – 1 000 | 1 470 000 |
| Dodécan‑1‑ol | 1 000 – 10 000 | 1 000 000 – 10 000 000 |
| Tétradécanol | N.D. | 1 000 000 – 10 000 000 |
| Hexadécan‑1‑ol | 1 000 – 10 000 | 1 380 000 |
| Alcools en C14‑C18 | N.D. | 284 000 |
Abréviations : N.D. = quantité non déclarée au‑delà du seuil de déclaration de 100 kg; S.O. = renseignement non inclus dans une enquête menée en vertu de l’article 71 de la LCPE.
a Les valeurs désignent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), sauf pour l’octan‑1‑ol, qui n’était pas visé par l’enquête. Veuillez consulter l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Le volume de production mondiale de ces alcools dans les pays membres de l’OCDE a été estimé à 2,5 millions de tonnes (OCDE 2006a). Plus de la moitié du volume produit total d’alcools aliphatiques à longue chaîne est utilisé comme intermédiaires de synthèse, 65 % de ce volume étant employé dans des applications propres au site d’utilisation (OCDE 2006a). Ces substances sont largement utilisées comme auxiliaires de production, notamment comme tensioactifs, lubrifiants, déformants et agents flottants dans divers procédés de fabrication. L’autre moitié de la production d’alcools à longue chaîne est employée dans les matériaux d’emballage alimentaire et comme additifs dans les produits disponibles aux consommateurs, notamment les produits de soins personnels, les produits de nettoyage, les peintures et revêtements et les lubrifiants (OCDE 2006a).
Les utilisations des alcools à longue chaîne dans les aliments, les cosmétiques et les produits de santé naturels (PSN) au Canada sont résumées dans les tableaux 2‑4 à 2-6. Les alcools à longue chaîne qui ne figurent pas dans les tableaux n’ont pas d’utilisations répertoriées.
| Alcool | Matériau d’emballage alimentaire | Additif indirect b | Additif alimentaire | Agent aromatisant alimentaire | Risque d’exposition |
|---|---|---|---|---|---|
| Hexan‑1‑ol | Non | Non | Non | Oui | Oui |
| Octan‑1‑ol | Non | Non | Non | Oui | Oui |
| Nonan‑1‑ol | Non | Non | Non | Oui | Oui |
| Décan‑1‑ol | Non | Oui (produit de nettoyage, suivi d’un rinçage à l’eau potable) | Non | Oui | Oui |
| Dodécan‑1‑ol | Oui (adhésifs, boyaux à saucisse, concentrés de couleur) | Non | Non | Oui | Oui |
| Tétradécanol | Non | Oui (produit de rinçage pour mains) | Non | Oui | Oui |
| Hexadécan‑1‑ol | Oui (carton, récipients en aluminium) | Non | Non | Oui | Oui |
| Alcools en C14‑C18 | Oui (carton) | Non | Non | Non | Non |
a Communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2016 et 18 décembre 2017; sans référence.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments et pouvant se retrouver de manière fortuite dans les aliments sous forme de résidus.
| Alcool | Nombre de produits cosmétiques dans lesquels les substances ont été trouvées | Produit et concentration maximale (poids %) |
|---|---|---|
| Octan‑1‑ol | 7 produits |
Produits pour la peau / 1 % Produits de coiffure / < 0,1 % |
| Décan‑1‑ol | 4 produits |
Produits pour la peau / 10 % Produits de coiffure / < 0,1 % Maquillage / < 3 % |
| Dodécan‑1‑ol | 510 produits |
Produits pour la peau / 30 % Produits capillaires / 30 % Produits pour le bain / 3 % Pâte dentifrice / 10 % |
| Tétradécanol | 936 produits |
Produits pour la peau / 30 % Produits capillaires / 30 % Produits pour le bain / 3 % Maquillage / 10 % |
| Hexadécan‑1‑ol | 12 149 produits |
Adhésifs / 100 % Antisudorifique / 100 % Produits pour le bain / 30 % Atomiseur pour l’haleine / 100 % Nettoyant / 100 % Produits capillaires / 100 % Maquillage / 100 % Produit de massage / 10 % Rince‑bouche / 10 % Produits pour la peau / 30 % Produits pour les ongles / 100 % |
a D’après les déclarations faites en vertu du Règlement sur les cosmétiques à Santé Canada. Communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 19 octobre 2016; sans référence.
b Aucune des substances ne figure sur la Liste critique des ingrédients cosmétiques. La Liste des ingrédients dont l’utilisation est interdite ou restreinte dans les cosmétiques (plus communément appelée la Liste critique des ingrédients cosmétiques ou simplement la Liste critique) est un outil administratif que Santé Canada utilise pour communiquer aux fabricants et à d’autres personnes que certaines substances peuvent contrevenir à l’interdiction générale qui figure à l’article 16 de la Loi sur les aliments et drogues (LAD) ou peuvent contrevenir à une ou plusieurs dispositions du Règlement sur les cosmétiques. L’article 16 de la LAD stipule : « Il interdit de vendre un cosmétique qui, selon le cas, contient une substance – ou en est recouvert – susceptible de nuire à la santé de l’individu qui en fait usage ». En outre, la Liste critique comprend certaines substances qui peuvent rendre peu probable la classification d’un produit comme cosmétique en vertu de la LAD.
| Alcool | BDIPSN / BDPSNH b | Sous‑catégorie / commentaires (s’il y a lieu) |
|---|---|---|
| Hexan‑1‑ol | Oui/Non | Rôle non médicinal pour usage oral comme exhausteur de goût |
| Octan‑1‑ol | Oui/Non | Rôle non médicinal pour usage oral comme exhausteur de goût |
| Nonan‑1‑ol | Oui/Non | Rôle non médicinal pour usage oral comme exhausteur de goût |
| Décan‑1‑ol | Oui/Non | Rôle non médicinal pour usage oral comme exhausteur de goût |
| Dodécan‑1‑ol | Oui/Oui |
Rôle non médicinal pour usage topique ou oral comme stabilisateur d’émulsion, exhausteur de goût, ingrédient de parfum, agent de conditionnement de la peau – émollient, tensioactif – stimulateur de mousse, agent d’augmentation de la viscosité – aqueux, ou agent d’augmentation de la viscosité – non aqueux Présent dans les PSN actuellement homologués |
| Tétradécanol | Oui/Oui |
Rôle non médicinal pour utilisation comme stabilisateur d’émulsion, exhausteur de goût, ingrédient de parfum, agent de conditionnement de la peau – émollient, tensioactif – stimulateur de mousse, agent d’augmentation de la viscosité – aqueux, ou agent d’augmentation de la viscosité – non aqueux Présent dans les PSN actuellement homologués |
| Hexadécan‑1‑ol | Oui/Oui |
Rôle non médicinal pour utilisation comme émollient, stabilisateur d’émulsion, agent opacifiant, plastifiant, agent raidisseur, tensioactif – agent émulsifiant ou agent épaississant Présent dans les PSN actuellement homologués |
Abréviations : BDIPSN = Base de données des ingrédients des produits de santé naturels; BDPSNH = Base de données des produits de santé naturels homologués.
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada au Bureau d’évaluation du risque des substances existantes, Santé Canada, 26 octobre 2016; sans référence.
Les alcools à longue chaîne sont présents comme produits de formulation dans les produits antiparasitaires au Canada (ARLA 2010).
2.4 Devenir et comportement dans l’environnement
2.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), les alcools à longue chaîne ne devraient pas persister dans l’air, l’eau, les sédiments ou le sol.
2.4.2 Potentiel de bioaccumulation
D’après les valeurs log Koe comprises entre 5 et 7 environ et des facteurs de bioconcentration estimés d’environ 6 000 à 40 000 L/kg (ECCC 2016b), le dodécan‑1‑ol, le tétradécanol, l’hexadécan‑1‑ol et les alcools en C14‑C18 devraient se bioaccumuler dans les organismes. Cependant, le potentiel de bioaccumulation de ces substances dans les organismes est probablement inférieur aux estimations en raison de la dégradation métabolique de ces alcools. Compte tenu de leurs faibles valeurs log Koe et de leurs faibles facteurs de bioconcentration (ECCC 2016b), les autres alcools à longue chaîne ne devraient pas subir de bioaccumulation considérable dans les organismes.
2.5 Effets nocifs potentiels sur l’environnement
2.5.1 Caractérisation du risque écologique
Les risques environnementaux des alcools à longue chaîne ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) des substances organiques. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil propre à une substance dans le cas des alcools à longue chaîne et les résultats de la classification des dangers, de l’exposition et des risques sont présentés dans ECCC (2016b).
Les classifications du danger et de l’exposition pour les alcools à longue chaîne sont résumées dans le Tableau 2‑7.
| Substance | Danger selon la CRE | Exposition selon la CRE | Risque selon la CRE |
|---|---|---|---|
| Hexan‑1‑ol | Faible | Faible | Faible |
| Octan‑1‑ol | Faible | Faible | Faible |
| Nonan‑1‑ol | Faible | Faible | Faible |
| Décan‑1‑ol | Faible | Faible | Faible |
| Dodécan‑1‑ol | Faible | Faible | Faible |
| Tétradécanol | Modérée | Faible | Faible |
| Hexadécan‑1‑ol | Modérée | Faible | Faible |
| Alcools en C14‑C18 | Modérée | Faible | Faible |
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le 2‑éthylhexan‑1‑ol, l’octan‑1‑ol, le nonan‑1‑ol, le décan‑1‑ol et le dodécan‑1‑ol ont été classés comme substances présentant un faible risque écologique. Il est donc peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
Le tétradécanol, l’hexadécan‑1‑ol et les alcools en C14‑C18 ont été classés comme substances présentant un risque modéré selon les renseignements examinés dans le cadre de l’approche CRE en raison d’un risque modéré d’effets nocifs dans les réseaux alimentaires aquatiques, compte tenu de leur potentiel de bioaccumulation. Cependant, le tétradécanol, l’hexadécan‑1‑ol et les alcools en C14‑C18 ont été classés comme substances présentant un faible risque d’exposition, et donc un faible risque global pour l’environnement. Il est donc peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
2.6 Effets nocifs potentiels sur la santé humaine
2.6.1 Évaluation de l’exposition
2.6.1.1 Milieux naturels et aliments
Les alcools à longue chaîne présentent une gamme de valeurs pour la solubilité dans l’eau et la pression de vapeur. La modélisation de la fugacité montre que le devenir environnemental prévu des substances de ce sous‑groupe dépend du type de rejet. En cas de rejet dans l’eau, les substances avec chaînes de longueur C10 et plus devraient se répartir dans les sédiments. Dans le cas des chaînes de longueur C14 et plus, lorsque les alcools sont rejetés dans l’air, moins de la moitié des alcools encore présents dans l’environnement se retrouvent dans l’air (OCDE 2006a). Les alcools à longue chaîne ne devraient pas être présents dans les milieux naturels à des concentrations importantes en raison de leur faible persistance dans l’environnement.
Comme le montre le Tableau 2‑4, les alcools à longue chaîne peuvent être utilisés comme agents aromatisants alimentaires, composants dans la fabrication de matériaux d’emballage alimentaire et additifs indirects utilisés dans les établissements de transformation des aliments. Les alcools à longue chaîne étant considérés comme présentant un faible danger, des estimations quantitatives de l’exposition par les aliments de la population générale n’ont pas été calculées.
2.6.1.2 Exposition par les produits disponibles aux consommateurs
Les alcools à longue chaîne sont présents dans de nombreux produits disponibles aux consommateurs, y compris les cosmétiques et les agents de nettoyage. Les alcools les plus fréquemment utilisés comprennent les alcools à longue chaîne de carbone (C10‑C18). Comme les alcools à longue chaîne sont considérés comme présentant un faible danger, des estimations quantitatives de l’exposition de la population générale n’ont pas été calculées.
2.6.2 Évaluation des effets sur la santé
Les alcools à longue chaîne ont fait l’objet d’un examen par d’autres instances (OCDE 2006a, b; US EPA 2006), et ces rapports ont été utilisés pour caractériser les effets sur la santé dans la présente évaluation. Une recherche a été effectuée dans les publications pour trouver de nouvelles données publiées entre 2006 et août 2021, et aucune nouvelle étude susceptible de donner lieu à une caractérisation des effets sur la santé différente de celle des évaluations de l’OCDE (2006 a, b) et de l'EPA (US EPA 2006) n’a été relevée.
L’OCDE a examiné le groupe des alcools à longue chaîne C6‑C22 (OCDE 2006a). En outre, des documents distincts sur l’évaluation des risques pour la santé humaine et l’environnement, disponibles pour des substances individuelles ou des groupes de ces substances, ont été pris en compte. Il s’agit notamment des évaluations pour l’hexan‑1‑ol (AGDH 2017a), l’octan‑1‑ol (AGDH 2017b; Bevan 2001; US EPA 2006), le 2‑éthylhexan‑1‑ol (Bevan 2001), le nonan‑1‑ol (Bevan 2001), le décan‑1‑ol (Bevan 2001; US EPA 2006a), le dodécan‑1‑ol (OCDE 2006a; MAK 2016; Bevan 2001), le tétradécanol (Bevan 2001) et l’hexadécan‑1‑ol (AGDH 2017c; Bevan 2001).
L’OCDE (2006a) a conclu que la famille des alcools à longue chaîne présente une faible toxicité après une exposition aiguë ou répétée par voie orale, par voie cutanée ou par inhalation. Le potentiel de bioaccumulation des alcools parents ou de leurs métabolites est très faible, car ils sont efficacement métabolisés par l’organisme (OCDE 2006a). Ces substances ne présentent pas de danger pour la santé humaine en termes de cancérogénicité, de génotoxicité, de toxicité pour la reproduction ou de toxicité pour le développement (OCDE 2006a; US EPA 2006).
De plus, aucun signe de toxicité n’a été observé après une exposition par inhalation aux alcools à longue chaîne (OCDE 2006a; US EPA 2006).
Les études subchroniques avec doses répétées sur les alcools à longue chaîne ont montré une faible toxicité avec des doses sans effet nocif observé (DSENO) subchroniques typiques allant de 200 à > 1 000 mg/kg p.c./j (OCDE 2006a). Les DSENO les plus faibles n’étaient associées à aucun effet nocif, et on a observé uniquement une irritation locale réversible de la peau ou des yeux chez les rats ou les souris mâles et femelles (OCDE 2006a; US EPA 2006).
Les effets primaires d’une exposition aiguë ou subchronique dus à divers alcools à longue chaîne consistaient, selon les études, en une irritation légère ou locale de la peau ou des yeux subséquente à des doses très élevées chez les animaux de laboratoire. De même, des études avec doses répétées ont montré que les alcools à longue chaîne ne provoquent pas de sensibilisation et n’ont pas le potentiel de provoquer une neurotoxicité (OCDE 2006a; US EPA 2006).
Les données disponibles dans ces évaluations internationales montrent que l’exposition aux alcools à longue chaîne par voie orale, par voie cutanée ou par inhalation ne produit pas d’effet systémique nocif chez les animaux de laboratoire. Rien n’indique que les alcools à longue chaîne soient cancérogènes, génotoxiques, neurotoxiques ou toxiques pour la reproduction ou le développement chez les animaux (OCDE 2006a; US EPA 2006).
2.6.3 Caractérisation du risque pour la santé humaine
On peut s’attendre à une exposition de la population générale aux alcools à longue chaîne par les milieux naturels, les aliments ou l’utilisation de produits disponibles aux consommateurs. Cependant, en raison de leur faible toxicité, les risques pour la santé humaine liés à l’exposition à ces substances sont jugés faibles (OCDE 2006a; US EPA 2006).
3. Alcools de lanoline
3.1 Identité des substances
Les renseignements concernant l’identité des alcools de lanoline sont résumés dans le Tableau 3‑1. Cette substance est également connue sous le nom commun d’alcool de laine.
| N° CAS | Nom sur la LIS (nom commun) | Structure chimique | Masse moléculaire moyenne (g/mol) |
|---|---|---|---|
| 8027‑33‑6 | Alcools de lanoline | Composition et structure variées (75 % de stérols et d’alcools triterpéniques; également des alcools aliphatiques ramifiés et non ramifiés) | 370 (pour tous les alcools dans ce sous‑groupe) |
Les alcools de lanoline sont principalement (75 %) composés de stérols et d’alcools triterpéniques. Le cholestérol est le composant individuel le plus important (36 %), suivi de deux triterpénoïdes tétracycliques, le lanostérol et l’agnostérol, et de leurs dérivés. Les stérols des alcools de lanoline sont similaires aux lipides physiologiques de la couche cornée (Imperial Oel 2017).
Les alcools de lanoline sont considérés comme des substances UVCB. Ils consistent en un mélange d’alcools qui présentent tous des propriétés physiques et chimiques similaires, une faible toxicité et des effets sur l’environnement. On produit ces substances en chauffant de la lanoline avec de l’eau et en séparant les composants acides de lanoline présents dans le mélange. Dans les produits cosmétiques, ils sont surtout utilisés sous forme acétylée.
3.2 Propriétés physiques et chimiques
Les valeurs mesurées des propriétés physiques et chimiques des alcools de lanoline sont présentées dans le Tableau 3‑2 (O’Neil 2006; ECHA 2017j). Des données additionnelles sur les propriétés physiques et chimiques sont présentées dans ECCC 2016b.
| Propriété | Plage de valeurs a |
|---|---|
| Point de fusion (°C) | 45–80 |
| Point d’ébullition (°C) | > 220 à < 420 |
| Masse volumique à 20 oC (g/cm3) | 0,935 |
| Log Koe (sans dimension) | 8,739 |
| Solubilité dans l’eau (mg/L) | 0,21 |
| Pression de vapeur à 20 °C (Pa) | 360 |
a ECHA 2017j
3.3 Sources et utilisations
Les alcools de lanoline sont des substances d’origine naturelle obtenues par l’hydrolyse de la lanoline (qui produit également de l’acide de lanoline), laquelle est un dérivé de sécrétions graisseuses des glandes sébacées du mouton (Cosmetics Info 2016). Cette réaction produit de la lanoline anhydre, qui comprend des alcools gras et des acides gras ainsi que des alcools de lanoline. Ils sont également appelés cire de laine, car ils aident les moutons à éliminer l’eau de leur pelage (Rudner et al. 1973; Rudner et al. 1975).
Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, les alcools de lanoline n’ont pas été fabriqués au Canada en 2011, mais de 1 000 kg à 10 000 kg ont été importés au Canada cette année‑là (Environnement Canada 2013) Note de bas de page 3 .
Dans l’industrie, les alcools de lanoline sont utilisés comme intermédiaires chimiques dans la fabrication des textiles, des cuirs ou des fourrures, et comme carburants biodiesel. En tant qu’émollients qui se lient bien à l’eau (Ngan 2002), les alcools de lanoline sont largement produits pour être utilisés dans la fabrication de produits pharmaceutiques et cosmétiques (Environnement Canada 2012). Les alcools de lanoline ne figurent pas sur la Liste critique des ingrédients cosmétiques. Les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques indiquent qu’ils sont utilisés dans certains produits cosmétiques au Canada. Leurs utilisations sont résumées dans le Tableau 3‑3. On les trouve également dans les produits antiparasitaires au Canada comme produits de formulation (ARLA 2010). Les alcools de lanoline ont été utilisés dans une crème pour la peau classée comme produit de santé naturel (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 30 avril 2021; sans référence). Les alcools de lanoline n’ont pas été trouvés comme composants dans la fabrication de matériaux d’emballage alimentaire ou comme additifs indirects utilisés dans les établissements de transformation des aliments, et ils ne sont pas des additifs alimentaires autorisés au Canada (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2017; sans référence).
| Nombre total de produits | Catégories de produits | Concentration maximale (% en poids) |
|---|---|---|
| 515 |
Produits capillaires Antisudorifique Produit pour le bain Hydratant et exfoliant Produit de massage Maquillage (yeux/lèvres) |
30 10 10 10 30 3 /10 |
3.4 Devenir et comportement dans l’environnement
3.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), les alcools de lanoline ne devraient pas persister dans l’air, l’eau, le sol ou les sédiments.
3.4.2 Potentiel de bioaccumulation
Bien que le log Koe des alcools de lanoline soit élevé (environ 8), le facteur de bioconcentration de ces substances est faible. Par conséquent, ces substances ne devraient pas subir de bioaccumulation considérable dans les organismes (ECCC 2016b).
3.5 Effets nocifs potentiels sur l’environnement
3.5.1 Caractérisation du risque écologique
Les risques pour l’environnement associés aux alcools de lanoline ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) pour les substances organiques. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil des alcools de lanoline, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Les alcools de lanoline ont été classés comme présentant un danger élevé selon les renseignements examinés selon l’approche CRE en raison des alertes structurelles de la boîte à outils de l’OCDE (LMC 2017), ces substances ayant été considérées comme présentant un potentiel de liaison aux œstrogènes et un mode d’action réactif. Cependant, compte tenu du faible risque d’exposition, il est peu probable que ces substances entraînent des préoccupations pour l’environnement au Canada.
3.6 Effets nocifs potentiels sur la santé humaine
3.6.1 Évaluation de l’exposition
Les consommateurs ne seront probablement pas exposés aux alcools de lanoline rejetés dans l’environnement par divers flux de déchets. En raison de leur point d’ébullition élevé et de leur faible volatilité, ces alcools ne sont pas susceptibles d’être présents dans l’atmosphère en quantité appréciable. En outre, en raison de leur insolubilité dans l’eau, les eaux usées ne sont pas susceptibles d’être une source d’exposition.
Les alcools de lanoline sont présents à des degrés divers dans les produits disponibles aux consommateurs. Cependant, les consommateurs les utilisent surtout dans les cosmétiques ou comme ingrédients dans des produits de santé naturels. L’utilisation des alcools de lanoline dans les cosmétiques devrait entraîner une exposition cutanée. En raison de la faible volatilité et de la nature des produits, l’exposition par inhalation et l’ingestion d’alcools de lanoline sont peu probables. Les alcools de lanoline ne sont pas utilisés dans les applications alimentaires. Par conséquent, on ne s’attend pas à ce qu’il y ait une exposition par les aliments.
3.6.2 Évaluation des effets sur la santé
Il n’existe aucune évaluation internationale pour cette substance. Par conséquent, il n’a pas été établi que les alcools de lanoline présentent un danger pour la santé humaine d’après les classifications réalisées par des organismes nationaux ou internationaux sur la cancérogénicité, la génotoxicité, la toxicité pour le développement ou la toxicité pour la reproduction.
Le principal effet des alcools de lanoline sur la santé devrait être une dermatite chez les personnes allergiques à la laine ou à la lanoline. Le groupe d’experts du CIR a indiqué qu’aucun effet nocif des alcools de lanoline n’a été signalé à la suite d’une exposition aiguë ou répétée chez les animaux de laboratoire ou des volontaires humains, et a conclu en outre que, d’après les données existantes, les alcools de lanoline et leurs dérivés étaient sûrs pour une utilisation dans les cosmétiques pour les humains (CIR 2005).
Dans une étude de toxicité pour le développement, l’exposition de rats par gavage à des alcools de lanoline à raison de 0, 100, 300 ou 1 000 mg/kg p.c./j du jour de gestation (JG) 5 au JG 19 n’a provoqué aucun effet sur les mères ou le développement (ECHA 2013).
3.6.3 Caractérisation du risque pour la santé humaine
Bien qu’il existe un risque d’exposition, les données disponibles pour les humains et les animaux n’indiquent pas d’effet nocif lié à l’exposition aux alcools de lanoline. Par conséquent, le risque pour la santé humaine associé aux alcools de lanoline est considéré comme faible.
4. Méthanolate de sodium
4.1 Identité de la substance
Cette substance est aussi appelée méthylate de sodium. Les renseignements concernant l’identité du méthanolate de sodium sont résumés dans le Tableau 4‑1 (PubChem2004‑ ).
| N° CAS | Nom dans la LIS (nom commun) | Formule moléculaire | Structure moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 124‑41‑4 | Méthanolate de sodium (méthylate de sodium) | CH3ONa |  |
54,024 |
4.2 Propriétés physiques et chimiques
Les valeurs mesurées des propriétés physiques et chimiques du méthanolate de sodium sont présentées dans le Tableau 4‑2 (PubChem2004‑ ; ChemIDplus 2017). D’autres propriétés physiques et chimiques de la substance sont présentées dans ECCC (2016b).
| Point de fusion (°C) | Masse volumique (g/cm³) | log Koe (sans dimension) | Pression de vapeur (mm Hg) | Température d’inflammation spontanée (°C) |
|---|---|---|---|---|
| > 127 | 1,3 | ₋3,180 | 4,79 × 10‑6 | 50–60 |
Le méthanolate de sodium réagit fortement avec l’eau, formant de l’hydroxyde de sodium caustique et du méthanol dans une réaction extrêmement exothermique.
4.3 Sources et utilisations
Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le méthanolate de sodium n’a pas été fabriqué au Canada en 2011, mais a été importé au Canada en quantités comprises entre 1 000 kg et 10 000 kg cette année‑là (Environnement Canada 2013) Note de bas de page 4 .
La majeure partie du méthanolate de sodium produit dans l’industrie est utilisée comme solvant et intermédiaire chimique dans la fabrication de produits chimiques en vrac, à grande échelle et spécialisés, y compris les produits pétroliers. Il est également utilisé comme réactif de transestérification dans la fabrication de produits pharmaceutiques, de produits alimentaires et de carburants biodiesel (BASF 2012). Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le méthanolate de sodium a été utilisé comme intermédiaire dans la fabrication de divers produits chimiques : produits cosmétiques, produits de nettoyage et d’entretien de l’ameublement, produits de lessive et de vaisselle, produits de soins pour animaux de compagnie et produits d’entretien automobile. En raison de sa grande réactivité et de sa réaction exothermique avec l’eau, le méthanolate de sodium ne devrait pas être présent en quantité appréciable dans les produits disponibles aux consommateurs.
Au Canada, le méthanolate de sodium peut être utilisé comme composant de matériaux d’emballage alimentaire à base de polyéthylène n’entrant pas en contact direct avec les aliments. L’exposition par les aliments n’est donc pas prévue (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, octobre 2016; sans référence). On ne dispose d’aucun renseignement indiquant que des produits disponibles aux consommateurs contiennent comme ingrédient du méthanolate de sodium.
4.4 Devenir et comportement dans l’environnement
4.4.1 Persistance dans l’environnement
Dans les modèles utilisés dans l’approche CRE (ECCC 2016b), le méthanolate de sodium est modélisé comme ayant une longue demi‑vie (environ 415 heures) dans l’air. Toutefois, compte tenu de la réactivité du méthanolate de sodium avec l’eau et l’humidité atmosphérique, la demi‑vie réelle de la substance dans l’air devrait être inférieure. Le méthanolate de sodium ne devrait pas persister dans l’eau, le sol ou les sédiments (ECCC 2016b).
4.4.2 Potentiel de bioaccumulation
Compte tenu de sa faible valeur log Koe et de son faible facteur de bioconcentration (ECCC 2016b), le méthanolate de sodium ne devrait pas subir de bioaccumulation considérable dans les organismes.
4.5 Effets nocifs potentiels sur l’environnement
4.5.1 Caractérisation du risque écologique
Le risque pour l’environnement associé au méthanolate de sodium a été caractérisé selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil du méthanolate de sodium et les résultats de la classification des dangers, de l’exposition et des risques sont présentés dans ECCC (2016b).
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le méthanolate de sodium a été classé comme substance présentant un faible risque pour l’environnement. Il est peu probable que cette substance suscite des préoccupations pour l’environnement au Canada.
4.6 Effets nocifs potentiels sur la santé humaine
4.6.1 Évaluation de l’exposition
Le méthanolate de sodium est très réactif et toute matière résiduelle du processus de fabrication réagira avec l’eau pour produire du méthanol et de l’hydroxyde de sodium en solution aqueuse.
Le méthanolate de sodium n’est un ingrédient d’aucun produit disponible aux consommateurs au Canada. Il n’y a pas non plus de rejets courants de méthanolate de sodium dans les eaux usées ou dans l’air, et tout méthanol produit par l’utilisation du méthanolate de sodium est brûlé à la torchère (OCDE 2006b). S’il devait y avoir des rejets, la substance serait immédiatement hydrolysée en méthanol et en hydroxyde de sodium lors de son l’exposition à l’environnement (PubChem2004‑ ).
Les milieux naturels ne devraient pas être exposés au méthanolate de sodium.
Dans l’ensemble, la population générale ne devrait pas être exposée au méthanolate de sodium.
4.6.2 Évaluation des effets sur la santé
Le méthanolate de sodium a fait l’objet d’un examen international et cet examen a été utilisé pour étayer la caractérisation des effets sur la santé dans la présente évaluation (OCDE 2006b). On n’a pas déterminé de risque pour la santé humaine d’après les classifications d’autres organismes nationaux et internationaux concernant leur cancérogénicité, leur génotoxicité, leur toxicité pour le développement ou leur toxicité pour la reproduction. Ce produit chimique a été jugé faiblement prioritaire pour la poursuite des travaux (OCDE 2006b) en raison de l’exposition peu probable de la population générale à celui‑ci dans des conditions normales. L’effet critique du méthanolate de sodium est dû à la formation d’hydroxyde de sodium après contact du méthanolate de sodium avec l’humidité, ce qui entraîne une corrosivité pour la peau et les yeux en cas de contact direct et une toxicité aiguë à doses répétées par voie orale, par voie cutanée ou par inhalation. Une étude plus approfondie des effets sur la santé n’est pas justifiée pour le moment, en raison de la réactivité de cette substance à l’humidité et de la faible exposition prévue de la population canadienne générale.
4.6.3 Caractérisation du risque pour la santé humaine
En raison de sa forte réactivité avec l’eau et de la réaction exothermique qui s'ensuit, le méthanolate de sodium ne devrait pas être présent en quantité appréciable dans les produits disponibles aux consommateurs ou dans l’environnement. Dans l’ensemble, on ne s’attend pas à ce que la population générale soit exposée au méthanolate de sodium et, par conséquent, le risque pour la santé humaine est jugé faible.
5. Méthanol
5.1 Identité de la substance
Le méthanol, communément appelé alcool méthylique ou alcool de bois, est une substance présente dans la nature et aussi d’origine anthropique. Les données concernant l’identité de cet alcool sont résumées dans le Tableau 5‑1 (ChemID 2017).
| N° CAS | Nom dans la LIS | Formule moléculaire | Structure moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 67‑56‑1 | Méthanol | CH4O | 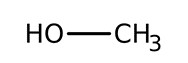 |
32,04 |
Le méthanol est miscible avec l’eau dans toutes proportions, mais il est également soluble dans de nombreux autres solvants organiques.
5.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques mesurées du méthanol sont présentées dans le Tableau 5‑2 (ChemIDplus 2017). D’autres propriétés physiques et chimiques de la substance sont présentées dans ECCC (2016b).
| Point de fusion (°C) | Point d’ébullition (°C) | log Koe (sans dimension) | Solubilité dans l’eau (mg/L) | Pression de vapeur (Pa) |
|---|---|---|---|---|
| ₋98 | 65 | ₋0,82 à ₋0,64 | Miscible | 12 790 à 20 °C |
Le méthanol est dégradé par la lumière du soleil, ce qui produit du dioxyde de carbone et de l’eau. Sa demi‑vie dans la troposphère est estimée à environ 17 à 18 jours (OCDE 2004c). Le méthanol devrait se volatiliser à partir de la surface de l’eau. Les demi‑vies de volatilisation estimées pour une rivière et un lac modèles sont respectivement de 4,6 et 35 jours (PubChem 2021).
5.3 Sources et utilisations
Le méthanol est une substance présente à l’état naturel, couramment produite par des bactéries dans des milieux anaérobies. Par conséquent, l’atmosphère contient une petite quantité de vapeur de méthanol. Les concentrations de méthanol dans l’air urbain, dans le monde, varient entre 1,05 × 10‑5 et 13,1 × 10‑5 mg/L (OCDE 2004c,d).
Chez les humains, le méthanol est également présent naturellement in vivo en tant que produit métabolique. Il a été démontré que la consommation de fruits, de légumes et de boissons alcoolisées augmente la concentration de méthanol dans le sang. Chez les humains en bonne santé, la concentration de méthanol dans le sang varie entre 0,25 mg/L et 5,2 mg/L (IPCS 1997b). L’EPA estime que la concentration de 2,5 mg/L représente l’extrémité supérieure des concentrations de méthanol dans le sang dans la population moyenne (IRIS 2013).
La production de méthanol est essentiellement de sources anthropiques. La production annuelle nationale est estimée entre 600 000 et 700 000 tonnes, mais cela ne représente qu’une faible fraction du volume mondial fabriqué (CERI 2016). Le Canada exporte également 250 000 tonnes supplémentaires de méthanol par an vers les États‑Unis et importe environ la même quantité des États‑Unis pour diverses applications (CERI 2016).
Le méthanol est un composant clé de la synthèse de produits chimiques plus complexes et est donc principalement utilisé dans des applications restreintes à une industrie ou à un site donné (Merck 2010, Methanol Institute 2021). La production de formaldéhyde représente le plus grand marché du méthanol. L’augmentation actuelle de la demande de méthanol est largement due aux nouvelles applications dans le domaine de l’énergie, qui représentent désormais collectivement 40 % de la consommation de méthanol. Ces utilisations comprennent les mélanges d’essence, la production de méthoxyméthane (aussi appelé diméthyléther ou DME) et de 2‑méthoxy‑2‑méthylpropane (aussi appelé méthyl tert‑butyl éther ou MTBE) ainsi que son utilisation directe comme biocarburant.
Une autre application du méthanol est dans le traitement des eaux usées. Les stations de traitement des eaux usées (STEU) utilisent des bactéries pour dénitrifier l’eau avant de la rejeter afin d’éviter que les effluents ne déclenchent des proliférations d’algues nuisibles en aval. La dénitrification se fait dans des conditions anaérobies, et le méthanol est ajouté comme source de carbone biodégradable pour accélérer l’activité bactérienne (Murphy 2009).
Les utilisations du méthanol dans les cosmétiques, les aliments et les PSN au Canada sont résumées dans le Tableau 5‑3. Les cosmétiques vendus au Canada qui contiennent une quantité de méthanol égale ou supérieure à 5 mL doivent être emballés dans un contenant protège‑enfants conformément à l’article 15.2 du Règlement sur les cosmétiques et doivent comporter certaines mises en garde sur l’étiquette conformément à l’article 24 du Règlement sur les cosmétiques. Les notifications présentées en vertu du Règlement sur les cosmétiques à Santé Canada indiquent que le méthanol est utilisé dans un total de 27 produits cosmétiques au Canada. Les notifications pour deux de ces produits indiquent des concentrations atteignant 3 % p/p, alors que les autres produits indiquent une teneur en méthanol inférieure à 0,3 % p/p (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 27 octobre 2016). Tous ces produits cosmétiques sont à usage topique et sont donc appliqués sur la peau.
| Groupes d’utilisation | Utilisations / poids de méthanol en % | Remarques |
|---|---|---|
| Produits cosmétiques |
Produits capillaires / 3 % Maquillage / 3 % Hydratant pour la peau / 0,1 % |
Dans 27 produits |
| Aliments et matériaux d’emballage alimentaire |
Encres d’imprimerie Matériaux en polymère Additifs alimentaires |
Peut entrer en contact direct avec les aliments et les personnes peuvent y être exposées |
| PSN | Solvant |
Figure dans la BDIPSN Présent dans les PSN actuellement homologués |
Abréviations : BDIPSN = Base de données des ingrédients des produits de santé naturels.
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada au Bureau d’évaluation du risque des substances existantes, Santé Canada, 26 octobre 2016, sans référence.
Le méthanol et l’alcool éthylique dénaturé avec du méthanol sont des additifs alimentaires autorisés, utilisés comme solvants dans un nombre limité d’aliments, comme le prescrit la Liste des solvants de support ou d’extraction autorisés (Santé Canada 2016b) et incorporés par renvoi dans les autorisations de mise en marché respectives délivrées en vertu de la Loi sur les aliments et drogues. Le méthanol peut également être utilisé comme composant dans la fabrication de divers matériaux d’emballage alimentaire à base de polymères (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, décembre 2016; sans référence).
L’alcool méthylique figure dans la Pharmacopée des États‑Unis (USP), accompagné d’une mise en garde indiquant qu’il est toxique et qu’on ne doit pas dépasser la limite de 200 µL/L. Il s’agit de l’une des impuretés organiques figurant dans la monographie de l’alcool déshydraté, et a été classé comme solvant de classe 2 dans le chapitre général sur les solvants résiduels. Les solvants résiduels sont des solvants dont la présence doit être limitée dans les substances médicamenteuses, les excipients, les ingrédients alimentaires et les produits officiels en raison de leur toxicité inhérente. En effet, l’exposition quotidienne autorisée aux solvants résiduels est de 30,0 mg/j et la concentration limite est de 300 ppm (ICH 2016). Cinquante‑sept médicaments en vente libre mentionnent le méthanol comme ingrédient non médicinal. Sept de ces produits ont été abandonnés en 2014 et il est peu probable qu’ils soient présents sur le marché. Aucun de ces produits n’énumère le méthanol comme ingrédient actif, ce qui permet de croire que la substance est présente à l’état de traces à la suite de la synthèse, l’extraction ou d’autres étapes de production (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 26 octobre 2016; sans référence). Le méthanol est également utilisé comme ingrédient dans les enrobages de comprimés déclarés comme produits de santé naturels. Cet enrobage est pulvérisé sur les comprimés et le méthanol s’évapore après le séchage (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 4 juin 2021; sans référence).
Le méthanol est un produit de formulation dans les produits antiparasitaires au Canada (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, au Bureau de la gestion du risque, Santé Canada, septembre 2017; sans référence).
La présence du méthanol dans les produits disponibles aux consommateurs découle de sa miscibilité, de sa volatilité et de son faible point de fusion. Le méthanol est formulé à la fois comme liquide et nettoyant en aérosol. La concentration en pourcentage varie en fonction de l’application prévue, avec des concentrations allant de traces à 5 % p/p dans les produits destinés à un usage fréquent à l’intérieur de la maison (p. ex., les nettoyants de sol, les lingettes, les nettoyants pour vitre, les nettoyants pour lentilles) (FDS 2015g).
On peut diviser en deux groupes les décapants à peinture et à vernis qui contiennent du méthanol : les groupes contenant du chlorure de méthylène (FDS 2013a, 2015hi,j, 2018b, 2019a,b) et ceux contenant d’autres solvants volatils (FDS 2016c, 2018a). Les décapants à peinture et à vernis avec chlorure de méthylène contiennent entre < 5 % p/p et 26 % p/p de méthanol, tandis que ceux contenant d’autres solvants contiennent entre < 5 % p/p et 35 % p/p de méthanol. Ces produits peuvent être utilisés à l’intérieur et à l’extérieur sur une variété de surfaces, dont le bois, la céramique, l’émail, le métal et la maçonnerie. On peut aussi les utiliser pour enlever les peintures à l’huile, au latex et aux résines époxydes.
Les produits d’entretien ménager contenant la plus forte concentration de méthanol en poids sont les agents de déglaçage. Le méthanol est présent à hauteur de 75 % dans les préparations de déglaçage, toutes destinées à être utilisées à l’extérieur de la maison (FDS 2013b).
Le méthanol est également couramment ajouté à divers produits d’arts et d’artisanat. Les colles pour maquettes et les diluants pour laque contiennent généralement moins de 10 % p/p de méthanol. Cependant, les moteurs pour maquettes et les combustibles de cuisson contiennent du méthanol à des concentrations pouvant atteindre 75 % p/p (FDS 2016a).
Le liquide lave‑glace disponible dans le commerce au Canada contient du méthanol à des concentrations atteignant 80 % p/p, et certains produits antigel pour essence seraient presque entièrement composés de méthanol (90 % à 100 % p/p) (FDS 2014f). Le méthanol est également ajouté aux produits destinés à augmenter l’indice d’octane de l’essence ou du diesel et est vendu dans les nettoyants pour pièces automobiles. Les préparations de ces deux applications contiennent du méthanol à des concentrations allant de moins de 5 % p/p à 100 % p/p (FDS 2011b, 2014g, 2015f).
5.4 Devenir et comportement dans l’environnement
5.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), on prévoit que le méthanol devrait persister dans l’air, mais ne devrait pas persister dans l’eau, les sédiments et le sol.
5.4.2 Potentiel de bioaccumulation
Compte tenu de sa faible valeur de log Koe et de son faible facteur de bioconcentration (ECCC 2016b), le méthanol ne devrait pas subir de bioaccumulation considérable dans les organismes.
5.5 Effets nocifs potentiels sur l’environnement
5.5.1 Caractérisation du risque écologique
Le risque écologique du méthanol a été caractérisé selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil du méthanol, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Selon les renseignements pris en compte selon l’approche CRE, le méthanol a été classé comme ayant un risque d’exposition élevé en raison de sa demi‑vie extrêmement longue dans l’air et des grandes quantités utilisées. Bien que les profils d’utilisation actuels indiquent un risque d’exposition élevé, il est peu probable que le méthanol soit préoccupant pour l’environnement au Canada, compte tenu de son faible danger.
5.6 Effets nocifs potentiels sur la santé humaine
5.6.1 Évaluation de l’exposition
5.6.1.1 Milieux naturels et aliments
Il est possible que le méthanol soit présent dans l’eau et dans l’air. Comme il est indiqué à la section 6.2, le méthanol a une demi‑vie estimée à 18 jours dans la troposphère. D’après les calculs selon le modèle de fugacité de niveau III, le méthanol dans l’environnement est présent dans une proportion de 73 % dans l’air et de 16 % dans l’eau (OCDE 2004c,d).
L’estimation de l’exposition au méthanol par inhalation est calculée à partir des données de surveillance de l’air intérieur dans quatre villes canadiennes. Bari et al. (2015) ont fait état d’une récente étude de Santé Canada visant à mesurer les variations saisonnières du méthanol en milieu résidentiel, tant à l’intérieur qu’à l’extérieur, à Edmonton, en Alberta (Santé Canada 2013). Des études de surveillance de l’air intérieur résidentiel et extérieur ont également été réalisées récemment dans quatre villes canadiennes (Santé Canada 2010a, 2010b, 2012, 2013). La moyenne géométrique, la moyenne arithmétique, le 5e centile (C5) et le 95e centile (C95) des concentrations mesurées par échantillonnage sur des périodes de 24 heures sont indiqués pour les conditions hivernales et estivales dans le Tableau 5‑4.
| Scénario Saison |
Intérieur Moyenne géométrique (moyenne arithmétique) |
Intérieur 5e – 95e centiles |
Extérieur Moyenne géométrique (moyenne arithmétique) |
Extérieur 5e – 95e centiles |
|---|---|---|---|---|
| Été | 0,196 (0,250) | 0,035–0,518 | 0,018 (0,021) | 0,008–0,034 |
| Hiver | 0,150 (0,197) | 0,056–0,433 | 0,017 (0,023) | 0,003–0,085 |
a Les moyennes les plus élevées parmi les 4 villes et les 5e et 95e centiles (C5 et C95) sont indiqués.
Les émissions de méthanol provenant de la production et de l’utilisation industrielles peuvent entraîner une exposition par inhalation pour les personnes résidant à proximité de ces installations industrielles. Les taux d’émission de méthanol ont été déterminés à partir des données de l’Inventaire national des rejets de polluants (INRP) et corrélés avec les émissions et les potentiels d’exposition les plus élevés (INRP 2014) pour une installation de production de méthanol ayant le volume de production le plus élevé et se trouvant le plus près de zones résidentielles. Ce scénario d’émissions aux limites supérieures a été utilisé dans SCREEN3 (1996) pour déterminer la dispersion du méthanol à diverses distances des sources industrielles de rejets dans l’atmosphère. SCREEN3 est un modèle gaussien d’évaluation de la dispersion atmosphérique inspiré du modèle Industrial Source Complex (ISC) qui évalue la concentration des agents polluants provenant de diverses sources dans un complexe industriel. Le facteur déterminant de la dispersion atmosphérique dans le modèle SCREEN3 est le vent. La concentration d’exposition maximale est calculée d’après une matrice intégrée de données météorologiques pour différentes combinaisons de conditions météorologiques, dont la vitesse du vent, la turbulence et l’humidité. Ce modèle estime la concentration des polluants atmosphériques présents dans les rejets émis par une source ponctuelle, surfacique ou volumique. SCREEN3 donne la concentration maximale d’une substance à des hauteurs de récepteur choisies et à diverses distances de la source de rejet, en aval du vent dominant, une heure après le rejet. Dans le cas des sources d’émission ponctuelles, l’exposition maximale après une heure (telle qu’évaluée par le modèle ISC, version 3) est multipliée par un facteur de 0,4 afin de tenir compte de la direction variable du vent, ce qui donne une estimation de la concentration dans l’air sur 24 heures (US EPA, 1992). Pour ce qui est de l’exposition sur une période d’un an, on peut s’attendre à ce qu’avec les changements de direction du vent, les concentrations atmosphériques de la substance dans la région autour d’une source d’émission surfacique ne varient pas autant que les concentrations mesurées près des sources de rejets ponctuels. Les conditions météorologiques donnant lieu à une exposition maximale sur 1 heure peuvent persister pendant plus longtemps. Ainsi, on détermine la concentration maximale pour 1 an en multipliant la concentration maximale sur 1 heure par un facteur de 0,2. Un scénario d’exposition a été élaboré pour les résidences situées à proximité d’une zone d’émission de 600 × 600 m2 (installation industrielle). En raison des diverses activités de l’installation industrielle qui provoquaient des turbulences locales, la superficie totale de l’installation a été considérée comme source d’émission surfacique. Une hauteur de récepteur correspondant à la taille moyenne des Canadiens (1,74 m) a été utilisée dans les calculs de dispersion. Les paramètres utilisés pour modéliser la dispersion du méthanol rejeté par l’installation industrielle sont présentés dans le tableau B‑1 (annexe B).
Les variations de la concentration de méthanol en fonction de la distance du centre du site de rejets industriel pour une hauteur de récepteur de 1,74 m sont présentées dans le tableau B‑2 (annexe B). La concentration ambiante maximale annualisée de méthanol est maximale à 800 m du point de rejet et est estimée à 0,53 mg/m3 (voir le tableau B‑2 de l’annexe B). Cette concentration est une estimation du pire scénario qui ne tient pas compte des propriétés physico‑chimiques du méthanol ni de sa dégradation dans l’air.
Le méthanol est présent de manière naturelle chez les humains, les animaux et les plantes. Les régimes alimentaires normaux et le métabolisme sont une source d’exposition et contribuent aux concentrations de fond de méthanol dans le sang. La population générale peut être exposée au méthanol par l’alimentation via la consommation de fruits et légumes frais, de jus de fruits, d’aliments contenant l’édulcorant artificiel aspartame et de boissons fermentées telles que les boissons alcoolisées ou le thé kombucha (US EPA 2013). La concentration moyenne de méthanol dans le sang d’une population américaine en bonne santé est de 0,73 mg/L, avec une fourchette variant de 0,32 à 2,61 mg/L. Selon l’EPA, l’alimentation seule n’augmenterait pas la concentration sanguine de méthanol au‑delà de 2,5 mg/L (OCDE 2004).
Au Canada, le méthanol est un additif alimentaire autorisé comme solvant vecteur pour les encres appliquées directement sur la viande ou la coquille des œufs pour y apposer des marques ou toute autre information. Pour cette application, on doit l’utiliser conformément aux bonnes pratiques de fabrication selon l’article B.01.045 du Règlement sur les aliments et drogues (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, décembre 2016; sans référence). Toutes les utilisations raisonnables de ces produits comportent un traitement thermique (cuisson) de la viande ou la mise aux rebuts des coquilles.
Il existe d’autres utilisations autorisées du méthanol en tant qu’additif alimentaire. Il peut servir de solvant d’extraction dans la fabrication de certains ingrédients alimentaires (extraits naturels, extraits d’épices, extrait de houblon et glycosides de stéviol, un édulcorant). Dans ces cas, il existe des limites quant à la quantité résiduelle de méthanol dans les aliments. Les utilisations autorisées des additifs alimentaires et les concentrations maximales de résidus admissibles sont présentées dans le Tableau 5‑5.
| Utilisation comme additif alimentaire | Concentration résiduelle maximale autorisée |
|---|---|
| Extraits naturels; extraits d’épices | 50 ppm |
| Extrait de houblon a | 2,2 % |
| Glycosides de stéviol | 200 ppm |
| Alcool éthylique dénaturé avec le méthanol autorisé dans les farines de graines oléagineuses végétales | 10 ppm |
a Conformément au sous‑alinéa B.02.130b)(v) et à l’alinéa B.02.133a) du Règlement sur les aliments et drogues.
Le méthanol est également présent à l’état naturel dans les fruits et légumes frais, ainsi que dans les produits fabriqués à partir de ceux‑ci, comme les jus, les sauces, les boissons alcoolisées et le vinaigre. La température et la durée de stockage des aliments, ainsi que les techniques de transformation telles que la pasteurisation, peuvent influer sur la concentration de méthanol dans les aliments transformés (Hou et al. 2008; Shaw et al. 2000).
Les boissons alcoolisées sont réglementées en tant qu’aliments et, à ce titre, elles doivent respecter les dispositions générales de l’alinéa 4(1)a) de la LAD, qui stipulent qu’il est interdit de vendre un aliment qui contient une substance toxique ou délétère, ou en est recouvert. Le Règlement sur les aliments et drogues ne contient pas de disposition spécifique régissant la présence de méthanol dans les boissons alcoolisées ou tout autre type d’aliment. Santé Canada n’a pas établi de limites maximales pour le méthanol dans les boissons alcoolisées, mais a fourni des directives aux autres ministères fédéraux et aux sociétés provinciales des alcools sur les concentrations de méthanol dans les boissons alcoolisées qui ne devraient pas présenter de problème pour les consommateurs. Les sociétés provinciales des alcools peuvent établir des limites pour le méthanol dans les boissons alcoolisées. Par exemple, la Régie des alcools de l’Ontario a des règlements limitant le méthanol à 400 mg/L dans différentes boissons (LCBO 2013).
Le méthanol peut être produit dans le corps humain par des processus métaboliques, ainsi que pendant la digestion de certains additifs alimentaires et de composés végétaux omniprésents comme la pectine (Dorokhov et al. 2015). Dans la présente évaluation, on a strictement quantifié l’exposition au méthanol présent dans les aliments au moment où ils sont consommés.
Les données sur la présence du méthanol utilisées pour estimer l’exposition par le régime alimentaire provenaient principalement de la base de données Volatile Compounds in Food (VCF) (Nijssen 1953–2017). Pour chaque catégorie d’aliments et de boissons de la base de données, la plus forte concentration de méthanol déclarée a été utilisée pour représenter la catégorie d’aliments (hypothèse prudente). Dans les cas où la concentration de méthanol était du même ordre dans plusieurs catégories d’aliments apparentées, les aliments ont été combinés en une seule catégorie et la plus forte concentration de méthanol indiquée parmi tous les aliments applicables a été choisie pour l’ensemble de la catégorie (p. ex., tous les fruits autres que les agrumes). Lors d’études supplémentaires, si on avait déclaré des concentrations de méthanol supérieures à la valeur maximale présente dans la base de données VCF, ces concentrations plus élevées ont été utilisées (tableau C‑1 de l’annexe C).
Les concentrations maximales de méthanol dans les aliments et les boissons alcoolisées qui ont été utilisées pour la présente évaluation allaient de 0,009 ppm dans les produits laitiers à 560 ppm dans le jus de tomate, à l’exception du brandy de poire, une eau-de-vie pour laquelle des concentrations de méthanol plus élevées ont été signalées, atteignant 9 300 ppm (tableau C‑1 de l’annexe C).
Les données sur la consommation alimentaire utilisées dans la présente évaluation proviennent de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) (Statistique Canada 2015). Comme la consommation de brandy n’était pas couverte dans l’ESCC, la part de marché de 0,7 % de tous les types de brandy au Canada (Nielsen 2017) a été appliquée à la consommation combinée de spiritueux déclarée dans l’enquête ESCC (whisky, vodka, rhum et gin) pour générer un taux de consommation du brandy.
Santé Canada a estimé l’exposition alimentaire au méthanol en multipliant la concentration maximale de méthanol présumée pour chaque aliment ou catégorie d’aliments (tableau C‑1 de l’annexe C) par la quantité de cet aliment qui aurait été consommée par chaque répondant. On a ainsi obtenu une distribution de l’exposition estimée au méthanol pour divers groupes d’âge (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 9 février 2018; sans référence).
Pour estimer l’exposition au méthanol découlant de son utilisation potentielle comme solvant d’extraction, les concentrations maximales de résidus autorisées indiquées dans la colonne 3 de la Liste des solvants de support ou d’extraction autorisés ont été employées ainsi que les renseignements sur la consommation tirés de l’ESCC de 2015. Cependant, l’exposition alimentaire au méthanol provenant de son utilisation comme solvant d’extraction dans la fabrication des glycosides de stéviol a été établie d’après une évaluation menée par la Direction des aliments en 2016, qui a employé les chiffres de consommation de l’ESCC de 2004 (Statistique Canada 2004) et avait supposé que les glycosides de stéviol sont utilisés dans tous les aliments dans lesquels leur utilisation est approuvée et qu’ils contiennent du méthanol à la concentration résiduelle maximale autorisée. L’exposition alimentaire au méthanol provenant de son utilisation potentielle comme solvant vecteur dans les encres de marquage de la viande et des œufs et comme composant des matériaux d’emballage alimentaire n’a pas été calculée, car elle devrait être négligeable par rapport à l’exposition provenant d’autres utilisations comme additif alimentaire.
L’exposition alimentaire au méthanol par les boissons alcoolisées, les sources naturelles (définies comme toutes les sources alimentaires naturelles autres que les boissons alcoolisées) et les utilisations potentielles comme additif alimentaire est présentée dans le Tableau 5‑6. Comme de nombreux aliments contenant du méthanol font partie du régime alimentaire des Canadiens, les estimations de l’exposition au 90e centile ont été calculées. Le 90e centile est représentatif de « toutes les personnes ».
| Groupe d’âge (hommes et femmes) (âge) | Boissons alcoolisées | Sources naturelles | Additif alimentaire |
|---|---|---|---|
| Moyenne (C90) | Moyenne (C90) | Moyenne (C90) | |
| 1–3 | S.O. (S.O.) | 2,35 (5,70) | 0,25 (0,56) |
| 4–8 | S.O. (S.O.) | 2,13 (5,08) | 0,25 (0,48) |
| 9–13 | S.O. (S.O.) | 1,06 (2,49) | 0,20 (0,40) |
| 14–18 | S.O. (S.O.) | 0,74 (1,78) | 0,11 (0,23) |
| 19–30 | 0,10 (0,36) | 0,64 (1,75) | 0,06 (0,13) |
| 31–50 | 0,13 (0,48) | 0,59 (1,53) | 0,16 (0,32) |
| 51–70 | 0,20 (0,76) | 0,49 (1,25) | 0,09 (0,20) |
| 71+ | 0,13 (0,51) | 0,56 (1,35) | 0,06 (0,13) |
Abréviation : S.O. = sans objet.
a Les valeurs moyennes et au 90e centile (C90) sont données en mg/kg p.c./j.
Les boissons alcoolisées et les utilisations potentielles comme additif alimentaire contribuent faiblement à l’exposition alimentaire au méthanol par rapport aux sources alimentaires naturelles (tableau 6‑6). La catégorie d’aliments contribuant le plus aux sources alimentaires naturelles d’exposition au méthanol était « les tomates et les sauces tomate », qui représentait 30 % de l’exposition dans tous les groupes d’âge combinés, et chez les enfants de 1 à 3 ans.
5.6.1.2 Exposition par les produits disponibles aux consommateurs
Exposition cutanée
Le méthanol a une masse molaire de 32,04 g/mol, une pression de vapeur élevée (12 790 hPa à 20 °C) et un faible coefficient de partage octanol‑eau (entre ‑0,82 et ‑0,64). Par conséquent, le méthanol devrait se volatiliser rapidement lorsqu’il est appliqué sur la peau, et la principale voie d’exposition au méthanol appliqué sur la peau est l’inhalation. Cela est confirmé par une étude sur l’application cutanée de désinfectants pour les mains contenant de l’éthanol, et qui a conclu que la principale voie d’exposition à l’éthanol par ce produit était l’inhalation (Ardnt et al. 2014). Le méthanol est plus léger que l’éthanol (32,04 g/mol pour le méthanol contre 46,07 g/mol pour l’éthanol) et a une pression de vapeur plus élevée et un coefficient de partage octanol‑eau plus faible. Par conséquent, il devrait avoir une demi‑vie après l’évaporation cutanée encore plus courte que celle de l’éthanol.
Le méthanol présent dans les produits destinés à une application cutanée (en particulier les produits cosmétiques topiques et les produits de santé naturels du tableau 6‑3) devrait s’évaporer peu après l’application. Par conséquent, les voies d’exposition humaine au méthanol sont l’inhalation et l’absorption orale.
Exposition par inhalation
La concentration de méthanol dans l’air intérieur des maisons au Canada peut être attribuée à diverses sources, dont les cosmétiques destinés à être appliqués sur la peau, les produits de nettoyage ménager, les produits d’entretien ménager et d’autres produits en aérosol. Afin d’évaluer le risque d’une exposition potentielle à long terme au méthanol dans les maisons, la moyenne géométrique et la valeur la plus élevée du 95e centile de méthanol dans les maisons canadiennes sans fumeur ont été sélectionnées dans des études d’échantillonnage de l’air réalisées dans des maisons situées dans quatre villes canadiennes, comme le montre le tableau 6‑4. Ces concentrations, soit 0,20 et 0,5182 mg/m3, respectivement, sont considérées comme des estimations des concentrations types de méthanol dans l’air intérieur.
Le produit destiné aux consommateurs contenant du méthanol pour usage domestique quotidien répété et donnant l’exposition prévue la plus élevée est un nettoyant tout‑usage en pulvérisateur contenant 5 % p/p de méthanol. En utilisant les facteurs d’exposition de ConsExpo Web pour les nettoyants tout‑usage en pulvérisateur indiqués dans le tableau B‑4 de l’annexe B, on obtient une concentration moyenne de 0,62 mg/m3 le jour de l’exposition.
Pour estimer l’exposition par inhalation à court terme au méthanol provenant de l’utilisation de cosmétiques et/ou de PSN, on a choisi des scénarios avec une limite supérieure d’exposition. Un produit de coiffure a été sélectionné car il s’agit de la plus grande quantité utilisée et du pourcentage le plus élevé de méthanol présent dans le produit (3 %). On considère que le méthanol contenu dans ce produit s’évapore rapidement et que l’inhalation devient la voie d’exposition au méthanol après utilisation de ce produit. Les facteurs d’exposition pour l’utilisation de produits de coiffure sont indiqués dans le tableau B‑4 (annexe B). La concentration moyenne résultante par inhalation a été établie à 5,1 mg/m3 à l’aide de ConsExpo (RIVM 2006, Ficheux et al. 2016). En amortissant cette exposition de 10 minutes sur 1 journée, on obtient une concentration moyenne de 0,35 mg/m3. Un produit de massage musculaire avec applicateur éponge contenant 50 % de méthanol a également été examiné. Compte tenu d’une utilisation de 2 mL de produit à chaque application, de l’évaporation rapide du méthanol dans ce produit au contact de la peau et des facteurs d’exposition donnés dans le tableau B‑4 (annexe B), la concentration moyenne par inhalation le jour de l’utilisation est de 2,0 mg/m3. L’exposition par inhalation à court terme au méthanol provenant de l’utilisation de décapants à peinture et à vernis ayant une teneur en méthanol de 5 % à 35 % a également été examinée. Le modèle « ConsExpo Exposure to Vapour » avec le mode Évaporation a été utilisé (RIVM 2018). Les facteurs d’exposition utilisés pour le calcul de l’exposition par inhalation au méthanol dans ce scénario figurent dans le tableau B‑3 (annexe B), selon la fourchette de tailles de projet (liées à la quantité de produit utilisée et à la superficie d’émission) et le taux de ventilation des pièces. Dans les décapants à peinture et à vernis, le méthanol agit comme cosolvant et est essentiel à l’efficacité du décapant (Wollbrinck 1993). Par conséquent, pour éviter la perte de ce solvant, on trouve souvent les produits décapants sous forme de gel (FDS 2013a,c, 2015h,j, 2018a; TDS 2019), lequel empêche l’évaporation du méthanol (Wollbrinck 1993). Pour tenir compte de la présence de cet obstacle à l’évaporation, on a choisi un facteur d’émission de 50 % pour tenir compte du rejet de méthanol par le décapant.
Pour les petits projets, la concentration moyenne de méthanol le jour de l’exposition (amortie sur 24 heures) était de 5,0 à 10,5 mg/m3 pour les produits contenant 5 % de méthanol et de 37 à 72 mg/m3 pour les produits contenant 35 % de méthanol. Pour les projets plus importants, la concentration moyenne de méthanol le jour de l’exposition, pour la gamme de produits, se situait entre 46 mg/m3 et 610 mg/m3.
Les décapants à peinture utilisés lors du resurfaçage des baignoires peuvent également avoir une concentration en méthanol comprise entre 5 % et 35 %. Les facteurs d’exposition utilisés pour le calcul de l’exposition par inhalation de méthanol dans ce scénario figurent dans le tableau B‑3 (annexe B). Les concentrations moyennes de méthanol le jour de l’exposition, pour le resurfaçage d’une baignoire dans une salle de bain, étaient de 65 mg/m3 et 460 mg/m3 pour les produits contenant 5 % et 35 % de méthanol, respectivement.
L’événement moyen et les concentrations maximales déterminés pour chacun de ces scénarios sont présentés dans le tableau B‑3 (annexe B).
5.6.2 Évaluation des effets sur la santé
Le méthanol a été examiné par l’ECHA (2015, 2016a) et l’EPA (2013a,b). Les résultats de ces examens ont servi à l’évaluation des effets de cette substance sur la santé. Une recherche dans la littérature scientifique a été effectuée pour trouver des études publiées jusqu’en avril 2020, et on n’a trouvé aucune étude donnant lieu à une évaluation des effets sur la santé différente de celles effectuées par ces organismes.
L’EPA (2013a) s’est penché sur diverses études sur la toxicité du méthanol dont les données portaient sur différentes espèces et différents paramètres et a établi une dose de référence (DRf) de 2 mg/kg p.c./j et une concentration de référence (CRf) de 20 mg/m3 fondées sur des effets sur le développement. La DRf et la CRf ont été calculées pour une population dans laquelle la concentration de méthanol dans le sang était égale ou inférieure à 2,5 mg/L, en raison de la métabolisation et de la consommation d’aliments (fruits et légumes) contenant naturellement du méthanol. Les effets sur le développement comprenaient des malformations du squelette (côtes cervicales ou côtes surnuméraires), des fentes palatines et une exencéphalie chez les souriceaux en l’absence de toute toxicité maternelle, une réduction du poids du cerveau chez les rats adultes et les ratons en développement, et des indications d’effets sur le développement chez les singes après une exposition par inhalation à des doses répétées (Kavet et Nauss 1990; Burbacher et al. 1999a, 1999b, 2004a, 2004b; Rogers et al. 1993; NEDO 1987; Fisher et al. 2000, OCDE 2004c). L’EPA a indiqué que ces études ont montré des effets systématiques sur le développement à des doses similaires chez les souris et les rats. Par ailleurs, la signification biologique de ces effets est jugée pertinente pour les humains, car une augmentation des côtes surnuméraires et une diminution du poids du cerveau peuvent se produire chez les humains et sont considérées comme des effets nocifs (US EPA 2013a, 2013b; Chernoff 2004). En raison de la nature des effets sur le développement, la DRf est jugée pertinente pour l’exposition de court à long terme. L’EPA a noté que même s’il existe des incertitudes quant à la pertinence pour l’humain des effets observés chez les rongeurs, il y avait suffisamment de preuves d’effets potentiels sur le développement chez les primates, ainsi que des lacunes dans les connaissances sur le métabolisme du méthanol chez les nourrissons humains, pour justifier le recours à des études sur les rongeurs pour déterminer les points de départ pour l’exposition par inhalation et par voie orale.
Le comité d’évaluation des risques (CER) de l’ECHA a déterminé que d’après les données existantes, les preuves étaient insuffisantes pour classer le méthanol d’après sa toxicité sur le développement humain (ECHA 2015d). Il a conclu que les paramètres les plus pertinents associés à l’exposition de la population générale par inhalation et par voie cutanée était des effets neurologiques transitoires et les doses sans effet calculées (DSEC) correspondantes de 43,3 mg/m3 et de 6,66 mg/kg p.c./j pour ces voies d’exposition compte tenu des valeurs limites d’exposition professionnelle existantes données à titre indicatif par l’Union européenne (UE). L’ECHA a subséquemment proposé une DSEC par voie orale de 88 mg/kg p.c. au-delà de laquelle on observe la toxicité aiguë du méthanol absorbé par ingestion. Cette DSEC reposait sur une acuité visuelle grandement réduite à 260 mg/kg p.c. (ECHA 2016b).
Il a été signalé qu’une exposition de courte durée des humains au méthanol en suspension dans l’air causait des vertiges, des maux de tête, des nausées, de l’insomnie, une vision trouble et une conjonctivite (US EPA 2005b). Dans une étude sur le lieu de travail, l’exposition à une concentration atmosphérique moyenne de 1 060 ppm (1 400 mg/m3) de méthanol provoquait une fréquence significativement plus élevée de maux de têtes, de nausées, de vertiges et de vision trouble chez les enseignants (Frederick et al. 1984). Dans une autre étude, des travailleurs ont signalé une irritation des yeux après une exposition de 25 minutes à 1 025 ppm (1 300 mg/m3) de méthanol dans l’air (NIOSH 1981).
Le méthanol ne présentait pas de potentiel génotoxique dans la majorité des essais in vitro et in vivo (IPCS 1997b, 2001; NTP 2004; OCDE 2004c,d). Le méthanol n’a pas été classé comme substance cancérogène par l’EPA, le CIRC ou le NTP (Cruzan 2009; CIRC 2018).
5.6.3 Caractérisation du risque pour la santé humaine
Exposition par inhalation
La CRf pour l’inhalation de méthanol de 20 mg/m3, calculée par l’EPA, a été comparée aux valeurs d’exposition mesurées et estimées des Canadiens au méthanol.
La concentration de méthanol à l’extérieur la plus élevée au 95e centile, indiquée dans le tableau 6‑4, était de 0,085 mg/m3. La concentration maximale de méthanol pour les personnes vivant à moins de 1 000 m d’une installation industrielle de méthanol a été estimée à 0,52 mg/m3. Ces deux concentrations de méthanol à l’extérieur sont inférieures à la CRf et ne sont donc pas préoccupantes.
La plus forte concentration de méthanol à l’intérieur au 95e centile, déterminée par la surveillance de l’air intérieur dans des villes canadiennes, était de 0,52 mg/m3 (tableau 6‑4). La concentration atmosphérique sur 24 heures, résultant de l’utilisation d’un nettoyant tout‑usage en pulvérisateur et contenant 5 % p/p de méthanol, a été estimée à 0,62 mg/m3. Pour ce qui est de l’exposition par inhalation au méthanol résultant de l’utilisation d’un produit de coiffure et de liquides soulageant la douleur musculaire, les concentrations le jour de l’exposition étaient de 0,35 et 2,0 mg/m3. D’autres produits cosmétiques (dont les crèmes hydratantes pour la peau) et des PSN donnaient lieu à une exposition plus faible. Toutes ces concentrations de méthanol à l’intérieur sont inférieures à la CRf et ne sont donc pas préoccupantes.
Pour ce qui est de l’exposition par inhalation au méthanol provenant de l’utilisation de décapants à peinture et à vernis, la plage de concentrations atmosphériques le jour de l’exposition (amortie sur 24 heures) pour les petits et grands projets varie de 10,5 mg/m3 à 611 mg/m3. Les petits projets (c.‑à‑d. les projets utilisant 1 000 g ou moins de produit, selon le tableau B‑3 de l’annexe B) utilisant des décapants à 5 % de méthanol ont donné des concentrations moyennes de méthanol sur 24 heures de 5,0 mg/m3 à 10,5 mg/m3, qui ne sont pas jugées préoccupantes par rapport à la CRf de 20 mg/m3. Les concentrations moyennes de méthanol sur 24 heures résultant de l’utilisation de décapants pour peinture dans des petits projets avec 35 % de méthanol allaient de 37 mg/m3 à 72 mg/m3. Ces concentrations sont préoccupantes par rapport à la CRf de 20 mg/m3.
Les concentrations moyennes de méthanol sur 24 heures résultant de l’utilisation de décapants à peinture dans des projets plus importants (utilisant plus de 1 000 g de produit) avec 5 % à 35 % de méthanol allaient de 46 mg/m3 à 610 mg/m3. Ces concentrations sont préoccupantes par rapport à la CRf de 20 mg/m3.
Les concentrations moyennes de méthanol sur 24 heures résultant de l’utilisation d’un décapant pour le resurfaçage de baignoires et contenant 5 % et 35 % de méthanol étaient de 65 mg/m3 et 460 mg/m3, respectivement. Ces concentrations sont préoccupantes par rapport à la CRf de 20 mg/m3.
Pour les grands projets et le resurfaçage de baignoires, l’exposition était également préoccupante lorsqu’elle est comparée à la DSEC du méthanol de 43 mg/m3 proposée par l’ECHA. Les petits projets avec des produits contenant 35 % p/p de méthanol peuvent également mener à une exposition préoccupante par rapport à la DSEC de 43 mg/m3 de méthanol.
Il est à noter qu’on a observé que des concentrations supérieures à 1 025 ppm (1 300 mg/m3) pour l’exposition au méthanol dans l’air donnaient lieu à des irritations et des vertiges après une exposition de courte durée chez les travailleurs (US EPA 2005b; Frederick et al. 1984; NIOSH 1980). L’exposition par inhalation dans des scénarios d’utilisation de décapants à peinture et à vernis, qui donnait lieu à des concentrations moyennes ou maximales de méthanol supérieures à cette valeur, peut être limitée par l’inconfort que l’utilisateur ressent pendant qu’il est exposé au produit.
L’utilisation de décapants à peinture et à vernis contenant du méthanol, prise en compte par cette évaluation de l’exposition par inhalation, est jugée préoccupante pour la santé humaine, car l’utilisation de ces produits peut causer une exposition par inhalation supérieure à la CRf. Toutes les autres expositions par inhalation calculées sont égales ou inférieures à la CRf et ne sont donc pas préoccupantes pour la santé humaine.
Exposition par voie orale
Pour établir sa DRf, l’EPA (2013a) a supposé une concentration maximale d’exposition par voie alimentaire au méthanol contenu dans des aliments naturels d’environ 14,3 mg/kg p.c./j. L’exposition par des aliments contenant naturellement du méthanol (tableau 6.6) ne devrait pas constituer un risque pour la population.
En ce qui concerne les additifs alimentaires, le méthanol utilisé comme solvant dans l’encre servant à marquer la coquille des œufs ou la viande ne devrait pas pénétrer dans l’aliment ni persister dans la viande après sa cuisson. Ces utilisations ne devraient donc pas être une source d’exposition au méthanol pour la population générale. De plus, compte tenu de sa volatilité, il est peu probable que le solvant résiduel du méthanol reste dans les aliments dont la présence est autorisée en tant qu’additif alimentaire (comme ceux qui sont énumérés dans le tableau 6‑3) après avoir été exposé à l’air. Les huiles végétales, les épices et les édulcorants, utilisés dans la préparation des aliments et des boissons, sont susceptibles de libérer davantage de méthanol résiduel s’ils sont chauffés pendant la préparation ou avant la consommation des aliments. L’utilisation de l’extrait de houblon est limitée, et on ne s’attend pas à ce que la population générale consomme ce produit sous sa forme pure.
Sur la base des quantités consommées et des modes d’utilisation des produits alimentaires pour lesquels l’utilisation du méthanol comme solvant est autorisée, on ne s’attend pas à ce que l’exposition dépasse la DRf de 2 mg/kg p.c./j.
L’exposition alimentaire estimée au méthanol par les boissons alcoolisées et son utilisation potentielle comme additif alimentaire (à l’exclusion des produits d’origine naturelle), figurant dans le tableau 6‑6, sont inférieures à la DRf de 2 mg/kg p.c./j pour tous les groupes d’âge, y compris le 90e centile des utilisateurs.
De petites quantités de méthanol peuvent être présentes comme solvant dans certains PSN sous forme de comprimé. Cependant, l’exposition par cette source ne devrait pas dépasser 2 mg/kg p.c./j et n’est donc pas préoccupante.
Exposition cutanée
En raison de l’évaporation rapide du méthanol appliqué sur la peau, on ne prévoit pas d’exposition par voie cutanée.
5.7 Incertitudes dans l’évaluation des risques pour la santé humaine
Pour estimer l’exposition par voie orale, on a utilisé la concentration maximale de méthanol dans tous les aliments ou catégories d’aliments. Il s’agit là d’une hypothèse prudente. Dans les cas où les données sur les concentrations de méthanol dans les aliments n’étaient disponibles que pour des aliments propres à une catégorie d’aliments donnée, la concentration maximale de méthanol dans un aliment donné a été considérée comme étant représentative de la catégorie dans son ensemble. L’effet de cette hypothèse sur la concentration estimée en méthanol dépendra de la catégorie d’aliments en question et de l’aliment représentatif choisi. Pour ce qui est de l’utilisation du méthanol comme solvant d’extraction, on a supposé que tous les aliments dans lesquels le méthanol est autorisé contenaient du méthanol à la concentration maximale résiduelle autorisée. Il s’agit là d’une hypothèse prudente. De plus, on a supposé que tous les aliments autorisés à contenir des glycosides de stéviol sont sucrés à l’aide de cet édulcorant particulier à la concentration maximale autorisée, ce qui est également une hypothèse prudente.
6. Butan‑1‑ol
6.1 Identité de la substance
Les renseignements concernant l’identité du butan‑1‑ol sont résumés dans le Tableau 6‑1 (PubChem2004‑ ).
| N° CAS | Nom dans la LIS | Formule moléculaire | Structure moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 71‑36‑3 | Butan‑1‑ol | C4H10O | 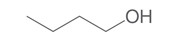 |
74,12 |
6.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques mesurées du butan‑1‑ol sont présentées dans le Tableau 6‑2 (ChemIDplus 2017). D’autres données sur les propriétés physiques et chimiques sont présentées dans ECCC 2016b.
|
Point de fusion (°C) |
Point d’ébullition (°C) |
Log Koe [sans dimension] |
Solubilité dans l’eau (mg/L) |
Pression de vapeur (mm Hg) |
|---|---|---|---|---|
| ₋89,8 | 117,7 | 0,88 | 8,50 × 104 | 6,7 |
Le butan‑1‑ol devrait se volatiliser depuis les surfaces d’eau. Les demi‑vies de volatilisation estimées pour une rivière et un lac modèles sont de 3,7 jours et 29 jours, respectivement.
6.3 Sources et utilisations
Le butan‑1‑ol est présent naturellement à la suite d’une fermentation. Il est également fabriqué par diverses voies de synthèse. Selon les renseignements obtenus lors d’une enquête menée en vertu de l’article 71 de la LCPE, le butan‑1‑ol n’était pas fabriqué au Canada en 2011, mais 68 000 kg de butan‑1‑ol ont été importés au Canada cette année‑là (Environnement Canada 2013)Note de bas de page 4 .
Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le butan‑1‑ol est présent dans des produits cosmétiques au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 19 octobre 2016; sans référence). La nature des produits et les concentrations maximales de butan‑1‑ol sont présentées dans le Tableau 6‑3. Les concentrations indiquent la quantité de butan‑1‑ol dans les préparations commerciales et ne tiennent pas compte de quelque dilution que ce soit avant ou pendant l’utilisation. Le butan‑1‑ol ne figure pas sur la Liste critique des ingrédients cosmétiques.
| Nombre de produits | Produits et concentration maximale |
|---|---|
| 46 | Produits pour la peau : 0,1 % Produits pour les ongles : 10 % |
Le butan‑1‑ol peut être utilisé comme composant de matériaux d’emballage alimentaire (matériaux à base d’époxy, de polyéthylène ou de polyuréthane, revêtements, chlorure de polyvinyle, polyester, encres d’impression, adhésifs) n’entrant pas en contact direct avec les aliments. Par conséquent, on ne prévoit pas d’exposition de la population générale. On sait que la substance est utilisée comme agent aromatisant alimentaire aux États‑Unis et dans l’Union européenne, et il est donc possible qu’elle soit présente comme agent aromatisant alimentaire dans les aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2016; sans référence).
Le butan‑1‑ol est également utilisé comme ingrédient non médicinal dans un certain nombre de PSN administrés par voie orale et par voie cutanée, ainsi que dans des médicaments en vente libre et sur ordonnance, y compris des préparations commerciales sous forme de comprimés, de capsules et de crèmes (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance et de la Direction des produits thérapeutiques, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 26 octobre et 1er novembre 2016; sans référence).
Dans les pesticides, le butan‑1‑ol est utilisé comme produit de formulation (ARLA 2010).
Le butan‑1‑ol est également présent dans une gamme de produits disponibles aux consommateurs. Les catégories de produits et les plages de concentrations sont présentées dans le Tableau 6‑4.
| Catégorie de produits | Type de produit / concentration maximale de butan‑1‑ol en % de poids | Référence |
|---|---|---|
| Entretien automobile |
Cire (3 % – 7 %) Nettoyants pour injecteurs de carburant (20 % – 30 %) |
FDS 2014a FDS 2014b |
| Solvant |
Solvant dans les peintures en pulvérisateur (5 %) Adhésifs époxydes (5 %) Peinture brillante pour bois / laque (5 % – 20 %) Solvant pour les marqueurs (6 %) |
FDS 2014c FDS 2015b FDS 2015c FDS 2016a |
6.4 Devenir et comportement dans l’environnement
6.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), le butan‑1‑ol ne devrait pas persister dans l’air, l’eau, les sédiments ou le sol (ECCC 2016b).
6.4.2 Potentiel de bioaccumulation
En raison de sa faible valeur log Koe et d’un faible facteur de bioconcentration (ECCC 2016b), le butan‑1‑ol ne devrait pas subir de bioaccumulation dans les organismes.
6.5 Effets nocifs potentiels sur l’environnement
6.5.1 Caractérisation du risque écologique
Les risques écologiques du butan‑1‑ol ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) pour les substances organiques. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil du butan‑1‑ol ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le butan‑1‑ol est classé comme présentant un faible risque écologique. Il est donc peu probable que cette substance soulève des préoccupations à l’égard de l’environnement au Canada.
6.6 Effets nocifs potentiels sur la santé humaine
6.6.1 Évaluation de l’exposition
6.6.1.1 Milieux naturels et aliments
Le butan‑1‑ol pourrait être présent dans l’eau et l’air en quantités limitées. D’après les résultats obtenus avec un modèle de fugacité de niveau III, le butan‑1‑ol devrait se répartir principalement dans l’air (83,5 %), le reste se retrouvant dans le sol (5,9 %) et l’eau (10,6 %) (OCDE 2001a). Il a été démontré qu’il se biodégrade rapidement dans des essais de biodégradation en milieu aqueux aérobie, et ne devrait donc pas persister dans les milieux aquatiques. Cette substance ne devrait pas non plus rester dans les sols de surface en raison de son évaporation rapide dans l’air.
Afin d’évaluer l’exposition type potentielle de la population générale au butan‑1‑ol dans l’air ambiant, Bari et al. (2015) ont mené des études de surveillance de l’air à l’intérieur et à l’extérieur des résidences. Des études de surveillance de l’air intérieur et de l’air extérieur ont été effectuées à Edmonton (Santé Canada, 2013), à Halifax (Santé Canada, 2012), à Regina (Santé Canada, 2010a) et à Windsor (Santé Canada, 2010b). On a constaté des variations saisonnières du butan‑1‑ol, tant à l’intérieur qu’à l’extérieur du milieu résidentiel. La moyenne géométrique, la moyenne arithmétique, le 5e centile (C5) et le 95e centile (C95) des concentrations obtenues par échantillonnage sur 24 heures sont indiqués pour l’hiver et l’été dans le Tableau 6‑5.
|
Scénario Saison |
Intérieur Moyenne géométrique (moyenne arithmétique) |
Intérieur 5e – 95e centiles |
Extérieur Moyenne géométrique (moyenne arithmétique) |
Extérieur 5e – 95e centiles |
|---|---|---|---|---|
| Été | 5,016 (8,880) | 1,240–19,59 | 0,474 (0,577) | 0,228–1,158 |
| Hiver | 1,464 (2,581) | 0,408–8,500 | 0,085 (0,120) | 0,042–0,284 |
a La moyenne maximale et les extrêmes de la fourchette des valeurs minimales et maximales pour les quatre villes sont indiquées, ainsi que la fourchette du 5e au 95e centiles [C5‑C95] [µg/m3]).
Les concentrations à l’intérieur reflètent l’exposition quotidienne au butan‑1‑ol due à de multiples sources.
D’après une comparaison des volumes de production, on s’attend à ce que l’exposition au butan‑1‑ol par les aliments contenant naturellement cette substance soit plus importante que l’exposition attribuable à son utilisation comme agent aromatisant alimentaire (Stofberg et Grundschober 1987). Sur le plan international, le JECFA a évalué le butan‑1‑ol en tant qu’agent aromatisant alimentaire et a estimé que l’ingestion de butan‑1‑ol par habitant était de 8 100 μg/j (140 μg/ kg p.c./j) pour la population américaine (International Organization of the Flavor Industry 1995; National Academy of Science 1987, ces deux études étant citées dans OMS JECFA 1999). Le JECFA a conclu « qu’il n’y avait aucun danger aux concentrations d’absorption estimées » pour le butan‑1‑ol lorsqu’il est utilisé comme agent aromatisant alimentaire. En l’absence de données canadiennes, l’estimation de l’absorption par habitant établie par le JECFA pour la population américaine est une estimation jugée acceptable pour tenir compte de l’exposition possible par les aliments de la population canadienne générale âgée de 1 an et plus, en raison de l’utilisation potentielle du butan‑1‑ol comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 2018; sans référence).
6.6.1.2 Exposition par les produits disponibles aux consommateurs
Comme le montrent les tableaux 7‑3 et 7‑4, le butan‑1‑ol est présent dans les produits disponibles aux consommateurs, notamment les cosmétiques et les produits d’entretien ménager et automobile. Le butan‑1‑ol est également utilisé comme ingrédient non médicinal dans un certain nombre de PSN, ainsi que dans des médicaments sur ordonnance et en vente libre. Les produits présentant le plus fort risque d’exposition au butan‑1‑ol sont examinés dans les scénarios ci‑dessous, pour chaque type de produit.
Exposition par inhalation
Les concentrations dues à l’exposition à long terme par inhalation au butan‑1‑ol ont été mesurées par Bari et al. (2015) et sont présentées dans le tableau 7‑5.
Plusieurs produits sentinelles ont été choisis pour évaluer l’exposition par inhalation à court terme au butan‑1‑ol. On a évalué l’exposition par inhalation à court terme au butan‑1‑ol attribuable à l’utilisation d’une peinture en pulvérisateur contenant 5 % p/p de butan‑1‑ol. Les facteurs d’exposition pour l’utilisation de la peinture en pulvérisateur sont présentés dans le tableau B‑5 (annexe B). Selon ce scénario, on obtient une concentration moyenne de butan‑1‑ol le jour de l’exposition de 1,0 mg/m3 et une dose externe de 0,23 mg/kg p.c. le jour de l’exposition.
Il existe deux groupes de produits époxydes contenant du butan‑1‑ol. Le premier consiste en un revêtement acrylique à deux composantes utilisé pour resurfacer les baignoires (FDS 2015b). Les facteurs d’exposition pour l’utilisation du revêtement acrylique sont indiqués dans le tableau B‑6 (annexe B). En supposant l’exposition et l’utilisation de 900 g de produit indiquées dans le tableau B‑6 (annexe B), on obtient une concentration moyenne de butan‑1‑ol le jour de l’exposition de 0,72 mg/m3. En utilisant une quantité d’air respiré de 16,3 m3/j et un poids de 70,9 kg pour un adulte moyen, on obtient une dose d’exposition de 0,17 mg/kg p.c./j. Étant donné que les instructions sur l’emballage prévoient une ventilation accrue pendant l’application des produits, le facteur de ventilation et donc l’exposition sont des valeurs très prudentes.
Une exposition par inhalation à court terme au butan‑1‑ol provenant de l’utilisation de laque/vernis ayant une proportion en butan‑1‑ol de 5 % à 20 % a été examinée (FDS 2015c, 2016a). L’utilisation des facteurs d’exposition indiqués dans le tableau B‑7 (annexe B) donne une plage de concentrations moyennes de butan‑1‑ol le jour de l’exposition de 3,3 à 13,2 mg/m3. En utilisant une quantité d’air respiré de 16,3 m3/j et un poids de 70,9 kg pour un adulte moyen, on obtient une plage de doses d’exposition variant de 0,8 mg/kg p.c./j à 2,4 mg/kg p.c./j.
Exposition par voie orale
Pour estimer l’exposition quotidienne au butan‑1‑ol présent en tant qu’ingrédient non médicinal dans les PSN ainsi que dans les médicaments sous ordonnance et en vente libre préparés sous forme de capsules ou de comprimés, on a utilisé l’activité maximale par unité de dose de 0,02 mg décrite pour les comprimés à libération prolongée dans la base de recherche des ingrédients actifs de la FDA pour les produits pharmaceutiques approuvés (US FDA 2019). En supposant, dans ce scénario, une dose quotidienne de quatre comprimés à libération prolongée, on obtient une exposition orale quotidienne de 4 × 0,02 / 59,5 = 0,0013 mg/kg p.c./j pour les adolescents et de 4 × 0,02 / 70,9 = 0,0011 mg/kg p.c./j pour les adultes.
Exposition cutanée
Des expériences in vitro menées sur des échantillons de peau humaine exposés au butan‑1‑ol dans des conditions sans et avec ventilation ont donné lieu à des taux d’absorption de 2,2 % à 9,4 % et < 1 %, respectivement (Boman et Maibach 2000). Le butan‑1‑ol est volatil et le fait de permettre son évaporation depuis la peau donne lieu à de faibles valeurs d’absorption totale.
Le scénario qui entraîne l’exposition la plus élevée pour les produits cosmétiques est l’utilisation d’un vernis à ongles contenant du butan‑1‑ol à des concentrations pouvant atteindre 10 % en poids. Pour les adultes, si on utilise la valeur par défaut de 0,16 g pour l’application instantanée du vernis à ongles et une valeur prudente de 10 % d’absorption cutanée, on obtient une exposition systémique le jour de l’application de 0,022 mg/kg p.c. pour des adultes pesant 70,9 kg. Pour les adolescents, l’utilisation de la valeur par défaut de 0,16 g pour l’application du vernis à ongles avec application instantanée et une valeur prudente de 10 % d’absorption cutanée, on obtient une exposition systémique le jour de l’application de 0,027 mg/kg p.c. pour les adolescents pesant 59,4 kg. Ces valeurs sont jugées prudentes, car elles ne tiennent pas compte de l’évaporation du butan‑1‑ol.
On a estimé l’exposition cutanée au butan‑1‑ol due à une crème hydratante pour le corps classée comme PSN, avec une concentration de 0,1 %, en utilisant les valeurs par défaut de 8,6 g et 10 g pour les adolescents et les adultes, respectivement. Une fréquence d’application de 1,1 fois/j et une valeur prudente de 10 % d’absorption cutanée donnent des doses d’exposition de 0,016 mg/kg p.c./j et 0,015 mg/kg p.c./j pour des adolescents et des adultes pesant 59,4 kg et 70,9 kg, respectivement.
6.6.2 Évaluation des effets sur la santé
Le butan‑1‑ol a fait l’objet d’examens à l’étranger et ces examens ont été utilisés pour étayer la caractérisation des effets sur la santé de la présente évaluation (US EPA 2011; OCDE 2001a).
L’EPA (2011) a calculé une DRf de 0,09 mg/kg p.c./j pour le butan‑1‑ol en se basant sur les effets neurodéveloppementaux dénotant la plus grande sensibilité (dilatation des ventricules latéraux ou du troisième ventricule) sur le cerveau et sur des effets sur le squelette (ossification retardée du sternum) chez les fœtus de rats, nés de mères Wistar (Imp:DAK) exposées à 300, 1 000 ou 5 000 mg/kg p.c./j de butan‑1‑ol pendant 8 semaines avant l’accouplement, pendant l’accouplement (3 semaines) et jusqu’au JG 20. Les fœtus nés de mères du groupe ayant reçu la dose maximale étaient également de taille significativement inférieure à celle des témoins. Cependant, aucune mortalité ou effet nocif n’a été constaté chez les mères traitées au butan‑1‑ol (Sitarek et al. 1994). Des malformations du squelette ont également été observées chez les fœtus dans des études sur la reproduction ou le développement après une exposition par inhalation à une plage de doses de 18 000 mg/m3 à 24 000 mg/m3 de butan‑1‑ol, 7 heures/jour, du JG 1 au JG 19 chez des rats Sprague‑Dawley (Nelson et al. 1989a, b). Cependant, les rats ont été exposés à des doses très élevées de butan‑1‑ol dans ces études (US EPA 2011).
Mentionnons notamment qu’une exposition subchronique (90 jours) par inhalation à 154 ou 308 mg/m3 de vapeurs de butan‑1‑ol (6 heures/jour, 5 jours/semaine) a provoqué l’aggravation progressive d’une piètre coordination motrice (effets neuromusculaires) chez des rats Wistar (Imp:DAK) mâles adultes. Une diminution significative de la concentration d’hémoglobine a également été observée dans les deux groupes de doses, tandis qu’une diminution des globules rouges et une augmentation des globules blancs n’ont été observées que dans le groupe ayant reçu la dose maximale. Cependant, aucun signe de toxicité n’a été observé chez les rats, quel que soit leur groupe (avec ou sans traitement). Les auteurs ont calculé une DSENO de 154 et une dose minimale entraînant un effet nocif observé (DMENO) de 308 mg/m3 dans cette étude (US EPA 2011; Korsak et al.1994).
Dans un rapport d’évaluation, l’ECHA (2018) a conclu que le butan‑1‑ol n’est pas préoccupant en termes de toxicité pour la reproduction ou le développement, en raison de l’absence d’effets sur le développement chez les fœtus de rats Sprague‑Dawley nés de mères ayant reçu 316, 1 454 ou 5 654 mg/kg p.c./j de butan‑1‑ol par l’eau potable tout au long de la grossesse (JG 0 à 20) (Ema et al. 2005). Les auteurs de l’étude ont calculé une DSENO de 1 454 mg/kg p.c./j pour les mères et les fœtus. Cependant, l’EPA a estimé une DMENO de 5 654 mg/kg p.c./j reposant sur des effets sur le développement (diminution du poids corporel des fœtus, augmentation de la fréquence des variations squelettiques) et une DSENO de 1 454 mg/kg p.c./j à partir de cette étude (US EPA 2011).
On a estimé, dans la présente étude, que les effets neurodéveloppementaux rapportés par Sitarek et al. (1994) ont été obtenus avec un modèle de rat approprié (Noritake et al. 2013; Zmyslony et al. 2004; Jedrychowski et al. 1990) et les résultats ont été jugés pertinents sur le plan biologique pour les nourrissons humains en développement (Cherian et al. 2003). De plus, l’EPA a utilisé l’étude de Sitarek et al. (1994) pour calculer la DRf, car elle a été considérée comme une étude bien conçue qui a examiné les effets critiques du butan‑1‑ol sur le cerveau en développement.
6.6.3 Caractérisation du risque pour la santé humaine
Comme des effets sur le développement ont été observés en l’absence de toxicité maternelle, les sous‑populations en âge de procréer (adolescentes et adultes) ont été ciblées par l’étude de caractérisation des risques pour toutes les expositions par inhalation, sauf l’exposition de longue durée.
Exposition par inhalation
Le 95e centile de l’exposition à long terme au butan‑1‑ol par inhalation à l’intérieur, selon les mesures de surveillance de l’air au Canada, était de 0,02 mg/m3. Lorsque la concentration minimale entraînant un effet nocif observé (CMENO) de 308 mg/m3 a été corrigée pour une exposition de 24 heures/jour et de 7 jours/semaine, on a obtenu une CMENO de 55 mg/m3 pour le déficit neurocomportemental, avec une marge d’exposition (ME) de 2 800. Cette ME est jugée adéquate à la fois pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé, et pour assurer la protection contre l’exposition par les milieux naturels.
Avec un scénario d’inhalation à court terme dû à l’utilisation de revêtement époxyde pour baignoire contenant 5 % p/p de butan‑1‑ol, on a obtenu une concentration moyenne de butan‑1‑ol le jour de l’exposition de 0,72 mg/m3 et une dose d’exposition de 0,17 mg/kg p.c./j. Avec la DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on obtient une ME de 1 800. Cette ME est jugée adéquate à la fois pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Un scénario d’inhalation à court terme dû à l’utilisation de laque contenant 5 % p/p à 20 % p/p de butan‑1‑ol a donné une plage de concentrations moyennes de butan‑1‑ol le jour de l’exposition de 3,3 à 13,2 mg/m3, ou une plage de doses de 0,8 à 2,4 mg/kg p.c./j. Avec la DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on obtient une ME de 375 à 94. Ces ME sont potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Exposition par voie orale
Sur la base des expositions estimées de 0,0013 mg/kg p.c./j et de 0,0011 mg/kg p.c./j calculées dans un scénario de consommation de quatre comprimés à libération prolongée contenant 0,02 mg de butan‑1‑ol par jour et d’une DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on a obtenu des ME de 230 000 et 270 000 pour les adolescents et les adultes, respectivement. Ces ME sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Sur la base d’une exposition alimentaire estimée à 0,140 mg/kg p.c./j due à l’utilisation de butan‑1‑ol comme agent aromatisant alimentaire et d’une DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on a obtenu une ME de 2 100 pour la population générale âgée de 1 an et plus. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
D’après une exposition systématique maximale de 0,027 mg/kg p.c./j par un vernis à ongles contenant 10 % de butan‑1‑ol, une valeur prudente de 10 % d’absorption cutanée (Boman et Maibach 2000) et une DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on obtient une ME de 11 000. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Sur la base d’une exposition maximale de 0,016 mg/kg p.c./j par des crèmes hydratantes considérées comme des médicaments en vente libre, contenant 0,1 % de butan‑1‑ol, et en utilisant une absorption cutanée de 10 % (Boman et Maibach 2000) et une DMENO de 300 mg/kg p.c./j pour les effets sur le développement, on obtient une ME de 18 000. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
6.7 Incertitudes dans l’évaluation des risques pour la santé humaine
L’absorption cutanée de 10 % utilisée pour le butan‑1‑ol est prudente, car cette valeur concerne le butan‑1‑ol pur appliqué sur la peau dans des conditions sans ventilation. Il peut subsister une incertitude dans l’extrapolation de la voie orale à la voie cutanée, et de la voie orale à l’inhalation pour ce qui est des paramètres utilisés pour les différents scénarios d’exposition.
Il peut également y avoir une incertitude en ce qui concerne les facteurs d’exposition utilisés dans les scénarios pour déterminer l’exposition au butan‑1‑ol par inhalation. En particulier, selon la nature des produits, les conditions d’utilisation peuvent différer des paramètres utilisés dans le scénario d’exposition.
7. Alcools en C6
7.1 Identité des substances
Les données concernant l’identité des alcools en C6 examinés dans la présente évaluation sont résumés dans le Tableau 7‑1 (PubChem2004‑ ).
| N° CAS | Nom dans la LIS (nom usuel) | Formule moléculaire | Structure chimique | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 108‑93‑0 | Cyclohexanol | C6H12O | 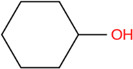
|
100,161 |
| 108‑11‑2 | 4‑Méthylpentan‑2‑ol‑ (méthylisobutylcarbinol, MIBC) | C6H14O |  |
102,177 |
| 77‑99‑6 | Propylidynetriméthanol (triméthylolpropane, TMP) | C6H14O3 |  |
134,175 |
7.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques mesurées des alcools en C6 sont présentées dans le Tableau 7‑2 (ChemIDPlus 2017). D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Propriété | Cyclohexanol | MIBC | TMP |
|---|---|---|---|
| Point de fusion (°C) | 25,4 | ₋90 | 58 |
| Point d’ébullition (°C) | 160,8 | 131,6 | 289 |
| Log Koe (sans dimension) | 1,23 | 1,43 | ₋1,48 |
| Solubilité dans l’eau (mg/L) | 4,2 × 10‑6 | 1,64 × 104 | 1 × 106 |
| Pression de vapeur (mm Hg) | 0,8 | 5,3 | 4,49 × 10‑5 |
| Constante de la loi de Henry (atm‑m3/mol) | 4,4 × 10‑6 | 4,45 × 10‑5 | 7,93 × 10‑12 |
| Demi‑vie dans l’air (heure) | 7,3 | 10,0 | 9,3 |
Le cyclohexanol et le MIBC sont des alcools secondaires et le TMP est un alcool primaire. Tous comportent six atomes de carbone. En raison des disparités dans leur structure moléculaire, ces substances présentent des variations de propriétés physiques et chimiques.
Les alcools en C6 sont relativement volatils, ont une solubilité dans l’eau très élevée, des points d’ébullition élevés et (sauf le TMP) une pression de vapeur élevée. Le TMP a une faible pression de vapeur en raison de la présence d’une liaison hydrogène plus forte. Dans l’air, ces alcools réagissent avec les radicaux hydroxyles produits par réaction photochimique, et les demi‑vies qui en résultent sont indiquées dans le tableau 8‑2. Le cyclohexanol et le MIBC ne sont pas sensibles à la photolyse directe par la lumière solaire (PubChem 2004‑ ). Le MIBC est une substance génératrice d’ozone modérément réactive, mais le cyclohexanol et le TMP ne devraient pas être réactifs à cet égard. Dans le sol, le cyclohexanol et le MIBC devraient avoir une mobilité élevée à très élevée, et la volatilisation à partir des surfaces humides du sol est prévue pour les deux substances. En outre, le MIBC peut être biodégradable dans le sol. Aucune des deux substances ne devrait être absorbée par les sols en suspension ou les sédiments dans l’eau. Le TMP ne devrait pas avoir une grande mobilité dans le sol en raison de son faible coefficient de partage Kco (carbone organique–eau) de 1. De même, en raison de sa faible constante de la loi de Henry, il ne devrait pas se volatiliser à partir des surfaces d’eau, contrairement au cyclohexanol et au MIBC.
7.3 Sources et utilisations
Tous les alcools en C6 examinés dans la présente évaluation sont des produits chimiques fabriqués en grande quantité. Dans l’industrie, ils sont utilisés comme solvants et dans la production de polymères et de résines, ainsi que dans l’exploitation minière. Commercialement, ils sont présents comme ingrédients dans les produits de construction, les peintures et les produits d’entretien automobile. Le MIBC peut être formé naturellement dans les substances volatiles émises par le fromage Beaufort de montagne (concentration inconnue) (Dumont et Adda 1978). Le MIBC n’est pas présent dans d’autres sources naturelles en quantités appréciables.
Ces alcools sont fabriqués par diverses voies de synthèse. Les volumes totaux de fabrication et d’importation au Canada en 2011, indiqués en réponse à une enquête menée en vertu de l’article 71 de la LCPE, sont présentés dans le Tableau 7‑3 (Environnement Canada 2012).
| Alcool | Production totale (kg)a | Importation totale (kg)a |
|---|---|---|
| Cyclohexanol | N.D. | 770 |
| MIBC | N.D. | 1 500 000 |
| TMP | N.D. | 210 000 |
Abréviation : N. D. = aucune valeur déclarée au‑delà du seuil de déclaration de 100 kg.
a Les valeurs sont indicatives des quantités fournies en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Ces alcools en C6 ont diverses utilisations industrielles. Le cyclohexanol est une importante matière première dans l’industrie des polymères, le MIBC est utilisé comme agent moussant dans la flottation des minéraux et comme solvant dans les colorants, les huiles, les gommes, les résines et les cires, et le TMP sert principalement comme précurseur des résines alkydes. Ces trois substances sont utilisées comme solvants. Elles sont également présentes dans une gamme de produits disponibles aux consommateurs. Les catégories de produits et les plages de concentrations sont présentées dans le Tableau 7‑4. Les plages présentées indiquent les concentrations des alcools en C6 dans les produits commerciaux et ne tiennent pas compte d’une éventuelle dilution avant ou pendant l’utilisation.
| Alcool | Catégorie de produits | Type de produit | % en poids dans le produit |
|---|---|---|---|
| Cyclohexanol | Construction ou peinture |
Glaçure pour céramique Peinture pour bricolage |
25–50 2,5–10 |
| Entretien automobile |
Nettoyant pour chambre de combustion interne a Mise au point de moteur a |
5–15 5–10 |
|
| MIBC | Construction ou peinture |
Peinture a Activateur époxyde Laque a Peinture spécialisée |
7–18 7–13 5 |
| Entretien automobile |
Lubrifiants a Traitement du moteur a Nettoyant pour chambre de combustion interne |
5–10 3–10 |
|
| Construction ou peinture | Revêtement de sol a | ||
| TMP | Autres | Adhésif/produits d’étanchéité a |
a Utilisations non confidentielles déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Comme le montre le Tableau 7‑4, le cyclohexanol, le MIBC et le TMP sont présents dans les produits disponibles aux consommateurs. On les trouve principalement dans les produits d’entretien automobile et les produits de construction et de peinture, bien que le TMP soit également présent dans un nombre limité de produits cosmétiques.
Les alcools en C6 peuvent être utilisés comme composants dans la fabrication de matériaux d’emballage alimentaire et comme additifs indirects utilisés dans les établissements de transformation des aliments au Canada (voir le Tableau 7‑5). En raison de la solubilité élevée du TMP dans l’eau, on ne s’attend pas à ce qu’il soit présent sous une forme non polymérisée dans ces matériaux d’emballage alimentaire. Comme on sait que le cyclohexanol et le MIBC sont tous deux utilisés dans le monde comme agents aromatisants alimentaires, il est donc possible que ces substances soient présentes comme agents aromatisants alimentaires vendus au Canada (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, décembre 2016; sans référence).
| Alcool | Matériau d’emballage alimentaire | Additifs indirects b | Additifs alimentaires | Agent aromatisant alimentaire | Risque d’exposition |
|---|---|---|---|---|---|
| Cyclohexanol | Oui – composants d’encres, couvre‑laque, film laminé | Oui – additif pour l’eau de chaudière | Non | Oui | Oui |
| MIBC | Oui – composant de films (couche non en contact avec les aliments) | Non | Non | Oui | Oui |
| TMP | Oui – composant des adhésifs, aide au traitement des films, pigments, revêtement de cannette (y compris les préparations pour nourrissons), joints latéraux (y compris les préparations pour nourrissons) | Oui – lubrifiant | Non | Non | Oui |
a Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencé.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments qui peuvent se retrouver de manière fortuite dans les aliments sous forme de résidus.
D’après les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, parmi les alcools en C6, seul le TMP est présent dans deux produits cosmétiques au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 19 octobre 2016; sans référence). La nature des produits et les concentrations maximales de TMP sont présentées dans le Tableau 7‑6. Les concentrations indiquent la quantité de TMP dans les préparations commerciales et ne tiennent pas compte d’une éventuelle dilution avant ou pendant l’utilisation. Aucun des alcools en C6 ne figure sur la Liste critique des ingrédients cosmétiques.
| Alcool | Dans les cosmétiques | Produits et plage de concentrations |
|---|---|---|
| TMP | 2 produits |
Adhésif pour ongles : 3 à 10 % Maquillage/lèvres : 3 à 10 % |
Seul le TMP est présent dans des produits antiparasitaires (ARLA 2010), comme produit de formulation.
7.4 Devenir et comportement dans l’environnement
7.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), le MIBC devrait persister dans l’air, mais non dans l’eau, le sol ou les sédiments. Le TMP devrait persister dans l’eau, le sol et les sédiments, mais non dans l’air. Le cyclohexanol ne devrait pas persister dans l’air, l’eau, les sédiments ou le sol.
7.4.2 Potentiel de bioaccumulation
Compte tenu de leur faible log Koe et de leur faible facteur de bioconcentration (ECCC 2016b), les trois alcools en C6 ne devraient pas subir de bioaccumulation considérable dans les organismes.
7.5 Effets nocifs potentiels sur l’environnement
7.5.1 Caractérisation du risque écologique
Les risques pour l’environnement associés aux alcools en C6 ont été caractérisés selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et les données critiques utilisées pour dresser les profils des alcools en C6, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Les classifications de danger et d’exposition pour les alcools en C6 sont résumées dans le Tableau 7‑7.
| Substance | Danger selon la CRE | Exposition selon la CRE | Risque selon la CRE |
|---|---|---|---|
| Cyclohexanol | Faible | Faible | Faible |
| MIBC | Faible | Faible | Faible |
| TMP | Faible | Faible | Faible |
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le cyclohexanol, le MIBC et le TMP ont été classés comme présentant un faible risque écologique. Il est donc peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
7.6 Effets nocifs potentiels sur la santé humaine
7.6.1 Évaluation de l’exposition
7.6.1.1 Milieux naturels et aliments
Il est possible que les alcools en C6 soient présents dans l’eau et dans l’air en quantités faibles. D’après les résultats calculés à partir d’un modèle de fugacité de niveau III, le MIBC devrait se répartir principalement dans l’eau (59,6 %) et l’air (37,8 %), le reste se retrouvant dans le sol (2,5 %) (OCDE 2005a). On a calculé que le TMP se répartit principalement dans l’eau et les sédiments (OCDE 1990). Les alcools en C6 se biodégradent rapidement dans des essais de biodégradation en milieux aqueux aérobies et ne devraient donc pas persister dans les environnements aquatiques. Ils ne devraient pas non plus persister dans les sols de surface en raison de leur évaporation rapide dans l’air. L’exposition à ces alcools en C6 par les milieux naturels devrait être inférieure à l’exposition par les produits disponibles aux consommateurs.
La population générale peut être exposée aux alcools en C6 par les aliments. Le cyclohexanol et le TMP peuvent entrer en contact direct avec les aliments en raison de leur utilisation potentielle comme composants dans la fabrication de matériaux d’emballage alimentaire. Bien qu’il n’existe pas de données définitives sur l’utilisation du cyclohexanol et du MIBC comme agents aromatisants alimentaires au Canada, ces substances sont autorisées dans l’Union européenne à cette fin pour toutes les catégories d’aliments. Par conséquent, il est possible que le cyclohexanol et le MIBC soient présents comme agents aromatisants alimentaires vendus au Canada. L’exposition aux alcools en C6 par les aliments devrait être inférieure à l’exposition par les produits disponibles aux consommateurs (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada; décembre 2016, sans référence).
7.6.1.2 Exposition par des produits disponibles aux consommateurs
Des scénarios d’exposition ont été élaborés pour les produits contenant des alcools en C6 entraînant la plus grande exposition de la population générale.
Cyclohexanol : voie cutanée
Dans le cas du cyclohexanol, des scénarios d’exposition cutanée ont été élaborés pour l’utilisation comme nettoyant pour moteur d’automobile à combustion interne (enlèvement du carbone) contenant 15 % de cyclohexanol. L’exposition à court terme au cyclohexanol pour un adulte pesant 70,9 kg, sur la base de 0,1 g de produit étalé sur la surface des mains et en supposant une absorption de 100 % du cyclohexanol, est indiquée dans le tableau 8‑8. En supposant une fréquence d’utilisation de 6 fois/an, il n’y a pas eu lieu d’examiner l’exposition à long terme au cyclohexanol par ce produit.
Cyclohexanol : inhalation
Il existe un risque d’exposition au cyclohexanol par les peintures-émail avec paillettes pour bricolage. En se basant sur une densité de 1,2 pour les peintures, la masse totale de la peinture est de 8,9 g par contenant et on présume que 10 % de cette masse est du cyclohexanol. Les facteurs d’exposition pour l’utilisation de la glaçure émail avec paillettes pour bricolage, d’après le modèle à « taux constant » de ConsExpo (RIVM 2007) sont indiqués dans le tableau B‑8 (annexe B) et donnent une concentration moyenne de cyclohexanol égale à 0,20 mg/m3 le jour de l’exposition. Le cyclohexanol n’est présent que dans les peintures de bricolage pour maquettes de ce type avec paillettes métalliques. Les autres peintures de bricolage utilisé pour la décoration des maquettes ne contiennent pas cet alcool.
Il existe un risque d’exposition au cyclohexanol associé au recours à une surglaçure de céramique. Il s’agit d’un usage spécialisé, car le procédé nécessite l’utilisation d’un four à poterie. Sur la base d’une densité de 1,2 pour la surglaçure et d’une masse totale de 8,9 g par utilisation, 50 % de cette masse étant supposée être du cyclohexanol (FDS 2017), et en utilisant le modèle de « taux constant » de ConsExpo (RIVM 2007) avec les facteurs d’exposition indiqués dans le tableau B‑9 (annexe B), on calcule une concentration moyenne de cyclohexanol le jour de l’exposition égale à 1,0 mg/m3.
On a estimé l’exposition aux composants alcools dans la surglaçure de céramique d’après la limite supérieure des concentrations possibles de cyclohexanol indiquées sur la fiche de données de sécurité et un taux de ventilation reflétant l’étiquetage du produit, qui recommande l’utilisation du produit dans des zones et des fours bien ventilés (Duncan 2010).
MIBC
On juge que le MIBC présente un faible danger, et donc aucune estimation quantitative de l’exposition de la population générale n’a été calculée.
TMP : voie orale
Pour le TMP, on a utilisé un scénario d’exposition par voie orale à un rouge à lèvres contenant 10 % de TMP, et un scénario d’exposition par voie cutanée a été établi pour un adhésif pour ongles contenant 10 % de TMP. Dans le cas du scénario d’exposition par voie orale à un rouge à lèvres pour adultes (70,9 kg), on a utilisé une quantité de produit ingérée de 0,01 g et une fréquence d’utilisation de 2,40 par jour. Pour les enfants (31 kg), on a utilisé une quantité de produit ingérée de 0,01 g et une fréquence d’utilisation de 0,89 par jour.
TMP : voie cutanée
Pour estimer l’exposition par voie cutanée à un adhésif pour ongles contenant 10 % de TMP, on a utilisé une quantité de produit de 0,16 g avec une fréquence d’utilisation de 0,2 fois/jour et une hypothèse prudente d’absorption cutanée de 100 %.
En résumé, les valeurs d’exposition à court et à long terme par toutes les sources pour les scénarios d’exposition aux alcools en C6 sont présentées dans le Tableau 7‑8.
| Type d’exposition | % de la substance dans le produit | Exposition |
|---|---|---|
| Voie cutanée | 15 % de cyclohexanol dans un nettoyant pour moteur | 0,21 mg/kg p.c./j |
| Inhalation a |
10 % de cyclohexanol dans une peinture pour bricolage 50 % de cyclohexanol dans une surglaçure |
0,20 mg/m3 1,0 mg/m3 |
| Voie orale |
10 % de TMP dans un rouge à lèvres (adultes)b (enfants)b |
0,034 mg/kg p.c./j 0,029 mg/kg p.c./j |
| Voie cutanée | 10 % de TMP dans un adhésif pour ongles | 0,2 mg/kg p.c./j |
a L’exposition par inhalation est calculée sur une période de 24 heures.
b Le nombre d’applications par jour est de 2,4 pour les adultes et de 0,89 pour les enfants.
On n’a pas évalué l’exposition par inhalation au cyclohexanol par des produits d’entretien automobile, en raison de la courte période d’exposition des consommateurs à cette substance lors de l’application d’un nettoyant interne pour moteur automobile. Le TMP a une faible pression de vapeur et une faible volatilité et ne devrait donc pas donner lieu à une exposition par inhalation.
7.6.2 Évaluation des effets sur la santé
Les effets sur la santé de chacun des alcools en C6 visés par la présente évaluation ont été examinés au niveau international. Ces évaluations portaient notamment sur le cyclohexanol (EPA 2010; ECHA 2011; OCDE 2001b), le MIBC (OCDE 2005a) et le TMP (NIOSH 1994; OCDE 1994).
Aucun des alcools en C6 examiné dans la présente évaluation n’a été jugé dangereux pour la santé humaine en termes de cancérogénicité, de génotoxicité, de toxicité pour le développement ou de toxicité pour la reproduction, selon la classification réalisée par d’autres organismes nationaux ou internationaux.
Cyclohexanol – Toxicité subchronique
Dans une évaluation préliminaire sur 13 semaines avec doses répétées de la toxicité combinée pour la reproduction et le développement, des rats mâles et femelles ont été exposés au cyclohexanol à raison de 0, 205, 614 ou 1 640 mg/m3 (6 heures/jour; 5 jours/semaine). Aucun signe de toxicité liée au traitement n’a été observé dans aucun groupe de doses, et tous les paramètres macroscopiques, histologiques, biochimiques ou neurologiques étaient normaux. Cependant, on a observé une prostration et une diminution de l’activité chez les animaux du groupe ayant reçu la dose maximale juste après l’exposition, ce qui pourrait être un effet transitoire (US EPA 2010).
Dans la phase reproduction/développement de cette étude, des rats mâles et femelles ont été exposés par inhalation à 0, 205, 614 ou 1 640 mg/m3 de cyclohexanol pendant l’accouplement et la gestation, jusqu’au 4e jour de lactation. Des paramètres de reproduction et de développement ont été examinés chez tous les animaux. L’exposition à la dose maximale a provoqué une diminution du nombre de petits viables dans 2 des 11 portées, et une réduction du poids corporel moyen des petits a été observée à la mise bas et au jour PD 4. Converties en moyenne quotidienne, la CMENO et la CSENO étaient de 410 mg/m3 et 154 mg/m3, basées sur la perte de portées et la diminution du poids des petits, respectivement. Aucun signe de toxicité maternelle n’a été observé à la dose maximale (US EPA 2010).
Aucune étude de toxicité subchronique par voie orale ou voie cutanée n’a été trouvée pour le cyclohexanol.
MIBC – Toxicité subchronique
Dans une étude à court terme, l’exposition par inhalation au MIBC à 210, 826 ou 3 700 mg/m3 (6 heures/jour, 5 jours/semaine) pendant 6 semaines n’a provoqué aucun signe clinique de toxicité ou de mortalité chez les rats, et la dose maximale a été établie comme la CSENO (OCDE 2005a). De même, dans une étude par inhalation de 14 semaines, l’exposition au MIBC (209, 1 043 ou 4 172 mg/m3 pendant 6 heures/jour, 5 jours/semaine) n’a provoqué aucun changement d’importance toxicologique chez les rats et les souris mâles et femelles, et la dose maximale (4 200 mg/m3) a été établie comme la CSENO pour les deux espèces (Phillips et al. 1987).
TMP – Toxicité subchronique
Dans une étude combinée avec doses répétées sur la toxicité pour la reproduction ou le développement, le TMP a été administré par gavage à raison de 0, 12,5, 50, 200 ou 800 mg/kg p.c./j à des rats mâles et femelles pendant l’accouplement et la gestation et jusqu’au 3e jour de lactation. On a observé une diminution du poids corporel et une augmentation du poids du foie chez les rats mâles et femelles dans le groupe ayant reçu la dose maximale (800 mg/kg p.c./j), mais aucune modification histopathologique n’a été notée. On a suggéré une DSENO prudente de 200 mg/kg p.c./j. Toutefois, on n’a observé aucun changement histopathologique ou morphologique dans le foie, et aucun signe d’effet nocif systémique ou sur la reproduction (OCDE 1994).
Dans une étude sur l’exposition par voie alimentaire avec doses répétées de 90 jours, des doses de 20, 67, 200 ou 667 mg/kg p.c./j de TMP ont été administrées à des rats mâles et femelles. La dose maximale a provoqué une augmentation du poids du foie et de la rate, et une diminution des globules rouges. En outre, une diminution de l’activité de la transaminase glutamique pyruvique ou de la phosphatase alcaline sérique du foie a été observée uniquement chez les mâles à 200 mg/kg p.c./j et chez les deux sexes dans le groupe ayant reçu la dose maximale (OCDE 1994). Il semble s’agir d’un effet non nocif, car les modifications hormonales sans signe de changements histologiques peuvent refléter des changements adaptatifs. Ceci est confirmé par une autre étude dans laquelle une exposition par voie alimentaire pendant 5 mois à des doses plus élevées (1 500 ou 3 000 mg/kg p.c./j) de TMP n’a provoqué aucun effet lié à la substance (OCDE 1994). De même, aucun effet visible n’a été observé sur la peau des lapins après une application cutanée de 0,5 mL d’une solution aqueuse à 50 % de TMP à raison d’une fois par jour pendant 3 mois (OCDE 1994).
Ni le cyclohexanol, ni le MIBC, ni le TMP ne se sont avérés génotoxiques. Aucune étude à long terme ou sur la cancérogénicité n’a été trouvée pour les alcools en C6 (US EPA 2010; OCDE 2005a; OCDE 1994).
7.6.3 Caractérisation du risque pour la santé humaine
MIBC
En l’absence d’effets indésirables significatifs dans les études sur des animaux, les risques pour la santé humaine liés à l’exposition à cette substance sont jugés faibles.
Cyclohexanol : voie cutanée
Comme on n’a trouvé aucune étude sur l’exposition par voie cutanée ou par voie orale pour le cyclohexanol, on a procédé à une lecture croisée des résultats d’une étude par inhalation. En supposant un taux d’inhalation de 16 m3/j pour un adulte pesant 70,9 kg, la CSENO de 154 mg/m3 pour les effets sur la reproduction est convertie en une DSENO par exposition de 16 m3/j × 154 mg/m3 / 70,9 kg p.c. = 35,4 mg/kg p.c./j. L’exposition cutanée systémique à un nettoyant pour moteurs à 0,21 mg/kg p.c./j, en supposant une absorption cutanée de 100 %, donne une ME de 165 pour le jour de l’exposition. Compte tenu de la nature prudente de l’absorption cutanée à 100 % présumée pour le cyclohexanol, et de la nature des effets toxicologiques, cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Cyclohexanol : inhalation
La concentration moyenne de cyclohexanol le jour de l’utilisation de peinture pour bricolage est de 0,20 mg/m3, selon les calculs. L’utilisation de la CSENO quotidienne ajustée de 154 mg/cm3 pour les effets sur la reproduction donne une ME de 770. Compte tenu de la nature des hypothèses formulées dans le scénario d’exposition, à savoir que toute la peinture a été utilisée en une seule séance et que tout le cyclohexanol inhalé devient biodisponible, et compte tenu de la nature des effets toxicologiques, cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
La concentration moyenne de cyclohexanol le jour de l’utilisation dans la surglaçure de céramique est de 1,0 mg/m3, selon les calculs. Si on utilise une CSENO quotidienne ajustée de 154 mg/cm3 pour les effets sur la reproduction, on obtient une ME de 154. Compte tenu de la nature prudente des hypothèses formulées dans le scénario d’exposition, cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
TMP
Pour le TMP, les doses d’exposition à court terme dues à l’exposition orale à du rouge à lèvres sont de 0,014 mg/kg p.c./j pour les adultes et de 0,032 mg/kg p.c./j pour les enfants. Les doses d’exposition à long terme par le rouge à lèvres sont de 0,034 mg/kg p.c./j pour les adultes et de 0,029 mg/kg p.c./j pour les enfants. Par rapport à la DSENO de 200 mg/kg p.c./j pour la diminution du poids corporel, ces expositions donnent des ME de 14 000 et 6 250 pour l’exposition à long terme au rouge à lèvres pour les adultes et les enfants, respectivement. Compte tenu de la nature et des valeurs des effets toxicologiques, ces ME sont jugées adéquates, et le risque pour la population générale associé à l’exposition au TMP est jugé faible.
Pour le TMP, l’exposition cutanée à du vernis à ongles (absorption cutanée présumée de 100 %), on obtient une dose d’exposition systémique à court terme de 0,2 mg/kg p.c. À titre d’estimation prudente, la DSENO de 200 mg/kg p.c./j pour l’exposition à court terme au TMP a été utilisée, et en supposant une exposition au vernis à ongles de 0,2 mg/kg p.c. le jour de l’utilisation, on obtient une ME de 1 000. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
7.7 Incertitudes dans l’évaluation des risques pour la santé humaine
Étant donné que les sources, les utilisations et les propriétés du MIBC sont bien caractérisées, une caractérisation qualitative des risques est jugée appropriée pour cette substance. Il subsiste une certaine incertitude dans les facteurs d’exposition liés aux profils d’emploi des produits spécialisés contenant du cyclohexanol et du TMP.
8. Alcools aromatiques
8.1 Identité des substances
Les renseignements concernant l’identité des alcools aromatiques décrits dans la présente évaluation sont résumés dans le Tableau 8‑1 (PubChem2004‑ ).
| N° CAS |
Nom dans la LIS (nom usuel) |
Formule moléculaire | Structure moléculaire |
Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 108‑46‑3 | Résorcinol | C6H6O2 | 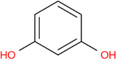 |
110,112 |
| 100‑51‑6 | Alcool benzylique | C7H8O | 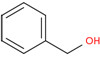 |
108,14 |
| 122‑97‑4 | 3‑Phénylpropan‑1‑ol | CH12O | 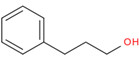 |
136,194 |
8.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques mesurées des alcools aromatiques sont présentées dans le Tableau 8‑2 (ChemIDplus 2017, Nair 2001). D’autres données sur les propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Propriété | Résorcinol | Alcool benzylique | 3‑Phénylpropan‑1‑ol |
|---|---|---|---|
| Point de fusion (°C) | 111 | ₋15,2 | ₋18 |
| Point d’ébullition (°C) | 280 | 205,3 | 235 |
| pKa (sans dimension) | 9,32 | 15,4 | — |
| log Koe (sans dimension) | 0,8 | 1,10 | 1,88 |
| Solubilité dans l’eau (mg/L) | 7,17 × 105 | 4,29 × 104 | 5,68 × 103 |
| Pression de vapeur (mm Hg à 25 °C) | 4,89 × 10‑4 | 0,094 | 0,0234 |
| Constante de la loi de Henry (atm‑m3/mol) | 9,88 × 10‑11 | 3,37 × 10‑7 | 2,03 × 10‑7 |
L’alcool benzylique et le 3‑phénylpropan‑1‑ol sont relativement plus volatils que le résorcinol. Ils ont tous une solubilité dans l’eau très élevée et les constantes de la loi de Henry sont très faibles.
8.3 Sources et utilisations
Ces trois substances sont présentes dans la nature. Cependant, la majeure partie de la production de ces substances est d’origine anthropique. Les volumes totaux fabriqués et importés au Canada en 2011, selon les déclarations faites en réponse à une enquête menée en vertu de l’article 71 de la LCPE, sont présentés dans le Tableau 8‑3 (Environnement Canada 2013).
| Alcool | Production totale (kg)a | Importation totale (kg)a |
|---|---|---|
| Résorcinol | 1 000 – 10 000 | 480 000 |
| Alcool benzylique | 5 000 | 735 000 |
| 3‑Phénylpropan‑1‑ol | N.D. | 1 350 |
Abréviation : N.D. = quantité non déclarée au‑delà du seuil de déclaration de la mise à jour de l’inventaire de la LIS de 100 kg.
a Les valeurs sont indicatives des quantités fournies en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Le résorcinol et l’alcool benzylique sont largement utilisés comme solvants dans l’industrie, mais les trois substances sont également présentes dans une gamme de produits disponibles aux consommateurs, y compris les produits d’entretien automobile, les produits d’entretien ménager et les produits de construction et de peinture. Le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol sont utilisés dans les cosmétiques. Les catégories de produits et les plages de concentrations des produits contenant des alcools aromatiques présentant le plus grand degré d’exposition sont indiquées dans le Tableau 8‑4. Les valeurs indiquent la concentration des alcools aromatiques dans les préparations commerciales et ne tiennent pas compte d’une éventuelle dilution avant ou pendant l’utilisation. L’époxy indiqué comme sous‑produit de l’alcool benzylique est utilisé dans les sites industriels et de construction à grande échelle.
| Alcool | Catégorie de produits | Type de produit | Alcool dans le produit, % en poids |
|---|---|---|---|
| Alcool benzylique | Entretien automobile |
Additif pour carburant Désodorisant pour automobile |
20–30 5–10 |
Produits nettoyants et d’entretien de mobilier |
Nettoyants tout‑usage Lingettes Assainisseur d’air Antirouille |
5–10 0,5–5 1–5 |
| Construction ou peinture |
Peinture en aérosol avec paillettes Plastifiant Colle époxyde (2 tubes) Revêtement époxyde pour les sols en béton Décapants pour cire et finition pour l’extérieur |
5 1–5 40–70 5‑40 |
|
| 3‑Phénylpropan‑1‑ol | Produits de nettoyage | Assainisseur d’air | 0,1–1 |
L’utilisation des alcools aromatiques comme composants dans la fabrication de matériaux d’emballage alimentaire ou comme additifs indirects utilisés dans les établissements de transformation des aliments n’a pas été relevée au Canada. L’alcool benzylique est un additif alimentaire dont l’utilisation est autorisée comme solvant vecteur dans des préparations aromatisantes non normalisées, selon la Liste des solvants de support ou d’extraction autorisés, incorporé par renvoi à son autorisation de mise en marché délivrée en vertu de la Loi sur les aliments et drogues. Comme le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol sont des agents aromatisants alimentaires reconnus, il est donc possible qu’ils soient présents comme agents aromatisants alimentaires dans les aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2016; sans référence) (voir le Tableau 8‑5).
| Alcool | Matériau d’emballage alimentaire | Additifs indirects b | Additifs alimentaires | Agents aromatisants alimentaires | Risque d’exposition |
|---|---|---|---|---|---|
| Résorcinol | Non | Non | Non | Oui | Oui |
| Alcool benzylique | Non | Non | Oui | Oui | Oui |
| 3‑Phénylpropan‑1‑ol | Non | Non | Non | Oui | Oui |
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada au Bureau d’évaluation du risque des substances existantes, Santé Canada, 17 novembre 2016, sans référence.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments qui peuvent se retrouver de manière fortuite dans les aliments sous forme de résidus.
D’après les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol sont présents dans les produits cosmétiques au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 27 octobre 2016; sans référence). Le résorcinol figure comme ingrédient restreint sur la Liste critique des ingrédients cosmétiques et son utilisation n’est pas autorisée dans les cosmétiques destinés à être employés sur la peau ou près de l’œil. La nature des produits et la concentration maximale des alcools sont présentées dans le Tableau 8‑6. Les concentrations indiquent la quantité d’alcool aromatique dans les préparations commerciales et ne tiennent pas compte d’une éventuelle dilution avant ou pendant l’utilisation.
L’alcool benzylique a été considéré comme un sensibilisant présumé dans le plan d’action continu communautaire de l’ECHA (ECHA 2015c). Pour une utilisation topique, des concentrations atteignant 10 % dans les produits à rincer et jusqu’à 3 % dans les produits sans rinçage sont autorisées. Les pays de l’UE et la Nouvelle-Zélande limitent l’utilisation de l’alcool benzylique employé comme agent de conservation dans les cosmétiques avec un maximum de 1,0 % en poids dans les préparations prêtes à l’emploi et dans les autres utilisations (autres que l’inhibition de la prolifération des microorganismes). En Europe, la quantité d’alcool benzylique doit être indiquée sur les cosmétiques si sa concentration dépasse 0,001 % en poids pour les produits sans rinçage et 0,01 % en poids pour les produits à rincer (CosIng 2018d).
Selon l’interprétation que fait Santé Canada de l’article 22 du Règlement sur les cosmétiques, des mises en garde précises sont requises lorsque le résorcinol est utilisé dans les teintures pour cheveux. L’interprétation de l’article 22 est décrite à l’entrée du résorcinol sur la Liste critique.
| Alcool | Nombre de cosmétiques dans lesquels la substance est présente | Nombre de produits et concentration maximale indiquée | Conditions d’utilisation | Liste critique des ingrédients |
|---|---|---|---|---|
| Résorcinol | 2 160 produits |
2 150 produits capillaires – 10 % 1 maquillage non permanent (utilisation autour des yeux et sur le visage) – 3 % |
Utilisation permise dans les teintures pour cheveux avec mise en garde | Substance décrite comme ingrédient restreint. Utilisation non permise dans les cosmétiques pour utilisation sur la peau. De plus, les limitations similaires à la teinture à base de goudrons pour cheveux s’appliquent. |
| Alcool benzylique | 12 050 produits |
Antisudorifiques – 20 % Produits pour le bain – 10 % Traceur pour les yeux – 30 % Nettoyant autour des yeux et pour le visage – 19 % Colorant/décolorant pour les cheveux – 30 % Produits de coiffure – 30 % Revitalisant – 10 % Maquillage – 10 % Produit de démaquillage – 1 % Hydratant – 30 % Vernis à ongles/dissolvant pour vernis à ongles – 3 % Shampooing – 10 % Pâte dentifrice – 3 % |
S.O. | S.O. |
| 3‑Phénylpropan‑1‑ol | 205 produits |
Lotion pour les mains, crème pour les pieds – 10 % Produits capillaires – 3 % Maquillage – 3 % Hydratant – 1 % |
S.O. | S.O. |
Abréviation : S.O. = sans objet.
Les utilisations des alcools aromatiques dans les PSN au Canada sont résumées dans le Tableau 8‑7.
| Alcool | BDIPSN | BDPSNH | Commentaires |
|---|---|---|---|
| Résorcinol | Oui | Oui |
Rôle médicinal en tant que substance de PSN visée par l’annexe 1, article 2 (un isolat) dans le RPSN Présent dans les PSN actuellement homologués |
| Alcool benzylique | Oui | Oui |
Rôle médicinal en tant que substance de PSN visée par l’annexe 1, article 2 (un isolat) dans le RPSN Rôle non médicinal pour utilisation comme exhausteur de goût, ingrédient de parfum, antimicrobien de conservation ou solvant. Pour utilisation topique comme ingrédient non médicinal, jusqu’à 10 % dans les produits à rincer et jusqu’à 3 % dans les produits sans rinçage Dose journalière admissible jusqu’à 5 mg/kg p.c./j, exprimée en équivalents d’acide benzoïque Doit être déclaré comme ingrédient médicinal dans les pastilles pour la gorge à des doses journalières égales ou supérieures à 100 mg/j et dans les produits anorectaux à des concentrations égales ou supérieures à 1 % p/p Présent dans les PSN actuellement homologués |
| 3‑Phénylpropan‑1‑ol | Oui | Oui |
Rôle non médicinal pour usage oral comme exhausteur de goût et utilisation topique comme ingrédient de parfum, agent masquant ou solvant Présent dans les PSN actuellement homologués |
Abréviations : PSN = produit de santé naturel; BDIPSN = Base de données des ingrédients des produits de santé naturels; BDPSNH = Base de données des produits de santé naturels homologués; RPSN = Règlement sur les produits de santé naturels.
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada au Bureau d’évaluation du risque des substances existantes, Santé Canada, 26 octobre 2016, sans référence.
L’alcool benzylique est présent comme ingrédient non médicinal dans les médicaments en vente libre, dans les désinfectants de surface, les vaporisateurs nasaux, les crèmes antidouleur, les écrans solaires, les rince‑bouche, les produits antifongiques et les shampoings antipelliculaires. Il est également un ingrédient non médicinal dans plusieurs médicaments sur ordonnance dont l’administration se fait principalement par voie intraveineuse (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance et Direction des produits thérapeutiques, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 30 avril 2021 et 23 mai 2019; sans référence).
L’alcool benzylique est présent dans les produits antiparasitaires en tant que produit de formulation (ARLA 2010).
De plus, le résorcinol a été détecté dans les champignons de type armillaire, dans les feuilles de tabac en petites quantités et dans la mélasse de canne à sucre (OCDE 2009; OMS 2006). L’alcool benzylique peut provenir de nombreux fruits, plantes, thés et huiles essentielles, notamment le jasmin, la jacinthe et l’ylang‑ylang (Merck Index 2010). Le 3‑phénylpropan‑1‑ol est présent dans les résines, les baumes, la cannelle et une variété de fruits, de baies et de champignons (PubChem 2004‑ ). Le résorcinol et le 3‑phénylpropan‑1‑ol sont également présents dans les boissons alcoolisées.
L’alcool benzylique a été trouvé comme agent aromatisant dans les produits de vapotage (Tierney et al. 2015; Czoli et al. 2019; Krüsemann et al. 2021). Les produits de vapotage (également connus sous le nom de cigarettes électroniques) peuvent représenter une source d’exposition supplémentaire à cette substance. L’évaluation du risque que présente cette utilisation pour la population générale, y compris le risque par rapport à celui qui est associé aux cigarettes classiques, et les options possibles pour atténuer le risque associé à ces produits font l’objet d’un cadre législatif distinct (Santé Canada [modifié 2020]).
8.4 Devenir et comportement dans l’environnement
En ce qui concerne leur devenir dans l’environnement, les alcools aromatiques ont une mobilité élevée à très élevée dans le sol. La volatilisation de ces substances à partir des surfaces humides du sol ne devrait pas être un processus de devenir important, pas plus que la volatilisation depuis les surfaces d’eau.
8.4.1 Persistance dans l’environnement
Comme tous les phénols, les alcools aromatiques devraient réagir relativement rapidement dans l’eau naturelle, sous l’action du soleil, avec les radicaux hydroxyles et les radicaux peroxydes produits par des mécanismes photochimiques. Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), les alcools aromatiques ne devraient pas persister dans l’air, l’eau, les sédiments ou le sol.
8.4.2 Potentiel de bioaccumulation
Compte tenu de leurs faibles valeurs log Koe et de leurs faibles facteurs de bioconcentration (ECCC 2016b), les alcools aromatiques ne devraient pas subir de bioaccumulation considérable dans les organismes.
8.5 Effets nocifs potentiels sur l’environnement
8.5.1 Caractérisation du risque écologique
Les risques environnementaux des alcools aromatiques ont été caractérisés selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer les profils des alcools aromatiques ainsi que les résultats de la classification des dangers, de l’exposition et des risques sont présentés dans ECCC (2016b).
Les classifications de danger et d’exposition pour les alcools aromatiques sont résumées dans le Tableau 8‑8.
| Substance | Danger selon la CRE | Exposition selon la CRE | Risque selon la CRE |
|---|---|---|---|
| Résorcinol | Faible | Faible | Faible |
| Alcool benzylique | Faible | Faible | Faible |
| 3‑Phénylpropan‑1‑ol | Faible | Faible | Faible |
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol ont été classés comme substances présentant un faible risque écologique. Il est donc peu probable qu’elles suscitent des préoccupations pour l’environnement au Canada.
8.6 Effets nocifs potentiels sur la santé humaine
8.6.1 Évaluation de l’exposition
8.6.1.1 Milieux naturels et aliments
Les résultats du modèle de fugacité de niveau III indiquent que les alcools aromatiques se répartissent principalement dans l’eau et le sol (OCDE 2008; OCDE 2001c). Comme ces alcools se biodégradaient rapidement dans des essais de biodégradation en milieu aqueux aérobie, ils ne devraient donc pas persister dans les milieux aquatiques et les sols. L’exposition aux alcools aromatiques par les milieux naturels devrait donc être faible.
Aucun des alcools aromatiques n’a été trouvé comme composant dans la fabrication de matériaux d’emballage alimentaire ni comme additif indirect utilisé dans des établissements de transformation des aliments au Canada. Le résorcinol, l’alcool benzylique et le 3‑phénylpropan‑1‑ol sont naturellement présents dans certains aliments, et sont potentiellement présents comme agents aromatisants alimentaires dans les aliments vendus au Canada. L’utilisation de l’alcool benzylique est également autorisée comme additif alimentaire au Canada à titre de solvant vecteur dans certaines préparations aromatisantes, selon la Liste des solvants de support ou d’extraction autorisés, et il y est incorporé par renvoi dans son autorisation de mise en marché en vertu de la Loi sur les aliments et drogues.
Une comparaison des volumes de production semble indiquer que l’exposition à l’alcool benzylique, en raison de son utilisation comme aromatisant alimentaire, devrait être supérieure à l’exposition par les aliments qui contiennent naturellement cet alcool (JECFA 2002). Par conséquent, l’exposition par cette source a été quantifiée plus à fond. Sur le plan international, le JECFA a évalué l’alcool benzylique comme agent aromatisant alimentaire et a estimé que la dose correspondante d’alcool benzylique par personne était de 17 000 μg/j (290 μg/kg p.c./j) pour la population américaine (International Organization of the Flavor Industry 1995; Lucas et al. 1999, tous deux cités dans JECFA 2002; IPCS 2005). D’après les données existantes, la dose d’alcool benzylique par personne calculée par le JECFA est une estimation prudente de l’exposition possible de la population canadienne par voie alimentaire, c’est‑à‑dire par toutes les utilisations de cette substance comme aromatisant alimentaire, y compris son utilisation comme agent aromatisant et solvant vecteur (additif alimentaire) dans les préparations aromatisantes dans la population générale âgée de 1 an et plus (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, 2018; sans référence). L’exposition à ces substances, par les aliments, devrait être inférieure à l’exposition attribuable à l’utilisation de certains produits disponibles aux consommateurs.
8.6.1.2 Exposition par les produits disponibles aux consommateurs
Comme le montre le tableau 9‑5, on trouve les alcools aromatiques à diverses concentrations dans les produits disponibles aux consommateurs au Canada.
Résorcinol
Seuls les produits disponibles aux consommateurs ont donné lieu à une exposition cutanée.
L’utilisation de teintures pour les cheveux donne lieu à la plus importante exposition cutanée au résorcinol. On obtient une exposition systémique de 1,4 mg/kg p.c./j dans un scénario dans lequel le résorcinol est utilisé dans un colorant capillaire permanent à une concentration de 10 %, à une fréquence d’utilisation de 0,02 par jour, avec une quantité de produit de 100 g, et en supposant une absorption cutanée de 10 % pour un adulte.
Alcool benzylique
Exposition par voie orale
Lorsqu’il est utilisé en tant que PSN ou médicament en vente libre dans les pastilles pour la gorge, l’alcool benzylique doit être déclaré comme ingrédient médicinal et être utilisé à des doses journalières égales ou supérieures à 100 mg/j. Cette substance est utile en raison de ses propriétés analgésiques et/ou anesthésiques et sa présence en des quantités de 100 à 500 mg par pastille concorde avec la Monographie sur les pastilles pour la gorge de la Direction des produits de santé naturels et sans ordonnance (Santé Canada 2018; BDIPSN 2021). Dans un certain nombre d’études sur les pastilles pour la gorge trouvées dans les bases de données publiques, la quantité d’alcool benzylique déclarée comme ingrédient non médicinal et indiquée sur l’emballage était de 5,0 à 6,5 mg par pastille. Une consommation maximale de 12 pastilles par jour donne une dose quotidienne maximale de 78 mg/j, ce qui se traduit par une exposition orale de 1,1 mg/kg p.c./j pour un adulte pesant 70,9 kg et de 1,3 mg/kg p.c./j pour un adolescent pesant 59,4 kg.
L’exposition orale à l’alcool benzylique peut également se faire par l’utilisation de cosmétiques, de PSN et de médicaments en vente libre formulés sous forme de baume à lèvres, de pâte dentifrice et de rince‑bouche. L’exposition par les produits ayant la plus forte concentration d’alcool benzylique est résumée dans le Tableau 8‑9, les facteurs d’exposition étant indiqués dans le tableau B‑10 (annexe B).
| Produit | Groupe d’âge | Dose calculée (mg/kg p.c./j) |
|---|---|---|
| Baume à lèvres | 9–13 à 19+ | 0,010 à 0,012 |
| Pâte dentifrice | 2–3 à 19+ | 0,068 à 0,27 |
| Rince‑bouche | 4–8 à 19+ | 0,72 à 0,86 |
Exposition cutanée
Une étude in vivo de l’absorption cutanée de l’alcool benzylique et d’autres dérivés benzyliques a été réalisée sur la peau de singes rhésus, dont on a constaté qu’elle ressemble à la peau humaine pour ce qui est de l’absorption des dérivés benzyliques. Le pourcentage d’absorption cutanée de l’alcool benzylique sur la peau abdominale à découvert a été établi à 32 ± 4 % (Bronaugh et al. 1990). Une étude in vitro a été réalisée pour déterminer l’évaporation et l’absorption cutanées de l’alcool benzylique (à partir d’une solution à 1 % dans l’éthanol) appliqué sur des échantillons de peau humaine dans différentes conditions de flux d’air au‑dessus de l’échantillon (Saiyasombati et Kasting 2003). Selon la vitesse de l’écoulement d’air, une absorption cutanée d’alcool benzylique comprise entre 48 % (faible écoulement d’air) et 12 % (fort écoulement d’air) de la dose appliquée a été mesurée. Compte tenu de ces études, on a utilisé une absorption cutanée de 50 % pour l’alcool benzylique dans la présente évaluation.
L’exposition cutanée la plus élevée à l’alcool benzylique par les PSN et les médicaments en vente libre est due à l’utilisation d’un écran solaire, qui est considéré comme le produit sentinelle. Pour l’écran solaire, la quantité utilisée par les adultes et les enfants de 2 à 3 ans est établie à 12 g/j et 3 g/j, respectivement. Pour un adulte pesant 70,9 kg et un enfant de 2 à 3 ans pesant 15,5 kg, un scénario prévoyant une concentration d’alcool benzylique dans l’écran solaire de 1,74 % et un taux d’absorption cutanée de 50 % donne une exposition systémique de 1,4 mg/kg p.c./j et de 1,7 mg/kg p.c./j, respectivement.
L’exposition systémique à l’alcool benzylique par contact cutané lors de l’utilisation d’un nettoyant facial à rincer est présentée dans le Tableau 8‑10. Les facteurs d’exposition utilisés dans ces calculs figurent dans le tableau B‑11 de l’annexe B.
| Produit | Groupe d’âge | Poids maximal | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|
|
Écran solaire Nettoyant facial |
2–3 à 19+ ans 4–8 à 19+ ans |
1,74 19 |
1,4 à 1,7 0,015 à 0,029 |
L’exposition systémique pour différents groupes d’âge par contact cutané avec des produits cosmétiques contenant de l’alcool benzylique trouvés au Canada a été établie et les valeurs sont présentées dans le Tableau 8‑11. Les facteurs d’exposition utilisés dans ces calculs figurent dans le tableau B‑12 de l’annexe B.
| Produit | Groupe d’âge | Poids maximal | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|
| Crème/hydratant pour le corps | 0–5 mois à 19+ ans | 30 | 159 à 68 |
| Désodorisant/antisudorifique | 9–13 à 19+ ans | 20 | 1,0 à 1,7 |
| Démaquillant pour les yeux | 4–8 à 19+ ans | 1 | 0,011 à 0,002 |
| Crème faciale | 9–13 à 19+ ans | 10 | 1,2 à 2,0 |
| Maquillage/fond de teint | 4–8 à 19+ ans | 10 | 0,74 à 0,33 |
| Parfum | 2–3 à 19+ ans | 3 | 0,28 à 0,10 |
| Shampooing | 0–5 mois à 19+ ans | 10 | 0,31 à 0,08 |
| Huile de massage | 6–11 mois à 19+ ans | 1 | 0,99 à 0,22 |
| Dissolvant pour vernis à ongles | 2–3 à 19+ ans | 3 | 0,76 à 0,46 |
L’exposition cutanée maximale à l’alcool benzylique par les produits d’entretien ménager disponibles aux consommateurs est attribuable à l’utilisation d’un nettoyant tout‑usage contenant jusqu’à 10 % d’alcool benzylique. Un scénario d’exposition cutanée a été établi pour ce produit, basé sur les facteurs d’exposition de ConsExpo Web (RIVM 2018) indiqués dans le tableau B‑13 (annexe B). On présume que 2,9 g de nettoyant (0,29 g d’alcool benzylique) entrent en contact avec la peau. Ce scénario conduit à des estimations prudentes pour une dose interne d’exposition à court terme de 0,2 mg/kg p.c. le jour de l’exposition et une dose d’exposition à long terme de 0,11 mg/kg p.c./j.
Exposition par inhalation
L’exposition par inhalation aux vapeurs d’alcool benzylique dues à l’application d’un nettoyant tout‑usage en pulvérisateur a été calculée à l’aide des facteurs d’exposition de ConsExpo Web indiqués dans le tableau B‑14 (annexe B). En utilisant ces hypothèses, le calcul de la concentration maximale et la concentration moyenne le jour de l’exposition a donné les valeurs suivantes : 0,099 mg/m3 et 0,016 mg/m3, respectivement. L’exposition systémique le jour de l’exposition est de 0,0038 mg/kg p.c.
L’exposition par inhalation aux vapeurs d’alcool benzylique dues à l’utilisation d’un assainisseur d’air liquide a été calculée selon le scénario à taux constant de ConsExpo Web, comme estimation prudente. Le produit liquide de 5,5 mL a une densité de 1,02, et contient 5 % en poids d’alcool benzylique et sa durée totale d’utilisation est de 30 jours. Les facteurs d’exposition pour ce scénario provenant de ConsExpo (RIVM 2018) figurent dans le tableau B‑15 (annexe B). En utilisant ces hypothèses, on obtient comme concentration maximale et moyenne le jour de l’exposition 3,8 μg/m3 et 0,21 μg/m3, respectivement. L’exposition systémique le jour de l’exposition est de 0,66 μg/kg p.c./j.
Un produit de revêtement protecteur époxyde à deux composantes contenant de l’alcool benzylique est utilisé sur les surfaces en béton (FDS 2010b). On s’attend à ce que ce produit soit utilisé par des professionnels ou des particuliers dans des pièces vides, généralement des garages ou des sous‑sols. Le scénario « exposition à la vapeur : taux constant » de ConsExpo pour un revêtement général, avec les facteurs d’exposition du tableau B‑16 (annexe B), a été utilisé pour déterminer l’exposition par inhalation liée à cette utilisation. Ce scénario a donné une concentration moyenne d’alcool benzylique le jour de l’exposition de 10 mg/m3. En utilisant une quantité d’air respiré de 14,4 m3/j associé à une activité légère et au poids d’un adulte moyen de 70,9 kg, on obtient une dose d’exposition de 2,1 mg/kg p.c./j. On considère que ce scénario d’exposition fournit une limite supérieure à l’exposition à l’alcool benzylique par d’autres produits spécialisés de construction ou de peinture.
3‑Phénylpropan‑1‑ol
Exposition cutanée
Bhatia et al. (2011) ont calculé l’exposition cutanée totale au 3‑phénylpropan‑1‑ol utilisé comme parfum dans 10 produits cosmétiques, dont une lotion pour le corps, une crème faciale, un shampooing et des produits pour le bain, entre autres. Pour obtenir une estimation prudente à partir de l’étude de plusieurs milliers de produits, ces auteurs ont calculé le 97,5e centile du composant 3‑phénylpropan‑1‑ol dans le parfum utilisé dans chaque produit et ont utilisé le 97,5e centile dans chacun des 10 produits. Selon la nature du produit, en particulier la durée pendant laquelle il est censé rester sur la peau et si le parfum était rincé, ils ont appliqué des facteurs de rétention de 0,001 à 1,0 au 3‑phénylpropan‑1‑ol. Un facteur de rétention de 1,0 a été attribué aux lotions pour le corps et aux crèmes parfumées à usage intensif. En utilisant les facteurs d’exposition pour les parfums (Ford et al. 2000; Cadby et al. 2002), on a estimé l’exposition systémique totale au 3‑phénylpropan‑1‑ol par ces produits à 0,0204 mg/kg p.c./j pour un adulte de 60 kg, la majorité de cette exposition provenant du parfum (0,008 mg/kg p.c./j) et de la lotion pour le corps (0,003 mg/kg p.c./j).
Une étude in vitro avec des échantillons de peau de rat a été réalisée pour déterminer l’évaporation et l’absorption cutanée du 3‑phénylpropan‑1‑ol en solution saturée à 75 % (S = 6,68 mg/mL) dans un tampon de pH 6,2 (Lopez 1998). La solution sur les échantillons de peau était renouvelée toutes les 30 minutes afin de maintenir un degré de saturation constant sur les échantillons de peau. Dans tous les échantillons, l’absorption cutanée de 3‑phénylpropan‑1‑ol était inférieure à 10 %. Les auteurs ont déterminé un coefficient de perméabilité Kp de 0,130 cm/h pour le 3‑phénylpropan‑1‑ol. Un modèle de flux maximal peut être utilisé pour cette substance, à l’aide de la formule suivante :
Flux maximal = Kp × S = 0,130 × 0,130 = 0,87 mg/(cm2·h)
L’exposition maximale au 3‑phénylpropan‑1‑ol par des produits cosmétiques disponibles au Canada est attribuable à une crème pour les pieds et à une lotion pour les mains dont la teneur en 3‑phénylpropan‑1‑ol est de 10 % en poids. Cette concentration est nettement supérieure à la concentration de saturation du 3‑phénylpropan‑1‑ol. En supposant l’utilisation quotidienne de la crème pour les pieds sur une surface de 1 170 cm2 des pieds avec un temps d’exposition de 1 heure pour les adultes (pesant 70,9 kg) et les adolescents (pesant 59,4 kg), l’exposition à long terme au 3‑phénylpropan‑1‑ol a été estimée à 0,60 mg/kg p.c./j et à 0,71 mg/kg p.c./j, respectivement. En supposant une utilisation deux fois par jour de la lotion pour les mains sur une surface de 860 cm2 des mains avec un temps d’exposition de 1 heure,
on a estimé l’exposition systémique à long terme au 3‑phénylpropan‑1‑ol due à cette lotion pour les mains à 0,88 mg/kg p.c./j et à 1,02 mg/kg p.c./j, respectivement.
Pour ce qui est de la distribution (en pourcentage) du 3‑phénylpropan‑1‑ol dans les produits hydratants pour le corps, certains produits contiennent 1 % de 3‑phénylpropan‑1‑ol. Cette concentration est proche de la concentration de saturation du 3‑phénylpropan‑1‑ol, qui s’épuise à mesure qu’une partie de la substance est absorbée par la peau. Par conséquent, la méthode du flux maximal n’a pas été utilisée pour cette exposition. En supposant une utilisation de 12 g et de 10,4 g du produit par les adultes et les adolescents, respectivement, on calcule, sur la base d’une absorption cutanée de 10 %, une exposition systémique pour les adultes et les adolescents de 0,169 mg/kg p.c./j et de 0,174 mg/kg p.c./j, respectivement.
Dans les PSN, le 3‑phénylpropan‑1‑ol est utilisé comme ingrédient non médicinal dans les lotions et les écrans solaires, avec des pourcentages maximaux déclarés de 0,6 % (BDPSNH 2021; BDIPSN 2021). L’exposition à ces produits est présumée être inférieure à l’exposition aux produits cosmétiques évalués quantitativement ci‑dessus.
8.6.2 Évaluation des effets sur la santé
Sur le plan international, les alcools aromatiques ont fait l’objet d’évaluations individuelles portant sur le risque qu’ils posent pour la santé humaine et l’environnement. Il s’agit notamment des évaluations du résorcinol (ECHA 2011 [up 2017]; OCDE 2008; /IPCS 2006; NTP 1992), de l’alcool benzylique (EC 2002; CIR 2001; OCDE 2001; NTP 1989) et du 3‑phénylpropan‑1‑ol (ECHA 2017c). Ces examens, ainsi que certaines études principales trouvées dans la littérature, ont été utilisés pour étayer la caractérisation des effets sur la santé dans la présente évaluation. Cet ensemble complet de données d’essai fiables sur divers animaux permet d’évaluer par lecture croisée certains composants non testés visés par la présente évaluation. Toutes les études décrites ici se rapportent aux substances décrites dans la présente évaluation.
Aucun des alcools aromatiques évalués n’a été classé comme substance présentant un risque pour la santé humaine d’après les études faites par d’autres organismes nationaux ou internationaux sur la cancérogénicité, la génotoxicité, la toxicité pour le développement ou la toxicité pour la reproduction.
Résorcinol (no CAS 108‑46‑3)
Le résorcinol peut provoquer une sensibilisation cutanée (IPCS 2006).
Dans une étude de détermination des doses subchroniques (13 semaines), des rats F344 mâles et femelles ou des souris B6C3F1 ont reçu par gavage du résorcinol ajouté dans l’eau potable pendant 5 jours/semaine à raison de 32, 65, 130, 260 ou 520 mg/kg p.c./j chez les rats et de 28, 56, 112, 225 ou 420 mg/kg p.c./j chez les souris. Les auteurs ont indiqué que presque tous les rats et les souris du groupe ayant reçu la plus forte dose (520 mg/kg p.c./j ou 420 mg/kg p.c./j) sont morts dans les 7 à 14 premiers jours en raison d’une réaction toxique aiguë. Aux doses non létales, le seul changement observé était une augmentation légère ou dispersée du poids du foie ou des surrénales chez les deux espèces et les deux sexes, effet qui n’a pas été jugé biologiquement significatif par les auteurs, car aucun changement n’a été observé dans les paramètres biochimiques, macroscopiques ou microscopiques chez les rats traités au résorcinol par rapport aux témoins (NTP 1992).
Dans une étude de toxicité pour la reproduction sur deux générations, l’administration de 120, 360, 1 000 ou 3 000 mg/L de résorcinol ajouté dans l’eau potable à des rats mâles et femelles n’a pas provoqué d’effets systémiques, parentaux ou sur la reproduction liés au traitement dans aucun groupe de doses. La dose maximale (3 000 mg/L) était équivalente à une DSENO de 233 mg/kg p.c./j (mâle) et de 304 mg/kg p.c./j (femelle) pendant la période de pré-accouplement et de gestation et une DSENO de 660 mg/kg p.c./j pour les rates pendant la période de lactation (RTF 2005). Dans une étude de toxicité pour le développement, l’exposition au résorcinol (dissous dans du propylène glycol) à 125, 250 ou 500 mg/kg p.c./j par gavage chez des rats (JG 6 à 15) n’a provoqué aucun effet nocif sur les fœtus en développement ou les mères, et la dose maximale a été considérée comme une DSENO (DiNardo 1985).
Le résorcinol s’est révélé généralement négatif dans la plupart des tests de génotoxicité, notamment le test de mutation bactérienne d’Ames, l’essai de synthèse non programmée de l’ADN, l’étude du locus de la thymidine kinase, l’essai de transformation morphologique de l’embryon de hamster, le test du micronoyau et le test RasH2 (OCDE 2008). L’EFSA (2010) a établi une DJA de 0,12 mg/kg p.c./j pour le résorcinol sur la base d’une DSENO de 50 mg/kg p.c./j pour des signes neurologiques aigus (ataxie, prostration, salivation et tremblements) qui ont disparu dans les 30 à 60 minutes suivant l’ingestion de résorcinol par les rats mâles et femelles. L’EFSA a obtenu cette DSENO à partir d’une étude de cancérogénicité du NTP dans laquelle le résorcinol a été administré (par gavage dans l’eau potable) à raison de 0, 112 ou 225 mg/kg p.c./j à des rats mâles et de 0, 50, 100 ou 150 mg/kg p.c./j à des rates pendant 5 jours/semaine pendant 2 ans (NTP 1992). L’EFSA a ensuite ajusté cette DSENO à 36 mg/kg p.c./j afin de tenir compte d’une semaine d’exposition de 7 jours à la suite d’une semaine d’administration de 5 jours. L’EFSA a considéré qu’il s’agissait d’une approche prudente pour tenir compte de l’exposition alimentaire au résorcinol chez les adultes ou les enfants susceptibles de consommer des crevettes crues, qui peuvent contenir plus de 35 mg/kg de résorcinol (EFSA 2010).
Alcool benzylique (no CAS 100‑51‑6)
Dans une étude avec doses répétées de 13 semaines, l’alcool benzylique a été administré (gavage/huile de maïs) à 50, 100, 200, 400 ou 800 mg/kg p.c./j à des rats mâles et femelles pendant 5 jours/semaine (NTP 1989). La dose maximale a provoqué des signes de neurotoxicité, se manifestant notamment par une démarche titubante, une respiration laborieuse et la léthargie, ainsi qu’une diminution du poids corporel chez les rats mâles et femelles. L’examen post‑mortem a révélé une nécrose du gyrus denté ou de l’hippocampe du cerveau, une nécrose des muscles squelettiques, ainsi qu’une atrophie et une congestion thymiques chez les deux sexes dans le groupe ayant reçu la dose maximale. Une réduction du poids corporel des rates a été observée à 400 mg/kg p.c./j, mais non à 800 mg/kg p.c./j (NTP 1989).
L’EPA a également examiné l’étude du NTP (1989) et a proposé une DRf orale subchronique (13 semaines) ou chronique (2 ans) de 1,0 mg/kg p.c./j ou 0,3 mg/kg p.c./j, respectivement, après amortissement de la dose de 5 jours/semaine sur 7 jours/semaine pour tenir compte de l’exposition. L’EPA a tenu compte d’une DSENO amortie pour une exposition sur 7 jours/semaine de 143 mg/kg p.c./j (basée sur une dose de 200 mg/kg p.c./j pour 5 jours/semaine) basée sur une diminution du poids corporel chez les rates, et une DMENO de 286 mg/kg p.c./j (400 mg/kg p.c./j) basée sur une hyperplasie de l’estomac antérieur chez les rats mâles (US EPA 2009). Ces effets ne semblent pas nocifs, car la diminution du poids corporel des rates dans les différents groupes de doses n’était pas liée à la dose et la prolifération des lésions de l’épithélium de l’estomac antérieur est connue pour se produire en raison de l’irritation des tissus due à l’administration par gavage (pendant 2 ans). Depuis l’examen de l’EPA, il a été proposé que les lésions prolifératives de l’épithélium de l’estomac antérieur chez les rats ne devraient pas être jugées pertinentes pour l’humain, à moins qu’une dose pertinente pour l’humain n’ait été utilisée ou qu’il y ait eu un développement de tumeurs sur plusieurs sites, ou encore si un produit chimique a un mode d’action génotoxique (Proctor et al. 2007).
Pour ces raisons, on a établi pour la présente évaluation une DSENO de 400 mg/kg p.c./j et une DMENO de 800 mg/kg p.c./j, car les changements du poids corporel ne semblaient pas être liés à la dose.
On a noté des signes équivoques de sensibilisation à l’alcool benzylique chez les animaux de laboratoire et les humains. Aucune mutagénicité n’a été observée et le potentiel de génotoxicité ou de cancérogénicité de l’alcool benzylique a été jugé négatif (OCDE 2001; JECFA 1996).
L’alcool benzylique est métabolisé en acide benzoïque dans le corps humain, et certains aspects de son danger pourraient être liés à ce métabolite (EC 2002).
3‑Phénylpropan‑1‑ol (no CAS 122‑97‑4)
Des données limitées sur les effets du 3‑phénylpropan‑1‑ol sur la santé ont été trouvées. Dans une étude de toxicité combinée pour la reproduction et le développement avec doses répétées, des rats mâles et femelles ont reçu 0, 100, 300 ou 1 000 mg/kg p.c./j de 3‑phénylpropan‑1‑ol par gavage (dans de l’huile de maïs) 14 jours avant l’accouplement, pendant l’accouplement (mâles et femelles) et la gestation, et jusqu’au 13e jour de lactation. Aucun signe clinique de toxicité maternelle ou de modification macroscopique ou histopathologique lié au composé n’a été observé dans aucun des groupes traités. La dose maximale d’essai de 1 000 mg/kg p.c./j a été considérée comme une DSENO pour la toxicité maternelle systémique. Une augmentation du nombre de petits morts ou cannibalisés et une diminution de la prise de poids corporel chez les petits F1 (issus de mères ayant reçu 1 000 mg/kg p.c./j) ont été observées 4 jours après la mise bas (94 %) et 13 jours après la mise bas (92 %). L’augmentation du nombre de petits morts était due à la perte d’une portée entière de 20 petits; les autres portées n’ont pas été touchées. Les auteurs ont présenté une DSENO de 300 mg/kg p.c./j pour les effets sur la reproduction et le développement (ECHA 2017).
L’exposition au 3‑phénylpropan‑1‑ol n’est pas connue pour provoquer des effets nocifs chez les volontaires humains après une exposition cutanée jusqu’à une concentration de 8 % pendant 48 heures (RIFM 1976b).
Le 3‑phénylpropan‑1‑ol ne s’est pas avéré mutagène sur les souches testées (RIFM 2002).
8.6.3 Caractérisation du risque pour la santé humaine
Résorcinol
Il a été déterminé que l’exposition cutanée au résorcinol due à l’utilisation de teinture pour les cheveux donnait lieu à une exposition systémique de 0,031 mg/kg p.c./j. Par rapport à la DSENO de 233 mg/kg p.c./j (dose maximale d’essai) établie dans une étude de toxicité pour la reproduction et le développement sur deux générations chez le rat, cette exposition donne une ME de 7 500. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Alcool benzylique
Exposition orale
La dose journalière maximale autorisée d’alcool benzylique dans les pastilles pour la gorge en tant qu’ingrédient non médicinal est de 100 mg/j. La dose journalière totale d’alcool benzylique contenu dans les pastilles en vente dans le commerce est de 78 mg/j. Cela se traduit par une exposition de 1,1 mg/kg p.c./j chez les adultes et de 1,3 mg/kg p.c./j chez les adolescents. Une étude par gavage avec doses répétées de 13 semaines sur des rats a donné une DSENO de 400 mg/kg p.c./j pour la neurotoxicité. On obtient ainsi une ME de 307 pour l’exposition orale à l’alcool benzylique contenu dans les pastilles chez les adolescents. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Le JECFA a estimé l’absorption par personne d’alcool benzylique en tant qu’agent aromatisant alimentaire à 290 μg/kg p.c./j. Par rapport à la DSENO de 400 mg/kg p.c./j pour la neurotoxicité, d’après une étude par gavage avec doses répétées sur 13 semaines, on obtient une ME de 1 380. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé. L’exposition estimée est également inférieure à la limite supérieure de la dose journalière admissible (DJA) de 5 mg/kg p.c./j établie par le JECFA pour l’acide benzoïque, les sels de benzoate, le benzaldéhyde, l’acétate de benzyle et l’alcool benzylique, exprimée en équivalents d’acide benzoïque (JECFA 2002). Par conséquent, le risque pour la population générale âgée de 1 an et plus en raison d’une exposition orale à l’alcool benzylique dans les agents aromatisants alimentaires, y compris son utilisation comme solvant vecteur (additif alimentaire) dans les préparations aromatisantes, est considéré comme faible.
L’exposition orale à d’autres produits dans la catégorie des PSN et des médicaments en vente libre, y compris les baumes à lèvres, les rince‑bouche et la pâte dentifrice, est comprise entre 0,010 mg/kg p.c./j et 0,86 mg/kg p.c./j. L’utilisation de la DSENO de 400 mg/kg p.c./j pour la neurotoxicité donne des ME de 40 000, 985 et 465 pour l’exposition aux baumes à lèvres, à la pâte dentifrice et aux rince‑bouche, respectivement. Ces ME sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Exposition cutanée
En utilisant les plages estimées d’absorption cutanée de 50 %, l’exposition systémique à l’alcool benzylique résultant de l’utilisation d’un écran solaire (à 1,74 %) a été calculée comme étant de 1,4 mg/kg p.c./j pour les adultes et de 1,7 mg/kg p.c./j pour les nourrissons de 2 à 3 ans. L’utilisation de la DSENO de 400 mg/kg p.c./j pour les effets neurotoxiques, d’après une étude de toxicité orale de 13 semaines chez des rats, donne des ME de 285 pour les adultes et de 235 pour les nourrissons. En raison de la gravité et de la nature non réversible des effets, du manque de données sur la neurotoxicité chronique et de la possibilité d’une exposition à long terme aux écrans solaires, ces ME sont jugées potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
L’exposition systémique à l’alcool benzylique résultant de l’utilisation d’un nettoyant facial chez les enfants, les adolescents et les adultes allait de 0,015 mg/kg p.c./j à 0,029 mg/kg p.c./j. L’utilisation de la DSENO de 400 mg/kg p.c./j donne des ME comprises entre 14 000 et 27 000, qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
L’exposition systémique à l’alcool benzylique due à l’utilisation de cosmétiques pour différents groupes d’âge, dont les valeurs sont présentées dans le Tableau 8‑11, est comparée à la DSENO de 400 mg/kg p.c./j pour donner les ME présentées dans le tableau B‑17 (annexe B). Les ME pour diverses catégories de produits (crème/hydratant pour le corps, désodorisant/antisudorifique, crème faciale) sont présentées dans le Tableau 8‑12 et ne sont pas jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
| Produit | Groupe d’âge | ME |
|---|---|---|
| Crème/hydratant pour le corps | 0–5 mois à 19+ ans | 2,5 à 5,9 |
| Désodorisant/antisudorifique | 9–13 ans à 19+ ans | 240 à 400 |
| Crème faciale | 9–13 ans à 19+ ans | 197 à 330 |
L’utilisation de l’alcool benzylique dans les nettoyants de surface tout‑usage donne lieu à une exposition de 0,11 mg/kg p.c./j. La DSENO de 400 mg/kg p.c./j donne une ME de 3 600. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Exposition par inhalation
L’exposition par inhalation à l’alcool benzylique due à l’utilisation d’un nettoyant tout‑usage a été estimée à 3,8 μg/kg p.c./j le jour de l’exposition. En utilisant la DSENO de 400 mg/kg p.c./j pour les effets neurotoxiques, d’après une étude de toxicité orale de 13 semaines chez des rats, on obtient une ME de 10 500. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
L’exposition par inhalation à l’alcool benzylique due à l’utilisation d’un assainisseur d’air liquide a été estimée à 0,66 μg/kg p.c./j le jour de l’exposition. En utilisant la DSENO de 400 mg/kg p.c./j pour les effets neurotoxiques, d’après une étude de toxicité par voie orale de 13 semaines chez des rats, on obtient une ME de 600 000. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
L’exposition par inhalation à l’alcool benzylique due à l’application d’un revêtement protecteur époxyde a été estimée à 2,1 mg/kg p.c./j le jour de l’exposition. En utilisant la DSENO de 400 mg/kg p.c./j pour les effets neurotoxiques, d’après une étude de toxicité orale de 13 semaines chez des rats, on obtient une ME de 190. Compte tenu de l’exposition intermittente et/ou de la durée limitée prévue, cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
3‑Phénylpropan‑1‑ol
Comme les effets jugés préoccupants sont des effets sur la reproduction et/ou le développement, la population cible est celle qui est en âge de procréer, en particulier les adultes et les adolescentes. La DSENO de 300 mg/kg p.c./j a été utilisée pour déterminer les ME dues à l’exposition de cette sous-population au 3‑phénylpropan‑1‑ol.
L’exposition systémique au 3‑phénylpropan‑1‑ol résultant de l’utilisation de crèmes pour les pieds et de lotions pour les mains contenant 10 % de ce produit par les adolescents a été estimée à 0,71 et à 1,04 mg/kg p.c./j, respectivement. En utilisant la DSENO de 300 mg/kg p.c./j, on a obtenu des ME de 420 et 290 pour l’exposition des adolescents au 3‑phénylpropan‑1‑ol résultant de l’utilisation de crèmes pour les pieds et de lotions pour les mains, respectivement. Ces ME sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Pour une teneur de 1 % de 3‑phénylpropan‑1‑ol dans un produit hydratant, les doses d’exposition systémique pour les adultes et les adolescents sont de 0,17 mg/kg p.c./j, avec une ME correspondante de 1 700. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Les risques associés à l’exposition aux produits mentionnés ci‑dessus sont considérés comme une limite supérieure pour les autres produits cosmétiques et les et PSN disponibles au Canada.
8.7 Incertitudes dans l’évaluation des risques pour la santé humaine
Il existe des incertitudes au sujet de l’absorption cutanée de l’alcool benzylique et du 3‑phénylpropan‑1‑ol. On a utilisé l’estimation prudente de 10 % pour l’absorption, qui était la valeur pour les conditions dans l’étude in vitro sans ventilation.
Il existe également une incertitude concernant la teneur en alcool benzylique et en 3‑phénylpropan‑1‑ol de certains des produits disponibles aux consommateurs. On constate une plage importante de concentrations déclarées sur les produits, et si on connaissait de façon plus précise ces concentrations, on éliminerait une certaine incertitude dans les ME. En outre, un grand nombre de produits contiennent ces substances, ce qui peut entraîner une exposition plus élevée, contribuant ainsi à l’incertitude.
9. 2‑Éthylhexan‑1‑ol
9.1 Identité de la substance
Les données concernant l’identité du 2‑éthylhexan‑1‑ol sont résumées dans le tableau 9‑1 (PubChem 2004‑ ).
| N° CAS | Nom sur la LIS (nom commun) | Formule moléculaire | Structure chimique | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 104‑76‑7 | 2‑Éthylhexan‑1‑ol | C8H18O | 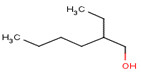 |
130,23 |
9.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques mesurées du 2‑éthylhexan‑1‑ol sont présentées dans le tableau 9‑2 (ECHA 2018b, PubChem 2004‑ ). D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Point de fusion (°C) | Point d’ébullition (°C) | Log Koe (sans dimension) | Solubilité dans l’eau (mg/L) | Pression de vapeur à 25 °C (Pa) |
|---|---|---|---|---|
| ₋89 | 184–186 | 2,9 à 25 °C | 900 à 20 °C | 93 à 20 °C |
Cette substance devrait se volatiliser depuis les surfaces d’eau.
9.3 Sources et utilisations
Le 2‑éthylhexan‑1‑ol est présent à l’état naturel dans le maïs, l’huile d’olive, le thé, le riz, le tamarin, les raisins, les bleuets et d’autres aliments.
Aucune quantité fabriquée de 2-éthylhexan-1-ol au Canada en 2011 n’a été déclarée en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Des importations totalisant 33 000 000 kg ont été déclarées dans cette enquête Note de bas de page 4 .
En réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), les utilisations suivantes ont été déclarées : comme agent de finition, carburant et additif pour carburant, lubrifiant et graisse, matériau de construction, solvant, adhésif, agent d’étanchéité et agent de nettoyage, et pour l’extraction du pétrole et du gaz. Cette substance est surtout utilisée dans des applications industrielles, principalement comme émollient et plastifiant.
Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le 2‑éthylhexan‑1‑ol ne se trouve dans aucun produit cosmétique au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 27 octobre 2016; sans référence). Il ne figure pas sur la Liste critique des ingrédients cosmétiques (Santé Canada 2018).
Comme le montre le tableau 9‑3, le 2‑éthylhexan‑1‑ol peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire au Canada et présente un potentiel de contact direct et d’exposition par les aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, décembre 2016). On sait qu’il est utilisé ailleurs dans le monde comme agent aromatisant alimentaire. Par conséquent, il est possible que cette substance soit présente comme agent aromatisant alimentaire dans les aliments vendus au Canada.
Cette substance est répertoriée dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), jouant un rôle non médicinal pour usage oral uniquement comme exhausteur de goût, avec une dose journalière admissible de 0,5 mg/kg p.c./j selon le JECFA (1997).
| Matériaux d’emballage alimentaire | Additifs accidentels b | Additifs alimentaires | Agents aromatisants alimentaires | Risque d’exposition |
|---|---|---|---|---|
| Oui (dans le plastifiant d’un film en PVC) | Non | Non | Oui | Oui |
a Communication personnelle de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, de Santé Canada, décembre 2016.
b Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments qui peuvent se retrouver de manière fortuite dans les aliments sous forme de résidus.
Les produits disponibles aux consommateurs qui contiennent cette substance sont indiqués dans le tableau 9‑4 et sont tous dans la catégorie des produits d’entretien automobile.
| Catégorie de produit | Type de produit | Poids en % dans le produit |
|---|---|---|
| Entretien automobile | Nettoyant pour moteurs; améliorateur de carburant | 1–10 |
a FDS 2008, 2011, 2014d, 2014e, 2015d.
Le 2‑éthylhexan‑1‑ol est également présent dans des produits antiparasitaires (ARLA 2010), comme produit de formulation.
9.4 Devenir et comportement dans l’environnement
9.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), le 2‑éthylhexan‑1‑ol ne devrait pas persister dans l’air, l’eau, les sédiments ou le sol (ECCC 2016b).
9.4.2 Potentiel de bioaccumulation
Compte tenu de sa faible valeur log Koe et de son faible facteur de bioconcentration (ECCC 2016b), le 2‑éthylhexan‑1‑ol ne devrait pas subir de bioaccumulation considérable dans les organismes.
9.5 Effets nocifs potentiels sur l’environnement
9.5.1 Caractérisation du risque écologique
Le risque écologique du 2‑éthylhexan‑1‑ol a été caractérisé selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour développer le profil du 2‑éthylhexan‑1‑ol, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Le 2‑éthylhexan‑1‑ol a été classé comme substance présentant un faible risque pour l’environnement, compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE. Il est donc peu probable que cette substance soulève des préoccupations à l’égard de l’environnement au Canada.
9.6 Effets nocifs potentiels sur la santé humaine
9.6.1 Évaluation de l’exposition
9.6.1.1 Milieux naturels et aliments
L’exposition à cette substance par les milieux naturels et les aliments devrait être limitée et être inférieure à celle qui est due à l’utilisation de certains produits disponibles aux consommateurs.
9.6.1.2 Exposition par les produits disponibles aux consommateurs
Pour estimer l’exposition cutanée, on a utilisé un scénario dans lequel les personnes sont exposées à des produits pour automobile en film mince contenant du 2‑éthylhexan‑1‑ol (US EPA 2011b). On suppose que la surface du bout des doigts (6 cm2) est exposée au produit sous forme d’un film d’une épaisseur de 0,016 cm. La masse volumique des produits pour automobile est d’environ 0,9 g/cm3, un maximum de 10 % du produit étant du 2‑éthylhexan‑1‑ol. Avec une absorption cutanée de 100 %, on obtient une exposition systémique à court terme de 0,12 mg/kg p.c./j le jour de l’exposition.
9.6.2 Évaluation des effets sur la santé
Le 2‑éthylhexan‑1‑ol n’a pas fait l’objet d’un examen international ni n’a été déclaré dangereux pour la santé humaine, sur la base des classifications faites par d’autres organismes nationaux ou internationaux concernant la cancérogénicité, la génotoxicité, la toxicité pour le développement ou la toxicité pour la reproduction.
L’administration subchronique (gavage de 90 jours) de 0, 25, 125, 250 ou 500 mg/kg p.c./j de 2‑éthylhexan‑1‑ol n’a pas entraîné de toxicité à faibles doses. Cependant, l’exposition à 250 mg/kg p.c./j a provoqué une diminution de la phosphatase alcaline (PAL) et du glucose sérique chez les rats mâles et une diminution de l’alanine aminotransférase (ALT) sérique chez les rates, ainsi qu’une augmentation du poids du foie chez les deux sexes. La dose maximale (500 mg/kg p.c./j) a entraîné une diminution significative de la prise de poids corporel, de l’ALT sérique, des concentrations de glucose et de cholestérol chez les rats mâles et femelles. On a constaté une augmentation des réticulocytes, de la PAL et des concentrations de protéines et d’albumine sériques chez les deux sexes. De plus, on a constaté une augmentation du poids relatif du foie, de l’estomac ou du cerveau chez les deux sexes (BASF 1992). La DMENO de 250 mg/kg p.c./j peut être associée à la diminution de la PAL sérique.
Dans une étude de toxicité pour le développement, des rates gravides ont reçu par voie orale (gavage) une dose unique de 800 ou 1 600 mg/kg p.c./j de 2‑éthylhexan‑1‑ol non dilué le 12e jour de gestation. Les témoins n’ont pas été gavés (ils n’ont pas été traités). L’exposition à 1 600 mg/kg p.c./j de 2‑éthylhexan‑1‑ol a entraîné une augmentation significative du nombre de petits malformés présentant une hydronéphrose et des anomalies de la queue ou des membres. Cependant, aucune toxicité maternelle, aucun décès de petit, ni aucune résorption fœtale n’ont été observés (Ritter 1986, 1987). Chez la souris, l’exposition pendant le développement (gavage) à 1 525 mg/kg p.c./j de 2‑éthylhexan‑1‑ol chez des souris gravides (JG 6 à 13) a entraîné une diminution de la prise de du poids corporel des mères, une réduction du nombre de petits viables et un faible poids des petits (Hardin 1987).
Dans une autre étude de toxicité pour le développement, l’exposition cutanée (avec recouvrement) à 0, 252, 840 ou 2 520 mg/kg p.c./j de 2‑éthylhexan‑1‑ol non dilué chez des rates gravides pendant 6 heures/jour, entre les JG 6 et 15, n’a pas entraîné de mortalité à aucune des doses. Le seul effet significatif déclaré était une diminution de la prise de poids corporel chez les mères du groupe ayant reçu la dose maximale. Aucun effet sur la gestation, aucune malformation, ni aucun effet tératogène n’ont été observés, à quelque dose que ce soit (Tyl et al. 1992). De même, l’exposition par inhalation à 850 mg/m3 de 2‑éthylhexan‑1‑ol pendant toute la durée de la gestation (7 heures/jour) n’a provoqué aucune malformation fœtale (Nelson et al. 1988).
9.6.3 Caractérisation du risque pour la santé humaine
En utilisant une absorption cutanée de 100 %, on a calculé que l’exposition systémique à court terme au 2‑éthylhexan‑1‑ol due à l’utilisation de nettoyants pour moteurs était de 0,12 mg/kg p.c./j. Une étude par gavage de 90 jours sur des rats a permis de déterminer une DSENO de 125 mg/kg p.c./j pour tenir compte de la diminution des concentrations d’enzymes sériques. On a ainsi obtenu une ME de 1 025 pour cette exposition. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé humaine.
10. 1,3‑Dichloropropan‑2‑ol
10.1 Identité de la substance
Le 1,3‑dichloropropan‑2‑ol (1,3‑DCP) est un composé d’origine anthropique qui n’existe pas dans la nature. Les données concernant l’identité du 1‑3 DCP sont résumées dans le tableau 10‑1 (ChemID 2017).
Le 1,3‑DCP est une substance chimique de la vaste classe des halohydrines, qui comprend les alcools halogénés. Plus précisément, le 1,3‑DCP est un chlorohydrine de glycérol, un sous-ensemble du groupe des halohydrines dans lequel un ou deux des groupes hydroxyle du glycérol (1,2,3‑trihydroxypropane) ont été remplacés par un ou deux atomes de chlore.
| N° CAS | Nom dans la LIS (nom commun) | Formule moléculaire | Structure chimique | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 96‑23‑1 |
1,3‑Dichloropropan‑2‑ol (1,3‑DCP) |
C3H6OCl2 | 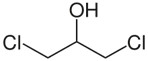 |
128,99 |
10.2 Propriétés physiques et chimiques
Les propriétés physiques et chimiques du 1,3‑DCP sont présentées dans le tableau 10‑2 (PubChem 2004‑ ). D’autres données sur les propriétés physiques et chimiques sont présentées dans ECCC 2016b.
| Propriété | Valeur |
|---|---|
| Point de fusion (°C) | ₋4 |
| Point d’ébullition (°C) | 174 |
| Masse volumique (g/cm3) | 1,39 |
| Pression de vapeur (mm Hg à 25 ºC) | 0,75 |
| Solubilité dans l’eau (g/L) | 110 |
| Log Koe (sans dimension) | 0,78 |
| pKa (sans dimension) | 12,87 ± 0,2 |
Le 1,3‑DCP est un liquide incolore ayant une odeur d’éther et une pression de vapeur relativement faible. Il est soluble dans l’eau.
10.3 Sources et utilisations
Le 1,3‑DCP n’est pas présent à l’état naturel et toutes les occurrences de cette substance sont d’origine anthropique (NTP 2005). On a déclaré un certain nombre de voies de synthèse à l’échelle industrielle et en laboratoire pour ce qui est de la production de 1,3‑DCP. Cependant, la méthode la plus courante fait appel à la réaction du chlorure d’allyle avec de l’acide hypochloreux. Le produit consiste en un mélange de 2,3‑dichloro‑2‑propanol (2,3‑DCP) et de 1,3‑DCP dans un rapport d’environ 7:3 (EPA 1984).
Dans la réaction catalysée par une base, le 2,3‑DCP et le 1,3‑DCP réagissent encore plus pour former de l’épichlorohydrine (EPA 1984). En raison de l’utilisation de l’épichlorohydrine, une contamination involontaire par le 1,3‑DCP peut se produire par dégradation thermique, par métabolisation ou par lessivage des composants des résines n’ayant pas réagi ou des produits chimiques synthétisés avec l’épichlorohydrine.
De petites quantités de 1,3‑DCP de grande pureté sont utilisées pour des applications spécialisées, notamment la détermination de l’analyte qu’est la vitamine A (NTP 2005). La population générale n’est pas exposée au 1,3‑DCP utilisé à cette fin.
Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le 1,3‑DCP a été fabriqué au Canada en quantités inférieures à 100 kg et importé au Canada en quantités d’environ 160 000 kg en 2011 (Environnement Canada 2013) Note de bas de page 4 . En 2008, on a fait état de l’utilisation de la substance par plusieurs entreprises pour fabriquer du papier et par une entreprise pour traiter l’eau (Environnement Canada 2009). Ces utilisations sont limitées à un site ou à une industrie et ne devraient pas entraîner de rejets de 1,3‑DCP dans l’environnement pendant la production de cette substance.
Le 1,3‑DCP n’est pas un ingrédient présent dans les produits disponibles aux consommateurs au Canada. Le phosphate de tris(1,3-dichloro-2-propanyle) (TDCPP), un ester 3:1 du 1,3‑DCP avec l’acide phosphorique, est produit à partir d’une réaction impliquant l’épichlorohydrine. Le TDCPP est une substance ignifuge couramment ajoutée à la mousse de polyuréthane souple utilisée dans les meubles et les coussins de canapés. Le TDCPP peut être présent dans divers produits disponibles aux consommateurs, notamment les automobiles, les meubles rembourrés, les tentes de camping, les produits pour bébés et les matériaux d’isolation de maison (ECCC, SC 2016). Le TDCPP est une substance ignifuge additive, ce qui signifie qu’il n’est pas chimiquement lié aux matériaux traités et est donc plus susceptible d’être libéré dans l’environnement pendant la durée de vie du produit. Le 1,3‑DCP a été détecté dans les émissions gazeuses lors d’essais en chambre de tapis et de coussins, ce qui indique que la dégradation du TDCPP en 1,3‑DCP peut se produire (ECCC, SC 2016).
On a également déterminé que le 1,3‑DCP résulte de la dégradation des polyélectrolytes polyamines de l’épichlorohydrine, une série de produits chimiques utilisés dans le traitement de l’eau (CIRC 2013). En Autriche, l’échantillonnage de 32 sites de cours d’eau a montré la présence de 1,3‑DCP dans l’eau, mais en concentrations inférieures à la limite de quantification. Des observations similaires ont été faites à différents endroits aux États‑Unis et au Royaume-Uni (Schuhmacher et al. 2005).
Les matériaux à base d’épichlorohydrine ont été largement utilisés dans le passé dans l’industrie des pâtes et papiers. En tant que composants de résines, ils étaient employés pour augmenter la résistance à l’état humide et pour blanchir les produits de papier, bien que l’industrie ait réalisé des efforts considérables pour réduire la concentration des chloropropanols dans leurs formulations de résines. On a trouvé du 1,3‑DCP dans les effluents, les liqueurs de blanchiment résiduaires et le lixiviat des décharges municipales (CIRC 2013).
Les protéines végétales hydrolysées (PVH) sont couramment utilisées comme agents aromatisants alimentaires ajoutés aux aliments transformés. Le processus de fabrication par hydrolyse acide, couramment utilisé pour produire des PVH, peut également synthétiser accidentellement le 1,3‑DCP (NTP 2005; Dolan et al. 2010).
Le 1,3‑DCP est fabriqué comme intermédiaire dans la production d’épichlorohydrine, qui est ensuite transformée en diverses résines époxydes. Par le passé, on a largement utilisé le 1,3‑DCP dans la production de plusieurs autres composés organiques importants pour l’industrie. La déshydratation du 1,3‑DCP avec le chlorure de phosphoryle forme le 1,3‑dichloropropène, un fumigant de sol. La chloration du 1,3‑DCP avec le pentachlorure de phosphore donne du 1,2,3‑trichloropropane, un intermédiaire industriel et un solvant. L’hydrolyse des dichlorohydrines a été utilisée dans la production de glycérol synthétique. Ces applications ont progressivement été abandonnées au profit de voies de synthèse plus sûres pour la fabrication du glycérol en raison de la toxicité du 1,3‑DCP (NTP 2005).
Le 1,3‑DCP a également été utilisé comme solvant pour les résines dures et la nitrocellulose, dans la fabrication de laques photographiques et de laque Zapon, comme colle pour le celluloïde et comme liant pour les aquarelles (Merck Index 2017). Une enquête sur les brevets et les demandes de brevet aux États‑Unis a montré que le produit chimique était utilisé comme fixateur de teinture et/ou agent anti‑décoloration. Ces applications ont également été abandonnées en raison de problèmes de toxicité (NTP 2005).
Diverses instances internationales, dont la Nouvelle-Zélande (New Zealand EPA 2010), l’Union européenne (CosIng 2016) et l’Asie du Sud‑Est (ASEAN 2018), ont toutes interdit l’utilisation du 1,3‑DCP dans les cosmétiques afin d’empêcher son emploi direct comme charge ou liant de couleur et prévenir son lessivage à partir des emballages de produit. La Liste critique des ingrédients cosmétiques n’inclut pas le 1,3‑DCP, dont la présence n’a été signalée dans aucun produit cosmétique au Canada, mais la liste contient l’épichlorohydrine, qui peut être contaminée par le 1,3‑DCP, comme ingrédient interdit (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2016; sans référence).
Il existe encore plusieurs autres utilisations spécialisées de la substance. Par exemple, on peut l’employer dans la détermination de la vitamine A, en tant qu’analyte (NTP 2005). Les utilisations spécialisées de cette substance n’ont pas été jugées pertinentes pour le présent rapport, car elles sont limitées à des milieux contrôlés et n’impliquent que de petites quantités. Une enquête sur les produits disponibles aux consommateurs au Canada n’a pas permis de trouver des produits contenant du 1,3‑DCP (Environnement Canada 2012). Des applications de cette substance au Canada ont été déclarées, y compris l’utilisation comme agent d’encollage dans la fabrication de papier et de carton qui peuvent être utilisés pour les matériaux d’emballage alimentaire n’entrant pas en contact direct avec les aliments. L’exposition serait donc négligeable (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, décembre, 2016; sans référence). Le présence de 1,3‑DCP n’a été déclarée dans aucun produit cosmétique au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 17 novembre 2016; sans référence).
Le 1,3‑DCP ne figure pas dans la BDIPSN et n’est présent dans aucun PSN autorisé au Canada (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 26 octobre 2016; sans référence).
10.4 Devenir et comportement dans l’environnement
10.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), le 1,3‑DCP devrait persister dans l’air, mais il ne devrait pas persister dans l’eau, le sol ou les sédiments.
10.4.2 Potentiel de bioaccumulation
En raison de sa faible valeur log Koe et de son faible facteur de bioconcentration (ECCC 2016b), le 1,3‑DCP ne devrait pas subir de bioaccumulation considérable dans les organismes.
10.5 Effets nocifs potentiels sur l’environnement
10.5.1 Caractérisation du risque écologique
Le risque écologique du 1,3‑DCP a été caractérisé selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil du 1,3‑DCP, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Le 1,3‑DCP a été classé comme présentant un danger modéré d’après les données examinées avec la CRE, en raison de son mode d’action réactif et des alertes structurelles d’après la boîte à outils de l’OCDE (LMC 2017), selon laquelle cette substance pourrait se lier aux protéines et à l’ADN. Cependant, le 1,3‑DCP a été classé comme substance présentant un faible risque d’exposition, et donc un faible risque global pour l’environnement. Il est donc peu probable que cette substance soulève des préoccupations à l’égard de l’environnement au Canada.
10.6 Effets nocifs potentiels sur la santé humaine
10.6.1 Évaluation de l’exposition
10.6.1.1 Milieux naturels et aliments
Il ne devrait pas y avoir d’exposition au 1,3‑DCP ajouté directement aux produits disponibles aux consommateurs. L’exposition à cette substance par les divers milieux naturels devrait résulter de la formation accidentelle ou de la dégradation, du lessivage ou de l’évaporation de sous‑produits de substances contenant de l’épichlorohydrine ou dérivées de celle‑ci.
Les polyélectrolytes polyamines de l’épichlorohydrine sont utilisés pour le traitement chimique de l’eau potable. Ce sont des promoteurs de coagulation et de floculation dont la dégradation a été associée à la formation de contaminants du dichloropropanol (NTP 2005). Entre 1991 et 1999, NSF International a relevé neuf cas pour lesquels la concentration de 1,3‑DCP et de 1,2‑DCP dépassait la limite admissible à l’époque, soit 9 ppb, dans des produits testés selon la norme NSF/ANSI 60 (NSF 2000). L’exigence (c.‑à‑d. le niveau admissible) qui figure dans la norme NSF/ANSI/CAN 60 est actuellement de 4 μg/L pour le total du 1,3‑DCP et du 2,3‑DCP (NSF 2017). Étant donné l’adoption généralisée des normes NSF/ANSI/CAN 60 et NSF/ANSI/CAN 61 par les systèmes de traitement de l’eau au Canada (NSF 2018), l’exposition au 1,3‑DCP par l’eau potable devrait être faible et bien en deçà des limites acceptables lorsque l’eau potable est traitée à l’épichlorohydrine.
Une contamination additionnelle de l’eau peut être due à l’industrie des pâtes et papiers (NTP 2005). Ce procédé a toujours utilisé des résines à base d’épichlorohydrine pour renforcer et blanchir les produits de papier. L’industrie s’est délibérément efforcée de réduire au minimum l’utilisation de chloropropanol dans ses activités de production. Cependant, diverses études ont révélé la présence de 1,3‑DCP dans les effluents et les liqueurs de blanchiment épuisées et les liqueurs noires des papeteries (CIRC 2013).
La principale exposition de la population générale au 1,3‑DCP est probablement attribuable aux aliments. Bien que le 1,3‑DCP puisse être utilisé comme composant dans la fabrication de produits de papier utilisés dans les matériaux d’emballage alimentaire, le risque d’exposition par cette source, s’il existe, a été jugé négligeable. Le 1,3‑DCP est un contaminant alimentaire qui peut se former au cours de la transformation de différentes denrées alimentaires. Santé Canada n’a pas établi de concentration maximale pour le 1,3‑DCP, mais en a établi une de 1 mg/kg pour le 3‑monochloropropane‑1,2‑diol (3‑MCPD) dans les sauces de style asiatique, comme les sauces de soja, les sauces aux huîtres et les sauces aux champignons. Il est inclus dans la Liste des concentrations maximales établies à l’égard de divers contaminants chimiques dans les aliments. Comme le 1,3‑DCP est généralement présent avec le 3‑MCPD, qui est considéré comme étant le chloropropanol le plus abondant dans les aliments, on s’attendrait à ce que la concentration maximale pour le 3‑MCPD réduise également les concentrations de 1,3‑DCP dans les aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, octobre 2016; sans référence). La présence accidentelle de 1,3‑DCP dans les aliments a été le principal sujet de préoccupation sur le plan international et a donné lieu à diverses restrictions déterminant les limites admissibles de chloropropanols dans les aliments, dont un résumé figure à l’annexe D. Avant l’adoption des règlements internationaux, des concentrations variables de 1,3‑DCP, généralement inférieurs à 0,1 mg/kg de poids sec en moyenne, avaient été trouvés dans de nombreux aliments. Le 1,3‑DCP est plus abondant dans la sauce soja et les produits à base de sauce soja. Les concentrations dans certains aliments, principalement la sauce soja et les produits à base soja, atteignaient 9,84 mg/kg (JECFA 2007a; CIRC 2013).
Le 1,3‑DCP peut être formé dans certaines conditions de transformation des aliments. Les PVH sont des résidus d’acides aminés extraits de céréales et/ou graines à haute teneur en protéines et ajoutés pour bonifier les aliments (CAC 2008). Les PVH fabriqués par hydrolyse acide (par opposition aux PVH produits par voie enzymatique) peuvent produire du 1,3‑DCP en tant que sous‑produit contaminant. Le procédé consiste à chauffer la source de protéines en présence d’acide chlorhydrique, ce qui entraîne la chloration des lipides résiduels et la formation de chloropropanols à partir du glycérol du triglycéride présent dans le grain (CAC 2008).
Des PVH acides sont couramment ajoutés aux aliments transformés, transférant ainsi involontairement du 1,3‑DCP dans le produit. On a constaté que les sauces soja et les produits à base de soja en particulier contiennent des concentrations élevées de 1,3‑DCP (NTP 2005, Kim et al. 2015).
Le 1,3‑DCP a également été trouvé dans des viandes séchées, mais on suppose qu’il a été formé par réaction du chlorure de sodium avec des graisses ou qu’il a migré dans l’aliment à partir des résines utilisées dans les boyaux de saucisse (NTP 2005).
Les concentrations de 1,3‑DCP trouvées dans les aliments (CIRC 2013), avant l’intervention des instances américaines, européennes et océaniques pour réduire sa présence, sont résumés dans le tableau 10‑3.
| Type de produit | LQ (mg/kg) | Nombre de produits échantillonnés | Produits avec une concentration < LQ | Concentration moyenne a (mg/kg) | Concentration maximale (mg/kg) |
|---|---|---|---|---|---|
| Sauce soja et produits à base de sauce soja | 0,002 – 0,15 | 484 | 371 | 0,110 | 9,84 |
| Viande et produits carnés | 0,005 | 99 | 51 | 0,019 | 0,11 |
| Poisson et fruits de mer | 0,005 | 29 | 26 | 0,0025 | 0,024 |
| Ingrédients alimentaires (y compris les PVH et les extraits de malt) | 0,010 | 56 | 13 | 0,008 | 0,070 |
a On présume que les produits dont la concentration est inférieure à la limite de détection (LD) ou à la limite de quantification (LQ) se situent à la moitié de ces limites, et la moyenne a été pondérée en fonction du nombre d’échantillons par pays.
Sur la base des renseignements fournis au JECFA, on a calculé l’ingestion de 1,3‑DCP par les aliments dans 10 pays (Australie, Danemark, Finlande, France, Allemagne, Irlande, Pays-Bas, Suède, Thaïlande et Royaume‑Uni) (JECFA 2007a). Les valeurs maximales d’exposition ont été trouvées en Australie et au Royaume-Uni, et l’exposition était maximale chez les enfants. Les produits carnés étaient le principal contributeur à l’ingestion dans toutes les estimations nationales, allant de 45 % à 99 % selon le régime alimentaire du pays. La sauce soja et les produits à base de sauce soja contribuaient jusqu’à 30 % dans toutes les estimations nationales, et les autres groupes alimentaires contribuaient jusqu’à 10 % de l’ingestion totale. Le JECFA a également réalisé une évaluation approfondie en utilisant les données de consommation alimentaire pour différents groupes alimentaires. On a déterminé que l’ingestion moyenne globale par toutes les sources était compris entre 0,008 μg/kg p.c./j et 0,090 μg/kg p.c./j (pour un poids corporel de 60 kg). Les produits carnés étaient également le principal contributeur à l’ingestion dans la plupart des groupes alimentaires, allant de 54 % à 72 %. La sauce soja et les produits à base de soja contribuaient à plus de 10 % de l’ingestion totale. Dans tous les groupes d’âge, les valeur d’exposition des consommateurs au 95e centile allaient de 0,025 μg/kg p.c./j à 0,136 μg/kg p.c./j, avec une exposition moyenne de 0,051 μg/kg p.c./j. Le JECFA note que l’évaluation de l’exposition « est susceptible d’entraîner une surestimation de l’exposition alimentaire, mais elle représente le scénario le plus défavorable » (JECFA 2007a).
10.6.1.2 Exposition par les produits disponibles aux consommateurs
Exposition par les retardateurs de flamme
L’exposition au 1,3‑DCP par inhalation et par voie cutanée a été estimée. La population générale peut subir une exposition supplémentaire au 1,3‑DCP lors de la dégradation du retardateur de flamme TDCPP, un ester 3:1 du 1,3‑DCP et de l’acide phosphorique (NTP 2005; ECCC, SC 2016).
Selon les données trouvées dans la littérature, le TDCPP ne s’hydrolyse pas facilement à des pH compris entre 6 et 9 et à des températures comprises entre 2 °C et 25 °C pour donner du 1,3‑DCP. En outre, l’UE cite une étude qui montre que parmi les métabolites du TDCPP présent dans l’urine des rats, on n’a trouvé aucune trace de 1,3‑DCP. Le TDCPP est considéré comme étant complètement métabolisé en CO2 (EC 2008). Les métabolites du TDCPP générés par la fraction microsomale de l’homogénat de foie comprenaient jusqu’à 6 % de 1,3‑DCP. Cependant, cette fraction a continué à diminuer lorsque la concentration du cofacteur nicotinamide adénine dinucléotide phosphate dans la solution a augmenté, ce qui indique que le 1,3‑DCP est probablement métabolisé davantage (EC 2008).
Plusieurs études sur les voies de dégradation du TDCPP indiquent qu’on a détecté le 1,3‑DCP de manière quantitative (dans les émissions de COV provenant de coussinages pour tapis) ou qualitative (0,01 mg/m3 à 0,1 mg/m3 provenant de sous-couches de tapis) dans les émissions mesurées dans des tests en chambre (NTP 2005).
L’exposition au TDCPP par les milieux naturels et les aliments a été estimée à 0,35 μg/kg p.c./j pour les nourrissons (ECCC, SC 2016). En utilisant une hypothèse prudente de dégradation métabolique de 10 % du TDCPP en 1,3‑DCP, basée sur l’étude du métabolite du foie chez le rat, on a calculé une exposition systémique maximale de 0,0314 μg/kg p.c./j par cette source.
L’évaluation du TDCPP a estimé l’exposition cutanée maximale quotidienne par contact avec des matelas à 1,9 μg/kg p.c./j pour les nourrissons de 0 à 0,5 an (ECCC, SC 2016). En utilisant l’hypothèse prudente d’une adsorption cutanée de 100 % de TDCPP et d’une dégradation de 10 % en 1,3‑DCP, d’après l’étude des métabolites du foie chez le rat, on a calculé une exposition systémique maximale de 0,19 μg/kg p.c./j de 1,3‑DCP par cette source.
Dans l’évaluation du TDCPP, la dose journalière moyenne pour la durée de la vie (DJMDV) pour le TDCPP a été calculée à 0,59 μg/kg p.c./j. L’utilisation du taux de dégradation métabolique de 10 % donne une exposition de la population générale au 1,3‑DCP de 0,059 μg/kg p.c./j.
10.6.2 Évaluation des effets sur la santé
Le 1,3‑DCP a fait l’objet d’un examen international (JECFA 2007, 2006; NTP 2005). La cancérogénicité a été considérée comme l’effet critique du 1,3‑DCP. Le CIRC a classé le 1,3‑DCP comme cancérogène du groupe 2B (CIRC 2013).
Dans une étude de cancérogénicité, des rats ont reçu du 1,3‑DCP dans l’eau potable à raison de 0, 2,1, 6,3 ou 19 mg/kg p.c./j chez les mâles et de 0, 3,4, 9,6 ou 30 mg/kg p.c./j chez les femelles, pendant 104 semaines. Les auteurs ont rapporté une augmentation liée à la dose du développement de carcinomes/adénomes hépatocellulaires, d’adénomes des tubules rénaux, d’adénomes ou de carcinomes de la langue et de carcinomes des cellules folliculaires de la thyroïde chez les deux sexes aux deux doses maximales d’essai (RCC 1986; Williams et al. 2010). Le JECFA a jugé que l’étude de RCC (1986) était critique et a calculé la plage des valeurs de la limite inférieure de l’intervalle de confiance de la dose-repère à 95 % (LICDR10) comme étant de 7,2 à 19,1 mg/kg p.c./j chez les rats mâles et de 3,3 mg/kg p.c./j à 7,7 mg/kg p.c./j chez les rates d’après l’occurrence des tumeurs (JECFA 2007a).
Le CIRC a également considéré que l’étude de RCC (1986) était importante et a conclu que le 1,3‑DCP peut être cancérogène pour l’humain, d’après les preuves suffisantes de cancer chez les animaux de laboratoire (CIRC 2013). Le JECFA (2002) a reconnu ces résultats et, en outre, a fait état d’une étude de toxicité subchronique (13 semaines) dans laquelle des rats mâles et femelles avaient reçu 0, 0,1, 1, 10 ou 100 mg/kg p.c./j de 1,3‑DCP dans de l’eau distillée (5 jours/semaine) par gavage. Dans cette étude, les auteurs ont observé une diminution du poids corporel, l’altération des paramètres biochimiques et des modifications histopathologiques dans le foie, les reins et l’estomac (Jersey et al. 1991). Le potentiel génotoxique du 1,3‑DCP n’est pas clair in vivo, mais des études réalisées in vitro ont démontré que le 1,3‑DCP peut interagir avec des chromosomes et influer sur la réparation de l’ADN. Par conséquent, on peut s’attendre à ce que cette substance soit génotoxique in vivo (JECFA 2002).
Aucune donnée sur la cancérogénicité n’était disponible pour les humains (CIRC 2013). La liste consolidée des substances cancérogènes, mutagènes ou toxiques pour la reproduction de la Commission européenne inclut le 1,3‑DCP dans la catégorie 2 des substances cancérogènes (EC 2002).
Le Committee on Carcinogenicity of Chemicals in Food du ministère de la Santé du Royaume-Uni a établi une DSENO de 1 mg/kg p.c./j basée sur une augmentation du poids du foie et des reins après une exposition subchronique (13 semaines; 5 jours/semaine, par gavage dans de l’eau distillée) après une exposition à 0,1, 1, 10 ou 100 mg/kg p.c./j de 1,3‑DCP chez des rats mâles et femelles. Cependant, les modifications histopathologiques dans le foie, l’estomac et les reins n’ont été observées que chez les rats mâles (Jersey et al. 1991, cité dans NTP 2005; Katoh et al. 1998). Dans une autre étude de toxicité subchronique, l’exposition par inhalation à 26, 105 ou 422 mg/m3 de 1,3‑DCP a causé des modifications des paramètres hématologiques et une augmentation du poids du foie et des reins dans les groupes ayant reçu la dose maximale. La DSENO et la DMENO ont été établies à < 26 mg/m3 et 26 mg/m3, respectivement (Kim et al. 2007).
10.6.3 Caractérisation du risque pour la santé humaine
L’Organisation mondiale de la santé (OMS) a utilisé des modèles dose-réponse et a estimé la dose-repère (DR10) et la LICDR10 pour une réponse de 10 % au‑dessus du bruit de fond pour l’occurrence des tumeurs. Ces valeurs étaient comprises entre 5,4 et 7,5 mg/kg p.c./j et entre 3,3 et 6,1 mg/kg p.c./j, respectivement, chez les rats mâles, et entre 7,6 et 10,3 mg/kg p.c./j et entre 6,6 et 7,7 mg/kg p.c./j, respectivement, chez les rates (JECFA 2007a,b).
Cancer
La comparaison de la plus faible valeur LICDR10 de 3,3 mg/kg p.c./j rapportée d’après les données sur l’occurrence de tumeurs chez les animaux, avec les valeurs moyenne et extrême de l’exposition alimentaire au 95e centile du JECFA de 0,051 μg/kg p.c./j et de 0,136 μg/kg p.c./j (JECFA 2007a) donne des ME orales d’environ 65 000 et 24 000, respectivement. La concentration requise par la norme 60 de la NSF/ANSI pour le 1,3‑DCP dans l’eau potable, soit 4 μg/L avec un taux de consommation de 2 L/j, donne une ME de 30 000. Ces ME sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé humaine.
Une hypothèse très prudente de la dose journalière moyenne pour la durée de la vie (DJMDV) pour l’exposition au 1,3‑DCP due à la décomposition du retardateur de flamme TDCPP donne une exposition estimée de la population générale de 0,059 μg/kg p.c./j. Comparée à la LICDR10 de 3,3 mg/kg p.c./j, cette valeur donne une ME pour cette voie d’exposition de 56 000. La ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé humaine.
Effets autres que le cancer
En utilisant la DSENO de 1 mg/kg p.c./j pour l’effet autre que le cancer qu’est l’augmentation du poids des reins et du foie, l’exposition orale de 0,136 μg/kg p.c./j par la consommation d’aliments estimée par le JECFA (JECFA 2007a) donne une ME de 7 300. Cette ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé humaine.
Si l’on considère l’exposition combinée par les aliments et par les milieux naturels au 1,3‑DCP, issu de la dégradation métabolique du TDCPP, on obtient une exposition totale de 0,136 + 0,03 = 0,166 μg/kg p.c./j. On obtient ainsi une ME de 6 000, qui est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé. En considérant l’exposition cutanée due à la dégradation métabolique du TDCPP dans les matelas, l’exposition systémique totale devient 0,19 μg/kg p.c./j. On obtient ainsi une ME de 5 300, qui est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Bien que l’exposition de la population générale au 1,3‑DCP ne soit pas préoccupante aux concentrations actuelles, on estime que cette substance a un effet préoccupant sur la santé en raison de sa désignation de cancérogène potentiel du groupe 2B par le CIRC. Par conséquent, l’exposition pourrait devenir préoccupante pour la santé humaine si elle devait augmenter. Des options sont envisagées afin d’assurer la surveillance des changements éventuels dans l’exposition au 1,3‑DCP.
10.7 Incertitudes dans l’évaluation des risques pour la santé humaine
Il existe une incertitude quant à la quantité quotidienne d’aliments consommés qui contiennent du 1,3‑DCP résiduel. Les valeurs de l’exposition au 1,3‑DCP par différents groupes d’aliments utilisées dans cette évaluation ont été déterminées par le JECFA à partir d’une enquête menée dans un nombre limité de pays.
11. Alcool allylique
11.1 Identité de la substance
Les données concernant l’identité de l’alcool allylique sont résumées dans le tableau 11‑1 (PubChem 2004‑ ).
| N° CAS | Nom sur la LIS (nom commun) | Formule moléculaire | Structure chimique | Masse moléculaire (g/mol) |
|---|---|---|---|---|
| 107‑18‑6 | Alcool allylique | C3H6O C4H10S | 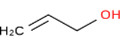 |
58,08 |
11.2 Propriétés physiques et chimiques
Les valeurs mesurées des propriétés physiques et chimiques de l’alcool allylique sont présentées dans le tableau 11‑2 (ChemIDplus 2017). D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Point de fusion (°C) | Point d’ébullition (°C) | Log Koe (sans dimension) | Solubilité dans l’eau (mg/L) | Pression de vapeur (mm Hg) |
|---|---|---|---|---|
| ₋129 | 97 | 0,17 | 6,32 × 104 | 26,1 |
11.3 Sources et utilisations
L’alcool allylique est un produit chimique important sur le plan industriel et il est fabriqué dans le monde entier. Selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, la substance n’a pas été fabriquée au Canada en 2011, mais 7 700 kg ont été importés au Canada cette année‑là (Environnement Canada 2013) Note de bas de page 4 .
L’alcool allylique est utilisé au Canada dans les peintures et les revêtements industriels à diverses fins : comme réactif de copolymères, inhibiteur de corrosion, produit de contrôle des dépôts, substance de laboratoire, matière première pour la fabrication en haute technologie (Environnement Canada 2013). La fabrication anthropique de l’alcool allylique se fait par l’hydrolyse du chlorure d’allyle. On le trouve également à l’état naturel dans la chair de crabe, les moules pourries et dans l’ail écrasé, sous forme de composant volatil. Dans l’ail, l’alcool allylique est un produit métabolique formé lors de la trituration des gousses d’ail (Lemar 2005). L’alcool allylique est également formé dans l’organisme par l’hydrolyse des esters allyliques utilisés comme agents aromatisants alimentaires (OCDE 2004e).
L’alcool allylique peut être utilisé comme composant dans la fabrication de matériaux d’emballage alimentaire en papier et en carton, on peut y être exposé et les aliments pourraient y être en contact direct (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de la gestion du risque, Santé Canada, octobre 2016; sans référence). L’alcool allylique n’est pas utilisé dans les cosmétiques au Canada (communication personnelle, courriel de la Direction de la sécurité des produits disponibles aux consommateurs et des produits dangereux, Santé Canada, au Bureau de la gestion du risque, Santé Canada, octobre 2016; sans référence). L’alcool allylique ne figure pas dans la BDIPSN ni dans aucun PSN homologué au Canada (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau de la gestion du risque, Santé Canada, 26 octobre 2016; sans référence).
11.4 Devenir et comportement dans l’environnement
11.4.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), l’alcool allylique ne devrait pas persister dans l’air, l’eau, le sol ou les sédiments.
11.4.2 Potentiel de bioaccumulation
Compte tenu de sa faible valeur log Koe et de son faible facteur de bioconcentration (ECCC 2016b), l’alcool allylique ne devrait pas subir de bioaccumulation considérable dans les organismes.
11.5 Effets nocifs potentiels sur l’environnement
11.5.1 Caractérisation du risque écologique
Les risques écologiques de l’alcool allylique ont été caractérisés selon l’approche CRE. Cette approche est résumée à l’annexe A, et les résultats de son application sont présentés dans ECCC (2016a).
Les considérations et données critiques utilisées pour élaborer le profil de l’alcool allylique, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, l’alcool allylique a été classé comme substance présentant un faible risque écologique. Il est donc peu probable que cette substance soulève des préoccupations à l’égard de l’environnement au Canada.
11.6 Effets nocifs potentiels sur la santé humaine
11.6.1 Évaluation de l’exposition
Aucun produit de consommation ne contient de l’alcool allylique. Pour cette raison, l’exposition directe n’a pas été prise en compte.
11.6.1.1 Milieux naturels et aliments
La principale utilisation industrielle de l’alcool allylique est comme copolymère réactif dans les peintures et les revêtements. La majeure partie de cette substance devrait réagir pour former les polymères résultants. Il pourrait y avoir un rejet limité dans l’environnement en raison de ses utilisations industrielles.
Il est possible que l’alcool allylique soit présent dans l’eau et dans l’air en quantités limitées. D’après les résultats calculés selon un modèle de fugacité de niveau III, l’alcool allylique devrait se répartir principalement dans l’air (67,6 %) et l’eau (25,1 %), et le reste dans le sol (7,3 %) (OCDE 2005b). Il a été démontré qu’il se biodégrade rapidement dans des essais de biodégradation en milieu aqueux aérobie, et ne devrait donc pas persister dans les environnements aquatiques. Cette substance ne devrait pas non plus rester dans les sols de surface en raison de son évaporation rapide dans l’air. Tout rejet d’alcool allylique dans l’atmosphère par divers flux d’utilisation entraînera sa dégradation en phase vapeur par réaction avec des radicaux hydroxyles produits par voie photochimique (demi‑vie de 15 heures) (Atkinson et al. 1989), par réaction avec l’ozone (demi‑vie de 19 heures) (Atkinson et Carter 1984) ou par des radicaux nitrate (demi‑vie de 31 heures) pendant la nuit (Atkinson 2000). Par conséquent, on ne s’attend pas à ce que cette voie d’exposition soit importante pour la population générale.
Cela est confirmé par une étude réalisée par le ministère japonais de l’Environnement en 2004, qui a révélé que l’exposition humaine totale moyenne à l’alcool allylique par l’air ambiant, l’eau de puits et l’eau des services publics était inférieure à la limite de détection minimale (OCDE 2005b). À partir de cette étude, l’OCDE a déterminé que l’exposition totale par voie orale par l’eau de puits ou l’eau des services publics était de 0,012 μg/kg p.c./j, et que l’exposition totale par inhalation par l’air ambiant était estimée à 0,015 μg/kg p.c./j.
L’alcool allylique est présent naturellement dans certains aliments, à savoir le crabe, les moules pourries et l’ail (OCDE 2005b). L’alcool allylique a été détecté à des concentrations de 0,3 μg/kg de poids sec dans les pattes et les pinces de crabe et de 0,1 μg/kg de poids sec dans la chair de crabe (Chung 1999). On l’a trouvé à des concentrations de 1 080 μg/kg de poids humide dans des moules pourries (Yasuhara 1987). La concentration en alcool allylique a été mesurée dans six échantillons de bulbes d’ail écrasés, pour une valeur médiane (moyenne) de 29,6 (43,7) mg/kg. La concentration d’alcool allylique dans l’ail dépendait de la méthode utilisée pour extraire les huiles d’ail de la phase aqueuse (Yu et al. 1989). La méthode d’extraction est importante, car l’alcool allylique est produit par l’activité enzymatique, qui peut être affectée par la méthode d’extraction. L’alcool allylique est libéré après l’ingestion d’ail (Egen‑Schwind et al. 1992) et a été détecté dans l’air expiré après l’ingestion de tous les produits à base d’ail (Laasko 1989).
L’alcool allylique peut également se former dans l’organisme par hydrolyse des esters allyliques présents comme agents aromatisants alimentaires. L’ingestion estimée d’alcool allylique par la chair de crabe et l’ail est de 18 μg/kg p.c./j en Europe et de 5,8 μg/kg p.c./j aux États‑Unis (OCDE 2005b).
On suppose que l’exposition orale à l’alcool allylique présent dans le crabe et l’ail représente la plus grande source d’exposition. Le tableau 12‑3 indique la quantité d’alcool allylique présent dans la chair de crabe et l’ail, les valeurs de consommation quotidienne moyenne pour ces aliments et les valeurs d’exposition orale quotidienne, à partir des données disponibles. Ces expositions s’appuient sur l’hypothèse prudente que les personnes consomment trois portions (75 g/portion) de crabe et quatre gousses (3 g/gousse) d’ail par jour.
| Type d’aliment | Concentration d’alcool allylique | Consommation quotidienne d’aliment | Exposition par voie orale (μg/kg p.c./j) |
|---|---|---|---|
| Chair de crabe a | 0,3 μg/kg de poids sec | 225 g | 0,001 b |
| Ail c | 29,6 mg/kg | 4 × 3 g | 5 b |
a Valeur calculée d’après le Guide alimentaire canadien (Santé Canada 2011). Le nombre recommandé de portions de « viandes et substituts » par jour pour les adultes (19 à 50 ans) est de 2 à 3 portions. L’un de ces groupes de portions est celui des « poissons, crustacés, volailles et viandes maigres, cuits », avec une portion recommandée de 75 g.
b Valeur obtenue en multipliant la quantité consommée à court terme par la concentration d’alcool allylique, puis divisée par 70 kg (poids corporel moyen d’un adulte).
c Valeur calculée pour 4 gousses d’ail par jour, nombre recommandé par le Centre médical de l’Université du Maryland en tant que supplément de santé, et limite de consommation élevée possible, compte tenu du poids moyen « humide » d’une gousse de 3 g.
11.6.2 Évaluation des effets sur la santé
Les effets de l’alcool allylique sur la santé humaine ont été examinés à l’étranger. Une évaluation toxicologique a été préparée en 2005 par l’OCDE dans le cadre de son Ensemble de données de dépistage (EDD) (Screening Information Data Set) (OCDE 2005b). Une autre évaluation a été publiée par l’Integrated Risk Information System de l’EPA (US EPA 1987). L’ECHA a publié un dossier d’homologation pour l’alcool allylique en 2016. Ces documents, ainsi que les évaluations préparées par d’autres instances, ont été utilisés pour étayer les renseignements sur les dangers présentés dans ce document.
Dans une étude de 13 semaines, l’alcool allylique a été administré par l’eau potable à raison de 0, 0,13, 0,62, 5,9, 11,6, 25,5, 41 ou 72 mg/kg p.c./j à des rats mâles et à raison de 0, 0,17, 0,94, 7,3, 13,2, 34, 43,7 ou 67,4 mg/kg p.c./j à des rates. La consommation d’eau a diminué de façon proportionnelle à la dose, ce qui indique un problème de palatabilité. Une diminution de la prise de poids corporel a été observée chez les deux sexes dans les deux groupes ayant reçu la dose maximale. Une augmentation du poids des reins chez les deux sexes ou une augmentation du poids du foie chez les rats mâles uniquement a été observée à partir de 41 mg/kg p.c./j. Les DSENO rapportées étaient de 11,6 mg/kg p.c./j pour les mâles et de 13,2 mg/kg p.c./j pour les femelles, sur la base d’une augmentation du poids des reins ou du foie, qui peut avoir été causée par une déshydratation (Dunlap et al. 1958).
Une exposition de 15 semaines à l’alcool allylique dans l’eau potable à raison de 0, 4,8, 8,3, 14 ou 48,2 mg/kg p.c./j chez les rats mâles et à raison de 0, 6,2, 6,9, 17,1 ou 58,4 mg/kg p.c./j chez les rates a entraîné une diminution de la prise de poids à 14 mg/kg p.c./j chez les mâles et à 58,4 mg/kg p.c./j chez les femelles. Une diminution de la consommation d’eau a été observée chez les animaux dans le groupe ayant reçu la dose maximale. Une augmentation du poids absolu ou relatif des reins a également été observée chez les rats mâles et femelles, en particulier à la dose maximale. La DSENO obtenue dans cette étude était de 4,8 mg/kg p.c./j chez les mâles et de 6,2 mg/kg p.c./j chez les femelles, et les auteurs ont jugé que la majeure partie de ces résultats étaient secondaires par rapport à la réduction de la consommation d’eau, en particulier, dans le groupe ayant reçu la dose maximale (OCDE 2005b; Carpanini et al. 1978).
Une exposition subchronique (12 semaines) par inhalation à l’alcool allylique chez des rats mâles à raison de 0, 2,4, 4,7, 12, 47, 95, 142, 237 ou 355 mg/m3 (7 heures/jour, 5 jours/semaine) n’a provoqué aucun signe clinique de toxicité à 47 mg/m3 ou à des doses inférieures. Cependant, les signes de toxicité ont augmenté à des doses plus élevées et comprenaient une diminution de la prise de poids corporel et une augmentation du poids des reins ou des poumons. Une CSENO de 12 mg/m3 et une CMENO de 47 mg/m3 ont été rapportées par cette étude (Dunlap et al. 1958).
Dans une étude de toxicité pour la reproduction et le développement, des rats mâles et femelles ont reçu de l’alcool allylique par gavage à raison de 0, 2, 8 ou 40 mg/kg p.c./j tout au long de l’accouplement, de la grossesse et jusqu’au jour 3 de lactation. Les animaux parents ont présenté des signes de salivation, une diminution de l’activité locomotrice, une respiration irrégulière, un larmoiement, des selles molles et une surface rugueuse du foie à la dose maximale (40 mg/kg p.c./j) chez les mâles. Chez les femelles, on a observé une atrophie du thymus et une hyperplasie des cellules lutéales de l’ovaire dans le groupe ayant reçu 40 mg/kg p.c./j. Des signes de nécrose du foie et d’hypertrophie du canal biliaire ont également été observés chez les deux sexes dans le groupe ayant reçu la dose maximale. Aucun effet indésirable n’a été observé dans les paramètres de la reproduction chez les deux sexes. Les femelles ont présenté un cycle œstral irrégulier à la dose maximale. On n’a relevé aucun effet nocif chez les descendants. La dose maximale semble être la DMENO pour ce qui est de la toxicité générale, ou de la toxicité pour la reproduction ou le développement (Allyl Alcohol Consortium 2004b; OCDE 2005b).
Dans une étude de toxicité prénatale pour le développement, l’alcool allylique a été administré par gavage à des rates gravides à raison de 0, 10, 35 ou 50 mg/kg p.c./j du 9e au 19e jours de gestation. Une toxicité maternelle significative a été observée à 35 mg/kg p.c./j et 50 mg/kg p.c./j, y compris une mortalité, la réduction de la prise de poids corporel et de la consommation d’aliments, une augmentation du poids du foie et la fréquence accrue de perte totale de la portée. Cependant, aucune augmentation du taux de malformation ou d’occurrence des variations n’a été observée. L’alcool allylique n’a pas eu d’effet sur la croissance intra‑utérine ou la survie des fœtus provenant de mères ayant survécu jusqu’à l’autopsie. Une DSENO de 10 mg/kg p.c./j a été rapportée pour la toxicité maternelle, d’après le poids du foie et une DMENO de 10 mg/kg p.c./j a été rapportée d’après une fréquence accrue de perte de portée dans le groupe ayant reçu la dose élevée (Lyondell Chemical Company 2005).
Aucune preuve claire de génotoxicité potentielle de l’alcool allylique n’a été établie, car les données sur la mutagénicité in vitro et in vivo sont équivoques. De plus, il n’y a pas de preuve manifeste de cancérogénicité chez les rats mâles, mais on a des preuves équivoques de cancérogénicité dans le foie (nodules hépatiques, carcinomes) chez des rates ayant reçu 3 200 mg d’alcool allylique dans l’eau potable pendant 106 semaines (OCDE 2005b).
11.6.3 Caractérisation du risque pour la santé humaine
L’exposition quotidienne moyenne par voie orale a été établie pour l’ail à 5 μg/kg p.c./j. L’alcool allylique présente une DMENO de 10 mg/kg p.c./j pour la toxicité pour le développement et la reproduction, principalement d’après une toxicité maternelle observée et une toxicité paternelle mineure chez les rats. Pour cette exposition, une ME de 2 000 a été calculée.
La ME est jugée adéquate pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé humaine.
11.7 Incertitudes dans l’évaluation des risques pour la santé humaine
Il subsiste une certaine incertitude concernant la source et l’utilisation de la concentration d’alcool allylique dans la chair de crabe. Des crabes vivants ont été achetés dans un commerce de fruits de mer à Hong Kong en 1996 et immédiatement cuits à la vapeur pendant 20 minutes. En raison de la nature isolée de cet échantillon, il est possible que l’alcool allylique ait été présent à une telle concentration uniquement à l’endroit précis où les crabes ont été prélevés ou à l’endroit où les crabes vivants ont été traités avant leur l’achat, ce qui aurait pu modifier leur exposition à l’alcool allylique. De plus, l’utilisation de 75 g de crabe par portion, à raison de 3 portions par jour, était une valeur prudente qui est probablement supérieure à la consommation quotidienne moyenne de crabe au Canada.
12. Conclusions
Compte tenu de toutes les données probantes présentées dans la présente ébauche d’évaluation préalable, les 21 alcools visés par la présente ébauche d’évaluation présentent un faible risque de nocivité. Il est proposé de conclure que les vingt et une substances visées par la présente évaluation ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des données contenues dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le méthanol, le butan‑1‑ol et l’alcool benzylique satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie et la santé humaines.
De plus, il est proposé de conclure que les 18 autres substances du groupe des alcools ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie et la santé humaines.
Par conséquent, il est proposé de conclure que le méthanol, le butan‑1‑ol et l’alcool benzylique satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE et que les 18 autres substances du groupe des alcools ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que le méthanol répond aux critères de persistance mais non de bioaccumulation et que le butan‑1‑ol et l’alcool benzylique ne répondent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[AENV] Alberta Environment. 2010. Soil and groundwater remediation guidelines for methanol. Edmonton (AB): Government of Alberta. (disponible en anglais seulement)
[AGDH] Australian Government Department of Health. 2017a. Inventory multi-tiered assessment and prioritisation: Human health tier II assessment for 1-hexanol. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). (disponible en anglais seulement)
[AGDH] Australian Government Department of Health. 2017b. Inventory multi-tiered assessment and prioritisation: Human health tier II assessment for 1-octanol. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). (disponible en anglais seulement)
[AGDH] Australian Government Department of Health. 2017c. Inventory multi-tiered assessment and prioritisation: Human health tier I assessment for 1-hexadecanol. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). [consulté le 1 février 20184]. (disponible en anglais seulement)
Allyl Alcohol Consortium. 2004. Preliminary reproduction toxicity screening study of allyl alcohol. Mitsubishi Chemical Safety Institute Ltd. Study No B040554, données non publiées. (disponible en anglais seulement)
Andrews LS, Clary JJ, Terrill JB, Bolte HF. 1987. Subchronic inhalation toxicity of methanol. J Toxicol Environ Health. 20:117-124. (disponible en anglais seulement)
Ardnt T, Schrofel S, Brunhilde G, Stemmerich K. 2014. Inhalation but not transdermal resorption of hand sanitizer causes positive ethyl glucuronide findings in urine. Forensic Sci Int. 237:126-130. (disponible en anglais seulement)
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2010. Liste des produits de formulation. Ottawa (ON), Santé Canada. [consulté le 5 août 2021]. (disponible en anglais seulement)
[ASEAN] ASEAN Cosmetic Directive. 2018. Annex II Part 1 – List of substances which must not form part of the composition of cosmetic products. [consulté le 14 janvier 2019]. (disponible en anglais seulement)
Atkinson R. 2000. Atmospheric chemistry of VOCs and NOx. Atmos Environ. 34(12-14):2063-2101. [consulté le 1 février 20183]. (disponible en anglais seulement)
Atkinson R, Carter WPL. 1984. Kinetics and mechanisms of the gas-phase reactions of ozone with organic compounds under atmospheric conditions. Chem Rev. 84(5): 437-70. (disponible en anglais seulement)
Atkinson R, Baulch DL, Cox RA, Hampson Jr. RF, Kerr JA, Troe J. 1989. Evaluated kinetic and photochemical data for atmospheric chemistry: Supplement III. IUPAC Subcommittee on Gas Kinetic Data Evaluation for Atmospheric Chemistry. J Phys Chem Ref Data. 18: 881-1097. (disponible en anglais seulement)
Baldwin EA, Nisperos-Carriedo MO, Baker R, Scott JW. 1991. Quantitative analysis of flavour parameters in six Florida tomato cultivars (Lycopersicon esculentum Mill). J Agric Food Chem. 39:1135-1140. (disponible en anglais seulement)
Bari A, Kindzierski WB, Wheeler AJ, Heroux M, Wallace LA. 2015. Source apportionment of indoor and outdoor volatile organic compounds at homes in Edmonton, Canada. Build Environ. 90:114-124. (disponible en anglais seulement)
BASF. 2012. GPS Safety Summary. Ludwigshafen, Germany. (disponible en anglais seulement)
BASF. 1992. Report on the study of the oncogenic potential of 2-ethylhexanol in rats after administration by gavage (aqueous emulsion) for 24 months. BASF Department of Toxicology for 2-Ethylhexanol Program Panel, Chemical Manufacturers Association, Washington, DC. (disponible en anglais seulement)
[BDPSNH] Base de données sur les produits de santé naturels homologués. 2021 [base de donnée sur Internet]. Ottawa (ON), Santé Canada. [consulté le 22 avril 2021].
Bevan, C. 2001. Monohydric alcohols C7 to C18, Aromatic and other alcohols. In: Bingham E, Cohrssen C, Powell CH, editors. Patty’s Toxicology, 5th ed., vol. 6. New York (NY): Wiley. (disponible en anglais seulement)
Bevan C, Tyler TR, Gardiner TH, Kapp RW Jr, Andrews L, Beyer BK. 1995. Two-generation reproduction toxicity study with isopropanol in rats. J Appl Toxicol. 15:117-123. (disponible en anglais seulement)
Bhatia SP, Wellington GA, Lalko CJ, Api AM. 2011. Fragrance material review on 3-phenyl-1-propanol. Food Chem Toxicol. 49:S246-S251. (disponible en anglais seulement)
Boman A, Maibach HI. 2000. Influence of evapo ration and solvent mixtures on the absorption of toluene and n-butanol in human skin in vitro. Ann Occup Hyg. 44: 125-135. (disponible en anglais seulement)
Bronaugh RL, Wester RC, Bucks D, Maibach HI, Sarason R. 1990. In vivo percutaneous absorption of fragrance ingredients in rhesus monkeys and humans. Food Chem Toxicol. 28:369-373. (disponible en anglais seulement)
Burbacher TM, Shen D, Grant K, Sheppard L, Damian D, Ellis S, Liberato N. 1999a. Reproductive and offspring developmental effects following maternal inhalation exposure to methanol in nonhuman primates Part I: methanol disposition and reproductive toxicity in adult females. Cambridge, MA: Health Effects Institute. (disponible en anglais seulement)
Burbacher TM, Grant K, Shen D, Damian D, Ellis S, Liberato N. 1999b. Reproductive and offspring developmental effects following maternal inhalation exposure to methanol in nonhuman primates Part II: developmental effects in infants exposed prenatally to methanol. Cambridge, MA: Health Effects Institute. (disponible en anglais seulement)
Burbacher TM, Shen DD, Lalovic B, Grant KS, Sheppard L, Damian D, Ellis S, Liberato N. 2004a. Chronic maternal methanol inhalation in nonhuman primates (Macaca fascicularis): exposure and toxicokinetics prior to and during pregnancy. Neurotoxicol Teratol. 26:201-221. (disponible en anglais seulement)
Burbacher TM, Grant KS, Shen DD, Sheppard L, Damian D, Ellis S, Liberato N. 2004b. Chronic maternal methanol inhalation in nonhuman primates (Macaca fascicularis): reproductive performance and birth outcome. Neurotoxicol Teratol. 26:639-650. (disponible en anglais seulement)
Cadby PA, Troy WR, Vey MGH. 2002. Consumer exposure to fragrance ingredients: providing estimates for safety evaluation. Regul Toxicol Pharmacol. 36:246-252. (disponible en anglais seulement)
Callejón RM, Morales ML, Ferreira ACS, Troncoso AM. 2008. Defining the typical aroma of sherry vinegar: sensory and chemical approach. J Agric Food Chem. 56:8086-8095. (disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada Partie III, vol. 22, no 3.
Canada. 2003. Règlement sur les produits de santé naturels. Gouvernement du Canada, Ottawa, ON. [consulté le 5 août 2021].
Canada, Ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999 : Avis concernant certaines substances de la Liste intérieure. Gazette du Canada, Partie I, vol. 146, no 48, Supplément.
Canada. 2016a. Plan de gestion des produits chimiques. Gouvernement du Canada. Ottawa. mai 2016. [accessed 15 mars 2018 Canada.
2016b. Liste des substances pour la troisième phase du plan de gestion des produits chimiques. Gouvernement du Canada. Ottawa, ON. mai 2016. [consulté le 5 août 2021].
Carpanini FM, Gaunt IF, Hardy J, Gangolli SD, Butterworth KR, Lloyd AG. 1978. Short-term toxicity of allyl alcohol in rats. Toxicology. 9: 29-45. (disponible en anglais seulement)
[CCA] Commission du Codex Alimentarius. 2008. Code d’usage pour la réduction des teneurs en 3-monochloropropane-1,2Diol (3-MCPD) lors de la production de protéines végétales hydrolysées obtenues par voie acide (PVHA) et de produits contenant ce type de protéines. Codex Alimentarius. FAO/OMS. Rome. CAC/RCP 64-2008.
[CCFAC] Codex Committee on Food Additives and Contaminants. 2001. Position paper on chloropropanols. CX/FAC 01/31. 33rd Session, The Hague, Netherlands, March 12-16, 2001. [consulté le 1 février 20183]. (disponible en anglais seulement)
[CCME] Conseil canadien des ministres de l'environnement. 2006. Protocole d'élaboration de recommandations pour la qualité des sols en fonction de l'environnement et de la santé humaine. Winnipeg (Manitoba), CCME.
[CCME] Conseil canadien des ministres de l'environnement. 2017a. Recommandations canadiennes pour la qualité des sols. Méthanol. Gatineau (QC), CCME. [consulté le 12 décembre 2021].
[CCME] Canadian Council of Ministers of the Environment. 2017b. Scientific criteria document for the development of the Canadian Soil Quality Guidelines for Methanol. [PDF] Gatineau (QC): CCME [consulté le 12 décembre 2021]. (disponible en anglais seulement)
[CERI] Canadian Energy Research Institute. 2016. Competitive analysis of Canadian petrochemical sector. Calgary (AB). (disponible en anglais seulement)
ChemIDPlus Advanced. 2017. Methanol (67-56-1). US Library of Medicine. National Institute of Health, Bethesda, MD. [consulté le 5 août 2021]. (disponible en anglais seulement)
ChemIDplus. 2017. ChemIDplus. Bethesda (MD): National Institutes of Health. [consulté le 18 mars 2017]. (disponible en anglais seulement)
Chemspider. 2017. Chemspider. London (UK): Royal Society of Chemistry. [consulté le 18 mars 2017]. (disponible en anglais seulement)
Cherian SS, Love S, Silver JA, Porter HJ, Whitelaw GL, Thoresen M. 2003. Posthemorrhagic ventricular dilation in the neonate: development and characterization of a rat model. J Neuropathol Exp Neurol. 62(3):292-303. (disponible en anglais seulement)
Chernoff N, Rogers JM. 2004. Supernumerary ribs in developmental toxicity bioassays and in human populations: incidence and biological significance. J Toxicol Environ Health B Crit Rev. 7:437-449. (disponible en anglais seulement)
Chung HY. 1999. Volatile components in crabmeats of Charybdis feriatus. J Agric Food Chem. 47(6): 2280-87. [consulté le 13 février 2018]. (disponible en anglais seulement)
[CIR] Cosmetic Ingredient Review. 2005a. Final report for the safety assessment for acetylated lanolin alcohol and related compounds. J Amer Coll Toxicol. Washington (DC). [consulté en mai 2017]. (disponible en anglais seulement)
Clark EW, Cronin E, Wilkinson DS. 1977. Lanolin with reduced sensitizing potential. A preliminary note. Contact Dermatitis. 3:69-74. (disponible en anglais seulement)
[COC] Committee on Carcinogenicity of Chemicals in Food. 2001. Consumer products and the environment, Department of Health, United Kingdom. Annual Report 2001. [consulté le 5 août 2021]. (disponible en anglais seulement)
Connelly LE, Rogers JM. 1997. Methanol causes posteriorization of cervical vertebrae in mice. Teratology. 55:138-144. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2016. List of Substances Prohibited in Cosmetics Products. European Commission. Brussels. [consulté le 14 janvier 2019]. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2018a. European Commission. Brussels. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2018b. Ingredient: Hexyl Alcohol. European Commission. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2018c. Ingredient: Ethylhexanol. European Commission. Database for information on Cosmetics substances and ingredients. [consulté le 2 février 2018]. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2018d. Ingredient: Benzyl alcohol. European Commission. Database for information on Cosmetics substances and ingredients. Regulation (EC) No 344/2013 [consulté le 7 février 2018] (disponible en anglais seulement)
[CosIng] Cosmetic Ingredient Database. 2018e. Ingredient: 1,3-benzenediol. European Commission regulation No. 1197/2013. Database for information on Cosmetics substances and ingredients. [consulté le 7 février 2018]. (disponible en anglais seulement)
Cosmetics Info. 2016. Lanolin Alcohol. Washington (DC): Personal Care Products Council. (disponible en anglais seulement)
Cruzan G. 2009. Assessment of the cancer potential of methanol. Crit Rev Toxicol. 39:347-363. (disponible en anglais seulement)
Curry P, Kramer G, Newhook R, Sitwell J, Somers D, Tracy B, Oostdam JV. 1993. Reference values for Canadian populations. Ottawa (ON): Health Canada, Environmental Health Directorate Working Group on Reference Values. (disponible en anglais seulement)
Czoli CD, Goniewicz MJ, Palumbo M, Leigh N, White CM, Hammond D. 2019. Identification of flavouring chemicals and potential toxicants in e-cigarette products in Ontario, Canada. Can J Public Health. 110: 542-550. (disponible en anglais seulement)
de Ceaurriz JG, Micillino JC, Bonnet P, Guenier JP. 1981. Sensory Irritation Caused by Various Industrial Airborne Chemicals. Toxicol Lett. 9:137-143. (disponible en anglais seulement)
Dolan LC, Matulka RA, Burdock GA. 2010. Naturally Occurring Food Toxins. Toxins (Basel). 2: 2289-2332. Dorokhov YL, Shindyapina AV, Sheshukova EV, Komarova TV. 2015. Metabolic methanol: molecular pathways and physiological roles. Physiol Rev. 95:603-644. (disponible en anglais seulement)
Duclos J, Latrasse A, Magnon F, Demaizieres D. 1971. Comparaison des produits fixes et volatils de variétés de framboises à divers stades de maturité. Annal Technol Agri. 20:1411-151.
Dumont JP, Adda J. 1978. Occurrence of Sesquiterpenes in Mountain Cheese Volatiles. J Agricult Food Chem. 26:364-367. (disponible en anglais seulement)
Duncan. 2010. Duncan Overglazes Information Guide. Fresno (CA): Duncan Enterprises. (disponible en anglais seulement)
Dunlap MK, Kodama JK, Wellington JS, Anderson HH, Hine CH. 1958. The toxicity of allyl alcohol. I. Acute and chronic toxicity. AMA Arch Ind Healt.h 18:303-311. (disponible en anglais seulement)
[EC] European Commission. 2002a. Consolidated list of C/M/R-substances (classified as category 1 or 2 carcinogens, mutagens or toxic to reproduction). [consulté le 2 février 2018]. (disponible en anglais seulement)
[EC] European Commission. 2002b. Opinion of the Scientific Committee on Food on Benzyl Alcohol. European Commission Health & Consumer Protection Directorate-General. Brussels. [consulté le 2 février 2018]. (disponible en anglais seulement)
[EC] European Commission. 2008. Risk assessment report on tris[2-chloro-(chloromethyl)ethyl] phosphate (TDCP). Ireland/UK: European Chemicals Agency. [consulté le 2 février 20188]. (disponible en anglais seulement)
[EC] European Commission. 2009. Opinion on Resorcinol. Scientific Committee on Consumer Safety. European Commission Health & Consumer Protection Directorate-General. Brussels. [consulté le 7 février 2018]. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : Classification du risque écologique des substances organiques. Ottawa (ON), Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Available from: eccc.substances.eccc@canada.ca. (disponible en anglais seulement)
[EC, SC] Environnement Canada, Santé Canada. [modifié le 21 avril 2007]. Catégorisation. Ottawa (ON): Gouvernement du Canada. [consulté le 25 septembre 2015].
[EC, SC] Environnement Canada, Santé Canada. [modifié le 15 décembre 2011]. Statut des substances priorisées. Ottawa (ON), Gouvernement du Canada. [consulté le 25 septembre 2015].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2016. Ébauche d'évaluation préalable : Groupe de certaines substances ignifuges organiques. Ottawa (ON), Gouvernement du Canada. [consulté le 17 octobre 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (ON), Gouvernement du Canada.
[ECHA] European Chemicals Agency. 2013 (consulté en février 2017). Lanolin alcohols – Developmental toxicity. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2015a. Candidate List of substances of very high concern for Authorisation. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2015b. General comments and answers to specific information requests. Methanol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Bureau. 2015c. Draft community rolling action plan (CoRAP) update for years 2016-2018. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Bureau. 2015d. Substance Evaluation Report, Methanol. Helsinki (FI): ECHA. [accessed 2019 January 10]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016a. Methanol. Committee for risk assessment (RAC), Committee for socio-economic analysis (SEAC). Helsinki, Finland. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016b. Methanol. Committee for risk assessment (RAC), Committee for socio-economic analysis (SEAC). Background document. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017a. Brief Profile. Hexan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017b. Brief Profile. Octan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017c. Brief Profile. 3-phenylpropan-1-ol (benzenepropanol). Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017d. Brief Profile. Nonan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017e. Decision on substance evaluation. Addressees: Registrant of decan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017f. Brief Profile. Decan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency . 2017g. Brief Profile. Dodecan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017h. Brief Profile. Tetradecan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2017i. Brief Profile. Hexadecan-1-ol. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency Registration Dossier Alcohols. 2017j. Lanolin. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2017k. 3-phenylpropan-1-ol Registration Dossier. Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2018a. Registration Dossier. 3-phenylpropan-1-ol (benzenepropanol). Helsinki (FI): ECHA. [consulté le 15 mars 2018]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2018b. Registration Dossier. 3-ethylhexan-1-ol. Helsinki (FI): ECHA. [accessed 2018 August 14]. (disponible en anglais seulement)
[ECHA] European Chemical Agency. 2018. Substance evaluation conclusion document. Evaluation report for Butan-1-ol (CAS No 71-36-3). Evaluating Member State: Hungary. Pp. 33. (disponible en anglais seulement)
[EC] European Commision. 2004. Directorate-General Health and Consumer Protection. Collection and collation of data on levels of 3-monochloropropanediol (3-MCPD) and related substances in foodstuffs. European Commission Joint Research Centre, Belgium June 2004. [consulté le 5 août 2021] (disponible en anglais seulement)
Egen-Schwind C, Eckard R, Jekat FW, Winterhoff H. 1992. Pharmacokinetics of vinyldithiins, transformation products of allicin. Planta Med. 58:8-13. (disponible en anglais seulement)
Ema M, Hara H, Matsumoto M, Hirose A, Kamata E. 2005. Evaluation of developmental toxicity of 1-butanol given to rats in drinking water throughout pregnancy. Food Chem Toxicol. 43:325-331. (disponible en anglais seulement)
Environnement Canada. 2009. Données de la mise à jour de l’inventaire de la LIS recueillies en vertu du paragraphe71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2013. Environnement Canada; 2013; Données de la mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances inanimées inscrites sur la Liste intérieure; Données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
[EU] European Union. 1990. List of authorized monomers and other starting substances which may continue to be used for the manufacture of plastic materials and articles intended to come into contact with foodstuffs pending a decision on inclusion in Section A (Section B); [cité le 14 mars 2017]. (disponible en anglais seulement)
[FAO/WHO] Expert Committee on Food Additives. 1970. FAO Nutrition Meetings Report Series No. 48A WHO/FOOD ADD/70.39. (disponible en anglais seulement)
[FDA] Code of Federal Regulations. Mise à jour en 2016. Silver Spring (MD): US Food & Drug Administration. (disponible en anglais seulement)
[FDA] Code of Federal Regulations. Mise à jour en 2017. Trimetylolpropane. Silver Spring (MD): US Food & Drug Administration. [consulté le 1 février 2018]. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2008. STP® Water Remover. Brampton (ON): The Clorox Company of Canada. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2009. Scope—Original Mint. Mason (OH): The Proctor and Gamble Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2010b. Epoyx Premium Clear Activator Part A. Toronto (ON): Rust-Oleum. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2011a. Diesel Fuel Catalyst and Diesel Fuel Catalyst Winterized. Benicia (CA): Red Line Synthetic Oil Corporation. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2011b. Prestone® Gas Treatment. Mississauga (ON): Preston Products Corp. [consulté le 15 septembre 2021]. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2013a. Fast Strip Paint and Varnish Stripper. Vernon Hills (IL): Rust-Oleum Corp. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2013b. Winshield washer -40°C. Montreal (QC): Reochem Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2013c. Zinsser Power Stripper. Vernon Hills (IL): Rust-Oleum Corp. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014a. Turtle Wax Premium Scratch Repair Kit—Clean Coat Pen. Quebec City (QC): Turtle Wax Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014b. K100D and K100MD. Youngstown (NY): Kinetic Fuel Technology, Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014c. AS504 Stone Grey Water-based Paint. Concord (ON): K-G Spray–Pak Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014d. Diesel Engine Cleaner. Seattle (WA): Bardahl Mfg. Corp. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014e. Diesel Kleen+Cetane Boost. Weatherford (TX): Power Service Products, Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014f. Prestone® De-cier for Windows and Wipers. Mississauga (ON): Prestone Products Corp. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2014g. Motomaster® Throttle Body Cleaner. Concord (ON): K-G Spray-Pak Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015a. Scope Mouthwash Classic– Cool Peppermint. Mason (OH): The Proctor and Gamble Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015b. R-O Tub and Tile. Concord, Ontario, Corporation Rust-Oleum. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015c. Watco Lacquer Fine Gloss. Concord, Ontario: Rust-Oleum Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015d. STP® Octane Booster. Danbury (CT): The Armor All / STP Products Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015e. STP® Octane Booster. Danbury (CT): The Armor All / STP Products Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015f. Dura Lube® Octane Booster. Gahanna (OH): Into Great Brands Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015g. Mildew Stain Blocker. Fort Lauderdale (FL): Star Brite Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015h. Circa 1850 Heavy Body Paint and Varnish RemoverHeavy Body Remover 1806. Montreal (QC): Swing Paints Ltd. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015i. Goof Off Paint Stripper Aerosol. Memphis (TN): W. M. Barr Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2015j. Goof Off All Purpose Paint Stripper. Memphis (TN): W. M. Barr Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2016a. MINWAX® Clear Brushing Lacquer, Clear Gloss. Upper Saddle River (NJ): Minwax Company. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2016b. Fondue Fuel. Montreal (QC), Reochem Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2016c. Goof Off Professional VOC Compliant. Memphis (TN), W. M. Barr Inc. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2017. Duncan OG 803—Mother of Pearl. Ceramic Overglaze. Duncan Enterprises, Fresno (CA). (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2018a. Circa 1850 Super D•Solver décapant en pâte. Les peintures Swing limitée, Montréal (QC).
[FDS] Fiche de données de sécurité. 2018b. Circa 1850 Furniture Stripper. Swing Paints Ltd, Montreal (QC). (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2019a. Dad’s Easy Spray Paint, Stain, and Varnish Remover, Professional Strength. Fort Wayne (IN): Sansher Corp. (disponible en anglais seulement)
[FDS] Fiche de données de sécurité. 2019b. Goof Off Pro Paint Stripper Adhesive Remover. Memphis (TN): W. M. Barr Inc. (disponible en anglais seulement)
Ficheux AS, Chevillottte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et al. 2016. Consumption of cosmetic products by the French population second part: Amount Data. Food Chem Toxicol. 90:130-141. (disponible en anglais seulement)
Fisher, JW, Dorman DC, Medinsky MA, Welsch F, Conolly RB. 2000. Analysis of Respiratory Exchange of Methanol in the Lung of the Monkey Using a Physiological Model. Toxicol Sci. 53:185-193. (disponible en anglais seulement)
Ford RA, Domeyer B, Easterday O, Maier J, Middleton J. 2000. Criteria for development of a database for safety evaluation of fragrance ingredients. Regul Toxicol Pharmacol. 31:166-181. (disponible en anglais seulement)
Frederick LJ, Schulte PA, Apol A. 1984. Investigation and control of occupational hazards associated with the use of spirit duplicators. Am Ind Hyg Assoc J. 45:51-55. (disponible en anglais seulement)
Gessner S, Below E, Diedrich S, Wegner C, Gessner W, Kohlmann T, Heidecke CD, Bockholdt B, Kramer A, Assadian O. 2016. Ethanol and ethyl glucuronide urine concentrations after ethanol-based hand antisepsis with and without permitted alcohol consumption. Am J Infection Control. 44:999-1003. (disponible en anglais seulement)
Hahn J, Monakhova YB, Hengen J, Kohl-Himmelseher M, Schüssler J, Hahn H, Kuballa T, Lachenmeier DW. 2014. Electronic cigarettes: Overview of chemical composition and exposure estimation. Tob Induc Dis. 12(1):23. (disponible en anglais seulement)
Hammond AH, Fry JR. 1999. Effect of cyanamide on toxicity and glutathione depletion in rat hepatocyte cultures: differences between two dichloropropanol isomers. Chem Biol Interact. 122:107-115. (disponible en anglais seulement)
Hammond C, Jenkins RL, Dimitratos N, Lopez-Sanchez JA, ab Rahim MH, Forde MM, Thetford A, Murphy DM, Hagen H, Stangland EE, et al. 2012. Catalytic and Mechanistic Insights of the Low-Temperature Selective Oxidation of Methane over Cu-Promoted Fe-ZSM-5. Chemistry. 18(49):15735-15745. (disponible en anglais seulement)
Hou CY, Lin YS, Wang YT, Jiang CM, Wu MC. 2008. Effect of storage conditions on methanol content of fruit and vegetable juices. J Food Composition Anal. 21:410-415. (disponible en anglais seulement)
Howard PH. 1990. Handbook of Environmental Fate and Exposure Data for Organics Chemicals, Volume 2. CRC Press, Boca Raton, Fl. (disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank. 2017. Bethesda (MD): National Institutes of Health. [consulté le 1 février 20184]. (disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2013. 1,3-dichloro-2-propanol (CAS 96-23-1). [consulté le 1 février 20184]. (disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2018. Search conducted for Methanol. Dernière mise à jour en juin 2018. (disponible en anglais seulement)
[ICH] International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use. 2016. ICH guideline Q3C on impurities: guideline for residual solvents Q3C(R6). Amsterdam. [consulté le 11 mai 2021]. (disponible en anglais seulement)
Imperial Oel. 2017. Lanolins and Lanolin Derivatives. Hamburg (Germany). [consulté le 4 août 2021]. (disponible en anglais seulement)
[INRP] Inventaire national des rejets de polluants. Aperçu des données déclarées et révisées. 2014. Gatineau (QC), Environnement Canada.
[IPCS] International Programme on Chemical Safety. 1997a. Environmental Health Criteria (EHC) 196. Methanol. Organisation mondiale de la Santé (OMS), Genève. (disponible en anglais seulement)
[IPCS] International Programme on Chemical Safety. 1997b. Methanol. Health and Safety Guide No. 105. Organisation mondiale de la Santé (OMS), Genève. (disponible en anglais seulement)
[IPCS] International Programme on Chemical Safety. 2001. Methanol. Poisons Information Monograph (PIM) 335. Milan, IPCS, Genève. (disponible en anglais seulement)
[IPCS] International Programme on Chemical Safety. 2005. Safety evaluation of certain food additives and contaminants. Benzyl derivatives. WHO Food Additive Series: 48, WHO, Genève. [consulté le 7 février 2018]. (disponible en anglais seulement)
[IPCS] International Programme on Chemical Safety. 2006. Resorcinol. Concise International Chemical Assessment Document 71. IPCS, Geneva. [consulté le 15 septembre 2021. (disponible en anglais seulement)
Ishii S, Yokotsuka T. 1972. Clarification of fruit juice by pectin trans-eliminase. J Agric Food Chem. 20: 787-791. (disponible en anglais seulement)
Ishii S, Yokotsuka T. 1973. Susceptibility of fruit juice to enzymatic clarification by pectin lyase and its relation to pectin in fruit juice. J Agric Food Chem. 21:269-272. (disponible en anglais seulement)
[Japan] Standard for Cosmetics. 2000. Ministry of Health and Welfare Notification No. 331. Tokyo. [consulté le 7 février 2018]. (disponible en anglais seulement)
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 1997. Evaluations of the Joint FAO/WHO Expert Committee on Food Additives: 2-ethyl-1-hexanol. Geneva (CH): World Health Organization. [consulté le 3 juin 2021]. (disponible en anglais seulement)
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 1999. Evaluation of certain food additives and contaminants. Forty-ninth report of JECFA. Geneva (CH): World Health Organization (WHO Technical Report Series 884). (disponible en anglais seulement)
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 2002. Evaluation of certain food additives and contaminants. Fifty-seventh report of the JECFA. Geneva (CH): World Health Organization. (WHO Technical Report Series 909). [consulté le 6 septembre 2018]. (disponible en anglais seulement)
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 2007a. Safety evaluation of certain food additives and contaminants: 1,3-dichloro-2-propanol (addendum). Prepared by the sixty-seventh meeting of JECFA. Geneva (CH): World Health Organization. (WHO Food Additives Series 58). pp. 209-238. (disponible en anglais seulement)
[JECFA] Joint FAO/WHO Expert Committee on Food Additives. 2007b. Evaluation of certain food additives and contaminants. Sixty-seventh report of JECFA. Geneva (CH): World Health Organization (WHO Technical Report Series 940). (disponible en anglais seulement)
Jedrychowski R, Gorny R, Stetkiewicz J, Stetkiewicz I. 1990. Subacute oral toxicity of 1,4-butanediol in rats. Polish J Occup Med. 3:421-428. (disponible en anglais seulement)
Jersey GC, Breslin WJ, Zielke GJ. 1991. Subchronic toxicity of 1,3-dichloro-2-propanol in the rat. Toxicologist. 11:353. (disponible en anglais seulement)
Katoh T, Haratake J, Nakano S, Kikuchi M, Yoshikawa M, Arashidani K. 1998. Dose-dependent effects of dichlorophenol on liver histology and lipid peroxidation in rats. Ind Health. 36:318-323. (disponible en anglais seulement)
Kavet R. Nauss KM. 1990. The toxicity of inhaled methanol vapors. Crit Rev Toxicol. 21:21-50. [consulté le 1 février 20184]. (disponible en anglais seulement)
Kim H-Y, Lee S-B, Lim K-T, Kim M-K, Kim J-C. 2007. Subchronic inhalation toxicity study of 1,3-dichloro-2-propanol in rats. Annal Occup Hyg. 51:633-643. (disponible en anglais seulement)
Kim W, Jeong YA, On J, Choi A, Lee J-y, Lee JG, Lee K-G, Pyo H. 2015. Analysis of 3-MCPD and 1,3-DCP in various foodstuffs using GC-MS. Toxicol Res. 31:313-319. (disponible en anglais seulement)
Korsak Z, Wisniewska-Knypl J, Swiercz R. 1994 Toxic effects of subchronic combined exposure to n-butyl alcohol and m-xylene in rats. Int J Occup Med Environ Health. 7:155-166. (disponible en anglais seulement)
Krüsemann EJZ, Havermans A, Pennings JLA, de Graaf K, Boesveldt S, Talhout R. 2021. Comprehensive overview of common e-liquid ingredients and how they can be used to predict an e-liquid’s flavour category. Tob Control. 30:185-191. (disponible en anglais seulement)
Laasko I, Seppanen-Laasko T, Hiltunen R, Muller R, Jansen H, Knoblock K. 1989. Volatile garlic odor components: gas phases and adsorbed exhaled air analysed by headspace gas chromatography–mass spectrometry. Planta Med. 55:257-261. (disponible en anglais seulement)
Lamb JC, Gulati DK, Barnes LH, Welch M 1997. Propylene glycol. Environ Health Perspect. 105(suppl 1): 231 -232. (disponible en anglais seulement)
[LCBO] Régie des alcools de l'Ontario. 2013. Normes d'emballage des produits. Toronto (ON). (disponible en anglais seulement)
Lemar KM, Passa O, Aon MA, Cortassa S, Müller CT, Plummer S, O’Rourke B, Lloyd D. 2005. Allyl alcohol and garlic (Allium sativum) extract produce oxidative stress in Candida albicans. Microbiol. 151: 3257-3265. (disponible en anglais seulement)
Lewis RJ. 2000. Sax's Dangerous Properties of Industrial Materials. Wiley, New York. 10. (disponible en anglais seulement)
[LMC] Laboratory of Mathematical Chemistry. 2017. The OECD QSAR Toolbox for Grouping Chemicals into Categories, v 4.1. Burgas (BG): University "Prof. Dr. Assen Zlatarov", Laboratory of Mathematical Chemistry. (disponible en anglais seulement)
Lovegren NV, Fisher GS, Legendre MG, Schuller WH. 1979. Volatile Constituents of Dried Legumes. J Agric Food Chem. 27:851-853. (disponible en anglais seulement)
Lum OL, Wong MK, Lee CK. 1990. A simple headspace-gas chromatographic method for the quantitative determination of organic volatiles of fresh orange juice. Food Chem. 37:313-317. (disponible en anglais seulement)
Lyondell Chemical Company. 2005. A Prenatal Developmental Toxicity Study of Allyl Alcohol in Rats. WIL Research Laboratories, LLC. Study No. WIL-14038. (disponible en anglais seulement)
MacLeod AJ, MacLeod G. 1970. The flavour volatiles of dehydrated cabbage. J Food Sci. 35:739-743. (disponible en anglais seulement)
[MAK] MAK Value Documentation. 1-Dodecanol. 2016. The MAK Collection for Occupational Health and Safety. 117-132. (disponible en anglais seulement)
Merck Index. 2010. An Encyclopedia of Chemicals, Drugs, and Biologicals (14th Edition - Version 14.6), Whitehouse Station, NJ: Merck & Co., Inc. (disponible en anglais seulement)
Merck Index. 2017. 1,3-dichloro-2-propanol. Royal Society of Chemistry. [consulté le 5 février 2018]. (disponible en anglais seulement)
Methanol Institute. 2021. Methanol. Alexandria, VA. [consulté le 5 août 2021]. (disponible en anglais seulement)
Montedoro G, Bertuccioli M. 1983. Application of GC and HPLC in the Predictive Quality Evaluation of Wines. Instrumental Analysis of Foods, Vol 2, ed. Charalambous G, Inglett G. pp. 409-435. (disponible en anglais seulement)
Murphy F. 2009. Methanol dosing trial for enhanced denitrification at Lilydale STP. 72nd Annual Water Industry Engineers and Operators’ Conference. [consulté le 16 octobre 2017]. (disponible en anglais seulement)
Nair B. 2001. Final report on the safety assessment of benzyl alcohol, benzoic acid, and sodium benzoate. Int J Toxicol. 20 (Suppl. 3):23-50. (disponible en anglais seulement)
Nawar WW, Yoo YJ, Bradley MS, Morin O. 1988. A study of the volatile components generated from butter oil by heat. Rev Fr Corps Gras. 35:117-122. (disponible en anglais seulement)
[NEDO] New Energy Development Organization. 1987. Toxicological research of methanol as a fuel for power station: summary report on tests with monkeys, rats and mice. Tokyo, Japan. (disponible en anglais seulement)
Nelson BK, Brightwell WS, Khan A, Hoberman AM, Krieg Jr EF. 1988. Teratological evaluation of 1-pentanol, 1-hexanol, and 2-ethyl-1-hexanol administered by inhalation to rats. Teratology. 37(5):480. (disponible en anglais seulement)
Nelson BK, Brightwell WS, Khan A, Burg JR, Goad PT. 1989a. Lack of selective developmental toxicity of three butanol isomers administered by inhalation to rats. Fundam Appl Toxicol. 12:469-479. (disponible en anglais seulement)
Nelson BK, Brightwell WS, Robertson SK. 1989b. Behavioral teratology investigation of 1-butanol in rats. Neurotoxicol Teratol. 11(3):313–315. (disponible en anglais seulement)
Nelson PE, Hoff JE. 1969. Tomato volatiles: effect of variety, processing and storage time. J Food Sci. 34: 53-57. (disponible en anglais seulement)
[New Zealand EPA] New Zealand Environmental Protection Agency. 2010. Schedule 4 – Components Cosmetic Products Must Not Contain. New Zealand [consulté le 14 janvier 2019]. (disponible en anglais seulement)
Ngan V. 2002. Allergy to wool alcohols. Hamilton (NZ): DermNet. (disponible en anglais seulement)
Nijssen LM, Ingen-Visscher CA van, Donders JJH [editors]. 1953-2017. VCF (Volatile Compounds in Food) Online. Database extract (v.16.4) for methanol (CAS 67-56-1) in food and beverages. Triskelion B.V. Zeist, Pays-Bas. [mise à jour le 13 février 2017; consulté le 12 décembre 2021.] (disponible en anglais seulement)
[NIOSH] National Institute for Occupational Safety and Health. 1981. Health hazard evaluation report No. HETA-81-177, 178-988. National Institute of Occupational Safety and Health, Cincinnati, OH. (disponible en anglais seulement)
Nosko S. 1974. [Evaluation of Williams-Christ brandies I. Reported analytical data of authentic brandies from Williams-Christ and other pear varieties, as well as blends thereof]. Deutsche Lebensmittel Rundschau 70:397-400. (disponible en anglais seulement)
Noritake K, Ikeda T, Ito K, Miwa Y, Senuma M, Takashima H, Tateishi T, Hisada S, Maki E. 2013. Study for collecting background data on Wistar Hannover [Crl:WI(Han)] rats in embryo-fetal development studies—comparative data to Sprague Dawley rats. J Toxicol Sci. 38:847-854. (disponible en anglais seulement)
[NSF] NSF International. 2000.Review of contaminant occurrences in drinking water treatment chemicals. A summary report of NSF International results (1991 to 1999). ANSI/NSF Standard 60: Drinking water treatment chemicals—health effects. Rapport preparé pour Santé Canada, Direction générale de la protection de la santé. (disponible en anglais seulement)
[NSF] NSF International. 2017. NSF/ANSI Standard 60: Drinking water treatment chemicals – health effects. Ann Arbor (MI): NSF International. (disponible en anglais seulement)
[NSF] NSF International. 2018. Survey of ASDWA members on the use of NSF/ANSI Standards: Standards 60, 61, 223 and 372. Addendum B: Health Canada Survey on Provincial/Territorial Adoption of NSF/ANSI 60 and 61. Ann Arbor (MI): NSF International. [consulté le 22 mai 2019]. (disponible en anglais seulement)
[NTP] National Toxicology Program. 1989. Toxicology and carcinogenesis studies of benzyl alcohol (CAS No. 100-51-6) in F344/N rats and B6C3F1 Mice (gavage studies). NTIS Report No. PB90-110206. (disponible en anglais seulement)
[NTP] National Toxicology Program. 1992. Toxicology and carcinogenesis studies of resorcinol (CAS No.108-46-3) in F344/N rats and B6C3F1 mice (gavage studies). Research Triangle Park, NC, United States Department of Health and Human Services, National Institutes of Health, National Toxicology Program, 235 pp. (NTP TR No. 403). (disponible en anglais seulement)
[NTP] National Toxicology Program. 2004. Review. NTP-CERHR expert panel report on the reproductive and developmental toxicity of methanol. Reprod Toxicol. 18:303-390. (disponible en anglais seulement)
[NTP] National Toxicology Program. 2005. 1,3-Dichloro-2-propanol [CAS No. 96-23-1]. Review of toxicological literature. Research Triangle Park (NC): NTP. (disponible en anglais seulement)
[NTP] National Toxicology Program. 2013. Toxicology and carcinogenesis studies of pyrogallol (CAS 87-66-1) in F344/N rats and B6C3F1/N mice (dermal studies). NTP TR 574. NIH Publication No. 13-5916. (disponible en anglais seulement)
[NTP] National Toxicology Program. Mise à jour en 2017. Testing Status of Pyrogallol—M960044. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1990. Tier 1 Screening SIDS Dossier on Trimethylolpropane. SIAM 1. Japon. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1995. SIDS Initial Assessment Report 2-ethylhexanol. SIAM 3. Suède et États-Unis. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2001a. SIDS Initial Assessment Report n-Butyl Alcohol. SIAM 13. Suisse. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2001b. Tier 1 Screening SIDS Dossier on Cyclohexanol. Paris (FR). (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2001c. SIDS Initial Assessment Profile Benzoates. SIAM 13, Pays-Bas. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004a. OECD List of High Production Volume Chemicals. Paris, France. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004b. The 2004 OECD List of High Production Volume Chemicals. Paris (FR) [cite le 13 mars 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004c. SIDS Initial Assessment Profile. Methanol. Summary Conclusions of the SIAR. SIAM 19. 19-22 octobre. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004d. SIDS Initial Assessment Profile. Methanol. SIAM 19. Berlin, Germany. 18-20 octobre. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004e. SIDS Initial Assessment Report: 2-propen-1-ol CAS No. 107-18-6. SIAM 21 [SIDS Initial Assessment Meeting], Washington, DC 18-21 octobre. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2005a. SIDS Initial Assessment Report 4-methylpentan-2-ol. SIAM 21. États-Unis. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2005b. SIDS Initial Assessment Report Allyl Alcohol. SIAM 21. États-Unis. [consulté le 9 février 2018] (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2006a. SIDS Initial Assessment Profile Long-chain Alcohols (C6-C22 alcohols). SIAM 22. TOME1:SIAR and TOME2: SIDS Dossiers prepared by Shell Chemicals Ltd and Peter Fisk Associates. Paris (FR). (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2006b. SIDS Initial Assessment Report Methanolates. SIAM 22. France. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2006c. SIDS Initial Assessment Profile. Oxo Alcohols C9 to C13. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2008. SIDS Initial Assessment Report Resorcinol. SIAM 27, Japon. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009. SIDS Dossier Resorcinol. ID: 108-46-3. (disponible en anglais seulement)
OECD QSAR Toolbox [Read-across tool]. 2014. Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (disponible en anglais seulement)
[OSHA] Occupational Safety and Health Administration. 1978. Occupational health guideline for methyl alcohol. US Department of Labor. (disponible en anglais seulement)
O’Neil MJ. 2006. The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. New Jersey (NY): Merck and Co. 929 p. (disponible en anglais seulement)
Phillips RD, Moran EI, Dodd DE, Fowler EH, Kary CD, O'Donoghue J. 1987. A 14-week vapour inhalation toxicity study of methyl isobutyl ketone. Fundam Appl Toxicol. 9:380-388. (disponible en anglais seulement)
Proctor DM, Gatto NM, Hong SJ, Allamneni KP. 2007. Mode-of-action framework for evaluating the relevance of forestomach tumors in cancer risk assessment. Toxicol Sci. 98:313-326. (disponible en anglais seulement)
PubChem [base de données] 2004- . Compound Summary. Methanol. Bethesda (MD): US National Library of Medicine. National Center for Biotechnology Information. [consulté le 15 septembre 2021]. (disponible en anglais seulement)
[RCC] Research & Consulting Co. 1986. 104-week chronic toxicity and oncogenicity study with 1,3-dichlor-propan-2-ol in the rat. Report No. 017820. Itingen, Suisse. (disponible en anglais seulement)
[RIFM] Research Institute for Fragrance Materials Inc. 1971b. Repeated insult patch test on human subjects. RIFM report number 2730, August 30. RIFM, Woodcliff Lake, NJ, États-Unis. (disponible en anglais seulement)
[RIFM] Research Institute for Fragrance Materials Inc. 1976a. Acute toxicity studies in rats, mice, rabbits and guinea pigs. RIFM report number 2019, May 12. RIFM, Woodcliff Lake, NJ, États-Unis. (disponible en anglais seulement)
[RIFM] Research Institute for Fragrance Materials Inc. 1976b. Report on human maximization studies. RIFM report number 1796, December 20. RIFM, Woodcliff Lake, NJ, États-Unis. (disponible en anglais seulement)
[RIFM] Research Institute for Fragrance Materials Inc. 2002. Mutagenicity study of 3-phenyl-1-propanol (phenyl propylalcohol) in the Salmonella typhimurium/mammalian microsome reverse mutation assay (Ames-Test). RIFM Report No. 57447. RIFM, Woodcliff Lake, NJ, États-Unis. (disponible en anglais seulement)
Ritter EJ, Scott WJ, Fradkin R, Ritter JM. 1986. Computer analysis of rat teratology data following administration of phthalates and their metabolites. Teratology. 33(3):93C. (disponible en anglais seulement)
Ritter EJ, Scott WJ, Randall JL, Ritter JM. 1987. Teratogenicity of di(2-ethylhexyl) phthalate, 2-ethylhexanol, 2-ethylhexanoic acid, and valproic acid, and potentiation by caffeine. Teratology. 35:41-46. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Cosmetic Products Fact Sheet. ConsExpo Consumer exposure model. Bilthoven (BE): Centre for Substances and Integrated Risk Assessment. [consulté le 15 septembre 2021] (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007. Paint Products Fact Sheet. ConsExpo Consumer exposure model. Bilthoven (BE): Centre for Substances and Integrated Risk Assessment. [consulté le 15 septembre 2021] (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2018. Cleaning Products Fact Sheet. Default Parameters for Estimating Consumer Exposure. Bilthoven (BE): Centre for Substances and Integrated Risk Assessment. [consulté le 15 septembre 2021] (disponible en anglais seulement)
Rodda LN, Beyer J, Gerostamoulos D, Drummer OH. 2013. Alcohol congener analysis and the source of alcohol: a review. Forensic Sci Med Pathol. 9:194-207. (disponible en anglais seulement)
Rogers JM, Mole ML, Chernoff N, Barbee BD, Turner CI, Logsdon TR, Kavlock RJ. 1993. The developmental toxicity of inhaled methanol in the CD-1 mouse, with quantitative dose-response modeling for estimation of benchmark doses. Teratology. 47:175-188. (disponible en anglais seulement)
[RTF] Resorcinol Task Force. 2005. A drinking water two-generation reproductive toxicity study of resorcinol in rats. Final report. 4769 pp. (WIL-455003). (disponible en anglais seulement)
Rudner EJ, Clendenning WE, Epstein E, Fisher AA, Jillson OF, Jordan WP, Kanof N, Larsen W, Maibach H, et al. 1973. Epidemiology of contact dermatitis in North America: 1972. Arch Dermatol. 108:537-540. (disponible en anglais seulement)
Rudner EJ, Clendenning WE, Epstein E, Fisher AA, Jillson OF, Jordan WP, Kanof N, Larsen W, Maibach H, et al. 1975. The frequency of contact sensitivity in North America 1972-1974. Contact Dermatitis. 1:277-280. (disponible en anglais seulement)
Saiyasombati P, Kasting GB. 2003. Disposition of benzyl alcohol after topical application of human skin in vitro. J Pharm Sci. 92:2128-2139. [consulté le 2 février 2018]. (disponible en anglais seulement)
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Ottawa (ON): Health Canada, Direction de la santé environnementale, Bureau des dangers des produits chimiques, Gouvernement du Canada. (disponible en anglais seulement)
Santé Canada. 2010a. Étude de la qualité de l'air intérieur à Regina (2007) : Sommaire des données d'échantillonnage des composés organiques volatiles, Ottawa (ON), Gouvernement du Canada. [consulté en juin 2017].
Santé Canada. 2010b. Étude d'évaluation de l'exposition à Windsor (2005-2006) : Sommaire des données d'échantillonnage des composés organiques volatiles, Ottawa (ON), Gouvernement du Canada. [consulté en juin 2017].
Santé Canada. 2011. Guide alimentaire canadien. Ottawa (ON), Gouvernement du Canada. [consulté le 2 février 2017].
Santé Canada. 2012a. Toxicity Profile. 1-Hexanol. Internal Health Canada document. (disponible en anglais seulement)
Santé Canada. 2012b. Toxicity Profile. 1-Octanol. Internal Health Canada document. (disponible en anglais seulement)
Santé Canada. 2012c. Étude de la qualité de l’air intérieur à Halifax (2009) : Sommaire des données des composés organiques volatils (COV). Ottawa (ON). Gouvernement du Canada.
Santé Canada. 2013. Edmonton Indoor Air Quality Study (2010): Volatile Organic Compounds (VOC) Data Summary. Ottawa (ON), Gouvernement du Canada. No de catalogue: H144-15/2013F-PDF [consulté le 1 février 20184]. (disponible en anglais seulement)
Santé Canada. 2016a. Document sur l'approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (ON), Gouvernement du Canada.
Santé Canada. 2016b. Liste des solvants de support ou d'extraction autorisés (Listes des additifs alimentaires autorisés). Ottawa (ON), Gouvernement du Canada. [consulté le 20 septembre 2021].
Santé Canada. [modified 14 juin 2018]. Liste critique des ingrédients de cosmétiques. Ottawa (ON), Gouvernement du Canada. [consulté le 26 juillet 2018].
Santé Canada. [modified 14 juillet 2020]. Réglementation des produits de vapotage. Ottawa (ON), Gouvernement du Canada. [consulté le 4 décembre 2020].
Schuhmacher R, Nurmi-Legat J, Oberhauser A Kainz M, Krska R. 2005. A rapid and sensitive GC-MS method for determination of 1,3-dichloro-2-propanol in water. Anal Bioanal Chem. 382:366-371. (disponible en anglais seulement)
SCREEN3 [computer model]. 2011. . Research Triangle Park (NC): US Environmental Protection Agency, Office of Air Quality Planning and Standards, Emissions, Monitoring, and Analysis Division. (disponible en anglais seulement)
Shaw PE, Moshonas MG, Hearn CJ, Goodner KL. 2000. Volatile constituents in fresh and processed juices from grapefruit and new grapefruit hybrids. J Agric Food Chem. 48:2425-2429. (disponible en anglais seulement)
Sitarek K, Berlinska B, Baranski B. 1994. Assessment of the effect of n-butanol given to female rats in drinking water on fertility and prenatal development of their offspring. Int J Occup Med Environ Health. 7: 365-370. (disponible en anglais seulement)
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes – Nutrition (ESCC). Information détaillée pour 2004 (cycle 2.2). Ottawa (ON), Gouvernement du Canada.
Statistique Canada. 2015. Enquête sur la santé dans les collectivités canadiennes (ESCC) 2015 - Fiche partagé. Estimations générées à l’aide de SAS 9.3 [GRID] à SAS EG 5.1. Ottawa (ON), Gouvernement du Canada.
Stofberg J, Grundschober F. 1987. Consumption ratio and food predominance of flavoring materials. Perfumer & Flavorist. 12: 27-68. (disponible en anglais seulement)
[TDS] Technical Data Sheet. 2019. Zinsser Power Stripper. Rust-Oleum Corp. Vernon Hills (IL). (disponible en anglais seulement)
Tierney PA, Karpinski CD, Brown JE, Luo W, Pankow JF. 2015. Flavour chemicals in electronic cigarette fluids. Tob. Control 25: e10-e15. (disponible en anglais seulement)
Tyl RW, Fisher LC, Kumbena MF, Vrbanic MA, Gingell R, Guest D, Hodgson JR, Murphy SR, Tyler TR, Astill BD. 1992. The developmental toxicity of 2-ethylhexanol applied dermally to pregnant Fischer 344 rats. Fundam Appl Toxicol. 19:176-185. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 1985. Health and environmental effects profile for allyl alcohol. Washington (DC). US EPA. EPA/600/X-85/396 (NTIS PB88170857). [consulté le 9 février 2018]. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 1986. Emergency Planning and Community Right-to-Know Act. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 1987. Integrated Risk Information System (IRIS) Chemical Assessment Summary Allyl Alcohol. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 1992. Screening procedures for estimating the air quality impact of stationary sources, revised. Washington (DC): US EPA. Report No.: EPA-454/R-92-019. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 1993. Reference Dose (RfD): Description and Use in Health Risk Assessments. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency.1996. Memo from Stanley B. Gross, Health Effects Division, to Kathryn Davis Special Review and Reregistration Division. "Fatty Alcohol Blend (1-decanol) Subchronic dermal toxicity study submitted by Fatty Alcohol Task Force. Case 819218. Chem No. 275A. DP Barcode D219235." May 15, 1996. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2002. National recommended water quality criteria 2001. Washington (DC): US EPA. Report # EPA-822-r-02-047. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2004. National Primary Drinking Water Standards. Washington (DC): US EPA. EPA 816-F-03-016. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2005a. Inert reassessment—n-butanol, CAS# 71-36-3 and isobutyl alcohol, CAS# 78-83-1. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2005b. Interim Acute Exposure Guideline Levels (AEGLs) - Methanol. Washington (DC): US EPA. National Advisory Committee for Acute Exposure Guideline Levels for Hazardous Substances. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2006. Inert reassessment decision document for n-decyl alcohol CAS# 112-30-1 and n-octyl alcohol CAS# 11-87-5. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2009. Provisional Peer-Reviewed Toxicity Values for Benzyl Alcohol. Washington (DC): US EPA. [consulté le 15 septembre 2021]. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization of cyclohexanol. Washington (DC): US EPA. [consulté le 20 mars 2017]. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2011a. Toxicological review of n-butanol (CAS 71-36-3). In support of summary information on the integrated risk information system (IRIS). Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2011b. Exposure factors handbook: 2011 Edition. Washington (DC): US EPA. [consulté le 31 juillet 2018]. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2012. Inventory Update Rule volumes. Toxic Substances Control Act (TSCA) Chemical Inventory database. Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2013a. Toxicological review of methanol (noncancer) (CAS RN 67-56-1) in support of summary information on the integrated risk information system (IRIS). (EPA/635/R-11-001) Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2013b. IRIS chemical assessment summary. Methanol (CAS RN 67-56-1). Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2013c. Toxicological review of methanol (noncancer). In support of summary information on the integrated risk information system (IRIS). Washington (DC): US EPA. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2021. The list of extremely hazardous substances and their threshold planning quantities. Washington (DC): US EPA. [consulté le 5 août 2021]. (disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2019. Inactive ingredient search for approved drug products. Washington (DC): US FDA. [consulté le 1 mai 2019]. (disponible en anglais seulement)
Wang ML, Wang JT, Choong YM. 2004. A rapid and accurate method for determination of methanol in alcoholic beverage by direct injection capillary gas chromatography. J Food Compos Anal. 17:187-196. (disponible en anglais seulement)
Williams G, Leblanc J-C, Setzer RW. 2010. Application of the margin of exposure (MoE) approach to substances in food that are genotoxic and carcinogenic: example: (CAS No. 96-23-1) 1,3-dichloro-2-propanol (DCP). Food Chem Toxicol. 48:S57-62. (disponible en anglais seulement)
White LR, Marthinsen ABL, Richards RJ, Eik-Nes KB, Nilsen OG. 1983. Biochemical and cytological studies of rat lung after inhalation of methanol vapour. Toxicol Lett. 17:1-5. (disponible en anglais seulement)
[OMS] Organisation mondiale de la Santé. 2007. Concise International Chemical Assessment Document 71. Resorcinol. Geneva (CH): WHO. (disponible en anglais seulement)
Wollbrinck T. 1993. The composition of proprietary paint strippers. J Am Inst Conserv. 32:43-57. (disponible en anglais seulement)
Yasuhara A. 1987. Comparison of volatile components between fresh and rotten mussels by gas chromatography – mass spectrometry. J Chromatogr. 409:251-258. (disponible en anglais seulement)
Yu TH, Wu CM, Liou YC. 1989. Volatile compounds from garlic. J Agric Food Chem. 37:725-30. [consulté le 1 février 20184]. (disponible en anglais seulement)
Zmyslony M, Palus J, Dziubałtowska E, Politanski P, Mamrot P, Rajkowska E, Kameduła M. 2004. Effects of in vitro exposure to power frequency magnetic fields on UV-induced DNA damage of rat hepatocytes. Bioelectromagnetics. 25:560-562. (disponible en anglais seulement)
Annexe A. Description de l’approche de la Classification du risque écologique des substances organiques
Les risques écologiques des substances du groupe des alcools ont été caractérisés selon la CRE (ECCC 2016a). La CRE est une approche qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui pondère plusieurs éléments de preuve pour obtenir un classement du risque. Elle permet de rassembler les divers éléments de preuve de façon à différentier les substances plus ou moins dangereuses et les potentiels d’exposition plus ou moins grands dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un unique paramètre dans un seul milieu (p. ex., la concentration létale médiane, CL50). Pour les substances UVCB qui ne pouvaient pas être représentées de manière appropriée par une structure chimique unique, une approche manuelle basée sur le jugement a été utilisée pour la classification. La méthode, qui est décrite en détail par ECCC (2016a), est résumée ci-dessous.
Les données sur les propriétés physico-chimiques, sur le devenir (demi‑vie de la substance chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de substances chimiques importées ou fabriquées au Canada ont été colligées à partir de publications scientifiques, de bases de données empiriques (p. ex., boîte à outils QSAR de l’OCDE, 2014) et des résultats des enquêtes menées en vertu de l’article 71 de la LCPE ou des données ont été produites à partir de certains résultats obtenus par modélisation de la relation quantitative structure‑activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de la substance.
Les profils de danger ont été établis principalement à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été calculés à partir de plusieurs paramètres, dont les taux de rejet potentiels, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance comme faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) afin de raffiner les classifications préliminaires du danger et de l’exposition. Cependant, dans le cas des UVCB, les profils de danger et d’exposition n’ont pu être établis entièrement en raison de l’absence de structure représentative permettant d’estimer les propriétés nécessaires et de l’absence de données empiriques pour ces propriétés. Par conséquent, la classification manuelle du danger et de l'exposition a été effectuée en examinant les constituants de l'UVCB et les renseignements soumis en réponse à une enquête menée en vertu de l'article 71 de la LCPE, les décisions étant prises sur la base de l'examen de substances similaires et du jugement des experts.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape consiste à ajuster les résultats de la classification du risque de modéré ou élevé à faible lorsque l’estimation du taux de rejet dans l’eau d’une substance après son passage par un système de traitement d’eaux usées prédisait un faible risque d’exposition. La deuxième étape servait à réévaluer les résultats d’un classement de risque faible à l’aide de scénarios de risques relativement prudents à l’échelle locale (dans la zone à proximité du point de rejet) et conçus pour protéger l’environnement afin de déterminer si l’on devrait accroître le classement du risque.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une classification supérieure ou inférieure du danger, de l’exposition et du risque subséquent. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Dans ce qui suit, nous discutons de deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient conduire à une modification du classement du danger, en particulier dans le cas des paramètres liés aux concentrations de résidus dans les tissus (le mode d’action toxique), dont un grand nombre sont prévues à partir de modèles QSAR (OCDE, QSAR Toolbox 2014). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) des résidus dans les tissus qui servira à l’analyse des résidus corporels critiques. L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profil structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Des changements ou des erreurs dans les quantités chimiques pourraient produire des différences dans le classement de l’exposition, car les classifications de l’exposition et du risque sont très sensibles aux taux d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas représenter les tendances futures.
Annexe B. Facteurs d’exposition de la population générale aux produits contenant du méthanol, du butan‑1‑ol, du cyclohexanol et de l’alcool benzylique
| Variable - Type de source | Variable d’entrée - Superficie |
|---|---|
| Superficie efficace d’émission a | 600 × 600 m2 |
| Débit d’émission | 25,75 (g/s) |
| Hauteur du récepteur b | 1,74 m (taille moyenne d’un adulte) |
| Hauteur de rejet à la source a | 10 m |
| Facteur d’ajustement c | 0,4 (direction du vent variable sur une période de 24 heures); 0,2 (direction du vent variable sur une période de 1 an) |
| Milieu urbain / milieu rural | Milieu rural |
| Météorologie d | 1 (météorologie complète) |
| Distance minimale et maximale | 0–2 000 m |
a Jugement professionnel.
b Curry et coll. (1993).
c US EPA (1992).
d Valeur par défaut dans SCREEN3.
| Distance (m) | Concentration maximale de méthanol sur 1 heure (μg/m3) | Concentration annuelle maximale de méthanol (μg/m3) |
|---|---|---|
| 1 | 973,5 | 194,7 |
| 100 | 1 241 | 248,2 |
| 200 | 1 485 | 297,0 |
| 300 | 1 777 | 355,4 |
| 400 | 2 046 | 409,2 |
| 500 | 2 296 | 459,2 |
| 600 | 2 452 | 490,4 |
| 700 | 2 603 | 520,6 |
| 800 | 2 629 | 525,8 |
| 900 | 2 586 | 517,2 |
| 1 000 | 2 512 | 502,4 |
| 1 100 | 2 427 | 485,4 |
| 1 200 | 2 340 | 468,0 |
| 1 300 | 2 256 | 451,2 |
| 1 400 | 2 175 | 435,0 |
| 1 500 | 2 099 | 419,8 |
| 1 600 | 2 027 | 405,4 |
| 1 700 | 1 959 | 391,8 |
| 1 800 | 1 896 | 379,2 |
| 1 900 | 1 837 | 367,4 |
| 2 000 | 1 782 | 356,4 |
| Scénario d’exposition - Scénario d'exposition | Décapant pour peintures et à vernis - Petit projet | Décapant pour peintures et à vernis - Grand projet | Décapant pour peintures et à vernis - Resurfaçage de baignoire |
|---|---|---|---|
| Quantité de produit utilisée | 500 g | 4 500 g | 1 650 g |
| Superficie de rejet du produit | 1 m2 | 9 m2 | 3,3 m2 |
| Facteur d’émission du méthanol | 50 % | 50 % | 50 % |
| Durée de l’application | 20 min. | 20 min. | 20 min. |
| Durée de l’exposition | 90 min. | 90 min. | 90 min. |
| Volume de la pièce | 34 m3 | 34 m3 | 3 410 m3 |
| Taux de renouvellement d’air | 0,5 à 2,5 h‑1 | 0,5 à 2,5 h‑1 | 2,0 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 12,8 kPa | 12,8 kPa | 12,8 kPa |
|
5 % de méthanol Concentration moyenne par événement Concentration max. Concentration moyenne le jour de l’exposition |
215a – 110b 295a – 185b 10,5a – 5,0b |
1 800a – 8 500b 2 400a – 1 550b 90a – 46b |
1 350 2 100 65 |
|
35 % de méthanol Concentration moyenne par événement Concentration max. Concentration moyenne le jour de l’exposition |
1 500a – 760b 2 050a – 1 300b 72a – 37b |
13 000a – 6 600b 17 000a – 11 000b 610a – 320b |
9 400 15 000 460 |
a Pour un taux de renouvellement d'air de 0,5 par heure.
b Pour un taux de renouvellement d'air de 2,5 par heure.
| Variable | Variable d’entrée |
|---|---|
| Scénario d’exposition | Nettoyant tout‑usage en pulvérisateur (application par pulvérisation) |
| Quantité de produit utilisée (pourcentage de méthanol) | 22,1 g (5 %) |
| Durée de l’exposition | 60 min. |
| Volume de la pièce | 58 m3 (salle de bain) |
| Taux de renouvellement d’air | 0,5 h‑1 |
| Taux d’inhalation | 16,3 L/min |
| Scénario d’exposition | Produits de coiffure |
| Quantité de produit utilisée (pourcentage de méthanol) | 2 g (3 %) |
| Durée de l’exposition | 10 min. |
| Volume de la pièce | 10 m3 (salle de bain) |
| Taux de renouvellement d’air | 2 h‑1 |
| Scénario d’exposition | Liquide pour soulagement des douleurs musculaires |
| Quantité de produit utilisée (pourcentage de méthanol) | 2 mL (50 %) |
| Volume inhalé – rejet de vapeur de méthanol | 1 m3 |
| Durée de l’inhalation | 1 min. |
| Utilisations par jour | 3 |
| Variable - Scénario d’exposition | Variable d’entrée - Exposition à la substance pulvérisée |
|---|---|
| Taux de production massique | 0,45 g/s |
| Durée de l’utilisation | 15 min. |
| Durée de l’exposition | 20 min. |
| Volume de la pièce | 34 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Taux d’inhalation a | 16,3 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
a Santé Canada, 1998.
| Variable - Scénario d’exposition | Variable d’entrée - Exposition à la vapeur, taux constant |
|---|---|
| Quantité de produit utilisée | 900 g |
| Durée de l’exposition | 60 min. |
| Durée d’émission | 24 h |
| Volume de la pièce | 35 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 6,7 mm Hg |
| Taux d’inhalation a | 16,3 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
a Santé Canada, 1998.
| Variable - Scénario d’exposition | Variable d’entrée - Scénario d’utilisation de laque |
|---|---|
| Quantité de produit utilisée | 500 g |
| Durée de l’exposition | 60 min. |
| Volume de la pièce | 50 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 6,7 mm Hg |
| Taux d’inhalation a | 16,3 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
a Santé Canada, 1998.
| Variable - Scénario d’exposition | Variable d’entrée - Modèle « dose constante » |
|---|---|
| Quantité de cyclohexanol dans le produit utilisée | 0,89 g |
| Durée de l’exposition | 60 min. |
| Volume de la pièce | 58 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Variable - Scénario d’exposition | Variable d’entrée - Modèle « dose constante » |
|---|---|
| Quantité de cyclohexanol dans le produit utilisée | 4,5 g |
| Durée de l’exposition | 60 min. |
| Volume de la pièce | 58 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Produit | Fréquence d’utilisation/j | Quantité ingérée (g) | Poids en % | Dose calculée (mg/kg p.c./j) |
|---|---|---|---|---|
|
Baume à lèvres, adulte Baume à lèvres, adolescent |
2,40 2,40 |
0,01 0,01 |
3 3 |
0,010 0,012 |
|
Pâte dentifrice, adulte Pâte dentifrice, adolescent Pâte dentifrice, enfant |
2,0 2,0 2,0 |
0,08 0,08 0,14 |
3 3 3 |
0,068 0,081 0,27 |
|
Rince‑bouche, adulte Rince‑bouche, adolescent Rince‑bouche, enfant |
1,0 1,0 0,85 |
1,7 1,7 1,0 |
3 3 3 |
0,72 0,86 0,82 |
a Des facteurs d’exposition provenant de documents directeurs internes de Santé Canada ont été utilisés.
| Produit | Fréquence d’utilisation/j | Quantité utilisée (g) | Poids en % | Exposition systémique b (mg/kg p.c./j) |
|---|---|---|---|---|
|
Écran solaire, enfants de 2‑3 ans c Écran solaire, adulte c Nettoyant facial, adulte d Nettoyant facial, adolescent d Nettoyant facial, enfant d |
1
1 1,60 0,70 0,70 |
3
12 2,6 2,6 2,5 |
1,74
1,74 10 10 10 |
1,7
1,4 0,029 0,015 0,028 |
a Des facteurs d’exposition provenant de documents directeurs internes de Santé Canada ont été utilisés.
b Pour les fréquences d’utilisation inférieures à 1 jour, on a calculé l’exposition systémique le jour de l’exposition.
c Un facteur d’absorption cutanée de 0,5 est utilisé pour l’alcool benzylique dans les écrans solaires.
d Un facteur de rétention de 0,01 et un taux d’absorption cutanée de 0,5 sont utilisés dans ce produit à rincer.
| Produit | Groupe d’âge | Fréquence d’utilisation/j | Quantité utilisée (g) | Facteur de rétention | Poids maximal en % | Exposition systémique a (mg/kg p.c./j) |
|---|---|---|---|---|---|---|
| Crème pour le corps / hydratant | 0–5 m à 19+ |
0,8 0,8 0,8 0,8 0,8 0,8 0,8 1,0 |
2 2,5 3,1 4,1 5 7,7 10 10 |
1 1 1 1 1 1 1 1 |
10 |
159 137 141 137 108 92 81 68 |
| Désodorisant / antisudorifique (à bille) |
9–13 14–18 19+ |
1,1 1,1 1,3 |
0,4 1 1 |
1 1 1 |
20 |
1,0 1,7 1,7 |
| Démaquillant pour les yeux |
4–8 9–13 14–18 19+ |
0,5 0,5 1 1,2 |
0,5 0,5 0,5 0,5 |
0,1 0,1 0,1 0,1 |
1 |
0,011 0,006 0,002 0,002 |
| Crème faciale |
9–13 14–18 19+ |
1 1 2 |
1,1 1,5 1,5 |
1 1 1 |
10 |
1,3 1,2 2,0 |
| Maquillage / fond de teint |
4–8 9–13 14–18 19+ |
1 1 1 1,2 |
0,34 0,39 0,41 0,54 |
1 1 1 1 |
10 |
7,4 4,6 3,3 4,4 |
| Parfum |
9–13 14–18 19+ |
1,4 1,4 1,7 |
4,3 4,3 4,3 |
1 1 1 |
10 |
7,2 4,8 4,9 |
| Shampooing |
0–5 m 6–11 m 1 an 2–3 4–8 9–13 14–18 19+ |
0,64 0,64 0,64 0,65 0,64 0,7 0,7 1,1 |
3,9 5,6 6,1 7,4 9,7 7,5 10,4 11,8 |
0,01 0,01 0,01 0,01 0,01 0,01 0,01 0,01 |
3 |
0,31 0,31 0,28 0,17 0,21 0,09 0,08 0,09 |
| Huile de massage |
6–11 m 1 an 2–3 4–8 9–13 14–18 19+ |
0,13 0,13 0,13 0,13 0,13 0,11 0,11 |
1,8 1,8 1,8 1,9 2,3 2,9 3,2 |
1 1 1 1 1 1 1 |
1 |
0,99 0,82 0,60 0,41 0,27 0,23 0,22 |
| Dissolvant pour vernis à ongles |
2–3 4–8 9–13 14–18 19+ |
0,05 0,13 0,13 0,2 0,18 |
0,76 0,76 2,25 2,25 2,25 |
1 1 1 1 1 |
3 |
0,76 0,5 0,8 0,54 0,46 |
a Pour les fréquences d’utilisation inférieures à 1 par jour, l’exposition systémique le jour de l’exposition a été calculée.
| Variable - Scénario d’exposition | Variable d’entrée - Nettoyant |
|---|---|
| Quantité d’alcool benzylique dans le produit utilisée | 0,29 g |
| Fréquence d’utilisation | 197 par année |
| Taux d’absorption cutanée | 50 % |
| Poids moyen d’un adulte | 70,9 kg |
| Variable - Scénario d’exposition | Variable d’entrée - Nettoyant tout‑usage en pulvérisateur |
|---|---|
| Quantité de produit utilisée | 16,7 g |
| Durée de l’application | 20 min. |
| Durée de l’exposition | 90 min. |
| Volume de la pièce | 58 m3 |
| Taux de renouvellement d’air | 0,5 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 0,94 mm Hg |
| Taux d’inhalation a | 16,3 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
| Variable - Scénario d’exposition | Variable d’entrée - Scénario de rejet constant |
|---|---|
| Quantité de produit utilisée / densité / pourcentage en alcool benzylique | 5,5 mL / 1,02 / 5 % |
| Durée de l’exposition | 20 min. |
| Fréquence exposition | 5 fois par jour |
| Durée d’utilisation du produit | 30 jours |
| Volume de la pièce | 20 m3 |
| Taux de renouvellement d’air | 0,6 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 0,94 mm Hg |
| Taux d’inhalation a | 9,3 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
| Variable - Scénario d’exposition |
Variable d’entrée - Revêtement protecteur général Exposition à la vapeur, taux constant |
|---|---|
| Quantité de produit utilisée | 3 000 g |
| Pourcentage d’alcool benzylique dans le produit | 70 |
| Durée de l’exposition | 60 min. |
| Durée d’émission | 24 h |
| Durée d’utilisation du produit | 35 jours |
| Volume de la pièce | 35 m3 |
| Taux de renouvellement d’air | 1,5 h‑1 |
| Valeur maximale pour limiter la concentration à la vapeur saturée | 0,094 mm Hg |
| Taux d’inhalation a | 14,4 m3/j |
| Poids moyen d’un adulte | 70,9 kg |
a Activité légère (Santé Canada 1998).
| Produit | Groupe d’âge (années) | Exposition systémique (mg/kg p.c./j) | ME |
|---|---|---|---|
| Crème/hydratant pour le corps |
0–5 mois 6–11 mois 1 2–3 4–8 9–13 14–18 19+ |
159 137 141 137 108 92 81 68 |
2,5 à 5,9 2,9 2,8 2,9 3,7 4,3 5,0 5,9 |
| Désodorisant/antisudorifique |
9–13 14–18 19+ |
3,3 8,6 7,8 |
122 46 51 |
| Démaquillant pour les yeux |
4–8 9–13 14–18 19+ |
0,011 0,006 0,002 0,002 |
37 000 67 000 220 000 260 000 |
| Crème faciale |
9–13 14–18 19+ |
1,3 1,2 2,0 |
305 330 197 |
| Maquillage/fond de teint |
4–8 9–13 14–18 19+ |
7,4 4,6 3,3 4,4 |
54 86 121 91 |
| Parfum |
9–13 14–18 19+ |
7,2 4,8 4,9 |
56 82 81 |
| Mousse pour cheveux |
2–3 4–8 9–13 14–18 19+ |
19 14 8,7 6,2 5,2 |
21 29 46 64 77 |
| Shampooing |
0–5 mois 6–11 mois 1 2–3 4–8 9–13 14–18 19+ |
0,31 0,31 0,28 0,17 0,21 0,09 0,08 0,09 |
1 290 1 300 1 440 2 340 1 900 4 480 4 800 4 560 |
| Huile de massage |
0–5 mois 1 2–3 4–8 9–13 14–18 19+ |
0,99 0,82 0,60 0,41 0,27 0,23 0,22 |
404 489 667 968 1 460 1 710 1 850 |
| Dissolvant pour vernis à ongles |
2–3 4–8 9–13 14–18 19+ |
0,76 0,5 0,8 0,54 0,46 |
526 807 498 735 877 |
Annexe C. Concentrations maximales de méthanol dans différentes catégories d’aliments
| Catégorie d’aliments visée par l’évaluation de l’exposition alimentaire | Concentration maximale de méthanol (ppm) | Aliments contenant la concentration maximale | Référence |
|---|---|---|---|
| Bière a | 34 | Bière taïwanaise |
Wang et al. 2004
DCP |
| Brandy a | 9 300 | Brandy de poire |
Nosko 1974
[VCF] ‡ |
| Vin fortifié* a | 329 | Vin fortifié | Rodda et al. 2013 |
| Eaux-de-vie* a | 328 | Whisky | Rodda et al. 2013 |
| Vin a | 209 | Vin rouge |
Montedoro et Bertuccioli 1983
[VCF] ‡ |
| Fruits – agrumes b | 213 | Jus d’orange Valencia |
Lum et al. 1990
[VCF] ‡ |
| Fruits – autres b | 16 | Framboises |
Duclos et al. 1971
[VCF] ‡ |
| Produits laitiers b | 0,009† | Beurre |
Nawar et al. 1988
[VCF] ‡ |
| Jus – pomme b | 136 | Jus de pomme Golden delicious | Ishii et Yokotsuka 1972 |
| Jus – raisin b | 132 | Jus de raisin Delaware | Ishii et Yokotsuka 1973 |
| Jus – pamplemousse b | 73,5 | (non pasteurisé) |
Shaw et al. 2000
[VCF] ‡ |
| Jus – orange b | 213 | Jus d’orange Valencia |
Lum et al. 1990
[VCF] ‡ |
| Jus – tomate b | 560 | Non pasteurisé |
Nelson et Hoff 1969
[VCF] ‡ |
| Jus – autre b | 113 | Jus d'ananas | Hou et al. 2008 |
| Légumes b | 4,4 | Lentilles |
Lovegren et al. 1979
[VCF] ‡ |
| Tomates et sauce de tomate b | 430 | Tomates fraîches |
Baldwin et al. 1991
[VCF] ‡ |
| Légumineuses b | 0,6 | Chou cuit |
MacLeod et MacLeod 1970
[VCF] ‡ |
| Vinaigre b | 193 | Vinaigre de vin rouge |
Callejón et al. 2008
[VCF] ‡ |
* Les panachés à base de vodka ou de vin fortifié ont été classés dans les catégories des spiritueux et des vins fortifiés, respectivement.
† La valeur rapportée était < 0,009 ppm.
‡ [VCF] = Base de données sur les composés volatils dans les aliments (Nijssen et al. 1953–2017).
a Boissons alcoolisées.
b Sources naturelles (autres que les boissons alcoolisées).
Annexe D. Résumé des différents règlements d’autres pays sur le 1,3‑DCP, adapté d’après le rapport du National Toxicology Program de 2005
| Pays ou organisation | Instance responsable / loi / disposition | Renseignement sur le règlement |
|---|---|---|
| États‑Unis | Toxic Substances Control Act (TSCA) | Le 1,3‑DCP est reconnu par la TSCA, qui impose aux producteurs et importateurs du produit chimique diverses restrictions et exigences en matière de rapports, d’essais et de tenue de registres. |
| États‑Unis | Food Chemicals Codex | Limite le 1,3‑DCP à 0,05 mg/kg (50 ppb) dans la sauce soja, concentration calculée sur une base sèche. |
| États‑Unis | FDA |
21CFR 173.60 : Le copolymère de diméthylamine‑épichlorohydrine (DEC) est utilisé comme agent de décoloration ou agent de floculation pour la clarification des liquides et jus sucrés raffinés. Sa concentration est limitée à 150 ppm de solides de sucre. Les concentrations de 1,3‑DCP et d’épichlorohydrine dans le DEC doivent être inférieures à 1 000 ppm et à 10 ppm, respectivement. 21CFR173.357 : Cette section a été modifiée dans le tableau du paragraphe par l’ajout des renseignements suivants : la DEC peut être utilisé comme agent de fixation pour immobiliser les préparations de l’enzyme glucose isomérase. Les préparations d’enzymes fixées sont utilisées dans la production de sirop de maïs à haute teneur en fructose. On a estimé que la limite résiduelle obligatoire de 1 000 ppm de 1,3‑DCP dans la DEC présente un risque minimal de cancer à vie pour les humains exposés à cette impureté. |
| États‑Unis | EPA | Détails concernant la quantité de 1,3‑DCP autorisée dans les déchets solides industriels et les gaz dégagés. |
| Australie / Nouvelle-Zélande | Food Standards Council | Code des normes alimentaires pour la sauce soja et la sauce aux huîtres : 0,005 mg/kg de 1,3‑DCP, sur une base de 40 % de poids sec. |
| Nouvelle-Zélande | Cosmetic Products Group Standard | Composants que les produits cosmétiques ne doivent pas contenir. |
| Royaume‑Uni | Dangerous Substance and Preparations Regulations | Substances visées par l’annexe 2 : Mentionnées dans les règlements 6A, 6B et 6C. |
| Royaume‑Uni | FSA | Avis à l’intention de l’industrie alimentaire afin de réduire les concentrations de 3‑MCPD autant que la technologie le permet. |
| Union européenne | Liste consolidée des substances C/M/R [cancérogènes, mutagènes ou toxiques pour la reproduction] | Inclut le 1,3‑DCP dans le groupe des cancérogènes de catégorie 2. |
| Union européenne | Substance incluse sur la Liste de l’OCDE de 2000 des substances chimiques produites en grande quantité | Enquête coopérative afin d’identifier les substances potentiellement dangereuses pour l’environnement et/ou pour la santé du grand public et des travailleurs. |
| Union européenne | Commission européenne | Règlement CE no 466/2002 : 0,02 mg/kg de 3‑MCPD dans l’acide PVH et la sauce soja, sur la base d’une teneur en matière sèche de 40 %. |
| Union européenne | Règlement de l’UE sur les cosmétiques | Liste des substances interdites dans les produits cosmétiques. |
| Organisation mondiale de la santé | JECFA | La dose admissible de 1,3‑DCP n’a pas été établie, en raison de la nature de sa toxicité. |
| Association des nations de l’Asie du Sud‑Est (ANASE) | Cosmetic Directive | Liste des substances qui ne doivent pas entrer dans la composition des produits cosmétiques. |
