Ébauche d’évaluation préalable - triclocarban
Titre officiel : Ébauche d’évaluation préalable - 3-(4-chlorophenyl)-1-(3,4-dichlorophényl)urée (triclocarban)
Numéro de registre du Chemical Abstracts Service 101-20-2
Environnement et Changement climatique Canada
Santé Canada
Octobre 2020
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et le ministre de la Santé ont effectué une évaluation préalable de la substance 3-(4-chlorophényl)-1-(3,4-dichlorophényl)urée, ci‑après appelée triclocarban. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ) pour le triclocarban est 101-20-2. Cette substance a été déclarée d’intérêt prioritaire pour une évaluation puisqu’elle répondait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
Selon les renseignements obtenus en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE, le triclocarban aurait été importé au Canada en volumes comprises entre 10 000 et 100 000 kg et entre 1 000 et 10 000 kg en 2008 et 2015, respectivement, mais les quantités fabriquées au Canada n’auraient pas dépassé le seuil de déclaration de 100 kg. Le triclocarban serait utilisé au Canada comme ingrédient antibactérien dans des produits cosmétiques et pharmaceutiques, dont les savons en barre et les nettoyants pour le visage.
Le risque du triclocarban pour l’environnement a été caractérisé selon l’approche de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au risque et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. On détermine les profils de risques en se fondant principalement sur divers paramètres, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité internes basés sur les réseaux trophiques, la biodisponibilité et l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons le vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. La méthode utilise une matrice du risque pour attribuer à ces substances un degré de préoccupation potentielle faible, modéré ou élevé, en fonction de leurs profils de danger et d’exposition. L’approche de la CRE a permis de classer l’exposition au triclocarban comme étant faible, d’après les profils d’emploi déclarés, et de classer le danger comme étant modéré. Comme cette substance est un agent antibactérien connu, sa classification de danger a été revue en utilisant un ensemble de données plus large que celui qui a été pris en compte dans l’analyse initiale selon la CRE. Sur la base de cette analyse supplémentaire, on considère que le triclocarban présente un danger élevé en raison de sa toxicité inhérente pour les organismes aquatiques et de son potentiel élevé de bioaccumulation dans les invertébrés et les gastéropodes aquatiques. Toutefois, en raison de son potentiel d’exposition limité, on considère que le triclocarban est peu susceptible de causer des dommages à l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d'évaluation préalable, le triclocarban présente un faible risque pour l'environnement. Il est proposé de conclure que le triclocarban ne répond pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
L’effet critique sur la santé relevé pour le triclocarban était une réduction du poids absolu et relatif des organes (rate, reins, foie, surrénales, cœur et hypophyse) accompagnée de modifications histologiques des organes dans les études sur les animaux. L’exposition au triclocarban a également entraîné des effets sur la diversité microbienne dans les excréments, le poids corporel et le poids des organes dans les études à doses répétées. De plus, on a observé, dans les études sur les animaux, des effets sur les tissus des organes reproducteurs mâles, la reproduction, les naissances vivantes, et une réduction du poids corporel des petits des rats et de la survie des petits. La population canadienne est principalement exposée au triclocarban par l’intermédiaire des cosmétiques et des produits pharmaceutiques. Les données de biosurveillance au Canada ont indiqué que la majeure partie de la population est faiblement exposée au triclocarban. Les marges d’exposition ont été jugées adéquates pour lever les incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est conclu que le triclocarban ne satisfait pas aux critères de l'alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que le triclocarban ne répond à aucun des critères de l'article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du triclocarban afin de déterminer si cette substance pose ou peut poser des risques pour l’environnement ou la santé humaine. Cette substance a été jugée d’intérêt prioritaire pour une évaluation dans le cadre du Plan de gestion des produits chimiques (PGPC) du Canada, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2007]).
Les risques posés à l’environnement par le triclocarban ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE décrit le danger associé à une substance en utilisant divers paramètres clés, dont le mode d’action, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. La CRE tient compte de l’exposition possible des organismes dans le milieu terrestre et aquatique, sur la base de facteurs comme le taux d’émission potentiel, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les diverses sources de données sont regroupées afin de relever les substances nécessitant une évaluation plus poussée qui permettra de déterminer leur potentiel ou leur probabilité d’effets nocifs sur l’environnement.
Pour la présente ébauche d’évaluation préalable, nous avons tenu compte des données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Des données environnementales pertinentes ont été trouvées par des recherches dans la littérature menées jusqu’en juillet 2018. Des données pertinentes pour la santé ont été trouvées jusqu’en octobre 2018. Des données empiriques tirées d’études clés ainsi que des résultats de modélisation ont servi à tirer les conclusions proposées. Lorsqu’ils étaient existants et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
La présente ébauche d’évaluation préalable a été rédigée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada (SC) et Environnement et Changement climatique Canada (ECCC), et elle inclut des intrants d’autres programmes de ces ministères. La partie de la présente évaluation portant sur la santé humaine a fait l’objet d’examens ou de consultations externes. Des commentaires sur les aspects techniques pertinents pour la santé humaine ont été reçus de R.S. Prosser (Université de Guelph, Canada), Hongbo Ma (University of Wisconsin – Milwaukee, États‑Unis), Ndeke Musee (University of Pretoria, Afrique du Sud) et Rolf Halden (Arizona State University, États‑Unis). Le volet environnemental de la présente évaluation est fondé sur le document décrivant la classification du risque écologique (publié le 30 juillet 2016), qui a fait l’objet d’une évaluation externe et d’une période de consultation publique de 60 jours. Les commentaires externes ont été pris en compte. Toutefois, Santé Canada et Environnement et Changement climatique Canada demeurent responsables du contenu définitif et des conclusions de la présente ébauche d’évaluation préalable.
La présente ébauche d’évaluation préalable est axée sur des données indispensables à la détermination de la conformité d’une substance aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des données scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . La présente ébauche d’évaluation préalable présente des données essentielles et des éléments à prendre en considération pour proposer une conclusion.
2. Identité de la substance
Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 3 ), le nom figurant dans la Liste intérieure des substances (LIS) et le nom commun du triclocarban sont présentés dans le tableau 2‑1.
| No CAS | Nom dans la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 101-20-2 | triclocarban | 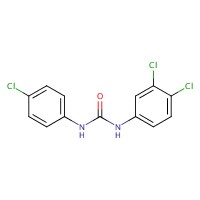 C13H9Cl3N2O C13H9Cl3N2O | 315,59 |
Synonymes : 1-(3',4'-dichlorophényl)-3-(4'-chlorophényl)urée; 3,4,4'-trichlorocarbanilide; 3,4,4'-trichlorodiphénylurée; carbanilide, 3,4,4'-trichloro-; N-(3,4-dichlorophényl)-N'-(4-chlorophényl)urée; N-(4-chlorophényl)-N'-(3,4-dichlorophényl)urée; trichlocarban; triclocarban; triclocarbanum; urée, N-(4-chlorophényl)-N'-(3,4-dichlorophényl)-; carbanilide, 3,4,4'-trichloro-; N-(4-chlorophényl)-N'-(3,4-dichlorophényl)urée; triclocarban; urée, N-(4-chlorophényl)-N'-(3,4-dichlorophényl)-; carbanilide, 3,4,4'-trichloro- (ChemIDplus, 2016).
Le triclocarban est un carbanilide composé de cycles benzéniques mono- et dichlorés liés par l'urée (également connu sous le nom de carbamide).
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques du triclocarban sont présentées dans le tableau 3‑1. Des propriétés physicochimiques supplémentaires figurent dans ECCC (2016b).
| Propriété | Valeur | Type de données | Référence clé |
|---|---|---|---|
| État physique | Solide | Expérimental | O’Neill 2013 |
| Point de fusion (°C) | 255,6 °C | Expérimental | Bradley 2014 |
| Pression de vapeur (Pa, 25 °C) | 3,6 x 10-4 | Modélisé | PubChem 2019 |
| Constante de la loi d’Henry (Pa·m³/mol) | 4,6 x 10-6 | Modélisé | PubChem 2019 |
| Solubilité dans l’eau (mg/L à 25 °C) | < 0,01 | Expérimental | REACH 2019 |
| Log Koe (sans dimension) | 4,32 | Expérimental | REACH 2019 |
| pKa (sans dimension, 20 °C) | 1,6 x 10-14 | Expérimental | REACH 2019 |
Abréviations : Koe : coefficient de partage octanol-eau; pKa : constante de dissociation acide.
4. Sources et utilisations
Le triclocarban était l’une des substances visées par les enquêtes menées en vertu de l’article 71 de la LCPE (Canada 2009, 2017Note de bas de page 4 ). Cette substance n’a pas été déclarée comme ayant été fabriquée au Canada au cours des années de déclaration 2008 et 2015. Les répondants ont déclaré avoir importé 10 000 à 100 000 kg et 1 000 à 10 000 kg de triclocarban au Canada en 2008 et 2015, respectivement. Les répondants ont déclaré l’avoir utilisé comme principe actif dans les produits de santé naturels, comme agent antibactérien dans les savons et pour prévenir les odeurs corporelles (Canada 2009, 2017).
Le triclocarban figure dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) en tant que produit de santé non naturel, et ne fait pas partie des produits de santé naturels homologués au Canada (BDIPSN 2019; BDPSNH 2018). Le triclocarban n’est pas un additif alimentaire, un additif indirect ou un composant utilisé pour fabriquer des matériaux d’emballage alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 31 août 2018; source non citée). Le triclocarban n’est pas un principe actif ni un formulant dans les produits antiparasitaires homologués (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 31 août 2018; source non citée).
Le triclocarban ne figure pas actuellement sur la Liste critique des ingrédients cosmétiques (Santé Canada 2018). Selon les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques entre décembre 2015 et décembre 2018, le triclocarban est utilisé au Canada dans sept produits cosmétiques, y compris dans les savons en barre et les nettoyants pour le visage (données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 7 janvier 2019; source non citée). On a aussi déclaré qu’il était utilisé comme principe actif dans un seul savon médicamenteux en vente libre qui est approuvé mais non commercialisé actuellement (communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 31 août 2018; source non citée).
Le triclocarban figure dans la Base de données des ingrédients du Conseil des produits de soins personnels en raison de ses fonctions déclarées de biocide cosmétique, d’agent déodorant et d’agent de conservation et de son utilisation déclarée dans les huiles, tablettes et sels de bain, les savons de bain et détergents, les produits de nettoyage, les déodorants et les poudres (PCPC 2018).
Le triclocarban a été trouvé en Europe dans diverses catégories de produits, y compris les produits d’assainissement de l’air, les revêtements et les peintures, les diluants, les décapants, les agents de remplissage, les mastics, les plâtres, la pâte à modeler, les peintures aux doigts, les encres et les toners, les produits pharmaceutiques, les produits de lavage et de nettoyage (CoRAP 2018). Le triclocarban n’a pas été trouvé dans ces produits ou d’autres produits disponibles aux consommateurs au Canada, autres que ceux énumérés ci‑dessus.
En Europe, le triclocarban est limité à moins de 1,5 % dans les produits cosmétiques à rincer lorsqu’il est utilisé à des fins autres que la conservation (Annexe III/100, EC 2018a), et à 0,2 % dans les produits cosmétiques lorsqu’il est utilisé comme agent de conservation (Annexe V/23, EC 2018b). La FDA des États‑Unis a publié une règle finale stipulant que le triclocarban (et 18 autres principes actifs) n’est pas généralement reconnu comme étant sûr ou efficace dans les produits de consommation antiseptiques destinés au lavage (mains et corps) en raison d’un manque de données permettant d’étayer l’innocuité et l’efficacité dans ce contexte (US FDA 2016).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par le triclocarban ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition, avec pondération de plusieurs sources de données, pour classer le risque. Les diverses sources de données sont combinées pour que l’on puisse distinguer les substances présentant une toxicité faible ou élevée et un risque d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex., CL50). Les paragraphes suivants résument l’approche, décrite en détail dans le document d’ECCC (2016a).
Les données sur les propriétés physicochimiques (demi-vie chimique dans divers milieux et biotes, coefficient de partition, bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson et les quantités importées ou produites au Canada proviennent de publications scientifiques, de bases de données empiriques (p. ex., boîte à outils QSAR de l’OCDE 2016) et des résultats d’enquêtes menées conformément à l’article 71 de la LCPE. Elles ont aussi été obtenues au moyen de modèles de type QSAR (relation quantitative structure-activité), du devenir du bilan massique ou de données sur la bioaccumulation. Ces données ont été utilisées soit pour alimenter d’autres modèles de bilan massique, soit pour compléter les profils des risques et de l’exposition des substances.
Nous avons déterminé les profils de dangers en nous fondant principalement sur les mesures du mode d’action toxique, de la réactivité chimique, des seuils de toxicité internes basés sur les réseaux trophiques, de la biodisponibilité et de l’activité chimique et biologique. Les profils d’exposition étaient également basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de catégoriser le potentiel de danger et d’exposition de chaque substance organique en trois niveaux : faible, modéré ou élevé. Nous avons aussi appliqué d’autres règles (p. ex., cohérence de la classification, marge d’exposition) pour préciser les classifications préliminaires du danger et de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen ou élevé à faible pour les substances présentant une estimation faible de la vitesse d’émission dans l’eau après traitement des eaux usées, ce qui représente un faible potentiel d’exposition. La deuxième étape servait à revoir les résultats d’une classification du potentiel de risque faible au moyen de scénarios de risque relativement prudents à l’échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer s’il fallait classer le risque potentiel à un niveau supérieur.
La CRE est une approche pondérée qui vise à réduire au minimum le surclassement ou le sous-classement du danger, de l’exposition et des risques subséquents. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le document ECCC 2016a. Nous décrivons ci‑après deux des domaines d’incertitude les plus importants. Une erreur dans les valeurs empiriques ou modélisées de toxicité aiguë pourrait modifier le classement du danger, surtout si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.‑à‑d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE, 2016). L’incidence d’une telle erreur est toutefois atténuée par le fait qu’une surestimation de la létalité médiane générera une valeur prudente (protectrice) de résidus dans les tissus qui sera utilisée lors de l’analyse des résidus corporels critiques (RCC). L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que la structure associée au mode d’action, la réactivité ou l’affinité de liaison aux œstrogènes. Les changements ou les erreurs touchant les quantités chimiques pourraient mener à un classement différent de l’exposition, car le classement de l’exposition et du risque est très sensible à la vitesse d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures. Les données indispensables et les éléments à prendre en compte pour développer les profils propres au triclocarban et les résultats de la classification du danger, de l’exposition et du risque sont présentés dans le document ECCC 2016b.
L’approche de la CRE a permis de classer l’exposition comme étant faible, basée en partie sur les profils d’emploi et les quantités déclarées dans le commerce (1 000 – 10 000 kg, Canada 2017), et de classer le triclocarban comme présentant un danger modéré. D’après cette combinaison de données, le triclocarban a été classé comme présentant un faible risque pour l’environnement. Les données mesurées dans les eaux de surface au Canada indiquent que les concentrations de triclocarban étaient inférieures à la limite de détection déclarée de 0,006 µg/L (Garcia‑Ac et al. 2009), ce qui corrobore le résultat de la classification CRE, à savoir qu’il est associé à une faible exposition pour les animaux sauvages. Le danger modéré a été déterminé à l’aide des règles de classification appliquées dans l’approche de la CRE, en particulier celles qui sont associées au facteur d’évaluation du danger (FED) en milieu aquatiqueNote de bas de page 5 et de la biodisponibilité.
Comme le triclocarban est un agent antibactérien connu avec un profil de dangerosité potentiellement élevé, une caractérisation supplémentaire du danger pour l’environnement a été réalisée à l’aide d’un ensemble de données plus grand que celui qui est utilisé dans le cadre de l’approche de la CRE. Les données empiriques sur la toxicité du triclocarban indiquent un danger élevé (plutôt qu’un danger modéré) pour les espèces aquatiques, en particulier pour les invertébrés aquatiques (les valeurs de toxicité pour toutes les espèces vont de 0,13 à 910 µg/L); annexe A, tableau A-1). Les données empiriques sur la bioaccumulation semblent indiquer un potentiel élevé de bioaccumulation chez les invertébrés aquatiques, en particulier chez les daphnies (FBC/FBA : 1 240 – 82 900) et les gastéropodes (FBC/FBA : 1 600 – 7 943) (annexe A, tableau A-2), deux organismes qui n’ont pas été pris en compte dans les paramètres de la CRE.
Compte tenu de ces renseignements supplémentaires, le danger du triclocarban est probablement plus important que prévu, d’après les paramètres de la CRE. Même s’il est peu probable que l’exposition actuelle au triclocarban dans l’environnement canadien soit préoccupante, le triclocarban est considéré néanmoins comme présentant un danger élevé en raison de sa toxicité intrinsèque pour les espèces aquatiques et de son potentiel élevé de bioaccumulation chez les invertébrés et les gastéropodes aquatiques. Par conséquent, le triclocarban pourrait être préoccupant pour l’environnement canadien si l’exposition venait à augmenter.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
6.1.1 Milieux naturels et aliments
Milieux naturels
Des études sur les milieux naturels ont mesuré le triclocarban dans l’eau potable, le sol et la poussière domestique. Santé Canada a analysé 65 systèmes de traitement de l’eau potable au Canada dans le cadre de l’Enquête nationale sur les sous-produits de désinfection et certains contaminants émergents dans l’eau potable au Canada (2009‑2010). Les concentrations de triclocarban dans l’eau traitée et non traitée provenant de puits, de rivières ou de lacs étaient inférieures au seuil de détection minimal (4 ng/L) dans 92 % des sites d’échantillonnage disponibles. Lorsque la substance était détectée (dans quatre échantillons), les concentrations trouvées dans l’eau de puits variaient de 9,2 à 29,3 ng/L dans les échantillons non traités et de 109,9 à 160,5 ng/L dans les échantillons traités, et la concentration maximale trouvée dans tous les échantillons était de 160,5 ng/L. Ces données indiquent que les concentrations de triclocarban peuvent être plus élevées dans l’eau traitée que dans l’eau non traitée. Les raisons n’en sont pas claires (communication personnelle, courriel de la Direction des sciences de la santé environnementale et de la radioprotection de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 20 septembre 2018; source non citée). Le triclocarban était en concentrations inférieures à la limite de détection (LD) dans une étude sur l’eau potable réalisée dans trois arrondissements de Montréal (LD = 3 ng/L; Garcia‑Ac 2009). Le triclocarban n’a pas été détecté dans l’eau potable lors d’une première étude de surveillance menée dans 12 zones métropolitaines aux États‑Unis (LD = 10 ng/L; Monsanto 1980). Toutefois, il se peut que cette étude soit antérieure aux utilisations modernes en pratique et la LD était élevée. Dans une étude plus récente, le triclocarban a été détecté en Espagne dans de l’eau minérale et de l’eau du robinet à raison de 53 et 56 ng/L, respectivement (limite de quantification LQ = 0,1 ng/L; Carmona 2014).
Le triclocarban a été mesuré dans des sols agricoles, après épandage de biosolides. Les concentrations rapportées variaient considérablement selon l’endroit, ce qui peut être dû à l’ampleur de l’application antérieure ou à une contamination de fond. Au Québec, des échantillons de sol provenant de deux régions qui avaient reçu 12 et 11 épandages de biosolides municipaux entre 1991 et 2006 présentaient des concentrations moyennes de triclocarban de 53 et 13 ng/g, respectivement (Viglino 2011). Dans la région mi‑Atlantique et en Virginie du Nord, aux États‑Unis, les champs qui avaient reçu une seule application de biosolides au cours des 3 à 13 années précédentes présentaient une concentration moyenne de triclocarban de 107,1 ng/g (poids sec). Les champs qui avaient reçu plusieurs épandages au cours de cette même période présentaient une moyenne légèrement plus élevée de 131,9 ng/g (poids sec) (Lozano 2018). Dans l’Illinois, les champs sur lesquels des biosolides avaient été épandus pendant 33 ans présentaient une concentration maximale de triclocarban de 1 251 ng/g (poids sec) et le sol des parcelles témoins présentait une concentration maximale de 744 ng/g (poids sec; Xia 2010).
Aucune donnée de surveillance environnementale au Canada n’a été trouvée pour le triclocarban dans la poussière domestique. Une concentration médiane de 200 ng/g de triclocarban a été déclarée dans une étude portant sur des échantillons de poussière provenant d’une installation sportive et éducative à usage mixte aux États‑Unis (Hartmann 2016). Une étude menée sur des échantillons de poussière provenant de 19 installations sportives et de 27 maisons individuelles en Oregon a fait état d’une concentration moyenne de 497 ng/g, et d’une concentration maximale de 9 760 ng/g de triclocarban (Chen 2018).
Aucune étude de surveillance environnementale du triclocarban dans l’air intérieur et extérieur n’a été trouvée. Comme le triclocarban a une faible pression de vapeur, il ne devrait pas migrer dans l’air.
Aliments
L’utilisation agricole des biosolides municipaux et des eaux usées régénérées a été rapportée dans divers pays, dont le Canada et les États‑Unis, et ces biosolides et eaux usées contiennent du triclocarban issu de cosmétiques, de médicaments et de produits de santé naturels. Les biosolides et les eaux usées régénérées peuvent donc être des sources potentielles de triclocarban dans les aliments (NICNAS 2017, SCCP 2005, U.S. EPA 2009 et 2002).
Les études disponibles dans les publications scientifiques portent principalement sur l’estimation de l’absorption de triclocarban présent dans le sol et l’eau par les fruits, les légumes, les céréales ou les produits animaux. Cependant, ces études sont limitées à des essais expérimentaux ou consistent en modélisations. Les seules concentrations mesurées de triclocarban dans les aliments au détail, que ce soit au Canada ou ailleurs, provenaient d’échantillons de légumes à feuilles et à racines achetés dans un marché en Espagne (Aparicio et al. 2018), qui contenaient tous des concentrations détectables de triclocarban. Aux fins de la présente évaluation, on a supposé que la concentration maximale de triclocarban de 14,6 ppb (ng/g de matière sèche) rapportée par Aparicio et al. (2018) dans la laitue, soit 0,79 ppb en poids humide, représente une valeur prudente pour tous les aliments de la catégorie générale des « légumes ».
Le taux de consommation alimentaire des « consommateurs d’aliments seulement » pour la catégorie des « légumes » ingérés en une journée, d’après l’Enquête sur la santé dans les collectivités canadiennes (ESCC) de 2004, a été utilisé pour les enfants de 6 mois à 3 ans (Statistique Canada 2004), et les données de consommation de l’ESCC de 2015 ont servi à tous les autres groupes d’âgeNote de bas de page 3 (Statistique Canada 2015). L’exposition au triclocarban par voie alimentaire a été estimée de manière prudente, en multipliant la concentration maximale de triclocarban dans la laitue, décrite ci‑dessus, par les taux de consommation moyens et au 90e centile pour les légumes, d’après les données de l’ESCC. Les estimations de l’exposition moyenne et au 90e centile par les aliments variaient de 2,31 à 6,84 ng/kg p.c./j et de 4,69 à 13,71 ng/kg p.c./j, respectivement (communication personnelle, courriel de la Direction des aliments de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 5 mars 2019; source non citée).
Le triclocarban n’a pas été détecté dans le lait maternel (n = 56, LD = 0,86 µg/L) dans une étude régionale à Ottawa faisant partie de l’Étude concernant l'utilisation de plastiques et de produits de soins personnels durant la grossesse (étude P4) (Arbuckle 2015). L’exposition due à l’allaitement a été estimée en utilisant la LD de cette étude et considérée comme une mesure prudente, et a été incluse dans la valeur de la dose journalière admissible chez l’humain ci‑dessous, pour les nourrissons allaités.
En tenant compte de toutes les sources d’exposition relevées, par les milieux naturels et les aliments, les estimations de la dose journalière chez l’humain vont de 7,8 ng/kg p.c./j pour les adolescents de 14 à 18 ans, à 113,8 ng/kg p.c./j pour les nourrissons allaités (0 à 5 mois).
Le tableau B‑1 de l’annexe B résume l’absorption potentielle de triclocarban par les milieux naturels et les aliments.
6.1.2 Biosurveillance
La quantité totale de triclocarban dans l’urine fournit une mesure de l’exposition combinée de toutes les voies d’exposition et de toutes les sources (y compris les milieux naturels, les aliments et les produits d’usage quotidien) auxquelles les personnes sont exposées. Dans des études sur des humains, 27 % de la dose ingérée était éliminé dans l’urine dans les 3 jours suivant l’exposition par voie orale, et le triclocarban (composé libre et métabolites) a pu être détecté dans l’urine après une exposition par voie cutanée (Hiles 1978a; Scharpf 1975; Schebb 2011b). L’élimination après l’administration d’une dose par voie orale est biphasique, avec des demi‑vies de 2,4 et 20 heures (Hiles 1978a). L’élimination après l’exposition par voie cutanée est monophasique, avec une demi‑vie de 8 à 10 heures (Scharpf 1975).Les principaux métabolites du triclocarban détectés dans l’urine sont les formes glucuronidées du triclocarban ou du triclocarban hydroxylé (2’ ou 3’-hydroxy-triclocarban). Le triclocarban total est détecté après déconjugaison enzymatique et hydrolyse acide; le triclocarban libre est rarement détecté dans l’urine humaine (Birch 1978, Ye 2011, Zhou 2012). Voir la section 6.2.1 pour plus de détails sur la métabolisation et l’élimination du triclocarban.
Le triclocarban était l’objet d’une biosurveillance dans le cycle 2 (2009-2011) de l’Enquête canadienne sur les mesures de la santé (ECMS). Dans cette étude, le triclocarban total a été détecté dans l’urine après déconjugaison enzymatique et hydrolyse acide. Le triclocarban a été décelé dans l’urine de moins de 4 % d’un échantillon national représentatif de 2 549 Canadiens, âgés de 3 à 79 ans (limite de détection, LD = 1 µg/L). Le 95e centile était inférieur à la LD dans tous les groupes d’âge, y compris les enfants, à l’exception du groupe des 40 à 59 ans, pour lequel les valeurs n’ont pas été rapportées en raison d’une forte variation (Santé Canada 2013). Le triclocarban total a été détecté dans seulement 4 % des échantillons d’urine (LD = 1,1 µg/L) chez les femmes enceintes (n = 80) dans une étude régionale réalisée à Ottawa et faisant partie de l’Étude sur l’utilisation des plastiques et des produits de santé personnels pendant la grossesse (étude P4) (Arbuckle 2015).
Du triclocarban total (après déconjugaison enzymatique et hydrolyse acide) a été détecté dans 37 % des échantillons d’urine (LD = 0,1 µg/L) d’une population générale âgée de 6 ans et plus dans le cadre de l’enquête américaine National Health and Nutrition Examination Survey (NHANES, n = 2 686) en 2013-2014, avec une valeur au 95e centile de 13,4 µg/L et une valeur maximale de 588 µg/L (Ye 2016). La différence de concentration au 95e centile semble indiquer une utilisation plus répandue ou plus importante du triclocarban dans la population américaine. Cependant, la fréquence de détection plus faible au Canada peut être en partie attribuable à la LD plus faible utilisée dans l’enquête NHANES par rapport à celle de l’ECMS. Le taux de détection du triclocarban dans l’urine le plus élevé a été de > 99 % dans un groupe de 209 volontaires adultes en bonne santé en Chine (LD = 0,005 µg/L). La valeur maximale rapportée dans cette étude était de 192 µg/L (Yin 2016).
Le triclocarban a été détecté dans 22 % des échantillons d’urine d’enfants dans l’étude NHANES en 2013-2014, par rapport à 37 % chez les adultes, avec une concentration urinaire au 95e centile de 0,9 µg/L chez les enfants (Ye 2016). Cependant, dans une étude américaine de moindre envergure (n = 181), le triclocarban a été détecté dans 37 % des échantillons d’urine (LD = 0,1 µg/L) d’enfants âgés de 3 à 6 ans, avec une valeur maximale rapportée de 8,5 µg/L (Hoffman 2018). À l’échelle mondiale, la fréquence de détection du triclocarban dans l’urine d’enfants était de 28 % au Danemark (6 à 11 ans, LD = 0,01 µg/L), non détecté en Allemagne (LQ = 1,0 µg/L) et jusqu’à 70 % au Brésil (6 à 14 ans, LD = 0,004 µg/L) (Fredericksen 2013; Moos 2014; Rocha 2018a, 2018b). Les concentrations maximales mesurées étaient de 1,0 µg/L au Danemark et de 0,94 µg/L au Brésil (Fredericksen 2013; Rocha 2018a).
Le triclocarban a été détecté dans le sang du cordon ombilical dans 22 % des échantillons de 33 nouveau‑nés américains (LD non indiquée) et dans 65 % de 92 nouveau‑nés chinois (LD = 0,002 µg/L) (Pycke 2014; Wei 2017). La concentration maximale rapportée dans cette dernière étude était de 0,82 µg/L. Le triclocarban n’a pas été détecté dans les échantillons de méconium (n = 54, LD = 0,53 ng/g) ou de lait maternel (n = 56, LD = 0,86 µg/L) dans l’étude P4, et n’a pas été détecté dans les échantillons de lait maternel (n = 20, LD = 1,2 µg/L) dans une étude américaine (Arbuckle 2015; Ye 2006).
Les doses journalières estimées de triclocarban ont été calculées d’après des données de biosurveillance obtenues dans les études ECMS et NHANES (Santé Canada 2013; Ye 2006). Dans une étude de pharmacocinétique menée chez l’humain sur l’exposition au triclocarban par voie orale, des volontaires humains (n = 6 hommes, de 20 à 40 ans) ont reçu une dose unique de 2,2 µmol de triclocarban radiomarqué au 14C par kilogramme de poids corporel (Hiles 1978b). Le triclocarban a été absorbé rapidement et une concentration plasmatique maximale de 3,7 nmol/g a été atteinte en moins de 3 heures. La dose administrée a été éliminée à 27 % dans l’urine en 80 heures. La métabolisation du triclocarban n’entraîne pas de rupture de la structure de base, et donc la récupération du radiomarqueur 14C dans l’urine est une estimation fiable de l’élimination de la dose initiale par cette voie, et peut être considérée comme un biomarqueur pertinent. Dans le cadre des études de biosurveillance de l’ECMS et de l’enquête NHANES, on a détecté du triclocarban total dans l’urine après sa déconjugaison enzymatique et son hydrolyse acide, ce qui est considéré comme une mesure adéquate du triclocarban (Santé Canada 2013; Ye 2006).
Les doses journalières estimées ont été obtenues à partir des valeurs au 95e centile des études ECMS et de l’enquête NHANES, avec une fraction d’élimination urinaire de 27 %, selon Hiles (1978b). Les concentrations au 95e centile rapportées par l’ECMS étaient inférieures à la LD, et une valeur de 1,0 µg/L a été utilisée comme estimation prudente de la concentration dans l’urine. L’annexe C présente de plus amples renseignements sur les valeurs par défaut et les modèles utilisés pour calculer la dose journalière estimée. Les doses journalières estimées basées sur les données de biosurveillance canadiennes varient de 0,07 à 0,11 µg/kg p.c./j. Les valeurs d’absorption sont présentées dans le tableau 6‑1.
| Source | Groupe d’âge (ans) | CU ou CUCr, P95 | FEU | Dose journalière estimée (mg/kg p.c./j) |
|---|---|---|---|---|
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 3 à 5 | 5 Bq/L | 0,27 | 0,00011 |
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 6 à 11 | 5 Bq/L | 0,27 | 0,000093 |
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 12 à 19 | 5 Bq/L | 0,27 | 0,000074 |
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 20 à 39 | 5 Bq/L | 0,27 | 0,000074 |
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 40 à 59 | 5 Bq/L | 0,27 | 0,000074 |
| Cycle 2 de l’ECMS (2009-2011) (Santé Canada 2013) | 60 à 79 | 5 Bq/L | 0,27 | 0,000074 |
| NHANES, 2013-2014 (Ye 2006) | 6 à 11 | 0,778 µg/g Cr | 0,27 | 0,000033 |
| NHANES, 2013-2014 (Ye 2006) | 12 à 19 | 1,97 µg/g Cr | 0,27 | 0,00015 |
| NHANES, 2013-2014 (Ye 2006) | 20+ | 17,6 µg/g Cr | 0,27 | 0,0012 |
| NHANES, 2013-2014 (Ye 2006) | Tous | 14,6 µg/g Cr | 0,27 | 0,0010 |
Abréviations : CU = concentration urinaire, CUCr = concentration urinaire ajustée pour la créatinine; Cr = créatinine; FEU = fraction d’élimination urinaire.
6.1.3 Produits cosmétiques et médicaments
On a déclaré la présence de triclocarban dans des savons en barre pour le corps et des nettoyants pour le visage, qui sont classés comme produits cosmétiques ou produits médicamenteux au Canada. Les concentrations de triclocarban signalées dans ces produits vont de < 0,1 % à 3 % (données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 7 janvier 2019; source non citée; communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 31 août 2018; source non citée). L’exposition potentielle a été estimée sur la base d’hypothèses prudentes et de valeurs par défaut. L’annexe C contient plus de détails sur les valeurs par défaut et les modèles utilisés pour générer les estimations de l’exposition. Les scénarios d’exposition sentinelle sont présentés dans le tableau 6‑2.
Les valeurs d’absorption cutanée provenant de diverses études réalisées chez l’humain ont été utilisées pour estimer une dose interne. L’absorption cutanée a été mesurée in vitro dans des chambres à diffusion statique ou dynamique montées avec de la peau humaine d’adulte et de nouveau‑né (Wester 1985). Le triclocarban a été appliqué à une charge surfacique de 27 µg/cm2. À 37 °C, 0,26 % de la dose appliquée a été absorbéNote de bas de page 7 par la peau abdominale des nouveau‑nés, et 0,23 % par la peau abdominale des adultes dans une chambre à diffusion statique. Dans un modèle à diffusion dynamique, 6 % de la dose a été absorbé par la peau abdominale des adultesNote de bas de page 7 . Dans un essai in vivo, du triclocarban radiomarqué au 14C a été appliqué sur une superficie de peau de 500 cm2 à raison de 4 µg/cm2 chez 5 hommes volontaires. Au cours d’une période de 7 jours, 7,0 % de la dose appliquée avait pénétré dans la peau, d’après l’élimination urinaire (Wester 1985). Dans deux études séparées, l’absorption de triclocarban a été mesurée chez des volontaires humains, après qu’ils ont eu pris une douche avec un savon contenant du triclocarban. Dans la première étude, 6 sujets mâles adultes avaient utilisé environ 7 g de savon contenant 2 % de triclocarban (équivalant à une charge surfacique d’environ 8 µg/cm2 avant le rinçage, d’après les valeurs par défaut pour le groupe d’âge de 19 ans et plus). La récupération moyenne totale dans l’urine et les matières fécales était de 0,39 % de la dose appliquée (0,16 % dans l’urine sur 2 jours et 0,23 % dans les matières fécales sur 6 jours) (Scharpf 1975). Dans la deuxième étude, 6 volontaires adultes (5 hommes, 1 femme) ont utilisé un savon contenant 0,6 % de triclocarban, et l’ont appliqué à une dose maximale moyenne de 4 µg/cm2. Après s’être enduits de savon, les volontaires ont laissé la mousse reposer pendant 15 minutes avant de se rincer. L’élimination urinaire moyenne sur 72 heures était de 0,6 % de la dose appliquée, ou 0,5 mg par douche par personne (Schebb 2011b). Dans chacune de ces études, la dose appliquée rapportée était la dose avant le rinçage. D’après ces études, l’absorption cutanée du triclocarban appliqué sous forme de savon avec une charge surfacique > 8 µg/cm2 (avant le rinçage) peut être estimée de façon prudente à 0,39 % de la dose appliquée (selon Scharpf 1975). L’absorption cutanée du triclocarban appliqué sous forme de savon à raison de 4 µg/cm2 ou moins (avant le rinçage) peut être estimée à > 0,6 % de la dose appliquée, selon Schebb (2011b), car l’élimination par les matières fécales n’a pas été rapportée. Afin de procéder à une estimation prudente, une valeur d’absorption de 1,0 % a été appliquée aux scénarios ayant une charge surfacique < 4 µg triclocarban/cm2.
| Scénario | Limite supérieure de concentration (%) | Groupe d’âge | Charge surfacique a (µg/cm2) | Absorption cutanée | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|---|
| Savon corporel (solide) | 3,0 b | 19+ ans | 2,3 | 1,0 | 0,0053 |
| Savon corporel (solide) | 3,0 b | 9 – 13 ans | 2,2 | 1,0 | 0,0067 |
| Nettoyant pour le visage | 0,4 c | 19+ ans | 36 | 0,39 | 0,0011 |
| Nettoyant pour le visage | 0,4 c | 9 – 13 ans | 43 | 0,39 | 0,0014 |
a Charge surfacique avant le rinçage.
b Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 7 janvier 2019; source non citée.
c Communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 31 août 2018; source non citée.
6.2 Évaluation des effets sur la santé
Le triclocarban a été l’objet d’un examen par le Comité scientifique des produits de consommation de la Commission européenne, le National Industrial Chemicals Notification and Assessment Scheme du ministère australien de la Santé et dans le cadre du programme High Production Volume Challenge de l’EPA (SCCP 2005; NICNAS 2017; US EPA 2002). Certaines données de ces sources ont été prises en compte dans la présente évaluation.
6.2.1 Toxicocinétique
Le triclocarban est facilement absorbé et métabolisé par voie orale et intraveineuse chez l’humain, le rat et d’autres espèces. Cette substance est moins facilement absorbée par voie cutanée, mais les doses absorbées par cette voie sont rapidement métabolisées et éliminées. Lorsque la substance est absorbée, la métabolisation n’induit pas un bris de sa structure de base, et elle subit une hydroxylation suivie d’une conjugaison avec l’acide glucuronique et des sulfates en proportions diverses, selon les tissus. La conjugaison a lieu avec le triclocarban ou des espèces hydroxylées. Une très faible partie de la dose absorbée (< 1 %) migre dans les tissus, selon les études sur des animaux (Hiles 1977, 1978b). Chez l’humain, les rats et les singes, plus de 90 % de la dose orale absorbée est éliminé dans l’urine et les matières fécales, la plus grande partie l’étant dans les matières fécales (Hiles 1978a, 1978b, 1978c). L’élimination du triclocarban par l’urine se produit jusque pendant 80 heures, et par les matières fécales jusque pendant 12 jours (Hiles 1977, 1978a; Scharpf 1975; Schebb 2011b).
Études chez l’humain
Chez l’humain, le triclocarban a été rapidement absorbé après l’administration de doses orales, atteignant une concentration plasmatique maximale après moins de 3 heures (Hiles 1978a). Après une application cutanée sous la douche avec un savon contenant jusqu’à 2 % de triclocarban, les concentrations de triclocarban et de métabolites étaient inférieures au seuil de détection (10 ppb) dans le sang à tous les temps d’échantillonnage (Scharpf 1975; Taulli 1977). Après l’administration par voie intraveineuse, le triclocarban est passé par une très courte phase de distribution dans le plasma, avec une demi‑vie inférieure à 5 minutes, suivie d’une phase d’élimination avec une demi‑vie de 8,6 heures (Scharpf 1975). Après une dose unique par voie orale, les deux tiers aux trois quarts de triclocarban dans le sang étaient sulfonés dans les 3 heures, et moins de 10 % était glucurono-conjugués. Dans les 24 heures, plus de 95 % du triclocarban présent dans le plasma était sulfoné (Taulli1977;Birch 1978). Les métabolites du triclocarban ont été éliminés du plasma en deux phases : les glucuronides ont été éliminés avec une demi‑vie de 1,8 heure, et les sulfates l’ont été avec une demi‑vie de 20,2 heures (Hiles 1978a). On a trouvé très peu de données indiquant ou décrivant la distribution du triclocarban dans les organes chez l’humain. Toutefois, on a trouvé du triclocarban dans l’hypothalamus dans 1 des 24 échantillons, et dans la substance blanche dans 2 des 10 échantillons dans une étude de biosurveillance, et dans le sang de cordon dans des études additionnelles (Van Der Meer 2017; Wei 2017; Pycke 2014).
Après l’exposition par voie cutanée, c’est‑à‑dire sous la douche avec un savon contenant du triclocarban, les métabolites éliminés avaient été principalement glucuronidés et très peu du triclocarban d’origine avait été détecté dans l’urine. La concentration maximale de glucuronides de N-triclocarban dans l’urine a été observée 10 à 24 heures après la douche avec un savon contenant 0,6 % de triclocarban, et cette valeur variait considérablement d’un individu à l’autre. Les douches quotidiennes répétées ont donné lieu à une concentration stationnaire des glucuronides de triclocarban dans l’urine (Schebb 2011b; Scharpf 29175). Après une seule exposition cutanée, la majeure partie du triclocarban a été éliminée dans l’urine pendant jusqu’à 36 heures, soit jusqu’à 0,6 % de la dose appliquée et de plus 0,24 % de la dose appliquée avait été éliminé dans les matières fécales (Scharpf 1975; Schebb 2011b). Après l’application d’une dose par voie intraveineuse, 18 % de la dose absorbée a été éliminé dans l’urine après 24 heures, et 20 % après 4 jours. Une quantité additionnelle de 10 % a été éliminée dans les matières fécales dans les deux jours suivants, et 55 % après 12 jours (Scharpf 1975). Après l’administration d’une dose par voie orale, 27 % de la dose a été éliminé dans l’urine dans les 80 heures et 70 % dans les matières fécales dans les 120 heures, ce qui indique des différences possiblement propres à chaque voie d’élimination (Hiles 1978a).
Études chez les animaux
Chez les singes rhésus adultes, les concentrations plasmatiques ont augmenté rapidement jusqu’à 12 heures après une injection intraveineuse et ont augmenté relativement lentement entre 12 et 24 heures, ce qui laisse entrevoir une cinétique de premier ordre (Hiles 1978b). Chez des rats Sprague-Dawley mâles, 43 % d’une dose de 14C-triclocarban administrée par gavage a été récupéré dans l’urine, la bile et les tissus après 72 heures (Hiles 1977). Dans cette même étude, 7,8 % de la dose a été récupéré dans les matières fécales, la bile, l’urine et les tissus 72 heures après l’exposition par voie cutanée à du 14C-triclocarban, dans une solution de savon à 10 % (Hiles 1977). Après l’administration de la substance par diverses voies (intraveineuse, orale ou cutanée) à des rats mâles, les seuls tissus qui présentaient plus de 0,01 % du 14C administré étaient le foie, les reins, les testicules et les poumons, par ordre d’accumulation relative. Cependant, les quantités étaient très faibles, allant de 0,072 % à 0,04 % de la dose administrée pour le foie et les poumons, respectivement (Hiles 1977). Dans une étude de toxicité postnatale et pour la reproduction, l’administration de doses ad libitum dans l’eau potable à des souris CD-1 femelles, le triclocarban s’est déplacé à travers le placenta et a été transféré par le lait maternel. Des composés apparentés au triclocarban ont été détectés dans l’encéphale, le cœur, la graisse et les gonades femelles des descendants à raison de 7 à 18 % de la dose absorbée et des concentrations beaucoup plus faibles (< 1 à 7 % de la dose absorbée) ont été mesurées dans l’encéphale, les muscles et le cœur des mères (Enright 2017).
Tout comme chez l’humain, les principaux métabolites détectés dans le plasma après l’administration par voie intraveineuse et orale chez des singes rhésus adultes étaient des formes sulfonées du triclocarban. Dans la bile, la majeure partie des espèces de triclocarban étaient glucuronidées (Hiles 1978b; Taulli 1977; Birch 1978). Après une exposition cutanée chez des rats, les conjugués de glucuronide ont été détectés seulement dans le plasma chez les groupes ayant reçu les doses plus élevées (Schebb 2011b). Chez les singes, l’élimination du plasma s’est produite en deux phases : d’abord une élimination rapide des espèces de glucuronides, suivie d’une élimination plus lente des espèces de conjugués sulfatés (Hiles 1978b). Après l’administration par voie orale ou intraveineuse chez les rats, environ 90 % de la dose administrée a été éliminé dans les matières fécales ou la bile, et 4,3 % dans l’urine (Hiles 1977). Après l’administration par voie cutanée, la dose absorbée a été régulièrement éliminée sur 72 heures, à raison de 15,6 % dans l’urine et de 77 % dans la bile (Hiles 1977). Chez les singes rhésus, environ 20 % de la dose absorbée a été éliminé dans l’urine après l’administration par voie intraveineuse, le reste ayant été éliminé dans les matières fécales (Hiles 1978b).
6.2.2 Études de toxicité aiguë, irritation et sensibilisation
Le triclocarban présente une faible toxicité aiguë par les voies orale et cutanée (SCCP 2005). On n’a trouvé aucune étude sur la toxicité par inhalation. Cependant, on ne s’attend pas à ce qu’il y ait exposition par inhalation, en raison de la faible pression de vapeur de cette substance. Le triclocarban n’est pas une substance irritante ni un sensibilisant selon les études sur les animaux et les humains (SCCP 2005).
6.2.3 Génotoxicité
Le triclocarban a donné des résultats négatifs dans les tests d’Ames, avec et sans activation métabolique, chez les souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium à des doses atteignant 5 000 µg/plaque (Bayer AG 1992; Bonin 1982; REACH 2019). Un test d’aberration chromosomique in vitro sur des cellules d’ovaires de hamsters chinois, avec et sans activation métabolique, à des concentrations atteignant 2 000 µg/mL réalisé avec du triclocarban a également donné des résultats négatifs (Soap and Detergent Association 2002). Dans des essais réalisés dans le cadre du programme Tox21, le triclocarban s’est révélé génotoxique dans les lignées cellulaires déficientes en voies de réparation de l’ADN (Kim 2019).
6.2.4 Études à doses répétées
Dans une étude à doses répétées, des rates Sprague‑Dawley sevrées au JPN 22 (4 par groupe) ont été exposées à 0, 0,2 ou 0,5 % de triclocarban ajoutés dans les aliments (ce qui équivaut environ à 103 et 257 mg/kg p.c./j, respectivement) pendant 28 jours, suivis d’une période d’élimination de 28 jours (Kennedy 2018). Aucune différence importante n’a été observée dans le poids corporel ou la prise de poids corporel. Des échantillons de matières fécales ont été prélevés pendant toute l’étude et l’ARNr 16S a été séquencé à partir de l’ADN des matières fécales totales extraites pour déterminer la diversité du microbiote. La diversité phylogénétique a diminué grandement au fil du temps dans les deux groupes traités pendant la phase de traitement (par rapport au jour 0) sur l’ensemble de la période de traitement. La tendance à la baisse de la diversité phylogénétique (par rapport au jour 0) était statistiquement significative dans le groupe ayant reçu la dose faible au jour de traitement 28 et aux jours 5, 12 et 28 dans le groupe ayant reçu la dose élevée. La diversité phylogénétique a augmenté pendant la période d’élimination, et au jour d’élimination 8 (et par la suite) elle était significativement différente dans les deux groupes à partir du jour 2. Un changement statistiquement significatif de la communauté microbienne, par rapport aux groupes témoins, s’est produit dans les deux groupes traités le deuxième jour de traitement et s’est poursuivi tout au long de la phase de traitement. Pendant la phase d’élimination, les communautés microbiennes ressemblaient de plus en plus au microbiote témoin au fil du temps. Dans le groupe ayant reçu la dose faible, les différences étaient statistiquement significatives au jour 2 de la période d’élimination, mais ne l’étaient plus au jour 8 et par la suite. Dans le groupe ayant reçu la dose élevée, les différences étaient statistiquement significatives jusqu’au jour 11, mais ne l’étaient plus au jour 28. Il n’y a pas eu de différence significative en termes de diversité phylogénétique ou de communauté microbienne entre les groupes traités dans l’une ou l’autre des phases de l’étude. Au cours de la phase de traitement, les Firmicutes constituaient le phylum dominant présent dans les deux groupes traités, et les Bacteroidetes constituaient l’espèce dominante dans le groupe témoin et au jour 0 dans les groupes traités. Pendant la phase d’élimination, l’abondance relative des Bacteroidetes et des Firmicutes dans les groupes traités est revenue à des concentrations qui n’étaient pas significativement différentes de ceux du groupe témoin (Kennedy 2018).
Des groupes de 12 souris C57BL/6 mâles adultes ont été exposés à 0, 3, 10, 30 et 90 mg/kg p.c./j de triclocarban par intubation intragastrique pendant 35 jours, dans une étude des effets à court terme sur la fonction cardiaque (Xie 2018). Les animaux ont été sacrifiés au jour 35 et leurs cœurs ont été retirés pour des analyses histologiques et métabolomiques. On a observé une diminution statistiquement significative du le poids corporel par rapport aux témoins aux doses de 10, 30 et 90 mg/kg p.c./j. Une diminution statistiquement significative du poids absolu du cœur a été observée aux doses de 30 et 90 mg/kg p.c./j, et une diminution statistiquement significative du poids relatif du cœur par rapport au poids corporel a été observée dans tous les groupes traités. L’examen histopathologique a révélé que les fibres cardiaques étaient plus épaisses et moins tachées chez les animaux des groupes ayant reçu les deux doses les plus élevées. Les données métabolomiques ont montré de multiples effets sur le métabolisme cardiaque, y compris des variations de la concentration des métabolites endogènes et des enzymes cardiaques participant au métabolisme et à la synthèse des acides gras (Xie 2018). L’importance biologique des effets métaboliques n’a pas été clairement établie. Les modifications métaboliques induites par le triclocarban font intervenir le récepteur constitutif des androstanes (CAR), dont le triclocarban est un activateur établi. Ce récepteur joue un rôle central dans l’induction des enzymes CYP et de phase II, ainsi que dans le métabolisme des lipides et du glucose, entre autres processus. Cependant, le CAR est mal conservé d’une espèce à l’autre et les récepteurs CAR de différentes espèces varient considérablement pour ce qui est de leur capacité à se lier et à être activés par les produits chimiques qui l’activent (Omiecinski 2011). Par conséquent, les altérations métaboliques induites par le CAR et celles subséquentes touchant la physiologie cardiaque observées par Xie et ses collègues ne sont probablement pas pertinentes pour les humains.
Dans une étude de toxicité chronique de deux ans réalisée selon un protocole approuvé par la Food and Drug Administration des États‑Unis, des groupes de 80 rats Sprague‑Dawley ont été exposés à 0, 25, 75 et 250 mg/kg p.c./j de triclocarban dans les aliments (Monsanto 1981). Les signes cliniques, le poids corporel et la consommation d’aliments ont été surveillés tout au long de l’étude. Des examens ophtalmoscopiques ont été effectués régulièrement et des évaluations cliniques de l’hématologie, de la biochimie clinique et des analyses de l’urine ont été réalisées à 6, 12, 20, 23 mois pour les mâles et à 25 mois pour les femelles. Un examen macroscopique à l’autopsie et un examen pathologique ont été réalisés à la fin de l’étude. Les lésions macroscopiques ont été examinées au microscope pour détecter les changements néoplasiques. Aucun signe clinique ou mortalité lié au traitement n’a été observé pendant toute la durée de l’étude. Aucune différence n’a été observée en ce qui concerne les observations ophtalmiques, la consommation alimentaire ou les analyses d’urine. On a observé des signes de respiration laborieuse, d’émaciation, des râles et de la mortalité chez les mâles témoins et traités, respectivement, aux semaines 64 à 86 et 70 à 83, en raison d’une infection respiratoire. Le poids corporel moyen des mâles aux doses de 250 mg/kg p.c./j et des femelles aux doses de 75 et 250 mg/kg p.c./j était légèrement réduit par rapport aux témoins pendant la plus grande partie de l’étude. On a observé de l’anémie chez les mâles à 75 et 250 mg/kg p.c./j et chez les femelles à 250 mg/kg p.c./j. Une légère augmentation de la phosphatase alcaline sérique, de l’azote uréique, du glucose et de la bilirubine totale a été observée chez les mâles ayant reçu la dose élevée à différents moments. Les variations statistiquement significatives du poids des organes comprenaient une augmentation du poids du foie chez les deux sexes à 75 et 250 mg/kg p.c./j, une augmentation du poids de la rate à 75 (mâles) et 250 mg/kg p.c./j (mâles et femelles), et une augmentation du poids des testicules et du cœur chez les mâles à 250 mg/kg p.c./j. Les auteurs n’ont observé aucun changement microscopique pouvant expliquer l’augmentation du poids des organes, et ils ont indiqué que les variations de poids des organes pourraient donc ne pas être biologiquement significatifs. Une fréquence accrue de testicules petits et flasques a été observée chez les mâles à 250 mg/kg p.c./j qui sont morts spontanément ou qui sont morts dans un état moribond entre 12 et 23 mois. Une augmentation similaire liée au traitement n’était pas apparente lors du sacrifice au terme de l’étude. Il n’y avait pas non plus de preuve d’augmentations liées à la dose de la fréquence des tumeurs sur quelque foyer que ce soit (Monsanto 1981). Une DSENO de 25 mg/kg p.c./j a été sélectionnée par le SCCP (2005) pour cette étude sur la base de l’anémie, d’une variation du poids des organes et du poids corporel observés à 75 mg/kg p.c./j.
6.2.5 Études in vitro
Dans des cellules cancéreuses de la prostate, un co-traitement avec l’androgène et le triclocarban a accéléré l’activation d’un gène rapporteur, en l’occurrence la luciférase, par le promoteur de la séquence régulatrice appelée Androgen Response Element (ARE ou élément de réponse aux androgènes) par rapport à l’androgène seul. Cet effet a été supprimé par un inhibiteur, la bicalutamide, qui a empêché la liaison au récepteur des androgènes (Duleba 2011). La coexposition au triclocarban et à l’œstrogène ou à la dihydrotestostérone augmente l’activation par les œstrogènes ou les androgène du gène rapporteur de la luciférase dans les lignées cellulaires comme HeLa 9908 et MDA-2kb (Tarnow 2013; Huang 2014; Christen 2010; Chen 2008; Blake 2010; Ahn 2008). Dans les cellules de cancer du sein MCF-7, le triclocarban favorise la prolifération cellulaire, réduit l’expression de l’ARN et des protéines ERα, et stimule l’expression de l’AhR en contexte de co-expression avec les œstrogènes (Huang 2014; Tarnow 2013). Dans les cellules mammaires non cancéreuses (MCF10A), le triclocarban a induit des caractéristiques de type lésion précancéreuse, y compris une dépendance réduite aux facteurs de croissance, une croissance indépendante d’une fixation et une prolifération cellulaire accrue (Sood 2013). L’exposition au triclocarban a entraîné des changements significatifs dans l’abondance des transcrits sensibles aux hormones thyroïdiennes dans les cellules GH3 de rat, a inhibé l’absorption d’iodure et a inhibé l’activité de la peroxydase thyroïdienne dans des modèles cellulaires de thyroïde (Hinther 2011; Wu 2016).
Le triclocarban a induit une déplétion de l’ATP à des concentrations non cytotoxiques et un battement arythmique important dans des cardiomyocytes pluripotents dérivés de cellules souches humaines (Chaudari 2018). D’après un essai in vitro Tox21, le triclocarban serait une substance chimique ayant des effets sur la fonction mitochondriale (Xia 2018).
6.2.6 Études de toxicité pour la reproduction et le développement
Dans une étude de toxicité pour la reproduction sur trois générations, le triclocarban a été administré à des groupes de 12 mâles et 24 femelles de rats Charles River CD par le régime alimentaire à raison de 0, 250, 500, 1 000 et 3 000 ppm (correspondant à une dose de 0, 23, 50, 95 et 280 mg/kg p.c./j, respectivement) (Monsanto 1983). Le triclocarban a été administré au moins 60 jours avant l’accouplement et de façon continue par la suite. Chaque génération parentale a été accouplée pour produire deux portées et certains animaux de la F2 ont été accouplés pour produire une troisième portée. Les descendants de la deuxième portée des parents de la F0 et de la F1 ont été sélectionnés pour être les parents des générations suivantes. Les générations F2 et F3 ont reçu la substance d’essai pendant une période de croissance de 80 jours avant l’accouplement, puis de façon continue par la suite. Tout au long de l’étude, on n’a observé aucun signe clinique lié au traitement, aucun effet sur le poids corporel ou la consommation alimentaire chez les générations adultes durant les périodes de croissance ou entre les périodes d’accouplement. On n’a observé aucune tendance récurrente dans les effets sur le poids corporel ou la consommation alimentaire des parents pendant les phases de gestation ou de lactation de l’étude. Les indices d’accouplement et de la fertilité des mâles n’ont pas été touchés par le traitement chez aucune des générations autres que la F1. Le taux de gravidité a été inhabituellement faible dans le groupe ayant reçu 3 000 ppm pour la deuxième portée de la génération F1. Dans une petite étude satellite, parmi les animaux du groupe ayant reçu 3 000 ppm et qui n’ont pas montré de fertilité, 1 mâle sur 3 et 3 femelles sur 10 étaient infertiles. Le nombre moyen de petits vivants à la naissance était inférieur à celui des témoins pour les deux portées du groupe ayant reçu la dose maximale dans la génération F0. Un effet similaire n’a pas été observé chez les générations F1 et F2. Le poids moyen des petits était significativement réduit au JPN 21 dans les deux portées du groupe de la génération F0 ayant reçu la dose maximale. On a observé une réduction du poids de la rate et du foie par rapport aux témoins chez les petits de la deuxième portée de la F3 à partir de 1 000 ppm, et le rapport poids des reins/poids corporel était inférieur à celui des témoins pour les animaux du groupe ayant reçu 3 000 ppm. Des effets histologiques ont été observés dans les reins des petits de la première portée F1 à 500 ppm et plus. Une congestion splénique a été observée chez les petits des femelles de la F3 à 3 000 ppm. Chez la génération adulte, des différences ont été observées dans le poids absolu et relatif de la rate, des reins, du foie, des surrénales, du cœur et/ou de l’hypophyse à 500 ppm et plus. L’évaluation histopathologique de certains tissus d’animaux adultes ayant reçu 3 000 ppm a révélé des effets sur la rate, le foie, les reins et la moelle osseuse (Monsanto 1983). Une DSENO de 250 ppm (23 mg/kg p.c./j) a été rapportée par le SCCP (2005) pour ce qui est des effets systémiques chez la génération parentale, d’après une variation du poids absolu et relatif des organes chez les animaux ayant reçu 500 ppm, valeur qui a été étayée par des changements histologiques constatés à la dose de 3 000 ppm (Monsanto 1983). Une DSENO de 1 000 ppm (95 mg/kg p.c./j) pour la toxicité pour la reproduction et le développement a été rapportée par le SCCP (2005), d’après un taux de gravidité réduit, une diminution du nombre de petits vivants à la naissance et une réduction du poids des petits au JPN 21 observée à 3 000 ppm (280 mg/kg p.c./j).
Dans une étude modifiée de toxicité pour le développement, des rates Sprague‑Dawley gravides et allaitantes ont été exposées au triclocarban dans leurs aliments à 0, 0,2 % ou 0,5 % (environ 0, 103 et 257 mg/kg p.c./j, respectivement) pendant une période de gestation seulement, de gestation et lactation/allaitement, ou de lactation/allaitement seulement (Kennedy 2015). Dans la première partie de l’étude, les rates gravides ont reçu du triclocarban à raison de 0 (n = 4), 0,2 % (n = 5) ou 0,5 % (n = 5) dans leur alimentation entre les JG 5 à 19. Les mères ont été sacrifiées au JG 19. Le triclocarban a été détecté dans le sérum des mères et le liquide amniotique. Une diminution statistiquement significative de la prise de poids corporel et de la T3 sérique a été notée chez les mères du groupe ayant reçu la dose de 0,5 %. On n'a observé aucun effet sur la survie ou le nombre d’implantations, l’ensemble des organes, le poids des organes sexuels, l’évaluation histologique ou physiologique macroscopique des organes (foie, reins, surrénales et ovaires), l’œstradiol circulant, la testostérone, la progestérone, la thyroxine (T4) et l’hormone de stimulation de la thyroïde. Le deuxième volet de l’étude a été divisé en deux parties, A et B, dans lesquelles des rates gravides ont été exposées au triclocarban dans leurs aliments entre le JG 5 et le JPN 21 (sevrage) ou au JPN 14, respectivement. Dans la partie A de cette étude, les rates gravides ont été exposées à 0 (n = 5) ou 0,5 % (n = 5) entre le JG 5 et le JPN 21. Les mères ont été sacrifiées soit au JPN 21 ou le jour où les descendants restants mouraient. À la naissance, il n’y avait aucune différence dans le nombre de naissances vivantes ou le poids à la naissance entre les groupes. Les nouveau‑nés provenant de mères du groupe ayant reçu 0,5 % de triclocarban, et allaités par celles‑ci, n’ont pas survécu au‑delà du JPN 8. Tous les nouveau‑nés descendants des animaux témoins et allaités par ceux‑ci ont survécu au‑delà du sevrage. Des bandes de lait ont été observées chez les petits du groupe ayant reçu 0,5 % (ce qui indiquait une consommation de lait), mais les glandes mammaires prélevées chez les mères du groupe ayant reçu 0,5 % p/p présentaient des signes d’involution. Dans la partie B de cette étude, les femelles gravides ont été exposées à 0 (n = 5) ou 0,5 % (n = 5) du JG 5 au JPN 14. Dans cette partie de l’étude, les portées des mères du groupe ayant reçu 0,5 % ont été réduites à 6 petits au JPN 0 et 3 petits ont été remplacés par des petits témoins. Au JPN 3, les petits témoins ont été remplacés par des petits nouveaux et en santé et au JPN 6, tous les petits nés de mères traitées ont été remplacés par de nouveaux petits témoins. Au JPN 9, les petits témoins ajoutés à la portée au JPN 3 ont été remplacés par des petits en santé. Les cotes de bandes de lait étaient similaires entre les groupes témoins et les groupes traités au JPN 1 et au JPN 3, mais les bandes de lait étaient absentes au JPN 6 chez les petits nés de mères ayant reçu 0,5 % et élevés par celles‑ci. Les glandes mammaires des mères traitées au JPN 14 ne manifestaient pas d’involution lorsque des petits additionnels en santé étaient continuellement fournis aux mères pour maintenir une activité d’allaitement normale. Dans le troisième volet de l’étude, des rates gravides ont reçu 0 (n = 5), 0,2 % (n = 5) ou 0,5 % (n = 5) dans les aliments, entre le JG 5 et le JPN 21. Les portées ont été réduites à 6 petits et ont été croisées : chaque mère a porté et allaité 2 petits de sa propre portée, et 2 petits provenant de chacun des autres groupes d’essai. Tous les groupes de mères (n = 5) ont élevé 30 petits : 10 petits nés de mères ayant reçu 0,5 %, 10 petits nés de mères ayant reçu 0,2 %, et 10 petits provenant de mères témoins. À la naissance, il n’y avait pas de différence quant aux naissances vives ou au poids moyen par portée. Au JPN 3, le poids corporel moyen était 16 et 25 % plus faible que celui des témoins chez les petits élevés par les mères ayant reçu 0,2 % et 0,5 %, respectivement. Dans chaque groupe de mères, on n’a constaté aucune différence entre le poids corporel des petits ayant eu une exposition in utero différente. Aucun petit élevé par les mères ayant reçu 0,5 % de triclocarban n’a survécu au‑delà du JPN 5, peu importe le type d’exposition in utero (n = 30). Vingt‑sept des 30 petits élevés par les mères ayant reçu 0,2 % ont survécu jusqu’au JPN 6, mais seulement 4 animaux de ce groupe ont survécu au‑delà du jour de sevrage. Tous les petits élevés par des mères témoins ont survécu au‑delà de la période d’étude, peu importe l’exposition in utero. Au sevrage, le poids corporel moyen des 4 petits survivants élevés par la mère traitée à 0,2 % était environ la moitié de celui des petits élevés par les mères témoins (l’analyse statistique n’a pas été possible, car les 4 petits ont élevés par la même mère). Les abdomens de tous les petits élevés par les mères exposées à l’une ou l’autre concentration de triclocarban étaient distendus et tous les petits ont eu la diarrhée. Aux JPN 4 et 5, l’examen pathologique macroscopique des petits élevés par les mères ayant été traitées à 0,5 % a révélé de petits ulcères gastriques aigus et une vacuolisation graisseuse des hépatocytes. Le statut in utero n’a eu aucun effet sur la distance anogénitale, la date d’ouverture du vagin ou le premier œstrus après l’ouverture du vagin, ou le poids des organes. Le fait d’avoir été élevé ou non par une mère n’a eu aucun effet sur la distance anogénitale (Kennedy 2015). La DMENO sélectionnée pour cette étude est de 0,2 % de triclocarban (103 mg/kg p.c./j, soit la dose d’essai la plus faible), sur la base d’une réduction du poids corporel et de la survie des petits allaités par les mères traitées à cette dose et au‑delà.
Dans une étude de toxicité pour la reproduction et de tératogénicité, des lapines de Nouvelle-Zélande (n = 20/groupe) ont reçu 0 (pas de traitement), 0 (excipient seulement), 250, 500 ou 1 000 mg/kg p.c./j dans un mélange 2:1 de triclocarban et de 3‑trifluorométhyl-4,4’-dichlorocarbaniliinde (TFC) par voie cutanée entre les JG 7 et 18 (Nolan 1979). Le triclocarban et le TFC ont été administrés dans une solution de savon à 1 % appliquée sur une zone de 14 x 24 cm sur le dos de chaque lapine, avec rinçage après 4 heures. Les animaux ont été sacrifiés le 29e jour et les fœtus ont été retirés par césarienne. Aucune différence significative n’a été signalée en ce qui concerne le nombre de fœtus vivants/morts, les résorptions, les implantations, les corps jaunes, le poids des fœtus et les malformations (d’après des examens macroscopiques, des tissus mous et du squelette). Aucune toxicité maternelle n’a été observée, mais on a constaté une irritation cutanée légère chez tous les animaux traités (Nolan 1979).
Des rats mâles Sprague-Dawley castrés ont été traités avec du triclocarban ajouté à leur alimentation ou par injection de propionate de testostérone pendant 10 jours (Chen 2008). Les animaux ont été divisés en quatre groupes (n = 12/groupe), en fonction du traitement. Le groupe 1 a reçu une injection de solution saline et une alimentation normale, le groupe 2 a reçu une injection de 0,2 mg/kg p.c./j de propionate de testostérone et une alimentation normale, le groupe 3 a reçu une injection de solution saline et 0,25 % de triclocarban dans son alimentation (équivalant à 123 mg/kg p.c./j) et le groupe 4 a reçu une injection de 0,2 mg/kg p.c./j de propionate de testostérone et 0,25 % de triclocarban dans son alimentation. Aucune différence significative n’a été détectée dans le poids corporel total, le poids des reins ou du foie entre les groupes. Aucune différence significative n’a été observée pour ce qui est du poids des vésicules séminales, de la glande de Cowper, du muscle élévateur de l’anus bulbo-caverneux (EABC) et du gland du pénis entre les rats témoins (groupe 1) et les rats ayant reçu uniquement du triclocarban (groupe 3). Une augmentation du poids de la prostate ventrale a été constatée chez les rats traités au triclocarban seulement (groupe 3), par rapport aux rats témoins (groupe 1). Le traitement avec le propionate de testostérone seulement (groupe 2) a augmenté de manière significative le poids des organes sexuels accessoires, par rapport aux témoins (groupe 1) et aux animaux ayant reçu du triclocarban seulement (groupe 3). Le traitement au propionate de testostérone et au triclocarban a entraîné une augmentation significative du poids de tous les organes sexuels accessoires, par rapport au traitement au propionate de testostérone seul, ce qui indique une synergie potentielle entre le propionate de testostérone et le triclocarban in vivo (Chen 2008).
Dans une étude de toxicité pour la reproduction chez les mâles, des rats mâles Sprague-Dawley (âgés de 48 à 52 jours) ont été divisés en groupes de 12 et traités avec 0 ou 0,25 % de triclocarban (équivalant à 129 mg/kg p.c./j) dans les aliments pendant 10 jours (Duleba 2011). Les animaux du groupe traité ont pris beaucoup plus de poids (poids final supérieur de 5,1 %) par rapport aux témoins. Les animaux traités avaient également un poids absolu et relatif du foie plus élevé que les témoins, mais le poids des reins, des surrénales et des testicules n’a pas été touché. On a également observé un poids absolu et relatif significativement plus élevé pour ce qui est des vésicules séminales (42 %), de la prostate ventrale (42 %), du muscle EABC (136 %) et du gland du pénis (35 %). On a également observé un poids sec nettement plus élevé des vésicules séminales, du muscle EABC et du gland du pénis, bien qu’on n’ait constaté aucune anomalie visible ou de différences histologiques dans les glandes sexuelles accessoires, le pénis ou les testicules. On a observé une hyperplasie dans les glandes vésiculaires qui étaient distendues de manière variable et contenaient du liquide, et avaient formé de nombreux plis complexes qui se sont étendus jusque dans la lumière et dans les acini de la prostate qui étaient également distendus par rapport aux témoins. Une teneur en protéines et en ADN significativement plus élevée a été observée dans la prostate ventrale, le muscle EABC et le gland du pénis par rapport aux témoins. Les concentrations de testostérone et d’hormone lutéinisante dans le sérum n’ont pas été modifiées de manière significative par le traitement au triclocarban (Duleba 2011).
6.2.7 Épidémiologie
Dans des études épidémiologiques, des associations potentielles ont été constatées entre les concentrations urinaires de triclocarban et les concentrations d’hormones pendant la grossesse et la diminution de l’âge gestationnel à la naissance (Aker 2018, Geer 2017). Dans un échantillon de cas-témoins (imbriqué dans une étude de cohorte) de 439 femmes enceintes, une diminution faible, mais statistiquement significative, de la triiodothyronine (T3) sérique totale (sur la base d’échantillons prélevés jusqu’à 4 périodes différentes de la grossesse) a été observée en relation avec une augmentation interquartile des concentrations urinaires de triclocarban (mesurées comme variable binaire : soit au‑dessus, soit en dessous de la LD). Une augmentation non significative de l’hormone de stimulation de la thyroïde (TSH) a également été associée à des concentrations de triclocarban supérieures à la LD. Cependant, l’association avec la concentration de T3 n’était plus significative dans une analyse de sensibilité réalisée chez des femmes ayant accouché à terme (> 37 semaines de gestation) (Aker 2018). Dans un groupe de 34 nouveau‑nés, la concentration de triclocarban dans le sang du cordon ombilical a été associée à une probabilité accrue de diminution de l’âge gestationnel à la naissance. Dans une analyse de sensibilité, le 2’-hydroxy-triclocarban a été associé de manière marginalement significative à une diminution de la longueur du corps à la naissance, mais le triclocarban dans le sang du cordon ombilical n’était plus associé à l’âge gestationnel à la naissance (Geer 2017).
Aucune association n’a été rapportée entre les concentrations urinaires de triclocarban et la croissance fœtale, les malformations fœtales, les lésions de l’ADN chez les enfants, la fréquence du diabète, la fécondité (délai avant la grossesse) et les paramètres de qualité du sperme adulte (Ferguson 2018; Wei 2017; Rocha 2018a; Li 2018; Smarr 2017, 2018).
6.3 Caractérisation des risques pour la santé humaine
Selon des études de toxicité aiguë, le triclocarban présente une faible toxicité pour les mammifères, il est peu irritant pour les yeux et la peau, et il n’est pas un sensibilisant. Dans une étude de toxicité de deux ans par le régime alimentaire, une anémie, une réduction du poids corporel et une augmentation du poids des organes ont été constatées chez le rat à des doses de 75 mg/kg p.c./j et plus, avec une DSENO de 25 mg/kg p.c./j (Monsanto 1981). Cette DSENO a été choisie comme point de départ par le SCCP de la Commission européenne dans son Avis sur le triclocarban (2005). Dans une étude de toxicité pour la reproduction par le régime alimentaire sur trois générations, une réduction du taux de grossesse chez la génération F1, une réduction du nombre de petits vivants à la naissance chez la génération F0, une réduction du poids corporel des petits de la génération F0 et une réduction du poids des organes des petits de la génération F3 ont été rapportées à 280 mg/kg p.c./j (bien qu’aucun de ces effets n’était présent chez toutes les générations), ce qui a donné lieu à une DSENO de 95 mg/kg p.c./j rapportée par le SCCP (2005) pour les effets sur la reproduction (Monsanto 1983). Dans cette même étude, une DSENO de 23 mg/kg p.c./j a été rapportée par le SCCP (2005) pour ce qui est des changements de poids absolu et relatif des organes (rate, reins, foie, surrénales, cœur et hypophyse) chez les parents, constatations étayées par des changements histologiques. Toutefois, aucun effet significatif sur la reproduction, la tératogénicité ou la toxicité maternelle n’a été rapporté chez les lapins lorsque jusqu’à 1 000 mg/kg p.c./j d’un mélange 2:1 de triclocarban et de TFC était appliqué par voie cutanée pendant la gestation (Nolan 1979).
Des effets ont également été observés à la plus faible dose par voie orale testée (103 à 129 mg/kg p.c./j) dans une étude à doses répétées et trois études de toxicité pour la reproduction et le développement de courte durée. Dans une étude par le régime alimentaire sur 28 jours, des changements significatifs de la diversité microbienne dans les matières fécales ont été observés aux doses de 103 mg/kg p.c./j et plus (dose d’essai la plus faible; Kennedy 2018). Dans une étude modifiée de toxicité pour le développement, on a observé une réduction du poids corporel et de la survie chez les petits (rats) nourris par des mères traitées à raison de 103 mg/kg p.c./j dans leurs aliments (plus faible dose testée) et plus (Kennedy 2015). Une augmentation significative du poids de multiples organes sexuels accessoires a été notée chez des rats mâles castrés lorsque la testostérone était administrée conjointement avec une dose dans les aliments de 123 mg/kg p.c./j de triclocarban (Chen 2008). Dans une étude connexe de toxicité pour la reproduction chez les mâles, les organes sexuels accessoires chez des rats mâles traités à raison de 129 mg/kg p.c./j dans les aliments ont présenté une augmentation du poids absolu et relatif, une hyperplasie et une morphologie altérée (Duleba 2011). Les effets sur le système reproducteur mâle sont cohérents avec les études in vitro qui montrent une amplification de la signalisation induite par la testostérone en présence de triclocarban.
Les scénarios d’exposition sentinelle pour le triclocarban sont basés sur l’utilisation topique quotidienne de produits cosmétiques et l’exposition par voie orale aux milieux naturels et aux aliments. En tenant compte des effets critiques et de la longue durée des scénarios d’exposition sentinelle, la DSENO de 23 mg/kg p.c./j pour la toxicité systémique dans une étude sur la toxicité pour la reproduction par le régime alimentaire sur trois générations a été sélectionnée comme point de départ. Les marges d’exposition résultantes devraient assurer une protection contre les effets sur la reproduction et autres effets systémiques rapportés dans des études de courte durée et dans une étude de toxicité chronique sur deux ans.
La population canadienne est exposée au triclocarban par les milieux naturels (y compris les aliments, l’eau potable et la poussière), les produits cosmétiques et les produits médicamenteux. Les données de biosurveillance indiquent que plus de 96 % de la population canadienne présente une concentration urinaire de moins de 1 µg/L de triclocarban. Dans une étude canadienne, le triclocarban n’a pas été détecté dans le lait maternel ou le méconium. Pour tenir compte du risque associé à l’exposition au triclocarban par les milieux naturels et les produits, les marges d’exposition résultant de l’exposition modélisée dans les scénarios sentinelles sont présentées dans le tableau 6‑3.
| Scénario d’exposition | Exposition systémique (mg/kg p.c./j) | Dose critique (mg/kg p.c./j) | Paramètre critique pour la santé | ME |
|---|---|---|---|---|
| Milieux naturels et aliments (0‑5 mois, nourris au sein) | 1,1 x 10-4 | DSENO 23 | Diminution du poids absolu et relatif des organes; histologie modifiée des organes | 200 000 |
| Savon corporel (solide, 9 à 13 ans) | 0,0067 | DSENO 23 | Diminution du poids absolu et relatif des organes; histologie modifiée des organes | 3 430 |
| Nettoyant pour le visage (9 à 13 ans) | 0,0014 | DSENO 23 | Diminution du poids absolu et relatif des organes; histologie modifiée des organes | 16 400 |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé.
À la lumière des paramètres prudents utilisés dans la modélisation de l’exposition aux produits, les marges calculées sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau suivant.
| Principales sources d’incertitude | Effet |
|---|---|
| Aucune donnée canadienne ou nord-américaine pour le triclocarban dans les aliments au détail n’a été trouvée. La concentration maximale de triclocarban signalée dans la littérature scientifique sur la laitue a été utilisée pour représenter tous les légumes dans l’évaluation d’ingestion alimentaire. | +/- |
| Il y avait peu d’études à doses répétées par voie cutanée pour le triclocarban. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d'évaluation préalable, le triclocarban présente un faible risque pour l'environnement. Il est proposé de conclure que le triclocarban ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le triclocarban ne satisfait pas aux critères de l'alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que le triclocarban ne satisfait à aucun des critères de l'article 64 de la LCPE.
Références
Ahn KC, Zhao B, Chen J, Cherednichenko G, Sanmarti E, Denison MS, Lasley B, Pessah IN, Kultz D, Chang DPY, Gee SJ, Hammock BD. (2008) In vitro biologic activities of the antimicrobials triclocarban, its analogs, and triclosan in bioassay screens: receptor-based bioassay screens. Environ Health Perspect 116: 1203-10. (disponible en anglais seulement)
Albanese KA, Lanno RP, Hadad CM, Chin Y-P. 2017. Photolysis- and dissolved organic matter-induced toxicity of triclocarban to Daphnia magna. Environ Sci Technol Lett 4: 457-462 (disponible en anglais seulement)
Aker AM, Johns L, McElrath TF, Cantonwine DE, Mukherjee B, Meeker JD. (2018) Associations between maternal phenol and paraben urinary biomarkers and maternal hormones during pregnancy: A repeated measures study. Environ Int 113: 341-349. (disponible en anglais seulement)
Aparicio I, Martín J, Abril C, Santos JL, Alonso E. 2018. Determination of household and industrial chemicals, personal care products and hormones in leafy and root vegetables by liquid chromatography-tandem mass spectrometry. Journal of Chromatography A 1533: 49–56. (disponible en anglais seulement)
Arbuckle TE, Weiss L, Fisher M, Hauser R, Dumas P, Berube R, Neisa A, LeBlanc A, Lang C, Ayotte P, Walker M, Feeley M, Koniecki D, Tawagi G. (2015) Maternal and infant exposure to environmental phenols as measured in multiple biological matrices. Science of the Total Environment 508: 575–584. (disponible en anglais seulement)
Arnot JA, Mackay D. 2008. Policies for chemical hazard and risk priority setting: Can persistence, bioaccumulation, toxicity and quantity information be combined? Environ. Sci. Technol. 42(13): 4648-4654. (disponible en anglais seulement)
Aylward LL, Vezina A, Deveau M, St. Amand A, Nong A, Hays S. 2015. Biomonitoring Equivalents for interpretation of urinary fluoride. Reg. Toxicol. Pharmacol. 72:158-167. (disponible en anglais seulement)
Barros S, Montes R, Quintana JB, Rodil R, Oliveira JMA, Santos MM, Neuparth T. 2017. Chronic effects of triclocarban in the amphipod Gammarus locusta : behavioural and biochemical impairment. Ecotoxicology and Environmental Safety 135: 276-283. (disponible en anglais seulement)
Bayer AG (1992) Preventol SB - Salmonella/microsome test. Report no. 21078. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Birch CG, Hiles RA, Eichhold TH, Jeffcoat AR, Handy RW, Hill JM, Willis SL, Hess TR, Wall ME. (1978)Biotransformation products of 3,4,4'-trichlorocarbanilide in rat, monkey, and man. Drug Metab Dispos 6: 169-76, (disponible en anglais seulement)
Blake LS, Martinovic D, Gray LE, Wilson VS, Regal RR, Villeneuve DL, Ankley GT. (2010) Characterization of the androgen-sensitive MDA-kb2 cell line for assessing complex environmental mixtures. Environ Toxicol Chem 29: 1367-76. (disponible en anglais seulement)
Bonin AM, Arkauskas AP, Angus DS, Baker RSU, Gallagher CH, Greenoak G, Lane Brown MM, Meher-Homji KM, Reeve V. (1982) UV-absorbing and other sunprotecting substances: genotoxicity of 2-ethylhexyl P-methoxycinnamate. Mut. Res. 105, 303-308. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Bradley, Jean-Claude; Lang, Andrew; Williams, Antony (2014): Jean-Claude Bradley Double Plus Good (Highly Curated and Validated) Melting Point Dataset. figshare. Dataset. (disponible en anglais seulement)
Brausch JM, Rand GM. 2011. A review of personal care products in the aquatic environment: environmental concentrations and toxicity. Chemosphere 82: 1518-1532. (disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2956.
Canada, ministère de l’Environnement. 2017. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances visées par la mise à jour de l’inventaire de 2017. Gazette du Canada, Partie I, vol. 151, no 2.
Carmona E, Andreu V, Pico Y. (2014) Occurrence of acidic pharmaceuticals and personal care products in Turia River Basin: From waste to drinking water. Science of the Total Environment 484: 53–63. (disponible en anglais seulement)
[ESCC] Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes - Nutrition (ESCC). Information détaillée pour 2004 (Cycle 2.2). Ottawa (Ont.), Statistique Canada.
Chaudhari U, Nemade H, Sureshkumar P, Vinken M, Ates G, Rogiers V, Hescheler J, Hengstler JG, Sachinidis A. (2018) Functional cardiotoxicity assessment of cosmetic compounds using human-induced pluripotent stem cell-derived cardiomyocytes. Arch Toxicol 92: 371-381. (disponible en anglais seulement)
Chen J, Ahn KC, Gee NA, Ahmed MI, Duleba AJ, Zhao L, Gee SJ, Hammock BD, Lasley BL. (2008) Triclocarban enhances testosterone action: a new type of endocrine disruptor? Endocrinology 149: 1173-9. (disponible en anglais seulement)
Chen J, Hartmann EM, Kline J, Van Den Wymelenberg, Halden RU. (2018) Assessment of human exposure to triclocarban, triclosan and five parabens in U.S. indoor dust using dispersive solid phase extraction followed by liquid chromatography tandem mass spectrometry. Journal of Hazardous Materials 360: 623–630. (disponible en anglais seulement)
Chiaia-Hernandez AC, Ashauer R, Moest M, Hollinghaus T, Jeon J, Spaak P, Hollender J. 2013. Bioconcentration of organic contaminants in Daphnia resting eggs. Environ Sci Technol 47: 10667-10675. (disponible en anglais seulement)
Christen V, Crettaz P, Oberli-Schrammli A, Fent K. (2010) Some flame retardants and the antimicrobials triclosan and triclocarban enhance the androgenic activity in vitro. Chemosphere 81:1245-1252. (disponible en anglais seulement)
Coogan MA, Edziyie RE, La Point TW, Venables BJ. 2007. Algal bioaccumulation of triclocarban, triclosan, and methyl-triclosan in a North Texas wastewater treatment plant receiving stream. Chemosphere 67: 1911-1918. (disponible en anglais seulement)
Coogan MA and La Point TW. 2008. Snail bioaccumulation of triclocarban, triclosan, and methyltriclosan in a north Texas, USA, stream affected by wastewater treatment plant runoff. Environ Toxicol Chem 27 (8): 1788-1793. (disponible en anglais seulement)
[CoRAP] ECHA Community Rolling Action Plan. 2018. Justification Document for the Selection of a CoRAP Substance: Triclocarban. March 20 2018. EC 202-924-1. (disponible en anglais seulement)
Dom N, Knapen D, Benoot D, Nobels I, Blust R. 2010. Aquatic multi-species acute toxicity of (chlorinated) anilines: experimental versus predicted data. Chemosphere 81:177-186. (disponible en anglais seulement)
Dong X, Xu H, Wu X, Yang L. 2018. Multiple bioanalytical method to reveal developmental biological responses in zebrafish embryos exposed to triclocarban. Chemosphere 193: 251-258. (disponible en anglais seulement)
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [modifié le 17 juillet 2015]. Ottawa (Ont.), gouvernement du Canada. [consulté le 29 août 2018].
Duleba AJ, Ahmed MI, Sun M, Gao AC, Villanueva J, Conley AJ, Turgeon JL, Benirschke K, Gee NA, Chen J, Green PG, Lasley BL. (2011) Effects of triclocarban on intact immature male rat: augmentation of androgen action. Reprod Sci 18:119-27. (disponible en anglais seulement)
[ECCC, SC] Environnement Canada, Santé Canada. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l'environnement de 1999 [LCPE (1999)]. Ottawa (Ont.).
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC et SC] Environnement Canada et Santé Canada. 2016. Rapport d’évaluation : triclosan : numéro de registre du CAS 3380-34-5. Ottawa (Ont.), Environnement Canada, Santé Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada. [consulté le 12 mars 2017].
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environment and Climate Change Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (QC). Available from: substances@ec.gc.ca. (disponible en anglais seulement)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017a. Évaluation préalable rapide des substances pour lesquelles l'exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017b. Ébauche d'évaluation préalable : substances jugées comme étant peu préoccupantes au moyen de l'approche de la Classification du risque écologique des substances organiques et de l'approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
[EC] European Commission. 2018a. Annex III: List of substances which cosmetics must not contain except subject to the restrictions laid down. [Mis à jour le 24 octobre 2018; cité le 31 mai 2019]. (disponible en anglais seulement)
[EC] European Commission. 2018b. Annex V: List of preservatives allowed in cosmetics products. [Mis à jour le 23 novembre; cité le 31 mai 2019]. (disponible en anglais seulement)
Enright HA, Falso MJS, Malfatti MA, Lao V, Kuhn EA, Hum N, Shi Y, Sales AP, Haack KW, Kulp KS, Buchholz BA, Loots GG, Bench G, Turteltaub KW, (2017) Maternal exposure to an environmentally relevant dose of triclocarban results in perinatal exposure and potential alterations in offspring development in the mouse model. PLoS ONE 12: e0181996. (disponible en anglais seulement)
Environnement Canada, Santé Canada. 2007. Catégorisation. Ottawa (Ont.), gouvernement du Canada. [mis à jour le 20 avril 2007; cite le 31 mai 2019].
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
Ferguson KK, Meeker JD, Cantonwine DE, Mukherjee B, Pace GG, Weller D, McElrath TF. (2018) Environmental phenol associations with ultrasound and delivery measures of fetal growth. Environ Int 112: 243-250. (disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food and Chemical Toxicology 90: 130-141. (disponible en anglais seulement)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC, 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food and Chemical Toxicology 78: 159-169. (disponible en anglais seulement)
Frederiksen H, Nielsen JKS, Morck TA, Hansen PW, Jensen JF, Nielsen O, Andersson, A-M, Knudsen LE. (2013) Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs. Int J Hyg Environ Health 216: 772-83. (disponible en anglais seulement)
Gao L, Yuan T, Cheng P, Bai Q, Zhou C, Ao J, Wang W, Zhang H. 2015. Effects of triclosan and triclocarban on the growth inhibition, cell viability, genotoxicity and multixenobiotic resistance responses of Tetrahymena theromphila. Chemosphere 139: 434-440. (disponible en anglais seulement)
Garcia-Ac A, Segura PA, Viglino L, Fϋrtos A, Gagnon C, Prévost M, Sauvé S. 2009. On-line solid-phase extraction of large-volume injections coupled to liquid chromatography-tandem mass spectrometry for the quantitation and confirmation of 14 selected trace organic contaminants in drinking and surface water. Journal of Chromatography A 1216: 8518-8527. (disponible en anglais seulement)
Geer LA, Pycke BFG, Waxenbaum J, Shere DM, Abulafia O, HaldenRU. (2017) Association of birth outcomes with fetal exposure to parabens, triclosan and triclocarban in an immigrant population in Brooklyn, New York. J Hazard Mater 323: 177-183. (disponible en anglais seulement)
Giudice BD, Young TM. 2010. Microbial triclocarban stimulates embryo production in the freshwater mudsnail Potamopyrgus antipodarium. Environ Toxciol Chem 29 (4): 966-970. (disponible en anglais seulement)
Han J, Won E-J, Hwang U-K, Kim I-C, Yim J-H, Lee J-S. 2016. Triclosan (TCS) and triclocarban (TCC) cause lifespan reduction and reproductive impairment through oxidative stress-mediated expression of the defensome in the mongonot rotifer (Brachionus koreanus). Comparative Biochemistry and Physiology Part C 185-186: 131-137. (disponible en anglais seulement)
Hartmann EM, Hickey R, Hsu T, Roman CMB, Chen J, Schwager R, Kline J, Brown GZ, Halden RU, Huttenhower C, Green JL. (2016) Antimicrobial Chemicals Are Associated with Elevated Antibiotic Resistance Genes in the Indoor Dust Microbiome. Environ. Sci. Technol. 50: 9807−9815. (disponible en anglais seulement)
Health Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Unpublished report. Ottawa (ON): Health Canada, Environmental Health Directorate. (disponible en anglais seulement)
Santé Canada. (2013) Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 2 (2009 à 2011). Ottawa (Ont.), gouvernement du Canada. [consulté le 17 avril 2019].
Santé Canada.(2018) Liste critique des ingrédients des cosmétiques : ingrédients interdits et d'usage restreint . Ottawa (Ont.), gouvernement du Canada. [consulté le 2 février 2019].
Higgins CP, Paesani Z, Abbot Chalew TE, Halden RU. 2009. Bioaccumulation of triclocarban in Lumbriculus variegatus. Environ Toxicol Chem 28 (12): 2580-2586. (disponible en anglais seulement)
Hiles RA, Birch CG. (1978a) The absorption, excretion and biotransformation of 3,4,4'-trichlorocarbanilde in humans. Drug Metabolism and Distribution 6: 177-183. (disponible en anglais seulement)
Hiles RA, Caudill D, Birch CG, Eichhold T. (1978b) The Metabolism and Disposition of 3,4,4’-Trichlorocarbanilide in the Intact and Bile Duct-Cannulated Adult and in the Newborn Rhesus Monkey (M. mulatfa). Toxicology and Applied Pharmacology 46:593-608 (disponible en anglais seulement)
Hiles RA. (1977) Metabolism and toxicity of halogenated carbanilides: Absorption, distribution and excretion of radioactivity from 3,4,4'-trichloro[14C]carbanilide (TCC) and 3-trifluoromethyl-4-4'-dichloro[14C]carbanilide (TFC) in rats. Fd Cosmet Toxicol 15:205-211. (disponible en anglais seulement)
Hinther A., Bromba CM, Wulff JE, Helbing CC. (2011) Effects of triclocarban, triclosan, and methyl triclosan on thyroid hormone action and stress in frog and mammalian culture systems. Environmental Science & Technology 45: 5395-5402. (disponible en anglais seulement)
Hoffman K, Hammel SC, Phillips AL, Lorenzo AM, Chen A, Calafat AM, Ye X, Webster TF, Stapleton HM. (2018) Biomarkers of exposure to SVOCs in children and their demographic associations: The TESIE Study. Environ Int 119: 26-36. (disponible en anglais seulement)
Huang H, Du G, Zhang W, Hu J, Wu D, Song L, Xia Y, Wang X. The in vitro estrogenic activities of triclosan and triclocarban. J Appl Toxicol 34: 1060-7. (disponible en anglais seulement)
Hyland KC, Blaine AC, Higgins CP. 2015. Accumulation of contaminants of emerging concern in food crops – part 2: plant distribution. Environ Toxicol Chem 34(10): 2222-2230. (disponible en anglais seulement)
Ismail NS, Muller CE, Morgan RR, Luthy RG. 2014. Uptake of contaminants of emerging concern by the bivalves Anodonta californiensis and Corbicula fluminea. Environ Sci Technol 48: 9211-9219. (disponible en anglais seulement)
Kennedy RC, Fling RR, Robeson MS, Saxton AM, Schneider LG, Darcy JL, Bemis DA, Zhao L, Chen J. (2018) Temporal dynamics of gut microbiota in triclocarban-exposed weaned rats. Environ Sci Pollut Res Int 25: 14743-14751. (disponible en anglais seulement)
Kennedy RCM, Menn FM, Healy L, Fecteau KA, Hu P, Bae J, Gee NA, Lasley BL, Zhao L, Chen J. (2015) Early life triclocarban exposure during lactation affects neonate rat survival. Reprod Sci 22: 75-89. (disponible en anglais seulement)
Kim S, Chen J, Cheng T, Gindulyte A, He J, He S, Li Q, Shoemaker BA, Thiessen PA, Yu B, Zaslavsky L, Zhang J, Bolton EE. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 2019 Jan 8; 47(D1):D1102-1109. doi:10.1093/nar/gky1033. [PubMed PMID: 30371825] (disponible en anglais seulement)
Lawrence JR, Zhu B, Swerhone GDW, Roy J, Wassenaar LI, Topp E, Korber DR. Comparative microscale analysis of the effects of triclosan and triclocarban on the structure and function of river biofilm communities. Science of the Total Environment. 407: 3307-3316. (disponible en anglais seulement)
Lenz KA, Pattison C, Ma H. 2017. Triclosan and triclocarban induce systemic toxic effects in a model organism in the nematode Caenorhabditis elegans. Environmental Pollution 231: 462-470. (disponible en anglais seulement)
Li H, ZhaoY, Chen L, Su Y, Li X, Jin L, Ge RS. (2017) Triclocarban and Triclosan Inhibit Human Aromatase via Different Mechanisms. Biomed Res Int 2017: 8284097. (disponible en anglais seulement)
Li AJ, Xue J, Lin S, Al-Malki AL, Al-Ghamdi MA, Kumosani TA, Kannan K. (2018) Urinary concentrations of environmental phenols and their association with type 2 diabetes in a population in Jeddah, Saudi Arabia. Environ Res 166: 544-552. (disponible en anglais seulement)
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [modifié le 6 février 2018]. Ottawa (Ont.), gouvernement du Canada. [consulté le 30 janvier 2019].
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, Renskers KJ, Scrafford CG. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol 46: 1516-1524. (disponible en anglais seulement)
Lozano N, Rice CP, Ramirez M, Torrents A (2018) Fate of triclocarban in agricultural soils after biosolid applications. Environ Sci Pollut Res 25:222–232. (disponible en anglais seulement)
Macherius A, Lapen DR, Reemtsma T, Rombke J, Topp E, Coors A. 2014. Triclocarban, triclosan, and its transformation product methyl triclosan in native earthworm species four years after a commercial scale biosolids application. Science of the Total Environment 472: 235-238. (disponible en anglais seulement)
Marzulli FN, Maibach HI. (1973) The use of graded concentrations in studying skin sensitizers: experimental contact sensitization in man. Food Cosmet. Toxicol. 12, 219-227. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Monsanto (1980) Study # MSL-1264 (9/22/1980) TCC Environmental Monitoring-Surface Waters and Drinking Waters. [Tel que cité dans EPA HPVIS]. (disponible en anglais seulement)
Monsanto (1981) A twenty-four month dietary toxicity/carcinogenicity study of TCC in rats. Report no. BDN-77-280. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Monsanto (1983) A three-generation reproduction study with TCC rats. Report no. BD-79-058. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Moos RK, Angerer J, Wittsiepe J, Wilhelm M, Bruning T, Koch HM. (2014) Rapid determination of nine parabens and seven other environmental phenols in urine samples of German children and adults. Int J Hyg Environ Health 217: 845-53. (disponible en anglais seulement)
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]. [modifié le 1er novembre 2016]. Ottawa (Ont.), gouvernement du Canada. [consulté le 30 janvier 2019].
[MSN] Ministère de la Santé nationale et du Bien-être social du Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances actuelles. Ottawa, MSN. No de catalogue : H39-199/1990F. ISBN 0-662-18397-5. 9 p. [cité dans Santé Canada 1998].
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2017. Urea, N-(4-chlorophenyl)-N'-(3,4-dichlorophenyl)-: Environment tier II assessment. Australian Department of Health. Accessed: 31 Jan 2019. (disponible en anglais seulement)
Nolen GA, Dierckman TA. 1979. Reproduction and teratogenic studies of a 2:1 mixture of 3,4,4'-trichlorocarbanilide and 3-trifluoromethyl-4,4'-dichloro-carbanilide inrats and rabbits. Toxicol Appl Pharmacol 51:417-425. (disponible en anglais seulement)
OECD QSAR Toolbox. 2016. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (disponible en anglais seulement)
Omiecinski CJ, Coslo DM, Chen T, Laurenzana EM, Peffer RC. 2011. Multi-species Analyses of Direct Activators of the Constitutive Androstane Receptor. Toxicological Sciences123 (2):550–562. (disponible en anglais seulement)
O'Neil, M.J. (ed.). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 1789. (disponible en anglais seulement)
[PCPC] Personal Care Products Council. 2018. Cosmetic Ingredient Identification Database (International Cosmetic Ingredient Dictionary (INCI)). [consulté le 30 janvier 2019]. (disponible en anglais seulement)
Prosser RS, Lissemore L, Shahmohamadloo RS, Sibley PK. 2015. Effect of biosolids-derived triclosan and triclocarban on the colonization of plant roots by arbuscular mycorrhizal fungi. Science of the Total Environment 508: 427-434. (disponible en anglais seulement)
Prosser RS, Lissemore L, Solomon KR, Sibley PK. 2014. Toxicity of biosolids-derived triclosan and triclocarban to six crop species. Environ Toxicol Chem 33(8): 1840-1848. (disponible en anglais seulement)
[PubChem] National Center for Biotechnology Information. PubChem Compound Database; CID=7547 [consulté le 5 mars 2019]. National Center for Biotechnology Information. PubChem Compound Database; CID=7547 (accessed Mar. 5, 2019). (disponible en anglais seulement)
Pycke BFG, Geer LA, Dalloul M, Abulafia O, Jenck AM, Halden RU. (2014) Human fetal exposure to triclosan and triclocarban in an urban population from Brooklyn, New York. Environ Sci Technol 48: 8831-8. (disponible en anglais seulement)
[REACH] Registration, Evaluation, Authorisation and Restriction of Chemicals. 2019. A registration dossier for Triclocarban [CAS RN 101-20-2] submitted to REACH. [Cité le 2019 February 2]. (disponible en anglais seulement)
Rocha BA, Asimakopoulos AG, Honda M, da Costa NL, Barbosa RM, Barbosa F, Kannan K. (2018a) Advanced data mining approaches in the assessment of urinary concentrations of bisphenols, chlorophenols, parabens and benzophenones in Brazilian children and their association to DNA damage. Environ Int 116: 269-277. (disponible en anglais seulement)
Rocha BA, de Oliveira ARM, Barbosa F. (2018b) A fast and simple air-assisted liquid-liquid microextraction procedure for the simultaneous determination of bisphenols, parabens, benzophenones, triclosan, and triclocarban in human urine by liquid chromatography-tandem mass spectrometry. Talanta 183: 94–101. (disponible en anglais seulement)
Sabourin L, Duenk P, Bonte-Gelok S, Payne M, Lapen DR, Topp E. 2012. Uptake of pharmaceuticals, hormones, and parabens into vegetables grown in soil fertilized with municipal biosolids. Science of the Total Environmemnt 431: 233-236. (disponible en anglais seulement)
Saravanabhavan G, Walker M, Guay M, Aylward L. 2014. Urinary excretion and daily intake rates of diethyl phthalate in the general Canadian population. Science of the Total Environment 500-501: 191-198. (disponible en anglais seulement)
Satyro S, Saggioro EM, Verissimo F, Buss DF, de Paiva Magalhaes D, Oliviera A. 2017. Triclocarban: UV photolysis, wastewater disinfection, and ecotoxicity assessment using molecular biomarkers. Environ Sci Pollut Res 24: 16077-16085. (disponible en anglais seulement)
[SCCP] European Commission Scientific Committee on Consumer Products. (2005) Opinion on Triclocarban for uses other than as a preservative. Colipa no P29. SCCP/0851/04. (disponible en anglais seulement)
Scharpf LGJ, Hill ID, MaibachHI. (1975) Percutaneous penetration and disposition of triclocarban in man: body showering. Arch Environ Health 30: 7-14. (disponible en anglais seulement)
Schebb NH, Flores I, Kurobe T, Franze B, Ranganathan A, Hammock BD, Teh, SJ. 2011a. Bioconcentration, metabolism and excretion of triclocarban in larval Qurt medaka (Oryzias latipes). Aquatic Toxicology 105: 448-454. (disponible en anglais seulement)
Schebb NH, Inceoglu B, Ahn KC, Morisseau C, Gee SJ, Hammock BD. 2011b. Investigation of human exposure to triclocarban after showering and preliminary evaluation of its biological effects. Environ Sci Technol 45: 3109-15. (disponible en anglais seulement)
Sherburne JJ, Anaya AM, Fernie KJ, Forbey JS, Furlong ET, Kolpin DW, Dufty AM, Kinney CA. 2016. Occurrence of triclocarban and triclosan in an agro-ecosystem following application of biosolids. Environ Sci Technol 50: 13206-13214. (disponible en anglais seulement)
Smarr MM, Honda M, Kannan K, Chen Z, Kim S, Louis G, Buck M. (2018) Male urinary biomarkers of antimicrobial exposure and bi-directional associations with semen quality parameters. Reprod Toxicol 77: 103-108 (disponible en anglais seulement)
Smarr MM, Sundaram R, Honda M, Kannan K, Buck LG. (2017) Urinary concentrations of parabens and other antimicrobial chemicals and their association with couples' fecundity. Environ Health Perspect 125: 730-736. (disponible en anglais seulement)
Sreevidya VS, Lenz KA, Svoboda KR, Ma H. 2018. Benzalkonium chloride, benzethonium chloride, and chloroxylenol – three replacement antimicrobials are more toxic than triclosan and triclocarban in two model organisms. Environmental Pollution 235:814-824. (disponible en anglais seulement)
Synder EH, O’Connor GA, McAvoy DC. 2010. Fate of 14-C triclocarban in biosolids-amended soils. Science of the Total Environment 408: 2726-2732 (disponible en anglais seulement)
Snyder EH, O’Connor GA, McAvoy DC. 2011.Toxicity and bioaccumulation of biosolid-borne triclocarban (TCC) in terrestrial organisms. Chemosphere 82: 460-467. (disponible en anglais seulement)
Soap and Detergent Association (2002) In vitro mammalian chromosome aberration test. Report no. 2002-01-TCC. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Sood S, Choudhary S, Wang HCR. (2013) Induction of human breast cell carcinogenesis by triclocarban and intervention by curcumin. Biochemical and Biophysical Research Communications 438: 600-606. (disponible en anglais seulement)
Sultana T, Murray C, Ehsanul Hoque M, Metcalfe C. 2017. Monitoring contaminants of emerging concern from tertiary wastewater treatment plants using passive sampling modelled with performance reference compounds. Environ Monit Assess 189:1 (disponible en anglais seulement)
Tamura I, Kagota K, Yasuda Y, Yoneda S, Morita J, Nakada N, Kameda Y, Kimura K, Tatarazako N, Yamamoto H. 2013. Ecotoxicity and screening level ecotoxicological risk assessment of five antimicrobial agents: triclosan, triclocarban, resorcinol, phenoxyethanol and p-thymol. J Appl Toxicol 33: 1222-1229. (disponible en anglais seulement)
Tanoue R, Nomiyama K, Nakamura H, Kim J-W, Isobe T, Shinohara R, Kunisue T, Tanabe S. 2015. Uptake and tissue distribution of pharmaceuticals and personal care products in wild fish from treated-wastewater-impacted streams. Environ Sci Technol 49: 11649-11658. (disponible en anglais seulement)
Tarnow P, Tralau T, Hunecke D, Luch A. (2013) Effects of triclocarban on the transcription of estrogen, androgen and aryl hydrocarbon receptor responsive genes in human breast cancer cells. Toxicol In Vitro 27: 1467-75. (disponible en anglais seulement)
Taulli TA, Hill JT, Pounds GW. (1977) High-pressure liquid chromatographic studies of TCC and metabolites in experimental animals and man. J Chromatogr Sci 15: 111-8. (disponible en anglais seulement)
Torres T, Cunha I, Martins R, Santos MM. 2016. Screening the toxicity of selected personal care products using embryo bioassays : 4-MBC, propylparaben, and triclocarban. Int J Mol Sci 17: 1762 (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2002. High Production Volume (HPV) Chemical Challenge Program Data Availability and Screening Level Assessment for Triclocarban. 201-14186A. Prepared for the HPV Challenge Program by the triclocarban Consortium. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2009. Targeted National Sewage Sludge Survey Statistical Analysis Report. Office of Water (4301T), Washington, DC. EPA-822-R-08-018. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook: 2011 Edition. [PDF] Washington (DC): National Center for Environmental Assessment, Office of Research and Development, U.S. Environmental Protection Agency. (disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2016. Safety and Effectiveness of Consumer Antiseptics; Topical Antimicrobial Drug Products for Over-the-Counter Human Use. 21 CFR Part 310. (disponible en anglais seulement)
Viglino L, Prevost M, Suave S. (2011) High throughput analysis of solid-bound endocrine disruptors by LDTD-APCI-MS/MS. J. Environ. Monit. 13: 583-590. (disponible en anglais seulement)
Vingskes AK and Spann N. 2018. The toxicity of a mixture of two antiseptics, triclosan and triclocarban, on reproduction and growth of the nematode Caenorhabditis elegans. Ecotoxicology 27: 420-429 (disponible en anglais seulement)
Wei L, Qiao P, Shi Y, Ruan Y, Yin J, Wu Q, Shao B. (2017) Triclosan/triclocarban levels in maternal and umbilical blood samples and their association with fetal malformation. Clin Chim Acta 466:133-137. (disponible en anglais seulement)
Wester RC, Maibach HI, Surichak J, Bucks DAW. (1985) Predictability of In Vitro Diffusion Systems: Effect of Skin Types and Ages on Percutaneous Absorption of Triclocarban. Dermatology 6: 223-226. [Tel que cité dans SCCP 2005]. (disponible en anglais seulement)
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Human and Ecological Risk Assessment 19(1): 158-188. (disponible en anglais seulement)
Witorsch RJ and Thomas JA. 2010. Personal care products and endocrine disruption: a critical review of the literature. Critical Reviews in Toxicology 40(S3): 1-30. (disponible en anglais seulement)
Wu Y, Beland FA, Fang JL. (2016) Effect of triclosan, triclocarban, 2,2',4,4'-tetrabromodiphenyl ether, and bisphenol A on the iodide uptake, thyroid peroxidase activity, and expression of genes involved in thyroid hormone synthesis. Toxicol In Vitro 32: 310-9. (disponible en anglais seulement)
Xia K, Hundal LS, Kumar K, Armbrust K, Cox AE, Granato TC. (2010) Triclocarban, triclosan, polybrominated diphenyl ethers, and 4-nonylphenol in biosolids and in soil receiving 33-year biosolids application. Environmental Toxicology and Chemistry 29: 597–605. (disponible en anglais seulement)
Xia M, Huang R, Shi Q, Boyd WA, Zhao J, Sun N, Rice JR, Dunlap PE, Hackstadt AJ, Bridge MF, Smith MV, Dai S, Zheng W, Chu PH, Gerhold, D, Witt KL, DeVito M, Freedman JH, Austin CP, Houck KA, Thomas RS, Paules RS, Tice RR, Simeonov A. (2018) Comprehensive Analyses and Prioritization of Tox21 10K Chemicals Affecting Mitochondrial Function by in-Depth Mechanistic Studies. Environ Health Perspect 126: 077010 (disponible en anglais seulement)
Xie W, Zhang W, Ren J, Li W, Zhou L, Cui Y, Chen H, Yu W, Zhuang X, Zhang Z, Shen G, Li H. (2018) Metabonomics Indicates Inhibition of Fatty Acid Synthesis, β-Oxidation, and Tricarboxylic Acid Cycle in Triclocarban-Induced Cardiac Metabolic Alterations in Male Mice. J Agric Food Chem 66: 1533−1542. (disponible en anglais seulement)
Xu X, Lu Y, Zhang D, Wang Y, Zhou X, Xu H, Mei Y. 2015. Toxic assessment of triclosan and triclocarban on Artemia salina. Bull Environ Contam Toxicol 95:728-733. (disponible en anglais seulement)
Yang L-H, Ying G-G, Su H-C, Stauber JL, Adams M-S, Binet MT. 2008. Growth inhibiting effects of 12 antibacterial agents and their mixtures on the freshwater microalga Pseudokirchneriella subcaptiata. Environ Toxicol Chem 27(5): 1201-1208. (disponible en anglais seulement)
Ye X, Wong LY, Dwivedi P, Zhou X, Jia T, Calafat AM. (2016) Urinary Concentrations of the Antibacterial Agent Triclocarban in United States Residents: 2013−2014 National Health and Nutrition Examination Survey. Environ Sci Technol 50: 13548−13554. (disponible en anglais seulement)
Ye X, Zhou X, Furr J, Ahn KC, Hammock BD, Gray EL, Calafat AM. (2011) Biomarkers of exposure to triclocarban in urine and serum. Toxicology 286: 69-74. (disponible en anglais seulement)
Yin J, Wei L, Shi Y, Zhang J, Wu Q, Shao B. (2016) Chinese population exposure to triclosan and triclocarban as measured via human urine and nails. Environ Geochem Health 38: 1125-35. (disponible en anglais seulement)
Zarate FM Jr, Schulwitz SE, Stevens KJ, Venables BJ. 2012. Bioconcentration of triclosan, methyl-triclosan, and triclocarban in the plants and sediments of a constructed wetland. Chemosphere 88: 323-329. (disponible en anglais seulement)
Zhou X, Ye X, Calafat AM. (2012) Automated on-line column-switching HPLC-MS/MS method for the quantification of triclocarban and its oxidative metabolites in human urine and serum. J Chromatogr B Analyt Technol Biomed Life Sci 881-882: 27-33. (disponible en anglais)
Annexes
Annexe A. Résumé des données sur les effets environnementaux du triclocarban
| Organisme d’essai | Paramètre | Valeur (µg/L ou µg/g p.s.) | Observations | Référence |
|---|---|---|---|---|
Cladocère (Daphnia magna) | CL50 96 h | 27,4 | - | Albanese et al. 2017 |
Cladocère (Daphnia magna) | CL50 48 h | 10 | - | Cité dans Brausch and Rand 2011 |
Cladocère (Ceriodaphnia dubia) | CL50 48 h | 3,1 | - | Cité dans Brausch et Rand 2011 |
Cladocère (Daphnia magna) | CMEO 21 j (croissance) CSEO 21 j (croissance) | 4,7 2,9 | - | Cité dans Brausch et Rand 2011 |
Cladocère (Daphnia magna) | CE50 48 h | 10 | - | Tamura et al. 2013 |
Cladocère (Ceriodaphnia dubia) | CSEO 8 j | 1,9 | - | Tamura et al. 2013 |
Cladocère (Daphnia similis) | CE50 48 h | 14 | - | Satyro et al. 2017 |
Anostracés (Artemia salina) | CL50 24 h | 17,8 | - | Xu et al. 2015 |
Mysidacé (Mysidopsis bahia) | CMEO 28 j (reproduction) CSEO, 28 j (reproduction) | 0,13 0,06 | - | Cité dans Brausch et Rand 2011 |
Mysidacé (Mysidopsis bahia) | CL50 48 h CL50 96 h | 15 10 | - | Cité dans Brausch et Rand 2011 |
Rotifère (Brachionus koreanus) | CL50 24 h | 388 | 200 µg/L : Réduction de la croissance de la population 100 µg/L : stress oxydatif Régulation transcriptionnelle des protéines de détoxification, antioxydantes et de choc thermique entraînant des changements dans la durée de vie et la fécondité | Han et al. 2016 |
Amphipode marin (Gammarus locusta) - | CMEO après 120 j (marqueurs biochimiques) | 2,5 | Aucun impact constaté sur la survie, la croissance ou la reproduction, peu importe la concentration; réponse monotonique 0,1 µg/L : niveaux de LPO plus élevés chez les femelles par rapport aux mâles 0,1 et 0,5 µg/L : activité de la CAT/GST significative 2,5 µg/L : concentrations de CAT/GST similaires ou plus faibles par rapport aux témoins; 65 % d’augmentation d’AChE pour les mâles et les femelles | Barros et al. 2017 |
Protozoaire d’eau douce (Tetrahymena thermophila) | CE50 24 h (croissance) | 295 | 1,0 µg/L : lésions à l’ADN 0,316 µg/L : régulation à la baisse de l’expression du gène MXR 0,79 µg/L : activité des transporteurs d’inhibition ou d’efflux | Gao et al. 2015 |
Nématode (Caenorhabditis elegans) | CL50 24 h | 910 | 10 µg/L : réduction de la taille du couvain, éclosion retardée | Lenz et al. 2017 |
Nématode (Caenorhabditis elegans) | CE50 96 h (reproduction et croissance) | 119 | - | Vingskes et Spann 2018 |
Oligochète (Lumbriculus variegatus) | 10 j (mortalité) | 100 (µg/g p.s.) | Aucune mortalité constatée | Higgins et al. 2009 |
Médaka (Oryzias latipes) | CL50 96 h | 85 | - | Tamura et al. 2013 |
Poisson zèbre (Danio rerio) | CSEO 9 j | 24 | - | Tamura et al. 2013 |
Poisson zèbre (Danio rerio) | CMEO 32 et 80 h post-fertilisation | 350 | - | Torres et al. 2016 |
Poisson zèbre (Danio rerio) | CL10 96 h CL50 96 h | 133,3 6,6 ----147,5 215,8 | 133,3 µg/L : inhibition de l’hormone thyroïdienne, expression altérée des gènes régissant l’hormone thyroïdienne 6,6 µg/L : expression altérée des protéines associées à la liaison, au métabolisme, au développement des muscles squelettiques, au développement du système nerveux et à la réponse immunitaire | Dong et al. 2018 |
Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 96 h | 120 | - | Cité dans Brausch et Rand 2011 |
Crapet arlequin (Lepomis macrochirus) | CL50 96 h | 97 | - | Cité dans Brausch et Rand 2011 |
Tête-de-boule (Pimephales promelas) | CSEO 22 j CMEO 22 jours (reproduction) | 1 5 | 1 µg/L : aucun effet sur la reproduction 5 µg/L : fécondité réduite Aucun effet sur la masse corporelle ou l’indice gonado-somatique | Villeneuve et al. 2017 |
Algue verte (Scenedesmus subspicatus) | CL50 72 h (croissance) | 20 | - | Cité dans Brausch et Rand 2011 |
Algue verte (Pseudokirch-neriella subcapitata) | CL50 72 h (croissance) | 0,017 | - | Cité dans Brausch et Rand 2011 |
Algue verte (Pseudokirch-neriella subcapitata) | CI50 72 h CSEO CMEO | 17 < 10 10 | Inhibition de la croissance | Yang et al. 2008 |
Algue verte (Pseudokirch-neriella subcapitata) | CMEO 14 j (croissance) CSEO 14 j (croissance) | 10 36 | - | Cité dans Brausch et Rand 2011 |
Algue verte (Pseudokirch-neriella subcapitata) | CE50 72 h | 29 | - | Tamura et al. 2013 |
Algue verte (Pseudokirch-neriella subcapitata) | CSEO 72 h | 5,7 | - | Tamura et al. 2013 |
Algue verte (Pseudokirch-neriella subcapitata) | CI50 72 h | 319 | - | Satyro et al. 2017 |
Structure d’une communauté sur un biofilm de cours d’eau | 8 semaines (biomasse) | 10 | Réduction significative de la biomasse d’algues Suppression de l’utilisation du carbone Communauté altérée, qui est passée des processus autotrophes à des processus hétérotrophes Variation significative de la composition des communautés, et des communautés bactériennes | Lawrence et al. 2009 |
Oursin vert (Paracentrotus lividus) | CMEO 8 et 80 h post-fertilisation | 0,64 | Diminution de la longueur des larves; anomalies morphologiques | Torres et al. 2016 |
Hydrobie des antipodes (Potamopyrgus antipodarum) | 2 – 4 semaines CSEO CMEO CE10 CE50 48 h | 0,5 0,2 0,5 2,5 | 2,5 µg/L : stimulation de la production d’embryons | Giudice et Young 2010 |
Ouaouaron / grenouille-taureau (Rana catesbeiana) | Essai biologique de 48 h sur des nageoires de queue de têtard en culture | 0,315 | Aucun effet sur les concentrations de transcrits TRß Diminution des concentrations de transcrits RLK1 Augmentation des concentrations de transcrits IHSP30 et CAT | Hinther et al. 2011 |
Laitue Maïs | 65 jours (symbiose : champignons mycorhiziens arbusculaires avec racines de plantes) | 0 – 0,304 (µg/g p.s.) | Aucune inhibition de la colonisation des racines des plantes par les champignons mycorhiziens arbusculaires | Prosser et al. 2015 |
Radis Carotte Soja Laitue Blé | 81 jours (levée des plantules, croissance) | 14 – 304 (µg/g p.s.) | Effets négligeables | Prosser et al. 2014 |
Communauté microbienne du sol | 31 jours (respiration, ammonification et nitrification d’une communauté microbienne de sol) | 6 – 717 (µg/g p.s.) | Effets négligeables | Synder et al. 2011 |
Abréviations : CL50 = concentration d’une substance qui est estimée létale pour 50 % des organismes d’essai; CMEO = concentration minimale entraînant un effet observé, c.‑à‑d. concentration la plus faible dans un essai de toxicité qui a provoqué un effet statistiquement significatif par rapport aux témoins; CSEO = concentration sans effet observé, c.‑à‑d. concentration maximale dans un essai de toxicité ne provoquant pas d’effet statistiquement significatif par rapport aux témoins; CE50 = concentration d’une substance dont on estime qu’elle a un effet sur 50 % des organismes d’essai; CE10 = concentration d’une substance dont on estime qu’elle a un effet sur 10 % des organismes d’essai; CAT = catalase; GST = glutathion transférase; LPO = peroxydation lipidique; AChE = acétylcholinestérase.
| Organisme d’essai | Concentration de triclocarban (durée) | FBC / FBA / FABS / FCR / FCP(L/kg ou ng/g) | Référence |
|---|---|---|---|
Médaka (Oryzias latipes) | Eau reconstituée en laboratoire (20 µg/L) (24 h) | FBC : 724 (le TCC a été métabolisé par oxydation en conjugués sulfatés et en conjugués d’acide glucuronique) | Schebb et al. 2011a |
Carassin (Carassius carassius) | Effluents de STEU (0,000023 – 0,000044 µg/ml) | FBA dans le plasma : < 0,1 – 8,6 | Tanoue et al. 2015 |
Algue verte (Cladophora spp) | Effluents de STEU (0,191 µg/L) | FBA : 1 900
| Coogan et La Point 2008 |
Algue verte (Cladophora spp) | (Effluents de STEU) 0,08 – 0,20 µg/L | FBA : 1 600 – 2 700
| Coogan et al. 2007 |
Cladocère (Daphnia longispina-galeata (œufs éphippies) | Sédiments du lac Greifensee (Suisse) (0,0024 – 0,0152 µg/g p.s.) (120 h) | FBC : 1 240 – 82 900
| Chiaia-Hernandez et al. 2013 |
Oligochète (Lumbriculus variegatus) | Sédiments enrichis en laboratoire (22,4 µg/g p.s.) (28 jours) | FABS : 1 600 – 2 200 | Higgins et al. 2009 |
Lombric (Eisenia foetida) | Biosolides (707 µg/g p.s.) (28 jours) | FABS : 2,2 – 20
| Synder et al. 2011 |
Lombric (Eisenia foetida) | Biosolides (7,6 – 10,8 µg/g p.s.) (28 jours) | FABS : 0,22 – 0,71 | Higgins et al. 2011 |
Hélisome commun de l’Est (Helisoma trivolvis)
| Effluents de STEU (0,191 µg/L) (2 semaines) | FBA : 1 600
| Coogan et La Point 2008 |
Petite corbeille d’Asie (Corbicula fluminea) | Effluents de STEU (14 jours) | FBC : 7 943
| Ismail et al. 2014 |
Moule (Anodonta californiensis) | Effluents de STEU (14 jours)
| FBC : 7 943
| Ismail et al. 2014 |
Laitue (Lactuca sativa) | Eau d’irrigation (0,35 µg/L) | FCR < 10 (récolte à la maturité) | Hyland et al. 2015 |
Fraise (Fragaria ananassa) | Eau d’irrigation (0,35 µg/L) | FCR < 100 FCP < 100 (récolte à la maturité) | Hyland et al. 2015 |
Maïs sucré (Zea mays) Carotte (Daucus carota) Tomate (Solanum lycopersicum) Pomme de terre (Solanum tuberosum) | Biosolides (6,03 µg/g p.s.) | Aucune absorption détectée à la récolte | Sabourin et al. 2012 |
Biosolides → sol → lombrics → souris sylvestre (Peromyscus maniculatus) → œufs d’étourneau sansonnet (Sturnus vulgaris) → œufs de crécelle d’Amérique (Falco sparverius) | Biosolides (1,25 µg/g p/p)
| FABS chez le lombric : 0,79 (valeur estimée, car les lombrics n’ont pas été dépurés) FABS dans le foie de la souris sylvestre : 0,20 FABS dans les œufs de l’étourneau : 0,25 FABS dans les œufs de la crécelle : 0,05 | Sherburne et al. 2016 |
Abréviations : p.s. = poids sec; FCR = facteur de concentration dans les racines; FCP = facteur de concentration dans les pousses; FABS = facteur d’accumulation du biote au sol ou du biote aux sédiments; FBA = facteur de bioaccumulation; FBC = facteur de bioconcentration; STEU = système (ou station) de traitement des eaux usées.
Annexe B. Exposition humaine par les milieux naturels et par les aliments
| Voie d’exposition | 0 - 5 mois a (nourris au sein) b | 0 à 6 mois a (nourris avec préparation) c | 6 à 11 mois d | 1 an e | 2 à 3 ans f | 4 à 8 ans g | 9 à 13 ans h | 14 à 18 ans i | 19 ans et + j |
|---|---|---|---|---|---|---|---|---|---|
| Air ambiant k | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. |
| Air intérieur l | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. | n.t. |
| Eau potable m | s.o. | 21,0 | 13,5 | 5,3 | 4,6 | 3,7 | 2,8 | 2,8 | 3,3 |
| Aliments et boissons n | 80,3 | n.t. | 53,6 | 13,7 | 12,5 | 11,9 | 6,7 | 4,7 | 5,1 |
| Sol o | s.o. | s.o. | 0,05 | 0,05 | 0,02 | 0,02 | 0,01 | 0,001 | 0,001 |
| Poussière p | 33,5 | 33,5 | 29,0 | 31,1 | 13,9 | 10,4 | 5,5 | 0,33 | 0,34 |
| Absorption totale | 113,8 | 54,5 | 96,0 | 50,1 | 31,1 | 26,0 | 15,1 | 7,8 | 8,7 |
Abréviations : s.o. = sans objet; n.t. = données non trouvées dans la littérature.
a On présume que le nourrisson pèse 6,3 kg (Santé Canada 2015b), respire 3,7 m³ d’air par jour (US EPA 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume qu’aucune ingestion de sol n’a lieu en raison des pratiques courantes des personnes qui s’occupent des nourrissons.
b On présume que les nourrissons allaités exclusivement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire. Le triclocarban n’a pas été détecté dans les échantillons de lait maternel de 80 femmes canadiennes deux à trois mois après l’accouchement (Arbuckle 2015). La limite de détection de 0,68 µg/L de cette étude a été utilisée pour estimer le niveau d’exposition à la limite supérieure.
c On présume que les nourrissons nourris avec préparation exclusivement consomment 0,826 L d’eau par jour (Santé Canada 2018), eau qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015b), respire 5,4 m³ d’air par jour (US EPA 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). Pour les nourrissons allaités, on présume qu’ils consomment 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les nourrissons nourris à la préparation, on présume qu’ils consomment 0,764 L d’eau par jour (Santé Canada 2018), eau qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
e On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
f On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
g On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m³ d’air par jour (US EPA 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k Aucune donnée de surveillance pour le triclocarban dans l’air ambiant (extérieur) n’a été trouvée, au Canada ou ailleurs.
l Aucune donnée de surveillance pour le triclocarban dans l’air intérieur n’a été trouvée, au Canada ou ailleurs.
m Une valeur maximale de 160,5 ng/L de triclocarban dans l’eau traitée provenant de stations de traitement de l’eau au Canada a été déclarée (communication personnelle, courriel de la Direction des sciences de la santé environnementale et de la radioprotection de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 20 septembre 2018; source non citée).
n Les taux de consommation alimentaire sont décrits dans Santé Canada (2015). Les valeurs au 90e centile fournies par la Direction des aliments ont été utilisées, sauf pour la tranche d’âge des nourrissons de 0 à 5 mois nourris à la préparation, et ces valeurs ont été supprimées en raison de la faible taille de l’échantillon, et pour la tranche d’âge des 6 à 11 mois qui incorporait à la fois l’allaitement et la valeur dans les aliments au 90e centile. Les sources et les valeurs de l’exposition au triclocarban par les aliments sont décrites à la section 6.1.1, et ont été fournies par la Direction des aliments de Santé Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 5 mars 2019; source non citée).
o Une valeur moyenne de 53 ng/g de triclocarban a été rapportée dans un sol agricole au Québec (Viglino, 2011).
p On n’a trouvé aucune donnée de surveillance de la poussière domestique au Canada. Une valeur maximale de 9 760 ng/g de triclocarban a été rapportée dans une étude sur la poussière recueillie dans des installations athlétiques et des maisons individuelles en Oregon (Chan 2018).
Annexe C. Dose journalière estimée de triclocarban d’après les données de biosurveillance
La dose journalière estimée de triclocarban a été calculée d’après les données de biosurveillance de l’ECMS et l’équation Dose quotidienne (µg/kg p.c./j) = TEU (µg/kg p.c./j) / FEU, où TEU est le taux d’élimination urinaire et FEU est la fraction d’élimination urinaire.
La valeur TEU a été calculée d’après l’équation TEU (µg/kg p.c./j) = CU (µg/L) x DU (L/kg p.c./j), où CU est la concentration urinaire et DU est le débit urinaire (Saravanabhavan 2014).
| Groupe d’âge (ans) | DU a (L/kg p.c./j) | CU, P95 b (µg/L) | TEU, P95 (µg/kg p.c./j) | FEU c | Dose journalière estimée (µg/kg p.c./j) |
|---|---|---|---|---|---|
| 3 à 5 | 0,030 | 1,0 | 0,030 | 0,27 | 0,11 |
| 6 à 11 | 0,025 | 1,0 | 0,025 | 0,27 | 0,09 |
| 12 à 19 | 0,020 | 1,0 | 0,020 | 0,27 | 0,07 |
| 20 à 39 | 0,020 | 1,0 | 0,020 | 0,27 | 0,07 |
| 40 à 59 | 0,020 | 1,0 | 0,020 | 0,27 | 0,07 |
| 60 à 79 | 0,020 | 1,0 | 0,020 | 0,27 | 0,07 |
Abréviations : DU = débit urinaire; CU = concentration urinaire; TEU = taux d’élimination urinaire; P95 = 95e centile; FEU = fraction d’élimination urinaire.
a Les débits urinaires sont tirés d’Aylward (2015).
b Les concentrations urinaires sont tirées de Santé Canada (2013). Les valeurs au 95e centile étaient < LD, et donc on a utilisé 1,0 µg/L comme valeur de substitution.
c Hiles 1978b.
La dose journalière estimée de triclocarban a été calculée d’après les données de biosurveillance de l’enquête NHANES, à l’aide de l’équation Dose journalière estimée (µg/kg p.c./j) = TEU (µg/kg p.c./j) / FEU, où TEU est le taux d’élimination urinaire et FEU est la fraction d’élimination urinaire.
Le TEU a été calculé d’après l’équation TEU (µg/kg p.c./j) = [CUCr (µg/g Cr) x TEC (mg/j)] / p.c. (kg) où CUCr est la concentration urinaire ajustée pour la créatinine, TEC est le taux d’élimination de la créatinine et p.c. est le poids corporel (Saravanabhavan 2014).
La valeur TEC a été calculée selon l’équation de Mage :
TEC = [0,993*1,64 [140 – âge] (poids1,5 taille0,5) / 1 000].
Les valeurs par défaut utilisées pour calculer le TEC sont présentées dans le tableau C-2.
| Tranche d’âge d’après différentes sources a (ans) | Âge (ans) b | Poids (kg) c | Taille (cm) d |
|---|---|---|---|
| 6 à11 | 8 | 23 | 127 |
| 12 à 19 | 15,5 | 62 | 162 |
| 20+ | 39,5 | 75 | 163 |
a Ye 2016.
b Les âges ont été sélectionnés pour correspondre aux groupes d’âge indiqués dans la littérature et les groupes d’âge par défaut du PGPC.
c Les poids sont basés sur les valeurs par défaut dans les scénarios d’exposition du PGPC.
d Les tailles correspondent au 50e centile des valeurs données dans les Normes de croissance de l’enfant de l’OMS.
| Groupe d’âge (ans) | TEC (mg/j) | CUCr, P95 a (µg/g Cr) | TEU (µg/kg p.c./j) | FEU b | Dose journalière estimée (µg/kg p.c./j) |
|---|---|---|---|---|---|
| 6 à 11 | 267,2 | 0,778 | 0,01 | 0,27 | 0,033 |
| 12 à 19 | 1 276,6 | 1,97 | 0,04 | 0,27 | 0,15 |
| 20+ | 1 390,1 | 17,6 | 0,33 | 0,27 | 1,21 |
| Tous | 1 390,1 | 14,6 | 0,27 | 0,27 | 1,00 |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; TEU = taux d’élimination urinaire; P95 = 95e centile; FEU = fraction d’élimination urinaire.
a Les concentrations urinaires sont tirées de Ye (2016).
b Hiles 1978b.
Annexe D. Paramètres utilisés pour estimer l’exposition par voie cutanée aux produits
L’exposition aux produits a été estimée à l’aide de paramètres précis trouvés dans la littérature. Les valeurs estimées des paramètres d’exposition par voie cutanée pour les cosmétiques et les produits médicamenteux sont présentées dans le tableau D-1.
| Scénario d’exposition | Hypothèses |
|---|---|
Savon corporel (solide) | 9 – 13 ans 19 ans et plus : Absorption cutanée : 1,0 % |
Nettoyant pour le visage | 9 – 13 ans 19 ans et plus : Absorption cutanée : 0,39 % |
