Évaluation préalable 7-(Diéthylamino)-4-méthyl-2H-1-benzopyran-2-one (coumarine 1)
Titre officiel : Évaluation préalable
7-(Diéthylamino)-4-méthyl-2H-1-benzopyran-2-one (coumarine 1)
Numéro de registre du Chemical Abstracts Service
91-44-1
Environnement et Changement climatique Canada
Santé Canada
Mai 2023
No de cat. : En84-332/2023F-PDF
ISBN : 978-0-660-47974-3
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de la 7-(diéthylamino)-4-méthylbenzopyr-2-one, appelée ci-après coumarine 1. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ) de cette substance est le 91-44-1. Cette substance a été désignée prioritaire pour une évaluation, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
D’après les renseignements déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE, la coumarine 1 n’a pas été fabriquée au Canada en quantité dépassant le seuil de déclaration de 100 kg en 2011, tandis qu’une quantité située entre 1000 kg et 10 000 kg a été importée au pays la même année. Les utilisations déclarées au Canada incluent des applications commerciales dans des articles en tissu, en textile ou en cuir. La coumarine 1 est aussi utilisée dans certains produits cosmétiques au Canada, tels que des colorants capillaires temporaires, des vernis à ongles et du maquillage pour le corps, les lèvres et le visage (y compris du maquillage pour les yeux). La coumarine 1 est également employée comme agent stabilisant dans des produits de nettoyage pour tapis et comme parfum dans d’autres produits de nettoyage (comme les nettoyants tout usage).
Le risque posé à l’environnement par la coumarine 1 a été caractérisé au moyen de la Classification du risque écologique (CRE) des substances organiques. La CRE est une approche fondée sur le risque qui tient compte de nombreux paramètres liés au danger et à l’exposition ainsi que d’une pondération des éléments de preuve pour déterminer la classification du risque. Les profils de danger sont principalement fondés sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons la vitesse d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice de risque est utilisée pour attribuer un degré faible, modéré ou élevé de préoccupation potentielle à une substance selon ses profils de risque et d’exposition. D’après les résultats de la CRE, il est peu probable que la coumarine 1 ait des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, la coumarine 1 présente un faible risque d’effets nocifs sur l’environnement. Il est conclu que la coumarine 1 ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
L’ensemble des données sur les effets sur la santé de la coumarine 1 a été jugé limité. Pour pallier cette contrainte, une approche de lecture croisée a été appliquée pour étayer l’évaluation des effets sur la santé. D’après les données disponibles sur les analogues, on a jugé que la toxicité pour le développement constituait l’effet critique. La population générale du Canada est principalement exposée à la coumarine 1 lors de l’utilisation de certains produits cosmétiques, comme des colorants capillaires temporaires, des vernis à ongles et du maquillage pour le corps, les lèvres et le visage (y compris du maquillage pour les yeux), ainsi que de certains produits de nettoyage. La comparaison des concentrations de coumarine 1 auxquelles les Canadiens peuvent être exposés dans l’eau potable ou lors de l’utilisation de vernis à ongles, de colorants capillaires temporaires en poudre, de maquillage pour le visage, de rouges/brillants à lèvres, de produits de nettoyage tout usage en aérosol ou de produits de nettoyage pour tapis et des concentrations associées à des effets nocifs observés lors d’études en laboratoire a permis de calculer des marges jugées adéquates pour tenir compte des incertitudes des ensembles de données sur les effets sur la santé et l’exposition. Toutefois, les marges entre l’exposition à la coumarine 1 attribuable à une utilisation occasionnelle de maquillage spécialisé pour le corps (pour les personnes âgées de 4 ans et plus) et de colorants capillaires temporaires en gel (pour les personnes âgées de 2 à 13 ans) et les concentrations d’effet critique pour la coumarine 1 sont jugées inadéquates pour tenir compte des incertitudes des ensembles de données sur les effets sur la santé et l’exposition.
À la lumière de tous les renseignements contenus dans la présente évaluation préalable, il est conclu que la coumarine 1 satisfait aux critères énoncés à l’alinéa 64c) de la LCPE, car elle pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que la coumarine 1 satisfait à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est également conclu que la coumarine 1 répond aux critères de persistance, mais pas à ceux de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de la 7-(diéthylamino)-4-méthylbenzopyr-2-one, appelée ci-après coumarine 1. Cette substance a été désignée prioritaire pour une évaluation, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2017]).
Le risque posé à l’environnement par la coumarine 1 a été caractérisé au moyen de la Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE permet de décrire le danger posé par une substance au moyen de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Elle tient aussi compte de l’exposition possible d’organismes aquatiques et terrestres en fonction de facteurs tels que la vitesse d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. Les divers éléments de preuve sont combinés afin de déterminer quelles substances requièrent une évaluation approfondie de leur potentiel d’effets nocifs sur l’environnement ou présentent une faible probabilité d’avoir de tels effets.
La présente évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par des parties intéressées. Nous avons recensé des données pertinentes jusqu’en avril 2019, et des recherches documentaires ciblées ont été menées jusqu’en juillet 2021. Des données empiriques tirées d’études clés ainsi que des résultats de modélisation ont été utilisés pour tirer les conclusions présentées. Lorsqu’ils étaient disponibles et pertinents, nous avons utilisé des renseignements présentés dans des évaluations effectuées par d’autres instances [p. ex. le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) de l’Australie, le Comité mixte d’experts FAO/OMS des additifs alimentaires (JECFA) et l’Autorité européenne de la sécurité des aliments (EFSA)].
Le personnel du programme d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada ont rédigé la présente évaluation préalable, qui comprend des intrants provenant d’autres programmes de ces ministères. Le volet sur la santé humaine de la présente évaluation a fait l’objet d’un examen externe ou de consultations. Des commentaires sur les parties techniques de ce volet ont été formulés par Tetra Tech Inc. (Theresa Lopez, Jennifer Flippin et Joan Garey). Le volet environnemental de la présente évaluation repose sur le document décrivant la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe ainsi que d’une période de commentaires du public de 60 jours. En outre, l’ébauche de la présente évaluation préalable (publiée le 31 octobre 2020) a été soumise à une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada demeurent responsables du contenu définitif et des conclusions de la présente évaluation préalable.
La présente évaluation préalable repose sur des renseignements essentiels pour déterminer si la substance visée satisfait aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des renseignements scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . L’évaluation préalable présente les renseignements essentiels et les considérations qui ont permis de tirer les conclusions rendues.
2. Identité de la substance
Le numéro de registre du Chemical Abstracts Service (no CAS), le nom qui figure sur la Liste intérieure (LI), le nom commun et la structure moléculaire de la coumarine 1 sont présentés dans le tableau 2-1.
| No CAS | Nom sur la LI (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) | Référence |
|---|---|---|---|---|
| 91-44-1 | 7-(Diéthylamino)-4-méthylbenzopyr-2-one (coumarine 1) |
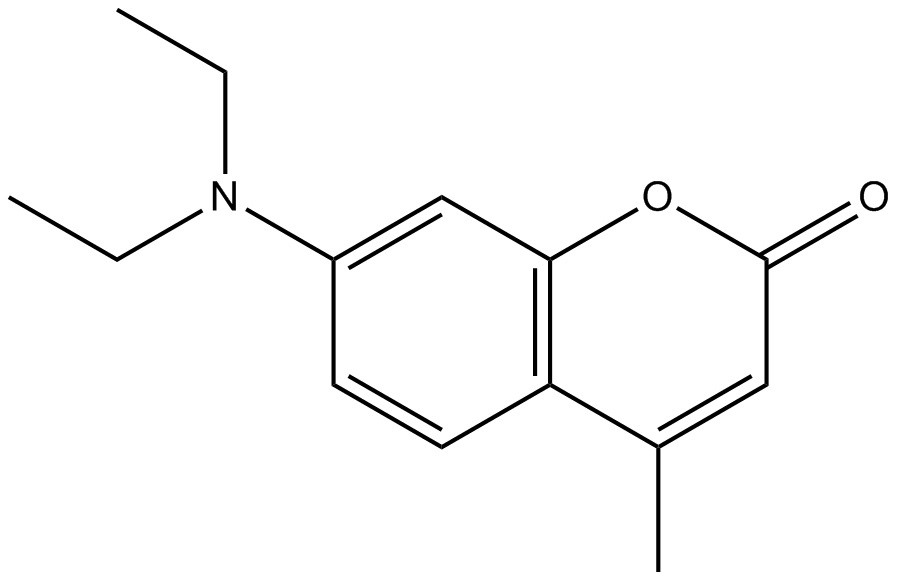 C14H17NO2
C14H17NO2
| 231,30 | ChemIDplus 1993- |
2.1 Sélection d’analogues
Une méthode de lecture croisée fondée sur les données d’analogues a été employée pour éclairer l’évaluation des effets sur la santé humaine. Nous avons choisi des analogues qui présentaient une structure semblable à celle de la coumarine 1 (propriétés physico‑chimiques et métabolisme similaires) et pour lesquels il existait des données empiriques pertinentes permettant de déterminer par lecture croisée les paramètres pour lesquels les données empiriques sur la coumarine 1 étaient limitées. Des renseignements sur l’identité et la structure chimique des analogues utilisés pour l’évaluation préalable sont présentés dans le tableau 2-2. L’annexe A fournit plus de détails sur les facteurs pris en compte pour la détermination des analogues. Pour plus de renseignements sur les propriétés physico-chimiques et les effets sur la santé de ces analogues, veuillez consulter l’annexe B.
| No CAS | Nom sur la LI (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) | Référence |
|---|---|---|---|---|
| 92-48-8 | 6-Méthylcoumarine (6‑méthylcoumarine) |
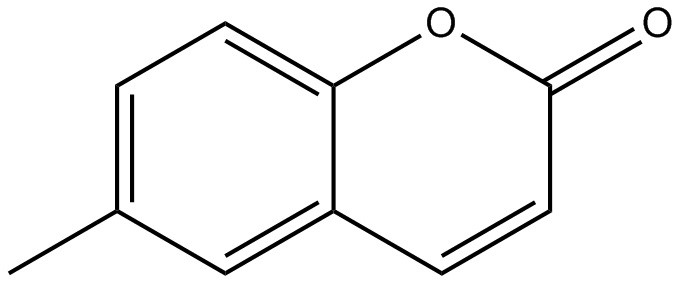 C10H8O2
C10H8O2 |
160,172 | ChemIDplus 1993- |
| 91-64-5 | Coumarine (coumarine) |
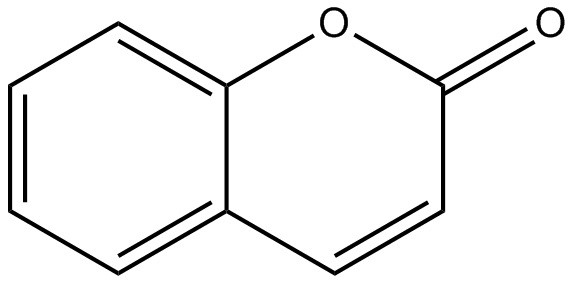 C9H6O2 |
146,133 | ChemIDplus 1993- |
La 6-méthylcoumarine s’est avérée être l’analogue le plus proche de la coumarine 1 pour lequel des données sur la toxicité chronique ont été recensées. Toutefois, aucune donnée sur la toxicité pour le développement et la reproduction de la 6‑méthylcoumarine n’a été trouvée, et nous avons utilisé celles sur la coumarine pour ce paramètre.
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques de la coumarine 1 sont résumées dans le tableau 3-1. D’autres propriétés physiques et chimiques sont rapportées par ECCC (2016 b).
| Propriété | Valeur | Référence clé |
|---|---|---|
| État physique | Poudre jaune pâle | FDS 2019 |
| Point de fusion (°C) | 72–75 | Epi Suite c2000-2012 |
| Pression de vapeur (Pa) | 0,00257 à 25 °C | Epi Suite c2000-2012 |
| Constante de Henry (Pa·m3/mol) | 0,0309 | Epi Suite c2000-2012 |
| Solubilité dans l’eau (mg/L) | 53,28 à 25 °C | Epi Suite c2000-2012 |
| log Koe (sans dimension) | 3,22 | Epi Suite c2000-2012 |
Abréviation : Koe = coefficient de partage octanol-eau
4. Sources et utilisations
D’après une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), la coumarine 1 n’a pas été fabriquée au Canada en quantité dépassant le seuil de déclaration de 100 kg en 2011. La même année, une quantité de la substance située entre 1000 et 10 000 kg a été importée au Canada (Environnement Canada 2013). Il a aussi été rapporté que la coumarine 1 est utilisée au Canada comme colorant dans des articles en tissu, en textile ou en cuir offerts dans le commerce (Environnement Canada 2013). D’après les renseignements reçus lors de la période de commentaires du public sur l’ébauche d’évaluation préalable, la coumarine 1 est utilisée dans la fabrication de composants de moteurs et comme parfum dans des produits de nettoyage.
D’après les déclarations faites en vertu du Règlement sur les cosmétiques, la coumarine 1 est présente dans des produits cosmétiques vendus au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux [DSPCPD] de Santé Canada [SC] au Bureau d’évaluation du risque des substances existantes [BERSE] de SC, octobre 2018; source non citée). La coumarine 1 peut être utilisée comme ingrédient marqueur dans un adhésif pour l’emballage de la viande, sans potentiel de contact direct avec la nourriture (communication personnelle, courriel de la Direction des aliments de SC au BERSE de SC, juillet 2021; source non citée). La coumarine 1 a aussi été détectée sous forme d’agent stabilisant dans un produit de nettoyage pour tapis offert au Canada (FDS 2015).
À l’échelle internationale, la coumarine 1 a été détectée dans des encres pour tatouage (Piccinini et al. 2015, Landeg et al. 2016), des produits de nettoyage (HCPA 2019, CPID c2001-2019, RB c2012-2019), des produits pour le traitement du cuir ou de textiles, des composés chimiques présents dans le papier et des colorants (ECHA c2007-2021).
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
D’après les modèles utilisés pour la CRE (ECCC 2016b), la coumarine 1 devrait persister dans l’eau, les sédiments et les sols, mais pas dans l’air.
5.2 Potentiel de bioaccumulation
Étant donné sa faible valeur de log Koe et ses faibles facteurs de bioconcentration (ECCC 2016b), la coumarine 1 ne devrait pas se bioaccumuler de façon importante dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation du risque pour l’environnement
Le risque posé à l’environnement par la coumarine 1 a été caractérisé en suivant l’approche de Classification du risque écologique des substances organiques (CRE) (ECCC 2016a). La CRE est une approche fondée sur le risque qui tient compte de nombreux paramètres liés au danger et à l’exposition ainsi que d’une pondération des éléments de preuve pour déterminer la classification du risque. Les divers éléments de preuve sont combinés pour distinguer les substances présentant un danger plus faible ou plus élevé et un potentiel d’exposition plus faible ou plus élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un unique paramètre dans un seul milieu (p. ex. la concentration létale médiane). Nous résumons ici la démarche décrite en plus de détail par ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada sont tirées de publications scientifiques, de bases de données empiriques accessibles (p. ex. la boîte à outils QSAR de l’OCDE [2014]) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été produites à partir de modèles de la relation (quantitative) structure-activité ([Q]SAR), du devenir du bilan massique ou de la bioaccumulation. Nous avons utilisé ces données comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition pour la substance.
Les profils de danger ont principalement été établis à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition sont aussi fondés sur de nombreux paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme étant faibles, modérés ou élevés. D’autres règles ont été appliquées (p. ex. constance de la classification, marge d’exposition) pour améliorer les classifications préliminaires du danger et de l’exposition.
Nous avons utilisé une matrice de risque pour attribuer à chaque substance un risque potentiel faible, modéré ou élevé, en fonction de la classification de son danger et de son exposition. Les classifications par la CRE du risque potentiel ont été vérifiées en suivant une approche en deux étapes. La première consistait à modifier à la baisse la classification du risque (de modéré ou élevé à faible) des substances caractérisées par une faible vitesse d’émission dans l’eau après le traitement des eaux usées, ce qui entraîne un faible potentiel d’exposition. La deuxième étape consistait à réévaluer la classification du faible potentiel de risque au moyen de scénarios de risque relativement prudents à échelle locale (c.-à-d. la zone entourant directement le point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être rehaussée.
La CRE est basée sur une approche pondérée qui vise à réduire au minimum la possibilité d’attribuer une classe trop élevée ou trop faible au danger et à l’exposition, et donc au risque. Les approches équilibrées utilisées pour traiter les incertitudes sont détaillées dans un document d’ECCC (2016a). Nous présentons plus bas deux des plus importantes sources d’incertitude. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées peut modifier la classification du danger, notamment si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2016). Toutefois, l’incidence d’une telle erreur est atténuée par le fait qu’une surestimation de la létalité médiane générera une valeur prudente (protectrice) pour les résidus dans les tissus qui servira à l’analyse des résidus corporels critiques. De même, une erreur de sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, comme le profilage structural du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités de substances chimiques peuvent se traduire par une classification différente de l’exposition, puisque les classifications de l’exposition et du risque sont très sensibles à la vitesse d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas représenter les tendances futures.
Les données critiques et les paramètres pris en compte pour élaborer les profils propres à la coumarine 1 et les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
D’après les classifications de faible danger et de faible exposition déterminées à partir des données prises en compte pour la CRE, la coumarine 1 a été classée comme ayant un faible potentiel de risque pour l’environnement. Il est donc peu probable que cette substance soit préoccupante pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
Nous n’avons trouvé aucune donnée de surveillance empirique pour la coumarine 1 dans l’air, l’eau ou le sol, au Canada ou ailleurs. Étant donné les propriétés physiques et chimiques de cette substance (elle est sous forme solide à température ambiante et a une faible pression de vapeur) ainsi que ses utilisations au Canada, il ne devrait pas y avoir de rejets dispersés de coumarine 1 dans l’air. Il n’y a aucune donnée indiquant la présence de coumarine 1 dans les aliments. La coumarine 1 peut être utilisée comme ingrédient marqueur dans un adhésif pour l’emballage de la viande, sans potentiel de contact direct avec des aliments (communication personnelle, courriel de la Direction des aliments de SC au BERSE de SC, octobre 2018 et juillet 2021; source non citée). En conséquence, il ne devrait pas y avoir d’exposition à cette substance à partir des aliments.
Étant donné l’absence de données de surveillance pour la coumarine 1 dans l’eau potable ou les eaux de surface au Canada, nous avons utilisé un scénario de rejet industriel basé sur les Environmental Assessment Unit Drinking Water Spreadsheets (Santé Canada 2015a) pour estimer la concentration de coumarine 1 dans les eaux de surface, en remplacement de l’eau potable. Nous avons utilisé comme intrants l’utilisation annuelle totale correspondant à la quantité maximale importée rapportée lors d’une enquête menée en vertu de l’article 71 de la LCPE (10 000 kg), le taux d’élimination dans les usines de traitement des eaux usées de 16 % (ECCC 2016b) et un taux maximal de perte dans les rejets d’eaux usées de 1 % (Santé Canada 2015a). La concentration résultante dans les eaux de surface estimée de manière prudente était de 0,18 µg/L. Cette concentration a été utilisée pour estimer l’exposition de la population générale du Canada à la coumarine 1 à partir de l’eau potable.
L’absorption journalière potentielle de coumarine 1 estimée pour la population générale du Canada à partir de l’eau potable allait de 0,003 µg/kg p.c./jour pour les personnes âgées de 14 à 18 ans à 0,02 µg/kg p.c./jour pour les nourrissons nourris au lait maternisé (voir le tableau C-1 de l’annexe C).
Produits offerts aux consommateurs
D’après les déclarations faites à Santé Canada au titre du Règlement sur les cosmétiques, la coumarine 1 est utilisée dans certains produits cosmétiques au Canada, tels que des colorants capillaires temporaires, des vernis à ongles, du maquillage pour le corps, les lèvres et le visage (y compris du maquillage pour les yeux), à des concentrations allant de moins de 0,1 à 10 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, datés d’octobre 2018 à mai 2019; source non citée). Selon les renseignements fournis lors de la période de commentaires du public, la coumarine 1 peut être utilisée comme parfum dans divers produits de nettoyage (comme les nettoyants tout usage) à des concentrations inférieures à 0,5 %. De plus, la coumarine 1 peut être présente dans des produits de nettoyage pour tapis (CPID c2001-2019; RB c2012-2019; FDS 2015), et on peut y être exposé pendant et après l’application. On s’attend à ce que les expositions à la coumarine 1 découlant de son utilisation comme colorant dans les articles en tissu, en textile et en cuir offerts dans le commerce (Environnement Canada 2013) soient inférieures à celles attribuables aux produits de nettoyage.
Aucune donnée sur l’absorption dermique de la coumarine 1 n’a été trouvée. Il existe des études sur l’absorption dermique, in vitro et in vivo, pour l’analogue coumarine. Elles indiquent que l’absorption se situe dans la gamme allant d’environ 45 % à 98 %, selon le vecteur utilisé (les valeurs les plus basses ont été mesurées dans des études menées avec des solvants à l’éthanol, tandis que les plus élevées ont été mesurées dans des émulsions huile-eau) (Beckley-Kartey et al. 1997; Yourick et al. 1997; Minghetti et al. 2000; Ford et al. 2001). En fonction des valeurs d’absorption dermique mesurées dans les émulsions huile-eau (qui sont considérées comme étant plus pertinentes pour estimer les expositions à la coumarine 1 à partir des produits cosmétiques présentés dans le tableau 7-1), il a été présumé que l’absorption dermique de la coumarine 1 était de 100 %. Il ne devrait pas y avoir d’exposition à la coumarine 1 par inhalation lors de l’utilisation de vernis à ongles, de colorants capillaires en gel, de maquillage pour les lèvres, le corps et le visage en raison de sa faible pression de vapeur. Pour les produits en poudre et en aérosol, les expositions par inhalation estimées étaient négligeables par rapport aux expositions dermiques. Les expositions dermiques et orales estimées ont été calculées pour tous les groupes d’âge concernés. Pour la plupart des produits, seuls les groupes d’âge assujettis aux expositions les plus élevées et les plus faibles sont présentés dans le tableau 7‑1, afin de représenter la gamme d’expositions. Veuillez consulter l’annexe D pour obtenir plus de détails sur les paramètres utilisés.
| Scénario d’exposition | Concentration maximalea | Exposition estimée |
|---|---|---|
| Vernis à ongles – 2 couches (dermique)– 2 à 3 ans | 2 % | 0,08 mg/kg pc/événement |
| Vernis à ongles – 2 couches (dermique)– ≥ 19 ans | 2 % | 0,043 mg/kg pc/événement |
| Colorant capillaire temporaire en poudre (dermique)– 2 à 3 ans | 0,5 % | 0,06 mg/kg pc/événement |
| Colorant capillaire temporaire en poudre (dermique)– ≥ 19 ans | 0,5 % | 0,012 mg/kg pc/événement |
| Colorant capillaire temporaire en gel (dermique)b – 2 à 3 ans | 1 % | 0,19 mg/kg p.c./événement |
| Colorant capillaire temporaire en gel (dermique)b– 4 à 8 ans | 1 % | 0,14 mg/kg p.c./événement |
| Colorant capillaire temporaire en gel (dermique)b – 9 à 13 ans | 1 % | 0,083 mg/kg p.c./événement |
| Colorant capillaire temporaire en gel (dermique)b – 14 à 18 ans | 1 % | 0,06 mg/kg p.c./événement |
| Colorant capillaire temporaire en gel (dermique)b – ≥ 19 ans | 1 % | 0,05 mg/kg p.c./événement |
| Maquillage pour le visage (dermique) – 4 à 8 ans | 0,3 % | 0,044 mg/kg p.c./événement |
| Maquillage pour le visage (dermique) – ≥ 19 ans | 0,3 % | 0,026 mg/kg p.c./jour |
| Maquillage pour le corps (dermique)c – 4-8 ans | 0,3 % | 0,27 mg/kg p.c./événement |
| Maquillage pour le corps (dermique)c – ≥ 19 ans | 0,3 % | 0,17 mg/kg p.c./événement |
| Rouge et brillant à lèvres (orale)c,f – 2 à 3 ans | 1 % | 0,015 mg/kg p.c./événement |
| Rouge et brillant à lèvres (orale)d – ≥ 19 ans | 1 % | 0,0059 mg/kg p.c./jour |
| Application d’un nettoyant pour tapis (dermique) – ≥ 19 ans | 0,01 %e | 0,002 mg/kg p.c./événement |
| Après application de nettoyant pour tapis (dermique liée au fait de ramper sur le sol) – 6 à 11 mois | 0,01 %e | 0,0036 mg/kg p.c./jour |
| Après application de nettoyant pour tapis (orale liée au contact main-bouche) – 6 à 11 mois | 0,01 %e | 0,00078 mg/kg p.c./jour |
| Après application de nettoyant pour tapis (orale et dermique combinées) – 6 à 11 mois | 0,01 %e | 0,0044 mg/kg p.c./jour |
| Nettoyant tout usage en aérosol – Pulvérisation (dermique) – ≥ 19 ans | 0.5%f | 0,0083 mg/kg p.c./jour |
| Nettoyant tout usage en aérosol – Essuyage (dermique) – ≥ 19 ans | 0.5%f | 0,042 mg/kg p.c./jour |
| Nettoyant tout usage en aérosol – Pulvérisation + essuyage (dermique) – ≥ 19 ans | 0.5%f | 0,0503 mg/kg p.c./jour |
a Communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée, sauf indication contraire.
b Tous les groupes d’âge sont présentés pour les colorants capillaires temporaires en gel en raison des problèmes de santé pouvant être causés par ces produits (voir la section 7.3).
c Produit spécialisé qui serait utilisé occasionnellement sur le visage ou le corps.
d Produit spécialisé qui serait utilisé occasionnellement.
e FDS 2015.
f Selon les renseignements reçus au cours de la période de commentaires du public; source non citée.
7.2 Évaluation des effets sur la santé
Il existe peu de données sur le danger associé à la coumarine 1. Aucune étude sur la cancérogénicité ou la toxicité pour la reproduction et le développement n’a été recensée. Les données sur les effets sur la santé d’analogues ont donc été utilisées pour éclairer l’évaluation de la coumarine 1. Des analogues ont été retenus en fonction de la similarité de leurs propriétés physiques et chimiques, de leur métabolisme et de leur structure. Les données propres à la substance seront présentées en premier, suivies de celles sur l’analogue ayant servi à éclairer la caractérisation des effets sur la santé de la coumarine 1.
La coumarine 1 a été analysée en tant que membre du groupe des coumarines par le National Industrial Chemicals Notification and Assessment Scheme de l’Australie (NICNAS 2016). Un dossier d’enregistrement soumis à l’ECHA (ECHA c2007-2021) est également disponible pour la coumarine 1.
Lors d’une étude limitée menée selon la méthode de Draize, des lapins ont été exposés à la coumarine 1 pendant une période de 8 à 14 jours. Aucun signe de toxicité systémique n’a été observé après l’application topique de coumarine 1 chez des lapins (Thomann et Krüger 1975). Cependant, la quantité de coumarine 1 appliquée sur les lapins n’est pas précisée dans l’étude.
Une étude limitée de 14 semaines par voie orale à dose répétée avec des rats est présentée dans le dossier de l’ECHA sur la coumarine 1. Toutefois, il est indiqué que les résultats de cette étude ne pouvaient pas être interprétés en raison de leur présentation limitée (ECHA c2007-2021).
En ce qui concerne la génotoxicité, la coumarine 1 a donné des résultats négatifs lors d’un test Ames avec ou sans activation métabolique (NICNAS 2016). Des résultats négatifs ont aussi été obtenus lors d’un test in vitro de mutation génique de l’hypoxanthine-guanine phosphoribosyltransférase (HPRT) effectué sur des fibroblastes pulmonaires de hamsters chinois (V79) (ECHA c2007-2021).
Aucune étude sur les effets de la coumarine 1 attribuables à une exposition chronique n’a été recensée. La 6-méthylcoumarine (no CAS 92-48-8) est l’analogue le plus proche pour lequel des données sur la toxicité chronique ont été trouvées.
La 6-méthylcoumarine et la coumarine 1 contiennent toutes deux un squelette de coumarine, constitué de deux cycles à 6 atomes fusionnés : un cycle benzénique et une lactone insaturée en positions α et β. La coumarine 1 comporte aussi un groupe méthyle en position 4 et un groupe diéthylamino en position 7. Pour ce qui est des propriétés physico-chimiques, la coumarine 1 et la 6-méthylcoumarine ont des masses moléculaires (231 g/mol et 160 g/mol, respectivement), des points de fusion (de 72 °C à 75 °C et 76,5 °C, respectivement), des points d’ébullition (240 °C et 304 °C, respectivement) et des valeurs de log Koe (3,22 et 2,06) semblables. Toutefois, la coumarine 1 et la 6-méthylcoumarine ont des solubilités dans l’eau (53,28 mg/L et 1189 mg/L, respectivement) et des pressions de vapeur (0,00257 Pa et 0,068 Pa, respectivement) qui diffèrent de plusieurs ordres de grandeur (annexe B).
D’après leur structure chimique, il est probable que la 6-méthylcoumarine et la coumarine 1 soient métabolisées par une 7-hydroxylation. À l’opposé, la coumarine est principalement métabolisée par une 3,4-époxydation (Lake 1999). La 6-méthylcoumarine s’est avérée être l’analogue le plus proche de la coumarine 1 pour lequel des données sur la toxicité chronique ont été recueillies. Toutefois, aucune donnée sur la toxicité pour le développement et la reproduction de la 6-méthylcoumarine n’a été trouvée. La coumarine a donc été utilisée pour déterminer ce paramètre.
La 6-méthylcoumarine a fait l’objet d’un examen à l’échelle internationale par le Comité mixte FAO/OMS d’experts sur les additifs alimentaires (JECFA 2004) et par l’Autorité européenne de la sécurité des aliments (EFSA 2019). Ces travaux ont été utilisés pour éclairer la section sur l’évaluation des effets sur la santé.
Lors d’une étude à dose répétée de 13 semaines, des souris B6C3F1 (10/sexe/dose) ont reçu par gavage de la 6-méthylcoumarine à des doses de 0, 50, 100, 200, 400 ou 800 mg/kg p.c./jour. Au cours de cette étude, une souris ayant reçu la dose de 400 mg/kg p.c./jour est morte. À la dose la plus élevée, trois souris sont mortes et des cas de prostration, de bradycardie, de bradypnée, d’hypoactivité, d’hypothermie et de perte du réflexe de préhension ont été signalés. Il n’y a eu aucune modification importante du poids du corps ou des organes, ni aucune observation importante lors des examens cliniques, macroscopiques et microscopiques à aucune des autres doses d’essai (NTP 2002, cité dans JECFA 2004).
Lors d’une autre étude à dose répétée de 13 semaines, des rats F344/N (10/sexe/dose) ont reçu par gavage de la 6-méthylcoumarine à des doses de 0, 75, 150, 300, 600 ou 1200 mg/kg p.c./jour. Pendant la première semaine de l’étude, un rat ayant reçu la dose de 600 mg/kg p.c./jour et tous les rats ayant reçu la dose d’essai la plus élevée sont morts. À la nécropsie, des lésions hépatiques microscopiques, avec divers degrés de congestion, de dégénération, de nécrose et d’hépatite, ont été observées chez les rats recevant la dose de 1200 mg/kg p.c./jour. Chez les mâles et les femelles ayant reçu 600 ou 1200 mg/kg p.c./jour, des effets cliniques ont été observés, y compris une hypoactivité, un larmoiement, une ataxie, un réflexe de redressement perturbé et un tonus des membres moindre. Chez les mâles et les femelles recevant la dose de 600 mg/kg p.c./jour, une diminution statistiquement significative du poids corporel a été observée à la semaine 13. Aux doses de 300 mg/kg p.c./jour et de 600 mg/kg p.c./jour, on a observé une augmentation du poids moyen relatif et absolu du foie chez les mâles et les femelles, ainsi qu’une diminution importante de l’activité de la cholinestérase sérique chez les femelles. Aucune autre modification des paramètres hématologiques, urinaires ou biochimiques du sérum n’a été observée à aucune des doses. Aucun effet lié au traitement n’a été observé à une dose de 150 mg/kg p.c./jour (NTP 2002, cité dans JECFA 2004).
Lors d’une étude à dose répétée de 13 semaines, des rats mâles Sprague-Dawley (de 6 à 8 rats par groupe) ont été exposés dans leur alimentation à la 6-méthylcoumarine, à une concentration de 0,82 % (695 mg/kg p.c./jour). Une vacuolisation des hépatocytes et une hausse du poids relatif du foie ont été rapportées. Il n’y a eu aucune augmentation de l’activité de l’aminotransférase plasmatique, aucune hyperplasie du canal biliaire, ni aucune cholangiofibrose (Lake et al. 1994, cité dans JECFA 2004 et NICNAS 2016).
Dans le cadre d’une étude à dose répétée de 14 semaines, des rats Osborne-Mendel (25/sexe/groupe) ont été exposés à la 6-méthylcoumarine dans leur alimentation, à une concentration de 0, 1000 ou 10 000 ppm (ce qui équivaut à 0, 100 ou 1000 mg/kg p.c./jour). Aucun effet lié au traitement sur la santé générale, le comportement, le poids corporel, la consommation alimentaire, le poids des organes, ni aucune modification macroscopique ou microscopique des tissus ou lors d’un examen hématologique n’ont été observés à aucune des doses (Hagan et al. 1967, cité dans JECFA 2004).
Lors d’une étude sur la cancérogénicité de deux ans, des rats Osborne-Mendel (25/sexe/groupe) ont été exposés à la 6-méthylcoumarine dans leur alimentation, à des doses de 0, 25, 50, 175, 250, 375 ou 750 mg/kg p.c./jour. Chez les mâles, on a relevé une diminution modérée de la croissance et une baisse de la prise alimentaire à la dose de 375 mg/kg p.c./jour et une importante diminution de la croissance à la dose de 750 mg/kg p.c./jour. À la dose d’essai la plus élevée, une métamorphose graisseuse, une télangiectasie focale et une prolifération de canaux biliaires dans le foie ont été observées. Une atrophie testiculaire a été observée à la dose de 750 mg/kg p.c./jour. Aucun autre effet lié au traitement, y compris la cancérogénicité, n’a été observé à aucune des doses d’essai (Hagan et al. 1967, cité dans EFSA 2019).
En ce qui concerne la génotoxicité, la 6-méthylcoumarine a donné des résultats négatifs lors de deux tests Ames (avec et sans activation métabolique), des résultats équivoques lors d’un test Ames avec Salmonella typhimurium TA100 (avec activation métabolique) et des résultats négatifs (avec activation métabolique) lors d’un essai sur des lymphomes de souris (ESFA 2019). Lors d’études in vivo de validité limitée, la 6-méthylcoumarine a donné des résultats négatifs lors d’un test du micronoyau sur des cellules de moelle osseuse de souris par gavage et d’un test du micronoyau sur des cellules de sang périphérique de souris par injection intrapéritonéale de 90 jours (EFSA 2019). Selon les données disponibles, la 6-méthylcoumarine ne devrait pas être génotoxique (EFSA 2019).
Il n’existe aucune étude sur la toxicité pour la reproduction et le développement de la coumarine 1 ou de la 6-méthylcoumarine. Ainsi, en adoptant une approche prudente, nous avons utilisé la coumarine pour éclairer la caractérisation de la toxicité pour la reproduction et le développement de la coumarine 1. Lors d’une étude sur le développement, des souris NMRI gravides (de 31 à 39 souris par groupe) ont reçu des doses de 0, 0,05, 0,10 ou 0,25 % de coumarine (équivalant à 0, 75, 150 ou 375 mg/kg p.c./jour, respectivement) dans leur alimentation pendant les jours 6 à 17 de la gestation. L’étude n’a pas porté sur les effets sur la mère. À toutes les doses, on a constaté une augmentation importante de la mortalité totale (c.-à-d. le nombre de mortinaissances et le nombre de petits morts avant l’âge de 3 semaines) (Roll et Bär, 1967, NICNAS 2016). À 375 mg/kg p.c./jour, une augmentation des résorptions tardives et une ossification retardée ont aussi été observées. La dose minimale avec effet nocif observé (DMENO) a été établie à 75 mg/kg p.c./jour, d’après la mortalité accrue chez les petits de moins de 3 semaines.
Il n’existe aucune étude sur la cancérogénicité de la coumarine 1. Comme mentionné précédemment, lors d’une étude à dose répétée de deux ans avec des rats Osborne-Mendel exposés à de la 6-méthylcoumarine, aucun effet cancérigène n’a été rapporté jusqu’à une dose de 750 mg/kg p.c./jour (Hagan et al. 1967, cité dans EFSA 2019). Des signes de cancérogénicité de la coumarine ont été relevés lors d’essais sur des animaux (NTP 1993, cité dans NICNAS 2016). Toutefois, les effets cancérigènes de la coumarine ont été liés à sa métabolisation par 3,4-époxydation (EFSA 2008), alors que, d’après leur structure chimique, la 6-méthylcoumarine et la coumarine 1 sont probablement métabolisées par 7-hydroxylation (Lake 1999). À la lumière des données disponibles, la coumarine 1 n’est probablement pas cancérigène.
7.3 Caractérisation du risque pour la santé humaine
La population générale du Canada peut être exposée à la coumarine 1 à partir de l’eau potable, en raison de rejets ponctuels dans l’eau. Les Canadiens peuvent être exposés à la coumarine 1 lors de l’utilisation de produits cosmétiques comme des colorants capillaires temporaires, des vernis à ongles et du maquillage pour le corps ou le visage (y compris pour les yeux et les lèvres). La présence de coumarine 1 a aussi été signalée dans divers produits de nettoyage, notamment des nettoyants tout usage et un nettoyant pour tapis.
D’après les données disponibles sur la coumarine 1 et sur l’analogue 6‑méthylcoumarine, la coumarine 1 n’est probablement pas génotoxique ni cancérigène (NICNAS 2016, ECHA c2007-2021, EFSA 2019).
Étant donné la gravité des effets observés et l’absence d’études sur la toxicité pour la reproduction et le développement de la coumarine 1 et de la 6-méthylcoumarine, une DMENO de 75 mg/kg p.c./jour a été établie comme niveau d’effet critique pour la caractérisation du risque, d’après la mortalité accrue observée chez les petits de moins de 3 semaines lors d’une étude sur la toxicité pour la reproduction et le développement réalisée avec la coumarine, un analogue de la coumarine 1.
Le tableau 7‑2 présente toutes les valeurs pertinentes de l’exposition et du danger pour la coumarine 1 ainsi que les marges d’exposition (ME) correspondantes pour la détermination du risque.
| Scénario d’exposition | Exposition estimée | Niveau d’effet critique | ME |
|---|---|---|---|
| Eau potable | 2,4E-5 mg/kg p.c./jour | DMENO = 75 mg/kg p.c./jour | 3 125 000 |
| Vernis à ongles – 2 couches (dermique) – 2 à ≥ 19 ans | 0,043–0,08 mg/kg pc/événement | DMENO = 75 mg/kg p.c./jour | 937–1744 |
| Colorant capillaire temporaire en poudre (dermique) – 2 à ≥ 19 ans | 0,012–0,06 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 1250–6250 |
| Colorant capillaire temporaire en gel (dermique)b – 2 à 3 ans | 0,19 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 395 |
| Colorant capillaire temporaire en gel (dermique)b – 4 à 8 ans | 0,13 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 577 |
| Colorant capillaire temporaire en gel (dermique)b – 9 à 13 ans | 0,083 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 904 |
| Colorant capillaire temporaire en gel (dermique)b – 14 à 18 ans | 0,06 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 1250 |
| Colorant capillaire temporaire en gel (dermique)b – ≥ 19 ans | 0,05 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 1500 |
| Maquillage pour le visage (dermique) – 4 à ≥19 ans | 0,026–0,044 mg/kg p.c./jour | DMENO = 75 mg/kg p.c./jour | 1704–2884 |
| Maquillage pour le corps (dermique)c – 4 à ≥ 19 ans | 0,17–0,27 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 280–447 |
| Rouge/brillant à lèvres (orale) – 2 à ≥ 19 ans | 0,0089–0,015 mg/kg p.c./événement | DMENO = 75 mg/kg p.c./jour | 5000–8427 |
| Pendant l’application de nettoyant pour tapis (dermique) – ≥ 19 ans | 0,002 mg/kg pc/événement | DMENO = 75 mg/kg p.c./jour | 37 500 |
| Après l’application de nettoyant pour tapis (orale et dermique combinées) – 6 à 11 mois | 0,00437 mg/kg p.c./jour | DMENO = 75 mg/kg p.c./jour | 17 162 |
| Nettoyant tout usage en aérosol – Pulvérisation + essuyage (dermique) – ≥ 19 ans | 0,0503 mg/kg p.c./jour | DMENO = 75 mg/kg p.c./jour | 1491 |
Abréviations : ME – marge d’exposition; DMENO – dose minimale avec effet nocif observé.
a Pour la plupart des produits cosmétiques, seuls les groupes d’âge assujettis aux expositions les plus élevées et les plus faibles sont présentés, afin de représenter la gamme complète d’expositions.
b Pour les colorants capillaires temporaires en gel, toutes les tranches d’âge sont présentées compte tenu des problèmes de santé que posent ces produits.
c Produit spécialisé qui serait utilisé occasionnellement sur le visage ou le corps.
Les marges d’exposition calculées pour les milieux de l’environnement, les vernis à ongles, les colorants capillaires temporaires en poudre, le maquillage pour le visage, les rouges et brillants à lèvres, les nettoyants pour tapis et les nettoyants tout usage en aérosol sont jugées adéquates pour tenir compte des incertitudes des ensembles de données sur les effets sur la santé et l’exposition. Toutefois, les marges d’exposition calculées pour le maquillage pour le corps (personnes âgées de 4 ans et plus) et les colorants capillaires temporaires en gel (personnes âgées de 2 à 13 ans) sont jugées inadéquates pour tenir compte des incertitudes des ensembles de données sur les effets sur la santé et l’exposition.
7.4 Incertitudes de l’évaluation du risque pour la santé humaine
Les sources clés d’incertitude sont présentées dans le tableau ci-après.
| Source clé d’incertitude | Incidence |
|---|---|
| Les données sur l’absorption dermique de la coumarine 1 ne sont pas disponibles. En conséquence, les données sur l’absorption dermique de l’analogue coumarine ont été prises en compte et présumées équivalentes à celles sur l’absorption par voie orale. | + |
| Il n’existe aucune donnée de surveillance pour la coumarine 1 dans l’environnement. | +/- |
| Il n’existe aucune donnée sur la toxicité chronique ou la toxicité pour la reproduction et le développement de la coumarine 1, et les renseignements sur la toxicité dermique sont limités. | +/- |
+ = incertitude avec potentiel de surestimation de l’exposition/du risque; - = incertitude avec potentiel de sous-estimation de l’exposition/du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation de l’exposition/du risque.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, la coumarine 1 présente un faible risque d’effets nocifs sur l’environnement. Il est conclu que la coumarine 1 ne satisfait pas aux critères énoncés aux alinéas 64a) ou 64 b) de la LCPE, car elle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière de tous les renseignements contenus dans la présente évaluation préalable, il est conclu que la coumarine 1 satisfait aux critères énoncés à l’alinéa 64c) de la LCPE, car elle pénètre ou pourrait pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que la coumarine 1 satisfait à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est également conclu que la coumarine 1 répond aux critères de persistance, mais pas à ceux de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Beckley-Kartey S.A.J., Hotchkiss S.A.M. et Capel M. 1997. Comparative in vitro skin absorption and metabolism of coumarin (1,2-benzopyrone) in human, rat and mouse; Toxicol. Appl. Pharmacol., 145, p. 34-42 (disponible en anglais seulement).
Boîte à outils QSAR de l’OCDE. [Outil de lecture croisée]. 2014. Version 3.3. Paris (France), Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique (disponible en anglais seulement).
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch.33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, Environnement, min. de l’. 2012. Loi canadienne sur la protection de l’environnement (1999), 1999 [PDF] : Avis concernant certaines substances de la Liste intérieure. Gazette du Canada, Part I, vol. 146, no 48, Supplément.
ChemIDplus [base de données]. 1993- . Bethesda (MD), US National Library of Medicine [consultée le 28 août 2018] (disponible en anglais seulement).
ChemSpider [base de données]. 2015. Search results for CAS RN 91-44-1. Londres (R.-U.), Royal Society of Chemistry [consultée le 3 mai 2019] (disponible en anglais seulement).
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (Pays-Bas), Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement] (disponible en anglais seulement).
[CPID] Consumer Product Information Database USA and Canada. c2001-2019. Resolve Professional Carpet Extraction Cleaner, Professional Use [consulté en mai 2019] (disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (Qc), ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Disponible à substances@ec.gc.ca (disponible en anglais seulement).
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation des substances chimiques; Ottawa (Ont.), gouvernement du Canada [consulté le 30 avril 2019].
[ECHA] Agence européenne des produits chimiques. c2007-2021. Registered substances database; search results for CAS RN 91-44-1. Helsinki (Finlande), ECHA [consulté le 30 juillet 2021] (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité des aliments. 2004. Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to Coumarin Question Number: EFSA-Q-2003-118 (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité des aliments. 2008. Coumarin in flavourings and other food ingredients with flavouring properties – Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) (disponible en anglais seulement).
[EFSA] Autorité européenne pour la sécurité des aliments. 2019. Scientific Opinion on Flavouring Group Evaluation 217 Revision 2 (FGE.217Rev2), consideration of genotoxic potential for α,β‐unsaturated ketones and precursors from chemical subgroup 4.1 of FGE.19: lactones; EFSA Journal, volume 17: Issue 1 (disponible en anglais seulement).
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPA] Environmental Protection Agency des États-Unis. 2012. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. Washington (DC), Health Effects Division, Office of Pesticide Programs, Office of Chemical Safety and Pollution Prevention (disponible en anglais seulement).
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]. c2000-2012. Ver. 4.11. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY), Syracuse Research Corporation (disponible en anglais seulement).
Ficheux A.S., Chevillotte G., Wesolek N., Morisset T., Dornic N., Bernard A., Bertho A., Romanet A., Leroy L., Mercat A.C., Creusot T., Simon E. et Roudot A.C. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem. Toxicol., 90, p. 130-141 (disponible en anglais seulement).
Ficheux A.S., Morriset T., Chevillotte G., Postic C. et Roudot A.C. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food Chem. Toxicol., 66, p. 36-43 (disponible en anglais seulement).
Ford R.A., Hawkins D.R., Mayo B.C. et Api A.M. 2001. The in vivo dermal absorption and metabolism of [4-14C] coumarin by rats and by human volunteers under simulated conditions of use in fragrances. Food Chem. Toxicol., 39(2), p. 153-62 (disponible en anglais seulement).
[FDS] Fiche de données de sécurité. 2015. Electrolux Pet Stain & Odor W/BS2X with Baking Soda [PDF]. Michigan City (IN), Fas-Pak [consulté en août 2021] (disponible en anglais seulement).
[FDS] Fiche de données de sécurité. 2019. 7-Diethylamino-4-methylcoumarin [PDF]. Lancashire (R.-U.), Thermo Fisher Scientific [consulté le 3 mai 2019] (disponible en anglais seulement).
Garcia-Hidalgo E., von Goetz N., Siegrist M. et Hungerbühle K. 2017. Use-patterns of personal care and household cleaning products in Switzerland. Food Chem. Toxicol., 99, p. 24-39 (disponible en anglais seulement).
Hagan E.C., Hansen W.H., Fitzhugh O.G., Jenner P.M., Jones W.I., Taylor J.M., Long E.L., Nelson A.A. et Brouwer J.B. 1967. Food flavourings and compounds of related structure. II.Subacute and chronic toxicity. Food Cosmet. Toxicol., 5(2), p. 141-57 (disponible en anglais seulement).
[HCPA] Household & Commercial Products Association. 2019. Consumer Product Ingredients Database: Diethylaminomethylcoumarin [Internet]. Washington (DC), HCPA (disponible en anglais seulement).
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2004. Safety evaluation of certain food additives and contaminants prepared by the sixty-first meeting of the Joint FAO/WHO Expert Committee on Food Additives. WHO Food Additives Series No. 52 (disponible en anglais seulement).
Lake B.G. 1999. Coumarin metabolism, toxicity and carcinogenicity: relevance for human risk assessment; Food Chem. Toxicol., 1999(4), p. 423-53 (disponible en anglais seulement).
Landeg S., Kirby A., Lee S., Bartlett F., Titmarsh K., Donovan E., Griffin C., Gothard L., Locke I. et McNair H. 2016. A randomized control trial evaluating fluorescent ink versus dark ink tattoos for breast radiotherapy; Br. J. Radiol., 89(1068):20160288 [consulté en mai 2019] (disponible en anglais seulement).
Loretz L., Api A.M., Barraj L., Burdick J., Davis D.A., Dressler W., Gilberti E., Jarrett G., Mann S., Pan Y.H.L., et al. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem. Toxicol., 44, p. 2008-2018 (disponible en anglais seulement).
Minghetti P., Casiraghi A., Cilurzo F. et Montanari L. 2000. Development of local patches containing melilot extract and ex vivo–in vivo evaluation of skin permeation. Eur. J. Pharm. Sci., 10(2), p. 111-117 (disponible en anglais seulement).
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2016. Coumarins : Human health tier II assessment. Gouvernement de l’Australie, ministère de la Santé [consulté en avril 2019] (disponible en anglais seulement).
Piccinini P., Contor L., Pakalin S., Raemaekers T. et Senaldi C. 2015. Safety of tattoos and permanent make-up. State of play and trends in tattoo practices. Report on Work Package 2. Administrative Arrangement N. 2014-33617. Analysis conducted on behalf of DG JUST. Piccinini P, Contor L, Pakalin S, Raemaekers T, Senaldi C. JRC Technical Reports. Report EUR 27528. European Commission, 2015 (disponible en anglais seulement).
- c2012-2019. Professional Resolve Carpet Extraction Cleaner [Internet]. Parsippany (NJ), Reckitt Benckiser LLC [consulté en mai 2019] (disponible en anglais seulement).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4 [PDF]. Bilthoven (Pays-Bas), RIVM, rapport no 320104001/2006 [consulté en mai 2019] (disponible en anglais seulement).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2018. Cleaning products fact sheet: default parameters for estimating consumer exposure – updated version 2018. Bilthoven (Pays-Bas), RIVM, rapport no 2016-0179 [consulté en mai 2019] (disponible en anglais seulement).
Roll R. et Bär F. 1967. Effect of coumarin (o-hydroxyeinnamic acid-lactone) on pregnant female mice. Arzneimittelforschung, 1, p. 97-100, en allemand.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.), gouvernement du Canada (disponible en anglais seulement).
Santé Canada. 2015. Environmental Assessment Unit Drinking Water Spreadsheets [format Excel]. Ottawa (Ont.), Santé Canada (disponible en anglais seulement).
Santé Canada. [Modifié le 25 juin 2021]. Facteurs d’exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 août 2021].
Thomann P. et Krüger L. 1975. Acute oral, dermal, and inhalation studies. Environ. Qual. Saf. Suppl., 4, p. 193-8 (disponible en anglais seulement).
Vocanson M., Valeyrie M., Rozières A., Hennino A., Floc’h F., Gard A. et Nicolas J.F. 2007. Lack of evidence for allergenic properties of coumarin in a fragrance allergy mouse model. Contact Dermatitis, 6, p. 361-4 (disponible en anglais seulement).
Yourick J.J. et Bronaugh R.L. 1997. Percutaneous absorption and metabolism of coumarin in human and rat skin. J. Appl. Toxicol., 13(3), p. 153-158 (disponible en anglais seulement).
Annexe A – Approche de lecture croisée
| Élément pris en compte | Justification |
|---|---|
| 1) Structure chimique. L’accent est mis sur des analogues ayant un squelette de coumarine, squelette constitué de deux cycles à 6 atomes fusionnés : un cycle benzénique et une lactone insaturée en positions α et β. | Les analogues qui ont des structures chimiques similaires devraient avoir des profils de toxicité similaires. |
| 2) Métabolites similaires (prédits ou observés). | Les analogues qui sont métabolisés par des voies similaires en produits de dégradation similaires devraient avoir des profils de toxicité similaires. |
| 3) Alertes structurales communes. | Les analogues ayant des alertes structurales similaires devraient avoir une similarité plus grande sur le plan de la toxicité. |
| 4) Propriétés physico-chimiques similaires. L’accent a été mis sur les structures chimiques ayant une masse moléculaire, une solubilité dans l’eau, une pression de vapeur et une valeur de log Koe similaires. | Les analogues ayant des propriétés physico-chimiques similaires peuvent avoir des profils toxicologiques similaires. |
Annexe B – Résumé du danger associé à la coumarine 1, à la 6-méthylcoumarine et à la coumarine
| Nom chimique | Coumarine 1 | 6-Méthylcoumarine | Coumarine |
|---|---|---|---|
| Rôle | Substance visée | Analogue | Analogue |
| No CAS | 91-44-1 | 92-48-8 | 91-64-5 |
| Structure chimique | 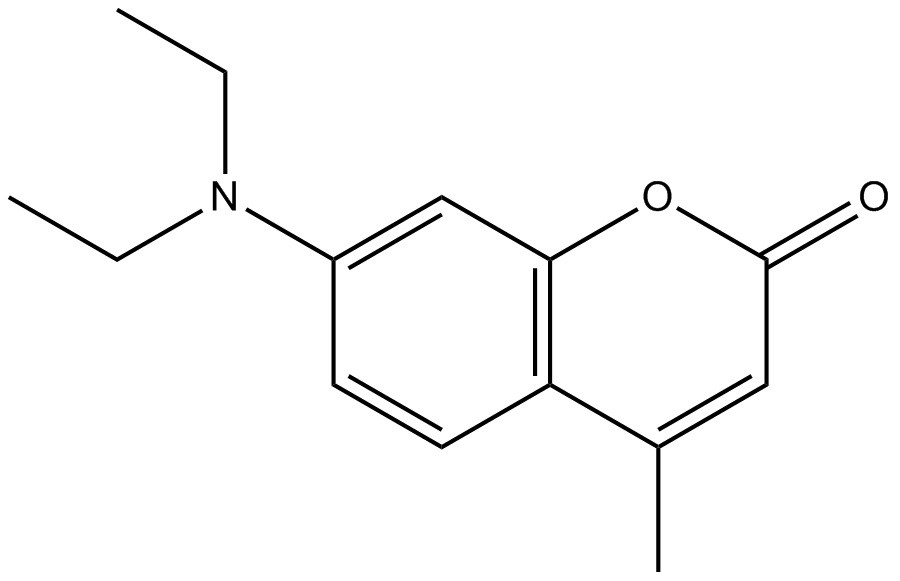 |
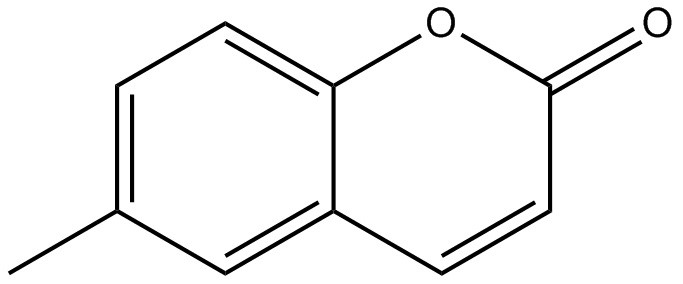 |
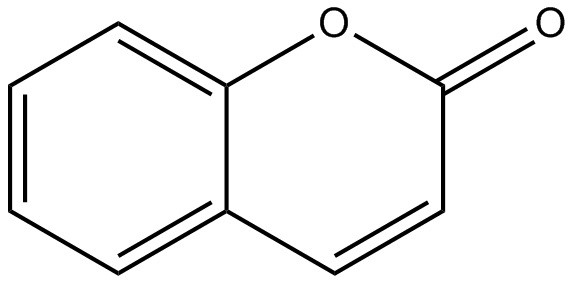 |
| Masse moléculaire (g/mol) | 231,290 (ChemIDplus 1993- ) | 160,172 (ChemIDplus 1993- ) | 146,144 (ChemIDplus 1993- ) |
| Point de fusion (°C) | 72–75 (Epi Suite c2000-2012) | 76,5 (ChemIDplus 1993- ) | 71 (ChemIDplus 1993- ) |
| Point d’ébullition (°C) | 240 (ChemSpider 2015) | 304 (ChemIDplus 1993- ) | 301,7 (ChemIDplus 1993- ) |
| Pression de vapeur (Pa) | 0,00257 (Epi Suite c2000-2012) | 0,068 (Epi Suite c2000-2012) | 0,087 (Epi Suite c2000-2012) |
| Solubilité dans l’eau (mg/L) | 53,28 à 25 °C (Epi Suite c2000-2012) | 1189 à 25 °C (Epi Suite c2000-2012) | 5126 à 25 °C (Epi Suite c2000-2012) |
| log Koe (sans dimension) | 3,22 à 25 °C (Epi Suite c2000-2012) | 2,060 à 25 °C (Epi Suite c2000-2012) | 1,51 à 25 °C (Epi Suite c2000-2012) |
| Toxicité aiguë (orale) | DL50 : 5000 mg/kg p.c. chez le rat et 1780 mg/kg p.c. chez la souris (NICNAS 2016) | DL50 : 1680 mg/kg p.c. chez le rat (NICNAS 2016) | DL50 : 290–680 mg/kg p.c. chez diverses souches de rat; 196‑780 mg/kg p.c. chez diverses souches de souris (NICNAS 2016) |
| Sensibilisation cutanée | Lors d’un test de maximisation sur des cobayes femelles, la coumarine s’est avérée non sensibilisante (ECHA c2007-2019). Lors d’un test épicutané limité chez des humains, il n’y a eu aucune réaction positive (ECHA c2007-2021). |
Aucun signe de potentiel photoallergène chez les cobayes et les humains (NICNAS 2016). Lors d’un test de maximisation avec des humains, il n’y a eu aucune réaction cutanée après exposition des volontaires à de la 6‑méthylcoumarine à 4 % dans du pétrolatum (NICNAS 2006). | Aucun potentiel de sensibilisation cutanée (SCCP 2005, cité dans NICNAS 2016).
La coumarine pure a de très faibles capacités de sensibilisation (Vocanson et al. 2007). |
| Toxicité subchronique à dose répétée (orale) | Étude par voie orale (régime alimentaire) avec des rats (14 semaines) : Étude limitée décrite dans la section sur l’évaluation des effets sur la santé (ECHA c2007-2021) |
Étude par gavage avec des rats (13 semaines) : Vecteur : non précisé DSENO = 150 mg/kg p.c./jour, d’après une diminution importante de l’activité de la cholinestérase sérique chez les femelles et une augmentation du poids moyen relatif ou absolu chez les deux sexes à la dose suivante de 300 mg/kg p.c./jour (NTP 2002, cité dans JECFA 2004). Étude par voie orale (régime alimentaire) avec des rats (13 semaines) : 695 mg/kg p.c. = légère vacuolisation des hépatocytes (Lake et al. 1994, cité dans JECFA 2004). Étude par voie orale (régime alimentaire) avec des rats (14 semaines) : DSENO = 1000 mg/kg p.c./jour (dose d’essai la plus élevée) (Hagan et al. 1967, cité dans JECFA 2004). |
Étude par gavage avec des rats (13 semaines) : Vecteur : huile de maïs DSENO = 75 mg/kg p.c./jour, d’après une dégénération hépatocellulaire centrilobulaire et une nécrose accompagnée d’une inflammation active chronique et d’une hyperplasie des canaux biliaires à la dose de 150 mg/kg p.c./jour (NTP 1993, cité dans NICNAS 2016). |
| Toxicité à long terme à dose répétée (orale) | S.O. | Étude par voie orale (régime alimentaire) avec des rats (2 ans) : DSENO = 250 mg/kg p.c./jour, d’après une diminution modérée de la croissance à la dose suivante de 375 mg/kg p.c./jour (Hagan et al. 1967) |
Étude par gavage avec des rats (2 ans) : Vecteur : huile de maïs DMENO = 25 mg/kg p.c./jour, d’après des lésions au foie, aux reins et au préestomac (NTP 1993). |
| Toxicité pour la reproduction et le développement (orale) | S.O. | S.O. | Étude par voie orale (régime alimentaire) avec des souris (jours 6 à 17) : DMENO = 75 mg/kg p.c./jour, d’après une mortalité accrue chez les petits âgés de moins de 3 semaines (Roll et Bär 1967).. |
| Toxicité génétique | Négative (NICNAS 2016) | Négative (EFSA 2019) | Négative (EFSA 2004) |
| Cancérogénicité (orale) | S.O. | Étude par voie orale (régime alimentaire) avec des rats (2 ans) : Aucune cancérogénicité observée jusqu’à 750 mg/kg p.c./jour (EFSA 2019). |
Eacute;tude par gavage avec des rats et des souris (2 ans) : Vecteur : huile de maïs DMENO = 50 mg/kg p.c./jour, d’après des incidences accrues d’adénomes des tubules rénales chez les rats mâles, des incidences accrues d’adénomes alvéolaires et bronchiolaires, de carcinomes alvéolaires et bronchiolaires et d’adénomes hépatocellulaires chez les souris femelles (NTP 1993, cité dans NICNAS 2016). Étude par voie orale (régime alimentaire) avec des chiens (2 ans) : DSENO = 10 mg/kg p.c./jour, d’après des lésions histologiques du foie à la dose suivante de 25 mg/kg p.c./jour (NICNAS 2016). |
Abréviations : S.O. – sans objet; DL50 – dose létale médiane; DSENO – dose sans effet nocif observé; DMENO – dose minimale avec effet nocif observé.
Annexe C – Absorption journalière estimée pour divers groupes d’âge de la population générale du Canada
| Voie d’exposition | De 0 à 5 moisa (nourri au sein)b |
De 0 à 5 moisa (nourri au lait maternisé)c |
De 6 à 11 moisd | 1 ane | De 2 à 3 ansf | De 4 à 8 ansg | De 9 à 13 ansh | De 14 à 18 ansi | ≥ 19 ansj |
|---|---|---|---|---|---|---|---|---|---|
| Eau potablek | S.O. | 0,024 | 0,015 | 5,9E-3 | 5,2E-3 | 4,2E-3 | 3,2E-3 | 3,2E-3 | 3,7E-3 |
Abréviation : S.O. = sans objet.
a On présume que le nourrisson pèse 6,3 kg, respire 3,7 m3 d’air par jour et ingère 21,6 mg de poussière par jour. On présume également qu’il n’y a aucune ingestion de sol en raison des pratiques types des soignants (Santé Canada 2021).
b Exclusivement pour les nourrissons nourris au sein, en présumant d’une consommation de 0,744 L de lait maternel par jour (Santé Canada 2021) et que le lait maternel est la seule source d’alimentation.
c Exclusivement pour les nourrissons nourris avec du lait maternisé, en présumant d’une consommation de 0,826 L d’eau par jour (Santé Canada 2021), cette eau étant utilisée pour reconstituer le lait. Voir la note de bas de page sur l’eau potable pour obtenir des détails.
d On présume que le nourrisson pèse 9,1 kg, respire 5,4 m3 d’air par jour, boit 0 L d’eau par jour, ingère 7,3 mg de sol par jour et 27,0 mg de poussière par jour. Pour les nourrissons nourris au sein, on présume qu’ils consomment 0,632 L de lait maternel par jour. Pour les nourrissons nourris au lait maternisé, on présume qu’ils consomment 0,764 L d’eau par jour (Santé Canada 2021), cette eau étant utilisée pour reconstituer le lait. Voir la note de bas de page sur l’eau potable pour obtenir des détails.
e On présume que le bébé pèse 11,0 kg, respire 8,0 m3 d’air par jour, boit 0,36 L d’eau par jour, ingère 8,8 mg de sol par jour et 35,0 mg de poussière par jour (Santé Canada 2021).
f On présume que l’enfant pèse 15 kg, respire 9,2 m3 d’air par jour, boit 0,43 L d’eau par jour, ingère 6,2 mg de sol par jour et 21,4 mg de poussière par jour (Santé Canada 2021).
g On présume que l’enfant pèse 23 kg, respire 11,1 m3 d’air par jour, boit 0,53 L d’eau par jour, ingère 8,7 mg de sol par jour et 24,4 mg de poussière par jour (Santé Canada 2021).
h On présume que l’enfant pèse 42 kg, respire 13,9 m3 d’air par jour, boit 0,74 L d’eau par jour, ingère 6,9 mg de sol par jour et 23,8 mg de poussière par jour (Santé Canada 2021).
i On présume que la personne pèse 62 kg, respire 15,9 m3 d’air par jour, boit 1,09 L d’eau par jour, ingère 1,4 mg de sol par jour et 2,1 mg de poussière par jour (Santé Canada 2021).
j On présume que la personne pèse 74 kg, respire 15,1 m3 d’air par jour, boit 1,53 L d’eau par jour, ingère 1,6 mg de sol par jour et 2,6 mg de poussière par jour (Santé Canada, 2021).
k Exposition estimée à 0,18 µg/L d’après le NSACB EAU Drinking Water Spreadsheet (2003) et les données les plus élevées sur le volume (10 000 kg).
Annexe D – Paramètres utilisés pour estimer les expositions des humains à partir de produits offerts aux consommateurs
Les estimations d’exposition ont été calculées pour des poids corporels par défaut de 6,3 kg (0-5 mois), 9,1 kg (6-11 mois), 11 kg (1 an), 15 kg (2-3 ans), 23 kg (4-8 ans), 42 kg (9-13 ans), 62 kg (14-18 ans) et 74 kg (≥ 19 ans) (Santé Canada 2021). Les expositions dermiques et orales estimées attribuables aux produits cosmétiques ainsi qu’aux nettoyants pour tapis ont été calculées au moyen de ConsExpo Web (2016). Les expositions à la coumarine 1 après l’application de nettoyants pour tapis ont été calculées en utilisant le document EPA 2012 pour les jeunes enfants. Les expositions par inhalation estimées pour tous les scénarios étaient négligeables par rapport aux expositions dermiques, et n’ont donc pas été présentées. Les paramètres utilisés pour estimer les expositions sont décrits au tableau D-1.
| Scénario d’exposition | Hypothèsea,b |
|---|---|
| Vernis à ongles (dermique) 2 couches de vernis appliquées sur les ongles des doigts et des orteils |
Concentration maximale rapportée : 2 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Quantité de produit sur la peau : 0,06 g/utilisation (2-3 ans), 0,16 g/utilisation (14-18 ans, ≥ 19 ans) [modifié à partir de Ficheux et al. 2014, ajusté par un facteur de 0,206 pour les adultes et de 0,205 pour les enfants pour tenir compte de la quantité de vernis qui se retrouve sur la peau] |
| Colorant capillaire temporaire en poudre (dermique)c | Concentration maximale rapportée : 0,5 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Charge : application instantanée Quantité de produit : 1,75 g (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, mai 2019; source non citée) Facteur de rétention : 0,1 |
| Colorant capillaire temporaire en gel (dermique)c | Concentration maximale déclarée : 1 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Scénario : application présumée être semblable à celle d’un gel pour les cheveux Charge : application instantanée Quantité de produit : 3,7 g (14-18 ans, ≥ 19 ans) [Ficheux et al. 2016], 2,8 g (2-3 ans), 3,1 g (4-8 ans), 3,5 g (9-13 ans), d’après la valeur pour les 14-18 ans, modifiée en fonction des différences de surface de la moitié de la tête. Facteur de transfert : 0,1 d |
| Rouge et brillant à lèvrese (orale) |
Concentration maximale rapportée : 1 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Fréquence : 1 fois/jour (2-3 ans), 2,5 fois/jour (14-18 ans), 2 fois/jour (≥ 19 ans) Quantité ingérée : 0,022 g (Ficheux et al. 2016) |
| Maquillage pour le visage (dermique) | Concentration maximale rapportée : 0,3 % (communication personnelle, courriels de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Scénario de maquillage pour le visage tiré de Cosmetic Fact Sheet (RIVM 2006), avec information supplémentaire sur la quantité appliquée Fréquence : 1,2 fois/jour (≥ 19 ans) [Loretz et al., 2006]; les expositions par événement ont été calculées pour le groupe des 4-8 ans étant donné que la fréquence d’utilisation est inférieure à 1 fois/jour (Garcia-Hidalgo et al. 2017 et jugement professionnel) Charge : application instantanée Quantité de produit : 0,34 g (4-8 ans), 0,54 g (≥ 19 ans) [Loretz et al. 2006] |
| Maquillage pour le corpsf (dermique) |
Concentration maximale rapportée : 0,3 % (communication personnelle de la DSPCPD de SC au BERSE de SC, octobre 2018; source non citée) Scénario pour un hydratant pour le corps tiré de Cosmetics Fact Sheet (RIVM 2006), avec information supplémentaire sur la quantité appliquée Surface : 3393 cm2 (4-8 ans : on présume que le visage, les bras et les 3/4 des jambes sont exposés), 7263 cm2 (≥ 19 ans : on présume que le visage, les bras, les 3/4 des jambes et la moitié du tronc sont exposés). Quantité de produit : 2,05 g (4-8 ans) [Ficheux et al. 2016, avec modification de la surface], 4,14 g (≥ 19 ans) [Ficheux et al. 2016, avec modification de la surface] |
| Application de nettoyant pour tapis (dermique) |
Concentration : 0,01 % (FDS 2015) Groupe d’âge : ≥ 19 ans Surface exposée : 2200 cm2 Charge : application instantanée Fraction de poids de la substance : 0,01 % Quantité de produit : 1,5 g |
| Après application de nettoyant pour tapis (dermique) | Concentration : 0,01 % (FDS 2015) Scénario basé sur les procédures normalisées d’exploitation résidentielle de l’EPA (2012) Absorption dermique = résidu en surface × concentration × efficacité du transfert sol-peau × coefficient de transfert × durée de l’exposition × (1 m2/10 000 cm2) × 1 000 000 µg/g/p.c. Groupe d’âge : 6 à 11 mois Résidu en surface : 9 g/m2 (basé sur la valeur par défaut de ConsExpo pour la quantité de nettoyant délogeable après l’application; RIVM 2018) Efficacité du transfert sol-peau : 0,06 (EPA 2012, valeur par défaut pour les tapis) Coefficient de transfert : 1528 cm2/h (EPA 2012, valeur par défaut de 1800 cm2/h pour les surfaces dures et les tapis, ajustée selon la surface corporelle d’un enfant de 6 à 11 mois)g Durée de l’exposition : 4 h (EPA 2012, valeur par défaut pour les tapis) Facteurs de conversion : 1 m2/10 000 cm2, 1 000 000 µg/g |
| Après application de nettoyant pour tapis (orale) | Concentration : 0,01 % (FDS 2015) Scénario basé sur EPA (2012) pour une absorption due au contact main-bouche Groupe d’âge : 6 à 11 mois Absorption due au contact main-bouche = charge de résidu sur les mains × surface mise en bouche × [durée de l’exposition × nombre d’intervalles de recharge par heure] × [1- (1 – facteur d’extraction de la salive; 0,48)fréquence du contact main-bouche, 20/nombre de recharges, 4]/p.c. Charge de résidu sur les mains (mg/cm2) : fraction de la substance sur les mains par rapport au résidu sur la surface totale tirée de l’étude de Jazzercise × dépôt dermique total calculé pour le scénario par voie dermique (mg/jour)/surface des deux mains. Il peut y avoir de légères différences dues à l’arrondissement des nombres. Dépôt dermique : exposition dermique (mg/kg p.c./jour) × p.c. Fraction de la substance sur les mains par rapport au résidu sur la surface totale tiré de l’étude de Jazzercise : 0,15 Surface des deux mains : 240 cm2 Surface mise en bouche : 22 cm2/événement Durée d’exposition : 4 h/jour Nombre d’intervalles de recharge par heure : 4 intervalles/h Facteur d’extraction de la salive : 0,48 Fréquence de la mise en bouche : 20 événements/h Nombre de recharges : 4 |
| Nettoyant tout usage en aérosol – Pulvérisation (dermique) | Concentration : 0,5 % (selon les renseignements recueillis pendant la période de consultation publique) Scénario : nettoyant en aérosol pour salle de bain – pulvérisation, selon la fiche d’information sur les produits de nettoyage (RIVM, 2018). Groupe d’âge : ≥ 19 ans Surface exposée : 2200 cm2 Charge : taux constant Fraction de poids de la substance : 0,5 % Taux de contact : 46 mg/min Durée de la diffusion : 2,67 min |
| Nettoyant tout usage en aérosol – Essuyage (dermique) | Concentration : 0,5 % (selon les renseignements reçus pendant la période de commentaires publics) Scénario : nettoyant en aérosol pour salle de bain – rinçage, selon la fiche d’information sur les produits de nettoyage (RIVM, 2018). Groupe d’âge : ≥ 19 ans Surface exposée : 225 cm2 Charge : application instantanée Fraction de poids de la substance : 0,5 % Quantité de produit : 0,62 g |
a Les expositions à partir de cosmétiques ont été estimées au moyen du document ConsExpo Web (2016).
b Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information ConsExpo pertinente pour le scénario présenté.
c Produit appliqué au moyen d’une éponge. Le scénario tient compte du produit qui se retrouve sur les mains durant l’application et qui est éliminé lors du lavage des mains. On présume que la moitié du contenant est utilisée.
d Le facteur de transfert suppose que seulement 10 % du produit appliqué sur les cheveux est en contact avec le cuir chevelu et pourrait être absorbé par voie dermique.
e Produit spécialisé qui serait utilisé à l’occasion et probablement réappliqué pendant la journée.
f Produit spécialisé qui serait utilisé à l’occasion.
g Coefficient de transfert = (1800 cm2 × 4500 cm2)/5300 cm2 = 1528 cm2/h.
