Évaluation préalable - extrait de lotus corniculatus
Titre officiel : Évaluation préalable - extrait de lotus corniculatus
Numéro de registre du Chemical Abstracts Service
84696-24-2
Environnement et Changement climatique Canada
Santé Canada
No de cat. : En84-281/2021F-PDF
ISBN 978-0-660-39847-1
Août 2021
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministères de l’Environnement et de la Santé ont réalisé l’évaluation préalable de l’extrait de Lotus corniculatus. Le numéro de registre du Chemical Abstracts Service (No CASNote de bas de page 1 ) de l’extrait de Lotus corniculatus est le 84696-24-2. L’évaluation de cette substance a été jugée prioritaire, car celle-ci satisfaisait au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE.
Lotus corniculatus est une plante aussi communément appelée lotier corniculé. D’après les renseignements déclarés dans les enquêtes menées conformément à l’article 71 de la LCPE, l’extrait de Lotus corniculatus n’était pas fabriqué ni importé au Canada en quantité supérieure au seuil de déclaration de 100 kg. Les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques ont permis de déterminer que des extraits de graines et de fleurs de Lotus corniculatus étaient présents dans les cosmétiques vendus au Canada.
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de la classification des risques écologiques (CRE) des substances organiques, une approche fondée sur les risques qui tient compte de plusieurs paramètres liés à la fois au danger et à l’exposition et pondère de multiples éléments de preuve. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition comprennent le taux d’émission potentiel, la persistance globale et le potentiel de transport à longue distance. Une matrice des risques permet d’attribuer à des substances un degré de préoccupation potentielle faible, modéré ou élevé, en fonction de leurs profils de danger et d’exposition. D’après les résultats de la CRE, il est peu probable que l’extrait de Lotus corniculatus cause des effets nocifs pour l’environnement.
D’après tous les éléments de preuve contenus dans la présente d’évaluation préalable, il est peu probable que l’extrait de Lotus corniculatus cause des effets nocifs pour l’environnement. Il est conclu que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés aux alinéas 6a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
La population générale du Canada peut être exposée à l’extrait de Lotus corniculatus en utilisant des cosmétiques, notamment les lotions pour le corps et les baumes pour les lèvres. Certains phénotypes de Lotus corniculatus sont connus pour synthétiser des glycosides cyanogènes et les consommateurs utilisant des produits contenant de l’extrait de Lotus corniculatus peuvent être exposés à l’acide cyanhydrique. Bien que tous les extraits végétaux soient des mélanges complexes de plusieurs substances phytochimiques et d’après les propriétés chimiques connues Lotus corniculatus, l’acide cyanhydrique est considéré comme étant la substance la plus préoccupante sur le plan toxicologique.
L’acide cyanhydrique est une substance qui induit une toxicité systémique en altérant la capacité des cellules à utiliser l’oxygène en perturbant la chaine de transport des électrons, interrompant ainsi la respiration cellulaire. Dans des études réalisées sur des rongeurs, l’acide cyanhydrique a produit des effets sur l’appareil reproducteur masculin, tandis que l’exposition à de faibles concentrations d’acide cyanhydrique était associée à des neuropathies et à des perturbations de la thyroïde chez les humains. Les marges entre les concentrations estimées d’exposition au cyanure provenant d’extraits de Lotus corniculatus utilisés dans des cosmétiques et les niveaux d’effet critique sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé en ce qui concerne tous les paramètres.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que l’extrait de Lotus corniculatus ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministères de l’Environnement et de la Santé ont réalisé l’évaluation préalable de l’extrait de Lotus corniculatus. L’évaluation de cette substance a été jugée prioritaire, car celle-ci satisfaisait au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE (ECCC et SC [modifié en 2007]).
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de la méthode de classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés liés au mode d’action, à la réactivité chimique, à la toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique et tient compte de l’exposition possible des organismes des milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émission potentiel, la persistance globale et le potentiel de transport à longue distance dans l’atmosphère. Le regroupement des divers éléments de preuve permet de déterminer les substances pour lesquelles une évaluation approfondie du risque d’effets nocifs sur l’environnement est nécessaire ou celles qui sont peu susceptibles de causer de tels effets sur l’environnement.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et l’exposition et des renseignements supplémentaires soumis par les intervenants. Des données pertinentes ont été trouvées jusqu’en octobre 2018. Des recherches ciblées dans la littérature ont été effectuées jusqu’en octobre 2018. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont permis de tirer des conclusions. Quand ils étaient pertinents, les renseignements contenus dans des évaluations réalisées par d’autres administrations ont été pris en compte.
La présente évaluation préalable a été préparée par le personnel du Programme de la sécurité des produits de consommation de Santé Canada et du Programme d’évaluation des risques de la LCPE d’Environnement et Changement climatique Canada. Les employés d’autres programmes de ces ministères y ont également contribué. La partie de la présente évaluation portant sur les risques pour l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe par des pairs et d’une période de consultation publique de 60 jours. La partie concernant la santé humaine a quant à elle été soumise à un examen ou une consultation externes. Les commentaires sur les parties techniques dédiées à la santé humaine ont été formulés par Theresa Lopez, M.Sc., Jennifer Flippin, M.Sc., et Joan Garey, Ph. D. De plus, l’ébauche de la présente évaluation préalable (publiée le 7 décembre 2019) a fait l’objet d’une période de consultation publique de 60 jours. Bien que les commentaires provenant de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et de Santé Canada restent responsables du contenu définitif et des résultats de la présente évaluation préalable.
Cette dernière s’appuie sur des renseignements essentiels qui permettent de déterminer si la substance satisfait aux critères énoncés à l’article 64 de la LCPE à partir de l’examen de données scientifiques et de l’application d’une approche fondée sur le poids de la preuve et le principe de précautionFootnote 2 . La présente évaluation préalable comporte des données critiques et des considérations sur lesquelles ses conclusions sont fondées.
2. Identité de l’extrait de Lotus corniculatus
Lotus corniculatus est une plante à fleurs de la famille des pois, présente presque partout dans le monde et communément appelée lotier corniculé. D’origine végétale, l’extrait de Lotus corniculatus est un mélange complexe de plusieurs substances phytochimiques appelées substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques (UVCB). Ces substances proviennent de sources naturelles ou de réactions complexes et ne peuvent pas être synthétisées par simple combinaison de composants seuls. Les UVCB, qui ne consistent pas en un mélange recherché de substances distinctes, sont considérées comme formant une substance unique.
Pour pouvoir évaluer les risques pour l’environnement et la santé humaine associés à l’extrait de Lotus corniculatus, les composants de l’extrait potentiellement préoccupant d’un point de vue toxicologique ont été identifiés à partir des données empiriques existantes. Plus particulièrement, Lotus corniculatus est réputé pour son polymorphisme et sa capacité à produire des glycosides cyanogènes, composés végétaux secondaires participant au métabolisme et à la défense contre les prédateurs. Les phénotypes cyanogènes produisent la linamarine et sa forme méthylée, la lotaustraline, toutes deux pouvant libérer de l’acide cyanhydrique (HCN) par hydrolyse enzymatique. Les concentrations de glycosides sont les plus élevées dans les feuilles des plantes immatures, mais sont généralement faibles dans les graines et les feuilles des plantes adultes (Grant et Sidhu, 1967). Il s’est avéré que les concentrations de glycosides étaient semblables dans les fleurs et dans les feuilles en croissance (Gebrehiwot et Beuselinck, 2001). La structure chimique des glycosides cyanogènes et le produit de leur hydrolyse figurent dans le Tableau 2‑1.
| No CAS | Nom | Formule chimique représentative | Structure chimique représentative | Masse molaire (g/mol) |
|---|---|---|---|---|
| 554-35-8 | Linamarine | C10H17NO6 | ![CC(C)(O[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O)C#N](/content/dam/eccc/images/pded/lotus-corniculatus/20210714-f21a.jpg) | 247,25 |
| 534-67-8 | Lotaustraline | C11H19NO6 | (O[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O)C#N](/content/dam/eccc/images/pded/lotus-corniculatus/20210714-f21b.jpg) | 261,27 |
| 74-90-8 | Acide cyanhydrique; acide prussique | HCN | 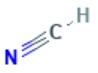 | 27,03 |
Si les phénotypes cyanogènes de Lotus corniculatus étaient utilisés pour obtenir les extraits de plantes, ces produits pourraient contenir de la linamarine et de la lotaustraline. La toxicité potentielle de ces substances repose principalement sur leur capacité à produire de l’HCN, qui peut également se transformer en anion cyanure (CN-) en fonction du pH et de la température (EFSA, 2004). Les plantes acyanogènes peuvent être dépourvues de glycosides, des enzymes pour les hydrolyser ou des deux (Compton et Jones, 1985) et sont donc une source potentielle de cyanure.
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques des principaux composants de l’extrait de Lotus corniculatus sont résumées dans le Tableau 3‑1. Quand il existait peu ou pas de données expérimentales sur une propriété, des modèles de relation quantitative structure-activité ([Q]SAR) ont servi à générer des prédictions de valeurs associées à la substance étudiée. D’autres propriétés physiques et chimiques ont été décrites dans un document d’ECCC (2016b).
| Propriété | Linamarine | Lotaustraline | HCN | Principales références |
|---|---|---|---|---|
| No CAS | 554-35-8 | 534-67-8 | 74-90-8 | S. o. |
| État physique | Solide | Solide | Liquide ou gazeux | Kim et coll. 2019; OMS, 2004 |
| Point de fusion (°C) | 145 | 147 | -13,24 à -13,4 | PhysProp, 2013; Gail et coll., 2012 |
| Point d’ébullition (°C) | 434 | 446 | 25,6 à 25,7 | PhysProp, 2013; Gail et coll., 2012 |
| Pression de vapeur (Pa) (à 25 °C) | 8,17 × 10-12 | 1,08 × 10-12 | 98 900 à 100 000 | PhysProp, 2013; Chatwin et coll., 1987; Daubert et Danner, 1985 |
| Constante d’Henry (Pa·m3/mol) | 7,6 × 10-9 | 1,01 × 10-8 | 13,5 à 5167,6 | PhysProp, 2013; Gaffney et coll., 1987; Yoo et coll., 1986 |
| Solubilité dans l’eau (mg/L) | 5,65 × 105 | 1,8 × 105 | 1 × 106; miscible | PhysProp, 2013; Lide, 1990 |
| Log Koe (sans dimension) | -1,91 | -1,41 | -0,25 à 0,66 | PhysProp, 2013; US EPA, 1984; Hansch et coll., 1995 |
Abréviations : S. o. = sans objet; Koe = coefficient de partage octanol-eau
4. Sources et utilisations
L’extrait de Lotus corniculatus a fait l’objet d’une enquête menée conformément à l’article 71 de la LCPE (Canada, 2012). En 2012, aucune déclaration des quantités d’extrait de Lotus corniculatus produites ou importées au Canada n’indique un dépassement du seuil de déclaration de 100 kg (Environment Canada, 2013).Note de bas de page 3
Lotus corniculatus figure dans la Base de données d’ingrédients de produits de santé naturels en tant que produit homéopathique, dont la plante et les fleurs fraichement récoltées constituent les ingrédients principaux et la dilution homéopathique minimale est de 12CH (c.-à-d. une dilution à 10-24). Cependant, aucune préparation homéopathique contenant Lotus corniculatus n’est actuellement homologuée comme produit de santé naturelle dans la Base de données des produits de santé naturels homologués (BDIPSN, 2018; BDPSNH, 2018).
Les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques ont permis de déterminer que les extraits de graine et de fleur de Lotus corniculatus étaient présents dans des produits cosmétiques, notamment dans des nettoyants faciaux, des crèmes hydratantes pour la peau, des fonds de teint, des exfoliants pour le visage, des shampoings et revitalisants et des baumes pour les lèvres. Ces extraits figurent dans la Base de données d’identification des ingrédients des produits cosmétiques (Cosmetic Ingredient Identification Database) du Personal Care Products Council, laquelle contient tous les renseignements publiés dans la dernière édition de l’International Cosmetic Ingredient Dictionary and Handbook et indique les fonctions de divers revitalisants pour la peau.
5. Risques d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de la méthode de classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche fondée sur les risques, qui sert à classer ces derniers en tenant compte de plusieurs paramètres liés au danger et à l’exposition et en pondérant différents éléments de preuve. La combinaison de ces derniers permet de différencier les substances peu ou très nocives et les potentiels d’exposition faibles ou élevés dans divers médias environnementaux. Une telle approche permet de réduire l’incertitude globale de la caractérisation des risques par rapport à une méthode de caractérisation qui reposerait sur un paramètre unique dans un seul média (par exemple, la concentration létale médiane). Puisque l’extrait de Lotus corniculatus est une substance UVCB et ne peut être adéquatement représenté par une seule structure chimique, une méthode de classification manuelle fondée sur le jugement a été utilisée. La partie qui suit résume cette approche, qui est décrite en détail dans un document d’ECCC (2016a).
Les profils de danger sont principalement basés sur des paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne induite par le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition ont aussi été déterminés à partir de plusieurs paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à longue distance. La comparaison des profils de danger et d’exposition avec les critères de décision a permis de classifier les potentiels de danger et d’exposition de chaque substance organique comme étant faibles, modérés ou élevés. D’autres règles ont été appliquées (par exemple, en matière de constance du classement et de marges d’exposition), ce qui a permis d’affiner les classements préliminaires des risques et de l’exposition. Cependant, dans le cas de Lotus corniculatus, les profils de danger et d’exposition n’ont pu être entièrement définis en raison de l’absence de structure représentative permettant d’estimer les propriétés étudiées et faute de données empiriques sur ces propriétés. Par conséquent, le danger et l’exposition ont été manuellement classifiés grâce à l’examen des constituants UVCB et des renseignements issus de l’enquête menée conformément à l’article 71 de la LCPE (Environnement Canada, 2013), à la prise de décisions basées sur l’examen de substances similaires et à des avis d’experts.
Une matrice des risques a servi à classer le niveau de risque associé à chaque substance comme faible, modéré ou élevé, selon les classifications du danger et de l’exposition. Les risques déterminés à l’aide de la CRE ont été vérifiés au moyen d’une approche en deux étapes. La première étape a consisté à ajuster les résultats de la classification, en faisant passer le niveau de risque de moyen à élevé à faible pour les substances qui présentaient un faible taux d’émission estimé dans l’eau en sortie de traitement des eaux usées, le potentiel d’exposition à ces substances étant donc faible. La seconde étape a consisté à examiner les résultats de la classification des faibles niveaux de risque en se basant sur des scénarios de risque locaux (c.-à-d. dans la zone à proximité du point de rejet) relativement prudents et conçus pour protéger l’environnement, afin de déterminer si le niveau de classification des risques devait être augmenté.
La CRE utilise une approche pondérée permettant de réduire au minimum le risque de sous-classifier ou surclassifier les dangers et l’exposition et les risques qui en résultent. Les approches équilibrées tenant compte des incertitudes sont décrites en détail dans le document d’ECCC (2016a). Deux des domaines d’incertitude les plus importants sont décrits ci-dessous. Des erreurs dans les valeurs de toxicité aigüe empiriques ou modélisées pourraient entrainer des modifications de la classification des dangers, en particulier dans le cas des paramètres dépendant des valeurs liées aux résidus présents dans les tissus (c.-à-d. les paramètres liés au mode d’action toxique), nombre de ces valeurs étant prédites à l’aide de modèles QSAR (Boite à outils QSAR de l’OCDE, 2014). Cependant, l’impact de ces erreurs est atténué par le fait qu’une surestimation de la létalité médiane se traduira par l’utilisation d’une valeur prudente (conservatrice) liée aux résidus présents dans les tissus pour l’analyse critique des résidus corporels. Les erreurs dues à une sous-estimation de la toxicité aigüe seront atténuées grâce à l’utilisation d’autres paramètres de danger tels que le profilage structurel du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Les changements ou erreurs dans les quantités chimiques pourraient conduire à des différences de classification de l’exposition, les classifications de l’exposition et du risque étant très sensibles au taux d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas représenter les tendances futures.
Les données critiques et les facteurs à considérer, utilisés pour élaborer les profils spécifiques de l’extrait de Lotus corniculatus, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans un document d’ECCC (2016b).
Selon les données prises en compte dans la CRE, le risque d’exposition associé à l’extrait de Lotus corniculatus est classé faible. Le potentiel de danger associé à l’extrait de Lotus corniculatus a été classé comme élevé selon les alertes structurales de la boite à outils QSAR de l’OCDE (2014), qui a permis de déterminer que cette substance pouvait se lier aux récepteurs endocriniens. Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés de manière approfondie en raison du faible risque d’exposition associé à cette substance. Il est par conséquent peu probable que l’extrait de Lotus corniculatus soit nocif pour l’environnement au Canada.
6. Risque d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
Entre janvier 2015 et janvier 2018, la présence d’extrait de Lotus corniculatus dans des cosmétiques a été déclarée au Canada. Les produits déclarés étaient notamment des produits pour le visage avec ou sans rinçage (nettoyants, hydratants, fonds de teint et exfoliants), des produits pour les cheveux (shampoings et revitalisants), des hydratants pour la peau pouvant servir de lotion pour le corps et des baumes pour les lèvres.
L’extrait de Lotus corniculatus peut libérer de la linamarine et de la lotaustraline, des glycosides cyanogènes, ou le produit de leur hydrolyse, soit l’HCN (l’annexe A comporte des renseignements supplémentaires). Dans une étude portant sur divers cultivars de Lotus corniculatus, les concentrations maximales d’HCN étaient comprises entre 70 et 139 µg/g en poids frais et entre 296 à 784 µg/g en poids sec (Borsos et coll., 1976). Ces valeurs concordent généralement avec celles de Gebrehiwot et Beuselinck (2001), qui ont indiqué que, pour la plante en entier, la teneur en HCN des cultivars cyanogènes était en moyenne de 636 µg/g en poids sec lorsqu’ils poussaient en plein champ et de 800 µg/g en poids sec lorsqu’ils étaient cultivés en serre. De même, la teneur moyenne en cyanure dans les feuilles de cultivars cyanogènes (n = 158) étudiés par Briggs et Schultz (1990) était d’environ 810 µg/g en poids sec.
La concentration maximale de cyanure dans Lotus corniculatus mentionnée par la littérature était de 1000 µg/g en poids humide, soit la valeur la plus élevée observée parmi 204 variétés récoltées dans 33 pays (Ross et Jones, 1983). D’après les résultats de Borsos et coll. (1976) mentionnés ci-dessus, il est estimé que cette valeur correspond à environ 5000 µg/g en poids sec. À supposer que l’extrait de Lotus corniculatus ne soit pas délibérément enrichi en cyanure et qu’aucune mesure n’ait été prise pour empêcher toute perte d’HCN pendant l’extractionNote de bas de page 4 , la concentration d’HCN dans les extraits ne devrait pas dépasser la concentration maximale en poids sec observée. Par conséquent, l’exposition a été estimée à partir d’une teneur en HCN de 5000 µg/g (0,5 %) d’extrait de Lotus corniculatus.
Les estimations de l’exposition associée à l’utilisation de cosmétiques ont été calculées à partir des profils prévus d’utilisation par la population générale. La concentration la plus élevée indiquée dans les déclarations relatives aux produits soumises à Santé Canada (ou la limite supérieure dans le cas d’une fourchette de valeurs) a été multipliée par la concentration maximale en poids sec (soit 5000 µg/g) de cyanure total (sous forme liée ou non) dans la matière végétale, ce qui a permis d’estimer la teneur maximale en cyanure des produits. Dans le cas de produits appliqués sur la peau, l’hydratant pour le corps a été retenu comme scénario d’exposition sentinelle, la quantité maximale de HCN appliqué par voie cutanée étant estimée à 250 µg/jour, ce qui correspond à une charge superficielle de 0,014 µg/cm2/jour pour les adultes. D’autres renseignements sur la teneur en HCN des produits déclarés et l’exposition estimée figurent à l’annexe B.
À supposer que le poids corporel d’un adulte soit de 70,9 kg et que l’absorption soit totale, la charge cutanée de 250 µg/jour correspond à une dose systémique de 3,5 µg/kg p.c./jour. Toutefois, l’HCN est une substance volatile, dont le point d’ébullition avoisine 25 °C. Ainsi, à une température par défaut à la surface de la peau de 32 °C (Freitas, 1999), cette substance se volatilisera rapidement. Le calculateur de la pénétration d’une dose finie dans la peau (NIOSH, 2013), qui met en œuvre des solutions dans le modèle de Kasting et Miller (2006) de cinétique d’absorption d’une dose finie de composés volatils par la peau, a servi à prédire l’élimination d’une dose appliquée en surface et à estimer la fraction massique totale qui peut être absorbée par la peau par rapport à celle éliminée par évaporation. La somme des quantités estimées d’HCN diffusé dans la couche cornée de l’épiderme, l’épiderme viable, le derme et la circulation générale, a permis d’obtenir une dose percutanée de 3,4 x 10-5 µg/cm2, laquelle correspond à une concentration plasmatique d’HCN de 0,009 µg/kg p.c./jour (voir annexe C).
L’HCN qui s’évapore de la surface de la peau au lieu d’être absorbé peut entrainer une exposition par inhalation. Par conséquent, les concentrations d’HCN dans l’air ont été déterminées à l’aide de la modélisation de l’exposition ConsExpo (ConsExpo, 2016). La concentration théorique maximale d’HCN dans l’air a été estimée à 21 µg/m3, en moyenne pendant l’application de la lotion pour le corps, ce qui correspond à une concentration d’exposition moyenne quotidienne d’HCN de 0,15 µg/m3 et à une concentration plasmatique de 0,03 µg/kg p.c./jour, à supposer que l’absorption par inhalation soit totale. Les autres paramètres par défaut utilisés dans les scénarios d’exposition et les détails des calculs sont fournis à l’annexe B.
L’absorption directe par la peau de substances volatiles présentes dans la phase gazeuse peut également constituer une voie d’exposition importante (Weschler et Nazaroff, 2014). Néanmoins, Gaskin et coll. (2013) ont démontré que l’absorption transdermique de l’HCN gazeux est relativement faible. Par conséquent, l’absorption cutanée de substances présente dans la phase gazeuse lors de l’utilisation de cosmétiques est considérée comme négligeable et aucune valeur quantitative n’a été estimée.
L’utilisation de l’extrait de Lotus corniculatus dans les baumes pour les lèvres a également été déclarée, lorsqu’il existait un risque d’ingestion du produit. Dans le cadre de la présente évaluation préalable, il a été supposé que le baume pour les lèvres contenait de l’extrait de Lotus corniculatus à des concentrations allant jusqu’à 1 %, soit la limite supérieure de l’intervalle des concentrations maximales déclarées à Santé Canada, et que tout le produit appliqué était ingéré. La dose maximale d’exposition systémique potentielle à l’HCN par voie orale associée à l’utilisation de baume pour les lèvres contenant de l’extrait de Lotus corniculatus est estimée à 0,03 µg/kg p.c./j pour un adulte de 70,9 kg. Le baume pour les lèvres peut également être utilisé par les jeunes enfants et les tout-petits et la concentration plasmatique maximale chez ces derniers a été estimée à 0,07 µg/kg p.c./jour. D’autres précisions sur les hypothèses et les paramètres par défaut ayant servi à estimer l’exposition par voie orale figurent à l’annexe B.
Aucune donnée empirique sur les concentrations d’extrait de Lotus corniculatus dans le milieu environnemental au Canada n’a été trouvée, mais les concentrations devraient être négligeables. L’extrait de Lotus corniculatus ne devrait pas être présent dans les aliments ou les boissons.
6.2 Évaluation des effets sur la santé
La toxicité des glycosides cyanogènes d’origine végétale dépend de l’hydrolyse enzymatique des molécules mères qui libère l’HCN. La toxicité du cyanure a été étudiée en profondeur à la fois chez l’humain et chez des animaux de laboratoire et les mécanismes biochimiques d’action du cyanure sont généralement semblables à ceux observés chez la plupart des mammifères (NRC, 2002). Le cyanure interrompt la respiration cellulaire, entrainant un état d’hypoxie, en se liant à la cytochrome C oxydase, le complexe enzymatique final de la chaine de transport des électrons (située dans la membrane des mitochondries des cellules eucaryotes). La toxicité du cyanure est essentiellement due à l’incapacité des cellules à utiliser l’oxygène comme récepteur d’électrons, laquelle entraine une perturbation de la synthèse de l’adénosine triphosphate, principale source d’énergie des cellules (Nelson, 2006). Le cyanure est une substance toxique pour le système circulatoire et les organes et systèmes les plus sensibles aux faibles concentrations d’oxygène sont aussi les plus sensibles à la toxicité aigüe du cyanure, comme c’est notamment le cas des systèmes nerveux, cardiovasculaires et respiratoires. La description suivante n’est pas censée être exhaustive, mais elle fournit un aperçu des valeurs sanitaires recommandées pour l’HCN et des doses les plus faibles associées à des effets nocifs et mentionnées dans des publications. Les effets de l’HCN sur la santé ont été antérieurement examinés par Santé Canada (Canada, 2018) et les cyanures simples sous forme libre ont font l’objet de diverses évaluations menées à l’étranger, dont les plus récentes ont été réalisées par l’Agence de protection de l’environnement des États-Unis (US EPA, 2010) et par l’Organisation pour l’alimentation et l’agriculture et l’Organisation mondiale de la Santé (FAO/OMS, 2012).
Le Conseil national de la recherche des États-Unis (NRC) a fixé un seuil recommandé d’exposition aigüe (ou AEGL-1) de 1 ppm (1 mg/m3) d’HCN à partir des résultats d’études de surveillance réalisées chez des travailleurs exposés à l’HCN dans leur milieu de travail (NRC, 2000). Les valeurs des AEGL visent à représenter les seuils d’exposition applicables au grand public, notamment aux sous-populations vulnérables telles que les nourrissons, les enfants et les personnes âgées, souffrant d’asthme ou atteintes d’autres maladies (NRC, 2002). L’AEGL-1 pour l’HCN est basé sur une évaluation du poids des preuves qui a conclu qu’une exposition de 8 h à 1 mg/m3 d’HCN ne causait pas d’effet nocif pour la santé dans la population générale. Étant donné que cette valeur repose sur des expositions durant de longues périodes de travail (en général 8 h/jour), la méthode servant à déterminer la valeur de l’AEGL est considérée comme prudente (NRC, 2002). La valeur de l’AEGL-1 sur 8 h a été déterminée à partir d’un examen des données de dose-réponse extraites de plusieurs études de surveillance citées, puis ajustée à des durées d’exposition à l’AEGL plus courtes (voir NRC, 2002). Les analyses de régression ont permis de déterminer que la relation entre la durée d’exposition (t) et la concentration (C) pour la toxicité de l’HCN chez un primate non humain était décrite par l’équation C2 × t = k (NRC, 2002), où k est une constante. Par conséquent, il est possible de déterminer par extrapolation la valeur d’AEGL-1 sur 10 minutes, soit 6,9 mg/m3, à partir de la valeur d’AEGL-1 sur 8 h, soit 1 ppm.
Des études de l’exposition subchronique au cyanure par l’eau potable menées chez des rongeurs n’ont mis en évidence aucun signe clinique de neurotoxicité ni aucun effet histopathologique sur l’encéphale ou la thyroïde chez des rats et les souris ayant respectivement reçu des doses pouvant atteindre 12,5 et 26 mg de cyanure/kg p.c./jour (NTP, 1993). Cependant, des changements à peine perceptibles ont été observés dans l’appareil reproducteur masculin, en particulier une diminution du poids de la queue des épididymes, des épididymes en entier et des testicules et des anomalies dans la composition du sperme, les rats semblant être l’espèce la plus sensible. Aucun changement n’a été observé dans les concentrations de spermatozoïdes dans les épididymes par rapport aux groupes témoins et les auteurs n’ont pas considéré que l’effet sur les rongeurs était important sur le plan biologique. Cependant, les humains ont une production de sperme plus faible que celle des rats et l’impact possible d’une baisse de la qualité du sperme est plus important chez les humains que chez les rats (US EPA, 2010). Par conséquent, la limite inférieure de l’intervalle de confiance à 95 % de la dose correspondant à une variation du poids de la queue des épididymes chez les rats mâles égale à un écart-type de la moyenne du groupe témoin (limite inférieure de l’intervalle de confiance de la dose de référence ou BMDL1ÉT) a été choisie par l’US EPA comme point de départ pour la détermination de la dose de référence (DR) d’exposition chronique par voie orale. Les facteurs d’incertitude, dont le total est de 3000, ont été appliqués à la BMDL1ÉT de 1,9 mg/kg p.c./jour, ce qui a permis d’obtenir une DR finale d’exposition chronique de 0,6 µg/kg p.c./jour (US EPA, 2010). Le Comité mixte (FAO/OMS) d’experts des additifs alimentaires a également calculé une dose d’HCN quotidienne maximale admissible et provisoire à partir du même point de départ (JECFA, 2011).
L’exposition chronique au cyanure par inhalation a également été mise en évidence chez des travailleurs exposés sur leur lieu de travail. L’US EPA (2010) a déterminé la concentration de référence (CR) pour une exposition chronique par inhalation à partir de l’observation des effets sur la thyroïde et des symptômes neurologiques chez les employés de trois usines de galvanoplastie (El Ghawabi et coll., 1975). Des travailleurs masculins (n = 36) exposés de façon chronique à l’HCN pendant 5 à 15 ans ont présenté des taux significativement anormaux d’absorption de l’iode par la thyroïde, une hypertrophie de la thyroïde et des symptômes au niveau du système nerveux central (SNC), comme des céphalées, de la fatigue et des modifications sensorielles du gout et de l’odorat (El Ghawabi et coll., 1975). Les résultats des mesures ponctuelles effectuées dans la zone respiratoire indiquent que la concentration moyenne d’HCN dans toutes les usines était comprise entre 7,07 et 11,5 mg/m3 et que l’excrétion urinaire de thiocyanates était fortement corrélée avec les mesures ponctuelles d’exposition. Vingt des travailleurs exposés (soit 56 %) présentaient une hypertrophie légère à modérée de la thyroïde et une modification de l’absorption d’iodure. Ni la durée d’exposition ni les concentrations dans l’air n’étaient corrélées avec la fréquence ou l’ampleur des effets, bien que, étant donné la petite taille de l’échantillon et l’intervalle relativement étroit des concentrations d’exposition, cela ne soit pas complètement inattendu. L’US EPA (2010) a choisi la concentration minimale moyenne dans l’air de 7,07 mg/m3 comme dose minimale avec effet nocif observé (DMENO). Cette valeur a été ajustée à une exposition continue de 2,5 mg/m3 pour être utilisée comme point de départ pour la détermination de la CRNote de bas de page 5 . Les facteurs d’incertitude (3000 au total) ont été appliqués à la DMENO ajustée, ce qui a permis d’obtenir une concentration finale de référence pour l’exposition chronique par inhalation de 0,8 µg/m3 (US EPA, 2010).
Les données existantes ne suffisent pas à évaluer le potentiel cancérigène du cyanure chez les humains. Une étude de deux ans, dans laquelle des groupes 10 mâles et 10 femelles rats ont ingéré de la nourriture fumigée contenant des doses d’HCN estimées à 4,3 et 10,8 mg de cyanure/kg p.c./jour, n’a fourni aucune preuve de lésions histopathologiques attribuables au cyanure (Howard et Hanzal, 1955), en plus du fait qu’elle présentait de nombreuses limites méthodologiques. Aucune étude évaluant la cancérogénicité de l’HCN par inhalation n’a été trouvée.
6.3 Caractérisation des risques pour la santé humaine
L’exposition des consommateurs à l’extrait de Lotus corniculatus devrait se limiter à l’utilisation de cosmétiques. L’extrait de Lotus corniculatus peut contenir des glycosides cyanogènes ou le produit de leur hydrolyse, soit l’HCN. Bien que l’extrait de Lotus corniculatus puisse être présent dans les produits pour la peau censés être appliqués par voie topique et vu la forte volatilité de l’HCN, la principale voie d’exposition devrait être l’inhalation. L’ingestion de la substance peut se produire lors de l’utilisation de baumes pour les lèvres contenant de l’extrait de Lotus corniculatus.
L’exposition chronique à des concentrations relativement faibles de cyanure a été associée à une neuropathie et à des effets sur la thyroïde chez des travailleurs exposés sur leur lieu de travail et à un taux de croissance réduit et à un dysfonctionnement de l’appareil reproducteur mâle dans des études menées chez des rongeurs. L’exposition aigüe à des concentrations toxiques minimales de cyanure est réputée causer des effets modérés sur le SNC, notamment des céphalées (NRC, 2000; Canada, 2018). Les doses critiques associées à une toxicité aigüe (par inhalation) et chronique (par voie orale ou par inhalation) du cyanure ont été retenues comme points de départ pour la comparaison avec les limites supérieures estimatives de l’exposition au cyanure due à l’utilisation de produits contenant de l’extrait de Lotus corniculatus.
Le Tableau 6‑1 fournit les valeurs pertinentes d’exposition et de danger pour une exposition potentielle à l’HCN causée par l’utilisation de produits cosmétiques sentinelles contenant de l’extrait de Lotus corniculatus et les marges d’exposition (ME) résultantes.
| Scénario d’exposition | Exposition estimée | Dose critique | Effet critique sur la santé | ME |
|---|---|---|---|---|
| Lotion pour le corps - adulte (inhalation quotidienne) | 0,15 µg/m3 | 2,5 mg/m3 (DMENO)a | Hypertrophie de la thyroïde et modification de l’absorption d’iodure | > 16 000 |
| Lotion pour le corps - adulte (absorption cutanée quotidienne) | 0,009 µg/kg p.c./jour | 1,9 mg/kg p.c./jour (BMDL)b | Diminution du poids de la queue des épididymes chez les rats mâles | > 200 000 |
| Lotion pour le corps - adulte (pour chaque inhalation) | 21 µg/m3 | 6,9 mg/m3 (AEGL-1)c | La valeur de l’AEGL-1 est considérée comme « prudente » d’après des études sur l’exposition en milieu de travail | 329 |
| Baume pour les lèvres - adulte (absorption quotidienne par voie orale) | 0,03 µg/kg p.c./jour | 1,9 mg/kg p.c./jour (BMDL)b | Diminution du poids des épididymes chez les rats mâles | > 60 000 |
| Baume pour les lèvres - tout-petits (absorption quotidienne par voie orale) | 0,07 µg/kg p.c./jour | 1,9 mg/kg p.c./jour (BMDL)b | Diminution du poids des épididymes chez les rats mâles | > 25 000 |
Abréviations : ME = marge d’exposition
a El Ghawabi, 1975; US EPA, 2010
b NTP, 1993; US EPA, 2010.
c NRC, 2002. La valeur d’AEGL-1 sur 10 minutes a été déterminée à l’aide de la valeur d’AEGL-1 sur 8 heures, soir 1 ppm, et par extrapolation à une exposition de 10 minutes à partir de l’équation C2 x t = k, où C est la concentration, t la durée et k une constante.
D’après l’utilisation de paramètres prudents pour l’estimation de l’exposition due à l’utilisation de cosmétiques, les marges entre les valeurs estimatives d’exposition et les doses critiques observées dans des études épidémiologiques réalisées chez les humains et chez les animaux sont considérées comme suffisantes pour tenir compte de toutes les incertitudes dans les bases de données sur la toxicologie et l’exposition.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Bien qu’il existe des données canadiennes relatives aux concentrations de l’extrait de Lotus corniculatus dans les cosmétiques, certaines lacunes importantes subsistent dans les bases de données sur l’exposition. De même, bien que la toxicité et le mode d’action du cyanure soient bien documentés, certaines incertitudes liées aux effets sur la santé ont été déterminées. Les principales sources d’incertitudes sont décrites dans le Tableau 6‑2 ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| La teneur maximale possible en HCN dans l’extrait de Lotus corniculatus n’est pas connue. | +/- |
| Il n’existe aucune donnée permettant de déterminer si les extraits de Lotus corniculatus sont préparés avec des phénotypes cyanogènes. Dans le cadre de la présente évaluation, tous les extraits ont été considérés comme cyanogènes. | + |
| En raison de la volatilité de l’HCN, il est impossible d’affirmer que le produit final contient de l’HCN, même si l’extrait provenait d’un phénotype cyanogène. Dans le cadre de la présente évaluation, il a été considéré qu’aucune quantité d’HCN n’était perdue entre le traitement de l’extrait et l’utilisation du produit par le consommateur et que la conversion des glycosides mères en HCN était totale. | + |
| Aucune donnée sur la cancérogénicité du cyanure par inhalation n’a été trouvée et la seule étude portant sur l’exposition par voie orale présente des limites méthodologiques et ne permet pas d’évaluer le potentiel cancérigène de l’HCN. | +/- |
| Il existe des incertitudes quant au fait de savoir dans quelle mesure le cyanure induit une toxicité pour la reproduction chez les humains, comme c’est le cas chez les rats, car la base de données sur le cyanure s’appuie sur un nombre insuffisant d’études de la toxicité pour l’appareil reproducteur masculin. | +/- |
| Il n’existe pas d’études d’exposition chronique par voie orale ni d’études d’exposition chronique ou subchronique par inhalation, réalisées chez les animaux. | +/- |
| Dans l’étude d’exposition par voie orale menée sur 90 jours chez les rats dans le cadre du National Toxicology Program (NTP, 1993), les critères d’effets sur la thyroïde n’ont pas été étudiés. | +/- |
| L’étude d’exposition chronique par inhalation réalisée chez les humains (El Ghawabi et coll., 1975) n’a pas évalué les critères d’effets sur l’appareil reproducteur masculin n’ont pas été étudiés (mais s’est concentrée sur la glande thyroïde et l’absorption de l’iode). De plus, il n’existait aucune corrélation entre la durée de l’exposition et le degré d’hypertrophie de la thyroïde dans cette étude. | +/- |
| Il existe de nombreuses autres sources d’HCN que l’extrait de Lotus corniculatus en plus du fait que l’HCN peut interagir avec d’autres substances chimiques comme le monoxyde de carbone. | - |
+ = incertitude pouvant causer une surestimation des risques; - = incertitude pouvant causer une sous-estimation des risques; +/- = on ne sait pas si l’incertitude peut causer une surestimation ou une sous-estimation des risques.
Bien qu’aucune donnée n’ait été trouvée concernant les concentrations de glycosides cyanogènes ou d’HCN dans l’extrait de Lotus corniculatus ou des produits finis, les hypothèses avancées sont considérées comme suffisamment prudentes.
7. Conclusion
D’après tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, il est peu probable que l’extrait de Lotus corniculatus cause des effets nocifs pour l’environnement. Il est conclu que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que l’extrait de Lotus corniculatus ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [Modifié le 9 novembre 2018.] Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 novembre 2018]
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [Modifié le 6 février 2018.] Ottawa (Ont.), gouvernement du Canada. (Disponible le 20 novembre 2018)
Berrin JG, McLauchlan WR, Needs P, Williamson G, Puigserver A, Kroon PA, Juge N. 2002. Functional expression of human liver cytosolic β‐glucosidase in Pichia pastoris: Insights into its role in the metabolism of dietary glucosides. Eur J Biochem. 269(1):249-258. (Disponible en anglais seulement)
Borsos O, Haraszti E, Vetter J. 1976. Nehany Lotus corniculatus fajta cianglikozid szintjenek valtozasa a vegetacios idoszak folyaman. Botanikai kozlemenyek. (Disponible en anglais seulement)
Briggs MA, Schultz JC. 1990. Chemical defense production in Lotus corniculatus L. II. Trade-offs among growth, reproduction and defense. Oecologia. 83(1):32-37. (Disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch.33. Gazette du Canada Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. [PDF] Gazette du Canada, Partie I, vol. 146, no 48, Suppléments.
Canada. 2018. Ébauche d’évaluation préalable cyanures. Ottawa (Ont.), Environnement et Changement climatique Canada, Santé Canada. [Consulté le 21 novembre 2018.]
Chatwin TD, Trepanowski J, Wadsworth ME. 1987. Attenuation of cyanide in soils. Phase I Report. Resource Recovery and Conservation Company and the University of Utah [cited in AGDH 2010]. (Disponible en anglais seulement)
Compton SG, Jones DA. 1985. An investigation of the responses of herbivores to cyanogenesis in Lotus corniculatus L. Biol J Linn Soc Lond. 26(1):21-38. (Disponible en anglais seulement)
[ConsExpo] Consumer Exposure Model. 2016. Web version. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (Disponible en anglais seulement)
Daubert TE, Danner RP. 1985. Data compilation tables of properties of pure compounds. New York: Design Institute for Physical Property Data (US) and American Institute of Chemical Engineers. (Disponible en anglais seulement)
Dorr RT, Paxinos J. 1978. The current status of laetrile. Ann Intern Med. 89:389-397. (Disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environment and Climate Change Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Available from: substances@ec.gc.ca. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2004. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) on hydrocyanic acid in flavourings and other food ingredients with flavouring properties. Question number EFSA-Q-2003-145. EFSA Journal. 105:1-28. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2007. Opinion of the Scientific Panel on Contaminants in the Food Chain on a request from the Commission related to cyanogenic compounds as undesirable substances in animal feed. Question no EFSA-Q-2003-064. EFSA Journal. 434:1-67. (Disponible en anglais seulement)
El Ghawabi SH, Gaafar MA, El-Saharti AA, Ahmed SH, Malash KK, Fares R. 1975. Chronic cyanide exposure: a clinical, radioisotope, and laboratory study. Occup Environ Med. 32(3):215-219. (Disponible en anglais seulement)
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données compilées par Environnement Canada, Santé Canada; Programme des substances existantes.
[FAO/WHO] Food and Agricultural Organization/World Health Organization. 2012. Cyanogenic Glycosides (addendum). Safety Evaluation of Certain Food Additives and Contaminants. Prepared by the Seventy-fourth Meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO Food Additive Series 65. (Disponible en anglais seulement)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et al. 2016. Consumption of cosmetic products by the French population second part: amount data. Food Chem Toxicol. 90:130-141. (Disponible en anglais seulement)
Frakes RA, Sharma RP, Willhite CC. 1986. Comparative metabolism of linamarin and amygdalin in hamsters. Food Chem Toxicol. 24:417-420. (Disponible en anglais seulement)
Freitas RA Jr. 1999. Nanomedicine, Volume I: Basic Capabilities. Austin (TX): Landes Bioscience. 524 pp. (Disponible en anglais seulement)
Gaffney JS, Streit GE, Spall WD, Hall JH. 1987. Beyond acid rain. Do soluble oxidants and organic toxins interact with SO2 and NOx to increase ecosystem effects? Environ Sci Tech. 21(6):519. (Disponible en anglais seulement)
Gail E, Gos S, Kulzer R, Lorosch J, Rubo A, Sauer M, Kellens R, Reddy J, Steir N, Hasenpusch W. 2012. Cyano Compounds, Inorganic, Ullmann’s Encyclopedia of Industrial Chemistry. (Disponible en anglais seulement)
Gaskin S, Pisaniello D, Edwards JW, Bromwich D, Reed S, Logan M, Baxter C. 2013. Chlorine and hydrogen cyanide gas interactions with human skin: In vitro studies to inform skin permeation and decontamination in HAZMAT incidents. J Hazard Mater. 262:759-765. (Disponible en anglais seulement)
Gebrehiwot L, Beuselinck PR. 2001. Seasonal variations in hydrogen cyanide concentration of three Lotus species. Agron J. 93(3):603-608. (Disponible en anglais seulement)
Grant WF, Sidhu BS. 1967. Basic chromosome number, cyanogenetic glucoside variation, and geographic distribution of Lotus species. Can J Bot. 45(5):639-647. (Disponible en anglais seulement)
Hansch C, Leo A, Hoekman D. 1995. Exploring QSAR: hydrophobic, electronic and steric constants. Washington (DC): American Chemical Society. 348 pp. (Disponible en anglais seulement)
Hernández T, Lundquist P, Oliveira L, Cristià RP, Rodriguez E, Rosling H. 1995. Fate in humans of dietary intake of cyanogenic glycosides from roots of sweet cassava consumed in Cuba. Nat Toxins. 3(2):114-117. (Disponible en anglais seulement)
Howard JW, Hanzal RF. 1955. Pesticide Toxicity, Chronic Toxicity for Rats of Food Treated with Hydrogen Cyanide. J Agric Food Chem. 3:325-329. (Disponible en anglais seulement)
[JECFA] Joint Expert Committee on Food Additives. 2011. Evaluation of Certain Food Additives and Contaminants. World Health Organization (WHO) Technical Report Series 966 [PDF]. [Consulté le 12 mars 2019]. (Disponible en anglais seulement)
Jones DA, Turkington R. 1986. Biological flora of the British Isles. Lotus corniculatus L. J Ecol. 74(4):1185-1212. (Disponible en anglais seulement)
Kasting GB, Miller MA. 2006. Kinetics of finite dose absorption through skin 2: Volatile compounds. J Pharm Sci. 95(2):268–280. (Disponible en anglais seulement)
Kim S, Chen J, Cheng T, Gindulyte A, He J, He S, Li Q, Shoemaker BA, Thiessen PA, Yu B, Zaslavsky L, Zhang J, Bolton EE. 2019. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 47(D1):D1102-1109. (Disponible en anglais seulement)
Lide DR, editors. 1990. CRC Handbook of Chemistry and Physics. 72nd ed. Boca Raton (FL): CRC Press. (Disponible en anglais seulement)
Meesters JAJ, Nijkamp MN, Schuur AG, Te Biesebeek JD. 2018. Cleaning Products Fact Sheet. Default parameters for estimating consumer exposure - Updated version 2018. RIVM Report 2016-0179. (Disponible en anglais seulement)
Nelson L. 2006. Acute cyanide toxicity: mechanisms and manifestations. J Emerg Nurs. 32(4):S8-S11. (Disponible en anglais seulement)
Németh K, Plumb GW, Berrin JG, Juge N, Jacob R, Naim HY, Williamson G, Swallow DM, Kroon PA. 2003. Deglycosylation by small intestinal epithelial cell β-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans. Eur J Nutr. 42(1):29-42. (Disponible en anglais seulement)
[NIOSH] National Institute for Occupational Safety and Health. 2013. Finite Dose Skin Permeation Calculator. Atlanta (GA): Centers for Disease Control and Prevention. [Consulté le 8 novembre 2018]. (Disponible en anglais seulement)
[NRC] National Research Council. 2000. Hydrogen cyanide. In: Spacecraft Maximum Allowable Concentrations for Selected Airborne Contaminants, Volume 4. Washington (DC): National Academy Press. 330-365 pp. (Disponible en anglais seulement)
[NRC] National Research Council. 2002. Acute Exposure Guideline Levels for Selected Airborne Chemicals, Volume 2. Subcommittee on Acute Exposure Guideline Levels Committee on Toxicology. [Consulté le 21 novembre 2018]. (Disponible en anglais seulement)
[NTP] National Toxicology Program. 1993. NTP technical report on toxicity studies of sodium cyanide (CAS No. 143-33-9) administered in drinking water to F344/N rats and B6C3F1 mice. [PDF] Washington (DC): US Department of Health and Human Services. NIH Publication 94-3386. [Consulté le 21 novembre 2018]. (Disponible en anglais seulement)
OECD QSAR Toolbox [Read-across tool]. 2014. Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
Nikitakis J, Lange B, editors. 2016. International cosmetic ingredient dictionary and handbook. 16th ed. Washington (DC): Personal Care Products Council. (Disponible en anglais seulement)
[PhysProp] Interactive PhysProp Database [database]. c2013. Syracuse (NY): SRC, Inc. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu (Dutch National Institute for Public Health and the Environment). 2006. Cosmetics Fact Sheet: To assess the risks for the consumer. [PDF] RIVM report no.: 320104001/2006. [Consulté le 19 novembre 2018]. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu (Dutch National Institute for Public Health and the Environment). 2014. General Fact Sheet - General default parameters for estimating consumer exposure - Updated version 2014. [PDF] RIVM report no.: 090013003/2014 [Consulté le 19 novembre 2018]. (Disponible en anglais seulement)
Ross MD, Jones WT. 1983. A genetic polymorphism for tannin production in Lotus corniculatus and its relationship to cyanide polymorphism. Theor App Genet. 64(3):263-268. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 1984. Health effects assessment for cyanide. Washington (DC):: US EPA. EPA540186011. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2010. Toxicological Review of Hydrogen Cyanide and Cyanide Salts. In Support of Summary Information on the Integrated Risk Information System (IRIS) [PDF]. Washington (DC): US EPA [consulté le 21 novembre 2018]. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2011. Exposure Factors Handbook: 2011 Edition. Washington (DC): Office of Research and Development, National Center for Environmental Assessment (NCEA), US EPA. EPA/600/R-090/052F. 1436 pp. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2012. Air Pollution Training Institute, Course 414: Control of Gaseous Emissions. Research Triangle Park (NC): Office of Air and Radiation, Office of Air Quality Planning and Standards, US EPA. 503 pp. [Consulté le 19 novembre 2018.] (Disponible en anglais seulement)
Vetter J. 2000. Plant cyanogenic glycosides. Toxicon. 38:11-36. (Disponible en anglais seulement)
Weschler CJ, Nazaroff WW. 2014. Dermal uptake of organic vapors commonly found in indoor air. Environ Sci Tech. 48(2):1230-1237. (Disponible en anglais seulement)
[WHO] World Health Organization. 2004. Concise International Chemical Assessment Document 61: Hydrogen Cyanide and Cyanides, Human Health Aspects. Geneva (CH): WHO. 73 pp. (Disponible en anglais seulement)
Yoo KP, Lee SY, Lee WH. 1986. Ionization and Henry’s Law Constants for Volatile, Weak Electrolyte Water Pollutants. Korean J Chem Eng. 3:67. (Disponible en anglais seulement)
Annexe A. Glycosides cyanogènes et risque d’exposition à l’HCN associé à l’utilisation de cosmétiques contenant de l’extrait de Lotus corniculatus
Les glycosides cyanogènes sont des molécules relativement petites généralement présentes en faibles concentrations dans des végétaux (Briggs et Schultz, 1990). Bien que ces dernières varient selon la saison, les concentrations d’HCN sont toujours plus élevées au printemps et en été qu’en automne et en hiver (Gebrehiwot et Beuselinck, 2001). Les concentrations de cyanure sont maximales dans les feuilles en croissance et diminuent lorsque les feuilles se développent et s’épaississent, tandis que les graines contiennent peu ou pas de glycoside cyanogène (Jones et Turkington, 1986; Vetter, 2000). Il existe peu de données sur la teneur en cyanure des fleurs de Lotus corniculatus, bien que dans un cultivar obtenu en serre, la concentration de cyanure dans les fleurs était semblable à celle mesurée dans les feuilles (Gebrehiwot et Beuselinck, 2001).
Dans la matière végétale intacte, les glycosides cyanogènes sont stockés dans des compartiments cellulaires distincts de ceux qui contiennent les enzymes hydrolytiques comme les ß-glucosidases. La mastication de la plante par les herbivores ou sa transformation pour la production d’extraits peut entrainer la rupture de ces compartiments et la formation d’HCN. L’hydrolyse d’un gramme de linamarine peut libérer 109,3 mg d’HCN (soit 105,2 mg de CN-) et celle d’un gramme de lotaustraline 103,4 mg d’HCN (soit 99,6 mg de CN-). On a longtemps cru que les humains et les autres mammifères ne possédaient pas les enzymes endogènes nécessaires pour hydrolyser et métaboliser les glucosides contenus dans les aliments (Dorr et Paxinos, 1978; Frakes et coll., 1986; Hernandez et coll., 1995), bien que les glycosides puissent être hydrolysés et que de l’HCN puisse être libéré sous l’action d’enzymes microbiennes présentes dans le tube digestif (EFSA, 2007). Depuis, l’existence de β-glucosidases humaines endogènes a été prouvée (Berrin et coll., 2002; Németh et coll., 2003), bien que ces enzymes ne semblent pas être capables d’hydrolyser la linamarine, le principal glycoside produit par Lotus corniculatus et plusieurs autres espèces végétales constituant une part importante de l’alimentation humaine. Par conséquent, s’ils ne sont pas métabolisés par le microbiote intestinal, les glycosides mères sont absorbés et excrétés dans l’urine sans causer d’exposition à l’HCN (EFSA, 2007).
Il est raisonnable de supposer que l’HCN peut être libéré à partir des glycosides cyanogènes pendant la production et la transformation de l’extrait de Lotus corniculatus si la matière végétale est homogénéisée ou traitée par des procédés techniques qui compromettent son intégrité. Les extraits provenant de phénotypes acyanogènes qui produisent le glycoside, mais pas l’enzyme peuvent également contenir des glycosides intacts. Bien qu’aucune donnée n’ait été trouvée concernant la capacité de la microflore cutanée à hydrolyser des glycosides cyanogènes, il se pourrait que les glycosides non hydrolysés qui subsistent dans les extraits végétaux libèrent également de l’HCN par ce mécanisme. Quant à la voie orale, tous les glycosides cyanogènes qui sont absorbés par la peau sans être métabolisés par le biote cutané ne devraient pas entrainer d’exposition à l’HCN étant donné que les mammifères ne disposent pas d’enzymes hydrolytiques.
Annexe B. Paramètres par défaut et hypothèses permettant d’estimer l’exposition à l’acide cyanhydrique par inhalation et par voie orale lors de l’utilisation de cosmétiques
Les scénarios d’exposition sentinelles ont servi à estimer l’exposition potentielle au cyanure découlant de l’utilisation de produits cosmétiques contenant de l’extrait de Lotus corniculatus. Les hypothèses de scénarios sont résumées dans le tableau B-1. Les expositions ont été estimées à partir du poids supposé des adultes, soit 70,9 kg, et des tout-petits, soit 15,5 kg (Santé Canada, 1998) et le taux d’inhalation a été estimé à 16,2 m3/jour chez les adultes. Les concentrations dans l’air ont été estimées à l’aide de la version Web de ConsExpo ou des algorithmes provenant du modèle (version Web de ConsExpo, 2016).
| Scénario d’exposition | Hypothèses |
|---|---|
Lotion pour le corps | Concentration maximale d’HCN dans le produit : 25 mg/kg (concentration maximale de cyanure dans l’extrait de Lotus corniculatus [voir la section 5.1] multipliée par la concentration maximale d’extrait dans le produit selon les déclarations sur les cosmétiques). Quantité de produit : 10 g (Ficheux et coll., 2016) Fréquence : 1/jour (Ficheux et coll., 2015) Facteur de rétention : 1 (RIVM, 2006) Volume de la pièce : 10 m3 (RIVM, 2014) Taux de renouvèlement de l’air : 2/h (RIVM, 2014) Durée d’application : 1 minute (d’après un expert) Durée de l’exposition : 10 minutes (US EPA, 2011) Surface de rejet : 17 530 cm2 (Ficheux et coll., 2016) Température : 32 °C (température de la peau par défaut; NIOSH, 2013). Pression de vapeur : 959 torrs à 32 °C (calculée à l’aide de l’équation d’Antoine – voir l’annexe C) Taux de transfert de masse : 0,167 m/min (Meesters et coll., 2018) |
Baume pour les lèvres | Concentration maximale d’HCN dans le produit : 50 mg/kg (concentration maximale de cyanure dans l’extrait de Lotus corniculatus [voir la section 5.1] multipliée par la concentration maximale d’extrait dans le produit selon les déclarations sur les cosmétiques). Quantité de produit : 0,022 g (Ficheux et coll., 2016) Concentration maximale d’HCN (mg/kg) : 50 Fréquence : 2/jour chez les adultes; 1/jour chez les tout-petits (Ficheux et coll., 2015) Quantité ingérée : 100 % (pire scénario théorique) Facteur de rétention : 1 (RIVM, 2006) |
Annexe C. Pénétration d’une dose déterminée de substances volatiles dans la peau
L’équation d’Antoine peut servir à estimer la pression de vapeur dans un intervalle de températures précis. L’équation est la suivante :
où p est la pression de vapeur (mm HG), T la température (°C) et A, B et C des constantes propres au composant. Les constantes d’Antoine pour l’acide cyanhydrique proviennent d’un document de l’US EPA (2012).
| A | B | C | Tmin oC | Tmax oC |
| 7,528 23 | 1329,49 | 260,418 | -16,4 | 46,2 |
Par conséquent, la pression de vapeur de l’acide cyanhydrique à 32 °C (température à la surface de la peau par défaut) peut se calculer comme suit :
Le calculateur de la pénétration d’une dose déterminée dans la peau (NIOSH, 2013) résout le problème de l’élimination d’une dose appliquée en surface et peut servir à estimer les flux, les concentrations dans la peau et la quantité d’une substance chimique qui est absorbée. Dans le cas de substances très volatiles comme le cyanure, l’exposition par voie cutanée variera non seulement en fonction de la dose appliquée en surface, mais également selon le rapport entre le taux d’évaporation et le taux d’absorption. En effet, le calculateur de la pénétration d’une dose déterminée dans la peau permet de prédire qu’à une température de la peau de 32 °C, le flux d’évaporation maximal sera nettement supérieur au flux d’absorption maximal (Tableau C-1).
| Paramètre | Valeur |
|---|---|
| Flux d’absorption maximal ([Jabs] max) | 1,645 x 10-3 μg/cm²/h¹ |
| Temps pour atteindre le flux d’absorption maximal | 0,471 heure |
| Flux d’évaporation maximal | 2789,242 μg/cm²/h¹ |
| Temps pour atteindre le flux d’évaporation maximal | 2,778 x 10-10 heure |
Le calculateur de la pénétration d’une dose déterminée dans la peau a servi à estimer la distribution de la perméance après une application cutanée (tableau C-2). La somme de la solution absorbée totale dans toutes les couches de la peau et de celle absorbée dans le système circulatoire a été estimée à 6,9 x 10-3 µg/cm2. À supposer que la concentration d’HCN est de 0,5 %, cette somme correspond à une dose par unité de surface de 3,4 x 10-5 µg/cm2. Cette valeur peut être multipliée par une surface corporelle de 530 cm2 et divisée par le poids corporel d’un adulte de 70,9 kg, ce qui donne une dose générale d’HCN de 0,009 µg/kg p.c./jour.
| Élimination de l’HCN | Masse par unité de surface (µg/cm2) |
|---|---|
| Évaporé | 0,564 |
| Surface de la peau | 0,0 |
| Couche cornée | 1,57 × 10-6 |
| Épiderme viable | 4,18 × 10-6 |
| Derme | 5,71 × 10-5 |
| Absorbé dans le système circulatoire | 6,84 × 10-3 |
