Évaluation préalable - Groupe des pigments et colorants
Titre officiel : Évaluation préalable - Groupe des pigments et colorants
Numéros de registre du Chemical Abstracts Service
596-03-2, 1326-03-0, 8005-03-6, 12224-98-5, 26694-69-9, 42373-04-6
Environnement et Changement climatique Canada
Santé Canada
Août 2020
No de cat. : En14-414/2020F-PDF
ISBN 978-0-660-35222-0
Sommaire
En vertu de l’article 68 ou de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], la ministre de l’Environnement et la ministre de la Santé ont produit une évaluation préalable portant sur 6 des 25 substances collectivement appelées « groupe des pigments et colorants » dans le Plan de gestion des produits chimiques. Ces 6 substances furent désignées comme étant prioritaires pour une évaluation, car elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE ou furent déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine. L’application d’autres méthodes d’évaluation a permis de conclure que 19 des 25 substances étaient peu préoccupantes et des rapports distinctsNote de bas de page 1Note de bas de page 2 présentent les décisions les concernant. La présente évaluation préalable porte donc sur les 6 substances énumérées ci-dessous et qui dans le présent document seront désignées sous le nom de groupe des pigments et colorants.
NE CASa |
Nom figurant sur la Liste intérieure |
Nom commun |
|---|---|---|
596-03-2 |
4’,5’-Dibromo-3’,6’-dihydroxyspiro[isobenzofurane-1(3H),9’-[9H]xanthène]-3-one |
D&C Orange 5 |
1326-03-0 |
Molybdotungstophosphate de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium |
Pigment Violet 1 |
8005-03-6b,c |
noir acide 2 C.I. |
Acid Black 2 |
12224-98-5 |
Molybdotungstophosphate de 9-[2-(éthoxycarbonyl)phényl]-3,6-bis(éthylamino)-2,7-diméthylxanthylium |
Pigment Red 81 |
26694-69-9 |
Sulfate de 9-[2-(éthoxycarbonyl)phényl]-3,6-bis(éthylamino)-2,7-diméthylxanthylium et d’éthyle |
n.d. |
42373-04-6 |
Chlorure de 3-méthyl-2-[(1-méthyl-2-phényl-1H-indol-3-yl)azo]thiazolium |
Basic Red 29 |
Abréviation : n.d. = Non disponible
a Le numéro de registre du Chemical Abstracts Service (NE CAS) est la propriété de l’American Chemical Society et toute utilisation ou redistribution, sauf quand cela est requis pour des exigences réglementaires et/ou pour des rapports au gouvernement du Canada quand l’information et les rapports sont requis en vertu d’une loi ou d’une politique administrative, est interdite sans autorisation écrite préalable de l’American Chemical Society
b Ce composé est un UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
c Cette substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais fait l’objet de la présente évaluation préalable parce qu’elle a été jugée prioritaire en raison d’autres préoccupations pour la santé humaine.
Les substances du groupe des pigments et colorants sont utilisées comme agents colorants dans un vaste éventail d’utilisations. Les substances de ce groupe se retrouvent dans des produits de consommation, notamment les cosmétiques (p. ex., les produits capillaires, les rouges à lèvres et baumes à lèvres, le maquillage, la peinture faciale, le vernis à ongles), les matériaux d’emballage pour aliments, les encres (p. ex., encres d’impression, tampons encreurs), les tissus et les matériaux d’art et d’artisanat pour enfants (p. ex., crayons de cire, craies). Selon les renseignements divulgués en vertu de l’article 71 de la LCPE pour l’année civile 2011, aucune des substances du groupe des pigments et colorants n’a été fabriquée en une quantité dépassant le seuil de 100 kg. On a déclaré l’importation de D&C Orange 5 en quantité inférieure au seuil de 100 kg, de Pigment Violet 1 et de l’Acid Black 2 dans des quantités entre 1 000 et 10 000 kg, de Pigment Red 81 et de NE CAS 26694-69-9 en quantité inférieure au seuil de 100 kg, et finalement de Basic Red 29 dans des quantités entre 100 et 1000 kg.
Les risques pour l’environnement associés aux substances du groupe des pigments et colorants ont été caractérisés au moyen de la Classification du risque écologique (CRE) des substances organiques, approche fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition avec une pondération des éléments de preuve pour obtenir un classement du risque. Les profils de risque sont principalement fondés sur les paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons les taux d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice de risques est utilisée pour assigner un niveau faible, modéré ou élevé de préoccupation potentielle, à partir des profils de risque et d’exposition des substances. À la lumière des résultats de l’analyse de CRE il a été déterminé que les substances du groupe des pigments et colorants présentaient un faible potentiel d’être nocives pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le NE CAS 26694-69-9, et le Basic Red 29 présentent un faible risque d’être nocifs pour l’intégrité globale de l’environnement. Il est conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le NE CAS 26694-69-9, et le Basic Red 29 ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
La principale voie d’exposition de la population générale aux substances du groupe des pigments et colorants est l’utilisation de produits de consommation qui en contiennent. Les principales sources d’exposition sont les voies orale et cutanée. L’évaluation des expositions cutanées et orales potentielles au D&C Orange 5 et à l’ Acid Black 2 repose sur l’application de cosmétiques. L’évaluation des expositions potentielles au Pigment Violet 1, au Pigment Red 81 et au NE CAS 26694-69-9 est fondée sur l’utilisation par les bambins de matériaux d’art et d’artisanat pour enfants. L’évaluation des expositions cutanées et orales potentielles au Basic Red 20 est fondée sur le contact avec des tissus. Selon nos évaluations, les expositions par inhalation au Pigment Violet 1 occasionnées par l’utilisation de craie sont faibles par rapport aux expositions orales. Nous estimons que l'exposition par inhalation aux autres substances du groupe des pigments et colorant n’est pas préoccupante en raison de leur très faible volatilité et de leurs utilisations.
Lors d’études en laboratoire, on n’a observé aucun effet de D&C Orange 5 sur la santé découlant du traitement ou dépendant de manière cohérente de la dose. Les effets critiques du Pigment Violet 1 dus à son ingrédient colorant, le Basic Violet 10, sont la hausse de l’incidence d’astrocytomes dans le cerveau ou la moelle épinière, une hausse du taux de mortalité, un gain du poids des organes et une hausse de la consommation d’aliments. On n’a pas observé d’effets sur la santé découlant du traitement ou dépendant de manière cohérente de la dose dans les études cruciales utilisées pour la caractérisation du risque posé par l’Acid Black 2, fondées sur son analogue structurel, le Solvent Black 5. La perte de poids corporel était l’effet critique sur la santé retenu pour la substance au NE CAS 26694-69-9 et le Pigment Red 81 dû à son ingrédient colorant, le Basic Red 1. Nous avons adopté la démarche du seuil potentiel de toxicité (SPT) pour le Basic Red 29.
Nous considérons que les marges d’exposition — qui comparent les niveaux auxquels apparaissent les effets critiques sur la santé (ou, en leur absence, la plus haute dose d’essai dans les études cruciales) aux estimations d’exposition découlant de l’utilisation de produits de consommation — sont suffisantes pour diffuser les incertitudes dans les bases de données sur les effets sur la santé de l’exposition au D&C Orange 5, au Pigment Violet 1, à l’Acid Black 2, au Pigment Red 81 et au NE CAS 26694-69-9. Dans le cas du Basic Red 29, l’estimation de l’exposition occasionnée par les produits de consommation était plus basse que la valeur du seuil de préoccupation toxicologique, basé sur sa classe de Cramer et sa génotoxicité globale négative, ce qui indique une faible probabilité de constituer un risque pour la santé humaine. Aux niveaux actuels d’exposition, nous considérons que le Basic Red 29 est peu préoccupant pour la santé humaine.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le NE CAS 26694-69-9, et le Basic Red 29 ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le NE CAS 26694-69-9, et le Basic Red 29 ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 ou de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada, 1999), la ministre de l’Environnement et la ministre de la Santé ont produit une ébauche d’évaluation préalable portant sur 6 des 25 substances appelées collectivement « groupe des pigments et colorants » dans le Plan de gestion des produits chimiques, afin de déterminer si elles présentent ou pourraient présenter un risque pour l’environnement et la santé humaine. Ces 6 substances ont été désignées comme prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine (ECCC et SC, modifié en 2017).
Parmi d’autres substances, le document sur l’approche scientifique de la Classification des risques écologiques (CRE) des substances organiques (ECCC 2016a) a considéré les 19 autres substances énumérées au tableau 1‑1. Chacune a été désignée comme étant peu préoccupante pour la santé humaine et l’environnement, à la suite de leur évaluation par l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada, 2016), ou de leur évaluation suivant la démarche appliquée dans l’Évaluation rapide de substances auxquelles l’exposition de la population générale est limitée (ECCC et SC 2018a). C’est pourquoi ces autres substances ne sont pas mentionnées davantage dans le présent document. Le lecteur trouvera les conclusions relatives à ces 19 substances dans les rapports Évaluation préalable des substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) (ECCC et SC 2018b) et Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. (ECCC et SC 2018a).
Nom figurant sur la Liste intérieure (LI) |
Approche d’évaluation |
Références |
|
|---|---|---|---|
2387-03-3 |
2-Hydroxynaphtalène-1-carbaldéhyde-[(2-hydroxy-1-naphtyl)méthylène]hydrazone |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
2478-20-8 |
6-Amino-2-(2,4-diméthylphényl)-1H-benzo[de]isoquinoléine-1,3(2H)-dione |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
4378-61-4 |
4,10-Dibromodibenzo[def,mno]chrysène-6,12-dione |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
5521-31-3 |
2,9-Diméthylanthra[2,1,9-def:6,5,10-d’e’f’]diisoquinoléine-1,3,8,10(2H,9H)-tétrone |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
5718-26-3 |
2-[(1,5-Dihydro-3-méthyl-5-oxo-1-phényl-4H-pyrazol-4-ylidène)éthylidène]-1,3,3-triméthylindoline-5-carboxylate de méthyle |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
6858-49-7 |
Carbanilate de 2-[4-(2,2-dicyanovinyl)-N-éthyl-3-méthylaniline]éthyle |
CRE/SPT |
ECCC et SC 2018b |
7576-65-0 |
2-(3-Hydroxy-2-quinolyl)-1H-indène-1,3(2H)-dione |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
13082-47-8 |
Hydroxyde de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium |
CRE/SPT |
ECCC et SC 2018b |
16294-75-0 |
14H-Anthra[2,1,9-mna]thioxanthén-14-one |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
62973-79-9 |
Molybdosilicate de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
63022-09-3 |
Molybdophosphate de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
66241-11-0 |
2,4-Dinitrophénol sulfuré, leucodérivés |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
68310-07-6 |
Molybdophosphate de 3,6-bis(éthylamino)-9-[2-(méthoxycarbonyl)phényl]-2,7-diméthylxanthylium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
68409-66-5 |
Molybdophosphate de (4-{[4-(diéthylamino)phényl][4-(éthylamino)-1-naphtyl]méthylène}cyclohexa-2,5-dién-2-ylidène)diéthylammonium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
68814-02-8 |
(4-{Bis[p-(diéthylamino)phényl]méthylène}cyclohexa-2,5-dién-1-ylidène)diéthylammonium, molybdophosphate |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
75627-12-2 |
Molybdophosphate de 3,6-bis(éthylamino)-9-[2-(méthoxycarbonyl)phényl]-2,7-diméthylxanthylium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
80083-40-5 |
Xanthylium, [(éthoxycarbonyl)-2 phényl]-9 bis(éthylamino)-3,6 diméthyl-2,7, molybdotungstosilicat |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
102082-92-8 |
3,6-Bis(diéthylamino)-9-[2-(méthoxycarbonyl)phényl]xanthylium, molybdosilicate |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
106276-80-6 |
2,3,4,5-Tétrachloro-6-cyanobenzoate de méthyle, produits de réaction avec la p-phénylènediamine et le méthoxyde de sodium |
CRE/Examen préalable rapide |
ECCC et SC 2018a |
Les six substances examinées dans le présent rapport d’évaluation préalable sont ci-après désignées comme le groupe des pigments et colorants.
Le risque environnemental engendré par les substances du groupe des pigments et colorants a été caractérisé selon l’approche de la CRE (ECCC 2016a). La CRE caractérise les risques posés par une substance en utilisant des paramètres clés parmi lesquels le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, à partir de divers facteurs, dont les taux d’émission potentiels, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. Les divers éléments de preuve sont groupés pour repérer les substances qui nécessitent une évaluation approfondie en raison de leurs risques pour l’environnement ou celles dont la probabilité de nuire à l’environnement est faible.
Bien que nous ayons individuellement évalué chaque substance du groupe des pigments et colorants dans la présente évaluation préalable, nous avons utilisé une même substance pour nous éclairer sur les effets du Pigment Red 81 et du no CAS 26694-69-9 comme composant et comme analogue structurel respectivement. Le regroupement des substances du groupe des pigments et colorants n’a pas été formé sur la base de leur structure chimique et bien que certains pigments contenant du xanthène soient structurellement proches, certains membres ne sont pas du tout apparentés du point de vue de leur structure.
Dans la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements communiqués par des parties intéressées. Les données utiles ont été colligées jusqu’en octobre 2016. Nous avons réalisé des recherches documentaires jusqu’en avril 2017 et recueilli des données supplémentaires de la part de parties prenantes jusqu’en mai 2017. Les données empiriques tirées d’études importantes ainsi que certains résultats issus de la modélisation ont servi à étayer les conclusions. Nous avons tenu compte des renseignements présentés par des évaluations faites par d’autres instances, lorsqu’ils disponibles et pertinents.
Le personnel du Programme d’évaluation des risques de la Loi canadienne de la protection de l’environnement de Santé Canada et d’Environnement et Changement climatique Canada a rédigé cette ébauche d’évaluation préalable qui intègre la contribution d’autres programmes de ces deux ministères. Le volet de l’évaluation portant sur l’environnement est fondé sur le document décrivant la Classification du risque écologique (CRE) (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe par des pairs ainsi que d’une période de commentaires par le public de 60 jours. Les portions de la présente évaluation portant sur la santé humaine ont fait l’objet d’un examen ou de consultations par des tiers externes. Mmes Theresa Lopez et Jennifer Flippin, ainsi que Mme Joan Garey de Tetra Tech ont émis des commentaires sur les parties techniques portant sur la santé humaine. De plus, l’ébauche de la présente évaluation préalable (publiée le 5 janvier 2019) a fait l’objet d’une période de commentaires de 60 jours. Santé Canada et Environnement et Changement climatique Canada ont tenu compte de ces commentaires par des tiers. Toutefois, les ministères assument l’entière responsabilité du contenu final et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des renseignements cruciaux permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, les renseignements scientifiques ont été étudiés et intégrés à une démarche basée sur le poids de la preuve et le principe de précaution.Note de bas de page 3 La présente évaluation préalable contient les informations critiques et les raisonnements à partir desquels nous avons atteint les conclusions.
2. Identité des substances
Le tableau 2-1 présente le no CAS, le nom sur la Liste intérieure (LI), les noms usuels pour chaque substance et les structures représentatives des membres du groupe des pigments et colorants. Le Pigment Violet 1 et le Pigment Red 81 ont été classés comme des substances distinctes en vertu de la LCPE (CCCE, HC [modifié 2017]). Les principales préoccupations relatives à ces substances concernent leur fraction organique. Cependant, il est reconnu que ces substances possèdent des caractéristiques de type UVCB en raison de la variation de leur fraction inorganique (tableau 2-1). Bien que certaines des substances du groupe des pigments et colorants possèdent une structure apparentée xanthènes (le Pigment Violet 1, le Pigment Red 81 et le no CAS 26694-69-9), il existe parmi elles une grande diversité sur les plans de la structure chimique et de la catégorie d’utilisation (p. ex., les pigments, les colorants basiques, les colorants acides).
| NO CAS | Nom dans la LIS(nom usuel) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 596-03-2 | 4’,5’-Dibromo-3’,6’-dihydroxyspiro[isobenzofurane-1(3H),9’-[9H]xanthène]-3-one D&C Orange 5 | 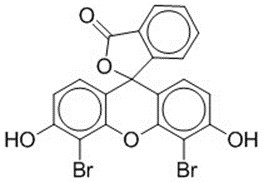 C20H10Br2O5 C20H10Br2O5 | 490,10 |
| 1326-03-0a,b | Molybdotungstophosphate de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium (Pigment Violet 1) | ![CCN(CC)C1=CC2=[O+]C3=CC(N(CC)CC)=CC=C3C(C4=CC=CC=C4C(O)=O)=C2C=C1](/content/dam/eccc/images/pded/pigments-and-dyes/t2-1b.jpg) [C28H31N2O3]n.PTMA [C28H31N2O3]n.PTMAn = 6 PTMA : O3.P2O5.xWO3.yMoO3 x = 12 – 32 y = 1 – 12 | de 7361 à 8328 |
| 8005-03-6a | Noir acide 2 C.I. (L'Acid Black 2 est aussi appelé nigrosine, il est hydrosoluble) | ![[O-]S(C(C=C1)=CC=C1NC(C(NC2=CC=C(S([O-])(=O)=O)C=C2)=CC3=N4)=CC3=[N+](C5=C4C(NC6=CC=CC=C6)=CC=C5)C7=CC=CC=C7)(=O)=O.[Na+]](/content/dam/eccc/images/pded/pigments-and-dyes/t2-1c.jpg) C36H26N5NaO6S2 C36H26N5NaO6S2 | 711,74 |
| 12224-98-5a,b | Molybdotungstophosphate de 9-[2-(éthoxycarbonyl)phényl]-3,6-bis(éthylamino)-2,7-diméthylxanthylium (Pigment Red 81) | ![CCNC1=CC2=[O+]C3=CC(NCC)=C(C)C=C3C(C4=CC=CC=C4C(OCC)=O)=C2C=C1C](/content/dam/eccc/images/pded/pigments-and-dyes/t2-1d.jpg) [C28H31N2O3]n.PTMA [C28H31N2O3]n.PTMA n = 6 PTMA : O3.P2O5.xWO3. yMoO3x = 12 – 32 y = 1 – 12 | de 7361 à 8328 |
| 26694-69-9 | Sulfate de 9-[2-(éthoxycarbonyl)phényl]-3,6-bis(éthylamino)-2,7-diméthylxanthylium et d’éthyle | ![CCOC(c1ccccc1c2c(cc(C)c(NCC)c3)c3[o+]c4c2cc(C)c(NCC)c4)=O.O=S([O-])(OCC)=O](/content/dam/eccc/images/pded/pigments-and-dyes/t2-1e.jpg) C30H36N2O7S C30H36N2O7S | 568,68 |
| 42373-04-6 | Chlorure de 3-méthyl-2-[(1-méthyl-2-phényl-1H-indol-3-yl)azo]thiazolium (Basic Red 29) | C=CS3)C4=C1C=CC=C4.[Cl-]](/content/dam/eccc/images/pded/pigments-and-dyes/t2-1f.jpg) C19H17N4SCl | 368,89 |
Abréviations – PTMA : tungstate molybdate de phosphate (O3.P2O5.xWO3.yMoO3).
a La substance associée à ce numéro CAS est un « UVCB » (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques). La structure chimique montrée est représentative. La formule moléculaire et le poids moléculaire correspondent à la structure montrée.
b La structure exacte (p. ex., le rapport stœchiométrique entre la portion xanthène et le contre-ion tungstate molybdate de phosphate dépend du pH et de la température de précipitation pendant la fabrication (Herbst et Hunger 2004). La structure représentative correspondant à n = 6 pour la portion cationique colorante et la portion de sel anionique, le PTMA : O3.P2O5.xWO3.yMoO3 est en accord avec celle présentée par Laden (1997).
2.1 Sélection d’analogues et utilisation de modèles de relation (quantitative) structure-activité
Une approche de lecture croisée tirant parti des données sur les analogues et des résultats de modèles de relation (quantitative) structure-activité [R(Q)SA] a été employée, au besoin, pour les volets environnement et santé humaine de l’évaluation. Nous avons choisi des analogues ayant une structure et/ou une fonctionnalité semblables aux substances de ce groupe (p. ex., pour leurs propriétés physicochimiques ou toxicocinétiques) pour lesquelles nous disposons de données empiriques pertinentes permettant une lecture croisée pour des substances pour lesquelles nous ne disposons que peu de données empiriques. Les données détaillées de lecture croisée et des modèles (Q)SAR choisis pour étayer les évaluations des effets du groupe des pigments et colorants sur I'environnement et la santé humaine sont examinés plus en détail dans les sections correspondantes du présent rapport. Le tableau 2.2 donne la liste des analogues et des composants des colorants de certains pigments utilisés pour éclairer cette évaluation.
| No CAS de l’analogue ou du composant | Nom sur la LIS ou autre nom(noms usuels) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) | Substance cible |
|---|---|---|---|---|
| 81-88-9a,b | Chlorure de 9-(2-carboxyphényl)-3,6-bis(diéthylamino)xanthylium (Basic Violet 10, Rhodamine B ou D&C Red 19) | \CC)C=C1)CC.[Cl-]](/content/dam/eccc/images/pded/pigments-and-dyes/t2-2a.jpg) C28H31ClN2O3 C28H31ClN2O3 | 479,017 | Pigment Violet 1a, no CAS 26694-69-9b |
| 989-38-8a | Chlorure de 9-[2-(éthoxycarbonyl)phényl]-3,6-bis(éthylamino)-2,7-diméthylxanthylium (Basic Red 1 ou Rhodamine 6G) | ![CCNc1c(C)cc2c(c3c(C(OCC)=O)cccc3)c(cc(C)c(NCC)c4)c4[o+]c2c1.[Cl-]](/content/dam/eccc/images/pded/pigments-and-dyes/t2-2b.jpg) C28H31ClN2O3 C28H31ClN2O3 | 479,0169 | Pigment Red 81a, no CAS 26694-69-9 |
| 11099-03-9c | Nigrosine soluble dans l’alcool (aussi appelé Solvent Black C.I. 5) | ![[H]N1C2=C(C=CC=C2)N(C3=CC=CC=C3)C(C1=C4)=CC5=C4N=C6C(N5C7=CC=CC=C7)=C/C(C(N(C8=CC=CC=C8)[H])=C6)=N/C9=CC=CC=C9](/content/dam/eccc/images/pded/pigments-and-dyes/t2-2c.jpg) (valeur de l’entier : 1)C42H30N6 (valeur de l’entier : 1)C42H30N6 | 618,73 | Acid Black 2 |
| 36877-69-7b | Chlorure de 9-[2-carboxy-5(ou 6)-isothiocyanatophényl]-3,6-bis(diéthylamino)xanthylium (Rhodamine B isothiocyanate) | \CC)C=C1)CC.[Cl-]](/content/dam/eccc/images/pded/pigments-and-dyes/t2-2d.jpg) C29H30ClN3O3S C29H30ClN3O3S | 536,087 | No CAS 26694-69-9b |
Abréviation- n.d. : non disponible.
a Nous ne considérons pas que le Basic Violet 10 et le Basic Red 1 soient respectivement des analogues du Pigment Violet 1 et du Pigment Red 81, mais ce sont des composants des colorants que nous pouvons utiliser pour nous éclairer sur les effets potentiels sur la santé de leur pigment apparenté respectif. (Le lecteur trouvera plus de renseignements à la section 6.2.)
b Nous n’utilisons le Basic Violet 10 et la Rhodamine B isothiocyanate en lecture croisée que pour le paramètre toxicologique d’absorption cutanée de la substance no CAS 26694-69-9.
c Ce composé est un UVCB (sois une substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique). Nous faisons une lecture croisée pour l’Acid Black 2, car les deux substances sont de la nigrosine : le Solvent Black C.I. 5 se dissous dans l’alcool et l’Acid Black 2 dans l’eau.
3. Propriétés physiques et chimiques
Nous présentons au tableau 3-1 un résumé des propriétés physiques et chimiques disponibles des substances du groupe des pigments et colorants. Nous n’avons que peu d’informations expérimentales sur leurs propriétés physiques et chimiques. Le lecteur trouvera dans ECCC (2016b) d’autres propriétés physiques et chimiques. La pression de vapeur publiée de le D&C Orange 5 est très basse (1,18 × 10-16 mm de Hg à 25 °C; LookChem 2008). Nous n’avons pas trouvé dans les publications scientifiques, de données sur la pression de vapeur des autres substances. La pression de vapeur du Basic Red 29, estimée à l’aide du module MPBPWIN de la suite EPI (EPI Suite © 2000-2012), est également très basse (1,23 × 10-10 mm de Hg à 25 °C). On peut prévoir que les autres substances de ce groupe auront une très basse pression de vapeur étant donné leur poids moléculaire plutôt élevée et leur structure moléculaire (par; ex, l’ionisation).
Substance |
Hydrosolubilité |
log Koe |
Principales références |
|---|---|---|---|
D&C Orange 5 |
« Légèrement soluble », 0,5 mg/L (estimée) |
5,29 (estimée) |
LookChem 2008, ECCC 2016b |
Pigment Violet 1 |
Insoluble, < 0,1 mg/mL |
n.d. |
Chemicalland21 2016, Keith et Walters cités par Cameo Chemicals 2017a |
Acid Black 2 |
10 – 50 mg/mL à 18 °C |
n.d. |
Keith et Walters 1992 cités par NCBI 2005 |
Pigment Red 81 |
« légèrement soluble » 1 – 5 mg/mL |
n.d. |
Keith et Walters 1992 cité par Cameo Chemicals 2017b, Ash et Ash 2013b |
No CAS 26694-69-9 |
< 0,01 mg/L (estimée) |
4,15 (estimée) |
ECCC 2016b |
Basic Red 29 |
1,88 mg/L (estimée) |
4,76 (estimée) |
ECCC 2016b |
Abréviation — n.d. : non disponible
4. Sources et utilisations
Aucune des substances du groupe des pigments et colorants n’est produite dans la nature. Elles n’ont jamais été incluses dans une enquête menée conformément à un avis publié en vertu de l’article 71 de la LCPE (Canada 2012). Pendant l’année civile 2011, aucune importation de D&C Orange 5, de Pigment Red 81 ni de no CAS 26694-69-9 au-dessus du seuil de déclaration de 100 kg n’a été déclarée. Le tableau 4‑1 contient un résumé des quantités totales importées des autres substances du groupe des pigments et colorants. Aucune activité manufacturière supérieure au seuil de déclaration n’a été déclarée.
Nom usuel |
Importations totales (kg) |
Année de déclaration |
|---|---|---|
Pigment Violet 1 |
3 005 |
2011 |
Acid Black 2 |
1 000 – 10 000 |
2011 |
Basic Red 29 |
100 — 1 000 |
2011 |
a Les valeurs proviennent des quantités déclarées lors d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Consultez le questionnaire pour les inclusions et exclusions particulières (annexes 2 et 3).
Au Canada et ailleurs dans le monde, on utilise les substances du groupe des pigments et colorants comme colorants, ce qui inclut une gamme d’applications possibles résumées au tableau 4‑2. Une note en bas de tableau précise si les utilisations confirmées au Canada proviennent des codes d’utilisation mentionnés par les répondants d’une enquête menée suivant un avis émis en vertu de l’article 71 de la LCPE, de renseignements fournis à Santé Canada ou d’autres informations publiques.
Substance |
Utilisations |
Référence |
|---|---|---|
D&C Orange 5 |
Cosmétiquesa,b (produits pour le bain, nettoyants, peinture faciale, rouge à lèvres, maquillage, vernis à ongles et produit bronzant), médicaments, teinture pour papier, encre pour maquillage permanent et tatouage,b tissus |
Ash et Ash 2013a, 2013 b, CPSD 2016,c EWG © 2007-2016, SIMDUT 2009a, USFDA 2015 |
Pigment Violet 1 |
Matériaux d’art et d’artisanat pour enfants,d matériaux d’emballage alimentaire,e encres |
CPMA 2016,f ECCC 2016c, Environnement Canada 2013, FD 2016e |
Acid Black 2 |
Cosmétiquesa (gel capillaire et maquillage pour les yeux), matériaux d’emballage alimentairee, encres, cuir |
CPSD 2016,c ETAD 2016,h FD 2016,e Hunger 2003 |
Pigment Red 81 |
Matériaux d’art et d’artisanat pour enfants,a matériaux d’emballage alimentaire,e encres, peintures ou revêtements, plastiques, tissus |
Ash et Ash 2013a, CPMA 2016,f Dionisio et coll. 2015, FD 2016,e SIMDUT 2007 |
No CAS 26694-69-9 |
Matériaux d’art et d’artisanat pour enfants;g encres |
CPMA 2016,f SIMDUT 2009b |
Basic Red 29 |
Tissus |
ETAD 2016,h Hunger 2003 |
a Utilisation confirmée au Canada selon les informations publiques.
b Selon les informations divulguées à Santé Canada en vertu du Règlement sur les cosmétiques. Ces substances sont utilisées au Canada dans certains produits cosmétiques.
c Communication personnelle, courriels envoyés par la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2016, sans référence.
d Utilisations non confidentielles divulguées dans le cadre d’une une enquête menée conformément à un avis émis en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Consultez le questionnaire pour les inclusions et exclusions particulières (annexes 2 et 3).
e Utilisation signalée dans la fabrication de certains matériaux d’emballage alimentaire au Canada (communication personnelle, courriel de la direction des aliments de Santé Canada, au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2016, sans référence).
f Communication personnelle, courriel de la Color Pigments Manufacturers Association Inc. au Bureau de l’évaluation des risque des substances existantes de Santé Canada, 2016, sans référence.
g Utilisation au Canada d’après des informations publiques, bien qu’il y ait peu de preuves directes.
h Communication personnelle de la Ecological and Toxicological Association of Dyers au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2016, sans référence.
Nous n’avons pas relevé d’utilisation des substances du groupe des pigments et colorants dans les pesticides, les médicaments ou les produits de santé naturels. Aucune de ces substances n’est autorisée comme additif alimentaire au Canada, bien que le D&C Orange 5 soit autorisé dans les médicaments pour usage externe comme agent colorant (Canada 1978, Santé Canada 2015 (modifié), BDPSNH 2016 (modifié), BDIPSN 2017 (modifié), communication personnelle, courriels du Bureau de la gestion des risques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2016, sans référence, Recherche dans les étiquettes de pesticides 2016 [modifié]).
5. Risque d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Nous avons caractérisé les risques posés par les substances du groupe des pigments et colorants en utilisant l’approche de la Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche fondée sur le risque qui tient compte de multiples paramètres liés au danger et à l’exposition et de la pondération de nombreuses données probantes pour obtenir un classement du risque. Ces diverses sources de preuve sont combinées en vue de différencier les substances dont la puissance est basse ou élevée ou qui présentent un potentiel d’exposition inférieur ou supérieur dans divers milieux. Une telle approche permet de réduire l’incertitude générale associée à la caractérisation du risque, comparativement à une démarche de caractérisation qui ne se fonderait que sur une unique mesure dans un seul milieu (p. ex. la concentration létale médiane, CL50). Les paragraphes qui suivent résument la méthode, qui est décrite en détail par ECCC (2016a).
Nous avons colligé les données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieu et biotes, le coefficient de partition et la bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson, et les volumes de ces produits importés ou fabriqués au Canada, à partir des publications scientifiques, des bases de données empiriques disponibles (p. ex. Boîte à outils QSAR de l’OCDE, 2014)) et des réponses aux enquêtes menées conformément aux avis émis en vertu de l’article 71 de la LCPE. Nous avons produit d’autres données à partir de la relation (quantitative) structure-activité ([Q]SAR) sélectionnée ou les modèles du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées pour alimenter d’autres modèles de bilan massique ou pour compléter les profils des risques et de l’exposition des substances.
Les profils de danger reposent principalement sur les paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Les profils d’exposition reposent aussi sur plusieurs paramètres dont le taux potentiel d’émission, la persistance globale et le potentiel de transport sur de grandes distances. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de catégoriser les potentiels de risque et d’exposition de chaque substance comme faible, moyen ou élevé. D’autres règles (p. ex., la cohérence de la classification ou la marge d’exposition) ont également été appliquées en vue de préciser les classifications préliminaires du danger et de l’exposition.
Une matrice de classification du risque a été utilisée pour classer chaque substance selon le risque faible, modéré ou élevé de préoccupation qu’elle suscite à la lumière de ses classes de danger et d’exposition. Nous avons vérifié les classifications de la CRE sur le niveau de risque potentiel en suivant une démarche en deux étapes. La première étape consistait à ajuster la classification du risque posé par les substances de modéré ou élevé à bas pour celles qui présentaient un faible taux estimé de rejet dans l’eau après le traitement des eaux usées, ce qui constitue un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats de classement faible ou moyen à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer si le classement du risque devrait être réévalué à un niveau supérieur.
La CRE utilise une approche pondérée visant à réduire au minimum toute surestimation ou sous-estimation des classes de danger, d’exposition et du risque subséquent. ECCC (2016a) présente en détail les méthodes équilibrées de traitement des incertitudes. Nous décrivons ci-après deux des zones d’incertitude les plus importantes. Les erreurs sur les valeurs de toxicité aiguë empiriques ou modélisées peuvent modifier le classement du danger, en particulier, les paramètres dépendant des valeurs de résidus dans les tissus (le mode d’action toxique), dont plusieurs sont des valeurs prédites par les modèles (Q)SAR (Boîte à outils QSAR de l’OCDE, 2014). L’incidence d’une telle erreur sera cependant atténuée, puisque toute surestimation de la létalité médiane se traduira par une valeur prudente (protectrice) pour les résidus dans les tissus utilisés pour l’analyse des résidus corporels critiques (RCC). L’erreur de sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de risque tels que le profil structurel du mode d’action, la réactivité ou l’affinité pour les récepteurs d’œstrogène. Les changements ou les erreurs dans les quantités chimiques pourraient mener à des classifications différentes de l’exposition, la classification de l’exposition et du risque étant hautement sensible à la vitesse d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les estimations de quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
Le lecteur trouvera dans ECCC (2016b), les données critiques et les paramètres utilisés pour produire les profils des substances du groupe des pigments et colorants carboxyliques et les résultats du classement du danger, de l’exposition et du risque.
Les classifications du danger et de l’exposition des substances du groupe des pigments et colorants sont résumées dans le tableau 5-1.
Substance |
Classification du danger selon la CRE |
Classification de l’exposition selon la CRE |
Classification du risque selon la CRE |
|---|---|---|---|
D&C Orange 5 |
élevée |
faible |
modéré |
Pigment Violet 1 |
élevée |
faible |
modéré |
Acid Black 2 |
élevée |
faible |
modéré |
Pigment Red 81 |
élevée |
faible |
modéré |
No CAS 26694-69-9 |
élevée |
faible |
faible |
Basic Red 29 |
élevée |
faible |
faible |
À la lumière des données examinées lors de la CRE, le D&C Orange 5 a été classé comme ayant un faible potentiel de poser un risque pour l’environnement. Alors que le D&C Orange 5 a été classé comme présentant un potentiel modéré de causer des effets nocifs dans les réseaux trophiques aquatiques étant donné son potentiel de bioaccumulation, il a été classé comme présentant un potentiel de risque élevé en raison des alertes structurelles émises par la boîte à outils (Q)SAR de l’OCDE (OCDE 2016), qui classifient cette substance comme étant un liant potentiel aux récepteurs endocriniens. Le D&C Orange 5 été classé comme substance présentant un potentiel modéré de risque pour l’environnement. Les effets potentiels et leurs manifestations éventuelles dans l’environnement n’ont pas été étudiés davantage en raison de la faible exposition à cette substance. Sur la base des modes d'utilisation actuels, il est peu probable que cette substance suscite des préoccupations l’environnement au Canada.
À la lumière des données examinées lors de la CRE, le Pigment Violet 1 et l’Acid Black 2 ont été classés comme ayant un faible potentiel d’exposition, mais aussi un potentiel de risque élevé, compte tenu de l’accord entre leur mode d’action réactive et leur rapport de toxicité élevés, qui, ensemble, laissent à penser que ces substances chimiques sont probablement très puissantes. À cause de leur potentiel de bioaccumulation, le Pigment Violet 1 et l’Acid Black 2 ont été classés comme présentant un potentiel élevé d’avoir des effets nocifs sur les réseaux trophiques aquatiques et terrestres. Nous avons classé le Pigment Violet 1 et l’Acid Black 2 comme présentant un potentiel modéré de risque pour l’environnement. Les effets potentiels et leurs manifestations éventuelles dans l’environnement n’ont pas été étudiés davantage en raison de la faible exposition à ces substances. Sur la base des modes d’utilisation actuels, il est peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
À la lumière des données examinées lors de la CRE, le Pigment Red 81 a été classé comme ayant un faible potentiel d’exposition, mais aussi un potentiel de danger élevé compte tenu de sa toxicité élevée et son potentiel élevé d’avoir des effets nocifs sur les réseaux trophiques aquatiques étant donné son potentiel de bioaccumulation. Le Pigment Red 81 a été classé comme ayant un potentiel modéré de poser un risque pour l’environnement. Les effets potentiels et leurs manifestations éventuelles dans l’environnement n’ont pas été étudiés davantage en raison de la faible exposition à cette substance. Sur la base des modes d’utilisation actuels, il est peu probable que cette substance suscite des préoccupations pour l’environnement au Canada
À la lumière des données examinées lors de la CRE, le no CAS 26694-69-9 et le Basic Red 29 ont été classé comme ayant un faible potentiel d’exposition. Toutefois, le no CAS 26694-69-9 et le Basic Red 29 ont été classé comme ayant respectivement un potentiel modéré et élevé de causer des effets nocifs dans les réseaux trophiques aquatiques étant donné leur potentiel de bioaccumulation. Ces deux substances ont été classées comme ayant un potentiel de danger élevé à cause de l’accord entre leur mode d’action réactive et leur rapport toxique élevés, qui, ensemble, laissent à penser que ces substances chimiques sont probablement très puissantes. Le no CAS 26694-69-9 et le Basic Red 29 sont classés comme ayant un potentiel modéré de poser un risque pour l’environnement. Cependant, le classement du risque pour l’environnement a été abaissé à faible après l’ajustement de la classification du risque fondée sur les quantités actuellement utilisées (cf. la sous-section 7.1.1 du document sur l’approche scientifique de la CRE [ECCC 2016a]). Les effets potentiels et leurs manifestations éventuelles dans l’environnement n’ont pas été étudiés davantage en raison de la faible exposition à cette substance. Sur la base des modes d’utilisation actuels, il est peu probable que cette substance suscite des préoccupations pour l’environnement au Canada.
6. Risque d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
On n’a pas retrouvé les substances du groupe des pigments et colorants dans un milieu environnemental au Canada ou ailleurs. Globalement, étant donné les faibles quantités commercialisées au Canada, leur très faible volatilité, l’hydrosolubilité faible ou très faible des pigments et de certains colorants, la dilution des substances colorantes dans les milieux aqueux et les taux prévisibles de suppression par les systèmes de traitement d’eau (surtout les pigments), l’exposition aux substances du groupe des pigments et colorants provenant des milieux de l’environnement devrait être minimale, voire inexistante.
Au Canada, les substances du groupe des pigments et colorants ne sont pas des additifs alimentaires approuvés, mais certaines pourraient être utilisées lors de la fabrication de matériaux d’emballage alimentaire. Toutefois, puisqu’il n’y a pas de contact direct avec les aliments emballés, nous ne prévoyons pas que les humains soient exposés par voie alimentaire aux substances du groupe communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, 2016-2017, sans référence).
Nous avons évalué l’exposition découlant de l’utilisation de produits de consommation. Les tableaux 6‑1 et 6‑2 présentent les estimations d’exposition occasionnée par l’utilisation qui se traduisent par les niveaux d’exposition potentielle les plus élevés à chaque substance par les voies orales et cutanées. Nous avons estimé les expositions potentielles en utilisant des hypothèses prudentes et les valeurs par défaut présentées à l’annexe A.
Substance |
Scénario |
Groupe d’âge |
Exposition systémique par événement (mg/kg p.c.) |
Exposition systémique quotidienne (mg/kg p.c./j) |
|---|---|---|---|---|
D&C Orange 5 |
Brillant à lèvres |
Enfant |
S.O. |
0,029 |
D&C Orange 5 |
Rouge à lèvres |
Adultes |
S.O. |
0,034 |
D&C Orange 5 |
Peinture faciale |
Tout-petits |
0,95 |
S.O. |
Pigment Violet 1 |
Crayons de cirea |
Bambins |
S.O. |
0,00076 |
Pigment Violet 1 |
Craiea |
Bambins |
S.O. |
0,000239 |
Pigment Red 81 |
Tampons encreurs pour décoration corporelle |
Bambins |
0,048 |
S.O. |
No CAS 26694‑69-9 |
Crayons de peinture |
Bambins |
0,419 |
0,021 |
Basic Red 29 |
Mâchonnement des tissus |
Nourrissons |
S.O. |
0,0000013 |
Abréviations : S.O. = sans objet.
a Nous avons utilisé la fraction bioaccessible mesurée de Basic Violet 10 dans le Pigment Violet 1 pour caractériser le risque potentiel pour la santé humaine de l’exposition au Pigment Violet 1 dans les crayons de cire (voir annexe A) comme démarche raffinée, alors que nous avons prudemment supposé (comme approximation au premier degré) que tout le Pigment Violet 1 présent dans la craie en tant que composant du Basic Violet 10 serait bioaccessible (bien que l’on prévoit que la bioaccessibilité du Basic Violet 10 soit plus basse que 100 % dans la craie).
Pour l’estimation des expositions potentielles à l’Acid Black 2 et au Basic Red 29, par voie cutanée, nous avons prudemment posé que celles-ci étaient équivalentes à l’absorption par le tractus gastro-intestinal. Selon les résultats de l’étude d’absorption cutanée réalisée par la Food and Drug Administration des États-Unis, l’absorption cutanée de le D&C Orange 5 se situait entre 0,06 % et 0,5 % (selon le véhicule). Dans cette évaluation préalable, nous avons utilisé 0,5 % pour estimer les expositions cutanées potentielles au D&C Orange 5. Nous n’avons pas relevé de données sur l’absorption cutanée pour le no CAS 26694-69-9. Toutefois, une étude par Gomma et coll. (2012) de l’écoulement à travers le derme a montré que l’absorption cutanée de colorants au xanthène d’une structure similaire (sous-saturée dans une solution de sel de phosphate tamponnée à pH 7,4) serait basse. Dans cette étude, la quantité cumulée de Basic Violet 10 qui avait percolé à travers un échantillon de peau complète (1164 µm) d’oreille de porc pendant 48 h était de 0,54 (± 0,17) g/cm2. De tous les colorants étudiés par Gomaa et coll., le Basic Violet 10 est celui dont la structure est la plus proche du no CAS 26694-69-9. Toutefois, l'utilisation d'une peau de porc de pleine épaisseur pourrait réduire l'absorption cutanée en raison de la longueur du trajet dans la peau. Lorsque de la peau humaine dermatomée (330 µm) a été utilisée, la quantité cumulée d'isothiocyanate de rhodamine B (no CAS 36877-69-7) percolée en 48 heures a été de 4,99µg/cm2. Cette méthode est considérée plus conservatrice que l'utilisation de peau porcine pleine épaisseur. Nous présumons que l’absorption cutanée du no CAS 26694-69-9 est similaire à celle du Basic Violet 10 et de l’isothiocyanate de rhodamine B et avons donc estimé que l’exposition cutanée se situerait entre 0,54 et 4,99 µg/cm2.
Bien que l’utilisation de certains produits d’art et d’artisanat pour enfant entraîne un contact de la peau avec Pigment Violet 1 et Pigment Red 81, nous ne prévoyons pas leur absorption cutanée, car ces pigments sont de grands complexes de poids moléculaire supérieur à 1000 g/mol. De plus, puisque ces pigments ne se dissolvent pas facilement dans l’eau et qu’en général ils sont conçus pour être insolubles dans la matrice du produit (Herbst et Hunger 2004), ils ne se dissoudront pas aisément dans la sueur et donc ne pourront pas traverser facilement la peau intacte (BfR 2007). Nous ne prévoyons donc pas d’exposition systémique au Pigment Violet 1 et au Pigment Red 81 par voie cutanée.
Substance |
Scénario |
Groupe d’âge |
Exposition systémique par événement (mg/kg p.c.)a |
Exposition systémique quotidienne (mg/kg p.c./j)a |
|---|---|---|---|---|
D&C Orange 5 |
maquillage pour le visage |
adultes |
S.O. |
0,0048 |
D&C Orange 5 |
peinture faciale |
bambins |
0,032 |
S.O. |
Acid Black 2 |
gel capillaire |
adultes |
S.O. |
0,0016 |
No CAS 26694-69-9 |
crayons de peinture |
bambins |
de 0,0017 à 0,016 |
de 0,0017 à 0,016 |
Basic Red 29 |
tissus, port de vêtements |
nourrissons |
S.O. |
0,0002 |
Basic Red 29 |
tissus, port de vêtements |
adultes |
S.O. |
0,00013 |
Abréviations : S.O. = sans objet.
a À des fins de prudence, nous avons posé que l’absorption cutanée à l’Acid Black 2 et au Basic Red 29 était équivalente à celle du tractus gastro-intestinal. Nous avons supposé que l’absorption cutanée de D&C Orange 5 était de 0,5 %. Nous avons supposé que l’absorption cutanée du no CAS 26694-69-9 se situait entre 0,54 et 4,99 µg/cm2.
L’utilisation de craies pour enfant contenant le Pigment Violet 1 peut occasionner son exposition par inhalation, mais nous considérons que les expositions potentielles par cette voie sont basses par rapport aux expositions orales.
Dans une divulgation faite en vertu du Règlement sur les cosmétiques, une encre à maquillage permanent et tatouage contenant 1 % à 3 % de D&C Orange 5 a été signalé à Santé Canada (courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2016, sans référence). Nous prenons note de l’existence d’une exposition systémique potentielle au D&C Orange 5 dans les encres de tatouage, mais elle n’a pas été quantifiée puisque l’exposition à cette substance découlant d’autres usages devrait être plus répandue parmi la population générale.
6.2 Évaluation des effets sur la santé
Il existe peu d’informations disponibles sur la toxicité des substances du groupe des pigments et colorants. Nous avons choisi des analogues structuraux pour faire la lecture croisée des dangers posés par le no CAS 26694-69-9 et l’Acid Black 2, et utilisé le composant colorant respectif du Pigment Violet 1 et du Pigment Red 81 pour nous éclairer la caractérisation des effets potentiels sur la santé.
6.2.1 Pigment Violet 1
Dans un essai de mutagénicité in vitro, Zeiger et coll. (1987) ont trouvé que le Pigment Violet 1 n’était pas mutagène avec ou sans activation métabolique. Nous avons réalisé une recherche de structures analogues pour lesquelles existaient des données sur la toxicité à dose répétée, dont la carcinogénicité, mais nous n’avons trouvé aucun analogue adéquat sur les plans des propriétés structurelles et physico-chimiques. Les informations disponibles indiquent que le Pigment Violet 1 peut se dissocier et libérer le Basic Violet 10 un de ces composants. Ceci est compatible avec le mode de fabrication de pigments complexes comme le Pigment Violet 1 (Herbst et Hunger 2004). De plus, des données du programme de toxicologie de l’université Duke confirment qu’une petite quantité de Basic Violet 10 pourrait être bioaccessible dans le tractus gastro-intestinal après ingestion d’un produit contenant du Pigment Violet 1. La note c de l’annexe A contient plus d’informations (communication personnelle du programme de toxicologie de l’université Duke au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2017, sans référence.) Ainsi, en absence de données sur les effets sur la santé propres au Pigment Violet 1, nous considérons que la toxicité du Basic Violet 10 est pertinente et nous l’avons utilisée pour éclairer la caractérisation des effets du Pigment Violet 1 sur la santé.
Le Groupe scientifique sur les additifs alimentaires, les arômes, les auxiliaires technologiques et les matériaux en contact avec les aliments de l’Autorité européenne de sécurité des aliments (EFSA 2005), la Food and Drug Administration aux États-Unis (Lipman 1995), le Centre international de recherche sur le cancer (CIRC), l’American Federal Color Additive Scientific Review Panel (Hart et coll. 1986) et le Comité scientifique de cosmétologie de la Commission européenne (SCC 1993) ont résumé dans leurs évaluations les informations sur les effets du Basic Violet 10.
Le Basic Violet 10 est très absorbé par le tractus gastro-intestinal et il est fortement métabolisé. On a trouvé que seulement 3 % à 5 % des doses administrées survivaient inchangées dans l’urine et les selles des chiens, chats et lapins (CIRC 1978).
Aucun effet cancérogène n’a été signalé dans les études d’exposition alimentaire chronique de rats et de chiens réalisées dans les années 1950 et 1960 et qui ont été résumées par Hart et coll. (1986). Toutefois, les résultats de trois études plus récentes sur la cancérogénicité causée par l’exposition orale des rongeurs, déposées à l’EPA des États-Unis mentionnent le potentiel cancérogène du Basic Violet 10 (90 à 92 % de pureté).
Dans la première étude qui s’étendant sur 29 mois, des rats CD (70/sexe/groupe) ont consommé dans leur diète du Basic Violet 10 à raison de 0 % ou 0,075 % (ce qui correspond à entre 43 et 56 mg/kg p.c./jour respectivement pour les mâles et les femelles, selon la consommation moyenne de la substance indiquée dans le rapport d’étude). Ils ont reçu du Basic Violet 10 pendant les 2 mois précédents l’accouplement et, donc, les rats y furent exposés in utero (Bio/dynamics Inc. 1981a,1981b, Hart et coll. 1986, EFSA 2005). On a observé (Bio/dynamics Inc. 1981a,1981b) chez les animaux des deux sexes, une baisse importante de la masse corporelle entre la 6e et la 38e semaine, une hausse de la consommation d’aliments et une augmentation de la masse absolue et relative des organes (glandes surrénales, thyroïdes, reins et foie). Une hausse importante des tumeurs des cellules folliculaires de la thyroïde chez les mâles traités (adénomes : 12/56 par rapport à 2/57 chez les témoins; carcinome : 5/56 par rapport à 1/57 chez les témoins) a été observée (Bio/dynamics Inc. 1981b, Hart et coll. 1986, EFSA 2005). Dans la deuxième étude (Bio/dynamics Inc. 1980a, 1981c, Hart et coll. 1996, EFSA 2005), des rats CD (70/sexe/groupe de traitement, 140/sexe pour les témoins) ont reçu des doses plus basses de Basic Violet 10 (0 %, 0,002 %, 0,005 % ou 0,02 %, soit 0, 1, 3 ou 11 mg/kg p.c./jour pour les mâles et 0, 1, 3 ou 16 mg/kg p.c./jour pour les femellesNote de bas de page 4), dans leur alimentation pendant 27 ou 29 mois (mâles et femelles respectivement). On n’a observé aucun changement histopathologique dans la thyroïde. On a observé une baisse du poids corporel chez les femelles ayant reçu des doses faibles et élevées, la hausse du poids des organes (thyroïde, foie, rein, rate et surrénales) et la hausse de la consommation alimentaire par les femelles ayant reçu des doses élevées, et une mortalité accrue des mâles ayant reçu une forte dose. En nous fondant sur la hausse de la mortalité des mâles et la hausse du poids des organes et de la consommation alimentaire chez les femelles aux doses d’essai les plus élevées, nous avons adopté pour en caractériser les risques posés par le Pigment Violet 1, une dose sans effet nocif observé (DSENO) de 3 mg/kg p.c./jour. Bio/dynamics Inc. (1980a, 1981c) a observé une hausse légère, mais significative, de l’incidence des astrocytomes dans le cerveau ou la moelle épinière des mâles ayant reçu de fortes doses (l’incidence était respectivement de 1, 1, 0 et 5 pour les témoins et les doses faible, moyenne et élevée) et de tumeurs à cellules granuleuses dans le cerveau des mâles ayant reçu des doses moyennes à élevées (l’incidence était respectivement de 0, 0, 2 et 2 pour les témoins et les doses faible, moyenne et élevée).
Dans le cadre de la troisième étude, des souris CD‑1 (60/sexe/groupe de traitement, 120/sexe pour les témoins) ont reçu dans leur alimentation du Basic Violet 10 (0 %, 0,005 %, 0,02 % ou 0,10 %, soit 0, 9, 33 ou 166 mg/kg p.c./jour pour les mâles et 0, 10, 40 ou 196 mg/kg p.c./jour pour les femellesNote de bas de page 5 ) pendant 22 et 25 mois pour les mâles et femelles, respectivement (Bio/dynamics Inc. 1980b, 1981d, Hart et coll. 1986, EFSA 2005). Les chercheurs ont observé une hausse du nombre total de tumeurs hépatocellulaires (adénomes et carcinomes) chez les deux sexes à toutes les doses et, chez les femelles seulement, une hausse dépendant de la dose des carcinomes hépatocellulaires (0/115, 2/60, 5/60 ou 14/60). La hausse des tumeurs hépatocellulaires chez les souris mâles ne devrait pas être significative étant donné l’absence d’une réponse en fonction de la dose, l’absence de toute histopathologie liée au traitement du foie ou de tout autre tissu, hormis l’augmentation de l’incidence de hépatocytomégalie chez les mâles ayant reçu une dose élevée (Bio/dynamics Inc.1980b, 1981d), et les incidences similaires de tumeurs hépatocellulaires observées dans les témoins anciens observés par d’autres laboratoires pendant une période de temps similaire (Lang 1995).
En outre, on n’a observé aucune hausse de l’incidence de néoplasie lors d’une étude limitée sur la peinture pour la peau, dans le cadre de laquelle des souris ICR furent exposées au Basic Violet 10 en raison de 9,3 mg/kg p.c./jourNote de bas de page 6 deux fois par semaine pendant 18 mois (Carson 1984; Hart et coll. 1986).
S’appuyant sur les études alimentaires susmentionnées qui indiquent une incidence accrue des tumeurs hépatiques chez les souris et des tumeurs thyroïdiennes chez les rats, la Food and Drug Administration des États-Unis considère que le Basic Violet 10 est un cancérigène voir voie orale chez les animaux (Lipman 1995). Le Comité scientifique de cosmétologie de la Commission européenne (SCC) a également jugé que cette substance était potentiellement préoccupante pour la santé en raison des preuves de sa carcinogénicité chez les souris (SCC 1993). La CIRC (1987) a classé le Basic Violet 10 dans le Groupe 3 (non classifiable au plan la carcinogénicité pour l’humain). Des études plus récentes ont remis en question la pertinence pour les humains de l’apparition de carcinomes hépatocellulaire chez les souris, notamment à cause de la rareté de ces carcinomes chez l’humain, en particulier de ceux induits par une substance chimique (Velázquez et coll. 1996, Carmichael et coll. 1997, EFSA 2011). Bien que la pertinence de la hausse des carcinomes hépatocellulaires dépendant de la dose, particulièrement en l’absence toute histopathologie hépatique associée au traitement soit incertaine (Bio/dynamics Inc. 1980b, 1981d; Hart et coll. 1986; EFSA 2005), on a observé à des doses plus basses des astrocytomes dans le cerveau et la moelle épinière des rats mâles (Bio/dynamics Inc. 1980a, 1981c). Ainsi, une limite inférieure de la dose repère (LIDR10) de 10,2 mg/kg p.c./jour a été calculée pour ce type de tumeur (courriel du Bureau de la science de la santé environnementale et de la recherche de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2017, sans référence).
Les résultats des études sur la génotoxicité du Basic Violet 10 sont mitigés. La mutagénicité observée dans certains tests d’Ames a été attribuée à la présence d’impureté dans les échantillons de l’essai (Hart et coll. 1986, EFSA 2005). De même, les résultats positifs pour la génotoxicité observée pour certaines épreuves d’aberration chromosomique et essais sur les dommages à l’ADN ont été attribués à des impuretés ou à la phototoxicité des couleurs (Hart et coll. 1986). Dans les essais in vivo (Tripathy et coll. (1995, cité par EFSA, 2005) ont observé chez la drosophile une hausse de la fréquence des taches sur les ailes et l’induction de mutations létales récessives liées au sexe et les ont interprétés comme indicative de la génotoxicité.
Aucun effet nocif sur le rendement de la reproduction des rats auxquels on avait administré du Basic Violet 10 dans leur diète n’a été signalé, pas plus que des anormalités des tissus mous des rats et lapins auxquels la substance d’essai (aucune dose mentionnée) a été administrée par gavage (Burnett et coll. 1974; Pierce et coll. 1974). De même, les deux études susmentionnées sur des rats n’ont révélé aucune toxicité pour le développement lorsque les rats parents furent alimentés avec du Basic Violet 10 à la hauteur de 0,075 % (correspondant à de 43 à 56 mg/kg p.c./jour) à partir d’une période de 2 mois avant l’accouplement jusqu’à la fin de la lactation (Bio/dynamics Inc. 1981b, 1981c). À des doses de 43 à 56 mg/kg p.c./jour, Bio/dynamics Inc (1981b) a observé une diminution de la taille des portées, mais seulement dans le cas d’une baisse de la masse corporelle des rats parents (Bio/dynamics Inc. 1981b).
6.2.2 Pigment Red 81 et no CAS 26694-69-9
À l’instar de la caractérisation des effets du Pigment Red 81 sur la santé, celle du Pigment Violet 1 est fondée sur un composant, alors que celle du no CAS 26694-69-9 est fondée sur un analogue structurel – dans les deux cas, le Basic Red 1. Lors d’un essai in vitro sur la mutagénicité bactérienne, Zeiger et coll. (1992) ont trouvé que le pigment rouge 81 n’était pas mutagène avec ou sans activation métabolique. Si toutefois le Pigment Red 81 se dissocie, il produit la même portion organique que le Basic Red 1. Or, des données du programme de toxicologie de l’université Duke ont confirmé qu’une petite quantité de Basic Red 1 serait bioaccessible dans le tractus gastro-intestinal après l’ingestion d’un produit contenant du Pigment Red 81 (communication personnelle du Programme de toxicologie de l’université Duke au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2017, sans référence). Ainsi, la portion cationique du colorant organique du Basic Red 1 est considérée être un composant du Pigment Red 81 et conséquemment, en absence de données spécifiques sur ce pigment en particulier, nous avons utilisé la toxicité du Basic Red 1 pour nous éclairer sur les effets potentiels du Pigment Red 81 sur la santé.
Nous n’avons pas relevé d’études sur les effets du no CAS 26694-69-9 sur la santé. Nous avons sélectionné le Basic Red 1 comme étant le meilleur analogue pour la comparaison des données sur le danger permettant une lecture croisée pertinente pour le no CAS 26694-69-9, en nous fondant sur sa structure chimique (OECD QSAR Toolbox 2016) ainsi que sur son adéquation du point de vue de ses propriétés physico-chimiques. Sur le plan de la structure, le Basic Red 1 est aussi plus proche du no CAS 26694-69-9 que le Basic Violet 10, l’un des analogues utilisés dans la partie de ce rapport portant sur l’évaluation de l’exposition par absorption cutanée, à cause de l’absence de données empiriques sur l’absorption cutanée à partir desquelles nous pourrions faire une lecture croisée basée sur le Basic Red 1.
Les essais de génotoxicité in vitro ont globalement trouvé que le Basic Red 1 était génotoxique. Bien qu’à l’instar du Pigment Red 81 (Zeiger et coll. 1992), les informations disponibles indiquent que le Basic Red 1 n’est pas mutagène, lors d’essais de mutation inverse sur les bactéries (Nestmann et coll. 1979; Matula et coll. 1982; Wuebbles et Felton 1985; Zeiger et coll. 1987; NTP 1989), on a trouvé qu’il était mutagène lors des essais sur des cellules de lymphome de souris sans activation métabolique (NTP 1989). On a trouvé un résultat positif pour les échanges de chromatides sœurs dans les cultures de cellules d’ovaire du hamster chinois sans activation métabolique, et des résultats variables pour les aberrations chromosomiques des mêmes cellules (Au et Hsu 1979; NTP 1989; Loveday et coll. 1990).
Le NTP (1989) a étudié la toxicité et la carcinogénicité potentielles du Basic Red 1 (pur à 97,4 %) sur des rats F344/N et des souris B6C3F1. Ces animaux ont reçu la substance d’essai dans leur diète pendant 14 jours, 13 semaines et 2 ans.Note de bas de page 7
Des rats (5/sexe/groupe) ont reçu 0, 310, 620, 1250, 2500 ou 5000 ppm (correspondant à 0, 37, 76, 150, 400 ou 750 mg/kg p.c./jour pour les mâles et 0, 47, 100, 209, 486 ou 909 mg/kg p.c./jour les femelles) de Basic Red 1 dans leur diète pendant 14 jours. On a trouvé une DSENO de 76 à 100 mg/kg p.c./jour et une dose minimale avec des effets nocifs observés (DMENO) de 150 à 209 mg/kg p.c./jour à partir de la baisse de poids corporel chez les deux sexes. À des doses plus élevées, on a aussi observé des mortalités, de la diarrhée, des poils ébouriffés, une baisse d’activité et une démarche non coordonnée. On a également noté une baisse de poids corporel aux doses d’essais les plus élevées chez les souris des deux sexes (5/sexe/groupe) ayant reçu pendant 14jours 0, 310, 620, 1250, 2500 or 5000 ppm de la substance dans leur diète (correspondant à 0, 48, 100, 199, 418 ou 870 mg/kg p.c./jour chez les mâles et 0, 66, 133, 263, 532 ou 1081 mg/kg p.c./jour chez les femelles). Aucun signe clinique spécifique à cette substance n’a été observé.
Lors d’une étude sur 13 semaines, des rats (10/sexe/groupe) ont reçu dans leur diète du Basic Red 1 à des doses de 0, 120, 250, 500, 1000 ou 2000 ppm (correspondant à 0, 9, 18, 40, 81 ou 190 mg/kg p.c./jour pour les mâles et 0, 14, 28, 60, 123 or 268 mg/kg p.c./jour pour les femelles). On a trouvé une DSENO de 18 à 28 mg/kg p.c./jour et une DMENO de 40 à 60 mg/kg p.c./jour sur la base d’une baisse du poids corporel des mâles et une hausse dépendante dans la dose pour l’incidence et la gravité de l’atrophie de la moelle osseuse chez les deux sexes. Pendant 13 semaines, on a aussi administré à des souris (10/sexe/groupe) du Basic Red 1 dans leur diète à des doses de 0, 500, 1000, 2000, 4000 ou 8000 ppm (soit 0, 68, 135, 270, 600 ou 1460 mg/kg p.c./jour pour les mâles et 0, 88, 182, 375, 775 ou 1758 mg/kg p.c./jour pour les femelles). Une baisse du poids corporel a été observée chez les femelles à une DMENO de 375 mg/kg p.c./jour. À des doses plus élevées, on a observé chez les souris mâles une baisse de poids corporel, une vacuolisation cytoplasmique minimale à modérée des hépatocytes et la mortalité (1/10).
Lors d’une expérience s’étendant sur deux ans, des rats (50/sexe/groupe) ont reçu dans leur diète 0, 120 ou 250 ppm de Basic Red 1 (soit 0, 5 ou 10 mg/kg p.c./jour pour les mâles et 0, 5 ou 12 mg/kg p.c./jour pour les femelles) et on a observé, à forte dose, une hausse marginale, mais significative, de l’hyperplasie focale de de la médulla surrénale chez femelles (8 %, 12 %, 16 %). À haute dose, on a aussi observé une hausse de l’incidence des lésions néoplasiques dans les glandes surrénales des femelles (6 %, 6 %, 16 %; valeurs historiques des témoins : 6 % +/- 5 %) et de phéochromocytomes malins (combinés; 6 %, 6 %, 20 %) et de kératoacanthomes chez les mâles (2 %, 4 %, 16 %; valeurs historiques des témoins : 3 % +/- 5 %). Il n’est pas clair que ces tumeurs soient pertinentes. En effet, dans l’étude de 13 semaines susmentionnée, on n’avait pas spécifié que l’épithélium et les surrénales étaient les tissus cibles et les tumeurs n’ont été observées que chez un seul des sexes. Étant donné ces effets, nous avons établi une DSENO de 5 mg/kg p.c./jour et une DMENO de 10 à 12 mg/kg p.c./jour.
Dans le cadre d’un essai de 103 semaines, on a ajouté 0, 1000 ou 2000 ppm de Basic Red 1 (0, 210 ou 440 mg/kg p.c./jour) à la diète des souris mâles, et 0, 500 ou 1000 ppm de cette même substance (0, 125 or 250 mg/kg p.c./jour) à celle des femelles (effectif total : 50/sexe/groupe). Une DMENO de 125 mg/kg p.c./jour a été déterminée, en se fondant sur la baisse de gain de poids des femelles après 35 semaines. Aucun effet néoplasique n’a été observé chez les souries mâles ou femelles.
Le NTP (1989) signale que l’on n’a pas trouvé de preuve que le Basic Red 1 était cancérogène pour les souris et des preuves ambiguës de cancérogénicité chez les rats des deux sexes (hausse de l’incidence de lésions néoplasiques dans les surrénales des femelles et de kératoacanthomes chez les mâles). De même, dans une l’évaluation antérieure, le CIRC (1987) a classé le Basic Red 1 dans son groupe 3, c’est-à-dire non classifiable sur le plan de sa cancérogénicité chez l’humain.
6.2.3 Acid Black 2
Selon nos informations limitées, il n’y a pas de preuve que l’Acid Black 2 serait génotoxique ou cancérigène (Allmark et coll. 1957; Au et Hsu 1979; Kubinski et coll. 1981; CEC 1988; Yamaguchi 1988; BIBRA 1993). L’absence de génotoxicité observée est davantage appuyée par l’absence de génotoxicité observée dans les études (ETAD 1988, SNBL 2011a, 2011b, 2011c, 2011d; Zeiger et coll. 1988) sur son analogue structurel le Solvent Black 5 (no CAS 11099-03-9). Bien qu'ils appartiennent à des catégories d'application différentes, tous deux sont des nigrosines : l’Acid Black 2 est la forme hydrosoluble et le Solvent Black sa forme soluble dans l’alcool.
Nous avons retrouvé une étude d’administration de doses répétées de l’Acid Black 2, mais nous ne l’avons pas retenue pour cette évaluation, car elle ne présente pas de renseignements sur la pureté, comportait peu d’animaux et signalait une forte mortalité pour tous les groupes (Allmark et coll. 1957). Nous avons donc considéré une étude combinée de dose répétée de toxicité pour la reproduction et le développement du Solvent Black 5 (analogue structurel), que nous décrivons plus bas. Aucune étude à dose répétée n’a été trouvée.
Lors de l’étude combinée à dose répétée avec un essai de dépistage de la toxicité pour la reproduction ou le développement, on a administré par gavage pendant 42 jours, 0, 40, 200 ou 1000 mg/kg p.c./jour de Solvent Black 5 (pureté inconnue) à des rats CD (12/sexe/groupe). On a traité les mâles pendant 14 jours avant l’accouplement, pendant la période d’accouplement jusqu’à 1 jour avant la nécropsie et les femelles 14 jours avant l’accouplement, pendant la période d’accouplement jusqu’au quatrième jour de lactation. Des groupes satellites formés de rats (5/sexe) traités avec l’excipient et de groupes ayant reçu des doses élevées furent soumis à une période de récupération de 14 jours. La progéniture a été sacrifiée quatre jours après la naissance. Aucun changement découlant du traitement chez les parents ou leur progéniture n’a été observé et la plus haute dose d’essai (1000 mg/kg p.c./jour) a été choisie pour la caractérisation du risque (SNBL 2011e, 2011f).
6.2.4 D&C Orange 5
Dans le cadre d’une étude, on a exposé trois générations de rats (10 mâles et 20 femelles/groupe) à 5, 50, 150 ou 300 mg/kg p.c./jour de D&C Orange 5 (pureté de 93 %) dans leur diète. L’étude comportait quatre groupes de contrôles parallèles (un par dose). On a administré le traitement à des rats reproducteurs deux semaines avant l’accouplement. Ceux-ci se sont accouplés deux fois pour produire les générations F1a et F1b et ont été sacrifiés après le sevrage des rats F1b. Les rats F1a ont été sacrifiés 21 jours après la naissance, à la fin de la période de lactation, alors que les rats F1b se sont accouplés pour produire les générations F2a, F2b et F2c. Après leur sevrage, les rats F2a ont été sacrifiés et les rats F2b se sont accouplés pour produire la génération F3a. Après le troisième accouplement, la moitié des mères F1b furent sacrifiées au 19e jour de gestation et les autres mères donnèrent naissance à leur progéniture, et furent ensuite sacrifiées avec leur progéniture après le sevrage de ceux‑ci. Les rats F3a furent aussi sacrifiés après leur sevrage. En l’absence d’effets cohérents dépendant de la dose, la dose essai la plus élevée de 300 mg/kg p.c./jour a été choisie pour la caractérisation de la toxicité systémique pour la reproduction et le développement (CTFA 1972a, Rapport d’étude 1972).
Deux autres études plus courtes ont été relevées (CTFA 1972b, 1972c), mais nous considérons qu’elles sont de faible qualité (p. ex., nombre peu élevé d’animaux, peu de détails, plusieurs groupes de témoins parallèles et absence de statistiques) et donc nous ne les considérons pas davantage.
Globalement, le D&C Orange 5 n’est pas mutagène dans les essais in vitro sur les bactéries (Brown et coll. 1979, Muzall et Cook 1979, Green et Pastewka 1979, 1980). De même, on n’a pas observé de hausse de l’incidence de néoplasie dans une étude limitée d’une durée de 18 mois sur la peinture pour la peau, dans le cadre de laquelle des souris ICR ont été exposées deux fois par semaine à 9,2 mg/kg p.c./jourNote de bas de page 8 de D&C Orange 5 (Carson 1984). Se fondant sur des études chroniques non publiées sur des rats et des souris (Lipman 1995), la Food and Drug administration des États-Unis considère que le D&C Orange 5 n’est pas cancérigène.
6.2.5 Basic Red 29
On considère que généralement la carcinogénicité et la génotoxicité sont les effets critiques potentiellement préoccupants des substances azoïques aromatiques comme le Basic Red 29 (Environnement Canada et Santé Canada 2013). Un des mécanismes principaux de la toxicité des substances azoïques aromatiques est la rupture réductrice des liens azoïques et la libération subséquente d’amines aromatiques libres. Ces amines aromatiques peuvent être converties en composés intermédiaires électrophiles réactifs par oxydation métabolique (Environnement Canada et Santé Canada 2013).
Bien qu’aucune donnée d’essais in vivo ou in vitro ne suggère que le Basic Red 29 subit une brisure du lien azoïque, nous considérons qu’un tel potentiel existe et que cette possibilité serait cohérente avec la démarche suivie lors de l’Évaluation préalable de certains colorants azoïques basiques (ECCC et SC 2016) et l’ensemble de connaissances disponibles pour la majorité des substances aromatiques azoïques en général (Environnement Canada et Santé Canada 2013). Nous n’avons pas relevé de données sur le danger pour les métabolites azoïques prévisibles du Basic Red 29 — c.-à-d. la 1-méthyl-2-phényl-1H-indol-3-amine (no CAS non trouvé) et le chlorure de 2-amino-3-méthyl-1,3-thiazol-3-ium (no CAS non trouvé) , ni pour les analogues du métabolite thiazolique (c.-à-d. les nos CAS 56010-23-2, 6149-13-9 ou 652152-19-7), ni pour le no CAS 23747-09-3, un analogue du métabolite indolique. Or, il n’existe pas d’indication des effets préoccupants, comme une catégorisations par un organisme national ou international de la cancérogénicité ou de la génotoxicité des produits de la brisure réductive du lien azoïque. En outre, le Basic Red 29 n’est pas mutagène pour les souches TA 98 et TA 100 de Salmonella typhimurium dans des conditions réductives (Cameron et coll. 1987).
Notre base de données sur les effets du Basic Red 29 sur la santé est limitée à différentes études de mutagénicité in vitro (Cameron et coll. 1985, 1987). L’essai d’Ames du Basic Red 29 a montré qu’il était mutagène pour la souche TA 1537 de Salmonella typhimurium, sans ou avec activation métabolique (fraction S9 du hamster ou du rat), mais n’était pas mutagène pour les souches TA1535, TA 1538, TA98 et TA100 de Salmonella typhimurium sans ou avec activation métabolique (fraction S9 du hamster ou du rat). Cameron et coll. (1985) ont obtenu des résultats ambigus lors d’un essai sur les lymphomes de souris sans ou avec activité métabolique. Bien que ces essais aient indiqué que le Basic Red 29 puisse être mutagène, en contrepartie, la substance n’était pure qu’à 21 % et donc un ou plusieurs contaminants auraient pu causer la réponse positive (toutefois, les contaminants n’ont pas été identifiés). Nous avons utilisé les modèles (Q)SAR pour compléter les résultats empiriques in vitro sur la génotoxicité et leurs prédictions pour ce paramètre ont été interprétées comme étant négatives ou ambiguës (Derek Nexus 2016, Leadscope Model Applier 2016; TIMES 2016). Globalement, en nous fondant sur les renseignements disponibles, nous considérons que le Basic Red 29 n’est pas génotoxique.
Puisqu’aucune étude sur la toxicité du Basic Red 29 n’a été trouvée et que, selon la documentation scientifique, les composés parents de certains colorants azoïques basiques sont systématiquement absorbés avant la cassure du lien azoïque (ECCC et SC 2016), nous avons aussi considéré les analogues structurels du Basic Red 29, nous n’avons toutefois pas relevé de données empiriques adéquates sur le danger.
6.3 Caractérisation des risques pour la santé humaine
On retrouve le Pigment Violet 1 dans un petit nombre de produits de consommation. Nous avons utilisé le Basic Violet 10, le composant colorant du Pigment Violet 1, pour éclairer la caractérisation des effets du Pigment Violet 1 sur la santé. L’effet critique sur la santé pour la caractérisation du risque est la hausse petite, mais significative de l’incidence des astrocytomes dans le cerveau ou la moelle épinière des rats mâles (Bio/dynamics Inc. 1980a, 1981c). Nous avons donc dérivé une limite de dose repère estimée de 10 % (LDR10) pour les astrocytomes dans le cerveau et la moelle épinière des rats mâles. Ce point de départ protège de la hausse de l’incidence des tumeurs hépatiques chez les souris et les tumeurs thyroïdiennes chez les rats. Le tableau 6‑3 donne les estimations pertinentes pour l’exposition au Pigment Violet 1, les niveaux d’effets critiques pour le Basic Violet 10 et les marges d’exposition résultantes.
Scénario d’exposition |
Exposition systémique |
Niveau d’effet critique (mg/kg pc/jour)a |
Paramètre d’effet critique pour la santé a |
Marge d’expo- sition |
|---|---|---|---|---|
Crayons de cire (quotidienne, orale, bambin) |
0,00076 mg/kg p.c./j |
LDR10 = 10,2 |
Astrocytomes dans le cerveau et la moelle épinière chez le rat mâle |
13 400 |
Craie (quotidienne, orale, bambin) |
0,000239 mg/kg p.c./j |
LDR10 = 10,2 |
Astrocytomes du cerveau et de la moelle épinière chez le rat mâle |
42 700 |
Crayons de cire (quotidienne, orale, bambin) |
0,00076 mg/kg p.c./j |
DSENO = 3 |
Hausse de la mortalité chez les rats mâles et hausse du poids des organes et de la consommation chez les femelles de 11 et 16 mg/kg p.c./j respectivement |
3 950 |
Craie (quotidienne, oral, bambin) |
0,000239 mg/kg p.c./j |
DSENO = 3 |
Hausse de la mortalité chez les rats mâles et hausse du poids des organes et de la consommation chez les femelles de 11 et 16 mg/kg p.c./j respectivement |
12 500 |
a Basé sur les effets du composant colorant du violet basique 1 sur la santé.
Comme l’indique le tableau 6-3, la comparaison des expositions estimées au Pigment Violet 1 avec la gamme des niveaux d’effets critiques produit des marges d’exposition entre 3 950 et 42 700. Ces marges d’exposition sont considérées être adéquates pour compenser les incertitudes dans les bases de données sur les effets de l’exposition sur la santé.
La caractérisation des autres substances du groupe des pigments et colorants ne repose que sur des effets non cancéreux. Nous avons choisi le Basic Red 1 comme étant l’analogue le plus adéquat assorti de données sur le danger pour faire une lecture croisée de la substance no CAS 26694-69-9 et nous avons utilisé sa toxicité pour nous informer des effets possibles du Pigment Red 81 sur la santé, puisque l’on considère que la partie colorante cationique et organique du Basic Red 1 est un composant du Pigment Red 81. De même, étant donné le peu de données empiriques, il n’y a aucune preuve indiquant que l’Acid Black 2, son analogue structural le Solvent Black 5, ou le D&C Orange 5 seraient génotoxiques ou cancérigènes.
Le tableau 6‑3 donne les estimations pertinentes pour l’exposition au pigment violet 81, le no CAS 26694-69-9, l’Acid Black 2 et le D&C Orange 5, ainsi que les marges d’exposition résultantes.
Substance |
Scénario d’exposition | Exposition systémique | Niveau d’effet critique |
Marge d’expo-sition |
|---|---|---|---|---|
Pigment Red 81 |
Tampons encreurs pour décoration corporelle (par événement, orale, bambin) |
0,048 mg/kg p.c. |
DSENO = 76 mg/kg p.c./j basée sur la baisse de masse corporelle de rats de 150-209 mg/kg p.c./j pour les deux sexes a |
1 583 |
No CAS 26694-69-9 |
Stylo à peinture (par événement, orale, bambin) |
0,419 mg/kg p.c. |
DSENO = 76 mg/kg p.c./j basée sur la baisse de masse corporelle de rats de 150-209 mg/kg p.c./j pour les deux sexes a |
181 |
No CAS 26694-69-9 |
Stylo à peinture (quotidienne, orale, bambin) |
21 mg/kg p.c. /j |
DSENO = 5 mg/kg p.c./j basée sur la hausse de l’hyperplasie focale de la médulla surrénale des rats femelles et les lésions néoplasiques des surrénales des rats femelles et les kératoacanthomes chez les rats mâles à 10-12 mg/kg p.c./j a |
238 |
No CAS 26694-69-9 |
Stylos à peinture (par événement, cutanée, bambin) |
0,0017-0,016 mg/kg p.c. |
DSENO = 76 mg/kg p.c./j basée sur la baisse de masse corporelle de rats de 150-209 mg/kg p.c./j pour les deux sexes a |
4750 – 45 000 |
No CAS 26694-69-9 |
Crayons de peinture (quotidienne, cutanée, bambin) |
0,0017 - 0,016 mg/kg p.c./j |
DSENO = 5 mg/kg p.c./j basée sur la hausse de l’hyperplasie focale de la médulla surrénale des rats femelles et les lésions néoplasiques des surrénales des rats femelles et les kératoacanthomes chez les rats mâles à 10-12 mg/kg p.c./j a |
313 – 2941 |
Acid Black 2 |
Gel capillaire (quotidienne, cutanée, adulte) |
0,0016 mg/kg p.c./j |
Plus haute dose d’essai (1000 mg/kg p.c./j) dans une étude de dépistage de 42 jours sur l’effet de à dose combinée répétée sur la reproduction et le développement b |
625 000 |
D&C Orange 5 |
Brillant à lèvres (quotidienne, orale, enfant) |
0,029 mg/kg p.c./j |
Plus haute dose d’essai (300 mg/kg p.c./j) dans une étude sur trois générations de rats |
10 000 |
D&C Orange 5 |
Rouge à lèvres (quotidienne, orale, adulte) |
0,034 mg/kg p.c./j |
Plus haute dose d’essai (300 mg/kg p.c./j) dans une étude sur trois générations de rats |
8 824 |
D&C Orange 5 |
Maquillage pour le visage (quotidienne, cutanée, adulte) |
0,0048 mg/kg p.c./j |
Plus haute dose d’essai (300 mg/kg p.c./j) dans une étude sur trois générations de rats |
63 000 |
D&C Orange 5 |
Peinture pour le visage (par événement, orale, bambin) |
0,95 mg/kg p.c. |
Plus haute dose d’essai (300 mg/kg p.c./j) dans une étude sur trois générations de rats |
316 |
D&C Orange 5 |
Peinture pour le visage (par événement, cutanée, bambin) |
0,032 mg/kg p.c. |
Plus haute dose d’essai (300 mg/kg p.c./j) dans une étude sur trois générations de rats |
9 375 |
a Basée sur les effets sur la santé du composant colorant ou l’analogue Basic Red 1.
b Basée sur les effets sur la santé de l’analogue, le Solvent Black 5.
Comme le montre le tableau 6‑4, la comparaison entre les expositions estimées au Pigment Red 81 et l’Acid Black 2, dans la gamme des niveaux des effets critiques donne des marges d’exposition respectives de 1 583 et 625 000. Le tableau montre aussi que la comparaison de l’estimation des expositions au no CAS 26694-69-9 et à le D&C Orange 5 avec la gamme des niveaux d’effets critiques donne des marges d’exposition respectives de 181 à 45 000 et de 316 à 63 000. Ces marges d’exposition sont considérées être adéquates pour compenser les incertitudes dans les bases de données sur les effets sanitaires de l’exposition.
Dans le cas du Basic Red 29, les données empiriques spécifiques sur le danger manquaient et nous n’avons trouvé aucun analogue structural adéquat à propos duquel existeraient des données sur le danger. La plus forte exposition au Basic Red 29 trouvée était de 0,0002 mg/kg p.c./jour (0,2 µg/kg p.c./jour) pour des bébés, découlant de l’exposition cutanée journalière à des tissus. Étant donné le manque d’information sur le danger et les faibles estimations d’exposition, nous avons jugé qu’une démarche basée sur le seuil de préoccupation toxicologique (SPD) était pertinente et, ainsi, nous l’avons adoptée (Santé Canada 2016). Nous avons fixé un seuil de préoccupation toxicologique de 0,0015 mg/kg p.c./jour, en nous fondant sur la structure chimique du Basic Red 29, une substance de la classe structurelle III de Cramer (OCDE, boîte à outils QSAR Toolbox 2016) et sa génotoxicité globalement négative. Ainsi, puisque l’Exposition était inférieure à la valeur du SPD, le Basic Red 29 n’est pas été considéré être préoccupant pour la santé humaine, au niveau actuel d’exposition.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Le tableau suivant présente les plus importantes sources d’incertitude.
Source clé d’incertitude |
Effet |
|---|---|
Il existe peu de données physicochimiques empiriques pour toutes les substances. |
+/- |
Les expositions au Pigment Violet 1 par voie orale qui ont été estimées à partir de l’ingestion accidentelle de crayons de cire par des bambins, à partir de la concentration moyenne mesurée du colorant Basic Violet 10 extrait de différentes fournitures artistiques. De manière prudente, nous avons supposé que l’exposition par voie orale au Pigment Violet 1 et au Pigment Red 81 lors de l’ingestion accidentelle d’autres fournitures artistiques se traduisait par une bioaccessibilité de 100 % du composant colorant, bien que l’on puisse s’attendre à ce la bioaccessibilité des composants colorants de ces pigments soit beaucoup plus basse. |
+ |
L’estimation de l’exposition cutanée au no CAS 26694-69-9 fondée sur les données d’absorption cutanée des substances analogues, le Basic Violet 10 et l’isothiocyanate de rhodamine B est incertaine. Toutefois, on peut considérer que l’exposition estimée est prudente, puisque nous avons utilisé la quantité cumulée de Basic Violet 10 et d’isothiocyanate de rhodamine B ayant traversé la peau pendant 48 h pour estimer l’exposition systématique par la peinture, laquelle demeure moins longtemps sur la peau. |
+/- |
Il existe peu ou pas du tout de données empiriques sur les dangers occasionnés par le Pigment Violet 1, le Pigment Red 81, le no CAS 26694-69-9, l’Acid Black 2 et le Basic Red 29. |
+/- |
Pour les analogues structuraux trouvés, nous n’avons pas de base complète de données couvrant toutes les durées d’exposition et voies d’expositions pertinentes (p. ex., aucune étude à court terme de l’exposition cutanée au Basic Red 1 et aucune étude de l’exposition cutanée chronique au Solvent Black 5). |
+/- |
Nous n’avons trouvé aucun analogue adéquat du Basic Red 29 ayant des données empiriques sur le danger. |
- |
L’utilisation des informations toxicologiques disponibles sur les analogues pour caractériser le risque du no CAS 26694-69-9 et de l’Acid Black 2 pour la santé humaine est entachée d’incertitude. |
+/- |
+ : incertitude ayant le potentiel de surestimer l’exposition ou le risque
- : incertitude ayant le potentiel de sous-estimer l’exposition ou le risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le D&C Orange 5, Pigment Violet 1, l’Acid Black 2, Pigment Red 81, no CAS 26694-69-9, et le Basic Red 29 ont un faible risque d’effets nocifs sur les organismes et sur l’intégrité globale de l’environnement. Il est conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le no CAS 26694-69-9, et le Basic Red 29 ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le no CAS 26694-69-9, et le Basic Red 29 ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE , car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que le D&C Orange 5, le Pigment Violet 1, l’Acid Black 2, le Pigment Red 81, le no CAS 26694-69-9, et le Basic Red 29 ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Allmark MG, Mannell WA et Grice HC. 1957. « Chronic toxicity studies on food colours, part III: observations on the toxicity of malachite green, new coccine and nigrosine in rats ». J Pharm Pharmacol. vol. 9, no 9, p. 622-628. (disponible en anglais seulement)
Ash M, Ash I. c2013a. Handbook of paper and pulp chemicals. Synapse Information Resources, Inc.
Ash M, Ash I. c2013b. Handbook of textile processing chemicals. Synapse Information Resources, Inc. (disponible en anglais seulement)
Au W et Hsu TC. 1979. « Studies on the clastogenic effects of biologic stains and dyes ». Environ Mutagen. vol. 1, no 1, p. 27-35. (disponible en anglais seulement)
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données dans l’Internet]. [Modifié le 20 jan 2017]. Ottawa (Ontario), gouvernement du Canada. [Consulté le 21 avril 2017].
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifiée le 10 août 2016]. Ottawa (Ontario), gouvernement du Canada. [Consultée le 21 avril 2017].
[BfR] Institut fédéral allemand d’évaluation des risques (Allemagne). 2007. Introduction to the problems surrounding garment textiles. BfR Information No 018/2007, 1er juin 2007. Disponible sur demande. (disponible en anglais seulement)
Bibra [base de données]. 1993. Toxicity Profile: Nigrosine. First edition. TNO BIBRA International Ltd. [consulté le 21 déc 2011]. (disponible en anglais seulement)
Bio/dynamics Inc. 1980a. A long-term toxicity/carcinogenicity study of D&C Red #19 in rats. Étude no 1100-26834. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bio/dynamics Inc. 1980b. A long-term feeding study of D&C Red #19 in mice. Étude no 1100-26836. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bio/dynamics Inc. 1981a. Long-term oral toxicity/carcinogenicity study of 0.075% D&C Red #19 in rats. Étude no 1100-26835. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bio/dynamics Inc. 1981b. Long-term oral toxicity/carcinogenicity study of 0.075% D&C Red #19 in rats. Volume 1. Projet no 78-2243. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bio/dynamics Inc. 1981c. Long-term oral toxicity/carcinogenicity study of D&C Red #19 in rats. Volume 1. projet no 77-1880. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bio/dynamics Inc. 1981d. A long-term feeding study of D&C Red #19 in mice. Volume 1. Projet no 77‑1881. East Millstone (New Jersey), Bio/dynamics. (disponible en anglais seulement)
Bremmer HJ et van Veen MP. 2002. Children’s toys fact sheet to assess the risk for the consumer. Rapport no 612810012/2002 de l’institut pour la santé publique et l’environnement des Pays-Bas[PDF]. (disponible en anglais seulement)
Bremmer HJ, Prudhomme de Lodder LCH et van Engelen JGM. 2006. Cosmetics fact sheet. Rapport no 320104001/2006 de l’institut pour la santé publique et l’environnement des Pays-Bas [PDF]. (disponible en anglais seulement)
Brown JP, Dietrich PS et Bakner CM. 1979. « Mutagenicity testing of some drug and cosmetic dye lakes with the Salmonella/mammalian microsome assay ». Mutat Res. vol. 66, no 2, p. 181-185. (disponible en anglais seulement)
Burnett CM, Agerborg, HPK Jr, Birzelleca JF, Eagle E, Abert AG, Pierce EC, Kirschman JC et Scala RA. 1974. « Teratogenic studies with certified colors in rat and rabbits ». Toxicol Appl Pharmacol. vol. 29, no 1, p. 121. (disponible en anglais seulement)
Cameo Chemicals [base de données dans l’Internet]. 2017a. Version 2.7. Washington (DC): National Oceanic and Atmospheric Administration des États-Unis. [modifié en sept 2016; consulté le 23 mars 2017]. (disponible en anglais seulement)
Cameo Chemicals [base de données dans l’Internet]. 2017b. Version 2.7. Washington (DC): National Oceanic and Atmospheric Administration des États-Unis. [modifié en sept 2016; consulté le 23 mars 2017]. (disponible en anglais seulement)
Cameron TP, Hughes TJ, Kirby PE, Fung VA et Dunkel VC. 1987. « Mutagenic activity of 27 dyes and related chemicals in the Salmonella/microsome and mouse lymphoma TK +/- assays ». Mutat Res. vol. 189, no 3, p. 223-261. (disponible en anglais seulement)
Cameron TP, Hughes TJ, Kirby PE, Palmer KA, Fung VA et Dunkel VC. 1985. « Mutagenic activity of 5 thiazole compounds in the Salmonella/microsome and mouse lymphoma TK+/- assays ». Mutat Res. vol. 155, no 1-2, p. 17-25. (disponible en anglais seulement)
Canada. [1978]. Règlement sur les aliments et drogues C.R.C., ch. 870, par. C.01.040.2.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999) L.C. 1999, ch.33. Gazette du Canada, partie III, vol. 22, no 3.
Canada, ministère de L’Environnement. 2012. « Loi canadienne sur la protection de l’environnement (1999) - Avis concernant certaines substances de la Liste intérieure », Gazette du Canada, partie I, vol. 146, no 48, supplément.
Carmichael NG, Enzmann H, Pate I et Waechter F. 1997. « The significance of mouse liver tumor formation for carcinogenic risk assessment: results and conclusions from a survey of ten years of testing by the agrochemical industry ». Environ Health Perspect. vol. 105, no 11, p. 1196-1203. (disponible en anglais seulement)
Carson S. 1984. « Skin painting studies in mice with 14 FD&C and D&C colors: FD&C Blue No. 1, Red No. 3, and Yellow No. 5, D&C Red No. 7, Red No. 9. Red No. 10, Red No. 19, Red No. 21, Red No. 27, Red No. 31, Red No. 36, Orange No. 5, Orange No. 10, and Orange No. 17 ». J Toxicol Cutaneous Ocul Toxicol. vol. 3, no 4, p. 357-370. (disponible en anglais seulement)
Chemicalland21. 2016. Rhodamine Blue. [consulté le 23 Mar 2016]. (disponible en anglais seulement)
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987. « Agents classified by the IARC monographs », vol. 1 - 116. IARC Monogr Eval Carcinog Risks Hum. (disponible en anglais seulement)
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Man. 1978. Some aromatic amines and related nitro compounds: hair dyes, colouring agents and miscellaneous industrial chemicals [PDF]. IARC Monogr Eval Carcinog Risks Hum, vol. 16. (disponible en anglais seulement)
[ConsExpo] Consumer Exposure Model [Internet]. 2006. Version 4.1. Bilthoven (Pays-Bas): Rijksinstituut voor Volksgezondheid en Milieu [Institut de santé publique et d’environnement des Pays-Bas]. (disponible en anglais seulement)
[CPSC] Consumer Product Safety Commission (États-Unis). 1994. Brief description of the CPSC staff hazard assessment procedure for lead in crayons. Consumer Product Safety Commission des États-Unis. (disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1972a. D&C Orange No. 5: Results of inclusion in the diet of rats for three generations. Rapport non publié déposé à l’USFDA (Washington, DC). Washington (DC): Cosmetic, Toiletry and Fragrance Association, Inter-Industry Color Committee. p. 17325-17455. Rapport no CMF000009. [Accès restreint]. (disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1972b. Safety evaluation of D&C Orange No. 5 in a teratology study in the rat. Rapport non publié déposé à l’USFDA (Washington, DC). Cosmetic, Toiletry and Fragrance Association, Inter-Industry Color Committee. p. 13525-13555. Rapport no CMF000009. [Accès restreint]. (disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1972c. Safety evaluation of D&C Orange No. 5 in a teratology study in the rabbit. Rapport non publié déposé à l’USFDA (Washington, DC). Cosmetic, Toiletry and Fragrance Association, Inter-Industry Color Committee. p. 13556-13577. Rapport no CMF000009. [Accès restreint]. (disponible en anglais seulement)
Derek Nexus [module de la prédiction de la toxicité]. 2016. Ver. 5.0.2. Leeds (Royaume-Uni): Lhasa Limited. [Accès restreint]. (disponible en anglais seulement)
Dionisio KL, Frame AM, Goldsmith MR, Wambaugh JF, Liddell A, Cathey T, Smith D, Vail J, Ernstoff AS, Fantke P, Jolliet O et Judson RS 2015. « Exploring consumer exposure pathways and patterns of use for chemicals in the environment ». Toxicol Rep. vol. 2, p. 228-237. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ontario): gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Gatineau (Québec). Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Québec). Disponible auprès de substances@ec.gc.ca. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016c. Data collected from a targeted information gathering initiative for assessments under the Chemicals Management Plan (juin 2016). Données produites par ECCC et Santé Canada Programme des substances existantes. (disponible en anglais seulement)
[ECCC et SC] Environnement et Changement climatique Canada et Santé Canada. [modifié le 12 mars 2017]. Catégorisation de substances chimiques. Ottawa (Ontario). Gouvernement du Canada. [consulté le 26 avril 2017].
[ECCC et SC] Environnement et Changement climatique Canada et Santé Canada. 2016. Évaluation préalable. Groupe des substances azoïques aromatiques et à base de benzidine. Certains colorants basiques azoïques dispersés [PDF].
[ECCC et SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Ottawa (Ontario).
[ECCC et SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ontario): gouvernement du Canada.
[EFSA] Autorité européenne de sécurité des aliments. 2005. « Review of the toxicology of a number of dyes illegally present in food in the EU. Question number EFSA-2005-082 ». EFSA Jour., vol. 263. 71 p. (disponible en anglais seulement)
[EFSA] Autorité européenne de sécurité des aliments. 2011. « Statement of EFSA on the scientific evaluation of two studies related to the safety of artificial sweeteners ». EFSA Jour. vol. 9, no 2, p. 2089, 16 p. (disponible en anglais seulement)
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows. [modèle d’estimation]. © 2000-2012. Ver. 4.11. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (New-York): Syracuse Research Corporation. (disponible en anglais seulement)
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. 1983. Final report on extractability of dyestuffs from textiles. Bâle (Suisse) : ETAD. Projet no A 4007. (disponible en anglais seulement)
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. 1988. Executive summary on the ETAD Project T 2015. Toxicological testing of major colorants, with attachments and cover letter dated 06/03/88. Bâle (Suisse) : ETAD. TSCA OTS0000621, Doc #FYI-AX-0688-0621. (disponible en anglais seulement)
[EWG] SkinDeep Cosmetics Database [base de données]. © 2007-2016. Washington (DC), Environmental Working Group. [Consulté le 12 oct 2016]. (disponible en anglais seulement)
Gomaa YA, Garland MJ, McInnes FJ, Donnelly RF, El-Khordagui LK et Wilson CG. 2012. « Flux of ionic dyes across microneedle-treated skin: effect of molecular characteristics ». Int J Pharm. vol. 438, no 1‑2, p. 140-149. (disponible en anglais seulement)
Green MR et Pastewka JV. 1979. « Mutagenicity of some lipsticks and their dyes for Salmonella typhimurium TA98 ». Environ Mutagen. vol. 1, no 2, p. 116. (disponible en anglais seulement)
Green MR et Pastewka JV. 1980. « Mutagenicity of some lipsticks and their dyes ». J Natl Cancer Inst. vol. 64, no 3, p. 665-669. (disponible en anglais seulement)
Hansen P, Tønning K, Malmgren-Hansen B et Jacobsen E. 2008. Survey and health assessment of chemical substances in hobby products for children. Ministère danois de l’Environnement, Agence de protection environnementale du Danemark). Enquête sur les substances chimiques présentes dans les biens de consommation no 93. (disponible en anglais seulement)
Hart RW, Freni SC, Gaylor DW, Gillette JR, Lowry LK, Ward JM, Weisburger EK, Lepore P et Turturro A. 1986. « Final report of the Color Additive Scientific Review Panel ». Risk Anal. vol. 6, no 2, p. 117-154. (disponible en anglais seulement)
Herbst W et Hunger K. 2004. Industrial organic pigments: production, properties, applications. 3e édition. Weinheim (Allemagne), Wiley-VCH. (disponible en anglais seulement)
Hunger K. 2003. Industrial dyes: chemistry, properties, applications. Weinheim (Allemagne), Wiley-VCH. (disponible en anglais seulement)
Keith LH et Walters DB. 1992. National Toxicology Program’s Chemical Solubility Compendium. Chelsea (MI),Lewis. (disponible en anglais seulement)
Kubinski H, Gutzke GE et Kubinski ZO. 1981. « DNA-cell-binding (DCB) assay for suspected carcinogens and mutagens ». Mutat Res. vol. 89, no 2, p. 95-136. (disponible en anglais seulement)
Laden P, directeur. 1997. Chemistry and Technology of Water Based Inks. Londres (Royaume-Uni), Blackie Academic and Professional, an imprint of Chapman & Hall. p. 150. (disponible en anglais seulement)
Lang PL. 1995. Spontaneous neoplastic lesions in the Crl:CD-1® BR Mouse. Wilmington (Massachusetts), Charles River Laboratories. (disponible en anglais seulement)
Leadscope Model Applier [module de prédiction]. 2016. Ver. 2.1. Columbus (Ohio), Leadscope, Inc. [Accès restreint]. (disponible en anglais seulement)
Lipman AL. 1995. « Safety of xanthene dyes according to the U.S. Food and Drug Administration ». Dans Heitz JR, Downum KR, dir. Light-activated pest control, vol. 616. Washington (DC), American Chemistry Society. p. 34. (disponible en anglais seulement)
LookChem. 2008. 4’,5’-Dibromofluorescein: CasNO. 596-03-2. Hangzhou (Chine), LookChem.com. [consulté le 23 Mar 2016]. (disponible en anglais seulement)
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Laurie Pan YH, Re T, Renskers K, Scrafford C et Vater S. 2006. « Exposure data for personal care products: hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant ». Food Chem Toxicol. vol. 44, no 12, p. 2008-2018. (disponible en anglais seulement)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG et Sewall C. 2005. « Exposure data for cosmetic products: lipstick, body lotion, and face cream ». Food Chem Toxicol. vol. 43, p. 279-291. (disponible en anglais seulement)
Loveday KS, Anderson BE, Resnick MA et Zeiger E. 1990. « Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. V: results with 46 chemicals ». Environ Mol Mutagen. vol. 16, no 4, p. 272-303. (disponible en anglais seulement)
Matula TI, Downie R, Butterfield AG et Nestmann ER. 1982. « Mutagenicity of Rhodamine dyes B and 6G and their impurities in Salmonella and Saccharomyces cerevisiae ». Environ Mutagen. vol. 4, no 3, p. 378‑379. (disponible en anglais seulement)
[NCBI] National Center for Biotechnology Information. 2005. [modifié le 2016]. PubChem compound database [base de données dans l’Internet]. CID 5359556. [Consultée le 29 mar 2016]. (disponible en anglais seulement)
Nestmann ER, Douglas GR, Matula TI, Grant CE et Kowbel DJ. 1979. « Mutagenic activity of rhodamine dyes and their impurities as detected by mutation induction in Salmonella and DNA damage in Chinese hamster ovary cells ». Cancer Res. vol. 39, no 11, p. 4412-4417. (disponible en anglais seulement)
[NTP] National Toxicology Program (États-Unis). 1989. Toxicology and carcinogenesis studies of Rhodamine 6G (C.I. Basic Red 1) (CAS No. 989-38-8) in F344/N rats and B6C3F1 mice (feed studies [PDF]). Research Triangle Park (Caroline du Nord), Department of Health and Human Services des États-Unis, National Toxicology Program. Rapport no TR-364. Numéro de publication du NIH : 89-2819. (disponible en anglais seulement)
OCDE, Boîte d’outil QSAR. 2014 Ver. 3.3. Paris (France), Organisation pour la coopération et le développement économiques, Laboratoire de chimie mathématique. (disponible en anglais seulement)
OCDE, Boîte d’outil QSAR. 2016. Ver. 3.4. Paris (France), Organisation pour la coopération et le développement économiques, Laboratoire de chimie mathématique.
Pierce EC, Agersborg, HPK Jr, Borzelleca JF, Burnett CM, Eagle E, Ebert AG, Kirschman JC et Scala RA. 1974. « Multi-generation reproduction studies with certified colors in rats ». Toxicol Appl Pharmacol. vol. 29, no 1, p. 121-122. (disponible en anglais seulement)
Rapport d’étude. 1972. A multi-generation study in rats. Rapport non publié déposé à l’USFDA (Washington, DC). p. 6312-6319. Rapport no CAP8C0061. [Accès restreint]. (disponible en anglais seulement)
Recherche dans les étiquettes de pesticides 2016 [Base de données, modifiée le 25 jan 2016]. Ottawa (Ontario), Santé Canada. [Consultée le 30 sept 2015]. (disponible en anglais seulement)
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ministre des Approvisionnements et Services Canada. Ministre des Approvisionnements et Services Canada. Numéro de catalogue En40-215/41E. [Consulté le 25 nov 2016].
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l'exposition. Ottawa (Ont.) : Santé Canada
Santé Canada 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), gouvernement du Canada. (disponible en anglais seulement)
Santé Canada. [Modifié le 7 oct 2015]. Liste des colorants autorisés. Ottawa (Ontario): gouvernement du Canada. [Consulté le 27 sept 2016].
Santé Canada. 2016. Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ontario): gouvernement du Canada. [Consulté en mai 2017].
[SCC] Comité scientifique de cosmétologie. 1993. CI 45170. Reports of the Scientific Committee on Cosmetology concerning the use of certain colourants in cosmetic products. Produits pour la 45e réunion du Comité scientifique de cosmétologie, 2 oct 990. Luxembourg (Luxembourg), Commission des communautés européennes. p. 498-503. (disponible en anglais seulement)
[SCCS] Comité scientifique pour la sécurité des consommateurs. 2012. The SCCS’s notes of guidance for the testing of cosmetic substances and their safety evaluation, 8e revision [PDF]. (disponible en anglais seulement)
[SIMDUT] Fiche de données de sécurité. 2007. Body art ink pad. Warren (New Jersey): Horizon Group. [consulté le 12 oct 2016]. Available upon request. (disponible en anglais seulement)
[SIMDUT] Fiche de données de sécurité. 2009a. Wax Based Make Up/Face Paint Crayon Products. Orlando (Floride),Wolfe Brothers Face Art & FX. [Consulté le 4 oct 2016]. Disponible sur demande. (disponible en anglais seulement)
[SIMDUT] Fiche de données de sécurité. 2009b. Paint pens. Warren (New Jersey), Horizon Group [Consulté le 12 oct 2016]. Disponible sur demande. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011a. Essai de mutation inverse du Solvent Black 5 C.I. dans les bactéries. [trad.]. Tokyo (Japon), Laboratoires biomédicaux Shin Nippon. Étude no SBL807‑015. 35 p. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011b. Essai de mutation inverse du Solvent Black 5 C.I. sur des bactéries [trad.], Tokyo (Japon), Laboratoires biomédicaux Shin Nippon. 9 p. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011c. Essai in vitro d’aberration chromosomique du Solvent Black 5 C.I. sur des cultures de cellules de mammifères [trad.]. Tokyo (Japon), Laboratoires biomédicaux Shin Nippon. Étude no SBL807-010. 40 p. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011d. Essai in vitro d’aberration chromosomique du Solvent Black 5 C.I. dans des cultures de hamster chinois [trad.]. Tokyo (Japon): Laboratoires biomédicaux Shin Nippon. 10 p. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011e. Essai combiné de doses orales répétées et toxicité pour la reproduction et le développement du Solvent Black 5 C.I. [trad.]. Tokyo (Japon), Laboratoires biomédicaux Shin Nippon. Étude no SBL807-006. 360 p. (disponible en anglais seulement)
[SNBL] Laboratoires biomédicaux Shin Nippon Ltd. 2011f. Essai combiné de doses répétées du Solvent Black 5 C.I. administrées à des rats et évaluation préalable de sa toxicité pour la reproduction et le développement [trad.] Tokyo (Japon). Laboratoires biomédicaux Shin Nippon. 18 p. (disponible en anglais seulement)
[TIMES] TIssue Metabolism Simulator [Module de prédiction]. 2016. ver. 2.27.19. Université Prof.-Dr.-Assen-Zlatarov de Bourgas (Bulgarie), Laboratoire de chimie mathématique. [Accès restreint]. (disponible en anglais seulement)
[USEPA] US Environmental Protection Agency. 2008. Child-Specific Exposure Factors Handbook. EPA/600/R-06/096F. (disponible en anglais seulement)
[USEPA] US Environmental Protection Agency. 2012. Standard operating procedures for residential exposure assessments. Washington (DC): EPA des États-Unis, Office of Chemical Safety and Pollution Prevention, Office of Pesticide Programs, Health Effects Division. (disponible en anglais seulement)
[USFDA] US Food and Drug Administration. 1984. « Rules and Regulations: D & C Orange No. 5 ». Federal Register. vol. 49, no 66, p. 13339-13343. (disponible en anglais seulement)
[USFDA] US Food and Drug Administration. 2015. Color Additive Status List. Silver Springs (Maryland). Food and Drug Administration des États-Unis. (disponible en anglais seulement)
Velazquez SF, Schoeny R, Rice GE et Cogliano VJ. 1996. « Cancer risk assessment: historical perspectives, current issues, and future directions ». Drug Chem Toxicol. vol. 19, no 3, p. 161-185. (disponible en anglais seulement)
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K et Hertz-Picciotto I. 2010. « Usage pattern of personal care products in California households ». Food Chem Toxicol. vol. 48, no 11, p. 3109-3119. (disponible en anglais seulement)
Wuebbles BJY et Felton JS. 1985. « Evaluation of laser dye mutagenicity using the Ames/Salmonella microsome test ». Environ Mutagen. vol. 7, no 4, p. 511-522.
Yamaguchi T. 1988. « Adsorption of carcinogenic and/or mutagenic pigments on DNA-binding Sepharose ». Agric Biol Chem. vol. 52, no 3, p. 845-847. (disponible en anglais seulement)
Zeiger E, Anderson B, Haworth S, Lawlor T et Mortelmans K. 1988. « Salmonella mutagenicity tests: IV. Results from the testing of 300 chemicals ». Environ Mol Mutagen. vol. 11, suppl. 12), p. 1-158. (disponible en anglais seulement)
Zeiger E, Anderson B, Haworth S, Lawlor T et Mortelmans K. 1992. « Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals ». Environ Mol Mutagen. vol. 19, suppl. 21, p. 2-141. (disponible en anglais seulement)
Zeiger E, Anderson B, Haworth S, Lawlor T, Mortelmans K et Speck W. 1987. « Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals ». Environ Mutagen. vol. 9, suppl. 9, vol. 1-110. (disponible en anglais seulement)
Zeilmaker MJ, Kroese ED, van Haperen P, van Veen MP, Bremmer HJ, van Kranen HJ, Wouters MFA et Janus JA. 1999. Cancer risk assessment of azo dyes and aromatic amines from garment and footwear. (disponible en anglais seulement)Bilthoven (Pays-Bas), Rijkinstituut voor Volkgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. Rapport no 601503014. (disponible en anglais seulement)
Zeilmaker MJ, van Kranen HJ, van Veen MP et Janus JA. 2000. Cancer risk assessment of azo dyes and aromatic amines from tattoo bands, folders of paper, toys, bed clothes, watch straps and ink. Bilthoven (Pays-Bas) Rijksinstituut voor Volksgezondheid en Milieu [Institut pour la santé publique et l’environnement des Pays-Bas]. Rapport no 601503019, 45 p. (disponible en anglais seulement)
Annexe A. Estimation de l’exposition potentielle des humains aux substances du groupe des pigments et colorants
Nous avons utilisé des scénarios d’exposition sentinelle pour estimer l’exposition potentielle des humains aux substances du groupe des pigments et colorants. Le tableau A-1 résume les hypothèses des scénarios. Sauf indication contraire, nous avons estimé les expositions au moyen de la version 4.1 de ConsExpo ou d’algorithmes provenant de ce modèle (ConsExpo 2006). Sauf indication contraire, l’absorption cutanée est présumée d’être de 100 %.
Substance |
Scénario d’exposition sentinelle |
Hypothèsesa |
|---|---|---|
D&C Orange 5 |
Brillant à lèvres |
Concentration : ≤ 10 % (courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, 2016, sans référence) Groupe d’âge : enfants Masse corporelle : 31,0 kg Fréquence : 0,89/jour (Wu et coll., 2010; présume prudemment la même fréquence d’utilisation que les baumes pour les lèvres) Quantité de produit : 0,01 g/application (Loretz et coll. 2005) |
D&C Orange 5 |
Rouge à lèvres |
Concentration : ≤ 10 % (courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, 2016, sans référence) Groupe d’âge : adultes Poids corporel : 70,9 kg Fréquence : 2,4/jour (Loretz et coll. 2005) Quantité de produit : 0,01 g/application (Loretz et coll. 2005) |
D&C Orange 5 |
Maquillage pour le visage |
Concentration : ≤ 10 % (courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, 2016, sans référence) Groupe d’âge : adultes Poids corporel : 70,9 kg Fréquence : 1,24/jour (Loretz et coll. 2006) Quantité de produit : 0,54 g/application (Loretz et coll., 2006) Absorption cutanée : 0,5 % (USFDA 1984) |
| D&C Orange 5 | Peinture faciale |
Concentration : £ 7 % (SIMDUT 2009a) Estimation par événement d’exposition orale : |
Pigment Violet 1 |
Crayons de cireb |
Concentration (conc) : 0,0205 % pour le pigment violet 1c Estimation de l’exposition journalière par voie orale |
Pigment Violet 1 |
Craie |
Concentration (conc) : 0,04 % (ECCC 2016c) Estimation de l’exposition journalière par voie orale |
Acid Black 2 |
Gel capillaire |
Concentration : ≤ 0,1 % (courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, 2016, sans référence) Groupe d’âge : adultes Poids corporel : 70,9 kg Fréquence : 0,59/jour (Bremmer, 2006) Quantité de produit : 1,9 g/application (Bremmer 2006) Facteur de rétention (facteur de transfert des cheveux au cuir chevelu) : 0,1 (SCCS 2012) |
Pigment Red 81 |
Tampons encreurs pour décoration corporelle |
Concentration (conc) : 30 % (SIMDUT 2007) Estimation de l’exposition journalière par voie oralee |
No CAS 26694-69-9 |
Crayons de peinture |
Groupe d’âge : bambins d Estimation de l’exposition journalière par voie orale Pour l’estimation de l’exposition journalière par voie orale |
Basic Red 29 |
Tissus portés à la bouche |
Concentration (conc) : 1 % (BfR 2007) Estimation de l’exposition journalière par voie orale |
Basic Red 29 |
Tissus, port de vêtements |
Concentration (conc) : 1 % (BfR 2007) Estimation de l’exposition journalière par voie cutanée |
a Les âges pour les bébés, les bambins, les enfants et les adultes sont respectivement de 0 à 6 mois, de 6 mois à 4 ans, de 5 à 11 ans, et de 20 à 59 ans. Les poids corporels par défaut ont été tirés de Santé Canada (1998).
b Le scénario a été adapté de l’évaluation du plomb dans les crayons de cire par la CPSC (1994, Consumer Product Safety Commission des États-Unis).
c Nous avons tiré la concentration utilisée pour estimer l’exposition au Pigment Violet 1 de l’ingestion des crayons à cire des mesures de bioaccessibilité du composant colorant, le Basic Violet 10. La teneur moyenne signalée du Basic Violet 10 tirée de différentes fournitures d’art contenant du Pigment Violet 1 était de 205 ppm, nous a été fournie par le Programme de toxicologie de l’université Duke (communication personnelle du Programme de toxicologie de l’université Duke au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2017; sans référence). Nous considérons que l’utilisation de cette concentration est prudente. En effet, la concentration déclarée de Pigment Violet 1 dans un crayon de cire est de 1,4 % (ECCC 2016c) c’est-à-dire à la limite inférieure des teneurs déclarées par l’Art and Creative Materials Institute (1 % à 16 %; même référence que ci-dessus) et l’on prévoit généralement que la bioaccessibilité du Pigment Violet 1 contenu dans la matrice du crayon de cire sera plus basse que celle du même pigment des autres fournitures artistiques.
d On considère que ce groupe d’âge est le plus exposé à cause de l’utilisation de marqueurs ou de stylos, notamment puisque les bambins sont les plus susceptibles à les porter à la bouche (USEPA 2008).
e De manière prudente, nous avons présumé que l’exposition par voie orale découlant des contact mains-bouche ou objet-bouche avec l’encre d’un tampon encreur pour la décoration corporelle équivalait à celle d’un marqueur à pointe de feutre. L’ingestion d’encre d’un tampon encreur pour décoration corporelle est limitée aux expositions découlant d’événement puisque l’utilisation chronique ou journalière n’est pas prévue. Toutefois, l’exposition a été estimée en utilisant l’exposition cumulative à l’encre pendant huit heures, laquelle est représentative des expositions chroniques ou journalières orales (ou cutanées) à l’encre d’un marqueur pendant laquelle nous présumons qu’une personne absorbera 25 cm de ligne d’encre par jour. Nous considérons que cette estimation est suffisamment élevée pour couvrir les positions orales potentielles pour un événement d’utilisation d’un tampon encreur pour décoration corporelle. Nous avons utilisé le niveau à 90e percentile pour l’application d’encre d’un instrument d’écriture soit 100 µg/cm (communication personnelle de l’Art and Creative Materials Institute (ACMI), de l’université Duke au Bureau de l’évaluation des risques des substances existantes de Santé Canada 2009, sans référence).
f La consistance (c.-à-d., la densité) de la peinture des crayons à peinture (que l’on peut appeler marqueurs à peinture) est présumée être similaire à celle de l’encre d’un marqueur à pointe de feutre, et non celle de la peinture appliquée au pinceau.
g L’exposition par voie orale découlant de l’ingestion par contact mains-bouche ou objet-bouche d’encre d’un marqueur à peinture est prudemment présumée être la même que celle découlant de l’utilisation d’un marqueur à pointe de feutre. L’exposition est estimée à partir de l’exposition cumulative à l’encre pendant huit heures, qui est représentative des expositions chroniques ou quotidiennes, orales ou cutanée à l’encre d’un marqueur, pendant laquelle on présume qu’une personne absorbera l’équivalent d’une ligne de 25 cm d’entre par jour. Nous avons utilisé le niveau à 90e percentile pour l’application d’encre d’un instrument d’écriture, soit 100 µg/cm. (Communication personnelle de l’Art and Creative Materials Institute (ACMI), de l’université Duke au Bureau de l’évaluation des risques des substances existantes de Santé Canada 2009, sans référence.) Nous supposons une absorption de 100 %.
h La masse surfacique des tissus correspondant à celle de tous les tissus synthétiques qui est représentative des fibres acryliques. Les colorants basiques (comme le Basic Red 29) sont habituellement utilisés pour teindre les polyacrylonitriles (les fibres acryliques), les nylons modifiés et les polyesters modifiés (Hunger 2003), bien que par le passé on les a utilisées pour teindre plusieurs fibres différentes.
i La migration des colorants dans les tissus varie considérablement selon le type de fibres, le type de teinture utilisé, la charge de teinture, la technologie utilisée pour teindre, l’intensité de la couleur et le post-traitement subséquent. L’exposition cutanée provenant des tissus est en partie déterminée par la quantité de colorants qui migre depuis le tissu à la peau humaine (ETAD, 1983). Le groupe de travail « Textiles » (BfR, 2007) utilise une période de pointe de la migration initiale de 0,5 % pour estimer l’exposition aux colorants provenant de vêtements nouvellement achetés non lavés, et le taux de migration chronique devrait être inférieur à un dixième de la valeur mesurée pour la première migration afin de refléter l’exposition après les lavages initiaux. On suppose que le taux de migration de la transpiration est similaire au taux de migration de la salive. Cette interprétation concorde avec les observations de Zeilmaker et coll. (1999) des comportements de lixiviation des colorants à partir de tissus. En conséquence, la fraction de colorant qui migre par jour à partir d’un tissu est présumée être de 0,0005 pour estimer les expositions cutanées et orales chroniques.
j Le facteur d’ajustement combiné que nous avons présumé pour tenir compte du taux de pénétration du marché et de la probabilité de porter un vêtement coloré en rouge une journée donnée est de 0,1 (10 %), il est considéré être prudent. Le taux de pénétration du marché de toute teinture à tissu particulière dans le marché canadien est relativement bas (p. ex., étant donné le nombre possible de teintures disponibles) et dans le cas du Basic Red 29, selon la mise à jour de la Liste intérieure, on en aurait importé en 100 et 1000 kg pendant l’année de déclaration 2011, ce qui est peu (Environnement Canada 2013). La portion de cette fraction de 10 % attribuée à la probabilité supposée de porter un tissu teint en rouge, un jour donné, repose sur le jugement professionnel.
