Évaluation préalable - Groupe des acides gras et dérivés
Titre officiel : Évaluation préalable - Groupe des acides gras et dérivés
Environnement et changement climatique Canada
Santé Canada
Août 2020
No de cat. : En14-418/2020F-PDF
ISBN 978-0-660-35505-4
Résumé
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et la ministre de la Santé ont procédé à l’évaluation préalable de neuf des 16 substances appelées collectivement « groupe des acides gras et dérivés » dans le Plan de gestion des produits chimiques. Les neuf substances dans la présente évaluation ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou ont été considérées comme une priorité sur la base d’autres préoccupations pour la santé humaine ou l’environnement. Les graisses et les huiles glycéridiques du margousier (NR CASNote de bas de page 1 8002-65-1) étaient incluses dans l’ébauche d’évaluation préalable du groupe des acides gras et dérivés publiée le 18 août 2018. Toutefois, selon d’autres renseignements obtenus, ces substances UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques) nécessitent une évaluation approfondie. Celle-ci sera présentée dans une évaluation préalable distincte. Il a été établi à l’aide d’autres approches que quatre des 16 substances sont peu préoccupantes. Les décisions concernant ces substances figurent dans des rapports distinctsNote de bas de page 2Note de bas de page 3. En outre, deux substances ont été classées dans un groupe plus pertinent, compte tenu de leur structure chimique et de leurs utilisationsNote de bas de page 4. Ainsi, la présente évaluation préalable porte sur les neuf substances énumérées dans le tableau ci‑dessous. Nous désignerons les neuf substances visées par la présente évaluation préalable comme le groupe des acides gras et dérivés. Les NR CAS, les noms sur la Liste intérieure (LI), les noms communs et les abréviations de ces substances sont présentés dans le tableau ci-dessous.
NR CAS |
Nom sur la LIS |
Nom commun et abréviation |
|---|---|---|
112-38-9 |
Acide undéc-10-énoïque |
Acide undécylénique |
463-40-1 |
Acide linolénique |
Acide α-linolénique (AAL) |
8001-20-5 a,b |
Huile de Canton |
Huile d’abrasin |
61790-12-3 a |
Acides gras de tallöl |
Acides gras de tallöl |
61790-44-1a |
Acides gras de tallöl, sels de potassium |
Sels de potassium d’acides gras de tallöl |
90028-66-3a,c |
Onagre, Oenothera biennis, ext. |
Huile d’onagre |
61788-89-4a |
Dimères d’acides gras en C18 insaturés |
Dimères d’acides gras |
68937-90-6a,b |
Trimères d’acides gras en C18 insaturés |
Trimères d’acides gras |
92044-87-6a,c |
Esters 2-éthylhexyliques d’acides gras de coco |
Cocoate d’éthylhexyle |
a La substance associée à ce numéro CAS est une substance UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
b Cette substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais fait l’objet de la présente évaluation parce qu’elle a été jugée prioritaire en raison d’autres préoccupations à l’égard de la santé humaine.
c Cette substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais fait l’objet de la présente évaluation parce qu’elle a été jugée prioritaire en raison d’autres préoccupations à l’égard de l’environnement.
D’après une enquête menée en vertu de l’article 71 de la LCPE, quatre acides gras et dérivés sur neuf ont été fabriqués au Canada en 2011 dans les quantités suivantes : 1 430 kg d’acides gras de tallöl, 10 000 à 100 000 kg de sels de potassium d’acides gras de tallöl et 100 à 1 000 kg de dimères d’acides gras et la même quantité de trimères d’acides gras. On a déclaré l’importation au Canada de sept substances sur neuf au cours de la même année dans les quantités suivantes : 1 000 à 10 000 kg d’AAL, 120 412 kg d’huile d’abrasin, 6 317 473 kg d’acides gras de tallöl, 47 992 kg de sels de potassium d’acides gras de tallöl, 293 472 kg de dimères d’acides gras, 1 088 638 kg de trimères d’acides gras et 6 470 kg de cocoate d’éthylhexyle. Selon les déclarations, les deux autres substances, soit l’acide undécylénique et l’huile d’onagre, n’ont ni été fabriquées ni importées au Canada en 2011 en des quantités supérieures au seuil de déclaration de 100 kg.
Ces substances se trouvent naturellement dans l’environnement ou proviennent de sources naturelles comme les plantes et les graisses et huiles animales. On a déclaré plusieurs utilisations des substances de ce groupe, notamment dans les lubrifiants et graisses, les adhésifs et les produits d’étanchéité, les peintures et les revêtements, les carburants et les produits connexes, et les emballages alimentaires. Certains de ces produits sont vendus aux consommateurs. Plusieurs des substances de ce groupe sont utilisées dans des cosmétiques ainsi que dans des produits de santé naturels vendus sans ordonnance.
Les risques pour l’environnement associés aux substances du groupe des acides gras et dérivés ont été caractérisés à l’aide de la classification du risque écologique (CRE) des substances organiques. La CRE est une méthode fondée sur le risque qui tient compte de plusieurs paramètres évaluant à la fois le danger et l’exposition dans le but de classer le risque en fonction d’une pondération des éléments de preuve. Les profils de danger sont principalement basés sur des paramètres comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité internes dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique. Les paramètres pris en compte pour dresser les profils d’exposition sont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport sur de grande distance. À l’aide d’une matrice des risques, on assigne un degré de préoccupation faible, modéré ou élevé aux substances suivant leur profil de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il est improbable que les substances du groupe des acides gras et dérivés soient nocives pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les neuf substances du groupe des acides gras et dérivés présentent un faible risque d’effets nocifs sur l’environnement. Il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont pas aux critères énoncés aux alinéas 64(a) ou (b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans les conditions à avoir, immédiatement ou à long terme, des effets nocifs sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
L’Organisation de coopération et de développement économiques (OCDE) a évalué l’AAL en même temps qu’un groupe d’acides aliphatiques en 2014. Selon l’OCDE, l’AAL et les principaux composants des acides gras de tallöl, de l’huile d’onagre, des dimères et trimères d’acides gras et des acides gras libres du cocoate d’éthylhexyle ne possèdent aucune propriété indiquant un risque d’effets généraux sur la santé humaine, comme en témoignent les renseignements toxicologiques de l’huile d’abrasin.
L’Autorité européenne de sécurité des aliments a conclu en 2010 que les études de laboratoire menées sur la forme conjuguée du principal composant de l’huile d’abrasin n’indiquent aucun risque de génotoxicité, de toxicité pour la reproduction, ni de cancérogénicité.
Dans le volet I des évaluations du risque pour la santé humaine réalisées par le ministère australien de la Santé sur plusieurs substances chimiques en 2017, on a jugé que les dimères d’acides gras ne posaient aucun risque inacceptable pour la santé humaine.
D’après l’information des évaluations susmentionnées menées à l’étranger, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères d’acides gras et les trimères d’acides gras ne présentent aucun effet général préoccupant pour la santé, et le risque pour la santé humaine est jugé faible.
L’exposition de la population générale à l’acide undécylénique peut découler de son utilisation comme aromatisant dans certains aliments, et de son utilisation dans des cosmétiques, ainsi que dans des produits de santé naturels. L’exposition au cocoate d’éthylhexyle peut survenir lorsqu’on utilise des cosmétiques. Les données existantes sur les effets sur la santé de l’acide undécylénique et de son sel de sodium, ainsi que sur le cocoate d’éthylhexyle et ses produits hydrolysés, révèlent des effets sur le poids corporel et celui des organes et des effets sur des paramètres de biochimie clinique. La marge d’exposition entre les doses estimées d’exposition pour les deux substances et les doses critiques tirées d’études en laboratoire ont été jugées adéquates pour tenir compte des incertitudes liées aux bases de données sur les effets sur la santé et l’exposition.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont pas aux critères énoncés à l’alinéa 64(c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada, 1999), le ministre de l’Environnement et la ministre de la Santé ont procédé à l’évaluation préalable de neuf des 16 substances appelées collectivement « groupe des acides gras et dérivés » dans le Plan de gestion des produits chimiques, pour déterminer si elles présentent ou pourraient présenter un risque pour l’environnement ou la santé humaine. Les neuf substances de la présente évaluation ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou ont été considérées comme étant prioritaires sur la base d’autres préoccupations pour la santé humaine ou l’environnement (ECCC, SC [modifié en 2017]). Les graisses et les huiles glycéridiques du margousier (NR CASNote de bas de page 5 8002-65-1) étaient incluses dans l’ébauche d’évaluation préalable du groupe des acides gras et dérivés publiée le 18 août 2018. Toutefois, selon d’autres renseignements obtenus, ces substances UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques) nécessitent une évaluation approfondie. Celle-ci sera présentée dans une évaluation préalable distincte.
Quatre autres substances (énumérées au tableau 1‑1) ont été évaluées à l’aide du document sur l’approche scientifique de Classification du risque écologique (CRE) des substances organiques (ECCC 2016a) et du document d’évaluation scientifique intitulé Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada, 2016), ou de l’« Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC 2018a). Il a été établi qu’elles étaient faiblement préoccupantes pour la santé humaine et pour l’environnement. C’est la raison pour laquelle elles ne sont pas visées par le présent rapport. Les conclusions pour une substance sont données dans l’Évaluation préalable des substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC 2017b), tandis que celles pour les trois autres substances sont présentées dans l’Évaluation préalable rapide de substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC 2018a).
NR CAS |
Nom sur la Liste intérieure des substances (LIS) |
Approche utilisée pour l’évaluation de la substance |
Références |
|---|---|---|---|
68139-89-9 |
Acides gras de tallöl maléatés |
CRE, SPT |
ECCC, SC, 2018b |
53980-88-4 |
Acide 5(ou 6)-carboxy-4-hexylcyclohex-2-én-1-octanoïque |
CRE, Évaluation rapide |
ECCC, SC, 2018a |
68647-55-2 |
Acides gras de tallöl, esters avec la triéthanolamine |
CRE, Évaluation rapide |
ECCC, SC, 2018a |
CDSL#11556-0 |
Acides gras, produits de réaction avec l’anhydride maléique |
CRE, Évaluation rapide |
ECCC, SC, 2018a |
En outre, deux substances ont été classées dans un groupe plus pertinent en raison de caractéristiques structurales semblables ou de fonctions ayant une importance toxicologiqueNote de bas de page 6.
Les neuf substances visées par la présente évaluation préalable seront ci‑après désignées « groupe des acides gras et dérivés ».
Les risques pour l’environnement posé par les substances du groupe des acides gras et dérivés ont été caractérisés à l’aide de la CRE (ECCC, 2016a). La CRE permet de décrire le danger occasionné par une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique et permet d’examiner l’exposition éventuelle d’organismes des milieux aquatique et terrestre en fonction de facteurs comme la vitesse d’émission potentielle, la persistance globale et le potentiel de transport sur grande distance dans l’atmosphère. Les divers éléments de preuve sont rassemblés pour rechercher les substances qui nécessitent une évaluation plus poussée du risque d’effets nocifs sur l’environnement ou qui présentent une faible probabilité d’effets nocifs sur l’environnement.
Dans le cadre du Programme d’évaluation coopérative des produits chimiques, l’Organisation de coopération et de développement économiques (OCDE) a étudié l’AAL et les principaux composants des acides gras de tallöl, de l’huile d’onagre, des dimères et trimères d’acides gras et des acides gras libres du cocoate d’éthylhexyle, et elle a publié un rapport d’évaluation initiale (SIAR) sur des ensembles de données d’évaluation (SIDS). L’évaluation de l’OCDE a été soumise à un examen rigoureux (y compris un examen par des pairs) et à une approbation par les instances gouvernementales d’autres pays. Santé Canada et Environnement et Changement climatique Canada sont des participants actifs à ce processus et considèrent que ces évaluations sont fiables. En outre, l’Autorité européenne de sécurité des aliments a examiné la forme conjuguée du principal composant de l’huile d’abrasin et le ministère australien de la Santé a examiné les dimères d’acides gras dans le cadre du volet I de l’évaluation des risques pour la santé humaine causés par plusieurs substances. Le SIAR de l’OCDE et les examens de l’EPA des États‑Unis, de l’Autorité européenne de sécurité des aliments et du ministère australien de la Santé ont servi de base à la caractérisation des effets sur la santé de la présente évaluation préalable.
La présente évaluation préalable tient compte des données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, notamment les données supplémentaires fournies par les intervenants. Les données pertinentes ont été relevées jusqu’en juin 2017. Des données empiriques d’études clés ainsi que certains résultats obtenus par modélisation ont servi à formuler les conclusions. Lorsqu’ils étaient pertinents, nous avons utilisé les renseignements tirés des évaluations d’autres administrations.
La présente évaluation préalable a été rédigée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle inclut des contributions d’autres programmes de ces ministères. Le volet de la présente évaluation portant sur l’environnement repose sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’une évaluation externe par des pairs et d’une période de consultation publique de 60 jours. De plus, l’ébauche de la présente évaluation préalable (publiée le 18 août 2018) a fait l’objet d’une période de consultation publique de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
Le présent document repose sur des renseignements critiques permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, nous avons examiné les renseignements scientifiques à la lumière d’une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 7. La présente évaluation préalable expose les données critiques et les considérations sur lesquelles sont fondées les conclusions.
2. Identité des substances
Le numéro de registre du Chemical Abstracts Service (NR CAS), le nom sur la LIS et le nom commun ou l’abréviation de chaque substance du groupe des acides gras et dérivés figurent au tableau 2‑1. Les données sur l’identité des composants des UVCB (substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques) figurent à l’annexe A. On peut obtenir une liste d’autres noms de ces composés chimiques (p. ex. leurs noms commerciaux) dans les National Chemical Inventories (NCI, 2015).
Les acides gras sont des composés organiques ayant au moins un groupe carboxylique terminal, et leurs dérivés contiennent au moins un lien ester. Les substances de la présente évaluation préalable sont des acides gras à composant unique (acide undécylénique, acide α-linolénique), des substances complexes qui comprennent un mélange de plusieurs composantes, soit des acides gras saturés, insaturés ou non définis (huile d’abrasin, acides gras de tallöl, huile d’onagre, dimères et trimères d’acides gras) ou des produits d’une réaction directe des acides gras, dont un sel de potassium (sel de potassium d’acides gras de tallöl) et un ester d’acide gras (cocoate d’éthylhexyle). L’annexe A présente le degré de saturation, la longueur de la chaîne carbonée et la distribution des principaux composants des substances de ce groupe.
| NR CAS(abréviation) | Nom sur la LIS(nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 112-38-9 | Acide undéc-10-énoïque (acide undécylénique) |
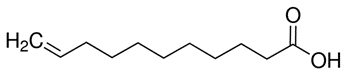 C11H20O2
C11H20O2 | 184,28 |
| 463-40-1(AAL) | Acide linolénique(acide α-linolénique) |
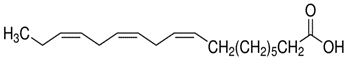 C18H30O2
C18H30O2 | 278,43 |
| 8001-20-5 | Huile de Canton(huile d’abrasin) | UVCB | Non précisée |
| 61790-12-3 | Acides gras de tallöl (acides gras de tallöl) | UVCB | Non précisée |
| 61790-44-1 | Acides gras de tallöl, sels de potassium (sels de potassium d’acides gras de tallöl) | UVCB | Non précisée |
| 90028-66-3 | Onagre, Oenothera biennis, ext. (huile d’onagre) | UVCB | Non précisée |
| 68937-90-6 | Trimères d’acides gras en C18 insaturés (trimères d’acides gras) | UVCB | 801,03 |
| 61788-89-4 | Dimères d’acides gras en C18 insaturés (dimères d’acides gras) | UVCB | 564,92 |
| 92044-87-6 | Esters 2-éthylhexyliques d’acides gras de coco (cocoate d’éthylhexyle) | UVCB | Non précisée |
Abréviation : UVCB = substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques
2.1 Sélection d’analogues
Une approche faisant appel à la lecture croisée à partir de données d’analogues ou des composants des substances ciblées, s’il y a lieu, a servi à guider l’évaluation des effets sur l’environnement et la santé humaine. Les analogues choisis présentaient une structure ou une fonction semblable à celle des substances du groupe (propriétés physicochimiques similaires, toxicocinétique) et les données empiriques pertinentes de ces analogues ont servi à effectuer une lecture croisée avec peu de données empiriques. On trouvera de plus amples détails sur les données utilisées pour la lecture croisée en vue d’éclairer l’évaluation des risques pour la santé et pour l’environnement des substances du groupe des acides gras et dérivés dans les sections pertinentes du présent rapport.
3. Propriétés physicochimiques
Dans le tableau 3‑1, on trouvera un résumé des propriétés physicochimiques des substances du groupe des acides gras et dérivés. Lorsque les données expérimentales sur une propriété étaient peu nombreuses ou inexistantes, des modèles (Q)SAR (relations quantitatives structure-activité) ont été utilisés pour obtenir des valeurs prédites (boîte à outils QSAR de l’OCDE, 2016). D’autres propriétés physicochimiques sont présentées dans ECCC (2016b).
Nous ne disposions pas de données sur les propriétés physicochimiques de toutes les substances parce que beaucoup d’entre elles étaient des UVCB. En général, les acides gras présentent une faible solubilité dans l’eau, une faible pression de vapeur ainsi qu’un coefficient de partage octanol-eau (log Koe) et un coefficient de partage carbone organique-eau (log Kco) modérés à élevés, ce qui laisse à penser qu’ils sont plus souvent présents dans le sol et les sédiments. Comme le sel de potassium d’acides gras de tallöl (NR CAS 61790‑44‑1) est un sel d’acides gras, sa solubilité dans l’eau devrait être plus grande (HERA, 2002). D’après l’OCDE (2014), il existe deux tendances claires associées à l’augmentation de la longueur de la chaîne alkyle : i) la hausse du point de fusion, du point d’ébullition et du coefficient de partage et ii) la baisse de la solubilité dans l’eau et de la pression de vapeur. Par ailleurs, pour une longueur donnée de chaîne carbonée, le point de fusion augmente à mesure que croît la saturation et baisse avec la hausse de l‘insaturation (OECD, 2014).
Les acides gras constituant ce groupe de substances sont surtout des acides gras linéaires ayant une chaîne de 16 ou 18 atomes de carbone, à quelques exceptions près, comme l’acide undécylénique (NR CAS 112‑38‑9), un acide gras en C11 à un seul composant, et le cocoate d’éthylhexyle (NR CAS 92044‑87‑61), un acide gras principalement en C12 et en C14, et les acides gras en C18 en dimères ou en trimères (dimères ou trimères en C18 insaturés, NR CAS 61788‑89‑45 et 68937‑90‑6). La longueur de la chaîne, le nombre, l’emplacement et l’isomérisation de ou des doubles liaisons de la chaîne carbonée peuvent modifier les propriétés physicochimiques, mais, dans l’ensemble, les propriétés physicochimiques devraient être semblables pour les substances complexes, car elles forment un mélange des acides gras à une chaîne carbonée mentionnés précédemment.
Propriété |
Acide undécyléniquea |
AALb |
Dimères d’acides grasc |
Trimères d’acides grasd |
|---|---|---|---|---|
État physique |
solide |
liquide |
liquide |
liquide |
Pression de vapeur (Pa) |
0,0192 |
7,2 × 10-5 |
négligeable (estimé) |
négligeable (estimé) |
Constante de la loi de Henry (Pa·m3/mol) |
0,53 (estimé) |
3,52 (estimé) |
ND |
ND |
Solubilité dans l’eau (mg/L) |
38,46 à pH 4,27 |
0,124 (estimé) |
> 0 - < 0,12 |
> 0 - < 0,37 |
log Koe (sans dimension) |
4,0 |
6,46 |
1 – 2,5 (pH 2) |
2,2 – 8,9 (pH 2) |
log Kco (sans dimension) |
2,84 |
4,068 (estimé) |
6,34 (estimé) |
6,73 (estimé) |
Abréviations : ND = non déterminé; Koe = coefficient de partage octanol‑eau; Kco = coefficient de partage carbone organique-eau]
a ECHA (c2007-2017a), ChemIDPlus (1993-)
b ChemIDPlus (1993-), EPISuite (c2000-2012)
c ECHA (c2007-2017b)
d ECHA (c2007-2017c)
4. Sources et utilisations
Deux des acides gras du groupe sont naturellement présents dans l’environnement. L’acide undécylénique est un composant naturel de la sueur humaine (Alternative Medicine Review, 2002). Il est produit par la levure Rhodotorula glutinis var. lusitanica et est présent dans l’huile essentielle du Juniperus chinensis et du hujopsis dolabrata ainsi que du lait écrémé en poudre (Burdock, 2010). L’AAL est considéré comme un acide gras essentiel présent dans certaines huiles végétales (p. ex. de canola ou de soja), certaines noix (p. ex. noix de Grenoble) et graines (p. ex. graines de lin ou de chia) (IOM, 2005; Les diététistes du Canada, 2017). Les huit autres substances proviennent de sources naturelles (d’huiles végétales et de graisses animales) souvent clairement identifiées. L’huile d’abrasin provient des graines d’un arbre, le tung (Vernicia fordii et Vernicia montana), ou arbre à huile de bois de Chine (Shockey et coll., 2016). L’huile d’onagre tire son origine de l’onagre (Oenothera biennis), une plante herbacée (NTP, 2009). Le cocoate d’éthylhexyle vient de l’huile de coco. Les acides gras de tallöl et les sels de potassium d’acides gras de tallöl sont issus de l’huile de tall, un sous-produit de la pulpe de bois résineux (Robinson et coll., 2009). Dans le cadre de la période de consultation publique, l’industrie a précisé que les dimères et les trimères d’acides gras proviennent principalement d’acides gras de tallöl et qu’une faible proportion provient d’acides gras d’origine végétale comme l’acide oléique.
Toutes les substances du groupe des acides gras et dérivés ont fait l’objet d’une enquête menée conformément à l’avis émis en vertu de l’article 71 de la LCPE (Canada, 2012). Le tableau 4‑1 résume les déclarations sur les aux quantités totales des substances du groupe fabriquées et importées au Canada.
Nom commun |
Quantité fabriquée totale (kg) |
Quantité importée totale (kg) |
Année de déclaration |
Référence de l’enquête |
|---|---|---|---|---|
Acide undécylénique |
ND |
ND |
2011 |
Environment Canada, 2013 |
AAL |
ND |
1 000 – 10 000 |
2011 |
Environment Canada, 2013 |
Huile d’abrasin |
ND |
120 412 |
2011 |
Environment Canada, 2013 |
Acides gras de tallöl |
1 430 |
6 317 473 |
2011 |
Environment Canada, 2013 |
Sels de potassium d’acides gras de tallöl |
10 000 – 100 000 |
47 992 |
2011 |
Environment Canada, 2013 |
Huile d’onagre |
ND |
ND |
2011 |
Environment Canada, 2013 |
Trimères d’acides gras |
100 – 1 000 |
293 472 |
2011 |
Environment Canada, 2013 |
Dimères d’acides gras |
100 – 1 000 |
1 088 638 |
2011 |
Environment Canada, 2013 |
Cocoate d’éthylhexyle |
ND |
6 470 |
2011 |
Environment Canada, 2013 |
Abréviation : ND = non déclarée
a Les valeurs correspondent aux quantités déclarées lors de l’enquête menée en vertu de l’article 71 de la LCPE (Environment Canada, 2013). Voir l’enquête pour les inclusions ou les exclusions particulières (annexes 2 et 3).
Au tableau 4‑2, on trouvera un résumé des principales utilisations des substances du groupe des acides gras et dérivés selon les déclarations effectuées dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Environment Canada, 2013). Aucune utilisation de l’acide undécylénique ou de l’huile d’onagre dépassant le seuil de déclaration de 100 kg n’a été signalée. Le tableau 4‑4 énumère d’autres utilisations au Canada, sauf pour les trimères d’acides gras, lesquelles ne figurent dans aucun des produits associés à ces usages.
Principales utilisationsa |
AAL |
Huile d’abrasin |
Acides gras de tallöl |
Sels de potassium d’acides gras de tallöl |
|---|---|---|---|---|
Lubrifiants et graisses |
O |
O |
O |
O |
Adhésifs et produits d’étanchéité |
O |
N |
O |
N |
Produits en papier |
N |
N |
O |
O |
Emballage alimentaire |
N |
N |
O |
O |
Carburants et produits connexes |
O |
N |
N |
N |
Peintures et revêtements |
O |
O |
O |
N |
Produits de soins personnels |
N |
N |
O |
N |
Matériaux pour les bâtiments et la construction |
N |
N |
O |
N |
Extraction du pétrole et du gaz naturel |
N |
N |
O |
N |
Nettoyage et entretien de mobilier |
N |
N |
O |
N |
Entretien des voitures |
N |
N |
O |
N |
Traitement de l’eau |
N |
N |
O |
N |
Matériaux en métal |
N |
N |
O |
N |
Autres |
O |
O |
O |
O |
Abréviations : O = utilisation déclarée pour cette substance; N = aucune utilisation déclarée pour cette substance.
a Utilisation non confidentielle déclarée dans le cadre de l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Voir la collecte de données pour les inclusions et exclusions particulières (annexes 2 et 3).
Principales utilisationsa |
Trimères d’acides gras |
Dimères d’acides gras |
Cocoate d’éthylhexyle |
|---|---|---|---|
Lubrifiants et graisses |
O |
O |
N |
Adhésifs et produits d’étanchéité |
O |
O |
N |
Produits en papier |
N |
O |
N |
Emballage alimentaire |
N |
O |
N |
Carburants et produits connexes |
O |
O |
N |
Peintures et revêtements |
O |
O |
N |
Produits de soins personnels |
O |
O |
O |
Matériaux pour les bâtiments et la construction |
N |
O |
N |
Extraction du pétrole et du gaz naturel |
O |
O |
N |
Traitement de l’eau |
N |
O |
N |
Matériaux en métal |
O |
O |
N |
Revêtements de sol |
O |
N |
N |
Autres |
O |
O |
O |
Abréviations : O = utilisation déclarée pour cette substance; N = aucune utilisation déclarée pour cette substance.
a Utilisation non confidentielle déclarée dans le cadre de l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Voir la collecte de données pour les inclusions et exclusions particulières (annexes 2 et 3).
Utilisation |
AU |
AAL |
Huile d’abrasin |
Acides gras de tallöl |
|---|---|---|---|---|
Matériaux d’emballage alimentairea |
N |
O |
O |
O |
Ingrédient médicinal ou non médicinal dans les désinfectants ou dans les médicaments destinés aux humains ou aux animauxb |
N |
O |
N |
O |
Base de données sur les ingrédients des produits de santé naturelsc |
O |
O |
N |
O |
Ingrédient médicinal ou non médicinal présent dans des produits de santé naturels homologuésd |
O |
O |
N |
N |
Présence dans les cosmétiques selon les déclarations faites en vertu du Règlement sur les cosmétiquese |
O |
O |
N |
O |
Produit de formulation dans des produits antiparasitaires homologuésf |
O |
O |
Ng |
O |
Abréviations : AU = acide undécylénique; O = utilisation déclarée pour cette substance; N = aucune utilisation déclarée pour cette substance.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 25 mai 2016; sans référence
b BDPP [modifiée en 2016]; communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 28 avril 2016; sans référence.
c BDIPSN [modifiée en 2019]
d BDPSNH [modifiée en 2018]
e Communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 22 avril 2016; sans référence
f Par ailleurs, aucune de ces substances n’a été homologuée comme matière active d’un produit antiparasitaire au Canada (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 9 mai 2016; sans référence).
g Peut être utilisé comme un produit de formulation, mais, à l’heure actuelle, il n’est pas homologué et n’est présent dans aucun produit (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 9 mai 2016; sans référence).
Utilisation |
Sels de potassium d’acides gras de tallöl |
Huile d’onagre |
Dimères d’acides gras |
CEH |
|---|---|---|---|---|
Matériaux d’emballage alimentairea |
O |
N |
O |
N |
Additif indirecta |
O |
N |
O |
N |
Ingrédient médicinal ou non médicinal dans les désinfectants ou dans les médicaments destinés aux humains ou aux animauxb |
N |
O |
N |
N |
Base de données sur les ingrédients des produits de santé naturelsc |
O |
O |
N |
O |
Ingrédient médicinal ou non médicinal présent dans des produits de santé naturels homologuésd |
N |
O |
N |
N |
Présence dans les cosmétiques selon les déclarations faites en vertu du Règlement sur les cosmétiquese |
N |
O |
N |
O |
Produit de formulation dans des produits antiparasitaires homologuésf |
Ng |
N |
O |
N |
Abréviations : CEH = cocoate d’éthylhexyle; O = utilisation déclarée pour cette substance; N = aucune utilisation déclarée pour cette substance.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 25 mai 2016; sans référence
b BDPP [modifiée en 2016]; communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 28 avril 2016; sans référence.
c BDIPSN [modifiée en 2019]
d BDPSNH [modifiée en 2018]
e Communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 22 avril 2016; sans référence
f Par ailleurs, aucune de ces substances n’a été homologuée comme matière active d’un produit antiparasitaire au Canada (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 9 mai 2016; sans référence).
g Peut être utilisé comme un produit de formulation, mais, à l’heure actuelle, il n’est pas homologué et n’est présent dans aucun produit (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 9 mai 2016; sans référence).
5. Risque d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe des acides gras et dérivés ont été caractérisés au moyen de la Classification du risque écologique des substances organiques (CRE) (ECCC, 2016a). La CRE est une approche fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de différents éléments probants en vue de classer le risque. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer les substances présentant une toxicité faible ou élevée, et un risque d’exposition faible ou élevé dans divers milieux. Cette façon de faire permet de réduire l’incertitude globale liée à la caractérisation des risques, contrairement à une approche reposant sur un seul paramètre mesuré dans un seul milieu (p. ex. concentration létale médiane [CL50]). Comme l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle sont des substances UVCB qui ne peuvent pas être représentés par une seule structure chimique, nous avons fait appel à une méthode de classification manuelle fondée sur le jugement. La partie qui suit résume cette méthode, qui est décrite en détail dans ECCC (2016a).
Les données sur les propriétés physicochimiques, sur le devenir (demi-vie de la substance chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de substances chimiques importées ou fabriquées au Canada ont été colligées à partir de publications scientifiques, de bases de données empiriques (p. ex., boîte à outils [Q]SAR de l’OCDE, 2016) et des résultats des collectes de données réalisées en vertu de l’article 71 de la LCPE, ou des données ont été produites à partir de certains résultats obtenus par modélisation de la relation (quantitative) structure-activité ([Q]SAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger des substances et d’exposition à ces dernières.
Les profils de danger reposent principalement sur les paramètres liés au mode d’action toxique, à la réactivité chimique, au seuil de toxicité interne dans le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été élaborés à l’aide de plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger d’exposition ont été comparés aux critères de décision afin de classer le danger et le risque d’exposition de chaque substance comme étant faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex. cohérence de la classification, marge d’exposition) pour améliorer les classifications préliminaires de danger ou d’exposition. Toutefois, dans le cas des UVCB, les profils de danger et d’exposition n’ont pas pu être entièrement établis en raison de l’absence d’une structure représentative permettant d’estimer les propriétés désirées et les données empiriques manquantes sur ces propriétés. Par conséquent, nous avons réalisé une classification manuelle du danger et de l’exposition en étudiant les composants des UVCB et les données recueillies lors des enquêtes menées en vertu de l’article 71 de la LCPE, et les décisions prises sont fondées sur l’examen de substances similaires et le recours au jugement d’un spécialiste.
Une matrice des risques a été utilisée pour classer le risque associé à chaque substance comme étant faible, modéré ou élevé, suivant la classification du danger et de l’exposition. Les classifications du risque obtenues à l’aide de la CRE ont subi une vérification en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (qui passe de modérée ou élevée à faible) des substances dont l taux d’émission dans l’eau est estimé bas après le traitement des eaux usées, ce qui constitue un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classification faibles à la lumière de scénarios de risques relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si la catégorisation du risque devrait être rehaussée.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une surcatégorisation ou d’une sous-catégorisation du danger, de l’exposition et du risque subséquents. Les approches équilibrées utilisées pour réduire les incertitudes sont décrites en détail dans ECCC (2016a). Dans ce qui suit, nous décrivons deux des zones d’incertitudes les plus importantes. Les valeurs erronées de toxicité aiguë empirique ou modélisée peuvent provoquer un changement de la classification du danger, en particulier dans le cas des paramètres reposant sur des valeurs de résidus dans les tissus (p. ex. mode d’action toxique), dont un grand nombre sont prédites à partir d’une modélisation de la (Q)SAR (boîte à outils QSAR de l’OCDE, 2016). La fréquence de ce type d’erreur est toutefois atténuée parce qu’une surestimation de la CL50 donnera une valeur prudente (protectrice) de résidus dans les tissus qui servira à l’analyse des résidus corporels critiques. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres du danger tels que la structure associée au mode d’action, la réactivité ou l’affinité de liaison aux œstrogènes. Les changements ou les erreurs touchant les quantités de substances chimiques peuvent conduire à des classifications différentes de l’exposition, la classification de l’exposition et du risque étant très sensible à la vitesse d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu de l’estimation des quantités utilisées actuellement, et pourraient ne pas rendre compte des tendances futures.
Les données critiques et les éléments sur lesquels nous avons élaboré les profils des substances du groupe des acides gras et dérivés ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Les classifications du danger et de l’exposition des substances du groupe des acides gras et dérivés sont résumées au tableau 5-1.
Nom commun |
Classification du danger à l’aide de la CRE |
Classification de l’exposition à l’aide de la CRE |
Classification du risque à l’aide de la CRE |
|---|---|---|---|
Acide undécylénique |
faible |
faible |
faible |
AAL |
élevé |
faible |
faible |
Huile d’abrasin |
faible |
élevé |
faible |
Acides gras de tallöl |
faible |
faible |
faible |
Sels de potassium d’acides gras de tallöl |
faible |
faible |
faible |
Huile d’onagre |
élevé |
faible |
faible |
Trimères d’acides gras |
faible |
faible |
faible |
Dimères d’acides gras |
faible |
faible |
faible |
Cocoate d’éthylhexyle |
faible |
faible |
faible |
Comme ils présentent un danger et une exposition faibles selon la CRE, l’acide undécylénique, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, les trimères et dimères d’acides gras et le cocoate d’éthylhexyle ont été classés comme présentant un faible potentiel de risque pour l’environnement. On a déclaré l’importation ou la fabrication de quantités élevées d’acides gras de tallöl et de quantités mdérées sels de potassium d’acides gras de tallöl, toutefois la CRE leur attribue chacun un potentiel d’exposition faible, étant donné leur faible persistance globale. De plus, de nouveaux renseignements ont été examinés à la suite de la période de consultation publique sur l’ébauche d’évaluation préalable sur les acides gras de tallöl et les sels de potassium d’acides gras de tallöl. Par conséquent, le danger associé à ces substances selon la CRE est passé d’élevé à faible en fonction d’un mode d’action narcotique et du faible potentiel d’effets nocifs sur les réseaux trophiques aquatiques d’après le potentiel de bioaccumulation. Il est donc peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
L’AAL et l’huile d’onagre ont été classés comme ayant un faible potentiel d’exposition pour l’environnement d’après la CRE. Ces substances ont été classées comme ayant un potentiel élevé de danger selon la CRE, compte tenu de leur mode d’action réactifNote de bas de page 8 et du risque accru d’effets nocifs sur les réseaux trophiques aquatiques et terrestres attribuables au potentiel de bioaccumulation. Les alertes structurales de la boîte à outils de l’OCDE ont permis de relever que l’AAL et l’huile d’onagre pourraient se lier à l’ADN ou à des protéines. Ces deux substances ont d’abord été classées comme présentant un potentiel modéré de risque pour l’environnement, mais cette catégorisation a été revue à la baisse (potentiel faible) à la suite d’une correction reposant sur les quantités actuellement utilisées (voir section 7.1.1. du document ECCC, 2016a). Les effets potentiels et leur manifestation dans l’environnement n’ont pas été examinés en profondeur, compte tenu de la faible exposition à ces substances. Au vu des profils actuels d’utilisation, il est peu probable que ces substances soulèvent des préoccupations à l’égard de l’environnement au Canada.
D’après la CRE, l’huile d’abrasin a été catégorisée comme ayant un potentiel d’exposition élevé, en raison des quantités modérées utilisées et d’une marge élevée d’exposition. Selon la CRE, la substance a été classée comme présentant un faible potentiel de danger et, par conséquent, un faible potentiel de risque pour l’environnement. Il est peu probable que cette substance soit préoccupante pour l’environnement au Canada.
6. Risque d’effets nocifs sur la santé humaine
6.1 Aperçu et approche
Les études de toxicité existantes indiquent la faible toxicité aiguë de plusieurs des acides gras et de leurs sels. Les DL50 estimées des sept substances du groupe pour les animaux de laboratoires sont supérieures à 2 000 mg/kg p.c. par la voie orale, et supérieures à 3 000 mg/kg p.c. par la voie cutanée (HERA, 2002). Même si les profils de prédiction de la boîte à outils de l’OCDE ont permis d’établir que l’AAL et l’huile d’onagre sont des substances pouvant se lier à l’ADN compte tenu de leur structure, les prédictions (Q)SAR de génotoxicité tirées de la base de données (Q)SAR du Danemark (2015) pour l’AAL et les principaux composants de l’huile d’onagre étaient négatives. En outre, l’OCDE (2014) n’a découvert aucune propriété indiquant un risque d’effets systémiques sur la santé humaine ou d’activité mutagène ou clastogène chez l’AAL, un acide gras essentiel pour les humains et principal composant de l’huile d’onagre ainsi que chez 78 autres acides gras composants de ladite huile. Étant donné l’apparente toxicité faible de certains acides gras et de leurs dérivés déterminée par des études de toxicité à doses aiguës et avec doses répétées, l’AAL, l’huile d’abrasin, l’huile d’onagre, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl et les dimères et trimères d’acides gras ont fait l’objet d’une évaluation qualitative (voir la section 6.3). Les deux autres substances, soit l’acide undécylénique et le cocoate d’éthylhexyle, sont plus complexes et sont décrites en détail à la section 6.4.
En l’absence de données sur les UVCB, les données sur les principaux composants (voir le tableau A-1 de l’annexe A) et les produits d’hydrolyse potentiels sont celles qui ont guidé la caractérisation des effets possibles des substances du groupe des acides gras et dérivés sur la santé.
6.2 Renseignements généraux sur les substances du groupe des acides gras et dérivés
Milieux naturels
Aucune donnée empirique n’a été trouvée sur la présence de ces substances dans les milieux naturels au Canada ou ailleurs. En général, en raison des propriétés physicochimiques et des profils actuels d’utilisation, les acides gras du groupe des acides gras et dérivés sont rarement présents dans l’air, mais ils peuvent l’être dans l’eau à la suite de rejet industriel ou de l’utilisation de produits de consommation (rejet à l’égout). Cependant, l’exposition de la population générale aux substances du groupe des acides gras et dérivés dans les milieux naturels ne devrait pas être préoccupante.
Données générales sur la toxicocinétique et le métabolisme des acides gras
Il n’existe aucune donnée de toxicocinétique propre aux substances du groupe des acides gras et dérivés, hormis l’AAL pour lequel nous en avons trouvé quelques renseignements. La longueur de la chaîne et le nombre d’instaurations des acides gras influencent l’absorption des graisses. Les acides gras à courte chaîne sont absorbés en proportion beaucoup plus grande que les acides gras à longue chaîne, car ils peuvent se solubiliser dans la phase aqueuse du contenu gastro-intestinal (Ramírez et coll., 2001).
L’absorption cutanée des acides gras a tendance à diminuer à mesure que la longueur de la chaîne augmente (Howes, 1975). Une étude in vitro réalisée avec de la peau humaine a confirmé la pénétration de plusieurs composants d’acides gras (p. ex. acide oléique, linoléique, laurique et caprique, Kezutyte et coll., 2013). Un modèle in vitro a permis de prédire une absorption cutanée à 100 % de l’acide α-linolénique (NR CAS 463‑40‑1) (Buist et coll., 2010; Kim et coll., 2014). Toutefois, l’absorption cutanée prédite du cocoate d’éthylhexyle était très faible, de l’ordre de 1,26 × 10-5 à 4,46 × 10-5 mg/cm²/application (dossier de l’ECHA, c2007-2017d). Les différences observées dans les propriétés physicochimiques des acides gras pourraient jouer un rôle dans leur affinité pour les lipides de la peau et leur mécanisme d’action (Kezutyte et coll., 2013).
6.3 AAL, huile d’abrasin, huile d’onagre, acides gras de tallöl, sels de potassium d’acides gras de tallöl, dimères et trimères d’acides gras
Il n’existe pas de catégorisation internationale visant la cancérogénicité, la génotoxicité, la toxicité pour le développement ou la pour l’AAL, l’huile d’abrasin, l’huile d’onagre, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, et les dimères et trimères d’acides gras. Les études publiées sur la toxicité à doses répétées administrées par voie orale et cutanée montrent une faible toxicité des acides gras et de leurs sels (HERA, 2002). L’OCDE a mené une évaluation des effets sur la santé humaine d’un groupe de 78 acides gras homologues à chaîne droite d’origine naturelle et d’un petit nombre de sels et d’esters d’acides gras simultanément, notamment l’AAL et huit principaux composants des UVCB de la présente évaluation (voir l’annexe A). En outre, l’OCDE (2014) a ajouté les acides gras de tallöl (NR CAS 61790‑12‑3) à la liste des substances complémentaires permettant d’éclairer l’évaluation des acides gras à chaîne droite. Les effets nocifs des acides gras et de leurs dérivés n’ont été observés qu’à des doses élevées d’exposition (p. ex. supérieures à 3 000 mg/kg p.c./jour). C’est pourquoi que l’on peut considérer que l’AAL, l’huile d’abrasin, l’huile d’onagre, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl et les dimères et trimères d’acides gras présentent un faible potentiel de danger.
6.3.1 Acide alpha-linolénique (AAL)
La population générale du Canada pourrait être exposée à l’AAL présent naturellement dans les aliments et entrant dans la composition d’emballages alimentaires, de cosmétiques, de produits de santé naturels vendus sans ordonnance, de certains fongicides, de carburants, de lubrifiants et graisses et de peintures et revêtements.
L’AAL est un acide gras essentiel n-3 ou oméga-3 polyinsaturé qui ne peut être synthétisé par les humains (IOM, 2005; FAO, 2010).
L’Institute of Medicine (IOM) des États-Unis a établi un apport nutritionnel de référence d’AAL, en particulier un apport suffisant, qui a été adopté par Santé Canada (Santé Canada, 2010). L’apport suffisant pour les divers groupes d’âge varie de 0,5 g/jour pour les nourrissons (de 0 à 12 mois) (selon l’apport provenant du lait maternel et d’aliments complémentaires) à 1,1 et 1,6 g/jour pour les femmes et les hommes âgés de 14 ans et plus, respectivement. Ces apports suffisants ont été calculés en fonction d’un apport qui soutient une croissance et un développement neuronal normaux et qui n’entraîne aucune carence en nutriments. Actuellement, il n’existe aucun apport maximal tolérable de l’AAL (IOM, 2005).
On ne dispose d’aucune étude de génotoxicité ou étude de toxicité à doses répétées pour l’AAL. Toutefois, il existe plusieurs études sur les effets bénéfiques de l’AAL chez l’humain utilisé à des fins nutraceutiques ou pharmaceutiques. L’OCDE (2014) a examiné les effets nocifs possibles sur la santé humaine de l’AAL en même temps que ceux d’un groupe de 78 acides gras homologues à chaîne droite d’origine naturelle. Selon l’OCDE, l’AAL, un acide gras non ramifié en C18, ne possède pas de propriétés indiquant un danger d’effets généraux sur la santé humaine ou d’activité mutagène ou clastogène, d’après les données toxicologiques d’un autre acide gras en C18, soit l’huile d’abrasin. Même si les alertes structurales de la boîte à outils QSAR de l’OCDE ont déterminé que l’AAL et l’huile d’onagre sont des substances pouvant se lier à l’ADN, les prédictions de mutagénicité négative de l’AAL issues des quatre principaux modèles et des résultats du test d’Ames effectué sur Salmonella typhimurium tirés de la base de données (Q)SAR du Danemark (2015) indiquent que son potentiel de mutagénicité est faible.
La base de données sur le danger est réduite, mais les données existantes indiquent que le potentiel de danger et le risque pour la santé humaine sont faibles.
6.3.2 Huile d’abrasin
La population générale du Canada pourrait être exposée à l’huile d’abrasin présente dans les emballages alimentaires, les peintures et revêtements et les lubrifiants et graisses.
L’acide α-éléostéarique (NR CAS 506‑23‑0, presque 80 % de l’huile d’abrasin), le principal constituant de l’huile d’abrasin, se transforme en acide linoléique conjugué (ALC 9Z11E‑18:2) dans le foie et le plasma chez le rat (Tsuzuki et coll., 2004). Se fondant sur des études menées avec des animaux, l’Autorité européenne de sécurité des aliments (2010a) a déterminé que l’huile riche en acide linoléique conjuguée (ALC) ne représentait pas un risque de génotoxicité, de toxicité pour la reproduction ou de cancérogénicité. En outre, on a déterminé que l’acide α‑éléostéarique possèdait une activité antitumorigène dans les cellules cancéreuses et dans des modèles animaux. Une étude in vitro récente a révélé que l’acide α‑éléostéarique inhibait la croissance et induisait l’apoptose dans des cellules tumorales mammaires humaines (Zhou et coll., 2014). Dans une étude in vivo, Tsuzuki et coll. (2004) ont fait état d’un effet antitumorigène puissant de l’acide α‑éléostéarique dans des cellules tumorales du colon humain transplantées dans des souris nues.
Des rats sevrés et des rats adultes des deux sexes ont reçu de l’huile d’abrasin par gavage à raison de 74 960 ou 10 708 mg/kg p.c./jour, respectivement, pendant 14 jours. Tous les rats sevrés sont morts au 5e jour, et 50 % des rats adultes sont décédés à la fin de l’étude. Le même effet a été observé chez les rats adultes à partir du 3e jour du traitement. Cependant, l’autopsie n’a révélé aucune lésion macroscopique ou changement pathologique. La dose minimale avec effet nocif observé (DMENO) se rapportant à la mortalité des rats adultes était de 10 708 mg/kg p.c./jour (McPherson, 1973). Lorsque les rats ont été traités avec l’huile d’abrasin administrée à la concentration de 6 000 à 14 400 mg/kg p.c./jour dans l’alimentation pendant 28 jours, on a observé une augmentation du cholestérol sérique. Aucun autre effet sur la santé n’a été déclaré par l’auteur (Hegstead et coll., 1957).
La base de données sur le danger est réduite, mais les données existantes indiquent que le potentiel de danger et le risque pour la santé humaine de l’huile d’abrasin sont faibles.
6.3.3 Huile d’onagre
La population générale du Canada est exposée à l’huile d’onagre présente dans des cosmétiques et des produits de santé naturels.
Il n’existe aucune étude de génotoxicité sur l’huile d’onagre. Toutefois, se fondant sur une étude de génotoxicité in vitro, l’OCDE (2014) conclut que l’acide linoléique (NR CAS 60‑33‑3), le principal constituant de l’huile d’onagre (70 % à 77 %) n’est pas mutagène.
Dans des études à long terme dans lesquels des rats SD des deux sexes ont reçu de l’Efamol, un produit à base d’huile d’onagre contenant 70 % à 73 % d’acide linoléique, par gavage, à la dose de 0, 0,3, 1,0 ou 2,5 mL/kg p.c./jour (équivalant à 0, 279, 928 ou 2 321 mg/kg p.c./jour d’huile d’onagre) durant 53 semaines, on n’a trouvé aucun effet nocif d’importance par rapport aux témoins (Everett et coll., 1988a, cité dans NTP 2009; EMA, 2011). En outre, l’Efamol n’a pas entraîné de différences considérables dans la nature ou la fréquence des tumeurs entre les animaux traités et les animaux témoins lorsque les rats SD ont reçu le même schéma posologique durant 104 semaines ou, dans le cas des souris CD‑1, durant 78 semaines (DSENO = 2 321 mg/kg p.c./jour, Everett et coll., 1988b, cité dans NTP, 2009 et EMA, 2011). Lorsqu’on a administré à des rats mâles F344/DuCrj de l’huile d’onagre à la dose de 5 233 mg/kg p.c./jour dans leur alimentation (seule dose à l’étude) durant 15 semaines, le seul effet observé était une augmentation de la concentration de cholestérol (DSENO = 5 233 mg/kg p.c./jour, Fukushima et coll., 2001).
Plusieurs études réalisées avec des animaux indiquent qu’un supplément d’huile d’onagre ajouté à l’alimentation n’a eu aucun effet sur la mise bas, le poids de la mère ou le poids à la naissance, la vitesse de croissance postnatale, la concentration de prostaglandine E2 du fœtus ou du placenta (NTP, 2009). Après l’exposition de rats Wistar à de l’huile d’onagre ajoutée à l’alimentation à la concentration de 0 ou 1 543 mg/kg p.c./jour pendant cinq semaines jusqu’à l’accouplement, on n’a relevé aucun effet sur la mise bas, le poids à la naissance, la vitesse de croissance postnatale ou le poids de la mère (DSENO = 1 543 mg/g p.c./jour, Leaver et coll., 1986, cité dans NTP, 2009). Certaines études montrent que l’exposition à l’huile d’onagre pourrait être bénéfique à la reproduction et au développement, car la fonction reproductive des mâles et la survie des nouveau-nés seraient augmentées (NTP, 2009).
L’acide oléique (NR CAS 112‑80‑1), l’acide palmitique (NR CAS 57‑10‑3) et l’acide linoléique (NR CAS 60‑33‑3), principaux constituants de l’huile d’onagre, ne possèdent pas de propriétés indiquant un risque d’effets généraux sur la santé humaine, d’après l’OCDE (2014). La base de données sur le danger est réduite, mais les données existantes indiquent que le potentiel de danger et le risque pour la santé humaine de l’huile d’onagre sont faibles.
6.3.4 Acides gras de tallöl et sels de potassium d’acides gras de tallöl
La population générale du Canada peut être exposée aux acides gras de tallöl présents dans les emballages alimentaires, quelques produits pharmaceutiques, ainsi que les cosmétiques. Ces acides gras sont aussi utilisés par les consommateurs canadiens dans des adhésifs et des produits d’étanchéité, des matériaux pour les bâtiments et la construction, des produits de nettoyage et d’entretien du mobilier, des produits d’entretien des voitures, des lubrifiants et graisses et des produits agricoles.
Les sels de potassium d’acides gras de tallöl peuvent entrer dans la composition d’emballages alimentaires utilisés à diverses fins commerciales et industrielles, et peuvent être présents comme constituant des additifs indirects (nettoyants pour les surfaces en contact avec les aliments qui doivent être rincées à l’eau potable).
On ne dispose d’aucune étude de toxicité portant uniquement sur les sels de potassium d’acides gras de tallöl. Dans le cas des acides gras en général, les formes salines acides et alcalines d’un même acide gras devraient toutefois partager bon nombre de propriétés physicochimiques et toxicologiques semblables lorsqu’elles sont biodisponibles (HERA, 2002). Par conséquent, on s’attend à ce que les effets sur la santé potentiels induits par les sels de potassium d’acides gras de tallöl soient semblables à ceux des acides gras de tallöl. En outre, la contribution du cation du sel de l’acide gras, l’ion potassium dans le cas qui nous concerne, ne devrait pas s’ajouter de façon excessive à la charge normale de l’organisme, pour ce qui est d’induire des effets sur la santé aux niveaux actuels d’exposition. Par conséquent, les effets sur la santé potentiels induits par l’ion potassium dissocié des sels de potassium d’acides gras de tallöl ne feront pas l’objet de la présente évaluation.
Les acides gras de tallöl n’étaient pas mutagènes dans des souches de Salmonella typhimurium (OCDE, 2014) et n’étaient pas clastogènes ni dans les lymphocytes humains ni dans les cellules d’ovaire de hamsters chinois, en présence ou en absence d’une activation métabolique (ECHA c2007-2017e).
Dans une étude menée sur deux générations, on a administré à des rats des deux sexes (souche non précisée) 0, 5 ou 10 % d’acides gras de tallöl dans l’alimentation (équivalant à 0, 2 500 ou 5 000 mg/kg p.c./jour). La génération F0 a été exposée de l’âge de 80 jours à 100 jours et durant la période de sevrage de la première génération (F1). Après le sevrage, 20 mâles et 20 femelles de la F1 par groupe ont continué à recevoir la même alimentation que les parents. À l’âge de 100 jours, ces rats on a permis aux rats de s’accoupler et ont eu des petits (F2). Le traitement n’a eu aucun effet sur le nombre de petits vivants à la naissance ou mort-nés et sur le nombre de portées de la F1 ni sur le poids au sevrage de la F1. On n’a signalé aucun changement lié au traitement sur les indices de fertilité, de viabilité, de lactation ou de gestation. Les paramètres hématologiques, de biochimie clinique et d’analyse d’urine sont demeurés les mêmes, et l’examen pathologique macroscopique et microscopique n’a révélé aucun effet lié au traitement (DSENO pour la toxicité sur la reproduction ≥ 5 000 mg/kg p.c./jour, OCDE, 2014).
Dans une étude de 90 jours effectuée sur des rats des deux sexes (souche non précisée), ont reçu dans leur alimentation des acides gras de tallöl à la dose de 0, 5, 10 ou 25 % (équivalant à 0, 2 500, 5 000 ou 12 500 mg/kg p.c./jour). Aucun effet lié au traitement n’a été constaté dans les groupes traités. Une DSENO de 2 500 mg/kg p.c./jour a été trouvée par l’OCDE (2014) d’après la légère diminution de la consommation d’aliments dans le groupe ayant reçu la dose moyenne et celui ayant reçu la dose élevée. Des rats SD mâles ont reçu un distillat d’acides gras de tallöl dans leur alimentation pendant 28 jours à raison de 0, 15, 30 ou 60 % (équivalant à 0, 7 500, 15 000 ou 30 000 mg/kg p.c./jour). On a signalé une baisse considérable de la vitesse de croissance accompagnée d’une légère diminution de la consommation d’aliments chez les rats traités avec 15 000 mg/kg p.c./jour d’acides gras de tallöl. Tous les dix animaux du groupe ayant reçu la dose élevée sont morts dans les quatre premiers jours (Seppanen, 1969). L’OCDE (2014) a établi que l’acide oléique et l’acide linoléique, les principaux composants des acides gras de tallöl, ne possédaient pas de propriétés indiquant un risque d’effets généraux sur la santé humaine. La base de données sur les dangers est limitée, mais les données existantes indiquent que les acides gras de tallöl et les sels de potassium d’acides gras de tallöl présentent un potentiel de danger et des risques pour la santé humaine faibles.
6.3.5 Dimères et trimères d’acides gras
La population générale du Canada peut être exposée aux dimères d’acides gras présents dans les emballages alimentaires utilisés à des fins industrielles ou commerciales, certains produits de soins personnels et une huile d’un filtre à air spécialisé vendu aux consommateurs (FS, 2016). Les dimères d’acides gras peuvent aussi entrer dans la composition d’un additif indirect (lubrifiant pour les surfaces non alimentaires), mais il ne devrait pas y avoir d’exposition à partir de ce produit.
Au Canada, les trimères d’acides gras ne sont utilisés dans aucun produit offert aux consommateurs, mais ils ont plusieurs utilisations industrielles ou commerciales.
Les dimères d’acides gras contiennent deux molécules d’acide gras, des acides dicarboxyliques et sont obtenus par la dimérisation d’acides gras insaturés. On peut pousser la réaction chimique pour former des trimères d’acides gras qui contiennent trois molécules d’acide gras. Les produits commerciaux contiennent surtout des dimères (C16‑18), mais les dimères d’acides gras comprennent aussi différentes proportions de trimères d’acides gras (dossier de l’ECHA, c2007-2017c) et vice versa. Il n’existe aucune étude sur la toxicité des trimères d’acides gras. Les données toxicologiques sur les dimères d’acides gras ont donc servi à éclairer la caractérisation des dangers des trimères d’acides gras, compte tenu des similitudes de leurs propriétés physicochimiques.
Dans des essais in vitro, avec ou sans activation métabolique, les dimères d’acides gras ont donné un résultat négatif dans les essais de mutation génique réalisés sur des souches de Salmonella typhimurium ou des lignées cellulaires de lymphome de souris. Ils ont aussi donné un résultat négatif dans les essais d’aberration chromosomique effectués avec des lymphocytes humains (US EPA, 2005).
Dans une étude sur la toxicité pour la reproduction, on a administré à des rats SD des deux sexes des dimères d’acides gras dans leur alimentation à une concentration de 0, 200, 2 000, ou 20 000 ppm (concentration équivalente à 0, 15/17, 145/169 ou 1 450/1 692 mg/kg p.c./jour, mâles ou femelles). Les mâles ont reçu des doses pendant au moins quatre semaines, à partir de la deuxième semaine précédant l’accouplement, et les femelles ont reçu leur traitement deux semaines avant l’accouplement jusqu’au sixième jour de lactation, au minimum. On a noté une légère diminution du gain de poids (statistiquement non significative) et une augmentation de la piloérection (absence de relation dose-réponse) chez les rats parents des groupes ayant reçu la dose élevée. On n’a relevé aucun effet à la naissance et sur les naissances vivantes, la taille et le poids des portées, le poids des petits, la viabilité, ni aucune anomalie externe visible chez tous les petits. Il n’y avait aucun effet manifeste signalé chez les mères dans cette étude (DSENO mères/développement = 1 450/1 692 mg/kg p.c./jour, US EPA, 2005).
Dans une étude de 90 jours, des rats SD ont été traités avec des dimères d’acides gras ajoutés à leur alimentation à la concentration de 0, 0,1, 1 ou 5 % (équivalant à 0, 74/90, 740/854 ou 3 591/4 085 mg/kg p.c./jour, mâles/femelles). À la dose de 3 591/4 085 mg/kg p.c./jour (mâle/femelle), on a constaté des changements hystopathologiques, comme une agrégation des macrophages dans les nœuds lymphatiques mésentériques, des variations statistiquement significatives de plusieurs paramètres de biochimie clinique, et une diminution considérable du poids absolu et relatif de la rate et du foie chez les deux sexes (DSENO = 740/854 mg/kg p.c./jour, US EPA, 2005).
Dans le volet I des évaluations des risques pour la santé humaine posés par plusieurs substances chimiques réalisées par le ministère australien de la Santé (AGDH, 2017), les dimères d’acides gras ont été recensés comme étant l’un des produits chimiques ne présentant aucun risque grave pour la santé des travailleurs et de la population générale. La base de données sur les dangers est limitée, mais les données existantes indiquent que les dimères et les trimères d’acides gras présentent un potentiel de danger et des risques pour la santé humaine faibles.
6.4 Acide undécylénique et cocoate d’éthylhexyle
6.4.1 Acide undécylénique
6.4.1.1 Évaluation de l’exposition
Milieux naturels et aliments
Nous n’avons retrouvé aucune donnée empirique sur la présence de l’acide undécylénique dans l’air, l’eau, le sol, les sédiments ou la poussière au Canada ou dans d’autres pays. On n’a pas déclaré d’utilisation de cet acide dépassant le seuil de déclaration de 100 kg en réponse à l’avis émis en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Par conséquent, on ne prévoit aucune exposition à l’acide undécylénique dans les milieux naturels (voir section 6.2).
L’acide undécylénique est utilisé comme aromatisant dans des boissons alcoolisées, des produits de boulangerie, des produits laitiers congelés, des gélatines ou des poudings, des sauces, des produits de viande, des boissons non alcoolisées et des bonbons mous (Burdock, 2010). Le Comité mixte FAO/OMS d’experts sur les additifs alimentaires (JECFA) a évalué 42 aromatisants, dont des esters connexes, des acides, des aldéhydes et des alcools non conjugués et insaturés à chaîne aliphatique linéaire ou ramifiée (OMS, 1999). Dans le cadre de cette évaluation, le Comité estimait que l’absorption d’acide undécylénique par personne découlant de l’utilisation comme aromatisant alimentaire était de 0,01 µg/kg p.c./jour pour la population des États‑Unis et de 0,5 µg/kg p.c./jour pour la population européenne. Ces estimations de l’absorption, obtenues à l’aide d’une approche de l’absorption quotidienne maximisée calculée à partir de données d’enquête, ont été déterminées en présumant que la production annuelle d’acide undécylénique déclarée aux États‑Unis et en Europe était consommée par seulement 10 % de la population (« consommateurs uniquement »), et que seulement 60 % de la production annuelle avait été déclarée dans les collectes de données menées sur les quantités (International Organization of the Flavor Industry, 1995; US National Academy of Sciences, 1989, toutes deux citées dans OMS, 1999).
Produits de consommation
L’acide undécylénique est actuellement présent dans des produits de santé naturels comme ingrédient médicinal ou non médicinal (BDPSNH [modifiée en 2018]). Un produit destiné à l’administration par voie orale a été repéré comme contenant de l’acide undécylénique comme ingrédient non médicinal, et l’exposition quotidienne estimée à ce produit varie de 0,42 à 0,63 mg/kg p.c./jour (voir l’annexe B). Les produits topiques recensés comme contenant de l’acide undécylénique comme ingrédient non médicinal sont couverts par les estimations d’exposition à des cosmétiques décrits ci‑dessous.
Il a été établi que l’acide undécylénique est présent dans plusieurs cosmétiques au Canada, dont des hydratants pour le visage et le corps, des shampoings, du maquillage, des nettoyants pour le visage et le corps et des revitalisants pour les ongles (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, daté du 22 avril 2016; sans référence). On trouvera au tableau 6‑1 un résumé des scénarios d’exposition sentinelle s’appliquant aux cosmétiques contenant de l’acide undécylénique. Le logiciel ConsExpo Web a servi à estimer l’exposition aux cosmétiques (ConsExpo Web, 2016), et les renseignements sur les paramètres utilisés pour la modélisation sont présentés à l’annexe B. Les estimations de l’exposition par voie cutanée présentées au tableau 6‑1 représentent des doses d’exposition externe. Comme on n’a repéré aucune donnée sur l’absorption cutanée de l’acide undécylénique et compte tenu de ses propriétés physicochimiques (faible poids moléculaire, log Koe modéré), on a présumé une absorption cutanée de 100 %.
Scénario de produit |
Gamme de concentration |
Estimation de l’exposition cutanée des adultes (mg/kg p.c./jour) |
Estimation de l’exposition cutanée des nourrissons (mg/kg p.c./jour) |
|---|---|---|---|
Lotion pour le corps |
0,0025 % |
0,0017 |
0,0079 |
Lotion pour le corps spécialiséea |
0,3 % – 1 % |
0,093 – 0,31 |
S.O. |
Hydratant pour le visage |
0 % – 0,1 % |
0 – 0,03 |
S.O. |
Maquillage |
0,0011 % – 0,3 % |
0,0001 – 0,028 |
S.O. |
Revitalisant pour les ongles |
3 % – 10 % |
0,04 – 0,14 mg/kg-p.c. par application |
S.O. |
Abréviation : S.O. = sans objet
a Lotions pour le corps spécialisées pour apaiser et réchauffer, destinées aux adultes uniquement (pour les pieds et les jambes)
6.4.1.2 Évaluation des effets sur la santé
L’acide undécylénique n’a pas induit de mutations géniques dans les études réalisées in vitro, avec ou sans activation métabolique, sur des souches de Salmonella typhimurium ou des lignées cellulaires de lymphome de souris. Il n’a pas non plus produit d’aberrations chromosomiques dans les lymphocytes humains ni causé des lésions à l’ADN dans les hépatocytes de rats (dossier de l’ECHA, c2007-2017a). Dans une étude in vivo, l’acide undécylénique n’a pas induit de formation de micronoyaux dans la moelle osseuse de souris ayant reçu des doses administrées par gavage pouvant aller jusqu’à 4 000 mg/kg (dossier de l’ECHA, c2007-2017a). On n’a relevé aucune étude sur la cancérogénicité de l’acide undécylénique.
Dans une étude sur la toxicité pour le développement prénatal, des rates SD gravides ont été traitées avec de l’acide undécylénique à la dose de 0, 150, 450 ou 750 mg/kg p.c./jour par gavage, du 6e au 20e jour de gestation (15 jours). Toutes les rates du groupe ayant reçu 450 mg/kg p.c./jour présentaient une hypersalivation et un gain de poids corporel considérablement réduit par rapport aux témoins. On n’a pas observé d’embryotoxicité ou de tératogénicité. La dose la plus élevée, soit 750 mg/kg p.c./jour, a été éliminée de l’étude en raison de la mortalité élevée chez les mères (DSENO pour la tératogénicité = 450 mg/kg p.c./jour, DSENO pour la toxicité des mères = 150 mg/kg p.c./jour, DMENO pour la toxicité des mères = 450 mg/kg p.c./jour pour l’hypersalivation et le gain de poids corporel réduit, dossier de l’ECHA, c2007-2017a). Dans une étude sur la toxicité pour le développement et la reproduction, on a administré de l’acide undécylénique à des rats SD des deux sexes à raison de 0, 50, 150 ou 450 mg/kg p.c./jour par gavage. Les mâles ont reçu le traitement deux semaines avant l’accouplement, et pendant la période d’accouplement (deux semaines) jusqu’à leur euthanasie (au moins quatre semaines au total). Les femelles ont été traitées deux semaines avant l’accouplement, pendant la période d’accouplement (deux semaines), et au cours de la période de gestation et de lactation jusqu’au 4e jour post-partum. Aucun des paramètres liés à la reproduction ou au développement examinés n’a varié. Deux mâles du groupe ayant reçu la dose élevée sont morts au 3e jour et deux, au 35e jour, sans signes cliniques de toxicité ante-mortem. Une DMENO de 450 mg/kg p.c./jour a été déterminée en fonction de la mortalité dans le groupe des mâles ayant reçu la dose élevée (DSENO pour l’effet parental = 150 mg/kg p.c./jour, DSENOF1 = 450 mg/kg p.c./jour, DSENO pour le rendement de la reproduction = 450 mg/kg p.c./jour; dossier de l’ECHA, c2007-2017a). Lorsque les rats ont reçu par voie orale de l’acide undécylénique à raison de 0, 100, 200 ou 400 mg/kg p.c./jour durant neuf mois par gavage et qu’ils ont été par la suite accouplés, on n’a constaté aucune anomalie dans les portées, ni signe de toxicité chez les rats parents (dossier de l’ECHA, c2007-2017a).
Dans une étude de 90 jours portant sur le sel de sodium de l’acide undécylénique (pas de NR CAS mentionné, mais présumément le 1002‑62‑6, dossier de l’ECHA, c2007-2017a), des rats SD des deux sexes ont reçu par gavage 0, 20, 60 ou 180 mg/kg p.c./jour durant 50 jours. Le groupe ayant reçu la dose de 180 mg/kg p.c./jour a été examiné au 50e jour, puis a reçu une dose supplémentaire de 360 mg/kg p.c./jour durant 40 jours (groupes ayant reçu 180 ou 360 mg/kg p.c./jour), puis a bénéficié d’une période de rétablissement de quatre semaines. Les signes cliniques dépendants de la dose ayant été déclarés étaient les suivants : ptyalisme, respiration bruyante, difficultés respiratoires et piètre état clinique. Un gain de poids corporel réduit chez les mâles, accompagné d’une baisse de la consommation des aliments dans les groupes ayant reçu la dose de 180 mg/kg p.c./jour et dans les groupes ayant reçu 180 ou 360 mg/kg p.c./jour ont été signalés. On a aussi fait état d’une glycémie réduite (réversible) et d’une concentration réduite des triglycérides (non réversible) chez les femelles des groupes ayant reçu 180 mg/kg p.c./jour ainsi que dans les groupes ayant reçu 180/360 mg/kg p.c./jour. On a observé un œdème et une infiltration de cellules de l’inflammation dans le préestomac dans les mêmes groupes traités. Une cardiomyopathie, se manifestant par une dégénérescence réversible du myocarde et une agrégation de cellules mononuclées, a été signalée chez les deux sexes dans les groupes ayant reçu 180 ou 360 mg/kg p.c./jour exclusivement. Une DMENO de 180 mg/kg p.c./jour (DSENO = 60 mg/kg p.c./jour) a été calculée pour le sel de sodium de l’acide undécylénique dans le dossier de l’ECHA (c2007-2017a), ce qui correspond, après conversion, à des doses équivalentes d’acide undécylénique de 160 mg/kg p.c./jour (DMENO) et de 53 mg/kg p.c./jour (DSENO), respectivement. Étant donné la rareté des études pertinentes sur les effets sur la santé de l’acide undécylénique, les données sur le danger tirées du dossier de l’ECHA ont servi à éclairer la caractérisation des effets critiques et des risques subséquents.
6.4.1.3 Caractérisation des risques pour la santé humaine
Le JECFA a estimé à l’aide de calculs l’absorption par sujet découlant de la présence possible d’acide undécylénique dans un aromatisant alimentaire à 0,01 µg/kg p.c./jour pour la population des États‑Unis et à 0,5 µg/kg p.c./jour pour la population européenne. Dans ses conclusions, le JECFA estime que l’utilisation d’acide undécylénique comme aromatisant n’est pas préoccupante, surtout parce qu’il devrait être oxydé en l’aldéhyde et l’acide carboxylique correspondants, qui sont complètement métabolisés dans les voies des acides gras et de l’acide tricarboxylique (OMS, 1999).
L’acide undécylénique n’était pas mutagène in vitro ni in vivo. Cet acide n’a pas induit d’effets sur la reproduction ou le développement à des doses orales pouvant aller jusqu’à 450 mg/kg p.c./jour chez les rats. Cependant, des effets chez les mères, comme l’hypersalivation, le gain moindre de poids corporel et la mort, sont apparus à cette dose. Par ailleurs, une étude menée sur 90 jours avec le sel de sodium de cet acide administré par voie orale révèle des changements liés au traitement, comme la variation de plusieurs paramètres de biochimie clinique et une baisse du gain du poids corporel, à une dose équivalente d’acide undécylénique de 160 mg/kg p.c./jour (considérée être la DMENO; DSENO = 53 mg/kg p.c./jour). Il a été jugé adéquat de recourir à des doses critiques issues d’une étude sur la toxicité orale du sel de sodium de l’acide undécylénique administré pendant 90 jours pour caractériser les risques pour la santé humaine associés à une exposition à cet acide. Cette approche est jugée prudente, car les sels d’acide gras ont généralement une plus grande biodisponibilité étant donné qu’ils sont plus solubles dans l’eau que les acides libres.
Aucune étude sur la toxicité par voie cutanée n’a été trouvée. Par conséquent, les doses critiques par voie orale ont été utilisées dans les scénarios d’exposition externe par voie cutanée présentés au tableau 6‑1, et on a présumé une absorption par voie cutanée de 100 %.
Le tableau 6‑2 présente toutes les valeurs sur l’exposition et le danger de l’acide undécylénique, ainsi que les marges d’exposition résultantes, nécessaires à la détermination du risque.
Scénario d’exposition |
Exposition générale |
Dose critique par voie orale |
Paramètre d’effet critique |
ME |
|---|---|---|---|---|
Ingrédient non médicinal dans un produit de santé naturel – oral |
0,42 – 0,63 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
84 – 126 |
Hydratant pour le corps (adultes) |
0,0017 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
31 176 |
Hydratant pour le corps (nourrissons) |
0,0079 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
6 709 |
Hydratant pour le corps spécialisé (adultes) |
0,093 – 0,31 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
172 – 570 |
Hydratant pour le visage |
0 – 0,03 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
1 767 |
Maquillage |
0,0001 – 0,028 mg/kg p.c./jour |
53 mg/kg p.c./jour (DSENO) |
Variation dans les paramètres cliniques, le poids corporel et les signes cliniques |
1 893 – 530 000 |
Revitalisant pour les ongles (par application) |
0,04 – 0,14 mg/kg p.c./jour |
150 mg/kg p.c./jour (DSENO) |
Effets généraux chez les parents |
1 071 – 3 750 |
Abréviation : DSENO = dose sans effet nocif observé
Compte tenu des paramètres prudents utilisés dans la modélisation de l’exposition et les conditions d’utilisation recommandées, le recours aux doses critiques du sel de l’acide undécylénique que l’on présume être absorbé en plus grande quantité que l’acide undécylénique en raison de sa plus grande solubilité, on a jugé que les marges calculées étaient suffisantes pour compenser les incertitudes présentes sans les bases de données sur les effets sur la santé et l’exposition.
6.4.1.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes figurent dans le tableau ci‑après.
Principales sources d’incertitudes |
Incidence |
|---|---|
L’absorption cutanée de l’acide undécylénique comporte une certaine incertitude, mais l’hypothèse de 100 % est jugée raisonnable, étant donné la taille de la molécule et le type de substance. |
+ |
Nous n’avons trouvé aucune étude à long terme d’exposition par voie orale, par inhalation ou voie cutanée. Il n’existe pas de données sur l’absorption par voie cutanée. |
+/- |
Le recours à une dose critique du sel de l’acide undécylénique pour caractériser les risques associés à cet acide comporte une certaine incertitude. |
+/- |
+ = incertitude accompagnée d’un risque de surestimation du risque d’exposition; - = incertitude accompagnée du risque de sous-estimation du risque d’exposition; +/- = risque inconnu de sur ou de sous-estimation du risque.
6.4.2 Cocoate d’éthylhexyle
6.4.2.1 Évaluation de l’exposition
Milieux naturels et aliments
Aucune donnée empirique sur la présence du cocoate d’éthylhexyle dans l’air, l’eau, le sol, les sédiments ou la poussière et les aliments n’a été trouvée pour le Canada ou un autre pays. Au vu des déclarations sur les quantités importées au Canada en 2011 (voir le tableau 4‑1), l’apport par l’eau potable a été estimé à l’aide du chiffrier pour l’eau potable de l’unité d’évaluation environnementale (Santé Canada, 2015), des vitesses prédites d’élimination par le système de traitement des eaux usées (SimpleTreat, 1997) et des données sur les quantités de substances au Canada (Environnement Canada, 2013). L’apport prédit de cocoate d’éthylhexyle provenant de rejets industriels et de rejets à l’égout potentiels dans l’eau potable était inférieur à 2,5 ng/kg p.c./jour et est donc considéré comme négligeable.
Cosmétiques
Au Canada, le cocoate d’éthylhexyle est principalement utilisé comme émollient dans les cosmétiques, dont des hydratants, des nettoyants, des revitalisants, du maquillage, des produits coiffants, des produits de rasage, des produits pour le bain et des produits de massage (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, datée du 22 avril 2016; sans référence). Le tableau 6‑4 résume les scénarios d’exposition sentinelle de cosmétiques contenant du cocoate d’éthylhexyle. Le logiciel ConsExpo Web a servi à estimer l’exposition attribuable aux cosmétiques (ConsExpo Web, 2016), et des renseignements sur les paramètres utilisés dans la modélisation sont présentés à l’annexe B.
Scénario de produit |
Gamme des concentrations |
Estimation de l’exposition cutanée des adultes (mg/kg p.c./jour)a |
Estimation de l’exposition générale par voie cutanée des adultes (mg/kg p.c./jour)b |
Estimation de l’exposition orale des tout‑petits (mg/kg p.c./jour)c |
|---|---|---|---|---|
Hydratant pour le corps |
1 % – 10 % |
0,68 – 6,8 |
0,041 à 0,41 |
S.O. |
Hydratant pour le visage |
0 % – 30 % |
9,1 |
0,55 |
S.O. |
Maquillage |
0,025 – 100 % |
0,00024 – 9,4 |
1,4 × 10-5 à 0,56 |
S.O. |
Huile capillaire |
10 % – 30 % |
2 – 6,1 |
0,12 à 0,37 |
S.O. |
Rouge ou brillant à lèvres |
0 % – 0,1 % |
0,00034 |
S.O. |
0,00065 |
Huile de massage (pour le corps)d |
0,1 – 0,3 % |
0,045 – 0,14 mg/kg p.c. par application |
0,0027 à 0,0084 mg/kg p.c. par application |
S.O. |
Abréviation : S.O. = sans objet
a Scénarios d’exposition par voie cutanée, à l’exception du rouge à lèvres, qui fait partie d’un scénario d’exposition par voie orale.
b Les expositions générales par voie cutanée ont été calculées à l’aide d’une valeur d’absorption cutanée de 6 %
c On a présumé une utilisation occasionnelle (non quotidienne) du rouge à lèvres par les tout‑petits.
d On a émis l’hypothèse que l’huile de massage n’était pas utilisée tous les jours. Par conséquent, l’exposition a été estimée en fonction de l’application (non quotidienne).
On a prédit que l’absorption cutanée du cocoate d’éthylhexyle variait entre 1,26 × 10-5 à 4,46 × 10‑5 mg/cm²/application (ECHA, c2007-2017d). Cependant, on ne dispose d’aucun détail sur la méthode utilisée pour calculer cette prédiction. Dans une étude in vivo menée chez le rat, l’absorption cutanée de 2‑éthylhexanol, l’un des produits de l’hydrolyse du cocoate d’éthylhexyle, se situait entre 5 % et 6 % après 96 heures d’exposition par voie cutanée (Deisinger et coll., 1994, cité dans EC, SC, 2011). Compte tenu des propriétés physicochimiques du cocoate d’éthylhexyle, l’absorption cutanée de cette substance devrait être inférieure à celle du 2‑éthylhexanol, une molécule plus petite et plus hydrophile que le cocoate d’éthylhexyle. Par ailleurs, le cocoate d’éthylhexyle peut être hydrolysé dans la couche cornée de l’épiderme (voir section 6.4.2.2). C’est pourquoi l’absorption cutanée de 6 % tirée de l’étude in vivo menée chez le rat avec le 2‑éthylhexanol a servi à estimer l’exposition générale au cocoate d’éthylhexyle administré par voie cutanée (voir tableau 6‑4).
6.4.2.2 Évaluation des effets sur la santé
On ne dispose d’aucune étude sur le cocoate d’éthylhexyle. En tant qu’ester d’acide gras, le cocoate d’éthylhexyle est rapidement hydrolysé par les sucs digestifs pour donner l’alcool et l’acide gras libre correspondants dans le tractus gastro-intestinal après une exposition par voie orale (Bookstaff et coll., 2003, cité dans ECHA, c2007‑2017f). C’est la raison pour laquelle les données existantes sur les effets sur la santé des produits d’hydrolyse du cocoate d’éthylhexyle et celles sur les principaux composants de ce dernier ont servi dans la présente évaluation à éclairer la caractérisation des effets sur la santé possibles du cocoate d’éthylhexyle.
Données sur la toxicité des produits d’hydrolyse du cocoate d’éthylhexyle
Le cocoate d’éthylhexyle peut être hydrolysé en acides gras et en 2‑éthyl-1-hexanol (2‑EH, NR CAS 104‑76‑7) après une absorption dans le tractus gastro-intestinal. Après une exposition par voie cutanée, l’absorption du 2‑EH était seulement de 5 % à 6 % chez le rat pendant les 96 premières heures (Deisinger et coll., 1994, cité dans EC, SC, 2011). Étant donné les profils actuels d’utilisation qui indiquent une exposition par voie cutanée, il est important d’examiner comment le cocoate d’éthylhexyle peut être métabolisé par les estérases de la peau. La majorité de l’activité estérase de la peau humaine se produit dans l’épiderme et les follicules pileux (Tokudome et coll., 2015), mais cette activité a aussi été décelée dans la couche cornée (Beisson et coll., 2001). Ces données laissent croire que le cocoate d’éthylhexyle peut être hydrolysé par des estérases dans la couche cornée pour produire du 2‑EH.
La DMENO de 150 mg/kg p.c./jour (DSENO = 50 mg/kg p.c./jour) du 2‑EH est issue d’une étude à long terme où l’on a observé une réduction du gain pondéral et une augmentation du poids relatif du cerveau, de l’estomac, des reins et du foie chez les rats des deux sexes après que du 2‑EH a été administré par gavage à la dose de 0, 50, 150 ou 500 mg/kg p.c./jour durant 24 mois (EC, SC, 2011).
Pour ce qui est de l’exposition par voie cutanée, on n’a relevé aucun signe de toxicité chez les petits en développement jusqu’à la dose maximale à l’étude de 2 520 mg/kg p.c./jour dans une étude sur la toxicité pour le développement menée avec des rats exposés par voie cutanée à des doses de 2‑EH de 0, 252, 420, 840, 1 680 ou 2 520 mg/kg p.c./jour du 6e au 15e jour de la gestation (DSENO = 2 520 mg/kg p.c./jour). Toutefois, on a observé une réduction du gain de poids corporel chez les mères à la dose de 1 680 mg/kg p.c./jour (EC, SC, 2011). En outre, la DMENO la plus faible par voie cutanée du 2‑EH, soit 834 mg/kg p.c./jour, provenait d’une étude de courte durée au cours de laquelle on a noté une lymphopénie, une diminution du poids de la rate et des effets histopathologiques sur la peau chez les rats des deux sexes, après une exposition à 0, 0,5 ou 1,0 mL de 2‑EH (équivalant à 0, 417 ou 834 mg/kg p.c./jour) à 9 reprises sur une période de 12 jours (EC, SC, 2011).
Il est connu que le 2‑EH est rapidement et largement métabolisé en acide 2‑éthylhexanoïque (2‑EHA, NR CAS 149‑57‑5) par oxydation in vivo. Santé Canada avait auparavant évalué les risques pour la santé humaine associés au 2‑EHA (EC, SC, 2011). La toxicité pour le développement était l’effet critique choisi par Santé Canada pour le 2‑EHA (EC, SC, 2011). Santé Canada a déterminé que la DMENO la plus faible par voie orale du 2‑EHA était de 100 mg/kg p.c./jour (EC, SC, 2011) d’après l’augmentation dépendante de la dose des malformations squelettiques observées chez les fœtus au cours d’une étude sur la toxicité pour le développement par voie orale dans laquelle des rates gravides ont reçu 0, 100, 300 ou 600 mg/kg p.c./jour de 2‑EHA dans l’eau potable du 6e au 19e jour de gestation (EC, SC, 2011). Le mode d’action sous-jacent à la toxicité pour le développement induite par une exposition au 2‑EHA par voie orale n’est pas clairement établi. Il a été démontré que le 2‑EHA induit une prolifération des peroxysomes chez des rongeurs (EC, SC, 2011), mais la prolifération de peroxysomes médiée par le récepteur activé par les proliférateurs de peroxysomes (PPARα) risque d’être moins pertinente pour les humains, et le rôle du PPARα dans la toxicité pour le développement et la reproduction reste à établir (EC, SC, 2011).
La dose critique de cocoate d’éthylhexyle équivalente à celle de 2‑EH pour une exposition par voie orale est d’environ 120 mg/kg p.c./jour (DSENO) pour des effets généraux après une exposition de 24 mois chez le rat. La dose critique de cocoate d’éthylhexyle équivalente à celle de 2‑EH pour l’exposition par voie cutanée est d’environ 6 045 mg/kg p.c./jour (DSENO) pour l’apparition d’effets sur le développement, et de 2 015 mg/kg p.c./jour (DSENO) pour l’apparition d’effets chez la mère après une exposition de neuf jours chez le rat. La DSENO du cocoate d’éthylhexyle la plus faible par voie cutanée correspondant à la dose de 2‑EH provenant d’une étude à doses répétées de 12 jours est de 1 000 kg/p.c./jour pour une fréquence accrue de lymphopénie, une réduction du poids de la rate et des effets histopathologiques sur la peau à la dose supérieure suivante.
Il n’existe aucune évaluation effectuée par un autre pays sur les effets sur la santé des acides gras de noix de coco produits par une hydrolyse du cocoate d’éthylhexyle induite par des estérases. Toutefois, l’OCDE (2014) a établi que les principaux acides gras de noix de coco, soit l’acide laurique (NR CAS 143‑07‑7), l’acide myristique (NR CAS 544‑63‑8), l’acide oléique (NR CAS 112‑80‑1) et l’acide palmitique (NR CAS 57‑10‑3), ne possèdent aucune propriété indiquant des effets nocifs généraux sur la santé humaine.
Données toxicologiques sur le principal composant du cocoate d’éthylhexyle en tant qu’UVCB
Le laurate d’éthylhexyle (NR CAS 20292‑08‑4), l’un des principaux composants du cocoate d’éthylhexyle (45 % à 52 %), a donné un résultat négatif au test d’Ames réalisé avec des souches de S. typhimurium, en présence ou en absence d’activation métabolique (Belsito et coll., 2013). Dans un essai in vivo, il n’a pas induit de génotoxicité chez la souris à des doses administrées par voie orale pouvant aller jusqu’à 5,0 mL/kg (Fiume et coll., 2015). Dans une étude d’une durée de 28 jours, le laurate d’éthylhexyle n’a pas causer d’effets nocifs chez le rat SD après une administration par gavage à des doses pouvant aller jusqu’à 1 000 mg/kg p.c./jour (DSENO = 1 000 mg/kg p.c./jour, Fiume et coll., 2015).
6.4.2.3 Caractérisation des risques pour la santé humaine
Le produit de l’hydrolyse du cocoate d’éthylhexyle, soit le 2‑EH, n’a eu aucun effet sur le développement des fœtus de rat après une exposition par voie cutanée au cours de la gestation. Cependant, le 2‑EH a entraîné un gain de poids corporel moindre chez les mères. Il a aussi eu des effets sur le poids corporel et celui des organes après une exposition de longue durée par voie orale chez le rat. Par ailleurs, une absorption cutanée de 6 % tirée d’une étude menée in vivo chez le rat avec du 2‑EH a servi à estimer l’exposition générale au cocoate d’éthylhexyle.
L’exposition de la population générale au cocoate d’éthylhexyle devrait surtout découler de l’utilisation de cosmétiques. Le tableau 6‑5 présente toutes les valeurs pertinentes d’exposition et de danger associées à une utilisation quotidienne de produits contenant du cocoate d’éthylhexyle. Au tableau 6‑6, on trouvera toutes les valeurs pertinentes d’exposition et de danger associées à une utilisation intermittente de produits contenant la substance.
Outre les scénarios par voie cutanée présentés aux tableaux 6‑5 et 6-6, on a obtenu une marge d’exposition variant de 184 615 à 352 941 après avoir comparé l’exposition par voie orale d’adultes et de tout-petits utilisant du rouge ou du brillant à lèvres contenant du cocoate d’éthylhexyle à une dose critique par voie orale de 2‑EH (DSENO converti = 120 mg/kg p.c./jour). La dose critique de 2‑EH par voie orale n’entraîne aucun effet sur le développement induit par le 2‑EHA (DMENO convertie = 218 mg/kg p.c./jour) administré par voie orale.
Scénario d’exposition |
Exposition générale (mg/kg p.c./jour)a |
Dose critique (convertie)b |
Paramètre d’effets critiques |
ME |
|---|---|---|---|---|
Hydratant pour le corps (adultes) |
0,041 à 0,41 |
DSENO = 120 mg/kg p.c./ jour
|
Étude par voie orale de 24 mois, calculée pour le 2‑EH, pour des effets généraux |
293 à 2 927 |
Hydratant pour le visage |
0,55 |
DSENO = 120 mg/kg p.c./jour |
Étude par voie orale de 24 mois, calculée pour le 2‑EH, pour des effets généraux |
200 |
Maquillage |
1,44 × 10-5 à 0,56 |
DSENO = 120 mg/kg p.c./jour |
Étude par voie orale de 24 mois, calculée pour le 2‑EH, pour des effets généraux |
196 à plus de 7 millions |
Huile capillaire |
0,12 à 0,37 |
DSENO = 120 mg/kg p.c./jour |
Étude par voie orale de 24 mois, calculée pour le 2‑EH, pour des effets généraux |
297 à 917 |
Abréviation : DSENO = dose sans effet nocif observé
a Expositions estimées à l’aide d’une absorption par voie cutanée de 6 %
b DSENO de 50 mg/kg p.c./jour pour le 2‑EH équivalente à une DSENO de 120 mg/kg p.c./jour pour le cocoate d’éthylhexyle à l’aide du poids moléculaire de son principal composant, soit le laurate d’éthylhexyle
Scénario d’exposition |
Exposition externe (mg/kg p.c./jour) |
Dose critique |
Paramètre d’effets critiques |
ME |
|---|---|---|---|---|
Huile de massage pour le corps (adultes) |
0,045 – 0,14 mg/kg par application |
DSENO = 1 000 kg/p.c./jour |
Étude de 12 jours par voie cutanée, calculée à partir du 2‑EH, pour des effets généraux |
7 143 – 22 222 |
Abréviation : DSENO = dose sans effet nocif observé
Les marges d’exposition susmentionnées sont considérées comme adéquates pour tenir compte des incertitudes liées aux bases de données sur les effets sur la santé et l’exposition.
6.4.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci‑dessous.
Principales sources d’incertitude |
Incidence |
|---|---|
Les concentrations maximales ont servi à estimer l’exposition à des cosmétiques, et donneront probablement une surestimation. |
+ |
La valeur d’absorption cutanée utilisée pour estimer l’exposition attribuable aux cosmétiques comporte une certaine incertitude. Cependant, il est fort probable que l’absorption cutanée soit faible étant donné les propriétés physicochimiques de la substance et les données existantes sur l’absorption cutanée des produits de dégradation. |
+ |
Il n’existe aucune étude sur la génotoxicité ou étude sur la toxicité à doses répétées pour le cocoate d’éthylhexyle. Les études sur la toxicité des principaux composants et les produits d’hydrolyse potentiels du cocoate d’éthylhexyle ont servi à éclairer la caractérisation des effets sur la santé du cocoate d’éthylhexyle. |
+/- |
Comme l’ampleur de l’hydrolyse du cocoate d’éthylhexyle en 2‑EH sur la peau n’est pas connue, le recours à une dose critique issue d’études sur le 2‑EH administré par voie cutanée ou orale pour caractériser les risques associés à une exposition au cocoate d’éthylhexyle, en présumant une hydrolyse de 100 %, donnera probablement une surestimation. |
+ |
+ = incertitude avec risque de surestimation du risque d’exposition; - = incertitude avec risque de sous-estimation du risque d’exposition; +/- = risque inconnu de sur ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle présentent un risque faible d’effets nocifs sur l’environnement. Il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que l’acide undécylénique, l’AAL, l’huile d’abrasin, les acides gras de tallöl, les sels de potassium d’acides gras de tallöl, l’huile d’onagre, les dimères et trimères d’acides gras et le cocoate d’éthylhexyle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[AGDH] Australian Government Department of Health. 2017. Dimer acid. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme. [Dernière mise à jour le 3 mai 2017.] (Disponible en anglais seulement.)
Alternative Medicine Review. 2002. Undecylenic Acid, Monograph. [PDF] Alternative Medicine Review. 7(1):68-70. (Disponible en anglais seulement.)
Base de données (Q)SAR du Danemark [base de données]. 2015. Division of Diet, Disease Prevention and Toxicology, National Food Institute, Technical University of Denmark. [Consulté le 13 septembre 2017.] (Disponible en anglais seulement.)
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [Modifiée en 2019.] Ottawa (Ont.), Santé Canada. [Consulté en décembre 2017.]
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [Modifiée le 7 juillet 2015.] Ottawa (Ont.), gouvernement du Canada. [Consultée le 22 avril 2016.]
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifiée en 2018]. Ottawa (Ont.), Santé Canada. [Consultée le 29 juin 2017.]
Beisson F, Aoubala M, Marull S, Moustacas-Gardies A-M, Voultoury R, Verger R, Arondel V. 2001 Use of the tape stripping technique for directly quantifying esterase activities in human stratum corneum. Anal Biochem. 290:179–185. (Disponible en anglais seulement.)
Belsito MD, Hill RA, Klaassen CD, Liebler DC, Marks Jr JG, Ronald C. 2013. Amended Safety Assessment of Alkyl Esters as Used in Cosmetics. (Disponible en anglais seulement.)
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]. 2016. Paris (FR) : Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement.)
Bookstaff, R.C. et coll. 2003. The safety of the use of ethyl oleate in food is supported by metabolism data in rats and clinical safety data in humans. Regul Toxicol Pharmacol. 37(1):133-48. (Disponible en anglais seulement.)
Buist HE, van Burgsteden JA., Freidig AP, Maas WJ, van de Sandt JJ. 2010. New in vitro dermal absorption database and the prediction of dermal absorption under finite conditions for risk assessment purposes. Regul. Toxicol. Pharmacol. 57, 200–209. (Disponible en anglais seulement.)
Burdock GA, éditeur. 2010. Fenaroli’s Handbook of Flavor Ingredients, 6e éd. 10-Undecenoic acid. Boca Raton (FL): CRC Press, Taylor & Francis Group. (Disponible en anglais seulement.)
Canada. 1999. Loi canadienne sur la protection de l’environnement, 1999. L.C. 1999, ch.33. Gazette du Canada partie III, vol. 22, n° 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. [PDF] Gazette du Canada, partie I, vol. 146, n° 48, Supplément.
ChemIDplus [base de données]. 1993- . Bethesda (MD): US National Library of Medicine. [Mise à jour le 26 novembre 2012; consultée le 29 juin 2017.] (Disponible en anglais seulement.)
CHEMPRO. Date inconnue. Top-notch technology in production of oils and fats. Gujarat (Inde) : CHEMPRO [mise à jour : non précisée; consulté le 14 décembre 2016]. (Disponible en anglais seulement.)
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. (Disponible en anglais seulement.)
Deisinger PJ, Boatman RJ, Guest D. 1994. Metabolism of 2-ethyhexanol administered orally and dermally to the female Fisher 344 rat. Xenobiotica 24:429–440 [cité dans EC, SC 2011]. (Disponible en anglais seulement.)
[EC, SC] Environnement Canada, Santé Canada. 2011. Évaluation préalable pour le Défi concernant : l’acide 2-éthylhexanoïque : numéro de registre du Chemical Abstracts Service 149-57-5. Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 mai 2017.]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada. [Consulté en 2016.]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018 b. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Gatineau (Qc), ECCC.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Qc), ECCC. [Renseignements en appui au Document sur l’approche scientifique : Classification du risque écologique des substances organiques.] Disponible au : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. c2007-2017a. Registered substances database; search results for CAS RN 112-38-9. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. c2007-2017b. Registered substances database; search results for CAS RN 61788-89-4. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. c2007-2017c. Registered substances database; search results for CAS RN 68937-90-6. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. c2007-2017d. Registered substances database; search results for CAS RN 92044-87-6. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. C2007-2017e. Registered substances database; search results for CAS RN 68955-98-6. Submission from Pine Chemicals Association. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[ECHA] European Chemicals Agency. C2007-2017f. Registered substances database; search results for CAS RN 91051-05-7. Submission from Pine Chemicals Association. Helsinki (FI) : ECHA. [Consulté le 20 mai 2017.] (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2010. Scientific opinion on the safety of “conjugated linoleic acid (CLA)-rich oil” (Clarinol®) as a Novel Food ingredient [PDF]. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA)2, 3 European Food Safety Authority (EFSA), Parme, Italie. [Consulté le 12 juin 2017.] (Disponible en anglais seulement.)
[EMA] Agence européenne des médicaments. 2011. Assessment report on Oenothera biennis L., Oenothera. lamarckiana L., oleum. Based on Article 16d(1), Article 16f and Article 16h of Directive 2001/83/EC as amended (traditional use). Committee on Herbal Medicinal Products (HMPC), European Medicines Agency. 16 décembre 2011, EMA/HMPC/277791/2009. (Disponible en anglais seulement.)
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement.)
Esoteric Oils. (c1998-2019). Fatty acids found in evening primrose oil. Le Cap (Afrique du Sud) : Sallamander Concepts (Pty) Ltd. [Mis à jour le 17 avril 2019; consulté le 14 décembre 2016.] (Disponible en anglais seulement.)
Everett, D.J., Greenough, R.J., Perry, C.J., McDonald, P., and Bayliss, P. 1988a. Chronic toxicity studies of Efamol evening primrose oil in rats and dogs. Med Sci Res, 16(16):863-864. [Cité dans NTP 2009.] (Disponible en anglais seulement.)
Everett, D.J., Perry, C.J., and Bayliss, P. 1988b. Carcinogenicity studies of Efamol evening primrose oil in rats and mice. Med Sci Res, 16(16):865-866. [Cité dans NTP 2009.] (Disponible en anglais seulement.)
[FAO] Organisation des Nations Unies pour l’alimentation et l’agriculture. 2014. Graisses et acides gras dans la nutrition humaine : rapport d’une consultation d’experts, 10 – 14 novembre 2008, Genève. Étude FAO : Alimentation et nutrition 91. Rome (Italie), Organisation des Nations Unies pour l’alimentation et l’agriculture.
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food and Chemical Toxicology 90:130-141. (Disponible en anglais seulement.)
Fiume MM, Heldreth BA, Wilma FB. 2015. Safety assessment of alkyl esters as used in cosmetics. Int J Toxicol. 34(2 Suppl):5S-69S. (Disponible en anglais seulement.)
[FS] Fiche signalétique. 2016. No-Toil Biodegradable Foam Filter Oil. Gastonia (NC): Mann+Hummel Filtration Technology US LLC. [Consultée le 29 juin 2017.] (Disponible en anglais seulement.)
Fukushima M, Ohhashi T, Ohno S, Saitoh H, Sonoyama K, Shimada K-, Sekikawa M, Nakano M. 2001. Effects of diets enriched in n-6 or n-3 fatty acids on cholesterol metabolism in older rats chronically fed a cholesterol-enriched diet. Lipids 36(3):261-6. (Disponible en anglais seulement.)
Hegsted DM, Gotsis A, Stabe FJ.1957. The effect of various fats upon experimental hypercholesteremia in the rat. J Nutrition. 63(3): 377-391. (Disponible en anglais seulement.)
[HERA] Human & Environmental Risk Assessment. 2002. Human & Environmental Risk Assessment on ingredients of European household cleaning products: Fatty Acid Salts, Human Health Risk Assessment, Draft for Public Comment. Bruxelles (Belgique) : HERA. [Consulté le 29 juin 2017.] (Disponible en anglais seulement.)
Howes D.1975. The percutaneous absorption of some anionic surfactants. J. Soc. Cosmet. Chem. 26:47-63. (Disponible en anglais seulement.)
International Organization of the Flavor Industry. 1995. European inquiry on volume of use. Rapport inédit présenté à la Flavor Manufacturers’ Association of the United States, Washington DC, États-Unis. [Cité dans OMS 1999]. (Disponible en anglais seulement.)
[IOM] Institute of Medicine. 2005. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients). Chapter 8 and Summary Tables. Washington (DC): The National Academies Press. [Consulté le 29 juin 2017.] (Disponible en anglais seulement.)
Kezutyte T. Desbenoit N. Brunelle A. Briedis V. 2013. Studying the penetration of fatty acids into human skin by ex vivo TOF-SIMS imaging. Biointerphases. 8(1):3. (Disponible en anglais seulement.)
Kim K, Nam YA, Kim HS, Hayes AW, Lee B-. 2014. a-linolenic acid: Nutraceutical, pharmacological and toxicological evaluation. Food Chem Toxicol. 70:163-78. (Disponible en anglais seulement.)
Leaver, H.A., Lytton, F.D., Dyson, H., Watson, M.L., and Mellor, D.J. 1986. The effect of dietary ω3 and ω6 polyunsaturated fatty acids on gestation, parturition and prostaglandin E2 in intrauterine tissues and the kidney. Prog Lipid Res, 25:143-146. [Cité dans NTP 2009.] (Disponible en anglais seulement.)
Les diététistes du Canada. 2017. Sources alimentaires d’acides gras oméga-3 [Internet]. [Publié le 6 décembre 2013; consulté le 15 mai 2017]
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem. Toxicol. 43:279-291. (Disponible en anglais seulement.)
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, Re T, Renskers K, Scrafford C, Vater S. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem. Toxicol. 44:2008-2018. (Disponible en anglais seulement.)
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, Renskers KJ, Scrafford CG. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem. Toxicol. 46:1516-1524. (Disponible en anglais seulement.)
McGuire JM, Powis PJ. 1998. Gas Chromatographic Analysis of Tall Oil Fractionation Products After Methylation with Ν,Ν-Dimethylformamide Dimethylacetal. Journal of Chromatographic Science. 36:104-108. (Disponible en anglais seulement.)
McPherson Jr JC. 1973. Suppression of food intake in the rat by tung oil. Revue canadienne de physiologie et pharmacologie 51(10):733-6. (Disponible en anglais seulement.)
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2015. No 2. Columbus (OH): American Chemical Society, Chemical Abstracts Service. [Consultée le 29 juin 2017.] (Disponible en anglais seulement.)
[NTP] National Toxicology Program (US). 2009. Chemical Information Review Document for Evening Primrose Oil (Oenothera biennis L.) [CAS No. 90028-66-3]. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. [Consulté le 29 juin 2017.] (Disponible en anglais seulement.)
[OCDE] Organisation de coopération et de développement économiques. 2014. SIDS Initial Assessment Profile (SIAP): Aliphatic Acids Category. CoCAM [Cooperative Chemicals Assessment Meeting] 6, du 30 septembre au 3 octobre 2014. [Consulté le 29 juin 2017.] (Disponible en anglais seulement.)
OECD QSAR Toolbox. 2016 [outil de lecture croisée]. Paris (FR), Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique.
[OMS] Organisation mondiale de la Santé. 1999. Safety evaluation of certain food additives: fifty-first meeting of the Joint FAO/WHO Expert Committee on Food Additives. Série Additifs alimentaires de l’OMS, no 42. Genève (CH) : Organisation mondiale de la Santé. [Consulté le 20 mai 2017]. (Disponible en anglais seulement)
Ramírez M, Amate L, Gil A. 2001. Absorption and distribution of dietary fatty acids from different sources. Early Human Development 65 Suppl. (2001) S95–S101. (Disponible en anglais seulement.)
Robinson V, Bergfeld WF, Belsito DV, Klaassen CD, Marks Jr JG, Shank RC, Slaga TJ, Snyder PW, Andersen FA. 2009. Amended safety assessment of tall oil acid, sodium tallate, potassium tallate, and ammonium tallate. International Journal of Toxicology. 28(Suppl 3):252S-258S. (Disponible en anglais seulement.)
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : un guide pour les calculs de l’exposition. Ottawa (Ont.), Santé Canada, Les Grands Lacs : Impact sur la santé.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de la santé environnementale. (Disponible en anglais seulement.)
Santé Canada. 2010. Tableaux des ANREF. [Internet]. [Mis à jour le 29 novembre 2010; consulté le 20 mai 2017].
Santé Canada. 2015. Environmental Assessment Unit drinking water spreadsheets [document Excel]. Ottawa (Ont.) : Santé Canada. [Consulté le 29 juin 2017.] (Disponible en anglais seulement.)
Santé Canada. 2016. Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 mars 2017.]
Seppanen 1969 cité dans : Anon. 1989. Final report on the safety assessment of tall oil acid. J. Amer. Coil. Toxicol. 8:769-776. (Disponible en anglais seulement.)
Shockey J, Rinehart T, Chen Y, Yangdong W, Zhiyong Z, Lisong H. 2016. Chapter 10: Tung (Vernicia Fordii and Vernicia montana). In: McKeon T, Hayes D, Hildebrand D, Weselake R, editors. Industrial Oil Crops. Amsterdam (NL): AOCS Press, Elsevier Inc. (Disponible en anglais seulement.)
SimpleTreat [modèle sur l’élimination des usines de traitement des eaux usées]. 1997. Ver. 3.0. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu (RIVM) [Institut national de la santé publique et de l’environnement]. RIVM, Laboratory for Ecological Risk Assessment, PO Box 1, 3720 BA Bilthoven. Pays-Bas. (Disponible en anglais seulement.)
Tokudome Y, Katayanagi M, Hashimoto F. 2015. Esterase activity and intracellular localization in reconstructed human epidermal cultured skin models. Ann Dermatol. 27(3):269–274. (Disponible en anglais seulement.)
Tsuzuki T, Tokuyama Y, Igarashi M, Miyazawa T. 2004a. Tumour growth suppression by a-eleostearic acid, a linolenic acid isomer with a conjugated triene system, via lipid peroxidation. Carcinogenesis. 25(8):1417-1425. (Disponible en anglais seulement.)
Tsuzuki T, Igarashi M, Miyazawa T. 2004b. Conjugated eicosapentanoic acid inhibits transplanted tumor growth via membrane lipid peroxidation in nude mice. J. Nutr. 134:1162-6. (Disponible en anglais seulement.)
Univar. c2019. Dimer acids and trimer acids. Twinsburg (OH): Univar’s Oleochemicals Team [anciennement Chemical Associates]. [Consulté le 17 août 2016.]
[US EPA] Environmental Protection Agency des États-Unis. 2005. Detail Query Results for Fatty Acid Dimers and Trimer Category. Posting dates of documents from HPV Challenge web site from which data have been entered into the HPVIS: February 2, 2005. [Consulté le 2 juillet 2017.] (Disponible en anglais seulement.)
US National Academy of Sciences. 1989. Evaluating the Safety of Food Chemicals. Washington DC, États-Unis. [Cité dans OMS 1999.] (Disponible en anglais seulement.)
Wormuth M, Scheringer M, Vollenweider M, Hungerbühler K. 2006. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans? Risk Analysis. 26(3):803-824. (Disponible en anglais seulement.)
Zhuo RJ, Wang F, Zhang XH, Zhang JJ, Xu J, Dong W, Zou ZQ. 2014. α-eleostearic acid inhibits growth and induces apoptosis in breast cancer cells via HER2/HER3 signaling. Mol Med Rep. 1892:993-998. (Disponible en anglais seulement.)
Annexes
Annexe A. Données sur l’identité des substances
Principaux constituants des acides gras en tant que composant individuel |
Acide gras à un seul composant (%) |
Composants des principaux acides gras d’UVCB (%) |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
CAS RN |
AG évalués par l’OCDE en 2014 (nom selon l’IUPAC ou CAS) |
Nom commun |
Caractéristiques structurales |
Acide α-linolénique (AAL) 463-40-1 |
Acide undécylénique 112-38-9 |
Huile d’abrasin 8001-20-5a |
Acides gras de tallöl 61790-12-3b |
Sels de potassium d’acides gras de tallöl 61790-44-1 |
Huile d’onagre 90028-66-3c |
Cocoate d’éthylhexyle 92044-87-6a |
Trimères d’acides gras 68937-90-6d Dimères d’acides gras 61788-89-4 |
124-07-2 |
Acide octanoïque |
Acide caprylique |
C8:0 |
- |
- |
- |
- |
- |
- |
5-10 |
- |
334-48-5 |
Acide décanoïque |
Acide décanoïque |
C10:0 |
- |
- |
- |
- |
- |
- |
8 |
- |
463-40-1 |
Acide (9Z,12Z,15Z)-9,12,15-octadécatriénoïque |
Acide alpha-linolénique |
C18:3 ; cis-9,12,15 |
>99 |
- |
- |
- |
- |
- |
- |
- |
112-38-9 |
s.o. |
Acide undécylénique |
C11:1 ; cis 10 |
- |
>99 |
- |
- |
- |
- |
- |
- |
143-07-7 |
Acide dodécanoïque |
Acide laurique |
C12:0 |
- |
- |
- |
- |
- |
- |
45-52 |
- |
544-63-8 |
Acide tétradécanoïque |
Acide myristique |
C14:0 |
- |
- |
- |
- |
- |
- |
16-21 |
- |
57-10-3 |
Acide hexadécanoïque |
Acide palmitique |
C16:0 |
- |
- |
~4 |
~6,3 |
~6,3 |
5,8-7 |
7-10 |
- |
57-11-4 |
Acide octadécanoïque |
Acide stéarique |
C18:0 |
- |
- |
- |
- |
- |
1,5-2,5 |
- |
source prédominante |
112-80-1 |
Acide (9Z)-9-octadécénoïque |
Acide oléique |
C18:1; cis 9 |
- |
- |
~8 |
39-48,2 |
39-48,2 |
5-11 |
5-8 |
- |
60-33-3 |
Acide (9Z,12Z)-9,12-octadécadiénoïque |
Acide linoléique |
C18 :2; cis 9, cis 1 |
- |
- |
~4 |
34-35,9 |
34-35,9 |
70-77 |
- |
- |
26764-25-0 |
s.o. |
Acide octadécadiénoïque |
C18:2; trans 7, cis 9 |
- |
- |
- |
2,3-10 |
2,3-10 |
- |
- |
- |
506-23-0 |
s.o. |
Acide alpha-éléostéarique |
C18:3; cis 9, trans 11, trans 13 |
- |
- |
~80 |
- |
- |
- |
- |
- |
506-26-3 |
s.o. |
Acide gamma-linolénique |
C18:3; cis-6,9,12 |
- |
- |
- |
- |
- |
9-10,9 |
- |
- |
a CHEMPRO (date inconnue)
b McGuire et Powis (1998)
c Esoteric Oils (c1998-2019)
d Univar (c2019)
Annexe B. Paramètres utilisés pour estimer l’exposition des humains
L’exposition aux cosmétiques a été principalement estimée à l’aide du logiciel ConsExpo Web (2016). Les estimations de l’exposition ont été calculées en fonction d’un poids corporel de 70,9 kg pour un adulte (20 ans et plus), de 15,5 kg pour un tout‑petit (de 6 mois à 4 ans) et de 7,5 kg pour un nourrisson (de 0 à 6 mois) (Santé Canada, 1998). Les paramètres estimée de l’exposition par voie cutanée et orale aux cosmétiques sont décrits aux tableaux B-1 et B‑2, respectivement. Vous trouverez les détails sur les taux d’absorption cutanée utilisés pour calculer l’exposition générale à la section 6.4.1 pour l’acide undécylénique et 6.4.2 pour le cocoate d’éthylhexyle.
Produit (substance) |
Hypothèsesa |
|---|---|
Hydratant pour le corps (acide undécylénique et cocoate d’éthylhexyle)
|
Adultes : Quantité de produits (g/utilisation) : 4,4 (Loretz et coll., 2005) Fréquence (utilisation/jour) : 1,1 (Loretz et coll., 2005) Surface exposée : corps en entier – tête = 16 925 cm2 (Santé Canada, 1995)
Nourrissons (pour l’acide undécylénique seulement) : Quantité de produit (g/utilisation) : 1,4 (Wormuth et coll., 2006) Fréquence (utilisation/jour) : 1,7 (Wormuth et coll., 2006) Surface exposée : corps en entier – tête = 3 020 cm2 (Santé Canada, 1995) |
Hydratant pour le corps spécialisé |
Adultes :
Quantité de produit (g/utilisation) : 2,2 (on a présumé une utilisation de la moitié de la quantité de lotion pour le corps) Fréquence (utilisation/jour) : 1 Surface exposée : On a présumé une utilisation sur les jambes et les pieds uniquement (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, datée du 22 avril 2016; sans référence)
|
Hydratant pour le visage (acide undécylénique et cocoate d’éthylhexyle)
|
Adultes : Quantité de produit (g/utilisation) : 1,2 (Loretz et coll., 2005) Fréquence (utilisation/jour) : 1,8 (Loretz et coll., 2005) Surface exposée : Moitié de la surface de la tête = 637,5 cm2 (Santé Canada, 1995)
|
Maquillage (acide undécylénique et cocoate d’éthylhexyle) |
Adultes : Quantité de produit (g/utilisation) : 0,54 (Loretz et coll., 2006) Fréquence (utilisation/jour) : 1,24 (Loretz et coll., 2006) Surface exposée : Moitié de la surface de la tête = 637,5 cm2 (Santé Canada, 1995) |
Huile capillaire (cocoate d’éthylhexyle) |
Adultes : Quantité de produit (g/utilisation) : 13,1 (Loretz et coll., 2008) Fréquence (utilisation/jour) : 1,24 (Loretz et coll., 2006) Facteur de rétention (ou de transfert) : 0,1 (quantité de cuir chevelu disponible pour une absorption) Surface exposée : Moitié de la surface de la tête = 637,5 cm2 (Santé Canada, 1995) |
Revitalisant pour les ongles (acide undécylénique) |
En l’absence de données sur ce scénario d’exposition, la quantité de crème à main a été corrigée à l’aide d’un facteur tenant compte de la surface exposée (paume de la main jusqu’au bout des doigts).
Adultes : Quantité de produit (g/utilisation) : 0,1 g (quantité corrigée de crème à main 1,7 g × 0,058; correction en fonction de la surface exposée) Fréquence inférieure à une fois par jour, l’estimation de l’exposition est en fonction de l’application Surface exposée : mains = 910 cm2 (Santé Canada, 1995), surface exposée des ongles ~ 50 cm2 (Ficheux et coll., 2014) |
Huile de massage (pour le corps) (cocoate d’éthylhexyle)
|
Adultes : Quantité de produit (g/utilisation) : 3,2 (Ficheux et coll., 2016) Fréquence inférieure à une fois par jour, estimation de l’exposition en fonction de l’application Surface exposée : surface corporelle totale – moitié de la surface de la tête – moitié de la surface du tronc = 14 380 cm2 (Santé Canada, 1995) |
a Un facteur de rétention de 1 a été utilisé, à moins d’avis contraire.
Produit (substance) |
Hypothèses |
|---|---|
Ingrédient non médicinal dans un produit de santé naturela (acide undécylénique) |
2 à 3 capsules, une fois par jour. 15 mg d’acide undécylénique par capsule.
Adultes : Dose estimée = 15 mg/capsule × 2 ou 3 capsules/jour 70,9 kg Dose estimée = 0,42 à 0,63 mg/kg p.c./jour
|
Rouge ou à lèvres à lèvresb (cocoate d’éthylhexyle)
|
Adultes : Quantité de produits (g/utilisation) : 0,01 (Loretz et coll., 2005) Fréquence (utilisation/jour) : 2,4 (Loretz et coll., 2005)
Tout-petits : Quantité de produits (g/utilisation) : 0,01 (considérée comme la même que celle des adultes) Fréquence inférieure à une fois par jour, estimation de l’exposition en fonction de l’application |
a Le produit est associé à un usage recommandé « l’ail est traditionnellement utilisé en phytothérapie pour atténuer les symptômes associés à des infections des voies respiratoires supérieures et à des affections catarrhales », à un énoncé relatif à la période de consommation « consultez un professionnel de la santé pour une utilisation dépassant six semaines » et à d’autres conditions d’utilisation recommandées, comme des mises en garde et des précautions, des contre-indications et des réactions indésirables connues (BDPSNH [modifiée en 2018]; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, datée du 28 avril 2016, sans référence).
b On a supposé que la quantité utilisée a été complètement ingérée, aucune exposition cutanée
