Évaluation préalable - Groupe des amides gras
Titre Officiel: Évaluation préalable groupe des amides gras
Numéros de registre du Chemical Abstracts Service: 112-84-5, 301-02-0, 68784-17-8
Environnement et Changement climatique Canada
Santé Canada
Avril 2019
No de cat. : En14-373/2019F-PDF
ISBN 978-0-660-30372-7
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), la ministre de l’Environnement et la ministre de la Santé ont procédé à l’évaluation préalable de trois des douze substances appelées collectivement « groupe des amides gras » dans le Plan de gestion des substances chimiques. Ces trois substances ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE. Par la suite, il a été déterminé à l’aide d’autres approches que cinq de ces douze substances sont peu préoccupantes. Les décisions concernant ces substances figurent dans un rapport distinctNote de bas de page 1. Par ailleurs, quatre substances ont été catégorisées dans d’autres groupes plus pertinents, sur la base de caractéristiques structurales ou de fonctions ayant une importance toxicologiqueNote de bas de page 2. Les trois substances visées par la présente évaluation préalable sont ci‑après désignées « groupe des amides gras ».
| No CASa | Nom sur la Liste intérieure des substances (LIS) | Nom commun |
|---|---|---|
| 112-84-5 | (Z)‑Docos‑13‑énamide | Érucamide |
| 301-02-0 | Oléamide | Oléamide |
| 68784-17-8b | Acide iso‑octadécanoïque, produits de réaction avec la tétra‑éthylènepentamine | Produits de réaction de l’AIOD avec la TEPA |
a Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Society. Toute utilisation ou redistribution, sauf si elle sert à répondre à des besoins législatifs ou si elle est nécessaire aux rapports destinés au gouvernement fédéral lorsque des renseignements ou des rapports sont exigés par la loi ou une politique administrative, est interdite sans l’autorisation écrite préalable de l’American Chemical Society.
b Ce produit est un UVCB (substance de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
L’érucamide et l’oléamide sont des substances qui existent naturellement dans l’environnement et qui sont le fruit de processus abiotiques (p. ex. feux de forêt) ou biotiques. En 2011, elles n’étaient pas fabriquées au Canada, mais ont été importées pour être surtout utilisées dans la fabrication de produits en plastique et de caoutchouc. Au cours de la même année, entre 1 000 000 et 10 000 000 kg d’érucamide et entre 100 000 et 1 000 000 kg d’oléamide ont été importés au Canada. L’érucamide et l’oléamide présents dans les milieux naturels, les aliments ou les produits proviennent de sources naturelles ou anthropiques.
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA n’est pas une substance trouvée naturellement dans l’environnement. En 2011, on n’a déclaré aucune fabrication de cet UVCB au Canada, et entre 100 et 1 000 kg de ce dernier a été importé au Canada. Son utilisation au Canada se limite aux lubrifiants et aux graisses. Les produits de réaction de l’AIOD avec la TEPA entrent surtout dans la composition d’huiles pour les moteurs hors‑bord à deux temps. Les rejets de cette substance dans l’environnement attribuables aux usages industriels et aux produits de consommation devraient être minimes.
Les risques pour l’environnement associés à l’érucamide, à l’oléamide et aux produits de réaction de l’AIOD avec la TEPA ont été caractérisés à l’aide de la classification du risque écologique (CRE) des substances organiques, c’est‑à‑dire une approche basée sur le risque qui considère plusieurs paramètres liés au danger et à l’exposition et attribue un classement de risque après pondération de plusieurs éléments de preuve. Les profils de danger sont principalement basés sur des paramètres comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique. Les paramètres pris en compte pour dresser les profils d’exposition sont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. À l’aide d’une matrice des risques, on assigne aux substances un niveau de préoccupation, soit faible, modéré ou élevé, à partir de leurs profils de danger et d’exposition. Selon les résultats de la CRE, l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA sont considérés comme peu susceptibles de causer des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA présentent un faible risque d’effets nocifs sur l’environnement. Il est conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
L’érucamide et l’oléamide présentent une faible toxicité aigue et ne sont pas génotoxiques. Aucun effet nocif de l’érucamide n’a été observé au cours des études avec doses répétées sur la toxicité pour le développement, menées avec des animaux de laboratoire; c’est la raison pour laquelle on considère que l’érucamide présente un faible potentiel de danger. Les données sur les effets sur la santé de l’oléamide étaient peu nombreuses, mais comme sa structure chimique, ses propriétés physicochimiques et sa toxicocinétique sont semblables à celles de l’érucamide, on s’attend à ce qu’elle présente aussi un faible potentiel de danger.
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA est faiblement toxique à court terme et n’est pas génotoxique. On n’a relevé aucun effet nocif sur la santé lors d’une étude menée à court terme sur la toxicité avec des doses répétées et lors d’une étude combinée sur la toxicité pour la reproduction et pour le développement. Cet UVCB devrait présenter un faible potentiel de danger.
Compte tenu de la faible toxicité de l’érucamide, de l’oléamide et des produits de réaction de l’AIOD avec la TEPA, il est jugé que le risque pour la santé humaine est faible.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), la ministre de l’Environnement et du Changement climatique et la ministre de la Santé ont procédé à l’évaluation préalable de trois des douze substances appelées collectivement « groupe des amides gras » dans le Plan de gestion des substances chimiques, pour déterminer si ces trois substances présentent ou pourraient présenter un risque pour l’environnement ou la santé humaine. Les trois substances ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2007]).
Parmi les neuf autres substances, cinq d’entre elles (énumérées dans le tableau 1‑1 ci‑dessous) ont été évaluées à l’aide de la Classification du risque écologique (CRE) des substances organiques (ECCC, 2016a) et de l’évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC, 2018), et il a été établi qu’elles étaient faiblement préoccupantes pour la santé humaine et l’environnement. C’est la raison pour laquelle elles ne font pas l’objet du présent rapport. Les conclusions pour ces cinq substances figurent dans le document Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC, 2018).
| No CASa | Nom sur la Liste intérieure des substances (LIS) | Méthode utilisée pour évaluer la substance | Référence |
|---|---|---|---|
| 68478-81-9 | Acide oléique, produits de réaction avec l’anhydride 2-dodécénylsuccinique et la N,N’-bis(2-aminoéthyl)éthane-1,2-diamine | CRE/évaluation préalable rapide | ECCC, HC, 2018 |
| 71820-35-4 | Acides gras de tallöl, à bas point d’ébullition, produits de réaction avec la pipérazine-1-éthanamine | CRE/évaluation préalable rapide | ECCC, HC, 2018 |
| Numéro d’identification confidentiel 11053-1 | Acides gras composés avec l’éthylènediamine | CRE/évaluation préalable rapide | ECCC, HC, 2018 |
| Numéro d’identification confidentiel 11555-8 | Acides gras, produits de réaction avec l’anhydride maléique et la triéthanolamine | CRE/évaluation préalable rapide | ECCC, HC, 2018 |
| Numéro d’identification confidentiel 11557-1 | Acides gras, produits de réaction avec l’anhydride maléique et l’oléylamine | CRE/évaluation préalable rapide | ECCC, HC, 2018 |
a Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Society. Toute utilisation ou redistribution, sauf si elle sert à répondre à des besoins législatifs ou si elle est nécessaire aux rapports destinés au gouvernement fédéral lorsque des renseignements ou des rapports sont exigés par la loi ou une politique administrative, est interdite sans l’autorisation écrite préalable de l’American Chemical Society.
Les quatre autres substances ont été répertoriées dans d’autres groupes de substances plus pertinents sur la base de caractéristiques structurales ou de fonction ayant une importance toxicologiqueNote de bas de page 3.
Les trois substances du présent rapport (ci‑après désignées « groupe des amides gras ») ont été évaluées d’après leurs différences sur le plan des caractéristiques structurales, des propriétés physicochimiques, des sources et des utilisations. Nous avons évalué l’érucamide et l’oléamide ensemble et l’UVCB composé des produits de réaction de l’AIOD avec la TEPA séparément.
Nous avons caractérisé les risques pour l’environnement de l’érucamide, l’oléamide et des produits de réaction de l’AIOD avec la TEPA à l’aide de la CRE (ECCC, 2016a). Dans la CRE, on décrit le danger associé à une substance en utilisant des paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Cette méthode tient compte de l’exposition possible des organismes dans le milieu aquatique et terrestre en fonction de facteurs tels que le taux d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont rassemblés pour rechercher les substances qui nécessitent une évaluation plus poussée du risque d’effets nocifs sur l’environnement ou qui présentent une faible probabilité d’effets nocifs sur l’environnement.
Dans la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition. Les données pertinentes ont été relevées jusqu’en juin 2017. Nous avons utilisé des données empiriques tirées d’études clés ainsi que certains résultats de modélisation pour tirer les conclusions. Quand ils étaient disponibles et pertinents, nous avons tenu compte des renseignements présentés dans des évaluations réalisées par d’autres pays.
La présente évaluation préalable a été préparée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle inclut des intrants d’autres programmes de ces ministères. Le volet de l’évaluation portant sur l’environnement est fondé sur le document décrivant la Classification du risque écologique (publié le 30 juillet 2016), qui a fait l’objet d’une évaluation externe et d’une période de commentaires du public de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente évaluation préalable demeurent la responsabilité d’Environnement et Changement climatique Canada et de Santé Canada.
Le présent document repose sur des renseignements critiques permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, nous avons examiné les renseignements scientifiques à la lumière d’une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 4. La présente évaluation préalable fournit les données critiques et les considérations sur lesquelles est fondée la conclusion.
2. Caractérisation des risques pour l’environnement
Dans la présente évaluation préalable, les risques pour l’environnement associés aux substances ont été caractérisés au moyen de l’approche de la Classification du risque écologique des substances organiques (CRE) (ECCC, 2016a). La CRE est une méthode fondée sur le risque qui tient compte de plusieurs paramètres pour évaluer le danger et l’exposition, d’après une pondération des différents éléments probants dans le but de classer le risque. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer les substances présentant une toxicité faible ou élevée, et un risque d’exposition faible ou élevé dans divers milieux. Cette façon de faire permet de réduire l’incertitude globale liée à la caractérisation des risques, contrairement à une approche reposant sur un seul paramètre mesuré dans un seul milieu (p. ex. létalité médiane [CL50]). Comme on considère les produits de réaction de l’AIOD avec la TEPA comme un UVCB (substance de composition inconnue ou variable, produits de réaction complexes ou matières biologiques) et qu’ils ne peuvent être représentés par une seule structure chimique, nous avons fait appel à une classification manuelle basée sur le jugement. Les paragraphes suivants résument cette approche, qui est décrite en détail par ECCC (2016a).
Les données sur les propriétés physicochimiques, le devenir (demi‑vie de la substance chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de substances chimiques importées ou fabriquées au Canada ont été colligés à partir de publications scientifiques, de bases de données empiriques disponibles (p. ex. boîte à outils de la RQSA de l’OCDE) et des résultats des collectes de renseignements réalisées en vertu de l’article 71 de la LCPE, ou ont été produites à partir de certains résultats obtenus par modélisation de la RQSA, du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger des substances et d’exposition à ces dernières.
Les profils de danger reposent principalement sur les paramètres que sont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans les réseaux trophiques, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition reposaient aussi sur plusieurs paramètres, soit le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer le danger et le risque d’exposition de chaque substance comme étant faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex. cohérence de la classification, marge d’exposition) pour améliorer les classifications préliminaires de danger et d’exposition. Toutefois, dans le cas des UVCB, il n’a pas été possible d’établir le profil complet du danger et de l’exposition, car on ne disposait pas d’une structure représentative nécessaire pour estimer les propriétés voulues et de données empiriques sur ces propriétés. Par conséquent, il a fallu classifier manuellement le danger et l’exposition en examinant les constituants de l’UVCB et les renseignements obtenus des collectes réalisées en vertu de l’article 71 de la LCPE, et en prenant des décisions reposant sur l’analyse de substances similaires et un jugement expert.
Une matrice des risques a été utilisée pour classer le risque associé à chaque substance comme étant faible, modéré ou élevé, suivant la classification du danger et de l’exposition. Les classifications du risque obtenues par la CRE ont subi une vérification en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (qui passe de modéré ou élevé à faible) des substances présentant une estimation faible du taux d’émission dans l’eau après le traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classification faible à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait être reclassée à un niveau supérieur.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une surclassification ou d’une sous‑classification du danger, de l’exposition et du risque subséquent. Les approches équilibrées utilisées pour réduire les incertitudes sont décrites en détail par ECCC (2016a). Dans ce qui suit, nous décrivons deux des domaines d’incertitude les plus importants. Les valeurs de toxicité aiguë empiriques ou modélisées erronées peuvent entraîner un changement de la classification du danger, en particulier dans le cas des paramètres reposant sur des valeurs de résidus dans les tissus (p. ex. mode d’action toxique), dont un grand nombre sont prédites à partir d’une modélisation de la RQSA. L’incidence de ce type d’erreur est toutefois atténuée par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) de résidus dans les tissus qui servira à l’analyse des résidus corporels critiques (RCC). L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres du danger tels que la structure associée au mode d’action, la réactivité ou l’affinité de liaison aux œstrogènes. Les changements ou les erreurs touchant les quantités de substances chimiques peuvent conduire à des classifications différentes de l’exposition, la classification de l’exposition et du risque étant très sensible au taux d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités réputées être actuellement utilisées, mais pourraient ne pas rendre compte des tendances futures.
3. Érucamide et oléamide
3.1 Identité des substances
Le tableau 3‑1 présente le no CAS, le nom sur la LIS et le nom commun de l’érucamide et l’oléamide.
| No CAS |
Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (Da) |
|---|---|---|---|
| 112-84-5 |
(Z)‑Docos‑13‑énamide (Erucamide; erucyl amide; erucic acid amide) | 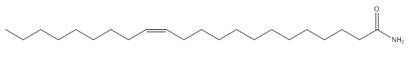 C22H43NO C22H43NO |
337,58 |
| 301-02-0 |
9-Octadecenamide, (Z)- (Oleamide; oleyl amide; oleic acid amide) |
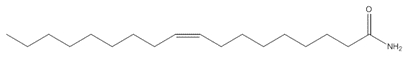 C18H35NO C18H35NO |
281,4 |
3.1.1 Recours à des données déduites d’analogues et modèles RQSA
Des travaux menés sous contrat pour Santé Canada confirment la validité du recours à des données d’analogues (RSI, 2017). Il a été jugé adéquat de recourir aux données de l’érucamide pour combler les lacunes de données de l’oléamide, car leur structure (tous deux sont des amides simples primaires, insaturés et aliphatiques d’acides gras), leurs propriétés physicochimiques (tous deux sont fortement lipophiles) et leur toxicocinétique (tous deux subissent une métabolisation par hydrolyse pour produire les acides gras correspondants) sont semblables.
3.2 Propriétés physicochimiques
Un résumé des propriétés physicochimiques de l’érucamide et de l’oléamide sont présentées au tableau 3‑2 et 3‑3, respectivement. Lorsque les données expérimentales sur une propriété physicochimique étaient peu nombreuses ou inexistantes, nous avons utilisé des modèles pour obtenir les valeurs prédites de la substance. D’autres propriétés physicochimiques figurent dans ECCC (2016b).
| Propriété | Valeur | Mesurée ou prédite | Référence clé |
|---|---|---|---|
| État physique | Solide | s.o. | US EPA, 2010a |
| Point de fusion (°C) | 77,5 | Mesurée | SRC, 2010 cité dans US EPA, 2010a |
| Point d’ébullition (°C) | 461,05 | Prédite | MPBPWIN, 2008 |
| Pression de vapeur (mm Hg) | 8,2 × 10−8 | Prédite | MPBPWIN, 2008 |
| Constante de la Loi de Henry (atm m3/mol) | 2,8 × 10−6 | Prédite | HENRYWIN, 2008 |
| Solubilité dans l’eau (mg/L) | 4,5 × 10−4 | Prédite | WSKOWWIN, 2010 |
| log Koe (sans dimension) | 8,44 | Prédite | KOWWIN, 2010 |
Abréviations : Koe, coefficient de partage octanol‑eau; s.o., sans objet
| Propriété | Valeur | Mesurée ou prédite | Référence clé |
|---|---|---|---|
| État physique | Solide | S.o. | US EPA, 2010a |
| Point de fusion (°C) | 76 | Mesurée | US EPA, 2010a |
| Point d’ébullition (°C) | 414,63 | Prédite | MPBPWIN, 2008 |
| Pression de vapeur (mm Hg) | 1,2 × 10−6 | Prédite | MPBPWIN, 2008 |
| Constante de la Loi de Henry (atm m3/mol) | 9,2 × 10−7 | Prédite | HENRYWIN, 2008 |
| Solubilité dans l’eau (mg/L) | 0,037 | Prédite | NOM05, 1987 cité dans US EPA, 2010a |
| log Koe (sans dimension) | 6,48 | Prédite | KOWWIN, 2010 |
Abréviations : Koe, coefficient de partage octanol‑eau; s.o., sans objet
3.3 Sources et utilisations
Les amides gras sont présents naturellement dans l’environnement et peuvent être produits par des processus abiotiques (soit la combustion) et biotiques. On synthétise commercialement les amides gras en faisant réagir les acides gras avec de l’ammoniac à température et à pression élevées et en procédant à une déshydratation par la suite ou en faisant subir une ammonolyse à des esters d’acides gras (Johansson, 2001). L’érucamide et l’oléamide sont issus de l’acide érucique et de l’acide oléique, respectivement, qui sont tous deux des acides gras insaturés oméga‑9 qui existent naturellement en grande quantité dans les huiles végétales et de graines (p. ex. canola et colza) (Johansson, 2001). Les amides d’alkyle sont produits après que des acides gras aient réagi avec l’ammoniac durant la combustion de la biomasse (p. ex. feux de forêt) et la cuisson à l’huile (Simoneit et al., 2003). On a décelé de l’érucamide dans l’air ambiant au Chili (Simoneit et al., 2003), et de l’érucamide et de l’oléamide dans la poussière domestique au Canada (CNRC, 2011).
L’érucamide et l’oléamide sont des amides primaires ayant une chaîne alcényle en C21 et en C17, respectivement. D’après les données recueillies en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), l’érucamide et l’oléamide ne sont pas fabriquées au Canada en quantités dépassant le seuil de 100 kg et sont importées au pays. Le tableau 3‑4 présente un résumé des quantités totales importées d’érucamide et d’oléamide selon les déclarations (Environnement Canada, 2013).
Nom commun |
Intervalle des quantités totales importées (kg) |
|---|---|
Érucamide |
1 000 000 à 10 000 000 |
Oléamide |
100 000 à 1 000 000 |
a Les valeurs reflètent les quantités déclarées dans le cadre d’une collecte de données menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Consulter la collecte de données pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
Selon les données déclarées en vertu de l’article 71, divers secteurs utilisent l’oléamide et l’érucamide au Canada, surtout dans la fabrication de matières plastiques et en caoutchouc (Environnement Canada, 2013) où elles jouent généralement un rôle d’agent glissant et d’agent anti‑adhérent. Elles sont ajoutées aux préparations de plastique et émergent graduellement à la surface du matériau pour former une couche solide lubrifiante qui réduit la friction et l’adhésion entre le polymère et la surface de contact (Croda, c2008; Cooper et Tice, 1995).
Au tableau 3‑5, on trouvera un résumé des utilisations de l’érucamide et de l’oléamide déclarées lors de la collecte de données menée en vertu de l’article 71 (Environnement Canada, 2013).
| Utilisation | Érucamide | Oléamide |
|---|---|---|
| Automobile, aéronef et transport | O | O |
| Entretien des automobiles | O | N |
| Sacs compostables, préparation de mélanges | O | N |
| Emballage d’aliments | O | O |
| Encre, encre en poudre et colorants | O | N |
| Lubrifiants et graisses | N | O |
| Matières plastiques et en caoutchouc | O | O |
| Production de polymère | O | N |
| Jouets, équipement pour les terrains de jeu et les sports | O | N |
Abréviations : N = non; O = oui
Le tableau 3‑6 présente des données sur d’autres utilisations de l’érucamide et de l’oléamide au Canada.
| Utilisation | Érucamide | Oléamide |
|---|---|---|
| Matériaux d’emballage alimentairea | O | Oe |
| Base de données sur les ingrédients des produits de santé naturelsa | N | O |
| Formulant dans des produits antiparasitaires homologués au Canadab | O | O |
Abréviations : N = non; O = oui
a Communication personnelle, courriels de la Direction générale des produits de santé et des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 21 janvier 2016, sans référence.
b Courriel de novembre 2015 de l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada; sans référence
En plus des utilisations déclarées ci‑dessus, les données internationales sur l’utilisation indiquent plusieurs applications de l’érucamide avec ou sans l’oléamide : antimousses dans des préparations de détergents synthétiques destinés à un usage industriel ou domestique, opacifiants et agents neutralisant la viscosité dans les cosmétiques, solubilisants pour les colorants, agents hydrofuges dans les textiles et solvants ou additifs dans les cires, etc. (Milne, 2005; Ash et Ash, 2008).
3.4 Risque de causer des effets nocifs sur l’environnement
Les données critiques et les considérations sur lesquelles nous avons élaboré les profils de l’érucamide et de l’oléamide ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Selon les renseignements considérés dans le cadre de la CRE, l’érucamide a été classée comme étant associée à un risque élevé d’exposition étant donné sa grande persistance globale et les grandes quantités importées annuellement déclarées dans les données recueillies en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Selon les renseignements considérés dans le cadre de la CRE, l’oléamide a été classé comme étant associé à un risque modéré d’exposition en raison de sa grande persistance globale et des quantités modérées importées annuellement indiquées dans les données déclarées en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). La CRE a permis de classer ces deux substances comme ayant un faible potentiel de danger et par conséquent, un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
3.5 Risque de causer des effets nocifs sur la santé humaine
3.5.1 Évaluation de l’exposition
La présente section fournit des renseignements généraux sur l’exposition à l’érucamide et à l’oléamide. Comme on juge que l’érucamide et l’oléamide présentent un faible potentiel de danger, on n’a pas calculé d’estimations quantitatives de l’exposition de la population générale.
Milieux naturels et aliments
L’érucamide et l’oléamide n’ont pas été mesurées dans l’air intérieur, l’air ambiant, le sol ou l’eau potable au Canada, mais ont été détectées dans la poussière domestique au Canada (CNRC, 2011), et l’érucamide a aussi été décelée dans de l’eau potable en bouteille aux États‑Unis (Naidenko et al., 2008). L’érucamide et l’oléamide sont présentes dans la poussière domestique de plancher au Canada à une concentration moyenne de 78,6 et de 5,3 µg/g, respectivement (CNRC, 2011). L’acide érucique et l’acide oléique sont les principaux acides gras composant les huiles végétales de graines, qui peuvent être transformés en partie en leurs amides correspondants durant la cuisson ou en grande friture en réagissant avec l’ammoniac. Conformément au Règlement sur les aliments et drogues, les acides gras monoénoïques en C22 (acide érucique) sont interdits à des concentrations supérieures à 5 % de la proportion d’acides gras totaux dans les huiles de cuisson, les huiles à salade, les margarines et le shortening ou les aliments qui ressemblent à la margarine ou au shortening (Canada, [1978]). On a détecté de l’érucamide dans la fraction aérosol de l’air ambiant à Santiago, au Chili, à des concentrations situées entre 2 et 1 072 ng/m3, ce qui est révélateur de sa présence dans les huiles à graines utilisées en cuisine (Simoneit et al., 2003). L’érucamide et l’oléamide présentent de très faibles pressions de vapeur et devraient donc être absents dans la phase gazeuse de l’air. La présence des deux substances n’a pas été signalée dans les réseaux d’eau potable au Canada, mais on a détecté de l’érucamide dans l’une des neuf marques d’eau potable en bouteille analysées aux États‑Unis à la concentration de 1,2 µg/L (Naidenko et al., 2008).
L’érucamide et l’oléamide ne sont pas répertoriées en tant qu’additifs alimentaires approuvés dans les Listes des additifs alimentaires autorisés, qui ont été incorporés par renvoi dans leur autorisation de mise en marché respective délivrée en vertu de la Loi sur les aliments et drogues (Santé Canada [modifié en 2016]). Les deux substances servent à la fabrication de certains matériaux d’emballage alimentaire, mais seul l’érucamide risque d’entrer directement en contact avec les aliments à la suite d’une migration. L’oléamide entre parfois dans la composition des lubrifiants utilisés sur les surfaces non alimentaires au cours de la transformation alimentaire, mais on ne s’attend à aucune exposition de la population générale découlant de cette utilisation (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 21 janvier 2016; sans référence).
Dans une étude européenne, on a examiné la migration de ces deux substances vers une substance simulant le lait, en utilisant une méthode de remplissage à chaud dans une vaste gamme de biberons vendus pour la plupart par des États membres de l’Union européenne, mais aussi au Canada, aux États‑Unis et en Suisse (Simoneau et al., 2012). L’érucamide a migré dans 9 biberons en polypropylène sur 149 (303 µg/kg en moyenne), et l’oléamide a migré dans 2 biberons en polypropylène sur 149 (1 357 µg/kg en moyenne) et 2 biberons en silicone sur 5 (116 µg/kg en moyenne) (Simoneau et al., 2012).
Produits de consommation
Il n’existe aucune fiche signalétique publique sur l’érucamide ou l’oléamide. Toutefois, compte tenu de leur utilisation comme additifs dans divers plastiques (p. ex. PP, PE, PEBD, PVC, silicone, AVE), et leur capacité à émerger à la surface du produit (Cooper et Tice, 1995), l’exposition de la population générale à ces deux substances devrait découler de l’utilisation des produits de consommation et se faire par voie orale et cutanée. Des études danoises ont quantifié l’érucamide présent dans les parties adhésives étirables qui servent à fermer les couches pour bébé (max 82 µg/g, extraction au DCM), le tissu extérieur d’un veston pour tout‑petits (380 µg/g, substance artificielle simulant la salive) et dans la fibre plastique (limbe) d’un gazon artificiel (88 à 177 µg/g, extraction au DCM), et l’oléamide dans la fibre extérieure composant des mitaines d’enfant (12 à 83 µg/g, substance artificielle simulant la salive), des vêtements pour fétichistes (max de 330 µg/g) et dans des housses de couette et des taies d’oreiller en coton (8 µg/g, prélavage, extraction accélérée par DCM) (Nilsson et al., 2006; Nilsson et al., 2008; Tønning et al., 2009). Des données publiées par un fabricant japonais de couches jetables indiquent que de l’érucamide a été ajoutée au produit à une concentration variant entre 0,2 et 0,4 % (c.‑à‑d. environ 2 000 à 4 000 µg/g) (Nonwoven, 2003).
L’oléamide figure dans la base de données sur les ingrédients des produits de santé naturels, car il joue un rôle médicinal en tant que produit de santé naturel correspondant à la définition de l’article 2 (un isolat) l’annexe 1 du Règlement sur les produits de santé naturels. Toutefois, il n’est pas répertorié dans la base de données des produits de santé naturels homologués comme étant présent dans les produits de santé naturels actuellement homologués au Canada (communication personnelle, courriels de la Direction générale des produits de santé et des aliments de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 21 janvier 2016; sans référence).
3.5.2 Évaluation des effets sur la santé
Toxicocinétique
En raison de la faible pression de vapeur des deux substances, on ne prévoit pas que l’inhalation soit une voie d’exposition importante.
L’érucamide a été l’objet d’une étude de quatre semaines sur la digestibilité menée avec des rats Sprague‑Dawley (SD). On a ajouté la substance à une concentration de 10 % dans des aliments semi‑synthétiques sans supplément de matières grasses. Les échantillons de matières fécales de toute la semaine ont été mis en commun, pesés et analysés pour déterminer leur teneur en graisse. L’analyse indique une absorption d’érucamide dans le tractus gastro‑intestinal dans une proportion variant entre 52,8 % et 72,9 % au cours de la période d’étude de quatre semaines (Anonyme, 1960a, cité dans ECHA, c2007‑2016a). Cependant, l’absorption de l’amide parent pourrait être limitée, car elle devrait subir une hydrolyse pour donner un acide gras et de l’ammoniac dans le tractus gastro‑intestinal. Dans une étude sur l’hydrolyse, on a mesuré une perte d’oléamide d’environ 95 % après une incubation de quatre heures à 37 °C dans une substance simulant du liquide gastrique contenant des sels biliaires. On a observé une production d’acide oléique qui respecte la stœchiométrie (Cooper et al., 1995). L’amide parent subit probablement une hydrolyse au cours de sa métabolisation. Lors d’une expérience visant à examiner la métabolisation de l’érucamide dans le foie, on a incubé le composé avec un homogénat frais de foie de rat pour déterminer le degré d’hydrolysation en acide gras respectif (acide érucique) et en ammoniac. Il a été établi que l’érucamide était efficacement hydrolysé par l’homogénat de foie de rat dans une proportion de 37,6 % en quatre heures (Anonyme, 1960b, cité dans ECHA, c2007‑2016a). Les deux substances sont des substrats connus qui subissent une hydrolyse induite par l’hydrolase des amides gras. Les proportions relatives d’hydrolyse sont semblables et étaient de 1 sur 0,83 (oléamide/érucamide), la proportion de référence étant de 0,526 nmol/min/ng d’hydrolase d’amides gras (Boger et al., 2000).
Génotoxicité
L’érucamide et l’oléamide font l’objet d’essais de génotoxicité conformes aux lignes directrices de l’Organisation de coopération et de développement économiques (OCDE) et ne sont ni mutagènes ni clastogènes. Les études de mutagénicité de l’érucamide et de l’oléamide réalisées avec Salmonella typhimurium (TA98, TA100, TA1535, TA1537 et TA1538) ont donné des résultats négatifs, avec ou sans activation métabolique (Jones et al., 1990a, 1990b, cité dans ACCC, 2004; JETOC, 2008, cité dans CCRIS, 2011). De même, l’oléamide a aussi donné un résultat négatif avec Escherichia coli (JETOC, 2008, cité dans CCRIS, 2011). Dans les essais in vitro sur cellules de mammifères, l’érucamide n’a pas induit de mutations dans les cellules de lymphome de souris L5178Y (Anonyme, 2010a, cité dans ECHA, c2007‑2016a), et on n’a observé aucune aberration chromosomique dans les cellules de poumons de hamsters chinois, avec ou sans activation métabolique (Anonyme, 2010b, cité dans ECHA, c2007‑2016a).
Toxicité aiguë et à doses répétées
L’érucamide et l’oléamide présentent tous deux une faible toxicité aiguë dans les études menées conformément aux lignes directrices de l’OCDE. L’érucamide mélangée à de l’huile de maïs a été administrée par gavage à des rats Wistar adultes des deux sexes à une dose totale de 5 000 mg/kg p.c. (administration de deux doses de 2 500 mg/kg p.c. en 24 heures). On a observé les animaux pendant une période de 14 jours. Aucune mortalité n’est survenue au cours de la période d’observation. À la fin de l’étude, tous les animaux ont été sacrifiés, et l’examen macroscopique n’a montré aucun effet lié au traitement (Reijnders JBJ, 1988, cité dans ACCC, 2004). Dans une autre étude, l’érucamide a été appliquée sur la peau de rats mâles et femelles à une dose de 2 000 mg/kg p.c. durant 24 heures. Après une période d’observation de 14 jours, on n’a décelé aucun effet sur le poids corporel et aucun signe clinique chez les rats. On a noté une légère desquamation chez un rat mâle. On n’a relevé aucun décès au cours de l’étude, et aucune anomalie macroscopique apparente à la nécropsie (Anonyme, 2010c, cité dans ECHA, c2007‑2016a). Dans le dossier résumant l’étude sur l’oléamide présenté à la Commission européenne, la DL50 provenant de plusieurs études variait de > 2 000 à > 10 000 mg/kg p.c. chez le rat, mais pour toutes les sources citées, les études étaient peu détaillées (European Chemicals Bureau, 2000).
Le résumé d’une étude à doses répétées sur 90 jours réalisée conformément aux lignes directrices de l’OCDE a été présenté à l’Agence européenne des produits chimiques (ECHA) en vertu du règlement REACH. L’érucamide diluée dans de l’huile de maïs a été administrée à des rats Wistar mâles et femelles par gavage à une dose de 0, 100, 300 ou 1 000 mg/kg p.c./jour. On n’a noté ni mortalité ni signe clinique non transitoire de toxicité lié au traitement dans les groupes traités. On a observé un léger effet sur le poids corporel moyen chez les femelles du groupe ayant reçu la dose moyenne et du groupe ayant reçu la dose élevée par rapport aux témoins (101 % et 106 %, respectivement) qui était en corrélation avec une légère augmentation non statistiquement significative de la consommation d’aliments dans ces groupes. On a aussi observé une diminution de la numération plaquettaire chez les mâles ayant reçu la dose moyenne et ceux ayant reçu la dose élevée, mais cette variation n’était pas dépendante de la dose, et, selon les auteurs, se situait dans la fourchette des témoins historiques. De même, le taux de cholestérol moyen significativement plus faible noté uniquement dans le groupe des mâles ayant reçu la dose moyenne a été considéré comme fortuit. On n’a relevé aucun effet lors des tests neurocomportementaux effectués à la fin de la période d’étude. Chez les femelles, il n’y avait aucune augmentation statistiquement significative du poids absolu de la rate dans le groupe ayant reçu la dose élevée et du poids relatif de la rate (par rapport au poids du cerveau) dans le groupe ayant reçu la dose faible et dans celui ayant reçu la dose élevée, par rapport aux témoins. Cette augmentation était qualifiée de minime. On n’a décelé aucune anomalie pathologique macroscopique ou histopathologique dans les organes examinés, dont la rate. Par conséquent, la variation du poids de la rate n’a pas été considérée comme un effet nocif. Compte tenu des renseignements présentés dans le résumé et de l’absence de résultats ayant une pertinence toxicologique, peu importe la dose, on a déterminé que la dose sans effet nocif observé (DSENO) est supérieure à 1 000 mg/kg p.c./jour (Anonyme, 2015a, cité dans ECHA, c2007‑2016a).
On n’a également relevé aucun résultat ayant une pertinence toxicologique dans d’autres études à doses répétées par voie orale chez le rat (non conformes aux lignes directrices) de courte durée réalisées avec une dose de 7 500 mg/kg p.c./jour sur 5 jours (Molnar, 1960, cité dans ACC], 2004) et avec une concentration de 10 % dans l’alimentation (~5 000 mg/kg p.c./jour) sur 4 semaines (Anonyme, 1960a, cité dans ECHA, c2007‑2016a).
Toxicité pour la reproduction et le développement
L’étude menée avec l’érucamide administrée à doses répétées pendant 90 jours conformément aux lignes directrices de l’OCDE et que l’on a résumée précédemment comprenait l’examen des tissus et des organes reproducteurs, ainsi que de paramètres de la fertilité. On n’a décelé aucun effet sur le compte des spermatozoïdes ou sur leur morphologie. Le pourcentage de spermatozoïdes motiles était plus faible, tout comme celui des spermatozoïdes se déplaçant rapidement dans l’épididyme, mais un compte de spermatozoïdes statiques plus élevé chez deux animaux du groupe ayant reçu la dose faible. Aucun effet n’a été observé dans le groupe ayant reçu la dose élevée. Compte tenu de l’absence d’une régularité et d’un effet dépendant de la dose, on considère que ce résultat est peut‑être spontané et vraisemblablement non lié à la substance. Chez les animaux femelles, l’érucamide n’a eu aucun effet sur le cycle œstral (Anonyme, 2015a, cité dans ECHA, c2007‑2016a).
Des études sur les effets de l’acide érucique (métabolite de l’érucamide) et de l’acide oléique (métabolite de l’oléamide) sur la reproduction ont été relevées et examinées. L’une des études portait sur les effets de l’acide érucique et l’acide oléique sur la fertilité des rats (Carroll et Noble, 1957). Dans cette étude, les rats mâles (2 à 6 par groupe) recevaient une alimentation contenant 15 % d’acide érucique ou 15 % d’acide oléique (qui équivaut à 7 500 mg/kg p.c./jour) pendant environ 3 mois avant l’accouplement avec des femelles (3 à 12 par groupe) recevant la même alimentation pendant la même période que les mâles ou avec des femelles recevant une alimentation normale sans suppléments d’acides gras. On a observé une diminution de la fertilité des mâles à qui on a administré une alimentation contenant 15 % d’acide érucique lorsqu’ils s’accouplaient à des femelles ayant eu la même alimentation ou à des femelles ayant eu une alimentation normale. À l’opposé, les mâles ayant reçu un supplément de 15 % d’acide oléique dans leur alimentation n’ont montré aucune inhibition de la fertilité. Reyes et al. (1995) ont observé que le fait de nourrir des rats mâles et femelles Wistar sevrés et des hamsters dorés de Syrie avec une alimentation contenant 25 % d’huile de colza (41,5 % d’acide érucique, selon les calculs environ 5 200 mg/kg p.c./jour) pendant une période de 90 jours avant l’accouplement n’entrainait pas d’effets nocifs visibles sur la reproduction ou le développement. Étant donné les doses excessives utilisées par Carrol et Noble (1957), l’absence d’effets sur la fertilité observés dans l’étude avec l’huile de colza et l’absence d’effets observés sur les paramètres de la reproduction dans l’étude sur 90 jours conforme aux lignes directrices de l’OCDE menée jusqu’à la dose limite, les substances ne sont probablement pas des substances toxiques pour la reproduction.
Un résumé d’une étude sur la toxicité pour le développement menée conformément aux lignes directrices de l’OCDE a été présenté à l’ECHA en vertu du règlement REACH. L’érucamide a été administrée à des rats femelles gravides Wistar à une dose de 0, 100, 300 ou 1 000 mg/kg p.c./jour du 5e jour au 19e jour de la gestation, et les animaux ont été sacrifiés au 20e jour de la gestation. On n’a observé aucune toxicité liée au traitement chez les mères et aucun effet sur le poids de l’utérus gravide, le nombre de corps jaunes, les implantations, les résorptions, le pourcentage de pertes avant implantation ou le pourcentage de pertes après implantation dans tous les groupes traités. À l’examen des fœtus, on n’a relevé aucun effet lié au traitement pour ce qui est du rapport des sexes, du nombre de fœtus vivants ou morts ou du nombre moyen de fœtus par rapport aux témoins. En général, le poids de la portée n’était pas touché, et on a observé uniquement un poids significativement plus faible de la portée des femelles (diminution de 27 %), dans le groupe ayant reçu la dose faible par rapport aux témoins. Comme cette observation n’était pas dépendante de la dose et ne concernait que les femelles, elle était probablement fortuite. On a constaté une augmentation statistiquement significative de la fréquence d’une ossification incomplète de l’os interpariétal chez les petits du groupe ayant reçu la dose faible, mais pas dans le groupe ayant reçu la dose moyenne ou la dose élevée. On a constaté une augmentation de la fréquence d’une coloration plus foncée du lobe droit du foie chez les petits du groupe ayant reçu la dose moyenne, mais pas dans le groupe ayant reçu la dose faible ou la dose élevée. Aucun de ces deux effets ne dépendait de la dose et n’avait probablement pas d’importance toxicologique. D’après les données du résumé de l’étude et compte tenu de l’absence d’effets sur le développement, peu importe la dose, la DSENO est donc supérieure à 1 000 mg/kg p.c./jour (Anonyme, 2015b, cité dans ECHA, c2007‑2016a).
3.5.3 Caractérisation des risques pour la santé humaine
L’érucamide et l’oléamide ne sont pas génotoxiques et présentent une faible toxicité aiguë. Aucun effet critique de l’érucamide n’a été observé jusqu’à la dose limite de 1 000 mg/kg p.c./jour dans les études sur la toxicité pour le développement et à doses répétées menées conformément aux lignes directrices. Comme l’érucamide n’est pas génotoxique et en l’absence d’effets significatifs pathologiques macroscopiques ou histopathologiques dans l’étude à doses répétées jusqu’à la dose limite, la cancérogénicité ne devrait pas être problématique. Par ailleurs, on n’a relevé aucun effet sur les organes reproducteurs ou les paramètres examinés au cours de l’étude. On disposait de données limitées sur la toxicité de l’oléamide. Toutefois, comme l’érucamide et l’oléamide présentent une structure chimique, des propriétés physicochimiques et une toxicocinétique semblables, on s’est fondé sur les données de l’érucamide pour conclure que l’oléamide présente probablement une toxicité faible.
Comme on considère que l’érucamide et l’oléamide présentent un faible potentiel de danger, les estimations de l’exposition aux sources relevées et découlant des usages répertoriés ne sont pas considérées comme significatives, et le risque pour la santé humaine est jugé faible.
3.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Comme les études permettant d’examiner les effets de l’oléamide sur la santé sont peu nombreuses, on a eu recours aux données d’un analogue, soit l’érucamide, pour combler les lacunes de données sur la santé humaine. Toutefois, cette approche a eu pour effet d’augmenter les incertitudes dans l’évaluation des risques pour la santé humaine.
4. Produits de réaction de l’AIOD avec la TEPA
4.1 Identité des substances
Le no CAS et le nom sur la LIS des produits de réaction de l’AIOD avec la TEPA, qui sont considérés comme une substance UVCB, est présenté au tableau 4‑1. Selon un plan d’essai présenté à l’Environmental Protection Agency des États‑Unis dans le cadre du High Production Volume Challenge program, cette substance est synthétisée en combinant de l’AIOD liquide à un lubrifiant hautement raffiné à base d’huile qui sert de diluant, suivi de l’ajout de TEPA (ACC, 2003). D’après la structure chimique, les produits de réaction sont des polyamides variables dans lesquels les acides gras (n = 1 à 3) prennent diverses positions (azote en position 1, 7 et/ou 13, respectivement) du réactif polyamine. La substance n’est pas isolée d’huiles de base raffinées, mais est plutôt mélangée à d’autres additifs pour préparer des huiles lubrifiantes (la concentration de cette substance varie de 9 % à 34 % en poids [ACC, 2003]). Il est impossible d’obtenir des détails sur la composition des divers constituants de cette substance, notamment la proportion des substances de départ (s’il y a lieu) n’ayant pas réagi et qui pourraient demeurer dans le produit fini (huile lubrifiante). Toutefois, dans un dossier public présenté à l’ECHA en vertu du règlement REACH, le titulaire indique que le no CAS 68784‑17‑8 est un agent dispersant à base de polyamide dont le poids moléculaire moyen est supérieur à 1 000 (ECHA, c2007‑2016b). Les structures représentatives des constituants du mélange sont aussi présentées au tableau 4‑1.
| No CAS | Nom sur la LIS |
Structure représentative des substances de départ et des produits de réaction | Poids moléculaire (Da) |
|---|---|---|---|
| 68784-17-8a |
Acide iso-octadécanoïque, produits de réaction avec la tétra-éthylènepentamine | 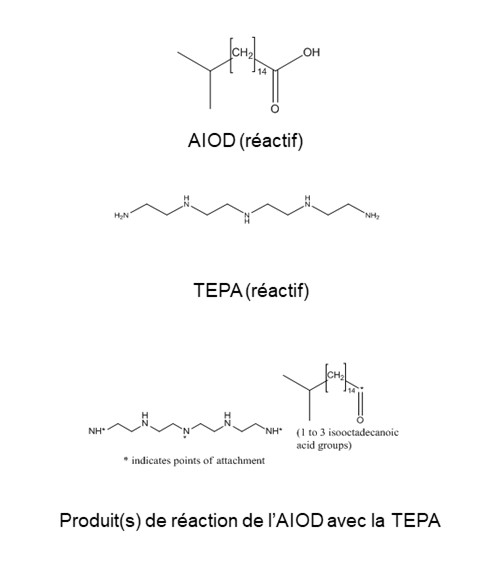 |
284 AIOD (réactif) 189 TEPA (réactif) Environ > 1 000 produit(s) de réaction de l’AIOD avec la TEPA |
Abréviations : AIOD = acide iso‑octadécanoïque; TEPA = tétra‑éthylènepentamine
a Le no CAS 68784‑17‑8 est une substance UVCB (substance de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
4.2 Propriétés physicochimiques
Le tableau 4‑2 présente un résumé des propriétés physicochimiques des principaux produits de réaction possible de l’AIOD avec la TEPA. La réaction de l’AIOD avec la TEPA produira un mélange de polyamides dont le poids moléculaire moyen est supérieur à environ 1 000. Lorsque les données expérimentales d’une propriété physicochimique étaient peu nombreuses ou n’existaient pas, des modèles ont été utilisés pour prédire les valeurs associées à la substance. Les données expérimentales concernent le mélange. Les données modélisées ont été obtenues pour une fourchette de propriétés physicochimiques de tous les produits possibles, d’après les structures représentatives du tableau 4‑2 (soit les produits de réaction de la TEPA portant 1 à 3 groupes AIOD). D’autres propriétés physicochimiques sont répertoriées dans ECCC (2016b).
Propriété |
Valeur ou fourchettea |
Type de données |
Référence clé |
|---|---|---|---|
État physique |
Liquide |
s.o. |
Anonyme, 2012a, cité dans ECHA, c2007‑2016b |
Point de fusion (°C) |
1 |
Mesurée |
Anonyme, 2012b, cité dans ECHA, c2007‑2016b |
Point d’ébullition (°C) |
220 à 350 |
Mesurée |
Anonyme, 2012c, cité dans ECHA, c2007‑2016b |
Pression de vapeur (mm Hg) |
5,26 × 10−26 à 5,99 × 10−11 |
Prédite |
MPBPWIN, 2008b |
Constante de la Loi de Henry (atm m3/mol) |
8,53 × 10-16 à 1,23 × 10−13 |
Prédite |
HENRYWIN, 2008c |
Solubilité dans l’eau (mg/L) |
< 0,05 |
Mesurée |
Anonyme, 2012d, cité dans ECHA, c2007‑2016bd |
log Koe (sans dimension) |
4,79 à 18,38 |
Prédite |
ACD/Percepta, c1997‑2015 |
Abréviations : Koe = coefficient de partage octanol‑eau; s.o. = sans objet.
a La fourchette des valeurs prédites (c.‑à‑d. modélisées) concerne la TEPA sur laquelle sont rattachés 1 à 3 groupes AIOD.
b méthode de Grain modifié
c méthode des liaisons
d technique de mesure de la turbidité et spectrophotométrie UV/visible en mode transmittance
4.3 Sources et utilisations
D’après les renseignements recueillis lors de la collecte de données menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), l’UVCB composé des produits de réaction de l’AIOD avec la TEPA n’a pas été fabriqué au Canada en quantités supérieures au seuil de déclaration de 100 kg. Selon les déclarations, on a importé au Canada des quantités variant de 100 à 1 000 kg en 2011 (Environnement Canada, 2013). Les renseignements déclarés en vertu de l’article 71 indiquent que l’UVCB composé des produits de réaction de l’AIOD avec la TEPA est utilisé dans des lubrifiants et des graisses (Environnement Canada, 2013).
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA n’est pas naturellement présent dans l’environnement. Par conséquent, les rejets de cette substance dans l’environnement découlant des usages industriels en système fermé et de l’utilisation des produits de consommation devraient être minimes (ECHA, c2007‑2016b).
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA n’a pas été mesuré dans les milieux naturels, n’est pas réputé être présent dans les matériaux d’emballage alimentaire, n’est pas autorisé comme additifs alimentaires et est absent des médicaments, des produits de santé naturels, des cosmétiques et des produits antiparasitaires au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation, de la Direction générale des produits de santé et des aliments et de l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada destinés au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2016; sans référence).
Cette substance sert à préparer des huiles lubrifiantes (produits finis) utilisées dans les moteurs à deux temps à refroidissement liquide comme agents dispersants sans cendre pour réduire les dépôts sur les pistons et empêcher le blocage des segments et le préallumage du moteur (ACC, 2004). La concentration de cet UVCB dans les huiles (produits finis) varie généralement de 9 % à 34 % en poids, et l’UVCB est alors mélangé à l’essence dans une proportion de 50:1 à 100:1 (ACC, 2004). L’UVCB composé des produits de réaction est présent dans l’huile destinée aux moteurs hors-bord à deux temps à des concentrations variant de 9 % à 10 % (CPID, 2016; US HPD, 2001‑2015), et il s’agit aussi d’un produit de consommation vendu au Canada (Amazon, 2008‑2017a,b,c).
Cet UVCB a aussi été décelé dans un produit assouplissant le linge vendu aux formulateurs d’assouplisseurs et de détergents à lessive, et selon une fiche signalétique, sa concentration serait inférieure ou égale à 100 % (FS, 2011; Croda.com, c2016). Cependant, il était impossible de confirmer que ce produit a été vendu aux consommateurs au Canada.
Selon des données d’autres pays, les produits de réactions sont utilisés dans des liquides de frein, des fluides frigorigènes, des fluides thermiques, des fluides hydrauliques, des fluides métallurgiques, des huiles à moteur, des radiateurs électriques fonctionnant à l’huile et des agents technologiques (CPCat, 2014; ECHA, c2007‑2016b).
4.4 Risques de causer des effets nocifs sur l’environnement
Les données critiques et les considérations sur lesquelles nous avons élaboré les profils des produits de réaction de l’AIOD avec la TEPA ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Sur la base des classifications de faible danger et de faible exposition fondées sur les renseignements considérés dans la CRE, les produits de réaction de l’AIOD avec la TEPA ont été classés comme ayant un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances entraînent des préoccupations à l’égard de l’environnement au Canada.
4.5 Risques de causer des effets nocifs sur la santé humaine
4.5.1 Évaluation de l’exposition
Milieux naturels
Il n’existe aucune étude publiée sur les quantités mesurées de produits de réaction de l’AIOD avec la TEPA dans un milieu naturel au Canada ou dans d’autres pays. Étant donné les faibles quantités importées au Canada en 2011, l’utilisation ponctuelle ou limitée et la mobilité relativement faible de la substance dans l’environnement (c.‑à‑d. volatilité faible prédite, faible solubilité dans l’eau et log Koe élevé), la présence des produits de réaction dans un milieu naturel devrait être minimale, et le risque pour la santé humaine de la population générale découlant des rejets devrait être faible.
Produits de consommation
Il a été déterminé que l’UVCB composé des produits de réaction de l’AIOD avec la TEPA entre dans la composition des huiles destinées aux moteurs hors-bord à deux temps. Les huiles des moteurs à deux temps sont mélangées physiquement à du carburant ou, dans le cas de l’injection directe, sont combinées au carburant dans la chambre de combustion sous la forme d’un jet de quantité précise (NMMA Canada, c2015). Compte tenu du profil d’utilisation limitée, l’exposition orale et par inhalation de la population générale ne devrait pas avoir lieu. L’exposition cutanée pourrait survenir au cours du ravitaillement en carburant d’un moteur à deux temps d’une motomarine. Les moteurs hors-bord à deux temps à injection directe nécessitent un remplissage du réservoir d’huile (distinct). Les moteurs hors-bord à deux temps à injection non directe requièrent un mélange physique du carburant à l’huile dans le réservoir portable à chaque remplissage. Il peut se produire une exposition cutanée lorsque de l’huile nouvelle entre accidentellement en contact avec la peau dans le bateau ou sur le quai avant ou après le mélange avec l’essence. L’absorption cutanée devrait être minime compte tenu du Koe, de la solubilité dans l’eau et du poids moléculaire moyen du mélange. Les huiles à moteur sont visqueuses, ce qui entraîne une vitesse de diffusion relativement lente de l’huile dans l’épiderme.
4.5.2 Évaluation des effets sur la santé
Toxicocinétique
Compte tenu de la faible pression de vapeur de cet UVCB, l’inhalation ne devrait pas être une voie importante d’exposition. On s’attend à ce que l’absorption cutanée et orale soit minime en raison du poids moléculaire moyen élevé (> 1 000) et du log Koe élevé.
Génotoxicité
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA a été l’objet d’essais de génotoxicité menés conformément aux lignes directrices de l’OCDE et s’est révélé non mutagène ou clastogène. Les études de mutagénicité sur bactéries réalisées avec Salmonella typhimurium (TA98, TA100, TA1535, et TA1537) ont donné des résultats négatifs, avec ou sans activation métabolique (Anonyme, 1986b, cité dans ACC, 2003). Cet UVCB n’a pas induit d’aberrations chromosomiques dans les lymphocytes humains du sang périphérique en culture, avec ou sans activation métabolique (Anonyme, 2006, cité dans ECHA, c2007‑2016b).
Toxicité aiguë et avec doses répétées
On a étudié la toxicité aigue avec cinq rats SD mâles et cinq rats SD femelles qui ont reçu une dose orale unique de 5 000 mg/kg p.c. de produits de réaction de l’AIOD avec la TEPA. Au cours de la période d’observation de 14 jours, aucun animal n’est décédé, et aucun signe important de toxicité n’a été relevé au cours de la nécropsie. La DL50 a été calculée et s’avère être supérieure à 5 000 mg/kg p.c. (Anonyme, 1985, cité dans ACC, 2003). Dans une étude sur la toxicité aiguë par voie cutanée, la substance a été appliquée sur la peau de cinq lapins blancs de Nouvelle‑Zélande mâles et femelles à une dose de 2 000 mg/kg p.c. durant 24 heures. On n’a observé aucune mortalité (DL50 > 2 000 mg/kg p.c.), même si on a noté une irritation cutanée (résultats microscopiques : hyperkératose légère, croûtes cutanées, inflammation du derme et acanthosis) (Anonyme, 1986a, cité dans ACC, 2003).
Le résumé d’une étude sur la toxicité aigue avec des doses répétées menée conformément aux lignes directrices de l’OCDE a été présenté à l’ECHA en vertu du règlement REACH. L’UVCB composé des produits de réaction de l’AIOD avec la TEPA a été administré à des rats SD mâles et femelles (14/sexe/dose dans le groupe témoin et le groupe ayant reçu la dose élevée; 7/sexe/dose dans le groupe ayant reçu la dose faible) par gavage à une dose de 0, 60, 250 ou 1 000 mg/kg p.c./jour dans de l’huile de maïs (vecteur) pendant 28 jours. L’étude comprenait aussi une période d’observation post‑traitement de 14 jours au cours de laquelle un sous‑groupe d’animaux du groupe témoin et un sous-groupe du groupe ayant reçu la dose élevée n’ont reçu aucun autre traitement. Aucun résultat important n’a été signalé, peu importe la dose et le paramètre examiné, notamment le poids corporel et le gain de poids, la consommation d’aliments, les paramètres hématologiques et de biochimie clinique, le comportement neurologique, le poids des organes, la pathologie macroscopique et l’histopathologie. Il a été déterminé que la DSENO était > 1 000 mg/kg p.c./jour (Anonyme, 2007a, cité dans ECHA, c2007‑2016b).
Toxicité pour la reproduction et le développement
Un résumé d’une étude sur la toxicité pour le développement et la reproduction combinés réalisée conformément aux lignes directrices de l’OCDE a été présenté à l’ECHA en vertu du règlement REACH. Un groupe de 12 mâles rats SD et un groupe de 12 femelles ont reçu des produits de réaction de l’AIOD avec la TEPA par gavage à la dose de 0, 150, 450 ou 1 000 mg/kg p.c./jour dans de l’huile de maïs pour un total de 39 à 43 doses, du 14e jour précédant l’accouplement au 3e jour de la lactation. Les femelles parents sans signes d’accouplement après 14 jours ont été séparées des mâles et ont continué à recevoir un traitement jusqu’au 25e jour suivant la cohabitation (pour un total de 52 doses). On a noté les observations cliniques concernant les animaux parents et mesuré la consommation d’aliments et le poids corporel au cours de la période d’étude. À la nécropsie, certains organes ont été pesés et on a consigné les observations macroscopiques et microscopiques (organes non précisés dans le résumé de l’étude). La fonction de reproduction des mâles et des femelles n’a pas été touchée de façon importante, peu importe la dose. On n’a constaté aucun effet nocif, peu importe le paramètre examiné et la dose à l’étude chez les animaux parents. On n’a relevé aucun effet statistiquement significatif sur la viabilité des petits (nombre de petits nés et vivants au jour 0 suivant la naissance) ou rapport des sexes, peu importe la dose. De même, aucun effet n’a été signalé sur le poids corporel des petits, et il n’y a eu aucune observation clinique durant les jours où on a effectué un examen (0 et 4e jour après la naissance). On a déterminé que la DSENO fondée sur une toxicité générale et pour la reproduction chez les parents et une toxicité pour le développement chez les petits était > 1 000 mg/kg p.c./jour (Anonyme, 2007b, cité dans ECHA, c2007‑2016b).
4.5.3 Caractérisation des risques pour la santé humaine
L’UVCB composé des produits de réaction de l’AIOD avec la TEPA n’est pas génotoxique et présente une faible toxicité aiguë par voie orale et cutanée. Aucun effet nocif sur la santé n’a été observé dans l’étude sur la toxicité aigue avec des doses répétées ou chez les animaux parents ou les petits de l’étude sur la toxicité pour le développement et la reproduction combinés. Les deux études ont été réalisées jusqu’à la dose limite de 1 000 mg/kg p.c./jour. Comme la substance n’est pas génotoxique et en l’absence d’effets pathologiques macroscopiques ou histopathologiques importants dans les études sur la toxicité examinées (jusqu’à la dose limite), la cancérogénicité ne devrait pas être préoccupante.
La principale source d’exposition aux produits de réaction de l’AIOD avec la TEPA devrait découler d’un déversement sur la peau d’huile destinée à des moteurs hors-bord à deux temps vendue aux consommateurs au Canada. Compte tenu des faibles quantités importées annuellement, de l’utilisation ponctuelle et limitée et des propriétés physicochimiques indiquant une faible mobilité dans l’environnement (c.‑à‑d. volatilité faible et solubilité dans l’eau négligeable ou faible), l’exposition de la population générale au Canada devrait être minime.
Comme on n’a noté aucun effet nocif à la dose la plus élevée étudiée et que l’exposition est minime, le risque pour la santé humaine est jugé faible.
4.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Comme les produits de réaction de l’AIOD avec la TEPA présentent un poids moléculaire supérieur à 500, et qu’il s’agit d’un UVCB, les valeurs prédites par modélisation des propriétés physicochimiques comportent une grande incertitude. Cette incertitude est jugée acceptable, car les produits de réaction de l’AIOD avec la TEPA sont un UVCB et parce que les valeurs obtenues par modélisation reposent sur les structures représentatives des principaux produits de réaction. Le fait que les valeurs prédites et les valeurs mesurées des principaux paramètres physicochimiques concordent renforce la confiance dans les valeurs prédites obtenues par modélisation et le faible risque évalué d’absorption par voie cutanée et de mobilité dans l’environnement.
La présente évaluation des risques pour la santé humaine s’appuyait exclusivement sur les résumés du petit nombre d’études toxicologiques effectuées sur les produits de réaction de l’AIOD avec la TEPA présentés en vertu du règlement REACH. Bien qu’elle soit basée sur des usages limités et l’exposition minime subséquente à laquelle on s’attend dans la population générale, cette incertitude est jugée acceptable.
5. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA présentent un faible risque d’effets nocifs sur l’environnement. Il est conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que l’érucamide, l’oléamide et les produits de réaction de l’AIOD avec la TEPA ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[ACC] American Chemistry Council. 2004. Fatty Nitrogen Derived Amides Categories [EPA] High Production Volume (HPV) Chemicals Challenge: Assessment of Data Availability and Test Plan. Fatty Nitrogen Derivatives Panel (disponible en anglais seulement).
[ACC] American Chemistry Council. 2003. Test Plan for Isooctadecanoic acid reaction products with TEPA. Petroleum Additives Panel (disponible en anglais seulement).
ACD/Percepta [module de prévision]. c1997-2015 Version 14.0.0 (Build 2726). Toronto (Ontario), Advanced Chemistry Development, Inc. (disponible en anglais seulement).
Anonyme. 2015a. Auteurs non mentionnés [Erucamide Repeated Dose 90-Day Oral Toxicity]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Anonyme. 2015b. Auteurs non mentionnés [Erucamide Prenatal Developmental Toxicity Study]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement.
Anonyme. 2012a. Auteurs non mentionnés. [Isooctadecanoic acid reaction products with TEPA appearance/physical state/colour observed behaviour study]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement.
Anonyme. 2012b. Auteurs non mentionnés. [Isooctadecanoic acid reaction products with TEPA melting point/melting range (OECD Guideline 102) study]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement).
Anonyme. 2012c. Auteurs non mentionnés. [Isooctadecanoic acid reaction products with TEPA thermal gravimetric analysis boiling point study]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement).
Anonyme. 2012d. Auteurs non mentionnés. [Isooctadecanoic acid reaction products with TEPA turbidity measurement technique water solubility study]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement).
Anonyme. 2010a. Auteurs non mentionnés [In vitro mammalian cell gene mutation test in mouse lymphoma L5178Y cells]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Anonyme. 2010b. Auteurs non mentionnés [Erucamide In vitro mammalian chromosome aberration test in Chinese hamster lung fibroblasts (V79)]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Anonyme. 2010c. Auteurs non mentionnés [Erucamide Acute Dermal Toxicity Study]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Anonyme. 2007a. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA Repeated Dose 28-Day Oral Toxicity]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement).
Anonyme. 2007b. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA Combined developmental and reproductive toxicity study]. [Cité dans ECHA c2007-2016b] (disponible en anglais seulement).
Anonyme. 2006. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA chromosomal aberrations in cultured human peripheral blood lymphocytes]. [Cité dans ECHA c2007-2015b] (disponible en anglais seulement).
Anonyme. 1986a. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA Acute Dermal Toxicity Study]. [Cité dans ACC 2003] (disponible en anglais seulement).
Anonyme. 1986b. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA Bacterial Reverse Mutation Assay]. [Cité dans ACC 2003] (disponible en anglais seulement).
Anonyme. 1985. Auteurs non mentionnés [Isooctadecanoic acid reaction products with TEPA Acute Oral Toxicity Study]. [Cité dans ACC 2003] (disponible en anglais seulement).
Anonyme. 1960a. Auteurs non mentionnés [4-week digestibility diet study on erucaylamide]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Anonyme. 1960b. Auteurs non mentionnés [Incubation of erucamide with rat liver homogenate]. [Cité dans ECHA c2007-2016a] (disponible en anglais seulement).
Ash M, Ash I. 2008. Handbook of food packaging chemicals and materials. 2e édition. Endicott (New York), Synapse Information Resources, Inc. p. 531 et 621 (disponible en anglais seulement).
Boger DL, Fecik RA, Patterson JE, Miyauchi H, Patricelli MP, Cravatt BF. 2000. Fatty acid amide hydrolase substrate specificity. Bioorganic & Medicinal Chemistry Letters(10):2613-2616 (disponible en anglais seulement).
Canada. [1978]. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Carroll KK, Noble RL 1957. Influence of a dietary supplement of erucic acid and other fatty acids on fertility in the rat; sterility caused by erucic acid. Can J Biochem Physiol. 35(11):1093-105 (disponible en anglais seulement).
[CCRIS] Chemical Carcinogenesis Research Information System [base de données]. 2011. Bethesda (Maryland), US National Library of Medicine. [Mis à jour le 7 août 2011; consulté le 10 mai 2018] (disponible en anglais seulement).
[CNRC] Conseil national de recherche du Canada. 2011. Chemicals management plan Health Canada moderate priorities: Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Rapport rédigé sous contrat pour le compte de Santé Canada. Ottawa (Ont.), Santé Canada (disponible en anglais seulement).
Cooper I, Lord T, Tice PA. 1995. Hydrolysis studies on oleamide in simulated gastrointestinal fluids. Food Additives & Contaminants, 12:6, 769-777 (disponible en anglais seulement).
Cooper I, Tice PA. 1995. Migration studies on fatty acid amide slip additives from plastics into food simulants. Food Additives and Contaminants. 12(2): 235-244 (disponible en anglais seulement).
[CPCat] Chemical and Product Categories [base de données]. 2014. Ver. 04. Washington (DC), US Environmental Protection Agency. [Mis à jour le 21 mai 2014; consulté le 20 juillet 2016] (disponible en anglais seulement). [Base de données décrite dans Dionisio KL, Frame AM, Goldsmith MR, Wambaugh JF, Liddell A, Cathey T, Smith D, Vail J, Ernstoff AS, Fantke P, et al. 2015. Exploring consumer exposure pathways and patterns of use for chemicals in the environment. Toxicol Rep. 2:228-237.] (disponible en anglais seulement).
[CPID] Consumer Product Information Database. 2001-2016. McLean (VA): DeLima Associates. [Révisé le 23 avril 2006; consulté le 8 novembre 2016]. Isooctanoic acid, reaction products with tetraethylenepentamine; no CAS 68784-17-8 (disponible en anglais seulement).
Crodahomecare.com. c2016. Snaith (Royaume-Uni), Croda International Plc. [Consulté le 10 mai 2018] (disponible en anglais seulement).
crodapolymeradditives.com. c2008. Crodamide slip & anti-block: for easier processing & handling of polymers. Snaith (Royaume-Uni), Croda International Plc. [Consulté le 25 avril 2017]. BP002 05/08 (disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ontario).
[ECCC] Environnement et Changement climatique Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Québec). Sur demande : substances@ec.gc.ca (disponible en anglais seulement).
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2007]. Catégorisation de substances chimiques. Ottawa (Ontario), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée, Ottawa (Ontario), ECCC, SC.
[ECHA] Agence européenne des produits chimiques. c2007-2016a. Registered substances database. Helsinki (Finlande), ECHA. [Mis à jour le 22 mars 2017; consulté le 10 mai avril 2018] (disponible en anglais seulement).
Environnement Canada. 2013. Données de la mise à jour de l’inventaire de la LIS 2012 obtenues en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données produites par Environnement Canada et Santé Canada, Programme des substances existantes.
Fedorova I, Hasimoto A, Fecik RA, Hendrick MP, Hanus LO, Boger DL, Rice KC, Basile AS. 2001. Behavioral evidence for the interaction of oleamide with multiple neurotransmitter systems. The Journal of Pharmacology and experimental Therapeutics. 299:332-342 (disponible en anglais seulement).
[FS] Fiche signalétique. 2011. Cirrasol st ultra-lq-(rb). Snaith (Royaume‑Uni), Croda International Plc. [Consulté le 19 décembre 2016] (disponible en anglais seulement).
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Ver. 3.20. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New York), Syracuse Research Corporation (disponible en anglais seulement).
[JETOC] Japan Chemical Industry Ecology-Toxicology & Information Center. 2008. Mutagenicity test data of existing chemical substances based on the toxicity investigation system of the industrial safety and health law. Supplement 4. [Cité dans CCRIS, 2011] (disponible en anglais seulement).
Johansson I. 2001. Amides, Fatty Acid. Kirk-Othmer encyclopedia of chemical technology. Version en ligne. New York (New York), John Wiley & Sons, Inc. [Consulté le 10 mai 2018]. [Accès restreint] (disponible en anglais seulement).
Jones E, Cook PGS, Grant RA, Kitching J. 1990a. Crodamide ER (Erucamide): Bacterial Mutation Assay. Report number CDA 58A/891761. Huntingdon Research Center Ltd., Huntingdon, Cambridgeshire (Royaume-Uni). [Cité dans ACC, 2001] (disponible en anglais seulement).
Jones E, Cook PGS, Grant RA, Kitching J. 1990b. Crodamide OR (Oleamide): Bacterial Mutation Assay. Report number CDA 58C/891778. Huntingdon Research Center Ltd., Huntingdon, Cambridgeshire (Royaume-Uni). [Cité dans ACC, 2001] (disponible en anglais seulement).
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.68. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New York), Syracuse Research Corporation (disponible en anglais seulement).
Milne GWA, dir. de publ. 2005. Gardner’s commercially important chemicals – Synonyms, trade names, and properties. Hoboken (New Jersey), John Wiley & Sons, Inc. p. 262 et 459 (disponible en anglais seulement).
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Ver. 1.43. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New York), Syracuse Research Corporation (disponible en anglais seulement).
Naidenko O, Leiba N, Sharp R, Houlihan J. 2008. Bottle water quality investigation: 10 major brands, 38 pollutants. Washington (DC), Environmental Working Group (disponible en anglais seulement).
Nilsson NH, Malmgren-Hansen, Bernth N, Pedersen E, Pommer K. 2006. Survey and health assessment of chemical substances in sex toys. Survey of chemical substances in consumer products No. 77. Copenhague (Danemark), ministère de l’Environnement du Danemark (disponible en anglais seulement).
Nilsson NH, Malmgren-Hansen B, Thomsen US. 2008. Mapping, emissions and environmental health assessment of chemical substances in artificial turf. Survey of chemical substances in consumer products No. 100. Copenhague (Danemark), ministère de l’Environnement du Danemark (disponible en anglais seulement).
NMMA.ca. c2015. Bolton (Ontario), National Marine Manufacturers Associate Canada. [Consulté le 10 mai 2018] (disponible en anglais seulement).
NOM05. 1987. PC-Nomograph-Programs to Enhance PC-Gems Estimates of Physical Properties for Organic Chemicals. Version 2.0 (disponible en anglais seulement).
Nonwoven for sanitary articles. 2003. Medical Textiles. July: 2-3 (disponible en anglais seulement).
Reijnders JBJ. 1988. Acute Oral Toxicity of UNISLIP 1753 in Rats. Report number 0812/1044. RCC NOTOX. [Cité dans ACC 2004] (disponible en anglais seulement).
Reyes H, Ribalta J, Hernández I, Arrese M, Pak N, Wells M, Kirsch RE. 1995. Is dietary erucic acid hepatotoxic in pregnancy? An experimental study in rats and hamsters. Hepatology. 21(5):1373-9 (disponible en anglais seulement).
[RSI] Risk Sciences International. 2017. Addressing human health hazard data gaps through the use of read-across for a group of primary amides. Rapport définitif. Ottawa (Ontario), Santé Canada. [Accès restreint] (disponible en anglais seulement).
Santé Canada. Listes des additifs alimentaires autorisés. [Modifié le 9 septembre 2016]. Ottawa (Ontario), Santé Canada. [Consulté le 10 mai 2018].
Simoneau C, van den Eede L, Valzacchi S. 2012. Identification and quantification of the migration of chemicals from plastic baby bottles used as substitutes for polycarbonate. Food Additives and Contaminants - Part A Chemistry, Analysis, Control, Exposure and Risk Assessment. 29 (3): 469-480 (disponible en anglais seulement).
Simoneit BRT, Rushdi AI, Abas MRB, Didyk BM. 2003. Alkyl amides and nitriles as novel tracers for biomass burning. Environmental Science and Technology. 37 (1): 16-21 (disponible en anglais seulement).
SRC. 2010. The Physical Properties Database (PHYSPROP). Syracuse (New York), SRC. [Consulté le 10 mai 2018] (disponible en anglais seulement).
Tønning K, Jacobsen E, Pedersen E, Strange M, Poulsen PB, Møller L, Boyd HB. 2009. Survey and health assessment of 2 year-olds to chemical substances in consumer products. Survey of chemical substances in consumer products No. 102. Copenhague (Danemark), ministère de l’Environnement du Danemark (disponible en anglais seulement).
[US EPA] U.S. Environmental Protection Agency. 2010a. Screening-level hazard characterization document: Fatty Nitrogen Derived (FND) Amides Category. Washington (DC), US EPA, Office of Pollution Prevention and Toxics (disponible en anglais seulement).
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.42. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New York), Syracuse Research Corporation (disponible en anglais seulement).
