Évaluation préalable groupe de certaines substances ignifuges organiques 1,6,7,8,9,14,15,16,17,17,18,18-Dodécachloropentacyclo[12.2.1.16,9.02,13.05,10]octadéca-7,15-diène déchlorane plus (DP)
Titre officiel : Évaluation préalable groupe de certaines substances ignifuges organiques 1,6,7,8,9,14,15,16,17,17,18,18-Dodécachloropentacyclo[12.2.1.16,9.02,13.05,10]octadéca-7,15-diène Déchlorane Plus (DP
Numéro de registre du Chemical Abstracts Service 13560-89-9
Environnement et Changement climatique Canada
Santé Canada
Mai 2019
No de cat. : En14-369/2019F-PDF
ISBN 978-0-660-30092-4
Sommaire
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont procédé à l’évaluation préalable de la substance 1,6,7,8,9,14,15,16,17,17,18,18-dodécachloropentacyclo[12.2.1.16,9.02,13.05,10]octadéca-7,15-diène, connue sous le nom de Déchlorane Plus® (Déchlorane Plus ou DP) (numéro de registre du Chemical Abstracts Service [no CAS] 13560-89-9). Le DP fait partie du groupe de certaines substances ignifuges organiques, groupe constitué de dix substances organiques ayant une fonction similaire, soit l’application à des matériaux en vue de retarder l’inflammation et la propagation du feu. Le DP a été identifié d’intérêt prioritaire pour une évaluation en raison d’autres préoccupations pour la santé humaine.
Le DP n’est pas présent naturellement dans l'environnement. D’après les renseignements recueillis lors d'une enquête menée en vertu de l'article 71 de la LCPE, les importations de DP au Canada étaient de 1 000 à 10 000 kg en 2011, pour une utilisation en tant qu'additif ignifuge pour plusieurs applications. Les utilisations du DP connues à l'échelle internationale comprennent des applications de gainage de fils et câbles, l’électronique, des appareils électroménagers, l’automobile, des connecteurs en matière plastique dure et des matériaux à base de matière plastique pour toiture. Des utilisations similaires sont connues ou devraient exister au Canada. Le DP est actuellement commercialisé en tant que solution de substitution au décabromodiphényléther (décaBDE) pour une variété d’applications de substances ignifuges pour des fils électriques et des câbles, l’automobile, des matériaux en matière plastique pour toiture et des connecteurs en matière plastique dure. Bien que le DP ne soit pas produit au Canada, c’est une substance produite en grande quantité aux États‑Unis, et sa production en Chine a récemment été rapportée. Les estimations récentes de production de DP vont de 450 000 à 4 500 000 kg pour l’importation/production aux États-Unis.
Les rejets de DP dans l’environnement sont les plus susceptibles de survenir au cours de la production, de la formulation ou de l’utilisation industrielle. Les rejets dans l’environnement devraient principalement résulter du traitement des eaux usées, certains sites en rejettant directement dans l’eau. Bien que du DP puisse être présent dans les produits commerciaux et des produits disponibles pour les consommateurs, les renseignements sur les rejets dans l’environnement de tels produits sont limités, et de tels rejets devraient être diffus et faibles par rapport à ceux des sources ponctuelles des systèmes de traitement des eaux usées et des eaux industrielles. Généralement, le DP est caractérisé par une solubilité dans l’eau très faible, une pression de vapeur faible à très faible et des coefficients de partage carbone organique-eau et de partage octanol-eau très élevés. Après son rejet dans l’environnement, le DP devrait se retrouver principalement dans le sol et/ou les sédiments, en fonction du milieu de rejet, moins de 4 % restant dans l’air ou l’eau. En se basant sur des détections de DP dans des régions éloignées de l'Arctique et sur une possible importante efficacité de transport prédite (modèle de l’Organisation de coopération et de développement économique [OCDE] pour les polluants organiques persistants [POP]), le transport de DP lié à des particules peut être important pour le transport à grande distance de cette substance. Du DP a été mesuré dans l'environnement au Canada, ainsi qu'à l'échelle internationale, dans la plupart des milieux.
Des données expérimentales et des données modélisées indiquent que la biodégradation aérobie ou anaérobie du DP est très limitée et que cette substance devrait être très persistante dans l'eau, le sol et les sédiments. Des modélisations du DP dans l'air suggèrent une demi-vie inférieure à 1 jour dans la phase gazeuse, mais le DP sera plus que probablement sorbé sur des particules en suspension dans l'air et, par conséquent, la persistance dans l'air pourrait être plus longue.
Les études publiées sur la bioaccumulation et la bioamplification, ainsi que les mesures ubiquistes dans le biote, indiquent que le DP peut être fortement bioaccumulé et bioamplifié dans des organismes et des réseaux trophiques.
Étant donné les données empiriques limitées sur la toxicité aquatique du DP (en raison de sa faible solubilité dans l’eau), le potentiel de toxicité pour les poissons due à une absorption alimentaire dans l’eau a été étudié en suivant une approche de résidus corporels critiques (RCC). Les résultats des RCC suggèrent que le DP dans le biote (tissus de poissons du Canada) n’atteint pas une concentration dans les tissus entraînant une létalité aiguë ou chronique chez les organismes aquatiques. En raison du manque de données sur l’écotoxicité du DP dans le sol et les sédiments, des données sur la toxicité chronique pour deux substances analogues, le chlordane (no CAS 57-74-9) et le mirex (no CAS 2385-85-5), ont été évaluées. Bien que l’utilisation de ces analogues soit considérée prudente, les résultats suggèrent que le DP peut entraîner des effets à faible concentration chez les organismes vivant dans les sédiments ou le sol.
Des scénarios industriels ont été élaborés afin d’obtenir des estimations de l’exposition, en tenant compte des données disponibles sur les sites industriels, dont celles sur les quantités potentielles utilisées. Ces scénarios étaient basés sur un rejet industriel dans l’eau conduisant à une répartition de DP dans les sédiments et dans des biosolides d’eaux usées, suivi de leur épandage sur le sol. De plus, des données récentes de surveillance des systèmes de traitement des eaux usées à travers le Canada ont été utilisées pour mieux développer l’analyse de l’exposition. Des analyses de quotient de risque, intégrant des estimations prudentes de l’exposition à des renseignements sur la toxicité, ont été effectuées pour les organismes vivant dans les sédiments ou le sol, ainsi que pour la faune. Les résultats de ces analyses indiquent que le DP pourrait représenter un risque pour les organismes vivant dans les sédiments. De plus, bien que dans la plupart des scénarios pour le sol le DP présentait un faible risque pour les organismes en se basant sur les niveaux d’utilisation actuelle et de rejet au Canada, au moins un des scénarios d’exposition dans le sol suggère que les concentrations environnementales estimées de DP sont proches du niveau qui pourrait entraîner un risque pour les organismes vivant dans le sol.
La persistance élevée du DP suggère un potentiel d’accumulation dans l’environnement dû aux émissions passées et présentes, conduisant à des expositions à long terme dans les sédiments et le sol. Le DP devrait fortement s’adsorber sur les matières/solides en suspension lorsqu’il est rejeté dans les eaux de surface, soit directement suite à des activités industrielles soit indirectement par des systèmes de traitement des eaux usées, pour finir par se déposer dans les zones de dépôt des sédiments (c.-à-d. des puits). Dans plusieurs études, il a été rapporté des concentrations de DP dans les sédiments de la région des Grands Lacs excédant les concentrations environnementales estimées pour les sédiments utilisées pour les scénarios industriels et basées sur les quantités utilisées au Canada, suggérant que l’exposition au DP dans des zones spécifiques du Canada pourrait être sousestimée et que des mesures de précaution devraient être prises. Il serait bon de noter que le DP est une substance produite en grande quantité aux États‑Unis et que le transport passé et/ou présent du DP dans l'environnement à partir du nord des États-Unis, en particulier la production près des Grands Lacs, peuvent ainsi contribuer à une exposition du DP au Canada.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, il existe un risque d’effet nocif du DP sur l’environnement. Nous concluons que le DP satisfait aux critères de l'alinéa 64(a) de la LCPE, car il pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l'environnement ou sa diversité biologique. Toutefois, nous concluons que le DP ne satisfait à aucun des critères de l'alinéa 64(b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l'environnement nécessaire à la vie.
Aucune classification des effets du DP sur la santé par des organismes de réglementation nationaux ou internationaux n’a été trouvée. D'après les renseignements disponibles sur sa génotoxicité, il est improbable qu’il le soit. Lors d'études de toxicité par voie orale à dose répétée chez des animaux, aucun effet nocif n’a été observé à la dose la plus élevée testée.
Les principales sources d’exposition de la population générale au Canada devraient être les milieux de l’environnement (air, poussière, sol et eau) et les aliments, y compris le lait maternel.
En se basant sur les estimations d’absorption due aux milieux de l’environnement et aux aliments et sur le fait qu’aucun effet nocif pour la santé n’a été identifié, le risque posé par le DP à la population générale est considéré faible. Nous concluons donc que le DP ne satisfait à aucun des critères de l’alinéa 64(c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Conclusion globale
Nous concluons que le DP satisfait à un ou plusieurs des critères de l'article 64 de la LCPE. Il a été déterminé que le DP satisfait aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l'Environnement et de la Santé ont procédé à des évaluations préalables de substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances qui ont été déclarées d’intérêt prioritaire pour une évaluation, car elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE ou soulevaient des préoccupations ayant trait à l’environnement ou à la santé humaine (ECCC, SC modifié en 2017). Toutes ces substances ont une fonction similaire, soit l'application sur des matériaux en vue d'empêcher l'ignition et la propagation du feu. Ces substances sont également des solutions potentielles de remplacement d'autres produits ignifuges actuellement soumis à des contrôles réglementaires ou à un retrait progressif au Canada ou à l'échelle mondiale.
La présente évaluation préalable est centrée sur la substance 1,6,7,8,9,14,15,16,17,17,18,18-Dodécachloropentacyclo
[12.2.1.16,9.02,13.05,10]octadéca-7,15-diène, communément connue sous le nom de Dechlorane Plus® (Déchlorane Plus ou DP). Le numéro de registre du Chemical Abstracts Service (no CAS) du DP est 13560-89-9. Cette substance a été identifiée d’intérêt prioritaire lors de la catégorisation des substances inscrites sur la Liste intérieure des substances (LIS) en raison d’autres préoccupations pour la santé humaine. Le DP satisfaisait aux critères de persistance, mais pas de manière certaine à ceux ayant trait à la toxicité intrinsèque et à la bioaccumulation.
La présente évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l'environnement, les dangers, les utilisations et l'exposition, dont des renseignements soumis par des parties intéressées. Nous avons relevé des données pertinentes jusqu’en février 2017 pour ce qui est des évaluations ayant trait à l’environnement et à la santé humaine. Des données empiriques tirées d'études clés ainsi que certains résultats provenant de modélisations ont été utilisés pour tirer nos conclusions. Lorsqu'ils étaient pertinents, nous avons utilisé des renseignements présentés dans des évaluations d'autres juridictions.
La présente évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada (ECCC). Elle intègre des intrants provenant d'autres programmes menés dans ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'environnement ont fait l'objet d'un examen écrit externe par des pairs et/ou de consultations. Jon Arnot (Arnot Research and Consulting), Li Shen (ministère de l'Environnement de l'Ontario) et Ian Doyle (UK EA) ont fait des commentaires sur les parties techniques concernant l'environnement. Des experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA) ont fait des commentaires sur les parties techniques concernant la santé humaine. Des commentaires ont aussi été faits par Patricia McGinnis (consultante indépendante), Pam Williams (E Risk Sciences) et Paul Rumsby (National Centre for Environmental Toxicology). De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, Santé Canada et ECCC assument la responsabilité du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est centrée sur des renseignements critiques pour déterminer si cette substance satisfait à des critères de l’article 64 de la LCPE. À cette fin, nous avons étudié ces renseignements scientifiques et suivie une approche basée sur le poids de preuve et le principe de précautionNote de bas de page 1 . Nous présentons dans la présente évaluation préalable des renseignements critiques et des éléments pris en compte à partir desquels nous avons tiré nos conclusions.
2. Identité de la substance
La présente évaluation préalable traite du 1,6,7,8,9,14,15,16,17,17,18,18-dodécachloropentacyclo[12.2.1.16,9.02,13.05,10]octadéca-7,15-diène (Dechlorane Plus®, Déchlorane Plus ou DP). Cette substance est une substance ignifuge organique faisant partie du groupe de certaines substances ignifuges organiques établi dans le cadre de l’Initiative des groupes de substances du Plan de gestion des produits chimiques. L'identité structurelle de cette substance est présentée dans le tableau 21. D'autres noms attribués à cette substance sont présentés à l'Annexe A. Aux fins de la présente évaluation, nous désignerons le Déchlorane Plus par l’acronyme DP.
Le produit technique commercial DP est principalement un mélange des stéréoisomères syn- et anti-, mélange composé habituellement d'environ 25 % de syn-DP et 75 % d'anti-DP (Sverko et al. 2011). Le DP est une substance ignifuge chlorée cycloaliphatique produite par condensation de Diels-Alder du cycloocta-1,5-diène et de l’hexachlorocyclopentadiène dans un rapport molaire de 2/1 (Sverko et al. 2011).
| No CAS | Structure chimique | Masse moléculaire (g/mol) | Formule chimique |
|---|---|---|---|
| 13560-89-9 | 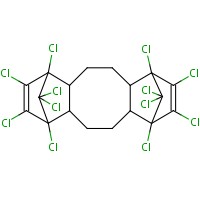 |
653,729 | C18H12Cl12 |
2.1 Sélection d’analogues et utilisation de (Q)SAR
Des directives sur l'utilisation d'une approche de lecture croisée et de modèles de relations quantitatives structure-activité ((Q)SAR) pour combler des lacunes dans les données ont été préparées par diverses organisations telles que l'Organisation de coopération et de développement économiques (OCDE). Ces méthodes ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l'Union européenne. Pour la présente évaluation, nous avons utilisé une approche de lecture croisée basée sur des données sur des analogues et les résultats de modèles QSAR, le cas échéant, pour étayer l'évaluation ayant trait à l’environnement.
Des analogues ont été sélectionnés en raison de leur structure et leur fonction similaires à celles du DP (p. ex. sur la base de leur toxicité dans les sédiments et le sol) et parce que des données empiriques pertinentes sur ceux-ci pouvaient être utilisées pour une lecture croisée. L'applicabilité des modèles QSAR a été déterminée au cas par cas. Nous donnons des détails sur les données obtenues par lecture croisée et les modèles QSAR retenus pour étayer les évaluations ayant trait à la santé humaine et à l'environnement dans les sections pertinentes du présent rapport.
Les analogues utilisés pour étayer les sections sur la toxicité dans les sédiments et le sol de la présente évaluation ayant trait à l’environnement sont présentés dans le tableau 22. Les options pour des analogues du DP sont limitées, étant donné que pour la plupart des analogues chimiques du DP il y a aussi un manque de données sur leur toxicité dans le sol et les sédiments. Le DP est utilisé en remplacement du produit ignifuge organochloré mirex (également appelé Déchlorane, no CAS 2385-85-5) (Feo et al. 2012). Le mirex a donc été identifié comme analogue potentiel. Le chlordane a aussi été identifié comme analogue de structure et de fonction similaires au moyen de la Boîte à outils QSAR de l'OCDE, pour lequel des données sur la toxicité dans les sédiments et le sol étaient disponibles. Le DP, le chlordane et le mirex (ainsi que d’autres « déchloranes ») sont tous synthétisés de la même manière à partir de l’hexachlorocyclopentadiène et devraient se comporter de façon similaire dans l'environnement (p. ex. répartition dans le sol et les sédiments, stabilité/persistance, etc.) (Environnement Canada 1977). Il est prudent d’utiliser le chlordane et le mirex comme analogues pour la toxicité, car ils sont davantage biodisponibles et, donc, probablement plus toxiques que le DP (au moins pour les organismes aquatiques) en raison de leur solubilité dans l’eau supérieure à celle du DP. Par conséquent, ces analogues étaient considérés comme des « pires cas », et représentaient une protection en ce qui a trait aux effets sur l’environnement dans le cas des sédiments et du sol.
Bien que le mirex n'ait jamais été homologué comme pesticide au Canada, il a été utilisé dans le monde entier comme insecticide pour la lutte contre les fourmis et d’autres insectes ravageurs et comme produit ignifuge (Environnement Canada 2014, PISSC 1984, PISSC 1988). Le chlordane est un pesticide organochloré qui a été utilisé au Canada depuis le milieu des années 1940 jusque dans les années 1980, mais son homologation et son utilisation en vertu de la Loi sur les produits antiparasitaires ont été discontinuées en 1991 (CCME 1999). Le chlordane et le mirex sont inscrits sur la Liste des substances toxiques (Annexe 1) de la LCPE.
D’autres substances de type déchlorane, comme le déchlorane 602 (no CAS 31107-44-5), le déchlorane 603 (no CAS 13560-92-4), le déchlorane 604 (no CAS 34571-16-9) et le Chlordène Plus (no CAS 13560-91-3) sont des analogues connus du DP (Sverko et al. 2011). Ils ont aussi été détectés dans l'environnement et le biote. Les déchloranes 602, 603 et 604 sont identifiés eux-mêmes comme produits ignifuges, et le déchlorane 603 et le Chlordène Plus ont été détectés dans les pesticides organochlorés (Shen et al. 2011a). Le déchlorane 602 et le déchlorane 604 sont inscrits sur la Liste extérieure des substances du Canada, indiquant qu'ils sont utilisés à l'échelle internationale. Toutefois, toute utilisation d’une de ces quatre substances au Canada devrait être mineure. En outre, il existe peu ou pas de données sur la toxicité dans les sédiments et le sol de ces substances et, par conséquent, il n’existe pas de données empiriques pertinentes pouvant être utilisées pour une lecture croisée pour l'évaluation du DP ayant trait à l’environnement. Enfin, les composés de type DP comportent aussi des impuretés produites par des réactions secondaires lors de sa synthèse (p. ex. 1,4-DP, Vinalcyclohexane (VCH)-DP, 1,3- DP Monoadduct(DPMA), 1,5-DPMA) (Sverko et al. 2010). Ces composés ont été détectés dans une carotte de sédiments de la rivière Niagara, en aval d'un producteur industriel de DP aux États-Unis (Sverko et al. 2010). L'évaluation de ces substances de type déchlorane est jugée hors de la portée de la présente évaluation préalable.
| Substance (no CAS) | Nom de la substance | Masse moléculaire (g/mol) | Structure empirique/ formule moléculaire |
|---|---|---|---|
| 57-74-9 | Chlordane (1,3,4,7,8,9,10,10-Octachlorotricyclo [5.2.1.02,6]déc-8-ène | 409,781 | 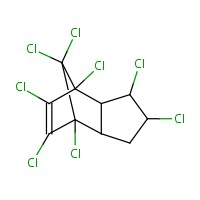 C10H6Cl8 C10H6Cl8 |
| 2385-85-5 | Mirex (Dodécachloro-pentacyclo-[5.3.0.02,6.03,9.04,8] décane) | 545,546 | 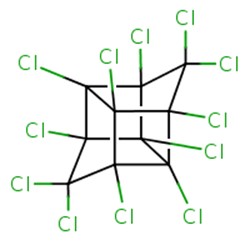 C10Cl2 C10Cl2 |
Pour l'évaluation ayant trait aux risques pour la santé humaine, nous n’avons trouvé aucun analogue approprié pour combler des lacunes dans les données et nous avons utilisé une approche (Q)SAR pour prédire le potentiel carcinogène du DP. D'autres détails sont donnés dans la section « Évaluation des effets sur la santé ».
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques déterminent les caractéristiques globales d'une substance et sont utilisées pour estimer la pertinence de différentes substances pour divers types d'application. De telles propriétés jouent également un rôle clé pour déterminer le devenir dans l'environnement des substances (y compris leur potentiel de transport à grande distance), ainsi que leur toxicité pour les humains et les organismes non humains. Nous présentons dans le tableau 31 un résumé des valeurs expérimentales, modélisées et clés des propriétés physiques et chimiques du DP pertinentes pour le devenir et la toxicité dans l’environnement. Nous présentons aussi à l’Annexe B un tableau détaillé des propriétés physiques et chimiques du DP (valeurs empiriques et modélisées) ainsi qu'un résumé des propriétés physiques et chimiques d’analogues.
Des modèles (Q)SAR ont été jugés utilisables pour prédire des propriétés physiques et chimiques du DP, leur domaine d’applicabilité les couvrant (c.-à-d. que les domaines des paramètres liés à la structure ou aux propriétés sont représentés dans l’ensemble d’apprentissage utilisé pour ces modèles). L’uniformité interne des propriétés physiques et chimiques du DP a été vérifiée en suivant la procédure d'ajustement des moindres carrés (AMC) (Schenker et al. 2005). Les moyennes géométriques ou arithmétiques (pour les log) des valeurs les plus fiables et les plus indépendantes tirées de données empiriques et de données modélisées ont été utilisées pour déterminer les intrants utilisés pour l’AMC (des valeurs de liquide sous-refroidi pour la solubilité dans l’eau, la pression de vapeur et la solubilité dans l'octanol ont été utilisées) (tableau B-1; pour toutes les valeurs des propriétés physiques et chimiques, consulter le tableau B-2). En déterminant l'uniformité interne des propriétés, le modèle AMC produit également des valeurs prédites. Aux fins de la présente évaluation, nous avons retenu un log Koe de 8,78 calculé avec la méthode AMC. Cette valeur se trouve à la limite inférieure de la gamme des valeurs prédites par le modèle, et elle est donc prudente pour les estimations de la bioaccumulation. Afin de maintenir l’uniformité interne des valeurs des propriétés physiques et chimiques, les valeurs obtenues avec la méthode AMC pour la solubilité dans l’eau et la pression de vapeur ont également été prises en compte. La valeur de solubilité dans l’eau (2,85 x 10-7 mg/L) obtenue avec la méthode AMC se situe dans la gamme des valeurs modélisées prédites (tableau 31), mais elle est légèrement inférieure aux estimations empiriques rapportées. Étant donné que les détails et les méthodes du rapport original sur le test de solubilité dans l’eau ne sont pas disponibles aux fins d’examen par le gouvernement du Canada, nous avons utilisé pour la présente évaluation la valeur de solubilité dans l’eau obtenue avec la méthode AMC aux fins de modélisation. Les valeurs finales retenues sont résumées dans le tableau 3-1 (les références sont fournies à l'Annexe B).
Généralement, le DP se caractérise par une solubilité dans l’eau très faible, une pression de vapeur faible à très faible et des coefficients de partage carbone organique-eau et octanol-eau très élevés.
| Propriété | Valeur expérimentale/ estimée | Valeur modélisée | Valeur retenue pour la modélisation |
|---|---|---|---|
| Point de fusion (°C) | > 325 – 350 | 170 – 350 | 350 |
| Point d'ébullition (°C) | s.o. – se dégrade avant ébullition | 486,83 | s.o. |
| Pression de vapeur (Pa) | 0,8 (à 200 °C) | 3,57 x 10-11 – 1,01 x10-8 | 6,57 x10-11 (1,08 x 10-7 liquide sous-refroidi) |
| Constante de Henry (Pa·m3/mol) | s.o. | de 0,151 à 0,754 | 0,151 |
| log Koe | s.o. | 8,29 –11,27 | 8,78 |
| log Kco | 6,65 | 7,62 – 7,68 | 6,65 |
| log Koa | s.o. | 12,99 – 14,79 | 12,99 |
| Solubilité dans l’eau (mg/L) | < 1,67 x 10-6 – 2,49 x 10-4 | 4,42 x10-10 – 8,4 x 10-4 | 2,85 x 10-7 (4,69 x 10-4 liquide sous-refroidi) |
| pKa | s.o. | s.o. | s.o. |
Abréviations : pKa = constante de dissociation acide; s.o. = sans objet
a Les détails sur les valeurs de propriétés physiques et chimiques et les références sont fournies à l'Annexe B.
4. Sources
Il n'existe aucune source naturelle connue de DP. Actuellement, il existe deux producteurs de DP connus dans le monde : un aux États-Unis et l'autre en Chine (Hoh et al. 2006, Wang et al. 2010). La quantité produite annuellement à l’échelle mondiale a été estimée de 4500 à 5000 tonnes (Wang et al. 2010, Feo et al. 2012).
D’après les renseignements recueillis lors d’une enquête menée pour l’année 2011 en vertu de l’article 71 de la LCPE, entre 1000 et 10 000 kg de DP, y compris le DP présent dans certains produits et/ou articles manufacturés, ont été importés au Canada par quelques entreprises. Aucune quantité de DP n’a été rapportée produite au Canada cette année-là (Canada 2013). Selon le résultat d'une mise à jour de la LIS effectuée pour l'année 2008, du DP avait été importé au Canada par plusieurs entreprises en quantités similaires (même ordre de grandeur) à celles rapportées pour 2011.
Aux États-Unis, le DP est une substance chimique produite en grande quantité (EPA 2011). Selon l'EPA, les quantités de DP produites/importées aux États‑Unis de 1986 à 2006 ont été constantes, soit de 450 000 à 4 500 000 kg.
En Chine, du DP est produit depuis environ 2003-2005, avec une production annuelle estimée entre 300 000 et 1 000 000 kg (Wang et al. 2010).
5. Utilisations
À l'échelle internationale, le DP est utilisé comme additif ignifuge dans des applications ayant trait aux fils et câbles pour l’électronique, à l’automobile, aux matériaux en matière plastique pour toiture et aux connecteurs en matière plastique dur (Weil et Levchik 2009, Sverko et al. 2008, Sverko et al. 2010, Sverko et al. 2011, ECHA 2013). Des utilisations semblables sont connues ou attendues au Canada. D’après des déclarations faites en vertu de l’article 71 de la LCPE (Environnement Canada 2013-2014), du DP est utilisé au Canada comme substance ignifuge pour la production automobile (ECCC 2013-2014).
En tant que substance ignifuge, le DP est utilisé dans de nombreux systèmes polymères. Ces systèmes sont typiquement thermoplastiques ou thermodurcissables, tel qu'indiqué dans les tableaux 5-1 et 5-2. Les polymères thermoplastiques sont produits grâce à un procédé de durcissement réversible, alors que les polymères thermodurcissables le sont grâce à procédé irréversible (Modor Plastics 2013). Parmi les exemples de polymères thermoplastiques qui peuvent contenir du DP, se trouvent le nylon (Weil et Levchik 2009), le polyester (KEMI 2007), l’ABS (acrylonitrile-butadiène-styrène), le caoutchouc naturel, le PBT (poly(téréphtalate de butane-1,4-diyle)), le poly(propane-1,2-diyle), et le SBR (copolymère séquencé butadiène-styrène) (OxyChem 2007). Le DP peut être utilisé dans des polymères thermodurcissables comme les résines époxydes et de polyester, la mousse de polyuréthane, le poly(éthane-1,2-diyle), le terpolymère éthylène-propylène-diène, le caoutchouc polyuréthane, le caoutchouc silicone et le néoprène (OxyChem 2007). La quantité de DP dans ces matières varie de 8 % dans le PBT jusqu'à 40 % dans le caoutchouc silicone (OxyChem 2007). D’après la documentation du producteur (OxyChem 2007), le DP est produit pour être utilisé uniquement par des clients industriels. Le DP est un additif ignifuge dans des applications industrielles primaires.
| Type de produit | Concentration de DP | Références |
|---|---|---|
| Nylon | 0 – 35 % | KEMI 2007, Weil et Levchik 2009 |
| Polyester | 0 – 16 % | KEMI 2007 |
| Acrylonitrile butadiène styrène | 16,9 % | OxyChem 2007 |
| Caoutchouc naturel | 18,7 % | OxyChem 2007 |
| Poly(téréphtalate de butane-1,4-diyle) (PBT) | 8 – 18 % | OxyChem 2007 |
| Poly(propane-1,2-diyle) | 20 – 35 % | OxyChem 2007 |
| Copolymère séquencé butadiène-styrène (SBR) | 30 % | OxyChem 2007 |
| Type de produit | Concentration de DP | Références |
|---|---|---|
| Résines époxydes | 25,5 % | OxyChem 2007 |
| Résines de polyester non saturé | NP | OxyChem 2007 |
| Mousse de polyuréthane | 17,5 – 35 % | OxyChem 2007 |
| Poly(éthane-1,2-diyle) réticulé | 25,5 % | OxyChem 2007 |
| Caoutchouc polyuréthane | 20 – 30 % | OxyChem 2007 |
| Caoutchouc silicone | 18,8 – 40 % | OxyChem 2007 |
| Néoprène | 10 % | OxyChem 2007 |
| Terpolymère d'éthylène-propylène-diène (EPDM) | 33 % | OxyChem 2007 |
Abréviations : NP = Non précisé
Les applications et les types de produits dans lesquels les matériaux polymères susmentionnés sont présents concernent principalement des applications électriques et électroniques comme des revêtements de fils électriques, des bobines, des connecteurs en matière plastique dure pour télévisions et ordinateurs, des interrupteurs, des serre-câbles, des boîtiers d'outils électriques et des montants (Weil et Levchik 2009). Le DP peut aussi être utilisé comme produit ignifuge dans des textiles militaires. Toutefois, cette utilisation est minime (Weil et Levchik 2009). De plus, l’ECHA (2013) indique que le DP est utilisé dans des articles en cuir.
Le DP peut aussi être utilisé dans les résines époxydes, ainsi que des laminats et des résines phénoliques (OxyChem 2007), bien que les applications dans des produits disponibles pour les consommateurs ne soient pas connues.
Le DP n'est pas inscrit comme un additif alimentaire homologué dans les Listes des additifs alimentaires, qui ont été incorporées comme référence dans les autorisations de mise en marché émises en vertu de la Loi sur les aliments et drogues (Santé Canada [modifié en 2017]). Il n'a pas non plus été identifié comme utilisé/présent dans des formulations pour matériaux d'emballage alimentaire ni comme additif indirect (courriel de 2013 de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada, non référencé). Au Canada, le DP n'est inscrit ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient médicinal ou non médicinal dans des produits pharmaceutiques finaux, des produits de santé naturels ou des médicaments vétérinaires (BDPP 2013, BDIPSN 2013, BDPSNH 2013, courriel de 2013 de la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada (non référencé)). D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le DP n'est pas utilisé dans des produits cosmétiques au Canada (courriels de 2014 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada, non référencé).
6. Rejets dans l'environnement
Les rejets anthropiques dans l'environnement sont dus à diverses pertes se produisant durant la production, l'utilisation industrielle, l'utilisation commerciale ou par des consommateurs, la durée de vie utile et l'élimination d'une substance et de produits en contenant. Les rejets de DP dans l’environnement au Canada dus à son utilisation comme substance ignifuge devraient être ponctuels (p. ex. installations de traitement et systèmes de traitement des eaux usées). Des rejets épisodiques dus à des activités industrielles pourraient aussi survenir pendant le nettoyage de contenants de transport vides. Les municipalités et les activités industrielles génèrent de grandes quantités d’eaux usées, traitées habituellement dans des usines de traitement des eaux usées (UTEU) avant d’être rejetées dans l’environnement (Shanmuganathan et al. 2017). Les effluents et les biosolides des UTEU sont considérés être des voies par lesquelles des polluants organiques, dont les substances ignifuges comme le DP, peuvent être rejetés dans des environnements aquatiques (par les effluents) ou terrestres (application de biosolides sur des terres agricoles et des pâturages) (Shanmuganathan et al. 2017).
L’utilisation du DP comme additif dans des produits suggère que des émissions diffuses peuvent résulter de l’utilisation de produits commerciaux ou de produits disponibles pour les consommateurs. Bien qu’incertaine, la vitesse de tels rejets est assumée faible en comparaison de celle des sources ponctuelles industrielles et des UTEU. Globalement, des rejets diffus dus à des produits (p. ex. dans l’air ou l’eau) devraient être dispersés géographiquement et durant la durée de vie utile et la fin de vie de ces produits.
Bien que le DP ait une faible volatilité, les rejets dans l’air (p. ex. provenant de la production industrielle, de la poussière ou de produits) peuvent conduire à un dépôt atmosphérique sur le sol et l’eau (Sverko et al. 2010). Quand une substance est transférée non intentionnellement sur des terres, elle peut être lessivée jusque dans les égouts ou des eaux de surface ou transférée par le vent ou la pluie vers des sols à proximité. Cependant, étant donné la faible volatilité du DP, cette voie de rejet devrait être très limitée. Finalement, bien que la majorité des sites d’enfouissement au Canada traite leur lixiviat en l’envoyant vers une UTEU, certains ne collectent ni ne traitent leur lixiviat et peuvent potentiellement rejeter des substances dans le sol ou des eaux surface. De plus, bien qu’il soit limité, il existe un potentiel de rejet de substances dans l’atmosphère par les sites d’enfouissement qui ne collectent ni ne détruisent les gaz qu’ils produisent.
Bien que le DP ait été identifié comme substance à faible utilisation, il est produit en grande quantité aux États-Unis et est produit dans la région des Grands Lacs (Niagara Falls, New York). Au Canada, il a été mesuré à des concentrations relativement élevées lors de nombreuses études réalisées dams les milieux de la région des Grands Lacs, en particulier à proximité de la rivière Niagara et du lac Ontario, en aval de l’usine de production américaine, suggérant des rejets de DP dans l’environnement dus aux activités de production (Hoh et al. 2006, Sverko et al. 2010).
Ces renseignements ont été utilisés pour développer des scénarios de caractérisation de l'exposition afin d'estimer les concentrations environnementales qui en découlent.
7. Concentrations environnementales mesurées
Le DP a été mesuré dans l'environnement au Canada ainsi qu'ailleurs dans le monde, les concentrations les plus élevées étant mesurées près de zones urbaines ou industrielles (tableau 7-1, tableau 7-2, ECCC 2017). Au Canada, lors de nombreuses études, des concentrations de DP relativement élevées ont été mesurées dans les milieux de la région des Grands Lacs, en particulier à proximité de la rivière Niagara et du lac Ontario, en aval de l'usine de production américaine de DP.
Dans le cadre du Réseau de mesure des dépôts atmosphériques (RMDA), des mesures de concentrations atmosphériques de DP ont été faites lors de plusieurs études menées dans la région des Grands Lacs de l'Amérique du Nord (Canada et États-Unis) (Hoh et al. 2006, Venier et Hites 2008, Salamova et Hites 2011). Entre 2005 et 2014, les concentrations totales mesurées sur deux sites éloignés, un rural, et deux sites urbains allaient de 0,17 à 2,5 pg/m3 en phase gazeuse, alors que les concentrations en phase particulaire étaient beaucoup plus élevées et allaient d’une non-détection à 340,36 pg/m3 (Salamova et Hites 2011, Hung et al. 2016, données non publiées). La concentration de l'isomère anti excédait presque toujours celle de l’isomère syn en phase gazeuse comme en phase particulaire. Les mesures les plus élevées (p. ex. 490 pg/m3) ont été faites sur un site d'échantillonnage situé à Sturgeon Point (New York), à 50 km d'une usine de production de DP (Hoh et al. 2006). Une diminution significative des concentrations de DP avec la distance à l’usine de production a été observée (Sverko et al. 2011).
Un récent échantillonnage d'air actif à grand volume sur un site semi-urbain à Toronto (Canada) a permis de déterminer que le DP était l'un des produits ignifuges organiques les plus fréquemment détectés (fréquence de détection de 87 à 96 %), avec des concentrations totales de DP (gaz et particules) allant jusqu'à 2,3 pg/m3 pour le syn-DP et jusqu'à 5,2 pg/m3 pour l'anti-DP (Shoeib et al. 2014).
Xiao et al. (2012) ont détecté du DP dans 11 des 14 échantillons d'air (échantillonage à grand volume) prélevés dans une station éloignée à Alert au Nunavut (Canada). Les concentrations totales de DP allaient d’une non‑détection (< 0,05 pg/m3) à 2,1 pg/m3. Les concentrations moyennes de syn-DP et d'anti-DP étaient respectivement de 0,18 et 0,57 pg/m3.
Des concentrations de DP dans les précipitations ont été mesurées dans la région des Grands Lacs (50 à 890 pg/L) (Salamova et Hites 2011). Entre 2005 et 2010, des concentrations de DP ont été mesurées dans les eaux de surface de deux lacs éloignés (lac Opeongo et lac Siskiwit) dans la région du Bouclier canadien, ainsi que dans deux des Grands Lacs inférieurs, (Muir et al. 2011). Les concentrations les plus élevées ont été mesurées dans le lac Ontario, 6,7 pg/L, suivi de celles dans le lac Opeongo, 2,4 pg/L, et dans le lac Érié, 1,7 pg/L. Les concentrations dans les échantillons prélevés dans le lac Siskiwit étaient inférieures à la limite de détection de l’étude. Venier et al. (2014) ont prélevé des échantillons d'eau de surface des Grands Lacs et rapporté que le lac Ontario présentait les concentrations les plus élevées de DP (14 pg/L), alors que le lac Huron présentait les plus faibles (1,0 pg/L). Muir et al. (2014) ont rapporté une concentration moyenne du DP de 4,89 pg/L dans les eaux centrales du lac Ontario.
Aucune mesure du DP dans le sol n'a été rapportée au Canada. Toutefois, des concentrations de DP dans le sol allant jusqu’à 13 400 ng/g poids sec (ps) ont été rapportées à Hui’an, en Chine (Wang et al. 2010).
La concentration de DP a été quantifiée dans des sédiments de surface de la région des Grands Lacs de l'Amérique du Nord lors de nombreuses études. Lors d’une étude exhaustive, Shen et al. (2010) ont mesuré le DP dans les sédiments de surface du lac Ontario (sites d'échantillonnage aux États-Unis et au Canada), du lac Érié, du lac Michigan, du lac Supérieur et du lac Huron, les concentrations de syn-DP et d'anti-DP allaient respectivement de 0,0048 à 23 µg/kg ps et de 0,009 à 82 µg/kg ps (la concentration totale de DP allait de 0,014 à 110 µg/kg ps). Pour les deux isomères, les concentrations moyennes les plus faibles de DP dans les sédiments de surface ont été mesurées dans le lac Supérieur (bien que le site présentant la concentration la plus faible soit situé dans le lac Huron) et les plus élevées ont été mesurées dans le lac Ontario, qui est situé en aval de l’usine de production de DP à Niagara Falls (New York) (Sverko et al. 2011). Shen et al. (2011b) ont mesuré le DP dans les sédiments de surface des affluents canadiens des Grands Lacs, la concentration de DP la plus élevée a été mesurée dans les sédiments de la rivière Niagara (sites d'échantillonnage aux États-Unis et au Canada) : de 21 à 310 µg/kg ps. Sverko et al. (2008) ont rapporté que les concentrations totales de DP allaient de 2,23 à 586 µg/kg ps pour les échantillons de sédiments de surface du lac Ontario collectés en 1998. Sverko et al. (2008) ont aussi rapporté des concentrations de 0,061 à 8,62 µg/kg ps dans des échantillons du lac Érié prélevés en 1997 et 1998.
Des carottes de sédiments prélevées dans les Grands Lacs ont été utilisées pour étudier l’évolution des concentrations de DP avec le temps. Sverko et al. (2010) ont observé la concentration la plus élevée de DP, 920 µg/kg ps, dans une section de carotte du lac Ontario correspondant à la période 1976-1980, près de l'embouchure de la rivière Niagarara. Pour cette étude, il a été rapporté des diminutions de la concentration de DP après ce pic, coïncidant avec l'adoption de lois américaines fédérales et des États visant à réduire les rejets libres de produits chimiques (comme le DP) dans la rivière Niagara (y compris l'installation d'une usine de traitement de l'eau) (Sverko et al. 2010). Les études sur les carottes de sédiments du lac Ontario menées par Qiu et al. (2007) et Shen et al. (2010, 2011a) ont indiqué une période correspondante : les concentrations de DP dans les sédiments ont atteint leur pic au début des années 1980 et, selon le site du lac Ontario, elles ont fluctué autour des deux tiers du maximum ou diminué légèrement par rapport aux concentrations pics. Sverko et al. (2008) ont prélevé des carottes de sédiments sur différents sites du lac Érié afin de comparer les concentrations entre 1980 et 2002. L'étude a révélé que les concentrations diminuaient spatialement vers l'ouest, les concentrations moyennes les plus élevées, 40 et 2,5 µg/kg ps, ayant été mesurées respectivement dans le bassin est et le bassin ouest. Yang et al. (2011) ont prélevé 16 carottes de sédiments dans les Grands Lacs et ont mis en évidence une concentration maximale de DP dans le lac Ontario 183 fois supérieure à celle des autres lacs. Yang et al. (2011) ont aussi déterminé que, bien que les flux de DP dans le lac Ontario aient diminué par rapport au pic de 14 à 20 ng/cm2/an dans les années 1990, les flux récents dans le lac Ontario sont de 2 à 4 ng/cm2/an. Étant donné que le DP est toujours produit à l'heure actuelle, la diminution de l'intrant dans le lac Ontario peut refléter la diminution de la production ou une amélioration du contrôle des rejets (Yang et al. 2011). Contrairement au lac Ontario, la vitesse de rejet de DP dans lac Supérieur est en croissance sur tous les sites à l'exception d'un seul (Yang et al. 2011).
Le DP a été quantifié dans les sédiments en suspension de la rivière Niagara au moyen d'un échantillonnage deux fois par semaine réalisé Shen et al. (2011a), Sverko et al. (2008) et Reiner et al. (2006). Les concentrations allaient de 5,4 à 89 µg/kg ps entre 1980 et 2002. Une demi-vie dans les sédiments en suspension dans la rivière Niagara a été établie à 17 ans (Reiner et al. 2006).
Les seuls échantillons de sédiments canadiens pour analyse du DP ne provenant pas des Grands Lacs sont ceux du lac Winnipeg, au Manitoba, prélevés entre 2000 et 2003. Ces échantillons avaient des concentrations moyennes respectives de syn-DP et d’anti-DP de 0,0117 et 0,0183 µg/kg ps (Tomy et al. 2007).
Récemment, des concentrations de DP dans l’effluent d’eaux usées et les sous‑produits de système de traitement des eaux usées (p. ex. biosolides) ont été rapportées pour le lagon et les procédés de traitement primaire, secondaire et de pointe de huit UTEU canadiennes. Les concentrations allaient de 17 à 247 ng/L dans l’influent, de 2 à 139 ng/L dans l’effluent et de 96 à 740 ng/g ps dans les biosolides (le pourcentage de détection du DP total était supérieur à 90 % pour les échantillons d’eaux usées et de biosolides). L’efficacité d’élimination médiane des huit UTEU se situait entre 51 et 66 % pour le DP total. Lors d’une étude réalisée par Kolic et al. (2009), le syn-DP et l’anti-DP ont tous deux été détectés dans les biosolides collectés dans une UTEU de la région de Toronto. Les concentrations de syn-DP et d’anti-DP étaient respectivement d'environ 100 ng/g et de 10 à 100 ng/g (valeurs déterminées à partir d'un graphique à échelle logarithmique).
Lors de nombreuses études, le DP a été dosé dans des biotes échantillonnés en Amérique du Nord, particulièrement dans la région des Grands Lacs. Par exemple, Muir et al. (2011, 2014) ont mesuré la concentration de DP dans des échantillons de zooplancton, de mysidacés, de poisson fourrage et de touladi prélevés dans le lac Érié, le lac Ontario et le lac Opeongo entre 2005 et 2010. Les concentrations allaient de la non-détection à 0,070 ng/g ph, les concentrations les plus élevées étant chez le chabot provenant du lac Ontario. Les tendances temporelles du DP ont été étudiées pour les Grands Lacs au moyen de l'analyse d’échantillons de tissus du touladi, un prédateur de niveau trophique supérieur. Les échantillons ont été prélevés tous les quatre à six ans dans le lac Ontario de 1979 à 2004, et des concentrations tissulaires de DP allant de 0,31 à 0,85 ng/g ph (2,3 à 7,2 ng/g pl) (Ismail et al. 2009) ont été rapportées, ainsi qu’une demi-vie de 16 ans. Shen et al. (2010) ont rapporté une concentration de 0,020 à 0,440 ng/g pl pour le syn-DP et de 0,033 à 0,330 ng/g pl pour l’anti-DP dans les échantillons de touladi prélevés dans le lac Supérieur, le lac Huron et le lac Ontario de 1998 à 2002. Guo et al. (2017) ont rapporté une concentration moyenne géométrique de DP dans des échantillons de touladi (prélevés en 2010) de 0,150 ng/g pl (lac Superieur et lac Michigan), de 0,640 ng/g pl (lac Ontario) et de 1,030 ng/g pl (lac Huron), ainsi qu’une moyenne géométrique de 0,450 ng/g pl pour des échantillons de doré provenant du lac Érié. Du DP a aussi été mesuré dans plusieurs autres espèces de poisson au Canada (Hoh et al. 2006, Tomy et al. 2007, Houde et al. 2014, etc.).
Du DP a récemment été mesuré dans des échantillons de petit lard de bélugas (Delphinapterus leucas) (collectés en 2013) dans l’Arctique canadien (moyenne de 1,28 ± 0,15 ng/g pl), ainsi que chez des bélugas (moyenne de 0,44 ± 0,12 ng/g pl) et des petits rorquals (Balænoptera acutorostrata) (0,31 ± 0,06 ng/g pl) dans l’estuaire du Saint-Laurent (Simond et al. 2017).
De plus, DP a été mesuré dans plusieurs autres espèces de poissons au Canada (Hoh et al. 2006, Tomy et al. 2007, Houde et al. 2014, etc.)
Du DP a été mesuré chez des oiseux au Canada, y compris dans des œufs de faucon pèlerin et de goéland argenté (1,5 à 4,5 ng/g ph) collectés dans la région des Grands Lacs, les concentrations les plus élevées ayant été mesurées dans la colonie de la rivière Niagara ou dans les nids du lac Ontario, les plus proches de l'usine de production de DP (Gauthier et al. 2007, Guerra et al. 2011). Su et al. (2015) ont rapporté que les concentrations de DP dans des oeufs de goéland argenté de la région préoccupante des Grands Lacs, collectés en 2012 et 2013, étaient nettement supérieures (~220 % plus élevées) à celles dans les oeufs de des mêmes colonies collectés en 2006 et 2007. La concentration maximale de DP mesurée dans les oeufs de goéland argenté était de 54,6 ng/g ph (sur le site de Five–mile Island). Venier et al. (2010) ont quantifié le DP dans le plasma de pygargues à tête blanche au Canada (mesure moyenne du DP = 0,19 ng/g ph).
Les données terrestres canadiennes sont limitées. Cependant, Muir et al. (2014) ont rapporté des données sur le DP dans les tissus de loup dans l'Arctique.
Pour plus de détails sur d’autres études sur le biote canadien, voir le document d'appui d’ECCC (2017).
| Milieu | Sites | Années (non continues) | Gamme de concentrations |
|---|---|---|---|
| Air (pg/m3) | Ontario, Nunavut | 2004-2010 | < 0,05 – 340,36 |
| Eau (pg/L) | Lac Érié, lac Ontario, lac Opeongo, lac Siskiwit | 2005-2010 | < LD – 950 ±190 (précipitations) < LD – 13,9 (eau de lac) |
| Sédiments (µg/kg poids sec) | Lac Supérieur, lac Huron, rivière Sainte-Claire, lac Érié, rivière Niagara, lac Ontario, lac Winnipeg | ~1975-2007 | < LD – 310 (2003) 2,23 – 586 (1998) 920 (valeur maximale, 1976 – 1980) |
| Biosolides (ng/g poids sec) | Huit sites à travers le Canada | 2013-2015 | 96-740 |
| Eaux usées (ng/L) influent effluent | Huit sites à travers le Canada | 2013 - 2015 | 17 – 247 2 – 139 |
| Biote – milieu aquatique (ng/g pl) | Lac Érié, lac Ontario, lac Opeongo, lac Winnipeg, lac Supérieur, lac Huron, lac Érié, rivière Niagara | 1979-2010 | < LD – 7,2 |
| Biote – milieux terrestre et aviaire (ng/g pl) | Territoires du Nord-Ouest, chutes Niagara, bassin canadien des Grands Lacs, Whistler (C.-B.) | 2000-2010 | < LD – 230 |
Abréviation : LD = limite de détection
a Voir les documents à l'appui (ECCC 2017) pour des références et des détails sur les études.
b Bien que les effluents des systèmes de traitement des eaux usées et les biosolides et les biosolides ne soient pas « l'environnement », ils sont inclus dans ce tableau puisque ce sont la voie par laquelle le DP provenant d’intrants industriels devraient être rejetés dans l'environnement.
| Milieu | Sites | Années (non continues) | Gamme de concentrations |
|---|---|---|---|
| Air (pg/m3) | Canada, États‑Unis, Danemark, Norvège, Suède, Espagne, Chine, mer du Nord, Corée du Sud, Mongolie, océan Pacifique, océan Indien, océan Austral, Arctique-Antarctique | 2004-2011 | < LD – 26 734 |
| Eau (pg/L) | Canada, États‑Unis, mer du Nord, Chine, Japon, Arctique-Antarctique | 1974-2010 | < LD – 1740 |
| Sédiments (ng/g ps) | Canada, États‑Unis, Grands Lacs, Danemark, Îles Féroé, Finlande, Norvège, Suède, Espagne, Chine | ~1975-2011 | syn-DP : < LD – 720 anti-DP : < LD – 2640 |
| Sol (ng/g ps) | Chine | 2006-2010 | < LD – 13 400 |
| Biosolides (ng/g ps) | États-Unis, Danemark, îles Féroé, Finlande, Islande, Norvège, Suède, Espagne | 2002-2010 | 0,31 – < 200 |
| Effluents d’eaux usées, eaux pluviales (ng/L) | Suède | 2009-2010 | < LD – 1,2 |
| Biote – milieu aquatique (ng/g pl) | Canada, île Hendrickson, Allemagne, îles Féroé, Espagne, Islande, Norvège, Chine, Corée du Sud, Japon, Brésil | 1979-2011 | < LD – 1971 |
| Biote – terrestre et aviaire (ng/g pl) | Canada, États‑Unis, îles Zaffarines, Espagne, Finlande, Suède, Norvège, République tchèque, Islande, Allemagne, Italie, Chine, Indonésie, Corée du Sud, Tasmanie, Afrique du Sud | 2000-2010 | < LD – 3820 |
Abréviation : LD = limite de détection
a Voir les documents à l'appui (ECCC 2017) pour des références et des détails sur les études.
b Bien que les effluents des systèmes de traitement des eaux usées et les biosolides ne sont pas « l'environnement », ils représentent une source directe pour l'environnement et sont inclus dans ce tableau.
8. Devenir et comportement dans l'environnement
8.1 Distribution dans l'environnement
Le DP devrait principalement être rejeté par des sources industrielles dans les eaux usées (une voie d’entrée dans les eaux de surface et le sol). Il peut aussi dans une certaine mesure migrer vers l’atmosphère à partir des produits commerciaux ou des produits disponibles pour les consommateurs en tant que produit ignifuge non réactif pouvant être libéré par des polymères (CECBP 2008). Le DP est probablement fortement éliminé par adsorption sur des biosolides dans les UTEU, biosolides qui peuvent ensuite être épandus sur des sols agricoles. Une modélisation de la fugacité de niveau III (tableau 8-1) a été faite avec le modèle EQC mis à jour (v. 1.0, 2012) afin de décrire le devenir du DP après de tels rejets dans l'environnement. De manière générale, les résultats de la modélisation de la fugacité de niveau III montrent que le DP devrait se retrouver principalement dans le sol et/ou les sédiments, selon le milieu dans lequel il est rejeté.
| Substance rejetée dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 0,5 | 0,5 | 84,1 | 14,9 |
| Eau (100 %) | négligeable | 3,5 | négligeable | 96,5 |
| Sol (100 %) | négligeable | négligeable | 99,9 | 0,1 |
Sa très faible solubilité dans l’eau (2,85 x 10-7 mg/L), sa faible pression de vapeur (6,57 x 10-11 Pa à 25 °C) et ses coefficients de partage très élevés (log Koe de 8,78 et log Kco estimé de 6,65) suggèrent que le DP rejeté dans l'environnement sera moins susceptible de se retrouver et/ou de demeurer dans l'air et l'eau, se retrouvant plutôt dans les sédiments et le sol. Si le DP est rejeté dans l'air, une petite fraction (< 1 %) devrait demeurer dans l'air (en phase gazeuse), la plus grande partie se déposant sur le sol et l'eau, puis passant dans les sédiments. Toutefois, d'après les profils de transport prédits (voir la description ci-après), la petite quantité de DP qui demeure dans l'air peut potentiellement se disperser.
Les coefficients de partage élevés indiquent que le DP rejeté dans les eaux de surface par des systèmes de traitement des eaux usées devrait s'adsorber sur la fraction organique des solides en suspension et des sédiments, moins de 4 % demeurant dans l'eau. Cependant, comme dans le cas de l'air, la petite fraction restante demeurera probablement dans l'eau et pourra être transportée (p. ex. transport par des particules). D'après son log Kco élevé, une fois dans les sédiments, le DP ne devrait pas être mobile et peut demeurer dans ce milieu en étant peu dégradé.
Lorsque le DP est rejeté dans le sol (c.-à-d. lors de l'épandage de biosolides sur des terres agricoles), la plus grande partie de la fraction massique devrait être adsorbée sur le sol (99,9 %), en raison de son log Kco élevé estimé et de sa nature hydrophobe. En raison de sa faible pression de vapeur, le DP ne devrait pas s'évaporer (se volatiliser) à partir des surfaces de sol sèches et, donc, demeurera probablement dans le sol. En outre, le DP devrait être faiblement dégradé dans le sol. Le DP restera probablement dans ce milieu, avec des processus de perte régis par l'enfouissement dans le sol ou le ruissellement en surface. Les résultats de la modélisation de la fugacité de niveau III (tableau 8-1) confirment que le DP résidera en grande partie dans le sol et les sédiments, selon le milieu dans lequel il est rejeté (nouveau modèle EQC 2011).
8.1.1 Potentiel de transport à grande distance
Les valeurs de log Koa (12,99) et de log Kae (-4,22 à -3,52) prédites pour le DP suggèrent un faible potentiel de transport jusqu’à l'Arctique (Wania 2006, Brown et Wania 2008). Cette substance est définie comme ayant une capacité de sorption élevée, se sorbant sur les particules présentes dans l’atmosphère ou l’eau. Par conséquent, la sédimentation de ces particules devrait limiter le transport à grande distance (Brown et Wania 2008). Cependant, si le transport de la substance liée aux particules est plus efficace que prévu, le DP pourrait être transporté vers des régions éloignées comme l’Arctique.
Xiao et al. (2012) ont détecté du DP dans 11 des 14 échantillons collectés par échantillonnage à grand volume dans une station éloignée à Alert au Nunavut (Canada) (moins de 0,05 pg/m3 à 2,1 pg/m3), et cette détection de DP était principalement associée aux particules. Le DP a été détecté dans tous les échantillons collectés dans l’ouest de la région subarctique du Canada (lac Little Fox, Yukon) entre août 2011 et décembre 2014 (DP total de 0,1 à 1,8 pg/m3) dans le cadre du Programme de lutte contre les contaminants dans le Nord (Yu et al. 2015). Le DP a été détecté chez des loups de régions éloignées de l’Arctique canadien (Muir et al. 2014), ainsi que chez des bélugas de l’Arctique (Simond et al. 2017).
Xiao et al. (2012) ont aussi collecté des échantillons intégrés sur un mois dans une station éloignée proche du lac Nam Co sur le plateau tibétain, de 2006 à 2008. Le DP n’a pas été détecté à cet endroit éloigné. Quand ils sont comparés aux niveaux rapportés à faible altitude, ces résultats suggèrent que la précipitation orographique (pluie due au relief) peut limiter le transport du DP vers des altitudes plus élevées. Bien que la production du DP se limite à la Chine et à l’Amérique du Nord, du DP a été mesuré ailleurs lors de nombreuses études. Des concentrations atmosphériques allant de 0,58 pg/m3 (Rao, Suède) à 9,4 pg/m3 (Lille Valby, Danemark) ont été rapportées lors d’études européennes (TemaNord, 2011). Du DP a été détecté dans tous les échantillons de particules atmosphériques prélevés à Svalbard dans l’Arctique européen de 2012 à 2013, à des concentrations allant de 0,05 à 5 pg/m3 (Salmova et al. 2014). Möller et al. (2010) ont détecté du DP dans l’air et l’eau de mer dans des endroits éloignés depuis l’est de la mer du Groenland jusqu’à l’Antarctique. Par exemple, des concentrations allant de 0,05 à 4,2 pg/m3 ont été mesurées dans des échantillons d’air (échantillonnage de 2 à 6 jours) prélevés dans la couche d’air limite marine au-dessus de l’océan Atlantique. De plus, des niveaux relativement élevés ont été rapportés dans des échantillons collectés dans le cadre de l'Étude d'échantillonnage passif atmosphérique mondial (GAPS) dans des endroits éloignés (Sverko et al. 2011). Cette dernière étude couvrait les sept continents, les concentrations atmosphériques rapportées allaient de la non-détection à plus de 75 pg/m3 à Cape Grim, en Tasmanie (Moller et al. 2012, Sverko et al. 2011, Xian et al. 2011). Lors de récentes études réalisées dans des lieux éloignés de l’Extrême-Arctique norvégien, du DP a été mesuré dans l’air, l’eau de mer, les sédiments de fjord, le sol, la mousse, les excréments (renne et oiseau), les œufs, ainsi que les tissus d’oiseau, de phoque et d’ours blanc (Ma et al. 2015, Na et al. 2015, Vorkamp et al. 2015). Du DP a été mesuré dans le biote marin arctique (jusqu’à 6,81 ng/g pl) (Na et al. 2017). Ces études empiriques suggèrent que le DP fait l’objet d’un transport à grande distance.
Le modèle de criblage des POP de l’OCDE peut être utilisé pour identifier des produits chimiques à fort potentiel de persistance et de transport à grande distance (OCDE 2006). La distance de transport caractéristique (DTC) calculée pour le DP à l'aide du modèle de l'OCDE est de 2508 km, indiquant que le DP peut potentiellement être transporté dans l'air. Toutefois, sur une distance inférieure à la limite suggérée (5097 km, DTC du PCB-28) pour les polluants mondiaux par Klasmeier et al. (2006). Ce modèle a aussi permis de calculer une persistance globale (Pglob) de 260 jours ainsi qu’une efficacité de transfert (ET), qui est le pourcentage du flux d'émissions dans l'air qui se déposent à la surface (eau ou sol) dans une région éloignée. L'ET calculée pour le DP était de 9,7 %, une valeur supérieure à la limite de 2,248 % (PCB-28) établie sur la base des substances de référence du modèle connues empiriquement pour se déposer sur le sol ou l'eau. Cette ET élevée signifie que le DP pourrait se déposer dans une certaine mesure à la surface de la Terre dans des régions éloignées.
En général, bien que le DP (d’après ses propriétés physiques et chimiques et certains modèles) ne devrait pas constituer une préoccupation importante pour le transport à grande distance en phase gazeuse, le rôle du transport de la substance liée à des particules nécessite un examen plus approfondi en raison de sa forte efficacité de transport prédite et sa détection dans des régions éloignées.
8.2 Persistance dans l'environnement
En se basant sur les rejets probables de DP et ses caractéristiques de partage prédites et compte tenu des concentrations mesurées dans l'environnement, la persistance dans l’environnement sera analysée pour tous les milieux de l’environnement. Afin d'évaluer le poids de la preuve concernant la persistance du DP, des données empiriques et des données modélisées ont été prises en compte. Les processus pertinents de transformation du DP comprennent la photodégradation et la biodégradation. Les données empiriques tirées d’études de dégradation de l'industrie décrites dans la présente évaluation sont tirées de soumissions publiques de l'industrie à d’autres organismes gouvernementaux (p. ex. IUCLID, EPA), les études originales de l'industrie n'étant pas disponibles pour le gouvernement du Canada. Les données empiriques tirées d’études de l'industrie n’ont donc pas pu être examinées directement afin de s’assurer de leur validité.
De façon générale, les prédictions des modèles confirment les résultats expérimentaux montrant que la biodégradation aérobie ou anaérobie du DP est très limitée et que le DP devrait donc être persistant dans l'eau, le sol et les sédiments. Les modélisations de la persistance du DP dans l’air ne sont pas cohérentes, indiquant une demi-vie inférieure à 0,5 jour pour la photolyse et une demi-vie de 160 jours pour la réaction avec l’ozone. Toutefois, la sorption du DP sur les particules en suspension dans l'air devrait se produire, ce qui diminuerait la vitesse de photolyse et conduirait à une demi-vie plus longue. Une persistance globale (Pglob) de 260 jours est prédite par l'outil de l'OCDE pour les POP.
8.2.1 Dégradation abiotique
Aucune donnée empirique sur la dégradation dans l'air n'a été trouvée pour le DP. La demi-vie prédite pour la dégradation du DP dans l'atmosphère, due à sa réaction avec les radicaux hydroxyles, est de 0,468 jour (journée de 12 heures, AOPWIN 2010). Les résultats obtenus avec le modèle AEROWIN (2010) indiquent la sorption d’une fraction importante du DP sur des particules en suspension dans l'air (Phi de 0,9 à 0,96) et, par conséquent, la vitesse de photodégradation du DP est probablement inférieure à celle prédite (c.-à-d. une demi-vie plus longue que celle de 0,468 jour prédite). Sverko et al. (2011) suggèrent que la modélisation du DP dans l'air (basée sur la phase gazeuse) sousestime la demi-vie en raison de son association aux particules qui diminue les vitesses de réaction. L'outil de l'OCDE pour les POP prédit une persistance globale (Pglob) de 213 jours pour les émissions de DP dans l'air, avec 98,82 % de la substance rejetée dans l'air se retrouvant dans les aérosols. Une persistance globale (Pglob) de 260 jours pour tous les milieux (air, eau, sol) est prédite.
L’ensemble de données le plus récent de l'IUCLID pour le DP (EPA 2009) est un résumé d’une étude de 1979 faisant état d’une photodégradation limitée (< 10 %) du DP dans l'eau (eau de lac eutrophe et eau distillée), irradié sous une lampe à mercure en verre borosilicaté pendant 168 heures (la demi-vie de photolyse a été estimée à plus de 24 ans). La source de lumière ne reproduisait pas la lumière naturelle du soleil, mais fournissait plusieurs flux de photons de longueur d’onde du spectre solaire (supérieure à 290 nm), flux qui augmentaient la vitesse de phototransformation par rapport à celle prédite pour la lumière naturelle du soleil.
Sverko et al. (2008) ont entrepris une étude simple de photodégradation pour laquelle une solution de chaque isomère du DP dans une solution d'isooctane (100 ng/mL) a été irradiée avec du rayonnement ultraviolet (λ ~ 365 nm) pendant 30 jours. Une diminution de la concentration mère du DP de 10 % a été observée après 168 heures (h), de 40 % après 264 h et de 65 % après 504 h. L'anti-DP semblait se dégrader plus rapidement que le syn-DP. De même, Wang et al. (2011) ont réalisé trois expériences de photolyse et ont mis en évidence une déchloration (produits de dégradation DP [-Cl+H] et [-2Cl+2H]), mais aussi d'autres produits de dégradation de DP non identifiés.
Le DP ne comporte pas de groupe fonctionnel pouvant subir une hydrolyse.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre/ unité de dégradation | Méthode | Référence |
|---|---|---|---|---|---|
| Air | Oxydation atmosphérique | 0,468 jourb | Demi-vie/jour | Modèle | AOPWIN 2010a |
| Air | Réaction avec l'ozone | 160,12 jours | Demi-vie/jour | Modèle | AOPWIN 2010a |
| Eau | Hydrolyse | NDc | NDc | Modèle | HYDROWIN 2010a |
| Eau | Photolyse | > 24 ans (< 10 %, 168 heures) | Demi-vie (% de dégradation/ heure) |
Lampe à mercure en verre borosilicaté (agent solubilisant utilisé) | Chou et al. 1979 |
| Isooctane (solvant) | Photolyse | 10 % après 168 h 40 % après 264 h 65 % après 504 h |
% de dégradation/ heure | Lumière UV λ > 365 nm |
Sverko et al. 2008 |
a Le résultat est un score numérique de 0 à 5
b Le résultat est un score de probabilité
c DBO – demande biologique en oxygène
e Sous-modèle 4 : enquête d'expert (résultats qualitatifs)
f Sous-modèle 3 : enquête d'expert (résultats qualitatifs)
g Sous-modèle 5 : MITI, probabilité linéaire
h Sous-modèle 6 : MITI, probabilité non linéaire
8.3 Potentiel de bioaccumulation
L’évaluation du potentiel de bioaccumulation du DP porte sur plusieurs paramètres, dont les propriétés physiques et chimiques, le facteur de bioconcentration (FBC), le facteur de bioamplification (FBAm), le facteur d’amplification trophique (FAT) et le facteur de bioaccumulation (FBA). Le rôle de la biotransformation métabolique dans la détermination du potentiel de bioaccumulation est également abordé. Des données empiriques et certaines données modélisées ont été prises en compte. La plupart des études expérimentales originales (non publiées) sur la bioaccumulation/bioconcentration de l’industrie ne sont pas disponibles pour le gouvernement du Canada, et les données ne sont disponibles qu’auprès de sources secondaires (c.-à-d. format de l’IUCLID), limitant donc l’évaluation de la fiabilité et des détails de l’étude. Les données ayant trait au potentiel de bioacccumulation sont prises en compte en suivant une approche basée sur le poids de la preuve.
En se basant sur ses propriétés physiques et chimiques (p. ex. diamètre maximal modérément grand, solubilité dans l’eau très faible, log Koe élevé et faible valeur expérimentale du FBC), le DP devrait avoir un faible potentiel de bioconcentration. Toutefois, des études de surveillance réalisées dans diverses parties du monde ont rapporté des concentrations de DP mesurables dans des organismes aquatiques et terrestres. Les données sur des FBAm, des FBA, et des FABS sur le terrain indiquent qu’une bioaccumulation et une bioamplification du DP ont lieu. Des études du métabolisme chez la faune (poissons et oiseaux) n’indiquent aucune preuve de la présence de produits de la transformation métabolique, suggérant peu ou pas de métabolisme du DP. Le log Koe du DP (8,78) est considéré hors du domaine du modèle (8,2) BCFBAF pour le bilan massique sur trois niveaux trophiques (Arnot et Gobas 2003) et du modèle QSAR (Dimitrov et al. 2005). Bien que la modélisation du FBC et du FBA pour le DP ait été faite, il est reconnu que ses prédictions sont extrapolées au-delà du domaine de données empiriques du modèle et sont donc ainsi moins certaines. Elles sont considérées comme un élément de preuve à l'appui et incluses dans le document à l'appui d’ECCC (2017).
8.3.1 Facteur de bioconcentration (FBC)
Les données expérimentales sur le FBC du DP proviennent de quelques études plus anciennes (p. ex. Boudreau 1973, Gara et Rauisina 1975, Chou et al. 1979, Zitko 1980, CHIRP c2008, consulter ECCC 2017). Cependant, aucune n’est considérée fiable en raison de diverses limites (p. ex. concentrations d’exposition dépassant largement la solubilité dans l’eau, courtes expositions et utilisation d’agents dispersants). Pour l'étude du CHRIP (c2008), des carpes japonaises ont été exposées à du DP pendant 8 semaines (0,0027 mg/L et 0,000027 mg/L, c.-à-d. 2 à 4 ordres de grandeur supérieurs à la solubilité dans l’eau), résultant en un FBC allant de 14 à 121. Zitko (1980) n'a observé aucune absorption du DP dans les tissus des poissons à partir de l'eau en 96 heures, mais a observé une accumulation du DP dans les tissus à partir des aliments (voir la prochaine section). Toutefois, ces études indiquent qu’une absorption du DP par les poissons a lieu, avec des concentrations de DP allant jusqu'à 8,8 mg/kg ph après 30 jours mentionnées dans une étude (Boudreau 1973). De plus, étant donné la solubilité très faible du DP, l'état stable (et par conséquent la concentration maximale de DP dans les tissus) ne devrait être atteint qu’après un très long temps (le FBC pourrait donc être sousestimé). Par exemple, s’il est assumé que le dépassement de la solubilité dans l’eau est la seule limitation de ces études sur le FBC, un nouveau calcul du FBC avec une correction pour les concentrations dans l’eau telle que celle rapportée par Arnot et Gobas (2006), pourraient donner des valeurs du FBC beaucoup plus grandes.
En raison des limitations des études disponibles sur la bioconcentration du DP, une modélisation cinétique du bilan massique a été effectuée (ECCC 2017). Cependant, le log Koe du DP (8,78) est considéré hors du domaine du modèle (environ 8,2) pour le bilan massique à trois niveaux trophiques du modèle BCFBAF (Arnot et Gobas 2003) et du modèle QSAR (Dimitrov et al. 2005). Bien que la modélisation du FB pour le DP ait été entreprise, il est reconnu que les prédictions sont extrapolées au‑delà du domaine des données empiriques du modèle, et sont donc moins certaines. Malgré cette limitation, les résultats correspondent généralement aux données empiriques observées, suggérant que la bioconcentration est insignifiante.
Des récentes études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al. 2005, Sakuratani et al. 2008) suggèrent que la probabilité qu'une molécule traverse les membranes cellulaires par diffusion passive diminue de manière significative à mesure que le le diamètre maximal (Dmax) augmente. En utilisant le modèle de FBCmax avec facteurs d'atténuation (Dimitrov et al. 2005), le diamètre maximal du DP varie de 1,35 à 1,48 nm, suggérant que la vitesse d'absorption du DP pourrait être limitée dans une certaine mesure en raison d’effets stériques à la surface des branchies.
Pour un log Koe de 8,78, la fraction biodisponible de DP prédite dans la colonne d'eau (à l'exclusion de la perte attribuable à la volatilisation) est, d’après les modèles de bilan massique des poissons, de 0,005 %, suggérant que l'absorption à partir de l'eau par les branchies n'est pas une voie d'exposition dominante dans le cas du DP. Ceci suggère aussi que l'absorption de DP par voie alimentaire du DP représente une grande partie de l'absorption globale lorsque les expositions dues aux aliments et à l’eau sont prises en compte (c.‑à‑d. la bioaccumulation).
8.3.2 Facteur de bioaccumulation (FBA)
Les études sur le FBA du DP sont limitées. Lors d’une étude récente dans la région des Grands Lacs d’Amérique du Nord, du DP a été rapporté dans l’eau (moyenne géométrique pour tous les lacs de 1,7 pg/L) et dans les tissus de poissons (touladi (Salvelinus namaycush), moyenne géométrique pour tous les lacs de 0,37 ng/g pl, DP max = 1,05 ng/g pl dans le lac Huron) (Guo et al. 2017). Les log FBA pour les poissons rapportés sur une base de moyenne géométrqiue de DP (poids de lipides) pour le syn-DP et l’anti-DP étaient supérieurs à 5 (c.‑à‑d. FBA ~100 000, lu sur un graphique) (Guo et al. 2017). En utilisant les moyennes géométriques du DP total pour les poissons et l’eau susmentionnées, le log FBA serait ~ 5,32 (c.-à-d. FBA de 210 230 sur la base du poids de lipides) (en assumant 5 % de lipides, FBA = ~10 510 ph).
Bien que peu de valeurs du FBA aient été rapportées pour les systèmes aquatiques au Canada, un examen préliminaire des concentrations de DP dans l’eau (1,7 à 13,9 pg/L) et de DP dans les tissus de poissons (70 à 1600 pg/g ph) rapportées pour le lac Ontario au cours des dernières années suggère qu’une bioaccumulation importante dans les poissons pourrait avoir lieu (voir les données de Reiner et al. 2006, Tomy et al. 2007, Muir et al. 2011, Ismail et al. 2009, Shen et al. 2010, Shen et al. 2011a, Venier et al. 2014). Muir et al. (2014) ont rapporté un log FBA du DP pour le zooplancton du lac Ontario de 9,1 (BFA = 1,26 x 109) et de 8,6 pour les mysidacés (FBA = 3,98 x 108) (FBA calculés avec les concentrations massiques de DP des invertébrés), suggérant une très forte bioaccumulation.
Pour une étude menée dans un réservoir naturel du sud de la Chine près d’usines de recyclage de déchets électroniques, le DP dans l’eau a été comparé au DP dans le biote, et il a été rapporté que le syn-DP et l'anti-DP étaient bioamplifiés considérablement dans les organismes aquatiques (Wu et al. 2010). Les données sur le DP dans l'eau (dissous) et les tissus (poids humide pour 2 invertébrés, 4 poissons et 1 reptile) collectées en 2006 ont été utilisées pour calculer les FBA. Les FBA du DP allaient de 135 à 25 118, 4 des 6 espèces testées exhibant une bioaccumulation significative/élevée (identifié par les auteurs comme ayant un log du FBA supérieur à 3,7). Il y avait certaines incertitudes associées à cette étude, dues aux détails limités sur la méthode d’analyse, à la petite taille des échantillons et à l'absence de renseignements sur le moment de l'échantillonnage de l'eau ou du biote pouvant renforcer les hypothèses de « l'état d’équilibre ». Néanmoins, du DP a été détecté chez toutes les espèces aquatiques, à des concentrations allant de 19,1 à 9630 ng/g pl.
Zitko (1980) a observé une accumulation de DP dans les tissus provenant des aliments au cours d'une période d'alimentation de 42 jours : un facteur d'accumulation corrigé de 0,024 a été rapporté pour la concentration après 28 jours. Toutefois, pour une substance hydrophobe comme le DP, les méthodes utilisées lors de cette étude souffrent de plusieurs limitations (Sverko et al. 2011). Bien que ces résultats ne soient pas fiables, cette étude a mis en évidence l’absorption du DP par les poissons (concentration maximale dans les tissus rapportée de 176 µg/kg ph après 15 jours).
En raison du manque de données dans la littérature sur le FBA obtenues empiriquement , une modélisation cinétique du bilan massique corrigée pour le métabolisme a été faite pour combler cette lacune (ECCC 2017). Toutefois, pour un log Koe de 8,78, le modèle prédit une bioaccumulation pour un Koe supérieur à celui des substances avec FBA mesurés (p. ex. les BPC) présentes dans l'ensemble d’apprentissage du modèle et, par conséquent, ces résultats sont moins certains. Malgré cette limitation, les résultats sont généralement cohérents avec les données observées empiriques sur le FBA (Wu et al. 2010), suggérant que le potentiel de bioaccumulation est élevé.
Les études rapportant des facteurs d'accumulation biote-sédiments (FABS) supérieur à 1 indiquent une bioaccumulation dans le biote à partir des sédiments. Des études rapportant des FABS allant de 0,0003 à 11, la majorité rapportant un FABS inférieur à 1 (tableau 84), ont été trouvées. Toutefois, des poissons (plutôt qu’un organisme benthique) étaient souvent utilisés lors de ces études, ce qui peut conduire à des FABS inférieur à 1, les sédiments n’étant pas la seule voie (primaire) d’exposition au DP pour ces organismes.
Les données sur le FBA indiquent un potentiel de bioaccumulation du DP élevé. En général, ces études sont en accord avec celles sur le FBAm et le FAT présentées à la section 8.3.3 et suggèrent qu’une bioaccumulation du DP a lieu.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre/ unité de dégradation | Méthode | Référence |
|---|---|---|---|---|---|
| Boues activées | Biodégradation | 0,6 % | Biodégradation à 2 semaines DBO/% | 301C de l'OCDE (test MITI modifié) | EPA 2011 |
| Biosolides d’eaux usées | Biodégradation aérobie | 0 % | Biodégradation à 21 jours/% | Méthodes standards d’étude de l’eau et des eaux usées (13e éd.) 1971 | EPA 2009 EPA 2011 |
| Biosolides d’eaux usées anaérobies | Biodégradation anaérobie | 0 % | Biodégradation à 2 et 6 semaines/% | DP radiomarqué dans les effluents avec organismes de biosolides d’eaux usées anaérobies | EPA 2009 EPA 2011 |
| Eau | Biodégradation primaire (aérobie) | 0,7766a « récalcitrant » | > plusieurs mois | Modèle QSAR | BIOWIN 2010d |
| Eau | Biodégradation (aérobie) | -1,5964a « récalcitrant » | > plusieurs mois | Modèle QSAR | BIOWIN 2010e |
| Eau | Biodégradation (aérobie) | -0,6853b « biodégradé lentement » | > plusieurs mois | Modèle QSAR | BIOWIN 2010f |
| Eau | Biodégradation (aérobie) | 0,00b « biodégradé lentement » | > plusieurs mois | Modèle QSAR | BIOWIN 2010g |
| Eau | Biodégradation (aérobie) | % DBOc = 1 (DBO = 1 dans l’ensemble d’apprentissage) « biodégradé lentement » | > plusieurs mois | Modèle QSAR | Catalogic 2012 |
| Eau | Biodégradation (aérobie) | 0e « biodégradé lentement » | > plusieurs mois | Modèle QSAR | TOPKAT 2004 |
a Le résultat est un score numérique de 0 à 5
b Le résultat est un score de probabilité
c DBO – demande biologique en oxygène
e Sous-modèle 4 : enquête d'expert (résultats qualitatifs)
f Sous-modèle 3 : enquête d'expert (résultats qualitatifs)
g Sous-modèle 5 : MITI, probabilité linéaire
h Sous-modèle 6 : MITI, probabilité non linéaire
8.3 Potentiel de bioaccumulation
L’évaluation du potentiel de bioaccumulation du DP porte sur plusieurs paramètres, dont les propriétés physiques et chimiques, le facteur de bioconcentration (FBC), le facteur de bioamplification (FBAm), le facteur d’amplification trophique (FAT) et le facteur de bioaccumulation (FBA). Le rôle de la biotransformation métabolique dans la détermination du potentiel de bioaccumulation est également abordé. Des données empiriques et certaines données modélisées ont été prises en compte. La plupart des études expérimentales originales (non publiées) sur la bioaccumulation/bioconcentration de l’industrie ne sont pas disponibles pour le gouvernement du Canada, et les données ne sont disponibles qu’auprès de sources secondaires (c.-à-d. format de l’IUCLID), limitant donc l’évaluation de la fiabilité et des détails de l’étude. Les données ayant trait au potentiel de bioacccumulation sont prises en compte en suivant une approche basée sur le poids de la preuve.
En se basant sur ses propriétés physiques et chimiques (p. ex. diamètre maximal modérément grand, solubilité dans l’eau très faible, log Koe élevé et faible valeur expérimentale du FBC), le DP devrait avoir un faible potentiel de bioconcentration. Toutefois, des études de surveillance réalisées dans diverses parties du monde ont rapporté des concentrations de DP mesurables dans des organismes aquatiques et terrestres. Les données sur des FBAm, des FBA, et des FABS sur le terrain indiquent qu’une bioaccumulation et une bioamplification du DP ont lieu. Des études du métabolisme chez la faune (poissons et oiseaux) n’indiquent aucune preuve de la présence de produits de la transformation métabolique, suggérant peu ou pas de métabolisme du DP. Le log Koe du DP (8,78) est considéré hors du domaine du modèle (8,2) BCFBAF pour le bilan massique sur trois niveaux trophiques (Arnot et Gobas 2003) et du modèle QSAR (Dimitrov et al. 2005). Bien que la modélisation du FBC et du FBA pour le DP ait été faite, il est reconnu que ses prédictions sont extrapolées au-delà du domaine de données empiriques du modèle et sont donc ainsi moins certaines. Elles sont considérées comme un élément de preuve à l'appui et incluses dans le document à l'appui d’ECCC (2017).
8.3.1 Facteur de bioconcentration (FBC)
Les données expérimentales sur le FBC du DP proviennent de quelques études plus anciennes (p. ex. Boudreau 1973, Gara et Rauisina 1975, Chou et al. 1979, Zitko 1980, CHIRP c2008, consulter ECCC 2017). Cependant, aucune n’est considérée fiable en raison de diverses limites (p. ex. concentrations d’exposition dépassant largement la solubilité dans l’eau, courtes expositions et utilisation d’agents dispersants). Pour l'étude du CHRIP (c2008), des carpes japonaises ont été exposées à du DP pendant 8 semaines (0,0027 mg/L et 0,000027 mg/L, c.-à-d. 2 à 4 ordres de grandeur supérieurs à la solubilité dans l’eau), résultant en un FBC allant de 14 à 121. Zitko (1980) n'a observé aucune absorption du DP dans les tissus des poissons à partir de l'eau en 96 heures, mais a observé une accumulation du DP dans les tissus à partir des aliments (voir la prochaine section). Toutefois, ces études indiquent qu’une absorption du DP par les poissons a lieu, avec des concentrations de DP allant jusqu'à 8,8 mg/kg ph après 30 jours mentionnées dans une étude (Boudreau 1973). De plus, étant donné la solubilité très faible du DP, l'état stable (et par conséquent la concentration maximale de DP dans les tissus) ne devrait être atteint qu’après un très long temps (le FBC pourrait donc être sousestimé). Par exemple, s’il est assumé que le dépassement de la solubilité dans l’eau est la seule limitation de ces études sur le FBC, un nouveau calcul du FBC avec une correction pour les concentrations dans l’eau telle que celle rapportée par Arnot et Gobas (2006), pourraient donner des valeurs du FBC beaucoup plus grandes.
En raison des limitations des études disponibles sur la bioconcentration du DP, une modélisation cinétique du bilan massique a été effectuée (ECCC 2017). Cependant, le log Koe du DP (8,78) est considéré hors du domaine du modèle (environ 8,2) pour le bilan massique à trois niveaux trophiques du modèle BCFBAF (Arnot et Gobas 2003) et du modèle QSAR (Dimitrov et al. 2005). Bien que la modélisation du FB pour le DP ait été entreprise, il est reconnu que les prédictions sont extrapolées au‑delà du domaine des données empiriques du modèle, et sont donc moins certaines. Malgré cette limitation, les résultats correspondent généralement aux données empiriques observées, suggérant que la bioconcentration est insignifiante.
Des récentes études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al. 2005, Sakuratani et al. 2008) suggèrent que la probabilité qu'une molécule traverse les membranes cellulaires par diffusion passive diminue de manière significative à mesure que le le diamètre maximal (Dmax) augmente. En utilisant le modèle de FBCmax avec facteurs d'atténuation (Dimitrov et al. 2005), le diamètre maximal du DP varie de 1,35 à 1,48 nm, suggérant que la vitesse d'absorption du DP pourrait être limitée dans une certaine mesure en raison d’effets stériques à la surface des branchies.
Pour un log Koe de 8,78, la fraction biodisponible de DP prédite dans la colonne d'eau (à l'exclusion de la perte attribuable à la volatilisation) est, d’après les modèles de bilan massique des poissons, de 0,005 %, suggérant que l'absorption à partir de l'eau par les branchies n'est pas une voie d'exposition dominante dans le cas du DP. Ceci suggère aussi que l'absorption de DP par voie alimentaire du DP représente une grande partie de l'absorption globale lorsque les expositions dues aux aliments et à l’eau sont prises en compte (c.‑à‑d. la bioaccumulation).
8.3.2 Facteur de bioaccumulation (FBA)
Les études sur le FBA du DP sont limitées. Lors d’une étude récente dans la région des Grands Lacs d’Amérique du Nord, du DP a été rapporté dans l’eau (moyenne géométrique pour tous les lacs de 1,7 pg/L) et dans les tissus de poissons (touladi (Salvelinus namaycush), moyenne géométrique pour tous les lacs de 0,37 ng/g pl, DP max = 1,05 ng/g pl dans le lac Huron) (Guo et al. 2017). Les log FBA pour les poissons rapportés sur une base de moyenne géométrqiue de DP (poids de lipides) pour le syn-DP et l’anti-DP étaient supérieurs à 5 (c.‑à‑d. FBA ~100 000, lu sur un graphique) (Guo et al. 2017). En utilisant les moyennes géométriques du DP total pour les poissons et l’eau susmentionnées, le log FBA serait ~ 5,32 (c.-à-d. FBA de 210 230 sur la base du poids de lipides) (en assumant 5 % de lipides, FBA = ~10 510 ph).
Bien que peu de valeurs du FBA aient été rapportées pour les systèmes aquatiques au Canada, un examen préliminaire des concentrations de DP dans l’eau (1,7 à 13,9 pg/L) et de DP dans les tissus de poissons (70 à 1600 pg/g ph) rapportées pour le lac Ontario au cours des dernières années suggère qu’une bioaccumulation importante dans les poissons pourrait avoir lieu (voir les données de Reiner et al. 2006, Tomy et al. 2007, Muir et al. 2011, Ismail et al. 2009, Shen et al. 2010, Shen et al. 2011a, Venier et al. 2014). Muir et al. (2014) ont rapporté un log FBA du DP pour le zooplancton du lac Ontario de 9,1 (BFA = 1,26 x 109) et de 8,6 pour les mysidacés (FBA = 3,98 x 108) (FBA calculés avec les concentrations massiques de DP des invertébrés), suggérant une très forte bioaccumulation.
Pour une étude menée dans un réservoir naturel du sud de la Chine près d’usines de recyclage de déchets électroniques, le DP dans l’eau a été comparé au DP dans le biote, et il a été rapporté que le syn-DP et l'anti-DP étaient bioamplifiés considérablement dans les organismes aquatiques (Wu et al. 2010). Les données sur le DP dans l'eau (dissous) et les tissus (poids humide pour 2 invertébrés, 4 poissons et 1 reptile) collectées en 2006 ont été utilisées pour calculer les FBA. Les FBA du DP allaient de 135 à 25 118, 4 des 6 espèces testées exhibant une bioaccumulation significative/élevée (identifié par les auteurs comme ayant un log du FBA supérieur à 3,7). Il y avait certaines incertitudes associées à cette étude, dues aux détails limités sur la méthode d’analyse, à la petite taille des échantillons et à l'absence de renseignements sur le moment de l'échantillonnage de l'eau ou du biote pouvant renforcer les hypothèses de « l'état d’équilibre ». Néanmoins, du DP a été détecté chez toutes les espèces aquatiques, à des concentrations allant de 19,1 à 9630 ng/g pl.
Zitko (1980) a observé une accumulation de DP dans les tissus provenant des aliments au cours d'une période d'alimentation de 42 jours : un facteur d'accumulation corrigé de 0,024 a été rapporté pour la concentration après 28 jours. Toutefois, pour une substance hydrophobe comme le DP, les méthodes utilisées lors de cette étude souffrent de plusieurs limitations (Sverko et al. 2011). Bien que ces résultats ne soient pas fiables, cette étude a mis en évidence l’absorption du DP par les poissons (concentration maximale dans les tissus rapportée de 176 µg/kg ph après 15 jours).
En raison du manque de données dans la littérature sur le FBA obtenues empiriquement , une modélisation cinétique du bilan massique corrigée pour le métabolisme a été faite pour combler cette lacune (ECCC 2017). Toutefois, pour un log Koe de 8,78, le modèle prédit une bioaccumulation pour un Koe supérieur à celui des substances avec FBA mesurés (p. ex. les BPC) présentes dans l'ensemble d’apprentissage du modèle et, par conséquent, ces résultats sont moins certains. Malgré cette limitation, les résultats sont généralement cohérents avec les données observées empiriques sur le FBA (Wu et al. 2010), suggérant que le potentiel de bioaccumulation est élevé.
Les études rapportant des facteurs d'accumulation biote-sédiments (FABS) supérieur à 1 indiquent une bioaccumulation dans le biote à partir des sédiments. Des études rapportant des FABS allant de 0,0003 à 11, la majorité rapportant un FABS inférieur à 1 (tableau 84), ont été trouvées. Toutefois, des poissons (plutôt qu’un organisme benthique) étaient souvent utilisés lors de ces études, ce qui peut conduire à des FABS inférieur à 1, les sédiments n’étant pas la seule voie (primaire) d’exposition au DP pour ces organismes.
Les données sur le FBA indiquent un potentiel de bioaccumulation du DP élevé. En général, ces études sont en accord avec celles sur le FBAm et le FAT présentées à la section 8.3.3 et suggèrent qu’une bioaccumulation du DP a lieu.
| Méthode | Organisme testé | Durée | FBA ou FABS (L/kg ph sauf indication contraire) | Référence |
|---|---|---|---|---|
| FBA, échantillons de terrain | Grands Lacs de l’Amérique du Nord | ND, échantillons de terrain | 210 227 (touladi/doré, pl) | Guo et al. 2017 |
| FBA, échantillons de terrain | Lac Ontario, Canada | ND, échantillons de terrain | 3,98 x 108 (mysidacés, pl) | Muir et al. 2014 |
| FBA, échantillons de terrain | Lac Ontario, Canada | ND, échantillons de terrain | 1,26 x 109 (zooplancton, pl) | Muir et al. 2014 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | 135 (vivipare chinoise) | Wu et al. 2010 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | < 5 000 (poisson à tête de serpent) | Wu et al. 2010 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | > 5 000 (crevette) | Wu et al. 2010 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | > 5 000 (carassin) | Wu et al. 2010 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | > 5 000 (carpe de vase) | Wu et al. 2010 |
| FBA, échantillons de terrain | Réseau trophique d’un réservoir du sud de la Chine | ND, échantillons de terrain | 25 118 (serpent d'eau) | Wu et al. 2010 |
| FABS, échantillons de terrain | Réseau trophique d’eau douce, Chine | ND, échantillons de terrain | DP total : jusqu’à 9 (carassin) | Wang et al. 2015 |
| FABS, échantillons de terrain | Baie d’Helgoland | ND, échantillons de terrain | syn-DP : 0,2 (plie rouge) | Sühring et al. 2016 |
| FABS, échantillons de terrain | ND | ND, échantillons de terrain | syn-DP : 0,88 (0,33-2,8), anti-DP : 0,33 (0,086-1,0) | Wang et al. 2012 |
| FABS, échantillons de terrain | Carassin (Carassius auratus) | ND | DP total : 0,004 syn-DP : 0,007 anti-DP : 0,003 | Zhang et al. 2011b |
| FABS, échantillons de terrain | Carpe de vase (Cirrhinus molitorella) | ND, échantillons de terrain | DP total : 0,025 syn-DP : 0,01 anti-DP : 0,025 | Zhang et al. 2011b |
| FABS, échantillons de terrain | Poisson à tête de serpent (Ophicephalus argus) | ND, échantillons de terrain | DP total : 0,003 syn-DP : 0,06 anti-DP : 0,001 | Zhang et al. 2011b |
| FABS, échantillons de terrain | Touladi | ND, échantillons de terrain | syn-DP : 0,0008 anti-DP : 0,0003 | Shen et al. 2014 |
Abréviation : ND = non disponible
8.3.3 Facteur de bioamplification (FBAm)
Un FBAm supérieur à 1 indique qu'une bioamplification a potentiellement lieu, et qu’elle peut être considérée comme un indicateur du potentiel d'absorption et d'accumulation dans le biote. Nous présentons dans le tableau 85 des données empiriques sur le FBAm pour le DP.
Yu et al. (2013) ont étudié la bioamplification du DP dans des chaînes trophiques aviaires terrestres à Beijing, en Chine. Des FBAm (normalisées pour les lipides) ont été déterminées pour le hibou prédateur (Bubo buboet Athene noctua) et ses proies (rat surmulot, Rattus norvegicus) et que pour le faucon crécerelle (Falco tinnunculus) et ses proies (moineau friquet, Passer montanus). Les FBAm étaient supérieurs à 1 pour la chaîne alimentaire hibou-rat, mais inférieures à 1 pour la chaîne alimentaire faucon-moineau. Aucune bioaccumulation stéréosélective n’a été observée pour les isomères du DP chez les espèces étudiées.
Lors d’une étude de terrain menée dans le sud de la Chine (She et al. 2013), une petite chaîne alimentaire d’herbivores (sol de rizière, plants de riz et escargots pommes) a été examinée et des FBAm du DP des plants de riz (Oryza sativa) aux escargots pommes (Pomacea canaliculata), normalisés pour les lipides, allaient de 0,59 à 7,9, avec des valeurs moyennes de 3,1 pour le syn-DP et de 2,3 pour l'anti-DP (tableau 85). Ces FBAm étaient comparables à ceux déterminés pour les polybromodiphényléthers (PBDE) dans les mêmes échantillons.
Bien que des FBAm de 5,2 pour le syn-DP et de 1,9 pour l’anti-DP aient été rapportés dans une étude en laboratoire sur les alevins de truite arc-en-ciel exposés à du DP par voie alimentaire (Tomy et al. 2008), une évaluation récente de cette étude (Arnot et Quinn 2015) suggère qu’une erreur d’un ordre de grandeur d’environ 100 a été faite lors du calcul, signifiant que les FBAm normalisés pour les lipides sont en fait d'environ 0,089 (syn-DP) et 0,046 (anti‑DP). Dans l'étude originale, soixante poissons ont été exposés pendant 49 jours, suivi par une phase de dépuration de 112 jours. L'étude de Tomy et al. (2008) suggère que le syn-DP est plus biodisponible (ou se transforme plus lentement) que l’anti-DP (tableau 8-5). Les auteurs ont avancé que la conformation structurelle différente des entités latérales de chlorocyclopentène de l'isomère anti le rend plus susceptible à une attaque biologique. Le criblage du foie des poissons suggère que, si des métabolites du DP sont détectés dans les réseaux trophiques aquatiques, il est probable que ce ne soit pas à cause d’une biotransformation in vivo du composé parent. Malgré la dose délibérément élevée de DP, aucune dégradation du DP de type déchloration, hydroxylation, méthoxylation ou méthylsulfonation n’a été détectée dans les extraits de foie.
L'ampleur de la bioaccumulation des isomères syn-DP et anti-DP a été évaluée dans des échantillons de réseau trophique archivés provenant du lac Winnipeg et du lac Ontario (Tomy et al. 2007). La bioamplification a été évaluée en utilisant des facteurs de bioamplification calculés ajustés au niveau trophique (FBAmNT) pour les relations prédateur-proie et des facteurs d'amplification trophique (FAT) (consulter la section 8.3.4). Pour le lac Winnipeg, une bioamplification n’a été observée que pour la relation trophique doré-grand corégone pour l'anti-DP (FBAmNT supérieur à 11). Les auteurs suggèrent que ceci indique une élimination stéréosélective du syn-DP par rapport à l'anti-DP par le doré ou bien que le doré peut métaboliser le syn-DP plus facilement. Dans le lac Ontario, des valeurs du FBAmNT supérieures à 1 ont été observées pour la relation trophique truite-éperlan (anti-DP : 11, syn-DP : 12), et le FBAm truite-gaspareau était égale ou légèrement inférieure à 1. Les auteurs suggèrent que le touladi, contrairement au doré, n'accumule ni ne métabolise pas stéréosélectivement les isomères, appuyant leur hypothèse de différences interspécifiques de bioaccumulation et de biotransformation.
| Organisme testé | FBAm (/kg) | Efficacité d'assimilation alimentaire (α; %)a | Référence |
|---|---|---|---|
| Crécerelle/moineau | (FBAm < 1) anti-DP : 0,35 syn-DP : 0,31 DP total : 0,32 |
NR | Yu et al. 2013 |
| Hibou/rat | (FBAm > 1) anti-DP : 1,9 syn-DP : 2,4 DP total : 2,0 |
NR | Yu et al., 2013 |
| Escargots pommes/plants de riz | (FBAm > 1) syn-DP : 3,1 (de 0,63 à 7,9) anti-DP : 2,3 (de 0,59 à 4,7) |
NR | She et al. 2013 |
| Truite arc-en-ciel (Oncorhyncus mykiss) | (FBAm < 1) de ~0,046 (anti-DP) à ~0,089 (syn-DP) |
de 3,9 (anti-DP) à 6,0 (syn-DP) | Arnot et Quinn (document non publié), Tomy et al. 2008 |
| Doré/ grand corégone (lac Winnipeg) | anti-DP : 11 syn-DP : 0,3 |
NR | Tomy et al. 2007 |
| Doré jaune/meunier noir (lac Winnipeg) | syn-DP : 0,6 | NR | Tomy et al. 2007 |
| Doré/laquaiche aux yeux d'or (lac Winnipeg) | anti-DP : 0,8 syn-DP : 0,4 |
NR | Tomy et al. 2007 |
| Laquaiche aux yeux d'or/zooplancton (lac Winnipeg) | syn-DP : < 0,1 | NR | Tomy et al. 2007 |
| Touladi/gaspareau (lac Ontario) | anti-DP : 0,9 syn-DP : 1,0 |
NR | Tomy et al. 2007 |
| Touladi/éperlan (lac Ontario) | anti-DP : 11 syn-DP : 12 |
NR | Tomy et al. 2007 |
| Touladi/chabot (lac Ontario) | anti-DP : 0,1 syn-DP : 0,1 |
NR | Tomy et al. 2007 |
| Chabot/Diporeia (lac Ontario) | anti-DP : 0,2 syn-DP : 0,3 |
NR | Tomy et al. 2007 |
Abréviation : ND = non rapporté
a L'efficacité d'assimilation alimentaire est également appelée efficacité d'absorption (EA ou α) et est une mesure du transfert d'une substance chimique du tractus gastro-intestinal (TGI) à l'organisme par rapport à la quantité totale de substance à laquelle l'organisme est exposé par voie alimentaire.
Bien qu’il existe certaines incertitudes sur les données sur la bioamplification, il est raisonnable de considérer que le DP serait bioamplifié dans des chaînes alimentaires étant donné ses propriétés physiques et chimiques (valeurs élevées de log Koe (8,78) et de log Koa (12,99)). Comme l’ont suggéré Gobas et al. (2003) et Kelly et al. (2007), le DP peut avoir le potentiel d’être bioamplifié dans des chaînes alimentaires terrestres. Cependant, ces coefficients de partage ne tiennent pas compte des paramètres physiologiques comme le métabolisme et les données empiriques sur la bioaccumulation. Les données de bioamplification disponibles suggèrent que les FBAm du DP peuvent être supérieurs à 1 pour certaines relations trophiques, suggérant que les expositions par voie alimentaire peuvent contribuer significativement à un transfert trophique et à une accumulation dans les réseaux trophiques de l'environnement.
Lors d’une étude sur l'efficacité d'assimilation de produits chimiques par des poissons, Xiao et al. (2013) ont étudié 15 produits chimiques, dont le DP, pour déterminer l’efficacité d'absorption globale (Ea) en utilisant une méthode de référence (exposition unique). Les poissons étudiés ont reçu une seule fois des aliments contaminés, puis la distribution chimique a été analysée après cinq jours. L'efficacité d'absorption (Ea) apparente et l'efficacité d'absorption « de référence » du DP ont été évaluées respectivement à 0,37 et 0,28.
8.3.4 Facteur d'amplification trophique (FAT)
Le FAT est une mesure du potentiel de bioamplification moyen d'une substance dans un réseau trophique dans des conditions de terrain. Il est estimé en comparant des concentrations de substance normalisées dans le biote et à différents niveaux trophiques.
Récemment, il a été déterminé que le DP total (ainsi que ses isomères) est bioamplifié dans un réseau trophique de l’Antarctique couvrant neuf espèces aquatiques dans la péninsule Fildes (FAT supérieur à 3 (appelé dans cette étude foodweb biomagnification factor (facteur de bioamplification du réseau trophique) ou FWMF)(Na et al. 2017). La bioamplification de l’anti-DP (FTA = 3,34) était légèrement supérieure à celle du syn-DP (2,87).
Le syn-DP et l'anti-DP ont été tous deux bioamplifiés de manière significative dans un réseau trophique d'un réservoir situé à proximité d'ateliers de recyclage de déchets électroniques dans le sud de la Chine (Wu et al. 2010; voir la section sur le FBA pour les détails de l'étude). Lors de cette étude, menée en 2006, des FAT de 11,3 (syn-DP) et de 6,6 (anti-DP) ont été déterminés, indiquant que les deux isomères du DP étaient nettement bioamplifiés dans tout le réseau trophique. Le FAT du syn-DP était presque deux fois psupérieur à celui de l'anti‑DP, suggérant un potentiel de bioamplification du syn-DP supérieur à celui de l'anti-DP dans le réseau trophique actuel. L’appauvrissement en isomère anti‑DP dans les organismes par rapport à des échantillons abiotiques et une présence moindre dans les niveaux trophiques supérieurs suggèrent aussi un métabolisme stéréospécifique de l'anti-DP et une absorption sélective du syn‑DP.
L’anti-DP et le DP total ont été significativement bioamplifiés dans un réseau trophique aquatique (deux invertébrés et cinq espèces de poissons) du canal de Beijing-Hangzhou, situé près de l’installation de production de DP dans la province du Jiangsu en Chine (Wang et al. 2015). Des valeurs de FAT (normalisées en lipides) de 3,1 (syn-DP), 1,9 (anti-DP) et 2,2 (DP total) ont été rapportées, la valeur du FAT du syn-DP n’étant toutefois pas significative.
Des résultats similaires ont été rapportés dans une étude de 2008 sur cinq espèces de poissons provenant de 22 rivières à travers la Corée du Sud (Kang et al. 2010). La proportion d'anti-DP mesurée dans les échantillons provenant de sites urbains industriels était nettement moindre que celle de l’étalon technique de DP, indiquant que les isomères du DP ont des comportements de bioaccumulation différents, le syn-DP étant plus bioaccumulé dans le biote que l'anti‑DP.
Des FAT du DP normalisés pour les lipides ont été déterminés en étudiant des échantillons archivés du réseau trophique du lac Winnipeg et du lac Ontario (Tomy et al. 2007). Bien qu'il y ait des différences entre les FAT des isomères dans le réseau trophique du lac Winnipeg, aucun FAT statistiquement significatif n’a été mis en évidence pour l'un ou l'autre des isomères dans le réseau trophique du lac Ontario. Un FAT de 2,5 pour l'anti-DP et un FAT inférieur à 1 pour le syn-DP ont été calculés dans le cas du lac Winnipeg.
8.3.5 Autres études liées à la bioaccumulation
Pour une étude récente sur le DP, des microcosmes de foie de goéland à bec cerclé nicheur de Montréal (Larus delawarensis) ont été utilisés pour examiner le métabolisme in vitro du DP (Chabot-Giguere et al. 2013). Aucune dégradation des deux isomères du DP ne s'est produite au cours de l'épreuve de 90 minutes.
Dans une étude avec des œufs d'étourneau sansonnet (Sturnus vulgaris), le DP était l'un des produits ignifuges les plus prévalant détectés dans échantillons prélevés sur des sites d'échantillonnage à travers le Canada (tout comme certains PBDE). Le DP (les deux isomères) a été détecté dans 41 % des échantillons d’homogénats de regroupement d’œufs examinés, avec des concentrations allant jusqu'à 24 ng/g ph (Chen et al. 2013) indiquant un transfert maternel.
Une étude de la répartition du DP dans les tissus de deux espèces de poissons de fond (poisson à tête de serpent et carpe de vase) du sud de la Chine a permis de déterminer une distribution préférentielle du syn-DP dans le foie par rapport aux muscles et une rétention persistante élevée de l'anti-DP dans le cerveau par rapport au foie, suggérant que ce dernier isomère peut traverser la barrière hématoencéphalique chez les poissons (Zhang et al. 2011b). Les niveaux médians allaient de 0,18 à 39,1 ng/g ph pour le syn-DP et de 0,22 à 52,9 ng/g ph pour l'anti-DP.
Ces études sur la faune fournissent des preuves variables suggérant une biodisponibilité et un métabolisme du DP, possiblement spécifiques de l’espèce et pouvant être différents pour les organismes aquatiques et les organismes terrestres.
8.4 Résumé du devenir dans l'environnement
Du DP devrait être rejeté dans l'environnement dans des eaux usées. Il peut exister un potentiel de migration du DP des matières plastiques vers l'atmosphère, étant donné que cette substance est ajoutée à la matrice polymère et pourrait donc être lixiviée dans une certaine mesure. Toutefois, il n'existe actuellement aucune preuve pour confirmer son importance. Une forte tendance de sorption en phase solide dans divers milieux (y compris des particules en suspension dans l'air) indique que le DP se retrouvera dans des biosolides, des sédiments et des particules en suspension dans l'air et qu'il sera transféré vers le sol lors de dépôts secs et de l'épandage de biosolides sur des terres agricoles. L'exposition aux organismes dans l'eau devrait être faible. La persistance intrinsèque élevée du DP suggère que des expositions à long terme peuvent être attendues dans les sédiments et le sol, avec un potentiel d'accumulation significatif dans les milieux proches de sources d'émission continues. Le processus d'élimination de l'environnement devrait inclure l'enfouissement dans les sédiments et le sol. Le DP devrait subir un transport à grande distance dans l’atmosphère et se déposer dans des milieux éloignés, en raison du transport de particules fines, comme cela a été mis envidence pour d’autres produits ignifuges hydrophobes à forte sorption sur les particulaires en suspension dans l’air. Étant donné la biodisponibilité de cette substance, une exposition à long terme peut conduire à des niveaux élevés dans les tissus dans le biote, à un transfert dans le réseau trophique et à une bioamplification.
9. Potentiel d'effets nocifs sur l'environnement
9.1 Évaluation des effets sur l'environnement
Des données empiriques sur le DP, ainsi que des données comparatives pertinentes sur des analogues structurels, le chlordane et le mirex, ont été prises en compte pour le poids de la preuve pour l’évaluation des effets du DP sur l’environnement. En plus d’études in vivo, des études récentes in vitro sur le DP ont été réalisées afin d’examiner les effets sur les cellules pour mieux comprendre le mécanisme de ses effets sur le système endocrinien.
La modélisation de la toxicité du DP par QSAR n’a généralement indiqué aucun effet à saturation. Le log Koe du DP excédait aussi les seuils limites du modèle, et la substance était mal couverte par les domaines des modèles de toxicité. Par conséquent, les prédictions de la modélisation sont considérées incertaines.
Pour le DP, les résultats de la plupart des études empiriques sur la toxicité aquatique présentent un niveau élevé d'incertitude et une applicabilité questionnable, principalement parce que les concentrations de traitement excédaient la limite de solubilité dans l’eau du DP de plusieurs ordres de grandeur. De plus, étant donné que le DP se rétrouve préférentiellement dans le sol ou les sédiments, la toxicité aquatique de la phase dissoute n'est pas le mileu de l’environnement le plus pertinent pour tester les effets de cette substance. Pour cette raison, les effets potentiels en milieu aquatique sont évalués en suivant une approche basée sur l’exposition par voie alimentaire et les résidus corporels critiques (RCC), et un poids moindre est donné à l'exposition en phase aqueuse pour l'évaluation des effets du DP sur l’environnement.
Le DP est classé comme narcotique de surface de base/composé organique neutre et/ou halogénure éthénylique/prop-2-ènylique pour la toxicité aquatique dans ECOSAR. Pour le profil de la Boîte à outils QSAR de l’OCDE (2012), le DP est mis dans la classe 4 (agissant avec un mode d’action spécifique) selon la classification de la toxicité Verhaar. En suivant les règles de Cramner de classification de la toxicité, celle du DP a été classée comme élevée (classe III). Avec la Boîte à outils de l’OCDE (OASIS v. 1.3), des alertes liées à la liaison aux protéines et à la liaison à l’AND ont été déclenchées en raison de la présence du groupe halogénure d’éthényle.
Peu de résultats sur le DP sont disponibles dans le profil (2012) de la Boîte à outils RQSA de l'OCDE; la liaison aux protéines de l'OCDE est désignée comme étant élevée (classe 3) pour le DP. De même, la liaison aux protéines est définie comme étant > 100 jours (OASIS, version 1.2, OCDE). Bien que le mode d’action du DP puisse ne pas être complètement compris pour les organismes aquatiques (p. ex., les organismes vivant dans les sédiments), ses analogues, les insecticides de type cyclodiène (p. ex., le chlordane), sont généralement considérés comme des neurotoxines pour les organismes terrestres (EC 1999).
Globalement, les études disponibles indiquent qu’une exposition chronique au DP a des impacts sur une gamme de biomarqueurs liés au stress oxydatif, à la génotoxicité et aux hormones thyroïdiennes ou sexuelles. Une meilleure compréhension est nécesaire afin de clarifier, en termes de voie de ces effets nocifs, quelle amorce moléculaire pourrait déclencher des événements clés et, au final, causer des modifications des organes ou au niveau des organes.
D'après les résultats obtenus lors de tests de toxicité chronique du DP et des analogues chlordane et mirex dans le sol et les sédiments, le DP peut potentiellement avoir des effets à faible concentration sur les organismes vivant dans le sol comme les lombrics et des insectes. Le chlordane, un de ses analogues, a aussi le potentiel de causer des effets à faible concentration sur les organismes vivant dans les sédiments. Toutefois, le DP n’exhibe pas pas de potentiel d'effets sur la faune, d’après les études actuelles sur des rongeurs et des oiseaux.
9.1.1 Eau
Le potentiel de toxicité aquatique due à l’absorption alimentaire a été évalué en tenant compte du comportement prédit du DP, à savoir un degré élevé de partage dans les particules, une stabilité élevée dans l'environnement et un potentiel de bioaccumulation par l’intermédiaire du régime alimentaire.
Lors de deux études récentes, la toxicité du DP pour des organismes aquatiques a été examinée. Kang et al. (2016) ont étudié le stress oxydatif et la perturbation du système endocrinien chez le poisson zèbre (Danio rerio) suite à un gavage alimentaire de DP dans de l’huile de maïs. Le DP a été administré aux poissons les jours 0 et 2 (dose de 0,3 à 3 µg/g), résultant en une concentration de DP dans les tissus du poisson allant jusqu’à 420 ng/g ph le jour 6. Des effets sur les biomarqueurs des hormones thyroïdiennes et sexuelles, ainsi que dommages dus au stress oxydatif, ont été mesurés à diverses doses. Les auteurs ont suggéré que la DP pouvait altérer les voies régulatrices dans le cerveau. Toutefois, lors de la même étude, le développement d’embryons et de larves de poisson n’a pas été affecté par une exposition dans l’eau (jusqu’à 267 µg/L de DP).
Baron et al. (2016) ont exposé des moules méditérranéennes (Mytilus galloprovinciallus) à du DP par voie alimentaire pendant 6 jours et ont rapporté des dommages à l’ADN à la concentration la plus faible testée (algues dopées avec 5,6 µg/L de DP, correspondant à 4700 ng DP/moule (4,7 µg/moule)), suggérant un potentiel génotoxique du DP. La formation de micronoyaux a aussi été induite par le DP à la concentration la plus élevée (algues dopées avec 100 µg/L, correspondant à 21 000 ng DP/moule (21 µg /moule)). Aucune réponse physiologique au DP n’a été observée.
Gagne et al. (2017) ont étudié des moules bleues (Mytilus edulis) exposées pendant 29 jours à du DP dans l’eau et rapporté une accumulation de DP liée à la dose. De plus, des biomarqueurs d’un stress oxydatif croissant au niveau des branchies (peroxydation des lipides) ont été mesurés pour des concentrations de DP dans les tissus égales ou supérieures à 0,98 ng/g ph (171,9 ng/g pl), correspondant à une exposition à 0,01 µg/L de DP. Aucun effet génotoxique n’a été observé aux concentrations testées lors de cette étude.
Le concept de résidus corporels critiques (RCC) a été utilisé pour étudier le potentiel d'effets nocifs d’une absorption de DP par voie alimentaire chez un poisson présentant une teneur en lipides de 5 %. Ce concept de RCC porte sur la question de savoir si un produit chimique présent dans l'environnement peut s’accumuler jusqu’à des niveaux critiques pour le corps associés à des effets comme la mortalité résultant d’une narcose de base. McCarty et Mackay (1993) et McCarty et al. (2013) ont montré que les concentrations internes des substances narcotiques causant le décès de poissons sont relativement constantes à environ 2 à 8 mmol/kg pour une exposition aiguë et à 0,2 à 0,8 mmol/kg pour une exposition chronique. McCarty et Mackay (1993) ont fourni la formule mathématique suivante pour estimer les résidus corporels critiques chez le poisson.
RCC = FBA (5 % de lipides) x concentration dans l'eau du produit chimique/MM
RCC = résidus corporels critiques chez le poisson (mmol/kg)
FBA (5 % de lipides) = peut être le FBA ou le FBC normalisé pour 5 % de lipides (L/kg)
MM = masse moléculaire de la substance (g/mol),
concentration de produit chimique dans l'eau (mmol/L)
Les RCC ont été calculés en utilisant la valeur modélisée du FBA de 2,12 x106 (ECCC 2017). La solubilité dans l’eau a été utilisée comme concentration environnementale dans les eaux de surface (c.-à-d. que si les concentrations environnementales dans les eaux de surface sont proches des niveaux équivalents à la limite de solubilité dans l'eau, il peut alors être déterminé s'il existe un potentiel d'effets nocifs dû au réseau trophique; p. ex. poissons et mammifères piscivores) (voir le tableau 9-1).
Comme deuxième approche, la concentration la plus élevée de DP rapportée dans des tissus de poisson au Canada (0,85 ng/g ph) a été convertie en unité de RCC et comparée au seuil. De plus, comme l'exposition du DP par voie alimentaire est la voie d'exposition la plus probable, la fugacité biote-régime alimentaire a été aussi déterminée (ECCC 2017).
| Approche | Concentration du DP dans l'eau (mg/L) | FBA (L/kg) | RCC (mmol/kg) | Correspond aux effets aigus des RCC pour une narcose de base (létalité) (2-8 mmol/kg) | Correspond aux effets chroniques des RCC pour une narcose de base (létalité) (0,2-0,8 mmol/kg) |
|---|---|---|---|---|---|
| FBA modélisé | 2,85 x 10-7 a | 2,12 x 106 b | 9,24 x 10-4 | non | non |
| Échantillon du biote | ND | ND | 1,30 x 10-6 c | non | non |
Abréviation ; ND = non disponible
a Limite de solubilité dans l’eau utilisée comme concentration de DP dans l'eau. En utilisant la limite de solubilité du DP dans l’eau mesurée (ECHA 2013) (inférieure à 1,67 x 10-6, le RCC est égal à 5,19x 10-3 mmol/kg.
b Valeur modélisée la plus élevée du BCFBAF pour DP (2010).
C Valeur moyenne la plus élevée de DP dans les tissus de poissons au Canada (touladi, lac Ontario) rapportée à 0,85 ng/g ph par Ismail et al., 2009.
Les RCC estimés sont inférieurs aux seuils de létalité aiguë ou chronique. La comparaison de la concentration maximale dans les tissus de poisson avec les seuils de RCC montre aussi qu’aucun effet nocif aigu ou chronique ne devrait se manifester. Toutefois, il demeure un potentiel d'effets sublétaux.
9.1.2 Études empiriques sur les sédiments
Étant donné qu'aucune donnée sur la toxicité du DP dans les sédiments n'a été trouvée, les données de toxicité du mirex et du chlordane dans les sédiments ont été examinées à des fins de lecture croisée. En ce qui concerne le mirex, bien que plusieurs études de toxicité aquatique pour les poissons et les invertébrés (p. ex. les crustacés) aient été réalisées et mis en évidence une toxicité élevée (Environnement Canada 1977, PISSC 1984), dans aucune des études sur la toxicité dans les sédiments nous n’avons trouvé des paramètres de toxicité utilisables.
En ce qui concerne le chlordane, des recommandations intérimaires sur la qualité des sédiments (RIQS) canadiennes ont été établies en se basant sur des ensembles de données obtenues sur le terrain et des tests de toxicité dans des sédiments dopés (p. ex. organismes marins) (CCME 1999). Dans le rapport sur les RIQS, une RIQS de 4,5 µg/kg ps et une concentration avec effet probable (CEP) de 8,87 µg/kg ps pour l’eau douce, ainsi qu'une RIQS de 2,26 µg/kg ps et une CEP de 4,79 µg/kg ps pour l’eau marine sont établies. Parmi les études menées sur le terrain, au cours desquelles des effets sur les invertébrés benthiques ont été associés au chlordane dans les sédiments, on retrouve une étude canadienne menée dans le port de Toronto, qui a associé la diminution de la richesse des espèces et de l'abondance des chironomidés à un niveau moyen de chlordane dans les sédiments de 10,5 µg/kg ps (bien que d’autres pesticides organochlorés aient aussi été présents) (CCME 1999, Jaagumagi 1988, Jaagumagi et al. 1989). Lors d’une autre étude, une diminution de la densité de bivalves a été identifiée en réponse à des ajouts de chlordane dans des platins de sable à marée basse en Nouvelle-Zélande, où les concentrations de chlordane près de la surface ont atteint environ 7,5 µg/kg fines sèches (Pridmore et al. 1991). Parmi les études de toxicité mentionnées dans le rapport sur les RIQS, on retrouve une étude la Nouvelle-Zélande sur un bivalve marin, Macoma Liliana, exposé au chlordane lors d’épreuves biologiques sur des sédiments (Roper et Hickey 1994). Cette étude a mis en évidence un mouvement d'évitement sublétal significatif en dehors des sédiments dopés avec 20 µg/kg ps de chlordane de (96 h), ainsi que des effets aigus, CL10 et CL50, à 111 et à 238 µg/kg ps. Dans le rapport sur les RIQS, une étude du Canada est aussi analysée : une CL50 à 96 h de 120 µg/kg ps de chlordane a été rapportée pour la crevette grise de sable (Crangon septemspinosa) lors de tests sur les sédiments (McLeese et Metcalfe 1980). Lors d’une autre étude canadienne réalisée par McLeese et al. (1982), une CL50 à 288 h inférieure à 5,8 mg/kg ps a été rapportée pour le néréis (Nereis virens). Des études plus récentes sur les effets du chlordane sur des organismes vivant dans les sédiments portaient généralement sur les effets de mélanges de contaminants plutôt que sur des effets directement attribuables au chlordane seul.
| Organisme testé | Type de test | Paramètre | Chlordane dans les sédiments (µg/kg en ps)c | Référence |
|---|---|---|---|---|
| Crevette grise de sable (Crangon septemspinosa) | Toxicité dans les sédiments : surviea | CL50 à 96 h | 120 | McLeese et Metcalfe 1980 |
| Néréis (Nereis virens) | Toxicité prolongée dans les sédiments : surviea | CL50 à 288 h | < 5,8 | McLeese et al. 1982 |
| Bivalve marin (Macomona liliana) | Toxicité prolongée dans les sédiments : surviea | CL50 à 10 j | 238 | Roper et Hickey 1994 |
| Bivalve marin (Macomona liliana) | Toxicité prolongée dans les sédiments : surviea | CL10 à 10 j | 111 | Roper et Hickey 1994 |
| Bivalve marin (Macomona liliana) | Toxicité prolongée dans les sédiments : évitementa | Évitement à 96 h | 20 | Roper et Hickey 1994 |
| Organismes benthiques d'eau douce | Enquête des données sur le terrain liées aux sédiments et aux invertébrés benthiquesb | Diminution de la diversité des espèces et de l'abondance des Chironomidae | 0,0105 | CCME 1999 |
| Organismes benthiques marins | Enquête des données expérimentales sur le terrain liées aux sédiments et aux invertébrés benthiquesa | Diminution de la densité de la bivalve | ~7,5 résidus fins secs (près de la surface) | Pridmore et al. 1991 |
| Base de données des organismes vivant dans les sédiments d'eau douce | S.O. | RIQS pour l'eau douce | 4,5 | CCME 1999 |
| Base de données des organismes vivant dans les sédiments d'eau douce | S.O. | CEP pour l'eau douce | 8,87 | CCME 1999 |
| Base de données des organismes vivant dans les sédiments marins | S.O. | RIQS pour l’eau marine | 2,26 | CCME 1999 |
| Base de données des organismes vivant dans les sédiments marins | S.O. | RIQS pour l'eau douce | 4,79 | CCME 1999 |
Abréviations : CL = concentration létale; RIQS = recommandations intérimaires sur la qualité des sédiments; CEP = concentration avec effet probable
a Chlordane technique utilisé pour l'étude.
b Enquête sur échantillon des invertébrés benthiques et des sédiments dans le lac Ontario (port de Toronto); par conséquent, probablement une exposition à un mélange de produits chimiques et pas uniquement au chlordane.
c Les tests de toxicité du chlordane dans des sédiments dopés indiquent l'apparition de la toxicité pour les organismes benthiques à des concentrations plus élevées que celles observées dans les études sur le terrain. Cela est probablement attribuable au temps d'exposition plus court lors de ces études en laboratoire, ainsi qu'à l'exposition au chlordane seul par opposition aux mélanges chimiques contenant du chlordane (Environnement Canada 1998).
Une VCT de 0,120 mg/kg a été retenue pour le DP (basée sur le chlordane) dans les sédiments. Cette VCT est le paramètre le plus faible représentatif d'un organisme vivant dans les sédiments (Crangon septemspinosa) trouvé au Canada. Un facteur d’évaluation de 10 est utilisé, pour ajuster un paramètre de toxicité aiguë à court terme (CL50 à 96 h) à une concentration sans effet chronique, et un autre facteur d’incertitude de 10 est utilisé pour tenir compte des variations interespèces et intraespèces (seulement 3 espèces testées). La VCT résultante est de 0,0012 mg/kg ps. Lorsque cette valeur est ajustée pour tenir compte de la teneur en carbone organique du test (0,28 %) par rapport la teneur en carbone organique standard dans les sédiments (3 %) (Webster et al. 2004), la CESE pour les organismes vivant dans les sédiments est établie à 0,0129 mg/kg ps. Étant donné que les sédiments du test contenaient 0,28% de CO, la solubilité maximale du DP (basée sur celle de l'analogue chlordane) dans les sédiments était de ~9,45 mg/kg ps (ECCC 2017). La limite de solubilité dans les sédiments n'a donc pas été excédée dans les conditions de l'étude.
9.1.3 Études empiriques dans le sol
Il existe des études limitées sur la toxicité du DP dans le sol. Les données sur les analogues chlordane et mirex ont aussi été examinées.
Yang et al. (2016) ont exposé le ver de terre (Eisenia fetida) à 0,1, 0,5, 6,25 et 12,5 mg DP/kg pendant 28 jours afin d’étudier la létalité, le stress oxydatif, la neurotoxicité et les effets de cellulose. Bien que la mortalité et le poids n’aient pas été affectés par le DP au cours des 28 jours, des effets sur le stress oxydatif, l’activité enzymatique (neurotoxicité et cellulose) et des dommages à l’ADN ont été observés aux doses les plus faibles (p. ex. mois de 0,1 à 0,5 mg/kg). Les auteurs ont conclu qu’une exposition à long terme au DP cause un strress aux vers, et que le stress oxydatif joue un rôle significatif dans la toxicité du DP.
Zhang et al. (2014) ont exposé le ver de terre (Eisenia fetida) à 0,1, 1, 10 et 50 mg/kg de DP pendant 14 jours pour étudier la létalité, les dommages oxydatifs, la neurotoxicité et les profils transcriptomiques. La toxicité aiguë était faible (aucun effet significatif du traitement sur le poids corporel ou la létalité à aucune des concentrations). Toutefois, des dommages oxydatifs et des effets sur les gènes et les voies liés aux dommages neuronaux ont été rapportés.
Plusieurs tests de toxicité du chlordane et du mirex dans le sol ont été réalisés (tableau 92), la plupart datant de plusieurs décennies et rapportant des paramètres différents. Le rétablissement du lombric (Lumbricus terrestris) 5 jours après une exposition de 10 à 30 jours au chlordane dans un sol artificiel a été évalué (Cikutovic et al. 1999). Le pourcentage des lombrics complètement rétablis 5 jours après la fin de l’exposition variait de 75 % à 81,2 %, à la concentration la plus faible (6,25 ug/mg ps). Aucune DMEO n'a été déterminée. La survie (DL50 à 20 heures) du grillon automnal (Gryllus pennsylvanicus) a été rapportée comme étant de 0,89 ppm dans le sol (hypothèse de 0,89 mg/kg ps) lors d’une bioépreuve au cours de laquelle des grillons étaient placés sur le sol une heure après le traitement du sol avec du chlordane (Harris et al. 1964).
La dose d'état de choc (DE30) et la dose létale (DL50) du mirex ont été déterminées pour le cloporte vulgaire (Armadillidium vulgare) et le mille-pattes diplopode (Oxidus gracilis) en les nourrissant avec des aliments contenant différentes concentrations de poudre de mirex technique (Kuang et de la Cruz 1977). La DE30 et la DL50 (dues à la nourriture) après une exposition de 10 jours étaient respectivement de 4,1 ppm (assumé équivalent à 4,1 mg/kg ps) et de 35,2 ppm pour A. vulgare et de 2,7 ppm et 198,7 ppm pour O. gracilis. Rajanna et de la Cruz (1975) ont réalisé une étude de phytotoxicité pour examiner les effets du mirex sur la germination, l'émergence, et la croissance de semis de plantes couramment cultivées dans des champs ou des prés (voir ECCC 2017 pour la liste des espèces). La germination totale, l'émergence des semis et la croissance précoce étaient réduites chez plusieurs espèces de plantes par rapport à celles des témoins après une exposition à des concentrations égales ou supérieures à la concentration testée la plus faible de 0,15 ppm dans le sol (0,15 mg/kg ps). Des effets significatifs du mirex sur la vitesse de croissance des semis après 2 semaines (poids sec de I00 semis) ont été constatés pour l'ensemble des 6 espèces. La vitesse de croissance était réduite de manière significative à 0,15 ppm dans le sol (0,15 mg/kg) dans le cas du trèfle incarnat, du sorgho d'Alep et de l'ivraie multiflore, à 0,30 ppm (0,30 mg/kg) dans le cas de la fétuque élevée et de la luzerne et à 0,70 ppm (0,70 mg/kg) dans le cas du trèfle alsike.
| Substance (DP, mirex, chlordane) | Organisme testé | Type de test | Paramètre | Valeur (mg/kg ps, sauf indication contraire) | Référence |
|---|---|---|---|---|---|
| DP | Eisenia fetida | Stress oxydatif, neurotoxicité, cellulose, dommages à l’ADN | Létalité/ poids corporel Exposition de 28 jours | > 12,5 | Yang et al. 2016 |
| DP | Eisenia fetida | Stress oxydatif, neurotoxicité, cellulose, dommages à l’ADN | Activités enzymatiques antioxydantes/ Dommages oxydatifs/ Activité AChE et cellulose/ dommages à l’ADN Exposition de 28 jours | 0,1- 0,5 (varie suivant le test) | Yang et al. 2016 |
| DP | Eisenia fetida | Toxicité aiguë, stress oxydatif, neurotoxicité | Létalité/ poids corporel | > 50 | Zhang et al. 2014 |
| DP | Eisenia fetida | Toxicité aiguë, stress oxydatif, neurotoxicité | Marqueurs du stress oxydatif, activité enzymatique | 0,1-50 (varie suivant le test) | Zhang et al. 2014 |
| Chlordane | Lombric (Lumbricus terrestris) | Toxicité prolongée dans le sol : guérison après la blessure | Guérison de la blessure après 5 jours Exposition de 10 jours |
< 6,25 (81,2 % des verres de terre guéris) | Cikutovic et al. 1999 |
| Chlordane | Lombric (Lumbricus terrestris) | Toxicité prolongée dans le sol : guérison après la blessure | Guérison de la blessure après 5 jours Exposition de 20 jours |
< 6,25 (75,0 % des verres de terre guéris) | Cikutovic et al. 1999 |
| Chlordane | Lombric (Lumbricus terrestris) | Toxicité prolongée dans le sol : guérison après la blessure | Guérison de la blessure après 5 jours Exposition de 30 jours |
< 6,25 (80,9 % des verres de terre guéris) | Cikutovic et al. 1999 |
| Chlordane | Grillon automnal (Gryllus pennsylvanicus) | Toxicité dans le sol : survie | DL50 à 20 h | 0,89 ppm dans le solb | Harris et al. 1964 |
| Mirex | Isopode (Armadillidium vulgare) | Toxicité dans le sol, exposition alimentaire | DE30 à 10 j | 4,1 ppm | Lue et de la Cruz 1977 |
| Mirex | Isopode (Armadillidium vulgare) | Toxicité dans le sol, exposition alimentaire | DL50 à 10 j | 35,2 ppm | Lue et de la Cruz 1977 |
| Mirex | Diplopode (Oxidus gracilis) | Toxicité prolongée dans le sol : exposition alimentaire | DE30 à 10 j | 2,7 ppm | Lue et de la Cruz 1977 |
| Mirex | Diplopode (Oxidus gracilis) | Toxicité prolongée dans le sol : exposition alimentaire | DL50 à 10 j | 198,7 ppm | Lue et de la Cruz 1977 |
| Mirex | Trèfle incarnat (Trifolium incarnatum), sorgho d'Alep (Sorghum halpense, ivraie multiflore (Lolium multiflorum) | Toxicité prolongée dans le sol : vitesse de croissance des semis | Réduction significative de la vitesse de croissance des semis après deux semaines | < 0,15c | Rajanna et de la Cruz 1975 |
Abréviations : DL = dose létale; DE = dose d'état de choc
a Rapportée comme dose nécessaire pour tuer 50 % des vers avec un pesticide; présentée comme DL50 dans la présente évaluation.
b Il n’est pas clair si ppm représente une solution en mg/L ajoutée au sol ou des mg/kg de sol (poids sec).
c Rapportée dans cette étude comme mg/kg de sol, convertie pour la présente évaluation.
Sur la base des paramètres disponibles provenant d’études de toxicité dans le sol et sur l'analogue mirex, la concentration < 0,15 mg/kg ps (diminution de la vitesse de croissance de 3 espèces de plante après 2 semaines) est retenue comme VCT, représentant la plus faible valeur de l'étude prolongée. Étant donné l'incertitude liée à la variation interespèce et intraespèce (2 niveaux trophiques couverts par les données analogues) des paramètres chroniques, un facteur d'évaluation de 10 est appliqué. De plus, étant donné que la VCT est une valeur sans limite (c.-à-d. effets à la concentration la plus faible testée), un autre facteur d'évaluation de 10 est appliqué. La VCT résultante est de 0,0015 mg/kg ps. Lorsque cette valeur est ajustée pour tenir compte de la teneur en carbone organique (0,04 %) du test par rapport à la teneur en carbone organique standard dans le sol (2 %, ECHA 2010), la CESE pour les organismes vivant dans le sol est établie à 0,075 mg/kg ps. Étant donné que le sol utilisé pour les tests de cette dernière étude contenait 0,04 % de CO, la solubilité maximale du DP (basée sur celle de l'analogue mirex) était d'environ 31,7 mg/kg ps.
9.1.4 Études empiriques sur la faune
Il existe des études limitées sur le DP pertinentes pour la faune. Les études de toxicité standard du DP à dose répétée chez des mammifères (rongeurs) n'ont généralement pas mis en évidence d’effet nocif à la plus forte dose testée, par exemple 5000 mg/kg pc/j (étude de 90 jours avec le rat d’Oscarson (1975), étude de 28 jours par voie orale sur la reproduction avec le rat de Brock et al. (2010)). Lors d’une étude de toxicité aiguë par voie orale, le DP n'avait aucun effet sur des rats Sherman-Wistar à la dose administrée la plus élevée de 25 000 mg/kg pc/j, et la DSENO après 90 jours lors d’une étude (subchronique) à dose répétée était de 100 000 ppm (EPA 2008, cité par Crump et al. 2011). Veuillez consulter la section « Effets sur la santé humaine » pour une analyse détaillée des études de toxicité chez d'autres rongeurs ou mammifères.
Crump et al. (2011) ont étudié les effets liés à la concentration du DP en suivant des approches de toxicité in vivo et in ovo pour les hépatocytes embryonnaires de poulet domestique (Gallus gallus domesticus) et les embryons de poulet. Le DP était injecté dans les œufs avant l'incubation, et a fait l'objet d'un suivi jusqu'au bêchage (soit le jour 22). Aucun effet toxique manifeste n’a été relevé jusqu’à la dose maximale de 3 uM dans les hépatocytes, et jusqu’à la dose nominale de DP la plus élevée (500 ng/g/œuf) pour le bêchage des embryons. De plus, aucun changement dans les niveaux de transcrit d’ARNm des gènes ciblés n'a été observé, malgré la réponse de ces gènes ciblés à d’autres produits ignifuges (p. ex. HBCD) lors d’études précédentes. Les auteurs ont conclu que le DP n'a pas eu d’incidence significative sur la cytotoxicité ou la viabilité embryonnaire chez le poulet à des concentrations dix fois supérieures à celles détectées dans les œufs de goéland argenté de la région des Grands Lacs. Toutefois, une différence dans la teneur en isomère syn-DP et anti-DP a été détectée entre les solutions mères et les tissus hépatiques. La proportion de syn‑DP passait de 0,34 à 0,65, alors que celle d'anti-DP passait de 0,66 à 0,35.
Li et al. (2013) ont étudié l'effet du DP sur la caille des blés mâle (Corturnix coturnix) exposée de façon continue à du DP commercial par gavage pendant 90 jours, à des doses allant de 1 à 100 mg/kg pc/j. L'activité enzymatique hépatique et le stress oxydatif ont été mesurés. Les auteurs ont rapporté des effets du DP sur certaines mesures d'activité enzymatique (p. ex. diminution significative des enzymes PROD chez tous les groupes exposés par rapport au groupe témoin, augmentation significative de l'enzyme ÉRND et d'enzymes antioxydantes (catalase) chez les groupes fortement exposés par rapport au groupe témoin). De plus, cette étude a montré que le DP était plus susceptible de s'accumuler dans le foie (par rapport au sérum, aux muscles), et que le syn‑DP s'accumulait (par rapport à l'anti-DP) dans les groupes fortement exposés au DP.
| Organisme testé | Type de test | Paramètre | Valeur | Référence |
|---|---|---|---|---|
| Poulet domestique (Gallus gallus domesticus) | Toxicité pour la faune : bêchage des embryons | 90 jours Cytotoxicité, bêchage des embryons, expression de l'ARN messager | > 500 ng/g œuf (dose nominale), > 3 uM pour la cytotoxicité |
Crump et al. 2011 |
| Caille des blés (Corturnix coturnix) | Étude subchronique chez la faune | 90 jours Mesures d'activité enzymatique | 1 mg/kg pc/j | Li et al. 2013 |
Les études existantes sur des mammifères et des oiseaux suggèrent que, bien que le DP puisse être biodisponible pour la faune, il ne présente pas d'effet toxique manifeste (aucun effet à la plus forte dose). Toutefois, les récentes études à l'échelle moléculaire portant sur des oiseaux suggèrent que le DP peut affecter les niveaux d'activité enzymatique chez les espèces testées, bien que la pertinence de ces résultats pour l’environnement ne soit pas claire.
Une VCT de 5000 mg/kg pc/j (aucun effet nocif jusqu'à la dose la plus élevée de 5000 mg/kg pc/j) tirée de l’étude de Brock et al. (2010) a été retenue à partir d'une gamme de tests en laboratoire sur des rongeurs lors d’une étude combinée de toxicité à dose répétée sur la reproduction de 28 jours réalisée en suivant les lignes directrices de l'OCDE (voir la section sur l'évaluation pour la santé). Cette DSENO est en accord avec les résultats d’une étude de 90 jours par voie orale, plus ancienne et non publiée (Oscarson 1975). En assumant une exposition des petits mammifères comme les campagnols et les musaraignes, l'approche de la valeur toxicologique de référence (VTR) pour la faune (Sample et al., 1996) a été utilisée pour normaliser les effets chez le rat en fonction du poids corporel type de la musaraigne, qui représente une espèce faunique de remplacement pour les mammifères consommant des organismes du sol (voir ECCC (2017) pour les valeurs des intrants), résultant en une VTR de 11 798 mg/kg pc/j. Un facteur d'évaluation de 10 a été appliqué pour tenir compte de l'extrapolation des conditions de laboratoire à celles de terrain. La VTR obtenue pour la musaraigne était donc de 1179,8 mg/kg pc/j.
En supposant une exposition de la faune, la même VCT de 5000 mg/kg pc/j (aucun effet nocif jusqu'à la dose la plus élevée de 5000 mg/kg pc/j) tirée de l’étude de Brock et al. (2010) a été retenue pour déterminer la valeur toxicologique de référence pour la faune (piscivores). L'approche de la valeur toxicologique de référence (VTR) pour la faune (Sample et al., 1996) a été utilisée pour normaliser les effets chez le rat en fonction du poids corporel type du vison (Mustela vison) et de la loutre de rivière (Lontra canadensis), des espèces fauniques servant de substitut conduisant à des estimations respectives de VTR pour la faune de 3769 et 2288 mg/kg pc/j (voir la documentation à l'appui, ECCC 2017, pour les valeurs des intrants). Un facteur d'évaluation de 10 a été appliqué pour tenir compte de l'extrapolation de conditions de laboratoire à celles de terrain. La VTR obtenue pour la faune était de 228,8 (loutre) et 376,9 (vison) mg/kg pc/j.
9.2 Évaluation de l'exposition dans l'environnement
Bien que des concentrations de DP mesurées dans l’environnement aient été présentées, des données limitées sur les concentrations de DP dans l’eau au Canada ont été trouvées. Par conséquent, les concentrations environnementales ont été évaluées à partir de renseignements canadiens, y compris les quantités de substance estimées, les vitesses de rejet estimées et les caractéristiques du milieu récepteur. Des concentrations environnementales ont été estimées pour des scénarios de rejet industriel, tel qu'il est décrit ci-après.
9.2.1 Scénarios d'exposition et concentrations environnementales estimées
Une exposition au DP en milieu aquatique devrait avoir lieu si l'industrie (p. ex. production, formulation) rejette le DP soit directement dans l'eau, soit dans un système de traitement des eaux usées qui rejette ses effluents dans l'eau. La concentration de la substance dans les eaux réceptrices près du point de rejet du système de traitement des eaux usées est utilisée comme concentration environnementale estimée (CEE) pour l'évaluation du risque que pose la substance en milieu aquatique. Elle peut être calculée à l'aide de l'équation suivante :
CEE = [1000 x Q x P x (1 – T)] / (N x D x F)
avec
CEE = concentration en milieu aquatique résultant de rejets industriels, en mg/L
Q = quantité totale de substance utilisée chaque année sur un site industriel, en kg/an
P = pertes dans les eaux usées, fraction
T = taux d'élimination du système de traitement des eaux usées, fraction
N nombre de jours de rejets par an, en jour/an
D = débit de l'effluent du système de traitement des eaux usées, en m3/jour
F = facteur de dilution dans l'eau réceptrice, sans dimension
Plusieurs scénarios prudents de rejet industriel en milieu aquatique ont été élaborés pour couvrir une gamme d'activités industrielles connues avec du DP qui pourraient se dérouler au Canada. Parmi ces scénarios : fabrication de fils et de câbles, fabrication d'automobiles et fabrication de connecteurs en matière plastique dure. Des renseignements provenant de différentes installations prises en compte ont été recueillis pour élaborer des scénarios reflétant des pratiques et des conditions prévues, y compris le type de traitement des eaux usées, et les rejets directs ou indirects dans l'environnement récepteur.
Le DP étant importé en vrac dans des mélanges liquides qui peut générer des résidus dans les contenants de transport, les activités de nettoyage de ces contenants peuvent conduire à des rejets de cette substance dans l'environnement. Bien que les concentrations environnementales de DP attribuables à ces rejets puissent être élevées, de tels rejets devraient être de nature épisodiques et de courte durée. Étant donné ces éléments et les lacunes actuelles dans les données sur les activités et les pratiques de nettoyage de ces contenants, aucune caractérisation quantitative de l’exposition n’a pas été faite.
Dans le tableau 9-5, nous présentons la gamme des intrants utilisés pour estimer les concentrations de la substance dans le milieu aquatique près du point de rejet industriel. En se basant sur ces hypothèses, ces scénarios industriels ont permis de calculer des concentrations environnementales estimées (CEE) en milieu aquatique de 4,38 x 10-8 à 2,8 x 10-5 mg/L pour le DP total (dissous et associé à des particules). La CEE en milieu aquatique représente le niveau d'exposition dans les eaux réceptrices près du point de rejet sur chaque site.
| Intrant | Valeur | Justification et référence |
|---|---|---|
| Quantité utilisée par site (kg/an) | < 10 000 | Gamme couvrant les quantités par site indiquées dans l'enquête réalisée en vertu de l'article 71 ou hypothèses d'EC établiesà partir des données de l'article 71 |
| Pertes dans les eaux usées (%) | De 0,01 à 1,0 | OCDE 2004, 2009 |
| Efficacité d'élimination du système de traitement des eaux usées (%) | 60 et 94 | Prédit pour le traitement primaire et le traitement secondaire (STP Model 2.1, taux d'élimination le plus élevé de 4 modèles) |
| Nombre de jours de rejet par an (jour) | De 250 à 350 | Hypothèse standard d’EC pour des rejets continus |
| Débit de l'effluent du système de traitement des eaux usées (m3/j) | de 14 024 à 65 700 | Données du système de traitement des eaux usées propres au site |
| Facteur de dilution (-) | de 1 à 10 | Débit du système de traitement des eaux usées propre au site/débit de l'environnement récepteur. Lorsque le facteur de dilution était supérieur à 10, une valeur par défaut de 10 a été utilisée. |
En plus des rejets industriels modélisés de DP, des données de surveillance du DP dans les effluents et les biosolides de huit UTEU canadiennes (couvrant les lagunes, le traitement primaire, le traitement secondaire et les procédés de traitement liquide de pointe) ont été prises en compte dans des scénarios additionnels pour l’analyse de l’exposition (Shanmuganathan et al. 2017). Les concentrations environnementales estimées (CEE) en milieu aquatique calculées à partir du DP mésuré dans les effuents (facteur de dilution maximal = 10) allaient de 2,85 x 10-7 à 9,3 x 10-5 mg/L pour le DP total (dissous et associé aux particules).
Une approche basée sur le partage eau-sédiments à l'équilibre a été suivie pour estimer la concentration de DP dans les sédiments benthiques. Cette approche est basée sur un principe de répartition décrit par l'Agence européenne des produits chimiques (ECHA 2010) et intègre deux méthodes de calcul supplémentaires. La première méthode sert à estimer la concentration de la substance dans la phase aqueuse (dissoute) de l'eau sus-jacente à partir de sa concentration totale, selon des études de Gobas (2007 et 2010). La deuxième méthode sert à estimer la concentration de la substance dans les sédiments benthiques à partir de sa concentration dans la phase aqueuse de l'eau sus‑jacente, basée sur une hypothèse de partage à l'équilibre entre les sédiments benthiques et l'eau sus-jacente décrite par le National Center for Environmental Assessment de l'EPA des États-Unis (EPA 2003). À l'équilibre, la concentration environnementale estimée (CEE) dans les sédiments benthiques peut être corrélée de façon linéaire avec la concentration dans la phase aqueuse de l'eau sus-jacente. Des scénarios d'exposition dans les sédiments ont été élaborés en utilisant les CEE aquatiques tirées des scénarios de rejet industriel en milieu aquatique, ainsi que les CEE tirées de la surveillance des UTEU à travers le Canada décrites ci-dessus, pour déterminer les CEE àl’équilibre dans les sédiments, normalisées pour une teneur en carbone organique de 3 % (la teneur en carbone organique typique dans les sédiments benthiques des rivières et des lacs) (Webster et al. 2004). Les CEE obtenues pour les sédiments benthiques allaient de 0,2 à 380 µg/kg ps (0,0002 à 0,38 mg/kg ps).
La gamme des CEE dans les sédiments est semblable à celle des concentrations mesurées de DP dans les sédiments des Grands Lacs. Par exemple, la concentration mesurée dans les sédiments des affluents du lac Supérieur était de 1,6 µg/kg ps (pourcentage de carbone organique non spécifié, Shen et al. 2011b) et celles les plus élevées mesurées dans les sédiments de la rivière Niagara (s’écoulant entre les lacs Érié et Ontario) allaient jusqu’à 310 µg/kg ps (dans un affluent de la rivière Niagara) et 586 µg/kg ps dans les sédiments des eaux libres du lac Ontario (pourcentage de carbone organique pour l'échantillon non fourni) (Shen et al. 2011a, 2011b, Sverko et al. 2008). La rivière Niagara a un long passé d'activités industrielles et de rejets connexes, y compris la production de DP à Niagara Falls (New York), qui a eu une influence sur les concentrations de composés chimiques relativement élevées le long de la rivière et dans le lac Ontario (Shen et al. 2011a, 2011b). Il n’est pas clair dans quelle mesure la source de DP dans ces régions provenait du Canada.
Une approche décrite par l'Agence européenne des produits chimiques (ECHA 2010) a été suivie afin de déterminer les concentrations environnementales estimées dans le sol (CEE sol) résultant de l'épandage de biosolides d'eaux usées sur des terres. Cette approche est basée sur les quantités de biosolides accumulés dans la couche supérieure de 20 cm de sol (profondeur de labourage) au cours d'une période de dix années consécutives. L’hypothèse sous-jacente de cette méthode était qu’il n'y avait aucune perte de substances par volatilisation, lixiviation ou ruissellement lors de la pénétration des substances dans les sols suite à l'épandage. Toutefois, la perte attribuable à la dégradation était prise en compte (une demi-vie de deux ans dans le sol était assumée). Des scénarios d'exposition dans le sol ont été élaborés à partir des scénarios décrits ci-dessus, en utilisant les concentrations dans les biosolides et les vitesses l’UTEU spécifiques du site. La concentration estimée dans les biosolides allait de 0,012 à 5,1 mg/kg ps, et les CEE sol résultantes (standardisées à 2 % de carbone organique (ECHA 2010)) allaient de 1,39 x 10-4 à 0,059 mg/kg ps.
En plus des concentrations dans les biosolides estimées susmentionnées, des données mesurées sur les biosolides provenant de la surveillance de huit UTEU à travers le Canada (décrites plus haut) ont été utilisées pour la même approche de l’ECHA (2010) afin de déterminer les CEE sol. Les concentrations mesurées de DP dans les biosolides des UTEU allaient de 0,38 à 0,74 mg/kg ps, et les CEE sol obtenues (standardisées pour 2 % de carbone organique (ECHA 2010)) allaient de 0,0044 à 0,0084 mg/kg ps.Ces dernières CEE sol basées sur des concentrations mesurées dans les biosolides sont situées dans la gamme des CEE sol calculées au moyen des données modélisées sur les biosolides des scénarios industriels.
Une absorption totale journalière (ATJ) par la faune a été calculée pour la musaraigne consommant des organismes du sol (vers de terre) exposés à du DP appliqué dans les sols par épandage de biosolides, en utilisant le modèle BASL4. En utilisant la concentration maximale prédite de DP dans les biosolides (5,1 mg/kg) et en assumant un épandage sur le sol une fois par année pendant 10 ans (et une demi-vie de dégradation de 2 ans), l’ATJ obtenue est de 0,0716 mg/kg pc/j. Cette valeur est jugée prudente étant donné que le modèle BASL4 ne tient pas compte du métabolisme dans son estimation.
L’absorption totale journalière (ATJ) du vison (Mustela vison) et de la loutre de rivière (Lontra canadensis), deux piscivores, a été estimée en suivant l'approche de l'EPA des États-Unis (1993). Pour ce calcul de l’ATJ, une concentration dans les tissus du touladi de 0,00085 mg/kw (ph) a été retenue, représentant la concentration moyenne de DP la plus élevée publiée pour le biote canadien (Ismail et al. 2006), résultant en une CEE de 1,10 x 10-4 mg/kg pc/j pour le vison et de 1,16x 10-4 mg/kg pc/j pour la loutre (ECCC 2017).
En plus des sources industrielles de DP, les produits commerciaux et les produits disponibles pour les consommateurs peuvent représenter une source de DP dans l'environnement (p. ex. par volatilisation ou par production de particules lors d’une abrasion (BESC 2004)). Bien qu’il n’existe dans la littérature pratiquement aucune donnée quantifiée sur les rejets provenant des produits, la détection de DP dans des échantillons de poussière (voir la section 10.1.1.2 sur la santé humaine) et les milieux des UTEU (influent, effluent et biosolides) (Kolic et al. 2009, Davis et al. 2012, LaGuardia et al. 2012, Shanmuganathan et al. 2017) indiquent que cette substance peut être rejetée à partir de produits commerciaux ou de produits disponibles pour les consommateurs (Davis et al. 2012). Une étude canadienne récente sur les UTEU a mis en évidence la détection de DP total (syn-DP et anti-DP) dans plus de 90 % des échantillons d’eaux usées ou de biosolides. Les concentrations allaient respectivement de 17 à 247 ng/L, de 2 à 139 ng/L et de 96 à 740 ng/g ps dans les influents, les effluents et les biosolides. Les efficacités médianes d’élimination dans ces UTEU allaient de 51 à 66 % pour le DP total (Shanmuganathan et al. 2017). En ce qui concerne la poussière, un récent échantillonnage actif à grand volume de l’air sur un site semi-urbain à Toronto (Canada) a permis de déterminer que le DP était l’un des produits ignifuges organiques les plus fréquemment détectés (Shoeib et al. 2014), suggérant des sources non ponctuelles diffuses. De même, lors d'autres études réalisées au Canada, la détection de DP dans la poussière domestique a été attribuée aux produits disponibles pour les consommateurs contenant du DP, puisqu'aucune installation de production de DP ne se trouvait à proximité (p. ex. Zhu et al. 2007). Les concentrations médianes de DP dans la poussière se situaient au deuxième rang par rapport à celles d’autres produits ignifuges bromés autres que des PBDE mesurés lors de la récente Enquête sur la poussière domestique au Canada (413 maisons, voir la section 10.1.1.2 sur la santé humaine). Néanmoins, la concentration médiane de DP était inférieure aux concentrations de produits ignifuges à base de phosphates organiques dans la poussière relevées lors de cette même étude. Une concentration au 95ème percentile de 151,2 ng/g pour la poussière domestique au Canada a été déterminée pour la présente évaluation (voir la section 10.1.1.3 sur la santé humaine), suggérant que les rejets de DP par cette voie sont mesurables.
Bien qu’aucune vitesse de rejet au cours de la durée de vie utile n'ait été trouvée pour le DP, une vitesse d’émission spécifique de 0,3 ng/m2/h a été déterminée pour le décaBDE (provenant d’un mélange d’octaBDE) lors d’un test de 105 jours sur un boîtier de téléviseur (23 °C) (Kemmlein et al. 2003). Dans un rapport de l'OCDE (2009), la volatilité potentielle dans l'atmosphère au cours de la durée de vie utile de produits ignifuges organiques génériques présents dans des matières plastiques a été estimée à 0,05 % pour une utilisation à l’intérieur ou à l’extérieur. Cependant, cette valeur générique pourrait être surestimée pour un produit ignifuge organique très peu volatil comme le DP. Des rejets dans l’environnement de cette substance à partir de polymères par lixiviation sont jugés possibles. Le potentiel de rejet de produits ignifuges organiques dans l’eau par des matières plastiques au cours de leur vie utile est estimé à 0,05 % si la substance est utilisée à l’intérieur et à 0,16 % si la substance est utilisée à l’extérieur (OCDE 2009a). La grande majorité des produits serait utilisée confinée à l’intérieur et, donc, un taux de rejet de 0,05 % serait plus probable (OCDE 2009a). Pour le Canada, un scénario général pour le rejet diffus du DP par des produits commerciaux ou des produits disponibles pour les consommateurs a été déterminé, en assumant le taux de rejet à l’intérieur de 0,05 % par année pendant la durée de vie utile de l’OCDE (2009a). En utilisant la valeur supérieure de la gamme des quantités importées au Canada en 2011 (10 000 kg) et en assumant que toute cette quantité est utilisée dans des produits commerciaux ou des produits disponibles pour les consommateurs, le rejet est estimé à 5 kg. Ce scénario comprend plusieurs hypothèses : utilisation la valeur supérieure de la gamme des quantités importées, utilisation complète du DP dans des produits, toutes les utilisations dans des produits sont connues et déclarées au Canada, faible exposition dans l’eau pendant la durée de vie utile et utilisation à l’intérieur. Ce résultat suggère que les rejets de DP par des produits commerciaux ou des produits disponibles pour les consommateurs sont limités. Toutefois, le résultat obtenu avec ce scénario est jugé très incertain.
Dans l'ensemble, les rejets provenant de produits commerciaux et de produits disponibles pour les consommateurs devraient être géographiquement dispersés et avoir lieu pendant la durée de vie utile et la fin de vie de ces produits. Tandis que le scénario présenté ci-dessus peut fournir une estimation grossière de tels rejets dans l'environnement pendant la durée de vie utile de ces produits, il y existe une absence de données permettant de quantifier l'élimination de déchets solides de poussière et les rejets en fin de vie utile dus à tous les articles manufacturés, y compris de sources non résidentielles. Des huit UTEU ayant participé à une campagne d’échantillonnage des effluents au Canada (Shanmuganathan et al. 2017), plusieurs recevaient et traitaient le lixiviat de sites d’enfouissement situés à proximité (communication personnelle de la Division des priorités émergeantes d’ECCC, 1er février 2018). La charge moyenne de DP pour les trois UTEU qui recevaient du lixiviat de site d’enfouissement était plus de 4 fois supérieure à celle des UTEU qui n’en recevaient pas. Ceci suggère que le lixiviat des sites d’enfouissement peut représenter une source non négligeable de DP dans l’influent des UTEU. Cependant, étant donné que la quantité totale de DP se retrouvant dans les sites d’enfouissement provenant de l’élimination en fin de vie de produits, d’articles manufacturés et d’autres matériaux n’est pas connue, et étant donné que les concentrations de DP dans le lixiviat des sites d’enfouissement n’ont pas été mesurées, il n’est pas actuellement possible de confirmer ou de quantifier une contribution du lixiviat des sites d’enfouissement comme source de DP dans les UTEU.
9.3 Caractérisation des risques pour l'environnement
9.3.1 Analyse des quotients de risque
Une analyse du quotient de risque, intégrant des estimations prudentes de l'exposition aux renseignements sur la toxicité, a été réalisée pour les sédiments et le sol ainsi que pour les espèces sauvages, afin de déterminer s’il existe un potentiel d’effets nocifs sur l’environnement au Canada. Aucune analyse du quotient de risque n’a été faite pour le milieu aquatique en raison de la faible probabilité d'exposition au DP dans l'eau et de données de toxicité aquatique non fiables. La valeur des RCC en milieu aquatique (mentionnée ci‑dessus) suggère une faible probabilité de létalité pour les organismes aquatiques due à une exposition dans l'eau. Toutefois, des effets sublétaux ne peuvent pas être écartés.
Les scénarios industriels spécifiques du site et les données mesurées sur les UTEU présentés plus haut (section 9291) ont conduit à calculer une CEE de 4,38 x 10-8 à 9,3 x 10-5 mg/L pour le DP total. Cette CEE représente le niveau d'exposition dans les eaux réceptrices près du point de rejet. En utilisant la CEE en milieu aquatique pour déterminer les CEE à l'équilibre dans les sédiments, standardisées à 3 % de carbone organique, les CEE dans les sédiments obtenues vont de 0,0002 à 0,38 mg/kg ps. Une concentration estimée sans effet (CESE) de 0,0129 mg/kg ps (17,1 µg/kg ps) a été calculée à partir d'une étude sur la toxicité chronique de l'analogue chlordane pour des organismes vivant dans des sédiments marins (voir la section sur les effets sur l’environnement). Le quotient de risque résultant (CEE/CESE) est 0,01 à 29,9. Par conséquent, des effets nocifs sur des organismes vivant dans les sédiments sont possibles pour ces scénarios industriels. De plus, en tenant compte de la limite supérieure de la gamme de concentrations de DP mesurées dans les sédiments dans le sud de la région des Grands Lacs (p. ex. 2,23-586 µg/kg ps dans les échantillons de sédiments de surface du lac Ontario prélevés en 1998 (Sverko et al. 2008), le risque pour les organismes vivant dans les sédiments pourrait être supérieur.
En suivant une approche similaire de quotient de risque, les CEE dans le sol prédites résultant de l'épandage de biosolides sur les terres (standardisées à 2 % de carbone organique) allaient de 1,39 x 10-4 à 0,059 mg/kg ps. La CESE pour les organismes vivant dans le sol (basée sur les valeurs de toxicité pour les plantes pour l'analogue mirex) est de 0,075 mg/kg ps (voir la section sur les effets sur l’environnement). Les quotients de risque ainsi obtenus (CEE/CESE) allaient de 0,002 à 0,78. Ceci suggère que des effets nocifs sur les organismes vivant dans le sol sont actuellement improbables dans le cas de tels scénarios. Cependant, il convient de noter que, dans au moins un scénario, le quotient de risque est proche de 1 et, par conséquent, un changement dans les facteurs contribuant à une CEE plus élevée dans le sol (p. ex. quantité utilisée beaucoup plus importante ou demi-vie de dégradation dans le sol supérieure aux 2 ans assumés) pourrait conduire à une possibilité de risque pour les organismes vivant dans le sol.
Une ATJ pour la faune a été calculée pour la musaraigne consommant des organismes du sol (vers de terre), au moyen du modèle BASL4, avec lequel le DP dans le sol est calculé à partir des quantités de biosolides d’eaux usées épandues sur les terres. Pour le calcul de l’ATJ, une concentration maximale de DP prédite dans les biosolides (5,1 mg/kg) a été assumée, au cours d'une exposition de dix ans, conduisant à une ATJ de 0,0716 mg/kg pc/j. La valeur toxicologique de référence (VTR) était de 1179,8 mg/kg pc/j (voir la section sur l'évaluation des effets sur l'environnement). Le quotient de risque résultant (ATJ/VTR) est de 6,1 x 10-5 pour la musaraigne, indiquant que même avec des hypothèses prudentes, il est improbable que les concentrations actuelles de DP dans le biote canadien excèdent les seuils d'effets minimaux (tableau 96).
Une AJT pour les piscivores sauvages a été calculée pour le vison (Mustela vison) et la loutre de rivière (Lontra canadensis), en suivant l'approche de l'EPA des États-Unis (1993). Une concentration de 0,00085 mg/kg ph dans les tissus du touladi a été retenue pour représenter la concentration moyenne de DP la plus élevée publiée pour le biote canadien (Ismail et al. 2006), conduisant à une AJT de 1,10 x 10-4 (vison) à 1,16 x 10-4 (loutre) mg/kg pc/j (voir la documentation à l'appui (ECCC 2017) pour des détails sur les intrants du modèle pour le calcul de l’AJT). Les VTR calculées étaient de 376,9 (vison) et 228,8 (loutre) mg/kg pc/j (voir la section sur l'évaluation des effets sur l'environnement). Les quotients de risque (AJT/VTR) obtenus sont de 2,93 x 10-7 pour le vison et 5,08 x 10-7 pour la loutre, indiquant que, même avec des hypothèses prudentes, il est improbable que les concentrations actuelles de DP dans le biote canadien excèdent les seuils d’effets minimaux (d’un ordre de grandeur de 10 000) (tableau 96).
| Milieu | Scénario | CESE ou VTR | CEE ou AJT | QR |
|---|---|---|---|---|
| Sédiments | Rejets industriels dans l'eau et rejets surveillés des UTEU dans l’eau | 0,0129 mg/kg ps | 0,0002 à 0,38 mg/kg ps | 0,01 à 29,9 |
| Sol | Épandage de biosolides sur le sol (scénario industriel et biosolides des UTEU surveillées | 0,075 mg/kg ps | 1,39 x 10-4 à 0,059 mg/kg ps | 0,002 à 0,78 |
| Faune (organismes vivant dans le sol) | Musaraigne (consommant des vers de terre, exposition de 10 ans) | 1179,8 (musaraigne) mg/kg pc/j | 0,0716 mg/kg pc/j | 6,1 x 10-5 |
| Faune (piscivore) | Piscivore (vison et loutre) | 376,9 (vison) 228,8 (loutre) mg/kg pc/j |
1,10 x 10-4 (vison) 1,16 x 10-4 (loutre) mg/kg pc/j |
2,93 x 10-7 (vison), 5,08 x 10-7 (loutre) |
9.3.2 Prise en compte des éléments de preuve et conclusion
Le DP devrait être persistant dans l'eau, le sol et les sédiments. Le DP devrait avoir un potentiel de bioaccumulation modéré à élevé, et cette substance est présente à grande échelle dans le biote à des concentrations élevées (jusqu'à plus de 100 µg/kg ps), suggérant qu’une bioaccumulation se produit. Bien que les quantités de DP importées au Canada soient faibles, les données de surveillance des effluents d’UTEU à travers le Canada, ainsi que des mesures environnementales dans certaines régions du Canada (p. ex. la région des Grands Lacs) suggèrent que du DP pénètre dans l'environnement au Canada. Une partie de cette exposition au DP dans l’environnement est due potentiellement à la proximité de sources de production de DP dans la région des Grands Lacs (p. ex. Niagara Falls, New York). Le DP est une substance produite en grande quantité aux États-Unis et, par conséquent, un transport de DP dans l’environnement peut se produire du nord des États-Unis vers le Canada, conduisant à une exposition et des risques plus élevés pour les organismes canadiens dans certaines régions du Canada (c.-à-d., le sud des Grands Lacs). À cet égard, les données de surveillance des effluents des UTEU indiquent que l’exposition au DP au Canada est supérieure à celle prédite en se basant sur son utilisation au Canada. Ces renseignements, ainsi que des renseignements sur ses utilisations, indiquent qu’il existe un potentiel de rejet dans l'environnement au Canada. Une fois rejeté dans l'environnement, le DP se retrouvera principalement dans les sédiments et le sol, où il est susceptible de persister longtemps. En se basant sur les mesures faites dans des régions éloignées et sur les résultats de modélisations, le DP, en raison de sa sorption sur des particules, peut potentiellement être transporté à grande distance et déposé dans des zones éloignées.
Il y a un manque d'études sur l'écotoxicité du DP. Des tests d’écotoxicité du DP basés sur des paramètres non apicaux ont mis en évidence des effets du DP (stress oxydatif, génotoxicité, etc.) sur les organismes vivant dans le sol et les organismes aquatiques. De plus, les analogues du DP utilisés pour la présente évaluation, le chlordane et le mirex, exhibent un potentiel de toxicité pour les organismes vivant dans les sédiments et les organismes terrestres. Cependant, étant donné que ces analogues sont plus biodisponibles que le DP, ils sont plus toxiques et représentent une hypothèse prudente pour le calcul de CESE. En utilisant ces CESE « prudentes », il est montré qu’il existe un risque d’effet nocif sur les organismes vivant dans les sédiments (et, dans un scénario, un risque proche pour les organismes vivant dans le sol). En raison de la possibilité d’exposition à des sources de DP dans la région des Grands Lacs et de l’incertitude liée aux augmentations potentielles de l’utilisation du DP au Canada (p. ex. en tant que produit ignifuge de remplacement au décaBDE dans une variété d’applications de substances ignifuges, fils et câbles électriques, automobile, matériaux en matière plastique pour toiture, connecteurs en matière plastique dure), il faut faire preuve de prudence.
De plus, bien qu’ils n’aient pas été visés par la présente évaluation, d’autres analogues de type déchlorane (p. ex. Déchlorane 602, Déchlorane 603, Déchlorane 604, CP) détectés dans l'environnement et le biote au Canada à des concentrations de l’ordre de celle du DP (ou dans certains cas à des concentrations plus élevées), il faudrait prendre en compte le potentiel d’effets cumulatifs dus à ces substance. Les composés liés au DP comprennent aussi des impuretés formées par des réactions secondaires lors de la synthèse du DP (p. ex., 1,4-DP, VCH-DP, 1,3-DPMA, 1,5-DPMA) (Sverko et al. 2010). Pour toutes ces substances, il y a des lacunes dans les renseignements sur la production, les applications, les propriétés physiques et chimiques et la toxicité, mais des études initiales indiquent qu'elles peuvent avoir des caractéristiques de P et de B semblables à celles du DP (Sverko et al. 2011).
Ces renseignements indiquent que le DP peut causer des effets nocifs sur l’environnement au Canada.
9.3.3 Incertitudes de l'évaluation des risques pour l'environnement
Un manque de données empiriques et le recours à la modélisation contribuent à plusieurs incertitudes de la présente évaluation environnementale du DP. L’estimation des propriétés physiques et chimiques a largement nécessité l’utilisation de modèles QSAR et, bien que des tentatives aient été faites pour conserver une cohérence interne à ces propriétés, la modélisation de cette substance peut être problématique en raison de sa nature très hydrophobe. Par conséquent, le niveau de confiance dans les propriétés régissant sa biodisponibilité et son absorption (p. ex. coefficients de partage), en particulier celles utilisées pour la modélisation de l’exposition et de la toxicité (c.-à-d. log Koe), est modéré.
Il y a une confiance élevée dans le fait que le DP est très stable dans l'environnement et y séjournera longtemps, et qu’il sera bioaccumulé dans des organismes en raison d'expositions dues au réseau trophique ou au contact direct avec le sol ou les sédiments plutôt qu’avec l'eau.
Des données empiriques limitées sur le FBA ont conduit à utiliser des modèles de bilan massique pour obtenir des renseignements à l'appui. Ces modèles sont très sensibles à une erreur dans le log Koe, la vitesse de métabolisme ou l'efficacité d'assimilation alimentaire. Le niveau de confiance dans les résultats de la modélisation du FBA est donc considérée faible à modéré.
Les estimations de la CEE dans le sol et les sédiments pour des scénarios industriels sont basées sur un modèle de bilan massique. Plusieurs paramètres de ce modèle sont connus pour être variables (facteurs d'émission, taux d'élimination dans les UTEU, adsorption sur les biosolides, limites de rejet d’effluent) et ont conduit à définir des gammes de concentrations environnementales estimées (CEE). Néanmoins, des données de surveillance du DP récentes (effluent et biosolides) dans 8 UTEU à travers le Canada sont en accord avec la gamme de CEE prédites dans les sédiments et le sol. Il est difficile de quantifier l’impact de l’incertitude sur ces paramètres sur les estimations de CCE dans le sol, puisqu’il n’y a pas encore de données de surveillance canadiennes fiables avec sur les sources d’émission du champ proche permettant une comparaison avec le DP dans le sol. Par conséquent, des estimations prudentes de CEE sont utilisées pour une analyse plus poussée de l'exposition de la faune, mais, dans l'ensemble, le niveau de confiance dans les scénarios d'émission utilisés pour calculer les CEE est modéré.
Des scénarios d'exposition à utiliser pour des analyses de risque ont été élaborés en se basant sur les meilleurs renseignements disponibles. Ils sont considérés suffisamment prudents pour caractériser les risques potentiels posés par les rejets de DP dans l'environnement canadien dus à son utilisation. Même avec des hypothèses prudentes sur les quantités de DP utilisées sur des sites industriels, les quotients de risque étaient inférieurs à 1 pour la plupart des scénarios relatifs au sol, suggérant un faible risque actuel pour ces organismes. Toutefois, le quotient de risque approchait de 1 dans un scénario relatif au sol (quotient de risque = 0,78). L'incertitude de ce scénario est liée aux facteurs décrits dans les estimations de CEE dans le sol susmentionnées.
Il existe des renseignements limités caractérisant les rejets potentiels dus à l’utilisation de produits et à leur élimination/recyclage à la fin de leur vie utile. De plus, des incertitudes existent quant à la quantité de produits utilisés. Bien qu'un scénario d'exposition générale suggérant de faibles quantités de rejets dispersés de DP dus aux produits commerciaux et aux produits disponibles pour les consommateurs ait été élaboré, ce domaine de l'évaluation représente une zone d'incertitude de l'exposition d'organismes au DP au Canada. De plus, de récentes données de surveillance d’UTEU suggèrent que le DP présent dans des produits commerciaux et des produits disponibles pour les consommateurs peut être une source importante.
De plus, le DP est une substance produite en grande quantité aux États-Unis. Par conséquent, son transport dans l’environnement peut se produire du nord des États-Unis vers le Canada, conduisant à une exposition pour les organismes canadiens plus importante que celle de certaines estimations faites en se basant sur l’utilisation actuelle du DP au Canada. En raison de l'incertitude relative aux niveaux d'exposition du DP au Canada, une surveillance est recommandée.
Une importante zone d'incertitude est liée aux lacunes dans les données sur la toxicité du DP pour les organismes benthiques et les organismes terrestres. Les options d’analogues sont limitées pour le DP, étant donné qu’il existe aussi un manque de données sur l’écotoxicité dans le sol et les sédiments des analogues chimiques les plus similaires au DP. L’utilisation du chlordane et du mirex en tant qu’analogues est probablement prudente (ces analogues sont probablement plus toxiques), car ils sont considérés plus biodisponibles que le DP. Malgré des modes d’action prédits semblables, l’obtention de données par lecture croisée à partir de ces analogues n’est pas directe. Il est probable qu’il existe des différences entre le degré de toxicité du DP et celui de ces analogues. Les études sur la toxicité de ces analogues datent de plusieurs dizaines d’années et leurs détails sont limités, contribuant à une incertitude de leurs résultats. Néanmoins, des études sur la toxicité du DP non apicales suggèrent des effets chroniques dans la gamme de concentrations déterminées pour ces analogues, permettant de conlure à la toxicité du DP. Le niveau de confiance dans les données sur la toxicité dans le sol et les sédiments est modéré.
Des données limitées sur la toxicité à court terme du DP par voie orale à dose répétée chez des mammifères étaient disponibles pour l'évaluation de la toxicité pour la faune. Le niveau de confiance dans le fait d’utiliser des données de toxicité pour les mammifères pour la faune est modéré.
Enfin, bien que l’évaluation de substances de type déchlorane (p. ex. Déchlorane 602, Déchlorane 603, Déchlorane 604, etc. décrits à la section 2.2 sur l’identité de la substance) soit hors de la portée de la présente évaluation préalable, les données sur les concentrations dans les milieux de l’environnement et le biote, ainsi que celles sur le devenir, le comportement et la toxicité (y compris le potentiel d’exposition cumulative et les effets avec le DP) sont importantes pour comprendre la similarité de ces substances au DP.
10. Potentiel d'effets nocifs sur la santé humaine
10.1 Évaluation de l'exposition
La présente évaluation de l’exposition est basée sur l’exposition totale aux isomères du DP (c.-à-d. les expositions à l’anti-DP et au syn-DP). Par conséquent, il n’y a que la somme des isomères de DP qui est rapportée et utilisée pour calculer les estimations d’absorption de DP.
10.1.1 Milieux naturels et aliments
En raison de sa très faible solubilité dans l’eau et de sa tension de vapeur faible à très faible, le DP devrait se répartir principalement dans les particules, la poussière, le sol et les sédiments après avoir été rejeté dans l'environnement. Le DP est identifié comme substance à forte capacité de sorption, se sorbant sur les particules dans l’air (voir la section 8).
Les Canadiens peuvent être exposés au DP présent dans l'air, la poussière, le sol, les sédiments, l'eau et les aliments, incluant le lait maternel. Des estimations prudentes de l’absorption journalière de DP sont présentées à l’Annexe C. Pour tous les groupes d'âge, la principale contribution à l’absorption journalière estimée est celle des aliments, suivie de l'ingestion de poussière et l'inhalation de particules de l'air. L'exposition du DP par ingestion d'eau et de sol s'est avérée très faible et a été jugée négligeable. L'estimation la plus élevée d'absorption journalière était de 8,3 ng/kg pc/j pour de jeunes enfants (de 0,5 à 4 ans).
10.1.1.1 Air ambiant
Le DP a fait l'objet d'une surveillance dans l'air ambiant au Canada et ailleurs (voir la section 7). Hoh et al. (2006) ont été les premiers à rapporter la présence de DP dans l'environnement en 2004, sur des sites du Réseau de mesure des dépôts atmosphériques (RMDA) le long des Grands Lacs, où le DP était souvent détecté (> 90 %) dans l'air extérieur. Des concentrations de DP sur un site canadien (site de Point Petre, un site rural) ont été mesurées jusqu’à 21 pg/m3 (n = 12). Toutefois, les concentrations de DP étaient les plus élevées (maximum de 490 pg/m3) sur le site de Sturgeon Point (population de 10 000) (New York), avec une valeur médiane de 2,5 pg/m3. Les auteurs ont constaté que les concentrations élevées mesurées à Sturgeon Point, un site relativement rural, étaient possiblement associées aux émissions de l'installation de production de DP située à proximité de Niagara Falls (NY) (Hoh et al. 2006). D’autres études du RMDA ont été publiées depuis 2006, et des niveaux plus élevés de DP ont aussi été constatés sur le site de Sturgeon Point (Venier et Hites 2008, Salamova et Hites 2011, Venier et al. 2015). Salamova et Hites (2011) n’ont pas observé de changement important dans les concentrations atmosphériques de DP de 2005 à 2009. Ces auteurs ont toutefois observé une augmentation significative de la concentration de DP avec la distance de l’usine de Niagara Falls (NY) (Salamova et Hites 2011).
Dans une autre étude de surveillance de l’air dans la région des Grands Lacs, réalisée par Environnement Canada (période allant de 2008 à 2010), des concentrations de DP allant jusqu’à 340 pg/m3 ont été mesurées dans les échantillons (n = 30) prélevés sur le site de l’île Burnt, en Ontario (Hung et al. 2016).
Deux études récentes de surveillance de l’air ambiant menée à Toronto (Canada) ont montré que le DP était souvent détecté (> 90 %), et des concentrations ont été mesurées jusqu’à 7,5 pg/m3 (n = 70) dans des échantillons prélevés entre 2010 et 2012 (Diamond et al. 2013, Shoeib et al. 2014).
En plus de la surveillance canadienne dans la région des Grands Lacs, le DP a aussi été surveillé à Alert, au Nunavut, un site éloigné dans l'Extrême-Arctique canadien (Xiao et al. 2012), où les concentrations allaient jusqu'à 2,1 pg/m3 dans les échantillons (n = 14) prélevés en 2006-2007, indiquant que le DP peut avoir fait l'objet d’un transport atmosphérique à grande distance (voir la section 8.1.1).
La concentration maximale de 340 pg/m3 mesurée au Canada dans la région des Grands Lacs par Environnement et Changement climatique Canada (Hung et al. 2016) a été retenue pour calculer l’absorption journalière de DP due à l’air ambiant de la population canadienne . Cette valeur est beaucoup plus élevée que celle relevée sur d’autres sites au Canada (p. ex. Hoh et al. 2006, Shoeib et al. 2014), mais semblable aux concentrations les plus élevées mesurées sur le site de Sturgeon Point par le RMDA (Hoh et al. 2006) près d’une source ponctuelle. Ces estimations devraient représenter les expositions de la population générale, y compris des populations du Nord, étant donné les faibles niveaux mesurés dans le Nord canadien (Xiao et al. 2012).
10.1.1.2 Air intérieur
Lors d’une étude récente réalisée par Venier et al. (2016), le DP a été mesuré dans l’air intérieur à Toronto (Ontario), à des niveaux allant jusqu’à 316 pg/m3, avec une médiane de 38 pg/m3 (n = 34) pour le DP total (c.-à-d. syn-DP plus anti‑DP). Cequier et al. (2014) ont étudié la présence du DP et de 36 autres produits ignifuges dans des habitations en Norvège (n = 48) et les salles de classe de deux écoles primaires (n = 6). Les isomères du DP ont été détectés dans 4 % des échantillons prélevés dans les résidences, mais n’ont pas été détectés dans les salles de classe des écoles. Les concentrations dans les salons des résidences allaient d’une non-détection (limite de détection non spécifiée) à 15 pg/m3 (somme des valeurs maximales pour les isomères). Lors d’une autre étude en Europe, le DP a été mesuré dans un nombre limité d’échantillons d’air intérieur (n = 3) (environnement intérieur précis non indiqué) prélevés en 2009 en Norvège, mais n’a pas été détecté (limite de détection de 16 pg/m3) (TemaNord 2011). La concentration maximale de DP total de 340 pg/m3 rapportée par Venier et al. (2016) a été retenue pour le calcul des absorptions journalières de DP de la population générale dues à l’air intérieur.
10.1.1.3 Poussière
La présence ubiquiste du DP dans la poussière domestique est misse en évidence par la fréquence de détection élevée observée lors de plusieurs études canadiennes et internationales sur la poussière domestique (Annexe D).
Lors de l’étude de référence canadienne des produits ignifuges halogénés, le DP a été mesuré dans les échantillons de poussière domestique (n = 413) collectés en 2007-2010 dans 13 villes canadiennes à travers le Canada, dans le cadre de l’Enquête sur la poussière domestique au Canada (EPDC), en suivant la méthode décrite par Fan et al. (2016). Le DP a été détecté dans 100 % des échantillons (n = 498), et les concentrations allaient de 3,40 à 2508 ng/g (limite de détection de 1,53 ng/g) avec une concentration médiane et une concentration au 95ème percentile de 14,4 et 152,1 ng/g respectivement (Kubwabo et al., manuscrit en cours de rédaction, Bureau de la science de la santé environnementale et de la recherche de Santé Canada, non référencé, 5 juin 2017). ).
Le DP a aussi été mesuré (> 90 %; n = 20) dans des échantillons prélevés en 2012 dans la région du Grand Toronto (RGT) en Ontario. Les concentrations allaient d’une non-détection (limite de détection = 4 ng/g) à 170 ng/g, avec une moyenne de 34,5 ng/g (Diamond et al. 2013). Le DP a été détecté dans 99 % des échantillons de poussière domestique prélevés en 2007-2008 dans des maisons (n = 116) à Vancouver, Canada (Shoeib et al. 2012). Les échantillons ont été prélevés dans les maisons des participantes à l'étude CHiRP (Chemicals, Health and Pregnancy). Les concentrations de DP mesurées lors de cette étude allaient d’une non-détection (limite de détection = 0,7 ng/g) à 354 ng/g, avec une médiane de 7,3 ng/g et une valeur au 95ème percentile de 57,7 ng/g (Shoeib et al. 2012). Lors d’une autre étude, le DP a aussi été détecté dans tous les échantillons de poussière prélevés dans des habitations à Ottawa (Ontario) en 2002-2003 (n = 69), à des concentrations allant de 2,3 à 182 ng/g, à l'exclusion d'un échantillon dont la concentration de 5683 ng/g n’a pas pu être expliquée à partir des réponses au questionnaire (Zhu et al. 2007). La concentration médiane et la concentration au 95ème percentile pour cet ensemble d'échantillons étaient de 14 et de 121 ng/g, respectivement. Étant donné qu'il n'y avait pas d'installation de production de DP à proximité d'Ottawa, les auteurs ont noté que la présence de DP dans la poussière domestique était probablement due à des produits disponibles pour les consommateurs contenant du DP.
Lors d’études canadiennes récemment publiées, le DP a été mesuré dans 35 maisons et 10 bureaux à Toronto en 2012 (Abbasi et al. 2016) et dans 23 maisons à Toronto en 2013 (Venier et al. 2016). Les concentrations de DP dans la poussière allaient de la non-détection à 732 ng/g, avec des résultats similaires trouvés pour les maisons et les bureaux. Abbasi et al. (2016) ont aussi analysé l’association du DP dans la poussière, provenant de l’étude de 2012, et de la poussière sur les produits (n = 65) présents aux mêmes endroits. Le DP n’a été détecté dans aucun des tampons de prélèvement de cette étude, ce que les auteurs ont expliqué par un biais pour les produits contenant du brome plutôt que du chore (la fluorescence V du brome a été utilisée pour cribler les produits avant l’échantillonnage).
Une présence ubiquiste du DP a aussi été mise en évidence dans la poussière domestique aux États-Unis, et les concentrations sont généralement similaires à celles mesurées au Canada. Le DP a été détecté dans tous les échantillons prélevés sur les surfaces des pièces habitées de 16 maisons en Californie en 2006 et en 2011, avec des concentrations allant de 3 à 47 ng/g (médiane allant jusqu'à 10 ng/g) (Dodson et al. 2012). Le DP a aussi été détecté dans tous les échantillons de poussière (n = 38) prélevés en 2002-2003 dans des maisons à Boston, au Massachusetts (échantillons prélevés dans les aspirateurs des participants de l’étude), avec des concentrations de DP allant jusqu'à 111,5 ng/g, avec une médiane de 13,1 ng/g (Johnson et al. 2013).
Le DP a aussi fait l’objet d’analyses dans la poussière de cabines d'avion. Allen et al. (2013) ont échantillonné la poussière provenant de 19 aéronefs commerciaux fabriqués entre 1986 et 2003 par Boeing, Airbus, Canadair Regional, McDonell Douglas ou Embraer. Des échantillons de poussière ont été prélevés dans 19 aéronefs, un aéronef ayant été échantillonné à deux reprises, pour un total de 40 échantillons, l'année d'échantillonnage et le site de l'aéroport n'ayant pas été spécifiés. Le DP a été détecté dans 100 % des échantillons. Pour la poussière prélevée dans les tapis d'avion, les concentrations de DP allaient de 132 à 13 700 ng/g, avec une médiane de 440 ng/g, tandis que pour la poussière prélevée dans les évents d'aération, les concentrations de DP allaient de 65 à 11 800 ng/g, avec une médiane de 460 ng/g (Allen et al. 2013).
La concentration de DP au 95ème percentile (152,1 ng/g) tirée de l'Étude canadienne sur la poussière domestique (communication personnelle du Bureau de la science de la santé environnementale et de la recherche de Santé Canada, 5 juin 2017) a été retenue pour estimer l'absorption de DP par la population générale du Canada due à l’ingestion de poussière. Bien que les concentrations dans certains environnements (p. ex. les aéronefs) puissent être plus élevées, l'ampleur générale de ces expositions (fréquence et durée) devrait être inférieure à celle des estimations prudentes d'absorption journalière de la population générale du Canada basées sur la poussière domestique.
10.1.1.4 Sol et sédiments
Aucune donnée de surveillance du DP dans les sols au Canada n’a été trouvée (voir la section 7). Cependant, lors de plusieurs études, une surveillance du DP dans les sédiments dans la région des Grands Lacs a été réalisée (Sverko et al. 2008, Sverko et al. 2010, Shen et al. 2010, Shen et al. 2011). Par exemple, le DP a été détecté dans tous les échantillons de sédiments de surface prélevés dans les Grands Lacs de 2001 à 2007, à des concentrations de DP total allant de de 0,014 à 110 ng/g ps, les concentrations les plus élevées ayant été mesurées dans les échantillons du lac Ontario (Shen et al. 2010).
En suivant des approches prudentes, une concentration environnementale estimée (CEE) maximale de DP dans le sol de 59 000 ng/g ps(0,059 mg/kg ps) a été estimée pour l'épandage de biosolides sur une terre agricole (voir la section 9.2.1). Étant donné qu'aucune étude de surveillance du DP dans le sol au Canada appropriée ou pertinente n'a été trouvée, la CEE maximale pour le sol (59 000 ng/g ps) a été retenue pour calculer les absorptions limites supérieures de la population canadienne due à l'ingestion de sol.
10.1.1.5 Eau potable
Aucune étude sur la concentration de DP dans l'eau potable n'a été trouvée au Canada ni ailleurs. Toutefois, le DP a fait l'objet d'une surveillance dans des eaux de surface au Canada et ailleurs (voir la section 7). Les études de surveillance des Grands Lacs ont montré que les concentrations de DP sont les plus élevées dans le lac Ontario, jusqu'à 13,9 pg/L, lors d’une surveillance pendant la période 2005-2012 (Muir et al. 2011, 2014, Venier et al. 2014). Étant donné qu'aucune donnée sur l'eau potable n'était disponible, l'exposition due à l'eau potable a été caractérisée à l'aide des données de surveillance d’eaux de surface. L'absorption journalière de DP pour la population générale du Canada a été basée sur la concentration la plus élevée de DP mesurée dans les Grands Lacs (moyenne de 13,9 pg/L pour le lac Ontario) (Venier et al. 2014). L'utilisation de données sur les eaux de surface est considérée prudente pour l’estimation de l’absorption due à l'eau potable, aucune élimination lors du traitement de l'eau potable n'étant prise en compte.
10.1.1.6 Aliments
Aucune étude sur la concentration de DP dans des aliments commercialisés n'a été trouvée au Canada. Toutefois, le DP a été récemment mesuré dans trois catégories d'aliments pour bébés (préparation, céréales et purée) achetés aux États-Unis et en Chine en 2013 (Liu et al. 2014). Les concentrations de DP dans les préparations (n = 12), les céréales (n = 15) et les purées (n = 8) provenant des États-Unis allaient respectivement jusqu'à 83,2, 427 et 23,6 pg/g ph. Les concentrations de DP dans les préparations (médiane de 16 pg/g poids frais) étaient supérieures d’un ordre de grandeur à celles récemment rapportées pour le lait maternel (médiane de 1,6 pg/g poids frais) de femmes allaitant au Canada (Zhou et al. 2014; concentrations en poids humide obtenues grâce à une communication personnelle avec le Bureau de la science de la santé environnementale et de la recherche de Santé Canada, 15 mai 2014, voir la section 10.1.1.7). Il est à noter que la concentration maximale dans un échantillon de céréales (427 pg/g ph) prélevé aux États-Unis était la deuxième plus importante pour le DP total de l'étude de Liu et al. (2014). De même, lors d’une autre étude sur le panier de consommation menée au Japon, du DP a été détecté dans quatre groupes d’aliments (sucre et produits de confiserie, légumes et leurs produits, poisson, mollusques et crustacés et leurs produits, viande et œufs), à des concentrations allant de 1,5 à 3,3 pg/g ph (Kakimoto et al. 2014). Les auteurs ont noté que la contamination pouvait provenir de matières premières comme le blé et le sucre ou du processus de fabrication des produits de confiserie (Kakimoto et al. 2014). Les concentrations dans le poisson mesurées lors de cette étude japonaise étaient inférieures à celles rapportées par Ismail et al. (2009) pour le touladi du lac Ontario. Lors d’une étude antérieure, du DP a été mesuré dans du flétan provenant du Groenland (440 pg/g) commercialisé au Japon (Kakimoto et al. 2012). Enfin, une étude précédente a suggéré que les légumes, les grains et le poisson provenant d'une zone polluée par du DP de la Chine étaient très contaminés par le DP, avec des concentrations de DP total allant de 56,8 pour la loche à 2700 pg/g pour les oignons verts (Hoh et al. 2006).
La présence de DP dans le biote a été rapportée au Canada, et la détection de DP dans des poissons dans la région des Grands Lacs a été rapportée dans plusieurs études (Hoh et al. 2006, Shen et al. 2010, Ismail et al. 2009, Muir et al. 2011, Muir et al. 2014, Guo et al. 2017). Les concentrations les plus élevées étaient associées à des échantillons archivés de touladi prélevés dans le lac Ontario de 1979 à 2004. Les concentrations moyennes de DP ont atteint leur maximum en 1988, à 7,2 ng/g pl (0,85 ng/g ph), puis ont diminué au cours des années suivantes jusqu’à 2,3 ng/g pl (0,31 ng/g ph) en 2004 (Ismail et al. 2009). À l’inverse, les concentrations de DP mesurées lors d’une autre étude allaient de 0,14 à 0,91 ng/g pl dans les échantillons archivés de doré prélevés de 1980 à 2000 dans le lac Érié, aux États-Unis, et aucune augmentation ni diminution avec le temps n’a été observée (Hoh et al. 2006). Récemment, Guo et al. (2017) ont rapporté des moyennes géométriques de DP allant de 0,15 ng/g pl (lac Superior et lac Michigan) à 1,03 ng/g pl (lac Huron) dans des échantillons de touladi collectés en 2010 (voir la section 7). La surveillance du DP dans des échantillons de poisson collectés dans le lac Winnipeg entre 2000 et 2003 par Tomy et al. (2007) a mis en écidence des concentrations moyennes de DP de 0,054 ng/g pl pour le grand corégone, de 0,430 ng/g pl pour les moules, de 0,450 ng/g pl pour la lotte et de 0,816 ng/g pl pour la laquaiche aux yeux d'or (n = 5 pour chaque espèce). Houde et al. (2014) ont rapporté que le DP n'a pas été détecté dans des homogénats du corps entier d’échantillons de perchaude prélevés dans le fleuve Saint‑Laurent (Québec).
Pour ce qui est de la surveillance du DP dans les régions du Nord, le DP n'a pas été détecté (limite de détection non indiquée) dans la majorité des échantillons de muscle et de foie de poisson analysés dans les pays nordiques (TemaNord 2011). Du DP a été mesuré dans des échantillons de petit lard de béluga dans l’Arctique canadien (moyenne = 1,28 ± 0,15 ng/g pl) (Simond et al. 2017), tel qu’indiqué à la section 7. Du DP a été mesuré dans le foie de poissons de Norvège (Schlabach et al. 2011), dans des moules bleues d'Islande (Schlabach et al. 2011), dans des perchaudes de Finlande (TemaNord 2011) et dans des flétans du Groenland (Kakimoto et al. 2012). Toutefois, les concentrations étaient généralement inférieures à la valeur limite supérieure (7,2 ng/g pl) mesurée dans le touladi du lac Ontario (Ismail et al. 2009). Le DP n'a pas été détecté chez le caribou lors d’une étude sur le réseau trophique dans l'Arctique canadien (communication personnelle, Division de la recherche sur les contaminants aquatiques d’Environnement Canada, octobre-novembre 2014, non référencé).
Les estimations de l'absorption journalière de DP par la population générale due à la consommation de préparations pour nourrissons, de produits céréaliers, de plats préparés et de soupes ont été basées sur les concentrations maximales dans les préparations pour nourrissons, les céréales et les purées mélangées mesurées dans des échantillons achetés en 2013 dans des magasins aux États‑Unis (Liu et al. 2014). Les estimations de l'absorption journalière de DP due à la consommation de poisson ont été basées sur la concentration maximale de 7,2 ng/g pl (0,85 ng/g ph) mesurée dans le touladi du lac Ontario (Ismail et al. 2009). Cette concentration est jugée appropriée pour calculer l’absorption limite supérieure de la population générale du Canada, en faisant l’hypothèse que le DP est présent à cette concentration dans 100 % des poissons, des mollusques, des crustacés et des aliments connexes. Bien que certaines populations du nord au Canada puissent consommer de plus grandes quantités de fruits de mer ou de gibier selon la saison, cette estimation est jugée suffisamment prudente pour tenir compte de cette variabilité.
10.1.1.7 Lait maternel
Au Canada, une biosurveillance du DP dans le lait maternel a été rapportée (Siddique et al. 2012, Zhou et al. 2014), de même qu’en Chine (Ben et al. 2013, Annexe E). Le DP a été détecté dans plus de 85 % des échantillons de lait maternel (n = 87) collectés dans deux villes canadiennes : Kingston en Ontario (n = 39; prélevés en 2003-2004) et Sherbrooke au Québec (n = 48; prélevés en 2008-2009). Les concentrations de DP dans les échantillons collectés à Kingston allaient d’une non-détection (limite de détection = 0,05 ng/g) à 6,4 ng/g pl, et celles dans les échantillons collectés à Sherbrooke d’une non-détection à 8,0 ng/g pl dans. La concentration médiane dans les échantillons de la cohorte de Kingston était de 0,74 ng/g pl et celle au 95ème percentile était de 3,4 ng/g pl. Les concentrations médiane et au 95ème percentile dans les échantillons de la cohorte de Sherbrooke étaient respectivement de 0,58 et 2,1 ng/g pl (Siddique et al. 2012).
Du DP a été détecté dans 55 % des échantillons de lait maternel collectés en 2008-2009 chez une autre cohorte plus importante (n = 105) de femmes allaitantes de Sherbrooke, Québec (Zhou et al. 2014). Lors de cette étude, les concentrations de DP rapportées allaient d’une non-détection (limite de détection = 0,010 ng/g) à 15 ng/g pl, avec une concentration médiane de 0,074 ng/g pl (équivalant à 1,6 pg/g ph) et au 95ème percentile de 3,5 ng/g pl. Le moment de la collecte non enregistré constituait une limite de cette étude, la collecte de chaque échantillon ayant pu être faite depuis l'accouchement jusqu'à six mois après (Zhou et al. 2014). En Chine, le DP a également été mesuré dans le lait maternel de mères résidant à proximité et à distance d'activités de recyclage de déchets électroniques (Ben et al. 2013). Les concentrations de DP dans le lait des mères résidant à proximité de ces zones (médiane de 4,46 ng/g pl; n = 44) étaient supérieures à celle de celui des mères résidant à distance de ces zones (médiane de 2,19 ng/g pl; n = 44) (Ben et al. 2013). Les concentrations dans l’une ou l’autre de ces zones étaient supérieures à celles rapportées dans les études canadiennes.
Les estimations de l'absorption journalière par des enfants allaités ont été faites en se basant sur la concentration au 95ème percentile de 0,054 ng/g ph (convertie à 0,06 µg/L de lait entier basé sur une masse volumique du lait maternel de 1,03 g/mL) rapportée pour les participantes de Sherbrooke, Québec (Zhou et al. 2014; concentrations en ph obtenues lors d'une communication personnelle avec le Bureau de la science de la santé environnementale et de la recherche de Santé Canada, 15 mai 2014).
10.1.2 Produits disponibles pour les consommateurs
Le DP est un additif ignifuge utilisé pour traiter plusieurs polymères servant à diverses applications comme le revêtement de fils électriques, des connecteurs en matière plastique dure pour télévision et ordinateur, des décorations en matière plastique et des matériaux de toiture (Weil et Levchik 2004, Oxychem 2004, voir la section 5), et il est raisonnable de penser que ces utilisations ont lieu au Canada. Au Canada, la construction automobile fait partie des utilisations confirmées du DP, dans des assemblages de capteur (EC 2013-2014). Les concentrations de DP dans les matières plastiques vont de 8 % dans le poly(téréphtalate de butane-1,4-diyle) (PBT) à 40 % dans le caoutchouc silicone (OxyChem 2007).
La présence de DP n'a pas été détectée dans des produits destinés aux enfants, comme des jouets, qui mèneraient à une exposition fréquente chez ceux‑ci. De plus, dans le cadre de tests préliminaires réalisés par Santé Canada, le DP n’a pas été détecté (limite de dosage de 0,3 %) dans 39 sous-échantillons prélevés dans 23 articles manufacturés pour enfants (p. ex. chaises en mousse, coussins d'allaitement, jouets, etc.) achetés dans des magasins de détail à Ottawa, en Ontario, en janvier et en mai 2014 (Santé Canada 2014). Bien qu’il ait été observé à l’occasion que des enfants mettent dans leur bouche différents objets non destinés à cet usage, y compris des produits électriques et électroniques, la fréquence et la durée de ce comportement ne devraient pas être plus importantes que celles de la mise en bouche de jouets ou autres articles manufacturés destinés aux enfants (Juberg et al. 2001).
En tant qu'additif ignifuge, le DP peut être libéré par des polymères traités lors de leur abrasion. Toutefois, les rejets dus à la lixiviation ou à la migration devraient être limités en raison des propriétés physiques et chimiques de cette substance. En raison de la faible pression de vapeur du DP, l'exposition par inhalation devrait être faible. La solubilité dans l’eau négligeable du DP limite également le potentiel de transfert ou de migration par l'eau, la transpiration ou la salive. D'après les renseignements actuels sur le profil d'utilisation et les propriétés physiques et chimiques du DP, le potentiel d'exposition de la population générale du Canada à cette substance due à des articles manufacturés, y compris des véhicules, est faible et, aucune estimation d’une telle exposition n'a donc été faite. De plus, toute exposition due à des articles manufacturés devrait être prise en compte indirectement dans les estimations de l’exposition due à l’air intérieur et la poussière (voir les sections 10.1.1.2 et 10.1.1.3).
10.1.3 Biosurveillance
En plus du lait humain (section 10.1.1.7, Annexe E), le DP a été mesuré dans plusieurs matrices biologiques, dont le sérum sanguin, le tissu placentaire et le sérum du cordon ombilical (Aannexe F).
Au Canada, des isomères du DP ont été détectés dans la majorité (87 %; LD de 0,12 ng/g pl) des échantillons de sérum sanguin maternel (n = 102) collectés en 2008-2009 chez des mères après l’accouchement, à Sherbrooke, Québec (Zhou et al. 2014). Les concentrations de DP dans le sérum allaient d’une non‑détection (limite de détection = 0,08 ng/g pl) à 81 ng/g pl, avec une concentration médiane de 2,4 ng/g pl et au 95ème percentile de 31,6 ng/g pl. Le rapport entre les deux isomères du DP mesurés dans les échantillons de sérum humain, calculés en tant que anti-DP/(anti-DP + syn-DP) était 0,8, similaire à celui rapporté pour le mélange technique de DP.
En Europe, le DP a également été fréquemment détecté (94 %, limite de dosage de 0,16 ng/g pl) dans 48 échantillons d’une banque de sérum collectés en France (Brasseur et al. 2014), ainsi que dans des échantillons de sérum collectés chez 46 femmes en Norvège participant à l’étude de cohorte mère‑enfant (aucun échantillon n’a été prélevé chez les enfants) (Cequier et al. 2015). Les échantillons de sérum prélevés en France en 2003-2005 provenaient d’un nombre égal de femmes et d’hommes demeurant à proximité d’incinérateurs de déchets solides municipaux. Les concentrations de DP allaient d’une non‑détection à 7,04 ng/g pl, avec une concentration médiane de 1,2 ng/g pl. Dans les échantillons prélevés chez des femmes en Norvège, la concentration de DP allait d’une non-détection à 31 ng/g pl, avec une concentration médiane de 1,3 ng/g pl. Lors d’une autre étude sur 24 paires mère/tout-petit (11-15 mois) en Suède, le DP n’a pas été fréquemment détecté (limite de dosage de la méthode de 140 pg/échantillon pour l’anti-DP). Le DP a été détecté dans le sérum d’un tout-petit (148 ng/g pl pour le DP total) et chez une mère (88 ng/g pl pour le DP total). Ces échantillons ne provenaient pas d’une même famille (Sahlstrom et al. 2014). Aucune source de production n’a été identifiée en Europe (section 4).
Lors de plusieurs études réalisées en Chine, la présence de DP a été surveillée dans des matrices biologiques afin de déterminer l’ampleur de l’exposition dues à des installations de recyclage de déchets électroniques (p. ex., Ren et al. 2009, Yan et al. 2012, He et al. 2013, Yang et al. 2013, Ben et al. 2014). Les concentrations médianes de DP dans les échantillons de sérum prélevés chez les groupes faiblement exposés (participants résidant à distance des activités de recyclage de déchets électroniques) allaient jusqu’à 13,7 ng/g pl (Ren 2009, Yang et al. 2013), et étaient statistiquement inférieures à celles des groupes associés à des expositions plus importantes aux déchets électroniques. Les concentrations médianes de DP dans le sérum étaient respectivement de 121 et 265 ng/g pl dans les échantillons prélevés en 2011 chez des hommes (n = 33) et des femmes (n = 37) exposés sur des sites de recyclage de déchets électroniques (Yan et al. 2012).
Ben et al. (2014) ont étudié le transfert du DP par le placenta chez 72 femmes résidant dans la zone de recyclage de déchets électroniques de Wenling, en Chine. Des échantillons de sérum maternel, de placenta et de sérum de cordon ont été prélevés en 2010-2011, et les concentrations de DP dans les trois matrices étaient fortement corrélées. Les concentrations médianes de DP dans le sérum maternel, le tissu placentaire et le sérum de cordon du groupe fortement exposé (n = 48, ayant habité à Wenling pendant plus de 20 ans) étaient respectivement de 8,43, 3,21 et de 2,82 ng/g pl, et étaient statistiquement supérieures à celles du groupe faiblement exposé (n = 24, ayant habité à Wenling pendant moins de trois ans), qui étaient respectivement de 3,55, 1,09 et 1,82 ng/g pl. Les auteurs ont souligné que la présence de DP dans le sérum du cordon est une indication de la translocation potentielle du DP de la mère vers les tissus fœtaux. Des produits de déchloration du DP, ou des métabolites potentiels, ont également été détectés chez l’humain lors de quelques études chinoises (p. ex. Ren et al. 2009, Ben et al. 2014). Toutefois, les sources de ces produits déchlorés (produits in vivo ou lors d'une exposition externe) n'ont pas été déterminées.
La concentration de DP mesurée dans le sérum peut fournir une mesure de l’exposition globale à partir de diverses voies (orale, dermique, inhalation) et due à toutes les sources d’exposition, y compris les milieux de l’environnement, les aliments et les produits. Une comparaison directe des données sur les concentrations dans le sérum humain et de rat a fait l’objet d’une discussion en tant que moyen pour évaluer les expositions internes chez les humains (Aylward et Hays 2011), et il existe une étude sur la toxicocinétique du DP chez le rat qui peut être prise en compte pour une telle comparaison (décrite plus en détail à la section 10.2.7) (Li et al. 2013). Les niveaux de DP dans le sérum humain, 2,4 ng/g pl au 50ème percentile (Zhou et al. 2014), étaient inférieurs à ceux du groupe témoin de rats (supposé avoir été exposés par voie alimentaire ou la poussière, 61 ng/g pl) et à ceux du groupe exposé à la plus forte dose de 100 mg/kg pc/j pendant 90 jours (690 ng/g pl) (Li et al. 2013). Toutefois, étant donné le profil de distribution inhabituel du DP observé chez le rat lors de l’étude de Li et al. et des renseignements limités sur la toxicocinétique chez le rat et l’humain, la comparaison entre les humains et les rats reste limitée.
10.2 Évaluation des effets sur la santé
Aucune classification des effets du DP sur la santé par des organismes de réglementation nationaux ou internationaux n’a été trouvée. L’EPA des États‑Unis a développé des documents sur la caractérisation des dangers du DP (EPA 2011, 2014).
10.2.1 Carcinogénicité
Aucune étude sur la toxicité chronique ou la cancérogénicité n'a été trouvée. Plusieurs autres éléments de preuve ont été étudié afin d'évaluer le potentiel cancérogène du DP (davantage de détails sont disponibles dans le document de Santé Canada de 2015). La Boîte à outils QSAR de l'OCDE (OCDE 2009b, 2011, 2012) et le modèle OASIS TIMES (TIMES 2012) ont été utilisés pour identifier des analogues potentiels. Dans l'ensemble, aucun analogue approprié n'a pu être identifié. L'approche de QSAR était basée sur plusieurs modèles QSAR statistiques pour évaluer le potentiel carcinogène du DP. Ces modèles ont produit des résultats variés, avec un faible niveau de confiance dans la prédiction globale. Une troisième approche a consisté à définir toute alerte structurelle associée à la carconigénicité à l'aide de modèles numériques. Un des modèles de criblage des alertes structurelles parmi deux ensembles de modèles a déclenché une alerte pour la carcinogénicité non génotoxique basé sur la présence de fragments de cycloalcanes polyhalogénés. Dans l'ensemble, les résultats demeurent non concluants.
10.2.2 Génotoxicité
En termes de génotoxicité in vitro, les résultats d’épreuves Ames sur des souches de Salmonella typhimurium (TA98, TA100, TA1535, TA 1537 et TA 1538) étaient négatifs avec ou sans activation métabolique (S9) (Mortelmans et Tanaka 1980). Les résultats d'une épreuve in vitro sur des lymphomes de souris étaient également négatifs avec ou sans S9 (Jotz et Mitchel 1980).
Une étude sur la génotoxicité in vivo a été trouvée. Des souris ont reçu par gavage oral 0, 500, 2000 ou 5000 mg/kg pc/j de DP pendant 10 jours (Wu et al. 2012). Des échantillons de foie ont été prélevés pour une épreuve Comet et les résultats de génoxicité étaient négatifs.
10.2.3 Toxicité aiguë
Les études sur la toxicité aiguë menées chez des animaux de laboratoire ont suggéré une faible préoccupation quant à la toxicité aiguë par voie orale, dermique ou par inhalation (Powers 1964, Moldovan 1971a, b, Kinert 1975).
10.2.4 Toxicité à dose répétée
Aucun effet nocif sur la santé n'a été observé lors d’aucune des études sur la toxicité par voie orale à dose répétée, pour lesquelles la dose testée allait jusqu’à 5000 mg/kg pc/j.
Lors d’une étude récente de Wu et al. (2012), des souris ICR mâles (6/dose) ont été exposées à du DP dans de l'huile de maïs par gavage oral, à des doses de 500, 2000 ou 5000 mg/kg pc/j jour pendant 10 jours. Le poids corporel et le poids des organes (foie, reins et testicules) n'ont pas été affectés par le traitement au DP. Pour cette étude, le stress hépatique oxydatif, les dommages à l'ADN et les profils transcriptomiques et métabolomiques ont été étudiés au niveau moléculaire. Des réponses au stress oxydatif et une modification de l'expression génétique associées au métabolisme des glucides, des lipides, des nucléotides et de l'énergie et aux processus de transduction de signaux ont été observés. Aucun effet sur la santé n'ayant été observé, ces changements physiologiques n'ont pas été considérés être des effets nocifs.
Dans le cadre d'un test de criblage combiné de la toxicité pour la reproduction et pour le développement à dose répétée, réalisé en suivant les lignes directrices de l'OCDE, des rats Crl:CD (SD) ont été exposés à du DP dans de l'huile de maïs à raison de 0, 750, 1500 ou 5000 mg/kg pc/j par gavage oral (Brock et al. 2010). Pendant la phase de toxicité à dose répétée, les animaux (10/sexe/dose) ont été traités pendant 28 jours. Aucun effet lié au traitement sur des signes cliniques de toxicité, le poids corporel, la consommation d'aliments, le neurocomportement et une batterie d'observations fonctionnelles n'a été observé. Aucun effet n'a été observé sur les paramètres hématologiques, l'analyse d'urine, la coagulation ou les paramètres de chimie clinique. Aucune modification du poids des organes (cœur, foie, testicules, ovaires, glandes thyroïde et parathyroïde) liée à la dose n'a été observée. Des décès ont été observés dans tous les groupes, y compris le groupe témoin, dus à des erreurs lors du gavage (tableau 101). Les auteurs ont déterminé une dose sans effet observé (DSEO) de 5000 mg/kg pc/j.
| Dose (mg/kg pc/j) | Mortalité chez les rats mâles | Mortalité chez les rats femelles |
|---|---|---|
| 0 | 0/10 | 2/10 |
| 750 | 1/10 | 1/10 |
| 1 500 | 2/10 | 1/10 |
| 5 000 | 0/10 | 1/10 |
Li et al. (2013) ont examiné les effets potentiels sur la santé de rats à des doses plus faibles. Des rats mâles Sprague-Dawley (7/dose) ont reçu du DP par gavage oral dans de l'huile de maïs à raison de 0, 1, 10 ou 100 mg/kg pc/j pendant 90 jours. Aucun changement significatif du poids corporel ni du poids relatif ou absolu du foie n'a été observé. Aucun dommage histopathologique du foie n'a été observé. Les autres organes n'ont pas été examinés. En ce qui concerne les paramètres de chimie clinique, une diminution significative de l'activité de l’alanine aminotransférase (ALT), de la phosphatase alcaline (ALP) et de la concentration totale d'acides biliaires (TBA) et une augmentation des niveaux de glucose ont été observées à la dose de 100 mg/kg pc/j. Les auteurs ont conclu que le DP ne causait pas d’effet nocif sur le foie jusqu’à la dose testée la plus élevée de 100 mg/kg pc/j.
Lors d’une autre étude subchronique, des rats albinos de la souche Charles River (15/sexe/dose) ont reçu dans leur alimentation du DP à raison de 0, 10 000, 30 000 et 100 000 ppm (0, 500, 1500 et 5000 mg/kg pc/j) pendant 13 semaines (Oscarson 1975). Aucun effet statistiquement significatif lié au traitement n’a été observé sur le poids corporel ou des organes (cerveau, gonades, cœur, reins, rate), l'analyse d'urine, les paramètres de chimie clinique ou hématologiques. Aucun signe clinique ni aucune observation pathologique ou histopathologique lié au traitement n'a été observé. Le poids absolu ou relatif (par rapport au poids corporel ou du cerveau) du foie était plus important chez les animaux ayant reçu le dose élevée, mais le poids absolu du foie n'était pas statistiquement significatif chez les mâles et ces augmentations n'étaient pas associées à des lésions histopathologiques quelconque. Aucun effet nocif n’a donc été observé jusqu’à la dose testée la plus forte de 5000 mg/kg pc/j.
Une étude sur la toxicité à dose répétée par inhalation a été trouvée. Des rats COBS (5/sexe/dose) ont été exposés au DP à raison de 0 (groupe témoin non traité), 640 ou 1524 mg/m3, 6 heures par jour, 5 jours par semaine pendant 28 jours (Bishop 1975). Les animaux ont été exposés dans une chambre où le DP était présent sous forme de poussière. Une augmentation significative du poids absolu du foie a été observée chez les deux sexes à partir de la dose de 640 mg/m3. Une hépatocytomégalie correspondante (gonflement des cellules du foie avec signe de cytotoxicité et de nécrose) des hépatocytes centro-lobulaires a été observée chez les mâles à 640 et 1524 mg/m3 et chez certaines femelles à la concentration la plus élevée. Des effets sur les poumons ont été observés. Tous les animaux traités ont présenté une légère augmentation du nombre de macrophages dans les alvéoles. Une augmentation significative du poids absolu des poumons a été observée chez les femelles aux doses de 640 et 1524 mg/m3 et à la dose de 1524 mg/m3 chez les mâles. Une concentration minimale avec effet nocif observé (CMENO) de 640 mg/m3 a été établie pour cette étude, mais aucune CSENO n'a été établie.
Une étude sur la toxicité par voie dermique à dose répétée a été trouvée. Des lapins blancs néo-zélandais mâles et femelles (5/sexe/groupe) ont reçu du DP dans une solution aqueuse à 3 % de méthylcellulose, à raison de 0 (groupe témoin non traité), 500 ou 2000 mg/kg pc/j, 5 jours par semaine pendant quatre semaines (Trzyna 1975). La substance testée a été appliquée sur plus de 20 % de la surface corporelle totale, sur peau scarifiée rasée. Les sites d'application n'ont pas été occlus, mais les animaux ont été individuellement hébergés et munis de colliers élisabéthains tout au long de l'étude. Les seuls signes cliniques liés au traitement étaient un érythème minimal ou absent sur le site d'application. Les femelles ont présenté une diminution liée à la dose statistiquement significative, absolue et relative (par rapport au poids corporel et cérébral), du poids des gonades (utérus et ovaires combinés) à partir de la dose de 500 mg/kg pc/j et une diminution significative du poids relatif du foie (par rapport au poids corporel et cérébral) à une dose de 2000 mg/kg pc/j. Étant donné qu'aucune histopathologie correspondante n'a été observée dans ces organes (foie et ovaires), une DSENO de 2000 mg/kg pc/j a été établie pour cette étude par l’EPA dans les documents de caractérisation préalable du danger (EPA 2011, 2014a).
10.2.5 Toxicité pour la reproduction et le développement
Des effets potentiels du DP sur la reproduction et le développement ont été étudiés lors d’une étude combinée de criblage de la toxicité à dose répétée pour la reproduction et le développement susmentionnée (Brock et al. 2010). Pendant la phase de toxicité pour la reproduction et le développement, les animaux (20/sexe/groupe) ont reçu 0, 750, 1500 ou 5000 mg/kg pc/j de DP dans de l'huile de maïs par gavage oral. Les rats mâles ont été traités pendant au moins 63 jours (21 jours avant l'accouplement, 14 jours d'accouplement, 28 après l'accouplement). Les rates ont été traitées pendant un maximum de 60 jours (21 jours avant l'accouplement, 14 jours pendant l'accouplement et jusqu'à 25 jours après l'accouplement, du jour de gestation (JG) 0 jusqu'au jour d'allaitement (JA) 3). Des décès ont été observés dans tous les groupes, y compris le groupe témoin, décès liés à des erreurs de gavage (tableau 10-2). Aucun effet sur les indices de reproduction et de fertilité n'a été observé chez les parents, mâles ou femelles. Aucune toxicité maternelle n'a été observée jusqu'à la dose la plus élevée testée. Aucun effet sur le développement n'a été observé chez les petits de génération F1 jusqu'à la dose la plus élevée testée. Les auteurs ont établi une DSEO de 5000 mg/kg pc/j pour la toxicité pour la reproduction et le développement.
| Dose (mg/kg pc/j) | Mortalité chez les rats mâles | Mortalité chez les rats femelles |
|---|---|---|
| 0 | 1/20 | 0/20 |
| 750 | 1/20 | 2/20 |
| 1 500 | 0/20 | 0/20 |
| 5 000 | 2/20 | 1/20 |
10.2.6 Sensibilisation
Aucune sensibilisation cutanée n'a été observée chez des cobayes traités avec du DP lors d’un test de Buehler (Brett 1975).
10.2.7 Toxicocinétique
Lors d’études de toxicocinétique (Chou et al. 1979, Saunders et Quistad 1983, OxyChem 2005) pour lesquelles des rats ont reçu par voie orale du DP radiomarqué, il a été montré que le DP était mal absorbé par voie gastrointestinale. Dans l'étude Chou et al. (1979), au moins 75 % du DP radiomarqué (en suspension aqueuse contenant 5 % de Tween-80 et 5 % de gomme arabique) ont été excrétés dans les matières fécales 24 heures après le traitement. Dans l'étude de Saunder et Quistad (1983), au moins 83 % du DP radiomarqué (vecteur non précisé dans la source secondaire) ont été excrétés dans les matières fécales quatre jours après le traitement (OxyChem 2005). Moins de 0,1 % du DP a été excrété dans l'urine lors de ces deux études. De la radioactivité a été détectée dans des échantillons de tissus, les niveaux les plus élevés étant détectés dans le foie et les ovaires. Des niveaux plus faibles ont été détectés dans le sang, les reins et les poumons. Le DP a été excrété très lentement lorsque les niveaux de DP dans le sang, les reins et le foie restaient inchangés entre 4 et 24 heures après le traitement (Chou et al. 1979). Un métabolite polaire a été détecté, mais n'a pas été identifié lors de ces deux études.
Li et al. (2013) ont également examiné les profils d'accumulation des deux isomères du DP (syn-DP et anti-DP) chez le rat. Les profils de répartition ont mis en évidence que les deux isomères du DP étaient mesurés, le niveau le plus élevé étant dans le foie, suivi du sérum et des muscles. Des isomères déchlorés du DP (Cl11-DP) ont été mesurés dans ses tissus. Puisque le Cl11-DP a également été détecté dans le DP commercial, il n'était pas clair si ce Cl11-DP était un métabolite ou s'il provenait du produit commercial. Le DP commercial contient deux isomères (syn-DP et anti-DP) dans un rapport 1/3. À la faible dose de 1 mg/kg pc/j, aucune stéréosélectivité de l'anti-DP ni du syn-DP dans les tissus (muscle, foie et sérum) n'a été observée, basée sur le rapport de la concentration d'anti-DP et de la concentration totale de DP (fanti) qui était comparable à celui du DP commercial. Aux doses plus élevées (10 et 100 mg/kg pc/j), le fanti était inférieur, suggérant des concentrations plus élevées de syn-DP dans les tissus. Deux groupes d'animaux ont été exposés à 0 ou 100 mg/kg pc/j de DP pendant 45 jours, suivi de 45 jours de dépuration afin d'examiner les profils d'élimination. Il a été montré que les deux isomères du DP étaient plus susceptibles de s'accumuler dans le foie ou d'être éliminés plus lentement dans le foie que dans les muscles. Les demi-vies d'élimination étaient de 24 jours (syn-DP) et de 25 jours (anti-DP) dans le sérum, de 44 jours (syn-DP) et de 54 jours (anti-DP) dans les muscles, et de 179 jours (syn-DP) dans le foie. Les auteurs n'ont pas calculé de demi-vie d'élimination de l'anti-DP dans le foie, car le niveau d'anti-DP a augmenté de façon non significative après la dépuration.
10.3 Caractérisation des risques pour la santé humaine
Aucune classification des effets du DP sur la santé par des organismes de réglementation nationaux ou internationaux n’a été trouvée. Les résultats pour la base de données de toxicité génétique étaient tous négatifs, ce qui indique que le DP n'est pas susceptible d'être toxique génétiquement. Aucune étude concernant la toxicité chronique n'a été recensée. Les analyses d'autres éléments de preuve visant à évaluer le potentiel carcinogène du DP n'ont pas été concluantes.
Aucun effet dommageable n'a été observé chez les animaux de laboratoire ayant reçu par voie orale du DP à des doses pouvant aller jusqu'à 5000 mg/kg p.c. par jour dans une étude de toxicité par voie orale à doses répétées combinée à un test de dépistage de la toxicité pour la reproduction et le développement de 28 jours (Brock et al., 2010) et dans une étude de toxicité subchronique de 90 jours (Oscarson, 1975), toutes deux menées chez le rat. Il y a huit ordres de grnadeur entre la dose maximale sans effet observé et l'estimation de la limite supérieure d'exposition au DP pour l'ensemble de la population canadienne dans les milieux naturels (poussière, air, eau), et les aliments ou le lait maternel (8,2 ng/kg p.c. par jour pour les jeunes enfants de 0,5-4 ans). Cette marge est jugée adéquate pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
10.4 Incertitudes de l'évaluation des risques pour la santé humaine
La présente évaluation préalable comporte des incertitudes ayant trait aux bases de données sur l'exposition et les effets sur la santé.
Aucune donnée sur les aliments commercialisés au Canada n’était disponible dans la littérature de base. Toutefois, des données sur les produits alimentaires pour nourrissons étaient disponibles aux États-Unis.
Aucune étude sur des volontaires ni aucune étude épidémiologique n'a été trouvée. Aucune étude sur la toxicité chronique chez des animaux de laboratoire n'était disponible, les études les plus longues n'étant qu’au plus de 90 jours et la taille des échantillons des études sur la toxicité à dose répétée était relativement petite. Il existe des incertitudes sur le fait de savoir si des animaux en gestation peuvent présenter des toxicocinétiques différentes et s’il existe des différences de sensibilité aux effets induits chimiquement entre les petits et les adultes.
Toutefois, la marge d'exposition importante est considéré adéquate pour tenir compte des incertitudes des bases données sur l’exposition et les effets sur la santé.
En reconnaissant que l'évaluation des substances de type déchlorane (décrites à la section 2.2) soit hors de la portée de la présente évaluation préalable et que la similarité de ces substances avec le DP ne soit pas bien comprise, il existe une incertitude quant au potentiel de co-exposition et au mode d'action commun de ces substances.
11. Conclusion
En tenant compte de tous les éléments de preuve avancés dans la présente évaluation préalable, il existe un risque d’effet nocif du DP sur l’environnement. Nous concluons que le DP satisfait aux critères de l’alinéa 64(a) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l'environnement ou sa diversité biologique. Toutefois, nous concluons aussi que le DP ne satisfait à aucun des critères de l’alinéa 64(b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l'environnement essentiel à la vie.
En se basant sur les renseignements disponibles sur son potentiel à causer des effets nocifs sur la santé humaine, nous concluons que le DP ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un risque au Canada pour la vie ou la santé humaine.
Nous concluons que le DP satisfait à un ou plusieurs des critères de l’article 64 de la LCPE. Il a été déterminé que le DP satisfait aux critères de persistance et de bioaccumulation stipulés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Abbasi G., Saini A., Goosey E. et Diamond M.L.; 2016; Product screening for sources of halogenated flame retardants in Canadian house and office dust; Sci. Total Environ., 545–546, p. 299–307 (disponible en anglais seulement).
ACD/Percepta [Module de prédiction]; c1997-2012; Toronto (ON) : Advanced Chemistry Development [consulté en septembre 2014] (disponible en anglais seulement).
[AEROWIN] AEROWIN Program for Windows [Modèle d’estimation]; 2010; v. 1.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Allen J.G., Stapleton H.M., Vallarino J., McNeely E., McClean M.D., Harrad S.J., Rauert C.B. et Spengler J.D.; 2013; Exposure to flame retardant chemicals on commercial airplanes; Environ. Health, 12, p. 17 (disponible en anglais seulement).
[AOPWIN] Atmospheric Oxidation Program for Windows [Modèle d’estimation]; 2010; v. 1.92a; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Arnot J.A. et Gobas F.A.P.C.; 2003; A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs; QSAR Comb. Sci., 22(3), p. 337-345 (disponible en anglais seulement).
Arnot J.A. et Gobas F.A.P.C.; 2006; A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms; Environ. Rev., 14, p. 257-297 (disponible en anglais seulement).
Arnot J.A. et Quinn C.L.; 2015; Development and Evaluation of a Database of Dietary Bioaccumulation Test Data for Organic Chemicals in Fish; Environ. Sci. Technol., 49, p. 4783−4796 (disponible en anglais seulement).
Aylward L.L. et Hays S.M.; 2011; Biomonitoring-based risk assessment for hexabromocyclododecane (HBCD); International journal of hygiene and environmental health, 214(3), p. 179-187 (disponible en anglais seulement).
Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2013. Santé Canada. [consulté le 24 mars 2014]. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?lang=fra.com
[BASL4] Biosolids-Amended Soil Level 4 Model; 2011; v. 2.00; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre (disponible en anglais seulement).
[BBM with Mitigating Factors] Baseline Bioaccumulation Model with Mitigating Factors; 2008; Gatineau (QC) : Environnement Canada, Division des évaluations écologiques [modèle développé en se basant sur Dimitrov et al. 2005]; disponible sur demande (disponible en anglais seulement).
[BCFBAF] Bioaccumulation Program for Windows [Modèle d’estimation]; 2010; v. 3.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014].
[BDPP] Base de données sur les produits pharmaceutiques; modifiée le 17 février 2017; Ottawa (ON) : gouvernement du Canada [consultée le 24 avril 2014].
[BDIPSN] Base de données d’ingrédients de produits de santé naturels; [modifiée le 21 juin 2017]; Ottawa (ON) : gouvernement du Canada [consultée le 24 avril 2014].
[BDPSNH] Base de données des produits de santé naturels homologués; [modifié le 10 août 2016]; Ottawa : gouvernement du Canada [consulté le 24 avril 2014].
Ben Y.J., Li X.H., Yang Y.L., Li L., Di J.P., Wang W.Y., Zhou R.F., Xiao K., Zheng M.Y., Tian Y. et Xu X.B.; 2013; Dechlorane plus and its dechlorinated analogs from an e-waste recycling center in maternal serum and breast milk of women in Wenling, China; Environmental Pollution, 173, p. 176-181 (disponible en anglais seulement).
Ben J.Y., Li X.H., Yang L.Y., Li L.J., Zheng Y.M., Wang Y.W. et Xu B.X.; 2014; Placental transfer of dechlorane plus in mother-infant pairs in an e-waste recycling area (Wenling, China); Environ. Sci. Technol., 48(9), p. 5187-93 (disponible en anglais seulement).
Bergman A., Rydén A., Law R.J., de Boer J., Covaci A., Alaee M., Birnbaum L., Petreas M., Rose M., Sakai S., Van den Eede N. et van der Veen I.; 2012; A novel abbreviation standard for organobromine, organochlorine and organophosphorus flame retardants and some characteristics of the chemicals; Environment International, 49, p. 57-82 (disponible en anglais seulement).
[BIOWIN] Biodegradation Probability Program for Windows [Modèle d’estimation]; 2010; v. 4.10; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Bishop A.; 1975; 28-Day Subacute Dust Inhalation Toxicity Study with Dechlorane Plus 25 in Rats; Laboratoire d'essai : Industrial BIO-TEST Laboratories Inc., Report no.: IBT No. 663-06279; Société détentrice : Hooker Chemical Corporation, Report date: 1975-06-18; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
Boethling R.S., Howard P.H., Beauman J.A. et Larosche M.E.; 1995; Factors for intermedia extrapolations in biodegradability assessment; Chemosphere, 30(4), p. 741-752 (disponible en anglais seulement).
Boudreau J.; 1973; Cité dans : HPV Challenge – Robust Summaries & Test Plans: Dechlorane Plus. Final revision as identified by the submitter, June 8, 2009. Thirty-Day Static Biological Magnification Studies with Dechloranes 602, 604 and Plus 515 in Bluegills; Industrial Bio-Test Laboratories Inc., IBT no 665‑03736 et 631-02353 (disponible en anglais seulement).
Brasseur C., Pirard C., Scholl G., De Pauw E., Viel J.F., Shen L., Reiner E.J. et Focant J.F.; 2014; Levels of dechloranes and polybrominated diphenyl ether (PBDEs) in human serum from France; Environ. Int., 65C, p. 33-40 (disponible en anglais seulement).
Brett B.; 1975; Skin sensitization tests with five samples in albino guines pigs; rapport IBT no 601-06278; Laboratoire d'essai : Industrial Bio-Test Laboratories Inc.; TSCAT document OTS0205956de l’EPA des États-Unis (disponible en anglais seulement).
Brock W.J., Schroeder R.E., McKnight C.A., VanSteenhouse J.L. et Nyberg J.M.; 2010; Oral Repeat Dose and Reproductive Toxicity of the Chlorinated Flame Retardant Dechlorane Plus; Int. Toxicol., 29(6), p. 582-593 (disponible en anglais seulement).
Brown T. et Wania F.; 2008; Screening Chemicals for the Potential to be Persistent Organic Pollutants: A Case Study of Arctic Contaminants; Environ. Sci. Technol., 42, p. 5202-5209 (disponible en anglais seulement).
Canada; 1999; Loi canadienne sur la protection de l'environnement (1999), L.C., 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada; 2000; Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada. Partie II, vol. 134, no 7, p. 607-612.
Canada, ministère de l'Environnement; 2009; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2967.
Canada, ministère de l'Environnement; 2013; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances ignifuges organiques; Gazette du Canada, Partie I, vol. 147, no 13, p. 613-633.
Canada; ministère de l'Environnement, ministère de la Santé; 2011; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances ignifuges organiques; Gazette du Canada (supplément), Partie I, vol. 145, no 41.
CATALOGIC [Modèle numérique]; 2012; v. 5.11.6; Bourgas (Bulgarie) : Univerité Prof. Assen Zlatarov, Laboratoire de chimie mathématique (disponible en anglais seulement).
[CCME] Conseil canadien des ministres de l'environnement; 1999; Recommandations canadiennes pour la qualité des sédiments : protection de la vie aquatique – Chlordane; dans Recommandations canadiennes pour la qualité de l'environnement, 1999; Conseil canadien des ministres de l'environnement, Winnipeg.
[CECBP] Programme de surveillance des contaminants de l’environnement de la Californie; 2008; Brominated and chlorinated organic chemical compounds used as flame retardants; Materials for the December 4-5, 2008 Meeting of the California Environmental Contaminant Biomonitoring Program Scientific Guidance Panel (SGP), 32 p. (disponible en anglais seulement).
Cequier E., Ionas A.C., Covaci A., Marcé R.M., Becher G. et Thomsen C.; 2014; Occurrence of a broad range of legacy and emerging flame retardants in indoor environments in Norway; Environ. Sci Technol., 48, p. 6827-6835 (disponible en anglais seulement).
Cequier E., Marcé R.M., Becher G. et Thomsen C.; 2015; Comparing human exposure to emerging and legacy flame retardants from the indoor environment and diet with concentrations measured in serum; Environ. Int., 74, p. 54-59 (disponible en anglais seulement).
Chabot-Giguere B., Letcher R.J. et Verreault J.; 2013; In vitro biotransformation of decabromodiphenyl ether (BDE-209) and Dechlorane Plus flame retardants: A case study of ring-billed gull breeding in a pollution hotspot in the St. Lawrence River, Canada; Environ. Int., 55, p. 101-108 (disponible en anglais seulement).
Chen D., Wang Y., Yu L., Luo X., Mai B., Li S.; 2013; Dechlorane plus flame retardant in terrestrial raptors from northern China; Environ. Pollut., 176, p. 80‑86 (disponible en anglais seulement).
Chou T.W., Liu D.H.W., Mabey W.R., Mitoma C. et Smith J.H.; 1979; Cité dans : HPV Challenge- Robust Summaries & Test Plans: Dechlorane Plus. Final revision as identified by the submitter, June 8, 2009. Vapour Pressure and Water Solubility. Metabolism and Environmental Screening Studies on Dechlorane Plus; SRI International, SRI Project No. LSC-8060 (disponible en anglais seulement).
[CHRIP] Chemical Risk Information Platform [base de données]; c2008; Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Management Centre (CMC) [consulté en janvier 2011] (disponible en anglais seulement).
Cikutovic M.A., Fitzpatrick C., Goven A.J., Venables B.J., Giggleman M.A. et Cooper E.L.; 1999; Wound Healing in Earthworms Lumbricus terrestris: A Cellular-Based Biomarker for Assessing Sublethal Chemical Toxicity; Bull. Environ. Contam. Toxicol., 62, p. 508-514 (disponible en anglais seulement).
Commission européenne; 2008; IUCLID Dataset [Dechlorane Plus], no CAS 13560-89-9 [en ligne]; Édition de 2000 en format CD-ROM; Ispra (Italie) : Commission européenne, Centre commun de recherche, Institut pour la protection de la santé et des consommateurs, Bureau européen des substances chimiques [consulté en janvier 2012] (disponible en anglais seulement).
Crump D., Chiu S., Gauthier L.T., Hickey N.J., Letcher R.J. et Kennedy S.W.; 2011; The effects of Dechlorane Plus on toxicity and mRNA expression in chicken embryos: A comparison of in vitro and in ovo approaches; Comp. Biochem. Physiol. C, 154, p. 129-134 (disponible en anglais seulement).
Davis E., Klosterhaus S. et Stapleton H.; 2012; Measurement of flame retardants and triclosan in municipal sewage sludge and biosolids; Environ. Int., 40, p. 1-7 (disponible en anglais seulement).
Diamond M., Goosey E., Saini A. et Chaudhuri S.; 2013; Assessment of the prevalence and exposure to the new flame retardants (NFRs) in Canadian indoor environments; préparé pour Santé Canada; Diamond Environmental Research Group, Université de Toronto (disponible en anglais seulement).
Dimitrov S., Dimitrova N., Parkerton T., Comber M., Bonnell M. et Mekenyan O.; 2005; Base-line model for identifying the bioaccumulation potential of chemicals; SAR QSAR Environ. Res., 16(6), p. 531-554 (disponible en anglais seulement).
Dodson R.E., Perovich L.J., Covaci A., Van den Eede N., Ionas A.C., Dirtu A.C., Brody J.G. et Rudel R.A.; 2012; After the PBDE Phase-Out: A Broad Suite of Flame Retardants in Repeat House Dust Samples from California; Environ. Sci. Technol., 46(24), p. 13056-13066 (disponible en anglais seulement).
[EC] Environnement Canada; 2013-2014; Data for certain organic flame retardants substance grouping collected under the Canadian Environmental Protection Act, 1999, section 71: Notice with respect to certain organic flame retardant substances; données préparées par Environnement Canada, Santé Canada, Programme des substances existantes (disponible en anglais seulement).
[EC] Environnement Canada; 2014; Liste des substances toxiques gérées sous la Loi canadienne sur la protection de l’environnement.
[ECCC] Environnement et Changement climatique Canada; 2017; Supporting documentation: Summary tables for Dechlorane Plus; Gatineau (QC) : Environnement et Changement climatique Canada; Information in support of the Screening Assessment for 1,4:7,10-Dimethanodibenzo[a,e]cyclooctene, 1,2,3,4,7,8,9,10,13,13,14,14-dodecachloro-1,4,4a,5,6,6a,7,10,10a,11,12,12a-dodecahydro-; disponible sur demande auprès de : substances@ec.gc.ca
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié le 12 mars 2017]; Catégorisation de substances chimiques; Ottawa (ON) : gouvernement du Canada [consulté le 31 juillet 2013].
[ECHA] Agence européenne des produits chimiques; ©2007-2013; Substances enregistrées; Résultats de recherche pour le no CAS 13560-89-9; Helsinki (Finlande) : ECHA [mis à jour le 27 novembre 2012; consulté en mars 2014] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2010; Guidance on information requirements and chemical safety assessment. Chap. R.16: Environmental exposure estimation. Mai 2010. Guidance for the implementation of REACH; Helsinki (Finlande) : Agence européenne des produits chimiques (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2013a; Substances enregistrées; Helsinki (Finlande) : ECHA [consulté le 26 juillet 2013].
[ECHA] Agence européenne des produits chimiques; 2013b; Substances enregistrées; Résultats de recherche pour le no CAS 13560-89-984852-53-9; 2013 Experimental water solubility report (OECD 105 Study); Helsinki (Finlande) : ECHA [consulté en août 2015].
[ECOSAR] Ecological Structure Activity Relationships Class Program [Modèle d’estimation]; 2012; v. 1.11; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Environnement Canada; 1977; Mirex in Canada; Report of the Task Force on Mirex to the Joint Department of Environment and National Health and Welfare Committee on Environmental Contaminants; Ottawa (disponible en anglais seulement).
Environnement Canada; 1998; Canadian sediment quality guidelines for chlordane, dieldrin, endrin, heptachlor epoxide, and lindane: Supporting document; Service de la Conservation de l'environnement, Direction générale de la science des écosystèmes, Direction de la qualité de l'environnement et de la politique scientifique, Division des recommandations et des normes, Ottawa; ébauche (disponible en anglais seulement).
Environnement Canada; 2013; Site Specific Analysis Report: no CAS 13560-89-9, 20 février 2013; Rapport non publié; Gatineau (QC) : Environnement Canada, Division des évaluations écologiques (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 1993; Wildlife Exposure Factors Handbook. Vol. I; EPA/600/R-93/187a; Office of Research and Development (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2003; Exposure and human health reassessment of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds. Part I: Estimating exposure to dioxin-like compounds, Volume 3: Site-specific assessment procedures, Chapter 4: Estimating exposure media concentrations, EPA/600/P-00/001Cb; Environmental Protection Agency des États-Unis, National Center for Environmental Assessment, Washington (DC), décembre 2003 (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2004; HPV Challenge; Robust Summaries and Test Plans: Dechlorane Plus [pdf]; Lettre d'accompagnement datée du 24 septembre 2004 (no de doc. 201-15635) (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis. 2009. HPV Challenge; Robust Summaries and Test Plans: Dechlorane Plus; Lettre d'accompagnement datée du 3 mars 2009 (no de doc. 201-16774); rapport IUCLID daté du 7 novembre 2008 (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2011; Screening-level hazard characterization – Dechlorane plus (CASRN 13560-89-9) (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2014; An alternatives assessment for the flame retardant decabromodiphenyl ether (decaBDE) Final Report January 2014 [pdf] (disponible en anglais seulement).
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [Estimation Model]; 2000-2012; v. 4.1; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Fan X., Kubwabo C., Rasmussen P.E. et Wu F.; 2016; Non-PBDE halogenated flame retardants in Canadian indoor house dust: sampling, analysis, and occurrence; Environ. Sci. Pollut. Res., 23, p. 7998–8007 (disponible en anglais seulement).
Feo M.L., Barón E., Eljarrat E. et Barceló D.; 2012; Dechlorane Plus and related compounds in aquatic and terrestrial biota: a review; Anal. Bioanal. Chem., 404, p. 2625-2637 (disponible en anglais seulement).
[GAC] Global Automakers of Canada; 2013; Communication personelle.
Gagne P.-L., Fortier M., Fraser M., Parent L. et Vaillancourt C.; 2017; Dechlorane Plus induces oxidative stress and decreases cyclooxygenase activity in the blue mussel; Aquatic Toxicology, 188, p. 26-32 (disponible en anglais seulement).
Gara M.J. et Rauisina G.; 1975; Cité dans : HPV Challenge- Robust Summaries & Test Plans: Dechlorane Plus. Final revision as identified by the submitter, June 8, 2009. Thirty-Day Dynamic Bioaccumulation Studies with Dechlorane Plus 515 in Bluegill Sunfish; Industrial Bio-Test Laboratories, Inc. IBT Nos.621-06768 and 631-04618 (disponible en anglais seulement).
Gauthier L., Hebert C., Weseloh D.V.C. et Letcher R.J.; 2007; Current-Use Flame Retardants in the Eggs of Herring Gulls (Larus argentatus) from the Laurentian Great Lakes; Environ. Sci. Technol., 41, p. 4561-4567 (disponible en anglais seulement).
Gobas F.; 2007; Development and review of a generic water-sediment modeling framework for organic chemicals; Rapport préparé pour Environnement Canada; Burnaby (C.-B.) : Université Simon Fraser, Faculté de l'environnement; 26 mars 2007 (disponible en anglais seulement).
Gobas F.; 2010; Comments on approach to sediment exposure approach; Rapport prepare pour Environnement Canada; Burnaby (C.-B.) : Université Simon Fraser University, Faculté de l’environnement; 25 mars 2010 (disponible en anglais seulement).
Gobas F.A.P.C., Kelly B.C. et Arnot J.A.; 2003; Quantitative structure activity relationships for predicting the bioaccumulation of POPs in terrestrial food-webs; QSAR Comb. Sci., 22, p. 329-336 (disponible en anglais seulement).
Guerra P., Alaee M., Eljarrat E. et Barcelo D.; 2011; Introduction to Brominated Flame Retardants:Commercially Products, Applications, and Physicochemical Properties; dans Eljarrat E. et Barceló D. éditeurs, 2011, Brominated Flame Retardants; Série : The Handbook of Environmental Chemistry, volume 16, Heidelberg (Berlin) : Springer, 290 p. (disponible en anglais seulement).
Guo J., Venier M., Salamova A. et Hites R.A.; 2017; Bioaccumulation of dechloranes, organophosphate esters, and other flame retardants in Great Lakes fish; Science of the Total Environment, 583, p. 1-9 (disponible en anglais seulement).
Harris C.R., Mazurek J.H. et Svec H.J.; 1964; Comparison of the toxicity to insects of certain insecticides applied by contact and in the soil; J. Econ. Entom., 57(5), p. 698-702 (disponible en anglais seulement).
He S., Li M., Jin J., Wang Y., Bu Y., Xu M., Yang X. et Liu A.; 2013; Concentrations and trends of halogenated flame retardants in the pooled serum of residents of Laizhou Bay, China; Environ. Tox. Chem.; 32(6); p. 1242-1247 (disponible en anglais seulement).
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [Modèle d’estimation]; 2011; v. 3.20; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Hoh E., Zhu L. et Hites R.A.; 2006; Dechlorane Plus, a chlorinated flame retardant, in the Great Lakes; Environ. Sci. Technol., 40, p. 1184-1189 (disponible en anglais seulement).
Hooker Chemical; 1977; Rapport d’étude (anonyme); Cité dans : HPV Challenge- Robust Summaries & Test Plans: Dechlorane Plus Final revision as identified by the submitter, June 8, 2009. Melting Point, Boiling Point, Density, and Vapour Pressure. Hooker Dechlorane Plus -Toxicological Review. Septembre (disponible en anglais seulement).
Houde M., Berryman D., de Lafontaine Y. et Verrault J.; 2014; Novel brominated flame retardantsd and dechloranes in three fish species from the St. Lawrence River, Canada; Sci. Total. Environ., 479-480, p. 48-56 (disponible en anglais seulement).
Hung H., Alexandrou N. et Dryfhout-Clark H.; 2016; Données non publiées sur la surveillance de la qualité de l'air pour le Plan de gestion des produits chimiques soumises à la Division des évaluations écologiques d'Environnement et Changement climatique Canada, Gatineau (QC).
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [Modèle d’estimation]; 2010; v. 2.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Ismail N., Gewurtz S.B., Pleskach K., Whittle D.M., Helm P.A., Marvin C.H. et Tomy G.T.; 2009; Brominated and Chlorinated Flame Retardants in Lake Ontario, Canada, Lake Trout (Salvelinus namaycush) between 1979 and 2004 and possible influences of food-web changes; Environ. Toxicol. Chem., 28(5), p. 910-920 (disponible en anglais seulement).
[IVL] (Institut de recherche environnementale de la Suède); Kaj L., Norström K., Egelrud L., Remberger M., Lilja K. et Brorström-Lundèn E.; 2010; Results from the Swedish National Screening Programme 2009; Institut de recherche environnementale de la Suède, Stockholm (disponible en anglais seulement).
Jaagumagi R.; 1988; The in-place pollutants program. Volume V, Part B. Benthic invertebrates studies results; ministère de l'Environnement de l'Ontario, Direction des ressources en eau, Section de biologie aquatique, Toronto (disponible en anglais seulement).
Jaagumagi R., Persaud D. et Lomas T.; 1989; The in-place pollutants program. Volume V, Part A. A synthesis of benthic invertebrates studies;ministère de l'Environnement de l'Ontario, Direction des ressources en eau, Section de biologie aquatique, Toronto (disponible en anglais seulement).
Johnson P.I., Stapleton H.M., Mukherjee B., Hauser R. et Meeker J.D.; 2013; Associations between brominated flame retardants in house dust and hormone levels in men; Sci. Total Environ., 445-446, p. 177-184 (disponible en anglais seulement).
Jotz M.M. et Mitchel A.D.; 1980; An evaluation of mutagenic potential of Hooker Research Center compound Dechlorane Plus employing the L5178Y TK+/- mouse lymphoma assay; Laboratoire d'essai : SRI International, Report no.: SRI Project LSC-8971 [cité dans OxyChem 2009] (disponible en anglais seulement).
Juberg D., Alfano K., Coughlin R. et Thompson K.; 2001; An observational study of object mouthing behavior by young children; Pediatrics, 107, p. 135 (disponible en anglais seulement).
Kakimoto K., Nagayoshi H., Yoshida J., Akutsu K., Konishi Y., Toriba A. et Hayakawa K.; 2012; Detection of dechlorane plus and brominated flame retardants in marketed fish in Japan; Chemosphere, 89(4), p. 416-419 (disponible en anglais seulement).
Kang J.-H., Kim J.-C., Jin G.-Z., Park H., Baek S.-Y. et Chang Y.-S.; 2010; Detection of Dechlorane Plus in fish from urban-industrial rivers; Chemosphere, 79(8), p. 850-854 (disponible en anglais seulement).
Kang H., Moon H.-B. et Choi K.; 2016; Toxicological responses following short-term exposure through gavage feeding or water-borne exposure to Dechlorane Plus in zebrafish (Danio rerio); Chemosphere, 146, p. 226-232 (disponible en anglais seulement).
[KEMI] Swedish Chemicals Agency Commodity Guide [base de données sur Internet]. 2007. CAS no 13560-89-9 Dechlorane Plus. [consulté en juin 2013] (disponible en anglais seulement).
Kinert J.C.; 1975; Acute dust inhalation toxicity study in rats for Dechlorane Plus 25. OTS0537030; Laboratoire d'essai : Industrial Bio-Test Laboratories Inc., Report no.: IBT No. 663-06279, Société détentrice : Hooker Chemical Corporation; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
Klosterhaus S.L., Stapleton H.M., La Guardia M.J. et Greig D.J.; 2012; Brominated and chlorinated flame retardants in San Francisco Bay sediments and wildlife; Environ. Int., 47, p. 56-65 (disponible en anglais seulement).
Kelly B.C., Ikonomou M.G., Blair J.D., Morin A.E. et Gobas F.A.P.C.; 2007; Food Web-Specific Biomagnification of Persistent Organic Pollutants; Science, 317, p. 236-239 (disponible en anglais seulement).
Kemmlein S., Hahn O. et Jann O.; 2003; Emissions of organophosphate and brominated flame retardants from selected consumer products and building materials; Atmospheric Environment, 37, p. 5485-5493 (disponible en anglais seulement).
Klasmeier J., Matthies M., MacLeod M., Fenner K., Scheringer M., Stroebe M., Le Gall A.C., McKone T.E., van de Meent D. et Wania F.; 2006; Application of multimedia models for screening assessment of long-range transport potential and overall persistence; Environ. Sci. Technol., 40, p. 53-60 (disponible en anglais seulement).
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [Modèle d’estimation]; 2010; v. 1.10; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [Modèle d’estimation]; 2010; v. 2.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Kolic T.M., Shen L., MacPherson K., Fayez L., Gobran T., Helm P.A., Marvin C.H., Arsenault G. et Reiner E.J.; 2009; The analysis of halogenated flame retardants by GC-HRMS in environmental samples; Journal of Chromatographic Science, 47, p. 83-91 (disponible en anglais seulement).
Kolic, T.M., Shen, L., MacPherson, K., Fayez, L., Gobran, T., Helm, P.A., Marvin, C.H., Arsenault, G., Reiner, E.J., 2009. The analysis of halogenated flame retardants by GC-HRMS in environmental samples. Journal of Chromatographic Science 47:83-91 (disponible en anglais seulement).
[KOWWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d'évaluation]. 2010. Version 1.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm (disponible en anglais seulement).
Li Y., Yi L., Wang J., Wu J., Mai B. et Dai J.; 2013; Accumulation pattern of Dechlorane Plus and associated biological effects on rats after 90d of exposure; Chemosphere, 90(7), p. 2149-2156 (disponible en anglais seulement).
Li Y., Yu L.H., Zhu Z.C., Dai J.Y., Mai B.X., Wu J.P. et Wang J.S.; 2013; Accumulation and effects of 90-day oral exposure to Dechlorane Plus in Quail (Cortunix cortunix); Environ. Tox. and Chem., 32(7), p. 1649-1654 (disponible en anglais seulement).
Liu L.Y., Salamova A. et Hites R.A.; 2014; Halogenated flame retardants in baby food from the United States and from China and the estimated dietary intakes by infants; Environ. Sci. Technol., 48(16), p. 9812-9818 (disponible en anglais seulement).
Lue K.Y. et de la Cruz A.A.; 1977; Mirex incorporation in the environment: toxicity in two soil macroarthropods and effects on soil community respiration; Water, Air, and Soil Pollution, 9, p. 177-191 (disponible en anglais seulement).
Ma Y.X., Xie Z.Y., Halsall C., Moller A., Yang H.Z., Zhong G.C., Cai M.H. et Ebinghaus R.; 2015; The spatial distribution of organochlorine pesticides and halogenated flame retardants in the surface sediments of an Arctic fjord: The influence of ocean currents vs. glacial runoff; Chemosphere, 119, p. 953-960 (disponible en anglais seulement).
McCarty L.S., Arnot J.A. et Mackay D.; 2013; Evaluation of critical body residue for acute narcosis in aquatic organisms; Environ. Toxicol. Chem., 32(10) (disponible en anglais seulement).
McCarty L.S. et Mackay D.; 1993; Enhancing ecotoxicological modeling and assessment: critical body residues and modes of toxic action; Environ. Sci. Technol., 27, p. 1719-1728 (disponible en anglais seulement).
McLeese D.W. et Metcalfe C.D.; 1980; Toxicities of eight organochlorine compounds in sediment and seawater to Crangon septemspinosa; Bull. Environ. Contam. Toxicol., 25, p. 921-928 (disponible en anglais seulement).
McLeese, D.W., Burridge, L.E., Van Dinter, J. 1982. Toxicities of five organochlorine componds in water and sediment to Nereis virens. Bull Environ Contam Toxicol 28(22):216-221 (disponible en anglais seulement).
Modor Plastics; 2013; Thermoset vs. Thermoplastics [consulté en juin 2013].
Moldovan M.; 1971a; Dechlorane Plus tested as a 50% w/v suspension in water containing 0.5% tween 80, acute oral toxicity study; Laboratoire d'essai : Food and Drug Research Laboratories Inc. Report no.: I. B. L No 9039; Société détentrice : Hooker Chemical Corporation; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
Moldovan M.; 1971b; Dechlorane Plus tested as supplied. Acute dermal toxicity study; Laboratoire d'essai : Food and Drug Research Laboratories Inc. Report no.: I. B. L. No: 9039; Société détentrice : Hooker Chemical Corporation; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
Möller, A., Xie, Z., Caba, A., Sturm, R., Ebinghaus, R. 2010. Large-Scale Distribution of Dechlorane Plus in Air and Seawater from the Arctic to Antarctica. Environ. Sci. Technol. 44:8977-8982 (disponible en anglais seulement).
Möller A., Xie Z., Cai M., Sturm R. et Ebinghaus R.; 2012; Brominated flame retardants and dechlorane plus in the Marine Atmosphere from Southeast Asia toward Antarctica; Environmental Sci. Technol., 46, p. 3141-3148 (disponible en anglais seulement).
Mortelmans K.E. et Tanaka W.; 1980; In vitro microbial mutagenesis assay of Dechlorane Plus; Laboratoire d'essai : SRI International; Report no.: SRI Project LSC-8971 [cité dans OxyChem 2009] (disponible en anglais seulement).
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [Modèle d’estimation]; 2010; v. 1.43; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Muir D.C.G., Teixeira C., de Jourdan B., Morris A., Backus S., Tomy G., Marvin C., MacInnis G., Spencer C. et De Silva A.; 2014; Using Remote Environments to detect New Persistent and Bioaccumulative chemicals in commerce; Affiche du Plan de gestion des produits chimiques d'Environnement et Changement climatique Canada présentée en septembre 2014 (disponible en anglais seulement).
Muir D.C.G., Teixeira C.F., Epp J., Young T., Wang X., Keir M. et Backus S.; 2011; Bioaccumulation of Selected Halogenated Organic Flame Retardants in Remote Lakes and in the Great Lakes; Affiche présentée à la SETAC (disponible en anglais seulement).
Na G., Wei W., Zhou S., Gao H., Ma X., Qiu L., Ge L., Bao C. et Yao Z.; 2015; Distribution characteristics and indicator significance of dechloranes in multi-matrices at Ny-Alesund in the Arctic; Journal of Environmental Sciences, 28, p. 8-13 (disponible en anglais seulement).
Na G., Yao Y., Gao H., Li R., Ge L., Titaley I.A., Santiago-Delgado L. et Simonich S.L.M.; 2017; Trophic magnification of dechlorane Plus in the marine food webs of Fildes Peninsula in Antarctica; Marine Pollution Bulletin (accepté pour publication) (disponible en anglais seulement).
[New EQC] New Equilibrium Criterion Model [Modèle d’estimation]; 2012; v. 1.0 (bêta); Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre [consulté en juillet 2014] (disponible en anglais seulement).
[OASIS Forecast] Optimized Approach based on Structural Indices Set [Modèle d’estimation]; 2005; v. 1.20; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique (disponible en anglais seulement).
Occidental Chemical Company IUCLID Data Set; 2004; cité dans EPA 2009 (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2004; Emission scenario document on plastics additives; Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement; Series on Emission Scenario Documents No. 3. Report (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2006; OECD POV and LRTP Screening Tool [Internet]; v. 2.2 Software and Manual; Paris : OCDE; Nouvelle version du logiciel POPorNot 1.0 distribuée lors de l’atelier OCDE/PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants; École polytechnique fédérale de Zurich (Suisse) (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2009a; Emission scenario document on plastics additives [pdf]; Paris, France : Organisation de coopération et de développement économiques, Direction de l'environnement; Series on Emission Scenario Documents No. 3. Report No. ENV/JM/MONO(2004)8/REV1. JT03267870 [consulté en février 2014] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2009b; Guidance Document for Using the OECD (Q)SAR Application Toolbox to Develop Chemical Categories According to the OECD Guidance on Grouping of Chemicals; Paris (France) : OCDE, Direction de l'Environnement; Series on Series on Testing and Assessment No. 102 [PDF]; Report No. ENV/JM/MONO(2009)5, JT03260091 (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2011; QSAR Toolbox User Manual: Strategies for grouping chemicals to fill data gaps to assess genetic toxicity and genotoxic carcinogenicity [pdf] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; Direction de l'environnement; 2012; QSAR Application Toolbox; v. 2.3; Développée par : Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique (disponible en anglais seulement).
Oscarson E.T.; 1975; 90-Day Subacute Oral Toxicity Study with Dechlorane Plus 25 in Albino Rats; Laboratoire d'essai : Industrial BIO-TEST Laboratories Inc., Report no.: IBT No. 622-06273; Société détentrice : Hooker Chemical Corporation; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
[OxyChem] Occidental Chemical Company; 2004; Transmittal letter on Dechlorane Plus submitted to the US EPA High Production Volume Program [consulté le 27 févreir 2014] (disponible en anglais seulement).
[OxyChem] Occidental Chemical Company; 2005; Transmittal letter on Dechlorane Plus submitted to the US EPA High Production Volume Program [consulté le 27 février 2014] (disponible en anglais seulement).
OxyChem® Dechlorane Plus® Manual [PDF]; 2007; v. 07-27-2007 (disponible en anglais seulement).
[OxyChem] Occidental Chemical Company; 2009; Final Revised Summaries IUCLID data set on Dechlorane Plus submitted to the US EPA High Production Volume Program [consulté le 27 février 2014] (disponible en anglais seulement).
[PISSC] Programme international sur la sécurité des substances chimiques;1984; Critère d'hygiène de l'environnement no 34, Chlordane Health and Safety Guide; Programme des Nations Unies pour l'environnement, Organisation internationale du travail, Organisation mondiale de la Santé, Genève (disponible en anglais seulement).
[PISSC] Programme international sur la sécurité des substances chimiques;1988; Health and Safety Guide No. 13, Chlordane health and Safety Guide; Programme des Nations Unies pour l'environnement, Organisation internationale du travail, Organisation mondiale de la Santé, Genève (disponible en anglais seulement).
Powers M.B.; 1964; Dechlorane Plus 25 toxicity data report. Acute oral dose range – rats; Laboratoire d'essai : Hazelton Laboratories Inc. Report no.: Lot No: D-64-438, D-64-439; Société détentrice : Hooker Chemical Corporation; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
Pridmore R.D., Thrush S.F., Wilcock R.J., Smith T.J., Hewitt J.E. et Cummings V.J.; 1991; Effect of the organochlorine pesticide technical chlordane on the population structure of suspension and deposit feeding bivalves; Mar. Ecol. Prog. Ser., 76, p. 261-271 (disponible en anglais seulement).
Qiu X.H., Marvin C.H. et Hites R.A.; 2007; Dechlorane Plus and Other Flame Retardants in a Sediment Core from Lake Ontario; Environ. Sci. Technol., 41, p. 6014-6019 (disponible en anglais seulement).
Rajanna B. et de la Cruz A.A.; 1975; Mirex Incorporation in the Environment: Phytotoxicity on Germination, Emergence, and Early Growth of Crop Seedlings; Bulletin of Environmental Contamination & Toxicology, 14(1), p. 77-82 (disponible en anglais seulement).
Reiner E., Helm P., Tomy G., Ladwig G., Ismail N., Pleskach K., Klawunn P., Sverko E., Muir D., Whittle M. et al.; 2006; Dechlorane Plus® in the Niagara River and Lake Ontario: Temporal Trends in Suspended Sediments and Lake Trout; Affiche présentée dans le cadre de la 232e réunion nationale de l'ACS s'étant déroulée à San Francisco, Californie, du 10 au 14 septembre 2006 (disponible en anglais seulement).
Ren G., Yu Z., Ma S., Li H., Peng P., Sheng G. et Fu J.; 2009; Determination of Dechlorane Plus in Serum from Electronics Dismantling Workers in South China; Environ. Sci. Technol., 43, p. 9453-9457 (disponible en anglais seulement).
TetkoRoper D.S. et Hickey C.W.; 1994; Behavioural responses of the marine bivalve Macomona liliana exposed to copper- and chlordanedosed sediments; Mar. Biol., 118, p. 673-680 (disponible en anglais seulement).
Sahlström L.M., Sellström U., de Wit C.A., Lignell S. et Darnerud P.O.; 2014; Brominated flame retardants in matched serum samples from Swedish first-time mothers and their toddlers; Environ. Sci. Technol., 48(13), p. 7584-7592 (disponible en anglais seulement).
Sakuratani Y., Noguchi Y., Kobayashi K., Yamada J. et Nishihara T.; 2008; Molecular size as a limiting characteristic for bioconcentration in fish; J. Environ. Biol., 29(1), p. 89-92 (disponible en anglais seulement).
Salamova A., Hermanson M.H. et Hites R.A.; 2014; Organophosphate and Halogenated Flame Retardants in Atmospheric Particles from a European Arctic Site; Environ. Sci. Technol., 48, p. 6133-6140 (disponible en anglais seulement).
Salamova A. et Hites R.A.; 2011; Dechlorane Plus in the Atmosphere and Precipitation near the Great Lakes; Environ. Sci. Technol., 45, p. 9924-9930 (disponible en anglais seulement).
Sample B.E., Opresko D.M. et Suter II G.W.; 1996; Toxicological Benchmarks for Wildlife: 1996 Revision; Oak Ridge (Tennessee) : Health Sciences Research Division; soumis au Department of Energy des États-Unism contract No. DE‑AC05-84OR21400 (disponible en anglais seulement).
Saunders A.L. et Quistad G.B.; 1983; Dechlorane Plus metabolism by rats; Laboratoire d'essai : Zoecon Corporation Report no.: Report No. 3761-35-04-83 [cité dans OxyChem 2009] (disponible en anglais seulement).
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de l’hygiène du milieu (disponible en anglais seulement).
Santé Canada; 2014; CMP Survey 2014-2015: Determination of Flame Retardants in Consumer Products. Project No.: 2014-2048; 19 juin 2014; rapport non publié (disponible en anglais seulement).
Santé Canada; 2015; Supporting documentation: Carcinogenic potential information for 1,4:7,10-Dimethanodibenzo[a,e]cyclooctene, 1,2,3,4,7,8,9,10,13,13,14,14-dodecachloro-1,4,4a,5,6,6a,7,10,10a,11,12,12a-dodecahydro- (Dechlorane Plus®); Ottawa (ON) : Santé Canada; Disponible sur demande auprès de : substances@ec.gc.ca. (disponible en anglais seulement).
Santé Canada; [modifié le 3 mai 2017]; Listes des additifs alimentaires autorisés; Ottawa (ON) : Santé Canada, Direction des aliments [consulté le 24 avril 2014].
Shanmuganathan M., Zhang Z., Sverko E., Brymer R., Gill B., Smyth S.A. et Marvin C.H.; 2017; The analysis of halogenated flame retardants in Canadian wastewater treatment plants using gas chromatography with tandem mass spectrometry (GC-MS/MS); Water Quality Research Journal, soumis pour publication (disponible en anglais seulement).
Schenker U., Macleod M., Scheringer M. et Hungerbühler K.; 2005; Improving data quality for environmental fate models: a least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds; Environ. Sci. Technol., 39, p. 8434-8441 (disponible en anglais seulement).
She Y., Wu J., Zhang Y., Peng .Y, Mo L., Luo X. et Mai B.; 2013; Bioaccumulation of polybrominated diphenyl ethers and several alternative halogenated flame retardants in a small herbivorous food chain; Environmental Pollution, 174, p. 164-170 (disponible en anglais seulement).
Shen L., Reiner E., Macpherson K., Kolic T., Sverko E., Helm P.A., Bhavsar S., Brindle I.D. et Marvin C.H.; 2010; Identification and Screening Analysis of Halogenated Norbornene Flame Retardants in the Laurentian Great Lakes: Dechloranes 602, 603, and 604; Environ. Sci. Technol., 44, p. 760-766 (disponible en anglais seulement).
Shen L., Reiner E.J., Helm P.A., Marvin C.H., Hill B., Zhang X., MacPherson K.A., Kolic T.M., Tomy G.T. et Brindle I.D.; 2011a; Historic trends of Dechloranes 602, 603, 604, Dechlorane Plus and other norbornene derivatives and their bioaccumulation potential in Lake Ontario; Environ. Sci. Technol., 45, p. 3333-3340 (disponible en anglais seulement).
Shen L., Reiner E., Macpherson K., Kolic T., Helm P., Richman L., Marvin C., Burniston D., Hill B., Brindle I., McCrindle R. et Chittim B.; 2011b; Dechloranes 602, 603, 604, dechlorane plus, and chlordane plus, a newly detected analogue, in tributary sediments of the Laurentian Great Lakes; Environ. Sci. Technol., 45, p. 693-699 (disponible en anglais seulement).
Shoeib M., Ahrens L., Jantunen L. et Harner T.; 2014; Atmospheric concentrations of organobromine, organochlorine and organophosphate flame retardants in Toronto, Canada; Ébauche de manuscrit (disponible en anglais seulement).
Shoeib M., Harner T., Webster G.M., Sverko E. et Cheng Y.; 2012; Legacy and current-use flame retardants in house dust from Vancouver, Canada; Environ. Pollut., 169, p. 175-182 (disponible en anglais seulement).
Siddique S., Xian Q., Abdelouahab N., Takser L., Phillips S.P., Feng Y.L., Wang B. et Zhu J.; 2012; Levels of dechlorane plus and polybrominated diphenylethers in human milk in two Canadian cities; Environ. Int., 39, p. 50-55 (disponible en anglais seulement).
Simond A.E., Houde M., Lesage V. et Verreault J.; 2017; Temporal trends of PBDEs and emerging flame retardants in belugas from the St. Lawrence Estuary (Canada) and comparisons with minke whales and Canadian Arctic belugas; Environ. Res., 156, p. 494-504 (disponible en anglais seulement).
STP Model [Modèle d’estimation]; 2001; v. 1.5; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre (disponible en anglais seulement).
Su G., Letcher R.J., Moore J.N., Williams L.L., Martin P.A., de Solla S.R. et Bowerman W.W.; 2015; Spatial and temporal comparisons of legacy and emerging flame retardants in herring gull colonies spanning the Laurentian Great Lakes and United States; Environmental Research, 142, p. 720-730 (disponible en anglais seulement).
Sühring R., Busch F., Fricke N., Kotke D., Wolschke H. et Ebinghaus R.; 2016; Distribution of brominated flame retardants and dechloranes between sediments and benthic fish- A comparison of freshwater and marine habitat; Science of the Total Environment, 542, p. 578-585 (disponible en anglais seulement).
Sverko E., Reiner E.J., Tomy G.T., Mccrindle R., Shen L., Arsenault G., Zaruk D., Macpherson K.A., Marvin C.H., Helm P.A. et al.; 2010; Compounds structurally related to Dechlorane Plus in sediment and biota from Lake Ontario (Canada); Environ. Sci. Technol., 44, p. 574-579 (disponible en anglais seulement).
Sverko E., Tomy G.T., Marvin C.H., Zaruk D., Reiner E., Helm P.A., Hill B. et McCarry B.E.; 2008; Dechlorane Plus levels in sediment of the Lower Great Lakes; Environ. Sci. Technol., 42(2), p. 361-366 (disponible en anglais seulement).
Sverko E., Tomy G.T., Reiner E.J., Li Y.-F., McCarry B.E., Arnot J.A., Law R.J. et Hites R.A.; 2011; Dechlorane plus in the environment: A Reivew; Environ. Sci. Technol., 45, p. 5088-5098 (disponible en anglais seulement).
TemaNord; 2011; Schlabach M., Remberger M., Brorström-Lundén E., Norström K., Kaj L., Andersson H., Herzke D., Borgen A. et Harju M.; Brominated Flame Retardants (BFR) in the Nordic Environment. Copenhagen (Danemark) : Conseil des ministres des pays nordiques.
[TIMES] TIssue MEtabolism Simulator [Module de prédiction]; 2012; v. 2.27.5; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique (disponible en anglais seulement).
Tomy G., Pleskach K., Ismail N., Whittle M., Helm P., Sverko E., Zaruk D. et Marvin C.; 2007; Isomers of Dechlorane Plus in Lake Winnipeg and Lake Ontario Food Webs; Environ. Sci. Technol., 41, p. 2249-2254 (disponible en anglais seulement).
Tomy G., Thomas C.R., Zidane T.M., Murison K.E., Pleskach K., Hare J. et Arsenault G.; 2008; Examination of Isomer Specific Bioaccumulation Parameters and Potential In vivo Hepatic Metabolites of syn- and anti-Dechlorane Plus Isomers in Juvenile Rainbow Trout (Oncorhynchus mykiss); Environ. Sci. Technol., 42, p. 5562-5567 (disponible en anglais seulement).
[TOPKAT] Toxicity Prediction by Komputer Assisted Technology [Module de prédiction]; 2004; v. 6.2; San Diego (CA) : Accelrys Software Inc (disponible en anglais seulement).
Trzyna G.E.; 1975; 28-Day Subacute Dermal Toxicity Study with Dechlorane Plus 25 in Albino Rabbits; Laboratoire d'essai : Industrial BIO-TEST Laboratories Inc. Report no.: IBT No. 601-06280; Société détentrice : Hooker Chemical Corporation. Date du rapport : 13 juin 1975; TSCAT document OTS0537030 de l’EPA des États-Unis (disponible en anglais seulement).
[VCCLAB] Virtual Computational Chemistry Laboratory, ALOGPS [non-Java interface]; 2005 [consulté en octobre 2013] (disponible en anglais seulement).
Venier M., Audy O., Vojta S., Bečanova J., Romanak K., Melymuk L., Krátká M., Kukučka P., Okeme J., Saini A., Diamond M.L. et Klánová J.; 2016; Brominated flame retardants in the indoor environment – Comparative study of indoor contamination from three countries; Environment International, 94, p. 150-160 (disponible en anglais seulement).
Venier M., Dove A., Romanak K., Backus S. et Hites R.; 2014; Flame Retardants and Legacy Chemicals in Great Lakes' Water; Environ. Sci. Technol., 48(16), p. 9563-72 (disponible en anglais seulement).
Venier M. et Hites R.A.; 2008; Flame Retardants in the Atmosphere near the Great Lakes; Environ. Sci. Technol., 4, p. 4745-4751 (disponible en anglais seulement).
Venier M., Salamova A. et Hites R.A.; 2015; Halogenated Flame Retardants in the Great Lakes Environment; Acc. Chem. Res., 48 (7), p. 1853-1861 (disponible en anglais seulement).
Venier M., Wierda M., Bowerman M. et Hites R.A.; 2010; Flame retardants and organochlorine pollutants in bald eagle plasma from the Great Lakes region; Chemosphere, 80, p. 1234-1240 (disponible en anglais seulement).
Vorkamp K., Bossi R., Riget F.F., Skov H. et Sonne C.; 2015; Novel brominated flame retardants and dechlorne plus in Greenland air and biota; Environmental Pollution, 196, p. 284-289 (disponible en anglais seulement).
Wang D.G., Guo M.X., Pei W., Byer J.D. et Wang Z.; 2015; Trophic magnification of chlorinated flame retardants and their dechlorinated analogs in a fresh water food web; Chemosphere, 118, p. 293-300 (disponible en anglais seulement).
Wang L., Jia H., Liu X., Yang M., Hong W., Sun Y., Su Y., Qi H., Song W., Lin J. et Li Y.; 2012; Dechloranes in a river in northeastern China: spatial trends in multi-matrices and bioaccumulation in fish (Enchelyopus elongatus); Ecotoxicology and Environmental Safety, 84, p. 262-267 (disponible en anglais seulement).
Wang D.G., Yang M., Qi H., Sverko E., Ma W.L., Li Y.F., Alaee M., Reiner E.J. et Shen L.; 2010; An Asia-Specific Source of Dechlorane Plus: Concentration, isomer profiles, and other related compounds; Environ. Sci. Technol., 44, p. 6606-6613 (disponible en anglais seulement).
Wania F.; 2006; Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic; Environ. Sci. Technol., 40, p. 569-577 (disponible en anglais seulement).
[WATERNT] Water Solubility Program [Estimation Model]; 2010; v. 1.01; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Webster E., Mackay D., Di Guardo A., Kane D. et Woodfine D.; 2004; Regional differences in chemical fate model outcome; Chemosphere, 55, p. 1361-1376 (disponible en anglais seulement).
Weil E.D. et Levchik S.V.; 2009; Flame Retardants for Plastics and Textiles: Practical Applications; Cincinnati (Ohio) : Hanser Publishers, 297 p. (disponible en anglais seulement).
Wilson R., Jones-Otazo H., Petrovic S., Mitchell I., Bonvalot Y., Williams D. et Richardson G.M.; 2013; Revisiting dust and soil ingestion rates based on hand-to-mouth transfer; Human and Ecological Risk Assessment, 19(1), p. 158-188 (disponible en anglais seulement).
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [Modèle d’estimation]; 2010; v. 1.42; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
Wu B., Liu S., Guo X., Zhang Y., Zhang X., Li M. et Cheng S.; 2012; Responses of mouse liver to dechlorane plus exposure by integrative transcriptomic and metabonomic studies; Environ. Sci. Technol., 46(19), p. 10758-64 (disponible en anglais seulement).
Wu J.P., Zhang Y., Luo X.J., Wang J., Chen S.J., Guan Y.T. et Mai B.X.; 2010; Isomer-Specific Bioaccumulation and Trophic Transfer of Dechlorane Plus in teh Freshwater Food Web from a Highly Contaminated Sites, South China; Environ. Sci. Technol., 44, p.606-611 [cité dans EPA HCD] (disponible en anglais seulement).
Xian Q., Siddique S., Li T., Feng Y.L., Takser L. et Zhu J.; 2011; Sources and environmental behavior of dechlorane plus – A review; Environ. Int., 37, p. 1273‑84 (disponible en anglais seulement).
Xiao H., Shen L., Yushan S., Barresi E., DeJong M., Hung H., Lei Y., Wania F., Reiner E., Sverko E. et al.; 2012; Atmospheric concentrations of halogenated flame retardants at two remote locations: the Canadian high arctic and the Tibetan Plateau; Environ. Pollut., 161, p. 154-161 (disponible en anglais seulement).
Xiao R., Adolfsson-Erici M., Akerman G., McLachlan M.S. et MacLeod M.; 2013; A benchmarking method to measure dietary absorption efficiency of chemicasl by fish; Environ. Toxicol. Chem., 32(12), p. 2695-2700 (disponible en anglais seulement).
Yan X., Zheng J., Chen K.H., Yang J., Luo X.J., Yu L.H., Chen S.J., Mai B.X. et Yang Z.Y.; 2012; Dechlorane plus in serum from e-waste recycling workers: influence of gender and potential isomer-specific metabolism; Environment International, 49, p. 31-37 (disponible en anglais seulement).
Yang M., Jia H., Ma W., Qi H., Cui S. et Li Y.; 2012; Levels, compositions, and gas-particle partitioning of polybrominated diphenyl ethers and dechlorane plus in air in a Chinese northeastern city; Atmos. Environ., 55, p. 73-79 (disponible en anglais seulement).
Yang Q., Qiu X., Li R., Liu S., Li K., Wang F. et Zhu T.; 2013; Exposure to typical persistent organic pollutants from an electronic waste recycling site in Northern China; Chemosphere, 91(2), p. 205-211 (disponible en anglais seulement).
Yang R.Q., Wei H., Guo J.H., McLeod C., Li A. et Sturchio N.C.; 2011; Historically and Currently Used Dechloranes in the Sediments of the Great Lakes; Environ. Sci. Technol., 45, p. 5156-5163 (disponible en anglais seulement).
Yang Y., Ji F., Cui Y. et Li M.; 2016; Ecotoxicological effects of earthworm following long-term Dechlorane Plus exposure; Chemosphere, 144, p. 2476‑2481 (disponible en anglais seulement).
Yu L., Luo X., Zheng X., Zeng Y., Chen D. et Wu J.; 2013; Occurrence and biomagnification of organohalogen pollutants in two terrestrial predatory food chains; Chemosphere, 93(3), p. 506-511 (disponible en anglais seulement).
Yu Y., Hung H., Alexandrou N., Roach P. et Nordin K.; 2015; Multiyear measurements of flame retardants and organochlorine pesticides in air in Canada’s western sub-Arctic; Environ. Sci. Technol., 49, p. 8623-8630 (disponible en anglais seulement).
Zhang H., Wang P., Li Y., Shang H., Wang Y., Wang T., Zhang Q. et Jiang G.; 2013; Assessment on the occupational exposure of manufacturing workers to dechlorane plus through blood and hair analysis; Environ. Sci. Technol., 47(18), p. 10567-73 (disponible en anglais seulement).
Zhang L.J., Ji F.N., Li M., Cui Y.B. et Wu B.; 2014; Short-term effects of Dechlorane Plus on the earthworm Eisenia foetida determined by a systems biology approach; J. Hazard Mater., 273, p. 239-246 (disponible en anglais seulement).
Zhang Y., Wu J.P., Luo X.J., Sun Y.X., Mo L., Chen S.J. et Mai B.X.; 2011b; Tissue distribution and its dechlorinated analogs in contaminated fish : high affinity for anti-DP; Environmental Pollution, 159, p. 3647-3652 (disponible en anglais seulement).
Zheng J., Wang J., Luo X.J., Tian M., He L.Y., Yuan J.G., Mai B.X. et Yang Z.Y.; 2010; Dechlorane Plus in human hair from an e-waste recycling area in South China: comparison with dust; Environ. Sci. Technol., 44(24), p. 9298-303 (disponible en anglais seulement).
Zhou S.N., Siddique S., Lavoie L., Takser L., Abdelouahab N. et Zhu J.; 2014; Hexachloronorbornene-based flame retardants in humans: Levels in maternal serum and milk; Environ. Int., 66, p. 11-17 (disponible en anglais seulement).
Zhu J., Feng Y.L. et Shoeib M.; 2007; Detection of Dechlorane Plus in residential indoor dust in the city of Ottawa, Canada; Environ. Sci. Technol., 41(22), p. 7694-7698 (disponible en anglais seulement).
Zitko V.;1980; The uptake and excretion of mirex and dechloranes by Atlantic salmon; Chemosphere, 9, p. 73-78 (disponible en anglais seulement).
Annexe A : Identité structurelle
| No CAS | Autres noms |
|---|---|
| 13560-89-9 | 1,2,3,4,7,8,9,10,13,13,14,14-Dodécachloro-1,4,4a,5,6,6a,7,10,10a,11,12,12a-dodécahydro-1,4:7,10-diméthanodibenzo[a,e]cyclooctène; Bis(hexachlorocyclopentadièno)cyclooctane Dodécachlorodiméthanodibenzocyclooctane DDCDiMeDiBzcOb Déchlorane A Déchlorane Plus Déchlorane Plus 1000 Déchlorane Plus 25 Déchlorane Plus 2520 Déchlorane Plus 35 Déchlorane Plus 515 Dech Plus Dodécachlorododécahydrodiméthanodibenzocyclooctane; Dodécachlorododécahydrodiméthanodibenzocyclooctène |
Sélection d’analogues et utilisation de modèles (Q)SAR
Les analogues utilisés pour étayer les sections sur la toxicité dans les sédiments et le sol de la présente évaluation environnementale sont présentés dans le tableau 2-2. Le DP est un substitut au produit ignifuge mirex (également appelé Déchlorane, no CAS 2385-85-5), et le mirex a donc été identifié comme analogue potentiel. Le chlordane a également été identifié par la Boîte à outils QSAR de de l'OCDE comme analogue ayant une structure et une fonction similaires et pour lequel des données sur la toxicité dans les sédiments et le sol étaient disponibles. Le DP, le chlordane, et le mirex (ainsi que d’autres « déchloranes ») sont tous synthétisés de façon similaire à partir de l’hexachlorocyclopentadiène, et ils devraient se comporter de façon similaire dans l'environnement (p. ex. répartition dans le sol et les sédiments, stabilité/persistance, etc.) (Environnement Canada 1977).
Bien que les indices pour les analogues puissent varier sur le plan de la similarité prédite (DP et Chlordane le sont de 59,14 [Indice de similarité Tanimoto] à 92,7 % [similarité structurelle de Chem ID], le mirex et DP le sont de 67,35 [similarité structurelle de Chem ID] à 68,94 % [indice de similarité Tanimoto]), les structures (p. ex. poids moléculaire, degré de chloration) et les profils de réactivité appuient l'idée selon laquelle ces substances sont des analogues appropriés pour l'écotoxicité des sols ou des sédiments. L'utilisation du chlordane et du mirex comme analogues pour la toxicité est probablement prudente, car ces deux substances sont davantage biodisponibles et, donc, probablement plus toxiques que le DP (au moins pour les organismes aquatiques) en raison de leur solubilité dans l’eau plus grande. Par conséquent, l’utilisation ces analogues a été jugée appropriée pour représenter le DP pour la partie ayant trait à l'évaluation des effets environnementaux (pour les organismes vivant dans les sédiments ou le sol).
Bien que le mirex n'ait jamais été homologué pour une utilisation comme pesticide au Canada, il a été utilisé à travers le monde entier comme insecticide d'ingestion (formulé dans des appâts), pour la lutte contre les fourmis et d’autres insectes ravageurs, et comme produit ignifuge dans des matières plastiques, le caoutchouc, des peintures, le papier et des produits électriques (Environnement Canada 2014, PISSC 1984). Le mirex est inscrit sur la Liste des substances toxiques (Annexe 1) de la Loi canadienne sur la protection de l'environnement (1999) [LCPE], et est réglementé en vertu du Règlement de 1989 sur le mirex.
Le chlordane est un pesticide organochloré qui était utilisé au Canada entre le milieu des années 1940 et les années 1980, mais son homologation et son utilisation en vertu de la Loi sur les produits antiparasitaires ont été abandonnées en 1991 (CCME 1999). Le chlordane est inscrit sur la Liste des substances toxiques (Annexe 1) de la LCPE.
Le chlordane existe sous plusieurs formes isomères, les plus communes étant les formes (cis) et (trans) (EPA 1979). Le nom chimique en nomenclature de l'UICPA du chlordane est le 1,2,4,5,6,7,8,8-octachloro-3a,4,7,7a-tétrahydro-4,7-méthanoindane. Le chlordane technique est un mélange de plus de 140 hydrocarbures chlorés (ATSDR 1989a). Le chlordane de qualité technique est composé d’environ 24 % d'isomère g, de 19 % d'isomère a, de 10 % d'heptachlor, de 21 % d'isomères du chlordène, de 7 % de nonachlor et de 18,5 % de composés chlorés connexes (Environnement Canada 1998).
Annexe B : Propriétés physiques et chimiques
Les propriétés physiques et chimiques du DP ont été vérifiées aux fins d'uniformité interne, en suivant la procédure d'ajustement par la méthode des moindres carrés (AMC) (Schenker et al. 2005). Pour ce faire, la moyenne géométrique ou arithmétique (pour les log des coefficients de partage) des valeurs disponibles pour chaque paramètre physicochimique (pression de vapeur, solubilité dans l’eau, solubilité dans l'octanol, log Koe, log Koa et log Kae) a été utilisée comme intrant dans le modèle. Des valeurs de sous-refroidissement ont été utilisées pour la pression de vapeur, la solubilité dans l’eau et la solubilité dans l'octanol. Les valeurs utilisées pour déterminer ces moyennes représentent les valeurs indépendantes les plus fiables disponibles tirées de données empiriques et de données modélisées (tableau B-1; pour toutes les valeurs physiques et chimiques, consulter le tableau B-2). En déterminant l'uniformité interne de ces propriétés, le modèle AMC produit également des valeurs prédites (tableau B-1).
Bien que des estimations basées sur des données expérimentales de la solubilité dans l’eau et de la pression de vapeur existent pour le DP, une incertitude subsiste quant à ces valeurs. Aux fins de la présente évaluation, la valeur du log Koe de 8,78 calculée au moyen de la méthode AMC a été retenue. Afin de maintenir l'uniformité interne des valeurs des propriétés physiques et chimiques, les valeurs obtenues au moyen de la méthode AMC pour la solubilité dans l’eau et la pression de vapeur ont également été prises en compte. Les valeurs finales retenues sont résumées dans le tableau 2-1. Généralement, le DP se caractérise par une solubilité dans l’eau très faible, une pression de vapeur faible à très faible et des coefficients de partage carbone organique-eau et octanol-eau très élevés.
| Source des données | Pression de vapeur (Pa) | Solubilité dans l’eau (mol/m3) | Solubilité dans l'octanol (mol/m3) | log Koe | log Kae | log Koa |
|---|---|---|---|---|---|---|
| Valeurs expérimentales DP | PD | 6,12 x10-8 | 4,67 x10-7d | PD | PD | PD |
| Valeurs expérimentales DP | PD | 3,81 x10-7 | 0,719 | PD | PD | PD |
| Modèle EPI Suite (pas d'intrant) | 1,53 x10-9 | 6,77 x 10-13a | PD | 11,27 | -3,52 | 14,79 |
| Modèle EPI Suite | 1,01 x10-8 | 1,0 x 10-9b | PD | PD | PD | PD |
| Modèle EPI Suite | 3,57 x10-11 | PD | PD | PD | PD | PD |
| VCC/AGLOG | PD | 1,28 x 10-6 | PD | 8,29 | PD | PD |
| ACD/Percepta | PD | 7,65 x 10-7 | PD | 9,36 | PD | PD |
| Moyenne géométrique/ Intrants moyensc,e AMC (valeur pour le liquide sous-refroidi entre parenthèses) | 8,20 x 10-10 (1,35 x 10-6) | 1,58 x 10-8 (2,60 x 10-5) | 5,79 x 10-4 (9,52 x 10-1) | 9,64 | -3,52 | 14,79 |
| Extrant moyene AMC (valeurs pour le liquide sous-refroidi entre parenthèses) | (6,57 x 10-11) | 7,18 x 10-7 (4,36 x 10-10) | 430 (2,62 x 10-1) | 8,78 | -4,42 | 12,99 |
| % d’ajustement | -92 | -97 | 45 071 | -80 | -86 | -98 |
a WSKOWWIN 2010
b WATERNT 2010 (méthode des fragments)
c Moyenne arithmétique de log calculée puisque équivalente à la moyenne géométrique des valeurs antilog (des coefficients de partage)
d Afin d'optimiser l'indépendance des estimations de paramètres, les valeurs modélisées fondées sur la valeur de log Koe de l'utilisateur n'ont pas été incluses dans le calcul de moyenne géométrique de la solubilité dans l’eau.
e Toutes les sources de données du tableau B-2 (noter de la conversion des unités pour la solubilité dans l’eau) autres que la solubilité dans l’octanol (EPA 2009 et ECHA 2013a). Les valeurs individuelles énumérées sont des valeurs à l’état solide pour la solubilité dans l’eau, la pression de vapeur et la solubilité dans l’octanol; les moyennes/moyennes géométriques des intrants et des extrants AMC pour l’état liquide sous-refroidi sont entre parenthèses sous l’intrant.
PD = pas de donnée
| Propriété | Type | Valeura | Température (°C) | Référence |
|---|---|---|---|---|
| État physique | Expérimental | Poudre blanche cristalline | NA | Occidental Chemical Company 2004 |
| Point de fusion (°C) | Expérimental | > 325 | NA | Merck Index 2001, EPA 2009 |
| Point de fusion (°C) | Expérimental | 350 | NA | EPA 2009 |
| Point de fusion (°C) | Modélisé | 349,84 | NA | MPBPWIN 2010 |
| Point de fusion (°C) | Modélisé | 170,60 | NA | MPBPWIN 2010 (méthode de Joback adaptée) |
| Point de fusion (°C) | Modélisé | 260,22 (valeur moyenne) | NA | MPBPWIN 2010 (méthode de Gold et Ogle) |
| Point d'ébullition (°C) | Modélisé | 486,83 Non pertinente; devrait se dégrader avant l’ébullition | NA | MPBPWIN 2010 |
| Masse volumique (kg/m3) | Expérimental | 1,8 (1,8 g/cm3) 38-42 lb/pi3 (0,61-0,67 g/cm3) (DP-515 et DP-25) |
NA | EPA 2009 |
| Masse volumique (kg/m3) | Expérimental | 25-30 lb/pi3 (0,4-0,48 g/cm3) (DP-35) |
NA | EPA 2009 |
| Pression de vapeur (Pa) | Expérimental | 0,8 (6 x 10-3 mm Hg) |
200 | EPA 2009 |
| Pression de vapeur (Pa) | Modélisé | 1,53 x10-9 (1,15 x 10-11 mm Hg) |
25 | MPBPWIN 2010 (méthode de Grain modifiée) |
| Pression de vapeur (Pa) | Modélisé | 1,01 x10-8 (7,59 10-11 mm Hg) |
25 | MPBPWIN 2010 (méthode MacKay) |
| Pression de vapeur (Pa) | Modélisé | 3,57 x10-11 (2,68 x 10-13 mm Hg) |
25 | MPBPWIN 2010 (méthode Antoine) |
| Pression de vapeur (Pa) | Modélisé | 1,08 x 10-7 (liquide sous‑refroidi) |
25 | Extrant AMC Schenker et al. 2005 |
| Pression de vapeur (Pa) | Modélisé | 6,57 x10-11 (solide; non sous-refroidi)b |
25 | Extrant AMC Schenker et al. 2005 |
| Constante de Henry (Pa.m3/mol) | Modélisé | 0,754 (7,44 x 10-6 atm·m3/mole, 3,04 x 10-4 sans unité) (log Kae = -3,52) |
25 | HENRYWIN 2011 (méthode d'estimation fondée sur les liaisons) |
| Constante de Henry (Pa.m3/mol) | Modélisé | 1,3b (log Kae = -3,28) |
25 | AMC Schenker et al. 2005 |
| log Koe (sans dimension) | Modélisé | 11,27 | 25 | KOWWIN 2010 |
| log Koe (sans dimension) | Modélisé | 8,29 | 25 | ALOGPS 2.1 VCCLAB 2005 |
| log Koe (sans dimension) | Modélisé | 9,36 | 25 | ACD/Percepta 1997-2012 |
| log Koe (sans dimension) | Modélisé | 8,78b | 25 | Extrant AMC Schenker et al. 2005 |
| log Kco (sans dimension) | Expérimental/ estimé | 6,653 | NS | Chou et al. 1979 |
| log Kco (sans dimension) | Modélisé | 7,68 (estimé à partir de l'ICM) 7,76d |
NS | KOCWIN 2010 |
| log Koa (sans dimension) | Modélisé | 14,79c | 25 | KOAWIN 2010 |
| log Koa (sans dimension) | Modélisé | 12,46d | 25 | KOAWIN 2010 |
| log Koa (sans dimension) | Modélisé | 12,99b | 25 | AMC Schenker et al. 2005 |
| Solubilité dans l’eau (mg/L) | Expérimental | 0,249 mg/L (249 ppb; moyenne de 197 ppb et 301 ppb) |
25 | Scharf DJ. 1978 |
| Solubilité dans l’eau (mg/L) | Expérimental | ~4,0 x 10-5 mg/L (207 ng/L et 572 ng/L pour les deux isomères)e |
22 | Chou et al. 1979g |
| Solubilité dans l’eau (mg/L) | Expérimental | < 1,67 x 10-6f | 20 | ECHA 2013b |
| Solubilité dans l’eau (mg/L) | Modélisé | 4,42 x 10-10c | 25 | WSKOWWIN 2010 |
| Solubilité dans l’eau (mg/L) | Modélisé | 7,64 x 10-6d | 25 | WSKOWWIN 2010 |
| Solubilité dans l’eau (mg/L) | Modélisé | 6,54 x 10-7 | 25 | WATERNT 2010 |
| Solubilité dans l’eau (mg/L) | Modélisé | 8,4 x 10-4 | 25 | ALOGPS 2.1 VCCLAB 2005 |
| Solubilité dans l’eau (mg/L) | Modélisé | 5,0 x 10-4 | 25 | ACD/Percepta de 1997 à 2012 |
| Solubilité dans l’eau (mg/L) | Modélisé | 4,69 x 10-4 (liquide sous-refroidi)b |
25 | Extrant AMC Schenker et al. 2005 |
| Solubilité dans l’eau (mg/L) | Modélisé | 2,85 x 10-7 (solide; c.-à-d. non sous‑refroidi) |
25 | Extrant AMC Schenker et al. 2005 |
Abréviations : log Koe = coefficient de partage octanol-eau; log Kco = coefficient de partage carbone organique-eau; log Koa = coefficient de partage octanol-air; pKa = constante de dissociation acide; NA = non applicable
a Les valeurs entre parenthèses représentent les valeurs originales rapportées par les auteurs ou estimées au moyen des modèles.
b Pour la méthode d'ajustement des moindres carrés (AMC), voir le tableau B-1 pour une liste des valeurs utilisées.
c log Koe utilisé = 11,27 (KOWWIN).
d logKoe utilisé = 8,78 (méthode AMC).
e EPA (2009) HPV (ensemble de données de l'IUCLID du 7 novembre 2008) a indiqué que le résultat indirect de l'expérience de partage sédiments-eau a suggéré que la solubilité était d'environ 44 ng/L (total pour les deux isomères). Cette valeur inférieure a également été considérée comme la meilleure estimation de la solubilité dans l’eau.
f Le résumé du rapport sur la solubilité dans l’eau de l’ECHA (2013b) a été publié après l’analyse des données et la modélisation aux fins de l’évaluation du DP. Par conséquent, il n’a pas été inclus dans la méthode d’ajustement des moindres carrés (AMC) pour déterminer les propriétés physiques et chimiques retenues. Cependant, l’ECHA (2013b) a rapporté un résultat très semblable à la valeur de solubilité dans l’eau AMC retenue pour la modélisation faite pour la présente évaluation et jugé approprié aux fins de l’évaluation finale.
| Propriété | Pression de vapeur (Pa) | log Koe | log Kco | Solubilité dans l’eau(mg/L) |
|---|---|---|---|---|
| Chlordane | 1,0 x 10-5 | 5,2-6,0 | 4,78 | 0,56 |
| Mirex | 1 x 10-4 | 6,89 | 6 | 0,085 |
a Propriétés physiques et chimiques telles que citées par Environnement Canada (1998).
b Propriétés physiques et chimiques expérimentales telles que présentées dans Episuite (2000-2012).
Annexe C : Estimations de l'absorption journalière de DP par divers groupe d'âge de la population générale du Canada
| Voie d'exposition | 0-6 moisa allaitésb | 0-6 mois nourris à la préparationc | 0-6 mois non nourris à la préparationd | 0,5-4 anse | 5-11 ansf | 12-19 ansg | 20-59 ansh | ≥ 60 ansi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | 1,2E-05 | 1,2E-05 | 1,2E-05 | 2,6E-05 | 2,0E-05 | 1,1E-05 | 9,7E-06 | 8,4E-06 |
| Air ambiantk | 9,5E-05 | 9,5E-05 | 9,5E-05 | 2,0E-04 | 1,6E-04 | 9,0E-05 | 7,8E-05 | 6,8E-05 |
| Eau potablel | s.o. | 1,5E-06 | 5,6E-07 | 6,3E-07 | 4,9E-07 | 2,8E-07 | 2,9E-07 | 3,1E-07 |
| Alimentsm | 5,5E-03 | 1,1E-03 | 2,9E-03 | 7,7E-03 | 6,6E-03 | 3,8E-03 | 2,9E-03 | 2,3E-03 |
| Poussièren | 7,7E-04 | 7,7E-04 | 7,7E-04 | 4,0E-04 | 1,5E-04 | 5,6E-06 | 5,4E-06 | 5,3E-06 |
| Solo | s.o. | s.o. | s.o. | 5,3E-05 | 4,0E-05 | 1,4E-06 | 1,3E-06 | 1,2E-06 |
| Absorption totale | 6,4E-03 | 1,9E-03 | 3,7E-03 | 8,3E-03 | 6,9E-03 | 3,9E-03 | 3,0E-03 | 2,4E-03 |
Abréviations : s.o. = sans objet.
a On assume que le nourrisson pèse 7,5 kg, respire 2,1 m3 d'air par jour (Santé Canada 1998) et ingère respectivement 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b On assume que le nourrisson allaité exclusivement consomme 0,742 L de lait maternel par jour (Santé Canada 1998). La concentration au 95ème percentile de DP total (0,054 ng/g poids ph) dans les échantillons de lait maternel (n = 102) recueillis en 2008-2009 auprès de femmes de Sherbrooke, Québec, Canada (Zhou et al. 2014; communication personnelle de l'EHSRB, Santé Canada, datée du 15 mai 2014), multipliée par une masse volumique du lait maternel de 1,03 g/mL (convertie à 0,06 ug/L) a été retenue pour le calcul de la limite supérieure d'absorption journalière de DP due au lait maternel.
c On assume que le nourrisson nourri à la préparation exclusivement consomme 0,8 L d'eau par jour (Santé Canada 1998), eau utilisée pour reconstituer la préparation. Pour plus de détails, consulter la note de bas de page sur les aliments, ainsi que la note de bas de page sur l'eau.
d On assume que le nourrisson non nourri à la préparation exclusivement consomme 0,7 L d'eau par jour, 45,1 g de produits céréaliers par jour et 99,1 g de plats préparés et de soupes par jour (Santé Canada 1998). Environ 50 % des enfants non nourris au lait maternisé ont commencé à manger des aliments solides à 4 mois, et 90 % ont commencé à 6 mois (Santé et Bien-être social Canada 1990).
e On assume que l'enfant pèse 15,5 kg, respire 9,3 m3 d'air par jour, boit 0,7 L d'eau par jour, consomme 54,7 g de poisson par jour, 162,2 g de produits céréaliers par jour et 149,1 g de plats préparés et de soupes par jour (Santé Canada 1998), et qu'il ingère respectivement 41 et 14 mg de poussière et de sol par jour (Wilson et al. 2013).
f On assume que l'enfant pèse 31,0 kg, respire 14,5 m3 d'air par jour, boit 1,1 L d'eau par jour, consomme 89,8 g de poisson par jour, 290,1 g de produits céréaliers par jour et 180,0 g de plats préparés et de soupes par jour (Santé Canada 1998), et qu'il ingère respectivement 31 et 21 mg de poussière et de sol par jour (Wilson et al. 2013).
g On assume que l'adolescent pèse 59,4 kg, respire 15,8 m3 d'air par jour, boit 1,2 L d'eau par jour, consomme 97,3 g de poisson par jour, 320,9 g de produits céréaliers par jour et 213,0 g de plats préparés et de soupes par jour (Santé Canada 1998), et qu'il ingère respectivement 2,2 et 1,4 mg de poussière et de sol par jour (Wilson et al. 2013).
h On assume que l'adulte pèse 70,9 kg, respire 16,2 m3 d'air par jour, boit 1,5 L d'eau par jour, consomme 111,7 g de poisson par jour, 248,4 g de produits céréaliers par jour, et 220,5 g de plats préparés et de soupes par jour (Santé Canada 1998), et qu'il ingère respectivement 2,5 et 1,6 mg de poussière et de sol par jour (Wilson et al. 2013).
i On assume que l'adulte pèse 72,0 kg, respire 14,3 m3 d'air par jour, boit 1,6 L d'eau par jour, consomme 72,9 g de poisson par jour, 229,0 g de produits céréaliers par jour, et 213,8 g de plats préparés et de soupes par jour (Santé Canada 1998), et qu'il ingère respectivement 2,5 et 1,5 mg de poussière et de sol par jour (Wilson et al. 2013).
j La concentration maximale de 340 pg/m3, mesurée dans la région des Grands Lacs (île Burnt, Ontario, Hung et al. 2014), a été retenue pour estimer la limite supérieure d'absorption journalière due à l'air ambiant. Il est assumé que les Canadiens passent 3 heures par jour à l’extérieur (Santé Canada 1998).
k La concentration maximale de DP total (316 pg/m3, n = 23) dans l’air intérieur à Toronto, Ontario, Canada (Venier et al. 2016), a été retenue pour estimer la limite supérieure d’absorption due à l’air intérieur. Il est assumé que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada 1998).
l Aucune donnée de surveillance de l'eau potable n’a été trouvée. La concentration moyenne de DP de 13,9 pg/L dans le lac Ontario, la plus élevée parmi celles des Grands Lacs (Venier et al. 2014), a été retenue pour estimer la limite supérieure d'absorption journalière due à l'eau potable.
m Aucune donnée de surveillance dans les aliments commercialisés au Canada n’a été trouvée. Cependant, des données sur trois catégories d'aliments pour bébés ont été trouvées pour des échantillons collectés aux États-Unis (Liu et al. 2014). Les concentrations maximales de DP dans des préparations pour nourrissons (83,2 pg/g ph), des céréales (427 pg/g ph) et des purées (23,6 pg/g ph) vendues aux États-Unis ont été retenues pour estimer la limite supérieure d'absorption journalière des nourrissons due à des préparations (groupe nourri à la préparation pour nourrissons seulement), des produits céréaliers (nourrissons non nourris à la préparation et tous les groupes d'âge supérieur) et des plats préparés et des soupes (nourrissons non nourris à la préparation et tous les groupes d'âge supérieur), respectivement. La limite supérieure de la concentration moyenne de 0,85 ng/g ph (7,2 ng/g pl) chez le touladi du lac Ontario (Ismail et al. 2009) a été retenue pour estimer la limite supérieure d'absorption journalière due à tous les produits alimentaires liés au poisson du groupe des aliments aquacoles. Les quantités d'aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d'âge ont été tirées de l'Enquête sur la nutrition au Canada de 1970-1972 (Santé Canada 1988).
n La concentration de DP total au 95ème percentile (152,1 ng/g, n= 498) de l'étude de base canadienne (communication personnelle du BRSSE de Santé Canada datée du 5 juin 2017) a été retenue pour estimer la limite supérieure d'absorption journalière due à la poussière.
o Aucune donnée de surveillance des sols en Amérique du Nord n’a été trouvée. Par conséquent, la concentration environnementale estimée (CEE) maximale dans le sol de 59 000 ng/g ps (0,059 mg/kg ps) a été retenue pour estimer la limite supérieure d'absorption journalière due au sol.
Annexe D : DP dans la poussière domestique
| Emplacement | Type d'échantillon | Année d'échantillonnage | Taille de l'échantillon | Médiane [gamme] (ng/g) | P95 (ng/g) | Référence |
|---|---|---|---|---|---|---|
| Divers, Canada | Aspirateur | 2007-2010 | 498 | 14,4 [< LDM (1,2 ng/g pour syn‑DP; 1,9 ng/g pour anti‑DP) à 2508] | 152,1 | Kubwabo et al. 2017 (non publié) |
| Ottawa, Ontario, Canada | Aspirateur | 2002-2003 | 69 | 14 [2,3-182]a | 121 | Zhu et al. 2007 |
| Ottawa, Ontario, Canada | Aspirateur | 2007 | 7 | 22 [14-61] | 60 | Zhu et al. 2007 |
| Vancouver (C.‑B.), Canada | Aspirateur | 2007-2008 | 116 | 6,8 [< 0,8-354] | 57,7 | Shoeib et al. 2012 |
| Toronto, (Ontario), Canada (TI) | Aspirateur | 2010-2011 | 5 | 8,2 (moyenne) [LD à 35] |
NS | Diamond et al. 2013 |
| Toronto (Ontario), Canada | Aspirateur | 2012 | 20 | 30,9 (moyenne) [< 0,010- 170] |
NS | Diamond et al. 2013 |
| Toronto (Ontario), Canada | Aspirateur | 2013 | 34 (de 23 habitations) | 22 [ND-732] | NS | Venier et al. 2016 |
| Californie, États-Unis | Surfaces des aires de vie | 2006 | 16 | 10 [3-47] | NS | Dodson et al. 2012 |
| Californie, États-Unis | Surfaces des aires de vie | 2011 | 16 | 4,5 [< 2-15] | NS | Dodson et al. 2012 |
| Boston, États‑Unis | Aspirateur | 2002-2003 | 38 | 13,1 [NS-111,5] | 44,4 (P90) | Johnson et al. 2013 |
Guangzhou, Chine (urbain) |
Surfaces des aires de vie | 2008-2009 | 27 | 13,8 [2,78-70,4] | 62,2 | Wang et al. 2011 |
| Région rurale, Chine | Surfaces des aires de vie | 2008-2009 | 20 | 3,95 [ND-27,1] | 26,8 | Wang et al. 2011 |
Yuangtan (Chine) (rural) |
Surfaces des aires de vie | NS | 10 | 64,9 (moyenne) [32,6-118] |
NS | Zheng et al. 2010 |
Yuangtan (Chine) (urbain) |
Surfaces des aires de vie | NS | 27 | 18,9 (moyenne) [2,78-70,4] |
NS | Zheng et al, 2010 |
Abréviations : P95 = 95ème percentile;
P90 = 90ème percentile;
NS = non spécifié; ND = non détecté;
TI = Étude pilote poussée de Toronto
a À l'exclusion d'une valeur extrême de 5683 ng/g.
Annexe E : DP dans le lait maternel
| Emplacement | Année d'échantillonnage | n | Gamme (ng/g pl) | Médiane (ng/g pl) | P95 (ng/g pl) | Référence |
|---|---|---|---|---|---|---|
| Sherbrooke, Québec, Canada | 2008-2009 | 105 | < 0,01-15 | 0,074 | 3,5 | Zhou et al. 2014 |
| Kingston, Ontario, Canada | 2003-2004 | 39 | < 0,05-6,4 | 0,74 | 3,4 | Siddique et al. 2012 |
| Sherbrooke, Québec, Canada | 2008-2009 | 48 | < 0,05-8 | 0,58 | 2,1 | Siddique et al. 2012 |
| Wenling, Chine; groupe fortement exposé | 2010-2011 | 44 | 1,01-590 | 4,46 | NS | Ben et al. 2013 |
| Wenling, Chine; groupe faiblement exposé | 2010-2011 | 44 | 0,83-8,05 | 2,19 | NS | Ben et al. 2013 |
Abréviations : pl = poids de lipides; P95 = 95ème percentile; n = nombre d'échantillons; NS = non spécifié
Annexe F : DP dans des matrices biologiques
| Emplacement | Année d'échantillonnage; n | Gamme (ng/g pl) |
Moyenne (ng/g pl) | P95 (ng/g pl) | Référence |
|---|---|---|---|---|---|
| Sherbrooke, Québec, Canada | 2008-2009; 102 | ND-81 | 2,39 | 31,6 | Zhou et al. 2014 |
| Besançon, France | 2003-2005; 48 | ND-7,04 | 1,20 | NS | Brasseur et al. 2014 |
| Région d'Oslo, Norvège | 46 | ND-31 | 1,3 | NS | Cequier et al. 2014 |
| Wenling, Chine; groupe fortement exposé | 2010-2011; 48 | Maternel : 1,28-900 Placenta : 0,92-197 Ombilical : 0,680-89,7 | 8,43 3,21 2,82 | NS | Ben et al. 2014 |
| Wenling, Chine; groupe faiblement exposé | 2010-2011 | Maternel : 1,69-11,6 Placenta : 0,459-2,86 Ombilical : 0,450-27,2 | 3,55 1,09 1,82 | NS | Ben et al. 2014 |
| Ville de Guiyu, Chine (travailleur de l'industrie du désassemblage de déchets électroniques) | 2005 | 7,8-465 | 42,6 | NS | Ren 2009 |
| Haojiang, Chine (travailleurs de l'industrie de la pêche) | 2005 | 0,93-50,5 | 13,7 | NS | Ren 2009 |
| Tianjin, Chine (groupe exposé de travailleurs et de résidents locaux) | 2009 et 2010; 35 | 4,21-12,4 | 6,29 | Yang et al. 2013 | |
| Tianjin, Chine (groupe témoin, à proximité des usines de recyclage de déchets électroniques, mais ne participant pas au désassemblage) | 2009 et 2010; 21 | 0,53-1,79 | 1,06 | NS | Yang et al. 2013 |
Abréviations : pl = poids de lipides; P95 = 95ème percentile; n = nombre d'échantillons; ND = non détecté; NS = non spécifié
