Évaluation préalable groupe de certaines substances ignifuges organiques 1,1’-(éthane-1,2-diyl)bis[pentabromobenzène] décabromodiphényléthane (DBDPE)
Titre officiel : Évaluation préalable groupe de certaines substances ignifuges organiques 1,1’-(Éthane-1,2-diyl)bis[pentabromobenzène] Décabromodiphényléthane (DBDPE)
Numéro de registre du Chemical Abstracts Service 84852-53-9
Environnement et Changement climatique Canada Santé Canada
Mai 2019
No de cat. : En14-370/2019F-PDF
ISBN 978-0-660-30244-7
Sommaire
Conformément à l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable du 1,1’-(éthane-1,2-diyl)bis[pentabromobenzène]. Cette substance, communément connue sous le nom de décabromodiphényléthane ou DBDPE, est répertoriée à l’aide du numéro de registre du Chemical Abstracts Service (no CAS) 84852-53-9. Cette substance fait partie du groupe de certaines substances ignifuges organiques du Plan de gestion des produits chimiques du Canada. Ce groupe est constitué de dix substances organiques ayant une fonction similaire, soit l’application à des matériaux en vue de retarder leur inflammation et la propagation du feu. Le DBDPE a été identifié d’intérêt prioritaire pour une évaluation sur la base de préoccupations pour l’environnement identifiées grâce au Programme sur les substances nouvelles de la LCPE. Bien que cette substance ne figure pas sur la Liste intérieure (LIS), elle est commercialisée au Canada depuis la période de transition entre l’établissement de la LIS et l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) (entre le 1er janvier 1987 et le 1er juillet 1994).
D’après les données d’une enquête menée en vertu de l’article 71 de la LCPE et des données obtenues grâce au Programme sur les substances nouvelles, la quantité de DBDPE importée au Canada en 2011 se situait entre 1 000 000 à 10 000 000 de kg, y compris le DBDPE sous forme pure, dans des formulations et dans des produits commerciaux ou des disponibles pour les consommateurs. Le DBDPE est utilisé au Canada en tant qu’additif ignifuge dans de nombreuses applications, comme des matériaux en matière plastique ou en caoutchouc, des équipements électroniques et électriques, des adhésifs et des produits d’étanchéité.
Le DBDPE n’est pas présent naturellement dans l’environnement. Globalement, les sources d’exposition au DBDPE sont principalement les circuits de déchets ou les effluents d’usines de production ou de traitement qui utilisent le DBDPE comme additif ignifuge, mais aussi les rejets provenant de produits disponibles pour les consommateurs ou de produits commerciaux. Le DBDPE est devenu important sur le plan commercial depuis le début des années 1990 en raison de ses propriétés ignifuges et, plus récemment, comme produit de remplacement du décabromodiphényléther (décaBDE), une substance ignifuge à la structure similaire.
Généralement, le DBDPE a une très faible solubilité dans l’eau, une faible pression de vapeur et des coefficients de partage carbone organique-eau et octanol-eau très élevés. Un analogue ayant une structure proche, le décaBDE, a été utilisé pour obtenir certaines propriétés physiques et chimiques par lecture croisée, ainsi que pour prédire son comportement dans l’environnement. Le DBDPE a été mesuré dans l’environnement au Canada ainsi qu’à l’échelle internationale, les concentrations les plus élevées étant relevées près des zones urbaines et/ou industrielles. Lorsqu’il est rejeté dans l’environnement, le DBDPE devrait demeurer principalement dans le sol et/ou les sédiments. Le transport de la substance liée à des particules peut contribuer à son transport sur de grandes distances et à son dépôt dans des zones éloignées.
Des données expérimentales et des données modélisées indiquent que la biodégradation aérobie (y compris en présence de plantes) et la dégradation anaérobie du DBDPE est limitée et que cette substance devrait être persistante dans l’eau, le sol et les sédiments. Une transformation limitée du DBDPE a aussi été observée lors d’applications à haute température ou du recyclage. Une photodégradation du DBDPE pouvant être rapide dans des solvants a été rapportée lors d’études, mais plus lente dans d’autres matrices/substrats, et les prédictions modélisées de dégradation atmosphérique suggèrent que le DBDPE est persistant dans l’air (demi‑vie en phase gazeuse supérieure à 4 jours). Même si la dégradation du DBDPE devrait être lente ou limitée, il existe une incertitude quant aux produits de dégradation finaux dans l’environnement. Des produits potentiels de dégradation du DBDPE ont été évalués sur la base de prédictions tirées d’études de photodégradation, de modélisation de la biodégradation/métabolisme, ainsi qu’en tenant compte de données sur l’analogue décaBDE. La débromation du DBDPE devrait se poursuive à partir des nonabromodiphényléthanes et des octabromodiphényléthanes (BDPE) avec formation BDPE a sept, six et cinq atomes de brome (similaires au décaBDE), ou conduire à une voie de nonaBDE hydroxylée. Compte tenu de l’absence de données expérimentales, une modélisation QSAR (relation quantitative structure-activité) a été effectuée pour évaluer les caractéristiques de ces produits potentiels de dégradation du DBDPE. La modélisation préliminaire indique que les produits de dégradation du DBDPE peuvent être considérés comme des analogues des polybromodiphényléthers (PBDE) moins bromés et qu’ils seront persistants, bioaccumulables dans certains cas et potentiellement très toxiques pour les organismes aquatiques. Il a été conclu lors de l’évaluation préalable des PBDE ayant trait à l’environnement (juin 2006) que les PBDE moins bromés, à savoir le tétraBDE, le pentaBDE et l’hexaBDE, satisfont aux critères du Règlement sur la persistance et la bioaccumulation de la LCPE.
Il existe des données empiriques limitées sur l’accumulation du DBDPE dans le biote, mais ces données combinées aux propriétés physiques et chimiques de cette substance indiquent un faible potentiel de bioaccumulation dans des organismes.
D’après des tests de toxicité chronique dans le sol, le DBDPE peut causer des effets sur la reproduction des lombrics à des concentrations élevées, ainsi que sur la survie et la croissance de plantes. Aucun effet n’a été observé jusqu’à la dose testée la plus élevée (5000 mg/kg) chez des organismes vivant dans les sédiments lors de tests de toxicité chronique. Aucune valeur critique de toxicité dans l’eau (pélagique) n’a été déterminée pour le DBDPE lors de la présente évaluation, en raison de résultats incertains lors de tests aquatiques. Les sédiments et les sols sont considérés plus pertinents pour évaluer l’exposition au DBDPE, en raison de sa forte hydrophobie et de son devenir attendu dans l’environnement.
Le DBDPE devrait être rejeté dans l’environnement au Canada suite à des activités de traitement industrielles. L’utilisation du DBDPE comme additif dans des produits suggère que des émissions diffuses peuvent provenir de produits commerciaux ou de produits disponibles pour les consommateurs et que, même s’il y a des incertitudes, la vitesse d’émission est supposé faible par rapport à celle de sources industrielles ponctuelles au cours de l’intégration de cette substance dans des produits. Des scénarios industriels (tenant compte des renseignements disponibles sur le site), avec rejet de DBDPE dans l’eau et le sol et répartition prévue dans les sédiments, ont été utilisés pour estimer l’exposition. Des analyses du quotient de risque, intégrant des estimations prudentes de l’exposition et des renseignements sur la toxicité, ont été effectuées pour les milieux sédimentaires et terrestres (sol et faune). Ces analyses ont montré que les risques actuellement posés par le DBDPE lui-même sont faibles.
Compte tenu du manque de renseignements sur la quantité des produits de transformation du DBDPE au Canada, une analyse de quotient de risque n’a pas été faite pour ces produits. Toutefois, les résultats de cette analyse sont cohérentes avec les préoccupations contenues dans le Rapport sur l’état des connaissances scientifiques écologiques concernant le décabromodiphényléther de 2010 selon lesquelles le DBDPE devrait se transformer en produisant des substances moins bromées d’une manière analogue à celle du décaBDE. Les produits de dégradation, prédits nocifs pour l’environnement, devraient représenter une fraction mineure comparativement au DBDPE d’origine. Cependant, ils constituent une fraction similaire aux fractions prédites/mesurées de produits de débromation de l’analogue décaBDE. Si les niveaux de DBDPE dans l’environnement continuent d’augmenter (p. ex., en raison de son utilisation comme produit ignifuge de substitution), l’ensemble des produits de dégradation bromés potentiels pourrait devenir important.
Compte tenu de tous les éléments de preuves avancés dans la présente évaluation préalable du DBDPE et du potentiel de persistance, de bioaccumulation et de toxicité intrinsèque de ses produits de dégradation, il existe un risque que le DBDPE ait des effets nocifs sur l’environnement. Il est conclu que le DBDPE satisfait aux critères de l’alinéa 64(a) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique. Toutefois, il est conclu que le DBDPE ne satisfait pas aux critères de l’alinéa 64(b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
Aucune classification des effets du DBDPE sur la santé par des organismes de réglementation nationaux ou internationaux n’a été trouvée. Aucune étude sur la toxicité chronique ou la cancérogénicité du DBDPE n’a été identifiée. D’après les renseignements disponibles sur la génotoxicité, le DBDPE n’est pas jugé génotoxique. Aucun effet nocif n’a été observé lors d’études sur la toxicité subchroniques chez des animaux. Lors de deux études distinctes sur la toxicité pour le développement, aucun effet sur la mère ni sur le développement lié au traitement n’a été observé chez les animaux de laboratoire exposés à du DBDPE par voie orale. Il existe des données limitées de biosurveillance chez les humains.
Les doses les plus élevées testées sur des animaux de laboratoire, pour lesquelles aucun effet lié au traitement n’a été observé, sont six à sept ordres de grandeur supérieures aux estimations d’exposition au DBDPE de la population générale du Canada due aux milieux de l’environnement ou aux produits disponibles pour les consommateurs. Cette marge est considérée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Sur la base de ces éléments, il est conclu que le DBDPE ne satisfait pas aux critères de l’alinéa 64(c) de la LCPE.
Conclusion générale
Il est conclu que le DBDPE satisfait à un ou plusieurs des critères de l’article 64 de la LCPE.
Il a aussi été déterminé que le DBDPE satisfait aux critères de persistance, mais non à ceux de bioaccumulation, du Règlement sur la persistance et la bioaccumulation de la LCPE. Toutefois, le DBDPE peut contribuer à la formation dans l’environnement, de produits de dégradation persistants, bioaccumulables ou intrinsèquement toxiques, comme des BDPE moins bromés.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE, Canada 1999], les ministres de l’Environnement et de la Santé ont procédé dans le cadre du Plan de gestion des produits chimiques à l’évaluation préalable d’une des dix substances collectivement appelées groupe de certaines substances ignifuges organiques, afin de déterminer si elle présente ou peut présenter un risque pour l’environnement ou la santé humaine.
L’Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances qui ont été déclarées prioritaires pour une évaluation, car elles satisfaisaient aux critères de catégorisation en vertu de l’article 73 de la LCPE ou étaient considérées comme prioritaires en raison de préoccupations relatives à l’environnement ou à la santé (Environnement Canada et Santé Canada 2007). Toutes ces substances présentent une fonction similaire qui est l’application sur des matériaux en vue d’empêcher l’ignition et la propagation du feu. Ces substances sont des substituts potentiels d’autres produits ignifuges qui sont actuellement soumis à des contrôles réglementaires ou à un retrait progressif au Canada ou à l’échelle mondiale. La présente évaluation préalable vise le 1,1’-(éthane -1,2-diyl)bis[pentabromobenzène] ou décabromodiphényléthane (DBDPE) (NR CAS 84852-53-9).
Étant donné que le DBDPE ne figure pas sur la Liste intérieure des substances (LIS), en vertu de la LCPE (Canada, 2005), il est soumis au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères). Des évaluations des risques liés aux substances nouvelles pour la santé humaine et l’environnement vont valoir des préoccupations écologiques, et DBDPE est ainsi soupçonné d’être « toxique » au sens de la LCPE. Le DBDPE est commercialisé au Canada depuis la période de transition entre l’établissement de la LIS et l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles (entre le 1er janvier 1987 et le 1er juillet 1994). Des mesures de gestion des risques (c.-à-d. des conditions ministérielles) ont été imposées aux déclarants de substances nouvelles afin d’atténuer les risques potentiels pour l’environnement.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que des renseignements supplémentaires soumis par les intervenants. Nous avons relevé des données pertinentes jusqu’en janvier 2017 pour l’évaluation écologique et l’évaluation en matière de santé humaine. Suite à une soumission d’une partie intéressée, des renseignements ciblés ont été ajoutés jusqu’en avril 2019 dans la partie de la présente évaluation ayant trait à l’environnement. Des données empiriques obtenues d’études clés, des données d’analogues ainsi que certains résultats provenant de modèles ont servi à formuler les conclusions proposées. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
La présente évaluation préalable a été rédigée par le personnel du Programme de l’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada (ECCC) et elle intègre les résultats d’autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’un examen externe par écrit par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques liées à l’environnement ont été reçus de la part de Jon Arnot (Arnot Research and Consulting), de John Biesemier (Chemtura), d’Adrian Covaci (Université d’Anvers), de Miriam Diamond (Université de Toronto), et de Marcia Hardy (Albemarle). Des commentaires sur les parties techniques liées à la santé humaine ont été reçus de la part de Michael Jayjock de LifeLine group, de Paul Rumsby du U.S. National Centre for Environmental Toxicology, et de Pam William d’E Risk Sciences. De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires par le public de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
La présente évaluation préalable repose sur des renseignements permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné les renseignements scientifiques et suivi une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page 1 . La présente évaluation préalable contient des renseignements critiques et décrit les éléments pris en compte pour formuler la conclusion proposée.
2. Identité des substances
Le 1,1’-(éthane -1,2-diyl)bis[pentabromobenzène] ou décabromodiphényléthane (DBDPE) est un produit ignifuge organique faisant partie du groupe des produits ignifuges organiques dans le cadre de l’Initiative des groupes de substances du Plan de gestion des produits chimiques. L’identité structurelle de cette substance est présentée dans le tableau 2-1. D’autres noms pour cette substance sont présentés à l’annexe A (tableau A-1). Aux de la présente évaluation, le décabromodiphényléthane sera désigné par son acronyme DBDPE.
| NR CAS | Structure chimique | Masse moléculaire (g/mol) | Formule chimique |
|---|---|---|---|
| 84852-53-9 | 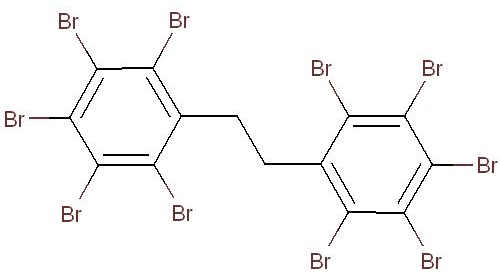 |
971,23 | C14H4Br10 |
2.1 Sélection des analogues et utilisation de modèles de relations quantitatives structure-activité [RQSA]
Des directives sur l’utilisation d’une technique de lecture croisée et de modèles de relations quantitatives structure-activité [R(Q)SA] pour combler les lacunes dans les données ont été élaborées par diverses organisations telles que l’Organisation de coopération et de développement économiques (OCDE). Ces méthodes ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l’Union européenne (UE). Dans la présente évaluation, nous avons utilisé des données déduites à partir d’analogues et les résultats de modèles RQSA, le cas échéant, pour éclairer les évaluations des effets sur la santé humaine et l’environnement. Un analogue a été sélectionné pour sa structure et sa fonction similaires à celles du DBDPE (p. ex., ses propriétés physiques et chimiques et son devenir environnemental) et à cause des données empiriques pertinentes connues qui pouvaient être appliquées à la technique de lecture croisée et compléter l’ensemble de données des propriétés physicochimiques du DBDPE. Ainsi, nous avons déterminé l’applicabilité des modèles RQSA au cas par cas. Les données déduites à partir d’analogues et les modèles RQSA choisis pour éclairer les évaluations des effets du DBDPE sur la santé humaine et l’environnement sont traités de façon plus approfondie dans les sections pertinentes du présent rapport.
Le tableau 2-2 présente l’analogue utilisé pour éclairer l’évaluation des effets sur l’environnement. Le décabromodiphényléther (décaBDE) constitue à un analogue à structure proche de celle du DBDPE (p. ex., coefficient de Dice de 85,1 %, Boîte d’outil RQSA, OCDE 2012), et il est jugé adéquat pour l’analyse de certaines propriétés physiques et chimiques (p. ex., coefficient de partage octanol-eau [log Koe], hydrosolubilité, pression de vapeur) ainsi que les données sur le DBDPE mesurées et estimées (annexe B). Le décaBDE est traité tout au long de cette évaluation, notamment en comparant son comportement avec celui du DBDPE (p. ex., dégradation, transport à grande distance, potentiel de bioaccumulation et écotoxicité). Toutefois, on note entre les deux substances certaines différences en termes de composition moléculaire, de dimensions et de configurations, qui peuvent influer sur le mode d’interaction de ces molécules avec leur environnement (Albemarle 2016, communications du fabricant à Environnement Canada en 2014, source non citée). Lorsque l’on compare les deux substances, le pont éthane entre les deux anneaux aromatiques du DBDPE (plutôt que le pont éther du décaBDE) devrait le rendre légèrement plus hydrophobe que le décaBDE, et on prévoit qu’il donnera à la molécule une plus grande flexibilité de conformation (Covaci et al. 2011). Selon Albemarle (2016), la débromation du DBDPE (une voie de dégradation) exige plus d’énergie que celle du décaBDE.
| Substance (no CAS) | Nom de la substance | Masse moléculaire (g/mol) | Structure empirique/ formule moléculaire |
|---|---|---|---|
| 1163-19-5 | Décabromodiphényléther (décaBDE) | 959 171 |  C12Br10O C12Br10O |
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques définissent les caractéristiques globales d’une substance et sont utilisées afin de déterminer la pertinence de différentes substances pour divers types d’application. De telles propriétés jouent également un rôle clé dans la détermination du devenir dans l’environnement des substances (y compris leur potentiel de transport à grande distance), ainsi que leur toxicité pour les humains et les organismes non humains. Le tableau 3-1 résume les valeurs expérimentales, modélisées et principales liées aux propriétés physiques et chimiques du DBDPE, qui se rapportent à son devenir dans l’environnement et à son écotoxicité. Un tableau détaillé des propriétés physiques et chimiques du DBDPE (valeurs empiriques et modélisées) ainsi qu’un résumé des propriétés physiques et chimiques des analogues sont présentés à l’annexe B.
Le DBDPE a été jugé adaptable à un modèle de prévisions de propriétés physiques et chimiques fondé sur des relations quantitatives structure-activité, car il s’inscrit dans le domaine d’applicabilité pertinent (c.-à-d. que les domaines de paramètres liés à la structure ou aux propriétés sont représentés dans la base de calibration utilisée pour les modèles).
Les propriétés physiques et chimiques du DBDPE ont été vérifiées aux fins d’uniformité interne, conformément au procédé d’ajustement par la méthode des moindres carrés (Schenker et al., 2005). Nous avons utilisé des moyennes géométriques ou arithmétiques (pour les variables logarithmiques) des valeurs les plus fiables et les plus indépendantes relevées dans les données empiriques, les données modélisées et les données d’analogues pour déterminer les valeurs d’entrée dans l’ajustement par la méthode des moindres carrés (annexe B, tableaux B-1 et B-2). Les valeurs ajustées pour les liquides sous-refroidis comprenaient des valeurs d’entrée liées à l’hydrosolubilité, à la pression de vapeur et à la solubilité dans l’octanol (Schenker et al., 2005). En déterminant l’uniformité interne des propriétés, le modèle d’ajustement selon la méthode des moindres carrés produit également des valeurs prévues. Tandis que des données expérimentales liées au log Koe, à l’hydrosolubilité et à la pression de vapeur existent pour le DBDPE, une incertitude subsiste quant à ces valeurs, notamment la valeur expérimentale du log Kow de 3,55 (p. ex., Stieger, 2014). Aux fins de la présente évaluation, la valeur de log Koe de 9,89 calculée par ajustement selon la méthode des moindres carrés a été sélectionnée. Afin de maintenir l’uniformité interne des valeurs de propriétés physiques et chimiques, les valeurs obtenues par ajustement selon la méthode des moindres carrés pour l’hydrosolubilité et la pression de vapeur ont également été prises en compte. Les valeurs finales sélectionnées sont résumées au tableau 3-1.
Généralement, le DBDPE se caractérise par une hydrosolubilité très faible, une pression de vapeur faible à très faible ainsi qu’un coefficient de partage carbone organique-eau et un coefficient de partage octanol-eau tous deux très élevés.
| Propriété | Valeurs expérimentales | Valeurs modélisées | Valeur choisie pour la modélisationc |
|---|---|---|---|
| État physique | Poudre blanc cassé | s.o. | s.o. |
| Point de fusion (°C) | 345 à 355 | 259,7 | 345 |
| Point d’ébullition (°C) | s.o. – se dégrade avant ébullition | 600,9 | s.o. |
| Masse volumique (kg/m3) | 868 à 3250 (tassée) | s.o. | s.o. |
| Pression de vapeur (Pa) | ~1 × 10-6a – < 1 × 10-4 | 2,85 × 10-16 à 5,59 × 10-10 | 5,59 × 10-10 (liquide sous-refroidi : 8,21 × 10-7) |
| Constante de Henry (Pa m3/mol) | s.o. | 2,59 × 10-4 – [6,71 × 10-2 | 6,51 × 10-3 – 6,71 × 10-2 |
| log Koe (sans dimension) | ~3,55 b, 8,7a | 7,86 à 13,64 | 9,89 |
| log Kco (sans dimension) | s.o. | 6,38 à 8,58 | 8,58 |
| log Koa (sans dimension) | s.o. | 14,45 à 19,22 | 14,45 |
| Solubilité dans l’eau (mg/L) | < 1 × 10-4a – 7,2 × 10-4 | 7,34 × 10-10 – 2,15 × 10-2 | 8,10 × 10-6 (liquide sous-refroidi : 1,19 × 10-2) |
| pKa | s.o. | s.o. | s.o. |
a Valeur en données déduites à partir d’analogues découlant de l’analogue décaBDE.
b Valeur expérimentale estimée du log Koe (3,55) jugée très incertaine et, par conséquent, non incluse dans la valeur moyenne du Koe pour l’ajustement selon la méthode des moindres carrés.
c Consulter l’annexe B, tableau B-2, pour des détails sur les valeurs de propriétés physiques et chimiques et des références.
4. Sources
On n’a trouvé dans les publications aucune mention de la présence naturelle du DBDPE dans l’environnement. Les sources d’exposition au DBDPE sont anthropiques, comprenant principalement des flux de déchets ou des effluents d’usines de fabrication et de systèmes de traitement qui utilisent le DBDPE comme additif ignifuge, de même des rejets issus de produits commerciaux ou offerts aux consommateurs dans l’environnement.
Le DBDPE est devenu important sur le plan commercial depuis le début des années 1990 en tant que produit ignifuge à part entière et, plus récemment, en tant que produit de substitution du décaBDE commercial (Kierkegaard et al., 2004, Covaci et al., 2011; EFSA, 2012). Les fabricants nord-américains de décaBDE ont progressivement arrêté la production, l’importation et la vente de la substance en 2012, en collaboration avec l’Environmental Protection Agency des États-Unis et ECCC (BSEF, env. 2001-2015). Des efforts gouvernementaux sont toujours mis en œuvre pour limiter la fabrication, l’importation et l’utilisation de décaBDE (Environnement Canada, env. 2006-2013). Au Canada, la gestion des risques liés au décaBDE se fonde sur des préoccupations concernant la transformation du décaBDE en polybromodiphényléthers (PBDE) moins bromés, comprenant les tétraBDE, les pentaBDE et les hexaBDE, qui sont des substances jugées très persistantes et bioaccumulables (Environnement Canada, 2010, Canada, env. 2006-2013).
Étant donné qu’au Canada, le DBDPE ne figure pas sur la Liste intérieure des substances (LIS), il est visé par le Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères), en vertu de la LCPE. Les renseignements obtenus par une enquête menée en vertu de l’article 71 de la LCPE, et les données obtenues par le Programme de déclaration de substances nouvelles, la quantité totale de DBDPE importée au Canada en 2011 variait de 1 000 000 à 10 000 000 kg, y compris le DBDPE présent dans certains produits. On n’a relevé aucune quantité de DBDPE fabriquée au Canada. La quantité totale de DBDPE exportée à partir du Canada en 2011 était inférieure à 100 000 kg (Canada 2005, ECCC 2013-2014).
À l’échelle mondiale, la fabrication de DBDPE est signalée aux États-Unis (Covaci et al., 2011, USEPA, 2012). Dans ce pays, le DBDPE est une substance chimique figurant à l’inventaire régi par la Loi américaine réglementant les substances toxiques (Toxic Substances Control Act, TSCA) et elle est soumise à un Règlement sur les nouvelles utilisations importantes (Significant New Use Rule, SNUR). En 2012, entre 22 720 000 et 45 450 000 kg (soit 50 à 100 millions de livres) de DBDPE étaient produits ou importés par les États-Unis (USEPA, 2012). Selon le rapport des données sur les produits chimiques de l’USEPA (2012), cinq entreprises ont été recensées comme producteurs ou importateurs de DBDPE aux États-Unis.
On n’a recensé aucune quantité de DBDPE fabriquée en Europe (Environment Agency, 2007). Même si le DBDPE est défini comme un produit chimique à faible volume de production (inférieur à 1 000 000 kg/an) sur le site Web du système européen d’information sur les produits chimiques (European Chemical Substances Information Systems, ESIS 1995-2012, consulté en mars 2014), d’autres sources indiquent que la quantité de la substance utilisée en Europe pourrait être supérieure. Par exemple, la quantité de DBDPE utilisée en Europe a été estimée à 2 500 000 kg/an, avec des tendances de données qui laissent entendre une hausse de la consommation de la substance (Environment Agency, 2007), principalement en Allemagne (Covaci et al., 2011). La base de données des pays nordiques sur les substances dans les préparations (SPIN) (consultée en avril 2014) a indiqué des utilisations de DBDPE en 2006 et de 2008 à 2011 en Suède, avec une quantité variant de 5000 à 39 000 kg/an (SPIN, 2006). La substance est définie comme un produit chimique à fort volume de production sur le site Web des substances chimiques existantes de l’OCDE (consulté en mars 2014).
La quantité de DBDPE récemment produite (p. ex., 2006) en Chine a été déclarée comme variant de 11 000 000 à 12 000 000 kg/an (Shi et al., 2009, Zhang et al., 2009). Shi et al. (2009) indiquent que la Chine est devenue un important fabricant de produits ignifuges bromés au cours des dernières décennies.
5. Utilisations
Le DBDPE est fabriqué par la bromation directe du diphényléthane (Weil et Levchik 2009) et est commercialisé dans le monde entier sous différentes appellations commerciales (annexe A, tableau A-1). La substance est déclarée comme étant relativement pure; sa qualité commerciale varie généralement entre 96 % et 98,5 % (par poids) de pureté, avec la partie restante comprenant principalement les congénères nonabromodiphényléther (1 à 3 % en poids) et octabromodiphényléther (moins de 1 % par poids) (Chemtura, 2005, Environment Agency, 2007, Albemarle, 2008, 2013 et 2016).
Étant donné qu’au Canada, le DBDPE ne figure pas sur la Liste intérieure des substances, il est soumis au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères), en vertu de la LCPE (Canada, 2005). De récentes mesures de gestion des risques (c.-à-d. des conditions ministérielles) fondées sur des évaluations du risque écologique lié aux substances nouvelles ont limité l’importation du DBDPE aux fins d’utilisation en tant que composé ignifuge des revêtements de fils et de câbles, des pièces et des revêtements thermoplastiques et thermodurcissables. La substance est également soumise à des restrictions en matière de rejet et d’élimination (Canada 2004, 2011). D’après les renseignements soumis en vertu de l’article 71 de la LCPE (Canada, 2013) et ceux soumis en vertu du Règlement sur les renseignements concernant les substances nouvelles [conditions ministérielles 13228 et 16260] (Canada 2004, 2011), le DBDPE est utilisé au Canada comme produit ignifuge dans les applications suivantes : les matériaux en plastique et en caoutchouc tels que des pièces et des revêtements thermoplastiques et thermodurcissables (aux fins d’utilisation dans des résines et des plastiques en polymère), les composants électriques et électroniques, y compris des appareils, des revêtements de fils et de câbles pour le secteur des télécommunications, les automobiles, les aéronefs et le transport, les adhésifs et les produits d’étanchéité, et la fabrication de produits chimiques organiques de base. On a également déclaré l’utilisation de DBDPE dans la fabrication du tissu des coussins de sécurité gonflables et, plus généralement, dans les véhicules à moteur (ECCC 2013-2014). On s’attend à ce que les taux de charge typiques en DBDPE des polymères soient similaires à ceux du décaBDE, soit de 10 % à 15 % par poids (Environment Agency, 2007).
À l’échelle internationale, on utilise le DBDPE comme produit de substitution du décaBDE. Il est donc utilisé dans des applications similaires, comme la fabrication de produits en plastique (y compris des résines polyester et vinylester) et en caoutchouc, et comme additif dans des textiles, tels que le coton et le polyester (Covaci et al., 2011). La substance est également utilisée dans des polymères destinés à des applications électroniques et électriques ainsi que dans des adhésifs et des produits d’étanchéité (EFSA, 2012). La documentation de fabricants indique que le DBDPE est approprié pour une utilisation dans des systèmes où le recyclage mécanique est prévu, en raison de sa stabilité thermique impressionnante et des faibles caractéristiques d’efflorescence (c.-à-d. la migration des additifs vers la surface du matériau au fil du temps) des résines finies (Albemarle, 2007). Le fabricant soutient également que la forte teneur en brome du DBDPE lui confère une forte résistance aux flammes, pour une charge d’ignifugeant moins élevée que celle nécessaire pour d’autres substances. Il indique que l’on peut en retrouver dans les dispositifs électroniques, les fils et les câbles, dans les immeubles où le courant électrique est présent et dans plusieurs utilisations liées aux transports (Albemarle, 2016).
Des renseignements issus d’études européennes ont indiqué que, en Europe et au Royaume-Uni, le DBDPE est principalement utilisé comme produit ignifuge pour les polymères (en tenant compte d’au moins 90 % du tonnage fourni). La quantité restante devrait être principalement utilisée pour les textiles (Environment Agency, 2007). Les données issues de la base de données SPIN sur l’utilisation de DBDPE en 2006 et de 2008 à 2011 en Suède indiquent que toutes les utilisations de la substance s’inscrivent dans la catégorie de la fabrication de produits en caoutchouc ou en plastique (notamment de produits ignifuges et d’agents extincteurs). Pour la Finlande, des données indiquent l’utilisation de DBDPE aux fins de fabrication d’autres matériaux de transport (notamment des adhésifs et des agglomérants).
Actuellement, le DBDPE est le deuxième additif ignifuge bromé le plus utilisé en Chine, avec une production augmentant de 80 % par année (Covaci et al., 2011). Ce phénomène est probablement lié à la croissance rapide des industries électrique et électronique du pays au cours des dernières décennies (Shi et al., 2009). Au Japon, l’utilisation du DBDPE est susceptible de remplacer celle du décaBDE (Watanabe dg Sakai 2003, Covaci et al., 2011). En effet, l’utilisation du DBDPE a continuellement augmenté au Japon de 1993 à 2000, tandis que la consommation de décaBDE a baissé au cours de la même période (de Wit et al., 2011).
Le DBDPE ne figure pas comme additif alimentaire approuvé dans les listes des additifs alimentaires autorisés qui sont incorporées par référence dans leur autorisation respective de commercialisation émise en vertu de la Loi sur les aliments et drogues (Santé Canada, modifié en 2017). Il n’a pas non plus été défini comme étant utilisé ou présent dans des formulations de matériaux d’emballage des aliments ou comme additif accidentel (courriel de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada, août 2013, source non citée). De plus, le DDBPE n’est inscrit ni dans la base de données sur les produits pharmaceutiques, ni dans la base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu’ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, les produits de santé naturels ou les médicaments vétérinaires au Canada (BDPP [modifié en 2017]; BDIPSN [modifié en 2016]; BDIPSN [modifié en 2017]; courriel de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau de gestion du risque de Santé Canada, juillet 2013, source non citée). Selon les notifications soumises en vertu du Règlement sur les cosmétiques à Santé Canada, le DBDPE n’est pas utilisé dans les produits cosmétiques au Canada (courriel de la Direction de la sécurité des produits de consommation de Santé Canada, adressé au Bureau de l’évaluation des risques des substances existantes de Santé Canada en juillet 2013; source non citée).
Le DBDPE n’est pas présent dans un produit homologué réglementé par la Loi sur les produits antiparasitaires (courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada adressé au Bureau de gestion du risque de Santé en mai 2012, source non citée).
Avec la réglementation accrue et l’arrêt progressif de la production de polybromodiphényléthers (PBDE), on s’attend à une hausse de la production et l’utilisation de DBDPE (Ricklund et al., 2008).
6. Rejets dans l’environnement
Les rejets anthropiques dans l’environnement dépendent de différentes pertes qui surviennent pendant la fabrication, l’utilisation industrielle, l’utilisation commerciale ou par les consommateurs, la durée de vie utile, et l’élimination de la substance. Les rejets de DBDPE dans l’environnement canadien, dus à l’utilisation de la substance comme additif ignifuge, devraient provenir de sources ponctuelles (p. ex., usines de traitement, fabrication de produits) ainsi que d’autres sources diffuses. Des rejets peuvent se produire tant dans l’environnement intérieur que dans l’environnement extérieur.
Selon de récentes déclarations faites conformément à l’article 71 de la LCPE et des documents techniques accessibles au public, le DBDPE est importé au Canada sous forme pure, en formulation et dans des produits commerciaux ou des produits offerts aux consommateurs. (Canada, 2013, CCC, 2011).
Les rejets de DBDPE dans l’environnement sont le plus susceptibles de survenir au cours de la fabrication, de la formulation ou de l’utilisation industrielle. Les rejets dans l’environnement devraient, quant à eux, se produire par l’intermédiaire des eaux usées, avec certains rejets provenant de sites industriels et finissant directement dans l’eau. Des données canadiennes sur les effluents et les biosolides dans les eaux usées montrent que les systèmes publics de traitement des eaux usées ayant des intrants industriels proportionnellement plus élevés (p. ex. supérieurs à 30 %) affichent des concentrations de DBDPE plus élevées (p.ex., dix fois plus élevées) que les installations traitant principalement des intrants d’influents ménagers (non industriels) (Kim et al., 2014, Melymuk et al., 2014). Des rejets dans le sol pourraient se produire pendant l’épandage de biosolides d’eaux usées sur des terres agricoles et des pâturages.
La migration du DBDPE depuis des produits commerciaux et des produits offerts aux consommateurs ou du DBDPE présent sous forme d’additif ignifuge bromé mélangé avec un produit polymérique (plutôt qu’un produit ignifuge réactif chimiquement lié à produit polymérique) constitue un risque de rejet dans l’environnement (Guerra et al., 2011). On a proposé que le DBDPE pût être rejeté dans l’air ou la poussière par volatilisation ou par abrasion d’un produit contenant la substance (Melymuk et al., 2014), ce qui peut entraîner le dépôt de DBDPE dans le sol et l’eau et des rejets aux systèmes publics de traitement des eaux usées.
Même si le DBDPE à une faible volatilité, ses émissions atmosphériques (p. ex., découlant de particules en suspension dans l’air, de poussière ou de rejets issus de produits) pourraient entraîner des dépôts atmosphériques dans le sol et l’eau. Par exemple, une tendance accrue de concentrations de DBDPE dans des sédiments d’étang à proximité d’installations de fabrication de produits chimiques a été attribuée au transport de la substance par le mouvement de l’air et par des particules en suspension dans l’air (Wei et al., 2012). Lorsqu’une substance est transférée vers les terres, elle peut se lier au sol, pénétrer dans les égouts ou les eaux de surface par lessivage, ou être transférée par le vent ou la pluie vers le sol proche.
Enfin, bien que la majorité des sites d’enfouissement du Canada traitent leur lixiviat dans un système public de traitement des eaux usées, ceux qui ni ne collectent ni ne traitent leur lixiviat pourraient rejeter des substances dans le sol ou l’eau de surface (par l’entremise des lixiviats) ou, même si peu probable, il pourrait y avoir des rejets de substances dans l’atmosphère par l’intermédiaire de gaz de sites d’enfouissement qui ne collectent ni ne détruisent leurs gaz d’enfouissement.
Cette information ainsi que les renseignements sur le devenir dans l’environnement sont utilisés pour développer davantage les scénarios de caractérisation de l’exposition afin d’estimer les concentrations environnementales qui en découlent.
7. Concentrations environnementales mesurées
La mesure et l’analyse de substances très hydrophobes comme le DBDPE dans les milieux naturels présentent des défis, notamment la très faible solubilité dans l’eau et les solvants organiques, la tendance à s’adsorber aux particules et aux solides (p. ex., organismes et parois d’enceinte), la dégradation durant le nettoyage et l’application de la méthode instrumentale, et plus généralement, le manque d’expertise en matière d’analyse de la substance (Breitholtz et al., 2006, Kierkegaard et al., 2009). Le DBDPE est un produit ignifuge bromé difficile à analyser; ainsi, le taux d’incertitude quant à cette substance peut atteindre 40 % à 60 % selon l’étalon interne utilisé pour la quantification (communication d’A. Covaci adressée à Environnement Canada en 2014, source non citée). À ce jour, la plupart des études ont analysé le DBDPE par chromatographie en phase gazeuse couplée à la spectrométrie de masse impliquant l’ion bromure. De plus, à l’instar des autres substances chimiques « émergentes », on ne dispose pas de méthodes analytiques établies pour détecter, identifier et quantifier les produits de la transformation du DBDPE dans les matrices environnementales (Dirtu et al. 2014, Lambropoulou et Nollet 2014).
Le DBDPE a été détecté dans l’environnement canadien ainsi que dans d’autres pays, généralement à de faibles concentrations. Les plus fortes concentrations de DBDPE ont tendance à être relevées près des zones urbaines ou industrielles (tableaux 7-1 et 7-2, ECCC et SC 2017).
Peu d’études ont signalé la présence de DBDPE dans l’air. Des échantillons d’air et de précipitations ont été prélevés tous les 12 jours à cinq sites près des Grands Lacs d’Amérique du Nord, de 2003 à 2011. Sur la base de données du Réseau de mesure des dépôts atmosphériques (RMDA), Ma et al. (2013) ont déclaré des concentrations atmosphériques moyennes globales de DBDPE (vapeur + particules) de 1,2 à 5,2 pg/m3 pour les cinq sites (la fréquence de détection variait de 8 à 54 %), avec les plus fortes concentrations relevées près de zones urbaines (augmentant en fonction de la population). Vernier et Hites (2008) ont évalué des données antérieures sur les mêmes sites et déterminé une concentration moyenne maximale d’environ 22 pg/m3 près d’une zone urbaine (Cleveland), mais des concentrations plus faibles dans une zone éloignée (Eagle Harbour, Michigan, environ 1 pg/m3, données tirées de graphique).
Dans l’Arctique canadien (calotte glaciaire Devon, Nunavut), du DBDPE a été détecté au niveau de certains puits à neige; cependant, les schémas de concentration n’ont pas montré de tendances temporelles de dépôt claires (Meyer et al., 2012), et les concentrations [non détectées (ND) à 24 pg/L (détectée seulement deux fois)] étaient, en moyenne, inférieures à celles qui avaient été déclarées dans l’Arctique norvégien. Du DBDPE a été mesuré dans des précipitations dans la zone des Grands Lacs, avec des concentrations moyennes de 256 à 1440 pg/L entre 2003 et 2009 (Salmova et Hites, 2010 et 2011).
À ce jour, seule l’étude de Venier et al. (2014) a retrouvé du DBDPE dans des eaux de surface canadiennes, soit des concentrations moyennes à l’échelle du bassin des Grands Lacs allant de 0,25 ± 0,05 pg/L (lac Huron) à 10,8 pg/L (lac Ontario). Ces auteurs ont relevé une concentration de DBDPE de 6,7 pg/L dans le lac Supérieur. Toutefois, cette valeur a été influencée par la station d’échantillonnage près du centre urbain fortement industrialisé de Thunder Bay (Ontario). D’autres études des eaux de surface canadiennes n’ont cependant pas détecté de DBDPE (Law et al., 2006, Muir et al. 2011).
Tandis qu’aucune mesure du DBDPE dans le sol n’a été déclarée pour le Canada ou l’Amérique du Nord, la substance a été mesurée et détectée dans le sol en Asie (p. ex. 1,13 [terres agricoles] à 1612 ng/g p.s. (terres industrialisées d’un site de recyclage de déchets électroniques) pour la Chine (Lin et al., 2015).
Des concentrations de DBDPE dans des sédiments ont été déclarées pour les Grands Lacs (de 0,11 à ~200 ng/g p.s.) (Kolic et al., 2009, Yang et al., 2012). Une récente étude sur des carottes de sédiments des Grands Lacs (Canada et États-Unis) a déclaré des concentrations de DBDPE dans des sédiments de surface allant de 0,11 à 2,8 ng/g p.s., avec les plus fortes concentrations relevées dans le lac Michigan (jusqu’à 2,5 ng/g p.s.) et le lac Huron (jusqu’à 2,8 ng/g p.s.) [Yang et al., 2012]. Le DBDPE était la sixième substance la plus fréquemment détectée parmi les 13 produits ignifuges bromés analysés. Yang et al. (2012) ont noté que bien que les concentrations de DBDPE dans les sédiments de surface étaient inférieures d’un ordre de grandeur environ à celles du décaBDE (0,87 à 106 ng/g p.s.), l’apport en DBDPE augmente rapidement, et les concentrations estimées dans les sédiments doublent à tout les trois à cinq ans dans le lac Michigan et à tous les six à sept ans dans le lac Ontario). Dans une autre étude, Kolic et al. (2009) ont présenté des concentrations de DBDPE allant approximativement de 8 à 200 ng/g p.s. (données tirées de graphique) dans les sédiments de surface du lac Ontario et de ses affluents. Cependant, le DBDPE n’a pas été détecté dans les sédiments du lac Winnipeg dans le cadre d’un programme d’échantillonnage mené en 2003 (Law et al., 2006). Dans une étude sur les sédiments marins de l’Arctique, Cai et al. (2012) ont mesuré du DBDPE dans des sédiments du bassin canadien, de la mer de Chukchi et de la mer de Béring dans la partie ouest de l’océan Arctique (de concentrations non détectées à 452,6 pg/g p.s.), avec une moyenne de 166,7 pg/g p.s. Ces concentrations présentaient le même ordre de grandeur que les concentrations de décaBDE mesurées dans la même étude.
Ailleurs en Amérique du Nord, Wei et al. (2012) ont signalé une tendance à la hausse des concentrations de DBDPE dans les sédiments de lac ou d’étang, en fonction de la proximité avec des installations de fabrication de produits chimiques qui produisent du DBDPE (et du décaBDE) en Arkansas (États-Unis), y compris la concentration de DBDPE la plus élevée relevée à ce jour (atteignant 2394 ng/g p.s.). Étant donné qu’il n’y a pas de rejet d’eau découlant d’activités de fabrication dans les eaux de surface (mais qu’il y a eu des volumes d’entrée d’eau et de biosolides aux systèmes de traitement des eaux usées de 1952 à 1989), on a supposé que la voie d’entrée principale pour le transport du DBDPE et du décaBDE issus de sources d’émissions pour finir dans les sites d’échantillonnage comprenait le mouvement de l’air et les particules en suspension dans l’air.
Le DBDPE a été largement signalé dans les effluents d’eaux usées et les biosolides (une voie potentielle vers l’eau de surface et le sol). Au Canada, une étude récente de 20 systèmes de traitement des eaux usées menée par Kim et al. (2014) a signalé des concentrations moyennes de DBDPE dans des effluents terminaux, variant de concentrations non détectées à 7,1 ng/L, avec 86 % des échantillons contenant des concentrations non détectables de DBDPE. Une autre étude de six systèmes de traitement des eaux usées a détecté du DBDPE dans deux des quatre échantillons; la concentration en question était estimée à environ 3 ng/L (valeur tirée de graphique) (Zhou et al., 2010a). Les estimations des concentrations de DBDPE dans les biosolides de systèmes de traitement des eaux usées varient considérablement. Au Canada, les mesures de l’Ontario varient de 5,6 ng/g p.s. (biosolides d’épuration) (Konstantinov et al., 2006) à environ 100 ng/g p.s. (Kolic et al., 2009, valeurs tirées de graphique), bien que le niveau de traitement ne soit pas indiqué. Une étude de 20 systèmes de traitement des eaux usées a déclaré des concentrations de biosolides traités variant de concentrations non détectées à 220 ng/g p.s. (Kim et al., 2014).
Au Canada, le DBDPE a été échantillonné dans les tissus de poissons de plusieurs espèces d’eau douce, et les concentrations détectées variaient généralement de concentrations non détectées à des concentrations très faibles [c.-à-d. concentration moyenne inférieure ou égale à 1 ng/g poids lipidique (pl) ou poids humide (ph)) (Law et al., 2006, Ismail et al., 2006, Kolic et al., 2009, Byer et al., 2010, Byer, 2013, Zhou et al., 2010b, Muir et al., 2011, Environnement Canada, 2014). À titre d’exception, on relève une étude déclarant une concentration de 26,7 ng/g pl (3,78 ng/g ph) dans le foie d’un des 11 grands brochets de la zone du fleuve Saint-Laurent et de ses affluents (Houde et al., 2014). Le DBDPE n’a pas été détecté dans les moules ou le plancton du lac Winnipeg (2000 à 2002) (Law et al., 2006), ni dans le zooplancton échantillonné entre 2006 et 2010 dans les Grands Lacs (lac Ontario et lac Érié) ou dans une zone éloignée du lac Ontario (lac Opeongo) (Muir et al., 2011).
Des études sur des oiseaux, menées au Canada ont parfois détecté du DBDPE. On n’a pas détecté de DBDPE dans les œufs de quatre espèces de goélands [Goéland à ailes grises (Larus glaucescens), Goéland de Californie (Larus californicus), Goéland à bec cerclé (Larus delawarensis), et Goéland argenté (Larus argentatus) collectés dans 26 colonies dans l’ensemble du Canada (de la côte atlantique à la côte pacifique) (Chen et al., 2012). Le DBDPE a été détecté dans l’un des 12 œufs de Faucon pèlerin collectés dans le bassin versant des Grands Lacs, à une concentration de 8,2 ng/g pl (Guerra et al., 2012), mais il n’a pas été détecté dans le plasma de Pygargue à tête blanche prélevé dans la région des Grands Lacs, malgré les fortes concentrations de décaBDE relevées dans les mêmes échantillons (Venier et al., 2010). Dans le bassin d’œufs de sept colonies de goélands argentés (Larus argentatus) du secteur des Grands Lacs laurentiens recueillis entre 1982 et 2006 (Gauthier et al., 2009), aucune trace de DBDPE n’a été détectée avant 1996. Cependant, la substance a été détectée dans 5 des 63 bassins d’échantillonnage non consécutifs d’œufs entre 1996 et 2004 (à des concentrations moyennes jusqu’à 11 ng/g ph). En 2005, la présence de DBDPE a été détectée dans les œufs de trois colonies sur sept à des concentrations atteignant jusqu’à 288 ng/g ph. En 2006, les œufs de deux colonies sur sept présentaient des concentrations de DBDPE jusqu’à 44 ng/g ph (Gauthier et al., 2009)
Des échantillons de graisse du phoque annelé de l’Arctique canadien prélevés en 2006 ne présentaient pas de concentrations de DBDPE mesurables (de Wit et al., 2011). On a détecté du DBDPE dans moins de 14 % des échantillons de tissus adipeux d’ours blancs de l’Arctique canadien, prélevés notamment en Alaska et à Svalbard entre 2005 et 2008 (McKinney et al., 2011b).
| Milieu (unités) | Emplacements | Années (non continues) | Plage de concentrations |
|---|---|---|---|
| Air (pg/m3) | Nunavut, Grands Lacs | de 2005 à 2008 | ND à 22 |
| Eaux de surface (pg/L) | Lac Winnipeg, Grands Lacs (Ontario) | de 2004 à 2012 | ND à 10,8 |
| Sédiments (ng/g p.s.) | Lac Winnipeg, Grands Lacs (Ontario), bassin canadien (organismes marins de l’Arctique) | de 2003 à 2008 | ND à 200 |
| Effluents d’eaux usées (ng/L) | Ontario | NI | ND à 7,1 |
| Biosolides (ng/g p.s.) | Ontario | de 2003 à 2010 | ND à 220 |
| Biote – milieu aquatique (ng/g pl) | Fleuve Saint-Laurent, Ontario, Québec, Nouveau-Brunswick, Nouvelle-Écosse, Grands Lacs, Lac Winnipeg | de 2000 à 2012 | ND à 26,7 |
| Biote – organismes terrestres et aviaires (ng/g pl) | Grands Lacs, Arctique canadien, sud des Territoires du Nord-Ouest | de 1982 à 2010 | ND à 8,2c |
Abréviations : ND = non détecté; NI = non indiqué
a Voir les renseignements à l’appui (ECCC et SC 2017) pour des références et des détails sur les études.
b Bien que les effluents des systèmes d’assainissement des eaux usées et des biosolides ne soient pas considérés comme « environnement », ils représentent une source directe pour l’environnement et sont inclus dans ce tableau.
c Il est à noter que la plage de concentrations de DBDPE déclarée pour les organismes terrestres et aviaires en « poids humide » (ph) va d’une concentration non détectée à 288 ng/g.
| Milieu | Emplacements | Années (de façon non continue) | Plage de concentrations |
|---|---|---|---|
| Air (pg/m3) | Amérique du Nord, Europe, Asie, Afrique | de 2003 à 2011 | ND à 3578 |
| Eaux de surface (pg/L) | Amérique du Nord, Europe, Asie | de 2003 à 2010 | ND à 38 |
| Sol (ng/g p.s.) | Asie | de 2006 à 2007 | ND à 1612 |
| Sédiments (ng/g p.s.) | Amérique du Nord, Europe, Asie | de 2002 à 2009 | ND à 2394 |
| Effluents d’eaux usées (ng/L) | Amérique du Nord, Europe | d2009 | ND à 7,1 (écart-type de ± 5,6) |
| Biosolides (ng/g p.s.)b | Amérique du Nord, Australie, Afrique, Asie | de 1998 à 2010 | ND à 4820 |
| Biote — milieu aquatique (ng/g pl) | Amérique du Nord, Amérique du Sud, Asia, Europe | de 1986 à 2010 | ND à 352 |
| Biote — animaux terrestres et oiseaux (ng/g pl) | Amérique du Nord, Europe, Asie | de 1982 à 2010 | ND à 863 |
a Voir les renseignements à l’appui (ECCC et SC 2015) pour des références et des détails sur les études.
b Les effluents des systèmes d’assainissement des eaux usées et des biosolides ne sont pas considérés comme étant l’« environnement », mais ils figurent à ce tableau puisqu’ils constituent la voie par laquelle on prévoit que les DBDPE des sources industrielles sont rejetés dans l’environnement.
Cependant, il est important de tenir compte de la mesure dans laquelle les concentrations de DBDPE dans l’environnement peuvent augmenter à l’avenir; par exemple, en ce qui concerne les produits ignifuges organiques, il est proposé de remplacer le décaBDE. Ma et al. (2013) ont récemment déterminé que les concentrations atmosphériques particulaires de DBDPE dans la région des Grands Lacs étaient similaires aux concentrations atmosphériques de décaBDE à la plupart des lieux d’échantillonnage, sauf Cleveland, où la fabrication du décaBDE devait avoir lieu. Les auteurs ont indiqué, par ailleurs, que la tendance laisse entendre que les deux substances sont utilisées et qu’elles présentent les mêmes sources et applications (p. ex., produits offerts aux consommateurs). Goosey et al. (2013) ont également déterminé que les concentrations de DBDPE dans la poussière à des habitations de Toronto étaient similaires aux concentrations de décaBDE (voir la partie 10); les deux concentrations découlent probablement d’équipement électronique et électrique.
Une comparaison des rapports de mesure pour des données sur des systèmes de traitement des eaux usées peut fournir des preuves sur le contexte dans lequel l’utilisation de DBDPE est élevée ou les cas de remplacement du décaBDE (Ricklund et al., 2008). Kim et al. (2013; 2014) ont mesuré les concentrations de DBDPE et de décaBDE dans les mêmes échantillons d’influents et d’effluents provenant de 20 systèmes de traitement des eaux usées au Canada et représentant des populations de 1500 à plus de 1 000 000 d’individus. La concentration médiane de DBDPE dans les influents était de 3,7 ng/L (maximum = 130 ng/L), tandis que la concentration médiane de décaBDE était de 74,8 (concentration maximale = 433 ng/L), donnant ainsi un rapport médian [DBDPE]/[décaBDE] dans les influents de 0,05. De même, la concentration médiane de DBDPE dans des effluents terminaux était de 0,2 (concentration maximale = 7,1 ng/L), tandis que la concentration médiane de décaBDE était de 3,7 (concentration maximale = 59,9 ng/L), donnant ainsi un rapport [DBDPE]/[décaBDE] similaire de 0,055. Une étude internationale sur le DBDPE dans les biosolides d’épuration (Ricklund et al., 2008) a montré que les rapports [DBDPE]/[décaBDE] dans les échantillons canadiens de biosolides variaient de 0,01 à 0,078. Ces rapports relatifs aux eaux usées et aux biosolides indiquent que les rejets de DBDPE qui atteignent les systèmes de traitement des eaux usées (y compris ceux qui découlent de produits commerciaux et de produits offerts aux consommateurs) demeurent inférieurs aux rejets de décaBDE.
8. Devenir et comportement dans l’environnement
8.1 Distribution dans l’environnement
Le DBDPE devrait être rejeté dans l’environnement par l’entremise d’eaux usées principalement, mais il peut subir une migration à partir de certains produits vers l’atmosphère, étant donné que les produits ignifuges bromés non réactifs peuvent être rejetés par certains polymères (p. ex., PBDE) (Guerra et al., 2011). Le DBDPE est susceptible d’être fortement éliminé par adsorption dans les biosolides de systèmes de traitement des eaux usées (Kim et al. 2014) et il peut être épandu sur des sols agricoles pendant l’amendement avec des biosolides. Le modèle de fugacité de niveau III (tableau 8-1), utilisant le modèle EQC mis à jour (version 1.0, 2012), a été appliqué en vue de décrire le devenir du DBDPE relativement à ces modes d’entrée dans l’environnement. De manière générale, les résultats du modèle de fugacité de niveau III montrent que le DBDPE devrait résider principalement dans le sol et les sédiments, selon son milieu de rejet.
| Substance rejetée dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 0,5 | 0,4 | 82,7 | 16,4 |
| Eau (100 %) | négligeable | 2,5 | négligeable | 97,5 |
| Sol (100 %) | négligeable | négligeable | 99,9 | 0,1 |
La très faible hydrosolubilité (8,10 × 10-6 mg/L), la faible pression de vapeur (à 25 °C, 5,59 × 10-10 Pa), le faible coefficient de partage air-eau (log Kae = -4,57), et les coefficients de partage très élevés (log Koe de 9,89 et log co estimé de 8,58) indiquent que le DBDPE rejeté dans l’environnement est moins susceptible de se répartir ou de demeurer dans l’air et l’eau, et qu’il finira plutôt dans les sédiments et le sol. Si le DBDPE est rejeté dans l’air, une petite fraction (moins que 1 %) devrait demeurer dans l’air, avec la plus grande partie se déposant dans le sol et l’eau, puis dans les sédiments. Toutefois, d’après les taux de dégradation (plus de 4 jours) et les tendances de transport prévus (voir la description ci-après), la petite masse de DBDPE qui demeure dans l’air peut se disperser.
Les coefficients de partage élevés indiquent que le DBDPE rejeté dans l’eau de surface par des systèmes de traitement des eaux usées devrait s’adsorber à la fraction organique de matières solides en suspension et aux sédiments, avec 2,5 % de la substance demeurant dans l’eau. La volatilisation à partir de l’eau de surface dans l’air n’est pas prévue. Cependant, la petite fraction de la substance dans l’air est probablement persistante et peut être transportée (p. ex., transport par des particules). D’après son log Kco élevé, une fois dans les sédiments, le DBDPE ne devrait pas être mobile et peut demeurer dans ce milieu en subissant une dégradation lente ou limitée.
Lorsque le DBDPE est rejeté dans le sol en fonction de l’épandage de biosolides sur des terres agricoles, la plus grande partie de la fraction massique devrait s’adsorber au sol (99,9 %) en raison de la nature très hydrophobe de la substance. L’évaporation de la substance à partir du sol dans l’air n’est pas prévue, compte tenu de sa très faible pression de vapeur. Si le DBDPE est rejeté dans le sol, il devrait demeurer immobile, si l’on se base sur le log Kco élevé estimé. En outre, une faible dégradation du DBDPE dans le sol est prévue; ainsi, la substance est susceptible de demeurer dans ce milieu, et le processus de perte dans le sol sera principalement stimulé par l’enfouissement dans le sol ou le ruissellement en surface. Les résultats du modèle de fugacité de niveau III (tableau 8-1) confirment que, à l’état stable, le DBDPE se répartit en grande partie dans le sol et les sédiments, selon son milieu de rejet (nouveau modèle EQC, 2012).
8.1.1 Potentiel de transport à grande distance
Les valeurs de log Koa (14,45) et de log Kae (-4,57) prévues pour le DBDPE indiquent un faible potentiel d’atteinte de l’Arctique (Wania, 2006, Brown et Wania, 2008). La substance est définie comme ayant une capacité de sorption élevée, s’adsorbant notamment aux particules dans un milieu atmosphérique et aqueux. Par conséquent, on prévoit que la décantation des particules limite le transport à grande distance (Brown et Wania 2008). Toutefois, si le transport de DBDPE adsorbé sur des particules est plus efficace que prévu, compte tenu des faibles taux de dégradation prévus dans l’air (plus que quatre jours en phase gazeuse, et plus longtemps dans les particules atmosphériques), il est possible que le DBDPE persiste et soit transporté dans l’Arctique.
Le DBDPE a été mesuré au niveau de puits à neige en 2005, 2006 et 2008 dans l’Arctique canadien (calotte glaciaire Devon, Nunavut); cependant, les schémas de concentration n’ont pas montré de tendances temporelles de dépôt claires (Meyer et al., 2012). Dans l’Arctique norvégien, Hermanson et al. (2010) ont mesuré des volumes d’entrée de DBDPE d’environ 3,6 pg/cm2/an (~1988) à 3,4 pg/cm2/an (2005) dans les 34 mètres supérieurs d’une carotte de glace (valeurs représentatives de 1953 à 2005) à partir de la nappe glaciaire la plus occidentale du Svalbard, ce qui laisse entendre que le transport en phase particulaire pourrait être plus important que prévu ou la quantité de produit ignifuge utilisée dans des régions à l’origine des dépôts sur cette nappe glaciaire influe sur les observations (Hermanson et al., 2010). Cependant, d’autres données de surveillance de régions éloignées indiquent que le DBDPE ne se trouve apparemment pas en grande quantité dans l’Arctique (p. ex., de Wit et al., 2010, McKinney et al., 2011b).
Le modèle de dépistage de l’OCDE (LTRP POPs) peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al (2006). La distance de parcours caractéristique (DTC) calculée pour le DBDPE à l’aide du modèle de l’OCDE est de 2860 km, ce qui indique que le DBDPE a un fort potentiel de transport dans l’air (avec 99,99 % de la masse dans l’air répartie dans des particules et des aérosols), mais cette distance est inférieure à la limite (5097 km, DTC des PCB 28) proposée pour les polluants mondiaux par Klasmeier et al. (2006). Le modèle calcule également une persistance globale (Pglob) de 277 jours ainsi que l’efficacité de transfert (ET), qui est le pourcentage du flux d’émissions dans l’air qui se déposent à la surface (eau ou sol) dans la région éloignée. L’ET calculée du DBDPE était de 12,7 %, ce qui est supérieur à la limite de 2,248 % (PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu’elles sont déposées de l’air sur le sol ou dans l’eau. L’ET élevée indique que le DBDPE pourrait se déposer à la surface de la Terre dans des régions éloignées.
Globalement, tandis que le DBDPE (considérant ses propriétés physiques et chimiques) ne devrait pas constituer une préoccupation importante en termes de transport sur de grande distance. En effet, la forte efficacité de transport prédite et certaines détections de DBDPE dans des régions éloignées, suggère que le transport de la substance sur des particules faciliterait le transport à grande distance du DBDPE. Par ailleurs, on ne connaît pas la mesure dans laquelle les produits de décomposition potentiels du DBDPE (voir la section suivante) peuvent être transportés sur de grandes distances.
8.2 Persistance dans l’environnement
Sur la base des rejets probables de DBDPE et de ses caractéristiques de répartition, la persistance de cette substance dans l’environnement est la plus pertinente pour le sol et les sédiments, où la plus grande partie de la substance devrait se retrouver. Toutefois, en raison du transport potentiel du DBDPE en phase particulaire dans l’air et l’eau, tous les milieux sont analysés dans la présente section. Des données empiriques et modélisées ont été prises en compte dans le poids de la preuve pour la persistance du DBDPE. Des données ont également été comparées à des données de l’analogue décaBDE. Des processus de transformation pertinents du DBDPE comprennent la photodégradation, la biodégradation, la biotransformation, la combustion, et la pyrolyse.
De façon générale, les prévisions de modèles concordent avec des données expérimentales selon lesquelles la biodégradation aérobie et anaérobie du DBDPE est limitée et la substance devrait donc être persistante dans l’eau, le sol et les sédiments. La photodégradation du DBDPE dans des solvants [p. ex., le n-hexane et le tétrahydrofurane (THF)] peut être rapide, cependant, elle pourrait être bien plus longue dans d’autres matrices/substrats (p. ex., supérieure à 224 jours dans de la poudre de polystyrène choc; Kajiwara et al. 2008). Des prévisions modélisées pour le DBDPE dans l’air indiquent une demi‑vie supérieure à 4 jours (phase gazeuse) et une persistance globale (Pglob) de 277 jours (modèle de l’OCDE pour les polluants organiques persistants). On manque d’analyses du DBDPE dans des conditions à long terme (p. ex., plus que six mois) pertinentes sur le plan environnemental en vue de déterminer les voies de dégradation et les produits de dégradation (possiblement à cause des difficultés analytiques). Néanmoins, des produits de dégradation du DBDPE ont été évalués sur la base des prévisions tirées d’études de la photodégradation et de la modélisation de la biodégradation, et en tenant compte des produits de dégradation de l’analogue décaBDE.
Les tableaux 8-2 et 8-3 présentent des données empiriques et modélisées de la dégradation du BDBPE. On peut trouver une description détaillée dans ECCC et SC (2017).
8.2.1 Dégradation abiotique
Un résumé (2019, Albemarle Europe SPRL, résumé de renseignements soumis dans le cadre de REACH en tant que déclarant principal et fourni à Environnement et Changement climatique Canada lors de consultations ayant trait aux modifications proposées pour le Règlement sur certaines substances toxiques interdites : 2018, non référencé) d’une étude sur la dégradation du DBDPE lors d’applications à haute température et pendant plusieurs cycles de recyclage est disponible. Pour cette étude, des échantillons de polystyrène choc traités avec des produits ignifuges (12 % de DBDPE et 4 % de trioxyde d’antimoine) ont été soumis à 6 cycles de recyclage à 250 °C, que les chercheurs ont qualifié des conditions proches d’un pire cas pour des processus d’utilisation à haute température. Lors de cette étude, aucune dégradation observable en octaBDPE ou en congénères moins bromés à des niveaux de 100-200 ppm dans la résine n’a été observée. Il a été déterminé qu’environ 0,2 % du DBDPE était débromé en nonaBDPE pendant les six cycles de recyclage.
Kajiwara et al. (2008) n’ont observé aucune dégradation du DBDPE dans de la poudre de polystyrène choc enrichie exposée à la lumière du soleil pendant 224 jours (la demi‑vie a été estimée à plus de 224 jours), tandis que la demi‑vie du décaBDE dans la même matrice a été estimée à 51 jours. Les différences entre le DBDPE et le décaBDE ont été attribuées à des différences structurelles entre le pont éther (oxygène) et le pont éthane.
Nadjia et al. (2014) a mesuré la dégradation photolytique très rapide du DBDPE dans le solvant sous une lumière ultraviolette/visible artificielle : 63,18 % en 180 secondes. Le processus de dégradation est présenté comme une débromation réductive progressive.
Wang et al. (2012) ont étudié la dégradation photolytique du DBDPE soumis à des rayons ultraviolets, à l’aide d’une gamme de matrices et de solvants, y compris le méthanol et l’eau, et l’acide humique et l’eau (afin de simuler le milieu aquatique) et le gel de silice (afin de simuler le milieu pédologique et sédimentaire). Ces dernières matrices sont les plus pertinentes pour des conditions environnementales. La dégradation photolytique s’est produite dans tous les solvants/matrices (dont aucun n’a été exposé à la lumière du soleil), avec une perte de 33,7 à 99,6 % de DBDPE. Les taux de dégradation dépendaient du solvant utilisé (tableau 8-2). Toutes les matrices ont montré une débromation et une formation de nonaBDE avec une dégradation ultérieure en octoBDE et heptaBDE, bien que le pourcentage de produits de dégradation liés à la substance d’origine n’ait pas été déclaré dans l’étude. Les auteurs reconnaissent que la présence de nonaBDE dans les solutions d’origine peut découler d’impuretés de produits techniques (pureté non déclarée) et de la dégradation durant l’injection d’échantillons; cependant, les concentrations de nonaBDE ont augmenté continuellement de 0 à 45 min, et les concentrations d’octaBDE (à partir de 4 minutes) et de heptaBDE (à partir de 30 minutes) ont augmenté continuellement au cours des expériences. La formation de tétraBDE et d’hexaBDE avec de plus longues durées d’exposition a été proposée, mais pas surveillée.
Dans une étude préliminaire, Kierkegaard et al (2009) ont étudié le DBDPE technique dans du n-hexane exposé à une lampe fluorescente reproduisant la lumière du jour et ils ont découvert que le DBDPE était dégradé, produisant deux congénères non bromés ainsi qu’un certain de pics provisoirement définis comme étant des produits de dégradation octabromés. Les auteurs ont également déclaré que le DBDPE se dégrade en congénères bromés (principalement deux nonaBDE) au cours de la préparation et de l’analyse des échantillons, bien qu’il semblait moins sensible à la dégradation thermique que le décaBDE (Kierkegaard et al., 2009).
La demi‑vie prédite de la dégradation atmosphérique du DBDPE en raison de sa réaction aux radicaux hydroxyles est de 4,47 jours pour la fraction chimique qui est en phase gazeuse (12 h par jour, AOPWIN, 2010). Les résultats du modèle AEROWIN (2010) prévoient l’absorption d’une fraction importante du DBDPE par des particules en suspension dans l’air (Phi = 1), par conséquent, la vitesse de photolyse du DBDPE est probablement inférieure à celle prévue (c.-à-d. une demi‑vie plus longue que la demi‑vie de 4,47 jours prévue). Cela concorde avec le résultat du modèle de l’OCDE pour les polluants organiques persistants, selon lequel 99,9 % du DBDPE est adsorbé aux aérosols, et sa persistance globale est de 277 jours.
D’après des données modélisées de la dégradation abiotique et des données empiriques liées au DBDPE, la substance devrait être persistante dans l’air (tableau 8-2). Cependant, selon la modélisation du devenir, seulement une très petite partie du DBDPE rejeté dans l’environnement se répartirait dans l’air. Par conséquent, les concentrations atmosphériques de la substance devraient être faibles. Le Kco élevé du DBDPE laisse entendre que la substance rejetée directement dans l’air s’adsorbera probablement aux particules, avec une élimination ultérieure dans le sol ou l’eau par des dépôts secs et humides. En raison de sa faible hydrosolubilité, de son comportement d’adsorption aux particules et de sa légère atténuation par des matières humiques, la photolyse du DBDPE dans des eaux naturelles, des sols et des biosolides devrait être limitée (Environment Agency, 2007).
Le DBDPE ne contient pas de groupements fonctionnels pouvant subir une hydrolyse.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre de dégration (unité) | Méthodes | Référence |
|---|---|---|---|---|---|
| Polystyrène choc (PSC) | Photolyse | > 224 jours | Demi‑vie (jour) | Étude publiée | Kajiwara et al., 2008 |
| Tétrahydrofurane | Photolyse | 1,89 min | Demi‑vie (minute) | Étude publiée | Nadjia et al. 2014 |
| N-hexane | Photolyse | 16,6 min | Demi‑vie (minute) | Étude publiée | Wang et al., 2012 |
| Tétrahydrofurane | Photolyse | 6 minutes | Demi‑vie (minute) | Étude publiée | Wang et al., 2012 |
| Méthanol/eau | Photolyse | > 240 min | Demi‑vie (minute) | Étude publiée | Wang et al., 2012 |
| Acide humique/eau | Photolyse | 30 à 60 min | Demi‑vie (minute) | Étude publiée | Wang et al., 2012 |
| Gel de silice | Photolyse | 75,9 min | Demi‑vie (minute) | Étude publiée | Wang et al., 2012 |
| Air | Oxydation atmosphérique | 4,47 joursb | Demi‑vie (jour) | Modèle | AOPWIN, 2010a |
| Air | Réaction avec l’ozone | s.o.c | s.o.c | Modèle | AOPWIN, 2010a |
| Eau | Hydrolyse | s.o.c | s.o.c | Modèle | HYDROWIN, 2010a |
a EPI Suite (2010-2012).
b AEROWIN (2010) prédit que l’adsorption du BDBPE sur les aérosols constitue une fraction importante (Phi = 1), ainsi la vitesse de photolyse du DBDP sera probablement inférieure à celle prévue (c.-à-d. donc une demi‑vie plus longue que prévue).
c Le modèle ne précise pas d’estimation pour ce type de structure.
8.2.2 Biodégradation
Des essais en laboratoire ont montré que le DBDPE n’est pas susceptible de se biodégrader rapidement dans des conditions aérobies. Une étude de CITI (1991a) mesurant la biodégradation par des micro-organismes a déterminé une plage de biodégradation de 1 % à 6 % (moyenne de 2 %) sur 28 jours dans un essai de biodégradation rapide pour le DBDPE.
Une étude de biodégradabilité intrinsèque menée par Schaefer et Carpenter (2010), qui faisait suite à l’essai CONCAWE (ébauche de méthode 302D de l’OCDE), a déterminé un taux moyen de dégradation cumulée de 2,2 % après 90 jours, ce qui indique que le DBDPE n’est pas intrinsèquement biodégradable dans des conditions aérobies. Les auteurs de l’étude indiquent qu’ils ont aussi analysé les milieux d’essai pour y trouver les produits de dégradation prévus (à l’aide d’enceintes d’essai radiomarquées), et n’ont trouvé aucun produit de transformation sur une période de 90 jours. Toutefois, ils n’ont pas mentionné le seuil de pourcentage pour l’identification.
Les quatre sous-modèles de biodégradation ultime BIOWIN (2010) et Catalogic (2012) prévoient que la biodégradation soit très lente ou récalcitrante. En outre, un modèle de biodégradation primaire, à savoir le sous-modèle BIOWIN 4 (modèle d’enquête sur la biodégradation primaire), prévoit que la substance soit récalcitrante.
Les données existantes sur la biodégradation anaérobie du DBDPE indiquent que, si la substance se dégrade, cela se fait de manière très lente. Une étude de la biodégradation aérobie qui comparaît du DBDPE radiomarqué dans des traitements biotiques et abiotiques de boues de digestion anaérobies (dose initiale de DBDPE de 31 mg/L dans du tétrahydrofurane), n’a signalé aucune minéralisation ou transformation sur 63 ans (Schaefer et Matthews, 2011). Des mesures de la radioactivité du carbone 14 aux jours 0, 30 et 63 ainsi que dans un bilan massique de milieux (boues solides, sol extractible et substance volatilisée) n’ont détecté que le DBDPE d’origine. Des études de laboratoire antérieures de l’analogue décaBDE (Gerecke et al., 2005, 2006) ont également montré que le décaBDE subissait une lente débromation réductive médiée par voie anaérobie, avec une demi‑vie allant jusqu’à 700 jours.
Trois études récentes ont examiné la dégradation aérobie et anaérobie et la transformation du DBDPE dans des sols et des sédiments pendant un essai d’une durée de six mois (Stenzel et Schaefer 2015a, 2015b, 2015c). Ces études ont évalué la transformation du DBDPE d’origine grâce à des mesures de la radioactivité de marqueurs pendant la durée de l’étude et ont signalé une hausse de 1,6 % à 9,9 % de la radioactivité maximale des produits (c.-à-d. les produits potentiels de la dégradation) dans les sédiments et entre 2,2 % et 3,1 % dans le sol (bien que la radioactivité des produits a diminué dans certains essais de sol). Bien que les auteurs aient suggéré que la radioactivité des marqueurs des produits pourrait être attribuée à des impuretés et aient conclu à l’absence de dégradation (c.-à-d. plus que 91 % de BDBPE à la fin de l’étude), les impuretés ne devraient pas s’accroître pendant la durée de l’essai. Globalement, ces nouvelles études suggèrent que le BDBPE s’est peu dégradé, voire pas du tout, pendant la période de six mois de ces études.
Lors d’une autre étude, la biotransformation de DBDPE radiomarqué a été suivie dans des systèmes de sol aérobies pendant 60-61 jours, dans un environnement de serre avec ou sans plantes poussant (2019, Albemarle Europe SPRL, résumé de renseignements soumis dans le cadre de REACH en tant que déclarant principal et fourni à Environnement et Changement climatique Canada lors de consultations ayant trait aux modifications proposées pour le Règlement sur certaines substances toxiques interdites: 2018, non référencé). Pour cette étude, quatre types de sol (loam sableux, loam, loam limoneux, sable loameux) et six espèces de plante (radis, ivraie, luzerne, courgette, maïs et citrouille) ont été utilisés. L’étude a montré que le DBDPE et le nonaBDPE passaient peu dans les racines de l’ivraie (le nonaBDPE jusqu’à 0,10 % de la quantité totale de radioactivité et le DBDPE jusqu’à 2,89 % de la quantité totale de radioactivité) et de façon moindre ou comparable dans les racines des autres espèces. Le DBDPE était l’analyte prédominant dans les échantillons de racine et de sol, déterminé par analyse CLHP/bêta RAM. Aucun passage de DBDPE des racines vers les pousses n’a été observé chez ces six espèces de plante. Les niveaux de nonaBDPE étaient soit inférieurs soit statistiquement les mêmes que ceux observés dans le mélange utilisé pour les tests. Aucun hexa-BDPE, hepta-BDPE ni octaBDPE n’a été détecté dans aucun des échantillons de plante ou de sol et, globalement, les résultats de l’étude suggèrent qu’aucune biodégradation du DBDPE n’a eu lieu dans ces sols ou ces plantes. De plus, aucun congénères débromés n’a été identifié, en se basant sur l’analyse chimique non ciblée.
Ces tests de biodégradation aérobie et anaérobie ainsi que des résultats de modélisation indiquent que la demi‑vie du décaBDE dans l’eau est susceptible d’être longue et que la substance est donc susceptible de persister dans l’eau (tableau 8-3). D’après un ratio d’extrapolation de 1:1:4 pour une demi‑vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995), le DBDPE devrait être persistant dans le sol et les sédiments et est donc susceptible de demeurer à long terme dans ces milieux.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Méthodes | Référence |
|---|---|---|---|---|---|
| Boues activées | Biodégradation | 1 % à 6 % (moyenne 2 %) |
Biodégradation de 28 jours Demande biochimique en oxygène/% | Étude 301C de l’OCDE (essai MITI modifié) |
CITI, 1991a |
| Mélange de boues préexposées et de sol | Hausse de la biodégradation aérobie | 2,2 % | Biodégradation aérobie de 90 jours Concentration inhibitrice/ carbone organique total/activité du carbone-14 | Étude 302D de l’OCDE (essai CONCAWE) |
Schaefer et Carpenter, 2010 |
| Boues de digestion anaérobies | Biotique/ abiotique Minéralisation anaérobie | 0 (biotique) 0 (abiotique) |
Minéralisation anaérobie de 63 jours/% | Étude 314c de l’OCDE (boues de digestion anaérobies) |
Schaefer et Matthews, 2011 |
| Eau | Biodégradation primaire (aérobie) | 0,7743a « récalcitrant » |
s.o. | Modèle RQSA | BIOWIN, 2010d |
| Eau | Biodégradation (aérobie) | -0,4568a « récalcitrant » |
s.o. | Modèle RQSA | BIOWIN, 2010e |
| Eau | Biodégradation (aérobie) | -0,6209b « se biodégrade lentement » |
s.o. | Modèle RQSA | BIOWIN, 2010f |
| Eau | Biodégradation (aérobie) | 0,00b « se biodégrade lentement » |
s.o. | Modèle RQSA | BIOWIN, 2010g |
| Eau | Biodégradation (aérobie) | % DBO = 0,41c « se biodégrade très lentement » |
, Demi‑vie de biodégradation ultime > 10 ans | Modèle RQSA | Catalogic, 2012 |
a Le résultat s’exprime par une valeur numérique de 0 à 5. s.o., sans objet.
b Le résultat s’exprime par un taux de probabilité.
c Une certaine incertitude est associée aux prévisions du modèle, étant donné que moins 60 % (42 %) de la substance est couverte par le domaine structural du modèle.
d Sous-modèle 4 : enquête d’expert (résultats qualitatifs)
e Sous-modèle 3 : enquête d’expert (résultats qualitatifs)
f Sous-modèle 5 : MITI, probabilité linéaire
g Sous-modèle 6 : MITI, probabilité non linéaire
Le DBDPE semble modérément bien couvert par les modèles de biodégradation utilisés pour estimer la dégradation. Le nombre de fragments et la taille moléculaire couverts par le domaine des sous-modèles BIOWIN 5 et 6 (biodégradation aérobie, MITI) indique un niveau de couverture élevé pour le DBDPE. Le domaine couvert par les sous-modèles BIOWIN 3 et 4 (biodégradation aérobie, enquête d’expert) comprend les substances composées de moins de fragments de bromure aromatique et de plus faibles masses moléculaires que le DBDPE; cependant, les prévisions de la dégradation concordent avec d’autres résultats modélisés et données empiriques. Il y a une certaine incertitude à l’égard des prévisions du modèle CATALOGIC (2012) du fait qu’il ne couvre que 42 % du DBDPE par son domaine structural (une couverture structurale de plus de 60 % est recommandée). Toutefois, étant donné que les résultats prévus concordent avec les prévisions d’autres modèles (sous-modèles BIOWIN) ainsi qu’avec les données empiriques existantes, on suppose que le modèle extrapole correctement au-delà de l’espace d’interpolation.
Des prévisions modélisées et des données expérimentales indiquent une biodégradation très lente ou limitée du DBDPE (ECCC et SC 2017). Des prévisions du modèle CATALOGIC (2012) indiquent que lorsque la biodégradation se produit, bien que la plus grande partie de la substance demeure sous sa forme d’origine, elle présente une fable probabilité de débromation limitée dans des conditions aérobies et anaérobies, menant à la formation de nonaBDPE et d’octaBDPE, de nonaBDPE hydroxylés, et d’une forme d’acide phényle bromé (ECCC et SC 2015).
Wei et al.(2012) ont mesuré deux composés bromés inconnus dans des sédiments d’étang près de la fabrique de DBDPE en Arkansas aux États-Unis (un ancien bassin de biosolides d’un système de traitement des eaux usées), qui ont ensuite été définis comme deux nonabromodiphényléthanes (nonaBDPE) lors d’une mise en correspondance avec des pics de débromation photolytique dans de l’hexane. La concentration de nonaBDPE a augmenté vers la surface, avec un rapport de 1,3 nona/DBDPE comparativement à environ 0,7 nona/DBDPE dans des sédiments standard ou d’étang. La présence accrue de nonaDBDPE a été attribuée à la débromation du DBDPE dans les sédiments supérieurs de l’un des étangs. Cet étang a montré une débromation du DBDPE, qui a été attribuée à un processus complexe impliquant probablement des influences physiques et biologiques [voir les renseignements à l’appui (ECCC et SC 2017).
Récemment, on a mesuré la débromation très lente de l’analogue décaBDE dans Les microcosmes sédimentaires d’un lac éloigné du Bouclier canadien, et ce, dans des conditions naturelles pendant un mois (Orihel et al 2015). Bien qu’une petite perte de décaBDE marqué au carbone 13 ait été mesurée, des octaBDE et des nonaBDE se sont formés à partir du décaBDE marqué au carbone 13 dans des sédiments littoraux et de fond, et des quantités infimes de diBDE à heptaBDE ont été détectées dans certains échantillons. On a déterminé que le degré de débromation n’était pas influencé par des conditions de lumière ou d’obscurité, même si davantage de nonaBDE et d’octaBDE étaient formés dans des conditions oxiques que dans des conditions anoxiques.
8.2.3 Biotransformation métabolique
Des études empiriques de la biotransformation métabolique traitant des voies de dégradation et des produits de dégradation potentiels du DBDPE sont décrites dans la section « Potentiel de bioaccumulation ».
8.2.4 Combustion et pyrolyse
La dégradation thermique de DBDPE dans des incendies est définie comme une source potentielle de produits de dégradation. Le DBDPE peut être sensible à la formation de bromotoluènes par clivage du pont éthane (Eljarrat et Barceló 2011, Dirtu et al. 2014). Jakab et al (2003) signalent que dans des conditions de pyrolyse, le DBDPE dans les échantillons de polystyrène choc produit un nombre relativement élevé de toluènes bromés, y compris le produit principal, le pentabromotoluène (PBT), ainsi que d’autres toluènes moins bromés. Cette voie diffère de celle du décaBDE, qui peut se décomposer pour produire des dibenzofuranes bromés dans des conditions de pyrolyse (Jakab et al., 2003); la formation de dibenzofuranes bromés n’est généralement pas observée pour le DBDPE. Divers rapports de l’industrie ont été examinés pour ce qui a trait aux déterminations analytiques de dibenzo-p-dioxines polybromées (DDPB) et de dibenzofuranes polybromés (DFPB) en relation avec des produits commerciaux ou des polymères contenant du DBDPE (2019, Albemarle Europe SPRL, résumé de renseignements soumis dans le cadre de REACH en tant que déclarant principal et fourni à Environnement et Changement climatique Canada lors de consultations ayant trait aux modifications proposées pour le Règlement sur certaines substances toxiques interdites : 2018, non référencé). Dans ces rapports, il est noté que la dégradation thermique et l’incinération du DBDPE conduit principalement à des toluènes polybromés plutôt qu’à des DDPB et des DFPB. Cet examen a permis de conclure que le produit ignifuge, le polymère contenant le produit ignifuge et le polymère contenant le produit ignifuge après recyclage simulé ne contenaient pas de DDPB/DFPB, ou que les quantités étaient inférieures aux limites de dosage des méthodes respectives.
8.2.5 Persistance des produits de dégradation
Un résumé de la transformation potentielle du DBDPE est présenté dans le document des renseignements à l’appui (ECCC et SC 2015). Des études de la photodégradation en laboratoire (largement menées avec des solvants) décrites dans la section précédente signalent une débromation du DBDPE (Nadjia et al., 2014) en nonaBDE, en octaBDE et en heptaBDE (Wang et al., 2012; Dirtu et al. 2014). Des prévisions du modèle CATALOGIC (2012) indiquent que la biodégradation peut entraîner une débromation limitée dans des conditions aérobies et anaérobies, ce qui entraînerait, à son tour, la formation de nonaBDE et d’octaBDE, de nonaBDE hydroxylés, et d’une forme d’acide phényle bromé. Ces produits de dégradation prévus devraient représenter une fraction minime par rapport au DBDPE d’origine; cependant, ils sont similaires aux fractions prévues/mesurées de produits de dégradation du décaBDE Dans le modèle CPOP, le modèle Bmax (CPOP, 2012) utilise des données sur le métabolisme de rats en vue de prévoir la transformation du DBDPE en DBDPE et en nonaBDE hydroxylé. Compte tenu de l’analogue proche du DBDPE, à savoir le décaBDE, qui est une substance qui se débrome en PBDE moins bromés (notamment des nonaBDE aux tétraBDE) dans des conditions spécifiques (p. ex., photodégradation, dégradation aérobie et métabolisme) (Environnement Canada, 2010), il est raisonnable de s’attendre à ce que le DBDPE puisse se débromer en produits de dégradation de BDPE moins bromés (p. ex., nonaBDE, octaBDE, heptaBDE, hexaBDE, et pentaBDE) à la suite de la voie de débromation établie pour le décaBDE (annexe C, tableau C-1).
Trois études récentes ont examiné la dégradation aérobie et anaérobie et la transformation du DBDPE dans des sols et des sédiments pendant un essai d’une durée de six mois (Stenzel et Schaefer 2015a, 2015b, 2015c). Ces études ont évalué la transformation du DBDPE d’origine grâce à des mesures de la radioactivité de marqueurs pendant la durée de l’étude et ont signalé une hausse de 1,6 % à 9,9 % de la radioactivité maximale des produits (c.-à-d. les produits potentiels de la dégradation) dans les sédiments et entre 2,2 % et 3,1 % dans le sol (bien que la radioactivité des produits a diminué dans certains essais dans le sol). Les auteurs ont suggéré que la radioactivité des marqueurs des produits pourrait être attribuée à des impuretés, toutefois il est improbable que les impuretés se fussent accrues pendant la durée de l’essai. D’autres incertitudes de ces études proviennent des défis analytiques de la mesure du DBDPE. Étant donné que l’on s’attend à ce que la formation de produits de transformation n’affecte qu’une petite fraction du DBDPE d’origine, les mesures précises de DBDPE et les concentrations de produits non parents sont critiques pour la compréhension du processus de transformation. D’une part, ces nouvelles études indiquent une dégradation très limitée, voire inexistante, du DBDPE pendant les six mois de l’étude (p. ex., 91 % du DBDPE a subsisté). D’autre part, ce résultat n’est pas complètement inattendu étant donné les estimations obtenues par l’évaluation que la demi‑vie du DBDPE dans le sol et les sédiments se situe entre plusieurs mois et quelques années, et la prédiction que les produits de transformation constituent une fraction petite (mais importante) par rapport au DBDPE d’origine.
En raison du manque de données expérimentales sur les produits de dégradation, une modélisation RQSA a été effectuée pour évaluer leur persistance, leur biodégradation et leur toxicité. Consulter l’annexe C pour une description de la modélisation RQSA et des propriétés physiques et chimiques des produits de dégradation (tableau C-2).
Afin d’évaluer la persistance des produits de dégradation, une méthode de modélisation de la dégradation fondée sur les RQSA a été utilisée. Des résultats de sous-modèles BIOWIN (2010) indiquent que tous les produits de dégradation potentiels (nonaBDE à pentaBDE, DBDPE et nonaBDE hydroxylés, et acides phényles bromés) démontrent une biodégradation très lente ou récalcitrante dans l’eau (l’annexe C, tableau C-3).
Les produits de dégradation prévus ne contiennent pas de groupes fonctionnels qui devraient subir une hydrolyse, sauf les acides phényles bromés, qui sont reconnus pour leur teneur en halogénures d’alkyle. Le modèle HYDROWIN (2010) prévoit que les halogénures d’alkyle réagissent rapidement avec l’eau pour produire de l’acide d’origine et un halogénure d’hydrogène avec une demi‑vie inférieure à 10 minutes (ou plus rapide) (tableau C-3).
La demi‑vie prédite pour la dégradation atmosphérique des nonaBDE aux pentaBDE, du DBDPE et du nonaBDE hydroxylés en raison de leur réaction avec des radicaux hydroxyles varie d’environ 2 jours à plus de 4 jours (12 h par jour; AOPWIN, 2010) (tableau C-3). Le modèle AOPWIN (2010) définit également les acides phényles bromés comme subissant une réaction à l’ozone et prévoit une demi‑vie de 79,3 jours.
Par conséquent, compte tenu de tous les résultats modélisés, il y a des preuves que la dégradation prévue des BDPE débromés (des pentaBDE aux nonaBDE) et du nonaBDE hydroxylé est lente et que ces substances sont persistantes dans l’eau et l’air. D’après un ratio d’extrapolation de 1:1:4 pour une demi‑vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995), les nonaBDE aux pentaBDE, le DBDPE et le nonaBDE hydroxylés, et les acides phényles bromés sont très persistants dans le sol et les sédiments.
8.3 Potentiel de bioaccumulation
Des propriétés de la substance (log Koe, log Koa, taille moléculaire et diamètre transversal) ainsi que des données empiriques [facteur de bioconcentration (FBC), facteur de bioamplification (FBM), facteur d’amplification trophique (FAT), et facteur de bioaccumulation (FBA)] ont été pris en compte pour évaluer le potentiel de bioaccumulation du DBDPE.
Kelly et al. (2004) ont démontré que l’absorption du produit chimique par voie orale chez des poissons (et d’autres espèces sauvages) diminue avec l’augmentation du log Koe à partir de 7 environ jusqu’à 7,5, car la diffusion de substances hydrophobes à travers une couche d’eau non agitée vers la membrane luminale (c.-à-d. tractus gastro-intestinal) d’un organisme limite la vitesse d’absorption pour des substances comme le DBDPE qui ont un log Koe et une hydrosolubilité très élevés. Même si Arnot et Gobas (2003a, 2004, 2006) déclarent que le domaine de log Koe de leur modèle varie de 1 à 9, on considère qu’il y a suffisamment de preuves empiriques sur le terrain (p. ex., facteur de bioaccumulation) pour appuyer les estimations modélisées dépassant le log Koe d’environ 8,2. Ainsi, le log Koe de 9,89 pour le DBDPE est considéré comme étant hors du domaine du modèle pour le bilan massique du modèle BCFBAF sur trois niveaux trophiques (Arnot et Gobas, 2003a) et du modèle QSAR de Dimitrov et al. (2005). Plus important encore, le manque de données empiriques sur le facteur de bioconcentration et le facteur de bioaccumulation pour des produits chimiques dont le log Koe est supérieur à 8,3 ne permet pas d’effectuer une analyse comparative de données de référence liées aux résultats prévus. Ainsi, la bioaccumulation du DBDPE n’a pas été modélisée dans la présente évaluation. Cependant, des données empiriques sur l’analogue décaBDE ont été prises en compte dans l’analyse en raison de sa structure et de ses propriétés physiques et chimiques similaires.
Il y a eu des discussions dans les publications scientifiques concernant le potentiel de bioaccumulation du DBDPE (Law et al., 2006, Wang et al., 2010, et Hardy et al., 2012). Même si le DBDPE semble biodisponible pour certains organismes, les preuves disponibles sont équivoques quant à une bioaccumulation plus élevée. D’après ses propriétés physiques et chimiques (p. ex., diamètre maximal modérément large, hydrosolubilité très faible et log Koe élevé), le DBDPE devrait avoir un faible potentiel de bioconcentration. D’une part, des études de surveillance de diverses parties du monde ont signalé des concentrations de DBDPE mesurables dans des organismes aquatiques et terrestres. D’autre part, un grand nombre d’études du biote (fréquemment plus de 50 %) rapportent un nombre très élevé de non-détections (ECCC et SC 2015). Des données sur des FBM et des FBA sur le terrain ne sont pas cohérentes et présentent des incertitudes à prendre en compte. Des études du DBDPE chez des rats et des espèces sauvages indiquent que le DBDPE peut être biodisponible pour l’absorption, et que le métabolisme peut se produire chez certaines espèces.
Ainsi, même s’il semble que le DBDPE peut s’accumuler dans les tissus de certains organismes dans une certaine mesure, actuellement, il n’existe pas de preuves adéquates du potentiel de bioaccumulation. Présentement, il y a plus d’éléments de preuve indiquant que le potentiel de bioaccumulation du DBDPE est limité par une faible biodisponibilité, une faible efficacité de l’assimilation alimentaire (Kelly et al., 2004), des restrictions relatives à l’absorption stérique, et un certain niveau de métabolisme.
En ce qui concerne les produits de dégradation potentiels du DBDPE, la présente évaluation donne des preuves de modélisation préliminaire indiquant que de l’hexaBDE au nonaBDE, les congénères peuvent avoir un potentiel de bioaccumulation élevé et que ce dernier augmentera pour les congénères nonaBDE à hexaBDE.
L’évaluation du potentiel de bioaccumulation présentée ci-après tient compte de données empiriques liées au facteur de bioconcentration, au facteur de bioamplification, au facteur d’amplification trophique, au facteur de bioaccumulation, et au métabolisme.
8.3.1 Facteur de bioconcentration (FBC)
Des données expérimentales sur le FBC du DBDPE existent dans une étude (FBC inférieur à 2,5 à 34 L/kg) (CITI, 1991b). Cette étude a examiné la carpe japonaise exposée pendant huit semaines à des concentrations de DBDPE de 0,5 mg/L et 0,05 mg/L. Bien que l’étude ait indiqué qu’elle répondait aux normes de bonnes pratiques de laboratoire (BPL) de 1981, les concentrations d’exposition dans l’étude ont largement dépassé l’hydrosolubilité du DBDPE, et des agents dispersants ont été utilisés, car il n’est pas certain que des conditions à l’état stable ont été atteintes dans le système expérimental.
De récentes études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al., 2005; Sakuratani et al., 2008) laissent entendre que la probabilité qu’une molécule traverse la membrane cellulaire branchiale par diffusion passive diminue de façon importante à mesure qu’augmente le diamètre maximal (Dmax). D’après le modèle de FBCmax avec des facteurs d’atténuation (Dimitrov et al., 2005), le diamètre maximal du DBDPE varie de 1,4 à 1,7 nm. Cela laisse supposer que le DBDPE est susceptible de connaître un taux d’absorption réduit découlant d’effets stériques à la surface des branchies, ce qui permettrait aux processus d’élimination d’atténuer l’accumulation.
À un log Koe de 9,89 (tableau 3-1), la fraction biodisponible prévue de DBDPE dans la colonne d’eau (excluant la perte découlant de la volatilisation) selon les modèles de bilan massique des poissons est de 0,15 % (modèle BCFBAF, version 1.5), ce qui indique que la plus grande partie de la substance chimique dans la colonne d’eau n’est pas absorbée à la surface des branchies.
8.3.2 Facteur de bioaccumulation (FBA)
Les facteurs de bioaccumulation sont mesurés dans des conditions naturelles en tant que rapport entre les charges de substance chimique absorbées dans le corps entier découlant de toutes les expositions et les concentrations se trouvant dans l’eau ambiante. Le calcul du FBA est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances, car il intègre toutes les expositions à la substance chimique, y compris l’exposition alimentaire qui prédomine pour les substances présentant un log Koe supérieur à 4,0 environ (Arnot et Gobas, 2003a).
Un résumé d’une étude (2019, Albemarle Europe SPRL, résumé de renseignements soumis dans le cadre de REACH en tant que déclarant principal et fourni à Environnement et Changement climatique Canada lors de consultations ayant trait aux modifications proposées pour le Règlement sur certaines substances toxiques interdites: 2018, non référencé) sur la bioaccumulation du DBDPE (98.9 % et 98,6 % de pureté) due à une exposition alimentaire chez le crapet arlequin (Lepomis macrochirus) est disponible. Cette étude préliminaire à été réalisée afin de déterminer une gamme de doses et les conditions optimales pour une étude finale (en cours). L’étude a été réalisée en suivant les protocoles TG 305 et GLP de l’OCDE et comprenait un témoin positif (2,2’,4,4’5,5’-hexachlorobiphényle) et un témoin d’assimilation (oxyde de chrome (III)). Le crapet arlequin a été exposé à une alimentation commerciale traitée avec des concentrations nominales de DBDPE de 100 µg/g pendant 28 jours et de 1000 µg/g pendant 56 jours. Des résultats limités spécifiques au DBDPE ont été fournis. Toutefois, les chercheurs ont indiqué que l’efficacité d’absorption du DBDPE dans les voies gastro-intestinales du poisson était négligeable, et que le DBDPE ne s’accumulait pas dans les tissus. Le FBA du DBDPE à l’équilibre, exprimé sur une base de lipides, était respectivement de 0,0030 et de 0,0010 pour les groupes traités avec la dose faible et la dose élevée. Le résumé indique qu’aucun métabolites du DBDPE ne s’est formé dans les viscères.
Une étude menée dans la rivière Dongjiang (un affluent de la rivière Pearl) en Chine, où des études antérieures ont déclaré des concentrations de PBDE et de DBDPE dans des sédiments faisant partie des plus élevées au monde (He et al., 2012), a comparé le DBDPE dans des échantillons d’eau, de sédiments et de muscles de poissons pour la carpe de vase (Cirrhinus molitorella), le tilapia (Tilapia nilotica), et le Pléco commun (Hypostomus plecostomus) (échantillons prélevés en 2009 et 2010). Les concentrations de DBDPE mesurées étaient environ d’un ordre de grandeur supérieures aux concentrations de décaBDE relevées chez les poissons, ce qui n’était pas le cas pour les sédiments de la même étude. Les concentrations de DBDPE dans l’eau (dissoutes) et des muscles de poissons ont été utilisées pour estimer les valeurs de logFBA, donnant ainsi des valeurs de 6,1 à 7,0, ce qui indique une forte bioaccumulation (tableau 8-5). Toutefois, il y a des limitations et des incertitudes associées à cette étude. Par exemple, la concentration totale de DBDPE (y compris les particules pouvant être ingérées) peut représenter une exposition par l’eau, car l’exposition alimentaire n’est pas traitée, mais pourrait être très importante. En outre, l’étude comprenait des tailles d’échantillons plus petites, et des échantillons d’eau et de poissons ont été prélevés à différents moments, ce qui laisse entendre que l’« état stable » n’a pas été atteint (Arnot et al., 2006).
8.3.3 Facteur de bioamplification (FBM)
Des valeurs de FBM décrivent le processus dans lequel la concentration d’un produit chimique dans un organisme atteint un niveau plus élevé que celui atteint dans le régime alimentaire de l’organisme, en raison de l’absorption alimentaire (Gobas et Morrison, 2000). Un FBM dépassant 1 indique qu’il y a éventuellement une bioamplification et peut être considéré comme un indicateur du potentiel d’absorption et d’accumulation dans le biote. Le tableau 8-4 présente des données empiriques sur le FBM pour le DBDPE.
Dans une étude récente menée au sud de la Chine, on a analysé du DBDPE et du décaBDE chez des Martins-pêcheurs (Alcedo atthis), un oiseau piscivore, et leurs poissons de proie; ces substances provenaient d’un site de recyclage des déchets (Mo et al., 2012). Les FBM ont été calculés en tant que rapports entre les concentrations normalisées pour les lipides dans les muscles du Martin-pêcheur et les concentrations moyennes sur une base de lipides chez des poissons de proie. Pour le DBDPE, les FBM variaient de 0,10 à 0,77, ce qui indique que la bioamplification n’a pas eu lieu dans le cadre de la relation tropique analysée. Cette constatation contraste avec les valeurs de FBM du décaBDE, qui dépassaient 1. Dans une étude similaire comparant le DBDPE chez des Martins-pêcheurs dans la réserve de la biosphère de Dinghuisham et un site de référence au sud de la Chine, Mo et al (2013) ont également déclaré un FBM inférieur à 1 pour le DBDPE, des poissons-proies au Martin-pêcheur.
Une autre étude menée au sud de la Chine (She et al., 2013) a examiné une chaîne alimentaire d’espèces herbivores (sols de rizières, plants de riz et escargots pommes) et ont constaté que, même si les concentrations de DBDPE étaient mesurables dans des sols de rizières (14,7 ng/g p.s.) et des plants de riz (3,59 ng/g p.s.), elles n’étaient pas détectables chez les escargots pommes. Un rapport de concentration plant/sol de 0,20 a été déterminé pour le DBDPE.
Law et al. (2006) ont examiné la bioamplification et l’amplification potentielles du DBDPE dans le lac Winnipeg (Canada). Des échantillons de tissus musculaires de poissons (six espèces), de plancton, de moules, de sédiments, et d’eau ont été prélevés entre 2000 et 2004. Le DBDPE n’a pas été détecté dans l’eau, les sédiments, le zooplancton, les moules ou le grand corégone (Coregonus clupeaformis), mais il a été détecté chez le doré jaune (Stizostedion vitreum) (1,01 ng/g pl), le méné émeraude (Notropis atherinoides) (0,30 ng/g pl), la laquaiche aux yeux d’or (Hiodon alosoides) (0,62 ng/g pl), le meunier noir (Catostomus commersoni) (0,08 ng/g pl), et la lotte (Lota lota) (0,66 ng/g pl). Des facteurs de bioamplification (poids lipidique corrigé) pour les espèces de poissons de proie présentant des concentrations détectables de DBDPE variaient 0,2 à 9,2, avec quatre des cinq FBM déterminés comme étant supérieurs à 1. Toutefois, cette étude présente un certain nombre de limitations, notamment : les concentrations de DBDPE étaient faibles et proches du seuil de détection (0,1 µg/g), les tailles d’échantillons étaient petites, et les échantillons ont été collectés à différents moments, ce qui signifie qu’on ne peut supposer un état stable. Par ailleurs, les concentrations lipidiques étaient très faibles pour certaines espèces; ainsi, les données normalisées en fonction des lipides découlent peut-être d’une surestimation du FBM (Environnement Canada, 2010).
| Organisme d’essai | Valeurs à l’état stable, cinétiques et normalisées par rapport aux lipides (/kg) | Référence |
|---|---|---|
| Martins-pêcheurs (Alcedo atthis)/poissons de proie | < 1 | Mo et al., 2013 |
| Martins-pêcheurs (Alcedo atthis)/poissons de proie | 0,10 à 0,77 (FBM < 1) | Mo et al., 2012 |
| Doré jaune/Méné émeraude | 3,0 | Law et al., 2006 |
| Doré jaune/Meunier noir | 9,2 | Law et al., 2006 |
| Doré jaune/Laquaiche aux yeux d’or | 1,6 | Law et al., 2006 |
| Lotte/Méné émeraude | 2,0 | Law et al., 2006 |
| Grand corégone/Méné émeraude | 0,2 | Law et al., 2006 |
Les données de bioamplification disponibles sont limitées et la plupart des études ne fournissent pas de données cinétiques (p. ex., efficacité de l’assimilation alimentaire, taux d’élimination). Les efficacités de l’assimilation alimentaire déclarées chez les poissons pour l’analogue décaBDE sont faibles et varient de 0,02 % à 0,5 % (Kierkegaard et al., 1999, Stapleton et al., 2004, Wan et al., 2013). Dans une étude établissant des points de référence de composés absorbables et non absorbables, le DBDPE a été détecté dans des matières fécales, mais pas chez les poissons, ce qui confirme que cette constituait un choix adéquat en tant que point de référence non absorbable (Xiao et al., 2013).
La combinaison du log Koe de 9,89 et du log Koa de 14,45 indique qu’en cas d’exposition terrestre par voie alimentaire, le DBDPE ne devrait pas se bioamplifier dans les chaînes alimentaires terrestres comme le suggèrent Gobas et al. (2003) et Kelly et al (2007). Cependant, ces coefficients de partage ne tiennent pas compte des paramètres physiologiques comme le métabolisme. Kelly et al. (2004) abordent le fait que des FBM plus faibles liés à la transformation métabolique sont plus courants chez les oiseaux et les mammifères que chez les poissons, car ces organismes ont généralement une plus grande capacité de métabolisme des contaminants organiques.
Les études disponibles n’indiquent pas explicitement que le FBM du DBDPE dépasse 1. Toutefois, les expositions alimentaires au DBDPE peuvent toujours contribuer aux charges corporelles individuelles ainsi qu’au transfert trophique et à l’accumulation chez certaines espèces et dans certains réseaux trophiques.
8.3.4 Facteur d’amplification trophique (FAT)
Le FAT est une mesure du potentiel de bioamplification moyen d’une substance dans un réseau trophique étudié dans des conditions naturelles et il est estimé en mettant en corrélation des concentrations de substance normalisées dans le biote à différents niveaux trophiques.
Seule une étude nord-américaine a été recensée, présentant des résultats liés au FAT du DBDPE dans un réseau trophique pélagique (Law et al., 2006, voir la section relative au facteur de bioamplification pour des détails sur l’étude). Un FAT du DBDPE dans le lac Winnipeg a été défini à 2,7, ce qui indique l’occurrence d’une amplification tropique. Cependant, tel qu’il est décrit ci-dessus, les incertitudes dans cette étude sont jugées importantes et peuvent entraîner une surestimation de la bioamplification et de l’amplification trophique.
Des estimations du FAT ont été déclarées par un rapport de surveillance norvégien (KLIF, 2013) pour la partie continentale et les régions arctiques. Étant donné que les FAT étaient basés sur des échantillons représentatifs provenant de réseaux trophiques plutôt que d’une vraie « chaîne alimentaire » (c.-à-d. pas une relation trophique), les valeurs sont présentées dans les rapports à titre d’estimations. En outre, les auteurs indiquent que les incertitudes de l’étude devraient être prises en compte : par exemple, des échantillons de tissus d’organismes ont été prélevés du foie, du plasma et d’œufs (plutôt que de muscles ou de la graisse comme c’est le cas traditionnellement), et, étant donné que ces organismes influent sur le taux de renouvellement (c.-à-d. le taux de renouvellement plus court de ces tissus reflète une période d’exposition plus courte), il se peut que le potentiel de bioamplification dans l’environnement ne soit traduit avec précision. Malgré ces mises en garde, l’estimation du FAT (poids lipidique transformé en log) était de 3,9 (r2 = 0,49) pour le DBDPE dans le milieu marin de l’Arctique, de la morue polaire à l’ours polaire, et de 14,5 (r2 = 0,23) pour les échantillons marins de la partie continentale (de la morue au phoque commun d’eau douce), ce qui laisse supposer une amplification trophique élevée.
8.3.5 Autres études de la bioaccumulation et de la transformation métabolite
Deux études pharmacocinétiques à dose unique sur des rats ont démontré une absorption négligeable à limitée du DBDPE après administration orale. Une étude pharmacocinétique (Black, 2012) a constaté une absorption limitée du DBDPE par les rats en ayant reçu une seule dose dans de l’huile de maïs (100 mg/kg de DBDPE radiomarqué au carbone 14 et non), et que la substance ne s’accumulait pas dans les tissus. Presque toute la radioactivité administrée a été récupérée dans des matières fécales (89,7 %) et l’eau de rinçage de la cage (0,25 %) après 168 heures. Au total, les tissus échantillonnés contenaient moins de 0,02 % de la dose, ce qui laisse croire que le DBDPE a été éliminé dans les matières fécales au lieu d’être absorbé par le tractus gastro-intestinal (section 10.2, Évaluation des effets sur la santé).
Wang et al. (2010) ont étudié le potentiel de biodisponibilité du DBDPE chez les mammifères [à partir de 100 mg/kg p.c. par jour de DBDPE (et de décaBDE) dans de l’huile de maïs pendant 90 jours] ainsi que les métabolites potentiels chez des rats exposés à du DBDPE comparativement à des rats témoins. Au moins sept bromes inconnus contenant des composés ont été notés dans le foie de rats exposés à DBDPE. Cependant, aucun de ces composés ne concordait avec la période de rétention analytique de produits de débromation du DBDPE (des heptaBDE aux nonaBDE) définis au cours d’une expérience de photodégradation concomitante (EEEC et SC, 2015). Les seuls deux produits métaboliques affichant des pics suffisamment élevés pour fournir des renseignements structurels ont été relevés dans le foie et les reins principalement, et on a émis l’hypothèse selon laquelle il s’agirait d’un nonaBDE méthylsulfoné (MeSO2) et d’un nonaBDE éthylsufoné (EtSO2). Toutefois, Banasik et al. (2010) affirment que les données des spectres de masse ne concordent pas avec les structures sulfonées. En outre, le pourcentage d’absorption du DBDPE par rapport à sa transformation et à son élimination n’a pas été quantifié dans cette étude. Pour plus de détails sur cette étude, consultez la partie 10.2 Évaluation des effets sur la santé.
Le modèle Bmax du CPOP (2012) utilise le métabolisme de rats pour prédire les produits de dégradation de DBDPE. Deux produits de dégradation ont été prévus : le DBDPE hydroxylé et le nonaBDE hydroxylé.
McKinney et al. (2011a) ont comparé la débromation oxydative et réductive du DBDPE et d’autres produits ignifuges bromés (y compris le décaBDE) en utilisant un essai in vitro sur des microsomes du foie de mammifères se nourrissant d’organismes marins de l’Arctique (ours blanc, béluga, phoque annelé, et rat de laboratoire). Des essais de biotransformation ont été effectués en incubant des microsomes hépatiques avec des produits ignifuges organiques ou un mélange de produits ignifuges organiques, et en les comparant à des organismes témoins (c.-à-d. sans activité enzymatique). Généralement, les microsomes de tous les spécimens ont considérablement appauvri le DBDPE (de 44 % à 74 % dans les essais comprenant un seul produit ignifuge organique, et de 27 à 59 % dans les essais comprenant un mélange de produits ignifuges organiques, soit plus que tous les PBDE). Les auteurs ont conclu que la simple débromation n’était pas la voie principale (aucune preuve évidente de la formation d’un métabolite de DBDPE quelconque). Deux nonaBDE potentiels ont été détectés dans des essais et dans des organismes témoins (qui ne présentaient pas d’activité enzymatique), découlant probablement de la contamination et d’une débromation enzymatique. Deux métabolites phénoliques ont été détectés dans les microsomes hépatiques d’ours blancs, mais constituaient moins de 20 % du DBDPE appauvri. En général, on n’a pas détecté de métabolites pouvant refléter le degré d’appauvrissement du DBDPE (ou du décaBDE). Selon les auteurs, cela pourrait être dû à des concentrations faibles ou non détectables de métabolites, à des métabolites non extractibles, etc. Un examen industriel de cette étude laisse supposer que l’absorption, plutôt que le métabolisme, est responsable de l’appauvrissement du DBDPE (Hardy, 2012).
Malgré une seule exposition dans une étude de l’efficacité de l’absorption alimentaire d’un produit chimique chez des poissons, le DBDPE a été sélectionné comme « point de référence de composé absorbable » lorsqu’aucune absorption dans le tube digestif n’était attendue (Xiao et al., 2013). Dans une étude, des poissons ont été nourris avec un seul repas comprenant des aliments contaminés, puis analysés en termes de distribution chimique après cinq jours. Dans tous les essais, le DBDPE a été détecté dans les matières fécales, mais pas dans les tissus.
Une étude récente de l’exposition alimentaire (pendant 21 jours) de crécerelles à un analogue proche (à forte pureté), à savoir le décaBDE, a noté une absorption, une accumulation et une dégradation de la substance (débromation) en PBDE moins bromés in vivo (Letcher et al., 2014). À la fin de la période d’exposition de 25 jours, la concentration de décaBDE dans le foie et la graisse de rats exposés était bien plus élevée que chez les oiseaux témoins. Des nonaBDE et des octaBDE ont été détectés dans le plasma de crécerelles, tandis que des heptaBDE ont été détectés dans leur foie et leur graisse. Une élimination in vivo a également été observée : au 25e jour de la période d’élimination, le décaBDE dans le plasma s’est appauvri de 82 %.
Ces études sur des poissons, des rongeurs et des espèces sauvages fournissent des preuves variables et équivoque du degré de biodisponibilité et de métabolisme du DBDPE. Des études à court terme et à dose unique montrent que le DBDPE est excrété seulement avec une absorption minime chez les poissons et les rongeurs. D’autres études indiquent la biodisponibilité (absorption) et la transformation métabolique potentielle du DBDPE. Pour la substance, ces deux processus peuvent être propres à l’espèce et varier en termes de durée de l’exposition alimentaire.
8.3.6 Potentiel de bioaccumulation prévu des produits de dégradation
Tel qu’il est décrit dans la section sur la persistance, il existe certaines preuves d’un débromation possible du DBDPE engendrant des produits de dégradation. Étant donné qu’il n’y a pas de données expérimentales caractérisant le potentiel de bioaccumulation des produits de dégradation potentiels du DBDPE, cette mesure est déterminée à l’aide de la modélisation basée sur les RQSA. Pour les prévisions faites à l’aide du modèle RQSA, le log Koe des produits de dégradation a été estimé à l’aide de la méthode de l’ajustement des valeurs expérimentales fondée sur le DBDPE (annexe C, tableau C-2). Les valeurs modélisées de log Koe obtenues de 4,83 à 9,0 indiquent que certaines de ces substances ont un potentiel modéré à élevé de bioaccumulation dans le biote aquatique.
Le tableau C‑4 de l’annexe C présente les résultats détaillés de la modélisation du FBC et du FBA. Les résultats varient grandement : le modèle BCFBAF (EPI Suite, 2000-2012) prévoit que la plupart des produits de dégradation aient une bioconcentration faible à modérée, avec des FBC estimés sur la base des concentrations totales en milieu aquatique variant de 3,2 à 3803 (méthode de régression linéaire). Les estimations du FBC et du FBA pour un poisson de niveau trophique intermédiaire représentatif des eaux canadiennes, corrigées pour la biotransformation potentielle [constante du taux métabolique prévu (kM) = 0,016 à 0,271 pour 100 g de poisson à 15 oC], allaient de 38,9 à 3510 (FBC faibles à modérées) et de 738 à 176 000 (FBA faibles à élevées), respectivement (EPI Suite, 2010 à 2012). Cette modélisation indique que les produits de dégradation présentant le plus fort potentiel de bioaccumulation englobent l’hexaBDPE jusqu’à l’octaBDPE.
Les taux de biotransformation métabolique modélisés (kM) pour les produits de dégradation se situent généralement dans la plage des taux prévus pour le DBDPE d’origine (kM selon le modèle BCFBAF (2010) = 0,006/jour pour 100 g de poisson à 15 °C pour un poisson de niveau trophique intermédiaire représentatif des eaux canadiennes; kM selon le modèle CPOP = 0,0209/jour environ), à l’exception des acides phényles bromés. Les valeurs de kM pour les octaBDPE et les nonaBDPE sont également comparables à celles mesurées ou prévues pour leurs homologues octaBDE et nonaBDE (0,03/jour et 0,02, respectivement, pour 184 g de poisson à 15 oC) (Environnement Canada, 2010). Les valeurs de BDPE de kM prévues pour les BDPE moins bromés (pentaBDE à heptaBDE) sont plus élevées pour les PBDE moins bromés (Environnement Canada, 2010).
Ces résultats indiquent un potentiel de bioaccumulation élevé de certains produits de dégradation moins bromés du DBDPE, qui est confirmé par la recherche sur des produits de dégradation de l’analogue décaBDE. Cependant, il doit être considéré qu’il y a une incertitude quant à ces estimations (voir la section sur les incertitudes). En particulier, à un log Koe supérieur à 8,2, les estimations de la bioaccumulation pour le nonaBDPE hydroxylé et les produits de dégradation de DBDPE hydroxylés excèdent les limites d’ensemble de données du modèle BCFBAF, et les résultats basés sur cette extrapolation sont moins certains. Il convient de noter que le modèle FBC estime la bioconcentration découlant de l’exposition par l’eau, qui peut ne pas être la voie d’exposition dominante pour les produits de dégradation de DBDPE; par conséquent, les estimations du FBA peuvent mieux représenter le potentiel de bioaccumulation de ces substances. En outre, la prise en compte des valeurs de Koe (4,83 à 9,0) et de log Koa (8,61 à 17,27) indique que certaines de ces substances au moins auront un potentiel de bioamplification dans les réseaux trophiques terrestres à la suite d’une exposition alimentaire et d’une faible perte par exhalation. En raison de l’absence de données mesurées pour des données d’entrée fiables, la modélisation de la bioamplification terrestre n’a pas été effectuée dans la présente évaluation.
8.4 Résumé du devenir dans l’environnement
Le DBDPE devrait être rejeté dans l’eau de surface de sources industrielles, principalement par des eaux usées. Il peut y avoir un potentiel de migration du DBDPE des plastiques à l’atmosphère (poussière et air), compte tenu du fait que la substance est ajoutée à la matrice polymère et pourrait subir une lixiviation dans une certaine mesure. Une forte tendance d’adsorption en phase solide dans divers milieux (y compris des particules en suspension dans l’air) indique que le DBDPE résidera dans des biosolides, des sédiments et des particules en suspension dans l’air et qu’il sera transféré du sol à partir de dépôts secs et de l’épandage de biosolides sur des terres agricoles. L’exposition aux organismes directement par l’eau devrait être minime. La persistance intrinsèque élevée du DBDPE laisse entendre que des expositions à long terme peuvent être attendues dans les sédiments et le sol, avec un potentiel d’accumulation important dans les milieux environnants, découlant d’émissions continues. Le processus d’élimination de l’environnement devrait inclure l’enfouissement dans les sédiments et le sol et une dégradation potentiellement très lente. Le DBDPE devrait subir un transport à grande distance dans l’air et se déposer dans des milieux éloignés en raison du transport de particules, tel qu’il est prouvé par d’autres produits ignifuges hydrophobes affichant une forte adsorption aux particules atmosphériques. Même avec une exposition à long terme au DBDPE dans des milieux terrestres et aquatiques, d’après les publications limitées disponibles, cette substance ne devrait pas être hautement biodisponible; ainsi, les niveaux de résidus dans les tissus des organismes et la migration dans les réseaux trophiques ne devraient pas être importants. Toutefois, les futures études de bioaccumulation devraient être mesurées.
Il n’existe presque aucune donnée disponible sur les produits de dégradation potentiels du DBDPE. Toutefois les conclusions de cette analyse correspondent aux préoccupations exprimées dans le Rapport sur l’état des connaissances scientifiques écologiques concernant le décabromodiphényléther de 2010 (Environnement Canada 2010) de la dégradation possible du DBDPE en produits moins bromés à l’instar du décaBDE. Des prévisions basées sur la modélisation RQSA indiquent que les produits de dégradation prévus du DBDPE sont susceptibles de se retrouver et de se comporter dans l’environnement de façon similaire au DBDPE (résidant en phase solide dans divers milieux, expositions à long terme prévues dans le sol et les sédiments, et transport à grande distance potentiel dans l’air dû au transport de particules fines); cependant, certains produits de dégradation présentent également un fort potentiel de bioaccumulation dans les organismes, similairement à des PBDE analogues.
9. Potentiel d’effets nocifs sur l’environnement
9.1 Évaluation des effets sur l’environnement
Des données empiriques pour le DBDPE ainsi que des données comparatives pour son l’analogue structurel, le décaBDE, ont été prises en compte dans le poids de la preuve pour évaluer les effets écologies du DBDPE. La modélisation de toxicité aquatique du DBDPE fondée sur la RQSA n’a pas jugée fiable, à cause du dépassement des valeurs seuils de log Koe, ou parce que les ensembles de données d’apprentissage ne couvraient pas bien la substance (ECCC et SC 2017).
Les résultats des études de toxicité aquatique les plus empiriques présentent un haut niveau d’incertitude, une fiabilité contestable et des résultats qui sont difficiles à traduire relativement à l’environnement (p. ex., utilisation de solvants, études de la fraction aqueuse). Étant donné que la majeure partie du DBDPE se dépose dans le sol ou les sédiments (p. ex., la fraction biodisponible du DBDPE dans l’eau est de 0,15 % (modèle BCFBAF, version 1.5), l’exposition aquatique n’est pas considérée comme étant une voie d’exposition importante sur le plan environnemental. Pour cette raison, combinée à l’incertitude liée aux données de toxicité aquatique disponibles, aucune valeur critique de toxicité (pélagique) ni concentration estimée sans effet (CESE) n’ont été déterminées dans la présente évaluation. Cependant, des études récentes de l’analogue décaBDE dans des milieux aquatiques indiquent que des effets au niveau des molécules peuvent se produire chez certaines espèces.
Les résultats d’essais de toxicité chronique dans le sol et les sédiments indiquent que le DBDPE semble avoir le potentiel de causer des effets à de forts degrés d’exposition sur la reproduction de lombrics ainsi que sur la survie et la croissance des plantes, tandis qu’aucun effet n’a été observé pour les organismes vivant dans les sédiments. Aucun effet toxique manifeste n’a été relevé chez des espèces sauvages, bien que le DBDPE puisse affecter l’activité enzymatique chez certaines espèces d’essai.
9.1.1 Études empiriques dans l’eau
En raison de la lente cinétique d’absorption des composés hautement hydrophobes, on s’attend à ce que les essais de toxicité aiguë menés ne laissent pas suffisamment de temps pour établir un état stable (Tolls et al., 2009; Mayer et Reichenberg, 2006). Pour le DBDPE, des résultats d’études empiriques de toxicité aquatique présentent un niveau élevé d’incertitude ou des résultats imprécis; par exemple, le dépassement de la limite d’hydrosolubilité ou l’utilisation de méthodes d’essai difficiles à traduire relativement à des niveaux d’effets dans l’environnement (p. ex., approche liée à la fraction aqueuse, solubilisant).
Dans une étude, Nakari et Huhtala (2010) ont constaté que des effets du DBDPE sur des organismes aquatiques sont possibles à de faibles concentrations (p. ex., DBDPE = 0,0063 à 0,025 mg/L), bien que la dose dépasse largement la limite d’hydrosolubilité du DBDPE et que des solubilisants aient été utilisés Dans cette étude, on a démontré que le DBDPE supprimait le succès d’éclosion d’œufs de poisson zèbre, tandis que dans les hépatocytes de truites arc-en-ciel et de truites brunes, le DBDPE a augmenté la synthèse de la vitellogénine (un marqueur des effets œstrogéniques), inhibé l’activité de monooxygénase dépendant du cytochrome CYP1, et accru l’activité des isoformes UGT (Nakari et Huhtala, 2010). Bien qu’il y ait certaines questions sur la fiabilité de cette étude (p. ex., la concentration du solvant utilisé, le dépassement de la limite d’hydrosolubilité), les résultats donnent à penser que des effets aquatiques sont possibles dans les milieux où des substances similaires à des solubilisants coexistent avec du DBDPE dans l’eau (p. ex., la cosolvatation dans des effluents, les interactions du carbone organique dissous, les interactions d’agents de surface) ou éventuellement dans les cas où l’exposition à très long terme permet l’établissement de conditions à l’état stable.
D’après les renseignements donnés dans un résumé d’étude (2019, Albemarle Europe SPRL, résumé de renseignements soumis dans le cadre de REACH en tant que déclarant principal et fourni à Environnement et Changement climatique Canada lors de consultations ayant trait aux modifications proposées pour le Règlement sur certaines substances toxiques interdites : 2018, non référencé), Daphnia magna a été exposé à du DBDPE radiomarqué dans des conditions de circulation pendant 21 jours, en suivant les protocoles TG 211 et GLP de l’OCDE. L’étude incluait un solvant (diméthylformamide) et des contrôles du traitement de l’eau de dilution, et a été faite avec deux concentrations moyennes de traitement mesurées de 0,000256 et 0,000356 mg/L. Les résultats de l’étude n’ont montré aucun effet statistiquement significatif lié au traitement sur la survie, la reproduction et la croissance, aux deux concentrations. La CSEO pour cette étude a été établie à 0,000356 mg/L, alors que la CMEO était supérieure à 0,000356 mg/L.
Le décaBDE a également limité l’hydrosolubilité, et les premières évaluations des dangers ont indiqué que des effets toxiques aigus ou chroniques importants n’étaient pas susceptibles de se produire chez des organismes aquatiques à des concentrations soumises à un milieu hydrosoluble (p., ex., Environnement Canada, 2006; Environment Agency, 2007). Cependant, des études récentes de la toxicité aquatique de la substance ont signalé des effets sur des organismes aquatiques, des poissons et des amphibiens, comme des effets sur la croissance, la reproduction, le développement, le dysfonctionnement hormonal thyroïdien, et des altérations neurocomportementales après l’exposition à un faible niveau de décaBDE (Kuo et al., 2010; He et al., 2011, Noyes et al., 2011, Qin et al., 2012, ECHA, 2012). La plus faible concentration sans effet observé (CSEO) pour l’exposition par l’eau est déclarée comme étant inférieure à 0,001 mg/L pour la métamorphose retardée chez des amphibiens (Qin, 2010, voir également ECHA, 2012a). L’exposition de poissons au décaBDE par l’alimentation (études de l’alimentation), notamment le méné à grosse tête, à des concentrations pertinentes sur le plan environnemental, a montré que la substance peut interférer avec le système hormonal thyroïdien chez des alevins (Noyes, 2011, Noyes, 2013). Certaines questions concernant les études ci-après impliquent des problèmes méthodologiques liés à la quantification des effets du décaBDE dans la plage d’hydrosolubilité, des études n’étant pas fondées sur de bonnes pratiques de laboratoire, etc. De même, on ne peut exclure l’hypothèse selon laquelle des congénères de PBDE autres que le décaBDE auraient contribué aux effets signalés (Selon ECHA [2012], les produits de débromation observés dans les études incluent des nonaBDE, des octaBDE, des heptaBDE, des hexaBDPE et des pentaBDE). Toutefois, ces études soulèvent des préoccupations relativement aux effets toxicologiques potentiellement graves du décaBDE, et par analogie, du DBDPE.
Dans le profil de la boîte à outils RQSA de l’OCDE (2012), le DBDPE est classé comme un narcotique de surface de base/organique neutre pour la toxicité aquatique par les modèles OASIS (version 1.2) et ECOSAR; cependant, la classification aquatique par Verhaar (Modified) répertorie le DBDPE comme un composé de classe 4 (composés et groupes de composés agissant par un mécanisme spécifique). De même, des alertes de liaisons aux protéines sont définies (OASIS, v.1.2, OCDE).
Mayer et Reichenberg (2006) ont démontré une limite de point de fusion d’environ 210 °C, au-dessus de laquelle un produit chimique ne présentant qu’une narcose de référence (mode d’action) ne peut exercer une toxicité létale aiguë par des expositions aqueuses, c.-à-d. CL50. Étant donné que les effets sublétaux observés exigent des niveaux d’exposition bien au-dessus des limites de solubilité chimique, le poids de la preuve laisse entendre que le DBDPE est probablement une substance toxique de référence et que les expositions aqueuses uniquement ne peuvent avoir un effet létal sur les organismes dans des milieux aquatiques. Même si la modélisation de l’exposition utilisant des résidus corporels critiques (RRC) peut fournir des indications quant au potentiel d’effets néfastes (sublétaux) à la suite d’expositions environnementales et alimentaires combinées dues à une incertitude liée aux estimations du FBA, une analyse des RCC a été menée.
Consulter le document des renseignements à l’appui (ECCC, 2017) pour un examen des études de toxicité aquatique existantes.
9.1.2 Études empiriques dans les sédiments
Des essais de toxicité sur des organismes vivant dans des sédiments ont été effectués avec des chironomidés (Chironomus riparius) et des oligochètes (Lumbriculus variegates) (Krueger et al., 2003a, b; Hardy et al., 2012) (tableau 9-1). Les chironomidés (moucherons) ont été exposés au DBDPE dans des sédiments avec de l’eau sus-jacente pendant 28 jours dans des conditions statiques. Dans les essais sur les oligochètes, dix oligochètes par concentration d’essai ont été exposés au DBDPE pendant 28 jours dans des conditions de renouvellement continu. Dans les deux études, des effets potentiels ont été relevés, mais les paramètres n’ont pas montré d’effet important. Par conséquent, les valeurs de CE50 et les CSEO trouvées dans les études sur les chironomidés et les oligochètes pour tous les paramètres mesurés dépassaient la plus forte concentration, supérieure 5000 mg/kg. . Étant donné que les sédiments mis à l’essai contenaient 1,8 % de carbone organique, la solubilité maximale (ECCC et SC 2017) du DBDPE dans les sédiments était supérieure à 52,9 mg/kg p.s. Ainsi, il se peut que la limite de solubilité dans les sédiments ait été dépassée dans les conditions de l’étude, bien qu’aucun effet nocif n’ait été observé dans les organismes d’essai.
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/kg p.s). [poids sec] | Référence |
|---|---|---|---|---|
| Moucheron (Chironomus riparius) | Toxicité prolongée dans les sédiments : survie, émergence et développement | CE50 après 28 jours CMEO CSEO |
> 5000 > 5000 5000 |
Krueger et al., 2003a, Hardy et al., 2012 |
| Oligochète (Lumbriculus variegates) | Toxicité prolongée dans les sédiments : survie et croissance | CE50 après 28 jours CMEO CSEO |
> 5000 > 5000 > 5000 |
Krueger et al., 2003b, Hardy et al., 2012 |
Abréviations : CE – concentration produisant un effet, CMEO – concentration minimale avec effet observé, CSEO – concentration sans effet observé.
À l’instar de la toxicité aquatique, une récente étude de la toxicité dans les sédiments impliquant l’analogue décaBDE a signalé des effets sur des larves de poisson dans des sédiments (comportement et expression par la voie neurologique) à des concentrations plus faibles que celles qui ont été déterminées antérieurement (12,5 mg/kg) (Garcia Reyero, 2014), ce qui laisse entendre que des effets toxicologiques découlant de faibles niveaux de DBDPE constituent une possibilité, si un mode d’action similaire est déterminé.
Une valeur critique de toxicité de 5000 mg/kg (supérieure à 5000 mg/kg) est choisie pour le DBDPE dans des sédiments, représentant le seul paramètre de toxicité du DBDPE disponible, bien que cette valeur ne soit liée à aucun effet observé à cette concentration. En raison de l’incertitude liée à des variations interspécifiques et intraspécifiques pour un essai de la toxicité chronique, un facteur d’évaluation de 10 est appliqué. La CESE qui résulte est de 500 mg/kg p.s. Lorsque cette valeur est ajustée à partir de la teneur en carbone organique d’essai (1,8 %) à une teneur en contenu en carbone organique standard dans les sédiments (3 %) (Webster et al., 2004), la CESE pour les organismes vivant dans les sédiments est de 833 mg/kg p.s.
9.1.3 Études empiriques dans le sol
Des essais de toxicité dans le sol ont été effectués avec des eaux usées et des bactéries du sol, des lombrics et des plantes (Hardy et al., 2011) (tableau 9-2). Chez le lombric (Eisenia fetida), la survie (28 jours) et la reproduction (56 jours) n’ont pas été touchées (CSEO et CE50 supérieures à 3720 mg/kg), mais la reproduction au 56e jour a été affectée à la plus forte concentration (reproduction réduite de 60 %). Des concentrations de DBDPE ont montré une réduction importante dans le sol chez tous les groupes d’essai, variant d’une réduction de 17 % à 40 %, dépassant la valeur de 20 % généralement acceptée comme un environnement d’essai stable. Cependant, compte tenu du fait que des effets sont toujours notés, il est probable qu’ils demeurent similaires ou s’accentuent avec des concentrations stables.
Les effets du DBDPE sur l’émergence et la croissance de plantules terrestres ont été évalués par Hardy et al (2011) dans une étude de 21 jours. Le maïs (Zea mays), l’oignon (Allium cepa) et l’ivraie vivace (Lolium perenne) représentaient les monocotylédones, tandis que le concombre (Cucumis sativa), le soja (Glycine max) et la tomate (Lycopersicon esculentum) représentaient les dicotylédones. Aucun effet nocif sur un paramètre n’a été signalé pour le maïs, l’ivraie vivace ou le soja, donnant des valeurs de CE25 supérieures à 6250 mg/kg. La survie moyenne du groupe des concombres a été réduite de 18 % à la plus forte concentration (CSEO = 6250, CSEO = 3125 mg/kg). Des réductions de 22 % et 24 % de la haute moyenne de plants d’oignons, et de 32 % et 30 % de leur poids ont été observées aux deux plus fortes concentrations (CMEO = 3125, CSEO = 1563 mg/kg). Des effets sur la hauteur et le poids de plants de tomates à la plus forte concentration de DBDPE ont entraîné des réductions de 37 % et 40 % comparativement aux témoins (CMEO = 6250, CSEO = 3125 mg/kg). Une CE25 de 2440 mg/kg a été déclarée pour l’oignon.
Étant donné que le sol d’essai pour cette dernière étude contenait 2,7 % de carbone organique, la solubilité maximale du DBDPE était de 79,4 mg/kg p.s. [document de renseignements à l’appui, ECCC et SC, 2015]. Par conséquent, la limite de solubilité dans le sol peut avoir été dépassée dans les conditions de l’étude. Cela donne à penser que du DBDPE libre peut avoir été présent dans le système d’essai et qu’il peut avoir contribué aux effets observés par l’entremise de facteurs tels que l’obstruction physique des surfaces respiratoires.
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/kg p.s.) | Référence |
|---|---|---|---|---|
| Lombrics (Eisenia fetida) | Essai de survie de 28 jours | CL50 | > 3720 | Aufderheide, 2003 |
| Lombrics (Eisenia fetida) | Essai de reproduction de 56 jours | CE10 CE50 CMEO CSEO |
1860 3180 3720 (reproduction réduite de 60 %) 1910 |
Aufderheide, 2003 |
| Plantes : monocotylédones Oignon (Allium cepa) | 21 jours Survie et reproduction | CMEO CSEO CE25 |
3091 (3125 – valeur nominale) 1722 (1563 – valeur nominale) 2440 (réduction de la hauteur de 22 % et 24 % à 3125; réduction du poids de 32 % et 30 % à 6250, respectivement) |
Porch et Krueger, 2005 |
| Plantes : dicotylédones Tomate (Lycopersicon esculentum) | 21 jours Survie et reproduction | CMEO CSEO CE25 |
6076 (6250 – valeur nominale) 2677 (3125 – valeur nominale) 4990 (réduction de la hauteur de 37 % et réduction du poids de 40 % à 6250) |
Porch et Krueger, 2005 |
Abréviation — CL : Concentration létale, CE : concentration produisant un effet, CMEO : concentration minimale avec effet observé, CSEO : concentration sans effet observé.
D’après des paramètres découlant d’une série d’études de toxicité dans le sol (bactéries du sol, lombrics et six espèces de plantes), la plus faible concentration à laquelle un effet évident a été déterminé est la valeur de CE10 pour la reproduction du lombric de 1860 mg/kg de DBDPE dans le sol, et la CE25 pour la baisse du poids de plants d’oignons de 2440 mg/kg (CSEO dans l’oignon = 1563 mg/kg, mais de faibles valeurs de CE sont privilégiées par rapport à des valeurs de CSEO). La valeur de CE25 est considérée comme un effet évident et mesurable (c.-à-d. la valeur de CE10 est proche d’une valeur « sans effet »; par conséquent, aux fins de la présente évaluation, la valeur de 2440 mg/kg a été choisie comme valeur critique de toxicité. D’après les variations interspécifiques et intraspécifiques pour un essai de toxicité chronique et l’incertitude liée à la période d’exposition nécessaire pour le DBDPE, un facteur d’évaluation total de 10 a été appliqué, et la CESE obtenue est de 244 mg/kg de sol sec. Lorsque cette valeur est ajustée à partir de la teneur en carbone organique (0,027) à une teneur en carbone organique standard dans le sol de 2 % (ECHA, 2010), la CESE pour les organismes vivant dans le sol est de 180,7 mg/kg de poids sec.
9.1.4 Études empiriques dans la faune
Il existe peu d’études sur le DBDPE relativement aux espèces sauvages. Des études de toxicité standard à doses répétées chez des mammifères (rongeurs) menées avec du DBDPE n’ont généralement montré aucune dose sans effet nocif observé (DSENO) à la plus forte dose d’essai : 1000 mg/kg p.c./jour (étude sur des rats de 90 jours), et 1250 mg/kg p.c./jour par jour (étude prénatale chez des rats et des lapins) (Margitich, 1992, Hardy et al., 2002, 2010 et 2011). Wang et al (2010) ont déclaré une dose minimale avec effet observé (DMEO) de 100 mg/kg p.c. par jour, sur la base d’une hausse importante des taux sériques de l’hormone thyroïdienne triiodothyronine (T3) à cette dose chez des rats mâles Sprague-Dawley rats (six rats, par traitement, ont reçu par voie orale 100 mg/kg p.c./jour de DBDPE dans de l’huile de maïs pendant 90 jours). Le lecteur trouvera plus de détails sur l’analyse détaillée des études de toxicité chez des rongeurs dans la section 10.2 sur l’évaluation des effets sur la santé.
Egloff et al. (2011) ont mené une étude de l’approche in vitro-in ovo combinée afin de déterminer des effets liés à la concentration sur la toxicité manifeste et les niveaux d’expression hépatique par l’ARN messager (mARN) de 11 transcriptions dans des cultures primaires d’hépatocytes embryonnaires de poulets. Ils ont ajouté (en raison de n = 3 réplicats par groupe de traitement) du DBDPE à des concentrations de 0,001, 0,003, 0,01, 0,03, 0 et1, 0,2 μM (ces concentrations dépassent celles signalées chez les espèces sauvages); incubées pendant 36 heures. La viabilité des hépatocytes n’a pas été modifiées par le DBDPE (ou n’importe quel produit ignifuge bromé). À 0,2 µM, le DBDPE a produit 29 et 59 fois plus (4/5) d’isoenzymes.
Des études existantes sur les mammifères et sur les oiseaux laissent entendre que même si le DBDPE était biodisponible pour les espèces sauvages, il ne présentait pas d’effet dangereux manifeste (aucun effet à la plus forte dose), et les organismes peuvent indiquer un potentiel de métabolisme du DBDPE. Toutefois, des études récentes au niveau des molécules (oiseaux et poissons) laissent entendre que le DBDPE peut affecter les niveaux d’activité enzymatique chez les espèces d’essai.
Les valeurs critiques de toxicité estimées à 754 et 458 mg/kg p.c./jour chez des espèces sauvages ont été déterminées à l’aide de la méthode des valeurs toxicologiques de référence (Sample et al., 1996), selon laquelle des effets chez les rats ont été normalisés à un poids corporel typique du vison d’Amérique (Mustela vison) et de la loutre de rivière (Lontra canadensis) respectivement, qui sont des espèces fauniques représentatives (ECCC, 2015). Parmi un ensemble d’essais de laboratoire sur de rongeurs, nous avons choisi la DSENO de 1000 mg/kg p.c./jour obtenue par Margitich (1992) lors de son étude sur 90 jours de la toxicité subchronique par voie orale pour les rats, pour dériver la valeur critique de toxicité (VCT) et la valeur toxicologique de référence (VTR) [voir la sous‑section 10.2.1]. Nous appliqué un facteur d’évaluation de 10 à la VCT pour contrebalancer l’extrapolation depuis la valeur de dose sans effet subchronique à la valeur de dose avec effet chronique. Nous obtenons des VTR respectivement de 75,4 et 45,8 mg/kg p.c./jour dans l’alimentation du vison et de la loutre de rivière.
9.1.5 Effets des produits de dégradation sur l’environnement
Des prévisions modélisées de la toxicité aquatique ont été effectuées pour des produits de dégradation potentiels du DBDPE (annexe C, tableau C-5). Similairement au DBDPE, l’environnement pélagique est peu susceptible d’être la voie d’exposition la plus importante pour les BDPE plus bromés très hydrophobes (p. ex., octaBDE et nonaBDE, et nonaBDE et DBDPE hydroxylés), mais il fournit les seules données de toxicité pour les produits de dégradation et sert ainsi de niveau grossier d’évaluation. Le modèle ECOSAR (2012) classe les pentaBDE aux nonaBDE comme organiques neutres sur la base de leur structure chimique. Deux produits de dégradation potentiels prévus par le modèle CATALOGIC (2012) comprennent les nonaBDE hydroxylés (classés comme phénols) et les acides phényles bromés (classés comme acides halogénés, acides halogénés de vinyle ou d’allyle, et organiques neutres). Le dérivé de DBDPE hydroxylé prévu par le modèle CPOP (2012) de métabolisme chez des rats a été défini comme un alcool benzylique en plus d’organique neutre. En général, on a estimé que la plupart des groupes de produits de dégradation prévus avaient des effets toxiques chroniques à de très faibles concentrations (beaucoup moins de 1 mg/L) pour certains paramètres au moins, ce qui constitue une préoccupation si les substances se forment dans l’environnement. Par ailleurs, on a estimé que les nonaBDPE, octaBDPE et nonaBDE hydroxylés n’avaient pas d’effet à la concentration de saturation en raison de leur très faible hydrosolubilité et de leur log Koe élevé (supérieur à 8).
Étant donné que les produits de dégradation potentiels devraient être plus biodisponibles et plus susceptibles d’être bioaccumulables que le DBDPE d’origine, la toxicité aquatique prévue à de faibles concentrations doit être prise en compte, malgré l’incertitude liée au modèle. Même si l’on ne dispose pas de données empiriques sur la toxicité pour les BDPE moins bromés, des données sur le décaBDE sont également prises en compte et appuient l’hypothèse selon laquelle les produits de dégradation pourraient être intrinsèquement toxiques (p. ex., des tétraBDE aux hexaBDE) (Environnement Canada, 2006).
9.2 Évaluation de l’exposition de l’environnement
Les concentrations de DBDPE mesurées dans l’environnement ont été présentées et des données limitées sur les concentrations de DBDPE dans l’eau au Canada ont été recensées. Par conséquent, les concentrations environnementales ont donc été évaluées sur la base des renseignements canadiens disponibles, y compris les estimations relatives aux quantités estimées de la substance, les estimations relatives aux taux de rejets et les caractéristiques du milieu récepteur. Des concentrations environnementales ont été estimées pour des scénarios de rejets industriels, comme ceux décrits ci-après.
9.2.1 Scénarios d’exposition industrielle et concentrations environnementales estimées
Une exposition aquatique au DBDPE devrait avoir lieu si la substance est rejetée durant les procédés de fabrication industrielle (p. ex., formulation) ou directement dans un plan d’eau de surface récepteur ou un système de traitement des eaux usées qui rejette ses effluents dans un plan d’eau de surface récepteur. La concentration de la substance dans les eaux réceptrices près du point de rejet de système d’assainissement est utilisée comme concentration environnementale estimée (CEE) dans l’évaluation du risque (p. ex., pour l’eau et les sédiments) que pose la substance en milieu aquatique. On peut la calculer à l’aide de l’équation suivante :
CEE = [1000 x Q x L x (1-R)] / [N x F x D]
où
CEE : concentration en milieu aquatique due aux rejets industriels, en mg/L
Q : quantité de substance totale utilisée chaque année sur un site industriel, en kg/an
L : pertes dans les eaux usées, fraction
R : taux d’élimination du système de traitement des eaux usées, fraction
N : nombre de jours de rejets annuels, en jour/an
F : débit de l’effluent du système d’assainissement des eaux usées, en m3 par jour
D : facteur de dilution dans l’eau réceptrice, sans dimension
Étant donné que le DBDPE est utilisé par des installations industrielles et qu’il devrait être rejeté dans l’eau, plusieurs scénarios prudents de rejets industriels en milieu aquatique ont été élaborés pour couvrir une gamme d’activités industrielles potentielles diverses au Canada. Ces scénarios incluent des composés en caoutchouc et en plastique, des moules à injection en plastique, des installations d’extrusion du plastique, des installations d’enduction d’envers pour textiles, et d’autres installations utilisant du DBDPE pour des activités industrielles non précisées (ECCC, SC 2019 présente des descriptions des scénarios industriels). Des renseignements provenant de différentes installations prises en compte ont été recueillis, et les scénarios ont reflété des pratiques et des conditions prévues, y compris le type de traitement des eaux usées, les rejets directs ou indirects dans les milieux récepteurs, et l’environnement récepteur.
Le tableau 9-3 présente la série de données d’entrée sur le DBDPE utilisée pour estimer les concentrations de la substance dans le milieu aquatique près du point de rejet industriel. D’après ces hypothèses, ces scénarios industriels donnent des concentrations environnementales totales estimées dans le milieu aquatique de 3,0 × 10-7 à 2,1 × 10-3 mg/L. Les valeurs de CEE représentent les concentrations totales de DBDPE (associées aux particules et dissoutes) dans le plan d’eau récepteur près du point de rejet à chaque site et, dans certains cas, ces concentrations ont dépassé la limite d’hydrosolubilité du DBDPE (c.-à.-d. limite de DBDPE dissous) d’un à plus de deux ordres de grandeur. Les plus fortes CEE découlent de scénarios industriels impliquant des rejets importants. Ces scénarios présentent également des incertitudes (p. ex., industries du textile ou industries non précisées) et sont jugés plus prudents.
| Intrant | Valeur | Justification et référence |
|---|---|---|
| Quantité utilisée par site (kg) | 1000 à 1 000 000 | Enquête ou déclaration de substances nouvelles en vertu de l’article 71 |
| Pertes dans les eaux usées (%) | 0,001 à 1,0 | OCDE, 2004, 2009 |
| Efficacité d’élimination du système de traitement des eaux usées (%) | 0, 59,7 ou 94 | Prévision sans traitement, avec traitement primaire ou traitement secondaire |
| Nombre de jours de rejets annuels (jours) | 250 ou 350 | Hypothèse standard liée à la CE pour des rejets continus ou données de l’INRP |
| Débit de l’effluent du système d’assainissement des eaux usées (m3/jour) | 2900 à 400 000 | Données sur un réseau d’assainissement propre au site |
| Facteur de dilution (sans unité) | 1 à 10 | Débit propre au site du débit du réseau d’assainissement ou de l’environnement récepteur. Lorsque le facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. |
Outre les rejets industriels modélisés de DBBPE, des données de surveillance des effluents et des biosolides de 20 systèmes de traitement des eaux usées (comprenant des lagons, et des procédés primaires, secondaires et avancés de traitement de liquides) ont été considérées dans l’analyse de l’exposition. (Kim et al. 2014). Les concentrations environnementales dans l’environnement aquatique calculées à partir des mesures du DBDPE dans les effluents tombent entre 7,8 × 10-8 et 1,4 × 10-6 mg/L pour le DBDPE total (dissous ou associé à des particules).
Une méthode du partage eau-sédiment à l’équilibre a été utilisée pour estimer la concentration de DBDPE dans les sédiments benthiques. Cette approche est basée sur un principe de répartition décrite par l’Agence européenne des produits chimiques (ECHA, 2010) et intègre deux autres méthodes de calcul supplémentaires. La première méthode consiste à estimer la concentration de la substance dans la phase aqueuse (réellement dissoute) de l’eau sus-jacente de sa concentration totale, selon des études menées par Gobas (2007 et 2010). La deuxième méthode consiste à estimer la concentration de la substance dans les sédiments benthiques à partir de sa concentration dans la phase aqueuse de l’eau sus-jacente sur la base d’une hypothèse de partage à l’équilibre entre les sédiments benthiques et l’eau sus-jacente, tel qu’il est décrit par le National Center for Environmental Assessment de l’Environmental Protection Agency des États-Unis (USEPA, 2003). À l’équilibre, la concentration environnementale estimée (CEE) dans les sédiments benthiques peut être en corrélation, de façon linéaire, avec la concentration dans la phase aqueuse de l’eau sus-jacente. Des scénarios d’exposition des sédiments ont été élaborés à l’aide des CEE de scénarios de rejets industriels dans l’eau et la surveillance les CEE de systèmes d’épuration des eaux à travers le Canada décrite plus haut, dans le but de déterminer la CEE des sédiments à l’équilibre, normalisée à 3 % de carbone organique (la teneur typique de carbone organique dans les sédiments benthiques des rivières et des lacs). Les CEE dans les sédiments benthiques variaient de 3,34 × 10-4 à 8,78 mg/kg p.s.
Une méthode décrite par l’Agence européenne des produits chimiques (ECHA, 2010) a été utilisée afin de déterminer les CEE dans le sol découlant de l’épandage sur des terres de biosolides tirés des eaux usées. Cette méthode utilise les quantités de biosolides accumulés dans la couche supérieure de 20 cm du sol (profondeur de labourage) au cours d’une période de dix années consécutives comme fondement pour les CEE dans le sol. Selon une hypothèse sous-jacente de la méthode, la dégradation, la volatilisation, le lessivage et le ruissellement au moment de la pénétration des substances dans les sols après l’épandage de biosolides n’ont entraîné aucune perte. Cette hypothèse a permis d’obtenir des CEE dans le sol prudentes. Des scénarios d’exposition dans le sol ont été élaborés en étendant les scénarios de rejets dans le milieu aquatique décrits ci-dessus, en utilisant la concentration dans les biosolides d’eaux usées et les taux de production de stations de traitement des eaux usées propres au site. La concentration estimée dans les biosolides variait de 0,1 mg/kg p.s. à 730 mg/kg p.s. Les CEE dans le sol ont été normalisées à 2 % de carbone organique (ECHA, 2010) ou pour une application sur plus de dix ans (20 cm), et les valeurs de CEE obtenues variaient de 0,0046 à 25,3 mg/kg p.s.
9.2.2 Scénarios d’exposition relatifs aux produits offerts aux consommateurs et concentrations environnementales estimées
En plus de sources industrielles de DBDPE, les produits commerciaux et des produits offerts aux consommateurs représentent une source potentielle de DBDPE dans l’environnement, notamment par la volatilisation et par la production de particules découlant de l’abrasion (BESC, 2004). La présence de DBDPE dans des échantillons de poussière (voir la section sur la santé humaine) et les milieux de systèmes de traitement des eaux usées (influents, effluents et biosolides de stations d’épuration) (Ricklund et al., 2008, Kolic et al., 2009, Davis et al., 2012, Kim et al., 2014), appuient le fait que la substance peut être rejetée à partir de produits offerts aux consommateurs (Davis et al., 2012, Melymuk et al., 2014), bien qu’il y ait peu de publications quantifiant ces rejets. Même si des taux de rejets au cours de la durée de vie utile de produits commerciaux et de produits offerts aux consommateurs n’ont pas été déterminés pour le DBDPE, une étude menée par Kemmlein et al. (2003) a déterminé un taux d’émission spécifique (TES) de 0,3 ng/m2/h pour le décaBDE (découlant d’un mélange d’octaBDE commercial) au cours d’un essai de 105 jours sur un boîtier de téléviseur (23 °C). Un rapport de l’OCDE (2009) définit la volatilité potentielle dans l’atmosphère liée à la durée de vie utile pour des produits ignifuges organiques génériques présents dans des plastiques; cette volatilité est estimée à 0,05 % au cours de la durée d’utilisation pour l’utilisation intérieure et extérieure. Cependant, cette valeur générique pourrait être une surestimation pour une très faible volatilité de produit ignifuge organique comme le DBDPE. On considère que des rejets environnementaux de la substance par la lixiviation de polymères plastiques sont possibles, mais faibles. Le rejet potentiel de produits ignifuges organiques dans l’eau découlant de plastiques au cours de leur durée de vie utile est estimé à 0,05 % pendant la durée d’utilisation, si la substance est destinée à une utilisation intérieure, ou à 0,16 % si la substance est destinée à une utilisation extérieure (OCDE, 2009). La grande majorité des produits serait emmurée ou destinée à un usage intérieur; ainsi, le taux de rejet de 0,05 % est applicable et peut être une surestimation puisque le contact avec l’eau n’est pas prévu.
Étant donné le manque de données sur le DBDPE, nous avons étudié les résultats des recherches actuelles sur les rejets de décaBDE par les produits pour comprendre le comportement du DBDPE. À partir des mesures faites à Toronto (Canada), Melymuk et al. (2014) ont proposé une voie typique de rejet de PBDE en milieu urbain, :
- rejets issus de produits offerts aux consommateurs en environnement intérieur (p. ex., par volatilisation ou par abrasion de produits contenant une substance ignifuge), puis transport (de poussière) dans l’environnement extérieur;
- dépôts sur des surfaces;
- lessivage dans les eaux d’orage (systèmes de traitement d’eaux usées et tributaires).
L’examen de la charge dans le lac Ontario de décaBDE provenant de Toronto a déterminé que la source qu’environ 30 % de la charge totale provenait de systèmes de traitement des eaux usées, environ 60 % des tributaires, et moins de 8 % de dépôts atmosphériques (particules sèches et humides) (Melymuk et al., 2014). En supposant une voie similaire pour les rejets de DBDPE issus de produits, les concentrations mesurées disponibles dans l’eau, les sédiments et les biosolides (Kim et al., 2014) sont bien en deçà des concentrations estimées par des scénarios d’exposition liée à des utilisations industrielles. Par conséquent, les scénarios existants semblent protéger adéquatement d’autres rejets potentiels à partir de produits commerciaux et de consommation.
Divers mécanismes de transfert de produit ignifuge organique à partir de produits offerts aux consommateurs dans la poussière ont été proposés (Toms et al., 2011). Dans une étude, des vêtements renfermant de la poussière ont été proposés comme source importante d’additifs ignifuges, y compris le DBDPE transféré dans les systèmes de traitement des eaux usées par des activités de nettoyage et de lavage (Schreder et La Guardia, 2014, Melmyuk et al., 2014).
Schreder et La Guardia (2014) ont mesuré la concentration moyenne de DBDPE dans de la poussière domestique et des eaux usées de lavage échantillonnées dans 20 habitations au nord-ouest des États-Unis entre 2011 et 2012. La concentration moyenne de DBDPE dans les eaux usées de lavage était de 24,5 ng/L. Il est à noter que la concentration de DBDPE dans les eaux usées de lavage est légèrement supérieure à l’hydrosolubilité modélisée, mais qu’elle peut refléter une concentration totale. Les auteurs ont également mesuré les concentrations de DBDPE dans les influents et les effluents à deux systèmes de traitement des eaux usées desservant ces habitations. Ces systèmes reçoivent plus de 80 % de leurs volumes entrants de ménages, avec des rejets de produits ignifuges inconnus provenant des sources industrielles restantes. À l’aide des proportions d’influents prévues à partir des eaux usées de lavage et des ménages, les auteurs ont déterminé que les eaux usées de lavage pourraient constituer la principale source de produits ignifuges organiques dans ces systèmes de traitement des eaux usées (Schreder et La Guardia, 2014).
Des données sur les eaux usées de lavage du nord-est des États-Unis issues de l’étude de Schreder et La Guardia (2014) sont jugées suffisamment représentatives pour établir un scénario d’exposition pertinent pour les eaux usées de lavage au Canada, notamment comme voie de rejet de DBDPE découlant de produits offerts aux consommateurs dans l’environnement. ECCC indique que l’utilisation moyenne d’eau domestique est de 343 L/jour par Canadien, dont 20 % sont utilisés pour le lavage (Environnement Canada, 2013-2014). Ces valeurs, multipliées par 365 jours/an, 35 540 400 de Canadiens et les concentrations moyennes de DBDPE dans les eaux usées de lavage déclarées précédemment, donnent un rejet national annuel de 21,8 kg/an de DBDPE (Schreder et La Guardia, 2014, Statistique Canada, 2014).
Dans l’ensemble, les rejets issus de produits offerts aux consommateurs devraient être géographiquement dispersés et se propager pendant la durée de vie utile et la fin de vie utile de ces produits. Le faible taux de rejet de 21,8 kg/année, dispersé dans tout le Canada, suggère que le potentiel d’exposition au DBDPE provenant des eaux usées de lavage est plus faible que le potentiel d’exposition lié aux sources industrielles. Par conséquent, les scénarios d’exposition provenant des utilisations industrielles présentées ci-dessus paraissent protéger adéquatement des rejets potentiels dus aux eaux usées de lavage.
Tandis que le scénario relatif au lavage présenté ci-dessus tient compte d’une source majeure de rejet dans l’environnement au cours de la durée de vie utile de produits offerts aux consommateurs, il y a une absence de données permettant de quantifier l’élimination de déchets solides de poussière et les rejets en fin de vie utile découlant de tous les articles manufacturés, y compris de sources non résidentielles. Par exemple, on a décelé dans de l’eau d’infiltration provenant d’un site de recyclage du métal en Norvège une concentration moyenne de DBDPE de 80 ng/L, bien que le DBDPE n’ait pas été détecté dans l’eau d’infiltration d’un site d’enfouissement municipal dans la même étude (Nyholm et al., 2013).
9.2.3 Exposition des produits de dégradation
À l’instar des substances chimiques « émergentes » et de leurs produits de dégradation, nous manquons de données sur la présence de données de la dégradation du DBDPE dans l’environnement; possiblement à cause de l’absence de méthodes analytiques établies de détection, identification et quantification des produits de dégradation dans les matrices environnementales (Dirtu et al. 2014, Lambropoulou et Nollet 2014). Étant donné le peu de données empiriques sur les produits de dégradation potentiels du DBDPE, les méthodes d’estimation de l’exposition potentielle à ces substances dans l’environnement sont limitées. On suppose que la quantité de produits de dégradation est inférieure aux volumes déclarés pour le DBDPE d’origine. À l’aide de rapports des produits de dégradation du DBDPE prévus/générés à l’aide du modèle CPOP (2012) et en fonction de la voie de transformation, les rapports molaires de produits de dégradation initiaux pourraient varier entre 3 % et 6 % de DBDPE (formation de nonaBDPE ou de nonaBDE hydroxylé par biodégradation aérobie), à 31 % et 56 % de DBDPE (DBDPE hydroxylé et nonaBDE hydroxylé prévus pour des produits du métabolisme de rats in vivo). Les rapports molaires liés au métabolisme de rats in vivo indiquent qu’un tiers à la moitié du DBDPE d’origine biodisponible pour les organismes pourrait être transformé, ce qui pourrait avoir des conséquences pour l’exposition des espèces sauvages. Toutefois, les preuves présentées laissent supposer que seule une petite fraction du DBDPE sera biodisponible (voir la section sur la bioaccumulation), limitant ainsi l’exposition des espèces sauvages à ces produits de biotransformation. Les rapports molaires pour la biodégradation aérobie pourraient être les plus pertinents pour le DBDPE relevé dans le sol et éventuellement dans les sédiments ou les eaux usées ou les biosolides. Un faible rapport (3 à 6 %) est attribué à ces produits de dégradation relativement au DBDPE d’origine; cependant, les modèles indiquent qu’à l’instar du produit d’origine, certains produits de transformation pourraient être persistants et, ainsi se bioaccumuler dans l’environnement sur de longues périodes. Le rapport prévu (de 3 % à 6 %) tombe dans l’éventail des produits possibles de la dégradation du DBDPE (pas une substance d’origine) publiée dans une étude de six mois sur la transformation du DBDPE fondée sur la mesure de marqueurs radioactifs (p. ex, la radioactivité moyenne de la substance d’origine s’est accrue de 1,6 % à 9,9 %, le maximum, dans les sédiments et de 2,2 % à 3,1 % dans le sol, malgré la présence possible d’impuretés), bien que la longueur de l’étude fût plus courte que la demi-vie prévue pour la biodégradation du DBDPE (Stenzel et Schaefer 2015a, 2015b, 2015c). En outre, ce pourcentage de transformation est similaire à celui de la débromation du décaBDE mesurée dans des microcosmes sédimentaires sur une période d’un mois (perte de décaBDE marqué au carbone 13 jusqu’à un pourcentage de 3,5 % de PBDE total) (Orihel et al. 2015), ainsi qu’à la transformation de décaBDE prévue à l’aide du modèle CPOP (2012). Le rapport molaire des BDPE moins bromés (c.-à.-d. octaBDE et moins) devrait être inférieur à 1 % relativement au DBDPE d’origine. Par conséquent, même s’il semble, d’après les rapports molaires prévus pour la voie de dégradation, que les produits de dégradation devraient représenter une fraction mineure par rapport au DBDPE d’origine, ils constituent une fraction similaire à celle prévue/mesurée pour l’analogue décaBDE. Par ailleurs, si les concentrations de DBDPE dans l’environnement continuent d’augmenter, le gisement de produits de dégradation potentiel devrait également augmenter.
9.3 Caractérisation des risques pour l’environnement
9.3.1 Analyse du quotient de risque
Une analyse du quotient de risque, intégrant des estimations prudentes de l’exposition aux renseignements liés à la substance, a été réalisée pour les sédiments et le sol ainsi que pour les espèces sauvages, afin de déterminer si la substance pourrait avoir des effets nocifs sur l’environnement au Canada. On n’a pas mené d’analyse du quotient de risque pour le milieu aquatique pélagique en raison de la faible pertinence et de données de toxicité peu fiables.
Les scénarios industriels propres au site (fondés sur les plans d’eau récepteurs réels) présentés ci-dessus ont donné des concentrations environnementales (CEE) de 7,8 × 10-8 mg/L à 2,1 × 10-3 mg/L (BDBPE total). Ces valeurs de CEE représentent le niveau d’exposition dans les eaux réceptrices près du point de rejet. En utilisant des CEE en milieu aquatique pour déterminer les CEE à l’équilibre dans les sédiments, normalisées à 3 % de carbone organique, nous obtenons des valeurs de CEE dans les sédiments entre 3,34 × 10-4 et 8,78 mg/kg p.s. Une CESE a été calculée à partir de valeurs de toxicité chronique chez des organismes vivant dans les sédiments, donnant une valeur de 833 mg/ kg p.s. (voir la section sur l’évaluation des effets sur la santé). Le quotient de risque obtenu (CEE/CESE varie 1,76 × 10-7 à 0,011. Par conséquent, l’occurrence d’effets néfastes sur les organismes est peu probable pour ces scénarios industriels, dans une marge d’erreur supérieure à 1000 fois.
Les CEE prévues dans le sol découlant de l’épandage de biosolides d’eaux usées sur les terres (normalisées à 2 % de carbone organique) variaient de 0,00046 à 25,3 mg/kg p.s. La CESE pour les organismes du sol est calculée à 180,7 mg/kg p.s. (voir la section liée à l’évaluation des effets sur l’environnement). Le quotient de risque (CEE/CEE) varie de 2,5 × 10-6 à 0,14. Conséquemment, l’occurrence d’effets néfastes sur les organismes est peu probable à ces sites, à l’intérieur d’une marge d’erreur d’un facteur dix.
La dose journalière admissible (DJA) chez des espèces sauvages a été calculée à partir de la DJA pour le vison d’Amérique (Mustela vison) et la loutre de rivière (Lontra canadensis) consommant du poisson, en suivant l’approche de l’Environmental Protection Agency des États-Unis (1993). En calculant la DJA, une concentration dans les tissus du foie de grands brochets de 0,00378 mg/kg (ph) a été choisie et assimilée à la concentration corporelle à titre d’hypothèse prudente. Cette valeur représentait la plus forte concentration de DBDPE dans le biote canadien (Houde et al., 2014), donnant une DJA de 0,0007 mg/kg p.c./jour (pour la loutre) à 0,002 g/kg p.c./jour (pour le vison). EEEC et HC (2017) donne des détails sur les données d’entrée modélisées pour le calcul de la DJA. Les valeurs toxicologiques de référence (VTR) étaient de 75,4 (vison) et 45,8 (loutre) mg/kg p.c. par jour (voir la section liée à l’évaluation des effets sur l’environnement). Les quotients de risque (DJA/VTR) obtenus sont de 9,48 × 10-6 pour le vison et 4,07 × 10-5 pour la loutre, ce qui indique que même avec des hypothèses prudentes, les concentrations actuelles de DBDPE dans le biote canadien sont susceptibles de dépasser les seuils d’effets mineurs, dans une marge d’erreur supérieure à 1000 fois (tableau 9-4).
| Milieu | Scénario | CESE/VTR | CEE/DJA | QR |
|---|---|---|---|---|
| Sédiments | Rejets dans l’eau par l’industrie (ou l’eau de lessive, les eaux usées ou les produits offerts aux consommateurs) | 833 mg/kg p.s. | de 3,34 × 10-4 à 8,78 mg/kg p.s. | de 1,76 × 10-7 à 0,011 |
| Sol | Épandage de biosolides sur le sol | 180,7 mg/kg p.s. | de 4,6 ×10-4 à 25,3 mg/kg p.s. | 2,5 × 10-6 à 0,14 |
| Faune | Piscivores – DJA (vison/poisson) | 75,4 (vison) et 45,8 (loutre) mg/kg p.c./jour | 0,0007 (loutre) à 0,002 (vison) mg/kg p.c./jour | 9,48 × 10-6 (vison) 4,07 × 10-5 (loutre) |
9.3.2 Examen des éléments probants et conclusion
Le DBDPE ainsi que ses produits de dégradation devraient être persistants dans l’air, l’eau et les sédiments. Il est difficile d’établir le potentiel de bioaccumulation du DBDPE à partir de données limitées, cependant le poids de la preuve à ce jour laisse entendre que le potentiel de bioaccumulation du DBDPE devrait être faible. Toutefois, compte tenu de l’analogue décaBDE et des études préliminaires et de modélisation sur les produits de dégradation du DBDPE, il existe une certaine préoccupation concernant la formation potentielle de produits de dégradation bioaccumulables (et plus dangereux) qui peuvent être considérés comme des analogues de polybromodiphényléthers (PBDE) moins bromés. L’évaluation écologique préalable sur les PBDE (juin 2006) a conclu que les PBDE moins bromés, notamment le tétraBDE, le pentaBDE et l’hexaBDE, répondent aux critères décrits dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Cependant, les quantités élevées de DBDPE qui sont importées au Canada et les utilisations de cette substance indiquent un risque de rejet généralisé dans l’environnement au Canada. Une fois rejeté dans l’environnement, le DBDPE se retrouvera principalement dans les sédiments et le sol, où il est susceptible de persister pendant de longues périodes, entraînant l’accumulation de la substance, comme le montrent les temps de doublement rapide dans les sédiments des Grands Lacs. Le DBDPE, par sorption aux particules, présente également un potentiel de transport sur de grandes distances et de déposition dans des régions éloignées, d’après des résultats de la modélisation du transport sur de grandes distances et de certaines mesures dans des zones éloignées. La plupart des premières études sur les dangers indiquent que le DBDPE présente un faible potentiel de toxicité pour les sédiments aquatiques, les organismes terrestres et les espèces sauvages; toutefois, certaines incertitudes subsistent quant au mode d’action du DBDPE. Au moins un ensemble d’études du DBDPE en milieu aquatique (en dépit de l’usage de solvants) indique des effets au niveau moléculaire à de faibles concentrations; et des études récentes sur l’analogue décaBDE ont également signalé des effets sur des organismes aquatiques (exposition dans l’eau, les sédiments et par l’alimentation) à de faibles concentrations, ce qui justifie de faire preuve de prudence. Des données modélisées sur la toxicité aquatique de produits de dégradation potentiels du DBDPE laissent supposer des effets à de faibles concentrations dans la plage d’hydrosolubilité. Le manque de données empiriques sur la toxicité (p. ex., pour les organismes pélagiques, benthiques et du sol) pour des produits de dégradation potentiels est une importante source d’incertitude, ce qui justifie l’application du principe de prudence. En général, les conclusions de cette analyse sont conformes aux inquiétudes exprimées dans le Rapport sur l’état des connaissances scientifiques écologiques concernant le décabromodiphényléther (Environnement Canada 2010) relatives à la transformation possible du DBDPE en produits moins bromés, à l’instar du décaBDE. Même s’il semble que, sur la base des rapports molaires de la voie de dégradation, les produits de dégradation devraient représenter une fraction mineure comparativement au DBDPE d’origine; ils constituent toutefois une fraction similaire aux fractions prévues/mesurées de produits de débromation du décaBDE, et si les concentrations de DBDPE continuent d’augmenter (comme cela est visible dans les sédiments des Grands Lacs), le gisement de produits de dégradation bromés potentiels du DBDPE pourrait devenir important.
Ces renseignements indiquent que le DBDPE peut causer des effets écologiques nocifs au Canada.
9.3.3 Incertitudes de l’évaluation des risques pour l’environnement
L’un des principaux domaines d’incertitude influant sur les résultats de l’évaluation est l’« incertitude analytique ». Le DBDPE est un produit ignifuge bromé difficile à analyser; ainsi, le taux d’incertitude quant à cette substance peut atteindre 40 % à 60 % selon l’étalon interne utilisé pour la quantification (comm. pers., A. Covaci). La mesure inexacte du DBDPE dans les divers milieux peut avoir une incidence sur l’évaluation impliquant des données mesurées et, plus important encore, sur l’évaluation de la bioaccumulation et du danger.
On sait avec un degré élevé de certitude que le DBDPE est très stable dans l’environnement, notamment en raison de son long temps de séjour.
De manière générale, les données existantes sur la bioaccumulation du DBDPE sont limitées et incertaines, et des mesures effectuées en laboratoire et sur le terrain de qualité fiable ne sont pas disponibles. Tandis que le poids de la preuve actuel indique un potentiel de bioaccumulation faible à modéré, les valeurs de log Koe et de log Koa indiquent que le DBDPE peut subir une bioamplification dans les réseaux trophiques terrestres à la suite d’une exposition alimentaire. Une sous-estimation de la biodisponibilité du DBDPE pourrait donner lieu à une sous-estimation de l’exposition d’organismes au DBDPE. Un niveau de confiance modéré est attribué à la conclusion d’un potentiel de bioaccumulation du DBDPE faible à modéré.
Des CESE et des VRT ont été définies aux fins de l’analyse des risques, à l’aide des VCT tirées d’études de la toxicité du DBDPE dans le sol, les sédiments et chez des rongeurs, qui ont déclaré peu ou pas de toxicité. Toutefois, il existe des lacunes en matière de données sur la toxicité du DBDPE pour la faune et ses effets sur les espèces pélagiques et les organismes vivant dans les sédiments et le sol résultant d’une exposition prolongée au DBDPE (p. ex. pendant la durée de vie et sur plusieurs générations). En outre, on recense des études récentes sur la toxicité de l’analogue décaBDE en milieu aquatique et sédimentaire, qui signalent des effets à de plus faibles concentrations (p. ex., des concentrations dix fois plus faibles dans les sédiments que les CESE actuelles); bien qu’il y ait également des incertitudes liées à ces études, il est possible que les futures études de toxicité sur le DBDPE déterminent des effets similaires à de faibles concentrations. Cette incertitude a été prise en compte dans l’application du principe de prudence et la conclusion proposée pour l’évaluation. En raison des résultats peu fiables sur la toxicité aquatique et d’hypothèses de faible pertinence quant à l’exposition au DBDPE en milieu pélagique, le risque n’a pas été déterminé pour le milieu aquatique pélagique. Cela peut représenter une source d’incertitude relativement au risque pour les organismes aquatiques; cependant, l’exposition au DBDPE en milieu pélagique est jugée plus faible que les expositions par l’entremise de la chaîne alimentaire benthos et benthique. Généralement, le niveau de confiance à l’égard des résultats de toxicité du DBDPE est faible à modéré.
Ces incertitudes proviennent du manque d’information sur les concentrations dans l’environnement du Canada, notamment dans l’eau, le sol, les sédiments et le biote. Malgré cette limitation, les meilleurs renseignements disponibles ont servi à la production des scénarios d’exposition utilisés dans l’analyse des risques ont été produits à l’aide des meilleures informations disponibles. Ainsi, nous considérons qu’elles sont suffisamment prudentes pour caractériser les risques potentiels de rejet de DBDPE d’origine dans l’environnement canadien. En dépit des hypothèses prudentes de l’utilisation de grandes quantités de DBDPE dans des sites industriels, les quotients de risque pour de DBDPE d’origine étaient très inférieurs à 1, ce qui indique des risques faibles.
L’évaluation de l’exposition est centrée sur les sources industrielles ponctuelles de DBDPE considérées être les plus pertinentes pour l’environnement. Étant donné son utilisation comme additif ignifuge, une petite quantité de DBDPE migrera de produits, comme l’indique les concentrations retrouvées dans la poussière domestique (voir la partie sur les effets sur la santé). Pour cette évaluation, nous ne disposions que de peu de renseignements caractérisant les rejets potentiels causés par l’utilisation de produits, leur évacuation et leur recyclage. Jusqu’à maintenant, il n’existe pas de données sur la lixiviation de DBDPE à partir de sites d’enfouissement au Canada et, bien que la majorité des sites d’enfouissement traitent leur lixiviat dans des systèmes de gestion des eaux usées, des données sur la lixiviation aideraient à interpréter les rejets de fin de vie utile. La quantité de DBDPE dans les produits (en tenant compte de tous les produits importés et utilisés) pourrait être élevée. Toutefois, considérant tous les renseignements disponibles sur le décaBDE, son analogue, on peut supposer que les scénarios de rejets industriels actuels englobent les voies importantes de rejets causée par l’utilisation des produits. De plus, le scénario d’exposition à la poussière et aux eaux usées de lavage fondé sur les concentrations de DBDPE mesurées aux États-Unis laisse à penser que les scénarios de rejets industriels actuels englobent le rejet de DBDPE par cette voie au Canada. La confiance aux scénarios d’exposition au DBDPE est généralement modérée.
La plus forte incertitude dans la présente évaluation est liée au manque de données sur la présence de produits de dégradation du DBDPE dans l’environnement; on ne sait pas quels sont les produits de dégradation qui peuvent être produits dans l’environnement ainsi que les quantités de ces derniers. On dispose de peu de données empiriques sur les produits de dégradation, et les quelques études en laboratoire signalant la dégradation du DBDPE portent sur la photodégradation, surtout dans des solvants, dont certains ne sont pas pertinents sur le plan environnemental. En outre, il n’existe pas de méthode analytique accréditée pour la mesure des produits potentiels de la dégradation dans les matrices environnementales, ce qui limite les études de surveillance. Cependant, sur la base de l’analogue chimique décaBDE, la débromation du DBDPE dans l’environnement devrait avoir lieu. Bien que les seuls produits débromés du DBDPE définis à ce jour dans des études empiriques soient les nonaBDE (dans les sédiments et les solvants) jusqu’aux heptaBDPE (solvants uniquement), la débromation du DBDPE en hexaBDE et pentaBDPE devrait également avoir lieu sur la base de l’analogue proche décaBDE.
Par conséquent, même si la présente évaluation prévoit que les produits de dégradation du DBDPE aient une persistance globale, un potentiel de bioaccumulation et une écotoxicité élevés, il doit être considéré qu’il y a une incertitude quant à ces estimations. On ne recense aucune étude expérimentale évaluant les propriétés physiques et chimiques, la persistance, le potentiel de bioaccumulation, ou la toxicité de produits de dégradation débromés du DBDPE en vue de vérifier les valeurs prévues. Les produits de dégradation prévus s’inscrivent dans le domaine des modèles de persistance et de bioaccumulation présentés, mais il y a moins de certitude quant aux prévisions de la toxicité aquatique. Il est possible que la toxicité aquatique soit surestimée pour les produits de dégradation. Cependant, sur la base de l’analogue décaBDE, on s’attend à ce que les produits de dégradation de DBDPE soient plus biodisponibles et dangereux que le DBDPE d’origine.
10. Potentiel d’effets nocifs sur la santé humaine
10.1 Évaluation de l’exposition
10.1.1 Milieux naturels et aliments
Le DBDPE est caractérisé par une très faible hydrosolubilité et une très faible volatilité. Lorsqu’il est rejeté dans l’environnement, il devrait se répartir principalement dans la poussière, le sol et les sédiments. En milieu résidentiel, le DBDPE est une composante courante de la poussière domestique. D’après les taux d’absorption dans l’air, l’eau, les aliments, la poussière, et le sol d’une étude de Santé Canada (1998), l’absorption totale estimée du DBDPE à partir des milieux naturels et d’aliments pour la population canadienne varie de 0,001 µg/kg p.c./jour pour les adultes âgés de plus de 60 ans, à 0,062 µg/kg p.c. par jour pour les nourrissons âgés de 0 à 6 mois. La poussière est le principal facteur contribuant à l’exposition journalière totale liée aux milieux naturels et aux aliments. Ces résultats sont résumés à l’annexe D.
Les concentrations en milieu naturel choisies pour calculer l’absorption estimée sont décrites dans les sections suivantes :
10.1.1.1 Air
Air ambiant
Des concentrations de DBDPE signalées dans l’air ambiant sont présentées dans le document de renseignements à l’appui (ECCC et SC 2015).
Aucun relevé de DBDPE dans l’air ambiant canadien n’a été recensé, bien que le DBDPE ait été détecté dans des noyaux de glace de l’île Devon (Nunavut) (Meyer et al., 2012). Par ailleurs, le DBDPE a été détecté dans des échantillons d’air ambiant d’autres pays. La concentration atmosphérique de DBDPE aux États-Unis est surveillée dans le cadre du Réseau de mesure des dépôts atmosphériques (RMDA), avec des données publiées disponibles de 2003 à 2011. La plus forte concentration moyenne (phases gazeuse et particulaire) déclarée pour un site urbain à Cleveland (Ohio) était de 22 pg/m3, dans le cadre d’une surveillance effectuée entre 2005 et 2006 (Venier et Hites, 2008). Au cours de la même période (2005-2006), la plus faible concentration moyenne déclarée était de 1,0 pg/m3 trouvée dans un site éloigné à Eagle Harbor (Michigan). Au cours de la période allant de 2005 à 2011, la plus forte concentration moyenne (phase particulaire uniquement) était de 5,2 pg/m3 à un site urbain également situé à Cleveland (Ohio), tandis que la plus faible concentration moyenne (phase particulaire uniquement) déclarée était de 1,2 pg/m3 à un site éloigné également situé à Eagle Harbor (Michigan) (Ma et al. 2013). Les auteurs de cette étude ont indiqué que les données étaient trop éparses pour le DBDPE afin de déterminer s’il y avait une tendance temporelle (aucune tendance parmi les cinq sites d’échantillonnage dans les Grands Lacs). Les concentrations moyennes de sept ou dix substances mesurées, y compris le DBDPE, étaient supérieures à Chicago, même si la population de Cleveland ne représente qu’un tiers de celle de Chicago, et selon les auteurs, cela pourrait être lié à la présence d’une ou de plusieurs sources industrielles de produit ignifuge à Cleveland ou dans ses environs (Ma et al., 2013). Le DBDPE a aussi été détecté dans des particules atmosphériques à Aspvreten (Suède), une concentration maximale de 7,9 pg/m3 a été signalée à ce lieu éloigné (Egebäck et al., 2012). Un projet d’analyse préalable nordique a déclaré des concentrations de DBDPE dans l’air ambiant à des lieux au Danemark, en Norvège et en Suède (Coopération des pays nordiques, 2011). Parmi tous les lieux surveillés, la plus forte concentration a été signalée pour les particules atmosphériques recueillies dans une région urbaine d’Oslo (Norvège), elle était de 44 pg/m3.
La concentration maximale de DBDPE dans l’air ambiant déclarée pour la Chine était de 3578 pg/m3 dans une zone fortement industrialisée et urbanisée (Shi et al., 2009). Tian et al. (2011) ont également déclaré un taux de dépôt de 41 600 ng/m2 par an (environ 114 ng/m2 par jour) dans la même zone fortement industrialisée et urbanisée (ainsi que 9780 et 850 ng/m2/an près d’un site de recyclage de déchets électroniques et à un site rural, respectivement) au sud de la Chine.
Pour calculer l’estimation de la limite supérieure de la contribution de l’air extérieur à la dose journalière reçue par la population canadienne, nous avons utilisé la plus forte concentration moyenne mesurée à Cleveland (Venier et Hites, 2008), que nous avons considéré protectrice, pour l’exposition urbaine au Canada et, tel que l’a proposé Ma et al. (2013), elle peut également tenir compte des sources ponctuelles de DBDPE.
Air intérieur
Une étude récente sur la mesure du DBDPE dans l’air intérieur de 23 maisons de Toronto (Canada) a signalé des concentrations allant de la non-détection à 74 pg/m3 (Venier et al. 2016). Des études sur la qualité de l’air intérieur résidentiel à Oslo, en Norvège, et dans trois villes suédoises différentes ont décelé des concentrations non détectées à des concentrations de 963 pg/m3 (Karlsson et al., 2007; Cequier et al., 2014). Un projet d’analyse préalable nordique a déclaré une concentration maximale de DBDPE de 56 pg/m3 dans des particules atmosphériques au sein d’un bâtiment de bureaux à Oslo (Norvège) (Coopération des pays nordiques, 2011). Le DBBPE n’a pas été détecté dans l’air intérieur de trois aéronefs au cours de vols en Suède (LD = 0,01 picomole; Strid et al., 2014), ni dans l’air intérieur d’un hôtel au Japon (Takigami et al., 2009).
La concentration maximale de74 pg/m3 déclarée dans l’étude au Canada (Venier et al., 2016) a été utilisée pour calculer l’estimation de la limite supérieure de l’absorption quotidienne de DBDPE dans l’air intérieur par la population canadienne.
Les estimations de l’exposition par l’air (intérieur et ambiant) sont montrées à l’annexe D. Les estimations pour l’air intérieur et extérieur, sont inférieures à 0,0001 µg/kg .pc./jour ce qui est jugé négligeable.
10.1.1.2 Poussière
Le DBDPE est une composante courante de la poussière domestique et sa présence a été signalée dans de nombreux échantillons de poussière domestique. Bien que la source de DBDPE ne soit généralement pas définie, elle peut être constituée par des équipements électroniques contenant du DBDPE sous forme d’additif ignifuge ou par de la poussière pénétrant dans les habitations à partir de milieux extérieurs. Dans une étude canadienne non publiée, cinq maisons à Toronto ont fait l’objet d’un échantillonnage chaque année de 2010 à 2012, et la concentration maximale de DBDPE dans la poussière était de 5600 ng/g. Les auteurs de cette étude ont indiqué que les profils de poussières contenant du DBDPE pour les salons et les chambres à coucher étaient supérieurs, comparativement aux cuisines. En 2011, aucune concentration de DBDPE n’a été détectée dans des échantillons supplémentaires d’essuie-glace de cinq maisons de Toronto, ni dans la majorité des essuie-mains de personnes vivant dans ces maisons [fréquence de détection de 8 %; nombre de participants non précisé] (Diamond et al., 2013). Dans le cadre d’études canadiennes récemment publiées, on a mesuré le DBDPE dans la poussière de 35 maisons et 10 bureaux à Toronto en 2012, et de 23 maisons à Toronto en 2013. Les concentrations de DBDPE dans la poussière allaient de la non-détection à 5500 ng/g, les gammes de concentrations étant plus larges et les moyennes plus élevées dans les maisons que dans les bureaux. Les échantillons de frottis de fenêtres en 2013 ont produit de concentrations de DBDPE allant de la non-détection à 6,8 ng/m2 [pour une fréquence de détection de 23,5 %] (Abbasi et al. 2016; Venier et al. 2016). La plus forte concentration maximale de DBDPE dans de la poussière domestique aux États-Unis est de 11 070 ng/g, déclarée par Stapleton et al. (2008) dans une étude au cours de laquelle des échantillons ont été prélevés à 20 habitations dans la grande région de Boston. Par ailleurs, le DBDPE a été mesuré dans des échantillons de poussière prélevés à 16 habitations de San Francisco, avec la plus forte concentration déclarée à 2800 ng/g (Dodson et al., 2012).
Abbasi et al. (2016) ont également analysé l’association de DBDPE dans la poussière trouvée dans l’étude de 2012 avec de la poussière sur des produits dans les mêmes lieux. On a surtout retrouvé le DBDPE sur la surface de téléviseurs à écran plat (de la non-détection à 6262 ng/frottis), suivi par les appareils audio ou vidéo et les électroménagers (de la non-détection à 1380 ng/frottis). Les auteurs ont montré qu’il existait une corrélation positive entre la moyenne géométrique des concentrations d’ignifugeants halogénés (dont le DBDPE) dans la poussière des maisons et des bureaux et celles dans la poussière des surfaces des produits électroniques.
En Europe, la plus forte concentration maximale de DBDPE signalée pour la poussière domestique était de 24 000 ng/g trouvée en Suède; elle a été mesurée dans un des six appartements échantillonnés. Toutefois, dans les cinq autres appartements et dans une maison, les concentrations variaient de 470 à 2200 ng/g (Sahlström et al., 2012, Remberger et al., 2014). La concentration maximale déclarée en Roumanie (12 240 ng/g) était comparable à la concentration maximale déclarée aux États-Unis (Dirtu et al., 2012). Des valeurs inférieures furent relevées dans de la poussière domestique d’Oslo en Norvège (4460 ng/g; Cequier et al., 2014), de Prague em Tchéquie (3567 ng/g, Kalachova et al., 2012), de la région des West Midlands en Grande-Bretagne Uni (3400 ng/g, Harrad et al., 2008), de 2126 ng/g en Belgique Ali et al., 2011a) et de 1570 ng/ en Allemagne (Fromme et al., 2014). En Asie, la concentration maximale signalée dans la poussière domestique en milieu urbain était de 16 000 ng/g en Chine (Qi et al., 2014), mais des concentrations maximales plus faibles ont été déclarées dans d’autres pays : 2175 ng/g à la ville de Koweït (Ali et al., 2013a) et 850 ng/g à Gujrat au Pakistan (Ali et al., 2012a). La concentration maximale de DBDPE déclarée dans de la poussière domestique de Nouvelle-Zélande était de 1430 ng/g (Ali et al., 2012b). Les différences dans les concentrations observées peuvent être dues aux normes d’inflammabilité variables dans différentes régions ou à la diversité des produits offerts aux consommateurs présents dans chaque habitation.
Au chapitre des environnements intérieurs non résidentiels, Ali et al. ( 2011a), Goosey et al. (2009) et Harrad et al. (2008) ont étudié la poussière dans les salles de classe, les bureaux et les véhicules de la région des West Midlands (Royaume-Uni). C’est la poussière des véhicules que l’on a retrouvé la plus forte concentration maximale de DBDPE, soit 2900 ng/g (Harrad et al., 2008). À Prague (République tchèque), la concentration maximale de DBDPE signalée dans de la poussière de véhicules était de 3567 ng/g (Kalachova et al., 2012). Les concentrations maximales de DBDPE dans de la poussière de véhicules à la ville de Koweït (Koweït) (8200 ng/g) et à Faisalabad (Pakistan) (5420 ng/g) étaient généralement supérieures aux concentrations déclarées pour la poussière de véhicules en Europe. Toutefois, un échantillon de poussière dans une nouvelle voiture en Suède présentait une concentration de 92 000 ng/g (Remberger et al., 2014). Au cours de vols effectués en Suède, les concentrations de DBDPE dans trois aéronefs variaient de moins de 1460 à 5730 ng/g (Strid et al., 2014). Les concentrations maximales de DBDPE déclarées dans la poussière des bâtiments non résidentiels en Allemagne et en Suède allaient de 140 (écoles) à 8100 ng/g (centres de conférence) (Brommer et al., 2012; Remberger et al., 2014). Dans une étude de 81 habitations et bâtiments urbains et ruraux en Chine, les concentrations mesurées des bâtiments urbains étaient supérieures aux concentrations des bâtiments ruraux, avec des concentrations maximales de 5300 (bureau) à 13 000 ng/g (usine de champignons) (Qi et al., 2014). La concentration la plus forte déclarée dans trois bureaux de Pékin (Chine) était de 16 200 ng/g (Cao et al., 2014). Dans des installations de traitement de déchets électroniques en Thaïlande, les concentrations de DBDPE dans la poussière variaient de 380 à 44 000 ng/g (moyenne = 8630 ng/g); les six mesures les plus élevées (de 12 500 à 44 000 ng/g) dans l’ensemble des 21 échantillons ont été associées à la poussière de salles abritant des ordinateurs personnels et des imprimantes (Ali et al., 2011b). Des concentrations de 20 000 et 23 000 ng/g ont également été détectées dans un site de traitement des déchets électroniques en Suède (Remberger et al., 2014).
Des résultats d’études nord-américaines sont considérés comme étant les plus représentatifs des concentrations de DBDPE dans la poussière canadienne. Bien que les résultats de l’étude de Toronto aient montré une plus faible concentration maximale de DBDPE dans la poussière intérieure, nous avons choisi la valeur maximale de 11 070 ng/g obtenue par Stapleton et al. (2008) a Boston pour déterminer la limite prudente pour l’absorption quotidienne par la poussière pour la population canadienne générale. Cette concentration est considérée comme la limite supérieure et tient compte de la variabilité potentielle des concentrations dans la poussière de différents milieux intérieurs (p. ex., bureaux, véhicules, aéronef).
Pour tous les groupes d’âge, l’exposition découlant de l’ingestion de poussière contribuait à entre 76 % et 100 % de la dose journalière estimée de DBDPE.
10.1.1.3 Sol et sédiments
Aucune donnée de surveillance du DBDPE dans le sol n’a été déterminée au Canada et aux États-Unis. Bien que des concentrations de DBDPE aient été déclarées dans le sol de surface en Indonésie et dans le sol de terres agricoles en Chine (Ilyas et al., 2011; Shi et al., 2009), on a estimé que les estimations modélisées de la concentration dans les sols au Canada (voir ci-dessous) étaient plus pertinentes pour les estimations de l’absorption en fonction du sol.
Une concentration environnementale estimée (CEE) maximale de DBDPE dans le sol de 25,3 µg/g p.s. (25,3 mg/kg p.s.) a été estimée pour l’épandage de biosolides sur un champ agricole à l’aide de méthodes prudentes (voir la section 9.2.1). Étant donné qu’aucune étude pertinente de surveillance du DBDPE dans le sol n’a été relevée, la CEE maximale dans le sol a été retenue pour calculer les estimations de la limite supérieure de l’absorption provenant de l’ingestion de sol pour la population canadienne.
10.1.1.4 Eau
Des concentrations de DBDPE signalées dans l’eau de surface et les précipitations sont présentées dans le document de renseignements à l’appui (ECCC et SC 2017). Aucune mesure dans l’eau souterraine ou l’eau potable n’a été recensée.
Le DBDPE a été détecté dans les cinq Grands Lacs à des concentrations moyennes de 0,25 ± 0,05 pg/L (Lac Huron) à 6,7 ± 5,0 pg/L (Lac Supérieur) [LD non précisée]. La plus forte concentration a été relevée au lac Ontario à 10,8 pg/L, même s’il n’y avait qu’un seul échantillon de ce lac dans lequel le DBDPE a été détecté. Les auteurs ont indiqué que la concentration mesurée dans le lac Ontario était similaire aux concentrations mesurées dans le lac Supérieur (Venier et al., 2014). D’autres études de l’eau de surface canadienne n’ont pas détecté de DBDPE (Law et al., 2006, Muir et al., 2011).
En Norvège, on a détecté du DBDPE dans l’une des trois sources d’eau alimentant des systèmes de traitement de l’eau à une concentration moyenne de 5,1 ng/L (dans deux tiers des échantillons composites d’eaux usées entrantes), mais il n’a pas été détecté dans l’eau d’infiltration d’un site d’enfouissement municipal à Drammen, également en Norvège (Nyholm et al., 2013). Le DBDPE n’a pas été détecté dans la mer, le goulet de marée, et l’eau de rivière en Espagne (LD = 5,0 ng/L) (Valls-Cantenys et al., 2013).
Le DBDPE n’a pas été détecté dans un étang au sud de la Chine (Wu et al., 2010). Une autre étude a échantillonné de l’eau de surface de la rivière Dongjiang au sud de la Chine et signalé la présence de DBDPE en phase dissoute (c.-à-d. eau filtrée à partir de l’échantillon) et en phase particulaire (He et al., 2012). Le DBDPE a été détecté à une concentration maximale de 38 pg/L en phase dissoute, et de 110 ng/g poids sec en phase particulaire. La rivière Dongjiang coule à travers la ville de Dongguan, une base de fabrication intensive d’équipements électroniques et de télécommunications; par conséquent, on suppose que les activités industrielles environnantes contribuent à l’apport de DBDPE dans la rivière.
La plus forte concentration de DBDPE signalée dans l’eau de surface en Amérique du Nord (de 10,8 pg/L mesurée dans le lac Ontario) a été utilisée pour calculer l’estimation de la limite supérieure de l’absorption par l’eau potable pour la population canadienne. Dans le cadre du Réseau de mesure des dépôts atmosphériques (RMDA), des quantités mesurables de DBDPE ont également été déclarées dans les précipitations pour plusieurs lieux aux États-Unis (Salamova et Hites 2010, Ma et al., 2013). Du fait que les précipitations subissent de nombreuses transformations avant de devenir de l’eau potable, l’applicabilité des données de précipitations pour estimer l’exposition de la population générale au DBDPE par l’eau potable est incertaine.
10.1.1.5 Aliments
Aucun rapport de DBDPE dans des aliments canadiens n’a été recensé. Dans deux études d’aliments du Royaume-Uni et d’Ireland, plus de 100 types d’échantillons d’aliments ont été analysés (y compris de la viande, du poisson, du lait, du fromage, des œufs, et des légumes) et le DBDPE n’a été détecté dans aucun échantillon d’aliments (Fernandes et al., 2010; Tlustos et al., 2010). Cependant, le DBDPE a été détecté dans des préparations pour nourrissons et des aliments pour bébés aux États-Unis et en Chine dans une récente étude. Les concentrations maximales de DBDPE mesurées dans des échantillons d’aliments achetés en 2013 dans des magasins aux États-Unis étaient de 28,6 pg/g poids frais (pf) dans des préparations pour nourrissons, et de 48,8 pg/g pf dans des céréales pour bébés. Même si le DBDPE n’a pas été détecté dans de la purée pour bébés aux États-Unis, il a été détecté dans des échantillons de Chine (10,2 à 16,2 pg/g dans de la viande, des légumes, et divers types de purée mélangée). Dans la même étude, plusieurs produits ignifuges halogénés ont aussi été détectés dans des préparations pour nourrissons et des aliments pour bébés, y compris du Dechlorane plus (DP). D’après des analyses d’aliments et d’emballages de DP, les auteurs ont conclu qu’il était peu probable que les échantillons aient été contaminés à partir de leur emballage, mais plutôt que des aliments crus étaient contaminés ou qu’ils ont été contaminés au cours de leur transformation (Liu et al., 2014). Par extension, on suppose que les concentrations de DBDPE dans les céréales pour bébés sont dues à la contamination d’aliments crus ou à une infiltration durant la transformation.
Tel qu’il est montré dans la section 7, le DBDPE a été échantillonné dans les tissus de plusieurs espèces de poisson d’eau douce au Canada. Les concentrations trouvées allaient généralement de la non-détection à des concentrations très faibles [c.-à-d. concentration moyenne inférieure ou égale à 1 ng/g poids lipidique (pl) ou poids humide (ph)] (Ismail et al., 2006, Law et al., 2006, Kolic et al., 2009, Byer et al., 2010, Zhou et al., 2010b, Muir et al., 2011). La plus forte concentration mesurée dans les muscles de poisson était de 3,3 ng/g pl, dans le cadre de l’échantillonnage de six différentes espèces de poissons dans le lac Winnipeg (Law et al., 2006), tandis que la plus forte concentration hépatique était de 26,7 ng/g pl, découlant d’échantillons de deux espèces de poissons du fleuve Saint-Laurent (Houde et al., 2014). Les estimations de l’absorption quotidienne de DBDPE découlant de la consommation de préparations pour nourrissons et de céréales pour bébés pour la population générale étaient basées sur les concentrations maximales dans les échantillons de ces produits (Liu et al., 2014). Les estimations de l’absorption quotidienne découlant de la consommation de poissons étaient basées sur la concentration maximale de DBDPE dans des muscles de poisson déclarée pour les poissons du lac Winnipeg, notamment le ménomini (Law et al., 2006). Cette estimation suppose que tous les poissons ont consommé du DBDPE et elle est considérée comme tenant compte de la variabilité potentielle de l’exposition alimentaire en raison des habitudes alimentaires variables, y compris la consommation accrue de poisson ou la consommation potentielle de foie de poisson par certaines sous-populations.
10.1.1.6 Lait maternel
Le DBDPE n’a pas été détecté [LD = 1,7 ng/g poids lipidique (lw)] dans 91 % des échantillons de lait maternel prélevés chez 105 femmes adultes allaitantes à Sherbrooke (Québec) en 2008-2009 (voir l’annexe D). Cependant, la valeur au 95e centile et la valeur maximale étaient de 3,3 et 25 ng/g pl, respectivement (Zhou et al., 2014). En Nouvelle-Zélande, le DBDPE n’a pas été détecté dans le lait maternel de 35 des 36 nouvelles mères; un échantillon a montré une valeur de 325,50 pg/g pl (Mannetje et al., 2013). Une estimation de la limite supérieure de l’absorption quotidienne découlant du lait maternel a été calculée sur la base de la concentration de DBDPE au 95e centile déclarée dans l’étude menée à Sherbrooke (Québec) (Zhou et al., 2014).
10.1.2 Produits offerts aux consommateurs
Le DBDPE est un additif ignifuge utilisé dans la fabrication de produits de plastique et de caoutchouc, en tant qu’additif dans les textiles et les polymères, et pour des applications électriques (Covaci et al., 2011; EFSA, 2012) (voir la section 5). Le DPDPE devrait avoir des taux de charge en polymères similaires à ceux du décaBDE, qui est commercialisé à titre de produit de substitution (Environment Agency, 2007). L’annexe E résume les concentrations de DBDPE déclarées dans des produits offerts aux consommateurs.
Santé Canada a mené des essais sur 23 articles (p. ex., des jouets pour enfants, des coussins d’allaitement, des matelas de lit d’enfant, et d’autres produits en plastique, en mousse et en textile) achetés dans des magasins de détail à Ottawa en 2014. Le DBDPE a été détecté à une concentration supérieure à la limite de dosage (LD de 0,5 %) dans le textile d’une tente pour enfants; la substance n’a été détectée dans aucun des 22 autres produits (Santé Canada, 2014a, b). Une autre étude canadienne a testé des concentrations de produits ignifuges bromés dans un certain nombre d’articles manufacturés accessibles aux consommateurs de la région du Grand Toronto en 2012. Le DBDPE n’a pas été détecté dans la majorité de ces produits, sauf dans des boîtiers de téléviseur, des produits informatiques et des écrans de téléviseur, avec des concentrations maximales de 100 à 500 µg/g. Les auteurs ont noté que le DBDPE et certains autres produits ignifuges bromés étaient souvent détectés dans un seul échantillon de chaque type de produit, et ils ont indiqué que « les sources de ces produits ignifuges à un niveau aussi faible demeuraient vagues » (Mochungong et al., 2014).
Les articles en polymère noir en contact avec les aliments de différents distributeurs européens ont été analysés dans le but de détecter du brome, ainsi que les produits ignifuges qu’ils contenaient. Sur les dix articles testés, trois contenaient du DBDPE et du tétrabromobisphénol A (poêle électrique), ainsi que du décabromodiphényléther (décaBDE) (couvercle de bouteille isolante) ou du bis(2,4,6-tribromophénoxy)éthane (couteau à pommes) à des concentrations de brome allant de 279 à 5975 µg/kg. Les concentrations conférant des propriétés ignifuges étaient plus faibles que prévu et les auteurs laissent entendre qu’il est très probable que des morceaux de plastique recyclé contenant des produits ignifuges aient été utilisés dans la fabrication de ces articles. Bien que les concentrations des substances individuelles n’aient pas été déterminées, les auteurs ont également indiqué que « les données obtenues montrent que dans certains cas, le DBDPE est la nouvelle substance qui remplace le décaBDE » (Puype et al., 2015).
En Asie, d’autres études (Chen et al. 2010b; Kajiwara et al. 2011) ont analysé de nombreux articles manufacturés à la recherche de DBDPE, notamment des composants électroniques (boîtiers de téléviseur, moniteurs d’ordinateurs et accessoires informatiques), des intérieurs de voiture (intérieurs en plastique et revêtements en mousse de polyuréthane et en textile de siège), des articles ménagers (rideaux, papier peint et matériaux de construction), et des meubles (divan, matelas, coussin, et sous-tapis). Parmi ces études, les concentrations de DBDPE étaient les plus fortes dans des boîtiers de téléviseur (concentrations non détectées à 268,23 µg/g). Dans une étude japonaise distincte, du DBDPE mélangé à du plastique en polystyrène choc et du DBDPE présent dans des boîtiers en plastique de téléviseur ne s’est pas dégradé à la lumière naturelle du soleil après 244 jours (expérience menée dans une chambre vitrée à température contrôlée, dans laquelle des tubes contenant des échantillons ont été constamment mis en rotation pendant 14 heures chaque jour afin d’atteindre une exposition à la lumière uniforme, et les tubes secoués une fois par semaine pour garantir une exposition homogène des particules à la lumière du soleil; Kajiwara et al., 2008). L’exposition au DBDPE découlant du contact direct avec les produits électroniques est jugée minime. Toute abrasion sur les surfaces en plastique au cours de la vie utile de ces articles peut entraîner l’adhésion du DBDPE aux particules de poussière dans la zone environnante; cette possibilité est prise en compte dans les estimations de l’exposition par la poussière (voir la section 10.1.1.2).
Même si Chen et al. (2010b) ont déclaré des concentrations de DBDPE dans des revêtements en textile dans des intérieurs de voiture en Chine, le DBDPE n’a pas été détecté dans des sièges de voiture ou dans des rembourrages de meubles dans le cadre d’une récente étude menée au Canada (Mochungong et al., 2014). Le DBDPE a été déclaré pour des utilisations non précisées dans des véhicules à moteur, ainsi que dans la fabrication de textiles de coussins de sécurité gonflables d’automobiles au Canada (ECCC 2013-2014; Santé Canada, 2014a, b). Des preuves basées sur des études limitées en Europe et en Asie indiquent que la durée passée dans une voiture peut représenter une source d’exposition au DBDPE par la poussière. Cependant, la limite supérieure de l’absorption quotidienne de poussière calculée d’après des études menées sur des résidences est considérée comme tenant compte de la variabilité potentielle dans d’autres milieux intérieurs tels que les véhicules (voir la section 10.1.1.2). L’utilisation de DBDPE dans des textiles de meubles n’a pas été déclarée en Amérique du Nord. Les renseignements actuels indiquent que le potentiel d’exposition de la population canadienne au DBDPE par des textiles de meuble est faible.
Le DBDPE a été détecté dans différents types de jouets achetés en Chine (jouets en plastique dur, en caoutchouc/plastique souple, en mousse, en textile, et rembourrés) avec les plus fortes concentrations mesurées dans des jouets en plastique dur. Des concentrations sont indiquées dans l’annexe E (Chen et al., 2009).Note de bas de page 2 Étant donné que le DBDPE est utilisé dans des matériaux en plastique, en caoutchouc et en textile plutôt que dans la mousse (ECCC 2013-2014; Santé Canada, 2014a, b), l’exposition potentielle au DBDPE par le mâchonnement de jouets en plastique dur par des enfants âgés de 6 mois à 4 ans a été modélisée. Un taux de migration de 0,00769 μg/cm2 par minute, basé sur le mâchonnement de jouets en plastique ou en caoutchouc par des volontaires (Chen et al., 2009), a été utilisé dans un algorithme pour estimer l’absorption quotidienne par voie orale. L’estimation de la limite supérieure de l’exposition causée par le mâchonnement de jouets en plastique dur était de 1,9 × 10-4 mg/kg p.c./jour (annexe F). Même si le contact cutané avec des jouets ou le contact main-bouche après avoir joué avec des jouets peut entraîner une exposition au DBDPE, cette dernière devrait être minime en raison des propriétés physiques et chimiques de la substance. Par conséquent, elle ne devrait pas contribuer de façon importante à l’exposition systématique globale découlant de jouets.
Chen et al (2009) ont réalisé leurs propres estimations pour le mâchonnement de jouets de plastique dur à l’aide de leurs propres algorithmes pour les substances ignifuges bromés mesurés dans l’étude. Leurs estimations pour le DBDPE (de 1,3 ×10-6 à 1,5 × 10-5 mg/kg p.c./jour) sont proches des estimations obtenues à partir du modèle utilisé dans la présente évaluation.
10.1.3 Biosurveillance
L’annexe G résume les concentrations de DBDPE déclarées dans du sérum, du plasma et des cheveux humains.
Zhou et al. (2014) ont détecté du DBDPE dans 6 % des échantillons de sérum prélevés en 2008‑2009 chez 102 femmes adultes allaitantes de Sherbrooke (Québec) a des concentrations entre 3,4 (LD) et 123 ng/g poids lipidique (pl). Ils ont proposé que la toxicocinétique et des méthodes analytiques ont contribué aux faibles fréquences de détection du DBDPE dans les échantillons humains. Le DBDPE n’a pas été détecté dans le sérum de Chinoise du Nord (Zhu et al., 2009) ni dans celui de Californienne (Petreas et al., 2012). En outre, le DBDPE n’a pas été détecté dans le plasma ou le sérum de résidents suédois (Karlsson et al., 2007; Remberger et al., 2014).
La présence de DBDPE dans des échantillons de cheveux humains du sud de la Chine a été déclarée par Zheng et al (2011), mais on suppose qu’elle découle e dépôts de poussière plutôt que d’une indication de séquestration dans des cheveux humains. Les auteurs ont montré que les concentrations de DBDPE dans la poussière dans ces différents secteurs suivaient le même schéma de répartition géographique que dans les cheveux et qu’il y avait une corrélation importante (r = 0,97, p = 0,03) entre les échantillons de poussière et les échantillons de cheveux en termes de concentrations de DBDPE, ce qui indique que la poussière constitue l’une des voies d’exposition principales pour le DBDPE dans les cheveux (c.-à-d. des dépôts de poussière dans les cheveux). Dans une autre étude, de plus faibles concentrations de DBDPE ont été signalées dans les poils de chiens et de chats de compagnie au Pakistan (concentration maximale de 17,6 ng/g), et le DBDPE n’a pas été détecté dans le sérum de ces animaux (Ali et al., 2013b).
De faibles concentrations de DBDPE relevées dans du sérum humain concordent avec les faibles niveaux d’exposition prévus à l’aide de modèles. Il est à noter que différentes études ont utilisé des variations dans le cadre de la méthode analytique par couplage entre la chromatographie en phase gazeuse et la spectrométrie de masse dans du sérum et du plasma humains ainsi que du lait maternel. Aux fins d’analyse du DBDPE dans le sérum et le plasma, Petreas et al. (2012) ont utilisé un couplage entre la chromatographie en phase gazeuse et la spectrométrie de masse haute résolution avec la spectrométrie de masse en mode d’ionisation par impact électronique. Zhou et al. (2014) ont, quant à eux, utilisé un couplage entre la chromatographie en phase gazeuse et la spectrométrie de masse avec la spectrométrie de masse en mode d’ionisation chimique par capture d’électrons, à l’aide de la surveillance ionique sélective (SIM) [paires d’ions m/z 890,5 et 892,6], tout comme Zhu et al. (2009) et Karlsson et al. (2007) [pairs d’ions m/z 79 et 81]. Aux fins d’analyse du lait maternel (voir l’annexe G), Mannetje et al. (2013) ont utilisé la chromatographie en phase gazeuse haute résolution combinée couplée à la spectrométrie de masse haute résolution, avec la surveillance ionique sélective et des paires d’ions (ions spécifiques non précisés dans l’article), tandis que Zhou et al. (2014) ont utilisé la chromatographie en phase gazeuse couplée à la spectrométrie de masse en mode d’ionisation négative par capture d’électrons (INCE), à l’aide de la surveillance ionique sélective et de paires d’ions. Zhou et al. (2014) et Mannetje et al. (2013) étaient les seules études ayant détecté du DBDPE dans le sérum et le lait maternel. En raison de variations dans la méthode analytique des études disponibles cherchant à mesure le DBDPE dans le sérum, le plasma et le lait maternel, il y a des preuves à l’appui de l’observation selon laquelle les résultats de biosurveillance donnent des détections de DBDPE faibles (à très faibles) dans les fluides biologiques.
10.2 Évaluation des effets sur la santé
L’annexe A présente un résumé des renseignements disponibles sur les effets du DBDPE sur la santé.
On n’a relevé aucune classification des effets du DBDPE sur la santé d’organismes de réglementation nationaux ou internationaux.
En outre, on n’a recensé aucune étude sur la toxicité chronique et la cancérogénicité liée au DBDPE. Des études de la mutagénicité avec le DBDPE dans des souches de Salmonella typhimurium (TA 98, TA 100, TA 1535, TA 1537, et TA 1538) et d’Escherichia coli (WP2 uvrA) étaient négatives lors d’essais avec ou sans activation métabolique à des concentrations allant de 0 à 5000 μg/plate dans le DMSO (Stankowski, 1988; San et Wagner, 1991). Aucune aberration chromosomique n’a été relevée dans des cellules pulmonaires de hamster de Chine à des concentrations de 78 à 625 μg/mL pendant 6 heures avec ou sans activation métabolique (Putman et Morris, 1992). Un essai indépendant à doses répétées réalisé avec une suspension de DBDPE dans de la carboxyméthylcellulose à des concentrations de 625 à 5000 μg/ml avec ou sans activation métabolique a également été négatif (Putman et Morris, 1992). Aucune étude in vivo n’a été relevée. Par conséquent, sur la base des renseignements disponibles, le DBDPE n’est pas considéré être un mutagène in vitro.
En l’absence d’études sur la toxicité chronique ou sur la cancérogénicité du DBDPE, Santé Canada a mené une analyse des prévisions du modèle RQSA pour la cancérogénicité. Les résultats n’étaient pas concluants. Cependant, les prévisions du modèle RQSA appuyaient les constatations d’essais in vitro selon lesquelles le DBDPE n’est pas génotoxique. Des renseignements plus détaillés de la modélisation RQSA sur la cancérogénicité et la génotoxicité sont présentés à l’annexe H.
La UK Environment Agency (EA) a évalué le DBDPE en 2007 (Environment Agency, 2007) et a indiqué dans son rapport que l’absence de signes de cancérogénicité dans les études à doses répétées, comme des changements proliférants, et l’absence de génotoxicité selon les données disponibles laissent entendre que le DBDPE n’est pas susceptible d’être cancérigène (Environment Agency, 2007).
Plusieurs études à doses répétées ont été recensées. Dans une étude de la toxicité subchronique par voie orale, on a administré par gavage pendant 90 jours consécutifs des doses de 0, 100, 320 et 1000 mg/kg par jour de DBDPE dans de l’huile de maïs à des rats Sprague-Dawley mâles et femelles (10 animaux/sexe/groupe, et 10 animaux/sexe/groupe additionnels ajoutés aux groupes témoins et de groupes ayant reçu une forte dose). À la fin des 90 jours, tous les animaux ont été sacrifiés, hormis les animaux supplémentaires du groupe témoin et du groupe à dose élevée. Ils ont été maintenus en vie pendant une période de récupération de 28 jours afin de déterminer la réversibilité, la persistance ou l’apparition retardée d’effets toxiques. Les résultats de l’étude n’ont pas montré de signes cliniques de toxicité systémique liés au traitement, de lésions oculaires, d’altérations dans l’analyse d’urine, ou de valeurs hématologiques ou de chimie clinique chez le groupe traité ou le groupe de récupération. Par ailleurs, aucune différence importante sur les plans biologique ou toxicologique n’a été observée dans les poids corporels, les gains de poids corporel et la consommation de nourriture. Chez les rats mâles exposés à la substance, on a relevé des différences statistiquement significatives dans les poids relatif et absolu moyens du foie à une dose de 1000 mg/kg p.c. par jour ainsi que des changements hépatiques inférieurs, comprenant une vacuolisation hépatocellulaire minime à légère (mâles ayant reçu une dose élevée) et une hypertrophie des hépatocytes centrolobulaires minime à légère (mâles ayant reçu une dose élevée et éventuellement une dose moyenne). Ces changements histomorphologiques et au niveau du poids du foie avaient, cependant, disparu à la fin de la période de récupération de 28 jours. Aucun changement lié au traitement n’a été constaté dans le foie de rats femelles. Aucun changement histomorphologique lié au traitement n’a été relevé dans un autre tissu (40 organes ont été examinés). Dans l’ensemble, une DSENO de 1000 mg/k p.c. par jour, soit la plus forte dose testée, a été définie à partir de cette étude (Margitich, 1992; Hardy et al., 2002).
Dans une étude menée par Wang et al (2010), des rats mâles Sprague-Dawley ont reçu par voie orale 100 mg/kg p.c. par jour de DBDPE dans de l’huile de maïs pendant 90 jours. Aucun changement important n’a été observé dans le poids corporel, ni dans le poids du foie ou des reins. Cependant, le DBDPE a entraîné des changements dans les paramètres cliniques [suppression du sérum glutamo-oxalacétique transaminase (SGOT), de la phosphatase alcaline (ALP) et de la créatinine (Cr), et augmentation de la concentration totale d’acides biliaires (TBA)]. Le groupe scientifique sur les contaminants de la chaîne alimentaire (CONTAM) de l’Autorité européenne de sécurité des aliments (CONTAM) a considéré ces effets comme n’étant pas importants sur le plan toxicologique (EFSA, 2012). Les résultats de cette étude ont également indiqué que le DBDPE peut provoquer une expression génétique dépendant du récepteur PXR (pregnane-X-receptor) en raison de la légère hausse de l’ARNm du CYP1A4 dans le foie, mais on n’a pas observé d’expression génétique dépendant du récepteur d’arylhydrocarbures (AhR) ou du récepteur CAR (constitutive androgen receptor) ni d’effets néfastes potentiels (Wang et al., 2010; EFSA, 2012). Banasik et al. (2011) ont commenté les constatations de cette étude et considéré divers changements comme étant des réponses adaptatives naturelles.
Une étude de la toxicité orale à court terme a été recensée, dans laquelle le DBDPE a été administré par gavage à des rats SD (6 animaux/sexe/groupe) à des doses de 0 à 1250 mg/kg/jour dans de l’huile de maïs pendant 28 jours consécutifs. À 1250 mg/kg p.c./jour, la plus forte dose testée, il n’y a pas eu d’effets sur la mortalité, les signes cliniques, le poids corporel, la consommation de nourriture, le gain de poids corporel, les valeurs chimiques sériques et hématologiques, l’analyse urinaire, les examens oculaires, les résultats de l’autopsie macroscopique, et la légère microscopie des tissus choisis (glandes surrénales, cœur, foie, ganglion mésentérique, parathyroïde, rate, et thyroïde). On a observé une hausse légère et réversible dans le poids relatif du foie chez des rats femelles ayant reçu une forte dose, sans histopathologie. En outre, aucune preuve d’effets retardés ou progressifs n’a été relevée au cours de la période de récupération de 14 jours (Margitich, 1991).
La toxicité orale aiguë du DBDPE est jugée faible, sur la base de l’absence de mortalité et de signes cliniques de toxicité chez des rats SD ayant reçu 5000 mg/kg p.c. de DBDPE par gavage (Mallory, 1988a). Un essai de toxicité aiguë par absorption cutanée a été mené sur des lapins blancs néo-zélandais, au cours duquel le DBDPE a été appliqué sur leur peau dorsale rasée intacte à une dose de 2000 mg/kg p.c. et couvert pendant 24 heures. Aucune mortalité n’a été observée et tous les animaux ont pris du poids (Mallory, 1988b).
La toxicité du DBDPE pour le développement a été examinée chez des rats et des lapins par voie orale. Dans une étude menée par Mercieca (1992a), des groupes de 25 rats femelles SD ont reçu 0, 125, 400 ou 1250 mg/kg .pc./jour de DBDPE suspendu dans de l’huile de maïs par gavage du 6e au 15e jour de gestation, puis ont été sacrifiées le 20e jour. Il n’y avait pas de signes de toxicité parmi les mères au cours de la gestation sauf les matières fécales blanchâtres; cela est probablement dû à la grande quantité de matière d’examen dans les matières fécales observée chez la moitié des mères ayant reçu la plus forte dose. Tous les animaux ont survécu jusqu’à l’autopsie, et les poids corporels et la consommation de nourriture des animaux traités étaient comparables à ceux des animaux témoins. Il n’y a pas eu d’effets liés au traitement sur le poids du fœtus, le rapport de masculinité et la résorption tardive. On n’a relevé aucune anomalie viscérale ou externe chez les descendants. Toutefois, une hausse statistiquement significative dans le nombre de litières avec des os hyoïdes non ossifiés et une ossification réduite du crâne ont été observées à 400 mg/kg p.c./jour. Cette observation a été considérée par l’auteur comme étant fortuite, car on n’a pas observé de hausse similaire à la dose la plus forte. Un certain nombre de variations sont se produites dans une ampleur similaire chez les animaux témoins et les animaux traités. Dans cette étude, aucune toxicité pour le développement n’a été observée chez des rats jusqu’à la dose la plus forte testée de 1250 mg/kg/jour (Mercieca, 1992a).
Des examens similaires ont été menés chez des lapins. Des groupes de 20 lapins blancs néo-zélandais femelles ayant subi une insémination artificielle antérieurement ont reçu 0, 125, 400 ou 1250 mg/kg p.c./jour de DBDPE suspendu dans 0,5 % de méthylcellulose par gavage du 6e au 18e jour de gestation. On n’a observé aucun signe clinique ni aucune mortalité liés au traitement chez les mères. Un avortement a eu lieu chez un animal de chaque groupe traité avec 125 et 400 mg/kg p.c./jour et chez deux animaux du groupe traité avec 1250 mg/kg p.c./jour. Toutefois, au vu de la faible incidence de cette observation, et étant donné que les lapins sont connus pour avoir un taux d’avortement spontané élevé, cette constatation est jugée fortuite. Il n’y a pas eu d’effets liés au traitement sur le poids du fœtus, le rapport de masculinité et la résorption précoce ou tardive. Aucune anomalie liée au traitement avec le DBDPE n’a été observée. La seule différence statistiquement significative était une hausse du nombre de litières avec la 27e vertèbre présacrée à la dose de 1250 mg/kg p.c./jour (9 litières comparativement à 4 pour les animaux témoins). Cependant, compte tenu du fait qu’il s’agit d’une constatation courante chez les lapins (la plage des témoins historiques du laboratoire étant de 12,5 % à 93,8 %), elle n’a pas été jugée néfaste. Une faible incidence d’anomalies vasculaires a été observée dans les groupes traités avec une dose moyenne et une dose élevée. On a observé une valvule aortique élargie, un arc aortique en forme de bulbe et un ventricule droit mal développé chez un fœtus du groupe traité avec une dose de 400 mg/kg p.c./jour. On a également noté une malformation de l’arc aortique et un sous-développement du ventricule droit chez deux fœtus d’une seule litière du groupe traité avec 1250 mg/kg p.c./jour. D’après ces faibles incidences, les malformations déclarées n’ont pas été considérées comme indiquant un effet lié au traitement. Dans l’ensemble, aucune toxicité maternelle n’a été observée dans cette étude, et ce, à toutes les doses testées. Aucun effet néfaste sur le développement n’a été observé chez les lapins traités avec du DBDPE à des doses allant jusqu’à 1250 mg/kg p.c./jour (Mercieca, 1992b).
Hardy et al. (2010) ont mené une étude similaire chez des rats et des lapins afin d’évaluer les effets embryotoxiques et tératogènes potentiels du DBDPE. Les animaux ont reçu du DBDPE par gavage à des doses de 0, 125, 400 ou 1250 mg/kg p.c./jour du 6e au 15e jour de gestation pour les rattes, et du 6e au 18e jour de gestation pour les lapins. Tous les rattes et lapins femelles ont été sacrifiées au 20e ou 29e jour, respectivement, et ont subi une césarienne. On n’a observé aucune mortalité liée au traitement, absorption ou signe clinique de toxicité au cours de l’étude. Les poids corporels, le gain de poids corporel ou la consommation d’aliments n’ont pas été touchés par le traitement. Aucune anomalie interne importante n’a été observée chez les deux espèces lors de l’autopsie. Les paramètres de césarienne étaient comparables entre le groupe traité et le groupe témoin. Aucune malformation liée au traitement ou variation dans le développement ne s’est produite. Ces résultats d’étude n’ont montré aucune preuve de toxicité maternelle, de toxicité pour le développement ou de tératogénicité chez des rats ou des lapins traités avec du DBDPE à des doses allant jusqu’à 1250 mg/kg p.c./jour (Hardy et al., 2010).
Aucune étude sur la toxicité pour la reproduction n’a été recensée. Cependant, il n’y a pas eu d’effets néfastes sur les organes reproducteurs (parmi les 40 organes examinés) dans l’étude de 90 jours sur l’exposition par voie orale chez des rats, à des doses allant jusqu’à 1000 mg/kg p.c./jour (Margitich, 1992; Hardy et al., 2002).
Des renseignements sur la toxicocinétique du DBDPE ont indiqué que le DBDPE était mal absorbé par voie orale. Dans une étude citée dans le rapport d’évaluation du Royaume-Uni, aucune radioactivité n’a été détectée dans le plasma, la bile et l’urine de rats exposés à une seule dose de 1000 mg/kg p.c./jour de DBDPE radiomarqué au carbone 14, suspendu dans de l’huile de maïs à divers intervalles pour une durée allant jusqu’à 168 heures après le dosage (Environment Agency, 2007).
Dans une étude menée par Black (2012), des rats ont reçu par gavage une dose unique de 100 mg/kg p.c. de DBDPE radiomarqué au carbone 14 dans de l’huile de maïs, et des tissus, de la bile, des matières fécales et de l’urine ont été analysés pour leur contenu radiochimique. Jusqu’à 168 heures après l’administration de la dose, 89 % du contenu radioactif a été récupéré dans les matières fécales, et aucune trace de la dose n’a été détectée dans l’urine. Il n’a généralement pas détecté de radioactivité dans les tissus, c’est à dire les tissus adipeux, le rein, le foie, la rate et le tractus gastro-intestinal formé de l’estomac, l’intestin grêle le gros intestin et cæcum (et leur contenu). Il n’a trouvé dans aucun échantillon de bile de radioactivité accrue par rapport aux animaux témoins. En outre, il n’a pas détecté de radioactivité dans le sang et le plasma à tous les points temporels. La plus grande partie de la radioactivité dans le tractus gastro-intestinal a été relevée sur 24 heures, et aucune radioactivité n’a été observée 72 heures après l’exposition. Il a supposé que cette radioactivité avait été excrétée dans les matières fécales (Black, 2012).
10.3 Caractérisation des risques pour la santé humaine
On n’a relevé aucune classification des effets du DBDPE sur la santé d’organismes de réglementation nationaux ou internationaux. En outre, on n’a recensé aucune étude sur la toxicité chronique et la cancérogénicité liée au DBDPE. D’après les renseignements disponibles sur la génotoxicité, le DBDPE n’est pas jugé génotoxique in vitro.
Aucun effet nocif n’a été observé chez des rats exposés à du DBDPE par voie orale pendant 28 ou 90 jours, aux doses de 1250 ou 1000 mg/kg p.c. par jour, respectivement. Aucune étude de la toxicité pour la reproduction n’a été recensée. Dans deux études distinctes sur la toxicité pour le développement, aucun effet sur la mère lié au traitement n’a été observé chez des rats et des lapins exposés au DBDPE par voie orale, et aucune malformation ni aucun effet sur le développement n’ont été constatés chez la progéniture.
De même, on n’a observé aucun effet nocif chez des animaux de laboratoire exposés à des doses orales allant jusqu’à 1000 mg/kg p.c./jour dans le cadre d’études de la toxicité subchronique (deux études de 90 jours par gavage chez le rats). Il y a sept ordres de grandeur entre cette dose et la plus forte estimation de l’absorption quotidienne totale du DBDPE découlant de milieux naturels et d’aliments (0,000062 mg/kg p.c. par jour chez des nourrissons âgés de 0 à 6 mois). Cette marge d’exposition est jugée adéquate pour traiter les incertitudes dans les bases de données concernant les effets sur la santé et l’exposition. Données de biosurveillance limitées pour le DBDPE chez des adultes au Canada (Zhou et al., 2014), aux États-Unis (Petreas et al., 2012) et dans d’autres lieux dans le monde (Remberger et al., 2014; Mannetje et al., 2013; Zhu et al., 2009; Karlsson et al., 2007) ont donné une faible fréquence de détection dans le sérum, le plasma ou le lait maternel, ce qui semble confirmer un faible niveau d’exposition environnementale chez la population générale.
Les produits offerts aux consommateurs, notamment des jouets pour enfants, ont été définis comme une source potentielle d’exposition des jeunes enfants au DBDPE. Toutefois, six ordres de grandeur séparent les plus fortes doses administrées lors d’études de toxicité orale subchroniques ou à court terme (1250 mg/kg p.c./jour dans une étude de 28 jours sur le rat et quatre études de la toxicité pour le développement chez les rats et les lapins et 1000 mg/kg p.c./jour dans une étude de 90 jour sur le rat) ne produisant pas d’effets nocifs chez les animaux de laboratoire de l’estimation de l’exposition (1,9 × 10−4 mg/kg p.c./jour) d’enfants âgés de 6 à 48 mois ayant mâchonné des jouets en plastique dur. Cette marge d’exposition est jugée adéquate pour rendre compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
10.4 Incertitudes de l’évaluation des risques pour la santé humaine
Des incertitudes sont liées à l’estimation de l’exposition humaine au DBDPE dans des milieux naturels, car cette substance est un produit ignifuge bromé difficile à analyser; ainsi, le taux d’incertitude quant à cette substance peut atteindre 40 % à 60 % selon l’étalon interne utilisé pour la quantification (communication d’A. Covaci adressée à Environnement Canada en 2014, source non citée). Même si les études choisies pour calculer les estimations de l’exposition étaient jugées pertinentes pour le Canada, la plupart n’étaient pas canadiennes, et les données liées à des emplacements canadiens étaient limitées (p. ex., concentrations dans l’eau de surface en tant que utilisées comme substitut des concentrations dans l’eau potable; concentrations dans le lait maternel échantillonnées auprès d’une population urbaine). Toutefois, les estimations de l’exposition découlant des milieux naturels étaient fondées sur des hypothèses prudentes.
Des incertitudes sont également associées à l’estimation de l’exposition par des produits offerts aux consommateurs, y compris des doutes liés aux hypothèses utilisées dans le modèle pour estimer l’exposition au DBDPE par le mâchonnement. Le taux de migration expérimental pour le transfert du DBDPE de jouets à la bouche était basé sur le plus fort taux observé chez cinq volontaires, et non sur le taux moyen. Cependant, puisqu’il s’agit d’une hypothèse protectrice, nous sommes confiants que l’exposition n’a pas été sous-estimée. En outre, même si elles sont limitées, les données de biosurveillance semblent appuyer les faibles niveaux d’exposition environnementale de la population générale.
Une incertitude est associée à l’évaluation des effets cancérogènes et sur la reproduction du DBDPE, en raison de l’absence d’études sur la toxicité chronique, et les effets cancérogènes et sur la reproduction. Toutefois, l’ensemble des preuves indique que cette substance est peu susceptible d’être mutagène; on n’a pas observé d’effets nocifs à la plus forte dose testée dans les études de la toxicité subchronique et à court terme disponibles, et des résultats s’inscrivant dans des marges d’exposition importantes ont été déterminés pour les effets non cancérigènes.
11. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le DBDPE présente un risque d’effets nocifs sur les organismes, mais pas sur l’intégrité globale de l’environnement. Il est conclu que le DBDPE répond aux critères énoncés à l’alinéa 64a) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. Toutefois, il est conclu que le DBDPE ne répond pas aux critères énoncés à l’alinéa 64(b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de l’adéquation des marges entre l’estimation d’exposition découlant de milieux naturels ou de produits offerts aux consommateurs et des plus fortes doses testées sur les animaux de laboratoire, sans effet lié au traitement lors d’expositions subchroniques, il est conclu que le DBDPE ne satisfait pas aux critères de l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine
Il est conclu que le DBDPE satisfait à l’un ou à plusieurs des critères énoncés à l’article 64 de la LCPE. Il a été déterminé que le DBDPE satisfaisait aux critères de persistance, mais pas à ceux de bioaccumulation formulés dans le Règlement sur la persistance et la bioaccumulation de la LCPE. Toutefois, le DBDPE pourrait contribuer à la formation dans l’environnement de produits de dégradation persistants, bioaccumulables et intrinsèquement toxiques, comme des BDPE moins bromés.
Références
Abbasi G, Saini A, Goosey E et Diamond ML. 2016. « Product screening for sources of halogenated flame retardants in Canadian house and office dust ». Sci. Total Environ. 545–546:299–307.
ACD/Percepta [module de prévision]. Env. 1997-2012. Toronto (Ont.) : In Silico Prediction of Physicochemical, ADME, and Toxicity Properties. Advanced Chemistry Development. [Consulté en juillet 2014.] (disponible en anglais seulement)
[AEROWIN] AEROWIN Programme d’évaluation de la sorption sur les particules de l’atmosphère pour Microsoft Windows [modèle d’évaluation]. 2010. Version 1.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.]
Albemarle. 2001. Fiche technique : SAYTEX® 8010 Flame Retardant. Albemarle Corporation. [Consulté en mai 2011.] Voir Fiche signalétique de substance ignifuge [PDF]. (disponible en anglais seulement )
Albemarle. 2007. Albemarle to Expand Production of Popular SAYTEX® 8010 Flame Retardant. Albemarle Corporation- News and Events documentation (1999-2008).
Albemarle. 2008. Fiche signalétique : SAYTEX® 8010 Flame Retardant. Albemarle Corporation. Date de révision : 12 novembre 2008. [Consulté en juin 2011.]
Albemarle. 2016. CMP Certain Organic Flame Retardants Substance Grouping; CAS#84852-53-9; 1,2 bis [2,3,4,5,6-pentabromophneyl]ethane (EBP). Lettre au Plan de gestion des produits chimiques, Gouvernement du Canada, 6 décembre 2016.[Accès restreint.]
Ali, N., Ali, L., Medhi, T., Dirtu, A.C., Al-Shammari, F., Neels, H., Covaci, A. 2013a. Levels and profiles of organochlorines and flame retardants in car and house dust from Kuwait and Pakistan: Implication for human exposure via dust ingestion. Environment International 55:62-70.
Ali, N., Dirtu, A.C., Van den Eded, N., Goosey, E., Harrad, S., Neels, H., Mannetje, A., Coakley, J., Douwes, J., Covaci, A. 2012b. Occurrence of alternative flame retardants in indoor dust from New Zealand: Indoor sources and human exposure assessment. Chemosphere 88:1276-1282.
Ali, N., Malik, R.N., Mehdi, T., Eqani, S.A., Javeed, A., Neels, H., Covaci, A. 2013b. Organohalogenated contaminants (OHCs) in the serum and hair of pet cats and dogs: Biosentinels of indoor pollution. Sci. Total Env. 449:29-36.
Ali, N., Van den Eede, N., Dirtu, A.C., Neels, H., Covaci, A. 2012a. Assessment of human exposure to indoor organic contaminants via dust ingestion in Pakistan. Indoor Air 22:200-211.
[AOPWIN] Programme d’évaluation de réaction dans l’atmosphère pour Microsoft Windows [modèle d’évaluation]. 2010. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.]
Arnot, J.A., Gobas, F.A.P.C. 2003a. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot, J.A., Gobas, F.A.P.C. 2003b. Categorization of organic substances on the Domestic Substances List for bioaccumulation potential. Rapport présenté à Environnement Canada, Division des substances existantes. Juin 2003. Gatineau (Qc) : Environnement Canada.
Arnot, J.A., Gobas, F.A.P.C. 2004. A food web bioaccumulation model for organic chemicals in aquatic ecosystems. Environ. Toxicol. Chem. 23(10):2343-2355.
Arnot, J.A., Gobas, F.A.P.C. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ. Rev. 14:257-297.
Aufderheide, J. 2003. Effects of Saytex 8010 on the survival and reproduction of the earthworm, Eisenia fetida. ABC Laboratories, Columbia (MO), É.-U. : Study number 47634.
Banasik, M., Harbison, R.D., Lee, R.V., Lassiter, S., Smith, C.J., Stedeford, T. 2011. Comment on "comparative tissue distribution, biotransformation and associated biological effects by decabromodiphenyl ethane and decabrominated diphenyl ether in male rats after a 90-day oral exposure study". Environ. Sci. Technol. 45(11):5060-1.
Banasik, M., Hardy, M., Harbison, R.D., Stedeford, T. 2010. Comment on "Brominated flame retardants in children’s toys: concentration, composition, and children’s exposure and risk assessment." Environ. Sci. Technol. 44(3):1154-1155.
[BCFBAF] Programme de calcul de la bioaccumulation dans le poissons pour Microsoft Windows [modèle d’évalution]. 2010. Version 3.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.]
[BDPSNH] Base de données sur les produits de santé naturels homologués. [Modifiée le 10 août 2016.] Ottawa (Ontario) : Gouvernement du Canada. [Consultée le 24 avril 2014.]
Bergman, Å., Rydén, A., Law, R.J., de Boer, J., Covaci, A., Alaee, M., Birnbaum, L., Petreas, M., Rose, M., Sakai, S., Van den Eede, N., van der Veen, I. 2012. A novel abbreviation standard for organobromine, organochlorine and organophosphorus flame retardants and some characteristics of the chemicals. Environment International 49:57-82.
Bhaskar, T., Matsui, T., Uddin, M.A., Kaneko, J., Muto, A., Sakata, Y. 2003. Effect of Sb2O3 in brominated heating impact polystyrene (HIPS-br) on thermal degradation and debromination by iron oxide carbon composite catalyst (fe-C). Appl. Catal. B 43(3):229-41.
[BIOWIN] Programme de probabilité de biodégradation pour Microsoft Windows [modèle d’évaluation]. 2010. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Consulté en janvier 2014.]
Black, S. 2012. Final Study Report: Pharmacokinetic studies of [14C] decabromodiphenyl ethane (EBP). Présenté à Albemarle. Report Number: RTI/0212983.001.002. RTI International (NC), 36 p. [Accès restreint.]
Blankinship, A., Krueger, H. 2003a. A 48-hour static acute toxicity test with the cladoceran (Daphnia magna). Wildlife International Ltd, Easton (MD), É.-U. : Project number 471A-106. [Accès restreint.]
Blankinship, A., Krueger, H. 2003b. A 96-hour static acute toxicity test with the rainbow trout (Oncorhynchus mykiss). Wildlife International Ltd, Easton (MD), É.-U. : Project number: 471A-107. [Accès restreint.]
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]. 2012. Version 3.0. Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement. Projet de l’OCDE sur les relations quantitatives de structure-activité [(Q)SARs].
Breitholtz, M., Ruden, C., Hansson, S.O., Bengtsson, B.E. 2006. Ten challenges for improved ecotoxicological testing in environmental risk assessment. Ecotox. and Environ. Safety 63:324-335.
Bremmer, H.J., van Veen, M.P. 2002. Version mise à jour pour ConsExpo 4 [en ligne]. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu [Institut national néerlandais de la santé publique et de l’environnement]. Rapport du RIVM no 612810012/2002. Brommer, S., Harrad, S., Van den Eede, N., Covaci, A. 2012. Concentrations of organophosphate esters and brominated flame retardants in German indoor dust samples. J. Environ. Monit. 14:2482-2487.
Brown T, Wania F. 2008. Screening Chemicals for the Potential to be Persistent Organic Pollutants: A Case Study of Arctic Contaminants Environ. Sci. Technol. 2008, 42 :5202-5209.
[BSEF]: Brominated Science Forum [en ligne]. env. 2001-2015. [Consulté en janvier 2015.]
Byer, J.D. 2013. Organohalogenated persistent organic pollutants in American Eel (Anguilla Rostrata) captured in Eastern Canada. [Mémoire.] Kingston (ON) : Université Queen’s, 238 p.
Byer, J.D., Alaee, M., Brown, R.S., Lebeuf, M., Trottier, S., Backus, S., Blunt, S., Jeir, M., Jonefal, M., Pacapavicius, G., et al. 2010. Brominated flame retardants in American eel (a reason for the eel’s decline) [PDF]. (disponible en anglais seulement)
Cai, M.G., Hong, Q.Q., Wang, Y., Luo, X.J., Chen, S.J., Cai, M.H., Qiu, C.R., Huang, S.Y., Mai, B.X. 2012. Distribution of polybrominated diphenyl ethers and decabromodiphenylethane in surface sediiments from the Berring Sea, Chukchi Sea, and Canada Basin. Deep-Sea Research II 81-84:95-101.
Canada 2013. Ministère de l’Environnement . Loi canadienne sur la protection de l’environnement (1999) Avis relative à certaines substances ignifuges organiques [PDF]. Gazette du Canada, partie I, vol. 147, no 13, p. 613-633.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C., 1999, ch. 33. Partie III, vol. 22, no 3.
Canada. 2004. Ministère de l’Environnement. Condition ministérielle no 13228, Gazette du Canada I 138(40):2645-2646. [Consulté le oct. 2004]
Canada. 2004 Annonce de conditons relatives à l’application, l’utilisation et le rejet de la substance 1,1’-(éthane-1,2-diyl)bis[pentabromobenzène]. Canada Gazette partie I 138, no 40, p. 2645-2646. [Consulté le 2 octobre 2004.]
Canada. 2005. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères). C.P. 2005-1484, DORS/2005-247. [Consulté le 31 août 2005.]
Canada. 2010. Loi canadienne sur la sécurité des produits de consommation [pdf]. L.C., 2010, ch. 21. Gazette du Canada, Partie III, vol. 33, no 3.
Canada. 2011. Ministère de l’Environnement, condition ministérielle no 16260 [PDF]. Gazette du Canada, Partie I, vol. 145, no 20, 14 mai 2011, p. 1513-1515.
Canada. env. 2006-2013. Polybromodiphényléthers (PBDE) - Fiches de renseignements et foire aux questions - Substances chimiques [en ligne]. [Consulté en janvier 2015.]
Canada. Ministère de la Santé nationale et du Bien-être social. 1990. L’allaitement maternel au Canada : pratiques et tendances. Ottawa (Ontario) No de catalogue H39-199/1990F; ISBN 0-662-18397-5. 9 p. [cité par Santé Canada, 1998.]
Cao, Z., Xu, F., Covaci, A., Wu, M., Yu, G., Wang, B., Deng, S., Huang, J. 2014. Differences in the seasonal variation of brominated and phosphorus flame retardants in office dust. Environ. Int. 65:100-106.
CATALOGIC [modèle informatique]. 2012. Version 5.11.13. Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique. (disponible en anglais seulement)
[CCC] Canada Colours and Chemicals. 2011. Fiche signalétique FR-1410. Code produit : 9311. ICL Industrial Products. Date de révision : 11 février 2011. [Consulté en février 2014.]
Cequier, E., Ionas, A.C., Covaci, A., Marcé, R.M., Becher, G., Thomsen, C. 2014. Occurrence of a broad range of legacy and emerging flame retardants in indoor environments in Norway. Environ. Sci. Technol. 48:6827-6835.
Chemtura. 2005. Fiche signalétique : Firemaster® 2100 et Firemaster® 2100C. Chemtura USA Corporation. MSDS Number : 01129. Date d’entrée en vigueur : 31 décembre 2005.
Chen, D., Letcher, R.J., Burgess, N.M., Champoux, L., Elliot, J.E., Hebert, C.E., Martin, P., Wayland, M., Weseloh, D.V.C., Wilson, L. 2012. Flame retardants in eggs of four gull species (Laridae) from breeding sites spanning Atlantic to Pacific Canada. Environmental Pollution 168:1-9.
Chen, S., Ma, Y., Wang, J., Chen, D., Luo, X., Mai, B. 2009. Brominated flame retardants in children’s toys: Concentration, composition, and children’s exposure and risk assessment. Environ. Sci. Technol. 43:4200-4206.
Chen, S., Ma, Y., Wang, J., Chen, D., Luo, X., Mai, B. 2010a. Response to "Comment on ‘Brominated flame retardants in children’s toys: Concentration, composition, and children’s exposure and risk assessment.’" Environ. Sci. Technol. 44:1154-1155.
Chen, S., Ma, Y., Wang, J., Tian, M., Luo, X., Chen, D., Luo, X., Mai, B. 2010b. Measurement and human exposure assessment of brominated flame retardants in household products from South China. J. Hazardous Material 176:979-984.
[CITI] Chemicals Inspection and Testing Institute. 1991a. Test of biodegradability of Saytex-402 by microorganisms. Kurume Research Laboratories, Chemical Biotesting Center. Test number 11893. [Accès restreint.]
[CITI] Chemicals Inspection and Testing Institute. 1991b. Test of biodegradability of Saytex-402 by microorganisms. Kurume Research Laboratories, Chemical Biotesting Center (Japon). Test number 41894. [Accès restreint.]
[CMABFRIP] Chemical Manufacturers Association Brominated Flame Retardant Industry Panel.1997a. Decabromodiphenyl oxide (DBDPO): determination of n-octanol/water partition coefficient. Wildlife International Ltd. Project Number 439C-101, 16 juin 1997. [Accès restreint.]
[CMABFRIP] Chemical Manufacturers Association Brominated Flame Retardant Industry Panel. 1997b. Decabromodiphenyl oxide (DBDPO): determination of water solubility. Wildlife International Ltd. Project Number 439C-102, juin 1997. [Accès restreint.]
Covaci, A., Harrad, S., Abdallah, M. A.-E., Ali, N., Law, R.J., Herzke, D., de Wit, C. 2011. Novel brominated flame retardants: A review of their analysis, environmental fate and behaviour. Environment International 37:532-556.
[CPOP] Modèle de polluants organiques persistants canadien. 2012. Version 1.1.18. Gatineau (Qc) : Environnement Canada, Division des substances existantes; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratory of Mathematical Chemistry. [Modèle créé à partir du cadre de Mekenyan et al., 2005.]
De Wit, C.A., Herzke, D., Vorkamp, K. 2010. Brominated flame retardants in the Arctic environment - trends and new candidates. Science of the Total Environment 408:2885-2918.
De Wit, C.A., Kierkegaard, A., Ricklund, N., Sellström. 2011. Emerging Brominated Flame Retardants in the Environment. In Brominated flame retardants in the environment. Eljarrat, E., Barceló, D., éds. The Handbook of Environmental Chemistry, Springer.
Desjardins, D., Krueger, H. 2003. A 96-hour toxicity test with the freshwater alga (Selenastrum capricornutum). Wildlife International Ltd, Easton (MD), É.-U. : Project number 471A-108A.
Diamond, M.L., Goosey, E., Saini, A., Chaudhuri, S. 2013. Assessment of the prevalence and exposure to new flame retardants (NFRs) in Canadian indoor environments. Étude inédite menée sous contrat pour Santé Canada, 86 p.
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531-554.
Dirtu AC, Ionas IC, Malarvannan G, Covaci A. 2014. « Transformation Products of Brominated Flame Retardants (BFRs) ». In Lambropoulou DA et Nollet LML directeurs 2014. Transformation Products of Emerging Contaminants in the Environment. Analysis, Processes, Occurrence, Effects and Risks. West Sussex, UK: John Wiley and Sons Ltd. 935 pp.
Dirtu, A.C., Ali, N., Van den Eede, N., Neels, H., Covaci, A. 2012. Country specific comparison for profile of chlorinated, brominated and phosphate organic contaminants in indoor dust. Case study for Eastern Romania, 2010. Environ. Int. 49:1-8.
Dodson, R.E., Perovich, L.J., Covaci, A., Van den Eede, N., Ionas, A.C., Dirtu, A.C., Brody, J.G., Rudel, R.A. 2012. After the PBDE Phase-Out: A Broad Suite of Flame Retardants in Repeat House Dust Samples from California. Environ. Sci. Technol. 46:13056-13066. [EC] Communautés européennes. 2002. Rapport d’évaluation des risques de l’Union européenne. Bis(pentabromophenyl) ether. CAS No.: 1163-19-5. EINECS No.: 214-604-9. Évaluation des risques. Rapport définitif préparé par la France et le Royaume-Uni au nom de l’Union européenne, 2002.
[EC] Communauté européenne. 2003. Technical guidance document on risk assessment in support of commission Directive 93/67/EEC on risk assessment for new notified substances and commission regulation 1488/94/EC on risk assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market. Bruxelles (Belgique) : CE.
[ECCC 2013-2014] Environnement et Changement climatique Canada 2013-2014. Données sur le Groupe de certaines substances ignifuges organiques, recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances ignifuges organiques. Données préparées par Environnement et Changement climatique Canada et Santé Canada dans le cadre du Programme des substances existantes.
[ECCC et SC] Environment et changement climatique Canada et Santé Canada. 2017. Information in support of the Screening Assessment for Benzene, 1’1-(1,2-ethanediyl)bis [2,3,4,5,6-pentabromo-; Decabromodiphenyl ethane (DBDPE) . Gatineau (QC) : ECCC et SC, Disponible sur demande à substances@ec.gc.ca.
[ECCC et SC] Environnement Canada et Santé Canada. 2007. Caractérisation des substances chimiques. Ottawa (Ontario) : Gouvernement du Canada. [Consulté le 31 juillet 2013.]
[ECHA] Agence européenne des produits chimiques. ©2007-2013. Substances enregistrées [base de données. Recherche sur le NR CAS 84852-53-9. Helsinki (Finlande) : [Actualisée le 27 novembre 2012; consultée en mars 2014.]
[ECHA] Agence européenne des produits chimiques. 2010. Guidance on information requirements and chemical safety assessment. Chap. R.16: Environmental exposure estimation. Mai 2010. Guidance for the implementation of REACH. Helsinki (Finlande) : Agence européenne des produits chimiques.
[ECOSAR] Programme d’estimation de la classe de relations écologiques structure-activité [modèle d’évaluation]. 2012. Version 1.11. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific Opinion on Emerging and Novel Brominated Flame Retardants (BFRs) in Food. Groupe scientifique sur les contaminants de la chaîne alimentaire. EFSA Journal 10(10):2908. 125 p. (disponible en anglais seulement)
Egeback, A.L., Sellstrom, U., McLachlan, M.S. 2012. Decabromodiphenyl ethane and decabromodiphenyl ether in Swedish background air. Chemosphere 86:264-269.
Egloff, C., Crump, D., Chiu, S., Manning, G., McLaren, K.K., Cassone, C.G., Letcher, R.J., Gauthier, L.T., S.W. 2011. In vitro and in ovo effects of four brominated flame retardants on toxicity and hepatic mRNA expression in chicken embryos. Toxicology Letters 207:25-33.
Eljarrat, E., Barceló, D, éds. 2011. Brominated Flame Retardants. Série : The Handbook of Environmental Chemistry, volume 16. Heidelberg (Berlin) : Springer, 290 p.
Environment Agency. 2007. Environmental risk evaluation report: 1,1’-(Ethane-1,2-diyl)bis[penta-bromobenzene] (CAS: 84852-53-9). 84852-53-9. Agence environnement, gouvernement du Royaume-Uni.
Environnement Canada. 2006. Loi canadienne sur la protection de l’environnement 1999. Rapport d’évaluation écologique préalable des polybromodiphényléthers. [Consulté en juin 2006.]
Environnement Canada. 2010. Rapport sur l’état des connaissances scientifiques écologiques concernant le décabromodiphényléther (décaBDE) : Bioaccumulation et transformation. [Consulté en août 2010.]
Environnement Canada. 2013. Utliser l’eau de manière judicieuse. [Consulté en novembre 2014.]
Environnement Canada. 2014. Le Programme national de suivi et de surveillance des contaminants dans le poisson d’Environnement Canada (2010-2012). Base de données communiquée de la Division de la surveillance de la qualité des eaux douces (programme des Grands Lacs) à la Division de l’évaluation écologique.
Environnement Canada. env. 2006-2013. Gestion des risques liés au décaBDE : élimination progressive volontaire des exportations au Canada.
[EPI Suite] Suite de programmes d’évaluation pour Microsoft Windows [modèle d’évaluation]. 2000-2012. Version 4.1. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible na anglais seulement)
[ESIS] European Chemical Substances Information System [base de données sur Internet]. ©1995-2012. Centre commun de recherche (CCR). [Consultée en mars 2014.]
[ETRMA] European Rubber and Tyre Manufacturer Association. 2010. Tyre and General Rubber Goods Generic Exposure Scenario. Emission Factor Guidance for Formulation and Industrial Use. [Comprend une fiche du SpERC dur le ERC 3 et le ERC 6d.] Préparé par : ChemRisk LLC. Pittsburgh (PA), É.-U pour ETRMA Bruxelles (Belgique), cersion 2.0. 4 août 2010.
Fernandes, A., Smith, F., Petch, R., Panton, S., Carr, M., Mortimer, D., Tlustos, C., Rose, M. 2010. The emerging BFRs hexabromobenzene (HBB), bis(2,4,6-tribromophenoxy)ethane (BTBPE), and decabromodiphenylethane (DBDPE) in UK and Irish foods. Résumé du Fifth International Workshop on Brominated Flame Retardants, tenu du 7 au 9 avril 2010 à Kyoto, Japon.
Fromme, H., Hilger, B., Kopp, E., Miserok, M., Völkel, W. 2014. Polybrominated diphenyl ethers (PBDEs), hexabromocyclododecane, (HBCD) and "novel" brominated flame retardants in house dust in Germany. Environment International 64:61-68.
Garcia-Reyero, N., Escalon, B.L., Prats, E., Stanley, J.K., Thienpont, B., Melby, N.L., Barón, E., Eljarrat, E., Barceló, D., Mestres, J. et al. 2014. Effects of BDE-209 contaminated sediments on zebrafish development and potential implications to human health. Environment International 63:216-223.
Gauthier, L., Potter, D., Hebert, C., Letcher, R.J. 2009. Temporal Trends and Spatial Distribution of Non-Polybrominated Diphenyl Ether Flame Retardants in the Eggs of Colonial Populations of Great Lakes Herring Gulls. Environ. Sci. Technol. 43(2):312-7.
Gerecke, A.C., Giger, W., Hartmann, P.C., Heeb, N.V., Kohler, H.-P.E., Schmid, P., Zennegg, M., Kohler, M. 2006. Anaerobic degradation of brominated flame retardants in sewage sludge. Chemosphere 64:311-317.
Gerecke, A.C., Hartmann, P.C., Heeb, N.V., Kohler, H.-P.E., Giger, W., Schmid, P., Zennegg, M., Kohler, M. 2005. Anaerobic degradation of decabromodiphenyl ether. Environ. Sci. Technol. 39(4):1078-1083.
Gobas, F.A., Kelly, B.C., Arnot, J.A. 2003. Quantitative structure activity relationships for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb. Sci. 22:329-336.
Goosey, E., Abdallah, M.A., Roosens, L., Harrad, S., Covaci, A. 2009. Dust from UK primary school classrooms and daycare centres: Its significance as a pathway of exposure of young children to perfluoroalkyl compounds (PFCs) and brominated flame retardants (BFRs). Organohalogen Compd 71:436-441.
Great Lakes. 2003. Fiche signalétique : Firemaster® 2100. Great Lakes Chemical Corporation. Date de révision : 18 novembre 2003.
Guerra, P., Alaee, M., Eljarrat, E., Barcelo, D. 2011. Introduction to Brominated Flame Retardants:Commercial Products, and Physicochemical Properties. In Eljarrat, E., Barceló, D., éds. 2011. Brominated Flame Retardants. Série : The Handbook of Environmental Chemistry, volume 16, Heidelberg (Berlin) :Springer, 290 p.
Guerra, P., Alaee, M., Jiménez, B., Pacepavicius, G., Marvin, C., MacInnis, G., Eljarrat, E., Barceló, D.,Champoux, L., Fernie, K. 2012. Emerging and historical brominated flame retardants in peregrine falcon (Falco peregrinus) eggs from Canada and Spain. Environnment International 40:179-186.
Hardy, M.L. 2004. A comparison of the fish bioconcentration factors for brominated flame retardants with their nonbrominated analogues. Environ. Toxicol. Chem. 23:656-661.
Hardy, M.L., Aufderheide, J., Krueger, H.O., Mathews, M.E., Porch, J.R., Schaefer, E.C., Stenzel, J.I., Stedeford, T. 2011. Terrestrial toxicity evaluation of decabromodiphenyl ethane on organisms from three trophic levels. Ecotox. and Environ. Safety 74:703-710.
Hardy, M.L., Krueger, H.O., Blankinship, A.S., Thomas, S., Kendall, T.Z., Desjardins, D. 2012. Studies and evaluation of the potential toxicity of decabromodiphenyl ethane to five aquatic and sediment organisms. Ecotox. and Environ. Safety 75:73-79.
Hardy, M.L., Margitich, D., Ackerman, L., Smith, R.L. 2002. The Subchronic Oral Toxicity of Ethane,1,2-Bis(pentabromophenyl) (Saytex 8010) in Rats. International Journal of Toxicology 21:165.
Hardy, M.L., Margitich, D., Ackerman, L., Smith, R.L. 2002. The subchronic oral toxicity of ethane, 1,2-bis(pentabromophenyl) (Saytex 8010) in rats. Int. J. Toxicol. 21:165-170.
Hardy, M.L., Mercieca, M.D., Rodwell, D.E., Stedeford, T. 2010. Prenatal developmental toxicity of decabromodiphenyl ethane in the rat and rabbit. Birth Defects Res. B. Dev. Reprod. Toxicol. 89(2):139-146.
Harrad, S., Ibarra, C., Abdallah, M.A., Boon, R., Neels, H., Covaci, A. 2008. Concentrations of brominated flame retardants in dust from United Kingdom cars, homes, and offices: Causes of variability and implications for human exposure. Environ. Int. 34:1170-1175.
He, M.J., Luo, X.J., Chen, M.Y., Sun, Y.X., Chen, S.J., Mai, B.X. 2012. Bioaccumulation of polybrominated diphenyl ethers and decabromodiphenyl ethane in fish from a river system in a highly industrialized area, South China. Sci. Total Environ. 419:109-115.
[HENRYWIN] Programme de calcul de la loi de Henry sur Microsoft Windows [modèle d’évaluation]. 2011. Version 3.20. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Hermanson, M.H., Isaksson, E., Forsstrom, S., Teixeira, C., Muir, D.C.G., Pohjola, V.A., Van der Wal, R.S.V. 2010. Deposition history of brominated Flame retardant compounds in an Ice core from Holtedahlfonna, Svalbard, Norway. Environ. Sci. Technol. 2010:7405-7410.
Houde, M., Berryman, D., de Lafontaine, Y., Verrault, J. 2014. Novel brominated flame retardantsd and dechloranes in three fish species from the St. Lawrence River, Canada. Sci. Total Environ. 479-480:48-56.
[HYDROWIN] Programme de calcul des taux d’hydrolyse pour Microsoft Windows Hydrolysis Rates Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Ilyas, M., Sudaryanto, A., Setiawan, I.E., Riyadi, A.S., Isobe, T., Ogawa, S., Takahashi, S., Tanabe, S. 2011. Characterization of polychlorinated biphenyls and brominated flame retardants in surface soils from Surabaya, Indonesia. Chemosphere 83:783-791.
Ismail, N., Bewurtz, S.B., Pleskach, K., Whittle, D.M., Helm, P.A., Marvin, C.H., Tomy, G.T. 2009. Brominated and chlorinated flame retardants in Lake Ontario, Canada, Lake Trout (Salvelinus Namaycush) between 1979 and 2004 and possible influence of food-web changes. Environ. Toxicol. Chem. 28(5):910-920.
Ismail, N., Pleskach, K., Marvin, C., Whittle, M., Keir, M., Helm, P., Tomy, G.T. 2006. Temporal trends of flame retardants in Lake Ontario lake trout (1979-2004). Organohalogen Compd 68:1808-1811.
Jakab, E., Uddin, M.d.A., Bhaskar, T., Sakata, Y. 2003. Thermal decomposition of flame-retarded high impact polystyrene. J. Anal. Appl. Pyrolysis 68-69:83-99.
Kajiwara, N., Noma, Y., Takigami, H. 2008. Photolysis studies of technical decabromodiphenyl ether (DecaBDE) and ethane (DeBDethane) in plastics under natural sunlight. Enviro. Sci. Technol. 42:4404-4409.
Kajiwara, N., Noma, Y., Takigami, H. 2011. Brominated and organophosphate flame retardants in selected consumer products on the Japanese market in 2008. J. Hazard Mater. 192:1250-1259.
Kalachova, K., Hradkova, P., Lankova, D., Hajslova, J., Pulkrabova, J. 2012. Occurrence of brominated flame retardants in household and car dust from the Czech Republic. Sci. Total Environ. 441:182-193.
Karlsson, M., Julander, A., van Bavel, B., Hardell, L. 2007. Levels of brominated flame retardants in blood in relation to levels in household air and dust. Environ. Int. 33:62-69.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem. 23(10):2324-2336.
Kelly, B.C., Ikonomou, M.G., Blair, J.D., Morin, A.E., Gobas, F.A.P.C. 2007. Food Web-Specific Biomagnification of Persistent Organic Pollutants. Science 317:236-239.
Kemmlein, S., Hahn, O., Jann, O. 2003. Emissions of organophosphate and brominated flame retardants from selected consumer products and building materials. Atmos. Environ. 37:5485-5493.
Kierkegaad, A., Sellström, U., McLachlan, M.S. 2009. Environmental analysis of higher brominated diphenyl ethers and decabromodiphenyl ethane. Journal of Chromatography A., 1216:364-375.
Kierkegaard, A. 2007. PBDEs in the environment. Time trends, bioaccumulation and the identification of their successor, decabromodiphenyl ethane [thèse de doctorat]. Department of Applied Environmental Science, Université de Stockholm, Stockholm, Suède. 68 p.
Kierkegaard, A., Balk, L., Tjärnlund, U., de Wit, C.A., Jansson, B. 1999. Dietary uptake and biological effects of decabromodiphenyl ether in rainbow trout (Oncorhynchus mykiss). Environ. Sci. Technol. 33:1612-1617.
Kierkegaard, A., Bjorkland, J., Fridean, U. 2004. Identification of the Flame Retardant Decabromodiphenyl Ethane in the Environment. Environ. Sci. Technol. 38:3247-3253.
Kim, M., Guerra, P., Alaee, M., Smyth, S.A. 2014. Occurrence and fate of four non-regulated brominated flame retardants in wastewater treatment plants. Environmental Science and Pollution Research21(23):13394-13404.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40:53-60.
[KLIF] Agence norvégienne du climat et de la pollution. 2013. Perfluorinated alkylated substances, brominated flame retardants and chlorinated paraffins in the Norwegian Environment - Screening 2013. Tromso (Norvège) : NILU (institut norvégien de recherches sur l’air) et SWECO Group, 98 p.
[KOAWIN] Programme de calcul du coefficient de partage octanol-air sur Microsoft Windows [modèle d’évaluation]. 2010. Version 1.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
[KOCWIN] Programme du calcul du coefficient de sorption normalisé du carbone sur microsoft Windows [modèle d’évaluation]. 2010. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Kolic, T.M., Shen, L., MacPherson, K., Fayez, L., Gobran, T., Helm, P.A., Marvin, C.H., Arsenault, G., Reiner, E.J., 2009. The analysis of halogenated flame retardants by GC-HRMS in environmental samples. Journal of Chromatographic Science 47:83-91.
Konstantinov, A., Arsenault, G., Chittim, B., Kolic, T., MacPherson, K., McAlees, A., McCrindle, R., Potter, D., Reiner, E.J., Tashiro, C., Yeo, B. 2006. Characterization of mass-labeled [13C14]-decabromodiphenylethane and its use as a surrogate standard in the analysis of sewage sludge samples. Chemosphere 64:245-249.
[KOWWIN] Programme de calcul du coefficient de partage octanol-eau pour Microsoft Windows [modèle d’évaluation]. 2010. Version 1.68. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Krueger, H., Thomas, S., Kendall, T. 2003a. S8010: A prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International Ltd, Easton (MD), USA. Project number 471A-110.
Krueger, H., Thomas, S., Kendall, T. 2003b. S8010: A prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment with a total of 2% organic carbon. Wildlife International Ltd, Easton (MD), USA. Project number 471A-109.
Kuo, Y.M., Sepulveda, M.S., Sutton, T.M., Ochoa-Acuna, H.G., Muir, A.M., Miller, B., Hua, I. 2010. Bioaccumulation and biotransformation of decabromodiphenyl ether and effects on daily growth in juvenile lake whitefish (Coregonus clupeaformis). Ecotoxicology19(4):751-60.
Lambropoulou DA, Nollet LML. 2014. « Outlook ». In Lambropoulou DA et Nollet LML dir. 2014. Transformation Products of Emerging Contaminants in the Environment. Analysis, Processes, Occurrence, Effects and Risks. West Sussex, UK: John Wiley and Sons Ltd.935 pp.
Laouedj, N., Abdelkader, E., Ulrich, M., Bekka, A. 2014. Spectroscopic behaviour of saytex 8010 under UV-visible light and comparative thermal study with some flame retardant. J. Photochem. Photobiol. A Chem. 275:96-102.
Law, K., Halldorson, T., Danell, R., Stern, G., Gewurtz, S., Alaee, M., Marvin, C., Whittle, M, Tomy, G. 2006. Bioaccumulation and trophic transfer of some flame retardants in a lake Winnipeg (Canada) food web. Environ. Toxicol. Chem. 25:2177-2186.
Letcher, R.J., Marteinson, S.C., Fernie, K.J. 2014. Dietary exposure of American kestrels (Falco sparverius) to decabromodiphenyl ether (BDE-209) flame retardant: Uptake, distribution, debromination and cytochrome P450 enzyme induction. Environment International63:182-190.
Lin, Y., Ma, J., Qiu, X., Zhao, Y., Zhu, T. 2015. Levels, spatial distribution, and exposure risks of decabromodiphenylethane in soils of North China. Environ. Sci. Pollut. Res.
Liu, L.-Y., Salamova, A., Hites, R.A. 2014. Halogenated flame retardants in baby food from the United States and from China and the estimated dietary intakes by infants. J. Environ. Sci. Technol. 48:9812-9818.
Ma, Y., Salamova, A., Venier, M., Hites, R.A. 2013. Has the phase-out of PBDEs affected their atmospheric levels? Trends of PBDEs and their replacements in the Great Lakes atmosphere. Environ. Sci. Technol. 47:11457-11464.
Mallory, V. 1988a. Acute exposure oral toxicity. Report no. PH 402-ET-001-88. Decabromodiphenylethane. Lot #SH-6427-49. Rapport inédit.
Mallory, V. 1988b. Acute exposure dermal toxicity. Report no. PH 422-ET-001-88. Decabromodiphenylethane. Lot #SH-6427-49. Rapport inédit.
Mallory, V. 1988c. Primary dermal irritation study in rabbits. Report no. PH 420-ET-001-88. Decabromodiphenylethane. Lot #SH-6427-49. Rapport inédit.
Mallory, V. 1988d. Primary eye irritation study in rabbits. Report no. PH 421-ET-001-88. Decabromodiphenylethane. Lot #SH-6427-49. Rapport inédit.
Mannetje, A., Coakley, J., Bridgen, P., Brooks, C., Harrad, S., Smith, A.H., Pearce, N., Douwes, J. 2013. Current concentrations, temporal trends and determinants of persistent organic pollutants in breast milk of New Zealand woman. Science of the Total Environment458-460:399-407.
Margitich, D. 1991. 28 day toxicity study in rats. Report no. PH 436-ET-002-90. Saytex°R 402. Lot #23-014-2A. Rapport inédit.
Margitich, D.L. 1992. Subchronic 90 day oral toxicity study in rats. PH 470-ET-001-91. Saytex 402.Lot#23-014-2A. Waverly (PA) : Pharmakon Research International Inc.
Mayer, P., Reichenberg, F. 2006. Can highly hydrophobic organic substances cause aquatic baseline toxicity and can they contribute to mixture toxicity? Environ. Tox. and Chem. 25(10):2639-2644.
[MPBPWIN] Programme d’estimation du point d’ébullition pour Microsoft Windows [modèle d’évaluation]. 2010. Version 1.43. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
McCarty, L.S., Arnot, J.A., Mackay, D. 2013. Evaluation of critical body residue for acute narcosis in aquatic organisms. Environ. Toxicol. Chem. 32(10).
McCarty, L.S., Mackay, D. 1993. Enhancing ecotoxicological modeling and assessment: critical body residues and modes of toxic action. Environ. Sci. Technol. 27:1719-1728.
McKinney, M., Dietz, R., Sonne, C., De Guise, S., Skirnisson, K., Karlsson, K., Steingrimsson, E., Letcher, R.J. 2011a. Comparative hepatic microsomal biotransformation of selected PBDES, including Decabromodiphenyl ether, and Decabromodiphenyl ethane flame retardants in Arctic marine-feeding mammals. Environ. Sci. Technol. 30(7):1506-1514.
McKinney, M., Letcher, R.J., Aars, J., Born, E.W., Branigan, M., Dietz, R., Evans, T.J., Gabrielsen, G.W., Peacock, E., Sonne, C. 2011b. Flame retardants and legacy contaminants in polar bears from Alaska, Canada, East Greenland and Svalbard, 2005-2008. Environment International 37:365-374.
Mekenyan, G., Dimitrov, S.D., Pavlov, T.S., Veith, G.D. 2005. POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ. Res. 16(1-2):103-133.
Melymuk L, Robson M, Csiszar S, Helm P, Kaltenecker G, Backus S, Bradley L, Gilbert B, Blanchard P, Jantunen L, Diamond M. 2014. From the City to the Lake: Loadings of PCBs, PBDEs, PAHs and PCMs from Toronto to Lake Ontario. Environ Sci Technol 48: 3732−3741.
Mercieca, M.D. 1992a. Developmental toxicity (teratology) study in rats with Saytex°R 402. SLS Study No. 3196.24. Document inédit.
Mercieca, M.D. 1992b. Developmental toxicity (teratology) study in rabbits with Saytex°R 402. SLS Study No. 3196.26. Document inédit.
Meyer, T., Muir, D.C.G., Teixeira, C., Wang, X., Young, T. 2012. Deposition of brominated flame retardants to the Devon Ice Cap, Nunavut, Canada. Environ. Sci. Technol. 46:826-833.
MG Chemicals. 2011. Material Safety Data Sheet Code: 833FRB - Part B Name: Epoxy - Flame Retardant.MG Chemicals. Révisé le 11 avril 2011. [Consulté en février 2014.]
Mo, l., Wu, J.P., Luo, X.J., Li, K.L., Peng, Y., Feng, A.H., Zhang, Q., Zou, F.S., Mai, B.X. 2013. Using the kingfisher (alcedo atthis) as a bioindicator of PCBs and PBDEs in the Dinghushan biosphere reserve, China. Environ. Tox. and Chem. 32(7):1655-1662.
Mo, L., Wu, J.P., Luo, X.J., Zou, F.S., Mai, B.X. 2012. Bioaccumulation of polybrominated diphenyl ethers, decabromodiphenyl ethane, and 1,2-bis(2,4,6-tribromophenoxy) ethane flame retardants in kingfishers (alcedo atthis) from an electronic waste-recycling site in south china. Environ. Tox. and Chem. 31(9):2153-2158.
Mochungong, P., Abbasi, G., Diamond, M.L., Zhu, J. 2014. Polybrominated diphenyl ethers and alternative brominated flame retardants in furniture and electric and electronic devices collected from the Greater Toronto Area, Canada. Manuscrit inédit. 20 p.
Muir, D.C.G., Teixeira, C.F., Epp, J., Young, T., Wang, X., Keir, M., Backus, S. 2011. Bioaccumulation of Selected Halogenated Organic Flame Retardants in Remote Lakes and in the Great Lakes. Affiche présentée à la SETAC.
Nakari, T., Huhtala, S. 2010. In vivo and in vitro toxicity of decabromodiphenyl ethane, a flame retardant. Environ. Tox. 25(4):333-338.
[NCI] National Chemical Inventories [base de données sur cédérom]. 2009. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. [Consulté en juin 2010.]
[New EQC] New Equilibrium Criterion Model. 2012. Version 1.0 (Beta). Peterborough (Ont.) : Université Trent, Canadian Environmental Modelling Centre. [Consulté en mai 2014.] (disponible en anglais seulement)
Newton PE. 2003. A sensitization study (maximization method) of Saytex 8010 in guinea pigs. Study No. 972-001. MPI Research Inc., Mattawan (MI). Document inédit.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
Nordic Co-operation. 2011. Brominated Flame Retardants (BFR) in the Nordic Environment [PDF]. TemaNord 2011:528, 86 p.
Norris, B., Smith, S. 2002. Research into the mouthing behaviour of children up to 5 years old [PDF]. Consumer and Competition Policy Directorate, Department of Trade and Industry, Londres (Royaume-Uni). [Cité dans Exposure Factors Handbook, USEPA, 2011.] Noyes, P.D., Hinton, D.E., Stapleton, H.M. 2011. Accumulation and debromination of decabromodiphenyl ether (BDE-209) in juvenile fathead minnows (Pimephales promelas) induces thyroid disruption and liver alterations. Toxicological Sciences 122(2):265-74.
Noyes, P.D., Lema, S.C., Macaulay, L.J., Douglas, N.K., Stapleton, H.M. 2013. Low Level Exposure to the Flame Retardant BDE-209 Reduces Thyroid Hormone Levels and Disrupts Thyroid Signaling in Fathead Minnows. Environ. Sci. Technol. 47:10012-10021.
Nyholm, J.R., Grabic, R., Arp, H.P.H., Moskeland, T., Andersson, P.L. 2013. Environmental occurrence of emerging and legacy brominated flame retardants near suspected sources in Norway. Science of the Total Environment 443:307-314.
[OCDE] Organisation de coopération et de développement économiques. 1994. Selected brominated flame retardants (Risk Reduction Monograph No. 3, OECD Environment Monograph Series No. 102) [PDF], Paris (France). (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2000. Series on Testing and Assessment. No. 23. Guidance document on aquatic toxicity testing of difficult substances and mixtures [PDF]. Paris (France) : Direction de l’environnement de l’OCDE. 53 p.
[OCDE] Organisation de coopération et de développement économiques. 2004. Emission scenario document on textile finishing industry [PDF]. Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement. Report No.: ENV/JM/MONO(2004)12, JT00166691. [Consulté en février 2014.] (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009. Emission scenario document on plastics additives [PDF]. Paris, France : Organisation de coopération et de développement économiques, Direction de l’environnement. Series on Emission Scenario Documents No. 3. Rapport no ENV/JM/MONO(2004)8/REV1. JT03267870. [Consulté en février 2014.] (disponible en anglais seulement)
Orihel, D., Bisbicos, T., Darling, C.T.R., Dupuis, A.P., Williamson, M., Muir, D.C.G. 2016. Probing the debromination of the flame retardant decabromodiphenyl ether in sediments of a boreal lake. Environ. Toxicol. Chem.
Orihel, D., Bisbicos, T., Dupuis, A.P., Muir, D.C.G. 2014. Debromination of the flame retardant decabromodiphenyl ether in lake sediments. Document inédit.
Papa, E., Kovarich, S., Gramatica, P. 2010. QSAR modeling and prediction of the endocrine-disrupting potencies of brominated flame retardants. Chem. Res. Toxicol. 23:946-954.
Petreas, M., Park, J.S., Wang, M., Wang, Y., Guo, W., Tarrant, D., Rhee, A., Harwani, S. 2012. The California Biomonitoring Program: Persistent organic pollutants in archived and contemporary serum. Global NEST J. 1:80-85.
Porch, J., Krueger, H. 2005. S8010: A toxicity test to determine the effects of the test substance on seedling emergence of six species of plants. Wildlife International Ltd, Easton (MD), É.-U. : Project number 471-101A.
Putman, D.L. 1992. Chromosome aberrations in Chinese hamster lung (CHL) cells. Report no. T9499.227025. Saytex°R 402. Document inédit.
Puype, F., Samsonek, J., Knoop, J., Egelkraut-Holtus, M., Ortliebb, M. 2015. Evidence of waste electrical and electronic equipment (WEEE) relevant substances in polymeric food-contact articles sold on the European market. Food Addit. Contam. Part A 32(3):410-426.
Qi, H., Li, W.-L., Liu, L.-Y., Zhang, Z.-F., Zhu, N.-Z., Song, W.-W., Ma, W.-L., Li, Y.-F. 2014. Levels, distribution and human exposure of new non-BDE brominated flame retardants in the indoor dust of China. Environ. Pollut. 195:1-8.
Qin, X., Xia, X., Xia, Z., Yang, Z., Yan, S., Zhao, Y., Wei, R., Li, Y., Tian, M., Zhao, X., Qin, Z., Xu, X. 2010. Thyroid disruption by technical decabromodiphenyl ether (DE-83R) at lowconcentrations in Xenopus laevis. J. of Environmental Sciences 22(5):744-751.
Recherche de produits pharmaceutiques en ligne [base de données]. Version du 17 février 2017. Ottawa (Ontario). Gouvernement du Canada. [Consulté le 24 avril 2014.]
Remberger, M., Kaj, L., Hansson, K., Bibi, M., Brorström-Lundén, E., Haglund, P., Liljelind, P., Bergek, S., Andersson, R., Kitti-Sjöström, R. 2014. Screening of Emerging Brominated Flame Retardants (BFRs) and Polybrominated dibenzofurans (PBDFs). IVL Swedish Environmental Research Institute Ltd. IVL Report B2110. 49 p. + 6 annexes.
Ricklund, N., Kierkegaard, A., McLachlan, M.S. 2008a. An international survey of decabromodiphenyl ethane (deBDethane) and decabromodiphenyl ether (decaBDE) in sewage sludge samples. Chemosphere 73:1799-1804.
Sahlstrom, L., Sellstrom, U., de Wit, C.A. 2012. Clean-up method for determination of established and emerging brominated flame retardants in dust. Anal. Bioanal. Chem. 404:459-466.
Sakuratani, Y., Noguchi, Y., Kobayashi, K., Yamada, J., Nishihara, T. 2008. Molecular size as a limiting characteristic for bioconcentration in fish. J. Environ. Biol. 29(1):89-92.
Salamova, A., Hites, R.A. 2010. Evaluation of Tree Bark as a Passive Atmospheric Sampler for Flame Retardants, PCBs, and Organochlorine Pesticides. Environ. Sci. Technol. 44:6196-6201.
Salamova, A., Hites, R.A. 2011. Discontinued and alternative brominated flame retardants in the Atmosphere and precipitation from the Great lake basin. Environ. Sci. Technol. 45:8698-8706.
Sample, B.E., Opresko, D.M., Suter, G,W. II. 1996. Toxicological Benchmarks for Wildlife: 1996 Revision. Oak Ridge (TN) : Health Sciences Research Division. Présenté au United States Department of Energy. Contract No. DE-AC05-84OR21400.
San, R.H., Wagner, V.O. 1991. Salmonella/mammalian-microsome plate incorporation mutagenicity assay (Ames test) and Escherichia coli WP2 uvrA reverse mutation assay. Report no. Saytex°R 402. Rapport inédit.
Santé Canada. [Modifié le 3 mai 2017.] Listes des additifs alimentaires autorisés. Ottawa (ON): Santé Canada, Direction des aliments. [Consulté le 24 avril 2014.]
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l’exposition. Ottawa (Ont.) : Les Grands Lacs : Impact sur la santé, Direction générale de la protection de la santé, Santé Canada.
Santé Canada. 1998. Exposure Factors for Assessing Total Daily Intake of Priority Substances by the General Population of Canada. Rapport inédit. Décembre 1998. Section des substances d’intérêt prioritaire, Direction de l’hygiène du milieu, Santé Canada.
Santé Canada. 2014a. CMP survey 2014-2015: Determination of flame retardants in consumer products. Project no. 2014-2048. 19 juin 2014.
Santé Canada. 2014b. CMP survey 2014-2015: Determination of flame retardants in consumer products. Project no. 2014-2048. 12 août 2014.
Schaefer, E.C., Carpernter, K. 2010. Saytex 8010 : An evaluation of Inherent Biodegradability using the CONCAWE Test. Wildlife International Ltd. Project No. 471E-104. Draft OECD Guideline 302D. Wildlife International Ltd (MD). 45 p.
Schaefer, E.C., Matthews, M.E. 2011. Saytex 8010 : Biodegradation in anaerobic digester sludge. Wildlife International Ltd. Project No. 471E-105. OECD Guideline 314C. Wildlife International Ltd (MD). 56 p.
Schenker, U., Macleod, M., Scheringer, M., Hungerbühler, K. 2005. Improving data quality for environmental fate models: a least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds. Environ. Sci. Technol. 39:8434-8441.
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool Version 2.0 [PDF]. Version 2.0. Organisation de coopération et de développement économiques; Zurich (Suisse) : École polytechnique fédérale. Distribué lors de l’atelier OCDE-PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada) du 31 mai au 2 juin 2006.
Schreder, ED, La Guardia, MJ. 2014. Flame Retardant Transfers from U.S. Households (Dust and Laundry Wastewater) to the Aquatic Environment. Environ Sci Technol.
She, Y.Z., Wu, J.P., Zhang, Y., Peng, Y., Mo, L., Luo, X.J., Mai, B.X. 2013. Bioaccumulationof polybrominated diphenyl ethers and several alterantive flame retardants in a small herbivorous foodchain. Environmental Pollution 174:164-170.
Shi, T., Chen, S.J., Luo, X.J., Zhang, X.L., Tang, C.M., Luo, Y., Ma, Y.J., Wu, J.P., Peng, X.Z., Mai, B.X. 2009. Occurrence of Brominated Flame Retardants other than Polybrominated Diphenyl Ethers in Environmental and Biota Samples from Southern China. Chemosphere 74:910-916.
[SPIN] Substances in Preparations in Nordic Countries [base de données]. 2006. Copenhague (Danemark) : Conseil des ministres des pays nordiques. [Consulté en mars 2011.] (disponible en anglais seulement)
Stankowski, L.F. 1998. Ames/Salmonella plate incorporation assay. Report no. PH301-ET- 001-88. Decabromodiphenylethane (DBDPE). Lot #SH-6427-49. Rapport inédit.
Stapleton, H.M., Alaee, M., Letcher, R.J., Baker, J.E. 2004. Debromination of the flame retardantdecabromodiphenyl ether by juvenile carp (Cyprinus carpio). Environ. Sci. Technol. 38:112-119.
Stapleton, H.M., Allen, J.G., Kelly, S.M., Konstantinov, A., Klosterhaus, S., Watkins, D., McClean, M.D., Webster, T.F. 2008. Alternate and new brominated flame retardants detected in U.S. house dust. Environ. Sci. Technol. 42:6910-6916.
Stenzel JI, Schaefer EC 2015a. DBDPEthane: Aerobic Transformation in Soil. Wildlife International, projet no 471E-106, présenté à la société Albemarle. [Accès restreint.]
Stenzel JI, Schaefer EC. 2015b. DBDPEthane: Aerobic and Anaerobic Transformation in Aquatic Sediment Systems. Wildlife International, projet no 471E-107, présenté à la société Albemarle. [Accès restreint.]
Stenzel JI, Schaefer EC. 2015c. DBDPEthane: Anaerobic Transformation in Soil. Wildlife International, projet no 471E-108, présenté à la société Albemarle. [Accès restreint.]
Stieger, G., Scheringer, M., Ng, C.A., Hungerbühler, K. 2014. Assessing the persistence, bioaccumulation potential and toxicity of brominated flame retardants: Data availability and quality for 36 alternative brominated flame retardants. Chemosphere 116:118-123.
Strid, A., Smedje, G., Athanassiadis, I., Lindgren, T., Lundgren, H., Jakobsson, K., Bergman, A. 2014. Brominated flame retardant exposure of aircraft personnel. Chemosphere 116:83-90.
Sun, R.B., Xi, Z.G., Yan, J., Yang, H.L. 2012. Cytotoxicity and apoptosis induction in human HepG2 hepatoma cells by decabromodiphenyl ethane. Biomed. Environ. Sci. 25(5):495-501.
Takigami, H., Suzuki, G., Hirai, Y., Ishikawa, Y., Sunami, M., Sakai, S. 2009. Flame retardants in indoor dust and air of a hotel in Japan. Environ. Int. 35:688-693.
Tian, M., Chen, S.-J., Wang, J., Tian, S., Luo, X.-J., Mai, B.-X. 2011a. Atmospheric deposition of halogenated flame retardants at urban, e-waste, and rural locations in southern China. Environ. Sci. Technol. 45:4696-4701.
Tlustos, C., Fernandes, A., Rose, M. 2010. The emerging BFRs - hexabromobenzene (HBB), bis(2,4,6-tribromophenoxy)ethane (BTBPE) and decabromodiphenylethane (DBDPE) – in Irish foods. Organohalogen Compd. 72:1577-1579.
Tolls, J., Muller, M., Willing, A., Steber, J. 2009. A new concept for the environmental risk assessment of poorly soluble compounds and its application to consumer products. Integrated Environmental Assessment and Management 5(3):374-378.
Toms, L.-M.L., Hearn, L., Sjödin, A., Mueller, J.F. 2011. Introduction to Brominated Flame Retardants: Commercially Products, Applications, and Physicochemical Properties. In Eljarrat, E., Barceló, D., éds. 2011. Brominated Flame Retardants. Série : The Handbook of Environmental Chemistry, volume 16. Heidelberg (Berlin) : Springer. 290 p. Tue, N.M., Takahashi, S., Suzuki, G., Isobe, T., Viet, P.H., Kobara, Y., Nobuyasu, S., Zhang, G., Sudaryanto, A., Tanabe, S. 2013. Contamination of indoor dust and air by polychlorinated biphenyls and brominated flame retardants and relevance of non-dietary exposure in Vietnamese informal e-waste recycling sites. Environ. Int. 51:160-167.
[USEPA] Environmental Protection Agency des États-Unis. 1993. Wildlife Exposure Factors Handbook. Vol. I. EPA/600/R-93/187a. Office of Research and Development.
[USEPA] Environmental Protection Agency des États-Unis. 2011. Exposure factors handbook: 2011 edition. National Center for Environmental Assessment, Washington (DC); EPA/600/R-09/052F. Disponible auprès du National Technical Information Service, Springfield (VA). (disponible en anglais seulement)
[USEPA] Environmental Protection Agency des États-Unis. 2012. Chemical Data Reporting. Washington (DC) : USEPA, Office of Pollution Prevention and Toxics. Résultat de la recherche sur le NR CAS 84852-53-9. [Consultée en février 2014.] (disponible en anglais seulement)
[USEPA] Environmental Protection Agency des États-Unis. 2014. An alternative assessment for the flame retardant decabromodiphenyl ether (DecaBDE) (final report) [PDF]. 901 p. (disponible en anglais seulement)
Valls-Cantenys, C., Villaverde-de-Sáa, E., Rodil, R., Quintana, J.B., Iglesias, M., Salvadóa, V., Celab, R. 2013. Application of polydimethylsiloxane rod extraction to the determination of sixteen halogenated flame retardants in water samples. Analytica Chimica Acta 770:85-93.
Van Hoven, R.L., Glassbrook, N., Nixon, W.B. 2002. Determination of the vapor pressure of Saytex 8010 using the spinning rotor gauge method. Wildlife International Ltd. Project number: 471C-102. Présenté à Albemarle Corporation. [Accès restreint.]
Van Hoven, R.L., McGregor, J.A., Nixon, W.B. 1999a. Saytex 8010: Determination of water solubility by the generator column method. Wildlife International Ltd. Project number: 471C-101. Présenté à Albemarle Corporation. [Accès restreint.]
Van Hoven, R.L., McGregor, J.A., Nixon, W.B. 1999b. Saytex 8010: Determination of the noctanol/water partition coefficient by the generator column method. Wildlife International Ltd. Project number: 471C-103. Présenté à Albemarle Corporation. [Accès restreint.]
[VCCLAB] Virtual Computational Chemistry Laboratory. 2005. ALOGPS 2. [Consulté en octobre 2013.] (disponible en anglais seulement)
Venier M, Audy A, Vojta S, Bečanová J, Romanak K, Melymuk L, Krátká M, Kukučka P, Okeme J, Saini A, et al. 2016. Brominated flame retardants in the indoor environment — Comparative study of indoor contamination from three countries. Environment International 94:15-160.
Venier, M., Dove, A., Romanak, K., Backus, S., Hites, R. 2014. Flame Retardants and Legacy Chemicals in Great Lakes’ Water. Environ. Sci. Technol. 48(16):9563-72.
Venier, M., Wierda, M., Bowerman, M., Hites, R.A. 2010. Flame retardants and organochlorine pollutants in bald eagle plasma from the Great Lakes region. Chemosphere 80:1234-1240.
Vernier, M., Hites, R. 2008. Flame Retardants in the Atmosphere near the Great Lakes. Environ. Sci. Technol. 42:4745-4751.
Wan, Y., Zhang, K., Dong, Z., Hu, J. 2013. Distribution is a major factor affecting bioaccumulation of decabrominated diphenyl ether: Chinese sturgeon (Acipenser sinensis) as an example. Environ. Sci. Technol. 47(5):2279-86.
Wang, F., Wang, J., Dai, J., Hu, G., Wang, J., Luo, X., Mai, B. 2010. Comparative tissue distribution, biotransformation, and associated biological effects by decabromodiphenyl ethane and decabrominated diphenyl ether in male rats after a 90-Day oral exposure study. Environ. Sci. Technol. 44(14):5655-5660.
Wang, F., Wang, J., Wang, J., Mai, B., Dai, J. 2011. Response to comment on "comparative tissue distribution, biotransformation and associated biological effects by decabromodiphenyl ethane and decabrominated diphenyl ether in male rats after a 90-day oral exposure study". Environ. Sci. Technol. 45(11):5062-3.
Wang, J., Chen, S., Nie, X., Tian, Luo, X., An, T., Mai, B. 2012. Photolytic degradation of decabromodiphenyl ethane (DBDPE). Chemosphere 89(7):844-9.
Wang, J., Ma, Y.-J., Chen, S.-J., Tian, M., Luo, X.-J., Mai, B.-X. 2010. Brominated flame retardants in house dust from e-waste recycling and urban areas in South China: Implications on human exposure. Environ. Int. 36:535-541.
Wania, F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40:569-577.
Watanabe, I., Sakai, S. 2003.Environmental release and behavior of brominated flame retardants. Environment International 29:665-682.
[WATERNT] Programme d’estimation de hydrosolubilité [modèle d’évaluation]. 2010. Version 1.01. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Webster, E., Mackay, D., Di Guardo, A., Kane, D., Woodfine, D. 2004. Regional differences in chemical fate model outcome. Chemosphere 55:1361-1376.
Wei, H., Aziz-Schwanbeck, A.C., Zou, Y., Corcoran, M.B., Poghosyan, A., Li, A., Rockne, K.J., Christensen, E.R., Sturchio, N.C. 2012. Polybromodiphenyl ethers and decabromodiphenyl ethane in aquatic sediments from Southern and Eastern Arkansas, United States. Environ. Sci. Technol. 46:8017-8024.
Weil, E.D., Levchik, S.V. 2009. Flame Retardants for Plastics and Textiles: Practical Applications. Cincinnati (OH) : Hanser Publishers. 297 p.
Weisbrod, A.V., Woodburn, K.B., Koelmans, A.A., Parkerton, T.F., McElroy, A.E., Borgå, K. 2009. Evaluation of bioaccumulation using in vivo laboratory and field studies. Integr. Environ. Assess. Manag. 5(4):598-623.
Wilson, R., Jones-Otazo, H., Petrovic, S., Mitchell, I., Bonvalot, Y., Williams, D., Richardson, G.M. 2013. Revisiting Dust and Soil Ingestion Rates Based on Hand-to-Mouth Transfer (diponible en anglais seulement)
[WSKOWWIN] Programme d’estimation de l’hydrosolubilité de composés organiques pour Microsoft Windows [modèle d’évaluation]. 2010. Version 1.42. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janvier 2014.] (disponible en anglais seulement)
Wu, J.P., Guan, Y.T., Zhang, Y., Luo, X.J., Zhi, H., Chen, S.J., Mai, B.X. 2010. Trophodynamics of Hexabromocyclododecanes and Several Other Non-PBDE Brominated Flame Retardants in a Freshwater Food Web. Environ. Sci. Technol. (44):5490-5495.
Xanthos, M., Todd, D.B. 2004. Plastics Processing. Encyclopedia of Polymer Science and Technology.
Xiao R, Adolfsson-Erici M, Åkerman G, McLachlan MS, MacLeod M. 2013. « A benchmarking method to measure dietary absorption efficiency of chemicals by fish ». Environ Toxicol Chem 32: 2695-2700.
Yang, R., Wei, H., Guo, J., Li, A. 2012. Emerging Brominated Flame retardants in the sediment of the Great Lakes. Environ. Sci. Technol. 46:3119-3126.
Zhang, X.L., Luo, X.J., Chen, S.J., Wu, J.P., Mai, B.X. 2009. Spatial distribution and vertical profile of polybrominated diphenyl ethers, tetrabromobisphenol A, and decabromodiphenylethane in river sediment from an industrialized region of South China. Environmental Pollution 157:1917-1923.
Zheng, J., Luo, X.-J., Yuan, J.-G., Wang, J., Wang, Y.-T., Chen, S.-J., Mai, B.-X., Yang, Z.-Y. 2011. Levels and sources of brominated flame retardants in human hair from urban, e-waste, and rural areas in South China. Environ. Pollut. 159:3706-3713.
Zhou, S.N., Buchar, A., Siddique, S., Takser, L., Abdelouabab, N., Zhu, J. 2014. « Measurements of selected brominated flame retardants in nursing women: implications for human exposure ». Environ. Sci. Technol. 48:8873-8880.
Zhou, S.N., Reiner, E.J., Marvin, C., Helm, P., Riddell, N., Dorman, F., Misselwitz, M., Shen, L., Crozier, P., MacPherson, K. et al. 2010a. Development of liquid chromatography atmospheric pressure chemical ionization tandem mass spectrometry for analysis of halogenated flame retardants in wastewater. Anal. Bioanal. Chem. 396:1311-1320.
Zhou, S.N., Reiner, E.J., Marvin, C., Kolic, T., Riddell, N., Helm, P., Dorman, F., Misselwitz, M., Brindle, I.D. 2010b. Liquid chromatography atmospheric pressure photoionization tandem mass spectrometry for analysis of 36 halogenated flame retardants in fish. Journal of Chromatography A. 1217:633-641.
Zhu, L., Hites, R. 2006. Brominated Flame Retardants in Tree Bark from North America. Environ. Sci. Technol. 40:3711-3716.
Zhu, L., Ma, B., Hites, R. 2009. Brominated flame retardants in serum from the general population in northern China. Environ. Sci. Technol. 43(18):6963-6968.
Annexe A. Identité structurelle
| No CAS | Autres nomsa |
|---|---|
| 84852-53-9 | 1,1’-(Éthane-1,2-diyl)bis[pentabromobenzène] (TSCA, ASIA-PAC, NZIoC) 1,1’-(Éthane-1,2-diyl)bis[pentabromobenzène] (EINECS) 1,2-Bis(2,3,4,5,6-pentabromophényl)éthane;1,2-Bis(pentabromophényl)éthane; décabromodiphényléthane; décabromodiphényléthylène Décadiphényl 8010; éthylènebis(pentabromobiphényl); éthylènebispentabromobenzène; 1,2,3,4,5-pentabromo-6-[2-(2,3,4,5,6-pentabromophényl)éthyl]benzène; 2,2’,3,3’,4,4’,5,5’,6,6’-décabromobibenzyl; éthane 1,2-bis(pentabromophényl); BDPE-209; DBDiPhEtb; DBDE; EBPE; DeBrPylE, EPB
FCP 801; Firemaster 2100; Firemaster 2100C; Planelon BDE; RDT 3; S 8010; SAYTEX 8010; CG 801; PBB-209; SLFR-2; produit ignifuge SAYTEX 4010; SAYTEX 4010 ZD; produit ignifuge SAYTEX 402 (n’est plus commercialisé); produit ignifuge SAYTEX 8010; SAYTEX 8010 ZD; Netguard 8010; NNN® Br-971; Ecoflame B-971; YCFR-03; DBDPE/RDT-3; FR-1410 |
a Noms tirés du National Chemical Inventories (NCI, 2009), de l’étude de l’ECHA (env. 2007-2013) (consultée le 6 mars 2014), de Bergman et al., 2012, etc.
Sélection des analogues
Le décabromodiphényléther (décaBDE) constitue un analogue structurel proche du DBDPE, jugé adéquat pour l’analyse de certaines propriétés physiques et chimiques en regard des données sur le DBDPE. (L’annexe B contient une description de l’ajustement de la valeur expérimentale, AVE, et la méthode des moindres carrés.) Le décaBDE est traité tout au long de cette évaluation, notamment en comparant son comportement avec celui du DBDPE (p. ex., dégradation, transport à grande distance, potentiel de bioaccumulation, et écotoxicité). Toutefois, on note entre les deux substances des différences de composition moléculaire, de dimensions et de configurations, qui peuvent influer sur le mode d’interaction des molécules avec leur environnement y compris les interactions avec les membranes, les récepteurs les enzymes et les solvants (communication de fabricant à l’intention d’Environnement Canada datée de 2014, source non citée, Albemarle 2016). Par exemple, d’après un fabricant de produits chimiques, le décaBDE existe en tant que conformère tridimensionnel, disposé dans l’espace de sorte que les noyaux aromatiques soient orthogonaux (presque perpendiculaires) les uns aux autres avec une courbe de 120° au pont oxygène, tandis que le pont éthane du DBDPE crée une séparation suffisante entre les deux noyaux aromatiques complètement remplacés de sorte que la molécule puisse assumer plusieurs configurations tridimensionnelles, chaque configuration ayant ses propres dimensions moléculaires. Le conformère le plus stable du DBDPE est plié à un angle aigu au pont éthane, donnant une longueur moléculaire plus courte que le décaBDE. Néanmoins, le volume moléculaire, la surface exposée et le diamètre transversal du DBDPE sont plus grands que ceux du décaBDE (communication de fabricant à l’intention d’Environnement Canada datée de 2014, source non citée, Albemarle 2016). En comparant les deux substances, le pont éthane du DBDPE entre les anneaux aromatiques (plutôt que le pont éther du décaBDE) devrait le rendre légèrement plus hydrophobe que ceux du décaBDE, et il devrait conférer à la molécule une plus grande souplesse de conformation (Covaci et al., 2011). Comme le signale Albemarle (2016), la débromation du DBDPE requiert plus d’énergie que celle du décaBDE.
Annexe B. Propriétés physiques et chimiques
Certaines valeurs modélisées du Koe et de l’hydrosolubilité du DBDPE ont été déterminées par l’ajustement de valeurs expérimentales dans le modèle KOWWIN (2010). Cette méthode estime le Koe ou l’hydrosolubilité pour un produit chimique donné (c.-à-d. DBDPE) en comparant sa structure à celle d’un produit chimique analogue qui a une valeur empirique (c.-à-d. décaBDE). La valeur empirique pour l’analogue est ajustée sur le plan quantitatif pour tenir compte de l’effet des différences structurelles sur le Koe ou l’hydrosolubilité lorsqu’on compare les deux substances chimiques. La lecture croisée des valeurs empiriques de l’analogue décaBDE ont également été prises en compte pour l’hydrosolubilité, le log Koe et la pression de vapeur, afin d’inclure dans les calculs de la moyenne géométrique avec les autres données sur le DBBPE.
Les propriétés physiques et chimiques du DBDPE ont été vérifiées aux fins d’uniformité interne, conformément au procédé d’ajustement par la méthode des moindres carrés (Schenker et al., 2005). Pour ce faire, la moyenne géométrique ou arithmétique de chaque paramètre physique et chimique applicable (pression de vapeur, hydrosolubilité, solubilité dans l’octanol, log Koe, log Koa et log Kae) a été saisie dans le modèle. Des valeurs de sous-refroidissement ont été utilisées pour la pression de vapeur, l’hydrosolubilité et la solubilité dans l’octanol. Les valeurs utilisées pour déterminer les moyennes arithmétique et géométrique [pour les coefficients de partage (log)] représentent les valeurs indépendantes les plus fiables disponibles découlant de données empiriques, de la modélisation et d’analogues (tableau B-1; pour toutes les valeurs physiques et chimiques, consulter le tableau B-2). En déterminant l’uniformité interne des propriétés, le modèle d’ajustement selon la méthode des moindres carrés produit également des valeurs prévues. Généralement, le DBDPE se caractérise par une hydrosolubilité très faible, une pression de vapeur faible à très faible ainsi qu’un coefficient de partage carbone organique-eau (Kco) et un coefficient de partage octanol-eau (Koe) très élevés. Tandis que des données expérimentales liées au log Koe, à l’hydrosolubilité et à la pression de vapeur existent pour le DBDPE, une incertitude subsiste quant à ces valeurs (p. ex., Stieger, 2014). Aux fins de la présente évaluation, la valeur de log Koe de 9,89, représentant la moyenne géométrique vérifiée par ajustement selon la méthode des moindres carrés, a été utilisée. Cette valeur est légèrement supérieure à celle de l’analogue proche décaBDE (8.7) (Environnement Canada, 2010), mais légèrement inférieure à la valeur déterminée par la méthode AVE avec le décaBDE (10.23). Afin de maintenir l’uniformité interne des valeurs de propriétés physiques et chimiques, les valeurs obtenues par ajustement selon la méthode des moindres carrés pour l’hydrosolubilité et la pression de vapeur ont également été prises en compte. Le fort ajustement en pourcentage de la valeur de solubilité dans l’octanol après vérification au moyen d’un ajustement par la méthode des moindres carrés indique qu’il est probable que cette valeur d’entrée initiale soit largement sous-estimée. Si aucune valeur n’était incluse pour cette variable dans l’ajustement par la méthode des moindres carrés, le logKoe serait supérieur à 10. Les valeurs finales sélectionnées sont résumées au tableau B-1.
| Source des données | Pression de vapeur (Pa) | Solubilité dans l’eau (mol/m3) | Solubilité dans l’octanol (mol/m3) | Log Koe | Log Kae | Log Koa |
|---|---|---|---|---|---|---|
| Valeurs expérimentales DBDPE | 1,00 × 10-4 | 7,41 × 10-7 | 1,96 × 10-3i | AD | AD | AD |
| Valeurs expérimentales DBDPE | AD | AD | 8,75 × 10-4i | AD | AD | AD |
| Données déduites à partir de l’analogue décaBDE | 4,63 × 10-6 | 1,04 × 10-7 | AD | 8,7 | AD | AD |
| Ajustement de la valeur expérimentale pour le décaBDE | AD | 4,23 × 10-9 | AD | 10,23 | AD | AD |
| Modèle EPI Suite (pas d’intrants) | 2,11 × 10-12 | 1,19 × 10-15a | AD | 13,64 | -5,58 | 19,22c |
| Modèle EPI Suite | AD | 1,0 × 10-9b | AD | AD | AD | 14,28d |
| Modèle EPI Suite | AD | AD | AD | AD | AD | 15,81e |
| Modèle EPI Suite | AD | AD | AD | AD | AD | 13,44f |
| VCC/AGLOGs | AD | 2,21 × 10-5 | AD | 7,86 | AD | AD |
| ACD/Percepta | AD | 5,0 × 10-9 | AD | 10,63 | AD | AD |
| Moyenne géométrique/ moyenneg Valeurs d’entrée obtenues par ajustement des moindres carrés (valeurs de solubilité des liquides sous-refroidis) | 9,92 × 10-8 (1,46 × 10-4) | 1,72 × 10-9h (2,52 × 10-6) | 0,00131 (1,92)i | 10,21 | -5,58 | 15,69h |
| Valeurs de sortie obtenues par ajustement des moindres carrés (valeur de solubilité des liquides sous-refroidis) | 5,59 × 10-10 (8,21 × 10-7) | 8,34 × 10-9 (1,22 × 10-5) | 64,1 (9,41 × 104) | 9,89 | -4,57 | 14,45 |
| % d’ajustement des valeurs | -99 % | 385 % | 4,88 × 106 % | 53 % | 929 % | -94 % |
Abréviation ⸺ AD : aucune donnée
a WSKOWWIN, 2010.
b WATERNT, 2010 (méthode des fragments).
c KoaWin, 2010 utilisant le log Koe de 13,64 de KOWWIN (pas d’intrants).
d KoaWin, 2010 utilisant le log Koe de 8,7.
e KoaWin, 2010 utilisant le log Koe de 10,23 de la méthode d’ajustement de la valeur expérimentale pour le décaBDE.
f KoaWin, 2010 utilisant le log Koe de 7,86.
g La moyenne arithmétique calculée pour des valeurs archivées est équivalente à la moyenne géométrique des valeurs exponentielles (de coefficients de partage). Dans l’ajustement selon la méthode des moindres carrés, toutes les valeurs d’entrées sont de 1 par défaut pour la variance estimée, sauf pour la solubilité dans l’octanol (= 3), en raison du niveau d’incertitude élevé à l’égard des données de solubilité dans l’octanol.
h Afin d’optimiser l’indépendance des estimations de paramètres, les valeurs modélisées fondées sur la valeur de log Koe de l’utilisateur (p. ex., hydrosolubilité du modèle WSKOWWIN, autre que celle par défaut) n’ont pas été incluses dans le calcul de moyenne géométrique de l’hydrosolubilité. Toutefois, toutes les valeurs de log Koe ont été entrées dans le modèle KOAWIN, car ce dernier constituait la seule source de données de Koa (pour éviter de fausser l’interprétation du Koa et pencher vers une valeur de log Koe unique).
i Toutes les sources de données dans le tableau B-2 (avec conversions d’unités) autres que la solubilité dans l’octanol [communication personnelle, rapport de fabricant non publié, présenté à la Division des évaluations écologiques (Environnement Canada, 2013); source non citée]. Les valeurs individuelles énumérées sont des valeurs à l’état solide, toutefois, les valeurs d’entrée de l’hydrosolubilité, de la pression de vapeur et de la solubilité dans l’eau étaient des « valeurs de liquides sous-refroidis » (Shenker et al., 2005) obtenues au moyen d’une division par le rapport de fugacité pour le DBDPE. Les valeurs d’entrée et de sortie incluses dans l’ajustement par la méthode des moindres carrés pour les liquides sous-refroidis figurent entre crochets en dessous des valeurs à l’état solide.
| Propriété | Type | Valeura | Température (°C) | Référence |
|---|---|---|---|---|
| État physique | Valeurs expérimentales | Poudre blanche ou blanc cassé | s.o. | Albemarle, 2008 |
| Point de fusion (°C) | Valeurs expérimentales | (>) 345§ | s.o. | Chemtura, 2005 Albemarle, 2008 |
| Point de fusion (°C) | Valeurs expérimentales | 351 à 355 | s.o. | Grands Lacs, 2003 |
| Point de fusion (°C) | Valeurs expérimentales | 350 | s.o. | Albemarle, 2001 |
| Point de fusion (°C) | Valeurs modélisées | 259,71 | s.o. | MPBPWIN, 2010 |
| Point d’ébullition (°C) | Valeurs expérimentales | Non pertinente; devrait se dégrader avant ébullition | s.o. | Environment Agency, 2007 |
| Point d’ébullition (°C) | Valeurs modélisées | 600,86 | s.o. | MPBPWIN, 2010 |
| Densité (kg/m3) | Valeurs expérimentales | 868 (0,868 g/mL) | 25 | Albemarle, 2001 |
| Densité (kg/m3) | Densité tassée | 3250 (3,25 g/cm3) | 25 | Albemarle, 2001 |
| Densité (kg/m3) | Densité aérée | 1760 (1,760 g/mL) | 25 | Albemarle, 2001 |
| Pression de vapeur (Pa) | Valeurs expérimentales | < 1 × 10-4 Pa | 20 | Commission européenne, 2002, Van Hoven et al., 2002 (jauge à rotor) |
| Pression de vapeur (Pa) | Valeurs modélisées | 2,11 × 10-12 (1,58 × 10-14 mmHg)c | 25 | MPBPWIN, 2010 (méthode de Grain modifiée) |
| Pression de vapeur (Pa) | Valeurs modélisées | 1,35 × 10-11 (1,01 × 10-13 mmHg) | 25 | MPBPWIN, 2010 (méthode MacKay) |
| Pression de vapeur (Pa) | Valeurs modélisées | 2,85 × 10-16 (2,14 × 10-18 mmHg)c | 25 | MPBPWIN, 2010 (méthode Antoine) |
| Pression de vapeur (Pa) | Valeurs modélisées | ~1 × 10-6 | 25 | Environment Agency, 2007 |
| Pression de vapeur (Pa) | Valeurs modélisées | 5,59 × 10-10 (liquide sous-refroidi : 8,21 × 10-7)§ | 25 | Ajustement par moindres carrés; Schenker et al., 2005 |
| Constante de la loi de Henry (Pa m3/mol) | Valeurs modélisées | 6,51 × 10-3§ (6,42 × 10-8 atm m3/mol) (log Kae = -5,58) | 25 | HENRYWIN, 2011 (méthode d’estimation fondée sur les liaisons) |
| Constante de la loi de Henry (Pa m3/mol) | Valeurs modélisées | 2,98 × 10-3 (2,94 × 10-8 atm m3/mol) | 25 | HENRYWIN, 2011 (méthode d’estimation fondée sur les groupes) |
| Constante de la loi de Henry (Pa m3/mol) | Valeurs modélisées | 6,7 × 10-2 (6,16 × 10-9 atm m3/mol) (log Kae = 4,57) | 25 | (PV/HSg), ajustement par moindres carrés (Schenker et al., 2005) |
| Log Koe (sans dimension) | Valeurs expérimentales/valeurs estimées | ~3,55 (estimation jugée incertaine; non fiable) | 25 | Van Hoven et al., 1999b |
| Log Koe (sans dimension) | Valeurs modélisées | 13,64 | 25 | KOWWIN, 2010 |
| Log Koe (sans dimension) | Valeurs modélisées | 10,23c | 25 | KOWWIN, 2010 Ajustement de la valeur expérimentale (AVE) |
| Log Koe (sans dimension) | Valeurs modélisées | 7,86 | 25 | ALOGPS 2.1 VCCLAB 2005 |
| Log Koe (sans dimension) | Valeurs modélisées | 10,63 | 25 | ACD/Percepta de 1997 à 2012 |
| Log Koe (sans dimension) | Valeurs modélisées | 9,89g§ | 25 | Ajustement par moindres carrés (Schenker et al., 2005) |
| Log Kco (sans dimension) | Valeurs modélisées | 6,38 (méthode de l’ICM) | 25 | KOCWIN 2010 |
| Log Kco (sans dimension) | Valeurs modélisées | 8,58 d§ (méthode du Koe) | 25 | KOCWIN 2010 |
| Log Koa (sans dimension) | Valeurs modélisées | 19,22 | 25 | KOAWIN, 2010 |
| Log Koa (sans dimension) | Valeurs modélisées | 15,44d§ | 25 | KOAWIN, 2010 |
| Log Koa (sans dimension) | Valeurs modélisées | 14,45g | 25 | Ajustement par moindres carrés (Schenker et al., 2005) |
| Hydrosolubilité (mg/L) | Valeurs expérimentales | ~7,2 × 10-4 [(~0,72 μg/L) | 25 | Van Hoven et al., 1999a (colonne de générateur) |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 9,71 × 10-7 (méthode des fragments) | 25 | WATERNT 2010 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 2,16 × 10-8c | 25 | WSKOWWIN, 2010 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 3,85 × 10-9d | 25 | WSKOWWIN, 2010 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 7,34 × 10-10f | 25 | WSKOWWIN, 2010 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 2,15 × 10-2 | 25 | ALOGPS 2.1 VCCLAB 2005 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 4,11 × 10-6e | 25 | WATERNT (ajustement de la valeur expérimentale), 2010 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 5,0 × 10-9 | 25 | ACD/Percepta de 1997 à 2012 |
| Hydrosolubilité (mg/L) | Valeurs modélisées | 8,10 × 10-6g§ (liquide sous-refroidi : 1,19 × 10-2) | 25 | Ajustement par moindres carrés (Schenker et al., 2005) |
Abréviations ⸺ log Koe : coefficient de partage octanol-eau, log Kco : coefficient de partage carbone organique-eau, log Koa : coefficient de partage octanol-air, pKa : constante de dissociation acide, s.o. : sans objet.
§ Indique la valeur choisie pour la modélisation.
a Les valeurs entre parenthèses représentent les valeurs originales rapportées par les auteurs ou estimées par les modèles.
b Densité apparente du sol
c Log Koe utilisé = 8,7 (d’après des données déduites à partir d’analogues du décaBDE).
d Log Koe utilisé = 9,89 (Ajustement par moindres carrés).
e Hydrosolubilité utilisée = 1,0 × 10-4 mg/L [valeur maximale découlant de l’analogue décaBDE (< 1,0 × 10-4 mg/L)].
f Log Koe utilisé = 10,23 (d’après la méthode d’ajustement de la valeur expérimentale du log Koe du décaBDE).
g Pour l’ajustement par moindres carrés (LSA); voir le tableau B-1 pour une liste des valeurs d’entrée utilisées.
| Propriété | Type | Valeur | Référence |
|---|---|---|---|
| Pression de vapeur (Pa) | Valeurs expérimentales | 4,63 × 10-6 (21 °C) | EC, 2002 |
| Pression de vapeur (Pa) | Valeurs expérimentales | < 133,32 (250 °C) | OCDE, 1995 |
| Log Koe (sans dimension) | Valeurs expérimentales | 8,7 (6,27 à 9,7) | Environnement Canada, 2010 EC, 2002 CMABFRIP, 1997a |
| Log Koe (sans dimension) | Valeurs expérimentales | 6,265 (25 °C) | MacGregor et Nixon, 1997 |
| Hydrosolubilité (mg/L) | Valeurs expérimentales | 0,02 à 0,03 (20 à 30 µg/L) < 0,1 µg/L | OCDE, 1995 |
Annexe C. Modélisation des produits de la dégradation potentielle du DBDPE : propriétés physico-chimiques, dégradation, bioaccumulation et toxicité en milieu aquatique
| Produits de la dégradation du BDPEa | Masse moléculaire (g) b | Log Koeb | PBDEc | Masse moléculaire (g)d | Log Koee |
|---|---|---|---|---|---|
nonaBDPEs |
892,33 | 9,0 | nonaBDEs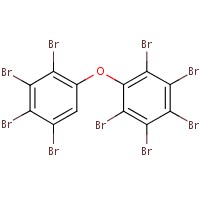 |
880,4 | 7,8 |
octaBDPEs |
813,4 | 8,11 | octaBDEs |
801,4 | 6,9 |
heptaBDPEs |
734,5 | 7,22 | heptaBDEs |
722,3; | 6,0 |
hexaBPDEs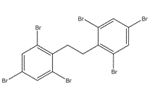 |
655,6 | 6,33 | hexaBDEs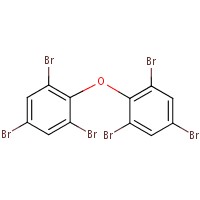 |
643,6 | 5,1 |
pentaBPDEs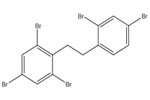 |
576,8 | 5,44 | pentaBDEs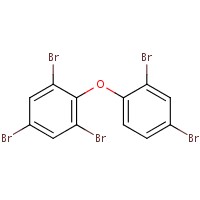 |
564,7 | 4,3 |
a Modèle SMILES pour les nonaBDE à partir du modèle CATALOGIC (2012); le reste des BDPE a été généré en modifiant les congénères de biphényles polychlorés (BPC), notamment à l’aide du lien : www.epa.gov/osw/hazard/tsd/pcbs/pubs/congenertable.pdf, en tant que source de structure. Les codes SMILES pour les congénères de BDPE générés ont été vérifiés dans le programme de dessin EPI.
b Estimation découlant des modèles EPI Suite (2002-2012). Koe estimé par le modèle KOWWIN, v 1.68 (2010) à l’aide de la méthode AVE et d’une référence de log Koe de 9,89 pour DBDPE.
c Valeur sélectionnée à partir de Chem ID Plus (consulté en 2014), pour établir une correspondance avec les congénères de BDPE.
d Valeurs tirées de l’évaluation préalable des PBDE (Environnement Canada, 2006).
e Valeurs tirées de l’état des connaissances scientifiques écologiques sur décabromodiphényléther (Environnement Canada, 2010).
| Produit de dégradation | Poids moléculaire (g/mol) | Log Koea | Hydrosolubilité (mg/L)b | SMILES (représentatif)c,d |
|---|---|---|---|---|
| DBDPE | 971,23 | 9,89 | 8,10 × 10-6 | c1(c(c(c(c(c1Br)CCc2c(c(c(c(c2Br)Br)Br)Br)Br)Br)Br)Br)Br |
| nonaBDPE | 892,33 | 9,0 | 8,92 × 10-7 | Brc1cc(CCc2c(Br)c(Br)c(Br)c(Br)c2Br)c(Br)c(Br)c1Br |
| octaBDPE | 813,44 | 8,11 | 3,06 × 10-6 | BrC1=C(C(Br)=C(Br)C(Br)=C1)CCC2=C(Br)C=C(Br)C(Br)=C2Br |
| heptaBDPE | 734,54 | 7,22 | 1,63 × 10-5 | BrC1=C(C(Br)=C(Br)C(Br)=C1Br)CCC2=CC=CC(Br)=C2Br |
| hexaBPDE | 655,64 | 6,33 | 8,55 × 10-5 | BrC1=C(C(Br)=CC(Br)=C1)CCC2=C(Br)C=C(Br)C=C2Br |
| pentaBPDE | 576,75 | 5,44 | 4,4 × 10-4 | BrC1=C(C(Br)=CC(Br)=C1)CCC2=CC=C(Br)C=C2Br |
| DBDPE hydroxylé | 987,27 | 8,35 | 1,05 × 10-5 | OC(Cc1c(Br)c(Br)c(Br)c(Br)c1Br)c1c(Br)c(Br)c(Br)c(Br)c1Br |
| nonaBPDE hydroxylés | 908,33 | 8,52 | 1,65 × 10-5 | Oc1c(Br)c(Br)c(CCc2c(Br)c(Br)c(Br)c(Br)c2Br)c(Br)c1Br |
| Acides phényles bromés | 940,33 | 4,83 | 2,33 × 10-4 | OC(=O)C(Br)=C(Br)C(Br)=C(CCc1c(Br)c(Br)c(Br)c(Br)c1Br)C(=O)Br |
a Valeur de log Koe du DBDPE basée sur la méthode AVE (KOWWIN, 2010).
b Valeur d’hydrosolubilité tirée du modèle WATNT (2010), sauf pour le DBDPE (voir le tableau B-2)
a Modèle SMILES pour les nonaBDE et les acides phényles bromés et hydroxylés à partir du modèle CATALOGIC (2012); le reste des BDPE a été généré en modifiant les congénères de biphényles polychlorés (BPC), notamment à l’aide du lien : www.epa.gov/osw/hazard/tsd/pcbs/pubs/congenertable.pdf, en tant que source de structure. Les codes SMILES pour les congénères de BDPE générés ont été vérifiés dans le programme de dessin EPI.
d Code unique SMILES choisi aux fins de présentation à partir d’une liste de différents modèles SMILES par espèce bromée; toutefois, la modélisation RQSA a été effectuée à l’aide d’un modèle SMILES représentatif de configurations « extrêmes » (répartition déséquilibrée des atomes de brome) et de configurations « équilibrées » (répartition équilibrée des atomes de brome) pour chaque congénère. Les seules différences de modélisation signalées parmi les différentes configurations de brome pour le même congénère concernaient la dégradation photolytique (AOPWIN), mais ces différences étaient mineures.
| Produit de dégradation | Log Koea | Demi‑vie prévue par oxydation atmosphérique (AOPWIN, version 1.92) | Biodégradation (Biowin, version 4.10 – sous-modèles 3, 4, 5, 6) et demi‑vie extrapolée | Demi‑vie prévue par réaction à l’ozone (AOPWIN, version 1.92) | Demi‑vie prévue par hydrolyse (HYDROWIN, version 2) |
|---|---|---|---|---|---|
| nonaBDPE | 9,0 | 4,27 jours | « Ne se biodégrade pas rapidement » à « récalcitrant » | s.o.b | s.o.b |
| octaBDPE | 8,11 | 4,093 jours | « Ne se biodégrade pas rapidement » à « récalcitrant » | s.o.b | s.o.b |
| heptaBDPE | 7,22 | 3,925 jours | « Ne se biodégrade pas rapidement » à « récalcitrant » | s.o.b | s.o.b |
| hexaBPDE | 6,33 | 3,071 jours | Sous-modèles 3, 5 et 6 : « Ne se biodégrade pas rapidement » à « récalcitrant », sous-modèle 4 (dégradation primaire) : « mois » | s.o.b | s.o.b |
| pentaBPDE | 5,44 | 2,224 joursa | Sous-modèles 3, 5 et 6 : « Ne se biodégrade pas rapidement » à « récalcitrant », sous-modèle 4 (dégradation primaire) : « mois » | s.o.b | s.o.b |
| DBDPE hydroxylé | 8,35 | 1,098 jours | « Ne se biodégrade pas rapidement » à « récalcitrant » | s.o.b | s.o.b |
| nonaBPDE hydroxylés | 8,51 | 2,809 jours | « Ne se biodégrade pas rapidement » à « récalcitrant » | s.o.b | s.o.b |
| Acides phényles bromés | 4,83 | 2,955 jours | Sous-modèles 3, 5 et 6 : « Ne se biodégrade pas rapidement » à « récalcitrant », sous-modèle 4 (dégradation primaire) : « mois » | 79,323 jours | Fonction hydrolysable détectée : halogénures d’acyle; les halogénures d’acyle réagissent rapidement (certains violemment) avec l’eau pour donner l’halogénure d’acide et d’hydrogène d’origine. Les demi‑vies d’hydrolyse sont inférieures à 10 minutes (ou plus rapides). |
a Selon la disposition des atomes de brome (Br), la demi‑vie du pentaDBPE dans l’air varie de moins 2 jours (c.-à-d., 1,5 jour) à plus de 2 jours.
b Le modèle ne donne pas d’estimation pour ce type de structure.
Similairement au DBDPE d’origine, on s’attend à ce que des produits de dégradation du DBDPE soient modérément bien couverts par des modèles de biodégradation BIOWIN utilisés pour estimer la dégradation. Toutefois, il semble qu’il y ait une faible couverture des produits de dégradation du DBDPE par les modèles CPOP (2012) (la plupart des produits de dégradation s’inscrivent dans moins de 30 % du domaine structurel). Ainsi, les prévisions de la biodégradation par les modèles CPOP et CATALOGIC ne sont pas incluses dans l’évaluation pour les produits de dégradation.
Le facteur de bioconcentration (FBC) et le facteur de bioaccumulation (FBA) des produits de dégradation du DBDPE ont été estimés à l’aide de modèles fondés sur la structure et d’un modèle cinétique du bilan massique à trois niveaux trophiques. Toutes les estimations du FBC et du FBA, à l’exception du sous-modèle 1 du modèle BCFBAF, contenu dans la version 4.1 de l’application EPIWIN (v4.1), ont été corrigées pour le métabolisme parce qu’il représente une voie d’élimination fondamentale de plusieurs produits chimiques comme le TCP. Cette correction a été effectuée en calculant les constantes du taux de métabolisme (kM) à l’aide la méthode RQSA basée sur la structure.
La majorité des produits de dégradation du DBDPE prévus répondent aux critères requis pour être considérés comme étant « dans le domaine » pour le modèle de bilan massique d’Arnot et Gobas; les substances répondent aux critères de paramètres mécanistes et globaux qui sont : d’être un organique neutre (sauf pour les nonaBDE hydroxylés et les acides phényles bromés), d’avoir une masse moléculaire inférieure à 1200 environ, et d’avoir un log Koe inférieur à 9 (sauf le nonaBDPE). Il semble qu’il y ait une faible couverture des produits de dégradation du DBDPE par les modèles CPOP (la plupart des produits de dégradation tombent à moins de 40 % du domaine structurel). Ainsi, les prévisions de la bioaccumulation par les modèles CPOP et CATALOGIC ne sont pas incluses dans la présente évaluation.
| Produit de dégradation | Masse moléculaire (g) | Log Koea | FBC prévu (sans métabolisme) (L/kg poids humide) | FBC prévub Poissons de niveau trophique intermédiaire (métabolisme) (L/kg poids humide) | FBA prévub Poissons de niveau trophique intermédiaire (métabolisme) (L/kg poids humide) | Constante du taux métabolique prévu (kM)b (1/jour) (100 g de poisson, 15 °C) |
|---|---|---|---|---|---|---|
| octaBDPE | 813,4 | 8,11 | 3803 | 466,8 | 165 600 | 0,016 |
| heptaBDPE | 734,5 | 7,22 | 108 380 | 1790 | 17 600 | 0,025 |
| hexaBPDE | 655,6 | 6,33 | 6975 | 3510 | 44 210 | 0,039 |
| pentaBPDE | 576,8 | 5,44 | 1804 | 2756 | 5636 | 0,062 |
| DBDPE hydroxylé | 987,27 | 8,35 | 1610 | 98,31 | 16 380 | 0,047 |
| nonaBPDE hydroxylés | 908,3 | 8,52 | 2394 | 38,9 | 4042 | 0,083 |
| Acides phényles bromés | 940,3 | 4,83 | 3,16 | 693,9 | 738,5 | 0,271 |
a Estimation par le modèle KOWWIN, v 1.68 (2010) à l’aide de la méthode AVE et d’une référence de log Koe de 9,89 pour DBDPE. Il est à noter que le nonaBDE n’a pas été inclus étant donné qu’au log Koe de 9, la substance dépasse à la limite pour les produits chimiques de la base de calibration dans le modèle.
b Estimation du modèle BCFBAF, v 3.01 (2008).
| Nom commun | Organisme d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| nonaBDPE | poisson, Daphnia magna, algue verte, etc. | toxicité aiguë et toxicité chronique | AECSb | ECOSAR, version 1.11 |
| octaBDPE | poisson, Daphnia magna, algue verte, etc. | toxicité aiguë et toxicité chronique | AECS | ECOSAR, version 1.11 |
| heptaBPDE | Daphnia magna, poisson, mysidacé marin | Vc | 7,3 × 10-11 à 6,75 × 10-6 (AECS pour les autres essais) | ECOSAR, version 1.11 |
| hexaBDPE | Daphnia magna, poisson, mysidacé marin, algue verte (toxicité aiguë et toxicité chronique) | Vc, CE50 après 96 h | 9,72 × 10-10 à 0,00080 (AECS pour les autres essais) | ECOSAR, version 1.11 |
| pentaBDPE | algue verte, Daphnia magna, poisson, mysidacé marin | Vc, CL50 après 96 h | 1,27 × 10-8 à 0,002 (AECS pour les autres essais) | ECOSAR, version 1.11 |
| DBDPE hydroxylé (organique neutre) | poisson, Daphnia magna, algue verte | Vc | 2,02 × 10-7 à 7,3 × 10-5 (AECS pour les autres essais) | ECOSAR, version 1.11 |
| DBDPE hydroxylé (alcools benzyliques) | poisson, Daphnia magna | Vc | 2,92 × 10-7 à 1,05 × 10-4 (AECS pour les autres essais) | ECOSAR, version 1.11 |
| nonaBPDE hydroxylés (substance organique neutre/phénols) | poisson, Daphnia magna, algue verte, etc. | toxicité aiguë et toxicité chronique | AECS | ECOSAR, version 1.11 |
| acides phényles bromés (acides halogénés) | poissons | Vc | 0,000186 | ECOSAR, version 1.11 |
| acides phényles bromés (acides halogénés de vinyle ou d’allyle) | poissons | Vc | 9,44 × 10-6 | ECOSAR, version 1.11 |
| acides phényles bromés (organique neutre) | poisson, Daphnia magna | Vc, CL50 après 96 h, CL50 après 48 h | 0,000191 à 0,000992 | ECOSAR (v.1.11) |
a Toutes les valeurs estimées par le modèle ECOSAR, v 1.11 (2012) à l’aide des propriétés physiques et chimiques se trouvent au tableau D-2.
b AECS, absence d’effets à la concentration de saturation; Vc, valeur chronique, CL, concentration létale.
Annexe D. Estimations de l’absorption quotidienne de DBDPE par divers groupes d’âge au sein de la population générale du Canada
| Voie d’exposition | 0 à 6 moisa (allaités)b | 0 à 6 moisa (nourris à la préparation)c | 0 à 6 moisa (non nourris à la préparation)d | 0,5 à 4 anse | 5 à 11 ansf | 12 à 19 ansg | 20 à 59 ansh | 60 et plusi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 |
| Air intérieurk | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 |
| Eau potablel | s.o. | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 | < 0,0001 |
| Alimentsm | 0,006 | 0,0004 | 0,0003 | 0,0007 | 0,0006 | 0,0003 | 0,0002 | 0,0002 |
| Poussièren | 0,056 | 0,056 | 0,056 | 0,029 | 0,011 | 0,0004 | 0,0004 | 0,0004 |
| Solo | s.o. | s.o. | s.o. | 0,023 | 0,017 | 0,0006 | 0,0006 | 0,005 |
| Absorption totale | 0,062 | 0,056 | 0,056 | 0,053 | 0,029 | 0,0013 | 0,0012 | 0,011 |
Abréviations ⸺ s.o. : sans objet.
a Hypothèses : poids de 7,5 kg, volume d’air respiré de 2,1 m3/jour, consommation d’eau de 0,8 L/jour (enfants nourris au lait maternisé) ou de 0,3 L/jour [enfants non nourris au lait maternisé, respectivement (Santé Canada, 1998)] et ingestion de 38 et 0 mg/jour de poussière et de sol (Wilson et al., 2013).
b On présume que les nourrissons allaités exclusivement consomment 0,742 L de lait maternel par jour (Santé Canada, 1998), et on présume que le lait maternel constitue la seule source alimentaire. La concentration pour le lait (maternel) entier de 0,061 µg/L était basée sur la concentration au 95e centile de 0,059 ng/g poids humide [ph] × 1,03 g/mL (densité du lait maternel) définie à partir de 105 échantillons de lait maternel humain prélevés en 2008-2009 chez des femmes adultes allaitantes à Sherbrooke (Québec) (Zhou et al., 2014; communication personnelle du Bureau de la science et de la recherche en santé environnementale (BSRSE) de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes (BERSE) de Santé Canada, en date du 15 mai 2014).
c On présume que les nourrissons nourris à la préparation exclusivement consomment 0,8 L d’eau par jour (Santé Canada, 1998), qui est utilisée pour reconstituer la préparation. On n’a déterminé aucune donnée de surveillance du DBDPE dans la préparation; par conséquent, l’absorption par voie alimentaire ne reflète que celle provenant de l’eau. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau.
d On assume que les nourrissons non nourris à la préparation exclusivement consomment 0,7 L d’eau par jour (Santé Canada, 1998) et environ 50 % des nourrissons non nourris à la préparation ont commencé à manger des aliments solides à 4 mois et 90 % à 6 mois (NHW, 1990).
e On présume que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boit 0,7 L d’eau par jour, qu’il consomme 54,7 g de poisson et 162,2 g de produits céréaliers par jour (Santé Canada, 1998), et qu’il ingère 41 et 14 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
f On présume que l’enfant pèse 31,0 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boit 1,1 L d’eau par jour, qu’il consomme 89,8 g de poisson et 290,1 g de produits céréaliers par jour (Santé Canada, 1998), et qu’il ingère 31 et 21 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
g On présume que l’enfant pèse 59,4 kg, qu’il respire 15,8 m3 d’air par jour, qu’il boit 1,2 L d’eau par jour, qu’il consomme 97,3 g de poisson et 320 g de produits céréaliers par jour (Santé Canada, 1998), et qu’il ingère 2,2 et 1,4 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
h On présume que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boit 1,5 L d’eau par jour, qu’elle consomme 111,7 g de poisson et 248,4 g de produits céréaliers par jour (Santé Canada, 1998), et qu’elle ingère 2,5 et 1,6 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
I On présume que la personne pèse 72,0 kg, qu’elle respire 14,3 m3 d’air par jour, qu’elle consomme 1,6 L d’eau par jour, qu’elle consomme 72,9 g de poisson et 229,0 g de produits céréaliers par jour (Santé Canada, 1998), et qu’elle ingère 2,5 et 1,5 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
j On n’a déterminé aucune donnée de surveillance de l’air ambiant au Canada. La concentration au 95e centile pour Cleveland (Ohio) (22 pg/m3 + 1,96 × 13 pg/m3 = 47,5 pg/m3) a été utilisée pour calculer les estimations de la limite supérieure de l’absorption quotidienne pour l’exposition par l’air ambiant. La concentration de DBDPE découlant de cet emplacement urbain a été jugée représentative du Canada. L’hypothèse selon laquelle les Canadiens passent 3 heures par jour à l’extérieur est utilisée (Santé Canada 1998).
k Vernier et al. (2016) ont mesuré le DBDPE dans l’air intérieure de 23 maisons de Toronto (Ontario) en 2013 et ont publié des concentrations allant de la non‑détection à 74 pg/m3 (0,074 ng/m3) (Venier et al. 2016). Nous avons utilisé la concentration maximale de 0,074 ng/m3 trouvée dans l’étude de Venier et al. (2016) sur l’air des résidences pour calculer les estimations supérieures de l’absorption quotidienne découlant de l’exposition à l’air intérieur. On a posé l’hypothèse que les Canadiens passaient chaque jour, 21 heures à l’intérieur (Santé Canada 1998).
l On n’a déterminé aucune donnée de surveillance de l’eau potable au Canada. La somme des concentrations moyennes les plus élevées de DBDPE (10,8 pg/L), mesurées à la surface de l’eau du lac Ontario (Venier et al., 2014), a été choisie pour calculer de l’estimation de la limite supérieure d’absorption quotidienne pour l’exposition par l’eau potable.
m On n’a déterminé aucune donnée de suivi des aliments du commerce au Canada; cependant, des données sur deux catégories d’aliments pour bébés ont été recensées pour les échantillons prélevés aux États-Unis (Liu et al., 2014). Les concentrations de DBDPE dans des préparations pour nourrissons (28,6 pg/g ph) et des céréales (48,8 pg/g ph) des États-Unis ont été choisies pour calculer les estimations de la limite supérieure d’absorption quotidienne pour l’exposition de nourrissons par l’entremise de préparations et de produits céréaliers, respectivement. Des données environnementales sur les poissons étaient également disponibles. La plus forte concentration sur une base de poids frais de 0,44 µg/kg (poids « frais » ou « humide ») fondée sur une demi-limite de détection de la méthode (LDM = 0,1 ng/g pl) × 8,78 % de lipides chez des ménominis du lac Winnipeg (Law et al., 2006) a été choisie pour calculer les estimations de la limite supérieure d’absorption quotidienne pour l’exposition à tous les produits alimentaires liés au poisson du groupe des aliments aquacoles. Bien que la plus forte concentration trouvée était de 3,3 ng/g pl dans la lotte du lac Winnipeg (section 10.1.1.5), que l’on peut convertir à 0,011 µg/kg en utilisant la teneur de 0,33 % de lipide de cette espèce. Les quantités d’aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada, 1998).
n La concentration maximale de DBDPE (11 070 ng/g poussière) de 20 maisons à Boston (Massachusetts) (Stapleton et al., 2008) a été choisie pour calculer les estimations de la limite supérieure d’absorption quotidienne pour l’exposition par la poussière. Des données canadiennes récentes sur 35 maisons et 10 bureaux de Toronto ont indiqué une concentration maximale de 5500 ng/g de DBDPE dans la poussière (Abbasi et al. 2016). Les données de Boston sont toujours utilisées pour le calcul de l’estimation de la limite supérieue.
o On n’a déterminé aucune donnée de surveillance des sols en Amérique du Nord. Par conséquent, la concentration environnementale estimée (CEE) maximale dans le sol de 25,3 µg/g p.s. (25,3 mg/kg p.s.) a été choisie pour calculer l’estimation de la limite supérieure d’absorption quotidienne par exposition au sol.
Annexe E. Concentrations de DBDPE dans les produits offerts aux consommateurs
| Catégorie de produit | Type de produit | Taille d’échantillon | Limite de détection | Concentration | Référence |
|---|---|---|---|---|---|
| Jouets | Jouet en mousse | 7 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Jouets | Jouet en plastique | 2 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Jouets | Chaise en mousse (pour enfants) | 1 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Jouets | Tente de jeu en textile | 2 | 0,3 % de poids dans l’échantillon | ≥ 0,5 % de poids dans l’échantillon (≥ limite de dosage) | Santé Canada, 2014a, b |
| Meubles | Coussin d’allaitement | 2 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Meubles | Matelas de lit d’enfant | 1 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Meubles | Garnitures en mousse de polyuréthane – véhicules | 18 | Non déterminée (utilisation d’un rapport signal/bruit de 3 à la place) | ND | Mochungong et al., 2014 |
| Meubles | Garnitures en mousse de polyuréthane – habitation | 9 | Non déterminé (utilisation d’un rapport signal/bruit de 3 à la place) | ND | Mochungong et al., 2014 |
| Meubles | Garnitures en tissu – véhicules | 12 | Non déterminé (utilisation d’un rapport signal/bruit de 3 à la place) | ND | Mochungong et al., 2014 |
| Meubles | Garnitures en tissu – habitation | 2 | Non déterminé (utilisation d’un rapport signal/bruit de 3 à la place) | ND | Mochungong et al., 2014 |
| Autres objets | Articles en caoutchouc/plastique | 5 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Autres objets | Textile violet | 1 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Autres objets | Mousse blanche | 1 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Autres objets | Composition inconnue (image) | 1 | 0,3 % de poids dans l’échantillon | ND | Santé Canada, 2014a, b |
| Jouets | Jouet en plastique dur | 30 (fréquence de détection de 80 %) | « ...variait de 0,00005 à 0,050 µg/g. » | ND à 117 µg/g; concentration moyenne = 9,17; concentration médiane = 5,54 | Chen et al., 2009 |
| Jouets | Jouet en mousse | 18 (fréquence de détection de 89 %) | « ...variait de 0,00005 à 0,050 µg/g. » | ND à 5,69 µg/g; concentration moyenne = 1,32; concentration médiane = 0,72 | Chen et al., 2009 |
| Jouets | Jouet en caoutchouc/plastique souple | 15 (fréquence de détection de 40 %) | « ...variait de 0,00005 à 0,050 µg/g. » | ND à 7,55 µg/g; concentration moyenne = 1,14; concentration médiane = ND | Chen et al., 2009 |
| Jouets | Jouet rembourré | 6 (fréquence de 0 % ou 50 % - voir la REMARQUE) | « ...variait de 0,00005 à 0,050 µg/g. » | ND (ou ND à 0,26 µg/g); voir la REMARQUE. | Chen et al., 2009 (REMARQUE : Les tableaux supplémentaires pour Chen et al. (2009) fournissaient des renseignements conflictuels. Le tableau S2 montre une plage de concentrations allant de concentrations non détectées à 0,26 µg/g, tandis que le tableau S5 montre des concentrations non détectées pour les six échantillons). |
| Télévisions | Caisson de téléviseur | 20 | « …variait de 0,5 à 25 ng/g » (0,0005 à 0,0025 µg/g) | ND à 268,23 µg/g; concentration moyenne = 30,15 µg/g; (fréquence de détection de 33,3 %) | Chen et al., 2010b |
| Ordinateurs | Boîtier d’écran d’ordinateur | 4 | « …variait de 0,5 à 25 ng/g » (0,0005 à 0,0025 µg/g) | ND | Chen et al., 2010b |
| Ordinateurs | Composant d’ordinateur [cartes à circuit imprimé d’ordinateur (n = 4) et accessoires d’ordinateur (clavier et souris, n = 4)] | 8 | « …variait de 0,5 à 25 ng/g » (0,0005 à 0,0025 µg/g) | ND à 66,02 µg/g; concentration moyenne = 15,06 µg/g; (fréquence de détection de 50 %) | Chen et al., 2010b |
| Ordinateurs | Boîtier de moniteur d’ordinateur | 13 | Non déterminée (utilisation d’un rapport signal/bruit de 3 à la place) | ND à 0,1 mg/g | Mochungong et al., 2014 |
| Ordinateurs | Boîtier d’accessoires d’ordinateur | 11 | Non déterminée (utilisation d’un rapport signal/bruit de 3 à la place) | ND | Mochungong et al., 2014 |
| Voitures | Intérieur de voiture (intérieurs en plastique et revêtement en mousse de polyuréthane et en textile) | 5 | « …variait de 0,5 à 25 ng/g » (0,0005 à 0,0025 µg/g) | ND à 1,41 µg/g; concentration moyenne = 0,28 µg/g; (fréquence de détection de 20 %) | Chen et al., 2010b |
| Meubles | Divan, matelas, coussin, et sous-tapis | 7 | « …variait de 0,5 à 25 ng/g » (0,0005 à 0,0025 µg/g) | ND | Chen et al., 2010 b |
| Téléviseur à écran ACL | Couverture en plastique arrière | 2 | NI | s.o., 130 µg/g | Kajiwara et al., 2011 |
| Téléviseur à écran ACL | Couverture en plastique avant | 2 | NI | ADD, 92 µg/g | Kajiwara et al., 2011 |
| Téléviseur à écran ACL | Panneau d’alimentation | 1 | NI | 1,1 µg/g | Kajiwara et al., 2011 |
| Téléviseur à écran ACL | Carte à circuit imprimé pour tube fluorescent (et bloc d’alimentation) | 2 | NI | 0,77, 2,4 µ/g | Kajiwara et al., 2011 |
| Téléviseur à écran ACL | Autres cartes à circuit imprimé | 2 | NI | 0,036, 0,38 µg/g | Kajiwara et al., 2011 |
| Téléviseur à écran ACL | Écran LCD | 2 | NI | s.o. | Kajiwara et al., 2011 |
| Ordinateur portatif | Châssis | 1 | NI | 0,67 µg/g | Kajiwara et al., 2011 |
| Ordinateur portatif | Partie supérieure de clavier | 1 | NI | ADD | Kajiwara et al., 2011 |
| Ordinateur portatif | Cartes à circuit imprimé | 1 | NI | 0,037 µg/g | Kajiwara et al., 2011 |
| Ordinateur portatif | Ventilateur de refroidissement et haut-parleur | 1 | NI | 19 µg/g | Kajiwara et al., 2011 |
| Ordinateur portatif | Adaptateur secteur | 1 | NI | ADD | Kajiwara et al., 2011 |
| Ordinateur portatif | Écran LCD | 1 | NI | ADD | Kajiwara et al., 2011 |
| Textile | Rideau | 2 | NI | ADD | Kajiwara et al., 2011 |
| Prise électrique | Prise électrique | 2 | NI | 0,32, 6,1 µg/g | Kajiwara et al., 2011 |
| Panneau isolant | Panneau isolant en polystyrène extrudé | 2 | NI | ADD | Kajiwara et al., 2011 |
| Papier peint | Papier peint en chlorure de polyvinyle | 4 | NI | ADD | Kajiwara et al., 2011 |
| Caisson de téléviseur | Caisson de téléviseur (plastique en polystyrène choc) | 3 (apparemment, chacun préparé à partir de 50 caissons de téléviseurs usagés) | 50 ng/g | Moyenne = 140 ± 5,7 µg/g | Kajiwara et al., 2008 |
| Caisson de téléviseur | Boîtier de moniteur de téléviseur | 15 | Non déterminée (utilisation d’un rapport signal/bruit de 3 à la place) | ND à 0,5 mg/g; concentration moyenne = 0,0 ± 0,1 mg/g | Mochungong et al., 2014 |
| Caissons audio et vidéo en polymères | « audio et vidéo » | 8 | Non déterminée (utilisation d’un rapport signal/bruit de 3 à la place) | ND à 0,5 mg/g; concentration moyenne = 0,0 ± 0,1 mg/g | Mochungong et al., 2014 |
Annexe F. Estimations de l’exposition causée par les produits offerts aux consommateurs
Absorption = (S × M × DE) / PC
| Symbole | Description | Valeur |
|---|---|---|
| Sa | Surface exposée au mâchonnement direct | 10 cm2 |
| Mb | Taux de migration | 0,00769 µg/cm2 par minute |
| DEc | Durée de l’exposition | 39 min/j |
| PCd | Poids corporel | 15,5 kg (tout-petit) |
| Absorption | Absorption | = 1,93 × 10−4 mg/kg p.c./jour |
a La surface exposée présumée pour le mâchonnement d’une poupée en plastique par un enfant de 7,5 mois (Bremmer et van Veen, 2002).
b Le taux de migration a été mesuré in vivo à l’aide de cinq volontaires qui ont mâchonné de petits morceaux d’un jouet en caoutchouc et en plastique pendant 15 ou 30 minutes, puis on a prélevé des échantillons de salive de chaque volontaire toutes les 5 minutes aux fins de traitement et d’analyse du produit ignifuge (Chen et al., 2009).
c Limite supérieure de la moyenne pour des enfants âgés de 6 mois à 4 ans ayant mâchonné des jouets (Norris et Smith, 2002, citée dans USEPA, 2011).
d Santé Canada (1998).
Annexe G. Concentrations de DBDPE dans les tissus humains
| Type de tissu et lieu | Période d’échantillonnage | Nombre d’échantillons | Limite de détection (ng/g) | Concentration moyenne (ng/g) | Référence |
|---|---|---|---|---|---|
| Lait maternel Sherbrooke (Québec) | 2008-2009 | 105 femmes adultes allaitantes | 1,7 ng/g poids lipidique [pl]; FD de 8,6 % | Médiane : ND 95e centile : 3,3 [ND à 25] | Zhou et al., 2014. |
| Lait maternel Nouvelle-Zélande, 2 zones urbaines et 2 zones rurales | 2007-2010 | 36 nouvelles mères (âge moyen : 26,9) | 227 pg/g | 113,5 pg/g : la moitié de la limite de détection [ND à 325,50] | Mannetje et al., 2013 |
| Sérum Sherbrooke (Québec) | 2008-2009 | 102 femmes adultes allaitantes | 3,5 ng/g pl; FD de 5,9 % | Médiane : ND 95e centile : 3,40 [ND à 123] | Zhou et al., 2014. |
| Sérum Tianjin (Chine) | 2006 | 128 (30 agents de nettoyage de bureaux, 69 étudiants universitaires, 29 agents de police) | 15 | ND | Zhu et al., 2009 |
| Sérum Californie (États-Unis) | 1996-1998; 2008-2009 | 1996-1998 : 50 échantillons de femmes d’origine laotienne ayant immigré à San Francisco. 2008-2009 : 30 échantillons de femmes adultes et 25 échantillons de femmes enceintes en Californie. | NP | ND ou à des concentrations inférieures à la quantification | Petreas et al., 2012 |
| Plasma Plusieurs villes (Suède) | NP | 5 | 1,03 ng/g poids lipidique | ND | Karlsson et al., 2007 |
| Cheveux Guangzhou (Chine) | NP | 29 | LQ : 2,01 | Médiane : 17,8 [6,05 à 88,7] | Zheng et al., 2011 |
| Cheveux Yuantan (Chine) | NP | 32 | LQ : 2,01 | Médiane : 9,57 [2,32 à 128] | Zheng et al., 2011 |
Abréviation ⸺ FD : fréquence de détection, ND : non détecté, NP : non précisé, LQ : limite de quantification
Annexe H. Résumé des renseignements sur les effets sur la santé du décabromodiphényléthane (DBDPE) (NR CAS 84852-53-9)
| Paramètre | Doses ou concentrations minimales avec effeta/résultats |
|---|---|
| Toxicité aiguë | DL50 minimale par voie orale (rats)> 5000 mg/kg (Mallory, 1988a, citée dans le rapport de l’Environment Agency de 2007). DL50 minimale par voie cutanée (lapins, 24 heures)> 2000 mg/kg (Mallory, 1988b, citée dans le rapport de l’Environment Agency de 2007). CMENO (par inhalation chez des rats) = 50 mg/L (il n’y avait pas de renseignements plus détaillés disponibles) [Li et al., 2004, citée dans le rapport de la Norwegian Pollution Control Authority (SFT) 2008] |
| Dose toxique à court terme pour l’exposition répétée | DSENO (par voie orale chez des rats) = 1250 mg/kg p.c. par jour , d’après l’absence d’effets sur la mortalité, les signes cliniques, le poids corporel, la consommation de nourriture, le gain de poids corporel, les valeurs chimiques sériques et hématologiques, l’analyse urinaire, les examens oculaires, les résultats de l’autopsie macroscopique, et la légère microscopie des tissus choisis (glandes surrénales, cœur, foie, ganglion mésentérique, parathyroïde, rate, et thyroïde).). Le DBDPE a été administré à des rats Sprague-Dawley (6 animaux/sexe/groupe) à des doses de 0, 125, 400 ou 1250 mg/kg p.c./jour par gavage dans de l’huile de maïs pendant 28 jours consécutifs. On a observé une hausse légère et réversible dans le poids relatif du foie chez des rats femelles ayant reçu une forte dose, sans histopathologie. En outre, une période de récupération de 14 jours après l’administration de 1250 mg/kg p.c./jour pendant 28 jours n’a montré aucune preuve d’effets retardés ou progressifs (Margitich, 1991, citée dans le rapport de l’Environment Agency de 2007). Aucune étude d’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Toxicité subchronique | DSENO (par voie orale chez des rats) = 1000 mg/kg p.c. par jour. Le DBDPE a été administré à des rats Sprague-Dawley mâles et femelles (10 animaux/sexe/groupe) à des doses de 0, 100, 320 ou 1000 mg/kg p.c./jour par gavage dans de l’huile de maïs pendant 90 jours consécutifs. De plus, 10 autres animaux/sexe/groupe ont été ajoutés au groupe témoin et groupe à forte dose. Après 90 jours, tous les animaux furent sacrifiés, hormis 10 animaux/sexe/groupe, choisis au hasard des groupes témoins et groupes de récupération exposés à une forte dose. L’étude s’est poursuivie sur ces animaux sans traitement pendant 28 jours supplémentaires afin de déterminer la réversibilité, la persistance et l’apparition retardée d’effets toxiques. L’exposition au DBDPE n’a pas produit de signes cliniques de toxicité systémique liée au composé, de lésions oculaires, d’altérations dans l’analyse urinaire, de chimie clinique, ou de valeurs hématologiques dans les groupes traité et de récupération (au bout de 30 jours et de 90 jours). Par ailleurs, aucune différence importante sur les plans biologique ou toxicologique n’a été observée dans les poids corporels, les gains de poids corporel et la consommation de nourriture. Il y avait des différences statistiquement significatives dans les poids moyens relatif et absolu du foie à 1000 mg/kg p.c./jour. On a également observé des changements hépatiques inférieurs, comprenant une vacuolisation hépatocellulaire minime à légère (mâles ayant reçu une dose élevée) et une hypertrophie des hépatocytes centrolobulaires minime à légère (mâles ayant reçu une dose élevée et éventuellement une dose moyenne). Mais ces effets n’ont pas été notés après une période de récupération de 28 jours, ce qui indiquait une réponse adaptative ou réversible. Ainsi, les auteurs ont proposé une DSENO de 1000 mg/kg p.c. par jour. Aucun changement lié au traitement n’a été constaté dans le foie de rats femelles. Aucun changement histomorphologique lié au traitement n’a été relevé dans l’ensemble des autres tissus (40 organes au total) examinés pour les deux sexes, sauf pour les preuves d’articles d’essai aspirés chez des rats individuels (Margitich, 1992, citée dans le rapport d’Environment Agency, 2007; Hardy et al., 2002). Autres études : DMEO (par voie orale chez des rats) = 100 mg/kg p.c. par jour d’après des altérations importantes dans les niveaux de créatinine sérique (Cr) et de la concentration totale d’acides biliaires (TBA) ainsi que dans le sérum glutamo-oxalacétique transaminase (AST) et la phosphatase alcaline (ALP) à cette dose. Des rats Sprague-Dawley mâles (12 par groupe) ont reçu du DBDPE par voie orale dans de l’huile de maïs pendant 90 jours. Les concentrations d’hormones thyroïdales (T3) ont considérablement augmenté chez les rats exposés, mais les niveaux de T4 n’ont pas montré d’altérations importantes. Des paramètres biochimiques, y compris les concentrations d’hormones thyroïdales, 13 paramètres de chimie clinique, et les niveaux d’expression d’ARNm de certaines enzymes ont également été surveillés pour six animaux par groupe. En plus des effets biochimiques susmentionnés, l’ARNm du CYP3A2 hépatique a été considérablement régulé à la hausse à cette dose, contrairement à l’ARNm des CYP1A1, CYP2B1, CYP2B2, qui n’ont pas été touchés. Toutefois, on n’a relevé aucun changement important dans les poids (relatif et absolu) du corps, du foie ou des reins (Wang et al., 2010). Les résultats de cette étude ont été remis en question par d’autres scientifiques dans la documentation publique (Banasik et al., 2011). Aucune étude d’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude empirique n’était disponible. Modèles prévisionnels de relations quantitatives structure-activité (RQSA) : En l’absence de données chroniques sur le DBDPE, les renseignements sur son pouvoir cancérogène ont été obtenus au moyen de modèles RQSA. Pour la majorité des modèles comme CASE Ultra Tox, CAESAR et ACD Percepta, les prévisions obtenues sur le DBDPE n’étaient pas concluantes. L’un des modèles sur la cancérogénicité chez les rongeurs, Leadscope Model Applier, qui est fondé sur un algorithme statistique, notamment l’absence d’activité prévue. Aucune alerte structurale n’a été signalée par le modèle RQSA Toxtree pour la cancérogénicité génotoxique et non génotoxique potentielles. En revanche, le modèle DEREK Nexus, un système expert, a prévu une cancérogénicité positive sur la base d’une voie non génotoxique. Afin de confirmer que tous les métabolites peuvent exercer une activité cancérogène, ils ont été soumis à un simulateur de métabolisme hépatique de rats in vitro à l’aide de la boîte à outils. Aucun des métabolites n’a été signalé en termes de présence d’alertes structurales pour la cancérogénicité non génotoxique potentielle. La majorité des modèles RQSA sur la cancérogénicité chez les rongeurs, sauf le modèle DEREK Nexus, ont prévu l’absence d’un pouvoir cancérogène pour les métabolites. La prévision par le modèle DEREK Nexus était encore une fois basée sur la voie non génotoxique généralement notée chez les composés aromatiques halogénés. Des métabolites qui ont été signalés relativement à la présence d’une alerte structurale pour la génotoxicité positive ont été exclus par des modèles RQSA pour les tests de mutagénicité d’Ames (Leadscope Model Applier, ACD Percepta, Toxtree, modèle hybride TIMES) ainsi que pour la génotoxicité in vivo (DEREK Nexus), y compris les micronoyaux in vivo de rongeurs (Leadscope Model Applier et TIMES). L’algorithme du modèle TIMES lié aux micronoyaux in vivointègre le simulateur de métabolisme in vivo du rat. On n’a pas constaté de métabolisme par le DBDPE de préparations microsomales hépatiques in vitro de rats, et d’autres mammifères plus gros comme le béluga et l’ours blanc (McKinney et al., 2011). Compte tenu du fait que le DBDPE a une masse et une taille moléculaires importantes en plus de son hydrosolubilité limitée dans l’eau et les solvants organiques, il est susceptible d’entraîner une absorption et une exposition systémique limitées. |
| Toxicité pour la reproduction | Aucune étude n’a été recensée. |
| Toxicité pour le développement | DSENO (par voie orale chez des rats) = 1250 mg/kg par jour d’après l’absence d’effets chez des mères et des fœtus à cette dose. Des rats femelles Crl:CD®BR VAF/Plus® ont été accouplées avec des rats mâles Sprague-Dawley Crl:CD®BR VAF/Plus®. Le DBDPE a été administré par gavage dans de l’huile de maïs à des doses de 0, 125, 400, ou 1250 mg/kg p.c./jour à des femelles (25 par groupe) du 6e au 15e jour de gestation. Des animaux ont été observés chaque jour afin de détecter chez eux des signes de toxicité. Le poids corporel et la consommation alimentaire ont également été mesurés. Tous les rats femelles ont été sacrifiées au 20e jour de gestation et ont subi une césarienne. On a pesé les fœtus, déterminé leur sexe et les a examinés minutieusement afin de détecter toute anomalie externe, viscérale et squelettique. On n’a observé aucune mortalité liée au traitement, absorption ou signe clinique de toxicité au cours de l’étude. Les poids corporels, le gain de poids corporel ou la consommation d’aliments n’ont pas été touchés par le traitement. On n’a observé aucune anomalie interne (utérus) au cours de l’autopsie. Les paramètres de césarienne étaient comparables entre le groupe traité et le groupe témoin. Aucune malformation ou variation dans le développement ne s’est produite (toutefois, une hausse statistiquement significative dans le nombre de litières avec des os hyoïdes non ossifiés et une ossification réduite du crâne ont été observées dans le groupe traité avec 400 mg/kg, mais pas à la dose plus élevée) (Mercieca, 1992a, citée dans le rapport de l’Environment Agency de 2007; Hardy et al., 2010). DSENO (par voie orale chez des lapins) = 1250 mg/kg par jour d’après l’absence d’effets chez des mères et des fœtus à cette dose. Des lapins blancs femelles néo-zélandais ont subi une insémination artificielle à l’âge de cinq mois et demi. Le DBDPE a été administré par gavage dans de l’huile de maïs à des doses de 0, 125, 400, ou 1250 mg/kg p.c. par jour à des femelles (25 par groupe) du 6e au 18e jour de gestation. Des animaux ont été observés chaque jour afin de détecter chez eux des signes de toxicité. Le poids corporel et la consommation alimentaire ont également été mesurés. Tous les rats femelles ont été sacrifiées au 29e jour de gestation et ont subi une césarienne. On a pesé les fœtus, déterminé leur sexe et les a examinés minutieusement afin de détecter toute anomalie externe, viscérale et squelettique. On n’a observé aucune mortalité liée au traitement, absorption ou signe clinique de toxicité au cours de l’étude. Les poids corporels, le gain de poids corporel ou la consommation d’aliments n’ont pas été touchés par le traitement. On n’a observé aucune anomalie interne (utérus) importante au cours de l’autopsie. Les paramètres de césarienne étaient comparables entre le groupe traité et le groupe témoin. Aucune malformation ou variation dans le développement ne s’est produite (toutefois, il y a eu une hausse statistiquement significative dans le nombre de litières avec la 27e vertèbre présacrée dans le groupe à forte dose, mais cette hausse s’inscrivait bien dans la plage historique) (Mercieca, 1992b, citée dans le rapport de l’Environment Agency de 2007; Hardy et al., 2010). Aucune étude d’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Paramètre de génotoxicité in vivo | Aucune étude n’a été recensée. |
| Génotoxicité et paramètres connexes in vitro | Essai de mutagénicité Résultats négatifs : Dans des souches de Salmonella typhimurium (souches TA 98, TA 100, TA 1535, TA 1537, et TA 1538) et d’Escherichia coli (souche WP2 uvrA), lorsque testées avec ou sans activation métabolique à des concentrations allant de 0 à 5000 μg/plate dans le DMSO (Stankowski, 1988; San et Wagner, 1991 – toutes citées dans le rapport de l’Environment Agency de 2007). Aberrations chromosomiques Résultats négatifs : Dans des cellules pulmonaires de hamster de Chine à des concentrations allant de 0 à 625 μg/mL pendant 6 heures avec ou sans activation métabolique (Putman et Morris1992, citée dans le rapport de l’Environment Agency de 2007). Résultats négatifs : Dans un essai indépendant à doses répétées mené avec du DBDPE suspendu dans de la carboxyméthylcellulose à des concentrations de 625, 1250, 2500 et 5000 μg/mL avec ou sans activation métabolique. Les durées d’exposition étaient les mêmes que celles utilisées dans le premier essai (Putman et Morris, 1992, citée dans le rapport de l’Environment Agency de 2007). |
| Perturbation endocrinienne | DMEO = 100 mg/kg p.c. par jour, d’après une hausse importante des taux sériques de l’hormone thyroïdienne triiodothyronine (T3) à cette dose. Des rats Sprague-Dawley mâles (6 par traitement) ont reçu par voie orale 100 mg/kg par jour de DBDPE dans de l’huile de maïs pendant 90 jours. Les concentrations d’hormones thyroïdales ont été surveillées par dosage radio-immunologique d’échantillons de sang prélevés au même moment de la journée. On n’a pas relevé d’altérations importantes des niveaux de thyroxine (T4). Aucune mesure pondérale ou étude histopathologique de la thyroïde n’a été indiquée dans l’étude (Wang et al., 2010). En outre, les résultats de cette étude ont été remis en question par d’autres scientifiques dans la documentation publique (Banasik et al., 2011). Modèle RQSA : Un modèle RQSA mis au point par Papa et al. (2010) a prévu que le DBDPE ait une affinité de liaison élevée avec le récepteur d’hydrocarbure d’aryle (AhR). L’application de la prévision du modèle a montré que l’activité de liaison avec le récepteur AhR des PBDE est au moins 50 à 100 fois inférieure à celle de la substance toxique de référence, à savoir le 2,3,7,8-tétrachlorooxanthrène (TCDD). Le modèle a également prévu que le DBDPE ait une activité modérée en tant que composé antagoniste du récepteur de la progestérone. Parmi les paramètres pour lesquels le modèle a prévu que le DBDPE entraîne une faible activité, on comptait l’enzyme 7-éthoxyrésorufine-O-déséthylase (EROD), l’agoniste du récepteur de mort, l’agoniste du récepteur des œstrogènes, la thyroxine (T4), et les transférases de soufre E2 (Papa et al., 2010). Il est à noter que, dans certains cas, les prévisions liées au DBDPE s’inscrivaient hors du domaine de prévision du modèle et pouvaient être moins fiables. |
| Irritation | Aucune irritation cutanée : Des lapins blancs néo-zélandais (3 mâles, 3 femelles) ont reçu une dose de 500 mg de DBDPE avec une solution saline sous occlusion pendant 4 heures. Après l’exposition, le site d’application a été rincé avec de l’eau et observé afin d’y détecter des signes d’irritation (érythèmes et œdèmes) avec des cotes relevées à 1, 24, 48, et 72 heures après le traitement. Aucun signe d’irritation cutanée n’a été observé; la cote moyenne entre 24 et 72 heures pour les érythèmes et les œdèmes était de 0 (Mallory, 1988, citée dans le rapport de l’Environment Agency de 2007). Légère irritation des yeux : Le DBDPE (100 mg) a été instillé dans le sac conjonctival de l’œil de chacun des six lapins néozélandais albinos (3 mâles, 3 femelles) et les yeux ont été examinés 1, 24, 48 et 72 heures après l’application. Aucune irritation de l’iris ou de la cornée n’a été notée à aucun moment. Une rougeur conjonctivale (cote de 1) a été observée chez tous les animaux au bout d’une heure. Cette rougeur a persisté jusqu’à 48 heures chez un seul mâle. Aucun effet n’a été observé chez les animaux au bout de 72 heures. La cote moyenne maximale au bout d’une heure était de 3,0 (Mallory, 1988, citée dans le rapport de l’Environment Agency de 2007). |
| Sensibilisation | Non concluant : Dans un test de maximalisation sur le cochon d’Inde, 40 cochons d’Inde (10 par sexe/groupe) ont reçu par injection intradermique 5 % de DBDPE dans l’excipient uniquement (0,5 % de méthylcellulose) en tant que témoin négatif, ou 5 % d’hexylcinnamaldehyde en tant que témoin positif. Après une semaine, des animaux ont reçu des timbres de l’excipient en tant que témoin positif (100 % de HCA) ou du DBDPE (100 %) par application topique sur des sites d’essai rasés dans des enveloppements occlusifs pendant 48 heures. Après 14 jours, les animaux ont reçu 1 % de DBDPE ou d’excipient ou 50 % de HCA pendant 24 heures et ils ont été observés à 24 et 48 heures. Une réponse positive (léger érythème) a été observée à 24 heures chez 90 % des animaux dans tous les groupes. Après 48 heures, seuls 2 sur 10 animaux témoins et 4 sur 20 animaux traités ont montré une réponse positive. Il est prévu que le DBDPE présente un faible risque de causer une sensibilisation de la peau, car il n’est généralement pas réactif (Newton, 2003; citée dans le rapport de l’Environment Agency de 2007). |
a DL50 : dose létale médiane, DMENO : dose minimale avec effet nocif observé; DSENO : dose sans effet nocif observé.
| Paramètre | Doses ou concentrations minimales avec effeta/résultats |
|---|---|
| In vitro | Des cellules HepG2 (hépatocytes humains) ont été cultivées en présence de DBDPE (3,125 à 100,0 mg/L) pendant 24, 48 et 72 heures, respectivement, et l’effet toxique du DBDPE a été étudié. Le DBDPE a inhibé la viabilité des cellules HepG2 en fonction du temps et de la dose, dans une plage allant de 12,5 mg/L à 100 mg/L et pendant 48 et 72 heures. Une induction de l’apoptose a été détectée à une concentration de 12,5 à 100 mg/L au bout de 48 et 72 heures, au moyen du marquage par l’iodure de propidium, accompagnée d’une surproduction d’espèces réactives de l’oxygène (Sun et al., 2012). Les auteurs ont indiqué que le mécanisme de cytotoxicité du DBDPE n’est pas clair et qu’il exige donc une étude approfondie. |
| Sensibilisation cutanée | Aucune preuve de propriétés de sensibilisation de la peau n’a été observée chez 200 professionnels de l’entreprise Wei-Dong Chemical, après une application répétée de DBDPE dans du pétrolatum pendant trois semaines (Li et al., 2004; citée dans le rapport de la Norwegian Pollution Control Authority (SFT) de 2008). |
a DL50 : dose létale médiane, DMENO : dose minimale avec effet nocif observé; DSENO : dose sans effet nocif observé.
