Évaluation préalable
Groupe de substances azoïques
aromatiques et à base de benzidine
Certains pigments monoazoïques
Environnement et Changement climatique Canada
Santé Canada
Mai 2016
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité des substances
- 2.1 Pigments jaunes monoazoïques (3 substances : PY1, PY3, PY73)
- 2.2 Pigments de β-naphtol (6 substances : PR3, PR4, PR6, PO2, PO5, NONPA)
- 2.3 Pigments de β-naphtol laqués (3 substances : PR49:1, PR50:1, PR53:1)
- 2.4 Pigments de BONA laqués (4 substances : PR48:2, PR48:5, PR52:1, PR63:1)
- 2.5 Pigments de naphtol AS (ou « pigments rouges de naphtol ») (11 substances : PR5, PR112, PR170, PR187, PR266, PR268, PO38, NAPNPA, NANPAP, NAPMPA, NAPPA), pigments laqués (PR247:1)
- 2.6 Pigments de naphtol AS laqués (PR247:1)
- 2.7 Pigments de benzimidazolone (PO36)
- 2.8 Pigments de pyrazoloquinazolone (PR251)
- 2.9 Sélection des analogues et utilisation de modèles de relations quantitatives structure-activité [R(Q)SA]
- 3. Propriétés physiques et chimiques
- 4. Sources et utilisations
- 5. Devenir et comportement dans l’environnement
- 6. Potentiel d'effets nocifs sur l'environnement
- 7. Potentiel d'effets nocifs sur la santé humaine
- 8. Conclusion
- Références
- Annexes
Liste des tableaux
- Tableau 2-1 : Identité des 33 pigments monoazoïques
- Tableau 2-2 : Analogues structuraux pour les sous-ensembles utilisés dans une lecture croisée des propriétés physicochimiques et des paramètres dans l'évaluation des effets sur l'environnement et la santé humaine
- Tableau 3-1 : Résumé des données expérimentales sur les propriétés physicochimiques (à température ambiante) des pigments monoazoïques et de leurs analogues
- Tableau 4-1 : 21 pigments monoazoïques ont été déterminés comme étant importés ou fabriqués au Canada en une quantité supérieure au seuil de déclaration de 100 kg/an dans une enquête réalisée en vertu de l’article 71 depuis 2005
- Tableau 4-2 : Résumé des renseignements sur les utilisations pour les pigments monoazoïques utilisés dans les emballages alimentaires au Canada
- Tableau 4-3 : Liste des produits antiparasitaires contenant des pigments monoazoïques comme produits de formulation
- Tableau 5-1 : Résumé des données de biodégradation sur les pigments monoazoïques et leurs analogues
- Tableau 5-2 : Diamètres moléculaires calculés pour certains des 33 pigments monoazoïques
- Tableau 5-3 : Données expérimentales sur le facteur de bioconcentration (FBC) pour les pigments monoazoïques et leurs analogues dans des études avec la carpe commune (Cyprinus carpio)
- Tableau 6-1 : Résumé des données empiriques sur la toxicité des pigments monoazoïques et leurs analogues
- Tableau 6-2 : Données empiriques sur la toxicité pour le sol de certains pigments monoazoïques
- Tableau 6-3 : Valeurs critiques de toxicité (VCT) aquatique et concentrations
estimées sans effet (CESE) pour le sous-ensemble des 33 pigments monoazoïques - Tableau 6-4 : Rejets de pigments monoazoïques dans les eaux usées provenant de divers secteurs au Canada
- Tableau 7-1 : Aperçu du potentiel d’exposition et de la disponibilité des données
liées aux effets sur la santé concernant les substances prises en considération dans l’évaluation des sous-ensembles des pigments monoazoïques - Tableau 7-2 : Résumé des estimations de l’exposition par voie orale et par voie cutanée aux pigments de β-naphtol par l’intermédiaire de l’utilisation de la peinture au doigt, de la peinture faciale, d’un masque de beauté et d’un rouge à lèvres
- Tableau 7-3 : Résumé des estimations de l’exposition par voie orale et par voie cutanée aux pigments de β-naphtol laqués par l’intermédiaire de l’utilisation de la peinture au doigt et de la peinture faciale
- Tableau 7-4 : Résumé des estimations de l’exposition par voie orale et par voie cutanée aux pigments de BONA laqués par l’intermédiaire de l’utilisation de la peinture au doigt et de la peinture faciale
- Tableau 7-5 : Résumé des estimations de l’exposition par voie orale et par voie cutanée aux pigments jaunes monoazoïques par l’intermédiaire de l’utilisation de la peinture faciale et la peinture au doigt
- Tableau 7-6 : Résumé des estimations de l’exposition par voie orale et par voie cutanée aux pigments de naphtol AS par l’intermédiaire de l’utilisation de la peinture faciale et la peinture au doigt
- Tableau 7-7 : Pigments de β-naphtol et leurs produits potentiels du clivage de la liaison azoïque
- Tableau 7-8 : Résumé des seuils d’effets critiques pour les pigments de βnaphtol
- Tableau 7-9 : Pigments de β-naphtol laqués et produits potentiels du clivage de la liaison azoïque
- Tableau 7-10 : Résumé des seuils d'effets critiques pour les pigments de β-naphtol laquésa
- Tableau 7-11 : Pigments de BONA laqués et produits potentiels du clivage de la liaison azoïque
- Tableau 7-12 : Résumé des seuils d'effets critiques pour les pigments de BONA laquésab
- Tableau 7-13 : Pigments jaunes monoazoïques, analogues et produits potentiels du clivage de la liaison azoïque
- Tableau 7-14 : Résumé des seuils d’effets critiques disponibles pour le sousensemble des pigments jaunes monoazoïques
- Tableau 7-15 : Résumé des seuils d'effets critiques pour les pigments de naphtol ASa
- Tableau 7-16 : Marges d’exposition pour le pigment de β-naphtol PR4 dans la peinture au doigt, le rouge à lèvres, le masque de beauté et les produits de santé naturels
- Tableau 7-17 : Marges d’exposition pour le pigment de β-naphtol PO5 dans la peinture au doigt (enfant)
- Tableau 7-18 : Marges d’exposition pour les pigments de β-naphtol laqués dans la peinture au doigt, la peinture faciale et le rouge à lèvres ou le baume à lèvres
- Tableau 7-19 : Marges d’exposition pour les pigments de BONA laqués dans la peinture au doigt et la peinture faciale
- Tableau 7-20 : Marges d’exposition pour les pigments jaunes monoazoïques dans la peinture au doigt et la peinture faciale
- Tableau 7-21 : Marges d’exposition pour les pigments de naphtol AS dans la peinture au doigt et la peinture faciale
Sommaire
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable de 33 pigments monoazoïques. Ces substances constituent un sous-groupe du groupe des substances aromatiques azoïques et à base de benzidine évaluées dans le cadre de l'Initiative des groupes de substances du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada d'après leur similarité structurale et leurs applications. Ces substances figurent parmi celles qui ont été jugées prioritaires pour une évaluation, car elles répondaient aux critères de catégorisation en vertu du paragraphe 73(1) de la LCPE (1999) ou étaient considérées comme prioritaires en raison d'autres préoccupations relatives à la santé humaine.
Le numéro de registre du Chemical Abstracts Service (n° CAS)Note de bas de page[1], le nom figurant dans la Liste intérieure des substances (LIS), le nom figurant dans le Colour Index (C.I) ou l’acronyme sont présentés pour les 33 substances dans le tableau suivant.
| N° CAS | Nom dans la LIS | Nom (et numéro) dans le Colour Index | Acronyme de la substance |
|---|---|---|---|
| 1103-38-4 | Bis{2-[(2-hydroxynaphtyl)azo]naphtalènesulfonate} de baryum | Pigment Red 49:1 (C.I. 15630:1) |
PR49:1 |
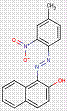
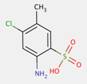
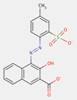
| 2425-85-6Note de bas de page Tableau 0 [a] | 1-(4-Méthyl-2-nitrophénylazo)-2-naphtol | Pigment Red 3 (C.I. 12120) |
PR3 |
| 2512-29-0Note de bas de page Tableau 0 [b] | 2-(4-Méthyl-2-nitrophénylazo)-3-oxo-N-phénylbutyramide | Pigment Yellow 1 (C.I. 11680) |
PY1 |
| 2786-76-7 | 4-{[4-(Aminocarbonyl)phényl]azo}-N-(2-éthoxyphényl)-3-hydroxynaphtalène-2-carboxamide | Pigment Red 170 (C.I. 12475) |
PR170 |
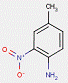
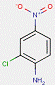
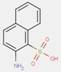
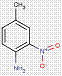
| 2814-77-9[a] | 1-(2-Chloro-4-nitrophénylazo)napht-2-ol | Pigment Red 4 (C.I. 12085) |
PR4 |
| 3468-63-1[a] | 1-(2,4-dinitrophénylazo)napht-2-ol | Pigment Orange 5 (C.I. 12075) |
PO5 |
| 5160-02-1 | Bis{2-chloro-5-[(2-hydroxy-1-naphtyl)azo]toluène-4-sulfonate} de baryum | Pigment Red 53:1 (C.I. 15585:1) |
PR53:1 |
| 6372-81-2 | Bis[2-[(2-hydroxy-1-naphtyl)azo]benzoate] de baryum | Pigment Red 50:1 (C.I. 15500:1) |
PR50:1 |
| 6407-74-5[a] | 4-[(2-Chlorophényl)azo]-2,4-dihydro-5-méthyl-2-phényl-3H-pyrazol-3-one | Pigment Yellow 60 (C.I. 12705) |
PY60 |
| 6410-09-9[a] | 1-[(2-Nitrophényl)azo]-2-naphtol | Pigment Orange 2 (C.I. 12060) |
PO2 |
| 6410-13-5[a] | 1-[(4-Chloro-2-nitrophényl)azo]-2-naphtol | Pigment Red 6 (C.I. 12090) |
PR6 |
| 6410-41-9[a] | N-(5-Chloro-2,4-diméthoxyphényl)-4-[[5-[(diéthylamino)sulfonyl]-2 méthoxyphényl]azo]-3 hydroxynaphtalène-2-carboxamide | Pigment Red 5 (C.I. 12490) |
PR5 |
| 6417-83-0[b] | 3-Hydroxy-4-[(1-sulfonato-2-naphtyl)azo]-2-naphtoate de calcium | Pigment Red 63:1 (C.I. 15880:1) |
PR63:1 |
| 6486-23-3[b] | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2-chlorophényl)-3-oxobutyramide | Pigment Yellow 3 (C.I. 11710) |
PY3 |
| 6535-46-2[b] | 3-Hydroxy-N-(o-tolyl)-4-[(2,4,5-trichlorophényl)azo]naphtalène-2-carboxamide | Pigment Red 112 (C.I. 12370) |
PR112 |
| 7023-61-2[b] | 4-[(5-Chloro-4-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de calcium | Pigment Red 48:2 (C.I. 15865:2) |
PR48:2 |
| 12236-62-3[b] | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2,3-dihydro-2-oxo-1H-benzimidazol-5-yl)-3-oxobutyramide | Pigment Orange 36 (C.I. 11780) |
PO36 |
| 12236-64-5[a] | N-[4-(Acétylamino)phényl]-4-[[5-(aminocarbonyl)-2-chlorophényl]azo]-3-hydroxynaphtalène-2-carboxamide | Pigment Orange 38 (C.I. 12367) |
PO38 |
| 12238-31-2 | Pigment Red 52:2 | Pigment Red 52:2 (C.I. 15860:2) |
PR52:2 |
| 13515-40-7[b] | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2-méthoxyphényl)-3-oxobutyramide | Pigment Yellow 73 (C.I. 11738) |
PY73 |
| 13824-00-5 | N-(p-Anisyl)-3-hydroxy-N-4-[(4-méthylphényl)azo]naphtalène-2-carboxamide | Non disponible | NAPMPA |
| 16403-84-2 | 4-[(5-Carbamoyl-o-tolyl)azo]-3-hydroxynapht-2-anilide | Pigment Red 268 (C.I. 12316) |
PR268 |
| 17852-99-2[b] | 4-[(4-Chloro-5-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de calcium | Pigment Red 52:1 (C.I. 15860:1) |
PR52:1 |
| 17947-32-9 | N-(p-Anisyl)-3-hydroxy-4-(phénylazo)naphtalène-2-carboxamide | Non disponible | NAPPA |
| 36968-27-1 | 4-{[4-(Aminocarbonyl)phényl]azo}-3-hydroxy-N-(2-méthoxyphényl)naphtalène-2-carboxamide | Pigment Red 266 (C.I. 12474) |
PR266 |
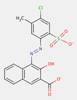
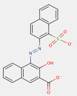
| 43035-18-3[a] | Bis[4-[[3-[[2-hydroxy-3-[[(4-méthoxyphényl)amino]carbonyl]-1-naphtyl]azo]-4-méthylbenzoyl]amino]benzènesulfonate] de calcium | Pigment Red 247:1 (C.I. 15915) |
PR247:1 |
| 49744-28-7 | 1-(4-Méthoxy-2-nitrophénylazo)napht-2-ol | Non disponible | NONPA |
| 59487-23-9[a] | 4-[[5-[[[4-(Aminocarbonyl)phényl]amino]carbonyl]-2-méthoxyphényl]azo]-N-(5-chloro-2,4-diméthoxyphényl)-3-hydroxynaphtalène-2-carboxamide | Pigment Red 187 (C.I. 12486) |
PR187 |
| 71832-83-2 | 4-[(5-Chloro-4-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de magnésium | Pigment Red 48:5 (C.I. 15865:5) |
PR48:5 |
| 74336-60-0[a] | 1-[(5,7-dichloro-1,9-dihydro-2-méthyl-9-oxopyrazolo[5,1-b]quinazolin-3-yl)azo]anthraquinone | Pigment Red 251 (C.I. 12925) |
PR251 |
| 83249-60-9 | 2-[(2-Hydroxy-6-sulfonato-1-naphtyl)azo]naphtalènesulfonate de calcium | Non disponible | NSNAC |
| 85005-63-6 | 4-[(2,4-Dinitrophényl)azo]-3-hydroxy-N-phénylnaphtalène-2-carboxamide | Non disponible | NANPAP |
| 94199-57-2 | N-(2-Éthoxyphényl)-3-hydroxy-4-[(2-nitrophényl)azo]naphtalène-2-carboxamide | Non disponible | NAPNPA |
Des évaluations visant à déterminer si 11 des pigments monoazoïques (PR3, PR4, PR5, PR6, PR187, PR247:1, PR251, PO2, PO5, PO38 et PY60 ) respectaient un ou plusieurs critères énoncés à l’article 64 de la LCPE (1999) ont déjà été menées dans le cadre du Défi du Plan de gestion des produits chimiques (PGPC). On a conclu qu’une substance (le Pigment Red 3) répond aux critères établis à l’alinéa 64c) de la LCPE (1999). Comme il est indiqué dans l’avis d’intention concernant les substances du groupe de substances azoïques aromatiques et à base de benzidineNote de bas de page[2], il a été reconnu que des évaluations et des conclusions relatives à certaines des substances du groupe pouvaient être mises à jour ultérieurement dans le cadre de l’évaluation du sous-groupe actuel. De façon précise, il existe de nouvelles données importantes qui renseignent l’évaluation écologique du sous-groupe des pigments monoazoïques, et les évaluations des onze substances ont été mises à jour en conséquence. De la même façon, de nouvelles données importantes sur la santé humaine pour dix des onze substances, à l’exception du Pigment Red 3, ont été relevées, et les évaluations des risques pour la santé humaine liées à ces dix substances ont donc été mises à jour.
Les 33 pigments monoazoïques ne devraient pas être produits de façon naturelle dans l’environnement. Parmi les 33 pigments monoazoïques, 21 pigments déclarés ont été fabriqués ou importés en quantités supérieures au seuil de déclaration de 100 kg par année au Canada. Certains des 33 pigments monoazoïques ont également été définis comme étant utilisés dans des produits offerts aux consommateurs. Aucune concentration mesurée dans l’environnement au Canada n’a été relevée pour l’une de ces substances.
Environnement
Les pigments monoazoïques se présentent principalement sous forme de particules à l’échelle submicrométrique ou micrométrique faible, et la poudre pigmentaire est habituellement composée de particules primaires (c.-à-d. le réseau cristallin d’un pigment), d’agrégats et d’agglomérats. La solubilité de ces 33 pigments monoazoïques est très faible dans l’eau (de l’ordre de quelques microgrammes ou du submicrogramme par litre) et faible dans l’octanol (moins de 20 mg/L). De ce fait, un logarithme du quotient des concentrations molaires d’un soluté dans l’octanol et dans l’eau représenterait raisonnablement le logarithme du coefficient de partage octanol-eau de ces pigments. Les propriétés physico-chimiques et la nature particulaire de ces substances laissent entendre que le sol et les sédiments devraient être les deux principaux milieux naturels où les pigments monoazoïques peuvent être préoccupants.
Par ailleurs, des données expérimentales indiquent que dans des conditions aérobies, les pigments monoazoïques devraient être persistants dans l’eau, le sol et les sédiments. La biodisponibilité de ces pigments devrait être faible étant donné leur nature particulaire et leur faible taux de solubilité dans l’eau. Ainsi, le potentiel de bioaccumulation dans les organismes pélagiques devrait être faible, ce qui confirme les résultats d’études sur la bioconcentration.
Étant donné la biodisponibilité limitée des pigments monoazoïques, aucun effet n’a été observé à la concentration de 1 000 mg/kg de sol (poids sec) dans les études de toxicité chronique dans le sol. « Aucun effet à la concentration de saturation » n’a été mis en évidence avec ces pigments dans les études d’écotoxicologie aiguë et chronique en milieu aquatique au cours desquelles aucun solvant n’a été utilisé. Les résultats de ces études ont permis de formuler une conclusion proposée selon laquelle les pigments monoazoïques ne devraient pas être nocifs pour les organismes vivant dans l’eau, le sol ou les sédiments à de faibles concentrations (pertinentes sur le plan environnemental).
Afin d’évaluer l’exposition potentielle aux pigments monoazoïques dans l’environnement, les concentrations environnementales (CEE) ont été estimées; le scénario de rejets industriels a été choisi pour évaluer l’exposition potentielle à ces substances. Les concentrations estimées sans effet (CESE) pour l’eau et le sol ont été calculées d’après les données expérimentales sur des valeurs critiques de toxicité. Les quotients de risque calculés (CEE/CESE) étaient inférieurs à 1, ce qui indique que les organismes vivant dans l’eau et le sol ne devraient subir aucun effet nocif.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les 33 pigments monoazoïques évalués dans la présente évaluation présentent un faible risque d’effets nocifs sur les organismes et sur l’intégrité globale de l’environnement. On conclut que ces pigments monoazoïques ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Santé humaine
En ce qui concerne la santé humaine, l’évaluation préalable actuelle vise 32 des 33 substances du sous-groupe des pigments monoazoïques, y compris les substances déjà évaluées et pour lesquelles de nouvelles données importantes sont désormais disponibles. La substance restante, le Pigment Red 3, a été évaluée antérieurement dans le cadre du Défi du PGPC, et des conclusions ont alors été formulées à son sujet. Étant donné que de nouvelles données importantes pour l’évaluation liée à la santé n’ont pas été déterminées pour le Pigment Red 3, la conclusion précédente sur la santé humaine pour cette substance n’a pas été mise à jour. Cependant, on a considéré que le Pigment Red 3 appuyait la technique de lecture croisée pour le sous-ensemble des pigments de bêta-naphtol dans l’évaluation sur la santé.
Pour l’évaluation sur la santé, la plupart des substances ont été évaluées en sous-ensembles présentant une parenté structurelle : les pigments de bêta-naphtol (PO2, PO5, PR4, PR6 et NONPA), les pigments de bêta-naphtol laqués (PR49:1, PR50:1 et PR53:1), les pigments laqués BONA (PR48:2, PR48:5, PR52:1, PR52:2 et PR63:1), les pigments jaunes monoazoïques (PY1, PY3 et PY73), les pigments de naphtol AS (NANPAP, NAPMPA, NAPNPA, NAPPA, PO38, PR5, PR112, PR170, PR187, PR266 et PR268). Les cinq autres substances (NSNAC, PO36, PR247:1, PR251 et PY60) ont été évaluées individuellement.
Un éventail de données disponibles a été relevé pour les divers sous-ensembles. En effet, plusieurs études relatives aux effets sur la santé ont été recensées pour le sous-ensemble des pigments de bêta-naphtol, des pigments de bêta-naphtol laqués et des pigments laqués BONA. De plus, on a trouvé quelques études des effets sur la santé pour le sous-ensemble des pigments jaunes monoazoïques et des pigments de naphtol AS. Aucune étude n’a cependant été recensée pour les autres pigments monoazoïques individuels visés par la présente évaluation.
Les pigments de bêta-naphtol et les pigments de bêta-naphtol laqués ont présenté une toxicité semblable dans les études à doses répétées sur des animaux et axées sur des organes et des systèmes cibles, notamment le système hématopoïétique, le foie et les reins. Les pigments de bêta-naphtol ont mis en évidence un pouvoir mutagène, alors que les pigments de bêta-naphtol laqués présentaient majoritairement des résultats de génotoxicité négatifs. Des signes de cancérogénicité ont été observés pour les sous-ensembles des pigments de bêta-naphtol (tumeurs du foie) et des pigments de bêta-naphtol laqués (tumeurs du foie et de la rate). Dans des études à doses répétées menées sur des animaux, le rein a été identifié comme le principal organe cible des pigments laqués BONA, alors que ces substances ne présentaient généralement pas la même toxicité hémolytique et hépatique observée pour les pigments de bêta-naphtol et les pigments de bêta-naphtol laqués. Les pigments laqués BONA présentaient en général des résultats négatifs dans les essais de génotoxicité et, d’après les résultats des études obtenus pour l’analogue PR57:1, ils ne présentaient pas de potentiel cancérogène. Les données disponibles sur la toxicité à court terme indiquent un faible potentiel de risque pour les sous-ensembles des pigments jaunes monoazoïques et des pigments de naphtol AS. Pour les cinq substances prises en compte comme substances individuelles (NSNAC, PO36, PR247:1, PR251 et PY60), seules des données empiriques limitées ont été recensées. Par conséquent, il est impossible de déterminer de façon concluante leurs effets critiques sur la santé.
L’exposition aux 32 pigments monoazoïques dans les milieux naturels ne devrait pas être une source importante d’exposition pour la population générale du Canada. Par conséquent, le risque pour la santé humaine est considéré comme étant faible dans les milieux naturels.
Dix-neuf pigments monoazoïques (NONPA, PO5, PO36, PO38, PR4, PR5, PR48:2, PR49:1, PR52:1, PR52:2, PR53:1, PR63:1, PR112, PR170, PR187, PR266, PY1, PY3 et PY73) ont été déterminés comme étant utilisés dans certains produits disponible aux consommateurs sur le marché canadien (p. ex., le maquillage, la peinture au doigt, les masques faciaux, les rouges à lèvres et des produits de santé naturels) et l’exposition de la population générale du Canada à ces substances a été caractérisée. Les marges entre les estimations de l’exposition et les concentrations associées à un effet critique provenant d’études sur les animaux étaient généralement considérées comme étant adéquates pour rendre compte des incertitudes dans les bases de données relatives aux effets sur la santé et à l’exposition.
Pour deux pigments monoazoïques (PR247:1 et PR268), des utilisations limitées au Canada ont été recensées. Cependant, l’exposition de la population générale du Canada ne devrait pas provenir de ces utilisations. Par conséquent, le risque pour la santé humaine n’est pas prévue.
En ce qui concerne les onze autres pigments monoazoïques (NANPAP, NAPMPA, NAPNPA, NAPPA, NSNAC, PO2, PR6, PR48:5, PR50:1, PR251 et PY60), aucune utilisation de ces substances dans les produits de consommation sur le marché canadien n’a été relevée. Par conséquent, d’après les renseignements disponibles sur l’exposition au Canada, on ne prévoit pas de risque pour la santé humaine concernant ces 13 pigments monoazoïques.
Certains pigments monoazoïques figurant dans la présente évaluation préalable ont des effets préoccupants en raison du potentiel de cancérogénicité. Bien que l’information disponible n’indique pas de risques pour la santé des canadiens aux niveaux actuels d’exposition, il pourrait y avoir des inquiétudes si l’exposition était pour augmenter.
À la lumière des renseignements fournis dans la présente évaluation préalable, on conclut que les 32 pigments monoazoïques étudiés dans la présente évaluation liée à la santé humaine ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines. En outre, aucune mise à jour n’a été apportée aux conclusions de l’alinéa 64c) concernant le Pigment Red 3 qui a déjà été évalué par le gouvernement du Canada dans le cadre du Défi du PGPC.
Conclusion générale
On conclut que les 32 pigments monoazoïques étudiés dans la présente évaluation ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE (1999).
La conclusion précédemment établie dans le cadre du Défi indiquant que le Pigment Red 3 répond aux critères établis à l’alinéa 64c) de la LCPE (1999) demeure inchangée.
1. Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999), les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe des substances aromatiques azoïques et à base de benzidine comprend 358 substances qui ont été déclarées prioritaires dans le cadre du processus de catégorisation, car elles satisfaisaient aux critères de catégorisation en vertu de l’article 73 de la LCPE (1999) ou étaient considérées comme prioritaires en raison de préoccupations relatives à la santé humaine (Environnement Canada et Santé Canada, 2007). On a déterminé que certaines substances de ce groupe de substances représentent une source de préoccupations pour d’autres administrations en raison du risque de clivage des liaisons azoïques, qui peut mener à la libération d’amines aromatiques connues pour être cancérogènes ou génotoxiques, ou susceptibles de l’être.
Bien que bon nombre de ces substances présentent des caractéristiques structurelles communes et des usages fonctionnels similaires comme teintures ou pigments dans plusieurs secteurs, nous avons tenu compte de la diversité au sein de ce groupe de substances en établissant des sous-groupes. L’établissement de sous-groupes en fonction de leurs similitudes structurelles, de leurs propriétés physiques et chimiques, ainsi que de leurs utilisations et applications fonctionnelles communes permet de tenir compte de la variabilité au sein de ce groupe de substances et de mettre en œuvre des approches propres aux sous-groupes dans le cadre des évaluations préalables. La présente évaluation préalable vise les substances qui appartiennent au sous-groupe des pigments monoazoïques. Nous avons également tenu compte des produits issus du clivage des liaisons azoïques (amines aromatiques), qui constituent un élément clé de l’évaluation des risques pour la santé humaine dans chaque sous-groupe. Certaines amines aromatiques, communément appelées amines aromatiques figurant sur EU22Note de bas de page[3], ainsi que les colorants azoïques connexes font l’objet de restrictions dans d’autres pays (Union européenne, 2006). Des renseignements sur l’approche de création de sous-groupes pour le groupe des substances azoïques aromatiques et à base de benzidine en vertu du Plan de gestion des produits chimiques, ainsi que des renseignements généraux additionnels et le contexte réglementaire, figurent dans un document distinct préparé par le gouvernement du Canada (Environnement Canada, Santé Canada, 2013b).
Les 33 substances présentées dans la présente évaluation préalable (tableau 2-1) constituent un sous-groupe des pigments monoazoïques. Onze substances de ce sous-groupe ont été évaluées antérieurement par le gouvernement du Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Parmi celles-ci, le Pigment Red 3 (numéro de registre du Chemical Abstracts Service [n° CAS] 2425-85-6) a déjà été évalué et déterminé comme répondant à l’alinéa 64c) de la LCPE (1999) (Environnement Canada, Santé Canada, 2009b). Aucun nouveau renseignement important n’a été relevé en ce qui a trait à la caractérisation des risques pour la santé humaine concernant le Pigment Red 3. Par conséquent, la conclusion précédente sur la santé humaine n’a pas été mise à jour pour cette substance dans la présente évaluation préalable. Cependant, le Pigment Red 3 est utilisé pour la déduction des données à partir d’analogues dans l’évaluation en matière de santé humaine des 32 autres pigments monoazoïques. En revanche, le Pigment Red 3 a été évalué dans le cadre de la caractérisation des risques pour l’environnement des 33 pigments monoazoïques dans la présente évaluation préalable. De même, deux des substances présentées dans la présente évaluation préalable (NANPAP [n° CAS 85005-63-6] et NAPNPA [n° CAS 94199-57-2) ont été précédemment incluses en avril 2008 dans le cadre d’une évaluation préalable de 145 substances persistantes, bioaccumulables et intrinsèquement toxiques (PBTi) qui n’ont pas été considérées comme étant dans le commerce. Ces deux substances sont prises en compte dans la présente évaluation préalable de certains pigments monoazoïques, car on a trouvé de nouveaux renseignements importants depuis la dernière évaluation des 145 substances persistantes, bioaccumulables et intrinsèquement toxiques.
Les évaluations préalables sont axées sur les renseignements permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE (1999). Pour ce faire, les renseignements scientifiques sont examinés afin de tirer des conclusions en intégrant la méthode du poids de la preuve et le principe de prudenceNote de bas de page[4].
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que des renseignements supplémentaires soumis par les intervenants. Nous avons relevé des données pertinentes jusqu’en mai 2014. Les données empiriques obtenues d’études clés, ainsi que certains résultats de modélisation ont servi à formuler des conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments de preuve les plus importants pour appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’une étude consignée par des pairs et d’une consultation de ces derniers. M. Harold Freeman, Ph. D. (North Carolina State University, États-Unis) et Mme Gisela Umbuzeiro, Ph. D. (University of Campinas, Brésil) ont fourni des commentaires portant sur les parties techniques concernant l'environnement. M. Harold Freeman, Ph. D. (North Carolina State University, États-Unis), David Josephy (Université Guelph, Canada), Michael Bird, Ph. D. (Université d’Ottawa, Canada) et M. Kannan Krishnan, Ph. D. (Université de Montréal, Canada), ont fourni des commentaires sur les parties techniques concernant la santé humaine. De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont présentées ci-après.
2. Identité des substances
La présente évaluation préalable porte sur 33 substances qui appartiennent au sous-groupe des pigments monoazoïques, qui fait partie du groupe de substances azoïques aromatiques et à base de benzidine. L’identité de chaque substance de cette évaluation préalable est présentée dans le tableau 2-1. Le no CAS, le nom figurant dans la Liste intérieure des substances (LIS), le nom générique dans le Colour Index (C.I.), le numéro de constitution du C.I. ainsi que l’acronyme sont présentés dans le tableau 2-1. Les acronymes des substances sont tirés des noms génériques indiqués dans le C.I. lorsqu’ils s’y trouvent. Autrement, ils sont basés sur les noms dans la LIS. On peut obtenir une liste d’autres noms de produits chimiques (p. ex. les noms commerciaux) du National Chemical Inventories (NCI, 2007).
| N° CAS | Nom dans la LIS | Nom générique dans le C.I. (numéro dans le C.I.) | Acronyme de la substance |
|---|---|---|---|
| 1103-38-4 | Bis{2-[(2-hydroxynaphtyl)azo]naphtalènesulfonate} de baryum | Pigment Red 49:1 (C.I. 15630:1) |
PR49:1 |
| 2425-85-6Note de bas de page Tableau 2-1[a] | 1-(4-Méthyl-2-nitrophénylazo)-2-naphtol | Pigment Red 3 (C.I. 12120) |
PR3 |
| 2512-29-0 | 2-(4-Méthyl-2-nitrophénylazo)-3-oxo-N-phénylbutyramide | Pigment Yellow 1 (C.I. 11680) |
PY1 |
| 2786-76-7 | 4-{[4-(Aminocarbonyl)phényl]azo}-N-(2-éthoxyphényl)-3-hydroxynaphtalène-2-carboxamide | Pigment Red 170 (C.I. 12475) |
PR170 |
| 2814-77-9Note de bas de page Tableau 2-1[b] | 1-(2-Chloro-4-nitrophénylazo)napht-2-ol | Pigment Red 4 (C.I. 12085) |
PR4 |
| 3468-63-1[b] | 1-(2,4-dinitrophénylazo)napht-2-ol | Pigment Orange 5 (C.I. 12075) |
PO5 |
| 5160-02-1 | Bis{2-chloro-5-[(2-hydroxy-1-naphtyl)azo]toluène-4-sulfonate} de baryum | Pigment Red 53:1 (C.I. 15585:1) |
PR53:1 |
| 6372-81-2 | Bis[2-[(2-hydroxy-1-naphtyl)azo]benzoate] de baryum | Pigment Red 50:1 (C.I. 15500:1) |
PR50:1 |
| 6407-74-5[b] | 4-[(2-Chlorophényl)azo]-2,4-dihydro-5-méthyl-2-phényl-3H-pyrazol-3-one | Pigment Yellow 60 (C.I. 12705) |
PY60 |
| 6410-09-9[b] | 1-[(2-Nitrophényl)azo]-2-naphtol | Pigment Orange 2 (C.I. 12060) |
PO2 |
| 6410-13-5[b] | 2-Naphtalénol, 1-[(4-chloro-2-nitrophenyl)azo]- | Pigment Red 6 (C.I. 12090) |
PR6 |
| 6410-41-9[b] | N-(5-Chloro-2,4-diméthoxyphényl)-4-({5-[(diéthylamino)sulfonyl]-2 méthoxyphényl}azo)-3 hydroxynaphtalène-2-carboxamide | Pigment Red 5 (C.I. 12490) |
PR5 |
| 6417-83-0 | 3-Hydroxy-4-[(1-sulfonato-2-naphtyl)azo]-2-naphtoate de calcium | Pigment Red 63:1 (C.I. 15880:1) |
PR63:1 |
| 6486-23-3 | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2-chlorophényl)-3-oxobutyramide | Pigment Yellow 3 (C.I. 11710) |
PY3 |
| 6535-46-2 | 3-Hydroxy-N-(o-tolyl)-4-[(2,4,5-trichlorophényl)azo]naphtalène-2-carboxamide | Pigment Red 112 (C.I. 12370) |
PY112 |
| 7023-61-2 | 4-[(5-Chloro-4-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de calcium | Pigment Red 48:2 (C.I. 15865:2) |
PR48:2 |
| 12236-62-3 | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2,3-dihydro-2-oxo-1H-benzimidazol-5-yl)-3-oxobutyramide | Pigment Orange 36 (C.I. 11780) |
PO36 |
| 12236-64-5[b] | N-[4-(Acétylamino)phényl]-4-{[5-(aminocarbonyl)-2-chlorophényl]azo}-3-hydroxynaphtalène-2-carboxamide | Pigment Orange 38 (C.I. 12367) |
PO38 |
| 12238-31-2 | Pigment Red 52:2 | Pigment Red 52:2 (C.I. 15860:2) |
PR52:2 |
| 13515-40-7 | 2-[(4-Chloro-2-nitrophényl)azo]-N-(2-méthoxyphényl)-3-oxobutyramide | Pigment Yellow 73 (C.I. 11738) |
PY73 |
| 13824-00-5 | N-(p-Anisyl)-3-hydroxy-N-4-[(4-méthylphényl)azo]naphtalène-2-carboxamide | Non disponible | NAPMPA |
| 16403-84-2 | N-[4-(Acétylamino)phényl]-4-[[5-(aminocarbonyl)-2-chlorophényl]azo]-3-hydroxynaphtalène-2-carboxamide | Pigment Red 268 (C.I. 12316) |
PR268 |
| 17852-99-2 | 4-[(4-Chloro-5-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de calcium | Pigment Red 52:1 (C.I. 15860:1) |
PR52:1 |
| 17947-32-9 | N-(p-Anisyl)-3-hydroxy-4-(phénylazo)naphtalène-2-carboxamide | Non disponible | NAPPA |
| 36968-27-1 | 4-{[4-(Aminocarbonyl)phényl]azo}-3-hydroxy-N-(2-méthoxyphényl)naphtalène-2-carboxamide | Pigment Red 266 (C.I. 12474) |
PR266 |
| 43035-18-3[b] | Bis[4-[[3-[[2-hydroxy-3-[[(4-méthoxyphényl)amino]carbonyl]-1-naphtyl]azo]-4-méthylbenzoyl]amino]benzènesulfonate] de calcium (2:1) | Pigment Red 247:1 (C.I. 15915) |
PR247:1 |
| 49744-28-7 | 1-(4-Méthoxy-2-nitrophénylazo)napht-2-ol | Non disponible | NONPA |
| 59487-23-9[b] | 4-[[5-[[[4-(Aminocarbonyl)phényl]amino]carbonyl]-2-méthoxyphényl]azo]-N-(5-chloro-2,4-diméthoxyphényl)-3-hydroxynaphtalène-2-carboxamide | Pigment Red 187 (C.I. 12486) |
PR187 |
| 71832-83-2 | 4-[(5-Chloro-4-méthyl-2-sulfonatophényl)azo]-3-hydroxy-2-naphtoate de magnésium | Pigment Red 48:5 (C.I. 15865:5) |
PR48:5 |
| 74336-60-0[b] | 1-[(5,7-dichloro-1,9-dihydro-2-méthyl-9-oxopyrazolo [5, 1-b]quinazolin-3-yl)azo]anthraquinone | Pigment Red 251 (C.I. 12925) |
PR251 |
| 83249-60-9 | 2-[(2-Hydroxy-6-sulfonato-1-naphtyl)azo]naphtalènesulfonate de calcium | Non disponible | NSNAC |
| 85005-63-6Note de bas de page Tableau 2-1[c] | 4-[(2,4-Dinitrophényl)azo]-3-hydroxy-N-phénylnaphtalène-2-carboxamide | Non disponible | NANPAP |
| 94199-57-2[c] | N-(2-Éthoxyphényl)-3-hydroxy-4-[(2-nitrophényl)azo]naphtalène-2-carboxamide | Non disponible | NAPNPA |
Le sous-groupe des 33 pigments monoazoïques a ensuite été divisé en « sous-ensembles » similaires sur le plan structurel aux fins de données déduites à partir d'analogues (OCDE, 2007). Chaque sous-ensemble de pigments monoazoïque est basé sur des catégories de pigments organiques synthétiques bien définis qui sont caractérisés par des structures connexes, y compris des éléments de couplage communs ainsi que des propriétés physicochimiques et des catégories d'application similaires. Cette approche est basée sur les commentaires des intervenants sur les substances azoïques (Environnement Canada et Santé Canada, 2012) et est en accord avec les principes d'établissement de catégories, tel qu'il est décrit dans les documents d'orientation de l'Organisation de coopération et de développement économiques (OCDE, 2007). Les sous-ensembles de pigments monoazoïques analysés dans la présente évaluation sont décrits ci-dessous.
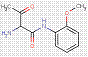
2.1 Pigments jaunes monoazoïques (3 substances : PY1, PY3, PY73)
Ce sous-ensemble est défini par la structure suivante, notamment avec un constituant d'accouplement d'acétoacétanilide commun, où R représente des substituants tels que le groupe méthyle (CH3), le groupe alkoxy (OCH3), le dioxyde d'azote (NO2), le chlore (Cl) et d'autres groupes fonctionnels (Herbst et Hunger, 2004) :

Le PY60 est généralement inclus dans les pigments monoazoïques selon la classification des industries (Herbst et Hunger, 2004). Cependant, il n'est pas considéré comme un analogue structural similaire aux pigments jaunes monoazoïques du sous-ensemble, tel qu'il est représenté par la structure mentionnée ci-dessus. Par conséquent, le PY60 n’est pas inclus dans le sous-ensemble des pigments jaunes monoazoïques analysé dans la présente évaluation préalable et il est traité comme un pigment individuel.
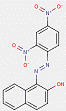
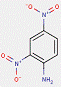
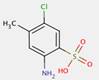
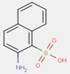
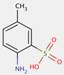
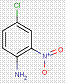
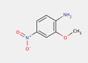
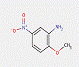
2.2 Pigments de β-naphtol (6 substances : PR3, PR4, PR6, PO2, PO5, NONPA)
Le sous-ensemble des pigments de β-naphtol est défini par la structure chimique générale suivante, notamment avec un constituant d'accouplement β-naphtol commun, où R1 et R2 représentent des substituants tels que le groupe méthyle (CH3), le groupe alkoxy (OCH3), le dioxyde d'azote (NO2), le chlore (Cl) et d'autres groupes fonctionnels (Herbst et Hunger, 2004) :

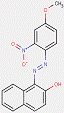
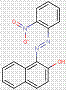
2.3 Pigments de β-naphtol laqués (3 substances : PR49:1, PR50:1, PR53:1)
Les pigments laqués sont fabriqués en précipitant des colorants solubles sur des liants inertes, notamment des sels de calcium, de magnésium, de baryum ou de strontium (p. ex., BaSO4). Les pigments laqués β-naphtol sont caractérisés par la structure générale ci-dessous, y compris le même constituant d'accouplement β-naphtol commun, tel que cela est le cas pour le sous-ensemble de pigments β-naphtol. Cependant, à l'inverse, le sous-ensemble comporte également des groupes ionisables (p. ex., -SO3-, -COO-) sur les cycles opposés au groupe fonctionnel β-naphtol, avec des substitutions supplémentaires, où Areprésente généralement un cycle benzénique ou naphténique, R indique le groupe méthyle (CH3), le groupe éthyle (C2H5) ou le contenu de cations liés aux carboxylates (COOM), n est une valeur numérique allant de 0 à 2, et M est habituellement un métal alcalin terreux (Herbst et Hunger, 2004) :

2.4 Pigments de BONA laquésNote de bas de page[5] (4 substances : PR48:2, PR48:5, PR52:1, PR63:1)
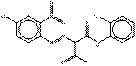
Le sous-ensemble des pigments de BONA laqués est caractérisé par la structure chimique générale suivante, y compris un constituant d'accouplement BONA commun, où RD indique généralement l'hydrogène (H), le chlore (Cl) ou le groupe méthyle (CH3), et M représente habituellement un métal alcalin terreux (Herbst et Hunger, 2004) :

Le PR52:2, qui appartient à la catégorie des pigments de BONA laqués selon la classification des industries, n'a pas été considéré comme un analogue structural similaire aux autres membres de ce sous-ensemble du fait qu'il possède la structure chimique générale montrée ci-dessus. Sur la base du nom chimique et de la structure de cette substance figurant dans le National Chemical Inventories, on définit la substance comme un complexe manganèse (ayant des liens manganèse-azote et manganèse-oxygène) et elle n'est pas considérée comme faisant partie du sous-ensemble dans la majeure partie de la présente évaluation, excepté dans la section sur la caractérisation des effets sur la santé humaine. Comme il existe peu de données relatives aux effets sur la santé de cette substance, les données déduites à partir d'analogues ont été prises en considération pour les effets sur la santé humaine dans le sous-ensemble de pigments de BONA laqué.

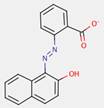
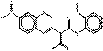
2.5 Pigments de naphtol AS (ou « pigments rouges de naphtol ») (11 substances : PR5, PR112, PR170, PR187, PR266, PR268, PO38, NAPNPA, NANPAP, NAPMPA, NAPPA), pigments laqués (PR247:1)
Le sous-ensemble des pigments de naphtol AS est caractérisé par la structure chimique générale suivante, y compris un constituant d'accouplement commun basé sur les dérivés la même partie de naphtol AS, où RK représente des substituants tels que CH3, OCH3, NO2, Cl et autres et RD représente RK, COOCH3, CONHC6H5, ou SO2N(C2H5)2 et m et n sont des chiffres entre 0 et 3 (Herbst et Hunger, 2004) :

Seule une substance est définie pour chacun des trois sous-ensembles suivants :
2.6 Pigments de naphtol AS laqués (PR247:1)
Il n'y a pas de principe structural commun à ces pigments au-delà du squelette de base du pigment naphtol AS. Cependant, Herbst et Hunger (2004) on indiqué une structure générale qui peut représenter une variété de représentants de pigments dans cette catégorie (où RD2 indique habituellement le groupe méthyle (CH3) et le trioxyde de soufre (SO3-); RD4 indique l'hydrogène (H) ou le groupe méthyle (CH3); RD5 indique l'hydrogène (H), le chlore (Cl) ou le CONHC6H4SO3-; RK2 indique l'hydrogène (H) ou le méthoxybenzène (OCH3), (RK4 indique l'hydrogène (H), le trioxyde de soufre (SO3-) ou le méthoxybenzène (OCH3; et M indique le baryum ou le calcium) :

2.7 Pigments de benzimidazolone (PO36)
Les pigments orange et jaunes de benzimidazolone sont dérivés de la structure générale suivante, où RD indique habituellement le chlore (Cl), le brome (Br), le groupe méthyle (CH3), le dioxyde d'azote (NO2), le méthoxybenzène (OCH3), le groupe carboxyle (COOH), le groupe amide (CONH2) et d'autres groupes fonctionnels (Herbst et Hunger, 2004) :

2.8 Pigments de pyrazoloquinazolone (PR251)
Le PR251 est obtenu en combinant de la (1) à de la pyrazolo-(5,1b)-quinazolone ainsi qu'à la structure générale (2) :
(1)

(2)

Ainsi, la structure générale suivante peut représenter les pigments de pyrazoloquinazolone, où R1 indique généralement le chlore (Cl) et R2, le groupe méthyle (CH3) :

Aucun analogue avec des données expérimentales disponibles n'a été relevé pour ces substances. En outre, une substance (n° CAS 83249-60-9) qui n'est pas un analogue à la structure proche d'une substance dans le groupe des 33 pigments (et qui n'a ni nom ni numéro dans le C.I.) n'a pas été incluse dans le sous-ensemble.
De plus amples renseignements sur les compositions chimiques, les formules moléculaires et les masses moléculaires des 33 pigments monoazoïques sont présentés à l’annexe 1.
2.9 Sélection des analogues et utilisation de modèles de relations quantitatives structure-activité [R(Q)SA]
Des lignes directrices relatives à l’utilisation des méthodes déduites à partir d’analogues ont été élaborées par divers organismes comme l’Organisation de coopération et de développement économiques (OCDE, 2014). Elles ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l’Union européenne (UE). Le rapport d'Environnement Canada et de Santé Canada (2013a) fournit la méthode de sélection des analogues, ainsi que l'utilisation des modèles sur les relations (quantitatives) structure-activité [R(Q)SA]. En ce qui concerne la caractérisation des effets sur la santé humaine, nous documentons le motif de l'utilisation d'analogues ou des données de modélisation R(Q)SA dans la section de l'Évaluation des effets sur la santé du présent rapport.
Les analogues utilisés pour éclairer l'évaluation écologique ont été choisis en fonction de la disponibilité des données empiriques utiles concernant les propriétés physico-chimiques, la persistance, l'accumulation biologique et l'écotoxicité. De telles données ont été utilisées au besoin comme données déduites à partir des analogues pour les pigments monoazoïques en raison du manque de données empiriques, ou comme soutien du poids de la preuve concernant les données empiriques existantes. Bien que les données déduites à partir d'analogues soient utilisées de préférence afin de combler les lacunes en matière de données pour les substances dans cette évaluation, l'applicabilité des modèles R(Q)SA aux pigments monoazoïques est déterminée au cas par cas.
En outre, tous les pigments dans les sous-ensembles donnés (y compris les analogues définis) sont considérés comme ayant des propriétés physiques et chimiques, un devenir dans l'environnement, une biodisponibilité et des effets biologiques relativement similaires. Les analogues pour un sous-ensemble donné qui ont été choisis répondaient généralement au domaine d'applicabilité de la structure pour le sous-ensemble (consulter la section précédente) et présentaient des données empiriques applicables aux fins d'analyse de données déduites à partir d'analogues. Dans le présent rapport d'évaluation, les analogues sont présentés avec un astérisque (p. ex., PY74*) comme dans le tableau 2-2. D'autres considérations pour l'utilisation de ces analogues en termes d'absorption, de potentiel de clivage de la liaison azoïque et de toxicité chez les mammifères sont traitées dans la section « Évaluation des effets sur la santé humaine ». Les propriétés physicochimiques des sous-ensembles de pigments monoazoïques, y compris des analogues choisis, sont incluses dans la section suivante.
| Sous-ensemble | Substance (n° CAS) | Nom générique dans le C.I. (numéro dans le C.I.) | Structure chimique, formule moléculaire (poids moléculaire) |
Lecture croisée |
|---|---|---|---|---|
| Pigments de β-naphtol | Rouge para* (6410-10-2) |
Pigment Red 1* (C.I. 12070) |
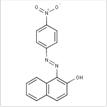 C16H11N3O3 (293 g/mol) |
Effets sur la santé humaine |
| Pigments jaunes monoazoïques | PY74* (6358-31-2) |
Pigment Yellow 74* (C.I. 11741) |
C18H18N4O6 (386 g/mol) |
Propriétés physicochimiques, effets écologiques, effets sur la santé humaine |
| Pigments jaunes monoazoïques | 80675-49-6* (80675-49-6) |
S/O (pas de nom dans le C.I.) | 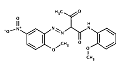 C18H18N4O6 (386 g/mol) |
Effets sur la santé humaine |
| Pigments de BONA laqués | PR48:1* (7585-41-3) |
Pigment Red 48:1* (C.I. 15865:1) |
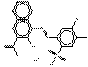 C18H11ClN2O6SBa (556 g/mol) |
Propriétés physiques et chimiques |
| Pigments de BONA laqués | PR48:3* (15782-05-5) |
Pigment Red 48:3* (C.I. 15865:3) |
C18H11ClN2O6SSr (506 g/mol) |
Propriétés physiques et chimiques |
| Pigments de BONA laqués | PR57:1* (5281-04-9) |
Pigment Red 57:1* (C.I. 15850:1) |
 C18H12N2O6SCa (424 g/mol) |
Propriétés physicochimiques, potentiel de persistance et de bioaccumulation, effets écologiques, effets sur la santé humaine |
| Pigments de naphtol AS | PR2* (6041-94-7) |
Pigment Red 2* (C.I. 12310) |
 C23H15Cl2N3O2 (436 g/mol) |
Propriétés physicochimiques, effets écologiques |
| Pigments de naphtol AS | PR22* (6448-95-9) |
Pigment Red 22* (C.I. 12315) |
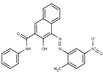 C24H18N4O4 (426 g/mol) |
Effets sur la santé humaine |
| Pigments de naphtol AS | PR23* (6471-49-4) |
Pigment Red 23* (C.I. 12355) |
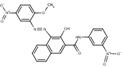 C24H17N5O7 (487 g/mol) |
Effets sur la santé humaine |
| Pigments de naphtol AS | PR146* (5280-68-2) |
Pigment Red 146* (C.I. 12485) |
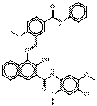 C33H27ClN4O6 (611 g/mol) |
Propriétés physicochimiques, effets écologiques |
| Pigments de naphtol AS | PR253* (85776-13-2) |
Pigment Red 253* (C.I. 12375) |
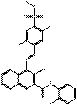 C25H20Cl2N4O4S (543 g/mol) |
Propriétés physicochimiques, effets écologiques |
3. Propriétés physiques et chimiques
Un résumé des données expérimentales sur les propriétés physiques et chimiques spécifiques qui jouent un rôle essentiel dans la détermination du devenir dans l'environnement et des effets biologiques des pigments monoazoïques est présenté dans le tableau 3-1. Des renseignements détaillés (avec des références) sur ces pigments et leurs analogues sont présentés à l'annexe 2 de ce rapport. Les propriétés des pigments dépendent fortement de la manière dont ils ont été préparés par les fabricants.
Les données expérimentales sur la pression de vapeur et les constantes de la loi de Henry ne sont pas disponibles pour la plupart des pigments. Toutefois, étant donné que de nombreux pigments monoazoïques sont de taille et de complexité moléculaires semblables pour les colorants dispersés, on peut s'attendre à ce qu'ils aient des pressions de vapeur s'inscrivant dans la même plage que les valeurs déclarées pour les colorants dispersés (c.-à-d., 10-11 à 10-9; Baughman et Perenich, 1988). De la même manière, tous les pigments monoazoïques devraient également présenter des valeurs de la constante de la loi de Henry très faibles. Par conséquent, un scénario impliquant l'exposition aux pigments monoazoïques dans l'air ne devrait pas être pertinent sur le plan environnemental pour ce groupe de substances. Cependant, l'exposition par voie aérienne aux pigments monoazoïques sous forme de poussières ou de particules est possible, notamment pour certains produits dont l'exposition par inhalation peut être pertinente (p. ex., peintures au pistolet).
Les pigments de β-naphtol laqués et les pigments de BONA laqués contiennent des groupes sulfonates ou carboxylates ionisables; par conséquent, la dissociation de contre-ions de métal peut être possible. Cependant, sur la base des preuves empiriques de la faible toxicité issues des études de l'écotoxicité, toute dissociation devrait être limitée et considérée comme moins pertinente par rapport au devenir dans l'environnement et à l'écotoxicité de ces pigments. En revanche, sur la base de la toxicité observée à la suite de l'exposition par voie orale dans des études sur des rongeurs, il est clair qu'un certain degré de dissociation ou de biodisponibilité des pigments laqués doit se produire dans le tractus gastro-intestinal (consulter la section « Évaluation des effets sur la santé humaine » pour de plus amples renseignements). Les autres sous-ensembles de pigments monoazoïques ne comportent pas de groupes ionisables; par conséquent, l'analyse de la dissociation n'est pas pertinente pour ces sous-ensembles. En outre, les pigments monoazoïques se décomposent avant ébullition; ainsi un point d'ébullition n'est pas applicable à ces substances.
| Sous-ensemble | Substance | Propriété (acronyme) et unités | Échelle ou valeurs |
|---|---|---|---|
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Point de fusion (PF) (°C) | Pas de point de fusion (effet endothermique dans une plage de températures allant de 260 à 290 °C directement suivi par une décomposition exothermique spontanée dans une plage de températures allant de 290 à 390 °C) |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Température de décomposition (TD), ºC | 249; 290 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Distribution granulométrique : diamètre médian massique (D50), µm | 1,96 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Densité, g/cm3 | 1,43 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Hydrosolubilité (HS, Se), µg/Le | 0,23; 7,5-7,6 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Solubilité dans le n-octanol (Soct), µg/L | 740; 5 960-9 530 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | 2,0; 2,9; 4,6 |
| Pigments jaunes monoazoïques | PY1; PY3; PY74* | Le logarithme du quotient du partage carbone organique-eau coefficient (Kco ), sans dimension |
5,5 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Point de fusion (PF) (°C) | Pas de point de fusion (la substance s'évaporer et se décompose avant la fusion); 357,5 °C |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Température de décomposition (TD), ºC | 310-370 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Distribution granulométrique : diamètre médian massique (D50), µm | 1,7-17,1 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Densité, g/cm3 | 1,20 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Hydrosolubilité (HS, Se), µg/L | inférieur(e) à 25; 100-280; 500-1 300; 8 900 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Solubilité dans le n-octanol (Soct), µg/L | 31-70; 4 600-6 000 |
| Pigments de BONA laqués | PR48:2; PR48:1*; PR48:3*; PR57:1* | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | -0,75 à 0,94 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Point de fusion (PF) (°C) | 212; 270-302 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Dimension moyenne des particules, µm | 0,26-0,37 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Densité, g/cm3 | 1,37-1,50 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Hydrosolubilité (HS, Se), µg/L | 3,3-6,8; 800 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Solubilité dans le n-octanol (Soct), µg/L | 1 760; 9 400-17 900 |
| Pigments de βnaphtol | PR3; PR4; PO2; PO5 | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | 2,4; 3,5-3,7 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Point de fusion (PF) (°C) | Pas de point de fusion (effet endothermique dans une plage de températures allant de 260 à 270 °C directement suivi par une décomposition exothermique spontanée dans une plage de températures allant de 270 à 290 °C); 306 °C |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Température de décomposition (TD), ºC | 270 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Dimension moyenne des particules, µm | 0,10-0,17 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Distribution granulométrique : diamètre médian massique (D50), µm | 4,56 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Densité, g/cm3 | 1,40-1,48 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Hydrosolubilité (HS, Se), µg/L | 3,0-24,9 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Solubilité dans le n-octanol (Soct), µg/L | 22,1; 100-202; 3 310-8 630 |
| Pigments de naphtol AS | PR5; PR112; PR187; PR266 PO38; PR2*; PR146*; PR253* | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | 0,4-1.1; 1,2-1.7; 2,5-3,2 |
| Pigments de β-naphtol laqués | PR53:1 | Point de fusion (PF) (°C) | Fusion sous décomposition à 330 °C |
| Pigments de β-naphtol laqués | PR53:1 | Température de décomposition (TD), ºC | 343-345 |
| Pigments de β-naphtol laqués | PR53:1 | Densité, g/cm3 | 1,5 |
| Pigments de β-naphtol laqués | PR53:1 | Hydrosolubilité (HS, Se), µg/L | 1 300-3 400 |
| Pigments de β-naphtol laqués | PR53:1 | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | -0,26 |
| Pigments de benzimidazolone | PO36 | Hydrosolubilité (HS, Se), µg/L | 14; inférieur(e) à 20,6 |
| Pigments de benzimidazolone | PO36 | Solubilité dans le n-octanol (Soct), µg/L | 86,1; supérieur(e) à 137 |
| Pigments de benzimidazolone | PO36 | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | 0,8 |
| Pigments de naphtol AS laqués | PR247:1 | Dimension moyenne des particules, µm | 0,18 |
| Pigments de naphtol AS laqués | PR247:1 | Hydrosolubilité (HS, Se), µg/L | 112 |
| Pigments de naphtol AS laqués | PR247:1 | Solubilité dans le n-octanol (Soct), µg/L | 178 |
| Pigments de naphtol AS laqués | PR247:1 | Le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau (log (Soct/Se)), sans dimension | 0,2 |
3.1 Distribution granulométrique et densité
La majorité des pigments organiques n'existent généralement pas sous forme de molécules individuelles, mais principalement sous forme de particules à l'échelle submicrométrique ou micrométrique faible. La poudre pigmentaire est composée habituellement de particules primaires (c'est-à-dire le réseau cristallin d'un pigment), d'agrégats et d'agglomérats. Les fabricants fournissent habituellement les spécifications physiques de leurs pigments, qui comprennent la distribution granulométrique (diamètre médian massique, D50) ou la granulométrie moyenne de la poudre pigmentaire. Ainsi, les utilisateurs peuvent déterminer le pigment qui est le mieux approprié pour colorer leurs produits, le résultat de la coloration dépendant essentiellement de la distribution granulométrique (Herbst et Hunger, 2004).
En termes de distribution granulométrique, des données déclarées sur le diamètre médian massique (D50) ont été prélevées à partir de renseignements déclarés dans les dossiers d'enregistrement REACH pour ces substances disponibles auprès de l'Agence européenne des produits chimiques (ECHA, 2012).Note de bas de page[6] Les données sur la distribution granulométrique présentées au tableau 3-1 indiquent que pour ce groupe de pigments, les valeurs du diamètre médian massique (D50) varient dans une plage allant de 1,7 à 17,1 µm (c'est-à-dire que 50 % de la masse totale de particules se situe au-dessous de cette plage).
Quant aux facteurs autres que la distribution granulométrique dépendant de la masse, certains auteurs ont signalé de très faibles tailles de particules pour les pigments monoazoïques; ces tailles étant souvent inférieures à 1 µm. Les données présentées au tableau 3-1 indiquent que les pigments de naphtol AS et de naphtol laqués ont une taille de particule moyenne de seulement 0,10 à 0,18 µm (c'est-à-dire 100 à 180 nm). Les particules de pigments de β-naphtol sont un peu plus grandes, mais leur taille moyenne demeure inférieure à 1 µm (0,26 à 0,37 µm).
Bäumler et al. (2000) ont également signalé des tailles de particules submicrométriques de pigments azoïques dans les encres de tatouage allant de 20 à 900 nm. Dans une autre étude, Høgsberg et al. (2011) ont démontré que les encres de tatouage contenant des pigments rouges et jaunes des classes monoazoïque et disazoïque à base de pyrazolone et de dichlorobenzidine présentaient des tailles de particules allant de moins de 100 nm à 1 000 nm. Par conséquent, on devrait considérer que les pigments monoazoïques présentent une vaste plage de granulométries (Canada, 2007; Santé Canada, 2011a). Cette échelle granulométrique peut constituer un facteur dans l’absorption sous la forme de particule insoluble (ce point est traité dans les sections respectives portant sur l’évaluation des effets sur l’environnement et l’évaluation des effets sur la santé humaine).
La densité des pigments monoazoïques varie dans une plage relativement étroite allant 1,2 à 1,5 g/cm3, ce qui est supérieur à la densité de l'eau. Par conséquent, lorsqu'ils sont rejetés dans l'eau, les pigments monoazoïques, qui sont des particules relativement lourdes, devraient se précipiter, puis résider dans les sédiments.
3.2 Températures de fusion et de décomposition
Les résultats indiquent que pour de nombreux pigments monoazoïques, les points de fusion sont très proches des températures de décomposition; dans certaines études; les substances se sont évaporées et décomposées avant la fusion. Dans certains essais, les points de fusion sont déclarés, mais la variation des données est importante (p. ex., de 212 à 270-302 ºC pour un sous-ensemble de pigments β-naphtol) (tableau 3-1). Pour certaines substances, les points de fusion n'ont pu être déclarés, à cause de l'occurrence d'un effet endothermique (à 260-290 °C), suivie par une décomposition exothermique spontanée (à 270-390 °C) (voir l'annexe 2 pour plus de détails).
Des données indiquent que comparativement aux pigments, les températures de décomposition des pigments laqués sont plus élevées. Par exemple, les températures de décomposition des pigments jaunes monoazoïques et des pigments de naphtol AS varient dans une plage allant de 249 à 290 ºC, par rapport à une plage allant de 310 à 370 ºC pour les pigments de BONA laqués et les pigments de β-naphtol laqués. Par conséquent, on peut conclure que dans le sous-groupe des 33 substances, la thermostabilité des pigments monoazoïques laqués est supérieure à celle des pigments non laqués.
3.3 Solubilité dans l'eau et le n-octanol
Dans l’ensemble, les pigments monoazoïques dans la présente évaluation préalable sont caractérisés par une faible hydrosolubilité. Parallèlement, certaines substances sont bien moins solubles dans l’eau que d’autres (tableau 3-1; annexe 2). Parmi certains sous-ensembles de pigments (p. ex., pigments de BONA laqués), la variation dans les valeurs d'hydrosolubilité est importante.
La faible solubilité des pigments organiques est le résultat de la conception intrinsèque des colorants, qui présentent des forces d'interaction intenses entre les molécules. Ces forces sont atteintes par l'introduction de substituants comme - CONH - dans la molécule (Lincke, 2003; Herbst et Hunger, 2004). Les liaisons intermoléculaires résultantes engendrent à leur tour une structure cristalline qui est à l'origine de la stabilité des pigments organiques (Lincke, 2003). Panina (2009) a souligné qu'en raison de leurs caractéristiques de la structure moléculaire, des pigments organiques ont tendance à former des solides fortement cristallins; en ce qui concerne les motifs structuraux très typiques, on relève des empilements π-π d'anneaux conjugués et des liaisons hydrogènes intermoléculaires C=O…H-N. Des interactions intermoléculaires aussi fortes à l'intérieur de la structure cristalline mènent à une forte énergie réticulaire et donc souvent à une très faible solubilité. (Toutefois, il faut aussi mentionner que tous les pigments azoïques existent sous forme cristalline comme particules solides avec liaison hydrogène, mais il se peut qu'il y ait des différences importantes en termes de solubilité dans l'eau et l'octanol entre des pigments diarylides et certains pigments monoazoïques. Par conséquent, certaines différences majeures dans la stabilité apparente de la structure cristalline ont également été prises en compte.) Ces différences de solubilité dans l'eau et l'octanol ont été observées pour les pigments azoïques de différentes classes structurales [p. ex., Anliker et Moser, 1987; Environnement Canada et Santé Canada 2013b)].
Les pigments non laqués de ce sous-groupe de 33 substances sont moins solubles dans l'eau que les pigments laqués. Par exemple, les sous-ensembles de pigments jaunes monoazoïques, de pigments de β-naphtol, de pigments de naphtol AS et de pigments de benzimidazolone sont caractérisés par de très faibles valeurs de solubilité allant de 0,2 à 25 µg/L (avec une seule valeur aberrante de 800 µg/L), tandis que les pigments de BONA laqués, les pigments de β-naphtol laqués et les pigments de naphtol AS laqués sont, en général, légèrement plus hydrosolubles (100 à 8 900 µg/L; voir le tableau 3-1 et l'annexe 2).
Dans l'ensemble, la solubilité des pigments non laqués et des pigments laqués dans le n-octanol est relativement plus élevée que leur hydrosolubilité, avec des valeurs de solubilité dans l'octanol atteignant l'ordre du milligramme par litre (tableau 3-1). Pour ce paramètre, similairement à certaines valeurs d'hydrosolubilité, la variation des données dans les sous-ensembles peut aussi être très élevée (voir le tableau 3-1 et l'annexe 2). Ces variations importantes des valeurs de solubilité dans l'eau et l'octanol peuvent être expliquées par les puretés différentes des pigments testés (p. ex., pigment pur c. produits finaux). Par exemple, la présence d'additifs comme des agents de dispersion dans un pigment commercial donné aura une incidence sur la solubilité apparente. D'autres facteurs, tels que la méthode d'essai de la solubilité ainsi que les conditions d'essai (p. ex., pH), peuvent également contribuer à la forte variabilité.
Dans le cas des sous-ensembles de pigments laqués, l'effet des différents contre-ions peut contribuer à la variabilité des valeurs de solubilité. Certains sous-ensembles de pigments laqués sont les sels de différents métaux--par exemple, les pigments de BONA laqués sont les sels du calcium, du baryum et du strontium, et différentes valeurs de solubilité peuvent, dans une certaine mesure, refléter les propriétés des contre-ions (Ca2+, Ba2+, Sr2+).
3.4 Coefficients de partage octanol-eau et carbone organique-eau
Aucune donnée expérimentale fiable sur le coefficient de partage octanol-eau (Koe) n'est disponible pour les pigments monoazoïques. Les données modélisées ne peuvent être considérées comme étant fiables; les valeurs de Koeobtenues à partir de modèles basés sur les fragments, tels que le modèle KOWWIN (2010), surestiment souvent la valeur réelle du Koe de substances très peu solubles comme les pigments. À l'occasion de l'atelier sur les relations quantitatives structure-activité (RQSA) organisé par Environnement Canada en 1999, des experts en modélisation ont classé de nombreuses catégories structurales de pigments et de teintures comme « difficiles à modéliser » à l'aide de RQSA (Environnement Canada, 2000). Les propriétés physiques et chimiques de nombreuses classes structurales de teintures et de pigments se prêtent souvent mal à la prévision modélisée, car on considère qu'elles « ne font pas partie du domaine d'applicabilité » (p. ex. domaines de la structure ou des paramètres des propriétés).
Selon le Guide des exigences d'information et d'évaluation de la sécurité chimique (ECHA, 2008) de l'Agence européenne des produits chimiques, afin de surmonter les difficultés en matière de mesure du Koe, les solubilités dans l'octanol et l'eau peuvent être déterminées dans des essais distincts. Avec ces valeurs de solubilité, le logarithme du quotient des solubilités dans l'octanol et l'eau (log (Soct/Se)) peut être calculé. Bien que l'étude ECHA (2008) admette que le quotient n'est pas exactement identique à celui du Koe, étant donné que ce dernier est lié à la répartition de la substance dans du n-octanol saturé d'eau et de l'eau saturée de n-octanol, elle recommande néanmoins de tenir compte de cette méthode pour les substances très peu solubles. Par conséquent, on considère qu'un paramètre de logarithme (Soct/Se) représenterait raisonnablement le partage octanol-eau (Koe) pour les pigments organiques. Cette approche a été utilisée dans des évaluations préalables antérieures sur les pigments (p. ex., la publication d'Environnement Canada et de Santé Canada, 2009a, b) et est également utilisée dans le présent rapport.
Dans l'ensemble du groupe des 33 pigments monoazoïques, les valeurs de log (Soct/Se), basées sur des valeurs de solubilité expérimentales dans l'eau et le n-octanol, varient grandement, notamment de inférieur(e) ou égal(e) à 0,2 à 4,6 (voir le tableau 3-1 et l'annexe 2). La comparaison des données entre les sous-ensembles de substances indique que, dans l'ensemble, les valeurs de log (Soct/Se) des pigments laqués sont très faibles; par exemple, quatre des cinq pigments laqués présentent des valeurs de log (Soct/Se) inférieures ou égales à 0,2, et seul un pigment laqué (PR57:1*) présente des valeurs de coefficient de partage carbone organique-eau supérieures, allant notamment de 0,65 à 0,94 (voir l'annexe 2). En revanche, les pigments jaunes monoazoïques présentent des valeurs de log (Soct/Se) allant de 2,0 à 4,6, et les pigments de β-naphtol, des valeurs allant de 2,4 à 3,7 (tableau 3-1; annexe 2).
Similairement aux points de fusion, la variabilité des données pour un paramètre de log (Soct/Se) pourrait aussi être importante; par exemple, dans le groupe des pigments de naphtol AS, les valeurs de log (Soct/Se) varient de 0,4 à 3,2 (tableau 3-1; annexe 1).
Seule une étude expérimentale sur les coefficients de partage carbone organique-eau (Kco ) est disponible; elle indique que le PY1 est caractérisé par une valeur de log Kco relativement élevée de 5,5.
Étant donné que les coefficients de partage octanol-eau (Koe) et carbone organique-eau (Kco ) sont des paramètres importants en termes de bioaccumulation des substances, ils seront traités de façon plus détaillée dans la section « Potentiel de bioaccumulation » du présent rapport.
3.5 Diamètres transversaux calculés
La nature particulaire et la faible hydrosolubilité des pigments organiques entraînent leur biodisponibilité très limitée. Parallèlement, la fraction hydrosoluble du pigment, même si infime, peut théoriquement traverser les membranes biologiques. Pour toutes les membranes biologiques, la perméabilité dépend d'une variété de facteurs, l'un d'eux étant le diamètre moléculaire de la substance.
En termes de diamètres transversaux des molécules, les pigments monoazoïques ont des diamètres effectifs (Deff) allant de 0,9 à 1,2 nm; les diamètres maximaux moyens (Dmax) varient de 1,4 à 1,8 nm, et les diamètres minimaux moyens (Dmin) sont de 0,8 nm ou moins (voir le tableau 5-2 dans la section, 5.2 « Potentiel de bioaccumulation »). Étant donné que ces paramètres sont importants en termes de perméabilité des substances par les membranes biologiques et de processus de bioaccumulation, une discussion détaillée sur les diamètres transversaux de ces pigments est présentée dans la section « Potentiel de bioaccumulation » du présent rapport.
3.6 Impuretés
Certaines substances, comme les résines, les rosins, les amines aliphatiques, et d'autres composés comme les surfactants, les agents dispersants et les agents de couplage, sont des additifs communs utilisés dans les préparations des pigments, selon l'application de ces derniers. Il est impossible d'éliminer ces impuretés par la filtration des pigments ou par le lavage intensif; même l'effet des procédés d'extraction à chaud a tendance à être lent et insatisfaisant (Herbst et Hunger, 2004). Il se peut que certaines quantités de ces substances aient été présentes dans certains pigments testés. Si tel est le cas, cela pourrait entraîner une variabilité des données et un manque de cohérence entre les études (p. ex. les études de biodégradabilité ou d'hydrosolubilité).
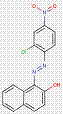
Dans la plupart des cas, les impuretés dans les pigments ne sont pas précisées. Cependant, pour une substance de ce sous-groupe de 33 pigments monoazoïques, à savoir le PR112, des renseignements sur la pureté et les impuretés sont disponibles. Selon l'étude ECHA (2012), des taux de pureté de 96 % à 100 % et de 90 % à 100% sont déclarés pour ce pigment, et un composant d'impureté est le 3-hydroxy-2′-méthyl-2-naphtanilide (n° CAS 135-61-5), ayant la structure suivante :

Des doutes subsistent quant à savoir si les données sur la pureté déclarées dans les différentes sources d'information représentent totalement la gamme de catégories de pigments monoazoïques utilisés dans les produits au Canada. Par conséquent, il est possible que les catégories de qualité inférieure entraînent une exposition à ces impuretés ainsi qu'à d'autres impuretés potentielles à des valeurs plus élevées que les concentrations indiquées dans la présente évaluation.
4. Sources et utilisations
4.1 Sources
Tous les 33 pigments sont d'origine anthropique; ils ne devraient donc pas être produits de façon naturelle dans l'environnement.
Au cours des dernières années, on a ajouté les 33 pigments monoazoïques inclus dans la présente ébauche d'évaluation préalable dans les enquêtes effectuées en vertu de l'article 71 de la LCPE (1999). Ces enquêtes visaient à recueillir des renseignements sur les activités de fabrication et d'importation au Canada, sur la base d'un seuil de déclaration de 100 kg/an. Seize (16) substances ont été évaluées pour l'année de déclaration 2005 (Canada, 2006), et 11 de ces substances ont été réévaluées dans le cadre de l'initiative du Défi du Canada pour les années de déclaration de 2006 et 2007 (Canada, 2007, 2008). Vingt substances ont été incluses dans une enquête pour l'année 2010 qui était axée sur le groupe de substances azoïques aromatiques et à base de benzidine (Canada, 2011).
Les résultats des enquêtes ont montré que 21 pigments monoazoïques sont importés ou fabriqués en quantités supérieures à 100 kg/an au Canada. Parmi ces derniers, 14 pigments monoazoïques ont été définis comme faisant l'objet d'activités de fabrication ou d'importation dans l'année civile 2010 (Canada, 2011), et 7 pigments ont été définis à partir d'enquêtes récentes (Environnement Canada, 2006, 2007b, 2008), ce qui indique que la quantité totale fabriquée ou importée de ces substances est de l'ordre de 100 000 à 1 000 000 kg/an. Ces activités ont été déclarées dans les secteurs suivants (énumération du plus fort au plus faible volume) : peintures et revêtements; fabrication de produits chimiques de base; encres liquides et en poudre et colorants; produits en plastique ou en caoutchouc; produits agricoles; emballages alimentaires; textiles et cuir; matériaux de construction; adhésifs et scellants, produits de nettoyage et meubles (Environnement Canada, 2006, 2007b, 2008, 2012).
| Sous-ensemble des pigments monoazoïques | Substance | Année 2005 (Canada 2006) | Années 2006-2007 (Canada, 2007a, 2007b) |
Année 2010 (Canada 2011) |
|---|---|---|---|---|
| Pigments de β-naphtol | PR3 | X | ||
| Pigments de β-naphtol | PR4 | X | X | |
| Pigments de β-naphtol | PO5 | X | X | |
| Pigments de β-naphtol | NONPA | X | ||
| Pigments de β-naphtol laqués | PR49:1 | X | ||
| Pigments de β-naphtol laqués | PR53:1 | X | ||
| Pigments de BONA laqués | PR48:2 | X | ||
| Pigments de BONA laqués | PR52:1 | X | ||
| Pigments de BONA laqués | PR52:2 | X | ||
| Pigments de BONA laqués | PR63:1 | X | ||
| Pigments jaunes monoazoïques | PY1 | X | ||
| Pigments jaunes monoazoïques | PY3 | X | ||
| Pigments jaunes monoazoïques | PY73 | X | ||
| Pigments de naphtol AS | PR5 | X | ||
| Pigments de naphtol AS | PR112 | X | ||
| Pigments de naphtol AS | PR170 | X | ||
| Pigments de naphtol AS | PR187 | X | X | |
| Pigments de naphtol AS | PR266 | X | ||
| Pigments de naphtol AS | PO38 | X | X | |
| Pigments de benzimidazolone | PO36 | X | ||
| Pigments de naphtol AS laqués | PR247:1 | X | X |
4.2 Utilisations
Les pigments monoazoïques sont généralement utilisés dans une grande variété de secteurs définis dans la section précédente. Ces utilisations ainsi que les utilisations définies en dehors de l’article 71 de la LCPE (1999) sont notamment les suivantes : les produits cosmétiques, les peintures et les revêtements, les textiles et le cuir, les emballages alimentaires, les agents de coloration dans les médicaments et les produits de santé naturels (PSN), les produits de formulation dans les produits antiparasitaires, les applications militaires, ainsi que les encres de tatouage. Ces utilisations sont analysées ci-dessous.
Produits cosmétiques
Selon les notifications soumises au Programme des cosmétiques de Santé Canada aux termes du Règlement sur les cosmétiques, le PY1, le PY3, le PY73, le PR4, le PR49:1, le PR53:1, le PR63:1 et le PR112 sont utilisés dans certains produits cosmétiques au Canada (courriels de la Direction de la sécurité des produits de consommation, Santé Canada, adressés au Bureau de l’évaluation des risques des substances existantes, Santé Canada, en 2011 et 2013, source non citée). Les produits cosmétiques contenant ces substances comprennent le maquillage pour le visage, des crèmes, des lotions ou des hydratants pour le corps, des revitalisants pour cheveux, des colorants capillaires, des fragrances, des crèmes à raser, des savons, des produits pour le bain, des vernis à ongles, des peintures faciales, et du rouge à lèvres (se référer à l’annexe F pour plus de détails).
Le PR3 et le PO5 sont répertoriés dans la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques (communément appelée « liste critique ») qui est un outil administratif que Santé Canada utilise pour faire savoir aux fabricants et à d’autres intervenants que les produts contenant certaines substances sont peu susceptibles d’être classés comme des cosmétiques en vertu de la Loi sur les aliments et les drogues, ainsi que certaines substances, si elles sont présentes dans un cosmétique, peuvent contrevenir à l’interdiction générale prévue à l’article 16 de la Loi sur les aliments et drogues ou à une disposition ducite (Santé Canada, 2011a).
Peintures et revêtements
Dix-neuf pigments monoazoïques (pigments de bêta-naphtol PR3, PR4, PO5, NONPA, pigments de bêta-naphtol laqués PR49:1, PR53:1, pigments laqués BONA PR48:2, PR52:1, PR52:2, PR63:1, pigments jaunes monoazoïques PY1, PY3 et PY73, pigments de naphtol-AS PO38, PR5, PR112, PR170, PR266, autres PO36) ont été définis comme étant utilisés dans les peintures et les revêtements au Canada, d’après les renseignements soumis en vertu de l’article 71 (Environnement Canada, 2006, 2007b, 2008, 2012). Sur la base des renseignements soumis en vertu de l’article 71, un certain nombre de pigments monoazoïques utilisés dans des peintures et des revêtements ont également été définis comme étant utilisés dans un produit ou un article manufacturé destinés à une utilisation par ou pour des enfants, bien que des renseignements précis sur le produit n’aient pas été fournis (Environnement Canada, 2012). Cependant, bien que des détails limités aient été disponibles sur les produits précis destinés à être utilisés dans les peintures et les revêtements en vertu des notifications de l’article 71, d’autres sources d’information ont également été prises en compte pour déterminer les produits et les concentrations raisonnablement prévisibles de ces substances. Au lieu d’être une liste exhaustive de tous les produits potentiels associés à une utilisation dans des peintures et des revêtements, cette section met l’accent sur les utilisations les plus pertinentes pour les enfants (peintures au doigt, matériel d’artistes et d’artisanat, y compris les peintures d’affiches, les peintures faciales, les peintures dans les jouets d’enfants) et sur des utilisations supplémentaires pour la population générale (peintures en aérosol) (se reporter à l’annexe G).
- Peintures au doigt : L’utilisation des peintures au doigt aux États-Unis a été déterminée pour certaines substances dans les sous-ensembles de pigments de bêta-naphtol (PR4, PO5), de pigments de bêta-naphtol laqués (PR49:1), de pigments laqués BONA (PR48:2), de pigments jaunes monoazoïques (PY1, PY3, PY73) et de pigments de naphtol-AS (PR5, PR112, PR170) (communication personnelle, courriel du programme de toxicologie de l’Université Duke adressé au Bureau de l’évaluation des risques des substances existantes [Santé Canada], en 2013, source non citée). Peintures au doigt : Un récent essai de produit mené en Europe a également détecté du PY1, du PY3, du PR4, du PO5, du PR5, et du PR112 dans les peintures au doigt (Hauri, 2006, 2008, 2009a, 2010a, 2011a). La norme européenne EN71-7 (Sécurité des jouets – Partie 7 : Peintures au doigt – Exigences et méthodes d’essai) énumère également le PY1, le PY3, le PR5, le PR170, le PO38, le PR48:2, et le PR63:1 comme des colorants autorisés dans les peintures au doigt au sein de l’Union européenne (UE) (BS, 2002). Par conséquent, d’après les renseignements ci-dessus, ces pigments monoazoïques sont considérés comme ayant une utilisation raisonnablement prévisible dans les peintures au doigt sur le marché canadien (annexe G, tableau G-1).
- Peintures faciales : Selon les notifications soumises à Santé Canada aux termes du Règlement sur les cosmétiques, le PR4 et le PY1 sont utilisés comme des ingrédients dans les peintures faciales (maquillage pour le corps) au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation [Santé Canada] adressés au Bureau de l’évaluation des risques des substances existantes [Santé Canada], en 2011 et 2013; source non citée). Cependant, la peinture faciale étant considérée comme un cosmétique visé par le Règlement sur les cosmétiques, on suppose que les autres pigments monoazoïques signalés pour des utilisations dans les cosmétiques pourraient également avoir des utilisations raisonnablement prévisibles dans les peintures faciales au Canada (se reporter à la section sur les cosmétiques ci-dessus : PY1, PY3, PY73, PR4, PR49:1, PR53:1, PR63:1 et PR112). Outre les plages de concentrations concernant le PR4 et le PY1 dans les peintures faciales déclarées en vertu du Règlement sur les cosmétiques à Santé Canada, des preuves issues de fiches signalétiques indiquent que, en général, les pigments se trouvent dans des peintures faciales et corporelles dans une des concentrations allant de 1 à 15 % (Derivan, 2012; Mont Marte International Ltd., 2012a). (Annexe G, tableau G-2)
- Autre matériel d’artistes et d’artisanat : Outre les peintures au doigt ci-dessus, les renseignements disponibles indiquent les utilisations de pigments monoazoïques dans le matériel d’artistes et d’artisanat. Les essais de produits réalisés par l’Agence de protection de l’environnement du Danemark ont permis de détecter du PR3 dans des peintures acryliques d’affiches à une concentration de 10 % (Hansen et al., 2008), tandis que des preuves issues de fiches signalétiques (FS) indiquent que le PR63:1, le PY1 et le PY3 sont également utilisés dans les peintures acryliques et les aquarelles pour enfants (Mont Marte International Ltd., 2009a, 2009b). Une autre source a indiqué que plusieurs pigments monoazoïques étaient considérés comme « recommandés » ou « convenables » pour des applications artistiques ou créatives et des fournitures scolaires, comme les peintures à l’huile, l’aquarelle et la gouache, les peintures acryliques, les crayons à papier, les crayons de cire et la craie (Clariant, 2011). Les essais de produits en Suisse ont également permis de détecter du PY1, du PY112, du PR5 et du PR53 dans la pâte à modeler pour enfants (Hauri, 2009b). Collectivement, les renseignements ci-dessus appuient l’utilisation raisonnable prévisible de pigments monoazoïques dans ces types de matériel d’artistes et d’artisanat (se reporter à l’annexe G, tableau G-4).
- Peintures dans les jouets d’enfants :Plusieurs sources indiquent l’utilisation potentielle d’autres pigments monoazoïques dans des peintures de jouets. Le PR49:1 est répertorié comme étant utilisé dans des jouets dans le Hawley’s Condensed Chemical Dictionary (Lewis, 2007), et le fournisseur de cette substance a déclaré que ses pigments organiques sont largement utilisés, y compris dans les jouets (LookChem, 2008). Une fiche signalétique de l’industrie indique l’utilisation de ces pigments de β-naphtol laqués dans les peintures de jouets (Siegwerk, 2012). Une monographie des pigments utilisés dans les industries de l’Amérique du Nord indique aussi l’utilisation éventuelle de plusieurs pigments monoazoïques dans les peintures de jouets, y compris le PR3, le PO5 et le PR112 (Clariant, 2013).
- Peinture en aérosol : Aux fins de la présente évaluation préalable, on suppose que les 19 pigments monoazoïques définis comme étant utilisés dans les peintures et les revêtements au Canada, d’après les renseignements soumis en vertu de l’article 71, peuvent être utilisés dans les peintures en aérosol. Il a été signalé que les concentrations génériques de pigments azoïques dans les peintures et les revêtements variaient de 3 % à 60 % (Centre international de recherche sur le cancer [CIRC], 2010b). Cependant, la concentration réelle de pigments devrait dépendre de l’utilisation de peintures et de revêtements particuliers. Des renseignements disponibles indiquent que certains pigments monoazoïques (PR170 et PY73) sont utilisés dans des peintures en aérosol à une concentration de 5 % (Household Products Database 1993–; Rust-Oleum Corp. 2006).
Emballage alimentaire
Au Canada, les colorants alimentaires sont réglementés en tant qu’additifs alimentaires en vertu du Règlement sur les aliments et drogues (Canada, 1978). Les couleurs qui sont autorisées pour une utilisation dans la nourriture sont énumérées dans la Liste des colorants autorisés, incorporée par renvoi dans l’Autorisation de mise en marché d’additifs alimentaires comme colorants publiée en vertu de la Loi sur les aliments et drogues (Canada, 1985). Aucun des pigments monoazoïques dans la présente évaluation préalable ne figure sur la Liste des colorants autorisés, à titre d’agent de coloration alimentaires autorisés.
Huit substances (PO5, PO38, PR53:1, PR112, PR170, PR187, PR266 et PR268) dans cette évaluation préalable ont été déterminées aux fins d’utilisation dans les matériaux d’emballage alimentaire au Canada (communication personnelle, courriel de la Direction des aliments [Santé Canada] adressé au Bureau de gestion du risque [Santé Canada], en 2011, source non citée). Un résumé des utilisations de pigments monoazoïques dans les emballages alimentaires est présenté au tableau 4-2.
| Substance | Renseignements sur les utilisations |
|---|---|
| PO5 | Utilisés dans la fabrication d'encres d'impression et de revêtements sans contact direct avec les aliments. Aucune exposition n'est prévue. |
| PO38 | Utilisés dans un système d'encre pour les matériaux d'emballage d'aliments n'étant pas en contact direct avec les aliments. Aucune exposition n'est prévue. |
| PR187 | Composants dans les concentrés de colorants à base de polyoléfine, qui peuvent être utilisés dans la fabrication de conteneurs, de fermetures, de films et de résines et qui sont en contact direct avec tout type d'aliment, sauf le lait. L’exposition ne devrait pas être importante. |
| PR170 | Généralement utilisés dans des encres sans contact direct avec les aliments. Une application avec un minimum de contact direct avec les aliments aux fins d'utilisation dans la formulation d'enveloppes en plastique pour l'emballage des saucisses. L’exposition ne devrait pas être importante. |
| PR53:1 | Composants dans les encres sans contact direct avec les aliments et les concentrés de colorants avec peu d'applications en contact direct avec les aliments. L’exposition ne devrait pas être importante. |
| PR112 | Composants dans les encres et les peintures sans contact direct avec les aliments. Aucune exposition n'est prévue. |
| PR268 | Composants dans les encres sans contact direct avec les aliments. Aucune exposition n'est prévue. |
| PR266 | Composants dans les encres sans contact direct avec les aliments. Aucune exposition n’est prévue. |
Agents de coloration dans les médicaments et les produits de santé naturels (PSN)
Les colorants autorisés dans la fabrication de médicaments au Canada sont régis en vertu du titre 1 de la partie C du Règlement sur les aliments et drogues (Canada, 1978). Le PR4 (sous le nom FLAMING RED [D&C Red no 36, ou C.I. no 12085) est présent sur la liste du Règlement sur les aliments et drogues comme colorant pouvant être employé dans les drogues à usage interne et externe et le PR63:1 (sous le nom DEEP MAROON (D&C Red no 34; C.I. no 15880:1) est présent sur la liste du Règlement sur les aliments et droguescomme colorant pouvant être employé dans les drogues à usage externe uniquement. Aucun des pigments monoazoïques dans la présente évaluation préalable n’a été déterminé comme étant présent dans les produits pharmaceutiques à usage humain, des médicaments vétérinaires ou des produits biologiques au Canada (BDPP, 2010; communication personnelle, courriel envoyé par la Direction des produits thérapeutiques [Santé Canada] au Bureau de gestion du risque [Santé Canada], en 2011, source non citée; communication personnelle, courriel envoyé par la Direction des produits biologiques et thérapies génétiques [Santé Canada] au Bureau de la gestion du risque [Santé Canada], en 2011, source non citée).
Le PR5 et le PR63:1 (répertoriés sous le nom de D&C Red no 34) ainsi que le PR4 (répertorié sous les noms de D&C Red no 36 ou Flaming Red) figurent aussi dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) à titre d’ingrédients non médicinaux, notamment comme additifs colorants, dans les produits de santé naturels (BDIPSN, 2011). En outre, le BDISPN précise que l'utilisation de PR4 est aussi autorisée dans des produits oraux, en une dose allant jusqu'à 1,0 mg/jour, à moins que des preuves supplémentaires en matière de sécurité soient soumises, alors que le PR5 et le PR63 :1 sont lisét pour utilisation topique (BDISPN, 2011). Le PR4 et le PR63:1 figurent dans la Base de données des produits de santé naturels homologués (BDPSNH) en tant qu'ingrédients non médicinaux présents dans les produits de santé naturels actuellement homologués. Le PR5 n'a été détecté dans aucun produit de santé naturel actuellement homologué (BDPSNH, 2008).
Produits de formulation dans les produits antiparasitaires
Neuf pigments monoazoïques qui sont utilisés comme produits de formulation dans des produits antiparasitaires homologués au Canada en vertu de la Loi sur les produits antiparasitaires (XXXX), une loi équivalente à la LCPE (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire [Santé Canada] au Bureau de gestion du risque [Santé Canada], en 2011 et 2013; source non citée), comme le montre le tableau 4-3, ne sont pas étudiés davantage dans la présente évaluation.
| Substance | Utilisation | Concentration (%) |
|---|---|---|
| PR3 | Peinture antisalissure | 0,965-3,39 |
| PR63:1 | Fongicides pour la lutte contre les maladies des plantes | 0,027-0,34 |
| PR112 | Peinture antisalissure | 1,692 |
| PR48:2 | Fongicides, traitements des semences, insecticides, rodenticides | 0,015-10,33 |
| PO36 | Peinture antisalissure, produits de préservation du bois | 1,25-1,47 |
| PY73 | Peinture antisalissure, appâts à mouches, produits de préservation du bois | 0,0746-1,25 |
| PR247:1 | Colliers contre les puces et les tiques | 0,3 |
| NONPA | Peinture antisalissure | 0,018 |
| PR187 | Peinture antisalissure | 1,9-3,9 |
Encres de tatouage
Selonles notifications soumises à Santé Canada aux termes du Règlement sur les cosmétiques, le PR4, PR112 et le PY3 sont utilisés dans les encres de tatouage permanentes (communication personnelle, courriel de la Direction de la sécurité des produits de consommation [Santé Canada] au Bureau de l’évaluation des risques des substances existantes [Santé Canada], en 2011 et 2013, source non citée). Les pigments monoazoïques PR63:1, PR170 et PY3 sont également inscrits comme ingrédients dans les fiches signalétiques des deux marques d’encres de tatouage disponibles à l’échelle internationale, y compris au Canada (SkinCandy, 2013a, 2013b; Starbrite, 2013). La Color Pigments Manufacturers Association (CPMA), qui représente les importateurs et les fabricants des pigments azoïques au Canada, a indiqué qu’au Canada, ses membres ne fournissent pas sciemment ces substances aux fins d’utilisation dans les encres de tatouage (CPMA, 2013).
Dans des études menées en Europe, les utilisations dans des encres de tatouage de plusieurs pigments monoazoïques tirés de la présente évaluation (PR3, PR4, PR5, PR49:1, PR53:1, PR63:1, PR112, PR170, PO5, PO36, PY1, PY3) ont également été signalées (Bäumler et al., 2000; NVWA, 2008; De Cuyper and D’hollander, 2010; Hauri, 2010b, 2010c, 2011b; Høgsberg et al. 2010; Agence de protection de l’environnement du Danemark, 2012) (voir l’annexe 6, tableau F-6).
Autres utilisations
Cinq pigments monoazoïques (PY3, PR4, PR112, PR187 et PO5) sont définis comme étant utilisés dans des textiles et le cuir, selon une étude récente menée en vertu de l’article 71 (Environnement Canada, 2012a).
Deux pigments monoazoïques ont été relevés dans des applications militaires au Canada : le PR49:1 est utilisé en tant qu'agent de prévention de la corrosion, et le PR170 est utilisé en tant qu'émail pour la résistance au feu, à la corrosion et à la saleté (courriel envoyé par le ministère de la Défense nationale au Bureau de gestion du risque de Santé Canada; en 2011, source non citée).
Le NONPA a été déterminé comme étant utilisé au Canada d'après les renseignements soumis par l'Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers (ETAD) (courriel envoyé par l'ETAD à Environnement Canada en 2010, source non citée). Le produit final n'a pas été confirmé.
5. Devenir et comportement dans l’environnement
Le devenir et le comportement dans l’environnement des substances chimiques décrivent le processus par lequel les produits chimiques se déplacent et sont transformés dans l’environnement. Les processus de devenir dans l'environnement qui sont habituellement traités comprennent la persistance des substances concernées dans les milieux naturels ainsi que leurs produits de dégradation, leur distribution dans les différents médias, leur migration dans les eaux souterraines, leur élimination des effluents par des méthodes standard de traitement des eaux usées et leur bioaccumulation dans les organismes.
Toutefois, la combinaison de la variabilité entre les substances chimiques et de la variabilité entre les environnements complique l'enquête sur un ensemble de propriétés ainsi que la prévision du comportement potentiel d'un produit chimique spécifique (Mackay et al., 2001). Tandis que certains attributs des substances chimiques dans l'environnement (p. ex. les concentrations) peuvent être mesurés directement, cela pas le cas d'autres attributs (p. ex. les taux d'évaporation ou la distance parcourue) qui ne peuvent être estimés qu'à l'aide de modèles. Cependant, les modèles actuels ne permettent pas toujours de traiter certains des produits chimiques, y compris les pigments, de façon satisfaisante (Mackay et al., 2009).
Il faut également souligner que la majorité des pigments organiques n'existent généralement pas sous forme de molécules individuelles, mais principalement sous forme de particules à l'échelle submicrométrique ou micrométrique faible. La poudre pigmentaire est composée habituellement de particules primaires (c'est-à-dire le réseau cristallin d'un pigment), d'agrégats et d'agglomérats.
Par conséquent, en tenant compte de tous ces renseignements, on a proposé de ne pas recourir à la modélisation de la fugacité pour décrire la répartition des pigments dans les milieux naturels. On a également estimé que des conclusions relativement fiables sur le devenir dans l'environnement de ces pigments pouvaient être établies sur la base de données expérimentales disponibles sur les propriétés physiques et chimiques de ces pigments.
Comme il a déjà été mentionné, les pigments monoazoïques ont une très faible solubilité dans l'eau, à l'échelle submicrométrique ou micrométrique faible par litre (voir le tableau 3-1). En prenant également en compte le fait que ces pigments se présentent principalement sous forme de particules à l'échelle submicrométrique ou micrométrique faible, on peut supposer que lorsque ces substances sont rejetées dans l'eau, elles y apparaissent principalement sous forme de particules ou se lient par adsorption à d'autres solides en suspension pour se déposer et constituer tôt ou tard des matériaux de fond.
Les rejets directs de pigments monoazoïques dans l'air ne devraient pas être importants, cependant, si c'était le cas, ces substances ne devraient pas résider dans ce milieu. En effet, même dans le scénario de la pire éventualité; si les pigments sont rejetés sous forme de molécules, et non sous forme de particules, ils devraient avoir de très faibles pressions de vapeur étant donné qu'il s'agit de grosses molécules complexes. Bien qu'on ne dispose pas de données expérimentales sur la pression de vapeur pour la plupart des pigments, ces derniers devraient avoir des pressions de vapeur si situant dans la plage de valeurs typique des colorants azoïques dispersés de structure similaire (c.-à-d. de 10-11 à 10-9 Pa, tel qu'il est indiqué par Baughman et Perenich, 1988).
Une autre raison de l'improbabilité de la volatilisation des pigments non chargés est que la tendance d'échappement ou la fugacité qui entraînent la volatilisation constituent également la force motrice de la sorption et de la bioconcentration (Baughman et Perenich, 1988).
La nature particulaire des pigments monoazoïques devrait avoir une forte influence sur leur devenir dans l'environnement, combinée à leur densité (plus élevée que la densité de l'eau), à leur stabilité chimique élevée et à leur très faible solubilité dans l'eau, ce qui laisse penser que ces pigments se répartiront par gravité dans les sédiments s'ils sont rejetés dans des eaux de surface et qu'ils auront tendance à demeurer dans le sol s'ils sont rejetés en milieu terrestre.
Par conséquent, pour ce sous-groupe de pigments monoazoïques, le sol et les sédiments devraient constituer les deux principaux milieux naturels préoccupants.
En raison de leur très faible hydrosolubilité, les pigments monoazoïques peuvent être considérés comme n'étant pas disponibles pour l'absorption par les organismes et la biodégradation. De plus, une fois qu'ils sont intégrés aux substances comme colorants, leur forme n'est probablement plus facilement disponible pour le biote (Øllgaard et al., 1998; Herbst et Hunger, 2004).
Il convient également de noter que, d'après les renseignements sur les propriétés physiques et chimiques et les utilisations des pigments monoazoïques, il ne devrait pas y avoir d'émissions atmosphériques de ces substances. Par conséquent, le potentiel de transport atmosphérique à grande distance de ces substances à partir de leurs sources d'émissions n'a pas été calculé.
5.1 Persistance et potentiel de bioaccumulation
5.1.1 Persistance dans l'environnement
Afin d'évaluer la persistance dans l'environnement des substances dans le sous-groupe des pigments monoazoïques, des données empiriques, des données modélisées et des renseignements disponibles sur des analogues structuraux ont été pris en compte.
On s'attend à ce que les caractéristiques transmises aux pigments entraînent la persistance de ces substances dans l'environnement. Par exemple, la Color Pigments Manufacturers Association, Inc. (CPMA, 2003) a déclaré que l'on conçoit les pigments pour qu'ils soient durables ou persistants dans l'environnement afin de pouvoir colorer des produits finis (p. ex. des revêtements, des encres, des peintures, et d'autres produits).
5.1.2 Biodégradation dans le milieu aquatique
Les résultats de plusieurs études sur la biodégradation sont disponibles pour certaines des substances de ce sous-groupe de pigments monoazoïques. Ces résultats sont résumés dans le tableau 5-1 (voir l'annexe 3 pour obtenir des renseignements plus détaillés sur les substances).
Les résultats des cinq études (annexe 3) indiquent que les valeurs de biodégradation des pigments monoazoïques et des pigments de BONA laqués sont relativement faibles, allant de 0 % à 14 %. Les résultats des études de biodégradation sur le PR53:1, représentant le sous-ensemble de pigments de β-naphtol laqués, sont quelque peu contradictoires, soit 0 % et 33 % (tableau 5-1; annexe 3).
| Sous-ensemble (substance) | Valeur de la biodégradation (%) | Durée de l'essai (en jours) |
Type de biodégradation | Référence |
|---|---|---|---|---|
| Pigments jaunes monoazoïques (PY1) | 14 | 28 | Intrinsèque | Étude présentée, 2012a |
| Pigments de BONA laqués (PR48:2; PR57:1*) | 0-12,9 | 28 | Immédiate | MITI, 1992; ECHA, 2012 |
| Pigments de βnaphtol laqués (PR53:1) | 0; 33 | 14; 21 | Immédiate (0) Intrinsèque (33) |
MITI, 1992; Commission européenne 2000a |
Les valeurs de biodégradation relativement élevées (12,9 %; 14 %; 33 %) pourraient probablement être attribuées à la biodégradation des impuretés organiques ou des additifs dans le pigment plutôt que dans le composant de pigment. En effet, les résines, les rosins, les amines aliphatiques, et d'autres composés comme les surfactants, les agents dispersants et les agents de couplage, sont des additifs communs utilisés dans les préparations des pigments, selon l'application de ces derniers (Herbst et Hunger, 2004). Les pigments azoïques sont très difficiles à purifier; il est quasiment impossible de supprimer certaines impuretés par filtration du pigment ou par lavage intensif. Même l'effet des procédés d'extraction à chaud a tendance à être lent et insatisfaisant. Des quantités considérables d'espèces solubles peuvent demeurer dans le pigment même après des heures régulières de reflux ou de filtration répétée avec de l'eau fraîchement distillée (Herbst et Hunger, 2004). Dans la plupart des cas, les impuretés dans les pigments ne sont pas précisées; cependant, pour le PR112, la substance 3-hydroxy-2′-méthyl-2-naphtanilide est déclarée comme un composant d'impureté, tandis que la pureté du pigment est déclarée comme étant de 90 % à 100 % (ECHA, 2012).
Par conséquent, la biodégradation des impuretés/additifs, et non des composants de pigment, dans les études de biodégradation pourrait donner des valeurs de biodégradation plus élevées que celles qui sont attendues.
Cependant, la pureté des pigments n'est peut-être pas la seule raison derrière les valeurs de biodégradation relativement élevées dans certaines études. Par exemple, les deux valeurs de biodégradation (14 % et 33 %; voir le tableau 5-1) sont déclarées dans des études de biodégradation, tandis que des protocoles de biodégradation facile ont été utilisés dans tous les autres essais (valeurs de biodégradation inférieures). Par conséquent, les différences dans les procédures d'essai de ces deux types d'essais de biodégradation peuvent expliquer les différences dans les données obtenues.
En effet, les essais de biodégradabilité immédiate sont des tests de dépistage rigoureux menés dans des conditions aérobies, dans lesquels l'inoculum ne devrait pas être préadapté à la dégradation de la substance d'essai par l'exposition antérieure à cette dernière ou à des substances chimiques structurellement apparentées. Au contraire, les essais de biodégradabilité intrinsèque permettent une exposition prolongée de la substance d'essai à des microorganismes et d'une faible proportion de la substance d'essai à la biomasse, ce qui offre une meilleure chance d'obtenir un résultat positif comparativement aux essais de biodégradation immédiate. Certains de ces essais peuvent être effectués en utilisant les microorganismes qui ont déjà été exposés à la substance d'essai, ce qui entraîne souvent l'adaptation, puis l'augmentation considérable du taux de dégradation (OCDE, 2005). Ainsi, les valeurs de biodégradation découlant des études de biodégradabilité intrinsèque sont généralement plus élevées (et parfois beaucoup plus élevées) que celles provenant des essais de biodégradation immédiate.
Par conséquent, on peut supposer que dans les études de biodégradation intrinsèque, c'est-à-dire dans les conditions les plus favorables, les pigments monoazoïques, les impuretés organiques ou les additifs peuvent se dégrader et donner des valeurs de biodégradation plus élevées que prévu. Ainsi, les valeurs de biodégradation élevées obtenues dans ces études ne reflètent pas la dégradabilité « réelle » du composant de pigment.
L'adsorption des pigments sur les boues (utilisées comme inoculum, c'est-à-dire la source des microorganismes dans l'essai) pourrait être une autre raison de la hausse relativement élevée (33 %) des valeurs de biodégradation, ce qui n'est pas typique des pigments purs. En effet, l'étude avec le PR53:1 mettait en avant le point important selon lequel dans une étude d'essai, 10 % de l'élimination du carbone organique dissous (COD) se produisaient à cause de l'adsorption sur des boues (voir l'annexe 3 pour obtenir plus de détails).
Par conséquent, la présence d'impuretés/additifs organiques et leur biodégradation ultérieure, et le type d'essai de biodégradation (c.-à-d. biodégradation intrinsèque par rapport à biodégradation immédiate) et l'adsorption de carbone organique dissous sur l'inoculum (boues) sont les principaux facteurs expliquant les valeurs exceptionnellement élevées de la biodégradation dans certains essais de biodégradation avec les pigments monoazoïques dans le milieu aquatique. Par conséquent, de telles études ne sont pas considérées comme des études clés et leurs résultats n’ont pas été utilisés dans l’évaluation des risques des pigments monoazoïques.
Les résultats d'études sur la biodégradation ne sont pas disponibles pour tous les sous-ensembles de pigments (ou pigments individuels) dans le sous-groupe des 33 pigments monoazoïques. Cependant, compte tenu du fait que les résultats des études de biodégradation avec les pigments purs sont très faibles (habituellement, moins de 10 % à 13 %) pour trois sous-ensembles de ce sous-groupe de pigments monoazoïques (voir le tableau 5-1 et l'annexe 3) ainsi que pour un groupe de pigments jaunes diarylides qui ont été évalués antérieurement par Environnement Canada et par Santé Canada (2014c), on peut supposer que tous les pigments monoazoïques ne se biodégradent pas facilement.
Ainsi, compte tenu de l’ensemble de ces renseignements, il peut être conclu que, dans des conditions aérobies, les pigments monoazoïques devraient être facilement biodégradables dans l’eau.
La persistance des pigments monoazoïques en milieux anoxiques est à l'origine d'une importante marge d'incertitude, en raison du manque de données sur les pigments. Bien que certains colorants azoïques soient déclarés biodégradables dans les eaux anoxiques par la réduction anaérobie de la liaison azoïque (- N=N -), entraînant ainsi la production d'amines aromatiques potentiellement nocives (Øllgaard et al., 1998), on n'a trouvé aucun document concernant le potentiel de dégradation anaérobie des pigments azoïques en milieu aqueux. En théorie, le cristal du pigment devrait d'abord se dissoudre pour introduire ses molécules constitutives dans le milieu aqueux et rendre les liaisons azoïques disponibles pour la réduction biotique ((Øllgaard et al., 1998). Cependant, on peut s'attendre à ce que seulement une petite proportion des pigments monoazoïques soit réduite de cette manière, compte tenu de leur état physique unique (les pigments sont habituellement composés de particules primaires, c'est-à-dire le réseau cristallin du pigment ainsi que des agrégats et des agglomérats) et de leur très faible solubilité dans l'eau, ce qui pourrait limiter la disponibilité des molécules pour la réduction biotique.
5.1.3 Biodégradation dans le sol et les sédiments
Aucune étude sur la biodégradation des pigments monoazoïques dans le sol ou les sédiments n'a été relevée. Cependant, des demi-vies approximatives dans le sol et les sédiments peuvent être calculées à l'aide des valeurs recommandées pour l'eau multipliées par des facteurs d'échelle. Ces facteurs sont des chiffres qui, lorsqu'ils sont multipliés par une constante du taux de dégradation ou une demi-vie pour un ensemble de conditions environnementales ou d'essai, donnent un taux pour un deuxième ensemble de conditions différent (USEPA, 2000).
Boethling et al. (1995) ont recueilli des données mesurées sur la demi-vie pour une grande variété de produits chimiques qui ont été mis à l'essai dans des échantillons de sol et d'eau prélevés dans l'environnement, puis ils ont calculé les rapports moyens entre la demi-vie dans l'eau et la demi-vie dans un sol à surface aérobie pour 20 substances chimiques. Il a été suggéré qu'à des fins d'évaluation, il est acceptable de supposer que la biodégradation dans l'eau de surface aérobie est quasiment aussi rapide que la dégradation dans un sol à surface aérobie et que les demi-vies dans les sédiments peuvent être trois à quatre fois plus longues (USEPA, 2000).
Par conséquent, en termes de demi-vie de biodégradation, en utilisant un ratio d’extrapolation de 1:1:4 pour l’eau, le sol et les sédiments (Boethling et al., 1995), et la demi-vie de biodégradation ultime supérieure ou égale à 182 jours dans l’eau sur la base des valeurs expérimentales sur la biodégradation de 0 à 13 % (pour les pigments monoazoïques purs).
Dans les sédiments anaérobies, une réduction de la liaison « azo » limitée par la solubilité est toujours possible. Cependant, étant donné les caractéristiques physiques et chimiques uniques des pigments monoazoïques (nature particulaire et faible hydrosolubilité solubilité), on s'attend à ce qu'une très petite proportion de ces pigments seulement soit disponible pour les microorganismes et la réduction biotique.
Par conséquent, compte tenu du fait que les pigments monoazoïques n'existent généralement pas sous forme de molécules individuelles, mais principalement sous forme de particules à l'échelle submicrométrique ou micrométrique faible, et que leur solubilité dans l'eau est très faible (de l'ordre du microgramme ou du submicrogramme par litre), la biodisponibilité de ces substances pour les microorganismes et la biotransformation (réduction biotique) devrait être très limitée. Cela est confirmé par les résultats de plusieurs études de biodégradation avec les pigments des trois sous-ensembles de ce sous-groupe de pigments monoazoïques (voir le tableau 5-1 et l'annexe 3) ainsi que des substances représentant un groupe de pigments jaunes diarylides (voir Environnement Canada et Santé Canada, 2014c). Dans le sol et les sédiments, ces substances ne devraient pas non plus se biodégrader facilement.
5.1.4 Dégradation abiotique
Aucune donnée expérimentale n'a été relevée pour la photodégradation des pigments monoazoïques dans l'air. Les prévisions à l’aide du modèle AOPWIN de EPISuite, version 4.10 (AOPWIN 2010) indiquent que les demi-vies calculées (réaction indirecte avec des radicaux hydroxyles sur la base d’une journée de 12 heures) pour la plupart des pigments étaient relativement courtes, soit de 0,6 à 11,5 heures seulement; seules trois substances (PY3, PR52:2 et NSNAC) ont des demi-vies légèrement plus longues de 24 à 26 heures.
Les pigments monoazoïques devraient être stables sur le plan hydrolytique. Par exemple, dans une étude sur le PR57:1* (analogue, représentant le sous-ensemble de pigments de BONA laqués, le pigment n’a pas été hydrolysé aux pH de 4, 7 et 9 (MITI, 1992).
5.1.5 Résumé de la persistance dans l’environnement
Sur la base des données empiriques (tableau 5-1 et annexe 3) et des considérations mentionnées précédemment, on s’attend à ce que les 33 pigments monoazoïques soient persistants dans l’eau, le sol et les sédiments, mais pas dans l’air (en raison de réactions avec les radicaux hydroxyles).
La nature particulaire et les propriétés physicochimiques uniques des pigments monoazoïques (faible solubilité, stabilité chimique et hydrolytique, faible potentiel de biodégradation facile) laissent penser que ces pigments se répartiront dans les sédiments (s'ils sont rejetés dans les eaux de surface) et auront une biodisponibilité limitée. Ainsi, leur bioaccumulation dans les organismes aquatiques et leur toxicité aquatique devraient être relativement faibles.
5.2 Potentiel de bioaccumulation
Afin d'évaluer le potentiel de bioaccumulation des substances de ce sous-groupe de pigments monoazoïques, seules des données empiriques ont été prises en considération, étant donné que l'absence de couverture structurelle des pigments dans les modèles de bioaccumulation actuels donnent un niveau élevé d'incertitude lié aux prévisions de modèles. Une méthode fondée sur le poids de la preuve impliquant les propriétés intrinsèques des substances, et les données empiriques disponibles sur la bioaccumulation ont été utilisées pour déterminer le potentiel global de bioaccumulation de ce sous-groupe de pigment.
5.2.1 Facteurs physiques et chimiques
5.2.1.1 Nature particulaire des pigments
Les pigments monoazoïques se présentent principalement sous forme de particules à l'échelle submicrométrique ou micrométrique faible, et la poudre pigmentaire est composée habituellement de particules primaires (c'est-à-dire le réseau cristallin d'un pigment), d'agrégats et d'agglomérats. Cela indique la biodisponibilité limitée de ces substances relativement aux organismes.
5.2.1.2 Solubilité dans l'eau
La solubilité dans l'eau des pigments monoazoïques est très faible, notamment de l'ordre du microgramme ou du submicrogramme par litre uniquement. Par conséquent, la biodisponibilité de ces substances relativement aux organismes devrait être très limitée.
5.2.1.3 Coefficients de partage octanol-eau et carbone organique-eau
Tel qu'il est mentionné dans la section sur les propriétés physiques et chimiques de ce rapport, un paramètre de solubilité dans l'octanol et l'eau (Soct/Se) représenterait de manière plus ou moins fiable le coefficient de partage octanol-eau pour les pigments organiques.
Pour tous les sous-ensembles de pigments laqués (c.-à-d. les pigments de BONA laqués, les pigments de β-naphtol laqués et les pigments AS laqués) et le seul pigment de benzimidazolone, le PO36 représentant 9 des 33 substances, les valeurs de log (Soct/Se), basées sur des valeurs de solubilité expérimentales dans l'eau et le n-octanol, varient grandement, notamment de -0,75 à 0,94 (voir le tableau 3-1 et l'annexe 2). Ces valeurs sont bien inférieures au critère de Koe pour la bioaccumulation (log Koe supérieur(e) ou égal(e) à 5) où ni le facteur de bioaccumulation (FBA) ni le facteur de bioconcentration (FBC) de la substance ne peuvent être déterminés selon une méthode indiquée dans l'article 5 du Règlement sur la persistance et la bioaccumulation (Canada, 2000). Par conséquent, sur la base des valeurs expérimentales du log (Soct/Se), ces 9 substances ont un faible potentiel de bioaccumulation dans les organismes.
Contrairement aux pigments laqués, les pigments non laqués donnent, dans l'ensemble, des valeurs de log (Soct/Se) plus élevées qui, en même temps, demeurent inférieures au critère de Koe pour la bioaccumulation (log Koe supérieur(e) ou égal(e) à 5), qui est mentionné ci-dessus. Par exemple, le PR5, le PR187, le PR266 et le PO38, qui représentent le sous-ensemble des pigments de naphtol AS, donnent des valeurs de log (Soct/Se) de 0,4 à 1,7, tandis que les valeurs de log (Soct/Se) pour le PO5, le PR112 et le PY3, qui représentent trois sous-ensembles différents des 33 pigments monoazoïques, sont légèrement plus élevées, allant de 2,4 à 2,9 (annexe 2).
Seuls trois pigments donnent des valeurs relativement élevées pour le logarithme du quotient des concentrations molaires d'un soluté dans le n-octanol et l'eau : le PR3 et le PR4 (sous-ensemble des pigments de β-naphtol pigments), qui donne des valeurs de log (Soct/Se) de 3,5 à 3,7, et le PY1 (sous-ensemble de pigments jaunes monoazoïques), qui est caractérisé par une valeur de log (Soct/Se) de 4,6 (annexe 2). Malgré tout, ces résultats sont inférieurs au critère de Koe pour la bioaccumulation (log Koe supérieur(e) ou égal(e) à 5).
Seule une étude expérimentale sur les coefficients de partage carbone organique-eau (Kco ) est disponible; elle indique que le PY1 (sous-ensemble des pigments jaunes monoazoïques) est caractérisé par une valeur de log Kco relativement élevée de 5,5 (voir le tableau 3-1). Selon les résultats de l'étude, la valeur de log Kcocalculée se situe en dehors de la plage étalonnée, ce qui signifie que le résultat peut uniquement être considéré comme une valeur reflétant un ordre de grandeur plutôt que comme une valeur absolue. Néanmoins, compte tenu de l'ordre de grandeur, les deux valeurs (càd. log (Soct/Se) = 4,6 et log Kco = 5,5) concordent, ce qui montre que les deux coefficients de partage sont proches du critère de Koepour la bioaccumulation (log Koe supérieur(e) ou égal(e) à 5) lorsque ni le FAB, ni le FBC de la substance ne peuvent être déterminés.
Par conséquent, sur la base des valeurs expérimentales du log (Soct/Se), on s’attend à ce que tous les pigments monoazoïques, sauf le PY1 (sous-ensemble des pigments jaunes monoazoïques), présentent un faible potentiel de bioaccumulation dans les organismes.
5.2.1.4 Taille moléculaire et diamètres transversaux
En ce qui concerne la bioaccumulation, il est également utile de tenir compte de la taille moléculaire et des diamètres transversaux, qui sont couramment utilisés par des autorités internationales dans la méthode du poids de la preuve pour tirer des conclusions sur le potentiel de bioaccumulation. Par exemple, l'étude ECHA (2008), qui décrit les « indicateurs pour une bioaccumulation limitée », ont montré que certains indicateurs supplémentaires pour le faible potentiel de bioaccumulation, en particulier un diamètre maximal (Dmax) moyen supérieur à 1,7 nm, pourraient être applicables aux substances ayant une faible solubilité dans le n-octanol et l'eau.
Des études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al., 2002, 2005) laissent entendre que la probabilité qu'une molécule traverse des membranes cellulaires à la suite d'une diffusion passive diminue de façon importante lorsque le diamètre maximal (Dmax) augmente; ainsi la probabilité diminue de façon notable lorsque le diamètre maximal est supérieur à environ 1,5 nm et de façon beaucoup plus importante lorsque le diamètre maximal est supérieur à 1,7 nm; Sakuratani et al. (2008) ont également étudié l'effet du diamètre transversal sur la diffusion passive à l'aide d'un ensemble d'essais sur le FBC comptant environ 1 200 substances chimiques nouvelles et existantes. Ils ont observé que les substances qui ne présentent pas un potentiel de bioconcentration très élevé (FBC inférieur à 5 000) ont souvent un diamètre maximal (Dmax) supérieur à 2,0 nm et un diamètre effectif (Deff) supérieur à 1,1 nm. Anliker et al. (1988) ont proposé qu'un deuxième plus grand diamètre transversal supérieur à 1,05 nm avec un poids moléculaire supérieur à 450 g/mol pourrait indiquer un manque de bioconcentration pour les colorants organiques. Par conséquent, les valeurs du Deff supérieures à 1,05 - 1,1 nm et les valeurs du Dmax supérieures à 1,5 - 1,7 nm peuvent servir d'indicateurs pour le potentiel de réduction du taux d'absorption à partir de l'eau. Une réduction du taux d'absorption permet à d'autres processus d'élimination interne comme le métabolisme et l'expulsion de la matière fécale, de réduire la charge globale de produits chimiques dans les tissus des organismes, réduisant ainsi la bioaccumulation dans tout l'organisme.
Il est connu que les pigments organiques synthétiques ont une nature particulaire; en général, ils sont caractérisés par une très faible solubilité dans l'eau et, par conséquent, une biodisponibilité très limitée. Parallèlement, la fraction hydrosoluble du pigment, même si infime, peut théoriquement traverser les membranes biologiques. Par conséquent, les diamètres moléculaires des pigments peuvent être liés à leur perméabilité dans la plupart des membranes biologiques.
Le tableau 5-2 présente des estimations du Deff, du Dmax et du Dmin moyens de certains pigments monoazoïques, calculés par le modèle FBCmax avec des facteurs d'atténuation (Dimitrov et al., 2005). Les calculs des diamètres transversaux des pigments monoazoïques comprennent l'analyse de jusqu'à 30 conformères.
| Sous-ensemble (nombre de pigments) | Deff moyen (nm) | Dmax moyen (nm) | Dmin moyen (nm) |
|---|---|---|---|
| Pigments jaunes monoazoïques (n = 3) | 1,0 | 1,5 | 0,7 |
| Pigments de β-naphtol (n = 6) | 0,9 | 1,4 | 0,6 |
| Pigments de β-naphtol AS (n = 11) | 1,2 | 1,8 | 0,8 |
| Pigments de benzimidazolone (n = 1) | 1,1 | 1,6 | 0,7 |
| Pigments de BONA laqués (n = 1) | 1,1 | 1,5 | 0,7 |
| Pigments de pyrazoloquinazolone (n = 1) | 1,1 | 1,8 | 0,7 |
Des données montrent que les diamètres transversaux des molécules de pigments de naphtol AS, de pigments de BONA laqués, de pigments de benzimidazolone, et de pigments de pyrazoloquinazolone ont un Deff moyen supérieur à 1,05 nm. Le Dmax moyen de tous les sous-ensembles de pigments, sauf les pigments de β-naphtol sont égaux ou supérieurs à 1,5 nm, tandis que les pigments de naphtol AS et les pigments de pyrazoloquinazolone ont un Dmax supérieur à 1,7 nm (tableau 5-2). Par conséquent, en ce qui concerne les diamètres transversaux, on peut supposer que les pigments jaunes monoazoïques (y compris le PY1, qui est caractérisé par des valeurs de log Soct/Se et de log Kco élevées) et les pigments de β-naphtol, dont les valeurs de diamètre ne dépassent pas les valeurs limites recommandées par Dimitrov et al. (2002, 2005) et par Sakuratani et al. (2008), ne connaîtront probablement pas une absorption limitée découlant d'effets stériques à la surface des branchies des poissons.
Toutefois, il faut noter que selon la méthode d'Arnot et al. (2010), des doutes subsistent concernant les seuils proposés par Dimitrov et al. (2002, 2005) et par Sakuratani et al. (2008), étant donné que les études sur la bioaccumulation utilisées pour calculer ces seuils n'ont pas toujours fait l'objet d'évaluations critiques. Arnot et al. (2010) soulignent que la taille moléculaire a un effet sur la solubilité et la capacité de diffusion dans l'eau et dans les phases organiques (membranes), et que les plus grosses molécules peuvent avoir un taux d'absorption plus lent. Toutefois, ces mêmes contraintes liées aux cinétiques s'appliquent aux voies de diffusion de l'élimination chimique (c.-à-d. absorption lente = élimination lente). Un potentiel de bioaccumulation important peut donc s'appliquer aux substances qui sont soumises à un processus d'absorption lent, si elles sont biotransformées ou éliminées lentement par d'autres processus. Cependant, si le taux d'absorption par les branchies est suffisamment atténué par l'encombrement stérique à un point tel que le taux d'élimination dépasse l'absorption, la bioconcentration sera réduite.
Il est important de tenir compte d'autres paramètres et processus physiologiques, tels que le métabolisme, ainsi que de renseignements sur le Koe (en effet, la substance peut être caractérisée par une valeur de Koe élevée et, en même temps, être rapidement métabolisée ou biotransformée dans l'organisme). Ainsi, les données doivent idéalement être prises en compte avec d'autres renseignements sur la bioaccumulation de ces substances.
5.2.2 Facteur de bioconcentration (FBC)
Pour le sous-groupe des pigments monoazoïques, deux études expérimentales sur le facteur de bioconcentration ont été relevées. Les résultats de ces études sont présentés au tableau 5-3.
| Substance | Sous-ensemble | FBC (L/kg) | Conditions d'essai | Référence |
|---|---|---|---|---|
| PR53:1 | Pigments de βnaphtol laqués | 0,9-1,8 (à 700 µg/L) | Durée de l'essai : 6 semaines Teneur en lipides dans les poissons : 3,4 % |
MITI, 1992 |
| PR53:1 | Pigments de βnaphtol laqués | 8,5-15 (à 70 µg/L) | Durée de l'essai : 6 semaines Teneur en lipides dans les poissons : 3,4 % |
MITI, 1992 |
| PR57:1* | Pigments de BONA laqués | inférieur(e) à 0,7-1,8 (à 300 µg/L) | Durée de l’essai : 6 semaines Teneur en lipides dans les poissons : 3,7 % |
MITI, 1992 |
| PR57:1* | Pigments de BONA laqués | inférieur(e) à 6,9 (à 30 µg/L) | Durée de l’essai : 6 semaines Teneur en lipides dans les poissons : 3,7 % |
MITI, 1992 |
Des données montrent que pour les pigments PR53:1 et PR57:1*, représentant les sous-ensembles de pigments de β-naphtol laqués et de pigments de BONA laqués, respectivement, toutes les valeurs du facteur de bioconcentration disponibles ne dépassent pas 15 L/kg chez la carpe commune, ce qui indique que ces deux sous-ensembles de pigments monoazoïques ont un faible potentiel de bioconcentration chez les poissons à partir de l'eau. Ces données concordent avec les valeurs de log (Soct/Se) mentionnées ci-dessus, qui sont très faibles pour ces sous-ensembles de pigments.
Aucune donnée expérimentale sur les FBC pour d'autres sous-ensembles des 33 pigments monoazoïques (ou leurs analogues) dans les organismes aquatiques n'a été relevée. Parallèlement, les données disponibles sur le FBC pour d'autres groupes (classes) de pigments laissent penser que ces pigments ont également un faible potentiel de bioconcentration chez les poissons à partir de l'eau (en fait, aucune étude expérimentale avec des valeurs de facteur de bioconcentration élevées pour n'importe quel pigment n'a été relevée. Par exemple, les résultats de plusieurs études sur le FBC pour les pigments jaunes diarylides indiquent que toutes les valeurs de FBC ne dépassent pas 6,2 L/kg chez la carpe commune, ce qui confirme que les pigments jaunes diarylides ont un faible potentiel de bioconcentration chez les poissons à partir de l'eau (pour obtenir plus de détails, voir Environnement Canada et Santé Canada, 2013d).
L'étude ECHA (2008) a présenté une méthode du poids de la preuve pour l'un des pigments jaunes diarylides, à savoir le Pigment Yellow 12. Compte tenu de la faible solubilité dans le n-octanol et du faible log (Soct/Se) ainsi que des données pharmacocinétiques (étude pharmacocinétique par molécule marquée au C14 chez des rats n'indiquant pas d'absorption par la nourriture et d'excrétion complète du Pigment Yellow 12 par les matières fécales), l'étude ECHA (2008) a conclu que le Pigment Yellow 12 n'est pas une substance bioaccumulable.
Dans les documents et recommandations scientifiques des autorités internationales, il existe d'autres données sur la bioaccumulation des pigments. Par exemple, Anliker et Moser (1987) ont étudié les limites de bioconcentration des pigments azoïques chez des poissons de même que les relations entre ces limites et le coefficient de partage et la solubilité dans l'eau et le n-octanol. Malgré une valeur élevée du log Koe calculée pour deux pigments, les log FBC établis de manière expérimentale étaient faibles. La raison de cette incohérence apparente est le potentiel de stockage très limité de gras (lipides) pour ces pigments, tel qu'il est indiqué par leur faible solubilité dans le n-octanol (inférieur(e) à 1 et inférieur(e) à 0,1 mg/L) et leur taille moléculaire importante (diamètre transversal de 0,97 et 1,68 nm).
Une autre étude, Anliker et al. (1988), a évalué les différents pigments et teintures, y compris deux pigments organiques pour lesquels les valeurs expérimentales du FBC chez les poissons étaient connues (16 hydrocarbures aromatiques halogénés ont été inclus aux fins de comparaison). Aucun des colorants dispersés, même les colorants très lipophiles ayant un log Koe supérieur à 3, ne s'est s'accumulé de façon importante chez les poissons. Les auteurs ont indiqué que la grande taille moléculaire des colorants empêche leur perméation efficace à travers des membranes biologiques (tissus des branchies) et, ainsi, limite leur absorption au cours de la période d'exposition.
Par conséquent, les résultats expérimentaux des études pharmacologiques et sur les facteurs de bioconcentration (FBC) indiquent que les pigments ont un potentiel limité en matière de bioaccumulation dans les organismes.
5.2.3 Considérations sur d'autres mécanismes possibles d'absorption et de bioaccumulation des pigments
Un autre aspect de la biodisponibilité et de la bioaccumulation des pigments chez les organismes non humains peut également être pris en compte. De nombreux pigments ont une taille de particules de l'ordre du nanomètre ou du micromètre et, par conséquent, s'inscrivent partiellement dans l'échelle nanométrique (p. ex. 1 à 100 nm; Canada, 2007; Santé Canada, 2011a). Lynch et al. (2006), Rothen-Rutishauser et al. (2006), Smart et al. (2006) et d'autres études indiquent que des nanoparticules peuvent être absorbées par différents types de cellules de mammifères et sont capables de traverser la membrane cellulaire et être ainsi internalisées. Plus important encore, l'interaction des nanoparticules avec les cellules et leur absorption dépendent de la taille (Limbach et al., 2005; Chithrani et al., 2006) et de la forme (Pal et al., 2007), et l'absorption se produit par l'intermédiaire de l'endocytose et de la phagocytose dans des cellules spécialisées.
La diffusion passive est considérée comme le principal mécanisme pour le transport de substances à travers l'épithélium pour la plupart des produits pharmaceutiques et des contaminants organiques environnementaux, bien que des mécanismes de transport facilité, actif, paracellulaire et phagocytaire (pinocytose et endocytose) puissent être importants pour certaines substances (DeVito, 2000). La diffusion passive plutôt qu'un processus facilité contrôle l'absorption des polluants organiques persistants et hydrophobes (Kelly et al., 2004).
Parallèlement, des études de la bioaccumulation dans lesquelles le mécanisme endocytaire ou phagocytaire pourrait être confirmé de manière fiable n'ont pu être relevées pour les pigments monoazoïques. Si ce mécanisme était typique (ou important) pour les pigments jaunes diarylides, les résultats des études sur la bioaccumulation, notamment les valeurs du FBC élevées (ou relativement élevées) refléteraient l'existence de ce phénomène en termes d'absorption de pigments. Cependant, toutes les valeurs expérimentales de FBC disponibles montrent que certains pigments monoazoïques, notamment les pigments de β-naphtol laqués et les pigments de BONA laqués, ainsi que les pigments jaunes diarylides (voir Environnement Canada et Santé Canada, 2013d) ont un très faible potentiel de bioaccumulation chez les poissons à partir de l'eau.
Les résultats des études sur l'écotoxicité, qui sont abordés dans la section suivante du présent rapport, indiquent que les dispersions aqueuses des pigments monoazoïques à forte pureté ne causent pas d'effets biologiques perceptibles. Cela indique que la biodisponibilité de ces substances est limitée et que la phagocytose ne joue probablement pas un rôle important dans l'absorption des pigments monoazoïques.
5.2.4 Résumé du potentiel de bioaccumulation
Compte tenu de la cohérence de différents éléments de preuve, y compris les faibles valeurs expérimentales du log (Soct/Se) (inférieur(e) à 3) pour la plupart des pigments monoazoïques (pour lesquels des données expérimentales sur la solubilité sont disponibles), des valeurs moyennes de Deff égales ou supérieures à 1,1 pour certains pigments, et des très faibles valeurs expérimentales du FBC (inférieur(e) ou égal(e) à 15 L/kg), en général, les substances dans les pigments monoazoïques ne devraient pas se bioaccumuler dans les organismes aquatiques. Aucune étude montrant des valeurs de FBC élevées pour un pigment quelconque n'a été relevée.
Parallèlement, sur la base des valeurs de log (Soct/Se) et de log Kco (4,6 et 5,5, respectivement), le PY1 devrait avoir un potentiel de bioaccumulation relativement élevé; cependant, la mesure des propriétés est incertaine, et l'extrapolation à partir des propriétés de répartition pour obtenir un résultat de bioaccumulation dans un organisme sans tenir compte de la physiologie de ce dernier est très incertaine.
Par conséquent, sur la base de la nature particulaire des pigments monoazoïques, de leur faible hydrosolubilité, de leurs valeurs de log (Soct/Se) généralement faibles, des diamètres transversaux relativement élevés de nombreux pigments, et des très faibles valeurs expérimentales de FBC pour certains pigments, on peut s’attendre à ce que les pigments monoazoïques aient un faible potentiel de bioaccumulation dans les organismes aquatiques.
On peut également dire que le faible potentiel de bioaccumulation des pigments monoazoïques chez les poissons dû à leur fiable biodisponibilité indique que ce groupe de substances devrait présenter une faible toxicité. Ce point est confirmé par les données écotoxicologiques (consulter la section suivante) et par l'absence d'effets nocifs considérables observés dans le cadre d'études sur la bioconcentration.
6. Potentiel d'effets nocifs sur l'environnement
6.1 Évaluation des effets écologiques
Afin de fournir les meilleures preuves possibles pour évaluer les effets écologiques de substances dans le sous-groupe des pigments monoazoïques, seules des données empiriques ont été prises en compte, étant donné le niveau élevé d'incertitude liée à la modélisation de l'écotoxicité de ce sous-groupe de substances.
6.1.1 Environnement aquatique
Deux études sur la toxicité aiguë et chronique sont disponibles pour un groupe de pigments monoazoïques. Le tableau 6-1 présente un résumé des données empiriques disponibles sur l'écotoxicité pour ce groupe de substances et leurs analogues structuraux, tandis que l'annexe 4 contient des renseignements plus précis sur des études spécifiques. Les études ont été menées avec différents systèmes expérimentaux (statique, semi-statique, en conditions dynamiques) à différentes durées d'essai (essais de toxicité aiguë et chronique) sur différents organismes, notamment des poissons (dard-perche Brachydanio rerio; medaka Oryzias latipes; carpe commune Cyprinus carpio), cladocère (Daphnia magna), et algues (Desmodesmus subspicatus et Pseudokirchneriella subcapitata, anciennement connu sous le nom de Selenastrum capricornutum).
| Sous-ensemble (substance) | Type d'essai (durée) | Organisme | Paramètre et valeur | Détails | Référence |
|---|---|---|---|---|---|
| Pigments jaunes monoazoïques (PY1; PY3) | Toxicité aiguë (96 h) |
Dard-perche (Brachydanio rerio) | CL0 = 1 mg/L; CL50 supérieur(e) à 1 mg/L | Semi-statique. Solution saturée de pigment (1 mg/L; purité 99, 7 %). | Étude présentée, 2012b |
| Pigments jaunes monoazoïques (PY1; PY3) | Toxicité chronique (21 jours) | Puce d'eau (Daphnia magna) | CSEO = 1 mg/L | Semi-statique. Solution saturée (1 mg/L; pureté : 99,7 %). Effets : mortalité; taux de reproduction; poids corporel et longueur; apparence de la première couvée; nombre de couvées, autre | Étude présentée, 2012c |
| Pigments jaunes monoazoïques (PY1; PY3) | Toxicité chronique (72 h) | Algues D. subspicatus |
CSEO = 1 mg/L | Statique. Solution saturée (1 mg/L; pureté : 99,7 %). Effets : taux de croissance/rendement | Étude présentée, 2012d |
| Pigments jaunes monoazoïques (PY1; PY3) | Toxicité aiguë (48 h) |
Puce d'eau (Daphnia magna) | Aucun effet à 100 mg/L; | Statique. Solution saturée (100 mg/L; pureté : 99,8 %). Effets : immobilisation | Étude présentée, 2012e |
| Pigments de benzimidazolone (PO36) | Toxicité aiguë (96 h) |
Dard-perche (Brachydanio rerio) | CL0 = 1 mg/L; CL50 supérieur(e) à 1 mg/L | Semi-statique. Solution saturée de 1 mg de pigment (pureté : 99,5 %) | Étude présentée, 2012f |
| Pigments de benzimidazolone (PO36) | Toxicité chronique (21 jours) | Puce d'eau (Daphnia magna) | CSEO = 1 mg/L | Semi-statique. Solution saturée (1 mg/L; pureté : 99,5 %). Effets : poids corporel et longueur d'un adulte; taux de reproduction; apparence de la première couvée; nombre de couvées | Étude présentée, 2012g |
| Pigments de βnaphtol laqués (PR53:1) | Toxicité aiguë (96 h) |
Dard-perche (Brachydanio rerio) | CL50 supérieur(e) à 500 mg/L | Statique. Cinq concentrations nominales (7-180 mg/L), contrôle du diméthylsulfoxyde (DMSO) (0,5 mg/L) et contrôle de l'eau en laboratoire | CPMA, 2006a |
| Pigments de β-naphtol laqués | Toxicité aiguë (48 h) |
Medaka (Oryzias latipes) | CL50 supérieur(e) à 420 mg/L; CL50 supérieur(e) à 500 mg/L |
Semi-statique. | CPMA, 2006a |
| Pigments de β-naphtol laqués | Toxicité aiguë (48 h) |
Puce d'eau (Daphnia magna) | Aucun effet à saturation (CE0 = 2,2 mg/L; CE0 = 3,4 mg/L) |
Solution saturée. Pureté du pigment : 98,1 %. Aucun effet indésirable à saturation (à 2,2 et 3,4 mg/L) | Commission européenne, ©2000 |
| Pigments de βnaphtol (PR3) | Toxicité aiguë (48 h) |
Puce d'eau (Daphnia magna) | Aucun effet indésirable à saturation (à 0,9 et 1,6 mg/L) |
Statique. Solution saturée; concentration de pigment mesurée par les niveaux de carbones organiques dissous Aucun effet indésirable (immobilisation) à saturation | Étude présentée, 2007e |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité chronique (21 jours) | Puce d'eau (Daphnia magna) | CSEO = 1 mg/L | Semi-statique. Solution saturée (1 mg/L). Effets : mortalité; nombre de juvéniles; apparence de la première couvée; taux intrinsèque de croissance naturelle; croissance | ECHA, 2012 |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité aiguë (72 h) |
Algues (Scenedesmus subspicatus) | CSEO = 1 mg/L | Statique. 1 mg/L de solution saturée Effets : inhibition liée au taux; inhibition du rendement. | ECHA, 2012 |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité aiguë (48 h) |
Puce d'eau (Daphnia magna) | CE50 supérieur(e) à 100 mg/L | Statique. Solution saturée (100 mg/L). Aucun effet important (immobilisation) observé à saturation. | Étude présentée, 2007a |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité aiguë (96 h) |
Carpe commune (Cyprinus carpio) | CL50 = 172 mg/L | Statique. Six concentrations d'essai (non mesurées) Aucune réaction toxique relevée jusqu'à une concentration de 90 mg/L. | Étude présentée, 2007b |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité aiguë (24 h) |
Puce d'eau (Daphnia magna) | CE50 = 990,7 mg/L | Statique. Sept concentrations; 10 % d'immobilisation observée jusqu'à 500 mg/L. | Étude présentée, 2007c |
| Pigments de βnaphtol AS (PR112; PR2*; PR253*; PR146*) | Toxicité aiguë (48 h) |
Puce d'eau (Daphnia magna) | CE50 supérieur(e) à 100 mg/L | Statique. Solution saturée (100 mg/L). Aucun effet important (immobilisation) observé à saturation. | Présentation de projet, 2007d |
| Pigments de BONA laqués (PR57:1*) | Toxicité aiguë (24-96 h) |
Medaka (Oryzias latipes) | CL50 valeurs : 33; 44; 50; 98; et 170 mg/L | Semi-statique et renouvellement continu Cinq concentrations nominales (7-180 mg/L), pureté : 87 %, contrôle du diméthylsulfoxyde (DMSO) (0,5 mg/L) et contrôle de l'eau en laboratoire | EA Japan, 1992 |
| Pigments de BONA laqués (PR57:1*) | Toxicité aiguë (24 h) |
Puce d'eau (Daphnia magna) | CE50 = 280 mg/L | Statique. Cinq concentrations nominales (90-940 mg/L; pureté : 87 %), contrôle du diméthylsulfoxyde (DMSO) à HCO-40 = 9:1 (100 mg/L) et contrôle de l'eau en laboratoire | EA Japan, 1992 |
| Pigments de BONA laqués (PR57:1*) | Toxicité aiguë (24 h - 7 jours) |
Puce d'eau (Daphnia magna) | CL50 = 13; 18; 43; 210 mg/L | Semi-statique. Cinq concentrations nominales (3-300 mg/L; pureté : 87 %), contrôle du diméthylsulfoxyde (DMSO) à HCO-40 = 9:1 (100 mg/L) et contrôle de l'eau en laboratoire Effets : immobilisation |
EA Japan, 1992 |
| Pigments de BONA laqués (PR57:1*) | Toxicité chronique (14 à 21 jours) | Puce d'eau (Daphnia magna) | CL50 = 9,7; 10 mg/L |
Semi-statique. Cinq concentrations nominales (3-300 mg/L; pureté : 87 %), contrôle du diméthylsulfoxyde (DMSO) à HCO-40 = 9:1 (100 mg/L) et contrôle de l'eau en laboratoire Effets : immobilisation |
EA Japan, 1992 |
| Pigments de BONA laqués (PR57:1*) | Toxicité chronique (14 à 21 jours) | Puce d'eau (Daphnia magna) | CE50 = 4,4; 9,1 mg/L; CSEO = 3 mg/L | Semi-statique. Cinq concentrations nominales (3-300 mg/L; pureté : 87 %), contrôle du diméthylsulfoxyde (DMSO) à HCO-40 = 9:1 (100 mg/L) et contrôle de l'eau en laboratoire Effets : immobilisation |
EA Japan, 1992 |
| Pigments de BONA laqués (PR57:1*) | Toxicité chronique (72 h) | Algue (P. subcapitata) | CSEO = 5,8 mg/L; CL50 = 190 mg/L | Statique. CE50 de 13 concentrations nominales (1-1 000 mg/L; pureté : 87 %) et contrôle Effets : biomasse |
EA Japan, 1992 |
Il est important de noter que les résultats de toutes ces études sont fondés sur des taux de charge, et qu'on n'a relevé aucune étude comportant des concentrations mesurées ou nominales. Pour les essais aquatiques, la concentration nominale est la concentration qui existerait si toutes les matières d'essai ajoutées à la solution d'essai étaient complètement dissoutes et ne se dissipaient pas (USEPA, 1996). Bien que nombre des études présentées au tableau 6-1 fassent référence aux « concentrations nominales », elles semblent employer ce terme en tant que synonyme de « taux de charge » ou de « concentrations non mesurées », ce qui, strictement parlant, n'est pas la même chose. Par exemple, dans des études où des solvants ou des dispersants n'ont pas été appliqués, les valeurs de toxicité déclarées étaient de plusieurs ordres de grandeur supérieures aux limites d'hydrosolubilité des pigments testés (p. ex., CE50 de 990 mg/L c. hydrosolubilité de 0,008 mg/L pour le PR253*; voir les annexes 4 et 2, respectivement), ce qui laisse penser que la solution d'essai ne s'était pas complètement dissoute et que ces valeurs de toxicité étaient, en fait, des taux de charge plutôt que des concentrations nominales « traditionnelles ».
Ainsi, dans les études où les taux de charge dépassaient de façon exponentielle les limites d'hydrosolubilité des pigments (lorsque des solvants ou des dispersants n'étaient pas appliqués), les paramètres auraient probablement dû être déclarés de façon plus précise, comme le EL50 (taux de charge causant des effets indésirables dans 50 % des organismes exposés) au lieu de la CE50 (concentration causant des effets indésirables dans 50 % des organismes exposés), le LL50 (taux de charge causant la mortalité chez 50 % des organismes exposés) au lieu de la LC50(concentration causant la mortalité dans 50 % des organismes exposés) et le TCSEO (taux de charge sans effet observé) au lieu de concentration sans effet observé (CSEO). Toutefois, il semble y avoir des opinions divergentes dans la littérature scientifique. Le document Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures de l'OCDE (OCDE, 2000), dans lequel le protocole de production de fractions aqueuses contaminées (WAF) est abordé, indique que les « fractions aqueuses » contaminées peuvent donc être considérées comme analogues au terme « concentrations nominales » qui est utilisé pour les substances d'essai typiques avec toutes les limites lui étant inhérentes. Le document indique également que les valeurs du LL50 et du EL50 sont comparables aux valeurs de la CL50 ou de la CE50 déterminées pour les substances testées dans leur plage de solubilité.
Un autre problème avec les essais dans lesquels le protocole de production de fractions aqueuses contaminées (WAF) est appliqué consiste à déterminer si les fractions hydrosolubles des pigments sont bien présentes dans l'eau d'essai après que les particules non dissoutes ont été retirées par membrane filtrante. Dans certaines études, malgré l'utilisation de la membrane filtrante, les particules de pigments sont probablement toujours présentes dans l'eau d'essai. Dans certains essais, des éléments indiquent que les particules non dissoutes ont été retirées par membrane filtrante à l'aide de filtres d'une taille de pores de 0,45 µm. Cependant, certains pigments ont une granulométrie moyenne bien inférieure à 0,45 µm. Par exemple, dans l'évaluation du PR5 dans le cadre du Défi (voir Environnement Canada et Santé Canada, 2009c), l'étude sur le PR146* (analogue du PR5) est traitée, et il est mentionné que les matières particulaires du PR146* peuvent traverser le filtre, car la granulométrie moyenne du PR146* n'est que de 110 nm, tandis que la taille des pores du filtre utilisé est de 0,45 µm (c.-à-d. 450 nm). Il est entendu que lorsque l'on parle d'un filtre de 0,45 µm, cela signifie, en fait, que 0,45 µm est la taille du pore le plus grand; cependant, étant donné que les particules de pigments sont d'une taille bien inférieure à 0,45 µm (450 nm), il est très probable que des particules de pigments non dissoutes soient présentes dans l'eau d'essai.
Dans des essais aquatiques où les concentrations sont exponentiellement plus élevées que les limites d'hydrosolubilité des pigments, des doutes importants subsistent concernant la concentration d'exposition réelle dans l'eau d'essai. On peut donc conclure que dans tous les essais aquatiques avec des pigments monoazoïques, où des solvants ou des dispersants avaient été appliqués (voir le tableau 6-1 et l'annexe 4) et où les valeurs de toxicité étaient bien au-dessus des valeurs d'hydrosolubilité des substances, les résultats ne peuvent être interprétés comme « non toxiques à la concentration de saturation » ou « sans effet à la concentration de saturation » (c.-à-d., à des limites d'hydrosolubilité).
Il doit aussi être mentionné que dans les essais aquatiques où des solvants ou des dispersants ont été utilisés, des effets biologiques graves (tels que la CE50 ou la CL50) ont été signalés, et certaines valeurs de toxicité sont à des concentrations relativement faibles (p. ex. CE50 de 4,4 mg/L ou CL50 de 9,7 mg/L pour le PR57:1*; voir le tableau 61 et l'annexe 4), ce qui, selon certains schémas de classification de l'écotoxicité, indique que les pigments testés peuvent être considérés comme modérément toxiques (c.-à-d. CE50 ou CL50 de 1 à 100 mg/L). Malheureusement, similairement aux études sans solvant mentionnées précédemment, aucune concentration mesurée n'a été déclarée dans le cadre de ces études.
Il existe différentes raisons à l'origine de tels effets biologiques dans les études avec des solvants ou des dispersants. La première raison est que les pigments monoazoïques peuvent être modérément toxiques; c'est-à-dire que lorsque leurs limites de solubilité ont considérablement augmenté pour atteindre un certain niveau (en utilisant les solvants ou les dispersants), ces substances peuvent causer des effets nocifs.
Herbst et Hunger (2004) ont indiqué que même si, selon la définition, le pigment idéal est pratiquement insoluble dans son milieu d'application, cela peut, en fait, ne pas être le cas pour les pigments organiques. Étant donné qu'un pigment qui est, dans une certaine mesure, soluble dans son transporteur devrait avoir un effet très faible voire se recristalliser, déteindre ou proliférer, il est important de prévenir la dissolution du pigment. Il existe encore certains essais acceptés qui sont utilisés pour déterminer la mesure dans laquelle un pigment organique tolère des solvants (Herbst et Hunger, 2004).
Par conséquent, il est possible que dans les essais de toxicité aquatique avec des dispersants et des solvants (voir le tableau 6-1 et l'annexe 4), la solubilité des pigments ait fortement augmenté, passant, par exemple, de quelques microgrammes par litre à quelques milligrammes par litre.
Par ailleurs, on a indiqué que même des dispersants non toxiques peuvent avoir un effet prononcé sur la forme physique des substances hydrophobes testées dans le milieu d'essai, ce qui peut influencer leur biodisponibilité (Rufli et al., 1998). Par conséquent, les résultats d'un essai impliquant un dispersant peuvent être propres à un système substance-dispersant défini, et être difficiles à extrapoler dans d'autres conditions d'exposition. Rufli et al. (1998) pensent que des contrôles visant les dispersants uniquement peuvent déterminer les effets liés aux dispersants, mais pas les interactions entre les dispersants et la substance.
En outre, des concentrations d'essai bien supérieures à l'hydrosolubilité de la substance d'essai peuvent contenir des impuretés plus solubles dont les effets peuvent aussi porter à confusion dans l'interprétation de la toxicité réelle de la substance (Weyman et al., 2012). En effet, la substance PR57:1*, caractérisée par des valeurs de toxicité aiguë relativement faibles (quelques microgrammes par litre), avait une très faible pureté de seulement 87 % (voir le tableau 6-1 et l'annexe 4). Par conséquent, des impuretés (dont la proportion dans le pigment était assez important; 13 %) dissoutes dans le solvant qui a été utilisé dans les essais pourraient entraîner des effets biologiques néfastes importants.
Weyman et al. (2012) ont également indiqué que lorsqu’un solvant est utilisé, mais que la substance d’essai n’est pas complètement dissoute, des matières non dissoutes présentes dans le milieu d’essai ont le potentiel d’avoir des effets (physiques) nocifs sur les organismes d’essai, comme le blocage de membranes de l’appareil branchial des poissons, l’encapsulation ou le piégeage des daphnies, ou la réduction de l’intensité de la lumière (et, par conséquent, les taux d’inhibition de la photosynthèse) dans les essais sur des algues.
Concernant les valeurs expérimentales de la toxicité avec quelques milligrammes par litre dans les essais aquatiques où des solvants et des dispersants sont utilisés afin que l'hydrosolubilité apparente dépasse la solubilité maximale en équilibre thermodynamique dans l'eau, il convient de souligner que l'atteinte de concentrations si élevées (sous forme moléculaire) de pigments monoazoïques n'est probablement pas réaliste dans l'environnement canadien. Il est reconnu que les valeurs d'hydrosolubilité sont rarement identiques dans des études en environnement aquatique et en laboratoire. En effet, les essais en laboratoire sont menés dans des conditions qui souvent ne tiennent pas compte des différents co-solvants qui existent dans le milieu environnant, ce qui pourrait finir par avoir une incidence sur la solubilité et la biodisponibilité d'une substance. La température, la pression et les surfactants (qui peuvent être présents dans les milieux aquatiques) sont d'autres facteurs importants pouvant avoir une incidence sur la solubilité des substances chimiques dans l'environnement. Parallèlement, l'amélioration de l'hydrosolubilité dans l'environnement ne devrait pas dépasser les limites de solubilité mesurées en laboratoire de plus de trois ou six ordres de grandeur.
Par conséquent, des études sans solvants ou dispersants puissants sont considérées comme étant plus pertinentes sur le plan environnemental et permettent ainsi une plus forte inférence sur le potentiel de toxicité des pigments dans l'environnement aquatique. Dans ces études, il y a également eu des cas sans effet à une concentration de saturation en raison de la faible biodisponibilité des pigments monoazoïques. Par conséquent, on s'attend à ce que les pigments monoazoïques ne soient pas nocifs pour les organismes aquatiques du fait de la biodisponibilité limitée de ces substances dans des conditions environnementales réalistes.
Enfin, il convient de noter que pour l'évaluation des risques des substances, les études sur la toxicité chronique sont souvent préférées aux études sur la toxicité aiguë, car l'absence d'effets dans des études à court terme ne signifie pas nécessairement que la substance ne sera pas toxique au cours d'une exposition à plus long terme. Pour le sous-groupe des 33 pigments monoazoïques, trois études de la toxicité chronique sans solvant avec le Daphnia magna sont disponibles (annexe 4). Dans ces études, plusieurs paramètres ont été étudiés, y compris (mais sans s'y limiter) la reproduction, la mortalité et l'immobilisation des organismes, ainsi que leur masse corporelle et leur longueur. Les valeurs de concentration sans effet observé (CSEO) (taux de charge sans effet observé, TCSEO) étaient de 1. En outre, trois études chroniques avec des algues sont également disponibles. Dans deux études de la toxicité chronique, les valeurs de CSEO (TCSEO) étaient de 1 mg/L, et dans une autre étude, cette valeur était de 5,8 mg/L. Dans tous les cas, les résultats peuvent être interprétés comme « sans effet à la concentration de saturation ».
Ainsi, les renseignements disponibles laissent penser qu'« aucun effet à la concentration de saturation », que ce soit dans les études de toxicité aiguë ou chronique, ne s'est produit à cause de la faible biodisponibilité des pigments et de leur faible toxicité intrinsèque. L'absence d'effets indésirables observés dans de l'eau saturée par des pigments a été régulièrement relevée dans de nombreux essais et elle concorde avec les résultats indiquant peu ou pas de concentration. Ces résultats indiquent que les seuils de toxicité interne critiques ne sont pas atteints à des concentrations d'équilibre thermodynamique maximales ou à des concentrations supérieures dans l'eau.
Malheureusement, aucune donnée n'est disponible pour analyser les expositions alimentaires chez les organismes aquatiques (c.-à-d. via le réseau trophique); par conséquent, le potentiel d'effets liés à cette voie d'exposition demeure incertain.
6.1.2 Sol et sédiments
Afin d'associer la toxicité au devenir potentiel des 33 pigments monoazoïques dans l'environnement, des données empiriques pour le sol ont également été prises en compte. Ce milieu naturel est essentiel, car lorsque les substances du sous-groupe y sont émises (via l'épandage de biosolides), elle devrait y résider dans leur quasi-totalité (c.-à.-d. peu de dégradation ou d'advection).
Trois études sur la toxicité dans le sol sont disponibles pour les sous-ensembles de pigments jaunes monoazoïques et de pigments de naphtol AS (tableau 6-2). Les données montrent que, à un taux de charge de 1 000 mg/kg de sol ou de sédiments, aucun effet indésirable (p. ex. mortalité, reproduction et biomasse des organismes pour les vers de terre, taille et poids des pousses, taux d'émergence et effets phytotoxiques visibles pour les plantes) n'a été observé dans les études de toxicité chronique.
| Sous-ensemble (substance) | Type d'essai | Organisme | Paramètre et valeur | Détails | Référence |
|---|---|---|---|---|---|
| Pigments jaunes monoazoïques (PY1) | Toxicité chronique (56 jours) | Lombric (Eisenia fetida) | CSEO = 1 000 mg/kg de sol (poids sec) | Directive 222 de l'OCDE pour les essais de produits chimiques Pigment de haute pureté (99,7 %). Effets : mortalité; reproduction; poids corporel | Étude présentée, 2012b |
| Pigments jaunes monoazoïques (PY1) | Toxicité chronique (21 jours) | Avoine (Avena sativa); colza (Brassica napus); soja (Glycine max) | CSEO = 1 000 mg/kg de sol (poids sec) | Directive 208 de l'OCDE pour les essais de produits chimiques Pigment de haute pureté (99,7 %). Effets : longueur et poids des tiges; taux d'émergence | Étude présentée, 2012i |
| Pigments de naphtol AS (PR112) | Toxicité chronique (21 jours) | Avoine (Avena sativa); colza (Brassica napus); soja (Glycine max) | CSEO = 1 000 mg/kg de sol (poids sec) | Directive 208 de l'OCDE pour les essais de produits chimiques Sol naturel. Effets : nombre de plantules émergées et de plantes mortes; effets phytotoxiques visibles | ECHA, 2012 |
Par conséquent, sur la base de ces données, on peut conclure que, à de faibles concentrations, les pigments monoazoïques ne devraient pas être nocifs pour les organismes vivant dans le sol. Cela s'explique probablement par la faible disponibilité de ces substances dans les diverses phases qui incluent le sol non tamisé (solides, eau et air).
Bien que ces pigments denses insolubles dans l'eau devraient principalement demeurer dans les sédiments, aucune étude sur la toxicité dans les sédiments n'est disponible pour ce sous-groupe de 33 pigments monoazoïques. Par conséquent, des conclusions n'ont pu être établies sur la toxicité des sédiments.
6.1.3 Calcul des concentrations estimées sans effet (CESE)
6.1.3.1 Valeurs de CESE aquatiques
Plusieurs données expérimentales sur la toxicité issues d'études sur l'écotoxicité aquatique aiguë et chronique sont disponibles pour les pigments monoazoïques (voir le tableau 6-2 et à l'annexe 4). La plage de valeurs empiriques sur la toxicité aiguë issue de ces études est relativement importante, allant de 4,4 mg/L à presque 1 000 mg/L. Il a déjà été noté que, dans la plupart des études, des taux de charge ont été signalés, et très souvent, les données sur la toxicité aiguë ont été exprimées sous forme de plages, et non de valeurs définitives (p. ex., CL50 supérieur(e) à 100 mg/L). Pour les études chroniques, des valeurs de CSEO ont été déclarées; dans la plupart des cas, la valeur déclarée était 1 mg/L.
Pour calculer les valeurs de CESE pour différents sous-ensembles de pigments monoazoïques, on a dû choisir des valeurs critiques de toxicité (VCT). Les valeurs de CESE aquatiques ont alors été calculées comme suit :
CESE (mg/L) = VCT/FA
où FE est un facteur d'évaluation.
Le tableau 6-3 comporte une justification pour la sélection des valeurs critiques de toxicité ainsi que les valeurs critiques de toxicité elles-mêmes, les facteurs d'évaluation, et les valeurs de CESE calculées. Les principes suivants ont été utilisés lors du choix d'un facteur d'évaluation. Pour la même substance (ou le même sous-ensemble de substances), on a préféré utiliser des études de la toxicité chronique plutôt que de la toxicité aiguë. Un facteur d'évaluation de 10 a été appliqué pour les études de la toxicité chronique où des valeurs de toxicité (p. ex., 1 mg/L) relativement faibles (p. ex., une CSEO) ont été déclarées. Étant donné qu'aucun effet significatif sur le plan biologique ou statistique (y compris des paramètres sensibles, comme le taux de reproduction) n'a été relevé (par rapport aux groupes témoins) pour certaines substances dans des études de la toxicité chronique et aigue avec des invertébrés, un facteur d'évaluation de 10 a été utilisé, même dans des études de la toxicité aiguë. Lorsque « aucun effet à la concentration de saturation » n'a été relevé, un facteur d'évaluation de 10 a été utilisé. Dans l'étude sur la toxicité aiguë avec des poissons (sous-ensemble de pigments de BONA laqués), un facteur d'évaluation de 100 a été appliqué.
Pour certains sous-ensembles de pigments ou pigments individuels, les valeurs de CESE n'ont pu être calculées à cause de l'absence de valeurs expérimentales sur la toxicité. Pour ces substances, la valeur de CESE la plus faible disponible pour l'ensemble du groupe des 33 pigments a été choisie comme donnée de substitution (dans le tableau 6-3, ces valeurs de CESE sont indiquées par un astérisque).
| Sous-ensemble | VCT aquatique | Facteur d'évaluation | CESENote de bas de page Tableau 6-3 [a] aquatique |
|---|---|---|---|
| Pigments jaunes monoazoïques | 1 mg/L (CSEO la plus faible issue d'un essai de toxicité chronique dans le sous-ensemble) | 10 | 0,1 mg/L |
| Pigments de BONA laqués | Poissons : 33 mg/L (valeur de toxicité aiguë la plus faible); invertébrés : 3 mg/L (CSEO issue d'une étude de toxicité chronique); algues : 5,8 mg/L (CSEO issue d'une étude de toxicité chronique) | Poissons : 100; invertébrés et algues : 10 | Poissons : 0,33 mg/L; invertébrés : 0,3 mg/L; algues : 0,58 mg/L. CESE finale : 0,3 mg/L (la plus faible parmi tous les organismes testés) |
| Pigments de β-naphtol laqués | 2,2 mg/L (CE0 la plus faible issue d'un essai de toxicité aiguë) | 10 | 0,22 mg/L |
| Pigments de β-naphtol | 0,9 mg/L (valeur de toxicité aiguë la plus faible dans le sous-ensemble) | 10 | 0,09 mg/L |
| Pigments de naphtol AS | 1 mg/L (CSEO la plus faible issue d'un essai de toxicité chronique) | 10 | 0,1 mg/L |
| Pigments de benzimidazolone | 1 mg/L (CSEO issue d'un essai de toxicité chronique) | 10 | 0,1 mg/L |
| Pigments de BONA laqués - individuels | Non disponible | Non disponible | 0,09 mg/L* |
| Pigments de naphtol AS laqués | Non disponible | Non disponible | 0,09 mg/L* |
| Pigments de pyrazoloquinazolone | Non disponible | Non disponible | 0,09 mg/L* |
| Pigments jaunes monoazoïques - individuels | Non disponible | Non disponible | 0,09 mg/L* |
| Autres pigments - individuels (NSNAC) | Non disponible | Non disponible | 0,09 mg/L* |
6.1.3.2 Valeurs de CESE dans le sol et les sédiments
Trois études sur la toxicité dans le sol sont disponibles pour le sous-ensemble des 33 pigments monoazoïques (tableau 6-2). Ces études sont considérées comme étant des études clés de haute qualité, et la valeur de toxicité (CSEO) de 1 000 mg/kg de sol (poids sec) a été choisie comme valeur critique de toxicité (VCT).
Compte tenu du fait que, dans les deux études impliquant des plantes, les valeurs critiques de toxicité (VCT) ont été basées sur les valeurs de concentration sans effet observé (CSEO) tirées d’études à long terme, lorsqu’on n’a relevé aucun effet nocif létal ou sublétal (ou des effets phytotoxiques dans les essais avec différentes plantes) à la concentration de charge de 1 000 mg/kg de sol, un facteur d’application de 10 a été utilisé pour tenir compte de la variabilité interspécifique et intraspécifique de la sensibilité uniquement.
Une étude de toxicité pour le sol a été menée avec des vers de terre, qui constituent des organismes modèles excellents dans les études de l'écotoxicité en raison de leur exposition aux polluants des sols par voie d'ingestion et d'absorption passive à travers leur peau. Étant donné qu'aucun effet biologique néfaste (y compris des paramètres sensibles comme la reproduction) n'a été observé dans cette étude à long terme, on a jugé qu'un facteur d'évaluation de 100 serait trop prudent pour le calcul d'une CESE. Ainsi, un facteur d'évaluation de 10 a été appliqué.
Les valeurs de CESE obtenues pour le sol peuvent donc être calculées comme suit :
CESE dans le sol = (1 000 mg/kg de poids sec)/10 = 100 mg/kg de sol (poids sec)
Étant donné qu'aucune étude sur la toxicité pour les sédiments n'a été relevée pour le sous-groupe des 33 pigments monoazoïques, les valeurs de CESE pour les sédiments basées sur des valeurs critiques de toxicité expérimentales n'ont pu être calculées.
6.1.4 Résumé des effets écologiques
Sur la base des divers éléments de preuve impliquant des données empiriques sur l'écotoxicité dans des milieux naturels variés (eau et sol), on peut conclure que les 33 pigments monoazoïques ne devraient pas être nocifs pour les organismes vivant dans l'eau ou le sol à de faibles concentrations. Les données empiriques ont permis de calculer les CESE dans l'eau et le sol pour une caractérisation plus précise du risque écologique (c.-à-d. CEE c. CESE) que posent les pigments monoazoïques pour divers milieux naturels. Aucune conclusion sur les effets écologiques des 33 pigments monoazoïques sur les organismes vivant dans les sédiments ne peut être tirée en raison du manque de données écotoxicologiques.
6.2 Évaluation de l'exposition de l'environnement
6.2.1 Concentrations environnementales mesurées
6.2.1.1 Canada
Aucune donnée sur les concentrations environnementales mesurées (dans le sol ou les sédiments) des 33 pigments monoazoïques au Canada n'a été relevée, on a donc estimé les concentrations environnementales sur la base des renseignements disponibles.
6.2.1.2 Autres pays
Au cours de 2007-2008, l'Agence de protection de l'environnement de la Suède a mis au point des méthodes d`analyse et a effectué « une étude d'évaluation préalable » de certains pigments (Lilja et al., 2008). Dans cette étude de surveillance, quatre pigments monoazoïques (PY1, PR53:1, PR170 et PO5) ont été analysés dans divers échantillons environnementaux. Les résultats de cette étude sont résumés ci-dessous.
6.2.1.2.1 Zones de référence
Aucun des quatre pigments n'a été détecté dans les échantillons de sol, d'eau de surface, de sédiments ou de poissons dans les zones de référence (c.-à-d. les concentrations des quatre pigments étaient inférieures aux seuils de détection).
6.2.1.2.2 Sources diffuses
Du PY1, du PR53:1 et du PR170 ont été détectés dans des boues issues d’usines de traitement des eaux usées. Les plus fortes concentrations étaient de 100 000 µg/kg poids sec (ps) et de 88 000 µg/kg poids sec (PR170, deux mois consécutifs à une usine de traitement des eaux usées), qui étaient environ 1 000 fois plus élevées que les niveaux relevés à d’autres usines de traitement des eaux usées. Les niveaux de PY1 ont atteint environ 70 à 360 µg/kg poids sec (trois sites; données extrapolées à partir de diagrammes), tandis que les concentrations de PR53:1 ont atteint 50 à 200 µg/kg poids sec (trois sites; données extrapolées à partir de diagrammes).
Les quatre pigments se trouvent tous dans les influents d’usines de traitement des eaux usées. Le PY1 a été trouvé à trois usines de traitement des eaux usées aux plus fortes concentrations allant de 0,13 à 0,38 µg/L. Les concentrations de PR53:1 étaient de 0,007 à 0,027 µg/L (quatre usines de traitement des eaux usées) et celles de PR170 étaient de 0,068 à 0,090 µg/L (trois usines de traitement des eaux usées), tandis que du PO5 a été trouvé à des concentrations allant de 0,027 à 0,067 µg/L. Il est important de noter que pour le PY1, le PR53:1 et le PR170, 100 % de la teneur dans les influents se trouvait en phase particulaire. Pour le PO5, une petite fraction, soit 7,5 % de la teneur, se trouvait en phase aqueuse.
Les concentrations de pigments dans les effluents sont inférieures à celles dans les influents : PY1, inférieur(e) à 0,013 µg/L; PR53:1 et PO5, inférieur(e) à 0,003 µg/L; et PR170, inférieur(e) à 0,053 µg/L. Les auteurs ont suggéré que l’absence de pigments dans les effluents indique que la suppression de ces pigments se produit durant le traitement des eaux usées.
Aucun de ces pigments n'a été détecté dans les échantillons d'eau de surface; en revanche, les deux pigments (PR53:1 et R170) ont été trouvés dans des échantillons de sédiments. Fait intéressant, les concentrations étaient légèrement supérieures en amont par rapport à celles observées en aval des points de rejet d’effluents (3,9 et 1,4 µg/kg poids sec, respectivement, pour le PR53:1, et 96 et 65 µg/kg poids sec, respectivement, pour le PR170), ce qui laisse penser que les pigments n’atteignent pas les eaux réceptrices uniquement par l’intermédiaire des déversements provenant des usines de traitement des eaux usées.
6.2.1.2.3. Sources ponctuelles
Les quatre pigments ont été détectés dans les effluents d’une laverie automatique aux concentrations suivantes : 0,19 µg/L (PY1), 0,085 µg/L (PR53:1), 1 µg/L (PR170) et 0,098 µg/L (PO5). Cet échantillon a été prélevé avant le traitement à une usine de traitement des eaux usées. Dans les effluents d’une deuxième laverie échantillonnés après avoir été traités par une usine de traitement des eaux usées municipales, seul du PR53:1 a été détecté (à 0,013 µg/L). La plus grande partie du PR53:1 détectée dans ces deux échantillons a été trouvée en phase aqueuse (85 % et 100 %, respectivement). Cette constatation s’oppose à celle de la distribution dans les influents des usines de traitement des eaux usées, où 100 % du pigment a été trouvé en phase particulaire, mais sous une forme relativement similaire aux effluents d’une usine de traitement des eaux usées, où 38 % du pigment a été trouvé en phase aqueuse. Les autres pigments n'ont été détectés que dans la phase particulaire des échantillons d'effluents de la laverie.
Les quatre pigments ont été détectés dans les eaux de traitement des opérations de désencrage de papier recyclé à une usine de papier aux concentrations suivantes : 27 à 61 µg/L (PY1), 160 à 450 µg/L (PR53:1), 6 à 9 µg/L (PT170), et 3 à 10 µg/L (PO5).
De fortes concentrations des quatre pigments ont aussi été détectées dans les boues issues des opérations de désencrage de papier recyclé à une usine de papier : 370 à 800 µg/kg poids sec (PY1), 1 100 à 4 200 µg/kg poids sec (PR53:1), 420 à 1 600 µg/kg poids sec (PT170) et jusqu’à 650 µg/kg poids sec (PO5).
Étant donné que la préparation printanière des bateaux, y compris le ponçage, la peinture et le polissage, est souvent effectuée à l'air libre, entraînant ainsi la propagation de poussières contenant des pigments, un échantillon de sol d'une marina a été analysé. Des concentrations de 0,13 µg/kg poids sec et de 0,007 µg/kg poids sec ont été détectées pour le PR170 et le PO5, respectivement, tandis que des concentrations de PR53:1 et de PY1 étaient inférieures aux seuils de détection.
6.2.1.2.4 Environnements urbains
Dans les eaux de surface, seul du PR53:1 a été trouvé (0,005 µg/L; un échantillon).
Les quatre pigments ont été détectés dans des eaux d’orage de la ville de Stockholm. Des concentrations étaient inférieures aux seuils de détection dans un échantillon, tandis que de fortes concentrations (dans la même plage ou même dans une plage supérieure à celle des influents des usines de traitement des eaux usées) ont été détectées dans deux autres sites, où 100 % des pigments détectés se trouvaient dans les matières particulaires des eaux d’orage. Des concentrations ont atteint 0,75 µg/L pour le PY1 (un échantillon), 0,21 et 0,37 µg/L pour le PR53:1 (deux échantillons), et 0,39 et 2,8 µg/L pour le PR170 (deux échantillons), tandis que les concentrations de PO5 tournaient autour de 0,06 µg/L (deux échantillons).
Dans les sédiments, on a trouvé du PR53:1 dans trois échantillons (5,9 à 13 µg/kg poids sec), tandis que du PR170 a été détecté dans deux échantillons (190 et 330 µg/kg poids sec).
Aucun des quatre pigments n'a été détecté dans des échantillons de poissons.
Compte tenu de tous ces renseignements, les auteurs ont conclu que la présence de pigments dans les boues et les eaux d’usines de traitement des eaux usées, les effluents de laveries publiques, les eaux d’orage, les sédiments, l’eau de surface et le sol, indique que des émissions diffuses de pigments se produisent. Les auteurs ont également souligné que puisque aucun des pigments n'a pu être détecté dans les échantillons issus de zones de référence, les émissions vers et dans les zones rurales semblent mineures.
Ailleurs, du PR53:1 a également été détecté dans un échantillon d'effluents d'usine de traitement des eaux sur le site d'une usine de désencrage en Allemagne (OCDE, 1999). La concentration moyenne arithmétique (trois rondes) était de 3,4 μg/L à l'aide d'un facteur de dilution de 30; une CEElocale de 0,11 μg/L a été calculée.
6.2.2 Rejets dans l'environnement
Étant donné qu'aucune donnée sur les concentrations environnementales mesurées des 33 pigments monoazoïques au Canada n'a été relevée, on a donc estimé les concentrations environnementales sur la base des renseignements disponibles.
Les rejets anthropiques d'une substance dans l'environnement dépendent de différentes pertes qui surviennent pendant la fabrication, l'utilisation industrielle, l'utilisation commerciale ou par les consommateurs,Note de bas de page[7] ainsi que l'élimination d'une substance. Afin d'estimer les rejets dans l'environnement à différentes étapes du cycle de vie des pigments monoazoïques, Environnement Canada a compilé des renseignements sur les secteurs pertinents et les gammes de produits ainsi que les facteurs d'émissionNote de bas de page[8] dans les eaux usées, le sol et l'air à différentes étapes du cycle de vie en vue de déterminer celles qui contribuent le plus aux concentrations environnementales. Nous avons également tenu compte des activités de recyclage et de transfert vers les sites d'élimination des déchets (sites d'enfouissement, incinération). Cependant, les rejets dans l'environnement à partir de ces sources n'ont pas été pris en compte sur le plan quantitatif, à moins que des renseignements spécifiques fiables sur le taux (ou le potentiel) de rejets à partir des sites d'enfouissement ou des incinérateurs ne soient disponibles.
Les facteurs liés au cycle de vie de ces substances ont été étudiés; les incertitudes sont reconnues et des hypothèses ont été émises, selon les renseignements disponibles. Des scénarios d'exposition pour les utilisations et les milieux préoccupants ont été élaborés, y compris la détermination des concentrations environnementales estimées (CEE) qui sont applicables. En outre, des analyses des quotients de risque comparent les concentrations estimées ou des concentrations environnementales mesurées avec les valeurs de la CESE (concentration estimée sans effet) afin d'évaluer les risques potentiels.
6.2.3 Définition des scénarios d'exposition les plus importants au Canada
La caractérisation de l'exposition est axée sur les scénarios d'exposition les plus importants. Ces scénarios représentent d'importants rejets dans l'environnement, ainsi que des niveaux d'exposition relativement élevés. En général, l'ampleur d'un rejet est directement liée à la quantité d'une substance fabriquée ou utilisée, ainsi qu'à ses facteurs d'émission applicables. Dans les cas où les rejets industriels sont semblables sur le plan de la quantité aux rejets des consommateurs ou aux rejets commerciaux, ils engendrent normalement des niveaux plus élevés d'exposition environnementale que ces derniers. Cela est dû au fait que les rejets industriels se concentrent dans un nombre limité de sites, alors que les rejets des consommateurs ou les rejets commerciaux sont dispersés dans tout le pays.
Trois scénarios ont été déterminés comme pouvant entraîner les rejets environnementaux les plus élevés à partir de secteurs définis dans des enquêtes menées en vertu de l'article 71 de la LCPE (consulter la section « Sources » du présent rapport). Ces scénarios étaient la fabrication de pigments, la formulation de peintures et de revêtements, et le désencrage, tel qu'il est résumé dans le tableau 6-4. La quantité de pigments monoazoïques fabriquée au Canada représentait plus de 40 % du commerce net de pigments monoazoïques au Canada. Les visites de site menées par Environnement Canada en 2010 ont permis de déterminer que les facteurs d'émission dans les eaux usées à des installations de fabrication de pigments étaient élevés, notamment de plus de 1 % (Environnement Canada, 2010). Le poids de 40 % pour le secteur de la fabrication et le facteur d'émission de plus de 1 % se sont traduits par un rejet relativement fort dans les eaux usées, soit plus de 0,4 % du commerce net des pigments monoazoïques. La fabrication des pigments a alors été choisie comme le scénario d'exposition le plus important.
| Secteur | Poids du secteur en tant que % des 33 pigments monoazoïques nets | Facteur d'émission dans les eaux usées (%) | Rejets dans les eaux usées en tant que % des 33 pigments monoazoïques nets |
|---|---|---|---|
| Fabrication de pigments | 40 | supérieur(e) à 1 | supérieur(e) à 0,4 (élevés) |
| Formulation de peintures et de revêtements | 65 | 0,3 | 0,2 (élevés) |
| Formulation d'encres liquides ou en poudre | 12 | 0,1 | 0,01 (faibles) |
| Désencrage | 8,3 | 20 | 1,7 (élevés) |
| Impression | 12 | 0,036 | 0,004 (faibles) |
| Plastiques et caoutchouc | 11 | 0,05 | 0,006 (faibles) |
| Produits agricoles | 4 | 2 | 0,08 (faibles) |
| Autres | 1 | 2 | 0,02 (faibles) |
La quantité de pigments monoazoïques dans les peintures et les revêtements était la plus importante utilisée parmi toutes les utilisations. Cette utilisation représentait 65 % du commerce de pigments monoazoïques au Canada. La formulation de peintures et de revêtements a été définie comme la principale activité industrielle à partir de données d'enquête. Le facteur d'émission dans les eaux usées découlant de la formulation de peintures et de revêtements a été jugé modéré, soit à 0,3% (Environnement Canada, 2012b). Lorsque le facteur d'émission modéré a été combiné à la quantité importante de pigments monoazoïques utilisée dans la formulation de peintures et de revêtements, on s'attendait à ce que les rejets environnementaux soient importants. Autrement dit, le poids de 65 % pour le secteur de la formulation de peintures et de revêtements et le facteur d'émission de 0,3 % se sont traduits par un rejet relativement fort dans les eaux usées, soit plus de 0,2 % du commerce net des pigments monoazoïques au Canada. Pour cette raison, la formulation de peintures et de revêtements a été choisie comme le deuxième scénario d'exposition le plus important. Les utilisations commerciales et par les consommateurs de peintures et de revêtements n'ont pas été considérées comme étant aussi importantes que l'activité de formulation industrielle selon le site, en raison de la nature dispersive des rejets découlant des utilisations commerciales et par les consommateurs. Ainsi, les utilisations commerciales et par les consommateurs n'ont pas été choisies aux fins d'analyse quantitative de l'exposition.
Pour le secteur de la formulation d'encres liquides et en poudre, le facteur d'émission dans les eaux usées était inconnu, tandis que la quantité utilisée dans le secteur était modérément élevée, soit 12 % du commerce net des pigments monoazoïques au Canada. Des entreprises ont indiqué qu'il n'y avait pas eu de rejets de pigments monoazoïques issus de ces opérations de formulation dans les eaux usées (courriel d'Environnement Canada de 2013, source non citée), tandis qu'aucune donnée sur les rejets n'était disponible pour les formulateurs d'encres liquides et en poudre. En raison de l'absence de ces données pour la formulation d'encres liquides et en poudre dans son ensemble, le facteur d'émission de 0,1 % pour les émissions de pigments (issues de la formulation d'encres) dans les eaux usées déclaré par l'USEPA (2012a) a été utilisé pour estimer les rejets potentiels de pigments monoazoïques. Ces rejets potentiels ont été jugés relativement faibles, représentant notamment 0,01 % du commerce net de pigments monoazoïques au Canada, sur la base du poids de secteur de 12 % et du facteur d'émission de 0,1 %. La formulation d'encres liquides et en poudre n'a donc pas été considérée comme étant un scénario d'exposition important et a été exclue de l'analyse quantitative de l'exposition.
Il existe, cependant, deux secteurs en aval de la formulation d'encres liquides et en poudre : l'imprimerie et le désencrage du papier recyclé. Les pigments monoazoïques détectés dans les encres d'imprimerie ont été utilisés pour l'impression sur du papier et du film plastique, selon les renseignements fournis par l'industrie (courriels de l'industrie adressés à Environnement Canada en 2013, source non citée). Par conséquent, on a déterminé que la quantité totale de pigments monoazoïques, formulée dans des encres liquides et en poudre, finit sur du papier imprimé et des films plastiques. Bien que les proportions de ces pigments entre les deux substrats étaient inconnues, une quantité substantielle devait être utilisée sur le substrat de papier. Compte tenu de cela et d'une grande partie recyclée de papier imprimé, il était prévu qu'une grande quantité de pigments monoazoïques destinés à la fabrication d'encres liquides et en poudre soit soumise au désencrage. Par ailleurs, le facteur d'émission découlant du désencrage a été estimé comme étant élevé, notamment à 20 % (discussion téléphonique entre un expert en pâtes et papiers d'une association industrielle et Environnement Canada en 2013, source non citée). Le poids de secteur de 12 % pour la formulation d'encres liquides et en poudre a donné un poids de secteur de 8,3 % pour le désencrage, lorsqu'on supposait prudemment que les pigments monoazoïques utilisés dans les encres liquides et en poudre finissaient sur du papier. Le poids de secteur du recyclage de papier a, quant à lui, été estimé à 69 % en 2010 (courriel de Marketing Strategy and Sustainability Consulting, Kitchener, Ontario, adressé à la Division des évaluations écologiques d'Environnement Canada en 2012; source non citée). Le poids de secteur de 8,3 % et le facteur d'émission de 20 % se sont traduits par un rejet fort dans les eaux usées, soit 1,7 % du commerce net des pigments monoazoïques au Canada. Le scénario des opérations de désencrage a donc été choisi comme le troisième scénario d'exposition le plus important.
Comparativement au scénario de désencrage, le scénario d`impression présentait un rejet bien inférieur dans les eaux usées. Selon l'USEPA (1995), la lithographie, la gravure, la flexographie, la typographie, et la sérigraphie étaient les cinq technologies de base utilisées pour l'impression, et seule la sérigraphie a généré des eaux usées qui ont fini dans le réseau d'égouts. Ces eaux usées provenaient des opérations de nettoyage pour la récupération de cadres. Ainsi, le facteur d'émission dans les eaux usées découlant de la sérigraphie a été utilisé pour représenter le pire scénario d'impression entraînant des rejets aquatiques.
Le facteur d'émission dans les eaux usées découlant de la sérigraphie a été estimé à 0,036 % comme suit : La quantité d'encre résiduelle restante dans un cadre après qu'une impression ait été déterminée à 0,039 kg pour une taille de cadre moyenne de 0,0137 m2, sur la base d'une quantité de nettoyant d'encre utilisée de 0,227 kg (USEPA, 1994b) et d'un ratio encre-nettoyant d'encre de 1:5.8 (USEPA, 1998) (0,227 kg × 1/5,8 = 0,039 kg). La quantité maximale d'encre résiduelle finissant dans les eaux usées à la suite des opérations de nettoyage était donc de 0,039 kg. En revanche, le volume d'encre requis pour une impression a été établi à 102 L pour la même taille de cadre, selon une méthode décrite par Screen Web (2000). Ce volume a été converti en la valeur de 109 kg pour une densité d'encre de sérigraphie de 1,07 kg/L obtenue de l'étude 3M (2007) (102 L × 1,07 kg/L = 109 kg). La quantité maximale d'encre résiduelle finissant dans les eaux usées représentait donc 0,036 % de la quantité d'encre utilisée (0,039 kg/109 kg × 100 % = 0,036 %). Ce pourcentage a été utilisé comme estimation pour le facteur d'émission dans les eaux usées issues de la sérigraphie ou comme estimation prudente pour le scénario d'impression.
Le facteur d'émission de 0,036 % combiné au poids de secteur de 12 % pour l'impression a donné un rejet relativement faible dans les eaux usées, notamment à 0,004 % du commerce net des pigments monoazoïques au Canada. Ainsi, le scénario d'impression n'a pas été sélectionné pour l'analyse quantitative de l'exposition.
Les quantités de pigments monoazoïques déclarées pour toutes les autres utilisations constituaient 16 % de la quantité totale utilisée au Canada, ces utilisations comprenaient les « plastiques et caoutchoucs » à 11 %, les « produits agricoles » à 4 % et toutes les autres catégories à 1 %. Les facteurs d'émission dans les eaux usées associés à ces autres utilisations étaient de 0,05 % pour l'industrie de fabrication des plastiques et des caoutchoucs, et de 2 % pour l'industrie agricole et les autres catégories (Commission européenne, 2003). Ces poids de secteur et les facteurs d'émission se sont traduits en des rejets relativement faibles dans les eaux usées, soit à 0,006 % du commerce net des pigments monoazoïques pour les plastiques et caoutchoucs, à 0,08 % pour les produits agricoles, et à 0,02 % pour toutes les autres catégories. Comparativement aux trois scénarios importants définis précédemment, ces autres utilisations présentaient des rejets bien plus faibles dans les eaux usées et n'ont donc pas été choisies pour des analyses quantitatives de l'exposition.
Le secteur du désencrage représentait un scénario d'exposition important non seulement pour l'eau, mais aussi pour le sol. Dans l'analyse de l'exposition dans le sol menée pour ce secteur, on a supposé que tous les pigments contenus dans du papier recyclé étaient supprimés des opérations de désencrage et se retrouvaient dans les boues. Ainsi, la quantité de pigments pénétrant dans le sol par l'intermédiaire de l'épandage de boues sur les sols représentait 8,3 % du commerce net de pigments monoazoïques au Canada, étant donné que le poids de secteur pour le désencrage a été prudemment estimé à 8,3 %. En comparaison, les produits agricoles représentaient beaucoup moins, soit 4 %, et leur contribution à l'exposition dans le sol étaient limitée à 4 %. Le scénario de désencrage était donc assez prudent pour une l'analyse préalable de l'exposition dans le sol. En revanche, une analyse de l'exposition dans le sol pour l'utilisation de produits agricoles n'a pas été retenue.
6.2.4 Estimations des concentrations environnementales estimées (CEE)
L'exposition aux pigments monoazoïques a été quantifiée sous la forme de CEE pour chacun des trois scénarios d'exposition définis. Ces concentrations étaient fondées sur les renseignements disponibles sur les quantités de pigments monoazoïques, les facteurs d'émission propres au secteur, les caractéristiques des systèmes de traitement des eaux usées concernés et les caractéristiques de l'environnement récepteur.
Les CEE ont été estimées pour l'eau, le sol et les sédiments. On a procédé ainsi car les pigments monoazoïques étaient principalement présents dans ces milieux à la suite de leur rejet par des systèmes de traitement des eaux usées dans des eaux réceptrices, de leur répartition à partir dans les sédiments, et de l'épandage de boues d'eaux usées sur les sols. Les concentrations environnementales estimées (CEE) dans l’eau et les sédiments ont été estimées pour chacun des trois scénarios, tandis qu’une CEE prudente dans le sol a été fournie pour le scénario de désencrage uniquement, étant donné qu’il s’agissait du scénario contribuant le plus fortement à l’exposition dans le sol. La CCE dans le sol a été estimée à 10,8 mg/kg et devrait représenter une limite supérieure pour tous les autres scénarios. Une analyse de ces CEE est fournie ci-dessous. Les calculs détaillés se trouvent à l'annexe 5.
6.2.4.1 CEE aquatiques liées à la fabrication de pigments
Moins de cinq pigments ont été déterminés à partir d'enquêtes menées en vertu de l'article 71 (Canada, 2006, 2007, 2008, 2011). Une importante installation de fabrication de pigments a été choisie pour estimer le niveau d'exposition aquatique pour le scénario de fabrication de pigments.
On a prévu que les pigments monoazoïques pénètrent dans le milieu aquatique par l'intermédiaire de systèmes de traitement des eaux usées. Environnement Canada a appris d'un certain nombre de visites de sites en 2010 que l'équipement de production de pigments était régulièrement nettoyé avec de l'eau. Les eaux usées générées ont ensuite été traitées sur place pour l'enlèvement des matières solides, puis rejetées dans le réseau d'égouts. On a donc prévu que tous les résidus de pigments présents à la suite du traitement sur place et hors site seraient rejetés dans des eaux réceptrices des effluents à partir du système de traitement des eaux usées.
La CEE aquatique a été estimée à partir d'un certain nombre de paramètres basés sur la compréhension (ci-dessus) des rejets aquatiques de pigments monoazoïques par l'installation de fabrication de pigments. Ces paramètres incluaient la quantité quotidienne de pigments monoazoïques produite, leur facteur d’émission dans les eaux usées, l’efficacité d’élimination des systèmes de traitement des usées sur place et hors site, le débit du système de traitement des eaux usées hors site, et la dilution des eaux réceptrices. La CEE aquatique des pigments monoazoïques calculée était de 29,7 μg/L.
Cette CEE a été jugée prudente. Premièrement, le facteur d'émission dans les eaux réceptrices a été estimé à 10 % de la quantité de pigments monoazoïques produite. Environnement Canada a appris que les produits perdus durant le nettoyage de l'équipement variaient grandement, mais ne dépassaient pas 10 % de la production ou du volume de retenue de l'équipement, sur la base des visites de sites, y compris celles effectuées à l'installation de fabrication de pigments (Environnement Canada, 2010), à une installation de formulation de peinture au latex (Environnement Canada, 2013a), à une installation de fabrication de revêtements en poudre (Environnement Canada, 2013b), à une installation de fabrication de cosmétiques (Environnement Canada et Santé Canada, 2010) et à une installation de nettoyage de camion-citerne (Environnement Canada, 2009b). La valeur de 10 % a été utilisée comme le plus fort facteur d'émission dans les eaux usées découlant du nettoyage de l'équipement de production des pigments. Deuxièmement, l’estimation de l’élimination par le système de traitement des eaux usées hors site variait de 0,5 % à 49,2 % en raison de la variabilité dans l’hydrophobie des pigments monoazoïques. La plus faible valeur de 0,5 % a été utilisée dans les calculs, de sorte que les rejets aqueux de pigments monoazoïques issus du système de traitement des eaux usées hors site représentaient la quantité maximale pénétrant dans le milieu aquatique. La combinaison du plus fort facteur d'émission avec le taux d'élimination des eaux usées le plus faible devait donner une estimation prudente de la CEE aquatique.
6.2.4.2 CEE aquatiques liées à la formulation de peintures et de revêtements
Soixante-quinze installations de formulation de peintures et de revêtements ont été identifiées par les utilisateurs industriels de pigments monoazoïques dans le cadre d'enquêtes menées en vertu de l'article 71 de la LCPE (1999 (Canada 2006, 2007, 2008, 2011), et huit d'entre elles ont été déterminées comme étant les utilisateurs les plus importants. En moyenne, huit installations ont utilisé 5 000 à 10 000 kg/an par pigment pour un ou plusieurs pigments monoazoïques. Ces huit installations ont donc été choisies pour déterminer le niveau d'exposition aquatique pour le secteur de formulation des peintures et des revêtements. En comparaison, les autres installations ont utilisé des quantités inférieures à 5 000 kg/an par pigment en moyenne. Moins de cinq de ces autres installations ont initialement été définies comme des utilisateurs importants en fonction d'enquêtes menées en vertu de l'article 71 de la LCPE (1999) [Canada, 2006, 2007, 2008, 2011], mais des questions de suivi (courriels des installations adressés à Environnement Canada en 2013, source non citée) ont montré que chacune de ces installations utilisait moins de 5 000 kg/an tous pigments monoazoïques combinés.
On a prévu qu'un ou plusieurs pigments monoazoïques pénètrent dans le milieu aquatique par l'intermédiaire de systèmes de traitement des eaux usées. Un certain nombre de visites d'installations de formulation de peintures et de revêtements ont révélé que les eaux usées étaient générées par le nettoyage de l'équipement et rejetées dans le réseau d'égouts après l'élimination des matières solides sur place (Crechem Technologies, 2005). Par conséquent, on a supposé que des eaux usées étaient générées par chacune des huit installations choisies à la suite du nettoyage de l'équipement de formulation. Les eaux usées ont d’abord été traitées sur place pour l’élimination des matières solides, puis traitées à nouveau par un système de traitement des eaux usées hors site. Les eaux usées traitées ont finalement été rejetées dans un plan d'eau.
La CEE aquatique pour chaque installation a été estimée à partir d'un certain nombre de paramètres. Ces paramètres incluaient la taille des lots de formulation, la teneur en pigments des peintures et revêtements, le facteur d'émission dans les eaux usées, l'efficacité d'élimination des systèmes de traitement des usées sur place et hors site, le débit du système de traitement des eaux usées hors site, et le facteur de dilution des eaux réceptrices. Les CEE aquatiques calculées pour les huit installations variaient de 0,51 à 25,9 μg/L.
En outre, elles étaient toutes des estimations prudentes. Dans ces estimations, la taille de lot de formulation la plus importante, soit 19 000 kg de peintures et de revêtements, a été trouvée dans une analyse de données industrielles (Environnement Canada, 2012) et utilisée pour déterminer la perte de pigments monoazoïques dans les eaux usées à partir du nettoyage de l'équipement de formulation. Étant donné que la plage des tailles de lot couvrait plus d'un ordre de grandeur, notamment de 1 000 kg à 19 000 kg, selon l'analyse de données industrielles, la perte dans les eaux usées a été déterminée comme représentant une limite supérieure. On ne s'attendait donc pas à ce que le niveau d'exposition aquatique obtenu à partir de la formulation des peintures et des revêtements dépasse les CEE calculées.
6.2.4.3 CEE aquatiques liées aux opérations de désencrage
Dix-sept installations ont été définies comme étant des sites menant des activités de désencrage du papier recyclé par trois sources de référence : le répertoire de Pulp and Paper Canada (2013), le répertoire de Lock-wood Post (2011) et la plateforme FisherSolveMC (2013). Parmi ces 17 installations, on disposait de suffisamment de renseignements pour effectuer des analyses de l'exposition aquatique sur 13 d'entre elles. Quoi qu'il en soit, ces 13 installations ont été jugées comme représentant bien le secteur canadien du désencrage.
Les CEE aquatiques ont été estimées pour 13 installations de désencrage du papier recyclé. Ces installations ont généré et traité leurs eaux usées respectives sur le site, puis les ont déversées directement dans des eaux réceptrices. Les paramètres utilisés dans le calcul des CEE comprenaient la quantité totale de pigments monoazoïques utilisée pour l'impression, la quantité de pigments monoazoïques entrant dans chaque installation, le facteur d'émission dans les eaux usées, l'efficacité d'élimination des systèmes de traitement des usées sur place, et le facteur de dilution des eaux réceptrices. Les CEE aquatiques calculées variaient de 0,09 à 7,67 μg/L. Elles étaient considérées comme prudentes, étant donné qu'on supposait que la quantité totale de pigments monoazoïques utilisée pour l'impression finissait sur du papier uniquement, sans correction pour la quantité utilisée sur des films plastiques.
6.2.4.4 CEE dans les sédiments liées à la fabrication de pigments, à la formulation de peintures et de revêtements et aux opérations de désencrage
Une méthode du partage eau-sédiment à l'équilibre décrite par l'Agence européenne des produits chimiques (ECHA, 2010) a été utilisée afin de déterminer les CEE des pigments monoazoïques dans les sédiments. Cette approche présume que la concentration dans les sédiments benthiques est en équilibre avec la concentration dans l'eau sus-jacente. Selon Gobas (2007), la concentration dans l'eau sus-jacente devrait correspondre à la concentration dans la phase aqueuse et ne devrait pas comprendre de quantités adsorbées par les sédiments en suspension. La concentration dans la phase aqueuse peut être estimée à partir de la CEE en milieu aquatique, ce qui représente la concentration totale dans l'eau. Ainsi, les CEE dans les sédiments pour les sites de fabrication de pigments, de formulation de peintures et de revêtements, et de désencrage ont été calculées à partir de leurs CEE respectives en milieu aquatique, et normalisées selon une teneur en carbone organique de 3 % pour les sédiments benthiques.
Les CEE dans les sédiments sont prudentes, étant donné que les concentrations dans la phase aqueuse ont été estimées de façon modeste. Dans la colonne d'eau, la concentration totale des pigments monoazoïques ou la CEE en milieu aquatique pour un site donné correspondait à une valeur fixe. Elle a été répartie entre la phase aqueuse et la phase solide (sédiments en suspension). La concentration dans la phase solide dépend de la teneur en carbone organique de la phase solide, et cette dernière a varié d'une faible valeur de 0,1 CO/kg à une valeur élevée de 0,2 CO/kg (Gobas, 2010). En choisissant la faible valeur de 0,1 CO/kg, cela a entraîné l'obtention de la concentration minimale dans la phase solide, et ainsi, l'obtention de la concentration maximale dans la phase aqueuse. Cette concentration maximale a ensuite engendré l'obtention de la CEE maximale dans les sédiments à chaque site.
6.2.4.5 CEE aquatiques liées à la fabrication de pigments, à la formulation de peintures et de revêtements, et aux opérations de désencrage
L'exposition aux pigments monoazoïques dans le sol a été estimée dans le cadre d'un scénario prudent. Ce scénario a été représenté par le scénario de désencrage du papier recyclé. Le scénario du désencrage a donné le plus fort rejet dans le sol par l'intermédiaire de l'épandage de boues sur le sol, étant donné que l'on supposait que la quantité totale de pigments monoazoïques utilisée pour l'impression finissait dans des boues. En outre, on a présumé que l'épandage de boues sur le sol était effectué à un taux moyen sans dégradation, volatilisation, ruissellement du sol ou pertes par lessivage. Ce scénario prudent a donné une CCE dans le sol de 10,8 mg/kg et devrait représenter une limite supérieure pour tous les autres scénarios (annexe 5).
6.2.5 Concentrations environnementales estimées (CEE) c. concentrations environnementales mesurées (CEM)
Les CEM des pigments monoazoïques en Suède ont été comparées aux CEE calculées pour le Canada. Les comparaisons directes des CEE canadiennes avec les CEM d’autres pays doivent être traitées avec prudence, car il existe divers facteurs qui peuvent expliquer les différences, telles que les tendances d’utilisation des substances, les volumes d’utilisation, les conditions dans les environnements récepteurs, les opérations de procédés industriels, les mesures d’atténuation, les méthodes de traitement aux systèmes de traitement des eaux usées, etc. Cependant, de nombreuses similarités peuvent être établies entre le Canada et la Suède. Dans les deux pays, les pigments monoazoïques sont utilisés à des fins relativement semblables. Les volumes des quatre pigments monoazoïques traités dans l'étude suédoise (PY1, PR53:1, PR170 et PO5) sont également similaires : en Suède, 122 à 180 t/an (2001 à 2005); au Canada, 100 à 200 t/an (enquêtes récentes). Par ailleurs, la Suède et le Canada sont des pays nordiques ayant des climats et des conditions environnementales similaires; par conséquent, on peut s'attendre à certaines similarités dans le devenir dans l'environnement et les effets biologiques des substances. Ainsi, dans ce cas, certaines analyses qualitatives des données suédoises ont été jugées appropriées comme source de données supplémentaires. Tel qu'il est décrit ci-dessous, les données de surveillance suédoises appuient le fait que les valeurs de CEE calculées pour les pigments monoazoïques dans l'environnement canadien ne sont pas sous-estimées.
Les résultats de la CEM (Suède) et de la CEE (Canada) indiquent que toutes les valeurs de CEM dans les sédiments calculées pour l'environnement canadien sont supérieures aux concentrations mesurées de pigments monoazoïques dans les sédiments déclarées par Lilja et al. (2008) en Suède : estimations de 0,04 à 14 mg/kg au Canada par rapport à 0,001 4 à 0,096 mg/kg (sources diffuses) et 0,005 9 à 0,330 mg/kg (environnement urbain) en Suède. Dans les zones de référence en Suède, les concentrations mesurées de pigments monoazoïques dans les sédiments étaient inférieures aux seuils de détection (c.-à-d. inférieur(e) à 0,0007 à 0,000 7 μg/kg).
Pour le milieu aquatique, les valeurs de CEE pour le Canada varient de 0,1 à 8 μg/L (scénario des opérations de désencrage) à 30 μg/L (scénario de fabrication des pigments), tandis que les concentrations mesurées des quatre pigments monoazoïques dans l'eau de surface dans les zones de sources diffuses et de référence en Suède étaient inférieures aux seuils de détection (c.-à-d. inférieur(e) à 0,001 1 à 0,015 μg/L pour le PY1, le PR53:1 et le PO5, et inférieur(e) à 0,048 à 0,085 μg/L pour le PR170).
Dans le sol, la valeur de CEE calculée pour les sols canadiens était de 10,8 mg/kg, tandis que la plus forte concentration mesurée de l'un des pigments monoazoïques (PR170) en Suède était remarquablement inférieure, soit 0,13 μg/kg seulement. Les concentrations d'autres pigments (PY1, PR53:1 et PO5), quant à elles, étaient inférieures aux seuils de détection.
En résumé, les données indiquent que les CEM de certains pigments en Suède sont inférieures (et parfois bien inférieures) aux CEE calculées pour l'environnement canadien. Étant donné les tendances d'utilisation générales similaires attendues, ces renseignements donnent une confirmation indirecte que les valeurs de CEE calculées pour les pigments monoazoïques dans l'environnement canadien devraient représenter des scénarios prudents et donneront des quotients de risque qui peuvent être considérés comme protecteurs.
6.3 Caractérisation du risque écologique
La démarche utilisée dans le cadre de cette évaluation écologique préalable visait à examiner les divers renseignements pertinents afin d’élaborer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence, conformément aux dispositions de la LCPE (1999). Les éléments de preuve retenus comprennent des renseignements sur les propriétés physiques et chimiques, le devenir dans l'environnement, l'écotoxicité et les sources des substances, ainsi que les résultats des analyses prudentes du quotient de risque, décrites ci-dessous.
Les pigments monoazoïques sont des substances de nature particulaire, de très faible solubilité, stables sur les plans chimique et hydrolytique, et qui ne sont pas facilement biodégradables. Ces pigments devraient se répartir par gravité dans les matières solides en suspension et les matériaux du lit, s'ils sont rejetés dans des eaux de surface. En tenant compte des rejets potentiels dans le sol, on s'attend à ce que les propriétés physiques et chimiques de ces pigments constituent le facteur moteur de leur répartition finale dans le sol.
Des données empiriques indiquent que les 33 pigments monoazoïques devraient être persistants dans l’eau, le sol et les sédiments, mais pas dans l’air (en raison de réactions avec les radicaux hydroxyles). Dans les sédiments anaérobies, une réduction de la liaison « azo » limitée par la solubilité est toujours possible. Cependant, étant donné les caractéristiques physiques et chimiques uniques des pigments monoazoïques (nature particulaire et très faible hydrosolubilité solubilité), on s'attend à ce qu'une très petite proportion de ces pigments seulement soit disponible pour les microorganismes et la réduction biotique.
Sur la base de la nature particulaire des pigments monoazoïques, de leur très faible hydrosolubilité, de leurs valeurs de log (Soct/Se) généralement faibles, des diamètres transversaux relativement élevés de nombreux de ces pigments, et des très faibles valeurs expérimentales de FBC disponibles pour certains des pigments, on peut s’attendre à ce que le groupe des 33 pigments monoazoïques ne se bioaccumule pas dans les organismes.
Les études de toxicité aquatique aiguë et chronique n’ont montré aucun effet indésirable à la concentration de saturation (c.-à-d. aux limites d’hydrosolubilité), en raison de la faible biodisponibilité des pigments. L’absence d’effets indésirables observés dans de l’eau saturée par des pigments concorde avec les résultats indiquant peu ou pas de bioconcentration de ces substances dans les organismes aquatiques. Ces résultats indiquent que les seuils de toxicité interne critiques ne sont pas atteints à des concentrations d'équilibre thermodynamique maximales ou à des concentrations supérieures dans l'eau.
Des études de la toxicité chronique dans le sol n'ont montré aucun effet indésirable (p. ex. mortalité, reproduction et biomasse des organismes pour les vers de terre, taille et poids des pousses, taux d'émergence et effets phytotoxiques visibles pour les plantes) à un taux de charge de 1 000 mg/kg de sol.
On peut conclure que, à de faibles concentrations, les pigments monoazoïques ne devraient pas être nocifs pour les organismes vivant dans l'eau ou le sol.
Pour le calcul des valeurs de CESE dans l'eau et le sol, la plupart des valeurs critiques de toxicité ont été choisies à partir d'études de la toxicité chronique; lorsque plusieurs études étaient disponibles, les plus faibles valeurs ont été utilisées. Des facteurs d'évaluation ont également été appliqués.
Pour évaluer le risque associé aux 33 pigments monoazoïques, les scénarios d’exposition les plus importants ont été définis sur la base de la fabrication, de l’importation et de l’utilisation de ces substances au Canada. Ces trois scénarios d'exposition aquatique (fabrication de pigments, formulation de peintures et de revêtements, et opérations de désencrage) ainsi que les scénarios d'exposition dans le sol et les sédiments ont été pris en compte. Les rejets potentiels de pigments monoazoïques dans les milieux aquatique et terrestre ont aussi été estimés.
La CEE pour l'exposition aquatique liée à la fabrication de pigments était de 29,7 μg/L. Pour les deux autres scénarios d'exposition aquatique liée à la formulation de peintures et de revêtements et aux opérations de désencrage (sur la base d'une variété de sites industriels), les valeurs de CEE allaient de 0,51 à 25,9 μg/L et de 0,09 à 7,67 μg/L, respectivement.
Une analyse du quotient de risque a été menée en comparant les valeurs de CEE aux valeurs de CESE aquatiques (qui variaient de 90 à 300 μg/L pour différents sous-ensembles de pigments monoazoïques). Cette analyse indique que même si une approche prudente est utilisée, c'est-à-dire lorsque les plus fortes valeurs de CEE aquatique représentant les trois scénarios d'exposition (29,7 μg/L, 25,9 μg/L, et 7,67 μg/L) sont comparées à la plus faible valeur de CESE aquatique (90 μg/L), les quotients de risque obtenus varient de 0,085 à 0,33. Ces quotients de risque prudents calculés (c.-à-d. les plus élevés possible) pour chacun des trois scénarios d'exposition, sur la base de renseignements disponibles, sont inférieurs à 1, ce qui indique que les organismes aquatiques ne devraient pas subir d'effets nocifs.
Une analyse des quotients de risque a également été menée pour le milieu terrestre. En comparant une valeur prudente de CEE 10,8 mg/kg dans le sol avec la valeur de CESE dans le sol de 100 mg/kg (poids sec), on obtient un quotient de risque de seulement 0,1, ce qui indique que les organismes vivant dans le sol ne devraient pas subir d'effets nocifs.
Bien que les valeurs de CEE (allant de 0,04 à 14,0 mg/kg pour différents sites industriels et différents types d'exposition) soient disponibles pour les sédiments, une analyse des quotients de risque a été menée pour ce milieu naturel, car aucune étude de toxicité dans les sédiments n'a été relevée pour les 33 pigments monoazoïques. Par conséquent, les valeurs de CESE pour les sédiments, sur la base de valeurs critiques de toxicité expérimentales, n'ont pu être calculées. Par conséquent, les valeurs de CESE pour les sédiments, sur la base de VCT expérimentales, n’ont pu être calculées. Les pigments monoazoïques peuvent présenter un danger pour les organismes benthiques sensibles à de faibles concentrations dans les sédiments. Les produits de décomposition de certaines de ces substances peuvent également être génotoxiques ou cancérogènes pour les organismes aquatiques.
En tenant compte de tous les éléments de preuve disponibles sur les propriétés physicochimiques, la persistance, le potentiel de bioaccumulation, l’écotoxicité, les utilisations industrielles et les rejets potentiels de ces substances, on s’attend à ce que les 33 pigments monoazoïques aient un faible potentiel de nuire à l’environnement au Canada.
6.3.1 Incertitudes dans l’évaluation des risques pour l’environnement
Il y a eu quelques incertitudes liées à l'évaluation du groupe des 33 pigments monoazoïques. Par exemple, les concentrations environnementales déclarées dans les essais de la toxicité aquatique peuvent être incertaines, en raison de l'utilisation de dispersants ou de solvants pour augmenter la solubilité des pigments dans l'eau d'essai. Certaines études expérimentales de la toxicité aiguë impliquant des dispersants et des solvants ont indiqué des effets biologiques prononcés à des concentrations relativement faibles (p. ex., quelques milligrammes par litre); cette constatation peut être attribuée aux effets toxiques causés par des impuretés contenues dans les pigments de faible pureté (p. ex., 87 % dans certaines études) testés, par différents additifs contenus dans les pigments ou par des interactions dispersant-pigment (ou solvant-pigment).
Il pourrait également avoir des doutes liés à des études de toxicité aquatique qui n'ont pas utilisé de solvants, étant donné que seuls les taux de charge ont été signalés, et qu'aucun renseignement sur les concentrations mesurées n'a été fourni. Certains essais ont indiqué que les particules non dissoutes ont été retirées par membrane filtrante à l'aide de filtres d'une taille de pores de 0,45 µm. Cependant, certains pigments ont une granulométrie moyenne bien inférieure à 0,45 µm. Par conséquent, les particules de pigments pourraient facilement traverser le filtre. Ainsi, l'utilisation d'une membrane filtrante dans certains essais ne signifie pas forcément que seules les fractions hydrosolubles de pigments sont présentes dans l'eau d'essai.
Par ailleurs, des doutes subsistent quant à l'absence d'études de la toxicité dans les sédiments, qui empêche de calculer les valeurs de CESE pour les sédiments de même qu'un quotient de risque pour le scénario d'exposition dans les sédiments. Cette information n'est pas pertinente, puisque les sédiments et le sol représentent un milieu naturel dans lequel les pigments monoazoïques devraient résider.
La pureté des pigments monoazoïques est aussi une source d'incertitude, car de nombreuses substances (p. ex. des résines, des rosins, différents surfactants, des agents dispersants, des agents de couplage) sont utilisées dans la préparation de pigments. Il est impossible d’éliminer complètement ces impuretés qui peuvent modifier certaines propriétés des pigments.
Une autre incertitude est liée à la dégradation des pigments monoazoïques. En raison d'un manque de données expérimentales, des doutes subsistent concernant le taux et l'ampleur de la dégradation des pigments monoazoïques dans les environnements anaérobies et la disponibilité biologique éventuelle des produits de dégradation résultants (p. ex. les amines aromatiques). On peut s'attendre à ce que l'état physique unique des pigments monoazoïques [particules] ainsi que leur hydrosolubilité relativement faible limitent la disponibilité des molécules pour la réduction biotique, de sorte que la formation de produits de dégradation sera également réduite.
En ce qui concerne la biodisponibilité et la bioaccumulation des pigments, il y a également une incertitude, d’un point de vue écotoxicologique. Étant donné que de nombreux pigments ont une taille de particules de l'ordre du nanomètre ou du micromètre, ils s'inscrivent partiellement dans l'échelle nanométrique. Certaines nanoparticules peuvent être absorbées par différents types de cellules et sont capables de traverser la membrane cellulaire et être ainsi internalisées. Plus important encore, l'interaction des nanoparticules avec les cellules ainsi que leur absorption peuvent se produire, par exemple, par l'entremise de l'endocytose ou de la phagocytose dans des cellules spécialisées. Il convient de noter, toutefois, qu'aucune étude sur la bioaccumulation avec des pigments monoazoïques (ou d'autres classes de pigments organiques), où ces mécanismes pourraient être confirmés de manière fiable, n'a été relevée.
Une autre source d'incertitude est l'utilisation de coefficients de partage pour prévoir le potentiel de bioaccumulation de pigments lorsque des données sur le FBA/FBC ne sont pas disponibles. Par exemple, sur la base des valeurs de log (Soct/Se) et de log Kco (4,6 et 5,5, respectivement), le PY1 devrait avoir un potentiel de bioaccumulation relativement élevé; cependant, la mesure des propriétés est incertaine, et l'extrapolation à partir des propriétés de répartition pour obtenir un résultat de bioaccumulation dans un organisme sans tenir compte de la physiologie de ce dernier est très incertaine.
L'extrapolation de données dans les sous-ensembles de pigments monoazoïques suscite également des doutes, notamment du fait que les substances de différents sous-ensembles (classes de pigments) ne pouvaient pas toujours être considérées comme des analogues structuraux similaires.
Enfin, il existe également des incertitudes liées au manque de données sur les concentrations dans l’environnement de pigments monoazoïques au Canada. On reconnaît également la possibilité que des rejets se dégagent des sites d'enfouissement, bien qu'ils soient difficiles à quantifier en raison du manque de données, et qu'ils contribueraient à des concentrations environnementales globales. Cependant, on prévoit que les quantités de ces substances déversées dans les divers milieux naturels ne dépassent pas de façon significative des quantités estimées ici, étant donné que des hypothèses prudentes ont été utilisées dans l'analyse de l'exposition.
7. Potentiel d'effets nocifs sur la santé humaine
Le risque pour la santé humaine du sous-groupe de pigments monoazoïques est caractérisé pour chacun des sous-ensembles, tel qu’il est résumé au tableau 7-1, en mettant l’accent sur des substances auxquelles la population générale du Canada devrait être exposée. Étant donné que les pigments monoazoïques sont généralement utilisés dans divers produits disponible aux consommateurs, l’évaluation de l’exposition est axée sur des produits qui donnent les valeurs estimatives d’exposition les plus prudentes pour chaque voie d’exposition (orale, cutanée et par inhalation). Des renseignements supplémentaires sur les effets sur la santé de substances similaires sur le plan structurel (désignés par « * » dans le tableau 7-1 ci-dessous) ont été utilisés pour la déduction de données à partir d’analogues dans certains cas.
| Sous-ensemble des pigments monoazoïques | SubstanceNote de bas de page Tableau 7-1[a] | Potentiel d’exposition pour la population générale du CanadaNote de bas de page Tableau 7-1 [b] | Disponibilité des données liées aux effets sur la santéNote de bas de page Tableau 7-1 [c] |
|---|---|---|---|
| Pigments de βnaphtol | PR4 | Oui | Toxicité à court terme, toxicité subchronique, toxicité chronique/cancérogénicité; génotoxicité |
| Pigments de βnaphtol | PO5 | Oui | Toxicité à court terme; toxicité subchronique; toxicité chronique/cancérogénicité; génotoxicité; absorption (in vitro par voie cutanée); réduction azoïque microbienne (autre) |
| Pigments de βnaphtol | NONPA | Oui | - |
| Pigments de βnaphtol | PR6 | Non | - |
| Pigments de βnaphtol | PO2 | Non | Génotoxicité |
| Pigments de βnaphtol | PR3Note de bas de page Tableau 7-1 [*] | S.O. (données déduites à partir d’analogues) | Toxicité à court terme; toxicité subchronique; toxicité chronique et cancérogénicité; génotoxicité; absorption/métabolisme (par voie orale); réduction azoïque microbienne (fécale) |
| Pigments de βnaphtol | Rouge para[*] | S.O. (données déduites à partir d’analogues) | Génotoxicité; métabolisme (par voie orale); réduction azoïque microbienne (fécale) |
| Pigments de βnaphtol laqués | PR49:1 | Oui | - |
| Pigments de βnaphtol laqués | PR53:1 | Oui | Toxicité à court terme; toxicité subchronique; toxicité chronique/cancérogénicité; génotoxicité; absorption/métabolisme (par voie orale); absorption (in vitro par voie cutanée); réduction azoïque microbienne (fécale) |
| Pigments de βnaphtol laqués | PR50:1 | Non | Génotoxicité; réduction azoïque microbienne (fécale) |
| Pigments de βnaphtol laqués | PR49[*] | S.O. (données déduites à partir d’analogues) | Toxicité à court terme, toxicité subchronique, toxicité chronique/cancérogénicité; génotoxicité |
| Pigments de BONA laqués | PR48:2 | Oui | Toxicité à court terme; génotoxicité |
| Pigments de BONA laqués | PR63:1 | Oui | Toxicité subchronique; génotoxicité;inférieur(e) à réduction azoïque microbienne (fécale, peau) |
| Pigments de BONA laqués | PR52:1 | Oui | - |
| Pigments de BONA laqués | PR52:2 | Oui | - |
| Pigments de BONA laqués | PR48:5 | Non | - |
| Pigments de BONA laqués | PR57:1[*] | S.O. (données déduites à partir d’analogues) | Toxicité à court terme; toxicité subchronique; toxicité chronique/cancérogénicité; génotoxicité; absorption (in vitro par voie cutanée) |
| Pigments jaunes monoazoïques | PY1 | Oui | Toxicité à court terme; génotoxicité |
| Pigments jaunes monoazoïques | PY3 | Oui | Toxicité à court terme; génotoxicité |
| Pigments jaunes monoazoïques | PY73 | Oui | Génotoxicité; réduction azoïque microbienne (fécale) |
| Pigments jaunes monoazoïques | PY74[*] | S.O. (données déduites à partir d’analogues) | Toxicité à court terme; toxicité subchronique; génotoxicité; absorption/métabolisme (par voie orale); réduction azoïque microbienne (autre) |
| Pigments jaunes monoazoïques | No CAS 80675-49-6[*] | S.O. (données déduites à partir d’analogues) | Toxicité à court terme; génotoxicité |
| Pigments de naphtol AS | PR5 | Oui | - |
| Pigments de naphtol AS | PR112 | Oui | Toxicité à court terme; génotoxicité; réduction azoïque microbienne (autre) |
| Pigments de naphtol AS | PR170 | Oui | Toxicité à court terme; génotoxicité |
| Pigments de naphtol AS | PR187 | Oui | - |
| Pigments de naphtol AS | PR266 | Oui | - |
| Pigments de naphtol AS | PR268 | NonNote de bas de page Tableau 7-1 [d] | Génotoxicité; réduction azoïque microbienne (fécale) |
| Pigments de naphtol AS | PO38 | Oui | - |
| Pigments de naphtol AS | NAPNPA | Non | - |
| Pigments de naphtol AS | NANPAP | Non | - |
| Pigments de naphtol AS | NAPMPA | Non | - |
| Pigments de naphtol AS | NAPPA | Non | - |
| Autres | PR247:1 | NonNote de bas de page Tableau 7-1 [e] | - |
| Autres | PO36 | Oui | - |
| Autres | PR251 | Non | - |
| Autres | PY60 | Non | - |
| Autres | NSNAC | Non | - |
7.1 Évaluation de l'exposition
7.1.1 Milieux naturels et nourriture
Aucune donnée empirique sur les concentrations des 32 pigments monoazoïques dans les milieux naturels au Canada ou ailleurs n'a été recensée.
Par ailleurs, à cause des très faibles pressions de vapeur de ces substances, l'inhalation de la fraction volatile par l'air ne devrait pas être une voie d'exposition importante (consulter la section « Devenir dans l'environnement »). De même, en raison de la très faible volatilité et solubilité dans l’eau des pigments monoazoïques, ces substances devraient être absorbées dans le sol et les sédiments lorsqu’elles sont rejetées dans l’eau. En outre, les valeurs de CEE dans le sol ont été calculées à partir de l’épandage de biosolides sur le sol, en tenant compte du fait que des pigments monoazoïques peuvent être présents dans des biosolides d’eaux usées après le traitement des eaux usées. Cependant, l’exposition de la population générale aux pigments monoazoïques par les milieux naturels ne devrait pas être importante.
Un certain nombre de pigments monoazoïques sont utilisés dans des emballages alimentaires; ainsi, ils peuvent se retrouver dans des aliments (voir le tableau 4-2 de la section « Utilisations »). Cependant, sur la base du risque minime de contact direct avec les aliments, l’exposition liée à cette utilisation n’est pas prévue ou n’est pas jugée importante.
7.1.2 Produits
Parmi les substances analysées dans la présente évaluation, l’exposition potentielle de la population générale par l’entremise de l’utilisation de produits a été définie pour 19 substances provenant de divers sous-groupes de pigments de β-naphtol (PR4, PO5, NONPA), de pigments de β-naphtol laqués (PR49:1, PR53:1), de pigments de BONA laqués (PR48:2, PR63:1, PR52:1, PR52:2), de pigments jaunes monoazoïques (PY1, PY3, PY73), de pigments de naphtol AS (PR5, PR112, PR170, PR187, PR266, PO38) et d’autres pigments (PO36).
Une variété de scénarios d’exposition ont été pris en compte, sur la base des utilisations prévues de pigments monoazoïques, y compris la peinture au doigt et les cosmétiques tels que la peinture faciale. La peinture au doigt et la peinture faciale ont été considérées comme des produits indicateurs de l’exposition cutanée et par événement selon les utilisations définies dans le secteur des peintures et des revêtements (voir la section « Utilisations »). En outre, les masques de beauté, les crèmes, les lotions et les hydratants pour le corps, ainsi que le rouge à lèvres ont été définis comme des produits indicateurs des utilisations de cosmétiques. Des estimations de l’exposition ont été calculées en fonction des renseignements propres à la substance ou des estimations génériques (consulter les annexes F à G pour obtenir des détails).
Pour l'exposition orale accidentelle de certains produits par un enfant, la peinture au doigt est considérée comme entraînant une exposition plus élevée comparativement à la peinture faciale, en raison de la probabilité plus forte d'ingestion durant l'activité. Pour l'exposition par voie cutanée liée à l'utilisation de peinture au doigt ou faciale, la teneur en pigment de la peinture détermine l'activité qui donne des estimations d'exposition plus élevées (voir l'annexe 8). Bien que certaines peintures faciales soient signalées à Santé Canada (Santé Canada, 2011c) à des concentrations allant de 0,3 % à 10 %, une plage de concentrations de 10 % à 15 % (Derivan, 2012) a été utilisée comme estimation générique par défaut pour les pigments dans les peintures faciales lorsqu'aucune donnée canadienne n'était disponible. Pour les peintures au doigt, les concentrations propres aux substances étaient utilisées lorsqu’elles étaient disponibles. En général, elles ne dépassaient pas des concentrations de 5 % (communication personnelle, courriel du programme de toxicologie de l’Université Duke adressée au Bureau de l’évaluation des risques des substances existantes [Santé Canada], en 2013; source non citée). Autrement, une plage de concentrations allant de 1 % à 3 % (Delta Creative, 2008) a été utilisée pour les peintures au doigt lorsque des renseignements propres aux substances n’étaient pas disponibles. La concentration de 15 % de pigment dans les peintures faciales dépassant celle des peintures au doigt, seul le scénario des peintures faciales a été utilisé pour tenir compte des estimations d’exposition cutanée à court terme les plus prudentes.
Les estimations indiquant la plus forte exposition parmi les produits définis sont résumées pour chaque voie d'exposition dans les sections suivantes, et ce, pour chaque sous-ensemble de pigments monoazoïques. Les annexes F à G présentent de plus amples renseignements sur les expositions estimées.
Pigments de β-naphtol (PR4, PO5 et NONPA)
L’exposition par voie orale et par voie cutanée aux pigments de β-naphtol est présentée dans le tableau 7-2. L’exposition orale par événement à partir de l’utilisation de peintures au doigt pour les pigments de β-naphtol variait de 0,15 à 0,45 mg/kg p.c. par événement. L’estimation de l’exposition quotidienne par voie orale de 0,0102 mg/PR4 /kg p.c. par jour était basée sur le rouge à lèvres contenant 3 % (p/p) de PR4 (communication personnelle, courriels de la Direction de la sécurité des produits de consommation [Santé Canada] adressés au Bureau de l’évaluation des risques des substances existantes [Santé Canada], 2013 à 2014; source non citée). L’exposition par voie cutanée au PR4 était estimée jusqu’à 0,054 mg/kg p.c. par événement dans la peinture faciale pour enfants et jusqu’à 0,136 mg/kg p.c. par jour dans les peintures au doigt, tandis que l’estimation de l’exposition quotidienne par voie cutanée au PR4 dans un masque de beauté pour adulte représente 0,005 mg/kg p.c. par jour. Pour l’exposition par inhalation aux PR4, PO5 et NONPA découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993-; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
| Produit (groupe d’âge) | Substance | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition orale quotidienne (mg/kg p.c. par jour) | Exposition cutanée par événement (mg/kg p.c.)Note de bas de page Tableau 7-2 [d] | Exposition cutanée quotidienne (mg/kg p.c. par jour)Note de bas de page Tableau 7-2 [b] |
|---|---|---|---|---|---|---|
| Peinture au doigt (enfant) | PO5 | 0,57Note de bas de page Tableau 7-2 [a] | 0,15 | - | 0,042 | - |
| Peinture au doigt (enfant) | PR4 | 1,75[a] | 0,45 | - | 0,129 | - |
| Masque de beauté (adulte) | PR4 | inférieur(e) à 1Note de bas de page Tableau 7-2[c] | - | - | inférieur(e) à 0,017 | inférieur(e) à 0,0049 |
| Rouge à lèvres (adulte) | PR4 | inférieur(e) à 3[c] | - | 0,0102 | - | - |
| Produits de santé naturelle (enfant) | PR4 | s. o. | - | 0,032 – 0,065Note de bas de page Tableau 7-2[f] | - | - |
| Produits de santé naturelle (Adolescent) | PR4 | s. o. | - | 0,017[f] | - | - |
| Produits de santé naturelle (adulte) | PR4 | s. o. | - | 0,014[f] | - | - |
Le PR4 est défini comme un ingrédient non médicinal sous le nom de D&C Red no 36 parmi plusieurs types de produits de santé naturels homologués devant être pris par voie orale et sa consommation par voie orale est autorisée jusqu’à 1,0 mg/jour (BDPSNH, 2008; BDIPSN, 2011). Sur la base de l’utilisation du PR4 dans les suppléments de multivitamines/minéraux pour lesquels une exposition quotidienne est prévue, l’exposition par voie orale au PR4 découlant de cette utilisation correspond aux estimations prudentes d’exposition de 0,014, de 0,017 et de 0,032 à 0,065 mg/kg p.c. par jour pour les adultes, les adolescents, et les enfants, respectivement (Tableau 7-2).
Pigments de β-naphtol laqués (PR49:1; PR53:1*)
L’exposition par voie orale et par voie cutanée aux pigments de β-naphtol laqués est présentée dans le tableau 7-3. Pour le PR49:1 et le PR53:1, la peinture au doigt et la peinture faciale ont été définies comme des scénarios d’exposition indicateurs. L’estimation de l’exposition par voie orale pour les pigments de β-naphtol laqués est de 0,52 mg/kg p.c. par événement (peinture au doigt). L’estimation de l’exposition par voie cutanée pour les pigments de β-naphtol est de 0,14 mg/kg p.c. par événement pour le PR53:1 dans la peinture faciale pour enfants. Pour l’exposition par inhalation au PR53:1 découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993-; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
| Produit (groupe d’âge) | Substance | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition cutanée par événement Note de bas de page Tableau 7-3 [c] (mg/kg p.c.) |
|---|---|---|---|---|
| Peinture au doigt (enfant) | PR49:1 | 2Note de bas de page Tableau 7-3 [a] | 0,52 | - |
| Peinture faciale (enfant) |
PR53:1 | 10–15Note de bas de page Tableau 7-3 [b] | - | 0,09–0,14 |
Pigments de BONA laqués PR48:2, PR52:1, PR52:2 e PR63:1)
L’exposition par voie orale et par voie cutanée aux pigments de BONA laqués est présentée dans le tableau 7-4. L’estimation de l’exposition par voie orale pour les pigments de BONA laqués est de 0,8 mg/kg p.c. par événement pour le PR63:1 dans la peinture au doigt. L’estimation de l’exposition par voie cutanée est de 0,14 mg/kg p.c. par événement pour le PR48:2, le PR52:2 et le PR63:1 dans la peinture faciale pour enfants. Pour l’exposition par inhalation aux PR48:2, PR52:1 et PR63:1 découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993-; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
| Produit (groupe d’âge) | Substances | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition cutanée par événementNote de bas de page Tableau 7-4 [c] (mg/kg p.c.) |
|---|---|---|---|---|
| Peinture au doigt (enfant) | PR48:2, PR52:2, PR63:1 |
0,7–3Note de bas de page Tableau 7-4 [a] | 0,2–0,8 | - |
| Peinture faciale (enfant) | PR48:2, PR52:2, PR63:1 |
10–15Note de bas de page Tableau 7-4 [b] | - | 0,09–0,14 |
Pigments jaunes monoazoïques (PY1, PY3 et PY73)
L’exposition par voie orale et par voie cutanée aux pigments jaunes monoazoïques est présentée dans le tableau 7-5. L’estimation de l’exposition par voie orale pour les pigments jaunes monoazoïques dans la peinture au doigt variait de 0,21 à 0,34 mg/kg p.c. par événement. L’estimation de l’exposition par voie cutanée est de 0,81 mg/kg p.c. par événement pour la peinture faciale pour enfants. Pour l’exposition par inhalation aux PY1, PY3 et PY73 découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993-; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
| Produit (groupe d’âge) | Substance | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition cutanéeNote de bas de page Tableau 7-5[c] par événement (mg/kg p.c.) |
|---|---|---|---|---|
| Peinture faciale (enfant) |
PY1, PY3, PY73 | 0,3–15Note de bas de page Tableau 7-5[a] | - | 0,016–0,81 |
| Peinture au doigt (enfant) |
PY1, PY3, PY73 | 0,8–1,3Note de bas de page Tableau 7-5[b] | 0,21–0,34 | - |
Pigments de naphtol AS (PR5, PR112, PR170, PR187, PR266 et PO38)
L’exposition par voie orale et par voie cutanée aux pigments de naphtol AS est présentée dans le tableau 7-6. L’estimation de l’exposition par voie orale pour les pigments de naphtol AS dans la peinture au doigt variait de 1,4 à 6,1 mg/kg p.c. par événement pour le PR5, le PR112 et le PR170. L’estimation de l’exposition par voie cutanée est de 0,81 mg/kg p.c. par événement pour le PR5, le PR112, le PR170, le PR266, et le PO38 dans la peinture faciale pour enfants. Pour l’exposition par inhalation aux PR112, PR170 et PR266 découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993–; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
| Produit (groupe d’âge) | Substance | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition cutanée par événementNote de bas de page Tableau 7-6 [c] (mg/kg p.c.) |
|---|---|---|---|---|
| Peinture faciale (enfant) |
PR5, PR112, PR170, PR266, PO38 | 10–15Note de bas de page Tableau 7-6 [a] | - | 0,54–0,81 |
| Peinture au doigt (enfant) |
PR5, PR112, PR170 | 1,1-5Note de bas de page Tableau 7-6 [b] | 0,28 – 1,29 | - |
Pigments de benzimidazolone (PO36)
Pour le PO36, l'exposition a été déterminée pour les produits indicateurs suivants : la peinture faciale et la peinture en aérosol. L’estimation de l’exposition par voie cutanée est de 0,81 mg/kg p.c. par événement pour la peinture faciale pour enfants. Une absorption cutanée de 6 % a été appliquée aux estimations de l'exposition par voie cutanée (consulter la section « Évaluation des effets sur la santé » pour obtenir plus de détails). Pour l’exposition par inhalation au PO36 découlant de la peinture de murs à l’aide d’un pulvérisateur sans air comprimé et du ponçage de la peinture, une fraction massique de 5 % de pigment dans la peinture a été utilisée (Household Products Database, 1993-; Rust-Oleum Corp., 2006). L’exposition par événement associée à ces utilisations a été estimée à 0,00037 et à 0,00055 mg/kg p.c., respectivement.
Exposition aux pigments monoazoïques dans les encres de tatouage
Le PR4, le PR112 et le PY3 sont définis comme étant des ingrédients utilisés dans des encres de tatouage (communication personnelle, courriel de la Direction de la sécurité des produits de consommation [Santé Canada] au Bureau de l’évaluation des risques des substances existantes [Santé Canada], 2011 et 2013; source non citée). En outre, les pigments monoazoïques PR63:1, PR170 et PY3 sont également inscrits comme ingrédients dans les fiches signalétiques des deux marques d’encres de tatouage disponibles à l’échelle internationale, y compris au Canada (SkinCandy, 2013a, 2013b; Starbrite, 2013). On prend donc en considération le potentiel d’exposition aux pigments monoazoïques utilisés dans les tatouages.
Les tatouages permanents représentent une source potentielle d’exposition, car ils sont injectés dans le derme, sous de la jonction dermo-épidermique à une profondeur de 1 à 2 mm (Lea et Pawlowski, 1987; Sperry, 1992). Par conséquent, contrairement à l’exposition par voie cutanée aux pigments monoazoïques, où l’absorption cutanée devrait être plus faible (estimée à 6 % pour les pigments monoazoïques et à 1 % pour les pigments laqués), on considère que l’injection intradermique d’encre de tatouage constitue une voie d’exposition systémique à ces substances.
Après l’injection d’encre de tatouage dans le derme, le devenir des particules des pigments devrait correspondre à l’une des trois options suivantes (EPA du Danemark, 2012). De un, le pigment injecté peut migrer vers le haut par le chemin tracé par l’aiguille et atteindre l’épiderme, qui desquamera (élimination épidermique) [Lea et Pawlowski, 1987]. De deux, le pigment injecté peut être éliminé sur une courte période (au cours des premières semaines après l’injection) par les macrophages et atteindre le système lymphatique à la suite d’une réaction inflammatoire du derme (Sperry, 1992). De trois, le pigment injecté pour former le tatouage stable est retenu dans le derme et est séquestré dans les lysosomes secondaires après la phagocytose par les macrophages et les fibroblastes du derme (Bäumler et al., 2000). Les fractions du pigment injecté correspondant à l’élimination à court terme et à la formation du tatouage stable représentent toutes deux des sources potentielles d’exposition systémique associée à un seul tatouage.
En ce qui concerne la fraction du tatouage soumise à l’élimination lymphatique à court terme, l’estimation de l’exposition humaine aux pigments monoazoïques à court terme dans les encres de tatouage était basée sur les résultats d’Engel et al. (2009), une étude in vivo de souris auxquelles on avait injecté du Pigment Red 22 (pigment monoazoïque) dans le derme. L’exposition systémique quotidienne à court terme a été estimée entre 0,12 mg/kg p.c. par jour et 1,1 mg/kg p.c. par jour pour un adulte (se reporter à l’annexe H pour les détails).
En ce qui concerne la fraction du pigment injecté formant le tatouage stable, le devenir in vivo à long terme du produit injecté n’a pas encore été élucidé. Les tatouages s’estompent avec le temps (Lehner et al., 2011) par plusieurs mécanismes : phagocytose continue et translocation par le système lymphatique (Gopee et al., 2005; Jemec, 2010), photodégradation du pigment se trouvant dans le tatouage (Doll et al., 2008; Kuramoto et al., 1996; Engel et al., 2007, 2009; Cui et al., 2004; Vasold et al., 2004; Bäumler et al., 2000, 2004; Hauri, 2013), métabolisme in vivo et élimination par le drainage du système veineux (EPA du Danemark, 2012). En ce qui concerne l’exposition par les tatouages, selon l’EPA du Danemark (2012), les connaissances actuelles sont jugées insuffisantes pour produire une évaluation quantitative de l’exposition qui soit valable. Par conséquent, on n’a pas calculé l’exposition systémique à long terme découlant de pigments monoazoïques présents dans les encres de tatouage permanentes.
7.1.3 Incertitude quant aux estimations de l’exposition
On reconnaît une incertitude concernant les types spécifiques de produits de peinture contenant certains des pigments monoazoïques présentés dans ce rapport. Par conséquent, puisque des données prudentes ont été choisies pour calculer les estimations de l’exposition, les estimations de l’exposition pour la peinture au doigt, la peinture faciale et la peinture en aérosol présentent des degrés variables d’incertitude, y compris le manque de renseignements propres à la teneur en pigment des types de peinture respectifs. Lorsque des données de sources nord-américaines étaient disponibles, les estimations de l'exposition étaient basées sur des concentrations propres aux substances. Cependant, lorsque ces renseignements n'étaient pas disponibles, les estimations de l'exposition comprenaient les teneurs en pigment génériques obtenues auprès de sources autres que nord-américaines. Il existe une incertitude en ce qui a trait à l'utilisation d'hypothèses génériques pour la teneur en pigment dans les peintures au doigt, les peintures faciales et les peintures en aérosol.
7.2 Évaluation des effets sur la santé
L'évaluation des effets sur la santé des pigments monoazoïques est axée sur les substances pour lesquelles il existe des renseignements actuels indiquant une exposition potentielle à la population canadienne (consulter la section « Évaluation de l'exposition »). Les effets sur la santé pour les différents sous-ensembles de pigments monoazoïques sont présentés dans le tableau 7-1 selon une échelle de confiance en ordre décroissant (du niveau le plus fort au plus faible) sur la base de la disponibilité et de la qualité des données sur les effets sur la santé.
Un facteur principal pris en compte dans la caractérisation du danger potentiel des substances azoïques aromatiques et à base de benzidine est la production potentielle de métabolites d'amines aromatiques à la suite de la réduction de la liaison azoïque dans des conditions anaérobies. Bien que le clivage de la liaison azoïque biologique soit généralement considéré comme une réaction métabolique importante pour des substances azoïques plus solubles, il n’est pas applicable à la même ampleur pour les pigments azoïques peu solubles comme les pigments diarylides, pour lesquels des données disponibles issues d’études expérimentales sur des animaux indiquent une biodisponibilité faible à négligeable et une toxicité systémique limitée correspondante (Golka et al., 2004; Environnement Canada et Santé Canada, 2013d). Cependant, dans le cas des pigments monoazoïques, l’observation de la toxicité après une exposition orale dans plusieurs études sur des animaux indique que certains pigments monoazoïques étudiés dans la présente évaluation sont suffisamment biodisponibles par voie orale. Ces substances sont susceptibles de subir un clivage de la liaison azoïque dans le tube digestif touchant, dans une certaine mesure, les métabolites d’amines aromatiques qui peuvent être également transformés en intermédiaires électrophiles réactifs par l’activation métabolique. Cependant, en raison du degré de lipophilie de certains des pigments monoazoïques (p. ex., les pigments de β-naphtol), ces substances peuvent aussi être absorbées en tant que pigment d’origine avec une liaison azoïque intacte. Par conséquent, une autre voie d’activation du pigment d’origine absorbé (clivage oxydatif de la liaison azoïque vers laquelle il libère le benzènediazonium et d’autres métabolites électrophiles réactifs) pourrait également exister pour certaines de ces substances (Moller et Wallin, 2000). Des considérations générales liées à l'absorption, au métabolisme et aux données déduites à partir d'analogues pour les effets sur la santé sont décrites pour chaque sous-ensemble.
On considère que la similarité des propriétés physiques et chimiques et des effets potentiels sur la santé au sein des sous-ensembles est principalement due au constituant d’accouplement commun de chaque sous-ensemble respectif, tandis que les différences entre les substances dans un sous-ensemble devraient être attribuables aux structures chimiques uniques de chaque substance (p. ex., le PR4 et le PO5 partagent le constituant d’accouplement 1-amino-2-naphtol commun à tous les pigments de β-naphtol; cependant la liaison azoïque se fait à 2-chloro-4-méthylaniline pour le PR4 et à 2,4-dinitroaniline pour le PO5). Les différents sous-ensembles de pigments monoazoïques dans la présente évaluation préalable sont ensuite répartis entre les sous-ensembles non chargés (pigments de β-naphtol, pigments de naphtol AS, pigments jaunes monoazoïques) et ces sous-ensembles de pigments « laqués » qui contiennent des groupes ionisables (pigments de β-naphtol laqués, pigments de BONA laqués). En raison de la présence de groupes ionisables (p. ex., – SO3−, – COO−) et du potentiel de dissociation, les sous-ensembles de pigments laqués sont considérés séparément des autres sous-ensembles de pigments non laqués en termes de biodisponibilité par les voies d’exposition orale et cutanée.
Pour les sous-ensembles de pigments laqués (pigments de β-naphtol laqués et pigments de BONA laqués), un degré raisonnablement élevé de biodisponibilité orale et de potentiel de clivage de la liaison azoïque est indiqué sur la base d'une étude sur l'absorption orale et le métabolisme du PR53:1 (un pigment de β-naphtol laqué), avec plusieurs études d'incubation fécale anaérobie in vitro sur le PR53:1 et le PR50:1 (pigments de β-naphtol laqués) ainsi que le PR63:1 (un pigment de BONA laqué). En revanche, pour les sous-ensembles de pigments, seules des données empiriques limitées ont été relevées. Sur la base des données collectives pour les pigments monoazoïques non laqués, un certain degré de biodisponibilité orale du pigment d’origine et des métabolites potentiels formés après clivage des liaisons azoïques a été défini pour le sous-ensemble des pigments de β-naphtol, tandis que l’on suppose une biodisponibilité relativement faible pour les sous-ensembles des pigments jaunes monoazoïques et des pigments de naphtol AS, compte tenu de la toxicité orale plus faible observée pour les deux derniers sous-ensembles.
On prévoit que l'absorption de ces substances à la suite de l'exposition par voie cutanée sera bien inférieure à celle qui suit l'exposition par voie orale. Sur la base des données disponibles (Platzek, 1999; Stingley et al. 2010; BRI, 2012) et en tenant compte du potentiel de clivage de la liaison azoïque par des bactéries de la peau, une valeur d’absorption par voie cutanée de 1 % est jugée appropriée pour les deux sous-ensembles de pigments laqués (c.-à-d., pigments de BONA laqués, pigments de β-naphtol laqués). Dans l’ensemble, les pigments sont considérés comme ayant une absorption par voie cutanée plus élevée que les pigments laqués, bien que pour ces deux sous-ensembles, l’absorption soit toujours considérée comme étant beaucoup plus faible que l’absorption gastro-intestinale (par voie orale). Sur la base des données disponibles sur l’absorption par voie cutanée pour le PO5 (un pigment de β-naphtol) et du Solvent Red 23 (un colorant diazoïque contenant la partie de β-naphtol lipophile, avec un poids moléculaire similaire à celui du PO5, mais avec une lipophilie plus élevée), une valeur prudente de 6 % de l’absorption par voie cutanée est considérée pour les sous-ensembles de pigments non laqués.
Dans les sections suivantes, une évaluation des effets sur la santé qui comporte un résumé des seuils d’effets critiques sur la santé est présentée pour chaque sous-ensemble.
7.2.1 Pigments de β-naphtol (PR4, PO5, NONPA, PR6, PO2)
Des renseignements sur les effets sur la santé sont principalement disponibles pour deux des cinq pigments de β-naphtol (PR4 et PO5) dans le sous-ensemble. Des études à doses répétées menées sur des animaux sont également disponibles en ce qui concerne le PR3. Cependant, cette substance a déjà été évaluée dans le cadre de l’initiative du Défi (Environnement Canada, Santé Canada, 2009b) et elle est utilisée pour la déduction des données à partir d’analogues uniquement. Les six substances sont toutes similaires sur le plan structurel : elles contiennent de l’aniline nitro-substituée qui est aussi couplée à une partie de β-naphtol (tableau 7-7). Le clivage réducteur de la liaison azoïque devrait produire l’aniline nitro-substituée respective (tableau 7-7) ainsi que la partie 1-amino-2-naphtol ci-dessous (n° CAS 2834-92-6, masse moléculaire : 159,2 g/mol). Étant donné que le 1-amino-2-naphtol est une caractéristique structurelle commune et un produit issu du clivage azoïque potentiel pour tous les pigments de β-naphtol, il est présenté ci-dessous, tandis que les structures d’origine propres aux substances et les métabolites de clivage azoïque correspondants figurent dans le tableau 7-7 :

| Identité et composition chimiques des pigments de β-naphtol d’origineNote de bas de page Tableau 7-7[a] | Identité et structure chimiques des produits potentiels du clivage de la liaison azoïqueNote de bas de page Tableau 7-7[b] |
|---|---|
PR3
|
2-Nitro-4-méthylaniline
|
PR4
|
2-Chloro-4-nitroaniline
|
PO5
|
2,4-Dinitroaniline
|
NONPA
|
2-Nitro-4-méthoxyaniline
|
PR6
|
2-Nitro-4-chloroaniline
|
PO2
|
2-Nitroaniline
|
Rouge para*
|
4-nitroaniline
|
Absorption et potentiel de clivage de la liaison azoïque
Pour l’absorption orale et le métabolisme, une étude sur le PR3 a été relevée, dans laquelle des rats mâles F344 (trois par période d’échantillonnage) on reçu une seule dose de PR3 de 11,8 mg/kg p.c. par gavage, avec du contenu des intestins, des matières fécales, de l’urine, du sang et d’autres tissus échantillons à 1, 4, 24 et 48 heures après l’administration de la dose (El Dareer et al, 1984). Il convient de noter que la dose de PR3 n’a pas été radiomarquée dans le cadre de cette étude et que l’analyse de la dose récupérée dans les matières fécales, l’urine et les tissus n’a permis de mesurer que le PR3 d’origine non modifié. Par conséquent, la récupération totale était uniquement fondée sur le PR3 d’origine non modifié et elle ne comprenait pas les métabolites du PR3 ou les produits potentiels du clivage azoïque. La récupération du PR3 non modifié dans les matières fécales et dans tous les tissus échantillonnés était incomplète; 50,0 % (± 10,1 %) et 72,4 % (± 10,1 %) de la dose de PR3 administrée a été récupérée à des durées d’échantillonnage de 24 et 48 heures, respectivement.
La plus grande partie de la dose a été récupérée dans le contenu des intestins et les matières fécales, avec de faibles quantités (inférieur(e) à 1 %) détectées dans les échantillons d'urine de 24 et de 48 heures. Des quantités limitées de PR3 (inférieur(e) à 2 %) ont également été détectées dans des « tissus en contact direct avec les composés », tandis qu'aucune trace de PR3 n'a été détectée dans d'autres tissus échantillonnés (plasma, sang entier, foie, reins, poumon) à une dose déclarée 10 fois plus élevée (données non présentées dans l'étude). Malgré les limites de l’étude (c.-à-d. que les conjugués de PR3 et les métabolites du clivage azoïque ne sont pas inclus dans les mesures, écarts-types importants liés à la récupération des PR3), certains renseignements sur l’absorption orale des PR3 peuvent être interprétés. Premièrement, la présence de concentrations détectables de PR3 non modifiés dans l’urine, bien que faibles (moins de 1 %) fournit la preuve d’une absorption du PR3 d’origine intact. Cette observation est conforme aux substances azoïques de β-naphtol plus lipophiles comme le colorant Sudan I qui a été excrété sous sa forme non modifiée en petites quantités dans l’urine de rats et de lapins après une exposition par voie orale, tandis qu’une fraction beaucoup plus grande de la dose a été excrétée sous la forme de conjugués du colorant Sudan I et de métabolites du clivage azoïque (Environnement Canada, Santé Canada, 2014a). La présence de PR3 non modifié dans l’urine des rats dans le cadre de la présente étude ainsi que la récupération incomplète de la dose de PR3 administrée laisse supposer qu’une fraction de la dose de PR3 a été absorbée intacte puis métabolisée in vivo ou qu’elle a subi un clivage azoïque avec des amines aromatiques par la microflore intestinale dans le tube digestif (NTP, 1992).
Des renseignements sur le métabolisme in vivo et la réduction azoïque microbienne sont disponibles pour la substance Rouge para* similaire sur le plan structurel et ils sont utilisés aux fins de données déduites à partir d’analogues des autres pigments de β-naphtol dans ce sous-ensemble. Rouge para* est un pigment de β-naphtol dont le nom C.I. est Pigment Red 1 (C.I. 12070) (Herbst et Hunger, 2004) et il est un isomère de position du PO2 dont la substitution mononitro est en position para par rapport à la position ortho, respectivement (tableau 7-7). Dans une étude utilisant des rats F344 (8 mâles/groupe), des « amines libres » (identité chimique précise non étudiée) ont été détectées dans les matières fécales après une seule dose orale de 15 mg de Rouge para* (Goldin et Gorbach, 1984). Des groupes de traitement supplémentaires par Rouge para* ont également été exposés aux antibiotiques afin de réduire le niveau d’activité azoréductase de la microflore intestinale et, par la suite, une baisse de la quantité totale d’amines a été détectée dans les matières fécales de ces groupes. Bien que cette étude n’ait pas permis de distinguer quelles étaient les « amines libres » détectées, les auteurs ont interprété les résultats comme la preuve d’un clivage azoïque du rouge para* et de la capacité des antibiotiques à réduire le niveau du clivage azoïque de cette substance (Goldin et Gorbach, 1984). Dans deux études distinctes in vitro utilisant la suspension de selles humaines ou des bactéries intestinales humaines cultivées, on a également constaté que le rouge para* subissait un clivage azoïque presque complet avec le métabolite 4-nitroaniline après un à deux jours d’incubation dans des conditions anaérobies (Xu et al., 2007; Xu et al., 2010).
D'autres preuves à l'appui du potentiel de clivage de la liaison azoïque microbienne des pigments de β-naphtol proviennent d'une étude sur le PO5 avec la souche de bactérie environnementale Shewanella J18 143 dans des conditions anaérobies (Pearce et al., 2008). Le clivage de la liaison azoïque a été mesuré comme une réduction dans l'absorption de PO5 par spectroscopie ultraviolette et visible. Cette étude a également démontré que la réduction était efficace pour la forme de dispersion des pigments, tandis qu'elle était bien plus limitée pour la poudre de pigment, en partie à cause de la plus faible solubilité dans le milieu de culture. Une incubation in vitro de PR3 dans le milieu de culture avec un homogénat fécal humain a montré des résultats similaires en raison de sa faible solubilité (BRI, 2013).
Les études ci-dessus, combinées aux observations empiriques des effets toxicologiques chez les animaux ayant reçu par voie orale des doses de PR3, de PR4 et de PO5 (consulter la section suivante « Effets sur la santé »), laissent penser que certaines quantités de ces pigments de β-naphtol et de leurs métabolites du clivage azoïque sont absorbées à des niveaux suffisants pour déclencher des réactions biologiques. Cependant, une estimation quantitative de l’absorption orale absolue de pigments de β-naphtol et de la fraction relative de la partie absorbée (pigment d’origine par rapport aux produits de clivage azoïque) ne peut pas être déterminée en raison des données limitées disponibles.
Pour l'absorption par voie cutanée, une étude in vitro de la pénétration par voie cutanée a indiqué que la plus grande partie du PO5 était récupérée à partir de nettoyants pour la peau, tandis qu'un certain niveau de radioactivité a été détecté dans toutes les préparations pour la peau. L'absorption quotidienne de la dose appliquée a été estimée à 0,005 % pour les crèmes et les formulations d'huiles, et à 0,001 % pour le talc; cependant, ces estimations ont été basées uniquement sur des concentrations dans le fluide récepteur (Hart et al., 1986, US FDA, 1986, BG Chemie, 2000a). D'après une étude in vitro plus récente avec un colorant azoïque lipophile à base de solvant, soit le Solvent Red 23, une récupération similaire a été obtenue dans le fluide récepteur lorsque le colorant a été appliqué à de la peau humaine dans une formulation d'huile solaire hydrophobe; jusqu'à 6 % de la dose appliquée a été trouvée dans l'épiderme humain (Yourick et al., 2007). Les pigments de β-naphtol et le Solvent Red 23 ont des poids moléculaires similaires (environ 300 à 350 g/mol) et contiennent la partie de β-naphtol lipophile. De plus, ils présentent une hydrosolubilité extrêmement faible (3,3 à 6,8 µg/L pour les pigments de β-naphtol [annexe B], 13,7 µg/L pour le Solvent Red 23 [Environnement Canada, Santé Canada, 2014a]), même si le Solvent Red 23 est bien plus lipophile que les pigments de β-naphtol (log Koe supérieur(e) à 7 estimé pour le Solvent Red 23 c. log (Soct/Se) de 2,4 à 3,7 pour les pigments β-naphtol). La liposolubilité absolue du Solvent Red 23 (« soluble » dans les huiles; CIRC, 1975) est bien plus élevée que celle des pigments de β-naphtol (1,8 à 18 mg/L dans l'octanol); par conséquent, la fraction dissoute dans la formulation hydrophobe disponible pour l'absorption par voie cutanée sera bien inférieure pour les pigments de β-naphtol comparativement au Solvent Red 23. Néanmoins, les pigments de β-naphtol sont considérés comme ayant un certain degré de liposolubilité menant à l'absorption potentielle par voie cutanée. Ainsi, l'application du taux d'absorption par voie cutanée de 6 % pour le Solvent Red 23, basée sur la récupération à partir des couches de peau et du fluide récepteur, est considérée comme appropriée.
Effets sur la santé
Un résumé des seuils d'effets critiques pour les pigments de β-naphtol est présenté dans le tableau 7-8. Les données de toxicité disponibles ont été minutieusement examinées dans des évaluations antérieures du PR3 (NTP, 1992; Environnement Canada, Santé Canada, 2009b), du PR4 (USFDA, 1988) et du PO5 (Hart et al., 1986; USFDA, 1986, CSC, 1993; BG Chemie, 2000a). Des données de génotoxicité sur ces trois substances ont également été examinées par Moller et Wallin (2000). Pour le PR3, un point de départ pour la cancérogénicité a été établi depuis l’évaluation précédente par Environnement Canada, Santé Canada (2009b) (se reporter à l’annexe I pour obtenir des détails sur le calcul de la dose repère [BMD] concernant le PR3).
| Substance | (DMENO/DSENO à court terme = (mg/kg p.c. par jour) | Toxicité subchronique DMENO/DSENO (mg/kg p.c. par jour) |
Toxicité chronique DMENO/DSENO (mg/kg p.c. par jour) |
Point de départ pour la cancérogénicité (mg/kg p.c. par jour) |
|---|---|---|---|---|
| PR3 | DMENO = 541-542 (RM, RF) ↑ poids du foie ↑ GPT ↑ SDH ↓ Hb ↓ hématocrite (NTP, 1992) |
DMENO = 125-183 (RM) ↑ poids du foie, hispathologie de la rate + moelle osseuse ↓ hématocrite ↑ réticulocytes ↑ taux sérique de créatine ↑ taux de bilirubine dans l'urine (Graham et Davis, 1968; NTP, 1992) |
DMENO = 272 (RM) BMDL10 = 11-15 (RM) |
BMDL10 = 911 BMDL10 = 911 |
| PR4 | Données déduites à partir d'analogues du PR3 et PO5 | Données déduites à partir d'analogues du PR3 et PO5 | DMENO = 50 DSENO = 12,5 (RM/RF) Changements histopathologiques dans la rate, anémie hémolytique (US FDA, 1988) |
Données déduites à partir d'analogues du PR3 et PO5 Données à l'appui sur le PR4 nodules néoplasiques hépatiques et cholangiome cystique chez des rats femelles (Kupradinun et al. 2002) |
| PO5 | DMENO = 100 (RM/RF) ↓ Hb + GR ↓ gain de poids corporel (Hoechst, 1973; BG Chemie, 2000) |
DMENO = 7,5 (chien) ↑ taux de bilirubine dans l'urine (Hazleton, 1964a; CSC, 1993; BG Chemie, 2000) |
DMENO = 50 (RM, RF) ↑ poids du foie ↓ hématocrite + Hb + GR ↑ taux de bilirubine dans l'urine (Hazleton, 1964b; Biodynamics, 1982) |
dose tumorigène = 500 (RF) Adénome et carcinome hépatiques combinés 3/52 (6 %) dans le groupe témoin 21/59Note de bas de page Tableau 7-8 [c],Note de bas de page Tableau 7-8 [d](36 %) 500 mg/kg p.c. par jour (10 000 ppm dans un régime alimentaire) (Biodynamics, 1982; BG Chemie, 2000a; Hart et al., 1986; USFDA, 1986) |
Génotoxicité
Des essais de génotoxicité in vitro ont été relevés pour le PR3, le PR4, le PO2, le PO5 et le rouge para*, tandis que certains essais in vivo ont aussi été recensés pour le PR3 et le PO5 (BG Chemie, 2000a; Moller et Wallin, 2000; Environnement Canada, Santé Canada, 2009b).
Pour la bactérie Salmonella dans le test d'Ames standard, le pouvoir mutagène semble être le plus fort pour le PO5, suivi du PR4 et du PR3, ce qui démontre une réponse faiblement positive dans une étude. Le PO5 été déclaré comme étant régulièrement positif dans la souche TA98, avec une plus forte réponse sans activation métabolique (S9), comparativement à la présence d'une activation métabolique (S9). Des résultats positifs ont également été observés pour les souches TA100, TA1537 et TA1538, mais les résultats variaient dans les différentes études (BG Chemie, 2000a; Moller et Wallin, 2000). Le PR4 a démontré une réponse mutagène, la plus forte ayant été relevée dans la souche TA98, mais généralement après l'activation métabolique (S9) uniquement; les réponses dans d'autres souches étaient mitigées ou négatives (Moller et Wallin, 2000). Le PR4 était aussi positif dans la souche TA98 avec ou sans activation métabolique (S9) lorsque la modification Prival de la mononucléotide flavine (FMN) était incluse dans l'essai (ILS, 2011). Le PR3 semblait bien moins mutagène que le PR4 ou le PO5, avec seulement une réponse faiblement positive observée dans les souches TA98 et TA100 avec une activation métabolique (S9) chez le hamster plutôt que le rat (Mortelmans et al.,1986), et une réponse négative dans d'autres souches avec ou sans activation métabolique (S9) dans d'autres études (Moller et Wallin, 2000; Environnement Canada, Santé Canada,2009b). Le PO2 n’a été testé que dans une étude dans laquelle il a été déclaré positif quant à la mutagénicité dans une souche TA98 sans activation S9 (Matsushima et al., 1978). L’isomère de position de PO2, le rouge para*, était également positif pour la mutagénicité dans les souches TA98 et TA1538, seulement avec activation métabolique (S9), et il était négatif dans la souche TA1535 avec et sans activation (Milvy et Kay, 1978).
Dans une étude plus récente, le rouge para* et un colorant azoïque de β-naphtol plus lipophile, le Sudan I, ont été testés pour évaluer leur potentiel génotoxique comparatif après un métabolisme oxydatif dans les lignées cellulaires humaines de cellules lymphoblastoïdes B AHH-1 et MCL-5, conçu pour exprimer les niveaux élevés d’activité du cytochrome P450 (Johnson et al., 2010). La lignée cellulaire AHH-1 exprime le CYP1A1 inductible, tandis que la lignée cellulaire MCL-5 présente l’activité de cinq autres enzymes CYP avec des niveaux plus élevés de CYP1A1 par rapport à la lignée cellulaire AHH-1. Étant donné que le colorant Sudan I est connu pour être activé dans le benzènediazonium et d’autres électrophiles réagissant avec l’ADN après une oxydation microsomale et médiée par la peroxydase (Stiborova et al., 2009), l’analyse dose-effet de sa génotoxicité après une oxydation a été examinée dans les cellules AHH-1 et MCL-5, tandis que le colorant rouge para* a aussi été inclus afin de déterminer si la structure azoïque commune des pigments de β-naphtol conférait un potentiel génotoxique similaire au colorant Sudan I (Johnson et al., 2010). Dans le cadre de cette étude, le rouge para* a induit des mutations directes in vitro au locus HPRT des cellules AHH-1 et MCL-5. Une mutagénicité plus élevée a été observée dans la lignée MCL-5 et elle corrélait aux niveaux relativement élevés d’activité du cytochrome P450 exprimés dans les cellules MCL-5 (Johnson et al., 2010). Une corrélation similaire entre les micronoyaux et l’activité du cytochrome P450 a été observée pour les colorants rouge para*, une plus grande réaction étant observée dans les cellules MCL-5 en raison de l’activité plus importante du cytochrome P450. Dans le cadre de cette étude, la dose-effet relative à la mutagénicité et aux micronoyaux était identique pour les colorants rouge para* et Sudan I, avec toutefois un potentiel relatif plus faible pour le colorant rouge para*. La présente étude fournit la preuve qu’un pigment monoazoïque de β-naphtol, le rouge para*, avec une substitution nitro sur un cycle benzénique, une hydrosolubilité et une lipophilie plus faibles, présentait néanmoins un potentiel génotoxique similaire comparable au colorant plus lipophile Sudan I. En s’appuyant sur ces observations, les auteurs de l’étude ont proposé que comme le colorant Sudan I, le rouge para* était oxydé de façon similaire en ion benzènediazonium ou en d’autres électrophiles réactifs à l’ADN après une oxydation par des enzymes microsomales. De la même manière, d’autres études ont également démontré que l’oxydation par des peroxydases du colorant Sudan I et d’un autre colorant azoïque de β-naphtol présentant une faible solubilité, le NDY3Note de bas de page[9], formait également des métabolites électrophiles réactifs par une voie similaire (Stiborova et al., 2009; Spadaro et Renganathan, 1994). Bien que les données soient limitées, les renseignements ci-dessus laissent entendre que, outre le colorant Sudan I, d’autres substances azoïques de β-naphtol connexes peuvent également être oxydées de la même manière que la structure azoïque d’origine en métabolites réactifs (Moller et Wallin, 2000). Toutefois, on ne sait pas dans quelle mesure ce mécanisme potentiel se produit pour les pigments de β-naphtol analysés dans la présente évaluation et s’il contribue à la toxicité et à la génotoxicité observées pour ces substances.
D’autres preuves de la génotoxicité des pigments de β-naphtol proviennent de l’essai de Comet in vitro(PO5) et in vivo (PR3). Le PO5 était positif dans l'essai de Comet dans des hépatocytes de rats exposés (Moller et al., 1998), tandis que l'exposition par voie orale de souris mâles ddY au PR3 a montré un dommage accru de l'acide désoxyribonucléique (ADN) dans les tissus du côlon 24 heures après l'exposition (Tsuda et al., 2000), ce qui indique un risque d'endommagement de l'ADN par ces substances. À l'inverse, tous les autres essais de génotoxicité in vitro étaient négatifs pour le PR3 et le PO5. La mutagénicité dans des cellules de mammifères in vitro a été testée uniquement pour le PO5, qui a montré une réponse négative dans des cellules de lymphomes de souris L5178Y et des cellules de hamsters chinois V79 (BG Chemie, 2000a). Aucune hausse des aberrations chromosomiques n'a été déclarée dans des études sur des cellules de hamsters chinois in vitro pour le PR3 [cellules ovariennes de hamster chinois (CHO); Environnement Canada, Santé Canada, 2009b] ou pour le PO5 (cellules V79;BG Chemie, 2000a); le PR3 était également négatif pour les échanges de chromatides sœurs dans les CHO (Environnement Canada, Santé Canada, 2009b). Le PO5 a aussi été déclaré négatif dans l'essai de synthèse d'ADN non programmée dans des hépatocytes primaires de rats (BG Chemie, 2000a). Les seules études de génotoxicité in vivo ont été négatives pour les aberrations chromosomiques dans la moelle osseuse de hamsters chinois exposés au PO5 par gavage (Hoechst, 1990; BG Chemie, 2000a) ou pour des micronoyaux dans la moelle osseuse ou la rate de souris à la suite d'une injection intrapéritonéale (Baranski et al., 1992; Environnement Canada, Santé Canada, 2009b).
Des données concernant plusieurs pigments de β-naphtol (PR3*, rouge para, PR4, PO5, PO2) indiquent un certain potentiel génotoxique par l’intermédiaire de la mutagénicité et des dommages à l’ADN, bien qu’une plage de puissance ait été observée pour toutes les substances testées (p. ex., le classement qualitatif du pouvoir mutagène dans la bactérie Salmonella était le plus élevé pour le PO5, intermédiaire pour le PR4 et faible pour le PR3). Aucune étude de génotoxicité n’a été recensée pour les deux pigments de β-naphtol dans ce sous-ensemble (NONPA, PR6). Cependant, il existe des preuves tirées d’une étude comparative sur le rouge para* et le Sudan I (Johnson et al., 2010) selon lesquelles ces deux pigments de β-naphtol, qui contiennent des substances azoïques, sont activés par une voie similaire, par l’intermédiaire de la formation de métabolites réactifs après une oxydation microsomale. Si cela est vrai, cette voie d’activation pour la mutagénicité pourrait s’appliquer à d’autres pigments de β-naphtol dans ce sous-ensemble. Cette interprétation est en accord avec les opinions de l’Autorité européenne de sécurité des aliments (EFSA) et du Comité du Royaume-Uni sur la toxicité (UK COT) qui sont fondées sur des similarités structurelles avec le Sudan I et en l’absence de données, on a supposé que le rouge para* était potentiellement génotoxique (EFSA, 2005; UK COT, 2005). Dans l’ensemble, il semble exister des preuves du pouvoir mutagène des pigments de β-naphtol.
Cancérogénicité
Des effets cancérogènes ont été observés dans des études de toxicité chronique sur des rongeurs pour le PR3 (NTP, 1992) et le PO5 (Hart et al., 1986; USFDA, 1986; BG Chemie, 2000a), l’augmentation des tumeurs hépatiques chez les rats femelles étant l’effet commun observé pour ces deux substances. Outre les tumeurs hépatiques observées chez les rats femelles, on a signalé que d’autres tumeurs étaient liées à l’exposition à ces deux substances, notamment une incidence accrue de tumeurs de la médullosurrénale chez le rat mâle et d’adénomes du tubule rénal chez la souris mâle pour le PR3 (NTP, 1992), ainsi qu’une incidence accrue des adénomes et carcinomes hépatocellulaires chez la souris CD-1 mâle exposée au PO5 (Hart et al., 1986; USFDA, 1986; BG Chemie, 2000a). Les détails des observations des effets néoplasiques découlant du PR4 et du PO5 sont disponibles dans d’autres références. Cependant, les tumeurs hépatiques chez les rats femelles étant l’observation régulière pour le PR3 et le PO5, cet effet est abordé plus en détail (ci-dessous et tableau 7-8) avec les preuves à l’appui d’un effet similaire chez les rats femelles exposées au PR4.
Le PR3 a été testé dans une étude de l’exposition chronique par l’alimentation chez les rats F344 (NTP, 1992) et les résultats de cette étude ont déjà été décrits dans l’évaluation préalable de cette substance, dans le cadre de l’initiative du Défi (Environnement Canada, Santé Canada, 2009b). Une augmentation statistiquement significative des adénomes hépatocellulaires a été observée chez les femelles du groupe exposé à la dose élevée par rapport aux témoins simultanés (tableau 7-8). D’autres effets non néoplasiques dans le foie des femelles exposées ont également été observés en commençant à la dose d’essai la plus faible, notamment des changements histopathologiques (foyers éosinophiles, foyers de cellules mixtes) et une augmentation du poids du foie (NTP, 1992; Environnement Canada, Santé Canada, 2009b), ce qui tend à confirmer que le foie est un organe cible du PR3 dans cette étude. Les adénomes hépatocellulaires ont été déclarés comme un type de tumeur rare chez les rats femelles du groupe témoin historique de cette souche et, par conséquent, l’incidence accrue observée chez les femelles exposées est attribuée à l’exposition au PR3, selon le NTP (NTP, 1992). Un point de départ pour la cancérogénicité (BMDL10 = 911 mg/kg p.c. par jour) pour le PR3 a été établi pour les données sur les adénomes hépatocellulaires (tableau 7-8, détails fournis à l’annexe I). D’autres effets observés chez les rats mâles et femelles dans le cadre de cette étude sont fournis ailleurs (NTP, 1992; Environnement Canada, Santé Canada, 2009b).
Pour le PO5, plusieurs études de l’exposition chronique par l’alimentation chez les rats et les souris ont été signalées dans des sources secondaires (Hart et al., 1986; USFDA, 1986; SCC, 1993; BG Chemie, 2000a). L’étude critique portait sur des rats (souche de rats albinos Charles River [CD], 70/sexe/dose) exposés par l’intermédiaire de leur mère pendant la gestation et la lactation, puis par voie orale jusqu’à la fin de l’étude au 30e mois ou à 130e semaine (Biodynamics, 1982; BG Chemie, 2000a). Une augmentation statistiquement significative de l’incidence combinée d’adénomes et de carcinomes hépatocellulaires a été observée chez les femelles exposées à la dose élevée (10 000 ppm ou 500 mg/kg p.c. par jour) par rapport au groupe témoin simultané (tableau 7-8). Comme pour l’étude de l’exposition chronique au PR3, d’autres effets néoplasiques chez les femelles exposées aux doses élevées de PO5 comprenaient l’augmentation du poids du foie et des changements histopathologiques dans le foie également à une dose élevée (vacuolisation focale, hépatite suppurée subaiguë, nécrose zonale ou dégénérescence). Outre l’augmentation du poids du foie qui a également été observée à la dose plus faible suivante (1 000 ppm ou 50 mg/kg p.c. par jour), des détails limités ont été fournis dans la source secondaire concernant l’incidence, les tumeurs ou les effets non néoplasiques dans le foie aux doses plus faibles dans la présente étude non publiée (BG Chemie, 2000a). D’autres détails sur les effets tirés d’études de l’exposition chronique au PO5 sont fournis dans les sources secondaires (Hart et al., 1986; USFDA, 1986; SCC, 1993; BG Chemie, 2000a).
Une source secondaire a déclaré que plusieurs études non publiées de la toxicité chronique par voie orale ont été menées chez le rat et chez la souris exposés au PR4 (USFDA, 1988). Cependant, ces données d’origine n’étaient pas disponibles, et des détails très limités ont été fournis dans la source secondaire en ce qui concerne les effets non néoplasiques et cancérogènes dans le foie relativement pour ces études. Par conséquent, aux fins de comparaison avec la cancérogénicité hépatique des rats femelles observée pour le PR3 et le PO5 et en raison de l’absence de détails pour les études non publiées de la toxicité chronique menées chez le rat exposé au PR4, une étude publiée plus récente de la toxicité chronique chez le rat exposé au PR4 est également prise en compte ici (Kupradinun et al., 2002). En bref, cette étude portait sur des rats Wistar (50/sexe/dose) exposés au PR4 par l’intermédiaire de la nourriture (groupe témoin, 1 000 ppm ou 50 mg/kg p.c. par jour, 2 000 ppm ou 100 mg/kg p.c. par jour) pendant 78 semaines avec le sacrifice terminal à la 98e semaine. Une incidence accrue de tumeurs hépatiques liée à la dose hebdomadaire (incidence combinée de tumeurs bénignes : nodules hyperplasiques et cholangiomes cystiques) chez les rats femelles (3/50 ou 6,0 % dans le groupe témoin, 1 000 ppm, 6/47 ou 12,8 %, 2 000 ppm, 8/50 ou 16,0 %, p = 0,059, test des tendances de Cochrane-Armitage) était liée à l’exposition au PR4 (Kupradinun et al., 2002). Aucun autre détail sur les effets hépatiques (chimie clinique, poids du foie, histopathologie non néoplasique) n’a été fourni dans cette étude.
Bien que l’étude de Kupradinun et al. ait démontré un certain potentiel de cancérogénicité du PR4 dans le foie des rats femelles à des doses beaucoup plus faibles que celles testées pour le PR3 ou le PO5, la réponse aux tumeurs observée cidessus dans le groupe témoin simultané pour le PR4 était relativement plus faible que celle observée pour le PR3 et le PO5 (tableau 7-8). La durée d’exposition pour le PR4 dans l’étude de Kupradinun et al. (2002) était plus courte (78 semaines) par rapport aux études menées avec le PR3 (102 semaines, NTP, 1992) ou le PO5 (130 semaines, Biodynamics, 1982). Par conséquent, bien que l’autopsie terminale pour le PR4 soit survenue à la 98e semaine dans l’étude de Kupradinun et al. (2002), les périodes d’exposition et de terminaison relativement plus courtes dans cette étude pourraient avoir entraîné une incidence des tumeurs pour le PR4 si les tumeurs s’étaient développées tardivement. Outre la durée d’exposition plus courte, les autres limites de l’étude de Kupradinun et al. comprenaient le court espacement entre les doses fortes et faibles, la déclaration limitée des effets non cancérogènes dans le foie et d’autres tissus et le manque d’antécédents d’incidence de tumeurs chez les rats Wistar de ce laboratoireNote de bas de page[10]. Néanmoins, compte tenu des données déduites à partir d’analogues sur des tumeurs hépatiques observées chez des rats femelles pour le PR3 et le PO5, des métabolites actifs similaires prévus pour le PR4, le PR3 et le PO5 (c.àd., dérivés de nitroaniline et 1-amino-2-naphtol, tableau 7-7) et des preuves à l’appui d’une réponse aux tumeurs pour le PR4 dans le foie des rats femelles de l’étude Kupradinun et al. (2002), on considère que le PR4 pourrait poser un risque cancérogène similaire à celui du PR3 et du PO5.
L'ensemble des preuves pour le PR3, le PR4 et le PO5, découlant principalement de tumeurs hépatiques observées chez des rats femelles, indique un potentiel cancérogène pour ces substances. Aucune étude empirique sur le cancer n’a été recensée pour les autres pigments de β-naphtol (NONPA, PO2, PR6, rouge para*). Le potentiel de données déduites à partir d’analogues sur la cancérogénicité pour les pigments de β-naphtol non testés est traité dans la section suivante (section 7.2.1 Résumé et considérations impliquant des données déduites à partir d’analogues).
Autres études de toxicité à doses répétées
Pour le PR3, le PR4 et le PO5, des effets non cancérigènes similaires ont été relevés, les plus communs étant l’hémolyse, la régénération des globules rouges ainsi que des poids accrus et des changements histopathologiques dans la rate et le foie dans des études de toxicité chronique et subchronique à court terme (tableau 7-8). Pour le PR3, l’hémolyse observée dans les résultats hématologiques (diminution des hématocrites, de l’hémoglobine ou des globules rouges, augmentation des réticulocytes) a été observée chez les rats ou les souris après des durées d’exposition de deux semaines et de 90 jours et au sacrifice intermédiaire de 15 mois pour la partie chronique de ces études (NTP, 1992). Ces effets hémolytiques étaient habituellement associés aux changements histopathologiques correspondants dans la rate (augmentation de la prolifération des cellules hématopoïétiques et pigment ou hémosidérine) dans les études de toxicité subchronique et à court terme. Cependant, cet effet n’était plus clairement observé dans la partie chronique de l’étude. Des changements histopathologiques dans le foie ont également été observés chez le rat après une exposition au PR3 avec une augmentation du poids du foie à toutes les durées d’exposition, un bilan biochimique après deux semaines (augmentation de la glutamate pyruvate transaminase [GPT] et de la SDH) et des changements histopathologiques dans le foie dans l’intervalle et au sacrifice terminal de l’étude de toxicité chronique (changements cellulaires focaux, dégénérescence kystique). Bien qu’une toxicité hépatique ait été observée chez les rats des deux sexes exposés au PR3, seules les femelles ont présenté une augmentation liée à l’exposition des adénomes hépatocellulaires (NTP, 1992, voir la section précédente). Pour le PO5, bien que les études originales sur la toxicité n’aient pas été publiées, des détails provenant de sources secondaires ont indiqué des observations semblables d’hémolyse et de réponses régénératives connexes dans la rate, ainsi qu’une augmentation du poids et des changements histopathologiques dans le foie constatés chez les souris, les rats et les chiens (BG Chemie, 2000a). Pour le PR4, toutes les données disponibles sur les effets non néoplasiques n’ont pas été publiées et elles provenaient d’une déclaration limitée dans une source secondaire (USEPA, 1988). Cependant, les renseignements disponibles ont indiqué des changements hémolytiques et des changements histopathologiques connexes dans la rate des rats (fibrose parenchymateuse, épaississement capsulaire, fragments fibreux capsulaires, hématopoïèse extramédullaire, pigmentation) ont également été observés pour cette substance (tableau 7-8), tandis que les observations d’effets non néoplasiques dans le foie n’ont pas été déclarées dans les sources secondaires.
D'autres effets dans les reins chez des rats et des souris ont également été notés pour le PR3, y compris une incidence et une gravité accrues de la néphropathie progressive chronique, de l'hyperplasie des tubules et de l'épithélium de cellules rénales transitionnelles de forme papillaire, en plus de la cytomégalie des tubules rénaux et des adénomes chez des souris mâles (NTP, 1992). Étant donné que les reins n’ont pas été clairement définis comme les organes cibles pour la toxicité dans les études portant sur un autre pigment de β-naphtol, le PO5 ou le PR4, on ne sait pas si cet effet est propre à la substance ou s’il peut être prévu après une exposition aux autres pigments de β-napthol.
Aucune étude de toxicité à doses répétées n’a été recensée pour les autres pigments de β-naphtol (NONPA, PO2, PR6, rouge para*).
Résumé et considérations impliquant des données déduites à partir d’analogues
Aucune donnée sur la toxicité n’a été déterminée pour toutes les substances du sous-ensemble des pigments de β-naphtol. Par conséquent, une technique de lecture croisée est utilisée pour éclairer les effets sur la santé des substances dans ce sous-ensemble, en se fondant sur les éléments de preuve suivants.
D’après les données disponibles concernant l’absorption orale (PR3), la réduction azoïque microbienne (rouge para*, PO5), et une toxicité semblable dans les études menées sur les animaux pour les pigments de β-naphtol testés (p. ex., le PR3, le PR4, le PO5), on considère qu’une certaine quantité de ces substances est absorbée au niveau systémique par voie orale sous la forme du pigment de β-naphtol d’origine ou de métabolites du clivage azoïque (1-amino-2-naphtol, diverses nitroanilines). Étant donné que les autres membres du sous-ensemble des pigments de β-naphtol partagent la même structure azoïque des pigments de β-naphtol d’origine, qu’ils ont des métabolites du clivage azoïque semblables, et qu’ils devraient avoir des propriétés physiques et chimiques similaires, notamment la solubilité dans l’eau et l’octanol, on considère qu’une biodisponibilité orale comparable peut être prévue pour toutes les substances dans ce sous-ensemble.
Bien que des données mécanistes limitées soient disponibles pour ces substances, en fonction de la documentation existante sur les effets sur la santé des substances azoïques en général, il est entendu que la toxicité observée pour les substances azoïques est due aux métabolites d’amines aromatiques après un clivage azoïque (avant l’absorption ou après l’absorption in vivo) ou à l’activation de la substance azoïque d’origine absorbée (Environnement Canada, Santé Canada, 2013b). Pour les autres substances azoïques qui partagent la même structure azoïque de β-naphtol que les pigments de β-naphtol, on sait que l’activation de la substance azoïque d’origine pourrait contribuer autant, sinon plus, à la toxicité que leurs métabolites d’amines aromatiques correspondants. Par exemple, l’effet nocif principal du colorant Sudan I chez les rongeurs est une augmentation liée à la dose des tumeurs hépatiques dans le foie des rats après une exposition orale chronique à des doses relativement faibles (Environnement Canada, Santé Canada, 2014a). Cet effet n’est pas observé pour l’aniline, un des principaux métabolites du clivage azoïque du colorant Sudan I. Étant donné que ce dernier est connu pour être absorbé en partie en tant que structure d’origine avec une liaison azoïque intacte (Environnement Canada, Santé Canada, 2014a), et qu’il a été démontré que les métabolites électrophiles de la structure d’origine du colorant Sudan I après une oxydation enzymatique causent des adduits à l’ADN dans le foie des rats in vivo (Stiborova et al., 2009), on considère que la structure d’origine activée du colorant Sudan I contribue à la formation de tumeurs hépatiques observées chez des rongeurs. Une observation similaire est mentionnée dans les études de génotoxicité du colorant Sudan I, avec une mutagénicité in vitro du colorant Sudan I observée dans le test d’Ames et qui est éliminée dans des conditions réductrices lors du test (Environnement Canada, Santé Canada, 2014a), ce qui indique que le colorant d’origine Sudan I, et non ses métabolites d’amines aromatiques, est mutagène dans ce test. Cette interprétation est soutenue en partie par une étude de la mutagénicité du Sudan I et du rouge para* qui a révélé des conditions de mutagénicité élevées favorisant une oxydation accrue par le CYP1A1 et d’autres isoenzymes du cytochrome P450 (Johnson et al., 2010), et non le clivage réducteur des liaisons azoïques et, par conséquent, l’oxydation des structures d’origine est responsable de la mutagénicité observée du Sudan et du rouge para* dans ces études. Par conséquent, en partant du principe que la toxicité d’une substance azoïque de β-naphtol peut être due à la structure d’origine ou aux métabolites d’amines aromatiques et étant donné que les pigments de β-naphtol devraient également être absorbés en partie en tant que pigments d’origine ainsi qu’en tant que métabolites du clivage azoïque, on considère que les structures d’origine et les métabolites aident à éclairer les données déduites à partir d’analogues au sein du sous-ensemble des pigments de β-naphtol.
Toutes les structures d’origine des pigments de β-naphtol partagent le 1-amino-2-naphtol commun (β-naphtol) relié à l’aniline par une liaison azoïque et avec au moins un substituant nitro sur le cycle benzénique de l’aniline en position ortho- ou para- ainsi que des substitutions supplémentaires (chloro-, méthyl-, méthoxy-) dans certains cas (Herbst et Hunger, 2004, tableau 7-7). Dans le cas de pigments de β-naphtol précis testés dans le cadre d’études chroniques sur les animaux, des substances avec un substituant nitro en positions ortho- (PR3, PO5) et para- (PR4, PO5) ont présenté une toxicité similaire, y compris des dommages aux érythrocytes, ainsi qu’une toxicité dans la rate et le foie et des tumeurs hépatiques (voir les sections ci-dessus et le tableau 78). Par conséquent, bien que certaines différences apparentes en matière de puissance aient été observées dans ces études (p. ex., le point de départ pour les tumeurs hépatiques était plus faible pour le PO5 que pour le PR3), les substances testées semblaient présenter, de façon qualitative, une toxicité similaire quelle que soit la position de la substitution nitro. De même, la présence de substitutions supplémentaires de retrait d’électrons (chloro- dans le PR4) ou de libération d’électrons (méthyl- dans le PR3) ne semblait pas modifier considérablement les types d’effets observés dans les études sur des animaux pour ces substances. Il convient de noter qu’une autre substance azoïque de β-naphtol, le Sudan I (aucune substitution sur le cycle benzénique de l’aniline), était aussi associée à une toxicité hépatique et à une augmentation des tumeurs hépatiques semblables à celles observées pour les pigments de β-naphtol, le PR3 et le PO5, chez les rats exposés par voie orale (Environnement Canada, Santé Canada, 2014a). La similarité structurelle des pigments de β-naphtol avec le Sudan I était en fait le fondement de l’avis de l’EFSA et du Comité du Royaume-Uni sur la toxicité selon lequel le rouge para* pourrait être potentiellement génotoxique et cancérogène (EFSA, 2005; UK COT, 2005). Par conséquent, malgré les différences en matière de position et de substitution nitro- et d’autres substitutions dans le sous-ensemble des pigments de β-naphtol (tableau 7-7), rien qui conduirait à l’attente d’une différence qualitative en matière de toxicité potentielle dans l’ensemble de ces substances n’apparaît de façon évidente dans les structures de ces substances. Cependant, différentes puissances toxicologiques devraient être prévues, comme cela a été observé pour les données disponibles concernant le PR3, le PR4 et le PO5.
Cette affirmation des données déduites à partir d’analogues pour les pigments de β-naphtol est appuyée par les données disponibles sur la toxicité des métabolites d’amines aromatiques correspondants des pigments de β-naphtol : 1-amino-2-naphtol, ainsi que les divers dérivés de nitroaniline (tableau 7-7). Les effets sur la santé de ces métabolites du clivage azoïque sont abordés ci-après en ce qui a trait aux données déduites à partir d’analogues dans le sous-ensemble des pigments de β-naphtol.
L’amine aromatique 1-amino-2-naphtol est commune à tous les pigments de β-naphtol, ainsi qu’une partie commune dans les pigments de β-naphtol laqués, les colorants Sudan, et certains colorants azoïques solubles comme l’Acid Orange II et il a été décelé sous la forme d’un métabolite après une exposition par voie orale à ces substances (Environnement Canada, Santé Canada, 2014a; CSSC, 2011). Bien qu’aucune étude de toxicité à doses répétées adéquate n’ait été relevée pour le 1-amino-2-naphtol, cette substance a formé des adduits liés par covalence dans les érythrocytes de rats in vivoet on a estimé qu’elle était sans doute le métabolite responsable des toxicités hémolytique et hépatique ainsi que de la toxicité pour la rate observées pour les pigments de β-naphtol laqués (section 7.2.2) et l’Acid Orange II (CSSC, 2011), étant donné que les autres amines aromatiques sulfonées rejetées à partir de ces substances ne sont pas associées à ce type de toxicité. Une régénération significativement stimulée du foie chez des rats partiellement hépatectomisés a également été observée après une exposition alimentaire au 1-amino-2-naphtol (Gershbein, 1982). Il a aussi été démontré que le 1-amino-2-naphtol produisait une espèce réactive de l’oxygène (Nakayama et al., 1983) et qu’il était cytotoxique pour les bactéries (Pan et al., 2012). Le 1-amino-2-naphtol peut être oxydé en un N-hydroxylamine puis en N-nitroso, mais cette substance pourrait aussi être convertie en une 1,2-naphtoquinoneimine intermédiaire, puis elle pourrait être rapidement hydrolysée pour former une 1,2-naphtoquinone (Gregory, 1986). La formation de naphtoquinone et de quinonéimines est bien caractérisée pour de nombreuses substances contenant des structures d’amine aromatique et d’amide aromatique, et on pense qu’elle constitue un autre mode d’action important pour la toxicité observée de ces types de substances par l’entremise de la production d’espèces réactives de l’oxygène ou en tant qu’électrophiles réactifs (Kumagai et al., 2012, Skipper et al., 2010). Étant donné que l’exposition à l’un ou l’autre des pigments de β-naphtol entraînerait le rejet d’une certaine quantité de 1-amino-2-naphtol, cette partie pourrait contribuer en partie aux effets potentiels sur la santé de tous les pigments de β-naphtol appuyant les données déduites à partir d’analogues pour ces substances.
Outre le 1-amino-2-naphtol, les autres métabolites du clivage azoïque des pigments de β-naphtol sont tous des nitroanilines ou des dérivés, avec des substitutions supplémentaires méthyle, chloro ou méthoxy (tableau 7-7). Des types d’effets sur la santé qualitativement similaires ont été observés pour ces nitroanilines où des données empiriques sont disponibles avec des effets souvent observés dans les érythrocytes ou la rate, le foie et les reins. Pour la 2-nitro-4-méthylaniline (du PR3), une étude d’exposition par voie orale sur 28 jours chez des rats a fait état de preuves d’hémolyse, d’une augmentation du poids du foie et des reins, et la chimie clinique a révélé une augmentation de l’urée sérique (mâles) et du sérum de gamma-glutamyl-aminotransférase (GGT) (femelles) à des doses de 200 et de 1 000 mg/kg p.c. par jour chez les femelles et les mâles, respectivement (BG Chemie, 2000b). La génotoxicité pour cette substance a présenté une mutagénicité mixte in vitro (positive dans les cellules de lymphomes de souris, mixte dans la Salmonella, négative dans les cellules V79 de hamsters). Elle était négative pour la synthèse d’ADN non programmée in vitro et les micronoyaux chez les souris in vivo. Pour la 2-nitro-4-chloroaniline (du PR6), des études non publiées à court terme et subchroniques par voie orale menées par le NTP chez les rats et les souris ont été déclarées dans une source secondaire (BUA, 2004). Chez les rats, la 2-nitro-4-chloroaniline a présenté des effets sur les organes cibles dans la rate (hémosidérose), les érythrocytes (hémolyse), le foie et les reins (augmentation du poids), les effets les plus faibles observés commençant à 50 et 100 mg/kg p.c. par jour chez les femelles et les mâles en particulier. Des études de toxicité à court terme portant sur des rats du Japon ( CHRIP ©2008a; Sakuratani et al., 2013 ) ont également signalé des effets dans le foie (augmentation du poids, inflammation rénale) et la rate (hématopoïèse extramédullaire) confirmant les résultats du NTP chez les rats. Chez les souris, le foie semblait être le principal organe cible (augmentation du poids, d’enzymes du sérum du foie, de l’hypertrophie centrolobulaire hépatique, des hépatocytes multinucléés) et une légère hémosidérose dans la rate était également observée. Des effets ont été constatés à des doses aussi faibles que 75 et 300 mg/kg p.c. par jour chez les souris femelles et mâles plus précisément (BUA, 2004). Dans ces études, les rats et les souris mâles ont présenté une certaine toxicité pour la reproduction, avec une diminution de la motilité du sperme chez les souris mâles et une baisse du poids des testicules et de l’épididyme chez les rats mâles (BUA, 2002). La 2-nitro-4-chloroaniline était surtout positive pour la mutagénicité dans la Salmonella, elle présentait une clastogénicité dans des cellules mammaliennes in vitro (échanges de chromatides sœurs et aberrations chromosomiques), tandis qu’elle était positive pour le test du micronoyau chez les souris in vivo (BUA, 2004). Pour la 2-nitroaniline (du PO2), des études menées chez les rats ont montré une augmentation de la méthémoglobine à partir du 28e jour d’exposition par inhalation (US EPA, 2009). Cependant, une toxicité limitée autre que la baisse du poids corporel a été observée pendant des études par voie orale à court terme et subchroniques. Les données sur la génotoxicité étaient beaucoup plus négatives pour la 2-nitroaniline (OCDE, 2001). Cependant, l’USEPA a estimé que les effets observés dans la 4-nitroaniline (du rouge para*) s’appliquaient de façon prudente dans les données déduites à partir d’analogues de la 2-nitroaniline (USEPA, 2009). Des études de toxicité sur la 4-nitroaniline (du rouge para*) ont signalé une méthémoglobine, une pigmentation de la rate, une hémosidérine dans le foie, une hyperplasie de la moelle osseuse, une hématopoïèse extramédullaire dans la rate et le foie, et une augmentation du poids de la rate et du foie (Environnement Canada, Santé Canada, 2014b). Le NTP a déclaré une preuve « équivoque » de la cancérogénicité de la 4-nitroaniline chez les rats, d’après l’augmentation de l’incidence d’hémangiosarcomes hépatiques et l’incidence combinée d’hémangiomes et d’hémangiosarcomes dans tous les sites, tandis que la preuve de sa génotoxicité était largement négative (Environnement Canada, Santé Canada, 2014b). Pour la 2-chloro-4-nitroaniline (du PR4), les études de toxicité disponibles étaient résumées par un ensemble de données de l’IUCLID soumis par l’industrie qui signalait qu’une exposition aiguë augmentait la méthémoglobine chez les rats, tandis que l’exposition alimentaire pour les rats pendant 118 jours était déclarée comme étant associée à des modifications dégénératives dans la rate, les reins, le foie et les testicules avec des effets commençant à 300 mg/kg p.c. par jour (Commission européenne, ©2000b). Cette substance a été déclarée positive pour la mutagénicité dans la Salmonella et le E coli, mais elle a été signalée négative pour la mutagénicité dans les cellules V79 de hamsters et pour la synthèse d’ADN non programmée in vitro. Elle n’augmentait pas le nombre de micronoyaux chez les hamsters in vivo (Commission européenne, ©2000b). Pour la 2,4-dinitroaniline (du PO5), un ensemble de données de l’IUCLID soumis par l’industrie a signalé une anémie et une hématopoïèse extramédullaire commençant à 20 mg/kg p.c. par jour et des effets sur les testicules à des doses plus élevées dans le cadre d’une étude par voie orale de 28 jours menée chez des rats (Commission européenne, ©2000c). Cette substance a été déclarée principalement positive pour la mutagénicité in vitro dans la Salmonella (Commission européenne, ©2000c; Assman et al., 1997) et elle est également positive pour les aberrations chromosomiques dans les lymphocytes humains (Huang et al., 1995), mais elle est négative pour d’autres essais de clastogénicicité et de mutagénicité in vitro et in vivo (Commission européenne, ©2000c). Pour la 2-nitro-4-méthoxyaniline (du NONPA), aucune donnée sur la toxicité pour les animaux n’a été trouvée; toutefois, des études à doses répétées étaient disponibles pour deux isomères de nitro-méthoxyaniline, le 2-méthoxy-4-nitroaniline (NO CAS 97-52-9) et le 2-méthoxy-5-nitroaniline (NO CAS 99-59-2) (NTP, 2006). Pour la 2-méthoxy-4-nitroaniline, une hémolyse, une augmentation des réticulocytes, une hématopoïèse extramédullaire, une augmentation des poids de la rate et du foie, une augmentation des enzymes hépatiques sériques ont été signalées à 300 mg/kg p.c. par jour dans une étude par voie orale de 28 jours menée chez les rats (NTP, 2006). Pour la 2-méthoxy-5-nitroaniline, une exposition alimentaire chronique a provoqué une augmentation des tumeurs chez les rats mâles (peau, glande de Zymbal), les rats femelles (glande de Zymbal, glande clitoridienne), et chez les deux sexes de souris (foie). Les deux isomères de méthoxy-nitroaniline étaient positifs pour la mutagénicité dans la Salmonella (NTP, 2006). On ne sait pas si la 2-nitro-4-méthoxyaniline (du NONPA), qui n’est pas testée, présenterait une toxicité similaire pour ces deux isomères.
Un parcours de résultats néfastes concernant la toxicité au niveau de l’érythrocyte ou pour la rate et concernant la toxicité hépatique pour une catégorie de nitroaromatiques a été élaboré et comprenait des nitroanilines dans sa structure (Sakuratani et al., 2013). Les deux parcours de résultats néfastes pour la toxicité hémolytique et hépatique sont fondés sur l’oxydation proposée du groupe d’amines aromatiques ou sur la réduction du groupe nitro en un hydroxylamine qui peut être ensuite métabolisé en groupe nitroso ou en ion nitrénium électrophile, ce qui donne lieu à une liaison aux protéines et à l’ADN, respectivement (Sakuratani et al., 2013; Neumann, 2005), tandis que l’hydroxylation de noyau et la formation subséquente d’une quinonéimine réactive ont également été proposées comme autre mécanisme des nitroanilines de liaison aux protéines (Matthews et al., 2012). Par conséquent, les données empiriques sur la toxicité qualitativement similaires concernant les nitroanilines qui devraient être rejetées à partir du clivage azoïque des pigments de β-naphtol sont corroborées de façon mécanistique par la voie d’activation commune de ces substances. Une pharmacocinétique et un métabolisme similaires des tissus après une exposition orale ont également été observés pour plusieurs de ces nitroanilines (Chopade et Matthews, 1983; Chopade et Matthews, 1984; Matthews et al., 1986; Matthews et al., 2012). Ainsi, les données déduites à partir d’analogues relatives aux effets sur la santé potentiels des pigments de β-naphtol sont appuyées par la toxicité et la pharmacocinétique qualitativement similaires, ainsi que par le parcours de résultats néfastes commun prévu des divers métabolites de nitroaniline des pigments de β-naphtol.
En résumé, d’après les données disponibles relatives aux effets sur la santé de certaines de ces substances (PR3, PR4 et PO5), une toxicité qualitativement similaire a été observée chez les animaux et elle se présente principalement sous la forme d’une toxicité hémolytique et des organes dans la rate et le foie (tableau 7-8). Une incidence accrue des tumeurs hépatiques chez les rats femelles a également été observée, d’après les études sur le PR3 (NTP, 1992) et le PO5 (Hart et al., 1986; USFDA, 1986) accompagnées des données à l’appui concernant le PR4 (Kupradinun et al., 2002). On a supposé que l’autre pigment de β-naphtol, le rouge para*, avait une carcinogénicité potentielle fondée sur une similarité structurelle avec le colorant azoïque de β-naphtol, le Sudan I (EFSA, 2005; UK COT, 2005) qui était également associé à une augmentation des tumeurs du foie chez les rats (Environnement Canada, Santé Canada, 2014a). Malgré les données limitées, les pigments de β-naphtol testés (PR3, PR4, PO5, PO2, rouge para*) ont également présenté un certain pouvoir mutagène qui varie toutefois. Aucune étude de toxicité à doses répétées n’a été recensée pour les autres pigments de β-naphtol étudiés ici (NONPA, PO2, PR6). Cependant, en se fondant sur des propriétés physiques et chimiques comparables, sur la similarité structurelle des pigments de β-naphtol, sur le potentiel de clivage des liaisons azoïques, sur une toxicocinétique et une toxicodynamique similaires prévues, ainsi que sur les effets communs sur la santé des métabolites attendus (résumés ci-dessus), tous les pigments de β-naphtol dans ce sous-ensemble devraient présenter une toxicité qualitativement similaire, y compris une cancérogénicité potentielle (tableau 7-8).
7.2.2 Pigments de β-naphtol laqués (PR53:1, PR49:1 et PR50:1)
Toutes les substances dans le sous-ensemble des pigments de β-naphtol laqués ont la même partie de β-naphtol que celle qui se trouve dans le sous-ensemble de pigments de β-naphtol. Cependant, la principale différence avec les pigments de β-naphtol laqués est qu’ils sont tous des sels de baryum (pigments laqués) d’anilines (PR50:1, PR53:1) ou de naphtylamine (PR49:1) substitués par un groupe sulfonique ou carboxylique (tableau 7-9). Étant donné que le 1-amino-2-naphtol est une caractéristique structurelle commune et un produit de clivage azoïque potentiel pour tous les pigments de βnaphtol laqués, sa structure est présentée ci-dessous, tandis que les structures d’origine propres aux substances et les métabolites du clivage azoïque correspondants figurent dans le tableau 7-9 :

| Identité Note de bas de page Tableau 7-9 [a]et structure chimiques des pigments de β-naphtol laqués d’origine | Identité et structure chimiques des produitsNote de bas de page Tableau 7-9 [b] potentiels du clivage de la liaison azoïque |
|---|---|
PR53:1
|
Amine Red Lake C
|
PR49:1
|
Acide de Tobias
|
PR50:1
|
Acide anthranilique
|
Absorption et potentiel de clivage de la liaison azoïque
Une étude sur l'absorption et le métabolisme in vivoa été relevée pour le PR53:1. Dans cette étude, on a administré du PR53:1 radiomarqué au C14 (appelé « Red no 9 » à des groupes de quatre rats F344 mâles pendant 24 heures dans un régime alimentaire à une concentration de 3 000 parties par million (ppm) (équivalente à une dose de 150 mg/kg p.c.) suivie d'une période de récupération de 24 heures (Chadwick et al., 1984). Le PR53:1 a été marqué sur le cycle naphténique ou benzénique afin de distinguer les deux produits du clivage de la liaison azoïque de chaque côté de la liaison azoïque, notamment le benzène-C14 pour l'amine Red Lake C et le naphtol-C14 pour le 1-amino-2-naphtol. Des échantillons d'urine, de matières fécales et de sang ont été prélevés au cours de l'étude de 0 à 48 heures. Un métabolisme important a été relevé, étant donné que la plus grande partie de la dose appliquée a été récupérée dans l'urine sous forme d'amine Red Lake C (35 %) et de 1-amino-2-naphtol (54 %), tandis que seule une petite fraction de la dose (inférieur(e) à 1 %) a été récupérée sous forme de PR53:1 inchangé. Une très faible accumulation de l'amine Red Lake C a été observée dans des érythrocytes, ce qui vient appuyer une étude antérieure sur l'absorption alimentaire de 10 jours déclarée par les mêmes auteurs, tandis que les données n'ont pas été présentées (Chadwick et al., 1984). Cependant, du 1-amino-2-naphtol a été détecté dans des échantillons sanguins à 24 heures et à 48 heures à 2 % de la dose administrée; un quart de cette dernière était liée par covalence aux érythrocytes. Dans l'ensemble, les résultats de cette étude indiquent qu'une importante fraction de PR53:1 et des produits du clivage de la liaison azoïque est absorbée par voie orale, avec important clivage de la liaison azoïque déclenché par des bactéries du tube digestif ou par des enzymes tissulaires in vivo. L'absence de récupération complète indique aussi la distribution possible à d'autres tissus qui ont été analysés; par conséquent, l'absorption orale finale de la substance d'origine ou des produits du clivage de la liaison azoïque est probablement supérieure à celle qui est indiquée dans l'étude. On s'attend à ce qu'un potentiel similaire d'absorption orale s'applique également aux deux autres pigments de β-naphtol laqués.
Dans une étude in vitro, un clivage important (~99 %) de la liaison azoïque du PR53:1 a été observé après une nuit d'incubation avec une préparation fécale de rat (Dillon et al., 1994, tandis qu'une autre étude a démontré un clivage de la liaison azoïque graduel, mais régulier du PR50:1 dans une culture anaérobie de 24 heures avec un homogénat fécal humain (BRI, 2013). Ces études in vitro appuient l'étude d'exposition par voie orale ci-dessus, ce qui laisse penser que le clivage de la liaison azoïque des pigments de β-naphtol laqués peut se produire, notamment, dans le tube digestif de mammifères, sur la base de structures et de propriétés physicochimiques similaires dans ces substances.
Concernant le contre-ion Ba2+, qui devrait se dissocier lors de l'absorption ou du clivage de la liaison azoïque du composant organique, une vaste plage d'absorption du Ba2+ a été déclarée dans des études expérimentales sur des animaux (7 à 85 % pour des rongeurs et des chiens) avec une plus forte absorption chez des animaux plus jeunes (SCHER, 2012; CCME, 2013). L'absorption gastro-intestinale de l'ion Ba2+ chez les humains a été estimée à 20 % chez les adultes, à 30 % chez les enfants (1 à 15 ans) et à 60 % chez les nourrissons (SCHER, 2012; CCME, 2013); par conséquent, l'exposition orale aux pigments de β-naphtol laqués devrait donner une fraction biodisponible de l'ion Ba2+dissocié. On suggère une instabilité des pigments de β-naphtol laqués dans des conditions gastriques simulées dans des documents sur les peintures et les revêtements (Lewis, 1995), qui font preuve de prudence quant aux applications de ces colorants dans des revêtements pouvant entraîner une exposition orale, comme dans le cas des jouets, en raison du rejet potentiel de l'ion Ba2+ (Siegwerk, 2012). D'autres pigments laqués à base de Ba2+ couplés à de l'acide béta-oxynaphtoïque (BONA) ont également montré une capacité de rejet d'ions Ba2+ dans des conditions gastriques simulées (Rastogi et Pritzle, 1998). Les parties azoïques organiques dissociées des pigments de β-naphtol laqués après l'absorption orale sont probablement plus solubles dans les contenus du tube digestif que prévu selon les solubilités dans l'eau et l'octanol mesurées pour les pigments de β-naphtol laqués d'origine. Par conséquent, les pigments de β-naphtol laqués dissociés par voie orale sont plus similaires à leurs sels et colorants acides solubles respectifs. La même hypothèse a été appliquée au PR53:1 et à son sel de sodium soluble correspondant (D&C Red no 8, n° CAS 1658-56-6) par la US Food and Drug Administration (FDA) pour considérer que l'exposition orale à l'un des sels serait essentiellement équivalente dans les conditions acides de l'estomac; par conséquent, les deux sels pourraient avoir des toxicités similaires (Hart et al., 1986).
La seule étude de l'absorption par voie cutanée disponible définie était une étude in vitro de la pénétration dans la peau impliquant de la peau humaine. Cette étude a déclaré un maximum de 0,06 % de PR53:1 radiomarqué au benzène-C14 détecté dans le fluide récepteur (Franz, 1983). En raison des données limitées sur l'absorption par voie cutanée, des données in vitro pour des analogues de pigment de BONA, notamment le PR57:1* (sel Ca2+) et le PR57* (sel Na+), sont prises en compte pour ce sous-ensemble. Par conséquent, une estimation prudente de 1 % d’absorption par voie cutanée est appliquée pour les pigments de β-naphtol laqués (consulter la section sur les pigments de BONA pour obtenir plus de détails). Les pigments de β-naphtol laqués et les pigments de BONA laqués présentent une similarité structurelle, avec des cycles naphténiques ou benzéniques opposés à la liaison azoïque. Ces deux types de pigments laqués sont des sels insolubles de groupes sulfonates ou carboxylates ionisables, la différence étant que les pigments de BONA laqués contiennent aussi un groupe carboxylate sur le C3 de la partie de 1-amino-2-naphtol et sont, par conséquent, des sels 1:1 des cations divalents, comparativement à 2:1 pour les pigments de β-naphtol laqués.
Collectivement, les pigments de β-naphtol laqués sont considérés comme étant biodisponibles par voie orale et soumis au métabolisme, y compris le clivage de la liaison azoïque, dans le tube digestif, avec un certain degré de dissociation de l'ion Ba2+ prévu. Ainsi, les données sur les effets sur la santé liés aux sels solubles de pigments de β-naphtol laqués ont été prises en compte pour des données déduites à partir d'analogues pour ce sous-ensemble.
Effets sur la santé
Des données pour toutes les durées d'études ont été relevées pour le PR53:1, tandis que seules des données sur la toxicité à doses répétées pour des expositions chroniques et subchroniques ont été recensées pour le PR49*, l'analogue Na+ du PR49:1. Des données déduites à partir d'analogues pour le PR49:1, le PR50:1 et d'autres pigments de β-naphtol laqués sont basées sur la plage des effets critiques et des DSENO et DMENO connexes liés au PR53:1 et au PR49* (sel de sodium). Un résumé des seuils d'effets critiques pour les pigments de β-naphtol laqués est présenté dans le tableau 7-10.
| Substance | DMENO/DSENO à court terme (mg/kg p.c. par jour) |
Toxicité subchronique DMENO/DSENO (mg/kg p.c. par jour) |
Toxicité chronique DMENO/DSENO (mg/kg p.c. par jour) |
Point de départ pour la cancérogénicité (mg/kg p.c. par jour) |
|---|---|---|---|---|
| PR53:1 | DMENO = 300 (RM, RF) Changements pathologiques observables à l'œil dans la rate (élargie, rouge foncée), le foie et les reins (rouges foncés) (NTP, 1982) |
DMENO = 30 DSENO = 4,5 (chien) Splénomégalie, anémie (CTFA, 1983a; BIBRA, 1989) DMENO = 125-150 (RM, RF) Élargissement et changement de couleur de la rate, hémosidérose hépatique, pigment dans les tubules rénaux (Davis et Fitzhugh, 1962; NTP, 1982) |
DMENO = 50 (RM, RF) Changements histopathologiques dans le foie (cytoplasme basophile) et la rate (hémorragie, fibrose) (NTP, 1982) |
BMDL10 = 44 (RM) Nodules néoplasiques hépatiques 0/50 (0 %) dans le groupe témoin 6/50Note de bas de page Tableau 7-10 [c] (12 %) 50 mg/kg p.c. par jour (ppm dans le régime alimentaire) 7/49[c] (14 %) 150 mg/kg p.c. par jour (ppm dans le régime alimentaire) (NTP, 1982) |
| PR49:1 | Données déduites à partir d'analogues du PR53:1 | Données déduites à partir d'analogues du PR53:1 et du PR49 | Données déduites à partir d'analogues du PR53:1 et du PR49 | N.D.Note de bas de page Tableau 7-10 [d] (aucun effet cancérogène signalé dans les études portant sur le PR49*) |
| PR49 (sel Na+) | Données déduites à partir d'analogues du PR53:1 | DMENO = 125 (RM, RF) Splénomégalie, anémie hémolytique (Davis et Fitzhugh, 1963) |
DMENO = 125 DSENO = 25 (RM, RF) Hémosidérose et hématopoïèse de la rate DMENO = 25 DSENO = 5 (RM, RF) Hyperplasie de la moelle osseuse (Davis et Fitzhugh, 1963) |
s.o. (aucun effet cancérogène déclaré dans les études sur le PR49) |
PR53:1
La caractérisation des effets sur la santé pour le PR53:1 est principalement basée sur des données résumées dans des examens secondaires (Hart et al., 1986; LSRO-FASEB, 1984; CIRC, 1993; OCDE, 1999a, b; CSC, 2000). Pour le potentiel de génotoxicité, un examen par la BIBRA (1989) a aussi été pris en compte et est résumé ci-dessus.
Génotoxicité
Le PR53:1 a généralement été déclaré négatif dans la plupart des études in vivo et in vitro, avec quelques réponses faibles ou équivoques déclarées dans quelques tests in vitro (mutagénicité de la Salmonella après incubation avec une préparation fécale, aberrations chromosomiques in vitro, et essai de transformation in vitro). L'autre réponse positive a été observée pour les échanges de chromatides sœurs in vivo dans la moelle osseuse de souris.
Les résultats du test d'Ames standard sur la Salmonella dans les études relevées étaient presque tous négatifs (Brown et al., 1979; Muzzall et Cook, 1979; Miyagoshi et al,. 1983; Longstaff et al., 1984; BUA, 1993; Zeiger et al., 1988; Dillon et al., 1994), et des réponses faiblement positives ou équivoques ont été détectées dans des souches TA97 et TA98 uniquement à des doses entraînant la précipitation des matières testées (Zeiger et al., 1988). Un essai de la mutation inverse menée sur la bactérie Escherichia coli a également donné une réponse négative (Hoechst AG, 1985). Dans des tests d'Ames modifiés Prival avec de la mononucléotide flavine où la réduction de la liaison azoïque était facilitée, du PR53:1 a aussi signalé négatif dans les souches TA98, TA100, TA1535 et TA1537 (BUA, 1993; Dillon et al., 1994), et négatif ou faiblement positif/équivoque dans la souche SalmonellaTA100 (Dillon et al., 1994). Cependant, des réponses positives et faiblement positives ont été observées dans les souches TA100 et TA98, respectivement, après une nuit d'incubation anaérobie du PR53:1 avec une préparation fécale de rat. Les auteurs de l'étude ont avancé que des résultats négatifs antérieurs issus de tests d'Ames modifiés avec de la mononucléotide flavine étaient probablement dus à un clivage de la liaison azoïque insuffisant et que le PR53:1 a un certain potentiel mutagénique dans la Salmonella, sur la base de la mutagénicité d'un ou de plusieurs de ses produits du clivage de la liaison azoïque (Dillon et al., 1994).
Par ailleurs, des études de la génotoxicité in vitrosur des cellules mammaliennes étaient principalement négatives, y compris un essai de la mutation du locus TK dans des cellules de lymphomes de souris L5178Y (Myhr et Caspary, 1990), des aberrations chromosomiques, des échanges de chromatides sœurs dans des cellules CHO (Ivett et al., 1989), et la synthèse d'ADN non programmée dans des hépatocytes primaires de rats (Kornbrust et Barfnecht, 1985; Williams et al., 1989). Les résultats pour les aberrations chromosomiques dans des cellules pulmonaires de hamsters chinois (V79) (BUA, 1993) ont été déclarés positifs (CNN, 2000) et négatifs (OCDE, 1999b) dans des sources secondaires; cependant, des détails insuffisants ont été fournis pour permettre l'évaluation de cette étude. Le PR53:1 a également été déclaré positif dans l'essai de la transformation cellulaire impliquant des cellules Balb/c 3T3 (Tennant et al., 1986) et des cellules BHK21/C13 (Longstaff et al., 1984); cependant, les deux études ont été considérées dans d'autres examens comme étant déclarées insuffisamment (CNN, 2000) ou n'étant pas assez fiables (OCDE, 1999a) pour être évaluées.
Pour les études de la génotoxicité in vivo; à la suite d'une injection intrapéritonéale de PR53:1 à des doses allant de 500 à 2 000 mg/kg p.c., aucune hausse statistiquement significative dans la synthèse d'ADN non programmée n'a été observée dans les hépatocytes de rat ou des micronoyaux de la moelle osseuse (Westmoreland et Gatehouse, 1992). Ce résultat confirme un résultat négatif antérieur pour la synthèse d'ADN non programmée dans des hépatocytes de rat à une dose plus faible de 500 mg/kg p.c. (Kornbrust et Barfnecht, 1985). Un résultat négatif a été signalé pour les aberrations chromosomiques dans la moelle osseuse après une injection intrapéritonéale (1 250 à 5 000 mg/kg p.c.) chez des souris, tandis que des résultats positifs pour les échanges de chromatides sœurs dans la moelle osseuse ont été déclarés dans la même étude (NTP, 2013). Le PR53:1 a également été déclaré négatif quant à la mutagénicité chez le Drosophila(Foureman et al., 1994).
Cancérogénicité
La cancérogénicité du PR53:1 a été testée dans plusieurs études de toxicité chronique chez des rats et des souris (NTP, 1982; CTFA 1982; Davis et Fitzhugh, 1962; OCDE, 1999a). Cependant, les études provenant du National Toxicology Program des États-Unis (NTP) sont les plus récentes et contiennent des détails disponibles dans des rapports publiés. Par conséquent, ces études sont résumées ici. En bref, l’essai sur la toxicité chronique mené par le NTP (1982) comprenait une exposition pendant deux ans des rats F344 (50/sexe/dose, témoins, 1 000 ppm ou 50 mg/kg p.c. par jour, 3 000 ppm ou 150 mg/kg p.c. par jour) et des souris B6C3F1(50/sexe/dose, 1 000 ppm ou 130 mg/kg p.c. par jour, 2 000 ppm ou 260 mg/kg p.c. par jour) au PR53:1 dans un régime alimentaireNote de bas de page[11].
Une augmentation de l’incidence de sarcomes de la rate a été observée uniquement chez les rats F344 mâles soumis à une forte dose (principalement fibrosarcomes et ostéosarcomes : 0/50, témoins, 0/50 à 50 mg/kg p.c. par jour, 26/48 (54 %) à 150 mg/kg p.c. par jour). Les tumeurs de la rate étaient considérées comme rares chez des rats F344, une très faible incidence de valeurs historiques ayant été déclarée dans le programme du NTP au moment de cette étude (3/2960 ou 0,1 % de fibrosarcomes de la rate signalées dans le NTP, 1982). Sur la base de la malignité des sarcomes de la rate et de leur tendance à se métastaser dans des tissus extraspléniques, combinées à une toxicité non cancérogène importante pour la rate observée dans toutes les études à doses répétées, le NTP a considéré l'association de l'exposition au PR53:1 avec des sarcomes de la rate comme étant non équivoque et représentant une preuve « positive » de la cancérogénicité du PR53:1 (NTP, 1982). Des types similaires de tumeurs de la rate ont été observés chez des rats Sprague-Dawley, notamment dans le groupe soumis à une forte dose (10 000 ppm = 500 mg/kg p.c. par jour) dans une autre étude de toxicité chronique par voie alimentaire avec le PR53:1 (4/70 mâles, 1/70 femelles, 0/70 témoins de chaque sexe); les tumeurs ont été considérées comme étant probablement liées à l’exposition, bien que leur incidence n’était par statistiquement significative (OCDE, 1999a). Ainsi, cette étude supplémentaire est considérée comme une preuve à l’appui de la cancérogénicité du PR53:1 par voie orale dans la rate des rats mâles. Cependant, aucune tumeur de la rate n'a été observée chez les rats F344 femelles exposées dans l'étude du NTP (NTP, 1982), et d'autres études de la toxicité chronique par voie orale chez des souris (CTFA, 1982; NTP, 1982) et des rats Osborne-Mendel (Davis et Fitzhugh, 1962) n'ont pas montré de réaction tumorigène observable à l'exposition au PR53:1. La raison de la sensibilité de ce type de tumeur au sexe et à l'espèce n'est pas connue.
Dans les études de la toxicité chronique par voie orale du NTP sur des souris et des rats, l'incidence de nodules néoplasiques hépatiques observée dans le foie de rats 344 mâles était statistiquement significative aux deux doses d'essai (0/50, 6/50 p = 0,013, et 7/49 p = 0,006, pour les témoins, 50 et 150 mg/kg p.c. par jour, respectivement) et était considérée comme une preuve « positive » de la cancérogénicité. Ces effets étaient également associés à des effets hépatiques non néoplasiques chez des rats mâles (changements dans le cytoplasme basophile, nécrose centro-lobulaire), tandis qu'une tendance statistiquement significative (p = 0,039) pour les nodules néoplasiques du foie (1/50, 1/50 et 5/50 pour les rats témoins, 50, 150 mg/kg p.c. par jour pour les groupes, respectivement) a aussi été observée pour les rats femelles et est considérée comme une preuve « équivoque » de la cancérogénicité (NTP, 1982). Une source secondaire a signalé une analyse sur microplaque de suivi menée par la USFDA qui laissait entendre que la réelle incidence de nodules néoplasiques hépatiques était inférieure à la signification statistique chez les rats mâles et femelles dans l’étude du NTP (cité dans LSRO-FASEB, 1984; BIBRA, 1989). Cependant, en l’absence de la source principale de l’analyse de la USFDA et compte tenu des détails limités fournis dans la source secondaire, les nodules néoplasiques observés sont considérés comme un indicatif de l’effet cancérogène de l’exposition au PR53:1, conformément aux conclusions par le NTP (1982). Dans l'étude sur des souris, une hausse statistiquement significative des carcinomes hépatocellulaires chez des souris mâles a également été signalée dans l'étude du NTP (4/50, 9/50 et 11/50 pour les témoins, faible dose et forte dose, respectivement); cependant, les incidences se situaient dans ou en dessous de la plage de valeurs historiques pour ce laboratoire (65/297) et n'étaient pas considérées comme étant liées à l'exposition par le NTP. Les autres études de la toxicité disponibles pour des souris et des rats n'ont pas indiqué d'incidence accrue de tumeurs hépatiques liées à l'exposition (NTP, 1982).
L'absence de cancérogénicité du PR53:1 par voie cutanée a été signalée sur la base de résultats de deux études de badigeonnage de la peau de souris (Carson, 1984a; Hart et al., 1986). Dans une étude, des souris ICR Swiss Webster (50 de chaque sexe dans les groupes de traitement et témoins) ont été exposées sur la peau rasée du dos (6 cm2) deux fois par semaine pendant 18 mois à de l'eau (groupe témoin recevant l'excipient) ou à 1 mg de PR53:1 dans 0,1 mL d'eau (environ 33 mg/kg p.c. par dose d'applicationNote de bas de page[12]). L'examen histologique n'a révélé aucune différence évidente dans les tumeurs de la peau ou d'autres tissus entre le groupe témoin et le groupe exposé au PR53:1 (Carson, 1984a; CIRC, 1993). En outre, des détails limités d'une autre étude par badigeonnage de la peau de souris CF-1 Carworth n'ont indiqué aucun effet cancérogène découlant de l'exposition hebdomadaire à une solution de 0,1 mL contenant 1 % de PR53:1 pendant 26 mois (tel qu'il est mentionné dans Hart et al., 1986). Bien que d'autres études étaient relativement limitées (c.-à-d. une seule dose testée; dose inférieure aux DMENO orales), les données fournissent des preuves d'une absence du potentiel cancérogène du PR53:1 directement appliqué sur la peau de souris à des doses d'essai données. En raison de la solubilité relativement faible du PR53:1 au sein du groupe témoin recevant l'excipient dans ces études (eau), de sa pénétration cutanée limitée in vitro (1 %) et de la faible dose testée par rapport aux DMENO orales pour les souris (dose externe appliquée de 33 mg/kg p.c. deux fois par semaine c. DMENO quotidienne orale de supérieur(e) ou égal(e) à 130 mg/kg p.c. par jour), la dose systémique découlant de ces études sur l'absorption cutanée devrait être négligeable, ce qui permet d'expliquer l'absence de cancérogénicité observée.
Une diminution évidente et statistiquement significative de l'incidence de leucémie lymphocytaire chez des rats des deux sexes ainsi qu'une baisse des tumeurs dans les glandes préputiales ont été observées dans l'étude de la toxicité chronique du NTP (NTP, 1982). Une baisse similaire de la leucémie lymphocytaire a été observée dans d'autres études de la toxicité chronique du NTP portant sur des colorants azoïques qui sont lipophiles (Sudan I, Solvent Yellow 77) ou hydrophiles (Acid Red 14, Acid Orange 10) (Haseman et Johnson, 1996). Tandis que la majorité des substances (testées par le NTP) qui réduisaient l'incidence de leucémie ont montré une toxicité pour la rate, ce phénomène n'a pas été observé dans tous les cas, y compris avec les colorants azoïques hydrosolubles susmentionnés. Le mécanisme de la réduction apparente de l’incidence de leucémie spontanée par ces substances n’est pas clair chez le rat F344.
Autres études de toxicité à doses répétées
Des études de la toxicité par voie orale à doses répétées pour le PR53:1 démontrent certains effets non cancérogènes communs, avec la rate, le sang, le foie et les reins comme principaux organes ou tissus cibles chez les espèces testées dans l'ordre général de sensibilité. Elle semble être plus importante chez le chien que chez le rat et la souris. Les observations les plus cohérentes déclarées dans les études impliquaient la toxicité pour la rate (c.-à.-d., congestion, hémorragie, fibrose, hyperplasie, hémosidérose, altération des tissus adipeux) et ont été observées chez les deux sexes dans plusieurs souches de rats dans des études de la toxicité chronique, subchronique et à court terme (Davis et Fitzhugh 1962; CTFA, 1982; NTP, 1982). Une toxicité pour la rate a également été observée dans des études sur des chiens (CTFA, 1983a) ainsi que dans des études de la toxicité subchronique et à court terme chez des souris (NTP, 1982). Dans les études de la toxicité chronique sur des souris qui n'ont pas signalé de toxicité pour la rate, la dose maximale tolérée n'a probablement pas été atteinte; par conséquent, les doses d'essai peuvent avoir été insuffisantes pour déclencher cet effet, appuyant ainsi la sensibilité inférieure des souris comparativement aux rats et aux chiens pour cet effet (NTP, 1982). Dans l'ensemble, la toxicité pour la rate a été observée à des DMENO de 30 mg/kg p.c. par jour dans l'étude de deux ans sur des chiens (CFTA, 1983), de 50 mg/kg p.c. par jour dans l'étude de la toxicité chronique sur des rats (NTP, 1982), et de 163 mg/kg p.c. par jour dans l'étude de 13 semaines sur des souris (NTP, 1982). La toxicité pour la rate est probablement associée ou secondaire à la clairance splénique à la suite de la toxicité primaire exercée sur les globules rouges; ce phénomène a également été signalé après l'exposition de chiens, de rats et de souris à l'aniline. Des doses similaires à celles auxquelles la toxicité pour la rate a été observée incluaient des effets dans les globules rouges (anémie, baisse de l’hémoglobine et du volume de globules rouges, présence de corps de Heinz, hausse des réticulocytes) de même que l’hémosidérose et la pigmentation dans le foie et les reins, qui indiquent une destruction accrue des globules rouges après la toxicité primaire exercée sur les globules rouges découlant de l’exposition au PR53:1 ou aux produits du clivage de liaison azoïque. L'association de la toxicité dans la rate avec la toxicité dans les cellules de globules rouges observée dans cette étude a aussi été déclarée pour plusieurs amines aromatiques (aniline, p-chloroaniline, o-toluidine) (NTP, 1982; Goodman et al., 1984; Weinburger et al., 1985).
D'autres observations communes non liées au cancer impliquaient des effets dans le foie et les reins. La toxicité pour le foie chez les rats (Davis et Fitzhugh, 1962; CTFA, 1982; NTP, 1982) et les chiens (CTFA, 1983a) impliquait une hausse du poids et de la taille du foie, une hémosiderose ainsi que d'autres effets (changements dans le cytoplasme basophile et nécrose centro-lobulaire) chez des rats mâles (NTP, 1982). Des observations dans les reins incluaient la pigmentation accrue des rats des deux sexes à la suite d'une exposition chronique, subchronique et à court terme de même qu'une régénération des tubules rénaux après une exposition chronique chez des rats femelles (NTP, 1982). D'autres effets moins communs ont été signalés dans des études sur des rats menées par le NTP (dégénérescence des tubules testiculaires, dilatation d'acinus mammaires, hyperplasie des ganglions lymphatiques des bronches; NTP, 1982) et par la USFDA (hyperplasie de moelle osseuse; Davis et Fitzhugh, 1962), ainsi que dans une étude sur des souris (inflammation chronique de l'estomac; CTFA, 1982).
PR49:1Note de bas de page[13]
On n'a recensé aucune étude sur la toxicité à doses répétées, l'absorption ou le métabolisme pour le PR49:1. Toutefois, sur la base d'hypothèses similaires à celles qui ont été formulées pour le PR53:1, on considère qu'un certain degré de biodisponibilité et de dissociation du PR49:1 se manifeste après l'exposition par voie orale. Par conséquent, étant donné que la dissociation de l'ion Ba2+ et de l'anion azoïque organique est susceptible de se produire, les études sur la toxicité orale du sel de sodium PR49* (D&C Red no 10) sont considérées ici comme appuyant la toxicité orale du PR49:1. Des hypothèses similaires pour la toxicité par voie cutanée sont également considérées comme s'appliquant au PR49:1.
Génotoxicité
Plusieurs sels du PR49, y compris le sel de baryum PR49:1, ont été déclarés négatifs dans le test d'Ames standard (examiné dans Combes et Haveland-Smith, 1982), tandis que le PR49* (sel de sodium) a été déclaré positif dans la souche Salmonella TA1538 avec ou sans activation métabolique (S9) (Chung et al., 1981). Le PR49* a également été déclaré négatif dans le test d'Ames modifié Prival dans une souche TA98 (Zhou et al., 1987). Le sel de sodium devrait être plus soluble et disponible pour le clivage azoïque facilité dans cet essai; par conséquent, une réponse négative donne à penser que les produits du clivage azoïque n'étaient pas mutagènes dans une souche TA98 dans des conditions d'essai. Le PR49:1 a aussi été déclaré non concluant et négatif pour la mutagénicité avec ou sans activation métabolique (S9), respectivement, dans l'essai sur des lymphomes de souris (Seifried et al., 2006). Aucune donnée sur la génotoxicité n'a été relevée pour le PR49:1 ou ses sels connexes; cependant, les données in vitro disponibles n'indiquent pas un fort pouvoir mutagène.
Cancérogénicité
Dans une étude de badigeonnage chronique sur la peau, des souris ICR Swiss Webster (50 de chaque sexe dans un groupe d'exposition et 25 de chaque sexe dans un groupe témoin) ont été exposées sur la peau rasée du dos (6 cm2) deux fois par semaine pendant 18 mois à de l'eau (groupe témoin recevant l'excipient) ou à 1 mg de « Red no 10 » (D&C Red no 10 ou sel de sodium PR49) dans 0,1 mL d'eau (environ 33 mg/kg p.c.Note de bas de page[14] par dose d'application). L'examen histologique n'a révélé aucune différence évidente dans les tumeurs de la peau ou d'autres tissus entre le groupe témoin et le groupe exposé d'exposition (Carson, 1984). Comme dans le cas du PR53:1, ces données fournissent des preuves d'une absence du potentiel cancérogène du sel de sodium PR49 directement appliqué sur la peau de souris à des doses d'essai données. Cependant, en raison de la pénétration cutanée limitée prévue pour la substance ionisée largement soluble ainsi que la faible dose testée par rapport aux DMENO orales pour les rats et les chiens (dose cutanée externe de 33 mg/kg p.c. deux fois par semaine c. DMENO quotidienne orale chez les rats et les chiens supérieure ou égale à 25-30 mg/kg p.c. par jour avec une absorption importante attendue), la dose systémique découlant de ces études sur l’absorption cutanée devrait être négligeable, ce qui permet d’expliquer l’absence de cancérogénicité observée.
Autres études de toxicité à doses répétées
Les résultats d'une étude de la toxicité subchronique par alimentation de 20 semaines menée par la US FDA, dans laquelle cinq rats Osborne-Mendel de chaque sexe ont été exposés à une concentration alimentaire de 0 %, 0,25 %, 0,5 %, 1 % ou 2 % (équivalente aux doses de 0, 125, 250, 500 et 1 000 mg/kg p.c. par jour) de PR49*, n'ont indiqué aucun changement dans la mortalité, la croissance ou d'autres signes graves de toxicité. Toutefois, un léger effet sur les paramètres hématologiques (baisse de l'hémoglobine et de l'hématocrite, hausse des normoblastes en circulation) et une splénomégalie modérée ont été observés dans les groupes d'essai comparativement avec au groupe témoin, indiquant une DMENO subchronique de 125 mg/kg p.c. par jour, soit la plus faible dose testée (Davis et Fitzhugh, 1963). Dans une étude de la toxicité chronique par alimentation de 2 ans menée par la US FDA, 25 rats de chaque sexe ont été exposés à une concentration alimentaire de 0 %, 0,01 %, 0,05 %, 0,25 % ou 1 % (équivalente aux doses de 0, 5, 25, 125 et 500 mg/kg p.c. par jour) pendant 103 semaines. Les seuls effets liés à l'exposition étaient un élargissement statistiquement significatif de la rate dans les groupes soumis à une concentration de 0,25 % et de 1 % (125 et 500 mg/kg p.c. par jour) avec une hémosidérose et une érythropoïèse de la rate connexes confirmées par l'histologie, tandis que les rates dans le groupe soumis à la concentration de 0,05 % (25 mg/kg p.c. par jour) n'étaient pas histologiquement différentes de celles du groupe témoin. Une hyperplasie modérée de la moelle osseuse a également été observée à la concentration alimentaire de 0,05 % et au-dessus (supérieur(e) ou égal(e) à 25 mg/kg p.c. par jour). Des échantillons sanguins prélevés tout au long de l'étude auprès de cinq rats de chaque sexe dans chaque groupe n'ont montré aucun effet apparent sur l'hémoglobine, l'hématocrite ou les globules blancs; cependant, des groupes d'essai ont montré une « polychromatophilie, des cellules cibles, et des normoblastes occasionnels dans le sang périphérique ». Aucune différence évidente dans les effets, comme les poids d'organes ou les incidences de tumeurs, n'a été signalée entre les groupes d'exposition et témoin (Davis et Fitzhugh, 1963). Les DMENO chroniques sont estimées à 125 mg/kg p.c. par jour pour les effets sur la rate (DSENO = 25 mg/kg p.c. par jour) et 25 mg/kg p.c. par jour pour l'hyperplasie de la moelle osseuse (DSENO = 5 mg/kg p.c. par jour).
Dans une étude de la toxicité par voie alimentaire sur des chiens Beagle (six de chaque sexe par groupe) ayant reçu du PR49* à une concentration alimentaire de 0 %, 0,015 %, 0,1 % ou 5 % (équivalente aux doses de 0, 4,5, 30 et 150 mg/kg p.c. par jour) pendant deux ans, aucun changement lié à l'exposition dans le poids corporel, la consommation alimentaire ou le comportement n'a été relevé. Des paramètres hématologiques ont été déclarés touchés chez les chiens nourris avec une concentration de 0,1 % (30 mg/kg p.c. par jour) et au-dessus, avec des baisses de l'hématocrite, de l'hémoglobine et des érythrocytes, dont la gravité s'est accentuée à la dose de 5 %. Le taux de bilirubine dans l'urine a également augmenté à une concentration alimentaire de 0,1 % et au-dessus. Une incidence accrue de splénomégalie liée à la dose s'est manifestée à la concentration alimentaire 0,1 % et au-dessus, tandis le poids du foie a augmenté dans le groupe ayant reçu une concentration alimentaire de 5 %. Des preuves de destruction des globules rouges ont été signalées à la concentration alimentaire de 0,1 % et au-dessus, sur la base de constatations histologiques de l'hémosidérose et dérythropoïèse accrues de la rate, ainsi que de la pigmentation du foie, de la moelle osseuse et des tubules rénaux. Une hyperémie aiguë grave a été relevée dans des sections de tissus de tous les chiens du groupe soumis à une concentration alimentaire de 5 %. Une étude de la toxicité subchronique plus limitée (90 jours) (un chien Beagle de chaque sexe dans chaque groupe) dans la même plage de doses a également fourni des preuves d'effets sur le sang (bilirubinurie, splénomégalie, hémosidérose de la rate, du foie ou des reins, augmentation des globules rouges nucléés) et appuie les constatations de l'étude de la toxicité chronique (USFDA, 1972). Sur la base de ces données, la DMENO chronique est estimée à 30 mg/kg p.c. par jour, avec une DSENO de 4,5 mg/kg p.c. par jour.
PR50:1
Aucune étude empirique de la toxicité à doses répétées n'a été recensée pour le PR50:1. En cohérence avec les données sur le clivage de la liaison azoïque pour le PR53:1, le PR50:1 a montré un clivage graduel, mais régulier de la liaison azoïque au cours des 24 heures d'incubation avec un homogénat fécal humain dans des conditions anaérobies (BRI, 2013). Similairement aux données sur le PR53:1 (Dillon et al., 1994), le PR50:1 était, en outre, négatif pour la mutagénicité dans les souches Salmonella TA98 et TA100 avec ou sans activation métabolique (S9) et par la modification Prival de la mononucléotide flavine (FMN) (ILS, 2011). Cependant, Dillon et al. (1994) ont suggéré que la FMN seule peut être insuffisante pour entraîner le clivage de la liaison azoïque pour le PR53:1, étant donné que ce dernier a montré une réponse mutagène dans les souches TA98 et TA100 après une nuit d'incubation avec une préparation fécale de rat dans des conditions anaérobies. Par conséquent, on ne peut déterminer avec certitude si les résultats du test d'Ames modifié pour le PR50:1 sont négatifs, car les métabolites ne sont pas mutagènes ou à cause du clivage de la liaison azoïque insuffisant par la modification de la mononucléotide flavine.
Résumé et considérations impliquant des données déduites à partir d’analogues
Des données mécanistes limitées sont disponibles pour les substances du sous-ensemble des pigments de β-naphtol laqués. Toutefois, sur la base des propriétés physicochimiques, des structures et des métabolites attendus du clivage de la liaison azoïque similaires, des données déduites à partir d'analogues pour les effets sur la santé dans le sous-ensemble sont considérées comme raisonnables. Étant donné que les pigments de β-naphtol laqués devraient subir une dissociation de l’ion Ba2+ et également un clivage azoïque dans une certaine mesure, les effets sur la santé des métabolites potentiels du clivage azoïque sont également pris en compte ici.
Outre le 1-amino-2-naphtol qui est commun à tous les pigments de β-naphtol laqués (les effets potentiels sur la santé du 1-amino-2-naphtol sont abordés dans la section 7.2.1, Résumé et considérations impliquant des données déduites à partir d’analogues), les autres métabolites correspondants sont tous des anilines (PR50:1, PR53:1) ou de la naphtylamine (PR49:1) (tableau 7-9) substitués par un groupe sulfonique ou carboxylique avec l’ion Ba2+. La contribution potentielle de l’ion Ba2+ et des autres métabolites de la toxicité observée des pigments de β-naphtol laqués d’origine est fondée sur une comparaison des données sur ces métabolites mettant l’accent uniquement sur les effets critiques les plus courants pour les pigments de β-naphtol laqués dans le tableau 7-10, à savoir l’hémolyse et les effets correspondants dans la rate (splénomégalie, augmentation du poids, hémosidérose, modifications dégénératives), ainsi que la toxicité hépatique (pour le PR53:1).
La toxicité de l’ion Ba2+ a été résumée dans plusieurs études récentes désignant les reins comme les organes cibles chez les souris, les rats et les cochons d’Inde et indiquant des preuves de pigmentation, d’augmentation du poids des reins et de néphropathie (SCHER, 2012; CCME, 2013). Dans les études disponibles sur l’ion Ba2+, aucun effet clair précis à l’exposition n’était apparent dans les paramètres hématologiques ou dans la rate ou le foie (poids des organes, histopathologie) à des doses bien plus élevées que celles où la toxicité hémolytique et la toxicité pour la rate ou le foie avaient été observées dans le cadre d’études portant sur le PR53:1. Par exemple, des effets précis ont été observés dans la rate de rats et de souris, dans le cadre de l’étude de 13 semaines portant sur le PR53:1 à des doses de 150 et de 163 mg/kg par jour, respectivement, ce qui correspond à des doses de l’ion Ba2+ de 23 et de 25 mg/kg p.c. par jour pour les rats et les souris (en supposant que 100 % du PR53:1 se dissocie pour rejeter l’ion libre Ba2+). Aucun effet similaire n’a été observé dans la composante subchronique d’une étude portant sur le chlorure de baryum dans l’eau potable (NTP, 1994) à des doses de l’ion Ba2+ 10 et 20 fois plus élevées chez les rats et les souris, respectivement (200 mg de l’ion Ba2+ par kg p.c. par jour chez le rat, 495 mg de l’ion Ba2+ par kg p.c. par jour chez la souris). Par conséquent, tous les effets liés au PR53:1 dans le sang ou la rate semblent ne pas être liés à la contribution de l’ion Ba2+. Une analyse similaire appuie la conclusion selon laquelle l’ion Ba2+ n’est pas susceptible de contribuer aux lésions hépatiques liées au PR53:1. Par conséquent, ces effets observés liés au PR53:1 sont probablement dus à la partie organique de cette substance en tant que colorant azoïque d’origine ou de produits du clivage azoïque. Étant donné que les études menées sur les animaux qui portent sur le PR49* (sel Na+) ne comprenaient pas une exposition à l’ion Ba2+, les effets observés dans ces études (p. ex., hémolyse, splénomégalie, hémosidérose, hyperplasie de la moelle osseuse, bilirubine dans l’urine) appuient le fait que les parties organiques communes du PR53:1 et du PR49* sont responsables des effets observés dans les érythrocytes, la rate et le foie pour ces substances.
La partie 1-amino-2-naphtol est commune au PR53:1 et au PR49:1, et le PR50:1 devrait contribuer de la même manière à la toxicité des deux substances. Par conséquent, la toxicité potentielle des métabolites uniques du clivage azoïque de ces substances est prise en compte en premier. Pour ces deux substances, les métabolites uniques du clivage azoïque contiennent des groupes solubilisants du fait de la substitution par un groupe sulfonique (amine Red Lake C du PR53:1 ou acide de Tobias du PR49:1) ou de la substitution par un groupe carboxylique (acide anthranilique du PR50:1) (voir le tableau 7-9).
Pour l’amine Red Lake C, une étude par voie orale de 28 jours chez des rats n’a signalé aucun changement lié à l’exposition en matière d’hématologie, de chimie clinique, du poids des organes ou aucun changement macroscopique ou microscopique dans les tissus à des doses allant jusqu’à 1 000 mg/kg p.c. par jour (Environnement Canada, Santé Canada, 2014b). En comparaison, la composante à court terme de l’étude du NTP sur le PR53:1 chez les rats a signalé des changements facilement observables dans la rate (augmentation de 2 à 5 fois la taille, rouge foncé) ainsi que dans le foie et les reins (couleur rouge foncé ou brun-rougeâtre) à une dose de 300 mg/kg p.c. par jour, ce qui correspond à une dose maximale théorique de 148 mg/kg p.c. par jour pour l’amine Red Lake CNote de bas de page[15]. Étant donné que l’amine Red Lake C n’a pas présenté d’effets toxiques à la dose testée la plus élevée de 1 000 mg/kg p.c. par jour dans une étude plus longue (28 jours par rapport à 14 jours pour la composante à court terme de l’étude du NTP portant sur le PR53:1) il est peu probable que la dose correspondante beaucoup plus faible de l’amine Red Lake C soit responsable des changements liés au PR53:1 observés dans la rate. Pour l’acide de Tobias (du PR49:1 et du PR49*), on a observé l’absence d’une toxicité précise semblable chez des rats exposés par voie orale à une dose allant jusqu’à 1 000 mg/kg p.c. par jour dans une étude de dépistage de toxicité pour la reproduction et le développement (durée d’exposition de 49 et de 39 jours pour les mâles et les femelles, respectivement), même si une diminution du poids du foie a été signalée à des doses élevées (JECDB, 2013a). Une étude de toxicité chronique par voie alimentaire pour l’acide de Tobias n’a pas révélé de changements dans la mortalité, la survie ou l’incidence de tumeurs à des doses allant jusqu’à 1 300 mg/kg p.c. par jour; toutefois, d’autres effets n’ont pas été déclarés (Della Porta et Dragani, 1982). ). Par rapport à la toxicité du PR49:1, des études sur le sel de sodium PR49* ont indiqué des effets chez des rats aussi faibles que 25-125 mg/kg par jour (hyperplasie de la moelle osseuse, changements hématologiques indiquant une destruction des globules rouges, splénomégalie) qui correspondent à des doses maximales théoriques de l’acide de Tobias d’environ 14-70 mg/kg par jourNote de bas de page[16]. Étant donné que ces types d’effets n’ont pas été observés au cours de l’étude à court terme de l’acide de Tobias chez les rats à des doses bien plus élevées (jusqu’à 1 000 mg/kg p.c. par jour; JECDB, 2013a), il est peu probable que la partie acide de Tobias ait contribué à l’hémolyse et à la réponse régénérative observée dans les études portant sur le PR49*. La faible toxicité observée pour l’amine Red Lake C (du PR53:1) et l’acide de Tobias (du PR49:1 et du PR49*) est conforme aux observations générales concernant les amines sulfonées en tant que groupe qui ne devraient pas avoir de potentiel carcinogène et qui seraient généralement associées à une toxicité systémique plus faible (Jung et al., 1992).
Pour le PR50:1, l’unique produit du clivage azoïque est l’acide anthranilique (tableau 79) que l’on trouve de façon endogène à partir du métabolisme du tryptophane et pour lequel une faible toxicité est déduite de l’étude de toxicité chronique par voie alimentaire chez des rats et des souris exposés à l’acide anthranilique et qui n’a pas présenté d’augmentations liées à l’exposition de la survie ou de l’incidence des tumeurs à des concentrations alimentaires allant jusqu’à 30 000 ppm chez le rat (équivalant à 1 500 mg/kg p.c. par jour) et 50 000 ppm chez la souris (équivalant à 6 500 mg/kg p.c. par jour)Note de bas de page[17], tandis qu’une légère augmentation de l’hématopoïèse a été observée chez les rats mâles et femelles (NCI, 1978). Par conséquent, toute exposition au PR50:1 ne devrait pas avoir une toxicité importante induite par la partie de l’acide anthranilique après un clivage azoïque.
D’après les données relevées pour l’ion Ba2+et les produits du clivage de la liaison azoïque du PR53:1 (amine Red Lake C) et du PR49:1 (acide de Tobias), il y a peu de preuves que ces substances ont significativement contribué à la toxicité sur des organes cibles observée pour le PR53:1 et le PR49:1 (données basées sur le PR49*), notamment des preuves d’anémie hémolytique et de changements histopathologiques dans la rate (et le foie pour le PR53:1). Cependant, des toxicités similaires pour le PR53:1 et le PR49:1 (testés en tant que PR49*) ont été observées à des doses relativement similaires, ce qui laisse entendre que le métabolite commun à ces deux substances, soit le 1-amino-2-naphtol, est responsable de ces effets. Bien qu’aucune étude adéquate sur la toxicité à doses répétées n’ait été relevée pour le 1-amino-2-naphtol, des données mécanistes semblent indiquer qu’il peut être théoriquement activé avec une N-hydroxylamine, mais plus probablement avec une naphtoquinoneimine réactive, ce qui appuie le rôle que le 1-amino-2-naphtol joue dans la toxicité observée du PR53:1 et du PR49:1 (testés en tant que PR49*). La formation de naphtoquinone et de quinonéimines est bien caractérisée pour de nombreuses substances, sur la base d’une structure d’amine aromatique et d’amide aromatique, et on pense qu’elle constitue un autre mode d’action important pour la toxicité observée de ces substances (Skipper et al., 2010). D’autres substances qui pourraient produire du 1-amino-2-naphtol ont démontré une toxicité similaire pour des organes cibles dans le sang, la rate et le foie, y compris les colorants de type Sudan, les pigments de β-naphtol (section 7.2.1) et même les colorants acides hydrosolubles comme l’Acid Orange II (no CAS 633-96-5). Dans le cas de l’Acid Orange II, des effets hémolytiques puissants ont été démontrés par voie orale avec des preuves d’un clivage important de la liaison azoïque avec de l’acide sulfanilique et du 1-amino-2-naphtol (SCCS, 2011). Compte tenu de l’absence de toxicité prévue pour l’acide sulfanilique dans le sang, la rate ou le foie (Jung et al., 1992), la toxicité sur des organes cibles observée dans le cas de l’Acid Orange II révèle également la contribution du 1-amino-2-naphtol. De plus, l’observation d’une fixation par liaison covalente du naphtol-C14 aux globules rouges dans l’étude de l’absorption orale et du métabolisme pour le PR53:1 (voir la section 7.2.2 Absorption et potentiel de clivage de la liaison azoïque) fournit des preuves que les effets hémolytiques du PR53:1 sont dus plus probablement au 1-amino-2-naphtol.
En résumé, d’après les données disponibles relatives aux effets sur la santé de certaines de ces substances (PR53:1, PR49*), une toxicité qualitativement similaire a été observée chez des animaux et elle se présente principalement sous la forme d’effets hémolytiques et connexes dans la rate (tableau 7-10). Ces substances étaient principalement négatives dans les études de génotoxicité disponibles. On a observé une incidence accrue de tumeurs de la rate chez les rats mâles dans le cadre d’études portant sur le PR53:1. Elle était semblable à celle observée pour l’aniline (Environnement Canada, Santé Canada, 2011). En l’absence de génotoxicité forte du PR53:1, cette incidence est jugée secondaire à la toxicité non néoplasique pour la rate (Westmoreland et Gatehouse, 1992; Weinburger et al., 1985). Étant donné que la toxicité hémolytique et la toxicité de la rate ont également été observées pour le PR49*, il est raisonnable de supposer un potentiel similaire pour les tumeurs de la rate en ce qui concerne le PR49:1 et les autres pigments de β-naphtol laqués s’ils sont testés dans les mêmes conditions que celles du PR53:1. La toxicité hépatique plus importante observée pour le PR53:1 n’a pas été reproduite dans les mêmes proportions dans les études sur le PR49* et aucune tumeur au foie n’a été signalée dans les études de toxicité chronique du PR49*; par conséquent, il n’est pas certain que les tumeurs hépatiques observées chez des rats dans le cas du PR53:1 soient un effet universel applicable aux autres pigments de β-naphtol laqués. Aucune étude de toxicité à doses répétées n’a été recensée pour l’autre pigment de β-naphtol laqué, le PR50:1. Cependant, la toxicité potentielle contribuée par la partie de l’acide anthranilique après un clivage azoïque devrait être faible. Cependant, en se fondant sur des propriétés physiques et chimiques comparables, sur la similarité structurelle des pigments de βnaphtol laqués, sur le potentiel de clivage des liaisons azoïques, sur une toxicocinétique et une toxicodynamique similaires prévues, ainsi que sur les effets sur la santé communs du métabolite prévu (avec une toxicité des érythrocytes conférée par la partie commune du 1-amino-2-naphtol), tous les pigments de β-naphtol laqués dans ce sous-ensemble devraient présenter un potentiel toxicologique qualitativement similaire. Par conséquent, en l’absence de données relatives aux effets sur la santé de toutes les substances dans ce sous-ensemble, une technique de lecture croisée prudente est envisagée avec les effets critiques sur la santé recensés pour ces substances (tableau 7-10) qui s’appliquent à toutes les substances dans ce sous-ensemble, à l’exception de la cancérogénicité hépatique du PR53:1. Il n’est pas certain que les tumeurs hépatiques observées pour le PR53:1 puissent être extrapolées aux autres pigments de β-naphtol laqués.
7.2.3 Pigments de BONA laqués (PR48:2, PR63:1, PR52:1, PR52:2 et PR48:5)
Le sous-ensemble des pigments de BONA laqués comprend le PR63:1 (Ca2+), les pigments laqués à base de PR48 (PR48:2 Ca2+, PR48:5 Mg2+) et les pigments laqués à base de PR52 (PR52:1 Ca2+, PR52:2 Mn2+); les formes acides libres sont présentées dans le tableau 7-11. Bien que le PR52:2 n'était pas considéré comme faisant partie de ce sous-ensemble dans les sections précédentes, il est inclus ici afin d'éclairer la caractérisation des effets sur la santé humaine de ce sous-ensemble, compte tenu des données limitées disponibles pour le sous-ensemble entier. De même, le PR57:1* est inclus en tant qu'analogue pour ce sous-ensemble, et toutes les données sur la santé relevées pour d'autres sels connexes du PR48, du PR52, du PR63 et du PR57* (D&C Red no 6, pigment rubis B) sont aussi incluses. Tous les pigments de BONA laqués sont des sels de métal à solubilité relativement faible d’un groupe o-sulfonate sur le cycle phénylique (à base de PR48, à base de PR52) ou naphténique (PR63:1) opposé à une partie de BONA comportant une liaison azoïque commune. Le clivage de la liaison azoïque de toutes ces substances donne le dérivé commun 1-amino de BONA, à savoir l'acide 1-amino-2-naphtol-3-carboxylique (abrégé 1-amino-2-naphtol-3CA).
Les pigments de BONA laqués et leurs analogues partagent tous des caractéristiques structurelles communes, où des dérivés d’aniline o-sulfonés (à base de PR48, à base de PR52, PR57*) ou du naphtalène amino sulfoné (comme de l’acide de Tobias dans le PR63:1) partagent une liaison azoïque avec une partie de BONA. En outre, ces substances partagent des propriétés physicochimiques et des solubilités communes et devraient donc se comporter de la même façon à la suite d'une exposition par voie orale ou par voie cutanée, en termes d'absorption et de potentiel de clivage de la liaison azoïque. Le clivage de la liaison azoïque générera des dérivés d’aniline o-sulfo-substitués ou de l’acide de Tobias avec la partie commune, l’acide 1-amino-2-naphtol-3-carboxylique (1-amino-2-naphtol-3-CA, n° CAS 13065-86-6). CA. Étant donné que le 1amino-2-naphtol-3CA est une caractéristique structurelle commune et un produit de clivage azoïque potentiel pour tous les pigments de BONA laqués, sa structure est présentée ci-dessous, tandis que les structures d’origine propres aux substances et les métabolites du clivage azoïque correspondants figurent dans le tableau 7-11 :

| IdentitéNote de bas de page Tableau 7-11[a] et structure chimiques des pigments de BONA laqués d’origine | Identité et structure chimiques des produitsNote de bas de page Tableau 7-11 [b] potentiels du clivage de la liaison azoïque |
|---|---|
PR48:2
|
Acide Red 2B
|
PR52:1
|
Amine Red Lake C
|
PR63:1
|
Acide de Tobias
|
PR57:1*
|
Acide Red 4B
|
Absorption et potentiel de clivage de la liaison azoïque
Sur la base des données limitées sur le métabolisme et la biodisponibilité orales, les pigments de BONA laqués devraient se comporter de la même manière que les pigments de β-naphtol laqués en termes de biodisponibilité orale et cutanée, en raison de leurs propriétés physicochimiques similaires. Par conséquent, un certain degré de biodisponibilité est attendu, comme la dissociation du contre-ion (Ca2+, Mg2+, Mn2+) et l'absorption du composant d'acide libre d'origine de la molécule de pigment BONA ou de produits du clivage de la liaison azoïque. Le PR63:1 devrait subir un important clivage de la liaison azoïque, tel qu'il est indiqué par une étude in vitroqui démontre le clivage de la liaison azoïque rapide et important d'une demi-vie de 0,54 heure dans des conditions anaérobies avec un homogénat fécal humain (BRI, 2013). Ainsi, le PR63:1 et les autres pigments de BONA laqués devraient également subir un clivage de la liaison azoïque après une exposition orale, avec une absorption ultérieure de métabolites. D'autres preuves concluantes de la biodisponibilité orale des pigments de BONA laqués proviennent de l'observation empirique d'effets toxicologiques dans études expérimentales sur des animaux, après une exposition par voie orale à ces substances, ce qui indique clairement l'absorption des pigments d'origine ou de leurs métabolites. Bien qu'aucune valeur précise pour l'absorption orale ne puisse être déterminée, une estimation prudente de 100 % pour l'absorption orale de la structure azoïque d'origine ou des métabolites du clivage azoïque est avancée, en cohérence avec l'absorption orale importante observée pour les pigments de β-naphtol laqués connexes (supérieur(e) à 35 à 54 % à partir de métabolites urines radiomarqués au C14 après l'exposition par voie orale au PR53:1).
Les études pour l'absorption cutanée in vivo ou in vitro pour le PR57* impliquaient de la peau de porc, notamment du dos, du tronc ou de l'oreille (SCCS, 2012). La première étude n'a pas détecté de PR57* dans un échantillon de 72 heures du fluide récepteur ou des couches de peau et elle a indiqué une absorption cutanée estimée à moins de 0,07 %, sur la base des seuils de détection (chromatographie en phase liquide à haute résolution, limites de détection de 9 à 21 ng/mL). La deuxième étude a signalé que 0,091 % de la dose appliquée (sans doute le fluide récepteur ou les couches de peau) et plus de 99 % de la matière testée était récupérée dans le nettoyant pour la peau. Bien que des limites aient été relevées pour les deux études, une faible absorption cutanée générale du PR57* est évidente. Étant donné que l'hydrosolubilité du PR57:1* (sel Ca2+) est d'environ trois ordres de grandeur inférieure à celle du PR57* (sel Na+) testée dans ces études, l'absorption cutanée du PR57:1* est considérée comme relativement faible par rapport à celle du PR57*, généralement en accord avec les données sur la faible absorption cutanée des pigments de β-naphtol laqués (0,06 %) présentée dans la section précédente. Cependant, les études in vitro disponibles sur l'absorption cutanée peuvent ne pas tenir compte de l'activité microbienne de la flore normale de la peau qui a été déclarée comme clivant la liaison azoïque (Stingley et al., 2010, Platzek, 1999). Une incubation in vitroincubation du PR63:1 avec les bactéries de la peau Staphylococcus et Micrococcus sp. a démontré qu'un clivage azoïque se produisait pour cette substance (BRI, 2012). Sur la base des études disponibles, l'estimation de 1 % pour l'absorption cutanée est jugée prudente pour les pigments de BONA laqués, tenant compte du potentiel de clivage de la liaison azoïque sur la peau.
Effets sur la santé
Les plus faibles seuils d'effets critiques choisis parmi les données de toxicité disponibles sont présentés au tableau 7-12. Pour la toxicité à court terme, la plage de DMENO pour le PR48:2 et le PR57:1* est utilisée pour des données déduites à partir d'analogues d'autres pigments de BONA laqués. Aucun seuil critique d'effet issu d'autres études de la toxicité chronique n'a été choisi en raison du faible degré de confiance lié à l'ensemble de données disponibles. Concernant les études de la toxicité chronique, des données pour les pigments de BONA laqués proviennent directement de données déduites à partir d'analogues du PR57:1*. Tandis que le PR52:2 est considéré comme étant une substance organométallique, on suppose un profil de toxicité similaire à ceux d'autres pigments de BONA laqués à titre d'approche prudente.
En raison de la base de données limitée sur les effets sur la santé pour les pigments de BONA laqués, des données pour la toxicité à doses répétées et d'autres effets sont largement basées sur le PR57:1*. En outre, les effets sur la santé liés aux produits potentiels du clivage de la liaison azoïque du PR48, du PR52 et du PR63 sont également considérés comme éclairant les effets sur la santé de substances d'origine correspondantes. Une comparaison de certains pigments de BONA laqués avec les pigments de β-naphtol laqués correspondants (homologues) est prise en compte, puisque les différences dans la toxicité peut être expliquée, en partie, par le groupement carboxylique 3 de 1-amino-2-naphtol-3CA qui distingue le 1-amino-2-naphtol-3CA de la partie de 1-amino-2-naphtol (p. ex., PR63:1 c. PR49:1).
Le PR57:1* a un substitut de o-sulfonate sur le cycle phénylique opposé à la partie de BONA comportant une liaison azoïque. Les propriétés physicochimiques des cinq pigments de BONA laqués sont similaires; par conséquent, ils peuvent générer des produits du clivage de la liaison azoïque similaires avec une partie de 1-amino-2-naphtol-3CA commune. Ainsi, les données de toxicité disponibles pour le PR57:1* sont considérées comme étant applicables pour des données déduites à partir d'analogues d'autres pigments de BONA laqués dans ce sous-ensemble. Le PR57:1* et le PR57* ont été bien étudiés, avec de nombreuses données générées pour appuyer leurs utilisations approuvées comme colorant cosmétique aux États-Unis et en Europe ainsi qu'une utilisation limitée en Europe en tant qu'additif alimentaire « E 180 » dans les croûtes du fromage comestibles. Les PR57:1* et PR57* sont considérés comme étant en cohérence avec l'hypothèse d'une équivalence toxicologique pour les deux sels lors d'une exposition par voie orale (USFDA, 1982), et un résumé des données de toxicité disponibles à titre de source secondaire est présenté ci-dessous (USFDA, 1982; JECFA, 1986; BIBRA, 1993a, b; OCDE, 1994; EFSA, 2010; CSSC, 2012). Pour les pigments laqués à base de PR48 (PR48:2 Ca2+, PR48:5 Mg2+), les données de toxicité disponibles comprennent un examen par la BIBRA (1997a) et une étude de dépistage de toxicité pour la reproduction et le développement chez des rats (CHRIP, ©2008b). Pour le PR63:1, aucun examen accessible au public des données relatives aux effets sur la santé de cette substance n’a été trouvé. Bien qu’une évaluation de sécurité ait été menée par la USFDA concernant le PR63:1, défini sous le nom de D&C Red No 34, pour l’utilisation approuvée comme colorant dans des drogues et des cosmétiques à usage externe (USFDA, 1976), les détails de cette évaluation ne sont pas accessibles au public. Par conséquent, les données publiées sur la toxicité du PR63:1 sont résumées. Aucune donnée de toxicité n'a été relevée pour l'acide libre ou des sels du PR52.
| Substance | DMENO/DSENO à court terme (mg/kg p.c. par jour) |
Toxicité subchronique DMENO/DSENO (mg/kg p.c. par jour) |
Toxicité chronique DMENO/DSENO (mg/kg p.c. par jour) |
|---|---|---|---|
| PR48:2 | DMENO = 200 (RM, RF) DSENO = 1 000 (RM) Foie (dégénérescence/nécrose des tubes proximaux chez les rats femelles, poids accru des reins et changements basophiliques des tubules chez les rats mâles (CHRIP ©2008b) |
Aucune donnée adéquate | Données déduites à partir d'analogues du PR57:1* |
| PR52:1; PR52:2 | Données déduites à partir d'analogues du PR48:2 et du PR57:1* | Aucune donnée adéquate | Données déduites à partir d’analogues du PR57:1* |
| PR63:1 | Données déduites à partir d’analogues du PR48:2 et du PR57:1* | DSENO = 2 500 (MR/FR) (Hansen et al. 1960)[b] |
Données déduites à partir d’analogues du PR57:1* |
| PR57:1* | DMENO = 100 (RM, RF) Reins (nécrose, régénération, cellules bulleuses dans l'épithélium tubulaire) (FDSC, 1993) |
DMENO = 1000 (RM, RF) (Hansen et al., 1958)[b] |
DMENO = 150 DSENO = 25 (RM) Reins (gravité accrue de la néphropathie chronique progressive chez des rats mâles et femelles) (IRDC, 1981) |
Cancérogénicité et génotoxicité
Aucune donnée empirique sur la cancérogénicité n’a été recensée pour les pigments de BONA laqués pris en compte dans la présente évaluation (PR63:1, pigments laqués PR48:2 et PR48:5 à base de PR48, pigments laqués PR52:1 et PR52:2 à base de PR52). Cependant, les données sur la toxicité chronique n’étaient pas disponibles pour un autre pigment de BONA laqués, le PR57* son sel de sodium, le PR57*. Les études de l’exposition chronique par l’alimentation au PR57* sur des souris et des rats et une étude longitudinale de badigeonnage de la peau sur le PR57:1* chez des souris ont été prises en compte pour fournir des preuves de l’absence de cancérogénicité de ces substances par voie orale ou cutanée (USFDA 1982, décrites dans la section cidessous, Autres études de toxicité à doses répétées). Sur la base des données disponibles, le PR57:1* et le PR57* ne sont pas considérés comme présentant un fort potentiel de cancérogénicité.
Les données disponibles sur la génotoxicité pour les pigments de BONA laqués sont résumées ci-dessous. Des réponses génotoxiques négatives dans le test d'Ames standard avec ou sans activation métabolique (S9) ont été déclarées pour le « Red 2B, CI 15865 » (sans doute le PR48) dans les souches TA1535 et TA1537 (Milvy et Kay, 1978) et pour le PR48:4 (sel Mn2+) dans les souches TA98, TA100, TA1535 et TA1537 (ETAD, 1988). Le PR63:1 a été déclaré négatif dans le test d'Ames standard dans les souches Salmonella TA98 et TA100, avec ou sans activation métabolique (S9) (Miyagoshi et al., 1983). Le PR63:1 aussi été déclaré négatif et faiblement positif dans un test d'Ames modifié Prival avec un supplément de FMN dans les souches TA98 et TA100, respectivement (ILS, 2011). Le PR57:1* et le PR57* étaient négatifs pour plusieurs paramètres de génotoxicité, y compris la mutagénicité in vitro dans des cellules bactériennes et mammaliennes, des aberrations chromosomiques in vitro dans des cellules mammaliennes et un essai des micronoyaux in vivo sur des souris (CSSC, 2012).
Autres études de toxicité à doses répétées
Les effets graves sur la santé du PR48:2 sont basés sur une étude japonaise menée selon la ligne directrice 422 de l’OCDE sur les essais dans des conditions de bonnes pratiques de laboratoire dans laquelle des groupes de rats (souche Crl: CD (SD), 12 de chaque sexe par groupe) ont été exposés par gavage oral quotidien au PR48:2 à une dose de 0, 40, 200 ou 1 000 mg/kg p.c. par jour pendant 42 jours (14 jours précédant l’accouplement jusqu’au 4e jour de lactation). Le sacrifice a été effectué au 43e jour (groupe principal) ou après la période de récupération de 14 jours dans un groupe satellite (cinq de chaque sexe pour le groupe témoin et le groupe à forte dose), tandis que des progénitures F1 ont été sacrifiées quatre jours après leur naissance. Une dégénérescence ou nécrose accrue de l'épithélium tubulaire proximal dans les reins a été observée à 200 mg/kg p.c. par jour. Cependant, on a signalé que l'effet avait disparu après la période de récupération de 14 jours (CHRIP, ©2008b).
On considère comme effets critiques sur la santé pour le PR57:1* les changements non cancérogènes dans les reins, avec une DMENO à court terme/subchronique de 100 mg/kg p.c. par jour (la plus faible dose testée) sur la base des lésions rénales chez des rats femelles (FDSC, 1993), et une DMENO chronique de 150 mg/kg p.c. par jour (DSENO de 25 mg/kg p.c. par jour), sur la base de l'incidence accrue de maladie rénale spontanée (néphropathie chronique progressive) chez des rats mâles (IRDC, 1981; USFDA, 1982).
Les reins sont, semble-t-il, les principaux organes cibles de la toxicité du PR57:1* chez les rats des deux sexes, montrant une hausse de l'incidence et de la gravité liée à la dose de diverses lésions des tubules rénaux. La plus récente étude sur le PR57:1* parmi les études recensées a été menée en 1993 par le Japanese Food & Drug Safety Center (Hatano Research Institue, Japan) selon la ligne directrice 422 de l'OCDE sur les essais dans des conditions de bonnes pratiques de laboratoire et elle est considérée comme l'étude de la plus haute qualité disponible pour le PR57:1* ou le PR57* (FDSC, 1993; OCDE, 1994; EFSA, 2010; SCCS, 2012). Dans cette étude, des rats mâles et femelles [13 de chaque sexe par groupe de dose, souche Crj:CD (Sprague-Dawley)] ont été exposés par gavage oral à une dose de 0, 100, 300 ou 1 000 mg/kg p.c. par jour (dans une solution de gomme arabique à 5 %) pendant 42 jours pour les mâles et environ 39 jours pour les femelles (14 jours avant l'accouplement, 22 jours de gestation, 3 jours de lactation). Aucune modification liée à l'exposition n'a été observée dans le taux de survie, le poids corporel, la consommation alimentaire ou les paramètres hématologiques chez les mâles et les femelles. Aucun changement lié à l'exposition n'a été observé dans les paramètres de la reproduction ou les paramètres de toxicité pour le développement. Des constatations histopathologiques similaires sur les tubules rénaux ont également été faites chez les mâles dans une étude de détermination des doses de 14 jours, et on a noté un poids accru des reins chez les mâles soumis à une forte dose dans l'étude principale, ce qui vient appuyer l'hypothèse des reins étant les organes cibles dans cette étude. Les DMENO pour cette étude ont été estimées à 100 mg/kg p.c. par jour pour les rats femelles et à 300 mg/kg p.c. par jour pour les rats mâles (FDSC, 1993; OCDE, 1994). D'autres études antérieures de la toxicité à doses répétées pour le PR57:1* ou le PR57* appuient également l'hypothèse des reins étant les organes cibles, bien que l'on ait noté qu'une baisse ou une absence de la prévalence apparente des effets rénaux et d'autres effets dans plusieurs études de toxicité alimentaire subchronique et à court terme peut être due à la dose systémique maximale comparativement aux études par gavage (Leist, 1982; FDSC, 1993).
Plusieurs examens des études mentionnées ci-dessus sur le PR57:1* ont tenu compte des données de toxicité pour calculer une DSENO définitive pour l'établissement des concentrations indicatives (JECFA, 1986; EFSA, 2010), bien que 100 mg/kg p.c. par jour était considéré comme étant une valeur proche, sur la base de l'ensemble de données disponible (EFSA, 2010). La DSENO de 15 mg/kg p.c. par jour pour l'étude sur trois générations chez des rats (Weil et Carpenter, 1973) a été prise en compte par la US FDA (1982) en tant que base pour le calcul d'une absorption quotidienne acceptable.
Un bref extrait de réunion résume les résultats d'une étude de la toxicité subchronique orale menée par la US FDA, dans laquelle des rats (10 de chaque sexe par groupe, souche non indiquée) ont été exposés à une concentration alimentaire de 0 %, 0,25 %, 0,5 %, 1 %, 2 % ou 5 % (équivalente aux doses de 0, 125, 250, 500, 1 000 et 2 500 mg/kg p.c. par jour) pendant 90 jours (Hansen et al., 1960). Aucune modification liée à l'exposition n'a été observée dans le poids corporel, la prise alimentaire, la numération globulaire ou les poids des organes terminaux. Ainsi, la plus forte dose testée de 2 500 mg/kg p.c. par jour (5 %) a été considérée comme la DSENO dans l'étude (Hansen et al., 1960).
La toxicité par absorption cutanée des pigments de BONA laqués a été étudiée dans une étude de toxicité chronique par badigeonnage de la peau sur des souris. Brièvement, des souris ICR Swiss Webster (50 de chaque sexe dans un groupe d'exposition et 25 de chaque sexe dans un groupe témoin) ont été exposées sur la peau rasée du dos (6 cm2) deux fois par semaine pendant 18 mois à de l'eau (groupe témoin recevant l'excipient) ou du PR63:1 (D&C Red no 34) et du PR57:1* (D&C Red no 7) à 0,1 mg/mL dans de l'eau (environ 33 mg/kg p.c.Note de bas de page[18] par dose d'application). Aucune modification liée à l'exposition n'a été observée dans le poids corporel, le taux de survie, le comportement ou la pathologie clinique. L'examen histologique n'a révélé aucune différence évidentes dans les tumeurs de la peau ou d'autres tissus entre le groupe témoin et le groupe exposé d'exposition (Carson, 1984a, b; CIRC, 1993). Sur la base de l'absorption cutanée prévue, la dose systémique attendue de cette application sera faible et insuffisante pour causer des effets systémiques. Par conséquent, la conception de l'étude et les faibles doses choisies limitent l'interprétation des résultats de cette étude.
Résumé et considérations impliquant des données déduites à partir d’analogues
En se fondant sur des propriétés physiques et chimiques comparables, sur la similarité structurelle des pigments de BONA laqués, sur le potentiel de clivage des liaisons azoïques, sur une toxicocinétique et une toxicodynamique similaires prévues, ainsi que sur les métabolites communs du clivage azoïque, tous les pigments de BONA laqués dans ce sous-ensemble devraient présenter une toxicité qualitativement similaire. Le principal fondement pour la déduction de données sur les effets sur la santé des pigments de BONA laqués s’appuie sur les données disponibles sur la toxicité à court terme du PR48:2 ainsi que sur les données à court terme, subchroniques et chroniques des analogues des pigments de BONA laqués, le PR57* et le PR57:1*. Ces renseignements ainsi que les renseignements supplémentaires concernant les métabolites du clivage azoïque sont fournis dans les sections ci-dessous.
Dans l’ensemble, en se fondant principalement sur les données déduites à partir d’analogues pour les données sur les effets sur la santé concernant le PR57:1*, les pigments de BONA laqués devraient avoir un faible potentiel de cancérogénicité et de génotoxicité. Par conséquent, les effets sur la santé non cancérogènes sont considérés comme les paramètres préoccupants. D’après les données déduites à partir d’analogues pour le PR48:2 et le PR57:1*, les niveaux d’effets sur la santé sont fondés sur des DMENO de 100 à 200 mg/kg p.c. par jour (plage des DMENO pour le PR57:1* et le PR48:2) en ce qui concerne les lésions rénales chez des rats femelles, tandis qu’une DMENO chronique de 150 mg/kg p.c. par jour (DSENO de 25 mg/kg p.c. par jour) est fondée sur l’incidence accrue de maladie rénale spontanée (néphropathie chronique progressive) chez des rats mâles (aussi à des doses plus élevées chez les rats femelles) exposés au PR57:1* (IRDC, 1981; USFDA, 1982). Étant donné que les poids moléculaires du PR57:1* et les pigments de BONA évalués sont très proches en termes de plages (425 g/mol c. 443 à 461 g/mol, respectivement), des doses molaires équivalentes ont été calculées pour chaque substance.
Des effets rénaux similaires ont été observés pour le PR48:2 et le PR57:1* dans le cadre du même protocole d'étude expérimentale chez des rats, notamment en termes de lésions (dégénérescence/nécrose des cellules des tubules rénaux) et de plage de puissance : DMENO de 200 mg/kg p.c. par jour pour le PR48:2 (CHRIP, ©2008b) comparativement à une DMENO de 100 mg/kg p.c. par jour pour le PR57:1* (FDSC, 1993). Dans d'autres études de la toxicité à court terme et chronique sur le PR57:1*, les reins ont été définis comme les organes cibles pour la toxicité. Une toxicité des tubules rénaux a également été notée dans des études de la toxicité par voie orale à court terme chez des rats pour d'autres analogues de pigments de BONA laqués, y compris le n° CAS 17841-23-2 (Sun Chemical, 2004). Cependant, dans ces études, les rats mâles semblaient plus sensibles que les femelles à la toxicité rénale; généralement, ce phénomène est plus typique de la toxicité rénale, tel que le prouvent les observations de la néphropathie chronique progressive chez les rats mâles Hard et Khan, 2004). La sensibilité apparente plus accentuée des rats femelles dans les études de dépistage de toxicité pour la reproduction et le développement (ligne directrice 422 de l’OCDE) concernant le PR48:2 et le PR57:1* peut être due à l’état de grossesse des femelles dans le cadre de ces études; toutefois, il existe des incertitudes quant à la raison de la sensibilité observée chez les femelles gravides. Cependant, l'ensemble des renseignements sur les pigments de BONA laqués indique fortement que les reins sont les organes cibles pour la toxicité des pigments de BONA laqués.
En se basant sur l’hypothèse selon laquelle l’exposition aux pigments de BONA laqués connaîtra un clivage de la liaison azoïque dans une certaine mesure, la toxicité des produits potentiels du clivage de la liaison azoïque (tableau 7-11) des pigments de BONA laqués est également prise en compte ici.
Bien qu’aucune donnée sur la toxicité n’ait été relevée pour le métabolite commun 1-amino-2-naphtol-3-CA qui est partagé par tous les pigments de BONA laqués (tableau 7-11), certaines données sur les effets sur la santé étaient disponibles pour l’acide Red 2B (à partir du PR48:2, du PR48:5), l’amine Red Lake C (à partir du PR52:1 et du PR52:2), l’acide de Tobias (PR63:1) et l’acide Red 4B (à partir de l’analogue PR57:1*).
La toxicité de l’acide Red 4B (à partir de l’analogue PR57:1*) a été étudiée dans le cadre de l’étude de dépistage de toxicité pour la reproduction et le développement (ligne directrice 422 de l’OCDE) chez des rats à l’aide du même protocole que celui décrit ci-dessus pour le PR57:1, et aucun effet lié à l’exposition n’a été observé jusqu’à la dose testée la plus élevée de 1 000 mg/kg p.c. par jour chez les mâles ou femelles F0 en termes de paramètres de la reproduction et de paramètres de toxicité pour le développement (JECDB, 2013b). En comparaison, une étude avec le PR57:1* azoïque d’origine utilisant la même conception (ligne directrice 422 de l’OCDE) a signalé une dégénérescence/nécrose des cellules des tubules rénaux à une dose beaucoup plus faible de 100 mg/kg p.c. par jour. Compte tenu des réponses différentes pour l’acide Red 4B et le PR57:1* azoïque d’origine dans le type d’étude, toute quantité d’acide Red 4B pouvant être générée à partir du PR57:1* d’origine ne devrait pas contribuer de manière importante à la toxicité observée du PR57:1*. Ainsi, la toxicité du PR57:1* peut être due à l’activation du PR57:1* d’origine lui-même ou à l’autre produit de clivage de la liaison azoïque, à savoir le 1-amino-2-naphtol-3CA. Tandis qu’aucune donnée de toxicité n’était disponible pour le 1-amino-2-naphtol-3CA, et compte tenu du fait que le PR57:1* est susceptible de subir un certain degré de clivage de la liaison azoïque après l’exposition orale, il est probable que le 1-amino-2-naphtol-3CA contribue, dans une certaine mesure, à la toxicité orale observée du PR57:1*. En ce qui concerne la génotoxicité, l’acide Red 4B a été déclaré négatif pour la mutagénicité in vitro dans la Salmonella, le E. coli, et dans les cellules de lymphomes de souris et cette substance a également montré des résultats négatifs pour la synthèse d’ADN non programmée dans des hépatocytes primaires de rats (CCRIS, 2012). Dans l’ensemble, le métabolite de l’acide Red 4B devrait présenter un faible potentiel de toxicité systémique et de génotoxicité. Aucune étude à doses répétées n’a été recensée pour l’acide Red 2B (du PR48:2 et du PR48:5). Cependant, une étude par voie orale de 28 jours chez les rats concernant l’amine Red Lake C de l’isomère de position (du PR52:1 et du PR52:2, ainsi que le PR53:1 du pigment de β-naphtol laqué) n’a indiqué aucun effet lié à l’exposition sur le poids corporel, la consommation alimentaire, les paramètres chimiques cliniques ou hématologiques, le poids des organes ou les anomalies macroscopiques ou microscopiques jusqu’à la plus forte dose testée de 1 000 mg/kg p.c. par jour (Environnement Canada, Santé Canada, 2014b). Cette faible toxicité systémique de l’amine Red Lake C concorde avec celle de l’acide Red 4B (paragraphe précédent) et d’autres amines aromatiques sulfonées (Jung et al., 1992) et s’applique probablement aussi à l’acide Red 2B. La toxicité de l’acide de Tobias (du PR63:1) a été décrite dans la section précédente (voir la section 7.2.2 Résumé et considérations impliquant des données déduites à partir d’analogues), étant donné que cette substance est également un métabolite des pigments de β-naphtol laqués PR49:1* et PR49*. Dans le cadre d’une étude de dépistage de toxicité pour la reproduction et le développement (durée d’exposition de 49 et de 39 jours pour les mâles et les femelles, respectivement), l’exposition des rats à l’acide de Tobias a donné lieu à l’absence semblable d’une toxicité précise observée jusqu’à la dose testée la plus élevée de 1 000 mg/kg p.c. par jour, bien qu’une diminution du poids du foie ait été signalée à une dose élevée (JECDB, 2013a).
Par conséquent, les renseignements disponibles dans le paragraphe ci-dessus indiquent une toxicité systémique limitée découlant de la plupart des métabolites attendus du clivage azoïque des pigments de BONA laqués. Même si aucune donnée sur les effets sur la santé n’a été recensée pour le 1-amino-2-naphtol-3CA, le produit du clivage de liaison azoïque pourrait contribuer, dans une certaine mesure, à la toxicité observée des pigments de BONA laqués, y compris le PR57:1*. Puisque les autres produits potentiels du clivage de liaison azoïque, notamment les dérivés d’aniline o-sulfo-substitués (PR48, PR52, PR57*) et l’acide de Tobias (PR63), indiquent un faible potentiel de risque, il est raisonnable de s’attendre à ce que le métabolite commun 1amino-2-naphtol-3CA soit responsable des effets observés pour le PR48:2 et PR57:1* et à ce qu’il contribue de la même manière à la toxicité des autres pigments de BONA laqués dans ce sous-ensemble.
Dans l’ensemble, bien que les données soient limitées, on estime que la technique de lecture croisée concernant les effets sur la santé du PR48:2 et du PR57:1* (tableau 712) s’applique à toutes les substances dans le sous-ensemble des pigments de BONA laqués.
7.2.4 Pigments jaunes monoazoïques (PY1, PY3 PY73)
Le PY1, le PY3 et le PY73 n'offrent pas d'ensembles de données fiables pour les effets sur la santé humaine. Les données limitées recensées provenaient d'études de la génotoxicité, y compris des tests d'Ames modifiés Prival pour les trois substances, ainsi que des études de la toxicité par voie orale à court terme sur le PY1 et le PY3. Aucune étude de la toxicité chronique n'a été relevée pour l'une de ces substances, et seules des études de toxicité à doses répétées ont été relevées pour le PY73. Deux analogues, le PY74* le n° CAS 80675-49-6*, ont été pris en compte pour éclairer le potentiel de risque du PY1, du PY3 et du PY73. Ces cinq substances ainsi que leurs produits potentiels du clivage de la liaison azoïque sont présentés au tableau 7-13.
Absorption et potentiel de clivage de la liaison azoïque
Malgré des poids moléculaires et des solubilités dans l'eau et l'octanol similaires, les pigments jaunes monoazoïques semblent moins biodisponibles que les pigments de β-naphtol après une exposition par voie orale. Dans l'étude de la toxicocinétique orale du PY74* et du PR3 (un pigment de β-naphtol) sur des rats, une seule dose de PY74* de 12,6 mg/kg p.c. dans de l'huile de maïs a été administrée par gavage oral à des rats F344 mâles (n = 12), avec des tissus regroupés (contenu des intestins, matières fécales, plasma, sang entier, foie, reins, poumons et urines) auprès de trois rats sur lesquels on a prélevé des échantillons à 1, 4, 24 et 48 heures après le dosage (El Dareer et al., 1984). Aucune trace de PY74* n'a été détectée, sauf dans les tissus intestinaux directement en contact avec le contenu des intestins et dans l'urine (moins de 1 %) à 24 heures et 48 heures. Au bout de 48 heures, jusqu'à 85,9 % du PY74* administré a été récupéré dans les matières fécales, avec 2,1 % dans le contenu des intestins, donnant ainsi un taux de récupération totale de 88,2 % (écart-type de ± 21,7 %). Les métabolites du PY74* n'ont pas été étudiés. Malgré l'importante variabilité dans la récupération relevée dans cette étude, des quantités relativement faibles de PR3 ont été récupérées, ce qui indique une absorption et un clivage de la liaison azoïque de cette substance relativement supérieurs. Par conséquent, le potentiel limité d'absorption et de clivage de la liaison azoïque du PY74* est considéré comme étant, au moins, inférieur à celui du PR3.
Une comparaison similaire est observée quant aux résultats de l'étude de dégradation azoïque microbienne (Pearce et al., 2008). Dans cette étude, le PO5 (un pigment de βnaphtol) a démontré un potentiel relatif bien supérieur pour la réduction de la liaison azoïque par la souche J18 143 de Shewanella comparativement au PY74*. Pour les pigments commerciaux contenant les dispersions, on a noté une réduction de plus 80 % de l'absorbance du PO5 après 160 heures d'incubation, par rapport à la réduction d'environ 10 % pour le PY74*. Après 20 heures, le PO5 a montré une réduction de plus de 20 % de l'absorbance, tandis que moins de 5 % du PY74* a été absorbé. On a suggéré que la résistance relativement supérieure aux solvants organiques et la plus faible réduction azoïque microbienne du PY74* étaient dues à la structure cristalline de la substance étant stabilisée par la liaison hydrogène et par les forces de Van der Waals, tandis que seules ces dernières sont présentes dans les pigments de β-naphtol.
| Pigment jaune monoazoïque d'origine | Produits potentiels du clivage de la liaison azoïque |
|---|---|
PY1
|
2-Nitro-4-méthylaniline
|
PY3
|
2-Nitro-4-chloroaniline
|
PY73
|
2-Nitro-4-chloroaniline
Amine d’acétoacét-o-anisidide
|
PY74*
|
2-Méthoxy-4-nitroaniline
Amine d’acétoacét-o-anisidide
|
No CAS 80675-49-6*
|
2-Méthoxy-5-nitroaniline
(aucun non ou n° CAS)
|
Le clivage réducteur de la liaison azoïque devrait théoriquement produire des dérivés de nitroaniline et une amine d'un dérivé d'acétoacétanilide.
Dans l'ensemble, les études citées ci-dessus indiquent que l'ampleur et le taux de clivage de la liaison azoïque devraient être faibles et relativement bien plus bas pour le PY74* que pour les pigments de β-naphtol comme le PR3 et le PO5. Par conséquent, une biodisponibilité orale et un potentiel de clivage de la liaison azoïque globalement plus faibles pour les pigments jaunes monoazoïques sont prévus comparativement aux pigments de β-naphtol.
Effets sur la santé
Bien que les analogues fournissent des renseignements supplémentaires sur la toxicité subchronique et à court terme, des données sur tous les paramètres pertinents, notamment issues d'études de la toxicité chronique, n'étaient pas disponibles. À titre d'approche prudente, les effets sur la santé des produits potentiels du clivage de la liaison azoïque sont aussi pris en compte, bien qu'aucune étude de la toxicité chronique n'ait été recensée à cet égard. Tandis qu'on manque d'études de la toxicité chronique dans l'ensemble, on considère que les effets chroniques potentiels sur la santé peuvent être similaires, sur le plan quantitatif, à ceux d'autres pigments monoazoïques à base de nitroaniline (c.-à-d. le sous-ensemble des pigments de β-naphtol), avec une hypothèse de potentiel relatif de toxicité inférieur tenant compte des facteurs suivants.
L'hypothèse d'une similarité dans les effets chroniques sur la santé entre les pigments jaunes monoazoïques et les pigments de β-naphtol est principalement fondée sur le fait que ces deux sous-ensembles libéreront des dérivés de nitroaniline après le clivage de la liaison azoïque, et que ces dérivés sont au moins partiellement responsables de la toxicité chronique des substances d'origine. À titre d'exemple, le PY1 et le PR3 peuvent libérer de la 2-nitro-4-méthylanine et sont, par conséquent, des homologues mutuels pour ce métabolite. Les métabolites de dérivés de la nitroaniline formés à partir de ces deux sous-ensembles devraient montrer une génotoxicité, une toxicité pour les organes cibles (hémolyse, histopathologie de la rate et du foie) et des niveaux de toxicité similaires qui sont caractérisés par la catégorie plus générale de nitroaromatiques (Sakuratani et al., 2013). Ces types d'effets sont également observés dans des études de la toxicité chronique pour les pigments de β-naphtol, où des métabolites de nitroaniline peuvent être responsables des effets observés.
Le potentiel relatif de toxicité inférieur supposé pour la toxicité chronique des pigments jaunes monoazoïques est basé sur la biodisponibilité apparente et le clivage de la liaison azoïque inférieurs à la suite de l'exposition par voie orale, tel qu'il est décrit dans la section précédente, ainsi que sur la toxicité relative à court terme plus faible comparativement à celle des pigments de β-naphtol. Les études de toxicité à court terme disponible sur les PY1 et PY3 impliquant des rats n'indiquent pas un fort potentiel de toxicité. Tandis qu'une étude par gavage de 30 jours avec du PY1 a indiqué des effets éventuellement liés à l'exposition (poids accru du foie chez les femelles et indication d'une hémolyse chez les mâles) à 1 000 mg/kg p.c. par jour (Hoechst, 1979), l'étude par alimentation à court terme n'a indiqué aucune réponse à la plus forte concentration alimentaire testée de 1 250 mg/kg p.c. par jour (Étude présentée, 2012r). Cette toxicité limitée est confirmée par les analogues; par exemple, le PY74* démontre des changements potentiels liés à l'exposition (poids accru du foie et preuves d'hémolyse) seulement à la plus forte dose testée de 1 000 mg/kg p.c. par jour dans une étude par gavage de 90 jours chez des rats (ECHA, 2012), similairement à l'étude sur le PY1 (Hoechst, 1979). Toutefois, similairement à l'absence d'effets relevée dans l'étude par alimentation à court terme sur le PY3, aucun effet n'a été observé chez les rats à des concentrations de 1 126 à 1 160 mg/kg p.c. par jour (les plus fortes doses testées) dans une étude par alimentation de 28 jours sur un autre analogue de pigment jaune monoazoïque (no CAS 80675-49-6*)(ECHA, 2012). Les effets apparents liés à l'exposition qui ont été observés pour le PY1 et le PY74* à des doses inférieures peuvent être dus aux pics de concentrations dans le plasma plus élevés que prévus découlant de l'administration par bolus de la substance d'essai par gavage, comparativement à l'absence d'effets constatée dans les études par alimentation sur le PY3 et le n° CAS 80675-49-6*. En comparaison, les DMENO orales à court terme chez les rats pour les pigments de β-naphtol variaient de 100 à 542 mg/kg p.c. par jour pour le PO5 (32 jours) et le PR3 (14 jours), tel qu'il a été mentionné précédemment. Par conséquent, le potentiel de toxicité des pigments jaunes monoazoïques est jugé inférieur à celui des pigments de β-naphtol. La différence en termes de potentiel relatif de toxicité apparent pour la toxicité à court terme est considérée comme étant encore plus inférieure, puisque les effets observés pour le PY1 et le PY74* n'étaient pas indésirables par rapport aux effets plus prononcés pour le PO5 et le PR3. En outre, puisque les études pour le PY1 et le PY74* étaient des études par gavage comparativement à des études par alimentation pour le PR3 et le PO5, les pigments jaunes monoazoïques devraient montrer une toxicité relative encore plus faible dans les études par alimentation (tel que le confirment les DSENO aux plus fortes doses alimentaires pour le PY3 et le no CAS 80675-49-6*). Dans l'ensemble, malgré l'absence d'effets toxicologiques évidents pour les pigments jaunes monoazoïques dans les études à court terme, le potentiel de toxicité de ces derniers est jugé inférieur à celui des pigments de β-naphtol; ce potentiel relatif de toxicité est aussi considéré comme s'appliquant à la toxicité chronique potentielle des pigments jaunes monoazoïques.
Les seuils d'effets critiques pour la toxicité à court terme des pigments jaunes monoazoïques sont résumés au tableau 7-14.
| Substance | DMEO/DSENO à court terme (mg/kg p.c. par jour) |
|---|---|
| PY1 | DMEO = 1 000 (RF; poids accru du foie; Hoechst, 1979) |
| PY3 | DSENO = 1 250 (RM/RF; étude présentée, 2012r) |
| PY73 | Données déduites à partir d'analogues du PY1 et PY3 |
7.2.5 Pigments de naphtol AS (PR5, PR112, PR170, PR187, PR266, PR268 et PO38)
Parmi les substances dans le sous-ensemble de pigments de naphtol AS, sept substances devraient connaître une exposition actuelle au Canada. Ces substances comportent toutes la même structure de base, notamment un cycle anilinique qui partage une liaison azoïque avec la partie de naphtol AS; cependant, on note une forte variabilité entre les substitutions des deux côtés de la liaison azoïque, ce qui rend ce sous-ensemble plus hétérogène que les sous-ensembles traités précédemment. Contrairement au sous-ensemble des pigments jaunes monoazoïques, le clivage potentiel de la liaison azoïque de ces substances générera des métabolites d'amines aromatiques très différents qui peuvent tous avoir des toxicités diverses. Les propriétés physicochimiques des pigments de naphtol AS sont également plus variables, probablement en raison des différences structurelles des substances dans ce sous-ensemble. Par exemple, tandis que les données disponibles indiquent une plage étroite d’hydrosolubilité dans le sous-ensemble de pigments de naphtol AS (3 à 24,9 µg/L), la solubilité dans l’octanol varie de plus de deux ordres de grandeur (p. ex., 22,1 µg/L pour le PR187 par rapport à 7 800 µg/L pour le PR112). Ces différences dans la solubilité dans l'octanol peuvent être dues à la variabilité dans la biodisponibilité potentielle des pigments de naphtol AS. Compte tenu des données de toxicité limitées disponibles et des incertitudes plus prononcées liées à une plus forte variabilité structurelle des pigments de naphtol AS, une plus vaste base de données déduites à partir d'analogues est prise en compte pour la caractérisation des risques, en utilisant principalement le PR22* et le PR23* comme analogues, mais également en dehors de ce sous-ensemble. Le PR22* et le PR23* contiennent des parties de nitroaniline qui sont libérées lors du clivage de la liaison azoïque. Cependant, les nitroanilines substituées ne sont peut être pas applicables aux données déduites à partir d'analogues d'autres pigments de naphtol AS qui ne contiennent pas de parties de nitroanilines.
Absorption et potentiel de clivage de la liaison azoïque
Les seules données recensées pour le potentiel de réduction azoïque portaient sur le PR112. Le potentiel de clivage de la liaison azoïque du PR112 a été étudié dans une incubation anaérobie avec la souche bactérienne Shewanella J18 142 (Pearce et al., 2008). Tandis que certains niveaux de réduction azoïque ont été observés pour le PR112, l'étude a démontré un potentiel bien plus limité de réduction azoïque du PR112 par rapport au pigment de β-naphtol PO5, qui a subi un important clivage réducteur de la liaison azoïque au cours de l'étude.
Des quantités limitées de PR23* ont été métabolisées en 5-nitro-o-anisidine, ce qui indique une biodisponibilité limitée (NTP, 1978). Par ailleurs, une étude de la toxicocinétique par voie orale du PR23* chez des rats a indiqué une absorption ou un clivage de la liaison azoïque relativement limités du PR23* comparativement au pigment de β-naphtol PR3, malgré les écarts-types importants liés aux PR23* récupéré (El Dareer et al,. 1984).
Effets sur la santé
Les données sur les effets sur la santé ont été recensées pour le PR112 (toxicité à court terme, génotoxicité, réduction azoïque microbienne), le PR170 (toxicité à court terme, génotoxicité) et le PR268 (génotoxicité, réduction azoïque microbienne).
Parmi les multiples études de génotoxicité recensées pour le PR112, des études antérieures sur le PR112 ont signalé une mutagénicité positive dans le test d'Ames standard et dans des cellules V79 de hamsters chinois; cependant, ces résultats se sont avérés attribuables à des impuretés ou non reproductibles (NTIS, 1986; BIBRA, 1997b). Des résultats négatifs ont été obtenus d'un autre test d'Ames standard (ETAD, 1988) et des études plus récentes avec la modification Prival de la mononucléotide flavine qui étaient conformes aux bonnes pratiques de laboratoire, ainsi que pour la mutagénicité et la clastogénicité dans des cellules V79 de hamsters chinois (ECHA, 2012). La PR170 a également indiqué une absence de mutagénicité dans le test d'Ames standard (Étude présentée, 2012s); en outre, des résultats négatifs pour la mutagénicité et les aberrations chromosomiques ont été observées dans des cellules V79 de hamsters chinois (Étude présentée, 2012t, u). Le PR268 était négatif pour la mutagénicité dans les souches Salmonella TA98 et TA100 dans le foie de hamsters avec ou sans activation métabolique (S9) et avec la modification Prival de la mononucléotide flavine (ILS, 2011).
Une étude in vitro sur le PR22* avec des cellules pulmonaires de hamsters chinois n'a montré aucune hausse des aberrations chromosomiques ou de la polyploïdie avec ou sans activation métabolique (S9) dans le foie de rats (JECDB, 2013c). Cependant, des résultats mixtes pour la mutagénicité ont été obtenus dans le test d'Ames standard avec des résultats positifs (TA98, TA100, TA1537, ±S9; E. coli WP2 uvrA +S9) et négatifs (TA1535 ± S9; E. coli WP2 uvrA -S9). Les réponses positives concordent avec celles des pigments monoazoïques contenant des substitutions nitro (pigments de β-naphtol), ce qui laisse penser que le pigment est biologiquement disponible pour les bactéries comme molécule d'origine ou après la réduction azoïque de la nitroaniline. Dans les deux cas, ces résultats indiquent que le PR22* était suffisamment soluble ou biodisponible pour déclencher une réponse positive dans cette étude, ce qui est confirmé par le rejet de 5-nitro-o-toluidine à des concentrations supérieures à 30 ppm à la suite de la réduction chimique du PR22* et du pigment de naphtol AS connexe PR8 (ETAD, 2008). Dans l'ensemble, les données sur le PR22* indiquent un certain potentiel de toxicité et de génotoxicité in vitro, ce qui indique, au moins, une biodisponibilité limitée du PR22* ou de ses métabolites du clivage de la liaison azoïque dans ces études.
Le PR23* a été testé dans une étude de l'exposition chronique par l'alimentation chez des rats et des souris (NTP, 1992). Les phases subchronique et à court terme de cette étude ont indiqué une hémolyse et des hausses du poids du foie à une concentration alimentaire de 50 000 ppm chez des rats (dose équivalente à 2 500 mg/kg p.c. par jour). L'étude a également démontré un faible potentiel carcinogène pour le PR23*, avec de preuves équivoques pour les tumeurs rénales et l'hyperplasie des tubules à une concentration alimentaire de 50 000 ppm chez des rats (dose équivalente à 2 500 mg/kg p.c. par jour).Étant donné que le produit potentiel du clivage de la liaison azoïque, à savoir la 5-nitro-o-anisidine, était lui-même positif pour la cancérogénicité à de nombreux sites chez les rats, à des doses faibles de 200 à 400 mg/kg p.c. par jour (NTP, 1978), le potentiel de toxicité global et la réponse plus faibles du PR23* laissent supposer que des quantités limitées de PR23* se sont rompues au lien azoïque pour produire du 5-nitro-o-anisidine; ce qui semble indiquer une biodisponibilité limitée des métabolites toxiques, tel qu’il est mentionné dans la section précédente.
Une récente étude de la toxicité à court terme chez des rats menée selon la ligne directrice 407 de l'OCDE pour les essais de produits chimiques a été déclarée dans le dossier REACH pour le PR112 (ECHA, 2012). Dans cette étude, des rats Wistar [cinq de chaque sexe par groupe, souche Crl:Wi(Han)] ont été exposés pendant 28 jours par gavage quotidien à du PR112 dans un excipient de propylèneglycol à une dose de 0, 100, 300 ou 1 000 mg/kg p.c. par jour. Aucun effet toxicologiquement significatif n'a été signalé pour tous les paramètres mesurés (signes cliniques, poids corporel et des organes, hématologie, analyse d'urine, chimie clinique, pathologie clinique, histopathologie), et la plus forte dose testée de 1 000mg/kg p.c. par jour a été considérée par les auteurs de l'étude comme la DSENO. Certains changements hématologiques ont été observés, y compris une hausse des réticulocytes (mâles, 1 000 mg/kg p.c. par jour), des niveaux accrus de méthémoglobine (femelles supérieur(e) ou égal(e) à 100 mg/kg p.c. par jour) et une baisse du volume corpusculaire moyen (femelles supérieur(e) ou égal(e) à 100 mg/kg p.c. par jour), bien qu'ils ne soient pas considérés comme toxicologiquement significatifs par les auteurs de l'étude, étant donné que ces valeurs étaient se situaient dans les plages normales (ECHA, 2012).
De la 2,4,5-Trichloroaniline (n° CAS 636-30-6), un produit potentiel du clivage de la liaison azoïque du PR112, a été détecté comme la cause de la méthémoglobine et de corps de Heinz après une exposition aiguë, tandis que des études de la toxicité par voie orale à court terme sur des rats ont également relevé des changements hématologiques concordant avec l'hémolyse et les poids du foie accrus à des doses faibles allant jusqu'à 40 mg/kg p.c. par jour (BUA, 2001). Bien que la hausse des réticulocytes et de la méthémoglobine observée pour le PR112 concorde avec les effets de la 2,4,5-trichloroaniline, l'observation de hausses moins prononcées du volume cellulaire moyen ne concorde pas avec un effet hémolytique dans cette étude. Compte tenu de l'incertitude concernant l'hypothèse selon laquelle la hausse des réticulocytes et de la méthémoglobine observée dans l'étude de dossier REACH est liée à l'exposition au PR112, une dose sans effet nocif observé (DSENO) de 1 000 mg/kg p.c. par jour est prise en compte pour la présente évaluation. Une autre étude à court terme sur des rats a indiqué l'absence d'effets sur le comportement, les paramètres urinaires, l'hématologie ou la pathologie clinique ou microscopique à la suite de 28 doses par gavage de PR112 à une concentration de 500 mg/kg p.c. sur une période de 43 jours (CNN, 1988; BIBRA 1997b). Un essai des ganglions lymphatiques locaux a également été déclaré négatif pour le PR112 (ECHA, 2012).
Dans l'ensemble, les études de toxicité à doses répétées disponibles sur le PR112 ne fournissent pas de preuves d'effets nocifs clairs à des doses allant jusqu'à 1 000 mg/kg p.c. par jour; une absence de réponse positive dans des essais in vitro a également indiqué un manque de potentiel génotoxique pour cette substance.
Une étude de toxicité à court terme par voie orale non publiée dans laquelle des rats Wistar (cinq de chaque sexe par groupe) ont reçu pendant 28 jours une dose de 0, 500, 2 500 ou 12 500 ppm de PR170 dans des aliments, selon la ligne directrice 407 de l'OCDE pour les essais de produits chimiques (Étude présentée, 2012v), n'a montré aucun changement apparent lié à la dose ou à l'exposition dans l'hématologie, l'analyse d'urine, la chimie clinique, ou la pathologie des tissus. Le groupe exposé à la dose la plus élevée de 12 500 ppm (1 172 et 1 193 mg/kg p.c. par jour pour les mâles et les femelles, respectivement) est considéré comme caractérisant la DSENO dans cette étude.
Dans une étude de la toxicité pour la reproduction et le développement à court terme (ligne directrice 422 de l'OCDE pour les essais des produits chimiques) dans laquelle des rats (12 de chaque sexe par groupe) ont été exposés à du PR22* par gavage pendant 37 jours pour les mâles et environ 40 jours pour les femelles (14 jours avant l'accouplement, 23 jours de gestation jusqu'au 4e jour de lactation) à une dose de 0, 100, 300 ou 1 000 mg/kg p.c. par jour (JECDB, 2013c), aucun changement lié à l'exposition n'a été signalé dans les paramètres de la reproduction ou du développement et aucun effet lié à la dose n'a été relevé dans l'hématologie, les paramètres urinaires, la chimie clinique, la pathologie clinique, ou l'histopathologie. Cependant, une hausse liée à la dose du poids du foie a été constatée chez les mâles et les femelles; elle a atteint une signification statistique à 1 000 mg/kg p.c. par jour. La dose intermédiaire de 300 mg/kg p.c. par jour a été considérée comme la dose sans effet observé (DSEO) dans cette étude (JECDB, 2013c).
En l'absence de données empiriques sur la santé, des données déduites à partir d'analogues sont appliquées à la totalité de ce sous-ensemble, y compris les pigments de naphtol AS qui ne partagent pas le même métabolite (5-nitro-o-anisidine) comme le PR23*. Dans l'ensemble, les données déduites à partir d'analogues dans ce sous-ensemble indiquent une faible toxicité d'après des études à court terme; 1 000 mg/kg p.c. par jour est considéré comme une DSENO à court terme pour le sous-ensemble entier, sur la base des effets observés pour le PR22*, en tenant compte des résultats du PR112 (DSENO jusqu'à 1 000 mg/kg p.c. par jour), du PR170 (DSENO de 1 172 mg/kg p.c. par jour) et du PR23* (DMENO à court terme de 2 500 mg/kg p.c. par jour). Un résumé des seuils d'effets critiques est présenté au tableau 7-15.
| Substance | DSENO à court terme (mg/kg p.c. par jour) |
|---|---|
| PR112 | DSENO = 1 000 (RM, RF) (ECHA, 2012) |
| PR170 | DSENO = 1 172/1 193 (RM/RF) (Étude présentée, 2012v) |
| PR5; PR187; PR266; PR268; PO38; NAPNPA; NANPAP; NAPMPA; NAPPA | Données déduites à partir d'analogues du PR22*, du PR112 et du PR170 |
La seule étude de toxicité chronique était pour l'analogue PR23*, qui a montré un faible potentiel carcinogène à de faibles doses telles que 2 500 mg/kg p.c. par jour chez des rats.
Bien que le PR22* et le PR23* contiennent des parties de nitroaniline, ces analogues ont aussi démontré un faible potentiel d'effets dans des études à court terme sur des rats, avec des DMEO de 1 000 mg/kg p.c. par jour pour le PR22* (poids accru du foie) et de 2 500 mg/kg p.c. par jour pour le PR23* (poids du foie, preuve d'hémolyse). L'étude de toxicité chronique pour le PR23* indique également un plus faible potentiel carcinogène à la dose élevée de 2 500 mg/kg p.c. par jour que celui prévu de son métabolite (5-nitro-o-anisidine), ce qui laisse supposer une faible biodisponibilité du PR23* d'origine aux voies de dégradation. Les données disponibles sur la réduction azoïque microbienne pour le PR112 (Pearce et al., 2008) et les toxicocinétiques orales chez le rat pour le PR23* (El Dareer et al., 1984) ) indiquent aussi un faible potentiel global d'absorption ou de réduction azoïque microbienne par rapport aux pigments de β-naphtol analysés dans les mêmes études. Dans l'ensemble, ces pigments de naphtol AS sont considérés comme montrant une toxicité chronique et à court terme similaire, sur le plan qualitatif, à celle des pigments de β-naphtol avec un plus faible potentiel relatif de toxicité, sur la base de la comparaison des données de toxicité à court terme.
7.2.6 Autres pigments monoazoïques (PO36, PR247:1, PR251, PY60, NSNAC)
Aucune donnée sur la toxicité précise d’une substance n’a été définie pour les autres pigments monoazoïques qui, autrement, ne figurent pas dans l’un des sous-ensembles de pigments des sections précédentes. Parmi ces substances, la preuve d’exposition n’a été relevée que pour le PO36.
PO36
Aucune donnée relative aux effets sur la santé n'a été relevée pour le PO36. Cependant, étant donné que le PO36 peut générer une nitroaniline à partir du clivage de la liaison azoïque similaire à celles du sous-ensemble des pigments de β-naphtol on avance la supposition prudente selon laquelle des pigments de β-naphtol peuvent découler des expositions chroniques et à court terme au PO36. En se fondant principalement sur la solubilité dans l'octanol de 10 à 100 fois inférieure du PO36 (86,1 jusqu'à plus de 137 µg/L) comparativement aux pigments de β-naphtol (1 760 à 17 900 µg/L), la biodisponibilité du PO36 est également jugée inférieure en termes de potentiel d'effets chroniques et à court terme.
PR247:1, PR251, PY60, NSNAC
Les renseignements disponibles n’ont pas permis de déterminer les sources d’exposition à ces substances; par conséquent, seule une caractérisation limitée des risques a été réalisée pour ces substances, aucune exposition n’étant attendue. Aucune donnée sur les effets sur la santé n’a été recensée pour le PR247:1, le PR251, le PY60 ou le NSNAC et aucun analogue proche riche en données n’a été trouvé pour être utilisé dans la technique de lecture croisée. Outre le PR247:1, aucune donnée empirique sur les propriétés physiques et chimiques les plus pertinentes (p. ex., solubilité dans l’eau ou l’octanol) n’a été recensée pour aider à conclure sur la biodisponibilité et le potentiel de subir un clivage pour ces substances. Cependant, il convient de noter que deux de ces substances contiennent des parties pour lesquelles certains effets sur la santé pourraient être attendus.
Un clivage azoïque théorique du PR251 produirait une 1-aminoanthraquinone (NO CAS 82-45-1) qui a présenté des effets sur la rate et les reins, dans le cadre d’études à doses répétées, et sur le comportement d’allaitement, dans le cadre d’une étude sur la reproduction (OCDE, 1996). Plusieurs aminoanthraquinones apparentées ont présenté des preuves positives de cancérogénicité chez les rongeurs dans des études de la toxicité chronique, bien que les données précises déduites à partir d’analogues de cet effet pour la 1-aminoanthraquinone soient incertaines (Sendelbach, 1989).
Le clivage de la liaison azoïque théorique du PY60 libérerait du 2-chloroaniline (n° CAS 95-51-2) dont la toxicité pour les globules rouges et la rate, fréquente dans le cas d’autres chloroanilines, a été observée chez des rats (Environnement Canada, Santé Canada, 2014b). Aucune donnée sur les effets sur la santé n’a été relevée pour les métabolites potentiels du clivage azoïque du PR247:1 ou du NSNAC. Toutefois, les deux parties de l’aminonaphtol de chaque côté de la liaison azoïque du NSNAC sont sulfonées et l’une des parties du dérivé de naphtol AS dans le PR247:1 est sulfonée, ce qui laisserait entendre une biodisponibilité accrue par voie orale pour ces substances (par analogie avec les sous-ensembles des pigments de β-naphtol laqués et des pigments de BONA laqués évalués dans la présente évaluation). Cependant, ces amines sulfonées ne devraient pas présenter un potentiel cancérogène et elles sont généralement associées à une toxicité systémique plus faible (Jung et al., 1992). Aucune donnée sur les effets sur la santé n’a été recensée pour l’autre partie du dérivé de naphtol AS non sulfonée dans le PR247:1; par conséquent, la toxicité potentielle associée à cette structure est incertaine.
Bien qu’il puisse exister des effets sur la santé associés aux métabolites du clivage azoïque théorique de certaines de ces substances (1-aminoanthraquinone à partir du PR251 et 2-chloraniline à partir du PY60), le degré d’incertitude concernant les rejets potentiels de ces métabolites à partir de pigments d’origine est élevé. Par conséquent, en l’absence de données sur ces substances, les effets critiques sur la santé ne peuvent pas être déterminés de façon concluante.
7.2.7 Incertitudes quant aux données toxicologiques
En reconnaissant le caractère inadéquat de l’ensemble de données à divers degrés, selon le sous-ensemble, des hypothèses générales pour prévoir le potentiel de risque ont été appliquées aux sous-ensembles de pigments monoazoïques. L'hypothèse principale est que la toxicité des substances et des analogues dans un ensemble est due aux métabolites potentiels des amines aromatiques qui, pour un sous-ensemble de pigments monoazoïques donné, peuvent être un métabolite commun (p. ex., le 1-amino-2-naphtol est métabolite potentiel commun pour toutes les substances dans les sous-ensembles de pigments de β-naphtol et de β-naphtol laqués). Dans d'autres cas, des métabolites très étroitement apparentés peuvent être utilisés pour un sous-ensemble donné (p. ex., des dérivés de nitroaniline substitués pour des substances dans le sous-ensemble de pigments de β-naphtol. On s'attend à ce que l'exposition systémique de ces métabolites d'amines aromatiques communs ou très étroitement proches entraîne des effets sur la santé similaires après l'exposition aux substances d'origine. Cette approche impliquant des données déduites à partir d'analogues a également été appliquée à des sous-ensembles de pigments monoazoïques pour lesquels des données concernant les effets sur la santé sont plus limitées (p. ex., les pigments jaunes monoazoïques) et ceux qui sont intrinsèquement plus diverses en termes de structure chimique et de propriétés physicochimiques (p. ex.. ensemble de pigments de naphtol AS). En outre, aucune étude sur la toxicité chronique n'a été relevée pour des substances ou des analogues des sous-ensembles de pigments jaunes monoazoïques et de pigments de naphtol AS; des données déduites à partir d'analogues du sous-ensemble de pigments de β-naphtol ont été appliquées au scénario de la pire éventualité pour les effets chroniques sur la santé. Dans l'ensemble, tandis que l'application de l'approche fondée sur des données déduites à partir d'analogues pour le potentiel de risque dans les sous-ensembles de pigments monoazoïques est considérée comme logique, il faut noter que le degré d'incertitude lié aux données déduites à partir d'analogues est plus élevé pour ces sous-ensembles de pigments monoazoïques avec une absence ou une quantité très limitée de données de toxicité et plus de structures hétérogènes et de propriétés physicochimiques. Ces facteurs entraînent un niveau de confiance coté dans l'évaluation des effets sur la santé des différents sous-ensembles de pigments monoazoïques. Voici les sous-ensembles classés selon le niveau de confiance le moins élevé au plus élevé : pigments de βnaphtol supérieur(e) à pigments de β-naphtol laqués supérieur(e) à pigments de BONA laqués supérieur(e) à pigments jaunes monoazoïques supérieur(e) à pigments de naphtol AS supérieur(e) à pigments individuels. Cet ordre a été suivi dans le cadre de l'analyse des données disponibles sur les effets sur la santé pour les substances pour lesquelles une exposition actuelle des consommateurs au Canada est connue (consulter la section « Évaluation de l'exposition »).
Les pigments monoazoïques dans le sous-ensemble de pigments de β-naphtol présentent des valeurs d'hydrosolubilité relativement faibles comparativement aux colorants azoïques très hydrosolubles ou aux colorants de solvants azoïques liposolubles. Par conséquent, il y a une incertitude concernant la biodisponibilité et l'absorption des pigments monoazoïques d'origine et de leurs métabolites du clivage de la liaison azoïque; cette incertitude est prise en compte dans l'évaluation des effets sur la santé. En outre, des doutes subsistent quant au degré précis d’absorption des pigments de β-naphtol p laqués après une exposition par voie orale; cependant, on s’attend à ce que l’absorption orale soit importante (supérieur(e) à 35 à 54 % à partir de métabolites urinaires radiomarqués au C14 après l’exposition par voie orale au PR53:1.
Tandis qu'il semble clair qu'un certain degré d'absorption orale, de clivage de la liaison azoïque dans les intestins, et de dissociation est prévu après l'exposition par voie orale aux pigments de β-naphtol laqués, on admet une incertitude quant à l'extrapolation à l'exposition par voie cutanée. Il demeure aussi des incertitudes quant aux facteurs contributifs spécifiques responsables de la biodisponibilité orale apparente des pigments de β-naphtol laqués. Pour les pigments de BONA laqués, une incertitude est reconnue quant à la valeur absolue de l'absorption orale; cependant, on s'attend à ce qu'une absorption et un clivage de la liaison azoïque importants se produisent après l'exposition par voie orale.
Des valeurs d’absorption cutanée de 6 % pour les pigments et de 1 % pour les pigments laqués sont appliquées dans l’évaluation; ces valeurs sont considérées comme des estimations prudentes, sur la base de données liées à une substance à bien plus forte lipophilie (Solvent Red 23) et de données sur un analogue de pigment de BONA laqué, à savoir le PR57*, respectivement. Ces valeurs d'absorption cutanée tiennent compte de l'absence d'activité microbienne de la flore normale de la peau dans des études in vitro sur l'absorption cutanée (Platzek, 1999; Stingley et al., 2010) en observant le clivage de la liaison azoïque dans une incubation in vitro du PR63:1 avec les bactéries de la peau Staphylococcus et Micrococcus (BRI, 2012).
Pour les pigments de naphtol AS, en raison du peu de données disponibles sur la toxicité, la variabilité structurelle dans le sous-ensemble accentue l'incertitude liée aux données déduites à partir d'analogues dans ce sous-ensemble pour les effets potentiels sur la santé. Par exemple, puisque la toxicité potentielle des substances azoïques peut être attribuée, en partie, à leurs métabolites d'amines aromatiques respectifs, des différences dans les substitutions sur la partie d'amines aromatiques des pigments de naphtol AS peuvent influer sur leur métabolisme et donc sur la toxicité relative de ces substances.
Pour les pigments de BONA laqués, les deux études de toxicité subchronique déclarées pour le PR63:1 et le PR57:1* ont un niveau de confiance inférieur en raison des détails limités fournis et des effets signalés à des niveaux bien plus bas dans des études de toxicité à court terme de plus haute qualité pour le PR48:2 et le PR57:1*.
Pour le sous-ensemble des pigments de naphtol AS, il y a une incertitude quant à leur biodisponibilité et à leur toxicité ainsi qu’à leurs métabolites potentiels du clivage de la liaison azoïque dans ce sous-ensemble en raison de la variabilité dans les substitutions du cycle anilinique du constituant d’accouplement de naphtol AS. Des doutes sont également reconnus relativement aux données déduites à partir d'analogues sur les effets sur la santé pour le PR22* et PR23* ainsi que d'autres manquant de parties de nitroaniline. Il y a aussi une forte incertitude liée aux effets chroniques potentiels des pigments de naphtol AS. La seule étude de toxicité chronique était pour l'analogue PR23*, qui a montré un faible potentiel carcinogène à de faibles doses telles que 2 500 mg/kg p.c. par jour chez des rats. On a appliqué une hypothèse prudente selon laquelle les pigments de naphtol AS peuvent montrer une toxicité chronique similaire, sur le plan qualitatif, à celle des pigments de β-naphtol (PR3, PR4, PO5), mais le potentiel relatif de toxicité global découlant de données de toxicité à court terme sur les pigments de naphtol AS est confirmé par des preuves limitées d'une biodisponibilité relative et d'un potentiel de clivage de la liaison azoïque des pigments de naphtol AS plus faibles.
Pour le PO36, l'hypothèse d'une toxicité qualitative similaire entre le PO36 et les pigments β-naphtol (PR3, PR4, PO5) repose sur l'hypothèse selon laquelle ces substances peuvent générer des dérivés de nitroaniline similaires. Contrairement au cas des pigments jaunes monoazoïques, qui peuvent également générer des dérivés de nitroaniline, aucune étude de toxicité sur le PO36 ne permet d'émettre l'hypothèse d'un potentiel de toxicité global plus faible pour cette substance. On note une forte incertitude quant à l'hypothèse selon laquelle une solubilité relative dans l'octanol plus faible entraînerait une biodisponibilité relative inférieure du PO36, et quant au fait de baser des données déduites à partir d'analogues sur cette hypothèse uniquement.
7.3 Caractérisation des risques
La caractérisation des risques sur la santé humaine a mis l'accent sur les pigments monoazoïques pour lesquels on peut s'attendre à une exposition de la population générale du Canada.
Pour 11 pigments monoazoïques pris en compte dans la présente évaluation (PR6, PO2, PR50:1, PR48:5, NAPNPA, NANPAP, NAPMPA, NAPPA, PR251, PY60 et NSNAC) dont la présence sur le marché canadien n’a pas été déclarée, il ne devrait pas y avoir d’exposition de la population générale du Canada et, par conséquent, ces substances ne sont pas prises en compte dans les sections de caractérisation des risques ci-dessous. Bien qu’une utilisation restreinte au Canada ait été relevée pour le PR247:1 et le PR268 (se reporter à la section 4. Sources et utilisations), l’exposition de la population générale à ces substances ne devrait pas être importante et, par conséquent, ces substances ne sont pas non plus incluses dans les sections ci-dessous.
À l’inverse, pour 19 pigments monoazoïques dans la présente évaluation dont la présence dans certains produits disponibles sur la marché canadien est indiquée (PR49:1, PY1, PR170, PR53:1, PR63:1, PY3, PR112, PO36, PR52:2, PY73, PR266, NONPA, PR48:2, PR52:1, PR4, PO5, PO38, PR187 et PR5), l’exposition à ces substances a été estimée pour la population générale au Canada pour des voies et des durées d’exposition pertinentes. L’exposition à ces substances dans des milieux naturels ne devrait pas être une source d’exposition importante; par conséquent, le risque pour la population générale du Canada d’être exposée de cette manière devrait être faible. Le risque d’une exposition à des produits spécifiques pour les divers ensembles de pigments monoazoïques est caractérisé pour chaque sous-ensemble.
7.3.1 Pigments de β-naphtol
L’exposition aux pigments de β-naphtol dans divers produits disponible aux consommateurs y compris la peinture au doigt, la peinture faciale et le rouge à lèvres a été estimée. Les estimations des risques associés à des scénarios d’exposition au PR4 et au PO5 sont présentées dans les tableaux 7-16 et 7-17, respectivement.
Le risque pour l’exposition orale par événement au PR4 et au PO5 par le contact main-bouche, notamment durant la peinture au doigt par des enfants, a été estimé en comparant les estimations de l’exposition avec les niveaux d’effet. Compte tenu de la nature intermittente du scénario de la peinture au doigt, on a jugé qu’une exposition quotidienne continue était peu probable et, par conséquent, des marges d’exposition pourraient être plus appropriées pour des niveaux d’effet aigus par rapport à ceux à court terme. Cependant, les deux estimations des risques sont présentées dans les tableaux 7-16 et 7-17. Pour le PR4, des données déduites à partir d’analogues sur les effets sur la santé pour d’autres pigments de β-naphtol, le PO5 et le PR3, ont été utilisées en l’absence de données sur la toxicité aiguë ou à court terme concernant le PR4 (tableau 7-16). D’après les niveaux d’effet à court terme, les marges d’exposition (ME) pour le PR4 variaient de 220 à 1 200 (tableau 7-16) et la ME était de 670 pour le PO5 (tableau 7-17). Cependant, selon une comparaison avec une DMENO aiguë de 100 mg/kg p.c. par jour (signes cliniques provenant d’une étude à dose unique par voie orale chez les rats, BG Chemie, 2000a), les ME étaient beaucoup plus élevées et variaient de 4 780 à 14 330 pour le PR4 et le PO5, respectivement. En tenant compte de la nature intermittente des expositions pour l’exposition par voie orale à la peinture au doigt chez les enfants, et du fait qu’une exposition quotidienne continue serait peu probable, les ME pour le niveau d’effet aigu pourraient être plus appropriées. Par conséquent, la plage de ME présentée ci-dessus, y compris les ME des DMENO aiguës, est jugée appropriée pour rendre compte des incertitudes liées aux bases de données concernant l’exposition et les effets sur la santé pour ce scénario d’exposition.
Le risque provenant de l’exposition cutanée par événement au PR4 découlant de l’utilisation de la peinture au doigt chez les enfants a été estimé en comparant les estimations de l’exposition avec les niveaux d’effet pour le PR3 et le PO5 provenant d’études de la toxicité par voie orale aiguë et à court terme (décrites dans le paragraphe ci-dessus, tableau 7-16). D’après les niveaux d’effet à court terme par voie orale, les ME par voie cutanée concernant le PR4 variaient de 780 à 4 200. En revanche, d’après une DMENO en exposition orale aiguë, la ME par voie cutanée pour le PR4 était de 16 670. Pour l’exposition cutanée par événement au PO5 dans la peinture au doigt chez les enfants (tableau 7-17), les ME fondées sur la DMENO à court terme et sur la DMENO aiguë étaient de 2 380 et de 51 190, respectivement. Compte tenu de la nature intermittente du scénario d’exposition avec la peinture au doigt et du fait que des ME cutanées par événement fondées sur des niveaux d’effets aigus pourraient être plus appropriées, et étant donné que l’exposition cutanée est comparée aux niveaux d’effets provenant d’études par voie orale, les ME sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé pour ce scénario d’exposition.
| Durée et voie d'exposition | Produit (groupe d’âge) | Estimations de l'exposition (mg/kg p.c. par jour) |
Seuils d'effets critiques (mg/kg p.c. par jour) | Marge d'exposition |
|---|---|---|---|---|
| Exposition orale par événement | Peinture au doigt (enfant) | 0,45 | Court terme (14 à 32 jours) DMENO = 100-541Note de bas de page Tableau 7-16[a] DMENO aiguë (dose unique) = 2 150Note de bas de page Tableau 7-16 [b] |
220 – 1 200 4 780 |
| Exposition cutanée par événement | Peinture au doigt (enfant) | 0,129 | Court terme (14 à 32 jours) DMENO = 100-541[a] DMENO aiguë (dose unique) = 2 150[b] |
780 – 4 200 16 670 |
| Exposition quotidienne par voie orale | Rouge à lèvres (adulte) |
0,0102 | Chroniques non cancérogènes, DSENO = 12,5 | 1 230 |
| Exposition quotidienne par voie orale | Rouge à lèvres (adulte) |
0,0102 | Tumeur au foie (plage des points de départ) 500 – 911Note de bas de page Tableau 7-16[d] |
49 000 – 89 300 |
| Exposition quotidienne par voie orale | Produits de santé naturels (enfant) | 0,032 – 0,065 | Chroniques non cancérogènes, DSENO = 12,5 | 190 – 390 |
| Exposition quotidienne par voie orale | Produits de santé naturels (enfant) | 0,032 – 0,065 | Tumeur au foie (plage des points de départ) 500 – 911[d] |
7 700 – 28 500 |
| Quotidienne par voie orale | Produits de santé naturels (adolescents) | 0,017 | Chroniques non cancérogènes, DSENO = 12,5 | 740 |
| Exposition quotidienne par voie orale | Produits de santé naturels (adolescents) | 0,017 | Tumeur au foie (plage des points de départ) 500 – 911[d] |
29 400 – 53 600 |
| Exposition quotidienne par voie orale | Produits de santé naturels (adulte) | 0,014 | Chroniques non cancérogènes, DSENO = 12,5 | 890 |
| Exposition quotidienne par voie orale | Produits de santé naturels (adulte) | 0,014 | Tumeur au foie (plage des points de départ) 500 – 911[d] |
35 700 – 65 100 |
| Quotidienne par voie cutanée | Masque de beauté (adulte) | 0,0049Note de bas de page Tableau 7-16 [c] | Chroniques non cancérogènes, DSENO = 12,5 | 25 500 |
| Quotidienne par voie cutanée | Masque de beauté (adulte) | 0,0049[c] | Tumeur au foie (plage des points de départ) 500 – 911[d] |
102 000 – 186 000 |
| Durée et voie d'exposition | Estimations de l'exposition (mg/kg p.c. par jour) |
Seuils d'effets critiques (mg/kg p.c. par jour) |
Marge d'exposition |
|---|---|---|---|
| Exposition orale par événement | 0,15 | Court terme (32 jours) DMENO = 100 DMENO aiguë (dose unique) = 2 150 |
670 1 4330 |
| Exposition cutanée par événement | 0,042Note de bas de page Tableau 7-17 [a] | Court terme (32 jours) DMENO = 100 DMENO aiguë (dose unique) = 2 150 |
2 380 51 190 |
Le risque de l’exposition quotidienne par voie orale au PR4 dans le rouge à lèvres a été estimé en comparant les estimations de l’exposition avec les niveaux d’effets chroniques (tableau 7-16). Pour la cancérogénicité, les points de départ pour la cancérogénicité de données déduites à partir d’analogues provenant d’autres pigments de β-naphtol, le PO5 et le PR3, ont été utilisés en l’absence de données adéquates pour le PR4. Pour les effets non cancérogènes du PR4 (DSENO chronique = 12,5 mg/kg p.c. par jour), la ME était de 1 230. En ce qui concerne la cancérogénicité, les ME variaient de 49 000 à 89 300 en fonction des points de départ pour les tumeurs au foie observées chez des rats femelles exposées au PO5 (dose tumorigène = 500 mg/kg p.c. par jour; incidence supérieure de 26 à 30 % par rapport au groupe témoin) et au PR3 (BMDL10 = 911 mg/kg p.c. par jour). Étant donné que l’estimation de l’exposition était fondée sur la limite supérieure de concentration de PR4 signalée pour les rouges à lèvres actuellement utilisés au Canada (3 %), et que la majorité des rouges à lèvres sur le marché canadien contiennent du PR4 dont les concentrations sont inférieures à 3 %, ces ME sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé pour ce scénario d’exposition.
Le risque découlant de l’exposition quotidienne par voie orale au PR4 dans les produits de santé naturels a été dérivé en comparant les estimations d’exposition basées sur la limite maximum permise de 1,0 mg/jour (BDIPSN, 2011) avec les niveaux d’effets chroniques (tableau 7-16). Pour les effets non cancérogènes du PR4 (DSENO chronique =12,5 mg/kg p.c. par jour), les ME variaient de 190 à 890 selon le groupe d’âge et sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé pour ce scénario d’exposition. Pour la cancérogénicité, les points de départ pour la cancérogénicité de données déduites à partir d’analogues provenant des autres pigments de β-naphtol, le PO5 et le PR3, ont aussi été utilisés en l’absence de données adéquates pour le PR4 (tumeurs au foie observées chez des rats femelles; PO5, dose tumorigène = 500 mg/kg p.c. par jour; incidence supérieure de 26 à 30 % par rapport au groupe témoin; PR3, BMDL10 = 911 mg/kg p.c. par jour). En ce qui concerne la cancérogénicité, les ME variaient de 7 700 à 65 100 en fonction du groupe d’âge et des points de départ. Bien que l’ébauche d’évaluation présentait la limite inférieure de la marge d’exposition comme potentiellement inadequate, cette limite est basée sur l’application de plusieurs hypotheses prudentes (par exemple, hypoth`se d’une exposition continue au PR4 dans les produits de santé naturelle pour la durée d’une vie, le PR4 étant présent à la limite maximum permise de 1,0 mg/jour, et un potentiel cancérogène comme le plus dangereuax des analogue, le PO5). De plus, en faisant la moyenne des expositions spécifiques aux groups d’âges sur toute une vie devrait résulter en une dose moyenne journalière plus faible globalement sur une vie entière et en une étendue des marges d’exposition correspondantes plus élevées (Santé Canada, 2013; US EPA, 2005). Aussi, la sous-population ciblée pour l’utilisation des produits de santé naturelle est les enfants (i.e. les multivitaminesNote de bas de page[19]) pour les ages de 4 à 8 ans, ainsi le poids corporel de 15.5 kg utilisé pour représenter un enfant de 4 ans (voir le tableu 7-2) et la limite inférieure correspondante pour les marges d’exposition pour les enfants est considérée comment prudente. Ainsi, à la lumière des hypotheses prudentes mentionnées ci-haut, les marges entre l’exposition estimée au PR4 par utilisation dans des produtis de santé naturelle oraux et les niveaux d’effets critiques établis à partir d’étude animales sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l’exposition.
En ce qui concerne le risque découlant d’une exposition quotidienne par voie cutanée au PR4 dans les masques de beauté, une comparaison des estimations pour une exposition par voie cutanée avec une DSENO chronique non cancérogène de 12,5 mg/kg p.c. par jour donne une ME de 2 550. En ce qui concerne la cancérogénicité, les ME variaient de 102 000 à 186 000 en fonction des points de départ pour les tumeurs au foie observées chez des rats femelles exposées au PO5 (dose tumorigène = 500 mg/kg p.c. par jour; incidence supérieure de 26 à 30 % par rapport au groupe témoin) et au PR3 (BMDL10 = 911 mg/kg p.c. par jour). Ces marges d’exposition sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l’exposition pour ce scénario d’exposition.
Dans l’ensemble, les ME calculées les scénarios d’exposition concernant les produits de consommation dans les tableaux 7-16 et 7-17 sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
On considère que les scénarios d’exposition caractérisés dans les tableaux 7-16 et 7-17 ci-dessus représentent les expositions pour les produits indicateurs à ces substances et, par conséquent, l’exposition et le risque découlant des autres utilisations potentielles des produits déterminés pour ces substances (voir la section 4.2 intitulée Utilisations) devraient être inférieurs à ceux présentés ici.
Sur la base des données déduites à partir d’analogues du PR3, du PR4 et du PO5, les autres substances dans le sous-ensemble de pigments de β-naphtol (PR6, PO2 et NONPA) devraient également avoir des effets similaires sur la santé humaine, y compris la cancérogénicité potentielle.
7.3.2 Pigments de β-naphtol laqués (PR49:1, PR53:1)
L'exposition aux pigments de β-naphtol laqués a été caractérisée à partir de l'utilisation de divers produits disponible aux consommateurs, y compris les peintures au doigt, les peintures faciales et le rouge à lèvres; ces produits devraient entraîner la plus forte exposition parmi les produits déterminés. La comparaison entre les estimations de l’exposition découlant de l’utilisation de chaque produit défini avec un seuil d’effet critique donne des ME qui sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé (voir le tableau 7-18).
Le seuil d’effet critique pour le calcul des ME à court terme par voie orale et par voie cutanée était fondé sur des changements pathologiques observables à l’œil dans la rate, le foie et les reins de rats, dans le cadre d’une étude par voie orale de 14 jours sur le PR53:1 (NTP, 1982) avec des effets observés à la dose testée la plus faible (DMENO de 300 mg/kg p.c. par jour). La comparaison de la DMENO par voie orale à court terme avec l’exposition orale par événement au PR49:1 découlant de l’utilisation de cette substance dans les peintures au doigt (enfant) donne une ME de 580. La comparaison avec les estimations de l’exposition cutanée par événement découlant de l’utilisation du PR49:1 et du PR53:1 dans les peintures faciales donne une ME de 2 200.
Les seuils d'effets critiques pour les effets non cancérigènes chroniques (DMENO = 50 mg/kg p.c. par jour) et les effets cancérigènes [dose repère (BMDL10) pour les tumeurs hépatiques = 44 mg/kg p.c. par jour] pour le calcul des marges d'exposition étaient basés sur une étude de l'exposition chronique au PR53:1 par l'alimentation chez le rat (NTP, 1982). L'exposition orale quotidienne au PR53:1 par l'utilisation de rouge à lèvres a donné des marges d'exposition supérieures ou égales à 44 000.
Dans l’ensemble, les ME calculées pour les scénarios concernant les produits dans le tableau 7-18 sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. On considère que les scénarios d’exposition caractérisés ici représentent des produits indicateurs et, par conséquent, l’exposition et le risque découlant des autres utilisations potentielles de produits de consommation déterminés pour ces substances (voir la section 4.2 intitulée Utilisations) devraient être inférieurs à ceux présentés ici.
| Substance | Durée et voie d'exposition | Produit (groupe d’âge) | Estimations de l’exposition (mg/kg p.c. par événement/ par jour) |
Seuils d'effets critiques (mg/kg p.c. par jour)d | ME |
|---|---|---|---|---|---|
| PR49:1 | Exposition orale par événement | Peinture au doigt (enfant) | 0,52 | DMENO à court terme (14 jours) = 300 | 580 |
| PR49:1 PR53:1 |
Exposition cutanée par événementNote de bas de page Tableau 7-18 [a] | Peinture faciale (enfant) | 0,135 | DMENO à court terme (14 jours) = 300 | 2 220 |
| PR53:1 | Exposition quotidienne par voie orale | Rouge à lèvres/baume pour les lèvres (adulte) | 0,001 | Chroniques non cancérogènes, DMENO = 50 | 50 000 |
| PR53:1 | Exposition quotidienne par voie orale | Rouge à lèvres/baume pour les lèvres (adulte) | 0,001 | Tumeurs du foie BMDL10 = 44 |
44 000 |
7.3.3 Pigments de BONA laqués (PR48:2 et PR63:1)
L’exposition aux pigments de BONA laqués a été estimée à partir de l’utilisation de divers produits disponibles aux consommateurs, y compris la peinture au doigt et la peinture faciale (tableau 7-19). Pour le risque découlant de l’exposition par événement, une DMENO à court terme de 200 mg/kg p.c. par jour a été prise en compte pour représenter le seuil d’effet critique pour le PR48:2 et le PR63:1, sur la base d’une étude à doses répétées sur le PR48:2 (par gavage durant 42 jours; changements histopathologiques des tubules rénaux). La comparaison de l’exposition orale par événement aux peintures au doigt avec l’exposition cutanée par événement dans les peintures au doigt ou les peintures faciales a donné des ME par voie orale variant de 250 à 1 100. Des éléments indiquent une réversibilité de la toxicité rénale à partir de l’étude critique à court terme sur des animaux impliquant du PR48:2 et un autre pigment de BONA laqué connexe (PR57:1*). En outre, la durée de l’étude de 42 jours est bien plus longue que la durée prévue de l’exposition à la peinture au doigt (2 à 3 fois par semaine) et à la peinture faciale (6 fois par année). Ainsi, la plage des ME par voie orale est jugée prudente. Pour l’exposition cutanée par événement aux peintures au doigt et aux peintures faciales, la comparaison a donné des ME variant de 1 480 à 22 200.
Dans l’ensemble, les ME calculées pour les scénarios concernant les produits dans le tableau 7-19 sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. On considère que les scénarios d’exposition caractérisés ici représentent des produits indicateurs et, par conséquent, l’exposition et le risque découlant des autres utilisations potentielles de produits déterminés pour ces substances (voir la section 4.2 intitulée Utilisations) devraient être inférieurs à ceux présentés ici.
| Substance | Durée et voie d'exposition | Produit (groupe d’âge) | Estimations pour l’exposition (mg/kg p.c. par événement) | Seuils d'effets critiques (mg/kg p.c. par jour)d | Marge d'exposition |
|---|---|---|---|---|---|
| PR48:2 PR63:1 |
Exposition orale par événement | Peinture au doigt (enfant) | 0.18–0.77 | Court terme (42 jours) DMENO = 200 |
250–1 110 |
| PR48:2 PR63:1 |
Exposition cutanée par événement | Peinture au doigt (enfant) | 0,009–0,037Note de bas de page Tableau 7-19[a] | Court terme (42 jours) DMENO = 200 |
5 400 – 22 220 |
| PR63:1 | Exposition cutanée par événement | Peinture faciale (enfant) | 0,135[a] | Court terme (42 jours) DMENO = 200 |
1 480 |
7.3.4 Pigments jaunes monoazoïques (PY1, PY3 PY73)
L’exposition aux pigments jaunes monoazoïques a été estimée dans divers produits disponibles aux consommateurs, y compris la peinture au doigt et la peinture faciale (tableau 7-20). L’exposition quotidienne découlant de l’utilisation de crèmes, de lotions et de soins hydratants pour le corps contenant du PY1 a également été estimée (voir l’annexe F, tableau F-1); toutefois, aucune étude de toxicité chronique n’a été relevée pour les substances du sous-ensemble des pigments jaunes monoazoïques. Malgré l’absence d’effets toxicologiques évidents pour les pigments jaunes monoazoïques d’études à plus court terme, le potentiel de toxicité de ces derniers est jugé inférieur à celui des pigments de β-naphtol, sur la base de la comparaison d’études à court terme. Étant donné que les données disponibles pour les pigments de β-naphtol n’indiquent pas de préoccupations en matière de la santé liées à l’exposition cutanée chronique par l’utilisation de cosmétiques (tableau 7-16), le risque potentiel que la population générale du Canada soit exposée au PY1 à partir de l’utilisation d’une crème, d’une lotion et d’un hydratant pour le corps ne devrait pas être élevé.
Dans l’ensemble, les ME calculées pour les scénarios concernant les produits dans le tableau 7-20 sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. On considère que les scénarios d’exposition caractérisés ici représentent des produits indicateurs et, par conséquent, l’exposition et le risque découlant des autres utilisations potentielles de produits déterminés pour ces substances (voir la section 4.2 intitulée Utilisations) devraient être inférieurs à ceux présentés ici.
| Substance | Durée et voie d'exposition | Produit (groupe d’âge) | Estimations pour l’exposition (mg/kg p.c. par événement) | Seuils d'effets critiques (mg/kg p.c. par jour) | Marge d'exposition |
|---|---|---|---|---|---|
| PY1 PY3 PY73 |
Exposition orale par événement | Peinture au doigt (enfant) | 0,21-0,34 mg/kg p.c. par événement | Court terme (28 jours) DMEO = 1 000 DSENO = 1 250 |
2 900-4 800 3 700-6 000 |
| PY1 PY3 PY73 |
Exposition cutanée par événement | Peinture faciale (enfant) | 0,016-0,81 mg/kg p.c. par événementNote de bas de page Tableau 7-20 [a] | Court terme (28 jours) DMEO = 1 000 DSENO = 1 250 |
1 200-63 000 1 500-78 000 |
7.3.5 Pigments de naphtol AS
L’exposition aux pigments de naphtol AS a été estimée dans divers produits disponibles aux consommateurs, y compris la peinture au doigt et la peinture faciale (tableau 7-21). L’exposition cutanée et orale quotidienne découlant de l’utilisation de cosmétiques contenant du PR112 a également été estimée (voir l’annexe F, tableaux F-1 et F-3); toutefois, aucune étude de toxicité chronique n’a été relevée pour les substances du sous-ensemble des pigments de naphtol AS. Malgré l’absence d’effets toxicologiques évidents pour les pigments de naphtol AS d’après des études à plus court terme, le potentiel de toxicité de ces derniers est jugé inférieur à celui des pigments de β-naphtol, sur la base de la comparaison d’études à court terme. Étant donné que les données disponibles pour les pigments de β-naphtol n’indiquent pas de préoccupations en matière de santé liées à l’exposition cutanée ou orale chronique par l’utilisation de cosmétiques (tableau 7-16), le risque potentiel que la population générale du Canada soit exposée au PR112 à partir de l’utilisation de cosmétiques ne devrait pas être élevé.
Dans l’ensemble, les ME calculées pour les scénarios concernant les produits d dans le tableau 7-21 sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. On considère que les scénarios d’exposition caractérisés ici représentent des produits indicateurs et, par conséquent, l’exposition et le risque découlant des autres utilisations potentielles de produits déterminés pour ces substances (voir la section 4.2 intitulée Utilisations) devraient être inférieurs à ceux présentés ici.
| Substance | Durée et voie d'exposition | Produit (groupe d’âge) | Estimations de l'exposition (mg/kg p.c. par jour) |
Seuils d'effets critiques (mg/kg p.c. par jour)d | Marge d'exposition |
|---|---|---|---|---|---|
| PR5 PR112 PR170 PO38 |
Court terme par voie orale | Peinture au doigt (enfant) | 0,284–1,290 | Court terme (28 jours) DSENO = 1 000-1 172 |
780-4 130 |
| PR112 | Court terme par voie cutanée | Peinture faciale (enfant) | 0,813Note de bas de page Tableau 7-21 [a] | Court terme (28 jours) DSENO = 1 000 |
1 230-1 440 |
7.3.6 Pigments de benzimidazolone (PO36)
L’exposition au PO36 découlant de l’utilisation de peintures et de revêtements, y compris le matériel d’artistes et d’artisanat est attendue (annexe G, tableau G-4). Toutefois, aucune exposition ou estimation pour ces utilisations précises n’a été déterminée, étant donné qu’aucune donnée sur les effets sur la santé n’a été recensée pour cette substance. Cependant, bien qu’aucune ME précise n’ait été calculée pour le PO36, les risques estimés à partir de produits devraient être semblables ou inférieurs à ceux déjà présentés dans les sections précédentes concernant d’autres sous-ensembles de pigments monoazoïques.
7.3.7 Exposition aux pigments monoazoïques qui, autrement, n’ont pas été caractérisés
L’exposition cutanée et orale potentielle découlant de l’utilisation de 19 pigments monoazoïques contenus dans les peintures et les revêtements, comme l’utilisation du matériel d’artistes et d’artisanat (annexe G, tableau G-4), devrait être traitée par la caractérisation des risques des expositions indicatrices découlant de peintures au doigt ou de peintures faciales. Le risque découlant de l’exposition aux peintures au doigt et aux peintures faciales n’est pas très préoccupant aux niveaux d’exposition actuels. Par conséquent, on estime également que le risque attendu lié à l’exposition cutanée et orale aux pigments monoazoïques découlant d’autres utilisations de peintures et de revêtements n’est pas très préoccupant. Pour l’exposition par inhalation découlant de l’utilisation de peintures et de revêtements, comme la peinture au pistolet et le ponçage de la peinture, les estimations de l’exposition pour ces utilisations (annexe G, tableau G-5) indiquent une exposition faible (0,000367 à 0,00055 mg/kg p.c. par événement). Étant donné que ces estimations de l’exposition sont bien en deçà des expositions par événement pour la peinture au doigt et la peinture faciale, les risques liés aux expositions par inhalation sont jugés faibles.
7.3.8 Incertitudes de l'évaluation des risques pour la santé humaine
Le manque de données ou les données limitées sur la santé pour toutes les voies d'exposition pertinentes et les durées d'exposition suscitent une incertitude. En conséquence, l’extrapolation voie-à-voie et durée-à-durée était nécessaire dans certains cas, ce qui a entraîné des incertitudes dans les estimations des risques établies. Par exemple, les points de départ pour les effets sur la santé par voie orale ont été utilisés pour calculer les ME pour les expositions cutanées (p. ex., peinture faciale, crème pour le corps); toutefois, étant donné que les facteurs d’absorption par voie cutanée appliqués à l’estimation de l’exposition ont été jugés prudents, les ME obtenues sont également jugées prudentes. De plus, la durée et les fréquences d’exposition concernant plusieurs scénarios de produits tels que les peintures au doigt (2 à 3 fois par semaine) et les peintures faciales (6 fois par année) ne correspondaient pas précisément à celles du point de départ pour la toxicologie qui étaient souvent fondées sur des études de durée plus longue sur des animaux (supérieur(e) ou égal(e) à 14 jours) et sur une exposition continue. Par conséquent, les ME calculées pour les scénarios d’exposition impliquant des extrapolations durée-à-durée sont également jugées prudentes.
D’après les renseignements disponibles, certains de ces pigments monoazoïques sont inscrits comme ingrédients dans les encres de tatouage offertes aux consommateurs au Canada. Toutefois, les connaissances actuelles sur l’exposition systémique chronique découlant de colorants de tatouage injectés sont jugées insuffisantes pour une évaluation quantitative de l’exposition valide (EPA du Danemark, 2012). Bien que les effets sur la santé de plusieurs de ces pigments monoazoïques soient reconnus, y compris la cancérogénicité potentielle (p. ex., le PR3, le PR4, le PO5 et d’autres pigments de β-naphtol; le PR53:1), le risque associé à l’utilisation d’encres à tatouage n’a pas été caractérisé dans la présente évaluation préalable et il demeure une incertitude en raison de la forte incertitude liée à la caractérisation de l’exposition issue de l’utilisation des encres à tatouage.
Bien que l’exposition au PR4 à partir de l’utilisation dans des produits de santé naturelle oaraux n’indique par des préoccupation élevées de risques pour la santé humaine, les effets sur la santé du PR, incluant le potentiel cancérogène sont toujours reconnu. De plus amples renseignements concernant les quantité ou concentrations réelles de PR4 dans les produits de santé naturelle oraux, le nombre de canadiens consommant des produits de santé naturelle oraux contenant du PR4 aux niveaux maximum permit, le degré de respect des insctructions relaitive à l’utilisation de ces produits et le niveau d’exposition au PR4 à partir d’autres sources chez ces individus aideraient à réduire l’incertitude liée à la caractérisation de l’exposition pour cette sous-population.
7.3.9 Pigments monoazoïques avec effets préoccupants
Dans l’ensemble, les risques que posent les substances visées par cette évaluation pour la santé humaine sont faibles compte tenu des niveaux actuels d’exposition. Cependant, parmi les 32 pigments monoazoïques, certains pigments figurant dans la présente évaluation relative à la santé humaine ont des effets préoccupants en raison du potentiel de cancérogénicité. Une liste de ces substances est présentée à l’annexe J.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, les 33 pigments monoazoïques évalués dans la présente évaluation présentent un faible risque d’effets nocifs sur les organismes et sur l’intégrité globale de l’environnement. On conclut que ces pigments monoazoïques ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
D’après la comparaison entre les estimations de l’exposition chronique et à court terme découlant de l’utilisation de produits spécifiques et les seuils d’effet critique établis à partir d’études sur des animaux, on conclut que les 19 pigments monoazoïques suivants ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine : PR4, PO5, PR49:1, PR53:1, PR48:2, PR63:1, PR52:1, PR52:2, PY1, PY3, PY73, PR5, NONPA, PR187, PR112, PR170, PR266, PO38 et PO36. Pour les 13 autres substances (PR6, PO2, PR50:1, PR48:5, NAPNPA, NANPAP, NAPMPA, NAPPA, PR251, PR268, PR 247:1, PY60 et NSNAC), les données disponibles n’ont pas permis de déterminer les sources d’exposition actuelle de la population générale du Canada et, par conséquent, le risque pour la santé humaine de ces 13 pigments monoazoïques est jugé faible. À la lumière des renseignements fournis dans la présente évaluation préalable, on conclut que les 32 pigments monoazoïques ci-dessus étudiés dans la présente évaluation liée à la santé humaine ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines. En outre, aucune mise à jour n’a été apportée aux conclusions de l’alinéa 64c) concernant le Pigment Red 3 qui a déjà été évalué par le gouvernement du Canada dans le cadre du Défi du PGPC.
On conclut que les 32 pigments monoazoïques étudiés dans la présente évaluation ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE (1999).
La conclusion précédemment établie dans le cadre du Défi indiquant que le Pigment Red 3 répond aux critères établis à l’alinéa 64c) de la LCPE (1999) demeure inchangée.
Références
3M. 2007. Fiches signalétiques santé-sécurité : Encre sérigraphique 3M 1918, jaune avec une nuance rouge [en ligne]. St. Paul (MN) : 3M. [consulté le 18 avril 2013]. Accès : http://solutions.3mcanada.ca/wps/portal/3M/en_CA/WW2/Country
Anliker, R., Moser, P. 1987. The limits of bioaccumulation of organic pigments in fish: Their relation to the partition coefficient and the solubility in water and octanol. Ecotoxicol. Environ. Saf.13:43-52.
Anliker, R., Moser, P., Poppinger, D. 1988. Bioaccumulation of dyestuffs and organic pigments in fish. Relationships to hydrophobicity and steric factors.Chemosphere 17(8):1631-1644.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'évaluation]. 2010. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/opptintr/exposure/pubs/episuite.htm
Arnot, J.A., Arnot, M.I., Mackay, D., Couillard, Y., MacDonald, D., Bonnell, M., Doyle, P. 2010. Molecular size cutoff criteria for screening bioaccumulation potential: fact or fiction? Integr. Environ. Assess. Manag. 6(2):210-224.
Assmann, N., Emmrich, M., Kampf, G., Kaiser, M. 1997. Genotoxic activity of important nitrobenzenes and nitroanilines in the Ames test and their structure-activity relationship. Mutat. Res.395(2-3):139-144.
ASTreat [modèle sur l'élimination des usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (OH) : Procter & Gamble Company, C.P. 538707, Cincinnati (OH) 45253-8707, États-Unis.
Baranski, B., Przybojewska, B., Spiechowicz, E., Wyszynska, K., Zimnicki, J. 1992. Identification of potential carcinogenic dyes and intermediates on the basis of their genotoxicity [article en polonais]. Med. Pr.43:469-477.
BASF. 2008. Brochure Pigmosol. Accès : http://www.basf.com.mx/specialty_colorants/pdfs/pigmosol_brochure.pdf
Baughman, G.L., Perenich, T.A. 1988. Investigating the fate of dyes in the environment.Am. Dyest. Rep. 7(2):19-20, 22, 47-48. [cité dans Øllgaard et al., 1998].
Bäumler, W., Eibler, E.T., Hohenleutner, U., Sens, B., Sauer, J., Landthaler, M. 2000. Q-switch laser and tattoo pigments: first results of the chemical and photophysical analysis of 41 compounds. Laser Surg. Med. 26:13-21.
Bäumler, W., Vasold, R., König, B., Landthaler, M. 2004. Q-switched laser and tattoo pigments, a chemical analysis of laser induced decomposition compounds. Toxicologist 78(Suppl 1):1079.
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2011. Version 2.1. Ottawa (Ont.) : Santé Canada. [consulté le 15 février 2012]. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?url=&lang=fra
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada. [consulté en 2012]. Accès : http://www.hc-sc.gc.ca/dhp-mps/prodpharma/databasdon/index-fra.php
[BDPSNH] Base de données des produits de santé naturels homologués [base de données sur Internet]. 2008. Version 1.0. Ottawa (Ont.) : Santé Canada. [consulté en 2014]. Accès : http://webprod3.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?url=Search-Recherche&lang=fra
[BG Chemie] Berufsgenossenschaft der chemischen Industrie. 2000a. Toxicological Evaluation No. 223: 1-(2,4-Dinitro-phenylazo)-2-naphthol. CAS No. 3468-63-1. Heidelberg (Allemagne). Accès : http://www.bgrci.de/fileadmin/BGRCI/Downloads/DL_Praevention/Fachwissen/Gefahrstoffe/TOXIKOLOGISCHE_BEWERTUNGEN/Bewertungen/ToxBew223-E.pdf
[BG Chemie] Berufsgenossenschaft der chemischen Industrie. 2000b. Toxicological Evaluation No.118:2-Nitro-4-methylaniline. CAS No.89-62-3. Heidelberg (Allemagne). Accès : https://www.bgrci.de/fileadmin/BGRCI/Downloads/DL_Praevention/Fachwissen/Gefahrstoffe/TOXIKOLOGISCHE_BEWERTUNGEN/Bewertungen/ToxBew118-E.pdf
[BIBRA] British Industrial Biological Research Association. 1989. Toxicity profile: D&C Red 9. Surrey (Grande-Bretagne) : BIBRA Information Services Ltd. Accès : www.bibra-information.co.uk/profile-258.html
[BIBRA] British Industrial Biological Research Association. 1993a. Toxicity profile: Lithol rubine BK. Surrey (Grande-Bretagne) : BIBRA Information Services Ltd. Accès : www.bibra-information.co.uk/profile-213.html
[BIBRA] British Industrial Biological Research Association. 1993b. Toxicity profile: Lithol rubine B. Surrey (Grande-Bretagne) : BIBRA Information Services Ltd. Accès : www.bibra-information.co.uk/profile-388.html
[BIBRA] British Industrial Biological Research Association. 1997a. Toxicity profile: Pigment Red 48, 48:1, 48:2, 48:3, 48:4. Surrey (Grande-Bretagne) : BIBRA Information Services Ltd. Accès : www.bibra-information.co.uk/profile-144.html
[BIBRA] British Industrial Biological Research Association. 1997b. Toxicity profile: Pigment Red 112. Surrey (Grande-Bretagne) : BIBRA Information Services Ltd. Accès : www.bibra-information.co.uk/profile-448.html
Biodynamics. 1982. A long-term and toxicity/carcinogenicity study of 1% D&C Orange No.17 in rats. CTFA Color Additive Master File No. 9, Entry 512. [cité dans BG Chemie, 2000a].
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment.Chemosphere 30:741-752.
[BRI] Biopharmaceutical Research Inc. 2012. Testing the metabolism potential of selected aromatic azo and benzidine dyes in vitro in two representative human skin bacterial cultures under aerobic conditions.Rapport inédit préparé par Santé Canada. Vancouver (C.-B.) : Biopharmaceutical Research Inc. Study No. HEA-2011-002.
[BRI] Biopharmaceutical Research Inc. 2013. Determination of the metabolic reduction potential of selected aromatic azo- and benzidine-based substances: in vitro anaerobic fecal bacterial cultures of the human gastrointestinal tract. Rapport inédit préparé pour Santé Canada. Vancouver (C.-B.) : Biopharmaceutical Research Inc. Study Nos. HEA-2012-001 and HEA-2012-002.
Brown, J.P., Dietrich, P.S., Bakner, C.M. 1979 Mutagenicity testing of some drug and cosmetic dye lakes with the Salmonella/mammalian microsome assay. Mutat. Res. 66(2):181-186.
[BS] British Standards. 2002. BS EN 71-7:2002: Safety of toys. Part 7: Finger paints - requirements and test methods. London (Grande-Bretagne) : British Standards Institution. Accès : www.ee-techs.com/test/en71-7.pdf
[BUA] GdCh-Advisory Committee on Existing Chemicals. 1993. Pigment Red 53:1. BUA Report 124 (août 1993). Accès : http://www.hirzel.de/bua-report/
[BUA] GdCh-Advisory Committee on Existing Chemicals. 2001. 2,4,5-Trichloroaniline. BUA Report 227 (juin 2001). Accès : http://www.hirzel.de/bua-report/
[BUA] GdCh-Advisory Committee on Existing Chemicals. 2004. 4-Chloro-2-nitroaniline. BUA Report 235 (février 2002). Accès : http://www.hirzel.de/bua-report/
Cadby, P.A., Troy, W.R., Vey, M.G.H. 2002. Consumer exposure to fragrance ingredients: providing estimates for safety evaluation. Regul. Toxicol. Pharmacol. 36:246-252.
CAM Supply Inc. 2005. Material Safety Data Sheet: Colour Dispersion 13 - Deep Turquoise. Hemet (CA) : CAM Supply Inc. [consulté le 21 janvier 2013]. Accès : www.camtattoo.com/msds/Deep_turquoise.pdf
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870. Accès : http://www.canlii.org/fr/ca/legis/regl/crc-c-870/derniere/crc-c-870.html
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3. Accès : http://publications.gc.ca/gazette/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://publications.gc.ca/gazette/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Gazette du Canada, Partie I, vol. 143, no 40. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-10-03/html/notice-avis-fra.html
Canada. Ministère de l'Environnement. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Gazette du Canada, Partie I, vol. 140, no 9, p. 435-459. Accès : http://publications.gc.ca/gazette/archives/p1/2006/2006-03-04/pdf/g1-14009.pdf
Canada. Ministère de l'Environnement. 2007a. Loi canadienne sur la protection de l'environnement (1999) : Avis de première divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 141, no 5. p. 164-165. Accès : http://publications.gc.ca/gazette/archives/p1/2007/2007-02-03/pdf/g1-14105.pdf
Canada. Ministère de l'Environnement. 2007b. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 3 du Défi. Gazette du Canada, Partie I, vol. 141, no 33. p. 2378. Accès : http://publications.gc.ca/gazette/archives/p1/2007/2007-08-18/pdf/g1-14133.pdf
Canada. Ministère de l'Environnement. 2011. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques. Gazette du Canada, Partie I, vol. 145, no 51, supplément. Accès : www.gazette.gc.ca/rp-pr/p1/2011/2011-12-17/pdf/g1-14551.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2007c. Proposition de cadre réglementaire pour les nanomatériaux en vertu de la Loi canadienne sur la protection de l'environnement (1999). Accès : http://www.ec.gc.ca/subsnouvelles-newsubs/default.asp?lang=Fr&n=FD117B60-1
Carson, S. 1984a. Skin Painting Studies in Mice with 14 Fd&c and D&c Colors: Fd&c Blue no. 1, Red No. 3, and Yellow No. 5, D&C Red No. 7, Red No. 9, Red No. 10, Red No. 19, Red No. 21, Red No. 27, Red No. 31, Red No. 36, Orange No. 5, Orange No. 10, and Orange No. 17. J. Toxico1.-Cut. & Ocular Toxicol. 3(4):357-370.
Carson, S. 1984b. Skin Painting Studies in Mice on 11 Fd&C and D&C Colors: Fd&C Green no. 3, Red No. 2, Red No. 4, Yellow No. 6, and External D&C No. 7, D&C Orange No. 4, Violet No. 2, Red No. 17, Red No. 34, and Yellow No. 7. J. Toxicol.-Cut. & Ocular Toxicol. 3(3):309-331.
[CCME] Conseil canadien des ministres de l'environnement. 2013. Canadian Soil Quality Guidelines for Barium: Protection of Human Health Scientific Criteria Document. ISBN 978-1-896997-97-1 PDF. Accès : http://www.ccme.ca/assets/pdf/pn_1493_basqg_scd_prob_1.0.pdf
[CCRIS] Chemical Carcinogenesis Research Information System [base de données sur Internet]. 2012. Data on: 4-Chloro-6-amino-m-toluenesulfonic acid (88-51-7), p-toliudine-m-sulfonic acid (88-44-8). Bethesda (MD) : National Library of Medicine (États-Unis). [consulté en 2012]. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?CCRIS
Chadwick, M., Hayes, D., Mazrimas, M.J. 1984. Absorption, distribution, metabolism and excretion of Red No. 9. Rapport présenté à la Cosmetic, Toiletry and Fragrance Association par Arthur D. Little. [cité dans Hart et al., 1986].
Chithrani, B.D., Ghazani, A.A., Chan, W.C.W. 2006. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6:662-668.
Chopade, H.M., Matthews, H.B. 1983. Disposition and metabolism of 4-chloro-2-nitroaniline in the male F344 rat. J. Toxicol. Environ. Health. 12(2-3):267-82.
Chopadem H.M., Matthews, H.B. 1984. Disposition and metabolism of p-nitroaniline in the male F-344 rat. Fundam. Appl. Toxicol. 4(3 Pt 1):485-93.
[CHRIP] Chemical Risk Information Platform [base de données sur Internet]. ©2008a. Combined repeated dose and reproductive/developmental toxicity screening test of 4-chloro-2-nitroaniline by oral administration in rats (OECD TG422). [consulté en janvier 2013]. Accès : http://www.safe.nite.go.jp/japan/sougou/data/pdf/meti/sheet/05sheet_89634_422e.pdf
[CHRIP] Chemical Risk Information Platform [base de données sur Internet]. ©2008b. Combined repeated dose and reproductive/developmental toxicity screening test of 4-chloro-2-nitroaniline by oral administration in rats (OECD TG422). [consulté en janvier 2013]. Accès : http://www.safe.nite.go.jp/japan/sougou/data/pdf/meti/sheet/05sheet_89634_422e.pdf
Chung, K.-T., Fulk, G.E., Andrews, A.W. 1981. Mutagenicity testing of some commonly used dyes. Appl. Environ. Microbiol. 42(4):641-648.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1975. IARC Monographs on the Evaluation of Carcinogenic Risks to Man: Some aromatic azo compounds, Volume 8. IARC Working Group on the Evaluation of the Risk of Chemicals to Man which met in Lyon, 26 November-2 December 1974. Accès (résumé) : http://monographs.iarc.fr/ENG/Monographs/vol8/volume8.pdf
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1993. D&C Red No. 9 (CI Pigment Red 53:1). IARC Monogr. Eval. Carcinog. Risks Hum. 57:203-212. Accès : http://monographs.iarc.fr/ENG/Monographs/vol57/mono57-15.pdf
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2010b. Painting, firefighting, and shiftwork. IARC Monogr. Eval. Carcinog. Risks Hum. 98. Accès : http://monographs.iarc.fr/ENG/Monographs/vol98/mono98.pdf
Clariant. 2007. Colorants for the paint industry. [consulté le 3 juin 2007]. Muttenz (Suisse) : Clariant International Ltd. Accès : www.pigments.clariant.com/C12576850036A6E9/98D3F2AC436C5075C125786B0026B90B/$FILE/DP8523ED_Feb2011.pdf
Clariant. 2011. Creative colors: solutions to color up your working sphere. Muttenz (Suisse) : Clariant International Ltd. Accès : www.pigments.clariant.com/C12576850036A6E9/1DDFD805A4223FA5C12578DC0027084D/$FILE/DP5029E%207.11.pdf
Clariant. 2013. Colorants for coatings are our playground. [consulté le 10 mars 2013]. Muttenz (Suisse) : Clariant International Ltd. Accès : www.clariant.com/C125720D002B963C/news/BE00D1FA07C995A5C125742700437CFC/$File/DD1009E_0308_FL_ColorantsforCoatingsareourPlayground.pdf
Combes, R.D., Haveland-Smith, R.B. 1982. A review of the genotoxicity of food, drug and cosmetic colours and other azo, triphenylmethane and xanthene dyes. Mutat. Res. 98(2):101-248.
Commission européenne. ©2000a. IUCLID Dataset, barium bis [2-chloro-5-[(2-hydroxy-1-naphthyl)azo]toluene-4-sulphonate], CAS No. 5160-02-1 [en ligne]. Year 2000 CD-ROM edition. [provenance inconnue] : Commission européenne, Agence européenne des produits chimiques. [créé le 18 février 2000; consulté le 31 janvier 2013]. Accès : http://esis.jrc.ec.europa.eu/index.php?PGM=dat
Commission européenne. ©2000b. IUCLID Dataset, 2-chloro-4-nitroaniline, CAS No. 121-87-9 [en ligne]. Édition 2000 en format CD-ROM. [s.l.] : Agence européenne des produits chimiques, Commission européenne. [créé le 18 février 2000; consulté le 18 août 2014]. Accès : http://esis.jrc.ec.europa.eu/index.php? PGM=dat
Commission européenne. ©2000c. IUCLID Dataset, 2,4-dinitroaniline, CAS No. 97-02-9 [en ligne]. Édition 2000 en format CD-ROM. [s.l.] : Agence européenne des produits chimiques, Commission européenne. [créé le 19 février 2000; consulté le 18 août 2014]. Accès : http://esis.jrc.ec.europa.eu/index.php? PGM=dat
Commission européenne. 2003. Technical guidance document on risk assessment in support of Commission Directive 93/67/EEC on risk assessment for new notified substances; Commission Regulation (EC) No 1488/94 on risk assessment for existing substances; Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market. Part II. Environmental risk assessment. Commission européenne. Centre commun de recherche. 328 p. Accès : http://ihcp.jrc.ec.europa.eu/our_activities/public-health/risk_assessment_of_Biocides/doc/tgd/tgdpart2_2ed.pdf
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais pour la santé publique et l'environnement). Accès : www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
[CPMA] Color Pigments Manufacturers Association, Inc. 2003. Comments of the Color Pigments Manufacturers Association, Inc. on the draft guidance manual for the categorization of organic and inorganic substances on Canada's Domestic Substances List ('DSL') and Environment Canada's computer generated estimates and empirical data on approximately 12,000 discrete organic chemicals on the DSL. Gatineau (Qc) : Environnement Canada, Division des substances existantes. Disponible sur demande.
[CPMA] Color Pigments Manufacturers Association, Inc. 2006a. High Production Volume (HPV) Challenge Program: Test plan for C.I. Pigment Red 49 (barium) (CAS No.:1103-38-4). Alexandria (VA) : Color Pigments Manufacturers Association, Inc, Monoazo and Related Pigments Committee. Accès : www.epa.gov/hpv/pubs/summaries/cired49/c16299.pdf
[CPMA] Color Pigments Manufacturers Association, Inc. 2006b. High Production Volume (HPV) Challenge Program: Test plan for C.I. Pigment Red 48 (calcium) (CAS No.: 7023612) and C.I. Pigment Red 48 (barium) (CAS No.: 758413) and C.I. Pigment Red 52 (calcium) (CAS No.: 17852992).Alexandria (VA) : Color Pigments Manufacturers Association, Inc, Monoazo and Related Pigments Committee. Accès : www.epa.gov/hpv/pubs/summaries/cird4852/c16302tp.pdf
Crechem Technologies. 2003. Release scenarios for Canadian coating facilities.Préparé pour Environnement Canada, Gatineau (Qc). Ottawa (Ont.) : Crechem Technologies Inc.
Crechem Technologies. 2005. Fate of wastewater sludge. Préparé pour la Division des substances existantes, Environnement Canada, Gatineau (Qc). Ottawa (Ont.) : Crechem Technologies Inc.
[CSC] Comité scientifique de cosmétologie. 1988. CI 12370. Report by the Scientific Committee on Cosmetology Concerning Certain Colouring Agents (Opinion expressed on 1 July, 1986). Reports of the Scientific Committee on Cosmetology (seventh series). Commission des Communautés européennes. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/scc_o_7.pdf
[CSC] Comité scientifique de cosmétologie. 1993. CI 12075. Reports of the Scientific Committee on Cosmetology Concerning the Use of Certain Colourants in Cosmetic Products (5th meeting of SCC - October 10-11, 1990).inférieur(e) à/ In: Opinion of the Scientific Committee on Cosmetology (11/86-10/90). 8th Series Part 2. Commission européenne. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/scc_o_8b.pdf
[CSC] Comité scientifique de cosmétologie. 2000. CI 15585: 1-(4-chloro-o-sulpho-5-tolylazo)-2-naphthol. Opinions adopted during the 49th plenary meeting of 10 February 1992. In: Reports of the Scientific Committee on Cosmetology (Ninth Series). Luxembourg : Commission européenne. p. 137-141. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/scc_o_9.pdf
[CSPC] Comité scientifique des produits de consommation. 2006. The SCCP's notes of guidance for the testing of cosmetic ingredients and their safety evaluation.6e révision. Commission européenne, Direction générale de la santé et de la protection des consommateurs. Accès: http://ec.europa.eu/health/ph_risk/committees/04_sccp/docs/sccp_o_03j.pdf
[CSPC] Comité scientifique des produits de consommation. 2011. Opinion on Acid Orange 7.COLIPA n° C15. Comité scientifique des produits de consommation. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_057.pdf
[CSPC] Comité scientifique des produits de consommation. 2012. Opinion on Pigment Red 57.COLIPA n° C181. Comité scientifique des produits de consommation. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_112.pdf
[CSRSE] Comité scientifique des risques sanitaires et environnementaux. 2012. Assessment of the tolerable daily intake of barium. Bruxelles (Belgique) : Commission européenne. 13 p. Accès : http://ec.europa.eu/health/scientific_committees/environmental_risks/docs/scher_o_161.pdf
[CSSC] Comité scientifique de la sécurité des consommateurs. 2012. Opinion on Pigment Red 57. Accès : http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_112.pdf
[CTFA] Cosmetic, Toiletry & Fragrance Association. 1982. Submission by the CTFA: 30-Month Chronic Toxicology and Potential Carcinogenicity Study in Rats with in Utero and Lifetime Exposure to D&C Red No.9 in the Diet. Rapport final de Litton Bionetics, juillet 1982. [cité dans Hart et al., 1986; CSC, 2000].
[CTFA] Cosmetic, Toiletry & Fragrance Association. 1983a. Final Review and Analysis of Scientific Studies and Risk Assessments Supporting the Safety of D&C Red No.9. Washington (DC) :Cosmetic, Toiletry & Fragrance Association. [cité dans LSRO-FASEB, 1984; BIBRA, 1989].
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983b. Summary for the Results of Surveys of the amount and Frequency of use of cosmetic products by Women. Rapport préparé par Pitkin, B., Rodericks, J.V., Turnbull, D. Environ Corporation 1850 K Street, N.W, Washington (DC).
Cui, Y., Spann, A.P., Couch, L.H., Gopee, N.V., Evans, F.E., Churchwell, M.I., Williams, L.D., Doerge, D.R., Howard, P.C. 2004. Photodecomposition of Pigment Yellow 74, a pigment used in tattoo inks. Photochem. Photobiol. 80(2):175-184.
Davis, K.J., Fitzhugh, O.G. 1962. Pathologic changes noted in rats fed D&C Red No. 9 for two years. Toxicol. Appl. Pharmacol. 4(2):200-205.
Davis, K.J., Fitzhugh, O.G. 1963. Pathologic changes noted in rats fed D&C Red No. 10 (monosodium salt of 2-(2-hydroxy-1-naphthylazo)-1-naphthalenesulfonic acid) for two years. Toxicol. Appl. Pharmacol. 5:728-734.
De Cuyper, C., D'hollander, D. 2010. Materials used in body art. In: de Cuyper, C., Pérez-Cotapos, M.L. (éd.) Dermatologic complications with body art: tattoos, piercings and permanent make-up. Berlin (Allemagne) : Springer-Verlag. p. 13-28. Accès : www.springer.com/medicine/dermatology/book/978-3-642-03291-2
Della Porta, G., Dragani, T.A. 1982. Non-carcinogenicity in mice of a sulfonic acid derivative of 2-naphthylamine. Carcinogenesis. 3(6):647-9.
Delta Creative. 2008. Material Safety Data Sheet (MSDS): Finger Paint. City of Industry (CA) : Delta Creative, Inc. [consulté le 6 mai 2013]. Accès : www.deltacrafts.com/Uploads/media/documents/MSDS%20OF%20Finger%20paint.pdf
Derivan. 2012. Material Safety Data Sheet (MSDS): Derivan Face and Body Paint. Rhodes (Australie) : Derivan Pty. Ltd. [consulté le 6 mai 2013]. Accès : www.derivan.com.au/assets/msds/Derivan-Face-and-Body-Paint-MSDS.pdf
DeVito, S.C. 2000. Absorption through cellular membranes. In: Boethling, R.S., Mackay, D. (éd.) Handbook of property estimation methods for chemicals: environmental and health sciences. Boca Raton (FL) : CRC Press.
Dillon, D., Combes, R., Zeiger, E. 1994. Activation by caecal reduction of the azo dye D and C Red No. 9 to a bacterial mutagen. Mutagenesis9(4):295-299.
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res.16(6):531-554.
Dimitrov, S., Dimitrova, N., Walker, J., Veith, G., Mekenyan, O. 2002. Predicting bioconcentration potential of highly hydrophobic chemicals. Effect of molecular size. Pure Appl. Chem. 74(10):1823-1830.
Doll, P. Shi, F., Kelly, S., Wnek, W. 1998. The problem of catalytic fading with ink-jet inks. NIP14: International Conference on Digital Printing Technologies. Toronto (Ont.), Canada; octobre 1998; p. 118-121. Accès : http://www.americaninkjet.com/images/Problem_of_Catalytic_Fading.pdf
[EA Japan] Environment Agency du Japon. 1992. Investigation on the ecotoxicological effects of OECD high production volume chemicals. Tokyo (Japon) : Environment Agency, Environmental Health Department, Office of Health Studies. [cité dans OCDE, 2009b].
[ECHA] Agence européenne des produits chimiques. 2008. Guidance on information requirements and chemical safety assessment. Chapter R.11: PBT assessment. [Guidance for the implementation of REACH]. Helsinki (Finlande) : Agence européenne des produits chimiques. 97 p.
[ECHA] Agence européenne des produits chimiques. 2010. Guidance on information requirements and chemical safety assessment. Chapter R.16: Environmental exposure estimation, version 2. Helsinki (Finlande) : Agence européenne des produits chimiques.
[ECHA] Agence européenne des produits chimiques. 2012. Registered substances database. CAS RN: 1103-38-4, 2425-85-6, 2512-29-0, 2786-76-7, 2814-77-9, 3468-63-1, 5160-02-1, 6372-81-2, 6407-74-5, 6410-09-9, 6410-09-9, 6410-13-5, 6410-41-9, 6417-83-0, 6486-23-3, 6535-46-2, 7023-61-2, 12236-62-3, 12236-64-5, 12238-31-2, 13515-40-7, 13824-00-5, 16403-84-2, 17852-99-2, 17947-32-9, 36968-27-1, 43035-18-3, 49744-28-7, 59487-23-9, 71832-83-2, 74336-60-0, 80675-49-6, 83249-60-9, 85005-63-6 and 94199-57-2. Helsinki (Finlande) : Agence européenne des produits chimiques. [mis à jour le 27 novembre 2012; cité janvier 2012-mai 2013]. Accès : http://echa.europa.eu/web/guest/information-on-chemicals/registered-substances
[EFSA] Autorité européenne de sécurité des aliments. 2005. Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) to review the toxicology of a number of dyes illegally present in food in the EU. EFSA Journal 263:1-71. Accès : http://www.efsa.europa.eu/en/efsajournal/pub/263.htm
[EFSA] Autorité européenne de sécurité des aliments, groupe sur les additifs alimentaires et les sources de nutriments ajoutés aux aliments (ANS). 2010. Scientific Opinion on the re-evaluation of Litholrubine BK (E 180) as a food additive. EFSA J. 8(5):1586. 26 p. Accès : www.efsa.europa.eu/en/efsajournal/doc/1586.pdf
EI Dareer, S.M., Tillery, K.F., Hill, D.L. 1984. Investigations on the disposition of oral doses of some water-insoluble pigments. Bull. Envir. Contam. Toxicol. 32:171-174.
Engel, E., Santarelli, F., Vasold, R., Maisch, T., Ulrich, H., Prantl, L., Konig, B., Landthaler, M., Baumler, W. 2008. Modern tattoos cause high concentrations of hazardous pigments in skin. Contact Dermatitis 58:228-233.
Engel, E., Spannberger, A., Vasold, R., König, B., Landthaler, M., Bäumler, W. 2007. Photochemical cleavage of a tattoo pigment by UVB radiation or natural sunlight. J. Dtsch. Dermatol. Ges.5(7):583-589.
Engel, E., Vasold, R., Santarelli, F., Maisch, T., Gopee, N.V., Howard, P.C., Landthaler, M., Baumler, W. 2010. Tattooing of skin results in transportation and light-induced decomposition of tattoo pigments - a first quantification in vivo using a mouse model.Exp. Dermatol. 19:54-60.
Environnement Canada. 2000. Environmental categorization for persistence, bioaccumulation and inherent toxicity of substances on the Domestic Substances List using QSARs. Rapport final. Gatineau (Qc) : Environnement Canada, Division de l'évaluation des produits chimiques.
Environnement Canada. 2006. Données pour certaines substances recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada. 2007b. Données sur les substances du lot 1 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le Défi, publié le 9 décembre 2006 dans l'Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Données préparées par Environnement Canada, Santé Canada; Programme des substances existantes.
Environnement Canada. 2008. Données sur les substances du lot 3 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 3 du Défi. Données préparées par Environnement Canada, Santé Canada; Programme des substances existantes.
Environnement Canada. 2009a. Generation and management of effluent treatment and deinking residues from the pulp and paper industry. Préparé pour la Direction générale de l'intendance environnementale, Environnement Canada, Gatineau (Qc).
Environnement Canada. 2009b. A site visit to a tanktruck cleaning facility on October 15, 2009. [document interne]. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2010. Site visits to pigment manufacturing facilities. [Présentation pour la Division des évaluations écologiques, Environnement Canada, Gatineau (Qc)].
Environnement Canada. 2012a. Données sur certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques. Données compilées par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2012b. An analysis of exposure data based on USEPA Premanufacture Notices. [document interne]. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2013a. Report on a site visit to a latex paint formulation facility, January 15, 2013. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2013b. Report on a site visit to a powder coatings manufacture facility, February 6, 2013. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2013c. Report on a site visit to a water-based paint formulation facility in Montreal, Quebec, January 15, 2013. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2013d. Internal database of Canadian surface water sediments.Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada, Santé Canada. 2007. Substances chimiques : Catégorisation [en ligne]. Ottawa (Ont.) : Gouvernement du Canada. [mis à jour le 20 avril 2007; consulté le 10 juin 2014]. Accès : http://www.chemicalsubstanceschimiques.gc.ca/approach-approche/categor-fra.php
Environnement Canada, Santé Canada. 2009a. Évaluation préalable pour le Défi concernant le 1-[(2-Nitrophényl)azo]-2-naphtol (Pigment Orange 2). Numéro de registre du Chemical Abstracts Service 6410-09-9 [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=En&xml=84D0C842-1635-E36E-9E56-56338A17EDDC
Environnement Canada, Santé Canada. 2009b. Évaluation préalable pour le Défi concernant le 1-(4-méthyl-2-nitrophénylazo)-2-naphtol (Pigment Red 3). Numéro de registre du Chemical Abstracts Service 2425-85-6 [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=En&xml=3D4876AF-C407-BF92-EE26-8000E99F867D
Environnement Canada, Santé Canada. 2009c. Évaluation préalable pour le Défi concernant le N-(5-Chloro-2,4-diméthoxyphényl)-4-[[5-[(diéthylamino)sulfonyl]-2-méthoxyphényl]azo]-3-hydroxynaphtalène-2-carboxamide (Pigment Red 5). Numéro de registre du Chemical Abstracts Service 6410-41-9 [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=En&xml=FE00F8D1-4016-80F1-AF8D-96D3B4312EDC
Environnement Canada, Santé Canada. 2010. A site visit to a cosmetic manufacture facility, June 1, 2010. [document interne].
Environnement Canada, Santé Canada. 2011. Rapport de suivi sur une substance inscrite à la Aniline. Numéro de registre du Chemical Abstracts Service62-53-3. Santé Canada, décembre 2011. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=Fr&n=CCDA73CC-1
Environnement Canada, Santé Canada. 2012. Consultation technique multilatérale : Création proposée de sous-groupes de substances azoïques aromatiques et à base de benzidine. Rapport sommaire. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=Fr&n=01656691-1
Environnement Canada, Santé Canada. 2013a. Supporting document for the draft screening assessment. Aromatic Azo and Benzidine-Based Substance Grouping. Certain Monoazo Pigments. Disponible sur demande.
Environnement Canada, Santé Canada. 2013b. Initiative des groupes de substances du Plan de gestion des produits chimiques. Contexte et Établissement de sous-groupes des substances aromatiques azoïques et à base de benzidine. Mai 2013. Environnement Canada, Santé Canada. Disponible sur demande.
Environnement Canada, Santé Canada. 2013c. Évaluation préalable pour le Défi concernant le noir de carbone. Numéro de registre du Chemical Abstracts Service 1333-86-4. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/default.asp?lang=Fr&n=2cf34283-1
Environnement Canada, Santé Canada. 2014a. Ébauche d’évaluation préalable : Groupe de substances azoïques aromatiques et à base de benzidine. Certains colorants basiques azoïques dispersés. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Environnement Canada, Santé Canada. 2014b. Ébauche d’évaluation préalable : Groupe des substances azoïques aromatiques et à base de benzidine. Certaines amines aromatiques. Ottawa (Ont.) : Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/C58F84D0-9924-43C2-A967-E4FC58242C79/DSAR_Groupings_Azo-Pkg5-Aromatic%20Amines_FR.pdf
Environnement Canada, Santé Canada. 2014c. Évaluation préalable : Groupe des substances azoïques aromatiques et à base de benzidine Certains pigments jaunes diarylides. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Environnement Canada. 2014d. Examen préalable rapide des substances de la phase un de la mise à jour de l'inventaire de la Liste intérieure. Mars 2014. Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/7340E1B7-1809-4564-8C49-F05875D511CB/FSAR_RSII_FR.pdf
[EPA du Danemark] Environmental Protection Agency du Danemark. 2012. Chemical substances in tattoo ink. (Survey of Chemical Substances in Consumer Products, No. 116).Copenhague (Danemark) : Ministère de l'Environnement du Danemark, Environmental Protection Agency. Accès : www2.mst.dk/Udgiv/publications/2012/03/978-87-92779-87-8.pdf
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. 1988. Executive Summary on the ETAD Project T 2015 Toxicological Testing of Major Colorants, With Attachments and Cover Letter Dated June 3, 1988; 04/15/88; EPA Doc No. FYI-AX-0688-0621; Fiche No. OTS0000621. Accès : http://www.ntis.gov/search/product.aspx?abbr=OTS0000621
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigment Manufacturers. 2008. The restrictions on the marketing and use of azo colourants according to the European legislation following the Directive 2002/61/EC (19th Amendment of Council Directive 76/769/EEC). (ETAD Information Notice No. 6). Accès : http://www.etad.com/documents/Downloads/publications/notice_no_6_rev_2008.pdf.
Face Paints Direct. 2013. Ingredients in Common Face Paints. [en ligne] 2013. Face Paints Direct. [consulté le 12 février 2013]. Accès : http://www.facepaintsdirect.co.uk/ingredients.html
[FDSC] Food and Drug Safety Center. 1993. D&C Red No.7. Food and Drug Safety Center, Hatano Research Institute, 729-5 Ochiai, Hadano-shi, Kanagawa 257, Japon. Accès : http://dra4.nihs.go.jp/mhlw_data/home/pdf/PDF5281-04-9d.pdf
FisherSolve™ Platform [base de données sur Internet]. 2013. South Norwalk (CT) : Fisher International. [consulté en novembre 2012]. Accès : www.fisheri.com/products/index.php?sid=48
Foureman, P., Mason, J.M., Valencia, R., Zimmering, S. 1994. Chemical mutagenesis testing in Drosophila. X. Results of 70 coded chemicals tested for the National Toxicology Program. Environ. Mol. Mutagen. 23:208-227.
Franz, T.J. 1983a. Percutaneous absorption of D&C Orange No. 17 through human skin in vitro. Université de Washington, 28 mars 1983. Soumis par la Cosmetic, Toiletry, and Fragrance Association [cité dans Hart et al., 1986].
Franz, T.J. 1983b. Percutaneous absorption of D&C Red No. 9 through human skin in vitro.Université de Washington, 8 août 1983. Soumis par la Cosmetic, Toiletry, and Fragrance Association. [cité dans Hart et al., 1986].
Gershbein, L.L. 1982. Action of dyes and indicators on rat-liver regeneration. Food Chem. Toxicol. 20:1-8.
Gobas, F. 2007. Development and review of a generic water-sediment modeling framework for organic chemicals. Rapport préparé pour Environnement Canada. Burnaby (C.-B.) : Université Simon Fraser, Faculté d'environnement. 26 mars 2007.
Gobas, F. 2010. Comments on approach to sediment exposure approach. Rapport préparé pour Environnement Canada. Burnaby (C.-B.) : Université Simon Fraser, Faculté d'environnement. 25 mars 2010.
Goldin, B.R., Gorbach, S.L. 1984. Alterations of the intestinal microflora by diet, oral antibiotics, and Lactobacillus: decreased production of free amines from aromatic nitro compounds, azo dyes, and glucuronides. JNCI. 73(3):689-695.
Golka, K., Kopps, S., Myslak, Z.W. 2004. Carcinogenicity of azo colorants: influence of solubility and bioavailability. Toxicol. Lett.151(1):203-210.
Goodman, D.G., Ward, J.M., Reichardt, W.D. 1984. Splenic fibrosis and sarcomas in F344 rats fed diets containing aniline hydrochloride, p-chloroaniline, azobenzene, o-toluidine hydrochloride, 4,4′-sulfonyldianiline, or D & C Red No. 9. J. Natl Cancer Inst. 73(1):265-273.
Gopee, N.V., Yanyan, C., Olson, G., Warbritton, A.R., Miller, B.J., Couch, L.H., Wamer, W.G., Howard, P.C. 2005. Response of mouse skin to tattooing: use of SKH-1 mice as a surrogate model for human tattooing. Toxicol. Appl. Pharmacol. 209:145-158.
Graham, S.L., Davis, K.J. 1968. Subacute toxicity of toluidine red. Toxicol. Appl. Pharmacol. 13(3):388-391.
Green, E.J. 1990. The Sigma-Aldrich handbook of stains, dyes and indicators.Milwaukee (WI) : Aldrich Chemical Co. p. 716. [cité dans CIRC, 1993].
Gregory P. 1986. Azo Dyes: Structure – Carcinogenicity Relationships. Dyes and Pigments 7:45-56.
Hansen, P.L., Tønning, K., Malmgren-Hansen, B., Jacobsen, E. 2008. Survey and health assessment of chemical subtances in hobby products for children. (Survey of Chemical Substances in Consumer Products, No. 93). Copenhague (Danemark) : Ministère de l'Environnement du Danemark, Environmental Protection Agency. [consulté le 19 février 2013]. Accès : www2.mst.dk/udgiv/publications/2008/978-87-7052-763-7/pdf/978-87-7052-764-4.pdf
Hansen, W.H., Fitzhugh, O.G., Williams, M.W. 1958. Subacute Oral Toxicity of Nine D&C Coal-Tar Colors. J. Pharmacol. Exp. Therap. 122:29A.
Hansen, W.H., Wilson, D.C., Fitzhugh, O.G. 1960. Subacute oral toxicity of ten D&C coal-tar colors. Fed. Proc. 19:390.
Hard, G.C., Khan, K.N. 2004. A Contemporary Overview of Chronic Progressive Nephropathy in the Laboratory Rat, and Its Significance for Human Risk Assessment. Toxicologic Pathology 32:171-180.
Hart, R.W., Freni, S.C., Gaylor, D.W., Gillette, J.R., Lowry, L.K., Ward, J.M., Weisburger, E.K., LePore, P., Turtur, A. 1986. Final report of the Color Additive Scientific Review Panel. FDA Color Report. Risk Anal.6(2):117-154.
Haseman, J.K., Johnson, F.M. 1996. Analysis of National Toxicology Program rodent bioassay data for anticarcinogenic effects. Mutat. Res.350(1):131-141.
Hauri, U. 2006. [Finger paint/preservatives, primary aromatic amines, bitter substances, dyes, pH and declaration. Joint campaign of Basel-Stadt (specialist laboratory) and Aargau. Report No. 67]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2006&subkat=2&detail=Y0E9V99T
Hauri, U. 2008. [Finger paint/preservatives, primary aromatic amines, bitter substances, colorants, phthalates, nitrosamines, pH and declaration. Joint campaign of Basel-Stadt (specialist laboratory) and Aargau.Report No. 22]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2008&subkat=2&detail=5F38NZ9T
Hauri, U. 2009a. [Finger paint/preservatives, primary aromatic amines, bitter substances, colorants, phthalates, nitrosamines and declaration. Joint campaign of Basel-Stadt (specialist laboratory) and Aargau. Report No. 49]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2009&subkat=2&detail=7ZW62Z7N
Hauri, U. 2009b. [Game kneading/preservatives, primary aromatic amines, bitter substances, colorants, phthalates, nitrosamines and declaration. Report No. 44]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2009&subkat=2&detail=7WVJ92SK
Hauri, U. 2010a. [Finger paint/preservatives, bitter substances, dyes, nitrosamines. Report No. 35]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2010&subkat=2&detail=46K7Z36C
Hauri, U. 2010b. [Permanent make up/preservatives, pigments, aromatic amines, N-nitrosamines. Joint campaign by the cantons of Aargau, Basel-Land and Basel-Stadt (specialist laboratory). Report No. 7]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2010&subkat=2&detail=GQ8R7983
Hauri, U. 2010c. [Chinese tattoo inks/preservatives, pigments, N-nitrosamines. Report No. 42]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/kl/infos/berichte.cfm?sprache=de&site=21&year=2010&subkat=2&detail=2D9V242R
Hauri, U. 2011a. [Finger paint/preservatives, bitter substances, dyes, nitrosamines. Joint campaign by the cantons of Basel City (specialist laboratory) and Aargau]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/files/berichte/JB_Fingerfarben_2011_korr.pdf
Hauri, U. 2011b. [Inks for tattoos and PMU (permanent make-up)/Organic pigments, preservatives and impurities such as primary aromatic amines and nitrosamines. Joint campaign by the Swiss Association of Cantonal Chemists (Verband der Kantonschemiker der Schweiz - VKCS) with financial support from the FOPH (SwissFederal Office of Public Health), laboratory in charge: Basel City]. Basel (Suisse) : Kantonales Laboratorium. [article en allemand]. Accès : www.kantonslabor-bs.ch/files/berichte/JB_Tattoo_PMU_2011.pdf
Hauri, U. 2013. Pigments, Preservatives and Impurities in Tattoo Inks. Présentation à la première International Conference on Tattoo Safety.Symposium du BfR tenu à Berlin, les 6 et 7 juin 2013. Accès: http://www.bfr.bund.de/cm/343/pigments-preservatives-and-impurities-in-tattoo-inks.pdf
Hazleton Laboratories. 1964a. Final Report: two-year feeding study - dogs. CTFA Color Additive Master File No.9, Entry 61. [cité dans BG Chemie, 2000a].
Hazleton Laboratories. 1964b. Final Report: two-year feeding study - dogs. CTFA Color Additive Master File No.9, Entry 61. [cité dans BG Chemie, 2000a].
Hébert, M., Chaker, B. 2011. Bilan 2010 du recyclage des matières résiduelles fertilisantes. Québec (Qc) : Ministère du Développement durable, de l'Environnement et des Parcs, Direction des matières résiduelles et des lieux contaminés. 24 p.
Herbst, W., Hunger, K. 2004. Industrial organic pigments. 3e éd. Weinheim (Allemagne) : Wiley-VCH, Verlag GmbH & Co. KGaA. 660 p.
Hoechst, A.G. 1973. Pharma Forschung Toxikologie Hansaorange CM 70429 - 32-Tage-Fütterungsversuch. Rapport inédit no 0128/73. [cité dans BG Chemie, 2000a].
Hoechst, A.G. 1979. Pigment-Yellow Nr.1. Hansa-Gelb G. 30-Tag-oral-Test an SPF-Wistar-Ratten. ETAD Projeckt T 2005 / T2014. Bericht Nr. 710/79. Données inédites soumises par ETAD à ITC, 14 avril 1982. [cité dans NTIS/OTS0001185. Soumission initiale : Letter from Etad to USEPA Regarding Aminoanthraquinones with Attachments, dated 02/07/86.] Accès : http://www.ntis.gov/search/product.aspx?ABBR=OTS0001185
Hoecht, A.G. 1990. Evaluation of Hansa-Rot GG in the in vivo cytogenetic test in bone marrow cells of the Chinese hamster - chromosome analysis.Hoecht, A.G., Pharma Research Toxicology and Pathology. Rapport inédit no 90.0741. [cité dans BG Chemie, 2000a].
Høgsberg, T., Loeschner, K., Löf, D., Serup, J. 2011. Tattoo inks in general usage contain nanoparticles. Br. J. Dermatol. 165:1210-1218.
Household Products Database [base de données sur Internet]. 1993-. Bethesda (MD) : National Library of Medicine (États-Unis). [consulté le 12 décembre 2012]. Accès : www.householdproducts.nlm.nih.gov/
Huang, Q., Wang, L., Han, S. 1995. The genotoxicity of substituted nitrobenzenes and the quantitative structure-activity relationship studies.Chemosphere 30(5):915-23.
[ILS] Integrated Laboratory Systems, Inc. 2011. Assessment of the mutagenicity of twenty aromatic azo substances in the Ames mutagenicity assay using the Prival modification with and without FMN. Rapport inédit. Research Triangle Park (NC). ILS Project Study No. C191-006.
[IRDC] International Research and Development Corporation. 1981. D&C Red No. 6. Long-term feeding study in rats exposed in utero. Rapport inédit no 355-014 de l'International Research and Development Corporation. [cité (1981b) dans USFDA, 1982].
Ivett, J.L., Brown, B.M., Rodgers, C., Anderson, B.E., Resnick, M.A., Zeiger, E. 1989. Chromosomal aberrations and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. IV. Results with 15 chemicals. Environ. Mol. Mutagen. 14:165-187.
[JECDB] Japanese Existing Chemicals Database. 2013a. 2-Amino-1-naphthalenesulfonic acid (81-16-3 ). Accès : http://dra4.nihs.go.jp/mhlw_data/home/file/file81-16-3.html
[JECDB] Japanese Existing Chemicals Database. 2013b. 2-Amino-5-methylbenzenesulfonic acid (88-44-8). Accès : http://dra4.nihs.go.jp/mhlw_data/home/file/file88-44-8.html
[JECDB] Japanese Existing Chemicals Database. 2013c. C.I. Pigment Red 22 (6448-95-9 ).Accès : http://dra4.nihs.go.jp/mhlw_data/home/file/file6448-95-9.html
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires. 1986. Lithol rubine BK (WHO Food Additive Series 21). Accès : http://www.inchem.org/documents/jecfa/jecmono/v21je09.htm
Jemec, G.B. 2010. Comment on: Tattooing of skin results in transportation and light-induced decomposition of tattoo pigments. Exp Dermatol.19(1):61-2.
Johnson, G.E., Quick, E.L., Parry, E.M., Parry, J.M. 2010. Metabolic influences for mutation induction curves after exposure to Sudan-1 and Para Red.Mutagenesis 25:327-333.
Jung, R., Steinle, D., Anliker, R. 1992. A compilation of genotoxicity and carcinogenicity data on aromatic aminosulphonic acids. Food Chem. Toxicol. 30(7):635-660.
Karickhoff, S. 1981. Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils.Chemosphere 10:833-846.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife, and humans.Environ. Toxicol. Chem. 23:2324-2336.
Kornbrust, D., Barfnecht, T. 1985. Testing of 24 food, drug, cosmetic, and fabric dyes in the in vitro and the in vivo/in vitro rat hepatocyte primary culture/DNA repair assays. Environ. Mutagen. 7:101-120.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'évaluation]. 2010. Version 1.68. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 16 avril 2013]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Kumagai, Y., Shinkai, Y., Miura, T., Cho, A.K. 2012. The chemical biology of naphthoquinones and its environmental implications. Annu. Rev. Pharmacol. Toxicol. 52:221-47.
Kupradinun, P., Rienkijakarn, M., Tanyakaset, M., Tepsuwan, A., Kusamran, W.R. 2002. Carcinogenicity testing of the cosmetic dye: D&C Red No. 36. Asian Pac. J. Cancer Prev. 3(1):55-60.
Kuramoto, N. 1996. The photodegradation of synthetic colorants. In: Physico-Chemical Principles of Color Chemistry. (Peters, A.T., Freeman, H.S., éd.). Advances in Color Chemistry Series. Volume 4. Springer Netherlands, p. 196-253.
Lea, P.J., Pawlowski, A. 1987. Human tattoo: electronic microscopic assessment of epidermis, epidermal-dermal junction, and dermis. Int. J. Dermatol. 26(7):453-458.
Leist, K.H. 1982. Subacute toxicity studies of selected organic colorants.Ecotoxicology and Environmental Safety 6:457-463.
Lewis, P.A. 1995. Colored organic pigments. In: Koleske, J.V. (éd.) Paint and coating testing manual: fourteenth edition of the Gardner-Sward handbook. West Conshohocken (PA) : ASTM International.
Lewis, R.J. Sr. 2007. Hawley's condensed chemical dictionary. 15e éd. Wiley-Interscience; John Wiley & Sons, Inc.
Lilja, K., Kaj, L., Remberger, M., Brorström-Lundén, E., Leknes, H., Schlabach, M. 2008. Results from the Swedish National Screening Programme 2007: Subreport 3: pigments. Stockholm (Suède) : Swedish Environmental Research Institute (IVL) (financé par l'Environmental Protection Agency de la Suède). IVL Report No.: B1811. Accès : www.ivl.se
Limbach, L.K., Li, Y., Grass, R.N., Brunner, T.J., Hintermann, M.A., Muller, M., Gunther, D., Stark, W.J. 2005. Oxide nanoparticle uptake in human lung fibroblasts: effects of particle size, agglomeration, and diffusion at low concentrations. Environ. Sci. Technol.39:9370-9376.
Linak, E., Kälin, T., Inoguchi, Y. 2011. CEH marketing research report: organic color pigments [en ligne]. SRI Consulting (SRIC). 104 p. Report No.: 575.7000. [consulté en octobre 2013]. Accès : http://chemical.ihs.com/CEH/Public/Reports/575.7000
Lincke, G. 2003. Molecular stacks as a common characteristic in the crystal lattice of organic pigment dyes. A contribution to the "soluble-insoluble" dichotomy of dyes and pigments from the technological point of view.Dyes Pigments 59:1-24.
Lockwood-Post Directory 2011, Global Edition. Paperloop, Incorporated, 2011.
Longstaff, E., McGregor, D.B., Harris, W.J., Robertson, J.A., Poole, A. 1984. A comparison of the predictive values of the Salmonella/microsome mutation and BHK21 cell transformation assays in relation to dyestuffs and similar materials. Dyes Pigments 5:65-82.
LookChem. 2008. Hot product list [en ligne]. Zhejiang (Chine) : LookChem. [consulté le 14 novembre 2012]. Accès : www.lookchem.com/
Loretz, L., Api, A.M., Barraj, L., Burdick, J., Davis, D.A., Dressler, W., Gilberti, E., Jarrett, G., Mann, S., Pan, Y.H.L., et al. 2006. Exposure data for personal care products: hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant.Food Chem. Toxicol. 44:2008-2018.
Loretz, L.G., Api, A.M., Babcock, L., Barraj, L.M., Burdick, J., Cater, K.C., Jarrett, G., Mann, S., Pan, Y.H.L., Re, T.A., et al. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem. Toxicol. 46:1516-1524.
Loretz, L.J., Api, A.M., Barraj, L.M., Burdick, J., Dressler, W.E., Gettings, S.D., Han Hsu, H., Pan, Y.H.L., Re, T.A., Renskers, K.J., et al. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem. Toxicol. 43:279-291.
[LSRO-FASEB] Life Sciences Research Office - Federation of American Societies for Experimental Biology. 1984. Interim scientific report on evaluation of the evidence of carcinogenicity and genotoxicity of drugs and cosmetic ingredients. Bethesda (MD) : Federation of American Societies for Experimental Biology. NTIS Report No.: PB85-122513. Accès : www.ntis.gov/search/product.aspx?ABBR=PB85122513
Lynch, I., Dawson, K.A., Linse, S. 2006. Detecting cryptic epitopes created by nanoparticles. Sci. STKE 2006(327):pe14.
Mackay, D., Arnot, J.A., Webster, E., Reid, L. 2009. The evolution and future of environmental fugacity models. In: Devillers, J. (éd.) Ecotoxicology modeling. Emerging topics in ecotoxicology: principles, approaches and perspectives 2. Springer Science+Business Media, LLC. p. 355-375.
Mackay, D., Di Guardo, A., Paterson, S., Kicsi, G., Cowan, C.E. 1996a. Assessing the fate of new and existing chemicals: A five-stage process. Environmental Toxicology and Chemistry 15(9):1618-1626.
Mackay, D., Webster, E., Cousins, I., Cahill, T., Foster, K., Gouin, T. 2001. An introduction to multimedia models. Rapport final préparé comme document d'information pour l'atelier de l'OCDE (Ottawa, octobre 2001). Peterborough (Ont.) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry. 30 p. CEMC Report No.: 200102.
Mathews, J.M., Zhan, Q., Etheridge, A.S., Patel, P.R., Black, S.R., Banks, T.T., Fennell, T.R., Snyder, R.W., Burgess, J.P., Warren, S.D., Surh, I., Waidyanatha, S. 2012. Metabolism and disposition of 2-methoxy-4-nitroaniline in male and female Harlan Sprague Dawley rats and B6C3F1/N mice. Xenobiotica42(12):1213-24.
Matsushima, T., Teichmann, B., Sawamura, M., Sugimura, T. 1978. Mutagenicity of azo-compounds : improved methods for detecting their mutagenicity by the Salmonella mutation test. Mutat. Res.54:220-221.
Matthews, H.B., Chopade, H.M., Smith, R.W., Burka, L.T. 1986. Disposition of 2,4-dinitroaniline in the male F-344 rat. Xenobiotica 16(1):1-10.
Milvy, P., Kay, K. 1978. Mutagenicity of 19 major graphic arts and printing dyes. Journal of Toxicology and Environmental Health 4:31-36.
[MITI] Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Centre. [cité dans CPMA, 2006b; OCDE, 2009b].
Miyagoshi, M., Hayakawa, Y., Nagayama, T. 1983. [Studies on the mutagenicity of cosmetic azo-dyes]. Eisei Kagaku 29(4):212-220. [article en japonais].
Møller, P., Wallin, H. 2000. Genotoxic hazards of azo pigments and other colorants related to 1-phenylazo-2-hydroxynaphthalene. Mutat. Res.462:13-30.
Møller, P., Wallin, H., Grunnet, N., Risom, L., Knudsen, L.E. 1998. DNA damage in isolated rat hepatocytes exposed to C.I. pigment orange 5 and C.I. pigment yellow 12 by the alkaline comet assay. Teratog. Carcinog. Mutagen. 18(1):9-16.
Mont Marte International Ltd. 2009a. Mont Marte Acrylic Paint 12 PCE. Material Safety Data Sheet. Mont Marte International. [consulté le 4 juillet 2014]. Accès : https://www.schoolartsupplies.com.au/images/stories/MSDS_-_MONT_MARTE_ACRYLIC_PAINT_12_PCE_ALL_COLOURS_EXCEPT_BLACK_AND_RAW_UMBER_-_MCG0037.pdf
Mont Marte International Ltd. 2009b. Mont Marte Watercolour Paint 12 PCE. Material Safety Data Sheet. Mont Marte International. [consulté le 4 juillet 2014]. Accès : https://www.schoolartsupplies.com.au/images/stories/MSDS_-_MONT_MARTE_WATERCOLOUR_PAINT_12_PCE_ALL_COLOURS_EXCEPT_IVORY_BLACK_-_MCG0038.pdf
Mont Marte International Ltd. 2012. Mont Marte Body and Face Art Paint Safety Data Sheet. Mont Marte International. [consulté le 20 mars 2013]. Accès : http://montmarte.net/image/data/MSDS/MONT%20MARTE%20BODY%20AND%20FACE%20ART%20PAINT%20(EU)%20-%20MBRT2001-3.pdf
Mortelmans, K., Haworth, S., Lawlor, T., Speck, W., Tainer, B., Zeiger, E. 1986. Salmonella mutagenicity tests. II. Results from the testing of 270 chemicals. Environ. Mutagen. 8:1-119.
Muzzall, J.M., Cook, W.L. 1979. Mutagenicity test of dyes used in cosmetics with the Salmonella/mammalian-microsome test. Mutat. Res. 67:1-8.
Myhr, B.C., Caspary, W.J. 1991. Chemical mutagenesis at the thymidine kinase locus in L5178Y mouse lymphoma cells: results for 31 coded compounds in the National Toxicology Program. Environ. Mol. Mutagen.18(1):51-83.
Nakayama, T., Kimura, T., Kodama, M., Nagata, C. 1983. Generation of hydrogen peroxide and superoxide anion from active metabolites of naphthylamines and aminoazo dyes: its possible role in carcinogenesis.Carcinogenesis 4:765-769.
[NCI] National Cancer Institute. 1978. Bioassay of Anthranilic Acid for Possible Carcinogenicity (CAS No. 118-92-3). Technical Report Series No.36. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/lt_rpts/tr036.pdf
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2012. 2e éd. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. Accès : www.cas.org/products/other-cas-products/nci-on-cd
Neumann, H.G. 2005. Monocyclic aromatic amino and nitro compounds: toxicity, genotoxicity and carcinogenicity, classification in a carcinogen category.The MAK-Collection Part I: MAK Value Documentations, Vol. 21. DFG, Deutsche Forschungsgemeinschaft. Accès : http://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb0maryvere0021/pdf
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme (Australie). 2009. Triclosan [en ligne]. Sydney (Australie) : Australian Department of Health and Ageing, NICNAS. Priority Existing Chemical Assessment Report No.: 30. Accès : www.nicnas.gov.au/publications/car/pec/pec30/pec_30_full_report_pdf.pdf
[NPC] National Paint & Coatings Association. 2004. Exposure to crystalline silica and estimation of the associated human health risks from painting and sanding interior flat latex paint. Rapport final. Préparé pour National Paint & Coatings Association, Inc. Seattle (WA) : Radian International. 48 p. [préparé le 11 septembre 2000; errata corrigé le 26 juillet 2004].
[NPIRI] National Printing Ink Research Institute. 2000a. Raw materials data handbook: a reference guide to regulatory data and technical performance properties, vol. 4. Pigments. 2e éd. Woodbridge (NJ) : National Printing Ink Research Institute. p. 62. [cité dans Environnement Canada et Santé Canada, 2009b].
[NTIS] National Technical Information Service (États-Unis). 1986. Genotoxicity testing with C.I. Pigment Red 112 with Cover Letter Dated 082686 (Company Sanitized). FY-OTS-0986-0511S. NTIS/OTS0000511-1. Accès : http://www.ntis.gov/search/product.aspx?abbr=OTS00005110
[NTP] National Toxicology Program (États-Unis). 1978. Toxicology and Carcinogenesis Studies of C.I. Pigment Red 23 (CAS No. 6471-49-4) in F344 Rats and B6C3F1 Mice (Feed Studies). Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Technical Report Series No. 411. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr411.pdf
[NTP] National Toxicology Program (États-Unis). 1982. Carcinogenesis bioassay of D & C Red No. 9 (CAS No. 5160-02-1) in F344 rats and B6C3F1mice (feed study). Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Technical Report Series No.: 225. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr225.pdf
[NTP] National Toxicology Program (États-Unis). 1992. Toxicology and carcinogenesis studies of C.I. Pigment Red 3 in F344/N rats and B6C3F1 mice (feed studies). Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Technical Report Series No. 407. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr407.pdf
[NTP] National Toxicology Program (États-Unis). 1994. NTP Toxicology and Carcinogenesis Studies of Barium Chloride Dihydrate (CAS No. 10326-27-9) in F344/N Rats and B6C3F1 Mice (Drinking Water Studies).Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Technical Report Series No. 432. Accès : http://ntp.niehs.nih.gov/results/pubs/longterm/reports/longterm/tr400499/abstracts/tr432/index.html
[NTP] National Toxicology Program (États-Unis). 2006. 2-Methoxy-4-Nitroaniline (CAS RN 97-52-9). Prepared for NCI to support chemical nomination by Technical Resources International, Inc. under contract no. N02-CB-07007 (9/05; 3/06). Accès : http://ntp.niehs.nih.gov/ntp/htdocs/chem_background/exsumpdf/97-52-9_508.pdf
[NTP] National Toxicology Program (États-Unis). 2013. Rodent Bone Marrow Cytogenetics - Sister Chromatid Exchange. Study Number 832755. CASRN 5160-02-9, D&C Red No. 9. (rapport d'essai de la base de données, extrait en janvier 2013). Accès : http://tools.niehs.nih.gov/ntp_tox/index.cfm?fuseaction=invivosc.scsummary&study_no=832755&cas_no=5160-02-1&endpointlist=SC
[NVWA] Nederlandse Voedsel en Warenautoriteit. 2008. [Monitoring and Compliance of Permanent Make-Up and Tattoo Dyes (Review 2004-2007)]. Nederlandse Voedsel en Warenautoriteit (Netherlands Food and Consumer Product Safety Authority)/ [en néerlandais]. Accès : https://www.vwa.nl/txmpub/files/? p_file_id=28126
[OCDE] Organisation de coopération et de développement économiques. 1994. SIDS Initial Assessment Report: 2-Naphthalenecarboxylic acid, 3-hydroxy-4-[(4- methyl-2-sulfophenyl)azo]-, calcium salt (D & C Red No. 7). CAS RN 5281-04-9. SIDS Initial Assessment Meeting 2; 4-6 July 1994.Accès :http://www.inchem.org/documents/sids/sids/5281049.pdf
[OCDE] Organisation de coopération et de développement économiques. 1996. SIDS Initial Assessment Report: 1-aminoanthraquinone (CAS RN 82-45-1).Accès : http://www.inchem.org/documents/sids/sids/82451.pdf
[OCDE] Organisation de coopération et de développement économiques. 1999a. SIDS Initial Assessment Report: Pigment Red 53:1; CAS RN 5160-02-1. SIDS Initial Assessment Meeting 9; June-July 1999. Accès : www.chem.unep.ch/irptc/sids/oecdsids/5160021.pdf
[OCDE] Organisation de coopération et de développement économiques. 1999b. Screening Information Dataset: Pigment Red 53:1; CAS RN 5160-02-1.Accès : http://webnet.oecd.org/hpv/ui/handler.axd?id=B906455B-1CF2-48E8-B3E8-DCE481D4C09A
[OCDE] Organisation de coopération et de développement économiques. 2000. Guidance document on aquatic toxicity testing of difficult substances and mixtures. (OECD Series on Testing and Assessment No. 23). Paris (France) : OECD Environmental Health and Safety Publications Series on Testing and Assessment, No. 23. Report No.: ENV/JM/MONO(2000)6.Accès : www.oecd-ilibrary.org/docserver/download/9750231e.pdf?expires=1371748494&id=id&accname=guest&checksum=F77793DC9424557B142CC94AF4A2E7A4
[OCDE] Organisation de coopération et de développement économiques. 2001. SIDS Initial Assessment Report: 2-Nitroaniline (CAS RN 88-74-4). SIDS Initial Assessment Meeting 13; Nov 2001. Accès : http://www.chem.unep.ch/irptc/sids/OECDSIDS/NITROANILINE.pdf
[OCDE] Organisation de coopération et de développement économiques. 2005. OECD guidelines for testing of chemicals. Annex 1. Proposal for revised introduction to the OECD guidelines for testing of chemicals, section 3. Part 1: Principles and strategies related to the testing of degradation of organic chemicals. Paris (France): Organisation de coopération et de développement économiques.
[OCDE] Organisation de coopération et de développement économiques. 2007. Guidance on grouping of chemicals. (OECD Series on Testing and Assessment No. 80). Paris (France) : Organisation de coopération et de développement économiques. Report No.: ENV/JM/MONO(2007)28. Accès : http://search.oecd.org/officialdocuments/displaydocumentpdf/?doclanguage=en&cote=env/jm/mono(2007)28
[OCDE] Organisation de coopération et de développement économiques. 2009a. Emission scenario documents on pulp, paper and board industry. OECD series on Emission Scenario Documents, No. 23. Organisation de coopération et de développement économiques, 8 juillet 2009.
[OCDE] Organisation de coopération et de développement économiques. 2009b. SIDS Initial Assessment Report: 2-Naphthalenecarboxylic acid, 3-hydroxy-4-[(4-methyl-2- sulfophenyl)azo]-, calcium salt (D & C Red No. 7); CAS RN 5281-04-9. SIDS Initial Assessment Meeting 2 ; juillet 1994. Accès : www.inchem.org/documents/sids/sids/5281049.pdf
[OCDE] Organisation de coopération et de développement économiques. 2014. Guidance on Grouping of Chemicals. Second Edition. Series on Testing & Assessment No. 194. Accès : http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/? cote=env/jm/mono(2014)4&doclanguage=en
Øllgaard, H., Frost, L., Galster, J., Hansen, O.C. 1998. Survey of azo-colorants in Denmark: Consumption, use, health and environmental aspects.Copenhague (Danemark) : Ministry of Environment and Energy, Environmental Protection Agency du Danemark. Accès : www2.mst.dk/udgiv/publications/1999/87-7909-548-8/pdf/87-7909-546-1.pdf
Pal, S., Tak, Y.K., Song, J.M. 2007. Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study of the Gram-negative bacterium Escherichia coli. Appl. Environ. Microbiol. 73:1712-1720.
Pan, H., Feng, J., He, G., Cerniglia, C., Chen, H. 2012. Evaluation of impact of exposure of Sudan azo dyes and their metabolites on human intestinal bacteria. Anaerobe 18:445-453.
Panina, N. 2009. Crystal structure and morphology prediction of organic pigments. Nijmegen (Pays-Bas) : Radboud University Nijmegen, Radboud Repository. Accès : http://repository.ubn.ru.nl/handle/2066/75422
Pearce, C.I., Guthrie, J.T., Lloyd, J.R. 2008. Reduction of pigment dispersions by Shewanella strain J18 143. Dyes Pigments76:696-705.
Platzek, T., Lang, C., Grohmann, G., Gi, U.S., Baltes, W. 1999. Formation of a carcinogenic aromatic amine from an azo dye by human skin bacteria in vitro. Hum. Exp. Toxicol. 18(9):552-559.
Présentation de projet. 2007a. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge006.
Présentation de projet. 2007b. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge009.
Présentation de projet. 2007c. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge010.
Présentation de projet. 2007d. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge007.
Présentation de projet. 2007e. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge020.
Présentation de projet. 2007f. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Submission012.
Présentation de projet. 2007g. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Submission011.
Présentation de projet. 2007h. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Submission013.
Présentation de projet. 2007i. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Submission014.
Présentation de projet. 2007j. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Submission018.
Présentation de projet. 2007k. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge019.
Présentation de projet. 2007l. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge020.
Présentation de projet. 2007m. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge004.
Présentation de projet. 2007n. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge017.
Présentation de projet. 2007o. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge015.
Présentation de projet. 2007p. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge004.
Présentation de projet. 2007q. Projet non publié et confidentiel présenté à Environnement Canada, Division des substances existantes, dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. Sommaire de rigueur d'étude, no d'identification 13365Challenge005.
Présentation de projet. 2012a. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID34].
Présentation de projet. 2012b. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID35].
Présentation de projet. 2012c. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID36].
Présentation de projet. 2012d. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID37].
Présentation de projet. 2012e. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID69].
Présentation de projet. 2012f. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID15].
Présentation de projet. 2012g. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID17].
Présentation de projet. 2012h. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID39].
Présentation de projet. 2012i. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID40].
Présentation de projet. 2012j. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID31].
Présentation de projet. 2012k. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID72].
Présentation de projet. 2012l. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID32].
Présentation de projet. 2012m. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID62].
Présentation de projet. 2012n. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID11].
Présentation de projet. 2012o. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID12].
Présentation de projet. 2012p. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID13].
Présentation de projet. 2012q. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID44].
Présentation de projet. 2012r. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID67].
Présentation de projet. 2012s. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID48].
Présentation de projet. 2012t. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID53].
Présentation de projet. 2012u. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID54].
Présentation de projet. 2012v. Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes. [DocID51].
Pulp and Paper Canada Annual Mill Directory. 2013. Pulp and Paper Canada, © 2013 Business Information Group Magazines LP [division de Glacier BIG Holding Co. Ltd.]. Accès : http://www.ppcmilldirectory.com
Rastogi, S.C., Pritzl, G. 1998. Red lipstick: a source of barium to humans and the environment. Bull. Environ. Contam. Toxicol.60(4):507-510.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006a. Cosmetics fact sheet: to assess the risks for the consumer. Updated version for ConsExpo 4.Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). RIVM Report No: 320104001/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320003001.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006b. Cleaning products factsheet: to assess the risks for the consumer. Updated version for ConsExpo 4. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). RIVM Report No.: 320104003/2006. Accès : www.rivm.nl/bibliotheek/rapporten/320104003.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2008. Chemicals in Toys: A general methodology for assessment of chemical safety of toys with a focus on elements. RIVM report 320003001/2008. Pays-Bas : Institut national néérlandais de la santé publique et de l'environnement (Rijksinstituut voor Volksgezondheid en Milieu). Accès : http://www.rivm.nl/bibliotheek/rapporten/320003001.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2010. New default values for the spray model [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). [consulté le 27 juillet 2012]. Accès : www.rivm.nl/dsresource?type=pdf&objectid=rivmp:60686&versionid=&subobjectname=
Rothen-Rutishauser, B.M., Schürch, S., Haenni, B., Kapp, N., Gehr, P. 2006. Interaction of fine particles and nanoparticles with red blood cells visualized with advanced microscope techniques. Environ. Sci. Technol. 40:4353-4359.
Rufli, H., Fisk, P.R., Girling, A.E., King, J.M., Länge, R., Lejeune, X., Stelter, N., Stevens, C., Suteau, P., Tapp, J., et al. 1998. Aquatic toxicity testing of sparingly soluble, volatile, and unstable substances and interpretation and use of data. Ecotoxicol. Environ. Saf. 39(2):72-77.
Rust-Oleum Corp. 2006. Material Safety Data Sheet (MSDS): N Industrial Choice Aerosols. [consulté le 24 janvier 2013]. Vernon Hills (IL) : Rust-Oleum Corporation. Accès : www.msdsxchange.com/english/show_msds.cfm?paramid1=3316447
Sakuratani, Y., Zhang, H.Q., Nishikawa, S., Yamazaki, K., Yamada, T., Yamada, J., Hayashi, M. 2013.
Sakuratani, Y., Noguchi, Y., Kobayashi, K., Yamada, J., Nishihara, T. 2008. Molecular size as a limiting characteristic for bioconcentration in fish.J. Environ. Biol. 29(1):89-92. Categorization of nitrobenzenes for repeated dose toxicity based on adverse outcome pathways. SAR QSAR Environ. Res. 24(1):35-46.
Santé Canada. 1994. L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/approach/approche-fra.pdf
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2011a. Énoncé de politique sur la définition ad hoc de Santé Canada s'appliquant aux nanomatériaux. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/sr-sr/pubs/nano/pol-fra.php
Santé Canada. 2011b. Liste critique des ingrédients des cosmétiques – septembre 2011 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consulté en septembre 2012]. Accès : http://www.hc-sc.gc.ca/cps-spc/cosmet-person/indust/hot-list-critique/hotlist-liste-fra.php
Santé Canada. 2012. Liste des colorants autorisés (Listes des additifs alimentaires autorisés). Ottawa (Ont) : Santé Canada. Accès : http://www.hc-sc.gc.ca/fn-an/securit/addit/list/3-colour-color-fra.php
Santé Canada. 2013. Document d’orientation intérimaire sur l’évaluation de la santé humaine pour l’exposition à court-terme aux cancérogènres sur les site contaminés fédéraux Évaluation des risques au Canada. Ottawa (ON): Santé Canada. Accès: http://www.hc-sc.gc.ca/ewh-semt/contamsite/index-fra.php
Scott, B., Moore, L. 2000. Assessment of the risks to human health posed by azo colourants in toys, writing inks and paper products, and analysis of the advantages and drawbacks of restrictions on their marketing and use. Rapport final. Laboratory of the Government Chemist (LGC).
Screen Web [online companion to Screen Printing magazine]. 2000. How much ink do you need?Skokie (IL) : ST Media Group International. [consulté le 18 avril 2013]. Accès : www.screenweb.com/content/how-much-ink-do-you-need?page=0%2C3
[SDA] Soap and Detergent Association. 2010a. Appendix II-A-1: Dermal exposure parameters to estimate screening exposures to consumer products - North America. In: Consumer product ingredient safety: exposure and risk screening methods for consumer product ingredients. 2e éd. Washington (DC) : Soap and Detergent Association.
[SDA] Soap and Detergent Association. 2010b. Appendix II-A-2: Dermal exposure parameters to estimate screening exposures to consumer products - Europe.In: Consumer product ingredient safety: exposure and risk screening methods for consumer product ingredients. 2e éd. Washington (DC) : Soap and Detergent Association.
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2011. Ottawa (Ont.) : Santé Canada. [consulté en juin 2011]. [réserve de consultation].
Seifried, H.E., Seifried, R.M., Clarke, J.J., Junghans, T.B., San, R.H. 2006. A compilation of two decades of mutagenicity test results with the Ames Salmonella typhimurium and L5178Y mouse lymphoma cell mutation assays. Chem. Res. Toxicol.19(5):627-644.
Sendelbach, L.E. 1989. A review of the toxicity and carcinogenicity of anthraquinone derivatives. Toxicology 57(3): 227–240.
[Siegwerk] Siegwerk Druckfarben AG & Co. KGaA. 2012. Toy Regulations Global V1.3: Declaration on the suitability for use of Siegwerk products for application on toys which can be sucked, licked or swallowed. Siegburg (Allemagne) : Siegwerk. [consulté le 14 février 2013]. Accès : www.siegwerk.com/no_cache/en/customer-segments/product-safety/packaging-safety.html?np_downloads%5Baction%5D=download&np_downloads%5Buid%5D=134
SkinCandy. 2013a. Fiches signalétiques (diverses). Encres de tatouage contenant le Pigment Red 170 (Ass, Blacklight Red, Bloodline Flame Red, Bloodline Sunset Orange, Blood Orange, Crimson Blood, Knucklehead Red, Marz Orange, McLovin, Red, Red Grey, Red Hot, Sweet 16, Tangerine, Tokyo Red ). [consulté en décembre 2013]. Accès : http://skincandytattoosupply.com
SkinCandy. 2013b. Fiches signalétiques (diverses). Encres de tatouage contenant le Pigment Yellow 3 (Blacklight Yellow, Bloodline Clover Green, Canary Yellow, Candy Lime, Citron, Emerald Green, Lemon Glow, Lightning Lime, Mantis, Mushroom, OKR, Puce, Sour Apple Green, Tusk).[consulté en décembre 2013]. Accès : http://skincandytattoosupply.com
Skipper, P.L., Kim, M.Y., Sun, H.L., Wogan, G.N., Tannenbaum, S.R. Monocyclic aromatic amines as potential human carcinogens: old is new again.Carcinogenesis 31(1):50-8.
Smart, S.K., Cassady, A.I., Lu, G.Q., Martin, D.J. 2006. The biocompatibility of carbon nanotubes. Carbon44:1034-1047.
Spadaro, J.T., Renganathan, V. 1994. Peroxidase-catalyzed oxidation of azo dyes: mechanism of disperse Yellow 3 degradation. Arch Biochem Biophys. 312(1):301-7.
Sperry, K. 1992. Tattoos and tattooing. Part II: Gross pathology, histopathology, medical complications, and applications. Am. J. Forensic Med. Pathol. 13(1):7-17.
Starbrite. 2013. Fiches signalétiques (diverses). Encres de tatouage contenant le Pigment Red 63:1 (Deep Maroon). [consulté en décembre 2013]. Accès : http://www.painfulpleasures.com/body_jewelry/gallery/Tattoo/tattoo_ink/starbrite_tattoo_ink/Starbright_MSDS_FullChart.pdf
Stiborová, M., Martínek, V., Semanská, M., Hodek, P., Dracínský, M., Cvacka, J., Schmeiser, H.H., Frei, E. 2009. Oxidation of the carcinogenic non-aminoazo dye 1-phenylazo-2-hydroxy-naphthalene (Sudan I) by cytochromes P450 and peroxidases: a comparative study.Interdiscip. Toxicol. 2:195-200.
Stingley, R.L., Zou, W., Heinze, T.M., Chen, H., Cerniglia, C.E. 2010. Metabolism of azo dyes by human skin microbiota. J. Med. Microbiol.59(Pt.1):108-114.
Stubbs, D.H. 1973. Toluidine, para and chlornitraniline reds. In: Patton, T.C. (éd.) Pigment handbook, vol. 1. Properties and economics. New York (NY) : John Wiley & Sons. p. 461-472.
Sun Chemical. 2004. Subacute 28-day oral toxicity with Pigment Additive 007 by daily gavage in the rat, followed by a 14-day recovery period. Notox Project 374704; Notox Substance 124983. [Rapport présenté à l'Environmental Protection Agency des États-Unis]. Cincinnati (OH) : Sun Chemical Corporation. Accès : www.epa.gov/oppt/tsca8e/pubs/8ehq/2004/mar04/8ehq_0304_15525a.pdf
Tennant, R.W., Stasiewicz, S., Spalding, J.W. 1986. Comparison of multiple parameters of rodent carcinogenicity and in vitro genetic toxicity.Environ. Mutagen. 8:205-227.
Tennekes, H., Kaufmann, W., Dammann, M., van Ravenzwaay, B. 2004. The stability of historical control data for common neoplasms in laboratory rats and the implications for carcinogenic risk assessment. Regul. Toxicol. Pharmacol. 40(3):293-304.
[Therapeutic Guidelines] Therapeutic Guidelines Limited. 2008. Lund and Browder chart for calculating the percentage of total body surface area burnt (Figure 14.19). Publié dans eTG complete, mars 2008. [en ligne]. Disponible sur demande.
Tsuda, S., Matsusaka, N., Madarame, H., Ueno, S., Susa, N., Ishida, K., Kawamura, N., Sekihashi, K., Sasaki, Y.F. 2000. The comet assay in eight mouse organs: results with 24 azo compounds. Mutat. Res.465:11-26.
UE. 2006. Règlement (CE) no 1907/2006 du Parlement européen et du Conseil du 18 décembre 2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), instituant une agence européenne des produits chimiques, modifiant la directive 1999/45/CE et abrogeant le règlement (CEE) no 793/93 du Conseil et le règlement (CE) no 1488/94 de la Commission ainsi que la directive 76/769/CEE du Conseil et les directives 91/155/CEE, 93/67/CEE, 93/105/CE et 2000/21/CE de la Commission [en ligne]. Journal officiel de l'Union européenne L 396:1-849. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=oj:l:2006:396:0001:0849:fr:pdf
[UK COT] United Kingdom Committee on Toxicity. 2005. Urgent advice provided by COT: Mutagenicity of para red (p12). Joint statements of the COT with the CPM and COC: Para red risk assessment (p72). Committees on: Toxicity, Mutagenicity, Carcinogenicity of Chemicals in Food, Consumer Products and the Environment. Annual Report 2005. Accès : http://cot.food.gov.uk/pdfs/cotannualreportweb2005.pdf
[USEPA] Environmental Protection Agency des États-Unis. 1994b. Draft cleaner technologies substitutes assessment (CTSA): screen reclamation. Chapter 3: Background information on methodologies used in screen reclamation risk, performance and cost evaluation. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics. Report No.: EPA 744R-94-005a.
[USEPA] Environmental Protection Agency des États-Unis. 1995. EPA office of compliance sector notebook project - profile of the printing and publishing industry. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Enforcement and Compliance Assurance.
[USEPA] Environmental Protection Agency des États-Unis. 1996. Ecological effects test guidelines. OPPTS 850.1000 - Special considerations for conducting aquatic laboratory studies. [ébauche publique]. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Prevention, Pesticides and Toxic Substances. Report No.: EPA 712-C-96-113.
[USEPA] Environmental Protection Agency des États-Unis. 1998. Multimedia compliance/pollution prevention assessment guidance for screen printing facilities. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Enforcement and Compliance Assurance.
[USEPA] Environmental Protection Agency des États-Unis. 2000. Interim guidance for using ready and inherent biodegradability tests to derive input data for multimedia models and wastewater treatment plants (WWT) models (9/1/2000) [en ligne]. [consulté 2012-2013]. Accès : www.epa.gov/oppt/exposure/pubs/halflife.htm
[USEPA] Environmental Protection Agency des États-Unis. 2005. Guidelines for carcinogen risk assessment. Risk Assessment Forum. Washington, DC. EPA/630/P-03/001F. Available at: http://www.epa.gov/raf/publications/pdfs/CANCER_GUIDELINES_FINAL_3-25-05.PDF
[US EPA] US Environmental Protection Agency. 2009. Mononitroanilines Category (2-Nitrobenzeneamine CAS RN 88-74-4, 4-Nitrobenzeneamine CAS RN 100-01-6). Screening-Level Hazard Characterization. Environmental Protection Agency des États-Unis. Septembre 2009. Accès : http://www.epa.gov/hpvis/hazchar/Category_Mononitroanilines_Sept2009.pdf
[USEPA] Environmental Protection Agency des États-Unis. 2011. Exposure Factors Handbook: 2011 Edition. Washington (DC) : National Center for Environmental Assessment, Office of Research and Development, Environmental Protection Agency des États-Unis. Accès : http://www.epa.gov/ncea/efh/pdfs/efh-frontmatter.pdf
[USEPA] Environmental Protection Agency des États-Unis.2012a. AP42 - Compilation of air pollutant emission factors, vol. I. Stationary point and area sources. Chapter 6: Organic chemical process industry; Section 6.7: Printing inks. Washington (DC) : Environmental Protection Agency des États-Unis. [consulté le 19 décembre 2012]. Accès : www.epa.gov/ttnchie1/ap42
[USFDA] US Food and Drug Administration. 1976. Listing of D&C Red No.34 for Use in Externally Applied Drugs and Cosmetics. Federal Register47:57681-57691.
[USFDA] US Food and Drug Administration. 1982. D&C Red No. 6 and D&C Red No.7 [Docket No. 82N-0378]. Federal Register 47:57681-57691.
[USFDA] United States Food and Drug Administration. 1986. Listing of D&C Orange No. 17 for use in externally applied drugs and cosmetics. Federal Register 51:28331-28346.
[USFDA] US Food and Drug Administration. 1988. Comparative evaluation for additional safety considerations, D&C Red No. 36. Memorandum. Silver Spring (MD) : US Department of Health and Human Services, Food and Drug Administration.
Vasold, R., Naarmann, N., Ulrich, H., Fischer, D., König, B., Landthaler, M., Bäumler, W. 2004. Tattoo pigments are cleaved by laser light – the chemical analysis in vitro provide evidence for hazardous compounds. Photochem. Photobiol. 80(2):185-190.
Weil, C.S., Carpenter, C. 1973. Results of inclusion in the diet of rats for three generations. Rapport inédit du Mellon Institute, présenté à l'Inter-Industry Color Committee par Cosmetic, Toiletry and Fragrance Association, Inc. [cité dans EFSA, 2010].
Weinburger, M.A., Albert, R.H., Montgomery, S.B. 1985. Splenotoxicity associated with splenic sarcomas in rats fed high doses of D & C Red No. 9 or aniline hydrochloride. J. Natl Cancer Inst.75(4):681-690.
Westmoreland, C., Gatehouse, D. 1992. D and C Red No. 9: genotoxic or non-genotoxic carcinogen? Mutat. Res. 281:163-167.
Weyman, G.S., Rufli, H., Weltje, L., Salinas, E.R., Hamitou, M. 2012. Aquatic toxicity tests with substances that are poorly soluble in water and consequences for environmental risk assessment. Environ. Toxicol. Chem. 31(7):1662-1669.
Williams, G.M., Mori, H., McQueen, C.A. 1989. Structure-activity relationship in the rat hepatocyte DNA-repair test for 300 chemicals. Mutat. Res.221:263-286.
Williams, J.H. 1999. Regulations on additions of sludge-borne metals to soil and their adaptation to local conditions. In: L'Hermite, P. (éd.) Treatment and use of sewage sludge and liquid agricultural wastes. London (Grande-Bretagne) : Commission des Communautés européennes; Elsevier Applied Science. p. 243-250.
Wormuth, M., Scheringer, M., Hungerbühler, K. 2005. Linking the use of scented consumer products to consumer exposure to polycyclic musk fragrances. J. Ind. Ecol. 9(1-2):237-258.
Wu, X., Bennett, D.H., Ritz, B., Cassady, D.L., Lee, K., Hertz-Picciotto, I. 2010. Usage pattern of personal care products in California households.Food and Chemical Toxicology 48:3109-3119.
Xu, H., Heinze, T.M., Chen, S., Cerniglia, C.E., Chen, H. 2007. Anaerobic metabolism of 1-amino-2-naphthol-based azo dyes (Sudan dyes) by human intestinal microflora. Appl. Environ. Microbiol.73:7759-7762.
Xu, H., Heinze, T.M., Paine, D.D., Cerniglia, C.E., Chen, H. 2010. Sudan azo dyes and para red degradation by prevalent bacteria of the human gastrointestinal tract. Anaerobe 16:114-119.
Yourick, J.J., Sasik, C.T., Bronaugh, R.L. 2007. In vitro dermal absorption and metabolism of D&C red no. 17 in human and porcine skin. J. Cosmet. Sci. 58:255-266.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1988. Salmonellamutagenicity tests: IV. Results from the testing of 300 chemicals. Environ. Mol. Mutagen. 11(12):1-158.
Zeilmaker, M.J., Kroese, E.D., van Haperen, P., van Veen, M.P., Bremmer, H.J., van Kranen, H.J., Wouters, M.F.A., Janus, J.A. 1999. Cancer risk assessment of azo dyes and aromatic amines from garment and footwear. Bilthoven (Pays-Bas) : Rijkinstituut voor Volkgezondheid en Milieu (Institut national néérlandais pour la santé publique et l'environnement). RIVM Report No.: 601503 014. Accès : www.rivm.nl/bibliotheek/rapporten/601503014.html
Zeilmaker, M.J., van Kranen, H.J., van Veen, M.P., Janus, J.A. 2000. Cancer risk assessment of azo dyes and aromatic amines from tattoo bands, folders of paper, toys, bed clothes, watch straps and ink. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais pour la santé publique et l'environnement). 45 p. RIVM Report No.: 601503 019. Accès : www.rivm.nl/bibliotheek/rapporten/601503019.html
Zhou, Y., You, X., Ye, X. 1987. Mutagenicity of benzidines and their congener derivative dyes. Huanjing Kexue 8(2):31-34.
Annexes
- Annexe A : Identité chimique, structures, formules et poids moléculaires des 33 pigments monoazoïques, organisés par sousensemble
- Annexe B : Propriétés physiques et chimiques expérimentales (à une température ambiante selon la situation) des pigments monoazoïques et de leurs analogues
- Annexe C : Données expérimentales sur la biodégradation des pigments monoazoïques et de leurs analogues
- Annexe D : Données expérimentales sur la toxicité aquatique des 33 pigments monoazoïques et de leurs analogues
- Annexe E : Calculs de l'exposition écologique pour les pigments monoazoïques
- Annexe F : Estimations de l’exposition liée à l’utilisation de cosmétiques
- Annexe G : Estimations de l’exposition liée à l’utilisation de pigments monoazoïques dans les peintures.
- Annexe H. Estimation de l’exposition à court terme aux pigments monoazoïques dans l’encre de tatouage permanente (adulte)
- Annexe I : Calculs des doses repères pour le PR3, le PO5, le PR4 et le PR53:1
- Annexe J. Pigments monoazoïques avec effets préoccupants