Mise à jour de l’ébauche d’évaluation préalable - Groupe de certaines substances ignifuges organiques - TCPP et TDCPP
Titre officiel : Mise à jour de l’ébauche d’évaluation préalable - Groupe de certaines substances ignifuges organiques - Phosphate de tris(2-chloro-1-méthyléthyle) (TCPP) et Phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] (TDCPP)
Numéros de registre du Chemical Abstracts Service :
- 13674-84-5
- 13674-87-8
Environnement et Changement Climatique Canada
Santé Canada
Octobre 2020
Sommaire
Conformément à l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministre de l’Environnement et la ministre de la Santé ont procédé à une évaluation préalable du phosphate de tris(2chloro-1-méthyléthyle), ci‑après appelé TCPP, numéro de registre du Chemical Abstracts Service (no CAS) 13674-84-5, et du phosphate de tris[2-chloro-1-(chlorométhyle)éthyle], ci-après appelé TDCPP, no CAS 13674-87-8. Le TCPP et le TDCPP font partie du groupe de certaines substances ignifuges organiques, qui comprend dix substances organiques ayant des fonctions similaires, soit l’application à des matériaux en vue de retarder leur inflammation et la propagation du feu. Ces deux substances ont été désignées comme devant faire prioritairement l’objet d’une évaluation, en raison d’autres préoccupations pour la santé humaine. Une ébauche d’évaluation préalable pour le TCPP et le TDCPP a été publiée en octobre 2016. De nouveaux renseignements importants sont depuis devenus disponibles relativement à l’exposition à des produits de consommation, en particulier les produits en mousse contenant des substances ignifuges telles que le TCPP et le TDCPP. En conséquence, l’ébauche d’évaluation a été mise à jour et est présentée ci-après.
Le TCPP et le TDCPP sont des produits chimiques organiques définis qui ne sont pas naturellement présents dans l’environnement. Selon l’information issue d’une enquête menée en vertu de l’article 71 de la LCPE, aucun TCPP ni TDCPP n’est fabriqué au Canada. Les deux substances ont été majoritairement importées au Canada en tant que substances pures ou dans des articles manufacturés. Le volume total des importations en 2011 allait de 1 000 000 à 10 000 000 kg de TCPP, et de 100 000 à 1 000 000 kg de TDCPP.
Le TCPP est utilisé en tant qu’additif ignifuge au Canada pour la fabrication de matériaux de construction (p. ex. mousse de polyuréthane expansive utilisée en tant qu’isolant), et est présent dans des produits importés de mousse de polyuréthane en vaporisateur utilisés pour la même fonction. Le TCPP est également importé au Canada dans des articles manufacturés contenant de la mousse de polyuréthane flexible (utilisés dans les meubles rembourrés et les matelas) et en tant que produit imperméabilisant à vaporiser sur du textile destiné aux consommateurs. Les renseignements disponibles indiquent la possibilité d’une migration des substances ignifuges à partir des objets en mousse.
Le TDCPP est utilisé en tant qu’additif ignifuge au Canada dans la fabrication de mousse de polyuréthane flexible (utilisée dans des articles manufacturés comme les meubles rembourrés et les matelas). La substance est importée en tant que substance pure et dans des produits commerciaux et des produits de consommation aux fins de la même utilisation fonctionnelle.
Le TCPP est très soluble dans l’eau et possède un faible coefficient de partage octanol-eau, tandis que le TDCPP n’est que modérément soluble dans l’eau et possède un coefficient de partage octanol-eau modéré. Les deux substances ont une faible pression de vapeur et ne se dissocient pas dans l’eau. Des études empiriques indiquent qu’aucune des deux substances ne se biodégrade rapidement. On considère qu’elles sont très stables dans l’eau, les sédiments et le sol, mais pas dans l’air (phase gazeuse). D’après les résultats des études d’échantillonnage environnemental, il a été déterminé que le TCPP et le TDCPP étaient associés à des particules dans l’air où ils sont considérés comme très persistants. Les deux substances ont été détectées dans des échantillons d’air au-dessus des régions arctiques au Canada et en Europe et sont considérées avoir un potentiel de transport à grande distance lorsqu’elles sont adsorbées aux aérosols.
Les rejets potentiels de TCPP et de TDCPP dans l’environnement découlent des activités industrielles (lorsqu’ils sont mélangés à un polyol) et de l’utilisation de produits commerciaux et des produits de consommation. Les rejets provenant des activités industrielles devraient principalement pénétrer dans l’eau par les systèmes de traitement des eaux usées. D’après ses propriétés physiques et chimiques, le TCPP se répartira dans l’eau, et des quantités négligeables se répartiront dans les sédiments. D’autre part, le TDCPP peut, dans une certaine mesure, être présent tant dans les sédiments que dans l’eau. Au contraire du TCPP, qui est censé demeurer principalement sous forme dissoute dans les effluents, le TDCPP, en raison de sa plus grande propension à s’adsorber dans les solides, peut s’adsorber dans les biosolides des systèmes de traitement des eaux usées, qui peuvent finir en tant que matériel d’épandage sur les sols. Les émissions provenant des articles manufacturés, des produits commerciaux et des produits de consommation, pénètrent en principe dans l’environnement dans l’air ou la poussière, et finissent par se déposer à la surface des eaux et des sols. Toutefois, les rejets dans l’environnement par cette voie devraient être minimes et diffus.
Comme on pouvait s’y attendre étant donné les propriétés physiques et chimiques du TCPP et du TDCPP, les études en laboratoires ont permis de déterminer de faibles facteurs de bioconcentration et un métabolisme rapide pour ces deux substances, ce qui indique que leur potentiel d’accumulation dans le biote aquatique est limité. Une exposition importante chez les organismes de niveau trophique supérieur par la chaîne alimentaire n’est pas prévue pour le TCPP et le TDCPP. L’excrétion rapide des produits de biotransformation dans les études sur les mammifères laisse entendre qu’une bioaccumulation des métabolites est improbable.
Des données empiriques sur l’écotoxicité ont été recensées pour les deux substances. Le TCPP a présenté une toxicité modérée pour les organismes aquatiques et les plantes terrestres, tandis que le TDCPP a présenté une toxicité considérablement plus élevée pour les organismes aquatiques, y compris des effets sur le système endocrinien des poissons. D’autres effets sublétaux (c'est à dire neurotoxicité et effets génétiques chez les oiseaux) sont également notés dans des études in vivo et in vitro. Des données relatives aux paramètres découlant des études in vitro qui présentent un lien avec les effets au niveau des organismes ont été prises en compte dans l’évaluation du risque pour ces deux substances.
Étant donné le devenir dans l’environnement et les données disponibles sur la toxicité pour ces deux substances, des analyses du quotient de risque ont été effectuées dans le milieu aquatique pour déceler le TCPP, et dans les milieux aquatiques, des sédiments et du sol dans le cas du TDCPP. Les résultats découlant des analyses du quotient de risque indiquent que le risque associé à l’exposition des organismes à ces deux substances en raison des rejets issus des utilisations industrielles et des produits de consommation est faible si l’on s’en tient aux niveaux de rejet actuels prévus.
Compte tenu de tous les éléments de preuve contenus dans la présente mise à jour de l’ébauche d’évaluation préalable, le TCPP ou le TCDPP présente un faible risque d’effets nocifs sur l’environnement. Il est donc proposé de conclure que le TCPP et le TDCPP ne répondent pas aux critères énoncés à l’alinéa 64a) ou b) de la Loi canadienne sur la protection de l’environnement (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie
D’après les renseignements disponibles sur les concentrations présentes dans l’environnement, et d’après les résultats d’une enquête réalisée en vertu de l’article 71 de la LCPE, les sources d’exposition de la population au TCPP et au TDCPP seraient les milieux environnementaux (air, eau, poussière), les aliments, et l’utilisation de produits de consommation contenant cette substance (soit dans les produits tels que la mousse en vaporisateur et les produits imperméabilisants, et dans les articles manufacturés tels que le mobilier rembourré contenant de la mousse).
Selon l’information disponible sur les effets sur la santé du TCPP, les effets critiques pour la caractérisation du risque pour la santé humaine sont des effets sur la reproduction et le développement.
La marge d’exposition entre les estimations de l’exposition au TCPP à partir des milieux naturels (air, eau et poussière) et des aliments (y compris le lait maternel), ainsi que l’exposition découlant de l’utilisation de mousse isolante en vaporisateur et de produits imperméabilisants ou isolants en vaporisateur, et les niveaux d’effet critique, sont jugés adéquats pour répondre aux incertitudes dans les bases de données sur les effets sur la santé et l’exposition. Les marges entre les estimations de l’exposition découlant d’un contact cutané prolongé avec certains articles manufacturés contenant du TCPP, comme le mobilier rembourré contenant de la mousse et les matelas, et les niveaux d’effet critiques, sont jugés potentiellement inadéquats pour correspondre aux incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
D’après l’information disponible et les classifications effectuées par d’autres organismes de réglementation étrangers, les effets critiques pour la caractérisation du risque pour la santé humaine découlant de l’exposition au TDCPP sont la cancérogénicité et des effets non carcinogènes sur les reins et les testicules. Des tumeurs ont été observées dans de multiples organes, notamment les reins et le foie (chez les deux sexes), les testicules (chez les hommes) et les glandes surrénales (chez les femmes) dans le cadre d’une étude de cancérogénicité chez les rats réalisée sur deux ans. Les résultats des tests de génotoxicité étaient mixtes in vitro et principalement négatifs in vivo.
Les marges d’exposition entre les estimations de l’exposition au TDCPP à partir des milieux naturels (air, eau et poussière) et des aliments (y compris le lait maternel) au et les niveaux d’effet critique des effets cancérogènes et non cancérogènes sont jugés adéquats pour répondre aux incertitudes dans les bases de données des effets sur la santé et l’exposition. Les marges entre les estimations découlant d’un contact cutané prolongé avec des articles manufacturés contenant du TDCPP (comme le mobilier rembourré contenant de la mousse et les matelas) et les niveaux d’effet critiques des effets cancérogènes et non cancérogènes, sont jugés potentiellement non adéquats pour correspondre aux incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
À la lumière des renseignements contenus dans la présente mise à jour de l’ébauche d’évaluation préalable, il est proposé de conclure que le TCPP et le TDCPP répondent au critère énoncé à l’alinéa 64 (c) de la LCPE, étant donné qu’ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration, ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaines au Canada.
Il est donc proposé de conclure que le TCPP et le TDCPP répondent à l’un ou plusieurs des critères définis à l’article 64 de la LCPE. Il est également proposé de conclure que le TCPP et le TDCPP répondent au critère de persistance, mais pas au critère de bioaccumulation tels qu’ils sont définis dans le Règlement sur la persistance et la bioaccumulation afférent à la LCPE.
- 11-KT
- 11-ketotestosterone
- BAF
- Bioaccumulation Factor
- BCFs
- Bioconcentration Factors
- BCPP
- Bis(1-chloro-2-propyl) phosphate
- BDCPP
- Bis(1,3-dichloro-2-propyl) hydrogen phosphate
- BMD
- Benchmark Dose
- BMDL
- Benchmark Dose Limit
- BMDS
- Benchmark Dose Software
- BOD
- Biological Oxygen Demand
- CAS RN
- Chemical Abstracts Service Registry Number
- CDAT
- Chemical Data Access Tool
- CEPA
- Canadian Environmental Protection Act
- CHO-K1
- Chinese Hamster Ovary Cells
- CMP
- Chemicals Management Plan
- CTV
- Critical Toxicity Value
- DIY
- Do-It-Yourself
- DPD
- Drug Product Database
- Dpf
- Day Post Fertilization
- E2
- 17β-estradiol
- EC
- Effective Concentration
- ECCC
- Environment and Climate Change Canada
- ECHA
- European Chemicals Agency
- EU
- European Union
- F0
- Adult Fish
- F1
- First Generation
- HPT
- Hypothalamic-Pituitary-Thyroid
- HPT
- Hypothalmus-Pituitary-Testis
- i.v.
- Intravenous
- IARC
- International Agency for Research on Cancer
- Koc
- Organic Carbon–water partition coefficient
- Kow
- Octanol–Water partition coefficient
- LADD
- Lifetime Average Daily Dose
- LC
- Lethal Concentration
- LNHPD
- Licensed Natural Health Products Database
- LOD
- Limit of Detection
- LRTP
- Long-Range Transport Potential
- MDL
- Method Detection Limits
- MOE
- Margin of Exposure
- MUR
- Most Used Room
- NHANES
- National Health and Nutrition Examination Survey
- NHPID
- Natural Health Products Ingredients Database
- NOECs
- No Observed Effect Concentrations
- NRC
- National Research Council
- NTE
- Neurotoxic Esterase
- NTP
- National Toxicology Program
- OC
- Organic Carbon
- OECD
- Organisation for Economic Co-operation and Development
- OFR
- Organic Flame Retardants
- OPFRs
- Organophosphate Flame Retardants
- OPIDN
- Organophosphate-Induced Delayed Neurotoxicity
- P95
- 95th Percentile
- PEC
- Predicted Environmental Concentration
- PN
- Post-Natal
- PNEC
- Predicted No-Effects Concentration
- POD
- Point of Departure
- (Q)SAR
- (Quantitative) Structure-Activity Relationship
- RQ
- Risk Quotient
- SG
- Specific Gravity
- SMR
- Standardized Mortality Ratio
- SPF
- Spray Polyurethane Foam
- STP
- Sewage Treatment Plant
- T
- Testosterone
- T3
- Triiodothyronine
- T4
- Thyroxine
- TBP
- Tributyl Phosphate
- TCEP
- Tris(2-chloroethyl)phosphate
- TCPP
- 2-Propanol, 1-chloro-, phosphate (3:1)
- TDCPP
- 2-Propanol, 1,3-dichloro-, phosphate (3:1)
- TOC
- Total Organic Carbon
- TPF
- Textile Penetration Factor
- UDS
- Unscheduled DNA Synthesis
- UFAC
- Upholstered Furniture Action Council
- US EPA
- US Environmental Protection Agency
- VTG
- Vitellogenin
- WWTS
- Wastewater Treatment Systems
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE) (Canada, 1999), le ministre de l’Environnement et de la Santé procèdent à des évaluations préalables de substances afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
L’Initiative des groupes de substances est une composante clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances qui ont été déclarées prioritaires pour la prise de mesures, car elles satisfaisaient aux critères de catégorisation énoncés à l’article 73 de la LCPE ou étaient considérées comme prioritaires en raison de préoccupations relatives à l’environnement ou à la santé humaine (Environnement Canada et Santé Canada, 2007). Toutes ces substances présentent une fonction similaire qui est l’application sur des matériaux en vue de ralentir l’ignition et de limiter la propagation du feu. En outre, ces substances sont des substituts potentiels à d’autres produits ignifuges qui sont actuellement soumis à des contrôles réglementaires ou à un retrait progressif au Canada ou à l’échelle mondiale.
La présente ébauche d’évaluation préalable porte sur deux substances du groupe de certaines substances ignifuges organiques : le phosphate de tris(2-chloro-1-méthyléthyle) (no CAS 13674-84-5) ou TCPP et le phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] (no CAS 13674-87-8) ou TDCPP. Ces substances sont prises en compte dans une même évaluation préalable en raison de la similitude de leur structure chimique et d’autres paramètres d’évaluation. Les deux substances ont été désignées comme étant d’intérêt prioritaire pour une évaluation, en raison des préoccupations qu’elles suscitent pour la santé humaine.
Une ébauche d’évaluation préalable du TCPP et du TDCPP a été publiée en octobre 2016 (ECCC et Santé Canada, 2016). Il y était proposé de conclure que le TCPP constitue un danger pour la santé humaine et répond aux critères énoncés à l’alinéa 64c), mais n’a pas d’effet nocif sur l’environnement, tandis que le TDCPP ne constitue pas un danger pour la santé humaine et n’a pas d’effet nocif sur l’environnement. De nouveaux renseignements importants sur l’exposition cutanée aux produits en mousse ont ensuite été obtenus grâce aux consultations avec l’Agence européenne des produits chimiques (ECHA) sur son rapport « Screening report – An assessment of whether the use of TCEP, TCPP and TDCP in articles should be restricted », publié en 2018. À la suite de consultations supplémentaires auprès d’autres instances, l’exposition cutanée aux produits en mousse a été réexaminée, et un scénario mis à jour a été adopté. Sur la base de ces renseignements, une version mise à jour de l’ébauche d’évaluation est présentée ici.
La mise à jour de l’ébauche d’évaluation préalable tient compte des renseignements sur les propriétés physiques et chimiques, les quantités, les utilisations, les dangers et l’exposition, notamment les renseignements supplémentaires soumis par les intervenants. Les composantes de l’évaluation qui portent sur la santé humaine et l’environnement reposent sur des données pertinentes colligées jusqu’en juillet 2018. Des recherches documentaires ciblées ont été menées jusqu’en février 2019 pour la composante de l’évaluation qui concerne la santé humaine. Les études les plus importantes, ainsi que les résultats modélisés, ont fait l’objet d’une évaluation critique et ont été utilisées pour formuler des conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des risques et des dangers effectuées par d’autres instances ont été pris en compte.
La présente mise à jour de l’ébauche d’évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement et Changement climatique Canada (ECCC), avec la contribution d’autres programmes de ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’environnement ont fait l’objet d’un examen par des pairs et de consultations externes. Des commentaires sur les parties techniques liées à l’environnement ont été reçus de la part de Jon Arnot (Arnot Research and Consulting), Miriam Diamond (University of Toronto) et Andy Wang (ICL IP). Cathy Petito Boyce, Leslie Beyer, Chris Long et David Mayfield de Gradient Corp et de la Risk Assessment Division, Office of Pollution Prevention and Toxics, Environmental Protection Agency des États-Unis (USEPA) ont formulé des commentaires sur les parties techniques relatives à la santé humaine. De plus, la version préliminaire a fait l’objet d’une période de consultation publique de 60 jours. Certaines parties de la présente évaluation préalable qui portent sur la santé humaine ont fait l’objet d’une consultation externe supplémentaire, par écrit, auprès de pairs. Des commentaires ont été transmis par Richard Manderville (University of Guelph), Mohamed Abou-Elwafa Abdallah (University of Birmingham) et Kebede K. Kefeni (Tshwane University of Technology). Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument la responsabilité du contenu final et des résultats de l’ébauche d’évaluation préalable mise à jour.
La présente mise à jour de l’ébauche d’évaluation préalable est axée sur les renseignements essentiels pour déterminer si une substance satisfait aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des données scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 1. Dans le présent document, nous présentons ces renseignements essentiels et les éléments sur lesquels se fondent les conclusions proposées.
2. Identité des substances
Les identités du TCPP et du TDCPP, deux phosphates de choroalkyle, sont présentées dans le tableau 2.1. Une liste des noms chimiques et des appellations commerciales supplémentaires de ces deux substances figure dans le National Chemical Inventory (NCI 2013).
| No CAS | 13674-84-5 (TCPP) | 13674-87-8 (TDCPP) |
|---|---|---|
| Groupe chimique (groupe de la LIS) | Composés organiques | Composés organiques |
| Formule chimique | C9H18Cl3O4P | C9H15Cl6O4P |
| Structure chimique | 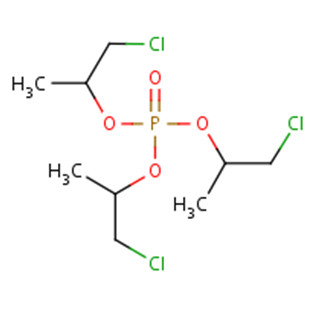 |
 |
| Chaîne SMILESa string | O=P(OC(CCl)C)(OC(CCl)C)OC(CCl)C | O=P(OC(CCl)CCl)(OC(CCl)CCl)OC(CCl)CCl |
| Masse moléculaire | 327.57 g/mol | 430.91 g/mol |
a Simplified Molecular Input Line Entry System.
2.1 Isomères du TCPP et du TDCPP
Le TCPP est fabriqué à partir de la réaction du trichlorure de phosphoryle et de l’oxyde de propylène en présence d’un catalyseur (PNUE, 1990; OMS, 1998). Après avoir éliminé les impuretés acides et le catalyseur résiduel, le produit final, que l’on appelle aussi TCPP, peut être composé de quatre isomères de chaîne du TCPP (soit les trois nos CAS 76025-08-6, 76649-15-5, 6145-73-9). La composition est dominée par le TCPP (jusqu’à 85 %); le reste est composé des trois autres isomères de chaîne présents en quantités variables en fonction des produits commerciaux des différents fournisseurs.
Les noms et structures chimiques des trois isomères de chaîne du TCPP sont indiqués dans le tableau 2.2.
| No CAS | 76025-08-6 | 76649-15-5 | 6145-73-9 |
|---|---|---|---|
| Nom chimique | phosphate de bis(1-chloropropane-2-yle) et de 2-chloropropyle | phosphate de bis(2-chloropropyle) et de 1-chloropropane-2-yle | phosphate de tris(2-chloropropyle) |
| Structure chimique |  |
 |
 |
Les études citées dans la présente évaluation sur le TCPP ont été exécutées à l’aide des produits commerciaux du TCPP. Le TCPP et ses isomères de chaîne ont présenté des propriétés chromatographiques très semblables et sont difficiles à séparer (EURAR, 2008a). Les propriétés physiques et chimiques prévues par un modèle sur les relations (quantitatives) structure-activité [R(Q)SA] (EPI Suite v4.1) ne diffèrent que très peu (ECCC, 2019). Pour les besoins de la présente évaluation, on présume que tous ces isomères de chaîne possèdent des propriétés physiques et chimiques et des propriétés dangereuses qui sont identiques. Puisque les différences dans les teneurs en isomères des produits commerciaux du TCPP ne devraient pas influer sur les propriétés physiques et chimiques et sur le profil de toxicité du TCPP, on considère que les données déclarées dans les études ayant été réalisées avec les produits commerciaux du TCPP (soit un mélange d’isomères de chaîne) sont valides pour évaluer le TCPP.
Le TDCPP est produit par la réaction de l’oxychlorure de phosphore et de l’épichlorhydrine (OMS, 1998). Le phosphate de tris(2-chloropropyle) (no CAS 78-43-3) est un isomère du TDCPP; toutefois, la présence de cet isomère n’a pas été déclarée dans les produits commerciaux du TDCPP.
2.2 Sélection des analogues et utilisation de modèles R(Q)SA
Des directives sur l’utilisation d’une technique de lecture croisée et de modèles R(Q)SA pour combler les lacunes dans les données ont été élaborées par diverses organisations telles que l’Organisation de coopération et de développement économiques (OCDE). Ces méthodes ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l’Union européenne (UE). Dans la présente évaluation, une méthode reposant sur les données obtenues à partir d’analogues et les résultats de modèles R(Q)SA, le cas échéant, a été utilisée pour éclairer les évaluations des effets sur la santé humaine et l’environnement. Les analogues choisis étaient de structure ou de fonctions similaires à celles des substances de ce groupe (toxicocinétique et propriétés physico-chimiques similaires) et leurs données empiriques pertinentes pouvaient être utilisées pour une extrapolation aux substances dont les données empiriques étaient insuffisantes. L’applicabilité des modèles R(Q)SA a été déterminée au cas par cas.
Les données d’extrapolation et les modèles R(Q)SA choisis pour éclairer les évaluations des effets du TCPP et du TDCPP sur la santé humaine et l’environnement sont traités de façon plus approfondie dans les sections pertinentes du présent rapport.
D’une manière générale, pour les besoins de l’évaluation du risque écologique, le TCPP et le TDCPP sont utilisés en tant qu’analogues l’un de l’autre lorsque les données sont insuffisantes concernant certains paramètres écologiques. Une technique de lecture croisée est appliquée lorsque l’on juge que les renseignements empiriques disponibles pour une substance sont appropriés pour combler les lacunes dans les données de l’autre substance. Aucun autre analogue n’a été utilisé dans l’évaluation du risque écologique. Les modèles R(Q)SA sont utilisés pour prédire le devenir dans l’environnement, la persistance et le potentiel de bioaccumulation. Les résultats de ces modèles sont considérés comme étant des éléments de preuve supplémentaires pour évaluer le TCPP et le TDCPP, et le poids relatif qui leur est attribué dépend de la fiabilité des méthodes et des résultats.
Dans l’évaluation des risques pour la santé humaine, le TDCPP et le phosphate de tris(2-chloroéthyle) [PTCE] ont été considérés comme des analogues qualitatifs pour évaluer le potentiel cancérogène du TCPP, car aucune étude à long terme ou sur la cancérogénicité du TCPP n’a été trouvée (davantage de détails sont disponibles dans le document Santé Canada, 2015a). L’identité du PTCE est présentée dans le tableau 2.3. De plus, plusieurs modèles R(Q)SA fondés sur les statistiques ont été utilisés pour évaluer le potentiel cancérogène du TCPP (davantage de détails sont disponibles dans le document de Santé Canada, 2015a).
| Substance (No CAS) | Nom de la substance | Masse moléculaire (g/mol) | Structure empirique/formule moléculaire |
|---|---|---|---|
| 115-96-8 | Phosphate de tris(2-chloroéthyle) (PTCE) | 285.49 |  C6H12Cl3O4P |
3. Propriétés physiques et chimiques
Les données expérimentales relatives aux propriétés physiques et chimiques du TCPP et du TDCPP ont été définies grâce aux recherches documentaires et aux soumissions de données.
On constate que plusieurs valeurs sont déclarées pour certaines propriétés physiques et chimiques du TCPP et du TDCPP (ECCC, 2019). Au moment d’examiner les données et d’évaluer la qualité et les détails des expériences, une valeur a été choisie pour caractériser chaque propriété physique et chimique (tableau 3‑1 et tableau 3‑2). Ces valeurs choisies sont ensuite appliquées dans la modélisation dans le cadre de l’évaluation.
3.1 TCPP
Propriété |
Type |
Valeur |
Température (°C) |
Référence |
|---|---|---|---|---|
| Point de fusion (°C) | Expérimental |
<-20 |
- |
SafePharm Laboratories 2002a |
| Point d’ébullition (°C) | Expérimental |
288 (ébullition avec décomposition) | - |
SafePharm Laboratories 2002a |
| Densité (kg/m3) | Expérimentale |
1,29 × 103 |
20 |
SafePharm Laboratories 2002a |
| Pression de vapeur (Pa) | Expérimentale |
0,0014 |
25 |
SafePharm Laboratories 2002b |
| Constante de la loi de Henry (Pa·m3/mol) | Calculée |
4,45 × 10-4 |
25 |
HENRYWIN 2011 |
| Log Koe (sans dimension) | Expérimental |
2,68 | Non précisée |
SafePharm Laboratories 2002c |
| Log Kco (sans dimension) | Expérimental |
2,76 |
- |
SafePharm Laboratories 2002c |
| Log Koa (sans dimension) | Valeur modélisée |
9,43 |
- |
KOAWIN 2010 |
| Hydrosolubilité (mg/L) | Expérimentale |
1 080 |
20 |
SafePharm Laboratories 2002c |
Abréviations : Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKoa, coefficient de partage octanol-air.
Un modèle de dissociation (ACD/pKaDB c1997-2012) n’a pas permis de déterminer de groupe fonctionnel dissociable; le TCPP est un composé organique neutre.
3.2 TDCPP
Propriété |
Type |
Valeur | Température (°C) |
Référence |
|---|---|---|---|---|
| Point de fusion (°C) | Expérimental |
<-20 |
- |
SafePharm Laboratories 2002d |
| Point d’ébullition (°C) | Expérimental |
326 |
- |
SafePharm Laboratories 2002d |
| Densité (kg/m3) | Expérimentale |
1 513 |
20 |
SafePharm Laboratories 2002d |
| Pression de vapeur (Pa) | Expérimentale |
5,6 × 10-6 |
25 |
SafePharm Laboratories 2002e |
| Constante de la loi de Henry (Pa·m3/mol) | Calculée |
1,33 × 10-4 |
25 |
HENRYWIN 2011 |
| Log Koe (sans dimension) | Expérimental |
3,69 | 20 |
SafePharm Laboratories 2002e |
| Log Kco (sans dimension) | Expérimental |
3,25 |
Non précisée |
Wildlife International 2006a |
| Log Koa (sans dimension) | Valeur modélisée |
10,96 |
- |
KOAWIN 2010 |
| Hydrosolubilité (mg/L) | Expérimentale |
18,1 |
20 |
SafePharm Laboratories 2002f |
Abréviations : Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau;
pKoa, coefficient de partage octanol-air.
Un modèle de dissociation (ACD/pKaDB c1997-2012) n’a pas permis de déterminer de groupe fonctionnel dissociable pour cette substance; le TDCPP est un composé organique neutre.
4. Sources et utilisations
Le TCPP et le TDCPP n’existent pas naturellement dans l’environnement. Les sources de TCPP et de TDCPP comprennent les activités industrielles et l’utilisation de produits contenant du TCPP ou du TDCPP.
En 2013, le TCPP et le TDCPP ont été inclus dans un avis émis en vertu de l’article 71 de la LCPE (1999) pour le groupe de certaines substances ignifuges organiques (Canada, 2013), dans le but de déterminer les sources et les utilisations actuelles de ces substances au Canada. D’après les réponses au présent avis, ni le TCPP ni le TDCPP ne sont fabriqués au Canada; toutefois, le total des importations au Canada était compris entre 1 000 000 kg et 10 000 000 kg pour le TCPP et entre 100 000 kg et 1 000 000 kg pour le TDCPP en 2011, dont une bonne partie sous forme de substances pures et une petite portion présente dans des produits commerciaux ou des produits offerts aux consommateurs (ECCC, 2013-2014).
Aussi bien le TCPP que le TDCPP sont inclus dans le Chemical Data Access Tool (CDAT) de l’Environmental Protection Agency des États-Unis (USEPA). Les données les plus récentes sont disponibles pour 2012 et indiquent un volume de production national d’environ 55 millions de livres (environ 25 000 000 kg) pour le TCPP et entre 10 et 50 millions de livres (environ 4 500 000 kg à 22 500 000 kg) pour le TDCPP (USEPA, 2012a). Un certain nombre de grands fabricants étrangers de TDCPP ont récemment arrêté leur fabrication de TDCPP (ECCC, 2013-2014); les raisons demeurent toutefois inconnues.
Des renseignements sur les quantités d’utilisation du TCPP et du TDCPP dans les pays nordiques sont disponibles jusqu’à l’année 2011 (SPIN, 2013). Le TCPP a été utilisé dans les quatre pays nordiques (Danemark, Finlande, Norvège et Suède) au cours des cinq dernières années, et les quantités totales d’utilisation dans ces quatre pays variaient de 1 050 000 kg à 1 994 000 kg de 2007 à 2011. Le TDCPP a été employé dans certains pays nordiques entre 2007 et 2011; toutefois, l’information sur la quantité d’utilisation reste confidentielle.
Les renseignements sur la quantité de fabrication ou d’importation des deux substances au Japon étaient disponibles pour les dernières années : 5 000 000 kg en 2010 (quantité déclarée : 5 000 tonnes) et 7 000 000 kg en 2011 (quantité déclarée : 7 000 tonnes) pour le TCPP, et moins de 1 000 000 kg en 2010 et 2011 (quantité déclarée : moins de 1 000 tonnes) pour le TDCPP (J‑CHECK, c2010).
Selon les données présentées en réponse à l’avis publié en vertu de l’article 71 de la LCPE pour le groupe de certaines substances ignifuges organiques (ECCC, 2013-2014), le TCPP est utilisé comme additif ignifuge au Canada. Il est mélangé à d’autres ingrédients pour la fabrication de matériaux de construction (p. ex. mousse de polyuréthane rigide à pulvériser et panneaux de mousse pour l’isolation); il est également présent dans des produits importés (p. ex. mousse de polyuréthane rigide à pulvériser) pour la même utilisation (ECCC, 2013-2014). Cette substance est aussi importée au Canada dans les produits manufacturés contenant de la mousse de polyuréthane flexible (p. ex. dans les meubles et les matelas) (ECCC, 2013-2014; CEH, 2013a,b; Stapleton et al., 2011); on a également signalé l’utilisation de cette substance en tant que produit imperméabilisant à pulvériser pour le textile destiné à une utilisation par les consommateurs (SDS, 2014).
Le TDCPP a été utilisé en tant qu’additif ignifuge dans la fabrication de mousse de polyuréthane flexible au Canada (employée dans le mobilier, les matelas et les sièges) (ECCC, 2013-2014).
En tant qu’additifs ignifuges, ces deux substances ne sont pas liées chimiquement au polymère dans les produits finis.
Il est interdit d’utiliser le TCPP et le TDCPP comme additifs alimentaires, et ils n’ont pas non plus été définis comme étant utilisés ou présents dans des formulations de matériaux d’emballage alimentaire ou comme additif indirect (courriel de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada daté de 2013, source non citée). De plus, le TCPP et le TDCPP ne sont inscrits ni dans la base de données sur les produits pharmaceutiques (BDPP [modification en 2017]), ni dans la base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la base de données sur les ingrédients des produits de santé naturels (BDIPSN [modification en 2017]), ni dans la base de données sur les produits de santé naturels homologués (BDPSNH [modification en 2016]) en tant qu’ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, les produits de santé naturels ou les médicaments vétérinaires (courriel de la Direction des produits thérapeutiques, de la Direction des produits de santé naturels et de la Direction des médicaments vétérinaires de Santé Canada adressé au Bureau de gestion du risque de Santé Canada de 2013, source non citée). D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le TCPP et le TDCPP ne sont pas utilisés dans les produits cosmétiques au Canada (courriels de 2013 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada; source non citée).
À l’échelle internationale, le TCPP et le TDCPP sont utilisés en tant que produits ignifuges et plastifiants (Sundkvist et al., 2010). Le TCPP et le TDCPP sont également utilisés dans la formulation de produits d’enduction d’envers pour le textile (p. ex. garnitures) aux États-Unis et en Europe (USCPSC, 2005a, b; EURAR, 2008b; EPA du Danemark, 2014). Bien qu’il n’y ait pas d’utilisation confirmée dans les textiles au Canada, des concentrations de TCPP et de TDCPP ont été mesurées dans la garniture de meubles achetés au Canada (CCE, 2015). Le TDCPP est également utilisé en tant que laque, peinture et colle (Sundkvist et al., 2010).
5. Rejets dans l’environnement
Les rejets anthropiques dans l’environnement dépendent de différentes pertes qui surviennent pendant la fabrication, l’utilisation industrielle, l’utilisation commerciale ou par les consommateurs, la durée de vie utile, et l’élimination de la substance. À cause de l’utilisation du TCPP et du TDCPP comme ignifugeants, les rejets de ces substances dans l’environnement au Canada devraient être diffus, avec quelques sources ponctuelles (p. ex. à partir des installations industrielles).
On ne prévoit pas d’émissions directes de TCPP et de TDCPP dans l’air. Les rejets de TCPP et de TDCPP dans le milieu aquatique se produisent pendant les utilisations industrielles. Selon les renseignements déterminés au Canada (ECCC, 2013‑2014), le TCPP et le TDCPP sont utilisés, comme additifs, pour fabriquer des mousses de polyuréthane. Les rejets provoqués par les activités industrielles devraient se produire au moment de leur mélange avec un polyol au cours des processus de fabrication. Les eaux usées rejetées par les installations de fabrication industrielle peuvent recevoir un traitement sur place avant de pénétrer dans des systèmes de traitement des eaux uséesNote de bas de page 2 situés à proximité. À partir de là, le TCPP et le TDCPP peuvent être rejetés dans les eaux de surface et peuvent se répartir dans les sédiments. Avec une hydrosolubilité élevée et un log Kco modéré, le TCPP ne devrait pas se répartir de façon notable dans les biosolides au cours du traitement des eaux usées; on considère donc que la voie conduisant à l’exposition au TCPP dans le sol en raison de l’application de biosolides est peu probable. D’autre part, la propension du TDCPP, qui possède un log Kco plus élevé et une hydrosolubilité plus faible, à se répartir dans les solides est plus grande et cette substance peut rester, dans une certaine mesure, dans les sédiments et les biosolides provenant des systèmes de traitement des eaux usées. En raison de la répartition dans les biosolides, il faudrait s’attendre à une exposition au TDCPP dans les sols en raison de l’épandage de biosolides.
Lorsqu’il s’agit d’additifs ignifuges que l’on mélange à un produit polymérique (plutôt qu’un produit ignifuge réactif lié chimiquement au produit polymérique), du TCPP et du TDCPP peuvent être rejetés, à partir des produits offerts aux consommateurs, dans l’environnement (Guerra et al., 2011), probablement dans l’air et directement dans la poussière. De telles émissions atmosphériques peuvent donner lieu à des dépôts atmosphériques dans le sol et l’eau. Lorsqu’elles sont présentes dans la poussière domestique, les substances peuvent finir dans les systèmes de traitement des eaux usées à la suite d’activités de nettoyage domestique courantes. Dans l’ensemble, les rejets issus des produits devraient être géographiquement dispersés et se propager pendant la durée de vie utile et la fin de vie utile de ces produits.
Les renseignements ci‑dessus relatifs au rejet sont utilisés pour développer davantage les scénarios d’exposition afin d’estimer les concentrations environnementales qui en découlent (voir la section 7.2).
6. Devenir et comportement dans l’environnement
6.1 Répartition dans l’environnement
Le devenir dans l’environnement d’une substance décrit le processus par lequel elle se déplace et est transformée dans l’environnement. Dans cette section, certaines caractéristiques générales du TCPP et du TDCPP seront traitées afin de déterminer leur devenir environnemental dans différents milieux, et ce, dans le but de comprendre comment les organismes entrent en contact avec ces substances dans un milieu donné, la persistance des deux substances dans les milieux environnementaux ainsi que leurs produits de dégradation et leur distribution dans les différents milieux.
Le rejet de TCPP et de TDCPP dans les eaux usées devrait être le résultat d’activités industrielles, et ces substances devraient subir une migration dans l’air et la poussière lorsque des produits sont utilisés.
D’après les propriétés physiques et chimiques (tableau 3‑1 et tableau 3‑2), le devenir dans l’environnement du TCPP et du TDCPP a été prédit à l’aide de la modélisation de fugacité de niveau III (EQC, 2011) en supposant des émissions constantes dans l’air, l’eau et le sol. Le modèle EQC de niveau III prend pour hypothèse des conditions hors de l’équilibre entre les milieux environnementaux, mais des conditions à l’équilibre dans chacun des milieux. Les résultats (tableau 6‑1 et tableau 6‑2) représentent les effets nets du partage chimique, du transport entre divers milieux, et de la perte tant par le processus d’advection (hors de la région modélisée) que par celui de la dégradation ou de la transformation, c’est‑à‑dire une répartition relative constante dans les milieux environnementaux physiques.
Selon le modèle EQC, le TCPP et le TDCPP démontrent un devenir et une répartition semblables dans l’environnement. Indépendamment du milieu environnemental dans lequel ces substances sont rejetées, la répartition dans l’air est négligeable, mais importante dans l’eau et le sol, en fonction du scénario de rejet. En raison de son hydrosolubilité considérablement plus faible et de son log Kco plus élevé, la répartition dans les sédiments est plus importante pour le TDCPP que pour le TCPP. On constate que le modèle ne peut tenir compte de l’association avec les particules dans le milieu atmosphérique; par conséquent, la prévision d’une répartition négligeable dans l’air diffère des données de surveillance de l’environnement déterminées pour le TCPP et le TDCPP.
Rejet de la substance dans |
Répartition dans l’air (%) |
Répartition dans l’eau (%) |
Répartition dans le sol (%) |
Répartition dans les sédiments (%) |
|---|---|---|---|---|
Air (100 %) |
Négligeable |
8,8 |
91,2 |
Négligeable |
Eau (100 %) |
Négligeable |
99,7 |
Négligeable |
0,3 |
Sol (100 %) |
Négligeable |
7,9 |
92,0 |
Négligeable |
Rejet de la substance dans |
Répartition dans l’air (%) |
Répartition dans l’eau (%) |
Répartition dans le sol (%) |
Répartition dans les sédiments (%) |
|---|---|---|---|---|
Air (100 %) |
Négligeable |
1,6 |
98,3 |
0,1 |
Eau (100 %) |
Négligeable |
94,6 |
Négligeable |
5,4 |
Sol (100 %) |
Négligeable |
1,0 |
99,0 |
0,1 |
Potentiel de transport à grande distance (PTGD)
L’analyse du devenir dans l’environnement par le modèle EQC a montré que, lorsque le TCPP et le TDCPP sont rejetés dans l’air, des fractions négligeables restent dans l’air, la majeure partie de ces substances se répartissant dans le sol. Par conséquent, dans l’air, le TCPP et l e TDCPP devraient se répartir principalement dans les particules en suspension. Cela a été confirmé par la surveillance de la qualité de l’air en Ontario, qui a montré que le TCPP et le TDCPP sont principalement présents en phase particulaire (Shoeib et Jantunen, 2013; Shoeib et al., 2014). Bien qu’il existe quelques modèles permettant de prévoir le PTGD (p. ex. TaPL3, outil de dépistage du potentiel de transport à grande distance et de persistance générale dans l’environnement de l’OCDE), ces modèles ne tiennent pas compte des substances associées à la phase particulaire et seraient donc considérés comme sous‑estimant le potentiel global de transport vers des régions éloignées.
En phase particulaire, les données empiriques confirment un degré élevé de persistance pour le TCPP et le TDCPP. Liu et al. (2014a) ont examiné l’oxydation initiée par le radical hydroxyle (HO·) dans l’air de trois produits ignifuges organophosphorés (PIOP) associés aux particules de (NH4)2SO4. En conservant la concentration du radical HO· à un état stable pendant l’expérience, on présume que des pseudo réactions de premier ordre se produisent. La demi‑vie a été estimée entre 7,6 et 9,7 jours pour le TDCPP; le calcul a été fait à partir de la durée de vie de 11 à 14 jours déclarée dans l’étude (Liu et al., 2014a). Dans une autre étude utilisant un composé de référence différent, Liu et al. (2014b) ont rapporté les demi‑vies du TDCPP en phase gazeuse et en phase particulaire. On a déterminé que la demi‑vie de cette substance dans la phase particulaire pouvait aller jusqu’à 5,6 jours (extrapolée à partir de la durée de vie égale à 8,1 jours), ce qui représente une durée plus longue que celle déterminée pour la phase gazeuse (demi‑vie de 1,3 jour, extrapolée à partir de la durée de vie de 1,9 jour) (Liu et al., 2014b).
Bien que le TCPP ne figure pas dans les études de Liu et al. (2014a et 2014b), d’après la similitude structurelle avec le TDCPP et d’autres esters phosphoriques qui ont fait l’objet de ces études, la demi‑vie en phase particulaire du TCPP pour l’oxydation du radical hydroxyle devrait être semblable à celle du TDCPP.
Les constatations de Liu et al. (2014a et 2014b) concordent avec les données sur l’environnement, ce qui laisse entendre que le TDCPP et le TCPP liés à des particules sont très persistants dans l’atmosphère en ce qui a trait à l’oxydation du radical HO·. En phase particulaire, le transport atmosphérique à grande distance de ces substances est corroboré sur la base des concentrations atmosphériques mesurées, en particulier celles des régions éloignées. Plus particulièrement, le TCPP et le TDCPP ont été détectés, ainsi que quatre autres produits ignifuges organophosphorés (PIOP) dans l’air de la mer du Nord, principalement adsorbés aux particules en suspension dans l’air (Moller et al., 2011). Les deux étaient présents dans des particules en suspension dans l’air au‑dessus du nord du Pacifique et de l’océan Indien vers les régions polaires (Moller et al., 2012) et dans un site de l’Arctique européen (Salamova et al., 2014a). Au Canada, le TCPP et le TDCPP étaient présents dans des échantillons d’air prélevés dans l’atmosphère des Grands Lacs (Salamova et al., 2014b) et de l’Arctique canadien (Jantunen et al., 2013a) (ECCC, 2019).
6.2 Persistance dans l’environnement
D’après les études de surveillance, le TCPP et le TDCPP dans l’air sont principalement associés aux particules. Une fois adsorbés aux particules, le TCPP et le TDCPP devraient être très persistants dans l’air.
Les données empiriques et modélisées sur la biodégradation indiquent constamment que le TCPP et le TDCPP sont stables dans l’environnement et qu’ils se dégradent lentement. Ni le TCDPP ni le TDCPP ne devraient subir d’hydrolyse dans les conditions environnementales du Canada.
Plusieurs études de biodégradation ont été recensées pour le TCPP et le TDCPP. Les constatations semblent indiquer qu’aucune biodégradation immédiate et rapide ne se produit dans l’eau ni pour l’une ni pour l’autre de ces substances; toutefois, on observe une biodégradation intrinsèque. Les modèles R(Q)SA disponibles prévoient une biodégradation lente des deux substances. Les détails sont fournis ci‑dessous.
6.2.1 Dégradation dans l’air
Le modèle AOPWIN (2010) a été utilisé pour estimer la demi‑vie d’une substance organique en phase gazeuse. Pour le TCPP et le TDCPP, le modèle prévoit des demi‑vies très courtes (2,9 et 7,1 heures, respectivement) compte tenu de l’oxydation atmosphérique; toutefois, comme ces substances devraient être associées à des particules en suspension dans l’air, ces prévisions ne sont pas jugées utiles pour l’évaluation. Le modèle AOPWIN ne tient pas compte de l’association des esters d’organophosphate avec les particules dans l’air, ce qui démontre une certaine résistance à l’oxydation des radicaux HO. En outre, ce modèle n’est pas en mesure de prédire la réaction du TCPP et du TDCPP avec les espèces photo‑oxydantes comme l’O3 dans l’atmosphère, et il ne peut pas simuler l’impact de la photolyse directe (AOPWIN, 2010). En raison de ces limites, le modèle AOPWIN n’est pas considéré comme pouvant être utilisé pour évaluer la dégradation de ces substances dans l’air.
Le poids de la preuve est donc accordé aux demi‑vies mesurées dans le cadre d’essais en laboratoire dirigés par Liu et al. (2014a et 2014b; demi‑vie de 5,6‑9,7 jours pour le TDCPP), ce qui est plus pertinent en ce qui a trait à leur présence observée dans l’environnement canadien. Étant donné la similarité chimique du TCPP et du TDCPP et la présence observée du TCPP adsorbé aux particules atmosphériques, le TCPP et le TDCPP devraient tous deux montrer une résistance à l’oxydation provoquée par le radical HO· et donc ne pas se dégrader rapidement dans l’air.
6.2.2 Hydrolyse
L’hydrolyse du TCPP et du TDCPP a été étudiée d’après divers pH et températures (Akzo Nobel, 2001a). Ces constatations sont résumées dans les tableaux 6‑3 et 6‑4 ci‑dessous.
Le TCPP a été testé à 50 ºC et selon trois conditions de pH différentes (pH 4, 7 et 9) (Akzo Nobel, 2001a). À la fin de cette étude de cinq jours, une diminution de moins de 1 % de la concentration de la substance d’essai a été observée dans tous les groupes d’essai. Les résultats indiquent que le TCPP ne subit pas d’hydrolyse importante dans les conditions de pH pertinentes sur le plan environnemental (6 à 9).
Pourcentage (%) d’hydrolyse |
Période d’essai (jour) | Conditions d’essai (pH) | Conditions d’essai (température) | Demi-vie extrapolée |
|---|---|---|---|---|
< 1 |
5 |
pH = 4, 7 et 9 |
50 ºC |
> 1 an |
Comme pour le TCPP, le TDCPP n’a pas présenté de dégradation après hydrolyse à 50 °C et avec un pH de 4 et 7 au cours d’une étude de cinq jours; toutefois, à un pH de 9, le TDCPP a présenté un taux d’hydrolyse de 6 % et 16 % aux jours 2 et 4, respectivement (Akzo Nobel, 2001b). Dans le cadre d’un essai d’hydrolyse plus long (sur 30 jours), la substance a fait l’objet d’un essai plus poussé à un pH de 9 et à des températures de 20 °C et 40 °C (Akzo Nobel, 2001b). Une dégradation de 3,9 % et de 44,5 % attribuable à l’hydrolyse a été observée à la fin de l’expérience. Les résultats semblent indiquer que l’hydrolyse du TDCPP ne devrait pas être importante dans des conditions environnementales normales (pH de 6 à 9, et température de 5 à 25 °C.
| Période d’essai (jours) | Conditions d’essai (pH et température) | Pourcentage (%) d’hydrolyse |
Demi-vie extrapolée |
|---|---|---|---|
5 |
pH 4, 50ºC |
Aucune hydrolyse importante |
> 1 an |
5 |
pH 7, 50ºC |
Aucune hydrolyse importante |
> 1 an |
5 |
pH 9, 50ºC |
16 % |
14,7 jours |
30 |
pH 9, 20ºC |
3,9 % |
120 jours |
30 |
pH 9, 40ºC |
44,5 % |
28 jours |
Compte tenu des données empiriques disponibles, il est très peu probable que les taux d’hydrolyse du TCPP et du TDCPP dans des conditions pertinentes sur le plan environnemental soient suffisamment rapides pour influer sur leurs concentrations environnementales.
6.2.3 Biodégradation
Plusieurs études se sont intéressées à la biodégradation du TCPP et du TDCPP. Les valeurs déclarées des paramètres de dégradation sont résumées dans les tableaux 6‑5 et 6‑6 ci‑dessous. Les modèles R(Q)SA ont également été utilisés pour fournir des éléments de preuve supplémentaires afin d’évaluer la dégradation de ces deux substances.
6.2.3.1 TCPP
Conformément aux données empiriques, le TCPP ne se biodégrade pas rapidement (tableau 6‑5) et ne répond pas aux critères de biodégradation immédiate (ECCC, 2019).
Il a été démontré que le TCPP présentait une certaine biodégradabilité intrinsèque. Lors d’un essai prolongé en flacon fermé mené dans des conditions aérobies, des boues activées ont été aérées pendant une semaine avant le début de l’essai mené avec 4 mg/L de TCPP (Akzo Nobel, 2002). La dégradation a commencé au jour 21 d’après la consommation d’oxygène mesurée et a atteint 13 % au jour 28, ce qui indique que la substance d’essai ne se biodégrade pas rapidement.
Dans une étude semi-continue menée avec des boues activées, du TCPP a été ajouté aux boues activées dans des conditions aérobies (Akzo Nobel, 2001c). La substance était complètement éliminée à la fin de l’étude de neuf semaines. Par conséquent, le TCPP a été considéré comme étant intrinsèquement biodégradable (Akzo Nobel, 2001c).
Dans une autre étude de biodégradabilité intrinsèque, une dégradation de 21 % du TCPP a été observée après une exposition de 28 jours à des boues d’épuration activées (Safepharm, 1996). Selon un résumé d’étude, il semble y avoir au début du test une période d’acclimatation d’environ 13 jours, qui est suivie d’une dégradation rapide sur trois jours (jusqu’à 13 %) puis d’une période de dégradation lente, bien qu’une dégradation totale de 21 % ait été atteinte à la fin de la période d’exposition de 28 jours. Aucun détail n’est disponible pour évaluer davantage les résultats dans cette étude (Safepharm, 1996).
Processus du devenir |
Inoculum d’essai |
Méthode |
Résultat de dégradation |
Référence |
|---|---|---|---|---|
| Biodégradation (biodégradation rapide) | Boues activées |
Équivalente à la méthode d’essai MITI, 301C de l’OCDE |
Dégradation sur 28 jours = 0 % | MITI, 1992 |
| Biodégradation (biodégradation rapide) | Boues activées |
Méthode non précisée |
DBO sur 28 jours = 6 % COT sur 28 jours = 2 % |
J-CHECK, c2010- |
| Biodégradation (biodégradation rapide) | Boues activées |
Test 301E de l’OCDE |
Dégradation sur 28 jours = 14 % (élimination du COD) | Bayer, 1991a |
| Biodégradation (biodégradation rapide) | Boues activées |
TSCA de l’USEPA 796.3100 |
CO2 sur 28 jours ≤ 6,7 % COD sur 28 jours ≤ 18,3 %
|
ABC Laboratories, 1993 |
| Biodégradation (biodégradation intrinsèque) | Boues activées |
Ligne directrice 835.3200 de l’OPPTS de l’USEPA |
DBO sur 28 jours = 13 % DBO sur 50 jours = 60 % DBO sur 84 jours = 100 % |
Akzo Nobel, 2002 |
| Biodégradation (biodégradation intrinsèque) | Boues activées |
Ligne directrice 302A de l’OCDE; directive 87/302/CEE; ISO TC 147 |
Élimination à 100 % à la fin des 9 semaines
|
Akzo Nobel, 2001c |
| Biodégradation (biodégradation intrinsèque) | Boues activées |
Méthode non précisée |
Dégradation sur 28 jours = 21 % (consommation d’O2) | SafePharm, 1996 |
Abréviations : DBO, demande biologique en oxygène; COT, carbone organique total; COD, carbone organique dissous.
6.2.3.2 TDCPP
Les données empiriques semblent indiquer que le TDCPP ne se biodégrade pas rapidement (tableau 6‑6). En général, la substance présente un taux de biodégradation plus lent que le TCPP, probablement en raison du fait que le chlore remplace les groupes méthyles. Les valeurs déclarées provenant des études en laboratoire sont toutes inférieures aux critères de biodégradation rapide (ECCC, 2019).
La dégradation du TDCPP a également été étudiée dans de l’eau prélevée dans deux rivières et deux zones côtières au Japon (Hattori et al., 1981) en conditions aérobies. Les rapports indiquent une dégradation de 18,5 % du TDCPP dans l’eau provenant de la rivière Oh et de 22 % dans l’eau de mer provenant de la baie d’Osaka après 14 jours.
Dans une étude de biodégradation intrinsèque, aucune dégradation n’a été observée après 28 jours (Safepharm Laboratories, 1996a). Il est à noter qu’aucune période d’acclimatation n’a été utilisée dans l’étude; par conséquent, les résultats ne sont pas jugés appropriés pour tirer des conclusions relativement à la biodégradation.
Processus du devenir |
Inoculum d’essai |
Méthode |
Résultat de dégradation |
Référence |
|---|---|---|---|---|
| Biodégradation (biodégradation rapide) | Boues domestiques |
OCDE 301B OCDE 301D |
Dégradation sur 28 jours = 0 % (dégagement de CO2) | Life Science Research, 1990 |
| Biodégradation (biodégradation rapide) | Boues activées |
Méthode non précisée |
DBO sur 28 jours = 1 %
|
J-CHECK, c2010- |
| Biodégradation (biodégradation rapide) | Non précisé |
OECD 301C OECD 302C |
DBO sur 28 jours = 0 à 4 %
|
CITI, 1992 |
| Biodégradation (biodégradation intrinsèque) | Boues activées |
OECD 302C |
Dégradation sur 28 jours = 0 % (consommation d’O2) | SafePharm Laboratories, 1996a |
| Biodégradation (anaérobie) | Boues anaérobies |
Méthode non précisée |
Dégradation sur 60 jours = 0 % (rejet de chlorure) | van Ginkel, 2005 |
Biodégradation |
Eaux libres du Japon |
Méthode colorimétrique au bleu de molybdène |
Dégradation sur 7 jours = 0 à 12,5 % Dégradation sur 14 jours = 0 à 22 % |
Hattori et al., 1981 |
Biodégradation |
Sol naturel |
OCDE 307 |
Dégradation sur 122 jours = 2,7 à 5,5 % (dégagement de CO2) | Wildlife International, 2005a |
Abréviation : DBO, demande biologique en oxygène.
Une modélisation fondée sur les R(Q)SA (Environnement Canada, 2007) a également été effectuée de façon à fournir des éléments de preuve supplémentaires pour caractériser la biodégradation du TCPP et du TDCPP. En résumé, les résultats de tous les sous-modèles de biodégradation BIOWIN (sous-modèle BIOWIN 3, 5 et 6) n’indiquent pas de biodégradation rapide pour le TCPP et le TDCPP; en outre, les prévisions de dégradation ultime établies par les modèles CPOP (2012) n’indiquent pas de biodégradation rapide (ECCC, 2019).
6.2.4 Dégradation dans le sol et les sédiments
Une étude portant sur la dégradation du TDCPP dans le sol naturel a été recensée (Wildlife International, 2005a). La substance a été appliquée à la surface du sol et les échantillons ont été incubés à une température de 20 ± 2 °C pendant 17 semaines. À la fin de l’étude, une dégradation très légère (dégagement de CO2 de 2,7 à 5,5 %) a été déclarée (Wildlife International, 2005a).
Aucune étude expérimentale supplémentaire n’a été trouvée en ce qui concerne la biodégradation de TCPP dans le sol ou les sédiments, ou la biodégradation du TDCPP dans les sédiments. Une modélisation limitée est disponible pour ces deux milieux. Par conséquent, un ratio d’extrapolation de 1:1:4 pour les demi-vies de biodégradation dans l’eau, le sol et les sédiments a été utilisé (Boethling et al., 1995). Compte tenu du fait que les demi-vies dans l’eau du TCPP et du TDCPP sont longues et probablement supérieures à 182 jours (d’après les résultats des études sur la biodégradation résumés dans le tableau 6‑6), la demi-vie du TCPP dans le sol devrait être supérieure à 182 jours et les demi-vies du TCPP et du TDCPP dans les sédiments devraient être supérieures à 365 jours. Le TCPP et le TDCPP devraient être persistants dans le sol et les sédiments.
6.2.5 Métabolisme du TCPP et du TDCPP
Le TCPP et le TDCPP subiraient une métabolisation rapide dans les organismes. Bien que l’on dispose de données indiquant des voies de transformation métaboliques chez les rats, la voie de transformation dans les organismes aquatiques demeure incertaine.
Dans l’ensemble d’étalonnage du modèle BCFBAF (2010), il existe des données permettant d’évaluer préalablement les demi-vies (jours) et les constantes du taux de biotransformation primaire (kM jour-1) du corps entier dans le cas de produits chimiques définis chez les poissons, calculés selon la méthode d’Arnot et al. (2008a et 2008b). Les estimations de la demi-vie de biotransformation in vivo empirique chez un poisson de 10 g sont de 0,05 et de 0,30 jour pour le TCPP et le TDCPP, respectivement. Les demi‑vies prévues par l’intermédiaire des R(Q)SA chez un poisson de 10 g sont de 0,14 et de 0,41 jour pour le TCPP et le TDCPP, respectivement (EPI Suite 2000-2012). Les estimations in vivo et in silico concordent très bien les unes avec les autres pour les deux produits chimiques. Les éléments de preuve disponibles permettent de supposer que les biotransformations primaires subies par le TCPP et le TDCPP sont relativement rapides chez les poissons; toutefois, les intermédiaires métaboliques n’ont pas été précisés. Dans le cadre d’une étude récente chez les oiseaux, il a été confirmé que le phosphate de bis(1,3-dichloropropane-2-yle (BDCPP, no CAS 72236-72-7) constituait un intermédiaire métabolique du TDCPP (Farhat et al., 2014).
Les études toxicocinétiques menées chez des rongeurs ont également fait état d’un métabolisme rapide du TCPP et du TDCPP (voir les sections 8.2.1.2 et 8.2.2.3 pour plus de détails). Une étude sur le TCPP a déterminé que, en moyenne, 89 % de la dose de cette substance administrée par voie orale ou intraveineuse a été éliminée dans les 72 heures qui ont suivi le traitement. Un métabolite important a été défini comme étant le phosphate de 0,0-[bis(1-chloro-2-propyle)]-0-(2,acide propionique) et représentait plus de 50 % de la dose (Stauffer Chemical Co., 1984). Dans une étude toxicocinétique sur le TDCPP, la récupération de la radioactivité 168 heures après l’administration était de 43,2 % dans l’urine, de 39,2 % dans les matières fécales, de 16,24 % dans l’air expiré (dioxyde de carbone) et de 2,51 % dans la carcasse (Minegishi et al., 1988). 1988). Le BDCPP, un diester du TDCPP, constituait un métabolite important (Lynn et al., 1981).
Le métabolisme rapide du TCPP et du TDCPP semble indiquer un faible potentiel d’accumulation dans les organismes (dont il sera question dans la section suivante). Parallèlement, ce métabolisme rapide entraîne la formation de métabolites potentiellement stables.
6.3 Potentiel de bioaccumulation
D’après les facteurs de bioconcentration (FBC) mesurés, les données empiriques semblent indiquer un faible potentiel de bioconcentration du TCPP et du TDCPP dans le biote aquatique. Puisqu’aucune donnée sur les facteurs de bioaccumulation (FBA) empiriques n’est disponible pour le TCPP ou le TDCPP, les modèles R(Q)SA ont été utilisés pour produire des estimations et les FBA modélisés qui en résultent sont faibles. Au vu de ces faibles FBA et des taux de biotransformation rapides de ces substances, la bioamplification du TCPP et du TDCPP à travers le réseau trophique est peu probable; par ailleurs, l’exposition aux organismes de niveau trophique supérieur devrait être inférieure à l’exposition aux organismes de niveau trophique inférieur.
6.3.1 Bioaccumulation dans les organismes aquatiques
Les FBC empiriques du TCPP et du TDCPP dans les organismes aquatiques ont été établis, et de faibles FBC ont été déclarés pour les deux substances (tableau 6‑7).
Dans une étude effectuée à l’aide d’un système expérimental avec eau statique, l’absorption et l’élimination de quatre produits ignifuges organophosphorés (y compris le TDCPP) ont été étudiées (Sasaki et al., 1981). Le taux d’absorption du TDCPP chez les cyprinodontidés et les carassins dorés était semblable, conformément aux concentrations mesurées dans l’eau d’essai; toutefois, il a été déclaré que la bioconcentration était bien plus élevée chez les cyprinodontidés que chez les carassins dorés. Les résultats révèlent une différence dans l’activité métabolique du TDCPP chez ces deux espèces (Sasaki et al., 1981). La demi-vie associée à l’élimination du TDCPP chez le cyprinodontidé est de 1,65 heure (OMS, 1998).
Substance |
Organisme d’essai |
Concentration et durée d’exposition |
FBC (L/kg) |
Référence |
|---|---|---|---|---|
TCPP |
Carpe Cyprinus carpio |
0,2 mg/L pendant 6 semaines |
0,8 – 2,8 |
CITI, 1992 |
TCPP |
Carpe Cyprinus carpio |
0,02 mg/L pendant 6 semaines |
< 1,9 – 4,6 |
CITI, 1992 |
TDCPP |
Carpe Cyprinus carpio |
0,02 mg/L pendant 6 semaines |
0,3 – 3,3 |
CITI, 1992 |
TDCPP |
Carpe Cyprinus carpio |
0,002 mg/L pendant 6 semaines |
< 2,2 – 22 |
CITI, 1992 |
TDCPP |
Cyprinodontidé Oryzias latipes |
0,3 – 1,2 mg/L pendant 96 heures (statique) |
31 – 59 |
Sasaki et al., 1982 |
TDCPP |
Cyprinodontidé Oryzias latipes |
0,04 – 0,4 mg/L pendant 72 – 144 heures (continue) |
31 – 46 |
Sasaki et al., 1982 |
TDCPP |
Cyprinodontidé Oryzias latipes |
0,04 – 0,08 mg/L pendant 30 – 32 jours (continue) |
49 – 59 |
Sasaki et al., 1982 |
Le MITI (Japon) a également évalué la bioconcentration du TCPP et du TDCPP (J‑CHECK, c2010). En vertu de la Chemical Substances Control Law du Japon, il a été déterminé que les deux substances ne présentaient pas une « bioconcentration élevée » (J‑CHECK, c2010); toutefois, aucun autre détail n’a été fourni dans la base de données.
Les modèles R(Q)SA ont été utilisés pour fournir des éléments de preuve supplémentaires afin de caractériser le potentiel de bioconcentration du TCPP et du TDCPP. Les résultats fournis par les modèles (BCFBAF et CPOP) n’ont révélé aucun FBC élevé (voir le tableau 6‑8).
Substance |
Organisme d’essai |
Paramètre et valeur |
Référence |
|---|---|---|---|
TCPP |
Poisson | FBC = 13,26 L/kg (poisson du niveau trophique intermédiaire) | BCFBAF, 2010 |
TCPP |
Poisson | FBC = 3,79 L/kg |
CPOP, 2012 |
TDCPP |
Poisson | FBC = 111,6 L/kg (poisson du niveau trophique intermédiaire) | BCFBAF, 2010 |
TDCPP |
Poisson | FBC = 4,52 L/kg |
CPOP, 2012 |
Le FBA est également pris en compte pour évaluer le potentiel de bioaccumulation du TCPP et du TDCPP.
Le FBA est mesuré dans des conditions naturelles en tant que rapport entre les charges de substance chimique absorbées dans le corps entier découlant de toutes les expositions et les concentrations se trouvant dans l’eau ambiante. Le calcul du FBA est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances, car il intègre toutes les voies d’exposition d’un organisme à la substance chimique, y compris l’exposition alimentaire qui prédomine pour les substances présentant un log Koe supérieur à 4,0 environ (Arnot et Gobas, 2003).
Aucune donnée empirique sur le FBA n’a été trouvée pour le TCPP ou le TDCPP. Puisque les valeurs de log Koe sont de 2,68 pour le TCPP et de 3,69 pour le TDCPP, l’accumulation par absorption alimentaire devrait être un processus relativement peu important pour ces substances. Les modèles R(Q)SA disponibles ont été utilisés pour estimer ce paramètre et les FBA estimés sont équivalents aux FBC des deux substances (tableau 6‑9).
Substance |
Organisme d’essai |
Paramètre et valeur |
Référence |
|---|---|---|---|
TCPP |
Poisson | FBA = 13,26 L/kg (poisson du niveau trophique intermédiaire) | BCFBAF, 2010 |
TDCPP |
Poisson | FBA = 111,7 L/kg (poisson du niveau trophique intermédiaire) | BCFBAF, 2010 |
Le faible potentiel de bioaccumulation prévu pour le TCPP et le TDCPP concorde avec les faibles FBC, la biotransformation rapide et la faible tendance au fractionnement lipidique (octanol) de ces deux substances dans les organismes aquatiques. Comme nous l’avons mentionné précédemment, le calcul des demi-vies de biotransformation des deux substances indique qu’elles sont inférieures à 0,5 jour chez les poissons, d’après la constante du taux de transformation primaire empirique (kM) (tableau 6‑10). Ainsi, la bioamplification à travers les réseaux trophiques est peu probable et l’exposition subie par les organismes de niveau trophique supérieur devrait être inférieure à celle des organismes de niveau trophique inférieur.
Substance |
Valeur kM expérimentale (par jour) |
Demi-vie de biotransformation (jour) |
FBC (L/kg) |
|---|---|---|---|
TCPP |
14,12 |
0,05 |
8 |
TDCPP |
2,29 |
0,30 |
12 |
6.3.2 Bioaccumulation dans les plantes terrestres
Eggen et al. (2013) ont mené une étude sur l’absorption et le déplacement des produits chimiques (y compris le TCPP et deux autres esters d’organophosphate, soit le PTCE et le phosphate de tributyle [TBP]) dans les aliments et les cultures fourragères. L’orge (Hordeum vulgare), le blé (Triticum aestivum), le colza (Brassica rapa), la fétuque des prés (Festuca pratense) et quatre cultivars de carottes (Daucus carota) ont été exposés au sol traité (TCPP à la concentration mesurée de 0,72 mg/kg en poids sec) pendant 17 semaines. À la fin de l’étude, des concentrations élevées de TCPP ont été mesurées dans les feuilles et les racines, mais des concentrations faibles ont été mesurées dans les graines, par rapport à la concentration d’exposition dans le sol traité (ECCC, 2019). Le facteur de concentration le plus élevé allait jusqu’à 25,6 (dans les feuilles de la fétuque des prés), ce qui indique qu’il n’y a pas d’accumulation significative du TCPP dans les plantes.
6.3.3 Potentiel de bioaccumulation des métabolites
Aucune étude sur le potentiel de bioaccumulation des métabolites du TCPP et du TDCPP dans les organismes n’a été recensée; toutefois, les résultats des études chez les poissons et les mammifères au sujet des composés d’origine ont fourni quelques preuves indirectes (voir les sections 8.2.1.2 et 8.2.2.3 pour obtenir des détails sur le métabolisme chez les mammifères). Indépendamment du fait que les produits de transformation du TCPP et du TDCPP peuvent être quelque peu différents chez les poissons et les mammifères, l’élimination des deux substances et de leurs produits de transformation à partir des organismes est rapide, ce qui semble indiquer que le potentiel de bioaccumulation du TCPP et du TDCPP est faible.
7. Potentiel d’effets nocifs sur l’environnement
7.1 Évaluation des effets sur l’environnement
Les données empiriques sur les effets indiquent que la toxicité du TCPP est considérablement plus faible que celle du TDCPP en ce qui concerne la survie et la croissance des organismes. Les effets sur le système endocrinien ont été observés uniquement pour le TDCPP chez les poissons. Les effets des deux substances sur les activités enzymatiques et la transcription des gènes associée à une variété de fonctions biologiques ont été observés dans des essais sur des cellules, mais à des degrés différents. La différence dans la toxicité globale des deux substances peut être due à une chloration plus élevée dans le TDCPP.
Les principales études sont décrites dans les sections suivantes, et on trouvera des renseignements détaillés dans ECCC (2019). Les données sur les critères d’effet pour la survie, la croissance ou le développement des organismes d’essai en lien avec l’exposition environnementale au Canada ont été prises en compte dans la caractérisation des risques.
7.1.1 Toxicité pour les organismes aquatiques
Des données sur la toxicité aiguë du TCPP et du TDCPP sont disponibles pour les trois taxons principaux (poissons, crustacés et algues) et des données sur la toxicité chronique sont disponibles pour les crustacés et les algues (ECCC 2013‑2014). Outre les études in vivo, on a examiné dans des études in vitro les effets sur les cellules et la transcription des gènes afin de comprendre le mécanisme de leurs effets sur le système endocrinien.
7.1.1.1 Effets du TCPP sur les organismes aquatiques
On a démontré que le TCPP présentait une toxicité modérée pour les organismes aquatiques. Les valeurs CE50/CL50 sur 24 et 96 heures allaient de 13,5 à 180 mg/L pour les trois principaux taxons (poissons, crustacés et algues). Les études de toxicité chronique disponibles portent seulement sur les crustacés et les algues, et font état de concentrations sans effet observé (CSEO) allant de 6 à 32 mg/L. La substance est jugée narcotique et n’a pas un fort potentiel de liaison à l’ADN ou aux protéines.
En ce qui concerne la génotoxicité, la majeure partie des données in vitro trouvées indiquait des résultats négatifs dans les essais sur cellules, tandis que certains essais étaient peu concluants ou ambigus en ce qui concerne la génotoxicité du TCPP (ECHA c2007-2015). En outre, les résultats d’études sur le rat semblent indiquer que cette substance n’a pas provoqué de dommages aux chromosomes ou à l’ADN (ECHA c2007-2015).
Liu et al. (2012) ont réalisé une étude pour examiner les effets de six ignifugeants organophosphorés, dont le TCPP et le TDCPP, sur le système endocrinien du poisson zèbre (Danio rerio). La première partie de l’étude mesurait : 1) les concentrations des hormones sexuelles et les transcriptions des principaux gènes associés à la stéroïdogenèse; et 2) l’affinité de liaison aux récepteurs des œstrogènes. Le TCPP a présenté effet plus faible d’après les essais sur les cellules, car les concentrations les plus faibles (1 mg/L) de TCPP influant sur le 17β-estradiol (E2) et la testostérone (T) dans les cellules H295 étaient supérieures de deux ordres de grandeur à la concentration la plus faible de TDCPP (0,01 mg/L), concentration à laquelle des effets comparables ont été observés. Par conséquent, le TCPP n’a pas été étudié plus à fond pour ce qui est de ses effets potentiels sur le système endocrinien du poisson zèbre (Liu et al., 2012).
7.1.1.2 Effets du TDCPP sur les organismes aquatiques
Le TDCPP présente une toxicité considérément plus élevée (même effet/réponse à des concentrations d’exposition plus faibles) pour les organismes aquatiques par rapport au TCPP, en raison probablement de la chloration plus forte de cette substance. Pour ce qui est du TDCPP, les CE50/CL50 sur 24 à 96 heures vont de 1,1 à 39 mg/L pour les trois taxons.
Des effets sur le développement et la reproduction des organismes d’essai ont été observés après une exposition à long terme au TDCPP. Dans la deuxième phase de l’étude de Liu et al. (2012), après une exposition au TDCPP pendant 14 jours, les concentrations de 17β-estradiol et de testostérone dans le plasma du poisson zèbre adulte ont fortement augmenté chez les mâles et les femelles exposés à une concentration de 1 mg/L. La concentration de 11-cétotestostérone (11-KT) dans le plasma a fortement diminué jusqu’à atteindre 0,04 mg/L et plus chez les poissons mâles. Toutefois, aucun changement important chez les poissons femelles dans l’un ou l’autre des groupes traités n’a été observé. Des effets significatifs sur la transcription des gènes apparentés (cytochrome P450 (CYP17), CYP19A et vitellogénine (VTG1)) dans les gonades et le foie des poissons n’ont été observés que dans le groupe ayant reçu la dose de 1 mg/L chez les poissons mâles et femelles, avec une réduction significative supplémentaire de la VTG à 0,2 mg/L chez les poissons femelles (Liu et al., 2012). Toutefois, cette étude n’a signalé aucune information sur la densité et la production du sperme chez les poissons mâles (Liu et al., 2012) (tableau 7‑1).
Paramètre |
Concentration sans effet (mg/L) |
Concentration la plus faible entraînant un effet (mg/L) |
|---|---|---|
E2 dans le plasma |
0,2 mg/L (mâles et femelles) |
1 mg/L (mâles et femelles) |
T dans le plasma |
0,2 mg/L (mâles et femelles) |
1 mg/L (mâles et femelles) |
11-KT dans le plasma |
0,04 mg/L (mâles) Aucun effet à toutes les concentrations d’essai (femelles) |
0,04 mg/L (mâles) Aucun effet à toutes les concentrations d’essai (femelles) |
Transcriptions de gènes dans les gonades et le foie |
0,2 mg/L (mâles) 0,04 mg/L (femelles) |
1 mg/L (mâles) 0,2 mg/L (femelles) |
Abréviations : E2 = 17β-œstradiol; T = testostérone; 11-KT = 11-cétotestostérone.
Wang et al. (2013) ont étudié l’effet du TDCPP sur le système endocrinien (thyroïde) des embryons du poisson zèbre. Les organismes d’essai ont été exposés à différentes concentrations de TDCPP (0,01 à 0,6 mg/L) de 2 heures à 144 heures après la fécondation. Les critères d’effet pour le comportement, les concentrations d’hormones thyroïdiennes dans le corps entier et les profils de transcription des gènes dans l’axe hypothalamo-hypophyso-thyroïde ont été étudiés (voir le tableau 7‑2). Un effet important sur le taux d’éclosion et de survie a été observé dans l’organisme d’essai à la suite d’une exposition à 0,6 mg/L. Une fréquence importante de malformation a été observée à une concentration encore plus faible, à 0,3 mg/L. Hormis les effets sur les paramètres liés au développement, les concentrations de thyroxine (T4) et de triiodothyronine (T3) dans le corps entier étaient très inférieures chez les poissons exposés à la substance aux concentrations de 0,05 et 0,3 mg/L, respectivement. Dix gènes associés à l’axe hypothalamo-hypophyso-thyroïde des embryons ou des larves du poisson zèbre ont également été étudiés; l’expression de l’ARN messager a été touchée dans huit de ces gènes à la suite d’une exposition au TDCPP à une concentration de 0,1 mg/L ou plus (Wang et al., 2013).
Paramètre |
Concentration sans effet (mg/L) |
Concentration la plus faible entraînant un effet (mg/L) |
|---|---|---|
Taux d’éclosion |
0,3 |
0,6 (taux d’éclosion considérablement plus faible) |
Taux de survie |
0,3 |
0,6 (taux de survie considérablement plus faible) |
Fréquence cardiaque |
0,05 |
0,1 (fréquence cardiaque considérablement plus faible) |
Poids corporel |
0,01 |
0,05 (considérablement plus faible) |
Malformation |
0,01 |
0,3 (fréquence considérablement plus élevée du taux de malformation, de courbure rachidienne) |
Concentration de T4 |
0,01 |
0,05 (considérablement plus faible) |
Concentration de T3 |
0,1 |
0,3 (considérablement plus élevée) |
Expressions de l’ARN messager de dix gènes |
0,05 |
0,1 (régulation positive importante) |
Abréviations : T4 = thyroxine; T3 = triiodothyronine.
Dans une étude chronique, l’homéostasie des hormones thyroïdiennes et le développement neuronal ont été étudiés chez la descendance de poissons zèbres adultes exposés au TDCPP pendant trois mois (Wang et al., 2015a) (tableau 7‑3). Les effets sur le développement général de la première génération (F1) de larves de poissons zèbres, les niveaux d’hormones thyroïdiennes et l’expression des gènes associés au système nerveux ont été mesurés. En général, aucun effet important n’a été observé à une concentration de 0,004 mg/L (Wang et al., 2015a).
Paramètre |
Concentration sans effet (mg/L) |
Concentration la plus faible entraînant un effet (mg/L) |
|---|---|---|
Taux d’éclosion |
0,004 |
0,02 (taux d’éclosion considérablement plus faible) |
Malformation |
0,02 |
0,1 (fréquence bien plus importante) |
Taux de survie |
0,004 |
0,02 (taux de survie considérablement plus faible) |
Poids corporel |
0,02 |
0,1 (poids corporel considérablement plus faible) |
Concentration F0 T4 |
0,004 |
0,02 (considérablement plus faible) |
Concentration F0 T3 |
0,02 |
0,1 (considérablement plus faible) |
Œufs T4 |
0,02 |
0,1 (considérablement plus faible) |
Œufs T3 |
0,1 |
Sans objet |
F1 5-JAF T4 |
0,02 |
0,1 (considérablement plus faible) |
F1 5-JAF T3 |
0,01 |
Sans objet |
F1 10-JAF T4 |
0,004 |
0,02 (considérablement plus faible) |
F1 10-JAF T3 |
0,02 |
0,1 (considérablement plus faible) |
5 gènes associés au système nerveux |
0,004 |
0,02 (régulation à la baisse considérable) |
4 concentrations de neurotransmetteurs dans des larves F1 exposées au TDCPP |
0,004 |
0,02 (concentration considérablement plus faible) |
Activité locomotrice |
0,02 |
0,1 (vitesse de nage considérablement plus faible) |
Abréviation : F0 = poisson adulte; F1 = première génération; T4 = thyroxine; T3 = triiodothyronine; JAF = jours après fécondation.
Dans une étude à plus long terme, les larves de poissons zèbres ont été exposées au TDCPP à des concentrations de 0, 0,004, 0,02 et 0,1 mg/L pendant 6 mois (Wang et al., 2015b) (tableau 7‑4). Les paramètres de développement ont été consignés au cinquième jour après fécondation (JAF) pour la première génération (F1). Les taux d’éclosion, de survie et de croissance n’ont pas été modifiés de manière importante dans la F1 issue des poissons F0 exposés. Toutefois, il y a eu une hausse importante de la fréquence des malformations dans les embryons F1 issus des parents exposés à 0,02 et 0,1 mg/L de TDCPP. Chez les poissons adultes (F0), il n’y avait pas de différence importante des taux de survie. Toutefois, on a observé une baisse de poids corporel à la concentration la plus basse, soit 0,004 mg/L, et d’autres paramètres de croissance ont été affectés à une concentration supérieure ou égale à 0,2 mg/L.
Paramètre |
Concentration sans effet (mg/L) |
Concentration la plus faible entraînant un effet (mg/L) |
|---|---|---|
Poids corporel (F0) |
Sans objet |
0,004 (poids corporel considérablement plus faible) |
Longueur |
0,1 |
Sans objet |
Rapport poids/longueur (F0) |
0,004 |
0,2 (rapport considérablement plus faible) |
Poids des gonades/poids corporel (F0) |
0,02 (mâle) 0,004 (femelle) |
0,1 (mâle) (rapport considérablement plus faible) 0,02 (femelle) (rapport considérablement plus élevé) |
Éclosion (F1) |
0,1 |
Sans objet |
Survie (F1) |
0,1 |
Sans objet |
Malformation (F1) |
0,004 |
0,02 (fréquence considérable) |
Production d’œufs |
0,004 |
0,02 (production considérablement plus faible) |
Concentration d’estradiol dans le plasma (E2) et de testostérone (T) chez le poisson femelle |
0,004 |
0,02 (concentration considérablement plus élevée) |
Concentration d’estradiol dans le plasma (E2) et de testostérone (T) chez le poisson mâle |
0,1 |
Sans objet |
4 niveaux de transcription des gènes dans le cerveau |
Sans objet |
0,004 (1 parmi 4 expressions génétiques évaluées) |
4 niveaux de transcription des gènes dans le foie |
0,004 |
0,02 (1 parmi 4 expressions génétiques évaluées) |
9 niveaux de transcription des gènes dans les gonades |
Sans objet |
0,004 (1 parmi 9 expressions génétiques évaluées) |
Dans une autre étude à long terme sur le TDCPP avec le même plan expérimental, les larves de poissons zèbres ont été exposées au TDCPP à des concentrations de 0, 0,004, 0,02 et 0,1 mg/L pendant 6 mois (Wang et al., 2015c) (tableau 7‑5). Aucun effet sur le développement général des embryons/larves de poissons n’a été signalé. En plus des effets sur certains paramètres d’expression génétique, les concentrations de deux neurotransmetteurs étaient bien plus basses dans le cerveau des poissons femelles dans tous les groupes traités. Toutefois, les concentrations de ces deux neurotransmetteurs dans le cerveau des poissons mâles n’ont pas changé, peu importe la dose d’essai. L’activité de l’acétylcholinestérase (en tant que biomarqueur de la présence de neurotoxines) et l’activité locomotrice n’ont pas été touchées chez tous les poissons adultes, peu importe la dose d’essai.
Paramètre |
Concentration sans effet (mg/L) |
Concentration la plus faible entraînant un effet (mg/L) |
|---|---|---|
Développement (éclosion, malformation, survie, poids) |
0,1 |
Sans objet |
5 expressions génétiques dans le système nerveux des larves de poissons zèbres |
0,02 |
0,1 (régulation positive importante pour 1 parmi 5 gènes évalués) |
5 expressions génétiques dans le système nerveux du poisson zèbre adulte |
0,004 |
0,02 (régulation à la baisse importante) |
α1-tubuline dans le cerveau du poisson |
0,004 (femelle) 0,02 (mâle) |
0,02 (femelle) 0,1 (mâle) (production considérablement plus faible) |
Protéine de base de la myéline dans le cerveau du poisson |
0,004 (femelle) 0,1 (mâle) |
0,02 (femelle) (production considérablement plus faible) Ne s’applique pas aux mâles |
Dopamine et sérotonine dans le cerveau du poisson femelle |
Sans objet |
0,004 (concentration considérablement plus faible) |
Dopamine et sérotonine dans le cerveau du poisson mâle |
0,1 |
Sans objet |
Activité de l’acétylcholinestérase chez le poisson adulte |
0,1 |
Sans objet |
Activité locomotrice |
0,1 |
Sans objet |
Dans une étude menée par Liu et al. (2013) s’intéressant aux effets du TDCPP sur les embryons et les larves du poisson zèbre, on n’a observé aucun changement dans le taux de survie 72 heures après éclosion et le taux de survie 120 heures après éclosion chez les organismes à l’essai exposés à une concentration de substance de 4 mg/L ou moins. Aucune malformation n’a été observée après une exposition à 2 mg/L de TDCPP, qui constituait la concentration maximale utilisée dans la deuxième partie de cette étude (Liu et al., 2013). En outre, il a été déterminé que le TDCPP influait sur l’expression de l’ARN messager associé à 6 réseaux de gènes de récepteurs à une très faible concentration (0,02 mg/L).
Dans une étude visant à évaluer la toxicité manifeste et le comportement dans les premiers stades de la vie d’un poisson zèbre (Danio rerio), les organismes d’essai ont été exposés à 0,033 à 100 µM de TCPP et de TDCPP pendant 0 à 5 jours après la fertilisation (JAF) (Dishaw et al., 2014). Une mortalité importante et de graves malformations ont été observées à partir du JAF 6 chez les poissons exposés au TDCPP à une concentration de 10 µM (l’équivalent de 4,3 mg/L). Toutefois, il n’y avait aucune mortalité ni aucune tératogénicité chez les poissons exposés au TCPP. L’activité de nage larvaire a été utilisée pour évaluer les effets neurocomportementaux. Les larves exposées au TCPP (100 µM, l’équivalent de 33 mg/L) étaient hyperactives à la lumière, même si leur capacité à nager n’était pas touchée comme l’a indiqué une activité normale durant la scotophase. Le TDCPP a entraîné une hyperactivité durant la photophase (5,6 µM, l’équivalent de 2,41 mg/L) et la scotophase (3,14 µM, l’équivalent de 1,35 mg/L) chez les organismes d’essai.
Dans une étude de toxicité chronique sur 28 jours avec Daphnia magna, Li et al. (2015) ont trouvé moins de descendants (34) à la concentration de traitement maximale (0,00645 mg/L) par rapport au groupe de témoins (39 descendants) (d’après un graphique). Des effets sur la longueur du corps ont également été observés chez les générations F0 et F1 des organismes d’essai. Une CE10 sur 28 jours de 0,0065 mg/L a été déterminée d’après les critères d’effets mentionnés pour la toxicité. L’expression de 155 gènes en cause dans 40 voies a été examinée, et on a constaté que l’expression de 57 gènes en cause dans 30 voies était significativement altérée. Sur la base d’un changement d’expression d’au moins 50 % chez au moins 3 gènes, on a déterminé que 9 de ces 30 voies avaient été altérées, y compris une voie pertinente pour la synthèse des hormones thyroïdiennes. Dans la même étude, on a signalé des effets sur la reproduction des organismes d’essai.
Dans une autre étude sur la toxicité chronique chez les poissons (Zhu et al., 2015), le nombre total d’œufs par femelle était significativement inférieur à celui du groupe témoin lorsque les femelles étaient exposées au TDCPP à une concentration de 0,0063 mg/L pendant 21 jours. On a établi une corrélation entre cet effet et l’expression des gènes dans les ovaires. Les effets sur le poids et la longueur du corps ont également été observés, mais seulement dans les organes des femelles après 120 jours d’exposition. Il n’y a pas eu de changement significatif dans l’histologie des gonades ni dans les concentrations de 11-cétotestostérone et de 17β-œstradiol (Zhu et al., 2015).
Dans l’ensemble, les études disponibles indiquent que l’exposition chronique au TDCPP a un effet sur la transcription des gènes associés à diverses fonctions biologiques (p. ex., la synthèse des protéines et la production d’hormones thyroïdiennes). Il y a lieu d’étudier plus à fond les voies par lesquelles les effets nocifs se manifestent, afin de comprendre quelle initiation moléculaire pourrait déclencher des événements clés ultérieurs et, en fin de compte, provoquer des modifications au niveau des organes ou des organismes.
7.1.1.3 Sélection de la valeur critique de toxicité pour les organismes aquatiques
Les principales études de toxicité pour les organismes aquatiques sont résumées dans le tableau 7.6 et sont à prendre en compte afin de sélectionner une valeur critique de toxicité pour les deux substances.
Substance |
Organisme d’essai |
Paramètre |
Valeur (mg/L) |
Référence |
|---|---|---|---|---|
TCPP |
Medaka Oryzias latipes |
CL50 sur 48 heures |
54,2 |
ECHA c2007-2017 |
TCPP |
Tête-de-boule Pimephales promelas |
CL50 sur 96 heures |
51 |
Mobil 1985 |
TCPP |
Embryons de poisson zèbre Danio rerio |
CL50 sur 96 heures |
13,5 |
Du et al. 2015 |
TCPP |
Crapet arlequin Daphnia magna |
CL50 sur 96 heures |
84 |
ECHA c2007-2017 |
TCPP |
Truite arc-en-ciel 2.0 Fonctions de distribution cumulative et ajustement des modèles |
CL50 sur 96 heures |
30 |
ECHA c2007-2017 |
TCPP |
Algues d’eau douce Pseudokirchneriella subcapitata |
CE50 sur 72 heures (taux de croissance) | 88 |
Wildlife International 2005b |
TCPP |
Algues d’eau douce Desmodesmus subspicatus |
CE50 sur 72 heures |
45 |
ECHA c2007-2017 |
TCPP |
Invertébrés Daphnia magna |
CSEO sur 21 jours (reproduction, mortalité des parents) |
32 |
SafePharm Laboratories 1995; UNEP 1999; WHO 1998 |
TCPP |
Algues d’eau douce Selenastrum capriconutum |
CSEO sur 96 heures |
6 |
Kroon et Ginkel 1992 |
TDCPP |
Cyprin doré Carassius auratus |
CL50 sur 24 heures |
1-5 |
ECHA c2007-2017 |
TDCPP |
Truite arc-en-ciel Oncorhynchus mykiss |
CL50 sur 96 heures |
1,1 |
SafePharm Laboratories 1993 |
TDCPP |
Médaka Oryzias latipes |
CL50 sur 96 heures |
3,6 |
ECHA c2007-2017 |
TDCPP |
Algues d’eau douce Pseudokirchneriella subcapitata |
CE50 sur 72 heures (taux de croissance) | 4,6 |
Wildlife International 2005c |
TDCPP |
Algues d’eau douce Desmodesmus subspicatus |
CSEO sur 72 heures (taux de croissance et biomasse) | > 10 |
ECHA c2007-2017 |
TDCPP |
Poisson zèbre Danio rerio |
Survie sur 6 jours |
0,6a |
Wang et al. 2013 |
TDCPP |
Poisson zèbre Danio rerio |
CE10 sur 6 jours b (malformation) | 0,3a |
Wang et al. 2013 |
TDCPP |
Poisson zèbre Danio rerio |
CE50 sur 21 jours (œufs accumulés) |
0,0063 |
Zhu et al. 2015 |
TDCPP |
Invertébrés Daphnia magna |
CE10 b sur 28 jours (nombre cumulatif de descendants, longueur du corps chez F0 et F1) |
0,0065 |
Li et al. 2015 |
TDCPP |
Poisson zèbre Danio rerio |
CSEO sur 90 jours (taux de survie et d’éclosion) |
0,004 |
Wang et al. 2015a |
TDCPP |
Poisson zèbre Danio rerio |
CSEO sur 180 jours (malformation) |
0,004 |
Wang et al. 2015b |
TDCPP |
Poisson zèbre Danio rerio |
CE10 b sur 240 jours (masse corporelle) |
0,0075 |
Yu et al. 2017 |
Abréviations : CE50 = concentration d’une substance susceptible de causer un effet chez 50 % des organismes d’essai; CL50 = concentration d’une substance susceptible de causer un décès chez 50 % des organismes d’essai; CSEO = concentration sans effet observé, c.-à-d. la concentration maximale ne causant pas d’effet statistiquement significatif par rapport aux témoins dans un essai de toxicité.
a La concentration d’essai la plus faible à laquelle un effet important a été observé.
b Différence de 10 % pour les paramètres ultimes signalés chez les organismes d’essai, par rapport aux témoins.
Pour le TCPP, la plus faible valeur de toxicité aiguë relevée est de 13,5 mg/L pour les embryons de poisson zèbre, déterminée à partir d’une étude de la CL50 sur 96 heures. Ce résultat a été choisi comme valeur critique de toxicité (VCT). Un facteur d’évaluation de 50 a été appliqué pour extrapoler une concentration létale aiguë à une concentration sans effet à long terme (CESE), en tenant compte du nombre d’espèces et de catégories d’organismes représentés dans l’ensemble de données disponibles (tableau 7‑7).
En ce qui concerne le TDCPP, aucun effet sur la survie et l’éclosion des embryons de poisson zèbre et aucun cas de malformation n’ont été signalés chez les poissons exposés à la substance à une concentration de 0,004 mg/L dans des études à long terme (Wang et al., 2015a et 2015b). Par ailleurs, on a constaté dans quelques autres études (Zhu et al., 2015; Li et al., 2015; Yu et al., 2017) certains effets sur le développement et la reproduction de Daphnia magna et du poisson zèbre. La CE50 sur 21 jours (production accumulée d’œufs) de 0,0063 mg/L était la plus faible concentration causant l’effet le plus significatif dans les études de toxicité chronique du TDCPP. Par conséquent, cette valeur (CE50 sur 21 jours = 0,0063 mg/L) a été choisie comme VCT et utilisée pour calculer une CESE pour cette substance (tableau 7‑7).
Substance |
VCT (mg/L) |
FE |
CESE (mg/L) |
|---|---|---|---|
TCPP |
CL50 sur 96 heures = 13,5 |
50a |
0,27 |
TDCPP |
CE50 sur 21 jours = 0,0063 (production accumulée d’œufs) |
5b |
0,0013 |
a Un facteur d’évaluation (FE) de 50 est appliqué pour calculer une concentration estimée sans effet (CESE) à long terme à partir de données de toxicité aiguë létale, en tenant compte du nombre d’espèces et de catégories d’organismes dans l’ensemble de données disponibles.
b Un FE de 5 est appliqué pour calculer une CESE à long terme à partir de données de toxicité chronique sublétale, en tenant compte du nombre d’espèces et de catégories d’organismes dans l’ensemble de données disponibles.
7.1.2 Toxicité pour les organismes vivant dans les sédiments
On n’a relevé aucune donnée de toxicité dans les sédiments pour le TCPP. Étant donné que le TCPP et le TDCPP ont présenté différents niveaux de toxicité sur les organismes aquatiques et des effets sur le système endocrinien, on considère qu’il ne convient pas de déterminer l’effet du TCPP sur les organismes vivant dans les sédiments par l’intermédiaire d’une lecture croisée. Par conséquent, la CESE n’est pas calculée pour le TCPP dans ce milieu.
Des données sur la toxicité dans les sédiments ont été relevées pour le TDCPP. Dans quelques études portant sur l’exposition chronique des moucherons au TDCPP, les CE50 sur 28 jours rapportées varient de 16 à > 71 mg/kg poids sec (p.s.); les CSEO rapportées varient de 3,9 à 71 mg/kg p.s. (Wildlife International, 2006b, 2006c, 2006d).
Après examen des données empiriques, la CE50 sur 28 jours (apparition des moucherons) de 16 mg/kg p.s. a été sélectionnée en tant que VCT pour le TDCPP. Une teneur en carbone organique de 5,3 % ayant été rapportée dans cette étude, la VCT a été ajustée par rapport à la teneur en carbone organique standard de 3 % avant de calculer la CESE. Compte tenu des données disponibles pour les sédiments, un facteur d’évaluation de 50 a été utilisé pour calculer la CESE, pour extrapoler une concentration sans effet avec exposition chronique d’après un critère d’effet médian chronique et pour tenir compte de la variabilité interspécifique et intraspécifique. Cela donne une CESE dans les sédiments de 0,18 mg/kg p.s. pour le TDCPP.
7.1.3 Toxicité pour les organismes vivant dans le sol
Des études de toxicité ont été menées sur les lombrics afin d’étudier les effets du TCPP et du TDCPP sur les organismes du sol. Après avoir exposé les lombrics (Eisenia foetida) à ces substances pendant une période allant jusqu’à huit semaines, les CE50, CL50 et les CSEO ont été rapportés (SafePharm Laboratories, 1996b et 1996c; Phytosafe, 2003a et 2004a). Ces valeurs ont été résumées dans le tableau 7‑8.
Deux études ont examiné la toxicité du TCPP et du TDCPP sur les plantes terrestres. Dans une étude, le blé commun (Triticum aestivum), la moutarde (Sinapis alba) et la laitue (Lactuca sativa) ont été exposés au TCPP pendant 21 jours et les effets sur le poids sec des plantes et la levée des plantules ont été étudiés à la fin de l’expérience (Phytosafe, 2003b). La CSEO la plus faible de l’étude était de 17 mg/kg p.s. pour la levée des plantules de la laitue. Dans une autre étude, le blé (Triticum aestivum), la moutarde (Sinapis alba) et le trèfle rouge (Trifolium pratense) ont été exposés au TDCPP et les effets sur l’émergence et la croissance des plantes ont été évalués (Phytosafe, 2004b). La CSEO la plus faible dans cette étude était de 19,3 mg/kg p.s. pour la levée des plantules.
Les résultats des principales études de toxicité dans le sol sont résumés dans le tableau 7-8 ci-dessous.
Substance |
Organisme d’essai |
Paramètre |
Valeur (mg/kg p.s.) |
Référence |
|---|---|---|---|---|
TCPP |
|
CL50 sur 14 jours |
97 |
SafePharm Laboratories 1996b |
TCPP |
|
CSEO de 14 jours (mortalité) | 32 |
SafePharm Laboratories 1996b |
TCPP |
|
CE50 sur 56 jours (reproduction) | 71 |
Phytosafe 2003a |
TCPP |
|
CSEO sur 56 jours (reproduction) | 53 |
Phytosafe 2003a |
TCPP |
|
CSEO sur 21 jours (émergence) | 17 |
Phytosafe 2003b |
TDCPP |
|
CL50 sur 14 jours |
130 |
SafePharm Laboratories 1996c |
TDCPP |
|
CSEO sur 14 jours (mortalité) | 100 |
SafePharm Laboratories 1996c |
TDCPP |
|
CE50 sur 57 jours (reproduction) | 67 |
Phytosafe 2004a |
TDCPP |
|
CSEO sur 57 jours (reproduction) | 9,6 |
Phytosafe 2004a |
TDCPP |
|
CSEO sur 19 jours (émergence) | 19,3 |
Phytosafe 2004b |
La CE50 sur 56 jours de 71 mg/kg p.s. et la CE50 sur 57 jours de 67 mg/kg p.s. étaient considérées comme les VCT pour le TCPP et le TDCPP, respectivement. Des teneurs en carbone organique ayant été rapportées dans ces études, les VCT ont été ajustées par rapport à la teneur en carbone organique standard de 2 % avant de calculer les CESE.
Compte tenu des données disponibles pour le sol, un facteur d’évaluation de 50 a été utilisé pour calculer les CESE, pour extrapoler une concentration sans effet avec exposition chronique d’après un critère d’effet médian sublétal et pour tenir compte de la variabilité interspécifique et intraspécifique. Les résultats sont présentés dans le tableau 7-9 ci-dessous.
Substance |
VCT (mg/kg p.s.) |
Teneur en CO (%) |
FE |
CESE (mg/kg p.s.) |
|---|---|---|---|---|
TCPP |
CE50 sur 56 jours = 71 |
1,4 |
50 |
2,03 |
TDCPP |
CE50 sur 57 jours = 67 |
10 |
50 |
0,27 |
7.1.4 Toxicité pour les oiseaux et les mammifères
Les études in vitro et in ovo sur le TCPP et le TDCPP ont été menées pour étudier leur neurotoxicité, leur cytotoxicité et les effets génétiques; les constatations fournissent des détails sur la réactivité chimique et le mode d’action. On note que les niveaux d’exposition utilisés dans ces études sont supérieurs de plusieurs ordres de grandeur aux concentrations des deux substances mesurées dans l’environnement canadien (c.-à-d. eau et œufs). Par conséquent, les effets observés dans les expériences en laboratoire ne devraient pas l’être à l’état sauvage d’après leurs niveaux d’événements environnementaux. Par conséquent, les données de toxicité provenant des études in vitro ou in ovo n’ont pas été utilisées dans l’analyse du quotient de risque pour ces substances.
7.1.4.1 Neurotoxicité
L’exposition au TCPP et au TDCPP n’a pas induit d’effet neurologique chez les poules ou les mammifères, respectivement. Les détails sont présentés dans les sections 8.2.1.6 et 8.2.2.6.
7.1.4.2 Effets sur le système endocrinien
Les effets sur le système endocrinien pour ces deux substances ont été évalués in ovo et in vitro.
Dans une étude dans laquelle on a surtout utilisé les cultures primaires de cellules neuronales aviaires, Crump et al. (2012) ont signalé que le TDCPP avait une cytotoxicité plus élevée que le TCPP. Les effets sur l’expression de l’ARN messager en association avec une variété de fonctions biologiques ont été étudiés. Les deux substances pourraient avoir un effet sur la transcription des gènes liés à la voie de l’hormone thyroïdienne à une concentration égale ou supérieure à 10 µM (équivalant à 3,3 mg/L et 4,3 mg/L, respectivement) (Crump et al., 2012).
Dans une étude de toxicité in ovo (Farhat et al., 2013), du TCPP et du TDCPP ont été injectés séparément dans des œufs de poulet et les concentrations les plus élevées utilisées étaient de 51 600 et 45 000 ng/g poids humide (p.h.) d’œufs, respectivement. On n’a observé aucune réaction létale, quelles que soient les doses de traitement des substances. Seul le TDCPP a fortement réduit les niveaux de T4 dans le plasma à une concentration de 7 640 ng/g et plus. De plus, on n’a observé aucun effet sur le bêchage des embryons de poulet. Toutefois un retard dans le bêchage a été observé dans des groupes ayant reçu une concentration plus élevée des deux substances, à 9 240 ng/g et plus pour le TCPP et à 7 640 ng/g et plus pour le TDCPP. Le développement embryonnaire (longueur du tarse, masse embryonnaire, longueur de la tête et du bec et taille de la vésicule biliaire) a été perturbé par les deux substances d’essai à la concentration maximale. On note que les niveaux d’exposition dans les études susmentionnées sont bien plus élevés que les concentrations mesurées dans les œufs d’oiseaux, à savoir < 6,7 ng/g pour le TCPP et jusqu’à 0,17 pour le TDCPP présents dans l’environnement (Chen et al., 2012; Leonards et al., 2011).
Dans une étude de 21 jours, des crécelles d’Amérique en captivité ont été regroupées et nourries avec du TCPP et du TDCPP à la même dose de 22 ng produits ignifuges organophosphorés/g p.c./j (Fernie et al., 2015). L’exposition à ces deux substances n’a pas eu d’effet significatif sur la masse corporelle ou la prise de poids corporel au fil du temps chez les organismes testés. Ces deux substances n’ont pas été détectées dans les tissus, ce qui laisse entendre un métabolisme rapide. Cependant, un certain effet biologique, c’est‑à‑dire le rapport A:G plasmique, a été observé chez les crécelles exposées au TCPP et au TDCPP. En outre, on a observé des effets sur les concentrations de triiodothyronine (T3) et la thyroxine (T4) dans le plasma ainsi que des changements dans la structure de la thyroïde et les activités enzymatiques connexes chez les organismes d’essai exposés au TCPP et au TDCPP (Frenie et al., 2015).
Des études in vitro ont été menées à l’aide de cellules mammaliennes pour évaluer les effets du TCPP et du TDCPP sur le système endocrinien (Follmann et Wober, 2006; Kojima et al., 2013). Les détails sont décrits dans les sections 8.2.1.4 et 8.2.2.5.
7.1.4.3 Effets génétiques
Les effets génétiques ont été également évalués dans l’étude de Farhat et al. (2013). Parmi les neuf transcriptions de l’ARN messager étudiées, des effets des deux substances sur certaines expressions génétiques ont été observés uniquement aux concentrations les plus élevées de TCPP et de TDCPP, à 51 600 et 45 000 ng/g p.h. d’œufs, respectivement (Farhat et al., 2013). Farhat et al. (2013) indiquent que les faibles concentrations de résidus dans les tissus relatives aux doses injectées peuvent être dues au métabolisme rapide du TCPP et du TDCPP dans les embryons de poulet, ce qui concorde avec l’observation faite dans les études sur les rats qui démontrent que la majorité des doses de TCPP et de TDCPP ont été éliminées rapidement dans les quelques jours qui ont suivi l’administration (Lynn et al., 1980; Minegishi et al., 1988).
Dans la même étude sur la cytotoxicité et l’expression de l’ARN messager dans les cultures de cellules aviaires (Crump et al., 2012), les deux substances ont perturbé la transcription des gènes associés au métabolisme xénobiotique (CYP2H1), à la voie des hormones thyroïdiennes et au métabolisme lipidique (L‑FABP et HRSP14-α), ainsi qu’à la croissance (IGF-1). Les deux substances ont démontré une régulation positive de la plupart des gènes étudiés à une concentration de 10 µM (équivalent à 3,3 mg/L et 4,3 mg/L pour le TCPP et le TDCPP, respectivement), à l’exception du TDCPP qui a démontré un effet sur l’expression de l’ARN messager d’un gène associé au métabolisme lipidique (L‑FABP) à toutes les concentrations d’essai (0,01 µM et plus, équivalent à 0,0043 mg/L et plus).
7.2 Évaluation de l’exposition de l’environnement
7.2.1 Concentrations environnementales mesurées
7.2.1.1 Données de surveillance environnementale pour le Canada
Il existe plusieurs études faisant état des concentrations dans l’environnement pour le TCPP et le TDCPP au Canada. Certaines de ces études ont mesuré les isomères individuels du TCPP (p. ex., ceux que l’on retrouve dans des produits commerciaux). Dans ces études, les concentrations mesurées ont été déterminées pour le TCPP lui-même ou pour la somme des isomères dans les échantillons environnementaux. Quelques autres études n’ont pas traité des isomères dans leurs rapports. Étant donné la prédominance du TCPP et la proportion considérablement plus faible de ses isomères de chaîne dans la plupart des produits commerciaux, ainsi que leur devenir semblable dans l’environnement, on considère que les concentrations mesurées rapportées dans les études de surveillance de l’environnement conviennent pour caractériser la présence de TCPP dans l’environnement, même en l’absence de renseignements sur les isomères du TCPP.
Des renseignements détaillés sont présentés dans ECCC (2019), et les principaux résultats sont résumés ci-dessous.
Des niveaux élevés de TCPP et de TDCPP dans l’air ont été signalés, d’après des échantillons prélevés sur le lac Supérieur, à une concentration de 1,35 ng/m3 pour le TCPP et de 0,034 ng/m3 pour le TDCPP au cours de l’année 2005 (Shoeib et Jantunen, 2013), et plus récemment dans l’Arctique canadien, entre 0,075 et 0,145 ng/m3 pour le TCPP et à 0,005 ng/m3 pour le TDCPP (Jantunen et al., 2013a). Dans une étude récente, le TCPP et le TDCPP ont été trouvés à 0,67 ng/m3 et à 0,15 ng/m3, respectivement, dans des échantillons d’air prélevés à Toronto au cours de l’année 2012 (Shoeib et al., 2014). Ces études ont montré que les deux substances sont associées à des particules atmosphériques (Shoeib et Jantunen 2013; Jantunen et al., 2013a; Shoeib et al., 2014).
Un certain nombre d’études environnementales ont fait état de la présence des deux substances dans les effluents des systèmes de traitement des eaux usées (STU), dans des échantillons de pluie et dans les eaux de surface (rivières et lacs) en Ontario (Andresen et al., 2007; Jantunen et al., 2013b; Venier et al., 2014; ECCC 2016a; Truong 2016; Truong et al., 2017; Hao et al., 2018). Le TCPP et le TDCPP ont tous deux été trouvés dans des échantillons prélevés dans les STEU visées par ces projets.
Pour ce qui est des eaux de surface, le TCPP a été détecté dans tous les échantillons de pluie et les échantillons d’eaux de surface prélevés dans tous les endroits de la région des Grands Lacs et des effluents de la région de Toronto. Cependant, la fréquence de détection du TDCPP dans les échantillons environnementaux était considérablement moindre. Le TDCPP n’a pas été détecté dans tous les échantillons de pluie et dans les échantillons d’eaux de surface en quelques endroits. Dans d’autres endroits où le TDCPP a été trouvé, cette substance était en quantité inférieure à la limite de détection (LD) dans certains des échantillons prélevés. Les données de surveillance du TCPP et du TDCPP dans l’environnement aquatique au Canada sont résumées dans les tableaux 7‑10 et 7‑11 ci-dessous.
| Milieu | Plage des concentrations mesurées (mg/L) | Concentration médiane mesurée (mg/L) | Concentration moyenne mesurée (mg/L) | Fréquence de détection (%) (nbre d’échantillons, si indiqué) | Référence |
|---|---|---|---|---|---|
| Effluent de la STEU1 | Non signalée | Non signalée | 7,8 × 10-5 | Non signalée | Andresen et al. 2007 |
| Effluent de la STEU2 | Non signalée | Non signalée | 6,9 × 10-5 | Non signalée | Andresen et al. 2007 |
| Effluents de la STEU8 | 4,7 × 10-4 – 2,6 × 10-3 | 1,1 × 10-3 | Non signalée | 100 (n = 36) | ECCC 2016a |
| STEU1 | 1,2 × 10-3 – 4,1 × 10-3 | 2,3 × 10-3 | 2,5 × 10-3 | 100 (n = 8) | Truong 2016 |
| STEU2 | 1,5 × 10-3 – 7,7 × 10-3 | 2,1 × 10-3 | 2,8 × 10-3 | 100 (n = 7) | Truong 2016 |
| STEU3 | 3,7 × 10-4 – 3,9 × 10-3 | 1,8 × 10-3 | 2,0 × 10-3 | 100 (n = 10) | Truong 2016 |
| STEU | 1,5 × 10-3 – 6,8 × 10-3 | Non signalée | 3,8 × 10-3 | 100 (n = 6) | Truong et al. 2017b |
| Effluents d’un STEU | 1,3 × 10-3 – 2,4 × 10-3 | Non signalée | Non signalée | 100 (n = 17) | Hao et al. 2018 |
| Biosolides de la STEU8 | 7,6 × 10-5 – 1,5 × 10-3 | 2,5 × 10-4 | Non signalée | 100 (n = 36) | ECCC 2016a |
| Échantillons de pluie | LD – 9,2 × 10-4 | 1,1 × 10-4 | 2,3 × 10-4 | 75 (n = 16) | Truong 2016 |
| Échantillons de pluie | 5,0 × 10-5 – 9,2 × 10-4 | Non signalée | 3,9 × 10-4 | 100 (n = 8) | Truong et al. 2017 |
| 13 affluents | 4,6 × 10-6 – 1,8 × 10-3 | Non signalée | 2,4 × 10-5 – 8,4 × 10-4 | Non signalé | Jantunen et al. 2013b |
| 4 points d’échantillon. sur le lac Ontario | Non signalée | Non signalée | 3,4 × 10-6 – 4,9 × 10-5 | 100 (n = 4) | Andresen et al. 2007 |
| Eau sublittorale du lac Ontario | 6,6 × 10-5 – 3,6 × 10-4 | 6,6 × 10-5 | 1,2 × 10-4 | 67 (n = 18) | Truong 2016 |
| Eaux de surface des Grands Lacs | 2,6 × 10-6 – 1,2 × 10-5 | Non signalée | Non signalée | 100 | Venier et al. 2014 |
| Ruisseau Etobicoke – débit lent | 3,4 × 10-4 – 1,4 × 10-3 | 1,0 × 10-3 | 9,2 × 10-4 | 100 (n = 7) | Truong 2016 |
| Ruisseau Etobicoke – débit élevé | 4,3 × 10-4 – 5,1 × 10-3 | 2,3 × 10-3 | 2,1 × 10-3 | 100 (n = 26) | Truong 2016 |
| Rivière Don – débit lent | 5,1 × 10-4 – 4,9 × 10-3 | 1,1 × 10-3 | 1,6 × 10-3 | 100 (n = 7) | Truong 2016 |
| Rivière Don – débit élevé | 7,9 × 10-4 – 4,2 × 10-3 | 1,5 × 10-3 | 1,8 × 10-3 | 100 (n = 22) | Truong 2016 |
| Ruisseau Highland – débit lent | 9,3 × 10-5 – 1,5 × 10-3 | 7,8 × 10-4 | 7,9 × 10-4 | 100 (n = 7) | Truong 2016 |
| Ruisseau Highland – débit élevé | 3,5 × 10-4 – 2,8 × 10-3 | 1,0 × 10-3 | 1,1 × 10-3 | 100 (n = 24) | Truong 2016 |
| Cours d’eau | 1,1 × 10-3 – 4,4 × 10-3 | Non signalée | 2,7 × 10-3 | 100 (n = 14) | Truong et al. 2017 |
| Eau de surface | 2,9 × 10-4 – 2,0 × 10-3 | Non signalée | Non signalée | 60 (n = 20) | Hao et al. 2018 |
Abréviations : STEU = station de traitement des eaux usées; LD = limite de détection.
a Bien que les effluents, les boues et les biosolides des STEU ne constituent pas « l’environnement », ils constituent néanmoins une source directe de rejets dans l’environnement et sont inclus dans ce tableau, car ils constituent la voie par laquelle le TCPP et le TDCPP présents dans les effluents industriels pourraient être rejetés dans l’environnement.
b Dans Truong et al., 2017, l’analyse en laboratoire a inclus chacun des isomères du TCPP. Les concentrations mesurées et présentées dans le tableau sont la somme des 4 isomères de TCPP présents dans les échantillons.
| Milieu | Plage des concentrations mesurées (mg/L) | Concentration médiane mesurée (mg/L) | Concentration moyenne mesurée (mg/L) | Fréquence de détection (%) | Référence |
|---|---|---|---|---|---|
| Effluent de la STEU1 | Non signalée | Non signalée | 3,5 × 10-5 | Non signalée | Andresen et al. 2007 |
| Effluent de la STEU2 | Non signalée | Non signalée | 2,6 × 10-5 | Non signalée | Andresen et al. 2007 |
| Effluents de la STEU8 | 8,7 × 10-5 – 4,2 × 10-4 | 2,3 × 10-4 | Non signalée | 100 (n = 36) | ECCC 2016a |
| STEU1 | 6,5 × 10-4 – 2,3 × 10-3 | 1,1 × 10-3 | 1,3 × 10-3 | 100 (n = 8) | Truong 2016 |
| STEU2 | 4,0 × 10-4 – 1,9 × 10-3 | 7,0 × 10-4 | 8,7 × 10-4 | 100 (n = 7) | Truong 2016 |
| STEU3 | LD – 2,1 × 10-3 | 8,8 × 10-4 | 9,9 × 10-4 | ?? (n = 10) | Truong 2016 |
| Effluents d’un STEU | 2,1 × 10-4 – 4,0 × 10-4 | Non signalée | Non signalée | 100 (n = 17) | Hao et al. 2018 |
| Biosolides de la STEU8 | 6,6 × 10-5 – 3,6 × 10-4 | 1,4 × 10-4 | Non signalée | 100 (n = 36) | ECCC 2016a |
| Échantillons de pluie | LD | Sans objet | Sans objet | Sans objet | Truong 2016 |
| 13 affluents | – 1,4 × 10-3 | - | 2,0 × 10-6 – 1,3 × 10-5 | - | Jantunen et al. 2013b |
| 4 points d’échantillon. sur le lac Ontario | Non signalée | Non signalée | 2,1 × 10-6 – 1,9 × 10-5 | Non signalée | Andresen et al. 2007 |
| Eau sublittorale du lac Ontario | LD | Sans objet | Sans objet | 0 (n = 18) | Truong 2016 |
| Eaux de surface des Grands Lacs | 8,7 × 10-7 – 4,0 × 10-6 | Non signalée | Non signalée | 100 | Venier et al. 2014 |
| Ruisseau Etobicoke – débit lent (n = 7) | LD | Sans objet | Sans objet | 0 (n = 7) | Truong 2016 |
| Ruisseau Etobicoke – débit élevé | LD – 4,7 × 10-4 | 1,7 × 10-4 | 1,8 × 10-4 | 65 (n = 26) | Truong 2016 |
| Rivière Don – débit lent | LD – 3,7 × 10-4 | LD | 1,4 × 10-4 | 43 (n = 7) | Truong 2016 |
| Rivière Don – débit élevé | LD – 3,7 × 10-4 | 1,6 × 10-4 | 1,6 × 10-4 | 64 (n = 22) | Truong 2016 |
| Ruisseau Highland – débit lent | LD | - | - | 0 (n = 7) | Truong 2016 |
| Ruisseau Highland – débit élevé | LD – 3,2 × 10-4 | 9,0 × 10-5 | 1,3 × 10-4 | 50 (n = 24) | Truong 2016 |
| Effluents d’eaux usées | 1,3 × 10-4 | Non signalée | Non signalée | 5 (n = 20) | Hao et al. 2018 |
Abréviation : STEU = station de traitement des eaux usées; LD = limite de détection.
a Bien que les effluents, les boues et les biosolides des STEU ne constituent pas « l’environnement », ils constituent néanmoins une source directe de rejets dans l’environnement et sont inclus dans ce tableau, car ils constituent la voie par laquelle le TCPP et le TDCPP des intrants industriels pourraient être rejetés dans l’environnement.
Aucune donnée n’a été déterminée pour les concentrations de TCPP ou de TDCPP dans le sol ou les sédiments au Canada.
McGoldrick et al. (2014) ont produit un rapport sur les concentrations de 6 produits ignifuges organophosphorés dans le corps entier homogénéisé de la truite grise et du doré jaune provenant de 16 plans d’eau de tout le Canada, allant des lacs nordiques éloignés soumis à une influence humaine minime (p. ex., lac Kusawa) aux lacs situés dans des régions fortement peuplées soutenant des activités agricoles et industrielles intenses (p. ex., lac Ontario). Le TCPP et le TDCPP ont été détectés au-dessus de leurs limites respectives de quantification (0,23 ng/g p.h. pour le TCPP et 0,11 ng/g p.h. pour le TDCPP) dans seulement une truite grise individuelle provenant du Grand lac de l’Ours dans les Territoires du Nord-Ouest. Les concentrations faibles à non détectables de TCPP et de TDCPP dans les poissons sont probablement dues à la décomposition métabolique.
Chen et al. (2012) ont rapporté des niveaux de produits ignifuges organophosphorés dans les œufs de goéland argenté recueillis sur l’île Channel‑Shelter (lac Huron) en 2010. Les concentrations de TCPP ont été détectées au-dessus de la limite de détection dans 12 des 13 échantillons et la concentration maximale était de 4,1 ng/g p.h. Les concentrations de TDCPP ont été détectées au-dessus de la limite de détection dans 2 des 13 échantillons et la concentration maximale était de 0,17 ng/g p.h. (Chen et al., 2012).
Dans une autre étude, 16 esters d’organophosphate ont été examinés chez les goélands argentés femelles (Larus argentatus) et leurs œufs provenant d’un site de colonie du lac Huron (Greaves et Letcher, 2014). Le TCPP et le TDCPP ont tous deux été détectés dans le jaune d’œuf séparé et l’albumine dans les mêmes proportions que celles rapportées par Chen et al. (2012). Parmi 6 parties du corps (graisse, muscle, globules rouges, plasma sanguin, foie et cerveau), le TCPP a été détecté uniquement dans les tissus adipeux et musculaires, avec une concentration plus importante dans la graisse (2,31 ± 1,64 ng/g p.h.), tandis que le TDCPP a été décelé dans les 6 parties du corps, la plus grande concentration ayant été observée dans les muscles (5,04 ± 3,69 ng/g p.h.) (Greaves et Letcher, 2014). Les mesures du TCPP et du TDCPP dans les œufs, dans ces études (Chen et al., 2012; Greaves et Letcher 2014) sont des indicateurs de la reproduction à proximité des zones urbaines très peuplées.
Su et al. (2014) ont analysé des échantillons de plasma provenant des goélands argentés qui ont été prélevés sur l’île Chantry (lac Huron). Puisque les triesters d’organophosphate devraient se dégrader en diesters d’organophosphate, une analyse du BCPP et du BDCPP a également été incluse dans l’étude (Su et al., 2014). Le TCPP et le BCPP n’ont pas été détectés dans l’un ou l’autre des 6 échantillons de plasma. Toutefois, le TDCPP a été décelé dans la moitié des échantillons de plasma et les concentrations mesurées variaient de 0,11 à 0,41 ng/g p.h. Pour ce qui est du BDCPP, il a été observé dans les 6 échantillons de plasma et les concentrations mesurées variaient de 0,72 à 3,49 ng/g p.h., montrant ainsi le métabolisme du TDCPP.
Dans un rapport non publié, de faibles concentrations de TCPP (0,9 à 5,5 ng/g p.h.) et de TDCPP (0,3 à 1,0 ng/g p.h.) dans le plasma ont été signalées chez des oisillons de faucon pèlerin (Falco peregrinus) (cité dans Fernie et al., 2015).
7.2.1.2 Données de surveillance environnementale obtenues dans d’autres pays
Le TCPP et le TDCPP ont également été mesurés dans l’air ambiant, les systèmes aquatiques, les sols, les sédiments, les plantes et le biote aquatique dans d’autres pays (annexe B2, ECCC 2019). Des écarts dans les concentrations rapportées de TCPP et de TDCPP dans différents pays peuvent découler des différents niveaux d’utilisation des produits contenant du TCPP et du TDCPP (Sundkvist et al., 2010).
Ces deux substances ont également été mesurées dans le sol en Europe et en Chine. Mihajlovic et al. (2011) ont mesuré une concentration moyenne de 0,0012 mg/kg de TCPP dans 6 échantillons de sol en Allemagne. Cependant, le TDCPP était inférieur à la limite de détection de 9 × 10-5 mg/kg.
Cui et al. (2017) ont mesuré le TCPP et le TDCPP dans des échantillons de sol urbain dans la ville subtropicale de Guangzhou, en Chine. L’échantillonnage a été effectué dans des parcs, des rizières et des champs de légumes, des zones commerciales, des ceintures vertes avec routes et des zones résidentielles. Le TCPP et le TDCPP ont tous deux été trouvés dans toutes ces zones d’échantillonnage. Les concentrations moyennes mesurées de TDCPP dans ces zones sont plus élevées que celles du TCPP. Parmi ces cinq zones d’échantillonnage, la fréquence de détection des deux substances dans les échantillons prélevés dans les parcs (n = 11), les zones commerciales (n = 12) et les ceintures vertes avec routes (n = 16) était de 100 %. Les concentrations moyennes les plus élevées des deux substances ont été relevées dans les zones commerciales et étaient de 0,006 mg/kg et 0,034 mg/kg, respectivement (Cui et al., 2017).
Des concentrations de produits ignifuges organophosphorés dans les influents et les effluents des STEU ont été rapportées dans quelques études de suivi environnemental (van der Venn et de Boer, 2012; Bendz et al., 2005). Les résultats indiquent une faible efficacité d’élimination du TCPP et du TDCPP dans diverses STEU en Espagne, en Allemagne, en Norvège, en Suède et au Japon (ECCC 2019). Ces renseignements sont pris en compte pour estimer les rejets de TCPP et de TDCPP dans l’environnement.
7.2.2 Scénarios d’exposition et concentrations environnementales estimées (CEE) au Canada
On dispose de certaines concentrations mesurées de TCPP et de TDCPP dans les eaux de surface au Canada. Pour les besoins de cette évaluation préalable, les concentrations dans l’environnement de TCPP et de TDCPP associées aux utilisations industrielles et de produits de consommation sont estimées d’après les renseignements disponibles, y compris les quantités d’utilisation, les taux de rejets estimés et les caractéristiques de l’environnement récepteur. Des renseignements sont fournis dans les sections suivantes.
7.2.2.1 Concentrations environnementales estimées de TCPP et de TDCPP dans le milieu aquatique dues à des utilisations industrielles
Les utilisations industrielles de TCPP et de TDCPP comprennent la fabrication de mousses de polyuréthane et de polyisocyanurate. Pour estimer l’exposition aquatique au TCPP et au TDCPP, on suppose que les deux substances sont rejetées au cours des activités industrielles vers un système d’assainissement qui rejette ses effluents dans un plan d’eau de surface récepteur. Les concentrations des substances dans les eaux réceptrices près du point de rejet de l’usine de traitement des eaux usées sont utilisées comme concentrations environnementales estimées (CEE), qui sont ensuite utilisées pour caractériser le risque que posent les substances en milieu aquatique.
La CEE aquatique due aux rejets par les activités industrielles (Ceau-ind) est calculée à l’aide de l’équation suivante.
Ceau-ind = (1000 × Q × P × (1 - T)) / (N×F×D)
Où :
Ceau-ind : concentration en milieu aquatique due aux rejets industriels, en mg/L
Q : quantité totale de substance utilisée chaque année sur un site industriel, en kg/an
P : pertes dans les eaux usées, fraction
T : taux d’élimination par le STEU, fraction
N : nombre de jours de rejets par an, en jour/an
F : débit de l’effluent de la STEU, en m3 par jour
D : facteur de dilution des eaux réceptrices, sans dimension
Étant donné que le TCPP et le TDCPP sont utilisés par des installations industrielles et qu’ils devraient être rejetés dans l’eau, plusieurs scénarios de rejets industriels en milieu aquatique ont été élaborés pour couvrir une gamme d’activités industrielles potentielles diverses au Canada. Les scénarios incluent le mélange de polyol et la fabrication de mousses de polyuréthane. Les informations recueillies auprès de différentes installations ont été prises en compte pour élaborer des scénarios d’exposition, afin de refléter le mieux possible les pratiques et les conditions, notamment le type de traitement des eaux usées, les rejets directs ou indirects dans le milieu récepteur et l’environnement récepteur.
Les valeurs d’entrée permettant d’estimer les concentrations aquatiques de TCPP et de TDCPP issues des activités industrielles sont résumées dans le tableau 7‑12.
Paramètre |
Valeur d’entrée pour le TCPP |
Valeur d’entrée pour le TDCPP |
|---|---|---|
Quantité utilisée par site (kg) |
100000 à 2000000 (ECCC 2013-2014) | 10000 à 200000 (ECCC 2013-2014) |
Pertes dans les eaux usées (%)a |
0,0011 à 0,3 | 0,0011 |
Efficacité d’élimination de la STEU sur place (%)b |
0
|
0
|
Taux d’efficacité d’élimination hors site de la STEU (%)c |
0 (van der Veen et de Boer, 2012) | 10-13 (ASTreat 2006, modèle STP‑EX (c2000-2013)) |
Nombre de jours de rejet par année (jours)d |
200–250
|
250
|
Débit de l’effluent du système d’assainissement des eaux usées, en m3 par jour |
4210 à 2100000 | 2908 à 2100000 |
Facteur de dilution (–)e |
1 à 10 |
1 à 10 |
a 0,0011 % représente 0,00006 % provenant de la maturation et de l’entreposage aux sites de production de la mousse et 0,0005 % provenant d’un traitement supplémentaire pour le TCPP et le TDCPP (EURAR, 2008a et 2008b); 0,3 % correspond à l’hypothèse standard pour le nettoyage des contenants servant au mélange de grands volumes, uniquement applicable au TCPP.
b Aucun traitement des eaux usées hors site n’est prévu.
c Le taux d’efficacité d’élimination hors site de la STEU est déterminé d’après les différents types de traitement des eaux usées, notamment l’utilisation de lagunes, le traitement primaire et le traitement secondaire.
d Les renseignements propres au site disponibles dans les données de l’Inventaire national des rejets de polluants (INRP) sont utilisés; autrement, une période standard de 250 jours est prise en compte pour les substances produites en grande quantité (Commission européenne, 2003).
e En général, le facteur de dilution correspond au ratio entre le débit de l’environnement récepteur et le débit de l’usine de traitement des eaux usées propre au site. Lorsque le facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée.
En tenant compte des renseignements ci-dessus, les CEE dans l’eau de surface sont calculées comme suit : 2 × 10-6 – 0,12 mg/L pour le TCPP et 1 × 10-7 – 1,6 × 10-4 mg/L pour le TDCPP.
7.2.2.2 CESE pour le TCPP et le TDCPP dans le milieu aquatique via les eaux usées de lavage en raison de l’utilisation de produits de consommation
Outre les sources industrielles, le TCPP et le TDCPP peuvent être rejetés dans l’environnement à partir d’articles manufacturés et de produits de consommation. Pour les émissions issues des produits de consommation, l’Union européenne a rapporté que la perte totale de TCPP ou TDCPP dans l’air et les eaux usées au cours de la durée de vie utile à l’intérieur ne devrait pas être supérieure à 0,25 %; la perte dans les eaux usées au cours de la vie utile extérieure devrait être de 0,75 % ou moins par an pour les deux substances; les mousses en fin de vie utile seront éliminées dans les sites d’enfouissement et les rejets devraient être négligeables (EURAR, 2008a et 2008b).
Comme le TCPP et le TDCPP ont été trouvés dans l’air intérieur et dans les échantillons de poussière au Canada et dans d’autres pays, il est fort probable qu’il y ait des rejets de ces deux substances dans l’environnement canadien à partir de produits de consommation (voir les sections 8.1.1.2 et 8.1.1.3). Les vêtements et la poussière qui s’y accumule peuvent créer une voie de pénétration du TCPP et du TDCPP via les articles ménagers manufacturés, et ces substances se retrouvent dans les STEU via les eaux de lavage (Schreder et La Guardia 2014; Saini et al., 2016).
Schreder et La Guardia (2014) ont mesuré les concentrations moyennes de TCPP et TDCPP dans les eaux usées de lavage échantillonnées dans 20 habitations au nord-ouest des États-Unis entre 2011 et 2012. Les concentrations moyennes de TCPP et de TDCPP détectées dans les eaux usées de lavage étaient de 0,1 mg/L et 0,018 mg/L, respectivement (Schreder et La Guardia, 2014). On note que les concentrations mesurées des deux substances dans les eaux usées de lavage sont inférieures à leurs limites d’hydrosolubilité.
Les concentrations de TCPP et de TDCPP dans les influents et les effluents de deux STEU locales desservant ces maisons ont également été rapportées dans cette étude (Schreder et La Guardia, 2014). Ces STEU reçoivent plus de 80 % de leurs volumes entrants de ménages, avec des rejets de produits ignifuges inconnus provenant de sources industrielles restantes. Compte tenu du pourcentage d’influents dus aux eaux usées de lavage et du pourcentage dû aux ménages, les auteurs ont déterminé que les eaux usées de lavage pourraient constituer la principale source de produits ignifuges organiques dans ces STEU (Schreder et La Guardia, 2014).
On considère que les données sur les eaux usées de lavage dans le nord-est des États-Unis fournies par l’étude de Schreder et La Guardia (2014) sont suffisamment représentatives pour créer un scénario d’exposition pertinent au Canada. On peut donc estimer les niveaux d’exposition au TCPP et au TDCPP dans les eaux de surface (valeurs CEE) en fonction des rejets de ces substances dus à l’utilisation d’articles manufacturés, via les eaux usées de lavage.
Saini et al. (2016) ont mené une étude pour mesurer les rejets de TCPP et de TDCPP et de quelques autres ignifugeants, en raison de leur accumulation sur les vêtements. Cette étude (Saini et al., 2016) a fait état de l’accumulation de ces ignifugeants sur les tissus et de leurs rejets dans les eaux usées via les eaux de lavage. Dans leur étude, les auteurs ont tenu compte des incertitudes, notamment les incohérences et les erreurs humaines lors du lavage manuel et de l’extraction des liquides. Les concentrations moyennes de TCPP (trois isomères en tout) et de TDCPP dans les eaux usées de lavage atteignaient 2 482 et 18 ng/L·dm2, respectivement pour les tissus en coton. Sur la base de diverses hypothèses concernant la composition de la charge de lavage, les auteurs ont estimé que les concentrations totales d’ignifugeants organophosphorés dans les eaux usées, d’après leur étude, semblent plus élevées que celles déterminées par Schreder et La Guardia (2014). Il est à noter que l’étude de Saini et al. (2016) porte sur une période d’exposition continue de 30 jours des tissus dans un environnement de bureau, ce qui n’est pas un scénario pertinent pour le Canada. Par conséquent, les données rapportées par Saini et al. de 2016 ne sont pas prises en compte dans l’estimation des rejets de ces substances dans les eaux usées via les eaux de lavage.
Environnement Canada indique que l’utilisation journalière moyenne d’eau domestique est de 343 L/jour par Canadien, dont 20 % sont utilisées pour le lavage (Environnement Canada, 2013). Si on multiplie cette valeur par 365 jours/an, par 35 540 400 Canadiens (Statistique Canada, 2014) et par les concentrations moyennes de TCPP et de TDCPP dans les eaux usées de lavage rapportées ci-dessus (Schreder et La Guardia, 2014), les rejets nationaux estimés de TCPP et de TDCPP découlant de l’utilisation de produits de consommation dans les eaux usées de lavage sont de 88 929 kg/an et de 15 918 kg/an, respectivement.
Les concentrations environnementales estimées (CEE) de TCPP et de TDCPP à proximité des points de rejet des STEU ont été calculées de manière probabiliste, d’après les données pour de nombreuses municipalités du Canada, y compris la population locale, le débit des effluents de la STEU et le taux d’efficacité d’élimination de la STEU. Nous avons utilisé les mêmes taux d’efficacité de l’élimination utilisés ci-dessus pour les scénarios en milieu industriel. Les valeurs au 5e et au 95e centiles des CEE dues à l’utilisation de produits de consommation étaient de 7,7 × 10-4 et de 1,3 × 10-2 mg/L pour le TCPP et de 1,2 × 10-4 et 2,2 × 10-3 mg/L pour le TDCPP.
Dans le cas du TCPP, la CEE maximale associée aux rejets découlant des utilisations industrielles (0,12 mg/L) dépasse la valeur maximale due aux rejets liés à l’utilisation de produits de consommation (1,3 × 10-2 mg/L), ce qui concorde avec l’hypothèse que les sources ponctuelles industrielles entraînent les plus fortes concentrations localisées dans l’environnement.
Pour ce qui est du TDCPP, la CEE maximale associée aux rejets découlant des utilisations industrielles (1,6 × 10-4 mg/L) était inférieure d’environ un ordre de grandeur à la CEE au 95e centile en raison des rejets par les eaux usées de lavage (2,2 × 10-3 mg/L), ce qui met en évidence l’importance de tenir compte des rejets de cette substance provenant de l’utilisation des produits de consommation.
Étant donné que les taux d’élimination les plus faibles ont été utilisés, les CEE associées à l’utilisation de produits de consommation sont jugées prudentes.
7.2.2.3 Concentrations environnementales estimées de TCPP et de TDCPP dans les sédiments en raison des utilisations industrielles et des produits de consommation
Une méthode du partage eau-sédiment à l’équilibre a été utilisée pour estimer la concentration de TCPP et de TDCPP dans les sédiments. Cette approche est basée sur un principe de répartition décrit par l’Agence européenne des produits chimiques (ECHA, 2010) et intègre deux autres méthodes de calcul supplémentaires. La première méthode consiste à estimer la concentration de la substance dans la phase aqueuse (dissoute) de l’eau sus-jacente de sa concentration totale, selon des études menées par Gobas (2007 et 2010). La deuxième méthode consiste à estimer la concentration de la substance dans les sédiments benthiques à partir de sa concentration dans la phase aqueuse d’eau sus-jacente, basée sur un partage à l’équilibre entre les sédiments benthiques et l’eau sus-jacente, tel que décrit par le National Center for Environmental Assessment de l’EPA (US EPA 2003). À l’équilibre, on présume que la CEE dans les sédiments benthiques est en corrélation linéaire avec la concentration dans la phase aqueuse de l’eau sus-jacente. Les scénarios d’exposition aux sédiments ont été élaborés sous forme de prolongement des scénarios de rejets industriels en milieu aquatique, décrits ci-dessus pour déterminer les CEE dans les sédiments à l’équilibre, normalisées à 3 % de carbone organique (une teneur typique en carbone organique dans les sédiments du fond des rivières et des lacs).
En tenant compte de tous les éléments ci-dessus, les calculs des CEE dans les sédiments associés aux rejets découlant des utilisations industrielles variaient de 4,1 × 10-5 à 2,1 mg/kg p.s. pour le TCPP et de 7,7 × 10-6 à 0,086 mg/kg p.s. pour le TDCPP.
Pour ce qui est du rejet de ces substances dû à l’utilisation de produits de consommation, celles-ci sont rejetées dans les eaux de surface après le traitement des eaux usées de lavage. Compte tenu de leur répartition dans les sédiments, les CEE dans les sédiments associées à ces rejets dus aux produits de consommation vont de 1,4 × 10-2 à 0,22 mg/kg p.s. pour le TCPP et de 6,4 × 10-3 à 0,12 mg/kg p.s. pour le TDCPP, d’après les fourchettes des CEE probabilistes en milieu aquatique au 5e et au 95e centiles.
7.2.2.4 Concentrations environnementales estimées de TCPP et de TDCPP dans les sols en raison des utilisations industrielles et des produits de consommation
Comme il est indiqué aux sections 7.2.2.1 et 7.2.2.2, les rejets de TCPP dans les eaux usées peuvent se produire dans les installations de fabrication industrielle et lors de l’utilisation de produits de consommation. Cependant, on considère que cette substance n’est pas éliminée par le traitement des eaux usées. Étant donné que le TCPP n’est pas comptabilisé dans les biosolides, son rejet au sol par l’épandage de biosolides ou son dépôt dans des sites d’enfouissement devrait être minime. De plus, un rejet direct dans ce milieu est peu probable. Par conséquent, on n’a pas calculé de CEE dans le sol pour le TCPP.
Pour ce qui est des utilisations industrielles de TDCPP, on présume également qu’il n’y a pas de traitement des eaux usées sur place. Cependant, il peut y avoir une certaine élimination pendant le traitement des eaux usées hors site. Pour estimer les rejets de TDCPP dans le sol, une méthode décrite par l’Agence européenne des produits chimiques (ECHA, 2010) a été utilisée pour quantifier le TDCPP adsorbé aux biosolides et estimer les CEE dans le sol découlant de l’épandage de biosolides. Cette méthode utilise les quantités de biosolides accumulés dans la couche supérieure de 20 cm du sol (profondeur de labourage) au cours d’une période de dix années consécutives pour calculer les CEE dans le sol. Selon une hypothèse sous-jacente de la méthode, il n’y a aucune perte attribuable à la dégradation, à la volatilisation, au lessivage et au ruissellement au moment de la pénétration des substances dans les sols. Cette hypothèse permet d’obtenir des valeurs prudentes pour les CEE dans le sol. Des scénarios d’exposition dans le sol ont été élaborés dans le cadre d’une extension des scénarios de rejets dans le milieu aquatique décrits ci-dessus, et utilisant les concentrations et les taux de production pour des STEU particulières.
Les hypothèses et les facteurs à prendre en compte standard sont appliqués comme suit :
- Élimination par les STEU : Selon les renseignements sur diverses stations figurant dans la base de données d’Environnement Canada (INRP, 1994‑2009), un taux d’élimination de 13 % pour le traitement secondaire a été pris en considération à la plupart des STEU hors site, tandis qu’un traitement primaire a été pris en considération à quelques autres STEU hors site et un taux d’élimination de 10 % a été appliqué. Dans certains cas, lorsqu’une lagune assurait le traitement des eaux usées, un taux d’élimination de 10 % était appliqué.
- Le taux d’épandage de biosolides est de 8,3 tonnes/ha/an.
- La période d’épandage de biosolides est de 10 années consécutives.
- La profondeur du sol et la masse volumique sont de 0,2 m et 1 200 kg/m3.
Pour tous les sites industriels concernant lesquels l’utilisation du TDCPP a été déterminée, les CEE dans le sol sont estimées entre 1,2 x 10-5 et 2,1 x 10‑3 mg/kg p.s.
Le TDCPP peut également être rejeté dans les eaux usées de lavage en raison de l’utilisation de produits de consommation. La sorption de cette substance sur les boues est estimée d’après la quantité totale rejetée (15 918 kg par année; voir la section 7.2.2.2). En prenant en compte le même taux d’élimination (13 %) pour le traitement secondaire pour la plupart des STEU hors site, la CEE calculée dans les biosolides est de 0,87 mg/kg. En appliquant les mêmes hypothèses standards pour l’épandage des biosolides dans les sols, décrites ci‑dessus pour les utilisations industrielles, les CEE résultantes dans les sols sont estimées à 0,03 mg/kg p.s.
7.3 Caractérisation des risques pour l’environnement
La démarche utilisée dans le cadre de la présente évaluation préalable visait à examiner les divers renseignements pertinents afin de tirer des conclusions fondées sur le poids de la preuve et le principe de prudence, conformément aux dispositions de la LCPE. Les données prises en compte comprenaient les résultats issus du calcul d’un quotient de risque prudent, ainsi que les renseignements sur les propriétés physiques et chimiques, les sources, le devenir de ces substances et leur présence dans l’environnement canadien, la persistance, le potentiel de bioaccumulation et la toxicité intrinsèque pour les organismes non humains.
7.3.1 Analyse du quotient de risque pour le milieu aquatique
Une analyse du quotient de risque (QR) est effectuée pour les scénarios sélectionnés en comparant les concentrations environnementales estimées (CEE) aux concentrations estimées sans effet (CESE) sélectionnées pour les organismes.
Comme nous l’avons indiqué dans la section 7.2, des CEE en milieu aquatique ont été calculées pour le TCPP et le TDCPP afin de caractériser leur exposition aux organismes aquatiques à la suite de rejets associés aux utilisations industrielles et au lavage par les consommateurs. Chaque scénario lié aux utilisations industrielles tenait compte de la quantité de TCPP et de TDCPP utilisée à chaque site industriel, du facteur d’émission pour les rejets dans les eaux usées, de l’élimination par la STEU, des débits des effluents et de la dilution dans les eaux réceptrices. Pour les rejets dus aux lavages effectués par les consommateurs, des concentrations mesurées des deux substances dans les eaux usées de lavage du nord-ouest des États-Unis ont été utilisées pour représenter ce type de rejets au Canada et pour ensuite estimer les rejets totaux de TCPP et de TDCPP découlant de l’utilisation de produits de consommation. Les CEE de ces deux substances dans les eaux usées de lavage ont été calculées de manière probabiliste.
En outre, les deux substances ont été trouvées dans les eaux de surface en Ontario (Jantunen et al., 2013b). Il est raisonnable de penser que les données de surveillance environnementale refléteraient les rejets provenant à la fois des activités industrielles et de l’utilisation de produits de consommation, ainsi que de leur dégradation dans l’environnement. Par conséquent, les concentrations mesurées de ces deux substances dans 13 affluents du sud de l’Ontario (Jantunen et al., 2013b) ont aussi été prises en compte dans l’analyse du quotient de risque.
Les CESE en milieu aquatique ont été extrapolées à partir du critère d’effet traduisant la plus grande sensibilité pour chaque substance (voir la section 7.1).
Les résultats des analyses du quotient de risque sont présentés dans le tableau 7‑13
Pour le TCPP, le quotient de risque est inférieur à 1 pour tous les sites industriels utilisant cette substance. En ce qui concerne les rejets de cette substance dans les eaux usées de lavage, la CEE au 95e centile pour les eaux usées de lavage était également inférieure à la CESE, soit un quotient de risque inférieur à 1 (tableau 8.8). Les concentrations moyennes mesurées de TCPP dans les échantillons de pluie, l’eau des Grands Lacs, des rivières et des effluents de l’Ontario varient entre 2,6 × 10-5 mg/L et 2,8 × 10-3 mg/L. La concentration maximale mesurée, soit 1,8 × 10-3 mg/L, a été observée dans les échantillons prélevés dans une rivière. Toutes les concentrations mesurées disponibles au Canada sont inférieures à la CESE. Ces résultats indiquent que le risque pour les organismes aquatiques associé aux rejets de TCPP provenant d’utilisations industrielles ou de l’utilisation de produits de consommation est faible.
Pour le TDCPP, le quotient de risque est inférieur à 1 pour tous les sites industriels utilisant cette substance. Sur la base des CEE probabilistes associées aux rejets des eaux usées de lavage, la CEE au 50e centile est bien inférieure à la CESE et seule la CEE au 87e centile est égale à la CESE. Le calcul des CEE selon l’approche probabiliste est jugé prudent. Le nombre de sites dont les rejets estimés de TDCPP se traduisent par des concentrations dans l’eau supérieures à la CESE est faible.
Selon les données de surveillance environnementale, le TDCPP n’a pas été détecté dans les échantillons d’eau de pluie ou d’eau de surface prélevés dans deux rivières à leurs faibles débits. Lorsque cette substance était détectée dans les eaux de surface de lacs et de rivières en Ontario, les concentrations moyennes mesurées variaient de 2,0 × 10-6 mg/L à 1,8 × 10-4 mg/L. Ces concentrations sont inférieures à la CESE pour cette substance. Une concentration maximale de 1,4 × 10-3 mg/L a été signalée dans des échantillons prélevés dans une rivière, tandis que la deuxième concentration maximale était de 8,4 × 10-4 mg/L et la concentration moyenne mesurée était de 1,3 × 10-4 mg/L pour la même rivière. Cela indique que la concentration occasionnellement élevée (c.‑à‑d. 1,4 × 10-3 mg/L) n’est pas représentative de la présence réaliste de cette substance dans l’environnement. Sur la base de toutes les données ci‑dessus, on estime que le risque pour les organismes aquatiques associé aux rejets de TDCPP provenant d’utilisations industrielles ou de l’utilisation de produits de consommation est faible.
Substance |
CEE ou plage de concentrations mesurées a (mg/L) |
CESE (mg/L) |
QR |
|---|---|---|---|
TCPP |
2 × 10-6 – 0,12 (CEE associées aux rejets issus des utilisations industrielles) | 0,27 |
7,4 × 10-6 – 0,44 |
TCPP |
1,3 × 10-2 (valeurs CEE au 95e centile dues à l’utilisation de produits de consommation) | 0,27 |
0,048 |
TCPP |
2,4 × 10-5 – 2,1 × 10-3 (concentrations moyennes mesurées dans les eaux de rivières et de lacs en Ontario; une concentration de 5,1 × 10-3 mg/L a été signalée comme valeur mesurée maximale dans un affluent) | 0,27 |
8,9 × 10-5 – 7,8 × 10-3 |
TDCPP |
1 × 10-7 – 1,6 × 10-4 (CEE associées aux rejets issus des utilisations industrielles) | 0,0013 |
7,7 × 10-5 – 0,12 |
TDCPP |
2,9 × 10-4, 1,3 × 10-3 et 2,2 × 10-3 (CEE aux 50e, 87e et 95e centiles dues à l’utilisation de produits de consommation) | 0,0013 |
0,22, 1 et 1,7 |
TDCPP |
2,0 × 10-6 – 1,8 × 10-4 (concentrations moyennes mesurées dans les eaux de rivières et lacs en Ontario; une concentration de 1,4 × 10-3 mg/L a été signalée comme valeur mesurée maximale dans une rivière) | 0,0013 |
6,4 × 10-4 – 0,14 |
a Les concentrations mesurées de TCPP et de TDCPP dans l’eau de surface ont été rapportées dans Jantunen et al., 2013b.
7.3.2 Analyse du quotient de risque pour les sédiments
En raison de la répartition minime dans les sédiments et du manque de données sur les effets (les données déduites à partir d’analogues ne s’appliquent pas au TCPP), on n’a pas effectué d’analyse de risques pour le TCPP dans les sédiments.
Dans le cas du TDCPP, les CEE dans les sédiments sont calculées d’après les CEE aquatiques estimées pour les scénarios de fabrication industrielle de mousses de polyuréthane et de rejets dans les eaux usées de lavage produites par le nettoyage domestique courant. La comparaison des CEE dans les sédiments avec les CESE et les quotients de risque obtenus sont présentés dans le tableau 7‑14. Les résultats indiquent un faible risque pour les organismes vivant dans les sédiments, dans lesquels les rejets de TDCPP proviennent d’activités industrielles ou de l’utilisation de produits de consommation.
Sources de rejets |
CEE (mg/kg p.s.) |
CESE (mg/kg p.s.) |
QR |
|---|---|---|---|
Utilisations industrielles |
7,7 × 10-6 – 0,0086 |
0,18 |
4,2 × 10-5 – 0,047 |
Produits de consommation |
6,4 × 10-3 – 0,12 |
0,18 |
0,035 – 0,67 |
7.3.3 Analyse du quotient de risque pour le TDCPP dans le sol
Le TCPP ne devrait pas être rejeté dans le sol à la suite de l’application de biosolides. Par conséquent, on n’a pas calculé de quotient de risque pour le TCPP.
Les résultats de l’analyse des risques pour le TDCPP présentés dans le tableau 7‑15 indiquent qu’il existe un faible risque pour les organismes vivant dans le sol en raison de l’épandage des biosolides, qui sont associés aux rejets de cette substance dus aux utilisations industrielles ou à l’utilisation de produits de consommation.
Sources de rejets |
CEE (mg/kg p.s.) |
CESE (mg/kg p.s.) |
QR |
|---|---|---|---|
Utilisations industrielles |
1,2 × 10-5 – 2,1 × 10-3 |
0,27 |
4,4 × 10-5 – 7,8 × 10‑3 |
Produits de consommation |
0,03 |
0,27 |
0,11 |
7.4 Examen des sources de données et conclusion
Afin de caractériser le risque écologique du TCPP et du TDCPP, les données techniques provenant de diverses sources ont été prises en compte (comme il est indiqué dans les sections pertinentes du présent rapport) et ont été pondérées qualitativement. Les principales sources de données étayant la conclusion de l’évaluation sont examinées ci‑dessous et résumées à l’annexe B, en ce qui concerne le niveau de confiance, leur pertinence et la pondération globale attribuée dans l’évaluation.
Le TCPP et le TDCPP ont été utilisés en volumes importants au Canada et à l’étranger. Les deux substances sont présentes dans l’environnement canadien depuis 1970. À l’étranger, la société ICL-IP a été un fabricant important de TDCPP. Elle a cessé de produire cette substance pour les meubles et les applications connexes utilisant la mousse souple de polyuréthane en 2014, mais elle la produit toujours pour les utilisations de mousse souple dans l’industrie automobile (ECCC 2013-2014; ECCC 2016b). Un autre grand fabricant, Albemarle, a également indiqué qu’il cesserait de fabriquer le TDCPP (Albemarle, 2012). Le niveau de confiance est modéré en ce qui concerne l’augmentation négligeable de la fabrication, de l’importation ou de l’utilisation de cette substance à laquelle on devrait s’attendre dans un proche avenir.
Les rejets de TCPP et de TDCPP dans l’air devraient provenir de la fabrication industrielle des mousses de polyuréthane, des matériaux de construction et des produits de consommation dans lesquels ils sont ajoutés. Cependant, des émissions directes dans l’air dues aux utilisations industrielles devraient être faibles en raison des faibles pressions de vapeur de ces substances. Bien que les émissions dues à l’utilisation des produits semblent minimes et diffuses, leurs quantités utilisées sont élevées et, à ce titre, les volumes globaux d’émissions peuvent ne pas être négligeables. Les rejets de TCPP et de TDCPP par les produits de consommation ont été mesurés dans les eaux usées de lavage qui entrent dans les STEU. Il est donc raisonnable de s’attendre à ce que les concentrations mesurées dans les eaux de surface reflètent les rejets provenant à la fois des activités industrielles et de l’utilisation de produits de consommation. Après être rejetés dans l’air, le TCPP et le TDCPP sont associés aux particules, et sur lesquelles ils ont démontré une plus grande persistance. Avec les concentrations atmosphériques mesurées dans les régions arctiques du Canada et de l’Europe, il existe suffisamment de données qui permettent de croire que les deux substances sont très persistantes dans l’air et démontrent un potentiel de transport atmosphérique à grande distance.
Les rejets de TCPP et de TDCPP provenant à la fois des activités industrielles et de l’utilisation de produits de consommation pénètrent principalement dans les eaux de surface après le traitement des eaux usées. Le TCPP demeure dans l’eau et un très faible pourcentage peut se répartir dans les sédiments. Le TDCPP reste également principalement dans l’eau, une petite partie pouvant se retrouver dans les sédiments. Pendant le traitement des eaux usées, cette substance devrait, dans une certaine mesure, se répartir dans les biosolides, qui peuvent ensuite être épandus sur les sols.
Les deux substances ne s’hydrolysent pas de façon importante dans les conditions environnementales et ne se biodégradent pas facilement. Toutefois, le TCPP et le TDCPP semblent se transformer rapidement chez diverses espèces de vertébrés (poissons, mammifères et oiseaux). Les données empiriques et modélisées fondées sur les QSAR indiquent un faible potentiel de bioconcentration et de bioaccumulation pour les deux substances. Compte tenu de ce qui précède, il existe un niveau de confiance élevé dans les données montrant une accumulation limitée de TCPP et de TDCPP dans le biote. La bioamplification par les chaînes alimentaires est peu probable et l’exposition à des organismes de niveau trophique supérieur devrait être inférieure à l’exposition à des organismes de niveau trophique inférieur.
Dans l’évaluation des effets écologiques, des données empiriques ont été trouvées et elles indiquent une toxicité modérée du TCPP et une toxicité élevée du TDCPP pour les organismes, d’après les critères d’effet pour la survie, la reproduction et la croissance. Alors que le TCPP ne semble pas avoir d’effet important sur le système endocrinien des poissons, des données empiriques ont confirmé que le TDCPP pouvait perturber les concentrations thyroïdiennes chez le poisson zèbre, ce qui peut constituer un facteur contribuant au taux de survie plus faible et à la fréquence plus élevée de malformations chez les organismes d’essai. Le TDCPP pourrait également modifier les concentrations d’hormones sexuelles chez les poissons à de faibles niveaux. Toutefois, aucun effet sur les générations de descendants n’a été rapporté après l’exposition des parents. Le niveau de confiance est de modéré à élevé pour ce qui est des principales données de toxicité qui ont été choisies pour extrapoler les CESE pour ces substances.
Les données sur la neurotoxicité, la cytotoxicité et la génotoxicité, ainsi que les effets sur d’autres biomarqueurs pour ces deux substances ont été déterminés dans des essais sur cellules chez les poissons et les oiseaux. Ces données sont utiles pour clarifier la réactivité chimique et le mécanisme d’action toxique. Toutefois, dans la présente évaluation, on constate que les CEE maximales dans l’eau (0,12 mg/L pour le TCPP et 0,0022 mg/L pour le TDCPP) sont inférieures à la concentration d’exposition du TCPP (1 mg/L) et du TDCPP (0,0033 mg/L), qui peuvent modifier les concentrations d’hormones ou démontrer des effets sur les activités d’enzyme et l’expression de l’ARN messager dans les essais sur des cellules. En théorie, les concentrations d’exposition les plus faibles utilisées dans les essais sur cellules (1 mg/L pour le TCP et 0,0043 mg/L pour le TDCPP) permettent d’extrapoler des concentrations tissulaires du TCPP et du TDCPP dans les poissons à environ 3 mg/kg et 0,0043 mg/kg, respectivement (en supposant une masse volumique de 1 kg/L pour les organismes aquatiques). Ces concentrations tissulaires sont bien plus élevées que les concentrations mesurées rapportées dans l’un ou l’autre des échantillons de poissons prélevés dans les plans d’eau canadiens. Compte tenu des concentrations mesurées (et de la fréquence élevée de non-détection) de TCPP et de TDCPP et de la faible bioaccumulation dans les organismes aquatiques, on estime avec un niveau de confiance élevé que ces deux substances n’auront pas d’impact sur les voies hormonales, la transcription des gènes ou les critères d’effet médiés par les récepteurs à leurs niveaux actuels d’occurrence chez les poissons.
Le TCPP et le TDCPP ont été détectés dans les œufs de goélands argentés. Ces constatations concordent avec les potentiels de liaison aux protéines pour ces deux substances. Les données de toxicité in ovo laissent entendre que les embryons de poulet sont également sensibles au TCPP et au TDCPP. La période de bêchage et de développement embryonnaire a été perturbée par les deux substances à des concentrations de 103 ng/g, tandis que l’effet hormonal n’était associé qu’au TDCPP au même niveau. Ces niveaux d’exposition associés à un effet dans l’étude de toxicité sont supérieurs de trois ordres de grandeur aux concentrations mesurées des deux substances dans les œufs.
En tenant compte de ce qui précède, une pondération plus importante est appliquée aux données sur les effets découlant des études in vitro et in vivo, qui sont directement liées aux effets au niveau des organismes pour l’estimation des CESE dans la présente évaluation.
L’évaluation de l’exposition a porté sur les rejets de ces deux substances provenant de la production de mousses de polyuréthane et de l’utilisation de produits de consommation via les activités de lavage. Des concentrations dans l’environnement ont été estimées avec un niveau de confiance plus élevé pour les milieux où la présence des substances est la plus probable d’après l’analyse du devenir dans l’environnement.
Une caractérisation du risque a été effectuée pour le milieu aquatique dans le cas du TCPP, et pour le milieu aquatique, les sédiments et le sol dans le cas du TDCPP. Les résultats de l’analyse des quotients de risque pour le TCPP dans le milieu aquatique sont inférieurs à 1, ce qui indique que le risque associé à l’exposition à cette substance dans l’environnement, dû aux utilisations industrielles ou au rejet de produits de consommation, est faible. Selon ces données, le TCPP a un faible potentiel de causer des dommages à l’environnement au Canada.
Pour ce qui est du TDCPP, les quotients de risque déterminés pour les sédiments et les sols sont inférieurs à 1. Dans le milieu aquatique, les CEE associées à toutes les utilisations industrielles sont également inférieures à la CESE. La probabilité que les concentrations dans l’environnement dépassent la CESE en raison de l’utilisation de produits de consommation est faible. Par conséquent, le risque associé à l’exposition au TDCPP dans l’environnement, en raison des utilisations industrielles ou des rejets par l’utilisation de produits de consommation est jugé faible. Selon ces données, le TDCPP a un faible potentiel de causer des dommages au Canada.
Bien que l’exposition de l’environnement au TDCPP ne soit pas préoccupante aux niveaux actuels, on estime que cette substance a un effet environnemental préoccupant en raison de sa toxicité élevée et de ses effets potentiels sur le système endocrinien des poissons. Par conséquent, la présence de ces substances pourrait être préoccupante pour l’environnement si l’exposition venait à augmenter.
7.5 Incertitudes dans l’évaluation des risques pour l’environnement
L’évaluation de l’exposition porte sur les sources ponctuelles industrielles. En raison de leur utilisation en tant qu’additifs ignifuges, les deux substances peuvent, avec le temps, migrer des produits vers l’air et dans la poussière, comme le démontrent les concentrations dans les échantillons atmosphériques d’air extérieur et de poussière intérieure. Le taux d’émissions diffuses découlant de l’utilisation des produits est très faible. Les quantités de ces substances importées dans les articles manufacturés n’ont pas été convenablement indiquées dans les réponses à l’avis émis en vertu de l’article 71 de la LCPE . La quantité de TCPP et de TDCPP dans les produits (tous les produits importés et utilisés) pourrait être élevée. Toutefois, on présume que les voies principales de rejet du TCPP et du TDCPP à partir des produits se reflètent dans les concentrations mesurées dans l’environnement. Nous avons également caractérisé les rejets dans l’environnement dus à l’utilisation de produits de consommation en tenant compte des concentrations mesurées de ces substances dans les eaux usées de lavage domestique. Les rejets issus du nettoyage des conteneurs de transport industriel n’ont pas été pris en compte de manière quantitative en raison d’un fort degré d’incertitude. Des hypothèses prudentes ont été formulées dans l’évaluation de l’exposition et le niveau de confiance associé aux scénarios d’exposition utilisés pour calculer les CEE est modéré.
D’après ses propriétés physiques et chimiques, le TCPP est hydrosoluble et une bonne partie de cette substance devrait rester dans le milieu aquatique. Les résultats établis par le modèle EQC de niveau III laissent entendre que seulement 0,3 % des rejets totaux de cette substance peuvent rester dans les sédiments, si elle est rejetée dans l’eau. Les CEE des sédiments pour le TCPP ont été dérivées des CEE prudentes dans l’eau de surface et leur valeur estimée peut atteindre 2,8 mg/kg p.s. Aucune donnée de toxicité empirique dans les sédiments n’a été déterminée pour cette substance. Compte tenu de la différence de toxicité aquatique entre le TCPP et le TDCPP et d’autres esters de phosphate, on considère que les données déduites à partir d’analogues ne s’appliquent pas pour déterminer la valeur d’un critère d’effet toxicologique. Par conséquent, on n’a pas calculé de CESE pour les sédiments et l’analyse du quotient de risque n’a pas été effectuée pour ce milieu. Le manque de données concernant les effets du TCPP sur les sédiments constitue une lacune dans la présente évaluation, ce qui pourrait donner lieu à des faux négatifs concernant le risque pour les organismes vivant dans les sédiments.
8. Potentiel de causer des effets nocifs pour la santé humaine
8.1 Évaluation de l’exposition
8.1.1 Milieux de l’environnement et aliments
Le TCPP et le TDCPP sont des substances ignifuges, un additif. Comme ils ne sont pas liés chimiquement à la matrice en polymère, il existe un potentiel de libération dans l’environnement par des produits disponibles aux consommateurs.
Les concentrations de TCPP et de TDCPP mesurées dans l’air, l’eau, la poussière et la nourriture sont davantage décrites ci-dessous (voir également la section 7.2.1, annexe A; ECCC, 2019). D’après les données de surveillance, l’absorption estimative la plus élevée de TCPP et de TDCPP dans la population générale par les milieux de l’environnement et les aliments est de 2,5 et de 0,86 µg/kg p.c. par jour pour les enfants de 6 mois à 4 ans et de 0 à 6 mois, respectivement (annexe C).
8.1.1.1 Air ambiant
Le TCPP et le TDCPP ont été détectés dans l’air extérieur au Canada et ailleurs (section 7.2.1). Les concentrations de TCPP et de TDCPP ont été mesurées au moyen d’échantillonneurs d’air actifs à grand débit autour des Grands Lacs et à Toronto de 2011 à 2013. Les concentrations moyennes du lac Supérieur, du lac Ontario et du lac Huron ont varié de 0,08 à 0,20 ng/m3 pour le TCPP et de 4,3 × 10-3 à 6 × 10-3 ng/m3 pour le TDCPP (Shoeib et al., 2014; Jantunen, 2014). Comme mentionné à la section 7.2.1, les concentrations moyennes de 0,671 ng/m3 pour le TCPP et de 0,158 ng/m3 pour le TDCPP avec les concentrations maximales correspondantes de 1,52 ng/m3 pour le TCPP et de 1,21 ng/m3 pour le TDCPP ont été mesurées à Toronto (n = 32) (Shoeib et al. 2014). La concentration du TDCPP a également été mesurée (9,5 × 10-3 ng/m3) dans les échantillons d’air extérieur (n = 20) dans une autre étude réalisée à Toronto de janvier 2011 à février 2012 en utilisant un échantillonneur d’air actif à grand débit (Diamond et al. 2013). Le TCPP n’a pas été surveillé dans l’étude de Diamond et al. (2013).
En Norvège, la concentration de TCPP mesurée dans 10 échantillons prélevés dans une zone urbaine variait de 240 à 3700 ng/m3 (Green et al., 2008). Les concentrations de TDCPP dans l’air ambiant ont également été mesurées à Chicago et à Cleveland, et les concentrations moyennes étaient de 0,079 ng/m3 (n = 27) et de 0,11 ng/m3 (n = 22), respectivement (Salamova et al., 2013). On a prélevé des échantillons d’air ambiant pour mesurer la concentration de TCPP à Chicago (n = 27) et à Cleveland (n = 22) en 2012. Les concentrations médianes étaient de 0,41 ng/m3 (à Chicago) et de 0,32 ng/m3 (à Cleveland), d’après la somme des phases vapeur et particulaires (Salamova et al., 2013). Dans une étude réalisée en Suède, la concentration mesurée de TCPP à un seul endroit était de 0,81 ng/m3 (Marklund et al., 2005a). Des concentrations de TCPP et de TDCPP ont été trouvées dans des régions éloignées telles que l’Arctique et l’Antarctique, ce qui semble indiquer que les deux substances pourraient être soumises au transport atmosphérique à grande distance (Moller et al., 2012; Green et al., 2008), ce qui concorde avec les propriétés physicochimiques de ces substances.
On a retenu les concentrations maximales de 1,52 ng/m3 et de 1,21 ng/m3 de la même étude de Toronto pour sélectionner les absorptions quotidiennes de TCPP et de TDCPP, respectivement, par l’exposition à l’air ambiant (Shoeib et al., 2014).
8.1.1.2 Air intérieur
On a surveillé l’air intérieur pour déceler le TCPP et le TDCPP dans 23 maisons à Toronto pendant une période d’échantillonnage de 28 jours de mai à août 2013. Le TCPP a été détecté dans l’air à des concentrations variant de 7,68 à 4190 ng/m3, pour une médiane de 73,6 ng/m3 et une fréquence de détection de 97 %. Le TDCPP a été détecté dans l’air à des concentrations variant de 0,045 à 5,5 ng/m3, pour une médiane de 0,525 ng/m3 et une fréquence de détection de 97 % (Vykoukalová et al., 2017). On a également surveillé l’air intérieur pour détecter le TCPP et le TDCPP dans 32 maisons de la région du Grand Toronto et dans 19 maisons à Ottawa pendant une période d’échantillonnage de 3 semaines de la fin février à la fin juillet de l’année 2015 (Yang et al. 2019). On a prélevé des échantillons d’air dans les chambres de toutes les maisons (n = 51) et dans la « pièce la plus fréquentée » dans 26 des 51 maisons. Le TCPP (déclaré comme la somme des isomères du TCPP, ƩTCPP) a été détecté dans l’air intérieur à des concentrations variant de 0,005 à 313 ng/m3 dans les chambres, la valeur au 95e centile étant de 71,5 ng/m3, la moyenne géométrique de 2,58 ng/m3 et la fréquence de détection de 82 %. Le TCPP a été détecté dans l’air intérieur à des concentrations variant de 0,005 à 127 ng/m3 dans les pièces les plus fréquentées dont la valeur au 95e centile est de 15,2 ng/m3, la moyenne géométrique de 7,4 ng/m3 et la fréquence de détection de 96 %. Le TDCPP a été détecté dans la totalité des échantillons d’air prélevés dans les chambres, les concentrations variant de 0,0173 à 0,672 ng/m3, la valeur au 95e centile étant de 0,418 ng/m3 et la moyenne géométrique de 0,113 ng/m3. Le TDCPP a également été détecté dans la totalité des échantillons d’air prélevés dans les pièces les plus fréquentées, les concentrations variant de 0,0243 à 1,55 ng/m3, la valeur au 95e centile étant de 0,730 ng/m3 et la moyenne géométrique de 0,159 ng/m3 (Yang et al., 2019).
On a également mesuré ces substances dans des maisons en Suède. Dans deux études faisant appel à 10 maisons, on a détecté le TCPP et le TDCPP dans l’air à des concentrations variant de 2,4 à 160 ng/m3 et d’une valeur inférieure au seuil de détection (1 ng/m3) à 17 ng/m3, respectivement (Staaf et Otsman 2005; Bergh et al. 2011). Pour le TDCPP, la plupart des échantillons se trouvaient à une valeur inférieure au seuil de détection de 1 ng/m3 (Bergh et al. 2011) (annexe A).
Le temps passé à l’intérieur peut aussi être passé dans des lieux autres que des maisons, à savoir les bureaux (adultes), les véhicules, les garderies, les écoles et les salles d’entraînement (pour les adultes et d’enfants). Les concentrations de TCPP et de TDCPP dans des bureaux en Suède et en Norvège variaient de 10 à 240 ng/m3 et de 0,2 à 150 ng/m3, respectivement (Marklund et al., 2005 b; Staaf et Otsman, 2005; Green et al., 2008; Bergh et al., 2011; Hartmann et al., 2004). Plus récemment, on a mesuré le TCPP et le TDCPP dans 10 bureaux en Chine à des concentrations maximales de 81 et de 14 ng/m3, respectivement, valeurs qui sont bien plus faibles que dans les bureaux en Europe (Yang et al. 2014). L’air intérieur des garderies et des daycare centres et des centres de soins en éducation à la petite enfance a été échantillonné récemment en Amérique du Nord. Dans une étude de 40 centres de soins en éducation à la petite enfance, Bradman et al. (2012) ont détecté du TDCPP avec une concentration moyenne de 0,59 ng/m3 et une valeur au 95e centile à 1,25 ng/m3. Le TCPP n’a pas été mesuré dans cette étude (Bradman et al., 2012). Les concentrations dans l’air de 10 garderies suédoises ont été mesurées; la concentration moyenne de TDCPP était de 6,7 ng/m3. La concentration moyenne de TCPP dans des garderies de Stockholm était de 19 ng/m3 (Bergh et al., 2011). On a surveillé les concentrations de TCPP et de TDCPP dans les salles d’entraînement à Boston, étant donné la présence de blocs de mousse; les concentrations étaient de 2,68 ng/m3 et de 12,5 ng/m3 pour un seul échantillon prélevé près du bloc de mousse et de 0,74 ng/m3 et 8,41 ng/m3 pour un seul échantillon prélevé loin du bloc de mousse, pour le TCPP et le TDCPP, respectivement (Carignan et al., 2013a).
Les automobiles et les avions peuvent également représenter des sources d’exposition au TCPP ou au TDCPP. L’air intérieur de véhicules contenait des concentrations mesurées non détectées (seuil de détection = 0,12 ng/m3) pouvant aller jusqu’à 2300 ng/m3 de TCPP (Hartmann et al., 2004; Staaf et Otsman, 2005). Hartmann et al. (2004) ont prélevé des échantillons d’air de 4 voitures de différents âges en Suisse, où la concentration maximale de TCPP de 260 ng/m3 a été mesurée dans une voiture de 9 ans. Les concentrations mesurées dans les autres voitures, ayant toutes moins d’un an, étaient inférieures à 23 ng/m3. Du TDCPP a été mesuré dans les voitures, mais par au-dessus du seuil de détection de la méthode d’analyse de 0,11 ng/m3 (Hartmann et al., 2004). Staaf et Otsman (2005) ont mesuré des concentrations dans une collection de véhicules personnels ou publics (1 voiture, 2 autobus publics et 1 voiture de métro) de Stockholm. La concentration de TCPP était de 1800 ng/m3 dans la voiture, de 330 et de 2300 ng/m3 dans les autobus et de 2000 ng/m3 dans la voiture de métro. Seul le TDCPP a été détecté, dans la voiture, à une concentration de 5 ng/m3 (la substance n’a pas été détectée dans les autobus et le métro [seuil de détection = 1 ng/m3]) (Staaf et Otsman, 2005). Étant donné la variabilité possible des concentrations de TCPP et de TDCPP dans les divers véhicules de transport, le nombre limité d’échantillons à l’étude, et les changements accrus dans l’air liés à l’ouverture fréquente des portes (et des fenêtres, selon la saison), il existe une incertitude dans l’estimation des expositions dans les véhicules.
L’absorption quotidienne de TCPP et de TDCPP découlant de l’exposition de la population générale au Canada à l’air intérieur a été estimée d’après les concentrations les plus élevées de 4190 et de 5,5 ng/m3, respectivement, dans les maisons à Toronto (Vykoukalová et al., 2017). On considère que ces concentrations mesurées dans l’air intérieur prennent en compte la variabilité des concentrations dans l’environnement associées à différents milieux (p. ex., garderie, bureau, salle d’entraînement, véhicule). Ces sources d’exposition possibles devraient donner des concentrations plus faibles que celles qui ont été estimées avec prudence pour les maisons, compte tenu de la faible fréquence et de la courte durée d’exposition, et étant donné que les concentrations rapportées dans ces micro-environnements sont très similaires.
8.1.1.3 Poussière
Dans plusieurs études, le TCPP et le TDCPP ont été mesurés dans la poussière de maisons, de bureaux et d’autres milieux de l’environnement au Canada et dans le monde (annexe A).
Du TCPP a été mesuré en 2007-2008 dans le cadre de l’Enquête sur la poussière domestique au Canada (EPDC) dans la poussière de 818 maisons situées dans différentes villes canadiennes et les valeurs de la concentration médiane et de la concentration au 95e centile étaient de 1,62 mg/kg et de 18,2 mg/kg, respectivement. Dans 95 % des échantillons, la concentration de TCPP mesurée variait de valeurs inférieures au seuil de détection de la méthode (0,11 mg/kg) à 120 mg/kg (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale, de Santé Canada, adressé au Bureau de l’évaluation des risques pour les substances existantes, de Santé Canada, daté du 13 décembre 2013; sans référence). La concentration de TCPP dans la poussière a également été mesurée dans d’autres études canadiennes. Des échantillons de poussière de 23 maisons à Toronto ont été prélevés pendant une période de 28 jours s’échelonnant de mai à août 2013. Le TCPP a été détecté dans la totalité des échantillons et les concentrations variaient de 0,270 à 39,3 mg/kg, et la concentration médiane était de 1,470 mg/kg (Vykoukalová et al., 2017). Des échantillons de poussière de 32 maisons de la région du Grand Toronto et de 19 maisons à Ottawa ont été prélevés lors d’une campagne d’échantillonnage de trois semaines en 2015. Les échantillons ont été prélevés dans les chambres de toutes les maisons (n = 51) et en plus, dans la « pièce la plus fréquentée » dans 26 des 51 maisons. Du TCPP (rapporté sous forme de la somme des isomères du TCPP, soit ƩTCPP) a été détecté dans 96 % des chambres à une concentration variant de 0,00375 à 299 mg/kg, dont la concentration au 95e centile était de 9,42 mg/kg et la moyenne géométrique de 0,934 mg/kg. Du TCPP a été détecté dans 100 % des échantillons prélevés dans la pièce la plus fréquentée, à une concentration variant de 0,268 à 161 mg/kg, à une concentration au 95e centile de 10,84 mg/kg et à une moyenne géométrique de 1,33 mg/kg (Yang et al. 2019).
Les résultats d’études provenant des États‑Unis et de l’Europe concordent avec les données canadiennes où le TCPP a été mesuré dans la poussière domestique avec une concentration moyenne variant de 0,5 à 3,1 mg/kg (Van den Eede et al., 2011; Brommer et al., 2012; Dodson et al., 2012; Bergh et al., 2011; Stapleton et al., 2009; Marklund et al., 2003).
On a utilisé la concentration au 95e centile de TCPP (18,2 mg/kg) dans la poussière domestique de l’EPDC pour estimer l’absorption quotidienne, par la poussière, par la population générale du Canada (communication personnelle du Bureau de la science et de la recherche en santé environnementale, de Santé Canada, datée du 22 août 2014).
Du TDCPP dans la poussière a été rapporté dans plusieurs études canadiennes de surveillance de la poussière à Toronto et dans différentes villes canadiennes. Dans le cadre de l’EPDC, le TDCPP a été mesuré dans 99,4 % des échantillons (n = 818) aux concentrations variant d’une valeur inférieure au seuil de détection de la méthode (0,08 mg/kg) à 139 mg/kg avec une concentration médiane et une concentration au 95e centile de 3,08 mg/kg et de 12,7 mg/kg (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale, de Santé Canada adressé au Bureau de l’évaluation des risques pour les substances existantes, de Santé Canada, daté du 13 décembre 2013; sans référence). Du TDCPP a également été mesuré dans la poussière de 23 maisons à Toronto lors d’une campagne d’échantillonnage de 28 jours de mai à août 2013. Du TDCPP a été détecté dans la totalité des échantillons à une concentration variant de 0,206 à 9,53 mg/kg, avec une concentration médiane de 0,917 mg/kg (Vykoukalová et al., 2017). Des échantillons de poussière de 32 maisons de la région du Grand Toronto et de 19 maisons à Ottawa ont été prélevés dans le cadre d’une campagne de prélèvement de trois semaines en 2015. Des échantillons de poussière ont été prélevés dans les chambres de toutes les maisons (n = 51) et, de plus, dans les pièces les plus fréquentées de 26 des 51 maisons. Du TDCPP a été détecté dans la totalité des chambres à une concentration variant de 0,430 à 9,28 mg/kg, avec une concentration au 95e centile de 6,76 mg/kg et une moyenne géométrique de 1,54 mg/kg. Du TDCPP a été détecté dans la totalité des échantillons des pièces les plus fréquentées à une concentration variant de 0,337 à 130 mg/kg, avec une concentration au 95e centile de 12,8 mg/kg et une moyenne géométrique de 2,05 mg/kg (Yang et al., 2019). Une autre étude canadienne a mesuré le TDCPP dans la poussière de 35 maisons et de 10 bureaux à Toronto en 2012 (Abbasi et al., 2016). Les concentrations de TDCPP dans la poussière ont varié de non détecté à 46 mg/kg dans les maisons (fréquence de détection de 83 %) et de non détecté à 190 mg/kg dans les bureaux (fréquence de détection de 90 %). Abbasi et al. (2016) ont également analysé l’association de la présence de TDCPP dans la poussière de l’étude de 2012 avec la poussière présente sur des produits (n = 65) au même endroit. On a principalement trouvé du TDCPP sur la surface de gros appareils électroménagers (concentration non détectée à 494 ng/lingette; fréquence de détection de 43 %, n = 7) et de télévisions à écran plat (concentration non détectée à 193,25 ng/lingette; fréquence de détection de 36 %, n = 14). Les auteurs ont montré qu’il y avait une corrélation positive entre les concentrations moyennes géométriques d’ignifuges halogénés (dont le TDCPP) dans la poussière de maison et de bureau et celles déterminées dans la poussière provenant de la surface de produits électroniques (Abassi et al., 2016).
Les études européennes et américaines de surveillance du TDCPP dans la poussière domestique rapportent des concentrations moyennes semblables à celles observées au Canada, variant de 0,08 à 2,8 mg/kg (Van den Eede et al., 2011; Brommer et al., 2012; Dodson et al., 2012; Stapleton et al., 2009; Ali et al., 2012).
La teneur en TCCPP et en TDCPP a également été surveillée dans la poussière de centres de soins en éducation à la petite enfance. En Suède, la concentration de TCPP a été mesurée dans la poussière de 10 garderies, avec une concentration moyenne de 4,5 mg/kg, tandis que la concentration moyenne de TDCPP était de 28 mg/kg (Bergh et al., 2011). En Californie, aux États-Unis, la présence du TDCPP dans la poussière a été détectée dans 39 centres de soins en éducation à la petite enfance à une concentration variant de 0,76 mg/kg à 71 mg/kg, la concentration moyenne étant de 6 mg/kg et la concentration au 95e centile de 37 mg/kg (Bradman et al., 2012). Le TCPP n’a pas été surveillé dans cette étude. Des échantillons de poussière ont également été prélevés dans des centres d’entraînement à Boston, au Massachusetts (Carignan et al., 2013a). Les concentrations médianes de TCPP et de TDCPP dans ces centres étaient de 2,48 mg/kg et de 13 mg/kg, respectivement (Carignan et al., 2013a).
Le TCPP et le TDCPP ont également été détectés souvent dans les bureaux et les différents véhicules. Webster et al. (2010) ont mesuré le TDCPP dans la poussière de bureaux et de voitures dans la région de Boston, aux États‑Unis, en 2009, où les concentrations moyennes étaient de 9,8 et de 26 mg/kg, respectivement. En Allemagne, on a mesuré les concentrations moyennes de TCPP et de TDCPP dans la poussière de bureaux (n = 10; 3 mg/kg et 0,15 mg/kg, respectivement) et de voitures (n = 12; 3,1 mg/kg et 130 mg/kg, respectivement) (Brommer et al., 2012). Les concentrations dans les bureaux et les voitures dépassaient les concentrations de TCPP et de TDCPP dans les maisons échantillonnées de la même étude. D’autres études ont également rapporté des concentrations de TCPP et de TDCPP plus élevées dans la poussière de voitures que dans la poussière domestique en Europe et au Moyen-Orient (Ali et al., 2013; Brandsma et al. 2014). En outre, on a aussi mesuré le TDCPP dans la poussière de cabines d’aéronefs, la concentration médiane dans la poussière des moquettes étant de 2,1 mg/kg et celle mesurée dans la poussière des bouches d’aération étant de 5,6 mg/kg (Allen et al., 2013). Le TCPP n’a pas été mesuré dans les aéronefs.
La concentration maximale de 139 mg/kg établie dans l’EPDC a été utilisée comme concentration prudente de TDCPP dans la poussière pour l’estimation de l’absorption dans la population générale du Canada, y compris les expositions pouvant être plus élevées dans les centres de soins en éducation à la petite enfance, comme observé aux États‑Unis.
8.1.1.4 Sol et sédiments
Il n’existe aucune donnée de surveillance du TCPP et du TDCPP dans le sol et les sédiments au Canada. Cependant, les deux substances ont été mesurées dans le sol dans une étude en Europe et une étude en Chine. Mihajlovic et al. (2011) ont déterminé la concentration moyenne de TCPP (0,0012 mg/kg) à partir de six échantillons de sol allemand. La concentration de TDCPP était inférieure au seuil de détection de 9 × 10-5 mg/kg (Mihajlovic et al., 2011). Cui et al. (2017) ont mesuré la concentration de TCPP et de TDCPP dans des échantillons de sol provenant de sols urbains de Guangzhou, en Chine. Les concentrations de TCPP ont varié d’une valeur inférieure au seuil de détection de la méthode (0,0002 mg/kg en poids sec, p.s.) à 0,016 mg/kg p.s., la concentration moyenne la plus élevée étant de 0,006 ± 0,005 mg/kg p.s. pour les échantillons (n = 12) de régions commerciales (fréquence de détection = 100 %). Les concentrations de TDCPP ont varié d’une valeur inférieure au seuil de détection de la méthode (0,0002 mg/kg p.s.) à 0,091 mg/kg p.s., la concentration moyenne étant la plus élevée à 0,034 ± 0,026 mg/kg p.s. pour les échantillons (n = 12) provenant également de régions commerciales (fréquence de détection = 100 %) (Cui et al., 2017).
La concentration moyenne dans le sol pour le TCPP (0,0012 mg/kg) et le seuil de détection pour le TDCPP (9 × 10-5 mg/kg) de l’étude réalisée par Mihajlovic et al. (2011) ont été utilisés pour estimer l’absorption de ces deux substances provenant du sol.
8.1.1.5 Eau potable
Des concentrations de TCPP et de TDCPP dans l’eau ont été rapportées au Canada (Venier et al., 2014; Jantunen et al., 2013b; Truong, 2016; Truong et al., 2017; Hao et al., 2018) (voir le tableau 7‑10 et le tableau 7‑11). Le TCPP a été mesuré dans une étude pilote sur l’eau du robinet à Barrie, en Ontario (n = 2), à une concentration de 11 ng/L (Jantunen, 2014). Aucune donnée sur les concentrations de TDCPP dans l’eau du robinet n’a été trouvée.
Les concentrations de TCPP et de TDCPP ont été mesurées dans l’eau de surface de tributaires ruraux et urbains se jetant dans le lac Ontario, les concentrations les plus élevées étant de 1839 ng/L et de 1437 ng/L dans les zones urbaines, respectivement. Le TCPP a été trouvé en concentrations plus faibles, soit entre 4,64 et 180 ng/L dans les régions rurales (Jantunen et al., 2013b). Truong (2016) a mesuré les concentrations de TCPP et de TDCPP dans trois ruisseaux lors des périodes de débit élevé et de débit faible à Toronto, au Canada. La concentration de TCPP (établie sur la somme de deux isomères de TCPP) a varié de 3,4 × 10-4 à 5,1 × 10-3 ng/L. La concentration de TDCPP a varié d’une valeur inférieure au seuil de détection (non indiquée) à 4,7 × 10-4 ng/L (Truong, 2016). Dans une autre étude, Venier et al. (2014) a mesuré des concentrations plus faibles de TCPP et de TDCPP à différents endroits autour des Grands Lacs (ECCC, 2019). Des échantillons d’eau de surface ont été prélevés de trois ruisseaux urbains à Toronto en 2014-2015 (n = 14) et la concentration des isomères de TCPP a été mesurée. Une concentration moyenne de TCPP (rapportée comme la somme des isomères du TCPP, ƩTCPP) de 2700 ng/L et une gamme de concentrations variant de 1100 à 4400 ng/L ont été rapportées (Truong et al., 2017). Dans une autre étude dans laquelle les concentrations de TCPP et de TDCPP dans des échantillons d’eau de ruisseaux urbains et d’eau lacustre en zone littorale prélevés dans la région de Toronto à l’été et à l’automne de 2014 et au printemps et à l’été de 2015. La présence du TCPP a été détectée dans 12 des 20 échantillons d’eau de surface dans une gamme de concentrations variant de 290 à 2010 ng/L, et celle du TDCPP a été détectée dans 1 des 20 échantillons d’eau de surface à une concentration de 130 ng/L (Hao et al., 2018).
Les concentrations de TCPP et de TDCPP ont été mesurées en Europe dans différents types de dépôts, dont la neige et la pluie, en plus de l’eau de surface de cours d’eau, d’estuaires et d’océan. Les concentrations de TCPP dans la pluie se sont révélées plus élevées que dans la neige, les concentrations moyennes étant de 372 ng/L et de 233 ng/L en Allemagne, respectivement (Mihajlovic et Fries, 2012). La présence de TDCPP a été détectée en concentrations moyennes de 46 ng/L dans la pluie et de 100 ng/L dans la neige (Mihajlovic et Fries, 2012). Les deux substances étaient moins concentrées plus au nord, les concentrations dans la neige variant de 68 à 210 ng/kg (TCPP) et de 4 à 29 ng/kg (TDCPP) en Suède (Marklund et al., 2005a).
Le TCPP a été mesuré dans l’eau de cours d’eau à des concentrations variant de 24 à 570 ng/L en Allemagne, concentrations qui étaient plus élevées que celles mesurées dans l’océan ou les estuaires (Bollman et al., 2012). Les mesures dans les échantillons prélevés dans des voies navigables situées à proximité d’usines de traitement des eaux usées (UTEU) en Allemagne, en Autriche et en Norvège ont monté que les concentrations sont d’environ 10 fois plus élevées en aval (Meyer et Bester, 2004; Andreson et al., 2004; Green et al., 2008; Martinez-Carballo et al., 2007). Des concentrations similaires de TCPP (100 à 310 ng/L) dans des cours d’eau ont été mesurées dans des régions rurales de la Corée du Sud, de l’Asie (Yoon et al., 2010). Le TDCPP a été mesuré dans des cours d’eau en Allemagne à des concentrations variant de 5 à 67 ng/L (Bollman et al., 2012). Ces concentrations sont plus faibles que celles mesurées dans l’eau (20 à 740 ng/L) près d’UTEU en Allemagne et en Suède (Meyer et Bester, 2004; Andreson et al., 2004; Green et al., 2008).
Comme les données sur les concentrations de TCPP et de TDCPP dans l’eau potable étaient limitées, les concentrations maximales dans l’eau de surface de 5100 ng/L (Truong, 2016) et de 1437 ng/L (Jantunen et al., 2013b), pour le TCPP et le TDCPP, respectivement, ont été considérées comme les données les plus utiles pour calculer une valeur estimative de la limite supérieure de l’absorption quotidienne par l’eau potable par la population générale du Canada.
8.1.1.6 Aliments
Aucun rapport d’étude de surveillance du TCPP ou du TDCPP dans des aliments produits au Canada n’a été trouvé. Le TCPP et le TDCPP sont surveillés dans des enquêtes sur les paniers d’épicerie par la FDA des États‑Unis depuis les années 1980. Aucune quantité de TDCPP n’a été rapportée; le TCPP a été détecté dans la peau de fruits à des concentrations variant de 0,05 à 0,82 µg/kg (ATSDR, 2012).
Une surveillance du TCPP et du TDCPP dans les poissons, les crustacés et les mollusques a été menée dans quatre études européennes (ECCC, 2019). Les concentrations dans les tissus des poissons (perche, morue, saumon et omble de fontaine) et les mollusques bivalves (moule) ont été mesurées dans l’eau douce et l’eau de mer de certaines régions en Suède et en Norvège. Les concentrations de TCPP et de TDCPP étaient inférieures au seuil de détection de 10 µg/kg dans les moules en Norvège, mais le TCPP a été détecté en concentrations allant jusqu’à 15,6 µg/kg dans des moules en Suède (Green et al., 2008; Sundkvist et al., 2010). Les concentrations de TCPP et de TDCPP dans des poissons à nageoires de pays nordiques ont varié d’une valeur inférieure au seuil de détection de 0,1 µg/kg à 5,7 µg/kg et de 0,3 µg/kg à 8,1 µg/kg, respectivement (Green et al., 2008; Evenset et al., 2009; Sundkvist et al., 2010). Dans une étude suédoise, des échantillons de poisson acheté dans une épicerie ont été prélevés et aucune des deux substances n’a été détectée en concentrations supérieures au seuil de détection de 1 µg/kg et de 9 µg/kg pour le TCPP et le TDCPP, respectivement (Campone et al., 2010).
Les limites supérieures des concentrations de TCPP de 15,6 µg/kg dans des mollusques en Suède et de TDCPP de 8,1 µg/kg dans des poissons à nageoires de l’Arctique en Norvège ont été choisies pour estimer l’absorption quotidienne de source alimentaire dans la population générale (Sundkvist et al., 2010; Evenset et al., 2009). On a également utilisé la limite supérieure des concentrations de TCPP dans des fruits (0,82 µg/kg) pour estimer l’absorption quotidienne de TCPP par les aliments. Les limites supérieures estimatives de l’absorption quotidienne par l’alimentation dans la population générale au Canada étaient de 0,068 et de 0,028 µg/kg p.c. par jour pour le TCPP et le TDCPP, respectivement (pour les enfants âgés de 6 mois à 4 ans). Ce sont des valeurs estimatives prudentes parce qu’elles on les a calculées en supposant que tous les poissons, crustacés et mollusques consommés contiennent du TCPP ou du TDCPP à la concentration maximale mesurée dans les poissons. Bien que dans certaines populations du nord ou d’autres sous-populations au Canada, on puisse consommer de plus grandes quantités de crustacés et de mollusques dans sa diète, cette valeur estimative est considérée comme suffisante pour tenir compte de cette plus grande consommation.
8.1.1.7 Lait maternel
Aucune donnée n’a été trouvée sur les concentrations de TCPP et de TDCPP dans le lait maternel au Canada et aux États-Unis. Le TCPP et le TDCPP ont été mesurés dans le lait maternel de 6 études de cohortes en Suède. La concentration de TCPP dans le lait maternel a été calculée à partir de la concentration de lipides en poids la plus élevée de 57 ng/g mesurée dans le lait maternel de 50 femmes, et a été transformée de la même manière pour obtenir une concentration de 1,99 µg/L. La concentration de 0,186 µg/L de TDCPP dans le lait maternel est fondée sur la concentration de lipides en poids la plus élevée (5,3 ng/g) mesurée dans le lait maternel de 90 femmes, corrigée avec la teneur en lipides dans le lait maternel (3,4 %) et la densité du lait maternel (Sundkvist et al., 2010).
Les concentrations de TCPP et de TDCPP ont également été mesurées dans le lait maternel de trois participantes en Australie. Les concentration de TCPP mesurées ont varié d’une valeur inférieure au seuil de détection de 2,4 µg/L à 14 µg/L et celles du TDCPP ont varié d’une valeur inférieure au seuil de détection de 0,053 µg/L à 0,14 µg/L (He et al., 2018).
Les concentrations maximales dans le lait maternel de 1,99 µg/L et de 0,186 µg/L pour le TCPP et le TDCPP, respectivement, mesurées dans une étude de cohorte en Suède (Sundkvist et al. 2010), ont été choisies comme données les plus pertinentes pour estimer la limite supérieure de l’absorption quotidienne de ces substances par les nourrissons allaités, grâce à la grande taille de l’échantillon de l’étude.
8.1.2 Produits de consommation
Le TCPP et le TDCPP sont des additifs ignifuges ayant diverses utilisations et applications (voir la section 4), dont certaines peuvent entraîner une exposition de la population générale. Les estimations de l’exposition par voie cutanée et orale ont été calculées à l’aide de méthodes prudentes dans le cadre des scénarios jugés pertinents pour la population générale. Le TCPP et le TDCPP sont des substances semi-volatiles. Par conséquent, ils ne devraient pas se présenter sous forme gazeuse en grandes quantités dans des conditions normales. L’exposition par inhalation n’a été estimée que pour les scénarios de travaux réalisés par les particuliers (c.‑à‑d. application d’isolant en mousse giclé et pulvérisation de substances imperméabilisantes) qui pourraient donner lieu à des concentrations élevées dans l’air pendant une courte durée. L’exposition par inhalation résultant des rejets quotidiens dans l’air (c.‑à‑d. les dégagements gazeux produits dans la maison, tels que les meubles et les matelas ou encore l’isolant qui est présent dans les maisons derrière les murs) devrait être couverte par l’estimation de l’exposition à l’air intérieur et à la poussière (voir les sections 8.1.1.2 et 88.1.1.3).
8.1.2.1 Articles manufacturés
Le TCPP et le TDCPP sont utilisés comme produits en mousse souple (p. ex., dans les meubles tels que les sièges ou les matelas), les matelas de sieste, les sièges de retenue pour enfant et dans la construction de bâtiments au Canada (ECCC 2013-2014; CEH 2013a,b; Stapleton et al. 2011). Le TCPP et le TDCPP se trouvent fréquemment dans la mousse des meubles à des concentrations atteignant 9 % p/p (Kemmlein et al. Stapleton et al. 2009 Stapleton et al. 2011 Stapleton et al. 2012; Ionas et al. 2014; US CPSC 2005a,b; ECCC 2013-2014). En outre, le TCPP et le TDCPP ont également été mesurés dans plusieurs produits pour enfants contenant de la mousse aux États‑Unis, notamment des matelas de sieste (CEH 2013b), des chaises en mousse (dont un contenant du TCPP, acheté au Canada) (CEH 2013a), des sièges de retenue pour enfant, des coussins de table à langer, des chaises à bascule et des matelas portables, à des concentrations allant de 0,11 à 1,4 % p/p pour le TCPP et de 0,24 à 12,4 % p/p pour le TDCPP (respectivement 1,11 à 14,4 mg/g et 2,4 à 124 mg/g) (Stapleton et al. 2011). Dans un essai mené par Santé Canada sur 23 produits pour enfants (p. ex., coussins d’allaitement, chaises en mousse de polyuréthane, jouets) achetés dans des magasins de détail à Ottawa, en Ontario, en 2014, du TDCPP a été détecté dans un jouet en mousse à une concentration moyenne d’environ 7 %; l’essai n’a pas détecté de TCPP au-dessus de la limite de quantification (LQ = 0,3 %) dans l’un ou l’autre des échantillons de mousse (Santé Canada, 2014). Dans une étude supplémentaire menée en 2015 par Santé Canada sur 21 produits en polyuréthane pour enfants (p. ex., des jouets, des coussins), les concentrations de TCPP étaient comprises entre 0,02 et 3,4 % p/p (LQ = 0,013 % p/p) (les concentrations maximales ont été trouvées dans les jouets de bain) tandis que les concentrations de TDCPP variaient entre 0,012 et 7,3 % p/p (LQ = 0,012 % p/p) (Santé Canada 2015b).
Les substances ignifuges peuvent également être présentes dans les revêtements de la face intérieure des tissus de couverture des meubles (p. ex., les canapés), appelés « enduction d’envers ». L’utilisation de TCPP ou de TDCPP en tant qu’enduction d’envers dans le rembourrage des meubles n’a pas été déterminée précisément pour le Canada, mais elle est connue aux États-Unis et en Europe (USACPSC 1998, 2005a,b; EURAR 2008b; Danish EPA 2014); par ailleurs, il est raisonnable de présumer que la population générale au Canada peut être exposée au TCPP ou au TDCPP présent dans les meubles. L’Upholstered Furniture Action Council (UFAC), une coalition volontaire de fabricants de meubles, a mis en avant le potentiel d’exposition cutanée à la couche d’enduction d’envers, soit par contact direct avec la substance découlant de la contamination de la surface extérieure du tissu (à partir de la couche d’enduction d’envers humide lorsque le textile est enroulé après la production), soit par la dégradation de la couche d’enduction d’envers, ou par le tissage du textile (cité dans USACPSC 1998). Dans une étude de la Commission de coopération environnementale (CCE), on a testé 132 produits d’ameublement (chaises, canapés, poufs) achetés entre décembre 2014 et avril 2015 au Canada, aux États‑Unis et au Mexique (CCE 2015). Seize substances ignifuges ont été mesurées et le TCPP et le TDCPP figuraient parmi les six substances détectées dans 61 des 132 produits testés, à des concentrations allant de 0,01 à 8,9 % p/p et de 0,03 à 5,8 % p/p, respectivement. Le TCPP était la substance ignifuge la plus fréquemment détectée dans les trois pays et a été le plus souvent détecté dans les échantillons de produits achetés au Canada (45 des 193 échantillons, soit 23 %). Le TDCPP a été détecté dans 8 des 193 échantillons (4 %) de produits achetés au Canada. Le TCPP a été trouvé principalement dans des échantillons de mousse (91 % des 54 produits contenant du TCPP), bien qu’il ait également été trouvé dans les échantillons de tissu (24 %), de matelassage (11 %) et de remplissage (4 %). On l’a également trouvé dans le rembourrage de chaises, de chaises de bureau, de poufs et de canapés. Le TDCPP a également été mesuré principalement dans les échantillons de mousse (73 % des 15 produits) et moins fréquemment dans du rembourrage (CCE 2015).
Bien que l’évaluation des risques faite par l’Union européenne, pour ce qui est du TCPP et du TDCPP, n’ait pas estimé l’exposition cutanée via les objets en mousse (EU RAR 2008a,b), cette organisation et d’autres ont signalé que certaines substances ignifuges migrent à partir de divers objets en mousse (EU RAR 2009; US CPSC 2005b; Arcadis EBRC 2011; Danish EPA 2015). Plus précisément, le programme américain US CSPC a montré que le TDCPP peut migrer à la surface de la mousse recouverte de tissu dans des conditions simulées de transpiration et de pression (c.‑à‑d. pour simuler une position assise) (U.S. CPSC 2005b). Plus récemment, l’ECHA a examiné l’exposition cutanée des enfants au TCEP, au TCPP et au TDCPP (c.‑à‑d. le TDCP) via des produits destinés à ceux-ci, p. ex., des matelas de bébé et des sièges de retenue pour enfant (ECHA 2018).
Compte tenu de l’ensemble des données sur la migration des substances ignifuges à partir des objets en mousse, et compte tenu des modèles et algorithmes développés par divers pays et organisations pour évaluer l’exposition par cette source, il a été jugé approprié d’évaluer l’exposition cutanée au TCPP et au TDCPP via la mousse souple de polyuréthane contenue dans les matelas ou les meubles rembourrés (p. ex., les canapés).
Les doses d’exposition cutanée ont été estimées pour les enfants et les adultes en contact cutané prolongé avec des matelas et des meubles contenant de la mousse, dans un scénario représentatif de la limite supérieure d’exposition potentielle (annexe D). Étant donné la nature prudente de ce scénario, cette estimation prendrait également en compte l’exposition potentielle due à l’enduction d’envers des meubles. Cette exposition a été modélisée à l’aide d’un algorithme qui correspond à celui des modèles utilisés par d’autres pays et organisations pour estimer l’exposition cutanée à une substance migrant depuis la mousse ou le l’enduction d’envers en textile (US CPSC 2006a; ECHA 2018; NRC 2000; Danish EPA 2014, 2015; Arcadis EBRC 2011).
Des études d’extraction visant à mesurer le TCPP et le TDCPP migrant de la mousse pour meubles vers des solutions aqueuses (p. ex., la sueur artificielle) ont été rapportées (US CPSC 2005b; TNO Quality of Life 2005, cité dans EU RAR 2008a). Dans l’étude TNO Quality of Life (2005), on a réalisé un test de migration sur un bloc de mousse non recouvert contenant 10 % de TCPP, ce qui a donné un taux de migration de 4,6 × 10-3 mg/cm2/h lorsque la pression a été appliquée à une pile mouillée composée de 15 papiers filtres placés directement sur la mousse. Le taux de migration de 5,6 × 10-5 mg/cm2/h du TDCPP utilisé pour estimer l’exposition cutanée est basé sur une étude de migration réalisée par le programme américain CPSC dans laquelle on a utilisé une mousse de meuble contenant 6,6 % p/p de TDCPP qui a été recouverte de tissu dans une maquette de meuble miniature (U.S. CPSC 2005b). Dans cette étude, la maquette de meuble a été mouillée, un papier filtre a été placé sur sa surface et une pression a été appliquée. Dans les deux cas, on a supposé que la substance ignifuge mesurée dans le papier filtre était disponible pour l’exposition cutanée via le liquide ayant migré depuis la mousse. Comme on n’a trouvé aucune donnée sur la relation entre le taux de migration du TCPP ou du TDCPP depuis la mousse et leurs concentrations dans la mousse testée, cette variable n’a pu être incluse dans l’algorithme utilisé pour estimer l’exposition cutanée.
L’absorption cutanée de TCPP et de TDCPP par la peau a également été étudiée. Les rapports RAR de l’UE concernant le TCPP et le TDCPP (TNO Quality of Life, 2005, 2006b, cité dans RAR 2008a,b) décrivent les études d’absorption cutanée in vitro réalisées à l’aide de membranes de peau humaine, avec une application directe de TCPP et de TDCPP radiomarqués; l’absorption totale maximale obtenue était de 23 % et de 40 % pour le TCPP et de 15 % pour le TDCPP. Les deux valeurs d’absorption de 23 et 40 % pour le TCPP ont été calculées à partir des études mettant plusieurs doses à l’essai. L’absorption cutanée de 40 % était basée sur des tests réalisés avec des concentrations plus faibles qui ont été jugées plus représentatives de l’exposition due au contact cutané avec la mousse. Cette valeur a été utilisée pour estimer l’exposition cutanée due au contact avec des meubles ou des matelas contenant du TCPP (TNO Quality of Life 2005). L’absorption cutanée de 15 % pour le TDCPP, obtenue par une étude in vitro, était basée sur une dose qui était supérieure à celle qui est habituellement reçue par l’exposition à des meubles en mousse (en d’autres mots, elle n’est pas représentative), et par conséquent elle a été ajustée dans le rapport RAR de l’Union européenne (EU RAR 2008b) en fonction du rapport des valeurs d’absorption d’après les études in vitro réalisées avec le TCPP (c.‑à‑d. valeur multipliée par un facteur de deux). On a ainsi obtenu une valeur d’absorption cutanée ajustée de 30 % pour le TDCPP (EU RAR 2008b). Cette valeur a été utilisée pour estimer l’exposition cutanée due au contact avec des meubles ou des matelas contenant du TDCPP.
Les estimations les plus élevées de l’exposition quotidienne au TCPP et au TDCPP par contact cutané prolongé avec des matelas ou des meubles contenant de la mousse souple de polyuréthane concernaient les nourrissons, et ces valeurs étaient de 0,54 mg/kg p.c./j et 5,0 × 10-2 mg/kg p.c./j, respectivement. De plus amples renseignements sur les hypothèses utilisées pour calculer les estimations de l’exposition par voie cutanée figurent à l’annexe D.
Les estimations de l’exposition par la mise à la bouche d’objets en mousse ont été calculées sur la base des taux de migration du TCPP et du TDCPP déterminés par la Danish EPA (Danish EPA 2015) dans des expériences plus représentatives de la migration lors de la mise à la bouche que les études de migration depuis la surface utilisées pour estimer l’exposition cutanée. La mousse contenue dans les produits pour enfants (c.‑à‑d. les sièges de retenue pour enfant, les porte-bébés, les matelas pour bébés) a été immergée dans un simulateur de sueur et incubée à 37 °C pendant 3 heures (Danish EPA 2015). On suppose que la migration du TCPP et du TDCPP dans le simulateur de sueur serait similaire à la migration dans la salive. On a ainsi obtenu des taux de migration moyens de 1,78 × 10-2 mg/cm2/h et 2,97 × 10-3 mg/cm2/h pour le TCPP et le TDCPP, respectivement (ECHA 2018). En supposant qu’un objet en mousse est mis à la bouche sur une surface de 10 cm2 pour les nourrissons et de 20 cm2 pour les tout-petits au cours d’une mise à la bouche de 24,5 minutes par jour (Norris et Smith 2002, citée dans US EPA 2011), on obtient des valeurs d’ingestion estimées de 9,7 et 9,4 µg/kg p.c./j pour le TCPP pour les nourrissons et les tout-petits, et de 1,6 µg/kg p.c./j pour le TDCPP pour les nourrissons et les tout-petits. D’autres détails liés aux hypothèses utilisées pour calculer les estimations de l’exposition par voie orale sont repris dans l’annexe D.
Voie d’exposition et durée d’exposition |
Source |
Groupe d’âge |
Exposition systémique au TCPP |
Exposition systémique au TDCPP |
|---|---|---|---|---|
Voie cutanée (quotidienne) |
Mousse dans les matelas ou meubles d’enfants |
Nourrisson (de 0 à 6 mois; 7,5 kg) |
0,16 – 0,54 mg/kg p.c./j |
1,5 × 10-2 – 5,0 × 10‑2 mg/kg p.c./j |
Voie cutanée (quotidienne) |
Mousse dans les matelas ou meubles d’enfants |
Tout-petit (de 0,5 à 4 ans; 15,5 kg) |
0,11 – 0,41 mg/kg p.c./j |
1,0 × 10-2 – 3,8 × 10-2 mg/kg p.c./j |
Voie cutanée (quotidienne) |
Mousse dans les matelas ou les meubles |
Adulte (70,9 kg) |
0,04 – 0,19 mg/kg p.c./j |
3,8 × 10-3 – 1,7 × 10-2 mg/kg p.c./j |
Mise à la bouche (intermittente) |
Mousse dans les produits pour enfants |
Nourrisson (de 0 à 6 mois; 7,5 kg) |
9,7 × 10-3 mg/kg p.c./j |
1,6 × 10-3 mg/kg p.c./j |
Mise à la bouche (intermittente) |
Mousse dans les produits pour enfants |
Tout-petit (de 0,5 à 4 ans; 15,5 kg) |
9,4 × 10-3 mg/kg p.c./j |
1,6 × 10-3 mg/kg p.c./j |
Le TCPP et le TDCPP sont utilisés dans d’autres articles manufacturés, tels que les textiles spécialisés dans le cas du TDCPP (p. ex., matériaux pour les tentes) et dans diverses pièces pour intérieur de véhicules dans le cas des deux substances (ECCC 2013-2014). Dans une étude, on a détecté du TDCPP dans le textile de 3 des 11 tentes testées (Keller et al. 2014). Bien que l’exposition au TCPP ou au TDCPP puisse se produire via ces produits, le potentiel d’exposition lié à l’utilisation de ces produits ne devrait pas être plus élevé que celui lié à la mousse de polyuréthane souple en raison de la fréquence et de la durée d’utilisation relativement élevées des produits en mousse (c.‑à‑d. les matelas, les produits pour enfants).
8.1.2.2 Autres produits de consommation
Au Canada, le TCPP est utilisé comme additif dans plusieurs types d’isolants en mousse de polyuréthane giclée (MPG) (ECCC 2013-2014). Selon le site Web de l’EPA sur l’isolant à base de MPG, même si les appareils basse pression à deux composants et la mousse à un composant sont utilisés par les applicateurs professionnels, ces types de produits peuvent aussi être utilisés par les particuliers (USEPA, 2015). À ce titre, deux scénarios ont été élaborés pour les particuliers réalisant eux-mêmes des projets d’isolation avec de la MPG, c’est-à-dire avec une mousse à un composant pour les petites tâches et avec un système basse pression à deux composants pour les tâches importantes. Bien que les étiquettes de produits isolants contenant de la MPG précisent des mesures de protection individuelle, telles que l’utilisation de gants ou une protection respiratoire, les estimations de l’exposition ne tiennent pas compte du port d’un équipement de protection individuelle, car les consommateurs n’ont pas nécessairement un accès facile à cet équipement ou peuvent ne pas bien l’utiliser. L’application de ces types de produits devrait être peu fréquente (c.‑à‑d. une fois tous les cinq ans (RIVM 2007)).
Pour un petit travail utilisant un seul composant (c.‑à‑d. seulement pour remplir les interstices autour des fenêtres et des portes), on a estimé l’exposition par inhalation et par voie cutanée au TCPP à l’aide de ConsExpo Web (2016). La concentration moyenne de TCPP dans l’air lors d’un événement pour ce type de petit travail est estimée à 180 µg/m3, ce qui équivaut à une ingestion de 0,88 µg/kg p.c./événement par inhalation. L’absorption cutanée de TCPP au cours de cette même activité a été estimée à 6,8 µg/kg p.c./événement. De plus amples détails au sujet de ce scénario figurent à l’annexe E, dans les tableaux E1 et E3.
Pour un grand projet avec mousse à deux composants (p. ex., isolation d’un grenier par un propriétaire), l’exposition par inhalation et par voie cutanée au TCPP a également été estimée. On dispose d’une étude dans laquelle les concentrations atmosphériques de TCPP ont été mesurées lors de l’application d’une MPG à deux composants pour un projet d’envergure réalisé par des professionnels (giclage mural intégral; ACC 2012). Les résultats de surveillance du système basse pression, obtenus par cette étude, ont été jugés représentatifs d’un scénario d’utilisation par un particulier. Les concentrations de TCPP dans la zone de respiration du préposé à l’application étaient comprises entre 477 et 2 940 µg/m3 (ACC 2012), soit des valeurs d’ingestion de 2,3 et de 14 µg/kg p.c./événement (annexe E, tableau E4) par inhalation. Dans cette étude, on a également fait état d’une concentration de TCPP dans l’air (27 à 45 µg/m3), soit un à deux ordres de grandeur (environ 10 à 100 fois) plus faibles lors des essais post-giclage (ACC 2012). L’absorption cutanée de TCPP pour ce scénario a été estimée à 635 µg/kg p.c./événement pendant l’application du produit à deux composants, d’après le modèle ConsExpo Web (2016). De plus amples détails au sujet de ce scénario figurent à l’annexe E, tableau E2.
Le TCPP peut également être présent dans un imperméabilisant à pulvériser soi-même à l’extérieur d’une tente (SDS 2014). Ce produit est destiné à être appliqué à l’extérieur de la tente une fois celle-ci montée (SDS 2014). Puisque cette application se fait à l’extérieur, l’exposition par inhalation découlant du produit pulvérisé devrait être minime. Le produit imperméabilisant peut entrer en contact avec 50 % des mains (455 cm2), ce qui entraîne une charge cutanée de 0,071 mg/cm2 (équivalant à 4,7 µg/kg p.c./événement) et une exposition systémique de 1,8 µg/kg p.c./événement (annexe E, tableau E5).
8.1.3 Biosurveillance
Nous avons trouvé certaines études de biosurveillance qui ont mesuré les concentrations urinaires de phosphate de bis(1-chloro-2-propyl) (BCPP), un biomarqueur possible du TCPP (Kosarac et al. 2016; Yang et al. 2019; Ospina et al. 2018; Butt et al. 2014; Castorina et al. 2017; Petropoulou et al. 2016; He et al. 2018; Chen et al. 2018). Cependant, le faible niveau de détection fréquent du BCPP peut être le résultat de la faible production de BCPP à partir du TCPP (Van den Eede et al. 2013), et les auteurs ont suggéré que des recherches supplémentaires étaient nécessaires pour déterminer un biomarqueur approprié pour le TCPP (Butt et al. 2014).
Depuis, un certain nombre d’autres études ont été menées sur la métabolisation du TCPP (Abdallah et al. Van den Eede et al. 2015b et 2016), mais il subsiste des incertitudes quant au biomarqueur le plus approprié pour cette substance. C’est pourquoi les valeurs d’ingestion basées sur les données de biosurveillance humaine du TCPP n’ont pas été calculées.
Le TDCPP est largement métabolisé dans le corps humain, ce qui donne un métabolite majeur : le diester du TDCPP, soit le phosphate d’hydrogène de bis(1,3‑dichloro-2-propyl) (BDCPP) (Van den Eede et al. 2013). Le BDCPP a été déterminé comme étant le principal métabolite (plus de 60 % dans l’urine de rat) dans des études de toxicocinétique in vivo chez les rats (Nomeir et al. 1981; Lynn et al. 1980, 1981). Le BDCPP a fait l’objet d’un contrôle dans l’urine humaine au Canada (Kosarac et al. 2016; Yang et al. 2019) et dans plusieurs études aux États‑Unis, notamment au niveau national dans le cadre de l’enquête National Health and Nutrition Examination Survey (NHANES), chez les femmes enceintes et les tout-petits (Ospina et al. 2018; Hoffman et al. Butt et al. 2014). Comme le BDCPP est la forme diester du TDCPP, on le considère comme un métabolite spécifique du TDCPP et un biomarqueur approprié dans les échantillons d’urine pour estimer l’exposition au TDCPP. D’autres renseignements sur ce métabolite figurent à la section 8.2.2.3.
On a mesuré le BDCPP dans des échantillons d’urine dans deux études canadiennes de biosurveillance (Kosarac et al. Butt et al. 2014 2019). Yang et al. (2018) ont détecté du BDCPP dans 73 % des échantillons d’urine ponctuels de 44 femmes préménopausées de Toronto et d’Ottawa, avec des concentrations non ajustées de BDCPP dans l’urine allant de 0,104 à 13,8 ng/mL. La moyenne géométrique et le 95e centile des concentrations non ajustées de BDCPP dans l’urine étaient respectivement de 0,740 ng/mL et 4,32 ng/mL (Yang et al. 2019). Kosarac et al. (2016) ont prélevé des échantillons d’urine de femmes enceintes (n = 24) dans la région de Hamilton (Ontario), au Canada, entre 2010 et 2012. Du BDCPP a été détecté dans environ 29 % des échantillons à des concentrations (non ajustées pour tenir compte de l’état d’hydratation) allant de < 0,25 à 1,77 ng/mL (LDM = 0,25 ng/mL), avec une moyenne géométrique de 0,27 ng/mL. À Chapel Hill, en Caroline du Nord (États-Unis), huit femmes enceintes (âgées de 28 à 36 ans au moment de la conception) ont fourni des échantillons d’urine entre décembre 2011 et mai 2012, pendant la grossesse et après la naissance (Hoffman et al. 2014). En tout, 39 échantillons d’urine ont été recueillis (3 échantillons pendant la 18e semaine de grossesse (un échantillon ponctuel et un de 24 heures), 1 échantillon ponctuel pendant la 28e semaine et un échantillon ponctuel peu après la naissance de l’enfant, une femme n’ayant pas fourni d’échantillon peu après la naissance). Le BDCPP a été détecté dans 38 des 39 échantillons d’urine, et la concentration maximale corrigée selon la densité était de 34,3 ng/mL, avec une valeur au 95e centile de 7,1 ng/mL et une moyenne géométrique de 2,1 ng/mL (communication personnelle de Hoffman à Santé Canada, juin 2014). D’après l’analyse des échantillons d’urine, les auteurs indiquent que l’exposition au TDCPP varie pour les femmes enceintes et qu’une mesure unique de BDCPP, prise au deuxième trimestre, fournit probablement des renseignements sur le classement de l’exposition tout au long de la grossesse.
Aux États-Unis, on a analysé des échantillons d’urine ponctuels pour détecter le BDCPP dans le cadre de la National Health and Nutrition Examination Survey (NHANES) de 2013-2014 (Ospina et al. 2018). Le BDCPP a été détecté dans 92 % des 2 666 échantillons (LD = 0,11 µg/L). La concentration moyenne géométrique de BDCPP pour tous les groupes d’âge (6 à 60 ans et plus) était de 0,856 µg/L (0,913 µg/g après correction pour la créatinine) avec une valeur au 95e centile de 7,23 µg/L (6,30 µg/g après correction pour la créatinine). Les enfants de 6 à 11 ans présentaient les plus fortes concentrations urinaires de BDCPP avec une moyenne géométrique de 2,25 µg/L (2,89 µg/g après correction pour la créatinine) et une valeur au 95e centile de 14,9 µg/L (14,8 µg/g après correction pour la créatinine). Les adultes de 60 ans et plus présentaient les plus faibles concentrations de BDCPP avec une moyenne géométrique de 0,497 µg/L (0,599 µg/g après correction pour la créatinine) et une valeur au 95e centile de 5,20 µg/L (4,03 µg/g après correction pour la créatinine).
À Princeton, dans le New Jersey, dans le cadre d’une étude avec jumelage mère/tout-petit, des échantillons ponctuels d’urine ont été recueillis chez 22 mères et 26 enfants « jumelés » (cinq mères étaient jumelées avec deux enfants; une mère n’a pas fourni l’urine de l’enfant), puis ont été analysés pour déceler le BDCPP (Butt et al. 2014). Du BDCPP a été détecté dans 100 % des échantillons des mères et des tout-petits. Les concentrations maximales corrigées pour la densité étaient de 11,0 ng/mL pour les mères et de 251 ng/mL pour les tout-petits, avec des moyennes géométriques de 2,4 ng/mL et 5,6 ng/mL pour les mères et les tout-petits, respectivement. Les auteurs ont déterminé une corrélation positive entre les mères et les tout-petits dans le cas du BDCPP et cette tendance peut indiquer qu’un environnement partagé est un facteur déterminant important de l’exposition au TDCPP (Butt et al. 2014). En Australie, on a également constaté que les concentrations de BDCPP chez les nourrissons étaient plus élevées que chez les adultes (Van den Eede et al. 2015a). L’utilisation répandue du TDCPP dans les produits pour enfants (Stapleton et al. 2011, CEH 2013b, Santé Canada 2014, 2015b), ainsi que le comportement particulier des jeunes enfants (c.‑à‑d. la mise à la bouche des objets et de la main) pourraient expliquer les concentrations plus élevées de BDCPP observées dans l’urine des enfants par rapport aux adultes.
Des données de biosurveillance supplémentaires ont été trouvées aux États‑Unis (Cooper et al. 2011; Carignan et al. 2013b) ainsi qu’en Australie (Van den Eede et al. 2015a). Carignan et al. (2013b) ont fait état d’une tendance positive entre les concentrations urinaires de BDCPP et le TDCPP dans la poussière des bureaux, qui n’a pas été observée dans d’autres environnements (c.‑à‑d. les maisons et les véhicules). Une autre étude menée à Boston a mesuré les niveaux de BDCPP dans l’urine et a mis en corrélation ces concentrations avec les niveaux de poussière détectés dans les maisons des personnes (Meeker et Stapleton, 2010; Meeker et al. 2013). Une analyse statistique a permis d’établir une corrélation faible (rS = 0,31), mais statistiquement significative (p = 0,03) entre les concentrations de BDCPP dans l’urine (sans correction pour la masse volumique) et les concentrations de TDCPP dans la poussière des maisons (Meeker et al. 2013).
La dosimétrie inverse a été utilisée pour estimer l’ingestion quotidienne à partir des concentrations urinaires, d’après un ensemble d’études les plus pertinentes (c.‑à‑d. des études canadiennes, des études portant sur des échantillons de grande taille provenant de pays similaires au Canada et des études portant sur de jeunes enfants et qui n'étaient pas couvertes par d’autres études) pour tenir compte des différents groupes d’âge (des enfants aux adultes), ainsi que des femmes enceintes, et les résultats sont présentés dans le tableau 8‑2. Un facteur de correction de 21 % pour l’élimination incomplète du BDCPP a été appliqué aux estimations. Cette valeur était basée sur une combinaison de données provenant d’études de toxicocinétique menées sur des rats (Minegishi et al. 1988; Nomeir et al. 1981; Lyn et al. 1980, 1981) (on trouvera des renseignements détaillés à l’annexe F). La métabolisation du TDCPP et l’élimination dans l’urine des rats sont relativement rapides, avec une demi-vie dans l’urine d’environ 12 heures (Minegishi et al. 1988). En outre, le métabolisme relativement rapide est conforme à l’étude in vitro sur des cellules humaines réalisée par van den Eede et al. (2013). De plus amples détails sur la toxicocinétique du TDCPP figurent à la section 8.2.2.3. Des précisions sur la dosimétrie inversée figurent à l’annexe F.
Étude |
Participants |
Lieu |
Moyenne géométrique et [valeur maximale] ou [au 95e centile] des concentrations dans l’urine (ng/mL) |
Estimations de l’ingestion (μg/kg p.c./j)a |
|---|---|---|---|---|
Kosarac et al. 2016 |
Femmes enceintes (n = 24) |
Hamilton (Ontario), Canada |
0,27b [1,77] |
0,07 [0,43] |
Yang et al. 2018 |
Femmes préménopausées (n = 44) |
Toronto et Ottawa (Ontario), Canada |
0,74b [P95 = 4,32] |
0,13 [0,79] |
Butt et al. 2014 |
Tout-petits (2 à 5 ans; jumelés avec les mères) (n = 23) |
New Jersey, États-Unis |
5,6c [251] |
1,6 [72]d |
Ospina et al. 2018 |
Enfants (6 à 11 ans) (n = 421) |
États-Unis |
2,89d [P95 = 14,8] |
0,39 [2,0] |
Ospina et al. 2018 |
Adolescents (12 à 19 ans) (n = 427) |
États-Unis |
1,14d [P95 = 6,82] |
0,17 [1,0] |
Ospina et al. 2018 |
Adultes (20 à 60 ans et plus) (n = 1 818) |
États-Unis |
0,850de [P95 = 4,33] |
0,13 [0,66] |
a Les estimations de l’ingestion sont basées sur la concentration moyenne géométrique indiquée dans la colonne précédente. Les valeurs entre parenthèses correspondent à l’estimation de l’ingestion établie à partir du maximum ou de la valeur P95 indiquée dans la colonne précédente.
b Les concentrations urinaires ne sont pas ajustées.
c Les concentrations sont normalisées en fonction de la densité (comme il est indiqué dans les études).
d Les concentrations sont corrigées en fonction de la créatinine (comme il est indiqué dans Ospina et al. 2018).
e Les concentrations chez les personnes de 20 à 59 ans sont utilisées (les concentrations chez les personnes de 60 ans et plus étaient plus faibles).
8.2 Évaluation des effets sur la santé
8.2.1 PTCP
8.2.1.1 Carcérogénicité et génotoxité
On n’a relevé aucune étude sur la toxicité chronique ou la cancérogénicité liée au TCPP. Le programme américain National Toxicology Program (NTP) (2018) a mené des études de toxicité et de cancérogénicité par voie orale sur 90 jours et 2 ans chez le rat et la souris, mais le rapport de l’étude n’était pas disponible au moment de l’évaluation. La préoccupation liée à la cancérogénicité potentielle était due à la similarité structurelle avec d’autres esters d’organophosphate qui ont présenté des effets cancérogènes dans les études de cancérogénicité sur deux ans réalisées sur des animaux de laboratoire.
Plusieurs autres données ont été étudiées pour caractériser le potentiel cancérogène du TCPP (davantage de détails sont disponibles dans Santé Canada, 2015a), notamment une approche analogue, les relations quantitatives structure-activité (QSAR) et l’approche des alertes structurales. On a considéré que le TCEP et le TDCPP pouvaient être utilisés aux fins de lecture croisée qualitative pour ce qui est de la cancérogénicité. Le gouvernement du Canada a publié une évaluation préalable finale pour le TCEP (Environnement Canada, Santé Canada, 2009) et a conclu que le TCEP démontrait un potentiel cancérogène et qu’il ne fallait pas exclure le fait que l’induction de tumeurs pouvait se faire par un mode d’action impliquant une interaction directe avec le matériau génétique. L’évaluation des effets sur la santé humaine pour le TDCPP décrite dans la section 8.2.2 indique que le TDCPP est associé au potentiel cancérogène. D’une manière générale, les données laissent entendre que le TCPP peut être cancérogène pour les rongeurs.
Un certain nombre d’études in vitro et in vivo ont été relevées.
Une bonne partie de ces études sont décrites en détail dans le rapport RAR de l’UE concernant le TCPP (EURAR 2008a). Des études de génotoxicité in vitro (tests d’Ames) ont montré peu de signes de potentiel mutagène chez les bactéries et les champignons (Stauffer Chemical Co. 1976, 1978d; Parmar 1977; Tenneco Chemicals Inc. 1977a, b; Nakamura et al. 1979; Anon 1980; Mobil Environmental and Health Safety Laboratory 1980; SafePharm Laboratories Ltd 1992; Zeiger et al. 1992; Follmann and Wober 2006). Les études in vitro sur des cellules de mammifères (tests des lymphomes de souris, tests de la synthèse non programmée de l’ADN, tests des comètes) ont donné des résultats équivoques (Stauffer Chemical Co. 1978e,f,g, 1980a; Environmental Affairs and Toxicology Department 1981; Covance Laboratories Inc. 2005b; Bayer 1991b; Williams et al. 1989; Follmann and Wober 2006). Les résultats obtenus dans l’un des essais in vitro portant sur des cellules de lymphome de souris effectué conformément aux lignes directrices de l’OCDE étaient positifs en présence de S9, révélant ainsi le potentiel de clastogène d’un métabolite. Les résultats de certains essais in vivo (tests du micronoyau et tests des comètes) étaient négatifs (Bayer, 1991c; Covance Laboratories Inc., 2006). D’autres études in vivo (tests de la synthèse non programmée de l’ADN, essais sur les aberrations chromosomiques) ont permis d’obtenir des résultats équivoques ou des résultats négatifs associés aux limites des études (Stauffer Chemical Co. 1978h; Bayer Healthcare 2005).
Le National Toxicology Program (NTP) des États-Unis a récemment réalisé des tests du micronoyau in vivo chez les souris mâles et femelles B6C3F1 et les rats mâles et femelles Sprague-Dawley (NTP 2018). Des cellules ont été recueillies dans le sang périphérique des animaux qui ont reçu, par voie orale, 0, 1 250, 2 500, 5 000, 10 000 ou 20 000 ppm de TCPP dans leur alimentation, cinq jours par semaine pendant 90 jours. Les doses correspondantes étaient de 0, 163, 325, 650, 1 300 et 2 600 mg/kg p.c./j, respectivement. Le rapport final n’est pas encore disponible, mais les données originales sont présentées sur le site Web du NTP. Des résultats positifs ont été observés chez les souris mâles. Des résultats négatifs ont été observés chez les rats mâles et femelles et chez les souris femelles.
Dans l’ensemble, le TCPP n’est pas jugé génotoxique in vivo (EU RAR 2008a).
8.2.1.2 Toxicocinétique
On a relevé plusieurs études de toxicocinétique avec doses orales ou par intraveineuse réalisées sur des rats de laboratoire (Minegishi et al. 1988; Stauffer Chemical Co., 1984). D’après ces études, l’absorption orale de TCPP semble être d’au moins 75 %. Le TCPP est largement réparti dans les tissus, y compris le foie, les reins, les poumons et les tissus adipeux. La quantité détectée dans ces tissus était très faible, indiquant ainsi une faible bioaccumulation. Le rapport entre l’élimination biliaire et l’élimination dans les matières fécales indiquait une recirculation entérohépatique à partir du tube digestif après administration orale. Le TCPP subit une forte métabolisation avant son élimination. L’urine constitue la principale voie d’élimination du TCPP, mais l’élimination par l’urine et les matières fécales dépend de la dose et de la voie (orale et intraveineuse). Dans une étude (Stauffer Chemical Co. 1984), on a constaté que pour la même dose (20 mg/kg) administrée par voie orale ou par intraveineuse, l’élimination urinaire était de 49 % pour la voie orale et de 63 % pour la voie intraveineuse. L’élimination dans les matières fécales était de 40 % pour la voie orale et de 27 % pour la voie intraveineuse. L’élimination totale par les deux voies a été rapide et constante, avec une moyenne de 89 % de la dose après 72 h. Dans la même étude, Stauffer Chemical Co. (1984) a également administré une dose plus élevée par voie orale (200 mg/kg). On a constaté que l’élimination se faisait à 70 % par l’urine et à 22 % par les matières fécales; le profil d’élimination dépend donc de la dose. Environ 2 % du TCPP est éliminé sans être modifié. Un métabolite important identifié dans l’urine et les matières fécales, qui représente plus de 50 % de la dose, est le phosphate de 0,0-[bis(1-chloro-2-propyle)]-0-(2,acide propionique) (forme triester du TCPP avec de l’acide carboxylique avec substitution d’un atome de chlore). Il a été suggéré que cet important métabolite était responsable du profil d’élimination dépendant de la dose. Lorsque les doses étaient faibles, ce métabolite était éliminé en quantités approximativement égales dans l’urine et dans les matières fécales. Lorsque les doses étaient élevées, il était éliminé principalement dans l’urine. Les autres métabolites identifiés comprennent des produits possibles de l’hydrolyse : la forme diester du TCPP (acide bis(1-chloro-2-propyl) monophosphorique) et l’halo-alcool (1-chloro-2-propanol). Le 1-chloro-2-propanol s’est révélé être une substance mutagène dans les études de génotoxicité in vitro, mais il n’a pas induit de tumeurs dans les études de cancérogénicité de deux ans dans l’eau potable réalisées chez les rats et les souris (NTP, 1998).
On a examiné, dans le cadre d’études in vitro, la métabolisation du TCPP (Study Submission 2013, Van den Eede et al. 2013, Abdallah et al. 2015, Van den Eede et al. 2015b et 2016), mais des incertitudes subsistent en ce qui concerne la toxicocinétique de cette substance chez les humains.
Deux études in vitro portant sur l’absorption cutanée, réalisées conformément aux lignes directrices de l’OCDE, ont été relevées (TNO Quality of Life, 2005, 2006b) (voir la section 8.1.2.1). Dans les études d’absorption cutanée in vitro , on a utilisé des membranes de peau humaine avec application directe de TCPP radiomarqué, ce qui a donné des taux d’absorption totaux maximaux de 23 % et 40 %. Ces deux valeurs d’absorption ont été établies à partir d’études dans lesquelles on a utilisé des doses différentes (voir la section 8.1.2.1).
8.2.1.3 Toxicité à doses répétées
Dans une étude de 14 jours, des rats Sprague-Dawley (10/sexe/dose) ont été traités à raison de 0, 4 200, 6 600, 10 600 ou 16 600 ppm de TCPP dans leur alimentation (Stauffer Chemical Co 1980b). Les doses correspondantes étaient de 0, 417, 648, 1 015 et 1 636 mg/kg p.c./j pour les mâles, et de 0, 382, 575, 904 et 1 517 mg/kg p.c./j pour les femelles, respectivement. Pour les mâles, une DSENO de 10 600 ppm (1 015 mg/kg p.c./j) a été définie d’après une réduction de la prise de poids au cours de la première semaine de traitement par rapport aux groupes témoins à 16 600 ppm. La prise de poids n’était pas différente de celle des groupes témoins au cours de la deuxième semaine. La consommation d’aliments a fortement diminué pendant les trois premiers jours de l’étude chez les rats mâles faisant partie des deux groupes exposés aux doses les plus élevées. Pendant le reste de l’étude, la consommation d’aliments de tous les groupes traités était semblable à celle des groupes témoins. Pour les femelles, la DSENO était de 16 600 ppm (1 517 mg/kg p.c./j), soit la dose d’essai la plus élevée.
Dans une étude par gavage oral, les rats Wistar mâles et femelles (6/sexe/dose) ont été traités avec 0, 10, 100 ou 1 000 mg/kg p.c./j de TCPP pendant 28 jours (Bayer, 1991d). L’étude a été réalisée conformément aux « directives de la communauté européenne » (EU RAR 2008a). Une étude préliminaire de sept jours a d’abord été réalisée sur des rats mâles et indiquait des effets non liés au traitement observés lorsque les animaux étaient exposés à des doses allant jusqu’à 1 000 mg/kg p.c./j pendant sept jours. Dans le cadre de la principale étude, une DSENO de 100 mg/kg p.c./j a été établie. Trois animaux sont décédés à la dose de 1 000 mg/kg p.c./j (un rat mâle est décédé en raison probablement d’une erreur de traitement et le décès de deux rates pourrait être lié au traitement). Les poids absolus et relatifs du foie ont fortement augmenté chez les mâles et les femelles à la dose de 1 000 mg/kg p.c./j. Tous les rats mâles du groupe exposé à 100 mg/kg p.c./j, à l’exception d’un seul, ont présenté une hypertrophie minime des hépatocytes périacinaires. Chez un rat mâle ayant reçu la dose de 100 mg/kg p.c./j et chez tous les rats mâles ayant reçu 1 000 mg/kg p.c./j, on a constaté une légère hypertrophie des hépatocytes périacinaires. Les rates traitées au TCPP n’ont pas présenté de changements hépatiques. La chimie clinique a indiqué une forte diminution de l’activité de la glutamate-pyruvate transaminase chez les rats mâles et femelles dans le groupe exposé à la dose de 1 000 mg/kg p.c./j.
L’Union européenne (EURAR 2008a) a décrit une étude non publiée de 13 semaines dans laquelle les rats mâles et femelles Sprague-Dawley (20 par sexe et par dose) ont reçu 0, 800, 2 500, 7 500 ou 20 000 ppm de TCPP dans leur alimentation (Stauffer Chemical Co., 1981c, cité dans le rapport RAR de l’UE 2008a). Les doses correspondantes étaient de 0, 52, 160, 481 et 1 349 mg/kg p.c./j pour les mâles, et de 0, 62, 171, 570 et 1 745 mg/kg p.c./j pour les femelles, respectivement. Pour les mâles, une DMENO de 800 ppm (52 mg/kg p.c./j), soit la dose d’essai la plus faible, a été déterminée d’après l’observation que tous les mâles traités ont présenté une forte augmentation des poids absolus et relatifs, ainsi qu’une légère hyperplasie des cellules folliculaires de la glande thyroïde. Les cas d’hyperplasie des cellules folliculaires de la glande thyroïde étaient de 0/20, 2/20, 2/20, 5/20 et 8/20 à 0, 800, 2 500, 7 500 ou 20 000 ppm, respectivement. À 2 500 ppm, une forte augmentation du poids relatif du foie a été observée, suivie d’une dégénérescence des tubules rénaux corticaux (formation de gouttelettes hyalines). Pour les femelles, une DSENO de 2 500 ppm (171 mg/kg p.c./j) a été déterminée avec une DMENO de 7 500 ppm, d’après une augmentation importante des poids absolus et relatifs du foie. À 20 000 ppm, une légère dégénérescence vacuolaire des tubules rénaux corticaux (chez quatre animaux par rapport à un animal témoin) et une légère hyperplasie des cellules folliculaires de la glande thyroïde (5/20 animaux traités par rapport à 0/20 animaux témoins) ont été observées chez les rates. Un gonflement des hépatocytes périportaux (hypertrophie) a été observé à 20 000 ppm chez les rats mâles (7/20 animaux traités par rapport à 0/20 animaux témoins) et femelles (8/20 animaux traités par rapport à 5/20 animaux témoins). Les poids corporels moyens des rats mâles et femelles dans les groupes exposés à la dose élevée étaient considérablement plus faibles que ceux des animaux témoins. Aucune altération significative des paramètres de chimie clinique, d’hématologie ou d’analyse urinaire n’a été observée. Aucun changement dans le plasma et dans l’activité de la cholinestérase dans les érythrocytes ou dans le cerveau n’a été observé.
Freudenthal et Henrich (1999) ont publié un article de revue scientifique sur une étude de toxicité subchronique, dans lequel les données étaient très semblables à l’étude de Stauffer Chemical Co. (1981c) décrite dans le rapport RAR de l’UE (2008a) et proviennent sans doute de la même étude. Les rats mâles et femelles Sprague-Dawley (20 par sexe et par dose) ont reçu 0, 800, 2 500, 7 500 ou 20 000 ppm de TCPP dans leur alimentation. Des changements semblables dans les poids absolus et relatifs du foie, dans les poids relatifs des reins et dans les poids corporels moyens aux mêmes doses que celles déclarées dans le rapport RAR de l’UE (2008a) ont été décrits. Toutefois, les cas signalés concernant les observations histopathologiques n’étaient pas les mêmes que ceux décrits dans le rapport RAR de l’UE (2008a). Une DMENO de 800 ppm a été établie d’après une augmentation significative du poids absolu et relatif du foie et d’une légère hyperplasie des cellules folliculaires de la thyroïde chez les mâles (EUR 2008a).
Le programme NTP (2018) a réalisé une étude de 90 jours dans laquelle des souris B6C3F1 mâles et femelles ont reçu par voie orale 0, 1 250, 2 500, 5 000, 10 000 ou 20 000 ppm de TCPP dans leur régime alimentaire. Les doses correspondantes étaient de 0, 163, 325, 650, 1 300 et 2 600 mg/kg p.c./j, respectivement. Le rapport d’étude n’est pas encore disponible. Les résultats préliminaires indiquaient que les souris mâles présentaient une forte diminution du poids corporel dès 2 500 ppm. Un effet semblable a été observé chez les souris femelles, mais à une dose plus élevée de 10 000 ppm. Les observations histopathologiques ont indiqué des cas d’hypertrophie du foie chez les souris mâles dès 2 500 ppm, de même que chez les souris femelles dès 5 000 ppm. Chez les souris mâles uniquement, des cas de modification cytoplasmique des tubules rénaux dans les reins ont été observés dès 2 500 ppm. Cette étude a montré des effets similaires à partir d’une dose de 10 000 ppm. Des effets hématologiques ont également été observés chez les deux sexes. La mortalité chez les mâles ayant reçu 20 000 ppm était élevée (NTP 2018).
8.2.1.4 Toxicité pour la reproduction
Une étude de toxicité orale portant sur la toxicité pour la reproduction de deux générations de rats a été menée conformément aux lignes directrices de l’OCDE (TNO Quality of Life, 2007; cité dans le rapport RAR de l’UE 2008a). Cette étude incluait une étude de détermination préliminaire des doses pour une étude de toxicité pour la reproduction sur une génération. On a noté un écart par rapport au plan d’étude, à savoir que les corps jaunes n’ont pas été comptés à la date prévue du sacrifice.
Dans l’étude préliminaire, des rats mâles et femelles ont été traités pendant cinq semaines avant l’accouplement et après l’accouplement. Les femelles ont été traitées pendant la gestation et la lactation jusqu’au jour postnatal (JPN) 21. Les mères ont été sacrifiées aux fins d’autopsie au JPN 21. Les mâles ont été sacrifiés après 42 jours d’exposition au moins. Les rats (10/sexe/dose) ont reçu, par voie orale, 0, 1 500, 5 000 ou 15 000 mg/kg de TCPP dans leur alimentation. Les doses administrées étaient équivalentes à 0, 95, 325 et 1 000 mg/kg p.c./j, respectivement, chez les rats mâles. Chez les rates, les doses administrées étaient équivalentes à 0, 108, 370 et 1 176 mg/kg p.c./j, respectivement, avant l’accouplement, à 0, 100, 314 et 963 mg/kg p.c./j, respectivement, pendant la gestation, et à 0, 193, 680 et 1 930 mg/kg p.c./j, respectivement, pendant l’allaitement. Chez les mères (génération F0), la DMENO était de 1 500 mg/kg dans l’alimentation (100 à 193 mg/kg p.c./j), d’après une augmentation importante des poids moyens absolus et relatifs de l’utérus à toutes les doses de traitement. Cet effet était indépendant de la perte de poids, car une diminution importante du poids corporel moyen à la fin des traitements a été observée uniquement dans le groupe exposé à la dose élevée. Chez les mâles F0 parents, la DMENO était de 95 mg/kg p.c./j, d’après une diminution significative du poids absolu de la prostate. Une diminution statistiquement significative du poids absolu de la prostate a été observée dans les groupes exposés à des doses faibles et élevées, avec une diminution non importante chez les animaux exposés à une dose moyenne. Aucun effet sur la motilité ou la densité du sperme épididymal ou sur la morphologie des spermatozoïdes n’a été observé. Les changements dans les poids des organes n’ont été associés à aucun changement macroscopique ou histopathologique. Pour ce qui est des paramètres de la reproduction, on n’a observé aucun effet sur l’intervalle précoïtal, l’indice d’accouplement et sur l’indice de fertilité des mâles et des femelles. Le traitement n’a pas eu d’effet sur le nombre de petits mis au monde et le ratio mâles/femelles. La mortalité des petits était bien plus élevée dans le groupe exposé à la dose élevée, y compris les 8 petits d’une mère.
Dans l’étude principale, les parents de la génération F0, soit 28 rats Wistar par sexe et par groupe, ont reçu du TCPP dans leur alimentation quotidienne pendant au moins 10 semaines, avant et pendant l’accouplement. Les femelles ont également été traitées pendant la gestation (environ trois semaines) et l’allaitement (trois semaines) jusqu’à ce qu’elles soient sacrifiées. Au sevrage (JPN 21), les petits de la génération F1 (28 animaux par sexe et par groupe, choisis au hasard) ont été exposés au TCPP pendant au moins 10 semaines pendant leur croissance jusqu’à l’âge adulte et pendant l’accouplement. Les femelles de la génération F1 ont continué d’être traitées pendant la gestation et l’allaitement jusqu’à ce que la génération F2 soit sevrée au JPN 21. Les doses globales déclarées étaient de 0, 85, 293 ou 925 mg/kg p.c./j de TCPP chez les mâles et de 0, 99, 330 ou 988 mg/kg p.c./j chez les femelles.
Pour ce qui est des effets sur les paramètres de la reproduction, aucune différence liée au traitement n’a été observée dans l’intervalle précoïtal, l’indice d’accouplement, l’indice de fécondité des femelles et l’indice de fertilité des mâles et des femelles, et pendant la gestation des deux générations. Une augmentation non importante des pertes post-implantation chez la génération F1 a été observée. Toutes les mères ont survécu lors de la mise à bas et il n’y a eu aucun petit mort-né, quel que soit le groupe. Le nombre moyen de petits mis au monde a diminué à la dose moyenne administrée à la génération F1 et à la dose élevée administrée aux générations F0 et F1, y compris la perte d’une portée (10 petits) d’une seule mère dans le groupe exposé à la dose élevée. Chez les mâles, on n’a constaté aucun effet, lié au traitement, sur la motilité du sperme épididymal ou le nombre de spermatozoïdes, la morphologie des spermatozoïdes ou le nombre moyen de spermatozoïdes dans les testicules chez les animaux F0 et F1 à l’autopsie.
La DMENO pour les femelles de la génération F0 représentait la dose d’essai la plus faible de 99 mg/kg p.c./j, d’après une diminution importante des poids moyens absolus et relatifs de l’utérus et les effets sur le cycle œstral. Des effets sur le cycle œstral ont été observés, ainsi qu’une augmentation importante de la durée moyenne du cycle œstral le plus long à toutes les doses. À la dose élevée, une forte diminution du nombre de cycles œstraux par animal et une augmentation importante du nombre d’animaux acycliques ont été observées. Chez les femelles de la génération F1, un effet semblable sur les poids de l’utérus et les cycles œstraux s’est révélé statistiquement significatif à la dose élevée. La DMENO pour les femelles de la génération F1 était de 99 mg/kg p.c./j d’après une diminution importante du poids absolu de l’hypophyse à toutes les doses. Chez les mâles de la génération F0, la DSENO était de 85 mg/kg p.c./j d’après une diminution importante du poids corporel moyen à la fin des traitements et du poids absolu moyen des vésicules séminales au dosage suivant de 293 mg/kg p.c./j. Chez les mâles de la génération F1, la DMENO était de 85 mg/kg p.c./j d’après une diminution importante du poids absolu moyen des reins observée à toutes les doses de traitement. Aucun changement macroscopique ou microscopique lié au traitement n’a été observé chez les animaux de la génération F0 ou F1.
Follmann et Wober (2006) ont mené des études in vitro pour examiner les effets œstrogéniques et antiœstrogéniques du TCPP. Aucun effet œstrogénique ou antiœstrogénique n’a été observé dans un essai sur le gène rapporteur de la levure recombinante effectué sur des cellules cancéreuses Ishikawa de l’endomètre humain. Kojima et al. (2013) ont utilisé des essais in vitro sur la transactivation basée sur les cellules pour examiner l’action agoniste ou antagoniste potentielle du TCPP contre un certain nombre de récepteurs nucléaires humains. Dans l’ensemble, le TCPP ne présentait pas d’activités agonistes ou antagonistes contre les récepteurs nucléaires, à l’exception d’une faible activité agoniste contre les récepteurs de prégnane-X.
8.2.1.5 Toxicité pour le développement
Dans l’étude préliminaire de détermination des doses de l’étude de toxicité pour la reproduction de deux générations décrite dans la section 8.2.1.4 (TNO Quality of Life, 2007; cité dans l’EURAR, 2008a), il a été déclaré qu’un nombre important d’avortons a été observé à toutes les doses de traitement au 21e jour après la naissance. L’EURAR (2008a) n’a pas proposé de définition du terme avorton. Le profil d’évaluation initial de l’Ensemble des données de dépistage de l’OCDE pour le TCPP (OCDE, 2009) a défini le terme « avorton » comme étant un petit ayant un poids inférieur au poids moyen des petits du groupe témoin moins deux écarts‑types. Chez les animaux de génération F0, on a constaté une diminution importante du poids corporel dans le groupe exposé à la dose moyenne (293 mg/kg p.c./jour pour les mâles et 32,9 mg/kg p.c./jour pour les femelles) avant l’accouplement. Un effet semblable sur le poids corporel a été observé dans les groupes exposés à la dose moyenne (293 mg/kg p.c./jour pour les mâles et 32,9 mg/kg p.c./jour pour les femelles) et à la dose élevée (925 mg/kg p.c./jour pour les mâles et 988,2 mg/kg p.c./jour pour les femelles) pendant la gestation et l’allaitement. Dans l’ensemble, la DMENO était de 925 mg/kg p.c./jour pour les mâles et de 988,2 mg/kg p.c./jour, d’après une augmentation importante du nombre d’avortons.
Dans l’étude principale de toxicité pour la reproduction de deux générations décrite dans la section 8.2.1.4 (TNO Quality of Life, 2007), les paramètres liés aux effets sur le comportement ont été étudiés chez les générations F0, F1 et F2.
Concernant la génération F0, une forte augmentation du nombre d’avortons a été observée à 99 mg/kg p.c./jour ou plus au 1er jour après la naissance. Le nombre moyen de petits mis au monde a diminué dans le groupe exposé à la dose élevée. On a constaté une augmentation importante du taux de mortalité des petits du 1er au 4e jour après la naissance dans les groupes exposés aux doses faibles et élevées, mais ce taux ne s’est pas révélé statistiquement significatif dans le groupe exposé à la dose moyenne. Dans le groupe exposé à la dose élevée, les poids moyens des petits étaient normaux au 1er jour après la naissance, mais ont fortement diminué à partir du 14e jour après la naissance. Une diminution importante des poids absolus et relatifs de la rate a été observée dans les groupes exposés aux doses moyennes et élevées. Le poids corporel des mères a diminué chez les femelles exposées à la dose élevée pendant la gestation. La consommation alimentaire moyenne a diminué chez les femelles de génération F0 dans les groupes exposés aux doses moyennes et élevées.
Concernant la génération F1, on a signalé une forte augmentation du nombre d’avortons provenant des femelles de génération F1 traitées avec 99 mg/kg p.c./jour et plus au 21e jour après la naissance. Une diminution du nombre moyen de petits mis au monde et du nombre moyen de petits vivants par portée a été observée dans les groupes exposés aux doses moyennes et élevées. Dans le groupe exposé à la dose élevée, on a noté la perte des dix petits d’une portée provenant d’une mère au 4e jour après la naissance. Les poids moyens des petits étaient normaux au 1er jour après la naissance, mais ont fortement diminué à partir du 7e jour après la naissance pour le groupe exposé à la dose élevée, et au 21e jour après la naissance pour le groupe exposé à la dose moyenne. Une diminution importante des poids absolus et relatifs de la rate a été observée dans les groupes exposés aux doses moyennes et élevées. Le poids corporel des mères a diminué chez les animaux de génération F1 exposés aux doses moyennes et élevées avant l’accouplement, pendant la gestation et pendant l’allaitement. La consommation alimentaire moyenne a diminué chez les femelles de génération F1 dans les groupes exposés aux doses moyennes et élevées.
La distance anogénitale a été mesurée chez tous les petits de génération F2 au 1er jour après la naissance et elle était comparable à celle des animaux témoins. Les paramètres de maturation sexuelle (ouverture du vagin et séparation du prépuce) ont été évalués chez une petite femelle et un petit mâle par portée de génération F2. À la dose élevée, on a pu observer un retard non important de l’ouverture du vagin et une séparation du prépuce considérablement retardée. Le poids corporel des petits mâles et femelles de génération F2 et exposés à une dose élevée a considérablement diminué du 28e au 42e jour après la naissance. Selon l’EURAR (2008a), les effets observés dans ce groupe sur l’ouverture vaginale et la séparation du prépuce sont sans doute attribuables à la toxicité. Ces effets pourraient être liés à une toxicité systémique, car le poids corporel des petits mâles et femelles de génération F2 et exposés à une dose élevée a considérablement diminué du 28e au 42e jour après la naissance.
Dans le cas des deux générations, les petits retrouvés morts n’ont présenté aucune anomalie. Aucun résultat macroscopique lié au traitement n’a été constaté chez les petits au moment de l’autopsie.
De manière générale, une DMENO pour le développement de 1 500 mg de TCPP par kg dans l’alimentation (99 mg/kg p.c./jour) a été déterminée dans cette étude, d’après une augmentation importante du nombre d’avortons observée chez la génération F0 au 1er jour après la naissance. Des effets semblables ont été observés chez la génération F1 au 21e jour après la naissance, mais pas au 1er jour après la naissance. L’Union européenne (EURAR, 2008a) a établi la même DMENO pour cette étude selon une méthode du poids de la preuve, et a estimé qu’il s’agissait d’une DMENO relativement prudente, car les effets sur les avortons n’ont pas été observés chez les deux générations au 1er jour après la naissance.
Le NTP (2018) a également réalisé une étude de tératologie (du 6e au 20e jour de gestation) au cours de laquelle des rates SD ont été exposées au TCPP par gavage à des doses de 0, 162,5, 325 ou 650 mg/kg p.c./jour. Le rapport d’étude n’est pas encore disponible. Les résultats préliminaires ont indiqué une augmentation du poids du foie chez les mères, toutes doses confondues. Une diminution du poids fœtal a été observée chez le groupe exposé à 650 mg/kg p.c./jour. Aucun autre effet important n’a été observé, à l’exception d’une certaine variation squelettique chez les fœtus, qui a également été notée chez le groupe témoin. Des augmentations non significatives du poids corporel et de la consommation d’aliments chez les mères ont également été observées.
8.2.1.6 Neurotoxicité
Dans le cadre d’une étude de neurotoxicité aiguë, quatre poules ont reçu, par voie orale, une dose de 13 200 mg/kg p.c. de TCPP (Sprague et al., 1981). Aucune inhibition de l’activité de la cholinestérase plasmatique ou de l’estérase neurotoxique dans le cerveau n’a été observée chez les animaux traités. Dans la deuxième partie de l’étude, 18 poules ont reçu deux fois, par voie orale, 13 200 mg/kg p.c. de TCPP à 21 jours d’intervalle. Les animaux ont montré des signes de toxicité systémique (diminution importante de la consommation d’aliments, diminution du poids corporel moyen, perte de plumes et arrêt de la ponte). Une des dix‑huit poules est décédée au 4e jour. À la suite d’un examen histologique, deux poules ont présenté une dégénérescence axonale minime dans le funicule dorsal de la zone cervicale, dans le funicule ventro‑latéral de la zone thoracique ou dans le funicule ventromédian de la moelle épinière lombo‑sacrée, des voies connues pour être sensibles à la dégénérescence entraînée par les composés organophosphorés. La démarche d’une de ces poules était également altérée. La dose administrée de 13 200 mg/kg p.c. était très au‑dessus de la dose limite recommandée de 2 000 mg/kg p.c. pour une étude de neurotoxicité aiguë retardée induite par les organophosphates dans les lignes directrices de l’OCDE (OCDE, 1995). Seules des incidences isolées de dégénérescence axonale minime ont été observées chez deux de ces dix‑huit poules; par ailleurs, aucune inhibition de l’activité de la cholinestérase plasmatique et de l’estérase neurotoxique n’a été observée. Dans l’ensemble, l’Union européenne (EURAR, 2008a) a jugé qu’il n’y avait pas de préoccupation concernant une neurotoxicité aiguë retardée.
L’étude de 13 semaines sur les rats (Stauffer Chemical Co., 1981c), décrite dans la section 8.2.1.3, a mesuré les activités de la cholinestérase. Aucun changement dans l’activité de la cholinestérase plasmatique, érythrocytaire et cérébrale, attribuable au traitement, n’a été observé.
8.2.1.7 Sensibilisation
Aucune sensibilisation de la peau n’a été observée dans un test de Buehler sur les cobayes et dans un essai des ganglions lymphatiques locaux de souris (SafePharm Laboratories, 1979, 2005).
8.2.2 TDCPP
8.2.2.1 Cancérogénicité
L’Union européenne a classé le TDCPP comme un agent cancérogène de catégorie 2 (possiblement cancérogène pour les humains) (Union européenne, 1998‑2017).
Une étude de cancérogénicité de deux ans a été menée sur des rats Sprague‑Dawley (60/sexe/groupe), au cours de laquelle les animaux ont reçu de la nourriture (à volonté) contenant du TDCPP (Stauffer Chemical Co., 1981a). Les doses administrées étaient de 0, 5, 20 ou 80 mg/kg p.c./jour. Dix animaux par sexe et par groupe ont été sacrifiés après 12 mois de traitement en tant que groupe intérimaire.
Les effets non cancérogènes sont décrits dans la section 8.2.2.5. Les taux de mortalité des rats étaient comparables parmi les groupes de traitement et les groupes témoins, à l’exception des mâles dans le groupe exposé à une dose élevée, pour lesquels le taux de mortalité était considérablement plus élevé que celui des groupes témoins après 12 mois de traitement. À la fin des traitements, le poids corporel des rats mâles et femelles dans les groupes exposés à une dose élevée était considérablement plus faible que celui des animaux témoins (> 20 %).
Dans le cas du groupe intérimaire traité sur 12 mois et des rats retrouvés morts avant la fin de ces 12 mois, le nombre d’incidences de tumeurs dans les reins, les testicules, le foie, le cerveau ainsi que la thyroïde et les glandes surrénales est présenté dans le tableau 8‑3 et le tableau 8‑4. Les glandes surrénales, le cerveau et la glande thyroïde des mâles et des femelles exposés aux doses faibles et moyennes n’ont pas été examinés. L’incidence des tumeurs des cellules interstitielles des testicules a augmenté chez les groupes ayant reçu des doses moyennes et élevées. Des incidences similaires de tumeurs ont été observées dans tous les autres tissus chez les animaux témoins et traités.
| Doses (mg/kg p.c./jour) | 0 | 5 | 20 | 80 |
|---|---|---|---|---|
| Tumeur des cellules interstitielles des testicules | 0/14 | 0/12 | 3/13 | 3/11 |
| Adénome hépatocellulaire | 0/15 | 0/12 | 0/13 | 3/14 |
| Adénome corticosurrénalien | 0/15 | s. o. | s. o. | 2/13 |
| Gliomes au cerveau (astrocytome/oligodendrogliome) | 0/15 | s. o. | s. o. | 0/14 |
| Adénome de la glande thyroïde/adénome folliculaire de la thyroïde | 0/14 | s. o. | s. o. | 0/11 |
s. o. : N’a pas été évalué dans l’étude.
a Comprend les incidences de tumeurs chez les rats retrouvés morts avant la fin du traitement de 12 mois.
| Doses (mg/kg p.c./jour) | 0 | 5 | 20 | 80 |
|---|---|---|---|---|
| Adénome hépatocellulaire | 0/11 | 0/13 | 0/9 | 1/10 |
| Adénome corticosurrénalien | 5/11 | s. o. | s. o. | 1/10 |
| Gliomes au cerveau (astrocytome/oligodendrogliome) | 0/11 | s. o. | s. o. | 0/10 |
| Adénome de la glande thyroïde/adénome folliculaire de la thyroïde | 0/9 | s. o. | s. o. | 0/6 |
s. o. : N’a pas été évalué dans l’étude.
a Comprend les incidences de tumeurs chez les rats retrouvés morts avant la fin du traitement de 12 mois.
Dans le groupe traité sur 24 mois, des effets cancérogènes ont été observés (Stauffer Chemical Co., 1981a). Les incidences des adénomes du cortex rénal (les deux sexes) et des tumeurs des cellules interstitielles des testicules (mâles) ont fortement augmenté dans les groupes exposés aux doses moyennes et élevées par rapport aux groupes témoins. À la dose élevée, une augmentation importante des incidences des adénomes hépatocellulaires (les deux sexes) et des adénomes corticosurrénaliens (femelles) a été observée. Les incidences des tumeurs pour ce groupe sont présentées dans le tableau 8‑5.
Doses (mg/kg p.c./jour) |
0 |
5 |
20 |
80 |
|---|---|---|---|---|
Adénome du cortex rénal |
1/45 |
3/49 |
9/48* |
32/46* |
Tumeur des cellules interstitielles des testicules |
7/43 |
8/48 |
23/47* |
36/45* |
Adénome hépatocellulaire |
2/45 |
7/48 |
1/48 |
13/46* |
Carcinome hépatocellulaire |
1/45 |
2/48 |
3/48 |
7/46 |
Gliomes au cerveau (astrocytome/oligodendrogliome) |
0/44 |
0/4 |
1/1 |
5/46 |
Adénome de la glande thyroïde/adénome folliculaire de la thyroïde |
0/40 |
2/2 |
1/2 |
5/41 |
* Très différent comparativement aux animaux témoins (p < 0,05).
Doses (mg/kg p.c./jour) |
0 |
5 |
20 |
80 |
|---|---|---|---|---|
Adénome du cortex rénal |
0/49 |
1/48 |
8/48* |
29/50* |
Adénome corticosurrénalien |
8/48 |
5/27 |
2/33 |
19/49* |
Adénome hépatocellulaire |
1/49 |
1/47 |
4/46 |
8/50* |
Carcinome hépatocellulaire |
0/49 |
2/47 |
2/46 |
4/50 |
Gliomes au cerveau (astrocytome/oligodendrogliome) |
1/46 |
1/4 |
2/5 |
1/48 |
| Adénome de la glande thyroïde/adénome folliculaire de la thyroïde | 3/42 |
0/2 |
s. o. |
9/49 |
* Très différent comparativement aux animaux témoins (p < 0,05).
S. O. : N’a pas été évalué dans l’étude.
Le mode d’action concernant les tumeurs observées chez les rongeurs n’a pas été totalement éclairci.
Les deux métabolites définis d’après des études in vivo et in vitro étaient le 1,3‑DCP et le 3‑MCPD (Nomeir et al., 1981; Lynn et al. 1981; Ulsamer et al., 1980) (consulter la section 8.2.2.2 pour obtenir des détails). Le 1,3‑DCP et le 3‑MCPD ont été classés en tant que cancérogènes de catégorie 2B par le Centre international de recherche sur le cancer (CIRC) (CIRC, 2012a, b). Comme le décrivent les monographies du CIRC concernant le 1,3‑DCP et le 3‑MCPD, les voies métaboliques proposées laissaient entendre que le 1,3‑DCP peut être métabolisé en 3‑MCPD et que le métabolisme du 1,3‑DCP et du 3‑MCPD peut produire plusieurs mutagènes et cancérogènes génotoxiques connus (1,3‑dichloroacétone, épichlorhydrine et glycidol). D’après les métabolites génotoxiques potentiels déterminés et les éléments de preuve concernant une liaison à l’ADN in vivo chez les souris, l’Environmental Protection Agency de la Californie (USEPA, 2011) a conclu que le TDCPP pouvait être cancérogène par l’intermédiaire d’un mécanisme génotoxique. Une étude métabolique in vitro récemment publiée (Van den Eede et al., 2013) a identifié des métabolites formés par une autre voie (déshalogénation oxydative) qui comprend la production d’un intermédiaire aldéhyde. Bien que l’aldéhyde puisse se métaboliser davantage en acide carboxylique ou en alcool, il a le potentiel de se lier à l’ADN ou aux protéines.
L’EURAR (2008 b) n’a pas déterminé de mode d’action, mais a indiqué que les tumeurs des cellules interstitielles des testicules pourraient être provoquées par des produits chimiques par l’intermédiaire d’un mode d’action non génotoxique qui entraînerait des modifications de l’axe hypothalamo‑hypophyso‑testiculaire. De même, l’hyperplasie est souvent considérée comme une lésion précancéreuse et l’EURAR (2008 b) a émis l’hypothèse que les tumeurs rénales auraient pu apparaître à la suite de changements hyperplasiques.
8.2.2.2 Génotoxicité
Un certain nombre d’études in vitro et in vivo ont été recensées.
Une bonne partie de ces études sont décrites en détail dans l’EURAR concernant le TDCPP (EURAR, 2008b). Les résultats des essais de mutation génétique in vitro portant sur les bactéries et les levures étaient principalement négatifs, avec ou sans activation métabolique (S9) (Mortelmans et al., 1986; Soderlund et al., 1985; Stauffer Chemical Co., 1981 b, 1983 b; Nakamura et al., 1979; Safepharm Laboratories Ltd, 1984, 1985a; Ishidate, 1983). Des résultats positifs ont été observés dans des souches particulières de Salmonella typhimurium, soit TA97, TA100 et TA1535, en présence d’une activation par S9 (Stauffer Chemical Co., 1983b; Soderlund et al., 1985). Dans les cellules mammaliennes, les résultats de certains essais in vitro (essai de mutation ponctuelle, essai sur l’échange de chromatides sœurs et essai limité sur la synthèse d’ADN non programmée) étaient négatifs (Stauffer Chemical Co., 1977; Soderlund et al., 1985). D’autres essais in vitro (essai sur des cellules de lymphome de souris, essai sur la présence d’aberrations chromosomiques, essai de transformation) ont produit des résultats incertains (Stauffer Chemical Co., 1977, 1981 b; Ishidate, 1983; Inveresk Research International, 1985; Soderlund et al., 1985; Covance Laboratories Inc., 2004).
Dans les essais in vivo, les résultats étaient négatifs pour un essai de mutations létales récessives liées au sexe visant l’espèce Drosophila, pour un essai de synthèse d’ADN non programmée chez les rats et pour un essai du micronoyau et un essai d’aberration chromosomique chez la souris (Stauffer Chemical Co., 1978a, 1981b; Brusick et al., 1980; Safepharm Laboratories Ltd, 1985b; Covance Laboratories Inc., 2005a). Morales et Matthews (1980) ont étudié la fixation par liaison covalente du TDCPP aux macromolécules chez les souris traitées au TDCPP par intraveineuse. Les animaux ont été sacrifiés six heures après le traitement. On a découvert que le TDCPP se liait facilement à l’ADN dans le foie et dans les reins. Le TDCPP se liait également à l’ARN et aux protéines dans le foie, les reins et les muscles.
Dans l’ensemble, les résultats des études de génotoxicité in vitro semblent indiquer la présence de certains signes de mutagénicité. Cependant, les résultats d’un certain nombre de ces études étaient négatifs.
8.2.2.3 Toxicocinétique
Trois études toxicocinétiques réalisées sur des rats exposés par voie orale ont été relevées (Minegishi et al., 1988; Nomeir et al., 1981; Matthews et Anderson, 1979). De manière générale, l’absorption par le tube digestif, après ingestion par voie orale, était supérieure à 90 %. Le TDCPP s’est rapidement réparti dans le corps et se trouvait à des teneurs élevées dans les reins, le foie et les poumons. Une étude toxicocinétique par administration orale a déterminé un délai maximal (Tmax) moyen de 9,6 heures pour le TDCPP dans le sang et les tissus (Minegishi et al., 1988). La dégradation métabolique était généralisée. La récupération de la radioactivité 168 heures après l’administration était de 43,2 % dans l’urine, de 39,2 % dans les matières fécales, de 16,24 % dans l’air expiré (dioxyde de carbone) et de 2,51 % dans la carcasse. La récupération de la radioactivité 24 heures après l’administration s’approchait de 35 % dans l’urine (le pourcentage a été estimé dans la figure en référence) (Minegishi et al., 1988). Environ 40 % de la radioactivité était excrétée par la bile. La bioaccumulation était censée être faible. Selon une étude toxicocinétique chez les rats, au cours de laquelle du TDCPP a été administré par voie intraveineuse, la demi‑vie d’élimination du TDCPP dans les tissus était comprise entre 1,5 et 5,4 heures en fonction du tissu (Nomeir et al., 1981).
Dans le cadre d’études toxicocinétiques au cours desquelles du TDCPP a été administré par voie intraveineuse, des métabolites du TDCPP ont été récupérés dans l’urine des rats (Nomeir et al., 1981; Lynn et al., 1980, 1981). Le principal métabolite identifié était un diester du TDCPP, soit le BDCPP (> 60 %). Lynn et al. (1981) ont identifié le 1,3‑dichloro‑2‑propanol (1,3‑DCP), un halo‑alcool qui serait produit par l’hydrolyse du TDCPP en diester BDCPP, le 1,3‑dichloro‑2‑propyl phosphate (monoester de TDCPP), ainsi qu’une quantité infime de TDCPP non métabolisé. Nomeir et al. (1981) ont noté qu’un métabolite polaire non identifié (32 %) avait été découvert dans l’urine, en plus des quantités infimes de 1,3‑dichloro‑2‑propyl phosphate (0,29 %) et du TDCPP non métabolisé (0,45 %). D’après Ulsamer et al. (1980), le 1,3‑DCP constituait le seul métabolite détecté dans l’urine des animaux traités au TDCPP (rats et lapins), mais ils n’ont pas fourni davantage de détails sur l’expérience.
Une étude métabolique in vitro effectuée à l’aide d’échantillons de foie a permis d’identifier les métabolites suivants : BDCPP (64 %), 3‑monochloro‑1, 2‑propanediol (3‑MCPD) (20 %), 1,3‑DCP (5,7 %) et un métabolite inconnu (11 %) (Nomeir et al., 1981). Nomeir et al. (1981) ont laissé entendre que l’absence des métabolites 3‑MCPD et 1,3‑DCP dans l’urine ou dans l’air expiré notée dans leur étude in vivo était probablement attribuable au fait que ces métabolites intermédiaires sont davantage métabolisés. Une autre étude métabolique in vitro a permis de déterminer un composé conjugué du glutathion associé au TDCPP (substitution de CI) et des métabolites dérivés (produit d’addition avec glycine et cystéine et produit d’addition avec cystéine) (Étude présentée, 2013).
Les études métaboliques in vitro utilisant des fractions de foie de rat ont indiqué que le TDCPP était métabolisé par un système oxydasique à fonction mixte à l’échelle des microsomes dépendant du NADPH et par un système de transférase dépendant du glutathion dans la fraction soluble (Sasaki et al., 1984; Nomeir et al, 1981). Dans une étude métabolique in vitro utilisant des fractions de foie humain (Van den Eede et al., 2013), conforme aux autres études métaboliques, le BDCPP (45 %) et le composé conjugué du glutathion (20 %) associé au TDCPP ont été identifiés. Une autre étude métabolique in vitro récemment publiée (Abdallah et al., 2015) appuie ces résultats.
Une étude sur l’absorption cutanée in vitro, réalisée sur de la peau humaine conformément aux lignes directrices de l’OCDE (TNO Quality of Life, 2006a), est décrite dans la section 8.1.2.1. Dans une étude in vivo, Nomeir et al. (1981) ont indiqué que le TDCPP était facilement absorbé par la peau des rats, mais le taux d’absorption n’a pas été précisé. La tendance de répartition a révélé que la concentration la plus élevée se situait dans le foie, suivi des poumons, de la peau, du sang, des reins, des tissus adipeux et des muscles.
8.2.2.4 Toxicité à doses répétées
Kamata et al. (1989) ont réalisé une étude de toxicité subchronique par voie orale d’une durée de 3 mois, au cours de laquelle des souris (12 par groupe de doses) ont reçu de la nourriture contenant 0,01, 0,04, 0,13, 0,42 et 1,33 % de TDCPP. La dose sans effet nocif observé (DSENO) pour les rats femelles était de 15,3 mg/kg p.c./jour, d’après une augmentation importante des poids absolus et relatifs des reins à la dose suivante de 0,04 % (61,5 mg/kg p.c./jour). La DSENO pour les rats mâles était de 0,04 % (47,3 mg/kg p.c./jour) d’après une augmentation importante des poids relatifs du foie et des reins à la dose suivante de 0,13 % (171,0 mg/kg p.c./jour).
Dans une étude de cancérogénicité de deux ans décrite précédemment dans la section 8.2.2.1 (doses administrées de 0, 5, 20 ou 80 mg/kg p.c./jour), des effets non cancérogènes ont été observés chez les animaux traités pendant 12 ou 24 mois (Stauffer Chemical Co., 1981a; Freudenthal et Henrich, 2000). Les doses administrées étaient de 0, 5, 20 ou 80 mg/kg p.c./jour. Dans le cas du groupe intérimaire traité sur 12 mois, la dose minimale ayant causé un effet nocif observé (DMENO) était de 80 mg/kg p.c./jour, d’après une diminution importante des poids corporels (diminution de plus de 20 % par rapport aux poids du groupe témoin à la fin de l’étude), une augmentation importante des poids absolus et relatifs du foie et des reins chez les rats mâles et femelles. Dans le cas des animaux traités sur 24 mois, la DMENO était de 5 mg/kg p.c./jour (dose testée la plus faible), d’après une hyperplasie de l’épithélium des tubules contournés dans les reins, une atrophie de l’épithélium germinal accompagnée d’une oligospermie dans les testicules, et une atrophie des vésicules séminales chez les rats mâles à partir de la dose à 5 mg/kg p.c./jour. À la dose suivante, qui est de 20 mg/kg p.c./jour, une augmentation importante des poids absolus et relatifs des reins et du poids relatif du foie a été observée chez les mâles et les femelles. Chez les mâles, on a également constaté une augmentation importante du poids absolu du foie et une incidence accrue de néphropathie chronique et d’hypertrophie testiculaire à cette dose moyenne. À la dose élevée de 80 mg/kg p.c./jour, on a constaté une diminution importante du poids corporel (> 20 %) et une augmentation importante des poids absolus et relatifs de la thyroïde chez les rats mâles et femelles par rapport aux animaux témoins. On a également pu observer des changements macroscopiques du foie, dont diverses décolorations ainsi que des masses, des nodules et des zones soulevées, une hyperplasie érythroïde et myéloïde de la moelle osseuse des côtes et une métaplasie érythroïde et myéloïde de la rate.
8.2.2.5 Toxicité pour la reproduction et le développement
On a trouvé une étude de toxicité pour la reproduction, qui a été effectuée sur des lapins mâles hollandais et au cours de laquelle les animaux (10 par groupe de doses) ont reçu 0, 2, 20 ou 200 mg/kg p.c./jour de TDCPP par voie orale (gavage) pendant 12 semaines (Stauffer Chemical Co., 1983c). La DSENO était de 20 mg/kg p.c./jour, d’après une augmentation importante des poids absolus des reins et des poids relatifs du foie à la dose suivante de 200 mg/kg p.c./jour. Aucun effet n’a été observé sur le comportement d’accouplement, sur la fertilité des mâles et sur la qualité ou la quantité de sperme. Aucune lésion histologique dans les reins, le foie, l’hypophyse, les testicules ou les épididymes n’a été constatée.
Dans une étude de cancérogénicité de deux ans décrite précédemment dans les sections 8.2.2.1 et 8.2.2.5 (Stauffer Chemical Co., 1981a; Freudenthal et Henrich, 2000), les effets non cancérogènes sur le système reproducteur des mâles ont été examinés. Les effets dans la vésicule séminale (diminution du produit sécrétoire et atrophie) se sont révélés importants dès 5 mg/kg p.c./jour, soit la dose la plus faible testée. Selon l’EURAR (2008b), les effets observés sur les testicules décrits précédemment peuvent être liés à un effet des tumeurs à cellules de Leydig. Les organes reproducteurs des femelles n’ont pas été analysés dans le cadre de cette étude.
Le TDCPP, le TCPP et le PTCE sont des substances étroitement liées qui sont semblables sur le plan de la composition chimique, des propriétés physiques et chimiques et de la toxicocinétique (davantage de renseignements sont disponibles dans Santé Canada, 2015a). Cependant, les effets sur la reproduction observés chez les animaux femelles testés avec du TCPP et du PTCE n’étaient pas uniformes (annexe G). L’Union européenne (EURAR, 2008b) a considéré que la technique de lecture croisée à partir des données sur la fertilité des femelles relatives au TCPP ou au PTCE ne convenait pas pour traiter tout effet possible sur la fertilité des femelles lié au TDCPP.
Dans une étude sur la toxicité pour le développement, des rates Sprague‑Dawley gravides (20 par groupe de doses) ont reçu 0, 25, 100 ou 400 mg/kg p.c./jour de TDCPP par voie orale (gavage) pendant les jours de gestation 6 à 15 (Stauffer Chemical Co., 1978b). La DSENO pour les mères était de 25 mg/kg p.c./jour, d’après une diminution importante de la consommation d’aliments et du poids corporel, et d’après des signes cliniques de toxicité, comme l’alopécie, une posture voûtée, un pelage rêche et des taches d’urine chez certains animaux à la dose suivante de 100 mg/kg p.c./jour. À la dose de 400 mg/kg p.c./jour, la plupart des animaux présentaient des signes cliniques de toxicité tels que des taches d’urine, une posture voûtée, la salivation, l’alopécie ainsi qu’une diminution importante du poids corporel. Un certain nombre d’animaux exposés à une dose élevée étaient maigres et avaient un pelage rêche et une croûte de sang autour du nez. La DSENO pour le comportement était de 100 mg/kg p.c./jour, d’après une augmentation importante du taux de résorption, une diminution importante de l’indice de viabilité fœtale et un retard dans le développement du squelette à la dose suivante de 400 mg/kg p.c./jour. Ces effets sur le développement pourraient être attribuables à la toxicité maternelle.
Une autre étude a été réalisée sur des rates Wistar gravides (15 à 24 par groupe de doses) qui ont reçu 0, 25, 50, 100, 200 ou 400 mg/kg p.c./jour de TDCPP par voie orale (gavage) pendant les jours de gestation 7 à 15 (Tanaka et al., 1981, cité dans l’EURAR [2008 b], extrait disponible en anglais seulement). La DSENO pour les mères était de 100 mg/kg p.c./jour, d’après une augmentation importante des poids absolus et relatifs des reins à la dose suivante de 200 mg/kg p.c./jour. Une augmentation de la mortalité (11 mères sur 15) et des signes cliniques de toxicité ont été observés à 400 mg/kg p.c./jour. La DSENO pour le développement était de 200 mg/kg p.c./jour, d’après une augmentation importante du nombre de décès des fœtus à la dose suivante de 400 mg/kg p.c./jour. Le rendement des essais fonctionnels (champ dégagé, labyrinthe aquatique, tige tournante, écran incliné, réflexe à la douleur et réflexe de sursaut auditif) était comparable à celui des animaux témoins dans le cadre de l’examen postnatal effectué à la dose de 200 mg/kg p.c./jour et aux doses inférieures.
Une étude sur le développement des rats publiée récemment a examiné le poids des organes, les taux sériques d’hormones thyroïdiennes, l’activité de l’acétylcholinestérase et les effets neurotoxiques pour le développement (Moser et al., 2015). Des rates Long‑Evans gravides (8 à 14 par groupe de doses) ont reçu 0, 15, 50 ou 150 mg/kg p.c./jour de TDCPP par voie orale (gavage) du 10e jour de gestion au sevrage (22e jour après la naissance). Chez les mères, seuls le foie, le sang et la thyroïde ont été prélevés aux fins d’analyse. La DSENO pour les mères était de 50 mg/kg p.c./jour, d’après une augmentation importante des poids absolus et relatifs du foie à la dose suivante de 150 mg/kg p.c./jour. L’activité sérique de l’acétylcholinestérase n’a pas été perturbée par le TDCPP, même à la dose la plus forte testée. Pour la progéniture, des tests neurocomportementaux (activité locomotrice, labyrinthe en zéro, batterie d’observations fonctionnelles, labyrinthe aquatique de Morris) ont été effectués à différents stades du cycle vital. Dans l’ensemble, de légers changements ont été observés lors de certains tests comportementaux, mais les effets étaient soit minimes, soit sans relation dose‑réponse claire, soit très variables (Moser et al., 2015). La DSENO pour le développement était de 50 mg/kg p.c./jour, d’après une diminution importante du poids corporel et du poids absolu du foie chez les deux sexes au 6eet au 22e jour après la naissance à la dose de 150 mg/kg p.c./jour. L’activité sérique de l’acétylcholinestérase a considérablement augmenté au 22e jour après la naissance à la dose de 150 mg/kg p.c./jour, mais l’activité cérébrale de l’acétylcholinestérase n’a pas été perturbée à toutes les doses au 6e et au 22e jour après la naissance. Les taux sériques d’hormones thyroïdiennes (T3, T4) n’ont pas été perturbés chez les mères et les petits (6e et 22e jour après la naissance).
8.2.2.6 Neurotoxicité
Certaines substances organophosphorées sont susceptibles de provoquer une neurotoxicité retardée induite par les organophosphates. Ce type particulier de neurotoxicité pourrait ne pas être détecté dans les études de toxicité courantes. Dans les protocoles réglementaires (lignes directrices de l’USEPA et de l’OCDE), la poule est l’animal expérimental de choix pour évaluer ce paramètre, car les autres petits animaux de laboratoire (rats, cobayes, souris) sont relativement peu sensibles (Weiner et Jortner, 1999).
Dans trois études indépendantes menées chez les poules, les animaux ayant reçu par voie orale du TDCPP aux fins d’exposition aiguë, pendant cinq jours consécutifs et 90 jours, n’ont pas montré de signes importants de paralysie ou de neurotoxicité (Stauffer Chemical Co., 1978c, 1981 b; US EPA, 2008).
8.2.2.7 Sensibilisation
Aucune sensibilisation cutanée n’a été observée dans les tests de maximalisation réalisés chez le cobaye (CIT, 2001, cité dans l’EURAR, 2008 b).
8.2.2.8 Études épidémiologiques
Une étude de cohorte rétrospective portant sur la mortalité des employés travaillant dans une usine de fabrication de TDCPP a été recensée (Stauffer Chemical Co., 1983a). L’étude a suivi 289 travailleurs, qui étaient employés depuis au moins trois mois entre 1956 et 1977; les travailleurs ont été suivis jusqu’en 1980. Plus de la moitié des employés ont travaillé moins de cinq ans et seulement 42 employés ont travaillé 15 ans ou plus. Les concentrations de TDCPP mesurées, fondées sur des échantillons pris dans les zones où la substance était respirée entre 1978 et 1981, étaient inférieures à la limite de détection de 8 ppb (140 µg/m3). Le ratio standardisé de mortalité (RSM) général fondé sur les décès observés par rapport aux décès prévus (toutes les causes de décès) était de 0,75. Le ratio standardisé de mortalité associé à toutes les tumeurs malignes était de 1,31 d’après trois décès observés par rapport à 2,3 prévus. Les trois cas de décès observés étaient des employés qui sont décédés d’un cancer du poumon et dont la consommation de cigarettes était moyenne à élevée.
Parallèlement à l’étude sur la mortalité (Stauffer Chemical Co., 1983b), une étude rétrospective sur la morbidité a été réalisée auprès de 124 travailleurs dans une usine de fabrication de TDCPP (Stauffer Chemical Co., 1983d). Les employés ont été classés comme étant des personnes exposées au TDCPP (93 travailleurs) ou non exposées au TDCPP (31 travailleurs). Les résultats de l’échantillonnage effectué dans la zone où la substance était respirée dans l’usine de fabrication indiquaient que les concentrations de TDCPP dans l’air se situaient toujours près ou en dessous de la limite de détection de 8 ppb (140 µg/m3). Ces travailleurs ont été soumis à un questionnaire autoadministré sur la santé, à un examen physique, à une exploration fonctionnelle respiratoire, à des radiographies de la poitrine et à un électrocardiogramme, ainsi qu’un à éventail d’analyses cliniques et biochimiques. Dans l’ensemble, il n’y a pas eu d’augmentation du risque d’effets respiratoires nocifs découlant de l’exposition au TDCPP, ni de constatation clinique anormale. Un excès de tumeurs bénignes (principalement des lipomes) (5,4 % contre 0 %), de dermatites (6,5 % contre 3,2 %) et de gynécomastie (3,3 % contre 0 %) a été observé dans le groupe exposé par rapport au groupe non exposé.
8.3 Caractérisation des risques pour la santé humaine
8.3.1 TCPP
En se fondant sur les données globales disponibles sur les effets sur la santé du TCPP, les effets critiques de la caractérisation des risques pour la santé humaine associés à l’exposition au TCPP sont les effets sur la reproduction et le développement. Bien qu’aucune étude de toxicité chronique ou de cancérogénicité ne soit disponible, des éléments de preuve laissent supposer que le TCPP peut présenter un potentiel cancérogène.
La préoccupation initiale liée à la cancérogénicité est attribuable à la similarité structurelle du TCPP avec d’autres esters d’organophosphate (p. ex. PTCE, TDCPP) qui ont présenté des effets cancérogènes dans les études de cancérogénicité réalisées sur des animaux de laboratoire. Commencé en 2012, le NTP a mené des études de 90 jours et de deux ans sur la toxicité par voie orale et la cancérogénicité chez les rats et les souris, mais un rapport d’étude n’est pas encore disponible. En l’absence d’une étude chronique, plusieurs autres éléments de preuve ont été étudiés pour évaluer le potentiel cancérogène du TCPP. Dans l’ensemble, les éléments de preuve laissent entendre que le TCPP peut être cancérogène pour les rongeurs; ce fait s’appuie sur une lecture croisée qualitative à partir du PTCE et du TDCPP qui sont jugés structurellement semblables au TCPP, ainsi que sur des R(Q)SA et des analyses d’alertes structurales.
Une étude de toxicité pour la reproduction sur deux générations chez les rats était disponible. Dans cette étude, une DMENO de 99 mg/kg p.c./jour (dose testée la plus faible) a été définie pour les effets sur la reproduction et le développement (TNO Quality of Life, 2007, cité dans l’EURAR, 2008a). En ce qui concerne l’effet sur la reproduction, le niveau d’effet était fondé sur une diminution importante du poids de l’utérus et sur les effets sur le cycle œstral des femelles de génération F0. L’effet sur les poids de l’utérus était également observé dans une étude préliminaire de toxicité pour la reproduction sur une génération. À ce niveau d’effet, on a également constaté une diminution importante du poids absolu de l’hypophyse chez les femelles F1 dans le cadre de l’étude sur deux générations. En ce qui concerne les effets pour le développement, une forte augmentation du nombre d’avortons a été observée à 99 mg/kg p.c./jour ou plus au 1er jour après la naissance pour la génération F0. Des effets semblables ont été observés chez la génération F1, ainsi que dans l’étude préliminaire de toxicité pour la reproduction sur une génération au 21e jour après la naissance, mais pas au 1er jour. On ne sait pas si ces effets sur le développement se sont produits in utero ou à la suite d’une exposition après la naissance.
Dans une étude alimentaire de 13 semaines (Stauffer Chemical Co., 1981c, cité dans l’EURAR, 2008 a et probablement publié par Freudenthal et Henrich, 1999), une augmentation importante du poids du foie chez les rats mâles a été signalée dès la dose testée la plus faible de 52 mg/kg p.c./jour. Bien que les mêmes effets sur le foie n’aient pas été observés à des doses plus élevées dans l’étude sur deux générations (TNO Quality of Life, 2007), des incertitudes sont associées à la pureté du TCPP dans les traitements utilisés dans chaque étude et divers niveaux d’effets critiques basés sur les deux études sont utilisés pour caractériser les risques liés à l’exposition au TCPP.
Une DSENO critique à court terme de 1 015 mg/kg p.c./jour a été définie d’après une réduction du gain de poids à la dose suivante de 1 636 mg/kg p.c./jour chez les rats mâles traités avec du TCPP pendant 14 jours (Stauffer Chemical Co., 1980b, cité dans l’EURAR, 2008a).
Les principales sources d’exposition de la population générale au TCPP devraient être les milieux de l’environnement (air, eau, poussière), la nourriture (y compris le lait maternel) et l’utilisation de produits de consommation.
Le tableau 8‑7 et le tableau 8‑8 présentent toutes les valeurs pertinentes d’exposition et de danger pour le TCPP, ainsi que les marges d’exposition (ME) qui en résultent, pour la détermination des risques. Une comparaison de l’estimation de l’absorption quotidienne totale à partir des milieux de l’environnement et d’aliments aux divers effets critiques subchroniques a permis d’établir des ME qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Les marges d’exposition des nourrissons et des tout‑petits qui mâchent un objet en mousse (p. ex. un jouet) contenant du TCPP sont également jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Cependant, les marges d’exposition en cas de contact cutané prolongé avec le TCPP qui se trouve dans des articles manufacturés, tels que des meubles rembourrés et des matelas contenant de la mousse, sont jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Ces renseignements concordent avec la conclusion de l’évaluation de l’ECHA publiée récemment sur l’utilisation du PTCE, du TCPP et du TDCPP dans les articles contenant de la mousse et les meubles rembourrés résidentiels utilisés par les enfants (ECHA, 2018).
Scénario |
Exposition systémique (mg/kg p.c./jour) |
ME |
|---|---|---|
Milieux de l’environnement et aliments (tous les groupes d’âge) |
8,5 x 10-4 – 2,5 x 10-3 |
20 800 – 116 470 (d’après des DMENO critiques subchroniques de 52 à 99 mg/kg p.c./jour) |
Contact cutané des nourrissons étendus sur des matelas ou des meubles contenant de la mousse |
0,16 – 0,54* |
96 – 620 (d’après des DMENO critiques subchroniques de 52 à 99 mg/kg p.c./jour) |
Contact cutané des adultes étendus sur des matelas ou des meubles contenant de la mousse |
0,04 – 0,19* |
275 – 2 350 (d’après des DMENO critiques subchroniques de 52 à 99 mg/kg p.c./jour) |
Mâchonnement d’un objet en mousse par un nourrisson (p. ex. jouet) |
9,7 × 10-3 |
5 400 – 10 200 (d’après des DMENO critiques subchroniques de 52 à 99 mg/kg p.c./jour) |
Mâchonnement d’un objet en mousse par un tout‑petit (p. ex. jouet) |
9,4 × 10-3 |
5 550 – 10 500 (d’après des DMENO critiques subchroniques de 52 à 99 mg/kg p.c./jour) |
* hypothèse selon laquelle 40 % du TCPP est absorbé d’après des doses jugées plus représentatives d’une exposition liée à un contact cutané avec de la mousse (TNO Quality Life, 2005).
L’utilisation d’une mousse isolante pulvérisée et d’un produit servant à imperméabiliser les tentes peut entraîner une exposition par inhalation et une exposition par voie cutanée pendant une courte durée et de manière peu fréquente. Les marges d’exposition ont été estimées d’après la comparaison des estimations de la limite supérieure par inhalation et par voie cutanée de l’exposition à la DSENO critique à court terme de 1 015 mg/kg p.c./jour (tableau 8‑8). Ces ME sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Scénario |
Exposition systémique (mg/kg p.c./événement) |
ME |
|---|---|---|
Application de mousse isolante pulvérisée (petit projet) |
6,8* (voie cutanée) |
1,5 × 105 (d’après une DSENO orale à court terme de 1 015 mg/kg p.c./jour) |
Application de mousse isolante pulvérisée (petit projet) |
0,88 (inhalation) | 1,2 × 106 (d’après une DSENO critique à court terme de 1 015 mg/kg p.c./jour) |
Application de la mousse isolante pulvérisée (grand projet) |
635* (voie cutanée) |
1 600 (d’après une DSENO orale à court terme de 1 015 mg/kg p.c./jour) |
Application de la mousse isolante pulvérisée (grand projet) |
2,3 à 14,0 (inhalation) | 7,25 x 104 à 4,4 x 05 (d’après une DSENO critique à court terme de 1 015 mg/kg p.c./jour) |
Application d’un produit servant à imperméabiliser les tentes |
1,8* (voie cutanée) |
5,6 × 105 (d’après une DSENO orale à court terme de 1 015 mg/kg p.c./jour) |
* hypothèse selon laquelle 40 % du TCPP est absorbé d’après des doses jugées plus représentatives d’une exposition liée à un contact cutané avec de la mousse (TNO Quality Life, 2005).
Dans l’ensemble, les ME relatives à l’absorption quotidienne de TCPP à partir de milieux de l’environnement et d’aliments, à l’exposition des nourrissons et des tout‑petits au TCPP par le mâchonnement de produits en mousse et à l’utilisation occasionnelle de mousses isolantes pulvérisées et de produits imperméabilisants pulvérisés sont jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Cependant, les ME entre les effets critiques et les estimations de l’absorption de TCPP attribuable à un contact cutané prolongé avec des meubles rembourrés ou des matelas contenant de la mousse pour tous les groupes d’âge sont jugées potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
8.3.2 TDCPP
D’après la classification de l’Union européenne, et d’après les données disponibles sur les effets sur la santé, l’effet critique pour la caractérisation des risques pour la santé humaine associés à l’exposition au TDCPP est la cancérogénicité. Une augmentation statistiquement significative de l’incidence des tumeurs (adénomes) a été observée chez les rats mâles et femelles exposés au TDCPP pendant deux ans. Des tumeurs ont été observées dans de multiples organes, notamment les reins et le foie (chez les deux sexes), les testicules (chez les mâles) et les glandes surrénales (chez les femelles) (Stauffer Chemical Co., 1981a). Une hyperplasie dans les reins et des anomalies histologiques dans les testicules ont été observées et pourraient être associées aux adénomes qui sont apparus dans les organes dès la dose moyenne. Pour ce qui est de la génotoxicité, des résultats mitigés ont été observés in vitro et des résultats négatifs ont été observés in vivo; toutefois, des éléments de preuve indiquent que le TDCPP peut se lier par covalence à l’ADN des souris (Morales et Matthews, 1980).
À l’aide de l’étude de cancérogénicité d’une durée deux ans au cours de laquelle des rats mâles et femelles ont été exposés au TDCPP par leur alimentation (Stauffer Chemical Co., 1981a; Freudenthal et Henrich, 2000), une modélisation de la dose repère (BMD) a été appliquée pour calculer un point de départ pour les effets cancérogènes critiques liés de l’exposition orale.
Une limite inférieure de l’intervalle de confiance de la dose repère (BMDL10) a été calculée pour chaque type de tumeurs et un modèle a été sélectionné sur la base de la meilleure correspondance parmi neuf modèles disponibles dans le logiciel Benchmark Dose Software (BMDS v.24) de l’Environmental Protection Agency des États‑Unis (annexe H). Une analyse dose‑réponse de chaque siège de tumeur par le logiciel BMDS indique que les testicules (tumeur des cellules interstitielles chez les rats mâles) sont l’organe le plus sensible, avec une BMDL10 de 6,74 mg/kg p.c./jour. Une BMDL10 semblable de 6,84 mg/kg p.c./jour a été déterminée pour l’adénome du cortex rénal chez les mâles. Chez les rats femelles, la BMDL10 associée à l’adénome du cortex rénal était de 8,29 mg/kg p.c./jour. Étant donné que les différences entre les niveaux des BMDL10 associés à l’adénome du cortex rénal pour les rats mâles et femelles étaient minimes, on considère que le TDCPP ne provoque pas d’effets propres au sexe dans les reins.
Dans le cas des effets non cancérogènes, une DMENO chronique critique de 5 mg/kg p.c. a été déterminée, dose à laquelle une hyperplasie de l’épithélium des tubules contournés dans les reins et des anomalies histologiques dans les testicules ont été observées chez les mâles à la dose testée la plus faible dans une étude de toxicité chronique de deux ans chez les rats (Stauffer Chemical Co., 1981a).
L’exposition potentielle de la population générale au TDCPP devrait principalement découler des milieux de l’environnement (air, eau, poussière), de la nourriture (y compris le lait maternel) et de l’utilisation d’articles manufacturés (matelas et canapés en mousse, meubles avec enduction d’envers de matériaux de rembourrage) qui peuvent contenir du TDCPP. Pour estimer le risque de cancer lié à l’exposition au TDCPP, des doses quotidiennes moyennes pour la durée de vie (DQMDV) découlant des milieux de l’environnement et des aliments ainsi que de l’exposition cutanée à des meubles ou à des matelas contenant de la mousse ont été calculées (voir l’annexe I pour les détails).
La comparaison de l’estimation de la DQMDV pour l’absorption quotidienne totale à partir des milieux de l’environnement et des aliments de 0,015 µg/kg p.c./jour à la BMDL10 de 6,74 mg/kg p.c./jour pour les effets cancérogènes entraîne une marge d’exposition pour la durée de vie de 455○400. Ces ME sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé concernant les effets cancérogènes. La comparaison des estimations de la DQMDV découlant de l’exposition cutanée aux matelas ou aux meubles contenant de la mousse de 4,5 à 19,0 µg/kg p.c./jour et la BMDL10 de 6,74 mg/kg p.c./jour entraîne une marge d’exposition pour la durée de vie allant de 355 à 1○1500 en ce qui concerne les effets cancérogènes. Ces ME sont jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition concernant les effets cancérogènes.
Le tableau 8‑9 présente toutes les valeurs pertinentes d’exposition et de danger autre que le cancer associées au TDCPP, ainsi que les ME qui en résultent, pour la détermination des risques. Les ME entre les effets critiques et l’estimation de l’absorption quotidienne de TDCPP provenant des milieux de l’environnement et des aliments ainsi que du mâchonnement de produits en mousse par les nourrissons et les tout‑petits sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé concernant les effets non cancérogènes. Cependant, les ME entre les effets critiques et les estimations des apports de TDCPP provenant d’un contact cutané prolongé avec des meubles rembourrés ou des matelas contenant de la mousse pour tous les groupes d’âge sont jugées potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé concernant les effets non cancérogènes.
Scénario |
Exposition systémique (mg/kg p.c./jour) |
Marges d’exposition pour les effets non cancérogènes (d’après une DMENO chronique orale de 5 mg/kg p.c. par jour) |
|---|---|---|
Milieux de l’environnement et aliments |
4,6 x 10-5 – 8,6 x 10-4 |
5 800 – 108 700 |
Contact cutané des nourrissons étendus sur des matelas ou des meubles contenant de la mousse |
1,5 × 10-2 – 5,0 × 10-2a |
100 – 333 |
Contact cutané des adultes étendus sur des matelas ou des meubles contenant de la mousse |
3,8 × 10-3 – 1,7 × 10-2a |
290 – 1 300 |
Mâchonnement d’un objet en mousse par un nourrisson ou un tout‑petit |
1,6 × 10-3 |
3 100 |
a Absorption estimée d’après la valeur ajustée d’absorption cutanée de TDCPP de 30 % obtenue à l’aide du rapport entre les valeurs d’absorption du TCPP in vitro (23 % et 40 %) et le taux d’absorption du TDCPP de 15 % (EURAR, 2008 b).
Des estimations de l’exposition systémique quotidienne ont également été calculées à l’aide de la dosimétrie inversée provenant de plusieurs études de biosurveillance (Kosarac et al., 2016; Yang et al., 2019; Ospina et al., 2018; Butt et al., 2014) dans lesquelles les concentrations de BDCPP, comme biomarqueur du TDCPP, ont été mesurées dans des échantillons ponctuels d’urine. Même si les estimations de l’exposition systémique quotidienne provenant des données de biosurveillance sont liées à un certain nombre d’incertitudes (voir la section 8.1.3), les données de biosurveillance fournissent une approximation des estimations de l’exposition à partir de toutes les voies et sources d’exposition potentielles (NRC, 2006). Les estimations de l’exposition systémique quotidienne fondées sur les moyennes géométriques des concentrations de BDCPP allaient de 7,0 x 10-5 mg/kg p.c./jour pour les femmes enceintes à 1,6 x 10-3 mg/kg p.c./jour pour les touts‑petits âgés de 2 à 5 ans. Les estimations de la limite supérieure de l’exposition systémique quotidienne fondées sur les concentrations de BDCPP maximales ou du 95e centile allaient de 4,3 x 10-4 mg/kg p.c.jour pour les femmes enceintes à 0,072 mg/kg p.c./jour pour les touts‑petits âgés de 2 à 5 ans. Ces apports concordent avec les estimations de l’exposition obtenues à l’aide de la modélisation et, compte tenu des incertitudes liées à l’utilisation des données de la biosurveillance humaine, soutiennent les conclusions selon lesquelles les ME peuvent être inadéquates, en particulier pour les jeunes enfants.
Dans l’ensemble, les ME relatives à l’absorption quotidienne de TDCPP à partir de milieux de l’environnement et d’aliments ainsi que du mâchonnement de produits en mousse par les nourrissons et les tout‑petits sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé pour les effets cancérogènes et non cancérogènes. Cependant, les ME entre les effets critiques et les estimations des apports de TDCPP provenant d’un contact cutané prolongé avec des meubles rembourrés ou des matelas contenant de la mousse pour tous les groupes d’âge sont jugées potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé concernant les effets cancérogènes et non cancérogènes.
8.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes des évaluations sur les effets du TCPP et du TDCPP sur la santé humaine sont présentées dans le tableau suivant.
Principale source d’incertitude |
Effets |
|---|---|
Il n’y a aucune donnée de surveillance canadienne sur la présence de TCPP et de TDCPP dans les aliments ou le lait maternel. Des données des États‑Unis ou de l’Europe ont été utilisées pour calculer les estimations de l’exposition à partir de ces sources. |
+/- |
Les estimations de l’exposition cutanée au TCPP et au TDCPP ne tiennent compte que de la mousse souple de polyuréthane recouverte. Les expositions à la mousse nue pourraient se traduire par des expositions cutanées plus élevées. |
- |
L’ampleur de l’effet du revêtement textile sur la migration du TCPP et du TDCPP depuis la mousse de polyuréthane souple est inconnue. |
+/- |
Il manque des données empiriques sur la relation entre le taux de migration du TDCPP ou du TCPP à partir de la mousse souple de polyuréthane et leurs concentrations dans la mousse testée. |
+/- |
Aucun facteur de contact avec la peau propre au TDCPP ou au TCPP n’a été déterminé; un facteur de 1 a été supposé. |
+ |
Pour le scénario d’exposition cutanée, on suppose que la migration constante du TCPP et du TDCPP par les liquides se produit à partir de la mousse souple de polyuréthane contenue dans les matelas et les meubles pendant toute la durée du contact cutané (p. ex., les taux de migration pourraient être différents selon que les conditions sont sèches ou humides). |
+ |
Les taux de migration passive utilisés et déterminés à l’aide d’une mousse immergée dans un simulateur de sueur pourraient ne pas représenter correctement la migration dans les scénarios de mâchonnement (c.‑à.‑d. que la migration pourrait être plus importante en raison de la succion). |
- |
Il y a peu de données de biosurveillance canadiennes disponibles sur le TCPP et le TDCPP. |
+/- |
Le fait de déterminer les apports de TDCPP pour diverses populations en se fondant principalement sur des échantillons ponctuels d’urine, y compris l’hypothèse sur les voies d’exposition, le moment de l’exposition par rapport au moment de l’échantillonnage, et la variabilité des volumes quotidiens d’urine autant entre les personnes que pour une même personne. |
+/- |
L’hypothèse selon laquelle toutes les concentrations de BDCPP mesurées dans l’urine sont associées à une exposition directe au TDCPP. |
+ |
L’hypothèse selon laquelle les concentrations de BDCPP dans l’urine humaine représentent une excrétion de 21 % de l’apport quotidien de TDCPP (en raison du manque de données toxicocinétiques chez l’humain) et que cette valeur reste constante pour tous les groupes d’âge. |
+/- |
Il n’existe aucune étude de toxicité par voie cutanée ou par inhalation pour le TCPP et le TDCPP, par conséquent l’extrapolation d’une voie d’exposition à une autre a été nécessaire. |
+/- |
Aucune étude sur la reproduction des femelles n’a été recensée pour le TDCPP. |
- |
Aucune donnée n’est disponible sur le mode d’action des tumeurs associées à l’exposition au TDCPP ou sur la contribution possible de deux métabolites du TDCPP (3‑MCPD, 1,3‑DCP), qui ont été classés comme des cancérogènes de catégorie 2B par le CIRC, sur l’effet cancérogène du TDCPP. |
+/- |
Aucune étude sur la toxicité chronique ou la cancérogénicité n’a été recensée pour le TCPP. |
+/- |
Aucune donnée n’est disponible sur la contribution potentielle de chaque isomère de chaîne à la toxicité globale du TCPP. |
+/- |
Les calculs de la BMD pour le TDCPP n’ont utilisé que les incidences des adénomes aux fins d’analyse, car les renseignements sur les incidences des adénomes et de carcinomes combinés n’étaient pas disponibles dans l’étude originale. |
+/- |
Le fait de tenir compte de la dose élevée peut avoir eu une incidence sur la courbe dose‑réponse lors du calcul de la BMD et de la BMDL pour le TDCPP. |
+/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; – = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/ – = potentiel inconnu d’entraîner une surestimation ou une sous-estimation du risque.
Le NPT des États‑Unis a mené des études de deux ans sur la cancérogénicité du TCPP chez les rats et les souris, mais un rapport d’étude n’est pas encore disponible. Le choix du PTCE et du TDCPP en tant qu’analogues définis à l’aide d’une technique de lecture croisée pour évaluer le potentiel cancérogène du TCPP est associé à l’incertitude, car il existe des ressemblances et des différences entre ces produits chimiques. Dans l’ensemble, d’après la technique de lecture croisée qualitative à partir des analogues, les R(Q)SA et les analyses d’alertes structurales, les renseignements laissent entendre que le TCPP peut être cancérogène pour les rongeurs.
Des incertitudes sont associées à la contribution potentielle de chaque isomère de chaîne à la toxicité globale du TCPP ainsi qu’aux niveaux de ces isomères en dehors de ce mélange; toutefois, puisqu’ils ne sont pas disponibles sur le marché et qu’ils ne sont généralement pas isolés dans une forme pure, la caractérisation approfondie des risques n’a pas été prise en compte dans cette évaluation.
9. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente mise à jour de l’ébauche d’évaluation préalable, le TCPP et le TDCPP présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que le TCPP et le TDCPP ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le TCPP et le TDCPP satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le TCPP et le TDCPP satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que le TCPP et le TDCPP répondent aux critères de persistance, mais pas à ceux de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Abbasi G, Saini A, Goosey E, Diamond ML. 2016. Product screening for sources of halogenated flame retardants in Canadian house and office dust. Sci Total Environ 545–546:299–307. (disponible en anglais seulement)
ABC Laboratories. 1993. Aerobic aquatic biodegradation of Antiblaze 80 using a shake flask test system. Final Report #40822. Analytical Bio-Chemistry Laboratories, Inc. (disponible en anglais seulement)
Abdallah MA, Zhang J, Pawar G, Viant MR, Chipman JK, D’Silva K, Bromirski M, Harrad S. 2015. High-resolution mass spectrometry provides novel insights into products of human metabolism of organophosphate and brominated flame retardants. Anal Bioanal Chem 407:1871-1883. (disponible en anglais seulement)
Abdallah MA, Pawar G, Harrad S. 2016. Human dermal absorption of chlorinated organophosphate flame retardants; implications for human exposure. Toxicol Appl Pharmacol 291:28-37. (disponible en anglais seulement)
[ACC] American Chemistry Council. 2012. Spray polyurethane foam ventilation research project – phase 2, American Chemistry Council’s Center for the Polyurethanes Industry. Rapport daté du 19 décembre 2012 et soumis à Environnement Canada le 31 octobre 2014.
ACD/pKaDB [Prediction Module]. c1997–2012. Version 9.04. Toronto (ON): Advanced Chemistry Development. [consulté en 2012]. [réserve de consultation]. (disponible en anglais seulement)
Addis T, Watanabe CK. 1961. The volume of urine in young healthy adults on a constant diet. J Biol Chem 27:267-272. (disponible en anglais seulement)
Ahrens VD, Maylin GA, Henion JD. 1979. Fabric release, fish toxicity, and water stability of the flame retardant Fyrol FR-2. Bull Environ Contam Toxicol 21:409–412. (disponible en anglais seulement)
Akzo Nobel. 2001a. Rapport de recherche final. Hydrolysis as a function of pH of TCPP.CGS-ENV F01047 T 01007 H. (disponible en anglais seulement)
Akzo Nobel. 2001b. Test plan for FYROL FR-2 (Tris[1,3-dichloro-20propyl] Phosphate). CAS No. 13674-87-8. High Production Volume Challenge Plan. Akzo Nobel Functional Chemicals LLC, 5 Livingstone Avenue, Dobbs Ferry, NY 10522. (disponible en anglais seulement)
Akzo Nobel. 2001c. Rapport de recherche final. Evaluation of the removal of TCPP in an aqueous medium – semi-continuous activated sludge method. CGS-ENV F01049 T01007 SC. (disponible en anglais seulement)
Akzo Nobel. 2002. Biodegradability of FYROL PCF in the prolonged closed bottle test. Akzo Nobel Report F02101. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Ali N, Dirtu A, Van den Eede N, Goosey E, Harrad S, Neels H, Mannetje A, Coakley J, Douwes J, Covaci A. 2012. Occurrence of alternative flame retardants in indoor dust from New Zealand: Indoor sources and human exposure assessment. Chemosphere 88: 1276–1282. (disponible en anglais seulement)
Ali N, Ali L, Medhi T, Dirtu A, Al-Shammari F, Neels H, Covaci A. 2013. Levels and profiles of organochlorines and flame retardants in car and house dust from Kuwait and Pakistan: Implication for human exposure via dust ingestion. Environ Int 55:62–70. (disponible en anglais seulement)
Allen JG, Stapleton HM, Vallarino J, McNeely E, McClean MD, Harrad SJ, Rauert CB, Spengler JD. 2013. Exposure to flame retardant chemicals on commercial airplanes. Environ Health 12:17. (disponible en anglais seulement)
Andresen JA, Muir D, Ueno D, Darling C, Theobald N, Bester K. 2007. Emerging pollutants in the North Sea in comparison to Lake Ontario, Canada, data. Environ Toxicol Chem 26(6): 1081–1089. (disponible en anglais seulement)
Anon. 1980. An Ames Salmonella/mammalian microsome mutagenesis assay for determination of potential mutagenicity of tris (2-chloropropyl) phosphate (Report No. 471-80). [cité dans PISSC, 1998]. (disponible en anglais seulement)
[AOPWIN] Atmospheric Oxidation Program for Windows [Estimation Model]. 2010. Version 1.92. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
Arcadis EBRC. 2011. Identification and evaluation of data on flame retardants in consumer products. Contract for European Commission [PDF]. (disponible en anglais seulement)
Arnot JA, Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337–345. (disponible en anglais seulement)
Arnot JA, Mackay D, Parkerton TF, Bonnell M. 2008a. A database of fish biotransformation rates for organic chemicals. Environ Toxicol Chem 27(11): 2263–2270. (disponible en anglais seulement)
Arnot JA, Mackay D, Bonnell M. 2008b. Estimating metabolic biotransformation rates in fish from laboratory data. Environ Toxicol Chem 27: 341–351. (disponible en anglais seulement)
ASTreat Model [sewage treatment plant removal model]. 2006. Version 1.0. Cincinnati (US): Procter & Gamble Company. [consuté en mars 2014]. Available from Procter & Gamble Company, P.O. Box 538707, Cincinnati, OH 45253-8707, US. (disponible en anglais seulement)
[ATSDR] Agency for Toxic Substances and Disease Registry [PDF]. 2012. Toxicological profile for Phosphate Ester Flame Retardants. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service. (disponible en anglais seulement)
Bayer. 1991a. Biodegradation test on TCPP. Bayer AG. [cité dans ECHA, c2007-2015, EURAR, 2008a, et UNEP, 1999]. (disponible en anglais seulement)
Bayer. 1991b. Tris-chlorisopropyl phosphate: Mutagenicity test on unscheduled DNA synthesis in rat liver primary cell cultures in vitro (rapport inédit). Bayer AG. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Bayer. 1991c. Tris-chloroisopropyl phosphate: Micronucleus test on the mouse (rapport inédit). Bayer AG. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Bayer. 1991d. 28-d study-full details needed. Bayer AG. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Bayer Healthcare. 2005. TCPP, Tris(2-chloro-1-methylethyl) phosphate Unscheduled DNA Synthesis test with rat liver cells in vivo (rapport inédit). Bayer AG. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
[BCFBAF] Bioaccumulation Program for Windows [Estimation Model]. 2010. Version 3.01. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [modifié le 17 février 2017]. Ottawa (Ont.), gouvernement du Canada. [consulté le 24 avril 2014].
Bendz D, Paxeus N, Ginn TR, Loge FJ. 2005. Occurrence and fate of pharmaceutically active compounds in the environment, a case study: Hoje River in Sweden. J Hazard Mater 122: 195–204. (disponible en anglais seulement)
Bergh C, Torgrip R, Emenius G, Ostman C. 2011. Organophosphate and phthalate esters in air and settled dust – a multi-location indoor study. Indoor Air 21:67–76. (disponible en anglais seulement)
Beyer A, Mackay D, Matthies M, Wania F, Webster E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ Sci Technol 34(4): 699–703. (disponible en anglais seulement)
[BIOWIN] Biodegradation Probability Program for Windows [Estimation Model]. 2010. Version 4.10. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
Boethling RS, Howard PH, Beauman JA, Larosche ME. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741−752. (disponible en anglais seulement)
Bradman A, Gaspar F, Castorina R, Tong-Lin E, McKone T. 2012. Environmental exposures in early childhood education environments. For California Air Resources Board. (disponible en anglais seulement)
Brandsma S, de Boer J, van Velzen M, Leonards P. 2014. Organophosphorus flame retardants and plasticizers in house and car dust and the influence of electronic equipment. Chemosphere 116:3–9. (disponible en anglais seulement)
Brommer S, Harrad S, Van den Eede N, Covaci A. 2012. Concentrations of organophosphate esters and brominated flame retardants in German indoor dust samples. J Environ Monit 14: 2482. (disponible en anglais seulement)
Brusick D, Matheson D, Jagannath DR, Goode S, Lebowitz H, Reed M, Roy G, Benson S. 1980. A comparison of the genotoxic properties of tris(2,3-dibromopropyl)phosphate and tris(1,3-dichloro-2-propyl)phosphate in a battery of short-term bioassays. J Environ Pathol Toxicol 3:207–226. (disponible en anglais seulement)
Butt C, Congleton J, Hoffman K, Fang M, Stapleton H. 2014. Metabolites of organophosphate flame retardants and 2-ethylhexyl tetrabromobenzoate (EH-TBB) in urine from paired mothers and toddlers. Environ Sci Technol 48:10432-10438. (disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C., 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, le 23 mars 2000, DORS/2000-107, Gazette du Canada, Partie II, vol. 134, nº 7, p. 607−612.
Canada. 2013. Article 71 de la LCPE, Avis concernant certaines substances ignifuges organiques, Gazette du Canada, Partie I, vol. 147, nº 13, le 30 mars 2013.
Campone L, Piccinelli A, Ostman C, Rastrelli L. 2010. Determination of organophosphorus flame retardants in fish tissues by matrix solid-phase dispersion and gas chromatography. Anal Bioanal Chem 397:799–806. (disponible en anglais seulement)
Carignan CC, Heigher-Bernays W, McClean MD, Roberts SC, Stapleton HM, Sjödin A, Webster TF. 2013a. Flame Retardant Exposure among Collegiate United States Gymnasts. Environ Sci Technol 47:13848-13856. (disponible en anglais seulement)
Carignan CC, McClean MD, Cooper EM, Watkins DJ, Fraser AJ, Heiger-Bernays W, Stapleton HM, Webster TF. 2013b. Predictors of tris(1,3-dichloro-2-propyl) phosphate metabolite in the urine of office workers. Environ Int 55:56–61. (disponible en anglais seulement)
[CEC] Commission de coopération environnementale. 2015. Amélioration des connaissances trilatérales sur les ignifugeants et leur utilisation dans les produits manufacturés – Analyse de certains ignifugeants contenus dans les meubles de bureau et de maison, Montréal, Canada, Commission de coopération environnementale, 16 p.
[CEH] Center for Environmental Health. 2013a. Playing on poisons: harmful flame retardants in children’s furniture [PDF]. (disponible en anglais seulement)
[CEH] Center for Environmental Health. 2013b. Naptime nightmares: toxic flame retardants in child care nap mats. (disponible en anglais seulement)
Chen D, Letcher RJ, Chu S. 2012. Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography–tandem quadrupole mass spectrometry. J of Chromatogr A 1220:169–174. (disponible en anglais seulement)
CIT. 2001. Skin sensitisation test in guinea pigs. Unpublished report [cité dans EURAR, 2008b]. (disponible en anglais seulement)
CITI. 1992. Published by Japan Chemical Industry Ecology Toxicology and Information Centre. Report Number: 2-1914. [cité dans ECHA, c2007-2015, EURAR, 2008b, et HSDB, 1983–]. (disponible en anglais seulement)
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (disponible en anglais seulement)
Cooper E, Covaci A, van Nuijs A, Webster T, Stapleton H. 2011. Analysis of the flame retardant metabolites bis(1,3-dichloro-2-propyl) phosphate (BDCPP) and diphenyl phosphate (DPP) in urine using liquid chromatography-tandem mass spectrometry. Anal Bioanal Chem 401: 2123–2132. (disponible en anglais seulement)
Covance Laboratories Inc. 2004. Chromosomal aberrations in chinese hamster ovary (CHO) cells. Rapport inédit. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Covance Laboratories Inc. 2005a. In vivo/in vitro Unscheduled DNA Synthesis in rat primary hepatocyte cultures at two timepoints with a dose range finding assay. Rapport inédit [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Covance Laboratories Inc. 2005b. Tris (2-chloro-1-methylethyl) phosphate: Mutation at the Thymidine Kinase (tk) Locus of Mouse Lymphoma L5178Y Cells (MLA) using the MitrotitreÒ Fluctuation Technique (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Covance Laboratories Inc. 2006. Detection of DNA damage in the liver of treated rats using the Comet assay (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
[CPOP] Modèle de polluants organiques persistants canadien. 2012. Version 1.1.18. Gatineau (Qué.), Environnement Canada, Division des substances existantes; Bourgas (BG): Prof. Assen Zlatarovm, université de Bourgas, Laboratoire de chimie mathématique [modèle basé sur celui de Mekenyan et al. 2005].
Crump D, Chiu S, Kennedy SW. 2012. Effect of TCPP and TDCPP on cytotoxicity and mRNA expression in primary cultures of avian hepatocytes and neuronal cells. Tox Sci 126(1):140–148. (disponible en anglais seulement)
Cui K, Wen J, Zeng F, Zhou X, Li S, Zeng Z. 2017. Determination of organophosphate ester flame retardants and plasticizers in soil samples by microwave-assisted extraction coupled with silica gel/alumina multilayer solid-phase extraction and gas chromatography-mass spectrometry. Anal Methods 9(6): 968-993. (disponible en anglais seulement)
Davison JM, Noble MCB. 1981. Serial changes in 24 hour creatinine clearance during normal menstrual cycles and the first trimester of pregnancy. BJOG 88:10–17. (disponible en anglais seulement)
Danish EPA [Environmental Protection Agency]. 2014. Survey, health and environmental assessment of flame retardants in textiles. Survey of chemical substances in consumer products No. 126. Miljøstyrelsen. (disponible en anglais seulement)
Danish EPA [Environmental Protection Agency]. 2015. Chemical substances in car safety seats and other textile products for children. Survey of chemical substances in consumer products No. 135. Danish Ministry of the Environment. (disponible en anglais seulement)
Diamond M, Goosey E, Saini A, Chaudhuri S. 2013. Assessment of the prevalence and exposure to the new flame retardants (NFRs) in Canadian indoor environments. Contract prepared for Health Canada. Diamond Environmental Research Group, University of Toronto. (disponible en anglais seulement)
Dirtu A, Ali N, Van den Eede N, Neels H, Covaci A. 2012. Country specific comparison for profile of chlorinated, brominated and phosphate organic contaminants in indoor dust. Case study for Eastern Romania, 2010. Environ Int 49:1–8. (disponible en anglais seulement)
Dishaw LV, Hunter DL, Padnos B, Padilla S, Stapleton HM. 2014. Developmental exposure to organophosphate flame retardants elicits overt toxicity and alters behavior in early life stage zebrafish (Danio rerio). Toxicol Sci 142(2): 445-454. (disponible en anglais seulement)
Driver J, Ross J, Mihlan G, Lunchick C, Landenberger B. 2007. Derivation of single layer clothing penetration factors from the pesticide handlers exposure database. Regul Toxicol Pharmacol 49(2): 125-37. [cité dans ECHA, 2008b]. (disponible en anglais seulement)
Dodson RE, Perovich LJ, Covaci A, Van den Eede N, Ionas AC, Dirtu AC, Brody JG, Rudel RA. 2012. After the PBDE Phase-Out: A Broad Suite of Flame Retardants in Repeat House Dust Samples from California. Environ Sci Technol 46(24):13056–13066. (disponible en anglais seulement)
Du Z, Wang G, Gao S, Wang Z. 2015. Aryl organophosphate flame retardants induced cardiotoxicity during zebrafish embryogenesis: By disturbing expression of the transcriptional regulators. Aqua Toxicol 161: 25-32. (disponible en anglais seulement)
[EC] Environnement Canada, Santé Canada. 2009. Évaluation préalable pour le Défi concernant : Éthanol, 2-chloro, phosphate (3:1) (phosphate de tris(2-chloroéthyle)) [PTCE] : Numéro de registre du Chemical Abstracts Service [Internet]. Ottawa (Ont.), Environnement Canada, Santé Canada. [consulté le 18 juin 2014].
[EC] Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999. Science Resource Technical Series, Technical Guidance Module: QSARs. Ébauche révisée de document de travail. Gatineau (Qué.), Environnement Canada, Division de l’évaluation écologique.
[EC] Environnement Canada. 2013. L'utilisation judicieuse de l'eau. [consulté en novembre 2014].
[EC] Environnement Canada, Santé Canada. 2007. Catégorisation de substances chimiques [Internet]. Ottawa (Ont.), gouvernement du Canada. [mis à jour le 25 mai 2013; consulté le 31 juillet 2013].
[EC, SC] Environnement Canada, Santé Canada. 2009. Évaluation préalable pour le Défi concernant l'Éthanol, 2-chloro-, phosphate (3:1)(phosphate de tris(2-chloroéthyle)) [PTCE]. Numéro de registre du Chemical Abstracts Service 115-96-8.
[EC] Environnement Canada. 2013-2014. Données recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) et conformément à l’« Avis concernant certaines substances ignifuges organiques », Gazette du Canada, vol. 147 nº 13. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
[ECCC] Environnement et Changement climatique. 2016a. Occurrence and Fate of Certain Organic Flame Retardants in Municipal Wastewater Treatment Systems: Organophosphorus. Environment and Climate Change Canada’s wastewater monitoring program under CMP. Rapport interne inédit. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016b. Données recueillies pendant la période de commentaires du public au titre de la Loi canadienne sur la protection de l’environnement (1999). Publication à la suite de l’évaluation préalable de deux substances, soit le Phosphate de tris(2-chloro-1-méthyléthyle) [TCPP], NO CAS 13674-84-5 et le Phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] [TDCPP)], NO CAS 13674-87-8, qui sont inscrites sur la Liste intérieure des substances (paragraphes 68[b] et 68[c] de la Loi canadiennes sur la protection de l’environnement [1999]). Données préparées par : ECCC, Santé Canada; Programme des substances existantes.
[ECCC] Environnement et Changement climatique Canada. 2019. Documentation à l’appui : renseignements à l’appui de l’Ébauche d’évaluation préalable – Groupe de certaines substances ignifuges organiques, Phosphate de tris(2-chloro-1-méthyléthyle) (TCPP), Phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] (TDCPP) mis à jour. Données écologiques supplémentaires. Gatineau (Qué.), Environnement et Changement climatique Canada, Division de l’évaluation écologique. Disponible sur demande à : substances@ec.gc.ca".
[ECCC, SC]. Environnement et Changement climatique Canada, Santé Canada. 2016. Ébauche d’évaluation préalable – Groupe de certaines substances ignifuges organiques, Phosphate de tris(2-chloro-1-méthyléthyle) [TCPP], NO CAS 13674-84-5 et le Phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] [TDCPP)], NO CAS 13674-87-8.
[ECHA] European Chemicals Agency. 2010. Guidance on information requirements and chemical safety assessment. Chapter R.16: Environmental exposure estimation. May 2010. Guidance for the implementation of REACH. Helsinki (FI): European Chemicals Agency. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. c2007-2015. Registered substances database; search results for CAS RNs 13674-84-5 and 13674-87-8. Helsinki (FI): ECHA. [consulté en décembre 2016]. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2018. Screening report: An assessment of whether the use of TCEP, TCPP and TDCP in articles should be restricted [PDF]. Version 3. Helsinki (FI): European Chemicals Agency. (disponible en anglais seulement)
Eggen T, Heimstad ES, Stuanes AO, Norli HR. 2013. Uptake and translocation of organophosphates and other emerging contaminants in food and forage crops. Environ Sci Poll Res 20:4520–4531. (disponible en anglais seulement)
Environmental Affairs and Toxicology Department. 1981. A murine lymphoma mutagenesis assay, heterozygous at the thymidine kinase locus for the determination of the potential mutagenicity of Antiblaze 80 (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [Estimation Model]. 2000–2012. Version 4.1. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [consulté en janvier 2014]. (disponible en anglais seulement)
[EQC] Equilibrium Criterion Model. 2011. Version 1.0 (Beta). Peterborough (ON): Trent University, Canadian Environmental Modelling Centre. (disponible en anglais seulement)
Étude présentée. 2013. Études confidentielles inédites présentées à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Qué.), Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Eulaers I, Jaspers VLB, Halley DJ, Lepoint G, Nygard T, Pinxten R, Covaci A, Eens M. 2014. Brominated and phosphorus blame retardants in White-tailed Eagle Haliaeetus albicilla nestlings: Bioaccumulation and associations with dietary proxies. SciTotal Environ 478:48–57. (disponible en anglais seulement)
EURAR. 2008a. European Union Risk Assessment Report. Tris(2-chloro-1-methylethyl)phosphate (TCPP). Luxembourg, Office des publications officielles des Communautés européennes. (disponible en anglais seulement)
EURAR. 2008b. European Union Risk Assessment Report. Tris[2-chloro-1-(chloromethyl)ethyl]phosphate (TDCP). Luxembourg, Office des publications officielles des Communautés européennes. (disponible en anglais seulement)
EURAR. 2009. European Union Risk Assessment report. TRIS (2-CHLOROETHYL) PHOSPHATE (TCEP). Luxembourg, Office des publications officielles des Communautés européennes. (disponible en anglais seulement)
European Commission. 2003. Technical Guidance Document on Risk Assessment. Part II. European Chemicals Bureau.
Evenset A, Leknes H, Christensen G, Waner N, Remberger M, Gabrielsen G. 2009. Screening of new contaminants in samples from the Norwegian arctic. Contract with Norwegian Pollution Control Authority. (disponible en anglais seulement)
Farhat A, Crump D, Chiu, S, Williams KL, Letcher RJ, Gauthier LT, Kennedy SW. 2013. In ovo effects of two organophosphate flame retardants – TCPP and TDCPP – on pipping success, development, mRNA expression, and thyroid hormone levels in chicken embryos. Toxicol Sci 134(1):92–102. (disponible en anglais seulement)
Farhat A, Crump D, Porter E, Chiu S, Letcher RJ, Su G, Kennedy SW. 2014. Time-dependent effects of the flame retardant tris(1,3-dichloro-2-propyl) phosphate (TDCPP) on mRNA expression, in vitro and in ovo, reveal optimal sampling times for rapidly metabolized compounds. Environ Toxicol Chem 33(12):2842-2849. (disponible en anglais seulement)
Fernie KJ, Palace V, Peters LE, Basu N, Letcher RJ, Karouna-Renier NK, Schultz SL, Lazarus RS, Rattner BA. 2015. Investigating Endocrine and Physiological Parameters of Captive American Kestrels Exposed by Diet to Selected Organophosphate Flame Retardants. Environ Sci Technol 49(12): 7448-7455. (disponible en anglais seulement)
Follmann W et Wober J. 2006. Investigation of cytotoxic, genotoxic, mutagenic, and estrogenic effects of the flame retardants tris-(2-chloroethyl) -phosphate (TCEP) and tris-(2- chloropropyl) -phosphate (TCPP) in vitro. Toxicol Lett 161(2):124–134. (disponible en anglais seulement)
Francis WJA. 1960. Disturbances of bladder function in relation to pregnancy. J Obst Gyn Brit Empire LXVII(3):353–366. (disponible en anglais seulement)
Freudenthal RI et Henrich RT. 1999.A subchronic toxicity study of Fyrol PCF in Sprague-Dawley rats. Int J Toxicol 18:173–176. (disponible en anglais seulement)
Freudenthal RL et Henrich RT. 2000. Chronic toxicity and carcinogenic potential of tris-(1,3-dichloro-2-propyl) phosphate in Sprague-Dawley rat. Int J Toxicol 19:119–125. (disponible en anglais seulement)
Fries E, Mihajlovic I. 2011. Pollution of soils with organophosphorus flame retardants and plasticizers. J Environ Monit 13: 2692. (disponible en anglais seulement)
Gobas F. 2007. Development and review of a generic water–sediment modelling framework for organic chemicals. Report prepared for Environment Canada. Burnaby (BC): Simon Fraser University, Faculty of Environment. March 26, 2007. (disponible en anglais seulement)
Gobas F. 2010. Comments on approach to sediment exposure approach. Report prepared for Environment Canada. Burnaby (BC): Simon Fraser University, Faculty of Environment. March 25, 2010. (disponible en anglais seulement)
Greaves AK et Letcher RJ. 2014. Comparative body compartment composition and in ovo transfer of OPFRs in North American Great Lakes Herring Gulls. Environ Sci Technol 48:7942–7950. (disponible en anglais seulement)
Green N, Schlaback M, Bakke T, Brevik E, Dye C, Herzke D, Huber S, Plosz B, Remberger M, Schoyen M, Uggerud H, Vogelsang C. 2008. Screening of selected metals and new organic contaminants 2007. Norwegian Pollution Control Authority. SPFO-report: 1014/2008. (disponible en anglais seulement)
Guerra P, Alaee M, Eljarrat E, Barcelo D. 2011. Introduction to Brominated Flame Retardants: Commercial Products, Applications, and Physicochemical Properties. In Eljarrat E, Barceló D. editors. 2011. Brominated Flame Retardants. Series: The Handbook of Environmental Chemistry. Volume 16. Heidelberg Berlin:Springer. 290 pp. (disponible en anglais seulement)
Hao C, Helm PA, Morse D, Reiner EJ. 2018. Liquid chromatography-tandem mass spectrometry direct injection analysis of organophosphorus flame retardants in Ontario surface water and wastewater effluent. Chemosphere 191:288-295. (disponible en anglais seulement)
Hartmann P, Burgi D, Giger W. 2004. Organophosphate flame retardants and plasticizers in indoor air. Chemosphere 57:781–787. (disponible en anglais seulement)
Hattori Y, Ishitani H, Kuge Y, Nakamoto M. 1981. Environmental fate of organic phosphate esters. Suishitsu Odaku Kenkyu, 4(3):137–141. [cité dans OMS, 1998]. (disponible en anglais seulement)
He C, Toms LL, Thai P, Van den Eede N, Wang X, Li Y, Baduel C, Harden FA, Heffernan AL, Hobson P, Covaci A, Mueller JF. 2018. Urinary metabolites of organophosphate esters: Concentrations and age trends in Australian children. Environ Int 111:124-130. (disponible en anglais seulement)
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [Estimation Model]. 2011. Version 3.20. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [consulté en janvier 2014]. (disponible en anglais seulement)
Higby K, Suiter CR, Phelps JY, Siler-Khodr T, Langer O. 1994.Normal values of urinary albumin and total protein excretion during pregnancy. Am J Obstet Gynecol 171:984–989. (disponible en anglais seulement)
Hoffman K. Daniels J. Stapleton HM. 2014. Urinary metabolites of organophosphate flame retardants and their variability in pregnant women. Environ Int 63:169–172. (disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank [base de données sur Internet]. 1983–. Bethesda (MD): National Library of Medicine (US). Revised 2006 Apr 14; [consulté en décembre 2013]. (disponible en anglais seulement)
Hughes MF, Edwards BC, Mitchell CT, Bhooshan B. 2001. In vitro dermal absorption of flame retardant chemicals. Food Chem Toxicol 39:1263–1270. (disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2012a. IARC monographs on the evaluation of the carcinogenic risks to humans: Some chemicals present in industrial and consumer products, food and drinking-water. 3-monochloro-1,2-propanediol [PDF]. IARC monograph 101:349–374. [Consulté le 19 février 2014]. (disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2012b. IARC monographs on the evaluation of the carcinogenic risks to humans: Some chemicals present in industrial and consumer products, food and drinking-water. 1,3-dichloro-2-propanol [PDF]. IARC monograph 101:375–390. [Consulté le 19 février 2014]. (disponible en anglais seulement)
[ICRP]. International Commission on Radiological Protection. 2003. Basic anatomical and physiological data for use in radiological protection: Reference values. ICRP Publication 89. Ann. ICRP 32(3-4). (disponible en anglais seulement)
Inveresk Research International. 1985. TDCP LV: Mouse lymphoma mutation assay, (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Ionas A, Dirtu A, Anthonissen T, Neels H, Covaci A. 2014. Downside of the recycling process: harmful organic chemicals in children’s toys. Environ Int 65:54–62. (disponible en anglais seulement)
Ishidate M. 1983. Application of chromosomal aberration tests in vitro to the primary screening for chemicals with carcinogenic and/or genetic hazards. From: Short-term tests for Carcinogenesis: Montpellier, 1981, 58–79. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
[J-CHECK] Japan CHEmicals Collaborative Knowledge database [base de données]. c2010- . Tokyo (JP): National Institute of Technology and Evaluation (NITE). [Consulté en mars 2013]. (disponible en anglais seulement)
Jantunen LM, Gawor A, Wong F, Bidleman T, Wania F, Stern G, Hung H. 2013a. Flame retardants, plasticizers and pesticides in the Canadian Arctic. A poster at Northern Contaminants Program 2013. (disponible en anglais seulement)
Jantunen L, Struger J, Backus S, Kraft J, Brommer S. 2013b. Organophosphate flame retardants in Southern Ontario tributaries and precipitation. A poster at the Sixth International Symposium of Flame Retardants (BFR 2013). (disponible en anglais seulement)
Jantunen L. 2014. TDCPP and TCPP concentrations in water from the Great Lakes area. Rapport inédit. Communications personnelles à Santé Canada : Ottawa (Ont.). (disponible en anglais seulement)
Juberg D, Alfano K, Coughlin R, Thompson K. 2001. An observational study of object mouthing behavior by young children. Pediatrics 107: 135. (disponible en anglais seulement)
Kajiwara N, Noma Y, Takigami H. 2011. Brominated and organophosphate flame retardants in selected consumer products on the Japanese market in 2008. J Hazard Mater 192:1250–1259. (disponible en anglais seulement)
Kamata E, Naito K, Nakaji Y, Ogawa Y, Suzuki S, Kaneko T, Takada K, Kurokawa Y, Tobe M. 1989. Acute and subacute toxicity studies of tris (1,3-dichloro-2-propyl) phosphate on mice. Eisei Shikenjo Hokoku 107:36–43 [résumé en anglais] [article en japonais] [cité dans PISSC, 1998 et NRC, 2000].
Keller AS, Raju NP, Webster TF, Stapleton HM. 2014. Flame retardant applications in camping tents and potential exposure. Environ Sci Technol Lett 1(2):152–155. (disponible en anglais seulement)
Kemmlein S, Hahn O, Jann O. 2003. Emissions of organophosphate and brominated flame retardants from selected consumer products and building materials. Atmos Environ 37:5485–5493. (disponible en anglais seulement)
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [Estimation Model]. 2010. Version 1.10. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
Kojima H, Takeuchi S, Itoh T, Iida M, Kobayashi S, Yoshida T. 2013. In vitro endocrine disruption potential of organophosphate flame retardants via human nuclear receptors. Toxicology 314:76–83. (disponible en anglais seulement)
Kosarac I, Kubwabo C, Foster WG. 2016. Quantitative determination of nine urinary metabolites of organophosphate flame retardants using solid phase extraction and ultra performance liquid chromatography coupled to tandem mass spectrometry (UPLC-MS/MS). J Chromatogr B 1014:24-30. (disponible en anglais seulement)
Kroon AGM, van Ginkel CG. 1992. Toxicity of Fyrol PCF to the freshwater alga Selenastrum capricornutum. Report Number: CRL F92015. Akzo Research Laboratories, Arnhem. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Lakind JS, Naiman DQ. 2008. Bisphenol A (BPA) daily intakes in the United States: Estimates from the 2003-2004 NHANES urinary BPA data. J Expo Sci Environ Epidemiol 18: 608-615. (disponible en anglais seulement)
Lentner C, editor. 1981. Geigy scientific tables volume 1: Units of measurement, body fluids, composition of the body, nutrition. 8th ed. Basel (CH): Ciba-Geigy Ltd. (disponible en anglais seulement)
Leonards P, Steindal EH, van der Veen, I, Berg V, Bustnes JO, van Leeuwen S. 2011. Screening of organophosphorus flame retardants 2010.SPFO-Report 1091/2011.TA-2786/2011; 2011. [cité dans Eulaers et al., 2014]. (disponible en anglais seulement)
Li H, Su G, Zou M, Yu L, Letcher RJ, Yu H, Giesy JP, Zhou B, Liu C. 2015. Effects of Tris(1,3-dichloro-2-propyl) Phosphate on Growth, Reproduction, and Gene Transcription of Daphnia magna at Environmentally Relevant Concentrations. Environ Sci Technol 49: 12975-12983. (disponible en anglais seulement)
Life Science Research. 1990. FYROL FR-2: Assessment of its ready biodegradability. Modified sturm test. LSR Report No: 90/AKL029/0232. Life Science Research Limited, Eye, Suffolk IP23 7PX, England. (disponible en anglais seulement)
Liu X, Ji K, Chio K. 2012. Endocrine disruption potentials of organophosphate flame retardants and related mechanisms in H295R and MVLN cell lines and in zebrafish. Aquat Toxicol 114-115:173–181. (disponible en anglais seulement)
Liu C, Wang Q, Liang K, Liu J, Zhou B, Zhang X, Liu H, Giesy JP, Yu H. 2013. Effects of tris(1,3-dichloro-2-propyl) phosphate and triphenyl phosphate on receptor-associated mRNA expression in zebrafish embryos/larvae. Aquat Toxicol 128-129:147–157. (disponible en anglais seulement)
Liu Y, Liggio J, Harner T, Jantunen L, Shoeib M, Li S-M. 2014a. Heterogeneous OH initiated oxidation: A possible explanation for the persistence of organophosphate flame retardants in air. Environ Sci Technol 48:1041–1048. (disponible en anglais seulement)
Liu Y, Huang L, Li S-M, Harner T, Liggio J. 2014b. OH initiated heterogeneous oxidation of tris-2-butoxyethyl phosphate: implications for its fate in the atmosphere. Atmos Chem Phys 14:19431–19468. (disponible en anglais seulement)
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [modifié le 10 août 2016]. Ottawa (Ont.), gouvernement du Canada. [consulté le 24 avril 2014].
Lynn RK, Wong K, Dickinson RG, Gerber N, Kennish JM. 1980. Diester metabolites of the flame retardant chemicals tris(1,3-dichloro-2-propyl) phosphate and tris(2,3- dibromopropyl) phosphate in the rat: identification and quantification. Res Commun Chem Pathol Pharmacol 28(2):351–360. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Lynn RK, Wong K, Garvie-Gould C, Kennish JM. 1981. Deposition of the flame retardant, tris(1,3-dichloro-2-propyl) phosphate, in the rat. Drug Metab Dispos 9(5):434–41. (disponible en anglais seulement)
Marklund A, Andersson B, Haglund P. 2003. Screening of organophosphorus compounds and their distribution in various indoor environments. Chemosphere 53:1137–1146. (disponible en anglais seulement)
Marklund A, Andersson B, Haglund P. 2005a. Traffic as a source of organophosphorus flame retardants and plasticizers in snow. Environ Sci Technol 39:3555–3562. (disponible en anglais seulement)
Marklund A, Andersson B, Haglund P. 2005b. Organophosphorus flame retardants and plasticizers in air from various indoor environments. J Environ Monit 7:814–819. (disponible en anglais seulement)
Martinez-Carballo E, Gonzalez-Barreiro C, Sitka A, Scharf S, Gans O. 2007.Dermination of selected organophosphate esters in the aquatic environment of Austria. Sci Total Environ 388: 290–299. (disponible en anglais seulement)
Matthews HB, Anderson MW. 1979. Disposition of tris-(1,3-dichloro-2-propyl) - phosphate in the rat. Toxicology and Applied Pharmacology. Abstracts Eighteenth Annual Meeting. A184. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
McGoldrick DJ, Letcher RJ, Barresi E, Keir MJ, Small J, Clark MG, Sverko E, Backus SM. 2014. Organophosphate flame retardants and organosiloxanes in predatory freshwater fish from locations across Canada. Environ Pollut 193:254–261. (disponible en anglais seulement)
Meeker JD and Stapleton HM. 2010. House dust concentrations of organophosphate flame retardants in relation to hormone levels and semen quality parameters. Environ Health Perspect 118(3): 318–323.
Meeker J, Cooper E, Stapleton H, Hauser R. 2013. Urinary metabolites of organophosphate flame retardants: temporal variability and correlations with house dust concentrations. Environ Health Perspect 121 (5):580. (disponible en anglais seulement)
Mekenyan G, Dimitrov SD, Pavlov TS, Veith GD. 2005. POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ Res 16(1–2):103−133. (disponible en anglais seulement)
Meyer J, Bester K. 2004.Organophosphate flame retardants and plasticizers in wastewater treatment plants. J Environ Monit 6:599–605. (disponible en anglais seulement)
Mihajlovic I, Miloradov MV, Fries E. 2011. Application to Twisselman extraction,SPME and GC-MS to assess input sources for organophosphate esters onto soil. Environ Sci Technol 45:2264–2269. (disponible en anglais seulement)
Mihajlovic I, Fries E. 2012. Atmospheric deposition of chlorinated organophosphate flame retardants (OFR) onto soils. Atmos Environ 56:177–183. (disponible en anglais seulement)
Miller RC, Brindle E, Holman DJ, Shofer J, Klein NA, Soules MR, O’Connor KA. 2004. Comparison of specific gravity and creatinine for normalizing urinary reproductive hormone concentrations. Clin Chem 50(5):924–932. (disponible en anglais seulement)
Minegishi KI, Kurebayashi H, Seiichi N, Morimoto K, Takahashi T, Yamaha T. 1988. Comparative studies on absorption, distribution, and excretion of flame retardants halogenated alkyl phosphate in rats. Eisei Kagaku 34(2):102–114 [cité dans ATSDR, 2012, et EURAR, 2008b]. (disponible en anglais seulement)
MITI. 1992. Ministry of International Trade and Industry (Japan). Biodegradation in water: screening tests. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan, Tokyo (Japan): Japan Chemical Industry Ecology-Toxicology and Information Centre. [cité dans EURAR, 2008a, et ECHA, c2007-2015]. (disponible en anglais seulement)
Mobil. 1985. Static 96-hour acute toxicity of Antiblaze 80 to Fathead Minnows. Report of test number: 50593. Mobil Environmental Health Science Laboratory, Pennington, New Jersey 08534. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Mobil Environmental and Health Safety Laboratory. 1980. An Ames Salmonella/Mammalian Microsome Mutagenesis Assay for Determination of Potential Mutagenicity of Tris (2-chloropropyl) phosphate (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Moller A, Xie Z, Caba A, Sturm R, Ebinghaus R. 2011. Organophosphorus flame retardants and plasticizers in the atmosphere of the North Sea. Environ Pollut 159:3660–3665. (disponible en anglais seulement)
Moller A, Sturm R, Xie Z, Cai M, He J, Ebinghaus R. 2012. Organophosphorus flame retardants and plasticizers in airborne particles over the Northern Pacific and Indian Ocean towards the polar regions: evidence for global occurrence. Environ Sci Tech 46(6):3127–3134. (disponible en anglais seulement)
Morales NM et Matthews HB. 1980. In vivo binding of the flame retardants tris(2,3-dibromopropyl)phosphate and tris(1,3-dichloro-2-propyl) phosphate to macromolecules of mouse liver, kidney and muscle. Bull Environ Contam Toxicol 25(1):34–8. (disponible en anglais seulement)
Mortelmans K, Haworth S, Lawlor T, Speck W, Tainer B et Zeiger E. 1986.Salmonella mutagenicity tests. 2. results from the testing of 270 chemicals. Environ Mutagen 8(suppl 7):1–119. (disponible en anglais seulement)
Moser VC, Phillips PM, Hedge JM, McDaniel KL. 2015. Neurotoxicological and thyroid evaluations of rats developmentally exposed to tris(1,3-dichloro-2-propyl)phosphate (TDCIPP) and tris(2-chloro-2-ethyl)phosphate (TCEP). Neurotoxicol Teratol 52:236-247. (disponible en anglais seulement)
Nakamura A, Tateno N, Kojima S, Kaniwa M-A, Kawamura T. 1979. The mutagenicity of halogenated alkanols and their phosphoric acid esters for Salmonella typhimurium. Mutat Res 66:373–380. [cité dans EURAR, 2008a,b]. (disponible en anglais seulement)
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2013. Columbus (OH): American Chemical Society, Chemical Abstracts Service. [consulté en octobre 2013]. (disponible en anglais seulement)
Neithardt AB, Dooley SL, Borensztajn J. 2002. Prediction of 24-hour protein excretion in pregnancy with a single voided urine protein-to-creatinine ratio. Am J Obstet Gynecol 186:883–886. (disponible en anglais seulement)
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]. [modifié le 21 juin 2017]. Ottawa (Ont.), gouvernement du Canada. [consulté le 24 avril 2014].
Nomeir AA, Kato S, Matthews HB. 1981. The metabolism and disposition of tris(1,3-dichloro-2-propyl) phosphate (Fyrol FR-2) in the rat. Toxicol Appl Pharm 57:401–413. (disponible en anglais seulement)
Norris et Smith. 2002. Research into the mouthing behaviour of children up to 5 years old. London (UK): Consumer and Competition Policy Directorate, Department of Trade and Industry [cité dans US EPA, 2011]. (disponible en anglais seulement)
[INRP] Inventaire national de rejets de polluants, 1994–2009.
[NRC] National Research Council. 2000. Toxicological Risks of Selected Flame-Retardant Chemicals. Washington, DC: The National Academies Press. [consulté le 16 juin 2014]. (disponible en anglais seulement)
[NRC] National Research Council. 2006. Human Biomonitoring for Environmental Chemicals. Washington, DC: The National Academies Press. [consulté le 5 décembre 2014]. (disponible en anglais seulement)
[NTP] National Toxicology Program.1998. NTP technical report on the toxicology and carcinogenesis studies of 1-chloro-2-propanol (technical grade) (CAS No. 127-00-4) in F344/N rats and B6C3F1 mice (drinking water studies) [PDF]. NTP TR 477. NIH publication No. 98-3967. NC (Research Triangle Park): US Department of Health and Human Services, Public Health Service, National Institutes of Health. [consulté le 4 avril 2014]. (disponible en anglais seulement)
[NTP] National Toxicology Program. 2018. Link to data search for CAS RN 13674-84-5. Short-term Toxicity Studies (mice and rats) and Prenatal Developmental Toxicity Studies (completed, not report available). [consulté le 29 juin 2018]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1995. Essai n° 418 : Neurotoxicité différée de substances organophosphorées à la suite d'une exposiiton aiguë [PDF]. [consulté le 6 janvier 2014].
[OCDE] Organisation de coopération et de développement économiques. 2002. SIDS Initial Assessment Report for tris(1-chloro-2-propyl)phosphate; CAS RN 13674-84-5. SIDS Initial Assessment Meeting 4; May 1996. [consulté le 18 juin 2014]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009. SIDS Initial Assessment Report for tris(1-chloro-2-propyl)phosphate; CAS RN 13674-84-5. SIDS Initial Assessment Meeting 28; April 2009. [consulté le 18 juin 2014]. (disponible en anglais seulement)
[OCDE] OECD Pov and LRTP Screening Tool. Version 2.0. Organisation de coopération et de développement économiques; Zurich (CH). (disponible en anglais seulement)
OMS. 1998. Flame retardants: Tris(chloropropyl) phosphate and tris(2-chloroethyl) phosphate [PDF]. Environmental Health Criteria 209. Organisation mondiale de la Santé, Genève. (disponible en anglais seulement)
Parboosingh J, Doig A. 1973. Studies of nocturia in normal pregnancy. J Obstet Gynaecol Br Commonw 80:888–895. (disponible en anglais seulement)
Parmar AS. 1977. Activity of trichloropropylene phosphate in the Salmonella/microsomal assay for bacterial mutagenicity. Bethesda, Maryland, Microbiological Associates (Project No. T1108). [cité dans PISSC, 1998].
Perucca J, Bouby N, Valeix P, Bankir L. 2007. Sex difference in urine concentration across differing ages, sodium intake, and level of kidney disease. Am J Physiol Regul Integr Comp Physiol. 292:R700-R705. (disponible en anglais seulement)
Phytosafe. 2003a. Laboratory determination of the long term toxicity of TCPP to earthworms (Eisenia fetida) using artificial soil substrate. PHYTOSAFE s.a.r.l., 2, rue Marx Dormoy, 64000 PAU, France. (disponible en anglais seulement)
Phytosafe. 2003b. Laboratory assessment of the side-effects of TCPP on plant growth. Report of Phytosafe Study Number: 03-69-012-ES. PHYTOSAFE s.a.r.l., 2, rue Marx Dormoy, 64000 Pau, France. [cité dans ECHA, c2007-2015, et EURAR, 2008a]. (disponible en anglais seulement)
Phytosafe. 2004a. Laboratory determination of the long term toxicity of TDCP to earthworms (Eisenia foetida) using artificial soil. Study Number: 04-99-021-ES.PHYTOSAFE s.a.r.l. Pau, France. [cité dans ECHA, c2007-2015, et EURAR, 2008b]. (disponible en anglais seulement)
Phytosafe. 2004b. Laboratory assessment of the side-effects of TDCP on plant growth. Study Number: 04-99-022-ES. PHYTOSAFE s.a.r.l. Pau, France. [cité dans ECHA, c2007-2015, et EURAR, 2008b]. (disponible en anglais seulement)
[PISSC] Programme international sur la sécurité des substances chimiques. 1998. Environmental Health Criteria 209: Flame retardants: tris(chloropropyl)phosphate and tris(2-chloroethyl)phosphate [PDF]. Organisation mondiale de la santé, Genève. [Internet]. [Consulté le 18 juin 2014]. (disponible en anglais seulement)
[Red Devil] Red Devil Inc. 2004. Foam & Fill minimal expanding polyurethane sealant MSDS. (disponible en anglais seulement)
Revúsová V, Zvara V, Gratzlová J. 1971. Some Laboratory Findings in Patients with Urolithiasis. Int Urol Nephrol 3(3): 251-258. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007. Do-it-yourself products fact sheet: to assess the risks for the consumer [PDF]. Bilthoven (NL): RIVM. Report No.: 320104007/2007.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2008. Chemicals in Toys. A general methodology for assessment of chemical safety of toys with a focus on elements [PDF]. Bilthoven (NL): RIVM. Report No.:320003001/2008. [consulté le 9 juillet 2018].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2014. General Fact Sheet: general default parameters for estimating consumer exposure – Updated version 2014 [PDF]. Bilthoven (NL): RIVM. Report No.: 090013003/2014. (disponible en anglais seulement)
SafePharm. 1996. Inherent biodegradation test. TCPP. SPL project number 0741457. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories Ltd. 1979. Determination of the contact sensitisation potential of Tris Mono Chloropropyl Phosphate (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories Ltd. 1984. Tolgard TDCP. LV: Ames test (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
SafePharm Laboratories Ltd. 1985a. Tolgard TDCP. LV: Ames test (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
SafePharm Laboratories Ltd. 1985b. Tolgard TDCP. LV: OECD 474 micronucleus study in the mouse. (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
SafePharm Laboratories Ltd. 1992. TMCPP: Reverse mutation assay “Ames Test” using Salmonella typhimurium and Escherichia coli (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories. 1993. Amgard TDCP. Acute toxicity to Rainbow Trout. Report reference JWH/AQ71/272. SafePharm Laboratories Limited, Derby, UK. [cité dans ECHA, c2007-2015, et EURAR, 2008b]. (disponible en anglais seulement)
SafePharm Laboratories. 1995. TCPP: Daphnia magna reproduction test. SPL Project number: 071-386. (disponible en anglais seulement)
SafePharm Laboratories. 1996a. Assessment of inherent biodegradability. TDCPP. SPL Project Number 071/455. (disponible en anglais seulement)
SafePharm Laboratories. 1996b. Acute toxicity to earthworms. Report of SPL Project Number: 071/458. SafePharm Laboratories Ltd., Derby. [cité dans ECHA, c2007-2015, et EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories. 1996c. Amgard TDCP.Acute toxicity to earthworms (Eisenia foetida).Report of Project Number 071/456.SafePharm Laboratories Limited, Derby, UK. (disponible en anglais seulement)
SafePharm Laboratories. 2002a. TCPP: Determination of general physic-chemical properties. SPL Project Number: 1613/007. SafePharm Laboratories Limited, P.O. Box No. 45, Derby, DE1 2BT, UK. (disponible en anglais seulement)
SafePharm Laboratories. 2002b. TCPP: Determination of general physicochemical properties, Report 1613/001, SafePharm Laboratories, PO Box 45, Derby, UK. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories. 2002c. TCPP: Determination of general physicochemical properties, Report 1613/002, SafePharm Laboratories, PO Box 45, Derby, UK. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
SafePharm Laboratories. 2002d. TDCP: Determination of general physicochemical properties, Report 1613/008, SafePharm Laboratories, PO Box 45, Derby, UK. (disponible en anglais seulement)
SafePharm Laboratories. 2002e. TDCP: Determination of vapour pressure. Report 1613/003, SafePharm Laboratories, PO Box 45, Derby, UK. (disponible en anglais seulement)
SafePharm Laboratories. 2002f. TDCP: Determination of general physicochemical properties, Report 1613/004, SafePharm Laboratories, PO Box 45, Derby, UK. (disponible en anglais seulement)
SafePharm Laboratories 2005. TCPP: local lymph node assay in the mouse (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Saini A, Thaysen C, Jantunen L, McQueen RH, Diamond ML. 2016. From Clothing to Laundry Water: Investigating the Fate of Phthalates, Brominated Flame Retardants, and Organophosphate Esters. Environ Sci Technol 50: 9289-9297. (disponible en anglais seulement)
Salamova A, Ma Y, Venier M, Hites R. 2013. High levels of organophosphate flame retardants in the Great Lakes atmosphere. Environ Sci Technol Lett September 2013. (disponible en anglais seulement)
Salamova A, Hermanson MH, Hites RA. 2014a. Organophosphate and halogenated flame retardants in atmospheric particles from a European Arctic site. Environ Sci Technol 48(11):6133–6140. (disponible en anglais seulement)
Salamova A, Ma Y, Venier M, Hites RA. 2014b. High levels of organophosphate flame retardants in the Great Lakes atmosphere. Envi Sci Tech Lett 1(1):8–14. (disponible en anglais seulement)
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : un guide pour les calculs de l'exposition, Ottawa (Ont.), Les Grands Lacs : Impact sur la santé, Direction générale de la protection de la santé, Santé Canada.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.), Santé Canada, Direction de l'hygiène du milieu. (disponible en anglais seulement)
Santé Canada. 2013. Document d’orientation provisoire surl’évaluation des risques pour la santé humaine associés à une exposition de courte durée aux substances cancérogènes présentes dans les sites contaminés [PDF], Ottawa (Ont.), Santé Canada. [consulté en janvier 2019].
Santé Canada. 2014. CMP Survey 2014-2015: Determination of flame retardants in consumer products. Rapport inédit. Santé Canada, Ottawa (Ontario). (disponible en anglais seulement)
Santé Canada. 2015a. Documentation à l’appui : renseignements sur le potention cancérogène du phosphate de tris(1-chloropropane-2-yle) 2. Ottawa (Ont.), Santé Canada. Disponible sur demande à : substances@ec.gc.ca".
Santé Canada. 2015b. Determination of TDCPP and TCPP in a Survey of Polyurethane Children’s Products. Rapport inédit. Santé Canada, Ottawa, Ontario. (disponible en anglais seulement)
Santé Canada. [modifié le 3 mai 2017]. Listes des additifs alimentaires autorisés. Ottawa (Ont.), Santé Canada, Direction des aliments. [consulté le 24 avril 2014].
Sasaki K, Suzuki T, Takeda M. 1982. Bioconcentration and excretion of phosphoric-acid triesters by killifish Oryzias-latipes. Bull Environl Contam Toxicol 28(6):752–759. (disponible en anglais seulement)
Sasaki K, Suzuki T, Uchiyama M. 1984. Metabolism of phosphoric acid trimesters by rat liver homegenate. Bull Environ Contam Toxicol 33:281–288. (disponible en anglais seulement)
Sasaki K, Takeda M, Uchiyama M. 1981. Toxicity, absorption, and elimination of phosphoric acid triesters by killifish and goldfish. Bull Environ Contam Toxicol 27:775–782. (disponible en anglais seulement)
Schreder ED, La Guardia MJ. 2014. Flame Retardant Transfers from U.S. Households (Dust and Laundry Wastewater) to the Aquatic Environment. Environ Sci Technol 48 (19): 11575–11583. (disponible en anglais seulement)
[SDS] Safety Data Sheet. 2014. Safe n Dry fire retardant and water repellent [PDF]. Brampton (ON): Empack Spraytech Inc. [consulté en février 2019]. (disponible en anglais seulement)
[SDS] Safety Data Sheet. 2015a. LePage Quad Window and Door Foam [PDF]. Mississauga (ON): Henkel. [consulté en février 2019]. (disponible en anglais seulement)
[SDS] Safety Data Sheet. 2015b. 1.75 Froth Polyol HFC INT [PDF]. Calgary (AB): Dow Chemical Canada ULC. [consulté en février 2019]. (disponible en anglais seulement)
[SDS] Safety Data Sheet. 2015c. UltraSeal® PF-200/PF-600 “B” Component [PDF]. Guelph (ON): Nuco Inc. [consulté en février 2019]. (disponible en anglais seulement)
[SDS] Safety Data Sheet. 2017. Large/small gap expanding polyurethane foam [PDF]. Pryor (OK): Red Devil, Inc. [consulté en février 2019]. (disponible en anglais seulement)
Shoeib M, Jantunen L. 2013. Legacy and current use of flame retardants in Great Lakes atmosphere. A poster at the Sixth International Symposium of Flame Retardants (BFR 2013). (disponible en anglais seulement)
Shoeib M, Ahrens L, Jantunen L, Harner T. 2014. Concentrations in air of organobromine, organochlorine and organophosphate flame retardants in Toronto, Canada. Atmos Environ 99: 140-147. (disponible en anglais seulement)
Soderlund EJ, Dybing E, Holme JA, Hongslo JK, Rivedal E, Sanner T, Nelson SD. 1985. Comparative genotoxicity and nephrotoxicity and nephrotoxicity studies of the two halogenated flame retardants tris(1,3-dichloro-2-propyl) phosphate and tris(2,3- dibromopropyl) phosphate. Acta Pharm Toxicol 56:20–29. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
[SPIN] Substances in Preparations in Nordic Countries [database on the Internet]. 2013. Copenhagen (DK): Nordic Council of Ministers. [consulté en octobre 2013]. (disponible en anglais seulement)
Sprague GL, Sandvik LL, Brookins-Hendricks MJ. 1981. Neurotoxicity of two organophosphorus ester flame retardants in hens. J Toxicol Environ Health 8(3):507–18. (disponible en anglais seulement)
Staaf T, Otsman C. 2005.Organophosphate trimesters in indoor environments. J Environ Monit 7:883–887. (disponible en anglais seulement)
Stapleton H, Klosterhaus S, Eagle S, Fuh J, Meeker J, Blum A, Webster T. 2009. Detection of organophosphate flame retardants in furniture foam and U.S. house dust. Environ Sci Technol 43:7490–7495. (disponible en anglais seulement)
Stapleton H, Klosterhaus S, Keller A, Ferguson P, van Bergen S, Cooper E, Webster T, Blum A. 2011. Identification of flame retardants in polyurethane foam collected from baby products. Environ Sci Technol 45:5323–5331. (disponible en anglais seulement)
Stapleton H, Sharma S, Gerzinger G, Ferguson P, Gabriel M, Webster T, Blum A. 2012. Novel and high volume use flame retardants in U.S. couches reflective of the 2005 PentaBDE phase out. Environ Sci Technol 46: 13432–13439. (disponible en anglais seulement)
Statistique Canada. 2014. Estimations de la population au 1er juillet, par âge et sexe. Tableau 17-10-0005-01.
Stauffer Chemical Co. 1976. Mutagenicity evaluation of Fyrol PCF (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1977. Mutagenicity evaluation of Fyrol FR-2 in the mouse lymphoma multiple endpoint test (MET). (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978a. Mutagenicity evaluation of Fyrol FR-2 in the mouse bone marrow cytogenetic analysis. (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978b. Teratology study in rats: FR-2 (Fyrol). (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978c. Toxicology reports on Fyrol FR-2. Vol I of II: Summary of in vitro delayed neurotoxicity evaluation. Report T-6303. USEPA TSCAT document OTS0204911. (disponible en anglais seulement)
Stauffer Chemical Co. 1978d. Mutagenicity evaluation of Fyrol PCF in the Ames Salmonella/microsome plate tests (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978e. Mutagenicity evaluation of Fyrol PCF in the mouse lymphoma forward mutation assay (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978f. Evaluation of Fyrol PCF in the unscheduled DNA synthesis in human WI-38 cells assay (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978g. Mutagenicity evaluation of Fyrol PCF in the in vitro transformation of BALB/3T3 cells assay (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1978h. Mutagenicity evaluation of Fyrol PCF in the rat bone marrow cytogenetic analysis (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1979. A 90-day neurotoxicity study in hens. Unpublished Report. [cité dans EURAR, 2008b, et ECHA, c2007-2015]. (disponible en anglais seulement)
Stauffer Chemical Co. 1980a. Morphological transformation of BALB/3T3 cells (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1980b. Fyrol PCF: A two-week dietary acute toxicity range finding study in male and female Charles River Sprague-Dawley derived rats (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1981a. A two-year oral toxicity/carcinogenicity study of Fyrol FR-2 in rats (volume I-IV) (final reports) with attachments, cover sheets and letter dated 093081. USEPA TSCAT document OTS0204911. (disponible en anglais seulement)
Stauffer Chemical Co. 1981b. Toxicology reports on Fyrol FR-2 (volume I - II) with attachments and cover letter dated 020381. EPA Doc No. 88-8100271. USEPA TSCAT document OTS0204911. (disponible en anglais seulement)
Stauffer Chemical Co. 1981c. Fyrol PCF 3-month dietary sub-chronic toxicity in rats (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Stauffer Chemical Co. 1983a. A mortality study of workers employed at a Fyrol FR-2 manufacturing plant. Report presented to TSCATS. EPA Doc No. 88-8400615 USEPA TSCAT document OTS0204911. (disponible en anglais seulement)
Stauffer Chemical Co. 1983b. Fyrol FR-2: Mutagenicity evaluation in Salmonella typhimurium. (rapport inédit). [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Stauffer Chemical Co. 1983c. Fyrol Fr-2 fertility study in male rabbits. Report presented to TSCATS. EPA Doc No. FYI-OTS-0183-0228 US EPA TSCAT document OTS0000228-0. (disponible en anglais seulement)
Stauffer Chemical Co. 1983d. A morbidity survey or workers employed at a Fyrol FR-2 manufacturing plant. Report presented to TSCATS. EPA Doc No. 88-8400602. US EPA TSCAT document OTS0204911. (disponible en anglais seulement)
Stauffer Chemical Co. 1984. Fyrol PCF metabolism/pharmacokinetic study in rats (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
[STP-EX] Sewage Treatment Plant Expanded Model. c2000-2013. Ver. 1.0. Windsor (ON): University of Windsor, Dept. of Civil and Environmental Engineering. [Model described in Seth R, Webster E, Mackay D. 2008. Continued development of a mass balance model of chemical fate in a sewage treatment plant. Water Res 42:595-604.]. (disponible en anglais seulement)
Su G, Greaves AK, Gauthier LT, Letcher RJ. 2014. Liquid chromatography-electrospray-tandem mass spectrometry method for determination of organophosphate diesters in biotic samples including Great Lakes herring gull plasma. J Chromatogr A 1374: 85-92. (disponible en anglais seulement)
Sundkvist A, Olofsoon U, Haglund P. 2010. Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk. J Environ Monit 12:943–951. (disponible en anglais seulement)
Tanaka S, Nakaura S, Kawashima K, Nagao S, Endo T, Onoda KI, Kasuya Y, Omori Y. 1981. Effect of oral administration of tris(1,3-dichloroisopropyl) phosphate to pregnant rats on prenatal and postnatal developments. Eisei Shikenjo Hokoku 99:50–55. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (ON): Trent University, Canadian Environmental Modelling Centre. (disponible en anglais seulement)
Tenneco Chemical Inc. 1977a. Activity of trichloropropylene phosphate in the Salmonella/microsomal assay for bacterial mutagenicity (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Tenneco Chemicals Inc. 1977b. Activity of TCPP in a test for differential inhibition of repair deficient and repair competent strains of Escherichia coli: Repair test (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Thorp JM, Norton PA, Lewis Wall L, Kuller JA, Eucker B, Wells E. 1999. Urinary incontinence in pregnancy and the puerperium: A prospective study. Am J Obstet Gynecol 181:266–273. (disponible en anglais seulement)
TNO Quality of Life. 2005. In vitro percutaneous absorption of [14C]tris(2-chloro-1-methylethyl)phosphate (TCPP) through human skin membranes using flow-through diffusion cells (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
TNO Quality of Life. 2006a. In vitro percutaneous absorption of neat [1,3-14C]TDCP (Tris (1,3-chloro-2-propyl) phosphate) through human skin membranes using flow-through diffusion cells. Unpublished report [cité dans EURAR, 2008b]. (disponible en anglais seulement)
TNO Quality of Life. 2006b. In vitro percutaneous absorption of neat [14C]TCPP (Tris(2-chloro-1-methylethyl)phosphate) through human skin membranes using flow-through diffusion cells (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
TNO Quality of Life. 2007. Oral two-generation reproduction toxicity study (including a dose range finding study) with Tris(2-chloro-1-methylethyl) -phosphate in rats (rapport inédit). [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Truong JW. 2016. Organophosphate Esters (OPEs) as Emerging Contaminants in the Environment: Indoor Sources and Transport to Receiving Waters. A thesis submitted in conformity with the requirements for the degree of Masters of Applied Science, Department of Chemical Engineering and Applied Chemistry University of Toronto. (disponible en anglais seulement)
Truong JW, Diamond ML, Helm PA, Jantunen LM. 2017. Isomers of tris(chloropropyl) phosphate (TCPP) in technical mixtures and environmental samples. Anal Bioanal Chem 409:6989-6997. (disponible en anglais seulement)
UNEP. 1999. United Nations Environmental Program. OECD Screening Information Data Sets (SIDS). SIDS Initial Assessment Profile. CAS RN 13674-84-5. UNEP Publications. (disponible en anglais seulement)
Union européenne. 1998-2017. Règlement (UE) nº 618/2012 de la Commission du 10 juillet 2012 modifiant, aux fins de son adaptation au progrès technique et scientifique, le règlement (CE) nº 1272/2008 du Parlement européen et du Conseil relatif à la classification, à l'étiquetage et à l'emballage des substances et des mélanges, Luxembourg, Office des publications officielles des Communautés européennes. [consulté le 26 octobre 2017].
[US California EPA] California Environmental Protection Agency. 2011. Evidence on the carcinogenicity of tris(1,3-dichloro-2-propyl)phosphate [PDF]. Office of Environmental Health Hazard Assessment, Reproductive and Cancer Hazard Assessment Branch. (disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission. 1998. Post-hearing comments of the Upholstered Furniture Action Council on the toxicity of flame retardants chemical treatments for upholstery fabrics [PDF]. Washington (DC). (disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission. 2005a. Analysis of FR Chemicals Added to Foams, Fabrics, Batting, Loose Fill, and Barriers [PDF]. Washington (DC): Directorate for Laboratory Sciences, US CPSC. (uff6) (disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission, 2005b. Migration of Flame Retardant Chemicals in Upholstered Furniture Foam [PDF]. Washington (DC): Division of Chemistry, US CPSC. (uhff2) (disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission. 2006a. CPSC Staff Preliminary risk assessment of flame retardant chemicals in upholstered furniture foam [PDF]. Washington (DC): Directorate for Health Sciences, US CPSC. (disponible en anglais seulement)
[US CPSC] US Consumer Product Safety Commission. 2006b. Quantitative assessment of potential health effects from the use of fire retardant (FR) chemicals in mattresses [PDF]. Washington (DC): Directorate for Health Sciences, US CPSC. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2003. Exposure and human health reassessment of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds [PDF], Part I: Estimating exposure to dioxin-like compounds, Volume 3: Site-specific assessment procedures, Chapter 4: Estimating exposure media concentrations,” EPA/600/P-00/001Cb, U.S. Environmental Protection Agency, National Center for Environmental Assessment, Washington, DC, December 2003. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2008. High Production Volume Information System (HPVIS): Unpublished study obtained from US EPA HPV Challenge Program. Neurotoxicity studies on CAS No. 13674-87-8. [consulté le 17 juin 2014]. (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook 2011. National Center for Environmental Assessment. Office of Research and Development. U.S. Environmental Protection Agency, Washington, DC 20460. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2012a. Chemical Data Access Tool (CDAT). (disponible en anglais seulement)
[US EPA] U.S. Environmental Protection Agency. 2012b. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. Office of Chemical Safety and Pollution Prevention, Washington (DC). (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2014. Benchmark dose software (BMDS). [consulté le 20 février 2014]. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2015. Information on the various types of spray polyurethane foam products [PDF]. United States Environmental Protection Agency. [consulté le 22 janvier 2015]. (disponible en anglais seulement)
Ulsamer AG, Osterberg RE, McLaughlin J. 1980. Flame-retardant chemicals in textiles. Clin Toxicol 17(1):101–131. (disponible en anglais seulement)
Van den Eede N, Dirtu A, Neels H, Covaci A. 2011. Analytical developments and preliminary assessment of human exposure to organophosphate flame retardants from indoor dust. Environ Int 37:454–461. (disponible en anglais seulement)
Van den Eede N, Dirtu A, Ali N, Neels H, Covaci A. 2012. Multi-residue method for the determination of brominated and organophosphate flame retardants in indoor dust. Talanta 89:292–300. (disponible en anglais seulement)
Van den Eede N, Maho W, Erratico C, Neels H, Covaci A. 2013. First insights in the metabolism of phosphate flame retardants and plasticizers using human liver fractions. Toxicol Lett 223(1):9–15. (disponible en anglais seulement)
Van den Eede N, Heffernan AL, Alyward LL, Hobson P, Neels H, Mueller JF, Covaci A. 2015a. Age as a determinant of phosphate flame retardant exposure of the Australian population and identification of novel urinary PFR metabolites. Environ Int 74:1-8. (disponible en anglais seulement)
Van den Eede N, De Meester I, Maho W, Neels H, Covaci A. 2015b. Biotransformation of three phosphate flame retardants and plasticizers in primary human hepatocytes: untargeted metabolite screening and quantitative assessment. J Appl Toxicol 36 :1401-1408. (disponible en anglais seulement)
Van den Eede N, Tomy G, Tao F, Halldorson T, Harrad S, Neels H, Covaci A. 2016. Kinetics of tris (1-chloro-2-propyl) phosphate (TCPP) metabolism in human liver microsomes and serum. Chemosphere 144:1299-1305. (disponible en anglais seulement)
Van der Veen I, de Boer J. 2012. Phosphorus flame retardants: properties, production, environmental occurrence, toxicity and analysis. Chemosphere 88:1119–1153. (disponible en anglais seulement)
van Ginkel CG. 2005. Attempt to demonstrate anaerobic biodegradation of TDCP. Memorandum summarising the test. Reference number CER M05044, Akzo Nobel Research and Technology Chemicals, 28th November 2005. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Van Haarst EP, Heldeweg EA, Newling DW, Schlatmann TJ. 2004. The 24-h frequency-volume chart in adults reporting no voiding complaints: defining reference vales and analysing variables. BJU Int 93:1257–1261. (disponible en anglais seulement)
Venier M, Dove A, Romanak K, Backus S, Hites R. 2014. Flame retardants and legacy chemicals in Great Lakes’ water. Environ Sci Technol 48: 9563–9572. (disponible en anglais seulement)
Versar Inc. 1986. Standard Scenarios for Estimating Exposure to Chemical Substances During Use of Consumer Products. Prepared for the U.S. Environmental Protection Agency, Office of Toxic Substances, Washington, D.C. (disponible en anglais seulement)
Vykoukalová M, Venier M, Vojta Š, Melymuk L, Bečanová J, Romanak K, Prokeš R, Okeme JO, Saini A, Diamond ML, Klánová J. 2017. Organophosphate esters flame retardants in the indoor environment. Environ Int 106: 97-104. (disponible en anglais seulement)
Wang Q, Liang K, Liu J, Yang L, Guo Y, Liu C, Zhou B. 2013. Exposure of zebrafish embryos/larvae to TDCPP alters concentrations of thyroid hormones and transcriptions of genes involved in the hypothalamic–pituitary–thyroid axis. Aquat Toxicol 126: 207–213. (disponible en anglais seulement)
Wang Q, Lai NL-S, Wang X, Guo Y, Lam PK-S, Lam JW-H, Zhou B. 2015a. Bioconcentration and transfer of the organophorous flame retardant 1,3-dichloro-2-propyl phosphate causes thyroid endocrine disruption and developmental neurotoxicity in zebrafish larvae. Environ Sci Technol 49: 5123-5132. (disponible en anglais seulement)
Wang Q, Lam JCW, Han J, Wang X, Guo Y, Lam PKS, Zhou B. 2015b. Developmental exposure to the organophosphorus flame retardant tris(1,3-dichloro-2-propyl) phosphate: Estrogenic activity, endocrine disruption and reproductive effects on zebrafish. Aquat toxicol 160: 163-171. (disponible en anglais seulement)
Wang Q, Lam JW-H, Man Y-C, Lai NL-S, Kwok KY, Guo Y, Lam PK-S, Zhou B. 2015c. Bioconcentration, metabolism and neurotoxicity of theorganophorous flame retardant 1,3-dichloro 2-propyl phosphate(TDCPP) to zebrafish. Aquat Toxicol 158: 108-115. (disponible en anglais seulement)
Webster T. Watkins D, Walker C. Fraser A, Heiger-Bernays W, Stapleton H, McClean M. 2010. PentaBDE alternatives in homes, offices and cars. Dioxin 2010: 30th International Symposium on Halogenated Persistent Organic Pollutants (San Antonio, Texas , du 12 au 17 septembre 2010). (disponible en anglais seulement)
Weiner ML and Jortner BS. 1999. Organophosphate-induced delayed neurotoxicity of triarylphosphates. Neurotoxicology 20(4):653–673. (disponible en anglais seulement)
Wildlife International. 2005a. TDCP aerobic transformation in soil. Project No.: 497E-106. Wildlife International, Ltd., 8589 Commerce Drive, Easton, Maryland 21601. (disponible en anglais seulement)
Wildlife International. 2005b. TCPP: A 72-hour toxicity test with the freshwater alga (Pseudokirchneriella subcapitata). Project number: 583A-101. Wildlife International, Ltd., 8589 Commerce Drive, Easton, Maryland 21601. (disponible en anglais seulement)
Wildlife International. 2005c. TDCP: A 72-hour toxicity test with the freshwater alga (Pseudokirchneriella subcapitata). Project number: 583A-102. Wildlife International, Ltd., 8589 Commerce Drive, Easton, Maryland 21601. (disponible en anglais seulement)
Wildlife International. 2006a. Tris[2-chloro-1-chloromethyl)ethyl]-phosphate (TDCP): Adsorption/desorption characteristics in representative soils, sediment, and sludge solids in accordance with OECD Guideline for Testing of Chemicals, 106: Adsorption – Desorption Using a Batch Equilibrium Method. Wildlife International, Ltd. project no.: 584E-101. Draft report 2nd June 2006. [cité dans EURAR, 2006b]. (disponible en anglais seulement)
Wildlife International. 2006b. TDCP: A 28-day sediment toxicity test with Chironomus riparius using spiked sediment. Project number: 583A-104. (disponible en anglais seulement)
Wildlife International. 2006c. TDCP: A Prolonged Sediment Toxicity Test with Hyalella azteca Using Spiked Sediment. Project Number: 583A-105. Wildlife International, Ltd., Easton, Maryland 21601. (disponible en anglais seulement)
Wildlife International. 2006d. Tris[2-chloro-1-(chloromethyl)ethyl]-phosphate (TDCP): A Prolonged Sediment Toxicity Test with Lumbriculus variegatus using Spiked Sediment. Final Report Project Number: 583A-106. Wildlife International, Ltd., Easton, Maryland 21601, U.S.A. [cité dans EURAR, 2008b]. (disponible en anglais seulement)
Williams GM, Mori H, McQueen CA. 1989. Structure-activity relationships in the rat hepatocyte DNA-repair test for 300 chemicals. Mutat Res 221:263–286. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Hum Ecol Risk Assess 19(1): 158–188. (disponible en anglais seulement)
Wu AHB. 2006. Tietz clinical guide to laboratory tests. 4th ed. St. Louis (MO): Saunders Elsevier. p. 1102–1104. (disponible en anglais seulement)
Yang F, Ding J, Huang W, Xie W, Liu W. 2014. Particle size-specific distributions and preliminary exposure assessments of organophosphate flame retardants in office air particulate matter. Environ Sci Technol 48(1):63–70. (disponible en anglais seulement)
Yang C, Harris SA, Jantunen LM, Sidiqque S, Kubwabo C, Tsirlin D, Latifovic L, Fraser B, St-Jean M, De La Campa R, You H, Kulka R, Diamond ML. 2018. Are Cell Phones an Indicator of Personal Exposure to Organophosphate Flame Retardants and Plasticizers? Environ Int 122: 104-116. (disponible en anglais seulement)
Yoon Y, Ryu J, Oh J, Choi B-G, Snyder S. 2010. Occurrence of endocrine disrupting compounds, pharmaceuticals and personal products in the Han River (Seoul, South Korea). Sci Total Environ 408:636–643. (disponible en anglais seulement)
Yu L, Jia Y, Su G, Sun Y, Letcher RJ, Giesy JP, Yu H, Han Z, Liu C. 2017. Parental transfer of tris(1,3-dichloro-2-propyl) phosphate and transgenerational inhibition of growth of zebrafish exposed to environmentally relevant concentrations. Environ Pollut 220: 196-203. (disponible en anglais seulement)
Zeiger E, Anderson B, Haworth S, Lawlor T, Mortelmans K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ Mol Mutagen 19 (supplement 21):2-141. [cité dans EURAR, 2008a]. (disponible en anglais seulement)
Zhu Y, Ma X, Su G, Yu L, Letcher RJ, Hou J, Yu H, Giesy GP, Liu C. 2015. Environmentally Relevant Concentrations of the Flame Retardant Tris(1,3-dichloro-2-propyl) Phosphate Inhibit Growth of Female Zebrafish and Decrease Fecundity. Environ Sci Technol 49: 14579-14587. (disponible en anglais seulement)
Annexes
Annexe A : Renseignements sur la surveillance de l’environnement pour le milieu atmosphérique intérieur
Les renseignements sur la surveillance de l’environnement pour le TCPP et le TDCPP relatifs au milieu atmosphérique (air intérieur et poussière) sont repris dans les tableaux suivants, tandis que les renseignements liés aux autres milieux sont présentés dans le document à l’appui (ECCC, 2019).
A1. Renseignements sur la surveillance de l’environnement pour la poussière au Canada
| Emplacement | Type d’échantillona |
Année d’échantillonnage |
Taille d’échantillon |
Médiane [fourchette] (mg/kg) | P95 (mg/kg) |
Référence |
|---|---|---|---|---|---|---|
Canada |
Aspirateur domestique |
2007 à 2010 |
134 |
1,1 |
9,6 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Canada |
Frais |
2007 à 2010 |
134 |
1,4 |
13 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Canada |
NS |
2007 à 2010 |
818 |
1,62 |
18,2 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Toronto, ON, Canada |
Frais |
2013 |
23 |
1 470 [0,270 à 39,3] | NS |
Vykoukalová et al., 2017 |
Région du Grand Toronto et Ottawa, ON, Canada |
NS |
2015 |
51 (chambres) | 0,934 (moyenne géométrique) [0,00375 à 299] | 9,42 |
Yang et al., 2019 |
Région du Grand Toronto et Ottawa, ON, Canada |
NS |
2015 |
26 (pièces les plus utilisées) | 1,33 (moyenne géométrique) [0,268 à 161] | 10,84 |
Yang et al., 2019 |
Abréviations : P95 = 95e centile; NS = non spécifié
a Les échantillons frais sont des échantillons de poussière fraîche collectés par des techniciens formés dans des locaux d’habitation au moyen d’un échantillonneur par aspiration; la poussière domestique qui s’est accumulée depuis un certain temps dans des espaces où l’on ne passe pas régulièrement l’aspirateur n’est pas incluse. Les échantillons issus d’aspirateurs domestiques désignent les échantillons obtenus des systèmes d’aspiration utilisés par les participants à l’étude.
Emplacement |
Type d’échantillona |
Année d’échantillonnage |
Taille d’échantillon |
Médiane [fourchette] (mg/kg) | P95 (mg/kg) |
Référence |
|---|---|---|---|---|---|---|
Toronto, ON, Canada (TI) |
Aspirateur domestique |
2010 (automne) et 2011 (été) |
28 |
0,32 (moyenne) |
0,89 |
Diamond et al., 2013 |
Toronto, ON, Canada |
Aspirateur domestique |
2012 |
20 |
2,5 (moyenne) |
46 (max) |
Diamond et al., 2013 |
Canada |
Aspirateur domestique |
2007 à 2010 |
134 |
2,0 |
12 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Canada |
Frais |
2007 à 2010 |
134 |
2,7 |
9 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Canada |
NS |
2007 à 2010 |
818 |
3,08 |
12,7 |
Communication personnelle du Bureau de la science et de la recherche en santé environnementale, Santé Canada Août 2014 |
Toronto, ON, Canada |
Frais |
2012 |
35 maisons |
3 463 (moyenne) [non détecté à 46] | NS |
Abbasi et al., 2016 |
Toronto, ON, Canada |
Frais |
2012 |
10 bureaux |
[non détecté à 190] |
NS |
Abbasi et al., 2016 |
Toronto |
Frais |
2013 |
23 |
0,917 [0,206 à 9,53] | NS |
Vykoukalová et al., 2017 |
Région du Grand Toronto et Ottawa, ON, Canada |
NS |
2015 |
51 (chambres) | 1,54 (moyenne géométrique) [0,430 à 9,28] | 6,76 |
Yang et al., 2019 |
Région du Grand Toronto et Ottawa, ON, Canada |
NS |
2015 |
26 (pièces les plus utilisées) | 2,05 (moyenne géométrique) [0,337 à 130] | 12,8 |
Yang et al., 2019 |
Abréviations : P95 = 95e centile; ON = Ontario; NS = non spécifié; TI = Étude pilote poussée de Toronto
a Les échantillons frais sont des échantillons de poussière fraîche collectés par des techniciens formés dans des locaux d’habitation au moyen d’un échantillonneur par aspiration; la poussière domestique qui s’est accumulée depuis un certain temps dans des espaces où l’on ne passe pas régulièrement l’aspirateur n’est pas incluse. Les échantillons issus d’aspirateurs domestiques désignent les échantillons obtenus des systèmes d’aspiration utilisés par les participants à l’étude.
A2. Renseignements sur la surveillance de l’environnement pour le milieu atmosphérique dans d’autres territoires
| Emplacement (année d’échantillonnage) | Espace |
Taille d’échan-tillon |
Concentration de TCPP (pg/m3) | Concentration de TDCPP (pg/m3) |
Référence |
|---|---|---|---|---|---|
Zone urbaine, Suède (NS) |
Maison |
2 |
[38 000 – 210 000] |
< 500 |
Marklund et al., 2005b |
Stockholm, Suède (NS) |
Maison |
10 |
[7 000 – 160 000] |
< LD (1 ng/m3) |
Staaf et Otsman, 2005 |
Stockholm, Suède (2009) |
Maison |
10 |
15 000 [2 400 – 64 000] |
3 100 [ND – 17 000] |
Bergh et al., 2011 |
Zone urbaine, Suède (NS) |
Bureau |
7 |
[10 000 – 160 000] |
[200 – 150 000] |
Marklund et al., 2005b |
Stockholm, Suède (NS) |
Bureau |
3 |
[41 000 – 120 000] |
NM |
Staaf et Otsman, 2005 |
Norvège (2007) |
Bureau |
2 |
[10 000 – 21 000] |
[< 40 – 7 100] |
Green et al., 2008 |
Stockholm, Suède (2009) |
Bureau |
10 |
110 000 [16 000 – 240 000] |
24 000 [NS – 73 000] |
Bergh et al., 2011 |
Zurich, Suisse (NS) |
Bureau |
3 |
[ND – 130 000] |
ND |
Hartmann et al., 2004 |
Stockholm, Suède (NS) |
Véhicule public ou personnel |
4 |
[5 000 – 2 300 000] |
NM |
Staaf et Otsman, 2005 |
Zurich, Suisse (NS) |
Véhicule personnel |
4 |
[ND – 260 000] |
ND |
Hartmann et al., 2004 |
Abréviations : NM = non mesuré; NS = non spécifié; ND = non détecté; LD = limite de détection
Emplacement |
Type d’échantillon |
Année(s) d’échantillonnage |
Taille d’échantillon |
Médiane [fourchette] (mg/kg) | P95 (mg/kg) |
Référence |
|---|---|---|---|---|---|---|
États-Unis |
Surfaces des aires de vie |
2006 |
16 |
2,1 |
120 (max) |
Dodson et al., 2012 |
États-Unis |
Surfaces des aires de vie |
2011 |
16 |
2,2 (max) |
2,2 |
Dodson et al., 2012 |
États-Unis |
NS |
2002 à 2007 |
50 |
1,04 |
5,49 |
Stapleton et al., 2009 |
Allemagne |
Aspirateur domestique |
2010 |
6 |
0,74 (moyenne) |
0,96 (max) |
Brommer et al., 2012 |
Allemagne |
Voiture |
2010 et 2011 |
12 |
3,1 [1,4 – 4,3] |
NS |
Brommer et al., 2012 |
Allemagne |
Maison |
2010 et 2011 |
6 |
0,74 [0,37 – 0,96] |
NS |
Brommer et al., 2012 |
Allemagne |
Bureau |
2010 et 2011 |
10 |
3 [0,18 – 9,4] |
NS |
Brommer et al., 2012 |
Roumanie |
NS |
2010 |
47 |
0,86 (max) |
3,72 (% au 75e centile) |
Dirtu et al., 2012 |
Belgique |
NS |
2006 à 2010 |
41 |
[0,45 – 1,38] |
14,5 |
Van den Eede et al., 2012 |
Espagne |
NS |
2006 |
1 |
0,185 |
0,185 |
Van den Eede et al., 2012 |
Stockholm, Suède |
NS |
2009 |
10 |
3,1 [0,7 – 11] |
NS |
Bergh et al., 2011 |
Pays-Bas |
Près de produits électroniques |
NS |
8 |
1,3 [0,48 – 3,8] |
NS |
Brandsma et al., 2014 |
Pays-Bas |
Sur des produits électroniques |
NS |
8 |
1,3 [0,58 – 4,5] |
NS |
Brandsma et al., 2014 |
Nouvelle-Zélande |
Mesures au sol |
2008 |
38 |
0,35 [0,02 – 7,6] |
2,93 |
Ali et al., 2012 |
Nouvelle-Zélande |
Mesures dans les matelas |
2008 |
16 |
0,250 [0,133 – 1,92] |
1,34 |
Ali et al., 2012 |
Pakistan |
NS |
2011 |
15 |
< 0,020 |
0,085 |
Ali et al., 2013 |
Koweït |
NS |
2011 |
15 |
1,46 (max) |
7,06 |
Ali et al., 2013 |
Koweït |
Poussière domestique |
2011 |
15 |
1,46 [0,12 – 7 065] |
NS |
Ali et al., 2013 |
Koweït |
Voiture |
2011 |
15 |
30,73 [2,49 – 134] |
NS |
Ali et al., 2013 |
Pakistan |
Poussière domestique |
2011 |
15 |
< 0,02 [< 0,02 – 0,085] |
NS |
Ali et al., 2013 |
Pakistan |
Voiture |
2011 |
15 |
0,1 [< 0,02 – 2 615] |
NS |
Ali et al., 2013 |
Abréviations : P95 = 95e centile; NS = non spécifié
Emplacement |
Type d’échantillon |
Année(s) d’échan-tillonnage |
Taille d’échantillon |
Médiane [fourchette] (mg/kg) | P95 (mg/kg) |
Référence |
|---|---|---|---|---|---|---|
É.-U. |
Établissement préscolaire, aspirateur |
2010 et 2011 |
49 |
2,26 [0,76 – 70,9] |
36,9 |
Bradman et al., 2012 |
É.-U. |
Surfaces des aires de vie |
2006 |
16 |
2,8 (max) |
24 |
Dodson et al., 2012 |
É.-U. |
Surfaces des aires de vie |
2011 |
16 |
2,1 |
2,1 |
Dodson et al., 2012 |
É.-U. |
NS |
2002 à 2007 |
50 |
1,88 (max) |
56,1 |
Stapleton et al., 2009 |
É.-U. |
NS |
2009 |
30 |
6,3 (moyenne) |
NS |
Webster et al., 2010 |
Allemagne |
Aspirateur |
2010 |
6 |
< 0,08 (moyenne) |
0,11 |
Brommer et al., 2012 |
Allemagne |
Voiture |
2010 et 2011 |
12 |
130 [< 0,08 – 620] |
NS |
Brommer et al., 2012 |
Allemagne |
Maison |
2010 et 2011 |
6 |
< 0,08 [< 0,08 – 0,11] |
NS |
Brommer et al., 2012 |
Allemagne |
Bureau |
2010 et 2011 |
10 |
0,15 [< 0,08 – 0,29] |
NS |
Brommer et al., 2012 |
Roumanie |
NS |
2010 |
47 |
0,060 |
0,13 (% au 75e centile) |
Dirtu et al., 2012 |
Belgique |
NS |
2006 à 2010 |
41 |
[0,162 – 0,36] |
0,99 |
Van den Eede et al., 2012 |
Espagne |
NS |
2006 |
1 |
0,124 |
0,124 |
Van den Eede et al., 2012 |
Stockholm, Suède |
NS |
2009 |
10 |
12 [2,2 – 27] |
NS |
Bergh et al., 2011 |
Pays-Bas |
Près de produits électroniques |
NS |
8 |
0,28 [0,07 – 3,2] |
NS |
Brandsma et al., 2014 |
Pays-Bas |
Sur des produits électroniques |
NS |
8 |
0,68 [0,1 – 7,4] |
NS |
Brandsma et al., 2014 |
Nouvelle-Zélande |
Mesures au sol |
2008 |
38 |
0,23 [0,02 – 1,7] |
1,89 |
Ali et al., 2012 |
Nouvelle-Zélande |
Mesures dans les matelas |
2008 |
16 |
0,103 [0,02 – 6,5] |
0,303 |
Ali et al., 2012 |
Pakistan |
NS |
2011 |
15 |
< 0,005 |
0,25 |
Ali et al., 2013 |
Koweït |
NS |
2011 |
15 |
0,36 |
1,56 |
Ali et al., 2013 |
Koweït |
Poussière domestique |
2011 |
15 |
0,36 [0,06 – 1,56] |
NS |
Ali et al., 2013 |
Koweït |
Voiture |
2011 |
15 |
7,63 [0,6 – 166] |
NS |
Ali et al., 2013 |
Pakistan |
Poussière domestique |
2011 |
15 |
< 0,005 [< 0,005 – 0,255] |
NS |
Ali et al., 2013 |
Pakistan |
Voiture |
2011 |
15 |
0,029 [< 0,005 – 1,24] |
NS |
Ali et al., 2013 |
Annexe B : Poids de la preuve de l’évaluation du risque écologique
Preuve |
Niveau de confiancea |
Pertinence pour l’évaluationb |
Pondération attribuéec |
|---|---|---|---|
Propriétés physiques et chimiques |
élevé |
élevée |
modérée à élevée |
Devenir et comportement dans l’environnement |
élevé |
élevée |
élevée |
Persistance dans l’environnement |
élevé |
élevée |
élevée |
Transport sur de grandes distances |
élevé |
élevée |
élevée |
Bioaccumulation dans les organismes aquatiques |
élevé |
modérée |
élevée |
Diminution potentielle de la quantité d’importation |
modéré |
modérée |
modérée |
Données sur les concentrations dans l’environnement |
modéré |
élevée |
modérée à élevée |
Concentration estimée de TCPP et de TDCPP dans l’environnement aquatique selon des scénarios de rejets causés par des activités industrielles et l’utilisation de produits de consommation |
modéré |
élevée |
modérée à élevée |
Concentration estimée de TCPP et de TDCPP dans les sédiments selon des scénarios de rejets causés par des activités industrielles et l’utilisation de produits de consommation |
faible |
élevée |
modérée |
Concentration estimée de TCPP et de TDCPP dans le sol selon des scénarios de rejets causés par des activités industrielles et l’utilisation de produits de consommation |
faible |
élevée |
modérée |
Analyse du quotient de risque pour le TCPP et le TDCPP dans l’eau |
élevé |
élevée |
élevée |
Analyse du quotient de risque pour le TDCPP dans les sédiments et le sol |
faible |
élevée |
modérée |
a Le niveau de confiance dépend de la qualité des données, de la variabilité des données et des lacunes dans les données (autrement dit, la mesure dans laquelle les données sont adaptées à l’objectif).
b La pertinence désigne l’incidence de la preuve dans l’évaluation.
c La pondération attribuée à chaque élément de preuve dépend de la pondération globale combinée du niveau de confiance et de la pertinence pour l’évaluation.
Annexe C : Valeurs estimatives de l’absorption quotidienne par divers groupes d’âge au sein de la population générale du Canada
Voie d’exposition |
De 0 à 6 moisa (allaite-ment)b | De 0 à 6 moisa (prépa-ration pour nourris-sons)c | De 0,5 à 4 ansd |
De 5 à 11 anse |
De 12 à 19 ansf |
De 20 à 59 ansg |
≥ 60 ansh |
|---|---|---|---|---|---|---|---|
Air ambianti |
5,3E-05 |
5,3E-05 |
1,1E-04 |
8,9E-05 |
5,1E-05 |
4,3E-05 |
3,8E-05 |
Air intérieurj |
1,0 |
1,0 |
2,2 |
1,7 |
9,8E-01 |
8,4E-01 |
7,3E-01 |
Eau potablek |
s.o. |
4,7E-01 |
2,0E-01 |
1,6E-01 |
8,9E-02 |
9,3E-02 |
9,8E-02 |
Alimentsl |
2,0E-01 |
ND |
6,8E-02 |
5,3E-02 |
2,9E-02 |
2,8E-02 |
1,9E-02 |
Poussièrem |
9,2E-02 |
9,2E-02 |
4,8E-02 |
1,8E-02 |
6,7E-04 |
6,4E-04 |
6,3E-04 |
Soln |
s.o. |
s.o. |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
Absorption totale |
1,3 |
1,6 |
2,5 |
1,9 |
1,1 |
9,6E-01 |
8,5E-01 |
Abréviations : s.o. = sans objet; ND = données non déterminées dans la littérature scientifique.
a On présume que le nourrisson pèse 7,5 kg, qu’il respire 2,1 m3 d’air par jour (Santé Canada, 1998) et qu’il ingère 38 mg de poussière et 0 mg de sol par jour (Wilson et al., 2013).
b Exclusivement en ce qui concerne les nourrissons allaités, on présume qu’ils consomment 0,742 L de lait maternel par jour (Santé Canada, 1998), et on présume que le lait maternel constitue la seule source alimentaire. La concentration du lait (maternel) entier de 1,99 µg/L se fondait sur une mesure signalée de TCPP de 57 ng/g lipides x 3,4 % (teneur lipidique du lait maternel) x 1,03 g/mL (densité du lait maternel) recensée dans 50 échantillons de lait maternel humain prélevés sur des sujets en Suède en 2006 (Sundkvist et al., 2010).
c Uniquement pour les nourrissons nourris à la préparation pour nourrissons, on présume qu’ils consomment 0,7 L d’eau par jour (Santé Canada, 1998); 50 % d’entre eux recevraient des aliments solides dès l’âge de 4 mois, et 90 %, dès l’âge de 6 mois (ministère de la Santé nationale, 1990).
d On présume que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boit 0,7 L d’eau par jour, qu’il consomme 54,7 g de poisson et 249,7 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’il ingère 41 mg de poussière et 14 mg de sol par jour (Wilson et al., 2013).
e On présume que l’enfant pèse 31 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boit 1,1 L d’eau par jour, qu’il consomme 89,8 g de poisson et 276 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’il ingère 31 mg de poussière et 21 mg de sol par jour (Wilson et al., 2013).
f On présume que la personne pèse 59,4 kg, qu’elle respire 15,8 m3 d’air par jour, qu’elle boit 1,2 L d’eau par jour, qu’elle consomme 97,3 g de poisson et 251,6 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,2 mg de poussière et 1,4 mg de sol par jour (Wilson et al., 2013).
g On présume que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boit 1,5 L d’eau par jour, qu’elle consomme 111,7 g de poisson et 281,2 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,6 mg de sol par jour (Wilson et al., 2013).
h On présume que la personne pèse 72,0 kg, qu’elle respire 14,3 m3 d’air par jour, qu’elle boit 1,6 L d’eau par jour, qu’elle consomme 72,9 g de poisson et 242,9 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,5 mg de sol par jour (Wilson et al., 2013).
i On a choisi la concentration la plus élevée, 1,52 ng/m3 à Toronto (Shoeib et al., 2014; Jantunen, 2014), pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant d’une exposition par l’air ambiant. On présume que les Canadiens passent trois heures par jour à l’extérieur (Santé Canada, 1998).
j On a choisi la concentration maximale dans l’air intérieur de 4190 ng/m3 dans les maisons à Toronto (Vykoukalová et al., 2017) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant d’une exposition par l’air ambiant. On présume que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada, 1998).
k On a choisi la concentration maximale de TCPP de 4 400 ng/L mesurée dans l’eau des cours d’eau urbains de Toronto (Truong et al., 2017) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par l’eau potable.
l On n’a recensé aucune donnée de surveillance des aliments du commerce au Canada; toutefois, des données environnementales sur les poissons, les mollusques et les crustacés étaient accessibles. On a choisi la concentration de TCPP de 15,6 µg/kg (en fonction d’une concentration maximale de TCPP signalée de 1 300 µg/kg lipides x 0,44 % teneur lipidique dans les moules) (n = 30) dans des moules recueillies en 2007 en Suède (Sundkvist et al., 2010) pour calculer les limites supérieures estimatives de l’exposition quotidienne au TCPP dans tous les produits alimentaires liés aux poissons du groupe des aliments aquacoles. On a choisi la concentration maximale dans les fruits ayant une peau (0,82 µg/kg) signalée dans les études sur le panier de provisions de l’EPA des États-Unis (ATSDR, 2012) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition au TCPP dans tous les aliments du groupe alimentaire des fruits et des produits à base de fruits. Les quantités d’aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada, 1998).
m Pour tous les groupes d’âge, on a choisi la concentration de TCPP au 95e centile (18,2 mg/kg) issue de l’étude de base canadienne (données préliminaires de l’Enquête sur la poussière domestique au Canada; Kubwabo et al., manuscrits en cours de rédaction, Bureau de la science et de la recherche en santé environnementale, Santé Canada; source non citée, 13 décembre 2013), mesurée dans diverses villes canadiennes, pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par la poussière.
n On n’a recensé aucune donnée de surveillance des sols en Amérique du Nord. On a choisi une concentration moyenne tirée d’une étude allemande sur les sols de 1,23 x 10-3 mg/kg pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par le sol.
Voie d’exposition |
De 0 à 6 moisa (allaite-ment)b | De 0 à 6 moisa (prépa-ration pour nourris-sons)c | De 0,5 à 4 ansd |
De 5 à 11 anse |
De 12 à 19 ansf |
De 20 à 59 ansg |
≥ 60 ansh |
|---|---|---|---|---|---|---|---|
Air ambianti |
4,2E-05 |
4,2E-05 |
9,1E-05 |
7,1E-05 |
4,0E-05 |
3,5E-05 |
3,0E-05 |
Air intérieurj |
1,4E-03 |
1,4E-03 |
2,9E-03 |
2,2E-03 |
1,3E-03 |
1,1E-03 |
9,6E-04 |
Eau potablek |
s.o. |
1,5E-01 |
6,5E-02 |
5,1E-02 |
2,9E-02 |
3,0E-02 |
3,2E-02 |
Alimentsl |
1,8E-02 |
ND |
2,9E-02 |
2,4E-02 |
1,3E-02 |
1,3E-02 |
8,2E-03 |
Poussièrem |
7,0E-01 |
7,0E-01 |
3,7E-01 |
1,4E-01 |
5,2E-03 |
4,9E-03 |
4,8E-03 |
Soln |
s.o. |
s.o. |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
Absorption totale |
7,2E-01 |
8,6E-01 |
4,6E-01 |
2,2E-01 |
4,9E-02 |
4,9E-02 |
4,6E-02 |
Abréviations : s.o. = sans objet; ND = données non déterminées dans la littérature scientifique.
a On présume que le nourrisson pèse 7,5 kg, qu’il respire 2,1 m3 d’air par jour (Santé Canada, 1998) et qu’il ingère 38 mg de poussière et 0 mg de sol par jour (Wilson et al., 2013).
b Exclusivement en ce qui concerne les nourrissons allaités, on présume qu’ils consomment 0,742 L de lait maternel par jour (Santé Canada, 1998), et on présume que le lait maternel constitue la seule source alimentaire. La concentration du lait (maternel) entier de 0,186 µg/L se fonde sur une mesure signalée de TCPP de 5,3 ng/g lipides x 3,4 % (teneur lipidique du lait maternel) x 1,03 g/mL (densité du lait maternel) recensée dans 90 échantillons de lait maternel humain prélevés sur des sujets en Suède en 2006 (Sundkvist et al., 2010).
c Exclusivement en ce qui concerne les bébés nourris à la préparation, on présume qu’ils consomment 0,8 L d’eau par jour (Santé Canada, 1998); il s’agit de l’eau utilisée pour reconstituer la préparation pour nourrissons. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boit 0,7 L d’eau par jour, qu’il consomme 54,7 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 41 mg de poussière et 14 mg de sol par jour (Wilson et al., 2013).
e On présume que l’enfant pèse 31 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boit 1,1 L d’eau par jour, qu’il consomme 89,8 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 31 mg de poussière et 21 mg de sol par jour (Wilson et al., 2013).
f On présume que la personne pèse 59,4 kg, qu’elle respire 15,8 m3 d’air par jour, qu’elle boit 1,2 L d’eau par jour, qu’elle consomme 97,3 g de poisson par jour (Santé Canada, 1998) et qu’elle ingère 2,2 mg de poussière et 1,4 mg de sol par jour (Wilson et al., 2013).
g On présume que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boit 1,5 L d’eau par jour, qu’elle consomme 111,7 g de poisson par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,6 mg de sol par jour (Wilson et al., 2013).
h On présume que la personne pèse 72 kg, qu’elle respire 14,3 m3 d’air par jour, qu’elle boit 1,6 L d’eau par jour, qu’elle consomme 72,9 g de poisson par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,5 mg de sol par jour (Wilson et al., 2013).
i On a utilisé la concentration la plus élevée dans l’air extérieur, de 1,21 ng/m3 à Toronto en Ontario (Shoeib et al., 2014), pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant d’une exposition par l’air ambiant. On présume que les Canadiens passent trois heures par jour à l’extérieur (Santé Canada, 1998).
j On a choisi une concentration de 17 ng/m3 dans l’air intérieur prélevée à Toronto (Bergh et al., 2011) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition à l’air ambiant. On présume que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada, 1998).
k On a choisi la concentration maximale de TDCPP (1 437 ng/L) mesurée dans l’eau des affluents des zones urbaines et rurales du lac Ontario (Jantunen et al., 2013b) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par l’eau potable.
l On n’a recensé aucune donnée de surveillance des aliments du commerce au Canada; toutefois, des données environnementales sur les poissons étaient accessibles en Europe. On a choisi la concentration de TDCPP pour le poisson entier de 8,1 µg/kg poids humide (en fonction d’une concentration maximale signalée de 192 µg/kg lipides x 5,73 % teneur lipidique) (n = 23) dans la morue franche, la morue polaire et l’omble chevalier recueillis en 2008 en Norvège (Evenset et al., 2009) pour calculer les limites supérieures estimatives de l’exposition quotidienne au TDCPP dans tous les produits alimentaires liés aux poissons du groupe des aliments aquacoles. Les quantités d’aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada, 1998).
m On a choisi la concentration maximale de TDCPP (139 mg/kg) indiquée dans l’étude de référence canadienne (données préliminaires de l’Enquête sur la poussière domestique au Canada, Kubwabo et al., manuscrits en cours de rédaction, Bureau de la science et de la recherche en santé environnementale, Santé Canada, source non citée, 13 décembre 2013), qui a été mesurée dans diverses villes canadiennes, pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition à la poussière.
n On n’a recensé aucune donnée de surveillance des sols en Amérique du Nord. On a choisi la limite de détection (LD) de 9 x 10-5 mg/kg tirée d’une étude allemande sur les sols pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par le sol. Cette limite supérieure est jugée prudente pour rendre compte des échantillons déclarés, qui présentent tous des valeurs inférieures à la LD.
Annexe D : Valeurs estimatives de l’exposition au TCPP et au TDCPP par contact avec des biens fabriqués
On a estimé, à partir des renseignements accessibles, l’absorption par exposition cutanée découlant du contact des nourrissons, des tout-petits et des adultes avec des matelas et des meubles contenant de la mousse. L’exposition cutanée des membres des autres groupes d’âge (c.-à-d. les enfants de 5 à 18 ans) se trouverait dans la fourchette couverte par ces populations. On a également estimé l’exposition orale des nourrissons et des tout-petits qui mâchonnent (suçotent) des biens fabriqués contenant de la mousse destinés à une utilisation par ou pour des enfants. Les tableaux D1 et D2 présentent les valeurs et les paramètres d’exposition, fondés sur des hypothèses prudentes, qui sont utilisés pour estimer les expositions.
Estimation de l’absorption par exposition cutanée
Absorption = [SC × FCP × FPT × M × DE × AC] / p.c.
Symbole |
Description |
Valeur |
|---|---|---|
SCa |
Surface de contact cutané |
545 - 1840 cm2 (nourrisson) 792 - 2890 cm2 (tout-petit) 2033 - 9100 cm2 (adulte) |
FCPb |
Facteur de contact avec la peau |
1 |
FPTc |
Facteur de pénétration textile |
0,1 (TCPP) |
Md
|
Vitesse de migration |
4,6 × 10-3 mg/cm2/h (TCPP) 5,6 × 10-5 mg/cm2/h (TDCPP) |
DEe |
Durée de l’exposition |
12 h/j (nourrisson) 12 h/j (tout-petit) 8 h/j (adulte) |
AC |
Absorption cutanée |
40 % (TCPP)f 30 % (TDCPP)g |
p.c.h |
Poids corporel |
7,5 kg (nourrisson) 15,5 kg (tout-petit) 70,9 kg (adulte) |
Absorption |
Absorption de TCPP (mg/kg p.c./j)
|
0,16 – 0,54 (nourrisson) 0,11 – 0,41 (tout-petit) 0,04 – 0,19 (adulte) |
Absorption |
Absorption de TDCPP (mg/kg p.c./j)
|
1,5 × 10-2 – 5,0 × 10-2 (nourrisson) 1,0 × 10-2 – 3,8 × 10-2 (tout-petit) 3,8 × 10-3 – 1,7 × 10-2 (adulte) |
a Dans ce scénario, on a utilisé une fourchette de surfaces de contact (SC) pour représenter le contact cutané avec un matelas. En ce qui concerne la plus petite SC de la fourchette, on présume qu’une personne porte un short et un t-shirt couvrant la moitié de ses membres. La surface de contact d’exposition est fondée sur l’exposition d’une partie de la moitié inférieure des membres (bras et jambes) et de l’arrière de la tête. On a multiplié les surfaces de contact des membres (Santé Canada, 1995) par une demie pour représenter la couverture par les vêtements, puis par un tiers, pour tenir compte de la forme triangulaire des membres, dont un seul côté est en contact direct avec le matelas (USCPSC, 2006a). On a multiplié la surface de contact de la tête (Santé Canada, 1995) par un facteur de 0,5 dans le but de représenter l’exposition de l’arrière de la tête seulement. En ce qui concerne la plus grande SC de la fourchette, on présume que la moitié du corps est en contact cutané avec le matelas (USEPA, 2012b).
b On n’a recensé dans la littérature scientifique aucun facteur de contact avec la peau (FCP), c.-à-d. la fraction de substance sur une surface qui adhère à la peau, particulier au TCPP ou au TDCPP. Par conséquent, on a choisi une valeur de 1, de façon à présumer que toute la quantité du produit chimique est susceptible d’être absorbée.
c On a appliqué un facteur de pénétration textile (FPT) au TCPP pour tenir compte du fait que la vitesse de migration du TCPP est déterminée à partir de mousse nue (EURAR, 2008a). Aucune donnée sur la pénétration textile propre au TCPP n’a été relevée dans la littérature scientifique. Par conséquent, on a attribué au FPT une valeur de 0,1 (Driver et al., 2007).
d Les vitesses de migration de 4,6 × 10-3 mg/cm2/h pour le TCPP (mousse nue) et de 5,6 × 10-5 mg/cm2/h pour le TDCPP (mousse recouverte) que l'on a utilisées afin d'estimer les expositions cutanées sont fondées sur les études de migration portant sur la mousse traitée garnissant les meubles menées respectivement par TNO Quality of Life (EURAR, 2008a) et la CPSC des États-Unis (USCPSC, 2005a). L’étude de TNO Quality of Life (2005) a consisté à mouiller des papiers filtres avec de la sueur artificielle et à les placer sur un bloc de mousse non recouverte contenant 10 % p/p de TCPP, puis à comprimer la mousse durant deux heures, ce qui a donné un taux de migration de 4,6 × 10-3 mg/cm2/h. L’étude de la CPSC des États-Unis a consisté à construire un siège miniature à partir d’un bloc de mousse recouvert d’un tissu de coton et de polyester, que l’on a fixé à du contreplaqué. On a imprégné le siège d’une solution saline, pour imiter la sueur, et on a appliqué une pression pour imiter l’action de s’allonger. On a déterminé un taux de migration de 5,6 × 10-5 mg/cm2/h pour le TDCPP selon la quantité maximale déclarée (8 µg) extraite quotidiennement du filtre (diamètre de 5,5 cm) au cours de la période d’essai de migration (6 heures) (USCPSC, 2005b).
e Le temps de sommeil étant plus long que celui que l’on passe assis, on a adapté les durées utilisées par la CPSC des États-Unis (2006a), qui correspondent aux moments de détente qu’une personne passe assise, afin d’obtenir la durée d’exposition pendant le sommeil. On a aussi tenu compte des durées d’exposition utilisées par d’autres administrations pour des scénarios d’exposition semblables (p. ex. la situation qui consiste à dormir sur un matelas ignifugé) (USCPSC, 2006b; ECHA, 2018).
f EURAR, 2008a.
g EURAR, 2008 b.
h Santé Canada, 1998.
Estimation de l’absorption découlant de l’exposition par voie orale
Absorptiona = [SC × M × DE] / p.c.
Symbole |
Description |
Valeur |
|---|---|---|
SCb |
Surface exposée au mâchonnement direct |
10 cm2 (nourrisson) 20 cm2 (tout-petit) |
Mc |
Vitesse de migration |
1,78 × 10-2 mg/cm2/h (TCPP) 2,97 × 10-3 mg/cm2/h (TDCPP) |
DEd |
Durée de l’exposition |
24,5 min/j |
p.c.e |
Poids corporel |
7,5 kg (nourrisson) 15,5 kg (tout-petit) |
Absorption |
Absorption de TCPP calculée en mg/kg p.c./j |
9,7 × 10-3 (nourrisson) 9,4 × 10-3 (tout-petit) |
Absorption |
Absorption de TDCPP calculée en mg/kg p.c./j |
1,6 × 10-3 (nourrisson) 1,6 × 10-3 (tout-petit) |
a On présume que le TCPP et le TDCPP sont entièrement absorbés en cas d’exposition par voie orale et que la présence d’un tissu sur un objet de mousse n’aurait aucun effet sur la migration (c.-à-d. que le facteur de pénétration textile, ou FPT, ne s’applique pas).
b La valeur déterminée de la surface exposée chez les nourrissons s’appuie sur de multiples sources (RIVM, 2008). Chez les tout-petits, elle est fondée sur un avis professionnel et correspond à deux fois la surface de l’ouverture de la bouche d’un tout-petit.
c On a utilisé des vitesses de migration de 1,78 × 10-2 mg/cm2/h pour le TCPP et de 2,97 × 10-3 mg/cm2/h pour le TDCPP afin d’estimer l’exposition orale. Pour déterminer les vitesses de migration du TCPP et du TDCPP qui se trouvent dans les produits infantiles (c.-à-d. les sièges de sécurité, les porte-bébés, les matelas pour lit de bébé), l’Environmental Protection Agency du Danemark (Danish EPA) a immergé des éléments en mousse issus de ces produits (une partie du tissu de recouvrement étant généralement incluse dans l’échantillon) dans une solution imitant la sueur et les y a laissés durant trois heures à 37 °C (Danish EPA, 2015). Les valeurs précises utilisées dans le présent document sont le résultat de la moyenne des vitesses de tous les échantillons pour chacun des produits ignifuges (ECHA, 2018). Ces vitesses de migration sont considérées comme étant plus représentatives de la migration en cas de mâchonnement que les vitesses issues des études de migration en surface utilisées pour l’estimation de l’exposition cutanée.
d Le temps que passent les enfants à mâchonner des produits en mousse comme les tapis de sieste, les sièges d’auto et les petits meubles est fondé sur la durée de mâchonnement des « autres objets » indiquée dans la publication de Norris et Smith, 2002 (citée dans USEPA, 2011).
e Santé Canada, 1998.
Annexe E : Estimation de l’exposition au TCPP à partir de produits de consommation
Exposition à partir de produits contenant du polyuréthane giclé
Le contact direct de la peau avec le polyuréthane giclé utilisé dans les isolants à pulvériser et les produits d’étanchéité peut entraîner une exposition cutanée au TCPP. Une exposition par inhalation peut aussi se produire pendant l’application du produit, le TCPP pouvant adhérer aux particules de poussière qui se trouvent dans l’air. Les produits utilisés à petite échelle (produits d’étanchéité) et à grande échelle (isolation) ont été pris en compte d’après la confirmation de leur utilisation au Canada (ECCC, 2013-2014). L’exposition d’un adulte utilisant des produits contenant du polyuréthane giclé ne devrait pas se produire souvent (environ tous les cinq ans, RIVM, 2007); par conséquent, on l’a estimée en fonction d’un événement ponctuel. Les valeurs d’exposition estimatives présentées ci-dessous sont fondées sur des hypothèses prudentes.
Absorption = [SC × EC × ρ × FP × AC] / p.c.
Symbole |
Description |
Valeur |
Référence |
|---|---|---|---|
SC |
Surface de contact avec le bout des doigts (cm2) |
10 |
Couche mince de Versar, scénario de l’application instantanée (Westat, 1987) |
EC |
Épaisseur de la couche d’huile sur la main (cm) |
1,59 × 10-2 |
Couche mince de Versar, scénario de l’application instantanée (Westat, 1987) |
r |
Densité du produit (g/cm3) |
0,027 |
Couche mince de Versar, scénario de l’application instantanée (Westat, 1987) |
FP |
Fraction de poids du TCPP |
30 % |
SDS, 2015a; SDS, 2015b; SDS, 2017 |
AC |
Absorption cutanée |
40 % |
EURAR, 2008a |
p.c. |
Poids corporel |
70,9 kg (adulte) |
Santé Canada, 1998 |
Absorption |
Absorption (µg/kg p.c./événement) |
6,8 |
- |
Absorption = SC × QP × FP × AC / p.c.
Symbole |
Description |
Valeur |
Référence |
|---|---|---|---|
SC |
Surface de contact du dos des mains et des avant-bras (cm2) |
2 185 |
Santé Canada, 1998 |
QP |
Quantité de produit sur la peau (g) |
0,25 |
RIVM, 2007 (mousses isolantes) |
FP |
Fraction de poids du TCPP |
0,45 |
SDS, 2015ca |
AC |
Absorption cutanée |
40 % |
EURAR, 2008a |
p.c. |
Poids corporel |
70,9 kg (adulte) |
Santé Canada, 1998 |
Absorption |
Absorption (µg/kg p.c./événement) |
635 |
- |
a Il est à noter que le document pourrait n’être accessible qu’aux professionnels; on l’a néanmoins sélectionné, car la concentration la plus élevée, considérée comme une approche prudente, s’y trouve.
Description |
Valeur |
Référence |
|---|---|---|
Volume de la pièce (m3) |
20 |
RIVM, 2014 (valeur par défaut pour une salle générique) |
Taux d’échange d’air (/h) |
0,6 |
RIVM, 2014 (valeur par défaut pour une salle générique) |
Durée d’exposition (min) |
30 |
RIVM, 2007 (mastic de jointoiement) |
Fraction de poids du TCPP |
30 % |
SDS, 2015a; SDS, 2015b; SDS, 2017 |
Quantité de produit (g) |
90a |
SDS, 2017; RIVM, 2007 |
Taux d’inhalation (m3/j) |
16,2 |
Santé Canada, 1998 |
Concentration moyenne par événement (µg/m3) |
180 |
Version Web du modèle ConsExpo, 2016 |
a La quantité de produit précédemment établie à 75 g (RIVM, 2007) a été adaptée de façon à tenir compte de produits offerts en plus grande quantité (p. ex. 12 oz pour le produit dont rend compte la source suivante : SDS, 2017).
Description |
Valeur |
Référence |
|---|---|---|
Fourchette de concentrations atmosphériques mesurées (µg/m3) |
477 à 2 940 |
ACC, 2012 |
Durée d’exposition (min) |
30 |
RIVM, 2007 (mousses isolantes) |
Poids corporel d’un adulte (kg) |
70,9 |
Santé Canada, 1998 |
Taux d’inhalation (m3/j) |
16,2 |
Santé Canada, 1998 |
Absorption (µg/kg p.c./événement) |
2,3 à 14 |
- |
Exposition découlant de la vaporisation d’un produit imperméabilisant
L’exposition d’un adulte utilisant des produits imperméabilisants à pulvériser ne devrait pas se produire souvent (environ une fois par an); par conséquent, on l’a estimée en fonction d’un événement ponctuel. Dans la mesure où un tel scénario se déroulerait à l’extérieur (SDS, 2014), donc en situation à taux d’échange d’air élevé, on présume que l’exposition par inhalation serait faible. Un contact cutané direct avec un produit imperméabilisant à pulvériser peut entraîner une exposition cutanée au TCPP. Les valeurs estimatives de l’absorption cutanée présentées ci-dessous sont fondées sur des hypothèses prudentes.
Absorption = [SC × QP × FP × AC] / p.c.
Symbole |
Description |
Valeur |
Référence |
|---|---|---|---|
SC |
Surface de contact du dos des mains (cm2) |
455 |
Santé Canada, 1998 |
QP |
Quantité de produit sur la peau (g) |
0,25 |
RIVM, 2012 |
FP |
Fraction de poids du TCPP |
0,13 |
SDS, 2014 |
AC |
Absorption cutanée |
40 % |
EURAR, 2008a |
p.c. |
Poids corporel |
70,9 kg (adulte) |
Santé Canada, 1998 |
Charge cutanée |
Charge cutanée (µg/kg p.c./événement) |
4,7 |
- |
Absorption |
Absorption (µg/kg p.c./événement) |
1,8 |
- |
Annexe F : Estimation d’absorption de TDCPP par la dosimétrie inversée sur les échantillons d’urine recueillis dans le cadre de la biosurveillance du BDCPP
La dosimétrie inversée a été utilisée pour estimer l’absorption quotidienne à partir des concentrations présentes dans l’urine des adultes, des femmes enceintes, des tout-petits (de 2 à 5 ans), des enfants (de 6 à 11 ans) et des adolescents (de 12 à 19 ans). Les concentrations urinaires issues de la littérature qui ont servi au calcul des degrés d’absorption sont présentées dans la section 8.1.3. Le tableau F1 présente les concentrations maximales ou au 95e centile pour chaque groupe d’âge. Tous les autres paramètres ont précédemment fait l’objet de discussions et sont également présentés ci-dessous. L’équation ci-dessous montre les absorptions quotidiennes calculées par dosimétrie inversée.
Absorption quotidienne = [[Urine] × Vurine ou TEC × RMM] / [p.c. × FEU]
Symbole |
Description |
Valeur |
|---|---|---|
[Urine]DU |
Concentration maximale du métabolite dans l’urine, corrigée en fonction de la densité urinaire (ng/mL) |
251 (tout-petits)a |
[Urine] |
Concentration maximale du métabolite dans l’urine, non corrigée (ng/mL) |
1,77 (femmes enceintes)b |
[Urine] |
Concentration du métabolite dans l’urine au 95e centile, non corrigée (ng/mL) |
4,32 (femmes préménopausées)c |
[Urine]CR |
Concentration du métabolite dans l’urine au 95e centile, corrigée en fonction de la créatinine (µg/g) |
14,8 (enfants)d 6,82 (adolescents)d 4,33 (adultes)d |
Vurine |
Volume quotidien total d’urine (L/j) |
2,7 (femmes enceintes)e 2,03 (femmes adultes)f 0,7 (tout-petits)g |
TECh |
Taux d’excrétion quotidienne de la créatinine (g Cr/j) |
0,65 (enfants) 1,4 (adolescents) 1,7 (adultes) |
p.c.i |
Poids corporel (kg) |
70,9 (adultes) 31,0 (enfants) 59,4 (adolescents) 15,5 (tout-petits) |
FEUj |
Fraction d’excrétion d’urine (fondée sur une étude toxicocinétique chez les rats) |
21 % (commune à tous les groupes d’âge) |
RMM |
Rapport de masse moléculaire entre le composé d’origine et le métabolite, c.-à-d., TCPP et BDCPP |
1,34 (commun à tous les groupes d’âge) |
Absorption |
Absorption (µg/kg p.c./j) |
0,43 (femmes enceintes) 0,79 (femmes préménopausées) 72,0 (tout-petits) 2,0 (enfants) 1,0 (adolescents) 0,66 (adultes) |
a Les tout-petits (n = 23) inclus dans cette étude provenaient du New Jersey (États-Unis), et ils étaient âgés de 1 à 5 ans (Butt et al., 2014).
b Les femmes enceintes (n = 24) qui ont participé à cette étude étaient de Hamilton, ON, Canada (Kosarac et al., 2016).
c Les femmes préménopausées (n = 44) qui ont participé à cette étude étaient de Toronto et d’Ottawa, ON, Canada (Yang et al., 2018).
d L’ensemble des 2 666 échantillons pour les enfants (n = 421), les adolescents (n = 427) et les adultes (n = 1818) proviennent de partout aux États-Unis et sont issus des données de l’étude NHANES 2013‑2014 (Ospina et al., 2018). Les données de l’étude NHANES sont considérées comme représentatives à l’échelle du pays.
e On a indiqué que les volumes interstitiels urinaires totaux quotidiens moyens variaient de 0,8 à 2,7 L/j chez les femmes enceintes (Davison et Nobel, 1981; Francis, 1960; Higby et al., 1994; Neithardt et al., 2002; Parboosingh et Doig, 1973; Thorp et al., 1999). Par prudence, on a choisi la valeur de 2,7 L/j comme limite supérieure pour la dosimétrie inversée.
f On a indiqué que les volumes interstitiels urinaires totaux quotidiens moyens variaient de 0,6 à 2,03 L/j chez les femmes adultes (Addis et Watanabe, 1961; Davison et Nobel, 1981; Francis, 1960; CIRP, 2003; Lakind et Naiman, 2008; Lentner, 1981; Parboosingh et Doig, 1973; Perucca et al., 2007; Revúsová, 1971; Wu, 2006). Par prudence, on a choisi la valeur de 2,03 L/j comme limite supérieure pour la dosimétrie inversée.
g On a indiqué que les volumes interstitiels urinaires totaux quotidiens moyens variaient de 0,45 à 0,7 L/j chez les tout-petits (3-5 ans) (CIRP, 2003; Lentner, 1981; Wu, 2006). Par prudence, on a choisi la valeur de 0,7 L/j comme limite supérieure pour la dosimétrie inversée.
h Valeurs maximales indiquées dans CIPR, 2003.
i Santé Canada, 1998.
j Valeur fondée sur des études toxicocinétiques menées sur des rats, qui montrent une récupération de la radioactivité du TDCPP, 24 heures après l’administration, d’environ 35 % dans l’urine (pourcentage estimé à partir d’une figure dans la source Minegishi et al., 1988); on a également observé une récupération du métabolite BDCPP dans l’urine de 60 % lorsque le TDCPP était administré par voie intraveineuse (Nomeir et al., 1981; Lynn et al., 1980, 1981). Afin d’obtenir la fraction d’excrétion urinaire, on a déterminé le pourcentage de BDCPP dans l’urine par rapport à la dose originale de TDCPP, à savoir : (0,35 mol de TDCPP total radiomarqué dans l’urine/mol de TDCPP administré radiomarqué) × (0,6 mol de BDCPP dans l’urine/mol de BDCPP total radiomarqué dans l’urine).
Annexe G : Résumé des effets sur la reproduction et le développement des animaux de laboratoire exposés au TCPP, au PTCE et au TDCPP
Des renseignements détaillés sur le TCPP et le TDCPP sont présentés dans d’autres sections du présent rapport d’évaluation préalable. Les renseignements sur le PTCE ont été obtenus grâce au rapport d’évaluation préalable pour le Défi sur le PTCE (Environnement Canada, Santé Canada, 2009).
TCPP
On a principalement observé des effets sur le cycle œstral et une diminution du poids de l’utérus chez les mères, ainsi qu’une diminution du poids des organes et du poids corporels à la fin des traitements chez les parents mâles. On n’a observé aucun autre effet sur la reproduction. Une forte augmentation du nombre d’avortons a été observée au sein des générations F1 et F2, sans autre anomalie.
PTCE
Une toxicité testiculaire a été observée chez les souris et les rats mâles dans un certain nombre d’études par voie orale et inhalation. Une diminution du nombre de petits vivants par portée et du nombre de portées a été observée chez les souris. Chez les souris femelles, aucun effet sur le cycle œstral ou la cyclicité n’a été constaté. Aucune toxicité pour le développement et aucune tératogénicité n’ont été observées à la suite de l’exposition de rates et de souris gravides au PTCE pendant la gestation.
TDCPP
On n’a observé aucun effet sur la reproduction des mâles chez les lapins. Il existe des lacunes dans les données sur le critère d’effet pour la santé reproductive des femelles, car aucune étude n’a été recensée. Aucun effet de toxicité pour le développement ou le développement neurologique n’a été observé chez les petits aux doses inférieures à celles auxquelles la toxicité maternelle a été observée chez les rates gravides exposées au TDCPP pendant la gestation.
D’après les études de toxicité chez l’animal, les effets de l’exposition au TCPP, au PTCE et au TDCPP sur la santé reproductive et le développement ne sont pas les mêmes.
Annexe H : Modélisation de la dose repère (BMD) et détermination d’un point de départ pour la caractérisation du risque de cancer concernant le TDCPP
Méthode générale
Le logiciel Benchmark Dose Software de l’Environmental Protection Agency des États-Unis (BMDS2.4) (USEPA, 2014) a été utilisé pour calculer la dose repère (BMD) et la limite inférieure de l’intervalle de confiance unilatéral de la dose repère (BMDL) à 95 % pour la caractérisation des risques de cancer associés à une exposition chronique au TDCPP. L’approche fondée sur la BMD, qui comprend une modélisation dose-effet, fournit une solution de rechange quantitative à l’évaluation dose-effet qui consiste à définir d’abord le point de départ, puis à extrapoler à partir de celui-ci pour obtenir des niveaux pertinents pour l’exposition humaine. On applique à l’analyse de la BMD et de la BMDL un type de modèle dichotomique restreint. On applique aux données dichotomiques une réponse de référence à laquelle est associé un risque 10 % supérieur à celui de la réponse historique, car cette valeur correspond à peu près à la limite de sensibilité observée dans la plupart des essais biologiques sur le cancer. Dans les études sur le cancer chez l’animal, la BMD10 se rapporte à une dose de substance qui produit une augmentation de 10 % du taux de réponse d’une tumeur par rapport au taux de réponse historique de ladite tumeur. La BMDL10 se rapporte à la limite inférieure de l’intervalle de confiance unilatéral de la dose repère (BMD10) à 95 %. La BMD10 et la BMDL10 sont calculées pour les ensembles de données associés à une tumeur qui proviennent de neuf modèles, et l’on choisit ensuite le modèle le plus adapté (consulter les précisions dans la section sur les modèles). Le paramètre de « réduction du coefficient de pente > = 1 » est appliqué. Ensuite, la plus faible des BMDL10 et des BMD10 associées à différents types de tumeurs est choisie comme valeur estimative prudente et raisonnable aux fins de la caractérisation ultérieure des risques. Concernant le calcul de la BMD et de la BMDL du TDCPP, neuf modèles ont été appliqués pour l’analyse de chacun des types de tumeurs (décrits au tableau H1) recensés dans l’étude de Stauffer Chemical Co. (1981a). Il s’agit des modèles Gamma, Logistic, LogLogistic, LogProbit, multistade, de cancérogénicité multistade, Probit, Weibull et Quantal-Linear (se reporter au tableau H2).
Choix du modèle
Le modèle qui convient le mieux a été choisi à partir des neuf modèles pour chaque type de tumeur, généralement d’après : la plus forte valeur p de la validité de l’ajustement; la plus faible valeur du critère d’information d’Akaike (CIA) (une mesure de la perte d’information en cas d’emploi d’un modèle dose-réponse qui peut servir à comparer différents modèles). Un ajustement était jugé adéquat d’après : la valeur p de la validité de l’ajustement; le résidu d’intérêt proportionné (SRI) se rapprochant le plus de la réponse de référence (10 % de risque supplémentaire); l’inspection visuelle de l’ajustement du modèle. On considère qu’une valeur p de validité d’ajustement > 0,1 et une valeur absolue de SRI (qui représente la réponse observée moins la réponse prévue, divisée par les erreurs types) < 2 constituent un ajustement acceptable. Si les modèles pour un type de tumeur donné n’étaient pas acceptés (p. ex. valeurs p < 0,1), alors les résultats provenant du groupe exposé à des doses élevées étaient omis et remodélisés.
Les résultats de l’estimation de la BMD10 et de la BMDL10 (mg/kg p.c./j) concernant les tumeurs provoquées par le TDCPP dans l’étude de Stauffer Chemical Co. (1981a) sont présentés dans le tableau H2.
Dose de traitement (mg/kg p.c./j) |
0 |
5 |
20 |
80 |
|---|---|---|---|---|
Adénome du cortex rénal, mâle |
1/45 |
3/49 |
9/48* |
32/46* |
Tumeur des cellules interstitielles des testicules, mâle |
7/43 |
8/48 |
23/47* |
36/45* |
Adénome hépatocellulaire, mâle |
2/45 |
7/48 |
1/48 |
13/46* |
Adénome du cortex rénal, femelle |
0/49 |
1/48 |
8/48* |
29/50* |
Adénome corticosurrénalien, femelle |
8/48 |
5/27 |
2/33 |
19/49* |
Adénome hépatocellulaire, femelle |
1/49 |
1/47 |
4/46 |
8/50* |
* La différence par rapport aux animaux témoins est statistiquement significative (p < 0,05).
| Tumeur | Modèle | Nbre de groupes | AIC | Valeur p | SRI | RR | BMD10 (mg/kg p.c./j) | BMDL10 (mg/kg p.c./j) |
|---|---|---|---|---|---|---|---|---|
| Adénome du cortex rénal, mâle | Multistade 2 | 4 | 141,65 | 0,98 | 0,019 | 0,1 | 12,24 | 6,84 |
| Tumeur des cellules interstitielles des testicules, mâle | LogProbit | 4 | 197,24 | 0,436 | -0,364 | 0,1 | 9,07 | 6,74 |
| Adénome hépatocel-lulaire, mâle | Multistade 3 | 4 | 131,24 | 0,037 | 0,048 | 0,1 | 59,64 | 33,87 |
| Adénome du cortex rénal, femelle | LogLogistic | 4 | 125,06 | 0,972 | 0,149 | 0,1 | 13,87 | 8,29 |
| Adénome corticosur-rénalien, femelle | Gamma | 4 | 156,47 | 0,289 | 0 | 0,1 | 66,45 | 27,89 |
| Adénome hépatocel-lulaire, femelle | LogLogistic | 4 | 95,21 | 0,724 | 0,66 | 0,1 | 47,95 | 26,52 |
Abréviations : AIC = critère d’information d’Akaike; RR = réponse de référence; p.c./j = poids corporel par jour; SRI = résidu d’intérêt proportionné
Annexe I : Calcul de la dose quotidienne moyenne pour la durée de vie (DQMDV)
Aux fins de l’estimation du risque de cancer associé à l’exposition au TDCPP, on a calculé une dose quotidienne moyenne pour la durée de vie (DQMDV) à partir des quantités qui se trouvent dans les milieux environnementaux et les aliments et de l’exposition aux meubles et aux matelas contenant de la mousse, selon l’équation suivante (Santé Canada, 2013) :
DQMDV = taux d’exposition x durée d’exposition / durée de vie
dans laquelle :
Taux d’exposition = absorption quotidienne en mg/kg p.c./j
Durée d’exposition = durée d’exposition au cours de l’étape de vie (en années)
Durée de vie = années dans une vie = 80 ans
Le tableau I-1 ci-après présente les absorptions quotidiennes estimatives associées aux milieux et aux aliments. Les valeurs inférieures et supérieures de l’exposition systémique estimative au TDCPP découlant de l’exposition cutanée aux meubles et aux matelas contenant de la mousse figurent dans le tableau Table I-2.
Voie d’expo-sition |
De 0 à 6 moisa (allai-tement)b | De 0 à 6 mois (prépa-ration pour nourris-sons)c | De 0,5 à 4 ansd |
De 5 à 11 anse |
De 12 à 19 ansf |
De 20 à 59 ansg |
60 ans et plush |
|---|---|---|---|---|---|---|---|
Air ambianti |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
Air intérieurj |
1,3E-04 |
1,3E-04 |
2,8E-04 |
2,2E-04 |
1,2E-04 |
1,1E-04 |
9,1E-05 |
Eau potablek |
s.o. |
1,4E-03 |
5,9E-04 |
4,6E-04 |
2,6E-04 |
2,8E-04 |
2,9E-04 |
Alimentsl |
1,5E-02 |
NI |
2,9E-02 |
2,4E-02 |
1,3E-02 |
1,3E-02 |
8,2E-03 |
Pous-sièrem |
1,6E-02 |
1,6E-02 |
8,2E-03 |
3,1E-03 |
1,1E-04 |
1,1E-04 |
1,1E-04 |
Soln |
s.o. |
s.o. |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
< 0,000 1 |
Absorp-tion totale |
3,1E-02 |
1,7E-02 |
3,8E-02 |
2,7E-02 |
1,4E-02 |
1,3E-02 |
8,7E-03 |
Abréviations : s.o. = sans objet; ND = données non déterminées dans la littérature scientifique.
a On présume que le nourrisson pèse 7,5 kg, qu’il respire 2,1 m3 d’air par jour (Santé Canada, 1998) et qu’il ingère 38 mg de poussière et 0 mg de sol par jour (Wilson et al., 2013).
b Exclusivement en ce qui concerne les nourrissons allaités, on présume qu’ils consomment 0,742 L de lait maternel par jour (Santé Canada, 1998), et on présume que le lait maternel constitue la seule source alimentaire. La concentration du lait (maternel) entier de 0,186 µg/L se fondait sur une mesure signalée de TCPP de 4,3 ng/g lipides x 3,4 % (teneur lipidique du lait maternel) x 1,03 g/mL (densité du lait maternel) recensée dans 90 échantillons de lait maternel humain prélevés sur des sujets en Suède en 2006 (Sundkvist et al., 2010).
c Exclusivement en ce qui concerne les nourrissons nourris à la préparation, on présume qu’ils consomment 0,8 L d’eau par jour (Santé Canada, 1998); il s’agit de l’eau utilisée pour reconstituer la préparation. Voir la note de bas de page sur l’eau potable pour plus de détails.
d On présume que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boit 0,7 L d’eau par jour, qu’il consomme 54,7 g de poisson et 249,7 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’il ingère 41 mg de poussière et 14 mg de sol par jour (Wilson et al., 2013).
e On présume que l’enfant pèse 31,0 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boit 1,1 L d’eau par jour, qu’il consomme 89,8 g de poisson et 276 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’il ingère 31 mg de poussière et 21 mg de sol par jour (Wilson et al., 2013).
f On présume que la personne pèse 59,4 kg, qu’elle respire 15,8 m3 d’air par jour, qu’elle boit 1,2 L d’eau par jour, qu’elle consomme 97,3 g de poisson et 251,6 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,2 mg de poussière et 1,4 mg de sol par jour (Wilson et al., 2013).
g On présume que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boit 1,5 L d’eau par jour, qu’elle consomme 111,7 g de poisson et 281,2 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,6 mg de sol par jour (Wilson et al., 2013).
h On présume que la personne pèse 72,0 kg, qu’elle respire 14,3 m3 d’air par jour, qu’elle boit 1,6 L d’eau par jour, qu’elle consomme 72,9 g de poisson et 242,9 g de fruits et de produits à base de fruits par jour (Santé Canada, 1998) et qu’elle ingère 2,5 mg de poussière et 1,5 mg de sol par jour (Wilson et al., 2013).
i On a utilisé la concentration moyenne de TDCPP dans l’air extérieur (établie à 0,158 ng/m3 à Toronto, en Ontario : Shoeib et al., 2014) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant d’une exposition par l’air ambiant. Les Canadiens sont présumés passer trois heures à l’extérieur chaque jour (Santé Canada, 1998).
j On a utilisé la concentration moyenne dans l’air intérieur (établie à 0,525 ng/m3 à Toronto : Vykoukalová et al., 2017) pour obtenir les valeurs estimatives moyennes de l’absorption quotidienne découlant de l’exposition par l’air intérieur. Les Canadiens sont présumés passer 21 heures par jour à l’intérieur (Santé Canada, 1998).
k On a choisi la concentration moyenne de TDCPP (1,3E-02 µg/L) mesurée dans l’eau des affluents des zones urbaines et rurales du lac Ontario (Shoeib et al., 2014; Jantunen et al., 2013b) pour calculer les limites supérieures estimatives de l’absorption quotidienne découlant de l’exposition par l’eau potable.
l On n’a recensé aucune donnée de surveillance des aliments du commerce au Canada; toutefois, des données environnementales sur les poissons étaient accessibles en Europe. On a choisi la concentration de TDCPP pour le poisson entier de 8,1 µg/kg poids humide (en fonction d’une concentration maximale signalée de 192 µg/kg lipides x 5,73 % teneur lipidique) (n = 23) dans la morue franche, la morue polaire et l’omble chevalier recueillis en 2008 en Norvège (Evenset et al., 2009) pour calculer les limites estimatives supérieures de l’exposition quotidienne au TDCPP dans tous les produits alimentaires liés aux poissons du groupe des aliments aquacoles. Les quantités d’aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada, 1998).
m On a choisi la concentration moyenne de TDCPP (12,7 mg/kg) indiquée dans l’étude de référence canadienne (données préliminaires de l’Enquête sur la poussière domestique au Canada, Kubwabo et al., manuscrits en cours de rédaction, Bureau de la science et de la recherche en santé environnementale, Santé Canada, source non citée, 13 décembre 2013), qui a été mesurée dans diverses villes canadiennes, pour calculer les valeurs estimatives moyennes de l’absorption quotidienne associée à l’exposition à la poussière.
n On n’a recensé aucune donnée de surveillance des sols en Amérique du Nord. On a choisi la limite de détection (LD) (9 x 10-5 mg/kg) tirée d’une étude allemande sur les sols pour estimer la limite supérieure de l’absorption quotidienne associée à l’exposition par le sol.
DQMDV issue des milieux environnants et des aliments = (0,031 × 0,5/80) + (0,038 × 4,5/80) + (0,027 × 7/80) + (0,014 × 8/80) + (0,013 × 40/80) + (0,008 7 × 20/80) = 0,014 8 µg/kg p.c./j
Groupe d’âge |
0 à 0,5 ans |
0,5 à 4 ans |
5 à 11 ans |
12 à 19 ans |
20 à 59 ans |
60 à 71 ans |
|---|---|---|---|---|---|---|
Absorption cutanée associée aux périodes passées étendu sur un matelas en moussea (µg/kg p.c./j) |
14,6 à 49,5 |
10,3 à 37,6 |
5,5 à 20,9 |
4,5 à 18,3 |
3,9 à 17,3 |
3,8 à 17,0 |
a Absorption estimée d’après la valeur ajustée d’absorption cutanée de TDCPP de 30 % obtenue par l’application du rapport des valeurs d’absorption du TCPP in vitro (23 % et 40 %) au taux d’absorption du TDCPP de 15 % (EURAR, 2008b).
DQMVDinf = (14,6 × 0,5/80) + (10,3 × 4,5/80) + (5,5 × 7/80) + (4,5 × 8/71) + (3,9 × 40/80) + (3,8 × 20/80) = 4,50 µg/kg p.c./j
DQMVDsup = (49,5 × 0,5/80) + (37,6 × 4,5/80) + (20,9 × 7/80) + (18,3 × 8/80) + (17,3 × 40/80) + (17,0 × 20/80) = 19,0 µg/kg p.c./j
