Rapport sur l’état des connaissances scientifiques groupe de certaines substances ignifuges organiques 2-(allyloxy)-1,3,5-tribromobenzène (EAT)
Titre officiel : Rapport sur l’état des connaissances scientifiques groupe de certaines substances ignifuges organiques 2-(Allyloxy)-1,3,5-tribromobenzène (EAT)
Numéro de registre du Chemical Abstracts Service 3278-89-5
Environnement et Changement climatique Canada
Santé Canada
Mai 2019
No de cat. : En14-371/2019F-PDF
ISBN 978-0-660-30311-6
Sommaire
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l'Environnement et de la Santé ont préparé un rapport sur l’état des connaissances scientifiques sur 2-(Allyloxy)-1,3,5-tribromobenzène (EAT) no CAS 3278-89-5.
L’objectif du présent rapport est d’examiner l’état actuel des connaissances scientifiques sur l’EAT et de fournir une analyse à jour de son potentiel d’effets nocifs sur l’environnement ou la santé humaine au Canada.
Cette substance fait partie du groupe de certaines substances ignifuges organiques. Ce groupe est constitué de dix substances organiques ayant une fonction similaire, soit l’application à des matériaux en vue de retarder leur inflammation et la propagation du feu. L’EAT a été identifié d’intérêt prioritaire pour la prise de mesures en raison de préoccupations potentielles pour l’environnement identifiées lors d’une évaluation réalisée en réponse à un avis publié en vertu des dispositions relatives aux nouvelles substances de la LCPE. Bien que cette substance ne soit pas inscrite sur la Liste intérieure des substances (LIS) et qu’elle soit donc sujette à l’article 81 de la LCPE, elle a été commercialisée au Canada depuis la période de transition entre l’établissement de la LIS et l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) (entre le 1er janvier 1987 et le 1er juillet 1994).
L’EAT n’est pas présent naturellement dans l’environnement. Il n’est pas actuellement produit au Canada. Une enquête menée en vertu de l’article 71 de la LCPE a permis de déterminer que, en 2011, moins de cinq déclarants ont importé au Canada une quantité totale d’EAT allant de 100 000 à 1 000 000 kg. Les utilisations de l’EAT au Canada sont présumées correspondre à celles déclarées au niveau international, à savoir comme produit ignifuge pour le polystyrène expansé, des polyoléfines, des produits électroniques, pour l’isolation de fils en polyamide/polyimide, dans des adhésifs, des revêtements et des textiles industriels.
D’après le rapport de mise à jour de l’inventaire de l’Environmental Protection Agency des États-Unis, de 4,5 à 230 tonnes (10 000 à 500 000 lb) d’EAT ont été produites à l’échelle nationale aux États-Unis en 2006. Le nombre de sites de production, de traitement et d’utilisation de cette substance déclarés allait de 1 à 99. Il est estimé que l’EAT est une substance produite en faibles quantités dans l’Union européenne, le terme « faible quantité » étant défini comme une quantité de 10 à 1000 tonnes par an.
L’EAT a une faible pression de vapeur prédite et une constante de Henry modérée, un log Koe et un log Kco expérimentaux et prédits élevés et une solubilité dans l’eau modélisée ou empirique très faible.
De l’EAT a été détecté dans l’environnement au Canada (air, eau et biote) et à l’échelle internationale (air, eau, sédiments, biosolides et biote). D’après les résultats tirés de données obtenues par modélisation, l’EAT devrait se retrouver principalement dans le sol et les sédiments, en fonction du milieu dans lequel il est rejeté, moins de 3 % restant dans l’eau. L’EAT a une demi-vie atmosphérique courte et se dégrade rapidement après son rejet dans l’air, lorsqu’il est en phase gazeuse. Des propriétés physiques et chimiques suggèrent que, dans l’air, un faible pourcentage de la substance sera adsorbé sur des particules et que la plus grande partie de la substance sera présente dans la phase gazeuse (99 %). Des modèles de transport à grande distance indiquent que l’EAT ne devrait pas être transporté sur de grandes distances dans l’environnement.
Des données expérimentales et modélisées sur sa biodégradation indiquent que l’EAT a une persistance modérée dans l’eau, le sol et les sédiments. Des données empiriques suggèrent qu’il est persistant lorsqu’il est adsorbé sur des sols ou des sédiments. Des données de modélisation suggèrent qu’il sera minéraliser en quelques mois, probablement en moins d’un an.
Des données de modélisation indiquent que l’EAT peut se bioaccumuler dans le biote et qu’il a un potentiel de bioamplification.
D’après les résultats tirés de tests empiriques de toxicité aquatique, l’EAT peut potentiellement avoir des effets nocifs sur les organismes pélagiques (poissons et crustacés). La modélisation suggère également des effets potentiels sur les organismes aquatiques à faible concentration. Aucune donnée sur la toxicité dans le sol ou les sédiments ou pour la faune n’était disponible. Le fait qu’aucun effet (DL50 par voie orale) à des concentrations supérieures à 2000 mg/kg pc par jour n’ait été observé chez des rats Sprague-Dawley suggère que des effets nocifs sont peu susceptibles de se produire chez les mammifères sauvages au niveau actuel des rejets industriels.
Quatre produits potentiels de transformation de l’EAT ont été prédits à l’aide d’une modélisation du devenir dans l’environnement. Trois de ces quatre substances peuvent être identifiées : le 3-(2,4,6-tribromophénoxy)propane-1,2-diol (no CAS 51286-98-7), l’oxyde de 2,4-dibromophényle et de prop-2-ènyle (no CAS 69227-61-8) et le 2,4,6‑tribromophénol (no CAS 118-79-6). Les résultats de la modélisation ont indiqué que certains de ces produits de transformation peuvent potentiellement s’accumuler dans une certaine mesure chez les poissons, et que l’un d’entre eux devrait avoir une toxicité modérée à élevée pour les algues, les daphnies et les poissons. Deux métabolites potentiels de l’EAT ont été prédits, le 2,4,6-tribromophénol (2,4,6-TBP) et l’acroléine. Cependant, le niveau de confiance de cette prévision de métabolites est faible, car l’EAT n’était pas couvert par le domaine du modèle. L’acroléine ne devrait pas persister ni se bioaccumuler dans l’environnement, mais elle est hautement toxique pour les organismes aquatiques. Le 2,4,6-TBP a été jugé persistant dans l’air et dans les biosolides. Il a été déterminé que le potentiel de bioconcentration de cette substance est modéré, et qu’elle est très toxique pour les organismes aquatiques.
De l’EAT est présent dans des produits commerciaux et dans des produits disponibles pour les consommateurs en tant qu’additif et produit ignifuge réactif. En tant que produit ignifuge réactif, il ne devrait pas y avoir de rejets d’EAT à partir de produits électroniques. Toutefois, des rejets à partir de produits dans lesquels de l’EAT est utilisé comme additif (mousse de polystyrène expansé) devraient survenir, mais seraient minimes et diffus. Des rejets plus importants d’EAT sont attendus suite à des utilisations industrielles (c.-à-d. la fabrication de produits). Des scénarios de rejets industriels élaborés pour fournir des estimations de l’exposition dans le milieu aquatique, y compris les sédiments et les biosolides, ont indiqué que le risque d’effets nocifs sur des organismes dans ces milieux est faible en raison des niveaux actuels de rejet. Afin d’évaluer les effets potentiels de l’EAT sur l’environnement, des calculs de résidus corporels critiques (RCC) ont été faits pour les poissons en se basant sur la concentration estimée dans l’eau pour le scénario de rejet industriel. Les valeurs des RCC estimées étaient inférieures au seuil de létalité pour les expositions aiguës et chroniques. Toutefois, en utilisant la limite de solubilité dans l’eau de l’EAT, ces seuils de RCC sont dépassés, indiquant qu’un danger de toxicité dû à sa létalité est néanmoins possible à des concentrations plus élevées dans l’eau.
Compte tenu de tous les éléments de preuve avancés dans le présent rapport sur l’état des connaissances scientifiques, il existe actuellement un faible potentiel d’effets nocifs de l’EAT sur l’environnement.
Pour l’évaluation des risques pour la santé humaine, l’exposition de la population générale à de l’EAT dans les milieux de l’environnement (air, eau et aliments) est jugée faible. L’exposition de la population générale due à l’utilisation de produits disponibles pour les consommateurs (p. ex. produits électroniques ou polystyrène expansé) devrait être minime, d’après les propriétés de l’EAT en tant que produit ignifuge réactif dans les matières plastiques et du faible potentiel d’exposition au polystyrène expansé contenant de l’EAT sous forme d’additif ignifuge.
Aucune classification des effets sur la santé de l’EAT par des organismes de réglementation nationaux ou internationaux n’a été trouvée. Des données empiriques limitées sur les effets sur la santé de l’EAT existaient. Des analyses de plusieurs éléments de preuve ont été non concluantes quant à son potentiel de génotoxicité ou de cancérogénicité. L’exposition de la population générale due aux milieux de l’environnement ou à des produits disponibles pour les consommateurs au Canada devrait être faible. Le potentiel d’effets nocifs sur la santé humaine est donc jugé faible. À titre d’élément de preuve supplémentaire, il serait bon aussi de noter que, pour la population générale, l’absorption estimée d’EAT à partir de milieux de l’environnement et d’aliments est inférieure à la plus faible valeur du seuil de préoccupation toxicologique établie.
Conclusion globale
Bien que les niveaux d’exposition estimés actuels à l’EAT n’indiquent pas de danger pour l’environnement ou la santé humaine, des préoccupations pourraient se manifester si les quantités importées et utilisées venaient à augmenter au Canada.
L’EAT étant une option commerciale pour remplacer d’autres produits ignifuges, il se peut que les quantités utilisées augmentent au Canada. Étant donné que l’EAT n’est pas inscrit sur la LIS, cette substance continuera d’être assujettie à l’article 81 du Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) de la LCPE, ce qui permettra de s’assurer d’une notification préalable à la mise en marché de toute importation ou production nouvelle de cette substance et de la mise en place de restrictions, le cas échéant.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation d’une des dix substances appelées collectivement groupe de certaines substances ignifuges organiques dans le cadre du Plan de gestion des produits chimiques, afin de déterminer si elle présente ou peut présenter un risque pour l’environnement ou la santé humaine.
L’Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances déclarées d’intérêt prioritaire pour une évaluation, car elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE ou soulevaient des préoccupations ayant trait à l’environnement ou à la santé humaine (Environnement Canada, Santé Canada 2007). Toutes ces substances ont une fonction similaire : l’application sur des matériaux afin de prévenir l’ignition et la propagation du feu. Ces substances sont des produits de substitution potentiels pour d’autres produits ignifuges actuellement soumis à des contrôles réglementaires ou à un retrait progressif au Canada et/ou à l’échelle mondiale.
Le présent rapport sur l’état des connaissances scientifiques (ECS) est centré sur la substance appelée 2-(Allyloxy)-1,3,5-tribromobenzène (EAT) (no CAS 3278-89-5).
Cette substance est inscrite sur la Liste extérieure des substances (LES). La LES est un inventaire des substances qui ne sont pas inscrites sur la Liste intérieure des substances (LIS), mais qui sont reconnues comme étant utilisées à l’échelle internationale. Étant donné que l’EAT n’est pas inscrit sur la LIS, il est soumis au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) en vertu de la LCPE (Canada 2005). Suite à des évaluations des risques pour la santé humaine ou l’environnement posés par des substances nouvelles menées en décembre 2000, l’EAT est suspecté satisfaire aux critères de toxicité de la LCPE. L’EAT a été commercialisé au Canada pendant la période de transition allant de l’établissement de la LIS à l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles, soit entre le 1er janvier 1987 et le 1er juillet 1994.
L’objet du présent rapport est de faire un examen des connaissances scientifiques actuellement disponibles sur l’EAT et de fournir une analyse à jour de son potentiel d’effets nocifs sur l’environnement ou la santé humaine au Canada.
Le présent rapport sur l’ECS tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, dont des renseignements soumis par des parties prenantes. Environnement et Changement climatique Canada et Santé Canada ont identifié des données pertinentes jusqu’en janvier 2017. Nous avons utilisé des données empiriques tirées d’études clés, ainsi que certains résultats provenant de modélisations, pour tirer nos conclusions. Lorsqu’ils étaient disponibles et pertinents, des renseignements contenus dans les évaluations effectuées par d’autres instances ont été pris en compte.
Le présent rapport sur l’ECS a été préparé par le personnel du Programme d’évaluation des risques travaillant à Santé Canada et Environnement et Changement climatique Canada. Il comprend des intrants d’autres programmes exécutés dans ces ministères. Les parties du rapport portant sur la santé humaine et l’environnement ont fait l’objet d’un examen externe écrit par des pairs et/ou d’une consultation. Des commentaires sur les portions techniques ayant trait à l’environnement ont été faits par le Dr Jon Arnot (Arnot Research and Consulting), le Dr Adrian Covaci (Université d’Anvers), la Dre Miriam Diamond (Diamond Environmental Research Group), M. Michael Francis (Nova Chemicals) et Mme Linda Santry (Nova Chemicals). Des commentaires sur les portions techniques ayant trait à la santé humaine ont été faits par des experts scientifiques sélectionnés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), dont Michael Jayjock (LifeLine Group), Bernard Gadagbui (TERA) et Patricia McGinnis (Independent Consultant). De plus, l’ébauche du présent rapport avait fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et des conclusions du présent rapport.
Le présent rapport dur l’ECS est centré sur des études critiques et des éléments de preuve pertinents pour l’évaluation. Pour l’établir, nous avons examiné des renseignements scientifiques et avons suivi une approche basée sur le poids de la preuve et le prinicpe de précautionNote de bas de page 1 . Dans le présent rapport, nous présentons les renseignements et considérations critiques à partir desquels nous avons tiré nos conclusions.
2. Identité de la substance
Aux fins du présent document, l’oxyde de 2,4,6-tribromophényle et de prop-2-ènyle sera désigné par le sigle EAT.
L’EAT est une substance aromatique et est considéré comme un produit ignifuge bromé. Il est synthétisé par condensation du 2,4,6-tribromophénol (TBP, lui-même un produit ignifuge) avec du 3-bromoprop-1-ène (Ma et al. 2012). Des renseignements sur l’identité de l’EAT sont présentés dans le tableau 2-1.
| No CAS | Masse moléculaire (g/mol) | Formule moléculaire | Structure chimique et formule moléculaire |
|---|---|---|---|
| 3278-89-5 | 370,86 | C9H7Br3O | 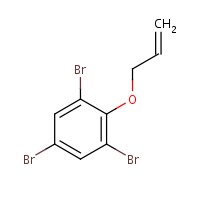 |
2.1 Sélection d’analogues
Des documents sur l’utilisation d’une approche de données croisées et de modèles de type (Q)SAR (Quantitative Structure-Activity Relationships) pour combler des lacunes dans les données ont été préparés par divers organisations, comme l’Organisation de coopération et de développement économiques (OCDE). Ces méthodes ont été appliquées dans divers programmes réglementaires, dont le Programme des substances existantes de l’Union européenne. Une analyse a été faite afin d’identifier des analogues de l’EAT. Toutefois, aucun analogue environnementalement pertinent n’a pu être retenu.
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques définissent les caractéristiques globales d’une substance et sont utilisées afin de déterminer la pertinence de différentes substances pour divers types d’applications. De telles propriétés jouent également un rôle clé dans la détermination du devenir dans l’environnement des substances (y compris leur potentiel de transport à grande distance), ainsi que de leur toxicité pour les humains et les organismes non humains.
Nous avons résumé dans le tableau 3-1 les propriétés physiques et chimiques, expérimentales et modélisées, de l’EAT pertinentes pour son devenir et sa toxicité dans l’environnement. Un tableau détaillé des propriétés physiques et chimiques de l’EAT (empiriques et modélisées) se trouve à l’Annexe A. Les données empiriques sur les propriétés physiques et chimiques de l’EAT sont limitées. Des données empiriques tirées du rapport de Great Lakes Solutions (2010) pour le produit ignifuge PHE-65 (défini par le no CAS 3278-89-5) et de présentations de projets d’étude (1996a-g) sont présentées dans le tableau 3-1. La pureté du PHE-65 (EAT) n’est pas connue. L’EAT est produit sous forme de poudre sèche (EPA 2006). Des données empiriques indiquent que le point de fusion de l’EAT se situe dans la gamme 74-76 °C (Présentation de projet d’étude 1996a), et que cette substance a une faible solubilité dans l’eau (0,24 mg/L) (Présentation de projet d’étude 1996g). Des valeurs empiriques de la pression de vapeur et du coefficient de partage octanol-eau sont disponibles. Cependant, étant donné que des limites ne sont pas associées à ces valeurs, elles n’ont pas été utilisées comme intrants pour la modélisation du devenir et de la toxicité. Les résultats d’une étude du spectre d’absorption de la lumière visible et ultraviolette n’ont mis en évidence aucun pic d’absorption dans la gamme visible (Présentation de projet d’étude 1996i). Des pics d’absorption ont été observés dans gamme ultraviolette, suggérant que l’EAT pourrait être photodégradé par le rayonnement ultraviolet.
Des modèles (Q)SAR ont été utilisés pour générer des données sur les propriétés physiques et chimiques de l’EAT (Annexe A). L’EAT a une faible solubilité dans l’eau prédite de 0,078 mg/L à 25 °C. Il a également une faible pression de vapeur prédite de 0,00854 à 0,0135 Pa, ainsi qu’une constante de Henry modérée prédite de 2,65 à 2,68 Pa·m3/mol à 25 °C. L’EAT est caractérisé par un coefficient de partage octanol‑eau élevé (log Koe modélisé de 5,59; valeur empirique supérieure à 4,86) et un coefficient de partage carbone organique-eau modéré à élevé (log Kco modélisé de 3,12 à 4,97).
Étant donné que l’EAT est un solide, les propriétés de liquide sous-refroidi liées à la pression de vapeur et à la solubilité dans l’eau ont été estimées et comparées aux résultats empiriques et du modèle (Q)SAR. Des estimations du rapport de fugacité ont été utilisées pour déterminer les propriétés de liquide sous-refroidi à partir des propriétés à l’état solide. Les valeurs de sous-refroidissement ne diffèrent pas considérablement de celles à l’état solide, sauf dans le cas des valeurs obtenues avec le modèle ECOSAR.
L’EAT fait partie du domaine d’applicabilité du modèle QSAR de l’EPI Suite. Les domaines de la structure et/ou des paramètres de propriété sont représentés dans l’ensemble d’apprentissage utilisé pour le modèle.
| Propriété | Valeur modélisée | Référence | Valeur empirique | Référence |
|---|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 0,078 | WSKOWWIN 2010 (v. 1.42) | 0,24 | Présentation de projet d’étude 1996g |
| Constante de Henry (Pa.m3/mol) | 2,68 | HENRYWIN 2010 v. 3.20 (estimation des liaisons) | ND | ND |
| log Koe (sans dimension) | 5,59 | KOWWIN 2010 (v. 1.68) | > 4,86 | Présentation de projet d’étude 1996e |
| Pression de vapeur (Pa) | 0,0135 | MPBPVPWIN 2010 (v. 1.43) (méthode de Grain modifiée – pression de valeur sélectionnée) | < 10 | Présentation de projet d’étude 1996d |
| log Kco | 3,12-4,97 | KOCWIN 2010 | 3,5-4,8 | Présentation de projet d’étude 1996f |
| log Koa | 8,55-9,05 | KOAWIN 2010 (v. 1.10) | ND | ND |
| pKaa | ND | ND | ND | ND |
Abréviations : log Koe = coefficient de partage octanol-eau;
log Kco = coefficient de partage carbone organique-eau;
log Koa = coefficient de partage octanol-air;
pKa = constante de dissociation acide;
ND = non disponible.
a ND, car l’EAT ne comporte pas de groupes ionisables
4. Sources
En se basant sur la littérature disponible, l’EAT n’est pas connu pour être présent naturellement dans l’environnement. Au Canada, de l’EAT était auparavant produit par Chemtura Corporation sous l’appellation commerciale PHE-65 (Ma et al. 2012, Covaci et al. 2011). L’EAT n’est pas actuellement produit au Canada (EC 2013-2014).
Quelques entreprises sont connues pour avoir importé de l’EAT au Canada en 2011 (Environnement Canada 2013). Entre 100 000 et 1 000 000 kg d’EAT ont été importés au Canada en 2011 (Environnement Canada 2013, EC 2013-2014). Ces renseignements ont été obtenus grâce à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2013).
D’après le rapport de mise à jour de l’inventaire de l’Environmental Protection Agency des États-Unis (EPA 2006), moins de 230 tonnes (moins de 500 000 lb) d’EAT ont été produites à l’échelle nationale aux États-Unis en 2006. Un nombre de sites de production, de traitement et d’utilisation variant de 1 à 99 a été rapporté. Cependant, il est à noter que ces chiffres pourraient être sousestimés (EPA 2006). Il est estimé que l’EAT est produit en faibles quantités dans l’Union européenne (UE) (Harju et al. 2009). Le terme « faible quantité » est défini comme une quantité allant de 10 à 1 000 tonnes par an (UK EA 2010).
5. Utilisations
À l’échelle mondiale, l’EAT peut être utilisé comme produit ignifuge dans divers polymères, comme le polyester, le polypropylène, le polystyrène et d’autres polycarbonates (Kolic et al. 2009). Le plus souvent, ces polymères sont utilisés dans des matériaux d’isolation en polyoléfine et polyamide/polyimide pour câbles et fils et dans du polystyrène expansé (PSE). Le PSE peut être utilisée dans des matériaux de construction ou d’emballage (Ash et Ash 2003, Nova Chemicals 2012). L’EAT est aussi utilisé comme produit ignifuge pour des produits électroniques, des adhésifs, des revêtements et des textiles industriels (Ash et Ash 2003, IPC modifié le 10 mars 2010).
L’EAT peut également être ajouté à des matières plastiques en tant que produit ignifuge réactif, c’est-à-dire qu’il est ajouté au cours du procédé de polymérisation afin de devenir partie intégrante du polymère (Fisk et al. 2003, Harju et al. 2009). Ceci conduit à polymère modifié ayant des propriétés ignifuges. Ce procédé réduit au minimum la libération du produit ignifuge par le polymère, car le produit ignifuge est lié de manière covalente au polymère tout en conservant ses propriétés ignifuges intactes pendant plus longtemps, avec des émissions apparemment plus faibles dans l’environnement (Harju et al. 2009).
L’EAT est également utilisé comme additif ignifuge pour le PSE et la mousse de polystyrène (rigide et souple) (OMS 1997, Harju et al. 2009). Il peut également être utilisé comme activateur pour les produits ignifuges aromatiques contenant du brome pour des applications dont les températures de procédé maximales ne dépassent pas 150 °C (Chemtura 2007). L’EAT est également utilisé comme produit ignifuge lors de la production d’isolants pour fils en polyamide/polyimide, de polyester, de polyéthylène, de polypropylène, de polystyrène et de polycarbonate (Clement et al. 2012). Au Canada, les utilisations de l’EAT comme produit ignifuge correspondent à celles à l’échelle internationale (EC 2013-2014).
L’EAT est inscrit par le Comité d’examen des polluants organiques persistants du Programme pour l’environnement des Nations Unies comme produit de remplacement du HBCD, dans un processus en deux étapes pour le PSE (UNEP 2012). Il est indiqué dans le rapport du Design for Environment (DfE) de l’EPA des États-Unis que l’EAT est recommandé dans des brevets comme produit de remplacement potentiel du HBCD (EPA 2014). Toutefois, il n’est pas recommandé dans ce rapport d’utiliser de l’EAT comme produit de remplacement potentiel du HBCD dans la mousse XPS, en raison de sa stabilité thermique médiocre aux températures d’exploitation. L’EAT n’est pas considéré comme un produit de remplacement économique pour le PSE, car il n’est viable que pour le procédé de production en deux étapes moins économique. Il a aussi été rapporté que l’EAT interfère avec le procédé de polymérisation du styrène, conduisant à un produit ayant une masse moléculaire moyenne plus faible et comportant des résidus de styrène n’ayant pas réagi. La mousse ainsi produite aurait une résistance ne satisfaisant pas aux exigences du code du bâtiment.
L’EAT n’est pas inscrit comme un additif alimentaire approuvé sur les listes des additifs alimentaires autorisés, qui ont été incorporées en référence dans les autorisations de commercialisation respectives émises en vertu de la Loi sur les aliments et drogues (Santé Canada modifié le 3 mai 2017). Il n’a pas non plus été identifié comme étant utilisé/présent dans des formulations pour matériaux d’emballage alimentaire ni comme additif indirect (Santé Canada 2013, courriel de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada daté d’août 2013, non référencé). Au Canada, l’EAT n’est inscrit ni dans la Base de données sur les produits pharmaceutiques (BDPP), ni dans la base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu’ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, des produits de santé naturels ou des médicaments vétérinaires (BDPP modifiée en 2017, BDIPSN modifiée en 2016, BDPSNH modifiée en 2017, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada en 2013, non référencé). En se basant sur les déclarations faites en vertu du Règlement sur les cosmétiques à Santé Canada, il n’est pas anticipé que de l’EAT soit utilisé dans des produits cosmétiques au Canada (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada adressé au Bureau de l’évaluation des risques des substances existantes de Santé Canada en 2014; non référencé).
6. Rejets dans l’environnement
De l’EAT peut potentiellement être rejeté dans l’environnement, en particulier lorsqu’il est utilisé comme additif ignifuge. Des rejets dans l’environnement au Canada peuvent se produire au cours d’une utilisation industrielle (p. ex. pendant la production de cette substance), d’une utilisation commerciale ou par des consommateurs ou de la durée de vie utile et de l’élimination de produits contenant de l’EAT. Des rejets peuvent survenir aussi bien dans des environnements intérieurs qu’extérieurs (Shoeib et al. 2012).
De l’EAT peut être présent dans des produits commerciaux et des produits disponibles pour les consommateurs. L’utilisation d’EAT comme additif dans le PSE et la mousse de PS (rigide ou souple) peut entraîner des rejets diffus à partir de produits commerciaux ou de produits disponibles pour les consommateurs et, bien qu’il y ait des incertitudes à ce sujet, la vitesse d’émission est assumée faible par rapport à celle de sources industrielles ponctuelles au cours de l’intégration de la substance dans des produits. L’utilisation de l’EAT en tant qu’agent réactif indique que la substance est chimiquement liée aux matrices de polymère et qu’elle aura un potentiel limité de lixiviation dans l’environnement (Stapleton 2010).
Le rejet dans l’environnement par lixiviation à partir de polymères est considérée très faible, cette substance étant incorporée dans le polymère et à la fin contenue dans la matrice solide de polymère du produit. Les produits contenant de l’EAT, par exemple le PSE (mousse de PS rigide ou souple), ne devraient pas entrer en contact avec l’eau. Le rejet potentiel dans l’eau de substances ignifuges utilisées comme additifs dans des matières plastiques est estimé à 0,05 % pendant la durée de vie si la substance est utilisée à l’intérieur ou à 0,16 % si elle est urilisée à l’extérieur (OCDE 2009). La majorité des produits contenant de l’EAT devrait être confinée et utilisée à l’intérieur. Le taux de rejet de 0,05 % est donc celui qui s’applique le mieux et peut probablement être une surestimation puisqu’il ne devrait pas y avoir de contact avec l’eau. Globalement, les rejets à partir de produits devraient être géographiquement dispersés et s’étaler sur toute la durée de vie utile et la fin de vie de ces produits.
En général, les eaux usées constituent un point d’entrée potentiel de l’EAT dans l’eau, ainsi que dans le sol lors de l’épandage de biosolides. Bien que la pression de vapeur de l’EAT soit faible, des résultats de surveillance indiquent qu’une fois dans l’air, des émissions de la substance peuvent conduire à des dépôts dans le sol et l’eau.
De l’EAT a été mesuré dans de la poussière domestique à Vancouver (Canada). De l’EAT a été détecté dans 81 % des échantillons de poussière, à des concentrations allant de moins de 0,04 à 52 ng/g (Shoeib et al. 2012). Nous traiterons plus en détail des concentrations d’EAT dans la poussière à la section 9.1.1.3. Ces mesures reflètent des rejets dispersés d’EAT dans l’environnement intérieur. Les rejets provenant de produits disponibles pour les consommateurs pourraient être contenus dans de la poussière domestique, qui pourrait se retrouver dans des systèmes de traitement des eaux usées. L’accumulation de substances ignifuges, dont l’EAT, dans les vêtements à partir de l’air intérieur et son transfert lors du lavage vers l’extérieur ont été étudiés par Saini et al. (2016). L’EAT n’a pas été détecté dans les eaux usées de lavage et ne s’est pas sorbé sur des tissus en coton ou en polyester.
7. Concentrations environnementales
7.1 Concentrations environnementales mesurées
Des données sur les concentrations d’EAT dans l’air, l’eau, la végétation et le biote au Canada ont été relevées (ECCC 2016). D’après les utilisations de l’EAT au Canada, les concentrations environnementales mesurées reflètent probablement des rejets dispersés à partir de produits ou d’activités industrielles.
7.1.1 Air
L’EAT a fait l’objet d’une surveillance dans l’air extérieur (méthode passive ou active) autour de la région des Grands Lacs et dans la zone urbaine de Toronto (Ontario) en 2011 (Diamond et al. 2013). La concentration moyenne d’EAT mesurée par échantillonnage actif à grand volume était inférieure à 1 pg/m3 sur un site opérant 24 heures deux fois par mois. La surveillance passive quotidienne de l’air ambiant pendant 3 mois en été et en hiver au cours d’une année sur 6 sites à Toronto a montré que l’EAT n’était pas présent pendant les mois d’hiver. Des concentrations d’EAT allant de 1 à 15 ng/disque de MPU (échantillonneur à disque de mousse de polyuréthane) ont été rapportées pendant les mois du printemps et de l’été. De l’EAT a été détecté dans des échantillons d’air de la région des Grands Lacs (Shoeib et Jantunen 2014, ECCC 2016). De l’EAT a été détecté dans 100 % des échantillons prélevés autour du lac Ontario en 2008 et dans 88 % des échantillons prélevés autour du lac Huron en 2012. Il a aussi été détecté sur un site urbain à Toronto (87 %). Les concentrations étaient principalement détectées en phase gazeuse et allaient de 0,04 à 11,1 pg/m3 (Shoeib et Jantunen 2014). Les concentrations moyennes d’EAT sur ces trois sites allaient de 0,11 à 2,5 pg/m3.
L’EAT a été analysé dans des échantillons d’air prélevés sur un site dans la région subarctique (Little Fox Lake, Yukon) d’août 2011 à décembre 2014 (Yu et al. 2015). Il a été détecté dans 26 % de tous les échantillons, à des concentrations allant de 0,007 à 0,107 pg/m3.
Lee et al. (2016) ont fait une analyse rétrospective des échantillons d’air collectés en 2005 dans le cadre du programme GAPS. Pour l’EAT, les niveaux dans l’atmosphère canadienne allaient de 0,008 à 0,98 pg/m3. En se basant sur les données sur la concentration pour toutes les périodes d’échantillonnage, la détection de l’EAT était la deuxième plus importante en termes de fréquence (71 %) sur une base globale.
De l’EAT a aussi été mesuré dans l’air aux États-Unis, en Norvège et en Suède (voir ECCC 2016), à des concentrations allant de 0,012 à 15 pg/m3.
7.1.2 Eau
De l’EAT a été détecté dans les eaux de surface du lac Ontario (0,22 pg/L) et du lac Opeongo (0,07 pg/L) (Muir et al. 2011). Pour les lacs Érié et Siskiwit, les concentrations étaient inférieures à la limite de détection (Muir et al. 2012). Xie et al. (2011) ont aussi collecté des échantillons d’eau de mer depuis un navire de croisière dans l’océan Atlantique et l’océan Austral en 2008. La concentration dans les 16 échantillons collectés pendant la période d’échantillonnage de deux mois était inférieure à la limite de détection (de moins de 0,1 à moins de 0,5 pg/L) (voir ECCC 2016).
7.1.3 Sédiments et sol
Aucune concentration d’EAT dans des sédiments ou des sols n’est disponible pour le Canada.
De l’EAT a été détecté dans tous les échantillons de sol prélevés sur 8 sites le long d’un transect à Birmingham (Royaume-Uni), de juin 2012 à janvier 2013 (Drage et al. 2016). Les concentrations dans le sol allaient de 0,01 à 0,69 ng/g (matière organique).
D’août 2012 à août 2013, des échantillons de sédiments de surface de rivière ont été prélevés sur la côte est du R.-U. (n = 23) et dans le fleuve Elbe en Allemagne. La concentration était inférieure à la limite de détection (59 pg/g ps) (Sühring et al. 2015a).
Des échantillons de sédiments ont été collectés sur des sites urbains au Danemark, aux îles Féroé, en Finlande, en Norvège et en Suède (TemaNord et al. 2011). Dans tous les échantillons, la concentration d’EAT était inférieure à la limite de détection, sauf dans le cas d’un échantillon prélevé en 2009 sur site urbain à Asefjorden (Norvège), dans lequel la concentration était de 0,092 ng/g ps. Aucune donnée n’est disponible pour la caractérisation des niveaux d’EAT dans le sol (ECCC 2016).
7.1.4 Eaux usées et biosolides
Bien que les effluents et les biosolides de systèmes de traitement des eaux usées ne soient pas considérés être l’« environnement », ils représentent une source directe dans l’environnement et sont donc inclus dans la présente discussion.
Une analyse de substances ignifuges bromées dans des vêtements et des eaux usées de lavage a été réalisée par Saini et al. (2016). L’EAT n’a pas été détecté sur les vêtements en coton ou en polyester ni dans l’eau de lavage (limite de détection de 1,1 pg).
L’EAT n’a pas été détecté lors de l’analyse d’un total de 186 échantillons d’effluent ou d’influent liquide (limite de détection de 0,0062 ng/L) et de 58 échantillons de biosolide (limite de détection non rapportée) prélevés dans 8 systèmes de traitement des eaux usées (Shanmuganathan et al. 2017, soumis).
De l’EAT a été mesuré dans des échantillons de biosolide prélevés à Reykjavik, Islande (11 ng/g ps), dans une usine de traitement des eaux usées de Reykjavik (27 ng/g ps) et dans une usine de traitement des eaux usées de Alesund, Norway (2,6 ng/g ps et 1,2 ng/g ps) en 2009 (TemaNord 2011). Les chercheurs ont aussi collecté des échantillons de biosolide dans des usines de traitement des eaux usées, des sites urbains et des sites de recyclage au Danemark, aux îles Féroé, en Finlande, en Suède, en Islande et en Norvège, mais les niveaux d’EAT étaient inférieurs aux limites de détection.
En Allemagne, de l’EAT a été détecté dans 15 des 18 échantillons de biosolide provenant de dix usines de traitement des eaux usées (Weisser 1992). Les niveaux allaient de < 5 à 91 µg/kg ps.
7.1.5 Biote
De l’EAT a été détecté chez un certain nombre d’organismes tels que le caribou, le loup, le phoque du groenland, le goéland à ailes grises, le goéland argenté, l’étourneau sansonnet, l’anguille américaine, l’anguille européenne, le zooplancton, la truite grise, le chabot, la moule bleue de la côte nord de l’Alaska, du Nunavut, de la mer de Barents, de la mer du Groenland, du lac Ontario et du lac Opeongo (ECCC 2016).
L’EAT était une des substances ignifuges halogénées, autres que des PBDE, les plus abondantes dans des échantillons analysés lors d’une étude sur la chaiîne trophique terrestre (végétation-caribou-loup) dans la région de Bathurst au Nunavut (Morris et al. 2014, non publié). De l’EAT a été détecté régulièrement dans les muscles et le foie de caribous (2,1 et 3.3 ng/g lipides (pl) respectivement), bien que les niveaux aient été plus importants dans les muscles et le foie de loups (4,0 et 0,99 ng/g pl respectivement).
De l’EAT a été détecté dans des échantillons d’anguille américaine (Anguilla rostrata) prélevés en Nouvelle-Écosse, au Nouveau-Brunswick, au Québec et en Ontario, à des concentrations allant de 0,25 ± 0,13 à 1,3 ± 0,4 ng/g (Byer et al. 2010). L’EAT était quantifiable dans 55 des 58 échantillons collectés sur sept sites en 2007 et 2008 (Byer et al. 2010).
Muir et al. (2014) ont analysé des échantillons de mysidacé prélevés dans le lac Ontario en juin 2013. Des concentrations de 0,063 ng/g ph d’EAT ont été mesurées dans les mysidacés. De 2005 à 2010, Muir et al. (2011) ont collectés des échantillons de zooplancton dans les lacs Érié, Ontario et Opeongo et dans la truite grise et la mysidacé du lac Ontario. La concentration d’EAT mesurée dans le zooplancton des lacs Ontario et Opeongo étaient respectivement de 0,0024 et 0,0032 ng/g ph. Dans la truite grise et le mysidacé, elle était respectivement de 0,327 et 0,032 ng/g ph. La concentration d’EAT dans le zooplancton du lac Érié était inférieure à la limite de détection.
Une étude de biosurveillance de l’EAT dans les œufs de trois espèces de goélands présents dans 19 colonies a été réalisée à travers le Canada en 2009 (Martin et Hughes 2016a). Des concentrations maximales respectives de 0,12 et 0,16 ng/g ph ont été rapportées pour le goéland à ailes grises (Larus glaucescenus) et le goéland argenté (Larus argentatus) à l’île Mitlenatch (C.-B.) et à l’île Manawagonish (N.-B.) Dans vingt pour cent des échantillons, la concentration d’EAT était supérieure à la limite de détection (0,02 ng/g ph). Une étude de biosurveillance des œufs d’étourneau sansonnet (Sturnus vulgaris) de 2009 a montré que le niveau d’EAT était inférieur à la limite de détection dans des échantillons provenant de 17 sites urbains à travers le Canada (Martin et Hughes 2016b).
La concentration d’EAT était inférieure à la limite de détection (< 3 ng/g ph) chez trois hirondelles (Tachycineta bicolor) lors d’une étude menée à proximité de deux systèmes de traitement des eaux usées et d’un réservoir de référence en Ontario, Canada (2007 à 2010) (Gilchrist et al. 2014).
Une gamme de polluants émergeants et historiques a été analysée dans les œufs de 3 espèces d’oiseaux marins (eider commun (Somateria mollissima), cormoran huppé (Phalacrocorax aristotelis) et goéland argenté européen (Larus argentatus) de la côte norvégienne afin d’évaluer les profils d’exposition à ces mélanges de substances. Les concentrations d’EAT étaient inférieures à la limite de détection (0,01 ng/g) (Huber et al. 2015).
Von Der Recke et Vetter (2007) ont détecté de l’EAT à raison de 5,4 µg/kg ph dans le petit lard et de 3,1 à 10 µg/kg ph dans le cerveau de phoques du Groenland (Phoca groenlandica) de la mer de Barents et de la mer du Groenland. Cette étude indique que l’EAT a été capable de pénétrer la barrière sang-cerveau. Le 2,3‑dibromopropyl-2,4,6-tribromophényléther (DPTE) était le composé organobromé prédominant dans ces échantilloons (322 à 470 ng/g ph dans le petit lard, 130 à 340 ng/g ph dans le cerveau). Le (2-bromoprop-2-ènyl)-2,4,6-tribromophényléther (BATE) était aussi présent dans ces échantillons à une concentration environ la même que celle d’EAT. Les rapports EAT/DPTE et BATE/DPTE étaient respectivement de 0,018 et 0,015 dans le petit lard et de 0,030 et 0,019 dans le cerveau. La co-occurrence générale de l’EAT et du BATE renforce l’hypothèse selon laquelle la source de l’EAT présent dans ces échantillons était la biotransformation du DPTE. Des études sur la transformation anaérobie du DPTE par des corrinoïdes super-réduits ont mis en évidence la formation d’EAT.
Sühring et al. (2015b) ont analysé le transfert maternel de substances ignifuges chlorées chez l’anguille européenne dans deux systèmes de drainage en Allemagne (fleuve Ems et fjord Schlei). L’étude a montré que l’EAT était absorbé de manière significative à partir des eaux environnantes, plutôt que juste à partir des aliments, et qu’il peut être produit lors de processus métaboliques ou de biotransformation. L’EAT a été détecté dans divers tissus de l’anguille, dont les muscles (0,7 à 6,2 ng/g), les œufs (0,16 à 0,80 ng/g) et les gonades (0,19 à 2,9 ng/g).
Des échantillons composites de moules bleues ont été collectés en 2009 dans les eaux de surface de deux stations urbaines à Åse, Norvège (TemaNord 2011). De l’EAT a été détecté dans un échantillon d’une des stations, à un niveau de 0,0045 ng/g ph.
8. Devenir et comportement dans l’environnement
8.1 Distribution dans l’environnement
L’EAT devrait être rejeté principalement dans les effluents industriels d’installations qui utilisent cette substance pour la fabrication de PSE et de produits électroniques. Aucune donnée sur la présence d’EAT dans le lixiviat de sites d’enfouissement n’a été rapportée à ce jour, mais de telles données pourraient être utiles pour interpréter les rejets en fin de vie utile.
La distribution massique de l’EAT calculée à l’aide du modèle de fugacité de niveau III (EQC 2012), en utilisant les émissions individuelles à l’équilibre dans l’air, l’eau et le sol, est donnée dans le tableau 8-1.
Les résultats obtenus avec le modèle de fugacité de niveau III montrent que l’EAT devrait résider principalement dans le sol ou les sédiments, selon le milieu dans lequel il est rejeté.
| EAT | Air | Eau | Sol | Sédiments |
|---|---|---|---|---|
| Air (100 %) | Négligeable | Négligeable | 78,6 | 20,7 |
| Eau (100 %) | Négligeable | 2,1 | Négligeable | 97,9 |
| Sol (100 %) | Négligeable | Négligeable | 100 | Négligeable |
a EQC, v. 1.00, 2012.
b Les propriétés physiques et chimiques et les demi-vies (t1/2) de l’EAT dans les milieux de l’environnement sont requises pour la modélisation et sont données à l’annexe A.
Quand de l’EAT est rejeté dans l’air, une quantité négligeable devrait rester dans la phase gazeuse, en raison de sa dégradation rapide due la la réaction avec des radicaux hydroxyles (t½ = 5,88 heures) et à son affinité pour les particules atmosphériques (log Koa élevé). Par conséquent, l’EAT ne devrait pas résider dans l’air suffisamment longtemps pour être transporté à grande distance dans l’air vers des régions éloignées. Cependant, des résultats de surveillance indiquent que l’EAT est plus persistant lorsqu’il est associé à des particules (section 7.1.1). Les particules se déposent sur le sol et l’eau sous forme de dépôts humides ou secs. La plus grande partie de l’EAT présent dans l’air sera transférée vers le sol (78,6 %), et une petite partie vers les sédiments (20,7 %). L’EAT a une faible pression de vapeur prédite, entre 0,0085 et 0,013 Pa, et une constante de Henry modérée, de 2,68 à 64,08 Pa·m3/mol. Les résultats de la modélisation indiquent que des quantités négligeables de cette substance se rétrouveront dans l’air.
Quand l’EAT est rejeté dans l’eau, la plus grande partie se retrouvera dans les sédiments (97,9 %) ou s’adsorbera fortement aux solides en suspension pour finalement se déposer dans les sédiments. Compte tenu de sa faible pression de vapeur (0,0135 Pa), l’EAT ne devrait pas se volatiliser à partir de l’eau de surface. L’EAT devrait s’adsorber sur les particules. Par conséquent, il est anticipé que les pertes d’EAT par les systèmes aqueux devraient aboutir dans les sédiments, où elles demeureront, car la biodégradation devrait être très lente (2 % de dégradation dans les sédiments). Il est improbable que l’EAT se retrouve dans l’eau à un degré important en raison de sa faible solubilité empirique de 0,24 mg/L, seule une petite quantité demeurant potentiellement sous forme dissoute dans l’eau (c.-à-d. ~ 2 %).
Quand l’EAT est rejeté dans le sol uniquement, il devrait y demeurer (100 %) en raison de sa nature hydrophobe. L’évaporation à partir du sol n’est pas attendue, compte tenu de sa faible pression de vapeur. Il est aussi anticipé que l’EAT devrait également être stable dans le sol et résister à la minéralisation (tableau 8-2), et les processus de perte pour le sol dépendront de l’enfouissement dans le sol ou du ruissellement en surface des particules de sol.
8.1.1 Potentiel de transport à grande distance
Les modèles pour la répartition gaz/aérosol sont basés sur la pression de vapeur ou le log Koa. Herzke et al. (2010) ont étudié le potentiel de transport à grande distance de l’EAT et ont trouvé qu’un log Koa de 9,05 et un log Kae de -2,96 (tableau 3-1) indiquent que l’EAT peut être transporté à grande distance. Toutefois, sa courte demi-vie atmosphérique suggère que le transport sera limité à l’environnement près de la source, car la substance devrait subir une dégradation peu de temps après son rejet dans l’air, lorsqu’elle est en phase gazeuse. Ma et. al. (2012) ont rapporté que de l’EAT était présent dans les phases particulaire et gazeuse dans la région des Grands Lacs (ECCC 2016). Lorsqu’il s’associe à des particules (aérosol), l’EAT devrait être plus persistant et susceptible à un transport à grande distance.
Nous avons utilisé le modèle de transport et de persistance de niveau III (TaPL3) (TaPL3 2000) pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l’air par 63 % de la substance. Beyer et al. (2000) ont proposé que des DTC > 2000 km représentent un potentiel de transport atmosphérique à grande distance (PTAGD) élevé, celles de 700 km à 2000 km un PTADG modéré et de < 700 km un PTAGD faible. En se basant sur une DTC estimée de 130 km, le potentiel de transport atmosphérique à grande distance de l’EAT est donc considéré faible.
Le modèle de criblage des POP de l’OCDE peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (OCDE 2006). La distance de transport caractéristique (DTC) calculée pour l’EAT à l’aide du modèle de l’OCDE est de 120 à 122 km, indiquant que l’EAT a toujours un potentiel de transport dans l’air, mais qu’il est inférieur à la limite suggérée (5097 km; DTC du PCB‑28) pour les polluants mondiaux par Klasmeier et al. (2006) et Liagkouridis et al. (2015). Le modèle permet aussi de calculer une persistance globale (Pglob) de 260 jours, ainsi qu’une efficacité de transfert (ET), qui est le pourcentage du flux d’émissions dans l’air qui se déposent à la surface (eau ou sol) dans une région éloignée. L’efficacité du transfert calculée pour l’EAT était de 8,18 × 10-3 %, qui est inférieure à la limite de 2,248 % (PCB-28) établie en se basant sur les substances de référence du modèle connues empiriquement pour se déposer sur le sol ou l’eau à partir de l’air. L’ET pour l’EAT a été estimée à 0,01 % par Liagkouridis et al. (2015) en utilisant la persistance globale (Pov) de l’OCDE et l’outtil de criblage du PTAGD.
La faible ET suggère que l’EAT ne se dépose pas à un degré important dans des régions éloignées. La détection d’EAT dans la région des Grands Lacs, à Vancouver et dans des centres urbains aux États-Unis (Shoeib et Jantunen 2014, Ma et al. 2012, Shoeib et al. 2012) suggère qu’il existe des sources (urbaines) locales d’EAT ou que la substance est transportée en phase gazeuse.
L’outil de l’OCDE pour les POP modélise un sous-milieu de matières particulaires (aérosol) dans l’air, tandis que le modèle TaPL3 tient compte du sous-milieu en phase liquide dans l’air (c.-à-d. la répartition dans la phase aqueuse à partir de la phase gazeuse, puis dépôts de pluie dans le sol et l’eau), mais ne tient pas compte des particules. En se basant sur la pression de vapeur de 0,013 Pa et le log Koa de 9,055, la plus grande partie de l’EAT devrait demeurer en phase gazeuse (environ 99 %).
En résumé, l’EAT devrait rester principalement en phase gazeuse dans l’atmosphère, le sol et les sédiments. En se basant sur ses propriétés physiques et chimiques et certains modèles, l’EAT ne devrait pas être très préoccupant en termes de transport à grande distance. En se basant sur la faible efficacité de transfert prédite pour l’EAT et sa courte demi-vie atmosphérique, le transport sera limité à l’environnement près de la source, puisque la substance devrait être dégradée peu de temps après son rejet dans l’air quand elle est en phase gazeuse.
Des données empiriques indiquent que l’EAT ne subira pas de photodégradation par la lumière visible, la photodégradation devrait plutôt être causée par du rayonnement ultraviolet (Présentation de projet 1996i).
8.2 Persistance dans l’environnement
En se basant sur les rejets d’EAT attendus et les caractéristiques de répartition, la persistance dans l’environnement est pertinente pour l’eau, le sol et les sédiments. Cependant, en raison de la détection fréquente d’EAT dans l’air, ce milieu sera également pris en compte. Des modélisations de l’EAT dans l’air donnent une demi-vie inférieure à un jour (en phase gazeuse) et une persistance (Pglob) de 171 jours (4107 heures) (Scheringer et al. 2009). Des données empiriques indiquent que l’EAT est persistant dans les sols et les sédiments. Toutefois, les données modélisées suggèrent qu’il sera minéralisé en quelques mois et probablement en moins d’un an dans les sols et les sédiments. Ces résultats contradictoires sont probablement dus au fait que si l’EAT est adsorbé sur des particules, la dégradation sera plus longue (tableau 82). Les données de surveillance de l’environnement au Canada reflètent les concentrations d’EAT dans des environnements intérieurs et extérieurs. Les données empiriques, les résultats de la modélisation de la fugacité de niveau III et les propriétés physiques et chimiques de l’EAT indiquent que le sol et les sédiments sont des réservoirs clés dans l’environnement pour l’EAT. Des données empiriques et des données modélisées sur l’EAT ont été prises en compte afin de fournir le meilleur poids de la preuve possible pour la persistance de l’EAT et de ses métabolites ou produits de transformation. Des métabolites potentiels de l’EAT ont été étudiés en se basant sur une modélisation du métabolisme. Nous présentons dans le tableau 8-2 des données sur la la dégradation abiotique modélée et la modélisation de la fugacité pour l’EAT.
8.2.1 Dégradation abiotique
L’hydrolyse de l’EAT a été déterminée à l’aide de la ligne directrice 111 de l’OCDE (Présentation de projet 1996g) (tableau 8-2). Les résultats ont montré une décomposition dans l’eau inférieure à 10 % après cinq jours à 50 °C dans des conditions acides, neutres ou alcalines (pH de 4, 7 et 9). La demi-vie correspondante (t½) à 50 °C est supérieure à un an.
Les résultats d’une étude du spectre d’absorption de la lumière visible et ultraviolette par l’EAT (Présentation de projet 1996i) ont donné une indication des longueurs d’onde auxquelles l’EAT est susceptible d’une photodégradation directe par la lumière solaire (limitée à la région 290-800 nm). Aucun pic d’absorption n’a été observé dans la gamme visible. Les résultats d’une étude sur le comportement photochimique de substances ignifuges ont indiqué que l’EAT peut subir une transformation photochimique dans des conditions de lumière solaire simulée (Zhang et al. 2016). Les demi-vies calculées de photolyse directe par le rayonnement solaire allaient de 1,9 jour en été à 21,9 jours en hiver.
La demi-vie prédite pour la dégradation atmosphérique de l’EAT en raison de sa réaction avec des radicaux hydroxyles est de 0,33 jour (12 heures par jour, AOPWIN 2010) (constante de vitesse globale de réaction avec OH de 32,42 x 10-12 cm3/molécule.s] (tableau 8-2). Les résultats obtenus avec le modèle AEROWIN (2010) prédisent qu’une petite fraction d’EAT sera absorbée sur des particules en suspension dans l’air (Phi = 0,007), en accord avec le résultat du modèle de l’OCDE pour les POP, qui prédit qu’environ 99 % de l’EAT présent dans l’air sera dans la phase gazeuse ou la phase d’aérosol et que sa persistance globale sera de 171 jours.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre pour la dégradation/ unité | Méthode | Référence |
|---|---|---|---|---|---|
| Air | Oxydation atmosphérique (constante de vitesse avec les radicaux OH) | Demi-vie (t 1/2)) |
0,33 jour 32,42 x 10-12 cm3/ molécule.s) |
Modèle QSAR | AOPWIN 2010 (v. 1.92a)a |
| Air | Réaction avec l’ozone | Demi-vie (t 1/2)) |
0,955 jour | Modèle QSAR | AOPWIN 2010 (v. 1.92a)a |
| Air | Oxydation atmosphérique (constante de vitesse avec les radicaux OH) | Demi-vie (t 1/2)) |
3,96 heures | Modèle QSAR | Kuramochi et al. 2014 |
| Eau | Hydrolyse | Demi-vie (t 1/2)) |
> 5 jours à un pH de 4, 7 et 9 | Ligne directrice no 111 de l’OCDE | Présentation de projet 1996 |
| Eau | Hydrolyse | n.a.b | n.a.b | Modèle QSAR | HYDROWIN, 2010a |
| Eau | Hydrolyse | Demi-vie (t 1/2)) |
2880 heures | Modèle QSAR | Kuramochi et al. 2014 |
| Eau | Hydrolyse | Demi-vie (t 1/2)) |
1,9-21,9 jours | CG-SMc | Zhang et al. 2016 |
a EPI Suite (2010-2012).
b Le modèle ne donne pas d’estimation pour ce type de structure.
c Chromatographie en phase gazeuse-spectrométrie de masse
8.2.2 Biodégradation
Des données qualitatives sur la dégradation primaire et finale de l’EAT (BIOWIN 2010) sont présentées dans les tableaux 8-2 et 8-3. Le modèle AOPWIN prédit une courte demi-vie de 0,330 jour dans l’air, suggérant que l’EAT n’est pas très stable dans ce milieu.
Des études empiriques indiquent qu’il est improbable que l’EAT soit biodégradé dans des conditions aérobies. L’élimination de l’EAT a été évaluée à l’aide d’un test semi‑continu sur des boues activées provenant d’une usine de traitement des eaux usées (Présentation de projet 1989a). Le pourcentage de récupération basé sur la quantité totale de substance testée ajoutée au système expérimental a été déterminé chaque semaine et au bout de 28 jours. Le degré élevé d’élimination de la substance testée a été attribué à l’adsorption à la surface des biosolides (91 % à 95 %). Toutefois, la biodégradation de la substance n’a pas pu être mise en évidence sur la base de l’analyse du carbone organique dissous (COD). L’élimination des biosolides par biodégradation est l’un des principaux processus d’élimination de l’EAT de l’eau (tableau 8-3).
Une étude sur la biodégradation aérobie rapide dans les sédiments a été menée en suivant la méthode 392 de l’Agence de l’environnement du Japon (similaire à la ligne directrice 301C de l’OCDE – test MITI modifié) (Présentation de projet 1989a) (tableau 8-3). Une biodégradation maximale de 2 % a été observée, mesurée au moyen de la demande biologique en oxygène (DBO), indiquant que l’EAT n’est pas biodégradé facilement.
Il existe des données empiriques limitées sur la persistance de l’EAT et, en conséquence, une approche de poids de la preuve basée sur une modélisation QSAR a été faite en utilisant les modèles de dégradation indiqués dans le tableau 8-3. Étant donné l’importance écologique du sol et des sédiments et le fait que l’EAT devrait demeurer dans ces milieux, la biodégradation dans le sol et les sédiments a été examinée. Les résultats de cette approche indiquent que l’EAT est également très stable dans le sol et les sédiments et qu’il est probable qu’il entraîne des expositions à long terme dans ces milieux.
Les données modélisées sur la persistance obtenues avec le sous-modèle 4 de BIOWIN indiquent que dans l’eau, il n’y aura pas de dégradation primaire importante de l’EAT. Des données modélisées obtenues avec les sous-modèles 3 et 6 de BIOWIN indiquent également qu’il faudra des mois ou plus pour que l’EAT soit complètement minéralisé dans l’eau. Néanmoins, des résultats obtenus avec le sous-modèle 5 de BIOWIN indiquent que l’EAT sera minéralisé dans l’eau en quelques mois. Les résultats de probabilité des modèles TOPKAT et CATABOL sont contradictoires, ceux du modèle TOPKAT suggèrent une vitesse de minéralisation plus rapide que ceux du modèle CATALOGIC. Des valeurs de biodégradation aérobie et anaérobie obtenues avec le modèle CATALOGIC indiquent une lente vitesse de minéralisation, en accord avec les données empiriques.
En utilisant un rapport d’extrapolation de 1/1/4 pour la demi-vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al. 1995), il est prédit que l’EAT sera persistant dans le sol et les sédiments.
L’hydrolyse de l’EAT n’a pu être estimée, car il n’y a pas de substance chimique de structure comparable dans l’ensemble d’apprentissage du modèle HYDROWIN (2010).
En résumé, des données empiriques indiquent une biodégradation minimale et une sorption de la substance dans les sédiments ou le sol, qui prolongeront sa demi-vie. Les données modélisées indiquent que l’EAT peut se dégrader à un faible degré en phase aqueuse, mais qu’il est plus résistant dans le sol et les biosolides. Des résultats de biodégradation aérobie, y compris des données empiriques et modélisées, indiquent que la biodégradation se produira en quelques mois plutôt qu’en quelques années. Dans l’ensemble, l’EAT est jugé modérément persistant dans l’eau, l’air, le sol, et les sédiments.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre de dégradation/ unité | Méthode | Référence |
|---|---|---|---|---|---|
| Boues activées | Biodégradation | 2 % | Biodégradation de 28 jours Demande biochimique en oxygène/% | Test semi‑continu d’élimination par des boues activées | Présentation de projet 1989a |
| Boues activées | Biodégradation | 91 à 95 % de la substance adsorbée sur les boues | Biodégradation de 90 jours/% | Test semi‑continu d’élimination par des boues activées | Présentation de projet 1989a |
| Eau | Biodégradation primaire (aérobie) | 2,93a « persistant » | Persistant | Modèle QSAR | BIOWIN 2010c |
| Eau | Biodégradation (aérobie) | 1,91a | Se biodégrade en quelques mois | Modèle QSAR | BIOWIN 2010d |
| Eau | Biodégradation (aérobie) | 0,389b | Non persistant | Modèle QSAR | BIOWIN 2010e |
| Eau | Biodégradation (aérobie) | 0,168b | Persistant (se biodégrade lentement) | Modèle QSAR | BIOWIN 2010f |
| Eau | Biodégradation (aérobie) | 0,96b « se biodégrade lentement » | Se biodégrade | Modèle QSAR | TOPKAT 2004 |
| Eau | Biodégradation (aérobie) | % DBO = 2,1 | « Se biodégrade lentement » | Modèle QSAR | Catalogic 2012 |
a Le résultat est un score numérique de 0 à 5.
b Le résultat est un score de probabilité pour la biodégradation rapide.
c Sous-modèle 4 : enquête d’expert (résultats qualitatifs)
d Sous-modèle 3 : enquête d’expert (résultats qualitatifs)
e Sous-modèle 5 : MITI, probabilité linéaire
f Sous-modèle 6 : MITI, probabilité non linéaire
8.2.3 Produits de transformation
Le modèle CATALOGIC (2012) prédit quatre produits de transformation possibles (moins de 5 % chacun, < 0,05 mole par mole de substance mère) pour l’EAT, produits moins hydrophobes que la substance mère et ayant des log Koe allant de 3,6 à 5,1. Les produits de transformation potentiels sont présentés dans le document d’ECCC (2016), par ordre décroissant du rapport molaire avec la substance mère. Trois des quatre substances peuvent être identifiées : le 3-(2,4,6-tribromophénoxy)propane-1,2-diol (no CAS 51286-98-7), l’oxyde de 2,4-dibromophényle et de prop-2-ènyle (no CAS 69227-61-8) et le 2,4,6-tribromophénol (no CAS 118-79-6). Ces quatre produits de transformation ne devraient pas subir de biodégradation ultime (EPI Suite 2012). Les résultats obtenus avec le modèle CATABOL suggèrent également que leur potentiel de biodégradation ultime est faible ou inexistant, c.-à-d. qu’ils seront biodégradés lentement. Les résultats obtenus avec le modèle linéaire MITI (BIOWIN 5) indiquent, toutefois, que les produits de transformation devraient subir une biodégradation primaire rapide.
La persistance de deux des métabolites potentiels de l’EAT, à savoir le 2,4,6‑tribromophénol (2,4,6-TBP) et l’acroléine, a été évaluée. Le 2,4,6-TBP en phase vapeur est dégradé dans l’atmosphère par réaction avec des radicaux hydroxyles produits photochimiquement, avec une demi-vie de réaction dans l’air estimée à 34 jours (OMS 2005). Le 2,4,6-TBP a atteint 49 % de sa demande biochimique en oxygène théorique en 28 jours en utilisant un inoculum de boues activées à raison de 30 mg/L lors d’un test MITI au Japon, un résultat qui ne respecte pas le critère de biodégradation immédiate (CITI 1992). L’acroléine est une substance hautement réactive dans l’air et dans l’eau et a une courte demi-vie dans ces milieux. Il est également improbable que l’acroléine se répartisse dans le sol et les sédiments depuis ces milieux.
8.3 Potentiel de bioaccumulation
Pour l’évaluation de l’EAT, nous avons pris en compte ses propriétés (log Koe, log Koa, taille moléculaire et sections) ainsi que les résultats de la modélisation de la bioaccumulation tirés d’une étude empirique sur sa bioamplification.
Aucune étude empirique sur les facteurs de bioconcentration (FBC) n’a été trouvée dans la littérature à ce jour. Les résultats d’une étude sur la chaîne alimentaire terrestre (végétation-caribou-loup) (Morris et al. 2014, non publiée) indiquaient que l’EAT ne subissait pas de bioamplification (tableau 8-5). Une modélisation cinétique du bilan massique corrigée pour le métabolisme a été utilisée pour la bioaccumulation, comblant ainsi les lacunes correspondantes dans les données empiriques. Les résultats de la modélisation du FBA et du FBC de l’EAT sont respectivement de 59 440 et 8965 L/kg.
Il existe des renseignements appuyant l’hypothèse selon laquelle l’EAT est un produit de biotransformation du 2,3-dibromopropyl-2,4,6-tribromophényléther (DPTE, no CAS 35109-60-5) (Von Der Recke et Vetter 2007, Ma et al. 2012). L’utilisation du DPTE comme produit ignifuge dans le polypropylène de qualité extrusion a été rapportée (PISSC 1997). En raison de la co-occurrence de l’EAT dans des échantillons de phoques contaminés par du DPTE et de rapports EAT/DPTE relativement constants, Von Der Recke et Vetter (2007) ont proposé que les résidus d’EAT mesurés chez des phoques proviendraient probablement de la transformation du DPTE, le produit principal étant l’EAT, qui représente 68 % du DPTE initial. Il est à noter que la production de DPTE a cessé au milieu des années 1980 (Ma et al. 2012).
Les FBC des quatre produits de transformation de l’EAT allaient de 189 à 2571 L/Kg ph et les FBA de 190 à 3967 L/Kg ph, suggérant qu’il existe un certain potentiel d’accumulation de ces composés dans les organismes aquatiques. Des valeurs de FBC de 513 et 83 ont respectivement été mesurées chez le poisson-zèbre (Brachydanio rerio) et la tête-de-boule (Pimephales promelas) dans le cas du 2,4,6-TBP, suggérant que le potentiel de bioconcentration du 2,4,6-TBP dans les organismes aquatiques est modéré (OMS 1995). L’exposition du crapet arlequin (Lepomis macrochirus) au 2,4,6‑TBP pendant 28 jours a conduit à une bioaccumulation de 20 fois la dose dans les tissus comestibles et à une bioconcentration 140 fois dans les viscères. Parmi les métabolites potentiels de l’EAT, l’acroléine est rapidement métabolisée par des organismes et n’est pas bioaccumulable (Environnement Canada, Santé Canada 2000). Un facteur de bioconcentration de 344 a été rapporté pour l’acroléine (Environnement Canada, Santé Canada 2000).
Une valeur modélisée de log Koe de 5,59 pour l’EAT (tableau 3-1) suggère que cette substance a un fort potentiel de bioaccumulation et de bioamplification dans le biote, car elle se situe dans la gamme de bioaccumulation et d’hydrophobie élevée du log Koe. De plus, la combinaison de la valeur de log Koe de 5,59 et de la valeur modélisée de log Koa de 8,55 suggère qu’une exposition par voie alimentaire terrestre peut constituer une importante voie d’absorption chez les mammifères. Gobas et al. (2003) ont proposé des critères de criblage pour la bioaccumulation potentielle de produits organiques chez les animaux à respiration aérienne, notamment un log Koe ≥ 2 et un log Koa ≥ 6.
Les résultats de la modélisation du FBC et FBA de l’EAT sont présentés dans le tableau 8-4. Des FBC allant d’environ 2300 à 8965 L/kg et un FBA de 59 440 L/kg ph pour les poissons de niveau trophique intermédiaire suggèrent que l’EAT est potentiellement fortement bioaccumulable dans le biote aquatique. Étant donné que des données empiriques sur le FBC ne sont pas disponibles pour le moment afin de calculer une constante du taux métabolique (kM), la kM pour l’EAT a été estimée à 0,02/jour pour un poisson de 10 grammes à 15 °C à l’aide du modèle BCFBAF (version 3.01) d’EPI Suite (2012). Le calcul de kM est présenté dans Arnot et al. (2009). Le FBC et le FBA de l’EAT ont été estimés à l’aide de modèles basés sur la structure et d’un modèle cinétique du bilan massique à trois niveaux trophiques. Toutes les estimations du FBC et du FBA, à l’exception de celle du sous-modèle 1 du modèle BCFBAF (dans EPIWIN v. 4.0), ont été corrigées pour tenir compte du métabolisme, car ce dernier représente une voie d’élimination fondamentale de nombreux produits chimiques.
Des études faisant le lien entre les données sur le FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al. 2005, Sakuratani et al. 2008) suggèrent que la probabilité pour une molécule de traverser la membrane cellulaire branchiale par diffusion passive diminue significativement à mesure qu’augmente le diamètre maximal (Dmax). Les résultats de ces études suggèrent que cette probabilité diminue de façon appréciable lorsque le Dmax est supérieur à environ 1,5 nm et de façon beaucoup plus appréciable dans le cas des molécules ayant un Dmax supérieur à 1,7 nm. En se basant sur l’analyse 3D de conformères de l’EAT, à l’aide du modèle FBCmax avec facteurs d’atténuation (Dimitrov et al., 2005), les diamètres moléculaire et effectif de l’EAT vont de 1,07 à 1,32 nm. Cela suggère qu’il est improbable que l’absorption de l’EAT soit restreinte par des effets stériques à la surface des branchies en raison de sa taille moléculaire.
Facteur de bioaccumulation (FBA)
Il n’existe pas de données empiriques sur la bioaccumulation de l’EAT. Les facteurs de bioaccumulation élevés obtenus par modélisation indiquent que l’EAT peut potentiellement être bioaccumulé dans le biote suite à une exposition due au régime alimentaire et à l’eau. Des données sur les propriétés physiques et chimiques de l’EAT suggèrent également qu’il pourrait être biodisponible dans l’environnement. Il est improbable que son absorption dans les branchies soit limitée en raison de son encombrement stérique. Cela indique qu’il existe un potentiel de bioaccumulation et de transfert dans la chaîne alimentaire de cette substance, ainsi qu’un potentiel d’exposition des espèces sauvages, pouvant indiquer un potentiel de toxicité accru pour l’environnement.
Facteur de bioamplification (FBAm)
Le processus grâce auquel la concentration d’un produit chimique dans un organisme atteint un niveau supérieur à celui de son alimentation, en raison de l’absorption alimentaire, est appelé bioamplification et est caractérisé par un facteur de bioamplification FBAm (Gobas et Morrison 2000). Un FBAm supérieur à 1 indique qu’une bioamplification survient potentiellement et peut être considérée comme un indicateur du potentiel d’absorption et d’accumulation dans le biote. Nous présentons dans le tableau 8-5 des données empiriques sur le FBAm de l’EAT. Les FBAm sont basés sur des concentrations moyennes arithmétiques corrigées pour les lipides de l’EAT chez le caribou, et le loup-caribou dans la région de Bathurst (Territoires du Nord‑Ouest et Nunavut) (Morris et al. 2014, non publié). Les FBAm allaient de 0,072 à 0,16 pour le régime alimentaire du caribou et de 0,34 à 5,2 pour le loup (foie et muscles du caribou respectivement). Toutefois, bien que les FBAm pour le loup-muscle du caribou dépassaient 1, ils n’ont pas été jugés statistiquement significatifs, et l’EAT n’est pas considéré comme subissant une bioamplification selon cette étude. Les auteurs ont suggéré que la bioamplification de l’EAT était influencée par une transformation environnementale et métabolique. Un projet mené par Muir et al. (2014) montre cependant que les facteurs de bioamplification de l’EAT pour le couple caribou-loup étaient supérieurs à 1 (4,3).
Facteur d’amplification trophique (FAT)
Le facteur d’amplification trophique (FAT) est une mesure du potentiel de bioamplification moyen d’une substance dans un réseau trophique dans des conditions de terrain. Il est estimé en corrélant les concentrations de la substance normalisées dans le biote à différents niveaux trophiques.
Une absence d’amplification trophique de l’EAT dans le réseau trophique terrestre (0,57) a été mise en évidence, en comparaison du FAT élevé dans le réseau alimentaire pélagique du lac Ontario (Muir et al. 2014). Ces auteurs ont rapporté un FAT de 3,1 pour l’EAT dans un réseau trophique pélagique du lac Ontario.
| kM (jour–1) | Modèle et base du modèle | Paramètre | Valeur (poids humide) (L/kg) | Référence |
|---|---|---|---|---|
| ~ 0,02/jour (10 g de poisson) | BCFBAF Sous-modèle 1 (régression linéaire) | FBCa | 2270 | BCFBAF 2010 (v. 3.01) |
| ~ 0,02/jour (10 g de poisson) | BCFBAF Sous-modèle 2 (bilan massique) (FBC d’Arnot-Gobas pour les poissons de niveau trophique intermédiaire) | FBCb | 8965 | BCFBAF 2010 (v. 3.01) |
| ~ 0,01 | FBCmax avec facteurs d’atténuation | FBCc | 5623 | Dimitrov et al. 2005 |
| ~ 0,02 /jour (10 g de poisson) | BCFBAF Sous-modèle 3 (bilan massique de Gobas) (FBA d’Arnot-Gobas pour les poissons de niveau trophique intermédiaire) | FBAb | 59 440 | BCFBAF 2010 (v. 3.01) |
Abréviations : kM = constante de vitesse métabolique;
FBC = facteur de bioconcentration;
FBA = facteur de bioaccumulation.
a Résultat généré à l’aide des valeurs de poids, de lipides et de température tirées de l’étude d’Arnot et Gobas (2003a).
b Résultats générés à l’aide des valeurs de poids, de lipides et de température pour un poisson de niveau trophique intermédiaire.
c Les facteurs d’atténuation possibles comprennent l’ionisation, la taille moléculaire, le métabolisme et la solubilité dans l’eau.
| Organisme testé | Rapport de la moyenne arithmétique ± écart-type | Référence |
|---|---|---|
| Régime alimentaire du caribou (automne/hiver) | 0,086 | Morris et al. 2014, non publié |
| Régime alimentaire du caribou (printemps) | 0,072 | Morris et al. 2014, non publié |
| Régime alimentaire du caribou (été) | 0,16 | Morris et al. 2014, non publié |
| Loup-muscle du caribou | 5,2 (non statistiquement significatif) | Morris et al. 2014, non publié |
| Loup-foie du caribou | 0,34 | Morris et al. 2014, non publié |
| Loup-corps complet du caribou | 4,3 (non statistiquement significatif) | Morris et al. 2014, non publié |
8.4 Résumé du devenir dans l’environnement
Des rejets d’EAT dans l’environnement au Canada peuvent se produire lors d’une utilisation industrielle (p. ex. fabrication de produits), de l’utilisation commerciale ou par un consommateur du produit, de la durée de vie et de l’élimination de la substance ou de produits en contenant. Des rejets peuvent survenir dans des environnements intérieurs ou extérieurs (Shoeib et al. 2012), et il devrait y avoir des rejets dans des eaux usées. Bien qu’il existe un certain potentiel de rejet d’EAT à partir de produits dans lesquels de l’EAT est utilisé comme additif ignifuge, l’absence de données empêche une quantification précise de l’exposition dans l’environnement due à la lixiviation à partir de produits commerciaux ou de produits disponibles pour les consommateurs.
En se basant sur ses caractéristiques de sorption élevées, l’EAT devrait se retrouver dans les sols, les biosolides ou les sédiments. L’EAT exhibe une dégradation primaire rapide et une dégradation ultime plus lente. La sorption entraînera des demi-vies plus longues dans les sols et les sédiments. La forte persistance de l’EAT signifie qu’il existe un potentiel d’accumulation au fil du temps dans les milieux sédimentaires et terrestres environnants, découlant d’émissions continues. L’EAT devrait être biodisponible et son potentiel de bioaccumulation élevé indique qu’il peut s’accumuler dans des organismes, alors qu’un potentiel de bioamplification ne peut être exclu.
9. Potentiel d’effets nocifs sur l’environnement
9.1 Effets sur l’environnement
Des propriétés physiques et chimiques, comme le log Koe et le log Koa, indiquent que l’EAT peut potentiellement être biodisponible pour des organismes aquatiques ou terrestres. D’aprè le profil de la Boîte à outil QSAR de l’OCDE (2012), le mode d’action de l’EAT est classé comme « réactif non spécifié ». Le groupe éthényle extrêmement réactif peut potentiellement s’avérer dangereux pour des organismes aquatiques, benthiques ou vivant dans le sol.
En suivant une approche in silico, Kharlyngdoh et al. (2015) et Pradhan et al. (2015) ont montré que l’EAT est un antagoniste potentiellement puissant du récepteur de l’androgène. Kharlyngdoh et al. (2015) ont aussi rapporté que l’EAT avait un impact sur l’expression des gènes du système de transport des acides aminés de type L (LAT), qui sont nécessaires pour que les acides aminés puissent passer au travers de la barrière sang-cerveau. La perturbation de la fonction des gènes du LAT a eu des impacts sur plusieurs troubles du cerveau.
Pradhan et al. (2015) ont analysé l’impact de l’EAT sur les propriétés de modulation du RA du poisson zèbre. Les résultats obtenus au moyen d’une analyse in silico et de deux logiciels, Molecular Operating Environment (MOE) et Internal Coordinate Mechanics (ICM), ont mis en évidence que l’EAT a le potentiel d’agir comme un antagoniste du RA du poisson zèbre.
La méthode de criblage in vitro d’hépatocytes embryonnaires aviaires a été utilisée pour étudier les effets de composés organiques ignifuges, dont l’EAT, sur la cytotoxicité et l’expression de l’ARNm de gènes associés au métabolisme xénobiotique, à la voie des hormones thyroïdiennes, au métabolisme des lipides et à la croissance (Porter et al. 2014). Il a été montré que l’exposition d’hépatocytes embryonnaires de poulet et de goéland argenté à de l’EAT faisait diminuer la viabilité des hépatocytes embryonnaires de poulet, avec une LC50 de 115 ± 36 µM. Aucun effet nocif n’a été rapporté quant à la viabilité des hépatocytes de goéland argenté. Il a aussi été rapporté que l’EAT se lie au récepteur des hydrocarbures aryliques (AhR) et l’active, et qu’il dérégule chez les hépatocytes de poulet l’expression du CYP1A4 (cytochrome P450 1A4 mRNA) (un enzyme métabolisant de type I) d’un facteur 11.
Crump et al. (2016) ont utilisé des méthodes développées pour les hépatocytes embryonnaires de poulet afin de comparer les paramètres à ceux d’un oiseau piscivore, le cormoran à aigrettes (Phalacrocorax auritus), qui serait exposé naturellement à des polluants de l’environnement. Il a été montré que l’EAT fait diminuer la viabilité des hépatocytes du cormoran d’une manière similaire à celle observée lors d’études avec des hépatocytes embryonnaires de poulet.
Il existe des preuves expérimentales confirmant que l’EAT a des effets nocifs sur des organismes aquatiques d’eau douce après une exposition à court terme (aiguë) à faible concentration. Des résultats empiriques de tests de toxicité aquatique pour le cladocère (Daphnia magna) et des poissons sont disponibles (Présentation de projet 1989b, 1990a, 1990b). Les valeurs allaient de plus de 0,019 à 0,40 mg/L (tableau 9-1).
Bien que la plus grande partie de l’EAT devrait se retrouver dans le sol, les sédiments ou la fraction lipidique du biote, p. ex. la fraction de soluté biodisponible de l’EAT est de 0,32 % (Arnot et Gobas 2008), seules des données de toxicité aquatique sont disponibles pour l’EAT. Aucune donnée empirique sur les effets chroniques de l’EAT n’est disponible.
9.1.1 Études empiriques en milieu aquatique
La toxicité aiguë de l’EAT pour le cladocère (Daphnia magna) et le crapet arlequin (Lepomis macrochiris) a été évaluée. Les résultats d’études statiques sur 48 heures pour la toxicité pour le cladocère (Daphnia magna) étaient de 0,26 et 0,40 mg/L (Présentation de projet 1989b, 1990b; tableau 9-1), résultant en une immobilité et des effets anormaux (p. ex. la montée à la surface des daphnies, ainsi que leur regroupement au fond des enceintes de test). Les résultats d’études statiques de toxicité pour le crapet arlequin ont permis de déterminer une concentration sans effet observé à 96 heures de 0,21 mg/L, basée sur l’absence de mortalité et d’effets anormaux à cette concentration.
9.1.2 Études modélisées en milieu aquatique
Nous avons résumé des données de toxicité aquatique modélisées obtenues au moyen des modèles EPI Suite (2012) et TOPKAT (2004) dans le tableau 9-2. Des valeurs de sous-refroidissement ont été utilisées pour la modélisation avec EPI Suite. Les valeurs modélisées sont supérieures à la solubilité dans l’eau de 0,76 mg/L et ne sont pas prises en compte pour le présent rapport. Les effets aigus de l’oxyde d’éthényle et de prop-2-ènyle sur des poissons et des daphnies étaient d’un ordre de grandeur inférieurs à la solubilité dans l’eau (0,089 à 0,16 mg/L, EPI Suite 2012). Les valeurs de toxicité chronique modélisées pour des composés organiques neutres étaient respectivement de 0,023 à 0,041 mg/L pour les poissons et les daphnies.
9.1.3 Estimation des résidus corporels critiques (RCC)
L’EAT ayant le potentiel d’être bioaccumulé, une analyse des résidus corporels critiques (RCC) a été entreprise afin d’étudier les expositions des poissons dues au réseau alimentaire ou à l’absorption à partir de l’eau. Le potentiel de toxicité due à l’absorption alimentaire a été étudié en se basant sur la partition importante de l’EAT dans les sédiments et le sol, sa stabilité dans l’environnement élevée et son potentiel de bioaccumulation par le régime alimentaire. L’exposition par absorption alimentaire est le scénario le plus préoccupant pour l’EAT, car ce composé a été identifié comme biodisponible. Bien qu’il existe des études sur la toxicité de l’EAT dans l’eau, les résidus corporels critiques ont été utilisés pour confirmer les résultats découlant de sources alimentaires.
Le concept de résidus corporels critiques a donc été appliqué afin d’étudier le potentiel de mortalité chez les poissons dû à l’absorption alimentaire de l’EAT biodisponible. Ce concept des RCC tient compte du fait de savoir si l’absorption d’un produit chimique présent dans l’environnement peut conduire à une accumulation à des niveaux dans le corps associés à la mortalité. McCarty (1986, 1987a, 1987b, 1990), McCarty et Mackay (1993), McCarty et al. (1985, 1991), Van Hoogen et Opperhuizen (1988) et McCarty et al. (2013) ont montré que les concentrations internes de substances narcotiques neutres causant la mort des poissons sont relativement constantes à environ 2‑8 mmol/kg pour une exposition aiguë et à 0,2-0,8 mmol/kg pour une exposition chronique. McCarty et Mackay (1993) et Escher et al. (2011) ont proposé la formule mathématique suivante :
RCC = FBA (5 % de lipides) x concentration dans l’eau du produit chimique/MM
avec :
RCC = résidus corporels critiques chez les poissons (mmol/kg)
FBA 5 % de lipides = peut être le FBA ou le FBC normalisé à 5 % de lipides (50 862 L/kg)
MM = masse moléculaire de la substance (370 g/mol)
Concentration chimique prédite dans l’eau près d’un site industriel où est utilisé de l’EAT (4 x 10- 6 g/L) (section 8.2.2)
Le RCC pour l’EAT a été estimé à 5,5 x 10-4 mmol/kg, une valeur inférieure aux seuils narcotiques internes pour la létalité aiguë ou chronique. Cependant, cela n’exclut pas le potentiel d’effets non létaux, qui ne peut être quantifié en suivant cette méthode. De plus, les rapports de fugacité biote-régime alimentaire (1,65) indiquent que l’EAT peut potentiellement être bioamplifié chez les poissons par le régime alimentaire. Les valeurs de capacité de fugacité (Zeau = 0,37, Zbiote = 8005, Zrégime alimentaire12 007 mol/(m3.Pa) montrent que la plus forte exposition pour le biote aquatique est celle due au régime alimentaire.
Bien que les résultats de RCC indiquent que l’EAT n’a pas le potentiel d’être bioaccumulé dans les tissus à des niveaux excédant les seuils de létalité des composés narcotiques, il existe un potentiel d’effets toxiques si la solubilité dans l’eau empirique (0,24 mg/L) est considérée être la concentration environnementale estimée (CEE).
En accord avec le fait que la plus grande partie de l’EAT devrait se retrouver dans le sol ou les sédiments, p. ex. la fraction de soluté biodisponible est de 0,32 % (Arnot et Gobas 2003a), les résultats de fugacité indiquent que les résultats de toxicité aquatique ne sont pas les plus pertinents pour cette substance sur le plan environnemental.
Aucune donnée de toxicité mesurée n’est disponible pour d’autres milieux de l’environnement
9.1.4 Produits de transformation
Le modèle ECOSAR (2012) a classé les dérivés de l’EAT comme composés organiques neutres, oxydes d’éthényle et de prop-2-ènyle et phénols, en se basant sur sa structure chimique. La toxicité aiguë et la toxicité chronique des produits de transformation sont respectivement estimées dans les gammes de 0,04 à 1,47 mg/L et de 0,06 à 0,26 mg/L, indiquant une toxicité modérée à élevée.
Des études sur la toxicité aquatique de deux métabolites potentiels de l’EAT, à savoir le 2,4,6-TBP et l’acroléine, ont conduit à des valeurs de toxicité aiguë du 2,4,6-TBP de 1,3 mg/L et 1,1 mg/L respectivement pour le cladocère (Daphnia magna) et la carpe commune (Cyprinus carpio), et à une CL50 à 96 h de 0,007 mg/L pour l’acroléine (Holcome et al. 1987) pour le têtard de grenouille (Xenopus laevis), suggérant que les deux substances présentent une toxicité aiguë. Des études indiquent que les organismes terrestres sont moins sensibles à une exposition aiguë à de l’acroléine (Eisler 1994).
| Organisme testé | Type de test | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Daphnia magna | Immobilisation aiguë (48 heures) | CE50 | > 0,019 | CHRIP-Japon, 2008 (cite la marge d’exposition) |
| Daphnia magna | Immobilisation aiguë (48 heures) | CE50 | 0,40 | Présentation de projet 1990a |
| Daphnia magna | Immobilisation aiguë (48 heures) | CE50 | 0,26 | Présentation de projet 1990b |
| Daphnia magna | 48 heures (absence d’immobilité) | DSEO | 0,23 | Présentation de projet 1990a |
| Daphnia magna | 48 heures (absence d’immobilité) | DSEO | 0,16 | Présentation de projet 1990b |
| Crapet arlequin (Lepomis macrochiris) | Toxicité aiguë (96 heures) | Toxicité aiguë (96 heures CL50) | > 0,21 | Présentation de projet1996 |
| Crapet arlequin (Lepomis macrochiris) | Toxicité aiguë (96 h) | DSEO | 0,21 | Présentation de projet1996 |
| Poisson | Toxicité aiguë (96 heures) | Toxicité aiguë (96 heures CL50) | > 0,025 | CHRIP/NITE 2005 |
Abréviations : CE50 = concentration d’une substance estimée susceptible d’avoir un effet chez 50 % les organismes tstés;
CL50 = concentration d’une substance estimée létale pour 50 % des organismes testés;
DSEO = dose sans effet observé, exposition à laquelle il n’y a aucune augmentation statistiquement ou biologiquement significative de la fréquence ou de la gravité d’un effet quelconque entre la population exposée et une population témoin appropriée.
| Organisme testé | Type de test | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 heures) | CL50 | 0,26 | ECOSAR 2012 (v. 1.11a) [relation structure-activité (RSA) de substance organique neutre – toxicité de référence) |
| Poisson | Toxicité chronique | NS | 0,023 | ECOSAR 2012 (v. 1.11) [relation structure-activité (RSA) de substance organique neutre – toxicité de référence) |
| Tête-de-boule (Pimephales promelas) | Toxicité aiguë (96 heures) | CL50 | 0,26 | ACD/Labs (v. 14.0) |
| Tête-de-boule (Pimephales promelas) | Toxicité aiguë (96 heures) | CL50 | < 0,098 | CPOP 2012 |
| Daphnia | Toxicité aiguë | CE50 à 48 h | 0,09 | ECOSAR 2012 (v. 1.11) [relation structure-activité (RSA) de substance organique neutre – toxicité de référence) |
| Daphnia | Toxicité aiguë | CE50 à 48 h | < 0,045 | CPOP 2012 |
| Daphnia | Toxicité chronique | NS** | 0,040 | ECOSAR 2012 (v. 1.11) (éther d’éthényle et de prop-2-ènyle) |
| Daphnia | Toxicité chronique | NS** | 0,041 | ECOSAR 2012 (v. 1.11) [relation structure-activité (RSA) de substance organique neutre – toxicité de référence) |
| Algues vertes | Toxicité aiguë | CE50 à 96 h | 0,26 | ECOSAR 2012 (v. 1.11) (éther d’éthényle et de prop-2-ènyle) |
| Algues vertes | Toxicité chronique | NS** | 0,14 | ECOSAR 2012 (v. 1.11) (éther d’éthényle et de prop-2-ènyle)) |
Abréviations : CE50 = concentration d’une substance estimée susceptible d’avoir un effet chez 50 % les organismes tstés;
CL50 = concentration d’une substance estimée létale pour 50 % des organismes testés;
NS = non spécifié
9.1.5 Calcul de la CESE et justification des facteurs d’évaluation
9.1.5.1 Eau
Une concentration estimée sans effet (CESE) a été calculée à partir de la valeur de toxicité aiguë de 0,26 mg/L (valeur expérimentale valable la plus sensible) pour le cladocère (Daphnia magna). La CESE a été obtenue en divisant la valeur de toxicité aiguë par un facteur d’évaluation de 100 afin de tenir compte de la variabilité interespèce et intraespèce de la sensibilité (10) et du passage d’effets à court et des effets à long terme (10), pour donner une valeur de 0,0026 mg/L.
9.1.5.2 Sol
Étant donné qu’aucune donnée de toxicité dans le sol n’était disponible pour l’EAT et qu’aucune donnée de toxicité dans le sol pour un analogue acceptable n’a été trouvée, aucun résultat quantitatif n’a été calculé pour la substance.
9.1.5.3 Sédiments
Étant donné qu’aucune donnée de toxicité dans les sédiments n’était disponible pour l’EAT et qu’aucune donnée de toxicité dans les sédiments pour un analogue acceptable n’a été trouvée, aucun résultat quantitatif n’a été calculé pour la substance.
9.1.5.4 Faune
Une dose létale (DL50) supérieure à 2 000 mg/kg pc/j a été rapportée lors d’une étude sur la toxicité aiguë par voie orale chez des rats Sprague-Dawley (Présentation de projet 2013). Aucune mortalité ni changement dans le poids corporel lié au traitement n’a été observé au cours de la période d’observation de 14 jours après le traitement. Des signes cliniques ont été observés après le traitement, dont une diminution de l’activité, une démarche vacillante, une coloration de l’urine et des matières fécales, des selles molles ou mucoïdes et des matières sombres autour du visage. Toutefois, ces signes ont toutefois disparu au bout du 4e jour suivant le traitement. Aucune anomalie liée au traitement n’a été relevée lors de l’autopsie. Des études sur l’EAT chez le rat suggèrent que cette substance n’est peut-être pas biodisponible pour une absorption.
La faible toxicité par voie orale chez le rat et les faibles concentrations aquatiques actuelles d’EAT dans l’environnement au Canada indiquent qu’une concentration environnementale estimée pour la faune n’est pas requise pour le moment.
9.2 Exposition dans l'environnement
9.2.1 Scénarios d’exposition et concentrations environnementales estimées (CEE) au Canada
De l’EAT peut être ajouté comme produit ignifuge au cours de la préparation du polystyrène expansé au Canada. Un scénario d’exposition a été élaboré, basé sur une utilisation de la substance pure avec un traitement secondaire hors site avant le rejet des effluents des usines de traitement des eaux usées dans diverses eaux de surface, dont des rivières de différentes tailles et un lac.
Étant donné que l’EAT est utilisé pour la fabrication de produits commerciaux et de produits disponibles pour les consommateurs et qu’il peut être présent dans des effluents industriels, un scénario d’exposition en milieu aquatique a été élaboré pour estimer la concentration dans les écosystèmes aquatiques. Une exposition aquatique à de l’EAT devrait avoir lieu si la substance est rejetée durant les procédés de fabrication ou de formulation industrielle ou vers un système de traitement des eaux usées dont les effluents sont rejetés dans un plan d’eau de surface récepteur. La concentration estimée de la substance dans les eaux réceptrices près du point de rejet du système de traitement est utilisée comme concentration environnementale estimée (CEE) pour l’évaluation du risque posé milieu aquatique. D’autres détails sur l’équation utilisée pour calculer la concentration dans le milieu aquatique sont disponibles dans le document ECCC 2016.
Nous présentons dans le tableau 9-3 la gamme des intrants utilisés pour estimer les concentrations en milieu aquatique près du point de rejet industriel résultant d’utilisations industrielles spécifiques au site. La concentration environnementale estimée (CEE) de EAT dans les eaux réceptrices a été estimée entre 2,0x10-7 et 4,2x10-6 mg / L.
| Intrant | Valeur | Justification et référence |
|---|---|---|
| Quantité (kg) | 100 à 10 000 | Renseignements déclarés en vertu de l’article 71 par un importateur; la quantité est présumée être utilisée par différents clients prévus |
| Pertes dans les eaux usées (%) | 0,1 | Hypothèse professionnelle basée sur l’utilisation |
| Efficacité d’élimination du système de traitement des eaux usées (%) | 91 | Prédite pour le traitement secondaire (Présentation de projet 1989a) |
| Nombre de jours de rejets annuels (jour) | 250 | Hypothèse standard d’EC pour une activité continue au sein d’installations industrielles |
| Débit de l’effluent du système de traitement des eaux usées (m3/j) | 700 000 à 325 627 000 | Données du système de traitement des eaux usées spécifiques au site |
| Facteur de dilution (–) | 10,0 | En assumant une dilution instantanée de l’effluent, le facteur de dilution du cours d’eau récepteur a été calculé en divisant le débit de l’effluent de l’installation (dans le cas d’un rejet direct dans le cours d’eau) ou de l’effluent de l’usine de traitement des eaux usées (reliée à l’installation) par le 10ème percentile de la distribution annuelle du débit du cours d’eau récepteur. Lorsque ce facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. Un facteur de dilution de 10 a également été utilisé pour les rejets dans un lac, une baie ou un bassin. Ce facteur de dilution maximal représente des expositions près du point de rejet de l’effluent. |
Une approche de partage eau-sédiments à l’équilibre a été suivie pour estimer la concentration d’EAT dans des sédiments benthiques. Cette approche est basée sur un principe de partage décrit par l’Agence européenne des produits chimiques (ECHA 2010). Elle comprend deux autres méthodes de calcul. La première méthode sert à estimer la concentration de la substance dans la phase aqueuse (dissoute) de l’eau sus-jacente à partir de sa concentration totale, selon des études menées par Gobas (2003 et 2010). La deuxième méthode sert à estimer la concentration de la substance dans les sédiments benthiques à partir de sa concentration dans la phase aqueuse de l’eau sus-jacente en se basant sur une hypothèse de partage à l’équilibre entre les sédiments benthiques et l’eau sus-jacente décrite par le National Center for Environmental Assessment de l’EPA des États-Unis (EPA 2003). À l’équilibre, la concentration environnementale estimée (CEE) dans les sédiments benthiques peut être corréler de façon linéaire avec la concentration dans la phase aqueuse de l’eau sus-jacente. Des scénarios d’exposition dans les sédiments ont été élaborés en tant qu’extension des scénarios de rejets industriels dans le milieu aquatique décrits ci‑dessus pour déterminer les CEE à l’équilibre dans les sédiments, normalisées pour une teneur en carbone organique de 4 % (teneur typique en carbone organique dans les sédiments benthiques des rivières et des lacs). Les CEE obtenues pour les sédiments benthiques allaient de 3,45 x 10-4 à 1,0 x 10-2 mg/kg ps.
Une méthode décrite par l’Agence européenne des produits chimiques (ECHA 2010) a été suivie afin d’estimer les CEE dans le sol résultant de l’épandage de biosolides d’eaux usées sur les terres. Les CEE dans le sol estimées avec cette approche sont basées sur la quantité de biosolides accumulés dans la couche supérieure de 20 cm du sol (profondeur de labourage) au cours de dix années consécutives. Une hypothèse sous-jacente de cette approche était qu’il n’y avait aucune perte de substance due à la dégradation, à la volatilisation, au lessivage ou au ruissellement au moment de sa pénétration dans le sol lors de l’épandage des biosolides. Cette hypothèse a donc conduit à calculer des CEE dans le sol prudentes. Des scénarios d’exposition dans le sol ont été élaborés dans le cadre d’une extension des scénarios de rejet dans les milieux aquatique et sédimentaire décrits ci-dessus, en utilisant des concentrations dans les biosolides et des vitesses de production basées sur des systèmes de traitement des eaux usées spécifiques du site. Les concentrations dans les biosolides allaient de 1,0 x 10-6 à 1,0 x 10-3 au Canada. Les CEE dans le sol ont été normalisées pour une teneur en CO de 2 %.
| Utilisation/secteur | CEE dans l’eau (mg/L) | CEE dans les sédiments (4 % de CO) (mg/kg ps) |
CEE dans le sol (2 % de CO) (mg/kg ps) |
|---|---|---|---|
| Préparation du polystyrène expansé | 2,010-7 à 4,2 x 10-6 | < 3,56 x 10-4 à 1,0 x 10-2 | < 1,0 x 10-6 à 3,0 x 10-3 |
9.3 Caractérisation des risques pour l’environnement
L’approche suivie pour l’évaluation ayant trait à l’environnement est d’examiner divers renseignements pertinents afin de tirer des conclusions en fonction du poids de la preuve et du principe de précaution, conformément aux dispositions de la LCPE. Les éléments de preuve pris en compte comprennent des résultats d’un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque ou pour l’environnement, les sources, le devenir de la substance et sa présence et distribution dans l’environnement.
9.3.1 Analyse du quotient de risque
Une analyse du quotient de risque, intégrant des estimations prudentes de l’exposition à des renseignements sur la toxicité, a été réalisée pour le milieu aquatique afin de déterminer s’il existe un potentiel d’effets nocifs sur l’environnement au Canada. Le scénario industriel présenté ci-dessus a permis de prédire des concentrations environnementales estimées (CEE) de 2,0 x 10-7 à 4,2 x 10-6 mg/L. Une concentration estimée sans effet (CESE) de 0,0026 µg/L a été calculée à partir de la valeur de toxicité aiguë de 0,26 mg/L (voir la section sur les effets sur l’environnement). Les quotients de risque obrenus (CEE/CESE) vont de 7,7 x 10-5 à 1,6 x 10-3. Par conséquent, il est improbable que les organismes aquatiques subissent des effets nocifs à proximité d’une installation industrielle utilisant de l’EAT au Canada.
| Milieu | Scénario | CESE | CEE | QR |
|---|---|---|---|---|
| Eau | Rejet industriel dans l’eau | 0,0026 mg/L | 2,0 x 10-7 à 4,2 x 10-6 mg/L | 7,7 x 10-5 à 1,6 x 10-3 |
Étant donné qu’aucune donnée sur la toxicité de l’EAT ou d’un analogue approprié dans le sol n’est disponible, aucune analyse du quotient de risque ne peut être faite. De même, aucune donné de toxicité de l’EAT ou d’un analogue approprié dans les sédiments n’étant disponible, aucune analyse du quotient de risque n’a été faite pour les organismes benthiques.
Aucune CEE pour la faune n’a été calculée, les données disponibles sur la toxicité chez les mammifères (c.-à-d. des résultats pertinents pour l’étude de la toxicité aiguë orale chez des rats Sprague-Dawley) indiquant un faible niveau de toxicité par voie orale et, donc, suggérant qu’il est improbable que des effets nocifs se manifestent pour ces scénarios industriels.
9.3.2 Prise en compte des éléments de preuve
Les rejets actuels d’EAT dans l’environnement dus à son utilisation industrielle comme additif et produit ignifuge réactif devraient être faibles. Les rejets dus à l’utilisation de produits commerciaux ou de produits disponibles pour les consommateurs devraient être minimes et diffus. Tous les calculs d’exposition industrielle ont été faits sur la base de données sur l’utilisation industrielle actuelle au Canada. Un tablleau résumant les principaux éléments de preuve pour la caractérisation des risques est présenté à l’Annexe B.
L’EAT ne devrait pas être persistant dans l’air et devrait être minéralisé dans l’eau dans un délai d’un an. L’EAT devrait se retrouver principalement dans les sols et les sédiments, où il devrait être très persistant. Toutefois, il existe un manque de données mesurées sur l’exposition dans le sol ou les sédiments au Canada.
L’EAT a un potentiel de bioaccumulation élevé, et des résultats de modélisation suggèrent que sa bioamplification est possible. L’EAT peut être utilisé pour remplacer d’autres produits ignifuges et, à ce titre, les quantités importées peuvent aller en augmentant. Cependant, les utilisations actuelles et les échantillonnages d’eaux usées et de biosolides au niveau des usines de traitement à travers le Canada ne suggèrent pas un potentiel de rejet à grande échelle dans l’environnement au Canada. Les résultats de modélisations indiquent que l’EAT ne présente pas de potentiel de transport à grande distance.Toutefois, des données de surveillance montrent que de l’EAT a été mesuré au nord du Canada. La source de cette substance peut être des rejets industriels, la météorisation de produits disponibles pour les consommateurs, la biotransformation d’autres composés de type tribromophénoxy ou le transport en phase gazeuse. Des données empiriques et des données modélisées indiquent que l’EAT a un potentiel de toxicité élevé pour les organismes aquatiques.
Une analyse des produits de transformation stables et des métabolites potentiels de l’EAT a été faite. Les résultats ont montré que les produits de transformation ne devraient représenter qu’une fraction mineure (jusqu’à 4,68 %) de la substance mère. Les résultats de modélisation ont prédits que les produits de transformation avaient un potentiel d’accumulation dans les organismes aquatiques faible à modéré et une toxicité faible à modérée.
Les données empiriques et les données modélisées sur la toxicité aquatique indiquent que l’EAT a le potentiel de causer des effets nocifs à faible concentration. Toutefois, la CEE dans l’eau estimée pour un rejet industriel est inférieure à la CESE pour les organismes aquatiques. En utilisant le CEE dans l’eau, une analyse des résidus corporels critiques (RCC) faite pour les poissons a montré que les résidus d’EAT dans les tissus étaient inférieurs aux seuils narcotiques internes pour la létalité chronique ou aiguë. Cependant, en utilisant la limite de solubilité de l’EAT dans l’eau, les seuils de létalité chronique ou aiguë étaient tous deux dépassés, indiquant un danger de toxicité car la létalité est néanmoins possible. Aucune donnée sur la toxicité dans le sol, les sédiments ou pour la faune n’était disponible. Le fait qu’aucun effet (DL50 par voie orale) n’ait été observé à des doses supérieures à 2000 mg/kg pc/j chez des rats Sprague‑Dawley suggère qu’il est improbable que la faune subisse des effets nocifs dans le cadre des scénarios industriels actuels. Ces renseignements indiquent que l’EAT a un faible potentiel d’effets nocifs sur l’environnement au Canada.
9.3.3 Incertitudes de l’évaluation des risques pour l’environnement
Des incertitudes existent sur plusieurs éléments de preuve clés. Bien qu’il existe un manque de données expérimentales pour certaines données clés, la substance est couverte par l’ensemble de données du modèle QSAR. Le niveau de confiance dans ces propriétés est modéré à élevé.
L’évaluation de l’exposition est centrée sur les sources industrielles ponctuelles comme sources les plus pertinentes pour la présence d’EAT dans l’environnement. L’absence de données sur la lixiviation à partir de sites d’enfouissement est une incertitude en termes d’évaluation de la validité de cette hypothèse. Aucune donnée sur les lixiviats d’EAT des sites d’enfouissement n’a été rapportée à ce jour, mais de telles données pourraient aider à interpréter les rejets en fin de vie. Les additifs ignifuges comme l’EAT devraient migrer à partir des produits manufacturés (p.ex. polystyrène expansé) durant leur vie utile et à la fin de leur vie, tel que montré par les concentrations mesurées dans la poussière domestique (voir la section 10.1.1.3). Il n’a pas été possible de développer d’autres scénarios d’exposition due à des articles manufacturés (p. ex. lixiviat de sites d’enfouissement pour traiter des articles manufacturés en fin de vie et poussière éliminée sous forme de déchet solide) en raison des renseignements actuellement disponibles, ajoutant une incertitude à la caractérisation globale de l’exposition. Finalement, bien que la majorité des sites d’enfouissement au Canada traite leur lixiviat en les dirigeant vers des systèmes de traitement des eaux usées, les sites qui ne collectent pas et ne traitent pas leur lixiviat peuvent potentiellement rejeter des substances dans le sol ou les eaux de surface.
Bien que les données indiquent que l’EAT pourrait traverser la barrière sang-cerveau, des données manquent pour élaborer ce raisonnement.
Une étude empirique plus approfondie s’avère nécessaire pour déterminer les niveaux d’EAT dans la poussière, les lixiviats de sites d’enfouissement et des milieux de l’environnement, les renseignements actuellement disponibles étant limités ou incertains. De même, les rejets dus au nettoyage des conteneurs industriels de transport n’ont pas été pris en compte de manière quantitative, en raison d’un fort degré d’incertitude. Des hypothèses prudentes ont été formulées, décrites dans ECCC 2016, mais dans l’ensemble le niveau de confiance dans les scénarios d’exposition utilisés pour obtenir des valeurs de CEE est modéré.
Bien qu’il existe un manque de données empiriques sur la bioaccumulation et la bioconcentration, la substance s’inscrit dans le domaine du modèle. L’incertitude majeure concerne la constante de vitesse métabolique (kM) et le fait de savoir si bioamplification est un facteur significatif. Le niveau de confiance dans les données sur la bioconcentration et la bioconcentration est modéré à élevé.
L’analyse des résidus corporels critiques (RCC) s’appuie sur le FBA modélisé en tant qu’intrant primaire du modèle pour le calcul des résidus dans les tissus de poissons. Étant donné le manque de données empiriques, le niveau de confiance dans les estimations des RCC est faible à modéré.
En se basant sur le comportement de partage prédit pour l’EAT, il existe une incertitude liée aux scénarios d’exposition dans le sol et les sédiments. De plus, en raison de ses propriétés physiques et chimiques, l’EAT devrait se retrouver dans les sols et les sédiments, mais aucune donnée sur sa toxicité dans le sol ou les sédiments n’est disponible. Le risque pour l’environnement peut donc être sousestimé en raison de cette lacune dans les données.
Il existe des lacunes dans les données sur la toxicité de l’EAT pour la faune. Les données disponibles sur la toxicité par voie orale de l’EAT chez les mammifères n’étaient pas applicables au modèle pour la faune et, donc, il existe une grande incertitude sur les effets potentiels de l’EAT sur la faune.
Il existe aussi une incertitude liée aux scénarios standards d’émission utilisés pour calculer les CEE dans l’eau, le sol et les sédiments. De plus, l’estimation n’a été faite que pour une seule source d’utilisation. Un certain nombre de paramètres du modèle sont connus pour être variables (facteurs d’émission, taux d’élimination dans les UTEU, adsorption sur les biosolides, limites de rejet d’effluent) et contribueront à déterminer une gamme de concentrations environnementales estimées (CEE). Le niveau de confiance dans les scénarios d’émission utilisés pour obtenir les valeurs de CEE est faible à modéré. Les valeurs des scénarios d’émission reflètent une comparaison relative du potentiel d’exposition à l’EAT.
Une analyse du quotient de risque a été faite pour tenir compte de l’exposition dans de l’eau contaminée par de l’EAT. Étant donné que les incertitudes sur les valeurs de CEE sont modérées à élevées, le niveau de confiance dans les données est faible à modéré.
10. Potentiel d’effets nocifs sur la santé humaine
10.1 Exposition
10.1.1 Milieux environnementaux et aliments
L’EAT est typiquement utilisé comme produit ignifuge dans des produits électroniques, dans des revêtements pour câbles et fils et dans le polystyrène expansé, les utilisations au Canada sont potentiellement similaires. En tant que substance ignifuge réactive, l’EAT peut être considéré comme étant chimiquement lié à la matrice polymère de certains produits (p. ex. isolation de câbles en polyoléfine ou polyamide/polyimide), ce qui limiterait le potentiel d’émission dans l’environnement au cours de la vie utile du produit. Pour d’autres produits dans lesquels l’EAT est utilisé comme additif ignifuge (p. ex. le polystyrène expansé), il peut y avoir un plus grand potentiel d’émission dans l’environnement par le produit. L’EAT a fait l’objet d’une surveillance dans divers milieux de l’environnement au Canada, et les résultats de ces études ont été présentés ci‑dessus (section 7.1.1).
D’après les données de surveillance environnementale présentées ci-dessous, la plus forte absorption quotidienne d’EAT à partir des milieux de l’environnement et des aliments est estimée à 0,041 ng/kg pc/j pour des enfants de 6 mois à 4 ans (Annexe C).
10.1.1.1 Air
Air ambiant
Au Canada, Diamond et al. (2013) ont surveillé l’air extérieur (pas de problème de stockage à cette période, voir la section relative à l’air intérieur ci-après) dans la région des Grands Lacs et dans la zone urbaine de Toronto (Ontario). Diamond et al. (2013) ont utilisé des méthodes passives et actives pour collecter des échantillons d’air extérieur à divers emplacements à Toronto en 2011. La concentration moyenne d’EAT dans les échantillons collectés par échantillonnage actif à grand volume était < 1 pg/m3 sur un site fonctionnant 24 heures deux fois par mois. L’échantillonnage passif quotidien a été effectué pendant une période de trois mois pendant l’été et l’hiver d’une année sur six sites à Toronto. Aucne concentration passive d’EAT dans l’air ambiant n’a été détectée durant les mois d’hiver, mais des concentrations allant de 1 à 15 ng/disque de MPU (échantillonneur à disque en mousse de polyuréthane) ont été mesurées au cours des mois de printemps et d’été (Diamond et al. 2013). De l’EAT a été détecté dans 100 % des échantillons collectés autour du lac Ontario, dans 88 % de ceux collectés autour du lac Huron et dans 87 % de ceux collectés sur un site de terrain à Toronto (Shoeib et Jantunen 2014). Les concentrations dans l’air ambiant allaient de 0,04 à 11,1 pg/m3, la plus forte concentration ayant été relevée à Toronto (Shoeib et Janunten 2014). Des concentrations allant de 0,012 à 15 pg/m3 pour un échantillonnage de 24 heures ont été mesurées en phase gazeuse et en phase particulaire lors d’une surveillance de l’air à Chicago (Illinois) et à Cleveland (Ohio) (Ma et al. 2012). Les concentrations mesurées dans des zones rurales aux États-Unis autour des Grands Lacs étaient inférieures, allant de 0,012 à 2,5 pg/m3 (Ma et al. 2012).
Des concentrations d’EAT ont été mesurées dans l’air ambiant en Norvège, en Suède et au Danemark dans le cadre de l’étude européenne TemaNord entre 2009 et 2010. La concentration moyenne d’EAT la plus élevée, de 0,27 pg/m3, a été rapportée pour l’air extérieur d’une zone urbaine (Oslo, Norvège). Au cours de la même période, la concentration moyenne la plus faible était < 0,016 pg/m3, à Copenhague au Danemark (TemaNord 2011). Dans le cadre du programme GAPS d’échantillonnage passif atmosphérique mondial, plusieurs nouveaux produits ignifuges bromés ont fait l’objet d’une surveillance sur divers sites urbains, ruraux et agricoles de chaque continent (n = 31), de l’EAT a été mesuré avec une fréquence de détection de 60 % à 78 % à l’échelle mondiale. Aucune autre donnée quantitative de cette étude n’est disponible (Lee et al. 2010).
La concentration moyenne maximale rapportée dans l’air ambiant (11 pg/m3) pour une zone urbaine canadienne, à savoir Toronto (Shoeib et Janunten 2014), a été utilisée pour estimer l’absorption quotidienne de la population canadienne.
Air intérieur
L’EAT a été détecté dans l’air intérieur au Canada et dans d’autres pays du nord de l’Europe. Au Canada, des échantillons d’air intérieur ont été collectés dans 20 habitations et bureaux à Toronto entre 2010 et 2012, et leur teneur en EAT a été mesurée (Diamond et al. 2013). Des échantillonneurs d’air ont été placés dans la chambre à coucher, le salon et/ou la cuisine des maisons. Les méthodes de stockage ont limité la capacité de quantifier les concentrations d’EAT, en raison de la rétention de l’EAT sur les parois en verre des contenants. Toutefois, les résultats ont mis en évidence la présence d’EAT dans l’air intérieur. Les concentrations moyennes d’EAT dans un immeuble à bureaux à Oslo (Norvège) allaient de < 1,3 à 1,7 pg/m3 (TemaNord 2011). Étant donné le manque de données canadiennes, la concentration dans l’air intérieur de 1,7 pg/m3 (TemaNord 2011) mesurée en Norvège a été retenue pour estimer l’absorption quotidienne totale d’EAT (Annexe C).
10.1.1.2 Sol et sédiments
Aucun rapport sur la présence d’EAT dans les sols ou les sédiments au Canada n’a été trouvé, ni ailleurs en Amérique du Nord. Sa faible volatilité et son log Koe modéré à élevé suggèrent que l’EAT se répartira plus facilement dans des biosolides, des sédiments et le sol que dans l’eau. En assumant que les biosolides provenant de systèmes de traitement des eaux usées sont épandus sur des terres agricoles, le modèle BASL4 a été utilisé pour prédire une concentration dans le sol allant de < 1,0 x 10-6 à 3,0 x 10-3 mg/kg ps (section 8.2.2.3). L’absorption journalière totale a été calculée en se basant sur l’estimation de la limite supérieure de la CEE.
10.1.1.3 Poussière
Une surveillance de l’EAT dans la poussière a été faite lors de plusieurs études au Canada. Une source potentielle d’EAT dans de la poussière domestique est l’équipement électronique (p. ex. l’isolation de câbles) (Diamond et al. 2013, Shoeib et al. 2012). Malgré la nature réactive de l’EAT, l’utilisation continue d’équipement électronique peut entraîner une décomposition du polymère contenant de l’EAT, qui peut se retrouver dans la poussière.
L’EAT a été inclus dans l’étude de référence canadienne sur les produits ignifuges halogénés dans la poussière domestique (n = 413) réalisée de 2010 à 2013 dans 13 villes canadiennes dans le cadre de l’Enquête sur la poussière domestique au Canada (EPDC). En suivant la méthode décrite par Fan et al. (2016), l’EAT a été détecté dans 67,7 % des échantillons (n = 631), et les concentrations allaient de la non‑détection (limite de détection de 0,5 ng/g) à 1060 ng/g, avec une concentration médiane de 0,98 ng/g et un 95ème percentile de 26,3 ng/g (Kubwabo et al., manuscrits en préparation; Bureau de la science et de la recherche en santé environnementale (BSRSE) de Santé Canada, 5 juin 2017, non référencé).
Lors d’une étude menée à Vancouver, une concentration moyenne d’EAT dans la poussière de 0,4 ng/g a été mesurée, avec une concentration au 95ème percentile de 7,84 ng/g pour 116 échantillons (Shoeib et al. 2012). À Toronto, de la poussière a été échantillonnée dans plusieurs habitations pendant trois ans. En 2010, des échantillons ont été prélevés dans quatre habitations et, en 2011, dans une autre résidence. La concentration maximale d’EAT dans la poussière en 2010/2011 était de 110 ng/g (n = 20) (Diamond et al. 2013). En 2012, une autre étude sur 20 habitations n’a pas permis de détecter de concentrations dans la poussière [limite de détection de 5,3 pg/g (n = 28)] (Diamond et al. 2013). La différence entre les concentrations d’EAT mesurées dans la poussière lors de ces deux études peut être due aux âges différents des habitations ou des articles présents dans les habitations (Diamond et al. 2013). Lors d’une étude canadienne récemment publiée, de l’EAT a été mesuré dans la poussière de 35 habitations et de 10 bureaux à Toronto en 2012 (Abbasi et al. 2016). Les concentrations d’EAT dans la poussière allaient de la non-détection (limite de détection de 0,015) à 30 ng/g, avec une concentration moyenne et une fréquence de détection plus élevées dans les bureaux (6,0 ng/g et 60 %) que dans les habitations (1,5 ng/g et 40 %). Abbasi et al. (2016) ont aussi analysé l’association de l’EAT dans la poussière de l’étude de 2012 avec la poussière présente sur les produits présents aux mêmes endroits. L’EAT a été détecté à des niveaux proches de la limite de détection (0,015 ng/g) dans la moitié des produits échantillonnés (n = 65), dont des écrans plats de TV, des ordinateurs personnels et des appareils électroménagers. Les auteurs ont montré qu’il existait une corrélation positive entre les concentrations moyennes géométriques des composés ignifuges halogénés (dont l’EAT) dans la poussière des habitations et des bureaux et celles dans la poussière présente à la surface de produits électroniques.
L’estimation limite supérieure de l’absorption quotidienne pour la population canadienne due à la poussière a été calculée à l’aide des concentrations d’EAT au 95ème percentile dans de la poussière domestique tirée de l’Enquête sur la poussière domestique au Canada (26,3 ng/g) (communication personnelle de BSRSE de Santé Canada, 5 juin 2017).
10.1.1.4 Eau
Étant donné sa faible solubilité dans l’eau (0,24 mg/L), la concentration d’EAT dans l’eau devrait être faible (Covaci et al. 2011). Une étude sur la surveillance de l’EAT dans les eaux de surface au Canada a été identifiée. Muir et al. (2011) ont prélevé des échantillons dans quatre lacs en Ontario, entre 2005 et 2010, et ont mesuré de faibles concentrations d’EAT (jusqu’à 0,22 pg/L). La présence d’EAT a également été rapportée dans les eaux de surface dans cinq régions en Norvège, à une concentration inférieure à la limite de détection de la méthode de 1,41 ng/L (DNV 2010) (section 8.2.1.2). La plus forte concentration d’EAT dans une eau de surface au Canada (0,22 pg/L) a été utilisée pour estimer l’absorption due à l’eau.
10.1.1.5 Aliments
Aucun rapport sur la présence d’EAT dans des aliments au Canada n’a été trouvé. Lors de deux études européennes, une surveillance de l’EAT dans des poissons et des mollusques et crustacés a été faite (Annexe C). Des concentrations d’EAT dans les tissus musculaires de poissons (omble chevalier et perche) et de crustacés bivalves (moule bleue) ont été rapportées par TemaNord (2011) en Norvège. Les concentrations d’EAT rapportées allaient respectivement de la non-détection (limite de détection = 0,00096 ng/g) à < 0,0046 ng/g et de la non-détection (limite de détection = 0,0019 ng/g) à 0,0045 ng/g pour les poissons à nageoires et les mollusques et crustacés. L’EAT avait antérieurement été détecté lors d’une étude de Von Der Recke (2007) dans la graisse (de 5,4 à 9,1 ng/g) et le cerveau (de 3,1 à 10 ng/g) de phoques du Groenland vivant dans la mer de Barents et la mer du Groenland (Covaci et al. 2011, EFSA 2012a). Étant donné la présence potentielle d’EAT dans des aliments consommés par des humains, notamment le poisson, à des concentrations allant jusqu’à 0,0045 ng/g, une estimation limite supérieure de l’absorption quotidienne due aux aliments pour la population générale du Canada a été estimée à 0,016 ng/kg pc/j (pour des enfants de 5 mois à 4 ans). Il s’agit d’une estimation prudente pour laquelle il a été assumé que tous les fruits de mer et poissons consommés contiendraient de l’EAT. Bien que certaines populations nordiques ou d’autres sous-populations au Canada puissent consommer de plus grandes quantités de fruits de mer ou de poisson, cette estimation est jugée suffisamment prudente pour tenir compte de cette variabilité.
10.1.2 Produits disponibles pour les consommateurs
L’EAT est principalement utilisé comme produit ignifuge dans le polystyrène expansé (PSE) et l’isolation en polyamide de câbles et de fils (Ash et Ash 2002). Selon le produit, l’EAT peut être classé comme additif ignifuge ou produit ignifuge réactif, un facteur pour le potentiel d’exposition à cette substance (Covaci et al. 2001). L’EAT est considéré comme produit ignifuge réactif lorsqu’il est utilisé dans de l’isolant pour revêtement de câbles et de fils. Il est ajouté au cours du processus de polymérisation et devient partie intégrale du polymère (Harju et al. 2009). Le polymère obtenu contenant de l’EAT a une structure moléculaire et des propriétés différentes. Les propriétés ignifuges sont conservées. Toutefois, la structure modifiée empêche la migration hors du produit dans l’environnement (Harju et al. 2009). Au cours d’une utilisation normale de tels fils et câbles à la maison, il ne devrait pas y avoir d’exposition directe à l’EAT.
À l’échelle mondiale, l’EAT est aussi utilisé couramment comme additif ignifuge dans le PSE et dans la mousse de polystyrène (Covaci et al. 2011). Les utilisations de l’EAT au Canada sont présumées être les mêmes qu’au niveau international. Le PSE est utilisé dans un certain nombre de produits de consommation. Il peut être utilisé dans des matériaux de construction, dans des produits tels que des panneaux d’isolation pour mur et des matériaux d’emballage (Nova Chemicls 2012). Les matériaux d’emballage en PSE modifié ne sont utilisés que comme mousse de protection pour l’expédition. L’emballage peut être introduit dans une habitation, mais il est généralement jeté peu de temps après le déballage, ce qui limite le potentiel d’exposition à l’EAT.
L’installation de panneaux d’isolation muraux est typiquement une activité professionnelle, mais il arrive qu’elle soit effectuée par des propriétaires dans le cadre de projets de rénovation. L’exposition dermique à l’EAT due à cette utilisation devrait être minime en raison de la durée limitée du contact avec le produit (seulement durant l’inhalation) et l’accès limité au PSE contenant de l’EAT (les panneaux d’isolation sont typiquement collés entre des panneaux à copeaux orientés ou comportent un revêtement en papier ou en aluminium). Ce produit est conçu pour être installé derrière des cloisons sèches. La modification des panneaux (p. ex., le découpage) peut entraîner un rejet limité des particules de mousse contenant de l’EAT dans l’air, qui se retrouveront dans la poussière. La population générale peut être exposée à l’EAT présent dans la poussière des habitations où des panneaux isolants en PSE modifié sont manipulés et installés. Un tel cas a été pris en compte à la section 9.1.1.3.
D’après ses propriétés physiques et chimiques, l’EAT est probablement peu biodisponible. L’exposition à de l’EAT due à des produits disponibles pour les consommateurs devrait être minime en raison de ses propriétés comme produit ignifuge réactif présent dans les polymères utilisés dans des revêtements isolants pour câbles et fils et du faible potentiel de contact avec le PSE modifié contenant de l’EAT.
10.2 Effets sur la santé
Il existe un nombre limité d’études empiriques sur la toxicité de l’EAT.
Lors d’une étude sur la toxicité aiguë par voie orale chez le rat, il a été suggéré que la toxicité aiguë est peu préoccupante, avec une dose létale (DL50) supérieure à 2000 mg/kg pc/j (Présentation de projet 2013). Au cours de la période d’observation de 14 jours après le traitement, aucune mortalité ni aucun changement dans le poids corporel lié au traitement n’a été observé. Des signes cliniques transitoires ont été observés après le traitement, mais ont disparu au bout de quatre jours. Aucune anomalie liée au traitement n’a été observée lors de l’autopsie.
Il a été montré que l’EAT était un faible sensibilisant pour la peau chez le cochon d’Inde (Présentation de projet 2013).
Les études sur la génotoxicité étaient limitées à des épreuves Ames in vitro sur des bactéries. Les résultats étaient négatifs pour les souches de Salmonella typhimurium TA98, TA100, TA1535 et TA1557 avec ou sans activation métabolique (Présentation de projet 2013). Les résultats étaient également négatifs pour dans la souche d’E. coli WP2 uvrA avec ou sans activation métabolique (Présentation de projet 2013).
Aucune étude sur la toxicité pour la reproduction ou le développement n’a été trouvée. Ezechias et al. (2012) ont étudié le potentiel de l’EAT à avoir une influence sur les récepteurs des œstrogènes et des androgènes au moyen de tests in vitro sur le gène rapporteur de la levure. Aucune activité œstrogène ni androgène de l’EAT n’a été observée. Lors d’une étude récente, il a été rapportée que l’EAT a exhibé une activité androgène lors d’une épreuve d’expression de la luciférase (Kharlyngdoh et al. 2015).
Aucune étude sur la toxicité à dose répétée ni aucune étude sur la toxicocinétique n’a été trouvée.
Plusieurs éléments de preuve ont été étudiés afin de contribuer à la caractérisation du potentiel génotoxique ou cancérogène de l’EAT (Annexe D). Trois approches ont été suivies : approche avec analogue, approche basée sur la relation quantitative structure‑activité (QSAR) et approche d’alertes structurales.
Pour l’approche avec analogue, la Boîte à outils QSAR de l’OCDE (OCDE 2009b, 2011, 2013) et le modèle OASIS TIMES (TIMES 2013) ont été utilisés pour identifier et évaluer des analogues potentiels. Aucun analogue adéquat n’a été trouvé au moyen de la Boîte à outils QSAR de l’OCDE. Le modèle OASIS TIMES a prédit qualitativement un certain nombre de métabolites possibles de l’EAT, dont deux, à savoir le 2,4,6‑tribromophénol (TBP) et l’acroléine, sont associés à des données disponibles sur le danger dans les sections suivantes. Le niveau de confiance dans la prédiction sur le métabolisme est faible, l’EAT se situant en dehors du domaine du modèle. Cependant, la transformation métabolique prédite semblait plausible en se basant sur la transformation métabolique en phase 1 couramment observée. En raison du manque de données toxicocinétiques empiriques, il serait bon de noter qu’il existe une incertitude quant à la capacité de l’EAT d’être métabolisé en ces deux métabolites et aux quantités de ces derniers.
Pour l’approche QSAR, plusieurs modèles QSAR basés sur des statistiques ont été utilisés pour évaluer le potentiel de l’EAT à induire des dommages chromosomiques (in vitro et in vivo) et une cancérogénicité. Des résultats limités ont été obtenus. Dans certains cas, l’EAT ou une structure partielle de l’EAT se situait en dehors du domaine du modèle. Dans d’autres cas, seul un faible nombre de produits chimiques similaires étaient couverts par l’ensemble d’apprentissage du modèle. Par exemple, le modèle QSAR, OASIS TIMES (TIMES 2013), a permis d’identifier des alertes pour l’EAT concernant son métabolisme potentiel en intermédiaire époxydique et en acroléine. Toutefois, 70 % des fragments structuraux de l’EAT n’étaient pas couverts par le domaine structural du modèle.
La troisième approche a servi à identifier des alertes structurales de l’EAT associées à une génotoxicité ou une cancérogénicité chez des mammifères. Des modèles de génotoxicité n’ont mis en évidence aucune alerte. Des profileurs d’alertes de cancérogénicité ont déclenché une alerte non génotoxique basée sur une structure aromatique polyhalogénée (DEREK Nexus 2013). Toutefois, le niveau de confiance dans cette prévision a été jugé faible. Le mode d’action des composés aromatiques polyhalogénés et leur cancérogénicité ne sont pas bien compris.
Dans l’ensemble, le niveau de confiance dans les résultats obtenus à partir de ces autres éléments de preuve est faible. Tel qu’il a été mentionné, bien qu’il y ait une incertitude associée à cette prévision, l’EAT a le potentiel d’être métabolisé en 2,4,6‑TBP et en acroléine, et nous étudions ces substances dans les sections suivantes.
10.2.1 2,4,6-Tribromophénol (TBP)
Le Programme international sur la sécurité des substances chimiques (PISSC) a publié un document, intitulé Concise International Chemical Assessment Document (CICAD), sur le 2,4,6-TBP et d’autres phénols bromés simples (PISSC 2005). Un certain nombre de tests de génotoxicité (Ames, aberrations chromosomiques in vitro et micronoyaux in vivo) sur le TBP sont décrits dans ce document, tests qui ont été réalisés en suivant les lignes directrices de l’OCDE. Tous ces tests, à l’exception de celui sur les cellules mammaliennes in vitro (aberrations chromosomiques), se sont avérés négatifs. Il n’y avait aucune preuve de génotoxicité lors d’un test de micronoyaux in vivo, jusqu’à la dose maximale admissible. Aucune étude à long terme ou sur la cancérogénicité de l’EAT n’a été trouvée. D’après la description faite dans PISSC (2005) et dans Hamers et al. (2006), le 2,4,6-TBP a été jugé puissant pour la liaison à la protéine de transport du plasma humain transthyrétine (TTR) in vitro, comparativement au ligand naturel thyroxine (T4). La TTR est l’une des protéines de transport se liant aux hormones thyroïdiennes dans le plasma de vertébrés. Certains tests in vitro sur un gène rapporteur ont suggéré que le 2,4,6-TBP pourrait exhiber une activité antiœstrogène (Hamers et al. 2006, Ezechias et al. 2012) et antiandrogéne (Ezechias et al. 2012). Hamers et al. (2006) ont également constaté que le 2,4,6-TBP est un inhibiteur puissant d’E2SULT (sulfatation par l’œstradiol sulfotransférase) in vitro, suggérant qu’il pourrait avoir une influence sur l’œstradiol. Lors d’une étude sur la toxicité à dose répétée par voie orale combinée à un test de dépistage de la toxicité pour la reproduction et le développement chez le rat, réalisée en suivant les lignes directrices de l’OCDE (en utilisant des doses de 0, 100, 300 ou 1000 mg/kg pc/j de 2,4,6-TBP) (Tanaka et al. 1999, cité dans PISSC 2005), aucun effet nocif n’a été observé sur le cycle œstral, l’indice de copulation, l’indice de fertilité, la durée de la période de gestation, le nombre de corps jaunes, les constatations liées à l’accouchement, le nombre d’implants, le nombre total de petits et le nombre de petits nés vivants, l’indice d’implantation, et l’indice d’accouchement dans aucun des groupes traités.
10.2.2 Acroléine
Le gouvernement du Canada a antérieurement évalué l’acroléine dans un rapport sur la Liste des substances d’intérêt prioritaire (Environnement Canada, Santé Canada 2000). Un rapport CICAD et un rapport d’évaluation initial SIDS de l’OCDE étaient également disponibles (PISSC 2002, OCDE 2000). L’acroléine est une substance très réactive qui se lie principalement au site de contact. Suite à une exposition aiguë ou répétée par inhalation, l’acroléine est cytotoxique et peut induire des effets histopathologiques dans les bronches et/ou la trachée. L’acroléine est mutagène in vitro, mais ne l’est pas in vivo. Il a été montré que l’acroléine peut réagir directement avec l’ADN et des protéines pour former des adduits stables in vitro. Toutefois, aucune augmentation de la réticulation croisée ADN-protéines dans les muqueuses nasales de rats exposés lors d’une étude par inhalation aiguë n’a été observée. Il a été jugé dans Environnement Canada et Santé Canada (2000) et PISSC (2002) que les données disponibles étaient inadéquates pour déterminer si l’acroléine a la capacité d’induire des tumeurs ou d’interagir directement avec l’ADN au niveau du site de contact après l’inhalation. Il a été conclu dans les documents PISSC (2002) et OCDE (2000) que l’acroléine n’est pas cancérogène par voie orale. Pour la voie orale, trois études sur la toxicité chronique ou la cancérogénicité réalisées avec des rats et des souris étaient disponibles. Aucune augmentation significative de l’incidence de tumeurs d’un type quelconque n’a été observée lors de ces études.
10.3 Caractérisation des risques pour la santé humaine
Des données empiriques limitées sur les effets sur la santé de l’EAT ont été identifiées. Des analyses d’autres éléments de preuve se sont avérées non concluantes quant au potentiel de génotoxicité ou de cancérogénicité de l’EAT. Des modélisations du métabolisme de l’EAT ont qualitativement prédit des métabolites potentiels, dont le 2,4,6-TBP et l’acroléine pour lesquels des données sur leur danger sont disponibles.
Des preuves suggèrent qu’il est improbable que le 2,4,6-TBP soit génotoxique. Des études in vitro ont suggéré que le 2,4,6-TBP pourrait avoir une influence sur les systèmes hormonaux thyroïdien, œstrogène et androgène, mais aucun effet nocif connexe n’a été observé lors d’études sur la toxicité in vivo pour la reproduction ou le développement. L’acroléine est une substance réactive qui est associée à des effets nocifs, principalement au site de contact, par inhalation ou par voie orale. Il a été montré que l’acroléine était mutagène in vitro, mais pas in vivo. Il a été conclu dans les documents PISSC (2002) et OCDE (2000) que l’acroléine n’est pas cancérogène par voie orale.
Il a été estimé que l’absorption quotidienne d’EAT de la population générale due aux milieux de l’environnement (air, eau, poussière) et aux aliments était inférieure à un nanogramme (c.-à-d. 0,13 ng/kg pc/j). L’exposition directe à l’EAT due aux produits disponibles pour les consommateurs devrait être minime en raison de sa faible biodisponibilité, de ses propriétés en tant que produit ignifuge réactif dans les polymères utilisés dans des revêtements de câbles et de l’isolation de fils et du faible potentiel de contact avec du PSE modifiée contenant de l’EAT. L’absorption d’EAT par la population générale due aux milieux de l’environnement étant estimée faible et l’exposition due aux produits disponibles pour les consommateurs devant être négligeable au Canada, le potentiel d’effets nocifs sur la santé humaine est considéré faible.
À titre d’élément de preuve supplémentaire, il est à noter que l’absorption estimée d’EAT de 0,13 ng/kg pc/j pour la population générale du Canada due aux milieux de l’environnement et aux aliments est inférieure au seuil de préoccupation toxicologique (SPT) de 2,5 ng/kg pc/j initialement proposé par Kroes et al. (2004). Le SPT fournit un point de référence générique à partir duquel la gamme des absorptions estimées peut être comparée. Les valeurs du SPT, calculées en suivant des approches probabilistes, établissent les seuils d’exposition chronique génériques par voie orale pour les humains, en dessous desquels la probabilité d’effets nocifs d’une substance devrait être faible. Un SPT de 0,15 µg/jour (équivalant à 2,5 ng/kg pc/j) a été établi pour les substances potentiellement cancérogènes avec des alertes structurales pour la génotoxicité. Bien que ce SPT puisse ne pas être applicable à l’EAT (l’EAT peut ne pas être génotoxique ni cancérogène), il est utilisé, car des très limitées sur le danger de l’EAT sont disponibles et c’est le point de référence le plus faible auquel l’exposition à l’EAT peut être comparée. D’autres valeurs du SPT plus élevées ont été établies pour différentes classes de substances non génotoxiques, basées sur des concentrations sans effet tirées d’études d’exposition chronique par voie orale (Munro et al. 1996a, b, Kroes et al. 2004, EFSA 2012b, Dewhurst et Renwick 2013).
D’après les données susmentionnées, le potentiel d’effets nocifs sur la santé humaine dus à une exposition à de l’EAT est jugé faible.
10.4 Incertitudes de l’évaluation des risques pour la santé humaine
Il existe certaines incertitudes associées à l’estimation de l’exposition à l’EAT due aux milieux de l’environnement. Bien qu’il existe des études canadiennes sur la poussière domestique, les eaux de surface et l’air extérieur, aucune étude canadienne sur l’air intérieur n’a été trouvée. Il existe une incertitude sur l’estimation de l’absorption à partir des aliments pour la population générale, car cette estimation est basée sur des données provenant d’Europe du Nord et uniquement sur le poisson. Cependant, l’estimation de l’absorption quotidienne totale due aux milieux de l’environnement et aux aliments est basée sur des hypothèses prudentes (p. ex. tous les fruits de mer consommés contiendraient de l’EAT).
Des données empiriques très limitées sur la toxicité de l’EAT ont été identifiées. Aucune étude sur la toxicité à dose répétée, sur la toxicité chronique/cancérogénicité, sur la toxicité pour la reproduction et le développement, sur la toxicocinétique ou sur les humains n’a été trouvée. En raison du nombre limité de données empiriques sur les effets sur la santé et du faible niveau de confiance dans l’analyse des autres éléments de preuve, dont l’incertitude sur la prévision métabolique, le niveau de confiance dans la base de données sur les effets sur la santéde l’EAT est faible. Toutefois, l’ensemble des preuves indique que l’exposition de la population générale à cette substance est faible.
11. Conclusion
Compte tenu de tous les éléments de preuve avancés dans le présent rapport sur l’état des connaissances scientifiques, le potentiel d’effets nocifs de l’EAT sur les organismes ou l’intégrité plus large de l’environnement est actuellement jugé faible.
D’après les renseignements présentés dans le présent rapport, le potentiel d’effets nocifs de l’EAT sur la santé humaine est actuellement jugé faible.
Bien que les niveaux d’exposition estimés actuels à l’EAT n’indiquent pas d’effets nocifs sur l’environnement ou la santé humaine, des inquiétudes pourraient se manifester si les quantités importées ou utilisées venaient à augmenter au Canada.
Comme l’EAT est une option commerciale pour remplacer d’autres produits ignifuges, il est possible que les quantités utilisées augmentent au Canada. Étant donné que l’EAT n’est pas inscrit sur la LIS, il continuera d’être assujetti à l’article 81 de la LCPE et au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) de la LCPE, ce qui garantira la notification préalable à la mise en marché de toute nouvelle importation ou production de cette substance et permettra de mettre en place des restrictions, au besoin.
Références
Abbasi G., Saini A., Goosey E. et Diamond M.L.; 2016; Product screening for sources of halogenated flame retardants in Canadian house and office dust; Sci. Total Environ., 545–546, p. 299–307 (disponible en anglais seulement).
ACD/Percepta [module de prédiction]; c1997-2012; Toronto (ON) : Advanced Chemistry Development [consulté en juillet 2014] (disponible en anglais seulement).
[AEROWIN] AEROWIN Program for Windows [modèle d’estimation]; 2010; v. 1.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté en janvier 2014] (disponible en anglais seulement).
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]; 2010; v. 1.92a; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Arnot J.A. et Gobas F.A.P.C.; 2003a; A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs; QSAR Comb. Sci., 22(3), p. 337-345 (disponible en anglais seulement).
Arnot J.A. et Gobas F.A.P.C.; 2003b; Categorization of organic substances on the Domestic Substances List for bioaccumulation potential; Rapport à la Division des substances existantes d’Environnement Canada, Gatineau (QC) : Environnement Canada (disponible en anglais seulement).
Arnot J.A., Mackay D. et Bonnell M.; 2006; A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms; Environ. Rev., 14, p. 257-297 (disponible en anglais seulement).
Arnot J.A., Mackay D. et Bonnell M.; 2008b; Estimating metabolic biotransformation rates in fish from laboratory data; Environmental Toxicology and Chemistry, 27(2), p. 341-351 (disponible en anglais seulement).
Arnot J.A., Mackay D., Parkerton T.F. et Bonnell M.; 2008a; Database of fish biotransformation rate for organic chemicals; Environmental Toxicology and Chemistry, 27(11), p. 2263-2270 (disponible en anglais seulement).
Arnot J.A., Meylan W., Tunkel J., Howard P.H., Mackay D., Bonnell M. et Boethling R.S.; 2009; A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish; Environ. Toxicol. Chem., 28(6), p. 1168-1177 (disponible en anglais seulement).
Ash M. et Ash I.; 2003; Handbook of cosmetic and personal care additives; 2ème édition; Synapse Information Resources Inc. ISBN-10 : 1-890595-38-1 (disponible en anglais seulement).
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels; 2013; Santé Canada [consultée le 24 avril 2014].
[BCFBAF] Bioaccumulation Program for Windows [modèle d’évaluation]. 2010. Version 3.01. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[BDPP] Base de données sur les produits pharmaceutiques; [modifiée le 17 février 2017]; Ottawa (ON) : gouvernement du Canada [consulté le 24 avril 2014]
[BDPSNH] Base de données des produits de santé naturels homologués; [modifiée le 10 août 2016]; Ottawa (ON) gouvernement du Canada [consulté le 24 avril 2014];
Beyer A., Mackay D., Matthies M., Wania F. et Webster E.; 2000; Assessing long-range transport potential of persistent organic pollutants; Environ. Sci. Technol., 34(4), p. 699‑703 (disponible en anglais seulement).
[BCFBAF] Bioaccumulation Program for Windows [modèle d’estimation]; 2010; v. 3.01; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation (disponible en anglais seulement).
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]; 2010; v. 4.10; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation] (disponible en anglais seulement).
Boethling R.S., Howard P.H., Beauman J.A. et Larosche M.E.; 1995; Factors for intermedia extrapolations in biodegradability assessment; Chemosphere, 30(4), p. 741‑752 (disponible en anglais seulement).
Boîte à outils QSAR de l’OCDE [outil de déduction à partir d’analogues]. 2012. Version 3.0. Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement. (disponible en anglais seulement).
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]; 2013; v. 3.1; Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement (disponible en anglais seulement).
Bureau européen des produits chimiques, Institute for Health and Consumer Protection. Technical Guidance Document on Risk Assessment [PDF] Report No.: EUR 20418 EN/2. 328 p. Luxembourg : Office des publications de l’Union européenne. (disponible en anglais seulement).
Byer J., Alaee M., Brown S., Lebeuf M., Trottier S., Backus S., Blunt S., Keir M., Konefal M., Pacepavicius G. et Hodson P.; 2010; Brominated flame retardants in American eel: a reason for the eel’s decline?; BFR 2010 (disponible en anglais seulement).
Canada; 1999; Loi canadienne sur la protection de l’environnement 1999 [pdf]; L.C., 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3
Canada; 2005; Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères); C.P. 2005-1484, DORS/2005-247 [consulté le 31 août 2005] (disponible en anglais seulement).
Canada, ministère de l’Environnement; 2013; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances ignifuges organiques [pdf]; Gazette du Canada, Partie I, vol. 147, no 13, p. 613-633.ra.html
CASEUltraT [module de prédiction]; 2013; v. 1.5.0.1; Beachwood (OH) : Multicase Inc. [consulté le 16 avril 2014]; www.multicase.com/products/prod03.htm (disponible en anglais seulement).
[CATALOGIC] [modèle numérique]; 2012; v. 5.11.6; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique (disponible en anglais seulement).
Chemtura; 2007; Technical information: PHE-65 halogenated flame retardant; Chemtura - Flame Retardants Overview [pdf, archivé]; Chemtura Corporation (disponible en anglais seulement).
[CHRIP] Chemical Risk Information Platform [base de données]; 2005; Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Management Centre (CMC) [consulté le 20 avril 2017] (disponible en anglais seulement).
[CHRIP] Chemical Risk Information Platform [database]. 2008. Tokyo (JP): National Institute of Technology and Evaluation, Chemical Management Centre (CMC). [accessed 2013 Nov 27].
[CITI];1992; Biodegradation and bioaccumulation data of existing chemicals based on the CSCL; Japon (Tokyo), Chemical Inspection and Testing Institute (disponible en anglais seulement).
Clement R.E., Reiner E.J. et Bhavsar S.P. ; 2012 ; Organohalogen contaminants of emerging concern in Great Lakes fish: a review; Analytical and Bioanalytical Chemistry, 404, p. 2639-2658.
Covaci A., Harrad S., Abdallah M.A.-E., Ali N., Law R.J., Herzke D. et de Wit C.A.; 2011; Novel brominated flame retardants: a review of their analysis, environmental fate and behavior; Environment International, 37, p. 532-556 (disponible en anglais seulement).
[CPOP] Modèle canadien pour les POP; 2008; Gatineau (QC) : Environnement Canada, Division de l’évaluation écologique; Bourgas (Bulgarie) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique [modèle basé sur celui de Mekenyan et al. 2005].
Crump D., Farhat A., Chiu S., Williams K.L. et Jones S.P.; 2016; Use of a novel double-crested cormorant ToxChip PCR array and EROD assay to determine effects of envornmental contamints in primary hepatoctyes; Environ. Sci. Technol., 50(6), p. 3265‑3274 (disponible en anglais seulement).
DEREK Nexus [module de prédiction de la toxicité]; 2013; v. 3.0.1; Leeds (Royaume-Uni) : Lhasa Limited [consulté le 15 avril 2014] (disponible en anglais seulement).
Dewhurst I. et Renwick A.G.; 2013; Evaluation of the threshold of toxicological concern (TTC)-Challenges and approaches; Regul. Toxicol. Pharmacol., 65(1), p. 168-177.
Diamond M., Gooset E., Saini A. et Chaudhuri S.; 2013; Exposure to new flame retardants in Canadian indoor environments; contrat prepare pour Santé Canada : octobre 2013 (disponible en anglais seulement).
Dimitrov S., Dimitrova N., Parkerton T., Comber M., Bonnell M. et Mekenyan O.; 2005; Base-line model for identifying the bioaccumulation potential of chemicals SAR QSAR; Environ. Res., 16(6), p. 531-554 (disponible en anglais seulement).
[DNV] The Norwegian Veritas AS; 2010; Environmental screening of selected new brominated flame retardants and selected polyfluorinated compounds (disponible en anglais seulement).
Drage D.S., Newton S., de Wit C.A. et Harrod S.; 2016; Concentrations of legacy and emerging flame retardants in air and soil on a transect in the UK West Midlands; Chemosphere, 148, p. 195-203 (disponible en anglais seulement).
Dwyer F.J., Hardesty D.K., Ingersoll C.G., Kunz J.L. et Whites D.W.; 2000; Assessing contaminant sensitivity of American shad, Atlantic sturgeon, and shortnose sturgeon; Action plan project Hudson River Estuary; Geological Survey des États-Unis (disponible en anglais seulement).
[EC] Environnement Canada; 2013-2014; Données sur certaines substances ignifuges organiques collectées en vertu de la Loi canadienne sur la protection de l’environnement 1999, article 71 : Avis concernant certaines substances ignifuges organiques; Données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes
[ECCC] Environnement et Changement climatique Canada; 2016; Supporting Documentation : Information in support of the State of the Science report for benzene, 1,3,5-tribromo-2-(2-propenyloxy)-; Gatineau (QC) : ECCC; substances@ec.gc.ca (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2010; Guidance on information requirements and chemical safety assessment; Chapter R.16: Environmental exposure estimation; mai 2010; Guidance for the implementation of REACH; Helsinki (Finlande) : Agence européenne des produits chimiques (disponible en anglais seulement).
[ECOSAR] Ecological Structure Activity Relationships Class Program [modèle d’estimation]; 2012; v. 1.11; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments; 2012a; Scientific opinion on brominated flame retardants in food: brominated phenols and their derivatives; EFSA Journal, 10(4), p. 2534 (disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments; 2012b; Scientific opinion on exploring options for providing advice about possible human health risks based on the concept of threshold of toxicological concern (TTC); EFSA J., 10(7), p. 2750.
Eisler R.; 1994; Acrolein hazards to fish, wildlife, and invertebrates: a synoptic review; Washington (DC) : National Biological Survey, U.S. Department of the Interior, 29 p. (Biological Report 23: Contaminant Hazard Reviews Report 28) (disponible en anglais seulement).
Environnement Canada; 2014; Legacy and current use flame retardants in Great Lakes atmosphere; Direction de la scioence et de la technologie, Burlington, Ontario, Canada (disponible en anglais seulement).
Environnement Canada, Santé Canada; 2000; Liste des substances d’intérêt prioritaire – Rapport d’évaluation pour l’acroléine : numéro de registre du Chemical Abstracts Service 3278-89-5; Ottawa (ON) : Environnement Canada, Santé Canada [6 mai 2014]. Substances chimiques : Catégorisation [en ligne]. Ottawa (Ont.) : gouvernement du Canada. [mis à jour le 25 mai 2013; consulté le 31 juillet 2013].
Environnement Canada, Santé Canada; 2007; Catégorisation de substances chimiques; Ottawa (ON) : gouvernement du Canada [mis à jour le 25 mai 2013; consulté le 31 juillet 2013].
Environment Agency du Royaume-Uni. 2010. Environmental prioritization of low production volume substances under REACH: PBT screening. [PDF] (disponible en anglais seulement)
[EPA] Environmental Protection Agency des États-Unis; 2006; Inventory update reporting, past IUR data: Non-confidential 2002 IUR company/chemical records: Benzene, 1,3,5-tribromo-2-(-propen-1-yloxy)-, CAS RN 3278-89-5 [en ligne]; Washington (DC) : Environmental Protection Agency des États-Unis [consulté le 15 août 2013]; Archivé (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2014; Flame retardant alternatives for hexabromocyclododecane (HBCD). Final Report; EPA Publication 740R14001 (disponible en anglais seulement).
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [Estimation Model]; 2012; v. 4.1; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation; Référence dans le texte : EPISuite 4.1 (disponible en anglais seulement).
[EQC] Equilibrium Criterion Model; 2012; v. 1.0; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre [consulté en juin 2013] disponible en anglais seulement).
Escher B.I., Ashauer R., Dyer S., Hermens J.L.M., Lee J.-H., Leslie H.A., Mayer P., Meador J.P. et Warne M.S.J.; 2011; Crucial role of mechanisms and modes of toxic action for understanding tissue residue toxicity and internal effect concentrations of organic chemicals; Integr. Environ. Assess. Manag., 7(1), p. 28-49
[ESIS] Système européen d’information sur les substances chimiques [base de données]; c1995-200[9]; Bureau européen des produits chimiques [consulté en décembre 2014];
Ezechias M., Svobodova K. et Cajthaml T.; 2012; Hormonal activities of new brominated flame retardants; Chemosphere, 87(7), p. 820-824 (disponible en anglais seulement).
Fan X., Kubwabo C., Rasmussen P.E. et Wu F.; 2016; Non-PBDE halogenated flame retardants in Canadian indoor house dust: sampling, analysis, and occurrence; Environ. Sci. Pollut. Res., 23, p. 7998–8007 (disponible en anglais seulement).
Fisk P.R., Girling A.E. et Wildey R.J.; 2003; Prioritisation of flame retardants for environmental risk assessment; UK Environment Science Agency (disponible en anglais seulement).
Gilchrist T.T., Letcher R., Thomas P. et Fernie K.J.; 2014; Polybrominated diphenyl ethers and multiple stressors influence the reproduction of free-ranging tree swallows (Tachycineta bicolor) nesting at wastewater treatment plants; Sci. Total Environ., 472, p. 63-71 (disponible en anglais seulement).
Gobas F.A.P.C.; 2010; Comments on approach to sediment exposure; Burnaby (C.-B.) : Université Simon Fraser, School of Resource & Environmental Management, 25 mars (disponible en anglais seulement).
Gobas F.A.P.C., Kelly B.C. et Arnot J.A.; 2003; Quantitative structure activity relationships for predicting the bioaccumulation of POPs in terrestrial food-webs; QSAR Comb. Sci., 22, p. 329-336 (disponible en anglais seulement).
Gobas F.A. et Morrison H.A.; 2000; Bioconcentration and biomagnification in the aquatic environment; dans Boethling R.S. et Mackay D. éditeurs; Handbook of property estimation methods for chemicals, environmental and healthsciences; Boca Raton (Floride) : CRC, p. 189C (disponible en anglais seulement).
Great Lakes Solutions; 2010; Flame Retardants Product Guide.;Philadelphia (Pennsylvanie) : Chemtura Corporation [consulté le 21 août 2013]; archivé (disponible en anglais seulement).
Hamers T., Kamstra J.H., Sonneveld E., Murk A.J., Kester M.H., Andersson P.L., Legler J. et Brouwer A.; 2006; In vitro profiling of the endocrine-disrupting potency of brominated flame retardants; Toxicol. Sci., 92(1), p. 157-73 (disponible en anglais seulement).
Harju M., Heimstad E., Herzke D., Sandanger T., Posner S. et Wania F.; 2009; Current state of knowledge and monitoring requirements; Emerging "new" brominated flame retardants in flame retarded products and the environment; Oslo (Norvège) : Autorité norvégienne de contrôle de la pollution (disponible en anglais seulement).
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [Estimation Model]; 2010; v. 3.20; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Herzke D., Harju M., Heimstad E., Dandanger T., Posner S. et Wania F.; 2010; Emerging “new” brominated flame retardants [pdf] : sources and transport (disponible en anglais seulement).
Holcome G.W., Phipps G.L., Sulaiman A.H. et Hoffman A.D.; 1987; Simultaneous multiple species testing: Acute toxicity of 13 chemicals to 12 diverse freshwater amphibian, fish and invertebrate families; Arch. Environ. Contam. Toxicol., 16, p. 697‑710 (disponible en anglais seulement).
[HYDROWIN] ] Hydrolysis Rates Program for Microsoft Windows [Estimation Model]; 2010; v. 2.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Huber S., Warner N.A., Nygard T., Remberger M., Harju M., Uggerud H.T., Kaj L. et Hanssen L.; 2015; A broad cocktail of environmental pollutants found in eggs of three seabird species from remote colonies in Norway; Environ. Toxicol. Chem., 34(6), p. 1296-1308 (disponible en anglais seulement).
Institut pour la santé et la protection des consommateurs; Technical Guidance Document on Risk Assessment [pdf]; rapport noEUR 20418 EN/2, 328p; Luxembourg : Office des publications officielles des Communautés européennes (disponible en anglais seulement).
IPC; [modifié le 10 mars 2011]; Joint Industry Guide: Material Composition Declaration for Electrotechnical Products, JIG-101 Ed. 4.0 [pdf]; États-Unis : Consumer Electronics Association [consulté le 21 février 2018] (disponible en anglais seulement).
Kharlyngdoh J.B., Pradhan A., Asnake S., Walstad A., Ivarsson P. et Olsson P.E.; 2015; Identification of a group of brominated flame retardants as novel androgen receptor antagonists and potential neuronal and endocrine disrupters; Environ. Int., 74, p. 60-70 (disponible en anglais seulement).
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [Estimation Model]; 2010; v. 1.10; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
[KOCWIN] The Soil Adsorption Coefficient Program [Estimation Model]; 2010; v. 2.00; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [Estimation Model]; 2010; v. 1.68; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Kolic T., Shen L., MacPherson K., Fayez L., Gobran T., Helm P., Marvin C., Arsenault G. et Reiner E.; 2009; The analysis of halogenated flame retardants by GC‑HRMS in environmental samples; J. Chromatographic Science, 47, p. 83-91 (disponible en anglais seulement).
Kroes R., Renwick A.G., Cheeseman M., Kleiner J., Mangelsdorf I., Piersma A., Schilter B., Schlatter J., van Schothorst F., Vos J.G. et Würtzen G.; 2004; Structure‑based thresholds of toxicological concern (TTC): guidance for application to substances present at low levels in the diet; Food Chem. Toxicol., 42(1), p. 65-83 (disponible en anglais seulement).
Kuramochi H., Takigami H., Scheringer M. et Sakai S.; 2014; Estimation of physicochemical properties of 52 non-PBDE brominated flame retardants and evaluation of their overall persistence and long-range transport potential; Science of the Total Environment, 491–492, p. 108–117 (disponible en anglais seulement).
Leadscope Model Applier [module de prédiction]; 2013; v. 1.7.4; Columbus (Ohio) : Leadscope Inc. [consulté le 16 avril 2014] [accès restreint] (disponible en anglais seulement).
Lee S.C., Sverko E., Harner T., Pozo K., Barresi E., Schachtschneider J., Zaruk D., DeJong M. et Narayan J.; 2016; Retrospective analysis of “new” flame retardants in the global atmosphere under the GAPS Network; Environ. Pollution., 217, p. 62-69 (disponible en anglais seulement).
Lee S.C., Sverko E., Harner T., Schachtschnieder J., Zaruk D., DeJong M. et Barresi E.; 2013; "New" flame retardants in the global atmosphere under the GAPS Network; Résumé présenté à la conférence BFR 2013 à San Francisco (CA) en avril 2013 [consulté en avril 2013] (disponible en anglais seulement).
Liagkouridis I., Cousins A.P. et Cousins I.T.; 2015; Physical–chemical properties and evaluative fate modelling of ‘emerging’ and ‘novel’ brominated and organophosphorus flame retardants in the indoor and outdoor environment; Science of the Total Environment; 524–525, p. 416–426 (disponible en anglais seulement).
Ma Y., Venier M. et Hites R.A.; 2012; Tribromophenoxy flame retardants in the Great Lakes atmosphere; Environmental Science & Technology, 46, p. 13112-13117 (disponible en anglais seulement).
Martin P. et Hughes K.; 2016a; Flame retardants in eggs of four gull species in Canada, 2008-2013; Résumé (août 2014); Division de l’écotoxicologie et de la santé de la faune, Environnement et Changement climatique Canada (disponible en anglais seulement).
Martin P. et Hughes K.; 2016b; Flame retardants in eggs of European starlings (Sturnus vulgaris) in Canada, 2008-2013; Résumé (août 2014 Division de l’écotoxicologie et de la santé de la faune, Environnement et Changement climatique Canada (disponible en anglais seulement).
McCarty L.S.; 1986; The relationship between aquatic toxicity QSARs and bioconcentration for some organic chemicals; Environ. Toxicol. Chem., 5, p. 1071-1080 disponible en anglais seulement).
McCarty L.S.; 1987a; Relationship between toxicity and bioconcentration for some organic chemicals: I Examination of the relationship; dans Kaiser K.L.E. éditeur, QSAR in Environmental Toxicology-II; Dordecht (Pays-Bas) : D Reidel Publishing Co., p. 207‑220 (disponible en anglais seulement).
McCarty L.S.; 1987b; Relationship between toxicity and bioconcentration for some organic chemicals: II Application of the relationship; dans Kaiser K.L.E. éditeur, QSAR in Environmental Toxicology-II; Dordecht (Pays-Bas) : D Reidel Publishing Co., p. 221‑229 (disponible en anglais seulement).
McCarty L.S.; 1990; A kinetics-based analysis of quantitative structure-activity relationships in aquatic toxicity and bioconcentration bioassays with organic chemicals; Thèse de doctorat, Université de Waterloo, Waterloo (ON), Canada (disponible en anglais seulement).
McCarty L.S., Arnot J.A. et Mackay D.; 2013; Evaluation of critical body residue for acute narcosis in aquatic organisms; Environ. Toxicol. Chem., 32(10) (disponible en anglais seulement).
McCarty L.S., Hodson P.V., Craig G.R. et Kaiser K.L.E.; 1985; The use of quantitative structure-activity relationships to predict the acute and chronic toxicities of organic chemicals to fish; Environ. Toxicol. Chem., 4, p. 595-606 (disponible en anglais seulement).
McCarty L.S. et Mackay D.; 1993; Enhancing ecotoxicological modeling and assessment: critical body residues and modes of toxic action; Environ. Sci. Technol., 27, p. 1719-1728 (disponible en anglais seulement).
McCarty L.S., Mackay D., Smith A.D., Ozburn G.W. et Dixon D.G.; 1991; Interpreting aquatic toxicity QSARs: the significance of toxicant body residues at the pharmacologic endpoint; Science of the Total Environment, Special Issue : « QSAR in Environ. Toxicol. », p. 109:515-525 (disponible en anglais seulement).
Mekenyan G., Dimitrov S.D., Pavlov T.S. et Veith G.D.; 2005; POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites; SAR QSAR Environ. Res., 16(1-2), p. 103-133.
Morris A.D., Muir D.C.G., Solomon K.R., Teixeira C., Duric M. et Wang X.; 2014; non publié; Bioaccumulation and trophodynamics of current use halogenated flame retardants in the Bathurst Region vegetation-caribou-wolf food chain in Canadian Arctic (disponible en anglais seulement).
Morris A.D., Muir D.C.G., Solomon K.R., Teixeira C., Duric M. et Wang X.; 2014; non publié; Supporting information for Morris et al. 2014 : Bioaccumulation and trophodynamics of current use halogenated flame retardants in the Bathurst Region vegetation-caribou-wolf food chain in Canadian Arctic (disponible en anglais seulement).
[MPBPVPWIN] Melting Point Boiling Point Vapour Pressure Program for Microsoft Windows [Estimation Model]; 2010; v. 1.43; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Muir D., Teixeira C., Epp J., Young T., Wang X., Keir M. et Backus S.; 2011; Bioaccumulation of selected halogenated organic flame retardants in remote lakes and in the Great Lakes [Affiche informative]; Burlington (ON) : Environnement Canada (disponible en anglais seulement).
Muir D., Tomy G., de Jourdan B., Orihel D. et Morris A.; 2014; non publié; Using remote environments to detect new persistent and bioaccumulative chemicals in commerce; Division de la recherché sur les contaminants aquatiques (DRCA), Environnement Canada, Burlington (ON) (disponible en anglais seulement).
Munro I.C., Ford R.A., Kennepohl E. et Sprenger J.G.; 1996a; Correlation of a structural class with no-observed-effect-levels: a proposal for establishing a threshold of concern; Food Chem. Toxicol., 34, p. 829-867 (disponible en anglais seulement).
Munro I.C., Ford R.A., Kennepohl E. et Sprenger J.G.; 1996b; Thresholds of toxicological concern based on structure-activity relationships; Drug Metab. Rev., 28(1‑2), p. 209-217 (disponible en anglais seulement).
Nova Chemicals Corp.; 2012; Technical data : Expandable polystyrene resins product chart; Nova Chemicals Corporation ; Archivé (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2000; SIDS Initial Assessment Report for: Acrolein [pdf]; CAS RN 107-02-8 : SIDS Initial Assessment Meeting; [consulé en mars 2000] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2009a; Emission scenario document on plastics additives [pdf]; Paris (France) : OCDE, Direction de l’environnement, Series on Emission Scenario Documents No. 3., rapport no ENV/JM/MONO(2004)8, JT00166678 [consulté en mars 2014] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2009b; Guidance Document for Using the OECD (Q)SAR Application Toolbox to Develop Chemical Categories According to the OECD Guidance on Grouping of Chemicals [pdf]; Paris (France) : OCDE, Direction de l’Environnement, Series on Testing and Assessment No. 102, rapport no ENV/JM/MONO(2009)5, JT03260091 (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2011; QSAR Toolbox User Manual: Strategies for grouping chemicals to fill data gaps to assess genetic toxicity and genotoxic carcinogenicity [Internet] [PDF] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2013;; OECD QSAR Toolbox [Read across tool]; v. 3.1; Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement [consulté le 10 avril 2014] (disponible en anglais seulement).
[OMS] Organisation mondiale de la Santé; 1997; Flame retardants: a general introduction (Environmental health criteria 192); Genève (Suisse) : Programme international sur la sécurité des substances chimiques; 995 (disponible en anglais seulement).
[OMS] Organisation mondiale de la Santé; 2005; 2,4,6-Tribromophenol and other simple brominated phenols; Concise international chemical assessment document 66 (disponible en anglais seulement).
Organisation de coopération et de développement économiques; Zurich (Suisse) : École polytechnique fédérale; Distribué lors de l’atelier OCDE/PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada) du 31 mai au 2 juin 2006 [consulté le 29 novembre 2013].
[PISSC]; 1997; Flame Retardants: A general introduction; Environmental Health Criteria 192; Programme international sur la sécurité des substances chimiques; Organisation mondiale de la santé (disponible en anglais seulement).
[PISSC] Programme international sur la sécurité des substances chimiques; 2002; Concise International Chemical Assessment Document 43: Acrolein [PDF]; Genève (Suisse) : Programme des Nations Unies pour l’environnement; Organisation internationale du Travail; Organisation mondiale de la Santé; En page couverture : First draft prepared by R. Gomes and M.E. Meek, Existing Substances Division, Bureau of Chemical Hazards, Health Canada, Ottawa, Canada, and M. Eggleton, Environment Canada, Hull, Quebec (disponible en anglais seulement).
[PISSC] Programme international sur la sécurité des substances chimiques; 2005; Concise International Chemical Assessment Document 66: 2,4,6-tribromophenol and other simple brominated phenols [pdf]; Genève (Suisse) : Programme des Nations Unies pour l’environnement; Organisation internationale du Travail; Organisation mondiale de la Santé; En page couverture : First draft prepared by Mr P.D. Howe, Dr S. Dobson, and Mr H.M. Malcolm, Centre for Ecology & Hydrology, Monks Wood, United Kingdom (disponible en anglais seulement).
Porter E., Crump D., Egloff C., Chiu D. et Kennedy S.W.; 2014; Use of an avian hepatocyte assay and the avian toxchip polymerase chain reaction array for testing priorization of 16 organic flame retardants; Environ. Toxicol. Chem., 33(3), p. 573-582 (disponible en anglais seulement).
Pradhan A., Asnake S., Kharlyngdoh J.B., Modig C. et Olsson P.-E.; 2015; In silico and biological analysis of anti-androgen activity of the brominated flame retardants ATE, BATE and DPTE in zebrafish; Chemico-Biological Interactions, 233, p. 35-45 (disponible en anglais seulement).
Présentation de projet d’études; 1989a; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 1; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1989b; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 2; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1990a; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 1; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1990b; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 2; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996a; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 1; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996b; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 2; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996c; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 3; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996d; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 4; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996e; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 5; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996f; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 6; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996g; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 7; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996h; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 8; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1996i; Étude confidentielle non publiée, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Disponible en tant que Sommaire de rigueur d’étude no 9; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation de projet d’études; 1997; Toxicological studies on 1,3,5-tribromo-2-(2-propenyloxy)-benzene CAS No. 3278-89-5; Données confidentielles non publiées présentées à Santé Canada dans le cadre du Programme des substances nouvelles; Ottawa (ON) : Santé Canada, Bureau de l’évaluation et du contrôle des substances nouvelles.
Présentation de projet d’études; 2013; Toxicological studies on 1,3,5-tribromo-2-(2-propenyloxy)-benzene CAS No. 3278-89-5; Données confidentielles non publiées présentées à Environnement Canada dans le cadre du Plan de gestion des produits chimioques; Gatineau (QC) : Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Saini A., Thaysen C., Jantunen L., McQueen R.H. et Diamond M.L.; 2016; From clothing to laundry water: investigating the fate of phthalates, brominated flame regardants, and organophosphate esters; Environ. Sci. Technol., 50(17), p. 9289-9297 (disponible en anglais seulement).
Sakuratani Y., Noguchi Y., Kobayashi K., Yamada J. et Nishihara T.; 2008; Molecular size as a limiting characteristic for bioconcentration in fish; J. Environ. Biol., 29(1), p. 89‑92 (disponible en anglais seulement).
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de l’hygiène du milieu (disponible en anglais seulement).
Santé Canada; [modifiée le 3 mai 2017]; Listes des additifs alimentaires autorisés; Ottawa (ON) : Santé Canada, Direction des aliments [consultée le 24 avril 2014].
Schenker U., Macleod M., Scheringer M. et Hungerbühler K.; 2005; Improving data quality for environmental fate models: a least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds; Environ. Sci. Technol., 39, p. 8434-8441 (disponible en anglais seulement).
Scheringer M., MacLeod M. et Wegmann F.; 2009; The OECD POV and LRTP Screening Tool. Version 2.2 [pdf] (disponible en anglais seulement).
Shanmuganathan M., Zhang Z., Sverko E., Brymer R., Gill B., Smyth S.A. et Marvin C.H.; 2017; Analysis of halogenated flame retardants in Canadian wastewater treatment plants using gas chromatography-tandem mass spectrometry; Analytical and Bioanalytical Chemistry, soumis (disponible en anglais seulement).
Shoeib M., Harner T., Webster G.M., Sverko E. et Cheng Y.; 2012; Legacy and current-use flame retardants in house dust from Vancouver, Canada; Environmental Pollution. 169, p. 175-182 (disponible en anglais seulement).
Shoeb M. et Jantunen L.; 2014; Legacy and current use flame retardants in Great Lakes atmosphere; Science et Technologie, Environnement Canada, Ontario, Canada.
Stapleton H.M.; 2010; Flame retardants: are they a health risk for children? Child Task Force Meeting; Raleigh (Caroline du nord, É.-U.), 11 janvier 2010 (disponible en anglais seulement).
Sühring R., Barber J.L., Wolschke H. et Kötke D.; 2015a; Fingerprint analysis of brominated flame retardants and Dechloranes in North Sea sediments; Environmental Research, 140, p. 569-578 (disponible en anglais seulement).
Sühring R., Frees M., Schneider M., Schubert S., Pohlmann J., Alaee M., Wolschke H., Hanel R. et Ebinghaus Marohn L.; 2015b; Maternal transfer of emerging brominated and chlorinated flame retardants in European eels; Science of the Total Environment, 530-531, p. 209-218 (disponible en anglais seulement).
Tanaka R., Yamada R., Oba K., Iga T. et Mikami S.; 1999; Combined repeat dose and reproductive/developmental toxicity screening test of 2,4,6-tribromophenol by oral administration in rats; Shizuoka, ministère de la santé et du bien-être du Japon, Biosafety Research Centre (Toxicity Testing Reports of Environmental Chemicals No. 7) [cité dans PISSC 2005]
[TaPL3] Long Range Transport and Persistence Level III model; 2000; v. 2.10; Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre (disponible en anglais seulement).
[TemaNord] Conseil de ministres des pays nordiques; 2011; Schlabach M., Remberger M., Brorström-Lundén E., Norström K., Kaj L., Andersson H., Herzke D., Borgen A. et Harju M., 2011, Brominated Flame Retardants (BFR) in the Nordic Environment; TemaNord 2011:528, Conseil de ministres des pays nordiques, Copenhague, Danemark (disponible en anglais seulement).
[TIMES] TIssue MEtabolism Simulator [module de prédiction]; 2013; v. 2.27.5; Bourgas (BG) : Université Prof. Assen Zlatarov, Laboratoire de chimie mathématique; [consultee le 10 avril 2014] (disponible en anglais seulement).
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [prediction module]; 2004; v. 3.1; San Diego (CA) : Accelrys Software Inc. (disponible en anglais seulement).
[UK EA] Agence environnementale du Royaume-Uni; 2010; Environmental prioritization of low production volume substances under REACH: PBT screening [PDF] (disponible en anglais seulement).
[UNEP] Programme des Nations Unies pour l’environnement; 2012; Report of the Persistent Organic Pollutants Review Committee on the work of its eighth meeting [pdf]; Convention de Stockholm sur les polluants organiques persistants; Genève (Suisse), 15–19 octobre; UNEP/POPS/POPRC.8/16/Add.3 (disponible en anglais seulement).
Van Hoogen G. et Opperhuizen A.; 1988; Toxicokinetics of chlorobenzenes in fish; Environ. Toxicol. Chem., 7, p. 213-219.
[VEGA] Virtual models for property Evaluation of chemicals within a Global Architecture; 2013; v. 1.0.8; Milan (Italie) : Istituto di Ricerche Farmacologiche Mario Negri, Laboratoire de chimie et de toxicology environnementale [consulté le 16 avril 2014] (disponible en anglais seulement).
Von der Recke R. et Vetter W.; 2007; Synthesis and characterization of 2,3‑dibromopropyl-2,4,6-tribromophenyl ether (DPTE) and structurally related compounds evidenced in seal blubber and brain; Environmental Science & Technology, 41, p. 1590-1595 (disponible en anglais seulement).
Weisser M.; 1992; Investigations on the contamination of municipal sewage sludges with organic pollutants; Université de Karlsruhe (Schriftenreihe ISWW, 63) (disponible en anglais seulement).
Wilson R., Jones-Otazo H., Petrovic S., Mitchell I., Bonvalot Y., Williams D. et Richardson G.M.; 2013; Revisiting dust and soil ingestion rates based on hand-to-mouth transfer; Human and Ecological Risk Assessment, 19(1), p. 158-188 (disponible en anglais seulement).
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]; 2010; v. 1.42; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Xie Z., Möller A., Ahrens L., Sturm R. et Ebinghaus R.; 2011; Brominated flame retardants in seawater and atmosphere of the Atlantic and the Southern Ocean; Environmental Science & Technology, 45, p. 1820-1826 (disponible en anglais seulement).
Yu Y., Hung H., Alexandrou N., Roach P. et Nordin K.; 2015; Multiyear measurements of flame retardants and organochlorine pesticides in air in Canada’s Western Sub-Arctic; Environ. Sci. Technol., 49(14), p. 8623-8630 (disponible en anglais seulement).
Zhang Y.-N., Chen J., Xie Q., Li Y. et Zhou C. ; 2016 ; Photochemical transformation of five novel brominated flame retardants: kinetics and photoproducts; Chemosphere, 150, p. 453-460 (disponible en anglais seulement).
Annexe A. Liste détaillée des propriétés physiques et chimiques de l’EAT
| Propriété | Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (°C) | Expérimental | 74 à 76 °C§ | ND | Great Lakes Solutions 2010 |
| Point de fusion (°C) | Expérimental | 74 à 77,6 | ND | Présentation de projet 1996a |
| Point de fusion (°C) | Modélisé | 101,74 | ND | MPBPWIN 2010 (v. 1.43) (valeur pondérée) |
| Point d’ébullition (°C) | Modélisé | 323,15 | ND | MPBPVPWIN 2010 (v. 1.43) (Méthode de Stein et Brown adaptée) |
| Point d’ébullition (°C) | Expérimental | 210 | ND | Présentation de projet 1996b |
| Masse volumique (kg/m3) | Expérimental | 2020 (2,02 g/cm3) | ND | Présentation de projet 1996c |
| Pression de vapeur (Pa) | Expérimental | < 10 | 20 | Présentation de projet 1996d |
| Pression de vapeur (Pa) | Modélisé | 0,00854 | 25 | MPBPWIN 2010 (v. 1.43) (méthode Antoine) modélisé |
| Pression de vapeur (Pa) | Modélisé | 0, 0135§ | 25 | MPBPVPWIN 2010 (v. 1.43) (méthode de Grain modifiée – pression de valeur sélectionnée) modélisé |
| Pression de vapeur (Pa) | Modélisé | 0,075 | ND | Propriété de liquide sous‑refroidi |
| Pression de vapeur (Pa) | Modélisé | 0,049 | 25 | ACD/Percepta [module de prédiction] c1997-2012 |
| Constante de Henry (Pa.m3/mol) | Modélisé | 2,68 | 25 | HENRYWIN 2010 (v. 3.20) (estimation des liaisons) |
| Constante de Henry (Pa.m3/mol) | Modélisé | 2,65 | 25 | HENRYWIN 2010 (v. 3.20) (estimation des liaisons) Sous-refroidi |
| log Koe (sans dimension) | Expérimental | > 4,86 | 25 | Présentation de projet 1996e |
| log Koe (sans dimension) | Modélisé | 5, 59§ | 25 | KOWWIN 2010 (v. 1.68) |
| log Koe (sans dimension) | Modélisé | 6,09 | ND | Propriété de liquide sous‑refroidi |
| log Kco (sans dimension) | Expérimental | 3,5-4,8 | ND | Présentation de projet 1996f |
| log Kco (sans dimension) | Modélisé | 3,12 | 25 | KOCWIN 2010 v. 2.00 (estimation de MCI) |
| log Kco (sans dimension) | Modélisé | 3,12 | 25 | KOCWIN 2010 v. 2.00 (estimation de MCI) Sous-refroidi |
| log Kco (sans dimension) | Modélisé | 4,07 | 25 | KOCWIN 2010 v. 2.00 (estimation du log Koe) |
| log Kco (sans dimension) | Modélisé | 4,35 | 25 | KOCWIN 2010 v. 2.00 (estimation du log Koe) Sous-refroidi |
| log Kco (sans dimension) | Modélisé | 4,97 | ND | ACD/pKaDB (v. 9.04) 2005 |
| log Kae (sans dimension) | Modélisé | -2, 96§ | ND | KOAWIN 2010 v. 1.10 |
| log Koa (sans dimension) | Modélisé | 8,55 | 25 | KOAWIN 2010 v. 1.10 |
| log Koa (sans dimension) | Modélisé | 9,05 | 25 | KOAWIN 2010 v. 1.10 Sous-refroidi |
| Solubilité dans l’eau (mg/L) | Expérimental | 0, 24§ | 20 à 22 | Présentation de projet 1996g |
| Solubilité dans l’eau (mg/L) | Modélisé | 0,06 | ND | Propriété de liquide sous‑refroidi |
| Solubilité dans l’eau (mg/L) | Modélisé | 0,078 | 25 | WSKOWWIN 2010 (v. 1.42) |
| Dmin (nm)a | Modélisé | 10,73 | ND | CPOP 2008 |
| Dmax (nm)b | Modélisé | 13,18 | ND | CPOP 2008 |
| pKa (sans dimension) | - | Aucun pKa, car l’EAT n’a pas de groupes ionisables | - | - |
Abréviations : log Koe= coefficient de partage octanol-eau;
log Kco = coefficient de partage carbone organique-eau;
log Kae = coefficient de partage air-eau;
log Koa = coefficient de partage octanol-air;
pKa = constante de dissociation acide;
ND = non disponible
§Indique une valeur retenue pour l;a modélisation
a diamètre minimal de la membrane cellulaire
b diamètre maximal de la membrane cellulaire
Annexe B. Poids de la preuve pour l’évaluation des risques pour l’environnement
| Élément de preuve | Niveau d’incertitudea | Pertinence pour l’évaluationb | Poids assignéc |
|---|---|---|---|
| Propriétés physiques et chimiques | Faible à modéré | Élevée | Modérée à élevée |
| Persistance | Faible à modérée | Modérée | Modérée à élevée |
| Produits de dégradation potentiels | Élevée | Modérée | Faible à modérée |
| Bioaccumulation | Moderate | Modérée à élevée | Modérée à élevée |
| Bioamplification | Faible à modérée | Modérée à élevée | Modérée à élevée |
| Toxicité pour les mammifères | Élevée | Élevée | Modérée |
| Résidus corporels critiques | Modérée | Élevée | Modérée à élevée |
| Données de surveillance | Faible | Élevée | Élevée |
| Analyse de quotient de risque | Modérée | Élevée | Modérée à élevée |
a Capacité à induire la vérité à partir des données étant donné le niveau d’incertitude et la puissance des données
b Descrit à quel point les données sont pertinentes scientifiquement et pour cette évaluation
c Poids final assigné à un élément de preuve qui est fonction des résultats assignés à la force d’interférence et de pertinence
Annexe C. Estimations de l’absorption quotidienne d’EAT par divers groupes d’âge de la population du Canada
| Voie d’exposition | 0‑6 moisa (allaités)b | 0-6 moisa (nourris avec une préparation)c | 0-6 moisa (pas nourris avec une préparation)d | 0,5-4 anse | 5-11 ansf | 12-19 ansg | 20- 59 ansh | 60 ans et plusi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | 3,9E-07 | 3,9E-07 | 3,9E-07 | 8,3E-07 | 6,4E-07 | 3,7E-07 | 3,1E-07 | 2,7E-07 |
| Air intérieurk | 4,2E-07 | 4,2E-07 | 4,2E-07 | 8,9E-07 | 7,0E-07 | 4,0E-07 | 3,4E-07 | 3,0E-07 |
| Eau potablel | s.o. | 2,3E-08 | 8,8E-09 | 9,9E-09 | 7,8E-09 | 4,4E-09 | 4,7E-09 | 4,9E-09 |
| Alimentsm | NI | NI | NI | 1,6E-05 | 1,3E-05 | 7,4E-06 | 7,1E-06 | 4,6E-06 |
| Poussièren | 1,3E-04 | 1,3E-04 | 1,3E-04 | 7,0E-05 | 2,6E-05 | 9,7E-07 | 9,3E-07 | 9,1E-07 |
| Solo | s.o. | s.o. | s.o. | 2,7E-06 | 2,0E-06 | 7,1E-08 | 6,8E-08 | 6,3E-08 |
| Absorption totale | 1,3E-04 | 1,3E-04 | 1,3E-04 | 9,0E-05 | 4,3E-05 | 9,2E-06 | 8,7E-06 | 6,1E-06 |
Abréviations : s.o. = sans objet; NI = non identifé dans la littérature.
a Il est assumé que le nourrisson pèse 7,5 kg, respire 2,1 m3 d’air par jour (Santé Canada 1998) et ingère respectivement 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b Il est assumé que les nourrissons allaités exclusivement consomment 0,742 L de lait maternel par jour (Santé Canada 1998), et que le lait maternel constitue la seule source alimentaire. Aucune donnée quantitative n’a été identifiée pour ce qui est des concentrations d’EAT dans le lait maternel.
c Il est assumé que les nourrissons nourris avec une préparation exclusivement consomment 0,8 L d’eau par jour (Santé Canada 1998), eau qui est utilisée pour reconstituer la préparation. Aucune donnée sur la surveillance de l’EAT dans des préparations n’a été trouvée. L’absorption par voie alimentaire est donc uniquement due à l’eau. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d ll est assumé que les nourrissons qui ne sont pas nourris exclusivement avec une préparation consomment 0,7 L d’eau par jour (Santé Canada 1998) et qu’environ 50 % de ces nourrissons ont commencé à manger des aliments solides à 4 mois et 90 % à 6 mois (Santé Canada 1998).
e Il est assumé que l’enfant pèse 15,5 kg, respire 9,3 m3 d’air par jour, boit 0,7 L d’eau par jour, consomme 54,7 g de poisson par jour (Santé Canada 1998) et ingère respectivement 41 et 14 mg de poussière et de sol par jour (Wilson et al. 2013).
f Il est assumé que l’enfant pèse 31,0 kg, respire 14,5 m3 d’air par jour, boit 1,1 L d’eau par jour, consomme 89,8 g de poisson par jour (Santé Canada 1998) et ingère respectivement 31 et 21 mg de poussière et de sol par jour (Wilson et al. 2013).
g Il est assumé que la personne pèse 59,4 kg, 15,8 m3 d’air par jour, boit 1,2 L d’eau par jour, consomme 97,3 g de poisson par jour (Santé Canada 1998) et ingère respectivement 2,2 et 1,4 mg de poussière et de sol par jour (Wilson et al. 2013).
h Il est assumé que la personne pèse 70,9 kg, respire 16,2 m3 d’air par jour, boit 1,5 L d’eau par jour, consomme 111,7 g de poisson par jour (Santé Canada 1998) et ingère respectivement 2,5 et 1,6 mg de poussière et de sol par jour (Wilson et al. 2013).
i Il est assumé que la personne pèse 72,0 kg, respire 14,3 m3 d’air par jour, 1,6 L d’eau par jour, consomme 72,9 g de poisson par jour (Santé Canada 1998) et ingère respectivement 2,5 et 1,5 mg de poussière et de sol par jour (Wilson et al. 2013).
j La plus forte concentration d’EAT au Canada (11,1 × 10-6 µg/m3), mesurée à Toronto, en Ontario (Shoeib et Jantunen, 2013), a été retenue pour calculer les estimations limites supérieures de l’absorption quotidienne due à l’air ambiant. Il est assumé que les Canadiens passent 3 heures par jour à l’extérieur (Santé Canada 1998).
k Aucune donnée canadienne sur la surveillance de l’air intérieur n’a été trouvée. La concentration maximale d’EAT (1,7 × 10-6 µg/m3) mesurée dans l’air de bureaux en Norvège (TemaNord 2011) a été retenue pour calculer les estimations limites supérieures de l’adsorption quotidienne due à l’air intérieur. Il est assumé que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada 1998).
l Aucune donnée sur la surveillance de l’eau potable n’a été trouvée. La concentration maximale d’EAT (0,22 pg/L) mesurée dans les eaux de surface du lac Ontario (Muir et al. 2011) a été retenue pour calculer les estimations limites supérieures de l’absorption quotidienne due à l’eau potable.
m Aucune donnée sur la surveillance des aliments commercialisés au Canada n’a été trouvée. Toutefois, des données environnementales sur des poissons étaient disponibles. La concentration maximale d’EAT (0,0045 µg/kg poids frais) mesurée chez la moule bleue en Norvège (TemaNord 2011) a été retenue pour calculer les estimations limites supérieures de l’absorption quotidienne due à tous les produits alimentaires liés aux poissons du groupe des aliments aquacoles. Les quantités d’aliments de plus de 12 groupes consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada 1998).
n Les concentrations d’EAT au 95ème percentile (26,3 ng/g) tirées de l’Étude sur la poussière domestique au Canada ont été retenues pour calculer les estimations limites supérieures de l’absorption quotidienne due à la poussière.
o Aucune étude adéquate ou pertinente sur la surveillance de l’EAT dans le sol ou les sédiments en Amérique du Nord n’a été trouvée. Par conséquent, la CEE maximale dans le sol de 3,0 µg/kg ps a été retenue pour calculer les estimations limites supérieures de l’absorption quotidienne due au sol.
Annexe D. Analyse d’autres éléments de preuve ayant trait au potentiel de génotoxicité et de cancérogénicité de l’EAT
Approche analogue (lecture croisée)
Analogue de l’EAT
La Boîte à outils (Q)SAR de l’OCDE (v. 3.1) a été utilisée pour le recherche d’analogues potentiels permettant de dans le cas de l’EAT le résultat d’une épreuve in vitro d’aberrations chromosomiques chez des mammifères, d’une épreuve in vivo de micronoyaux et la cancérogénicité (OCDE 2009, 2011, 2013). Un groupe initial d’analogues a été formé en se basant sur des groupes fonctionnels organiques similaires (halogénures d’aryle et alcènes). Suite à une analyse de ces groupes fonctionnels, aucun analogue approprié n’a été retenu.
Métabolites de l’EAT
Aucune donnée sur la toxicocinétique de l’EAT n’a été trouvée. Le simulateur d’activation métabolique in vivo chez le rat, disponible dans le logiciel OASIS TIMES (TIMES 2013), a été utilisé pour prédire (qualitativement) le métabolisme oral de l’EAT. Seules des transformations métaboliques de phase 1 ont été mises en évidence. Le niveau de confiance dans les prédictions métaboliques a été jugé faible, l’EAT n’étant pas couvert par le domaine du modèle (en se basant sur des caractéristiques structurelles inconnues de l’EAT qui n’étaient pas couvertes dans l’ensemble d’apprentissage). Néanmoins, les transformations métaboliques prédites semblaient plausibles, en se basant sur les transformations métaboliques de phase 1 couramment observées. Il existait dans la base de données OASIS TIMES des études sur la génotoxicité et la cancérogénicité de deux métabolites prédits, le 2,4,6‑tribromophénol et l’acroléine (tableau D-1).
| No CAS et nom chimique | Structure | Épreuve in vitro d’aberrations chromosomiques chez des mammifères | Épreuve in vivo | Cancérogénicité |
|---|---|---|---|---|
118-79-6 2,4,6-tribromophénol (2,4,6-TBP) |
 |
Lymphocytes périphériques humains : positive ± S9 (rat) Cellules pulmonaires de hamster de Chine : positive ± S9 |
Micronoyaux chez la souris (i.p.) : négative | Aucune donnée |
107-02-8 Acroléine |
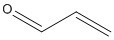 |
Cellules ovariennes de hamsters de Chine (CHO) : négative ± S9 Cellules CHO : positive |
aberrations des chromosomes chez le rat (i.p.) : négative | Rat : négative Souris : négative |
Approche basée sur une relation quantitative structure-activité (QSAR)
Plusieurs modèles QSAR statistiques (Leadscope Model Applier 2013, TIMES 2013, CASEUltra 2013, TOPKAT 2004, VEGA 2013) ont été utilisés pour prédire la génotoxicité (aberration chromosomique et micronoyaux) et la cancérogénicité. Les résultats sont présentés dans les tableaux D-2 à D-8. Dans l’ensemble, aucune prévision n’était associée à un niveau de confiance élevé.
| Modèle QSAR | Résultat de la prédiction | Fiabilité | Remarque |
|---|---|---|---|
| Aberrations chromosomiques in vitro, lymphocytes humains | Négatif | Non fiable | Le résultat prédit était principalement basé sur la valeur de log Koe élevée de l’EAT. La prédiction du modèle n’était pas précise pour l’analogue le plus proche de l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Échange de chromatides sœurs in vitro, cellules ovariennes du hamster de Chine | Négatif | Non fiable | Le résultat prédit était principalement basé sur la valeur de log Koe élevée de l’EAT. La prédiction du modèle n’était pas précise pour l’analogue le plus proche de l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Aberrations chromosomiques in vitro dans des cellules pulmonaires de hamster de Chine (CHL) | À l’extérieur du domaine | Sans objet | Sans objet |
| Aberrations chromosomiques in vitro dans des cellules ovariennes de hamster de Chine (CHO) | À l’extérieur du domaine | Sans objet | Sans objet |
| Modèle QSAR | Résultat des prédictions |
|---|---|
Aberrations chromosomiques in vivo, rat |
À l’extérieur du domaine |
Micronoyaux in vivo, souris |
À l’extérieur du domaine |
Micronoyaux in vivo, rongeur |
À l’extérieur du domaine |
| Modèle QSAR | Résultat des prédictions | Fiabilité | Remarque |
|---|---|---|---|
| Cancérogénicité chez le rat (mâle) | Négatif | Faible | Le modèle ne faisait pas de prédiction précise pour l’analogue le plus proche dans l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Cancérogénicité chez le rat (femelle) | Négatif | Faible | Le modèle ne faisait pas de prédiction précise pour l’analogue le plus proche dans l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Cancérogénicité chez la souris (mâle) | Négatif | Faible | Le modèle ne faisait pas de prédiction précise pour l’analogue le plus proche dans l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Cancérogénicité chez la souris (femelle) | Négatif | Faible | Le modèle ne faisait pas de prédiction précise pour l’analogue le plus proche dans l’ensemble d’apprentissage. L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires et ne couvrait pas la liaison double terminale de l’EAT. |
| Modèle QSAR | Résultat des prédictions | Fiabilité | Remarque |
|---|---|---|---|
| Aberrations chromosomiques in vitro (simulateur métabolique S9) (v. 5.05) | Actif (hors du domaine) | Faible | L’EAT était couvert par le domaine de propriétés physiques et chimiques, pas par celui des propriétés structurales. Seulement 30 % des fragments structuraux ont été reconnus par le modèle (70 % ont été classés comme fragments inconnus). La prédiction était « active », en raison du métabolisme prédit qui peut générer un métabolite époxyde intermédiaire et l’acroléine. |
| Micronoyaux in vivo (simulateur de l’activation métabolique in vivo chez le rat) (v. 2.02) | Actif (hors du domaine) | Faible | L’EAT était couvert par le domaine de propriétés physiques et chimiques, pas par celui des propriétés structurales. Seulement 30 % des fragments structuraux ont été reconnus par le modèle (70 % ont été classés comme fragments inconnus). La prédiction était « active », en raison du métabolisme prédit qui peut générer un métabolite époxyde intermédiaire et l’acroléine. |
| Modèle QSAR | Résultat des prédictions | Fiabilité | Remarque |
|---|---|---|---|
| Cancérogénicité chez le rat (mâle) (AF1) (v. 1.4.4.6) | Positif | Faible | L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires. |
| Cancérogénicité chez le rat (femelle) (AF2) | Négatif | Faible | L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires. |
| Cancérogénicité chez la souris (mâle) (AF3) | Négatif | Faible | L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires. |
| Cancérogénicité chez la souris (femelle) (AF4) | Positif | Faible | L’ensemble d’apprentissage contenait un faible nombre de produits chimiques similaires. |
| Modèle QSAR | Résultat des prédictions | Fiabilité | Remarque |
|---|---|---|---|
| NTP Cancérogénicité chez le rat (mâle) (v. 3.2) | Positif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| NTP Cancérogénicité chez le rat (femelle) (v. 3.2) | Négatif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| NTP Cancérogénicité chez la souris (mâle) (v. 3.2) | Positif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| NTP Cancérogénicité chez la souris (femelle) (v. 3.2) | Négatif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| FDA Cancérogénicité chez le rat (mâle) (v. 3.2) | À l’extérieur du domaine | Sans objet | Sans objet |
| FDA Cancérogénicité chez le rat (femelle) (v. 3.2) | Positif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| FDA Cancérogénicité chez la souris (mâle) (v. 3.2) | Négatif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| FDA Cancérogénicité chez la souris (femelle) (v. 3.2) | Positif | Faible | Aucun analogue dans l’ensemble d’apprentissage ayant une similarité supérieure à 0,8. |
| Modèle QSAR | Résultat des prédictions | Fiabilité | Remarque |
|---|---|---|---|
| Cancérogénicité chez le rat (CAESAR) (v. 2.1.8) | Non cancérogène (hors du domaine) | Faible | D’après l’algorithme du modèle, l’EAT a été considéré hors du domaine. |
Alertes structurales (alertes mécanistiques)
Les modèles d’alerte structurale de la Boîte à outils QSAR de l’OCDE (v. 3.1) (OCDE 2013) et de DEREK Nexus (v. 3.0.1) (DEREK Nexus 2013) ont été utilisés pour identifier toute alerte structurale de l’EAT associée à la génotoxicité ou à la cancérogénicité. Aucune alerte liée à la génotoxicité n’a été identifiée pour l’EAT (tableau D-9). L’EAT a déclenché une alerte non génotoxique pour la cancérogénicité (tableau D-9). Toutefois, cette prédiction est peu fiable. Le mode d’action pour les composés aromatiques polyhalogénés et la cancérogénicité n’est pas bien compris.
| Ensemble d’alertes structurales | Profileur d’alertes structurales | Alertes structurales | Référence |
|---|---|---|---|
| Boîte à outils QSAR de l’OCDE (v. 3.1) | Alertes de mutagénicité in vivo (micronoyaux) par ISS | Aucune alerte | TIMES 2013 |
| Boîte à outils QSAR de l’OCDE (v. 3.1) | Alertes liées à l’ADN par OASIS (v. 1.1) | Aucune alerte | TIMES 2013 |
| DEREK Nexus (v. 3.0.1) | Dommages chromosomiques (in vivo/in vitro) | Aucune alerte | DEREK Nexus 2013 |
| DEREK Nexus (v. 3.0.1) | Cancérogénicité chez des mammifères | Plausible. Composés aromatiques polyhalogénés. Alerte non génotoxique avec mécanisme inconnu. Prédiction peu fiable. | DEREK Nexus 2013 |
