Rapport sur l’état des connaissances scientifiques - Groupe de certaines substances ignifuges organiques - 2,3,4,5-tétrabromobenzoate de 2-éthylhexyle (TBB) et 3,4,5,6-tétrabromophtalate de bis(2-éthylhexyle) (TBPH)
Titre officiel : Rapport sur l’état des connaissances scientifiques - Groupe de certaines substances ignifuges organiques - 2,3,4,5-Tétrabromobenzoate de 2-éthylhexyle (TBB) et 3,4,5,6-tétrabromophtalate de bis(2-éthylhexyle) (TBPH)
Numéros de registre du Chemical Abstracts Service :
- 183658-27-7 (TBB)
- 26040-51-7 (TBPH)
Environnement et Changement climatique Canada Santé Canada
Mai 2019
No de cat. : En14-368/2019F-PDF
ISBN 978-0-660-30005-4
Sommaire
Conformément à l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont préparé un rapport sur l’état des connaissances scientifiques sur le 2,3,4,5-tétrabromobenzoate de 2-éthylhexyle (TBB) et le 3,4,5,6‑tétrabromophtalate de bis(2-éthylhexyle) (TBPH).
L’objectif du présent rapport est d’examiner l’état actuel des connaissances scientifiques sur le TBB et le TBPH et de fournir une analyse à jour du potentiel de causer des effets nocifs pour l’environnement et la santé humaine au Canada.
Ces deux substances font partie du groupe de certaines substances ignifuges organiques, lequel est constitué de dix substances organiques ayant une fonction similaire, soit l’application à des matériaux en vue de retarder l’inflammation et la propagation du feu. Les deux substances faisant l’objet du présent rapport sur l’état des connaissances scientifiques ont été déclarées d’intérêt prioritaire en raison de préoccupations relatives à l’environnement et à la santé humaine. De plus, le TBPH est commercialisé au Canada depuis la période de transition entre l’établissement de la Liste intérieure des substances (LIS) et l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles (entre le 1er janvier 1987 et le 1er juillet 1994). Le numéro de registre du Chemical Abstracts Service (no CAS), le nom commun, l’acronyme et le nom sur la Liste extérieure des substances (LES) ou dans le Toxic Substances Control Act (TSCA) des États-Unis de ces substances sont indiqués dans le tableau ci-dessous.
| No CAS | Nom commun (acronyme) | Nom dans la LES ou dans le TSCA |
|---|---|---|
| 183658-27-7 | 2,3,4,5‑Tétrabromobenzoate de 2-éthylhexyle (TBB) | 2,3,4,5-tetrabromo-, 2-ethylhexyl ester (nom dans le TSCA, anglais seulement) |
| 26040-51-7 | 3,4,5,6-Tétrabromophtalate de bis(2-éthylhexsyle) (TBPH) | Tétrabromophtalate de bis(2‑éthylhexyle) (nom dans la LES) |
Le TBB et le TBPH ne sont pas présents de façon naturelle dans l’environnement. Ces substances sont utilisées principalement comme additifs ignifuges dans des mousses de polyuréthane et/ou des plastifiants. Le TBPH peut être utilisé seul ou dans des mélanges commerciaux avec le TBB (mélange de TBB et de TBPH). Les mélanges commerciaux de TBB et de TBPH peuvent contenir seulement du TBB et du TBPH, ou peuvent contenir également des composés organophosphatés. Le no CAS 219632-53-8 a été attribué au mélange ne contenant que du TBB et du TBPH.
D’après les données cumulatives tirées d’une enquête effectuée en vertu de l’article 71 de la LCPE et du Programme des substances nouvelles, les importations de TBB et de TBPH au Canada se situaient entre 10 000 et 100 000 kg pour chaque substance en 2011. Entre 1990 et 2012, la production de TBPH aux États-Unis a été d’environ 450 à 4 500 tonnes par an. Aucune estimation de la production de TBB n’était disponible.
Le mélange de TBB et de TBPH contenant des composés organophosphatés est généralement considéré comme un substitut au mélange commercial de pentabromodiphényléther (pentaBDE), qui fait l’objet de mesures réglementaires ou d’un retrait progressif volontaire dans la plupart des pays. Le TBPH est également utilisé seul comme plastifiant pour le poly(chlorure de vinyle) et le néoprène. Au Canada, les mélanges contenant seulement du TBB et du TBPH, ou contenant également des composés organophosphatés, sont importés en tant qu’additifs ignifuges dans les articles manufacturés contenant de la mousse de polyuréthane flexible (matelas, oreillers, coussins et tout type de siège, de meuble et de garniture), tandis que le TBPH seul est importé en tant qu’additif ignifuge.
Bien qu’aucune étude visant à mesurer le TBB et le TBPH dans le sol n’ait été trouvée, ces composés ont été détectés et dosés dans des échantillons provenant de tous les autres milieux de l’environnement en Amérique du Nord. Des concentrations plus élevées dans le biote ont été associées aux lieux d’enfouissement, et ces deux composés ont été détectés dans divers organismes de l’Arctique.
Le TBB et le TBPH se caractérisent par une très faible hydrosolubilité, une très faible pression de vapeur et un coefficient de partage octanol-eau élevé à très élevé. Après leur rejet dans l’environnement, le TBB et le TBPH devraient se retrouver principalement dans le sol et/ou les sédiments, selon le milieu de rejet, et en faible quantité dans l’eau.
Les données expérimentales et les données modélisées indiquent que le potentiel de biodégradation aérobie du TBB et du TBPH est limité et que ces composés devraient persister dans l’eau, le sol et les sédiments Le TBB et le TBPH peuvent persister dans l’air par sorption à la matière particulaire fine. Ils peuvent donc être transportés sur une grande distance, comme le montre leur présence dans des milieux éloignés.
Les données empiriques semblent indiquer que le TBB et le TBPH ont un potentiel limité d’accumulation dans les tissus du biote. Des produits de métabolisation du TBB et du TBPH ont été mis en évidence lors d’études sur la bioaccumulation in vitro et in vivo.
D’après les résultats de tests de toxicité chronique et de toxicité aiguë, le TBB et le TBPH sont toxiques pour les organismes aquatiques à une faible concentration. Aucune donnée sur la toxicité pour les organismes vivant dans le sol et les sédiments n’a été répertoriée.
Le TBB et le TBPH devraient être rejetés dans l’environnement, surtout dans l’eau, dans les eaux usées provenant principalement de sources industrielles et d’articles manufacturés. Des analyses du quotient de risque, qui reposaient sur des estimations prudentes de l’exposition ainsi que sur des renseignements sur la toxicité, ont été réalisées pour des scénarios comportant des rejets industriels ainsi que pour les rejets résidentiels provenant d’articles manufacturés. Un faible potentiel de risque dans le milieu aquatique a été calculé pour le TBPH et un mélange TBB/TBPH. Un faible potentiel de risque a également été calculé dans le cas du TBB pour de petits mammifères (p. ex. musaraigne) à la suite de l’application de biosolides dans le sol. L’analyse des résidus corporels critique pour le TBB a mis en évidence un faible risque pour les poissons dû à une exposition par voie alimentaire et un faible risque pour les mammifères (p. ex. vison et loutre de rivière) qui consomment ces poissons.
Compte tenu de tous les éléments de preuve contenus dans le présent rapport sur l’état des connaissances scientifiques, le TBB et le TBPH présentent actuellement un faible potentiel de causer des effets nocifs pour l’environnement.
Nous n’avons relevé aucune classification des effets sur la santé du TBB et du TBPH par des organismes de réglementation nationaux ou internationaux. D’après les renseignements disponibles sur les effets sur la santé du TBB ou du TBPH et du mélange TBB/TBPH, les effets critiques pour la caractérisation des risques pour la santé humaine concernaient le système reproducteur. Les renseignements disponibles n’indiquent pas de carcinogénicité ni de génotoxicité.
Les principales sources d’exposition de la population générale au Canada devraient être les milieux de l’environnement (air, poussière, sol et eau), les aliments, y compris le lait maternel, et l’utilisation de produits disponibles aux consommateurs, tels que des meubles contenant de la mousse.
Les marges entre les estimations de l’apport des milieux de l’environnement, des aliments et du lait maternel, et par le contact avec des produits disponibles aux consommateurs, et les niveaux d’effets critiques sont jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Par conséquent, le potentiel de risques posés par le TBB et le TBPH à la santé humaine est considéré comme faible.
Résultat global
Bien que les niveaux d’exposition au TBB et au TBPH estimés actuellement n’indiquent pas de danger pour l’environnement ou la santé humaine, des inquiétudes pourraient être soulevées si les quantités importées et utilisées devaient augmenter au Canada.
Le TBB et le TBPH étant des produits de remplacement commerciaux aux composés ignifuges précédemment utilisés en grand volume, comme les polybromodiphényléthers (PBDE), et étant donné que la TBPH a un statut de composé produit en grand volume dans d’autres administrations, il est possible que les quantités utilisées au Canada aillent en augmentant. Étant donné que le TBB et le TBPH ne sont pas inscrits sur la LIS, ils continueront à être soumis au Règlement sur les renseignements concernant les substances nouvelles (Substances chimiques et polymères) de la LCPE. Ceci exigera la déclaration préalable à la mise en marché de toute importation ou production de ces substances, ainsi que la mise en place de restrictions si nécessaire. De plus, la manière actuelle avec laquelle ces substances sont restreintes (p. ex. conditions d’utilisation, de manipulation, d’élimination et de rejet) en vertu du Règlement sur les renseignements concernant les substances nouvelles (Substances chimiques et polymères) continuera d’être suivie, assurant ainsi que les rejets industriels seront réduits au minimum et que les registres sur les quantités et les utilisations de ces substances seront maintenus.
1. Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada, 1999), les ministres de l’Environnement et de la Santé procèdent à une évaluation des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
L’Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe de certaines substances ignifuges organiques comprend dix substances identifiées comme d’intérêt prioritaire pour une évaluation, car elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE et/ou étaient considérées comme d’intérêt prioritaire en raison de préoccupations liées à l’environnement et/ou à la santé humaine (Environnement Canada et Santé Canada, 2007). Toutes ces substances présentent une fonction similaire, soit l’application à des matériaux en vue de retarder l’inflammation et la propagation du feu. Ces substances sont également des produits de substitution potentiels à d’autres produits ignifuges qui sont actuellement soumis à des contrôles réglementaires ou à un retrait progressif au Canada et/ou à l’échelle mondiale.
Le présent rapport sur l’état des connaissances scientifiques fournit un résumé et une évaluation des connaissances scientifiques actuelles sur deux substances : le 2,3,4,5‑tétrabromobenzoate de 2‑éthylhexyle (TBB) et le 3,4,5,6-tétrabromophtalate de bis(2-éthylhexyle) (TBPH). Étant donné que le TBB et le TBPH ne figurent pas sur la Liste intérieure des substances (LIS), ils sont soumis au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) en vertu de la LCPE (Canada, 2005). Suite à des évaluations de risques posés par des substances nouvelles à la santé humaine et à l’environnement, réalisées entre 1997 et 2012, ces substances sont soupçonnées d’être « toxiques » en vertu des paragraphes 64a) et 64 c) de la LCPE. Le TBPH a été commercialisé au Canada depuis la période de transition entre l’établissement de la Liste intérieure des substances et l’entrée en vigueur du Règlement sur les renseignements concernant les substances nouvelles (entre le 1er janvier 1987 et le 1er juillet 1994). Des mesures de gestion du risque (c.-à-d. des conditions ministérielles) ont été imposées aux déclarants de volumes élevés de substances nouvelles afin d’atténuer les risques potentiels pour la santé humaine et l’environnement. L’objectif du présent rapport sur l’état des connaissances scientifiques est d’examiner les données scientifiques actuelles disponibles pour le TBB et le TBPH, d’évaluer leur potentiel d’effets nocifs pour l’environnement et la santé humaine et de déterminer si la manière avec laquelle ces substances sont restreintes est toujours appropriée.
Le présent rapport sur l’état des connaissances scientifiques comprend des considérations sur les renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que des renseignements supplémentaires soumis par les parties prenantes. Nous avons relevé des données pertinentes jusqu’en décembre 2016 pour les sections portant sur la santé humaine et l’environnement. Une recherche ciblée dans la littérature a été effectuée jusqu’en juillet 2018 pour les éléments touchant la santé humaine de cette évaluation. Les données empiriques tirées d’études clés, ainsi que certains résultats provenant de modèles, ont servi à formuler les conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans des évaluations effectuées par d’autres instances ont été utilisés.
Le présent rapport sur l’état des connaissances scientifiques a été préparé par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des intrants d’autres programmes exécutés par ces ministères. Les parties du présent rapport sur la santé humaine et l’environnement ont fait l’objet d’un examen externe par écrit par des pairs et/ou d’une consultation. Des commentaires sur les parties techniques ayant trait à l’environnement ont été reçus de : Jon Arnot Ph. D. (Arnot Research and Consulting), John Biesemier (Chemtura Corporation); Adrian Covaci Ph. D. (Université d’Anvers), Miriam Diamond Ph. D. (Université de Toronto) et de Heather Stapleton Ph. D. (Université Duke). Des commentaires sur les parties techniques ayant trait à la santé humaine ont été reçus de : Michael Jayjock Ph. D. (The LifeLine Group), Bernard Gadagbui Ph. D. (Toxicity Excellence for Risk Assessment), Patricia McGinnis Ph. D. (consultante indépendante et de la Risk Assessment Division, Office of Pollution Prevention and Toxics, Environmental Protection Agency des États-Unis). De plus, l’ébauche du présent rapport a été soumise à une période de consultation publique de 60 jours. Certaines parties portant sur la santé humaine dans cette évaluation ont fait l’objet d’une autre consultation ciblée auprès de pairs externes. Les commentaires reçus proviennent de Richard Manderville (Université de Guelph), de Mohamed Abou-Elwafa Abdallah (Université de Birmingham), et de Kebede K. Kefeni (Université Tshwane de la technologie). Bien que des commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada (ECCC) restent responsables du contenu final et des conclusions du présent rapport sur l’état des connaissances scientifiques.
Le présent rapport est axé sur les études essentielles et les éléments de preuve utiles à l’évaluation réalisée par l’examen des données scientifiques et l’intégration de l’approche par le poids de la preuve et de précautionNote de bas de page 1 . Ce rapport présente les renseignements et les considérations critiques sur lesquels repose la présente évaluation.
2. Identité des substances
Le présent rapport sur l’état des connaissances porte sur le 2,3,4,5-tétrabromobenzoate de 2-éthylhexyle et le 3,4,5,6-tétrabromophtalate de bis(2-éthylhexyle). Ces substances sont des additifs ignifuges bromés qui font partie du groupe de certaines substances ignifuges organiques de l’Initiative des groupes de substances du Plan de gestion des produits chimiques. La structure de ces substances est présentée dans le Tableau 21. Les structures chimiques de ces substances présentent de fortes similitudes. Ce sont toutes deux des esters aryliques tétrabromés, qui présentent la même substitution. Pour la présente ébauche de rapport sur l’état des connaissances scientifiques, nous avons utilisé les acronymes TBB et TBPH pour le 2,3,4,5-tétrabromobenzoate de 2-éthylhexyle et le 3,4,5,6-tétrabromophtalate de bis(2‑éthylhexyle). Ces abréviations sont dérivées des leurs noms communs respectifs. Fait à noter, les acronymes utilisés dans la littérature accessible à tous comprennent souvent l’identité de la partie estérifiée. Par exemple, les acronymes EH-TBB et BEH‑TBP sont souvent utilisés pour ces substances. Les autres noms utilisés pour ces substances sont indiqués à l’annexe A. Le TBB a seulement été trouvé commercialement en mélange avec le TBPH. Le mélange de TBB et de TBPH a son propre no CAS, le 219632-53-8 (4,5,6,7-tétrabromo-2-benzofurane-1,3-dione, produits de la réaction avec du 2-éthylhexan-1-ol).
| No CAS | Structure chimique | Masse moléculaire (g/mol) | Formule chimique |
|---|---|---|---|
| 183658-27-7 (TBB) | 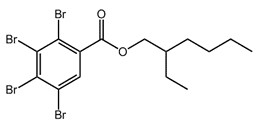 |
549,9 | C15H18Br4O2 |
| 26040-51-7 (TBPH) | 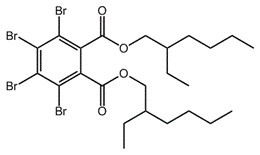 |
706,2 | C24H34Br4O4 |
2.1 Sélection d’analogues et utilisation de modèles RQSA
Des documents sur l’utilisation d’une approche de lecture croisée et de modèles de relations quantitatives structure-activité (RQSA) pour combler les lacunes dans les données ont été préparés par diverses organisations telles que l’Organisation de coopération et de développement économiques (OCDE). Ces méthodes ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l’Union européenne (UE). Pour le présent rapport, nous avons suivi une approche de lecture croisée à partir de données sur des analogues et de résultats de modèles RQSA, si nécessaire, pour guider les évaluations des effets sur la santé humaine et l’environnement. L’applicabilité des modèles RQSA a été déterminée au cas par cas. Les détails sur les données croisées et les modèles RQSA retenus pour guider les évaluations des effets du TBB et du TBPH sur la santé humaine et l’environnement sont traités de façon plus approfondie dans les sections pertinentes du présent rapport.
Dans la littérature accessible à tous, on dit parfois du TBPH qu’il est un « analogue bromé » du phtalate de di(2-éthylhexyle) (PDEH). Bien que ces substances aient le même noyau de phtalate, l’ajout de quatre atomes de brome au TBPH double pratiquement son poids moléculaire et modifie significativement un certain nombre des propriétés physicochimiques et caractéristiques de dangerosité. En fin de compte, comme cela est décrit dans les sections subséquentes du présent rapport, le PDEH n’a pas été retenu comme un analogue approprié pour l’ajustement des valeurs expérimentales ou l’obtention de données croisées pour le TBB et le TBPH. Les renseignements sur l’identité du PDEH et de son métabolite, le phtalate de mono(2‑éthylhexyle) (PMEH), sont présentés à titre d’être complet dans le Tableau 22. Aucun autre analogue adéquat n’a été identifié pour le TBB ou le TBPH.
| No CAS | Structure chimique | Masse moléculaire (g/mol) | Formule chimique |
|---|---|---|---|
| 117-81-7 (PDEH) | 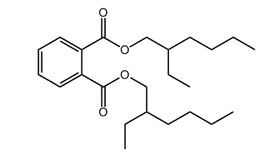 |
390,3 | C24H38O4 |
| 4376-20-9 (PMEH) | 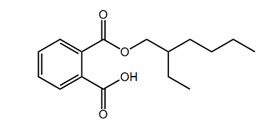 |
278,4 | C16H22O4 |
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques déterminent les caractéristiques globales d’une substance et sont utilisées afin de déterminer la pertinence de différentes substances pour divers types d’application. De telles propriétés jouent également un rôle clé dans la détermination du devenir des substances dans l’environnement (y compris de leur potentiel de transport à grande distance), ainsi que de leur toxicité pour les humains et les organismes non humains. Dans le tableau 31, nous résumons les valeurs clés modélisées des propriétés physiques et chimiques du TBB et du TBPH, pertinentes pour leur devenir dans l’environnement et leur écotoxicité.
Les propriétés physiques et chimiques du TBB et le TBPH peuvent être prédites au moyen de modèles reposant sur des relations quantitatives structure-activité (RQSA), car elles sont couvertes par le domaine d’applicabilité du modèle (c.-à-d. que les domaines des paramètres de structure et/ou de propriétés sont représentés dans l’ensemble utilisé pour les modèles). Les données empiriques sur les propriétés physicochimiques d’un mélange commercial contenant uniquement du TBB et du TBPH, en proportions inconnues, sont résumées à l’annexe B. Compte tenu de l’incertitude significative sur les données empiriques du mélange, les résultats modélisés ont été jugés plus appropriés pour les substances individuelles, et ont donc été utilisés dans le présent rapport. Seul le point de fusion empirique du mélange a été jugé approprié comme donnée croisée pour les substances individuelles. Des données empiriques sur le TBPH seul ont été identifiées dans la base de données de l’Agence européenne des produits chimiques (ECHA, 2013) et ont servi à déterminer les valeurs de propriétés physicochimiques clés.
Lorsqu’il y avait plus d’un résultat modélisé ou empirique valable pour une propriété physicochimique donnée, la valeur médiane a été utilisée comme valeur clé. Dans l’annexe B, nous présentons une description plus détaillée de la façon dont les valeurs clés ont été calculées (y compris la méthode d’ajustement par les moindres carrés de Schenker et al. [2005]), ainsi qu’une discussion plus approfondie des données empiriques.
Le TBB et TBPH se caractérisent par une hydrosolubilité modérée, une pression de vapeur faible ou très faible, un coefficient de partage carbone organique-eau élevé et un coefficient de partage octanol-eau élevé ou très élevé.
| Propriété | TBB | TBPH | Références |
|---|---|---|---|
| État physique | Liquide | Liquide | S.O. |
| Point de fusion (°C) | -25 (mélange) | -25 (mélange) | Great Lakes Chemical Corporation, 1997a |
| Point d’ébullition (°C) | 455 | 565 | MPBPWIN, 2010; ACD Percepta, c1996-2014 |
| Pression de vapeur (Pa) | 3,02 x 10-6 | 1,29 x 10-9 | MPBPWIN, 2010; ACD Percepta, c1996-2014 |
| Constante de Henry (Pa.m3/mol) | 5,88 x 10-1 | 2,97 x 10-2 | HENRYWIN, 2011 |
| Hydrosolubilité (mg/L) | 2,82 x 10-3 | 3,07 x 10-5 | ACD Percepta, c1996-2014; WATERNT, 2010; WSKOWWIN, 2010; VCCLAB, 2005; ECHA, 2013 |
| log Kae | -3,63 | -4,92 | S.O. (valeurs calculées) |
| log Koe | 7,71 | 10,10 | ACD Percepta, c1996-2014; KOWWIN, 2010; VCCLAB, 2005; Abraham et al., 1994; ECHA, 2013 |
| log Kco | 5,12 | 6,38 | KOCWIN, 2010 |
| log Koa | 11,34 | 15,03 | KOAWIN, 2010 |
4. Sources
Le TBB et le TBPH ne sont pas naturellement présents dans l’environnement. Un examen de la littérature sur les brevets accessible au public révèle que le TBB et le TBPH proviennent du même procédé synthétique et qu’ils peuvent l’un ou l’autre être le produit prédominant en fonction des conditions de la réaction (Bohen et al. 1991, Hill et al. 1997, Rose et al. 1998, Bartley et al. 2007). Le TBB et le TBPH sont tous deux présents dans le produit commercial Firemaster BZ-54 (no CAS 219632-53-8), dans des proportions respectives de 70 % à 80 % et de 20 % à 30 % (Ma et al. 2012, de Jourdan et al. 2014). Le Firemaster BZ-54 (BZ ‑54) est mélangé avec des produits ignifuges organophosphatés dans un rapport d’environ 50/50 pour produire un autre produit commercial, le Firemaster 550 (FM-550) (Weil et Levchick 2004; Chen et al. 2013). Les mélanges commerciaux ayant ces compositions seront respectivement appelés « mélange TBB/TBPH » et « mélange TBB/TBPH/organophosphates » dans le présent rapport. Le TBPH est vendu seul sous le nom DP-45, bien que sa fiche signalétique indique qu’une petite quantité de TBB résiduel est présente (La Guardia et al. 2012).
Les sources d’exposition au TBB et au TBPH dans l’environnement sont principalement les eaux usées ou les effluents des fabricants de mousse de polyuréthane qui utilisent des mélanges TBB/TBPH (ne contenant que du TBB et du TBPH ou comprenant d’autres composés) comme additifs ignifuges, des usines de mélange de matières plastiques qui utilisent le TBPH comme plastifiant et/ou composé ignifuge, des usines de traitement des eaux usées et du nettoyage des contenants de transport.
Le TBB et le TBPH ne sont pas inscrits sur la LIS. Par conséquent, ils sont visés par le Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) en vertu de la LCPE. D’après une enquête menée en vertu de l’article 71 de la LCPE, et compte tenu des données obtenues grâce au Programme de déclaration de substances nouvelles (y compris les données recueillies en vertu des exigences en matière de tenue des dossiers des conditions ministérielles), les quantités totales de TBB (dans les mélanges TBB/TBPH) et de TBPH (seul ou dans les mélanges TBB/TBPH) importées au Canada en 2011 se situaient entre 10 000 et 100 000 kg. Celles-ci comprennent les quantités des substances pures et des mélanges importés, ainsi que les quantités prémélangées dans des formulations industrielles (ECCC, 2013-2014; Environnement Canada, 2000-2014). Aucune production de l’une ou l’autre de ces substances n’a été recensée au Canada. Par ailleurs, il n’y a pas eu d’exportation de TBB ou de TBPH à partir du Canada en 2011.
L’importance commerciale du TBB et du TBPH s’est principalement accrue en raison de leur utilisation comme substituts au mélange commercial de pentabromodiphényléther (pentaBDE) (Covaci et al. 2011). En Europe, le TBPH est considéré comme une substance chimique produite en faible quantité (Harju et al. 2009). Aux États-Unis, la production de TBPH était approximativement de 450-4500 tonnes/an entre 1990 et 2012. Le TBPH est donc considéré comme une substance chimique produite en grande quantité (EPA 2014a; EPA 2014b; EPA 2014c). Les estimations de production du TBB aux États-Unis n’ont pas été divulguées et aucune autre estimation n’a pu être trouvée (EPA 2014c).
5. Utilisations
Selon la documentation du fabricant, le mélange TBB/TBPH et le mélange TBB/TBPH/organophosphate sont commercialisés pour des applications de mousses de polyuréthane flexibles (Great Lakes Solutions c2014a; Great Lakes Solutions c2014b). Le mélange TBB/TBPH est également commercialisé pour le secteur de l’automobile (Great Lakes Solutions c2014a).
Au Canada, étant donné que le TBB et le TBPH ne sont pas inscrits sur la Liste intérieure des substances (LIS), ils sont soumis au Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères) en vertu de la LCPE. Des mesures de gestion des risques (c.-à-d. des conditions ministérielles) ont été mises en œuvre pour certains déclarants de substances nouvelles, en général des déclarants de volumes élevés. Dans leur cas, les conditions ministérielles limitent l’importation de TBB et de TBPH aux fins d’utilisation comme additifs ignifuges dans des matrices polymères et imposent des restrictions sur les rejets dans l’environnement, l’élimination et la manipulation des conteneurs de transport (Canada 2002, 2003, 2006, 2010 et 2011).
D’après les renseignements présentés en vertu de l’article 71 de la LCPE (ECCC 2013-2014), le TBB et le TBPH sont utilisés au Canada comme produits ignifuges dans les articles manufacturés contenant de la mousse de polyuréthane flexible (matelas, oreillers, coussins et tout type de siège, de meuble et de garniture), les matières plastiques et les revêtements pour tissus industriels. Lors de tests préliminaires effectués par Santé Canada sur des articles manufacturés pour enfants (p. ex. coussins d’allaitement, jouets) achetés au Canada en 2014, le TBB et le TBPH ont été détectés dans une chaise en mousse, à une concentration maximale d’environ 5 % et 2 %, respectivement, mais pas dans les 22 autres articles manufacturés pour enfants (Santé Canada 2014). Dans un autre rapport sur des chaises en mousse pour enfants provenant de divers points de vente au détail, du TBB et du TBPH ont été détectés dans les deux chaises en mousse achetées au Canada (ainsi que dans la moitié des 40 chaises achetées aux États-Unis) (CEH 2013b). Un projet réalisé par la Commission de coopération environnementale (CCE) concernant la détection, dans 132 produits d’ameublement du Canada, des États‑Unis et du Mexique, de 16 produits ignifuges, dont le TBB et le TBPH. Les deux substances étaient présentes dans la mousse d’un sofa qui avait été acheté au Canada (CCE, 2015). Le TBB et le TBPH ont été mesurés (jusqu’à une concentration de 154,4 et 11,6 mg/g, respectivement) dans la mousse de polyuréthane flexible de véhicules (n = 18) provenant de sites de récupération de la région du Grand Toronto, au Canada (Mochungong et al. 2014).
Le TBB et le TBPH ne font pas partie des listes des additifs alimentaires, qui ont été incorporés par renvoi dans leurs propres autorisations de mise en marché émises en vertu de la Loi sur les aliments et drogues (Santé Canada [modifié en 2017]) et n’ont pas été identifiés comme utilisés ou présents dans les formulations pour matériaux d’emballage pour aliments ni dans des additifs de fabrication (courriel de 2013de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; non référencé). De plus, le TBB et le TBPH ne sont inscrits ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu’ingrédients médicinaux ou non médicinaux dans des produits pharmaceutiques finaux, des produits de santé naturels ou des médicaments vétérinaires au Canada (BDPP [modifié en 2017]; BDIPSN [modifié en 2017]; BDPSNH [modifié en 2016]; courriel de 2013 de la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada; non référencé). D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le TBB et le TBPH ne sont pas utilisés dans les produits cosmétiques au Canada (courriels de 2014 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada; non référencé).
Aux États-Unis, le mélange TBB/TBPH/organophosphate a été mesuré dans plusieurs articles manufacturés pour enfants contenant de la mousse de polyuréthane flexible, dont des tapis de sieste (CEH 2013a), des sièges d’auto, des matelas de table à langer, des matelas portables et un fauteuil à bascule (Stapleton et al. 2011). Ce mélange a également été mesuré dans des canapés contenant de la mousse de polyuréthane flexible (Stapleton et al. 2009; Stapleton et al. 2012) et dans 18 % des échantillons de mousse provenant de canapés manufacturés après le retrait progressif du pentaBDE (EPA 2014d). En Australie, le mélange TBB/TBPH est inscrit comme étant utilisé dans les garnitures d’automobiles et dans la mousse de meubles, à des concentrations inférieures à 20 % (NICNAS 2004).
À l’échelle internationale, le TBPH seul est principalement utilisé comme additif ignifuge et plastifiant pour le poly(chlorure de vinyle) (PVC), le néoprène, le caoutchouc butadiène-styrène et le caoutchouc éthylène-propylène-diène monomère (Great Lakes Solutions c2014c, Andersson et al. 2006, Covaci et al. 2011). Le PVC contenant du TBPH est utilisé dans des équipements électriques, comme isolant pour câbles et fils, ainsi que dans des films et des gaines (Great Lakes Solutions c2014c; Covaci et al. 2011). Parmi les articles et produits manufacturés pouvant contenir du TBPH, mentionnons les adhésifs, les revêtements, les tissus enduits et les tissus muraux (Great Lakes Solutions c2014c; Unitex Chemical Corporation 2009; Covaci et al. 2011; TemaNord 2011).
6. Rejets dans l’environnement
Les rejets anthropiques dans l’environnement dépendent de diverses pertes qui se produisent durant la fabrication, l’utilisation industrielle, l’utilisation commerciale ou par les consommateurs et l’élimination d’une substance ou d’un produit en contenant. Les rejets de TBB et de TBPH dans l’environnement au Canada résultant de leur utilisation comme additifs ignifuges devraient être diffus, avec quelques sources ponctuelles (p. ex. systèmes d’eaux usées connectés à des installations de production de mousse, des installations de mélange de matières plastiques et des usines de textiles). Les rejets peuvent avoir lieu dans des environnements intérieurs ou extérieurs. Dans le cas du TBPH seul, on s’attend à ce qu’il soit rejeté au Canada dans le cadre des activités industrielles suivantes : formulation, mélange de matières plastiques et fabrication de revêtements de tissus industriels. Pour le mélange TBB/TBPH, les activités conduisant à des rejets devraient être la fabrication de mousse de polyuréthane, l’injection d’isolants en polyuréthane et l’utilisation d’adhésifs à base de polyuréthane.
Les rejets ponctuels de TBB et de TBPH dans l’environnement peuvent être les plus importants pendant les étapes de fabrication, de formulation et/ou d’utilisation industrielle. Par exemple, La Guardia et al. (2010) ont établi une corrélation entre l’influence industrielle et les concentrations de TBB et de TBPH dans une petite usine de traitement des eaux usées (~ 10 000 habitants desservis) qui recevait des influents industriels. Plus particulièrement, les auteurs ont noté une baisse substantielle des concentrations de TBB et de TBPH dans les biosolides des eaux usées suite au départ de la région d’un fabricant de produits pour l’intérieur des automobiles. Toutefois, les rejets potentiels de TBB et de TBPH provenant de produits disponibles aux consommateurs pourraient aussi être très significatifs. En tant qu’additifs ignifuges (plutôt que des composés ignifuges réactifs liés chimiquement au polymère), la probabilité de rejets de TBB et de TBPH dans l’environnement est plus grande à partir des produits disponibles aux consommateurs (Guerra et al. 2011). Il est possible que le TBB et le TBPH soient présents dans la poussière de produits disponibles aux consommateurs par l’intermédiaire de différents processus comme une répartition directe, la volatilisation, l’adsorption, la météorisation ou l’abrasion (Toms et al. 2011). Melymuk et al. (2014) ont indiqué qu’une source importante de produits ignifuges dans les eaux usées pourrait être la poussière des textiles, des meubles et des produits électroniques, qui se retrouve dans les eaux usées suite à des activités de nettoyage et de lavage. Schreder et La Guardia (2014) présentent des éléments de preuve indiquant que la poussière domestique qui se retrouve dans les eaux usées de lavage est la principale source de TBB, de TBPH et d’autres produits ignifuges dans les usines de traitement des eaux usées qui desservent principalement des particuliers.
Les rejets dans l’environnement devraient être principalement attribuables aux eaux usées. Des rejets dans le sol pourraient aussi se produire suite à l’épandage de biosolides d’eaux usées sur des terres agricoles et des pâturages. Les émissions dans l’air peuvent donner lieu à des dépôts atmosphériques dans le sol et l’eau. Lorsqu’une substance est transférée accidentellement vers les terres, elle peut pénétrer dans le système de collecte des eaux usées ou les eaux de surface, ou bien être transférée par le vent ou la pluie vers le sol à proximité. Cependant, la faible volatilité du TBB et du TBPH porte à croire qu’ils n’auront pas tendance à demeurer dans la phase gazeuse à la suite de leur émission dans l’air ni à se volatiliser dans l’air à partir de l’eau ou du sol. Enfin, bien que la plupart des sites d’enfouissement au Canada traitent leur lixiviat au moyen de systèmes de traitement des eaux usées, les sites d’enfouissement dont les lixiviats ne sont pas recueillis et traités peuvent libérer ces substances dans les eaux souterraines (pouvant atteindre les eaux de surface).
Ces renseignements sont utilisés pour développer plus précisément les scénarios de caractérisation de l’exposition afin de calculer des concentrations environnementales estimées.
7. Concentrations environnementales mesurées
Des données sur les concentrations de TBB et de TBPH dans l’environnement canadien ont été répertoriées. Des données internationales supplémentaires ont également été recensées et incluses dans les tableaux 71 et 72 ci-dessous.
7.1 Air
Le TBB et le TBPH ont été détectés dans 89 % et 100 %, respectivement, des neuf sites nord-américains qui faisaient partie du Réseau d’étude d’échantillonnage passif atmosphérique mondial en 2005 (Lee et al. 2010). La surveillance de la qualité de l’air à Toronto a révélé que du TBB et du TBPH ont été détectés dans la majorité des échantillons (dans 96 et 85 %; n = 70) prélevés de 2010 à 2011, mais à des concentrations relativement faibles (jusqu’à 1,9 pg/m3 pour le TBB, et 1,1 pg/m3 pour le TBPH) (Shoeib et al. 2014). D’autres mesures faites à Toronto (Diamond et al. 2013) indiquent une fréquence de détection plus élevée (100 % pour le TBB et le TBPH) dans les échantillons d’air ambiant (n = 20) prélevés également en 2011. Dans cette étude, le TBB a été mesuré à une concentration atteignant 9 pg/m3 (moyenne de 3,2 pg/m3), et le TBPH à une concentration atteignant 7 pg/m3 (moyenne de 2,5 pg/m3) (Diamond et al. 2013).
Ma et al. (2012) ont mesuré les concentrations atmosphériques de TBB et de TBPH dans l’air des Grands Lacs pendant une période de deux ans (2008 à 2010) en utilisant des échantillons d’air prélevés par le Réseau de mesure des dépôts atmosphériques (RMDA). Les concentrations ont rapidement augmenté au fil du temps, et comme le montre le tableau 71, il existe une corrélation avec les zones d’échantillonnage plus urbaines (Ma et al., 2012). Dans cette étude, les sites de Chicago et de Cleveland présentaient les concentrations de TBB (0,5 à 55 pg/m3) et de TBPH (0,47 à 290 pg/m3) les plus élevées, tandis que les sites éloignés, comme Eagle Harbor et Sleeping Bear Dunes, présentaient les concentrations de TBB (0,05 à 7,5 pg/m3) et de TBPH (0,11 à 32 pg/m3) les plus faibles. Sur le site rural canadien (Point Petre, en Ontario), le TBB et le TBPH ont été détectés à une fréquence moins élevée (16 % et 53 %, respectivement; n = 45) que sur les sites urbains, et les concentrations de TBB (0,074 à 0,82 pg/m3) et de TBPH (0,18 à 3,7 pg/m3) étaient semblables à celles des sites éloignés aux États‑Unis (Ma et al. 2012).
De 2007 à 2008, Xiao et al. ont mesuré les concentrations de TBB et de TBPH dans l’air de l’Arctique canadien à Alert, au Nunavut, le lieu habité le plus au nord de la planète, et ont indiqué qu’elles étaient semblables à celles des principaux congénères du pentaBDE sur le marché, le BDE-47 et le BDE-99 (Iqaluit 2010, Xiao et al. 2012a). Les concentrations médianes de TBB et de TBPH étaient respectivement de 0,46 pg/m3 (gamme de 0,16 à 2,2 pg/m3) et de 0,69 pg/m3 (gamme de 0,1 à 1,5 pg/m3) (Xiao et al. 2012a). Cette étude suggère que le TBB et le TBPH présentent un potentiel de transport à grande distance.
7.2 Eau
Le TBB et le TBPH ont été mesurés dans le cadre d’une étude préliminaire dans les eaux libres du lac Ontario à des concentrations moyennes respectives de 0,8 et de 2,2 pg/L, tandis que seul le TBPH a été détecté dans les eaux libres du lac Érié, à une concentration moyenne de 1,51 pg/L (Muir et al. 2011). Venier et al. (2014) ont également signalé des concentrations de TBB et de TBPH dans les Grands Lacs dans environ le même nombre de sites d’eaux libres et les sites d’échantillonnage en milieu riverain, pour les échantillons prélevés de 2011 à 2012 (n = 5). Les concentrations de TBB et de TBPH étaient les plus élevées dans le lac Ontario (moyenne de 7,9 et de 0,27 pg/L, respectivement) et le lac Érié (moyenne de 5,6 et de 10,4 pg/L, respectivement). Valls-Cantenys et al. (2013) ont mesuré le TBPH dans une rivière en Espagne à une concentration moyenne de 2 200 pg/L, tandis que le TBB n’y a pas été détecté.
7.3 Sédiments et sol
Les concentrations moyennes de TBB et de TBPH dans les sédiments de la rivière Yadkin, en Caroline du Nord, au point de rejet d’une usine de traitement des eaux usées d’une usine textile étaient respectivement de 3 850 et 19 200 ng/g de COT. Aucun de ces composés n’a été détecté en amont de l’usine, et les concentrations étaient corrélées négativement avec la distance en aval (La Guardia et al. 2012). La Guardia et al. (2013) ont également mesuré des concentrations moyennes de TBB et de TBPH dans les sédiments de la baie de Durban, en Afrique du Sud, de 545 et 96 ng/g de COT, respectivement.
Au Canada, Pelletier et al. (2013) ont rapporté que les concentrations dans les sédiments étaient les plus élevées dans les échantillons de carottes de sédiments prélevés en 2012 dans le centre du lac Ontario. Les concentrations maximales respectives de TBB et de TBPH dans les sédiments étaient de 2,40 et 1,17 ng/g poids sec (ps). Les deux composés ont été détectés dans un même échantillon de sédiments du lac Érié (Pelletier et al., 2013). Les concentrations de TBB et de TBPH dans les sédiments sont traitées plus en détail dans la section sur la santé humaine (section 10.1.1.1).
Aucune étude publiée portant sur les concentrations de TBB ou de TBPH dans le sol canadien n’a été répertoriée.
7.4 Eaux usées et biosolides
Des concentrations de TBB et de TBPH ont été mesurées dans des échantillons d’eaux usées en Ontario, par Zhou et al. (2010a). Le TBB a été détecté dans tous les échantillons, à des concentrations allant d’environ 4 à 30 ng/L, tandis que le TBPH n’a été détecté que dans un échantillon, à une concentration d’environ 2 ng/L (Zhou et al. 2010a). Le TBB et le TBPH ont été parmi les analytes mesurés dans les échantillons d’influents, d’effluents et de biosolides, prélevés sur trois années (2013 à 2015), provenant de huit systèmes canadiens de traitement des eaux usées représentant différents types de traitements (Shanmuganathan et al. 2016). La fréquence de détection du TBB et du TBPH était de plus de 80 % dans les échantillons d’influents et de biosolides. Les concentrations de TBB variaient de 11 à 477 ng/L et celle non détectée était de 29 ng/L dans les échantillons d’influents et d’effluents, tandis que les concentrations de TBPH dans ces échantillons variaient de 0,4 à 326 ng/L et celle non détectée était de 44 ng/L, respectivement. Les concentrations de TBB et de TBPH dans les biosolides variaient de 5 à 1 227 ng/g p.s. et de 56 à 1 820 ng/g p.s., respectivement (Shanmuganathan et al. 2016). Les concentrations moyennes de TBB et de TBPH dans les biosolides ont également été indiquées, variant de substance non détectée à 2 491 ng/g p.s. et de 273 à 1 340 ng/g ps, et ces concentrations ont été mesurées dans des échantillons prélevés dans une grande usine de traitement secondaire des eaux usées en Californie (Davis et al. 2012).
| Milieu | Lieu, année | Concentration de TBB (fréquence de détection) | Concentration de TBPH (fréquence de détection) | Unité | Références |
|---|---|---|---|---|---|
| Air | Point Petre, Canada; 2008 à 2010 | 0,074 à 0,82 (16 %) | 0,18 à 3,7 (53 %) | pg/m3 | Ma et al. 2012 |
| Air | Sleeping Bear, États-Unis; 2008 à 2010 | 0,086 à 7,5 (24 %) | 0,11 à 16 (49 %) | pg/m3 | Ma et al. 2012 |
| Air | Eagle Harbor, États-Unis; 2008 à 2010 | 0,05 à 6,6 (60 %) | 0,13 à 32 (61 %) | pg/m3 | Ma et al. 2012 |
| Air | Sturgeon Point, États-Unis; 2008 à 2010 |
0,11 à 4,1 (36 %) | 0,14 à 17 (73 %) | pg/m3 | Ma et al. 2012 |
| Air | Cleveland, États-Unis; 2008 à 2010 | 0,5 à 55 (66 %) | 0,47 à 290 (99 %) | pg/m3 | Ma et al. 2012 |
| Air | Chicago, États-Unis; 2008 à 2010 |
0,5 à 19 (90 %) | 0,36 à 76 (93 %) | pg/m3 | Ma et al. 2012 |
| Air | Alert, Canada; 2007-2008 | 0,00 à14,42; 1,06 | 0,01 à 3,38; 0,46 | pg/m3 | Xiao et al. 2012a; Xiao et al. 2012b |
| Air | Toronto, Canada; 2010-2011 |
ND à 1,87 (96 %) | ND à 1,07 (87 %) | pg/m3 | Shoeib et al. 2014 |
| Air | Toronto, Canada; 2010-2011 |
3,2 (100 %) | 2,5 (100 %) | pg/m3 | Diamond et al. 2013 |
| Eau | Lac Érié; 2005 à 2010 |
ND | 1,51 | pg/L | Muir et al. 2011 |
| Eau | Lac Ontario; 2005 à 2010 | 0,80 | 2,2 | pg/L | Muir et al. 2011 |
| Eau | Lac Érié; 2012 | 5,6 | 10,4 | pg/L | Venier et al. 2014 |
| Eau | Lac Huron; 2012 | 1,3 | 4,5 | pg/L | Venier et al. 2014 |
| Eau | Lac Michigan; 2012 | 2,6 | 2,6 | pg/L | Venier et al. 2014 |
| Eau | Lac Ontario; 2011 | 7,9 | 0,27 | pg/L | Venier et al. 2014 |
| Eau | Lac Supérieur; 2011 | 1,4 | 3,0 | pg/L | Venier et al. 2014 |
| Eau | Ria, Espagne | ND | 1 300 | pg/L | Valls-Cantenys et al. 2013 |
| Eau | Rivière, Espagne | ND | 2 200 | pg/L | Valls-Cantenys et al. 2013 |
| Sédiments | Caroline du Nord, États‑Unis | ND à 3850 | ND à 19 200 | ng/g COT | La Guardia et al. 2012 |
| Sédiments | Lac Saint‑Pierre; 2012 | ND à 0,10 (40 %) | NQ à 0,18 (100 %) | ng/g ps | Pelletier et al. 2013 |
| Sédiments | Lac Ontario; 2012 | ND à 2,40 (38 %) | ND à 1,17 (94 %) | ng/g ps | Pelletier et al. 2013 |
| Sédiments | Lac Érié; 2012 | 0,18 (100 %) | 0,22 (100 %) | ng/g ps | Pelletier et al. 2013 |
| Sédiments | Bassin versant de l’océan Pacifique, Canada; 2012 | ND à NQ (33 %) | NQ (100 %) | ng/g ps | Pelletier et al. 2013 |
| Sédiments | Secteur de l’Atlantique, Canada; 2012 | ND à 0,35 (33 %) | NQ à 0,13 (100 %) | ng/g ps | Pelletier et al. 2013 |
| Sédiments | Baie de Durban, Afrique du Sud; 2011 | 545 (91 %) | 96 (60 %) | ng/g COT | La Guardia et al. 2013 |
| Sédiments en suspension | Montréal; 2012 | ND à 0,11 (27 %) | ND à 0,17 (40 %) | ng/g ps | Pelletier et al. 2013 |
a Les concentrations sont présentées en tant que gammes ou moyennes arithmétiques. ND = non détecté; NQ = inférieure à la limite de dosage; COT = carbone organique total; ps = poids sec.
7.5 Biote
Des concentrations de TBB et de TBPH ont été mesurées dans des œufs d’étourneau sansonnet (Sturnus vulgaris) collectés entre 2009 et 2011 sur des sites d’enfouissement et des sites industriels de cinq provinces, ainsi que sur des sites situés à 10 km et à 40 km de centres urbains, tous au Canada. Le TBB n’a pas été détecté dans les échantillons prélevés en 2009 et n’a donc pas été examiné davantage dans le cadre de l’étude. Parmi tous les sites échantillonnés, les concentrations médiane (2,2 ng/g ph) et maximale (26 ng/g ph) de TBPH les plus élevées ont été observées dans les œufs des sites d’enfouissement desservant respectivement Vancouver et Montréal (Chen et al. 2013).
Le TBB et le TBPH ont été détectés chez les goélands à bec cerclé (Larus delawarensis) de l’île Deslauriers en 2010 (Gentes et al. 2012). Même si ni l’une ni l’autre de ces substances n’a été détectée dans les échantillons de plasma, elles ont été détectées dans 11 % et 89 % des échantillons de foie, à des concentrations maximales respectives de 1,55 et de 17,6 ng/g ph (Gentes et al. 2012).
Le TBPH a été mesuré dans un tiers des œufs de faucon pèlerin (Falco peregrinis) prélevés sur des sites au Canada, à des concentrations atteignant 4,5 ng/g ph (Guerra et al. 2012).
Le TBB et le TBPH ont respectivement été détectés dans 32 % et 18 % des échantillons de poissons provenant des Grands Lacs ainsi que de deux autres lacs en Ontario. Les concentrations de TBB se situaient entre 0,011 et 0,041 ng/g, tandis que celles de TBPH allaient de 0,044 à 0,078 ng/g (type de poids non indiqué) (Zhou et al. 2010 b). Dans une étude plus récente menée par Houde et al., le TBPH a été détecté dans des échantillons de foie du grand brochet (Esox lucius) et du maskinongé (Esox masquinongy) provenant du fleuve Saint-Laurent et de ses affluents, tandis que le TBB n’y a pas été détecté (Houde et al. 2014).
Des concentrations de TBB et de TBPH ont été mesurées dans des échantillons de graisse de sotalies de Chine (Sousa chinensis) et de marsouins de l’Inde (Neophocaena phocaenoides) dans le delta de la rivière des Perles, en Chine. Les concentrations moyennes de TBB et de TBPH étaient respectivement inférieures à 0,04 et à 0,52 ng/g pl (poids lipidique) dans les échantillons de sotalies, et de 5,6 et 342 ng/g pl dans les échantillons de marsouins (Lam et al., 2009). Toutefois, ces valeurs ne devraient pas être interprétées comme des concentrations à l’état stable, car la majorité des animaux desquels proviennent ces échantillons ont été trouvés dans un état avancé de décomposition. Dans une étude plus récente menée par les mêmes auteurs, la concentration de TBB se situait au-dessus de la limite de détection pour les échantillons de sotalies, mais les concentrations rapportées pour les deux composés chez les marsouins étaient beaucoup plus faibles. Par ailleurs, dans une nouvelle étude, les concentrations moyennes de TBB et de TBPH étaient respectivement de 0,186 et 0,517 ng/g pl dans les échantillons de sotalies, et de 0,090 7 et 0,098 ng/g pl dans les échantillons de marsouins (Zhu et al. 2014).
Le TBPH a été détecté dans les tissus musculaires d’anguilles jaunes (Anguilla) juvéniles prélevées dans la rivière Vida près de la frontière entre le Danemark et l’Allemagne, à une concentration moyenne de 7,4 ng/g pl (Sühring et al. 2013).
Des échantillons provenant de sept espèces (un poisson, trois mammifères et trois oiseaux) de l’Arctique norvégien ont été analysés afin de déceler la présence de TBB et de TBPH. Le TBB a été détecté chez les sept espèces arctiques, alors que le TBPH n’a été détecté que chez cinq de ces sept espèces. Le pourcentage de détection du TBB était plus élevé que celui du TBPH chez les espèces dans lesquelles ces deux substances ont été trouvées. Le TBB a été détecté dans 90 % des échantillons de plasma des ours blancs (Ursus maritimus), à une concentration moyenne de 3,46 ng/g ph. Les résultats concernant les autres espèces sont indiqués dans le tableau 72 (Sagerup et al. 2010).
Enfin, le TBB et le TBPH ont été mesurés chez Elimia proxima, un mollusque indigène, et chez Corbicula fluminea, un mollusque envahissant, au point de rejet d’une station de traitement des eaux usées d’une usine textile sur la rivière Yadkin, en Caroline du Nord, et à différentes distances en aval. Les concentrations maximales présentées dans le tableau 72 correspondent à celles du point de rejet. Les concentrations les plus faibles et celles inférieures à la limite de détection (inférieures à 1 ng/g pl) se trouvaient en aval (16,8 à 44,6 km) (La Guardia et al. 2012).
| Organisme; tissu | Lieu; année | Concentration de TBB (fréquence de détection) | Concentration de TBPH (fréquence de détection) | Références |
|---|---|---|---|---|
| Goéland à bec cerclé; foie | île Deslauriers, Canada; 2010 | ND à 1,5 ng/g ph (11 %) | ND à 17,6 ng/g ph (89 %) | Gentes et al. 2012 |
| Étourneau sansonnet; homogénat d’œufs | 21 sites au Canada, notamment des sites d’enfouissement, des sites industriels, ainsi que des sites situés à 10 km et 40 km de centres urbains; 2009 à 2011 | ND | ND à 26 ng/g ph (47 %) | Chen et al. 2013 |
| Faucon pèlerin; œuf | Toronto et Montréal; 2007 à 2009 | ND | ND à 4,5 ng/g ph (33 %) | Guerra et al. 2012 |
| Poisson (non indiqué); non indiqué | Grands Lacs et deux autres lacs en Ontario; non indiqué | ND à 0,041 ng/g; 0,029 ng/g (type de poids non indiqué) (18 %) | ND à 0,078 ng/g; 0,060 ng/g (type de poids non indiqué) (18 %) | Zhou et al. 2010b |
| Grand brochet; foie | Fleuve Saint‑Laurent et ses affluents; 2008 à 2012 | ND | 5,4 ng/g pl (64 %) | Houde et al. 2014 |
| Maskinongé; foie | Fleuve Saint‑Laurent et ses affluents; 2008 à 2012 | ND | ND à 13 ng/g ph (40 %) | Houde et al. 2014 |
| Perchaude; homogénat de poissons entiers | fleuve Saint‑Laurent et ses affluents; 2008 à 2012 | ND | ND | Houde et al. 2014 |
| Anguille européenne (civelles); muscle | Rivière Vida, frontière Danemark/Allemagne; non indiqué | S.O. | 0,10 ng/g ph | Suhring et al. 2013 |
| Capelan; poisson entier | Svalbard, Norvège; 2009 | 0,378 ng/g ph (100 %) | 0,719 ng/g ph (90 %) | Sagerup et al. 2010 |
| Eider à duvet; foie | Svalbard, Norvège; 2009 | 0,862 ng/g ph (100 %) | 1,652 ng/g ph (60 %) | Sagerup et al. 2010 |
| Mouette tridactyle; foie | Svalbard, Norvège; 2009 | 0,732 ng/g ph (90 %) | 1,799 ng/g ph (70 %) | Sagerup et al. 2010 |
| Guillemot de Brünnich; œuf | Svalbard, Norvège; 2008 | 1 213 ng/g ph (90 %) | 1,799 ng/g ph (70 %) | Sagerup et al. 2010 |
| Phoque annelé; foie | Svalbard, Norvège; 2007 | 0,435 ng/g ph (100 %) | 0,573 ng/g ph (60 %) | Sagerup et al. 2010 |
| Renard arctique; foie | Svalbard, Norvège; 2007-2008 | 0,975 ng/g ph (90 %) | ND | Sagerup et al. 2010 |
| Ours blanc; plasma | Svalbard, Norvège; 2008 | 3 640 ng/g ph (90 %) | ND | Sagerup et al. 2010 |
| Perchaude; muscle | Finlande et Suède; 2009 | ND à 0,022 ng/g ph (63 %) | ND à 0,46 ng/g ph (88 %) | TemaNord 2011 |
| Omble chevalier; muscle | Îles Féroé; 2009 | 0,003 1 ng/g ps (100 %) | 0,011 ng/g ps (100 %) | TemaNord 2011 |
| Morue franche; foie | Îles Féroé, Islande, Norvège; 2005 à 2009 | ND à 0,12 ng/g ph (20 %) | ND à 0,2 ng/g ph (40 %) | TemaNord 2011 |
| Moule bleue | Islande, Norvège; 2009 | 0,0041 à 0,004 9 ng/g ph (100 %) | 0,009 à 0,057 ng/g ph (100 %) | TemaNord 2011 |
| Crabe | Norvège | ND | ND | DNV 2010 |
| Moules | Norvège | ND | ND | DNV 2010 |
| Sotalie de Chine; graisse | Delta de la rivière des Perles, Chine; 2002 à 2007 | ND | ND à 5,3 ng/g pl | Lam et al. 2009 |
| Marsouin de l’Inde; graisse | Delta de la rivière des Perles, Chine; 2003 à 2008 | ND à 70 ng/g pl | ND à 3 859 ng/g pl | Lam et al. 2009 |
| Sotalie de Chine; graisse | Delta de la rivière des Perles, Chine; 2003 à 2011 | 0,061 4 à 0,64 ng/g pl (100 %) | ND à 7,55 ng/g pl (83 %) | Zhu et al. 2014 |
| Marsouin de l’Inde; graisse | Delta de la rivière des Perles, Chine; 2003 à 2012 | ND à 0,219 ng/g pl (> 80 %) | ND à 1,06 ng/g pl (> 80 %) | Zhu et al. 2014 |
| Mollusque envahissant | Rivière Yadkin, États-Unis; 2009 | ND à 2 200 ng/g pl | ND à 1 370 ng/g pl | La Guardia et al. 2012 |
| Mollusque indigène | Rivière Yadkin, États-Unis; 2009 | ND à 1 740 ng/g pl | ND à 380 ng/g pl | La Guardia et al. 2012 |
a Les concentrations sont présentées en tant que gammes ou moyennes arithmétiques. ND = non détecté; S.O. = sans objet (non analysé); ph = poids humide; ps = poids sec; pl = poids lipidique.
8. Devenir et comportement dans l’environnement
8.1 Répartition dans l’environnement
Le modèle de fugacité de niveau III (EQC 2003) simule la répartition d’une substance dans un environnement d’évaluation hypothétique appelé « monde unitaire ». Le modèle EQC simule la distribution dans l’environnement d’une substance chimique à l’échelle régionale (à savoir 100 000 km2) et permet d’obtenir la fraction de la masse totale dans chaque milieu provenant d’une émission dans le monde unitaire et les concentrations qui en résultent dans chaque milieu. Environnement et Changement climatique Canada utilise seulement les résultats de la distribution masse-fraction comme renseignements généraux sur le devenir dans l’environnement d’une substance et n’utilise habituellement pas les résultats des concentrations par milieu pour la concentration environnementale estimée (CEE) dans l’évaluation d’une substance. Quelques exceptions peuvent se produire, par exemple lorsqu’un rejet grandement dispersif d’une substance laisse entendre que les concentrations à l’échelle régionale sont appropriées pour la CEE.
Les distributions masse-fraction pour le TBB et le TBPH sont respectivement présentées dans le tableau 81 et le tableau 82, et reposent sur des émissions individuelles à l’équilibre dans l’atmosphère, l’eau et le sol. Le modèle EQC de niveau III prend pour hypothèse des conditions hors équilibre entre les milieux de l’environnement, mais à l’équilibre au sein de chaque milieu. Les résultats représentent les effets nets du partage chimique, du transport intermilieu et de la perte par des processus d’advection (hors de la région modélisée) et de dégradation/transformation.
De manière générale, les résultats du modèle de fugacité de niveau III montrent que le TBB et le TBPH devraient se retrouver principalement dans le sol ou les sédiments suivant le milieu de rejet, et une fraction modeste devrait être présente dans l’eau (tableau 81 et tableau 82). Pour le paramétrage du modèle EQC, les demi-vies de réaction dans l’eau, le sol et les sédiments ont été jugées « négligeables », tandis que les résultats du modèle d’oxydation atmosphérique (AOPWIN) ont été utilisés comme intrants pour les demi-vies de réaction dans l’air (voir la section 8.2).
| Substance rejetée dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 0,045 7 | 0,028 9 | 99,3 | 0,592 |
| Eau (100 %) | Négligeable | 4,35 | 6,45 | 89,2 |
| Sol (100 %) | Négligeable | 0,012 3 | 99,7 | 0,252 |
| Substance rejetée dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | Négligeable | Négligeable | 99,6 | 0,400 |
| Eau (100 %) | Négligeable | 1,01 | 0,372 | 98,6 |
| Sol (100 %) | Négligeable | Négligeable | 99,7 | 0,344 |
La faible pression de vapeur du TBB et du TBPH (3,02 × 10-6 et 1,29 × 10-9 Pa, respectivement), leur coefficient de partage élevé (log Koe de 7,71 et de 10,10, et log Kco de 5,12 et de 6,38, respectivement) ainsi que leur persistance portent à croire qu’une fois dans l’environnement, ils auront peu tendance à se répartir dans l’air ou à y demeurer, et que de petites fractions demeureront dans l’eau.
Si le TBB et le TBPH sont rejetés dans l’air, une très petite fraction (moins de 0,1 %) devrait y demeurer. Ils se déposeront principalement dans le sol et l’eau, puis dans les sédiments. Toutefois, à la lumière des concentrations atmosphériques mesurées dans le Nord du Canada (où il n’y a pas de sources locales importantes), on peut déduire que les petites quantités de TBB et de TBPH qui demeurent dans l’air présentent un potentiel de transport à grande distance. Certains produits ignifuges organiques, comme certains PBDE, sont ou seraient fort probablement transportés à grande distance dans l’air en association avec des particules fines en suspension (p. ex. Breivik et al. 2006, Gouin et al. 2006). Les résultats du modèle AEROWIN semblent indiquer que ~40 % à 80 % du TBB et 99 à 100 % du TBPH rejetés dans l’air vont s’associer à la phase particulaire, principalement en raison des valeurs élevées estimées pour le log Koa (AEROWIN, 2010). Le modèle de criblage des POP de l’OCDE donne des résultats similaires pour la fraction des produits chimiques dans l’air qui sont associés aux particules d’aérosol : 0,65 et 1,00 pour le TBB et le TBPH, respectivement (OCDE 2009a). Les distances de parcours caractéristiques (DPC) prédites par le modèle de criblage des POP de l’OCDE pour le TBB et le TBPH étaient de 580 km et de 2 850 km, respectivement (OCDE 2009a).
Dans le cas d’un rejet dans l’eau, les coefficients de partage élevés (Koe et Kco) permettent de penser que le TBB et le TBPH s’adsorberont principalement à la fraction organique des matières en suspension et des sédiments. Des fractions relativement petites (moins de 5 %) pourraient demeurer dans l’eau et sans doute y persister (voir la section suivante). Étant donné les valeurs élevées estimées pour le log Kco, une fois adsorbés aux sédiments, le TBB et le TBPH ne devraient pas être mobiles et pourraient demeurer dans ce milieu sans subir de forte dégradation.
D’après ces mêmes valeurs estimées, le TBB et le TBPH devraient être relativement immobiles s’ils sont rejetés dans le sol. La faible valeur de la pression de vapeur indique que la volatilisation à partir des surfaces de sol sèches devrait être minime. Tout comme dans les sédiments, la dégradation du TBB et du TBPH devrait être faible dans le sol. La migration globale à l’extérieur du sol devrait donc être minime.
Dans l’ensemble, les propriétés physicochimiques et les résultats du modèle de fugacité de niveau III (tableau 81 et tableau 82) tendent à confirmer que le TBB et le TBPH se retrouveront principalement dans le sol ou les sédiments, en fonction du milieu de rejet (EQC 2003).
8.2 Persistance dans l’environnement
Étant donné les rejets probables et les caractéristiques de partage prédites du TBB et du TBPH et les concentrations de ces substances mesurées dans l’environnement, la persistance sera prise en compte pour tous les milieux de l’environnement. Afin de fournir le meilleur poids de la preuve possible pour déterminer la persistance du TBB et du TBPH, des données empiriques et des données modélisées ont été prises en compte. Les processus pertinents de transformation du TBB et du TBPH comprennent l’hydrolyse, la photodégradation et la biodégradation (catabolisme).
La prise en compte de tous les éléments de preuve ayant trait à l’hydrolyse, à la photodégradation et à la biodégradation permet de dresser un portrait global de la persistance attendue du TBB et du TBPH dans l’environnement. Les données sur l’hydrolyse abiotique corroborent la notion de lente hydrolyse en raison de l’encombrement stérique et de l’hydrosolubilité modérée. La photodégradation a seulement été étudiée directement pour les solvants organiques susceptibles de donner des atomes d’hydrogène par opposition à un système plus pertinent sur le plan de l’environnement. Toutefois, dans les études sur des mésocosmes de sédiments amendés, des temps de dissipation (TD50) plus courts dans la phase particulaire par rapport à la phase sédimentaire pourraient s’expliquer, au moins en partie, par l’exposition accrue de la phase particulaire à la lumière. Les données empiriques semblent également indiquer un faible potentiel global de biodégradation du TBB et du TBPH. Généralement, les prédictions des modèles ne corroborent pas entièrement ni ne réfutent les résultats empiriques indiquant que la biodégradation du TBB et du TBPH est limitée. En tenant compte de tous les éléments de preuve, ces composés devraient être persistants dans l’eau, le sol et les sédiments.
Dans le tableau 83, le tableau 84 et le tableau 85, nous présentons les données empiriques et les données modélisées sur la dégradation du TBB et du TBPH.
8.2.1 Dégradation abiotique
La structure chimique du TBB et du TBPH suggère que l’hydrolyse abiotique des groupes esters peut être favorisée pour ces composés en raison du caractère accepteur d’électrons des multiples substitutions d’atomes de brome du noyau aromatique. À l’inverse, les effets stériques des substituants esters ramifiés et la solubilité modérée des deux composés dans l’eau semblent suggérer une hydrolyse lente. Les données empiriques sur un mélange commercial de TBB et de TBPH montrent que la réaction d’hydrolyse est en fait lente. Une étude sur l’hydrolyse abiotique n’a révélé aucune hydrolyse mesurable pour le mélange de TBB/TBPH à un pH de 4, de 7 ou de 9 et à une température de 50 °C. D’après les paramètres de la méthode d’essai mentionnés (92/69/CEE C7), la demi-vie par hydrolyse était supérieure à une année pour chacune des valeurs de pH et à 25 °C (Great Lakes Chemical Corporation 1997b). Les demi-vies par hydrolyse prévues au moyen du modèle HYDROWIN pour le TBB et le TBPH ont sans doute été sous-estimées. Le tétrabromophényl et le 2-éthylhexyl ne sont pas disponibles dans la bibliothèque de fragments et ne peuvent pas être pris en compte autrement dans ce modèle (positions ortho). Ils ont donc été respectivement remplacés par le tribromophényl et l’isobutyl. Ces fragments substituts contribueraient moins à l’encombrement stérique de la réaction d’hydrolyse. De plus, le TBB et le TBPH sont peu solubles dans l’eau.
Davis et al. (2009) ont rapporté une photodébromination réductrice du TBB et du TBPH sous rayonnement solaire dans une série de solvants organiques. Dans tous les solvants, les vitesses de dégradation étaient plus lentes pour le TBB et le TBPH que pour leurs congénères décaBDE et nonaDBE visés par cette étude. Des produits de dégradation dibromés et tribromés ont été observés pour le TBB et le TBPH, la plupart ne présentant pas les deux ramifications esters dans le cas du TBPH (Davis et Stapleton 2009). Bien qu’aucune donnée sur la photodégradation du TBB et du TBPH dans l’air n’a été recensée, l’observation de ces composés dans les phases particulaire et gazeuse à Alert, au Nunavut, suggère que la photodégradation dans l’air serait relativement lente (Xiao et al. 2012 b).
Des produits de dégradation partiellement débromés ont également été identifiés lors d’une étude récente de mésocosme sur un mélange commercial TBB/TBPH (de Jourdan et al., 2013). La formation des produits de dégradation du TBPH était amplifiée dans la phase de particules en suspension par rapport à la phase de sédiments, ce qui concorde avec une plus grande exposition à la lumière. Des temps de dissipation médians estimés (TD50) ont été rapportés dans l’étude de mésocosme pour le TBB et le TBPH. Les TD50 du TBB et du TBPH étaient respectivement de 9 et 25 jours dans la phase particulaire. Le TD50 du TBPH dans les sédiments a été rapporté supérieur à 200 jours, puisque l’estimation de 9303 jours comportait une grande incertitude (de Jourdan et al. 2013). Aucun TD50 pour les sédiments n’a été rapporté pour le TBB.
Aucune donnée empirique sur la biodégradation du TBB et du TBPH dans l’air n’est disponible. Les demi-vies prédites pour la dégradation du TBB et du TBPH dans l’atmosphère par réaction avec les radicaux hydroxyles sont respectivement de 11,8 et de 5,9 heures (AOPWIN 2010). Ces demi-vies courtes semblent indiquer un potentiel limité de transport à grande distance du TBB et du TBPH dans la phase gazeuse, mais n’excluent pas un transport par des particules fines tel que susmentionné. La demi-vie de ces composés résultant de leur réaction avec l’ozone ne pouvait être estimée puisqu’ils ne contiennent pas de liaisons carbone-carbone doubles ou triples.
Par conséquent, compte tenu des données empiriques et les données modélisées de biodégradation abiotique, le TBB et le TBPH ne devraient pas persister dans la phase gazeuse, mais pourraient persister, adsorbés sur des particules fines dans l’air. Par ailleurs, ils devraient être persistants dans l’eau.
| Matière testée ou substance modélisée | Processus du devenir | Milieu | Paramètre ou prévision de dégradation | Valeur pour la dégradation | Méthode | Références |
|---|---|---|---|---|---|---|
| Mélange TBB/TBPH | Hydrolyse | Tampons aqueux; pH 4, 7, 9 |
Demi-vie | > 1 an | 92/69/CEE C7 | Great Lakes Chemical Corporation 1997b |
| TBB | Hydrolyse | Eau | Demi-vie | 34,1 jours (pH 7); 3,4 jours (pH 8) | RQSA | HYDROWIN 2010 |
| TBPH | Hydrolyse | Eau | Demi-vie | 29,2 jours (pH 7); 2,9 jours (pH 8) | RQSA | HYDROWIN 2010 |
| TBB | Mésocosme | Phase particulaire | Temps de dissipation médian (TD50) | 9 jours | Étude publiée | de Jourdan et al. 2013 |
| TBPH | Mésocosme | Phase particulaire | Temps de dissipation médian (TD50) | 25 jours | Étude publiée | de Jourdan et al. 2013 |
| TBPH | Mésocosme | Phase sédimentaire | Temps de dissipation médian (TD50) | > 200 jours | Étude publiée | de Jourdan et al. 2013 |
| TBB | Oxydation atmosphérique | Air (phase gazeuse) | Demi-vie | 11,8 heures | RQSA | AOPWIN 2010 |
| TBPH | Oxydation atmosphérique | Air (phase gazeuse) | Demi-vie | 5,9 heures | RQSA | AOPWIN 2010 |
| TBB | Réaction avec l’ozone | Air | S.O. | S.O. | RQSA | AOPWIN 2010 |
| TBPH | Réaction avec l’ozone | Air | S.O. | S.O. | RQSA | AOPWIN 2010 |
Abréviations : S.O. = sans objet; le modèle ne précise pas d’estimation pour ce type de structure. RQSA = relations quantitatives structure-activité.
8.2.2 Biodégradation
Des études empiriques de biodégradation ont été présentées pour le TBPH commercial et les mélanges TBB/TBPH. La biodégradabilité immédiate du TBPH a été évaluée au moyen d’un essai de Sturm modifié (OCDE 301B) dans un milieu inoculé avec des sels minéraux. La production cumulative de dioxyde de carbone se situait entre 2 % et 3 % de la production théorique, ce qui indique que le composé n’était pas facilement biodégradable (Pennwalt Corporation 1989a). La biodégradation immédiate d’un mélange commercial TBB/TBPH a été déterminée au moyen d’un essai en flacon fermé (OCDE 301D). Elle était inférieure à 6 % après 28 jours (Great Lakes Chemical Corporation 1998a). En supposant une cinétique de premier ordre, les demi-vies peuvent être calculées en modifiant l’équation de vitesse intégrée pour k et en effectuant une substitution dans l’expression pour la demi-vie. Les demi-vies qui en résultent sont d’environ 600 à 1000 jours pour le TBPH et de 300 jours pour le mélange TBB/TBPH. Les inoculats dans les deux études susmentionnées ont été recueillis dans des usines de traitement des eaux usées présumément locales qui traitent principalement des eaux usées domestiques. Des mesures de contrôle appropriées ont montré que les inoculats étaient viables et que la matière testée n’était pas inhibitrice dans aucun de ces essais.
Un test de dissipation en flacon agité (OPPTS 835.3170) a également été réalisé sur un mélange commercial TBB/TBPH (Great Lakes Chemical Corporation 2003a). Des demi‑vies de dégradation respectives de 3,5 et 8,5 jours ont été calculées dans l’eau active et les sédiments actifs. Selon la description de la méthode de CHLP-PI/SM, il est probable que seul le TBB ait été analysé lors de cette étude et que, par conséquent, une seule demi-vie est attribuée au mélange testé pour chaque milieu. Aucune raison n’a été donnée dans l’étude pour cette observation. D’après les propriétés physicochimiques et la modélisation de la dégradation, le TBPH devrait se dégrader plus lentement que le TBB. Ce résultat peut donc être considéré comme la meilleure éventualité pour le TBPH en ce qui a trait au potentiel de biodégradation. Dans les cas où les essais de biodégradabilité immédiate étaient faits sans solvant ou lorsque le solvant (chloroforme) était évaporé au complet avant le début de l’essai, le protocole de la méthode de dissipation en flacon agité a été modifié de façon à ce que le méthanol soit utilisé comme cosolvant. Il est possible que le méthanol ait augmenté la disponibilité pour la biodégradation. Par ailleurs, Davis et Stapleton (2009) ont démontré que le méthanol était un bon solvant donneur d’atomes d’hydrogène pour la photodégradation du TBB et du TBPH (Davis et Stapleton 2009). La photolyse pourrait expliquer environ le tiers de la dégradation de la matière testée dans les échantillons témoins stériles de cette expérience.
Une simulation de traitement des eaux usées au moyen d’un vase poreux (OCDE 303A, OPPTS 835.3220) a également été réalisée pour un mélange TBB/TBPH (Great Lakes Chemical Corporation 2002). La concentration mesurée (de TBB seulement, comme ci‑dessus) associée aux boues activées à la fin de la période de test de 21 jours était 111 % de la concentration nominale mesurée, indiquant qu’il n’y a pas eu de biodégradation. Une fois de plus, ce résultat est considéré représenter le meilleur scénario pour le TBPH.
Des modèles de biodégradation ont également été utilisés pour étayer le poids de la preuve en ce qui a trait à la persistance dans l’environnement. En outre, les modèles BIOWIN (2010) et CATALOGIC (2013) ont été utilisés pour modéliser la biodégradation. Les résultats concordent en partie avec les données empiriques sur la biodégradation. Le sous-modèle BIOWIN 4 prévoit que la biodégradation primaire sera plus rapide pour le TBPH que pour le TBB. Les sous-modèles BIOWIN prévoient un faible potentiel de biodégradation ultime pour les deux composés, alors que le modèle CATALOGIC prévoit des pourcentages de demande biologique en oxygène qui n’appuient pas clairement ni ne réfutent la persistance. Comme le modèle CATALOGIC (2013) permet de rendre compte de 52 et 75 % des fragments de TBB et de TBPH, respectivement, et de conclure qu’aucune de ces substances n’est couverte par le domaine structurel du modèle, il faut utiliser les résultats avec précaution. Le modèle CATALOGIC prévoit que l’hydrolyse des esters est fort probablement la première transformation pour les deux substances, accompagnée d’une débromation partielle en acide 3,4,5-tribromobenzoïque et en acide 4,5‑dibromophtalique comme produits de transformation les plus stables pour le TBB et le TBPH, respectivement. Ces produits de transformation sont traités plus à fond dans l’annexe C. Ces résultats variables de la modélisation de la biodégradation ne sont pas surprenants, car ces composés ont des caractéristiques structurelles qui sont habituellement associées à la biodégradabilité, à savoir les esters, mais présentent également un encombrement stérique autour des esters, une hydrosolubilité modérée et une forte adsorption aux solides, qui devraient ralentir significativement la biodégradation.
| Matière testée ou substance modélisée | Milieu | Paramètre ou prévision de dégradation | Valeur pour la dégradation | Méthode | Références |
|---|---|---|---|---|---|
| TBPH | Milieu inoculé avec des sels minéraux | Dégradation sur 28 jours | 2 à 3 % | OCDE 301B; 92/69/CEE C5 | Pennwalt Corporation 1989a |
| Mélange TBB/ TBPH | Milieu inoculé avec des sels minéraux | Dégradation sur 28 jours | 6 % | OCDE 301D; 92/69/CEE C4 | Great Lakes Chemical Corporation 1998a |
| Mélange TBB/ TBPH | Eau active | Demi-vie par dégradation primaire | 3,5 jours | OPPTS 835.3170 | Great Lakes Chemical Corporation 2003a |
| Mélange TBB/ TBPH | Sédiments actifs | Demi-vie par dégradation primaire | 8,5 jours | OPPTS 835.3170 | Great Lakes Chemical Corporation 2003a |
| Processus du devenir | Méthode de test ou base du modèle | Résultat et prévision du modèle pour le TBB | Résultat et prévision du modèle pour le TBPH | Références |
|---|---|---|---|---|
| Biodégradation primaire (aérobie) | Sous-modèle 4 : enquête d’expert | 2,94a (se biodégrade lentement) | 3,21a (se biodégrade rapidement) | BIOWIN 2010 |
| Biodégradation ultime (aérobie) | Sous-modèle 3 : enquête d’expert | 1,89a (se biodégrade lentement) | 1,97a (se biodégrade lentement) | BIOWIN 2010 |
| Biodégradation ultime (aérobie) | Sous-modèle 5 : probabilité linéaire du MITI | 0,29 b (se biodégrade lentement) | 0,36 b (se biodégrade rapidement) | BIOWIN 2010 |
| Biodégradation ultime (aérobie) | Sous-modèle 6 : Probabilité non linéaire MITI | 0,06 b (se biodégrade très lentement) | 0,06 b « se biodégrade très lentement » | BIOWIN 2010 |
| Biodégradation ultime (aérobie) | % DBO | 35 | 42 | CATALOGIC 2013 |
Abréviation : DBO = demande biochimique d’oxygène
a Le résultat s’exprime par une valeur numérique de 0 à 5.
b Le résultat s’exprime par une probabilité.
8.3 Potentiel de bioaccumulation
L’analyse du potentiel de bioaccumulation porte sur plusieurs paramètres, dont les propriétés physiques et chimiques, le facteur de bioconcentration (FBC), le facteur de bioamplification (FBAm), le facteur d’amplification trophique (FAT) et le facteur de bioaccumulation (FBA). Le rôle de la biotransformation métabolique dans la détermination du potentiel de bioaccumulation est également discuté. Les données empiriques et les résultats modélisés ont été pris en compte pour l’évaluation du potentiel de bioaccumulation du TBB. Seules les données empiriques sont présentées pour le TBPH, car le log Koe modélisé de 10,10 est en dehors du domaine des modèles de bioaccumulation disponibles et des données empiriques sur la bioaccumulation. Les valeurs modélisées du log Koe pour le TBB et le TBPH, respectivement de 7,71 et de 10,10, semblent indiquer que le TBB a un potentiel de bioaccumulation plus élevé dans le biote, tandis que le TBPH a un faible potentiel de bioaccumulation. De plus, les valeurs du log Koa du TBB et du TBPH, respectivement de 11,34 et de 15,03, suggèrent qu’en cas d’exposition terrestre par voie alimentaire, ces composés ont le potentiel de se bioamplifier dans les chaînes alimentaires terrestres, comme le suggèrent Gobas et al. (2003) et Kelly et al. (2007). Toutefois, le log Koe et le log Koa ne permettent pas à eux seuls de déterminer le potentiel de bioaccumulation, puisque ce ne sont que des coefficients de partage et qu’ils ne tiennent pas compte des paramètres physiologiques, comme la biotransformation. La biotransformation métabolique est un facteur important à considérer pour le TBB et le TBPH. Les observations faites sur les données empiriques soumises et dans la littérature accessible à tous, y compris dans des études sur le métabolisme in vitro, ont été prises en compte dans le cadre d’une approche du poids de la preuve afin d’évaluer les caractéristiques de bioaccumulation du TBB et du TBPH (ECCC 2013-2014; Bearr et al. 2010; Sagerup et al. 2010; Bearr et al. 2012; de Jourdan et al. 2012; La Guardia et al. 2012; Roberts et al. 2012; de Jourdan et al. 2014).
Bien que selon le poids de la preuve, les propriétés physicochimiques indiquent que le TBB puisse se bioaccumuler, ceci est fortement contredit par des études en mésocosme et des études sur l’alimentation chez le méné à grosse tête, les examens in vitro de la biotransformation métabolique et l’absence générale de concentrations plus élevées dans les relations prédateur-proie relevée dans les données de surveillance du biote. Ces éléments de preuve révèlent plutôt un faible potentiel de bioaccumulation. Bien que l’exposition par les branchies puisse être moins importante pour ces substances faiblement solubles dans l’eau, le facteur de bioconcentration empirique suggère également une bioaccumulation limitée.
Les propriétés physicochimiques (log Koe et facteurs stériques) ainsi que les études en mésocosme et les études sur l’alimentation suggèrent un potentiel limité de bioaccumulation pour le TBPH bien que, en général, cela puisse être moins dû à la biotransformation métabolique que dans le cas du TBB. La bioaccumulation de TBPH n’a pas été modélisée, puisque le log Koe estimé de 10,10 se trouve en dehors du domaine des modèles utilisés pour estimer le potentiel de bioconcentration et le potentiel de bioaccumulation (voir ECCC, 2018).
8.3.1 Facteur de bioconcentration (FBC) et facteur de bioaccumulation (FBA)
Un mélange commercial TBB/TBPH a été soumis à un test de bioconcentration dans des conditions d’écoulement (OCDE 305) (NICNAS 2004; Great Lakes Chemical Corporation 2003b). Pour cette étude, des alevins de truite arc-en-ciel ont été exposés à une concentration de 0,96 μg/L ou de 8,9 μg/L en présence de N,N‑diméthylformamide comme cosolvant (ne dépassant pas 0,01 %). Les concentrations mesurées dans les tissus chez le groupe exposé à la concentration de 0,96 μg/L étaient presque toutes inférieures à la limite de dosage tant pour la phase d’absorption que pour la phase de dépuration, ce qui rend l’analyse de ces données non fiables. La concentration d’exposition la plus élevée, 8,9 μg/L, est supérieure à la limite de quantification, mais d’un même ordre de grandeur que la solubilité prévue du TBB. Les deux concentrations d’exposition sont bien plus élevées que la solubilité prévue du TBPH. D’après la méthode d’analyse utilisée, le TBPH ne semble pas avoir été pris en compte comme composant du mélange dans cette étude. L’analyse par CHLP/SM reposait sur le suivi d’ions déterminés (mode négatif) à 485 et 487 uma, qui est plus susceptible de correspondre au TBB [M-Br+O]- (Zhou et al. 2010 b). De même, un seul pic est visible sur les chromatogrammes représentatifs des analyses faites sur les tissus, de l’eau et en matrice fortifiée, malgré les différences d’hydrophobicité qui devraient rendre le TBB et le TBPH sont facilement séparables par CHLP. Pour cette étude, on n’a pas cherché à identifier ni à doser les métabolites potentiels.
Les valeurs du FBC à l’équilibre pour le groupe exposé à la concentration la plus élevée étaient respectivement de 1,74, 2,27 et de 2,02 L/kg pour les tissus comestibles, les tissus non comestibles et les poissons entiers. Pour ce groupe d’exposition, la concentration moyenne dans les tissus comestibles a augmenté tout au long de la phase d’absorption de cinq semaines. Toutefois, l’équilibre a été atteint dans les tissus comestibles et non comestibles au jour 4, la tendance n’étant pas statistiquement significative. La durée pour atteindre l’état d’équilibre était probablement de plus de quatre jours, car pendant la phase de dépuration, il a fallu environ une semaine pour obtenir une clairance de 50 % (Great Lakes Chemical Corporation 2003b). Cette dépuration apparemment rapide concorde avec d’autres études publiées (Bearr et al. 2012, de Jourdan et al. 2012, de Jourdan et al. 2013). Malgré le fait que les deux composés du mélange n’aient pas été pris en compte, les résultats de cette étude vont dans le sens d’un potentiel de bioconcentration limité pour le TBB. D’après ses propriétés physicochimiques (notamment le log Koe et la taille moléculaire effective), le TBB devrait avoir un plus grand potentiel de bioaccumulation que le TBPH. À l’inverse, des données permettent de penser que le TBB est métabolisé plus rapidement que le TBPH.
| Matière testée | Organisme testé | Concentration expérimentale (durée) | FBC à l’équilibre (L/kg) | Références |
|---|---|---|---|---|
| Mélange TBB/ TBPH (seul le TBB a été analysé) | Truite arc-en-ciel (Oncorhynchus mykiss) | 8,9 μg/L (60 jours) | 1,74 (tissus comestibles); 2,27 (tissus non comestibles); 2,02 (poissons entiers) | Great Lakes Chemical Corporation 2003a |
De récentes études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al. 2005; Sakuratani et al. 2008) laissent entendre que la probabilité qu’une molécule traverse la membrane cellulaire branchiale par diffusion passive diminue de façon importante à mesure qu’augmente le diamètre maximal (Dmax). D’après l’analyse 3D des conformères calculés à l’aide du modèle FBCmax avec des facteurs d’atténuation (Dimitrov et al., 2005), les diamètres maximums du TBB et du TBPH sont de 1,5 et 1,7 nm, et les diamètres effectifs de 1,0 et 1,3 nm, respectivement. Par comparaison avec les seuils proposés par Dimitrov et al. (2005), cela semble indiquer que le TBB et le TBPH pourraient présenter une absorption limitée en raison des effets stériques à la surface des branchies. Ce phénomène pourrait expliquer en partie les faibles valeurs empiriques observées pour le FBC, conjointement avec le métabolisme du TBB et du TBPH absorbés.
Aucune mesure empirique n’a été répertoriée pour le FBA. Toutefois, La Guardia et al. ont déterminé les facteurs d’accumulation biote-sédiments (FABS) chez un bivalve (Corbicula fluminea) et un gastéropode (Elimia proxima) au point de rejet d’une station de traitement des eaux usées d’une usine textile (TBB et TBPH) et à diverses distances en aval (seul le TBPH a été détecté dans les sédiments en aval). Pour le TBB, les valeurs du log des FABS au point de rejet étaient environ de - 0,24 et de - 0,34 pour le bivalve et le gastéropode, respectivement. Pour le TBPH, elles étaient de - 1,73 à - 1,15 pour le bivalve et de - 1,74 à - 1,55 pour le gastéropode. Les auteurs ont conclu que la différence de l’ordre de grandeur des valeurs des FABS reflétait la biodisponibilité réduite du TBPH calculée à partir des propriétés physicochimiques (La Guardia et al., 2012).
8.3.2 Facteur de bioamplification (FBAm) et facteur d’amplification trophique (FAT)
Un FBAm dépassant 1 indique qu’il y a potentiellement une bioamplification, ce qui peut être considéré comme un indicateur du potentiel d’absorption et d’accumulation dans le biote, et est pris en compte dans l’ensemble du poids de la preuve.
Bearr et al. ((2010) ont examiné la bioaccumulation de TBB et de TBPH et de mélanges TBB/TBPH/organophosphate chez le méné à grosse tête par voie alimentaire. Après environ deux mois, les concentrations lipidiques de TBB et de TBPH chez les menés étaient significativement différentes de celles chez les témoins, mais il n’est pas clair que l’état d’équilibre ait été atteint. Les concentrations les plus élevées chez les poissons entiers ne représentent respectivement que 0,59 % et 0,19 % de l’exposition alimentaire quotidienne, ce qui indique que le potentiel de bioamplification de ces composés est faible. L’élimination directe est une possibilité, mais la détection des métabolites dans cette étude indique que ces composés présentent une certaine biodisponibilité et qu’ils ont été absorbés par les organismes (Bearr et al., 2010).
Il n’existe pas de données cinétiques sur la bioamplification (p. ex. efficacité de l’assimilation alimentaire ou vitesses d’élimination), bien qu’on puisse raisonnablement présumer que l’assimilation alimentaire est faible d’après Koe (Kelly et al. 2004). Bien qu’il n’y ait qu’une seule étude à ce sujet, les données disponibles sur la bioamplification suggèrent que les FBAm du TBB et du TBPH ne dépassent pas 1.
Le FAT est une mesure du potentiel de bioamplification d’une substance dans un réseau trophique dans des conditions de terrain. Il est estimé en mettant en corrélation les concentrations normalisées dans le biote à différents niveaux trophiques. Aucune valeur de FAT n’était disponible pour le TBB ni pour le TBPH au moment de la présente analyse. Toutefois, la surveillance de l’environnement effectuée par Sagerup et al. (2010) dans le Svalbard, en Norvège, ne tend pas à confirmer le potentiel de bioamplification entre les niveaux trophiques dans les réseaux alimentaires arctiques. De fait, la concentration normalisée moyenne de TBB dans les lipides de l’ours blanc (Ursus maritimus) était d’un ordre de grandeur plus élevée que chez sa proie la plus pertinente, le phoque annelé (Phoca hispida). Toutefois, la comparaison entre les concentrations plasmatiques chez l’ours blanc et celles dans les œufs, le foie et le corps entier des proies soulève des incertitudes. Cette augmentation de la concentration de TBB n’a pas été observée dans le cas d’autres relations prédateurs-proies parmi les organismes visés par l’étude. Par exemple, il n’y a pas eu d’augmentation entre le capelan (Mallotus villosus) et trois de ses prédateurs, le guillemot de Brünnich (Uria lomvia), la mouette tridactyle (Rissa tridactyla) et le phoque annelé. Les concentrations n’étaient pas non plus élevées chez le renard arctique (Vulpes lagopus), dont le réseau trophique est terrestre et marin, et qui consomme à l’occasion des restes de phoque annelé laissés par des ours blancs. Les concentrations normalisées moyennes de TBPH dans les lipides étaient toutes plus faibles chez les guillemots, les mouettes et les phoques par comparaison avec les capelans. Les concentrations dans le biote sont résumées au Tableau 72.
8.3.3 Autres études ayant trait à la bioaccumulation
L’accumulation et la transformation du TBB et du TBPH chez le méné à grosse tête ont récemment été examinées par de Jourdan et al. (2012, 2014) dans le cadre d’une étude sur un mésocosme amendé de sédiments. Les sédiments des mésocosmes ont reçu une concentration nominale de 500 ng/g de mélange de TBB et de TBPH, et les concentrations de TBB et de TBPH ajustées en fonction de la croissance ont été mesurées aux jours 7, 14, 28 et 42. Plusieurs produits de transformation bromés ont été identifiés (bien que les données n’aient pas été indiquées ou qu’une réponse limitée ait été rapportée). Les auteurs ont conclu que l’accumulation globale de TBB et de TBPH était irrégulière et limitée (de Jourdan et al. 2012; de Jourdan et al. 2014).
Bearr et al. (2012) ont étudié le métabolisme in vitro du TBB et du TBPH en utilisant des fractions sous-cellulaires d’hépatocytes de ménés à grosse tête, de carpes, de souris et de chélydres serpentines. Des données étaient disponibles pour la fraction S9, le cytosol et le microsome chez les poissons et les souris, mais seulement pour la fraction S9 chez les chélydres serpentines. Une incubation des fractions contenant 1 mg de protéines et 300 ng du mélange TBB/TBPH a été réalisée pendant deux heures. À l’exception du TBB chez les chélydres serpentines, une perte métabolique a été observée pour les deux composés chez toutes les espèces étudiées. Les taux métaboliques pour le TBB se situaient environ entre 1,5 et 3 pmol/mg/min chez les poissons et les souris. Le TBPH a été métabolisé par les chélydres serpentines, les souris et les poissons à des taux approximatifs de 0,2, 0,2 à 0,3, et 0,3 à 0,6 pmol/mg/min, respectivement. Dans l’hypothèse où la concentration dans le substrat était suffisamment importante pour approcher la vélocité maximale (Vmax), en supposant une cinétique d’ordre zéro pendant la durée de l’incubation, ces résultats semblent indiquer une demi-vie métabolique in vitro d’environ 1 à 2 heures pour le TBB (à l’exception des chélydres serpentines), et d’environ 1,5 à 4 heures pour le TBPH.
Une autre étude in vitro chez des mammifères a révélé que le TBB, mais pas le TBPH, était rapidement métabolisé par les microcosmes de foie de rat (Roberts et al. 2012). Dans la même étude, les métabolites du TBB étaient formés plus rapidement que ceux du TBPH par la carboxyl-estérase porcine. En général, la littérature indique que le TBPH est plus résistant au métabolisme que le TBB, ce qui est attribuable à l’encombrement stérique accru autour des groupes fonctionnels esters. Les métabolites spécifiques identifiés pour le TBB comprennent l’acide 2,3,4,5-tétrabromobenzoïque (ATBB), qui peut à son tour être métabolisé en 2,3,4,5-tétrabromobenzoate de méthyle (M-TBB), et le 3,4-dibromobenzoate de 2-éthylhexyle (EH-DBB) (Bearr et al. 2012; Roberts et al. 2012). Le 3,4,5,6-tétrabromophtalate de mono(2-éthylhexyle) (TBMEHP) a été identifié comme métabolite du TBPH (Roberts et al. 2012).
8.3.4 Bioaccumulation modélisée
Étant donné qu’aucun FBA empirique n’a été relevé pour le TBB, une valeur a été estimée au moyen de modèles basés sur la structure et d’un modèle cinétique du bilan massique à trois niveaux trophiques. La constante de vitesse métabolique médiane (kM) pour le TBB a d’abord été estimée à 0,195 7 jour-1 pour un poisson de 10 g à 15 °C à l’aide de la kM calculée à partir des RQSA dans le modèle BCFBAF (BCFBAF, 2010) et en supposant un log Koe de 7,71. Cette constante est du même ordre de grandeur que celles des phtalates non bromés similaires trouvés dans la base de données des kM du CEMC (BCFBAF 2010; Arnot et al. 2008). À l’aide de cette kM, un FBA pour le niveau trophique intermédiaire de 8 446 L/kg (IC de 95 % : 1 982 à 35 987 L/kg) a été obtenu (Arnot et Gobas 2003a; BCFBAF 2010). Des caractéristiques environnementales par défaut (p. ex. 0,5 mg/L pour le carbone organique total et le carbone organique dissous) ont été utilisées dans le modèle. En tenant compte de l’étude sur le « FBA alimentaire » décrite à la section 8.3.2, le FBA prédit peut être considéré comme une estimation du pire scénario de bioaccumulation du TBB pour les besoins d’une caractérisation des risques assez prudente, plutôt qu’un élément de preuve majeur pour le potentiel de bioaccumulation.
8.4 Résumé du devenir dans l’environnement
Le TBB et le TBPH devraient être rejetés dans l’environnement à partir de sources industrielles et d’articles manufacturés, principalement dans des eaux usées. Compte tenu de leurs propriétés physicochimiques, ces composés devraient s’adsorber fortement aux phases solides des différents milieux (p. ex. biosolides, sédiments, aérosols, sol). Les résultats du modèle de fugacité de niveau III permettent de penser que ces composés se retrouveront en grande partie dans le sol et les sédiments, selon le milieu où ils sont rejetés. En cas de rejet dans l’eau, une faible fraction, bien que non négligeable, devrait y demeurer. Le TBB et le TBPH ont été détectés dans tous les milieux de l’environnement à l’exception des sols. Aucune étude visant à les mesurer dans le sol canadien n’a pu être trouvée. Le TBB et le TBPH devraient persister dans tous les milieux, sauf dans la phase gazeuse. La sorption aux particules fines, qui se traduit par une plus longue persistance, et le transport atmosphérique qui en découle ont été observés pour d’autres produits ignifuges. Il s’agit d’une explication potentielle de la présence de ces composés dans le Nord canadien malgré les courtes demi-vies prévues dans la phase gazeuse (Breivik et al. 2006; Gouin et al. 2006; Xiao et al. 2012a; Xiao et al. 2012 b). Les métabolites du TBB et du TBPH présenteront sans doute une persistance similaire.
En ce qui concerne le poids général de la preuve sur la bioaccumulation, des études portant explicitement sur le métabolisme semblent indiquer que le potentiel de bioaccumulation du TBB et du TBPH est faible (Bearr et al. 2012; Roberts et al. 2012), et d’autres font état d’un métabolisme (Bearr et al. 2010; de Jourdan et al. 2012; Great Lakes Chemical Corporation 2003b; de Jourdan et al. 2014). Les résultats modélisés pour le FBA du TBB suggèrent un certain potentiel de bioaccumulation. Toutefois, si l’on tient compte d’un potentiel de bioaccumulation plus faible suggéré par les propriétés physicochimiques (p. ex. log Koe élevé dans le cas du TBPH et diamètres maximums modérément importants pour les deux composés), le poids de la preuve suggère que le potentiel de ces substances à être fortement bioaccumulables est faible.
9. Potentiel de causer des effets nocifs pour l’environnement
9.1 Effets sur l’environnement
Les données empiriques sur le TBB et le TBPH ont été prises en compte dans le poids de la preuve pour l’évaluation des effets sur l’environnement. Les données modélisées sur le TBB ont également été prises en compte afin d’étayer le poids de la preuve. Par contre, le TBPH n’est pas couvert par les modèles disponibles (log Koe supérieur à 9,0). Bien que le TBB et le TBPH rejetés devraient principalement se retrouver dans le sol et les sédiments, aucune donnée de toxicité adéquate ni analogue appuyée de données toxiques empiriques pertinentes n’a pu être identifiée pour ces milieux. Cependant, une fraction modeste de ces composés devrait demeurer dans le milieu aquatique, où le TBB et le TBPH devraient être rejetés. Des renseignements sont donc présentés pour ce milieu d’exposition. Une approche de partage à l’équilibre est utilisée pour estimer l’exposition dans le sol et les sédiments. Les effets sublétaux du TBB et du TBPH sur les organismes aquatiques et les oiseaux publiés dans la littérature accessible à tous ont également été examinés.
9.1.1 Données empiriques et modélisées sur la toxicité pour les organismes aquatiques
Des études empiriques sur la toxicité pour les organismes aquatiques étaient disponibles pour les mélanges TBB/TBPH, ainsi que pour le TBPH seul. Plusieurs niveaux trophiques pélagiques (c.-à-d. algues, invertébrés et poissons) sont représentés dans les ensembles de données disponibles. Toutefois, dans toutes les études, les organismes ont été exposés à des concentrations supérieures aux limites de solubilité prédites pour ces composés (2,82 x 10-3 mg/L pour le TBB et 3,07 x 10‑5 mg/L pour le TBPH). Des cosolvants organiques ont été utilisés pour chacune de ces études pour augmenter la solubilité du TBB et du TBPH, conduisant ainsi à des scénarios de pire exposition. Les résultats de ces études sont résumés dans le tableau 91.
Une étude d’immobilisation chez Daphnia magna (OCDE 202) a été menée sur le TBPH (Pennwalt Corporation 1989b). Des concentrations nominales allant jusqu’à 1 mg/L ont été utilisées, avec de l’acétone à titre de cosolvant. Les concentrations mesurées ont été présentées dans l’étude, mais avaient sans doute peu à voir avec les concentrations réelles dans l’eau (extraction avec de l’hexane et analyse dans de l’acétonitrile). Les valeurs nominales et mesurées de CE50 sur 48 h chez les daphnies immobiles et flottantes étaient respectivement de 0,34 mg/L et de 0,27 mg/L. La toxicité aiguë du TBPH pour la truite arc-en-ciel (OCDE 203) a également été étudiée (Pennwalt Corporation 1989c). Les poissons ont été exposés, en présence d’éthanol comme cosolvant, à des concentrations nominales qui dépassaient l’hydrosolubilité du TBPH de neuf ordres de grandeur dans certains cas. De la matière testée non dissoute a été observée à toutes les concentrations. Aucune mortalité n’ayant été observée, l’étude conclut qu’il n’y a aucun effet à saturation.
Une série d’études sur la toxicité pour les organismes aquatiques a également été présentée pour un mélange commercial TBB/TBPH (NICNAS 2004, Great Lakes Chemical Corporation 1998b, 1998c, 1998d). Parmi ces études, mentionnons une étude d’immobilisation de Daphnia magna (OCDE 202), un test de toxicité aiguë sur la truite arc-en-ciel (OCDE 203) et un test d’inhibition de la croissance d’algues (OCDE 201). Chacune d’elles comprenait du diméthylformamide comme cosolvant ainsi que des concentrations nominales de plusieurs ordres de grandeur supérieures à l’hydrosolubilité des deux composés. Les daphnies ont été exposées à des concentrations nominales allant de 0,10 à 10 mg/L, tandis que les truites et les algues ont été exposées à une seule concentration nominale de 10 mg/L. Les concentrations ont été mesurées en utilisant une méthode d’une extraction liquide-liquide dans du dichlorométhane, suivie d’une analyse par CHLP-PI avec une phase mobile isocratique contenant de l’acétonitrile à 98 %. Comme précédemment, les résultats ne représentent sans doute pas des concentrations réalistes dans l’eau. De plus, il n’est pas clair à quels composés correspondent les concentrations mesurées dans le mélange TBB-TBPH. Dans le « chromatogramme typique » de la solution mère et de la solution fortifiée, la matière testée est associée au deuxième des deux pics clairement résolus, ce qui semble indiquer qu’il s’agit du TBPH. Toutefois, dans le chromatogramme d’étalonnage, le premier pic d’élution n’est pas présent, ce qui pourrait indiquer qu’il s’agit du TBB, tandis que le TBPH est éludé hors de l’échelle de temps. L’étude ne fournit aucune explication quant à la différence entre la solution mère et la solution d’étalonnage. Les résultats des études sur la toxicité pour les organismes aquatiques sont présentés dans le tableau 91 sur la base des concentrations individuelles mesurées rapportées lors de ces études.
Enfin, un test de toxicité chronique a été présenté pour le cladocère, Daphnia carinata, exposé à un mélange TBB/TBPH (Lim 2003). L’acétone a été utilisée comme cosolvant à une concentration de 0,02 %, ce qui est plus élevé que la valeur de 0,01 % recommandée dans le Document d’orientation sur les méthodes statistiques applicables aux essais d’écotoxicité d’Environnement Canada (Environnement Canada 2007). Cette façon de procéder a peut-être favorisé l’absorption de la matière testée par comparaison avec les études susmentionnées. Aucune mortalité n’a été observée dans les témoins de solvant. Une mortalité significative a été observée en comparaison des traitements témoins sur une période de 15 jours. La CSEO et la CMEO étaient respectivement de 0,062 5 et de 0,125 mg/L, basées sur la mortalité après 15 jours d’exposition. La CL50 après 15 jours était de 0,079 mg/L. L’étude portait également sur le nombre de petits par adulte, et les auteurs ont conclu que le mélange TBB/TBPH n’avait pas d’effet important sur l’efficacité de la reproduction. À une concentration de 0,125 mg/L, qui causait une mortalité de 80 %, les survivants produisaient une quantité normale de petits par rapport aux témoins. Toutes les concentrations de cette étude ont été présentées sur une base nominale.
| Matière testée | Organisme testé | Paramètre | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Mélange TBB/ TBPH | Cladocère (Daphnia carinata) | CL50 après 15 jours | 0,079 (nominal) | Lim 2003 |
| Mélange TBB/ TBPH | Cladocère (Daphnia magna) | CE50 après 48 h (immobilisation) | 0,42 (mesurée) | Great Lakes Chemical Corporation 1998b |
| Mélange TBB/ TBPH | Cladocère (Daphnia magna) | CSEO après 48 h | 0,12 (mesurée) | Great Lakes Chemical Corporation 1998b |
| Mélange TBB/ TBPH | Truite arc-en-ciel (Oncorhynchus mykiss) | CSEO après 96 h | > 12 (mesurée) | Great Lakes Chemical Corporation 1998c |
| Mélange TBB/ TBPH | Algues (Selenastrum capricornutum) | CSEO après 96 h | > 5,1 (mesurée) | Great Lakes Chemical Corporation 1998d |
| TBPH | Cladocère (Daphnia magna) | CE50 après 48 h (immobilisation et daphnies flottantes) | 0,27 (mesurée) | Pennwalt Corporation 1989b |
| TBPH | Truite arc-en-ciel (Oncorhynchus mykiss) | CSEO après 96 h | > 31 (mesurée) | Pennwalt Corporation 1989c |
Abréviations : CL = concentration létale; CE = concentration entraînant un effet; CSEO = concentration sans effet observé.
Une concentration estimée sans effet (CESE) a été calculée à partir de la valeur critique de toxicité (VCT) de 0,079 mg/L (retenu comme paramètre le plus sensible et seule valeur chronique) pour Daphnia carinata, en divisant cette valeur par un facteur d’évaluation de 100. Comme le montre le tableau 91, Daphnia carinata semble être l’espèce la plus sensible parmi celles pour lesquelles on disposait de données de toxicité pour les organismes aquatiques. Toutefois, compte tenu de la grande incertitude concernant la validité des concentrations mesurées dans le cadre des études sur d’autres espèces, un facteur de 10 a été conservé afin de tenir compte de la variabilité intraspécifique et interspécifique en matière de sensibilité. Le facteur d’évaluation comprenait également un facteur de 10 permettant d’effectuer une extrapolation entre le paramètre de la mortalité et les effets sublétaux. La CESE obtenue pour l’eau est de 7,9 x 10-4 mg/L. On pense que cette CESE, qui s’approche de la limite de solubilité du TBB dans l’eau, pourrait s’appliquer au TBB, au TBPH ainsi qu’aux mélanges de ces deux composés.
La toxicité du TBB pour les organismes aquatiques a également été modélisée à l’aide du modèle ECOSAR. Par contre, le TBPH n’est pas couvert par le domaine du modèle. La toxicité aquatique des métabolites du TBB et du TBPH observés, proposés ou modélisés, qui est traitée à la section 8.3.3, a également été modélisée. En raison de l’encombrement stérique associé au groupe 2-éthylhexyle, le résultat de la relation structure-activité (RSA) organique neutre a été pris en compte plutôt que celui de la RSA du groupe ester, lorsqu’il était présent. Les valeurs prévues pour la toxicité chronique du TBB sont plus faibles que celles des métabolites. Si l’on prend pour hypothèse que le danger relatif peut être déduit à partir d’analogues, on peut penser que les métabolites ne soulèvent pas d’incertitudes autres que celles des composés d’origine. Cela concorde avec les arguments de Parkerton et Konkel (2000), selon lesquels les métabolites de phtalates contribuent également aux effets des résidus internes et aux effets narcotiques associés. Il est notoire que cela ne tient pas compte du potentiel d’autres effets sublétaux et que la modélisation initiale des RQSA des métabolites prévus comporte une grande incertitude en raison des études et des données limitées. Les résultats du modèle ECOSAR sont traités de façon plus approfondie et présentés à l’annexe C.
9.1.2 Effets chez les organismes aquatiques suite à une exposition alimentaire
Le potentiel théorique de toxicité par absorption alimentaire a été étudié en raison du partage important du TBB et du TBPH dans les sédiments et le sol et sur leur haute stabilité et leur présence probablement continue dans l’environnement (Mackay et al. 2014). L’exposition par voie alimentaire est pertinente tant pour le TBB que pour le TBPH, comme le suggèrent les concentrations mesurées dans l’environnement. Il n’existait aucun facteur de bioaccumulation empirique pour l’une ou l’autre de ces substances, et seul le TBB peut faire l’objet d’une modélisation de sa bioaccumulation (le log Koe élevé du TBPH, soit 10,10, exclu toute prévision fiable). Le concept de résidus corporels critiques (RCC) a donc été utilisé pour étudier le potentiel d’effets nocifs (c.-à-d. mortalité) chez les poissons dans le cas d’un apport alimentaire de TBB. Comme cette substance est la plus biodisponible des deux, l’analyse a en définitive été jugée prudente. Le concept de RCC porte sur la question de savoir si un produit chimique dans l’environnement peut être absorbé au point d’atteindre une charge corporelle critique causant la mortalité. McCarty (1986, 1987a, 1987 b, 1990), McCarty et Mackay (1993), McCarty et al. (1985, 1991), Van Hoogen et Opperhuizen (1988) et McCarty et al. (2013) ont montré que les concentrations internes des substances chimiques narcotiques neutres qui causent le décès des poissons sont relativement constantes : environ 2 à 8 mmol/kg pour les expositions aiguës et 0,2 à 0,8 mmol/kg pour les expositions chroniques. McCarty et Mackay (1993) et Escher et al. (2011) fournissent la formule mathématique suivante :
RCC = FBA (ou FBC, normalisé pour 5 % de lipides) x concentration du produit chimique dans l’eau/masse moléculaire du produit chimique
Les RCC sont calculés en utilisant le FBA modélisé pour le TBB. La concentration dans l’eau est la concentration environnementale estimée la plus élevée (calculée à la section 9.2.1 ci-après). Les résultats de l’analyse des RCC sont présentés et analysés dans la section sur la caractérisation des risques (section 9.3.1).
9.1.3 Autres études sur les effets sur l’environnement
D’autres études recensées dans la littérature accessible à tous fournissent des renseignements additionnels sur les effets potentiels du TBB et du TBPH sur l’environnement.
L’étude sur les sédiments amendés dans des mésocosmes, discutée à la section 8.3.3, comprend aussi l’état et les mesures biochimiques des ménés à grosse tête (Pimephales promelas) mis en cage au-dessus des sédiments (de Jourdan et al. 2012). Le coefficient de condition chez les poissons immatures, qui tient compte du poids total et de la longueur à la fourche, était de 0,88 +/- 0,1 dans le mésocosme témoin et de 1,00 +/- 0,1 dans le mésocosme exposé au mélange de TBB et de TBPH. Cette différence est statistiquement significative selon la comparaison par paire de Holm‑Sidak. Les seuls autres résultats statistiquement significatifs concernant le mélange de TBB et de TBPH dans cette étude provenaient de l’essai sur les substances réactives à l’acide thiobarbiturique (TBARS), une mesure du stress oxydatif. Ils étaient significativement plus faibles lors de la phase de dépuration que lors de la phase d’absorption pour les ménés immatures exposés au mélange de TBB et de TBPH, mais pas statistiquement significatifs par rapport au groupe témoin (de Jourdan et al. 2012).
L’étude menée par Bearr et al. (2010), discutée à la section 8.3.2, comportait également un examen du potentiel du TBB, du TBPH et de mélanges TBB/TBPH/organophosphate présents dans les aliments à induire des dommages à l’ADN dans les tissus hépatiques ou le sang des ménés à grosse tête, mesurés lors d’un essai de Comet. Le TBB, le TBPH et les mélanges TBB/TBPH/organophosphate ont induit une augmentation statistiquement significative du pourcentage d’ADN présent dans la queue de la comète par rapport aux échantillons témoins de foie, mais pas dans le cas du sang. Les ruptures des brins d’ADN mesurées dans le cadre de l’essai de Comet représentent des signes de la génotoxicité de ces formulations. Les concentrations tissulaires de TBB et de TBPH chez les poissons dont la teneur en lipides a été normalisée étaient de 0,02 mmol/kg à la fin de la période d’exposition. Le pourcentage d’ADN dans la queue représentait une augmentation non statistiquement significative lors de la phase de dépuration. Une seule concentration alimentaire a été évaluée au cours de cette étude, mais on ne peut pas déterminer clairement si des effets seraient associés à des concentrations tissulaires plus faibles.
McGee et al. (2013) ont étudié la toxicité des composants d’un mélange de TBB/TBPH/organophosphate pour la reproduction du poisson zèbre. Des expositions statiques jusqu’à 10 µM de TBB (5,5 mg/L) ou 10 µM de TBPH (7,1 mg/L) avec un vecteur de diméthylsulfoxide à 0,02 % dans un milieu contenant des embryons n’a pas engendré d’effets significatifs sur leur survie ou leur développement. D’autres composants du mélange de TBB/TBPH/organophosphate ont causé de graves troubles de croissance à ces concentrations. Même s’ils n’ont pas poussé leur étude plus loin, les auteurs pensent que l’absence de toxicité du TBB et du TBPH pour la reproduction pourrait être associée à une plus faible absorption par les embryons en comparaison d’autres composés, particulièrement due à l’adsorption sur les parois des enceintes d’essai.
9.1.4 Études empiriques chez des espèces fauniques
Egloff et al. (2011) ont réalisé une étude in vitro afin de déterminer les effets dépendant de la concentration sur les niveaux d’expression de l’ARN messager (ARNm) hépatique de 11 transcrits de gènes participant au métabolisme xénobiotique, au métabolisme lipidique et à l’homéostasie des hormones thyroïdiennes dans des cultures primaires d’hépatocytes embryonnaires de poulet. Du TBPH a été ajouté à des concentrations de 0,01, 0,1, 1, 3, 10 et 30 μM (n = 3 réplicats par groupe de traitement) et incubé pendant 36 h. La viabilité des hépatocytes n’a pas été affectée par le TBPH (ou tout autre composé ignifuge bromé). Le TBPH n’a induit aucun changement dans l’expression de l’ARNm pour aucun des gènes étudiés.
Les valeurs critiques de toxicité de 23 et 14 mg/kg pc/jour pour le TBB chez des piscivores sauvages ont été déterminées en suivant une approche de valeur de référence de toxicité pour la faune (Sample et al. 1996), dans laquelle les effets chez les rats ont été normalisés à un poids corporel typique du vison (Mustela vison) et de la loutre de rivière (Lontra canadensis) respectivement, qui représentent des espèces fauniques servant de substituts (voir ECCC, 2015, pour des détails sur les calculs et les intrants). La toxicité (réduction du poids de naissance des petits de la seconde génération, DSENO = 15 mg/kg p.c. par jour, DMENO = 50 mg/kg p.c. par jour, moyenne géométrique = 27 mg/kg p.c. par jour) a été déterminée à partir d’une étude sur la fertilité et la reproduction de deux générations de rats exposés par voie orale à un mélange de TBB et de TBPH (MPI Research Inc. 2008a; voir la section sur l’évaluation des risques pour l’analyse détaillée des études de toxicité chez les rongeurs). Bien que l’étude ait été réalisée avec un mélange TBB/TBPH, les résultats ont été jugés applicables au TBB aux fins de la caractérisation des risques. Un facteur d’évaluation de 10 a été appliqué pour représenter la variabilité au sein d’une espèce et entre les espèces. Étant donné qu’il s’agissait d’une étude réalisée sur deux générations et que le faible poids de naissance était lié à de nombreux problèmes en matière de développement et sur le plan neurologique, aucune contribution additionnelle au facteur d’évaluation n’est proposée pour effectuer une extrapolation aux effets chroniques ou sublétaux. La valeur toxicologique de référence était de 1,4 à 2,3 mg/kg p.c. par jour.
Pour l’exposition à partir du sol, les procédures utilisées dans le cas des visons et des loutres de rivière (c.-à-d. adaptation de la valeur de toxicité en fonction de la taille) ont été suivies pour extrapoler les données aux musaraignes. Si l’on prend une limite supérieure de 10 g pour le poids corporel des musaraignes, le résultat est une valeur de référence du seuil de toxicité normalisé en fonction du poids est de 7,3 mg/kg pc/jour.
9.2 Exposition dans l’environnement
Bien que des concentrations de TBB et de TBPH mesurées dans l’environnement aient été présentées, des données limitées sur les concentrations de TBB et de TBPH dans l’eau au Canada ont été recensées. Par conséquent, les concentrations dans l’environnement ont été évaluées sur la base des renseignements disponibles, y compris les quantités de la substance, les vitesses des rejets et les caractéristiques du milieu récepteur. Des concentrations environnementales estimées ont été calculées pour des scénarios de rejets industriels et de produits, comme indiqué dans les sections suivantes.
9.2.1 Scénarios d’exposition industrielle et concentrations environnementales estimées
Une exposition aquatique au TBPH ou à des mélanges TBB/TBPH devrait avoir lieu si les substances sont rejetées par l’industrie (p. ex., fabrication, formulation) soit directement dans des eaux de surface réceptrices soit dans un système de traitement des eaux usées qui rejette ses effluents dans un plan d’eau de surface récepteur. La concentration de la substance dans les eaux réceptrices près du point de rejet du système de traitement des eaux usées est utilisée comme concentration environnementale estimée (CEE) pour l’évaluation du risque que pose la substance en milieu aquatique. On peut la calculer à l’aide de l’équation suivante :
CEE = [1000 x Q x P x (1-T)] / (N x F x D)
Où :
CEE : concentration en milieu aquatique due aux rejets industriels, en mg/L
Q : quantité totale de substance utilisée chaque année sur un site industriel, en kg/an
P : pertes dans les eaux usées, fraction
T : taux d’élimination par le système de traitement des eaux usées, fraction
N : nombre de jours de rejets par an, en jour/an
F : flux de l’effluent du système de traitement des eaux usées, en m3 par jour
D : facteur de dilution dans les eaux réceptrices, sans dimension
Étant donné que le TBPH et les mélanges TBB/TBPH sont utilisés par des installations industrielles et que leur rejet dans l’eau est déclaré, plusieurs scénarios prudents de rejets industriels en milieu aquatique ont été élaborés pour couvrir une gamme d’activités industrielles diverses au Canada. Pour le TBPH, les scénarios incluent le mélange de matières plastiques, les revêtements de tissus industriels et la préparation de produits commerciaux. Pour le mélange de TBB/TBPH, les scénarios incluent la fabrication de mousse de polyuréthane, l’injection d’isolants en polyuréthane et l’utilisation d’adhésif de polyuréthane. Tous les scénarios intègrent un traitement primaire ou secondaire hors site des eaux usées avant le rejet dans les rivières ou les lacs. Une description plus détaillée de ces scénarios peut être consultée dans le rapport d’ECCC de 2018.
Dans le tableau 9-2, nous présentons la gamme des intrants utilisés pour estimer les concentrations de la substance dans le milieu aquatique près du point de rejet industriel. Ces scénarios conduisent à des concentrations environnementales estimées (CEE) dans l’eau allant de 1,7 x 10-6 à 3,8 x 10-4 mg/L pour le TBPH et de 5,1 x 10-10 à 3,3 x 10-6 mg/L pour le mélange TBB/TBPH. Ces valeurs sont les concentrations totales dans l’eau et elles ne tiennent pas compte du carbone organique dissous dans les eaux réceptrices. Lorsque les valeurs prédites de la CEE étaient supérieures à l’hydrosolubilité (3,1 x 10-5 mg/L pour le TBPH et 2,8 x 10‑3 mg/L pour le TBB), une valeur correspondant à dix fois l’hydrosolubilité a été utilisée pour la limite supérieure de la CEE. Dans le cas du mélange TBB/TBPH, une valeur correspondant à dix fois l’hydrosolubilité du TBB a été utilisée pour la limite supérieure. Par conséquent, pour les scénarios d’exposition industrielle, les CEE valides résultantes allaient de 1,7 x 10-6 à 3,1 x 10-4 mg/L pour le TBPH, alors que pour le TBB/TBPH elles étaient toutes inférieures à l’hydrosolubilité du TBB et donc considérées acceptables
| Intrant | Valeur | Justification et référence |
|---|---|---|
| Quantité utilisée par site (kg/an) | Moins de 20 000 | Enquête en vertu de l’article 71 ou déclaration de substances nouvelles |
| Pertes dans les eaux usées (%) | 0,001 1 à 1 | Tissu : OCDE (2004) Plastique : OCDE (2009 b) Mélange : hypothèse standard d’Environnement Canada |
| Efficacité d’élimination du système de traitement des eaux usées (%) | Primaire : 57 Secondaire : 81,6 | À titre d’hypothèse prudente, le taux d’élimination le plus bas pour l’un ou l’autre des composés, comme prédit par une série de modèles (ASTreat [2006], STP-EX [2008], SimpleTreat [2013] et modèle STP [2006]). Le modèle ASTreat a généré les taux les plus bas. |
| Nombre de jours de rejets annuels (jour) | Rejet industriel : 250 à 350 | Hypothèse standard de l’Inventaire national des rejets de polluants ou d’EC |
| Débit de l’effluent du système de traitement des eaux usées (m3 par jour) | 10 595 à 2 237 760 | Base de données interne du Système d’information pour les rapports réglementaires sur les effluents (2014) |
| Facteur de dilution (sans unité) | Lacs : 10 Rivières : 2,1 à 10 | Lacs : hypothèse standard d’Environnement Canada Rivières : débit de l’effluent du système de traitement des eaux usées propre au site/débit de l’environnement récepteur (HYDAT, 2013). Lorsque le facteur de dilution était supérieur à 10, une valeur maximale par défaut de 10 a été utilisée. |
Tel que discuté à la section 8.3, le modèle suggère un certain niveau de bioaccumulation du TBB. Le facteur de bioaccumulation probabiliste modélisé a été utilisé pour effectuer une analyse prudente des risques posés par le TBB à la faune piscivore (c.-à-d. 8446 L/kg). La concentration environnementale estimée chez des espèces sauvages a été calculée à partir de la dose journalière admissible (DJA) pour le vison d’Amérique (Mustela vison) et la loutre de rivière (Lontra canadensis) consommant du poisson, en suivant l’approche de l’Environmental Protection Agency des États-Unis (EPA 1993). Lors du calcul de la dose journalière admissible, une concentration dans l’eau (Ct) de 3,3 x 10-6 mg/L a été choisie comme la CEE dans l’eau la plus prudente de tous les scénarios pour le mélange TBB/TBPH. Ceci a donné une dose journalière admissible de 6,0 x 10-3 mg/kg pc/jour pour le vison et de 4,5 x 10‑3 mg/kg pc/jour pour la loutre de rivière.
La concentration dans le sol et le taux d’absorption potentiel par un petit mammifère (c.‑à-d. la musaraigne ou le campagnol) ont été estimés à l’aide d’un modèle de bilan massique qui comprend les principes de partage à l’équilibre afin d’estimer le devenir global de la substance dans le sol et l’exposition au biote du sol (BASL4 2011). Cette analyse a été effectuée pour le TBB en utilisant la concentration de biosolides la plus élevée calculée pour tous les scénarios du mélange TBB/TBPH à titre d’intrant. En supposant un taux d’application de biosolides de 8,3 tonnes/ha chaque année, pendant une période de 10 ans, on estime le taux d’absorption alimentaire par le petit mammifère terrestre au moyen du modèle BASL4 (2011). Une hypothèse implicite dans le modèle BASL4 est l’absence de métabolisme, ce qui a été conservé en tant qu’hypothèse extrêmement prudente, reconnaissant ainsi plusieurs éléments de preuve présentés dans la section 8.3.3 pour le métabolisme. La dose journalière admissible prévue pour le taux d’absorption de TBB par un petit mammifère est de 0,67 mg/kg pc/jour. Dans ce scénario, la concentration combinée modélisée dans la couche de sol 10 ans après l’application était de 0,02 mg/kg ps.
Une approche du partage eau-sédiment à l’équilibre a été suivie pour estimer la concentration de TBPH ou de mélange TBB/TBPH dans des sédiments benthiques. Cette approche est basée sur un principe de partage décrit par l’Agence européenne des produits chimiques (ECHA 2010) et intègre deux autres méthodes de calcul. La première méthode consiste à estimer la concentration de la substance dans la phase aqueuse (réellement dissoute) d’eau sus-jacente à partir de sa concentration totale, selon des études menées par Gobas (2007 et 2010). La deuxième méthode consiste à estimer la concentration de la substance dans les sédiments benthiques à partir de sa concentration dans la phase aqueuse d’eau sus-jacente et de l’hypothèse qu’il existe un partage à l’équilibre entre les sédiments benthiques et l’eau sus-jacente, comme décrit par le National Center for Environmental Assessment de l’Environmental Protection Agency des États-Unis (EPA 2003). À l’équilibre, la concentration environnementale estimée (CEE) dans les sédiments benthiques peut être corrélée, de façon linéaire, avec la concentration dans la phase aqueuse de l’eau sus-jacente. Des scénarios d’exposition des sédiments ont été élaborés dans le cadre d’une extension des scénarios de rejets industriels dans le milieu aquatique décrits ci-dessus pour déterminer les CEE à l’équilibre dans les sédiments, normalisées à une teneur en carbone organique de 4 % (une teneur en carbone organique typique dans les sédiments benthiques pour les rivières et les lacs). La CEE résultante dans les sédiments benthiques pour le TBPH allait de 8,0 x 10-3 à 1,4 mg/kg ps, alors que les valeurs résultantes de la CEE pour le mélange TBB/TBPH allaient de 2,5 x 10-6 à 1,6 x 10-2 mg/kg ps. Les valeurs de CEE les plus élevées sont proches des concentrations les plus élevées mesurées en Amérique du Nord de 3,9 mg/kg pour le TBB et de 19,2 mg/kg pour le TBPH (normalisées à ~1 % CO) au point de rejet d’une station de traitement des eaux usées d’une usine de textile (La Guardia et al. 2012).
9.2.2 Scénario d’exposition pour des produits disponibles aux consommateurs et concentrations environnementales estimées
Outre les sources industrielles, le TBB et le TBPH peuvent être rejetés dans l’environnement à partir d’articles manufacturés. La présence de TBB et de TBPH dans des échantillons de poussière appuie fortement les rejets de ces substances à partir de produits disponibles aux consommateurs (voir la section 10.1.1.3), et on a proposé divers mécanismes de transfert de tels produits à la poussière (Toms et al. 2011). Les vêtements, et la poussière qu’ils renferment, ont été proposés comme source importante d’additifs ignifuges, y compris de TBB et de TBPH transférés dans les systèmes de traitement des eaux usées et par des activités de nettoyage et de lavage (Schreder et La Guardia 2014; Melymuk et al. 2014).
Schreder et La Guardia (2014) ont mesuré les concentrations moyennes de TBB et de TBPH dans la poussière domestique et les eaux usées de lavage échantillonnées dans 20 résidences du nord-ouest des États-Unis entre 2011 et 2012. Des concentrations moyennes de 551 ng/L de TBB et de 711 ng/L de TBPH ont été mesurées dans les eaux usées de lavage. Il est indiqué que la concentration de TBPH dans les eaux usées de lavage est supérieure à l’hydrosolubilité modélisée, mais qu’elle peut refléter la concentration totale, ou simplement dépendre d’autres composants des eaux usées de lavage (p. ex., détergent). Les auteurs ont également mesuré les concentrations de TBB et de TBPH dans les influents et les effluents de deux stations de traitement des eaux usées locales desservant ces résidences. Ces stations reçoivent plus de 80 % de leurs intrants des ménages, avec des rejets de produits ignifuges inconnus provenant des sources industrielles restantes. À l’aide des proportions d’influents prévues à partir des eaux usées de lavage et des ménages, les auteurs ont déterminé que les eaux usées de lavage pourraient constituer la principale source de produits ignifuges organiques dans ces stations de traitement des eaux usées (Schreder et La Guardia 2014).
Des données sur les eaux usées de lavage du nord-est des États-Unis, tirées de l’étude de Schreder et La Guardia (2014), sont jugées suffisamment représentatives pour pouvoir établir un scénario d’exposition pertinent pour les eaux usées de lavage au Canada, notamment comme voie de rejet de TBB et de TBPH dans l’environnement provenant de produits disponibles aux consommateurs. Environnement Canada indique que l’utilisation moyenne d’eau domestique est de 343 L/jour par Canadien, dont 20 % sont utilisés pour le lavage (Environnement Canada, 2013). Ces valeurs, multipliées par 365 jours/an, 35 540 400 Canadiens et les concentrations moyennes de TBB et de TBPH dans les eaux usées de lavage déclarées précédemment, donnent des rejets annuels de 490 kg/an de TBB et de 633 kg/an de TBPH au niveau national (Schreder et La Guardia 2014; Statistique Canada 2014).
Les quantités annuelles de TBB et de TBPH rejetées par les ménages dans les eaux usées de lavage ont été utilisées pour estimer les concentrations dans l’environnement près de la source, en supposant 365 jours d’utilisation, 100 % de rejets, et les mêmes taux d’élimination de stations de traitement des eaux usées que ceux utilisés dans les scénarios d’utilisation industrielle. Les concentrations environnementales estimées près de la source variaient du 5e au 95e centile, de 1,4 x 10-9 à 3,8 x 10-6 mg/L pour le TBB et de 2,2 x 10-9 à 4,4 x 10-6 mg/L pour le TBPH.
En suivant l’approche décrite précédemment pour les scénarios d’exposition industrielle, les valeurs d’AQT des mammifères piscivores ont été calculées de manière probabiliste en utilisant la distribution des concentrations de TBB indiquée ci-dessus. Les valeurs d’AQT obtenues étaient de 1,3 x 10-4 mg/kg pc/jour et de 1,1 x 10-4 mg/kg pc/jour pour le vison et la loutre de rivière, respectivement.
Un faible taux d’absorption chez les mammifères a également été calculé pour ce scénario d’exposition. La concentration du TBB dans les biosolides a d’abord été estimée en multipliant le taux de rejet de TBB quotidien par personne par l’efficacité d’élimination du système de traitement des eaux usées la plus élevée et en divisant par le taux de production de biosolides quotidien par personne. En utilisant les mêmes paramètres que ceux décrits dans les scénarios industriels dans le modèle BASL4, le faible taux d’absorption chez les mammifères obtenu était de 0,24 mg/kg p.c. par jour. Lorsque les concentrations mesurées des biosolides de Shanmuganathan et al. (2016) ont été appliquées dans le modèle BASL4 avec les mêmes paramètres, le taux maximal d’absorption chez les petits mammifères, correspondant à la concentration maximale de TBB mesurée dans huit systèmes de traitement des eaux usées, était de 1,5 mg/kg/jour.
Dans l’ensemble, les rejets issus de produits disponibles aux consommateurs devraient être géographiquement dispersés et se propager pendant la durée de vie utile et la fin de vie utile de ces produits. Tandis que le scénario relatif au lavage présenté ci-dessus semble tenir compte d’une source majeure de rejet dans l’environnement au cours de la durée de vie utile de produits disponibles aux consommateurs, il y a une absence de données permettant de quantifier les rejets en fin de vie utile provenant d’articles manufacturés (y compris de sources non résidentielles) et l’élimination de la poussière. Kajiwara et al. (2014) ont déclaré des taux de lessivage pour un ensemble d’ignifugeants bromés dans les conditions de lieu d’enfouissement technique simulées variant de 0,001 à 0,58 % au cours d’une étude de 3,5 ans. Ceci appuie la pertinence du lixiviat des sites d’enfouissement en tant que source possible de TBB et de TBPH dans les eaux usées et/ou l’environnement. Toutefois, aucune donnée canadienne sur le lixiviat des sites d’enfouissement pour le TBB ou le TBPH n’a été déclarée à ce jour, mais ces données pourraient aider à interpréter les rejets provenant de l’élimination de déchets solides de poussière et les rejets en fin de vie utile.
9.3 Caractérisation des risques pour l’environnement
L’approche suivie pour l’évaluation du potentiel actuel de risques pour l’environnement consistait à examiner les divers renseignements pertinents afin d’en tirer des conclusions fondées sur une approche du poids de la preuve et le principe de prudence, tel que requis par la LCPE. Les éléments de preuve pris en compte comprennent les résultats d’un calcul prudent du quotient de risque ainsi que des données sur la persistance, la bioaccumulation, la toxicité intrinsèque ou pour l’environnement, les sources, le devenir de la substance, de même que sa présence et sa distribution dans l’environnement.
9.3.1 Analyse du quotient de risque
Une analyse du quotient de risque, intégrant des estimations prudentes de l’exposition et des renseignements sur la toxicité, a été effectuée pour le milieu aquatique, les résidus corporels critiques chez les poissons, l’absorption par les mammifères sauvages piscivores et l’absorption par les petits mammifères après l’épandage de biosolides à des fins agricoles afin de déterminer si ces substances pourraient avoir des effets nocifs sur l’environnement au Canada.
Bien qu’il soit prédit que le TBB et le TBPH finissent par se retrouver dans le sol ou les sédiments, de modestes fractions peuvent rester dans l’eau. Les scénarios industriels présentés à la section 9.2.1 ont conduit à des concentrations environnementales estimées (CEE) dans l’eau qui allaient de 1,7 x 10-6 à 3,1 x 10-4 mg/L pour le TBPH et de 5,1 x 10-10 à 3,3 x 10-6 mg/L pour le mélange TBB/TBPH (voir ECCC 2018). Une concentration estimée sans effet (CESE) de 7,9 x 10-4 mg/L a été calculée à partir d’une valeur de toxicité chronique qui pourrait s’appliquer à chacun des composés et au mélange de ces composés (voir la section 9.1). Les quotients de risque résultants (CEE/CESE) pour les scénarios industriels sont inférieurs à 1, allant de 2,1 x 10-3 à 0,39 pour le TBPH et de 6,5 x 10-7 à 4,2 x 10-3 pour le mélange TBB/TBPH. Le scénario pour les produits disponibles aux consommateurs présenté à la section 9.2.2 a donné des valeurs de CEE allant, pour le 5e au 95e centile, de 1,4 x 10-9 à 3,8 x 10-6 mg/L pour le TBB et de 2,2 x 10-9 à 4,4 x 10-6 mg/L pour le TBPH. Les quotients de risque sont semblables et inférieurs à 1, allant de 2,8 x 10-6 à 5,6 x 10-3 pour le TBPH et de 1,8 x 10-6 à 4,8 x 10-3 pour le TBB.
Des expositions au TBB ont été estimées pour les poissons à l’aide du facteur de bioaccumulation modélisé (8 446 L/kg), de la concentration environnementale estimée la plus élevée dans l’eau parmi les scénarios d’exposition industrielle (3,3 x 10-6 mg/L) et de la répartition des concentrations de TBB dans le scénario d’exposition pour les produits disponibles aux consommateurs. On considère que les incertitudes liées au facteur de bioaccumulation (FBA), ainsi que la variation des paramètres d’exposition pour le scénario pour les produits disponibles aux consommateurs, fournissent une répartition des niveaux d’exposition possibles pour un poisson de niveau trophique intermédiaire. Les niveaux de charge corporelle critique associés à des effets, comme la mortalité par narcose de référence (mode d’action), de 2 à 8 mmol/kg pour les expositions aiguës et de 0,2 à 0,8 mmol/kg pour les expositions chroniques (voir la section 9.1.2), sont présentés par rapport aux résidus corporels de poissons de taille moyenne présentés dans la figure 9‑1 pour le scénario industriel, et dans la figure 9-2 pour le scénario pour les produits disponibles aux consommateurs. En se basant sur cette comparaison, le TBB ne devrait pas conduire à des niveaux d’exposition pour les poissons pouvant causer une mortalité aiguë ou chronique par narcose de référence pour l’un ou l’autre des scénarios. Bien que les seuils pour la narcose de référence soient bien établis dans la littérature, la mortalité liée aux narcotiques n’est pas un paramètre particulièrement protecteur pour ces substances étant donné les preuves présentées pour les effets sublétaux. Bien qu’elle soit rudimentaire, une comparaison peut être effectuée entre les résidus corporels prédits chez les poissons présentés dans la figure 9-1 et dans la figure 9-2, et les concentrations tissulaires dont la teneur en lipides a été normalisée qui sont associées aux dommages à l’ADN dans les ménés têtes-de-boule (~ 0,02 mmol/kg) (Bearr et al. 2010; voir la section 9.1.3). Cette comparaison montre que les concentrations associées à la génotoxicité potentielle sont au moins de deux ordres de grandeur supérieurs et au 95e centile des estimations du pire des scénarios d’exposition.
En poursuivant avec le potentiel de bioaccumulation modélisé pour le pire des scénarios, les mammifères piscivores peuvent également être exposés au TBB en consommant des poissons contaminés. Par conséquent, une analyse de risques prudente a également été effectuée pour la faune piscivore, le vison d’Amérique et la loutre de rivière, pour le TBB. Les taux d’absorption sans effet prédits (valeur de référence du seuil, section 9.1.4) ont été comparés graphiquement aux valeurs de dose journalière admissible probabiliste (DJA, sections 9.2.1 et 9.2.2), dans la figure 9-1 et la figure 9-2 pour le scénario industriel ou celui pour les produits disponibles aux consommateurs, respectivement. Les figures montrent que les distributions des valeurs de la dose journalière admissible sont bien inférieures aux valeurs de référence du seuil calculées, ce qui suggère un risque faible. Numériquement, les valeurs de la dose journalière admissible au 95e centile pour le vison et la loutre de rivière sont approximativement de 0,032 mg/kg pc/jour et de 0,024 mg/kg pc/jour pour le scénario industriel et de 0,011 mg/kg pc/jour et de 0,009 mg/kg pc/jour pour le scénario pour les produits disponibles aux consommateurs, des valeurs qui sont bien inférieures aux valeurs de référence du seuil ajustées en fonction du poids de l’espèce de 2,3 mg/kg pc/jour et de 1,4 mg/kg pc/jour, respectivement.
Finalement, un taux d’absorption prudent de TBB présent dans le sol par de petits mammifères terrestres (p. ex., la musaraigne) a été calculé à l’aide du modèle BASL4 et les valeurs obtenues sont de 0,67 mg/kg pc/jour et de 0,24 mg/kg pc/jour pour le scénario industriel et celui pour les produits disponibles aux consommateurs (voir les sections 9.2.1 et 9.2.2), respectivement. La comparaison de ces valeurs avec la valeur de référence du seuil de toxicité normalisée au poids de 7,3 mg/kg pc/jour pour la musaraigne indique un risque faible pour les petits mammifères terrestres posé par l’épandage de biosolides sur le sol (tableau 9-4).
| Milieu | Scénario | CESE | CEE | QR |
|---|---|---|---|---|
| Eau | Rejets industriels dans l’eau | 7,9 x 10-4 mg/L |
1,7 x 10-6 à 3,1 x 10-4 mg/L |
2,1 x 10-3 à 0,39 |
| Eau | Rejets de produits dans les eaux usées de lavage résidentiel | 7,9 x 10-4 mg/L |
2,2 x 10-9 à 4,4 x 10-6 mg/L (5e au 95e centile) |
2,8 x 10-6 à 5,6 x 10-3 |
| Milieu | Scénario | CESE ou VTR | CEE ou DJA | QR |
|---|---|---|---|---|
| Eau (mélange TBB/TBPH) | Rejets industriels dans l’eau | 7,9 x 10-4 mg/L |
5,1 x 10-10 à 3,3 x 10-6 mg/L |
6,5 x 10-7 à 4,2 x 10-3 |
| Eau (TBB) | Rejets de produits dans les eaux usées de lavage résidentiel | 7,9 x 10-4 mg/L |
1,4 x 10-9 à 3,8 x 10-6 mg/L (5e au 95e centile) |
1,8 x 10-6 à 4,8 x 10-3 |
| Espèces sauvages (TBB) | Piscivore (vison/poissons), industriel | 2,3 mg/kg pc/jour | 0,032 mg/kg pc/jour (95e centile) | 1,4 x 10-2 |
| Espèces sauvages (TBB) | Piscivore (loutre/poissons), industriel | 1,4 mg/kg pc/jour | 0,024 mg/kg pc/jour (95e centile) | 1,7 x 10-2 |
| Espèces sauvages (TBB) | Piscivore (vison/poissons), produits disponibles aux consommateurs | 2,3 mg/kg pc/jour | 0,011 mg/kg pc/jour (95e centile) | 4,8 x 10-3 |
| Espèces sauvages (TBB) | Piscivore (loutre/poissons), produits disponibles aux consommateurs | 1,4 mg/kg pc/jour | 0,009 mg/kg pc/jour (95e centile) | 6,4 x 10-3 |
| Espèces sauvages (TBB) | Épandage de biosolides à des fins agricoles (petits mammifères), industriel | 7,3 mg/kg pc/jour | 0,67 mg/kg pc/jour | 9,2 x 10-2 |
| Espèces sauvages (TBB) | Épandage de biosolides à des fins agricoles (petits mammifères), produits disponibles aux consommateurs | 7,3 mg/kg pc/jour | 0,24 mg/kg pc/jour | 3,3 x 10-2 |
| Espèces sauvages (TBB) | Épandage de biosolides à des fins agricoles (petits mammifères), surveillance | 7,3 mg/kg pc/jour | 1,5 mg/kg pc/jour | 0,21 |

Figure 9-1. Description longue
Scénario d’exposition industrielle : Comparaison graphique des résidus corporels critiques (RCC) de TBB dans les poissons avec les seuils de toxicité aiguë et chronique pour les narcotiques; comparaison graphique de la dose journalière admissible (DJA) de TBB avec les valeurs toxicologiques de référence (VTR) pour les mammifères piscivores, le vison et la loutre de rivière; comparaison graphique de la DJA de TBB résultant de l’épandage de biosolides à des fins agricoles avec la valeur de référence du seuil pour la musaraigne.
Cette figure illustre la distribution estimée des taux de dose journalière admissible (DJA) pour le vison et la loutre de rivière (axe des abscisses) et de résidus corporels des poissons qu’ils consomment (axe des abscisses secondaire), où la valeur « Ce » (concentration prévue dans l’eau) est tirée du scénario d’exposition industrielle de la pire éventualité. Les centiles sont indiqués sur l’ordonnée. Les valeurs toxicologiques de référence (VTR) pour le vison et la loutre de rivière ainsi que les seuils de toxicité aiguë et chronique des résidus corporels des poissons sont indiqués par des lignes verticales. Les VTR sont d’environ deux ordres de grandeur au-dessus du 95e centile de la DJA pour le vison et la loutre de rivière. Le seuil de toxicité chronique des résidus corporels des poissons est d’environ trois ordres de grandeur au-dessus du 95e centile de la distribution estimée des résidus corporels des poissons.
La DJA pour la musaraigne après l’épandage de biosolides à des fins agricoles, modélisée d’après le scénario industriel associé à la concentration la plus élevée de biosolides, et la VTR pour la musaraigne sont également indiquées par des lignes verticales. La VTR pour la musaraigne est d’un ordre de grandeur au-dessus de la DJA.

Figure 9-2. Description longue
Scénario pour les produits disponibles aux consommateurs : comparaison graphique des résidus corporels critiques (RCC) de TBB dans les poissons avec les seuils de toxicité aiguë et chronique pour les narcotiques; comparaison graphique de la dose journalière admissible (DJA) de TBB avec les valeurs toxicologiques de référence (VTR) pour les mammifères piscivores, le vison et la loutre de rivière; comparaison graphique de la DJA de TBB résultant de l’épandage de biosolides à des fins agricoles avec la valeur de référence du seuil pour la musaraigne.
Cette figure illustre la distribution estimée des taux de dose journalière admissible (DJA) pour le vison et la loutre de rivière (axe des abscisses) et de résidus corporels des poissons qu’ils consomment (axe des abscisses secondaire), où la valeur « Ce » est la distribution des concentrations environnementales estimées correspondant au rejet de produits disponibles aux consommateurs par les eaux usées de lavage. La nature probabiliste de « Ce » augmente la variabilité des résultats de la DJA et de la répartition des résidus corporels de poissons par rapport aux résultats du scénario industriel calculés à partir d’une estimation déterministe de la valeur « Ce ». Les centiles sont indiqués sur l’ordonnée. Les valeurs toxicologiques de référence (VTR) pour le vison et la loutre de rivière ainsi que les seuils de toxicité aiguë et chronique des résidus corporels des poissons sont indiqués par des lignes verticales. Les VTR sont d’environ deux ordres de grandeur au-dessus du 95e centile de la DJA pour le vison et la loutre de rivière. Le seuil de toxicité chronique des résidus corporels des poissons est d’environ trois ordres de grandeur au-dessus du 95e centile de la distribution estimée des résidus corporels des poissons.
La DJA pour la musaraigne après l’épandage de biosolides à des fins agricoles, modélisée en utilisant la contribution des rejets de produits de consommation aux biosolides, et la VTR pour la musaraigne sont également indiquées par des lignes verticales. La VTR pour la musaraigne est d’un ordre de grandeur au-dessus de la DJA.
9.3.2 Prise en compte des éléments de preuve
Le TBB et le TBPH devraient être persistants dans l’eau, le sol, les sédiments et adsorbés aux particules fines dans l’air, mais pas dans la phase gazeuse. Toutefois, ces composés ne sont pas très bioaccumulables, en partie en raison de leur faible biodisponibilité, mais également de leur biotransformation métabolique. Les volumes de TBB et de TBPH importés au Canada, de même que les renseignements sur leurs utilisations, indiquent qu’il existe un potentiel de rejet dans l’environnement au Canada. Le TBB et le TBPH sont des additifs ignifuges pour le polyuréthane, alors que le TBPH sert également de plastifiant. Les sources de ces produits dans les eaux usées et subséquemment dans l’environnement devraient être les circuits de déchets industriels et les rejets d’articles manufacturés. Une fois rejetées dans l’environnement, ces substances se retrouveront principalement dans l’eau, le sol et les sédiments, la plus grande partie se retrouvant dans les deux derniers milieux. Le TBB et le TBPH peuvent potentiellement être transportés à grande distance (TGD), probablement en raison de leur association avec des particules fines atmosphériques. Les expositions aquatiques sont probablement limitées au terrain à proximité, étant donné le partage attendu dans les sédiments. En l’absence de données sur les effets pour les organismes vivant dans le sol ou pour les organismes benthiques, nous avons mis l’accent sur le milieu aquatique qui est le milieu recevant les rejets. Il a également été montré qu’un mélange TBB/TBPH présentait un potentiel modéré de toxicité pour les organismes aquatiques. Toutefois, un potentiel de risque faible est calculé lorsqu’il est établi en fonction de scénarios prudents d’exposition aquatique pour le TBPH et le mélange TBB/TBPH. Les concentrations calculées chez les poissons pour une exposition alimentaire et à l’eau au TBB sont de quelques ordres de grandeur inférieurs aux seuils de résidus corporels critiques établis pour la létalité découlant d’un mode d’action narcotique, et également bien inférieures aux concentrations tissulaires associées aux dommages réversibles à l’ADN chez les menés tête-de-boule. Un risque minimal a également été observé lors de la comparaison des taux d’absorption de TBB calculés pour la faune terrestre (chez le vison et la loutre de rivière qui en absorbent en consommant des poissons, de même que chez la musaraigne qui en absorbe par contact avec un sol amendé avec des biosolides) aux valeurs de référence toxicologiques ajustées en fonction du poids corporel. Puisque les données de toxicité chez les mammifères correspondent à des paramètres sensibles liés à la reproduction, une importance plus grande est accordée aux scénarios touchant les mammifères lors de la caractérisation du risque global que celle accordée à la comparaison des concentrations modélisées chez les poissons aux seuils narcotiques. Tous les calculs de l’exposition industrielle ont fait appel aux données de la quantité utilisée dans l’industrie au Canada. Un tableau résumant les éléments de preuve importants pour la caractérisation des risques est présenté à l’annexe D.
Ces renseignements indiquent que le TBB et le TBPH ont un potentiel faible de causer des effets nocifs pour l’environnement au Canada à ces niveaux d’expositions. Le TBB et le TBPH pourraient entraîner des effets nocifs sur l’environnement si les quantités utilisées ou leur présence dans les articles manufacturés devaient augmenter.
9.3.3 Incertitudes sur l’évaluation des risques pour l’environnement
Une incertitude importante a été relevée dans les données empiriques des propriétés physiques et chimiques disponibles pour un mélange TBB/TBPH, et dans les données sommaires disponibles sur le TBPH (voir l’annexe B). Les propriétés physiques et chimiques ont donc été modélisées individuellement pour le TBB et le TBPH. Plusieurs modèles aussi adéquats les uns que les autres ont été utilisés pour une propriété physique ou chimique donnée lorsque cela était possible. Un risque d’erreur aléatoire plus élevé a été relevé parmi les résultats du modèle, notamment pour le Koe et l’hydrosolubilité. Par exemple, les prévisions de l’hydrosolubilité obtenues au moyen de différents modèles pour le TBB et le TBPH couvrent respectivement trois et cinq ordres de grandeur. Afin d’augmenter la confiance dans les propriétés physiques et chimiques, l’erreur aléatoire a été corrigée en calculant le résultat médian de plusieurs modèles, alors que la possibilité d’une erreur systématique a été corrigée en ajoutant un facteur de 10 à la valeur médiane de l’hydrosolubilité ajustée à l’aide de la méthode des moindres carrés lors du calcul des concentrations environnementales estimées.
Une étude empirique sur la bioconcentration portant sur le mélange TBB/TBPH a été effectuée à l’aide d’un cosolvant organique, à des concentrations nominales légèrement supérieures à l’hydrosolubilité attendue pour le TBB et deux ordres de grandeur supérieurs à l’hydrosolubilité attendue pour le TBPH. De plus, il est probable que seul le TBB ait été analysé lors de la détermination des concentrations mesurées dans les tissus. Ces facteurs augmentent l’incertitude et diminuent la confiance en ce qui concerne la sous-estimation possible du facteur de bioconcentration (FBC). Aucune donnée empirique du FBC pour le TBB/TBPH n’a été recensée. Les résultats de la modélisation du FBC pour le TBB ont donc été utilisés pour les calculs de l’exposition des poissons et de l’absorption par les mammifères piscivores. Les résultats générés par ce modèle étaient prudents dans le contexte du faible potentiel de bioaccumulation de TBB suggéré par plusieurs autres éléments de preuve (p. ex., la biotransformation métabolique), et par conséquent, l’impact de l’incertitude était probablement minime (Bearr et al. 2010; Bearr et al. 2012; de Jourdan et al. 2012).
La caractérisation de l’exposition est centrée sur les sources ponctuelles industrielles et les rejets provenant de produits disponibles aux consommateurs dans les eaux usées domestiques de lavage, comme étant les sources les plus pertinentes pour le TBB et le TBPH dans l’environnement. L’absence de données sur la lixiviation à partir de sites d’enfouissement présente une incertitude importante en termes d’évaluation de la validité de cette hypothèse. En particulier, en tant qu’additifs ignifuges ne possédant que des liaisons non covalentes avec la matrice polymère, le TBB et le TBPH devraient migrer depuis les produits de consommation en service et les produits manufacturés en fin de vie utile, comme le montrent les concentrations observées dans la poussière domestique (voir la section Santé) et des études sur des lieux d’enfouissement simulés avec d’autres composés ignifuges bromés (Kajiwara et al. 2014). D’autres scénarios d’exposition d’articles manufacturés (p. ex., lixiviat de site d’enfouissement pour étudier les articles manufacturés en fin de vie utile et la poussière, éliminés sous forme de déchets solides) n’ont pas pu être élaborés avec les renseignements actuellement disponibles, ce qui ajoute de l’incertitude à la caractérisation de l’exposition globale. De plus, les rejets résultant du nettoyage de conteneurs de transport industriel n’ont pas été pris en compte de manière quantitative en raison d’un fort degré d’incertitude. Des hypothèses prudentes ont été formulées (tel que détaillé dans ECCC 2018), mais, dans l’ensemble, le niveau de confiance dans les scénarios d’exposition utilisés pour produire des valeurs de CEE est faible à modéré.
Pour le présent rapport sur l’état des connaissances scientifiques, une analyse du quotient de risque a été effectuée pour le milieu aquatique pélagique, pour des expositions des mammifères sauvages piscivores consommant des poissons contaminés par du TBB et pour l’absorption de TBB par de petits mammifères suite à l’épandage de biosolides à des fins agricoles. Des lacunes dans les données disponibles sur la toxicité pour les organismes aquatiques (p. ex. concentrations testées des ordres de grandeur supérieurs à l’hydrosolubilité, chimie analytique manquante ou mauvaise) ont introduit une plus grande incertitude et un niveau de confiance plus faible dans l’analyse de risques pour le milieu aquatique relativement à l’analyse des RCC chez les poissons et les scénarios d’absorption par les mammifères. Les concentrations modélisées chez les poissons (95e centile) étaient environ deux ordres de grandeur inférieurs aux concentrations tissulaires associées à des effets sublétaux (dommages à l’ADN). Toutefois, puisqu’une seule concentration alimentaire modifiée n’a été étudiée, il y avait une certaine incertitude à savoir si les effets sublétaux pourraient être observés à des concentrations tissulaires plus faibles. L’étude de la sensibilité de la reproduction des mammifères sur deux générations a suscité une confiance plus grande dans l’analyse de risques pour les mammifères sauvages piscivores. Des données empiriques de haute qualité pour le facteur de bioaccumulation réduiraient davantage l’incertitude relative aux RCC chez les poissons et à l’analyse de risques chez les mammifères piscivores.
En se basant sur le comportement au partage prédit pour le TBB et le TBPH, l’importance du sol et des sédiments comme milieu d’exposition n’est pas convenablement évaluée puisqu’il n’y a pas de données disponibles sur les effets sur les organismes benthiques ou vivant dans le sol. En effet, les seules données qui ont été trouvées sur les effets portent principalement sur l’exposition des organismes pélagiques. Le manque de données sur les effets pour ces milieux constitue une lacune importante en matière de données dans le présent rapport, ce qui pourrait donner lieu à des négatifs faux pour le risque pour les organismes benthiques et terrestres.
10. Potentiel de causer des effets nocifs pour la santé humaine
La présente évaluation ayant trait à la santé humaine est basée sur l’exposition combinée au TBB et au TBPH (c.-à-d. TBB/TBPH). L’évaluation des expositions combinées au TBB et au TBPH est une approche jugée prudente puisque ces substances sont toutes deux présentes dans l’environnement et dans certains articles manufacturés avec lesquels la population générale devrait entrer en contact. Bien que limités, des renseignements sur les effets sur la santé étaient disponibles pour le TBPH et des mélanges commerciaux TBB/TBPH. Toutefois, il y avait peu de renseignements disponibles pour le TBB. Pour le présent rapport, les niveaux d’effet les plus critiques ont été déterminés à partir d’études sur des mélanges de TBB et de TBPH.
10.1 Exposition
10.1.1 Milieux environnementaux et aliments
Le TBB et le TBPH ont récemment fait l’objet d’un suivi dans des milieux de l’environnement au Canada, notamment dans la région des Grands Lacs, et ailleurs dans le monde (voir la section 7, Concentrations mesurées dans l’environnement). Étant donné leur très faible hydrosolubilité et leur très faible volatilité, le TBB et le TBPH devraient principalement se retrouver dans les particules, la poussière et les sédiments lorsqu’ils sont rejetés dans l’environnement.
La population canadienne peut être exposée au TBB et au TBPH présents dans l’air, la poussière, le sol, les sédiments, l’eau et les aliments, incluant le lait maternel. Des estimations prudentes des doses journalières de TBB et de TBPH sont présentées à l’annexe E. Pour tous les groupes d’âge, la principale contribution à la dose journalière estimée provient de l’ingestion de poussière, d’aliments (poisson et lait maternel) et de l’inhalation de particules dans l’air intérieur. L’exposition à l’air ambiant et à l’eau était très faible et jugée négligeable. Les enfants allaités (0 à 6 mois) appartiennent au groupe d’âge le plus exposé, avec une dose estimée de 160 ng/kg pc/jour provenant principalement du lait maternel et de la poussière.
10.1.1.1 Air ambiant
Tel que décrit à la section 7, le TBB et le TBPH ont fait l’objet d’un suivi dans l’air ambiant au Canada et ailleurs.
Une surveillance de la qualité de l’air effectuée récemment à Toronto (Ontario, Canada) a montré que le TBB et le TBPH ont été détectés dans la majorité des échantillons (> 85 %) prélevés en 2010 et 2011, à des concentrations mesurées jusqu’à 9 pg/m3 et 7 pg/m3, respectivement (Shoeib et al. 2014; Diamond et al. 2013). Le TBB et le TBPH ont également été fréquemment détectés dans les échantillons d’air ambiant prélevés sur des sites urbains le long des Grands Lacs (de janvier 2008 à décembre 2010) faisant partie du Réseau de mesure des dépôts atmosphériques (RMDA) (Ma et al. 2012). Pour cette étude, les sites de Chicago et de Cleveland étaient associés aux concentrations les plus élevées de TBB (0,5 à 55 pg/m3) et de TBPH (0,36 à 290 pg/m3). Sur un site rural au Canada (Point Petre, Ontario), le TBB et le TBPH ont été détectés à une fréquence moins élevée (16 % et 53 %, respectivement; n = 45) que sur des sites urbains, et les concentrations de TBB (de 0,074 à 0,82 pg/m3) et de TBPH (de 0,18 à 3,7 pg/m3) étaient également semblables à celles mesurées sur des sites éloignés aux États-Unis (Ma et al. 2012). Les auteurs soulignent que les concentrations atmosphériques de TBB et de TBPH ont augmenté rapidement et de façon importante pendant la période d’échantillonnage, ce qui pourrait indiquer que ces composés sont en train de remplacer les PBDE (Ma et al. 2012).
Les estimations de l’absorption quotidienne de TBB et de TBPH due à l’exposition à l’air ambiant ont été faites en utilisant la somme des concentrations maximales respectives de 9 et 7 pg/m3 mesurées à Toronto (Diamond et al. 2013). Ces concentrations sont jugées suffisamment prudentes pour pouvoir calculer la limite supérieure des doses chroniques d’absorption par exposition pour la population générale du Canada.
Le TBB et le TBPH ont également été détectés dans l’Arctique canadien à Alert, au Nunavut, ce qui laisse entendre qu’ils peuvent avoir été transportés à grande distance. Les concentrations médianes de TBB et de TBPH étaient de 0,46 pg/m3 (0,16 à 2,2 pg/m3) et de 0,69 pg/m3 (0,1 à 1,5 pg/m3), respectivement (Xiao et al. 2012). Alert, au Nunavut, est la région habitée la plus au nord au monde (Iqaluit 2010), et les valeurs choisies pour effectuer le suivi à Toronto sont jugées suffisantes pour tenir compte de la variabilité potentielle des concentrations atmosphériques pour des populations du Nord, basée sur des comparaisons avec les niveaux rapportés pour Alert par Xiao et al. (2012).
10.1.1.2 Air intérieur
Deux études ont présenté des valeurs de TBB et de TBPH dans l’air intérieur d’échantillons prélevés au Canada. En 2013, les concentrations de TBB et le TBPH mesurées dans l’air de résidences à Toronto avaient pour valeurs maximales 291 et 43 pg/m3 et pour valeurs médianes 12 et 3,1 pg/m3, respectivement. Le TBB a été décelé dans les 34 échantillons prélevés, tandis que le TBPH n’a été décelé que dans 22 échantillons (Venier et al. 2016). Le TBB et le TBPH ont également été mesurés dans l’air de résidences de la région du Grand Toronto (n=32) et à Ottawa (n=19) entre février et juillet 2015 (campagne de prélèvements de trois semaines). Les échantillons d’air ont été prélevés à l’aide d’échantillonneurs à mousse de polyuréthane dans les chambres à coucher de toutes les résidences (n=51) et, en plus, dans la pièce la « plus fréquentée » de 26 des résidences. Dans tous les échantillons prélevés (n=77), la concentration de TBB mesurée variait de 1,40 à 2 833 pg/m3, pour une concentration moyenne de 77,24 pg/m3 et une fréquence de détection de 56 %. La concentration de TBPH mesurée variait de 3,50 à 146,62 pg/m3, pour une concentration moyenne de 8,90 pg/m3 et une fréquence de détection de 7 % (Yang et al. 2017).
Le TBB et le TBPH ont également été mesurés dans l’air intérieur dans plusieurs autres environnements. Bradman et al. (2014) ont détecté du TBB et du TBPH dans une certaine mesure (15 et 17,5 %) dans des échantillons d’air prélevés dans 40 centres d’éducation de la petite enfance (p. ex. garderies) en Californie, où les niveaux médians de ces deux substances n’ont pas été détectés (limite de détection de la méthode [LDM] = 0,1 ng/m3 ou 100 pg/m3). Les concentrations de TBB et de TBPH mesurées au 95e centile sont 2 290 et 990 pg/m3, respectivement. Dans une étude préliminaire récente portant sur l’exposition de gymnastes, des échantillons d’air ont été prélevés dans deux gymnases à Boston, aux États-Unis. Les concentrations de TBB et de TBPH mesurées étaient respectivement de 26 100 pg/m3 (26,1 ng/m3) et de 16 900 pg/m3 (16,9 ng/m3) à proximité des cavités remplies de coussins en mousse, et de 5 010 pg/m3 (5,01 ng/m3) et de 2 660 pg/m3 (2,66 ng/m3) à une certaine distance de ces cavités (Carignan et al. 2013). Dans les deux études (c.‑à‑d. Bradman et al. 2014, Carignan et al., 2013), les auteurs ont déclaré la présence de mousse de polyuréthane flexible comme étant une source d’exposition potentielle. L’Agence norvégienne sur le climat et la pollution a mesuré du TBB et du TBPH dans un nombre très limité d’échantillons d’air intérieur (environnement intérieur spécifique non précisé) (n=3) prélevés en 2009, avec des concentrations respectives de TBB et de TBPH allant de non détectées (seuil de détection = 1,2 pg/m3) à 6,7 pg/m3 et de 6,7 à 7,4 pg/m3 (TemaNord 2011).
Les estimations de la dose journalière de TBB et de TBPH due à l’exposition à l’air intérieur ont été faites en utilisant la somme des concentrations maximales de TBB et de TBPH (2 833 et 146,62 pg/m3, respectivement), mesurées dans des résidences de la région du Grand Toronto et à Ottawa (Yang et al. 2017). Ces niveaux sont jugés appropriés pour calculer la limite supérieure d’absorption pour la population générale du Canada.
10.1.1.3 Poussière
Le TBB et le TBPH ont été largement détectés lors d’études sur la poussière dans les maisons, les établissements d’éducation et d’autres environnements intérieurs, au Canada, aux États-Unis et ailleurs (annexe F).
Le TBB (pas le TBPH) faisait partie de l’étude de référence canadienne des produits ignifuges halogénés dans des échantillons de poussière domestique archivés prélevés de 2007 à 2010 dans 13 villes canadiennes dans le cadre de l’Enquête sur la poussière domestique au Canada (EPDC), selon la méthode décrite par Fan et al. (2016). Le TBB a été détecté dans 96,8 % des échantillons (n = 631), et les concentrations variaient de non détecté (LDM = 1,5 ng/g) à 22 371 ng/g, dont la médiane était de 123 ng/g et la valeur au 95e centile de 1 831 ng/g (Kubwabo et al., manuscrits en cours de rédaction, Bureau de la science de la santé environnementale et de la recherche [BSSER], Santé Canada, non référencé, 5 juin 2017). Le TBB a été détecté dans 95 % des échantillons, à des concentrations allant de non détecté (limite de détection de la méthode = 1,5 ng/g) à 15 636 ng/g, avec une concentration médiane de 101 ng/g et une concentration au 95e centile de 1 630 ng/g. Le TBB et le TBPH ont tous deux été détectés dans la majorité des échantillons de poussière domestique prélevés à Vancouver, en Colombie‑Britannique, en 2007-2008 (n=116) (Shoeib et al. 2012), et à Toronto en 2012 (n=12) (Diamond et al. 2013). Dans l’étude réalisée à Vancouver, les concentrations médianes de TBB et de TBPH ont été déclarées respectivement comme étant de 510 ng/g (de non détecté [limite de détection = 0,30 ng/g] à 18 000 ng/g) et de 330 ng/g (10 à 6 400 ng/g), avec des concentrations respectives au 95e centile de 1408 et 1107 ng/g (Shoeib et al. 2012). Dans l’étude préliminaire réalisée à Toronto, les concentrations de TBB et de TBPH allaient respectivement de non détecté (< 15 ng/g) à 7 300 ng/g et de non détecté (< 19 ng/g) à 9 200 ng/g.
Dans d’autres études canadiennes, on a mesuré le TBB et le TBPH dans la poussière de 35 résidences et de 10 bureaux à Toronto en 2012 (Abbasi et al., 2016), de 23 résidences à Toronto en 2013 (Venier et al., 2016), et de 51 résidences dans la région du Grand Toronto (n=32) et à Ottawa (n=19) (Yang et al., 2017). Les concentrations de TBB et de TBPH dans la poussière allaient de non détecté à 15 300 ng/g et de non détecté à 500 ng/g, respectivement, les variations étant plus grandes dans les domiciles que dans les bureaux. L’équipe d’Abbasi (2016) a également analysé l’association de TBB et de TBPH dans la poussière dans l’étude de 2012 portant sur la poussière sur des produits (n=65) dans les mêmes lieux. Le TBB a été décelé dans tous les ordinateurs personnels (14,82 à 1 010,0 ng/frottis, n=10) et à 79 % des appareils audio-vidéo (non détecté à 514,92 ng/frottis, n=20). Le TBPH a été détecté dans tous les ordinateurs personnels (0,22 à 194,06 ng/frottis, n=10) et les petits appareils électroménagers (0,04 à 14,23 ng/frottis, n=11), ainsi que dans 86 % des téléviseurs à écran plat (non détecté à 74,73 ng/frottis, n=14). Les auteurs ont indiqué qu’il y avait une corrélation positive entre les moyennes géométriques des concentrations des ignifuges (y compris le TBB et le TBPH) dans la poussière des résidences et des bureaux avec celles dans la poussière à la surface des appareils électroniques.
Les résultats des études sur la poussière domestique réalisées aux États-Unis sont généralement conformes aux données canadiennes, où les valeurs de la tendance centrale pour le TBB et le TBPH varient de 48 ng/g (médiane) à 322 ng/g (moyenne géométrique) et de 66 à 923 ng/g (moyennes géométriques) (Stapleton et al. 2008, 2009; Dodson et al. 2012; Springer et al. 2012; Johnson et al. 2013; Hoffman et al. 2014). Les concentrations maximales les plus élevées de TBB et de TBPH déclarées aux États-Unis sont de 75 000 ng/g (détection de 44 %) et 47 110 ng/g (détection de 60 %), respectivement, pour des échantillons (n=50) prélevés de 2002 à 2007 (Stapleton et al. 2009).
Les enfants passent plusieurs heures par jour à l’intérieur dans des établissements d’éducation de la petite enfance (p. ex. écoles, garderies), et l’exposition à la poussière dans ces établissements, surtout pour les jeunes enfants, est très importante étant donné le comportement propre aux jeunes enfants, comme le fait de ramper (sur le sol) et de porter fréquemment les mains à la bouche, des activités qui augmentent grandement l’exposition à la poussière (EPA, 2011). Bradman et al. (2014) ont mesuré le TBB et le TBPH dans les échantillons de poussière (en plus de l’air) recueillis dans 39 établissements d’éducation de la petite enfance (p. ex., garderie) en Californie. Ces deux substances ont été détectées dans 100 % des échantillons. Les concentrations médianes de TBB et de TBPH dans ces établissements étaient de 362 (jusqu’à 14 812 ng/g) et 133 ng/g (jusqu’à 7490 ng/g), respectivement, alors que les concentrations au 95e centile étaient de 6558 et 1299 ng/g, respectivement (Bradman et al. 2014). Des échantillons de poussière ont également été prélevés dans des écoles de niveau préscolaire et des garderies (2007-2008; n=36) du Royaume-Uni, où la concentration de TBB variait de non détecté (limite de détection = 2 ng/g) à 289 ng/g (moyenne de 45 ng/g), alors que la concentration de TBPH variait de non détecté (limite de détection = 2 ng/g) à 6 175 ng/g (moyenne de 381 ng/g) (Ali et al. 2011a).
Les concentrations de TBB et de TBPH ont également été mesurées dans des échantillons de poussière (n=8) (en plus d’échantillons d’air) prélevés dans deux gymnases pour une étude portant sur l’exposition des gymnastes qui a été menée à Boston (Carignan et al. 2013). Les concentrations médianes de TBB et de TBPH (28 900 et 30 000 ng/g, respectivement) dans le premier gymnase étaient beaucoup plus élevées que dans le deuxième gymnase (10 et 60 ng/g, respectivement). Également, les auteurs ont observé des concentrations médianes considérablement plus élevées de TBB et de TBPH dans les essuie-mains recueillis auprès des gymnastes après les pratiques (222 et 96,4 ng/essuie-mains, respectivement) comparativement à ceux recueillis avant (60,8 et 27,9 ng/essuie-mains, respectivement) (Carignan et al. 2013).
Du TBB et du TBPH ont également été fréquemment détectés dans les bureaux, les voitures et les avions. Webster et al. (2011) et Springer et al. (2012) ont inclus le TBPH dans leurs analyses de la poussière de bureau et dans les voitures dans la région de Boston, aux États-Unis, en 2009, où les concentrations médianes étaient de 410 et de 400 ng/g, respectivement. Ces concentrations étaient considérablement plus élevées que celles mesurées dans les résidences (concentration médiane de 150 ng/g) dans le cadre de la même étude. Dans une étude réalisée en Belgique, les concentrations de TBB et de TBPH dans les échantillons de poussière (n=6) étaient inférieures à celles mesures dans les maisons belges (n=39) (Ali et al., 2011a). Ces substances ont également été mesurées dans la poussière des cabines d’avions, avec des concentrations médianes de TBB et de TBPH dans les tapis de 350 et 640 ng/g, respectivement, et de 740 ng/g et 1 200 ng/g, respectivement, dans les prises d’air (Allen et al., 2013).
Étant donné qu’aucune donnée sur la poussière au Canada pour les établissements d’éducation de la petite enfance n’a été obtenue, et que les concentrations maximales de TBB et de TBPH dans les résidences canadiennes sont supérieures aux valeurs déclarées pour les établissements d’éducation de la petite enfance en Californie (Abbasi et al., 2016; Vennier et al., 2016; Yang et al., 2017), les absorptions quotidiennes de TBB et de TBPH dans la poussière, pour la population générale du Canada, ont été estimées à l’aide de la concentration maximale de TBB (22 371 ng/g) mesurée dans l’Enquête sur la poussière domestique au Canada (communication personnelle du BSSER, Santé Canada, datée du 5 juin 2017) et de la concentration maximale de TBPH (6 400 ng/g; n=116) de l’étude réalisée à Vancouver (Shoeib et al., 2012). Les valeurs sélectionnées sont jugées appropriées pour caractériser les expositions à l’air intérieur pour les Canadiens en fonction de la variabilité du potentiel d’exposition (p. ex., concentration, durée et fréquence) relativement à d’autres milieux.
10.1.1.4 Sol et sédiments
Comme décrit à la section 7, aucune donnée de surveillance sur le TBB et le TBPH dans le sol au Canada n’a été identifiée. Toutefois, ces deux substances ont récemment fait l’objet d’un suivi à l’aide de carottes de sédiments provenant de sites canadiens dans le lac Ontario et le lac Érié (Pelletier et al. 2013), de même qu’aux États-Unis (La Guardia et al. 2013).
Une concentration environnementale estimée (CEE) de 20 000 ng/kg ps (0,02 mg/kg ps) pour le mélange TBB/TBPH dans le sol canadien a été estimée aux fins d’épandage de biosolides sur une terre agricole à l’aide de méthodes prudentes (voir la section 9.2.1). Étant donné qu’aucune étude de suivi du TBB et du TBPH dans le sol n’a été relevée, la CEE dans le sol pour le mélange de TBB/TBPH a été retenue pour calculer les estimations d’absorption provenant de l’ingestion de sol pour la population générale du Canada.
10.1.1.5 Eau potable
Aucune étude sur la concentration de TBB et de TBPH dans l’eau potable n’a été relevée au Canada ni ailleurs. Toutefois, comme décrit à la section 7, le TBB et le TBPH ont fait l’objet d’un suivi dans l’eau de surface au Canada et ailleurs. Les niveaux de TBB et de TBPH dans les échantillons d’eau de surface (n=5) prélevés en 2011 et en2012 dans les Grands Lacs étaient plus élevés dans le lac Ontario (moyenne de 7,9 et 0,27 pg/L, respectivement) et dans le lac Érié (moyenne de 5,6 et 10,4 pg/L, respectivement) (Venier et al. 2014). Dans une étude préliminaire distincte, la concentration de TBB et de TBPH a été mesurée dans le lac Ontario à 0,8 et à 2,2 pg/L, respectivement, avec des résultats semblables pour le TBPH (moyenne de 1,5 pg/L) dans le lac Érié (Muir et al. 2011).
Étant donné qu’aucune donnée sur l’eau potable n’était disponible, l’exposition à ces substances dans l’eau potable a été caractérisée à l’aide des données de suivi de l’eau de surface. La limite supérieure de l’absorption quotidienne de TBB et de TBPH pour la population générale du Canada était fondée sur la somme des concentrations moyennes les plus élevées pour le TBB et le TBPH (7,9 et 10,4 pg/L, respectivement) dans le lac Ontario et le lac Érié, respectivement (Venier et al. 2014). Le TBPH est un plastifiant utilisé dans le poly(chlorure de vinyle) (Andersson et al. 2006) qui peut être utilisé pour la plomberie; ce pourrait être une source de contamination dans les réseaux de distribution d’eau potable. L’utilisation des concentrations de TBPH dans les eaux de surface à la limite supérieure, où aucun traitement de l’eau n’est présent, est jugée prudente pour tenir compte de cette incertitude.
10.1.1.6 Aliments
Aucune étude sur la concentration de TBB et TBPH dans les aliments mis en marché en Amérique du Nord n’a été relevée. Dans un rapport sur les composés ignifuges bromés dans les aliments, l’Autorité européenne de sécurité des aliments (EFSA) n’a pas identifié de données sur la présence de TBB et de TBPH dans les aliments et a indiqué que les concentrations mesurées dans les espèces sauvages peuvent indiquer la présence de ces composés dans les aliments (EFSA 2012). La surveillance environnementale du TBB et du TBPH dans les biotes au Canada et ailleurs est décrite dans la section 7. Le TBB et le TBPH ont été détectés dans 32 % et 18 % des échantillons de poisson (espèces et taille de l’échantillon non précisées) provenant des Grands Lacs et de deux autres lacs en Ontario, respectivement. Les concentrations de TBB allaient de 0,011 à 0,041 ng/g, tandis que celles de TBPH allaient de 0,044 à 0,078 ng/g (en poids non précisé) (Zhou et al. 2010 b). Lors d’une étude canadienne récente, du TBPH (mais pas du TBB) a été détecté dans des échantillons de foie de grand brochet (n=11) et de maskinongé (n=10) provenant du fleuve Saint-Laurent et de ses affluents. Aucune de ces deux substances n’a été détectée dans des échantillons de perchaude (n=29), poisson entier (Houde et al. 2014). À l’échelle internationale, le TBB n’a pas été détecté (ldm de 30 ng/g pl) dans des échantillons de tambour rayé (n=6) provenant de la baie de San Francisco aux États-Unis (Klosterhaus et al. 2012).
TemaNord (2011) a examiné des biotes en Europe du Nord à la recherche de plusieurs nouveaux produits ignifuges. Dans le muscle de la perchaude, la concentration de TBB allait de non détecté (limite de détection = 0,006 ng/g ph) à 0,025 ng/g ph, alors que celle du TBPH allait de non détecté à 0,008 9, à l’exception d’un ensemble d’échantillons combinés (n=6 et 10 individus) (0,46 ng/g ph) prélevés dans un lac endigué. Le TBB et le TBPH n’ont pas été détectés (limite de dosage de 1,1 ng/g ph) dans des échantillons de crabe et de moule de Norvège (DNV, 2010). Le TBB et le TBPH ont été mesurés dans le foie du phoque annelé (0,435 ng/g ph et 0,573 ng/g ph, respectivement), et le TBB a été mesuré (le TBPH n’a pas été détecté) dans le foie du renard arctique (0,975 ng/g ph; 90 %) et le plasma de l’ours blanc (3 640 ng/g ph; 90 %) à Svalbard, en Norvège (Sagerup et al. 2010).
En se basant sur les renseignements disponibles, la limite supérieure de l’absorption quotidienne du TBB et du TBPH par la consommation de poisson a été estimée à l’aide de la somme des concentrations maximales dans les poissons du Canada (0,041 et 0,078 ng/g ph, respectivement), mesurées dans les Grands Lacs (Zhou et al., 2010b). Ces concentrations sont jugées appropriées pour calculer la limite supérieure d’absorption pour la population générale du Canada en supposant que le TBB et le TBPH sont présents à cette concentration dans 100 % des poissons, des mollusques, des crustacés et des aliments connexes. Bien que certaines populations nordiques au Canada puissent consommer, de façon saisonnière, de plus grandes quantités de fruits de mer ou de gibier, cette estimation est jugée suffisamment prudente pour tenir compte de cette variabilité.
10.1.1.7 Lait maternel
Les données de biosurveillance du TBB et du TBPH dans le lait maternel sont limitées. Toutefois, des données canadiennes ont été identifiées pour le TBB et le TBPH où les deux substances ont respectivement été détectées dans 78,1 et 32,4 % des échantillons de lait maternel (n=105) prélevés en 2008-2009 dans une cohorte de femmes allaitantes provenant de Sherbrooke, au Québec. Pour cette étude, les concentrations de TBB et de TBPH allaient de non détecté (limite de détection = 0,003 ng/g pl) à 24 ng/g pl et de non détecté (limite de détection = 0,15 ng/g pl) à 6,6 ng/g pl, respectivement. Les concentrations médianes de TBB et de TBPH étaient 0,41 ng/g pl et non détecté (< 0,15 à 5,3 ng/g pl), respectivement, alors que les concentrations au 95e centile pour ces substances étaient de 5,3 et 4,0 ng/g pl, respectivement (Zhou et al. 2014). La limite supérieure des absorptions quotidiennes de TBB et de TBPH à partir du lait maternel a été calculée à l’aide des concentrations au 95e centile de TBB et de TBPH en poids humide, c.-à-d., 0,070 et 0,069 ng/g poids humide, respectivement (Zhou et al. 2014; concentrations en poids humide sont tirées d’une communication personnelle du BSSER, Santé Canada, datée du 15 mai 2014). Ces concentrations sont jugées appropriées pour calculer la limite supérieure d’absorption pour les enfants allaités dans la population générale du Canada.
10.1.2 Produits disponibles aux consommateurs
Le TBB et le TBPH sont des additifs ignifuges généralement utilisés ensemble dans un mélange ayant des utilisations et applications variées dans des articles manufacturés (voir la section 5), dont certaines peuvent se traduire par une exposition de la population générale à ces produits. Les estimations de l’exposition par voie cutanée et orale ont été calculées à l’aide de méthodes prudentes dans le cadre des scénarios jugés pertinents pour la population générale (tableau 101). Le TBB et le TBPH sont non volatils. Ils ne devraient donc pas être présents sous forme gazeuse lorsque les conditions sont normales. De plus, les rejets dans l’air devraient être représentés par les estimations de l’exposition à l’air intérieur et à la poussière (voir les sections 10.1.1.2 et 10.1.1.3).
D’après un examen de l’industrie au Canada, le TBB et le TBPH sont utilisés dans la mousse de polyuréthane flexible utilisée pour des articles manufacturés comme les matelas, les oreillers, les coussins, les sièges, les meubles et les produits d’ameublement (ECCC 2013-2014). Un mélange TBB/TBPH/organophosphate a été évalué par la Consumer Product Safety Commission (CPSC) des États-Unis lors de deux études sur les produits ignifuges dans la mousse et mesuré à des concentrations allant jusqu’à 6,8 % p/p (CPSC 2005a; CPSC 2005b). Le mélange de TBB/TBPH/organophosphate a été mesuré dans des canapés contenant de la mousse de polyuréthane flexible achetés aux États-Unis (Stapleton et al. 2009; Stapleton et al. 2012) et dans 18 % des échantillons de mousse provenant de canapés manufacturés après le retrait progressif du pentaBDE (EPA 2014d).
Lors de tests préliminaires effectués par Santé Canada sur des articles manufacturés pour enfants (p. ex. coussins d’allaitement, jouets) achetés dans des magasins de détail à Ottawa, en Ontario, en janvier et en mai 2014, on a décelé du TBB et du TBPH (au‑dessus de la limite de dosage de 0,3 %) dans trois sous-échantillons de mousse provenant d’une chaise en mousse, à des concentrations maximales approximatives de 5 % et 2 %, respectivement. Le TBB et le TBPH n’ont pas été détectés dans les 22 autres articles manufacturés pour enfants (Santé Canada 2014). Dans un rapport distinct sur des chaises en mousse pour enfants qui provenaient de divers points de vente au détail aux États-Unis et au Canada, le TBB et le TBPH ont été détectés dans les deux chaises en mousse achetées au Canada (ainsi que dans la moitié des 40 chaises achetées aux États-Unis) (CEH 2013b). Le mélange TBB/TBPH/organophosphate a également été mesuré dans d’autres articles manufacturés pour enfants aux États-Unis, y compris dans des tapis pour la sieste (CEH 2013a), des sièges d’auto, des matelas de table à langer, des matelas portatifs et un fauteuil à bascule, à des concentrations allant de 0,585 à 4,25 % (déclarées de 5,85 à 42,5 mg/g) (Stapleton et al. 2011). Plus récemment, le TBB et le TBPH ont fait partie des ignifuges ciblés dans une étude menée par la Commission de coopération environnementale (CCE). Dans cette étude, 132 éléments de mobilier ont été achetés aux États‑Unis et au Mexique entre décembre 2014 et avril 2015 et 717 échantillons ont été prélevés de ces produits (245 d’entre eux provenaient de produits achetés au Canada). Le TBB et le TBPH ont été détectés dans la mousse d’un sofa qui avait été acheté au Canada, à des concentrations de 3,9 % p/p et de 1,4 % p/p, respectivement (CCE, 2015). Enfin, le TBB et le TBPH ont également été décelés (jusqu’à une concentration de 154,4 et de 11,6 mg/g, respectivement) dans la mousse de polyuréthane flexible de véhicules (n = 18) provenant de sites de récupération de la région du Grand Toronto, au Canada (Mochungong et al. 2014).
En se basant sur les renseignements disponibles, nous avons estimé l’exposition par voie cutanée et par voie orale due au contact direct d’articles manufacturés contenant de la mousse de polyuréthane flexible (tableau 10-1). Les absorptions dues à l’exposition cutanée ont été estimées pour les enfants et les adultes en contact avec des matelas en mousse. Le taux de migration de 1,97 × 10-5 mg/cm2 par heure pour le mélange TBB/TBPH/organophosphate, fondé uniquement sur la mesure de la migration du TBB de la mousse, a été utilisé pour estimer les expositions cutanées d’après une étude de migration dirigée par la CPSC des États-Unis portant sur la mousse traitée garnissant des meubles et recouverte de tissu (CPSC 2005b). L’étude de migration était basée sur une concentration de mélange TBB/TBPH/organophosphate de 6,8 % dans la mousse qui était jugée appropriée en se basant sur les niveaux rapportés de TBB et TBPH allant jusqu’à 7 % (Santé Canada 2014). Le TBB est plus soluble dans l’eau que le TBPH (voir la section 3) et comme dans l’étude portant sur la migration, cette dernière était médiée dans un liquide, c.-à-d. une solution aqueuse saline (US CPSC, 2005b), ce taux de migration est probablement plus élevé que ce qu’on trouverait si le TBPH avait été mesuré. L’absorption cutanée de TBB et de TBPH par la peau humaine a été étudiée dans deux études in vitro (Frederiksen et al., 2016; Knudsen et al., 2016a). Le TBB aurait un taux d’absorption d’environ 11 %, tandis que celui du TBPH serait d’environ 8 % à 10 % (Frederiksen et al., 2016; Knudsen et al., 2016a). Puisque le taux de migration utilisé dans les estimations de l’exposition était fondé sur la migration du TBB, la valeur de l’absorption cutanée du TBB a été choisie pour l’estimation de l’absorption cutanée. Cependant, comme il est possible que l’absorption soit plus élevée en raison des différentes conditions d’utilisation ou en incluant l’absorption du TBPH, la valeur de la limite supérieure d’absorption de 100 % a également été prise en compte dans l’estimation.
Les absorptions dues à l’exposition par voie orale ont également été estimées pour les nourrissons et les jeunes enfants qui portent à leur bouche des articles manufacturés contenant de la mousse (p. ex., tapis pour la sieste, chaises pour enfants). En l’absence de taux de migration propres à la mise en bouche d’objets, le taux de migration utilisé pour le scénario d’exposition par voie cutanée a été appliqué pour le scénario d’exposition par voie orale des enfants qui portent des objets contenant de la mousse à leur bouche. On a supposé que les nourrissons et les tout-petits portent à leur bouche des articles contenant de la mousse pendant 24,5 minutes par jour (Norris et Smith 2002 cité dans EPA 2011). Des détails complets sur les scénarios d’exposition par voies cutanée et orale sont fournis dans l’annexe G.
Les absorptions estimées les plus élevées par l’exposition par voie cutanée au TBB et au TBPH étaient de 5,8 ×10-2 mg/kg p.c. pour les nourrissons. L’ingestion estimée pour les nourrissons et les tout-petits qui portent des objets en mousse à leur bouche était de 1,0 × 10-5 mg/kg pc/jour.
| Étude | Participants | Emplacement | Concentrations urinaires d’ATBBa (pg/mL) | Estimations de l’ingestion par dosimétrie inversée pour le TBB uniquement (ng/kg pc/jour) |
|---|---|---|---|---|
| Ospina et al. (2018) | Enfants (6 à 11 ans) (n=421) | États-Unis | < 50a [0,174 µg/g créatinine] (P50) 70a [0,235 µg/g créatinine] (P95) | 5,1 (P50) [10,2] 7,2 (P95) [13,8] |
| Ospina et al. (2018) | Adolescents (12 à 19 ans) (n=427) | États-Unis | < 50a (P50 et P95) [0,174 µg/g créatinine] | 5,3 (P50 et P95) [11,5] |
| Ospina et al. (2018) | Adultes (20 à 60 ans et plus) (n=1 818) | États-Unis | < 50a (P50 et P95) [0,174 µg/g créatinine] | 5,3 (P50 et P95) [11,6] |
| Butt et al. 2014 | Tout-petits (1 à 5 ans) (n=23) | New Jersey, États-Unis | 7,4b (moyenne géométrique) 84,9b (maximum) | 0,9 (moyenne géométrique) 10,7 (maximum) |
| Hoffman et al. 2014 | Adultes (femmes et hommes) (n=64) | Caroline du Nord, États‑Unis | 5,6c (moyenne géométrique) 340,6b (maximum) | 0,6 (moyenne géométrique) 36,2 (maximum) |
Abréviations : P50 = 50e centile; P95 = 95e centile
a Les concentrations indiquées ne sont pas corrigées en fonction de l’hydratation et les concentrations de créatinine sont indiquées entre crochets (comme dans les études).
b Les concentrations sont normalisées en fonction de la densité (tel que déclaré dans les études).
Les gammes d’absorption de TBB basées sur la dosimétrie inversée pour les tout-petits, les enfants et les adultes étaient semblables aux estimations d’absorption déterministes pour le mélange TBB/TBPH (1,8 à 78 ng/kg pc/jour) (voir l’annexe E). Toutefois, étant donné la brève demi-vie probable du TBB, l’échantillonnage d’urine ponctuel pour la dosimétrie inversée est variable et peut ne pas refléter la limite supérieure des expositions étant donné la variabilité pour une même personne et pour une même journée (Aylward et al. 2012). Knudsen et al. (2014) ont décrit le TBB comme étant rapidement métabolisé, et Hoffman et al. (2014) ont démontré que l’ATBB dans l’urine de rats exposés au mélange de TBB et de TBPH contenant des composés organophosphorés augmentait de façon importante pendant les deux à trois heures suivant l’exposition, mais semblait atteindre un palier environ six à huit heures après l’exposition.
Malgré ces limites, la dosimétrie inversée a été caractérisée comme méthode utile d’évaluation de l’exposition pour les expositions chimiques dans l’environnement, puisqu’elle permet de détecter et de doser des marqueurs stables des produits chimiques absorbés biologiquement dans le corps (Sexton et al. 2004; Aylward et al. 2012). Cependant, certaines des limites de la dosimétrie inversée mentionnées ci‑dessus devraient être prises en compte. Bien que deux de ces études soient basées sur de petites cohortes provenant des États-Unis, les données d’Ospina et al. (2018) sont considérées comme représentatives de la population nationale et probablement représentatives de la population canadienne étant donné les similitudes dans l’utilisation et la disponibilité des produits sur le marché aux États-Unis et au Canada. Également, bien qu’il y ait peu d’incertitude au sujet de la pertinence de l’ATBB en tant que biomarqueur in vivo de l’exposition au TBB, la valeur de la FEU (basée sur une étude de la toxicocinétique chez les rats) et son utilisation pour les humains sont une incertitude. Roberts et al. (2012) ont montré que la formation d’ATBB était beaucoup plus rapide dans les microsomes hépatiques du rat comparativement aux autres tissus du rat et aux tissus humains examinés lors de la même étude. Finalement, l’hypothèse de l’équivalence de l’absorption, de la distribution, du métabolisme et de l’élimination entre les groupes d’âge (adultes et enfants) et entre les individus (mâles et femelles) au fil du temps est une incertitude supplémentaire.
10.2 Effets sur la santé
Aucune classification des effets sur la santé du TBPH ou du TBB par des organismes de réglementation nationaux ou internationaux n’a pu être relevée. Aucune étude de toxicité chronique ou de cancérogénicité n’a été relevée. Peu d’information est disponible pour le TBB. Toutefois, des données limitées sont disponibles sur la toxicité à doses répétées à court terme, la toxicité aiguë et les effets génotoxiques du TBPH, de ainsi que sur les effets sur la reproduction et le développement du mélange TBB/TBPH.
10.2.1 Toxicocinétique
Métabolisme du TBPH ou du TBB
Les renseignements sur le métabolisme ou la présence du TBPH ou du TBB chez les mammifères sont limités. Lors d’une étude récente, Hoffman et al. (2014), ont évalué l’exposition humaine au mélange TBB/TBPH/organophosphate chez des volontaires humains des deux genres (n = 64). Les résultats ont montré une détection fréquente, mais très variable d’ATTB, un métabolite du TBB, dans les échantillons ponctuels d’urine humaine. Dans le cadre de la même étude, l’exposition de rats à une dose unique de 1 mg de mélange TBB/TBPH/organophosphate a mis en évidence l’élimination de l’ATBB dans l’urine, avec un maximum après environ trois heures et un palier après environ six à huit heures. Ces résultats ont montré une formation rapide d’ATBB à partir du TBB, ainsi qu’une élimination rapide de l’ATBB du corps, ce qui semble indiquer une possibilité limitée de bioaccumulation du TBB. Lors de cette étude toxicocinétique, les auteurs n’ont recherché que le TBB (et son métabolite) comme biomarqueur du mélange TBB/TBPH/composés organophosphate, étant donné que le TBB se limite aux mélanges TBB/TBPH/organophosphate alors que le TBPH est présent dans d’autres produits commerciaux (Hoffman et al. 2014). À noter que l’ATBB a été identifié comme métabolite principal dans des échantillons de sérum et d’urine (après 24 h) lorsque neuf rats femelles adultes SD ont été exposées à une dose unique par gavage (500 mg/kg pc dans de l’huile de maïs) d’un mélange commercial contenant plus de 95 % de TBPH et moins de 5 % de TBB. Lors de cette étude, un métabolite mineur, l’ATBP (acide 2,3,4,5-tétrabromophtalique) a été suggéré comme biomarqueur spécifique pour le TBPH (Silva et al. 2015). Toutefois, des études plus détaillées du métabolisme seraient nécessaires afin de tirer une conclusion définitive.
Lors d’une autre étude toxicocinétique, des rats femelles et des souris mâles ont reçu du TBB et du TBPH par voie intraveineuse ou orale (le vecteur de la dose étant de l’huile de maïs) et la radioactivité du TBB [14C] a été mesurée dans l’urine et les fèces. Les résultats ont montré que la récupération dans les matières fécales était minime avant 24 h. Cependant, un taux de récupération total de plus de 93 % du TBB dans l’urine et les fèces était observé 72 h après l’administration d’une dose unique et de doses répétées (0,1, 1,0, 10 ou 100 µmol/kg) par voie orale ou par intraveineuse (0,1 µmol/kg). Trois métabolites du TBB (ATBB, ATBB-glycine et ATBB-sulfate) étaient présents dans l’urine et les fèces après une administration unique ou répétée. Le ratio de la molécule de départ sur les métabolites variait avec la dose, mais pas après une exposition à une dose unique par rapport à l’exposition à une dose répétée (Knudsen et al., 2016b). Environ 20 % à 30 % du TBB administré par voie intraveineuse se sont retrouvés dans les fèces sous forme de métabolites et la rétention de TBB dans les tissus était minime. Par contre, le TBPH a principalement été éliminé dans les fèces après une administration par voie orale ou intraveineuse chez les rats (0,1 ou 10 µmol/kg) et les souris (0,1 µmol/kg). Toutefois, 75 % du TBPH (0,1 µmol/kg) administré par voie intraveineuse se retrouvait dans les fèces sous forme de métabolites, indiquant l’importance de l’excrétion biliaire (communication personnelle de G. Knudsen et du BERSE; non référencé).
Le métabolisme du TBPH ou du TBB a été étudié dans les fractions subcellulaires hépatiques ou intestinales de l’humain ou du rat (cytosol ou microsomes) et la carboxy‑estérase porcine (PCE) in vitro. Aucun métabolite du TBPH n’a été détecté dans les fractions subcellulaires de l’humain ou du rat, et aucune perte de TBPH n’a été observée dans les microsomes hépatiques humains. Toutefois, le TBPH s’est métabolisé lentement pour former du TBPMEH (tétrabromophtalate de mono[2‑éthyhexyle]) en présence de PCE purifié (Roberts et al. 2012; Springer et al. 2012). Également, aucun métabolite de TBPH de phase II, incluant ceux provenant de la sulfatation, de la glucuronidation ou de la conjugaison au glutathion dans les microsomes hépatiques humains et le cytosol n’a été détecté (Roberts et al. 2012). Par contre, le TBB s’est rapidement métabolisé en ATBB dans les microsomes hépatiques humains ou du rat. L’hydrolyse du TBB en ATBB était probablement catalysée par les carboxylestérases présentes, libérant également du 2-éthylhexanol. Aucun autre métabolite n’a été détecté lors de cette étude (Roberts et al. 2012). Il n’y a aucune indication de la participation des enzymes du cytochrome P450. Toutefois, les auteurs ont formulé l’hypothèse que les carboxylestérases étaient responsables du métabolisme du TBB puisque celui-ci était converti en ATBB lors de son incubation avec du PCE. Il a été proposé qu’un mécanisme semblable puisse être présent chez les humains puisqu’il a précédemment été démontré que les carboxylestérases humaines et porcines catalysent des réactions métaboliques de façon semblable (Huang et al. 1996). Toutefois, ceci n’a pas été clairement démontré lors de l’étude de Roberts et al. (2012). L’évaluation du métabolisme propre à l’espèce a révélé que la formation d’ATBB était beaucoup plus rapide in vitro dans les microsomes hépatiques du rat comparativement aux microsomes d’autres tissus du rat et de l’humain dans le cadre de la même étude, mais qu’elle était semblable à la formation d’ATBB dans le PCE.
Peu de renseignements sont disponibles sur le métabolisme du TBPH ou du TBB chez les mammifères. Selon les renseignements disponibles, il semble que le métabolisme rapide du TBB puisse réduire son potentiel de bioaccumulation. Inversement, un métabolisme plus lent du TBPH que celui du TBB peut entraîner un temps de résidence du TBPH plus long dans les tissus des mammifères. La présence d’atomes de brome volumineux dans le TBPH et le TBB pourrait empêcher la débromation complète de ces deux substances chez les mammifères, comme cela a été observé lors d’une étude sur la photodégradation (Davis et Stapleton 2009).
10.2.2 Cancérogénicité et génotoxicité
TBPH
Cancérogénicité
Aucune étude de toxicité chronique/cancérogénicité n’a été recensée pour le TBPH ou les mélanges commerciaux de TBPH et de TBB.
Génotoxicité
Les données sur la génotoxicité du TBPH sont généralement négatives. Le pouvoir mutagène du TBPH a été examiné in vivo (essai du micronoyau) par administration intrapéritonéale (80, 400 ou 2 000 mg/kg pc/jour) ou intradermique (2 000 mg/kg pc/jour; effectuée à cinq occasions distinctes, à 24 h d’intervalle) de TBPH à des souris mâles et femelles. Il n’y a pas eu d’augmentation du nombre d’érythrocytes micronucléés dans la moelle osseuse de souris traitées, que le TBPH soit administré de façon intrapéritonéale ou de façon intradermique. Il a été conclu que le TBPH n’était pas clastogène chez les souris mâles et femelles (Pennwalt Corporation 1987a).
Lors d’un test d’Ames in vitro, des souches de Salmonella typhimurium (TA 98, 100, 1535, 1537 et 1538) ont été exposées à différentes concentrations de TBPH (50, 158, 500, 1 580 et 5 000 µg/plaque dissout dans 0,1 mL de diméthylsulfoxyde [DMSO] avec ou sans activation métabolique ou 0,10 à 150 µL/plaque avec ou sans activation métabolique) afin d’examiner le pouvoir mutagène du TBPH. Aucune génotoxicité n’a été observée pour le TBPH (Pennwalt Corporation 1987b; Hazelton 1986).
Les risques de dommages à l’ADN par le TBPH ont été examinés à l’aide d’une épreuve d’aberrations chromosomiques pour laquelle des lymphocytes humains ont été exposés à 0, 40, 200 ou 1 000 µg/ml de TBPH. Le TBPH était faiblement clastogène à la dose la plus élevée (1 000 µg/mL) (Pennwalt Corporation 1987c).
En raison du manque de renseignements, les outils et modèles de prévision des RQSA in silico accessibles au Bureau de l’évaluation des risques des substances existantes (BERSE) ont été utilisés pour prédire le pouvoir cancérogène ou la génotoxicité du TBPH ou du TBB. Les modèles CaseUltra ou ModelApplier prédisent un pouvoir cancérogène positif du TBPH ou du TBB, mais ces modèles considèrent le PDEH comme analogue structurel (BERSE, 2014). Toutefois, la documentation disponible n’appuie pas un mécanisme d’action semblable pour le TBPH et le PDEH (Pennwalt Corporation 1988). Les modèles des RQSA (Percepta, Toxtree, Model Applier, TIMES, CaseUltra et Derek Nexus) prédisent également que le TBPH et le TBB ne sont pas génotoxiques (tableau 103). Ces prévisions négatives pour la génotoxicité sont basées sur des données empiriques limitées qui ont également mis en évidence l’absence de génotoxicité pour le TBPH dans les systèmes d’essai in vitro et in vivo (Huntingdon Life Sciences Ltd. 1997a,b; Pennwalt Corporation 1987a,b,c).
Mélange commercial TBB/TBPH
Aucun pouvoir mutagène n’a été observé lors de l’examen in vitro d’un mélange de TBB et de TBPH à une concentration d’au plus 5 000 µg/plaque, en l’incubant dans un test de mutation génétique de Salmonella typhimurium ou d’Escherichia coli (Huntingdon Life Sciences Ltd. 1997a). De même, le mélange de TBB et de TBPH n’était pas clastogène lors d’une épreuve chromosomique lorsque des lymphocytes humains ont été exposés à des concentrations de la substance allant de 78,1 à 5 000 µg/mL avec ou sans activation métabolique (Huntingdon Life Sciences Ltd. 1997 b).
En se basant sur les renseignements disponibles, c.-à-d. des données de génotoxicité généralement négatives et l’absence d’effets nocifs lors d’études de génotoxicité aiguë ou à court terme, le pouvoir cancérogène du TBB, du TBPH ou du mélange TBB/TBPH à des concentrations pertinentes chez l’humain est faible.
10.2.3 Toxicité pour la reproduction et le développement
TBPH
Aucune étude n’a été recensée au sujet de la toxicité du TBPH pour la reproduction ou le développement.
Mélange commercial TBB/TBPH
Les détails des études sur la reproduction et le développement ainsi que les effets critiques sélectionnés sont présentés à l’annexe H. Lors d’une étude de toxicité pour la reproduction sur deux générations, un mélange commercial TBB/TBPH mélangé à de l’huile d’arachide (5 mL/kg) a été administré quotidiennement à des doses de 15, 50 et 165 mg/kg pc/jour à des groupes de 25 rats CD mâles et femelles, et les effets sur la génération P0, F1 et F2 ont été examinés (MPI Research Inc. 2008a). Pour la génération P0, une réduction importante de la consommation d’aliments et du poids corporel avant l’accouplement a été observée, de même qu’une réduction importante du poids corporel pendant la gestation chez les femelles de la génération P0 dans le groupe 165 mg/kg pc/jour. Les petits mâles et femelles de la génération F1 ont un poids corporel statistiquement plus petit à la naissance et pendant la lactation, mais seulement dans le groupe ayant reçu la dose la plus élevée (165 mg/kg pc/jour). Également, une réduction importante du poids corporel a été observée avant l’accouplement ainsi que pendant la gestation et la lactation, mais uniquement chez les femelles de la génération F1 du groupe ayant reçu la dose à la plus élevée.
Une réduction importante du poids corporel (à la naissance) a également été observée chez les petits mâles et femelles de la génération F2 des groupes ayant reçu les doses de 50 et de 165 mg/kg pc/jour. De même, une augmentation statistiquement significative de la distance anogénitale a été observée chez les petits femelles de la génération F2 ayant reçu ces mêmes doses. Également, une augmentation importante du poids du thymus par rapport au poids corporel a été observée chez les petits mâles ou femelles de la génération F2 du groupe ayant reçu la dose de 50 mg/kg pc/jour. Les auteurs de la présente étude jugent que ces résultats sont sporadiques et non liés à la dose.
Bien que les auteurs de l’étude ne perçoivent pas les effets mentionnés ci-dessus comme importants, l’évaluation de Santé Canada est différente de celle des auteurs de l’étude et s’appuie sur le fait que l’effet le plus constant observé chez les générations P0, F1 et F2 était une diminution du poids corporel, une diminution de la prise de poids corporel et une diminution de la consommation alimentaire.
La diminution du poids corporel à la naissance des petits de la génération F2 est interprétée comme un effet nocif par Santé Canada et, par conséquent, une dose minimale avec effet nocif observé (DMENO) de 50 mg/kg pc/jour et une dose sans effet nocif observé (DSENO) de 15 mg/kg pc/jour ont été retenues pour la présente évaluation (annexe H). La DSENO de 15 mg/kg pc/jour a été retenue afin d’établir une marge d’exposition (ME). Un faible poids de naissance est généralement associé à plusieurs facteurs, dont une diminution de l’apport alimentaire pendant la grossesse, une baisse du poids corporel de la mère ou encore la prise de poids corporel ou le transfert de toxines au fœtus via le placenta (Beyer et al. 2011; Reyes et Manalich 2005). De faibles poids de naissance ont été associés à plusieurs problèmes de développement ou du comportement chez les animaux et les humains (Addison et al. 2009; Beyer et al. 2011). De plus, l’augmentation importante de la distance anogénitale observée chez les petits femelles de la génération F2 faisant partie des groupes ayant reçu la dose de 50 ou de 165 mg/kg pc/jour indique également le potentiel du mélange TBPH/TBB à produire des effets sur la reproduction, notamment durant la période critique de développement des rats. Une augmentation ou une diminution de la distance anogénitale est considérée comme un indicateur sensible de la toxicité pour la reproduction par les biologistes spécialisés en reproduction. Toutefois, en l’absence d’effets liés à la dose et d’effets biochimiques ou physiques nocifs, l’augmentation de la distance anogénitale chez les petits femelles de la génération F2 (MPI Research Inc. 2008a) était perçue comme une preuve supplémentaire de la toxicité du mélange TBB/TBPH. En l’absence de modifications histopathologiques, les évaluateurs de Santé Canada ne jugent pas une augmentation du poids du thymus et qu’une diminution du poids de la rate, non liées à la dose, soient importantes sur le plan toxicologique.
Lors d’une étude sur le développement, le mélange TBB/TBPH a été administré par gavage une fois par jour aux rates SD accouplées à des doses de 0, 50, 100 ou 300 mg/kg pc/jour pendant les jours de gestation 6 à 19, et les animaux ont été sacrifiés le 20e jour de gestation (MPI Research Inc. 2008 b).
Dans cette étude, la toxicité maternelle a été observée lors de l’exposition à 100 et 300 mg/kg pc/jour d’un mélange TBB/TBPH et les signes de toxicité incluaient la perte de poils sur l’abdomen, un poids corporel et un gain de poids corporel au cours de la gestation statistiquement plus faibles, ainsi qu’une consommation d’aliments plus faible. Une diminution importante du poids corporel du fœtus a été observée dans les groupes ayant reçu une dose de 100 ou 300 mg/kg pc/jour comparativement au groupe témoin. Aucune anomalie du squelette n’a été observée chez les fœtus des groupes exposés à 50 ou 100 mg/kg pc/jour. Toutefois, l’exposition à une dose de 300 mg/kg pc/jour de mélange TBB/TBPH a causé des malformations comme la fusion des arcs des vertèbres cervicales observées chez deux fœtus (chacun provenant d’une litière différente), qui ont été jugées comme étant liées à la dose. On a également observé une incidence accrue des variations de l’ossification des os des fœtus, de l’ossification incomplète des os crâniens et des sternèbres non ossifiées. Les auteurs de l’étude ont identifié une DSENO de 50 mg/kg pc/jour pour la toxicité maternelle et pour le développement (MPI Research Inc. 2008 b).
Dans l’ensemble, les données disponibles tirées des études sur la reproduction ou le développement susmentionnées indiquent que l’exposition au mélange TBPH/TBB ne produit peut-être pas d’effets nocifs pour le paramètre lié à la reproduction ou au développement après une exposition à court terme à des concentrations pertinentes chez l’humain.
10.2.4 Autres effets systémiques
TBPH
Toxicité à court terme et à doses répétées (28 jours) du TBPH et du TBPMEH
Des rats mâles et femelles Sprague-Dawley (SD) ont été exposés par voie alimentaire à 0, 200, 2 000 ou 20 000 ppm (0, 22, 223,4 ou 2 331 mg/kg pc/jour – conversion des doses par l’auteur de l’étude) de TBPH pendant 28 jours.
Aucun des groupes exposés au TBPH n’a présenté de mortalité ou de signes cliniques de toxicité. Les femelles exposées à une dose élevée ont présenté une légère diminution du poids corporel. L’activité de l’alanine-aminotransférase (ALT) a diminué de façon importante chez les femelles du groupe exposé à une dose élevée et des concentrations légèrement faibles de phosphore dans le sang ont été observées chez les femelles de tous les groupes et seulement chez les mâles du groupe exposé à une dose élevée. Les examens macroscopiques, histopathologiques, hématologiques et biochimiques n’ont révélé aucun autre effet nocif. Les résultats de l’analyse par microscopie électronique du foie étaient négatifs pour la prolifération de peroxysomes.
En comparaison, une exposition à 15 000 ppm (1 507 mg/kg pc/jour) de PDEH a entraîné une diminution de la consommation de nourriture, une diminution du gain de poids corporel et un rapport de conversion alimentaire élevé chez les rats du groupe témoin positif. De plus, les rats exposés au PDEH présentaient une perte de poils sur le ventre, un nombre élevé de plaquettes, une activité élevée de la phosphatase alcaline, des concentrations élevées d'urée et des rapports albumine/globuline (A/G) élevés chez les mâles, ainsi qu'une faible activité de l’alanine-aminotransférase et de l'aspartate‑aminotransférase chez les femelles. Les changements liés au poids des organes comprenaient une augmentation du poids du foie et un faible poids des testicules. Les mâles du groupe témoin positif présentaient également des testicules flasques et de petite taille. Les changements histopathologiques observés chez les rats exposés au PDEH comprenaient du cytoplasme éosinophilique granulaire des hépatocytes panacineux abondant chez les mâles et les femelles, un manque de glycogène dans les hépatocytes centrolobulaires chez les mâles et un manque d’épithélium germinal dans les testicules (Pennwalt Corporation 1988).
Il a été suggéré que le TBPH est métabolisé ou débromé pour former du PDEH et qu’il peut provoquer une toxicité chez des animaux (Roberts et al. 2012; Springer et al. 2012) Le PDEH est une substance toxique pour la reproduction reconnue chez les mâles et il a été proposé qu’il provoque une hépatotoxicité par l’activation du récepteur α activé par les proliférateurs des peroxysomes (PPARα) au moyen de son métabolite, le phtalate de mono(2-éthylhexyle) (PMEH), chez les rats et les souris (Rusyn et al. 2006).
Les données susmentionnées indiquent que le TBPH, qui a été proposé comme étant un analogue bromé du PDEH (Roberts et al. 2012; Springer et al. 2012), n’a pas entraîné d’effets nocifs chez les rats comparativement au PDEH qui a provoqué une nette toxicité lors de la même étude. Pour le TBPH, on a déterminé une DSENO de 223,4 mg/kg pc/jour et une DMENO de 2331 mg/kg pc/jour (Pennwalt Corporation 1988). Ces études indiquent que malgré des similarités dans leur composition chimique, le TBPH et le PDEH ne produisent pas des effets nocifs semblables et leurs modes d’action chez les animaux sont possiblement différents.
Lors d’une étude à court terme, des rates Fischer 344 gravides ont été exposées (le 18e et le 19e jour de gestation) par gavage à 0, 200 ou 500 mg/kg pc/jour de TBPMEH. Les résultats indiquent une diminution significative de la phosphatase alcaline dans le foie et une augmentation importante de l’alanine-transaminase (ALT) chez les mères ayant reçu 500 mg/kg pc/jour de TBPMEH. Les concentrations d’azote uréique dans le sang étaient beaucoup plus élevées et les concentrations de calcium (Ca+2) ont diminué de façon importante chez les mères du groupe exposé à la dose élevée. Les concentrations sériques de cholestérol et de T3 ont diminué de façon importante en fonction de la dose, mais aucun changement n’a été observé dans les concentrations sériques de T4. L’examen histopathologique du foie des mères du groupe exposé à une dose élevée (500 mg/kg pc/jour) a indiqué une prolifération et une apoptose, mais on n’a observé aucune différence en ce qui concerne les reins ou la glande thyroïde. De plus, aucune dose n’a provoqué de changements dans le poids des organes (foie, reins, glande surrénale ou ovaires). On a observé une augmentation importante des cellules germinales multinucléées dans les conduits séminifères des testicules de fœtus nés de mères ayant été exposées à une dose élevée de TBPMEH (500 mg/kg pc/jour). L’incubation ex vivo des testicules fœtaux en présence de TBPMEH n’a entraîné aucun changement dans la production de testostérone par rapport au groupe témoin. Cette étude a également révélé que contrairement au PMEH (métabolite du PDEH), l’exposition in utero au TBPMEH n’a pas entraîné de réduction de la production de testostérone et n’a pas entraîné d’action antiandrogène comme celle observée après une exposition au PMEH (Springer et al. 2012). Malgré les suggestions à l’effet que le TBPMEH et le PMEH ont des structures similaires, ces deux métabolites ne semblent pas agir de la même manière, ce qui appuie davantage le fait que le TBPH et le PDEH ont des propriétés dissimilaires.
Lors de la même étude, on a observé une diminution in vitro de l’activité de l’enzyme désiodinase dépendant de la dose lorsque des microsomes hépatiques de rats étaient co-incubés avec du TBPMEH à des concentrations de 0, 0,2, 2, 20, 100 ou 200 µM. Des cellules NIH 3T3 L1 murines ont été exposées à 0, 10, 50 ou 100 µM de TBPMEH pendant 7 jours. Celles exposées à des doses de 50 ou 100 µM ont entraîné une stimulation importante de l’accumulation des lipides, mais à une efficacité moindre que celles du groupe témoin positif de PMEH. L’exposition au TBPMEH a entraîné une augmentation de l’expression de la périlipine, protéine propre aux adipocytes, et a également provoqué l’activation du PPARα et du PPARγ ainsi que des gènes AOX ou FABP4 dirigés par ces derniers, respectivement. L’efficacité du TBPMEH était plus faible que celle du PMEH (100 µM), métabolite du PDEH. Fait intéressant, le TBPMEH, et non le TBPH, régulait à la hausse l’expression des gènes FABP4 et AOX. Par conséquent, les auteurs de l’étude ont proposé le TBPMEH comme obésogène environnemental (Springer et al. 2012). Cette indication devrait être considérée comme préliminaire puisque ces observations ont été effectuées dans des cellules murines in vitro; et sa pertinence chez les humains n’est pas claire.
L’exposition au TBPMEH in vitro a provoqué des modifications des hormones thyroïdiennes (en raison de l’inhibition de la désiodinase), et des modifications de la fonction des testicules et du foie fœtaux étaient liées à l’activité agoniste du PPARα et du PPARγ par le TBPMEH (Springer et al. 2012). La pertinence de ce mode d’action chez l’humain est discutable (Ito et Nakajima 2008). Cette étude a permis de déterminer plusieurs effets potentiels du TBPMEH dans différents systèmes in vitro ou in vivo. Toutefois, les effets étaient généralement observés après une exposition à dose élevée et ils étaient subtils par rapport à ceux produits par son analogue proposé, le PMEH. De plus, les données probantes indiquent que le TBPH n’est pas métabolisé en TBPMEH dans les microsomes humains (Roberts et al. 2012). Par conséquent, il est trop tôt pour tirer des conclusions sur la pertinence du mode d’action du TBPMEH chez les humains.
Analyse du RQSA du TBPH, du TBB et de leurs métabolites afin d’examiner leur similarité avec leurs analogues structuraux proposés
Le TBPH et son métabolite, le TBPMEH, intéressent les scientifiques puisqu’on a proposé que ces deux composés soient respectivement semblables structurellement ou fonctionnellement au PDEH et à son métabolite, le PMEH (Roberts et al. 2012).
Il a été suggéré que le TBPH soit un analogue bromé du PDEH, connu pour entraîner des effets nocifs sur la reproduction et le développement des animaux, et qui a également présenté un potentiel pour entraîner des modifications du système endocrinien (EURAR 2008).
Les données empiriques disponibles ne prouvent pas que le TBPH et le PDEH ont des effets semblables. Lors d’une étude sur la toxicité à doses répétées (28 jours), le TBPH n’a pas provoqué d’hépatotoxicité ou de prolifération des peroxysomes chez les rats (Pennwalt Corporation 1988). Cependant, l’exposition au PDEH a provoqué des signes de toxicité, y compris une faible consommation de nourriture, un faible gain de poids corporel et un rapport de conversion alimentaire élevé chez les rats. De plus, les rats exposés au PDEH présentaient également des changements biochimiques, macroscopiques ou histopathologiques défavorables (Pennwalt Corporation 1988g) qui n’étaient même pas qualitativement semblables aux effets du TBPH.
Dans le cadre d’une étude in vitro avec l’estérase salivaire humaine, le PDEH se métabolisait en PMEH environ 100 fois plus vite que le TBPH, indiquant des différences entre l’hydrolyse du TBPH et celle du PDEH (Niino et al. 2003). Ces différences pourraient être attribuables à l’hydrolyse métabolique réduite en raison de l’encombrement stérique causé par le TBPH entièrement bromé (Roberts et al. 2012). Il est suggéré que de telles différences de structure pourraient expliquer les propriétés différentes du TBPH et du PDEH (p. ex., des différences dans la liaison au récepteur et le métabolisme, etc.).
Pour examiner la question de plus près, Santé Canada a effectué une analyse RQSA pour déterminer la capacité de ces composés ignifuges, de leurs métabolites potentiels et du PDEH à se lier au récepteur des œstrogènes ou des androgènes (voir le tableau 103).
| Effets/modèles de R(Q)SA | TBPH | TBPMEH | TBB | ATBB | PDEH | PMEH |
|---|---|---|---|---|---|---|
| Affinité de liaison au récepteur des œstrogènes, TIMES | Faiblement actif (comme métabolite) | Faiblement actif | Non actif | Non actif | Faiblement actif | Faiblement actif |
| Liaison au récepteur des œstrogènes, profileur de la boîte à outils | Non liant | Non liant | Non liant | Non liant | Non liant | Non liant |
| Liaison au récepteur des œstrogènes, Système exp. de l’US EPA | Inconnu | Non actif | Inconnu | Non actif | Non actif | Non actif |
| Liaison au récepteur des œstrogènes, CaseUltra | Non actif | Non actif | Non actif | Non actif | Positif | Positif |
| Liaison au récepteur des œstrogènes, Percepta | Non liant | Non liant | Non liant | Non liant | Non liant | Non liant |
| Affinité de liaison au récepteur des androgènes, TIMES | Non actif | Non actif | Non actif | Non actif | Non actif | Faible |
| Liaison au récepteur des hydrocarbures aryliques, TIMES | Non liant | Non liant | Non liant | Non liant | Non liant | Non liant |
Brièvement, ces modèles de R(Q)SA n’ont prédit aucun potentiel du TBPH, du TBB ou de leurs métabolites (TBPMEH ou ATBB, respectivement) à se lier au récepteur des œstrogènes, des androgènes ou des hydrocarbures aryliques (voir le tableau 103). Ceci est semblable aux données tirées d’une étude récemment publiée qui n’indiquaient aucune capacité de liaison du TBPH ou du TBB ni aucune activité de ces substances in vitro semblable à celle de la TCDD (Saunders et al. 2013). De même, lors d’une épreuve sur le rapporteur de la luciférase, le TBPH et le TBB n’ont présenté aucun potentiel de liaison au récepteur des œstrogènes (comm. pers. du BSSER, 2014). Dans l’analyse RQSA, la seule exception était le modèle prévisionnel Oasis TIMES qui a prédit une faible activité pour le TBPH, basée sur la simulation de son métabolite, le monoester tétrabromé TBPMEH, qui semble être un métabolite favorisé du TBPH lors d’études in vitro (Roberts et al. 2012). Cette prévision est similaire à celle obtenue pour le métabolite PMEH du PDEH. Toutefois, le PMEH a également été retenu par les modèles de liaison au récepteur des androgènes CaseUltra et Times, tandis que pour le TBPMEH, le métabolite du TBPH n’a pas été retenu par ces modèles.
En se basant sur les observations ci-dessus, il est proposé que, bien que le TBPH et le PDEH semblent posséder des structures similaires, la présence du brome dans le TBPH peut entraîner d’importantes différences dans leurs propriétés physico-chimiques, leur capacité de liaison aux récepteurs et le potentiel ou le mode d’action des deux substances. Toutefois, des données probantes empiriques supplémentaires sont nécessaires pour mieux comprendre le(s) mode(s) ou mécanisme(s) d’action.
Toxicité à doses répétées à court terme (28 jours) du mélange commercial TBB/TBPH
L’exposition à des doses répétées du mélange TBB/TBPH de 0, 160, 400 ou 1000 mg/kg pc/jour par gavage pendant 28 jours (suivie d’une période de récupération de 14 jours) chez des rats SD mâles et femelles n’a pas causé de mortalité dans les différents groupes, peu importe les doses d’exposition. Les effets liés à l’exposition ont principalement été observés chez les femelles du groupe exposé à 1000 mg/kg pc/jour; ils comprenaient une diminution importante de la consommation de nourriture, une diminution de gain de poids corporel et un assouplissement de l’ouverture vaginale chez toutes les femelles au cours de l’exposition. Les deux sexes présentaient une salivation accrue dans le groupe exposé à une dose élevée seulement (1000 mg/kg pc/jour). De plus, on a observé une augmentation importante du rapport albumine-globuline (A/G) et de la concentration sérique de chlorure chez les rats mâles ou femelles du groupe exposé à 1000 mg/kg pc/jour. Une régénération de l’épithélium des tubules rénaux a également été observée chez tous les animaux de tous les groupes d’exposition. Tous ces changements étaient réversibles et les animaux se sont entièrement rétablis au cours d’une période de récupération de deux semaines. Les auteurs de l’étude ont déterminé la DSEO et la DMEO pour la toxicité systémique et les effets sur les reins comme étant inférieures ou égales à 160 mg/kg pc/jour, respectivement (WIL Research Laboratories Inc. 1997e), ce qui est accepté pour la présente évaluation.
Effets aigus du TBPH
L’exposition aiguë au TBPH n’a pas entraîné de mortalité ni de signes toxicologiques importants chez les animaux de laboratoire.
On a indiqué que la DL50 par voie orale pour le TBPH était supérieure à 5000 mg/kg pc/jour chez les rats CD mâles et femelles. Une seule dose orale (par gavage) de 5000 mg/kg p.c. par jour de TBPH n’a pas causé de mortalité ni de signe de toxicité (Jadlocki et Seckar 1987; WIL 1986a).
De même, une seule application cutanée de 2 mL/kg de TBPH sur la peau rasée de lapins blancs néo-zélandais mâles ou femelles n’a pas entraîné de mortalité ni de toxicité, et l’auteur de l’étude a indiqué que la DL50 par voie cutanée était supérieure à 2000 mg/kg ou équivalente à 3090 mg/kg pc/jour (Pennwalt Corporation 1987h; WIL 1986b).
Effets aigus du mélange commercial TBB/TBPH
Peu de renseignements sont disponibles sur le mélange TBB/TBPH. En l’absence de renseignements adéquats sur le TBPH et le TBB seuls, les renseignements accessibles pour le mélange TBB/TBPH ont été utilisés pour étayer l’évaluation.
On a indiqué que la DL50 du mélange TBB/TBPH était supérieure à 2000 mg/kg pc/jour chez les rats SD mâles et femelles (Huntingdon Life Sciences Ltd. 1996d). Lors d’une autre étude, on a indiqué que la DL50 par voie orale pour le mélange TBB/TBPH était supérieure à 5000 mg/kg pc/jour chez les rats Crl:CD BR mâles et femelles. Aucun changement pathologique ou lié à la mortalité n’a été observé (WIL Research Laboratories Inc. 1997f).
Une seule dose cutanée de 2000 mg/kg pc/jour du mélange TBB/TBPH n’a entraîné aucun effet nocif chez les rats Crl:CD BR mâles ou femelles, mais on a observé une desquamation ou un érythème léger ou réversible chez deux femelles. On a indiqué que la DL50 cutanée était supérieure ou égale à 2 000 mg/kg pc/jour (WIL Research Laboratories Inc. 1997 b). De même, une seule dose (0,5 mL) de mélange TBB/TBPH non dilué a provoqué une irritation légère, mais réversible, chez des lapins néo-zélandais mâles et femelles (WIL Research Laboratories Inc. 1997c).
10.2.5 Irritation et sensibilisation
TBPH
Une légère irritation de l’œil a été notée après l’instillation de 0,1 mL de TBPH dans la paupière inférieure de lapins néo-zélandais mâles et femelles. Ces effets étaient réversibles et les yeux étaient normaux 24 heures après l’exposition (Pennwalt Corporation 1987d; WIL 1986c). De même, le TBPH a provoqué très peu (HPVIS 2012) ou pas (Dossier ECHA) d’irritation cutanée (Pennwalt Corporation 1987e; WIL 1986d).
Le potentiel de sensibilisation cutanée du TBPH a été déclaré comme étant négatif chez les cobayes Dunkin-Hartley examinés à l’aide du test de Buehler (Pennwalt Corporation 1987f).
Mélange commercial TBB/TBPH
L’instillation de 0,1 mL de mélange TBB/TBPH dans les yeux de lapins néo-zélandais mâles ou femelles a provoqué une légère irritation réversible, qui a été complètement résolue en 4 jours ou moins (WIL Research Laboratories Inc. 1997a).
Le potentiel de sensibilisation cutanée du mélange TBB/TBPH a été examiné à l’aide du test de Buehler. L’exposition au mélange TBB/TBPH non dilué n’a pas entraîné de sensibilisation cutanée chez les cobayes (WIL Research Laboratories Inc. 1997d; NICNAS 2004). Toutefois, dans le cadre d’un test de maximalisation sur cobayes, une induction au moyen d’une infection par voie intradermique (80 % du mélange commercial dans l’Alembicol D) suivie d’une application topique (96 % du mélange commercial) ont provoqué une irritation allant de légère à bien définie chez 3 cobayes sur 10 (30 %) après l’exposition au mélange TBB/TBPH (50 % v/v dans l’Alembicol D), et il a été déclaré comme une substance ayant le potentiel de provoquer une sensibilisation cutanée (Huntingdon Life Sciences Ltd 1999c).
10.3 Caractérisation des risques pour la santé humaine
TBPH
Les résultats d’une étude de toxicité à doses répétées ont montré que l’exposition alimentaire au TBPH pendant 28 jours n’a provoqué aucun signe toxicologique significatif chez des rats mâles ou femelles (Pennwalt Corporation 1988). Aucun changement significatif n’a été observé après examen macroscopique ou histopathologique des tissus et aucun indice de prolifération des peroxysomes (PPAR‑α) dans le foie des rats exposés au TBPH. Une DMENO de 2331 mg/kg pc/jour a été identifiée étant donné qu’il s’agissait de la dose la plus élevée pour laquelle on a observé une diminution de l’ALT ou des niveaux de P. Toutefois, ces effets n’ont été observés que chez les femelles en l’absence de tout autre effet biochimique, macroscopique ou histopathologique nocif, ce qui n’indique pas de toxicité.
Mélange commercial TBB/TBPH
Pour le présent rapport, les seuils d’effets critiques pour la caractérisation des risques ont été obtenus à partir des études sur la reproduction et le développement. Lors d’une étude sur la toxicité pour la reproduction sur deux générations de rats, il a été déterminé que la DMENO la plus faible était de 50 mg/kg pc/jour, d’après une diminution significative du poids corporel des ratons femelles F2 à la naissance, avec une DSENO correspondante de 15 mg/kg pc/jour pour déterminer la marge d’exposition (ME) (tableau 104).
La comparaison de la DMENO la plus faible (15 mg/kg pc/jour) et de l’estimation la plus élevée de l’exposition quotidienne totale dans les milieux de l’environnement (1,6 × 10-5 mg/kg pc/jour) a conduit à une marge d’exposition d’environ 93 300. Cette marge est jugée adéquate pour rendre compte des incertitudes de la base de données sur l’exposition et les effets sur la santé.
Les données tirées d’une étude sur le développement suggèrent que le mélange TBB/TBPH ne produit peut-être pas d’effets nocifs pour le développement suite à une exposition à court terme des humains à des concentrations pertinentes (tableau 104).
En ce qui concerne le TBB et le TBPH présents dans certains articles manufacturés, le contact avec des articles manufacturés en mousse de polyuréthane flexible a été identifié comme source d’exposition potentielle. La comparaison de la DSENO de 15 mg/kg pc/jour tirée d’une étude par voie orale sur deux générations et de l’estimation la plus élevée de l’absorption cutanée quotidienne (5,8 × 10-2 mg/kg pc/jour) des nourrissons en contact avec des matelas de mousse pour enfants a conduit à une marge d’exposition d’environ 260. La comparaison de cette même DSENO (15 mg/kg pc/jour) et de l’estimation de l’ingestion par l’exposition intermittente par voie orale (1,0 × 10‑5 mg/kg pc/jour) des jeunes enfants (nourrissons et tout-petits) qui portent à leur bouche des articles manufacturés en mousse pour enfants a conduit à une marge d’exposition d’environ 106. Ces marges d’exposition sont jugées adéquates pour rendre compte des incertitudes de la base de données sur l’exposition et les effets sur la santé.
Des estimations de l’exposition quotidienne par absorption ont également été faites à l’aide de la dosimétrie inversée provenant d’études de biosurveillance américaines nationales et régionales (Ospinal et al., 2018; Butt et al. 2014; Hoffman et al. 2014) dans lesquelles les concentrations d’ATBB, comme biomarqueur du TBB, ont été mesurées dans des échantillons ponctuels d’urine. Bien que les estimations de l’absorption quotidienne tirées des données de biosurveillance soient associées à un certain nombre d’incertitudes (voir la section 10.1.3), la biosurveillance fournit une mesure directe de la dose interne du composé et reflète potentiellement l’absorption par toutes les voies d’exposition (NRC 2006). Les estimations de l’ingestion quotidienne de TBB basées sur la dosimétrie inversée des concentrations maximales d’ATBB 9 (ou au 95e centile) variaient de 1,07 × 10-5 à 3,62 × 10-5 mg/kg pc/jour. Il a été montré que ces concentrations sont variables, mais qu’elles sont globalement conformes aux estimations de l’exposition due aux milieux de l’environnement et à la nourriture.
Par conséquent, toutes les marges d’exposition sont jugées adéquates pour rendre compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
| Voie et durée de l’exposition | Source | Groupe d’âge | Exposition générale (mg/kg pc/jour) | ME basée sur une DSENO de 15 mg/kg pc/jour |
|---|---|---|---|---|
| Voie orale (voie principale) | Milieux naturels et aliments | Nourrisson (allaité) | 1,6 × 10-4 | ~ 93 300 |
| Voie cutanée (quotidienne) | Matelas en mousse pour enfants | Nourrisson | 1,7 × 10-2 à 5,8 × 10-2 | 260-7 900 |
| Voie orale (intermittente) | Articles manufacturés en mousse pour enfants | Nourrisson et tout-petit | 1,0 x 10-5 | 1 500 000 |
| Potentiellement toutes les voies (quotidiennes) | Potentiellement toutes les voies | Tout-petit | 1,07 × 10-5 (TBB seulement) | ~ 1 401 000 |
| Potentiellement toutes les voies (quotidiennes) | Potentiellement toutes les voies | Enfant (6 à 11 ans) | 1,38 x 10-5 (TBB seulement) | ~1 087 000 |
| Potentiellement toutes les voies (quotidiennes) | Potentiellement toutes les voies | Adolescent (12 à 19 ans) | 1,15 x 10-5 (TBB seulement) | ~1 304 000 |
| Potentiellement toutes les voies (quotidiennes) | Potentiellement toutes les voies | Adulte | 1,16 × 10-5 -3,63 × 10-5 (TBB seulement) | > 414 000 |
10.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Dans le présent rapport sur l’état des connaissances scientifiques, nous reconnaissons qu’il existe des incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
Les données empiriques canadiennes sur le TBB et le TBPH chez les poissons étaient très limitées. Aucune donnée sur le TBB et le TBPH dans les aliments du commerce en Amérique du Nord n’était disponible dans les principales publications. Par conséquent, l’hypothèse selon laquelle le poisson est la seule source d’exposition alimentaire (à l’exception du lait maternel) constitue une incertitude. L’estimation de l’exposition à certains articles manufacturés a été fondée sur les données de migration empiriques les plus élevées propres au mélange TBB/TBPH pour la mousse de polyuréthane souple recouverte d’un tissu de coton et de polyester. Cependant, même si la mousse était traitée par le mélange TBB/TBPH/organophosphate, seul le TBB a été mesuré dans cette étude, ce qui est une incertitude. L’ampleur de l’effet du recouvrement en tissu sur la migration du TBB et du TBPH est inconnue et est incertaine. De plus, il existe une incertitude dans l’utilisation d’une fourchette de valeurs d’absorption cutanée pour le TBB et le TBPH provenant de la mousse de polyuréthane souple dans le mobilier. Bien qu’on ait trouvé les valeurs d’absorption cutanée de chacune de ces deux substances (Frederiksen et al., 2016; Knudsen et al., 2016a), une absorption de 100 % a été retenue comme valeur limite supérieure de la fourchette pour tenir compte de la possibilité qu’il y ait des valeurs d’absorption plus élevées en raison d’effets inconnus de facteurs comme une peau recouverte, l’absorption de TBB et de TBPH combinés et différentes concentrations. Même si utiliser un taux d’absorption cutanée de 100 % entraîne probablement une surestimation de l’exposition, connaître le taux d’absorption de TBB et de TBPH ensemble serait très commode pour ce scénario. Les autres hypothèses formulées concernant la quantité de mélange de TBB/TBPH pouvant venir en contact direct avec la peau (p. ex., superficie exposée) sont également des incertitudes, mais elles entraînent probablement une surestimation de l’exposition (voir l’annexe G). Les estimations d’exposition par voie orale étaient basées sur l’étude de migration conçue pour une exposition par voie cutanée. Il existe donc des incertitudes en ce qui concerne la lixiviabilité de la salive et les taux de migration attribuables au comportement d’absorption orale. Bien que les scénarios prudents d’exposition par voie cutanée et orale aient été basés sur la mousse couverte (conformément à l’étude de migration), l’exposition à de la mousse non recouverte ne peut pas être exclue, ce qui représente une incertitude. La mousse est considérée comme un type de matière inapproprié pour l’évaluation de la limite supérieure d’exposition en raison de sa porosité et de son potentiel pour la migration de substances. Toutefois, il existe des incertitudes en ce qui concerne l’utilisation du TBB et du TBPH dans d’autres produits disponibles aux consommateurs sur le marché. Finalement, il existe également des incertitudes sur les données de biosurveillance utilisées en dosimétrie inversée qui étaient tirées d’études de biosurveillance américaines nationales et régionales.
La caractérisation des effets sur la santé comporte plusieurs incertitudes. La confiance dans la base de données sur les effets sur la santé est faible à modérée, étant donné qu’elle ne comporte pas de données sur les paramètres toxicologiques nécessaires à une évaluation exhaustive des risques. La base de données comprend des incertitudes en raison de différences entre les espèces et au sein d’une même espèce. Tel que susmentionné, aucune donnée sur la toxicité chronique ou la cancérogénicité du TBPH ou du TBB chez des animaux n’est disponible. Il existe peu de renseignements sur les effets à court terme ou les effets aigus du TBPH et du mélange TBB/TBPH. Il y a un manque de renseignements sur le métabolisme, le devenir et la biodisponibilité du TBPH et du TBB suite à une exposition cutanée ou à une exposition par ingestion ou par inhalation.
En ce qui concerne la caractérisation des risques, le présent rapport sur l’état des connaissances scientifiques est basé sur des études toxicologiques faites avec des rapports TBB/TBPH pouvant être différents de ceux qu’on retrouve dans les milieux de l’environnement et les produits disponibles aux consommateurs évalués dans le présent document. De plus, on ne peut exclure la possibilité que des produits commerciaux contenant différents rapports de ces substances puissent être disponibles sur le marché canadien.
11. Résultat
Compte tenu de tous les éléments de preuve contenus dans le présent rapport sur l’état des connaissances scientifiques, le TBB et le TBPH présentent un faible risque d’effets nocifs sur les organismes et sur l’intégrité globale de l’environnement.
Compte tenu de l’adéquation de la marge entre les estimations de la limite supérieure d’exposition dans les milieux de l’environnement ou par des produits disponibles aux consommateurs et les niveaux d’effets dans une étude sur la toxicité pour la reproduction portant sur deux générations, le potentiel du TBB et du TBPH de causer des effets nocifs sur la santé humaine est faible.
Bien que les niveaux d’exposition estimés actuels au TBB et au TBPH n’indiquent pas de danger pour l’environnement ou la santé humaine, il est important de reconnaître que ces substances sont des substances nouvelles, étant donné qu’elles ne sont pas inscrites sur la LIS et que, en vertu du Règlement sur renseignements concernant les substances nouvelles (substances chimiques et polymères), les conditions ministérielles imposent des pratiques de gérance pour prévenir leurs rejets dans l’environnement.
Des inquiétudes pourraient être soulevées si les quantités importées et utilisées au Canada venaient à augmenter ou si les conditions ministérielles n’étaient pas mises en œuvre.
Le TBB et le TBPH étant des produits de substitution commerciaux aux anciens composés ignifuges à grand volume, comme les polybromodiphényléthers (PBDE), et étant donné que le TBPH a un statut de composes à grand volume dans d’autres juridictions, il est possible que les quantités de ces produits augmentent au Canada. Étant donné que le TBB et le TBPH ne sont pas inscrits sur la LIS, ils continueront d’être soumis au Règlement sur renseignements concernant les substances nouvelles (substances chimiques et polymères) de la LCPE. Ceci permettra d’assurer la déclaration avant la mise en marché de toute nouvelle importation ou production de ces substances et permettra la mise en place d’autres restrictions, si nécessaire. De plus, la manière actuelle avec laquelle ces substances sont restreintes (p. ex. conditions sur l’utilisation, la manipulation, l’élimination et le rejet) en vertu du Règlement sur renseignements concernant les substances nouvelles (substances chimiques et polymères) restera en place, assurant ainsi que les rejets industriels seront réduits au minimum et que l’enregistrement des quantités et des utilisations de ces substances sera maintenu.
Références
Abbasi G, Saini A, Goosey E, Diamond ML. 2016. Product screening for sources of halogenated flame retardants in Canadian house and office dust. Sci. Total Environ. 545–546:299–307. [Disponible en anglais seulement]
Abraham, M.H., Chadha, H.S., Whiting, G.S., Mitchell, R.C. 1994. Hydrogen bonding. 32. An analysis of water-octanol and water-alkane partitioning and the ∆log P parameter of Seiler. J. Pharm. Sci. 83(8):1085-1100. [Disponible en anglais seulement]
ACD Percepta [module prévisionnel]. c1996-2014. Version 14.0. Toronto (Ont.) : Advanced Chemistry Development. [consulté en mai 2014]. [Disponible en anglais seulement]
Addison, K., Griffin, M.P., Moorman, J.R., Lake, D.E., O'Shea, T.M. 2009. Heart rate characteristics and neurodevelopmental outcome in low birth weight infants. J. Perinatol. 29(11):750-756. [Disponible en anglais seulement]
AEROWIN Program for Windows [modèle d’évaluation]. 2010. Version 1.00. Washington (DC): Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
Ali, N., Ali, L., Medhi, T., Dirtu, A.C., Al-Shammari, F., Neels, H., Covaci, A. 2013. Levels and profiles of organochlorines and flame retardants in car and house dust from Kuwait and Pakistan: Implication for human exposure via dust ingestion. Environ. Int. 55:62-70. [Disponible en anglais seulement]
Ali, N., Dirtu, A.C., Van den Eede, N., Goosey, E., Harrad, S., Neels, H., Mannetje, A., Coakley, J., Douwes, J., Covaci, A. 2012. Occurrence of alternative flame retardants in indoor dust from New Zealand: Indoor sources and human exposure assessment. Chemosphere 88:1276-1282. [Disponible en anglais seulement]
Ali, N., Harrad, S., Goosey, E., Neels, H., Covaci, A. 2011a. ″Novel″ brominated flame retardants in Belgian and UK indoor dust: Implications for human exposure. Chemosphere 83(10):1360-1365. [Disponible en anglais seulement]
Ali, N., Van den Eede, A.C., Dirtu, H., Covaci, A. 2011b. Assessment of human exposure to indoor organic contaminants via dust ingestion in Pakistan. Indoor Air 22:200-211. [Disponible en anglais seulement]
Allen, J.G., Stapleton, H.M., Vallarino, J., McNeely, E., McClean, M.D., Harrad, S.J., Rauert, C.B., Spengler, J.D. 2013. Exposure to flame retardant chemicals on commercial airplanes. Environ. Health 12:17. [Disponible en anglais seulement]
Andersson, P.L., Oberg, K., Orn, U. 2006. Chemical characterization of brominated flame retardants and identification of structurally representative compounds. Environ. Toxicol. Chem. 25(5):1275-1282. [Disponible en anglais seulement]
Arnot, J.A., Gobas, F.A.P.C. 2003a. Steady State BCF and BAF, v. 1.2. [Feuille de calcul Excel, basée sur Arnot, J.A., Gobas, F.A.P.C. 2003b.] [Disponible en anglais seulement]
Arnot, J.A., Gobas, F.A.P.C. 2003b. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345. [Disponible en anglais seulement]
Arnot, J.A., MacKay, D., Bonnell, M., Parkerton, T. 2008. A database of fish biotransformation rates. Environ. Toxicol. Chem. 27(11):2263-2270. [Disponible en anglais seulement]
Ash, M., Ash, I. 2003. Handbook of Paint and Raw Coating Materials. Synapse Information Resources, Inc., Endicott (NY). [Disponible en anglais seulement]
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’évaluation]. 2010. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
ASTreat Model [modèle sur l’élimination des usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (OH), É.-U. : Procter & Gamble Company. [consulté en mai 2014]. Disponible auprès de Procter & Gamble Company, C.P. 538707, Cincinnati (OH), 45253-8707, États-Unis. [Disponible en anglais seulement]
Aylward, L.L., Kirman, C.R., Adgate, J.L., McKenzie, L.M., Hays, S.M. 2012. Interpreting variability in population biomonitoring data: Role of elimination kinetics. Journal of Exposure Science and Environmental Epidemiology 22:398-408. [Disponible en anglais seulement]
Bartley, D.W., Siebecker, J.D., Falloon, S.B., inventeurs; Great Lakes Chemical Corporation, cessionnaire. 2007. Process for producing tetrabromobenzoate esters. United States patent 7307183 (B2). [Disponible en anglais seulement]
[BASL4] Biosolid-Amended Soil: Level IV model. 2011. Version 1.00. Peterborough (Ont.) : Université Trent, Canadian Environmental Modelling Centre. [consulté en mai 2014]. [Disponible en anglais seulement]
[BCFBAF] Bioaccumulation Program for Windows [modèle d’évaluation]. 2010. Version 3.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [database]. [modifié le 21 juin 2017]. Ottawa (Ont.) : gouvernement du Canada. [consulté le 24 avril 2014].
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. 2013. Santé Canada. [consulté le 24 avril 2014].
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [modifié le 10 août 2016]. Ottawa (Ont.) : gouvernement du Canada. [consulté le 24 avril 2014].
Bearr, J.S., Mitchelmore, C.L., Roberts, S.C., Stapleton, H.M. 2012. Species specific differences in the in vitro metabolism of the flame retardant mixture, Firemaster® BZ-54. Aquatic Toxicol. 124-125:41-47. [Disponible en anglais seulement]
Bearr, J.S., Stapleton, H.M., Mitchelmore, C.L. 2010. Accumulation and DNA damage in fathead minnows (Pimephales promelas) exposed to 2 brominated flame-retardant mixtures, Firemaster® 550 and Firemaster® BZ-54. Environ. Toxicol. Chem. 29(3):722-729. [Disponible en anglais seulement]
Bergman, Å., Rydén, A., Law, R.J., de Boer, J., Covaci, A., Alaee, M., Birnbaum, L., Petreas, M., Rose, M., Sakai, S. et al. 2012. A novel abbreviation standard for organobromine, organochlorine and organophosphorous flame retardants and some characteristics of the chemicals. Environ. Int. 49:57-82. [Disponible en anglais seulement]
[BERSE] Bureau d’évaluation du risque des substances existantes. 2014. Bureau d’évaluation du risque des substances existantes (BERSE), Santé Canada, Ottawa.
Beyer, B.K., Chernoff, N., Danielsson, B.R., Davis-Bruno, K., Harrouk, W., Hood, R.D., Janer, G., Liminga, U.W., Kim, J.H., Rocca, M., Rogers, J., Scialli, A.R. 2011. ILSI/HESI Maternal toxicity workshop summary: Maternal toxicity and its impact on study design and data interpretation. Birth Defects Res. (Part B) 92:36-51. [Disponible en anglais seulement]
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’évaluation]. 2010. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
Bohen, J.M., Mancuso, A.J., inventeurs; Atochem North America Inc., cessionnaire. 1991. High yield method for preparation of diakyl esters of polyhaloaromatic acids. United States patent 5049697. [Disponible en anglais seulement]
Bradman, A., Castorina, R., Gaspar, F., Nishioka, M., Colon, M., Weathers, W., Egeghy, P.P., Maddalena, R., Williams, J., Jenkins, P.L., McKone, T.E. 2014. Flame retardant exposures in California early childhood education environments. Chemosphere 116:61-66. [Disponible en anglais seulement]
Breivik, K., Wania, F., Muir, D.C.G., Alaee, M., Backus, S., Pacepavicius, G. 2006. Empirical and modeling evidence of the long-range atmospheric transport of decabromodiphenyl ether. Environ. Sci. Technol. 40(15):4612-4618. [Disponible en anglais seulement]
Butt, C., Congleton, J., Hoffman, K., Fang, M., Stapleton, M. 2014. Metabolites of organophosphate flame retardants and 2-ethylhexyl tetrabromobenzoate in urine from paired mothers and toddlers. Environ. Sci. Technol. 48(17):10432-10438. [Disponible en anglais seulement]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada. 2002. Condition ministérielle no 11173 [PDF], ministère de l’Environnement. Gazette du Canada, Partie I, vol. 136, no 24, p. 1780-1781 [consulté le 15 juin 2002.]
Canada. 2003. Condition ministérielle no 11910 [PDF], ministère de l’Environnement. Gazette du Canada, Partie I, vol. 137, no 44, 1er novembre 2003, p. 3426-3427.
Canada. 2005. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles (substances chimiques et polymères). C.P. 2005-1484, DORS/2005-247. [consulté le 31 août 2005.]
Canada. 2006. Condition ministérielle no 13961 [PDF], ministère de l’Environnement. Gazette du Canada, Partie I, vol. 140, no 18, p. 972-974. [consulté le 6 mai 2006.]
Canada. 2010. Condition ministérielle no 15926 [PDF], ministère de l’Environnement. Gazette du Canada, Partie I, vol. 144, no 28, p. 1878-1880. [consulté le 10 juillet 2010.]
Canada. 2011. Condition ministérielle no 8720 [PDF], ministère de l’Environnement. Gazette du Canada, Partie I, vol. 145, no 38, p. 2986-2988. [consulté le 17 septembre 2011.]
Canada. Ministère de l’Environnement. 2013. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances ignifuges organiques. Gazette du Canada, Partie I, vol. 147, no 13, p. 613-633.
Canada. Ministère de l’Environnement, ministère de la Santé. 2011. Loi canadienne sur la protection de l’environnement (1999) : Annonce de mesures prévues d’évaluation et de gestion, le cas échéant, des risques que certaines substances présentent pour la santé des Canadiens et l’environnement. Gazette du Canada, Partie I, vol. 145, no 41, annexe.
Carignan, C.C., Heiger-Bernays, W., McClean, M.D., Roberts, S.C., Stapleton, H.M., Sjodin, A., Webster, T.F. 2013. Flame retardant exposure among collegiate United States gymnasts. Environ. Sci. Technol. 47(23):13848-13856. [Disponible en anglais seulement]
CATALOGIC [modèle informatique]. 2013. Version 5.11.6. Bourgas, Bulgarie : Université Prof. Assen Zlatarov, Laboratory of Mathematical Chemistry. [consulté en mai 2014]. [Disponible en anglais seulement]
CCE. 2015. Amélioration des connaissances trilatérales sur les ignifugeants et leur utilisation dans les produits manufacturés : Analyse de certains ignifugeants contenus dans les meubles de bureau et de maison. Montréal, Canada : Commission de coopération environnementale. 16 p.
[CEH] Center for Environmental Health. 2013a. Playing on poisons: harmful flame retardants in children's furniture [PDF]. [Disponible en anglais seulement]
[CEH] Center for Environmental Health. 2013b. Naptime nightmares: toxic flame retardants in child care nap mats. [Disponible en anglais seulement]
Chemtura Corporation. 2007a. DP-45™ Technical Data Sheet [PDF]. West Lafayette (IN) : Chemtura Corporation. [Disponible en anglais seulement]
Chen, D., Martin, P., Burgess, N.M., Champoux, L., Elliott, J.E., Forsyth, D.J., Idrissi, A., Letcher, R.J. 2013. European starlings (sturnus vulgaris) suggest that landfills are an important source of bioaccumulative flame retardants to Canadian terrestrial ecosystems. Environ. Sci. Technol. 47(21):12238-12247. [Disponible en anglais seulement]
[CIPR].Commission internationale de protection radiologique. 2003. Basic anatomical and physiological data for use in radiological protection: Reference values. ICRP Publication 89. Ann. ICRP 32(3-4). [Disponible en anglais seulement]
Clark, B., Henry, J.G., Mackay, D. 1995. Fugacity analysis and model of organic-chemical fate in a sewage-treatment plant. Environ. Sci. Technol. 29:1488-1494. [Disponible en anglais seulement]
Commission européenne. 2004. Guidance Document on Dermal Absorption [PDF] (SANCO/222/2000 rev. 7, 19 mars 2004). [Disponible en anglais seulement]
Commission européenne. 2011. Identification and evaluation of data on flame retardants in consumer products. Rapport final. Bruxelles, Belgique : préparé pour la Commission européenne, Direction générale de la Santé et sécurité alimentaire, par ARCADIS Belgium, Contract no. 170 202/09/549 040. [Disponible en anglais seulement]
Communication personnelle. 2014. Bureau de la science de la santé environnementale et de la recherche, Santé Canada.
Covaci, A., Harrad, S., Abdallah, M.A.E., Ali, N., Law, R.J., Herzke, D., de Wit C.A. 2011. Novel brominated flame retardants: A review of their analysis, environmental fate and behaviour. Environ. Int. 37(2):532-56. [Disponible en anglais seulement]
Davis, E.F., Klosterhaus, S.L., Stapleton, H.M. 2012. Measurement of flame retardants and triclosan in municipal sewage sludge and biosolids. Environ. Int. 40(1):1-7. [Disponible en anglais seulement]
Davis, E.F., Stapleton, H.M. 2009. Photodegradation pathways of nonabrominated diphenyl ethers, 2-ethylhexyltetrabromobenzoate and di(2-ethylhexyl)tetrabromophthalate: identifying potential markers of photodegradation. Environ. Sci. Technol. 43(15):5739-5746. [Disponible en anglais seulement]
De Jourdan, B., Oakes, K., Hanson, M., Sibley, P., Servos, M., Muir, D., Solomon, K. 2012. Physiological effects of 3 non-pbde brominated flame retardants on pimephales promelas (fathead minnow) exposed in outdoor mesocosms. Environmental Pollution and Ecotoxicology, p. 55-66. [Disponible en anglais seulement]
De Jourdan, B.P., Hanson, M.L., Muir, C.G.D., Solomon, K.R. 2013. Environmental fate of three novel brominated flame retardants in aquatic mesocosms. Environ. Toxicol. Chem. 32(5):1060-1068. [Disponible en anglais seulement]
De Jourdan, B.P., Hanson, M.L., Muir, C.G.D., Solomon, K.R. 2014. Fathead minnow (pimephales promelas rafinesque) exposure to three novel brominated flame retardants in outdoor mesocosms: bioaccumulation and biotransformation. Environ. Toxicol. Chem. 33(5):1148-55. [Disponible en anglais seulement]
Diamond, M., Goosey, E., Saini, A., Chaudhuri, S. 2013. Assessment of the prevalence and exposure to the new flame retardants (NFRs) in Canadian indoor environments. Rapport préparé pour Santé Canada. Diamond Environmental Research Group, Université de Toronto. (Rapport inédit) [Disponible en anglais seulement]
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531-554. [Disponible en anglais seulement]
Dirtu, A.C., Ali, N., Van den Eede, N., Neels, H., Covaci, A. 2012.Country specific comparison for profile of chlorinated, brominated and phosphate organic contaminants in indoor dust. Case study for Eastern Romania, 2010. Environ. Int. 49:1-8. [Disponible en anglais seulement]
[DNV] The Norwegian Veritas AS. 2010. Moskeland, T. Environmental screening of selected "new" brominated flame retardants and selected polyfluorinated compounds 2009. Agence norvégienne du climat et de la pollution (KLIF). [Disponible en anglais seulement]
Dodson, R.E., Perovich, L.J., Covaci, A., Van den Eede, N., Ionas, A.C., Dirtu, A.C., Brody, J.G., Rudel, R.A. 2012. After the PBDE Phase-Out: A Broad Suite of Flame Retardants in Repeat House Dust Samples from California. Environ. Sci. Technol. 46(24):13056-13066. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2013-2014. Données sur le Groupe de certaines substances ignifuges organiques, collectées en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances ignifuges organiques. Données préparées par Environnement et Changement climatique Canada, Santé Canada; Programme des substances existantes.
[ECCC] Environnement et Changement climatique Canada. 2018. Supporting Documentation: Information in support of the State of the Science report for Benzoic acid, 2,3,4,5-tetrabromo-, 2-ethylhexyl ester and 1,2-Benzenedicarboxylic acid, 3,4,5,6-tetrabromo-, bis(2-ethylhexyl) ester. Gatineau (QC) : ECCC. Disponible sur demande : substances@ec.gc.ca. [Disponible en anglais seulement]
[ECHA] Agence européenne des produits chimiques. c2007-2013. Registered Substances database. Résultats de recherche portant sur CAS RN 26040-51-7. Helsinki (Finlande) : Agence européenne des produits chimiques. [mis à jour le 24 janvier 2014; consulté le 4 février 2014]. [Disponible en anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2010. Guidance on information requirements and chemical safety assessment. Chap. R.16: Environmental exposure estimation. Mai 2010. Guidance for the implementation of REACH. Helsinki (Finlande) : Agence européenne des produits chimiques. [Disponible en anglais seulement]
[ECHA]. Agence européenne des produits chimiques. 2013. bis(2-ethylhexyl) tetrabromophthalate. CAS RN 26040-51-7. Substance dossier. [consulté en mai 2014]. [Disponible en anglais seulement]
[ECOSAR] Ecological Structure Activity Relationships Class Program [modèle d’évaluation]. 2012. Version 1.11. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
[EFSA] Autorité européenne de sécurité des aliments. 2012. Groupe scientifique sur les contaminants de la chaîne alimentaire (CONTAM). 2012. Scientific Opinion on Emerging and Novel Brominated Flame Retardants (BFRs) in Food. EFSA Journal 10(10):2908. [Disponible en anglais seulement]
Egloff, C., Crump, D., Chiu, S., Manning, G., McLaren, K.K., Cassone, C.G., Letcher, R.J., Gauthier, L.T., Kennedy, S.W. 2011. In vitro and in ovo effects of four brominated flame retardants on toxicity and hepatic mRNA expression in chicken embryos. Toxicol. Lett. 207(1):25-33. [Disponible en anglais seulement]
Environnement Canada. 2000-2014. Données inédites et confidentielles pour Firemaster BZ-54, Firemaster 550, Pyronil 45, DP-45, et Uniplex FRP45, présentées à Environnement Canada en vertu de la Loi canadienne sur la protection de l’environnement : Règlement sur les renseignements concernant les substances nouvelles. Gatineau (Qc) : Environnement Canada.
Environnement Canada. 2007. Document d’orientation sur les méthodes statistiques applicables aux essais d’écotoxicité [en ligne]. Ottawa (Ont.) : Section de l’élaboration des méthodes et des applications, Centre de technologie environnementale, Environnement Canada. 283 p. Rapport SPE 1/RM/46.
Environnement Canada. 2013. L’utilisation judicieuse de l’eau. Ottawa (Ont.), gouvernement du Canada. Archivé [consulté en novembre 2014].
Environnement Canada, Santé Canada. 2007. Substances chimiques : Catégorisation [en ligne]. Ottawa (Ont.) : gouvernement du Canada. [mis à jour le 25 mai 2013; consulté le 31 juillet 2013].
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’évaluation]. 2000-2012. Version 4.1. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Université Trent, Canadian Environmental Modelling Centre. [consulté en mai 2014]. [Disponible en anglais seulement]
Escher, B.I., Ashauer, R., Dyer, S., Hermens, J.L.M., Lee, J.H., Leslie, H.A., Mayer, P., Meador, J.P., Warne, M.S.J. 2011. Integr. Environ. Assess. Manag. 7(1):28-49. [Disponible en anglais seulement]
[EURAR] European Union Risk Assessment Report 2008 [PDF]. CAS 117-81-7. Bis(2-ethylhexyl)phthalate (DEHP). Bureau Européen des Substances Chimiques. [Disponible en anglais seulement]
[EU] Union européenne. 2008. European Union risk assessment report: Tris(2-chloro-1-methylethyl) phosphate (TCPP) [PDF]. Luxembourg : Office des publications de l’Union européenne. 408 p. CAS : 13674-84-5 [consulté en mai 2014]. [Disponible en anglais seulement]
Fic, A., Žegura, B., Gramec, D., Mašič, L.P. 2014. Estrogenic and androgenic activities of TBBA and TBMEPH, metabolites of novel brominated flame retardants, and selected bisphenols, using the XenoScreen XL YES/YAS assay.Chemosphere 112:362-369. [Disponible en anglais seulement]
Frederiksen M, Vorkamp K, Jensen NM, Sørensen JA, Knudsen LE, Sørensen LS, Webster TF, Nielsen JB. 2016. Dermal uptake and percutaneous penetration of ten flame retardants in a human skin ex vivo model. Chemosphere 162:308-314. [Disponible en anglais seulement]
Gentes, M., Letcher, R.J., Caron-Beaudoin, E., Verreault, J. 2012. Novel flame retardants in urban-feeding ring-billed gulls from the St. Lawrence River, Canada. Environ. Sci. Technol. 46(17):9735-9744. [Disponible en anglais seulement]
Gobas, F.A.P.C., Kelly, B.C., Arnot, J.A. 2003. Quantitative Structure Activity Relationships for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb. Sci. 22:346-351. [Disponible en anglais seulement]
Gobas, F.A.P.C. 2007. Development and review of a generic water-sediment modeling framework for organic chemicals. Rapport préparé pour Environnement Canada. Burnaby (C.-B.) : Université Simon Fraser, Faculté d’environnement. 26 mars 2007. [Disponible en anglais seulement]
Gobas, F.A.P.C. 2010. Comments on approach to sediment exposure approach. Rapport préparé pour Environnement Canada. Burnaby (C.-B.) : Université Simon Fraser, Faculté d’environnement. 25 mars 2010. [Disponible en anglais seulement]
Gouin, T., Thomas, G.O., Chaemfa, C., Harner, T., Mackay, D., Jones, K.C. 2006. Concentrations of decabromodiphenyl ether in air from Southern Ontario: Implications for particle-bound transport. Chemosphere 64(2):256-261. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1997a. CN-2065: Physicochemical properties. 9 décembre 1997. Huntingdon Life Sciences Ltd. Study # GLC 037/970940. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1997b. CN-2065: Abiotic degradation: hydrolysis as a function of pH. 3 septembre 1997. Huntingdon Life Sciences Ltd. Study # GLC 042/970941. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1998a. CN-2065 : Ready biodegradability (closed bottle test). 8 janvier 1998. Huntingdon Life Sciences Ltd. Study # GLC 36/973741. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1998b. CN-2065: Acute toxicity to Daphnia magna. 29 avril 1998. Huntingdon Life Sciences Ltd. Study # GLC 33/973259. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1998c. CN-2065: Acute toxicity for Rainbow trout. 29 avril 1998. Huntingdon Life Sciences Ltd. Study # GLC 32/973376. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 1998d. CN-2065: Algal growth inhibition. 29 avril 1998. Huntingdon Life Sciences Ltd. Study # GLC 34/972950. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 2002. Porous pot test method for assessing the biodegradability of CN-2065 during wastewater treatment simulation. 8 mai 2002. Wildlife International Ltd. Project # 298E-101A. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 2003a. CN-2699: Shake flask die-away test. 21 février 2003. Wildlife International Ltd. Project # 298E-103. [Disponible en anglais seulement]
Great Lakes Chemical Corporation. 2003b. CN-2699: A flow-through bioconcentration test with the rainbow trout (Oncorhynchus mykiss). 9 avril 2003. Wildlife International Ltd. Project # 298A-114. [Disponible en anglais seulement]
Great Lakes Solutions. c2014a. Firemaster BZ-54 : Product Overview [en ligne]. West Lafayette (IN) : Chemtura. [consulté en mai 2014, archivé]. [Disponible en anglais seulement]
Great Lakes Solutions. c2014b. Firemaster 550 : Product Overview. West Lafayette (IN) : Chemtura. [consulté en mai 2014, archivé]. [Disponible en anglais seulement]
Great Lakes Solutions. c2014c. Firemaster DP-45: Product Overview [en ligne]. West Lafayette (IN) : Chemtura. [consulté en mai 2014, archivé]. [Disponible en anglais seulement]
Guerra, P., Alaee, M., Eljarrat, E., Barcelo, D. 2011. Introduction to Brominated Flame Retardants: Commercial Products, Applications, and Physicochemical Properties. In Eljarrat, E., Barceló, D., éds. 2011. Brominated Flame Retardants. Série : The Handbook of Environmental Chemistry, vol 16, Heidelberg (Berlin), Allemagne :Springer, 290 p. [Disponible en anglais seulement]
Guerra, P., Alaee, M., Jiménez, B., Paoepavicius, G., Marvin, C., Madnnis, G., Eljarrat, E., Barcelò, D., Champoux, L., Fernie, K. 2012. Emerging and historical brominated flame retardants in peregrine falcon (Falco peregrinus) eggs from Canada and Spain. Environ. Int. 40(1):179-186. [Disponible en anglais seulement]
Harju, M., Heimstad, E.S., Herzke, D., Sandanger, T., Posner, S., Wania, F. 2009. Current state of knowledge and monitoring requirements - Emerging "new" brominated flame retardants in flame retarded products and the environment [PDF]. Oslo (Norvège) : Autorité norvégienne de contrôle de la pollution. 113 p. Report No. TA-2462/2008 [consulté en mai 2014]. [Disponible en anglais seulement]
Hays S.M., Kirman C.R. 2017. Risk assessment and biomonitoring equivalent for 2-ethylhexyl-2,3,4,5 tetrabromobenzoate (TBB) and tetrabromobenzoic acid (TBBA). Regulatory Toxicology and Pharmacology. 89:186-192. [Disponible en anglais seulement]
Hazelton. 1986 (Project: 20988). Mutagenicity evaluation of CN-322. Hazelton Biotechnologies Company, Kensington (MD), USA. [Disponible en anglais seulement]
He, S., Li, M., Jin, J., Wang, Y., Bu, Y., Xu, M., Yang, X., Liu, A. 2013. Concentrations and trends of halogenated flame retardants in the pooled serum of residents of Laizhou Bay, China. Environ. Toxicol. Chem. 32(6):1242-1247. [Disponible en anglais seulement]
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d’évaluation]. 2011. Version 3.20. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014.] [Disponible en anglais seulement]
Hill, J.E., Favstritsky, N.A., Mamuzic, R.L., Bhattacharya, B., inventeurs; Great Lakes Chemical Corporation, cessionnaire. 10 juin 1997. One-pot synthesis of ring-brominated benzoate compounds. United States patent 5637757. [Disponible en anglais seulement]
Hoffman, K., Fang, M., Horman, B., Patisaul, H.B., Garantziotis, S., Birnbaum, L.S., Stapleton, H.M. 2014. Urinary tetrabromobenzoic acic (TBBA) as a biomarker of exposure to the flame retardant mixture Firemaster 550. Environ. Health Perspect. 122(9):963-969. [Disponible en anglais seulement]
Houde, M., Berryman, D., de Lafontaine, Y., Verreault, J. 2014. Novel brominated flame retardants and dechloranes in three fish species from the St. Lawrence River, Canada. Sci. Total Environ. 479-480(1):48-56. [Disponible en anglais seulement]
[HPVIS] High Production Volume Information System [base de données sur Internet]. 2012. USEPA [mis à jour le 3 février 2014]. [Disponible en anglais seulement]
Huang, T.L., Shiotsuki, T., Uematsu, T., Borhan, B., Li, Q.X., Hammock, B.D. 1996. Structure- activity relationships for substrates and inhibitors of mammalian liver microsomal carboxylesterases. Pharm. Res. 13:493-506. [Disponible en anglais seulement]
Huntingdon Life Sciences Ltd. 1996d. CN-2065 Acute Oral Toxicity to the Rat (Report No: GLC29/961902/AC). Huntingdon, Royaume-Uni : Huntingdon Life Sciences Ltd (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
Huntingdon Life Sciences Ltd. 1997a. CN-2065 Bacterial Mutation Assay (Report: GLC 38/97 612). Huntingdon, Angleterre : Huntingdon Life Sciences Ltd (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
Huntingdon Life Sciences Ltd. 1997 b. CN-2065 In Vitro Mammalian Chromosome Aberration Test in Human Lymphocytes (Report : GLC 39/971448). Huntingdon, Angleterre : Huntingdon Life Sciences Ltd (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
Huntingdon Life Sciences Ltd. 1999c. Firemaster BZ-54 Skin Sensitisation to the Guinea-pig (Magnusson & Kligman Method) (Report: GLC 081/984927/SS). Huntingdon, Angleterre : Huntingdon Life Sciences Ltd (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
[HYDAT] Base de données HYDAT. 2013. Environnement Canada, Relevés hydrologiques du Canada. [mis à jour le 8 juillet 2013; consulté en mai 2014]. [Disponible en anglais seulement]
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
Iqaluit 2010. 2010. Archivée - À propos du Nunavut. Gouvernement du Canada. [Disponible en anglais seulement]
Jadlocki, J.F., Seckar, J.A. 1987. Acute oral toxicity test in the rat. March 11, 1987. Pennwalt Corporation. Life Science Research Ltd. Study # 86/PTC013/634. [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Johnson, P.I., Stapleton, H.M., Mukherjee, B., Hauser, R., Meeker, J.D. 2013. Associations between brominated flame retardants in house dust and hormone levels in men. Sci. Total Environ. 445-446:177-184. [Disponible en anglais seulement]
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem. 23(10):2324-2336. [Disponible en anglais seulement]
Kelly, B.C., Ikonomou, M.G., Blair, J.D., Morin, A.E., Gobas, F.A.P.C. 2007. Food web-specific biomagnification of persistent organic pollutants. Science 317(5835):236-239. [Disponible en anglais seulement]
Klosterhaus, S.L., Stapleton, H.M., La Guardia, M.J., Greig, D.J. 2012. Brominated and chlorinated flame retardants in San Francisco Bay sediments and wildlife. Environ. Int. 47:56-65. [Disponible en anglais seulement]
Knudsen, G.A., Sanders, J.M., Birnbaum, L. 2014. Biological fates of flame retardants, 2-ethylhexyl tetrabromobenzoate and Bis(2-ethylhexyl tetrabromophthalate), in female Sprague Dawley rats. NCI, NIEHS, RTP (NC), É.-U. (Étude inédite). [Disponible en anglais seulement]
Knudsen, G.A., Hughes, M.F., Sanders, J.M., Hall, S.M., Birnbaum, L.S. 2016a. Estimation of human percutaneous bioavailability for two novel brominated flame retardants, 2-ethylhexyl 2,3,4,5-tetrabromobenzoate (EH-TBB) and bis(2-ethylhexyl) tetrabromophthalate (BEH-TEBP). Toxicol. Appl. Pharmacol. 311:117-127. [Disponible en anglais seulement]
Knudsen, G.A., Sanders, J.M., Birnbaum, L.S. 2016b. Disposition of the emerging brominated flame retardant, 2-ethylhexyl 2,3,4,5-tetrabromobenzoate, in female SD rats and Male B6C3F1 mice: Effects of dose, route and repeated administration. Toxicological Sciences. 154(2):392-402. [Disponible en anglais seulement]
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 1.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’évaluation]. 2010. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
[KOWWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 1.68. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
La Guardia, M.J., Hale, R.C., Harvey, E., Chen, D. 2010. Flame-retardants and other organohalogens detected in sewage sludge by electron capture negative ion mass spectrometry. Environ. Sci. Technol. 44(12):4658-4664. [Disponible en anglais seulement]
La Guardia, M.J., Hale, R.C., Harvey, E., Mainor, T.M., Ciparis, S. 2012. In situ accumulation of hbcd, pbdes, and several alternative flame-retardants in the bivalve (corbicula fluminea) and gastropod (elimia proxima). Environ. Sci. Technol. 46(11):5798-5805. [Disponible en anglais seulement]
La Guardia, M.J., Hale, R.C., Newman, B. 2013. Brominated flame-retardants in Sub-Saharan Africa: Burdens in Inland and coastal sediments in the eThekwini metropolitan municipality, South Africa. Environ. Sci. Technol. 47(17):9643-9650. [Disponible en anglais seulement]
Lakind, J.S., Naiman, D.Q. 2008. Bisphenol A (BPA) daily intakes in the United States: Estimates from the 2003-2004 NHANES urinary BPA data. Journal of Exposure Science and Environmental Epidemiology 18:608-615. [Disponible en anglais seulement]
Lam, J.C.W., Lau, R.K.F., Murphy, M.B., Lam, P.K.S. 2009. Temporal trends of hexabromocyclododecanes (HBCDs) and polybrominated diphenyl ethers (PBDEs) and detection of two novel flame retardants in marine mammals from Hong Kong, South China. Environ. Sci. Technol. 43(18):6944-6949. [Disponible en anglais seulement]
Lee, S.C., Sverko, E., Harner, T., Schachtschneider, J., Zaruk, D., DeJong, M., Barresi, E. 2010. "New" flame retardants in the global atmosphere under the GAPS Network. Toronto (Ont.) : Environnement Canada, Direction des sciences et de la technologie atmosphérique; Burlington (Ont.) : Environnement Canada, Direction de la science et de la technologie de l’eau. Résumé présenté lors du 5th International Symposium on Brominated Flame Retardants in Kyoto, à Kyoto (Japon), en avril 2010. [Disponible en anglais seulement]
Lentner, C. (éd.). 1981. Geigy scientific tables volume 1: Units of measurement, body fluids, composition of the body, nutrition. 8e éd. Bâle (Suisse) : Ciba-Geigy Ltd. [Disponible en anglais seulement]
Lim, R.P. 2003. Toxicity of Firemaster BZ-54 to the cladoceran, daphnia carinata. Rapport d’étude préparé pour International Sales and Marketing PTY Ltd., au nom de accessUTS Ltd. (Université de technologie de Sydney). Project number C02/62/008. [Disponible en anglais seulement]
Mackay, D., Hughes, D.M., Romano, M.L., Bonnell, M. 2014. The role of persistence in chemical evaluations. Integr. Environ. Assess. Manag. Article accepté. [Disponible en anglais seulement]
Ma, Y., Salamova, A., Venier, M., Hites, R.A. 2013. Has the Phase-Out of PBDEs Affected Their Atmospheric Levels? Trends of PBDEs and Their Replacements in the Great Lakes Atmosphere. Environ. Sci. Technol. 47(20):11457-11464. [Disponible en anglais seulement]
Ma, Y., Venier, M., Hites, R.A. 2012. 2-ethylhexyl tetrabromobenzoate and bis(2-ethylhexyl) tetrabromophthalate flame retardants in the great lakes atmosphere. Environ. Sci. Technol. 46(1):204-208. [Disponible en anglais seulement]
Mackay D, Hughes DM, Romano ML, Bonnell M. 2014. The role of persistence in chemical evaluations. Integr. Environ. Assess. Manag. 10(4): 588-594. [Disponible en anglais seulement]
McCarty, L.S. 1986. The relationship between aquatic toxicity QSARs and bioconcentration for some organic chemicals. Environ. Toxicol. Chem. 5(12):1071-1080. [Disponible en anglais seulement]
McCarty, L.S. 1987a. Relationship between toxicity and bioconcentration for some organic chemicals: I Examination of the relationship. In: Kaiser, K.L.E. (éd.) QSAR in Environmental Toxicology-II. Dordecht, Pays-Bas : D Reidel Publishing Co. p. 207-220. [Disponible en anglais seulement]
McCarty, L.S. 1987b. Relationship between toxicity and bioconcentration for some organic chemicals: II Application of the relationship. In: Kaiser, K.L.E. (éd.) QSAR in Environmental Toxicology-II. Dordecht, Pays-Bas : D Reidel Publishing Co. p. 221-229. [Disponible en anglais seulement]
McCarty, L.S. 1990. A kinetics-based analysis of quantitative structure-activity relationships in aquatic toxicity and bioconcentration bioassays with organic chemicals. Thèse de doctorat. Université de Waterloo, Waterloo (Ont.), Canada. [Disponible en anglais seulement]
McCarty, L.S., Arnot, J.A., Mackay, D. 2013. Evaluation of critical body residue for acute narcosis in aquatic organisms. Environ. Toxicol. Chem. 32(10):2301-2314. [Disponible en anglais seulement]
McCarty, L.S., Hudson, P.V., Craig, G.R., Kaiser, K.L.E. 1985. The use of quantitative structure-activity relationships to predict the acute and chronic toxicities of organic chemicals to fish. Environ. Toxicol. Chem. 4(5):595-606. [Disponible en anglais seulement]
McCarty, L.S., Mackay, D. 1993. Enhancing ecotoxicological modeling and assessment: critical body residues and modes of toxic action. Environ. Sci. Technol. 27:1719-1728. [Disponible en anglais seulement]
McCarty, L.S., Mackay, D., Smith, A.D., Ozburn, G.W., Dixon, D.G. 1991. Interpreting aquatic toxicity QSARs: the significance of toxicant body residues at the pharmacologic endpoint. Science of the Total Environment, Édition spéciale : « QSAR in Environ Toxicol. » 109:515-525. [Disponible en anglais seulement]
McGee, S.P., Konstantinov, A., Stapleton, H.M., Volz, D.C. 2013. Aryl phosphate esters within a major pentaBDE replacement product induce cardiotoxicity in developing zebrafish embryos: Potential role of the aryl hydrocarbon receptor. Tox. Sci. 133(1):144-156. [Disponible en anglais seulement]
Melymuk, L., Robson, M., Csiszar, S.A., Helm, P.A., Kaltenecker, G., Backus, S., Bradley, L., Gilbert, B., Blanchard, P., Jantunen, L., Diamond, M.L.. 2014. From the City to the Lake: Loadings of PCBs, PBDEs, PAHs and PCMs from Toronto to Lake Ontario. Environ Sci Technol. 48:3732-3741. [Disponible en anglais seulement]
Mochungong, P., Abbasi, G., Diamond, M.L., Zhu, J. 2014. Polybrominated diphenyl ethers and alternative brominated flame retardants in furniture and electric and electronic devices collected from the Greater Toronto Area, Canada. Manuscrit inédit. 20 p. [Disponible en anglais seulement]
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 1.43. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
MPI Research, Inc. 2008a. An oral two-generation reproduction and fertility study in rats. Study number 1038-008. [consulté le 29 septembre 2008]. [Disponible en anglais seulement]
MPI Research, Inc. 2008b. Prenatal developmental toxicity study in rats. Study number 1038-006. [consulté le 20 août 2008]. [Disponible en anglais seulement]
Muir, D.C.G., Teixeira, C.F., Epp, J., Young, T., Wang, X., Keir, M., Backus, S. 2011. Bioaccumulation of selected halogenated organic flame retardants in remote lakes and in the Great Lakes. Burlington (Ont.) : Environnement Canada, Division de la recherche sur la protection des écosystèmes aquatiques; Division du Monitoring et de la surveillance de la qualité des eaux douces. Affiche présentée lors du 32nd Annual SETAC North America Meeting, à Boston (MA). [consulté en novembre 2011]. [Disponible en anglais seulement]
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2014. Issue 1. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. [consulté en mai 2014]. [Disponible en anglais seulement]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2004. Full public report: Firemaster BZ-54 [DOC]. Canberra, Australie : NICNAS. 37 p. Report No.: STD/649 [consulté en mai 2014]. [Disponible en anglais seulement]
Niino, T., Ishibashi, T., Ishiwata, H., Takeda, K., Onodera, S. 2003. Characterization of human salivary esterase in enzymatic hydrolysis of phthalate esters. J. Health Sci. 49:76-81. [Disponible en anglais seulement]
Norris, B., Smith, S. 2002. Research into the mouthing behaviour of children up to 5 years old. Bureau de la consommation et de la concurrence [traduction], ministère britannique du commerce et de l’industrie [traduction]. Cité dans Exposure Factors Handbook, US EPA, 2011. [Disponible en anglais seulement]
[NRC] National Research Council (É.-U.). 2006. Human Biomonitoring for Environmental Chemicals. Washington (DC) : The National Academies Press. [consulté en décembre 2014]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2004. Emission scenario document on textile finishing industry [PDF]. Paris, France : Organisation de coopération et de développement économiques, Direction de l’environnement. Report No. : ENV/JM/MONO(2004)12, JT00166691. [consulté en mai 2014]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2009a. OECD Pov and LRTP Screening Tool [en ligne]. Version 2.2. Paris, France : Organisation de coopération et de développement économiques. Modèle de logiciel estimating overall persistence (Pov) and long-range transport potential (LRTP) of organic chemicals. [consulté en mai 2014]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2009 b. Emission scenario document on plastic additives [PDF]. Paris, France : Organisation de coopération et de développement économiques, Direction de l’environnement. Series on Emission Scenario Documents No. 3. Report No. ENV/JM/MONO(2004)8/REV1. JT03267870. [consulté en mai 2014]. [Disponible en anglais seulement]
Ospina, M., Jayatilaka, N.K., Wong, L.-Y., Restrepo, P., Calafat, A.M. 2018. Exposure to organophosphate flame retardant chemicals in the U.S. general population: Data from the 2013-2014 National Health and Nutrition Examination Survey [including supplementary information]. Environment International. 110:32-41. [Disponible en anglais seulement]
Parkerton, T.F., Konkel, W.J. 2000. Application of quantitative structure-activity relationships for assessing the aquatic toxicity of phthalate esters. Ecotox. Environ. Safety 45:61-78. [Disponible en anglais seulement]
Pelletier, M., Verreault, J., Backus, S. 2013. Données inédites de surveillance sur les sédiments issues du Plan de gestion des produits chimiques. Présenté à la Division des évaluations écologiques d’Environnement Canada, Gatineau (Qc).
Pennwalt Corporation. 1987a. Assessment of clastogenic action on bone marrow erythrocytes in the micronucleus test. 28 juillet 1987. Life Science Research, Ltd. Study # 87/PSV001/300 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987b. Assessment of mutagenic potential in histidine auxotrophs of Salmonella typhimurium (The Ames test). 8 janvier 1987. Life Science Research, Ltd. Study # 86/PTC018/601 [cité dans HVPIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987c. In vitro assessment of the clastogenic activity of RC9927 in cultured human lymphocytes. 18 mars 1987. Life Science Research, Ltd. Study # 87/PTC017/004 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987d. Acute eye irritation/corrosion in the rabbit. 21 janvier 1987. Life Science Research, Ltd. Study # 86/PTC016/686 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987e. Acute dermal irritation/corrosion test in the rabbit. 21 janvier 1987. Life Science Research, Ltd. Study # 86/PTC015/682 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987f. Delayed contact hypersensitivity study in guinea pigs. 6 mars 1987. Life Science Research, Ltd. Study # 87/PTC012/056 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1987h. Acute percutaneous toxicity in the rabbit. 21 janvier 1987. Life Science Research, Ltd. Study # 86/PTC014/676 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1988. Toxicity study by dietary administration to CD rats for four weeks. 7 avril 1988. Life Science Research, Ltd. Study # 87/PSV003/926 [cité dans HPVIS, ECHA]. [Disponible en anglais seulement]
Pennwalt Corporation. 1989a. Pyronil 45: Assessment of its ready biodegradability (modified Sturm test). 10 juillet 1989. Life Science Research Ltd. Study # 89/PSV032/0244 [cité dans HPVIS]. [Disponible en anglais seulement]
Pennwalt Corporation. 1989b. Pyronil 45 : Acute toxicity to daphnia magna. 10 juillet 1989. Life Science Research Ltd. Study # 89/PSV031/0195 [cité dans HPVIS]. [Disponible en anglais seulement]
Pennwalt Corporation. 1989c. Pyronil 45 : Acute toxicity to rainbow trout. 30 juin 1989. Life Science Research Ltd. Study # 89/PSV030/0194 [cité dans HPVIS]. [Disponible en anglais seulement]
Perucca, J., Bouby, N., Valeix, P., Bankir, L. 2007. Sex difference in urine concentration across differing ages, sodium intake, and level of kidney disease. Am. J. Physiol. Regul. Integr. Comp. Physiol. 292:R700-R705. [Disponible en anglais seulement]
Reyes, L., Manalich, R. 2005. Long-term consequences of low birth weight. Kidney International 68(97):S107-S111. [Disponible en anglais seulement]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2008. Chemicals in Toys. A general methodology for assessment of chemical safety of toys with a focus on elements [PDF]. Bilthoven (NL): RIVM. Report No.:320003001/2008. [consulté le 9 juillet 2018]. [Disponible en anglais seulement]
Roberts, S.C., Macaulay, L.J., Stapleton, H.M. 2012. In vitro metabolism of the brominated flame retardants 2-ethylhexyl-2,3,4,5-tetrabromobenzoate (tbb) and bis(2-ethylhexyl) 2,3,4,5-tetrabromophthalate (tbph) in human and rat tissues. Chem. Res. Toxicol. 25(7):1435-1441. [Disponible en anglais seulement]
Rose, R.S., Bhattacharya, B., Favstritsky, N.A., inventeurs; Great Lakes Chemical Corporation, cessionnaire. 1998. Use of ring-brominated benzoate compounds as flame retardants and/or plasticizers. United States patent 5728760. [Disponible en anglais seulement]
Rusyn, I., Peters, J.M., Cunningham, M.L. 2006. Effects of DEHP in liver: Modes of action and species-specific differences. Crit. Rev. Toxicol. 36(5):459-479. [Disponible en anglais seulement]
Sagerup, K., Herzke, D., Harju, M., Evenset, A., Christensen, G.N., Routti, H., Fuglei, E., Aars, J., Strøm, H., Gabrielsen, G.W. 2010. New brominated flame retardant in Arctic biota. Tromsø, Norvège : Klima- OG Forurensnings- Direktoratet, 30 p. Report No.: 1070/2010 [consulté en mai 2014]. [Disponible en anglais seulement]
Sahlström, L., Sellstrom, U., de Wit, C.A. 2012. Clean-up method for determination of established and emerging brominated flame retardants in dust. Anal. Bioanal. Chem. 404:459-466. [Disponible en anglais seulement]
Sahlström, L.M., Sellström, U., de Wit, C.A., Lignell, S., Darnerud, P.O. 2014. Brominated flame retardants in matched serum samples from Swedish first-time mothers and their toddlers. Environ Sci Technol. 48(13), 7584-7592. [Disponible en anglais seulement]
Sakuratani, Y., Noguchi, Y., Kobayashi, K., Yamada, J., Nishihara, T. 2008. Molecular size as a limiting characteristic for bioconcentration in fish. J. Environ. Biol. 29(1):89-92. [Disponible en anglais seulement]
Sample, B.E., Opresko, D.M., Suter, G,W. II. 1996. Toxicological Benchmarks for Wildlife: 1996 Revision. Oak Ridge (TN) : Health Sciences Research Division. Présenté au United States Department of Energy. Contract No. DE-AC05-84OR21400. [Disponible en anglais seulement]
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l’exposition. Ottawa (Ont.) : Les Grands Lacs : Impact sur la santé, Direction générale de la protection de la santé, Santé Canada.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu. [Disponible en anglais seulement]
Santé Canada 2014. CMP Survey 2014-2015 : Determination of Flame Retardants in Consumer Products. Project No.: 2014-2048. 19 juin 2014. (Rapport inédit) [Disponible en anglais seulement]
Santé Canada. [modifié le 3 mai 2017]. Listes des additifs alimentaires autorisés. Ottawa (Ont.) : Santé Canada, Direction des aliments. [consulté le 24 avril 2014].
Saunders, D.M.V., Higley, E.B., Hecker, M., Mankidy, R., Giesy, J.P. 2013. In vitro endocrine disruption and TCDD-like effects of three novel brominated flame retardants: TBPH, TBB & TBCO. Toxicol. Lett. 223:252-259. [Disponible en anglais seulement]
Schenker, U., Macleod, M., Scheringer, M., Hungerbühler, K. 2005. Improving data quality for environmental fate models: a least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds. Environ. Sci. Technol. 39(21):8434-8441. [Disponible en anglais seulement]
Schreder, E.D., La Guardia, M.J. 2014. Flame retardant transfers from U.S. households (dust and laundry wastewater) to the aquatic environment. Environ. Sci. Technol. 48(19) : 11575-11583. [Disponible en anglais seulement]
Seth, R., Webster, E., Mackay, D. 2008. Continued development of a mass balance model of chemical fate in a sewage treatment plant. Water Res. 42:595-604. [Disponible en anglais seulement]
Sexton, K., Needham, L.L., Pirkle, J.L. Human biomonitoring of environmental chemicals. Am. Scientist 2004:92:38-45. [Disponible en anglais seulement]
Shanmuganathan, M., Zhang, Z., Sverko, E., Brymer, R., Gill, B., Smyth, S.A., Marvin, C.H. 2016. The analysis of halogenated flame retardants in Canadian wastewater treatment plants using gas chromatography with tandem mass spectrometry (GC-MS/MS). Rapport inédit présenté dans le cadre du Plan de gestion des produits chimiques. Manuscrit en préparation. [Disponible en anglais seulement]
Shoeib, M., Ahrens, L., Jantunen, L., Harner, T. 2014. Concentrations in air of organobromine, organochlorine and organophosphate flame retardants in Toronto, Canada. Atmospheric Environment 99:140-147. [Disponible en anglais seulement]
Shoeib, M., Harner, T., Webster, G.M., Sverko, E., Cheng, Y. 2012. Legacy and current-use flame retardants in house dust from Vancouver, Canada. Environ. Pollut. 169:175-182. [Disponible en anglais seulement]
Silva MJ, Hilton D, Furr J, Gray LE, Preau JL, Calafat AM, Ye X. 2015. Quantification of tetrabromo benzoic acid and tetrabromo phthalic acid in rats exposed to the flame retardant Uniplex FPR-45. (publié en ligne). Arch Toxicol 25 March 2015. [Disponible en anglais seulement]
SimpleTreat [modèle sur l’élimination des usines de traitement des eaux usées]. 2013. Version 3.1. Bilthoven, Pays-Bas : Institut national néerlandais de la santé publique et de l’environnement (RIVM). [consulté en mai 2014]. Disponible auprès du RIVM, Laboratory for Ecological Risk Assessment, C.P. 1, 3720 BA Bilthoven, Pays-Bas.
[SIRRE] Système d’information et de rapports réglementaires sur les effluents [base de données interne]. 2014. Gatineau (QC) : Environnement et Changement climatique Canada. [consulté en mai 2014]
Springer, C., Dere, E., Hall, S.J., McDonnell, E.V., Roberts, S.C., Butt, C.M., Stapleton, H.M., Watkins, D.J., McClean, M.D., Webster, T.F., Schlezinger, J.J., Boekelheide, K. 2012. Rodent thyroid, liver, and fetal testis toxicity of the monoester metabolite of bis-(2-ethylhexyl) tetrabromophthalate (TBPH), a novel brominated flame retardant present in indoor dust. Environ. Health Perspect. 120(12):1711-1719. [Disponible en anglais seulement]
Stapleton, H.M., Allen, J.G., Kelly, S.M., Konstantinov, A., Klosterhaus, S., Watkins, D., McClean, M.D., Webster, T.F. 2008. Alternate and new brominated flame retardants detected in U.S. house dust. Environ. Sci. Technol. 42(18):6910-6916. [Disponible en anglais seulement]
Stapleton, H.M., Klosterhaus, S., Eagle, S., Fuh, J., Meeker, J.D., Blum, A., Webster, T.F. 2009. Detection of organophosphate flame retardants in furniture foam and U.S. house dust. Environ. Sci. Technol. 43(19):7490-7495 [Disponible en anglais seulement]
Stapleton, H.M., Klosterhaus, S., Keller, A., Ferguson, P.L., Van Bergen, S., Cooper, E., Webster, T.F., Blum, A. 2011. Identification of flame retardants in polyurethane foam collected from baby products. Environ. Sci. Technol. 45(12):5323-5331. [Disponible en anglais seulement]
Stapleton, H.M., Misenheimer, J., Hoffman, K., Webster, T.F. 2014. Flame retardant associations between children's handwipes and house dust. Chemosphere 116:54-60. [Disponible en anglais seulement]
Stapleton, H.M., Sharma, S., Getzinger, G., Ferguson, P.L., Gabriel, M., Webster, T.F., Blum, A. 2012. Novel and High Volume Use Flame Retardants in US Couches Reflective of 2005 pentaBDE Phase Out. Environ. Sci. Technol. 46:13432-13 539. [Disponible en anglais seulement]
Statistique Canada. 2014. Population par année, par province et par territoire. [consulté en novembre 2014].
[STP-EX] Sewage Treatment Plant Expanded Model. 2008. Windsor (Ont.) : Université de Windsor, Dept. of Civil and Environmental Engineering. [modèle décrit dans Seth et al., 2008]. [Disponible en anglais seulement]
[STP Model] Fugacity-based Sewage Treatment Plant Model. 2006. Version 2.1. Peterborough (Ont.) : Université Trent, Canadian Environmental Modelling Centre. [modèle basé sur Clark et al., 1995]. [Disponible en anglais seulement]
Sühring, R., Möller, A., Freese, M., Pohlmann, J., Wolschke, H., Sturm, R., Xie, Z., Hanel, R., Ebinghaus, R. 2013. Brominated flame retardants and dechloranes in eels from German Rivers. Chemosphere 90(1):118-124. [Disponible en anglais seulement]
[TemaNord] Conseil des ministres des pays nordiques. 2011. Schlabach, M., Remberger, M., Brorström-Lundén, E., Norström, K., Kaj, L., Andersson, H., Herzke, D., Borgen, A., Harju, M., 2011. Brominated Flame Retardants (BFR) in the Nordic Environment. TemaNord 2011:528. Conseil des ministres des pays nordiques, Copenhague, Danemark. [Disponible en anglais seulement]
Toms, L.-M.L., Hearn, L., Sjödin, A., Mueller, J.F. 2011. Introduction to Brominated Flame Retardants: Commercially Products, Applications, and Physicochemical Properties. In Eljarrat, E., Barceló, D., éds. 2011. Brominated Flame Retardants. Série : The Handbook of Environmental Chemistry, vol. 16. Heidelberg (Berlin) : Springer, 290 p. [Disponible en anglais seulement]
Unitex Chemical Corporation. 2009. Uniplex FRP-45 : CAS NO. 26040-51-7. Greensboro (NC) : Unitex Chemical Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
[US CPSC] US Consumer Product Safety Commission. 2005a. Analysis of FR Chemicals Added to Foams, Fabrics, Batting, Loose Fill, and Barriers [PDF]. Washington (DC) : Directorate for Laboratory Sciences, US CPSC. (uff6). [Disponible en anglais seulement]
[US CPSC] US Consumer Product Safety Commission, 2005b. Migration of Flame Retardant Chemicals in Upholstered Furniture Foam [PDF]. Washington (DC) : Division of Chemistry, US CPSC. (uhff2). [Disponible en anglais seulement]
[US CPSC] US Consumer Product Safety Commission. 2006. CPSC Staff Preliminary risk assessment of flame retardant chemicals in upholstered furniture foam. US Consumer Product Safety Commission. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 1993. Wildlife Exposure Factors Handbook. Washington, DC; EPA/600/R-93/187. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2003. Exposure and human health reassessment of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) and related compounds, Part I: Estimating exposure to dioxin-like compounds, Volume 3: Site-specific assessment procedures, Chapter 4: Estimating exposure media concentrations. National Center for Environmental Assessment, Washington, DC; EPA/600/P-00/001Cb. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2011. Exposure Factors Handbook: 2011 Edition. Washington (DC) : National Center for Environmental Assessment, EPA/600/R-09/052F. Disponible auprès du National Technical Information Service, Springfield (VA). [Disponible en anglais seulement]
US EPA] U.S. Environmental Protection Agency. 2012. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. Office of Chemical Safety and Pollution Prevention, Washington (DC). [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2013. TSCA Work Plan Chemicals. Washington (DC) : Office of Pollution Prevention and Toxics, USEPA. [consulté en juin 2013]. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2014a. Chemical Data Reporting (CDR): Non-confidential IUR Production Volume Information (1986-2002) [base de données]. Washington (DC) : USEPA. [consulté en mai 2014]. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2014 b. Inventory Update Reporting (IUR): Non-confidential 2006 IUR Company/Chemical Records [base de données]. Washington (DC) : USEPA [consulté en mai 2014]. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2014c. Chemical Data Access Tool (CDAT) [base de données]. Washington (DC) : USEPA. [consulté en mai 2014]. [Disponible en anglais seulement]
[US EPA] Environmental Protection Agency des États-Unis. 2014d. Design for the Environment. Flame Retardants Used in Flexible Polyurethane Foam: An Alternatives Assessment Update [PDF]. [Disponible en anglais seulement]
Valls-Cantenys, C., Villaverde-de-Sáa, E., Rodil, R., Quintana, J.B., Iglesias, M., Salvadó, V., Cela, R. 2013. Application of polydimethylsiloxane rod extraction to the determination of sixteen halogenated flame retardants in water samples. Anal. Chim. Acta. 770:85-93. [Disponible en anglais seulement]
Van den Eede, N., Dirtu, A.C., Ali, N., Neels, H., Covaci, A. 2012. Multi-residue method for the determination of brominated and organophosphate flame retardants in indoor dust. Talanta 89:292-300. [Disponible en anglais seulement]
Van Haarst, E.P., Heldeweg, E.A., Newling, D.W., Schlatmann, T.J. The 24-h frequency-volume chart in adults reporting no voiding complaints: defining reference vales and analysing variables. BJU International 93:1257-1261. [Disponible en anglais seulement]
Van Hoogen, G., Opperhuizen, A. 1988. Toxicokinetics of chlorobenzenes in fish. Environ. Toxicol. Chem. 7(3):213-219. [Disponible en anglais seulement]
[VCCLAB] Virtual Computational Chemistry Laboratory. 2005. ALOGPS 2.1. [consulté en octobre 2013]. [Disponible en anglais seulement]
Venier, M., Dove, A., Romanak, K., Backus, S., Hites, R. 2014. Flame retardants and legacy chemicals in Great Lakes' water Environ Sci Technol. 48(16): 9563-9572. [Disponible en anglais seulement]
Venier M, Audy O, Vojta S, Bečanova J, Romanak K, Melymuk L, Krátká M, Kukučka P, Okeme J, Saini A, Diamond ML, Klánová J. 2016. Brominated flame retardants in the indoor environment – Comparative study of indoor contamination from three countries. Environ Int. 94:150-160. [Disponible en anglais seulement]
[WATERNT] Water Solubility Program [modèle d’évaluation]. 2010. Version 1.01. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en mai 2014]. [Disponible en anglais seulement]
Webster, T., Watkins, D.J., Walker, C., Fraser, A.J., Heiger-Bernays, W., Stapleton, H.M., McClean, M.D. 2010. PentaBDE Alternatives in Homes, Offices and Cars. (résumé). [Disponible en anglais seulement]
Weil, E.D., Levchik, S.V. 2004. Commercial flame retardancy of polyurethanes. J. Fire Sci. 22(4):293-303. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1986a. Acute oral toxicity (LD50) study in Albino rats with CN-322: Final report. (WIL Project No: WIL-12069). Ashland (OH) : WIL Research Laboratories, Inc., [consulté le 10 mars 1986]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1986b. Acute oral toxicity (LD50) study in Albino rats with CN-322: Final report. (WIL Project No: WIL-12069). Ashland (OH), WIL Research Laboratories, Inc. [consulté le 10 mars 1986]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1986c. Primary eye irritation study in Albino rabbits with CN-322: Final report. (WIL Project No: WIL-12072). Ashland (OH) : WIL Research Laboratories, Inc., [consulté le 10 mars 1986]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1986d. Primary eye irritation study in Albino rabbits with CN-322: Final report. (WIL Project No: WIL-12071). Ashland (OH), WIL Research Laboratories, Inc. [consulté le 10 mars 1986]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997a. Primary Eye Irritation Study of CN-2065 in Albino Rabbits (WIL Project No: WIL-12372). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997 b. Acute Dermal Toxicity Study of CN-2065 in Albino Rats (WIL Project No: WIL-12371). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997c. Primary Dermal Irritation Study of CN-2065 in Albino Rabbits (WIL Project No: WIL-12372). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997d. Skin Sensitisation Study of CN-2065 in Albino Guinea Pigs (WIL Project No: WIL-12374). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997e. A 28-day Repeated Dose Oral Toxicity Study of CN-2065 in Rats (WIL Project No: WIL-12375). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
WIL Research Laboratories, Inc. 1997f. Acute Oral Toxicity Study of CN-2065 in Albino Rats (WIL Project No: WIL-12370). Ashland (OH), WIL Research Laboratories, Inc (Rapport inédit présenté par ISM Pty Ltd) [cité dans NICNAS 2004]. [Disponible en anglais seulement]
Wilson, R., Jones-Otazo, H., Petrovic, S., Mitchell, I., Bonvalot, Y., Williams, D., Richardson, G.M. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Human and Ecological Risk Assessment 19(1):158-188. [Disponible en anglais seulement]
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 1.42. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté en janvier 2014]. [Disponible en anglais seulement]
Wu, A.H.B. 2006. Tietz clinical guide to laboratory tests. 4e éd. St. Louis (MO) : Saunders Elsevier, p. 1102-1104. [Disponible en anglais seulement]
Xiao, H., Hung, H., Wania, F., Lao, R., Sabljic, E., Sverko, E., Lei, Y.D., Fellin, P., Barresi, E. 2012b. Field evaluation of a flow-through sampler for measuring pesticides and brominated flame retardants in the arctic atmosphere. Environ. Sci. Technol. 46(14):7669-7676. [Disponible en anglais seulement]
Xiao, H., Shen, L., Su, Y., Barresi, E., DeJong, M., Hung, H., Lei, Y., Wania, F., Reiner, E.J., Sverko, E., et al. 2012a. Atmospheric concentrations of halogenated flame retardants at two remote locations: The Canadian High Arctic and the Tibetan Plateau. Environ. Pollut. 161:154-161. [Disponible en anglais seulement]
Yang, C., Diamond, M.L., Latifovic, L., Tsirlin, D., Harris, S.A., Jantunen, L. 2017. Semivolatile Organic Compounds in Canadian Homes; A Comprehensive Household Exposure Study. Contract prepared for Health Canada. University of Toronto, Cancer Care Ontario, Environment and Climate Change Canada. (Rapport inédit). [Disponible en anglais seulement]
Zhou, S.N., Buchar, A., Siddique, S., Tasker, L., Abdelouahab, N., Zhu, J. 2014. Measurements of selected brominated flame retardants in nursing women: implications for human exposure. Environ. Sci. Technol. 48(15):8873-8880. [Disponible en anglais seulement]
Zhou, S.N., Reiner, E.J., Marvin, C., Helm, P., Riddell, N., Dorman, F., Misselwitz, M., Shen, L., Crozier, P., MacPherson, K. et al. 2010a. Development of liquid chromatography atmospheric pressure chemical ionization tandem mass spectrometry for analysis of halogenated flame retardants in wastewater. Anal. Bioanal. Chem. 396(3):1311-1320. [Disponible en anglais seulement]
Zhou, S.N., Reiner, E.J., Marvin, C., Kolic, T., Riddell, N., Helm, P., Dorman, F., Misselwitz, M., Brindle, I.D. 2010b. Liquid chromatography–atmospheric pressure photoionization tandem mass spectrometry for analysis of 36 halogenated flame retardants in fish.J. Chromat. A. 1217(5):633-641. [Disponible en anglais seulement]
Zhu, B., Lai, N.L.S., Wai, T., Chan, L.L., Lam, J.C.W., Lam, P.K.S. 2014. Changes of accumulation profiles from PBDEs to brominated and chlorinated alternatives in marine mammals from the South China Sea. Environ. Int. 66:65-70. [Disponible en anglais seulement]
Annexes
Annexe A : Identité des substances
| No CAS | Autres noms choisis pour le TBB et le TBPH |
|---|---|
| 183658-27-7 | 2,3,4,5-Tétrabromobenzoate de 2-éthylhexyle Acide benzoïque, 2,3,4,5-tetrabromo-, 2-ethylhexyl ester (TSCA, IECSC)a; EtH-TeBBzob; EHTeBBb; EH-TBBb; TBBb |
| 26040-51-7 | Tétrabromophtalate de bis(2-éthylhexyle) 1,2-Benzenedicarboxylic acid, 3,4,5,6-tetrabromo-, 1,2-bis(2-ethylhexyl) ester (TSCA)a; 1,2-Benzenedicarboxylic acid, 3,4,5,6-tetrabromo-, bis(2-ethylhexyl) ester (IECSC, NDSL, PICCS, NZIoC)a; Di(2-ethylhexyl) tetrabromophthalatea; Phthalic acid, tetrabromo-, bis(2-ethylhexyl) estera; DP 45a; Pyronil 45a; Uniplex FRP 45a; BEH-TEBPb; bEtH-TeBPhtb; TeBrDEHPb; BEH-TBPb; TBPHb |
| 219632-53-8 | Anhydride 4,5,6,7-tétrabromophtalique, produits de réaction avec le 2-éthylhexan-1-ol (IECSC, AICS, NZIoC)a; Firemaster BZ-54c; Firemaster 550c (lorsque mélangé dans un rapport 50:50 avec des produits ignifuges organophosphorés aromatiques) Mélange de TBB et de TBPH; mélange de TBB et de TBPH contenant des composés organophosphorés |
a Noms tirés du National Chemical Inventories (NCI, 2014).
b Noms tirés de Bergman et al. (2012).
c Noms tirés de Stapleton et al. (2012), de Chen et al. (2013), et de communication personnelle de Chemtura à la Division des évaluations écologiques d’Environnement Canada (2014, source non citée).
Annexe B : Propriétés physiques et chimiques
Les modèles d’EPI Suite ont été utilisés pour tous les paramètres du tableau B-1 (EPI Suite 2000-2012). L’option d’ajustement des valeurs expérimentales offertes dans les modèles HENRYWIN, KOWWIN et WATERNT n’a pas été utilisée pour le TBB et le TBPH, étant donné qu’aucun analogue physique ou chimique adéquat n’a été déterminé.
D’autres modèles appropriés ont été utilisés pour augmenter le niveau de confiance à l’égard des propriétés physiques et chimiques dérivées. Les modèles ACD/log P Classic et GALAS (Global, Adjusted Locally According to Similarity (mondial, ajusté à l’échelle locale selon la similarité)) de la suite ACD Percepta ont été jugés appropriés pour le TBB et le TBPH en raison de la représentation élevée des fragments aryles bromés dans les trousses de formation. Les modèles de la suite ACD Percepta ont également été utilisés pour estimer la pression de vapeur, l’hydrosolubilité et le log Kco (ACD Percepta, c1996-2014). Des modèles de calcul virtuel de chimie de laboratoire pour l’hydrosolubilité et le log Koe ont également été utilisés (ALOGPS, VCCLAB, 2005). Des relations linéaires d’énergie libre à plusieurs paramètres ont également été utilisées pour estimer le log Koe conformément à Abraham et al. (1994), à l’aide des paramètres de résolution calculés par Absolv (ACD Percepta, c1996-2014). On a présumé que chacun des résultats de modélisation comporte le même niveau approximatif d’incertitude pour le TBB et le TBPH. Par conséquent, le résultat médian de tous les modèles accessibles et appropriés pour un paramètre donné a été choisi comme valeur essentielle.
Les mesures empiriques du log Koe et de l’hydrosolubilité sont résumées dans la base de données des substances chimiques homologuées de l’ECHA pour le TBPH (ECHA, 2013). Les études dans leur intégralité n’étaient pas accessibles au moment de l’évaluation aux fins d’examen. Toutefois, les résumés accessibles sur le site Web de REACH indiquent qu’en vertu de la ligne directrice 117 de l’OCDE, la valeur empirique du log Koe est de 10,2 pour le TBPH. Ce résumé reconnaît que le résultat ne respecte pas le champ d’application de la ligne directrice 117. L’hydrosolubilité du TBPH, déterminée conformément à la ligne directrice 105, est indiquée comme une valeur sans bornes inférieure à 5 x 10-5 mg/L, sans cosolvant. Étant donné les limites que présentent ces résultats (p. ex., champ d’application, valeurs sans bornes) et le fait que les études n’étaient pas accessibles dans leur intégralité aux fins d’examen, il a été décidé qu’une méthode appropriée de comparaison des résultats afin de déterminer les propriétés physiques et chimiques était de les évaluer par rapport aux résultats des modèles appropriés pour calculer les médianes.
Les propriétés physiques et chimiques du TBB et du TBPH ont été vérifiées aux fins d’uniformité interne et ont été harmonisées conformément au procédé d’ajustement par la méthode des moindres carrés (Schenker et al., 2005). Pour ce faire, les valeurs médianes des paramètres physiques et chimiques applicables (pression de vapeur, hydrosolubilité, log Koe, log Koa et log Kae) ont été saisies dans le modèle comme données d’entrée. Le tableau B-1 résume les valeurs saisies dans le modèle d’ajustement selon la méthode des moindres carrés. Les extrants du modèle d’ajustement selon la méthode des moindres carrés ont produit des valeurs critiques pour ces paramètres qui sont résumées dans le tableau 3-1.
| Propriété | TBB | TBPH | Référence |
|---|---|---|---|
| Masse moléculaire (g/mol) | 549,9 | 706,2 | S.O. |
| Point de fusion (°C) | -25 | -25 | Great Lakes Chemical Corporation, 1997a |
| Point d’ébullition (°C) | 433 | 540 | MPBPWIN, 2010 |
| Point d’ébullition (°C) | 478 | 585 | ACD Percepta, c1996-2014 |
| Point d’ébullition médian (°C) | 455 | 562 | S.O. |
| Pression de vapeur (Pa) | 4,00 x 10-7 | 1,00 x 10-11 | ACD Percepta, c1996-2014 |
| Pression de vapeur (Pa) | 4,58 x 10-6 | 2,28 x 10-9 | MPBPWIN, 2010 (méthode de Grain modifiée) |
| Pression de vapeur médiane (Pa) | 2,49 x 10-6 | 1,15 x 10-9 | S.O. |
| log Koe | 7,73 | 10,08 | ACD/log P Classic (ACD Percepta, c1996-2014) |
| log Koe | 6,97 | 8,91 | ACD/log P GALAS (ACD Percepta, c1996-2014) |
| log Koe | 8,69 | 12,18 | Relations linéaires d’énergie libre à plusieurs paramètres; Abraham et al., 1994, (ACD Percepta, c1996-2014) |
| log Koe | 8,75 | 11,95 | KOWWIN, 2010 |
| log Koe | 6,99 | 8,36 | ALOGPS 2.1 (VCCLAB, 2005) |
| log Koe | S.O. | 10,2 | ECHA, 2013 |
| log Koe médian | 7,73 | 10,14 | S.O. |
| Hydrosolubilité (mg/L) | 3,42 x 10-3 | 1,92 x 10-6 | WATERNT, 2010 |
| Hydrosolubilité (mg/L) | 8,54 x 10-5 | 6,99 x 10-8 | WSKOWWIN, 2010 (log Koe médian intrant) |
| Hydrosolubilité (mg/L) | 8,92 x 10-4 | 1,90 x 10-5 | ACD/logS0 GALAS (ACD Percepta, c1996-2014) |
| Hydrosolubilité (mg/L) | 8,92 x 10-2 | 1,66 x 10-3 | ACD LogS Classic (ACD Percepta, c1996-2014) |
| Hydrosolubilité (mg/L) | 7,42 x 10-2 | 2,45 x 10-2 | ALOGPS 2.1 (VCCLAB, 2005) |
| Hydrosolubilité (mg/L) | S.O. | 5,0 x 10-5 | ECHA, 2013 |
| Hydrosolubilité médiane (mg/L) | 3,42 x 10-3 | 3,45 x 10-5 | S.O. |
| log Kco | 4,47 | 5,94 | KOCWIN, 2010 (méthode ICM) |
| log Kco | 5,12 | 6,38 | KOCWIN, 2010 (méthode Koe, log Koe médian intrant) |
| log Kco | 5,58 | 6,86 | ACD Percepta, c1996-2014 |
| log Kco médian | 5,12 | 6,38 | S.O. |
| log Koa | 11,32 | 14,99 | KOAWIN, 2010 (log Koe médian intrant) |
| log Kae | -3,59 | -4,91 | HENRYWIN, 2011 (à partir de la méthode Bond) |
Un ensemble de données empiriques sur les propriétés physiques et chimiques a été présenté pour un mélange commercial de TBB et de TBPH de proportion inconnue. L’ensemble de données empiriques contenait des mesures de propriétés comme l’hydrosolubilité et le coefficient de partage octanol-eau et des données supplémentaires ont été incluses dans le tableau B-2. Ces données comportent une incertitude importante. Plusieurs des valeurs ne sont pas bornées, tandis que d’autres sont contradictoires par rapport aux données empiriques présentées. Par exemple, on a indiqué une valeur d’hydrosolubilité de 2,01 mg/L pour un mélange de TBB et de TBPH (Great Lakes Chemical Corporation, 1997a). Cette valeur est excessivement élevée compte tenu des éléments hydrophobes des compositions chimiques (p. ex., chaînes alkyles ramifiées, noyau aromatique bromé). De plus, les exigences pour les cosolvants organiques, présentées dans les études qui s’y rattachent à des concentrations nominales auxquelles ils auraient dû être solubles selon cette valeur de 2,01 mg/L, indiquent également une faible confiance. Toutefois, on a déterminé un point de fusion de -25 °C comme valeur essentielle de cet ensemble de données qui a été attribué au TBB comme au TBPH, étant donné que les prévisions des modèles n’étaient pas raisonnables pour des substances qui sont indiquées comme étant liquides à une température et à une pression standard. De même, les limites empiriques d’ébullition peuvent également être plus réalistes pour les substances ignifuges que les valeurs issues des modèles.
| Propriété | Valeur empirique pour le mélange TBB/TBPH | Méthode |
|---|---|---|
| Point de fusion (°C) | < -25 | EEC 92/69, A.1 |
| Point d’ébullition (°C) | 317-331 | EEC 92/69, A.2 |
| Pression de vapeur (Pa) | 1,3 x 10-4 | EEC 92/69, A.4 |
| Hydrosolubilité (mg/L) | 2,01 | EEC 92/69, A.6 |
| Log Koe | > 6,2 | EEC 92/69, A.8 |
| Log Kco | > 4,5 | OCDE TGP/94.75 (Ébauche) |
Annexe C : Évaluation rapide RQSA des produits de transformation potentiels
Les métabolites potentiels déterminés dans la documentation publiée pour le TBB comprennent l’acide 2,3,4,5-tétrabromobenzoïque (ATBB), qui peut ensuite être métabolisé en méthyle 2,3,4,5-tétrabromobenzoate (M-TBB) et en 2-éthylhexyle 3,4-dibromobenzoate (EH-DBB) (Bearr et al., 2012, Roberts et al., 2012), alors que le tétrabromophtalate de mono(2-éthylhexyle) (TBMEHP) a été répertorié comme métabolite du TBPH (Roberts et al., 2012). Le dérivé le plus stable prévu déterminé par CATALOGIC (2013) est l’acide 3,4,5-tribromobenzoïque (TrBBA) pour le TBB, et l’acide 4,5-dibromophtalique (DBPA) pour le TBPH. Pour l’évaluation des RQSA de haut niveau pour la persistance, la bioaccumulation et les critères d’effet des dérivés du TBB et du TBPH, les valeurs du log Koe et de l’hydrosolubilité ont été estimées à l’aide des modèles ACD/logP Classic et WATERNT, respectivement. Le tableau C-1 résume les propriétés physiques et chimiques de base des dérivés déterminés. Les tableaux C-2 et C-3 présentent les résultats de l’évaluation des RQSA pour les paramètres de persistance et de bioaccumulation des dérivés potentiels.
Le TBB se retrouve lui-même également dans le domaine de modélisation du modèle ECOSAR. En raison de l’encombrement stérique des esters présents dans ces composés, les résultats de RSA de substance organique neutre (toxicité de référence) ont été évalués par rapport à la classe des esters. Les valeurs supérieures à 10 fois celle de l’hydrosolubilité ont été exclues du tableau C-4.
Cette analyse se veut une mesure préventive visant à démontrer que les métabolites du TBB et du TBPH observés, proposés ou modélisés ne soulèvent pas de préoccupations en matière de persistance, de bioaccumulation ou d’effets écologiques au-delà de celles des composés d’origine eux-mêmes. Il est reconnu qu’elle ne décèle pas les autres effets sublétaux potentiels et que la modélisation initiale des RQSA des dérivés prévus comporte une grande incertitude.
| Dérivé | MM (g/mol) | log Koe | Hydrosolubilité (mg/L) | SMILES |
|---|---|---|---|---|
| ATBB | 437,7 | 4,28 | 20,1 | BrC1=C(C(O)=O)C=C(Br)C(Br)=C1Br |
| M-TBB | 451,7 | 4,19 | 9,6 | BrC1=C(C(OC)=O)C=C(Br)C(Br)=C1Br |
| EH-DBB | 392,1 | 7,03 | 0,085 | BrC1=C(Br)C=C(C(OCC(CCCC)CC)=O)C=C1 |
| TBMEHP | 593,9 | 6,43 | 0,012 | BrC1=C(C(O)=O)C(C(OCC(CCCC)CC)=O)=C(Br)C(Br)=C1Br |
| TrBBA | 358,8 | 4,18 | 21,4 | BrC1=C(Br)C(Br)=CC(C(O)=O)=C1 |
| DBPA | 323,9 | 2,70 | 1667 | BrC1=C(Br)C=C(C(O)=O)C(C(O)=O)=C1 |
| Dérivé | log Koe | Demi-vie prévue pour l’oxydation atmosphérique (AOPWIN, 2010), jours | Demi-vie prévue par réaction à l’ozone (AOPWIN, 2010)a | Demi-vie prévue pour l’hydrolyse (HYDROWIN, 2010)b, jours | Résultats de biodégradation (BIOWIN, 2010, sous-modèles 3, 4, 5 et 6) |
|---|---|---|---|---|---|
| ATBB | 4,28 | 19,9 | s.o. | s.o. | Sous-modèles 3, 4, 6 : « biodégradation lente »; sous-modèle 5 : « biodégradation rapide » |
| M-TBB | 4,19 | 46,2 | s.o. | 1,8 (pH de 8) 18 (pH de 7) | Sous-modèles 3, 4, 6 : « biodégradation lente »; sous-modèle 5 : « biodégradation rapide » |
| EH-DBB | 7,03 | 0,971 | s.o. | 20,4 (pH de 8) 204 (pH de 7) |
Sous-modèles 3, 4, 5 : « biodégradation lente »; sous-modèle 6 : « biodégradation rapide » |
| TBMEHP | 6,43 | 0,936 | s.o. | 3,4 (pH de 8) 34 (pH de 7) | Sous-modèles 3, 4, 6 : « biodégradation lente »; sous-modèle 5 : « biodégradation rapide » |
| TrBBA | 4,18 | 18,4 | s.o. | s.o. | Sous-modèles 3, 4 : « biodégradation lente »; sous-modèles 5,6 : « biodégradation rapide » |
| DBPA | 2,70 | 9,95 | s.o. | s.o. | Sous-modèles 3, 4, 5, 6 : « biodégradation rapide » |
a Seuls les acétylènes et les oléfines (liaisons carbone-carbone doubles et triples) peuvent être modélisés pour la réaction à l’ozone.
b Seuls les esters, les carbamates, les époxydes, les halométhanes, les halogénures d’alkyle spécifiques et les esters phosphoriques peuvent être modélisés. Les fragments en position ortho sur les cycles phényliques ne sont pas pris en considération.
| Dérivé | log Koe | FBC prévu (sans métabolisme) (L/kg poids humide) | FBC prévu Poissons du niveau trophique intermédiaire (métabolisme) (L/kg poids humide) | FBA prévu Poissons du niveau trophique intermédiaire (métabolisme) (L/kg poids humide) | kM prévu (1/jour) (pour poisson de 10 g, 15 °C) |
|---|---|---|---|---|---|
| ATBB | 4,28 | 3,16 | 452 | 459 | 0,577 |
| M-TBB | 4,19 | 270 | 158 | 158 | 2,19 |
| EH-DBB | 7,03 | 1,29 x 104 | 518 | 8,95 x 103 | 0,232 |
| TBMEHP | 6,43 | 56,2 | 217 | 433 | 1,18 |
| TrBBA | 4,18 | 3,16 | 439 | 445 | 0,524 |
| DBPA | 2,70 | 3,16 | 27,2 | 27,2 | 3,03 |
| Substance | Log Koe | Hydrosolubilité (mg/L) | Organisme d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|---|---|
| TBB | 7,71 | 0,002 8 | Poissons, daphnies, algues vertes | Vtc | 0,000 6 - 0,018 | ECOSAR, 2012 |
| ATBB | 4,28 | 20,1 | Poissons, daphnies, algues vertes | Vtc | 4,0 - 16,8 | ECOSAR, 2012 |
| M-TBB | 4,19 | 9,6 | Poissons, daphnies, algues vertes | Vtc | 0,15 - 1,90 | ECOSAR, 2012 |
| EH-DBB | 7,03 | 0,085 | Poissons, daphnies, algues vertes | Vtc | 0,001 7 - 0,033 | ECOSAR, 2012 |
| MEH-TBP | 6,43 | 0,012 | Poissons, daphnies, algues vertes | Vtc | 0,008 - 0,12 | ECOSAR, 2012 |
| TrBBA | 4,18 | 21,4 | Poissons, daphnies, algues vertes | Vtc | 4,0 - 15,8 | ECOSAR, 2012 |
| DBPA | 2,70 | 1667 | Poissons, daphnies, algues vertes | Vtc | 44 - 112 | ECOSAR, 2012 |
Annexe D : Tableau du poids de la preuve pour la caractérisation des risques écologiques
| Élément de preuve | Niveau de confiancea | Pertinence pour l’évaluationb | Poids attribuéc |
|---|---|---|---|
| Ingestion quotidienne totale prévue par rapport à la valeur de référence du seuil de toxicité (reproduction) pour les mammifères pertinents, quotients de risque < 1 | Élevé | Élevée | Élevé |
| Résidus corporels critiques prévus chez les poissons par rapport aux concentrations et aux seuils de référence de narcose associés à des dommages à l’ADN, quotients de risque < 1 | Modéré | Élevée | Modéré à élevé |
| Persistance dans l’environnement | Modéré | Élevée | Modéré à élevé |
| Bioaccumulation dans les organismes | Modéré | Élevée | Modéré à élevé |
| Quotients de risque pour le milieu aquatique < 1 | Modéré | Modérée | Modéré |
| Ubiquité ou présence continue, transport à grande distance | Modéré | Faible à modérée | Faible à modéré |
| Sédiments et sols | s.o. | s.o. | s.o. |
Abréviations : s.o. = sans objet
a Le niveau de confiance est déterminé d’après la qualité des données, la variabilité, les lacunes dans les données et si les données conviennent aux fins voulues.
b La pertinence désigne l’incidence de la preuve dans l’évaluation.
c Un poids est attribué à chaque élément de preuve selon le niveau combiné de confiance et de pertinence dans l’évaluation.
Annexe E : Estimations combinées de l’absorption quotidienne du TBB et du TBPH par divers groupes d’âge au sein de la population générale du Canada
| Voie d’exposition | 0 à 6 moisa (allaitement au sein)b | 0 à 6 moisa (nourris à la préparation)c | 0 à 6 moisa (non nourris à la préparation)d | 0,5 à 4 anse | 5 à 11 ansf | 12 à 19 ansg | 20 à 59 ansh | ansi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | 5,6E-07 | 5,6E-07 | 5,6E-07 | 1,2E-06 | 9,4E-07 | 5,3E-07 | 4,6E-07 | 4,0E-07 |
| Air intérieurk | 7,3E-04 | 7,3E-04 | 7,3E-04 | 1,6E-03 | 1,2E-03 | 6,9E-04 | 6,0E-04 | 5,2E-04 |
| Eau potablel | S.O. | 2,0E-06 | 7,3E-07 | 8,3E-07 | 6,5E-07 | 3,7E-07 | 3,9E-07 | 4,1E-07 |
| Alimentsm | 1,4E-02 | NI | NI | 4,2E-04 | 3,4E-04 | 1,9E-04 | 1,9E-04 | 1,2E-04 |
| Poussièren | 1,5E-01 | 1,5E-01 | 1,5E-01 | 7,6E-02 | 2,9E-02 | 1,1E-03 | 1,0E-03 | 1,0E-03 |
| Solo | S.O. | S.O. | S.O. | 1,8E-05 | 1,4E-05 | 4,7E-07 | 4,5E-07 | 4,2E-07 |
| Absorption totale | 1,6E-01 | 1,5E-01 | 1,5E-01 | 7,8E-02 | 3,0E-02 | 2,0E-03 | 1,8E-03 | 1,6E-03 |
Abréviations : S.O. = sans objet; NI = données non déterminées dans la documentation.
a On présume que le nourrisson pèse 7,5 kg, respire 2,1 m3 d’air par jour (Santé Canada, 1998) et ingère 38 et 0 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
b On présume que les nourrissons allaités exclusivement consomment 0,742 L de lait maternel par jour (Santé Canada, 1998), et on présume que le lait maternel constitue la seule source alimentaire. La somme des concentrations du 95e centile de TBB (0,07 ng/g poids humide) et de TBPH (0,069 ng/g poids humide) dans les échantillons de lait maternel (n = 102) recueillis de 2008 à 2009 auprès de femmes de Sherbrooke, Québec, Canada (Zhou et al., 2014; communication personnelle de l’EHSRB, Santé Canada, datée du 15 mai 2014), multipliée par une densité du lait maternel de 1,03 g/mL (convertie à 0,072 et à 0,071 µg/L), a été choisie pour la dérivation de la limite supérieure d’absorption quotidienne de TBB et de TBPH par exposition au lait maternel.
c On présume que les nourrissons nourris à la préparation exclusivement consomment 0,8 L d’eau par jour (Santé Canada, 1998), qui est utilisée pour reconstituer la préparation. On n’a déterminé aucune donnée de surveillance du TBB et du TBPH dans la préparation; par conséquent, l’absorption par voie alimentaire ne reflète que celle provenant de l’eau. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On assume que les nourrissons non nourris à la préparation exclusivement consomment 0,7 L d’eau par jour (Santé Canada, 1998) et environ 50 % des nourrissons non nourris à la préparation ont commencé à manger des aliments solides à 4 mois et 90 % à 6 mois (Santé Canada, 1998).
e On présume que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boit 0,7 L d’eau par jour, qu’il consomme 54,7 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 41 et 14 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
f On présume que l’enfant pèse 31,0 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boit 1,1 L d’eau par jour, qu’il consomme 89,8 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 31 et 21 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
g On assume que la personne pèse 59,4 kg, qu’elle respire 15,8 m3 d’air par jour, qu’elle boit 1,2 L d’eau par jour, qu’elle consomme 97,3 g de poisson par jour (Santé Canada, 1998) et qu’elle ingère 2,2 et 1,4 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
h On assume que la personne pèse 70,9 kg, qu’il respire 16,2 m3 d’air par jour, qu’il boit 1,5 L d’eau par jour, qu’il consomme 111,7 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 2,5 et 1,6 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
i On assume que la personne pèse 72,0 kg, qu’il respire 14,3 m3 d’air par jour, qu’il boit 1,6 L d’eau par jour, qu’il consomme 72,9 g de poisson par jour (Santé Canada, 1998) et qu’il ingère 2,5 et 1,5 mg de poussière et de sol par jour, respectivement (Wilson et al., 2013).
j La somme des concentrations maximales de TBB (9 pg/m3) et de TBPH (7 pg/m3), mesurées à Toronto, Ontario, Canada (Diamond et al., 2013), a été choisie pour la dérivation de la limite supérieure d’absorption quotidienne par exposition à l’air ambiant. L’hypothèse selon laquelle les Canadiens passent 3 heures par jour à l’extérieur est utilisée (Santé Canada 1998).
k La somme des concentrations maximales de TBB (2833 pg/m3) et de TBPH (146,62 pg/m3), mesurées dans des résidences de la région du Grand Toronto et d’Ottawa (Yang et al., 2017), a été choisie pour le calcul de l’estimation de la limite supérieure d’absorption quotidienne par exposition à l’air intérieur. Il a été présumé que les Canadiens passaient 21 heures par jour à l’intérieur (Santé Canada, 1998).
l On n’a déterminé aucune donnée de surveillance de l’eau potable. La somme des concentrations moyennes les plus élevées de TBB (7,9 pg/L) et de TBPH (10,4 pg/L), mesurées à la surface de l’eau du lac Ontario et du lac Érié, respectivement (Venier et al., 2014), a été choisie pour la dérivation de l’estimation de la limite supérieure d’absorption quotidienne par exposition à l’eau potable.
m On n’a déterminé aucune donnée de suivi des aliments du commerce au Canada; toutefois, des données sur les poissons naturels étaient accessibles. La somme des concentrations maximales de TBB (0,041 ng/g) et de TBPH (0,078 ng/g), mesurées chez les poissons du lac Ontario (Zhou et al., 2010b), a été choisie pour la dérivation de l’estimation de la limite supérieure d’absorption quotidienne par exposition à tous les produits alimentaires liés au poisson du groupe des aliments aquacoles. Les quantités d’aliments de plus de 12 groupes alimentaires consommées quotidiennement par chaque groupe d’âge ont été tirées de l’Enquête Nutrition Canada de 1970-1972 (Santé Canada, 1998).
n La somme des concentrations maximales de TBB (22 371 ng/g) dans l’étude de base canadienne (communication personnelle de l’EHSRB, Santé Canada, datée du 5 août 2017), mesurées dans différentes villes canadiennes, et de TBPH (6 400 ng/g), mesurées dans des domiciles à Vancouver, Canada (Shoeib et al., 2012), ont été choisies pour le calcul de l’estimation de la limite supérieure d’absorption quotidienne par exposition à la poussière.
o On n’a déterminé aucune donnée de surveillance des sols en Amérique du Nord. Par conséquent, la concentration environnementale estimée (CEE) maximale de 0,02 mg/kg p.s. pour le mélange de TBB et de TPBH a été choisie pour la dérivation de l’estimation de la limite supérieure d’absorption quotidienne par exposition au sol.
Annexe F : Surveillance du TBB et du TBPH dans la poussière domestique
| Emplacement | Type d’échantillon | Année; n | [TBB] médianea (Intervalle) (ng/g) | [TBPH] médianea (Intervalle) (ng/g) | Référence |
|---|---|---|---|---|---|
| Divers emplacements, Canada | Vide | 2007-2010; 631 | 123 (< 1,5 – 22 371) | - NM | Kubwabo et al., 2017 (non publié) |
| Vancouver (C.-B.), Canada |
Vide | 2007-2008; 116 | 120 (< 0,30 – 18 000) | 99 (10 – 6 400) | Shoeib et al., 2012 |
| Toronto (Ont.) Canada | Aspirateur – intérieur des résidences | 2012; 35 | 215 (moyenne géométrique) (ND -7540) | 77 (moyenne géométrique) (ND -10 000) | Abbasi et al., 2016 |
| Toronto (Ont.) Canada | Aspirateur | 2013; 35 (dans 23 rési-dences) | 966 (121 – 15 300) | 431 (69 – 34 500) | Venier et al., 2016 |
| Région du Grand Toronto (RGT) et Ottawa | Aspirateur | 2015; 77 (dans 51 rési-dences; RGT : n=32; Ottawa : n=19) | 293 (59 – 10 041) | 489 (89 – 26 674) | Yang et al., 2017 |
| Californie (États-Unis) | Surfaces des aires de vie | 2006; 16 | 48 (4 – 4 700) | 140 (36 – 1 900) | Dodson et al., 2012 |
| Californie (États-Unis) | Surfaces des aires de vie | 2011; 16 | 100 (45 – 3 590) | 260 (< 2 – 3 800) | Dodson et al., 2012 |
| Boston (États-Unis) |
Tapis et planchers des AVP | 2006; 16 | 322 (moyenne géométrique) (< 6,6 – 15 030) | 234 (moyenne géométrique) (3 – 10 630) | Stapleton et al., 2008 |
| Boston (États-Unis) |
Tapis et planchers des chambres | 2006; 14 | 90,4 (moyenne géométrique) (< 10,6 – 378) | 105 (moyenne géométrique) (1,5 – 763) | Stapleton et al., 2008 |
| Boston (États-Unis) |
Vide | 2006; 7 | 91,1 (moyenne géométrique) (35,7 – 669) | 65,8 (moyenne géométrique) (24,3 – 111) | Stapleton et al., 2008 |
| Boston (États-Unis) |
Vide | 2002-2007; 50 | 840 (moyenne géométrique) (< 450 – 75 000) | 650 (moyenne géométrique) (< 300 – 47 110) | Stapleton et al., 2009 |
| Boston (États-Unis) |
Surfaces des aires de vie | 2006; 19 | 322 (moyenne géométrique) | 234 (moyenne géométrique) | Webster et al., 2010 |
| Boston (États-Unis) |
Surfaces des aires de vie | 2009; 30 | 248 (moyenne géométrique) | 923 (moyenne géométrique) | Webster et al., 2010 |
| Boston (États-Unis) |
Surfaces des aires de vie | 2009; 31 | NM | 150 (moyenne géométrique) (< 4 – 12 400) | Springer et al., 2012 |
| Boston (États-Unis) |
Surfaces des aires de vie | 2002-2003; 38 | 68,4(NP – 75 460) | 435(NP – 47 110) | Johnson et al., 2013 |
| Caroline du Nord | Vide dans les AVP | NP; 53 | 275,5 (< 8,9 – 18 149) | 487,0 (< 33,5 – 4 814) | Hoffman et al., 2014 |
Abréviations : AVP = aires de vie principales; NP = non précisé; NM = non mesuré;
a À moins d’indication contraire.
| Emplacement | Type d’échantillon | Année d’échantillonnage; n | [TBB] médiane (intervalle) | [TBPH] médiane (intervalle) | Référence |
|---|---|---|---|---|---|
| Anvers, Belgique | Tapis et planchers | 2008; 39 | 1 (< 2 – 436) | 13 (< 2 – 5 004) | Ali et al., 2011a |
| Belgique | Vide | 2010; 6 | < 9 | 6,11 (2,42 – 8,19) | Van den Eede et al., 2012d |
| Belgique | Vide | 2006; 2 | < 9 | 10,6 (10,3 – 11) | Van den Eede et al., 2012 |
| Iasi, Roumanie | Tapis | 2010; 47 | < 2 (< 2 – 21) | 10 (< 2 – 150) | Dirtu et al., 2012 |
| Roumanie | Vide | 2007; 3 | < 9 | 8,1 (3,25 – 12,7) | Van den Eede et al., 2012d |
| Stockholm, Suède | Surfaces des aires de vie | 2006; 6 | 172 (25 – 440) | 538,9 (260 – 950) | Sahlström et al., 2012d |
| Espagne | Vide | 2006; 1 | < 9 | 3,8 | Van den Eede et al., 2012d |
| Nouvelle-Zélande | Tapis et planchers | 2008 | 2 (< 2 – 2 285) | 12 (< 2 – 640) | Ali et al., 2012 |
| Nouvelle-Zélande | Matelas | 2008 | 3 (< 2 – 2 285) | 1 (< 2 – 50) | Ali et al., 2012 |
| Emplacement | Type d’échantillon | Année d’échantillonnage | [TBB] médiane (intervalle) | [TBPH] médiane (intervalle) | Référence |
|---|---|---|---|---|---|
| Nouvelle-Zélande | Tapis et planchers | 2008; 34 | 2 (< 2 – 2 285) | 12 (< 2 – 640) | Ali et al., 2012 |
| Nouvelle-Zélande | Matelas | 2008; 16 | 3 (< 2 – 40) | 1 (< 2 – 50) | Ali et al., 2012 |
| Gujrat (rural), Pakistan | Tapis et planchers | 2011; 31 | 0,03 (< 0,2 – 4,5) | 3,5 (< 0,2 – 141) | Ali et al., 2011b |
| Faisalabad, Pakistan | Surfaces des aires de vie | 2011; 15 | 0,4 (< 0,2 – 4,8) | 5,8 (1,6 – 167) | Ali et al., 2013 |
| Koweït, Koweït | Vide | 2011; 15 | 6,6 (0,6 – 550) | 54 (7,2 – 1835) | Ali et al., 2013 |
Annexe G : Estimations de l’exposition au TBB et au TBPH par contact avec des articles manufacturés
À partir des renseignements accessibles, on a estimé l’absorption par exposition cutanée pour le contact direct des nourrissons, des tout-petits et des adultes avec des matelas contenant de la mousse de polyuréthane flexible. On a également dérivé les estimations de l’exposition orale pour les nourrissons et les tout-petits qui mâchonnent (suçotent) les articles manufacturés en mousse destinés à une utilisation par ou pour des enfants. Les tableaux G-1 et G-2 présentent les valeurs et les paramètres d’exposition, fondés sur des hypothèses prudentes, qui sont utilisés pour estimer les expositions.
Estimation de l’absorption par exposition par voie cutanée
Absorption = [SC × FCP × M × DE × AC] / PC
| Symbole | Description | Valeur |
|---|---|---|
| SCa | Surface de contact avec la peau (cm2) | 545-1 840 (nourrisson) 797-2 890 (tout-petit) 2 033-9 100 (adulte) |
| FCPb | Facteur de contact avec la peau | 1 |
| Mc | Taux de migration (mg/cm2/h) | 1,97 × 10-5 |
| DEd | Durée d’exposition (h/j) | 12 (nourrisson) 12 (tout-petit) 8 (adulte) |
| ACe | Absorption cutanée | 11 %-100 % |
| PCf | Poids corporel (kg) | 7,5 (nourrisson) 15,5 (tout-petit) 70,9 (adulte) |
| Absorption | Estimation d’absorption (mg/kg pc/jour) | 1,9×10-3 – 5,8×10-2 (nourrisson) 1,3×10-3 – 4,4×10-2 (tout-petit) 5,0×10-4 – 2,0×10-2 (adulte) |
a Dans ce scénario, on a utilisé une fourchette de surfaces de contact (SC) pour représenter le contact cutané avec un matelas. Pour la valeur faible de SC utilisée, on présume qu’une personne porte un short et un t-shirt couvrant la moitié de ses membres. La surface de contact d’exposition est fondée sur l’exposition de la moitié inférieure des membres (bras et jambes) et de l’arrière de la tête. Les surfaces de contact des membres (Santé Canada, 1995) ont été multipliées par une demie pour représenter la couverture par les vêtements, puis par un tiers, pour tenir compte de la forme triangulaire des membres, dont un seul côté est en contact direct avec le matelas (CPSC, 2006). La surface totale de contact de la tête (Santé Canada, 1995) a été multipliée par la 0,5 dans le but de représenter l’exposition de l’arrière de la tête seulement. Pour la valeur élevée de SC utilisée, on présume que la moitié du corps est en contact cutané avec le matelas (US EPA, 2012).
b Aucun facteur de contact avec la peau (FCP) particulier au TBB, c.-à-d. la fraction de substance sur une surface qui adhère à la peau, n’a été déterminé dans la documentation. Par conséquent, on a choisi une valeur de 1, pour tenir compte que toute la quantité du produit chimique est susceptible d’être absorbée.
c Le taux de migration de 1,97 × 10-5 mg/cm2 par heure pour le mélange de TBB et de TBPH contenant des composés organophosphorés, utilisé pour estimer les expositions cutanées, est fondé sur une étude de migration dirigée par la CPSC des États-Unis portant sur la mousse traitée garnissant les meubles (US CPSC, 2005 b). Brièvement, on a construit une maquette de chaise miniature comprenant un bloc de mousse recouvert de coton-polyester attaché à du contreplaqué. On a mouillé la chaise miniature à l’aide d’une solution saline, pour imiter la sueur, et on a appliqué une pression pour imiter l’action de se coucher. On a déterminé un taux de migration de 1,97 × 10-5 mg/cm2 par heure pour le mélange de TBB et de TBPH contenant des composés organophosphorés selon la quantité maximale déclarée de TBB (2,8 µg) extraite quotidiennement du filtre (diamètre de 5,5 cm) au cours de la période d’essai de migration (6 heures) (US CPSC, 2005 b).
d La durée d’exposition pendant le sommeil a été ajustée en fonction des durées déclarées au CPSC (2006) de maintien de la position assise tranquillement pour tenir compte des durées de sommeil plus longues par rapport au fait d’être assis.
e D’après les études, l’absorption cutanée de TBB serait d’environ 11 % et celle du TBPH de 8 % à 10 % (Frederiksen et al., 2016; Knudsen et al., 2016a). Le taux de migration utilisé pour le mélange de TBB et de TBPH contenant des composés organophosphorés a été déterminé au moyen de la mesure de la migration du TBB de la mousse (CPSC, 2005b), et l’absorption cutanée de 11 % a été retenue comme la valeur minimale de la fourchette utilisée dans ce calcul d’absorption cutanée. La valeur d’absorption cutanée maximale de 100 % a été retenue pour la fourchette d’absorption cutanée pour tenir compte de la possibilité qu’il y ait des absorptions plus élevées (p. ex. en raison de la peau recouverte; de l’inclusion de l’absorption de TBPH; de l’exposition à différentes concentrations).
f Santé Canada (1998).
Estimation de l’absorption par exposition par voie orale
Absorption = [SC × M × DE] / PC
| Symbole | Description | Valeur |
|---|---|---|
| SCa | Surface exposée au mâchonnement direct | 10 cm (nourrisson) 20 cm2 (tout-petit) |
| Mb | Taux de migration | 1,97 × 10-5 mg/cm2/h |
| DEc | Durée de l’exposition | 24,5 min/j |
| PC | Poids corporel | 7,5 kg (nourrisson) 15,5 kg (tout-petit) |
| Absorption | Estimation d’absorption | 1,0 × 10-5 mg/kg pc/jour (nourrisson) 1,0 ×10-5 mg/kg pc/jour (tout‑petit) |
a La surface de contact chez les nourrissons est tirée de plusieurs références (RIVM, 2008). Chez les tout-petits, elle est fondée sur le jugement scientifique professionnel qui reflète le double de la surface de contact de l’ouverture de la bouche d’un tout-petit.
b Étant donné qu’il n’existe aucune autre donnée sur la migration, le taux de migration de 1,97 × 10-5 mg/cm2 par heure pour le mélange de TBB et de TBPH contenant des composés organophosphorés comme il a été présenté dans le scénario d’exposition cutanée, a également été utilisé pour estimer l’exposition orale.
c Le temps que passent les enfants à mâchonner des produits en mousse comme les tapis de sieste, les sièges d’auto et les petits meubles est fondé sur la durée de mâchonnement des « autres objets » indiquée dans la publication de Norris et Smith (2002) citée dans l’USEPA (2011).
d Santé Canada (1998).
Annexe H : Estimation d’absorption de TBB par la dosimétrie inversée sur les échantillons d’urine recueillis dans le cadre de la biosurveillance du ATBB
La dosimétrie inversée a été utilisée pour dériver les estimations d’absorptions quotidiennes à partir des concentrations présentes dans l’urine des tout-petits (âgés de 1 à 5 ans), des enfants (de 6 à 11 ans), d’adolescents (de 12 à 19 ans), ainsi que des hommes et des femmes adultes. Les concentrations urinaires dans la documentation ont été ajustées en fonction de la masse volumique ou de la créatinine et sont présentées dans la section 10.1.3. Le tableau H-1 présente les concentrations maximales ou au 95e centile pour chaque groupe d’âge. Tous les autres paramètres ont précédemment fait l’objet de discussions et sont également présentés ci-dessous. L’équation ci-dessous montre les absorptions quotidiennes calculées à l’aide de la dosimétrie inversée.
Absorption quotidienne = [[Urine]MV × VUrine ou TEC × RMM] / [PC × FEU]
| Symbole | Description | Valeur |
|---|---|---|
| [Urine]MV | Concentrations urinaires maximales du métabolite ajustées en fonction de la masse volumique (pg/mL) | 84,9 (tout-petits)a 341 (adultes)b |
| [Urine]CR | Concentrations urinaires au 95e centile du métabolite, corrigées pour tenir compte de la créatinine (µg/g) | 0,235 (enfants)c 0,174 (adolescents)c 0,174 (adolescents)c |
| Vurine | Volume quotidien total d’urine (L/j) | 0,7 (tout-petits)c 2,03 (adultes)d |
| TECf | Taux quotidien d’excrétion de la créatinine (g Cr/jour) | 0,65 (enfants) 1,4 (adolescents) 1,7 (adultes) |
| PCg | Poids corporel (kg) | 15,5 (tout-petits) 31,0 (enfants) 59,4 (adolescents) 70,9 (adultes) |
| FEUh | Fraction d’excrétion d’urine (fondée sur une étude toxicocinétique chez les rats) | 45 % (commune à tous les groupes d’âge) |
| RMM | Rapport de masse moléculaire entre le composé d’origine et le métabolite, c.-à-d., TBB et ATBB | 1,26 |
| Absorption | Absorption (ng/kg p.c. par jour) | 10,7 (tout-petits) 13,8 (enfants) 11,5 (adolescents) 11,6 (adultes) 36,2 (adultes) |
a Les tout-petits (n = 23) ont été recrutés au New Jersey (États-Unis), et ils étaient âgés de 1 à 5 ans (Butt et al., 2014). Cette étude comprenait les mères des tout-petits; toutefois, l’ATBB n’a pas été fréquemment détecté chez les mères et elles n’ont donc pas été incluses ici.
b Les participants adultes (n = 64), hommes et femmes, ont été recrutés en Caroline du Nord (États-Unis)(Hoffman et al., 2014)
c Ensemble des 2 666 échantillons pour les enfants de 6 à 11 ans (n=421), les adolescents (n=427) et les adultes (n=1818) de partout aux États-Unis, des données de 2013-2014 de NHANES (Ospina et al. 2018). Les données de NHANES sont considérées comme représentatives à l’échelle du pays.
d On a indiqué que les volumes interstitiels urinaires totaux quotidiens moyens variaient de 0,45 à 0,7 L/j chez les tout-petits (3-5 ans) (CIRP, 2003; Lentner, 1981; Wu, 2006). On a choisi une valeur de limite supérieure de 0,7 L/j par prudence pour la dosimétrie inversée.
e On a indiqué que les volumes interstitiels urinaires totaux quotidiens moyens variaient de 0,6 à 2,03 L par jour chez les hommes et les femmes (ICRP, 2003; Van Haarst et al., 2004; Wu, 2006; Perucca et al., 2007; Lakind et Naiman, 2008). On a choisi une valeur de limite supérieure de 2,03 L/j par prudence pour la dosimétrie inversée.
f Valeurs supérieures de la CIPR de 2003.
g Santé Canada, 1998
h Après l’administration orale de mélange de TBB et de TBPH contenant des composés organophosphorés radiomarqué (dans l’huile de maïs) dans le cadre d’une étude chez les rats et les souris, entre 43 % et 65 % du TBB radiomarqué a été excrété dans l’urine 24 heures après l’administration d’une dose unique et répétée (Knudsen et al., 2016b). On a choisi une valeur de 45 % (valeur médiane entre la dose unique à 24 h chez les rats [43 %] et les souris [47 %]) par prudence pour la dosimétrie inversée.
Annexe I : Résumé des études portant sur les effets critiques du mélange commercial de TBB et de TBPH sur la santé
Substance |
Paramètre |
Méthode |
Résultat |
|---|---|---|---|
Mélange commercial de TBPH et de TBB (MPI Research, inc., 2008a) |
Toxicité pour la reproduction |
Étude de fertilité et de reproduction sur deux générations de rats. Espèce/Souche : rats Crl:CD SD (n = 25/sexe/dose) Traitement : Mélange commercial de TBPH et de TBB (ratio de TBB:TBPH de 80:20 selon la soumission en vertu de l’art. 71) Voie d’administration : orale (gavage). Dose : 0, 15, 50 ou 165 mg/kg pc/jour; Véhicule : huile d’arachide Régime de dosage : La génération P0 a été traitée quotidiennement pendant 10 semaines avant l’accouplement, pendant l’accouplement, pendant la gestation et l’allaitement, jusqu’à l’anesthésie prévue. La génération F1 a commencé à recevoir le traitement quotidiennement 22 jours après la naissance (après un sevrage au 21e jour d’allaitement), jusqu’à l’euthanasie prévue. Après accouplement, la génération F1 a produit la génération F2. |
Résultats : Parents de la P0 : Seules les rates mères de la génération P0 appartenant au groupe exposé à 165 mg/kg pc/jour ont présenté un poids corporel et un gain de poids corporel plus faibles et statistiquement significatifs (liés au traitement) au cours de la période précédant l’accouplement (semaine 4, semaines 6-10). On a également observé une diminution du poids corporel au cours de la gestation chez les rats du groupe exposés à la dose la plus élevée. On a observé une diminution statistiquement significative de la consommation d’aliments hebdomadaire chez la génération P0 avant l’accouplement (comparable aux témoins durant la gestation et l’allaitement). Effets sur la reproduction de la P0 : Consommation d’aliments significativement plus faible, nombre total moyen de petits (vivants + morts) à la naissance dans les groupes exposés à 15 et à 50 mg/kg pc/jour comparativement aux témoins, mais comme cet effet n’a pas été observé dans le groupe exposé à 165 mg/kg pc/jour, les auteurs de l’étude l’ont jugé comme étant trompeur et non lié au traitement. Nombre moyen significativement plus faible de cicatrices d’implantation utérine dans le groupe exposé à 50 mg/kg p.c. par jour comparativement aux témoins, mais comme cet effet n’a pas été observé dans le groupe exposé à 165 mg/kg pc/jour, les auteurs de l’étude l’ont jugé comme étant trompeur et non lié au traitement. Petits de la F1 : Poids corporel plus faible et statistiquement significatif à la naissance et pendant l’allaitement (7e jour d’allaitement) chez les petits de la F1 et de la F2 exposés à 165 mg/kg p.c. par jour. Plus faible pendant l’allaitement (14e et 21e jour d’allaitement), mais seulement significatif lorsque les sexes sont combinés le 21e jour d’allaitement comparativement aux témoins. Le poids corporel plus faible (8-10 % plus faible que les témoins au 21e jour d’allaitement) au sevrage chez les petits de la F1 a entraîné un poids corporel plus faible avant l’accouplement des parents de la F1. Poids de la rate plus faible et statistiquement significatif [absolu et relatif (par rapport au poids du cerveau et au poids corporel)] chez les petits mâles de la F1 et les petits mâles et femelles de la F2 exposés à 165 mg/kg pc/jour au 21e jour d’allaitement. Parents de la F1 : Poids corporel et gain de poids corporel plus faibles et statistiquement significatifs avant l’accouplement chez les femelles de la F1 exposées à 165 mg/kg pc/jour. Poids corporel plus faible (non statistiquement significatif) avant l’accouplement chez les mâles de la F1 exposés à 165 mg/kg pc/jour, mais le gain de poids corporel n’a pas été touché. Situation semblable pour les femelles de la F1 exposées à 165 mg/kg p.c. par jour, mais différences significatives au 21e jour d’allaitement entre leur poids corporel et celui des témoins. Réduction statistiquement significative (dans la plupart des cas) de la consommation d’aliments chez les femelles de la F1 exposées à 165 mg/kg par jour. Reproduction de la F1 : Indice de petits mort-nés plus faible chez les groupes traités de la F1 comparativement aux témoins, mais non statistiquement significatif. Petits de la F2 : Poids à la naissance statistiquement plus faible des petits de la F2 exposés à 50 mg/kg pc/jour, mais légèrement différent (moins de 10 %; évaluateur calculé comme étant ~ 7-9 % avant l’allaitement, 3-4,5 % au 4e jour d’allaitement) et comparable à celui des témoins au cours de l’allaitement; les auteurs de l’étude n’ont pas considéré cet effet comme étant significatif sur le plan toxicologique. Les poids des petits de la F2 exposés à 165 mg/kg pc/jour étaient inférieurs et statistiquement significatifs à la naissance, pendant l’allaitement et au sevrage; cet effet a été considéré comme étant lié au traitement. La distance anogénitale était statistiquement plus longue chez les petits femelles de la F2 des groupes exposés à 50 et à 165 mg/kg pc/jour; la distance la plus grande a été observée au sein du groupe exposé à 50 mg/kg pc/jour (non liée à la dose); on a jugé que l’importance de cet effet n’était pas claire, particulièrement en l’absence d’effets sur les rapports de masculinité et les changements macroscopiques au 21e jour d’allaitement. Augmentation sporadique, mais statistiquement significative, du poids du thymus chez les petits de la F2 exposés à 50 mg/kg pc/jour (par rapport au poids du cerveau ou au poids corporel) comparativement aux témoins (15 % et 11 % de différence chez les femelles et les mâles, respectivement [valeur calculée par l’évaluateur]). L’auteur a jugé cet effet « trompeur et non lié au traitement ». 165 mg/kg pc/jour : différences statistiquement significatives entre les rapports du poids du cerveau par rapport au poids corporel chez les mâles et les femelles de la F2, plus faible rapport du poids du foie par rapport à celui du cerveau, poids de la rate plus faible (absolu et relatif par rapport au poids corporel ou au poids du cerveau) comparativement aux témoins. Les auteurs de l’étude indiquent que l’importance toxicologique de ces changements n’est pas claire. Niveaux d’effets dérivés de l’évaluateur : DMENO parentale = 165 mg/kg pc/jour (DSENO = 50 mg/kg pc/jour), fondées sur le poids corporel réduit des femelles de la P0 et de la F1. DMENO sur la reproduction = 50 mg/kg p.c. par jour (DSENO = 15 mg/kg pc/jour), fondées sur la distance anogénitale accrue chez les petits femelles de la F2. Effets critiques : DMENO néonatale = 50 mg/kg pc/jour; DSENO = 15 mg/kg pc/jour, fondées sur le poids corporel réduit chez les petits de la F2 à la naissance |
Mélange commercial de TBPH et de TBB (MPI Research, inc., 2008b) |
Toxicité pour le développement |
Espèces : Rates Crl:CD SD accouplées (âgées de 8-10 semaines; n = 25 femelles/ Traitement : Mélange commercial de TBPH et de TBB (ratio de TBB:TBPH de 80:20 selon la soumission en vertu de l’art. 71). Voie d’administration : orale (gavage). Dose : 0, 50, 100 ou 300 mg/kg p.c.; 5 mL/jour Fréquence : quotidienne, du 6e au 19e jour de gestation. Véhicule : Huile d’arachide; 5 mL/kg Tous les animaux ont été euthanasiés au 20e jour de gestation. |
Aucun cas de mortalité n’est survenu chez les animaux. Toxicité maternelle observée lors de l’exposition à 100 ou à 300 mg/kg (perte de poils sur l’abdomen, poids corporel et gain de poids corporel au cours de la gestation statistiquement plus faibles, consommation d’aliments plus faible). Le poids corporel des fœtus était statistiquement plus faible chez les groupes exposés à 100 ou à 300 mg/kg que chez les témoins. Aucune anomalie du squelette n’a été observée chez les fœtus des groupes exposés à 50 ou à 100 mg/kg pc/jour. Les fœtus exposés à 300 mg/kg pc/jour ont présenté des malformations comme la fusion des arcs neuraux des vertèbres cervicales observées chez deux fœtus (chacun provenant d’une litière différente). Ces effets ont été jugés comme non liés au dosage. On a également observé une incidence accrue des variations de l’ossification des os des fœtus, de l’ossification incomplète des os crâniens et des sternèbres non ossifiées. DSENO pour la toxicité maternelle et la toxicité pour le développement = 50 mg/kg pc/jour (déterminée par les auteurs). DME(N)O maternelle = 100 mg/kg pc/jour, fondée sur la réduction du poids corporel, du gain de poids corporel et de la consommation d’aliments. DME(N)O fœtale = 100 mg/kg pc/jour, fondée sur la réduction statistiquement significative du poids corporel. |
Mélange commercial de TBPH et de TBB (WIL Research Laboratories, inc., 1997e) [WIL-12375] |
Toxicité à court terme |
Espèce : rat SD (mâles et femelles) n = 12 mâles et 12 femelles, pour le groupe-témoin et le groupe exposé à 1 000 mg/kg pc/jour et 6 mâles et 6 femelles dans les groupes exposés à 160 et à 400 mg/kg pc/jour Dose : Gavage avec le mélange commercial de TBPH et de TBB (pureté : 97,4 %) à 0, 160, 400 ou 1 000 mg/kg pc/jour (5 mL/kg) pendant 28 jours consécutifs, suivi d’une période de récupération de 14 jours Véhicule : huile de maïs (5 mL/kg) Qualité de l’étude : BPL; OCDE 407 Batterie d’observations fonctionnelles ajoutées à la ligne directrice 407 normalisée de l’OCDE : observations de la cage domestique, de la manipulation, de l’activité locomotrice, observations sur le terrain et observations sensorielles, neuromusculaires et physiologiques. Observations de six animaux/sexe/ |
Aucune mortalité observée Les résultats liés au traitement comprennent l’assouplissement de l’ouverture vaginale chez un certain nombre de femelles de tous les groupes de dosage [témoin, 160, 400, 1 000 mg/kg pc/jour = 0/6, 1/6, 2/6, 5/12] – Les effets étaient réversibles au cours de la période de récupération. Salivation accrue chez la plupart des animaux des deux sexes dans le groupe exposé à une dose élevée (1 000 mg/kg pc/jour); généralement sporadique et à peu d’occurrences de la 1re semaine à la fin de l’administration de la dose – Les effets étaient réversibles au cours de la période de récupération. Faible incidence de formation de croûtes, d’assouplissement du scrotum, de substance jaune humide sur la région génito-urinaire et d’écoulement oculaire. Diminution statistiquement significative du gain de poids corporel moyen chez les animaux exposés à une dose élevée, chez les femelles exposées à une dose moyenne, ainsi que chez les femelles exposées à une faible dose à la 3e semaine. Diminution statistiquement significative du gain de poids corporel chez les femelles exposées à une faible dose de la 2e semaine à la fin de l’administration du dosage. Récupération comparable du gain de poids corporel entre les animaux exposés à une dose élevée et les animaux témoins. Récupération des poids corporels moyens des animaux exposés à une dose élevée; écart de 7 % par rapport aux témoins. Consommation d’aliments réduite observée chez les mâles exposés à 1 000 mg/kg pc/jour dans les 1re et 2e semaines et chez les femelles exposées à une dose élevée, moyenne et faible de la 1re semaine à la fin de l’administration du dosage; aucune différence par rapport aux témoins au cours de la récupération. Poids corporel moyen réduit chez les femelles exposées à une dose élevée lors des observations physiques effectuées à la 3e semaine d’étude. Aucune différence importante observée au cours de la batterie d’observations fonctionnelles et des essais d’activité motrice. Augmentation importante du ratio albumine-globuline (A/G) moyen dans le groupe exposé à une dose élevée à la 4e semaine d’étude. Augmentation importante de la concentration sérique moyenne de chlorure chez les rats mâles et femelles exposés à une dose élevée et chez les femelles exposées à une dose faible et moyenne; potentiellement liée au traitement. Diminution statistiquement significative du nombre moyen de plaquettes et de lymphocytes dans le groupe exposé à une dose élevée à la 4e semaine. Au cours de la période de récupération, les femelles du groupe exposé à une dose élevée ont présenté une augmentation du nombre total moyen de leucocytes et du nombre absolu de lymphocytes ainsi qu’une diminution de la concentration moyenne de globules rouges, d’hémoglobine et d’hématocrite – ces effets n’ont pas été jugés comme étant liés au traitement étant donné que les changements n’ont été observés que chez les femelles exposées à une dose élevée et que les valeurs correspondaient à celles observées autrefois dans les groupes témoins. Diminution significative du poids moyen absolu du cœur, des ovaires et des glandes surrénales chez les femelles exposées à une dose élevée comparativement aux témoins. Augmentation du poids moyen relatif du foie (par rapport au poids corporel) dans les groupes exposés à une dose élevée et chez les mâles exposés à une dose moyenne. Augmentation du poids moyen relatif du cerveau (par rapport aux moyennes finales de poids corporel) chez les femelles de tous les groupes de traitement et augmentation des poids relatifs du cœur et des reins chez les femelles du groupe exposé à une dose moyenne. *L’importance des effets est attribuable aux moyennes finales réduites du poids corporel. **Les auteurs ne jugent pas qu’ils sont des effets directs du traitement (les poids absolus des organes ne présentaient pas de différences par rapport aux poids corporels moyens finaux correspondants; le poids relatif ne présentait pas de différences par rapport aux moyennes de poids absolu des organes). À l’autopsie, on a observé une régénération de l’épithélium des tubules rénaux corticaux dans tous les groupes de traitement [témoin, 160, 400, 1 000 mg/kg pc/jour : mâles = 0/6, 2/6, 4/6, 5/6; femelles : 0/6, 6/6, 6/6, 6/6] – aucune observation de régénération de l’épithélium des tubules rénaux au sein du groupe exposé à 1000 mg/kg pc/jour. D’autres changements microscopiques du rein chez le groupe témoin et les groupes de traitement comprennent la néphropathie, la minéralisation tubulaire, l’hydronéphrose et l’inflammation non purulente. On a observé un rétablissement important ou complet de tous les effets chez les animaux 2 semaines après l’arrêt de l’exposition. DMEO = 160 mg/kg pc/jour, fondée sur les effets sur le poids corporel chez les femelles, sur les effets sur les reins chez les mâles et les femelles ainsi que sur les concentrations moyennes accrues de chlorure sérique chez les femelles exposées à toutes les doses. DMENO = 1 000 mg/kg pc/jour : modifications du poids corporel et des paramètres de chimie clinique chez les deux sexes. |
