Rapport sur l'état des connaissances scientifiques - Partie 1
Groupe de substances des phtalates
Esters phtaliques à chaîne moyenne
Numéros de registre du Chemical Abstracts Service
84-61-7; 84-64-0; 84-69-5; 523-31-9; 5334-09-8; 16883-83-3; 27215-22-1; 27987-25-3; 68515-40-2; 71888-89-6
Environnement Canada
Santé Canada
Août 2015
Table of Contents
- Tableaux et figures
- Synopsis
- 1. Introduction
- 2. Identité des substances
- 3. Propriétés physicochimiques
- 4. Sources
- 5. Usages
- 6. Rejets dans l'environnement
- 7. Devenir et comportement dans l'environnement
- 8. Possibilités d'effets nocifs sur l'environnement
- 9. Possibilités d'effets nocifs sur la santé humaine
- 10. Références
- Annexes
Tableaux et figures
- Tableau 1. Substances appartenant au sous-groupe des phtalates à chaîne moyenne
- Tableau 2-1. Synthèse de l'information sur l'identité des substances du sous-groupe des phtalates à chaîne moyenne
- Tableau 2-2. Identité des analogues du sous-groupe des phtalates à chaîne moyenne
- Tableau 2-3. Substances appartenant au sous-groupe des phtalates à chaîne moyenne retenues pour une approche de lecture croisée
- Tableau 2-4. Données obtenues par l'approche de lecture croisée utilisées pour quantifier divers paramètres évalués dans la présente étude
- Tableau 2-5. Information sur l'identité, la structure chimique et la ramification des analogues utilisés aux fins de la lecture croisée
- Tableau 3-1. Propriétés physicochimiques expérimentales et prévues (à température normale) des esters phtaliques à chaîne moyenne
- Tableau 4-1. Sommaire des quantités des substances appartenant au sous-groupe des phtalates à chaîne moyenne produites au Canada, importées et exportées en 2012
- Tableau 4-2. Sommaire de la production et de l'utilisation des substances du sous-groupe des phtalates à chaîne moyenne à l'échelle internationale
- Tableau 5-1. Résumé des usages de cinq phtalates à chaîne moyenne au Canada
- Tableau 5-2. Sommaire des principaux usages des phtalates à chaîne moyenne relevés à l'échelle internationalea
- Tableau 7-1. Sommaire de la modélisation de la fugacité de niveau III (EQC, 2011) du DIBP, du BCHP et du CHIBP, et pourcentage de répartition dans chaque milieu pour trois scénarios de rejet
- Tableau 7-2. Sommaire de la modélisation de la fugacité de niveau III (EQC, 2011) du DCHP, du DBzP, du BIOP, du B79P, du DIHepP et du DMCHP, et pourcentage de répartition dans chaque milieu pour trois scénarios de rejet
- Tableau 7-21. (Q)SAR model predictions for degradation of the medium-chain phthalates subgroup in air by hydroxyl radicals and through hydrolysis
- Tableau 7-22. Summary of key empirical data for biodegradation of medium-chain phthalates and analogue substances in water
- Tableau 7-23. Summary of modelled primary and ultimate biodegradation data for DIBP, BCHP, CHIBP, DCHP, DMCHP and DIHepP
- Tableau 7-24. Summary of modelled primary and ultimate biodegradation data for DBzP, B84P, B79P and BIOP
- Tableau 7-3. Sommaire de la modélisation de la fugacité de niveau III (EQC, 2011) du B84P et pourcentage de répartition dans chaque milieu pour trois scénarios de rejet
- Tableau 7-4. Sommaire des facteurs de bioaccumulation pour les phtalates à chaîne moyenne
- Tableau 8-1. Principales études sur la toxicité des phtalates à chaîne moyenne pour les organismes aquatiques prises en considération en vue de déterminer une valeur de toxicité critique
- Tableau 8-2. Principales études sur la toxicité des analogues du BCHP, du CHIBP et du DBzP pour les organismes aquatiques prises en considération pour déterminer une valeur de toxicité critique
- Tableau 8-3. Valeur prévue des paramètres de toxicité associés aux organismes aquatiques générée par ECOSAR (v1.00) pour les phtalates à chaîne moyenne
- Tableau 8-4. Sommaire des résultats du modèle pour le B79P et le BIOP
- Tableau 8-5. CSEP des phtalates à chaîne moyenne
- Tableau 8-6. Données d'entrée et de sortie de l'équation relative aux RCC pour le DIHepP et le B84P
- Tableau 8-7. Données d'entrée et de sortie de l'équation relative à la saturation maximale des phtalates à chaîne moyenne dans les sédiments
- Tableau 8-8. Données d'entrée et de sortie pour le calcul de la CSEP du DCHP, du BIOP, du B79P et du DMCHP dans les sédiments
- Tableau 8-9. Concentrations prévues dans l'environnement (CPE) déterminées à partir des concentrations mesurées dans l'environnement utilisées pour la caractérisation des risques écologiques
- Tableau 8-10. Synthèse des quotients de risque établis pour différents milieux et scénarios d'exposition concernant le DIBP et le DCHP
- Tableau 8-11. Sommaire des données requises pour réduire les incertitudes dans l'évaluation écologique des phtalates à chaîne moyenne
Synopsis
Le ministre de l'Environnement et le ministre de la Santé ont préparé un rapport sur l'état des connaissances scientifiques concernant dix esters phtaliques faisant partie du groupe des phtalates. Ce rapport vise à passer en revue les connaissances scientifiques actuelles sur les phtalates à chaîne moyenne afin de permettre au grand public de se pencher sur celles-ci, de les commenter et de fournir des renseignements supplémentaires à des fins d'examen, et ce, avant que des conclusions soient proposées dans une ébauche d'évaluation préalable qui sera publiée. Une approche pour l'évaluation des risques cumulatifs associés aux phtalates a aussi été proposée aux fins d'examen et de commentaires par le grand public, et elle sera utilisée pour la rédaction de l'ébauche d'évaluation préalable. Les principaux critères de sélection pour ce groupe étaient fondés sur la possibilité d'effets préoccupants similaires sur la santé; pour certains phtalates, sur la possibilité d'effets préoccupants sur le plan écologique; sur la possibilité d'exposition des consommateurs et des enfants; sur la possibilité de tirer parti des activités internationales et de les harmoniser; et sur la possibilité de gains d'efficacité en matière d'évaluation et de gestion des risques.
Bien que les phtalates présentent des caractéristiques structurales communes et des usages fonctionnels semblables, les sous-groupes ont été constitués de façon à refléter les différences observées quant à leurs effets préoccupants pour la santé et à leur devenir et leur comportement dans l'environnement. Du point de vue des dangers pour la santé, les sous-groupes se fondent d'abord et avant tout sur une analyse des rapports structure-activité (RSA). Cette analyse repose sur des études ayant trait à des événements importants touchant le mode d'action lié à l'insuffisance androgénique causée par les phtalates durant le développement de l'appareil reproducteur mâle chez le rat. Les effets des esters phtaliques sur ces événements importants semblent dépendre de la structure et être fortement associés à la longueur et à la nature de la chaîne alkyle. L'approche qui a permis de diviser les substances faisant partie du groupe des phtalates en trois sous-groupes en fonction des dangers qu'ils posent pour la santé est présentée plus en détail dans le document préparé par Santé Canada (2015a). Du point de vue écologique, l'établissement des sous-groupes était principalement fondé sur les différences dans le coefficient de partage octanol-eau (log Koe) et l'hydrosolubilité, ainsi que sur leurs répercussions sur la bioaccumulation et l'écotoxicité. Une annexe de l'approche préliminaire pour l'évaluation des risques cumulés associés aux phtalates contient de plus amples renseignements sur la justification écologique de l'établissement des sous-groupes (Environnement Canada et Santé Canada, 2015a).
Le numéro de registre CAS (numéro CASNote de bas de page[1]), ainsi que le nom commun et l'abréviation de chaque substance selon la Liste intérieure des substances (LIS) sont présentés dans le tableau ci-dessous.
| Numéro CAS | Nom chimique | Nom figurant dans la Liste intérieure des substances/nom commun et abréviation |
|---|---|---|
| 84-61-7 | ester dicyclohexylique de l'acide 1,2-benzènedicarboxylique | Phtalate de dicyclohexyle (DCHP) |
| 84-64-0 | ester butylique et cyclohexylique de l'acide 1,2-benzènedicarboxylique | Phtalate de butyle et de cyclohexyle (BCHP) |
| 84-69-5 | ester bis(2-méthylpropylique) de l'acide 1,2-benzènedicarboxylique | Phtalate de diisobutyle (DIBP) |
| 523-31-9 | ester bis(phénylméthylique) de l'acide 1,2-benzènedicarboxylique | Phtalate de dibenzyle (DBzP) |
| 5334-09-8 | ester cyclohexylique et 2-méthylpropylique de l'acide 1,2-benzènedicarboxylique | Phtalate de cyclohexyle et d'isobutyle (CHIBP) |
| 16883-83-3 | ester 2,2-diméthyl-1-(1-méthyléthyl)-3-(2-méthyl-1-oxopropoxy)propylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique | Phtalate de benzyle et de 3-isobutyryloxy-1-isopropyl-2,2-diméthylpropyle (B84P) |
| 27215-22-1 | ester isooctylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique | Phtalate de benzyle et d'isooctyle (BIOP) |
| 27987-25-3 | ester bis(méthylcyclohexylique) de l'acide 1,2-benzènedicarboxylique | Phtalate de bis(méthylcyclohexyle) (DMCHP) |
| 68515-40-2 | esters benzylique et alkyliques ramifiés en C7-9 et linéaires de l'acide 1,2-benzènedicarboxylique | Phtalates de benzyl(C7-9-alkyles) ramifiés et linéaires Phtalate de benzyle et d'octyle (B79P) |
| 71888-89-6 | esters dialkyliques ramifiés en C6-8 riches en C7 de l'acide 1,2-benzènedicarboxylique | Phtalates de dialkyles ramifiés en C6-8, riches en C7 Phtalate de diisoheptyle, (DIHepP) |
Les dix substances comprises dans le sous-groupe des phtalates à chaîne moyenne ne sont pas présentes à l'état naturel dans l'environnement. Cinq substances, soit le DIBP, le DCHP, le DIHepP, le B79P et le B84P, sont importées au Canada. Les quantités importées en 2012 étaient inférieures à 10 000 kg pour le DCHP et le DIHepP; elles variaient de 10 000 à 100 000 kg en ce qui concerne le DIBP; et de 100 000 à 1 000 000 kg pour le B79P et le B84P (Environnement Canada, 2014). Les quantités des cinq autres substances, soit le CHIBP, le BCHP, le DMCHP, le BIOP et le DBzP, qui ont été importées au Canada en 2012, se trouvaient sous le seuil de déclaration fixé à 100 kg. Aucun des phtalates à chaîne moyenne étudiés n'était fabriqué au Canada en des quantités supérieures au seuil de déclaration de 100 kg. Les adhésifs et les matériaux d'étanchéité utilisés dans les secteurs de la construction ou de l'automobile comptent parmi les principales utilisations du DIBP, du DCHP, du DIHepP, du B79P et du B84P. Au sein de l'industrie automobile, les phtalates à chaîne moyenne sont aussi employés dans les peintures et les enduits, ainsi que dans les résines qui sont ensuite moulées pour la fabrication de pièces d'automobiles. La plupart de ces substances sont aussi utilisées comme plastifiants dans la production de matières plastiques et dans la fabrication de produits manufacturés, notamment du matériel électrique et électronique ainsi que des jouets pour enfants. L'importation de B79P sous forme de matière première destinée à diverses applications a aussi été signalée.
On s'attend à ce que les phtalates à chaîne moyenne se retrouvent principalement dans les eaux par les effluents des eaux usées d'origine industrielle et par les rejets dispersés de produits de consommation. Les phtalates à chaîne moyenne se trouvant dans les produits ne sont pas intégrés dans la matrice, de sorte qu'ils sont susceptibles de migrer et d'être rejetés dans l'environnement. L'élimination de produits de consommation dans les systèmes de traitement des eaux uséesNote de bas de page[2] constitue une autre source possible de rejet dans l'environnement. Après leur rejet dans l'eau, on s'attend à ce que ces substances y demeurent et se répartissent dans les sédiments selon un degré de répartition déterminé par la taille moléculaire et l'hydrosolubilité des substances. Les phtalates à chaîne moyenne sont hydrophobes, ils peuvent être absorbés par les particules du sol et ils présentent une capacité limitée de volatilisation à partir de l'eau. Certains phtalates à chaîne moyenne ont été détectés et mesurés dans tous les milieux (c.-à-d. air, eau, sédiments et sol), y compris les régions éloignées, les eaux usées et le biote.
Ces substances se biodégradent relativement rapidement, en particulier dans des conditions aérobies. Cependant, à de très faibles concentrations, le processus de biodégradation peut être plus lent. Les processus de dégradation abiotique comme l'hydrolyse sont lents. Toutefois, aucune de ces substances ne devrait persister dans l'environnement.
Des données empiriques et modélisées indiquent que les phtalates à chaîne moyenne présentent un potentiel de bioaccumulation et de bioamplification allant de faible à modéré. Cependant, le DIBP et le DIHepP ont été mesurés chez diverses espèces aquatiques, ce qui confirme la biodisponibilité de ces substances.
Compte tenu des coefficients de partage élevés et des niveaux d'hydrosolubilité allant de faibles à modérés, l'exposition des organismes aux phtalates à chaîne moyenne se fera principalement par l'alimentation. Les résultats de tests en laboratoire normalisés donnent à penser que la plupart des phtalates à chaîne moyenne posent un risque allant de modéré à élevé pour les espèces aquatiques. Le DIHepP et le B84P ne semblent avoir aucun effet nocif à des concentrations allant jusqu'à leurs limites d'hydrosolubilité, et même au-delà. Les résultats d'une analyse de résidus corporels critiques (RCC) menée avec des organismes aquatiques en fonction de la limite de solubilité ont mis en lumière le fait que la concentration tissulaire maximale de DIHepP et de B84P est largement inférieure aux niveaux entraînant des effets nocifs graves ou des effets chroniques de létalité attribuables à la narcose.
Selon les résultats de tests de laboratoire réalisés pour le DIBP et le BBP, le BCHP, le CHIBP et le DBzP devraient également présenter un risque faible pour les organismes vivant dans les sédiments. Une analyse de RCC réalisée avec des organismes vivant dans les sédiments a révélé que la concentration tissulaire maximale calculée d'après la limite de saturation du DIHepP et de son facteur d'accumulation biote-sédiments (FABS) ne dépassait pas les concentrations minimales qui pourraient causer des effets narcotiques. Les valeurs de toxicité pour les organismes vivant dans les sédiments ont été établies sur la base des résultats de toxicité, pour les organismes aquatiques, du DCHP, du BIOP, du B79P et du DMCHP à l'aide d'une méthode de partage à l'équilibre. Cet exercice a permis de générer des valeurs de toxicité modérées pour les organismes vivant dans les sédiments.
Il convient de noter que l'analyse de RCC ne tient pas compte des effets nocifs éventuels résultant de modes d'action autres que la narcose de base. Les paramètres secondaires qui pourraient être dus à l'activité endocrinienne et aux modes d'action autres que la narcose n'ont pas été bien étudiés pour les phtalates à chaîne moyenne. Des études donnent à penser que certains phtalates (comme le BBP) peuvent perturber le système endocrinien. Celles-ci ne portaient toutefois pas sur les substances incluses dans le sous-groupe des phtalates à chaîne moyenne. L'information limitée sur l'activité œstrogénique des phtalates à chaîne moyenne chez les organismes aquatiques ne permet pas de démontrer qu'ils ont des effets à l'échelle des populations (comme la croissance, la reproduction ou la survie).
Des scénarios d'exposition qualitatifs visant le B79P et le B84P ont été établis pour le secteur automobile. Ils décrivent les rejets de ces substances dans l'eau à partir des installations où elles sont utilisées, par exemple dans les matériaux d'étanchéité et les revêtements automobiles. Les calculs des concentrations environnementales estimées (CEE) du B79P et du B84P étaient extrêmement incertains. Par conséquent, des données de contrôle ou de surveillance ont été utilisées à des fins de détermination des CEE. Des données de contrôle issues des différents usages de ces substances ont été utilisées pour estimer les niveaux d'exposition éventuels au DIBP et au DCHP, alors qu'une analyse de résidus corporels critiques a été réalisée pour le DIHepP. Les quotients de risque (QR) calculés indiquaient qu'il était improbable que ces substances posent un danger pour les organismes aquatiques. Étant donné qu'il n'existe aucune preuve d'importation au Canada de CHIBP, de BCHP, de DMCHP, de BIOP et de DBzP dans des quantités supérieures au seuil de déclaration de 100 kg, aucun scénario d'exposition n'a été établi pour ces substances.
Pour la population canadienne dans son ensemble, l'air intérieur, la poussière, les aliments et le lait maternel sont les principales sources d'exposition aux phtalates à chaîne moyenne. Comme certains renseignements obtenus indiquent qu'une proportion de ces substances se trouvant dans des biens manufacturés pourrait entrer en contact avec la peau, des scénarios d'exposition ont été établis pour décrire l'exposition dermique chez l'adulte et l'enfant. Enfin, le DIBP peut aussi être présent dans les jouets et les articles pour enfants; par conséquent, l'exposition par voie orale due au mordillement de ces produits a aussi été évaluée.
En ce qui concerne la santé humaine, les données d'études réalisées avec des animaux montrent que les phtalates à chaîne moyenne ont des effets systémiques, ainsi que des effets sur le développement et la reproduction se rapportant au foie et aux reins. Selon le phtalate en question, l'effet critique pour la caractérisation des risques se rapporte aux effets sur le développement chez les mâles. En effet, les données disponibles les plus probantes mettent en lumière des effets sur le développement de l'appareil génital, notamment l'altération des paramètres de féminisation et des malformations touchant les voies génitales, de même que des effets sur la fertilité. Ces effets sont attribuables à un mode d'action bien documenté appelé le « syndrome des phtalates chez le rat » (SPR). Ce syndrome a été associé aux niveaux d'exposition à ce sous-groupe de phtalates les plus faibles observés à ce jour dans le cadre d'études menées avec des animaux.
La comparaison de l'exposition estimée à sept phtalates à chaîne moyenne de différentes sources, comme l'environnement, les aliments, le contact avec des articles en plastique (PVC, polyuréthane, polyester, etc.), les jouets et les produits de soins personnelsNote de bas de page[3] de même que les niveaux de biosurveillance (le cas échéant) pour tous les groupes d'âge selon les seuils d'effets critiques appropriés, ont révélé des marges d'exposition (ME) jugées adéquates pour que les incertitudes relevées dans les bases de données sur l'exposition et les effets sur la santé soient dissipées. De plus, ces marges sont aussi considérées comme suffisantes pour offrir une protection contre les effets éventuels sur la reproduction, non seulement chez les hommes plus âgés, mais également chez les femmes, en plus des effets sur d'autres systèmes d'organes.
Les résultats de l'enquête menée en vertu de l'article 71 auprès de l'industrie révèlent que le CHIBP, le BCHP et le BIOP ne sont actuellement pas utilisés au-dessus du seuil de 100 kg. Par conséquent, la probabilité d'exposition de la population générale canadienne est considérée comme faible. Ainsi, le risque potentiel pour la santé humaine est jugé faible pour ces trois substances.
À la lumière des renseignements disponibles, il s'avère que les substances du sous-groupe des phtalates à chaîne moyenne ont un mode d'action commun, en ce qu'elles provoquent des effets caractéristiques du SPR sur l'appareil génital mâle. Bien que les ME associées aux dix phtalates visés par le présent rapport soient actuellement jugées adéquates sur le plan individuel, celles-ci ne tiennent pas compte du risque potentiel posé par l'exposition simultanée à ces substances.
Par conséquent, une proposition d'approche pour l'évaluation des risques cumulatifs est présentée dans un autre rapport (Environnement Canada et Santé Canada, 2015a).
1. Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) (LCPE [1999]) (Canada, 1999), le ministre de l'Environnement et le ministre de la Santé évaluent des substances pour déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou pour la santé humaine.
L'Initiative des groupes de substances constitue un volet clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe des phtalates comprend 14 substances dont l'évaluation a été jugée essentielle, car elles respectent les critères de catégorisation définis à l'article 73 de la LCPE (1999) ou encore, elles constituent des substances prioritaires en raison des préoccupations que suscitent leurs effets sur la santé humaine (Environnement Canada et Santé Canada, 2007). Certaines substances appartenant à ce groupe ont été jugées préoccupantes par d'autres autorités en raison de leurs effets potentiels sur la reproduction et le développement chez les humains. De plus, certains phtalates sont susceptibles d'avoir des effets écologiques préoccupants. Une étude réalisée dans le cadre de la première phase de la mise à jour de la Liste intérieure des substances (LIS) a révélé qu'un sous-ensemble de phtalates présentait un vaste éventail d'applications commerciales qui pourraient entraîner une exposition chez les humains, y compris les enfants (Environnement Canada, 2012). Le fait de se pencher sur ces substances en tant que groupe permet de tenir compte de leurs risques cumulés, lorsque cela est justifié.
Le présent rapport sur l'état des connaissances scientifiques (ECS) contient une synthèse et une évaluation des renseignements scientifiques actuels. Il servira de base à une ébauche d'évaluation préalable dont la publication est prévue en 2016. Le gouvernement du Canada a élaboré un ensemble de rapports sur l'ECS visant le groupe des phtalates afin de permettre au grand public de formuler des commentaires sur une proposition d'approche d'évaluation des risques cumulés associés à certains phtalates (Environnement Canada et Santé Canada, 2015a), et ce, avant que cette approche soit mise en œuvre en vue de rendre des conclusions sur les substances de ce groupe dans une ébauche de rapport d'évaluation préalable qui sera publié.
Ce rapport sur l'ECS porte sur les dix esters phtaliques répertoriés dans le tableau 1. Ils forment le sous-groupe des phtalates à chaîne moyenne, d'après la taille intermédiaire de leurs groupes latéraux fonctionnels. L'évaluation de ces substances est jugée prioritaire en vertu du paragraphe 73(1) de la LCPE (1999). Ces substances satisfont également aux critères de catégorisation relatifs à la persistance, mais pas à ceux se rapportant à la bioaccumulation ni à la toxicité intrinsèque pour les organismes non humains.
| Numéro CAS | Nom chimique de la substance | Abréviation |
|---|---|---|
| 84-69-5 | ester bis(2-méthylpropylique) de l'acide 1,2-benzènedicarboxylique | DIBP |
| 84-64-0 | ester butylique et cyclohexylique de l'acide 1,2-benzènedicarboxylique | BCHP |
| 5334-09-8 | ester cyclohexylique et 2-méthylpropylique de l'acide 1,2-benzènedicarboxylique | CHIBP |
| 84-61-7 | ester dicyclohexylique de l'acide 1,2-benzènedicarboxylique | DCHP |
| 27987-25-3 | ester bis(méthylcyclohexylique) de l'acide 1,2-benzènedicarboxylique | DMCHP |
| 71888-89-6 | esters dialkyliques ramifiés en C6-8 riches en C7 de l'acide 1,2-benzènedicarboxylique | DIHepP |
| 523-31-9 | ester bis(phénylméthylique) de l'acide 1,2-benzènedicarboxylique | DBzP |
| 16883-83-3 | ester 2,2-diméthyl-1-(1-méthyléthyl)-3-(2-méthyl-1-oxopropoxy)propylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique | B84P |
| 27215-22-1 | ester isooctylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique | BIOP |
| 68515-40-2 | esters benzylique et alkyliques ramifiés en C7-9 et linéaires de l'acide 1,2-benzènedicarboxylique | B79P |
Bien que les phtalates présentent des caractéristiques structurales communes et des usages fonctionnels semblables, les sous-groupes ont été constitués de façon à refléter les différences observées quant à leurs effets préoccupants pour la santé et à leur devenir et leur comportement dans l'environnement. Du point de vue des dangers pour la santé, les sous-groupes se fondent d'abord et avant tout sur une analyse des rapports structure-activité (RSA). Cette analyse repose sur des études ayant trait à des événements importants touchant le mode d'action lié à l'insuffisance androgénique causée par les phtalates durant le développement de l'appareil reproducteur mâle chez le rat. Les effets des esters phtaliques sur ces événements importants semblent dépendre de la structure et être fortement associés à la longueur et à la nature de la chaîne alkyle (Santé Canada, 2015a). Du point de vue écologique, l'établissement des sous-groupes était principalement fondé sur les différences dans le coefficient de partage octanol-eau (log Koe) et l'hydrosolubilité, ainsi que sur leurs répercussions sur la bioaccumulation et l'écotoxicité (Environnement Canada et Santé Canada, 2015a).
Ce rapport sur l'ECS évalue les renseignements sur les propriétés chimiques, le devenir dans l'environnement, les dangers, les usages et l'exposition, y compris les renseignements additionnels présentés par les intervenants. Des données pertinentes ont été recueillies jusqu'en décembre 2014 pour le volet écologique, et jusqu'en août 2014 pour le volet sanitaire de l'évaluation. De nouveaux renseignements concernant les dangers ont été obtenus après l'échéance de la revue de la littérature et seront intégrés à la prochaine phase du processus d'évaluation. Des données empiriques provenant d'études clés et certains résultats issus de modèles ont été utilisés. Lorsqu'elle était disponible et pertinente, l'information présentée dans les évaluations réalisées par d'autres autorités a été prise en considération.
Ce rapport sur l'ECS ne constitue pas un examen exhaustif ni critique de toutes les données disponibles. Il fait plutôt état des études les plus importantes et fiables sur le sujet, ainsi que des sources de données les plus pertinentes pour appuyer l'élaboration ultérieure d'une évaluation préalable.
Le présent rapport sur l'ECS a été préparé par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada, et il intègre les résultats d'autres programmes exécutés par ces ministères. Les volets de ce rapport portant sur l'écologie et la santé humaine ont fait l'objet d'une évaluation écrite par des pairs ou d'une consultation de ces derniers. Les chercheurs suivants ont fourni des commentaires sur les volets techniques relatifs à l'environnement : Frank Gobas (Frank Gobas Environmental Consulting), Chris Metcalfe (Ambient Environmental Consulting, Inc.), Thomas Parkerton (ExxonMobil Biomedical Sciences, Inc.) et Charles Staples (Assessment Technologies, Inc.). Les chercheurs suivants ont fourni des commentaires sur les volets techniques relatifs à la santé humaine : Andreas Kortenkamp (Brunel University), Donna Vorhees (The Science Collaborative), Michael Dourson (Toxicology Excellence for Risk Assessment), et Raymond York (York & Associates). Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu et des résultats finaux de ce rapport.
2. Identité des substances
Les esters phtaliques sont synthétisés par l'estérification de l'anhydride phtalique (anhydride de l'acide1,2-benzènedicarboxylique; no CAS 85-44-9) avec divers alcools (ACC, 2001). Les esters phtaliques produits sont des diesters de l'acide benzènedicarboxylique composés d'un cycle benzénique avec deux chaînes latérales ester. Les phtalates présentent la structure générale illustrée à la figure 1, où R1 et R2 représentent des chaînes latérales ester dont la longueur et la structure peuvent varier (ACC, 2001). Les groupes latéraux de type ester peuvent être identiques ou différents, et la nature des groupes latéraux détermine l'identité des phtalates, de même que leurs propriétés physiques et toxicologiques. Toutes les substances appartenant au groupe des phtalates sont des ortho-phtalates (o-phtalates) dont les chaînes latérales ester sont adjacentes l'une à l'autre aux positions 1 et 2 du cycle benzénique (voir la figure 1; US EPA, 2012).
La formule développée des esters phtaliques découle de la composition isomérique de l'alcool utilisé dans leur fabrication (Parkerton et Winkelmann, 2004). Les phtalates de dialkyle ont des groupes ester à chaîne alkyle ramifiée ou linéaire contenant de un à treize carbones, alors que les phtalates de benzyle contiennent généralement, en tant que groupe ester, un groupe phénylméthyle et une chaîne alkyle, et les phtalates de cyclohexyle, un cycle benzénique saturé (Parkerton et Winkelmann, 2004).
Figure 1. Structure générale des ortho-phtalates

Longue description pour la figure 1
Représentation bidimensionnelle de la structure moléculaire générale des phtalates d'intérêt.
La figure comporte deux éléments.
1) La structure moléculaire générale des phtalates d'intérêt est présentée à gauche. La structure moléculaire générale consiste en un cycle benzénique avec substitutions d'esters en positions 1 et 2. Les chaînes sur les liens esters sont représentées par les lettres « R1 » et « R2 ».
2) La définition des groupes R est indiquée à la droite de la figure. R1 et R2 peuvent être des chaînes alkyles saturées, linéaires ou ramifiées. R1 et R2 peuvent également être un groupement phényle ou un cycle cyclohexyle.
Les dix substances appartenant au groupe des phtalates qui font l'objet du présent rapport sur l'ECS appartiennent au sous-groupe des phtalates à chaîne moyenne et se caractérisent par la présence de groupes latéraux de type ester contenant principalement de trois à sept carbones, et au plus neuf carbones. La masse moléculaire de ces substances varie de 278,4 à 454,6 g/mol. Les groupes latéraux de type ester, qui se trouvent toujours en position ortho, se présentent selon l'un de trois agencements possibles : deux chaînes alkyle ramifiées ou linéaires dans le cas des phtalates de dialkyle; une chaîne alkyle et un groupe cyclique dans le cas des phtalates de phényle ou de benzyle; ou deux groupes cycliques dans le cas des phtalates dicycliques. Une synthèse de l'information sur l'identité des substances du sous-groupe des phtalates à chaîne moyenne est présentée au tableau 2-1.
Deux substances, à savoir le DIHepP (no CAS 71888-89-6) et le BIOP (no CAS 27215-22-1), sont des mélanges isomériques de molécules présentant des chaînes alkyle ayant un nombre déterminé d'atomes de carbone, mais dont la ramification peut varier. Le B79P (no CAS 68515-40-2) est considéré comme faisant partie des UVBC (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques); il possède des chaînes alkyle d'une longueur de sept à neuf carbones et à ramification variable. Les sept autres substances sont des composés chimiques définis à constituant simple.
| N° CAS Abréviation |
Nom chimique (nom figurant dans la LIS) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
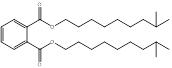
| 84-69-5 DIBP |
ester bis(2-méthylpropylique) de l'acide 1,2-benzènedicarboxylique (phtalate de diisobutyle) |
 C16H22O4 |
278,35 |
| 84-64-0 BCHP |
ester butylique et cyclohexylique de l'acide 1,2-benzènedicarboxylique (phtalate de butyle et de cyclohexyle) |
 C18H25O4 |
304,39 |
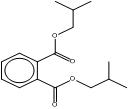
| 5334-09-8 CHIBP |
ester cyclohexylique et 2-méthylpropylique de l'acide 1,2-benzènedicarboxylique (phtalate de cyclohexyle et d'isobutyle) |
 C18H25O4 |
304,39 |
| 84-61-7 DCHP |
ester dicyclohexylique de l'acide 1,2-benzènedicarboxylique (phtalate de dicyclohexyle) |
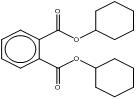 C20H26O4 |
330,43 |
| 523-31-9 DBzP |
ester bis(phénylméthylique) de l'acide 1,2-benzènedicarboxylique (phtalate de dibenzyle) |
 C22H18O4 |
346,39 |
| 27987-25-3 DMCHP |
ester bis(méthylcyclohexylique) de l'acide 1,2-benzènedicarboxylique (phtalate de bis(méthylcyclohexyle)) |
 C22H30O4 |
358,48 |
| 71888-89-6 DIHepPNotes de bas de page Tableau 2-1[a] |
esters dialkyliques ramifiés en C6-8 riches en C7 de l'acide 1,2-benzènedicarboxylique (phtalates de dialkyles ramifiés en C6-8, riches en C7) |
C22H34O4 |
362,51 |
| 27215-22-1 BIOPa |
ester isooctylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique (phtalate de benzyle et d'isooctyle) |
C23H28O4 |
368,48 |
| 68515-40-2 B79PNotes de bas de page Tableau 2-1[b] |
esters benzylique et alkyliques ramifiés en C7-9 et linéaires de l'acide 1,2-benzènedicarboxylique (phtalates de benzyl (C7-9-alkyles) ramifiés et linéaires) |
C22H28O4 |
368,48 |
| 16883-83-3 B84P |
ester 2,2-diméthyl-1-(1-méthyléthyl)-3-(2-méthyl-1-oxopropoxy)propylique et phénylméthylique de l'acide 1,2-benzènedicarboxylique (phtalate de benzyle et de 3-isobutyryloxy-1-isopropyl-2,2-diméthylpropyle) |
 C27H34O6 |
454,57 |
2.1 Choix des analogues et utilisation de modèles QSAR
Diverses organisations, notamment l'Organisation de coopération et de développement économiques (OCDE), ont établi des directives pour la mise en œuvre d'une approche de lecture croisée et de modèles de relations quantitatives structure-activité (ou QSAR) en vue de combler les lacunes en matière de données. Ces méthodes ont été appliquées dans le cadre de plusieurs programmes réglementaires, y compris le Programme des substances existantes de l'Union européenne (UE). Aux fins de la présente évaluation, une approche de lecture croisée tirant parti des données sur les analogues et des résultats de modèles QSAR a été appliquée, au besoin, pour contribuer aux volets sur l'écologie et la santé humaine. Des analogues semblables aux substances de ce sous-groupe sur les plans structural ou fonctionnel (p. ex. selon les propriétés physicochimiques ou la toxicocinétique) ont été choisis en raison des données empiriques pertinentes qu'ils offraient et qui pouvaient être utilisées lorsque les données empiriques associées aux substances cibles étaient limitées. L'applicabilité des modèles QSAR a été déterminée au cas par cas.
2.1.1 Choix des analogues utilisés dans l'évaluation relative à l'environnement
En ce qui concerne l'approche de lecture croisée pour l'évaluation écologique, des analogues candidats ont été choisis au moyen du logiciel Boîte à outils QSAR de l'OCDE (2012). Des substances semblables sur les plans structural et fonctionnel aux substances du sous-groupe des phtalates à chaîne moyenne et qui présentaient un indice de similarité de 80 % et plus ont été choisies comme point de départ. Les analogues choisis sont des esters phtaliques ayant une taille moléculaire et des groupes latéraux comparables qui provoquent une narcose et qui ont des propriétés physicochimiques comparables, particulièrement en ce qui concerne l'hydrosolubilité et les coefficients de partage, comme le Koe, qui influent sur la biodisponibilité environnementale.
Les données expérimentales sur le devenir et les effets des substances suivantes du sous-groupe des phtalates à chaîne moyenne sont limitées : BCHP, CHIBP, DBzP, DIHepP, BIOP. Une substance bien connue, le phtalate de benzyle et de butyle (BBP), qui est caractérisé par la présence d'un groupe latéral de type ester benzylique et d'une chaîne alkyle latérale non ramifiée à quatre carbones, est utilisée en tant qu'analogue du BCHP, du CHIBP et du DBzP, qui contiennent tous au moins un groupe cyclique et/ou une chaîne alkyle. Le phtalate de diphényle (DPhP), qui comporte deux groupes latéraux de type ester phénylique, est utilisé comme analogue du DBzP, qui possède deux groupes latéraux de type ester benzylique. Le phtalate de diisooctyle (DIOP) et le phtalate de bis(2-éthylhexyle) (DEHP), qui présentent deux chaînes alkyle latérales ramifiées contenant jusqu'à huit carbones, servent d'analogues du DIHepP, qui est principalement composé de deux chaînes alkyle latérales ramifiées comptant sept carbones. De plus, le phtalate de dibutyle (DBP), une substance sur laquelle il existe une grande quantité de données et qui possède des chaînes alkyle latérales non ramifiées à quatre carbones, peut être employé pour combler les lacunes relatives aux données sur le DIBP, qui présente des chaînes alkyle latérales ramifiées à quatre carbones. Il convient toutefois de noter qu'il existe une grande quantité de données sur le DIBP.
L'information sur l'identité des analogues est présentée au tableau 2-2. Des renseignements supplémentaires sur l'identité des analogues sont présentés à l'annexe A-1, et les propriétés physicochimiques des analogues sont résumées aux annexes A-2 et A-3. Le tableau 2-4 présente un sommaire des types de données obtenues pour chacun des analogues.
De plus, lorsque les données associées à certaines substances sont limitées ou inexistantes, on effectue au besoin une lecture croisée en utilisant les renseignements associés à des substances du sous-groupe qui sont similaires sur les plans structural et fonctionnel et pour lesquelles il existe une quantité importante de données. L'information concernant le DCHP est utilisée pour l'évaluation des caractéristiques du DMCHP, et celle concernant le B79P est utilisée pour l'évaluation des caractéristiques du BIOP. Sur le plan structural, ces substances sont assez semblables. Les groupes latéraux de type ester du DCHP présentent deux cyclohexanes, alors que ceux du DMCHP présentent deux méthylcyclohexanes. Le B79P, qui est un UVCB, possède un groupe latéral de type ester benzylique et une chaîne latérale ester ramifiée ou non ramifiée variable à huit carbones. Quant au BIOP, il possède une chaîne alkyle latérale ramifiée à huit carbones comme premier groupe ester ainsi qu'un groupe latéral de type ester méthylphénylique. Les noms et structures des substances sont résumés au tableau 2-3.
| Nom systématique de l'analogue (n° CAS) | Nom commun ou abréviation de l'analogue | Structure chimique, formule moléculaire et masse moléculaire (g/mol) de l'analogue | Substance cible du sous-groupe des phtalates à chaîne moyenne |
|---|---|---|---|
| Phtalate de benzyle et de butyle (85-68-7) |
BBP | 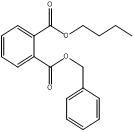 C19H20O4 312.35 |
1) BCHP (84-64-0) 2) CHIBP (5334-09-8) 3) DBzP (523-31-9) |
| Phtalate de diphényle (84-62-8) |
DPhP | 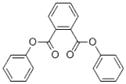 C20H14O4 318.33 |
DBzP (523-31-9) |
| Phtalate de dibutyle (84-74-2) |
DBP | 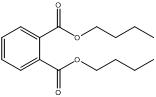 C16H22O4 278.34 |
DIBP (84-69-5) |
| Phtalate de diisooctyle (27554-26-3) | DIOP |  C24H38O4 390.56 |
DIHepP (71888-89-6)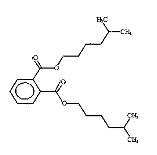 |
| Phtalate de bis(2 éthylhexyle) (117-81-7) |
DEHP |  C24H38O4 390.56 |
DIHepP (71888-89-6) |
| Nom commun ou abréviation de l'analogue du sous-groupe (n° CAS) | Structure chimique de l'analogue | Nom commun ou abréviation de la substance cible du sous-groupe (n° CAS) | Structure chimique de la substance cible |
|---|---|---|---|
| DCHP (84-61-7) |  |
DMCHP (27987-25-3) |  |
| B79P (68515-40-2) | 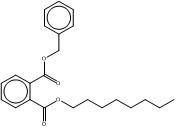 |
BIOP (27215-22-1) | 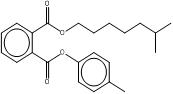 |
| Nom commun ou abréviation de l'analogue (n° CAS) | Persistance | Bioaccumulation | Écotoxicité |
|---|---|---|---|
| BBP (85-68-7) | Études sur la dégradation biotique et abiotique | Données sur les FBC, FBA, FABS et FBAm | Études de toxicité pour les organismes vivant dans les milieux aquatiques, les milieux terrestres et les sédiments |
| DPhP (84-62-8) | n.d. | n.d. | Études de toxicité pour les organismes vivant dans les milieux aquatiques |
| DIOP (27554-26-3) | Études sur la dégradation biotique | n.d. | Études de toxicité pour les organismes vivant dans les milieux aquatiques |
| DEHP(117-81-7) | Études sur la dégradation biotique et abiotique | Données sur les FBA et FABS | Études de toxicité pour les organismes vivant dans les milieux aquatiques et les sédiments |
| DBP (84-74-2) | Études sur la dégradation biotique et abiotique | n.d. | Études de toxicité pour les organismes vivant dans les milieux aquatiques et les sédiments |
2.1.2 Choix des analogues utilisés dans l'évaluation relative à la santé humaine
L'examen des similarités sur le plan de la longueur et de la nature des chaînes ester a permis de trouver des substances considérées comme étant les « plus proches analogues » des phtalates d'intérêt au sein du sous-groupe (Santé Canada, 2015a). Se reporter au tableau 2-5 pour obtenir de l'information sur les analogues du sous-groupe des phtalates à chaîne moyenne.
| N° CAS de l'analogue | Nom chimique de l'analogue | Nom commun de l'analogue (abréviation) | Structure chimique et formule moléculaire de l'analogue | Ramification des analogues (nombre de carbones dans la plus longue chaîne) | Phtalates du PGPC 2 pour lesquels des analogues ont été utilisés |
|---|---|---|---|---|---|
| 84-74-2 | Ester dibutylique de l'acide 1,2-benzènedi-carboxylique | Phtalate de dibutyle (DBP) |  |
Linéaire (4) | DIBP BCHP |
| 84-61-7 | Ester dicyclohexy-lique de l'acide 1,2-benzènedi-carboxylique | Phtalate de dicyclohexyle (DCHP) |  |
Cyclo (6) | DMCHP CHIBP BCHP |
| 84-69-5 | Ester bis(2-méthylpropy-lique) de l'acide 1,2-benzènedi-carboxylique | Phtalate de diisobutyle (DIBP) | 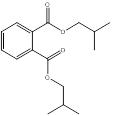 |
Ramifié (3) | CHIBP B84P |
| 2528-16-7 | Ester mono(phényl-méthylique) de l'acide 1,2-benzènedi-carboxylique | Hydrogéno-phtalate de benzyle (MBzP) | 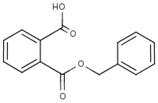 |
Mono (4) | DBzP B84P BIOP B79P |
| 85-68-7 | Ester butylique et phényl-méthylique de l'acide 1,2-benzènedi-carboxylique | Phtalate de benzyle et de butyle (BBP) |  |
Linéaire/benzyle (4 benzyl) | B84P |
| 27554-26-3 | Ester diisooctylique de l'acide 1,2-benzènedi-carboxylique | Phtalate de diisooctyle (DIOP) | Groupes ester diméthylhexyle (mélange d'isomères) Groupes ester méthylheptyle (mélange d'isomères) |
Ramifié (6-7) | BIOP |
| 28553-12-0 | Ester diisononylique de l'acide 1,2-benzènedi-carboxylique | Phtalate de diisononyle (DINP-1) | Groupes ester méthyléthylhexyle Groupes ester diméthylheptyle Groupes ester méthyloctyle Groupes ester isodécyle |
Ramifié (6*-9) | B79P |
3. Propriétés physicochimiques
Les propriétés physicochimiques déterminent les caractéristiques globales des substances et sont utilisées pour déterminer si elles conviennent à divers usages. Ces propriétés jouent également un rôle essentiel pour ce qui est de définir le devenir des substances dans l'environnement (y compris la possibilité qu'elles soient transportées sur de longues distances) et de déterminer leur toxicité pour les humains et les autres êtres vivants.
Lorsque les données expérimentales étaient limitées ou non disponibles, des modèles de relations quantitatives structure-activité (QSAR) étaient utilisés pour générer des données. Ces modèles se fondent principalement sur des méthodes d'addition de fragments et sur la forme neutre des substances chimiques comme donnée d'entrée. Les esters phtaliques à chaîne moyenne se prêtent bien à la modélisation QSAR, car ils font partie du domaine d'applicabilité du modèle (c.-à-d. que les domaines des paramètres des propriétés et/ou de la structure sont représentés dans la base d'apprentissage utilisée avec les modèles). Ces substances se présentent également sous forme neutre (non ionisée) dans l'environnement.
Le tableau 3-1 présente les propriétés physicochimiques expérimentales et modélisées des substances du sous-groupe des phtalates à chaîne moyenne. Les principales propriétés physicochimiques des substances figurent à l'annexe B. Des valeurs médianes ont été calculées pour l'hydrosolubilité, le log Koe et le log Kco, en fonction des estimations obtenues au moyen de divers modèles QSAR (se reporter à l'annexe B-2). La cohérence interne des valeurs expérimentales et/ou modélisées représentatives choisies pour les principales propriétés physicochimiques a été vérifiée par la méthode des trois types de solubilité décrite par Cole et Mackay (2000) et par Schenker et al. (2005). Selon les résultats obtenus, les valeurs du log Koe calculées au moyen du modèle de VCCLab (2005) ont été utilisées au lieu des valeurs médianes pour le DIHepP, le BIOP et le B84P.
| Propriété | Valeur (intervalle) | Type de données | Référence |
|---|---|---|---|
| État physique | Liquide | Expérimentales | US EPA, 2010 |
| Point de fusion (°C) | -64-66 | Expérimentales | HSDB, 1983-; Phys-Prop, 2006; Commission européenne, 2000 |
| Point d'ébullition (°C) | ~ 205-390 | Expérimentales | Haynes et Lide, 2010; Commission européenne, 2000 |
| Point d'ébullition (°C) | 323-474 | Modélisées | EpiSuite, 2012 |
| Masse volumique (kg/m3) | 787-1 076 | Expérimentales | Haynes et Lide, 2010; ECHA, c2007-2014 |
| Pression de vapeur (Pa) | 3,8 × 10-6-6,3 × 10-3 | Expérimentales | Daubert et Danner, 1989; Werner, 1952; Commission européenne, 2000; Cousins et Mackay, 2000; ECHA, c2007-2014 |
| Pression de vapeur (Pa) | 8,48 × 10-7-0,322 | Modélisées | EPI Suite, 2012 |
| Hydrosolubilité (mg/L) | 0,02-20,3 | Expérimentales | Leyder et Boulanger, 1983; Yalkowsky et al., 2010; HSDB, 1983-; Commission européenne, 2000; Letinksi et al., 2002; ECHA, c2007-2014 |
| Hydrosolubilité (mg/L) | 0,001-5,0 | Modélisées | EPI Suite, 2012; ACD/Percepta, c1997-2012; VCCLab, 2005 |
| Constante de la loi de Henry (Pa·m3/mol)Notes de bas de page Tableau 3-1[a].1 | 1,03 × 10-6-1,60 × 102 | Modélisées (estimation selon les liaisons chimiques) |
EPI Suite, 2012 |
| Log Koe (sans dimension)Notes de bas de page Tableau 3-1[b].1 | 4,11-5,5 | Expérimentales | Leyder et Boulanger, 1983; ECHA, c2007-2014 |
| Log Koe (sans dimension) | 4,46-7,41 | Modélisées | EPI Suite, 2012; ACD/Percepta, c1997-2012; VCCLab, 2005 |
| Log Kco (sans dimension)a | 2,91-6,10 | Modélisées (moyenne de l'ICM et du log Koe) |
EPI Suite, 2012 |
| Log Koa (sans dimension)a | 8,41-14,65 | Modélisées | EPI Suite, 2012 |
Les composés du sous-groupe des phtalates à chaîne moyenne sont des liquides huileux à température ambiante (US EPA, 2010), mais certains d'entre eux peuvent exister sous forme solide à de basses températures dans l'environnement (Cousins et al., 2003). Ils ne contiennent toutefois aucun groupe fonctionnel ayant un potentiel d'ionisation, alors ils devraient être neutres aux pH normalement observés dans l'environnement (6-9). Le point de fusion expérimental de ces substances varie de -64 °C à 66 °C. Il est à noter qu'il n'y a pas de cohérence en ce qui concerne les données sur le point de fusion et l'état physique du BCHP et du DBzP, et que ces données sont inconnues dans le cas du DMCHP. Cette situation crée une certaine incertitude en ce qui concerne l'évaluation des propriétés de ces substances, et en particulier l'évaluation de leur écotoxicité, au moyen de l'analogue BBP ou de l'approche de lecture croisée avec le DCHP. Il est impossible de prédire de manière fiable le point de fusion des phtalates en utilisant des modèles QSAR, alors de telles valeurs modélisées ne sont pas incluses dans le présent document (les points d'ébullition expérimentaux allaient d'environ 205 °C à 390 °C, alors que les points d'ébullition déterminés par modélisation allaient de 323 °C à 474 °C.
De manière générale, plus la chaîne alkyle est longue, moins la pression de vapeur et l'hydrosolubilité sont élevées, mais cette tendance est plus marquée dans le cas de l'hydrosolubilité (annexe B-2). Les phtalates à chaîne moyenne ont une hydrosolubilité de faible à modérée et une pression de vapeur de très faible à faible. Les valeurs empiriques et modélisées du log Koe étaient élevées, et les valeurs modélisées du log Kco étaient élevées ou très élevées.
4. Sources
Un nombre limité de données probantes indiquent que certains esters phtaliques, soit le DEHP, le DBP et le DIOP, peuvent être synthétisés par certaines espèces d'algues, y compris les algues rouges (Bangia atropurpurea) et les algues brunes (Sargassum wightii) (Chen, 2004; Sastry et Rao, 1995). Le processus de production des esters phtaliques et le rôle physiologique qu'ils jouent dans les algues n'ont pas encore été définis. Aucune étude semblable n'a été recensée en ce qui concerne les substances appartenant au sous-groupe des phtalates à chaîne moyenne. On ignore s'ils sont présents à l'état naturel dans l'environnement.
Une enquête a été menée en 2013 auprès de l'industrie en vertu de l'article 71 de la LCPE (1999) dans le but d'obtenir de l'information sur les quantités de substances faisant partie du groupe des phtalates qui ont été commercialisées au Canada (Canada, 2013). Le tableau 4-1 présente un sommaire des quantités totales des substances faisant partie du groupe des phtalates ayant été produites, importées et exportées en 2012. Étant donné la nature ciblée de l'enquête, les données sur les quantités utilisées qui ont été déclarées pourraient ne pas refléter intégralement tous les usages au Canada.
Les résultats d'une enquête menée en vertu de l'article 71 en 2012 (Environnement Canada, 2014) ont révélé qu'aucune des dix substances appartenant au sous-groupe des phtalates à chaîne moyenne n'était produite au Canada, et que les quantités importées de cinq substances, à savoir le CHIBP, le BCHP, le DMCHP, le BIOP et le DBzP, se trouvaient en deçà du seuil de déclaration de 100 kg. Cinq substances, soit le DCHP, le DIHepP, le DIBP, le B79P et le B84P, ont été importées. Les quantités importées de DCHP et de DIHepP étaient inférieures à 10 000 kg, celles de DIBP variaient de 10 000 à 100 000 kg, alors que celles de B79P et de B84P variaient de 100 000 à 1 000 000 kg (Environnement Canada, 2014; voir le tableau 4-1).
| Nom commun | Quantité produite (kg)Notes de bas de page Tableau 4-1[a].2 | Quantité importée (kg)a | Quantité exportée (kg)a |
|---|---|---|---|
| DIBP | 0 | De 10 000 à 100 000 | 0 |
| BCHP | 0 | 0 | 0 |
| CHIBP | 0 | 0 | 0 |
| DCHP | 0 | inférieur(e) à 10 000 | 0 |
| DBzP | 0 | 0 | 0 |
| DMCHP | 0 | 0 | 0 |
| DIHepP | 0 | inférieur(e) à 10 000 | 0 |
| BIOP | 0 | 0 | 0 |
| B79P | 0 | De 100 000 à 1 000 000 | supérieur(e) à 100 000 |
| B84P | 0 | De 100 000 à 1 000 000 | supérieur(e) à 100 000 |
Quatre phtalates à chaîne moyenne, soit le DMCHP, le B84P, le DIHepP et le DBzP, avaient précédemment été inclus dans la première phase de la mise à jour de la Liste intérieure des substances (Canada, 2009). Ainsi, les quantités de chacune ayant été commercialisées ont été déclarées en 2008. De façon semblable aux résultats de l'enquête menée auprès de l'industrie en vertu de l'article 71 pour l'année 2012 (Environnement Canada, 2014), aucune quantité de DMCHP n'a été produite ou importée au Canada en 2008 ni en 2012. Les quantités de DIHepP ayant été importées en 2008 étaient supérieures à celles de 2012. En effet, celles-ci variaient de 100 000 à 1 000 000 kg en 2008, alors qu'elles étaient inférieures à 10 000 kg en 2012. Moins de 100 000 kg de DBzP ont été importés en 2008, un volume qui est passé sous le seuil de déclaration de 100 kg en 2012. Les quantités de B84P ayant été importées se trouvaient dans le même intervalle de 100 000 à 1 000 000 kg en 2008 et en 2012. En outre, trois entreprises ont indiqué avoir produit des quantités se trouvant sous le seuil de déclaration de 100 kg en 2008.
Le tableau 4-2 présente un sommaire des quantités de phtalates à chaîne moyenne combinées qui ont été produites et utilisées aux États-Unis et dans l'Union européenne. Aucun rapport sur le CHIBP, le DBzP, le DMCHP et le BIOP n'a été présenté récemment en vertu du programme Inventory Update Reporting des États-Unis (US EPA, 2014a, b) ou du règlement de l'Union européenne sur l'enregistrement, l'évaluation, l'autorisation et les restrictions des substances chimiques (règlement REACH) (ECHA, c2007-2014a). Une faible quantité de BCHP a été utilisée aux États-Unis conformément aux déclarations de 2002, mais pas en 2006. Par ailleurs, aucun rapport n'a été présenté en vertu du règlement REACH. Ces données laissent croire à une dynamique commerciale semblable à celle du Canada en ce qui concerne ces cinq substances, puisque les quantités commercialisées au pays se trouvaient sous le seuil de déclaration de 100 kg. De plus, le CHIBP, le DBzP et le BIOP n'ont pas été signalés comme étant des substances chimiques produites en quantités faibles ou élevées par l'industrie de l'Union européenne (ESIS, 2014). Le DMPCHP a toutefois été classé comme une substance chimique produite en faibles quantités en Europe (ESIS, 2014).
De grandes quantités de DIHepP ont été produites et utilisées aux États-Unis en 2002 et en 2006. Celles-ci variaient d'approximativement 22 à 45 millions de kilogrammes (US EPA, 2014ab). Aucun rapport concernant le DIHepP n'a été présenté en vertu du règlement REACH (ECHA, c2007-2014a). Ces substances ont toutefois été classées comme des substances chimiques produites en grandes quantités en Europe (ESIS, 2014). Des renseignements récents indiquent que le DIHepP n'est plus produit en Amérique du Nord ni en Europe (ECHA, c2007-2014a; BASF Corporation, 2011a; BASF Corporation, 2011b).
À l'échelle internationale, des données ont été déclarées sur la production et l'utilisation de DIBP, de DCHP, de B79P et de B84P aux États-Unis et dans l'Union européenne (US EPA, 2014ab; ECHA, c2007-2014a; voir le tableau 4-2). En outre, ces quatre types de substances ont été classés comme étant produits en grandes quantités en Europe (ESIS, 2014).
| Nom commun | États-Unis 2002 (kg)Notes de bas de page Tableau 4-2[a].3 |
États-Unis 2006 (kg)a |
Union européenne (kg)Notes de bas de page Tableau 4-2[b].2 |
|---|---|---|---|
| DIBP | supérieur(e) à 227 000 - 454 000 | supérieur(e) à 227 000 - 454 000 | 1 000 000 - 10 000 000 |
| BCHP | inférieur(e) à 5 000 - inférieur(e) à 227 000 | AD | AD |
| CHIBP | AD | AD | AD |
| DCHP | supérieur(e) à 227 000 - 454 000 | inférieur(e) à 227 000 | 100 000-1 000 000 |
| DBzP | AD | AD | AD |
| DMCHP | AD | AD | AD |
| DIHepP | supérieur(e) à 22 680 000 - 45 359 000 | supérieur(e) à 22 680 000 - inférieur(e) à 45 359 000 | AD |
| BIOP | AD | AD | AD |
| B79P | supérieur(e) à 453 000 - inférieur(e) à 4 536 000 | supérieur(e) à 453 000 - inférieur(e) à 4 536 000 | 10 000 000 - 100 000 000 |
| B84P | supérieur(e) à 453 000 - inférieur(e) à 4 536 000 | supérieur(e) à 453 000 - inférieur(e) à 4 536 000 | 1 000 000 - 10 000 000 |
5. Usages
Les résultats d'une enquête menée auprès de l'industrie en vertu de l'article 71 (Environnement Canada, 2014) ont révélé que le DIBP, le DCHP, le DIHepP, le B79P et le B84P ont été utilisés en 2012 (Environnement Canada, 2014).
Les principaux usages signalés dans les réponses aux questions de la section 8 de l'enquête menée auprès de l'industrie (Environnement Canada, 2014) sont résumés dans le tableau 5-1. Les cinq substances sont utilisées dans des adhésifs et des matériaux d'étanchéité employés dans les secteurs de la construction et de l'automobile. La plupart de ces substances sont aussi utilisées comme plastifiants dans la fabrication de matériel électrique et électronique ainsi que de jouets pour enfants. L'importation de B79P sous forme de matières premières en vue d'un usage dans différentes applications a aussi été signalée (Environnement Canada, 2014).
| Principaux usagesNotes de bas de page Tableau 5-1[a].4 | DIBP | DCHP | DIHepP | B79P | B84P |
|---|---|---|---|---|---|
| Adhésifs et matériaux d'étanchéité | X | X | X | X | X |
| Peintures et revêtements | X | ||||
| Matériel électrique et électronique | X | X | |||
| Produits automobiles et de transport | X | X | X | ||
| Encres d'impression | X | ||||
| Jouets et articles pour enfants | X | ||||
| Matériaux plastiques et caoutchoucs | X |
Aucune des dix substances visées par le présent rapport sur l'ECS ne figure dans la Base de données sur les produits pharmaceutiques, dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, dans la Base de données sur les ingrédients des produits de santé naturels ni dans la Base de données sur les produits de santé naturels homologués à titre d'ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques, des médicaments vétérinaires ou des produits de santé naturels au Canada (BDPP, 2014; BDIPSN, 2014; BDPSNH, 2014; courriel adressé en septembre 2014 par la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée).
À l'exception du DIBP, aucun des phtalates examinés dans le présent rapport n'a été intégré à des matériaux utilisés pour l'emballage d'aliments ni n'a été utilisé à titre d'additif indirect selon l'information déclarée. Le DIBP a été signalé comme étant un plastifiant utilisé dans les films de polypropylène servant à emballer une variété d'aliments (courriel adressé en septembre 2014 par la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée). Toutefois, le DBzP et le DCHP figurent dans la liste des additifs indirects utilisés dans des substances pouvant être en contact avec les aliments de la FDA (US FDA, 2014).
Aucun des dix phtalates ne figure dans la Liste critique des ingrédients cosmétiques dont l'utilisation est restreinte ou interdite (plus communément appelée Liste critique des ingrédients cosmétiques ou simplement Liste critique), qui constitue un outil administratif utilisé par Santé Canada pour aviser les fabricants et d'autres intervenants que certaines substances, lorsqu'elles sont utilisées dans les cosmétiques, peuvent contrevenir à l'interdiction générale énoncée à l'article 16 de la Loi sur les aliments et drogues ou à une disposition du Règlement sur les cosmétiques. Selon les déclarations soumises à Santé Canada aux termes du Règlement sur les cosmétiques, aucun des dix phtalates à chaîne moyenne n'avait été utilisé dans la préparation d'un produit (courriel adressé en septembre 2014 par la Direction de la sécurité des produits de consommation [DSPC] de Santé Canada au Bureau de l'évaluation des risques des substances existantes [BERSE] de Santé Canada).
Une recherche sur les usages à l'échelle internationale a aussi été entreprise. Aucune donnée sur des usages du CHIBP ou du BIOP n'a été obtenue. Bien que des usages généraux du BCHP aient été déclarés, aucun type de produits ni d'articles précis n'a été signalé. Le tableau 5-2 présente un sommaire des données sur les usages généraux des autres phtalates à chaîne moyenne.
| Principaux usages | Exemples d'usages | Substances |
|---|---|---|
| Produits automobiles et de transport | Mastics et matériaux d'étanchéité, éléments d'isolation de fenêtres, peinture automobile, laques, vernis, adhésifs pour fabrication ou réparation d'automobiles, articles en plastique, tapis d'auto, enjoliveurs de roue | DIBP, DCHP, DIHepP, B79P, B84P |
| Revêtements/matériaux adhésifs/articles de bricolage | Adhésifs et agglutinants; matériaux d'étanchéité, revêtements, peintures, diluants, décapants, peintures au doigt; revêtements acryliques, laques et vernis; charges et agents de remplissage, mastics, mastics de finition, enduits, argiles à modeler; régulateurs de processus, durcisseurs; adhésifs en acétate de polyvinyle, matériaux d'étanchéité, revêtements et mastics en polysulfure et en polyuréthane coulable; inhibiteurs de corrosion; produits utilisés pour détecter les défauts ou les fissures dans les pièces automobiles, équipement agricole, pipelines, produits de traitement des surfaces non métalliques, cirages, mélanges de cires | DIBP, DCHP, DBzP, DIHepP, B79P, B84P |
| Encres/produits d'impression | Encres pour sérigraphie; produits en papier, encres, encres en poudre; agents colorants; solvants pour papier d'impression sensible à la pression; plastifiants dans les encres d'impression; papier/carton/carton blanchi pour sérigraphie; agents reprographiques pour la publication, l'impression et reproduction de médias enregistrés | DCHP, DMCHP, DIHepP, B79P, B84P |
| Câbles/fils/appareils/matériaux de construction | Isolants de fils et de câbles; piles et accumulateurs électriques; revêtements de sol, carreaux et sous-couches en vinyle; matériaux de construction et matériaux pour les travaux de construction spécialisés; surfaces artificielles, PVC avec sous-couche en mousse et coussinée, matelas gonflables en PVC | DIBP, DCHP, DMCHP, DIHepP, B79P, B84P |
| Articles vestimentaires/meubles | Articles en caoutchouc et en plastique, p. ex. ceintures, écouteurs, meubles, chaussures, sandales en plastique, ballons d'équilibre | DIBP |
| Jouets et articles pour enfants | Coussins d'allaitement, porte-bébés, tabliers pour poussette, matelas pour lits de bébé, jouets en mousse plastique, gommes à effacer, sandales en plastique, matières plastiques dans les articles de soins pour bébés et les jouets pour enfants, crayons | DIBP |
| Tissus | Enduits d'uréthane pour tissus, tissus, étoffes, vêtements; articles en cuir; étoffes avec imprimés décoratifs sur la surface extérieure; colorants textiles, et produits de finition et d'imprégnation, y compris javellisants et autres produits de traitement; encres pour sérigraphie; plastisols dans des articles comme des tissus, des étoffes et des vêtements | DIBP, DCHP, B79P, B84P |
| Emballage et transformation des aliments | Papiers et étiquettes pour usage alimentaire; plastiques acryliques utilisés dans les contenants de produits alimentaires; en tant qu'élément des articles en papier et en carton, enduits ou non, destinés à entrer en contact avec des aliments liquides ou gras; en tant qu'élément des substances adhésives utilisées dans les emballages destinés à des produits alimentaires; en tant qu'élément des substances polymères utilisées dans tous les aspects de la manipulation des aliments; pellicules plastiques, papier d'aluminium, cellophane. | DIBP, DCHP, DBzP |
6. Rejets dans l'environnement
La présence dans l'environnement de substances appartenant au sous-groupe des phtalates à chaîne moyenne est principalement attribuable à des sources anthropiques.
Selon l'information sur les usages des phtalates à chaîne moyenne recueillie grâce à l'enquête menée en vertu de l'article 71 et aux différentes initiatives de suivi (Environnement Canada, 2014), les systèmes aquatiques seraient principalement affectés par les rejets de phtalates. En général, les phtalates à chaîne moyenne sont libérés principalement dans le milieu aquatique par les effluents des eaux usées d'origine industrielle et par le rejet par dispersion de produits de consommation. Néanmoins, le niveau de rejet dans l'eau et dans d'autres milieux est incertain ou, en grande partie, inconnu. Dans les sites industriels, le nettoyage des recouvrements de planchers et de murs contenant des phtalates pourrait constituer une source de rejet dans l'environnement. Les activités générales de transport des phtalates peuvent causer des rejets par le reconditionnement des conteneurs et des camions. L'élimination de produits de consommation dans les systèmes de traitement des eaux usées constitue une autre source possible de rejet.
Dans certains cas, ces phtalates sont transportés aux fins d'élimination à des installations hors site où leur rejet dans les effluents est possible. Quelques cas de rejets dans l'air ont été signalés (Environnement Canada, 2014). Les phtalates à chaîne moyenne ne figurent pas dans la liste des substances de l'Inventaire national des rejets de polluants (INRP)(INRP, depuis 1995).
Les phtalates ne sont pas chimiquement liés à la matrice polymère. Ils ne peuvent donc pas se dégager des produits en plastique, y compris de ceux envoyés à la décharge. Dans les sites d'enfouissement où le lixiviat n'est pas collecté et traité, des substances peuvent être rejetées dans le sol et dans les eaux souterraines par cet intermédiaire.
7. Devenir et comportement dans l'environnement
7.1 Distribution dans l'environnement
Les tableaux 7-1, 7-2 et 7-3 ci-dessous présentent une synthèse de la distribution masse-fraction des substances du groupe des phtalates à chaîne moyenne selon les émissions constantes uniques dans l'air, l'eau et le sol. De vastes intervalles de distribution ont été établis, particulièrement pour les scénarios de rejets dans l'air et dans l'eau, en raison de la variété des propriétés physicochimiques, ainsi que des masses moléculaires des substances du groupe des phtalates à chaîne moyenne. Les substances pour lesquelles une distribution masse-fraction semblable a été prédite ont été regroupées. Les groupes cadrent généralement avec la masse moléculaire des phtalates. Les résultats figurant dans les tableaux 7-1 à 7-3 représentent les effets nets de la répartition chimique, du transport entre divers milieux ainsi que de la perte, tant par le processus d'advection (hors de la région modélisée) que par celui de la dégradation ou de la transformation. Les résultats de la modélisation de la fugacité de niveau III semblent indiquer que les phtalates à chaîne moyenne devraient se répartir dans les quatre milieux (air, eau, sol et sédiments), selon les propriétés physicochimiques de la substance en question et le milieu dans laquelle elle est rejetée. Les résultats de la modélisation de la fugacité pour chaque substance appartenant au groupe sont présentés à l'annexe C.
| Substances released to | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 21-40 | 810 | 50-70 | Négligeable |
| Eau (100 %) | Négligeable | 93-98 | Négligeable | 2-7 |
| Sol (100 %) | Négligeable | Négligeable | 100 | Négligeable |
| Substances released to | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 0-10 | 4-7 | 79-94 | 2-8 |
| Eau (100 %) | Négligeable | 47-70 | Négligeable | 30-53 |
| Sol (100 %) | Négligeable | Négligeable | 100 | Négligeable |
| Substances released to | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | Négligeable | 3 | 85 | 12 |
| Eau (100 %) | Négligeable | 18 | Négligeable | 83 |
| Sol (100 %) | Négligeable | Négligeable | 100 | Négligeable |
Lorsqu'ils sont rejetés dans l'air, les phtalates à chaîne moyenne tendent à se répartir davantage dans les matrices solides au fur et à mesure que l'hydrophobicité augmente, et cette tendance s'accompagne d'une répartition moindre dans l'air. Ces tendances s'harmonisent, d'une part, avec les propriétés physicochimiques des phtalates et, d'autre part, avec leur capacité croissante de s'adsorber sur le carbone organique et la diminution de leur volatilité, au fur et à mesure que la masse moléculaire augmente.
Lorsqu'ils sont rejetés dans l'eau, les phtalates à chaîne moyenne présentant une masse moléculaire moindre demeurent normalement dans ce milieu, et une faible proportion est distribuée dans les sédiments. Les phtalates à chaîne moyenne présentant une masse moléculaire moyenne sont généralement distribués de façon plus égale entre l'eau et les sédiments. Pour sa part, le B84P est principalement distribué dans les sédiments et, dans une proportion moindre, dans l'eau.
L'hydrophobicité de modérée à très élevée des phtalates à chaîne moyenne influence également leur mouvement dans le sol. La nature hydrophobe de ces substances se traduit par leur adsorption sur les particules de sol, ce qui réduit substantiellement leur mobilité dans le sol et retarde leur pénétration dans les eaux souterraines et dans les systèmes aquatiques (CCME, 1999). Lorsque les phtalates à chaîne moyenne sont rejetés dans le sol, leur presque totalité devrait y demeurer.
Selon les faibles constantes de la loi de Henry générées au moyen des modèles (tableau 3-1), les phtalates ont peu tendance à se volatiliser à partir de l'eau. Dans le cadre de leur analyse des constantes de la loi de Henry pour les phtalates, Cousins et al. (2003) ont observé que, même si les phtalates présentant une masse moléculaire faible ont des pressions de vapeur assez élevées, ce qui les amènerait à se volatiliser rapidement à l'état pur, leur hydrosolubilité élevée entraîne de très faibles constantes de la loi de Henry et, par conséquent, une lente volatilisation à partir d'une solution aqueuse. En ce qui concerne les phtalates ayant une masse moléculaire plus élevée, les chercheurs ont observé que l'hydrosolubilité diminue plus rapidement que la pression de vapeur avec l'allongement de la chaîne alkyle (Staples et al., 1997; Cousins et al., 2003), ce qui se traduit par une augmentation apparente de la constante de la loi de Henry. Par conséquent, les phtalates ayant une masse moléculaire plus élevée devraient s'évaporer plus rapidement à partir de l'eau. Cependant, cette tendance se voit réduite par une augmentation du potentiel de sorption sur la matière en suspension dans la colonne d'eau. L'effet combiné détermine les caractéristiques globales de la distribution, même si, en général, les phtalates ayant une masse moléculaire plus élevée se volatilisent lentement à partir de l'eau (Cousins et al., 2003).
7.1.1 Potentiel de transport sur de grandes distances
Le transport sur de grandes distances (TGD) désigne la capacité d'une substance d'être transportée dans un milieu mobile (généralement l'air ou l'eau) sur de grandes distances depuis son point de rejet. Portée par ce mouvement, la substance peut subir divers processus régissant son devenir, notamment se déposer dans l'eau à partir de l'air ou être incorporée dans le biote. Les concentrations de DIBP ont été mesurées loin des sources prévues de rejet dans les sédiments et le biote le long de la côte est de la baie d'Hudson (Morin, 2003) et dans l'air de la région arctique norvégienne (Xie et al., 2007). Le modèle de transport et de persistance de niveau III (TaPL3, 2000) conçu par le Centre canadien de modélisation environnementale et le modèle de dépistage des polluants organiques persistants (POP) créé par un groupe d'experts de l'OCDE à la suite de l'atelier OCDE-PNUE sur l'utilisation de modèles multimédias ont été utilisés pour évaluer le TGD comme explication possible de ces concentrations de DIBP. Il est possible de se procurer les intrants de ces modèles auprès d'Environnement Canada (2015). La distance de transport critique (DTC) calculée à l'aide des deux modèles était assez semblable, soit respectivement 246 km et 269 km. Ce résultat indique un transport atmosphérique sur des distances relativement courtes. Un tel comportement est conforme à ce qui peut être attendu en raison de la capacité limitée de cette substance à être rejetée dans l'air (décrite à la section 6), de la répartition prédite (tableau 7.1) et de la faible persistance du DIBP (voir la section 7.2). Les concentrations de DIBP détectées dans l'Arctique et les explications possibles sont examinées dans la section 8.2.1. Certains phtalates à chaîne moyenne présentent un log Koa très élevé (c.-à-d. 12), ce qui donne à penser qu'ils peuvent être adsorbés sur de fines particules et être transportés dans l'air. Cependant, étant donné leur faible persistance et leur capacité limitée à être rejetés dans l'air, leur transport sur de grandes distances semble inusité.
7.2 Persistance dans l'environnement
Il n'existe aucune étude sur la persistance dans l'environnement de la plupart des substances appartenant au sous-groupe des phtalates à chaîne moyenne. La dégradation des esters phtaliques a toutefois été bien caractérisée dans le cadre d'études portant sur quelques esters phtaliques à chaîne courte, moyenne et longue ou contenant des groupes latéraux cycliques. Plusieurs études ont été réalisées sur ces quelques substances. De façon générale, celles-ci permettent de comprendre assez bien les voies de dégradation biotique et, dans une moindre mesure, abiotique des esters phtaliques, leur comportement typique dans chaque milieu ainsi que leur vitesse de dégradation. Ces études peuvent servir à caractériser la persistance dans l'environnement des substances moins étudiées, y compris celles faisant partie du sous-groupe des phtalates à chaîne moyenne. La dégradation biotique et la dégradation abiotique des substances analogues BBP et DEHP ont été les mieux caractérisées (Peterson et Staples, 2003).
Les phtalates peuvent être dégradés par des processus biotiques et abiotiques. Sur le plan abiotique, ils sont soumis à l'hydrolyse et à la photolyse, mais ces processus tendent à être lents (Peterson et Staples, 2003). La biodégradation par des microorganismes ou des champignons dans des conditions aérobiques et, dans une moindre mesure, dans des conditions anaérobiques contribue le plus à la décomposition de ces substances dans l'environnement. Des études ont montré que les phtalates comportant des chaînes ester plus courtes (comme le BBP) peuvent se biodégrader et se minéraliser rapidement, alors que ceux ayant des chaînes latérales plus longues (comme le DEHP) tendent à être moins biodégradables (Liang et al., 2008). De plus, les différences entre les phtalates au chapitre de la biodégradabilité sont attribuées à l'effet stérique des chaînes ester, qui entrave la fixation d'enzymes hydrolytiques, ce qui se traduit par une hydrolyse réduite. Les différences entre les isomères phtaliques peuvent aussi influer sur la vitesse de dégradation, puisque les enzymes hydrolytiques des phtalates sont structuralement spécifiques (Liang et al., 2008). En revanche, on estime que le degré de ramification des chaînes ester n'a aucun effet sur la diminution de la dégradation (Ejlertsson et al., 1997). Le sous-groupe des phtalates à chaîne moyenne contient des substances présentant différentes chaînes latérales de longueurs variables. Par conséquent, leur vitesse de dégradation devrait être variable.
Des données empiriques sur la biodégradation concernant la persistance étaient disponibles pour trois substances du sous-groupe des phtalates à chaîne moyenne, soit le DIBP, le DCHP et le B79P. En revanche, il a été impossible de trouver dans des sources publiées et non publiées de tels renseignements et données sur les voies de dégradation abiotique des autres substances appartenant à ce sous-groupe.
Afin de caractériser le potentiel de dégradation des phtalates à chaîne moyenne sur lesquels les données existantes sont lacunaires, les données sur la substance analogue BBP ont été utilisées pour déterminer le potentiel de dégradation du BCHP, du CHIBP et du DBzP, et les données sur la substance analogue DEHP ont été utilisées aux mêmes fins pour le DIHepP. Les données concernant le DBP ont également été utilisées pour combler les lacunes concernant les données sur le DIBP. Dans ce sous-groupe, les données sur le DCHP ont été utilisées pour évaluer les propriétés du DMCHP, tandis que celles se rapportant au B79P ont été utilisées pour évaluer les propriétés du BIOP et du B84P. On a constaté que les phtalates à chaîne moyenne se prêtent bien à la prévision au moyen de modèles QSAR. Par conséquent, la vitesse d'hydrolyse, la dégradation par les radicaux hydroxyles, ainsi que la biodégradation primaire et ultime ont été prédites grâce aux programmes EPI Suite (2012) (plus précisément à l'aide des sous-modèles HYDROWIN [2010], AOPWIN [2010] et BIOWIN [2010]) et CATALOGIC (2012.
Les résultats empiriques sur la biodégradation des phtalates à chaîne moyenne et des analogues sont résumés dans le tableau 7-2-2. Une synthèse des résultats du modèle est présentée dans les tableaux 7-2-1, 7-2-3 et 7-2-4.
7.2.1 Dégradation abiotique
De façon générale, les esters phtaliques, y compris les phtalates à chaîne moyenne, sont relativement stables dans l'environnement abiotique. Les processus de dégradation abiotique, comme l'hydrolyse et la photolyse, se déroulent lentement et semblent être influencés par les niveaux de pH. Des études sur la biodégradation dans lesquelles des organismes inactivés par stérilisation ont servi de témoins indiquent que les pertes des esters phtaliques sont limitées à quelques points de pourcentage de la concentration initiale (Cheung et al., 2007; Kickham et al., 2012; Hashizume et al., 2002; Peng et Li, 2012). La taille et la complexité des chaînes latérales des esters phtaliques influent également sur la vitesse de dégradation abiotique. À titre d'exemple, on a été observé que le DEHP tend à se dégrader plus lentement que le BBP (Lertsirisopon et al., 2009).
Selon les observations effectuées, les vitesses d'hydrolyse des esters phtaliques diminuent et les demi-vies correspondantes augmentent en fonction de la longueur des chaînes latérales (Staples et al., 1997). En outre, ces phénomènes se produisent plus rapidement à des niveaux de pH plus élevés (Wolfe et al., 1980). À un pH de 8, les demi-vies déterminées par la cinétique de deuxième ordre ont varié de quelques mois à quelques années pour le DBP, un phtalate à chaîne plus courte, et ont atteint cent ans pour le DEHP, un phtalate à chaîne moyenne (Wolfe et al., 1980). Gledhill et al. (1980) ont estimé une demi-vie de l'hydrolyse de plus de 100 jours pour le BBP (un analogue du BCHP, du CHIBP et du DBzP). Lors d'essais de 140 jours à des pH de 5 à 9, la dégradation par hydrolyse du DBP, du BBP et du DEHP n'a pas dépassé 20 %. Le DEHP ne s'est pas hydrolysé à un pH neutre de 7 (Lertsirisopon et al., 2009). Les demi-vies de l'hydrolyse modélisées pour les substances du sous-groupe des phtalates à chaîne moyenne ont varié de 263 jours pour le BIOP à 11,6 années pour le DMCHP à un pH de 7. Elles étaient considérablement moins longues à un pH de 8, soit de 26 jours pour le BIOP à 1,1 année pour le DMCHP. À la lumière de ces observations, il est possible de conclure que l'hydrolyse est un processus lent et est peu susceptible de constituer un processus de devenir important pour les esters phtaliques dans des conditions environnementales normales (Staples et al., 1997).
La photolyse est une voie de dégradation plus importante pour les phtalates, bien qu'elle puisse également constituer un processus lent dans un milieu aquatique à un pH neutre (pH 7). En outre, certains phtalates, comme le DEHP, sont moins sensibles à la photolyse. L'exposition à la lumière naturelle du soleil s'est traduite par une dégradation de 20 % du BBP et du DBP au cours d'une période de 140 jours (Lertsirisopon et al., 2009). On a constaté que la photolyse était considérablement augmentée dans les conditions prévalant en milieux acide et alcalin (Lertsirisopon et al., 2009). Selon des observations réalisées, les demi-vies de dégradation des esters phtaliques DBP, BBP et DEHP diminuaient avec le pH et étaient accélérées dans des conditions d'essais extrêmes, soit à des pH de 5 et de 9. Les demi-vies étaient alors quatre à huit fois plus rapides que celles à un pH de 7 (Lertsirisopon et al., 2009).
Des modèles QSAR ont été utilisés pour évaluer la dégradation des phtalates à chaîne moyenne par les radicaux hydroxyles dans l'air. Les demi-vies modélisées ont varié de 5,3 heures pour le DMCHP à 13,8 heures pour le DIBP (AOPWIN, 2010), ce qui donne à penser que ces substances peuvent être dégradées assez rapidement par les radicaux hydroxyles dans l'air.
Le tableau 7-2-1 ci-dessous présente une synthèse des prévisions de dégradation par oxydation atmosphérique (AOPWIN, 2010) et par hydrolyse (HYDROWIN, 2010) établies au moyen des modèles QSAR. Il n'a pas été possible d'estimer la dégradation par la réaction avec l'ozone pour ces substances.
| Nom de la substance | Demi-vie dans l'air extrapolée (heures) | Demi-vie de l'hydrolyse estimée | Références |
|---|---|---|---|
| DIBP | 13,8 | 194 jours (pH 8); 5,3 années (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| BCHP | 7,6 | 193 jours (pH 8); 5,3 années (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| CHIBP | 7,7 | 267 jours (pH 8); 7,3 années (pH 7); | AOPWIN 2010; HYDROWIN 2010 |
| DCHP | 5,3 | 1,1 année (pH 8); 11,6 années (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| DMCHP | 5,3 | 1,1 année (pH 8); 11,6 années (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| DIHepP | 7,2 | 125 jours (pH 8); 3,4 années (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| DBzP | 10 | 32 jours (pH 8); 317 jours (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| B84P | 7,4 | 57 jours (pH 8); 1,5 année (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| BIOP | 8,8 | 26 jours (pH 8); 263 jours (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
| B79P | 7,4 | 55 jours (pH 8); 1,4 année (pH 7) | AOPWIN 2010; HYDROWIN 2010 |
7.2.2 Biodégradation
La biodégradation est la principale voie de dégradation des esters phtaliques dans l'environnement. Des études ont montré que les phtalates à chaîne moyenne présentant des chaînes ester plus courtes, comme le DBP ou le BBP, peuvent se biodégrader et se minéraliser plus rapidement, alors que ceux ayant des chaînes latérales plus courtes, comme le DEHP, tendent à être moins biodégradables (Wang et al., 2000; Chang et al., 2004). Ce phénomène est probablement attribuable à l'effet stérique des chaînes ester, qui entrave la fixation d'enzymes hydrolytiques, ce qui se traduit par une hydrolyse réduite. De plus, les enzymes hydrolytiques des phtalates sont spécifiques sur le plan structural et possèdent la capacité unique de dégrader les isomères phtaliques (Gu et al., 2005).
Les esters phtaliques peuvent être biodégradés par des bactéries aérobiques et par des bactéries anaérobiques facultatives. Cependant, un petit nombre de souches présentant un potentiel de dégradation anaérobique ont été isolées (Chang et al., 2005). En plus des bactéries, certaines espèces de champignons (Ganji et al., 1995; Sivamurthy et al., 1991; Engelhardt et al., 1977; Kim et Lee, 2005; Lee et al., 2007; Kim et al., 2002, 2003, 2007) et d'espèces de microalgues vertes (Yan et Pan, 2004; Yan et al., 2002) peuvent également dégrader les esters phtaliques.
La minéralisation microbienne des esters de l'acide phtalique dans l'environnement implique un ensemble de réactions communes à tous les phtalates (Hashizume et al., 2002; Staples et al., 1997; Yuan et al., 2002). Ce processus nécessite différentes enzymes métaboliques comme les estérases, les déshydrogénases, les décarboxylases et les dioxygénases. Par conséquent, il est peu probable qu'un seul organisme ait la capacité de minéraliser entièrement ces substances organiques complexes (Staples et al., 1997; Liang et al., 2008). Jusqu'à maintenant, on a montré que seules des cultures mixtes peuvent minéraliser entièrement les phtalates (Chatterjee et Dutta, 2008; Wang et al., 2004; Vega et Bastide, 2003). En premier lieu, les liens ester entre les chaînes alkyle et le noyau aromatique sont hydrolysés pour former des monoesters, puis de l'acide phtalique, et produire simultanément des alcools (Amir et al., 2005). Les étapes de l'oxydation secondaire par la voie du 3-oxoadipate ont pour effet de rompre le noyau aromatique de l'acide phtalique (Chatterjee et Karlovsky, 2010). La biodégradation des esters phtaliques peut être précédée d'une phase de latence, un phénomène qui serait lié à l'abondance d'organismes possédant la capacité de dégrader les isomères phtaliques (Kleerebezem et al., 1999). Les voies de dégradation fongique des phtalates diffèrent des voies de dégradation bactérienne, et on les attribue aux peroxydases et aux laccases, de puissantes enzymes ligninolytiques extracellulaires (Kim et al., 2002; Liang et al., 2008). De plus, le phytoplancton est aussi connu pour sa capacité à dégrader des esters phtaliques, notamment le DEHP, dans des conditions d'éclairage et d'alimentation adéquates (Li et al., 2007).
La biodégradation des esters libère des phtalates de monoalkyle dans l'environnement (McConnell, 2007). La plupart des études indiquent que les phtalates de monoalkyle se dégradent plus rapidement que les esters phtaliques (Peterson et Staples, 2003). En outre, des études sur la biodégradation des phtalates de monoalkyle à chaînes plus courtes et plus longues, notamment les chaînes latérales mono-n-butyle-, mono-isobutyle-, phtalate de mono-2-éthylhexyle-, monoisononyle, mono-n-hexyle/n-octyle/n-decyle- et mono-n-octyle/n-decyle-, montrent que toutes substances peuvent être rapidement biodégradées (Scholz, 2003). Le devenir dans l'environnement des phtalates de monoalkyle est en grande partie inconnu, mais, selon Peterson et Staples (2003), qui se sont fondés sur des données modélisées, leur répartition est plus importante dans l'eau que dans la matière contenue dans les systèmes de traitement des eaux usées en raison des différences au chapitre de l'hydrophobicité. Dans les sédiments, la sorption n'a aucun effet sur la vitesse de biodégradation des phtalates de monoalkyle, car les monoesters sont en grande partie ionisés aux niveaux de pH observables dans l'environnement. Les chercheurs ont déterminé que les demi-vies de plusieurs phtalates de monoalkyle dans les sédiments, y compris le MEHP et le MBP, variaient de 0,34 à 2 jours (Otton et al., 2008; Kickham et al., 2012). McConnell (2007) s'est penché sur la distribution des phtalates de monoalkyle dans un écosystème marin et a détecté des concentrations de phtalates de monoalkyle tant dans les échantillons d'eau que dans les échantillons de sédiments. Selon les observations, les phtalates de monoalkyle se dégradent à une vitesse commune, à savoir que la structure du groupe latéral fonctionnel n'a aucune incidence sur la vitesse de biodégradation.
À de faibles concentrations, on a observé que les esters phtaliques se biodégradent très lentement. Autrement dit, la biodégradation se poursuit jusqu'à ce que les concentrations chutent à des concentrations de l'ordre de parties par milliard (ppb), puis elle cesse, ce qui se traduit par une omniprésence des phtalates à de très faibles concentrations (Rubin et al., 1982; Boethling et Alexander, 1979). Ce phénomène a été attribué à l'incapacité généralisée des bactéries à produire des enzymes métaboliques à de faibles concentrations (Peterson et Staples, 2003), de même qu'aux caractéristiques des bactéries susceptibles de biodégradation chimique. Cela est vrai pour les eutrophes, qui peuvent croître à des concentrations élevées d'une substance chimique, mais possèdent une faible capacité de dégradation à de faibles concentrations, et pour les oligotrophes, qui peuvent dégrader des substances chimiques à de faibles concentrations, mais sont moins spécifiques de la substance cible (Rubin et al., 1982). Boethling et Alexander (1979) ont émis l'hypothèse que l'énergie générée par l'oxydation des substances chimiques à de faibles concentrations pourrait être insuffisante pour satisfaire la demande énergétique des microorganismes, ce qui limiterait leur prolifération aux concentrations requises pour entraîner une perte appréciable de la substance. D'autres explications ont été avancées, dont le manque de biodisponibilité pour la biodégradation en raison de l'adsorption ou, simplement, la contamination du matériel de laboratoire (Peterson et Staples, 2003). Malgré leur biodégradabilité intrinsèque, les esters phtaliques possèdent de longues demi-vies dans les sédiments en raison de leur haut niveau d'absorbtion, qui est dû à leur hydrophobicité (Kickham et al., 2012).
7.2.2.1 Biodégradation immédiate et intrinsèque par les microorganismes présents dans les boues
La plupart des esters phtaliques peuvent être biodégradés par des microorganismes, et la cinétique de premier ordre est fréquemment utilisée pour décrire leur biodégradation (Liang et al., 2008). De nombreuses études sur la biodégradation immédiate et intrinsèque ont été réalisées avec les microorganismes présents dans les boues activées et, dans certains cas, dans les boues adaptées au préalable, en utilisant des concentrations variables des substances lors des essais dans le but de déterminer le potentiel de biodégradation des esters phtaliques dans l'eau.
Outre les études publiées, les études non publiées réalisées par l'industrie et résumées aux termes du règlement de l'UE sur l'enregistrement, l'évaluation, l'autorisation et les restrictions des substances chimiques (REACH) ont été prises en considération. Les résumés des études sont disponibles auprès de l'Agence européenne des produits chimiques (c2007-2014a).
| Substance | Processus du devenir | Valeur de dégradation | Paramètre de la dégradation (unités) | Méthode d'essai; date | Référence |
|---|---|---|---|---|---|
| DIBP | Biodégradation aérobie 28 jours (boues activées) |
98 | % de DBO | Ligne directrice 302C de l'OCDE (Biodégradabilité dite intrinsèque : Essai MITI modifié [II]); rapport daté de 2002 | ECHA, c2007-2014b |
| DIBP | Biodégradation aérobie 28 jours (boues non adaptées) |
66-70 | % de DBO | Ligne directrice 301D de l'OCDE (Biodégradabilité dite intrinsèque : Essai en fiole fermée); rapport daté de 2007 | ECHA, c2007-2014b |
| DIBP | Biodégradation aérobie (boues activées) 28 jours |
98 | % de DBO | Ligne directrice 301C de l'OCDE (Biodégradabilité dite intrinsèque : Essai MITI modifié [I]); rapport daté de 2002 | ECHA, c2007-2014b |
| DIBP | Biodégradation aérobie 14 ou 28 jours |
42 | % de dégradation mesurée selon le dégagement de CO2 | Ligne directrice 301B de l'OCDE (Biodégradabilité facile : essai de dégagement de CO2); rapport daté de 2010 | ECHA, c2007-2014b |
| DIBP | Biodégradation aérobie (boues activées) 14 jours; 28 jours |
60-70 70-80 |
% de dégagement de CO2 | Ligne directrice 301B de l'OCDE (Biodégradabilité facile : essai de dégagement de CO2); rapport daté de 2007 | ECHA, c2007-2014b |
| DCHP | Biodégradation aérobie 28 jours |
68,5; 91 |
% de DBO; % de dégradation |
Non précisée; étude réalisée de 1976 à 1977 | ECHA, c2007-2014c |
| B79P | Biodégradation aérobie 24 heures (boues activées) |
57-81 | % de dégradation | Ligne directrice 302A de l'OCDE (Biodégradabilité dite intrinsèque : procédure BASI modifiée); 1981 | ECHA, c2007-2014d |
| B79P | Biodégradation aérobie 28 jours (boues activées adaptées au préalable) |
83 | % de dégradation | Procédure par agitation en flacon, ASTM; 1979 | ECHA, c2007-2014d |
| BBP (analogue du BCHP, du CHIBP et du DBzP) |
Biodégradation aérobie 14 jours (boues activées) |
81 | % de DBO | Ligne directrice 301C de l'OCDE (Biodégradabilité facile : Essai MITI modifié [I]); 1992 | ECHA, c2007-2014e |
| BBP (analogue du BCHP, du CHIBP et du DBzP) |
Biodégradation aérobie 27 jours (boues activées) |
93 | % de dégagement de CO2 | Méthode de chimie analytique 71-42 (procédure BASI); 1976 | ECHA, c2007-2014e |
| BBP (analogue du BCHP, du CHIBP et du DBzP) |
Biodégradation aérobie 27 jours (bactéries adaptées) |
96 | % de dégagement de CO2 | Procédure Thompson-Duthie-Sturm; 1976 | ECHA, c2007-2014e |
| BBP (analogue du BCHP, du CHIBP et du DBzP) |
Biodégradation aérobie 2 jours (boues activées) |
50 | % de dégradation | Procédure d'essai de disparition dans l'eau de rivière; 1976 | ECHA, c2007-2014e |
| BBP (analogue du BCHP, du CHIBP et du DBzP) |
Biodégradation aérobie (boues activées) 24 heures; 48 jours |
99; 93-99 |
% de dégradation | Biodégradation primaire | Graham, 1973; Saeger et Tucker, 1976 |
| DIOP | Biodégradation aérobie (boues activées) 24 heures; 4 jours |
84,5; supérieur(e) à 90 |
% de dégradation | Procédure BASI et essai de disparition dans des boues activées | O'Grady et al., 1985 |
| DEHP (analogue du DIHepP) |
Biodégradation aérobie 29 jours (boues activées provenant d'une région où du DEHP est produit) |
82 | % de dégagement de CO2 | Ligne directrice 301B de l'OCDE (Biodégradabilité facile : essai de dégagement de CO2); 1994 | ECHA, c2007-2014f |
| DEHP (analogue du DIHepP) |
Biodégradation aérobie 28 jours (boues activées) |
4-5 | % de dégagement de CO2 | Ligne directrice 301B de l'OCDE (Biodégradabilité facile : essai de dégagement de CO2); 1994 | Struijs et Stoltenkam, 1990; ECHA, c2007-2014f |
| DEHP (analogue du DIHepP) |
Biodégradation aérobie 28 jours (boues activées de source industrielle) |
60-70 | % de DBO | Méthode C.5 de l'UE (Dégradation : demande chimique en oxygène) tirée de la directive EG 79/831; 1984 | ECHA, c2007-2014f |
| DEHP (analogue du DIHepP) |
Biodégradation aérobie 28 jours (boues activées) |
63 | % de DBO | Ligne directrice 301F de l'OCDE (Biodégradabilité dite intrinsèque : essai de respirométrie manométrique); 1995 | ECHA, c2007-2014f |
Des données issues d'études sur la biodégradation menées avec des boues activées étaient disponibles pour le DCHP, le DIOP, le DIBP, le B79P, le BBP et le DEHP. Des résultats contradictoires ont été signalés dans certains cas, comme pour le DEHP. Ces différences entre les vitesses de biodégradation peuvent être attribuées à des différences entre les protocoles expérimentaux utilisés et les concentrations des substances évaluées et du substrat.
En ce qui concerne le DCHP, la synthèse d'une seule étude sur la biodégradation était disponible auprès de l'ECHA (c2007-2014c). Celle-ci a été menée entre les mois d'août 1976 et de janvier 1977. La dégradation de 25 µg/L de DCHP a été examinée durant 28 jours. Le pourcentage de demande biologique en oxygène (DBO) mesuré a atteint 68,5 %, et la chromatographie en phase gazeuse a permis de déterminer que la substance avait été dégradée à 91 %. Les résultats ont révélé que le DCHP se dégradait rapidement dans les conditions d'essai. Étant donné les ressemblances structurales entre le DCHP et le DMCHP, on estime que cette dernière substance se dégrade aussi rapidement.
Plusieurs études sur la minéralisation et la biodégradation du DIBP menées entre 2002 et 2010 au moyen de différents protocoles de l'OCDE ont été résumées par l'ECHA (c2007-2014b). Dans trois de celles-ci, la biodégradation du DIBP a été mesurée en tant que pourcentage de la DBO durant une période de 28 jours. Les résultats des essais ont varié de 66 à 98 % de la DBO, ce qui indique que le DIBP se dégrade rapidement. Des résultats similaires indiquant que le DIBP se dégrade rapidement ont été obtenus dans le cadre de deux études qui avaient pour objet de mesurer le dégagement de CO2 en tant que signe de biodégradation. Dans celle réalisée en 2007, une biodégradation d'au moins 60 % a été observée après 14 jours, alors qu'elle atteignait jusqu'à 80 % après 28 jours. En revanche, celle menée en 2010 montrait une biodégradation du DIBP d'à peine 40 %. La durée de l'étude de 2010 figurant dans le sommaire est peu claire, car le pourcentage final de dégradation fourni se fonde sur une période de 28 jours. Cependant, il est aussi précisé que l'étude a pris fin après 14 jours. Cela signifie qu'un taux de dégradation de 40 % a été enregistré en 14 jours et non pas en 28 jours. De façon générale, la majorité des études disponibles donnent à penser que le DIBP se biodégrade rapidement.
Deux études portant sur la biodégradation du B79P sur des périodes respectives de 24 heures et de 28 jours ont été résumées par l'ECHA (c2007-2014d). Les renseignements disponibles sur celles-ci sont limités et les résultats fournis sont exprimés seulement en tant que pourcentage de dégradation. Ces deux études ont respectivement révélé que le B79P se biodégrade de manière intrinsèque et rapidement dans les conditions d'essai. Le pourcentage de dégradation observé atteignait 83 % en 28 jours. Il est indiqué dans l'étude de 28 jours (ECHA, c2007-2014d) que des boues activées adaptées au préalable ont été utilisées, alors que la nature des boues activées utilisées dans le cadre de l'étude portant sur une période de 24 heures n'était pas précisée. Étant donné qu'une biodégradation du B79P atteignant jusqu'à 80 % a été observée en 24 heures, il est possible que des boues activées adaptées au préalable aient aussi été utilisées lors de cette étude.
Trois études sur la biodégradation du BBP réalisées entre les années 1970 et 1992 ont été résumées par l'ECHA (c2007-2013e). Le pourcentage de la DBO (81 % de DBO en 14 jours) (ECHA, c2007-2013e) et le pourcentage de CO2 dégagé (plus de 90 % de CO2 dégagé en 27 jours) (ECHA, c2007-2013e, f) ont révélé que la substance se biodégradait rapidement. Une autre étude (ECHA, c2007-2013e) visant à mesurer la biodégradation selon le pourcentage de CO2 dégagé a révélé que la dégradation du BBP avait atteint 50 % en 2 jours. Graham (1973) a constaté une biodégradation de 99 % en 48 heures dans des boues activées, un résultat semblable à ceux obtenus par Saeger et Tucker (1976) (biodégradation de 93 à 99 % en 24 heures).
Plusieurs études sur la biodégradation du DEHP étaient aussi disponibles (ECHA, c2007-2014f). Deux études portant sur la biodégradation immédiate exprimée en CO2 dégagé, menées au moyen du même protocole (c.-à-d. le protocole 301B de l'OCDE) dans les années 1990, ont abouti à des résultats contradictoires. Dans celle réalisée en 1992, le DEHP se biodégradait rapidement en 28 jours, les chercheurs ayant observé 82 % de CO2 dégagé (ECHA, c2007-2014f). Par ailleurs, dans l'étude effectuée en 1990, seulement de 4 à 5 % de CO2 avait été dégagé après 28 jours (Struijs et Stoltenkamp, 1990; ECHA, c2007-2014f). Des boues activées ont été utilisées dans le cadre de ces deux études. Cependant, dans celle de 1994, des boues provenant d'une usine de traitement des eaux usées située dans une région où se trouvent des producteurs importants de DEHP ont été utilisées. Par conséquent, il est possible que les microorganismes utilisés lors de l'étude de 1994 se fussent déjà adaptés au DEHP en raison de l'activité manufacturière locale. Dans le cadre d'une précédente étude réalisée en 1984 avec des boues d'origine industrielle qui s'étaient probablement aussi déjà adaptées au DEHP, le pourcentage de DBO enregistré après 28 jours variait de 60 à 70 % (ECHA, c2007-2014f). Une biodégradation immédiate, exprimée par un pourcentage de DBO de 63 %, a été observée lors d'une étude de 1994 fondée sur un essai de respirométrie manométrique (ECHA, c2007-2013l). Cette étude a également fait état d'une phase de latence de 8 jours précédant la biodégradation du DEHP. Graham (1973) et O'Grady et al.(1985) ont observé une biodégradation primaire rapide du DEHP dans les boues activées. En effet, la biodégradation de cette substance atteignait 91 % après 48 heures et 81,5 % après 24 heures. De plus, une biodégradation de plus de 90 % a été observée après une période variant de 2 à 5 jours (O'Grady et al.1985). O'Grady (1995) a également fait état de la biodégradation primaire rapide du DIOP, qui a subi une biodégradation de 85 % après 24 heures, un chiffre qui dépassait le seuil de 90 % après 4 jours.
En résumé, les phtalates à chaîne moyenne sont rapidement biodégradés par les microorganismes présents dans les boues activées. Le DCHP, le DIOP, le DIBP, le B79P, le BBP et le DEHP se dégradaient en général rapidement, mais certaines variations qui pourraient être attribuables à des conditions expérimentales non standards ont été observées. À titre d'exemple, l'utilisation de boues adaptées au préalable pourrait avoir accéléré la biodégradation du B79P ou y avoir contribué. Cependant, ces résultats sont semblables à la majorité des valeurs de dégradation obtenues pour les phtalates à chaîne moyenne dans les cas où des boues activées étaient utilisées en tant que substrat au lieu de boues adaptées au préalable. Étant donné que les phtalates à chaîne moyenne présentent généralement une structure similaire, ils sont considérés comme étant à la fois intrinsèquement et rapidement dégradables.
Biodégradation primaire et immédiate modélisée
Des modèles QSAR des programmes EPI Suite (2012) et CATALOGIC (2012) ont aussi été utilisés pour évaluer le potentiel de biodégradation intrinsèque et finale des phtalates à chaîne moyenne. Les chaînes SMILES et, lorsque disponibles, les propriétés physicochimiques, comme l'hydrosolubilité et le log Koe, ont servi d'intrants pour les modèles. On a constaté que les phtalates à chaîne moyenne se prêtaient généralement bien aux prévisions au moyen de modèles, à l'exception de deux substances, soit le B84P et le BIOP, car elles tombent hors du domaine d'applicabilité du modèle de CATALOGIC (2012). Cependant, puisque les résultats produits par le programme CATALOGIC (2012) pour le B84P et le BIOP étaient cohérents avec ceux obtenus pour l'ensemble des substances, ils ont été jugés acceptables et ont été inclus dans l'évaluation.
Les données établies grâce aux modèles QSAR indiquaient que la biodégradation des substances du sous-groupe des phtalates était relativement rapide. Les résultats fondés sur les sous-modèles BIOWIN 3, 4, 5 et 6 concernant le DIBP, le BCHP, le CHIBP, le DCHP, le DMCHP, le DIHepP et le BIOP ont révélé de façon constante que ces substances se biodégradaient rapidement. La biodégradation primaire selon le sous-modèle 4 a été estimée en jours ou en semaines, et les demi-vies de dégradation ultime établies au moyen du programme CATALOGIC (2012) variaient de 11 à 37 jours. Les chercheurs ont calculé que le DIHepP avait la demi-vie la plus longue parmi les phtalates à chaîne moyenne, un résultat qui était attendu des esters phtaliques de plus grande taille moléculaire. Cependant, il est possible que ses chaînes latérales presque linéaires permettent une biodégradation rapide, comme l'indiquent les sous-modèles BIOWIN. Le tableau 7-2-3 présente une synthèse des résultats établis au moyen des modèles.
Des vitesses de biodégradation légèrement inférieures ont été établies pour le DBzP, le B84P et le B79P. Ces résultats concordent avec l'observation selon laquelle les phtalates présentant des groupes latéraux de type ester plus longs et plus complexes sont moins biodégradables. Le B84P est le plus grand phtalate du sous-groupe des phtalates à chaîne moyenne. On a déterminé que la biodégradation primaire du DBzP, du B84P et du B79P se déroulait en quelques semaines. En ce qui concerne la biodégradation finale, les résultats produits par les modèles ont varié. Le sous-modèle BIOWIN 3 a indiqué une période allant de quelques semaines à quelques mois, alors que le sous-modèle BIOWIN 6 a révélé que ces substances n'étaient pas facilement biodégradables. Les demi-vies calculées au moyen du programme CATALOGIC (2012) variaient de 14 à 21 jours. Le tableau 7-2-4 présente une synthèse des résultats établis au moyen des modèles.
Dans l'ensemble, les résultats des modèles se sont révélés conformes aux données expérimentales sur la biodégradation, y compris celles portant sur le BBP et le DEHP, et ont montré que les substances faisant partie du sous-groupe des phtalates à chaîne moyenne se biodégradent rapidement. Selon les résultats des modèles, il est possible de classer les phtalates à chaîne moyenne de la façon suivante en fonction de leur vitesse de biodégradation :
DIBP supérieur(e) à BCHP, CHIBP, DBzP, DCHP, DMCHP supérieur(e) à B79P, BIOP, B84P supérieur(e) à DIHepP.
Le DIBP, le phtalate le plus petit et le plus simple du sous-groupe des phtalates à chaîne moyenne, devrait être le plus facilement dégradable. En revanche, le DIHepP devrait être le moins facilement dégradable, un résultat qui concorde avec les données expérimentales disponibles pour sa substance analogue, le DEHP, dont la vitesse de biodégradation est la plus faible.
| Processus du devenir | Paramètre de dégradation ou prévision | Méthode d'essai ou base du modèle | Demi-vie calculée ou déterminée par les modèles (t1/2 = jours) |
Référence |
|---|---|---|---|---|
| Dégradation aérobie primaire | 3,1-4,1 (biodégradation rapide; « jours ou semaines ») |
Sous-modèle 4 : Enquête d'experts (qualitative) | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 2,7-3,1Notes de bas de page Tableau 7-2-3[a].6 (biodégradation rapide; « semaines ou mois ») |
Sous-modèle 3 : Enquête d'experts (qualitative) | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 0,5-0,7Notes de bas de page Tableau 7-2-3[b].3 (biodégradation rapide) |
Sous-modèle 5 : Probabilité linéaire MITI | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 0,3-0,8b (biodégradation rapide) |
Sous-modèle 6 : Probabilité non linéaire MITI | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 40-80 (biodégradation rapide) |
% de DBO | De 11 à 37Notes de bas de page Tableau 7-2-3[c] | CATALOGIC, 2012 |
| Processus du devenir | Paramètre de dégradation ou prévision | Méthode d'essai ou base du modèle | Demi-vie calculée ou déterminée par les modèles (t1/2 = jours) |
Référence |
|---|---|---|---|---|
| Dégradation aérobie primaire | 3,7-3,8 (biodégradation rapide; « semaines ») |
Sous-modèle 4 : Enquête d'experts (qualitative) | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 2,4-2,7Notes de bas de page Tableau 7-2-4[a].7 (biodégradation rapide; « mois ») |
Sous-modèle 3 : Enquête d'experts (qualitative) | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 0,3-0,6Notes de bas de page Tableau 7-2-4[b].4 (biodégradation rapide) |
Sous-modèle 5 : Probabilité linéaire MITI | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 0,1-0,2b (biodégradation lente) |
Sous-modèle 6 : Probabilité non linéaire MITI | N. D. | BIOWIN, 2010 |
| Dégradation aérobie finale | 50-70 (biodégradation rapide) |
% de DBO | t1/2 = 14 - 21Notes de bas de page Tableau 7-2-4[c].1 | CATALOGIC, 2012 |
7.2.2.2 Biodégradation dans les eaux de surface et les sédiments
Des esters phtaliques ont été détectés dans l'eau douce partout dans le monde, et ces substances ont tendance à s'adsorber sur les sédiments (Chang et al., 2005). La plupart des esters phtaliques se dégradent rapidement dans les eaux de surface (Furtmann, 1994). Les microorganismes aérobies et anaérobies se trouvant dans les sédiments peuvent dégrader les esters phtaliques (Hashizume et al., 2002; Chang et al., 2004; Kim et al., 2008), bien qu'ils n'y soient pas aussi abondants que lorsqu'ils sont isolés dans des boues ou des sols activés. La biodégradation abiotique des esters phtaliques présentant des chaînes latérales plus longues est généralement lente (Lertsirisopon et al., 2006).
Un rapport de Furtmann (1994) indique que la biodégradation primaire du DIBP et du DCHP présents dans des échantillons prélevés dans le fleuve du Rhin et les rivières Ruhr et Emscher s'est déroulée rapidement à une température de 20 °C. À 4 °C, la dégradation était retardée de 3 à 4 jours. L'ajout d'azoture de sodium (une substance toxique qui a un effet bactériostatique sur la cytochrome oxydase dans la mitochondrie) avait pour effet d'interrompre les processus de dégradation. Hashizume et al. (2002) ont observé la biodégradation complète du DIBP sur une période de 7 jours dans des échantillons d'eau prélevés dans des rivières se trouvant dans des régions urbaines du Japon.
Tant les esters phtaliques que leurs métabolites primaires, les esters phtaliques monoalkyles, peuvent être dégradés rapidement par les microbes présents dans les sédiments. Cependant, leur vitesse de biodégradation diminue au fur et à mesure qu'augmente la sorption, ce qui peut se traduire par de longues demi-vies dans les sédiments pour les phtalates dont le log Kco est élevé (Kickham et al., 2012).
On a observé que les esters phtaliques monoalkyles se dégradent rapidement dans des sédiments naturels (Otton et al., 2008). Dans le cadre de la présente étude, les vitesses de biodégradation mesurées à une température de 22 °C étaient les mêmes dans les sédiments d'eau douce et d'eau de mer. Il ne semble exister aucune relation entre la demi-vie de dégradation et la longueur ou l'ampleur de ramification de la chaîne alkyle du monoester. Les demi-vies de huit esters monoalkyles testés (caractérisés par une chaîne latérale éthyl-, butyl-; benzyl-; iso-hexyl-; ethylhexyl-; n-octyl; iso-nonyl-; iso-decyl- alkyl) ont varié de 16 à 39 heures à une température de 22 °C dans des sédiments d'eau douce et d'eau de mer. Elles se sont révélées un peu plus longues, allant jusqu'à 200 heures à 5 °C dans des sédiments d'eau douce (Otton et al., 2008). Des températures plus basses entraînent une activité bactérienne plus faible, ce qui a pour effet de limiter la biodégradation.
Yuan et al. (2002) ont étudié la biodégradation de huit phtalates, y compris le DEHP, dans des sédiments de rivières à Taïwan. Les demi-vies aérobies moyennes ont varié de 2,5 à 14,8 jours, alors que les demi-vies anaérobies étaient plus longues, soit de 14,4 à 34,7 jours. Yuwatini et al.(2006) ont estimé à environ 14 jours la demi-vie de biodégradation du DEHP dans des sédiments.
La biodégradation aérobie dans les sédiments du DBP (une substance semblable au DIBP), du BBP et du DEHP a été étudiée par Lertsirisopon et al. (2006). La dégradation du DBP et du BBP a duré quelques jours (les demi-vies moyennes du DBP et du BBP étaient respectivement de 1,4 et de 1,8 jour) et a été précédée de courtes phases de latence (atteignant jusqu'à 0,7 jour pour le DBP et 1,4 jour pour le BBP). Par ailleurs, le DEHP, qui se caractérise par des chaînes alkyle plus longues, a subi une dégradation caractérisée par une phase de latence de 5 jours et une demi-vie moyenne de 252 jours. Kickham et al. (2012) ont déterminé que les demi-vies dans les sédiments du BBP, ainsi que du DEHP et du DINP, étaient respectivement de 2,9 et 347 jours.
7.2.2.3 Biodégradation dans le sol
La voie et la vitesse de biodégradation des esters phtaliques dans différents types de sols ont été étudiées. Il a été possible de déterminer la biodégradation dans le sol du DIBP (Ferreira et Morita, 2012), mais pas celle des autres substances du sous-groupe des phtalates à chaîne moyenne. En revanche, des données abondantes étaient disponibles pour la substance analogue DEHP (Gejlsberg et al., 2001; Scheunert et al., 1987; Wang et al., 2009; Schmitzer et al., 1988; Madsen et al., 1999). Le DEHP est considéré comme étant un bon analogue pour le DIHepP. Cependant, les constatations émanant des nombreuses études sur le DEHP peuvent généralement être aussi appliquées aux substances du sous-groupe des phtalates à chaîne moyenne. Le DEHP est le phtalate à chaîne moyenne qui tend à se biodégrader le plus lentement. Par conséquent, la vitesse de biodégradation des substances du sous-groupe des phtalates à chaîne moyenne devrait être équivalente ou inférieure à celle du DEHP.
Les tendances relatives à la vitesse de biodégradation des esters phtaliques dans le sol sont très semblables aux tendances concernant leur biodégradation dans l'eau (Peterson et Staples, 2003). Tant la longueur que la ramification du groupe ester latéral influent sur la vitesse de biodégradation. Les phtalates courts et linéaires ont tendance à se dégrader plus rapidement, alors que ceux présentant des groupes latéraux plus longs et ramifiés se biodégradent plus lentement (Zeng et al., 2004). Les températures élevées semblent accélérer la biodégradation dans le sol (Rüdel et al., 1993; Chen et al., 1997; Chang et al., 2009). Madsen et al. (1999) ont noté que le fait de multiplier par deux la température avait pour effet de doubler la vitesse de dégradation du DEHP. L'humidité du sol a également une incidence sur la vitesse de dégradation des esters phtaliques. En effet, une humidité plus élevée accélère la biodégradation et la minéralisation (Peterson et Staples, 2003). Enfin, des conditions aérobies devraient accélérer la biodégradation dans le sol. En ce qui concerne le DEHP, une biodégradation plus lente a été observée dans des conditions anaérobies (Madsen et al., 1999; Scheunert et al., 1987).
Ferreira et Morita (2012) ont étudié la biodégradation du DIBP dans le sol d'un site industriel de São Paulo, au Brésil, ayant fait l'objet d'une biorestauration. Calculée à l'aide d'une équation de cinétique de premier ordre (demi-vie = ln2/k) et la constante de vitesse de dégradation (k) de 0,01 indiquée dans Ferreira et Morita (2012), la demi-vie du DIBP équivaut à 69,3 jours. Les demi-vies établies pour le DEHP (calculées avec la cinétique de premier ordre) dans différents types de sols varient de 2 jours dans un sol limoneux, à 69,3 jours dans le sable (Rüdel et al., 1993; Shanker et al., 1985; Roslev et al., 1998; Peterson et Staples, 2003) et jusqu'à 77 jours dans le sol du site industriel du Brésil soumis à une biorestauration (Ferreira et Morita, 2012).
La minéralisation du DEHP dans le sol débute par une phase de latence (observée dans le cadre de certaines études), puis se poursuit avec deux phases cinétiques bien distinctes : la phase initiale d'environ 30 jours qui suit la cinétique de premier ordre, suivi d'une phase tardive plus lente (Dörfler et al., 1996; Peterson et Staples, 2003). Le phénomène, connu sous le nom de « séquestration », a été présenté par Peterson et Staples (2003) comme étant une explication possible de la lente phase de dégradation du DEHP. Il se produit lorsqu'une substance chimique hydrophobe pénètre dans des particules solides, n'est plus adsorbée par la surface et devient disponible pour les solvants d'extraction. La demi-vie du DEHP lors de la phase initiale a été chiffrée à 58 jours et celle de la phase tardive, à 147 jours (Dörfler et al., 1996). De façon similaire, dans le cadre d'une étude sur les sols réalisée par Wang et al. (2009), une phase de latence d'environ 5 jours a été observée avant la dégradation du DEHP à toutes les concentrations testées (de 10 à 1 000 mg/kg). Cette phase était suivie par une dégradation rapide durant les 30 premiers jours, à une concentration aussi faible que 10 % de la concentration initiale, à la concentration la plus faible ayant été évaluée, soit 10 mg/kg. Dans cette étude, la dégradation est demeurée stable après une période 30 jours, et aucune diminution importante de la concentration n'a été constatée jusqu'à la fin de l'expérience au terme de 55 jours. Les chercheurs ont montré que le niveau de biodégradation du DEHP dépendait de la concentration initiale de la substance, puisqu'après 55 jours, ce niveau était inférieur à 10 % avec la concentration la plus faible de 10 mg/kg, et variait de 20 à 35 % avec une concentration de 50 à 1 000 mg/kg respectivement. La relation de dépendance entre la vitesse de biodégradation du DEHP et la concentration initiale a également été mise en évidence par Fairbanks et al. (1985), qui ont constaté que les demi-vies étaient de deux à quatre fois plus longues avec les concentrations les plus élevées, et par Dörfler et al. (1996), qui ont remarqué une biodégradation plus lente avec de plus grandes concentrations initiales.
Les conditions environnementales, comme la température, l'humidité du sol et les niveaux d'oxygène, de même que la concentration initiale de la substance et le type de sol, ont toutes une incidence sur la vitesse de biodégradation des esters phtaliques. On sait aussi que la longueur et la complexité du groupe ester latéral influent sur la biodégradation de ces substances. La biodégradation du DEHP semble se dérouler en deux phases, soit une première phase durant laquelle la biodégradation est rapide, puis une phase où elle devient plus lente. Cette dernière peut être précédée d'une phase de latence. Il est possible que ce phénomène touche les substances du sous-groupe des phtalates à chaîne moyenne, particulièrement la phase de latence initiale, mais aucune étude semblable sur la dégradation n'a encore été réalisée pour ces substances. Il est toutefois admis que les demi-vies dans le sol établies pour le DEHP, qui vont de 2 à environ 77 jours, peuvent être considérées comme représentatives du groupe des phtalates à chaîne moyenne. Les chercheurs ont déterminé que la demi-vie du DIBP dans le sol atteignait 69,3 jours.
7.3 Potentiel de bioaccumulation
L'analyse du potentiel de bioaccumulation repose sur plusieurs paramètres pouvant s'appliquer, y compris les propriétés de la substance (p. ex. log Koe, log Koa), le facteur de bioconcentration (FBC), le facteur de bioamplification (FBAm), le facteur d'amplification dans le réseau trophique (FART) et le facteur de bioaccumulation (FBA). Le rôle du métabolisme dans la détermination du potentiel de bioaccumulation est aussi examiné.
Des données empiriques sur la bioaccumulation étaient disponibles pour deux substances du sous-groupe des phtalates à chaîne moyenne, soit le DIBP et le DIHepP. Le BBP, une substance sur laquelle il existe une grande quantité de données, servira d'analogue pour le BCHP, le CHIBP et le DBzP, alors que le DEHP sera utilisé comme analogue pour le DIHepP dans les cas où il n'existait pas de données sur les composés cibles (p. ex. le FBC). Se reporter à la section 2.1 pour en savoir davantage sur les facteurs justifiant le choix des analogues. Des données modélisées sont utilisées pour l'évaluation de la bioaccumulation des autres phtalates à chaîne moyenne.
Les log Koe des phtalates à chaîne moyenne vont de 4,11 à 6,92, ce qui donne à penser que ces substances peuvent se répartir dans le biote à partir de l'eau et d'autres milieux. Les résultats des études menées en laboratoire dont il est question ci-après montrent que d'autres facteurs ont une incidence sur la bioaccumulation des phtalates, notamment le métabolisme.
7.3.1 Facteur de bioconcentration (FBC)
Il existe seulement des données sur la bioconcentration des substances analogues BBP et DEHP, lesquelles sont utilisées comme données de référence pour le BCHP, le CHIBP, le DBzP et le DIHepP (se reporter à la section 2.1 pour en savoir davantage sur les facteurs justifiant le choix des analogues). Des études montrent que les FBC varient de 188 à 1 890, avec une valeur médiane de 663, selon des calculs fondés sur les concentrations totales et dissoutes (tableau D-1 de l'annexe D).
Ratzlaff (2004) a mené des études sur la bioconcentration de plusieurs phtalates afin de déterminer la mesure dans laquelle les différentes méthodes utilisées pour mesurer les concentrations de phtalates dans l'eau ont une incidence sur les FBC. Avec leur log Koe allant de modéré à élevé, on s'attendrait à ce que certains phtalates à chaîne moyenne soient associés à la matière organique, ce qui réduirait leur biodisponibilité. On s'attendrait aussi à ce la quantité de phtalates dissous dans le système soit surestimée et que le FBC soit sous-estimé dans les concentrations mesurées dans l'eau comprenant la fraction adsorbée sur la matière. La mesure des concentrations qui se sont dissoutes librement comprendrait seulement la fraction biodisponible qui peut être absorbée par l'intermédiaire de la surface respiratoire du poisson et, par conséquent, bioconcentrée. Ratzlaff (2004) a exposé une truite arc-en-ciel au BBP durant 61 jours, puis a calculé les FBC en fonction des concentrations totales dans l'eau (y compris la fraction associée à la matière organique) et des concentrations totales dissoutes librement dans l'eau, telles que définies sur le plan opérationnel. Étant donné que certains phtalates sont sorbés sur des particules de matière de petit diamètre (inférieur(e) à 0,45 µm) et ont quand même été détectés dans les concentrations dissoutes librement dans l'eau définies sur le plan opérationnel, un modèle a aussi été utilisé pour prédire les concentrations dissoutes librement selon le modèle de sorption en trois étapes à l'aide du log Koe, du log Kco, de la teneur en carbone organique, de la concentration de particules de matière de petit diamètre en suspension et du niveau de déséquilibre chimique entre ces particules et l'eau. De manière générale, les FBC ont augmenté durant la période d'absorption, puis ont atteint une valeur maximale au 21e jour, ce qui indique qu'un état stationnaire a été atteint. Comme il était attendu, les concentrations de BBP dissoutes librement dans l'eau étaient inférieures aux concentrations totales dans l'eau. Les FBC correspondants reposant sur les concentrations dissoutes librement dans l'eau définies sur le plan opérationnel étaient plus élevés (FBC = 1 890) que ceux calculés au moyen des concentrations totales dans l'eau (FBC = 918). Le FBC fondé sur les concentrations dissoutes librement prédites était beaucoup plus élevé, avec une valeur prédite de 11 500.
Carr et al. (1997) ont exposé des crapets arlequins à 0,034 mg/L de BBP durant 3 jours et ont mesuré les concentrations BBP dans ceux-ci. Les chercheurs ont opté pour une exposition de 3 jours à la lumière d'une précédente étude (Monsanto, non publiée) ayant démontré que l'équilibre dans les tissus du crapet arlequin avait été atteint après 3 jours (Carr et al., 1997). Cette période est largement moindre que celle de 21 jours déterminée par Ratzlaff (2004) comme étant nécessaire pour atteindre l'état stationnaire chez la truite arc-en-ciel. Les expériences qui reposent sur de courtes durées d'exposition tendent à sous-estimer le FBC, étant donné que les conditions de l'état stationnaire pourraient ne pas être atteintes (Staples, 2003). En fait, en mesurant les concentrations de BBP dans les tissus du crapet arlequin, Carr et al.(1997) ont calculé un FBC de 9,4 pour le poisson en entier, une valeur inférieure au FBC de 918 obtenu par Ratzlaff avec la période d'exposition plus longue, selon la concentration totale de BBP. Carr et al. (1997) ont aussi calculé le FBC en utilisant du BBP radiomarqué et ont obtenu pour un FBC de 194 (équivalent pour le poisson en entier), ce qui concorde avec les résultats obtenus lors de tests antérieurs qui visaient à mesurer la radioactivité totale et qui auraient inclus les métabolites dans la mesure.
SDes études visant à mesurer le BBP marqué au 14C sont disponibles. Cependant, Carr et al. (1997) ont constaté que ces calculs surestimaient la bioconcentration, puisque les métabolites ne peuvent pas être distingués de la substance mère. La base de données de l'ECHA (ECHA, c2007-2013) contient une synthèse détaillée d'une étude non publiée sur le FBC. Cette étude porte sur un essai dynamique réalisé avec du BBP radiomarqué à des concentrations d'exposition de 0,002 mg/L durant 21 jours. Elle a permis de constater que le BBP possède un faible potentiel de bioconcentration dans le crapet arlequin, avec un FBC de 188 pour le corps entier. Les concentrations ont également été mesurées dans les muscles et les viscères, et se sont révélées plus élevées dans les viscères que dans les muscles (FBC de 1 693 comparativement à 29).
Barrows et al. (1980) ont exposé des crapets arlequins à du BBP marqué au 14C dans des conditions dynamiques. Des échantillons de poisson et d'eau ont été recueillis durant 21 jours pendant l'essai, lorsque le point d'équilibre a été atteint. Avec une concentration moyenne dans l'eau de 0,0097 mg/L, un FBC de 663 a été calculé pour le corps entier. Après la phase d'exposition, les chercheurs ont placé le poisson dans un aquarium propre afin de surveiller la dépuration.
Les données empiriques sur la bioconcentration indiquent que le BBP est rapidement métabolisé par le poisson. Carr et al. (1997) ont comparé les mesures du BBP intact avec la radioactivité dans les tissus et ont calculé que plus de 90 % des composés radiomarqués dans les tissus du poisson constituaient des métabolites du BBP. Les chercheurs ayant observé une diminution de la concentration de BBP dans la solution au cours des 3 jours d'exposition, ils ont déterminé que la réduction du BBP intact dans les tissus du poisson était influencée par le métabolisme de la substance ainsi que l'exposition aux produits de dégradation de celle-ci directement dans l'eau et lors du métabolisme subséquent.
Ratzlaff (2004) a mesuré le phtalate de monobenzyle, un métabolite de type monoester du BBP, dans le poisson ayant été exposé au BBP. Aucune concentration n'a toutefois été détectée. L'étude indique que la quantité minimale détectable était assez élevée (31,3 ng/g) en raison de l'insensibilité relative de la nouvelle technique d'analyse.
McConnell (2007) a mesuré les métabolites des esters phtaliques dans le biote à False Creek Harbour, en Colombie-Britannique, en 2005. Le métabolite du DIHepP, le phtalate de monoheptyle (appelé « MC7P »), a été détecté dans des échantillons de moules bleues, de myes, de crabes dormeurs et de jeunes perches-ménés à des concentrations variant entre 6,9 et 350 ng/g (concentrations lipidiques équivalentes), mais pas aux niveaux trophiques supérieurs, comme chez le sourcil à taches blanches ou l'aiguillat commun (dans lesquels la quantité minimale détectable fluctuait de 0,018 à 41 ng/g de poids humide [ph]). Dans la plupart des cas, la concentration de DIHepP était supérieure à celle du métabolite. Le métabolite de la substance analogue BBP, l'hydrogéno-phtalate de benzyle (MBzP), a été détecté seulement dans la moule bleue et la jeune perche-méné, et des concentrations de BBP supérieures à celles de MBzP ont été observées.
Dans le cadre d'une étude, Mayer (1976) a calculé les FBC pour le DEHP à l'aide de DEHP marqué au 14C et de concentrations du composé d'origine mesurées par chromatographie en phase gazeuse. Les FBC consignés pour la tête-de-boule en fonction de la réactivité totale ont varié de 155 à 886 au cours d'une période d'exposition de 56 jours, alors que les FBC fondés sur les concentrations réelles de DEHP ont varié de 91 à 569. Le poisson a été exposé à des concentrations de DEHP marqué au 14C allant de 0,0019 à 0,062 mg/L, les plus faibles dans la plage de solubilité du DEHP (0,003 mg/L). Le chercheur a observé que les FBC diminuaient avec l'augmentation des concentrations. Il laisse croire que ce phénomène pourrait être attribuable à l'induction d'enzymes de détoxification dans le foie et à la hausse de la dégradation et de l'élimination du DEHP. Ces chiffres donnent à penser que le DIHepP aurait également un faible potentiel de bioaccumulation.
Des estimations du FBC ont été produites grâce à une version reposant sur trois niveaux trophiques du modèle du bilan massique d'Arnot et Gobas (Arnot et Gobas, 2003) pour un poisson de niveau trophique intermédiaire pesant 184 g. Les données modélisées sont considérées comme fiables, car les phtalates à chaîne moyenne tombent dans les domaines paramétriques et métaboliques du modèle. Le tableau D-2 de l'annexe D répertorie les FBC projetés pour chaque phtalate à chaîne moyenne, qui vont de 29 à 237 L/kg (ph). Il comprend également des estimations de la vitesse de biotransformation (kM). Les données expérimentales sur les FBC se rapportant au BBP, la substance analogue du BCHP, du CHIBP et du DBzP, varient de 9,4 à 1 890. Les modèles BCFBAF prédisent un FBC variant de 17 à 112 L/kg pour ces substances, ce qui indique que la kM dans ce modèle pourrait être surestimée à 3,4, 3,8 et 25. La base de données sur les vitesses de biotransformation métabolique d'Arnot et al. (2008a) contient des kM pour les phtalates ayant une masse moléculaire plus élevée. Elle s'élève à 1,17/jour pour le phtalate de diisoheptyle et à 3,52/jour pour le phtalate de diisononyle, ce qui semble indiquer que la kM de 25 pour le DBzP et le B84P est surestimée. En se fondant sur une kM de 3,52/jour, on obtient un FBC estimatif de 96 L/kg et de 45 L/kg pour le DBzP et le B84P respectivement (Arnot et al., 2008b). Néanmoins, les données expérimentales et issues de modèles sur la bioconcentration, de même que les mesures de métabolites dans les organismes aquatiques semblent indiquer que les phtalates à chaîne moyenne sont susceptibles d'être métabolisés.
7.3.2 Facteur de bioaccumulation (FBA)
Les facteurs de bioaccumulation sont mesurés dans des conditions naturelles en tant que rapport entre les charges de substance chimique absorbées dans le corps entier découlant de toutes les expositions et les concentrations se trouvant dans l'eau ambiante. Le calcul du FBA est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances, car il intègre toutes les sources d'exposition, y compris l'exposition alimentaire, qui est prédominante pour les substances présentant un log Koe supérieur à ~4,0 (Arnot et Gobas, 2003). Aucune étude portant sur les FBA n'a été trouvée dans la documentation publiée sur les phtalates à chaîne moyenne. Cependant, dans une thèse, Mackintosh (2002) a calculé les FBA du DIBP, du DIHepP, du DEHP et du BBP, entre autres phtalates, dans 18 organismes d'un réseau trophique marin. Le tableau D-3 de l'annexe D présente les valeurs moyennes des FBA du DIBP, du DIHepP, du DEHP et du BBP dans les algues vertes, le chabot et le muscle d'aiguillat commun. Ces valeurs sont censées être représentatives des trois niveaux du réseau trophique de False Creek (1er, 3e et 4e niveau trophique, respectivement). Les intervalles et les médianes obtenus par Mackintosh (2002) sont présentés dans le tableau 7-4.
| Substance | Critère d'effet toxicologique | Plage de valeurs (L/kg) | Médiane (L/kg) | Référence |
|---|---|---|---|---|
| DIBP | FBA, phNotes de bas de page Tableau 7-4[a].8 | 34-776 | 143 | Mackintosh, 2002 |
| DIHepP | FBA, pha | 12-3236 | 125 | Mackintosh 2002 |
| BBP | FBA, pha | 186-8709 | 717 | Mackintosh 2002 |
| DEHP | FBA, pha | 4,9-1097 | 38 | Mackintosh 2002 |
Les FBA moyens calculés par Mackintosh (2002) indiquent que les phtalates à chaîne moyenne présentent un faible potentiel de bioaccumulation, puisque la plupart des facteurs sont inférieurs à 1 000 et presque tous sont inférieurs à 3 000. Le FBA de 8 709 L/kg constitue une exception et a été calculé pour le BBP chez la macreuse à front blanc, selon l'analyse d'un échantillon de foie seulement. Les endroits où les échantillons ont été collectés ainsi que les différences entre les aires d'alimentation pourraient également avoir eu une incidence sur ces différences de FBA, car la macreuse à front blanc a une plus vaste aire d'alimentation et est plus mobile que les autres organismes visés par l'étude.
Le modèle de bioaccumulation pour le niveau trophique intermédiaire à l'état stationnaire publié par Arnot et Gobas (2003) prévoit pour les phtalates à chaîne moyenne des FBA variant de 1,48 à 2,6 L/kg (ph) en se fondant sur les mêmes kM que les prévisions de FBC et une efficacité d'assimilation alimentaire de 1 % pour chaque phtalate, afin de tenir compte du métabolisme intestinal (tableau D-2 de l'annexe D). Des études portant sur le DBP, le BBP et le DEHP chez le chabot armé ont révélé que ces substances étaient transformées très efficacement dans les intestins et n'étaient l'objet d'aucune accumulation découlant de l'exposition par l'alimentation, ce qui se traduit par une très faible (inférieur(e) à 0,01) assimilation (Webster et al., 2003). Tous les FBC et FBA projetés sont inférieurs à 1 000, ce qui indique que les phtalates à chaîne moyenne ont un faible potentiel de bioaccumulation. Les valeurs expérimentales des FBA du DIBP et du BBP, qui atteignent 78 et 631 L/kg chez le chabot armé, sont supérieures aux valeurs établies à l'aide du modèle, qui prévoyait un FBA de 34,31 pour le DIBP et de 117, 104 et 17 pour le BCHP, le CHIBP et le DBzP respectivement. Les différences pourraient être attribuables aux hypothèses utilisées dans le modèle.
7.3.3 Facteur d'accumulation biote-sédiments (FABS)
Le FABS est un paramètre qui décrit la bioaccumulation de composés associés aux sédiments dans les tissus de récepteurs écologiques (Burkhard, 2009). Étant donné les diverses capacités de sorption des lipides et du carbone organique, le point d'équilibre est représenté par une valeur de trois, puisque la capacité de sorption du carbone organique est 0,35 fois celle de l'octanol (lipide). Un FABS supérieur à trois indique par conséquent une concentration chimique plus grande dans le biote que dans les sédiments (Morin, 2003). Par ailleurs, l'American Society for Testing and Materials ([ASTM], 1997) recommande un seuil de 1,7 afin de représenter les conditions d'équilibre. Un FABS dépassant des valeurs approximatives de 1,7 à 3 (sur une base normalisée) indique une assimilation supérieure à ce qui peut être expliqué par la théorie du partage à l'équilibre à elle seule (un processus de bioaccumulation se produit).
Dans une étude sur la bioaccumulation des esters phtaliques dans les réseaux trophiques marins, Gobas et al. (2003) décrivent le déséquilibre qui se produit, à des degrés variables, entre les concentrations d'esters phtaliques dans l'eau de porosité des sédiments et les concentrations dans l'eau surjacente. Les chercheurs ont constaté que les concentrations dans l'eau de porosité des sédiments étaient supérieures aux concentrations dans l'eau surjacente, ce qui entraînerait un niveau d'exposition directe plus élevé pour les organismes invertébrés vivant dans les sédiments que pour les organismes épibenthiques présents dans l'épilimnion. Mackintosh (2002) a calculé les valeurs du FABS des esters phtaliques chez 18 organismes faisant partie du réseau trophique en divisant la concentration moyenne normalisée de lipides dans le biote par la concentration moyenne normalisée de carbone organique dans les sédiments. Les FABS calculés pour le DIBP, le DIHepP, le BBP et le DEHP étaient inférieurs à 1,7 (les valeurs sont présentées dans le tableau D-3 de l'annexe D), même pour les organismes invertébrés vivant dans les sédiments comme la panope du Pacifique et la palourde japonaise.
Dans le cadre d'une étude sur la distribution des esters phtaliques (y compris le DIBP et le BBP) chez les mammifères, chez les poissons, dans les sédiments et dans l'air de la baie d'Hudson, Morin (2003) a calculé les FABS des esters phtaliques chez le béluga et la morue polaire. Les sédiments sont considérés comme une source d'exposition alimentaire pour le béluga, puisqu'il utilise la succion pour chercher des organismes benthiques et qu'il peut ingérer des sédiments (Morin, 2003). Chez la morue polaire, les FABS équivalaient à 2,75 et à 3,45 kg de CO/kg de lipides pour le DIBP et le BBP respectivement. En ce qui concerne le béluga, les FABS s'élevaient à 4,19 et à 3,71 kg de CO/kg de lipides pour le DIBP et le BBP respectivement (Morin, 2003). Les FABS établis pour les bélugas sont semblables à ceux établis pour la morue polaire, ce qui donne à penser que les sédiments ne constituent pas une source importante de DIBP pour le béluga. Ces FABS sont supérieurs à ceux calculés à False Creek Harbour par Mackintosh (2002). Morin (2003) a mesuré des concentrations de DIBP plus élevées dans le biote et moindres dans les sédiments de l'Arctique. Un examen des explications possibles des concentrations plus élevées dans le biote de l'Arctique est présenté à la section 8.2.1.5.
7.3.4 Bioamplification
La bioamplification est le processus par lequel la concentration d'une substance chimique dans un organisme atteint un niveau supérieur à ce qui est observé dans l'alimentation de l'organisme en raison de l'assimilation alimentaire (Gobas et Morrison, 2000). Un facteur de bioamplification (FBAm) supérieur à 1 indique que la bioamplification pourrait se manifester. Les facteurs d'amplification dans le réseau trophique (FART) constituent une autre mesure du niveau de bioamplification dans le réseau trophique. Ils représentent l'augmentation moyenne de la concentration chimique en équivalences lipidiques pour chaque augmentation de la position dans la chaîne trophique (Mackintosh et al., 2004). Un FART supérieur à 1 indique une bioamplification chimique dans le réseau trophique, alors qu'un FART inférieur à 1 indique une dilution trophique. Peu d'études ont mesuré la bioamplification des phtalates à chaîne moyenne et de la substance analogue BBP.
Morin (2003) s'est penché sur la présence de DIBP et de BBP dans les tissus de bélugas et de morues polaires adultes, et a calculé des facteurs de bioamplification en équivalences lipidiques de 1,52 (de la morue au béluga; DIBP) et de 1,07 (de la morue au béluga; BBP). Ces valeurs, très semblables, donnent à penser que ces phtalates ont une capacité de bioamplification limitée (Morin, 2003).
Des chercheurs ont effectué des études sur le terrain afin d'évaluer la bioamplification ou la dilution trophique d'une variété d'esters phtaliques, y compris le DIBP, le BBP et le DIHepP (qu'ils nomment en anglais « di-iso-heptyl » et désignent par « C7 » dans les études) (Mackintosh et al., 2004; McConnell, 2007). Ces études avaient pour objet de calculer les FART dans le réseau trophique marin de False Creek Harbour, en Colombie-Britannique. Des échantillons ont été recueillis à quatre niveaux trophiques. Les FART ont été calculés sur la base des concentrations de phtalates dans le biote et du ratio de 15N/14N, qui tend à augmenter selon le niveau trophique (Mackintosh et al., 2004). Mackintosh et al. (2004) et McConnell (2007) ont calculé pour le DIBP, le BBP et le DIHepP des FART allant de 0,38 à 0,94, ce qui indique qu'il n'y a aucune bioamplification (voir les tableaux D-4 et D-5 à l'annexe D pour connaître toutes les valeurs). Aucune présence de DIHepP n'a été détectée dans les muscules du plus grand prédateur, l'aiguillat, ce qui pourrait réduire la capacité à détecter des tendances statistiquement significatives dans le réseau trophique. Les concentrations de DIBP, de BBP et de DIHepP selon la masse lipidique ont semblé diminuer légèrement au fur et à mesure que la position dans la chaîne trophique augmentait. Cependant, une telle corrélation ne s'est pas révélée statistiquement significative, ce qui semble indiquer qu'une faible dilution trophique pourrait se produire (Mackintosh et al., 2004).
McConnell (2007) a aussi calculé le FART pour le métabolite du DIHepP, le MC7P, qui s'est chiffré à 0,22 (McConnell, 2007). Il serait attendu que les métabolites des phtalates à chaîne moyenne ne se bioamplifient pas, puisqu'ils sont plus hydrosolubles et sont métabolisés plus rapidement dans les organismes.
Les données sur la bioamplification dont on dispose ne portent que sur un nombre limité de phtalates à chaîne moyenne et donnent à penser que l'exposition par l'alimentation ne contribue pas de façon importante au transfert trophique et à l'accumulation dans l'environnement par la chaîne trophique. Cette constatation concorde avec les FBC et FBA calculés, qui vont de faibles à modérés, et avec l'observation selon laquelle les phtalates à chaîne moyenne sont métabolisés par les poissons.
7.4 Sommaire du devenir dans l'environnement
Les phtalates à chaîne moyenne devraient être rejetés en premier lieu dans le milieu aquatique par l'intermédiaire des effluents d'eaux usées d'origine industrielle et par le rejet ou la dispersion de produits de consommation. Au fur et à mesure que leur masse moléculaire augmente, les substances du sous-groupe des phtalates à chaîne moyenne tendent de plus en plus à se sorber sur la matière solide dans différents milieux. Ainsi, certains phtalates à chaîne moyenne auront tendance à demeurer dans les sédiments et dans les boues, ce qui explique qu'ils pourraient également être rejetés dans le sol à la suite de leur application sur des terres agricoles. Selon les résultats modélisés, les phtalates à chaîne moyenne sont peu susceptibles d'être transportés sur de grandes distances. Néanmoins, le DIBP, la substance du sous-groupe qui présente la masse moléculaire la plus faible, a été détecté à de grandes distances de ses sources de rejet, ce qui est probablement attribuable au transport de particules, un phénomène dont les modèles QSAR ne tiennent actuellement pas compte. Les processus de dégradation abiotique et biotique des esters phtaliques sont assez bien connus. Les phtalates à chaîne moyenne peuvent être dégradés par des processus abiotiques, bien que ces derniers soient très lents dans l'environnement et soient influencés par les conditions environnementales, notamment le pH et la présence d'oxygène. En revanche, les processus de biodégradation peuvent être relativement rapides. Cependant, la vitesse de biodégradation et le niveau de minéralisation de chaque substance varient en fonction de la taille et de la complexité des groupes latéraux de type ester, les molécules les plus complexes et les plus grandes demeurant plus longtemps dans l'environnement. Les vitesses de biodégradation dans les sols et les sédiments sont semblables à celles observées dans l'eau. Les phtalates à chaîne moyenne présentant une faible masse moléculaire sont plus hydrosolubles et sont donc plus biodisponibles pour les organismes aquatiques. Les données sur la bioaccumulation dont on disposait ne portaient que sur un petit sous-ensemble du sous-groupe et concernaient principalement les substances présentant les masses moléculaires les plus faibles (c.-à-d. le DIBP et la substance analogue BBP). Selon ces données, les phtalates à chaîne moyenne auraient un potentiel de bioaccumulation allant de faible à modéré. Des études sur la bioconcentration donnent à penser que ces substances peuvent être métabolisées. Des études sur le terrain indiquent que le potentiel de bioaccumulation n'est pas important dans le réseau trophique, puisque les phtalates à chaîne moyenne ne s'y bioamplifient pas.
8. Possibilités d'effets nocifs sur l'environnement
8.1 Effets écologiques
Des données empiriques sur la toxicité pour les organismes aquatiques étaient disponibles pour les phtalates à chaîne moyenne suivants : DIBP, DCHP, B84P et B79P. Ces données provenaient à la fois d'études publiées et d'études non publiées. Des résumés des études non publiées réalisées par l'industrie ont été préparés aux termes du règlement de l'Union européenne sur l'enregistrement, l'évaluation, l'autorisation et les restrictions des substances chimiques (règlement REACH) et ont été affichés sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2014a). Étant donné que le niveau de détail du résumé de certaines études était limité, de multiples études ont été utilisées pour comparer les résultats.
L'évaluation des substances BCHP, CHIBP, DBzP, DMCHP et DIHepP a été effectuée avec des données empiriques portant sur le DIBP, le DCHP, le B84P et le B79P, avec les renseignements disponibles sur les analogues BBP, DPhP et DIOP, et avec des données obtenues par modélisation QSAR.
Il a été proposé que les phtalates présentant une faible masse moléculaire, notamment le DBP et le BBP (dont la masse moléculaire varie de 278,34 à 312,35 g/mol), ont pour mode d'action probable une narcose non polaire en raison de la corrélation positive qui existe entre les données sur la toxicité et le log Koe (Oehlmann et al., 2009). Adams et al. (1995) ont également indiqué que les phtalates de faible masse moléculaire sont plus toxiques que les narcotiques organiques neutres non spécifiques, ce qui signifie qu'ils seraient classés comme des narcotiques polaires ou alors comme des composés ayant un mode d'action « indéterminé ». En ce qui concerne les composés ayant une masse moléculaire élevée (supérieure à 312,35 g/mol), Rhodes et al. (1995) indiquent que, d'après leurs données, le mode d'action de ces substances serait associé à un « seuil de solubilité » selon lequel il y aurait une diminution de la solubilité aqueuse plus la masse moléculaire augmente, de sorte qu'une charge corporelle critique entraînant des effets nocifs ne pourrait être atteinte.
Les effets des phtalates à chaîne moyenne sur le système endocrinien chez les mammifères sont bien connus, mais les données portant sur les organismes aquatiques sont peu abondantes. La mesure dans laquelle les données de ces études portant sur des mammifères peuvent être extrapolées à d'autres espèces de vertébrés ou d'invertébrés est incertaine. Christiansen et al. (2000) signalent que les poissons téléostéens, par comparaison aux mammifères, présentent une capacité de métabolisation des xénobiotiques moindre, des mécanismes de régulation hormonale et de différenciation sexuelle différents, de même que des récepteurs d'hormones stéroïdiennes qui leur sont propres. La section portant sur les effets écologiques se limite à l'évaluation des études sur la toxicité pour les organismes aquatiques, alors que celle sur la santé humaine (section 9.2) présente une évaluation des données sur les mammifères. Des données limitées concernant les paramètres secondaires (mesurés à l'échelle moléculaire, biochimique, cellulaire, tissulaire, sanguine ou organique) donnent à penser que certains phtalates (comme le BBP) pourraient avoir des effets sur le système endocrinien. Cependant, les études portant sur les paramètres primaires (notamment sur le développement et la reproduction) ne révèlent aucun effet sur le système endocrinien. Aucune étude sur les paramètres secondaires pouvant être médiés par une activité endocrinienne n'a été réalisée pour les substances appartenant au sous-groupe des phtalates à chaîne moyenne. La pertinence de recourir à des analogues pour évaluer ces effets, qui sont propres à chaque substance et dépendent de sa structure, est grandement incertaine en ce qui concerne les organismes aquatiques. Ils n'ont donc pas été utilisés pour réaliser une lecture croisée ou pour calculer les facteurs d'évaluation s'appliquant aux phtalates à chaîne moyenne.
Les effets écologiques des phtalates à chaîne moyenne sont abordés ci-après dans les sections portant sur les compartiments environnementaux, soit l'eau, les sédiments et le sol.
En bref, les données empiriques sur la toxicité indiquent que les phtalates à chaîne moyenne présentent une toxicité modérée à élevée pour les organismes aquatiques (la concentration létale médiane [CL50] allant de inférieur(e) à 1 à 10 mg/L). Les données relatives à la toxicité pour les organismes aquatiques sont réunies dans les tableaux E-1 et E-2 de l'annexe E.
La plupart des études sur la toxicité des phtalates à chaîne moyenne pour les organismes aquatiques mesurent les paramètres primaires, notamment la survie, la croissance, le développement et la reproduction. Les paramètres secondaires qui pourraient être médiés par l'activité endocrinienne et des modes d'action autres que la narcose sont abordés dans la sous-section 8.1.1.3 de la section relative au milieu aquatique. Une synthèse des résultats disponibles figure dans le tableau E-4 l'annexe E.
Bien qu'il n'existe aucune information sur les possibles effets sur les espèces sauvages, un certain nombre d'études portent sur la toxicité chez les rongeurs (voir la section 9.2). Une exposition orale chronique à de faibles concentrations de phtalates à chaîne moyenne, notamment par l'ingestion d'aliments, peut constituer un scénario préoccupant en ce qui concerne les espèces sauvages. Un examen détaillé des répercussions éventuelles sur les espèces mammaliennes est présenté dans l'Évaluation des effets sur la santé (section 9.2).
Les métabolites de type monoester semblent être moins toxiques pour les organismes aquatiques que les composés d'origine; les effets sont abordés à la sous-section 8.1.1.4.
Les données sur la toxicité des phtalates à chaîne moyenne pour les organismes vivant dans le sol et les sédiments sont extrêmement limitées. Selon les données limitées sur les analogues, présentées aux sous-sections 8.1.2 et 8.1.3, les phtalates à chaîne moyenne seraient faiblement toxiques pour les organismes vivant dans les sédiments et le sol (CL50supérieur(e) à 100 mg/kg, poids sec [ps]]).
8.1.1 Eau
Toxicité pour les organismes aquatiques déterminée empiriquement
Des expériences écotoxicologiques ont été menées sur les phtalates à chaîne moyenne avec une variété d'organismes aquatiques et de substances chimiques. Selon les données empiriques sur la toxicité des phtalates à chaîne moyenne, ces substances présentent une toxicité modérée à élevée pour les organismes aquatiques (les concentrations létales médianes [CL50] allant de inférieur(e) à 1 à 10 mg/L) (se reporter aux tableaux E-1 et E-2 de l'annexe E).
Bradlee et Thomas (2003) décrivent un seuil de solubilité (limite) pour les phtalates, selon lequel la solubilité passe sous 1 mg/L lorsque les chaînes alkyle latérales contiennent plus de six carbones. Selon eux, les phtalates peuvent être classés en deux groupes en fonction de leurs propriétés toxicologiques aquatiques, soit le groupe des « phtalates courts », qui comportent des chaînes ester de moins de six carbones, et le groupe des « phtalates longs », dont les chaînes ester comptent plus de six carbones. Ils indiquent que les phtalates longs ne présentent aucune toxicité intrinsèque pour les organismes aquatiques, car la métabolisation rapide et la faible hydrosolubilité de ces substances font en sorte que la charge corporelle critique en matière de toxicité ne peut être atteinte (Bradlee et Thomas, 2003). Ils ont également noté que les phtalates longs forment des émulsions stables qui causent une toxicité artificielle lors des essais menés en laboratoire, les daphnies s'y trouvant emprisonnées. Le DBzP, le DCHP, le DMCHP, le B84P, le B79P, le BIOP et le DIHepP appartiennent tous au sous-groupe des phtalates à chaîne moyenne, dont les deux chaînes ester comptent au moins six carbones. Bon nombre des études écotoxicologiques décrites ci-après ont été réalisées au-dessus du seuil d'hydrosolubilité de ces substances et font état de la présence d'une couche superficielle. Lorsque le seuil de solubilité est dépassé, on observe la présence d'un agent stressant (une substance expérimentale non dissoute) qui ne pourrait se former dans des circonstances normales (en l'absence d'un déversement). Par conséquent, les résultats de ces études de toxicité ne sont pas applicables aux situations environnementales normales. Cela s'applique également aux essais de toxicité dans lesquels une partie des concentrations d'exposition est supérieure au seuil de solubilité et une partie des concentrations est inférieure à ce seuil. Dans ces cas, il est possible de voir une relation dose-réponse qui est en fait « fausse », car un agent stressant (non dissous) est présent lorsque les concentrations sont supérieures au seuil de solubilité, mais non lorsque les concentrations sont inférieures à ce seuil (communication personnelle, examen scientifique externe pour la Division de l'évaluation écologique [Environnement Canada] daté du 5 novembre 2014, non cité). Dans la plupart des cas, les études ont été menées à des concentrations ne dépassant pas le seuil d'hydrosolubilité.
Le DIBP est la substance la plus étudiée du groupe des phtalates à chaîne moyenne; des travaux ont été menés sur des poissons, des invertébrés et des algues. Le DIBP est également le phtalate à chaîne moyenne présentant la masse moléculaire la plus faible et, par conséquent, celui qui est le plus hydrosoluble et le plus biodisponible. Selon le résumé d'une étude bien étayée sur la toxicité aiguë pour la tête-de-boule -- une étude ne reposant sur aucune ligne directrice et dont on ne sait pas si elle était conforme aux bonnes pratiques de laboratoire (BPL) --, des anomalies comportementales ont été observées à de faibles concentrations de DIBP, et la CE50 à 96 heures était de 0,73 mg/L (ECHA, c2007-2014b). L'étude a été réalisée sous le seuil de solubilité du DIBP. Des effets chroniques sur la reproduction ont aussi été observés chez la daphnie (Daphnia magna), la CSEO à 21 jours étant de 0,27 mg/L. Cependant, il n'y avait aucune précision sur les lignes directrices qui auraient été suivies dans cette étude (ECHA, c2007-2014b). Selon le résumé d'une étude très bien étayée sur les algues, le DIBP est hautement toxique pour les algues : la CE50 à 72 heures, déterminée en fonction d'une réduction de la biomasse, était de 0,56 mg/L (ECHA, c2007-2014b). Dans cette étude, la concentration des solutions d'essai était fondée sur des mesures effectuées au début de l'étude. Selon les données empiriques, le DIBP est hautement toxique pour les poissons, les invertébrés et les algues, des effets ayant été observés à des concentrations allant de 0,27 à 4,8 mg/L (voir le tableau E-1 à l'annexe E).
La plupart des études sur la toxicité du B84P pour les organismes aquatiques ont été effectuées à des concentrations dépassant le seuil d'hydrosolubilité (0,81 mg/L). Le B84P est une substance dont les chaînes ester comptent plus de six carbones. Une étude confidentielle sur la toxicité aiguë de cette substance pour la daphnie, réalisée avec des concentrations nominales allant de 1 à 10 mg/L, a révélé une CL50à 48 heures de 7,5 mg/L (Étude présentée, 2014a). L'étude prévoyait l'utilisation d'acétone dans des béchers comme véhicule, à des concentrations atteignant 1 mL par 200 mL d'eau. Il n'y avait toutefois aucune indication au sujet de la présence ou de l'absence d'une émulsion à la surface de l'eau ou au sujet de l'emprisonnement des daphnies dans une telle émulsion. Les résumés des études portant sur les poissons révèlent tous l'absence d'effets à des concentrations se situant près du seuil d'hydrosolubilité ou supérieures à celui-ci. La CL50dépasse 0,3, 5 et 1 000 mg/L. Toutefois, aucun des résumés des études sur les poissons n'est suffisamment détaillé pour qu'il soit possible d'évaluer les études. Un essai de 96 heures mené chez la tête-de-boule, qui était conforme à la ligne directrice 203 de l'OCDE et respectait les BPL, a révélé une CL50 supérieure à 0,3 mg/L; il n'y avait toutefois aucune autre précision sur le sujet (ECHA, c2007-2014g). Ces données indiquent que les daphnies sont plus sensibles au B84P que les poissons, car aucun effet n'est observé chez ces derniers alors que les daphnies meurent à une concentration de 7,5 mg/L.
La toxicité du DCHP a été étudiée chez les poissons, les invertébrés, les algues et les amphibiens. Les données sur le DMCHP étant limitées, le DCHP sera également utilisé à des fins de lecture croisée en raison de sa similarité avec le DMCHP sur le plan de la structure et des propriétés physicochimiques. Le DCHP et le DMCHP comportent des chaînes ester de six carbones ou plus (six et sept carbones, respectivement), ce qui constitue la limite à partir de laquelle des émulsions se forment dans l'eau lorsque le seuil de solubilité est dépassé. L'hydrosolubilité du DCHP varie de 0,2 à 4 mg/L, et celle du DMCHP est estimée à 0,275 mg/L. Deux études ont été menées chez la daphnie à des concentrations voisines des seuils d'hydrosolubilité de manière à ce qu'aucune émulsion ne se forme. Une étude sur la toxicité aiguë pour la daphnie, dans laquelle les concentrations nominales variaient de 0,2 à 2 mg/L, n'a révélé aucune perte de mobilité sur une période de 48 heures à quelque concentration que ce soit (ECHA, c2007-2014c). Cependant, une étude de 21 jours réalisée à des concentrations mesurées (aucune concentration nominale n'a été signalée) a généré une CE50 de 0,679 mg/L et une CSEO de 0,181 mg/L (ECHA, c2007-2014c). Le résumé de l'étude est très peu détaillé, mais celle-ci a été considérée comme fiable parce qu'elle aurait été effectuée conformément à des lignes directrices de l'OCDE. Les études sur les poissons et les algues n'ont pas été jugées fiables, car elles ont été réalisées à des concentrations dépassant largement les seuils d'hydrosolubilité (10-100 mg/L et 2 mg/L, respectivement) (ECHA, c2007-2014c).
De Solla et Langlois (2014) ont eu recours à l'essai de tératogenèse sur embryons de grenouille du genre Xenopus(ASTM, 1998) comme test rapide pour détecter une éventuelle toxicité pour le développement. Dans un rapport d'étape sur les travaux en cours, ils ont signalé que, lors de tests de toxicité aiguë de 72 heures, l'exposition au DCHP à des concentrations dépassant le seuil d'hydrosolubilité a provoqué la mort, des malformations et des retards de développement chez les têtards de Xenopus tropicalis. Le DCHP a provoqué la mort d'un nombre beaucoup plus élevé de têtards de Xenopus tropicalis que de témoins à des concentrations supérieures à 4,1 mg/L (correspondant à des concentrations nominales de 23 mg/L). Dans la même gamme de concentrations létales, le DCHP était associé à une augmentation des malformations chez les têtards, notamment d'œdèmes et d'anomalies du cœur et des branchies. Toutes les concentrations de DCHP ont entraîné un retard de développement chez les têtards par rapport aux témoins, mais ce phénomène ne s'est avéré statistiquement significatif qu'à des concentrations de 4,1 et de 19 mg/L. Des effets sublétaux tels que des modifications de l'expression génétique ont été observés sous le seuil de 4,1 mg/L, ce qui donne à penser que le DCHP provoquerait un certain stress à l'échelle cellulaire et que ce stress favoriserait l'apparition de malformations et de problèmes de développement à des concentrations supérieures à 4,1 mg/L. Ces résultats indiquent que le DCHP et le DMCHP sont hautement toxiques pour les invertébrés aquatiques et modérément toxiques pour les amphibiens.
Le B79P s'est avéré toxique chez les algues, les daphnies et les poissons (voir le tableau E-1 à l'annexe E). Étant donné que le B79P et le BIOP sont semblables sur le plan de la structure et de la biodisponibilité aquatique et qu'il existe des lacunes relativement aux données sur le BIOP, les données sur les effets du B79P peuvent être utilisées dans l'évaluation du BIOP. Les résumés de diverses études s'intéressant aux effets du B79P chez les algues, les daphnies et les poissons étaient disponibles (ECHA, c2007-2014d). Les études sur les algues ont été réalisées à des concentrations dépassant le seuil d'hydrosolubilité et avec un solvant. Une CE50 de 521 à 674 mg/L a été observée, mais il y avait peu de détails en ce qui concerne ces études (ExxonMobil, 2006). Deux études menées auprès de la daphnie étaient disponibles (Étude présentée, 2014b; ECHA, c2007-2014d). Dans une étude au cours de laquelle des daphnies ont été exposées à des concentrations nominales de 1 à 10 mg/L de B79P dans de l'acétone, les chercheurs ont observé une CL50 à 48 heures de 4,5 mg/L. Cette étude comporte toutefois des limites, car l'entreprise l'ayant présentée a précisé que la composition du B79P utilisée lors de l'essai était différente de celle du produit qu'elle offre sur le marché. L'essai avait été mené avec une substance composée en grande partie d'alcools à huit carbones alors que la substance commercialisée est principalement composée d'alcools riches en C9. De plus, les daphnies se sont trouvées emprisonnées dans des émulsions aux concentrations de 1 et de 1,8 mg/L de B79P (Étude présentée, 2014b). Le résumé d'une étude faisait état d'une CE50 à 48 heures de 0,3 mg/L en ce qui concerne le B79P. L'étude en question était conforme à la ligne directrice 202 de l'OCDE, mais il manquait certains renseignements, notamment au sujet des concentrations nominales qui avaient été utilisées (ECHA, c2007-2014d). Par ailleurs, des études sur des poissons ont été réalisées à des concentrations dépassant le seuil d'hydrosolubilité (0,3 mg/L) sans qu'aucun effet ne soit observé (ExxonMobil, 2006). Brown et al. (1998) ont étudié les effets chroniques du phtalate de diheptyle/nonyle et d'autres esters phtaliques sur la daphnie en présence d'un dispersant chimique. Cette étude était conforme aux lignes directrices de l'OCDE et comportait une confirmation analytique. Aucun effet chronique sur la survie ou la reproduction des daphnies n'a été observé à une concentration nominale de 1 mg/L. Le résumé de l'étude indique que le BIOP et le B79P étaient hautement à modérément toxiques pour les daphnies à des concentrations inférieures au seuil d'hydrosolubilité.
Une synthèse des principales études sur les phtalates à chaîne moyenne qui étaient disponibles et qui ont été prises en considération pour la détermination d'une valeur critique de toxicité est présentée au tableau 8-1. Ces études ont fait l'objet d'une évaluation critique et ont été jugées fiables pour ce qui concerne l'établissement d'une valeur critique de toxicité (Environnement Canada, 2015).
| Nom de la substance | Organisme testé | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| DIBP | Tête-de-boule (Pimephales promelas) |
CE50, 96 heures | 0,73 | ECHA, c2007-2014b |
| DIBP | Daphnie (Daphnia magna) |
CSEO, 21 jours Reproduction |
0,27 | ECHA, c2007-2014b |
| DIBP | Algue verte (Pseudokirchneriella subcapitata) |
CE50, 72 heures Biomasse |
0,56 | ECHA, c2007-2014b |
| DCHP | Daphnie (Daphnia magna) |
CSEO, 21 jours | 0,181 | ECHA, c2007-2014c |
Aucune des études sur la toxicité du B79P et du BIOP pour les organismes aquatiques n'a été jugée suffisamment fiable pour être utilisée aux fins de la détermination d'une valeur critique de toxicité. Par conséquent, des résultats modélisés ont été utilisés pour définir cette valeur, comme l'indiquait la section 8.1.1.2.
Aucune donnée empirique n'était disponible pour le BCHP et le CHIBP. Cependant, étant donné que le BBP est considéré comme un analogue étroitement apparenté à ces substances sur le plan de la structure, des propriétés physicochimiques et de la biodisponibilité, comme il est indiqué à l'annexe A, le BBP sera employé à des fins de lecture croisée pour ces deux substances. Les études portant sur les poissons, les invertébrés et les algues montrent que ces substances ont une toxicité aiguë élevée et présentent des valeurs de toxicité inférieures à 1 mg/L (voir le tableau E-2 de l'annexe E pour connaître toutes les valeurs). Adams et al. (1995) ont mené une étude sur 14 esters phtaliques et ont constaté que le BBP provoquait une toxicité aiguë chez les poissons et les algues. De nombreux organismes aquatiques ont été soumis à des essais dans le cadre de cette étude, et ce sont les algues qui se sont révélées être les plus sensibles aux effets aigus du BBP, avec une CE50 à 96 heures de 0,21 mg/L et une CSEO inférieure à la concentration la plus faible ayant été utilisée (inférieur(e) à 0,1 mg/L). Les poissons étaient moins sensibles, mais la CL50 était tout de même de 0,82 à 1,7 mg/L. Des cas de mortalité ont été observés chez bien des espèces à la concentration de BBP la plus élevée ayant été testée, mais le taux de mortalité était insuffisant pour qu'il soit possible de calculer une CL50. Les valeurs présentées par Adams et al. (1995) sont fondées sur les concentrations mesurées au premier et au dernier jour de l'étude. Les auteurs mentionnent également les valeurs relatives au BBP signalées par Gledhill et al. (1980), notamment une CSEO à 96 heures de 0,36 mg/L chez le crapet arlequin. Bien qu'il n'ait pas été possible de calculer la CE50 pour la daphnie dans l'étude d'Adams et al. (1995), un effet toxique pour cet organisme a été observé par Rhodes et al. (1995), qui ont constaté une CMEO de 1,4 mg/L et une CSEO de 0,28 mg/L dans le cadre d'une étude de 21 jours. Cette dernière étude a aussi montré que les poissons étaient moins sensibles que les daphnies, aucun effet n'ayant été observé chez les poissons à la concentration expérimentale la plus élevée (0,2 mg/L). Les études d'Adams et al.(1995) et de Rhodes et al. (1995) portaient sur 14 phtalates, et les auteurs ont mentionné que bon nombre des essais avaient dû être repris en raison de la présence d'une microcouche de la substance à l'étude à la surface de l'eau. Le BBP a constitué l'exception dans ces deux études en ce sens qu'aucune trace de la substance n'a été décelée à la surface de l'eau, les essais en cause ayant été menés à des concentrations inférieures au seuil d'hydrosolubilité (les concentrations signalées par Rhodes et al. [1995] étaient toutes inférieures au seuil d'hydrosolubilité de 2,96 mg/L). Un essai en écoulement continu de 28 jours a été mené sur des mysis dans de l'eau salée exposés à des concentrations moyennes de BBP radiomarqué allant de 0,024 à 0,75 mg/L (ce qui correspond à des concentrations nominales de 0,031 à 0,5 mg/L; les concentrations moyennes équivalaient à 62-68 % des concentrations nominales pour la plupart des expositions). Les CSEO calculées selon la survie, la reproduction et la croissance étaient de 0,17, 0,075 et 0,075 mg/L, respectivement (Étude présentée, 2014c).
Une étude sur deux générations a été effectuée avec des têtes-de-boule en vue de mesurer les effets potentiels du BBP sur le développement, la croissance et la reproduction (Étude présentée, 2014d). L'étude, qui a été menée en écoulement continu et était conforme aux BPL ainsi qu'à diverses lignes directrices, comportait deux phases : une première, qui durait 21 jours et visait à évaluer la survie et le rendement de la reproduction chez les adultes, et une deuxième, qui se déroulait sur 126 jours et avait pour but d'évaluer le rendement des embryons issus de la première phase. Le BBP a été testé à des concentrations de 0,018 et de 0,064-0,067 mg/L (concentrations nominales de 0,025 et de 0,1 mg/L, respectivement) avec 100 µL/L de triéthylèneglycol en tant que véhicule. Durant la première phase, le BBP ne semblait avoir eu aucun effet notable sur la survie au stade adulte, le nombre d'œufs, le nombre de frais, le nombre d'œufs par frai, le taux de fertilité et le taux d'éclosion. De façon semblable, la deuxième phase n'a révélé aucun effet important du BBP sur la survie des alevins, sur la survie au stade adulte, sur la longueur et le poids des femelles, sur la longueur et le poids des mâles, ou sur la vitellogénine chez les femelles et les mâles (Étude présentée, 2014d).
La toxicité du BBP pour les organismes vivant dans les sédiments a été évaluée dans le cadre de deux études à l'aide d'essais réalisés dans de l'eau seulement. Le produit commercialisé sous le nom de « Santicizer 160 » (BBP) a été testé durant 48 heures à des concentrations de 1,25 à 20 mg/L sur Chironomus tentans, un organisme vivant dans les sédiments; la CL50 observée à 48 heures était de 1,64 mg/L. Une CSEO de 1,25 mg/L a été observée (ECHA, c2007-2013). L'étude a été menée avant la mise en œuvre de BPL et aurait été menée en « étroite conformité » avec une ligne directrice établie par Mosher et al. (1982) et une ligne directrice de l'EPA des États-Unis (US EPA, 1975). Call et al. (2001a) se sont penchés sur les effets du BBP sur H. azteca, C. tentans et L. variegatus durant dix jours à l'aide d'essais réalisés dans de l'eau, à des concentrations moyennes de 0,036 à 1,76 mg/L et selon un taux de récupération maximal de 90 %. La CL50 était de 0,46, de supérieur(e) à 1,76 et de 1,23 mg/L, respectivement. Ces données indiquent que le BCHP et le CHIBP peuvent également se révéler modérément à hautement toxiques pour les organismes aquatiques et les organismes vivant dans les sédiments qui seraient exposés aux substances à l'étude par l'intermédiaire de l'eau interstitielle.
Il n'existe aucune donnée empirique sur la toxicité du DBzP, mais une étude portant sur la toxicité aiguë du DPhP sera utilisée à des fins de lecture croisée : la seule différence entre ces substances concerne deux atomes de carbone, et les estimations relatives à l'hydrosolubilité et au log Koe sont très comparables (annexe A). Le DBzP devrait être légèrement moins biodisponible en raison de son hydrosolubilité moindre (0,51 mg/L) et de son log Koe(5,1) supérieur par rapport au DPhP (2,47 mg/L et 4,1). Une étude effectuée par Geiger et al. (1985) a révélé une CL50 aiguë de 0,08 mg/L pour la tête-de-boule, ce qui est inférieur au seuil d'hydrosolubilité du DBzP (0,51 mg/L) et du DPhP (3,039 mg/L). Des concentrations nominales de 0,1 à 0,48 mg/L (correspondant à des concentrations mesurées de 0,069 à 0,48 mg/L), toutes inférieures au seuil d'hydrosolubilité du DPhP, ont été utilisées dans le cadre de cette étude. Cela peut être considéré comme une estimation du cas le plus défavorable en ce qui concerne la toxicité du DBzP, car cette substance devrait être moins biodisponible que l'analogue.
Étant donné qu'il n'y avait qu'une seule étude sur la toxicité du DIHepP pour les organismes aquatiques, les données sur la toxicité du DIOP ont été utilisées à des fins de lecture croisée. Le DIOP présente la même structure de base que le DIHepP et compte un carbone supplémentaire dans chaque chaîne alkyle latérale. Brown et al. (1998) ont étudié les effets chroniques du DIHepP (qu'ils nomment en anglais « di-iso heptyl phthalate ») et d'autres esters phtaliques sur la daphnie en présence d'un dispersant chimique. Cette étude a été réalisée conformément à des lignes directrices de l'OCDE et comportait une confirmation analytique. Aucun effet chronique sur la survie ou la reproduction des daphnies n'a été observé à une concentration nominale de 1 mg/L. Deux articles bien étayés décrivent chacun une étude ayant porté sur le DIOP. Étant donné que les phtalates qui comportent des chaînes latérales de plus de six carbones ont tendance à former une couche superficielle à des concentrations supérieures à leur seuil d'hydrosolubilité, Adams et al. (1995) ont étudié la toxicité aiguë en utilisant un flacon muni d'un drain de fond pour transférer la solution dans les béchers, afin que toute portion de la substance à l'essai se trouvant dans une couche superficielle demeure dans le flacon. Malgré ces précautions, il a fallu répéter l'essai sur le DIOP, car les daphnies ont été emprisonnées à la surface lors de la première tentative. Les solutions ont été analysées au début et à la fin de l'étude. Pour les 14 substances étudiées, la concentration finale mesurée après les essais statiques a chuté à 50 % de la concentration initiale, et des concentrations moyennes ont été utilisées pour calculer la CE50. Il a été avancé que ce phénomène serait attribuable à une adsorption sur la surface du récipient. Les observations sont fondées sur l'immobilité des daphnies et non sur leur emprisonnement. La CE50 à 48 heures associée au DIOP était supérieure à la concentration expérimentale la plus élevée (0,16 mg/L), qui est également supérieure au seuil d'hydrosolubilité de cette substance (0,09 mg/L). Adams et al. (1995) ont étudié d'autres organismes aquatiques (poissons, autres invertébrés et algues) et, dans tous les cas, la CL50 et la CE50étaient supérieures à la concentration expérimentale la plus élevée (tant dans les essais statiques que dans les essais en écoulement continu). Rhodes et al. (1995) se sont penchés sur la toxicité chronique de 14 phtalates pour la daphnie. Les concentrations expérimentales ont été mesurées à des intervalles de 7 jours durant la période d'essai de 21 jours. Bien qu'aucune émulsion de DIOP n'ait été vue à la surface de l'eau, les chercheurs ont constaté que les organismes expérimentaux flottaient à la surface de l'eau à la CMEO de 0,14 mg/L. Une CSEO de 0,062 mg/L a été observée. Rhodes et al. (1995) ont examiné les paramètres les plus sensibles dans les études sur les daphnies et ont constaté que, dans le cas du DIOP, la survie et la reproduction présentaient une sensibilité identique. Ils indiquent que la reproduction constitue souvent le paramètre le plus sensible dans les études de toxicité chronique menées chez la daphnie. Cependant, sur les 14 substances étudiées, la reproduction n'a en aucun cas constitué le paramètre le plus sensible. Les chercheurs ont postulé que cette situation était attribuable au fait que la mortalité était due à des effets physiques. Il semble que l'immobilisation des daphnies constitue le principal mécanisme de toxicité du DIOP et du DIHepP, même à des concentrations voisines du seuil d'hydrosolubilité (0,02 mg/L dans le cas du DIHepP et 0,09 mg/L dans le cas du DIOP [HSDB, 201]).
Le tableau 8-2 présente une synthèse des principales études sur les analogues du BCHP, du CHIBP et du DBzP qui étaient disponibles et qui ont été prises en considération pour déterminer une valeur critique de toxicité dans l'eau. Ces études ont été évaluées et ont été jugées fiables pour établir une valeur critique de toxicité (Environnement Canada, 2015).
| Nom de la substance | Organisme testé | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| BBP | Truite arc-en-ciel (Salmo mykiss) |
CE50, 96 heures | 0,82 | Adams et al., 1995 |
| BBP | Mysis (Mysidopsis bahia) |
CSEO, 28 jours | 0,075 | Étude présentée, 2014c |
| BBP | Daphnie (Daphnia magna) |
CSEO, 21 jours | 0,28 | Rhodes et al., 1995 |
| BBP | Algue verte (Pseudokirchneriella subcapitata) |
CE50, 96 heures | 0,21 | Adams et al., 1995 |
| BBP | Algue verte (Pseudokirchneriella subcapitata) |
CSEO, 96 heures | inférieur(e) à 0,1 | Adams et al., 1995 |
| DPhP | Tête-de-boule (Pimephales promelas) |
CL50, 96 heures | 0,08 | Geiger et al., 1985 |
Modélisation de la toxicité pour les organismes aquatiques
Aucune donnée expérimentale sur la toxicité n'est disponible pour bon nombre de phtalates à chaîne moyenne, de sorte que les évaluations doivent alors se faire par lecture croisée. Le programme QSAR (ECOSAR, 2012) a été exécuté en utilisant les relations structure-activité des esters pour mettre à profit l'ensemble des données probantes disponibles. Certaines projections concernant le CHIBP, le DMCHP, le DIHepP et le BIOP semblent indiquer que ces substances pourraient se révéler non solubles aux concentrations avec effet prévisible après une exposition aiguë. Au terme d'un examen plus approfondi, les concentrations avec effet prévisible se sont révélées n'être supérieures qu'au seuil d'hydrosolubilité du DBzP et du DIHepP. Par conséquent, les concentrations modélisées seront uniquement utilisées pour l'évaluation de la toxicité des autres phtalates à chaîne moyenne. Les intervalles prévus par ECOSAR (2012) (tableau 8-3) concordent avec les données expérimentales, ce qui donne à penser que les phtalates à chaîne moyenne sont hautement à modérément toxiques pour les organismes aquatiques. Une synthèse de l'ensemble des projections est présentée au tableau E-3 de l'annexe E.
| Organisme | Durée (h) | Paramètre | Valeur prévue (mg/L) |
|---|---|---|---|
| Poisson | 96 | CL50 | 0,049-1,48 |
| Daphnie | 48 | CL50 | 0,05-2,2 |
| Algue verte | 96 | CE50 | 0,012-0,72 |
Comme aucune étude importante sur la toxicité du B79P ou du BIOP pour les organismes aquatiques n'a été trouvée, des valeurs obtenues par modélisation ont été utilisées pour déterminer une valeur critique de toxicité dans l'eau. En plus d'ECOSAR (v1.00), les modèles AIEPS (v2.05) et les sous-modèles CPOP d'OASIS (2008) ont été utilisés pour le B79P et le BIOP. Une synthèse des résultats obtenus par modélisation est présentée au tableau 8-4, et l'ensemble des projections figure dans le tableau E-3 de l'annexe E. Il s'est avéré qu'AIEPS (v2.05) - qui tire parti de fragments pour produire des projections - était associé à une bonne couverture structurale dans le cas de la base d'apprentissage (supérieur(e) à70 %), mais que les résultats dépassaient le seuil d'hydrosolubilité dans presque tous les cas. Les projections établies grâce au sous-modèle CPOP d'OASIS (2008) étaient supérieures à celles d'ECOSAR (v1.00) par environ un ordre de grandeur, et dans les deux cas, les algues étaient l'espèce la plus sensible. Ces substances ont été considérées comme ne faisant pas partie du domaine d'applicabilité du sous-modèle CPOP d'OASIS (2008), car leur log Koeétait supérieur à 5. Par conséquent, la CE50 à 96 heures relative aux algues calculée selon les relations structure-activité des esters avec ECOSAR (2012) a été utilisée comme valeur critique pour le B79P et le BIOP (soit 0,012 et 0,032 mg/L, respectivement). Ces valeurs critiques de toxicité obtenues par modélisation sont à moins d'un ordre de grandeur des valeurs critiques de toxicité obtenues expérimentalement pour les autres phtalates à chaîne moyenne (voir le tableau 8-5).
| Substance name | Organisme | Paramètre | Valeur prédite (mg/L) | Référence |
|---|---|---|---|---|
| B79P | Poisson | CL50, 96 h | 0,0045 - 0,763 | ECOSAR, 2012; TOPKAT, 2001; AIEPS, 2003-2007; CPOP, 2008 |
| B79P | Daphnie | CL50, 48 h | 0,05 - 31,11 | ECOSAR, 2012; AIEPS, 2003-2007; CPOP, 2008 |
| B79P | Algue | CE50, 72 et 96 h | 0,012 - 1,36 | ECOSAR, 2012; AIEPS, 2003-2007; CPOP, 2008 |
| BIOP | Poisson | CL50, 96 h | 0,108 - 0,504 | ECOSAR, 2012; AIEPS, 2003-2007; CPOP, 2008 |
| BIOP | Daphnie | CL50, 48 h | 0,122 - 13,89 | ECOSAR, 2012; AIEPS, 2003-2007; CPOP, 2008 |
| BIOP | Algue | CE50, 72 et 96 h | 0,032 - 1,75 | ECOSAR, 2012; AIEPS, 2003-2007; CPOP, 2008 |
Détermination de la concentration sans effet prévisible (CSEP)
Pour calculer la concentration sans effet prévisible (CSEP) des phtalates à chaîne moyenne, la première étape a consisté à évaluer l'acceptabilité des études disponibles et à choisir le paramètre le plus sensible (fiable) comme valeur critique de toxicité (VCT). Cette VCT a ensuite été divisée par un facteur d'évaluation pour tenir compte de la variabilité interspécifique et intraspécifique, des effets à court et à long terme et de l'éventail des espèces visées par l'ensemble de données, de façon à obtenir une CSEP pour chaque substance du sous-groupe des phtalates à chaîne moyenne. Les VCT, les facteurs d'évaluation et les CSEP correspondantes sont présentés au tableau 8-5. Malgré l'incertitude causée par l'éventail limité des espèces visées par l'ensemble de données, par la variabilité interspécifique et intraspécifique et par le fait que l'on ait estimé les effets à long terme par extrapolation en se fondant sur les effets à court terme, un facteur d'évaluation de 30 a été employé pour le DBzP, car l'analogue utilisé pour établir la VCT devrait être plus biodisponible que le DBzP.
| Substance | Organisme | Paramètre | VCT (mg/L) | Référence | FE | CSEP (mg/L) |
|---|---|---|---|---|---|---|
| DCHP | Daphnie (Daphnia magna) |
CSEO, 21 j | 0,181 | ECHA, c2007-2014c | 3 | 0,06 |
| DIBP | Algue verte (Pseudokirchneriella subcapitata) |
CE50, 72 h Biomasse |
0,56 | ECHA, c2007-2014b | 3 | 0,19 |
| BIOP | Algue | CE50, 96 h | 0,032 | ECOSAR, v1.00 | 10 | 0,0032 |
| B79P | Algue | CE50, 96 h | 0,012 | ECOSAR, v1.00 | 10 | 0,0012 |
| BCHPNotes de bas de page Tableau 8-5[a].9 | Mysis (Mysidopsis bahia) |
CSEO, 28 j | 0,075 | Étude présentée, 2014c | 3 | 0,025 |
| DBzPNotes de bas de page Tableau 8-5[b].5 | Tête-de-boule (Pimephales promelas) |
CL50, 96 h | 0,08 | Geiger et al., 1985 | 30 | 0,003 |
| CHIBPa | Mysis (Mysidopsis bahia) |
CSEO, 28 j | 0,075 | Étude présentée, 2014c | 3 | 0,025 |
| DMCHPNotes de bas de page Tableau 8-5[c].2 | Daphnie (Daphnia magna) |
CSEO, 21 j | 0,181 | ECHA, c2007-2014c | 3 | 0,06 |
Les tests standards de toxicité pour les organismes aquatiques n'ont révélé aucun signe de toxicité chimique du DIHepP ou du B84P jusqu'à leur seuil d'hydrosolubilité, bien que des cas de mortalité aient été observés chez les daphnies à des concentrations de 0,14 et 7,5 mg/L, respectivement. En l'absence d'une concentration minimale avec effet nocif observé (CMENO) définitive, il est impossible d'établir une CSEP.
La faible hydrosolubilité (de 0,001 à 0,81 mg/L) et la grande hydrophobicité (log Koe de 6,15 à 6,76) du DIHepP et du B84P donnent à penser que le régime alimentaire pourrait constituer une voie d'exposition plus pertinente que celle du milieu environnant. Pour cette raison, les valeurs des paramètres déterminées en fonction des concentrations dans l'eau pourraient ne pas rendre entièrement compte des effets potentiels des substances. Il est possible de mieux évaluer le potentiel de toxicité des substances absorbées principalement par le régime alimentaire en examinant les résidus d'une substance qui sont présents dans l'organisme entier (concentrations internes). Les résidus corporels critiques (RCC) peuvent être calculés en vue d'estimer la probabilité que la substance atteigne une concentration interne suffisamment élevée pour causer des effets par une narcose de base (McCarty et Mackay, 1993; McCarty et al., 2013).
Les RCC ont été calculés pour le DIHepP et le B84P grâce à l'équation proposée par McCarty et Mackay (1993) :
RCC = FBA × HS / MM
Où :
- RCC =
- Résidus corporels critiques (mmol/kg)
- FBA =
- Facteur de bioaccumulation dans le poisson (L/kg); normalisé à 5 % des lipides corporels
- HS =
- Hydrosolubilité de la substance (mg/L)
- MM =
- Masse moléculaire de la substance (g(g/mol)
Les valeurs utilisées pour les variables de l'équation et les résultats sont présentés dans le tableau 8-5 ci-dessous pour le DIHepP et le B84P. L'utilisation de l'hydrosolubilité maximale dans le calcul des RCC constitue un scénario conservateur, mais réaliste. Aucune donnée expérimentale sur le FBA n'est disponible pour permettre le calcul des RCC associés au B84P. Cependant, une tendance générale a été observée avec les autres phtalates à chaîne moyenne, selon laquelle les estimations du FBA obtenues au moyen de l'approche d'Arnot et Gobas (2003) avec une efficacité d'assimilation alimentaire de 1 % sont inférieures aux valeurs expérimentales. Par conséquent, les RCC ont également été calculés au moyen de l'estimation élevée du FBA obtenue avec le modèle BCFBAF (v3.01) (tableau 8-6).
| Substance | FBA (L/kg) | Hydrosolubilité (mg/L) | Masse moléculaire (g/mol) | RCC (mmol/kg) |
|---|---|---|---|---|
| DIHepP | 115 (poisson; Mackintosh, 2002) |
0,017 (Letinski et al., 2002) |
362,51 | 5,39 × 10-3 |
| DIHepP | 427 (moule; Mackintosh, 2002) |
0,017 (Letinski et al., 2002) |
362,51 | 0,02 |
| B84P | 54 (poisson; Arnot et Gobas, 2003) |
0,81 (Commission européenne, 2000) |
454,57 | 0,1 |
| B84P | 71 (poisson; BCFBAF, v3.01) |
0,81 (Commission européenne, 2000) |
454,57 | 0,13 |
McCarty et Mackay (1993) ont déterminé que les RCC associés à une narcose neutre de base à létalité aiguë chez les petits organismes aquatiques varient généralement de 2 à 8 mmol/kg, alors que ceux se rapportant à une exposition chronique vont de 0,2 à 0,8 mmol/kg. Les RCC calculés pour le DIHepP et le B84P sont inférieurs à ces valeurs, ce qui signifie qu'il est peu probable que les concentrations internes soient suffisamment élevées pour causer des effets sévères ou chroniques par un mode d'action reposant sur une narcose neutre.
Paramètres secondaires chez les organismes aquatiques
Les paramètres secondaires à des niveaux inférieurs d'organisation (à l'échelle moléculaire, biochimique, cellulaire, tissulaire et organique) constituent des mesures utiles pour appuyer l'évaluation du mode d'action toxicologique (Staples et al., 2011). La consultation d'articles scientifiques publiés sur le sujet a permis de constater qu'il n'existe aucune donnée sur des paramètres secondaires qui donnerait à penser que les phtalates à chaîne moyenne auraient des effets sur le système endocrinien des poissons. Des données limitées sont toutefois disponibles sur les effets du DCHP et du DIHepP sur le système thyroïdien des amphibiens, plus précisément sur la capacité de ces substances à altérer les gènes impliqués dans la reproduction et l'homéostasie des hormones thyroïdiennes chez les grenouilles (De Solla et Langlois, 2014; Sugiyama et al., 2005). De nombreux paramètres secondaires ont été établis, par des méthodes in vivo et in vitro, pour le BBP et le DEHP, soit les substances utilisées comme analogues pour certains phtalates à chaîne moyenne (voir le tableau 2-4 pour obtenir un résumé de l'approche de lecture croisée).
Le DCHP et le DIHepP sont étudiés en raison de leur capacité à modifier l'expression génique chez la grenouille Xenopus tropicalis, et en particulier l'expression des gènes impliqués dans la reproduction, l'homéostasie des hormones thyroïdiennes et le stress cellulaire (De Solla et Langlois, 2014). Si le DIHepP n'a pas modifié l'expression des gènes ciblés dans les embryons de grenouille, le DCHP a en revanche altéré l'expression des gènes associés aux stéroïdes sexuels, aux hormones thyroïdiennes et aux axes cellulaires. Le DCHP a augmenté l'expression des gènes liés à la reproduction et aux hormones thyroïdiennes chez les grenouilles exposées à des concentrations variant de 0,3 à 4,1 mg/L. L'altération de l'expression des gènes associés aux stéroïdes sexuels peut avoir des répercussions sur des événements ultérieurs de la vie, comme la différenciation sexuelle et la reproduction, tandis que les effets sur les taux d'hormones thyroïdiennes pourraient retarder le développement des têtards (De Solla et Langlois, 2014). Les données sont présentées au tableau E-4 de l'annexe E.
Sugiyama et al. (2005) ont réalisé des essais in vitro pour évaluer la capacité des phtalates, dont le DCHP, le BBP et le DEHP, à perturber le fonctionnement du système thyroïdien des amphibiens et ont comparé ces résultats avec ceux d'essais in vivo menés sur des têtards. Ils ont constaté que le DCHP était le plus puissant antagoniste de la triiodothyronine (T3), une hormone thyroïdienne, avec une CI50 de 0,43 mg/L, suivi du BBP et du DEHP, avec des CI50 de 12,5 mg/L et de plus de 19,53 mg/L, respectivement. Ils ont également constaté que les phtalates provoquaient une inhibition de l'expression du récepteur nucléaire des hormones thyroïdiennes de type β de l'ordre de 50 % dans le cas du BBP (à une concentration de 1,25 mg/L), de 42 % dans le cas du DCHP (à une concentration de 6,6 mg/L) et de 29 % dans le cas du DEHP (à une concentration de 19,53 mg/L). Un essaiin vivo de cinq jours mené sur des têtards a révélé que seul le BBP provoquait une inhibition de l'ordre de 48 % (à une concentration de 1,25 mg/L) de la hausse du nombre de transcrits du gène codant le récepteur des hormones thyroïdiennes de type β).
Les paramètres secondaires associés au BBP ont été examinés in vivo chez la tête-de-boule (Étude présentée, 2014d; Harries et al., 2000; Christiansen et al., 2000) et in vitro chez la truite arc-en-ciel (Chen et al., 2014; Jobling et al., 1995; Knudsen et Pottinger, 1999; Tollefsen, 2002). Les effets du DEHP sur le système endocrinien ont été amplement étudiés in vivo (Kim et al., 2002; Caunter et al., 2004; Carnevali et al., 2010; Wang et al., 2013; Ye et al., 2014) et in vitro (Sugiyama et al., 2005), bien que bon nombre de ces études aient été réalisées à des concentrations dépassant le seuil d'hydrosolubilité du DEHP.
Chez la truite arc-en-ciel, le BBP a déplacé l'œstradiol (17β-œstradiol) du récepteur des œstrogènes dans le foie (effets observés à 0,3 mg/L, Jobling et al., 1995, et à 51,5 mg/L, Knudsen et Pottinger, 1999) et de la protéine de liaison aux stéroïdes sexuels (à 1 124 mg/L, Tollefsen, 2002). Le BBP a également inhibé la liaison aux récepteurs des œstrogènes chez la grenouille Xenopus laevis dans une mesure de 50 % à une concentration de 7,4 mg/L (Suzuki et al., 2004). Lorsqu'ils se lient aux récepteurs des œstrogènes, les phtalates peuvent altérer la production de vitellogénine chez les espèces aquatiques (Mathieu-Denoncourt et al., 2015). Une étude a permis de constater que le BBP causait une élévation des taux de vitellogénine chez la truite arc-en-ciel après une injection intrapéritonéale (500 mg/kg, Christiansen et al., 2000).
En revanche, aucun changement n'a été remarqué dans d'autres études qui portaient sur la tête-de-boule (0,0675 mg/L, Étude présentée, 2014d; 0,071 mg/L, Harries et al., 2000). À des doses d'injection intrapéritonéale de 50 mg/kg, Knudsen et al. (1998) n'ont observé aucun effet sur l'induction des protéines de la zona radiata chez la truite arc-en-ciel, qui devrait être provoquée à des concentrations d'œstrogènes inférieures à celles qui seraient nécessaires pour entraîner la production de vitellogénine. Dans une étude menée sur des grenouilles mâles adultes du genre Xenopus, la vitellogénine n'a pas augmenté après une exposition à des concentrations de BBP atteignant 31 mg/L (Nomura et al., 2006.
Des effets ont été observés dans le cadre de ce qui semble être un essai nouveau sur l'activité œstrogénique. Chen et al. (2014) ont utilisé des éleuthéro-embryons transgéniques du poisson Oryzias melastigma et le gène rapporteur de la protéine à fluorescence verte pour évaluer l'activité œstrogénique associée au BBP et à d'autres phtalates. À une concentration de 1,5 mg/L, le BBP a provoqué un signal fluorescent dans le foie des éleuthéro-embryons exposés, dont l'intensité se rapprochait de celle du signal observé chez les poissons exposés à une concentration de 0,002 mg/L (2 ppb) de 17β-œstradiol. Chen et al. (2014) en ont conclu que le BBP possède une activité œstrogénique).
Des observations histopathologiques qualitatives ont été réalisées sur des tissus de têtes-de-boule mâles et femelles exposés à du BBP à des concentrations de 0,018 et de 0,067 mg/L (Étude présentée, 2014d). Les seuls effets observés à ces deux concentrations étaient des altérations histologiques dans les gonades, notamment une fréquence et une gravité accrues d'observations anormales relatives aux spermatogonies (de minimes à modérées) dans les testicules des mâles, caractérisées par une impression d'anomalie quant à la proportion de spermatogonies par rapport aux spermatocytes et aux spermatides à un stade donné. Chez les femelles, une fréquence légèrement accrue des cas d'atrésie ovocytaire (de minime à grave) a été observée. Au sein du groupe exposé à la concentration élevée, une altération des scores relatifs au stade des gonades a été constatée tant chez les mâles que chez les femelles (Étude présentée, 2014d).
Mankidy et al. (2013) ont étudié les mécanismes d'action moléculaires du BBP et du DEHP en évaluant les modifications transcriptionnelles observables lors du développement d'embryons de têtes-de-boule exposés à ces phtalates jusqu'à 96 heures après la fertilisation. Les concentrations utilisées dans le cadre des essais étaient supérieures au seuil d'hydrosolubilité du DEHP. L'exposition à une concentration de 1 mg/L de BBP et de 1 mg/L de DEHP a entraîné une peroxydation deux fois plus importante des lipides dans les membranes des embryons en développement. Aucun des phtalates n'a modifié l'expression de l'ARNm des récepteurs des œstrogènes (de type α ou β). Cependant, le BBP a causé une augmentation faible, mais statistiquement significative, de l'expression de l'ARNm des récepteurs des androgènes chez des embryons de poissons en développement à une concentration de 1 mg/L, tandis que le DEHP n'a entraîné qu'une légère augmentation de l'expression de l'ARNm des récepteurs des androgènes à la même concentration).
Des tests d'embryotoxicité chez la tête-de-boule ont montré que le DEHP était plus puissant que le BBP, provoquant un taux de mortalité de 30 % à une concentration de 1 mg/L. Étant donné la hausse importante du nombre de produits de la peroxydation des lipides observée dans les membranes des embryons en développement exposés au DEHP, et vu l'absence de régulation positive de l'expression de l'ARNm des enzymes contribuant à atténuer le stress oxydatif, les auteurs ont conclu que le stress oxydatif constituait le mécanisme critique de toxicité de cette substance (Mankidy et al., 2013).
Le DEHP a augmenté la production de vitellogénine chez le poisson zèbre (effet observé à 5 000 mg/kg par Uren-Webster et al., 2010, et à 2 × 10-5 mg/L par Carnevali et al., 2010), chez Gobiocypris rarus(à 0,0128 mg/L chez les femelles et à 0,0394 mg/L chez les mâles, selon Wang et al., 2013) et chez Oryzias melastigma (à 0,1 mg/L, selon Ye et al., 2013). Dans une étude menée sur de jeunes saumons de l'Atlantique, aucune concentration de vitellogénine n'a été décelée dans le plasma sanguin après une injection intrapéritonéale de 160 mg/kg de DEHP (Norrgren et al., 1999). Aucune augmentation statistiquement significative des concentrations de vitellogénine n'a été constatée chez les têtes-de-boule mâles exposées au DEHP dans l'eau (0,005 mg/L) ou par l'alimentation (125 ou 500 mg/kg); une hausse a toutefois été enregistrée chez les femelles à la dose élevée (ECHA, c2007-2014f).
Plusieurs articles font état d'une augmentation des concentrations d'hormones sexuelles chez les poissons après une exposition au DEHP. Chez les poissons mâles, une hausse des concentrations de testostérone a été notée après une exposition à 0,039 mg/L de DEHP (Wang et al., 2013), et une augmentation statistiquement significative des concentrations de 17β-œstradiol a été observée après une exposition à 0,039 et 0,1 mg/L de DEHP (Wang et al., 2013; Ye et al., 2013). Aucune modification importante des concentrations de testostérone n'a été observée chez les poissons mâles dans deux études (à des concentrations de 0,5 mg/L de DEHP, selon Ye et al., 2013, et de 0,012 mg/L de DEHP, selon Crago et Klaper, 2012). Crago et Klaper (2012) ont remarqué une diminution importante des concentrations plasmatiques de 17β-œstradiol après une exposition à 0,012 mg/L de DEHP. Chez les poissons femelles, les concentrations de testostérone ont augmenté après une exposition à 0,1 mg/L de DEHP (Wang et al., 2013; Ye et al., 2013), tandis que les concentrations de 17β-œstradiol ont diminué selon Wang et al. (2013) après une exposition à 0,013 mg/L et augmenté selon Ye et al. (2013) après une exposition à 0,1 mg/L. Dans tous les cas, les concentrations auxquelles les organismes étaient exposés étaient supérieures au seuil d'hydrosolubilité du DEHP.
L'indice gonado-somatique (IGS) est généralement employé à titre de marqueur biologique chez la faune aquatique pour évaluer l'exposition aux œstrogènes environnementaux (Wang et al., 2013). L'IGS du DEHP a été calculé par plusieurs auteurs, qui ont obtenu des résultats variés. Une hausse de l'IGS a été constatée chez des poissons mâles de l'espèce Gobiocypris rarus exposés à 0,118 mg/L de DEHP (Wang et al., 2013) et chez des femelles exposées à 2 × 10-5 mg/L et 0,118 mg/L de DEHP (Carnevali et al., 2010; Wang et al., 2013). Une baisse de l'IGS a été observée chez des poissons femelles de l'espèce Oryzias latipes après une exposition à 0,01 et 0,05 mg/L (Kim et al., 2002), alors qu'aucun effet n'a été noté chez les mâles à 0,012 et 0,05 mg/L (Crago et Klaper, 2012; Kim et al., 2002). Une forte augmentation de l'indice hépato-somatique (IHS) a été observée chez des poissons mâles de l'espèce Gobiocypris rarus après une exposition à 0,013 mg/L, mais aucune différence n'a été constatée chez les femelles (Wang et al., 2013). Uren-Webster et al. (2010) ont aussi remarqué une augmentation de l'IHS chez le poisson zèbre mâle exposé à 5 000 mg/kg de DEHP par injection intrapéritonéale).
Des travaux font également état de modifications histologiques après une exposition au DEHP. L'exposition du poisson Oryzias melastigma à 0,1 et 0,5 mg/L de DEHP a entraîné une diminution du nombre de spermatozoïdes dans les testicules et une augmentation du nombre de follicules atrétiques dans les ovaires (Ye et al., 2013). Un retard dans le développement des ovocytes a été constaté chez les femelles de l'espèce Oryzias latipes, des ovocytes matures ayant été décelés dans les ovaires de 37 %, 0 % et 22 % des femelles exposées à des concentrations de 0,001, 0,01 et 0,05 mg/L, respectivement, comparativement à 54 % des femelles du groupe témoin. Aucune altération de la forme des testicules n'a été remarquée chez les mâles (Kim et al., 2002). L'examen histologique des gonades de saumons de l'Atlantique exposés à 1 500 mg/kg de DEHP par voie alimentaire a révélé une hausse faible quoique statistiquement significative (3 %) de poissons intersexués, mais aucun renversement de sexe complet, de sorte que le ratio entre les sexes était asymétrique (Norman et al., 2007). Uren-Webster et al. (2010) n'ont constaté aucune lésion à l'ADN spermatique chez les poissons zèbres mâles après une exposition à 0,5, 50 et 5 000 mg/kg de DEHP par injection intrapéritonéale, mais il y avait une diminution de la proportion de spermatozoïdes et une augmentation de la proportion de spermatocytes à 50 mg/kg.
Staples et al. (2011) ont tenté de déterminer si les paramètres primaires à l'échelle de l'organisme entier et de la population intégraient les paramètres secondaires associés aux esters phtaliques en comparant les paramètres primaires et secondaires mesurés dans les études. Ils ont constaté que les CSEO primaires et secondaires associées aux esters phtaliques de faible masse moléculaire (C1 à C4) n'avaient pas des plages de valeurs concordantes et ont conclu que les paramètres secondaires offraient peu d'avantages pour ce qui est de l'évaluation pratique des risques écologiques concernant les espèces aquatiques. Cependant, le nombre de paramètres secondaires disponibles pour établir des comparaisons avec les paramètres primaires était plutôt limité. Aucune analyse des phtalates à chaîne moyenne de C5 à C7 n'a été fournie. Il n'a pas été possible de réaliser une comparaison entre les paramètres primaires et secondaires associés au DEHP, car Staples et al. (2011) ont indiqué que cette substance ne semble pas avoir d'effets négatifs sur les paramètres primaires ou secondaires qui concorderaient avec des contraintes relatives à la solubilité. En effet, bon nombre des études portant sur le DEHP ont été réalisées à des concentrations supérieures au seuil d'hydrosolubilité. Cependant, deux études récentes qui portaient sur les paramètres primaires ou secondaires ont été menées sous le seuil d'hydrosolubilité du DEHP. Carnevali et al.(2010) ont constaté une diminution importante de la fécondité chez les poissons zèbres femelles exposés à des concentrations nominales de DEHP allant de 2 × 10-5 à 0,40 mg/L. En mesurant plusieurs régulateurs clés de la maturation des ovocytes et de l'ovulation, ils ont conclu que le DEHP avait une incidence sur les signaux jouant un rôle dans la croissance et la maturation des ovocytes et dans l'ovulation, ce qui perturbe les fonctions ovariennes et empêche la production d'embryons. De plus, Corradetti et al. (2013) ont noté que l'exposition à 2 × 10-4 mg/L de DEHP altérait la capacité de reproduction du poisson zèbre en provoquant un arrêt de la mitose durant la spermatogenèse, ce qui augmente la fragmentation de l'ADN dans les spermatozoïdes et réduit la production d'embryons (jusqu'à 90 %).
Les données sur les mammifères évoquent toutefois un mode d'action reposant sur l'insuffisance androgénique, point qui sera abordé en détail à la section 9.2 (Effets sur la santé). Ce mode d'action n'a pas été étudié chez les organismes aquatiques dans le cas des phtalates à chaîne moyenne et de l'analogue BBP, ce qui constitue une lacune dans les données. Toutefois, une étude multigénérationnelle sur le BBP et le poisson tête-de-boule n'a révélé aucun effet sur les embryons au deuxième stade de développement (Étude présentée, 2014d). Les données portant sur l'analogue DEHP évoquent un mode d'action œstrogénique (Norrgren et al., 1999; Norman et al., 2007; Carnevali et al., 2010; Corradetti et al., 2013), alors que d'autres données indiquent que le mode d'action antiandrogène observé chez les mammifères serait également en cause chez les espèces aquatiques (Wang et al., 2013; Ye et al., 2014).
Toxicité des métabolites des esters phtaliques pour les organismes aquatiques
Étant donné la dégradation rapide des esters phtaliques à chaîne moyenne en monoesters et en acide phtalique, les chercheurs se sont intéressés à la toxicité de ces produits de dégradation pour les organismes aquatiques. Bien que les métabolites des phtalates à chaîne moyenne n'aient pas tous été étudiés, Scholz (2003) a constaté que les monoesters à chaîne courte étaient considérablement moins toxiques pour les organismes aquatiques que les diesters à chaîne courte. Des essais portant sur la toxicité aiguë de l'hydrogénophtalate d'isobutyle - produit de la dégradation du DIBP - ont révélé des CL50 de 125 mg/L chez le poisson et de 141 mg/L chez la daphnie (Scholz 2003). Jonsson et Baun (2003) ont évalué la toxicité de l'analogue BBP et de son métabolite, l'hydrogénophtalate de benzyle (MBzP), pour les algues et les daphnies. Ils ont remarqué que les monoesters sont plus hydrosolubles, plus hydrophiles et moins volatils dans des solutions aqueuses que les diesters correspondants. Dans un essai de toxicité de 72 heures mené sur des algues, les chercheurs ont constaté que la CE50 du BBP était de 0,96 mg/L, valeur qui concorde avec les données trouvées dans la littérature, que la CE50 du MBzP, produit de la dégradation du BBP, était de 28,6 mg/L, et que la CE50 de l'acide phtalique était de 2 270 mg/L. De façon similaire, un essai de 48 heures mené sur des daphnies a révélé une CE50 de 2,43 mg/L pour le BBP, une CE50 supérieure à 274 mg/L pour le MBzP et une CE50 de 103 mg/L pour l'acide phtalique. La tendance selon laquelle les diesters présentent une plus grande toxicité que les monoesters a été observée avec tous les diesters et les monoesters correspondants. Les diesters devraient donc constituer une source de préoccupation majeure dans le milieu aquatique.
8.1.2 Sédiments
Aucune donnée publiée sur la toxicité des phtalates à chaîne moyenne pour les organismes vivant dans les sédiments n'a été trouvée. Deux études portant sur la toxicité du DBP et du DEHP (deux esters phtaliques dont les chaînes comptent moins de six carbones) pour les organismes vivant dans les sédiments ont été trouvées (Call et al., 2001b; Brown et al., 1996).
Selon Call et al. (2001b), des essais antérieurs portant sur l'exposition d'invertébrés benthiques à d'autres substances chimiques ont révélé que ces organismes présentaient une sensibilité semblable à celle des invertébrés pélagiques et planctoniques, et il est possible, en se fondant sur la théorie du partage à l'équilibre, d'utiliser les données des essais effectués dans de l'eau seulement pour prédire les effets des phtalates dans des essais en laboratoire menés avec des sédiments enrichis. Call et al. (2001b) ont effectué des essais sur la toxicité du DBP (l'isomère à chaîne non ramifiée du DIBP) pour les organismes vivant dans les sédiments afin de comparer les résultats aux projections de toxicité obtenues au moyen de la théorie du partage à l'équilibre. Les concentrations mesurées dans les eaux surjacentes étaient grandement inférieures aux concentrations mesurées dans les eaux interstitielles et devraient donc avoir un effet négligeable sur la détermination de la CL50. Les données empiriques sur la toxicité pour les organismes vivant dans les sédiments ont montré que l'exposition au DBP se traduit par une réduction de la survie et du poids de C. tentans à toutes les concentrations de carbone organique dans les sédiments, la CL50 à 10 jours allant de 826 à 4 730 mg/kg ps. H. azteca s'est révélée moins sensible, avec une CL50 supérieure à la concentration d'exposition la plus élevée de 71 900 mg/kg ps, possiblement en raison d'une migration vers les eaux surjacentes pour éviter les concentrations élevées présentes dans les sédiments (Call et al., 2001b). Call et al. (2001b) ont appliqué la théorie du partage à l'équilibre aux valeurs de toxicité aqueuse du DBP tirées de leur étude précédente (Call et al., 2001a) afin de prédire la toxicité aiguë de la substance dans le cadre d'essais en laboratoire effectués avec des sédiments enrichis. Ils ont constaté que cette théorie permettait de prédire avec exactitude la toxicité aiguë des esters phtaliques pour les invertébrés benthiques vivant dans les sédiments lorsque les concentrations sont stables dans les sédiments et les eaux interstitielles et lorsque le comportement des organismes est tel qu'il entraîne une exposition continue. Call et al.(2001a) ont calculé la CL50 aqueuse du BBP. Étant donné que la toxicité aqueuse et le log Kco du DBP et du BBP sont semblables dans l'étude de Call et al. (2001a), la CL50 du BBP pour les organismes vivant dans les sédiments devrait aussi être de l'ordre de 826 à 4 730 mg/kg ps. En ce qui concerne l'analogue DEHP, aucun effet négatif sur la survie ou la croissance en fonction du poids sec n'a été observé à des concentrations de 0,273 à 0,382 mg/L dans les eaux interstitielles ou de 3 070 à 3 170 mg/kg ps dans la masse des sédiments.
Brown et al. (1996) ont étudié la toxicité du DEHP et du DIDP sur Chironomus riparius à des concentrations de 100, 1 000 et 10 000 mg/kg ps sur une période de 28 jours. Les concentrations expérimentales ont été mesurées au début et à la fin de l'étude et concordaient avec les concentrations nominales. À la lumière des résultats liés à l'émergence et à la distribution des sexes, les auteurs ont conclu que ces phtalates n'avaient aucun effet sur la survie, le développement ou l'émergence de C. riparius aux concentrations expérimentales. Les chercheurs ont aussi déterminé la concentration tissulaire de ces substances chez les moucherons en mesurant l'activité du carbone 14C. Ils ont constaté que la charge corporelle était assez importante (de 70 à 14 000 mg/kg) et qu'il ne semblait y avoir aucune incidence sur la santé des moucherons.
La saturation maximale des phtalates dans les sédiments peut être déterminée au moyen de la relation suivante :
Cs = Ceau × Kco × fco
où :
- C s =
- saturation maximale de la substance dans les sédiments (mg/kg ps)
- C eau =
- hydrosolubilité de la substance (mg/L)
- K co =
- coefficient de partage carbone organique-eau de la substance (L/kg CO)
- f co =
- fraction de carbone organique dans les sédiments (kg OC/kg)
La saturation maximale constitue la saturation thermodynamique maximale théorique d'un composé dans un milieu donné, à l'équilibre. Selon les principes de la thermodynamique, ce maximum ne peut être dépassé. La présence de cosolvants ou de surfactants dans les eaux de surface peut créer des conditions telles qu'il devient possible d'observer une solubilité en apparence supérieure à la solubilité maximale. Dans les phases solides comme les sédiments et le sol, la saturation maximale est fonction directe de la quantité de carbone organique présente dans la matrice, si l'on considère qu'il n'y a que des interactions hydrophobes avec la matière organique. Or, la teneur en carbone organique des sédiments peut varier d'un lieu à l'autre, alors on utilise souvent une teneur moyenne pour calculer la saturation maximale dans les sédiments. La solubilité apparente dans l'eau et la saturation dans les sédiments ou le sol peuvent entraîner une augmentation ou une diminution de la biodisponibilité d'un composé. Les valeurs calculées au moyen de l'équation présentée ci-dessus représentent par conséquent une limite de saturation théorique qui, aux fins de la biodisponibilité, peut être dépassée dans certaines circonstances. À titre d'exemple, il est difficile d'affirmer avec certitude que la saturation maximale théorique dans les phases solides est uniquement fonction des interactions hydrophobes. De telles circonstances sont difficiles à prédire sans information précise sur la nature des déversements et les caractéristiques du milieu récepteur. Étant donné la très grande hydrophobicité des phtalates à chaîne longue, il est probable que les interactions hydrophobes constituent le principal facteur ayant une incidence sur la saturation maximale.
Les données sur la saturation maximale des phtalates à chaîne moyenne sont présentées au tableau 8-7. Elles ont été établies en fonction d'un fco théorique de 0,04 (valeur par défaut pour la teneur moyenne en CO des milieux sédimentaires au Canada).
| Substance | Ceau (mg/L) | Kco (L/kg OC) | Cs calculée (mg/kg dw) |
|---|---|---|---|
| DIBP | 20,3 | 977 | 793,52 |
| BCHP | 3,76 | 4 898 | 736,63 |
| CHIBP | 4,82 | 4 266 | 822,45 |
| DCHP | 0,2 | 6 166 | 49,33 |
| DBzP | 0.51 | 13 490 | 275,19 |
| BIOP | 0.22 | 45 709 | 402.24 |
| B79P | 0,3 | 15 849 | 190,19 |
| DMCHP | 0,275 | 40 738 | 448,12 |
| DIHepP | 0,017 | 48 978 | 33,30 |
| B84P | 0,81 | 239 883 | 7 772,22 |
Calcul de la concentration sans effet prévisible (CSEP)
Il existe d'importantes lacunes en ce qui concerne les données sur la toxicité des phtalates à chaîne moyenne pour les organismes vivant dans les sédiments. À la lumière des données disponibles, la CL50 à 10 jours de 1 664 mg/kg ps pour C. tentans a été choisie comme VCT prudente, en fonction des effets du DBP (utilisé aux fins de la lecture croisée pour le DIBP et le BBP) dans les sédiments avec une teneur en carbone organique de 4,8 %. Cette VCT a ensuite été divisée par un facteur d'évaluation de 100 pour tenir compte de la variabilité interspécifique et intraspécifique et pour extrapoler les effets à long terme, de façon à obtenir une CSEP de 16,64 mg/kg ps. Cette CSEP, qui s'applique au DIBP et aux analogues BBP, BCHP, CHIBP et DBzP, est inférieure à la saturation maximale dans les sédiments ayant été calculée pour chacune des substances figurant au tableau 8-7. Étant donné qu'aucun effet n'a été observé dans les essais de toxicité pour les organismes vivant dans les sédiments réalisés avec du DEHP, il est impossible de calculer une CSEP pour le DIHepP. Le FABS de 0,526 kg CO/kg de lipides associé au DIHepP chez le chabot armé (Mackintosh, 2002) peut être utilisé dans une analyse des RCC pour déterminer le risque d'effets négatifs.
Application de la relation des RCC au DIHepP dans les sédiments :
RCC = FABS × Ss / MM
où :
- RCC =
- Résidus corporels critiques (mmol/kg)
- FABS =
- Facteur d'accumulation biote-sédiments (kg/kg); normalisé à 5 % des lipides corporels
- SS =
- Limite de saturation de la substance dans les sédiments (mg/kg)
- MM =
- Masse moléculaire de la substance (g/mol)
Les données d'entrée de l'équation étaient les suivantes : FABS de 0,526 kg/kg (chabot armé [Mackintosh, 2002]; voir le tableau D-3 de l'annexe D); limite de saturation du DIHepP dans les sédiments de 33,3 mg/kg (en supposant une teneur en CO de 4 % selon la moyenne observée dans les milieux sédimentaires au Canada; voir le tableau 8-7); masse moléculaire de 362,51 g/mol (tableau 2-1).
L'utilisation de la saturation maximale dans le calcul des RCC est une décision prudente, mais réaliste.
Selon ces données d'entrée, les RCC sont de 0,05 mmol/kg, ce qui donne à penser que la concentration du DIHepP dans les tissus des organismes vivant dans les sédiments demeurera inférieure à la concentration qui devrait entraîner des effets aigus ou chroniques associés à une narcose de base.
Il est possible de calculer la CSEP pour le DCHP, le DMCHP, le BIOP et le B79P dans les sédiments par la méthode du partage à l'équilibre (Redman et al., 2014), en multipliant la CSEP en milieu aquatique (CSEPaqu) par le Kco des substances et en utilisant une valeur par défaut pour la teneur des sédiments en carbone organique afin de présenter les valeurs en fonction du poids sec. Selon l'équation de Call et al. (2001b) :
Cs/fco = Kco × Cd
où :
Cs = concentration dans la masse des sédiments (mg/kg ps)
fco = fraction de carbone organique dans les sédiments (kg CO/kg ps)
Kco = coefficient de partage carbone organique-eau dans les sédiments (L/kg CO)
Cd = concentration dissoute libre (mg/L)
Une teneur en carbone organique de 4 % a été supposée pour les besoins du calcul. Les CSEP calculées pour les sédiments (CSEPs) varient entre 0,76 et 97,8 mg/kg ps, comme le montre le tableau 8-8. Toutes ces valeurs sont inférieures à la saturation maximale dans les sédiments présentée au tableau 8-7.
| Substance | Kco (L/kg CO) | Cd (mg/L) (tirée de la CSEPaqu) |
Cs calculée (mg/kg ps) (CSEPs) |
|---|---|---|---|
| DCHP | 6 166 | 0,06 | 14,8 |
| BIOP | 45 709 | 0,0032 | 5,85 |
| B79P | 15 849 | 0,0012 | 0,76 |
| DMCHP | 40 738 | 0,06 | 97,8 |
Il s'est avéré impossible de déterminer une CSEP pour le B84P, car aucune étude sur les organismes vivant dans les sédiments n'avait été menée et aucune CSEP en milieu aquatique ne pouvait être calculée. En outre, aucun FABS n'a été signalé pour le B84P, de sorte qu'aucune analyse des RCC n'a pu être effectuée.
8.1.3 Sol
Aucune donnée publiée sur la toxicité des phtalates à chaîne moyenne dans les sols n'a été trouvée; seul le résumé d'une étude portant sur l'analogue BBP était disponible.
Le résumé d'une étude non publiée conforme à la ligne directrice 207 de l'OCDE fait état de l'exposition de vers de terre de l'espèce Eisenia foetida à des concentrations nominales de 95 à 1 000 mg/kg ps de BBP dans un sol artificiel. Le poids et la survie des vers ont été consignés après 7 et 14 jours. Après 14 jours, aucun effet n'était observé à la concentration la plus élevée (1 000 mg/kg ps). Aucune différence importante de poids n'a été constatée entre le groupe exposé à la substance et le groupe témoin (ECHA c2007-2013).
Étant donné qu'aucune donnée ni aucun effet n'est mentionné dans le résumé de l'étude, il est impossible de calculer une CSEP en ce qui concerne le sol.
8.2 Exposition écologique
8.2.1 Concentrations mesurées dans l'environnement et les eaux usées
L'examen des concentrations d'esters phtaliques à chaîne moyenne mesurées dans l'environnement tient compte de plusieurs milieux, notamment l'air, l'eau, les sédiments, le sol et le biote. Des données mesurées sont disponibles principalement pour le DIBP et, dans une moindre mesure, pour le DCHP et le DIHepP dans l'eau, les sédiments et le biote au sein de zones urbaines (Environnement Canada, 2015). Aucune donnée n'est disponible concernant les concentrations environnementales de B79P et de B84P, soit les deux phtalates à chaîne moyenne les plus commercialisés au Canada. De plus, il n'existe aucune donnée sur les concentrations mesurées des phtalates à chaîne moyenne non commercialisés (CHIBP, DMCHP, BIOP, DBzP et BCHP).
Des concentrations de fond d'esters phtaliques sont fréquemment détectées dans l'air des laboratoires, dans l'équipement d'échantillonnage et d'analyse et dans les réactifs (McConnell, 2007). Pour garantir que les données environnementales sur les esters phtaliques seront acceptables, exactes et de grande qualité, il est indispensable de réduire et de déterminer la contamination de fond des échantillons et de nettoyer adéquatement l'équipement employé sur le terrain (Lin et al., 2003).
Concentrations mesurées dans l'air
Aucune donnée de surveillance des concentrations de phtalates à chaîne moyenne mesurées dans l'air n'a été trouvée au Canada. Des concentrations de DIBP et de DCHP ont été détectées dans l'air extérieur un peu partout dans le monde (Environnement Canada, 2015). Rudel et al. (2010) ont mesuré des concentrations de DIBP allant de 1,4 à 18 ng/m3 dans plus de 90 % des échantillons d'air qu'ils ont recueillis. Des concentrations plus faibles ont été détectées en Suède, la concentration maximale dans l'air atteignant 2,6 ng/m3à proximité de sites industriels (Cousins et al., 2007). Des concentrations allant de 0,096 à 0,549 ng/m3 ont aussi été mesurées dans la région arctique de la Norvège (Xie et al., 2007). Le DCHP a fait l'objet d'une surveillance dans des sites industriels et des régions rurales de la Californie, et aucune concentration n'a été détectée dans la plupart des échantillons prélevés (seuil de détection de 1 ng/m3) (Rudel et al., 2010).
Concentrations mesurées dans l'eau
Diverses concentrations de phtalates à chaîne moyenne ont été mesurées dans les eaux de surface au Canada (Environnement Canada, 2015). Des données portant principalement sur le DIBP étaient disponibles pour les eaux de surface de l'Alberta et de la Colombie-Britannique. Des concentrations moyennes de DIBP d'environ 5 ng/L ont été détectées dans des zones urbanisées, comme à False Creek Harbour, en Colombie-Britannique (McConnell, 2007; Mackintosh et al., 2006), bien que ces concentrations soient près des seuils de détection (6,4-7,9 ng/L). Sosiak et Hebben (2005) ont mesuré des concentrations médianes de 2,85 ng/L en aval d'usines de traitement des eaux usées en Alberta en employant des seuils de détection allant de 0,01 à 5,7 ng/L. Des concentrations plus élevées de DIHepP, allant de 2,91 à 153 ng/L (moyenne de 21,1 ng/L), ont été détectées à False Creek Harbour (Mackintosh et al., 2006).
Les concentrations de DIBP mesurées en milieu urbain dans d'autres pays sont supérieures à celles observées au Canada (Environnement Canada, 2015). Les concentrations médianes atteignaient 56 ng/L au début des années 1990 en Allemagne et 430 ng/L en 2005 en Chine (Furtman, 1994; Zeng, 2008).
Des données sur les concentrations de DCHP mesurées dans l'environnement sont disponibles seulement pour des pays autres que le Canada. Dans une étude de surveillance réalisée aux Pays-Bas, des concentrations médianes de 8 ng/L ont été détectées dans les eaux de surface, et des concentrations médianes légèrement supérieures à 15 ng/L ont été mesurées dans les effluents d'eaux usées (Vethaak et al., 2005). Le DCHP a aussi été détecté en Allemagne et en Chine, à des concentrations médianes inférieures à 0,03 et 76 ng/L, respectivement (Furtman, 1994; Zeng, 2008). Étant donné que les concentrations de DIBP étaient beaucoup plus élevées en Chine qu'au Canada, les concentrations de DCHP devraient être beaucoup moins élevées au Canada qu'en Chine.
Des produits de la dégradation du DIBP et du DIHepP ont été mesurés par Sosiak et Hebben (2005) dans les effluents d'une usine de traitement des eaux usées et dans les plans d'eau récepteurs en Alberta. Ni l'hydrogénophtalate d'isobutyle ni des monoesters formés à partir d'isomères à 7 carbones n'ont été détectés. Ce résultat concordait avec des observations réalisées au Japon, selon lesquelles le MIBP n'a pas été détecté dans le fleuve Tama (seuil de détection de 12 ng/L) (Suzuki et al., 2001). Blair et al. (2009) ont mesuré la concentration du mélange isomérique de phtalate de mono-iso-heptyle à False Creek Harbour, et les valeurs mesurées variaient de 2,71 à 6,61 ng/L dans les dix échantillons prélevés.
Des concentrations de BBP et de DBP allant de inférieur(e) à 0,02 à 1,3 µg/g ont été mesurées dans des biosolides à Vancouver, en Colombie-Britannique (Bright et Healy, 2003). Aucune donnée de surveillance concernant les biosolides n'était disponible pour les phtalates à chaîne moyenne.
Concentrations mesurées dans les sédiments
Des concentrations moyennes de DIBP et de DIHepP allant de 4 à 5,6 ng/g ps et de 27 à 60,8 ng/g, respectivement, ont été détectées dans les sédiments à False Creek Harbour (Mackintosh et al., 2006; McConnell, 2007). Le DIHepP est connu pour être l'objet d'une utilisation commerciale beaucoup moins grande que le DIBP (Environnement Canada, 2014). Ses concentrations supérieures dans les sédiments pourraient par conséquent être attribuables à sa nature plus hydrophobe. Mackintosh et al. (2006) ont constaté que les concentrations de phtalates étaient beaucoup moins élevées dans les sédiments de fond que dans les sédiments en suspension. Par exemple, la concentration du DIBP était de 1 190 ng/g ps dans les sédiments en suspension, alors qu'elle était de 4 ng/g ps dans les sédiments de fond. Du DIBP a été détecté dans des régions plus éloignées de la baie d'Hudson, mais à des concentrations moyennes inférieures (0,22 ng/g) (Morin, 2003). Une liste complète des concentrations mesurées dans les sédiments est présentée dans le document produit par Environnement Canada (2015).
Les concentrations maximales mesurées aux Pays-Bas atteignaient 11 ng/g, mais la concentration mesurée dans la plupart des échantillons était inférieure au seuil de détection de 2 ng/g (Vethaak et al., 2005).
Concentrations mesurées dans le sol
Aucune donnée de surveillance des concentrations de phtalates à chaîne moyenne dans le sol n'a été trouvée au Canada. Des concentrations de DIBP et de DCHP ont été détectées dans le sol à certains endroits en Chine (Environnement Canada, 2015). Des concentrations de DIBP allant de 40 à 1 420 ng/g ont été détectées dans des zones résidentielles en Chine (Zeng et al., 2009; Hongjun et al., 2013). Les concentrations de DCHP dans le sol de zones résidentielles étaient inférieures, soit d'environ 71 ng/g, et il y avait davantage d'échantillons présentant des concentrations inférieures au seuil de détection (Zeng et al., 2009). Selon les tendances observées en comparant les échantillons d'eau et de sédiments recueillis au Canada et en Chine, les concentrations mesurées dans le sol au Canada devraient aussi être inférieures.
Concentrations mesurées dans le biote
Un ensemble d'études portant sur la distribution des esters phtaliques de dialkyle en milieu marin ont été menées à False Creek Harbour. Le ministère de l'Environnement a compilé les concentrations selon le poids lipidique détectées dans le biote à False Creek Harbour et les a présentées dans un document rédigé en 2015 (Environnement Canada, 2015). L'analyse des échantillons recueillis en 1999 et en 2005 révèle que le DIBP est présent à au moins quatre niveaux de la chaîne alimentaire aquatique, soit chez les algues, chez les bivalves, chez les poissons et chez un oiseau (la macreuse à front blanc) (Mackintosh et al., 2004; McConnell, 2007). Les plus fortes concentrations ont été détectées chez les bivalves (32,4-160 ng/g pl) et les poissons (7-162 ng/g pl). S'il est vrai que le DIBP et d'autres phtalates à chaîne moyenne devraient être métabolisés par les organismes aquatiques, le fait que l'on ait décelé ces substances dans le biote pourrait être dû à une exposition continue dans ces régions urbaines.
Des concentrations de DIBP ont été trouvées chez la morue polaire et le béluga dans le cadre d'une étude réalisée dans la baie d'Hudson. Morin (2003) a comparé les concentrations mesurées chez des poissons dans l'Arctique avec celles observées par Mackintosh et al. (2004) dans des zones urbaines. Les comparaisons ont été effectuées entre le chabot armé (Leptocottus armatus) et la morue polaire, ces poissons se trouvant à un niveau trophique semblable. Mackintosh et al. (2004) ont mesuré une concentration d'environ 145 ng/g pl de DIBP dans le chabot armé à False Creek Harbour, et Morin (2003) a mesuré une concentration significativement plus élevée sur le plan statistique (p < 0,05) de 413 ng/g pl dans l'Arctique. Selon Morin, le DIBP est le seul phtalate qui était associé à une telle augmentation dans l'Arctique. Les concentrations médianes chez le béluga étaient supérieures, soit environ 544 ng/g pl.
Les phtalates à chaîne moyenne ne devraient pas être transportés sur de longues distances, comme indiqué à la section 7.1.1. Les fortes concentrations de DIBP mesurées dans le biote en Arctique sont donc surprenantes. La faible concentration (0,22 ng/g) mesurée dans les sédiments en Arctique (Morin, 2003) et les concentrations supérieures (27-60,8 ng/g) mesurées à False Creek Harbour (Mackintosh et al., 2006 et McConnell 2007) concordent avec les prédictions relatives au transport sur de longues distances. Les concentrations de DIBP dans l'eau n'ont pas été mesurées dans l'Arctique, mais selon Morin (2003), les données montrent que les esters phtaliques sont transportés vers le nord depuis des latitudes médianes, car les concentrations trouvées dans les différents écosystèmes sont semblables et les émissions provenant de sources situées dans l'Arctique (p. ex. des sites d'enfouissement de petite envergure) devraient être minimes. Les données ne permettent toutefois pas de déterminer la source de cette exposition. Comme les sources de DIBP dans l'Arctique devraient être minimes, il est possible que la morue polaire et le béluga aient été exposés à cette substance dans une autre région pendant leur migration. Morin (2003) décrit les bélugas vivant dans l'Est de la baie d'Hudson comme des résidents permanents du Nord. Ils quittent l'Est de la baie d'Hudson à l'automne et vont jusque dans la baie d'Ungava, et même jusqu'à Nain, à Terre-Neuve-et-Labrador, en hiver (COSEPAC, 2004). Autre source d'exposition possible, certaines proies des bélugas pourraient avoir été exposées au DIBP pendant leur migration. Aucune information sur le comportement migratoire de la morue polaire n'a été trouvée dans la littérature.
D'autres explications sont possibles pour les fortes concentrations mesurées dans le biote arctique, comme une contamination lors de la collecte des échantillons ou lors de l'analyse en laboratoire. Cela est toutefois peu probable, car des précautions ont été prises pour réduire le risque de contamination. L'étude menée dans l'Arctique a été réalisée par le même groupe de recherche de l'Université Simon Fraser qui était responsable des études menées à False Creek Harbour citées par McConnell (2007) et Mackintosh et al.(2004).
Les données présentées par Morin (2003) sont les seules sur les concentrations de phtalates à chaîne moyenne dans le biote arctique à avoir été publiées dans la littérature. D'autres travaux sont nécessaires dans ce domaine afin de déterminer si ces mesures peuvent être reproduites, compte tenu de leur nature inattendue.
8.2.2 Scénario d'exposition portant sur le B79P et le B84P
Aucune donnée sur les concentrations de B79P ou de B84P mesurées dans l'environnement n'est disponible. Ces deux substances sont les phtalates à chaîne moyenne commercialisés les plus présents dans les sites industriels au Canada (Environnement Canada, 2014). Le B79P et le B84P entrent dans la composition des matériaux d'étanchéité et des revêtements utilisés pour la fabrication d'automobiles et de véhicules légers. Grâce aux déclarations faites par l'industrie automobile en vertu de l'article 71 et aux échanges qui s'en sont suivis (Environnement Canada, 2014), il a été possible d'apprendre que le B84P et le B79P entrent dans la composition d'adhésifs et de matériaux d'étanchéité automobiles. Ces produits sont appliqués dans les ateliers de tôlerie, dans les ateliers de peinture et lors de l'assemblage général dans les usines de fabrication d'automobiles et de véhicules légers. Les adhésifs utilisés dans les ateliers de tôlerie sont appliqués entre les panneaux de la carrosserie des véhicules, et les matériaux d'étanchéité servent à étanchéifier les soudures au moment de l'assemblage des éléments de tôlerie. Les matériaux d'étanchéité sont généralement utilisés pour étanchéifier les lignes de soudure et les protéger contre l'humidité et la poussière, et sont appliqués directement sur les lignes de soudure et les joints. Dans les ateliers de tôlerie, les adhésifs et les matériaux d'étanchéité sont pompés directement depuis leur contenant (généralement des bidons de 55 gallons) et sont appliqués sur la carrosserie et les panneaux par des robots.
Dans les ateliers de peinture, les matériaux d'étanchéité sont conservés dans des bidons de 55 et de 300 gallons et sont appliqués directement au point d'utilisation. La plupart des matériaux d'étanchéité utilisés dans les ateliers de peinture sont appliqués par des robots directement sur la carrosserie des véhicules aux endroits où ils sont nécessaires. À titre d'exemple, certains matériaux d'étanchéité appliqués dans les ateliers de peinture sont utilisés aux fins d'atténuation sonore et sont appliqués sur le plancher du véhicule, de même que sur d'autres panneaux intérieurs où une atténuation sonore est requise. D'autres matériaux d'étanchéité sont habituellement appliqués le long des panneaux du plancher, à l'intérieur du coffre et dans d'autres cavités de la carrosserie. Ces produits ne sont généralement pas visibles après l'assemblage du véhicule. Les matériaux d'étanchéité sont parfois appliqués manuellement ou à l'aide d'une tige sur certaines parties des véhicules. L'installation du pare-brise lors de l'assemblage général se fait à l'aide d'un adhésif à base d'uréthane qui est conservé dans un bidon de 55 gallons et dont l'application est robotisée.
De plus, certaines peintures de réparation contiennent des phtalates. Les peintures de réparation sont utilisées aux fins de contrôle de la qualité et sont appliquées manuellement, en très petites quantités (généralement quelques millilitres par véhicule), dans une zone contrôlée dotée d'un système de filtration de l'air.
Étant donné l'usage qui est fait du B84P et du B79P, des quantités de ces substances risquent de se retrouver dans les eaux usées des installations où elles sont utilisées. Par exemple, l'industrie automobile précise qu'avant l'application de la peinture, une fois les matériaux d'étanchéité appliqués sur les lignes de soudure dans l'atelier de tôlerie, la carrosserie brute subit un lavage et un rinçage pour éliminer les résidus d'huile, de graisse et de saletés qui se sont accumulés sur les surfaces métalliques, à des fins de contrôle de la qualité (Environnement Canada, 2014). Il est donc possible, en théorie, que certaines quantités de matériaux d'étanchéité, et donc de phtalates, atteignent le système de traitement des eaux usées d'une usine donnée lors du procédé de nettoyage (phosphatation). Cependant, aucune information n'est disponible quant aux quantités de matériaux d'étanchéité et de leurs constituants qui pourraient se retrouver dans les eaux usées après la phosphatation ou le nettoyage. En outre, l'industrie automobile signale que les matériaux d'étanchéité enlevés durant le procédé de nettoyage et de rinçage deviennent solides, s'accumulent au fond du réservoir de boues et sont retirés à une fréquence prescrite (au moins une fois par année) (Environnement Canada, 2014). Toutefois, les phtalates ne sont pas chimiquement liés aux polymères, ce qui signifie qu'ils pourraient théoriquement migrer à partir des matériaux d'étanchéité solidifiés qui s'accumulent au fond des réservoirs de boues au cours d'une année. Cette réalité constitue une source majeure d'incertitude en ce qui concerne la présente évaluation de l'exposition. Il est donc impossible d'entreprendre une analyse quantitative de l'exposition en raison du manque d'information à ce sujet. Il serait recommandé de procéder à la collecte d'échantillons d'effluents dans les installations afin d'établir la concentration prévue dans l'environnement et de caractériser les risques.
En ce qui concerne les matériaux d'étanchéité et les adhésifs qui sont utilisés dans les ateliers de peinture ou lors de l'assemblage général, ils sont appliqués après le procédé de nettoyage et de rinçage qui précède l'application de la peinture et ne font donc pas l'objet d'un rinçage. Par conséquent, il ne devrait y avoir aucun rejet dans les eaux usées des installations.
8.3 Caractérisation des risques écologiques
8.3.1 Examen des sources de données
La biodégradation des phtalates à chaîne moyenne est relativement rapide dans l'environnement, de sorte que ces substances devraient persister dans l'eau, le sol et les sédiments pendant une période relativement courte. Cependant, les processus de biodégradation ralentissent lorsque les concentrations sont très faibles, de sorte qu'il devrait demeurer une certaine concentration de fond. Ayant une solubilité faible à modérée et un log Kco élevé, ces substances devraient être présentes dans l'eau, le sol et les sédiments. Des concentrations de phtalates à chaîne moyenne ont été décelées dans ces milieux un peu partout au monde, notamment au Canada. Les analogues BBP et DBP ont tous deux été détectés dans des biosolides à Vancouver. Selon une étude réalisée avec le phtalate à chaîne moyenne le plus court, à savoir le DIBP, les signes que la substance est transportée sur de longues distances, potentiellement par l'intermédiaire de fines particules, sont limités. Les phtalates à chaîne moyenne possèdent un potentiel de bioaccumulation faible à modéré. Ils sont modérément toxiques pour les organismes et agissent par narcose polaire. Les données concernant les effets des phtalates à chaîne moyenne sur le système endocrinien sont limitées. Si des études in vitro indiquent que l'analogue BBP pourrait avoir une faible action œstrogénique, les études in vivo, dont le nombre est limité, semblent indiquer qu'il n'y aurait aucune activité endocrinienne chez les poissons. Des études in vitro et in vivo ont révélé que l'analogue DEHP agissait comme un faible agoniste œstrogénique chez les poissons. Le DCHP entrave l'expression du gène de l'hormone thyroïdienne et perturbe les axes cellulaires chez les amphibiens.
Selon les déclarations faites par l'industrie dans le cadre d'une enquête réalisée en vertu de l'article 71 (Environnement Canada, 2014), les phtalates à chaîne moyenne sont utilisés au Canada dans les matériaux d'étanchéité et revêtements employés dans l'industrie automobile, dans les revêtements haute température, dans les adhésifs et matériaux d'étanchéité, et dans l'encre d'impression. De plus, les phtalates à chaîne moyenne sont importés au Canada sous la forme de solvants pour la fabrication de résines thermoplastiques et thermodurcissables, ou en tant que résines plastiques et câbles en PVC pour le matériel électronique. Cependant, seuls le B84P et le B79P seraient utilisés en grandes quantités au Canada. Cinq des substances visées par le présent rapport, soit le CHIBP, le BCHP, le DMCHP, le BIOP et le DBzP, semblent ne pas être importées ni utilisées au Canada en quantités supérieures aux seuils de déclaration. Trois substances, le DIBP, le DCHP et le DIHepP, sont importées au Canada en petites quantités et sont distribuées à différents clients, ou sont importées au pays dans des produits finis (p. ex. câbles en PVC, matériel informatique, machinerie pour l'entretien des fermes, jardins et pelouses) (Environnement Canada, 2014). Ainsi, les rejets de ces huit phtalates dans le milieu aquatique découlant d'activités industrielles devraient être sporadiques et faibles.
CHIBP, BCHP, DMCHP, BIOP et DBzP
Étant donné que le CHIBP, le BCHP, le DMCHP, le BIOP et le DBzP ne sont pas utilisés au Canada ou le sont de façon très limitée (Environnement Canada, 2014), l'exposition et les risques connexes ne seront pas définis de façon plus approfondie.
DIBP et DCHP
Les rejets de DIBP et de DCHP dans le milieu aquatique après leur utilisation à des fins industrielles ou leur utilisation par les consommateurs devraient être sporadiques et faibles. En raison de l'information limitée dont on dispose sur les procédés industriels et les possibles rejets de produits du DIBP et du DCHP, les concentrations prévues dans l'environnement (CPE) n'ont pas été déterminées au moyen d'estimations ou de calculs de paramètres, comme les pertes dans l'environnement et les taux d'élimination. On s'est plutôt servi des concentrations mesurées dans différents endroits au Canada pour définir les CPE et caractériser les risques. En choisissant des CPE fondées sur des concentrations mesurées, on a accordé une attention particulière à la précision analytique des valeurs déclarées (c.-à-d. la proximité par rapport aux seuils de détection) et au nombre d'échantillons inclus dans l'estimation. En ce qui concerne les phtalates à chaîne moyenne, les concentrations mesurées qui ont été choisies comme CPE sont présentées au tableau 8-6. Étant donné qu'aucune donnée de surveillance n'était disponible pour le DCHP, la concentration mesurée de DIBP a été utilisée pour le calcul de la CPE du DCHP. La valeur ainsi obtenue devrait constituer une hypothèse prudente, car les quantités de DIBP déclarées au Canada sont supérieures à celles du DCHP (tableau 4-2) et les usages signalés sont semblables (tableau 5-1). Une comparaison des concentrations de DCHP mesurées dans les effluents d'eaux usées d'autres pays (de l'ordre de 5,43 à 15 ng/L), qui sont inférieures à celles du DIBP au Canada (17,65 ng/L), vient corroborer cette hypothèse. Il a été possible de calculer une CPE relative aux sédiments seulement pour le DIBP (tableau 8-9), les autres phtalates à chaîne moyenne n'ayant jamais été mesurés dans les sédiments au Canada.
Le tableau 8-9 présente les CPE fondées sur les concentrations mesurées dans l'environnement.
| Nom commun | Endroit | Période d'échantillonnage | Concentration prévue dans l'environnement | Référence |
|---|---|---|---|---|
| DCHP | Alberta (Canada) En aval d'une installation de traitement des eaux usées municipales |
2002-2003 | 2,85 × 10-6 mg/L (2,85 ng/L)Notes de bas de page Tableau 8-9[a].10 |
Sosiak et Hebben, 2005 |
| DIBP | Alberta (Canada) En aval d'une installation de traitement des eaux usées municipales |
2002-2003 | 2,85 × 10-6 mg/L (2,85 ng/L) |
Sosiak et Hebben, 2005 |
| DIBP | Colombie Britannique (Canada) Sédiments à False Creek Harbour |
1999 | 5,6 ng/g dw | McConnell, 2007 |
Une analyse du quotient de risque a été réalisée pour le DIBP et le DCHP. Elle reposait sur une analyse qualitative de l'information sur l'exposition, des concentrations prévues dans l'environnement (CPE) (fondées sur des concentrations mesurées dans l'environnement) et de la toxicité. Le tableau 8-10 fait la synthèse de cette information.
| Nom commun | Milieu | CSEP | CPE | QR |
|---|---|---|---|---|
| DCHP | Eau | 6,0 × 10-2 mg/L | 2,85 × 10-6 mg/L | 4,75 × 10-5 |
| DIBP | Eau | 0,19 mg/L | 2,85 × 10-6 mg/L | 1,5 × 10-5 |
| DIBP | Sédiments | 16,64 mg/kg ps | 5,6 mg/kg ps | 0,34 |
Selon les données disponibles, il est peu probable que le DIBP et le DCHP soient néfastes pour l'environnement au Canada. Il convient de noter que l'utilisation de CPE fondées sur des concentrations mesurées dans l'environnement peut entraîner une sous-estimation des risques environnementaux. De nombreux facteurs peuvent avoir une incidence sur la mesure des concentrations de substances chimiques dans l'environnement, notamment la distance entre le lieu de collecte des échantillons et le lieu du rejet des substances, une dégradation environnementale due à un échantillonnage tardif, des erreurs de détection ou encore une dégradation des échantillons. En ce qui concerne le DIBP et le DCHP, une marge de sécurité de cinq ordres de grandeur a été prise en considération dans le calcul des QR en milieu aquatique afin de réduire l'importance de cette incertitude.
DIHepP
Les rejets de DIHepP dans le milieu aquatique après son utilisation à des fins industrielles ou son utilisation par les consommateurs devraient être sporadiques et faibles.
Les résultats d'une analyse des résidus corporels critiques (RCC) établis sur la base du seuil d'hydrosolubilité du DIHepP ont révélé que les concentrations tissulaires maximales de cette substance selon les seuils d'hydrosolubilité seront largement inférieures aux concentrations associées à des effets négatifs ou chroniques importants chez les organismes qui seraient attribuables à une narcose neutre. Des analyses semblables sur le DIHepP ayant été effectuées avec des organismes vivant dans les sédiments ont indiqué que les concentrations tissulaires maximales calculées à partir du seuil de saturation de cette substance dans des sédiments ayant une teneur en CO de 4 % ne dépassaient pas les concentrations minimales pouvant causer des effets de narcose. Ainsi, bien que le DIHepP ait été détecté dans les eaux de surface et les sédiments au Canada (aucune donnée de surveillance sur les concentrations dans le sol n'est disponible), il est peu probable que les concentrations internes chez les organismes exposés soient suffisantes pour causer des effets négatifs. Par exemple, une concentration maximale de DIHepP de 68,7 ng/L a été mesurée en amont d'une installation de traitement des eaux usées municipales (Sosiak et Hebben, 2005). Une telle concentration correspond à un RCC de 0,085 mmol/kg chez les organismes aquatiques (voir les calculs de RCC à la section portant sur l'évaluation des effets écologiques). Comme cette valeur est inférieure à l'intervalle de 2 à 8 mmol/kg et de 0,2 à 0,8 mmol/kg causant respectivement des effets aigus et des effets chroniques, les organismes aquatiques exposés à cette concentration dans l'environnement sont peu susceptibles de subir des effets négatifs attribuables à une narcose de base. De même, selon Mackintosh et al. (2006), la concentration maximale de DIHepP était de 60,8 ng/g ps dans un échantillon de sédiments estuariens recueilli à Vancouver, en Colombie-Britannique. Les RCC dans les organismes vivant dans les sédiments sont de 8,8 × 10-5 mmol/kg (voir les calculs de RCC à la section portant sur l'évaluation des effets écologiques), ce qui signifie que des effets négatifs attribuables à une narcose neutre sont peu probables.
Plusieurs études font état de la présence de DIHepP chez un bon nombre d'espèces aquatiques au Canada. En effet, une concentration moyenne de 44 ng/g ph a été mesurée dans des perches-ménés juvéniles (McConnell, 2007). Cette concentration a été convertie en unités de RCC afin qu'il soit possible de déterminer si les concentrations tissulaires dans les poissons étaient suffisamment élevées pour entraîner des effets nocifs dus à une narcose de base. Les RCC pour cette concentration tissulaire sont de 1,2 × 10-4 mmol/kg (0,044 mg/kg / MM de 362,51 g/mol). Cette valeur est inférieure aux intervalles de 2 à 8 mmol/kg et de 0,2 à 0,8 mmol/kg causant respectivement des effets aigus et des effets chroniques, ce qui donne à penser que le chabot armé serait peu susceptible de subir des effets nocifs dus à une narcose en raison de la présence de DIHepP dans ses tissus.
B84P et B79P
En raison de l'information limitée dont on dispose au sujet des procédés industriels et des possibles rejets de produits du B84P et du B79P, et en raison de l'absence de concentrations mesurées dans l'environnement, aucune concentration prévue dans l'environnement (CPE) n'est proposée à l'heure actuelle pour ces substances. Lorsque des données de surveillance seront disponibles, il sera possible de s'en servir pour estimer l'exposition potentielle et caractériser les risques.
8.3.2 Incertitudes dans l'évaluation du risque écologique
Les procédés industriels dans lesquels les phtalates à chaîne moyenne sont utilisés sont méconnus, ce qui a une incidence directe sur l'exactitude de l'évaluation de leur rejet dans l'environnement et de la caractérisation des risques auxquels ils sont associés. Il s'est révélé impossible de calculer les CPE sur la base de scénarios modélisés pour la plupart des substances, alors les CPE ont été calculées à partir de concentrations mesurées dans l'environnement. L'absence de données de surveillance et la disponibilité limitée d'information concernant les procédés industriels et les rejets des produits du B84 et du B79P font en sorte qu'il est impossible de calculer une CPE.
Bien que des données de surveillance aient été disponibles pour plusieurs endroits, il est possible qu'elles ne soient pas idéales pour caractériser les risques posés par les phtalates à chaîne moyenne. En effet, ces endroits pourraient être éloignés des points de rejet dans l'environnement. Une campagne de surveillance des 10 phtalates à chaîne moyenne sera entreprise par Environnement Canada de 2014 à 2015, qui visera notamment des installations de traitement des eaux usées d'un peu partout au Canada.
Morin (2003) fait état de données de surveillance limitées portant sur le DIBP dans l'Arctique, selon lesquelles cette substance est présente dans le biote. Des travaux plus poussés doivent être réalisés, car la présence de cette substance dans des endroits éloignés de toute source d'exposition est inattendue. Selon les projections relatives au transport sur de longues distances, les phtalates à chaîne moyenne ne peuvent parcourir de grandes distances. Le transport par l'intermédiaire de fines particules est considéré comme une explication plausible.
Les données de surveillance montrent clairement que les phtalates à chaîne moyenne sont présents dans le milieu aquatique. Selon diverses études, certains phtalates (comme le BBP) peuvent avoir des effets sur le système endocrinien. Ces études ne portaient toutefois pas sur les substances du sous-groupe des phtalates à chaîne moyenne. La pertinence de recourir à l'analogue BBP pour évaluer les possibles effets endocriniens des substances de ce sous-groupe chez les organismes aquatiques est incertaine. Ces effets varient d'une substance à l'autre et dépendent de la structure des substances. De plus, ils peuvent affecter les organismes à différentes étapes de la vie par un éventail de modes d'action. Par conséquent, les effets des phtalates à chaîne moyenne sur le système endocrinien devraient être évalués individuellement pour chaque substance.
Aucune donnée expérimentale sur les propriétés physicochimiques, la dégradation, la bioaccumulation et les effets écologiques n'était disponible concernant bien des phtalates à chaîne moyenne. Ainsi, des approches reposant sur des substances analogues et sur la lecture croisée ont été employées fréquemment dans le cadre de l'évaluation de ces substances. Ces approches ont été jugées appropriées, et les analogues et modèles QSAR ont été soigneusement évalués. Cependant, comme les données n'étaient pas spécifiques des phtalates à chaîne moyenne, l'utilisation de ces approches soulève une certaine incertitude parce qu'elle pourrait mener à une surestimation ou à une sous-estimation du risque global associé à la présence de ces substances dans l'environnement.
L'analyse de la biodégradation des phtalates à chaîne moyenne était associée à une certaine incertitude. Bien que des études sur la biodégradation aient été disponibles pour bon nombre de substances, elles reposent sur des protocoles différents sur le plan de la durée et du degré d'acclimatation de l'inoculum. Cette situation fait en sorte qu'il est difficile d'évaluer le taux de biodégradation et de comparer les résultats d'une étude à l'autre.
Les données relatives aux phtalates à chaîne moyenne présentées dans le tableau 8-11 sont nécessaires pour une meilleure évaluation des risques associés à ces substances.
| Lacunes en matière de données | Détails |
|---|---|
| Effets sur les organismes vivant dans les sédiments et les organismes vivant dans les sols | Études toxicologiques sur les espèces vivant dans les sédiments et les espèces vivant dans les sols réalisées selon les protocoles de l'OCDE ou d'autres protocoles reconnus à l'échelle internationale. |
| Études des effets sur l'activité endocrinienne et la reproduction chez les organismes aquatiques et les organismes terrestres | Études ou essais menés selon les protocoles de l'OCDE ou d'autres protocoles reconnus à l'échelle internationale dans le but d'évaluer les effets sur l'activité endocrinienne et la reproduction (y compris la dystrophie testiculaire) chez les espèces aquatiques, notamment les poissons, et chez les organismes terrestres, notamment les lombrics. |
| Surveillance dans les zones urbaines et dans l'Arctique | Travaux de recherche dans des régions urbaines menés par Environnement Canada en 2014-2015. Des études supplémentaires doivent être menées dans l'Arctique. |
| Procédés et usages industriels | Information sur les usages du B79P et du B84P dans l'industrie automobile. Connaissance générale des procédés et des usages pour une meilleure évaluation des rejets de phtalates à chaîne moyenne découlant d'activités industrielles. |
9. Possibilités d'effets nocifs sur la santé humaine
10. Références
Annexes
- Annexe A : Identité et propriétés physicochimiques des substances analogues
- Annexe B : Propriétés physicochimiques des substances du sous-groupe des phtalates à chaîne moyenne
- Annexe C : Résultats de la modélisation de la fugacité de niveau III (EQC, 2011) pour les esters phtaliques à chaîne moyenne
- Annexe D : Bioaccumulation
- Annexe E : Valeurs de toxicité
- Annexe F-1 : Estimation des doses journalières
- Annexe F-2 : Détermination des apports alimentaires
- Annexe G : Détermination des apports quotidiens de DIBP d'après les données de biosurveillance
- Annexe H : Résumé de la toxicocinétique des phtalates à chaîne moyenne (PCM)
- Annexe I : Renseignements complémentaires au sujet de la toxicité chronique et de la cancérogénicité du BBP
- Annexe J : Description et application du système d'évaluation de Downs et Black et indications relatives au niveau de preuve d'une association