Consultation sur la modification de la liste des espèces de la Loi sur les espèces en péril : espèces terrestres – Janvier 2016
- Introduction
- Ajout d'espèces à la Loi sur les espèces en péril
- Processus de consultation et d'inscription dans la Loi sur les espèces en péril
- Importance de l'ajout d'une espèce à l'annexe 1
- Espèces admissibles en vue de la modification de l'annexe 1
- Résumés du COSEPAC sur les espèces terrestres admissibles pour ajout ou reclassification à l'annexe 1
- Table des matières
- Ajout d'espèces à la Loi sur les espèces en péril
- Loi sur les espèces en péril et Liste des espèces en péril
- Comité sur la situation des espèces en péril au Canada (COSEPAC) et processus d'évaluation pour déterminer les espèces en péril
- Termes utilisés pour définir le degré de risque que court une espèce
- Espèces terrestres et aquatiques admissibles aux modifications de l'annexe 1
- Sollicitation de commentaires du public au sujet de la modification proposée de l'annexe 1
- Des questions pour vous aider à formuler vos commentaires
- Processus de consultation et d'inscription dans la Loi sur les espèces en péril
- But des consultations sur les modifications à apporter à la Liste
- Contexte législatif des consultations : les recommandations du ministre au gouverneur en conseil
- Figure 1 : Le processus d’inscription des espèces en vertu de la LEP
- Réponse du ministre de l'Environnement à l'évaluation par le COSEPAC : énoncé de réaction
- Périodes de consultations régulières et prolongées
- Qui est consulté et comment
- Rôle et impact des consultations publiques sur le processus d'inscription
- Importance de l'ajout d'une espèce à l'annexe 1
- Protection accordée aux espèces inscrites comme étant disparues du pays, en voie de disparition ou menacées
- Programmes de rétablissement et plans d'action visant les espèces disparues du pays, en voie de disparition ou menacées
- Permis et accords
- Protection accordée aux espèces inscrites comme étant des espèces préoccupantes
- Plans de gestion des espèces préoccupantes
- Espèces admissibles en vue de la modification de l'annexe 1
- Situation des espèces récemment évaluées et processus de consultation
- Formulation de commentaires
- Tableau 1 : Espèces terrestres récemment évaluées par le COSEPAC et admissibles à un ajout à l'annexe 1 ou à une reclassification
- Tableau 2 : Espèces terrestres récemment réévaluées par le COSEPAC (aucune consultation –confirmation du statut des espèces)
- Résumés du COSEPAC sur les espèces terrestres admissibles pour ajout ou reclassification à l'annexe 1
- Index
- Glossaire
Veuillez envoyer vos commentaires au plus tard :
le 4 mai 2016 pour les espèces terrestres faisant l'objet de consultations régulières;
et
le 4 octobre 2016 pour les espèces terrestres faisant l'objet de consultations prolongées.
Pour obtenir une description des processus de consultation auxquels ces espèces seront soumises, veuillez consulter le site Web Registre public des espèces en péril.
Veuillez envoyer vos commentaires par courriel au Registre public des espèces en péril.
Les commentaires peuvent également être envoyés par la poste :
Directrice générale
Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Pour en savoir davantage sur la Loi sur les espèces en péril, veuillez consulter le Registre public des espèces en péril.
Le gouvernement du Canada est voué à prévenir la disparition des espèces sauvages en péril de nos territoires. Dans le cadre de sa stratégie visant à honorer cet engagement, le gouvernement du Canada a adopté la Loi sur les espèces en péril (LEP), le 5 juin 2003. L'annexe 1 de la Loi, qui présente la liste des espèces qui sont protégées en vertu de la LEP, est aussi appelée la « Liste des espèces en péril ». Les espèces disparues du pays, en voie de disparition ou menacées qui figurent à l'annexe 1 bénéficient de la protection conférée par les interdictions et d’exigences en matière de la planification du rétablissement prévues à la LEP. Les espèces préoccupantes bénéficient d’exigences en matière de planification de la gestion. L'annexe 1 contenait initialement 233 espèces sauvages en péril et maintenant, 521 espèces forment la liste.
La liste complète des espèces qui figurent actuellement à l'annexe 1 peut être consultée sur le Registre public des espèces en péril.
Les espèces peuvent être ajoutées à l'annexe 1 dès qu'elles ont été évaluées comme étant en péril par le Comité sur la situation des espèces en péril au Canada (COSEPAC). La décision d'ajouter une espèce à l'annexe 1 est prise par le gouverneur en conseil suivant une recommandation formulée par la ministre de l’Environnement et du Changement climatique (ECC). Le gouverneur en conseil est le corps exécutif officiel qui donne la conséquence juridique aux décisions qui ont ensuite force de loi.
Le COSEPAC est reconnu en vertu de la LEP comme une autorité pour évaluer le statut des espèces sauvages en péril. Ce Comité est formé d'experts sur les espèces sauvages en péril. Ses membres ont une formation en biologie, en écologie et en génétique. De plus, ils ont un savoir traditionnel autochtone et dans d'autres domaines pertinents. Ils proviennent de diverses collectivités, y compris le milieu universitaire, les organisations autochtones, les organisations gouvernementales et les organisations non gouvernementales.
Le COSEPAC accorde la priorité aux espèces les plus susceptibles de disparaître, puis il commande un rapport de situation afin d'évaluer la situation de l'espèce. Pour être acceptés, les rapports de situation doivent être évalués par les pairs et approuvés par un sous-comité formé de spécialistes des espèces. Dans des circonstances particulières, les évaluations peuvent être exécutées en situation d'urgence. Lorsque le rapport de situation est terminé, le COSEPAC se rencontre pour l'examiner et discuter des espèces. Il détermine ensuite si les espèces sont en péril et, si tel est le cas, il évalue le niveau de risque et attribue un statut de conservation.
Le statut de conservation définit le degré de risque que court une espèce. Les termes utilisés dans la LEP sont « espèce disparue du pays », « espèce en voie de disparition », « espèce menacée » et « espèce préoccupante ». Une espèce sauvage est « disparue du pays » lorsqu'elle n'existe plus à l'état sauvage au Canada, mais qu'elle est présente ailleurs. Une espèce sauvage est « en voie de disparition » lorsqu'elle risque de façon imminente de disparaître du pays ou de la planète. Une espèce est « menacée » lorsqu'elle est susceptible de devenir en voie de disparition si rien n'est fait pour contrer les facteurs menaçant de la faire disparaître. Une espèce est « préoccupante » lorsqu'elle peut devenir une espèce menacée ou une espèce en voie de disparition en raison de l'effet cumulatif de ses caractéristiques biologiques et des menaces reconnues qui pèsent sur elle. Une fois que le Comité a évalué une espèce comme étant disparue du pays, en voie de disparition, menacée ou préoccupante, cette espèce peut être ajoutée à l'annexe 1.
Pour obtenir de plus amples renseignements sur le COSEPAC, consultez le site web de COSEPAC.
Le 6 octobre 2015, le COSEPAC a envoyé à la ministre de l'ECC ses dernières évaluations des espèces en péril. Environnement et Changement climatique Canada est actuellement en consultation relativement aux modifications apportées à l'annexe 1 afin d'y intégrer les nouvelles désignations de ces espèces terrestres. Pour obtenir la liste des espèces terrestres et leur statut, veuillez consulter les tableaux 1 et 2.
Pêches et Océans Canada mène des consultations distinctes pour les espèces aquatiques. Pour obtenir de plus amples renseignements sur les consultations pour les espèces aquatiques, consultez le site Web de Pêches et Océans Canada.
Le ministère de l'ECC mène des consultations pour toutes les autres espèces en péril.
On retrouve aussi environ 57 % des espèces terrestres en péril évaluées récemment dans les parcs nationaux ou d'autres territoires administrés par Parcs Canada, qui partage la responsabilité avec ECCC concernant ces espèces.
La conservation des espèces sauvages est une responsabilité légale commune, qui est partagée entre les gouvernements du Canada. Toutefois, la biodiversité ne sera pas conservée par des gouvernements qui agissent seuls. La meilleure façon de sécuriser la survie des espèces en péril et leur habitat se fait par une participation active de toutes les parties concernées. La LEP reconnaît cette collaboration et le fait que tous les Autochtones et tous les Canadiens ont un rôle à jouer pour prévenir la disparition des espèces sauvages de nos territoires. Le gouvernement du Canada vous invite et vous encourage à y participer. Une façon de participer est de partager vos commentaires concernant l'ajout ou la reclassification de ces espèces terrestres.
Vos commentaires sont pris en compte par rapport aux répercussions potentielles d'une inscription ou d’une non-inscription à l’annexe 1, puis ils sont utilisés pour rédiger les recommandations d'inscription proposées pour chacune de ces espèces.
Les questions suivantes visent à vous aider à fournir des commentaires sur les modifications proposées à la Liste des espèces en péril (voir le tableau 1 pour la liste des espèces faisant l’objet de la consultation). Elles ne sont pas limitatives et d’autres commentaires sont les bienvenus. Nous vous encourageons aussi à faire part des descriptions et des estimations des coûts ou des avantages pour vous ou votre organisation dans la mesure du possible, ainsi qu’à proposer des mesures qui pourraient être prises pour la conservation de ces espèces.
Renseignements sur le répondant
Répondez-vous à titre d’individu ou représentez-vous une collectivité, une entreprise ou une organisation (veuillez préciser)?
Bienfaits des espèces pour les personnes ou pour l'écosystème
Est-ce que l'une ou l'ensemble des espèces offrent des bénéfices pour vous ou pour les écosystèmes du Canada? Si oui, expliquez de quelle façon. Quelle est la valeur estimative de ces avantages? Les valeurs n'ont pas besoin d'être monétaires.
Par exemple :
- Est-ce qu’une partie ou l’ensemble de ces espèces procurent des bénéfices en soutenant votre moyen d’existence, par exemple, par la récolte, la subsistance ou la médecine?
- Est-ce qu’une partie ou l’ensemble de ces espèces procurent des bénéfices culturels ou spirituels, par exemple, en ce qui a trait aux loisirs, au sentiment d’appartenance ou à la tradition? Si oui, de quelle façon?
- Est-ce qu’une partie ou l’ensemble de ces espèces procurent des bénéfices environnementaux, par exemple, par la pollinisation, le contrôle des organismes nuisibles ou des inondations? Si oui, de quelle façon?
Incidences de vos activités et atténuation
- Selon les cartes fournies dans le présent document, est-ce qu’une de vos activités actuelles ou planifiées chevauche la répartition ou la présence de l’une ou plusieurs des espèces?
- Est-ce qu’une de vos activités actuelles ou planifiées risque de tuer, de blesser ou de harceler l’une ou l’ensemble de ces espèces, ou d’endommager ou détruire leur résidence? Si oui, quelles sont ces activités et de quelle façon touchent-elles l’espèce(s) concernée(s)?
- Que faites-vous ou que pourriez-vous faire pour éviter de tuer, de blesser ou de harceler l’espèce, ou d’endommager ou de détruire sa résidence?
Incidences de la modification de la Liste des espèces en péril
Selon ce que vous savez de la Loi sur les pêches et des renseignements présentés dans le présent document, pensez-vous que le fait de modifier la Liste des espèces en péril pour refléter les inscriptions proposées (tableau 1) n'aurait aucune incidence, aurait une incidence positive ou aurait une incidence négative sur vos activités ou sur l'espèce? Veuillez fournir autant de détails que possible.
Par exemple :
- Si une de vos activités a une incidence sur une espèce ou sur sa résidence, vous faudra-t-il éviter ou ajuster ces activités pour atténuer leur incidence? Quelles seraient les incidences de telles préventions ou atténuations?
- Pensez-vous que le fait d’inscrire les espèces à la liste entraînerait des coûts ou des bénéfices culturels ou sociaux pour vous, votre collectivité ou votre organisation?
- Pensez-vous que le fait d’inscrire les espèces à la liste entraînerait des coûts ou des bénéfices économiques pour vous, votre collectivité ou votre organisation?
- Pensez-vous que le fait d’inscrire les espèces à la liste entraînerait des coûts ou des bénéfices pour l’environnement ou les écosystèmes du Canada?
Renseignements supplémentaires pour les petites entreprises
Si vous répondez au nom d'une petite entreprise, veuillez fournir les détails suivants pour aider ECCC à rassembler de l'information afin de contribuer à l'analyse requise de la Lentille des petites entreprises qui fait partie du Résumé de l'étude d'impact de la réglementation qui accompagnera toute recommandation d'inscription à venir.
- Êtes-vous une entreprise qui exerce ses activités au Canada?
- Menez-vous des activités commerciales liées à l'offre de services ou de propriété (ce qui comprend les biens)?
- Êtes-vous une organisation qui mène des activités pour une raison d'intérêt public (c. à-d., bien-être social ou amélioration de la collectivité) telle qu'un gouvernement provincial ou une administration municipale, une école, un collège ou une université, un hôpital ou un organisme de bienfaisance?
- Votre entreprise appartient-elle à une collectivité des Premières Nations?
- Combien d'employés avez-vous?
- De 0 à 99
- 100 ou plus
- Quels sont vos revenus bruts annuels de l'année dernière?
- Moins de 30 000 $
- Entre 30 000 $ et 5 M$
- Plus de 5 M$
Pour que vos commentaires soient considérés à temps, vous devez les soumettre avant les dates limites suivantes :
Dans le cas des espèces terrestres faisant l'objet d'une période de consultations régulières, les commentaires doivent être soumis au plus tard le 4 mai 2016.
Dans le cas des espèces terrestres faisant l'objet de période de consultations prolongées, les commentaires doivent être soumis au plus tard le 4 octobre 2016.
Pour obtenir une description des processus de consultations auxquels ces espèces seront soumises (régulières ou prolongées), veuillez consulter le site Web Registre public des espèces en péril.
Les commentaires reçus avant ces dates limites seront pris en considération au cours du développement de la proposition d'inscription.
Veuillez envoyer vos commentaires par courriel au Registre public des espèces en péril.
Vous pouvez envoyer vos commentaires par courrier postal à l'adresse suivante :
Directrice générale
Service canadien de la faune
Environnement et Changement climatique Canada
Ottawa (Ontario)
K1A 0H3
L'ajout d'une espèce sauvage en péril à l'annexe 1 de la LEP aide le gouvernement fédéral à la protéger et à la conserver. Pour qu'il soit efficace, le processus d'inscription doit être transparent et ouvert. Le processus d'inscription des espèces en vertu de la LEP est résumé dans la figure 1.

Description longue pour la Figure 1
Cette figure indique les différentes étapes du processus d'inscription des espèces en vertu de la Loi sur les espèces en péril (LEP). Il s'agit d'un organigramme dont le contenu est le suivant :
- La ministre de l’Environnement et du Changement climatique (ECC) reçoit les évaluations du COSEPAC au moins une fois par année.
- Les ministères compétents font un examen interne pour déterminer la portée des consultations publiques et les analyses socioéconomiques nécessaires pour communiquer la décision concernant la liste.
- La ministre de l'ECC publie, dans le Registre public de la LEP, dans les 90 jours suivant la réception des évaluations des espèces préparées par le COSEPAC, un énoncé stipulant comment il ou elle réagira aux évaluations et, dans toute la mesure du possible, les délais d'exécution.
- S'il y a lieu, les ministères compétents mènent des consultations et toute autre analyse nécessaire pour préparer l'avis pour la ministre de l'ECC.
- La ministre de l'ECC transmet l'évaluation au gouverneur en conseil pour qu'il en accuse réception. Cela se produit généralement dans les trois mois suivant la publication de l'énoncé de réaction à moins que d'autres consultations soient nécessaires.
- Le gouverneur en conseil, dans les neuf mois suivant la réception de l'évaluation, peut décider, sur la recommandation de la ministre de l'ECC, d'ajouter ou non les espèces à l'Annexe 1 de la LEP ou encoure de retourner l'évaluation au COSEPAC pour obtenir plus d'information ou une réévaluation.
- Dès qu'une espèces est ajoutée à la liste de l'Annexe 1, elle bénéficie des dispositions applicables de la LEP.
Lorsque le COSEPAC évalue une espèce sauvage, il s'appuie uniquement sur les meilleurs renseignements disponibles pertinents au statut biologique de l'espèce. Il soumet ensuite l'évaluation à la ministre de l'ECC, qui la considère au moment de présenter les recommandations d'inscription au gouverneur en conseil. Ces consultations visent à fournir à la ministre une meilleure compréhension des incidences sociales et économiques potentielles des modifications proposées à la Liste des espèces en péril, et des répercussions potentielles de la non-inscription d’une espèce sur la liste.
Les commentaires obtenus pendant les consultations servent à éclairer le gouverneur en conseil aux fins de sa considération des recommandations de la ministre en matière d’inscription des espèces en péril. Le ministère doit recommander un des trois plans d’action. Le gouverneur en conseil peut soit accepter l'évaluation des espèces et modifier l'annexe 1 en conséquence; soit ne pas ajouter les espèces à l'annexe 1; ou soit renvoyer l'évaluation des espèces au COSEPAC pour qu'elle fasse l'objet d'un examen plus approfondi (figure 1).
Une fois que le COSEPAC a effectué son évaluation d'une espèce, il la remet à la ministre de l'ECC. Celui-ci dispose alors de 90 jours pour afficher une réponse sur le Registre public des espèces en péril et pour fournir des renseignements sur la portée des consultations et sur les échéanciers de mise en œuvre, dans la mesure du possible. Ces réponses sont appelées les énoncés de réaction. Les énoncés de réaction déterminent la durée des périodes de consultation (si elles sont « régulières » ou « prolongées ») en indiquant le moment où la ministre enverra l'évaluation au gouverneur en conseil. Ces consultations sur un groupe d'espèces commencent au moment de la publication des énoncés de réaction.
Les consultations régulières répondent aux besoins de consultation pour l'inscription de la plupart des espèces en péril. Elles durent habituellement de deux à trois mois, alors que les consultations prolongées peuvent prendre un an ou plus.
La durée des consultations doit être proportionnelle à l'incidence prévue d'une décision d'inscription et au délai pouvant être nécessaire pour effectuer les consultations. Dans certaines circonstances, l'inscription ou la non-inscription d'une espèce à l'annexe 1 pourrait avoir des incidences importantes et généralisées sur les activités de certains groupes de gens. Il est essentiel que ces intervenants aient l’opportunité de renseigner la décision en instance et, dans la mesure du possible, de fournir des commentaires sur les conséquences potentielles et de communiquer leurs idées sur la meilleure approche à l'égard des menaces pesant sur l'espèce. Une période plus longue peut parfois être nécessaire pour consulter suffisamment certains groupes. Ce peut être le cas avec des groupes qui se rencontrent rarement, mais qui doivent être mobilisés à plusieurs reprises. C'est pourquoi des consultations prolongées peuvent avoir lieu.
Une fois que les consultations régulières ou prolongées sont terminées, la ministre de l'ECC envoie les évaluations de l'espèce au gouverneur en conseil pour que le gouvernement prenne officiellement possession des évaluations. Celui-ci dispose alors de neuf mois pour rendre une décision d'inscription.
Les processus de consultation (consultations régulières ou prolongées) pour les espèces terrestres énumérées au tableau 1 seront annoncés au moment où la ministre publiera son énoncé de réaction. Ils seront affichés à compter du 4 janvier 2016 sur le Registre public des espèces en péril.
Il n'y aura aucune consultation sur les espèces déjà inscrites à l’annexe 1 et pour lesquelles aucun changement de statut n'est proposé (tableau 2).
Il est crucial de consulter les personnes qui seraient le plus touchées par les modifications proposées. Lorsqu'une espèce disparue du pays, en voie de disparition ou menacée est ajoutée à l'annexe 1, il existe des protections automatiques (pour plus de détails, voir ci-dessous « Protection accordée aux espèces inscrites comme étant disparues du pays, en voie de disparition ou menacées »). Cette protection immédiate ne s'applique pas aux espèces préoccupantes. La nature de la protection dépend du type d'espèce, de son statut de conservation et du lieu où elle se trouve. Environnement et Changement climatique Canada (ECCC) prend cela en considération pendant les consultations; les personnes susceptibles d’être touchées par les impacts des protections automatiques sont contactées directement, et les autres personnes intéressées sont invitées à participer aux consultations par diverses mesures.
On communiquera avec les Autochtones désignés comme ayant sur leurs territoires des espèces en péril pour qui sont envisagées les modifications proposées de l'annexe 1. Leur participation a une grande importance et leur rôle est reconnu dans la gestion des territoires traditionnels considérables et des terres de réserves et octroyées par une entente.
Un Conseil de gestion de la faune a été établi en vertu d'un accord de revendications territoriales et est autorisé aux termes de cet accord à exécuter des fonctions relatives aux espèces sauvages. Certaines espèces en péril admissibles se retrouvent sur des territoires où les accords de revendications territoriales s'appliquent et accordent des pouvoirs précis à un Conseil de gestion de la faune. Dans de tels cas, la ministre de l'ECC consultera le conseil pertinent.
Pour encourager d’autres personnes intéressées à participer aux consultations et rendre les renseignements nécessaires facilement accessibles, le présent document est distribué aux intervenants connus et affiché sur le Registre public des espèces en péril. Des consultations plus approfondies peuvent également avoir lieu par la tenue de réunions régionales ou locales ou par une approche plus ciblée.
ECCC envoie également un avis de cette consultation pour déterminer les groupes et individus concernés qui ont affiché leur intérêt. Ces groupes et individus comprennent, sans toutefois s'y limiter, les industries, les utilisateurs des ressources, les propriétaires fonciers et les organisations non gouvernementales à vocation écologique.
Dans la plupart des cas, il est difficile pour ECCC d'examiner la totalité des répercussions potentielles des actions de rétablissement au moment de l'inscription d'espèces. Les actions de rétablissement des espèces terrestres n’ont habituellement pas encore été définies au moment de l’inscription et leur incidence ne peut donc être entièrement comprise. Une fois qu'elles sont mieux comprises, des mesures sont prises pour réduire au minimum les impacts socio-économiques de l'inscription et maximiser les avantages. La LEP exige que les mesures de rétablissement soient préparées en consultation avec les intervenants considérés comme directement touchés par ces actions.
En plus du public, ECCC consulte les gouvernements des provinces et territoires ayant la responsabilité principale de la conservation et de la gestion de ces espèces sauvages en vue de leur inscription. Le Ministère consulte également d'autres ministères et organismes fédéraux.
Les résultats des consultations publiques sont d'une grande importance pour renseigner le processus d'inscription des espèces en péril. ECCC examine attentivement les commentaires reçus pour mieux comprendre les avantages et les coûts découlant des modifications à apporter à la Liste.
Les commentaires sont ensuite utilisés pour élaborer le Résumé de l'étude d'impact de la réglementation (REIR). Ce dernier consiste en un rapport qui résume l'impact d'une modification proposée à la réglementation. Il comprend une description de la modification proposée ainsi qu'une analyse des répercussions prévues qui considère les résultats des consultations publiques. En élaborant le REIR, le gouvernement du Canada reconnaît que le patrimoine naturel du Canada fait partie intégrante de notre identité et histoire nationales et que toutes les espèces sauvages, quelles qu'elles soient, sont importantes. Le gouvernement du Canada reconnaît également que l'absence d'une certitude scientifique complète n'est pas une raison pour reporter les décisions relatives à la protection de l'environnement.
Un projet de décret (voir le glossaire) est ensuite préparé pour aviser qu'une décision est actuellement prise par le gouverneur en conseil. Ce projet de décret proposant d'inscrire la totalité ou une partie des espèces à l'étude est ensuite publié, avec le REIR, dans la Partie I de la Gazette du Canada pour une période de commentaires de 30 jours.
La ministre de l'ECC tiendra compte des commentaires et de tous les renseignements supplémentaires reçus à la suite de la publication du projet de décret et du REIR dans la Partie I de la Gazette du Canada. La ministre présentera ensuite une recommandation finale d'inscription pour chacune des espèces au gouverneur en conseil. Le gouverneur en conseil décide ensuite d'accepter l'évaluation des espèces et de modifier l'annexe 1 en conséquence, de ne pas ajouter les espèces à l'annexe 1 ou de renvoyer l'évaluation des espèces au COSEPAC afin qu'elle soit plus détaillée et réexaminée. La décision définitive est publiée dans la Partie II de la Gazette du Canada et dans le Registre public des espèces en péril. Lorsque le gouverneur en conseil décide d'inscrire une espèce, elle figure légalement à l'annexe 1.
La protection qui prend effet après l'ajout d'une espèce à l'annexe 1 dépend de plusieurs facteurs, dont le statut de l'espèce en vertu de la LEP, le type d'espèce et le lieu où elle se trouve.
Les divers gouvernements du Canada partagent la responsabilité de la conservation des espèces sauvages. La LEP établit la protection légale pour les individus d’une espèce dès qu’elle est inscrite comme espèce disparue du pays, en voie de disparition ou menacée et, dans le cas d’espèces menacées ou en voie de disparition, pour leurs résidences. Ceci s’applique pour les espèces considérées comme des espèces sous juridiction fédérale ou si elles se trouvent sur le territoire domanial.
Les espèces sous juridiction fédérale comprennent les oiseaux migrateurs, définis dans la Loi de 1994 sur la convention concernant les oiseaux migrateurs, et les espèces aquatiques visées par la Loi sur les pêches. Un territoire domanial signifie une terre qui appartient au gouvernement fédéral ainsi que les eaux internes et la mer territoriale du Canada. Il signifie également une terre qui a été mise de côté à l'usage et au profit d'une bande en vertu de la Loi sur les Indiens (par exemple, les réserves). Dans les territoires, la protection des espèces en péril se retrouvant sur les territoires domaniaux ne s'applique que sur les territoires sous la tutelle de la ministre de l’Environnement et du Changement climatique (ECC) ou de l'Agence Parcs Canada.
Les oiseaux migrateurs sont protégés en vertu du Règlement sur les oiseaux migrateurs aux termes de la Loi de 1994 sur la convention concernant les oiseaux migrateurs,qui interdit strictement de causer du tort aux oiseaux migrateurs et de perturber ou détruire leurs nids ou leurs œufs.
En vertu de la LEP, il est interdit de tuer un individu d'une espèce sauvage inscrite comme espèce disparue du pays, en voie de disparition ou menacée ou une espèce disparue dont la réintroduction a été recommandée dans un programme de rétablissement. Il est interdit aussi de lui nuire, de le harceler, de le capturer, de le prendre, ou d'endommager ou de détruire sa résidence. Aux termes de la Loi, il est également interdit de posséder, de collectionner, d'acheter, de vendre ou d'échanger un tel individu.
Les espèces en péril qui ne sont pas aquatiques, qui ne sont pas protégées par la Loi de 1994 sur la convention concernant les oiseaux migrateurs et qui ne se trouvent pas sur le territoire domanial, ne reçoivent aucune protection immédiate dès leur inscription en vertu de la LEP. Plutôt, dans la plupart des cas, la responsabilité de la protection des espèces terrestres qui se retrouvent sur le territoire non domanial revient aux provinces et territoires où ces espèces sont trouvées. L'application des protections en vertu de la LEP à une espèce en péril sur des terres non domaniales exige que le gouverneur en conseil émette un décret définissant ces terres. Cela se fait seulement si la ministre est d'avis que les lois de la province ou du territoire ne protègent pas l'espèce de façon efficace. Pour mettre en œuvre ce décret, la ministre doit recommander que le décret soit effectué par le gouverneur en conseil. Si le gouverneur en conseil accepte d'effectuer le décret, les interdictions en vertu de la LEP s'appliqueront aux territoires provinciaux ou territoriaux précisés dans le décret. Le gouvernement fédéral consulte avant d'effectuer ce décret.
La planification du rétablissement passe par l'élaboration de programmes de rétablissement et de plans d'action pour les espèces disparues du pays, en voie de disparition ou menacées. Elle nécessite l'intervention de différents ordres de gouvernement responsables de la gestion des espèces, dépendamment du type d'espèce dont il s'agit et où elle se retrouve. Cela comprend les gouvernements fédéral, provinciaux et territoriaux ainsi que les conseils de gestion des ressources fauniques. Les programmes de rétablissement et les plans d'action sont également préparés en collaboration avec les organisations autochtones directement concernées. Les propriétaires fonciers et les autres intervenants directement concernés par le programme de rétablissement sont également consultés dans la mesure du possible.
Des programmes de rétablissement doivent être préparés pour toutes les espèces disparues du pays, en voie de disparition ou menacées. Ils comprennent des mesures qui visent à atténuer les menaces connues qui pèsent sur l'espèce en question et sur son habitat ainsi que les objectifs en matière de population et de répartition. D'autres objectifs peuvent être inclus, tels que l'intendance, pour conserver l’espèce, ou l'éducation, pour accroître la sensibilisation du public. Les programmes de rétablissement doivent inclure un énoncé de l'échéancier pour l'élaboration d'un plan d'action ou plus, lequel précisera les mesures nécessaires pour mettre en œuvre le programme de rétablissement. Dans la mesure du possible, les programmes de rétablissement doivent aussi identifier l'habitat essentiel de l'espèce, soit l’habitat nécessaire à la survie ou au rétablissement de l’espèce. S'il n'y a pas suffisamment d'informations disponibles pour déterminer l'habitat essentiel, le programme de rétablissement comprend un calendrier de réalisation des études. Ce calendrier décrit ce qui doit être effectué pour obtenir les informations nécessaires et l'échéance. En pareil cas, l'habitat essentiel peut être désigné dans un plan d'action subséquent.
Après l'inscription de nouvelles espèces, les programmes de rétablissement proposés sont affichés dans le Registre public des espèces en péril afin de permettre au public de les examiner et de formuler des commentaires. Dans le cas d'une espèce désignée en voie de disparition, les programmes de rétablissement proposés sont affichés dans un délai d'un an suivant leur ajout dans l'annexe 1 et dans le cas d'une espèce désignée menacée ou disparue du pays, ils sont affichés dans un délai de deux ans suivant leur ajout dans l'annexe 1.
Une fois qu’un programme de rétablissement a été affiché comme version finale, un ou des plans d’action basés sur le programme de rétablissement doivent être préparés. Les plans d'action incluent les mesures pour réagir aux menaces et atteindre les objectifs en matière de population et de distribution. De plus, ces plans d'action terminent la désignation de l'habitat essentiel et, dans la mesure du possible, expliquent les mesures qui sont proposées pour le protéger.
Pour les espèces terrestres inscrites à l’annexe 1 de la LEP comme disparues du pays, en voie de disparition ou menacées, la ministre de l'ECC peut autoriser des exceptions aux interdictions prévues par la LEP, lorsque et où elles s’appliquent. La ministre peut conclure des accords ou délivrer des permis uniquement pour l'une des trois raisons suivantes : pour la recherche, pour des activités de conservation ou si une activité touche une espèce de façon incidente. Les recherches doivent être relatives à la conservation d'une espèce et réalisées par des scientifiques qualifiés. Les activités de conservation doivent être bénéfiques pour une espèce inscrite ou requises pour augmenter ses chances de survie. Toutes les activités, y compris celles qui touchent une espèce inscrite, ses individus, des résidences ou de l’habitat essentiel de façon incidente, doivent satisfaire à certaines conditions. Il doit d'abord être établi que toutes les solutions de rechange raisonnables à l’activité ont été envisagées et que la solution adoptée est la meilleure. Ensuite, il faut également établir que toutes les mesures possibles seront prises afin de minimiser les conséquences négatives de l'activité pour l’espèce, son habitat essentiel ou la résidence de ses individus. Enfin, il doit être établi que l’activité ne compromettra pas la survie ou le rétablissement de l'espèce. Si elle a délivré un permis ou conclu un accord, la ministre doit, dans un tel cas, publier une justification de la décision d'émettre le permis ou de conclure l'entente dans le Registre public des espèces en péril.
La protection immédiate prévue par la LEP pour les espèces inscrites comme disparues du pays, en voie de disparition et menacées ne s'applique pas aux espèces préoccupantes. Cependant, toutes les mesures de protection et interdictions existantes, comme celles prévues par la Loi de 1994 sur la convention concernant les oiseaux migrateurs ou la Loi sur les parcs nationaux du Canada, restent en vigueur.
Pour les espèces préoccupantes, on élabore des plans de gestion qui sont affichés dans le Registre public des espèces en péril dans les trois ans suivant leur inscription à l'annexe 1 afin de permettre à la population de les examiner et de les commenter. Ces plans prévoient des mesures de conservation pertinentes pour les espèces concernées et leurs habitats. Les plans de gestion sont élaborés en collaboration avec les compétences responsables de la gestion de l'espèce concernée, notamment avec les conseils de gestion des ressources fauniques et les organisations autochtones directement concernés. Les propriétaires fonciers, les locataires et les autres personnes directement touchées par le plan sont également consultés dans la mesure du possible.
Le 6 octobre 2015, le COSEPAC a soumis 22 évaluations d'espèces en péril à la ministre de l’Environnement et du Changement climatique (ECC) pour les nouvelles espèces qui sont admissibles à un ajout à l'annexe 1 de la LEP. Dix-neuf de ces espèces sont des espèces terrestres et trois sont des espèces aquatiques. Le COSEPAC a également examiné la classification d‘espèces qui figurent déjà à l'annexe 1 et a modifié le statut de certaines d'entre elles. Deux espèces terrestres sont maintenant évaluées à un niveau de risque moins élevé dans la LEP et quatre espèces terrestres sont maintenant évaluées à un niveau de risque plus élevé dans la LEP. En tout, 25 espèces terrestres admissibles à un ajout à l'annexe 1 ou au changement de leur statut à l'annexe 1 sont incluses dans la présente consultation (tableau 1).
Une de ces espèces terrestres, la Saxifrage à épis, a été initialement évaluée par le COSEPAC comme espèce menacée en mai 2013. Cependant, le COSEPAC a informé la ministre qu'il devait réévaluer cette espèce en raison de nouvelles informations qui n'étaient pas disponibles au moment de l'évaluation de 2013. Ceci a été communiqué à Environnement et Changement climatique Canada (ECCC) alors que le document de consultation de décembre 2013 était déjà en production et, par conséquent, la Saxifrage à épis était incluse dans le document, mais les consultations n’ont pas eu lieu. Le COSEPAC a réévalué la Saxifrage à épis en mai 2015 en tant qu'espèce préoccupante, et l'espèce est incluse dans le document de consultation actuel comme une espèce terrestre éligible pour un ajout à l'annexe 1 de la LEP.
Le COSEPAC a également soumis des évaluations d‘espèces qui figurent déjà à l'annexe 1 afin de confirmer leur classification. Vingt de ces évaluations concernaient des espèces terrestres. Ces espèces ne sont pas incluses dans les consultations parce qu'aucune modification de la réglementation n'est proposée (tableau 2).
Pour obtenir de plus amples renseignements sur les consultations pour les espèces aquatiques, consultez le site Web de Pêches et Océans Canada à l'adresse www.dfo-mpo.gc.ca.
La participation des Canadiens fait partie intégrante du processus d’inscription tout comme de la protection ultime de la faune canadienne. Vos commentaires sont importants et considérés sérieusement. ECCC étudie tous les commentaires qu'il reçoit avant les dates limites présentées ci-après.
Les commentaires sur les espèces terrestres faisant l'objet d'une période de consultations régulières doivent être reçus au plus tard le 4 mai 2016.
Les commentaires sur les espèces terrestres faisant l'objet d'une période de consultations prolongées doivent être reçus au plus tard le 4 octobre 2016.
La plupart des espèces feront l'objet de consultations régulières. Pour les processus de consultation finale, veuillez vous rendre au siteWeb Registre public des espèces en péril
à compter du 4 janvier 2016.
Pour obtenir plus d'information sur la présentation des commentaires, veuillez consulter la section « Sollicitation des commentaires du public au sujet du projet de modification de l'annexe 1 » du présent document.
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Reptiles | Tortue boîte de l’Est | Terrapene carolina | ON |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Plantes vasculaires | Pin flexible | Pinus flexilis | BC AB |
| Plantes vasculaires | Rhynchospore à gros épillets | Rhynchospora macrostachya | NS |
| Plantes vasculaires | Vernonie fasciculée | Vernonia fasciculata | MB |
| Mollusques | Escargot-forestier écharge | Allogona profunda | ON |
| Mollusques | Patère de Pennsylvanie | Patera pennsylvanica | ON |
| Oiseaux | Martinet sombre | Cypseloides niger | BC AB |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Lichens | Anzie mousse-noire | Anzia colpodes | ON QC NB NS |
| Plantes vasculaires | Arnica de Griscom | Arnica griscomii ssp. griscomii | QC NL |
| Arthropodes | Halicte de l’île de Sable | Lasioglossum sablense | NS |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Mousses | Petit pompon | Crossidium seriatum | BC |
| Plantes vasculaires | Podistère du Yukon | Podistera yukonensis | YT |
| Plantes vasculaires | Saxifrage à épisNotea | Micranthes spicata | YT |
| Arthropodes | Agrion vif | Argia vivida | BC AB |
| Arthropodes | Bourdon terricole | Bombus terricola | YT NT BC AB SK MB ON QC NB PE NS NL |
| Reptiles | Crotale des prairies | Crotalus viridis | AB SK |
| Oiseaux | Starique de Cassin | Ptychoramphus aleuticus | BC, Océan Pacifique |
| Oiseaux | Phalarope à bec étroit | Phalaropus lobatus | YT NT NU BC AB SK MB ON QC NB PE NS NL, Océan Pacifique, Océan Arctique, Océan Atlantique |
| Mammifères | Caribou (Population de Terre-Neuve) | Rangifer tarandus | NL |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Plantes vasculaires | Céphalanthère d'Austin | Cephalanthera austiniae | BC |
| Arthropodes | Hespérie de Poweshiek | Oarisma poweshiek | MB |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Plantes vasculaires | Frêne bleu | Fraxinus quadrangulata | ON |
| Mammifères | Loup de l'Est | Canis sp. cf. lycaon | ON QC |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Plantes vasculaires | Cypripède blanc | Cypripedium candidum | MB ON |
| Plantes vasculaires | Rotala rameux (Population des plaines des Grands Lacs)Noteb | Rotala ramosior | ON |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Lichens | Érioderme boréal (Population de l'Atlantique) | Erioderma pedicellatum | NB NS |
| Plantes vasculaires | Mûrier rouge | Morus rubra | ON |
| Plantes vasculaires | Rotala rameux (Population des montagnes du Sud)Notec | Rotala ramosior | BC |
| Arthropodes | Héliotin blanc satiné | Schinia bimatris | MB |
| Arthropodes | Hespérie Ottoé | Hesperia ottoe | MB |
| Reptiles | Tortue ponctuée | Clemmys guttata | ON QC |
| Mammifères | Taupe de Townsend | Scapanus townsendii | BC |
| Mammifères | Caribou (Population de la Gaspésie-Atlantique) | Rangifer tarandus | QC |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Reptiles | Crotale de l'Ouest | Crotalus oreganus | BC |
| Mammifères | Caribou (Population boréale) | Rangifer tarandus | YT NT BC AB SK MB ON QC NL |
| Mammifères | Hermine de la sous-espèce haidarum | Mustela erminea haidarum | BC |
| Taxon | Espèce | Nom scientifique | Aire de répartition |
|---|---|---|---|
| Lichens | Érioderme boréal (Population boréale) | Erioderma pedicellatum | NL |
| Lichens | Sclérophore givré (Population de l'Atlantique) | Sclerophora peronella | NS |
| Mousses | Entosthodon fasciculé | Entosthodon fascicularis | BC |
| Mousses | Érythrophylle du Columbia | Bryoerythrophyllum columbianum | BC |
| Mousses | Tortule à poils lisses | Syntrichia laevipila | BC |
| Amphibiens | Grenouille à pattes rouges du Nord | Rana aurora | BC |
| Reptiles | Scinque de l'Ouest | Plestiodon skiltonianus | BC |
| Oiseaux | Guillemot à cou blanc | Synthliboramphus antiquus | BC Océan Pacifique |
| Mammifères | Oreillard maculé | Euderma maculatum | BC |
La section qui suit présente un résumé des justifications de la désignation par le COSEPAC du statut d'espèces individuelles et leur biologie, les menaces, la répartition et d'autres informations. Pour une explication détaillée de la situation de conservation d'une espèce individuelle, veuillez vous référer au rapport du COSEPAC pour cette espèce, qui est aussi disponible sur le Registre public des espèces en péril.
ou contactez :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement et Changement climatique Canada
Ottawa (Ontario)
K1A 0H3

Photo : © Allan Harris
Description longue pour la figure 1a
Photo d'un agrion vif (Argia vivida) mâle, en vue latérale, qui arbore la couleur bleu vif et les marques noires typiques de l'espèce.
Justification de la désignation
Cette demoiselle se trouve dans le sud de la Colombie-Britannique et à Banff, en Alberta. Dans la majeure partie de son aire de répartition canadienne, elle n'est présente que dans des sources thermales, cependant dans les vallées chaudes de l'Okanagan et du Fraser, on la trouve également dans les eaux plus fraîches de ruisseaux alimentés par des sources. La perte et la dégradation de l'habitat dans la plupart des sites suggèrent que les sous-populations ont connu un déclin. L'espèce est menacée par l'utilisation récréative intensive de sources thermales, le piétinement des sources d'eau fraîche par le bétail, ainsi que les poissons introduits. Les sites sont également vulnérables au développement potentiel du tourisme et aux changements au niveau des sources causés par des événements tels que les sécheresses, tremblements de terre et glissements de terrain.
Description et importance de l'espèce sauvage
L'agrion vif est une demoiselle robuste (ordre des Odonates) longue de 29,5 à 35 mm. Les mâles adultes sont généralement bleu vif, mais parfois aussi bleu-violet, et présentent des marques noires. Les femelles ressemblent aux mâles ou ont une coloration plus discrète, habituellement orange ou brun-rouge et noire. L'agrion vif se distingue des demoiselles semblables, qui appartiennent à d'autres genres, par les motifs de sa nervation alaire, la forme de ses organes reproducteurs et ses épines tibiales plus longues. La larve de l'agrion vif est courte, trapue, aplatie et munie de branchies larges, fortement pigmentées, en forme de feuilles. Dans une grande partie de son aire de répartition canadienne, l'agrion vif est une espèce spécialiste des sources thermales. L'agrion vif est le seul Odonate connu à se reproduire dans les sources géothermales en Amérique du Nord. La flore et la faune des sources thermales varient d'un site à l'autre.
Répartition
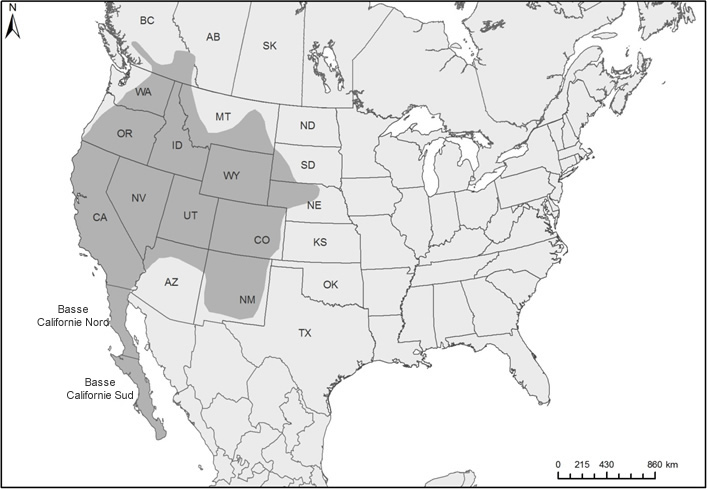
L'aire de répartition de l'agrion vif occupe la moitié sud de la Colombie-Britannique, depuis Pemberton, site le plus à l'ouest, jusque dans la vallée de l'Okanagan et dans la région des Kootenays, puis jusqu'à Banff, dans l'ouest de l'Alberta. Elle s'étend dans tout l'ouest des États-Unis, jusqu'à l'extrémité sud de la Basse-Californie, au Mexique, et vers l'est jusqu'au Nebraska.
Source : COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur l'agrion vif au Canada.
Description longue pour la carte 1
Carte de l'aire de répartition mondiale de l'agrion vif, y compris l'aire de répartition canadienne. L'espèce est présente dans l'ouest de l'Amérique du Nord, depuis le centre-sud de la Colombie-Britannique jusqu'à l'extrémité sud de la Basse-Californie, au Mexique, et jusqu'au Nebraska, en passant par 14 États.
Habitat
La larve de l'agrion vif vit dans les sources thermales et les sources fraîches ainsi que dans les petits cours d'eau qui leur sont associées. Au Canada, l'espèce se rencontre principalement dans les sources thermales dont la température est d'au moins 10 °C plus élevés que la température annuelle moyenne de l'air. Elle a également été signalée dans des sources fraîches de faible altitude situées dans la vallée de l'Okanagan et près de Lytton, deux des régions les plus chaudes en été au Canada. Les adultes se nourrissent et se reposent près de leur habitat aquatique et dans les forêts situées à proximité.
Biologie
L'agrion vif passe l'hiver sous forme de larve, puis les adultes apparaissent de la fin avril à la mi-octobre, selon les températures printanières. La température minimale requise pour le développement des oeufs est de 11 °C. La durée d'une génération est de 1 an dans le cas des sources thermales, mais elle peut atteindre 3 ans dans le cas des sources fraîches. Les adultes s'éloignent de 700 à 800 m dans la forêt avoisinante et se nourrissent de petits insectes volants, notamment des moustiques, des éphémères et de petits papillons. Durant les journées fraîches, les adultes se chauffent dans les parcelles de la forêt exposées au soleil, pour augmenter leur température corporelle. À la fin de l'été, les adultes retournent à la source pour se reproduire. Les femelles pondent sur les végétaux émergents, sous la surface de l'eau. Les larves vivent sous l'eau, où elles se nourrissent de petits invertébrés et se cachent dans la végétation aquatique. Les individus adultes sont la proie d'asiles, de libellules, d'araignées, d'amphibiens et d'oiseaux. Les larves sont consommées par des poissons, des amphibiens et peut-être des oiseaux aquatiques

Photo : © Jennifer Heron
Description longue pour la figure 1b
Photo d'un agrion vif récemment émergé (stade ténéral), en vue latérale, qui arbore une couleur gris-beige.
Taille et tendances des populations
On dispose de données sur la population pour un seul site, situé à Banff, où l'effectif a été évalué à 2 000 à 20 000 individus adultes en 2005; l'effectif n'a pas été estimé pour les autres sources, mais le nombre d'adultes y est probablement beaucoup plus petit, d'après la qualité de l'habitat et la disponibilité de milieux non aménagés. En outre, on ne dispose d'aucune donnée sur les tendances des populations, mais on sait que la plupart des sources ont été endommagées par l'utilisation commerciale ou récréative, ce qui donne à penser que les populations ont probablement subi des déclins.
Menaces et facteurs limitatifs
Les principales menaces pesant sur l'agrion vif sont la destruction et la dégradation de son habitat, notamment le détournement de l'eau et la dégradation de sa qualité (refroidissement, pollution, etc.) associés à l'exploitation des sources thermales à des fins commerciales, la modification des sources et des canaux de drainage à des fins récréatives (sources non commerciales) et l'utilisation des sources fraîches par le bétail, dans la vallée de l'Okanagan. Parmi les autres menaces potentielles, on compte les poissons introduits, à Banff, et la modification du débit des sources causé par la construction de routes. En outre, certaines sources sont vulnérables à la modification de leur débit par des phénomènes stochastiques comme les sécheresses, l'activité sismique et les glissements de terrain.
Protection, statuts et classements
L'agrion vif n'est protégé par aucune loi provinciale en Colombie-Britannique et en Alberta. Dans le parc national Banff, l'espèce est protégée aux termes de la Loi sur les parcs nationaux du Canada, qui s'applique à toutes les espèces présentes dans les parcs nationaux. En outre, dans certains sites du parc national Banff, certaines parties de l'habitat de l'espèce chevauchent l'habitat essentiel de la physe des fontaines de Banff et jouissent ainsi d'une protection. En Colombie-Britannique, l'habitat de l'agrion vif se trouve sur des terrains privés fortement aménagés et dans des parcs provinciaux, où l'habitat ne fait l'objet d'aucune protection précise. L'espèce est classée G5 (non en péril) à l'échelle mondiale et N2 (en péril) à l'échelle du Canada. À l'échelle provinciale, elle est classée S2 (en péril) en Colombie-Britannique et S1 (gravement en péril) en Alberta.

Photo : © David Richardson
Description longue pour la figure 2
Photographie d'une colonie d'anzie mousse-noire (Anzia colpodes), un lichen dont les thalles forment des rosettes gris verdâtre. Les lobes pleins du thalle reposent sur un coussin spongieux épais et dense de filaments noirs (l'hypothalle). Des rhizines robustes, mais épars, poussent du cortex inférieur jusqu'au substrat à travers l'hypothalle spongieux.
Justification de la désignation
Au Canada, ce lichen se trouve à la limite nord de son aire de répartition, et il a déjà été observé en Ontario, au Québec, au Nouveau-Brunswick et en Nouvelle-Écosse. Il semble être disparu de l'Ontario et du Québec et n'a pas été observé au Nouveau-Brunswick depuis environ une décennie. Il se trouve dans des sites dominés par des feuillus matures, comportant une humidité élevée et un éclairement modéré. En Nouvelle-Écosse, ce lichen est répandu, mais n'est pas commun. Les causes de son déclin ne sont pas claires. La principale menace actuelle est la déforestation. Le broutage par les mollusques et les changements climatiques pourraient faire partie des menaces additionnelles.
Description et importance de l'espèce sauvage
L'anzie mousse-noire, Anzia colpodes, est un lichen foliacé qui forme des rosettes gris verdâtre pouvant atteindre 20 cm de diamètre sur le tronc d'arbres feuillus. Les lobes pleins, de 1 à 2 mm de largeur, reposent sur un tissu noir, épais et spongieux composé d'hyphes filamenteux. Les corps fructifères de couleur brun rougeâtre sur la face supérieure renferment des asques qui sont inhabituels en ce qu'ils contiennent un grand nombre de spores minuscules qui constituent le seul moyen de reproduction de ce lichen.
Répartition
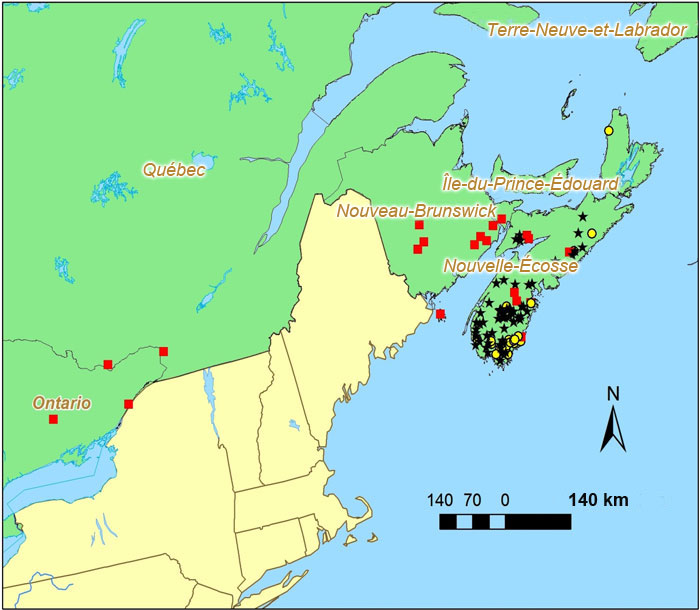
L'anzie mousse-noire est considérée comme endémique à l'Amérique du Nord, bien qu'elle ait été signalée à une occasion dans l'est de la Russie. Aux États-Unis, elle a été recueillie dans les Appalaches, de la Géorgie au Maine, mais aussi sur le plateau des monts Ozark et en Illinois, au Wisconsin et au Michigan. Au Canada, où elle se trouve à la limite nord de son aire de répartition, elle a été observée en Ontario, au Québec, au Nouveau-Brunswick et en Nouvelle-Écosse. Des relevés récents indiquent que l'anzie mousse-noire est maintenant absente des deux premières provinces, et sa présence n'a pas été signalée au Nouveau-Brunswick au cours de la dernière décennie. Ce lichen est répandu mais n'est pas commun en Nouvelle-Écosse.
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur l'anzie mousse-noire au Canada.
Description longue pour la carte 2
Carte montrant la répartition de l'Anzia colpodes au Canada, où l'espèce a été observée dans quatre provinces par le passé : l'Ontario, le Québec, le Nouveau Brunswick et la Nouvelle-Écosse. La carte indique l'emplacement des occurrences considérées comme existantes à l'heure actuelle, d'après le travail sur le terrain effectué pour le présent rapport, de même que les occurrences qui ont été découvertes avant 1995 et qui n'ont pas été visitées à nouveau et les occurrences revisitées où le lichen était absent.
Habitat
L'anzie mousse-noire croît sur le tronc de feuillus matures qui poussent sur des terrains plats ou en pente où l'humidité élevée est apportée par les milieux humides, les lacs ou les cours d'eau avoisinants. Son hôte est le plus souvent l'érable rouge, mais elle pousse aussi sur le frêne blanc, l'érable à sucre, le chêne rouge et, très rarement, sur d'autres espèces.
Biologie
On observe fréquemment sur l'anzie mousse-noire des corps fructifères qui constituent son seul moyen de reproduction. Les spores qu'ils éjectent doivent se poser sur le tronc d'un arbre hôte et y rencontrer une algue verte compatible. Cette algue est alors enveloppée d'hyphes filamenteux, et les deux organismes finissent par constituer un thalle visible. La durée d'une génération est probablement d'environ 17 ans. À la différence de nombreux autres lichens foliacés qui croissent sur des troncs d'arbre, l'anzie mousse-noire ne produit pas de propagules végétatives spécialisées qui constitueraient un moyen de reproduction asexuée.
Taille et tendances des populations
L'anzie mousse-noire semble avoir toujours été moins commune en Ontario et au Québec, et dans les États adjacents des États-Unis, qu'au Nouveau-Brunswick et en Nouvelle-Écosse. Dans les deux premières provinces, la présence du lichen n'a été signalée que quatre fois; tous les sites ont été visités de nouveau, mais l'anzie mousse-noire n'y a pas été retrouvée. Au Nouveau-Brunswick, on compte douze mentions de l'espèce, qui n'a pu être retrouvée pendant les recherches faites à six de ces sites en 2013.
En Nouvelle-Écosse, l'anzie mousse-noire n'est pas commune, mais elle est répandue. Trente-cinq occurrences ont été répertoriées dans la province depuis 1995. La population a été recensée aux neuf occurrences où elle a été observée pendant le travail sur le terrain effectué pour le présent rapport de situation. D'après ce recensement, la population totale de ce lichen au Canada pourrait s'établir à 3 700 individus, presque tous en Nouvelle-Écosse. De plus, le lichen n'était plus présent à trois des sept occurrences postérieures à 2006 qui ont été visitées à nouveau, ce qui indique un déclin d'environ 40 % au cours des dix dernières années.
Menaces et facteurs limitatifs
En Ontario et au Québec, la principale menace qui pèse sur l'anzie mousse-noire semble être la perturbation de l'habitat. Dans les rares sites où elle a été observée par le passé, l'étalement de la banlieue, les terrains à bâtir, les routes et les sentiers ont remplacé la forêt où elle poussait jadis. Les autres menaces probables dans ces provinces sont la pollution atmosphérique et la modification du régime climatique. La cause de la disparition de l'anzie mousse-noire de ces provinces n'est pas établie avec certitude, mais il est significatif que des déclins aient aussi été constatés dans les États adjacents des États- Unis.
Au Nouveau-Brunswick et en Nouvelle-Écosse, la principale menace est à l'heure actuelle l'abattage des vieilles forêts de feuillus. Le broutage par des mollusques introduits est une autre menace dont l'impact est inconnu. L'anzie mousse-noire a peu de substances secondaires qui dissuaderaient les herbivores de la brouter. On croit que les changements du régime climatique ont accéléré la propagation et augmenté l'impact des mollusques brouteurs, et que ceux-ci peuvent nuire à la capacité de reproduction du lichen. Les minuscules spores de l'anzie mousse-noire renferment peu de ressources permettant au tube germinatif de se développer à la recherche d'un partenaire algal compatible, processus qui doit se reproduire à chaque génération. De plus, ses crampons robustes mais clairsemés, qui permettent aux petits thalles de s'agripper fermement à l'écorce des arbres, relâchent leur prise à mesure que le lichen croît, de sorte que celui-ci est susceptible d'être détaché par le vent, la pluie ou les animaux.
À long terme, les changements climatiques et les modifications du régime climatique devraient, selon les prévisions, réduire les précipitations ou augmenter l'évaporation. Ces facteurs auront vraisemblablement des répercussions sur la survie de l'anzie mousse-noire, puisque cette espèce a besoin d'une combinaison particulière de caractéristiques climatiques et de caractéristiques du peuplement forestier. L'anzie mousse-noire est dans une grande mesure limitée aux arbres qui poussent près de plans d'eau, comme les marécages, le bord des marécages, les lacs et les cours d'eau.
Protection, statuts et classements
NatureServe a attribué la cote mondiale G3 (vulnérable)/G5 (non en péril) à l'anzie mousse-noire. La cote mondiale arrondie est G4 (apparemment non en péril). Aux États- Unis, la cote nationale de l'espèce est NNR (non classée). Au Michigan, en Caroline du Nord et en Pennsylvanie, elle est cotée SNR (pas encore évaluée), mais au Wisconsin, elle est cotée SX (présumée disparue) et on pense qu'elle est disparue aussi en Ohio. Au Canada, l'anzie mousse-noire est cotée NNR (non classée) par NatureServe. En Ontario, sa cote est SH (peut-être disparue); au Québec, sa cote est SNR (pas encore évaluée).
À l'heure actuelle, l'anzie mousse-noire ne bénéficie d'aucune protection ni d'aucun statut juridique au Canada, bien qu'un certain nombre d'occurrences soient protégées en Nouvelle-Écosse parce qu'elles se trouvent dans des zones sauvages protégées par la province ou dans des parcs nationaux.

Photo : © Michael Burzynski
Description longue pour la figure 3
Photo d'une colonie d'arnica de Griscom (Arnica griscomii ssp. griscomii). Cette plante basse à fleurs voyantes produit une rosette de feuilles basilaires où prennent naissance les tiges florifères. Les fleurs sont jaunes et réunies en capitules. Chaque capitule comprend un disque central de fleurs parfaites entouré de rayons constitués de fleurs pistillées.
Justification de la désignation
Cette plante formant un tapis est endémique au golfe du Saint-Laurent, au Canada, et se rencontre uniquement sur de petites falaises calcaires isolées et dans les landes de calcaire, au Québec et sur l'île de Terre-Neuve. L'espèce est de plus en plus menacée par la modification de son habitat sous l'effet des changements climatiques. L'instabilité de certains sites accroît la menace d'un phénomène stochastique qui pourrait entraîner la disparition de certaines petites souspopulations. L'utilisation de véhicules tout-terrain dans les landes de calcaire est une préoccupation.
Description et importance de l'espèce sauvage
L'arnica de Griscom (Arnica griscomii ssp. griscomii) est une petite plante herbacée vivace produisant des fleurs jaune vif réunies en capitules ressemblant à ceux de la marguerite. L'espèce est endémique à la région du golfe du Saint-Laurent, au Canada, où elle se rencontre uniquement au Québec et dans l'île de Terre-Neuve. Les capitules sont produits par des tiges d'environ 20 cm de hauteur prenant naissance à l'intérieur d'un groupe de feuilles pratiquement couchées sur le sol. La plante se propage au moyen de ses rhizomes (tiges souterraines) et forme souvent des colonies denses. Avec ses groupes serrés de fleurs voyantes, l'espèce pourrait posséder le charisme nécessaire pour inspirer chez le public un intérêt pour la préservation des escarpements et landes calcaires ainsi que de leur flore.
Répartition
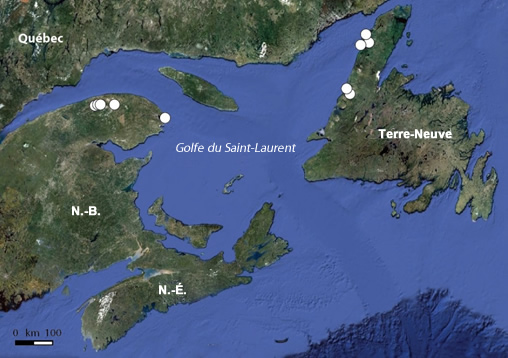
L'arnica de Griscom est endémique au Canada, et on n'en connaît que 8 souspopulations, dont 5 en Gaspésie, au Québec, et 3 dans l'île de Terre-Neuve.
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur l'arnica de Griscom au Canada.
Description longue pour la carte 3
Carte Google Earth annotée montrant la répartition canadienne de l'arnica de Griscom, qui est endémique de la région du golfe du Saint-Laurent et se rencontre uniquement au Québec et dans l'île de Terre-Neuve. Voir Tableau 2 dans l'Évaluation et Rapport de situation du COSEPAC sur L'arnica de Griscom Arnica griscomii ssp. griscomii au Canada pour plus d'information.
Habitat
L'arnica de Griscom pousse uniquement dans des sols riches en calcium. Elle préfère le plein soleil ou l'ombre partielle et se rencontre généralement sur des parois rocheuses et des talus d'éboulis, près d'affleurements rocheux et en bordure d'îlots de végétation dans les landes de graviers calcaires.
Biologie
L'arnica de Griscom est adaptée aux sites exposés où les conditions météorologiques sont extrêmes, et ses tiges meurent jusqu'à la surface du sol en hiver. La plante peut produire des graines sans qu'il y ait fécondation, et les graines sont transportées par le vent, comme celles du pissenlit. Des traces de broutage ont été observées, mais peu d'animaux semblent aimer consommer la plante. Étant donné ses exigences strictes en matière d'habitat et sa faible capacité de concurrencer les plantes à croissance plus rapide, l'arnica de Griscom a de la difficulté à coloniser de nouveaux sites.
Taille et tendances des populations
Il y a 125 individus florifères au Québec et environ 10 500 à Terre-Neuve. Les souspopulations de Terre-Neuve semblent stables, alors que celles du Québec sont peut-être en déclin.
Menaces et facteurs limitatifs
L'arnica de Griscom est principalement limitée par la compétition que lui livrent les plantes à croissance plus rapide. Elle ne peut prospérer que dans les milieux où les autres espèces sont désavantagées par les conditions édaphiques et climatiques extrêmes. Le changement climatique est probablement la principale menace pour l'espèce, car il y a un risque élevé que d'autres espèces profitent du climat plus doux pour supplanter l'arnica de Griscom. Les autres menaces mineures sont le piétinement par l'orignal et le caribou des bois, le piétinement et l'endommagement de l'habitat par les humains et leurs véhicules ainsi que le prélèvement d'individus pour l'horticulture.
Protection, statuts et classements
Toutes les sous-populations d'arnica de Griscom, sauf une, sont situées dans des parcs fédéraux ou des aires protégées provinciales et jouissent ainsi d'une certaine protection conférée par la réglementation de ces zones. La seule sous-population qui ne jouit d'aucune protection juridique est celle de l'île St. John, au large de la côte ouest de Terre-Neuve. Au Québec, l'arnica de Griscom est une « espèce menacée » aux termes de la loi provinciale.
À l'échelle mondiale, l'arnica de Griscom a reçu la cote de conservation G5T2 (l'espèce dans son ensemble n'est pas en péril, mais la sous-espèce du golfe du Saint- Laurent est en péril). Le taxon a également reçu la cote N2 (en péril) à l'échelle du Canada, la cote S1 (gravement en péril) à l'échelle du Québec et la cote S1S2 (gravement en péril à en péril) à l'échelle de Terre-Neuve-et-Labrador. Aux fins de la Situation générale des espèces sauvages au Canada, l'arnica de Griscom est considérée comme « en péril » au Québec et « possiblement en péril » à Terre-Neuve-et-Labrador.

Photo : © John Klymko
Description longue pour la figure 4a
Photo d'un bourdon terricole (Bombus terricola) récoltant du nectar sur une fleur jaune. Le bourdon terricole est un bourdon de taille moyenne à la tête courte (l'espace malaire est à peine plus long que large). Le patron de coloration jaune et noir de l'abdomen est distinctif. Le corps est couvert d'une pubescence courte et uniforme.
Justification de la désignation
Ce bourdon a une vaste répartition au Canada, allant de l'île de Terre-Neuve et des provinces maritimes, vers l'ouest jusqu'à l'est de la Colombie-Britannique, et vers le nord dans les Territoires du Nord-Ouest et dans l'extrême sud-ouest du Yukon. Peut-être entre 50 % et 60 % de l'aire de répartition mondiale de cette espèce se trouve au Canada. Cette espèce était historiquement l'une des espèces les plus communes de bourdon au Canada au sein de son aire de répartition. Toutefois, alors que cette espèce demeure relativement abondante dans la partie nord de son aire de répartition, elle a récemment connu un déclin d'au moins 34 % dans des zones du sud du Canada. Les causes du déclin demeure imprécises, cependant l'utilisation de pesticides, la conversion de l'habitat et la propagation de pathogènes provenant de colonies de bourdons aménagées seraient des facteurs contributifs.
Description et importance de l'espèce sauvage
Le bourdon terricole est un bourdon de taille moyenne, à tête et à langue courtes comparativement à celles d'autres espèces. Le patron de coloration distinctif à bandes abdominales jaune(s) et noires est constant à l'échelle de l'aire de répartition de l'espèce. Cette espèce est un important pollinisateur de nombreuses espèces de plantes cultivées et indigènes.
Répartition
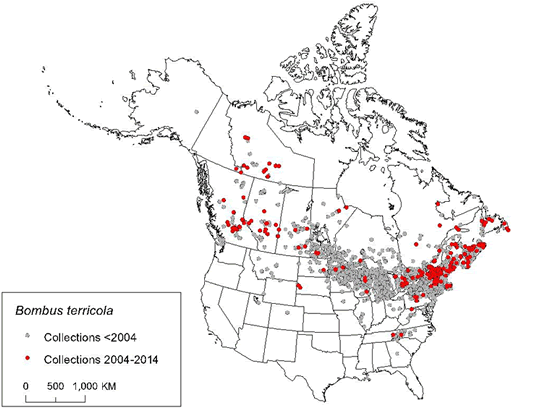
Le bourdon terricole se rencontre dans l'est de l'Amérique du Nord depuis le New Jersey jusqu'à Terre-Neuve-et-Labrador et, vers l'ouest, dans le nord des États-Unis et la plupart des régions du Canada jusqu'au sud des Territoires du Nord-Ouest, le sud-est du Yukon et l'est de la Colombie-Britannique. Dans la portion méridionale de son aire de répartition, des mentions dispersées de l'espèce ont été enregistrées en altitude dans les Appalaches, jusqu'en Géorgie au sud.
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur le bourdon terricole au Canada.
Description longue pour la carte 4
Carte illustrant l'aire de répartition mondiale du bourdon terricole, qui s'étend du sud vers le nord depuis la Géorgie jusqu'au Labrador en passant par l'est des États-Unis et, vers l'ouest, dans le nord des États-Unis jusqu'au Montana et au Canada jusqu'à la Colombie-Britannique et aux Territoires du Nord-Ouest. La carte indique les captures effectuées avant 2004 et celles effectuées entre 2004 et 2013.
Habitat
Le bourdon terricole fréquente divers types de milieux, dont des forêts mixtes, des terres agricoles, des zones urbaines, des prés de montagne, des prairies et des milieux boréaux. Il a été observé butinant les fleurs de plantes appartenant à de nombreux genres pour obtenir du pollen et du nectar. Comme de nombreuses espèces de bourdons, il aménage habituellement son nid dans des cavités préexistantes telles que des terriers abandonnés de mammifères et des troncs d'arbre pourris. Les reines hibernent dans le sol et dans des matières organiques en décomposition tels que des troncs d'arbre pourris.
Biologie
Le bourdon terricole a un cycle vital annuel. Les reines fécondées (fondatrices de nouvelles colonies) émergent de leur site d'hibernation au printemps et s'envolent à la recherche d'un site de nidification potentiel. Une fois ce site choisi, elles font provision de pollen et de nectar et retournent au nid pour y pondre les oeufs qui produiront la première cohorte d'ouvrières. Une fois émergées, ces dernières prennent en charge l'entretien du nid et l'approvisionnement de la colonie en pollen et en nectar. À la fin de l'été, des males et de nouvelles reines sont produits. Ces individus reproducteurs quittent la colonie pour s'accoupler, et les reines fécondées entrent en hibernation. Seules les jeunes reines fécondées passent l'hiver, et toutes les autres castes, incluant la vieille reine, meurent avant l'arrivée de l'hiver.

Photo : © Corey Sheffield
Description longue pour la figure 4b
Photo d'un bourdon terricole (Bombus terricola) récoltant du nectar. Le bourdon terricole est un bourdon de taille moyenne à la tête courte (l'espace malaire est à peine plus long que large). Le patron de coloration jaune et noir de l'abdomen est distinctif. Le corps est couvert d'une pubescence courte et uniforme.
Taille et tendances des populations
Le bourdon terricole était autrefois une des espèces les plus communes dans les échantillons de bourdons récoltés au Canada. Les populations ont toutefois commencé à décliner au début des années 1990 dans la portion sud-est de l'aire de répartition de l'espèce en Ontario. Dans de nombreux sites, le bourdon terricole représentait autrefois plus de 20 % de toutes les espèces de bourdons récoltées. Des études récentes (réalisées au cours des dix dernières années) indiquent que ce pourcentage est maintenant généralement inférieur à 4 %. Un déclin significatif de l'abondance de cette espèce a été noté à neuf des dix sites étudiés dans le sud et le centre du Canada, la réduction moyenne de son abondance relative s'établissant à 66,5 % entre avant et après les périodes d'échantillonnage de 10 ans. Cette espèce est aujourd'hui tenue pour absente dans de nombreux sites de collecte historiques dans ces régions. Quelques données de collecte ont toutefois été recueillies historiquement et plus récemment dans la portion septentrionale de l'aire de répartition de l'espèce, dans la forêt boréale.
Menaces et facteurs limitatifs
Le déclin du bourdon terricole est vraisemblablement dû à une combinaison de facteurs, mais ses causes précises demeurent méconnues. Les menaces potentielles pour l'espèce comprennent la propagation de pathogènes des colonies de bourdons domestiqués utilisés pour la pollinisation des cultures en serre aux espèces de bourdons indigènes lorsque les bourdons introduits s'échappent des serres, l'utilisation de pesticides (notamment de néonicotinoïdes) en agriculture, les changements climatiques et la perte d'habitat en milieu urbain et dans les régions soumises à une exploitation agricole intensive.
Protection, statuts et classements
Aucune loi canadienne n'assure une protection spécifique au bourdon terricole et à ses sites de nidification ou à son habitat. Au Québec, le bourdon terricole est inscrit sur la Liste des espèces susceptibles d'être désignées menacées ou vulnérables. NatureServe lui a attribué la cote de conservation mondiale G2G4 (en péril à apparemment non en péril).

Photo : © Mike McGrath
Description longue pour la figure 5a
Photos montrant un caribou de la population de Terre-Neuve (PTN) devant un lac. La fourrure du corps est brun clair, et avec un collier blanc autour du cou.
Justification de la désignation
Cette population a été évaluée la dernière fois en 2002 comme étant « non en péril » alors que la population comptait 85 000 individus. L'abondance de cette population a fluctué au cours des 100 dernières années et son nombre d'individus a maintenant diminué d'environ 60 % au cours des trois dernières générations de caribous. Le déclin a été causé par une nourriture limitée alors que la population connaissait une densité, une récolte et une prédation élevées. Différents indices semblent indiquer que la population connait une amélioration, mais on craint que le coyote de l'Est, lequel est récemment arrivé à Terre-Neuve, ne devienne un important prédateur et influence le recrutement de façon à ce que la population continue de diminuer.
Description et importance de l'espèce sauvage
Le caribou (Rangifer tarandus) est un cervidé de taille moyenne. Il possède des pattes assez longues et de gros sabots, qui facilitent sa survie dans les environnements nordiques. Le caribou se trouve au centre de la culture, de la vie spirituelle et des modes de subsistance de nombreuses collectivités autochtones et non autochtones partout au Canada. Sa morphologie, son écologie et son comportement sont très variables au sein de l'aire de répartition circumpolaire. En 2011, le Comité sur la situation des espèces en péril au Canada (COSEPAC) a reconnu 12 unités désignables (UD). Trois d'entre elles sont évaluées dans le présent rapport : la population de Terre-Neuve (PTN; UD 5); la population de la Gaspésie-Atlantique (PGA; UD 11) et la population boréale (PB; UD 6).
Répartition
À l'origine, le caribou occupait la totalité de l'île de Terre-Neuve, mais trois zones à très forte abondance ont été décrites au début du XXe siècle : la vallée de la rivière Humber, la partie centrale de l'île au sud de la voie ferrée et la presqu'île Avalon (Prichard, 1910, cité dans Banfield, 1961). Douze sous-populations de caribous étaient présentes avant l'établissement de nouvelles sous-populations par l'intermédiaire de plusieurs relocalisations réalisées dans les années 1960 et 1970 (Mercer et al., 1985). Jusqu'à 36 sous-populations ont existé (figure 1), mais il ne semble y en avoir que 14 aujourd'hui (Pardy-Moores, comm. pers.). On a observé des modifications de l'occupation dans certaines sous-populations; des preuves anecdotiques donnent à penser qu'un faible nombre de caribous a recommencé à occuper certaines (NLDEC, données inédites, 2013).
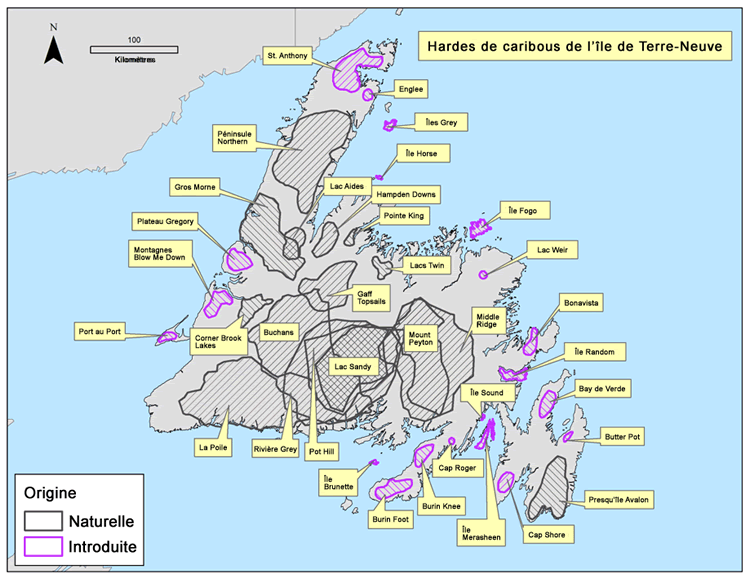
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le Caribou, population de Terre-Neuve, population de la Gaspésie-Atlantique et population boréale, au Canada.
Description longue pour la carte 5
Carte montrant la répartition de 36 sous-populations de caribous sur l'île de Terre-Neuve pendant les années 1990. Les zones abritant des sous-populations naturelles sont distinguées des zones abritant des populations introduites
Habitat
Les caribous de la PTN vivent dans les forêts de conifères, la toundra, les zones arbustives et les complexes de milieux humides. En général, plus les degrés de perturbation augmentent, plus les caribous privilégient les forêts de conifères à couvert fermé. Les perturbations anthropiques ont tendance à mener à la perte fonctionnelle de l'habitat résiduel.
Biologie
Les caribous mâles vivent habituellement moins de 10 ans, et les caribous femelles, moins de 15 ans. Les femelles âgées de 3 ans ou plus donnent naissance à un faon par an, soit un taux de reproduction global inférieur à celui d'autres d'espèces de cervidés d'Amérique du Nord. La durée d'une génération est estimée à 6 ans. Le succès reproducteur est étroitement lié à la disponibilité de la nourriture.

Photo : © John Blake, Newfoundland Wildlife Division
Description longue pour la figure 5b
Photos montrant un caribou de la population de Terre-Neuve (PTN) dans un paysage montagneux. La fourrure du corps est brun clair, et avec un collier blanc autour du cou.
Taille et tendances des populations
Depuis le début du XXe siècle au moins, la PTN connaît des fluctuations exceptionnelles. Après une estimation maximale de 100 000 individus dans les années 1900, la population a chuté d'environ 85 % pour s'établir à 10 000 à 15 000 individus entre 1925 et 1935. Elle a ensuite augmenté d'environ 84 % en 4 décennies, atteignant 94 000 individus au milieu des années 1990. En 2002, la PTN a chuté à 68 000 individus, puis a continué à baisser, pour atteindre 32 000 individus en 2013. La tendance sur 3 générations (18 ans; 1996-2013) est une baisse de 62 %. On pense que le déclin est attribuable à la faible disponibilité de la nourriture, laquelle a réduit la productivité et la survie des juvéniles, à la surchasse pendant la phase de déclin et peut-être à la prédation additive. Le déclin actuel semble faire partie des fluctuations naturelles de la population, et plusieurs indices de santé et de survie des faons relevés récemment donnent à penser que la population va augmenter.
Menaces et facteurs limitatifs
La persistance du caribou est principalement menacée par la perte d'habitat et la mortalité excessive, deux facteurs qui interagissent souvent puisque la prédation s'accroît en zones perturbées. Les perturbations anthropiques (p. ex. extraction et exploitation de ressources naturelles, aménagement de routes) et naturelles (p. ex. incendies de forêt, chablis) cumulatives sont associées au comportement d'évitement et à la baisse du recrutement en raison des taux de prédation accrus. Les activités de déboisement (p. ex. foresterie, exploitation pétrolière et gazière) font augmenter l'abondance d'autres proies (p. ex. orignal, cerf), ce qui peut entraîner une hausse des taux de mortalité du caribou. On estime que la prédation constitue une menace immédiate très importante pour le caribou dans les régions développées fréquentées par la PB ainsi que dans l'ensemble de l'aire de répartition de la PGA et, dans une mesure inconnue, mais probablement moindre, dans l'aire de répartition de la PTN. Dans la plus grande partie de cette dernière, les perturbations semblent moins importantes, car les incendies sont rares, et les activités forestières ou minières, relativement minimales. […]Des facteurs naturels, notamment les changements climatiques et les perturbations environnementales, peuvent avoir des répercussions sur l'habitat du caribou. La PTN, la PB et la PGA sont toutes associées, à diverses échelles, à des peuplements de conifères matures à anciens, qui sont touchés par des incendies. Or, les incendies se multiplieront vraisemblablement, en particulier dans l'aire de répartition de la PB. On connaît moins bien les effets des maladies, mais la propagation du ver des méninges dans certaines parties de l'aire de répartition de la PB ainsi que celle de plusieurs agents pathogènes dans les aires de répartition de la PB et de la PGA sont préoccupantes. Selon l'évaluation des menaces, l'impact global des menaces est « élevé-moyen » pour la PTN, « très élevé-très élevé » pour la PGA et « très élevé-élevé » pour la PB.
Protection, statuts et classements
Le COSEPAC a évalué la PTN en 1984, 2000 et 2002 et l'a désignée « non en péril ». La PTN a été classée S4 en 2012 à l'échelle provinciale. Dans l'aire de répartition de cette population, le bois n'a qu'une valeur marginale dans de vastes zones qui, par conséquent, ne risquent pas d'être perturbées à court terme par l'activité industrielle. […] Des plans d'aménagement forestier ont été modifiés pour aider le caribou dans certaines parties des trois UD, mais leur mise en oeuvre varie et leur efficacité est inconnue à ce jour. On a recours au contrôle des prédateurs chaque année depuis 2001 dans l'aire de répartition de la PGA et dans certaines parties de l'aire de répartition de la PB. Dans l'aire de répartition de la PTN, la chasse à l'ours noir et au coyote est autorisée, mais on n'a pas recours au contrôle direct des prédateurs.

Photo : © Denis Knopp
Description longue pour la figure 6
Photo de deux tiges florifères de céphalanthère d'Austin (Cephalanthera austiniae). Les tiges sont lisses, presque entièrement blanches et se terminent par jusqu'à 20 fleurs blanches groupées en un épi lâche. Les feuilles sont réduites à des écailles à base embrassante.
Justification de la désignation
Cette orchidée parasite se trouve en très faible nombre dans des localités dispersées dans le sud-ouest de la Colombie- Britannique. La disparition de certaines sous-populations ainsi qu'une fragmentation continue de l'habitat et une diminution de la qualité de l'habitat causées par le développement immobilier et les activités récréatives, rendent probable la disparition future de sous-populations. La dépendance de l'espèce à des conditions d'habitat spécifiques et son interdépendance avec un champignon et les espèces d'arbre qui y sont associées la rendent plus susceptible de disparaître.
Description et importance de l'espèce sauvage
La céphalanthère d'Austin (Cephalanthera austiniae) mesure jusqu'à 55 cm de hauteur et ne produit pas de chlorophylle; elle tire ses nutriments d'un champignon souterrain, lui-même associé à un arbre. L'espèce produit une tige lisse qui se termine par jusqu'à 20 fleurs blanches; les feuilles sont réduites à des écailles blanches de jusqu'à 10 cm de long, à base embrassante. Les fleurs dégagent un remarquable parfum de vanille et présentent une gorge jaune. L'espèce possède un rhizome mince muni de racines fibreuses ramifiées.
Répartition
La céphalanthère d'Austin est la seule représentante du genre Cephalanthera en Amérique du Nord. Elle pousse uniquement sur la côte nord-ouest du Pacifique, en Californie, en Oregon, dans l'État de Washington, en Idaho et en Colombie-Britannique. En Colombie-Britannique, on la rencontre uniquement dans l'extrême sud-ouest de la province, où des sous-populations ont été signalées dans le sud-est de l'île de Vancouver, dans l'île Saltspring ainsi que dans la vallée du bas Fraser.
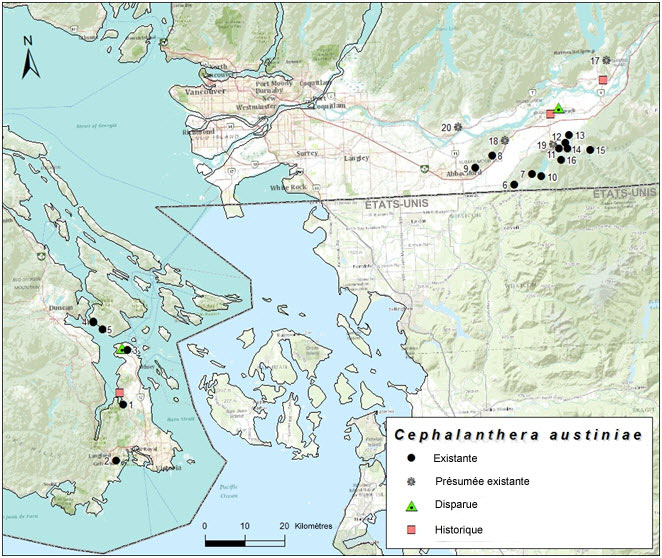
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur la céphalanthère d'Austin au Canada.
Description longue pour la carte 6
Carte montrant les occurrences (existantes, présumées existantes, disparues et historiques) de céphalanthère d'Austin en Colombie-Britannique, où l'espèce est présente dans les zones biogéoclimatiques côtière à douglas et côtière à pruche de l'Ouest. L'espèce est présente uniquement dans vallée du bas Fraser, entre les municipalités de Mission et de Chilliwack, dans l'île Saltspring ainsi que dans la grande région de Victoria, y compris la péninsule de Saanich, dans l'île de Vancouver.
Habitat
En Colombie-Britannique, la céphalanthère d'Austin se rencontre dans des forêts anciennes relativement peu perturbées et parfois dans des forêts de seconde venue âgées. Elle pousse généralement dans les forêts conifériennes ou mixtes et a besoin d'un réseau souterrain intact de champignons ectomycorihiziens. En Colombie-Britannique, la céphalanthère d'Austin est généralement observée dans les sites qui présentent une végétation au sol clairsemée et une épaisse litière de feuilles, mais elle a parfois été signalée dans des zones où les herbacées non graminoïdes et les arbustes sont abondants. En Colombie-Britannique, la céphalanthère d'Austin a été signalée à des altitudes allant de 0 à 550 m, sur des pentes de diverses inclinaisons (0 à 92 %), principalement dans des sites orientés au sud ou au sud-ouest. Dans certains sites, l'espèce pousse dans des sols à pH élevé, notamment des substrats rocheux carbonatés, des amas coquillers et des résidus miniers calcaires. La litière de feuilles produite par l'érable à grandes feuilles ou d'autres espèces d'arbres pourrait jouer un rôle important pour l'abaissement du pH dans certains autres sites.
Biologie
La céphalanthère d'Austin ne fleurit pas chaque année; la présence des fleurs permet de détecter l'espèce, mais ne reflète pas toute l'étendue souterraine des plantes. Les individus peuvent demeurer en dormance pendant un certain temps, et on ignore quels facteurs déclenchent la production des tiges florifères. La floraison s'échelonne dans le temps, du début mai à la mi-juillet, et des tiges florifères ont été observées jusqu'en septembre, mais ces mentions n'ont pas été confirmées. On ne connait pas les pollinisateurs de la céphalanthère d'Austin en Colombie-Britannique. La céphalanthère d'Austin est capable d'auto-pollinisation, et des taux considérables d'autofécondation ont été observés chez d'autres espèces du genre Cephalanthera, ce qui donne à penser qu'elles pourraient aussi s'autopolliniser. Comme les autres orchidées, les espèces du genre Cephalanthera produisent un très grand nombre de minuscules graines qui sont dispersées par le vent, généralement sur de courtes distances (moins de 6 m). En Colombie-Britannique, très peu de tiges florifères produisent des capsules ou des graines matures.
Pour se nourrir, la céphalanthère d'Austin parasite un champignon mycorhizien, qui est lui-même associé aux racines d'un arbre. La santé de l'arbre et du champignon mycorhizien est essentielle à la survie de l'espèce. Selon des études moléculaires réalisées dans des populations de céphalanthère d'Austin aux États-Unis, l'espèce s'associe uniquement à une espèce de champignon de la famille des Thelephoraceae.
Taille et tendances des populations
Neuf sous-populations étaient mentionnées dans le rapport de situation précédent (COSEWIC, 2000). Depuis, trois sites appartenant à deux sous-populations sont disparus, et on présume qu'une sous-population entière est disparue. Dans le cas de deux autres sous-populations, aucun individu de l'espèce n'a été observé depuis 2000 et 2006. Toutefois, ces sous-populations n'ont pas fait l'objet de relevés réguliers, et des individus de l'espèce pourraient y être en dormance; on présume donc que l'espèce y est encore présente, mais elle pourrait y être disparue. Depuis la publication du rapport de situation précédent, neuf nouvelles sous-populations de céphalanthère d'Austin ont été découvertes, et de nouveaux sites ont été trouvés à l'intérieur de sous-populations déjà connues. On compte actuellement 20 sous-populations connues de céphalanthère d'Austin au Canada, qui englobent 76 sites existants. En 2013, le nombre de tiges florifères observées dans chaque sous-population allait de 0 (individus en dormance) à 76.
Il est difficile de dégager des tendances quant au nombre total de tiges florifères, en raison des activités de suivi irrégulières, des périodes de dormance et de la variation des conditions climatiques annuelles, facteur pouvant avoir une incidence sur la floraison. Selon l'estimation des effectifs réalisée en 2013, dans le cadre de laquelle toutes les souspopulations, sauf 4, ont fait l'objet de nouveaux dénombrements, la population totale compte environ 344 tiges florifères. Le nombre de tiges florifères pourrait constituer une légère surestimation du nombre d'individus matures, car les tiges florifères qui sont très rapprochées pourraient appartenir à un même individu (il faudrait creuser pour déterminer le lien exact entre les tiges, ce qui pourrait tuer la plante). Cependant, l'effectif total pourrait aussi constituer une sous-estimation, car il est impossible de dénombrer les individus en dormance.
Le nombre d'individus estimé en 2013 est plus élevé que celui qui figurait dans le rapport de situation précédent (49 tiges florifères selon le rapport de situation du COSEPAC de 2000), ce qui est attribuable à une intensification des activités de recherche plutôt qu'à une augmentation du nombre d'individus dans les sites déjà connus. La population est gravement fragmentée, car la majorité des individus sont répartis entre des sous-populations petites, relativement isolées et probablement pour la plupart d'une faible viabilité.
Menaces et facteurs limitatifs
La principale menace pesant sur la céphalanthère d'Austin est la destruction de son habitat associée au développement résidentiel rapide. La majorité des sites hébergeant la céphalanthère d'Austin se trouvent sur des terrains privés (une partie ou la totalité des sites de 12 des 20 sous-populations se trouvent sur des terrains privés). Les terrains privés qui hébergent la céphalanthère d'Austin appartiennent à 22 propriétaires distincts, et plusieurs de ces propriétaires ont l'intention de subdiviser leur terrain. Certaines activités des propriétaires pourraient menacer la céphalanthère d'Austin, notamment l'entretien de la construction de bâtiments et de jardins, le fauchage accidentel et le piétinement. En outre, l'espèce est menacée par les activités d'exploitation forestière, qui peuvent directement détruire son habitat ou entraîner des modifications du régime hydrologique et des conditions d'ensoleillement, éliminer les arbres hôtes, détruire son champignon hôte, créer des effets de bordure et accroître la fragmentation. Les activités récréatives, notamment la randonnée pédestre et l'utilisation de motos hors-piste, peuvent endommager les individus de l'espèce ou leur habitat. Parmi les autres menaces, on compte la concurrence exercée par les plantes envahissantes, la cueillette de plantes, le surpâturage par les cerfs, les répercussions associées à la petite taille et au caractère isolé des sous-populations ainsi que les menaces pesant sur les espèces associées.
Protection, statuts et classements
La céphalanthère d'Austin figure à l'annexe II de la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction ainsi qu'à l'annexe 1 de la Loi sur les espèces en péril(LEP) du Canada, à titre d'espèce menacée. Un programme de rétablissement provincial, actuellement au stade d'ébauche, a été préparé pour l'espèce.
En Colombie-Britannique, la céphalanthère d'Austin est cotée S2 (en péril) à l'échelle provinciale et figure sur la liste rouge du Centre de données sur la conservation de la province. Au Canada, NatureServe a attribué à la céphalanthère d'Austin la cote N2 (en péril) à l'échelle nationale. À l'échelle mondiale, l'espèce est cotée G4 (apparemment non en péril).
Même si 12 des 20 sous-populations de céphalanthère d'Austin sont entièrement ou partiellement situées sur des terrains privés, 10 des sous-populations bénéficient d'une certaine protection, car elles sont situées en partie ou en totalité dans des parcs régionaux, des terres de la Couronne provinciales, des terres de la Couronne municipales, une réserve écologique gérée par BC Parks et un terrain appartenant au ministère de la Défense nationale. Une sous-population située sur des terres de la couronne provinciales est actuellement protégée de l'exploitation forestière à l'intérieur d'une zone d'habitat faunique.

Photo : © Adam Martinson
Description longue pour la figure 7
Photo d'un crotale des prairies (Crotalus viridis) montrant un Crotalidé au corps massif. Ce serpent est de couleur havane et présente des bandes ou des taches plus foncées sur le dos ainsi que des anneaux foncés sur la queue. Comme tous les crotales, le crotale des prairies possède une queue se terminant par des segments cornés (cascabelle) de même que des fossettes thermosensibles placées sous les yeux.
Justification de la désignation
Cette espèce a connu des déclins depuis les années 1930, résultant principalement d'une perte d'habitat à grande échelle en raison de la culture et d'une augmentation de la mortalité attribuable à la circulation routière. Certaines populations locales ont connu d'importants déclins récents, et l'espèce fait encore face à de graves menaces à l'échelle de son aire de répartition canadienne. L'espèce pourrait devenir « menacée » si les facteurs dont on craint l'influence négative sur sa persistance ne sont ni renversés ni gérés avec une efficacité démontrée.
Description et importance de l'espèce sauvage
Le crotale des prairies est un Crotalidé au corps massif. Il est de couleur havane et présente des bandes ou des taches plus foncées sur le dos ainsi que des anneaux foncés sur la queue qui sont habituellement olive à bruns. Les adultes atteignent en moyenne une longueur museau-cloaque de 120 cm et un poids de 1 000 g. Comme tous les crotales, le crotale des prairies possède une queue se terminant par des segments cornés (cascabelle) de même que deux fossettes thermosensibles placées sous les yeux et deux crochets rétractables à la mâchoire supérieure. Le crotale des prairies est l'une des trois espèces de crotales présentes au Canada et a fait l'objet de nombreuses études scientifiques en Alberta et en Saskatchewan. Cette espèce est l'un des symboles des Prairies canadiennes; la protection de son habitat de prairie contribuera à la conservation d'un écosystème en péril à l'échelle mondiale
Répartition
L'aire de répartition mondiale du crotale des prairies s'étend depuis le nord du Mexique jusqu'au sud du Canada, en passant par le centre des États-Unis. Au moins 3% de son aire de répartition se trouve au Canada. L'aire de répartition canadienne de l'espèce se limite au sud-est de l'Alberta et au sud-ouest de la Saskatchewan, où l'espèce est fortement associée aux vallées de cours d'eau importants. Un déclin de l'aire de répartition historique est présumé au Canada; toutefois, l'aire de répartition connue de l'espèce est demeurée relativement stable au cours des 40 dernières années. On compte environ 230 localités (c.-à-d. hibernacula) de l'espèce au Canada. Grâce à l'intensification des activités de recherche, le nombre de localités répertoriées a augmenté au cours des 15 dernières années, et cette tendance devrait se maintenir. Malgré la découverte de tanières, on note un déclin continu récent et prévu d'environ 30% du nombre de localités de crotale des prairies au Canada.
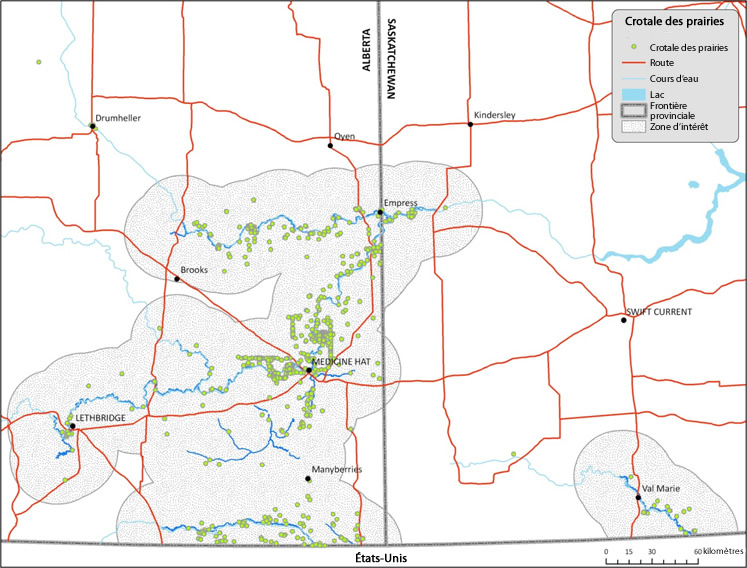
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur le crotale des prairies au Canada.
Description longue pour la carte 7
Carte montrant la zone d'occupation biologique maximale du crotale des prairies au Canada, estimée en fonction d'une zone tampon de 30 km calculée à partir de tous les cours d'eau le long desquels la présence d'hibernacula a été confirmée. Cette carte a été produite en 2009 à l'aide de données d'occurrence portant sur une période inconnue. Les mentions d'observation qui y sont indiquées montrent qu'il existe une nette disjonction entre le groupe d'observations effectuées le long de la rivière Frenchman, près de Val Marie, en Saskatchewan, et le reste de l'aire de répartition canadienne.
Habitat
Les individus de l'espèce ont besoin d’hibernacula, d'aires d'alimentation, de sites de gestation et de corridors de déplacement reliant ces éléments. Le crotale des prairies est souvent associé à des cours d'eau et à des fonds de coulées, à des prairies de terrain élevé ou à des badlands. Les refuges, comme les terriers ou les arbustes, constituent un microhabitat essentiel pour l'espèce. Les hibernacula sont généralement situés sur des versants exposés au sud ou à l'est, dans les bassins versants de cours d'eau importants. Ils comportent des ouvertures donnant accès à un milieu souterrain propice. Les sites de gestation offrent des conditions optimales pour le développement des jeunes et la protection contre les prédateurs. La superficie moyenne du domaine vital du crotale des prairies au Canada varie de 4 à 109 ha. La plus grande partie de la perte d'habitat (prairie) au Canada s'est produite avant les années 1930, en raison de l'agriculture. Quoi qu'il en soit, on a établi un déclin continu et prévu de 3 à 18 % de la superficie de l'habitat disponible du crotale des prairies au Canada, principalement en raison de l'expansion de l'agriculture intensive, mais aussi à cause des effets combinés du forage pétrolier et gazier, de l'urbanisation et des réseaux routiers
Biologie
Plusieurs comportements du crotale des prairies le rendent vulnérable aux menaces anthropiques. Parmi ces comportements figurent : 1) le rassemblement saisonnier des crotales aux sites d'hivernage et de gestation, 2) leur grande fidélité à l'égard des hibernacula et des sites de gestation, 3) les grandes distances parcourues par les individus entre les aires d'hivernage et les aires d'alimentation, 4) leur grande fidélité à l'égard des corridors de déplacement saisonniers et 5) leur comportement défensif caractéristique. Certains attributs biologiques limitent la capacité du crotale des prairies de se rétablir à la suite de déclins d'origine anthropique. Ces attributs comprennent la maturité tardive de l'espèce, sa croissance lente, son cycle de reproduction biennal ou triennal, le faible nombre de petits par portée, le taux élevé de mortalité juvénile et la durée considérable des générations
Taille et tendances des populations
On estime la taille de la population totale de crotale des prairies au Canada à au moins 22 300 (20 400 – 28 300) individus, dont au moins 14 900 (13 600 – 18 900) sont des adultes. La variation annuelle de la taille de la population adulte dans une localité donnée est probablement minime en conditions naturelles. En conséquence, une variation appréciable de l'abondance de l'espèce sur une courte période est probablement causée par l'activité humaine. Au cours des 40 dernières années, des déclins de l'abondance du crotale des prairies dans quelques tanières au Canada ont été inférés sur la base de données anecdotiques ou ont été déterminés dans le cadre d'études empiriques. Des déclins futurs des effectifs sont également prévus. Le crotale des prairies connaît un déclin continu de son abondance à l'échelle de son aire de répartition canadienne.
Menaces et facteurs limitatifs
La viabilité des populations de crotale des prairies au Canada est menacée par de nombreuses activités humaines. Ces activités sont associées aux catégories de menaces suivantes : routes et voies ferrées, chasse et capture, cultures annuelles et pérennes de produits autres que le bois, forage pétrolier et gazier, et zones résidentielles et urbaines. Ces menaces combinées contribuent à la perte, à la dégradation ou à la fragmentation de l'habitat et peuvent être une cause directe ou indirecte de mortalité, qu'il s'agisse de mortalité individuelle ou massive (p. ex., persécution de l'espèce dans les hibernacula). Parmi toutes les menaces pesant sur le crotale des prairies, les menaces que représentent les routes sont celles qui devraient avoir le plus d'impact sur la persistance de l'espèce au Canada au cours des dix prochaines années.
Protection, statuts et classements
Le crotale des prairies est considéré comme « non en péril » à l'échelle mondiale et aux États-Unis. Au Canada, l'espèce est considérée comme « vulnérable » à l'échelle nationale et « préoccupante » en Alberta. L'espèce n'avait pas été évaluée auparavant par le COSEPAC et n'est pas protégée en vertu de la Loi sur les espèces en péril du gouvernement fédéral. Aux termes de la Wildlife Act de la Saskatchewan et de la Wildlife Act de l'Alberta, il est interdit de posséder des individus de l'espèce ou de leur nuire de quelque façon que ce soit sans permis. Ces lois offrent également une certaine protection contre la destruction des hibernacula. Les gouvernements fédéral et provinciaux possèdent des terres d'une superficie combinée d'au moins 4 550 km² dans l'aire de répartition du crotale des prairies au Canada.

Photo : © Gary Allen
Description longue pour la figure 8
Photo en gros plan d'une fleur de cypripède blanc (Cypripedium candidum), orchidée vivace clonale. La fleur comprend un labelle en forme de petite poche rappelant une pantoufle. Il est long de 1,7 à 2,7 cm et blanc avec des veines ou des taches violacées. Les pétales et les sépales qui l'entourent sont tordus et verts à jaune brunâtre, généralement avec des stries ou des taches violet rougeâtre.
Justification de la désignation
Cette orchidée est connue au Canada au Manitoba et en Ontario où elle pousse principalement dans des prairies d'herbes hautes et des prairies mixtes. Ces sites nécessitent une gestion pour empêcher l'empiètement par la végétation ligneuse et pour demeurer convenables pour l'orchidée. Des activités de recherche accrues ont permis de découvrir des populations non connues auparavant au Manitoba, mais de nombreuses populations sont petites, et certaines sont disparues au cours des dernières années. La découverte de populations additionnelles, une protection accrue de l'habitat ainsi qu'une gestion active pour cette espèce ont mené à un changement de statut, passant d'espèce « en voie de disparition » à espèce « menacée ». Étant donné que la croissance des individus est lente et qu'un champignon partenaire est requis, l'espèce est particulièrement vulnérable aux disparitions locales. En plus de l'empiètement, l'espèce est menacée par les espèces végétales envahissantes, la modification de l'hydrologie, le développement résidentiel et commercial, l'entretien des bords de route et la collecte illégale.
Description et importance de l'espèce sauvage
Le cypripède blanc est une orchidée vivace qui produit des clones. Chaque individu produit une ou plusieurs tiges hautes d'environ 15 cm au moment de la floraison. Chaque tige possède trois ou quatre feuilles simples alternes à base embrassante. Chaque tige florifère porte généralement une fleur blanche en forme de petite poche, rappelant une pantoufle. Au Canada, la floraison a lieu de la mi-mai à la mi-juin. Les fruits sont produits à la fin de l'été et renferment de nombreuses graines minuscules.
Répartition
Actuellement, l'aire de répartition du cypripède blanc comprend 18 États et 2 provinces. Moins de 10 % de son aire mondiale se trouvent au Canada, et les sous-populations existantes se situent dans le sud de l'Ontario et au Manitoba. Les sous-populations du Manitoba se trouvent à environ 1 300 km de celles de l'Ontario. En Ontario, les sous-populations sont également éloignées les unes des autres, la souspopulation du comté de Hastings étant située à environ 400 km des sous-populations de l'île Walpole. Parmi les 39 sous-populations canadiennes connues, 22 sont considérées comme existantes, et environ la moitié de celles-ci comprennent un faible nombre d'individus matures.
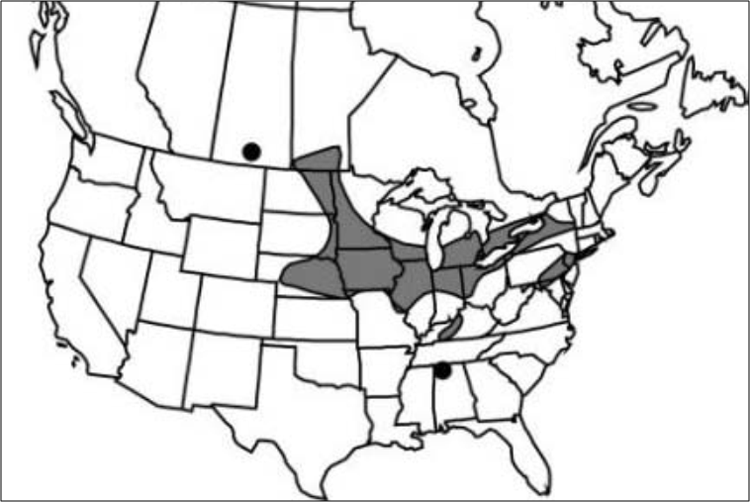
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le cypripède blanc au Canada.
Description longue pour la carte 8
Carte montrant l'aire de répartition mondiale du cypripède blanc, dans l'est de l'Amérique du Nord. L'aire actuelle comprend 18 États et 2 provinces. Aux États-Unis, l'espèce est considérée comme existante en Alabama, au Connecticut, en Illinois, en Indiana, en Iowa, au Kentucky, au Maryland, au Michigan, au Minnesota, au Missouri, au Nebraska, au New Jersey, dans l'État de New York, au Dakota du Nord, en Ohio, au Dakota du Sud, en Virginie et au Wisconsin et est considérée comme disparue en Pennsylvanie. Elle n'est plus considérée comme disparue au New Jersey et au Missouri. Au Canada, on trouve des sous-populations existantes au Manitoba et en Ontario.
Habitat
Au Canada, le cypripède blanc pousse généralement dans des fragments de prairies reliques indigènes humides et calcaires, y compris les vestiges de prairie situés dans les fossés qui bordent les routes et sont entourés de terres agricoles. Dans la plupart des sites, il semble y avoir un certain suintement des eaux souterraines. Sur les crêtes et à proximité des arbres ou des arbustes hauts, l'espèce privilégie les sites orientés vers le sud ou l'ouest, puisqu'elle ne tolère pas l'ombre. La sous-population du comté de Hastings pousse dans une tourbière minérotrophe.
Biologie
Le cypripède blanc produit sa première feuille à l'âge d'environ 3 ans et fleurit pour la première fois à l'âge de 12 ans ou plus. L'espèce est capable de demeurer en dormance pendant des périodes prolongées, et son rhizome peut survivre sous terre pendant jusqu'à 6 ans, en attendant l'arrivée de conditions propices à la production des parties aériennes. Au Manitoba, les gelées printanières tardives peuvent réduire la production de fruits de telle sorte qu'elle ne représente que 1 ou 2% de la production habituelle. Même si les graines microscopiques peuvent être dispersées sur des milliers de kilomètres par le vent, elles doivent s'associer avec des champignons terricoles précis qui fournissent les éléments nutritifs nécessaires à la germination.
Taille et tendances des populations
Au Manitoba, il y a environ 22 000 individus matures (tiges florifères). En Ontario, on trouve environ 536 individus matures dans la sous-population du comté de Hastings. On ne dispose actuellement d'aucune donnée pour les sous-populations de l'île Walpole. Puisque l'espèce peut demeurer en dormance sous terre durant de longues périodes et que le nombre de tiges florifères varie d'un individu à l'autre, les estimations de l'abondance du cypripède blanc comportent un degré élevé d'incertitude, et il est difficile d'évaluer les tendances des populations.
Menaces et facteurs limitatifs
Les menaces les plus imminentes et les mieux connues pesant sur le cypripède blanc sont associées à la destruction, à la dégradation et à la fragmentation de son habitat de prairie. Parmi les facteurs naturels et anthropiques qui contribuent à la diminution continue de la qualité et de la superficie de l'habitat, on compte l'empiètement des espèces ligneuses, les espèces envahissantes et le développement urbain. Au Manitoba, 9 des 19 sous-populations existantes sont limitées aux prairies reliques subsistant en bordure de routes. Dans ces milieux, les individus risquent d'être directement endommagés par les activités comme le fauchage en période de floraison et de fructification, l'entretien des clôtures et des câbles des services publics, l'application d'herbicides et le piétinement. En outre, l'espèce est particulièrement vulnérable à la collecte illégale dans ces sites facilement accessibles.
Les facteurs limitatifs naturels sont les quantités de lumière et d'eau disponibles, le faible taux de survie des semis, la maturité tardive, le faible taux de reproduction sexuée, la faible diversité génétique, la dépendance à l'égard de champignons terricoles et de pollinisateurs spécifiques, la concurrence exercée par les espèces ligneuses et les mauvaises herbes, le broutage, les gelées printanières tardives et l'hybridation. L'hybridation de l'espèce avec le cypripède jaune a été observée dans toute l'aire nord-américaine de celle-ci. Cependant, l'assimilation génétique du cypripède blanc par le cypripède jaune ne semble pas imminente dans les endroits où le cypripède blanc est plus abondant (ce qui est le cas dans la plupart des sous-populations canadiennes).
Protection, statuts et classements
Le cypripède blanc a été évalué pour la première fois par le COSEPAC en 1981 et a alors été désigné « espèce en voie de disparition ». Ce statut a été réexaminé et confirmé par le COSEPAC en avril 1999 et en mai 2000. Le statut a été réexaminé par le COSEPAC en novembre 2014, et l'espèce a alors été désignée comme étant « menacée ». Le cypripède blanc actuellement inscrit à titre d'espèce en voie de disparition dans l'annexe 1 de la Loi sur les espèces en péril du Canada. L'ébauche d'un programme de rétablissement fédéral a été présentée à Environnement Canada en 2011, et celle-ci comprend une proposition quant à l'habitat essentiel à désigner. Le cypripède blanc est désigné « espèce en voie de disparition » sous les régimes de la Loi sur les espèces en voie de disparition du Manitoba et de la Loi de 2007 sur les espèces en voie de disparition de l'Ontario.
Les sous-populations de cypripède blanc se trouvent sur des terrains privés, des terres provinciales ou des terres des Premières nations. La plupart des autres souspopulations ne sont pas protégées adéquatement, en raison d'un manque de sensibilisation (souvent attribuable à des changements de propriétaires ou de gestionnaires) ou d'un manque de renseignements et de ressources pour gérer l'habitat de façon à favoriser le cypripède blanc.

Photo : © Allan Harris
Description longue pour la figure 9
Photographie d'une coquille d'escargot-forestier écharge (Allogona profunda) montrant la spire déprimée. La coquille est jaune pâle et présente des bandes brunes, et sa surface est couverte de stries très fines qui traversent les tours.
Justification de la désignation
Au Canada, on ne connait cet escargot terrestre de grande taille que dans le parc national de la Pointe-Pelée et sur l'île Pelée. Une surabondance de Cormorans à aigrettes nicheurs a probablement mené à la perte de sous-populations sur certaines petites îles du lac Érié depuis le début des années 1980; des pertes historiques de zones boisées et de forêts ont également été constatées sur la terre ferme et sur l'île Pelée. Les menaces importances et continues importantes proviennent des activités récréatives et de l'érosion des berges. Une menace possible est la prédation par les Dindons sauvages introduits, dont le nombre augmente rapidement.
Description et importance de l'espèce sauvage
L'escargot-forestier écharge est un grand escargot terrestre (environ 30 mm de diamètre). La coquille présente habituellement une petite dent bien distincte sur le bord inférieur de l'ouverture, et un grand ombilic dégagé (un trou dans la partie centrale du dessous de la coquille). Le bord de l'ouverture de la coquille est blanc et s'évase vers l'extérieur. La coquille est jaune pâle et présente souvent des bandes brun pâle, et sa surface est couverte de stries très fines. Il est possible que les populations canadiennes d'escargot-forestier écharge soient génétiquement isolées d'autres populations, et elles pourraient avoir une importance particulière sur le plan de la conservation.
Répartition
L'aire de répartition de l'escargot-forestier écharge s'étend du sud de l'Ontario et de la péninsule supérieure du Michigan jusqu'au nord de l'Alabama, vers le sud, et jusqu'en Pennsylvanie et en Caroline du Nord, vers l'est. Des coquilles fossilisées trouvées le long du fleuve Mississippi, aussi loin au sud qu'en Louisiane, indiquent la limite sud de son aire de répartition durant le Pléistocène. Au Canada, l'espèce est confinée à la région de la forêt carolinienne de l'Ontario, sur la rive nord et les îles du lac Érié. La présence des sous-populations connues se limite actuellement à la Pointe-Pelée et à l'île Pelée, mais on compte des mentions historiques sur les plus petites îles du lac Érié et sur plusieurs sites continentaux.
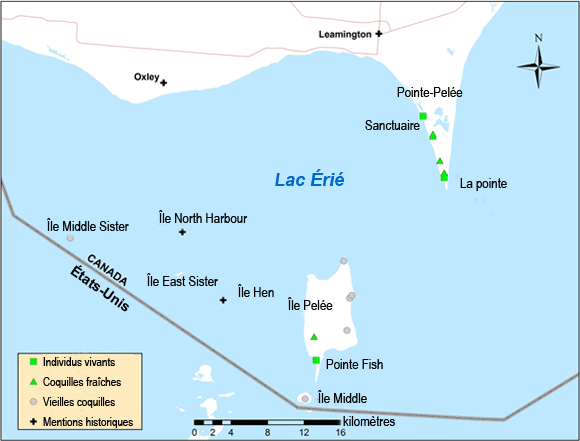
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur l'escargot-forestier écharge au Canada.
Description longue pour la carte 9
Carte montrant la répartition des mentions de l'escargot-forestier écharge à la Pointe-Pelée et sur les îles du lac Érié en 2013. La carte indique la présence d'individus vivants et de coquilles fraîches à la Pointe-Pelée et sur l'île Pelée. Il y a des mentions historiques de l'espèce sur l'île Middle, sur l'île Middle Sister, sur l'île East Sister, sur l'île North Harbour, sur l'île Hen, à Leamington et à Oxley.
Habitat
L'habitat de l'escargot-forestier écharge est constitué de forêts de feuillus. En Ontario, les sous-populations existantes se trouvent principalement dans les forêts et les zones boisées, dans un sol sableux. Des coquilles vides ont été trouvées sur certains sites bordant des forêts de feuillus et s'étendant à des alvars boisés (sol peu profond sur lit de calcaire) et à de la végétation arbustive sur sol sableux.
Biologie
On dispose de peu d'information sur la biologie de l'escargot-forestier écharge. Il s'agit d'un escargot terrestre à respiration aérienne. Les individus sont hermaphrodites (ils possèdent des organes reproducteurs mâles et femelles), et les deux membres d'un couple reproducteur produisent du sperme et des oeufs. L'escargot-forestier écharge peut atteindre la maturité en seulement un an, et vit au moins quatre ans. Pour hiberner, les individus s'enfouissent entre 5 à 10 cm dans le sol ou dans des dépressions peu profondes du tapis forestier, où la litière de feuilles agit comme isolant. L'escargot-forestier écharge est actif durant la nuit et le jour, mais a souvent besoin de s'abriter sous la litière de feuilles entre le milieu du matin et la fin de l'après-midi. La recherche de nourriture a habituellement lieu au sol. À cet égard, il semble que les plantes vertes et les champignons qui poussent sur des grumes en décomposition constituent d'importantes sources d'alimentation pour l'espèce. Les escargots terrestres ont besoin de milieux très humides pour s'alimenter, se déplacer et se reproduire, et la plupart des espèces ne sont présentes que dans les milieux forestiers ou boisés qui offrent de l'ombrage et retiennent l'humidité, par exemple dans le sol ou la litière de feuilles. Les individus ne se déplacent probablement que sur quelques mètres au cours de leur vie; les oeufs et les individus immatures ne se disperseraient ni par le vent ni par l'eau.
Taille et tendances des populations
La population canadienne a sans doute baissé au début du 19e siècle, quand la majeure partie de l'aire de répartition de l'espèce au Canada a été défrichée aux fins de l'agriculture. Plus récemment, le nombre de sites occupés a diminué avec la disparition apparente des sous-populations des îles Middle Sister, East Sister et Middle. La taille de la population globale est inconnue.
Menaces et facteurs limitatifs
Les menaces historiques et récentes qui pèsent sur l'espèce comprennent le déboisement et les Cormorans à aigrettes. La majeure partie de la couverture forestière dans la portion continentale de l'aire de répartition de l'escargot-forestier écharge a été défrichée depuis des décennies, et les populations actuelles se trouvent dans des zones où la menace de nouvelles coupes est négligeable. Les colonies de nidification des Cormorans à aigrettes ont considérablement augmenté sur les petites îles du lac Érié depuis le début des années 1980, et les changements de l'habitat associés au dépérissement de la végétation et à l'altération des propriétés chimiques du sol ont probablement contribué à la disparition des escargots sur ces îles. Les Cormorans préfèrent nidifier sur des îles inhabitées, et il est peu probable qu'ils colonisent la Pointe-Pelée et l'île Pelée.
Les menaces actuelles sont moins bien comprises. Le piétinement découlant de l'utilisation récréative des sentiers est probablement responsable de la mortalité des escargots à la Pointe-Pelée et à l'île Pelée. Les escargots peuvent aussi être tués par des brûlages dirigés. L'altération des processus de rivage, causée par les changements climatiques et l'aménagement des rives, entraîne une érosion considérable à la Pointe-Pelée et à l'île Pelée. De plus, la présence de plantes et de lombrics envahissants dans le sud de l'Ontario pourrait avoir modifié les écosystèmes forestiers et l'habitat des escargots. Enfin, l'introduction du Dindon sauvage et du Faisan de Colchide pourrait constituer une source supplémentaire de prédation.
Protection, statuts et classements
L'escargot-forestier écharge n'est protégé par aucune loi, réglementation, règle coutumière ou circonstance particulière au Canada, sauf dans les cas indiqués ci-après. L'espèce ne figure ni dans la liste de l'Endangered Species Act des États-Unis ni dans celle d'autres lois étatiques ou provinciales. Elle ne figure pas dans la liste des espèces visées par la Convention sur le commerce des espèces de faune et de flore sauvages menacées d'extinction (CITES). L'escargot-forestier écharge et son habitat sont protégés dans le parc national de la Pointe-Pelée et dans la réserve naturelle provinciale de la pointe Fish par la réglementation fédérale et provinciale sur les parcs, mais l'espèce demeure vulnérable face à certaines menaces comme les espèces envahissantes, le piétinement accidentel découlant des activités récréatives, etc.
La cote de conservation accordée à l'espèce à l'échelle nationale est G5 (non en péril), et la cote infranationale pour l'Ontario est S1 (gravement en péril). Aucune cote n'a été attribuée à l'espèce dans la plupart des États où elle est présente.

Photo : © John D. Ambrose
Description longue pour la figure 10
Photo de frênes bleus (Fraxinus quadrangulata) poussant sur une falaise rocheuse. Le tronc du frêne bleu est droit ou irrégulier et la cime est étroite, petite et de forme arrondie. L'écorce écailleuse est de couleur claire, gris rougeâtre ou gris havane. Les feuilles sont opposées et composées; elles comportent sept folioles. Les rameaux sont quadrangulaires en raison de la présence de quatre crêtes ou ailerons subéreux.
Justification de la désignation
Cet arbre a une répartition limitée dans les forêts caroliniennes du sud-ouest de l'Ontario. La petite taille de la population totale que l'on retrouve dans un paysage fragmenté, combinée avec l'impact potentiel croissant du broutage par le cerf de Virginie et l'infestation de l'agrile du frêne, une espèce envahissante, exposent l'espèce à un risque de connaître d'autres déclins dans la plupart des sites. De plus, les arbres matures sur l'île Middle sont menacés par les impacts causés par les Cormorans à aigrettes nicheurs. Ces facteurs ont mené à un changement de statut, passant d'espèce « préoccupante » à « menacée ».
Description et importance de l'espèce sauvage
Le frêne bleu est un arbre de dimensions moyennes, d'environ 20 m de hauteur et de jusqu'à 80 cm de diamètre. Il compte parmi les six espèces de frêne indigènes du Canada. Le tronc est droit ou irrégulier et la cime est étroite, petite et de forme arrondie. L'écorce écailleuse est de couleur claire, gris rougeâtre ou gris havane. Les feuilles sont composées et opposées; elles comportent 7 (5-11) folioles. Les rameaux sont quadrangulaires en raison de la présence de 4 crêtes ou ailerons subéreux très apparents (d'où l'épithète spécifique quadrangulata). Des grappes de petites fleurs sans pétales apparaissent au printemps à mesure que les nouvelles feuilles se déroulent. Le fruit est une samare uniséminée, habituellement tordue; son aile large porte une encoche. Le frêne bleu possède le trait distinctif de garder ses branches inférieures mortes, ce qui lui donne un aspect négligé. L'écorce interne contient une substance collante qui tourne au bleu quand elle est exposée à l'air (d'où le nom commun de l'espèce).
Répartition
Le frêne bleu a une répartition restreinte au Canada. Il se rencontre uniquement dans le sud-ouest de l'Ontario, dans les comtés et municipalités de Middlesex, Elgin, Lambton, Chatham-Kent et Essex, notamment à la pointe Pelée, dans l'île Peche à l'embouchure de la rivière Détroit, dans les îles du lac Érié, ainsi que dans les vallées des rivières Thames et Sydenham et du ruisseau Catfish. Cet arbre est plus largement répandu aux États-Unis, depuis l'Ohio vers le sud, jusqu'en Alabama, en Géorgie et en Arkansas, et vers l'ouest, jusqu'au Wisconsin, en Oklahoma et au Kansas.
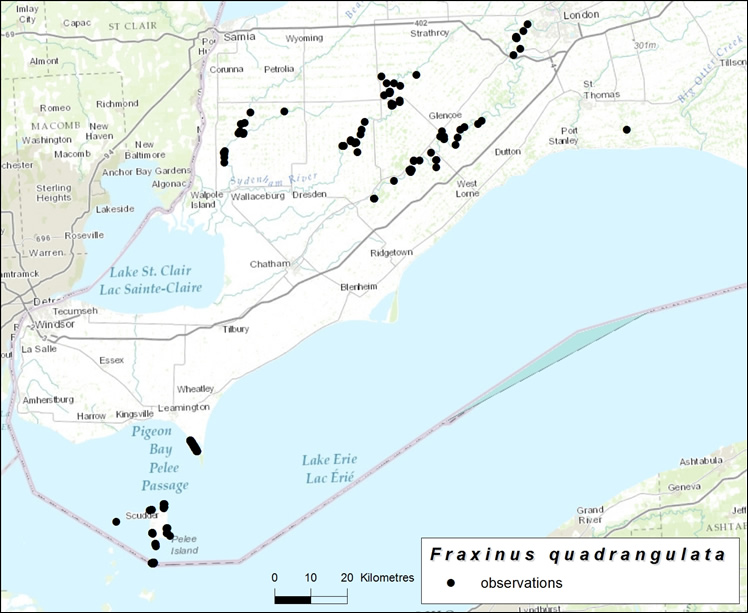
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le frêne bleu au Canada.
Description longue pour la carte 10
Carte de l'aire de répartition des sous-populations existantes de frêne bleu en Ontario. L'essence se trouve dans les sites suivants : pointe Pelée, île Peche, îles du lac Érié et vallées de la rivière Thames, de la rivière Sydenham et du ruisseau Catfish.
Habitat
Le frêne bleu pousse dans divers types d'habitat et de sol. En Ontario, il se trouve dans trois types d'habitat distincts : les plaines d'inondation et les vallées fluviales où il pousse dans des sols riches en association avec une variété d'autres essences; les sols peu profonds recouvrant des alvars et du calcaire dans les îles du lac Érié; et les plages stabilisées du parc national de la Pointe-Pelée et de la pointe Fish de l'île Pelée. La superficie et la qualité de tous ces milieux ont diminué au cours du dernier siècle. Bien que les effets de la fragmentation de l'habitat sur le frêne bleu n'aient pas été évalués, ce facteur devrait mener à la dégradation de l'environnement et peut-être à la dégradation des gènes de l'essence au cours d'une plus longue période, ce qui pourrait contribuer à réduire la probabilité de survie des sous-populations.
Biologie
À la différence des autres espèces de frêne, les fleurs du frêne bleu porte les organes de reproduction mâle et femelle. L'espèce se reproduit par graines et rien n'indique une propagation par voie clonale. Le frêne bleu peut vivre jusqu'à 300 ans (habituellement 150 à 200 ans) et atteint la maturité (mise à fruit) à environ 25 ans. Il produit à tous les 3 ou 4 ans des graines qui sont dispersées par le vent. La plupart se dispersent probablement en-deçà de 10 m de l'arbre parent, mais un petit nombre peuvent se disperser jusqu'à 200 m. Des graines peuvent être transportées sur de plus longues distances par l'eau ou des animaux.
Taille et tendances des populations
En 1983, la présence du frêne bleu a été signalée à14 sites dans quatre secteurs du sud-ouest de l'Ontario. Dès 2000, des recherches additionnelles avaient permis de répertorier un total de 37 sous-populations existantes. En 2001, 19 autres sites ont été répertoriés; la somme de ces 19 sites et des 37 sous-populations se traduit par un total de 56 sites. La population canadienne totale en 2001 a été estimée à moins de 1 000 arbres matures. Des travaux de terrain menés en 2012 et 2013 donnent à penser que le frêne bleu est plus abondant que ce qui avait été documenté par le passé. L'information sur environ la moitié des sites connus (n = 26) a été rassemblée et 1 806 arbres ont été dénombrés. De ceux-ci, 708 (39 %) étaient considérés comme matures (capables de produire des graines). De grands nombres de semis et de gaules ont été observés à quelques sites, en particulier dans le parc national de la Pointe-Pelée et la parcelle McAlpine de la rivière Sydenham.
Menaces et facteurs limitatifs
Depuis la dernière évaluation du statut, l'impact possible du broutage par les cerfs sur le recrutement et l'établissement du frêne bleu s'est révélé une préoccupation plus grande que celle indiquée précédemment. Bien que quelques sites recensés renfermaient de très grands nombres de semis et de jeunes arbres, il y avait peu d'indications de régénération à de nombreux autres, ce qui donne à penser que le broutage exercé par les cerfs pourrait empêcher l'établissement de jeunes arbres. De plus, l'agrile du frêne, un coléoptère non indigène envahissant, s'impose comme une nouvelle menace pour les espèces de frêne indigènes, dont le frêne bleu. Dépisté pour la première fois en Amérique du Nord en 2002, l'agrile du frêne s'est rapidement propagé. Au cours des relevés de 2012 et de 2013, des signes de l'agrile du frêne ont été décelés à 45,8 % (11 sur 26) des sites et chez 70 frênes bleus (3,7 %). Bien que, jusqu'à maintenant, peu de frênes bleus semblent avoir été tués par l'agrile du frêne (0,26 % des arbres recensés) et qu'ils semblent y être résistants, nul ne sait si l'impact de cet envahisseur augmentera à l'avenir. Parmi les autres menaces pesant sur le frêne bleu s'inscrivent les pratiques d'aménagement forestier qui peuvent comprendre l'abattage d'individus de l'espèce à cause de leur identification erronée par des propriétaires fonciers ou des autorités – soit délibérément ou par suite des mesures de gestion associées à l'agrile du frêne; l'altération des régimes de perturbations naturelles par le biais de la suppression des feux de forêt et de la gestion de l'eau; les impacts de l'élevage de bétail, y compris le broutage et le piétinement dans les milieux riverains; les activités récréatives (p. ex. les véhicules tout terrain dans les secteurs locaux), qui pourraient nuire à la régénération à cause du piétinement; et, dans l'île Middle, la nitrification des sols et les dommages aux arbres causés par le guano et les activités de nidification des Cormorans à aigrettes.
Protection, statuts et classements
Le COSEPAC a évalué le frêne bleu pour la première fois en avril 1983 et l'a désigné « espèce préoccupante ». Il a confirmé ce statut en novembre 2000. Lors du dernier réexamen, réalisé en novembre 2014, le frêne bleu a de nouveau été désigné « espèce menacée ». Le frêne bleu est désigné « espèce préoccupante » en vertu de la Loi sur les espèces en péril (2003) du gouvernement fédéral et de la Loi de 2007 sur les espèces en voie de disparition du gouvernement de l'Ontario. Bien que le frêne bleu soit considéré comme non en péril à l'échelle mondiale (G5) et non en péril à l'échelle nationale aux États-Unis (N5), il est considéré comme vulnérable (N3) au Canada et non classé en Ontario (S3?). Il est désigné « gravement en péril » (S1) en Virginie-Occidentale, en Pennsylvanie, au Wisconsin et en Iowa; « en péril » (S2) au Kansas et au Mississippi; et « vulnérable » (S3) en Virginie. Le frêne bleu est classé comme une espèce « gravement en péril à en péril » (S1S2) en Géorgie et « en péril à vulnérable » (S2S3) en Oklahoma. Il n'est pas classé (SNR) dans tous les autres États où il se trouve.

Photo : © Jason Gibbs
Description longue pour la figure 11
Photo d’un halicte de l’île de Sable (Lasioglossum sablense) mâle (vue latérale). Sur les pattes arrière et l’abdomen, l’abeille, à l’éclat métallique terne, est couverte de poils qui servent à recueillir le pollen. Elle porte une ponctuation dense sur la face dorsale du thorax, près de la base des ailes.
Justification de la désignation
À l'échelle mondiale, cette espèce est endémique à l'île de Sable, en Nouvelle-Écosse, et est présente sous la forme d'une population isolée ayant une très petite aire de répartition et aucune possibilité d'immigration de source externe. L'île n'a seulement qu'environ 13 km² de zone végétalisée qui fournit des sites d'alimentation et de nidification pour cette abeille. La nidification se fait probablement près ou dans cette zone végétalisée et les halictes ne sont pas connus pour parcourir de grandes distances (c.-à-d. > 200 m) pour s'alimenter. La fréquence et la gravité accrue des tempêtes, en plus des changements climatiques et de l'élévation du niveau de la mer qui y est associée, devraient provoquer des changements qui réduiront davantage la qualité et la quantité de l'habitat de l'abeille sur l'île. L'écotourisme représente également une menace potentielle future, qui pourrait aussi favoriser l'introduction et la propagation d'espèces envahissantes. L'habitat sur l'île est également vulnérable aux espèces de plantes envahissantes, aux chevaux introduits et aux inondations par l'eau de mer.
Description et importance de l'espèce sauvage
L'halicte de l'île de Sable (Lasioglossum sablense Gibbs) est une petite abeille (5– 6 mm) à l'éclat métallique terne qui appartient à la famille des Halictidés. L'espèce est endémique au Canada et unique à l'île de Sable, en Nouvelle-Écosse. Les halictes des 2 sexes se distinguent des 3 autres espèces d'abeilles de l'île de Sable (dont 2 appartiennent à la famille des Halictidés) à la fois par leur petite taille et leur ponctuation latérale dense sur la face dorsale du thorax.
Répartition
L'aire de répartition mondiale et canadienne de l'espèce est confinée à l'île de Sable, en Nouvelle-Écosse. Elle mesure approximativement 34 km² et exclut la zone intertidale. L'île est séparée de la partie continentale de la Nouvelle-Écosse par une distance 150 km.
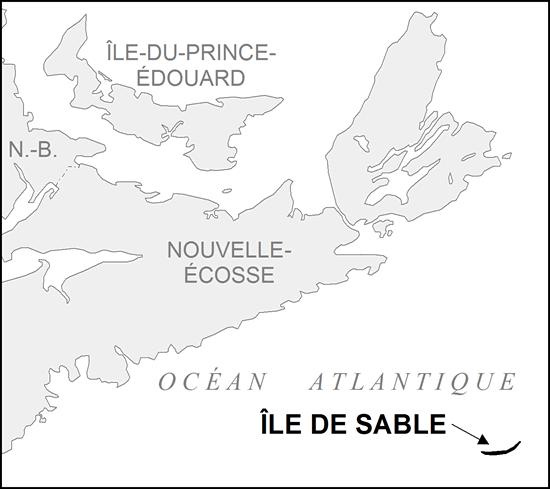
Carte créée par Mark L. Richardson (Environnement Canada).
Description longue pour la carte 11
Carte localisant l'Île de Sable, environs à 150 km au large de la Nouvelle-Écosse
Habitat
L'île de Sable est principalement formée de sols sablonneux à faible teneur en matière organique. Environ 13 à 15 km² de l'île (39 %) sont recouverts de végétation, et cette superficie est considérée comme un habitat potentiel de l'halicte. Les zones de végétation se composent de quelques communautés végétales distinctes, dont les plus importantes sont les prairies de plantes ammophiles, les terres partiellement couvertes de graminées et les étendues d'Éricacées. Les conditions climatiques sont fraîches, brumeuses et caractérisées par de grands vents durant l'été, et les conditions sont relativement douces en hiver. Les femelles creusent des nids souterrains. Les abeilles visitent les plantes à fleurs à la recherche de ressources en pollen et en nectar.
Biologie
L'halicte de l'île de Sable est une espèce généraliste qui récolte le pollen et le nectar d'une grande diversité de fleurs et construit son nid dans le sol. Les femelles qui ont été fécondées hivernent en tant qu'adultes et émergent au printemps pour construire des nids. Les femelles et les mâles reproducteurs sont produits à la fin de l'été. La saison de vol des adultes dure au moins du 1er juin au 11 septembre. Chez certaines espèces apparentées, une organisation sociale dans les nids a été observée, mais le comportement social de l'halicte de l'île de Sable n'a jamais été étudié.
Taille et tendances de la population
Il est impossible d'estimer la taille de la population d'halictes de l'île de Sable, compte tenu de la disponibilité des données recueillies sur cette espèce. Des quatre espèces d'abeilles fréquentant l'île de Sable, l'halicte de l'île de Sable est le moins souvent capturé. Les mentions historiques sont trop éparses pour bien estimer les tendances historiques. Les proportions relatives des deux espèces d'halictes de l'île, soit le L. novascotiae (Mitchell) et l'halicte de l'île de Sable, capturées au moyen de filets en 1966-1967, 2008 et 2013 sont comparables (3:1, 1:1, 2:1, respectivement).
La taille de la population a probablement diminué avec le temps, à cause de la réduction de l'étendue géographique de la zone de végétation sur l'île de Sable.
Menaces et facteurs limitatifs
La perte d'habitat due au recouvrement de la végétation par le sable ou à la submersion des basses terres par l'élévation du niveau de la mer aurait des effets négatifs sur la taille de la population d'halictes de l'île de Sable. Des conditions météorologiques difficiles pourraient aggraver cet effet tout en réduisant les activités de recherche de nourriture des adultes.
Les activités humaines passées ont peut-être aussi réduit l'étendue et la diversité de la végétation florifère. Les activités humaines en cours sont minimes en raison de l'isolement de l'île et du contrôle des visiteurs. L'augmentation du nombre de visiteurs sur l'île pourrait entraîner l'introduction d'espèces d'abeilles non indigènes.
Protections, statuts et classements
Aucune loi fédérale ou provinciale ne protège l'halicte de l'île de Sable. Aucune cote de conservation n'a été attribuée à cette espèce. L'habitat de l'espèce se trouve dans la réserve de parc national de l'Île-de-Sable, qui est protégée en vertu de la Loi sur l'Agence Parcs Canada.

Photo : © Robert P. Dana
Description longue pour la figure 12
Photo en vue latérale d'une hespérie de Poweshiek (Oarisma Poweshiek). Les nervures du dessous des ailes, surlignées d'écailles blanches, contrastent avec le fond brun pâle des ailes.
Justification de la désignation
La population canadienne est isolée et discontinue des populations des États-Unis, lesquelles se trouvent à 1000 km au sud. Des déclins généralisés au cours de la dernière décennie des deux côtés de la frontière signifient que le Canada comprend une partie significative de l'aire de répartition mondiale de l'espèce. Au Canada, cette espèce est limitée aux prairies indigènes à herbes hautes, un habitat qui a également connu des déclins semblables. Bien que la majeure partie de l'habitat occupé soit protégée, même avec une gestion appropriée, l'aire de répartition de ce papillon est si petite que l'espèce est de plus en plus vulnérable aux phénomènes stochastiques.
Description et importance de l'espèce sauvage
L'hespérie de Poweshiek est un petit papillon diurne de 24 à 30 mm d'envergure. Le dessus des ailes est brun foncé, avec les régions costale et basale des ailes antérieures suffusées d'orange. En dessous, les nervures des ailes postérieures sont surlignées d'écailles blanches qui contrastent avec le fond brun pâle des ailes. Cette hespérie se reconnaît facilement à son vol flottant. Elle fait partie d'un groupe très restreint de papillons diurnes spécialistes confinés aux prairies indigènes à grandes graminées au Canada. Elle n'est plus représentée que par une population au Canada et quelques populations isolées aux États-Unis. La disparition de cette espèce au Canada marquerait la perte d'un élément important de l'écosystème prairial, lui-même en voie de disparition.
Répartition
Anciennement, l'hespérie de Poweshiek se rencontrait depuis le sud-est du Manitoba jusqu'en Iowa en passant par l'est des Dakotas et l'ouest du Minnesota et formait des populations isolées dans le sud-est du Wisconsin, le nord-ouest de l'Illinois et le sud du Michigan. L'étendue réelle de son aire de répartition historique demeure incertaine, car une grande partie du territoire anciennement occupé par la prairie à grandes graminées a été convertie en terres agricoles au milieu des années 1800, avant même que soient constituées la plupart des collections de papillons diurnes dans la région. L'aire de répartition mondiale de l'hespérie de Poweshiek s'est considérablement contractée depuis le début des années 2000, et elle n'englobe plus aujourd'hui que le Manitoba, le Michigan et le Wisconsin. La population canadienne est isolée des populations états-uniennes et occupe un très petit territoire d'environ 40 km² d'habitat prairial dans le sud-est du Manitoba.
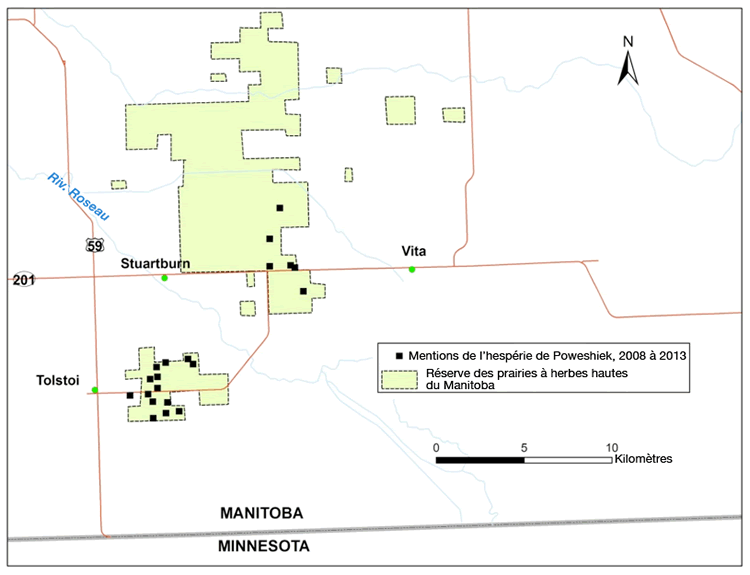
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur l'hespérie de Poweshiek au Canada.
Description longue pour la carte 12
Carte montrant l'aire de répartition canadienne de l'hespérie de Poweshiek dans le sud-est du Manitoba (établie d'après les relevés réalisés de 2008 à 2013), ainsi que les limites de la Réserve des prairies à herbes hautes du Manitoba. On distingue deux principaux foyers de population, séparés par une distance de 7 à 10 kilomètres. Un de ces foyers s'étend de part et d'autre de la route provinciale 201 entre Stuartburn et Vita, tandis que l'autre se trouve à l'est de Tolstoi.
Habitat
Au Canada, l'hespérie de Poweshiek se rencontre dans des prairies à grandes graminées humides à mésiques qui couvrent moins de 1 hectare à plusieurs centaines d'hectares. Ces milieux prairiaux consistent souvent en de longues ouvertures réparties dans des peuplements de chêne à gros fruits et de peuplier faux-tremble qui agissent comme brise-vent. Les parcelles d'habitat exploitées par l'espèce englobent des sections de prairie plus humides et d'autres plus sèches. La végétation des zones plus humides est dominée par diverses espèces de saules, la deschampsie cespiteuse, l'agrostide blanche, la muhlenbergie de Richardson, diverses cypéracées et l'éléocharide grêle. Dans les portions plus sèches, le barbon de Gérard, le sporobole à glumes inégales et diverses herbacées non graminoïdes dominent. Les plantes hôtes larvaires exploitées par l'hespérie de Poweshiek incluent le barbon de Gérard, le faux-sorgho penché et la muhlenbergie de Richardson. L'éléocharide uniglume est probablement aussi une plante hôte larvaire. La présence de la rudbeckie hérissée est également importante, car cette composée est la plante nectarifère préférée des adultes.
Biologie
L'hespérie de Poweshiek a une seule génération par année. Au Manitoba, la période de vol s'étend de la fin de juin à la fin de juillet et atteint généralement son point culminant entre le début et le milieu de juillet. Les adultes émergent plus tôt au cours des étés chauds et vivent quelques jours à une semaine. Les mâles patrouillent leur habitat à la recherche de femelles non accouplées en survolant les plantes hôtes et les graminées. Après s'être accouplées, les femelles déposent leurs oeufs sur le dessus des feuilles des plantes hôtes. L'éclosion survient dans les neuf ou dix jours suivants. Les chenilles subissent cinq mues et hibernent au cinquième stade, sur la face inférieure du limbe d'une feuille de graminée ou près de la base de la tige de la plante hôte. Au printemps, les chenilles redeviennent actives avec le retour des journées chaudes, se nourrissent et subissent deux à quatre mues additionnelles avant de se nymphoser au début de juin. Les adultes émergent environ deux semaines plus tard. Les mâles se dispersent sur une distance de 1,0 à 1,6 km, mais ils ne franchissent probablement pas les boisés denses, les cultures en rangs et les milieux où la végétation n'est pas dominée par les graminées. Les routes peuvent agir comme des barrières entre des parcelles d'habitat prairial propice ou des colonies de plantes nectarifères.
Taille et tendances des populations
On ne dispose d'aucune estimation de la taille des populations. Les fluctuations d'effectifs sont difficiles à déceler en raison des réactions de l'espèce au feu et à d'autres perturbations et à la variabilité de l'effort de recherche. Jamais plus de 240 adultes ont été dénombrés au cours d'une année depuis 2002. La taille de la population canadienne est vraisemblablement largement inférieure aux estimations de 5 000 à 10 000 individus proposées il y a un certain nombre d'années. La zone d'occurrence et la zone d'occupation ont peu changé depuis 2002.
Menaces et facteurs limitatifs
L'évolution naturelle due à la succession végétale des milieux prairiaux ouverts en milieux dominés par les arbustes ligneux et les arbres représente une menace pour l'habitat de l'hespérie de Poweshiek. En l'absence de perturbations naturelles telles que les feux de friches ou le broutage par le bison des plaines, une espèce indigène, les espèces ligneuses finissent par remplacer la végétation de prairie. On a eu recours au brûlage dirigé et au broutage par le bétail pour freiner la croissance de la végétation ligneuse dans l'habitat de l'hespérie de Poweshiek, mais les perturbations excessives qui surviennent à un moment inapproprié ou qui ont des impacts cumulatifs peuvent occasionner une forte mortalité larvaire et réduire l'abondance des plantes nectarifères. Les feux de friches se produisent à intervalles irréguliers et amplifient le risque de mortalité. Les feux fréquents (intervalle inférieur à cinq ans) représentent probablement la menace la plus importante pour l'hespérie de Poweshiek. Historiquement, la disparition et la fragmentation de l'habitat constituaient également des menaces, mais de nos jours, la conversion de l'habitat n'est plus considérée comme une menace dans la majorité des sites canadiens. La faible superficie de la zone d'occurrence accentue la vulnérabilité des populations canadiennes aux phénomènes météorologiques extrêmes.
Protection, statuts et classements
L'hespérie de Poweshiek a été désignée « menacée » par le COSEPAC en 2003 et inscrite comme telle dans la Loi sur les espèces en péril du gouvernement fédéral en 2005. L'habitat essentiel de l'espèce a été désigné, et il abrite environ 99 % de la population canadienne. L'espèce est inscrite à titre d'espèce « en voie de disparition » dans la Loi sur les espèces en voie de disparition du Manitoba. L'hespérie de Poweshiek est cotée G1 (gravement en péril) à l'échelle mondiale et, à l'échelle nationale, N2 (en péril) au Canada et N1 (gravement en péril) aux États-Unis. Le rang attribué selon la situation générale des espèces au Canada est « possiblement en péril ». La majeure partie de l'habitat de l'hespérie de Poweshiek se trouve dans la Réserve des prairies à herbes hautes du Manitoba, qui fait l'objet d'une gestion axée sur la conservation des prairies et n'est donc vraisemblablement pas menacée par le développement ou la conversion des terres à d'autres fins.

Photo : © Michael Runtz
Description longue pour la figure 13a
Photographie d'un loup de l'Est (Canis sp. cf. lycaon) du parc provincial Algonquin (Ontario) vu de côté. Le loup de l'Est présente habituellement un pelage plus fauve ou brun roux (roux sur les pattes avant) que ceux du loup gris et du loup boréal/des Grands Lacs.
Justification de la désignation
Cette espèce est un canidé de taille intermédiaire présentant un pelage brun-rougeâtre/fauve. La taille de sa population est petite (probablement < 1000 individus) et son aire de répartition, restreinte, se limite au centre-sud de l'Ontario et au centre-sud du Québec. La plupart des enregistrements proviennent de zones protégées dispersées, là où la mortalité ainsi que le taux d'hybridation avec le coyote de l'Est se produisent moins fréquemment qu'ailleurs dans son aire de répartition. Une expansion de la population est peu probable, en raison de la compétition avec le coyote de l'Est et d'un accroissement du taux de mortalité hors des zones protégées.
Description et importance de l'espèce sauvage
Le loup de l'est (espèce présumée Canis lycaon, anciennement Canis lupus lycaon) est un canidé de taille intermédiaire dont les femelles pèsent en moyenne 24 kg et les mâles 29 kg. La couleur de son pelage est souvent décrite comme étant brun-roux ou fauve, mais elle est très variable. Le loup de l'Est se définit par une combinaison de différences génétiques, de traits morphologiques et du rôle écologique qu'il joue en raison de sa préférence pour de plus petites proies que le loup gris (C. lupus). Comme le loup de l'Est s'hybride à divers degrés avec le coyote (C. latrans), on en définit les individus comme ceux présentant une grande « pureté » génétique distincte du loup gris et du coyote dans les analyses de génétique moléculaire. Il est important de remarquer que le loup de l'Est abordé dans le présent rapport n'est pas le même que le loup de l'Est de la région des Grands Lacs qui est abordé dans des rapports antérieurs et que le présent rapport désigne loup boréal/des Grands Lacs (Great Lakes/Boreal Wolf), un hybride entre le loup de l'Est et le loup gris. Bien que beaucoup de données appuient la validité du loup de l'Est comme espèce, sa taxinomie reste controversée. Le présent rapport considère le loup de l'Est comme Canis sp. c.f. lycaon, une espèce sauvage qui doit être protégée en raison de son caractère distinct, de sa persistance et de son importance comme grand carnivore, et parce qu'il s'agit sans doute d'une partie de la dernière population vestige de l'espèce de Canis de grande taille de l'est de l'Amérique du Nord. Les connaissances traditionnelles autochtones mentionnent l'existence d'un Canis de taille moyenne dans la région.

Photo : © Michael Runtz
Description longue pour la figure 13b
Photographie de deux loups de l'Est (Canis sp. cf. lycaon) du parc provincial Algonquin (Ontario) vu de face. Le loup de l'Est présente habituellement un pelage plus fauve ou brun roux (roux sur les pattes avant) que ceux du loup gris et du loup boréal/des Grands Lacs.
Répartition
On croit que la répartition du loup de l'Est est actuellement restreinte aux forêts mixtes (conifères et feuillus) du centre de l'Ontario et du sud-ouest du Québec, soit dans la région des Grands Lacs et du Saint-Laurent. Le loup de l'Est est disparu de la majeure partie de son aire de répartition d'origine en Amérique du Nord en raison de l'éradication des grands Canis durant quatre siècles. Selon les analyses génétiques, le loup de l'Est est présent dans le centre de l'Ontario et le sud du Québec (au nord du fleuve Saint-Laurent), formant des concentrations dans des aires protégées.
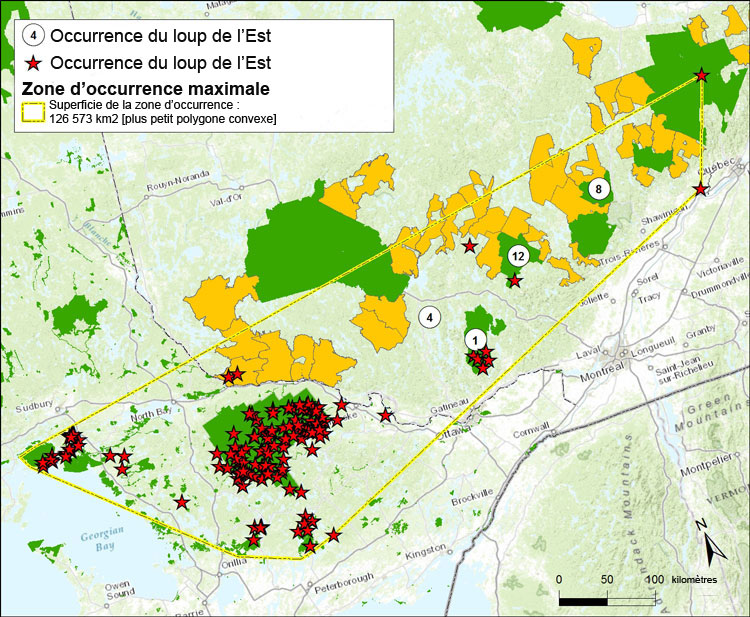
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur le loup de l'Est au Canada.
Description longue pour la carte 13
Carte délimitant la zone d'occurrence actuelle (126 573 km²) du loup de l'Est d'après l'analyse génétique de Canis échantillonnés depuis le Manitoba jusqu'aux provinces maritimes, notamment dans une bonne partie de la région des Grands Lacs. Les sites où le loup de l'Est a été trouvé sont indiqués par des symboles. Les aires protégées, les réserves fauniques et les zones d'exploitation contrôlée sont indiquées par des zones ombragées.
Habitat
Le loup de l'Est vit habituellement dans des paysages de forêt feuillue ou mixte à faible densité humaine, au sud de la région de la forêt boréale. Il préfère souvent aménager sa tanière dans un sol sableux. Ses tanières et ses sites de rendez-vous se trouvent habituellement près d'une source d'eau permanente dans des paysages dominés par des conifères ou des feuillus. Son territoire couvre souvent une superficie de près de 200 km².

Photo : © Michael Runtz
Description longue pour la figure 13c
Photographie d'un loup de l'Est (Canis sp. cf. lycaon) du parc provincial Algonquin (Ontario) vu de côté; l'individu regarde vers le photographe. Le loup de l'Est présente habituellement un pelage plus fauve ou brun roux (roux sur les pattes avant) que ceux du loup gris et du loup boréal/des Grands Lacs.
Biologie
Le loup de l'Est vit en meute familiale composée d'un couple de géniteurs et leur progéniture de l'année en cours et de l'année précédente. La femelle donne naissance à cinq louveteaux à la fin d'avril ou au début de mai. Les louveteaux restent à la tanière durant leur six à huit premières semaines; ils quittent la meute en se dispersant au bout de 37 semaines. La principale proie de ce prédateur est le cerf de Virginie (Odocoileus virginianus). Des analyses prédateur-proie et des analyses de son régime alimentaire indiquent que le loup de l'Est peut aussi chasser l'orignal (Alces americanus), mais avec une efficacité variable selon la meute, la saison ou l'année. Le castor (Castor canadensis) constitue également une bonne part de l'alimentation du loup de l'Est.
Taille et tendances des populations
Entre 170 et 195 loups de l'Est (de tous âges) ont été identifiés depuis 10 ou 15 ans. On ignore la taille de la population, mais elle compte vraisemblablement moins de 1000 individus matures. La population minimale estimée est de 236 individus matures, se trouvant pour la plupart dans des aires protégées. L'estimation maximale est de 1203 individus matures selon le meilleur scénario possible, c'est-à-dire si la densité de l'espèce est la même à l'extérieur des aires protégées. Or, comme la plupart des mentions de l'espèce ont été faites dans des aires protégées, la taille de la population mature du loup de l'Est se rapproche sans doute plutôt de 236 individus. Le parc Algonquin, où la plupart des mentions de l'espèce ont été faites, est le seul endroit pour lequel il existe des données sur la tendance de population : la tendance semble stable.
Menaces et facteurs limitatifs
La principale menace, ou facteur limitatif, hors des aires protégées est sans doute la mortalité d'origine humaine par chasse et piégeage, qui est facilitée par le réseau routier. D'après la recherche menée dans le parc Algonquin, une mortalité excessive limiterait la dispersion et modifierait la dynamique de reproduction de la meute, entraînant une autre menace importante, l'introgression de gènes (hybridation) avec le coyote de l'Est en raison du manque de partenaire de la même espèce. La perte et la fragmentation d'habitat liées à l'expansion du réseau routier et l'urbanisation devraient se poursuivre hors des aires protégées et empêcheront sans doute l'expansion de la population.
Protection, statuts et classements
Le loup de l'Est, sous-espèce du loup gris (Canis lupus lycaon), est désigné espèce préoccupante en vertu de la Loi sur les espèces en péril (LEP) du gouvernement fédéral et la Loi de 2007 sur les espèces en voie de disparition de l'Ontario. Aucune espèce de loup n'est visée par la Loi sur les espèces menacées ou vulnérables du Québec. Dans cette province, la chasse et le piégeage de loups sont permis dans les réserves fauniques, mais pas dans les parcs nationaux (fédéraux ou provinciaux). En Ontario, les loups sont protégés contre la chasse et le piégeage dans le parc Algonquin, dans les cantons entourant le parc, ainsi que dans les réserves fauniques de la Couronne provinciale (Crown Game Preserves). L'espèce est protégée contre la chasse, mais pas contre le piégeage dans le parc provincial de la Rivière des Français. Les loups ne peuvent être ni chassés ni piégés dans les parcs nationaux. Les collectivités autochtones conservent le droit constitutionnel de récolter des loups pour leur subsistance et à des fins cérémoniales, y compris dans les aires protégées. Un permis de chasse au petit gibier est requis pour chasser le loup en Ontario (limite de deux par année) et au Québec (aucune limite). NatureServe cote le Canis lupus lycaon N4 (apparemment non en péril). À l'échelle provinciale, le loup de l'Est est coté S4 (apparemment non en péril) en Ontario et n'est pas coté au Québec.

Photo : © Terry Gray
Description longue pour la figure 14
Photo d'un Martinet sombre (Cypseloides niger) sur son nid, dans une crevasse rocheuse. Le plumage est presque entièrement noir.
Justification de la désignation
Le Canada abrite environ 80 % de la population nord-américaine de cette espèce d'oiseau. L'espèce niche dans des habitats sur le flanc des falaises (souvent associés à des chutes) en Colombie-Britannique et dans l'ouest de l'Alberta. Comme de nombreux autres oiseaux qui se nourrissent essentiellement d'insectes volants, la population de cette espèce a connu un important déclin au cours des dernières décennies. Les causes de ce déclin ne sont pas bien comprises, mais seraient liées à des changements dans l'abondance de la nourriture qui pourraient se produire à un ou plusieurs points dans son cycle vital. L'ampleur et l'étendue géographique du déclin sont sources de préoccupation sur le plan de la conservation.
Description et importance de l'espèce sauvage
Le Martinet sombre est la plus grosse espèce de martinet d'Amérique du Nord. Le Canada abrite plus de 80 % de la population nord-américaine de l'espèce. Cet oiseau a le plumage presque entièrement noirâtre et de longues ailes pointues, et il est le seul martinet d'Amérique du Nord dont la queue est échancrée. En plus de présenter de nombreuses caractéristiques inhabituelles par rapport aux autres oiseaux terrestres pour ce qui est du cycle biologique (couvée d'un seul oeuf, longue période de développement au nid, nidification à des chutes et des cavernes éloignées), le Martinet sombre peut constituer un indicateur sensible des changements climatiques. Cela tient au fait que la réduction des quantités d'eaux de fonte issues de la couverture neigeuse et des glaciers est susceptible d'affecter les sites de nidification de l'espèce se trouvant à des chutes. Le Martinet sombre se nourrit exclusivement d'insectes qu'il capture en vol.
Répartition
L'aire de répartition mondiale de la sous-espèce présente au Canada est discontinue : elle comprend une aire nordique (depuis le sud-est de l'Alaska, le nord-ouest de la Colombie-Britannique et le sud-ouest de l'Alberta jusque dans le nord-ouest du Montana, le nord de l'Idaho et le nord de l'État de Washington), et des populations éparses au sud de cette aire (en Orégon, en Californie, en Utah, au Colorado, dans le nord du Nouveau- Mexique, dans le sud-est de l'Arizona). Cette sous-espèce niche aussi au Mexique aussi loin au sud que dans les États d'Oaxaca et de Veracruz, et peut-être aussi dans d'autres régions du pays. D'autres sous-espèces sont présentes ailleurs au Mexique, dans les Antilles et en Amérique centrale.
Source: La carte est une courtoisie de "Birds of North America Online", maintenu par Cornell Lab of Ornithology, Ithaca, NY.
Description longue pour la carte 14
Carte montrant la répartition du Martinet ramoneur durant la période de reproduction et en dehors de celle ci en Amérique du Nord, en Amérique centrale et dans les Antilles. La carte montre une répartition discontinue comprenant une grande aire de reproduction en Colombie-Britannique et en Alberta (qui s'étend dans les États étatsuniens adjacents), des sous-populations éparses au sud de cette aire, puis une grande aire continue au Mexique, ainsi qu'en Amérique centrale, et des populations résidentes permanentes éparses localisées dans les Antilles.
Habitat
Souvent à haute altitude, les Martinets sombres s'alimentent d'insectes au-dessus de milieux ouverts et de forêts de régions montagneuses et de basses terres. Ils nichent à des chutes, à proximité de celles-ci ou derrière leur rideau d'eau, ainsi que dans des cavernes situées dans des canyons et parfois dans des falaises maritimes. Leurs sites de nidification présentent les caractéristiques suivantes : présence d'eaux courantes, situation en hauteur, inaccessibilité, obscurité, et absence d'obstacles dans la ligne de vol.
Biologie
On sait peu de choses sur la biologie du Martinet sombre. On pense que l'espèce est monogame et longévive. Le plus vieux Martinet sombre répertorié est un individu ayant atteint l'âge de 16 ans. L'âge à la première reproduction est inconnu, mais vu les autres caractéristiques du cycle biologique de l'espèce, il pourrait être de 3 à 5 ans. Le Martinet sombre est l'une des deux seules espèces d'oiseaux terrestres du Canada dont la couvée ne compte qu'un oeuf, et les jeunes restent au nid extrêmement longtemps (7 semaines). Les individus nichant au Canada migrent vers le sud pour hiverner probablement en Amérique du Sud, leur aire d'hivernage exacte étant encore inconnue.
Taille et tendances des populations
La taille de la population canadienne de la sous-espèce borealis est difficile à déterminer, mais elle est estimée à entre 15 000 et 60 000 individus matures. On pense que le Canada abrite environ 81 % de la population nord-américaine, dont la grande majorité niche en Colombie-Britannique. L'Alberta abrite moins de 0,1 % de la population nord-américaine.
Dans l'ensemble de l'aire de répartition canadienne et étatsunienne du Martinet sombre, les effectifs de l'espèce présentent des tendances à la baisse. La population canadienne semble avoir diminué de plus de 50 % au cours de la période 1973-2012. Une durée d'une génération se situant entre 6,25 et 16,5 ans donne une baisse cumulative de population de 72 % à 96 % sur trois générations, la baisse se situant le plus probablement autour de 89 % sur la base de l'opinion d'experts (tendance annuelle moyenne de -6,5% sur 33 ans). Le taux de baisse a diminué dans les années récentes; l'estimation de la tendance décennale pour la période 2002-2012 est de -4,6 % par année, soit une baisse globale d'environ 38 % durant cette décennie la plus récente. Durant cette période, la probabilité que la population ait diminué de plus de 50 % était de 25 %, et celle que la population ait diminué de 25 à 50 % était de 45 %.
Menaces et facteurs limitatifs
Les menaces les plus importantes pesant sur le Martinet sombre sont largement inconnues, mais on pense qu'il s'agit des suivantes : 1) polluants atmosphériques qui réduisent la biomasse d'insectes aériens ou pourraient causer un échec de la reproduction chez des martinets, et 2) changements climatiques pouvant réduire le débit des cours d'eau aux sites de nidification ou désynchroniser la phénologie des arthropodes aériens d'avec le cycle de reproduction des martinets. D'autres menaces, comme les espèces indigènes problématiques, l'exploitation forestière, les cultures annuelles et pérennes de produits autres que le bois, l'élevage de bétail, l'exploitation de barrages hydroélectriques et la gestion de l'eau, et les activités récréatives, ont été jugées négligeables.
Protection, statuts et classements
Le Martinet sombre a été placé par Partenaires d'envol sur sa liste de surveillance continentale, et il est considéré comme étant une espèce préoccupante dans de nombreux plans de conservation des oiseaux à l'échelle d'États et de régions de conservation des oiseaux. L'espèce a été classée par l'UICN dans la catégorie « préoccupation mineure », et elle est jugée préoccupante sur le plan de la conservation aux États-Unis. Selon NatureServe, elle est apparemment non en péril tant à l'échelle mondiale qu'à celles du Canada et des États-Unis, mais ces évaluations ne sont pas récentes. Elle est classée comme gravement en péril, en péril ou vulnérable dans certains États, mais comme apparemment non en péril en Colombie-Britannique; elle n'a pas de classement pour l'Alberta.

Photo : © Robert Forsyth
Description longue pour la figure 15
Trois photographies présentant différents angles de coquilles fraîches d'individus de patère de Pennsylvanie (Patera pennsylvanica) morts récemment. Les escargots du genre Patera se caractérisent par leur coquille imperforée c'est-à-dire sans ombilic. Contrairement aux autres espèces du genre Patera, la patère de Pennsylvanie ne possède pas de dent pariétale sur la paroi de son ouverture, sa spire est plus élevée que chez les autres espèces, et le dernier tour de la coquille présente une décurrence plus marquée au niveau de l'ouverture. La coquille est mince, régulièrement striée, olive jaunâtre, constituée de 5,75 à 6 tours chez l'adulte. La lèvre de l'ouverture est blanche et étroitement réfléchie, avec une légère proéminence sur le côté interne du bord baso columellaire
Justification de la désignation
Cet escargot terrestre de grande taille se trouve dans la partie supérieure du centre-ouest de l'Amérique du Nord, la seule occurrence enregistrée au Canada étant située dans un parc boisé, et à proximité de celui-ci, à Windsor, en Ontario. Les relevés généraux d'escargots effectués dans tout le sud de l'Ontario au cours du dernier siècle n'ont pas permis de détecter l'espèce nulle part ailleurs. Des coquilles d'individus récemment morts ont été trouvées en 1992 et en 1996 mais seulement de vieilles coquilles ont été trouvées lors de vastes relevés en 2013. Les intrusions et perturbations humaines découlant des activités récréatives et les altérations de l'écosystème résultant des plantes et animaux envahissants, l'urbanisation environnante, la pollution provenant de sources locales et régionales, ainsi que les changements climatiques peuvent avoir contribué à la disparition de l'espèce; il semble qu'un autre escargot indigène soit disparu du même endroit au cours de la même période.
Description et importance de l'espèce sauvage
La patère de Pennsylvanie (Patera pennsylvanica) est un escargot terrestre de la famille des Polygyridés. La coquille est ronde et jaunâtre, mesure de 15 à 20 mm de diamètre et ne possède pas de protubérance semblable à une dent à l'ouverture, contrairement à celle des autres espèces du genre Patera. La seule population canadienne connue se trouvait à l'intérieur et à proximité de la forêt patrimoniale Black Oak, appartenant à la Ville de Windsor. On ne connaît pas l'importance écologique de la patère de Pennsylvanie, mais les gastéropodes, de manière générale, jouent plusieurs rôles importants dans le fonctionnement des écosystèmes forestiers, en participant aux processus de renouvellement des éléments nutritifs et de formation des sols.
Répartition
La patère de Pennsylvanie se rencontre depuis le sud-ouest de l'Ontario jusqu'à l'Iowa et au Missouri et, vers l'est, jusqu'en Pennsylvanie. L'aire de répartition mondiale de l'espèce se trouve essentiellement aux États-Unis et a une superficie d'environ 534 453 km². Moins de 0,001 % de cette aire de répartition se trouve au Canada. Des coquilles vides, mais fraîches ont été trouvées en 1992 et en 1996 à Windsor. Des coquilles vides et altérées ont été trouvées en 2013 au même endroit et à proximité. Aucun individu vivant n'a jamais été signalé au Canada. Dans le cadre des relevés des gastéropodes menés de 1916 à 2013, l'espèce n'a jamais été trouvée ailleurs dans le sud-ouest de l'Ontario.
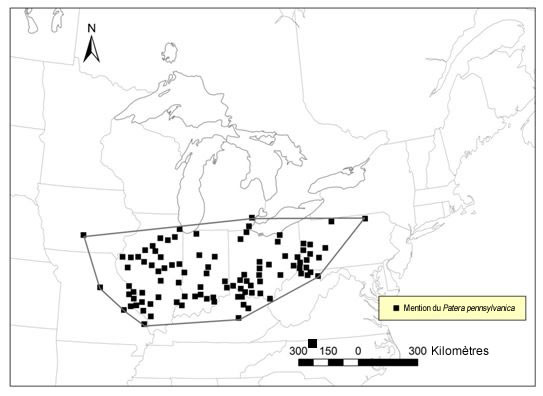
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur la patère de Pennsylvanie au Canada.
Description longue pour la carte 15
Carte montrant l'aire de répartition mondiale de la patère de Pennsylvanie, et les endroits où elle est (ou était) présente depuis le sud-ouest de l'Ontario jusqu'à l'Iowa et au Missouri et, vers l'est, jusqu'en Pennsylvanie. La superficie de l'aire de répartition mondiale est de 534 453 kilomètres carrés en s'appuyant sur la méthode du plus petit polygone convexe.
Habitat
La patère de Pennsylvanie vit généralement sur des versants boisés ou dans des ravins. Au Canada, l'espèce a été signalée dans une chênaie sableuse et dans un terrain perturbé ayant déjà servi à l'industrie légère. Le régime alimentaire de l'espèce pourrait être constitué de champignons, de litière de feuilles et de matière végétale fraîche, mais certains escargots de la famille des Polygyridés sont carnivores. En Ontario, parmi les tendances observées dans l'habitat de la patère de Pennsylvanie, on note un déclin général des chênaies et une diminution de leur biodiversité, et cette diminution pourrait nuire aux communautés d'escargots.
Biologie
On connaît très peu la biologie de la patère de Pennsylvanie. D'après ce que l'on sait d'autres espèces de la famille des Polygyridés, on peut inférer que l'accouplement a lieu en automne ou au début du printemps et que les oeufs sont pondus entre le printemps et la fin de l'été. Chaque ponte comprend de 20 à 80 oeufs, qui éclosent au bout de 20 à 60 jours environ. Le taux de croissance et, par conséquent, la taille des adultes (atteinte au bout d'un ou deux ans) sont très variables. Les périodes de croissance correspondent aux périodes d'activité, du printemps à l'automne. La maturité sexuelle est atteinte au bout de 2 à 3 ans, et on estime que la longévité se situe entre 3 et 5 ans. Les escargots sont des animaux ectothermes, exposés au gel en hiver et à la déshydratation en été. Les différentes espèces ont adopté diverses stratégies pour survivre aux températures extrêmes et à la sécheresse, outre l'entrée en dormance. Chez les Polygyridés des régions tempérées, la période d'hibernation s'étend du début octobre à la mi-avril. L'estivation s'observe à l'occasion, durant les longues périodes de chaleur et de sécheresse. Pour survivre à la dormance, les escargots ont besoin d'une couverture de neige ou de gîtes maintenant une certaine humidité. La plupart des Polygyridés sont actifs au crépuscule ou durant la nuit, la dispersion permettant la colonisation de nouveaux milieux se faisant très lentement, à raison d'environ 35 m en 3 ans. Les prédateurs et les parasites peuvent être une cause de mortalité pour les escargots terrestres.
Taille et tendances des populations
En 2013, on a consacré 17 heures-personnes, dans diverses conditions lumineuses et météorologiques, à chercher des individus vivants de l'espèce dans une parcelle de 200 m × 100 m de la forêt patrimoniale Black Oak et dans un secteur voisin ayant déjà servi à l'industrie légère. La parcelle incluait le secteur où des coquilles avaient déjà été trouvées. Dans cette parcelle, on a trouvé 14 coquilles vides (dont l'âge estimatif était de 5 à 15 ans), sous la litière de feuilles ainsi que dans les premiers 5 cm du sol; on y a également trouvé d'autres espèces d'escargots et de limaces; aucune coquille de patère de Pennsylvanie n'a été trouvée ailleurs dans la forêt, mais une coquille a été trouvée plus au sud, dans le secteur voisin ayant déjà servi à l'industrie légère. L'absence complète d'individus vivants et l'âge des coquilles trouvées en 2013 semble indiquer que la population a subi un déclin substantiel depuis 1996, et il est très probable que la patère de Pennsylvanie est aujourd'hui disparue de ce secteur ainsi que du Canada, car elle n'a jamais été trouvée ailleurs dans le sud-ouest de l'Ontario. Une immigration à partir de populations des États-Unis est improbable, car les rivières Détroit et Sainte-Claire ainsi que le lac Érié constituent un obstacle pour une telle dispersion.
Menaces et facteurs limitatifs
Les impacts d'origine humaine tels que la pollution, l'accumulation d'ordures, l'utilisation intensive du terrain à des fins récréatives et les changements apportés à la composition du sol et au régime hydrologique peuvent aussi affecter les populations d'escargots. Les espèces introduites (plantes, vers de terre, autres gastéropodes, etc.) peuvent aussi nuire à ces populations en modifiant le cycle des éléments nutritifs du sol, en réduisant la litière de feuilles et en engendrant une compétition interspécifique. Une limace introduite, la limace brune (Arion subfuscus), était abondante dans le site où ont été trouvées les coquilles de patère de Pennsylvanie, et a été observée en train de se nourrir de champignons. Le changement climatique peut avoir un impact prononcé sur la survie des escargots. Dans les régions tempérées, le changement climatique accroîtra à la fois la température moyenne et la fréquence des phénomènes météorologiques extrêmes tels que vagues de chaleur, sécheresses et précipitations abondantes, en plus d'éliminer l'isolation que procure la couverture de neige. Les escargots sont limités par leur faible capacité de dispersion ou de fuite, leur durée de génération relativement longue, leur faible résistance physiologique aux fluctuations des conditions environnementales, leur sensibilité à la bioaccumulation d'agents toxiques et leur flux génétique limité.
Protection, statuts et classements
Cote mondiale : G4 (apparemment non en péril). Cotes nationales : N1 (gravement en péril) au Canada; N4 (apparemment non en péril) aux États-Unis. Cotes infranationales : S1 (gravement en péril) en Ontario et en Virginie-Occidentale; S1S2 (gravement en péril à en péril) en Pennsylvanie. L'espèce est classée Special Concern (préoccupante) au Michigan.

Photo : © Lyn Baldwin
Description longue pour la figure 16a
Photo du petit pompon (Crossidium seriatum) montrant une petite mousse vert foncé à brun doré
Justification de la désignation
Cette très petite mousse a une aire de répartition très étroite dans l'ouest du Canada. On la retrouve seulement dans la steppe arbustive semi-aride de quatre vallées dans la région de l'Okanagan, dans la partie centrale la plus au sud de la Colombie-Britannique. Les relevés ont permis de confirmer la présence de l'espèce dans seulement 20 sites situés sur des pentes escarpées associées aux dépôts glaciolacustres calcaires. Les menaces incluent l'érosion due à l'utilisation récréative de l'habitat et l'entretien des tranchées de route. Les changements climatiques peuvent également représenter une menace, quoique les impacts potentiels soient inconnus. Un site est disparu en raison de la conversion de l'habitat.
Description et importance de l'espèce sauvage
Le petit pompon (Crossidium seriatum) est une petite mousse vert foncé à brun doré de 1 à 1,5 mm de hauteur. Elle pousse parfois en touffes, mais le plus souvent de façon éparse, les sujets étant dispersés parmi d'autres espèces de petites mousses des milieux secs. La population de petit pompon de Colombie-Britannique se situe à la limite septentrionale de l'aire de répartition de l'espèce en Amérique du Nord. Au Canada, l'espèce ne pousse que dans les prairies sèches de la partie sud de la région intérieure de la Colombie-Britannique. Ces prairies, qui constituent un type d'habitat rare, occupent moins de 1 % des terres de la province.
Répartition
Le petit pompon pousse dans tout l'ouest de l'Amérique du Nord. L'espèce a été signalée en Basse-Californie et au Chihuahua, au Mexique, en Arizona, en Californie, au Nevada, au Nouveau-Mexique, en Idaho et dans l'État de Washington, aux États-Unis, de même qu'en Colombie-Britannique, au Canada. Certains spécialistes considèrent que le petit pompon est présent en Europe, mais les autorités européennes en matière de taxonomie croient aujourd'hui que les spécimens répertoriés en Europe appartiendraient à une espèce différente, étroitement apparentée. Le petit pompon pourrait aussi être présent en Chine.
Au Canada, le petit pompon a été signalé uniquement dans les vallées du fleuve Fraser et des rivières Thompson, Nicola et Okanagan, dans le sud de la région intérieure de la Colombie-Britannique. La plupart des occurrences connues de l'espèce sont regroupées autour des villes de Kamloops et de Penticton, dans les vallées de la rivière Thompson et de la rivière Okanagan, respectivement.
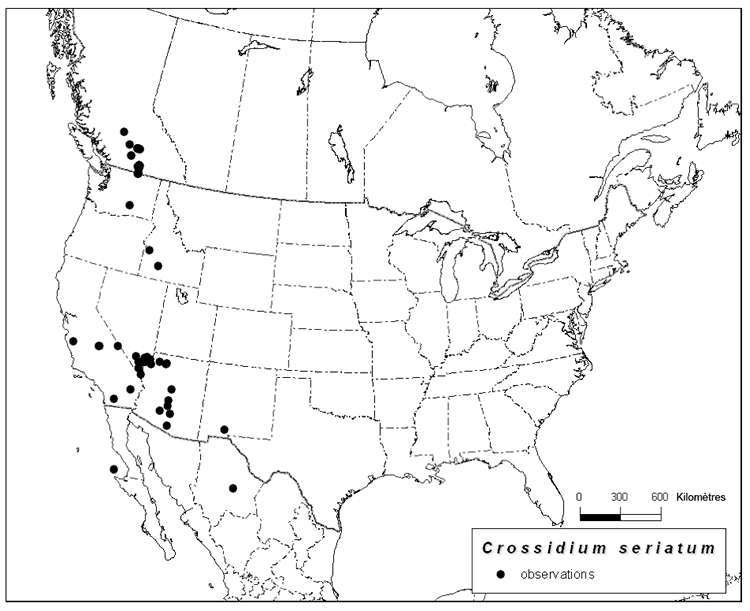
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le petit pompon au Canada.
Description longue pour la carte 16
Carte montrant la répartition du petit pompon en Amérique du Nord, où au moins 62 occurrences ont été répertoriées. Ces occurrences comprennent celles de la Basse Californie et du Chihuahua, au Mexique; de l'Arizona, de la Californie, du Nevada, du Nouveau-Mexique, de l'Idaho et de l'État de Washington, aux États Unis; et de la Colombie Britannique, au Canada.
Habitat
On trouve le petit pompon dans les régions semi-arides et arides de l'ouest de l'Amérique du Nord. L'espèce a été signalée dans des zones peuplées d'armoise, des prairies et des régions désertiques. Elle pousse principalement dans le sol, souvent sur du matériau parental riche en calcium. Au Canada, le petit pompon pousse dans les sols à texture fine associés aux limons, dans la steppe arbustive semi-aride du centre-sud de la Colombie-Britannique. Ces limons, qu'on trouve généralement le long des grandes vallées des rivières Thompson et Okanagan, sont souvent calcaires et proviennent de dépôts lacustres qui se sont formés au cours de la plus récente période glaciaire.

Photo : © Lyn Baldwin
Description longue pour la figure 16b
Photo de falaises limoneuses d'un canyon comme exemple d'habitat du petit pompon (Crossidium seriatum)
Biologie
Le petit pompon se reproduit au moyen de spores, mais peut probablement aussi se régénérer à partir de tissus des tiges et des rhizoïdes. La production de sporophytes dans la population de la Colombie-Britannique pourrait être peu fréquente. Des sporophytes ont été observés chez une seule occurrence, maintenant disparue. Les spores des bryophytes sont souvent dispersées par le vent et peuvent ainsi voyager sur de très grandes distances. Compte tenu de la vaste aire de répartition du petit pompon, qui comprend des îles et des milieux postglaciaires, il est probable que la production au moins épisodique de sporophytes, combinée à la dispersion sur de courtes et de grandes distances, joue un rôle dans la reproduction et la propagation de l'espèce. Les caractéristiques physiologiques du petit pompon, notamment sa période de dormance prolongée, la présence de papilles, de filaments et de soies sur ses feuilles et la marge enroulée de celles-ci, lui permettent de survivre dans les milieux arides et semi-arides.
Taille et tendances des populations
Il existe actuellement 20 sites connus de petit pompon en Colombie-Britannique. On comptait auparavant 15 sites connus de l'espèce : 9 de ces sites ont été récemment confirmés et 5 ont été présumés existants. L'un de ces sites (Cache Creek) a disparu. On a récemment trouvé le petit pompon dans six nouvelles localités, ce qui porte à 20 le nombre total de sites connus en Colombie-Britannique à l'heure actuelle. Les colonies de l'espèce sont petites, éparses et dispersées parmi d'autres espèces de mousses des milieux secs. Il est donc très difficile d'estimer la taille actuelle des populations de petit pompon ou les fluctuations de l'abondance de l'espèce.
Menaces et facteurs limitatifs
Le petit pompon pousse uniquement dans certains milieux de la partie sud de la région intérieure de la Colombie-Britannique. Une grande partie de ces milieux subissent des pressions croissantes liées à l'utilisation et à l'aménagement des terres, dont le pâturage du bétail et la conversion en terres agricoles et en zones urbaines. L'emplacement des microsites où le petit pompon est le plus susceptible d'être présent, en l'occurrence les falaises limoneuses, peut limiter les effets directs de telles utilisations. Le petit pompon peut probablement être touché par les changements de températures et de régimes de précipitations qui sont associés au changement climatique. Il est cependant difficile de prédire si ces changements auront des répercussions positives ou négatives sur le petit pompon.
Protection, statuts et classements
Le petit pompon ne bénéficie actuellement d'aucune protection juridique. À l'échelle mondiale, l'espèce a été classée « en péril à apparemment non en péril » (G2G4) par NatureServe. Le Nevada Natural Heritage Program considère que l'espèce est en péril (S2), alors que le British Columbia Conservation Data Centre la considère comme en péril à vulnérable (S2S3). L'espèce est non classée (SNR) en Arizona, en Californie, en Idaho, au Nouveau-Mexique et dans l'État de Washington. En Colombie-Britannique, le petit pompon pousse sur des terres des Premières Nations, des terres privées et des terres publiques provinciales. Aucune occurrence de l'espèce ne se trouve sur des terres officiellement protégées, bien que certains sites soient, dans une certaine mesure, à l'abri du développement du fait de leur instabilité géologique.

Photo : © Bree Walpole
Description longue pour la figure 17
Photo d'un Phalarope à bec étroit femelle (Phalaropus lobatus) (vue latérale) dans un milieu d'eau peu profonde. Sur cette image, la femelle est en plumage nuptial, arborant des bandes rouge orange à la base du cou et sur les côtés de la tête. Le reste de son plumage est surtout foncé (bleu gris) et blanc. En plumage d'hiver, la tête, la gorge, la poitrine et le dessous sont blancs et le dessus, la bande oculaire et la calotte sont foncés.
Justification de la désignation
Cet oiseau a connu un déclin au cours des 40 dernières années dans une importante aire de rassemblement; toutefois, les tendances de la population globale au cours des trois dernières générations sont inconnues. L'espèce fait face à des menaces potentielles dans ses lieux de reproduction incluant la dégradation de l'habitat associée aux changements climatiques. Elle est également vulnérable à l'exposition aux polluants et au pétrole pendant la migration et durant l'hiver. Il en est ainsi car les oiseaux se rassemblent en grand nombre sur l'océan, particulièrement là où les courants concentrent les polluants.
Description et importance de l'espèce sauvage
Le Phalarope à bec étroit est un petit oiseau de rivage, facile à reconnaître en plumage nuptial par les bandes rouge-orange qu'il arbore à la base et sur les côtés du cou. Le reste de son plumage nuptial est surtout bleu-gris et blanc. Les femelles sont plus colorées que les mâles. En plumage d'hiver, le Phalarope à bec étroit a la tête, la gorge, la poitrine et le dessous blancs et les parties supérieures, la bande oculaire et la calotte foncées. Contrairement à la plupart des autres oiseaux de rivage, le Phalarope à bec étroit passe la majeure partie de la période internuptiale en mer.
Répartition
La reproduction du Phalarope à bec étroit a lieu partout dans la région circumpolaire subarctique et du Bas-Arctique. Toutefois, la répartition de l'espèce, en particulier en mer, n'est pas entièrement connue. On pense que les principaux lieux d'hivernage des Phalaropes à bec étroit se reproduisant en Amérique du Nord se trouvent au large de la côte ouest du Pérou, les zones de migration s'étendant le long des côtes pacifique et atlantique de l'Amérique du Nord et à l'intérieur du continent vers la côte californienne. Des individus en reproduction ou de passage en migration ont été observés dans tous les territoires et provinces canadiens.
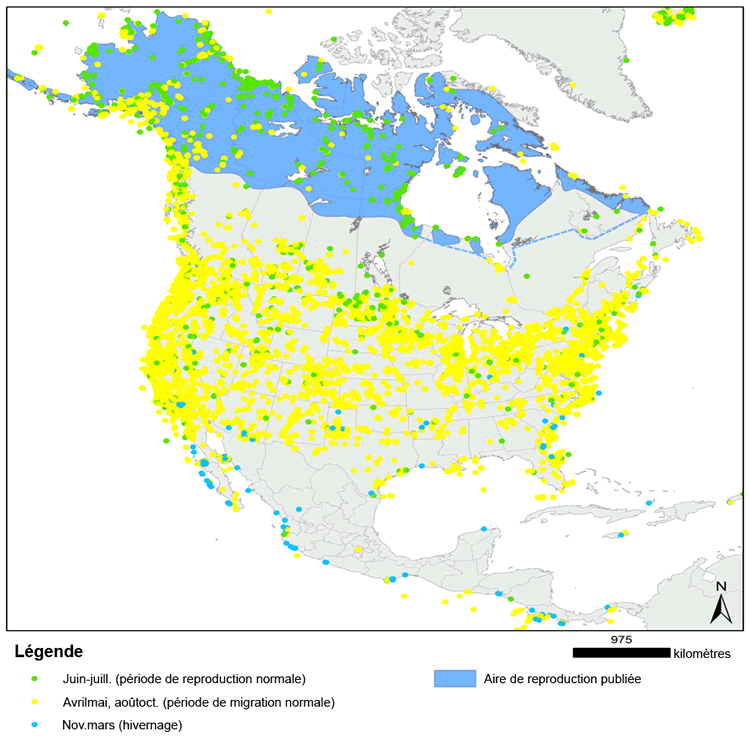
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le Phalarope à bec étroit au Canada.
Description longue pour la carte 17
Carte de l'Amérique du Nord et de l'Amérique centrale illustrant les localités où les Phalaropes à bec étroit ont été observés (a) en juin juillet (période de reproduction), (b) en avril mai et en août octobre (période de migration), et (c) en novembre mars (hivernage). La carte est fondée sur des données provenant de la base de données du relevé des oiseaux des T.N. O./Nt (SCF) et de eBird, ainsi que sur les plus récentes données publiées sur l'aire de reproduction.
Une aire de reproduction continue est montrée dans les portions septentrionales du continent. Des mentions de reproduction ont été répertoriées depuis la péninsule de l'Alaska, dans l'ouest, jusqu'à la côte du Labrador, à l'est. Les Phalaropes à bec étroit nichent partout au Yukon, mais le plus grand nombre d'observations ont été faites le long de la côte et sur l'île Herschel. Ils sont aussi communs partout dans les Territoires du Nord Ouest et, vers l'est, à travers le Nunavut, aussi loin, vers le nord, que l'île Victoria et le sud de l'île de Baffin.
Les Phalaropes à bec étroit passent l'hiver dans les milieux marins des basses latitudes, principalement le long de la côte pacifique. Des individus en hivernage sont aperçus ponctuellement le long de la côte atlantique de la Georgie et de la Floride et dans le golfe du Mexique.
Habitat
Pendant la migration et les mois d'hiver, les Phalaropes à bec étroit se concentrent en mer, dans les zones où les proies sont poussées vers la surface (par exemple par la convergence ou les remontées d'eau). Les individus migrateurs peuvent aussi, dans une moindre mesure, faire halte sur les lacs et les étangs à l'intérieur de l'Amérique du Nord, particulièrement les lacs salés où les invertébrés aquatiques sont abondants. La reproduction des Phalaropes à bec étroit a lieu dans les milieux humides subarctiques et du Bas-Arctique, près des étangs, lacs ou ruisseaux d'eau douce. L'assèchement des étangs d'eau douce et l'augmentation de la quantité d'arbustes et d'arbres dans ces milieux humides, en raison de l'évolution du climat, devraient avoir une incidence significative sur la qualité et la disponibilité de l'habitat de l'espèce.
Biologie
Toutes les espèces de phalaropes présentent des rôles sexuels inversés, les mâles s'occupant de la majorité des soins aux petits. Ce sont les femelles qui amorcent la sélection d'un site de nidification, et elles peuvent avoir plusieurs partenaires sexuels. Les nids sont de simples creux rudimentaires contenant quatre œufs. Ni les mâles ni les femelles ne défendent un territoire. Peu de temps après la ponte, les femelles abandonnent les mâles, qui couvent les oeufs, à la recherche d'autres partenaires. Les femelles se rassemblent ensuite près de la côte ou quittent les lieux de reproduction. Les mâles restent plus longtemps pour s'occuper des jeunes.
Pendant qu'ils sont en mer, les Phalaropes à bec étroit se rassemblent en grandes bandes et se nourrissent presque exclusivement de zooplancton.
Taille et tendances des populations
Les estimations de la taille des populations sont fondées, en grande partie, sur l'opinion de spécialistes. On estime qu'il y a, actuellement, en Amérique du Nord au moins 2 500 000 individus, dont environ 74 % ou 1 850 000 sont présents au Canada. Il s'agit probablement d'une sous-estimation, car ce nombre a été obtenu en calculant la somme approximative du nombre estimé d'individus pour les principales haltes migratoires connues. On ne connaît pas toutes les voies migratoires, ce qui signifie qu'une fraction inconnue des populations est exclue de cette somme.
Les tendances estimées dans diverses études ne sont pas précises et ne tiennent compte que d'une petite fraction de la population, n'offrant que peu d'éclairage sur la situation de la population. Des relevés ciblés effectués à l'embouchure de la baie de Fundy fournissent les données les plus fiables, bien que seulement pour une région restreinte. À une certaine époque, des millions d'individus passaient par là, les effectifs estimés atteignant jusqu'à 3 000 000 à l'embouchure de la baie de Fundy au cours des années 1970. Dès 1990, leur nombre avait chuté de façon dramatique. Selon les plus récents relevés (2009-2010), on estime que 550 000 Phalaropes à bec étroit sont présents entre les îles Grand Manan et Brier, dans la baie de Fundy. Malgré l'incertitude significative qui plane, les spécialistes s'entendent généralement pour dire que l'espèce est moins abondante dans la baie de Fundy qu'elle ne l'a déjà été. Des déclins ont aussi été observés dans les lieux de reproduction (par exemple à Churchill et à la baie La Pérouse, au Manitoba; à l'île Herschel, à Shingle Point et dans la plaine Old Crow, au Yukon), malgré que les observations soient limitées.
Menaces et facteurs limitatifs
Les nombreuses lacunes dans les connaissances sur l'espèce, particulièrement en ce qui concerne l'adaptabilité, la migration et la biologie hivernale, rendent difficile l'identification des menaces. Le changement du climat et les effets connexes sur l'habitat et le réseau alimentaire constituent probablement la plus grande menace pesant sur les Phalaropes à bec étroit dans leurs lieux de reproduction. L'accumulation de contaminants dans le milieu arctique, l'augmentation des activités industrielles et la perte de végétation causée par la croissance des populations de l'Oie des neiges auront probablement aussi des répercussions négatives sur les individus reproducteurs et leur habitat.
Les changements de la température, de la salinité et des courants océaniques dus aux changements climatiques affecteront probablement aussi l'espèce en dehors de la période de reproduction (c.-à-d. durant l'hiver). Une baisse de la disponibilité des proies dans les lieux de repos et d'hivernage habituels pourrait aussi avoir une incidence sur l'espèce. Parmi les autres menaces possibles, en dehors de la période de reproduction, on retrouve une augmentation des perturbations (par exemple du trafic maritime) et un changement de la qualité de l'eau. Pendant qu'ils sont en mer, les Phalaropes à bec étroit sont aussi vulnérables aux effets du mazoutage chronique et des déversements d'hydrocarbures de source ponctuelle, ainsi qu'à l'ingestion de microplastiques.
Protection, statuts et classements
Le Phalarope à bec étroit est protégé en vertu de la Loi sur la Convention concernant les oiseaux migrateurs (1994). L'espèce bénéficie aussi d'une protection en vertu de la Convention sur les espèces migratrices, dans laquelle elle figure à l'annexe II. L'espèce est classée comme « modérément préoccupante » dans le plan de conservation des oiseaux de rivage des États-Unis et le Plan canadien de conservation des oiseaux de rivage. Les cotes de conservation mondiale et nationale (Canada et États-Unis) du Phalarope à bec étroit indiquent que l'espèce est apparemment non en péril. Dans la liste rouge de l'Union internationale pour la conservation de la nature (UICN), l'espèce est classée comme une « préoccupation mineure » à l'échelle mondiale.

Photo : © Cindy Smith
Description longue pour la figure 18a
Photo d'un pin flexible mature poussant dans un site rocheux exposé, dont le houppier est fortement ramifié.
Justification de la désignation
Cette espèce d'arbre est menacée gravement et de façon imminente dans l'ensemble de son aire de répartition canadienne par la rouille vésiculeuse du pin blanc (un pathogène introduit), le dendroctone du pin ponderosa et les changements climatiques. Les relevés effectués à un certain nombre de sites en 2009 documentent une moyenne de 43 % et de 35 % d'arbres infectés ou morts, respectivement. L'information de relevés répétés mène à une estimation de la diminution de la population canadienne d'environ 1 % par année. À ce rythme, près des deux tiers des individus matures pourraient disparaître au cours des 100 prochaines années, et des sous-populations locales pourraient disparaître.
Description et importance de l'espèce sauvage
Le pin flexible mesure généralement 3 à 15 m de hauteur et possède un houppier arrondi et très ramifié. Ses aiguilles sont réunies en faisceaux de cinq. Les cônes femelles sont ovoïdes, brun clair à brun verdâtre, longs de 7 à 15 cm et larges de 4 à 6 cm. Ils s'ouvrent pour libérer les graines, puis tombent au sol. Les graines sont grosses, brunes, longues de 10 à 15 mm et généralement dépourvues d'ailes.
Les cernes de croissance annuelle du pin flexible peuvent fournir des renseignements sur le climat et le débit des cours d'eau des 500 à 1000 dernières années, alors que les données historiques ne sont généralement disponibles que pour les 100 dernières années, tout au plus. Ces renseignements sont importants, car ils nous permettent de comprendre et prévoir le changement climatique, y compris les sécheresses et le débit des cours d'eau. En outre, le pin flexible est une espèce clé, car il joue un rôle d'abri pour d'autres espèces, et ses graines constituent une importante source de nourriture pour les ours, les petits mammifères et les oiseaux.
Répartition
Le pin flexible est naturellement limité à l'ouest de l'Amérique du Nord et se rencontre depuis le sud-est de la Colombie-Britannique et le sud-ouest de l'Alberta jusque dans le nord de l'Arizona, le Nouveau-Mexique et le sud de la Californie. Au Canada, il se rencontre dans le sud-est de la Colombie-Britannique, le long du côté est du sillon des Rocheuses, depuis les environs de la ville de Field jusque près de la frontière avec les États-Unis, ainsi que dans le sud-ouest de l'Alberta, dans les Rocheuses et leurs contreforts, depuis les environs des plaines Kootenay jusqu'à la frontière avec les États- Unis.
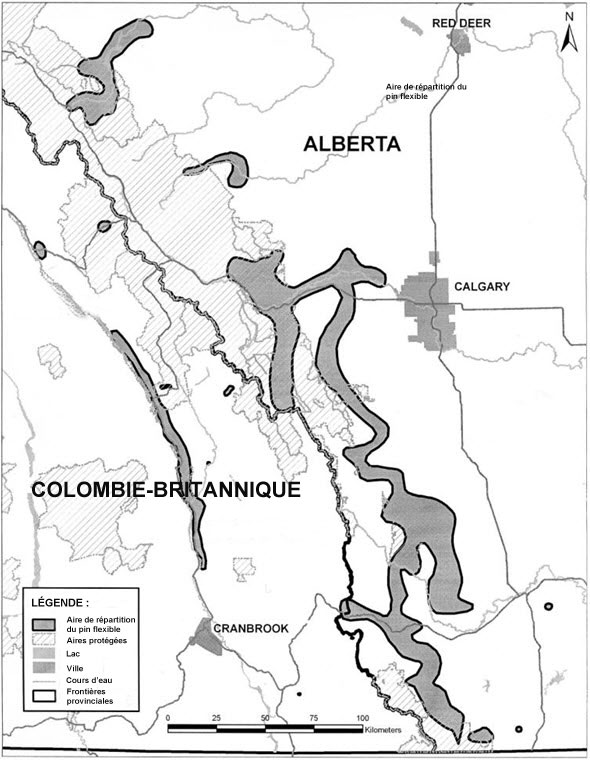
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le pin flexible au Canada.
Description longue pour la carte 18
Carte montrant l'aire de répartition actuelle du pin flexible au Canada. Celle-ci s'étend le long du côté est du sillon des Rocheuses, depuis le sud-est de la Colombie-Britannique (environs de la ville de Field) jusque près de la frontière avec les États-Unis, ainsi que dans les Rocheuses et leurs contreforts, depuis le sud-ouest de l'Alberta (environs des plaines Kootenay) jusqu'à la frontière avec les États-Unis.
Habitat
Au Canada, le pin flexible se rencontre généralement dans des sites chauds et secs, dans les portions inférieures des montagnes et des contreforts, à une altitude de 850 à 1900 m. Certains individus peuvent pousser à une altitude d'environ 2000 m, où ils peuvent former des peuplements mixtes avec le pin à écorce blanche. Le pin flexible peut se rencontrer dans des sites d'altitude relativement haute ou basse, à la limite des arbres. Il pousse sur des versants peu inclinés à escarpés généralement exposés au sud ou à l'ouest. En Colombie-Britannique, la majeure partie des peuplements de pin flexible se trouvent sur des falaises et des crêtes escarpées, alors qu'en Alberta certains peuplements se trouvent dans des terrains, des crêtes rocheuses et des affleurements rocheux à pente douce. Les sites occupés par le pin flexible sont souvent exposés aux forts vents, en plus de présenter un sol peu profond à drainage bon à rapide et de se situer sur les versants où les températures sont élevées, ce qui créée des conditions de sécheresse.
Biologie
Le pin flexible est longévif et vit fréquemment plusieurs centaines d'années, et des individus âgés de plus de 1000 ans ont déjà été observés. Les individus commencent à produire des cônes vers l'âge de 50 ans, mais parfois à un âge plus avancé, et atteignent leur pic de production seulement des dizaines d'années plus tard. La production de cônes est irrégulière, et la production de graines est très faible certaines années. Les graines sont principalement dispersées par les oiseaux, mais aussi par de petits mammifères. Cependant, la plupart des semis sont issus des graines dispersées par les oiseaux, de sorte que la dispersion par les petits mammifères contribue peu au recrutement. Les caractéristiques physiologiques des semis et des individus plus âgés leur permettent de tolérer les conditions environnementales difficiles, particulièrement la sécheresse.

Photo : © Cindy Smith
Description longue pour la figure 18b
Photo de cônes matures (ouverts) au bout d'une branche du pin flexible.
Le pin flexible dépend des champignons mycorhiziens, car ceux-ci permettent aux racines de prélever les éléments nutritifs et participent à la protection des racines contre les agents pathogènes. Toutefois, d'autres types de champignons peuvent endommager les graines, les tiges et les racines de l'espèce. En outre, les chenilles d'un petit papillon rare au Canada se nourrissent exclusivement des aiguilles du pin flexible.
Taille et tendances des populations
Au Canada, le nombre d'individus matures s'élèverait à environ 44,4 millions. La population canadienne diminue à un taux annuel moyen d'environ 1 % et pourrait donc avoir diminué de 66 % en 100 ans. Il est irréaliste de penser que l'effectif canadien pourrait être rétabli à partir des populations des États-Unis, car ces populations sont soumises aux mêmes menaces que celles observées au Canada, et plusieurs sont également en déclin.
Menaces et facteurs limitatifs
Dans toute son aire canadienne, le pin flexible est menacé de manière grave et imminente par la rouille vésiculeuse du pin blanc (causée par une espèce introduite), le dendroctone du pin ponderosa et le changement climatique. Chacune de ces trois menaces pèse gravement sur l'espèce, et elles interagissent d'une manière qui accentue la gravité de leurs répercussions. On prévoit que le changement climatique causera une augmentation de la fréquence, de l'intensité et de la durée des sécheresses ainsi que de la fréquence et de la gravité des incendies. En outre, les individus soumis au stress sont probablement plus vulnérables aux agents pathogènes et aux insectes.
Protection, statuts et classements
Le pin flexible figure sur la liste des espèces en voie de disparition (« endangered ») de la Wildlife Act de l'Alberta, mais cette loi ne prévoit aucune disposition offrant une protection générale aux individus et à leur habitat. Un programme de rétablissement provincial est en préparation. En Colombie-Britannique, le pin flexible ne bénéficie d'aucune protection juridique, mais il figure sur la liste bleue (espèces préoccupantes). Dans les deux provinces, de petites populations bénéficient d'une certaine protection dans les aires protégées provinciales. En outre, le pin flexible est présent dans certains parcs nationaux en Alberta et en Colombie-Britannique, où les individus et leur habitat sont protégés.
NatureServe a attribué au pin flexible les cotes de conservation S2 (en péril) en Alberta et S3 (vulnérable) en Colombie-Britannique.

Photo : © Syd Cannings
Description longue pour la figure 19
Photo d'une touffe de podistère du Yukon en pleine floraison. L'inflorescence est une ombelle composée dont les rayons sont peu nombreux à nombreux. Les cinq pétales sont jaune vif. Les feuilles basilaires sont dressées ou ascendantes, vert-bleu et pennées; elles comportent de 3 à 6 paires de folioles opposées. Les folioles les plus basses sont habituellement ternées (composées et divisées en trois parties égales) et les autres, simples
Justification de la désignation
Cette plante longévive, presque entièrement limitée au Canada, est en péril en raison de la perte prévue de son habitat alpin par suite de l'évolution rapide du climat. De plus, l'exploration et l'exploitation minière a lieu à plusieurs localités ou près de celles-ci.
Description et importance de l'espèce sauvage
Le podistère du Yukon est une plante vivace de 10 à 40 cm de hauteur qui pousse en touffes et forme souvent des colonies, à partir d'une racine pivotante allongée et charnue. Des feuilles basilaires pennées vert-bleu sous-tendent les tiges florifères, dépourvues de feuilles, portant des ombelles composées de petites fleurs qui sont jaune vif lorsqu'elles s'ouvrent puis passent au blanc.
À l'échelle mondiale, le podistère du Yukon compte parmi les quelques espèces limitées à des zones de l'Alaska et du centre-ouest du Yukon (est de la Béringie) qui ont échappé à la glaciation; environ 90 % de son aire de répartition mondiale se trouve au Canada. Il occupe une niche écologique étroite au Yukon.
Répartition
À l'échelle mondiale, le podistère du Yukon est limité au centre-ouest du Yukon et à un petit secteur adjacent de l'est de l'Alaska. Les 22 sous-populations canadiennes connues se trouvent dans deux régions disjointes : la région nord, centrée dans le sud des monts Ogilvie, et la région sud, située dans les chaînons Dawson et Ruby.
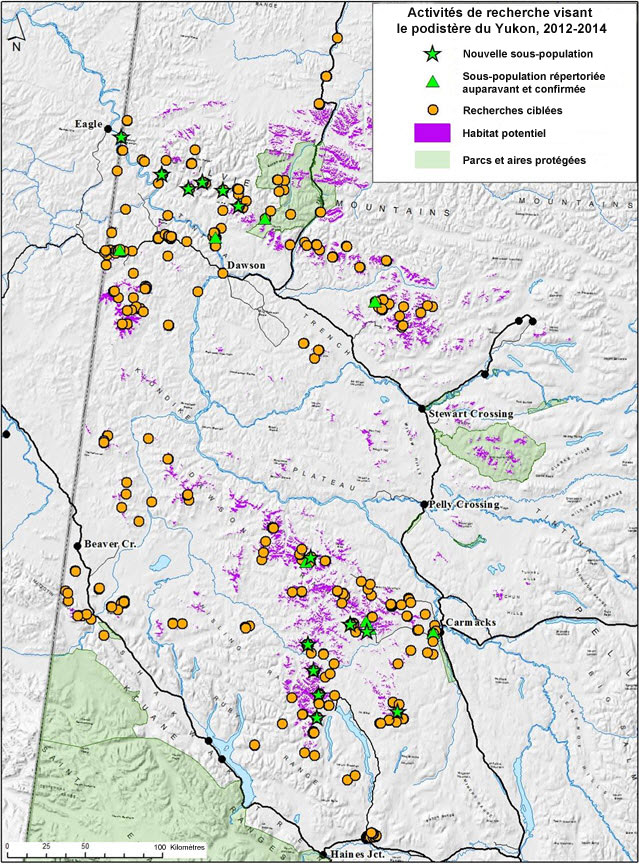
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le podistère du Yukon au Canada.
Description longue pour la carte 19
Carte illustrant les activités de recherche visant le podistère du Yukon, réalisées au Yukon de 2012 à 2014. Les symboles indiquent les endroits où de nouvelles sous populations ont été trouvées, où la présence des sous-populations connues a été confirmée et où des recherches ciblées ont été menées.
Habitat
Le podistère du Yukon est confiné à un habitat rocheux sec et bien drainé, où la végétation est clairsemée et le sol peu développé. Il ne tolère pas l'ombre. L'espèce privilégie les substrats, généralement en pente, où les matériaux de surface glissent périodiquement ou descendent lentement en aval par suite de l'action du gel. Le podistère du Yukon pousse sur des tors rocheux, des talus d'éboulis et des escarpements riverains où le substratum rocheux est exposé. La plupart des sites sont situés sur des pentes orientées vers le sud, mais, dans le cas de certains microsites abrités, quelques individus ont été trouvés sur des pentes orientées vers l'est ou l'ouest, à faible accumulation de neige. Le podistère du Yukon se trouve à une altitude allant de 702 à 1 757 m; 15 des 22 sous-populations du Yukon se trouvent entre 1 450 et 1 700 m.
Biologie
Il existe très peu d'information sur la biologie du podistère du Yukon, mais l'espèce est probablement longévive. Fleurissant tôt, la plante semble fructifier de manière échelonnée. Dans la plupart des sous-populations, la majorité des individus n'avaient pas fleuri, à l'exception des deux sous-populations de basse altitude. Les sous-populations visitées plus tard dans la saison montraient toutes un certain niveau d'échec de la production de fruits (50 à 70 % des individus dans une sous-population). La reproduction se fait par les graines, qui sont probablement dispersées par le vent sur de courtes distances. Il n'a pas été établi si la plante peut résister ou s'adapter aux perturbations.
Taille et tendances des populations
Le nombre total d'individus composant les sous-populations canadiennes de podistère du Yukon est estimé comme allant d'au moins 17 143 à plus de 24 093. Sept sous-populations comptaient 1 000 individus ou plus, 10 sous-populations en comptaient 200 à 1 000, et les 5 sous-populations restantes, moins de 200. Presque 20 000 individus du nombre total sont considérés comme matures. Aucune information sur les tendances n'est disponible.
Menaces et facteurs limitatifs
Il est prévu que la perte d'habitat résultant des changements climatiques constituera la menace la plus grave pour le podistère du Yukon. Les activités minières, qui peuvent nuire directement aux sous-populations et à leur habitat, sont considérées comme une faible menace. Sept des 22 sous-populations canadiennes connues se trouvent dans des concessions de quartz exploitées (18 % de la population canadienne), et une de celles-ci se trouve en partie dans une concession de placers exploitée. Sept autres (40 % de la population canadienne) sont situées dans des secteurs très jalonnés et à 2 km d'une concession active; les effets directs à long terme sur ces sous-populations ne sont toutefois pas considérés comme imminents. Une seule sous-population se trouve dans une aire protégée.
Protection, statuts et classements
Le podistère du Yukon ne jouit d'aucune protection et d'aucun statut juridiques au Canada et aux États-Unis à l'heure actuelle. Il n'est pas inscrit dans la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction (CITES).
NatureServe (2014) cote le podistère du Yukon « vulnérable » à l'échelle mondiale (G3), au Canada (N3) et au Yukon (S3). Aux États-Unis, sa cote est « gravement en péril à en péril » à l'échelle nationale (N1N2) et en Alaska (S1S2). Aux fins de la Situation générale des espèces au Canada et au Yukon, l'espèce est cotée 2 (possiblement en péril). Bien que l'extraction du quartz soit réglementé aux termes de la Loi sur l'extraction du quartz (2003), l'exploration est souvent menée à un niveau inférieur au seuil nécessitant un permis d'utilisation des terres et une évaluation environnementale. L'exploration à ce niveau peut poser une grave menace pour quelques petites sous-populations.

Photo : © Sean Blaney
Description longue pour la figure 20a
Photo montrant des inflorescences du rhynchospore à gros épillets (Rhynchospora macrostachya). Les inflorescences, des groupes denses d'épillets bruns allongés, sont principalement terminales et portées par un pédoncule long.
Justification de la désignation
Au Canada, ce carex vivace pousse seulement le long de deux rivages lacustres tourbeux et acides dans le sud-ouest de la Nouvelle-Écosse, où il est isolé de son aire de répartition principale qui se trouve dans la plaine côtière de l'Atlantique, aux États-Unis. La petite taille de sa population (total d'environ 700 individus répartis entre deux souspopulations) et ses besoins très spécifiques en matière d'habitat rend l'espèce vulnérable à l'aménagement des berges, à la régulation des niveaux d'eau (pour l'énergie hydroélectrique), ainsi qu'à l'ombrage et à la compétition causés par des plantes envahissantes introduites, notamment le nerprun bourdaine, qui bénéficient des concentrations accrues de nutriments dans ces deux lacs.
Description et importance de l'espèce sauvage
Le rhynchospore à gros épillets est une plante herbacée vivace de la famille des carex (Cypéracées). Il produit une dense touffe de feuilles basilaires de laquelle émergent des tiges florifères mesurant 150 à 170 cm de hauteur aux États-Unis et environ 100 cm au Canada. Les fleurs, hermaphrodites, sont entourées d'écailles brunes et présentent six soies barbelées allongées. Chaque fleur fécondée donne un akène dur et aplati qui mesure 5 à 6 mm de long et est surmonté d'un tubercule remarquablement long.
Le rhynchospore à gros épillets fait partie des nombreuses espèces à répartition disjointe de la flore de la plaine côtière de l'Atlantique qui sont rares au Canada et possèdent une population isolée dans le sud de la Nouvelle-Écosse. Ces espèces ont fait l'objet de programmes de vulgarisation qui ont permis de les faire connaître et apprécier d'un large public. La population canadienne de rhynchospore à gros épillets se trouve à 468 km des autres populations de l'espèce. Comme cette population se trouve à la limite nord de la répartition mondiale de l'espèce, elle pourrait avoir une importance particulière pour la diversité génétique de l'espèce dans son ensemble. Les akènes du rhynchospore à gros épillets, qui ressemblent à des graines, pourraient constituer une importante source de nourriture pour les canards sauvages dans le sud des États-Unis.
Répartition
Le rhynchospore à gros épillets se rencontre principalement dans les plaines côtières de l'Atlantique et du golfe du Mexique, depuis le sud du Maine jusqu'au nord-est de la Floride et à la Louisiane, mais il est aussi présent dans le sud-est du Michigan et la partie adjacente de l'Indiana, dans l'est de l'Oklahoma et les régions adjacentes du Kansas, du Missouri et de l'Arkansas ainsi que le long de la frontière entre le Tennessee et l'Alabama. En outre, des occurrences isolées ont été signalées au Kentucky et dans le nord de l'État de New York. Les mentions de l'espèce en Illinois, au Mississippi et au Vermont sont erronées. Au Canada, l'espèce est présente uniquement dans le sud de la NouvelleÉcosse, en bordure de deux lacs situés à 23 km l'un de l'autre. Moins de 1 % de la population mondiale de l'espèce se trouve au Canada.
Source: Modifié à partir de COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le rhynchospore à gros épillets au Canada.
Description longue pour la carte 20
Carte de la répartition canadienne du rhynchospore à gros épillets. L'espèce est présente aux lacs Carrigan et Molega, dans l'aire écologique nationale de l'Atlantique du COSEPAC, dans le sud-ouest de la Nouvelle-Écosse.
Habitat
Le rhynchospore à gros épillets pousse uniquement en milieu humide; au Canada, on le rencontre dans les zones riveraines à sol peu profond et acide qui sont entièrement (ou presque entièrement) exondées durant la période où l'eau est basse, pendant l'été. L'espèce pousse généralement dans des substrats graveleux souvent recouverts d'une mince couche de sol organique tourbeux, mais certains individus poussent dans une couche de tourbe plus épaisse ou dans une mince couche de sol organique, dans des fissures d'affleurements rocheux. Dans le sud des États-Unis, le rhynchospore à gros épillets se rencontre en outre dans des marais d'eau douce ou légèrement saline soumis à l'effet des marées, des forêts marécageuses ainsi que des marais et des vasières situées à l'intérieur de prairies à grandes graminées, mais également parfois dans des milieux perturbés comme des fossés, des sentiers de véhicules tout-terrain, des emprises de pipelines, des rizières et des ouvrages de retenue.

Photo : © Sean Blaney
Description longue pour la figure 20b
Photographie d'un milieu humide typique de l'habitat du rhynchospore à gros épillets.
Biologie
En Nouvelle-Écosse, le rhynchospore à gros épillets fleurit de juillet à septembre. On présume que l'espèce est en grande partie ou même uniquement pollinisée par le vent, comme la plupart des autres Cypéracées, et est autocompatible. À l'automne, les akènes, qui ressemblent à des graines, sont dispersés depuis la plante parent, et les longues soies dont elles sont munies pourraient favoriser leur dispersion par l'eau ou les animaux. En outre, les oiseaux aquatiques pourraient disperser sur de longues distances les graines qu'ils ingèrent ou qui restent accrochées à eux. Chez une espèce étroitement apparentée, la germination est favorisée par les conditions relativement sèches, qui sont idéales pour la croissance des semis. Le rhynchospore à gros épillets peut se reproduire avant l'âge de un an aux États-Unis, mais il ne peut probablement pas se reproduire avant deux ou trois ans en Nouvelle-Écosse, si on se fie aux rosettes végétatives de grosseur moyenne observées dans la province. L'espèce ne possède pas de rhizome, mais elle peut se reproduire par voie végétative en produisant de nouvelles rosettes à côté des rosettes existantes et se propager ainsi sur de très courtes distances. On en sait peu sur les paramètres démographiques de la multiplication par voie végétative, la longévité des individus distincts sur le plan génétique et des ramets ainsi que la durée d'une génération.

Photo : © Sean Blaney
Description longue pour la figure 20c
Individus du rhynchospore à gros épillets à l'anse Keddy, au lac Molega, en Nouvelle-Écosse la baie est visible en arrière- plan.
Taille et tendances des populations
En 2013, un dénombrement complet de la population canadienne a été réalisé; 688 individus ont été observés, dont 648 (95 %) dans une zone de 1,3 km sur 0,7 km au lac Carrigan et 36 (5 %) dans une bande de 30 m le long du rivage de l'anse Keddy, au lac Molega. Suffisamment d'activités de recherche ont été réalisées pour qu'on puisse supposer qu'il est peu probable qu'un grand nombre supplémentaire d'individus soit découvert à ces lacs ou que de nombreuses autres sous-populations soient présentes au Canada. On ignore les tendances en matière d'effectif, mais l'état de l'habitat à proximité des sous-populations connues donne à penser que la population est demeurée stable ou a connu un faible déclin au cours des trois dernières générations. En outre, la construction de barrages pourrait avoir causé des pertes considérables de sous-populations dans le passé.
Menaces et facteurs limitatifs
L'aménagement des rives n'a pas encore eu d'incidence sur les individus du lac Carrigan, mais 38 % de la population canadienne y est adjacente à un terrain privé qui pourrait faire l'objet d'un aménagement riverain, et 39 % additionnels se trouvent sur un terrain qui appartient actuellement à Nova Scotia Power mais pourrait finir par être vendu. L'ensemble de la sous-population du lac Molega (5 % de la population canadienne) pousse dans une petite zone non aménagée; toutefois, le rivage jouxte des terrains avec chalet presque partout autour de ce lac et risque fortement de faire l'objet d'un aménagement accru. Au lac Carrigan, tous les individus (95 % de la population canadienne) se trouvent dans une zone pour laquelle Nova Scotia Power possède un droit d'inondation, pour la production d'hydroélectricité. Selon Nova Scotia Power, le lac Carrigan n'a jamais fait l'objet d'une inondation d'origine humaine, et il est peu probable qu'il le fasse dans un avenir rapproché. Le nerprun bourdaine, arbuste exotique envahissant, est déjà présent très près de certaines occurrences au lac Carrigan et à 950 m de la sous-population du lac Molega. Toutefois, il semble peu probable que cette espèce ait des répercussions sur les milieux lacustres les plus fortement occupés par le rhynchospore à gros épillets. L'eutrophisation associée aux déchets rejetés par l'industrie de l'élevage du vison ou, au lac Molega, aux effets cumulatifs de centaines de nouveaux chalets constitue une menace potentielle pour l'avenir, car elle pourrait faire en sorte que le rhynchospore à gros épillets soit supplanté par des espèces plus agressives.
Protection, statuts et classements
Au Canada, le rhynchospore à gros épillets ne jouit d'aucune protection juridique, et aucune occurrence de l'espèce ne se trouve dans une aire protégée. Toutefois, il est protégé par la loi dans le Maine, au Connecticut et au Tennessee. Le rhynchospore à gros épillets est coté « gravement en péril » (N1) au Canada et en Nouvelle-Écosse (S1) et a été classé « possiblement en péril » en Nouvelle-Écosse et au Canada dans le cadre du Programme sur la situation générale des espèces. En outre, il a reçu la cote « non en péril » à l'échelle mondiale (G4) et à l'échelle nationale (N4) aux États-Unis, mais on lui a accordé les cotes « gravement en péril » (S1) au Kentucky, dans le Maine, au Missouri et au Rhode Island, modérément « gravement en péril » (S1S2) au Connecticut et au Tennessee, « en péril » (S2) en Arkansas, en Indiana et au Kansas, « vulnérable » (S3 ou S3?) en Caroline du Nord, dans l'État de New York et en Virginie ainsi que modérément « vulnérable » (S3S4) au Michigan. Le rhynchospore à gros épillets est coté « apparemment non en péril » (S4) au Delaware, est « non classé » (SNR) en Alabama, en Caroline du Sud, dans le District de Columbia, en Floride, en Louisiane, au Maryland, au Massachusetts, au New Jersey, en Oklahoma et au Texas et est « non classable » (SU) en Georgie. Il pourrait être « en péril » en Floride et modérément « vulnérable » en Alabama, en Georgie et au Massachusetts.

Photo : © Jennifer Anderson (USDA-NRCS PLANTS Database)
Description longue pour la figure 21
Photo de tiges érigées du rotala rameux (Rotala ramosior). Les feuilles sont opposées, disposées par paires à angle droit par rapport à celles qui les précèdent sur la tige. Des fleurs sont visibles à l'aisselle des feuilles. Les fleurs sont généralement solitaires et comportent quatre pétales blanc ou roses.
Justification de la désignation
Cette plante annuelle pousse sur le rivage de seulement deux lacs situés à la limite sud du Bouclier canadien dans le sud-est de l'Ontario. Les fluctuations d'une année à l'autre des niveaux d'eau le long des rivages lacustres ont une incidence sur l'abondance des plantes. Les impacts du développement, des activités de navigation de plaisance, et la manipulation des niveaux d'eau ont le potentiel de réduire le nombre d'individus.
Description et importance de l'espèce sauvage
Le rotala rameux est une petite plante annuelle de la famille de la salicaire (Lythracées). Ses petites fleurs sont sessiles et généralement solitaires à l'aisselle des feuilles. Les pétales, habituellement au nombre de quatre, sont blancs ou roses et mesurent jusqu'à 1 mm de longueur. Le rotala rameux atteint au Canada la limite nord de son aire de répartition en Amérique du Nord. Les populations qui se trouvent aux limites de l'aire d'une espèce peuvent être génétiquement distinctes.
Répartition
Le rotala rameux est indigène en Amérique du Nord, en Amérique centrale et en Amérique du Sud. En Amérique du Nord, il est présent dans l'est du Massachusetts à la Floride, et dans l'ouest, du sud du Minnesota au Texas et au Mexique. Il se rencontre seulement de façon sporadique dans les États du Midwest et la région intermontagnarde, mais plus fréquemment le long de la côte du Pacifique, de la Californie au centre-sud de la Colombie-Britannique. Le rotala rameux a une répartition disjointe au Canada, étant présent en Ontario et en Colombie-Britannique.
En Ontario, le rotala rameux se rencontre uniquement sur les rives du lac Puzzle et du long lac Sheffield (élargissement de la rivière Salmon) et de la rivière Clare, qui lui est adjacente. Ces plans d'eau se trouvent le long du bord méridional du Bouclier canadien, dans le comté de Lennox et Addington.
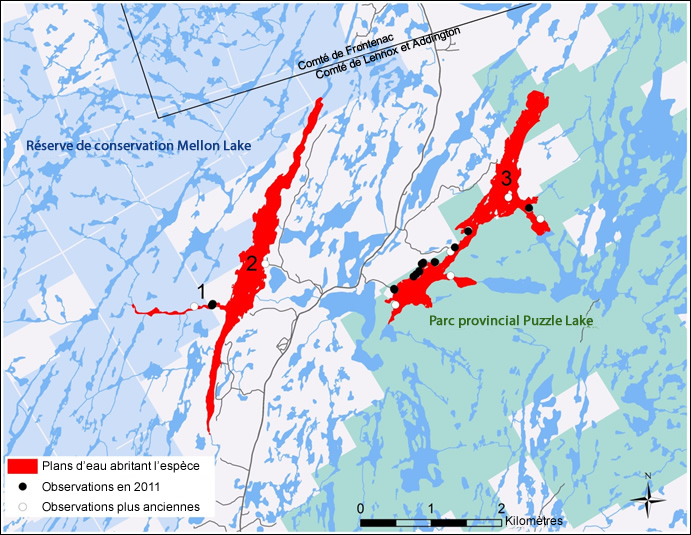
Source : COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le rotala rameux au Canada.
Description longue pour la figure carte 21
Carte montrant les sites où le rotala rameux a été observé en 2011 et les sites où il a été observé plus anciennement mais pas en 2011. L'espèce se rencontre uniquement sur les rives du lac Puzzle et du long lac Sheffield (élargissement de la rivière Salmon) et de la rivière Clare, qui lui est adjacente. Ces plans d'eau se trouvent le long du bord méridional du Bouclier canadien, dans le comté de Lennox et Addington.
Habitat
Le rotala rameux est une plante de milieux ouverts saisonnièrement humides soumis à des fluctuations naturelles ou artificielles des niveaux d'eau. Son habitat comprend les rives de cours d'eau, les fossés, les bords d'étangs, les berges sableuses à boueuses, les dépressions interdunaires et, à l'occasion, les bords humides de champs cultivés. Dans le centre-sud de l'Ontario, il se rencontre sur les rives de lacs et de cours d'eau dans des crevasses humides et peu profondes du substrat rocheux comportant de petites accumulations de sable, de gravier et de tourbe. Dans le sud-ouest de l'Ontario, il était autrefois présent dans un vieux champ humide qui se trouvait dans un vestige de prairie sableuse. Dans le sud de la vallée de l'Okanagan, en Colombie-Britannique, le rotala rameux se rencontre sur les rives boueuses à sableuses et humides à mouillées ou parfois salines de lagunes ou d'étangs et dans des dépressions côtières et des baissières peu profondes. Dans la région de Kamloops, il pousse dans des dépressions et des creux interdunaires sableux ou limoneux peu profonds ou sur des étendues de sable silteux boueux de rives de canaux exposées.
Biologie
Le rotala rameux est une plante annuelle associée à des milieux périodiquement inondés. Ses populations peuvent fluctuer considérablement d'une année à l'autre. La plante se reproduit de façon sexuée et produit un grand nombre de graines. La vaste majorité des graines sont dormantes lorsqu'elles parviennent à maturité en automne, mais la dormance est généralement levée lorsque les graines sont submergées à la fin de l'automne ou en hiver.
Taille et tendances des populations
La population canadienne totale a été estimée à au moins 6 859 individus en 2011. À l'époque, quatre sous-populations étaient distinguées, soit deux en Ontario (unité désignable des plaines des Grands Lacs) et deux en Colombie-Britannique (unité désignable des montagnes du Sud).
En Ontario, les nombres d'individus observés en 2011 étaient faibles en comparaison des nombres signalés antérieurement. Seulement 1 444 individus matures avaient alors été dénombrés (305 chez la sous-population du long lac Sheffield et de la rivière Clare et 1 139 chez la sous-population du lac Puzzle). Un nombre record d'individus matures a été enregistré en 2004, alors qu'entre 4 325 et 6 325 individus matures ont été observés (2 615 à 4 615 chez la sous-population du long lac Sheffield et de la rivière Clare et 1 610 à 1 710 chez la sous-population du lac Puzzle).
En Colombie-Britannique, entre 5 410 et 5 570 individus ont été dénombrés en 2011 à deux sites occupés par la sous-population de Kamloops. Aucun individu n'a été observé à l'autre site de Kamloops où la présence de l'espèce avait déjà mentionnée antérieurement, sur l'île McArthur. Aucun individu n'a été observé en 2011 chez la sous-population du sud de la vallée de l'Okanagan, mais certains sites n'ont pas visités, dont un qui abritait quelque 12 000 individus (nombre estimé) en 2004. Le nombre le plus élevé d'individus matures observés chez cette sous-population au cours d'une année donnée a été enregistré en 2004, alors que 12 180 individus matures ont été dénombrés.
Depuis la dernière évaluation, aucune perte de sous-population n'a été documentée en Ontario. Bien que peu fréquents, les dénombrements effectués dans les territoires occupés par les deux sous-populations semblent attester la présence de fluctuations annuelles, mais les données de dénombrement sont insuffisantes pour évaluer les tendances de ces sous-populations. En Colombie-Britannique, la sous-population de Kamloops est encore présente, mais la sous-population du sud de la vallée de l'Okanagan est considérée comme en déclin, et plusieurs sites historiques sont aujourd'hui disparus. La probabilité d'une immigration externe depuis les États-Unis est jugée extrêmement faible.
Menaces et facteurs limitatifs
L'aire de répartition du rotala rameux au Canada est limitée par l'association exclusive de la plante aux milieux inondés de façon saisonnière. En Ontario, l'aménagement des berges et les activités récréatives constituent les deux principales menaces pour l'espèce. En Colombie-Britannique, les espèces végétales envahissantes représentent la principale menace pour les populations existantes. La perte d'habitat occasionnée par le développement, la dégradation de l'habitat et les dommages infligés par le bétail, de même que l'altération des niveaux d'eau naturels du lac Osoyoos sont également considérés comme des menaces en Colombie-Britannique.
Protection, statuts et classements
Le rotala rameux a été désigné « en voie de disparition » par le COSEPAC en 1999 et figure à l'annexe 1 de la Loi sur les espèces en péril du gouvernement fédéral. L'élaboration d'un programme de rétablissement fédéral pour cette espèce n'est pas encore achevée. En novembre 2014, le COSEPAC a attribué la cote « menacée » à la population des plaines des Grands Lacs, et la cote « en voie de disparition » à la population des montagnes du Sud. Le rotala rameux est désigné « en voie de disparition » en vertu de la Loi de 2007 sur les espèces en voie de disparition. Cette loi confère une protection à l'espèce et à son habitat. Le rotala rameux est également protégé au parc provincial Puzzle Lake et à la réserve de conservation Mellon Lake. Aucune protection juridique spécifique ne lui est cependant accordée en Colombie-Britannique. La cote de conservation générale du rotala rameux est « en péril » en Ontario, en Colombie- Britannique et au Canada.

Photo : © Syd Cannings
Description longue pour la figure 22a
Photo de la saxifrage à épis (Micranthes spicata), où on voit des individus en fruits poussant en bordure d'un ruisseau. Les feuilles sont principalement basilaires, longuement pétiolées, orbiculaires à réniformes et bordées de cils et de dents pointues.
Justification de la désignation
Cette fleur sauvage vivace ne pousse qu'au Yukon et en Alaska. Au Canada, elle ne se trouve que dans de petits sites dans une zone géographique limitée où elle présente des différences génétiques par rapport à la population de l'Alaska. Elle pousse le long de ruisseaux frais et ombragés et dans des zones alpines rocheuses et humides qui pourraient être touchées par des activités minières et les effets potentiels des changements climatiques.
Description et importance de l'espèce sauvage
La saxifrage à épis est une plante herbacée vivace facile à repérer, qui pousse isolément ou en touffes à partir d'un rhizome court et épais. L'inflorescence est portée par une hampe mesurant 15 à 70 cm de hauteur. La saxifrage à épis, endémique de l'est de la Béringie, appartient à un petit cortège d'espèces dont la répartition mondiale connue se limite aux régions d'Alaska et de l'ouest du Yukon ayant été épargnées par les glaciations. La population canadienne se trouve à la limite est de l'aire de répartition de l'espèce et présente des différences génétiques par rapport à la population d'Alaska. Au Yukon, la saxifrage à épis semble occuper une niche écologique restreinte, caractérisée par des conditions d'habitat très spécifiques et par une courte saison de végétation.
Répartition
La saxifrage à épis est endémique au Yukon et à l'Alaska. En Alaska, elle se rencontre dans une bonne portion de la partie centrale de l'État. Au Canada, 12 souspopulations sont connues, toutes dans l'ouest du Yukon. Environ 10 % de l'aire de répartition mondiale de l'espèce se trouve au Canada.
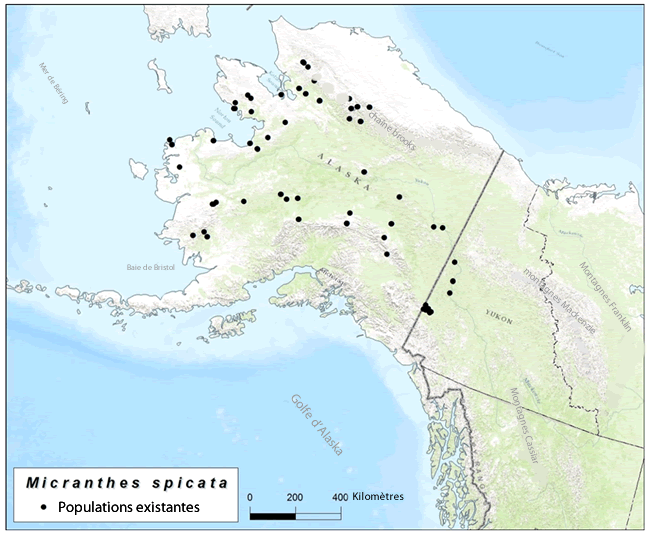
Source: COSEPAC 2015. Évaluation et Rapport de situation du COSEPAC sur le saxifrage à épis au Canada.
Description longue pour la carte 22
Carte de l'aire de répartition mondiale de la saxifrage à épis, qui a été signalée uniquement en Alaska et dans l'ouest du Yukon. En Alaska, l'espèce se rencontre de manière dispersée dans une bonne partie du centre de l'État, depuis la frontière du Yukon jusqu'à la côte ouest.
Habitat
Au Canada, la saxifrage à épis pousse dans deux types de milieux, tous deux caractérisés par des conditions fraîches et humides durant la saison de croissance : les berges fraîches et ombragées de ruisseaux, et les prés alpins rocheux humides. Sur les berges des ruisseaux, elle pousse sur des plates-formes rocheuses humides des affleurements voisins et dans l'étroite plaine inondable adjacente. Dans ces milieux, on la retrouve sur de petites accumulations de substrat recouvertes de limon et de mousses ainsi que sur le sol dénudé bordant les ruisseaux. L'espèce peut pousser isolément mais forme souvent des groupes denses pouvant réunir plusieurs douzaines d'individus. Dans les milieux alpins et la partie supérieure des milieux subalpins, elle pousse entre les blocs et les pierres ainsi que dans le gazon bordant les éboulis stabilisés.

Photo : © Syd Cannings
Description longue pour la figure 22b
Photo de l'habitat de la saxifrage à épis au ruisseau Spicata, où on voit des chutes, des affleurements rocheux bordant le ruisseau ainsi que l'ombre abondante fournie par la forêt composée de bouleaux d'Alaska, d'épinettes blanches, d'aulnes et de saules. Le reste de la végétation est constitué d'une combinaison diversifiée d'arbustes bas, de mousses, de graminées et d'autres plantes herbacées, avec une abondante litière de feuilles.
Les ruisseaux du Yukon qui hébergent une sous-population de saxifrage à épis ont plusieurs caractéristiques communes : ruisseaux étroits et rocheux; débit ininterrompu d'eau claire et froide; présence d'aufeis (glace formée en hiver par l'apport constant d'eau de source sur le ruisseau gelé, pouvant persister jusqu'en juillet) ou de pergélisol, lesquels contribuent au maintien d'un microclimat froid et humide; présence d'affleurements rocheux en bordure du ruisseau; ombre abondante fournie par le bouleau d'Alaska ou l'épinette blanche ainsi que les saules et les aulnes.
Biologie
On ne sait presque rien de la biologie de la saxifrage à épis. La plante se reproduit par son rhizome et par ses graines, dont on ne connaît pas les conditions de germination. L'autopollinisation est fréquente chez les Saxifragacées et pourrait exister chez la saxifrage à épis. On ne connaît pas la longévité de la plante, et on ne sait pas si elle maintient un réservoir de semences dans le sol.
On ne sait rien de la capacité de la plante à tolérer la perturbation et à repeupler le milieu par la suite. Elle semble pouvoir survivre à l'inondation, mais les fortes crues (comme les crues subites) peuvent provoquer un affouillement de la plaine inondable et ainsi éliminer les sous-populations existantes et leur réservoir de semences éventuel. Cependant, les individus poussant sur les affleurements rocheux au-dessus de la limite des crues pourraient fournir les graines nécessaires au rétablissement des populations, si les caractéristiques essentielles de l'habitat n'ont pas été altérées.
Taille et tendances des populations
Les 12 sous-populations comptaient au total plus de 4680 individus en 2014, dont environ 3 244 étaient matures. On s'attend à ce que de nouveaux individus soient découverts, mais il est peu probable que l'effectif total dépasse les 10 000 individus.
Malgré plus d'un siècle d'herborisation dans la région, la saxifrage à épis a été signalée une seule fois au Canada (en 1899) jusqu'à ce qu'elle y soit redécouverte en 2009. Il semble donc qu'elle était déjà rare ou peu commune à l'époque de la ruée vers l'or, à la fin du 19e siècle et au début du 20e siècle. Les données disponibles ne permettent pas d'établir les tendances des populations, mais il est probable que, dans les basses terres, une bonne partie de l'habitat de l'espèce a été altérée ou détruite depuis la fin du 19e siècle par l'exploitation des placers, la construction de routes et la coupe du bois. Ces activités se poursuivent aujourd'hui. Les occurrences alpines semblent être intactes.
Menaces et facteurs limitatifs
Au Yukon, l'exploitation des placers constitue la plus étendue des menaces d'origine humaine auxquelles est exposé l'habitat de la saxifrage à épis. L'intensité et la portée de ce type d'exploitation varient en fonction du prix de l'or. Des sous-populations peuvent être décimées ou détruites par l'effet direct de l'exploitation des placers ou par les travaux réalisés en amont qui peuvent nuire à son habitat, en provoquant par exemple un envasement (accumulation de sédiments), la formation de barrages ou un réalignement du cours d'eau. En outre, le changement climatique dû aux activités humaines pourrait accroître la gravité et la fréquence de certains phénomènes naturels, comme les crues subites, les incendies et les glissements de terrain.Aucune menace imminente ne pèse sur les quatre sous-populations alpines; toutefois, leur habitat est limité à une petite région du sud-ouest du Yukon. Les effets du changement climatique et l'exploitation minière de pointe pourraient constituer des menaces pour ces sous-populations dans le futur.
Protection, statuts et classements
NatureServe a attribué à la saxifrage à épis les cotes G3G4 (vulnérable à probablement non en péril) à l'échelle mondiale, N3N4 (vulnérable à probablement non en péril) à l'échelle des États-Unis, N2 (en péril) à l'échelle du Canada, S3S4 (vulnérable à probablement non en péril) à l'échelle de l'Alaska et S2 (en péril) à l'échelle du Yukon. Aux fins de la Situation générale des espèces, l'espèce est jugée « possiblement en péril » au Yukon et dans l'ensemble du Canada.
À l'heure actuelle, la saxifrage à épis ne jouit d'aucune protection juridique au Canada, et elle n'est pas visée par l'Endangered Species Act des États-Unis ni par la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction (CITES).
Dans le cas de 7 des 12 sous-populations (environ 70 % de la population canadienne), des concessions actives d'exploitation des placers ou d'exploitation du quartz recoupent l'habitat de l'espèce ou les secteurs situés en amont. Il existe des restrictions quant aux travaux pouvant être effectués dans ces concessions, mais elles visent principalement à protéger l'habitat des poissons, et il n'existe aucune obligation juridique de protéger les sous-populations existantes de saxifrage à épis ainsi que leur habitat.

Photo : © Carita Bergman
Description longue pour la figure 23a
Photo d'un Starique de Cassin (Ptychoramphus aleuticus) prise par en dessus. On voit que cet oiseau de mer est compact et pourvu d'ailes courtes. Le plumage est gris foncé, et l'œil est surmonté d'un petit croissant blanc. L'iris est blanc
Justification de la désignation
Environ 75 % de la population mondiale de cet oiseau de mer qui niche à même le sol se retrouve en Colombie- Britannique. Dans l'ensemble, on estime que la population canadienne est en déclin, mais le suivi de la population a été insuffisant pour déterminer la taille et les tendances. L'espèce fait face aux menaces posées par les mammifères prédateurs qui ont été introduits sur les îles où elle se reproduit. Les prédateurs ont été retirés de certaines colonies de reproduction, mais il est probable qu'une gestion continue des prédateurs sera nécessaire pour maintenir l'espèce. L'espèce fait également face à d'autres menaces lorsqu'elle s'alimente en mer, incluant les effets à grande échelle des changements climatiques sur ses proies océaniques, et les risques posés par le mazoutage.
Description et importance de l'espèce sauvage
Le Starique de Cassin est un petit oiseau de mer gris de la famille des Alcidés. Environ 75 % à 80 % de sa population mondiale se reproduit en Colombie-Britannique. Près de la moitié de tous les oiseaux de mer nichant dans cette province sont des Stariques de Cassin.
L'espèce compte deux sous-espèces, le Ptychoramphus aleuticus aleuticus et le P. a. australis. Seule la première est présente au Canada.
Répartition
Les Stariques de Cassin vivent le long de la côte nord-américaine de l'océan Pacifique. Ils passent la majeure partie de leur temps en mer et ne viennent à terre que pour se reproduire. La plupart nichent dans des colonies situées dans des îles côtières réparties depuis les Aléoutiennes occidentales, en Alaska, jusqu'au centre de la Basse- Californie; l'espèce niche occasionnellement en Sibérie et dans les Kouriles (îles russes dont certaines sont cependant revendiquées par le Japon). En dehors de la période de reproduction, les Stariques de Cassin sont répartis principalement depuis le sud-est de l'Alaska jusqu'au centre de la Basse-Californie, des concentrations étant observées au large de la Californie.
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur le Starique de Cassin au Canada.
Description longue pour la carte 23
Carte montrant la localisation et la taille relative (en nombre de couples) des colonies de Stariques de Cassin en Colombie-Britannique. Les Stariques de Cassin nichent dans 62 îles ou groupes d'îles situés dans les eaux côtières de Haida Gwaii, du nord et de l'ouest de l'île de Vancouver et de la portion nord de la côte continentale.
Habitat
Les Stariques de Cassin nichent dans des îles n'abritant pas de mammifères prédateurs indigènes, comme des ratons laveurs et des visons. En Colombie-Britannique, la grande majorité des stariques nichent dans des terriers dans des milieux boisés ou exempts d'arbres. La plupart des terriers se trouvent à moins de 100 m du rivage. La quantité de milieu propice à la nidification de l'espèce a diminué au cours des 75 dernières années en raison d'introductions de mammifères prédateurs dans les îles abritant une colonie. Des modifications de la végétation ont aussi entraîné une réduction de la quantité d'habitat de nidification de haute qualité dans certaines îles depuis les années 1980.
En mer, le Starique de Cassin occupe deux domaines océaniques : le système du courant de Californie, qui s'étend de la pointe nord de l'île de Vancouver jusqu'au Mexique, et le système du courant d'Alaska, situé au nord du premier. L'habitat marin de l'espèce est très variable à de multiples échelles temporelles. Les processus atmosphériques ou océanographiques qui élèvent les températures de l'océan (p. ex. phases de l'oscillation décennale du Pacifique durant lesquelles les eaux sont chaudes) sont associés à une performance de reproduction réduite, et ceux qui causent des phénomènes climatiques extrêmes (p. ex. épisodes El Niño) peuvent réduire les taux de survie des adultes.

Photo : © Carita Bergman
Description longue pour la figure 23b
Photo d'un Starique de Cassin (Ptychoramphus aleuticus) sur l'eau, en vue de côté. On voit que cet oiseau de mer est compact et pourvu d'ailes courtes. Le plumage est gris foncé, presque noir, et l'œil est surmonté d'un petit croissant blanc. L'iris est blanc
Biologie
Le nid ne compte qu'un seul oeuf, qui est couvé par les deux parents en alternance journalière durant environ 38 jours. Après l'éclosion, les parents réintègrent le terrier chaque soir pour nourrir le poussin sur une période d'environ 45 jours. Le jeune est indépendant une fois le nid quitté.
Dans le système du courant de Californie, le succès reproducteur et la fécondité des Stariques de Cassin se trouvent réduits dans les années où les eaux sont chaudes en raison de baisses de la disponibilité de nourriture. La réduction du succès reproducteur est attribuée à une désynchronisation entre la période d'alimentation des poussins et le pic d'abondance des proies zooplanctoniques essentielles pour l'espèce, pic qui se produit plus tôt et dure moins longtemps dans les années où les eaux sont chaudes. En outre, les adultes survivent moins bien durant les épisodes climatiques extrêmes. Par ailleurs, dans le système du courant d'Alaska, les épisodes El Niño réduisent les taux de survie des Stariques de Cassin, mais n'ont pas d'effet sur leur performance de reproduction.
Taille et tendances des populations
La population mondiale de Stariques de Cassin est estimée à 3,57 millions d'individus nicheurs, dont environ 2,69 millions (75 %) nichent au Canada. L'île Triangle abrite la plus grande colonie du monde, qui compte à elle seule environ 55 % de la population mondiale. Au cours des 75 dernières années, des colonies ont été éliminées par des prédateurs introduits, soit des rats, des ratons laveurs et des visons. L'ampleur de la baisse des effectifs de l'espèce est largement inconnue parce qu'on ne dispose de données sur les effectifs que depuis moins de 30 ans.
Menaces et facteurs limitatifs
Les principales menaces pesant sur l'espèce sont les changements climatiques, les prédateurs introduits et les déversements d'hydrocarbures. Les changements climatiques devraient donner lieu à un réchauffement des températures océaniques et à un accroissement de la fréquence des épisodes El Niño, ces deux facteurs ayant des conséquences négatives sur la reproduction et la survie des Stariques de Cassin. Ces impacts devraient être particulièrement importants et immédiats dans le système du courant de Californie. Par ailleurs, les rats, les ratons laveurs et les visons ont des effets destructeurs notables sur les colonies, et ils pourraient peut-être même en éliminer certaines. Enfin, la menace que présente la contamination par les hydrocarbures issue de déversements chroniques ou catastrophiques est constante et devrait s'accroître s'il y avait augmentation de la circulation de navire en mer.
Protection, statuts et classements
Dans sa liste rouge, l'UICN place le Starique de Cassin dans la catégorie « préoccupation mineure », et NatureServe lui attribue à l'échelle mondiale le statut de conservation « apparemment non en péril ». Aux échelles nationale et provinciale, la population reproductrice est considérée comme de vulnérable à en péril, tandis que la population non reproductrice est considérée comme apparemment non en péril. L'espèce a été placée sur la liste bleue de la Colombie-Britannique en tant qu'espèce préoccupante. Elle figure aussi dans cette province comme espèce désignée dans la stratégie de gestion des espèces sauvages désignées (Identified Wildlife Management Strategy) établie en vertu de la Forest Range and Practices Act. Une seule colonie de nidification (renfermant moins de 1 % de la population) ne bénéficie pas d'une protection officielle en Colombie- Britannique.

Photo : © Scott Gillingwater
Description longue pour la figure 24
Photographie d'une tortue boîte de l'Est (Terrapene carolina) sur un sol à végétation clairsemée. La photographie montre le côté et le devant de la dossière ainsi que le côté de la tête. La dossière est fortement bombée, de couleur brune ou noire avec des motifs jaunes. L'iris est rouge.
Justification de la désignation
Cette tortue était présente historiquement en Ontario selon les indications archéologiques et les connaissances traditionnelles autochtones. L'habitat a été profondément modifié et l'espèce n'existe plus. Des activités de recherche considérables ont documenté moins de 10 individus en Ontario, mais ceux-ci sont tous des individus en captivité de provenance inconnue ayant été relâchés et ne sont pas considérés comme faisant partie de l'ancienne population canadienne.
Description et importance de l'espèce sauvage
La tortue boîte de l'Est (Terrapene carolina) est une petite tortue terrestre, dont la longueur de la dossière dépasse rarement 16 cm. La dossière est légèrement carénée et fortement bombée, généralement brune ou noire avec des motifs dont la couleur varie du jaune à l'orange. Le plastron porte une charnière qui permet aux deux lobes de se refermer complètement sous la carapace. La tortue boîte de l'Est revêt une importance spéciale sur le plan culturel pour les Iroquoiens. L'espèce est aussi la plus grande espèce animale au monde à tolérer le gel.
Répartition
La tortue boîte de l'Est est présente dans une grande partie de l'est de l'Amérique du Nord. Dans le nord des États-Unis, l'espèce est présente depuis le centre du Michigan jusque dans le sud du Maine; dans le sud des États-Unis, elle est présente depuis l'est du Texas jusqu'en Floride. Des populations isolées sont présentes dans deux régions du Mexique. Aucune population indigène de la tortue boîte de l'Est n'existe au Canada. Des vestiges de tortues boîtes ont été trouvés à douze sites archéologiques en Ontario. Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a déjà évalué que la tortue boîte de l'Est était indigène au Canada (en Ontario).
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur la tortue boîte de l'Est au Canada.
Description longue pour la carte 24
Carte montrant les localités approximatives des 12 sites du sud de l'Ontario où des vestiges archéologiques du Terrapene carolina ont été trouvés.
Habitat
La tortue boîte de l'Est est associée aux forêts ouvertes décidues ou mixtes. L'espèce fréquente aussi les milieux adjacents à ces forêts, comme les vieux champs, les pâturages, les zones riveraines et les paysages suburbains. Elle a aussi besoin de petits milieux humides, de zones de suintement ou de ruisseaux. La tortue boîte de l'Est pond habituellement ses œufs dans des milieux ouverts à sol sableux ou loameux, et parfois à l'extérieur des zones qu'elle occupe le reste de l'année. De nombreux sites de nidification se trouvent dans des zones perturbées comme les champs pâturés ou le long des routes. L'hibernation se fait généralement sur terre, les individus s'enfouissant dans le sol meuble ou sous la litière de feuilles; cependant, certaines tortues boîtes de l'Est passent l'hiver en milieu aquatique, au fond des étangs ou des ruisseaux.
Biologie
La tortue boîte de l'Est mâle atteint habituellement la maturité à l'âge de 5-6 ans, et la femelle, à l'âge de 7-8 ans dans le sud de l'aire de répartition. Dans le nord de l'aire de répartition, les individus atteignent probablement la maturité à un âge plus avancé.
La plupart des femelles adultes ne pondent qu'une seule fois par année; cependant, dans les populations du sud, il peut y avoir jusqu'à quatre pontes par année. Dans le nord de l'aire de répartition, c'est habituellement en juin que la ponte a lieu. La taille de la ponte est de 1 à 11 œufs, mais une ponte de 4 à 7 œufs est plus courante. La période d'incubation peut durer de 61 à 90 jours dans le nord de l'aire de répartition de l'espèce. Les embryons du T. carolina sont caractérisés par un rapport des sexes qui dépend de la température. Une température d'incubation constante de 22,5 à 27,0 °C produit principalement des mâles, alors qu'une température d'incubation constante de 28,5 °C ou plus produit des femelles. La longueur moyenne de la dossière des nouveau-nés est de 30,3 mm, et leur poids moyen est de 8,2 g.
La tortue boîte de l'Est est omnivore, bien que les juvéniles soient principalement carnivores. Il a été confirmé que l'espèce consomme notamment des champignons, des mousses, des racines, des tiges, des graines et des fruits de diverses plantes, des invertébrés (escargots et limaces en particulier) et des vertébrés (habituellement consommés comme charogne). Les nids sont souvent pillés par les ratons laveurs, les renards et les moufettes. De nombreux prédateurs consomment les tortues juvéniles, notamment des mammifères, des serpents, des couleuvres et des oiseaux. Bien que les adultes soient mieux protégés contre les prédateurs, ils peuvent aussi être tués par des mammifères.
La superficie du domaine vital de la tortue boîte de l'Est est généralement petite. Elle est d'environ 2 ha, et peut atteindre plus de 30 ha dans le cas de certains individus. Bien que des déplacements saisonniers de 10,0 km aient été confirmés, ils sont inhabituels.
Taille et tendances des populations
Il n'existe aucune population de la tortue boîte de l'Est au Canada mais, en Ontario, des tortues boites ont été trouvées à des sites archéologiques, et d'autres ont été observées de manière sporadique durant au moins les 55 dernières années. Au XXe siècle, la présence de la tortue boîte de l'Est a été signalée pour la première fois en 1960 au Parc national de la Pointe Pelée et, en 1963, au parc provincial Rondeau. Il existe des mentions de tortues boîtes de l'Est à diverses localités du sud de l'Ontario (Brant, Essex, Haldimand- Norfolk, Hamilton-Wentworth, Kent, Lambton, Middlesex, Niagara et Waterloo) jusqu'en 2013. Il existe aussi une mention de tortue boîte de l'Est près de Montréal (Québec) en 1988. Certains individus appartiennent aux sous-espèces de la partie sud de l'aire de répartition de la tortue boîte de l'Est et la plupart de ces mentions, sinon toutes, sont généralement considérées comme des animaux domestiques ayant été remis en liberté.
Il existe de nombreuses observations de tortues boîtes de l'Est au Parc national de la Pointe Pelée qui couvrent beaucoup d'années, et le fait que certains individus aient réussi à passer l'hiver dans le parc a été documenté. Les relevés intensifs visant les tortues d'eau douce à Pointe Pelée qui ont été menés en 2000-2001 n'ont permis de repérer aucune tortue boîte de l'Est, mais quelques mentions de la présence de l'espèce ont été enregistrées depuis. Il semble peu probable que ces tortues soient des reliques d'une population indigène, parce que les relevés biologiques intensifs menés dans le parc au début du XXe siècle n'ont mené à la découverte d'aucune tortue boîte de l'Est.
La taille des populations aux États-Unis varie grandement; elle est de moins de 25 individus à plus de 1 700 individus. Cependant, la faible viabilité des petites populations ou des populations de faible densité a été montrée. La tortue boîte de l'Est demeure répandue, mais ses effectifs diminuent dans la majeure partie de son aire de répartition, et l'espèce a disparu dans de nombreuses régions, notamment dans le nord de son aire de répartition. L'espèce a fait l'objet de peu d'études à long terme, mais des baisses d'effectifs de 50 à 75 % ont été documentées, malgré le fait qu'un taux de survie annuel des adultes aussi élevé que 96 % ait été confirmé. Les taux de mortalité des oeufs et des juvéniles sont probablement assez élevés. Une étude a indiqué un taux de mortalité de 100 % chez les nouveau-nés et les juvéniles ayant fait l'objet d'un suivi.
Menaces et facteurs limitatifs
De nombreuses menaces guettent la tortue boîte de l'Est dans son aire de répartition. La mortalité sur les routes est une menace importante pour cette espèce terrestre, qui peut parcourir de grandes distances et facilement nicher sur les routes. L'exportation internationale légale de tortues boîtes de l'Est a déjà représenté un grand problème, mais la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d'extinction (CITES) a réglé le problème en fixant la limite d'exportation à zéro. Néanmoins, le prélèvement légal et illégal d'individus pour la vente ou à des fins d'utilisation personnelle constitue encore une importante menace pour l'espèce dans l'ensemble de son aire de répartition. La perte d'habitat et la fragmentation de l'habitat sont aussi des menaces importantes, parce que de grandes zones boisées intactes sont supprimées en raison du lotissement ou divisées par la construction de routes. Dans certaines régions, le taux de mortalité résultant du fait que certains individus sont coincés entre les rails des voies ferrées peut être élevé. La coupe ou la fauche du foin peut aussi entraîner la mort de tortues. Les maladies comme les iridovirus (des ranavirus) et les infections des voies respiratoires supérieures ont aussi causé de la mortalité dans certaines populations. Les incendies, y compris les brûlages dirigés, peuvent aussi mener à un taux de mortalité élevé des tortues boîtes de l'Est.
Protection, statuts et classements
La tortue boîte de l'Est figure à l'Annexe II de la CITES. À l'échelle mondiale, l'espèce est classée vulnérable (Vulnerable) mais, aux États-Unis, elle est considérée comme non en péril à l'échelle nationale (Secure nationally [N5]). Elle figure sur la liste des espèces gravement en péril (Critically Imperilled [S1]) dans deux États, à savoir le Maine et le New Hampshire.

Photo : © Cary Hamel
Description longue pour la figure 25
Photo de tiges florifères de vernonie fasciculée (Vernonia fasciculata). L'inflorescence est aplatie et est constituée d'un groupe dense de capitules. Chaque capitule est constitué d'un disque de fleurs violettes.
Justification de la désignation
Cette plante vivace remarquable a une aire de répartition géographique limitée au Canada, où elle occupe de petites prairies restantes qui se trouvent principalement le long des fossés sur le bord des routes et en bordure de cours d'eau dans le sud du Manitoba. Les quelques petites sous-populations sont exposées aux menaces telles que l'altération de la durée et de la fréquence des inondations, la culture, l'élevage, l'utilisation d'herbicides, et les activités d'entretien des routes et des emprises.
Description et importance de l'espèce sauvage
La vernonie fasciculée est une herbacée vivace à port dressé. Sa tige, glabre à légèrement pubescente, peut atteindre deux mètres de hauteur et porte des feuilles sessiles à dents pointues avec des fossettes bien visibles sur la face inférieure. L'inflorescence est aplatie et est constituée d'un groupe dense de capitules. Chaque capitule est constitué d'un disque de fleurs violettes. Les fruits, appelés « cypsèles », sont semblables à des graines. Ils possèdent une couronne de soies allongées qui favorise la dispersion par le vent.
L'espèce a été utilisée à des fins ornementales. Son utilisation à des fins culturelles et médicinales a également été signalée.
Répartition
L'aire de répartition canadienne de la vernonie fasciculée se limite à une petite zone située dans le sud-est du Manitoba. Son aire de répartition en Amérique du Nord s'étend vers le sud et couvre une grande partie du centre des États-Unis.
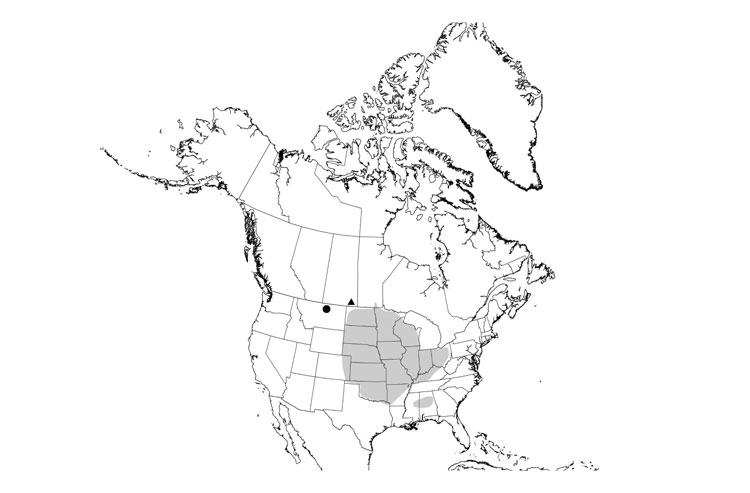
Source: COSEPAC 2014. Évaluation et Rapport de situation du COSEPAC sur la vernonie fasciculée au Canada.
Description longue pour la carte 25
Carte montrant l'aire de répartition de la vernonie fasciculée dans les prairies à grandes graminées du Midwest et de l'est des États Unis de même que la partie sud du Manitoba, au Canada.
Habitat
On trouve habituellement la vernonie fasciculée dans des prairies humides à mouillées et des zones riveraines. L'espèce ne tolère pas l'ombre dense. Au Manitoba, elle pousse dans les fossés en bordure de routes et les zones riveraines ouvertes à semiouvertes.
Biologie
La vernonie fasciculée est une espèce vivace qui fleurit un à deux ans après la germination des graines. Les fleurs sont visitées par des abeilles, des mouches et des papillons. Les graines sont adaptées pour la dispersion par le vent, mais peuvent aussi être dispersées par l'eau courante. L'espèce peut survivre à des inondations saisonnières et est généralement évitée par les mammifères brouteurs.
Taille et tendances des populations
On compte trois sous-populations connues de l'espèce au Canada, dont deux comportent chacune moins de 100 plantes (l'une de ces populations n'en compte que cinq). La plus grande sous-population regroupe des milliers de plantes – 21 000, selon une estimation grossière. Il est difficile d'évaluer les tendances globales en raison de l'absence de surveillance systématique, mais on sait que les effectifs d'au moins une des souspopulations ont diminué au cours de la dernière décennie. Deux sous-populations historiques, à Morris, au Manitoba, et à Weyburn, en Saskatchewan, sont considérées comme disparues.
Menaces et facteurs limitatifs
Les sous-populations situées en bordure de routes sont menacées par les activités d'entretien des routes et des fossés. Dans les zones riveraines, l'espèce est menacée par les modifications touchant la durée et la fréquence des inondations de même que par les activités agricoles.
Protection, statuts et classements
La vernonie fasciculée a été désignée comme espèce en voie de disparition par le COSEPAC en novembre 2014. Au Manitoba, la vernonie fasciculée est désignée comme espèce en voie de disparition en vertu de la Loi sur les espèces et les écosystèmes en voie de disparition. À l'échelle mondiale, NatureServe a attribué la cote G5 (non en péril) à la vernonie fasciculée; à l'échelle nationale au Canada, l'espèce est cotée N1 (gravement en péril). Les cotes attribuées à l'échelle infranationale sont S1 (gravement en péril) au Manitoba et SH (peut-être disparue) en Saskatchewan.
Lichens (1)
Mousses (1)
Plantes vasculaires (10)
- Arnica de Griscom
- Céphalanthère d'Austin
- Cypripède blanc
- Frêne bleu
- Pin flexible
- Podistère du Yukon
- Rhynchospore à gros épillets
- Rotala rameux (Population des plaines des Grands Lacs)
- Saxifrage à épis
- Vernonie fasciculée
Arthropodes (4)
Mollusques (2)
Reptiles (2)
Oiseaux (3)
Mammifères terrestres (2)
- Caribou (Population de Terre-Neuve)
- Loup de l'Est
Alberta
Colombie-Britannique
- Agrion vif
- Bourdon terricole
- Céphalanthère d'Austin
- Petit pompon
- Phalarope à bec étroit
- Pin flexible
- Starique de Cassin
Île-du-Prince-Édouard
Manitoba
Nouveau-Brunswick
Nouvelle-Écosse
- Anzie mousse-noire
- Bourdon terricole
- Halicte de l'île de Sable
- Phalarope à bec étroit
- Rhynchospore à gros épillets
Nunavut
Ontario
- Anzie mousse-noire
- Bourdon terricole
- Cypripède blanc
- Escargot-forestier écharge
- Frêne bleu
- Loup de l'Est
- Patère de Pennsylvanie
- Phalarope à bec étroit
- Rotala rameux (Population des plaines des Grands Lacs)
- Tortue boîte de l'Est
Québec
Saskatchewan
Terre-Neuve-et-Labrador
- Arnica de Griscom
- Bourdon terricole
- Caribou (Population de Terre-Neuve)
- Phalarope à bec étroit
Territoires du Nord-Ouest
Yukon