Espèces sauvages 2010 : chapitre 25
Mammifères
Mammalia - Classe de vertébrés homéothermes, dont les membres se caractérisent par la possession de glandes mammaires et d’un coeur à quatre cavités, y compris les êtres humains, les carnivores, les ongulés, les rongeurs, les baleines, etc.

En bref
- Il existe plus de 5000 espèces de mammifères connues, divisées en 26 ordres. Les rongeurs constituent l’ordre des mammifères comptant le plus grand nombre d’espèces et d’individus dans le monde.
- Au total, 218 espèces de mammifères ont été observées au Canada, dont 169 espèces classées dans les provinces et territoires, et 49 dans les régions océaniques.
- En excluant les espèces classées comme étant Disparue, Disparue de la région, Indéterminée, Non évaluée, Exotique ou Occasionnelle, la majorité (72%) des mammifères au Canada est en sécurité à l’échelle nationale (au niveau du Canada), alors que 16% sont sensibles, 6% sont en péril et 6% sont possiblement en péril à l’échelle nationale.
- Une espèce de mammifère est disparue du pays et une espèce qui était présente au Canada est maintenant éteinte.
- La plupart des changements dans les classifications de la situation générale des mammifères dans Espèces sauvages 2010 résultent de changements taxonomiques ou d’évaluations détaillées du COSEPAC.
- Le Rorqual bleu (Balaenoptera musculus) représente le mammifère le plus grand du monde; il peut atteindre jusqu’à 25 m de longueur et peser jusqu’à 100 tonnes.
Contexte
Du Morse (Odobenus rosmarus) vivant dans le Grand Nord, au Bison (Bison bison) des prairies, en passant par l’Écureuil roux (Tamiasciurus hudsonicus) observé dans votre cour ou le parc du quartier, les mammifères représentent un groupe familier et divers, présent partout au Canada. Les mammifères peuvent supporter le climat varié et parfois rigoureux du Canada, car ce sont des animaux à sang chaud (homéothermes), ce qui signifie qu’ils sont en mesure de maintenir leur température corporelle interne à un niveau stable, malgré les fluctuations de températures extérieures. On pense que les mammifères ont évolué d’un groupe de reptiles, appelés « synapsides », il y a plus de 200 millions d’années, peu de temps avant l’apparition des dinosaures. Depuis la disparition des dinosaures, il y a environ 65 millions d’années, les mammifères se sont répandus et diversifiés pour atteindre leur répartition mondiale actuelle.
Les mammifères se caractérisent par leurs poils, comme par exemple des poils veloutés et courts de la Taupe de Townsend (Scapanus townsendii) au pelage épais et pelucheux du Boeuf musqué (Ovibos moschatus). La fonction la plus importante des poils est l’isolation contre le froid. Par exemple, le pelage du Renard arctique (Vulpes lagopus) lui permet de demeurer actif même à des températures inférieures à -50°C! Certains mammifères perdent leur poil à l’âge adulte; ils utilisent donc d’autres méthodes d’isolation. Par exemple, l’isolation des cétacés (baleines, dauphins et marsouins), qui perdent leur poil tôt après leur naissance, est assurée par leur épaisse couche de graisse. Le camouflage (par exemple, le pelage d’hiver blanc du Lièvre d’Amérique, Lepus americanus) et la communication (par exemple, le Cerf de Virginie, Odocoileus virginianus, qui utilise sa queue blanche afin de transmettre un signal de danger lorsqu’il fuit un prédateur) constituent notamment d’autres fonctions du pelage. Il existe deux types principaux de poils, le duvet et le jarre, qui possèdent leurs propres fonctions. Le duvet épais et doux emprisonne une couche d’air chaud pour isoler le corps, alors que le jarre protège le duvet. Le duvet long et doux du Boeuf musqué est l’une des fibres naturelles les plus luxueuses et chères dans le monde.
Tous les mammifères femelles possèdent des glandes mammaires qui produisent du lait pour nourrir leurs jeunes. Le lait est riche en protéines et en matières grasses, et il fournit aux jeunes les nutriments et l’énergie nécessaires à leur développement et à leur croissance. Lorsqu’ils dépendent du lait de leur mère, les jeunes acquièrent des comportements sociaux et en apprennent sur leur environnement, y compris les aliments appropriés et la façon de les trouver. Certains mammifères, tels que le Caribou (Rangifer tarandus), donnent naissance à des jeunes précoces, qui sont bien développés et peuvent courir presque immédiatement après la naissance. Le jeune Caribou se relève en chancelant moins d’une heure après la naissance, et il peut courir assez rapidement pour suivre le troupeau dès sa première ou sa deuxième journée de vie. Au contraire, les jeunes des espèces à développement tardif naissent sans défense, souvent aveugles, et leur mobilité est très restreinte. Par exemple, les Écureuils gris (Sciurus carolinensis) naissent nus et édentés; leurs yeux et oreilles sont à peine visibles. Leurs yeux prennent plus d’un mois à s’ouvrir et les petits ne s’aventurent hors du nid que vers l’âge de deux mois.
Certains des mammifères du Canada les plus typiques sont ceux vivant dans la toundra arctique, y compris l’Ours blanc (Ursus maritimus), le Renard arctique, le Caribou, le Boeuf musqué et plusieurs types de lemmings. Bien que certains de ces mammifères, tels que le Caribou, migrent au sud pendant l’hiver, de nombreux autres habitent la toundra à longueur d’année. Les mammifères arctiques montrent bon nombre d’adaptations au très grand froid, y compris des poils épais ainsi que des taux métaboliques élevés. Plusieurs mammifères arctiques, tels que le Boeuf musqué et l’Ours blanc, ont évolué de façon à présenter une grande taille et une forme compacte qui réduisent la perte de chaleur. Des petits mammifères, tels que le Campagnol-lemming boréal (Synaptomys borealis), passent l’hiver sous la neige. La neige profonde sert de couche isolante et protège les lemmings des températures de surface extrêmes. De nombreux mammifères arctiques maintiennent leurs extrémités à des températures proches du point de congélation, alors que leur température corporelle interne ne fluctue pas. Par exemple, il est possible que la température des jambes d’un Caribou soit de 10°C inférieure à sa température interne. Cet accomplissement est rendu possible grâce à la disposition particulière des vaisseaux sanguins qui permettent à la chaleur du sang qui se dirige vers les extrémités d’être transférée au sang qui retourne vers le centre du corps (système d’échange thermique à contre courant). Un seul mammifère arctique, le Spermophile arctique (Spermophilus parryii), effectue une véritable hibernation, au cours de laquelle sa température corporelle tombe bien au-dessous de la normale.

État des connaissances
En général, les mammifères du Canada ont été bien étudiés, et la biologie fondamentale, la physiologie, la répartition ainsi que l’écologie de nombreuses espèces de mammifères sont bien comprises. Récemment, les avancées technologiques, y compris la télémétrie par satellites et de nouveaux outils génétiques, ont été utilisées pour accroître davantage les connaissances sur les mammifères canadiens. Toutefois, il existe encore des difficultés dans l’étude des mammifères en nature, y compris les comportements nocturnes ou discrets, la répartition éloignée, les problèmes dans la manipulation de mammifères sauvages, ainsi que les vastes distances que couvrent certains grands mammifères. En outre, de nombreux mammifères marins peuvent être difficiles à étudier, car ils passent beaucoup de temps sous l’eau et peu de temps en surface.
Les études sur les grands mammifères, tels que le Caribou, le Wapiti (connu également sous le nom de Cerf du Canada, Cervus elaphus) et l’Ours blanc, représentent un centre d’intérêt d’importance en mammalogie au Canada. Il est indispensable d’étudier les grands mammifères en raison de leur valeur économique, des conflits potentiels avec les humains ainsi que de leur importance dans les écosystèmes qu’ils habitent. Par exemple, des recherches récentes dans le parc national Banff ont montré qu’en régulant la population de Wapiti, les Loups gris (Canis lupus) ont des répercussions indirectes sur la structure de la végétation locale et les communautés d’oiseaux. Dans des zones à densité élevée de Loups gris, il y a moins de Wapitis, plus de végétation en régénération, plus de parulines et moins de moineaux. De telles études montrent l’importance des grands mammifères dans la formation de leurs écosystèmes locaux.
Le suivi des mammifères en mer constitue une tâche difficile, ce qui peut restreindre les recherches sur les mammifères marins en eaux profondes. Cependant, les nouvelles technologies, y compris la surveillance par satellite, la télédétection par satellite et la télédétection acoustique, contribuent à l’amélioration des connaissances dans ce domaine. Par exemple, la migration du Rorqual bleu (Balaenoptera musculus) et l’utilisation de l’habitat par ce dernier ont été suivies à l’aide de la télédétection par satellite et de la télédétection acoustique, ce qui a permis, pour la première fois, la surveillance permanente, spatiale, temporelle et à grande échelle des déplacements de cette espèce.
En général, les mammifères qui ne sont pas considérés comme importants sur le plan économique ou culturel (tels que les musaraignes, famille Soricidae) n’ont pas été étudiés autant que les grands mammifères, charismatiques ou importants sur le plan économique, comme l’Ours blanc ou le Caribou. Par exemple, les chauves-souris (ordre Chiroptera) sont généralement moins bien étudiées et moins bien comprises que bon nombre d’autres groupes de mammifères. En fait, la répartition, l’écologie et le cycle biologique de certaines chauves-souris au Canada sont encore très peu connus. Cependant, de nouvelles études commencent à combler cette lacune. Par exemple, des relevés récents menés en Nouvelle-Écosse ont permis de découvrir la première colonie de reproduction connue du Canada de Pipistrelle de l’Est (Pipistrellus subflavus). D’autres études récentes portant sur les chauves-souris ont traité de l’utilisation de l’habitat, de l’écholocation, du régime alimentaire et de l’écologie thermique des chauves-souris.
Richesse et diversité au Canada
Il existe neuf ordres de mammifères au Canada. Les rongeurs (ordre Rodentia) constituent de loin l’ordre le plus riche en espèces. Parmi les 218 espèces de mammifères canadiens, 169 sont classées uniquement dans les provinces et territoires et 49 ne le sont que dans les régions océaniques. La Colombie-Britannique (119 espèces, figure 25) possède la richesse en espèces de mammifères la plus élevée du Canada, principalement en raison des grands nombres d’insectivores (ordre Insectivora) et de chauves-souris (ordre Chiroptera) observés dans la province.
La majorité des 49 espèces de mammifères marins du Canada est présente dans la région de l’océan Atlantique (32 espèces) ou la région de l’océan Pacifique (30 espèces, figure 25).
Pleins feux sur la Chauve-souris nordique
La Chauve-souris nordique (Myotis septentrionalis) est une chauve-souris de taille moyenne présente dans l’ensemble des provinces et des territoires, à l’exception du Nunavut. À l’instar de toutes les chauves-souris canadiennes, la Chauve-souris nordique est nocturne. Pendant la journée, elle se perche sous les écorces décollées des arbres en putréfaction et, de nuit, elle chasse des insectes. La Chauve-souris nordique utilise principalement deux techniques de chasse : la capture d’insectes retrouvés sur les arbres et arbustes (glanage) et la capture d’insectes en vol. Dans les deux cas, la Chauve-souris nordique utilise l’écholocation pour détecter sa proie. Ces chauves-souris ne sont actives que pendant les mois chauds (environ d’avril à septembre). Pendant le reste de l’année, elles hibernent dans des grottes ou des mines abandonnées, où l’humidité est élevée et la température oscille juste au-dessus du point de congélation.
Le comportement nocturne et discret de la Chauve-souris nordique complique l’étude de cette espèce, mais les nouvelles technologies augmentent la capacité des scientifiques à examiner l’utilisation de l’habitat de la chauve-souris. Par exemple, les chercheurs peuvent installer des microphones dans divers habitats afin d’enregistrer les sons que les chauves-souris produisent en se nourrissant. Puisque les différentes espèces de chauves-souris émettent des sons distincts, des programmes peuvent analyser les enregistrements et découvrir le type d’habitats dans lesquels se nourrissent les diverses espèces. De plus, en capturant des chauves-souris et en leur fixant de minuscules radioémetteurs, les chercheurs peuvent trouver exactement sur quels arbres les chauves-souris préfèrent se percher. Les résultats de ces études montrent que les forêts matures, où sont présents de grands conifères et arbres à feuilles caduques en putréfaction, sont importantes pour ces chauves-souris. Ce type d’information aide les forestiers et les gestionnaires de la faune à prendre des décisions éclairées sur les types d’habitats qui doivent être conservés en vue du soutien de populations de chauves-souris saines. Le maintien d’arbres à feuilles caduques matures et de conifères ainsi que de parcelles de forêt mature intactes dans des secteurs récoltés pourrait soutenir les populations de Chauve-souris nordique. De même, les chauves-souris aident à endiguer des irruptions de parasites forestiers, tels que la Tordeuse des bourgeons de l’épinette (Choristoneura fumiferana).
La Chauve-souris nordique est plus fréquente dans l’est et le centre du Canada (classée en sécurité ou sensible) que dans l’ouest et le nord du pays (classée possiblement en péril ou indéterminée), étant donné sa préférence pour les forêts mixtes matures qui sont plus répandues dans l’est du Canada et l’existence de sites d’hibernation propices et du climat. En raison de sa vaste aire de répartition au Canada, la Chauve-souris nordique est classée en sécurité à l’échelle nationale.
Pleins feux sur la Baleine à bec commune
La Baleine à bec commune (Hyperoodon ampullatus) est ainsi appelée en raison de son bec semblable à celui des dauphins. Elle possède en outre un front proéminent en forme d’oeuf, qui est particulièrement prononcé chez les mâles adultes. L’espèce est présente dans le nord de l’océan Atlantique, car elle préfère les eaux profondes et froides. Les Baleines à bec communes sont des animaux très sociables; elles vivent en petits groupes, ou bandes. Les mâles sont plus grands que les femelles et peuvent atteindre jusqu’à 10 m de longueur et peser jusqu’à 7,5 tonnes! La mandibule du mâle compte deux petites dents, mais la femelle est édentée. La Baleine à bec commune plonge jusqu’à 1000 m de profondeur et peut y demeurer pendant 70 minutes, à la recherche de son aliment préféré, le calmar (genre Gonatus).
Deux populations distinctes de Baleines à bec communes sont présentes au Canada : l’une, à proximité de la côte nord du Labrador (population du détroit de Davis), et l’autre, à proximité de la côte sud-est de la Nouvelle-Écosse (population du plateau néo-écossais). Cette dernière habite dans un canyon sous-marin connu sous le nom du Goulet. Cette population d’environ 130 animaux possède une stratégie de migration et un cycle biologique hors du commun comparativement à d’autres populations de baleines à bec.
Les Baleines à bec communes ont été chassées pendant des siècles pour leur huile de spermaceti, qui était utilisée pour fabriquer de l’huile de graissage et des bougies de grande qualité. Les baleines à bec représentaient une proie facile pour les chasseurs de baleines, car elles sont attirées par les bateaux à cause de leur ardente curiosité. Les membres de la bande sont extrêmement protecteurs envers leurs compagnons blessés ou en difficulté, ce qui permettait aux baleiniers de pêcher la majorité de la bande, avant que les membres restants plongent pour fuir. Au milieu des années 1970, les populations mondiales de Baleines à bec communes ont été réduites à des niveaux de vulnérabilité. En 1973, la chasse commerciale a cessé et, en 1977, l’espèce a été classée espèce protégée par l’ « International Whaling Committee », mais les populations mondiales de Baleines à bec communes ne sont pas encore complètement rétablies. Au Canada, la population du détroit de Davis est actuellement classée non en péril par le Comité sur la situation des espèces en péril au Canada (COSEPAC), mais la population du plateau néo-écossais est classée en voie de disparition depuis 2002 et est maintenant protégée en vertu de la Loi sur les espèces en péril du Canada.
Heureusement pour les chercheurs, la nature sociable de la Baleine à bec commune a relativement facilité l’étude de sa biologie et de ses comportements, puisque les observateurs sont en mesure de s’approcher des baleines sans les déranger. Le Goulet, le foyer de la population de Baleines à bec communes du plateau néo-écossais, est une aire marine protégée, mais du gaz et du pétrole ont été découverts à proximité et il est situé près des routes de navigation transatlantiques. Les recherches récentes dans cette zone ont tenté d’établir les effets des activités humaines sur les baleines, y compris la navigation commerciale, les activités halieutiques ainsi que l’exploitation pétrolière et gazière en mer. À l’échelle nationale, la Baleine à bec commune est classée sensible; cette cote n’a pas changé depuis la publication du rapport Espèces sauvages 2000.
Pleins feux sur le Renard gris
Le Renard gris (Urocyon cinereoargenteus) représente le seul membre de la famille des chiens (famille Canidae) au Canada ayant la capacité de grimper aux arbres! Ce petit renard possède de courtes pattes ainsi que de longues griffes postérieures robustes lui permettant d’escalader des troncs d’arbres pour échapper aux prédateurs ou chercher de la nourriture, telle que des fruits, des oiseaux et des rongeurs. Au sol, les Renards gris se nourrissent de lapins et d’autres petits mammifères. Le Renard gris est légèrement plus petit et d’un gris plus foncé que le Renard roux (Vulpes vulpes); il est indigène de l’Ontario et a été également observé au Nouveau-Brunswick, au Québec, au Manitoba et en Alberta.
L’histoire des Renards gris au Canada est mystérieuse. Selon des données archéologiques provenant de villages autochtones, auparavant, les Renards gris étaient presque aussi abondants que les Renards roux dans le sud de l’Ontario. Toutefois, les documents des colons européens ne font aucune mention de cette espèce peu commune. En fait, les Renards gris n’ont été signalés pour la première fois qu’au début des années 1890 au Québec, puis en Ontario. Les causes de la disparition des Renards gris de l’Ontario pendant plus de 300 ans et les raisons de leur rétablissement au cours des 100 dernières années sont incertaines. Cependant, il a été suggéré que les chaudes températures des années récentes ont permis à des populations du nord, comme celles du sud de l’Ontario, de survivre et d’augmenter. Actuellement, l’île Pelée, dans le sud de l’Ontario, est le seul endroit connu au Canada où les Renards gris se reproduisent. Les observations de Renards gris qui ont été faites ailleurs en Ontario et dans le sud du Manitoba proviennent probablement d’individus seuls qui ont traversé la frontière des États-Unis, où les Renards gris demeurent répandus.
En raison de leur aire de répartition restreinte et de la petite taille des populations canadiennes, et parce que l’habitat boisé est menacé par l’aménagement, le Renard gris est classé en péril à l’échelle nationale. Dans le rapport Espèces sauvages 2000, l’espèce faisait partie de la catégorie non évaluée. Cette modification est attribuable à la mise à jour de l’évaluation par le COSEPAC, dans laquelle l’espèce a été classée menacée.
Résultats de l’évaluation de la situation générale
À l’échelle nationale, la majorité des mammifères sont classés en sécurité (62%, 135 espèces, figure 25 et tableau 36). Cependant, 13% sont classés sensibles (29 espèces), 6% sont en péril (12 espèces), 5% sont possiblement en péril (11 espèces), et un total de 1% est disparue du Canada (une espèce, le Putois d’Amérique, Mustela nigripes) et disparue (une espèce, le Vison de mer, Neovison macrodon). En outre, à l’échelle nationale, 5% des espèces de mammifères sont classées exotiques (11 espèces), 5% sont indéterminées (11 espèces) et 3% sont occasionnelles (sept espèces).
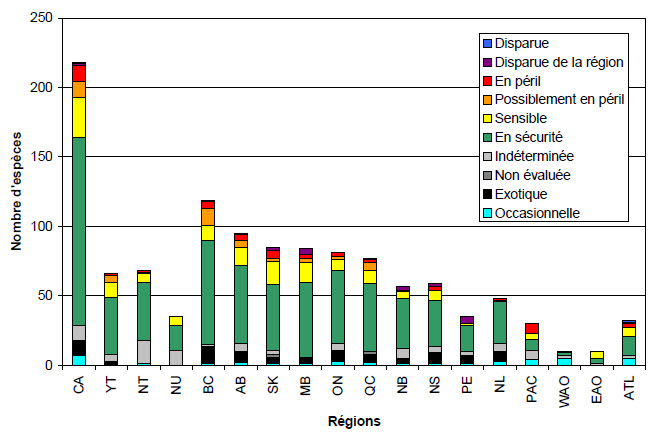
Description longue pour la figure 25
La figure 25 montre les résultats des évaluations de la situation générale des espèces de mammifères au Canada dans le rapport Espèces sauvages 2010. Le graphique à barres présente les espèces des mammifères disparues, disparues de la région, en péril, possiblement en péril, sensibles, en sécurité, indéterminées, non-évaluées, exotiques et occasionnelles au Canada, dans chaque province et territoire et dans les 4 régions océaniques. Des 218 espèces évaluées au Canada, une était classée disparue, une disparue de la région, 12 en péril, 11 possiblement en péril, 29 sensibles, 135 en sécurité, 11 indéterminées, 11 exotiques et 7 occasionnelles. Des 66 espèces évaluées au Yukon, une était classée en péril, 5 possiblement en péril, 11 sensibles, 41 en sécurité, 5 indéterminées et 3 exotiques. Des 68 espèces évaluées dans les Territoires du Nord-Ouest, une était classée en péril, une possiblement en péril, 6 sensibles, 42 en sécurité, 17 indéterminées et une occasionnelle. Des 35 espèces évaluées au Nunavut, 6 étaient classées sensibles, 18 en sécurité et 11 indéterminées. Des 119 espèces évaluées en Colombie-Britannique, une était classée disparue de la région, 5 en péril, 12 possiblement en péril, 11 sensibles, 75 en sécurité, une indéterminée, une non-évaluée, 12 exotique et une occasionnelle. Des 95 espèces évaluées en Alberta, une était classée disparue de la région, 4 en péril, 5 possiblement en péril, 13 sensibles, 56 en sécurité, 6 indéterminées, 8 exotiques et 2 occasionnelles. Des 85 espèces évaluées en Saskatchewan, 2 étaient classées disparues de la région, 6 en péril, 2 possiblement en péril, 17 sensibles, 47 en sécurité, 3 indéterminées, 2 non-évaluées, 5 exotiques et une occasionnelle. Des 84 espèces évaluées au Manitoba, 4 étaient classées disparues de la région, 3 en péril, 3 possiblement en péril, 14 sensibles, 54 en sécurité, une indéterminée, 4 exotiques et une occasionnelle. Des 81 espèces évaluées en Ontario, 3 étaient classées en péril, 2 possiblement en péril, 8 sensibles, 52 en sécurité, 5 indéterminées, une non-évaluée, 7 exotiques et 3 occasionnelles. Des 77 espèces évaluées au Québec, une était classée disparue de la région, 2 en péril, 6 possiblement en péril, 9 sensibles, 49 en sécurité, 2 non-évaluées, 6 exotiques et 2 occasionnelles. Des 57 espèces évaluées au Nouveau-Brunswick, 3 étaient classées disparues de la région, une en péril, 5 sensibles, 36 en sécurité, 7 indéterminées, 4 exotiques et une occasionnelle. Des 59 espèces évaluées en Nouvelle-Écosse, 2 étaient classées disparues de la région, 3 en péril, 7 sensibles, 33 en sécurité, 5 indéterminées, 8 exotiques et une occasionnelle. Des 35 espèces évaluées à l’Île-du-Prince-Édouard, 5 étaient classées disparues de la région, une sensible, 19 en sécurité, 3 indéterminées, 6 exotiques et une occasionnelle. Des 48 espèces évaluées à Terre-Neuve et Labrador, une était classée en péril, une sensible, 30 en sécurité, 6 indéterminées, une non-évaluée, 6 exotiques et 3 occasionnelles. Des 30 espèces évaluées dans la région de l’océan Pacifique, 7 étaient classées en péril, 4 sensibles, 8 en sécurité, 7 indéterminées et 4 occasionnelles. Des 10 espèces évaluées dans la région de l’océan Arctique Ouest, une était classée sensible, 2 en sécurité, 2 indéterminées et 5 occasionnelles. Des 10 espèces évaluées dans la région de l’océan Arctique Est, 5 étaient classées sensibles, 4 en sécurité et une indéterminée. Des 32 espèces évaluées dans la région de l’océan Atlantique, une était classée disparue, une disparue de la région, 3 en péril, 6 sensibles, 14 en sécurité, 2 indéterminées et 5 occasionnelles.
Comparaison avec les rapports Espèces sauvages précédents
Depuis la dernière évaluation en 2005, le nombre total d’espèces de mammifères est demeuré stable (tableau 36). Cependant, la classification nationale d’un total de 11 espèces a été changée. Parmi ces changements, deux espèces ont connu un niveau de risque plus élevé, deux espèces ont connu un niveau de risque moins élevé, trois espèces on été déplacées de la catégorie indéterminée, deux espèces ont été ajoutées et deux espèces ont été effacées. La plupart des changements dans les classifications nationales des mammifères dans le rapport Espèces sauvages 2010 étaient reliés à des changements taxonomiques, à une amélioration des connaissances, et à de nouvelles évaluations détaillées du COSEPAC (tableau 37).
| Classification nationale | Années des rapports Espèces sauvages 2000 |
Années des rapports Espèces sauvages 2005 |
Années des rapports Espèces sauvages 2010 |
Changement moyen entre les rapports | Changement moyen entre les rapports |
|---|---|---|---|---|---|
| 0 Disparue / Disparue de la région | 2 (1%) |
2 (1%) |
2 (1%) |
Stable | Stable |
| 1 En péril | 8 (4%) |
13 (6%) |
12 (6%) |
+2 espèces | +4 espèces |
| 2 Possiblement en péril | 9 (4%) |
10 (5%) |
11 (5%) |
+1 espèces | +2 espèces |
| 3 Sensitive | 29 (13%) |
25 (11%) |
29 (13%) |
Stable | Stable |
| 4 En sécurité | 139 (65%) |
139 (64%) |
135 (62%) |
-2 espèces | -4 espèces |
| 5 Indéterminée | 10 (5%) |
11 (5%) |
11 (5%) |
+1 espèces | -1 espèces |
| 6 Non évaluée | 3 (1%) |
0 (0%) |
0 (0%) |
-2 espèces | -3 espèces |
| 7 Exotique | 11 (5%) |
11 (5%) |
11 (5%) |
Stable | Stable |
| 8 Occasionnelle | 4 (2%) |
7 (3%) |
7 (3%) |
+2 espèces | +3 espèces |
| Total | 215 (100%) |
218 (100%) |
218 (100%) |
+2 espèces | +3 espèces |
| Nom scientifique | Nom français | Rang national 2005 | Rang national 2010 | Raison du changement |
|---|---|---|---|---|
| Canis lycaon | - | 3 | - | (T) Cette espèce est encore une fois considérée comme étant une sous-espèce de Canis lupus. |
| Corynorhinus townsendii | Oreillard de Townsend | 2 | 3 | (I) Amélioration des connaissances sur l’espèce. Cette espèce est plus abondante que prévue. |
| Dicrostonyx kilangmiutak | - | 4 | - | (T) Cette espèce n’est plus considérée comme étant une espèce valable. Elle est maintenant considérée comme une sous-espèce de Dicrostonyx groenlandicus. |
| Dicrostonyx nunatakensis | - | 5 | 2 | (I) Amélioration des connaissances sur l’espèce. Elle a une répartition très restreinte. |
| Enhydra lutris | Loutre de mer | 1 | 3 | (C) Depuis la publication du rapport Espèces sauvages 2005, le COSEPAC a réévalué cette espèce comme étant préoccupante (auparavant considérée comme étant menacée). |
| Erignathus barbatus | Phoque barbu | 4 | 5 | (C) Depuis la publication du rapport Espèces sauvages 2005, le COSEPAC a évalué cette espèce comme ayant des données insuffisantes. |
| Myotis sodalis | - | - | 5 | (I) Amélioration des connaissances sur l’espèce. Cette espèce n’a été trouvée que récemment au Canada. |
| Ochotona collaris | Pica à collier | 4 | 3 | (B) Changement dans les menaces de l’espèce. Le réchauffement climatique cause certaines disparitions locales. |
| Orcinus orca | Épaulard | 5 | 3 | (C) Populations du nord-ouest de l’Atlantique et de l’est de l’Arctique considérées préoccupantes selon une évaluation détaillée du COSEPAC en novembre 2007. |
| Sorex rohweri | - | - | 2 | (T) Taxonomiquement, il s’agit d’une nouvelle espèce qui n’avait pas été détectée auparavant par les scientifiques jusqu’en 2007. |
| Spilogale gracilis | Mouffette tachetée | 4 | 3 | (B) Changement dans les niveaux biologiques de l’espèce. |
Menace envers les mammifères canadiens
Les mammifères constituent un groupe vaste et varié, et les menaces auxquelles ils font face le sont également. La perte, la fragmentation et la dégradation de l’habitat représentent des menaces importantes pour de nombreuses espèces de mammifères, en particulier pour les grands mammifères, les espèces spécialistes en matière d’habitat et les mammifères dont l’aire de répartition coïncide avec des zones densément peuplées par les humains. D’autres menaces envers les mammifères canadiens comprennent la surexploitation, les maladies, les espèces exotiques, l’hybridation et le changement climatique.
Le manque d’information sur certains mammifères, tels que les chauves-souris et les musaraignes, complique également la détection ou l’inversement des déclins de populations. Par exemple, le syndrome du museau blanc chez les chauves-souris représente une préoccupation importante. Ce syndrome se caractérise par la présence d’une croissance fongique blanche sur le museau, les oreilles ou la membrane des ailes des chauves-souris affectées. Il s’attaque aux chauves-souris qui hibernent dans les cavernes, comme la Petite Chauve-souris brune (Myotis lucifugus). Depuis l’hiver 2006-2007, des mortalités massives de chauves-souris ont été observées dans les états nord-est des États-Unis. Cette maladie s’est propagée rapidement et au début de 2010, elle a été confirmé pour la première fois en Ontario et au Québec. Personne ne sait d’où provient le syndrome du museau blanc, mais selon une théorie, il aurait été transporté accidentellement par des gens de l’Europe. Les nouvelles maladies comme le syndrome du museau blanc sont un exemple sur la façon dont l’état de conservation pourrait potentiellement changer, même pour les espèces très communes.
Les mammifères marins affrontent généralement un ensemble différent de menaces comparativement aux mammifères terrestres et d’eau douce. En particulier, les activités humaines en mer peuvent parfois être néfastes aux mammifères marins. L’empêtrement dans des filets de pêche et les collisions avec des bateaux représentent deux des principales menaces. En outre, les activités pétrolières, telles que la prospection séismique et la circulation maritime commerciale, peuvent endommager l’ouïe des mammifères marins ou avoir des répercussions sur leur alimentation, leur migration ou leur communication. Actuellement, la circulation maritime commerciale est responsable d’une grande partie de la pollution par le bruit dans les océans du monde. Il reste énormément de travail à effectuer afin d’étudier entièrement ces répercussions.
L’exposition des mammifères marins aux polluants a été vivement publicisée. Par exemple, les Épaulards (Orcinus orca) résidants de la côte du Pacifique font partie des mammifères marins les plus contaminés du monde. Les mammifères marins sont vulnérables aux polluants pour plusieurs raisons, y compris leur position en haut de la chaîne alimentaire ainsi que leurs longs cycles biologiques. Les mammifères marins ne métabolisent généralement pas bien les polluants; ils les accumulent plutôt dans les graisses, d’où les polluants peuvent être transmis aux jeunes pendant l’allaitement ou aux prédateurs, y compris les humains. Les mammifères marins ayant des niveaux élevés de contamination peuvent faire face à des taux de survie réduits ainsi qu’à la suppression du système immunitaire entraînant des taux élevés de maladies. Toutefois, il est difficile d’établir des liens directs entre les niveaux élevés de contamination et le déclin des populations.
Conclusion
Comparativement aux mammifères terrestres et d’eau douce, la proportion de mammifères marins classés en sécurité est faible, et celle des mammifères marins classés en péril, sensible ou indéterminée est élevée, ce qui reflète les risques accrus auxquels ces espèces font face, ainsi que les lacunes sur le plan des connaissances des écosystèmes marins et des espèces qui y habitent.
Cette évaluation mise à jour a permis d’actualiser la liste nationale de la situation générale des mammifères à l’aide des dernières connaissances scientifiques. Les classifications nationales de la plupart des espèces de mammifères n’ont pas été modifiées, ce qui fait en sorte que la proportion de l’ensemble des espèces de mammifères dans chaque catégorie de la situation générale n’a pas beaucoup changé depuis les dernières évaluations.
Pour en savoir plus
Banfield, A. W. F. 1977. Les mammifères du Canada. Les presses de l’Université Laval, Québec, Québec: 406 pp.
Cetacean Research & Rescue Unit. Bottlenose whale (Hyperoodon ampullatus). (Consulté le 16 février 2010).
Forsyth, A. 1985. Mammals of the Canadian wild. Camden House, Camden East, Ontario: 351 pp.
Gaskin, D. E. 1972. Whales, dolphins and seals. Heinemann educational books, Auckland: 200 pp.
Hebridean Whale and Dolphin Trust. Northern Bottlenose Whale, Hyperoodon ampullatus. (Consulté le 16 février 2010). [en anglais seulement]
Jansa, S. 1999. Urocyon cinereoargenteus. Animal Diversity Web. (Consulté le 16 février 2010). [en anglais seulement]
MarineBio.org. 2005. Northern bottlenose whale - Hyperoodon ampullatus. (Consulté le 16 février 2010). [en anglais seulement]
Ollendorff, J. 2002. Myotis septentrionalis. Animal Diversity Web. (Consulté le 16 février 2010). [en anglais seulement]
Pêches et Océans Canada. 2006. Observatoire du Saint-Laurent / St. Lawrence Observatory. Recherche sur les mammifères marins au Canada. (Consulté le 16 février 2010).
Pêches et Océans Canada. 2005. Section de l’écologie et de l’évaluation des mammifères marins de l’Arctique. (Consulté le 16 février 2010).
Pêches et Océans Canada. 2005. Programme de recherche sur les cétacés. (Consulté le 16 février 2010).
Pêches et Océans Canada. 2004. Espèces aquatiques en péril – Épaulard, population migratrice du Pacifique nord-est. (Consulté le 16 février 2010).
Pêches et Océans Canada. 2004. Espèces aquatiques en péril - Baleine à bec commune, population du plateau néo-écossais. (Consulté le 16 février 2010).
Savage, A. et Savage, C. 1981. Wild mammals of western Canada. Western Producer Prairie Book, Saskatoon, Saskatchewan: 209 pp.
Références
Barber, K. (éditeur). 1998. The Canadian Oxford Dictionary. Oxford University Press. Toronto, Oxford, New York: 1707 pp.
Broders, H. G. et Forbes, G. J. 2004. Interspecific and intersexual variation in roost-site selection of northern long-eared and little brown bats in the Greater Fundy National Park ecosystem. Journal of Wildlife Management 68: 602-610.
Broders, H. G., Quinn, G. M. et Forbes, G. J. 2003 Species status, and the spatial and temporal patterns of activity of bats in southwest Nova Scotia, Canada. Northeastern Naturalist 10: 383-398.
Burtenshaw, J. C., Oleson, E. M., Hildebrand, J. A., McDonald, M. A., Andrew, R. K., Howe, B. M. et Mercer, J. A. 2004. Acoustic and satellite remote sensing of blue whale seasonality and habitat in the Northeast Pacific. Deep-Sea Research II 51: 967-986.
Caceres, M. C. et Pybus, M. J. 1997. Status of the northern long-eared bat (Myotis septentrionalis) in Alberta. Alberta Environmental Protection, Wildlife Management Division, Wildlife Status Report No. 3, Edmonton, Alberta: 19 pp.
COSEPAC. 2002. Mise à jour, évaluation et rapport de situation du COSEPAC sur le renard gris Urocyon cinereoargenteus au Canada. Comité sur la situation des espèces en péril au Canada, Ottawa: 34 pp.
COSEPAC. 2002. Mise à jour, évaluation et rapport de situation du COSEPAC sur la baleine à bec commune Hyperoodon ampullatus (population du plateau néo-écossais) au Canada. Comité sur la situation des espèces en péril au Canada, Ottawa: 25 pp.
Fuller, T. K. et Cypher, B. L. 2004. Grey Fox, Urocyon cinereoargenteus. In Canids: Foxes, wolves, jackals and dogs, status survey and conservation action plan (C. Sillero-Zubiri, M. Hoffmann et D. W. Macdonald, éditeurs). IUCN/SSC Canid Specialist Group. Gland, Switzerland and Cambridge: 430 pp.
Hebblewhite, M., White, C. A., Nietvelt, C. G., McKenzie, J. A., Hurd, T. E., Fryxell, J. M., Bayley, S. E. et Paquet, P. C. 2005. Human activity mediates a trophic cascade caused by wolves. Ecology 86: 2135-2144.
Jung, T. S., Thompson, I. D. et Titman, R. D. 2004. Roost site selection by forest-dwelling male Myotis in central Ontario, Canada. Forest Ecology and Management 202: 325-335.
Patriquin, K. J. et Barclay, R. M. R. 2003. Foraging by bats in cleared, thinned and unharvested boreal forest. Journal of Applied Ecology 40: 646-657.