Espèces sauvages 2010 : chapitre 8
Plantes vasculaires
Tracheophyta - Plantes caractérisées par de vraies racines, tiges et feuilles contenant des tissus vasculaires spécialisés dans lesquels circulent les liquides.

En bref
- Il existe plus de 352 000 espèces de plantes vasculaires dans le monde. Plus de 95% de celles-ci sont des plantes à fleurs, aussi appelées angiospermes (par exemple, les herbacées graminées, les orchidées, les érables). Les autres types de plantes vasculaires sont les gymnospermes (conifères, tels que les pins et les épinettes) et les plantes dépourvues de graines (par exemple, les fougères et les prêles). 5111 espèces de plantes vasculaires sont présentes au Canada.
- En excluant les espèces classées comme étant Disparue, Disparue de la région, Indéterminée, Non évaluée, Exotique ou Occasionnelle, la majorité (71%) des plantes vasculaires au Canada est en sécurité à l’échelle nationale (au niveau du Canada), alors que 13% sont sensibles, 12% sont possiblement en péril et 4% sont en péril à l’échelle nationale.
- Un total de 25 plantes vasculaires qui ont déjà été présentes au Canada sont maintenant disparue du pays.
- Un grand nombre d’espèces (1252) de plantes vasculaires sont exotiques. Elles représentent 24% de toutes les espèces de plantes vasculaires présentes au Canada. Il s’agit de la plus importante proportion d’espèces exotiques parmi tous les groupes taxonomiques couvert par ce rapport.
- Toutes les plantes vasculaires ont également été évaluées dans le rapport Espèces sauvages 2005. Dans le rapport de 2000, seulement les fougères et les orchidées avaient été évaluées.
Contexte
Les plantes jouent un rôle fondamental dans le maintien de la vie sur Terre, car elles constituent l’un des quelques groupes d’organismes pouvant produire leur propre nourriture. Par le processus chimique de la photosynthèse, qui implique les pigments verts de la chlorophylle, les plantes utilisent l’énergie du soleil pour transformer l’eau et le dioxyde de carbone en oxygène et en sucre, qui est utilisé comme une source alimentaire pour les plantes et les animaux herbivores. Les plantes produisent donc deux des ressources nécessaires à la survie des animaux : la nourriture et l’oxygène. De plus, elles sont essentielles dans l’environnement car elles aident à régulariser le climat, fournissent un habitat pour des espèces sauvages, contribuent aux cycles des nutriments et à la création du sol, améliorent la qualité de l’air et de l’eau et réduisent l’érosion du sol.
La plupart des végétaux que nous connaissons bien, tels que les fougères, les orchidées, les herbacées, les graminées, les arbustes et les arbres, sont des plantes vasculaires. Ces plantes possèdent des racines, des feuilles et un système vasculaire dans lequel l’eau, les sucres et les nutriments circulent. Les plantes vasculaires constituent le groupe de plantes le plus important de la planète, et forment la végétation dominante de la majorité de la masse continentale.
Les plantes qui ne produisent pas de graines, dont les fougères, les lycopodes et les prêles, représentent les plantes vasculaires les plus anciennes. Elles dominaient le monde pendant la période carbonifère, il y a environ 300 millions d’années. Des plantes mortes à cette époque ont formé les couches de houille dont on extrait le charbon encore de nos jours. Toutes les plantes dépourvues de graines se reproduisent à l’aide de spores. Pour de plus amples renseignements sur les plantes sans graines, consultez la section sur les fougères dans le rapport Espèces sauvages 2000.
Deux groupes de plantes à graines ont évolué à partir des plantes sans graines : les conifères (gymnospermes, par exemple, les pins et les épinettes) et les plantes à fleurs (angiospermes, par exemple, les herbacées, les orchidées, les érables, les chênes). Comme leur nom l’indique, les plantes à graines se reproduisent à l’aide de graines, et non de spores. Les graines sont des embryons entourés d’une membrane qui les protège de la sécheresse, des températures extrêmes et des autres conditions difficiles. La plupart des graines contiennent également une source alimentaire destinée à la plante en croissance. Les angiospermes entourent leur graine d’une couche additionnelle de protection, le fruit, qui protège les graines et qui permet souvent aux graines de se déplacer sur de longues distances. Les fruits peuvent être charnus (par exemple, bleuets, canneberges) ou secs (les samares de l’Érable à sucre, Acer saccharum, sont en réalité des fruits!).
Les plantes vasculaires sont généralement enracinées à un endroit et il peut alors être difficile de trouver un partenaire pour la reproduction. Les gymnospermes produisent du pollen (cellules reproductrices mâles) dans des cônes mâles et des oeufs dans des cônes femelles. Le pollen est libéré dans l’air et déplacé par le vent vers un cône femelle, où il féconde les oeufs. Ce processus de transport du pollen des cônes mâles vers les cônes femelles s’appelle la « pollinisation ». Puisque les chances de pollinisation fructueuse sont assez faibles, les gymnospermes produisent alors une grande quantité de pollen afin d’accroître leurs possibilités de féconder un cône femelle de la même espèce.
Chez les angiospermes, tous les organes reproducteurs sont situés dans les fleurs (même si les organes mâles et femelles ne se trouvent pas nécessairement dans la même fleur ni parfois dans le même plant). Certaines espèces d’angiospermes se reproduisent grâce à la pollinisation par le vent (par exemple, les graminées), mais la plupart compte sur des animaux, tels que les insectes, les oiseaux et même les chauves-souris, pour transporter le pollen de fleur en fleur. Les angiospermes attirent les pollinisateurs potentiels grâce à leurs pétales colorés et à leur doux parfum ou par le nectar qu’ils produisent. Certaines espèces ont évolué de façon à attirer des pollinisateurs très précis. Par exemple, les oiseaux mouches représentent les principaux pollinisateurs de la Lobélie cardinale (Lobelia cardinalis), qui les attire grâce à ses fleurs rouge vif. Cette fleur longue et étroite a une forme parfaite pour que l’oiseau-mouche puisse y insérer son bec et y puiser le nectar. Pendant que l’oiseau-mouche se nourrit, le pollen est dépose sur sa tête; il sera ainsi transporté à la prochaine fleur, où il fécondera les oeufs. En attirant des espèces ou des types particuliers de pollinisateurs, les plantes accroissent les chances que leur pollen atteigne une autre fleur de la même espèce.
Les plantes constituent de formidables usines chimiques qui fabriquent différents produits, à partir des substances défensives qui les protègent contre la prédation, les maladies et les parasites, jusqu’aux hormones qui régulent leur croissance. Les humains savent depuis longtemps que de nombreuses substances chimiques produites par les plantes possèdent des propriétés médicinales. Par exemple, on sait depuis longtemps que l’Achillée millefeuille (Achillea millefolium) permet de guérir les plaies et de traiter la fièvre, le rhume et d’autres malaises. Aujourd’hui, plus de 20 produits pharmaceutiques vendus au Canada contiennent de l’Achillée millefeuille.
État des connaissances
L’étude des plantes a une longue histoire au Canada, depuis les peuples autochtones qui s’en servaient pour se nourrir, s’abriter, se vêtir, comme matières premières et comme médicaments, jusqu’à l’arrivée des premiers colons européens, dont certains étaient des botanistes réputés (par exemple, Catherine Parr Traill, John Macoun). Une grande partie de la recherche actuelle est axée sur les plantes importantes pour l’agriculture, la foresterie ou la médecine, utilisant les nouveaux outils génétiques et moléculaires visant à étudier une grande variété de domaines, dont la physiologie des plantes, la génétique, la biotechnologie ainsi que les interactions entre les plantes et les ravageurs.
Comparativement à d’autres groupes d’espèces couverts dans le présent rapport, la répartition et la situation de nombreuses espèces de plantes vasculaires au Canada sont assez bien connues, en particulier dans le sud du pays. Néanmoins, les relevés systématiques permettent encore de mettre au jour de nouvelles informations, comme par exemple la découverte d’une nouvelle espèce d’arbre au Canada, à savoir le Peuplier des marais (Populus heterophylla, voir la section pleins feux sur le Peuplier des marais pour de plus amples renseignements). En plus de permettre la découverte de nouvelles espèces, les relevés systématiques améliorent les données sur la répartition et l’abondance des plantes vasculaires. Par exemple, au Nouveau-Brunswick, le premier relevé systématique de plantes rares mené dans la vallée supérieure de du fleuve Saint-Jean en 2001 et en 2002 a indiqué que deux espèces de graminées que l’on croyait rares dans la province, la Muhlenbergie de Richardson (Muhlenbergia richardsonis) et le Schizachyrium à balais (Schizachyrium scoparium), étaient en fait plus communes que ce qu’on pensait.
La répartition des plantes vasculaires dans les régions éloignées et dans le Nord canadien est moins bien connue que celle des plantes du sud du pays, notamment parce que moins d’amateurs et de professionnels étudient les plantes de ces régions, malgré la présence de communautés végétales uniques et d’espèces endémiques que l’on ne trouve nulle part ailleurs dans le monde. En outre, de nombreux spécimens du Nord canadien ont été inclus dans des collections nationales dans le sud du Canada. Certaines de ces collections ont été bien documentées et cataloguées (par exemple, l’herbier national du Musée canadien de la nature), mais d’autres n’ont été cataloguées que récemment, ce qui a permis de mettre au jour des renseignements sur les plantes vasculaires nordiques.
L’écologie végétale est l’étude des relations des plantes avec leur environnement physique (température, type de sol, luminosité, etc.) et « biologique » (interactions avec d’autres plantes, des animaux, des champignons, etc.). Cette science est importante pour comprendre une variété de questions, notamment la répartition des plantes, leur survie dans divers milieux et leur productivité. En outre, l’écologie végétale permet aux chercheurs de comprendre la façon dont les modifications du milieu (par exemple, changements climatiques, invasion d’espèces exotiques) peuvent affecter les communautés végétales. Par exemple, au Québec, des chercheurs étudiant des graminées dans des pâturages ont montré que l’exposition à des niveaux accrus de dioxyde de carbone peut influencer la succession végétale (changements dans la composition de la communauté dans le temps) et la richesse des espèces. Les connaissances en écologie végétale peuvent également permettre de préserver et de rétablir des communautés végétales indigènes. Par exemple, des chercheurs canadiens travaillent actuellement à la remise en état de la végétation de surface de tourbières qui étaient exploitées pour la tourbe. Il s’agit de la première étape en vue de leur restauration en un écosystème fonctionnel.
Richesse et diversité au Canada
Comparativement à d’autres groupes couverts dans le présent rapport, la richesse en espèces de plantes vasculaires est élevée dans tout le pays (figure 8), atteignant un sommet en Colombie-Britannique (2127 espèces indigènes). La flore de cette province est particulièrement variée dans le contexte canadien, puisque plusieurs centaines d’espèces de plantes vasculaires indigènes qui s’y trouvent ne sont présentes nulle part ailleurs au pays. D’autres régions du Canada représentent des centres locaux de diversité des plantes vasculaires et sont reconnues pour leurs concentrations de plantes endémiques, dont le plateau du Yukon central, les îles Ellesmere et de Baffin, la région de dunes sablonneuses du lac Athabasca, en Saskatchewan, et le golfe du Saint-Laurent.
La proportion d’espèces de plantes exotiques est élevée dans tout le pays, mais elle tend à être supérieure dans les provinces de l’est du Canada (22% à 36%) et inférieure dans les territoires (2% à 10%).
Pleins feux sur le Cypripède royal
Roi des orchidées, le Cypripède royal (Cypripedium reginae), qui peut atteindre jusqu’à 80 cm de hauteur, possède de magnifiques fleurs rose et blanc qui comptent trois pétales. Son nom générique signifie littéralement « sabot de la Vierge » (genre Cypripedium), en allusion à son pétale inférieur replié vers l’intérieur, ce qui lui donne l’apparence d’un sabot. Le Cypripède royal a besoin d’un sol très riche en nutriments et est présent dans les marais et les forêts humides ouvertes dans l’est et le centre du Canada.
À l’instar de toutes les orchidées, le cycle biologique du Cypripède royal est intrigant et complexe. Les graines d’orchidées sont très petites, presque microscopiques, et ne contiennent aucune source alimentaire pour aider la germination. Afin de survivre et de croître, la graine doit entrer en contact avec un champignon tellurique particulier qui lui fournira les nutriments nécessaires. Lorsque la plante produit des feuilles, elle est en mesure de se nourrir par la photosynthèse. Cependant, cette plante, qui croît très lentement, peut prendre jusqu’à 12 ans avant de fleurir! Pour se protéger contre les prédateurs affamés au cours de son long cycle de vie, les pousses et les feuilles du Cypripède royal sont couvertes de poils urticants qui découragent fortement les invertébrés et les grands prédateurs tels que le Cerf de Virginie (Odocoileus virginianus) de se nourrir de la plante.
Le Cypripède royal est pollinisé par des insectes, généralement des petites abeilles ou mouches. Cependant, contrairement à de nombreuses angiospermes, le Cypripède royal ne produit pas de nectar pour attirer les insectes; ces derniers seraient plutôt attirés par la couleur et la forme de ses pétales ainsi que par son odeur. Lorsque l’insecte pénètre dans la fleur, il est emprisonné dans le « sabot », son pétale inférieur replié. Pour s’échapper, l’insecte doit passer par le pistil (l’organe femelle de la fleur), où le pollen est balayé du corps de l’insecte pour féconder les oeufs. Enfin, l’insecte passe par l’étamine (l’organe mâle de la fleur), où il recueille davantage de pollen avant de quitter la fleur.
En raison notamment de la longueur et de la complexité de son cycle biologique, l’espèce est particulièrement vulnérable à une hausse des taux de mortalité des plants adultes. Par exemple, la cueillette par des jardiniers ou des collectionneurs a entraîné la disparition de populations entières, malgré le fait que le Cypripède royal ne pousse pas bien en milieu artificiel. La perte de l’habitat, les changements dans l’abondance et la répartition des insectes pollinisateurs ou des champignons telluriques, ainsi que le piétinement des jeunes pousses discrètes par des humains attirés par la beauté des plants adultes, constituent d’autres préoccupations relatives à l’espèce. Le Cypripède royal est répandu et commun localement dans la majeure partie de l’est du Canada, et il est classé en sécurité à l’échelle nationale.
Pleins feux sur les plantes carnivores
Les plantes carnivores possèdent la fascinante capacité de capturer et de tuer des insectes et d’autres petits animaux. Elles vivent principalement dans des tourbières pauvres en nutriments et des habitats aux sols acides et humides. Dans ces habitats, puisque les nutriments essentiels, comme l’azote, sont difficiles à obtenir, les plantes carnivores doivent compléter leur apport d’éléments nutritifs en se nourrissant des insectes qu’elles capturent. Fait intéressant, cette capacité de saisir et de digérer des proies a évolué de façon différente chez plusieurs familles végétales; la structure des plantes carnivores modernes et les méthodes de capture d’insectes sont donc assez variées.
Il existe 20 espèces de plantes vasculaires carnivores au Canada, réparties en quatre groupes : sarracénies (genre Sarracenia, une espèce), droséracées (genre Drosera, cinq espèces), grassettes (genre Pinguicula, trois espèces) et utriculaires (genre Utricularia, 11 espèces). Chaque groupe possède son propre mode de capture et de digestion des proies. Par exemple, les feuilles modifiées des droséracées sont couvertes de structures rouges semblables à des poils garnis d’une gouttelette de mucus collant et brillant. Les insectes sont attirés par leur apparence colorée et leurs sécrétions odorantes, mais dès qu’ils se posent sur une feuille, ils y adhèrent. Plus l’insecte lutte, plus les poils fléchissent vers l’intérieur pour retenir l’insecte. Les glandes des poils sécrètent des enzymes qui digèrent la proie, ce qui permet à la feuille d’absorber les nutriments.
Les utriculaires, qui capturent de minuscules proies aquatiques, possèdent les pièges actifs les plus complexes des plantes carnivores. Ces plantes flottent librement dans les eaux peu profondes, sans racines qui leur permettraient de tirer des nutriments du sol. Les feuilles sont très finement divisées et contiennent de nombreuses petites cavités, ou utricules. Ces utricules servent de pièges à succion; des structures ressemblant à des poils déclenchant l’ouverture de leur porte. Lorsqu’une proie frôle les poils, la porte de l’utricule s’ouvre et l’animal est entraîné vers l’intérieur avec la pénétration de l’eau. La succion étant relâchée, l’utricule reprend sa forme globuleuse et la porte se referme. La proie est ensuite digérée et l’eau est expulsée, recréant ainsi la succion et préparant le piège pour la prochaine victime. Fait étonnant, la porte de l’utricule s’ouvre en moins de 0,002 seconde; il s’agit de l’un des temps de réaction les plus rapides du règne végétal!
La majorité des plantes carnivores du Canada sont classées en sécurité, mais, à l’échelle nationale, deux espèces (Grassette à grand éperon, Pinguicula macroceras, et Utriculaire jaunâtre, Utricularia ochroleuca) sont classées sensibles et une autre (Droséra filiforme, Drosera filiformis) en péril.
Les plantes carnivores sont d’importantes composantes des milieux humides faibles en nutriments partout au pays. La principale menace envers ces espèces est la destruction de l’habitat attribuable à l’extraction de la tourbe, au drainage des zones humides et à la succession; de même, la collecte à des fins commerciales constitue une préoccupation pour toutes les espèces de plantes carnivores.
Pleins feux sur le Mélèze laricin
Le Mélèze laricin (Larix laricina), aussi appelé Mélèze d’Amérique, est présent dans l’ensemble des provinces et des territoires du Canada. Arbre emblème des Territoires du Nord-Ouest, il est unique en son genre dans le règne végétal, car il s’agit d’un conifère à feuilles caduques! À l’instar des autres conifères, le Mélèze laricin possède des cônes et des feuilles ressemblant à des aiguilles, mais à chaque automne, ses aiguilles molles et flexibles deviennent dorées et tombent, pour être remplacées au printemps.
Le Mélèze laricin croît dans diverses conditions de sol, mais il est surtout présent dans les sols froids mal drainés, dans les terrains marécageux et dans d’autres types de tourbières. De taille petite à moyenne, les plants matures mesurent généralement entre 15 et 23 m de hauteur, jusqu’à 40 cm de diamètre et peuvent vivre de 150 à 180 ans. Le Mélèze laricin est commun dans la forêt boréale et est considéré comme un arbre très résistant au froid. Afin de survivre à l’hiver, le Mélèze laricin profite d’un processus appelé « gel extracellulaire ». Durant le gel de l’eau, des cristaux de glace risquant de causer des dommages irréparables aux cellules se forment. Cependant, dans ce processus, le liquide cellulaire passe à travers la membrane de la cellule et se déverse dans les espaces vides entre les cellules, où le liquide peut geler sans endommager la structure interne des cellules, permettant ainsi au Mélèze laricin de survivre aussi loin au nord que la limite de distribution des arbres.
Le Mélèze laricin n’est pas une essence commerciale importante, mais il est récolté en vue de la fabrication de produits de pâtes et papiers. Son bois dur, résistant à la pourriture, est également utilisé pour produire des poteaux, des piquets de clôture et des traverses de chemin de fer. Auparavant, ses racines étaient utilisées dans la construction de navires. Les peuples autochtones utilisaient le Mélèze laricin à de nombreuses fins, notamment alimentaires et médicales, ainsi que pour construire des canoës et des raquettes. Les racines peuvent être utilisées pour tisser des sacs et coudre des canoës d’écorce.
Divers animaux se nourrissent de ses feuilles, de ses cônes, de ses graines et de son écorce, notamment le Tétras à queue fine (Tympanuchus phasianellus), l’Ours noir (Ursus americanus), le Lièvre d’Amérique (Lepus americanus), le Porc-épic d’Amérique (Erethizon dorsatum) et l’Écureuil roux (Tamiasciurus hudsonicus). Les principaux ravageurs du Mélèze laricin comprennent le Tenthrède du mélèze (Pristiphora erichsonii) et le Dendroctone du mélèze (Dendroctonus simplex).
À l’échelle nationale et dans l’ensemble des provinces et des territoires, le Mélèze laricin est classé en sécurité. Ses cousins indigènes, le Mélèze subalpin (Larix lyallii) et le Mélèze de l’Ouest (Larix occidentalis), qui ne sont présents qu’en Alberta et en Colombie-Britannique, sont également classés en sécurité à l’échelle nationale.
Pleins feux sur le Peuplier des marais
En 2002, dans le cadre d’un relevé biologique dans la forêt Bickford, dans le sud de l’Ontario, des chercheurs ont été stupéfaits de découvrir une nouvelle espèce au Canada. Et il ne s’agissait pas d’une petite espèce passant facilement inaperçue, mais bien d’un peuplement de plus de 60 arbres matures pouvant atteindre 27 m de hauteur! Cette nouvelle espèce est le Peuplier des marais (Populus heterophylla), un arbre à feuilles caduques appartenant à la famille des saules (famille Salicaceae) et étroitement lié aux peupliers, aux trembles et autres semblables (genre Populus). Le Peuplier des marais est assez commun dans le sud-est des États-Unis, mais il est plus rare dans le nord-est de ce pays.
Cet arbre décidu de taille moyenne peut atteindre 40 m de hauteur dans les sols humides des marais et des plaines inondables. Ses feuilles sont grandes et arrondies; son écorce rougeâtre est épaisse et rugueuse. À l’instar d’autres espèces de peupliers, les fleurs du Peuplier des marais croissent très tôt au printemps, avant même l’apparition des feuilles. Elles prennent la forme de chatons tombants, et chaque arbre possède des fleurs mâles ou femelles, mais jamais de fleurs des deux sexes. Le pollen est dispersé par le vent, depuis les fleurs mâles jusqu’aux fleurs femelles, où les oeufs sont fécondés et les graines commencent à se développer. Ces dernières sont légères et comportent des touffes de poils, ce qui leur permet d’être transportées par le vent ou de flotter sur l’eau. L’habitat du Peuplier des marais est souvent inondé au début du printemps, au moment de la production des graines. Celles-ci tombent alors dans l’eau et flottent jusqu’à ce que les niveaux d’eau diminuent; elles sont alors déposées sur le sol humide, où elles peuvent germer et croître. Le Peuplier des marais a une meilleure croissance dans les zones ouvertes peu ombragées, et on le trouve souvent le long des berges de marais ou de rivières. Les arbres matures ne sont pas présents en grand nombre dans l’aire de répartition de l’espèce et ils ne constituent la composante principale d’aucun type de forêt.
La découverte du Peuplier des marais au Canada nous rappelle qu’il nous en reste encore beaucoup à apprendre sur les espèces sauvages canadiennes, même dans des régions densément peuplées comme le sud de l’Ontario. En raison de son aire de répartition canadienne très limitée et de la petite taille de la population au pays, le Peuplier des marais est classé possiblement en péril à l’échelle nationale.
Résultats de l’évaluation de la situation générale
Parmi les 5111 espèces de plantes vasculaires retrouvées au Canada, 53% sont classés en sécurité à l’échelle nationale (2635 espèces, figure 8 et tableau 8), alors que 9% sont sensibles (484 espèces), 9% sont possiblement en péril (444 espèces) et 3% sont en péril (136 espèces). Moins de 1% des espèces de plantes vasculaires au Canada sont disparue du pays (25 espèces) et aucune n’est disparue à l’échelle mondiale. Au total, 24% des espèces de plantes vasculaires sont exotiques à l’échelle nationale (1252 espèces), soit la plus importante proportion d’espèces exotiques de tous les groupes d’espèces couverts dans ce rapport. Finalement, 2% des espèces de plantes vasculaires au Canada ont une classification indéterminée (112 espèces), et moins de 1% sont non évaluées (23 espèces).
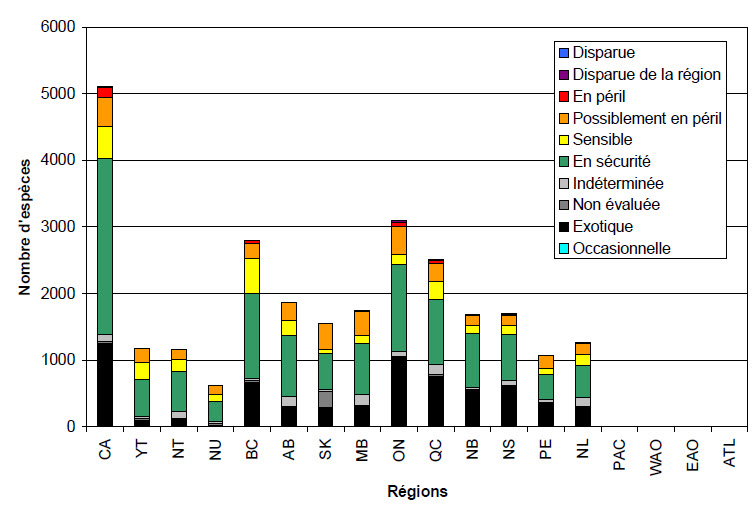
Description longue pour la figure 8
La figure 8 montre les résultats des évaluations de la situation générale des espèces de plantes vasculaires au Canada dans le rapport Espèces sauvages 2010. Le graphique à barres présente les espèces de plantes vasculaires disparues, disparues de la région, en péril, possiblement en péril, sensibles, en sécurité, indéterminées, non-évaluées, exotiques et occasionnelles au Canada, dans chaque province et territoire et dans les 4 régions océaniques. Des 5111 espèces évaluées au Canada, 25 étaient classées disparues de la région, 136 en péril, 444 possiblement en péril, 484 sensibles, 2635 en sécurité, 112 indéterminées, 23 non-évaluées et 1252 exotiques. Des 1183 espèces évaluées au Yukon, une était classée disparue de la région, une en péril, 218 possiblement en péril, 256 sensibles, 549 en sécurité, 38 indéterminées, 20 non-évaluées et 100 exotiques. Des 1158 espèces évaluées dans les Territoires du Nord-Ouest, 146 étaient classées possiblement en péril, 187 sensibles, 602 en sécurité, 103 indéterminées, 3 non-évaluées et 117 exotiques. Des 626 espèces évaluées au Nunavut, 137 étaient classées possiblement en péril, 111 sensibles, 296 en sécurité, 39 indéterminées, 29 non-évaluées et 14 exotiques. Des 2801 espèces évaluées en Colombie-Britannique, 2 étaient classées disparues de la région, 46 en péril, 229 possiblement en péril, 523 sensibles, 1282 en sécurité, 28 indéterminées, 17 non-évaluées et 674 exotiques. Des 1874 espèces évaluées en Alberta, une était classée disparue de la région, 6 en péril, 270 possiblement en péril, 221 sensibles, 924 en sécurité, 148 indéterminées, 4 non-évaluées et 300 exotiques. Des 1558 espèces évaluées en Saskatchewan, 3 étaient classées disparues de la région, 11 en péril, 388 possiblement en péril, 49 sensibles, 549 en sécurité, 30 indéterminées, 236 non-évaluées et 292 exotiques. Des 1740 espèces évaluées au Manitoba, 13 étaient classées en péril, 360 possiblement en péril, 117 sensibles, 768 en sécurité, 168 indéterminées, une non-évaluée et 313 exotiques. Des 3099 espèces évaluées en Ontario, 25 étaient classées disparues de la région, 62 en péril, 427 possiblement en péril, 149 sensibles, 1312 en sécurité, 73 indéterminées et 1051 exotiques. Des 2510 espèces évaluées au Québec, 11 étaient classées disparues de la région, 47 en péril, 265 possiblement en péril, 272 sensibles, 984 en sécurité, 142 indéterminées, 30 non-évaluées et 759 exotiques. Des 1690 espèces évaluées au Nouveau-Brunswick, 6 étaient classées disparues du Canada, 10 en péril, 161 possiblement en péril, 114 sensibles, 810 en sécurité, 31 indéterminées et 558 exotiques. Des 1695 espèces évaluées en Nouvelle-Écosse, 11 étaient classées disparues de la région, 9 en péril, 160 possiblement en péril, 126 sensibles, 699 en sécurité, 74 indéterminées et 616 exotiques. Des 1076 espèces évaluées à l’Île-du-Prince-Édouard, 8 étaient classées disparues de la région, une en péril, 188 possiblement en péril, 86 sensibles, 381 en sécurité, 44 indéterminées et 368 exotiques. Des 1272 espèces évaluées à Terre-Neuve et Labrador, 18 étaient classées en péril, 167 possiblement en péril, 167 sensibles, 485 en sécurité, 136 indéterminées, 15 non-évaluées et 284 exotiques. Aucune espèce n’était présente dans les régions océaniques.
Comparaison avec les rapports Espèces sauvages précédents
Le rapport Espèces sauvages 2010 marque la seconde évaluation nationale de toutes les plantes vasculaires au Canada (toutes les espèces de plantes vasculaires ont été évaluées pour la première fois dans le rapport Espèces sauvages 2005). Cependant, les fougères et les orchidées avaient également été évaluées dans le rapport Espèces sauvages 2000. Nous présentons ainsi en premier lieu une comparaison de toutes les espèces de plantes vasculaires, et ensuite nous présentons les tendances spécifiquement pour les fougères et les orchidées.
Toutes les espèces de plantes vasculaires
La catégorie des espèces possiblement en péril est celle qui a connu la plus importante diminution en termes de nombre d’espèces de plantes vasculaires, alors que la catégorie en sécurité a connu la plus importante augmentation dans le nombre d’espèces (tableau 8). La catégorie des espèces exotiques a également connu une grande augmentation dans son nombre d’espèces. Depuis la dernière évaluation en 2005, un total de 37 espèces ont été ajoutées à la liste nationale des plantes vasculaires.
Un total de 495 changements ont été faits à l’échelle nationale pour toutes les espèces de plantes vasculaires depuis la dernière évaluation en 2005. Parmi ces changements, 54 espèces ont connu un niveau de risque plus élevé, 132 espèces ont eu un niveau de risque moins élevé, 84 espèces ont été déplacées des catégories Indéterminée, Non évaluée, Exotique ou Occasionnelle, 131 espèces ont été ajoutées et 94 espèces ont été effacées. Les principales raisons de ces changements étaient une amélioration des connaissances sur les espèces et des changements reliés à la taxonomie (tableau 9).
| Classification nationale | Années des rapports Espèces sauvages 2000 | Années des rapports Espèces sauvages 2005 | Années des rapports Espèces sauvages 2010 | Changement moyen entre les rapports | Changement total depuis le premier rapport |
|---|---|---|---|---|---|
| 0 Disparue / Disparue de la région | - | 22 (0%) | 25 (0%) | - | +3 espèces |
| 1 En péril | - | 110 (2%) | 136 (3%) | - | +26 espèces |
| 2 Possiblement en péril | - | 552 (11%) | 444 (9%) | - | -108 espèces |
| 3 Sensible | - | 460 (9%) | 484 (9%) | - | +24 espèces |
| 4 En sécurité | - | 2572 (51%) | 2635 (53%) | - | +63 espèces |
| 5 Indéterminée | - | 112 (2%) | 112 (2%) | - | Stable |
| 6 Non évaluée | - | 30 (1%) | 23 (0%) | - | -7 espèces |
| 7 Exotique | - | 1216 (24%) | 1252 (24%) | - | +36 espèces |
| 8 Occasionnelle | - | 0 (0%) | 0 (0%) | - | Stable |
| Total | - | 5074 (100%) | 5111 (100%) | - | +37 espèces |
| Code | Description | Nombre d’espèces | Proportion des changements |
|---|---|---|---|
| B | Changement relié à des changements biologiques dans la taille de la population ou dans la répartition de l’espèce, ou dans les menaces qu’elle fait face. | 42 | 8% |
| C | Changement relié à une nouvelle évaluation du COSEPAC. | 37 | 7% |
| E | Changement relié à une erreur dans les rangs précédents. | 8 | 2% |
| I | Changement relié à une amélioration des connaissances sur les espèces. | 301 | 61% |
| P | Changement relié à des modifications dans la procédure. | 5 | 1% |
| T | Changement relié à la taxonomie. | 102 | 21% |
| Total | - | 495 | 100% |
Note: Dans le cas des plantes vasculaires, étant donné que le rang d’un grand nombre d’espèces a changé depuis la dernière évaluation, nous présentons seulement un résumé des raisons des changements.
Espèces de fougères seulement
Les fougères ont été évaluées pour la première fois dans le rapport Espèces sauvages 2000. Au total, trois espèces ont été ajoutées à la liste nationale depuis la première évaluation (tableau 10). Dans le temps, la plus grande augmentation a été observée dans le nombre d’espèces possiblement en péril (+3 espèces) et la plus grande diminution a été observée dans le nombre d’espèces en sécurité (-2 espèces).
| Classification nationale | Années des rapports Espèces sauvages 2000 | Années des rapports Espèces sauvages 2005 | Années des rapports Espèces sauvages 2010 | Changement moyen entre les rapports | Changement total depuis le premier rapport |
|---|---|---|---|---|---|
| 0 Disparue / Disparue de la région | 0 (0%) | 0 (0%) | 0 (0%) | Stable | Stable |
| 1 En péril | 3 (2%) | 5 (4%) | 5 (4%) | +1 espèces | +2 espèces |
| 2 Possiblement en péril | 18 (15%) | 24 (19%) | 21 (17%) | +2 espèces | +3 espèces |
| 3 Sensible | 20 (16%) | 15 (12%) | 19 (15%) | -1 espèces | -1 espèces |
| 4 En sécurité | 79 (65%) | 78 (63%) | 77 (61%) | -1 espèces | -2 espèces |
| 5 Indéterminée | 0 (0%) | 0 (0%) | 1 (1%) | +1 espèces | +1 espèces |
| 6 Non évaluée | 0 (0%) | 0 (0%) | 0 (0%) | Stable | Stable |
| 7 Exotique | 2 (2%) | 2 (2%) | 2 (2%) | Stable | Stable |
| 8 Occasionnelle | 0 (0%) | 0 (0%) | 0 (0%) | Stable | Stable |
| Total | 122 (100%) | 124 (100%) | 125 (100%) | +2 espèces | +3 espèces |
Espèces d’orchidées seulement
Les orchidées ont été évaluées pour la première fois dans le rapport Espèces sauvages 2000. Au total, une espèce a été enlevée de la liste nationale depuis la première évaluation (tableau 11). Dans le temps, la plus grande augmentation a été observée dans le nombre d’espèces sensibles (+4 espèces) et la plus grande diminution a été observée dans le nombre d’espèces possiblement en péril (-4 espèces).
| Classification nationale | Années des rapports Espèces sauvages 2000 | Années des rapports Espèces sauvages 2005 | Années des rapports Espèces sauvages 2010 | Changement moyen entre les rapports | Changement total depuis le premier rapport |
|---|---|---|---|---|---|
| 0 Disparue / Disparue de la région | 0 (0%) | 1 (1%) | 1 (1%) | +1 espèces | +1 espèces |
| 1 En péril | 7 (9%) | 8 (11%) | 8 (10%) | +1 espèces | +1 espèces |
| 2 Possiblement en péril | 10 (13%) | 5 (7%) | 6 (8%) | -2 espèces | -4 espèces |
| 3 Sensible | 6 (8%) | 10 (13%) | 10 (13%) | +2 espèces | +4 espèces |
| 4 En sécurité | 50 (64%) | 49 (64%) | 49 (64%) | -1 espèces | -1 espèces |
| 5 Indéterminée | 0 (0%) | 0 (0%) | 0 (0%) | Stable | Stable |
| 6 Non évaluée | 0 (0%) | 0 (0%) | 0 (0%) | Stable | Stable |
| 7 Exotique | 4 (5%) | 3 (4%) | 3 (4%) | -1 espèces | -1 espèces |
| 8 Occasionnelle | 1 (1%) | 0 (0%) | 0 (0%) | -1 espèces | -1 espèces |
| Total | 78 (100%) | 76 (100%) | 77 (100%) | -1 espèces | -1 espèces |
Menace envers les plantes vasculaires canadiennes
La diversité des plantes vasculaires étant si grande au Canada, il n’est pas surprenant que les menaces envers celles-ci soient également variées. À l’instar des autres groupes d’espèces, la perte et la dégradation de l’habitat constituent de graves problèmes. La perte de l’habitat survient lorsque les habitats naturels sont transformés en raison de l’utilisation des sols par les humains, par exemple pour l’agriculture et l’aménagement résidentiel, ou à la suite de processus naturels tels que la succession, un incendie ou une inondation. La dégradation de l’habitat peut revêtir de nombreuses formes, notamment la pollution, la modification du régime d’écoulement des eaux ou le piétinement par les humains ou des animaux. La surexploitation représente une autre menace envers quelques espèces, en particulier les plantes appréciées pour leur beauté (par exemple, le Cypripède royal) ou celles qui ont des propriétés médicinales.
Depuis les dernières années, les répercussions des espèces exotiques sont considérées comme de sérieuses menaces envers les espèces sauvages indigènes. Les plantes exotiques compétitionnent avec les espèces indigènes pour l’obtention de l’espace et des ressources. Par exemple, la Salicaire commune (Lythrum salicaria), une espèce européenne introduite au XIXe siècle, a modifié de nombreuses zones humides qui, de systèmes à grande diversité végétale, sont devenues des milieux presque entièrement dominés par un petit nombre d’espèces exotiques. Cette modification affecte de nombreuses espèces, y compris les mammifères, les reptiles, les amphibiens et les invertébrés dont la survie dépend des zones humides. Par exemple, le Rat musqué (Ondatra zibethicus) ne se nourrira pas de Salicaire commune et beaucoup d’oiseaux n’y nicheront pas. D’autres espèces exotiques, telles que le Butome à ombelle (Butomus umbellatus), présentent des menaces importantes le long des autoroutes dans l’Est du Canada, et certaines n’ont pas d’ennemis naturels. En outre, les espèces exotiques risquent d’introduire de nouvelles maladies qui nuiront à la santé des plantes indigènes. L’hybridation constitue également un problème. Dans ces cas, une espèce exotique se reproduit avec une plante indigène, ce qui affaiblit la génétique de cette dernière. Le Mûrier rouge (Morus rubra), une espèce indigène classée en péril, a décliné en partie en raison de l’hybridation avec le Mûrier blanc (Morus alba), une espèce exotique. Chaque année, des millions de dollars sont dépensés afin de lutter contre la présence dans les habitats naturels d’espèces exotiques telles que le Chardon penché (Carduus nutans), la Salicaire commune, la Centaurée maculée (Centaurea stoebe) et le Nerprun cathartique (Rhamnus cathartica).
Conclusion
La réévaluation de la situation générale des 5111 espèces canadiennes de plantes vasculaires constitue une réalisation importante, qui a fait appel aux botanistes de partout au pays et nécessité les données les plus actuelles en vue d’évaluer la répartition et la situation générale des plantes vasculaires du Canada. Les résultats de la présente réévaluation indiquent qu’à l’échelle nationale, la majorité des espèces de plantes vasculaires canadiennes sont classées en sécurité, bien que plusieurs d’entre elles soient possiblement en péril et en péril. Ces résultats mettent également en évidence la grande proportion d’espèces exotiques, soit 24% des espèces de plantes vasculaires, une proportion beaucoup plus importante que pour tous les autres groupes évalués dans le cadre du présent rapport.
Pour en savoir plus
Adrian, S. 2000. Carnivorous plants. Marston House, England: 240 pp.
Agriculture et Agroalimentaire Canada. L’herbier des plantes vasculaires. (Consulté le 25 février 2010).
Ames, D., Bainard-Acheson, P., Heshka, L., Joyce, B., Neufeld, J., Reeves, R., Reimer, E. et Ward, I. 2005. Orchids of Manitoba. Native Orchid Conservation Inc., Canada: 158 pp.
Association botanique du Canada. (Consulté le 25 février 2010).
Bibliothèque et Archives Canada. 2001. Susanna Moodie et Catharine Parr Traill. (Consulté le 25 février 2010).
Bruce-Grey Plant Committee. 1997. A guide to the orchids of Bruce and Grey counties, Ontario, second edition. Stan Brown Printers, Owen Sound: 105 pp.
Burchill, C. 2005. Vascular flora of Manitoba. (Consulté le 25 février 2010). [en anglais seulement]
Cody, W. J. 2000. Flora of the Yukon Territory. National Research Press, Ottawa: 669 pp.
Davis, S. D., Heywood, V. H., Herrera-MacBryde, O., Villa-Lobos, J. et Hamilton, A. (éditeurs). 1997. Centres of plant diversity: A guide and strategy for their conservation. Volume 3: The Americas. IUCN Publications Unit, Cambridge, England. (Consulté le 25 février 2010).
E-Flora BC. (Consulté le 25 février 2010).
Eastman, J. 1992. The book of forest and thicket. Trees shrubs and wildflowers of eastern North America. Stackpole Books, Harrisburg, Pennsylvania: 212 pp.
Farrar, J. L. 1995. Trees in Canada. Fitzhenry & Whiteside, Ontario and Natural Resources Canada, Ottawa: 502 pp.
Flora of North America. (Consulté le 1 février 2006).
Henry, J. D. 2002. Canada’s boreal forest. Smithsonian natural history series. Smithsonian Institute Press: 176 pp.
Herbier national du Canada. (Consulté le 25 février 2010).
Hinds, H. R. 2000. Flora of New Brunswick: A manual for the identification of the vascular plants of New Brunswick. University of New Brunswick, Fredericton: 699 pp.
Johnston, W. F. 1990. Tamarack. In Silvics of North America: 1. Conifers (R. M. Burns et B. H. Honkala, coordonateurs techniques). Agriculture Handbook 654. U.S. Department of Agriculture, Forest Service, Washington: 877 pp. (Consulté le 25 février 2010).
Maunder, J. E. 2001. A digital flora of Newfoundland and Labrador vascular plants. (Consulté le 25 février 2010).
McMaster, R. T. 2003. Populus heterophylla L. Swamp cottonwood. Conservation and research plan for New England. New England [PDF, 235 Ko] Wild Flower Society, Massachusetts. (Consulté le 10 janvier 2006).
Morris, A. 2003. New tree for Carolinian Canada [PDF, 742 Ko]. Carolinian Canada Newsletter, winter 2003-4. (Consulté le 10 janvier 2006).
AttentionFlore. (Consulté le 25 février 2010).
Prindle, T. 2000. NativeTech: Native American technology and art. An introduction to tamarack trees & traditions. (Consulté le 25 février 2010).
Rice, B. A. 2004. Carnivorous Plant FAQ v10.0. (Consulté le 25 février 2010).
Roland, A. E. 1998. The flora of Nova Scotia. Nimbus, Halifax: 1350 pp.
Scoggan, H. J. 1978. The flora of Canada (4 volumes). Canadian Museum of Nature, Ottawa: 1711 pp.
Victorin, M. 1995. Flore Laurentienne, troisième édition. Les presses de l’Université de Montréal, Montréal: 925 pp. (Consulté le 25 février 2010).
Waldron, G., Ambrose, J. et Rodger, L. 2003. Swamp cottonwood (Populus heterophylla), another new tree for Canada. Centre d'information sur le patrimoine naturel 8: 6. (Consulté le 25 février 2010).
White, D. J., Haber, E. et Keddy, C. 1993. Plantes envahissantes des habitats naturels du Canada : aperçu global des espèces vivant en milieu humide et en milieu sec et la législation visant leur élimination. Service canadien de la faune, Ottawa: 121 pp. (Consulté le 25 février 2010).
Références
Allaby, M. 1989. Dictionary of the environment. New York University Press, New York: 423 pp.
Chapman, A. D. 2009. Numbers of living species in Australia and the World, second edition. Report for the Australia Biological Resources Study, Canberra, Australia: 80 pp.
Jodoin, Y. 2006. Le roseau commun (Phragmites australis) en bordure des autoroutes du Québec: une étude génétique et biogéographique. Mémoire de maîtrise, École supérieure d’aménagement du territoire et de développement régional, Faculté d’Aménagement, d’Architecture et des Arts visuels, Université Laval, Québec: 39 pp.
Nature Trust of New Brunswick et Atlantic Canada Conservation Data Centre. 2003. Rare plant survey of the Upper St. John River with focus on Furbish’s Lousewort. The Nature Trust of New Brunswick, Inc. Fredericton: 61 pp.
Smith, D. 2001. Documenting plant domestication: The consilience of biological and archaeological approaches. PNAS 98: 1324-1326.
Vasseur, L. et Potvin, C. 1997. Natural pasture community response to enriched carbon dioxide atmosphere. Plant Ecology 135: 31-41.